Область техники
Изобретение относится к экспериментальной диагностике онкологических заболеваний и может быть использовано для комбинированной контрастной магнитно-резонансной томографической (ККМРТ) визуализации изображений процессов биомеханики: инфильтрации, инвазии и метастазирования из центров пролиферации (ЦП) злокачественных клеток (ЗК) (ЦПЗК) и злокачественных опухолей (ЗО) в сосуды, и нормальные ткани через 2-3 дня после перевивки злокачественных клеток (ЗК), и в дальнейшем, в течение всей жизни.
Уровень техники
Биопсия является обязательным методом подтверждения диагноза при подозрении на наличие онкологических заболеваний и заключается во взятии маленькой части биологической ткани из опухоли (при опухолях мозга применяют стереотаксическое отсасывание части опухоли иглой с вакуумным устройством), и микроскопическом выявлении в них ЗК. Данная процедура может вызывать у больных страх, боль, инфицирование, диссеминацию ЗК и спонтанное усиление роста опухоли.
В настоящее время не известны способы излечения «запущенных» солидных ЗО. Однако хорошо изучен способ лечения центров пролиферации ЗК, для которых при ККМРТ визуализации подтверждено отсутствие инфильтрации, инвазии и метастазирования ЗК из ЦПЗК в нормальные ткани. Для излечения больных с ЦПЗК применяют срочную лучевую терапию с последующим удалением ЦПЗК. Для подтверждения диагноза «ЦПЗК» недостаточно выявления ЗК и ЦПЗК, необходимы ККМРТ изображения ЦПЗК, подтверждающие отсутствие инфильтрации, инвазии и метастазирования ЗК из ЦПЗК в сосуды и нормальные ткани. Необходима визуализация ЗК и ЦПЗК до инфильтрации, инвазии и метастазирования ЗК из ЦПЗК или ЗО в сосуды и нормальные ткани.
Кроме того, знания биомеханики процессов инфильтрации, инвазии и метастазирования злокачественных клеток, прикрепления злокачественных клеток к кровеносным сосудам, митоза и пролиферации ЗК на поверхности сосудов, проникновения ЗК в сосуды, выхода ЗК из сосудов в нормальные ткани и развития ЦПЗК, и злокачественных опухолей необходимы при исследованиях по разработке и тестированию противоопухолевых препаратов.
Разработка средств и способов ранней ККМРТ визуализации биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные ткани является биоинженерной задачей.
Способ визуализации ККМРТ изображений инфильтрации, инвазии и метастазирования злокачественных клеток из ЦПЗК и ЗО в нормальные ткани и сосуды разработан для замены методик биопсии, при проведении которых эти определения не проводят.
Практически терапию ЦПЗК начинают через 6-14 дней после перевивки ЗК. Если терапию ЦПЗК и ЗО проводят без ККМРТ визуализации биомеханики процессов: инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные ткани и сосуды, получают разброс результатов, что делает их статистически недостоверными.
Из уровня техники известны контрастные магнитно-резонансные томографические средства (КМРТС) декстранферрит (ДФ) и декстранферрит, допированный катионами кобальта (Со2+), декстранмагнетит и цитрат магнетита, применение которых раскрыто в следующих источниках информации:
[2]. «Средство для раннего контрастного магнитно-резонансного томографического выявления центров пролиферации злокачественных клеток с питающими сосудами, границами инфильтрации и определение стадий развития в динамике», Патент РФ № 2692579;
[3]. «Средство и способ для раннего контрастного магнитно-резонансного томографического выявления злокачественных глиальных ЦПЗК с питающими сосудами в эксперименте», Патент РФ № 2655303,
[4]. «Способ ферримагнито-термохимиотерапии злокачественных опухолей комбинациями магнитоуправляемых нанопрепаратов с визуализацией онкогенеза, определением лечения предпочтительного в режиме реального времени и мониторингом результатов лечения в эксперименте», Патент РФ № 2563369,
[5]. «Визуализация экспериментальной глиомы С6 методом МРТ с помощью магнитных наночастиц, конъюгированных с моноклональными антителами к фактору роста эндотелия сосудов», Абакумов М.А., Шеин С.А., Вишвасрао Х., Нуколова Н.В., Сокольски-Папков, Сандалова Т.О., Губский И.Л., Гриненко Н.Ф., Кабанов А.В., Чехонин В.П. Бюллетень экспериментальной биологии и медицины, 2012, 154, № 8, 242-246. В данном источнике описан контрастный агент на основе наночастиц оксида железа и антител к VEGF, который визуализирует КМРТИ интракраниальной опухоли глиомы С6 через 14 дней после перевивки.
Основным недостатком приведенных выше средств является поздняя визуализация опухоли, без визуализации злокачественных клеток, инфильтрации, инвазии и метастазирования.
Перед контрастным МРТ сканированием злокачественных опухолей увеличивают яркость ККМРТИ места прививки внутривенным введением Магневиста® (МВ), но при введении МВ не увеличивают пространственное разрешение поэтому не визуализируют инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в сосуды и нормальные ткани, а оставляют их невидимыми.
Наиболее близкими по технической сущности к заявляемой группе изобретений является средство, представляющее собой 5% золь цитрат феррита (ЦФ) в полиглюкине, а также способ его применения для обнаружения сосудов, питающих опухоль, в эксперименте (прототип), раскрытые в следующей публикации:
[6] «Способ обнаружения сосудов, питающих опухоль, в эксперименте», Патент РФ №2382596.
От 0,01 до 0,2 мл 2% золь ЦФ применяют в качестве негативного МРТ контрастного средства-прототипа. Для получения КМРТИ золь ЦФ вводят мышам внутриартериально (ВА), В/В и ИП. Применение 3% водного золя ЦМ осуществляют в аналогичных условиях. Через 3-14 дней после подкожной перевивки аденокарциномы молочной железы Са 755 самкам мышей С57Bl/6j внутривенно последовательно вводят 0,2 мл 2% водный золь ЦМ и 0,2 мл МВ, и проводят КМРТ сканирование места перевивки ЗК. Визуализируют КМРТ изображения ЦПЗК у мышей С57Bl/6j. Через 3-4 дня после перевивки злокачественных клеток, при В/В или интраперитонеальном (ИП) введении 0,2 мл / кг Магневиста®, без предварительного введения СНМЦ, ранняя (через 48 – 96 ч) визуализация центров пролиферации злокачественных клеток с питающими сосудами не происходит из-за отсутствия достаточного числа чёрных вокселей, создающих контраст в ККМРТ изображениях совместно с белыми вокселями [2]. Однако основным недостатком аналогов является неустойчивость золей, содержащих наночастицы диаметром более 50 нм. Наносферы СНМЦ диаметром более 50 нм при хранении их водных золей в течение 1-3 недель слипаются и выпадают в осадок. При В/В введении СНМЦ диаметром более 50 нм они эндоцитируются клетками сердечно-сосудистой и ретикуло-эндотелиальной системы.
При В/В введении в организм цитрат магнетит увеличивает магнитную гетерогенность биологических тканей и повышает контраст МРТ изображений патогенных тканей за счёт подавления сигнала протонов молекул гидратной воды здоровых тканей. Магневист увеличивает яркость ККМРТ изображения, усиливая сигнал протонов молекул гидратной воды тканей с пониженным содержанием магнетита. При визуальном анализе ККМРТ изображений внутренних органов, выявляют малигнизированные сосуды, питающие опухоль. На 6-14 день после перевивки аденокарциномы молочной железы Са 755 в хвостовую вену самок мышей C57Bl/6j вводят 0,5 мл/кг 5% золь цитрат магнетита в полиглюкине. Через 10 мин - 30 ч после В/В введения цитрат магнетита в полиглюкине, за 3-9 мин до проведения контрастного МРТ сканирования, В/В вводят 0,2 мл/кг Магневиста®. Последующим контрастным МРТ сканированием места перевивки визуализируют ККМРТ изображения сосудов, питающих опухоль Са 755. К недостаткам способа обнаружения сосудов, питающих опухоль аденокарциномы молочной железы Са 755, относят эндоцитоз СНМЦ клетками сердечно-сосудистой и ретикуло-эндотелиальной системы.
Таким образом, в качестве недостатков известных из уровня техники решений, можно указать следующие:
- неустойчивость золей цитрат магнетита в полиглюкине, связанную с изменением физико-химических свойств поверхности наночастиц цитрат магнетита в полиглюкине, что приводит к образованию наночастиц диаметром от 190 до 19000 нм, образующих тромбы в сосудах лёгких и гибели животных «на игле»;
- отсутствие технических условий и подробного описания синтеза суперпарамагнитных наносфер и промежуточных продуктов синтеза в доступных источниках информации.
Краткое раскрытие сущности изобретения
Задачей настоящего изобретения является создание способа ранней (через 72 – 96 ч после перевивки) ККМРТ визуализации инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные ткани и кровеносные сосуды для замены существующих инвазивных способов биопсии на неинвазивные способы визуализации.
Технический результат, достигаемый при использовании заявляемого изобретения, заключается в получении суперпарамагнитного средства, представляющего собой СНМЦ с гидродинамическим диаметром от 13 до 18 нм, для ранней визуализации ККМРТ изображений биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в кровеносные сосуды и нормальные ткани. Кроме того, технический результат заключается в обеспечении возможности получения заявляемого суперпарамагнитного средства последовательным синтезом соединений формул 1, 2, 3, 4 и обеспечении возможности его индивидуального применения, а также применения в комбинации с Магневистом при ранней визуализации ККМРТ изображений биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные ткани и кровеносные сосуды. Кроме того, технический результат заключается в формировании оптимального состава комбинации СНМЦ-Магневист и параметров ККМРТ сканирования места введения ЗК.
Заявляемый способ на основе комбинированной контрастной магнитно-резонансной томографической визуализации биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные ткани и кровеносные сосуды обеспечивает:
- успешное применение заявляемого средства сразу после перевивки и при следующей визуализации ККМРТ изображений биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в кровеносные сосуды и нормальные ткани в динамике, которые подтверждают результаты патоморфологических и гистопатологических исследований;
- определение стадий развития ЦПЗК в динамике на иммунокомпетентных животных с перевиваемыми злокачественными опухолями.
Таким образом, преимуществом комбинированной КМРТ визуализации инфильтрации, инвазии и метастазирования злокачественных клеток из ЦПЗК и злокачественных опухолей в нормальные ткани и сосуды в динамике, перед биопсией и другими способами выявления ЗК является одновременное увеличение контраста, разрешения и яркости ККМРТИ этих процессов.
Визуализацию ЗК и ЦПЗК реализуют через 2-4 дня после перевивки ЗК В/В введением заявляемого соединения за 10 мин - 96 ч до ККМРТ мониторинга, с последующим В/В введением Магневиста® за 3 – 9 мин до ККМРТ мониторинга, за счет этого создают контраст, увеличивают разрешение и сокращают время МРТ релаксации Т1, Т2, Т*2 и время ранней ККМРТ визуализации Т1, Т2, Т*2 W 3D ККМРТ изображений высокого разрешения, кроме того, сокращают время, необходимое для выявления центров пролиферации злокачественных клеток с границами инфильтрации, с определением стадий их развития в динамике от 72 до 288 ч.
Для решения поставленной задачи разработаны:
- способ получения суперпарамагнитного средства, СНМЦ общей формулы (Fe3O4·Fe3+O)+ m (C6H7O7)- n (4), где содержание m от 30 до 35 % масс; n от 65 до 70 % масс;
m – представляет собой наносферы кристаллического нестехиометрического магнетита, покрытые катионами трёхвалентного железа, взятые в количестве от 30 до 35 % масс;
n – представляет собой анионы лимонной кислоты, покрывающие кристаллические наносферы нестехиометрического магнетита, взятые в количестве от 65 до 70 % масс.
СНМЦ применяют в качестве негативного контрастного МРТ препарата при ранней и пожизненной ККМРТ визуализации в динамике.
- состав СНМЦ-Магневист (СНМЦ-МВ), содержащий комбинацию негативного и позитивного КМРТ средств в оптимальных соотношениях;
- способ применения СНМЦ общей формулы (4), которые вводят В/В за 10 мин - 96 ч до ККМРТ мониторинга в эксперименте на иммунокомпетентных животных с ЦПЗК и ЗО;
- режим и параметры ККМРТ сканирования тела грызунов на МР томографе при визуализации биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные ткани и питающие кровеносные сосуды с определением стадий развития процесса в динамике.
Поставленная задача решается посредством:
- синтеза нового средства, состоящего из наносфер активированного анионами Cl- магнетита общей формулы (Fe3O4)m (FeOCl)n (3) взаимодействием средства формулы (3) с лимонной кислотой или цитратом натрия, при температуре от +80 ° до + 90 ° С, в результате чего получают СНМЦ общей формулы:
(Fe3O4·Fe3+O)+ m (C6H7O7)- n (4),
где m от 30 до 35 % масс.; n от 65 до 70 % масс.
Гидродинамический диаметр наносфер составляет от 13 до 18 нм. Заявляемое средство может быть использовано для ранней и далее до конца жизни для комбинированной контрастной магнитно-резонансной томографической визуализации ККМРТ изображений биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в кровеносные сосуды и нормальные ткани.
Результаты «поздней визуализации» ККМРТИ ЗО Г С6 представлены на фигурах 1 (h, j), полученных в сроки от 10 до 14 дней.
Через 6-14 дней после перевивки ЗК все близлежащие ЦПЗК сливаются вместе с образованием ЗО. При «поздней» визуализации выявляют ККМРТИ инфильтрации, инвазии и метастазирования ЗК из ЗО в кровеносные сосуды и нормальные ткани, и разрушение ЗО злокачественными клетками, фиг. 1 (h, j).
Поставленная задача решается также посредством разработки способа применения МРТ контрастного негативного средства, включающего следующую последовательность действий:
а) внутривенное введение лабораторным животным от 0,1 до 1 мл/кг, предпочтительно от 0,2 до 3,0 мл / кг, от 2% до 3% водного золя соединения общей формулы
(Fe3O4·Fe3+O)+ m (C6H7O7)- n (4), которое проводят за 10 мин - 96 ч до КМРТ сканирования, за счет этого обеспечивают избирательное увеличение числа чёрных вокселей в ККМРТ изображениях нормальных тканей с сокращением времени Т2 и Т*2 спин спиновой МРТ релаксации протонов молекул гидратной воды нормальных тканей с увеличением контраста и разрешения МРТИ в период времени до 96 ч до КМРТ сканирования;
б) внутривенное введение лабораторным животным от 0,1 до 2,0 мл/кг Магневиста®, предпочтительно от 0,2 до 1,5 мл/кг, которое проводят за 3 - 9 мин до КМРТ сканирования ЦПЗК, обеспечивая избирательное увеличение числа белых вокселей ККМРТ изображений злокачественных клеток млекопитающего с усилением яркости Т1, Т2 и Т*2 W ККМРТ изображений продолжительностью от 30 мин до 40 мин и сокращением времени Т1 градиентного эха (GRE) МРТ релаксации тканей от 10 мин до 30 мин;
в) проведение ККМРТ сканирования тканей в режимах получения Т1 W {600 / 15 [время повторения, мс/время эхо, мс], Т2 W (1950 / 85) спин эхо, Т2W градиент эхо (600 / 13) и Т*2 W градиент эхо (550 / 15)};
г) выявление ЗК и центров пролиферации злокачественных клеток с питающими сосудами и инфильтрацией злокачественных клеток в нормальные ткани на ККМРТ изображениях осуществляют по изменениям интенсивностей чёрных и белых вокселей в исследуемой области.
В качестве лабораторных животных используют грызунов: крыс линии Wistar и мышей линии C57Bl/6j.
В качестве лабораторных животных используют 90 самок крыс весом 180-190 г и 100 самок мышей весом 18-19 г, которых получают по ходу исследований из лаборатории экспериментальных животных ФГБУ НМИЦ онкологии им. Н.Н. Блохина Минздрава России.
Внутривенное введение грызунам 0,2 мл 2% водного золя соединения формулы (4) проводят за 10 мин - 96 ч до ККМРТ сканирования исследуемой области;
Внутривенное введение грызунам Магневиста® проводят из расчета 0,02 – 0,1 мл/кг за 5 мин до ККМРТ сканирования исследуемой области.
Поставленная задача решается также посредством разработки способа проведения МРТ исследования, включающего следующую последовательность действий:
- раннюю, через 48 ч – 96 ч после перевивки 106 злокачественных клеток визуализацию высококонтрастных Т1, Т2 и Т*2 W 3D изображений ЗК высокого разрешения, центров пролиферации злокачественных клеток с питающими их сосудами и границами инфильтрации злокачественных клеток, фигуры 1 (a, a’, b, b’), осуществляют перед ККМРТ сканированием исследуемой области в режиме «Angio».
Для увеличения контраста избирательно понижают яркость нормальных тканей млекопитающего внутривенным введением заявляемого средства общей формулы:
(Fe3O4·Fe3+O)+ m (C6H7O7)- n (4), а яркость ККМРТ изображений злокачественных клеток избирательно повышают внутривенным введением Магневиста®, за счет этого от 4 до 11 дней сокращают время появления на экране сканера ККМРТ изображений ЦПЗК или ЗО, инфильтрации злокачественных клеток через мембрану капсулы и их развития по стадиям. .
Обычно МРТИ ЗО получают через 7-14 дней после их прививки, в соответствии с заявляемым способом ККМРТИ можно получить уже через 3 дня, расчёт экономии времени: 7-3=4; 14-3=11.
На 2-3 день после перевивки ЗК в ЦПЗК недостаточно ЗК, а в МРТИ недостаточно чёрных и белых вокселей, поэтому оно не визуализируется. В/В введение магневиста увеличивает лишь число белых вокселей, но не приводит к визуализации КМРТ изображений. В/В введением заявляемого средства на 3-4 день после перевивки ЗК увеличивают содержание чёрных вокселей в КМРТ изображении ЦПЗК до уровня его визуализации. Последующим введением магневиста увеличивают содержание белых вокселей в ККМРТ изображении до уровня необходимой яркости, но яркость ККМРТИ длится не более 40 мин, далее изображения тускнеют и необходимо дополнительное введение Магневиста.
При ККМРТ мониторинге последовательно визуализируют увеличение объёма ЦПЗК, расширение границ инфильтрации, перфорацию мембраны ЦПЗК, инвазию и диссеминацию ЗК в нормальных тканях;
- внутривенное введение от 0,01 до 0,2 мл / кг Магневиста® обеспечивает увеличение яркости ККМРТ изображений, полученных после В/В введения комбинации СНМЦ-Магневист не более 30 мин. Поэтому за 7-10 мин до хирургического удаления ЦПЗК вместе с частью мозга, расположенного по границам инфильтрации, необходимо дополнительное введение Магневиста, если ККМРТИ успевает потускнеть из-за клиренса магневиста. Это необходимо делать, чтобы не оставлять ЗК, проникшие в нормальный мозг, фигуры 1 (a’, b’, c’).
Через 7-14 дней после перевивки ЗК, ЗО наполнена ЗК. Последовательным В/В, ведением животным заявляемого средства и Магневиста®, визуализируют ЗО, капсулу мембраны которых разрушают ЗК, фигура 1 (h, j).
Таким образом, в рамках изобретения заявляют средство на основе водного золя СНМЦ общей формулы (4):
(Fe3O4·Fe3+O)+ m (C6H7O7)- n (4),
При этом с увеличением, по сравнению с заявляемыми параметрами, отношения % масс m/n от 0,5 до 1,0 увеличивается гидродинамический диаметр СНМЦ от 18 нм до ~ 36 нм, уменьшается растворимость в воде с образованием водного золя ~ в 2 раза, увеличивается острая токсичность СНМЦ при внутривенных инъекциях LD50 мышей C57Bl/6j 0,5 г / кг, LD50 крыс Wistar 0,9 г / кг, а с уменьшением, также по сравнению с заявляемыми параметрами, отношения m/n от 1 до 0,5 увеличивается их растворимость в воде с образованием золя ~ в 2 раза, уменьшается острая токсичность при внутривенных инъекциях LD50 мышей C57Bl/6j 1,5 г / кг, LD50 крыс Wistar 1,9 г / кг.
Краткое описание изображений, поясняющих заявляемое изобретение
На Фиг. 1 (a, a', b, b’, c, c’) представлены Т2 W 3D комбинированные контрастные магнитно-резонансные томографические изображения высокого разрешения срезов ЦПЗК и ЗО глиомы С6, полученных на 5-10 день после стереотаксической перевивки КГ С6: (a) светлые пятна - срезы тяжей, состоящих из ЗК Г С6, под углом ~ 45° (чёрные стрелки), тёмные шарики – цельные ЗК Г С6, покрытые СНМЦ, (белые короткие стрелки), места инфильтрации ЗК в мозг (длинные стрелки); (a’) инфильтрация ЗК в мембрану капсулы (короткие стрелки) и в нормальные ткани мозга (инфильтрировавшие ЗК как пух окутывают ЦПЗК и ЗО), инфильтрация ЗК (длинная стрелка); (b) светлые пятна – ~ 45° срезы тяжей, состоящих из ЗК (чёрные стрелки), тёмные шарики – цельные ЗК (белые стрелки); (b’) светлые пятна - ~ 45° срезы тяжей, состоящих из ЗК, тёмные шарики – цельные ЗК (белые стрелки);
(с) пролиферирующие ЗК, покрытые СНМЦ (между 4 белыми стрелками) и светлое пятно вокруг тёмного кольца создают молодые дочерние КГ С6, которые не покрыты СНМЦ, пролиферация ЗК, инфильтрировавших из ЦПЗК через мембрану капсулы в нормальный мозг, светлое пятно в центре тёмного кольца - срезы ЗК, спиралевидные сосуды, питающие ЦПЗК, (чёрные стрелки), инвазия ЗК из ЦПЗК в мозг и близлежащий кровеносный сосуд (длинная чёрная стрелка); (с’) инвазия ЗК, покрытых СНМЦ, из ЦПЗК в кровеносный сосуд (чёрные стрелки); митоз и пролиферация ЗК (концы белых стрелок).
Материальный баланс опухоли: средний диаметр опухоли 4 мм. Из опухоли получили 3 МРТ среза толщиной 0,5 мм + 2 пропуска по 1 мм = 3,5 мм.
На Фиг. 1 (d, d’, e, е’) представлены Т2 W 3D комбинированные контрастные магнитно-резонансные томографические изображения высокого разрешения срезов ЗО глиомы С6, полученных на 7 день после стереотаксической перевивки КГ С6: (d) светлое круглое пятно - срез ЗК, находящихся в ЗО (большая чёрная стрелка), ЗО покрыта мембраной капсулы (2 маленькие белые стрелки), через которую ЗК инфильтрируют в ближайший кровеносный сосуд (3 большие белые стрелки), на изображении сосуда видно лишь его содержимое, стенки кровеносного сосуда не визуализируют, поэтому ЗК, прикрепившиеся к стенке сосуда, (вид сбоку) как-бы повисают рядом с ним (между большой и маленькой белыми стрелками). ЗО покрыта несколькими слоями сетчатой мембраны капсулы (5 маленьких белых стрелок), слои мембраны неравномерной толщины и проницаемы для ЗК (большая чёрная стрелка);
На Фиг. 1 (d’) белое, светлое пятно (большая чёрная стрелка) срез ЗК, которые находятся в капсуле ЗО, разрушаемой ЗК, (маленькие чёрные стрелки), инфильтрация ЗК из ЗО в ближайший кровеносный сосуд (между белой и чёрной стрелками). Инфильтрация ЗК в мембрану капсулы ЗО (маленькие чёрные стрелки); инфильтрация и инвазия ЗК из мембраны капсулы в нормальные ткани и малигнизированный спиралевидный кровеносный сосуд.
Множественная инфильтрация ЗК инициирует инвазию ЗК, при которой части мембраны, переполненные ЗК, отделяются от ЗО и открывают доступ СНМЦ к ЗК. Место выходящих из ЗО ЗК занимают СНМЦ (две наружные короткие, толстые белые стрелки).
На Фиг. 1 (e, е’) круглое белое, светлое пятно (большая чёрная стрелка) срез ЗК, которые находятся в капсуле ЗО, разрушаемой ЗК, (маленькие чёрные стрелки), инфильтрация ЗК из ЗО в ближайший кровеносный сосуд (большая белая стрелка). Инфильтрация ЗК в мембрану капсулы ЗО (маленькие чёрные стрелки); инфильтрация и инвазия ЗК из мембраны капсулы в нормальные ткани и малигнизированный спиралевидный кровеносный сосуд. представлено, как при множественной инфильтрации ЗК переполняют мембрану капсулы ЦПЗК, но мембрана не перфорирована, инфильтрировавшие мембрану ЗК (маленькие чёрные стрелки) проникают в кровеносный сосуд (белая стрелка), прикрепляются к крупным кровеносным сосудам, малигнизируют их, пролиферируют, проникают в сосуды и в левую половину мозга (концы белых стрелок).
На Фиг.1 (h, j) представлены Т2 W 3D, ККМРТ изображения высокого разрешения среза злокачественной опухоли Г С6 с визуализацией злокачественных клеток, процесса деградации мембраны капсулы ЗО и обсеменения всего мозга ЗК: (h) ЗО (между чёрными и белыми стрелками), питающие сосуды покрыты ЗК (белые и чёрные стрелки), мембрану, покрывающую ЗО, разрушили ЗК (маленькие чёрные стрелки), при инвазии ЗК в мозг, одновременно проникают СНМЦ в ЗО, (потемнение тканей ЗО), тёмные полосы -фрагменты многослойной мембраны ЗО; (j) фрагменты многослойной мембраны ЗО встречаются по всему мозгу (белые стрелки), плотность ЗК в мозге настолько велика, что питающие сосуды и клетки мозга не различимы.
На Фиг. 2 (a, b, c) представлена гистограмма участка ЦПЗК, включающая: (a) центр митоза и пролиферации злокачественных клеток, в котором преимущественно содержатся злокачественные клетки Г С6 в состоянии митоза и пролиферации; (b) мембрану ЦПЗК, состоящую из макрофагов, лимфоцитов, лейкоцитов и других иммунокомпетентных клеток (ИКК) в контакте со ЗКГ С6; (c) пограничные с мембраной ЦПЗК ткани мозга, содержащие много свежих (не имевших контакт со ЗК) макрофагов, лимфоцитов, лейкоцитов и небольшое число клеток Г С6. Злокачественные клетки, покрытые СНМЦ, окрашены по Перлсу, имеют тёмно-синюю окраску, округлую форму, ядро и мигрируют из центра митоза и пролиферации злокачественных клеток в нормальные ткани мозга (чёрные стрелки). Макрофаги, крупные светло-синие клетки, непредсказуемой формы, составляющие от 60 до 80% клеток в структуре мембраны ЦПЗК, мигрируют в сторону центра митоза ЗК (ЦМЗК) (белые стрелки). Снаружи мембраны ЦПЗК расположены подвижные, способные эндоцитировать, убивать и дефрагментировать ЗК, макрофаги и яйцевидные ЗК, преодолевшие мембрану ЦПЗК. Окраска по Перлсу, Х700.
На Фиг. 3 (а, b, c) представлена гистограмма пролиферирующих ЗК ЦПЗК глиомы С6 самки крысы Вистар на 10 день после интракраниальной, стереотаксической интрацеребральной инокуляции клеток Г С6: (a) полиморфные ЗКГ С6в состоянии митоза, который нарушают макрофаги (белые стрелки); (b) крупные, светлые клетки - макрофаги, которые затрудняют митоз ЗК, в макрофагах по всей площади гистограммы фрагменты ЗК (сине-фиолетовые точки, линии и пятна); (c) фрагментация ЗК внутри макрофагов (чёрные стрелки). Окрашивание по Перлсу, Х3000.
На Фиг.4 (a, b) представлены Т2 W 3D ККМРТ изображения высокого разрешения злокачественных клеток эпидермоидной карциномы лёгких Льюис (КЛЛ) на самках мышей С57Bl/6j. ККМРТ изображение инвазии ЗК КЛЛ из опухоли в нормальные ткани:
- (a) инвазия ЗК КЛЛ из опухоли (чёрные стрелки), пролиферация ЗК в лёгких (белые стрелки);
- (b) место инвазии жгута, который образовался при скручивании трёх злокачественных тяжей в опухолевой капсуле карциномы лёгких Льюис, расположенной в мышце бедра (две чёрные стрелки), жгут проникает через мембрану первичной опухоли в нормальные ткани (чёрная стрелка сверху); в нормальных тканях жгут распускается на отдельные тяжи (длинная белая стрелка сверху); клетки эпидермоидной карциномы лёгких Льюис, из которых состоят тяжи, делятся и пролиферируют в нормальных тканях с образованием кольцевых структур и вторичных ЦПЗК (короткие белые стрелки).
На Фиг. 5 (a, b, c) представлены Т2 W 3D ККМРТ изображения высокого разрешения злокачественных клеток аденокарциномы молочной железы Са 755 на МРТ срезах опухоли самок мышей С57Bl/6j, цельные ЗК – тёмные шарики т.к. покрыты СНМЦ, срезы ЗК - светлые шарики с тёмной полосой по периметру:
- (a) cлияние ЗК из 2х ЦПЗК, с образованием злокачественной опухоли (чёрные длинные стрелки), биомеханическая перфорация мембраны капсулы ЗО с частичным отщеплением её участка под давлением ЗК и инвазия ЗК через образовавшееся отверстие в жировую клетчатку (2 чёрные короткие стрелки снизу);
- (b) вторичная ЗО Са 755 и её ЗК (белые длинные стрелки), мембрана капсулы ЗО (между короткими чёрной и белой стрелками), жировая клетчатка (длинная чёрная стрелка);
- (с) злокачественные клетки Са 755 (белые стрелки), мембрана капсулы ЗО (между короткими чёрной и белой стрелками), жировая клетчатка (длинная чёрная стрелка).
На Фиг. 6 (a, b, c) в режиме «Ангио» представлены Т2 W 3D ККМРТ изображения высокого разрешения злокачественных клеток меланомы В16F-11 на 14 день после перевивки самкам мышей С57Bl/6j: (a) ЗК меланомы В16F-11 покрывают все сосуды, питающие опухоль (длинная белая стрелка);
(b) ЗК покрывают все кровеносные сосуды, кроме того, образуют множественные метастазы в левой и правой половинах тела мыши (между стрелками), извитые сосуды, характерные для ЗО (чёрная стрелка); (с) ЗК В16F-11 в состоянии митоза и пролиферации (концы белых стрелок).
Осуществление изобретения
Для получения СНМЦ заявляемого состава водные растворы солей 2х и 3х валентного железа превращают в гидроксиды железа при рН 10-11 (25% NH4OH). Суспензию гидроксидов железа нагревают до (+80) – (+90) ° С при перемешивании, и получают водную суспензию кристаллов магнетита:
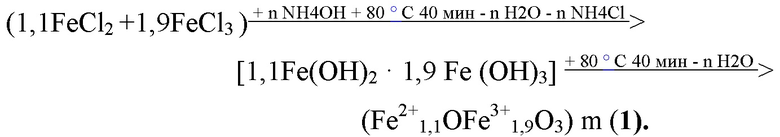
Кристаллы полученного магнетита формулы (1) перемешивают от 20 до 30 мин с 3% - 5% водным раствором FeCl2·4Н2О. Получают суспензию кристаллов магнетита, с поверхностью обогащённой катионами Fe2+, (Fe2+1,1OFe3+1,9O3)m·(FeCl2)n (2). Кристаллы магнетита общей формулы (2) обрабатывают 36% хлористоводородной кислотой от 2 до 3 ч. при перемешивании:
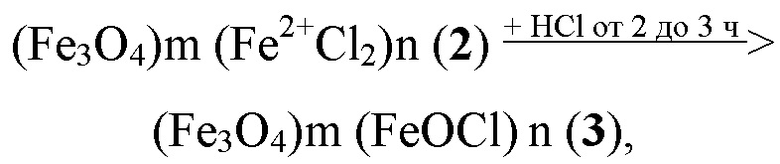
Суспензию кристаллов магнетита центрифугируют в течение 3 мин при 2000 об. / мин, супернатант собирают и пропускают через фильтры «Миллипор». Получают водный золь суперпарамагнитных наносфер активированного магнетита диаметром 11-14 нм, общей формулы:
(Fe3O4)m (FeOCl) n (3).
Покрытие наносфер общей формулы (3) ведут путём замещения анионов Сl¯ на цитрат анионы (C6H7O7)¯нагреванием водного золя суперпарамагнитных наносфер активированного магнетита от (+80) до (+90) ° С и перемешиванием с лимонной кислотой до образования водного золя соединения общей формулы (4),
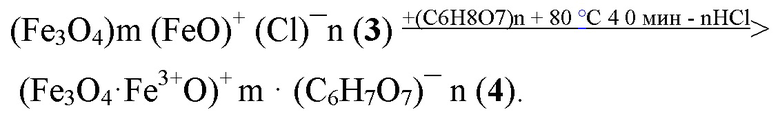
Для синтеза СНМЦ берут от 10% до 300% избыток (C6H8O7 ·H2O). К прозрачному 10% водному раствору лимонной кислоты или цитрата натрия при перемешивании добавляют водный золь наносфер активированного магнетита общей формулы (3), перемешивают при температуре от (+80) до (+90) °С, до образования водного золя соединения общей формулы (4). Золь очищают от исходных веществ в неоднородном постоянном магнитном поле индукцией 0,2 Тл, градиент 0,001 Тл / см. Получают СНМЦ общей формулы (4), с гидродинамическим диаметром от 13 до 18 нм. Намагниченность насыщения (Ms) СНМЦ составляет: от 6,3 кА / м до 8,9 кА / м; pH водного золя 6,5-6,9; ζ потенциал -31 ± 5 мВ; релаксивность 4550 ± 90 мл · мг - 1 с - 1. Растворимость в воде с образованием от 0,01 до 50% масс золя при 20 ° С.
Концентрация СНМЦ водного золя от 0,1 до 50% масс, удельное поглощение энергии (UAE) от 210 до 260 Вт / г Fe.
Онкогенез ЦПЗК
Митоз и пролиферация ЗК с образованием ЦПЗК происходят незаметно во время латентного периода развития ЗО, когда выявление и идентификация патологического процесса существующими методами ограничена малым числом ЗК и размерами ЦПЗК (от 30,0 мкм до 5,0 мм в диаметре). Привитые злокачественные опухоли могут образоваться в результате слияния нескольких ЦПЗК в процессе их развития. Часто глиальные ЗО Г С6 развиваются быстрее карциномы Эрлиха. На 3-10 день ЗК Г С6 визуализируют в режиме «Ангио» в местах перевивки, на ККМРТ изображениях срезов ЦПЗК, см. фиг. 1 (a, b, c, c’); на поверхности питающих ЦПЗК и ЗО кровеносных сосудов и в пространствах между сосудами, см. фиг.1 (d, d’, e, е’) и фиг. 6 (a, b, c).
ЗК малигнизируют участки сосудов и проникают внутрь сосудов. По сосудам ЗК попадают во все части мозга и тела с образованием ЦПЗК, см. фиг.1 (d, d’, e, е’), фиг. 4 (a, b, c), фиг. 5 (a, b, c) и фиг. 6 (a, b, c). Во время активной пролиферации (5-14 день после перевивки) объём ЗК, ЦПЗК и ЗО Г С6 увеличивается так быстро, а ЗК внедряются в мембрану капсулы и вызывают её перфорации так часто, что иммунокомпетентные клетки (ИКК) не успевают поддерживать «непроницаемость» мембраны капсулы. Через интактную мембрану капсулы ЦПЗК происходит инфильтрация ЗК и последующее метастазирование, фиг. 1 (d, d’, e, e’), фиг. 6 (a, b, c), а через образовавшиеся при перфорации мембраны капсулы ЗО отверстия происходят инвазии ЗК в нормальные ткани, фиг. 4 (a, b, c), фиг. 5 (a, b, c). Множественные перфорации постепенно разрушают мембрану капсулы ЗО. В конце онкогенеза остатки мембраны часто встречаются на месте распадающейся ЗО, остальное пространство черепа занимают ЗК, фиг. 1 (j).
Основным преимуществом комбинированной КМРТ визуализации В/В введением заявляемой комбинации СНМЦ-МВ, перед биопсией и другими способами диагностики онкологических заболеваний, является: выявление процессов инфильтрации злокачественных клеток, фиг. 1 (a, b, c, c’, e, e’); инвазии ЗК, фиг. 1 (d, d’, e, e’), фиг. 4 (a, b, c), фиг. 5 (a, b, c). Выявления множественного метастазирования злокачественных клеток, фиг. 6 (a, b, с); уничтожения питающих сосудов и разрушения мембраны злокачественной опухоли пролиферирующими злокачественными клетками, фиг. 1 (h, j).
Для выявления инфильтрации, инвазии и метастазирования ЗК из ЗО, в соответствии с заявляемым способом, последовательно внутривенно вводят заявляемую комбинацию СНМЦ (гидродинамический диаметр от 13 до 18 нм) и Магневист® (СНМЦ-МВ).
Комбинированная КМРТ визуализация биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО, заявляемой комбинацией СНМЦ-МВ включает две последовательные внутривенные инъекции контрастных средств и является малоинвазивной, кроме того, на 3 дня сокращается время и повышается безопасность и точность постановки диагноза по сравнению с биопсией.
Последовательное внутривенное введение комбинации негативного и позитивного МРТ контрастных препаратов СНМЦ-МВ приводит к ранней визуализации ККМРТ изображений биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в сосуды и нормальные ткани.
Кроме того, визуализируют состояния:
- отёка, митоза, малигнизации, неоангиогенеза, образования ЦПЗК и ЗО с мембранами капсул, см. фиг. 1 (a, b, c, c’, d, d’, e, е’), фиг. 4 (a, b, c), фиг. 5 (a, b, c), фиг. 6 (a, b, c).
- слияния нескольких ЦПЗК с образованием ЗО, см. фиг. 5 (a, b, c); фиг. 6 (a, b, c);
- разрушения мембраны капсулы и сосудистой системы ЗО, см. фиг. 1 (h, j);
- распада ЗО с диссеминацией всего организма ЗК, см. фиг. 1 (h, j).
Преимущества ККМРТИ высокого разрешения, по сравнению с КМРТИ, заключаются в том, что визуализируют процессы инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные ткани и сосуды в динамике, см. фиг.1 (a, b, c, d, d’, e, е’); фиг. 4 (a, b, c); фиг. 5 (a, b, c); фиг. 6 (a, b, c). Кроме того, визуализируют: ЗК, покрывающие, малигнизирующие и уничтожающие кровеносные сосуды, нормальные клетки и мембрану капсулы ЗО, фиг. 1 (h, j).
ККМРТ визуализация изображений процесса инвазии ЗК из правой половины мозга в левую половину мозга, фиг. 1 (d).
ККМРТ визуализация изображений процесса инфильтрации ЗК из правой половины мозга в левую половину мозга, фиг. 1 (e, e’).
При ККМРТ сканировании в динамике процесс инвазии ЗК из ЗО, фиг. 1 (d, d’), визуализируют как перемещение круглых светлых пятен из ЗО (короткая чёрная стрелка) в мембрану капсулы и из мембраны капсулы в кровеносный сосуд:
- фиг. 1 (d, d’) - несколько светлых пятен это - ЗК на месте инфильтрации (выхода) ЗК из ЗО в мембрану капсулы (длинная белая стрелка), из мембраны капсулы, через стенку кровеносного сосуда ЗК проникают в сосуд (длинная белая стрелка), светлое пятно визуализируют в месте проникновения (входа) ЗК в кровеносный сосуд (длинная белая стрелка);
- фиг. 1 (d, d’) - инвазия ЗК через отверстие в мембране ЗО, в кровеносный сосуд (между тремя длинными белыми стрелками), в сосуде визуализируют пролиферацию ЗК с образованием яркой светлой полосы (белая стрелка);
- фиг. 1 (e, e’) - через стенку кровеносного сосуда ЗК проникают в левую половину мозга под углом 90°, инфильтрация ЗК из кровеносного сосуда в нормальный мозг (между белой и чёрной стрелками). В результате повторяющихся инфильтраций ЗК проникают из ЗО в сосуды, а из сосудов в левую половину мозга и распространяются по всему организму. ЗК, инфильтрировавшие в левую половину мозга, пролиферируют, и участок мозга левой половины головы светлеет, фиг. 1 (e, e’).
По кровеносным сосудам ЗК распространяются по всему организму, изнутри прикрепляются к стенкам сосудов и вызывают многочисленные метастазы, из которых образуются вторичные ЗО, см. фиг. 6 (a, b, c).
ЗК разрушают нормальный мозг и кровеносные сосуды, вызывают: отёки, малигнизации, инфильтрации, инвазии и метастазирования. ЗК разрушают: мембрану капсулы ЗО, уничтожают кровеносные сосуды и все нормальные клетки мозга, и занимают их место, см. фиг. 1 (h, j).
Стадирование онкогенеза
На основании результатов ККМРТ сканирования в динамике развития неоангиогенеза, пролиферации, образования ЦПЗК и ЗО, инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в кровеносные сосуды и нормальный мозг с последующей деградацией ЗО, регистрируют последовательный переход заболевания от стадии к стадии:
- пролиферация ЗК и иммунный ответ в виде образования объёмной, сетчатой, мембраны капсулы ЦПЗК, «изолирующей» ЗК от нормального мозга – 1 стадия, митоз ЗК, пролиферация и развитие ЦПЗК с мембраной капсулы, фиг. 1 (a, a’, b, b’, c, c’);
- малигнизация кровеносных сосудов и покрытие питающих ЦПЗК кровеносных сосудов злокачественными клетками, увеличение интерстициального давления внутри ЦПЗК, растяжение мембраны капсулы ЦПЗК с увеличением объёма ЦПЗК – 2 стадия развития ЦПЗК, покрытие сосудов злокачественными клетками, с расширением границ и увеличением объёма ЦПЗК фиг. 1 (a, a’, b, b’, c, c’);
- контролируемая макрофагами и лимфоцитами инфильтрация ЗК через естественную мембрану капсулы и стенки сосудов в нормальный мозг - 3 стадия развития ЗО, фиг. 1 (d, d’, e, е’);
- переполнение макрофагов злокачественными клетками и их частями с потерей подвижности макрофагов, оттеснение обездвиженных макрофагов и убитых ЗК пролиферирующими злокачественными клетками в мембрану капсулы;
- отсутствие свежих макрофагов, лимфоцитов и других ИКК в ЦПЗК или ЗО, инвазия ЗК через перфорированную мембрану капсулы в нормальные ткани с проникновением СНМЦ в ЗО и покрытием ЗК слоем СНМЦ - 4 стадия развития злокачественных опухолей, фиг. 1 (c, c’, d, d’, h); фиг. 4 (a, b, c); фиг. 5 (a, b, c); фиг. 6 (a, b, c);
- метаболизм питающих сосудов и клеток нормального мозга злокачественными клетками – 5 стадия развития злокачественных опухолей, фиг. 1 (h, j).
Введенные в нормальные ткани тела в процессе перевивки ЗК пролиферируют, малигнизируют и инфильтрируют сосуды, капилляры и окружающие ткани, прикрепляются к сосудам снаружи, несколькими слоями покрывают сосуды, проникают внутрь сосудов, пролиферируют с образованием ЦПЗК и ЗО, фиг. 1 (a, b, c, c’, d, d’, e, е’, h). После малигнизации и проникновения ЗК в сосуды они распространяются по всему телу с образованием многочисленных метастазов, делая заболевание практически неизлечимым, фиг. 1 (c, c’, d, d’, e, е’); 6 (a, b, c). Без лечения грызуны живут от 7 до 34 дней.
При проведении КМРТ вводят Магневист® В/В и сканируют тело в различных режимах: визуализация изображений ЗК, инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО не происходит.
Биомеханика процессов инфильтрации, инвазии и метастазирования ЗК
Для визуализации особенностей биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО, по заявляемому способу, последовательно В/В вводят заявляемую комбинацию СНМЦ и Магневист® (СНМЦ-МВ). ККМРТ сканирование места перевивки ЗК ведут в режимах получения Т1, Т2 и Т*2 W градиент эхо 3D изображений высокого разрешения с визуализацией проникновения отдельных ЗК изнутри ЦПЗК в «толщу» мембраны её капсулы. Последующей инфильтрации ЗК из мембраны капсулы в пограничные нормальные ткани и сосуды, см. фиг. 1 (c, c’, d, d’); 4 (a, b, c); 5 (a, b, c).
С повышением интерстициального давления в капсуле ЦПЗК и ЗО всё большее число ЗК в минуту проникает в толщу мембраны капсулы. Множественная инфильтрация ЗК предшествует инвазии ЗК, см. фиг. 1 (c, c’, d, d’).
Собственным механическим давлением на мембрану, проникновением в щели мембраны, своим присутствием в мембране, своими выделениями ЗК разрыхляют её сетчатую структуру и вызывают инвазию ЗК, фиг. 1 (c, c’, d, d’); 4 (a, b, c); 5 (a, b, c).
Всё большее число ЗК инфильтрирует в нормальные ткани. Наконец происходит биомеханическая перфорация мембраны, и поток ЗК вырывается из ЦПЗК или ЗО в нормальные ткани, см. фиг. 1 (a, a’, b, b’, c, c’, d, d’); 4 (c); 5 (a, b, c).
Пример 1.
Через 2-4 дня после перевивки ЗК глиомы С6 вводят вместо заявляемой комбинации СНМЦ-МВ, только МВ. Сразу после введения МВ сканируют место перевивки в режимах получения Т1, Т2 и Т*2 W градиент эхо 3D изображений высокого разрешения. Воспроизводимые ранние контрастные 3D изображения высокого разрешения ЗК, центров пролиферации злокачественных клеток (ЦПЗК) и ЗО млекопитающих не визуализируются. Без последовательного В/В введения СНМЦ-МВ визуализация Т1, Т2 и Т*2 W градиент эхо 3D изображений высокого разрешения инфильтрации, инвазии и метастазирования ЗК в нормальные ткани не происходит.
На основании ККМРТ изображений высокого разрешения ЗК, ЦПЗК и ЗО, полученных МРТ сканированием грызунов в динамике, определяют строение ЦПЗК и ЗО, расположение пролиферирующих ЗК в ЦПЗК и ЗО в реальном времени, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’, h, j); фиг. 4 (a, b, c); фиг. 5 (a, b, c) и фиг. 6 (a, b, c).
Полученные ККМРТИ подтверждают гистограммы того же участка головного мозга, занятого ЦПЗК или ЗО глиомы С6. На ККМРТИ представлены ЗК в состоянии митоза, пролиферации и эндоцитоза макрофагами. Макрофаги изменяют форму ЗК, контактирующих с ними. Они препятствуют нормальному прохождению митоза, убивают и фрагментируют попавшиеся им при эндоцтозе ЗК, см. фиг. 2 (a, b, c); фиг. 3 (a, b, c).
С помощью ККМРТС выявляют ЦПЗК с границами инфильтрации ЗК в нормальные ткани, размеры и особенности инфильтрации и инвазии ЗК в нормальные ткани правой и левой половин мозга, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’).
Исследуют процессы:
- покрытия, малигнизации и инфильтрации питающих кровеносных сосудов злокачественными клетками, см. фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’); фиг. 6 (a, b, c);
- инфильтрации ЗК в кровеносные сосуды из ЦПЗК и ЗО правой половины мозга, а из сосудов в нормальные ткани левой половины мозга, фиг. 1 (d, d’, e, e’);
- перфорации и деструкции мембраны капсулы ЦПЗК под действием ЗК, фиг. 1 (d, d’, e, e’, h, j);
- деструкции питающих кровеносных сосудов, покрытых ЗК, фиг. 1 (d, d’, e, e’, h, j);
- деструкции ЦПЗК и ЗО под действием ЗК, фиг. 1 (d, d’, e, e’, h, j);
- деструкции ЗК под действием эндоферментов макрофагов, фиг. 3 (a, b, c).
Тестируют:
- 2% и 3% водные золи суперпарамагнитных наносфер магнетита цитрата диаметром от 13 до 18 нм, в качестве негативного контрастного магнитно-резонансного томографического (КМРТ) средства в комбинации с Магневистом®, которые вводят последовательно В/В при изменяющихся соотношениях и условиях в зависимости от поставленных задач.
Для предварительной оценки контрастирующих МРТ свойств СНМЦ, самкам мышей C57Bl/6j с карциномой легких Льюис (КЛЛ), аденокарциномой молочной железы Са 755, или меланомой В16 внутривенно вводят от 0,1 до 0,2 мл / кг 3% водный золь СНМЦ, или комбинацию СНМЦ - Магневист®.
Для оценки контрастирующих МРТ свойств комбинации СНМЦ-МВ, вначале вводят 0,2 мл / кг 3% водный золь СНМЦ. Дают мышам отдых от 1 ч до 24 ч. За 3-5 мин до ККМРТ сканирования вводят 0,2 мл / кг Магневист®. Сканируют, получают ККМРТИ высокого разрешения с визуализацией изображений инфильтрации, инвазии и метастазирования злокачественных клеток из центров пролиферации ЗК (ЦПЗК) и злокачественных опухолей в нормальные сосуды и ткани.
Биологические свойства СНМЦ
Острая токсичность СНМЦ при внутривенных инъекциях LD50 мышей C57Bl/6j 1,2 г / кг, LD50 крыс Wistar 1,7 г / кг. Злокачественные клетки, после их покрытия СНМЦ, продолжают делиться и пролиферировать, каждая из дочерних клеток содержит на поверхности ~ 1/2 материнских СНМЦ. При внутривенном введении мышам или крысам 0,2 мл / кг СНМЦ в виде 3% водного золя, наносферы быстро проникают в нормальные ткани и распределяются в них, понижают МРТ сигнал протонов молекул гидратной воды нормальных тканей и увеличивают число чёрных вокселей. Интактная мембрана ЦПЗК и ЗО богатая свежими макрофагами, лимфоцитами и другими ИКК, не пропускает СНМЦ внутрь ЦПЗК и ЗО. Поэтому ЗК в ЦПЗК остаются светлыми. Введение Магневиста® увеличивает число белых вокселей и яркость ЗК. Это создаёт контраст и повышает разрешение между ЦПЗК, ЗО и нормальными тканями. При ККМРТ сканировании в течение 30 – 40 мин получают яркие контрастные магнитно-резонансные томографические изображения высокого разрешения ЗК, покрывающих сосуды мозга; ЗК, находящихся в метастазах, ЦПЗК и ЗО, которые визуализируют в виде ККМТ срезов на темном фоне нормальных тканей, содержащих СНМЦ, см. фиг. 1 (a, b, c, c’). До проникновения СНМЦ через мембрану ЦПЗК или ЗО их содержимое остаётся светлым, фиг. 1 (d, d’, e, е’). После перфорации мембраны СНМЦ проникают в ЦПЗК и ЗО в неограниченных количествах и покрывают каждую ЗК. ККМРТИ ЦПЗК и ЗО темнеют, см. фиг. 1 (a, a’, b, b’, c, c’, h, j); 4 (a, b, c); 5 (a, b, c); 6 (a, b, c).
В организме грызунов несколько ЦПЗК сливаются вместе, с образованием ЗО, мембрана капсулы которых постепенно разрушается и частично метаболизируется ЗК, фиг. 1 (h, j). При однократном системном введении мышам или крысам 0,2 мл / кг 2% водного золя СНМЦ клиренс заканчивается через 6 месяцев в результате их полного метаболизма.
Ранняя визуализация онкогенеза это – получение ККМРТИ образования ЦПЗК в динамике от 3 до 5 дней после перевивки ЗК (латентный период развития опухолей длится в среднем 6 дней, ККМРТ изображения ЦПЗК и ЗО во время латентного периода до нас не получали).
Образование ЦПЗК мы относим к 1-2 стадиям онкогенеза.
Впервые представлены ККМРТ изображения онкогенеза по стадиям:
1 стадия - пролиферация ЗК, неоангиогенез и образование мембраны капсулы;
2 стадия - покрытие кровеносных сосудов, питающих ЦПЗК, злокачественными клетками, фиг. 1 (b; b’), с расширением границ и увеличением объёма ЦПЗК, фиг. 1 (a'; b’);
3 стадия - интенсивная инфильтрация ЗК через мембрану капсулы ЗО в сосуды и в нормальный мозг; фиг. 1 (d; d’);
4 стадия - инвазия ЗК через перфорированную мембрану капсулы ЗО фиг. 1 (e; e’); в нормальные ткани и сосуды с проникновением СНМЦ в ЗО и покрытием ЗК чёрной плёнкой СНМЦ, фиг. 1 (e; e’);
5 стадия - уничтожение питающих сосудов и клеток нормального мозга злокачественными клетками, фиг. 1 (h; j).
Основным преимуществом комбинированной КМРТ визуализации перед биопсией и другими способами диагностики онкологических заболеваний, путём увеличения контраста, разрешения и яркости ККМРТИ В/В введением СНМЦ-МВ, является выявление: процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в сосуды и нормальные ткани, фигуры 1 (a, b, c, d, e, h, j); 4 (a, b, c); 5 (a, b, c); 6 (a, b, с), которые подтверждаются гистограммами того же участка ЦПЗК или ЗО, фигуры 2 (a, b, c); 3 (a, b, c).
К поздней визуализации мы относим получение ККМРТИ ЗО сканированием места прививки после В/В введения СНМЦ-Магневист через 7-14 дней после перевивки ЗК. В это время происходят: пролиферация, интенсивная инфильтрация ЗК через мембрану опухолевой капсулы, инвазия и метастазирование ЗК, которые наблюдаются на ККМРТИ ЗО в динамике (3-4 стадии, при которых интенсивное лечение современными препаратами в клинике приводит к замедлению онкогенеза на 3-5 лет).
Ранняя ККМРТ визуализация биомеханики процессов инфильтрации, инвазии и метастазирования ЗК
Для реализации ранней ККМРТ визуализации изображений биомеханики процессов инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные ткани внутривенно вводят:
-от 0,1 до 3 мл / кг, предпочтительно от 0,2 до 1,0 мл / кг, от 2% до 3% водного золя соединения общей формулы (4) за 10 мин -96 ч до ККМРТ сканирования, этим обеспечивают избирательное увеличение числа чёрных вокселей в ККМРТ изображениях нормальных тканей с сокращением времени Т2, Т*2 W 3D ККМРТ изображений спин спиновой МРТ релаксации протонов молекул гидратной воды нормальных тканей с увеличением контраста и разрешения ККМРТИ от 10 мин до 96 ч;
- от 0,1 до 0,2 мл / кг Магневиста®, предпочтительно от 0,2 до 0,15 мл/кг, за 3 - 9 мин до раннего ККМРТ сканирования ЗО, этим обеспечивают избирательное увеличение числа белых вокселей ККМРТ изображений ЗК и ЦПЗК млекопитающего с усилением яркости Т1, Т2 и Т*2 W 3D ККМРТ изображений продолжительностью от 30 мин до 40 мин и сокращением времени Т1 градиентного эха (GRE) КМРТ релаксации тканей от 10 мин до 30 мин.
Выполняют раннюю, через 48 ч – 96 ч после имплантации 106 злокачественных клеток, визуализацию высококонтрастных Т1, Т2, Т*2 W 3D изображений высокого разрешения злокачественных клеток, центров пролиферации злокачественных клеток с питающими их сосудами и границами инфильтрации злокачественных клеток в нормальных тканях.
Таким образом, перед ККМРТ сканированием ЦПЗК в режиме «Angio» для увеличения контраста и объёмного разрешения ЗК избирательно понижают яркость нормальных тканей млекопитающего внутривенным введением заявляемого средства общей формулы (4), а яркость ККМРТ изображений злокачественных клеток избирательно повышают внутривенным введением Магневиста®.
За счет этого от 3 до 11 дней сокращают время визуализации ККМРТ изображений ЗК, центров пролиферации злокачественных клеток, инфильтрации, инвазии, метастазирования злокачественных клеток и их развития по стадиям.
Выявление центров пролиферации с визуализацией злокачественных клеток с питающими сосудами, границами инфильтрации, и определением стадий их развития в динамике осуществляют с помощью комбинированного контрастного магнитно-резонансного томографического мониторинга. Во время проведения ККМРТ мониторинга последовательно увеличивают число чёрных вокселей в нормальных тканях и белых вокселей в ЗТ, визуализируют ККМРТИ высокого разрешения ЦПЗК и ЗО.
Выявляют:
- пролиферацию ЗК и развитие ЦПЗК в месте прививки;
- увеличение числа ЗК и объёма ЦПЗК в динамике;
- расширение границ инфильтрации ЗК в динамике;
- наличие перфораций мембраны капсулы ЦПЗК и ЗО злокачественными клетками;
- инвазию и диссеминацию ЗК в нормальные ткани;
- метастазирование ЗК в нормальные ткани;
- разрушение мембраны капсулы ЗО злокачественными клетками и диссеминацию нормальных тканей ЗК.
Внутривенное введение от 0,1 до 0,2 мл/кг Магневиста® проводят для увеличения контраста и яркости ККМРТ изображений, полученных после В/В введения комбинации СНМЦ-МВ, за 7-10 мин до хирургического удаления ЦПЗК вместе со слоем нормального мозга, расположенным по границам инфильтрации, таблицы № 4, 5, 6.
Приведенные ниже примеры не являются ограничивающими изобретение.
Синтез СНМЦ с увеличенным содержанием катионов Fe2+
Пример 2. Синтез нанокристаллов магнетита, обогащённого катионами Fe2+
Готовят раствор смеси 22 г FeCl2·4H2O и 55 г FeCl3·7H2O в 500 мл воды, пропускают через стеклянный фильтр № 4, получают прозрачный фильтрат №1.
В водный 25% раствор гидроксида аммония с 20% избытком (40 г NH4OH, 150 мл) быстро (в течение 2 сек) прибавляют фильтрат №1 при перемешивании 3500 об. / мин. Продолжают перемешивать 30 мин при рН от 10 до 11 до полного превращения солей железа в гидроксиды железа:
[1,1Fe(OH)2, + 1,9Fe(OH)3], рН суспензии от 10 до 11, таблица № 1.
Водную суспензию смеси полученных гидроксидов нагревают40 мин при +85 - +90 °С при перемешивании 3500 об. / мин. Чистят от примесей в неоднородном постоянном магнитном поле (НПМП) индукцией от 0,2 до 3,0 Тл, градиент от 0,0012 до 0,013 Тл / см.
Получают 20 г нанокристаллов обогащённого Fe2+магнетита c профицитом Fe2+. Магнетит, обогащённый Fe2+ состава:
(Fe2+1,1O · Fe3+1,9O3) m, выход 85%.
При синтезе нанокристаллов магнетита, обогащённого Fe2+ в тех же условиях, получают от 18 до 20 г, выход от 73% до 87%. Кубические нанокристаллы шпинели, магнетит, обогащённый Fe2+ состава:
(Fe2+1,1O · Fe3+1,9O3) m , где:
- m от 50 до 170 - число молекул в нанокристаллах, обогащённого Fe2+ магнетита.
Теоретический выход 232 г магнетита, таблица № 1. Размеры нанокристаллов полученной суспензии определяют просвечивающей электронной микроскопией на ЕМ400, разрешение 1,4 Å Филипс (1 нм 10 Å; 1 мкм 1000 нм). Кристаллы обогащённого Fe2+ магнетита имеют диаметр от 16 до 20 нм.
При синтезе магнитоуправляемых препаратов биомедицинского назначения применяют, обогащённый Fe2+. При хранении сырые нанокристаллы магнетита слипаются и образуют агрегаты диаметром до 250 нм. При высушивании нанокристаллы образуют агрегаты диаметром до 1500 нм. Для уменьшения адгезии поверхности нанокристаллов магнетита, полученные нанокристаллы обрабатывают (травят) 36% хлористоводородной кислотой, которую прикапывают к водной суспензии нанокристаллов магнетита при перемешивании до образования наносфер магнетита округлой формы, которые покрыты анионами Cl¯.
Учитывая неустойчивость к окислению молекул стехиометрического магнетита, которая приводит к понижению Мs, синтез активированного магнетита и СНМЦ ведут из свежего обогащённого катионами Fe2+магнетита.
Нанокристаллы обогащённого Fe2+ магнетита формулы (2) обрабатывают 36% хлористоводородной кислотой, получают наносферы активированого магнетита формулы (3).
Синтез СНМЦ
Наносферы формулы (3) обрабатывают от 20% до 300% избытком водного раствора 10% лимонной кислоты фирмы «Сигма», получают СНМЦ общей формулы (4).
Пример 3. Синтез СНМЦ c профицитом Fe2+. Синтез суперпарамагнитных наносфер магнетита цитрата ведут по уравнениям реакций:
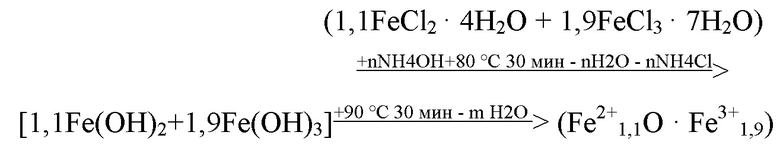
Кубические нанокристаллы диаметром от 16 до 20 нм общей формулы (1), обрабатывают (травят) от 2 до 4 ч 36% хлористоводородной кислотой, предпочтительно от 2 до 3 ч, таблица №2. Получают активированные наносферы диаметром от 11 до 14 нм. Покрытие наносфер общей формулы (4), цитрат анионами путём замещения анионов Сl¯ ведут при + 80 - + 90 °С и перемешивании от 1500 до 3500 об/мин, предпочтительно от 2000 до 3500 об/мин, рН от 3,5 до 6,9, до образования водного золя соединения общей формулы (4), (таблицы № 2, № 3, №8 и №9).
Магнетит формулы (2) окисляется в процессе диализа, при хранении и при синтезе активированного магнетита. В начале диализа происходит увеличение намагниченности насыщения (Ms) от 6,3 кА/м до 8,9кА/м. При продолжении диализа Ms падает.
Поэтому выделение магнетита ведут в НПМП индукцией от 0,2 до 3,0 Тл, градиент от 0,0012 до 0,013 Тл / см.
Если в реакции участвуют:
217,8 г 1,1FeCl2 · 4H2O и 545,3 г 1,9FeCl3 · 7H2O,
должен получаться теоретический выход 232 г Fe3O4
Теоретический выход магнетита 232 г 100%. При загрузках 1/10 мол получают от 13 до 19 г, выход от 56% до 82%, нанокристаллы обогащённого Fe2+ магнетита состава:
от (Fe2+1,1O · Fe3+1,9O3) m,
К 100 мл водного 10% золя свежего активированного магнетита формулы (3) при перемешивании прибавляют 200 мл водного раствора 40 г лимонной кислоты. Перемешивают при температуре от + 70 до + 90 °С в атмосфере азота до полного выделения HCl от 3 ч до 6 ч. Выделение НCl происходит с образованием связей между молекулами окиси железа и цитрат анионами, и образуется водный золь СНМЦ.
Очищенный золь СНМЦ концентрируют в неоднородном постоянном магнитном поле (НПМП) от 0,2 до 0,4 Тл, центрифугируют при 2000 об. / мин в течение 5 мин, супернатант сливают, концентрируют на роторном испарителе до получения 20% водного золя СНМЦ. При лиофильном высушивании получают СНМЦ с выходом от 52 до 76% , таблицы № 2, № 3, № 9.
При синтезе СНМЦ активированные наносферы магнетита диаметром от 12 до 14 нм, общей формулы (3), перемешивают в растворе от 5% до 20% лимонной кислоты (ЛК), (С6Н8O7 ·Н2О)n, фирмы Sigma. Синтез ведут в отсутствии кислорода, при нагревании от +70 до +90 °С в течение 4 ч. При взаимодействии наносфер активированного магнетита с молекулами ЛК при температуре от +70 до +90 °С в атмосфере азота происходит выделение НCl с образованием связей между молекулами окиси железа и цитрат анионами и образуется водный золь наносфер СНМЦ.
Реакционную смесь очищают от исходных веществ в неоднородном постоянном магнитном поле индукцией от 0,2 до 3,0 Тл, градиент от 0,0012 до 0,013 Тл/см, центрифугируют 2 мин при 2000 об. / мин.
Супернатант собирают и фильтруют через мембранные фильтры, диаметр пор 0,2 - 0,45 мкм, получают золь СНМЦ в воде. Цитрат анионы, образующие верхний слой СНМЦ, защищают их от окисления и слипания в водных золях.
Золь, содержащий от 2,0 до 5,0% СНМЦ, концентрируют в неоднородном постоянном магнитном поле (НПМП) индукцией 0,2 Тл, градиент 0,0012 Тл/см, разбавляют водой до образования 10% водного золя и центрифугируют 5 мин при 2000 об. / мин.
Полученный супернатант фильтруют через систему фильтров Миллипор (диаметр пор от 40 до 150 нм). 0,1 мл полученного фильтрата разбавляют до содержания СНМЦ от 0,01 до 0,001% и определяют гидродинамический диаметр наносфер, который составляет от 13 до 18 нм. Фильтрат СНМЦ концентрируют на роторном испарителе до 10% содержания сухого остатка. Выход от 30 до 70%
Выход наносфер СНМЦ зависит от соотношения ионов
(Fe3O4·Fe3+O)+ m и (C6H7O7)- n, взятых при синтезе СНМЦ. Выход 84%, таблица № 9.
Получают 10% водный золь, рН от 6,7 до 7,0 который стерилизуют в УЗ бане 6 ч в атмосфере азота, разливают по 10 мл в стеклянные флаконы объёмом 20 мл, замораживают при – 75 – 80 ° С и лиофильно высушивают до содержания воды от 0,01 до 0,10%. Флаконы заполняют сухим азотом, закрывают резиновыми пробками с металлическими колпачками. Хранят при + 4 ° С во флаконах, закрытых резиновыми пробками, снабжёнными металлическими колпачками. Срок хранения 3 года. Перед употреблением в стерильных условиях к СНМЦ прибавляют 3 мл стерильной дистиллированной свежепрокипячённой воды, насыщенной N2, доводят объём полученного золя до 5 мл. Закрывают флакон резиновой пробкой, снабжённой металлическим колпачком, помещают в ультразвуковую баню на 6 ч. Получают стерильный 2% водный золь, который имеет цвет, от тёмно-коричневого до чёрного, рН от 6,9 до 7,1.
Выход СНМЦ, таблица № 9.
Пример 3. Подбор соотношений СНМЦ / МВ.
При ранней ККМРТ визуализации центров пролиферации ЗК применяют комбинацию СНМЦ-МВ. В опытах по подбору соотношений СНМЦ / МВ, при которых сокращается время ранней визуализации ККМРТИ, для увеличения числа чёрных вокселей в визуализируемых МРТ изображениях тканей млекопитающего через 3-4 дня после перевивки ЗК вводят В/В0,2 мл водного от 2 до 3% золя заявляемого средства. При КМРТ сканировании места перевивки через 10 мин – 96 ч после введения СНМЦ визуализируют тёмные КМРТ изображения ЗК, ЦПЗК с питающими сосудами и пограничными тканями. Для увеличения контраста и яркости КМРТ изображений, за 5-9 мин до ККМРТ сканирования вводят МВ от 0,1 до 0,2 мл/кг. Для получения ККМРТИ в динамике постепенно вводят МВ и ведут ККМРТ сканирование. Визуализируют ранние контрастные МРТ изображения, которые отображают картину пролиферации ЗК и развития центров пролиферации злокачественных клеток в динамике.
Разработка заявляемой комбинации контрастного средства включает:
- подбор соотношения СНМЦ / Магневист® в комбинации заявляемого контрастного средства СНМЦ-МВ;
- увеличение числа чёрных вокселей в ККМРТ изображениях нормальных тканей и ЗК, и белых вокселей в ККМРТ изображениях отдельных групп ЗК и центров пролиферации злокачественных клеток с питающими сосудами для создания ККМРТ изображений с высоким пространственным разрешением;
- контрастный МРТ мониторинг места перевивки ЗО для ранней визуализации ККМРТ изображений, представляющих определённые стадии процесса развития отдельных групп ЗК и центров пролиферации злокачественных клеток.
Для решения указанной задачи к 0,2 г СНМЦ в стерильных условиях прибавляют 5 мл дистиллированной, насыщенной N2, стерильной воды, доводят объём полученного золя до 10 мл. Закрывают флакон резиновой пробкой, снабжённой металлическим колпачком, помещают в ультразвуковую баню на 5 ч. Получают стерильный 2% водный золь, который имеет окраску от тёмно-коричневой до чёрной, рН 7,0-7,2.
От 0,01 до 0,2 мл 2% золь СНМЦ вводят мышам внутри артериально (В/А), В/В или ИП в качестве негативного МРТ контрастного средства. Приготовление 3%, 4%, 5% водных золей СНМЦ осуществляют в аналогичных условиях, таблицы № 5 и № 6.
Пример 4. ККМРТ визуализация злокачественных клеток, ЦПЗК и ЗО глиомы С6
Злокачественные клетки, центры пролиферации злокачественных клеток (ЦПЗК) и ЗО глиомы C6 визуализируют в виде Τ2 взвешенных ККМРТ изображений (T2 W), благодаря разнице во временах поперечной релаксации Τ2 ЗК и ЦПЗК по сравнению с нормальным мозгом. Различия в протонной плотности (PD) и времени продольной релаксации Τ1 для ЗК, ЦПЗК, ЗО и нормальных тканей менее выражены. Эти различия наблюдают на параметрических картах, построенных по изображениям, полученным методом спинового эха при варьировании параметров ΤR и TE от 0,95 до 5,0 с и от 13 до 170 мс, соответственно. После В/В введения СНМЦ, за 5 мин до ККМРТ сканирования, вводят Магневист.
Злокачественные клетки, покрытые СНМЦ, визуализируют как T2 W 3D ККМРТ изображения срезов ЦПЗК или ЗО, фиг. 1 (a, a’, b, b’, c, c’); (a) яркие пятна это – срезы злокачественных клеток (концы стрелок), цельные злокачественные клетки (короткие стрелки), инвазия ЗК (длинная стрелка); (b) срезы ЗК - яркие пятна, цельные ЗК (концы стрелок); (с) цельные ЗК (между концами белых стрелок), срез ЗК - яркое пятно (в центре тёмного кольца), инфильтрация ЗК (чёрные стрелки); (с’) инвазия ЗК из ЗО на стенку сосуда (чёрные стрелки); митоз и пролиферация ЗК (концы белых стрелок).
Злокачественные клетки крепятся на питающих ЦПЗК и ЗО сосудах, делятся, покрывают их слоями, фиг. 1 (d, d’, e, е’).
На Т2 W 3D комбинированных контрастных магнитно-резонансных томографических изображениях высокого разрешения срезов центров пролиферации злокачественных клеток глиомы С6, полученных на 5-7 день после стереотаксической перевивки ЗК, одновременно наблюдают инфильтрацию ЗК и инвазию ЗК из ЗО фиг. 1 (d’): инфильтрация двух ЗК в мембрану происходит в верхней части ЗО (две маленькие чёрные стрелки); перфорация мембраны и инвазия ЗК происходит в нижней части ЗО, справа (концы толстых белых наружных стрелок).
ЦПЗК визуализируют в виде светлого пятна с тёмными и светлыми кольцами по его периферии, (толстая чёрная стрелка); интенсивная инфильтрация ЗК через мембрану ЦПЗК в соседний кровеносный сосуд (большая, белая, наружная стрелка), ( фиг. 1 (e, е’);
ЗО часто визуализируют с разрушенными сосудами и разрушенной мембраной капсулы или полным замещением нормальных клеток ЗК, фиг.1 (h, j).
При гистологических исследованиях состава тёмного кольца и пограничных участков ЦПЗК определяют макрофаги и ЗК, содержащие агрегаты СНМЦ, фиг. 2 (a, b, c) и 3 (a, b, c). Проникновению СНМЦ в ЦПЗК способствуют: небольшие размеры наносфер, гидродинамический диаметрот 13 до 18 нм, понижение гематоэнцефалического барьера из-за малигнизации и разрушения выстилающего эндотелия сосудов и высокой концентрация VGFE, увеличивающего проницаемость стенок сосудов. Тёмная полоса по периферии ЦПЗК увеличивает контраст МРТ изображений и способствует раннему выявлению ЗК и ЦПЗК, фиг. 1 (d, d’, e, е’).
Пример 5. Сканирование тела грызунов с получением изображений биомеханики процессов инфильтрации, инвазии и метастазирования злокачественных клеток с визуализацией ККМРТИ.
Через 72 ч после перевивки ЗК глиомы С6 3 самкам крыс Вистар вводят интраперитонеально (ИП) 0,1 г / кг «Zoletil 100», (Virbac). Спящим животным, В/В вводят 0,1 мл 2% водный золь СНМЦ. Через 10 мин животных по одному помещают в магнитное поле МР томографа, в режиме «Ангио» сканируют место перевивки ЗК. Визуализируют тёмные КМРТ изображений ЗК и ЦПЗК. Визуализация КМРТ изображений высокого разрешения ЗК и ЦПЗК не происходит. Тем же животным В/В вводят 0,2 мл/кг Магневист. Происходит визуализация чётких ККМРТ изображений высокого разрешения ЗК и ЦПЗК, фиг. 1 (a, b, c, c’, d, d’, e, е’). Животных выдерживают 24-48 ч в условиях вивария. Вводят ИП 0,1 г/кг «Zoletil 100». Спящих животных по одному помещают в магнитное поле томографа BioSpec BC 70/30 USR (Bruker) и в режиме «Ангио», сканируют место перевивки ЗК. Визуализируют тёмные КМРТ изображения ЗК и развивающейся мембраны ЦПЗК. Тем же животным за 5 мин до КМРТ сканирования вводят В/В 0,2 мл/кг Магневист. При ККМРТ сканировании визуализируют светлые ККМРТ изображения ЗК и развивающейся мембраны ЦПЗК, фиг. 1 (e, е’), обращают внимание на постепенное разрушение мембраны, фиг. 1 (d, d’),
Контрастное МРТ сканирование продолжают 30 мин. Через каждые 30 - 60 мин (до появления на ККМРТИ артефактов) дополнительно вводят животным Zoletil 100 и Магневист, и сканируют тело животных вновь. Через 5-14 дней непрерывных исследований с перерывами и заменой животных особями, привитыми за определённое время до начала ККМРТ мониторинга, получают ККМРТИ, фиг.1 (a, b, c, c’, d, d’, e, е’, h, j).
Предварительные опыты проводят на 3 самках крыс, которым стереотаксически интрацеребрально перевивают ЗК: глиомы С6 (Г С6).
После перевивки Г С6 у крыс линии Wistar на месте перевивки начинается пролиферация ЗК и, в течение 3-10 дней, образуются ЦПЗК и ЗО, фиг. 1 (a, b, c, c’, d, d’, e, е’), практически одновременно ЗК покрывают кровеносные сосуды мозга, а инфильтрации, инвазии и метастазирование в сосуды и нормальный мозг быстро увеличивают объём пролиферирующих ЗК и превращают ЦПЗК в ЗО.
Макрофаги, лимфоциты, лейкоциты и другие иммунокомпетентные клетки (ИКК) окружают ЗК с образованием мембраны капсулы ЦПЗК. Образуют объёмную, многослойную сетчатую мембрану, покрывающую ЦПЗК, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’); 2 (a, b, c); 3 (a, b, c); 4 (a, b, c); 5 (a, b, c); 6 (a, b, c).
При образовании многослойной мембраны из ИКК в её структуре остаются «щели» (участки, не содержащие клеток, способных задерживать и убивать злокачественные клетки). По этим «щелям» часть злокачественных клеток инфильтрирует через мембрану капсулы ЦПЗК в пограничные и нормальные ткани мозга, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’); 2 (a, b, c).
Многослойная «сетчатая» мембрана постепенно уплотняется, но и после уплотнения она не способна долго защищать нормальные ткани мозга от инфильтрации злокачественных клеток, фиг.1 (a, a’, b, b’, c, c’, d, d’, e, е’).
Патентуемое средство, СНМЦ, применяют в комбинации с Магневистом®, для ранней ККМРТ визуализации контрастных МРТ изображений ЗК и ЦПЗК, которые являются первыми признаками развития солидных злокачественных опухолей, фиг. 1 (a, b, c).
Пример 6. Сканирование с визуализацией ККМРТ изображений биомеханики процессов: инфильтрации, инвазии и метастазирования на клеточном уровне
Для анестезии, перед В/В введением препаратов, лабораторным животным (крысам) вводят интраперитонеально 0,1 г/кг «Zoletil 100», (Virbac). В контроле в хвостовую вену крыс с перевитой Г С6 вводят 0,2 мл 0,9% NaCl, через 3 дня животных размещают в поле 7 Тл томографа и проводят раннее ККМРТ сканирование тканей в режимах получения Т1 W {600 / 15 [время повторения, мс / время эхо, мс], Т2 W (1950 / 85) спин эхо, Т2 W градиент эхо (600 / 13) и Т*2 W градиент эхо (550 / 15). Визуализация ЗК и ЦПЗК не происходит, таблицы № 4, № 5 и №6.
В эксперименте, после анестезии, в хвостовую вену крыс с перевитой Г С6 вводят от 0,3 до 2,0 мл/кг 2% водного золя заявляемого средства, последовательно с Магневистом® 0,2 мл/кг. Проводят комбинированное контрастное магнитно-резонансное томографическое сканирования (ККМРТС). Визуализируют ККМРТИ ЗК высокого контраста и высокого разрешения, Фиг.1 (a, a’, b, b’, c, c’, d, d’, e, е’).
В первой группе ЗК и ЦПЗК визуализируют в виде ККМРТ изображений через 72 - 96 ч после перевивки ЗК.
Крысам 2 группы после проведения анестезии, в хвостовую вену вводят 1 мл/кг 3% СНМЦ. Место введения препарата промывают тёплой водой, протирают досуха, животных содержат при температуре +25 - +28 °С в стандартных условиях от 10 мин до 96 ч. Животных размещают в поле 7 Тл томографа BioSpec BC 70/30 USR (Bruker) и проводят раннее контрастное МРТ сканирование тканей в режимах получения Т1 W {600 / 15 [время повторения, мс/время эхо, мс], Т2 W (1950 / 85) спин эхо, Т2 W градиент эхо (600 / 13) и Т*2 W градиент эхо (550 / 15)} изображений. Визуализируют в течение до 96 ч тёмные не контрастные МРТ изображения, таблицы № 4, № 5 и № 6.
В 3 группе крысам вводят последовательно комбинацию 1 мл/кг 3% СНМЦ и 0,2 мл/кг МВ. При ККМРТ сканировании в аналогичных условиях визуализируют ККМРТИ высокого разрешения инфильтрации и инвазии ЗК и ЦПЗК, и ЗО, фиг. 1 (c, c’, d, d’, e, е’).
Для сравнения крысам 4 группы вводят Магневист® 0,2 мл/кг. Контрастным МРТ сканированием головного мозга визуализируют КМРТИ низкого разрешения, сохраняющие яркость в течение 30 мин.
В 5 группе крысам вводят комбинацию 3% СНМЦ 1 мл/кг и МВ 0,2 мл/кг визуализируют ККМРТИ ЗК, покрывающих сосуды, яркие, чёткие, высокого контраста и разрешения, фиг.1 (a, a’, b, b’, c, c’, d, d’, e, е’); таблицы № 5 и № 6.
Злокачественные клетки, инфильтрировавшие нормальные ткани, образуют ЦПЗК, которые визуализируют на ККМРТ изображениях в виде светлых пятен, полос и точек, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’). При продолжении ККМРТ сканирования более 30-40 мин, из-за уменьшения числа белых вокселей в результате клиренса МВ, визуализируют темные КМРТ изображения, таблицы № 4, № 5 и № 6.
При периодическом КМРТ мониторинге до 96 ч визуализируют патологические изменения в виде контрастных Т1, Т2 W 3D ККМРТ изображений ЦПЗК и ЗО с питающими сосудами, покрытыми ЗК, без дополнительного введения СНМЦ.
В 6 группе препараты вводят крысам в обратном порядке: МВ 0,2 мл/кг, СНМЦ 1 мл/кг. Визуализируют ККМРТИ низкого контраста и разрешения, таблицы № 5, 6. МРТ изображения ранних форм Г С6 не визуализируются, однако, через 7-14 дней в местах перевивки визуализируют ККМРТИ ЦПЗК, вторичных ЦПЗК, и третичных ЦПЗК глиомы С6. В опытных группах 2; 3; 4; 5 и 6 после анестезии за такой же период времени перед ранним, ККМРТ сканированием внутривенно вводят препараты, как указано в таблицах № 4, № 5 и № 6. Визуализируют ККМРТИ биомеханики процессов: инфильтрации, инвазии и метастазирования злокачественных клеток, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’); 4 (a, b, c); 5 (a, b, c); 6 (a, b, c), которые подтверждаются гистограммами ЦПЗК, фиг. 2 (a, b, c); 3 (a, b, c).
Комбинированные контрастные магнитно-резонансные томографические изображения высокого разрешения инфильтрации и инвазии ЗК на срезах ЦПЗК Г С6 визуализируют через 2 – 9 дней после перевивки ЗО внутрисосудистым введением заявляемой комбинации СНМЦ с гадолиний содержащим контрастёром, например, Магневистом®, фиг. 1 (a, a’, b, b’, c, c’).
Через 2-7 дней после перевивки Г С6 В/В вводят патентуемое средство формулы (4). Через промежуток времени 10 мин - 96 ч вводят МВ и визуализируют ККМРТ изображения мозга крыс с привитой Г С6, которые точнее отражают изменения тканей мозга, вызванные пролиферацией ЗК, малигнизацией, неоангиогенезом, инвазией, образованием ЦПЗК, ЗО и деструкцией мозга, чем известные комбинации декстранферит-Магневист (ДФ-МВ), фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’, h, j).
При ККМРТ сканировании визуализируют изображения высокого разрешения ЗК, ЦПЗК и ЗО. В динамике визуализируют, как ЗК покрывают кровеносные сосуды, питающие центр пролиферации злокачественных клеток и ЗО.
При раннем ККМРТ сканировании места перевивки визуализируют: центр пролиферации злокачественных клеток с питающими сосудами, покрытыми ЗК, находящимися в состоянии митоза и пролиферации. Параллельно с ЦПЗК и ЗК визуализируют инфильтрацию клеток Г С6 в пограничные ткани мембраны капсулы, малигнизацию пограничных тканей и деградацию ЗО, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’, h, j); Полученные результаты подтверждают гистологическим анализом участка головного мозга, занятого ЦПЗК глиомы С6, фиг. 2 (a, b, c), наблюдают торможение митоза ЗК и фрагментацию ЗК макрофагами, фиг. 3 (a, b, c).
В процессе развития ЦПЗК наблюдают патогенные биомеханические изменения в пограничных нормальных тканях: инфильтрацию, инвазию, метастазирование, отёк, неоангиогенез, малигнизацию, митоз, пролиферацию, замещение нормальных тканей злокачественными клетками, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’, h, j); 4 (a, b, c); 5 (a, b, c); 6 (a, b, c).
Изолированные "непроницаемой" мембраной злокачественные клетки продолжают делиться и пролиферировать с выделением белков, вызывающих малигнизацию пограничных тканей, объём ткани быстро увеличивается. Это приводит к увеличению интерстициального давления внутри мембраны, запредельному растяжению мембраны капсулы, инфильтрации, малигнизации, износу и разрушению мембраны ЦПЗК быстрее, чем иммунная система обновляет её. В результате этого происходит биомеханическая перфорация мембраны капсулы ЦПЗК, инвазия злокачественных клеток с отёком пограничных тканей, поражением лимфатических узлов, кровеносной системы и других жизненно-важных органов, фиг. 1 (a, a’, b, b’, c, c’, d, d’); 4 (a, b, c); 5 (a).
В метастазировании участвуют как отдельные ЗК так и «спящие» макрофаги, переполненные ЗК, утратившие былую подвижность, и переносимые током крови из разрушаемой злокачественными клетками мембраны злокачественной опухоли, фиг. 1 (h, j); 6 (a, b, c).
Отличительными признаками контрастных МРТ изображений высокого разрешения, по которым определяют стадии развития центров пролиферации злокачественных клеток и ЗО, наблюдаемых только в присутствии заявляемой комбинации, заявляемого КМРТ средства, СНМЦ в комбинации с Магневистом®, являются:
- образование и обновление элементов мембраны в динамике с поверхности и изнутри ЦПЗК в течение 3-4 дней после перевивки ЗК, которую визуализируют по периметру ЦПЗК при ККМРТ мониторинге развития центров пролиферации злокачественных клеток, фиг. 1 (a, a’, b, b’, c, c’, e, е’, h);
- биомеханическая перфорация и разрушение мембраны злокачественными клетками с инвазией и диссеминацией ЗКГ С6 в нормальные ткани и проникновением СНМЦ в ЦПЗК через 5 – 10 дней после перевивки ЗК, (содержимое ЦПЗК тёмное), фиг. 1 (a, a’, b, b’, c, c’, d, d’);
- инфильтрация ЗК, происходящая из ЦПЗК в ближайшие сосуды, не сопровождается проникновением СНМЦ в ЦПЗК, (содержимое ЦПЗК остаётся светлым), 1 (e, е’).
Через 2-4 дня после перевивки ЗГ C6 отбирают на МР томографе 10 крыс, диаметр ЦПЗК которых достигает 3-5 мм. Объём ЦПЗК определяют по результатам анализа ККМРТИ, полученным при сканировании тканей на томографе (Bruker). Объём вычисляют как произведение полной площади срезов (последовательностей) на сумму толщины срезов и пропущенного расстояния между ними, (за пропущенное расстояние всегда берут 1/2 толщины среза). Вычисления проводят по формуле (5), где, V - объём опухоли mm3; ZP сумма площадей срезов; ZT толщина среза и М-пропуск.
В течение 3 - 5 дней после перевивки, в результате развития в центрах пролиферации злокачественных клеток, неоангиогенеза, отёка, малигнизации и инфильтрации пограничных тканей, контраст и пространственное разрешение ККМРТИ изменяются, фиг. 1 (a, b, c, c’, e, е’, h, j).
При ККМРТ мониторинге развития опухоли через 5-10дней после перевивки визуализируют перфорацию мембраны ЦПЗК злокачественными клетками и диссеминацию ЗК в нормальные ткани, фиг. 1 (a, a’, b, b’, c, c’, d, d’); 4 (a, b, c); 5 (a); 6 (a, b, c).
На светлом фоне ЦПЗК визуализируют:
- тёмные участки мембраны, пронизанной извитыми сосудами, образовавшимися в процессе неоангиогенеза, множественные инвазии злокачественных клеток из ЦПЗК в малигнизированные сосуды, а из сосудов в нормальные ткани мозга, фиг. 1 (d, d’, e, e’);
- множественные метастазы, слившиеся с образованием центров пролиферации злокачественных клеток, из которых образуются вторичные бугристые опухоли (светлые пятна), фиг. 5 (a, a’, b, b’, c, c’, d, d’, e, e’); 6 (c).
Инфильтрация и инвазия ЗК в малигнизированные сосуды приводит к возникновению ВЦПЗК в левой половине мозга, фиг. 1 (d, d’, e, е’). В результате инфильтрации злокачественных клеток и их белков в пограничные нормальные тканимозга за 5-10 дней происходит их малигнизация и пролиферация ЗК с быстрым увеличением объёма злокачественных тканей. Одновременно визуализируют множество ВЦПЗК, фиг. 1 (d, d’, e, e’).
Первичный ЦПЗК диаметром 3 мм, за 11-15 дней трансформируется в бугристую опухоль, диаметром 32 мм, фиг. 1 (d, d’, e, e’, h, j). Интраваскулярная инвазия злокачественных клеток приводит к развитию вторичных центров пролиферации злокачественных клеток, в левой половине мозга, фиг.1 (d, d’, e, e’,e). Созревание опухоли сопровождается увеличением её объёма с запредельным растяжением и перфорацией мембраны ЦПЗК, фиг. 1 (d, d’); 4 (a, b, c); 5 (a, b, c); 6 (a, b, c). Биомеханическая перфорация мембраны сопровождается инвазией ЗК в нормальные ткани с одновременным проникновением СНМЦ в ЦПЗК, ВЦПЗК (тёмные пятна внутри ЦПЗК), фиг. 1 (a, a’, b, b’, c, c’, d, d’).
В процессе 14 дневного ККМРТ мониторинга развития ЦПЗК визуализируют образование множества ЦПЗК, ВЦПЗК и опухолей, которые получают питание от извитых, расширенных под действием VGEF сосудов и капилляров, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’).
Биомеханика ранней ККМРТ визуализации уменьшения сигнала протонов парамагнитных молекул гидратной воды на 5-10 день после перевивки злокачественных ЦПЗК включает:
- проникновение СНМЦ в ЦПЗК при капсулировании с обогащением поверхности ЗКСНМЦ с их тёмным окрашиванием, фиг. 1 (a, a’, b, b’, c, c’, e, e’);
- проникновение СНМЦ в нормальные ткани и органы РЭС, с увеличением числа чёрных вокселей в их ККМРТИ;
- увеличение контраста злокачественных клеток с визуализацией ККМРТ изображений высокого разрешения структуры ЦПЗК и ЗО, при ККМРТ сканировании места перевивки ЗК, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’, h, j);
- очень медленное проникновение СНМЦ в ткани ЦПЗК, изолированного от организма мембраной, при ККМРТ сканировании места перевивки ЗО визуализируют контрастные МРТ изображения ЦПЗК в виде белых пятен, окруженных тёмной объёмной полосой динамичной мембраны, изменяющейся в реальном времени, состоящей из макрофагов, лимфоцитов и других ИКК, фиг.1 (d, d’, e, е’);
- быстрое проникновение СНМЦ в ткани ЦПЗК и злокачественной опухоли, после перфорации мембраны ЦПЗК или ЗО;
- быстро увеличивая число СНМЦ нормальных тканей (в течение 5-10 мин) ослабляют ККМРТ сигнал протонов парамагнитных молекул гидратной воды этих тканей до гипоинтенсивного, увеличивают число чёрных вокселей в ККМРТ изображениях нормальных тканей, этим вызывают тёмную окраску ККМРТ изображений нормальных тканей - контрастный фон для белых изображений ЗК, который увеличивает разрешение ККМРТ изображений.
- КМРТ изображения нормальных тканей, содержащих достаточное число СНМЦ, имеют чёрный цвет.
Нативная мембрана ЦПЗК непроницаема для злокачественных клеток и наносфер, она не пропускает злокачественные клетки и СНМЦ в злокачественные ткани ЦПЗК. Поэтому ККМРТ изображения ЗК внутри ЦПЗК на 1-2 стадиях развития представлены пятнами белого цвета, фиг.1 (e, e’). На 3-4 стадиях развития ЦПЗК происходит перфорация мембраны ЦПЗК.
Биомеханическая перфорация мембраны капсулы происходит изнутри под давлением созревших злокачественных клеток ЦПЗК и сопровождается увеличением инфильтрации. Практически одновременным проникновением злокачественных клеток из ЦПЗК в нормальные ткани, СНМЦ с элементами мембраны переносятся в ЦПЗК, фиг. 1 (a, a’, b, b’, c, c’, d, d’); 4 (a, b, c); 5 (a, b, c). Сразу после перевивки ЗК начинается развитие от одного до нескольких центров пролиферации злокачественных клеток, В/В введение СНМЦ избирательно увеличивает число чёрных вокселей в ККМРТИ нормальных тканей. Многослойная мембрана ЦПЗК, состоящая из макрофагов и других иммунокомпетентных клеток поглощает СНМЦ. Это создаёт контраст между отдельными ЗК и частями ЦПЗК. Так визуализируют ККМРТИ структуры ЦПЗК, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’). ККМРТ изображения мембраны ЦПЗК содержат множества чёрных вокселей, визуализирующих множество ВЦПЗК, развитие которых ведёт к увеличению объёма вторичной опухоли на 1-2 порядка, фиг. 1 (d, d’, e, e’, h, j).
При В/В введении СНМЦ крысам через 4-5 дней после перевивки, визуализируют КККМРТ изображения ЦПЗК в виде белых пятен, окружённых тёмными кольцами мембраны, фиг. 1 (d, d’, e, е’). Магневиста® при В/В введении, через 2-14 дней после перевивки ЗК, проникает как в нормальные, так и в патологические ткани. Он усиливает ККМРТ сигналы протонов парамагнитных молекул гидратной воды тканей, увеличивает число белых вокселей, которые на ККМРТИ первичных центров пролиферации злокачественных клеток дают яркие белые пятна на фоне серой окраски нормальных тканей, фиг. 1 (a, b, c, c’, d, d’, e, e’). При последовательном В/В введении МВ в ККМРТ изображениях тканей к чёрным вокселям, прибавляют белые воксели. Контраст ККМРТИ изображений всех тканей организма усиливается. Особенно яркими становятся патологические ткани, изолированные нативной мембраной ЦПЗК, исключающей проникновение СНМЦ в ЦПЗК. Чёрные воксели нормальных тканей создают тёмный фон. Патологические ткани визуализируют в виде белых пятен на тёмном фоне нормальных тканей.
При ККМРТ сканировании животных с ЦПЗК или ЗО, тёмные нормальные или патологические ткани создают контраст на границе со светлыми тканями. Это способствует визуализации ККМРТИ высокого пространственного разрешения биомеханики процессов: инфильтрации, инвазии и метастазирования ЗК из ЦПЗК и ЗО в нормальные и пограничные ткани, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, e’); 4 (a, b, c); 5 (a, b, c); 6 (a, b, c).
Через 30 мин после однократного введения МВ до 80% его выводится из организма крысы, число белых вокселей ККМРТ изображения уменьшается и ККМРТИ темнеет. Учитывая быстрый клиренс МВ, в процессе ККМРТ мониторинга развития ЦПЗК, МВ вводят постепенно. Этим создают соответствующие соотношения чёрных и белых вокселей в ККМРТ изображениях тканей млекопитающего, и визуализируют яркие ККМРТ изображения ЗК высокого пространственного разрешения и контраста в течение всего ККМРТ мониторинга развития ЦПЗК. Визуализируют ранние ККМРТ изображения:
- первичных центров пролиферации злокачественных клеток с питающими сосудами;
- многослойной мембраны ЦПЗК;
- перфорацию мембраны ЦПЗК клетками Г С6 с их диссеминацией в нормальные ткани и проникновением СНМЦ в ЦПЗК.
Через 3 – 4 дня после перевивки ЗГ С6 в хвостовую вену крыс вводят от 0,5 до 1,0 мл / кг СНМЦ в виде 2% водного золя за 12 - 96 ч, а МВ от 0,1 до 0,2 мл / кг - за 3 - 9 мин до проведения контрастной МРТ визуализации с получением магнитно-резонансных Т1, Т2 и Т*2 W 3D изображений. Визуализируют ККМРТИ развития мембраны ЦПЗК, которые относят ко второй стадии развития ЦПЗК, инфильтрация ЗК через мембрану 3 стадия, фиг. 1 (e, e’); перфорации мембраны ЦПЗК, фиг. 1 (d, d’) 4 стадия; деградация ЗО, фиг. 1 (h, j) 5 стадия.
Пример 7. Ранняя ККМРТ визуализация центров пролиферации злокачественных клеток (ЦПЗК)
За 12 - 96 ч до контрастного магнитно-резонансного томографического сканирования места перевивки ЗК, вводят в хвостовую вену животных от 1,0 до 1000 мг / кг СНМЦ (на мышь весом 20 г, предпочтительно вводят от 0,2 до 1,4 мг).
Раннюю визуализацию ККМРТ изображений ЦПЗК с границами инфильтрации реализуют через 2-3 дня после перевивки ЗКВ/В введением заявляемых соединений общей формулы (4) за 10 мин - 96 ч до ККМРТ мониторинга, и В/В введением Магневиста® за 3 - 9 мин до ККМРТ мониторинга, этим создают контраст, сокращают время МРТ релаксации Т1, Т2, Т*2 и время ранней ККМРТ визуализации Т1, Т2, Т*2 взвешенных 3D ККМРТ изображений, кроме того, сокращают время необходимое для выявления центров пролиферации злокачественных клеток с границами инфильтрации с определением стадий их развития в динамике от 72 до 288 ч.
Результаты ранней ККМРТ визуализации с определением стадий развития центров пролиферации злокачественных клеток обрабатывают статистически по стандартизованным критериям.
За достоверные - принимают результаты с различиями ρ < 0,05 [8]. О.Ю. Реброва, Статистический анализ медицинских данных, Медиа Сфера, Москва (2002).
Пример 8. Ранняя ККМРТ визуализация ЦПЗК
Премедикацию животных проводят как в примере 5. Через 48 - 96 ч после перевивки глиомы С6, 3 самкам крыс Вистар вводят интраперитонеально (ИП) 0,1 г / кг «Zoletil 100», (Virbac). Спящим животным, В/В вводят 0,2 мл 2% водный золь СНМЦ. Патентуемое средство, СНМЦ, применяют в комбинации с Магневистом®, для ранней визуализации контрастных МРТ изображений ЦПЗК. Патентуемое средство, в виде 2 - 3% водного золя вводят от 1,0 до 2,0 мл / кг последовательно с Магневистом® 0,2 мл/кг в хвостовую вену крыс с перевитой Г С6.
Место введения препарата промывают тёплой водой, протирают досуха, животных содержат при температуре +25 - +28°С в стандартных условиях от 10 мин до 96 ч. Животных размещают в поле 7 Тл томографа и проводят раннее контрастное ККМРТ сканирование тканей в режимах получения Т1W{600 / 15 [время повторения, мс/время эхо, мс], Т2 W (1950 / 85) спин эхо, Т2. W градиент эхо (600 / 13) и Т*2 W градиент эхо (550 / 15)} изображений.
При ККМРТ сканировании визуализируют светлые ККМРТ изображения ЦПЗК, покрытого тёмной мембраной капсулы, фиг. 1 (d, d’, e, e’). ККМРТ сканирование продолжают 30 мин. Делают перерыв в ККМРТ сканировании животного на 3 ч. Животное отдыхает при температуре +25 - +28°С в стандартных условиях.
Проводят премедикацию и спящему животному вторично внутривенно вводят от 0,1 до 0,2 мл / кг Магневиста®. Животное размещают в поле 7 Тл томографа и проводят ККМРТ сканирование тканей в режимах получения Т1{600 / 15 [время повторения, мс/время эхо, мс], Т2 W (1950 / 85) спин эхо, Т2 W градиент эхо (600 / 13) и Т*2 W градиент эхо (550 / 15)} изображений. Последующим ККМРТ сканированием исследуемой области, визуализируют размытые границы инфильтрации ЗК С6 в нормальный мозг.
Пример 9. В хвостовую вену мышей весом ~ 18 г с эпидермоидной карциномой лёгких Льюис, аденокарциномой молочной железы Са 755, лимфолейкозом Р388 или меланомой В16F-11 вводят патентуемое средство в виде 2 - 3% водного золя от 0,1 до 0,2 мл / кг последовательно с Магневистом® 0,2 мл/кг. СНМЦ не проникают через нативную мембрану внутрь ЦПЗК, поэтому число чёрных вокселей на ККМРТ изображениях внутри ЦПЗК не увеличивается. СНМЦ проникают в нормальные ткани по капиллярам, эндоцитируются клетками РЭС, макрофагами, эндотелиальными и ЗК, уменьшают сигнал протонов парамагнитных молекул гидратной воды, создают контраст между нормальными и опухолевыми тканями, визуализируют ранние ККМРТ изображения первичных центров пролиферации злокачественных клеток с питающими сосудами.
Перфорацию мембраны ЦПЗК, инвазию злокачественных клеток в нормальные ткани визуализируют в динамике в процессе ККМРТ мониторинга, фиг. 4 (a, b, c); слияния нескольких ЦПЗК с образованием ЗО фиг. 5 (a, b, c); 6 (a, b, c). Метастазы меланомы В16F-11 пронизывают всё тело мыши, фиг. 6 (a, b, c). Гистограммы участка ЦПЗК с мембраной капсулы, покрывающей центр пролиферации злокачественных клеток, фиг. 2 (a, b, c). Эндоцитоз ЗК и фрагментация ЗК макрофагами фиг. 3 (a, b, c).
При ККМРТ визуализации развития центров пролиферации злокачественных клеток заявляемым способом, применяют комбинацию негативного и позитивного контрастных МРТ средств: СНМЦ-МВ. СНМЦ применяют в качестве - источника чёрных вокселей, а МВ в качестве - источника белых вокселей. Поскольку СНМЦ могут попадать в ЦПЗК из кровеносных сосудов, только до образования непроницаемой мембраны ЦПЗК, или после перфорации мембраны, а МВ диффундируют через все ткани, в том числе, и через нативную мембрану ЦПЗК, скорость проникновения СНМЦ в ткани центров пролиферации злокачественных клеток на много меньше скорости распределения МВ. Из-за этого концентрация СНМЦ в центрах пролиферации и неоангиогенеза повышается медленнее, чем концентрация МВ. С учётом этого избирательно увеличивают гетерогенность злокачественных и нормальных тканей по величине намагниченности, величине сигналов протонов парамагнитных молекул гидратной воды и яркости изображений. Повышая магнитную гетерогенность биологических тканей, увеличивают разность между величинами МРТ сигналов протонов парамагнитных молекул гидратной воды злокачественных и нормальных тканей, усиливают контраст, пространственное разрешение ККМРТ изображений, этим способствуют ранней контрастной визуализации ЦПЗК.
Результаты ранней ККМРТ визуализации инфильтрации, инвазии и метастазирования из центров пролиферации злокачественных клеток, фиг. 1 (a, a’, b, b’, c, c’, d, d’, e, е’, h, j); 4 (a, b, c); 5 (a, b, c); 6 (a, b, c) подтверждают гистопатологическими исследованиями, фиг. 2 (a, b, c); 3 (a, b, c).
Пример 10. Мышам 1 партии вводят в мышцу правого бедра суспензию 106 жизнеспособных клеток карциномы лёгких Льюис в 0,15 мл питательной среды 199 (pH 7,4). Через 3-4 дня отбирают 42 мыши. Поочерёдно проводят анестезию животных и раннюю ККМРТ визуализацию ЦПЗК и сосудов, питающих ЦПЗК карциномы лёгких Льюис. Порядок введения контрастных МРТ средств мышам, их количества, условия проведения раннего контрастного МРТ сканирования в группах 1, 2, 3, 4, 5, 6, таблица 1, фиг. 4 (a, b, c).
Мышам 2 партии вводят под кожу правой подмышечной области суспензию 106 жизнеспособных клеток аденокарциномы молочной железы Са 755 в 0,15 мл питательной среды 199 (pH 7,4). Через 2 дня отбирают 42 мыши, которых делят на 6 групп, по 7 особей в каждой. Последовательно проводят анестезию и раннюю ККМРТ визуализацию ЦПЗК и сосудов, питающих ЦПЗК аденокарциномы молочной железы Са 755.
Условия проведения раннего контрастного МРТ сканирования в группах 1, 2, 3, 4, 5, 6 из второй партии аналогичны таковым 1 партии, фиг. 5 (a, b, c).
Мышам 3 партии вводят под кожу правой подмышечной области суспензию 106 жизнеспособных клеток меланомы В16F-11 в 0,15 мл питательной среды 199 (pH 7,4). Через 3-4 дня отбирают 42 мыши. Поочерёдно проводят анестезию и раннюю визуализацию ЦПЗК и сосудов, питающих ЦПЗК меланомы В16F-11. Порядок введения контрастных МРТ средств мышам C57Bl/6j, их количества, условия проведения раннего контрастного МРТ сканирования в группах 1, 2, 3, 4, 5, 6 четвёртой партии аналогичны принятым в 1 партии, фиг. 6 (a, b, c).
Комбинированную КМРТ визуализацию изображений развития инфильтрации, инвазии и метастазирования из ЦПЗК в динамике на 7-9 день после перевивки меланомы В16F-11 самкам мышей C57Bl/6j реализуют в виде ККМРТ изображений, фиг. 6 (a, b, c).
Наблюдают метастазирование злокачественных клеток из ЦПЗК меланомы В16F-11. Клетки В16F-11 инфильтрируют в сосуды и поражают весь организм мыши, образуют множество ЦПЗК, для питания которых перестраивают всю кровеносную систему мыши. Малигнизируют все артерии и вены, которые после этого обеспечивают кровью только опухолевые ткани, фиг. 6 (a, b, c).
Мышей каждой партии, с ЦПЗК делят на 6 групп: 1, 2, 3, 4, 5 и 6. Первая - контрольная группа 12 мышей, 2, 3, 4, 5 и 6 опытные группы по 6 мышей в каждой группе. Предварительные опыты проводят на 2 мышах каждой группы: измеряют интенсивность МРТ сигнала и проводят визуальный анализ изображений. Определяют зависимость визуализации изображений, повторяющихся на определённых стадиях развития центров пролиферации злокачественных клеток в зависимости от локализации и структуры ЦПЗК, при эпидермоидной карциноме лёгкого Льюис, фиг. 4 (a, b, c). Мышам контрольной группы перед магнитно-резонансной томографией в период: от 6 минут до 30 ч, внутривенно вводят от 0,1 до 0,3 мл 0,9% раствора NaCl. Мышам опытных групп за такой же период, перед магнитно-резонансной томографией внутривенно вводят от 0,1 до 0,3 мл 1-2% водного золя СНМЦ и проводят сканирование на томографе (Bruker) в режимах получения Т*2 W {500 / 15 [время повторения, мс/время эхо, мс] и Т2W (1900 / 80) спин эхо и Т2 W градиент эхо (500 / 15)} изображений. Мониторинг жизнеобеспечения осуществляют с помощью Model 1025 smol Animal Monitoring and Gating System. (Operation Mammal) SA Instruments, Inc, (контроль частоты сердечных сокращений и ритм дыхания).
Зависимость визуализации ранних комбинированных контрастных магнитно-резонансных томографических изображений от времени, прошедшего после перевивки карциномы лёгких Льюис, аденокарциномы молочной железы Са 755, меланомы В16F-11 определяют при последовательном В/В введении комбинации ККМРТ средств: СНМЦ и МВ самкам мышей С57Bl/6j. Чёткие ранние ККМРТ изображения высокого контраста и разрешения визуализируют через 2-3 дня после перевивки путём введения в хвостовую вену мышей комбинации: СНМЦ 2,0 мл/кг, МВ 0,02 мл/кг. Яркие, чёткие ранние контрастные МРТ изображения высокого контраста и разрешения карциномы лёгких Льюис, аденокарциномы молочной железы Са 755, меланомы В16F-11 визуализируют через 3-4 дня после перевивки путём последовательного введения в хвостовую вену мышей комбинации: СНМЦ и МВ.
При В/В введении СНМЦ происходит уменьшение времени релаксации Т2, и Т*2, избирательное увеличение числа чёрных вокселей в ККМРТ изображениях нормальных тканей и ранняя ККМРТ визуализация изображений, связанная с избирательным увеличением контраста тканей. Последующее В/В введение Магневиста® приводит к уменьшению времени релаксации Т1 и избирательному увеличению числа белых вокселей в ККМРТ изображениях патогенных тканей. Это вызывает визуализацию ККМРТ изображений, усиление контраста, разрешения и яркости тканей.
При В/В введении комбинации позитивных и негативных ККМРТ средств избирательно увеличивается число белых вокселей в ККМРТ изображениях центров пролиферации злокачественных клеток и ЗО с питающими сосудами и чёрных вокселей в ККМРТ изображениях нормальных тканей. Благодаря этому происходит ККМРТ визуализация с избирательным усилением контраста, разрешения и яркости изображений центров пролиферации злокачественных клеток с питающими сосудами, и нормальных тканей.
Намагниченные наносферы соединения общей формулы (4) удерживают в своём окружении парамагнитные молекулы воды, этим ослабляют МРТ сигнал протонов и сокращают время релаксации Т2, увеличивают число чёрных вокселей в ККМРТ изображениях нормальных тканей, контраст, и разрешение. Магневист® повышает сигнал протонов и сокращает время релаксации Т1, результатом этого является увеличение числа белых вокселей в ККМРТ изображениях ЦПЗК и увеличение их яркости. Комбинации большого числа чёрных и белых вокселей приводят к визуализации ККМРТ изображений патолого-морфологических изменений в местах перевивки на стадии развития первичных центров пролиферации злокачественных клеток, образования границ инвазии и инфильтрации злокачественных клеток, сосудов, питающих ЦПЗК, формирования мембраны. Перфорации и фрагментации мембраны, фиг. 1 (h, j).
Одновременно с ЦПЗК визуализируют питающие их малигнизированные сосуды, покрытые ЗК, фиг. 1 (d, d’, e, e’, h); 6 (a, b, c).
Подтверждённые патоморфологическими и гистопатологическими методами ККМРТ изображения мест перевивки используют для ранней диагностики ЦПЗК, определения инфильтрации злокачественных клеток, стадий развития и коррекции планов лечения центров пролиферации злокачественных клеток, фиг. 2 (a, b, с); 3 (a, b, c).
Для одновременного достижения требуемых: контраста, разрешения и яркости ККМРТ изображений за 10 мин - 96 ч до магнитно-резонансного сканирования вводят патентуемые соединения общей формулы (4), и за 3 - 9 мин до магнитно-резонансного сканирования центров пролиферации злокачественных клеток вводят Магневист®.
ККМРТ сканирование ЦПЗК и злокачественных опухолей в динамике позволяет отличить инфильтрацию и метастазирование злокачественных клеток от инвазии злокачественных клеток:
а) при инфильтрации и метастазировании с сохранением интерстициального давления злокачественные клетки по одной - две выходят из ЦПЗК или злокачественных опухолей в пограничные ткани и сосуды, а СНМЦ в это время не проникают в ЦПЗК и злокачественные опухоли в заметных количествах;
б) при инвазии злокачественные клетки вызывают перфорацию мембраны капсулы, через образовавшееся отверстие наблюдается обмен, при котором, часть злокачественных клеток выходит в нормальные ткани, а «их место» занимают СНМЦ;
в) проникшие в ЦПЗК или опухоли СНМЦ, покрывают злокачественные клетки слоем СНМЦ, понижающим сигнал протонов, и делают их поверхность тёмной.
Использованные сокращения
1) (ЗК) - злокачественные клетки;
2) (Т2 W 3D ККМРТИ высокого разрешения ЗК Г С6) -
Т2 взвешенные 3D комбинированные контрастные магнитно-резонансные томографические изображения высокого разрешения злокачественных клеток глиомы С6;
3) (ЗО) – злокачественная опухоль;
4) (ЦМЗК) - центр митоза ЗК;
5) (W) - взвешенные;
6) (C6H7O7)- - цитрат анион,
7) (ЦПЗК) – центр пролифереции злокачественных клеток
8) (ВЦПЗК) – вторичный центр пролифереции злокачественных клеток
9) (Г С6) - глиома С6;
10) (ИКК) – иммунокомпетентные клетки;
11) (МРТ) - магнитно-резонансная томография;
12) (МРТИ) - магнитно-резонансные томографические изображения;
13) (КГ С6) - клетки глиомы С6;
14) (КМРТ) – контрастная магнитно-резонансная томография;
15) (ККМРТ) – комбинированная контрастная магнитно-резонансная томография;
16) (ККМРТС) - комбинированное контрастное МРТ сканирование;
17) (ККМРТИ) - комбинированные контрастные МРТ изображения
18) (ККМРТИ) - комбинированные контрастные магнитно-резонансные томографические изображения
19) (ЦПЗК Г С6) - центры пролифереции злокачественных клеток глиомы С6;
21) (СНМЦ) – суперпарамагнитные наносферы магнетита цитрата;
22) (В/В) – внутривенное
Таблицы
Таблица №1
Зависимость выхода нанокристаллов обогащённого Fe2+ магнетита формулы (2) от рН реакционной среды и скорости перемешивания
Оп.
7H2O
среды
(об/мин)
(%)
(нм)
(кА/м)
*) 20% избыток NH4(OH);
**) 20% избыток NaOH;
***) 20% избыток KOH.
Таблица №2
Зависимость выхода соединения формулы (4), от соотношения активированный магнетит формулы (3) / лимонная кислота и скорости перемешивания (об/мин)
№
Оп.
формулы (3)
(г)
(г)
(об/мин)
(г)
(%)
(нм)
(мл·мг–1с– 1)
*) рН среды повышается по мере выделения НСl с образованием соединения формулы (4).
Таблица №3
Зависимость выхода СНМЦ, соединение формулы (4), от рН реакционной среды и скорости перемешивания
№
Оп.
формулы (3)
(г)
(г)
(об/мин)
(г)
(%)
(нм)
(мл·мг-1с- 1)
*) рН повышается по мере выделения НСl.
Таблица №4.
Зависимость качества визуализации комбинированных контрастных магнитно-резонансных томографических изображений (ККМРТИ) центров пролиферации злокачественных клеток (ЦПЗК) от времени, прошедшего с момента перевивки, и от соотношения введенных контрастных МРТ препаратов
Оп.
(час)
(мг / кг)
(мл / кг)
КМРТИ
ККМРТИ
(Фигура №)
Таблица №5.
Зависимость визуализации ранних комбинированных контрастных МРТ изображений от состава и последовательности В/В введения СНМЦ и МВ, времени, прошедшего после перевивки глиомы С6, эпидермоидной карциномы лёгкого Льюис, аденокарциномы молочной железы Са 755 и меланомы В16F-11
крысам Линии Wistar
1 мл/кг.
Таблица №6.
Зависимость визуализации комбинированных контрастных МРТ изображений от состава и последовательности В/В введения заявляемых комбинаций КМРТ средств СНМЦ и МВ, времени, прошедшего после перевивки Г С6, эпидермоидной карциномы лёгкого Льюис, аденокарциномы молочной железы Са 755F-5 и меланомы В16F-11 самкам мышей С57Bl/6C
(ВЦПЗК К)
Таблица №7
Зависимость намагниченности насыщения (Ms) и релаксивности от соотношения ионов Fe2+ / Fe3+ в ядрах СНМЦ
Оп.
(мл·мг- 1 с- 1)
Таблица № 8
Зависимость скорости седиментации СНМЦ в водных золях от соотношения ионов (Fe3O4) m (Fe3+O) + n / (C6H7O7) - r при + 4 °С
Оп.
(Fe3O4) m (Fe3+O) + n / (C6H7O7) ¯ r (% мас.)
(г/мл)
СНМЦ
(мг/ч)
Скорость седиментации СНМЦ при хранении водных золей при + 4 °С зависит от соотношения ионов (Fe3O4) m (Fe3+O) + n / (C6H7O7) - r. При повышении содержания цитрат анионов скорость сидементации уменьшается.
Таблица № 9
Зависимость выхода СНМЦ от соотношения катионов и анионов
(Fe3O4) m (Fe3+O) + n / (C6H7O7) - r при синтезе СНМЦ
Оп.
(г/г)
(%)
СНМЦ
(г)
СНМЦ
(%)
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ РАННЕГО КОНТРАСТНОГО МРТ ВЫЯВЛЕНИЯ ЦЕНТРОВ ЗЛОКАЧЕСТВЕННОЙ ПРОЛИФЕРАЦИИ С ПИТАЮЩИМИ СОСУДАМИ, ГРАНИЦАМИ ДИФФУЗНОЙ ИНФИЛЬТРАЦИИ И ОПРЕДЕЛЕНИЕ СТАДИЙ ИХ РАЗВИТИЯ В ДИНАМИКЕ | 2017 |
|
RU2692579C2 |
| СРЕДСТВО И СПОСОБ ДЛЯ РАННЕГО КОНТРАСТНОГО МАГНИТНО-РЕЗОНАНСНОГО ТОМОГРАФИЧЕСКОГО ВЫЯВЛЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ГЛИАЛЬНЫХ ОПУХОЛЕЙ С ПИТАЮЩИМИ ИХ СОСУДАМИ В ЭКСПЕРИМЕНТЕ | 2016 |
|
RU2655303C2 |
| СПОСОБ ОБНАРУЖЕНИЯ СОСУДОВ, ПИТАЮЩИХ ОПУХОЛЬ, В ЭКСПЕРИМЕНТЕ | 2008 |
|
RU2382596C9 |
| СПОСОБ ДИАГНОСТИКИ ИНФИЛЬТРАТИВНЫХ ОПУХОЛЕЙ ПОЧЕК | 2020 |
|
RU2726589C1 |
| СПОСОБ ФЕРРИМАГНИТО-ТЕРМОХИМИОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ КОМБИНАЦИЯМИ МАГНИТОУПРАВЛЯЕМЫХ НАНОПРЕПАРАТОВ С ВИЗУАЛИЗАЦИЕЙ ОНКОГЕНЕЗА, ОПРЕДЕЛЕНИЕМ ТЕРАПИИ, ПРЕДПОЧТИТЕЛЬНОЙ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ, И МОНИТОРИНГОМ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2563369C1 |
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В ЭКСПЕРИМЕНТЕ | 2007 |
|
RU2343828C2 |
| СПОСОБ ВИЗУАЛИЗАЦИИ БИОЛОГИЧЕСКИХ ТКАНЕЙ И/ИЛИ ОРГАНОВ | 2019 |
|
RU2735463C1 |
| Способ прогнозирования эффективности химиотерапии при раке мочевого пузыря по данным магнитно-резонансной томографии | 2022 |
|
RU2800817C1 |
| Способ обнаружения свойств митохондрий глиобластомы человека индуцировать экстракраниальный диффузный опухолевый рост в органах экспериментальных животных | 2023 |
|
RU2794641C1 |
| Способ индуцирования роста аденокарциномы ободочной кишки человека в органах экспериментальных животных | 2023 |
|
RU2799251C1 |
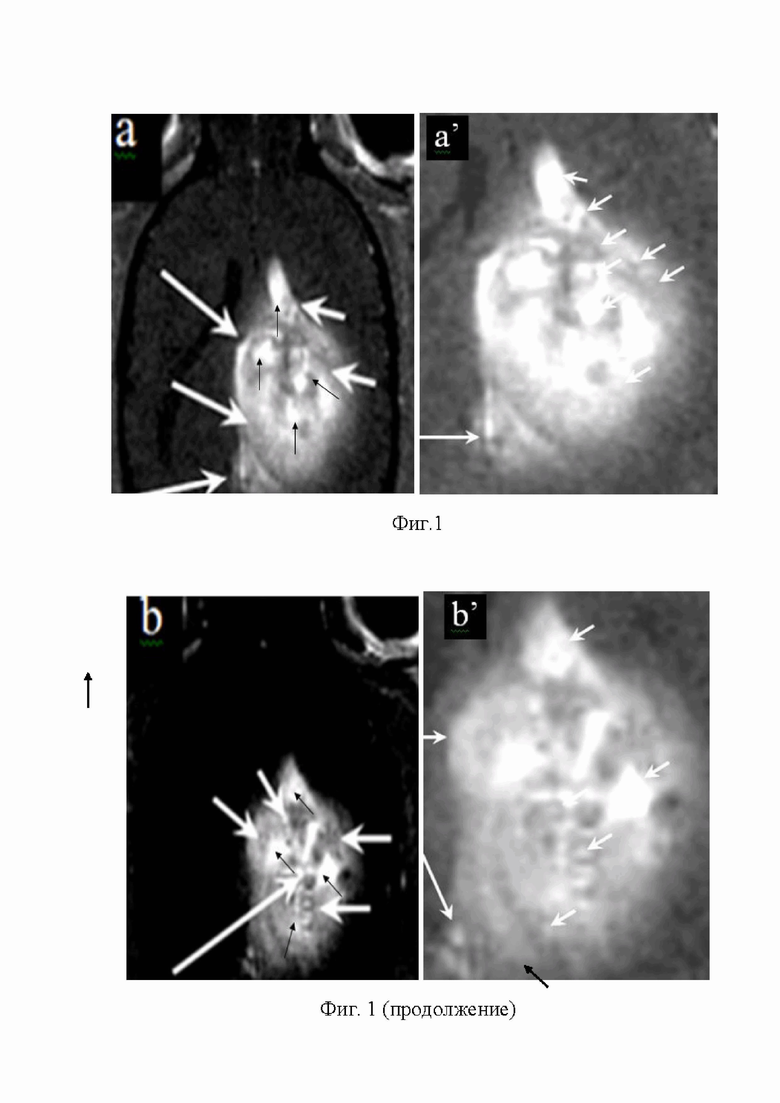
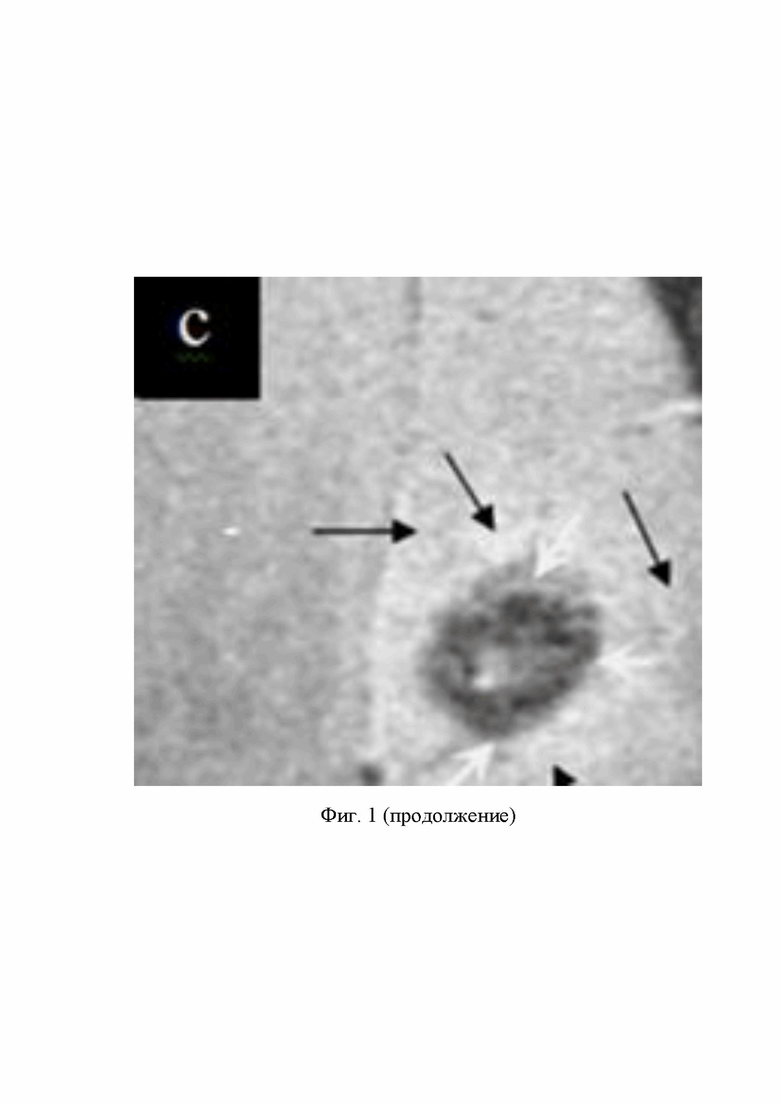
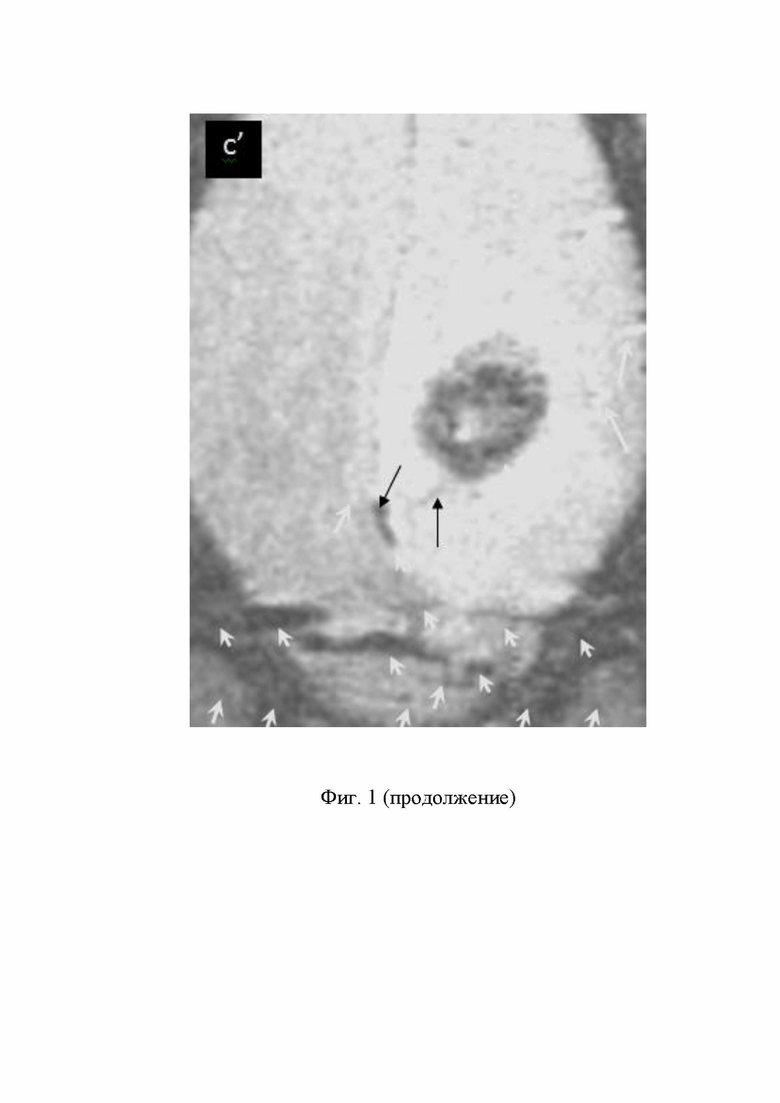
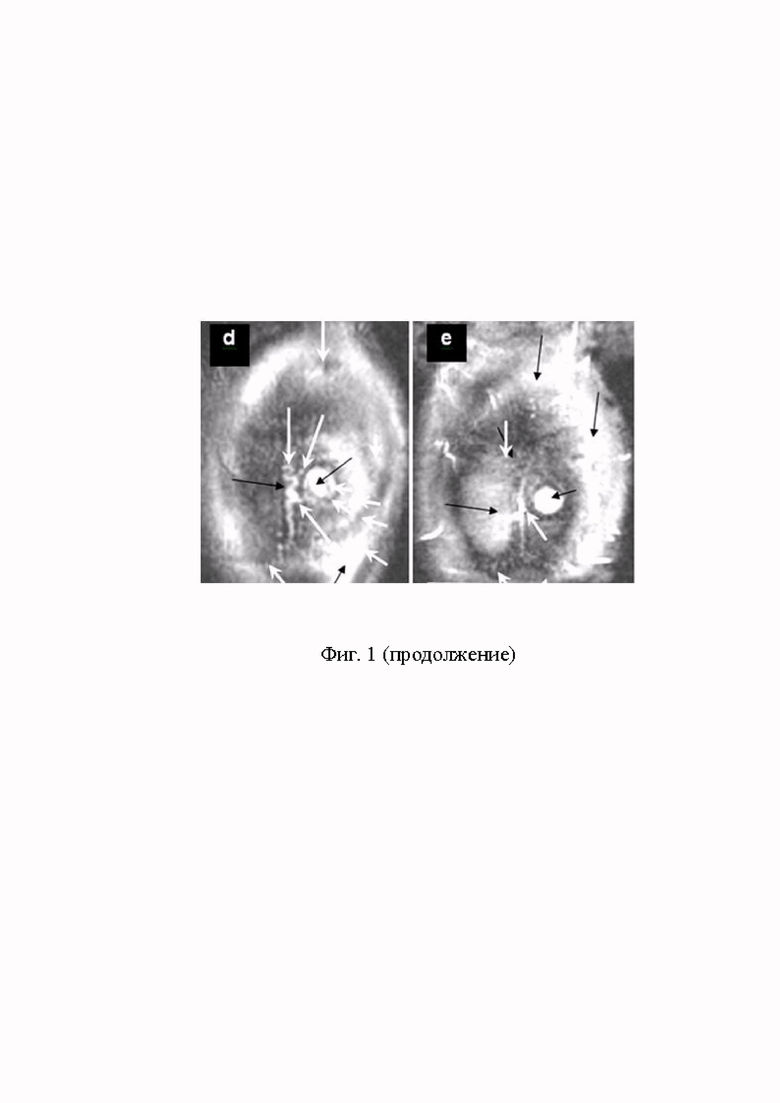

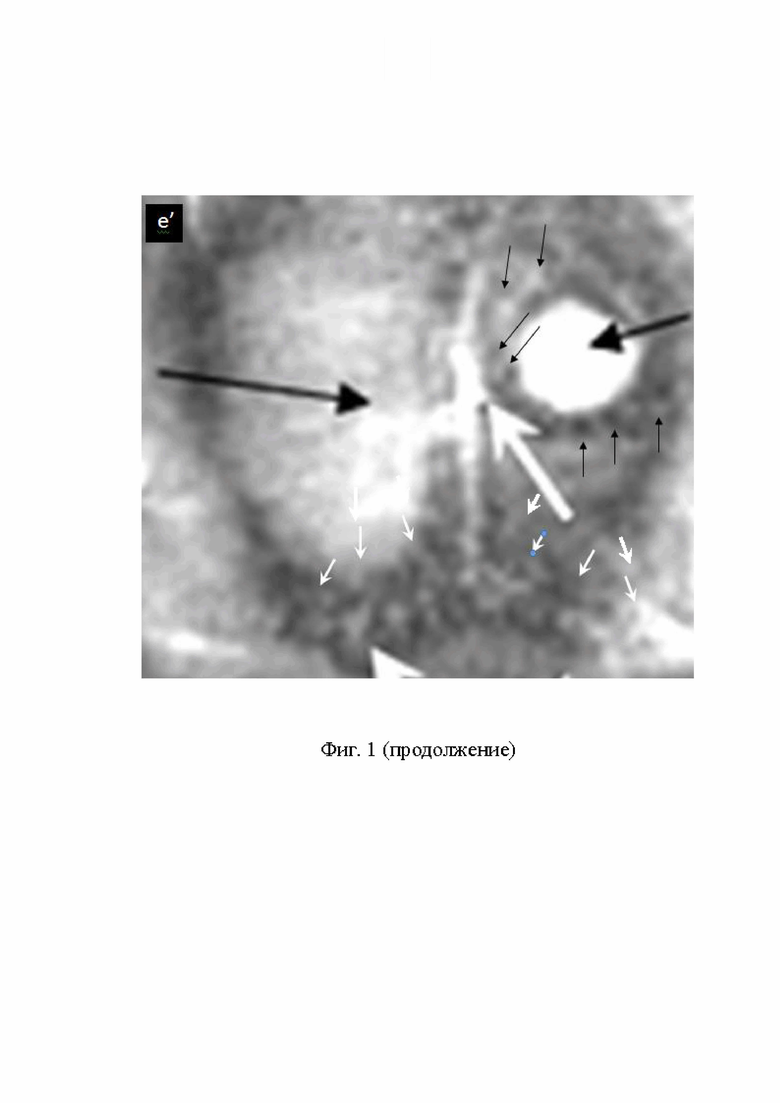
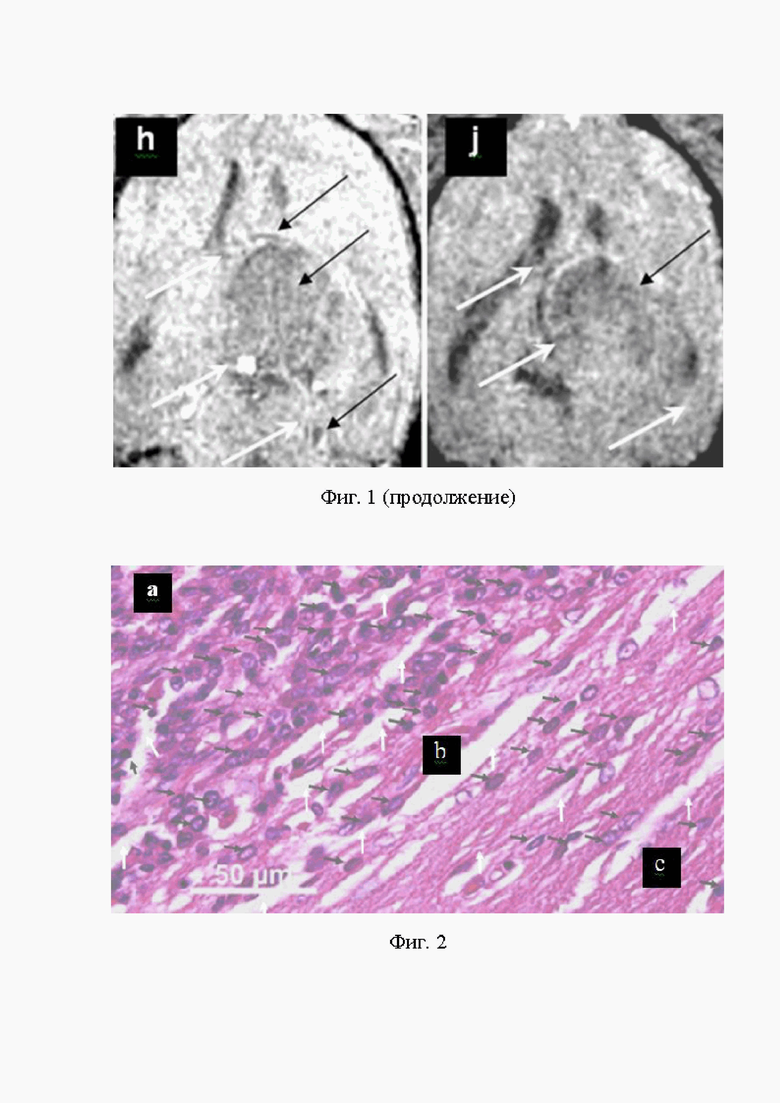
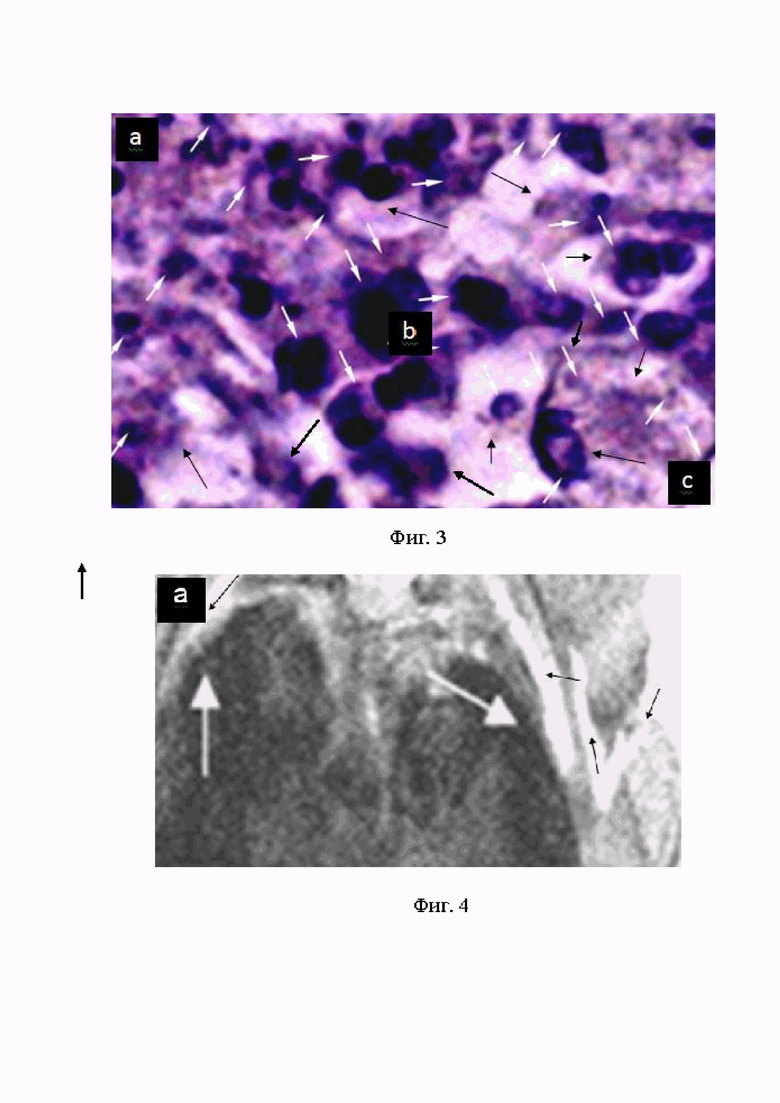
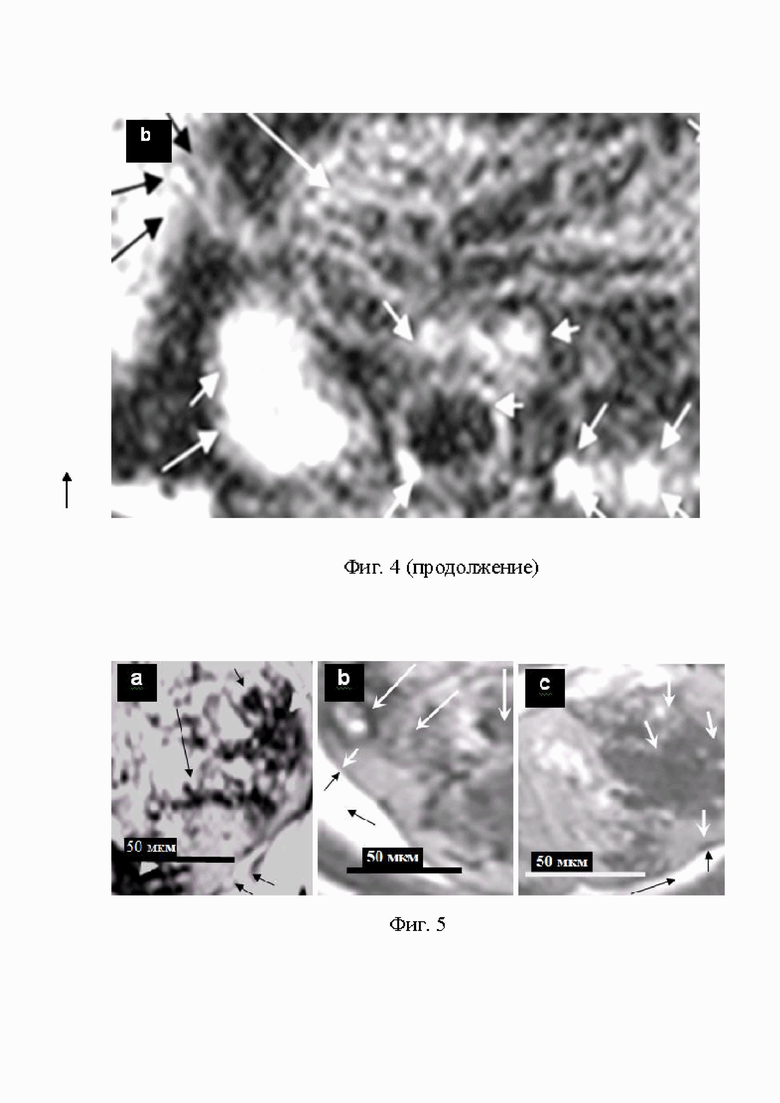
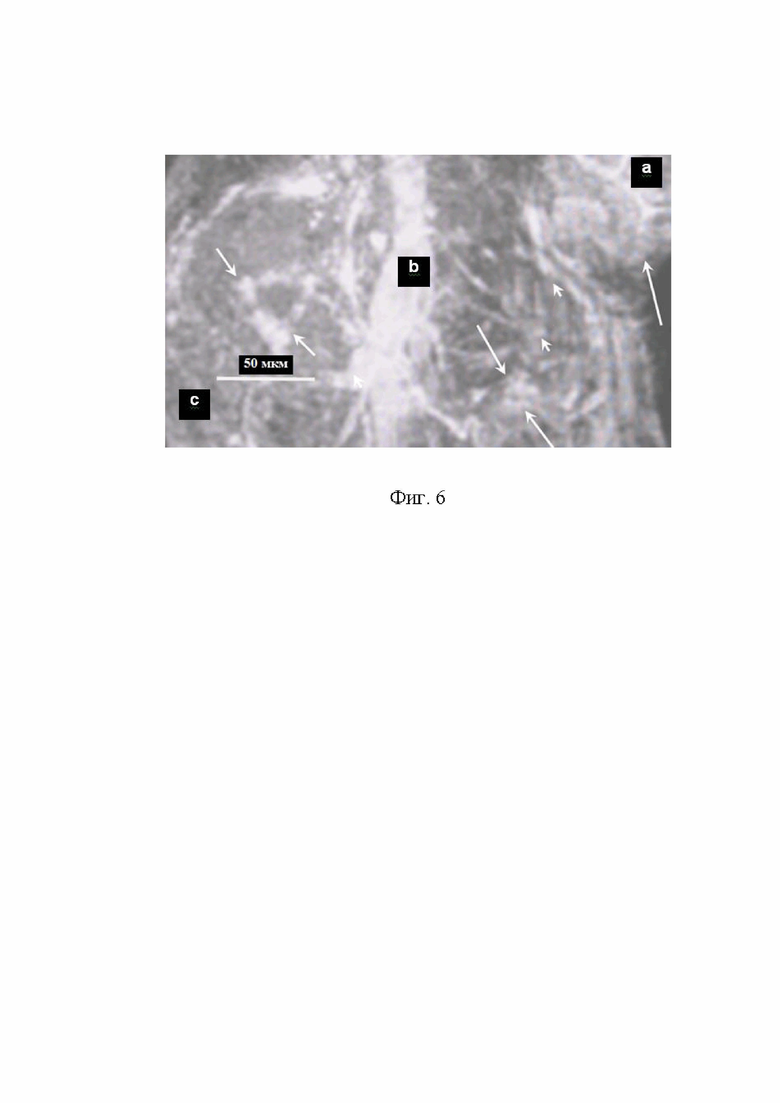
Изобретение относится к экспериментальной диагностике онкологических заболеваний, а именно к средству для комбинированной контрастной магнитно-резонансной томографической (ККМРТ) визуализации изображений процессов биомеханики: инфильтрации, инвазии и метастазирования из центров пролиферации (ЦП) злокачественных клеток (ЗК) из центров пролиферации ЗК (ЦПЗК) и злокачественных опухолей (ЗО) в сосуды и нормальные ткани и стадирования этих процессов. Предложенное средство представляет собой водный золь суперпарамагнитных наносфер магнетита цитрата (СНМЦ) общей формулы (Fe3O4·Fe3+O)+ m · (C6H7O7)‾ n, где m - кристаллическое магнетитовое ядро составляет от 30 до 35% массы СНМЦ, которое покрыто цитрат анионами, n, составляющими от 65 до 70% массы СНМЦ, при этом концентрация СНМЦ водного золя составляет от 0,001 до 40% мас., pH водного золя 6,5-6,9, гидродинамический диаметр наносфер СНМЦ составляет от 13 до 18 нм, намагниченность насыщения (Ms) СНМЦ составляет от 6,3 кА/м до 8,9 кА/м, ζ потенциал водного золя -31 ± 5 мВ, удельное поглощение энергии (UAE) от 210 до 260 Вт/г Fe, релаксивность 4550 ± 90 мл·мг-1 с-1. Также предложены способ получения средства и способ комбинированной контрастной магнитно-резонансной томографической (ККМРТ) визуализации изображений. Изобретение позволяет одновременно увеличить контраст, разрешения и яркость ККМРТИ. 3 н. и 8 з.п. ф-лы, 6 ил., 9 табл., 10 пр.
1. Средство для комбинированной контрастной магнитно-резонансной томографической (ККМРТ) визуализации изображений процессов биомеханики: инфильтрации, инвазии и метастазирования из центров пролиферации (ЦП) злокачественных клеток (ЗК) из центров пролиферации ЗК (ЦПЗК) и злокачественных опухолей (ЗО) в сосуды и нормальные ткани и стадирования этих процессов, представляющее собой водный золь суперпарамагнитных наносфер магнетита цитрата (СНМЦ) общей формулы
(Fe3O4·Fe3+O)+ m · (C6H7O7)‾ n,
где m - кристаллическое магнетитовое ядро составляет от 30 до 35% массы СНМЦ, которое покрыто цитрат анионами, n, составляющими от 65 до 70% массы СНМЦ, при этом
- концентрация СНМЦ водного золя составляет от 0,001 до 40% мас.,
- pH водного золя 6,5-6,9,
- гидродинамический диаметр наносфер СНМЦ составляет от 13 до 18 нм,
- намагниченность насыщения (Ms) СНМЦ составляет от 6,3 кА/м до 8,9 кА/м,
- ζ потенциал водного золя -31 ± 5 мВ,
- удельное поглощение энергии (UAE) от 210 до 260 Вт/г Fe,
- релаксивность 4550 ± 90 мл мг- 1 с– 1.
2. Способ получения средства по п. 1, включающий последовательное выполнение следующих действий:
- водные растворы солей 2- и 3-валентного железа превращают в гидроксиды железа при рН 10-11 (25% NH4OH), полученную суспензию гидроксидов железа нагревают при +80 - +90°С и перемешивают до получения водной суспензии кристаллов магнетита: (Fe2+1, 1 O1,1 Fe3+1,9O2,9) m, где m = 10 (1);
- полученные кристаллы магнетита формулы (Fe2+1,1OFe3+1,9O3)m перемешивают от 20 до 30 мин с 3% - 5% водным раствором FeCl2·4Н2О с получением суспензии кристаллов нестехиометрического магнетита, покрытых FeCl2, обогащённых катионами Fe2+, (Fe2+1,1O Fe3+1,9O3) m (FeCl2) n (2) при m/n от 10/2 до 20/4,
- полученные кристаллы магнетита общей формулы (2) обрабатывают при перемешивании 36% хлористоводородной кислотой в течение 2-3 ч, суспензию кристаллов магнетита центрифугируют 3 мин при 2000 об/мин, супернатант собирают и пропускают через фильтры «Миллипор», в результате чего получают водный золь суперпарамагнитных наносфер активированного магнетита диаметром 11-14 нм, общей формулы: (Fe3O4)m (FeOCl) n (3),
- наносферы активированного магнетита общей формулы (3) обрабатывают посредством замещения анионов Сl‾ на цитрат анионы (C6H7O7)‾ при нагревании водного золя суперпарамагнитных наносфер активированного магнетита от +80 до +90°С и перемешивании с лимонной кислотой до образования водного золя соединения общей формулы
(Fe3O4·Fe3+O)+ m · (C6H7O7)‾ n (4).
3. Способ по п. 2, характеризующийся тем, что полученный золь очищают от исходных веществ в неоднородном постоянном магнитном поле индукцией 0,2 Тл, градиент 0,001 Тл/см.
4. Способ по п. 2, характеризующийся тем, что количественное соотношение (Fe3O4 FeO)m/ (C6H7O7)n составляет от 30% мас./ 70% мас. до 35% мас./ 65% мас.
5. Способ по п. 2, характеризующийся тем, что наиболее предпочтительное количественное соотношение (Fe3O4 FeO)m/ (C6H7O7)n составляет от 30% мас./ 70% мас. до 32% мас./ 68% мас.
6. Способ комбинированной, контрастной магнитно-резонансной томографической (ККМРТ) визуализации изображений биомеханики процессов: инфильтрации, инвазии и метастазирования злокачественных клеток (ЗК) из центров пролиферации ЗК (ЦПЗК) и злокачественных опухолей (ЗО) в сосуды и нормальные ткани и стадирования онкогенеза от перевивки ЗК грызунам до разрушения ЗО злокачественными клетками с инфицированием всего организма, включающий:
а) внутривенное введение лабораторным животным от 0,1 до 3 мл/кг, от 2% до 3% водного золя соединения общей формулы: (Fe3O4FeO)m (C6H7O7)n, такого как определено в п.1, за 10 мин - 96 ч до ККМРТ сканирования;
б) внутривенное введение от 0,1 до 2,0 мл/кг Магневиста® за 3-9 мин до ККМРТ сканирования ЗО;
в) проведение ККМРТ сканирования тканей в режимах получения Т1 взвешенных {600/15 [время повторения, мс/ время эхо, мс], Т2 взвешенных (1950/85) спин эхо, Т2 взвешенных градиент эхо (600/13) и Т*2 взвешенных градиент эхо (550/15)};
г) визуализацию ЗК, ЦПЗК и ЗО с питающими сосудами и границами инфильтрации злокачественных клеток в нормальные ткани на ККМРТ изображениях осуществляют по изменениям интенсивностей чёрных и белых вокселей в исследуемой области.
7. Способ по п. 6, характеризующийся тем, что ЗК, ЦПЗК и ЗО глиомы C6 визуализируют в виде Τ2 W 3D ККМРТ изображений с учётом разницы во времени поперечной релаксации Τ2 W тканей ЦПЗК по сравнению с нормальным мозгом.
8. Способ по п. 6, характеризующийся тем, что различия в протонной плотности (PD) и времени продольной релаксации Τ1 для ЗК, ЦПЗК, ЗО, сосудов и нормальных тканей обнаруживают на параметрических картах, построенных по изображениям, спинового эха, варьируя параметры ΤR и TE от 0,95 до 5,0 с и от 13 до 170 мс соответственно.
9. Способ по п. 6, характеризующийся тем, что в качестве лабораторных животных используют самок крыс весом 180-190 г и самок мышей весом 18-19 г.
10. Способ по п. 6, характеризующийся тем, что предпочтительно на шаге а) обеспечивают внутривенное введение лабораторным животным от 0,3 до 1,5 мл/кг водного золя соединения общей формулы: (Fe3O4FeO)m (C6H7O7)n.
11. Способ по п. 6, характеризующийся тем, что предпочтительно на шаге б) обеспечивают внутривенное введение лабораторным животным от 0,02 до 0,1 мл/кг Магневиста®.
| СПОСОБ ОБНАРУЖЕНИЯ СОСУДОВ, ПИТАЮЩИХ ОПУХОЛЬ, В ЭКСПЕРИМЕНТЕ | 2008 |
|
RU2382596C9 |
| СРЕДСТВО ДЛЯ РАННЕГО КОНТРАСТНОГО МРТ ВЫЯВЛЕНИЯ ЦЕНТРОВ ЗЛОКАЧЕСТВЕННОЙ ПРОЛИФЕРАЦИИ С ПИТАЮЩИМИ СОСУДАМИ, ГРАНИЦАМИ ДИФФУЗНОЙ ИНФИЛЬТРАЦИИ И ОПРЕДЕЛЕНИЕ СТАДИЙ ИХ РАЗВИТИЯ В ДИНАМИКЕ | 2017 |
|
RU2692579C2 |
| СРЕДСТВО И СПОСОБ ДЛЯ РАННЕГО КОНТРАСТНОГО МАГНИТНО-РЕЗОНАНСНОГО ТОМОГРАФИЧЕСКОГО ВЫЯВЛЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ГЛИАЛЬНЫХ ОПУХОЛЕЙ С ПИТАЮЩИМИ ИХ СОСУДАМИ В ЭКСПЕРИМЕНТЕ | 2016 |
|
RU2655303C2 |
| СПОСОБ ФЕРРИМАГНИТО-ТЕРМОХИМИОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ КОМБИНАЦИЯМИ МАГНИТОУПРАВЛЯЕМЫХ НАНОПРЕПАРАТОВ С ВИЗУАЛИЗАЦИЕЙ ОНКОГЕНЕЗА, ОПРЕДЕЛЕНИЕМ ТЕРАПИИ, ПРЕДПОЧТИТЕЛЬНОЙ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ, И МОНИТОРИНГОМ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2563369C1 |
| БРУСНЕЦОВ Н.А | |||
| и др., Контрастные МРТ-препараты для диагностики и терапии злокачественных опухолей, Сборник научных трудов, 17-я международная Плёсская конференция по нанодисперсным магнитным жидкостям, 2016, с | |||
| Самовар-кофейник | 1918 |
|
SU354A1 |
| АБАКУМОВ М.А | |||
| и | |||
Авторы
Даты
2021-12-13—Публикация
2020-08-06—Подача