Изобретение относится к области медицины, а именно к способам получения изображений с помощью оптического просветления биологических тканей и органов и с использованием магниторезонансной томографии.
Трехмерная структура биологических тканей и органов порождает необходимость в объемной визуализации – томографии: рентгеновской, компьютерной томографии (КТ), магниторезонансной томографии (МРТ) или оптической томографии, в частности, оптической когерентной томографии (ОКТ), для получения полной структурной информации и функционировании ткани и органа в норме и при патологии.
Если КТ и МРТ обеспечивают значительную глубину зондирования, хотя в ряде случаев контраст изображений оказывается недостаточным и поэтому применяются различные контрастирующие агенты, то оптическая визуализация объемных тканей или целых органов затруднена из-за сильного рассеяния света, которое возникает за счет неоднородности показателей преломления различных составляющих биологической ткани.
Основные достижения в области снижения влияния рассеяния на глубину зондирования и получения высококонтрастных оптических изображений связаны с разработкой и применением способов иммерсионного просветления тканей, которые направлены на выравнивание показателя преломления мелкодисперсной фракции компонентов тканей и биологических жидкостей (согласование показателей преломления) для уменьшения мелкодисперсной структурной неоднородности и соответственно сильного рассеяния света. Полный обзор доступных методов иммерсионного оптического просветления можно найти в этих публикациях [V.V. Tuchin, Optical Clearing of Tissues and Blood, PM 154, SPIE Press, Bellingham, WA, 2006; Genina E.A., et al., Optical clearing of biological tissues: prospects of application in medical diagnostics and phototherapy, Journal of Biomedical Photonics & Engineering 1(1), 22-58 (2015); D.S. Richardson & J.W. Lichtman, Cell 162 (2): 246-257 (2015)]. Эти методы обычно можно разделить на два класса: методы, использующие иммерсионное оптическое просветление на основе химических растворителей или агентов на водной основе. Методы просветления на основе растворителей требуют начального обезвоживания, которое обычно достигается либо с помощью спирта (этанол, метанол) или тетрагидрофурана (THF) (K. Becker et al., PLoS ONE 7 (3): e33916 (2012); A. Erturk et al., Nat. Protoc. 7 (11): 1983-1995 (2012)). После обезвоживания, происходит оптическое просветление ткани путем согласования показателей преломления компонентов ткани с помощью соответствующих растворителей, в частности метилсалициата, бензилового спирта, бензилбензоата, дихлорметана и дибензилового эфира [K. Becker et al., PLoS ONE 7 (3): e33916 (2012); H. Dodt et al., Nat. Methods 4 (4): 331-336 (2007); A. Erturk et al., Nat. Protoc. 7 (11): 1983-1995 (2012); N. Renier et al., Cell 159 (4): 896-910 (2014)]. Из этого перечня следует, что все эти растворители являются опасными для жизни ядами и не могут быть в принципе использованы в медицине для просветления живых объектов. Кроме того, использование этих растворителей, особенно в сочетании со спиртами при предварительной дегидратации, часто приводит к гашению флуоресценции исследуемых белков – маркеров патологий [H. Dodt et al., Nat. Methods 4 (4): 331-336 (2007), K. Becker et al., PLoS ONE 7 (3): e33916 (2012)].
Такие недостатки не встречаются при использовании большинства иммерсионных просветляющих агентов на водной основе, подобные недавно разработанным SeeDB [M.T. Ke et al., Nat. Neurosci. 16 (8): 1154-1161 (2013)], Scale [H. Hama, Nat. Neurosci. 14 (11): 1481-1490 (2011) и WO2011 / 111876)] и FocusClear [A.S. Chiang et al., Proc. Natl. Аcad. Sci. 99 (l): 37-42 (2002) и патент США №6472216)] или 3DISCO [A. Erturk et al., Nat. Protoc. 7 (11): 1983-1995 (2012); F. Pavone et al., Whole-Brain Vasculature Reconstruction at the Single Capillary Level, Scientific Reports, 8:12573 (2018); Dan Zhu et al. Evaluation of seven optical clearing methods in mouse brain, Neurophoton. 5(3), 035007 (2018)]. Более 1600 химических веществ были недавно исследованы в качестве потенциальных оптических просветляющих агентов с помощью высокопроизводительной системы оценки эффективности оптического просветления тканей [Hiroki R. Ueda et al. Chemical Landscape for Tissue Clearing Based on Hydrophilic Reagents, Cell Reports (2018)].
Однако применение иммерсионных просветляющих агентов на водной основе или агентов, допускающих растворение в воде, ограничены относительно тонкими слоями тканей и требуют длительного времени иммерсии. В связи с этим ведется постоянный поиск эффективных и безвредных усилителей проницаемости тканей для иммерсионных агентов [A. Klingberg, Non-hazardous optical clearing of biological samples, WO 2017/093323 Al, 08.06.2017]. В этом патенте предлагается использовать эфир коричной кислоты в качестве иммерсионного просветляющего агента и композиции для дегидратации, дополнительно содержащие одно или несколько поверхностно-активных веществ, включая неионогенные поверхностно-активные вещества (ПАВ), например, полисорбатные ПАВ, такие как полисорбат 20 (Твин® 20), полисорбат 80 (Твин® 80), полиэтилен гликоль-октилфениловый эфир (TritonX-100), глицерин или 1-тиоглицерин. Способ, позволяет оптически просветлять ткани и органы мелких животных (например, мозг, легкие, сердце, почки, печень, селезенка или кости) за времена, составляющие несколько часов, и сохраняет флуоресценцию белков-маркеров. Можно указать еще целый ряд патентов, в которых предлагаются пути повышения эффективности оптического просветления и сохранения квантового выхода флуоресценции белков–маркеров (CN104568553A, US6472216 B1, CN 102749231 A, CN 103263678 A, W02013191274; EP2547999A4).
Несмотря на множество уже предложенных способов иммерсионного просветления и агентов, реализующих оптическую прозрачность тканей, многие из них не применимы для исследований на живых объектах in vivo по ряду принципиальных причин:
1) Многие из эффективных иммерсионных просветляющих агентов являются ядами;
2) Многие используют фиксированную ткань, необратимо дегидратированную, а также растворение липидных компонентов;
3) При больших концентрациях даже водорастворимые иммерсионные агенты могут привести к диссоциации коллагена, в результате чего пространственная структура коллагена разрушается, эндогенный оптический сигнал снижается или даже исчезает совсем, что сильно влияет на интенсивность генерации, например, второй гармоники.
Важно также отметить, что для фиксированных тканей время просветления существенно замедляется, до шести-семи раз (H. Schaefer, T. E. Redelmeier, Skin Barrier, Principles of Percutaneous Absorption, Karger, Basel et al. 1996) по сравнению с интактными тканями и органами, что является существенным преимуществом применения биологически совместимых иммерсионных агентов на живых (не фиксированных) тканях и органах.
Следует также отметить, что все известные методы оптического просветления не применялись в схемах многомодальной диагностики совместно с КТ или МРТ. Однако такая биомодальная или многомодальная диагностика дает огромную перспективу для визуализации как структурных, так и функциональных особенностей биологических тканей и органов в норме и при различных патологиях.
КТ и МРТ широко используют различные контрастирующие агенты. Например, первый представитель гадолиниевых контрастных веществ Gd (III) диэтилентриаминпентаацетат (Gd-DTPA или Magnevist) впервые был описан как МРТ-контрастный агент в 1981 году [см. Valérie C. Pierre, et al., Contrast agents for MRI: 30+ years and where are we going? J. Biol. Inorg. Chem. 2014 February; 19(2): 127–131. doi:10.1007/s00775-013-1074-5]. К 1983 году последовал первый отчет по исследованиям на животных с использованием Gd-DTPA в качестве МРТ контрастного агента. Год спустя, была подана первая патентная заявка на контрастное вещество МРТ [Патент США US4647447], которая была очень широкой и защищала каждую диагностическую среду, содержащую физиологически совместимую соль аниона комплексообразующей кислоты, и, хотя бы один центральный ион элемента с атомным номером от 21 до 29, 42, 44 или от 57 до 83. В 1988 году Магневист получил одобрение Управления по контролю за продуктами и лекарствами США (FDA) для проведения МРТ-исследования центральной нервной системы с усиленным контрастом. В 1993 году одобрение было распространено на остальную часть тела, за исключением сердца. Через пятнадцать лет после одобрения FDA Магневиста, были одобрены три других МРТ контрастных агента для внеклеточных жидкостей: ProHance (Gd-HP-DO3A) в 1992 году, Omniscan (Gd-DTPA-BMA) в 1993 году и Optimark (Gadoversetamide) в 1999 году. Кроме того, примерно в это же время было одобрено пять других контрастных веществ (три для внеклеточной жидкости, один для гепатобилиарной визуализации и один агент для пула крови). В 21 веке FDA одобрение получили MultiHance (Gd-BOPTA) в 2004 году, Eovist (Gadoxetate) в 2008 году, Аблавар (бывший Vasovist, MS-325) в 2008 году, Gadovist (Gadobutrol) в 2011 году и Dotarem (Gd-DOTA) в 2013 году; хотя многие из них, такие как Gd-DOTA, были одобрены намного раньше в Европе и других странах. И до настоящего времени, все контрастные агенты для внеклеточных жидкостей и пула крови, одобренные FDA, основаны на гадолинии. К концу 2009 года применение контрастных агентов на основе гадолиния оценивалось в 87,5 млн доз только в США; большинство (> 50 миллионов), использовали Gd-DTPA (Magnevist). В настоящее время из всех получивших одобрение FDA контрастных агентов для МРТ за пределами США для системного/парентерального введения используют только макроциклические хелатирующие соединения гадолиния, такие как Gadovist (Gadobutrol) и Dotarem (Gd-DOTA), по причине недостаточной стабильности линейных хелатирующих соединений, таких как Gd-DTPA (Magnevist). Недостаточная стабильность последних может вызывать патологии (например, нефрогенный системный фиброз) в организме пациентов с хронической и тяжелой почечной недостаточностью (т.е. при скорости клубочковой фильтрации почек < 30 мл/мин/1.73 м2), или острой почечной недостаточностью.
Технической проблемой настоящего изобретения является разработка способа исследования биологических тканей и органов путём бимодальной визуализации с использованием иммерсионного оптического просветления биологической ткани или органа на основе контрастных МРТ агентов.
Техническим результатом является повышение информативности и достоверности получаемых изображений за счёт синхронного во времени и пространстве повышения контраста оптического и МРТ-изображений для получения одновременно структурной и функциональной информации о тканях или органах.
Технический результат достигается тем, что в способе визуализации биологических тканей и/или органов, включающем иммерсионное оптическое просветление биологической ткани или органа, согласно изобретению, в ткань или орган вводят иммерсионный агент на основе гадолиния, проводят мониторинг диффузии агента в область исследования с помощью МРТ и одного из оптических методов, выявляют область с повышенным контрастом и в этой области регистрируют МРТ изображение ткани или органа, выявляют область оптического просветления, регистрируют в этой области оптическое изображение, осуществляют пространственную привязку МРТ изображения к основным структурам и органам для последующего совмещения МРТ в области повышенного контраста с оптическим изображением в области оптического просветления.
В качестве иммерсионного агента на основе гадолиния может быть выбран препарат «Гадовист» или «Магневист», или «Дотарем».
Введение иммерсионного агента осуществляют либо путём местного поверхностного нанесения на кожу, либо внутрь полого органа, либо путем внутритканевой или внутрисосудистой инъекции.
В качестве одного из оптических методов мониторинга диффузии агента в область исследования используют спектрофотометрию обратного рассеяния с пространственным разрешением и/или флуоресцентную спектроскопию, и/или конфокальную микроскопию, и/или многофотонную томографию, и/или оптическую когерентную томографию, и/или оптоакустическую визуализацию.
Мониторинг диффузии агента в область исследования для кожи проводят в течение 40-60 мин, для слизистых полых органов 10-30 мин, для межтканевой инъекции 5-10 мин, а для внутрисосудистой инъекции 10-100 мин.
Пространственную привязку к основным структурам и органам осуществляют по особенностям анатомического строения или функционирования ткани и органа.
Регистрацию оптического изображения осуществляют путём спектрофотометрии обратного рассеяния с пространственным разрешением и/или методом флуоресцентной спектроскопии, в том числе с разрешением во времени и при многофотонном возбуждении, и/или генерацией второй или третьей гармоник, и/или методом конфокальной микроскопии, и/или оптической когерентной томографии, и/или оптоакустической или фототермической визуализации.
Дополнительно исследуемые области биологической ткани и/или органов маркируют путём введения маркеров на основе флуоресцентных белков или окрашивания с помощью флуорофор-связывающих лигандов. При этом, маркирование осуществляют с помощью экспрессии флуоресцентных белков, таких как GFP, YFP и производных флуорофоров этой группы либо с помощью антител, связанных с флуорофорами.
Антитела включают все антитела, связанные с AF-красителями, такие как антиCD31-AF647, антиCD45-AF647, антиSiglecF-AF594, антиCDllc-AF647, а также их генно-инженерные химеры, полученные путем слияния аминокислотных последовательностей антител и их фрагментов с аминокислотными последовательностями флуоресцентных белков eGFP, eYFP, tdTomato, mCherry, iRFP и других им подобных.
В наших исследованиях было обнаружено, что контрастные МРТ агенты на основе гадолиния являются очень эффективными иммерсионными оптическими просветляющими агентами. Такое решение является безопасным, поскольку все эти агенты разрешены для применения и широко используются в клинической практике. Эти агенты могут не только пропускать больше света через ткани, увеличивая глубину зондирования самых разнообразных оптических средств диагностики, микроскопии и томографии (спектрофотометрии обратного рассеяния с пространственным разрешением, конфокальной микроскопии, многофотонной томографии (МФТ), оптической когерентной томографии), но и усиливать выход флуоресценции от молекулярных маркеров метаболических и патологических процессов в биологических тканях и органах.
Изобретение поясняется иллюстрациями.
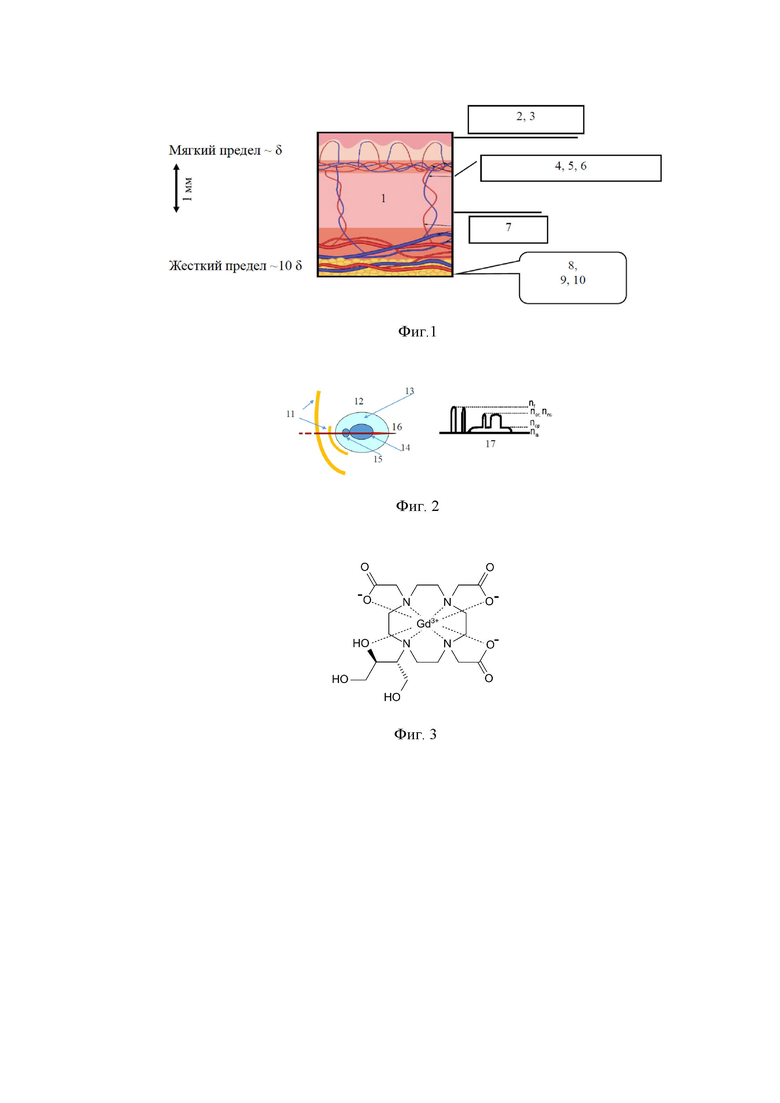
На фиг. 1 представлена иллюстрация глубины зондирования разными оптическими методами, где позициями обозначено: 1 – кожа; 2 – обычная микроскопия; 3 – сканирующая микроскопия ближнего поля; 4 – конфокальная микроскопия; 5 – двух- или трехфотонная микроскопия; 6 – микроскопия на основе генерации второй или третьей гармоники; 7 – оптическая когерентная томография (ОКТ); 8 – диффузная оптическая томография, включая флуоресцентную и с временным разрешением; 9 – оптическая томография с ультразвуковой модуляцией; 10 – фотоакустическая и фототепловая томография.
На фиг. 2 дано схематическое представление строения биоткани и клетки, распределение показателя преломления отдельных компонентов биоткани и клетки, их относительные размеры (мелкодисперсная фракция), где позициями обозначено: 11- белковые (коллагеновые, эластиновые и др.) волокна; 12 – клетка; 13 – цитоплазма; 14 – ядро; 15 – органелла; 16 – линия, вдоль которой показаны вариации показателя преломления n; 17 – распределение показателя преломления по сечению ткани вдоль направления 16; nf – показатель преломления вещества волокон; nor – показатель преломления вещества органеллы; nnc – показатель преломления вещества ядра; ncp – показатель преломления цитоплазмы; nis – показатель преломления межтканевого вещества.
На фиг. 3 представлена структурная химическая формула Гадобутрола (Gadobutrol) C18H31GdN4O9 – действующего вещества парамагнитного контрастного МРТ-агента Гадовиста (Gadovist).
На фиг. 4 показаны зависимости показателя преломления МРТ агентов от длины волны, измеренные с помощью многоволнового рефрактометра Atago DR-M2 1550 (Atago, Japan), где позициями обозначено: 18 – Магневист, 19 – Дотарем, 20 – Гадовист.
На фиг. 5 показана визуальная демонстрация эффективности иммерсионного оптического просветления с помощью МРТ агентов кожи мыши nu/BalbC при длительности пребывания образца кожи в агенте в течение 0, 30 и 60 мин: 18 – Магневист, 19 – Дотарем, 20 – Гадовист.
На фиг. 6 показана экспериментальная установка для измерения спектров пропускания кожи при ее иммерсионном оптическом просветлении с помощью МРТ агентов, на которой позициями обозначено: 21 – галогеновая лампа; 22 – волоконный световод с коллиматором; 23 – образец кожи, размещенный в кювете с МРТ-агентом; 24 – быстродействующий спектрометр на дифракционной решетке и ПЗС-линейке; 25 – персональный компьютер (ПК).
На фиг. 7 показаны кинетические кривые для отдельных спектральных составляющих коллимированного пропускания образцов кожи мыши на разных длинах волн, где позициями обозначено: 26 - на 500 нм, 27 – на 600 нм, 28 – на 700 нм, 29 – на 800 нм и 30 – на 900 нм в условиях иммерсионного оптического просветления с помощью МРТ-агентов: Гадовиста (20), Магневиста (18), Дотарема (19) и контрольного опыта с иммерсией образца кожи в физиологическом растворе (31).
На фиг. 8 показан внешний вид оптического когерентного томографа (ОКТ) Spectral Radar OCT System OCP930SR 022 (Thorlabs Inc., США) (930 нм) с шириной спектральной полосы 100 нм, выходной мощностью 2 мВт, максимальной глубиной сканирования в воздухе 1.6 мм и продольным разрешением в воздухе 6.2 мкм, где позициями обозначено: 32 – блок управления и обработки данных, 33 – интерферометрический сенсор, 34 – персональный компьютер.
На фиг. 9 представлены ОКТ-изображения ex vivo образцов кожи мыши при иммерсионном оптическом просветлении с помощью МРТ-агентов при длительности пребывания образца кожи в агенте в течение 0, 30 и 60 мин: 18 – Магневист, 19 – Дотарем, 20 – Гадовист.
На фиг. 10 представлены взвешенные МРТ-изображения области таза T1 (позиция 35) и мочевого пузыря T2 (позиция 36) человека без гадолиния (37), при низкой (38) и высокой (39) его концентрации (http://mriquestions.com/does-gd-affect-t2.html).
Изобретение представляет собой способ, подходящий для оптического просветления биологических тканей и органов, таких как кожа, полые органы (слизистые полости рта, мочевого пузыря, желчного пузыря, желудка, прямой кишки, вагины и шейки матки), легкие, кровеносные сосуды, молочная железа, хрящевая и костная ткани, а также другие ткани, доступные в результате эндоскопического исследования.
Фиг. 1 иллюстрирует основные проблемы оптической визуализации, обусловленные сравнительно малой глубиной зондирования разными оптическими методами, на примере исследования кожи. Глубина зондирования, δ (см), определяется в диффузионном приближении величинами коэффициента поглощения μа (1/см) и приведенного коэффициента рассеяния μs' (1/см) [V.V. Tuchin, Tissue Optics, 3rd ed., SPIE Press, PM 254, 2015]:
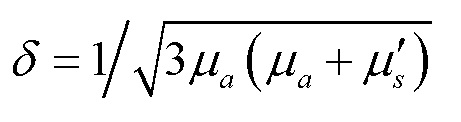 . (1)
. (1)
Для большинства биологических тканей μs' по величине много больше (от 10 раз и выше), чем μа. Коэффициент поглощения и его зависимость от длины волны, μа (λ), определяется концентрацией эндогенных и экзогенных хромофоров в биоткани, таких как гемоглобин, миоглобин, меланин, коллаген, эластин, бета-каротин, билирубин, вода и др. В свою очередь для большинства биотканей приведенный коэффициент рассеяния μs' определяется следующим соотношением [V.V. Tuchin, Tissue Optics, 3rd ed., SPIE Press, PM 254, 2015]:
μs' =μs(1– g) ~d2ρ(d/λ)0.37(m –1)2, (2)
где g – фактор анизотропии рассеяния; d – средний диаметр рассеивающих компонентов в биоткани; ρ – плотность (концентрация) рассеивающих компонентов; λ – длина волны зондирующего света; m ≡ ns/n0 – относительный показатель преломления биоткани, т.е. отношение показателя преломления рассеивающих компонентов ns к показателю преломления основного вещества ткани (межтканевого вещества и цитоплазмы) n0.
На Фиг. 1 показаны два предельных случая «мягкий» и «жесткий», которые демонстрируют возможность обеспечения той или иной глубины зондирования для получения качественных (не размытых) изображений в рамках различных оптических методов. Для всех этих методов принципиальным является увеличение глубины зондирования, что можно сделать только путем уменьшения коэффициента рассеяния.
Основной принцип иммерсионного оптического просветления проиллюстрирован на Фиг.2, где схематически представлено строение биоткани и клетки, распределение показателя преломления отдельных компонентов биоткани и клетки и их относительные размеры (мелкодисперсная фракция), такие как белковые (коллагеновые, эластиновые и др.) волокна (11); ядро клетки (14); органелла (15). Показана неоднородность распределения показателя преломления (17) по сечению ткани вдоль направления 16 с указанием показателей преломления веществ отдельных компонентов тканей: волокон (nf), органеллы клетки (nor), ядра клетки (nnc), цитоплазмы (ncp) и межтканевого пространства (nis). Именно такая неоднородность приводит к сильному рассеянию (см. соотношение (2)), которое может быть в значительной степени подавлено при согласовании показателей преломления указанных компонентов (m ≡ ns/n0 → 1, т.е. при n0 → ns приведенный коэффициент рассеяния μs'→ 0) при иммерсии этих тканей в иммерсионном агенте, в качестве которого предлагается использовать один из МРТ-контрастных агентов.
Представим несколько наиболее часто используемых в клинической практике парамагнитных контрастных МРТ-агентов, таких как Гадовист (Gadovist), Магневист (Magnevist) и Дотарем (Dotarem).
Структурная химическая формула Гадобутрола (Gadobutrol), C18H31GdN4O9 – действующего вещества Гадовиста (Gadovist) представлена на Фиг. 3. Гадовист представляет собой нейтральный (неионный) комплекс гадолиния (III) с макроциклическим лигандом — дигидрокси-гидроксиметилпропил-тетраазациклододекан-триуксусной кислотой (бутролом). Полное химическое название Гадобутрола [10-[2,3-Дигидрокси-1-(гидроксиметил)пропил]-1,4,7,10-тетраазацикло додекан-1,4,7-триацетато(3–)-N1, N4, N7, N10, O1, O4, O7] гадолиний (III), его молекулярная масса составляет 604,72. Он очень хорошо растворяется в воде, имеет чрезвычайно высокую гидрофильность. Макроциклический лиганд образует с парамагнитным ионом гадолиния прочный комплекс, характеризующийся высокой стабильностью как in vitro, так и in vivo. Для физиологической температуры 37°C физико-химические свойства раствора Гадовиста для внутривенного введения (1,0 ммоль/мл) таковы: осмолярность 1117 мОсм/л; осмоляльность 1603 мОсм/кг воды; вязкость 4,96 мПа·с; плотность 1.3 г/мл. Эти свойства определяют эффективность иммерсионного просветления, в том числе за счет сравнительно высокого показателя преломления (см. Фиг.4).
Магневист (Magnevist) (0,5 ммоль/мл) представляет собой смешанную соль гадопентетовой (диэтилентриаминпентауксусной) кислоты, гадолиния (III) и димеглюмина с молекулярной массой 469,01. Его осмоляльность при 37°C немного выше, чем у Гадовиста, и составляет 1960 (мОсм/кг H2O); вязкость 4,9 мПаскаль·сек при 20°C и почти вдвое меньшая, равная 2,9 мПаскаль·сек, при 37°C; плотность 1,210 г/мл при 20°C и 1,195 г/мл при 37°C; pH 7,0–7,9. Эти свойства также определяют эффективность иммерсионного просветления, в том числе за счет сравнительно высокого показателя преломления (см. Фиг.4).
Для Дотарема (Dotarem) действующим веществом является комплекс гадолиния (III) и гадотеровой кислоты (Gadoteric acid) с молекулярной массой 279,32. При внутривенном введении гадотеровая кислота распределяется главным образом во внеклеточной жидкости организма, не связывается с белками плазмы, не проникает через неповрежденный гематоэнцефалический барьер (ГЭБ), не проникает в материнское молоко, медленно преодолевает только плацентарный барьер. Быстро выводится с мочой в неизмененном виде.
Способ иммерсионного оптического просветления биологической ткани или органа заключается во введении иммерсионного МРТ-контрастного агента на основе гадолиния в ткань или орган из числа описанных выше (Гадовиста, Магневиста, Дотарема), а также иных МРТ-контрастных агентов, доступных для клинических исследований. Зависимости показателя преломления МРТ агентов от длины волны, измеренные нами с помощью многоволнового рефрактометра Atago DR-M2 1550 (Atago, Japan) для Магневиста (18), Дотарема (19), Гадовиста (20) представлены на Фиг. 4. Хорошо видно, что показатели преломления Магневиста (18), Дотарема (19) и Гадовиста (20) существенно выше показателя преломления цитоплазмы (ncp) и межтканевого вещества (nis), которые для длин волн 400-700 нм лежат в пределах от 1.335 для цереброспинальной жидкости и до 1.35 для межтканевого пространства многих тканей и цитоплазмы многих типов клеток [V.V. Tuchin, Tissue Optics, 3rd ed., SPIE Press, PM 254, 2015].
Регистрацию оптического изображения осуществляют с помощью эндоскопического устройства или прокалывания ткани с помощью тонкой иглы с встроенным миниатюрным волоконно-оптическим зондом.
При этом, в зависимости от типа клинического исследования и диагностики заболевания предпочтительный вариант введения иммерсионного агента может включать как неинвазивное или мало-инвазивное местное введение, например, на поверхность кожи или внутрь полого органа, включая слизистые полости рта, мочевого пузыря, желчного пузыря, желудка, прямой кишки, вагины и шейки матки, а также легкие, молочную железу, хрящевую, костную и другие ткани, доступные в результате эндоскопического исследования. Во многих случаях возможно введение МРТ-агентов путем внутритканевой или внутрисосудистой инъекции. Внутритканевая инъекция может быть хорошо совмещена с ОКТ исследованием с помощью игольчатого волоконного пробника, проникающего в мягкие ткани вплоть до центра, например, опухоли молочной железы или в легкие (Lorenser D., McLaughlin R.A., Sampson D.D. (2015) Optical Coherence Tomography in a Needle Format. In: Drexler W., Fujimoto J. (eds.) Optical Coherence Tomography. Springer, Cham; Jiawen Li, Bryden C. Quirk, Peter B. Noble, Rodney W. Kirk, David D. Sampson, Robert A. McLaughlin, Flexible needle with integrated optical coherence tomography probe for imaging during transbronchial tissue aspiration, J. Biomed. Opt. 22(10), 106002, 2017), а внутрисосудистая инъекция с эндоскопической ОКТ [Y. Ozaki, et al., Comparison of Contrast Media and Low-Molecular-Weight Dextran for Frequency-Domain Optical Coherence Tomography, Circulation Journal, 76, 922-927, 2012]. Внутрисосудистая инъекция МРТ-контрастного агента обеспечивает не только возможность бимодальной визуализации (МРТ-ОКТ) при исследовании нарушений стенок сосудов, но и доставляет системно МРТ-агент ко всем органам, где он накапливается и сохраняется в достаточном количестве для томографического исследования в течение примерно 10-100 мин. Поэтому мониторинг диффузии агента в область исследования с помощью МРТ и одного из оптических методов осуществляется обычно в течение 10-100 мин в зависимости от способа введения агента, типа ткани или органа, а предпочтительными, являются следующие интервалы времени введения: для кожи при местном введении интервал времени составляет примерно 40-60 мин, для слизистых полых органов примерно 10-30 мин, для межтканевой инъекции 5-10 мин, а для внутрисосудистой инъекции 10-100 мин (10-12 мин при исследовании стенок сосудистой системы, и вплоть до 100 мин – это время достижения максимума накопления МРТ агента в сравнительно объемных тканях, в том числе и опухолях).
Изобретение предлагает регистрацию МРТ-изображения ткани или органа повышенного контраста (Фиг. 10) и его пространственную привязку к основным структурам и органам исследуемого человека или животного для оптимального совмещения МРТ и оптического изображения, что отражено в формуле изобретения, где заявляется предпочтительный вариант осуществления способа в стадии регистрации МРТ изображения ткани или органа, которое реализуется по особенностям анатомического строения или функционирования ткани или органа (скорость диффузии воды) или, например, для головного мозга методом трактографии проводящих путей [Куликова С.Н. и др., Диффузионная тензорная магнитно-резонансная томография и трактография при рассеянном склерозе: обзор литературы, Журнал неврологии и психиатрии им. С.С. Корсакова. Рассеянный склероз, N 2, 52-59 (2012); Special Issue: Diffusion MRI of the brain: The naked truth, NMR in Biomedicine 32 (4) e3785, 2019].
В предпочтительном варианте осуществления способа в стадии мониторинга диффузии агента в область исследования с помощью одного из оптических методов предлагается использовать наиболее доступные во многих клинических лабораториях спектрофотометрию обратного рассеяния с пространственным разрешением, флуоресцентную спектроскопию, конфокальную микроскопию, МФТ, ОКТ, оптоакустическую визуализацию [V.V. Tuchin, Optical Clearing of Tissues and Blood, PM 154, SPIE Press, Bellingham, WA, 2006; Genina E.A., et al., Optical clearing of biological tissues: prospects of application in medical diagnostics and phototherapy, Journal of Biomedical Photonics & Engineering 1(1), 22-58 (2015); D.S. Richardson & J.W. Lichtman, Cell 162 (2): 246-257 (2015); V.V. Tuchin, Tissue Optics, 3rd ed., SPIE Press, PM 254, 2015].
В то же время, предпочтительный вариант осуществления способа в финальной стадии регистрации оптического изображения и его привязки к МРТ изображению по области оптического просветления (пониженного рассеяния света) включает спектрофотометрию обратного рассеяния с пространственным разрешением, как самый простой и широко используемый в клинике метод, но не всегда достаточный для получения требуемой информации об объекте исследования. В таком случае используют более информативные оптические методы исследования, а именно флуоресцентную спектроскопию с разрешением во времени и при многофотонном возбуждении, генерацию второй или третьей гармоник, конфокальную микроскопию, ОКТ, оптоакустическую или фототермическую визуализацию.
Для многих применений оптических технологий важно, чтобы флуоресцентные маркеры на основе флуоресцентных белков или при окрашивании ткани и клеток с помощью флуорофор-связывающих лигандов сохраняли свои флуоресцентные свойства после иммерсионного просветления. При этом уменьшение рассеяния света как для возбуждающего света, так и для возбужденной флуоресценции, должно приводить в целом к повышению интенсивности собираемого света флуоресценции из глубины ткани. Несмотря на то, что свободный гадолиний (III), в принципе, способен выступать в роли тушителя флуоресценции, нет оснований полагать, что стандартные МРТ-контрастные агенты могут привести к тушению флуоресценции различных флурофоров, в том числе триптофана и тирозина белков, так как концентрация свободных катионов гадолиния (III) в растворах хелатированного гадолиния (III), предназначенных для медицинского применения, является исчезающе малой. Тушение флуоресценции различных белков в биологических тканях за счет связывания непосредственно самого комплекса гадолиния (III) в области ультрафиолета невозможно исключить только в случае комплексообразующих хелатов, которые связываются с белками за счет гидрофобных остатков в составе хелатов, например, в случае Аблавара (Vasovist) [https://onlinelibrary.wiley.com/doi/pdf/10.1002/cmmi.1531].
Более того, можно использовать комбинированные маркеры, которые одновременно дают МРТ контраст за счет гадолиния и флуоресцентный контраст, например, за счет индоцианинового красителя Cy5.5 [A. Berdichevskia, H. S. Yameena, H. Dafnib, M. Neemanc, and D. Seliktara, Using bimodal MRI/fluorescence imaging to identify host angiogenic response to implants, PNAS 112(16), 5147–5152 (2015)]. Флуоресценция маркированных областей биологической ткани может быть обеспечена с помощью экспрессии флуоресцентных белков, таких как GFP, YFP и других известных мутантов и производных флуорофоров этой группы. Флуоресценция также может быть результатом окрашивания клеток биологической ткани с помощью антител, связанных с флуорофорами. Примеры для пары флуорофор-антитело включают все антитела, связанные с AF-красителями, примерами которых могут служить антиCD31-AF647, антиCD45-AF647, антиSiglecF-AF594, антиCDllc-AF647, а также их генно-инженерных химер, полученных путем слияния аминокислотных последовательностей антител и их фрагментов с аминокислотными последовательностями флуоресцентных белков eGFP, eYFP, tdTomato, mCherry, iRFP и других им подобных.
Изобретение будет дальше описано в следующих примерах.
Для измерений показателя преломления МРТ-агентов в диапазоне длин волн, характерных для оптических методов исследования, включая спектрофотометрию обратного рассеяния с пространственным разрешением, флуоресцентную спектроскопию с разрешением во времени и при многофотонном возбуждении, микроскопию при генерации второй или третьей гармоник, конфокальную микроскопию, ОКТ, оптоакустическую или фототермическую визуализацию, использовался многоволновый рефрактометр Аббе DR-M2/1550 (ATAGO, Япония). Для оценки возможности применения контрастных МРТ агентов «Magnevist» («Bayer HealthCare Pharmaceuticals», Германия), «Dоtаrem» (0.5 ммоль/мл, «Guerbet», Франция), «Gadovist» (1 ммоль/мл) в качестве иммерсионных оптических просветляющих агентов были измерены показатели преломления растворов на разных длинах волн в диапазоне от 450 нм до 1550 нм. Точность измерений рефрактометра составляла ±0.0001. Температура, при которой проводились измерения, составляла 21.5±2.3°С. Соответствующие зависимости для показателя преломления от длины волны для МРТ-агентов представлены на Фиг.4.
В результате можно говорить о подходящих показателях преломления для реализации оптического просветления кожи и многих других тканей с помощью растворов «Magnevist», «Dotarem» и «Gadovist».
Для измерения спектров коллимированного пропускания ex vivo образцов кожи мыши при их иммерсионном оптическом просветлении с помощью МРТ-агентов использовалась экспериментальная установка, представленная на Фиг. 6, которая состоит из галогенной лампы HL-2000 (Ocean Optics, США) (21), как источника белого света; двух волоконных световодов QP400-1-UV-VIS (Ocean Optics, США) с диаметром сердцевины 400 мкм и закрепленными на торцах волокон коллиматорами 74-ACR (Ocean Optics, США) (22) для обеспечения измерений в параллельном (коллимированном) пучке света; быстродействующего спектрометра на дифракционной решетке и ПЗС-линейке USB4000-Vis-NIR (Ocean Optics, USA) (24) для регистрации спектров и персонального компьютера (ПК) (25) для обработки и визуализации данных. Исследуемые образцы кожи, размещались в кювете с МРТ-агентами (23).
Количественная оценка эффективности оптического просветления и скорости диффузии МРТ-агентов проводились на образцах кожи мыши, полученных ex vivo после аутопсии. Шерсть перед измерениями удалялась с использованием крема-депилятора, подкожный жировой слой удаляли пинцетом. Площадь образцов составляла около 10×5 мм2. Каждый образец кожи закреплялся на пластиковой пластине с отверстием в центре и помещался в стеклянную кювету с раствором (23). Кювета с образцом устанавливалась между двумя оптическими волокнами с коллиматорами (22). Все измерения проводились при комнатной температуре (~25°C). Запись спектров коллимированного пропускания образца кожи проводилась каждые 30 сек в течение 1 часа с помощью спектрометра (24). В качестве агентов использовались МРТ-контрастные вещества Gadovist, Magnevist и Dotarem, а также физиологический раствор в качестве контроля.
С помощью цифрового микрометра (“Fujisan”, Китай) измерялась толщина образцов, а также проводилось их взвешивание с использованием цифровых весов (“Scientech”) до и после иммерсии в агенте в течение 1 часа. Было установлено, что только при использовании раствора «Gadovist» (20) не изменяется ни толщина, ни вес образца (Таблица 1). «Magnevist» (18) довольно сильно уменьшает как толщину, так и вес образца, что говорит о его гиперосмотических свойствах. «Dotarem» (19) влиял на толщину образца в обратном направлении, образец довольно сильно набухал.
Таблица 1. Значения толщины и веса каждого образца кожи мыши до и после иммерсии в МРТ-агентах.
Кинетические кривые для отдельных спектральных составляющих коллимированного пропускания образцов кожи мыши на длинах волн 500 нм (26), 600 нм (27), 700 нм (28), 800 нм (29) и 900 нм (30) в условия иммерсионного оптического просветления с помощью МРТ-агентов: Гадовиста (20), Магневиста (18), Дотарема (19), и контрольного опыта с иммерсией образца кожи в физиологическом растворе (31) представлены на Фиг. 7. Хорошо видно, что при иммерсии образцов кожи в растворах Gadovist, Magnevist, Dotarem с первых минут наблюдается увеличение коллимированного пропускания образцов, после чего наступает насыщение, обусловленное процессом диффузии молекул агента в ткани. Из экспериментальных кинетических кривых видно, что наилучшими просветляющими свойствами обладает Gadovist, который обеспечивает уже за десять минут увеличение пропускания кожи толщиной 280 мкм примерно в 32 раза на длине волны 500 нм и в 7-9 раз на длинах волн 700-900 нм (Таблица 2), при этом геометрические и массовые характеристики образцов не изменяются (Таблица 1).
Таблица 2. Кратность увеличения коллимированного пропускания света через кожу мыши при иммерсии в МРТ-агентах.
Из полученных временных зависимостей для коллимированного пропускания образцов были рассчитаны коэффициенты диффузии агентов в коже с использованием алгоритма, подробно описанного в работах [Tuchina, D. K., Shi, R., Bashkatov, A. N., Genina, E. A., Zhu, D., Luo, Q. and Tuchin, V. V. (2015) Ex vivo optical measurements of glucose diffusion kinetics in native and diabetic mouse skin. Journal of Biophotonics. 8, 332-346; Tuchina D.K., Bashkatov A.N., Bucharskaya A.B., Genina E.A., Tuchin V.V. (2017). Study of glycerol diffusion in skin and myocardium ex vivo under the conditions of developing alloxan-induced diabetes. Journal of Biomedical Photonics & Engineering, 3(2), 020302] и в основе которого лежат следующие соотношения:
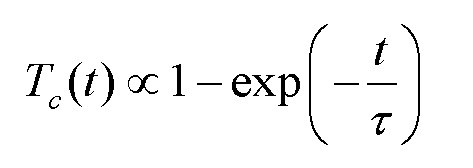 , (3)
, (3)
 ,
,
где Tc – измеряемое коллимированное пропускание образца ткани; τ – характерное время просветления ткани (диффузии агента в ткани), измеряемое по кинетической кривой, описываемой уравнением (3); l – толщина образца; Da – коэффициент диффузии агента.
Значения коэффициентов диффузии оказались достаточно близкими друг другу (Таблица 3).
Таблица 3. Коэффициенты диффузии МРТ-агентов в коже мыши, измеренные ex vivo.
Таким образом, по совокупности свойств можно говорить, что из всех исследуемых МРТ-агентов наиболее подходящим для оптического просветления кожи является Gadovist.
Возможность применения контрастных МРТ-агентов в качестве оптических просветляющих агентов была продемонстрирована также с использованием оптического когерентного томографа (ОКТ) Spectral Radar OCT System OCP930SR 022 (Thorlabs Inc., США) (930 нм) с шириной спектральной полосы 100 нм, выходной мощностью 2 мВт, максимальной глубиной сканирования в воздухе 1.6 мм и продольным разрешением в воздухе 6.2 мкм, внешний вид которого представлен на Фиг. 8, где показаны блок управления и обработки данных (32), интерферометрический сенсор (33) и ПК для управления и обработки данных (34). Исследования проводилась для in vitro образцов кожи мыши породы nu/BalbC. Средняя толщина кожи составляла 0.36±0.01 мм. Образцы кожи площадью приблизительно 1×1.5 см2 вырезали с помощью ножниц. Каждый интактный образец кожи помещали на стекло, делали снимок с использованием цифровой камеры и записывали скан на ОКТ. Затем образцы помещали в раствор исследуемого МРТ-агента. Запись сканов и изображений кожи повторялись через 30 и 60 мин воздействия агентов на кожу.
На Фиг. 5 представлена визуальная демонстрация эффективности иммерсионного оптического просветления с помощью МРТ-агентов ex vivo кожи мыши nu/BalbC при длительности пребывания образца кожи в агенте в течение 0, 30 и 60 мин: Магневист (18), Дотарем (19), Гадовист (20). Хорошо видны изображения надписей за образцом кожи после достаточного действия МРТ-агента.
На Фиг. 9 представлены ОКТ сканы ex vivo образцов кожи мыши nu/BalbC до, через 30 мин и 60 мин иммерсии в растворах Магневиста (18), Дотарема (19) и Гадовиста (20). При действии агентов на сканах наблюдается более четкая структура кожной и подкожной жировой ткани.
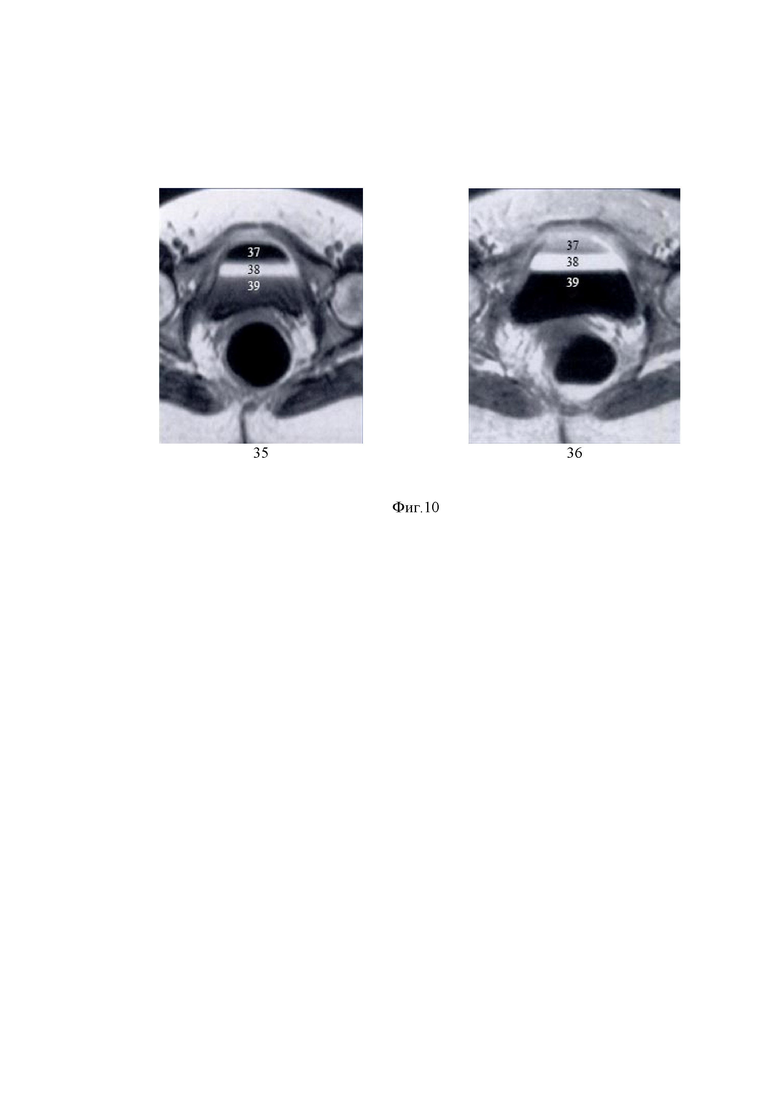
На Фиг. 10 представлены взвешенные МРТ-изображения области таза T1 (35) и мочевого пузыря T2 (36) человека, иллюстрирующие возможность привязки оптического (например, ОКТ-изображения, аналогичного представленному на Фиг. 9) и МРТ изображений по характерным структурным элементам изображения и зависимости контраста от концентрации накопленного гадолиния. Показаны изображения без гадолиния (37), с низкой (38) и высокой (39) концентрацией гадолиния.
Важно, что с увеличением Т1 эффектов, т.е. “яркий” МРТ контраст, возникающий из-за влияния на Т1 релаксацию протонов, будет расти по градиенту диффузии МРТ-агента в ткань, на большой глубине, где нет агента, эффект пропадет. Синхронно происходит изменение оптического контраста по глубине, который увеличивается по мере диффузии иммерсионного агента вглубь ткани за счет снижения рассеяния света, которое является причиной размытия изображения.
Из поясняющего МРТ изображения (Фиг.10) хорошо видно, что более плотный слой (в данном случае мочи), содержащий максимум гадолиния, имеет “черный” негативный контраст. При таких высоких концентрациях гадолиния сокращение T2 может привести к значительному снижению интенсивности сигнала, заметному как на T1-, так и на T2-взвешенных изображениях. Моча в мочевом пузыре может проявлять необычное явление тройного слоя. Там, где эффекты уменьшения T2 преобладают, возникает самый низкий сигнал в нижнем псевдослое, где концентрация гадолиния самая высокая. В среднем слое, где концентрация гадолиния умеренная, уменьшение T1 приводит к большому МРТ сигналу.
Сигналы с малым T2 могут иногда наблюдаться на МРТ артрограммах и венограммах (где высокие концентрации гадолиния вводятся непосредственно в суставы или сосуды); и при «первом прохождении» гадолиния через сосудистую систему в исследованиях с динамическим контрастированием или МРТ-ангиографии с временным разрешением.
Следует также отметить, что изменения оптического сигнала также связаны с концентрацией МРТ-агента: там, где его больше, эффективность оптического просветления выше и оптический сигнал выше. Эти изменения происходят синхронно с изменениями МРТ-изображения как в пространстве, так и во времени.
Заявляемое изобретение дает основу для принципиально нового подхода к мультимодальной визуализации, поскольку повышение контраста оптического и МРТ-изображений происходит синхронно во времени и пространстве, так как один и тот же агент обеспечивает усиленную визуализацию для обеих модальностей.
Применение МРТ-контрастирующих агентов открывает путь к эффективной мультимодальной визуализации с помощью оптических и МРТ технологий с автоматическим совмещением полей зрения МРТ и оптической визуализации.
Используемые агенты на основе гадолиния не только повышают контраст МРТ изображения ткани или органа, но также эффективно уменьшают рассеяние исследуемой биологической ткани и повышают контраст и глубину зондирования при получении оптического изображения, которое автоматически сопряжено с МРТ-изображением за счет использования одного и того же иммерсионного агента.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЕ ГАДОПЕНТЕТАТОМ ПРОИЗВОДНЫЕ БЕТА-ЦИКЛОДЕКСТРИНА | 2013 |
|
RU2541090C1 |
| СПОСОБ СОЗДАНИЯ ОПТИЧЕСКИХ ОКОН ПРОЗРАЧНОСТИ БИОЛОГИЧЕСКИХ ТКАНЕЙ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ В УЛЬТРАФИОЛЕТОВОЙ ОБЛАСТИ | 2019 |
|
RU2745614C1 |
| СПОСОБ ИССЛЕДОВАНИЯ СОСТОЯНИЯ КОЖИ МЕТОДОМ ОПТИЧЕСКОЙ КОГЕРЕНТНОЙ ТОМОГРАФИИ | 2007 |
|
RU2387365C2 |
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В ЭКСПЕРИМЕНТЕ | 2007 |
|
RU2343828C2 |
| КОНТРАСТНОЕ СРЕДСТВО ДЛЯ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ | 2011 |
|
RU2465010C1 |
| РЕНТГЕНОВСКАЯ УСТАНОВКА ДЛЯ ФОРМИРОВАНИЯ ИЗОБРАЖЕНИЯ ИССЛЕДУЕМОГО ОБЪЕКТА И ЕЕ ПРИМЕНЕНИЕ | 2006 |
|
RU2449729C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКОГО ИЗОБРАЖЕНИЯ МЕЖФАЛАНГОВЫХ СУСТАВОВ И ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2018 |
|
RU2697594C1 |
| КОНТРАСТНАЯ КОМПОЗИЦИЯ ДЛЯ МЕДИЦИНСКОЙ ДИАГНОСТИКИ НА ОСНОВЕ КОМПЛЕКСОВ ГАДОЛИНИЯ | 2009 |
|
RU2396983C1 |
| СПОСОБ НЕИНВАЗИВНОГО МОНИТОРИНГА БИОДЕГРАДАЦИИ ПОЛИМЕРНОГО СКАФФОЛДА | 2024 |
|
RU2832295C1 |
| СПОСОБ ОПТИЧЕСКОГО ПРОСВЕТЛЕНИЯ СЛИЗИСТОЙ ПОЛОСТИ РТА | 2021 |
|
RU2768584C1 |



Изобретение относится к области медицины, а именно к способам получения изображений с помощью оптического просветления биологических тканей и органов и с использованием магниторезонансной томографии. Способ визуализации биологических тканей или органов включает мониторинг диффузии иммерсионного агента, введенного в область исследования, посредством проведения МРТ-исследования и регистрации МРТ изображения области исследования с выделением области повышенного контраста и ее пространственной привязки, проведение для области повышенного контраста оптической когерентной томографии (ОКТ) и совмещение полученных изображений. В качестве иммерсионного агента для МРТ-исследования и ОКТ используют МРТ контрастный агент «Гадовист» или «Магневист», или «Дотарем», содержащий гадолиний. Технический результат состоит в повышении информативности и достоверности получаемых изображений. 8 з.п. ф-лы, 3 табл., 10 ил.
1. Способ визуализации биологических тканей или органов, включающий мониторинг диффузии иммерсионного агента, введенного в область исследования, посредством проведения МРТ-исследования и регистрации МРТ изображения области исследования с выделением области повышенного контраста и ее пространственной привязки, проведение для области повышенного контраста оптической когерентной томографии (ОКТ) и совмещение полученных изображений, отличающийся тем, что в качестве иммерсионного агента для МРТ-исследования и ОКТ используют МРТ контрастный агент «Гадовист» или «Магневист», или «Дотарем», содержащий гадолиний.
2. Способ по п.1, отличающийся тем, что введение иммерсионного агента осуществляют путём местного поверхностного нанесения на кожу или внутрь полого органа, или путем внутритканевой, или внутрисосудистой инъекции.
3. Способ по п.1, отличающийся тем, что мониторинг диффузии иммерсионного агента в область исследования для кожи проводят в течение 40-60 мин, для слизистых полых органов 10-30 мин, для межтканевой инъекции 5-10 мин, а для внутрисосудистой инъекции 10-100 мин.
4. Способ по п.1, отличающийся тем, что пространственную привязку области повышенного контраста проводят по особенностям анатомического строения или функционирования ткани или органа.
5. Способ по п. 1, отличающийся тем, что для мониторинга диффузии агента в область исследования используют флуоресцентную спектроскопию.
6. Способ по п.1 или 5, отличающийся тем, что исследуемые области биологической ткани или органа маркируют путём введения маркеров на основе флуоресцентных белков или окрашивания с помощью флуорофор-связывающих лигандов.
7. Способ по п. 6, отличающийся тем, что маркировку проводят посредством экспрессии флуоресцентных белков GFP, YFP и производных флуорофоров этой группы.
8. Способ по п. 7, отличающийся тем, что маркировку проводят антителами, связанными с флуорофорами.
9. Способ по п. 8, отличающийся тем, что антитела включают все антитела, связанные с AF-красителями, такие как антиCD31-AF647, антиCD45-AF647, антиSiglecF-AF594, антиCDllc-AF647, а также их генно-инженерные химеры, полученные путем слияния аминокислотных последовательностей антител и их фрагментов с аминокислотными последовательностями флуоресцентных белков eGFP, eYFP, tdTomato, mCherry, iRFP.
| US2007265521 A1 (REDEL THOMAS et al.) 15.11.2007 | |||
| US2004120557 A1 (SABOL JOHN M et al.) 24.06.2004 | |||
| Э.А.Генина и др | |||
| Оптическое просветление черепной кости многокомпонентными иммерсионными растворами и визуализация церебрального венозного кровотока | |||
| Известия Саратовского университета, сер.Физика, 2017, т.17, вып.2, сс.98-108 | |||
| Е.А.Зубкина и др |
Авторы
Даты
2020-11-02—Публикация
2019-06-14—Подача