УРОВЕНЬ ТЕХНИКИ
По настоящей заявке испрашивается приоритет предварительной заявки США 61/202661, поданной 24 марта 2009 года. Содержание предварительной заявки США 61/202661 включено в настоящий документ в качестве ссылки в полном объеме.
Настоящее изобретение относится к антиген-связывающим полипептидам, которые специфично связывают полипептид LIGHT, и к способам получения и применения таких антител. В частности, изобретение относится к гуманизированным антиген-связывающим полипептидам, которые специфично связывают полипептид LIGHT. Антиген-связывающие полипептиды могут использоваться для лечения и диагностики иммунных, воспалительных и злокачественных заболеваний и состояний, таких как воспалительное заболевание кишечника, болезнь Крона, язвенный колит, рассеянный склероз, ревматоидный артрит и трансплантация.
Белки, которые структурно родственны фактору некроза опухоли (TNF), в совокупности называют суперсемейством TNF. LIGHT, представитель суперсемейства TNF, экспрессируется на активированных T-клетках и незрелых дендритных клетках (Tamada et al., J. Immunology. 2000). LIGHT представляет собой трансмембранный белок типа II и он был назван представителем 14 суперсемейства TNF (TNFSF14) и также называется TL5, LTg, CD258 и HVEML. LIGHT представляет собой T-костимуляторную молекулу и он индуцирует пролиферацию T-клеток и продукцию цитокинов (Tamada K. et al., Nat. Med. 2000). LIGHT также индуцирует воспалительный ответ в моноцитах и эндотелиальных клетках (Otterdal et al., Blood 2006; Chang et al., J Biomed Sci. 2005).
LIGHT связывается с 3 различными рецепторами, экспрессируемыми на различных типах клеток: медиатором вхождения вируса герпеса (HVEM), экспрессируемым на T-клетках и B-клетках (Kwon et al., J. Biol. Chem. 1997)), рецептором лимфотоксина β (LTβR), экспрессируемым на стромальных клетках и некроветворных клетках (Ettinger et al., Curr Top Microbiol Immunol 2000) и рецептором-ловушкой 3/TR6. Как на дендритных клетках, так и на T-клетках, LIGHT усиливает пролиферацию T-клеток и продукцию цитокинов. rLIGHT может прямо костимулировать T-клеточные ответы (Tamada K. et al., Nat. Med. 2000).
Роль LIGHT в различных воспалительных и болезненных состояниях продемонстрирована с помощью различных моделей с использованием дефицитных по LIGHT моделей и сверхэкспрессирующих LIGHT трансгенных животных. Сверхэкспрессия LIGHT у мышей приводит к популяции гиперактивированных периферических T-клеток и спонтанному развитию тяжелого аутоиммунного заболевания. (Wang et al., J. Clin. Invest. 2001). Направленное разрушение LIGHT приводит к дефекту костимуляторной активации T-клеток и иммунного ответа Th1-типа. (Scheu et al., J Exp Med. 2002; Xu et al. J. Immunol. 2007).
Вследствие его сильной стимулирующей активности в отношении T-клеток, LIGHT является важным компонентом хронического воспаления. Таким образом, антитела против LIGHT, в частности, антитела-антагонисты LIGHT, могли бы быть эффективными для лечения заболеваний, связанных с хроническим воспалением. Такие заболевания включают, но ими не ограничиваются, заболевания, рассмотренные ниже.
Нарушенная регуляция иммунного ответа на флору кишечника является основной причиной воспалительного заболевания кишечника (IBD). T-хелперные клетки играют определяющую роль в нарушенном иммунном ответе при IBD. В частности, Th1-клетки связывают с болезнью Крона. Критическая роль LIGHT в воспалении кишечника была продемонстрирована на нескольких исследованиях. Сверхэкспрессирующие LIGHT трансгенные мыши являются чувствительными к опосредуемым T-клетками аутоиммунным заболеваниям и трансгенные по LIGHT мыши проявляют тяжелое опосредуемое T-клетками воспаление кишечника и у них развивается колит (Wang J. et al., J. Clin. Invest. 2004; Wang J. et al., J. Immunol 2005; Wang et al., J. Clin. Invest. 2001; Shaikh et al., J. Immunol. 2001). Кроме того, блокирование взаимодействия LIGHT с его рецептором растворимым LTβR-Fc смягчает индуцируемый TNBS колит (An, MM et al., Pharmacol Res. 2005). LIGHT картирован в области, перекрывающей локус чувствительности к IBD на хромосоме человека 19pl3.312-14 (Rioux et al., Am. J. Hum. Genet. (2000); Bonen et al., Gastroenterology (2003)).
Высокие уровни белка LIGHT выявлены в синовиальной жидкости пациентов с ревматоидным артритом (RA). См. например, Recombinant LIGHT-induced inflammatory mediators in synovial fibroblasts from RA patients (Pierer et al., Rheumatology (2007); Kang et al., Arthritis & Rheumatism (2007)) и Blocking LIGHT-receptor interaction prevents development of Collagen-Induced Arthritis (Fava et al., J. Immunol. (2003)). Наконец, в ноябре 2007 года Biogen IDEC сообщили о применении баминерцепта (слитый белок LTβR-Fc) на фазе IIa клинических испытаний для пациентов с RA (сообщение для прессы Biogen IDEC, датированное 9 ноября 2007 года).
LIGHT активируется в экспериментальных моделях гепатита. Блокирование взаимодействия LIGHT с рецепторами LIGHT посредством обработки антителом или растворимым LTβR значительно ослабляло воспаление печени и снижало продукцию воспалительных цитокинов и защищало мышей от летального гепатита (Anand et al., J. Clin. Invest. (2006); An et al. Biol. Pharm Bull. (2006)).
В нескольких исследованиях было продемонстрировано, что блокада взаимодействия LIGHT-рецептор препятствует реакции "трансплантат против хозяина" (GVHD) и продлевает выживание аллотрансплантата в моделях на животных (Xu et al., Blood (2007); Ye et al., J. Exp. Med. (2002); Fan et al., Transplantation (2007)).
Кроме исследований, упомянутых выше, блокирование рецепторов LIGHT (LTβR и HVEM) значительно снижает признаки заболевания в различных моделях на животных, таких как индуцируемый коллагеном артрит (CIA) и экспериментальный аутоиммунный энцефаломиелит (EAE), который является моделью на животных для рассеянного склероза (MS) (Fava et al., J. Immunol. (2003) и Suen et al., J. Exp. Med. (1997)). Мыши с нокаутом LIGHT также имеют дефицит продукции IL-12 и, в результате, лишены способности к развитию опосредуемых IFNγ антигенспецифических Th1-ответов на воспалительные стимулы.
Таким образом, в данной области существует потребность в создании антиген-связывающих полипептидов и антиген-связывающих полипептидов-антагонистов, которые специфично связываются с LIGHT, для лечения воспалительных, злокачественных и аутоиммунных заболеваний и состояний, таких как рассеянный склероз, IBD и RA, а также другое заболевание, описанное выше или известного в данной области. Антиген-связывающие полипептиды и антиген-связывающие полипептиды-антагонисты, которые специфично связывают LIGHT, имеют ряд преимуществ по сравнению с применением растворимого рецептора, такие как: 1) антитела имеют более длительное время полужизни в кровотоке по сравнению со слитыми белками Fc; 2) антитела обладают более высокой эффективностью, поскольку антитело может быть сконструировано так, чтобы оно обладало более высокой аффинностью к LIGHT по сравнению с растворимыми рецепторами; и 3) антитела являются более безопасной альтернативой растворимым рецепторам вследствие специфичности к LIGHT. Антитела-антагонисты LIGHT блокировали бы только опосредуемую LIGHT передачу сигнала, таким образом, смягчая локальный процесс воспаления без системного истощения архитектуры вторичной лимфоидной ткани, вызываемого растворимыми рецепторами, которое может в конечном итоге привести к иммуносупрессии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основывается на роли полипептида LIGHT в воспалительных заболеваниях. В частности, изобретение основывается на способности LIGHT стимулировать провоспалительные цитокины, такие как IFN-γ и IL-8, а также быть сильным стимулятором продукции IL-17 костимулированными посредством CD3 Th17-клетками. Связь между LIGHT и продукции IL-17 особенно важна, поскольку недавно было открыто, что Th17-клетки являются критическим пусковым фактором воспалительного процесса, вызывающего непрерывное воспаление и повреждение ткани при всех основных аутоиммунных состояниях, таких как рассеянный склероз (MS), воспалительное заболевание кишечника (IBD) и ревматоидный артрит (RA).
Изобретение относится, главным образом, к антиген-связывающим полипептидам, которые специфично связываются с TNF-подобным цитокином TL5, также известным как LIGHT (см. регистрационный номер GenBank no. AF036581, который включен в настоящий документ в качестве ссылки в полном объеме). В определенных вариантах осуществления антиген-связывающие полипептиды по настоящему изобретению содержат гуманизированную вариабельную область тяжелой цепи (VH) и гуманизированную вариабельную область легкой цепи (VK). Например, в определенных вариантах осуществления антиген-связывающие полипептиды по настоящему изобретению содержат каркасные (FR) области вариабельных областей легкой и тяжелой цепей антитела человека при по существу сохранении антиген-связывающей специфичности исходного моноклонального антитела (т.е. определяющих комплементарность областей (CDR)). Гуманизированная вариабельная область тяжелой цепи и/или гуманизированная вариабельная область легкой цепи являются по меньшей мере приблизительно на 87% гуманизированными, по меньшей мере приблизительно на 90% гуманизированными, по меньшей мере приблизительно на 95% гуманизированными, по меньшей мере приблизительно на 98% гуманизированными, или по меньшей мере приблизительно на 100% гуманизированными, исключая CDR. Молекулы антиген-связывающих полипептидов происходят из моноклональных антител-доноров (например, моноклональных антител-доноров мыши) и содержат CDR из моноклональных антител (например, CDR моноклональных антител мыши). В определенных вариантах осуществления антиген-связывающие полипептиды по настоящему изобретению представляют собой антагонисты активности LIGHT и/или взаимодействия LIGHT с рецепторами LIGHT.
Определенные варианты осуществления изобретения включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий вариабельную область тяжелой цепи гуманизированного антитела, содержащую: (1) CDR-H1, содержащую аминокислотную последовательность X1YX2X3X4 (SEQ ID NO:18); где X1 представляет собой аминокислоту D, S, T или N; X2 представляет собой аминокислоту Y, L или W; X3 представляет собой аминокислоту I или M; и X4 представляет собой аминокислоту Y, H, E или N; (2) CDR-H2, содержащую аминокислотную последовательность X5IX6PX7X8X9X10X11X12X13NX14X15FX16X17 (SEQ ID NO:19); где X5 представляет собой аминокислоту Y, M, V или W; X6 представляет собой аминокислоту D, N, H или F; X7 представляет собой аминокислоту Y, G или S; X8 представляет собой аминокислоту N, S, T или D; X9 представляет собой аминокислоту G, S или D; X10 представляет собой аминокислоту G, D, E или I; X11 представляет собой аминокислоту T или S; X12 представляет собой аминокислоту K или R; и X13 представляет собой аминокислоту Y или L; X14 представляет собой аминокислоту Q или E; X15 представляет собой аминокислоту K или N; X16 представляет собой аминокислоту K, I или R; и X17 представляет собой аминокислоту G, A или D; и (3) CDR-H3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) WX18X19 (SEQ ID NO:20); (ii) X20X21X22X23X24X25X26X27X28 (SEQ ID NO:21); и (iii) X20X21X22X23X24X25X26X27X28AMDF (SEQ ID NO:22); где X18 представляет собой аминокислоту D или N; X19 представляет собой аминокислоту R или Y; X20 представляет собой аминокислоту E, T или G; X21 представляет собой аминокислоту D, S или N; X22 представляет собой аминокислоту Y или G; X23 представляет собой аминокислоту G, S или V; X24 представляет собой аминокислоту I, S или W; X25 представляет собой аминокислоту S, W или A; X26 представляет собой аминокислоту T, F или M; X27 представляет собой аминокислоту Y, P или D; и X28 представляет собой аминокислоту S или Y.
Определенные варианты осуществления изобретения включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий вариабельную область легкой цепи гуманизированного антитела, содержащую: (1) CDR-L1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) X29X30SX31X32X33X34X35X36X37X38 (SEQ ID NO:38); (ii) X29X30SX31X32X33X34X35X36X37X38X39X40X41X42 (SEQ ID NO:39); и (iii) X29X30SX31X32X33X34X35X36X37X38X39X40X41X42H (SEQ ID NO:40); где X29 представляет собой аминокислоту K или R; X30 представляет собой аминокислоту A или S; X31 представляет собой аминокислоту Q или K; X32 представляет собой аминокислоту D, S или N; X33 представляет собой аминокислоту V, I или L; X34 представляет собой аминокислоту G, S, V или L; X35 представляет собой аминокислоту T, N или H; X36 представляет собой аминокислоту A, N или S; X37 представляет собой аминокислоту V, L, N или G; X38 представляет собой аминокислоту A, H, G или Y; X39 представляет собой аминокислоту N или T; X40 представляет собой аминокислоту T или Y; X41 представляет собой аминокислоту Y или M; X42 представляет собой аминокислоту F или H; (2) CDR-L2, содержащую аминокислотную последовательность X43X44X45X46X47X48X49 (SEQ ID NO:41); где X43 представляет собой аминокислоту W, Y, K или I; X44 представляет собой аминокислоту A, T или V; X45 представляет собой аминокислоту S или Y; X46 представляет собой аминокислоту T, Q или N; X47 представляет собой аминокислоту R, S или L; X48 представляет собой аминокислоту H, I, F или E; и X49 представляет собой аминокислоту T или S; и (3) CDR-L3, содержащую аминокислотную последовательность X50X51X52X53X54X55PX56T (SEQ ID NO:42); где X50 представляет собой аминокислоту Q или S; X51 представляет собой аминокислоту Q или H; X52 представляет собой аминокислоту S или Y; X53 представляет собой аминокислоту S, N, T или R; X54 представляет собой аминокислоту S, R, H или E; X55 представляет собой аминокислоту Y, W, V или L; и X56 представляет собой аминокислоту L или Y.
Определенные варианты осуществления изобретения включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий вариабельную область тяжелой цепи гуманизированного антитела, содержащую: (1) CDR-H1, содержащую аминокислотную последовательность X1YX2X3X4 (SEQ ID NO:18); где X1 представляет собой аминокислоту D, S, T или N; X2 представляет собой аминокислоту Y, L или W; X3 представляет собой аминокислоту I или M; и X4 представляет собой аминокислоту Y, H, E или N; (2) CDR-H2, содержащую аминокислотную последовательность X5IX6PX7X8X9X10X11X12X13NX14X15FX16X17 (SEQ ID NO:19); где X5 представляет собой аминокислоту Y, M, V или W; X6 представляет собой аминокислоту D, N, H или F; X7 представляет собой аминокислоту Y, G или S; X8 представляет собой аминокислоту N, S, T или D; X9 представляет собой аминокислоту G, S или D; X10 представляет собой аминокислоту G, D, E или I; X11 представляет собой аминокислоту T или S; X12 представляет собой аминокислоту K или R; и X13 представляет собой аминокислоту Y или L; X14 представляет собой аминокислоту Q или E; X15 представляет собой аминокислоту K или N; X16 представляет собой аминокислоту K, I или R; и X17 представляет собой аминокислоту G, A или D; и (3) CDR-H3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) WX18X19 (SEQ ID NO:20); (ii) X20X21X22X23X24X25X26X27X28 (SEQ ID NO:21); и (iii) X20X21X22X23X24X25X25X27X28AMDF (SEQ ID NO:22); где X18 представляет собой аминокислоту D или N; X19 представляет собой аминокислоту R или Y; X20 представляет собой аминокислоту E, T или G; X21 представляет собой аминокислоту D, S или N; X22 представляет собой аминокислоту Y или G; X23 представляет собой аминокислоту G, S или V; X24 представляет собой аминокислоту I, S или W; X25 представляет собой аминокислоту S, W или A; X26 представляет собой аминокислоту T, F или M; X27 представляет собой аминокислоту Y, P или D; и X28 представляет собой аминокислоту S или Y; и вариабельную область легкой цепи гуманизированного антитела, содержащую: (1) CDR-L1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) X29X30SX31X32X33X34X35X36X37X38 (SEQ ID NO:38); (ii) X29X30SX31X32X33X34X35X36X37X38X39X40X41X42 (SEQ ID NO:39); и (iii) X29X30SX31X32X33X34X35X36X37X38X39X40X41X42H (SEQ ID NO:40); где X29 представляет собой аминокислоту K или R; X30 представляет собой аминокислоту A или S; X31 представляет собой аминокислоту Q или K; X32 представляет собой аминокислоту D, S или N; X33 представляет собой аминокислоту V, I или L; X34 представляет собой аминокислоту G, S, V или L; X35 представляет собой аминокислоту T, N или H; X36 представляет собой аминокислоту A, N или S; X37 представляет собой аминокислоту V, L, N или G; X38 представляет собой аминокислоту A, H, G или Y; X39 представляет собой аминокислоту N или T; X40 представляет собой аминокислоту T или Y; X41 представляет собой аминокислоту Y или M; X42 представляет собой аминокислоту F или H; (2) CDR-L2, содержащую аминокислотную последовательность X43X44X45X46X47X48X49 (SEQ ID NO:41); где X43 представляет собой аминокислоту W, Y, K или I; X44 представляет собой аминокислоту A, T или V; X45 представляет собой аминокислоту S или Y; X46 представляет собой аминокислоту T, Q или N; X47 представляет собой аминокислоту R, S или L; X48 представляет собой аминокислоту H, I, F или E; и X49 представляет собой аминокислоту T или S; и (3) CDR-L3, содержащую аминокислотную последовательность X50X51X52X53X54X55PX56T (SEQ ID NO:42); где X50 представляет собой аминокислоту Q или S; X51 представляет собой аминокислоту Q или H; X52 представляет собой аминокислоту S или Y; X53 представляет собой аминокислоту S, N, T или R; X54 представляет собой аминокислоту S, R, H или E; X55 представляет собой аминокислоту Y, W, V или L; и X56 представляет собой аминокислоту L или Y.
Определенные варианты осуществления настоящего изобретения включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, включающий вариабельную область тяжелой цепи гуманизированного антитела, содержащую: (1) CDR-H1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) SSYIH (SEQ ID NO:23); (ii) DYYIY (SEQ ID NO:26); (iii) TYLIE (SEQ ID NO:29); (iv) TYWMN (SEQ ID NO:32); и (v) NYLIE (SEQ ID NO:35); (2) CDR-H2, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) WIFPGSDITKYNEKFKG (SEQ ID NO:24); (ii) YIDPYNGGTKYNQKFKD (SEQ ID NO:27); (iii) VINPGTGETKYNENFRA (SEQ ID NO:30); (iv) MIHPSDSESRLNQKFID (SEQ ID NO:33); и (v) VINPGSGDTKYNENFKG (SEQ ID NO:36); и (3) CDR-H3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) EDYGISTYSAMDF (SEQ ID NO:25); (ii) TSGSSWFPY (SEQ ID NO:28); (iii) WDR (SEQ ID NO:31); (iv) GNYVWAMDY (SEQ ID NO:34); и (v) WNY (SEQ ID NO:37).
Определенные варианты осуществления настоящего изобретения включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий вариабельную область легкой цепи гуманизированного антитела, содержащую: (1) CDR-L1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) KASQDVGTAVA (SEQ ID NO:43); (ii) RASQSISNNLH (SEQ ID NO:46); (iii) RSSQNLVHSNGNTYFH (SEQ ID NO:49); (iv) RASKSVSTSGYTYMH (SEQ ID NO:52); и (v) RSSQSLLHSNGNTYFH (SEQ ID NO:55); (2) CDR-L2, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) WASTRHT (SEQ ID NO:44); (ii) YTYQSIS (SEQ ID NO:47); (iii) KVSNRFS (SEQ ID NO:50); и (iv) ITSNLES (SEQ ID NO:53); и (3) CDR-L3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (i) QQYSSYPLT (SEQ ID NO:45); (ii) QQSNRWPLT (SEQ ID NO:48); (iii) SQSTHVPYT (SEQ ID NO:51); и (iv) QHSRELPYT (SEQ ID NO:54).
Дополнительные варианты осуществления настоящего изобретения включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий вариабельную область тяжелой цепи гуманизированного антитела, содержащую (1) CDR-H1, содержащую аминокислотную последовательность SYYIH (SEQ ID NO:23); (2) CDR-H2, содержащую аминокислотную последовательность WIFPGSDITKYNEKFKG (SEQ ID NO:24); и (3) CDR-H3, содержащую аминокислотную последовательность EDYGISTYSAMDF (SEQ ID NO:25); и/или вариабельную область легкой цепи гуманизированного антитела, содержащую (1) CDR-L1, содержащую аминокислотную последовательность KASQDVGTAVA (SEQ ID NO:43); (2) CDR-L2, содержащую аминокислотную последовательность WASTRHT (SEQ ID NO:44); и (3) CDR-L3, содержащую аминокислотную последовательность QQYSSYPLT (SEQ ID NO:45).
Варианты осуществления настоящего изобретения также включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий вариабельную область тяжелой цепи гуманизированного антитела, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (1) (1) QVQLVQSGAEVKKPGASVKVSCKASGYTFTX1YX2X3X4WVRQAPGQX'1LEWX'2GX5IX6PX7X8X9X10X11X12X13NX14X15FX16X17X'3X'4TX'5TX'6DX'7SX'8STX'9YMELSX'10LRSX'11DTAVYYCARWX18X19WGQGTLVTVSS (SEQ ID NO:1); (2) QVQLVQSGAEVKKPGASVKVSCKASGYTFTX1YX2X3X4WVRQAPGQX'1LEWX'2GX5IX6PX7X8X9X10X11X12X13NX14X15FX16X17X'3X'4TX'5TX'6DX'7SX'8STX'9YMELSX'10LRSX'11DTAVYYCARX20X21X22X23X24X25X26X27X28WGQGTLVTVSS (SEQ ID NO:2); и (3) QVQLVQSGAEVKKPGASVKVSCKASGYTFTX1YX2X3X4WVRQAPGQX'1LEWX'2GX5IX6PX7X8X9X10X11X12X13NX14X15FX16X17X'3X'4TX'5TX'6DX'7SX'8STX'9YMELSX'10LRSX'11DTAVYYCARX20X21X22X23X24X25X26X27X28AMDFWGQGTLVTVSS (SEQ ID NO:3), где X1 представляет собой аминокислоту D, S, T или N; X2 представляет собой аминокислоту Y, L или W; X3 представляет собой аминокислоту I или M; X4 представляет собой аминокислоту Y, H, E или N; X5 представляет собой аминокислоту Y, M, V или W; X6 представляет собой аминокислоту D, N, H или F; X7 представляет собой аминокислоту Y, G или S; X8 представляет собой аминокислоту N, S, T или D; X9 представляет собой аминокислоту G, S или D; X10 представляет собой аминокислоту G, D, E или I; X11 представляет собой аминокислоту T или S; X12 представляет собой аминокислоту K или R; и X13 представляет собой аминокислоту Y или L; X14 представляет собой аминокислоту Q или E; X15 представляет собой аминокислоту K или N; X16 представляет собой аминокислоту K, I или R; и X17 представляет собой аминокислоту G, A или D; где X18 представляет собой аминокислоту D или N; X19 представляет собой аминокислоту R или Y; X20 представляет собой аминокислоту E, T или G; X21 представляет собой аминокислоту D, S или N; X22 представляет собой аминокислоту Y или G; X23 представляет собой аминокислоту G, S или V; X24 представляет собой аминокислоту I, S или W; X25 представляет собой аминокислоту S, W или A; X26 представляет собой аминокислоту T, F или M; X27 представляет собой аминокислоту Y, P или D; X28 представляет собой аминокислоту S или Y; и где X'1 представляет собой аминокислоту R или G; X'2 представляет собой аминокислоту M или I; X'3 представляет собой аминокислоту K или R; X'4 представляет собой аминокислоту V или A; X'5 представляет собой аминокислоту M, L или I; X'6 представляет собой аминокислоту V или R; X'7 представляет собой аминокислоту T или K; X'8 представляет собой аминокислоту A, I или T; X'9 представляет собой аминокислоту V или A; X'10 представляет собой аминокислоту R или S; и X'11 представляет собой аминокислоту D или E.
Определенные варианты осуществления настоящего изобретения включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий вариабельную область тяжелой цепи гуманизированного антитела, содержащую аминокислотную последовательность, выбранную из группы, состоящей из:
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYIHWVRQAPGQRLEWMGWIFPGSDITKYNEKFKGRVTITRDTSASTAYMELSSLRSEDTAVYYCAREDYGISTYSAMDFWGQGTLVTVSS (SEQ ID NO:4); QVQLVQSGAEVKKPGASVKVSCKASGYTFTDYYIYWVRQAPGQGLEWIGYIDPYNGGTKYNQKFKDRVTMTRDTSISTAYMELSRLRSDDTAVYYCARTSGSSWFPYWGQGTLVTVSS (SEQ ID NO:5); QVQLVQSGAEVKKPGASVKVSCKASGYTFTDYYIYWVRQAPGQGLEWIGYIDPYNGGTKYNQKFKDKATLTVDKSTSTAYMELSSLRSEDTAVYYCARTSGSSWFPYWGQGTLVTVSS (SEQ ID NO:6); QVQLVQSGAEVKKPGASVKVSCKASGYTFTTYLIEWVRQAPGQGLEWMGVINPGTGETKYNENFRARVTMTRDTSISTAYMELSRLRSDDTAVYYCARWDRWGQGTLVTVSS (SEQ ID NO:7); и QVQLV QSGAEVKKPGASVKVSCKASGYTFTTYWMNWVRQAPGQGLEWMGMIHPSDSESRLNQKFIDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGNYVWAMDYWGQGTLVTVSS (SEQ ID NO:8).
Определенные варианты осуществления настоящего изобретения включают антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий вариабельную область легкой цепи гуманизированного антитела, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: (1) X'12X'13X'14X'15TQX'16PX'17X'18X'19X'20X'21X'22X'23X'24X'25X'26X'27X'28X'29X'30CX29X30SX31X32X33X34X35X36X37X38WX'31X'32QX'33PX'34X'35X'36PX'37X'38LIX'39X43X44X45X46X47X48X49GX'40PX'41RFSGSGSGTX'42FTLX'43IX'44X'45X'46X'47X'48EDX'49X'50X'51YYCX50X51X52X53 X54X55PX56TFGQGTX'52VEIKR (SEQ ID NO:9); (2) X'12X'13X'14X'15TQX'16PX'17X'18X'19X'20X'21X'22X'23X'24X'25X'26X'27X'28X'29X'30CX29X30SX31X32X33X34X35X36X37X38X39X40X41X42WX'31X'32QX'33PX'34X'35X'36X'37X'38LIX'39X43X44X45X46X47X48X49GX'40PX'41RFSGSGSGTX'42FTLX'43IX'44X'45X'46X'47X'48EDX'49X'50X'51YYCX50X51X52X53X54X55PX56TFGQGTX'52VEIKR (SEQ ID NO:10); и (3) X'12X'13X'14X'15TQX'16PX'17X'18X'19X'20X'21X'22X'23X'24X'25X'26X'27X'28X'29X'30CX29X30SX31X32X33X34X35X36X37X38X39X40X41X42HWX'31X'32QX'33PX'34X'35X'36X'37 X'38LIX'39X43X44X45X46X47X48X49GX'40PX'41RFSGSGSGTX'42FTLX'43IX'44X'45X'46X'47X'48EDX'49X'50X'51YYCX50X51X52X53X54X55PX56TFGQGTX'52VEIKR (SEQ ID NO:11), где X29 представляет собой аминокислоту K или R; X30 представляет собой аминокислоту A или S; X31 представляет собой аминокислоту Q или K; X32 представляет собой аминокислоту D, S или N; X33 представляет собой аминокислоту V, I или L; X34 представляет собой аминокислоту G, S, V или L; X35 представляет собой аминокислоту T, N или H; X36 представляет собой аминокислоту A, N или S; X37 представляет собой аминокислоту V, L, N или G; X38 представляет собой аминокислоту A, H, G или Y; X39 представляет собой аминокислоту N или T; X40 представляет собой аминокислоту T или Y; X41 представляет собой аминокислоту Y или M; X42 представляет собой аминокислоту F или H; X43 представляет собой аминокислоту W, Y, K или I; X44 представляет собой аминокислоту A, T или V; X45 представляет собой аминокислоту S или Y; X46 представляет собой аминокислоту T, Q или N; X47 представляет собой аминокислоту R, S или L; X48 представляет собой аминокислоту H, I, F или E; X49 представляет собой аминокислоту T или S; X50 представляет собой аминокислоту Q или S; X51 представляет собой аминокислоту Q или H; X52 представляет собой аминокислоту S или Y; X53 представляет собой аминокислоту S, N, T или R; X54 представляет собой аминокислоту S, R, H или E; X55 представляет собой аминокислоту Y, W, V или L; X56 представляет собой аминокислоту L или Y; и где X'12 представляет собой аминокислоту D или E; X'13 представляет собой аминокислоту I или V; X'14 представляет собой аминокислоту V или Q; X'15 представляет собой аминокислоту M или L; X'16 представляет собой аминокислоту S или T; X'17 представляет собой аминокислоту S, D, A или L; X'l8 представляет собой аминокислоту S, T или F; X'19 представляет собой аминокислоту L или Q; X'20 представляет собой аминокислоту A, S или P; X'21 представляет собой аминокислоту V или A; X'22 представляет собой аминокислоту S или T; X'23 представляет собой аминокислоту P, L или V; X'24 представляет собой аминокислоту G или K; X'25 представляет собой аминокислоту E, Q или D; X'26 представляет собой аминокислоту R, K или P; X'27 представляет собой аминокислоту A или V; X'28 представляет собой аминокислоту T или S; X'29 представляет собой аминокислоту I или L; X'30 представляет собой аминокислоту S, T или N; X'31 представляет собой аминокислоту F или Y; X'32 представляет собой аминокислоту Q или L; X'33 представляет собой аминокислоту K или R; X'34 представляет собой аминокислоту G или D; X'35 представляет собой аминокислоту Q или K; X'36 представляет собой аминокислоту A, S или P; X'37 представляет собой аминокислоту K, R или Q; X'38 представляет собой аминокислоту L или R; X'39 представляет собой аминокислоту Y или K; X'40 представляет собой аминокислоту V или I; X'41 представляет собой аминокислоту S, A или D; X'42 представляет собой аминокислоту D или E; X'43 представляет собой аминокислоту K или T; X'44 представляет собой аминокислоту S или N; X'45 представляет собой аминокислоту S или R; X'46 представляет собой аминокислоту V или L; X'47 представляет собой аминокислоту Q или E; X'48 представляет собой аминокислоту P, A или S; X'49 представляет собой аминокислоту F, A или V; X'50 представляет собой аминокислоту A или G; X'51 представляет собой аминокислоту T или V; и X'52 представляет собой аминокислоту R или K.
Определенные варианты осуществления настоящего изобретения также относятся к антиген-связывающему полипептиду, который специфично связывается с полипептидом LIGHT, содержащему вариабельную область легкой цепи гуманизированного антитела, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: DIQLTQSPSFLSASVGDRVTITCKASQDVGTAVAWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQYSSYPLTFGQGTKVEIKR (SEQ ID NO:12); EIVLTQSPDFQSVTPKEKVTITCRASQSISNNLHWYQQKPDQSPKLLIKYTYQSISGVPSRFSGSGSGTDFTLTINSLEAEDAATYYCQQSNRWPLTFGQGTKVEIKR (SEQ ID NO:13); EIVMTQSPATLSVSPGEKATLSCRASQSISNNLHWYQQKPGQAPRLLIYYTYQSISGIPARFSGSGSGTEFTLTISSLQSEDFAVYYCQQSNRWPLTFGQGTRVEIKR (SEQ ID NO:14); DVVMTQSPLSLPVTLGQPASISCRSSQNLVHSNGNTYFHWFQQRPGQSPRRLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSTHVPYTFGQGTKVEIKR (SEQ ID NO:15); DIVMTQTPLSLSVTPGQPASISCRSSQNLVHSNGNTYFHWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSTHVPYTFGQGTKVEIKR (SEQ ID NO:16); и DIVMTQSPDSLAVSLGERATINCRASKSVSTSGYTYMHWYQQKPGQPPKLLIYITSN LESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQHSRELPYTFGQGTKVEIKR (SEQ ID NO:17).
Определенные варианты осуществления настоящего изобретения относятся к антиген-связывающему полипептиду, который специфично связывается с полипептидом LIGHT, содержащему: (a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность: QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYIHWVRQAPGQRLEWMGWIFPGSDITKYNEKFKGRVTITRDTSASTAYMELSSLRSEDTAVYYCAREDYGISTYSAMDFWGQGTLVTVSS (SEQ ID NO:4) и (b) вариабельную область легкой цепи, содержащую аминокислотную последовательность: DIQLTQSPSFLSASVGDRVTITCKASQDVGTAVAWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQYSSYPLTFGQGTKVEIKR (SEQ ID NO:12).
В определенных вариантах осуществления настоящего изобретения антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT, содержат либо одну из указанных выше гуманизированных тяжелых цепей или гуманизированных легких цепей, либо их комбинации. Кроме того, в определенных вариантах осуществления антиген-связывающие полипептиды по настоящему изобретению содержат одну или несколько из указанных выше областей CDR из тяжелой цепи (т.е. CDR-H1, CDR-H2 или CDR-H3) или одну из указанных выше областей CDR из легкой цепи (т.е. CDR-L1, CDR-L2 или CDR-L3) или их комбинации.
В других вариантах осуществления настоящего изобретения антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, представляет собой молекулу антитела или ее фрагмент, такой как Fab-фрагмент, Fab'-фрагмент, F(ab')2-фрагмент или молекула scFv.
В определенных вариантах осуществления антиген-связывающий полипептид представляет собой молекулу антитела. Молекулы антител могут содержать химерные антитела, которые содержат, например, константную область тяжелой цепи человека и константную область легкой цепи человека, слитую с вариабельной областью тяжелой цепи мыши и вариабельной областью легкой цепи мыши. В других вариантах осуществления антиген-связывающий полипептид представляет собой молекулу scFv, которая содержит полипептид с формулой, выбранной из группы, состоящей из NH2-L-VH-X-VK-COOH и NH2-L-VK-X-VH-COOH; где L представляет собой лидерную последовательность; VH представляет собой вариабельную область тяжелой цепи гуманизированного антитела; X представляет собой линкерный полипептид; и VK представляет собой вариабельную область легкой цепи гуманизированного антитела. В дополнительных вариантах осуществления, молекула scFv слита или связана с полипептидом сывороточного альбумина человека (HSA) с образованием слитой молекулы scFV-HSA. Молекулу scFv можно подвергать слиянию или связывать с N- или C-концом HSA. В других вариантах осуществления антиген-связывающий полипептид представляет собой Fab-фрагмент. Fab-фрагмент по настоящему изобретению можно подвергать слиянию или связывать с HSA. Тяжелую цепь или легкую цепь Fab-фрагмента можно подвергать слиянию или связывать с N- или C-концом HSA.
Определенные варианты осуществления настоящего изобретения относятся к антиген-связывающему полипептиду, конъюгированному или слитому с терапевтическим или диагностическим средством. Например, лекарственные средства могут быть выбраны из группы, состоящей из цитотоксического средства, радиоактивной метки, иммуномодулятора, гормона, фермента, олигонуклеотида, фотоактивного лекарственного средства и их комбинации. Примеры диагностических средств могут включать радиоактивную метку, фотоактивное диагностическое средство, усиливающее действие ультразвука средство или нерадиоактивную метку.
Определенные варианты осуществления настоящего изобретения также относятся к композиции, содержащей антиген-связывающие полипептиды по изобретению и к способам получения таких полипептидов. Кроме того, варианты осуществления настоящего изобретения включают способы лечения или диагностики воспалительного, иммунного или злокачественного заболевания или состояния, включающие введение антиген-связывающих полипептидов и композиций по изобретению пациенту, нуждающемуся в этом. В других вариантах осуществления изобретение включает способы лечения заболеваний с использованием композиций по настоящему изобретению, включая, но ими не ограничиваясь, аутоиммунное заболевание (например, волчанку), воспалительное заболевание кишечника (IBD), хроническое обструктивное заболевание легких (COPD), артрит (например, ревматоидный артрит), рассеянный склероз, реакцию "трансплантат против хозяина" (GVHD), отторжение трансплантата, повреждение центральной нервной системы, опосредуемые Th1 заболевания кишечника, такие как болезнь Крона, псориаз, лейкоз или лимфому (например, хронический лимфоцитарный лейкоз (CLL)), атеросклероз, карциномы легкого и толстого кишечника и вирусные инфекции, такие как гепатит.
В определенных вариантах осуществления настоящее изобретение относится к выделенным полинуклеотидам, кодирующим указанные выше антиген-связывающие полипептиды. Полинуклеотиды могут быть функционально связаны с промотором, экспрессирующим кодируемые полипептиды, в подходящей клетке-хозяине. Кроме того, варианты осуществления настоящего изобретения включают способы продуцирования антиген-связывающих полипептидов по настоящему изобретению, включающие: a) культивирование клетки, трансформированной полинуклеотидом, кодирующим антиген-связывающий полипептид по настоящему изобретению для экспрессии кодируемого полипептида; и b) выделение экспрессированного таким образом полипептида.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 проиллюстрировано выделение Th1- и Th17-клеток из лимфоцитов периферической крови человека (PBL), выделенных из крови центрифугированием в градиенте плотности ficoll. После удаления моноцитов для выделения Th1-клеток клетки культивировали с 2 мкг/мл PHA плюс IL-12 и антителом против IL-4. Th17-клетки стимулировали связанным с планшетом антителом против CD3 вместе с растворимым антителом против CD28 или IL-12 вместе IL-18 в течение 2 суток при 37°С. Суспернатанты клеточных культур собирали и определяли в них продукцию IFN-γ и IL-17 посредством ELISA.
На фигуре 2 проиллюстрировано, как LIGHT индуцирует продукцию IL-17 в Th17-клетках. Th17-клетки стимулировали связанным с планшетом антителом против CD3 в отсутствие и в присутствии различных концентраций LIGHT в течение 2 суток при 37°C. Суперантанты клеточных культур собирали в определяли в них продукцию IL-17 посредством ELISA.
На фигуре 3 продемонстрировано, как моноклональное антитело мыши против LIGHT 10D11 ингибирует связывание LIGHT с его рецепторами. Слитые с Fc рецепторы LIGHT HVEM (TR2), рецептор-ловушку 3 (TR6) и LTβR наносили на 96-луночный планшет с использованием улавливания белком A. Связывание LIGHT-биотина с рецепторами определяли с использованием стрептавидин-HRP в отсутствие или в присутствии различных концентраций антител против LIGHT.
На фигуре 4 продемонстрировано, как моноклональное антитело мыши против LIGHT 10D11 ингибирует индуцируемую LIGHT продукцию IL-8 в эндотелиальных клетках. Клетки HUVEC высевали в 96-луночные планшеты. Клетки HUVEC в состоянии смыкания монослоя обрабатывали в течение 5 часов посредством LIGHT в отсутствие или в присутствии антитела против LIGHT 10D11 и не нейтрализующего контроля 19H9. Секрецию IL-8 из HUVEC определяли посредством ELISA.
На фигурах 5A-C продемонстрировано, как моноклональные антитела мыши против LIGHT ингибируют индуцируемый LIGHT апоптоз клеток HT-29. LIGHT/TL5 индуцирует гибель клеток в клеточной линии карциномы толстого кишечника HT-29. Для определения нейтрализующей активности антител против LIGHT использовали анализ жизнеспособности клеток HT-29 (как описано в примере 2). Клетки HT-29 предварительно обрабатывали IFN-γ в течение 6 ч при 37°C. Затем клетки культивировали с LIGHT в отсутствие или в присутствии различных концентраций антитела против LIGHT и контрольного антитела или LTβR-Fc в течение 3 суток. Жизнеспособность клеток определяли с использованием реагента Cell Titer Glo (Promega). На фигуре 5A представлена способность моноклонального антитела мыши против LIGHT 10D11 ингибировать индуцируемый LIGHT апоптоз клеток HT-29. На фигурах 5B и C показана способность антител мыши 5E10, 13C7, 14A10, 14G8, 15G4, 7G5, 18F1, 2B12, 16F12, 18B1 и 10D11AB ингибировать индуцируемый LIGHT человека (B) и яванского макака (C) апоптоз клеток HT-29.
На фигуре 6A проиллюстрировано выравнивание VH-домена антитела мыши против LIGHT 10D11 с наиболее сходной эмбриональной последовательностью, VH1-02 человека. Выравнивание использовали в качестве матрицы для создания гуманизированного VH 10D11, обозначенного на фигуре 6A как Hum 10D11 VH#1.
На фигуре 6B проиллюстрировано выравнивание VH-домена антитела мыши против LIGHT 10D11 с экспрессированным VH-доменом антитела, обозначенным как CAI54212 и который частично происходит из эмбриональной последовательности VH1-02, представленной на фигуре 6A. Выравнивание использовали в качестве матрицы для создания гуманизированного VH 10D11, обозначенного на фигуре 6B как Hum 10D11 VH#2.
На фигуре 6C проиллюстрировано выравнивание VK-домена антитела мыши против LIGHT 10D11 с наиболее сходным эмбриональным геном человека A26. Выравнивание использовали в качестве матрицы для создания гуманизированного VK 10D11, обозначенного на фигуре 6C как Hum 10D11 VK#1.
На фигуре 7 проиллюстрировано ингибирование индуцируемого LIGHT апоптоза клеток HT-29 2 различными гуманизированными антителами против LIGHT. Клетки HT-29 предварительно обрабатывали IFN-γ в течение 6 ч при 37°С. Затем клетки культивировали с LIGHT в отсутствие или в присутствии различных концентраций антител против LIGHT мыши и гуманизированных антител против LIGHT или контрольного антитела в течение 3 суток. Жизнеспособность клеток определяли с использованием реагента Cell Titer Glo (Promega).
На фигуре 8 проиллюстрировано ингибирование индуцируемого LIGHT апоптоза клеток HT-29 полностью гуманизированным антителом против LIGHT. Клетки HT-29 предварительно обрабатывали IFN-γ в течение 6 ч при 37°С. Затем клетки культивировали с LIGHT в отсутствие или в присутствии различных концентраций антител против LIGHT мыши и гуманизированных антител против LIGHT или контрольного антитела в течение 3 суток. Жизнеспособность клеток определяли с использованием реагента Cell Titer Glo (Promega).
На фигурах 9A и B проиллюстрировано ингибирование индуцируемого LIGHT человека (A) и яванского макака (B) апоптоза клеток HT-29 с помощью гуманизированных антител по сравнению с контрольным антителом 16H02. Клетки HT-29 предварительно обрабатывали IFN-γ в течение 6 ч при 37°С. Затем клетки культивировали с LIGHT в отсутствие или в присутствии различных концентраций антител против LIGHT мыши и гуманизированных антител против LIGHT или контрольного антитела в течение 3 суток. Жизнеспособность клеток определяли с использованием реагента Cell Titer Glo (Promega).
На фигурах 10A и B проиллюстрировано связывание антител против LIGHT с активированными T-клетками. Th1-, Th2- и Th17-клетки получали из лимфоцитов периферической крови человека (PBL), выделенных из крови центрифугированием в градиенте плотности ficoll. Th1- и Th17-клетки получали, как описано ранее (фигура 1). Th2-клетки получали культивированием PBL с 2 мкг/мл PHA с IL-4 и антителом против IFN-α в течение 3 суток. Через 3 суток клетки поддерживали с помощью 5 нг/мл IL-12. Клетки активировали посредством форбол-12-миристат-13-ацетата (PMA) и иономицина в течение 24 ч для индукции экспрессии LIGHT. Связывание антитела против LIGHT с активированными T-клетками определяли проточной цитометрией с использованием антитела козы против антител мыши, конъюгированного с PE.
На фигуре 10A проиллюстрировано связывание антител мыши против LIGHT с активированными Th17-клетками. Антитела против LIGHT инкубировали с Th17-клетками в течение 40 минут при комнатной температуре. В качестве отрицательного контроля использованы IgG1 мыши.
На фигуре 10B проиллюстрировано связывание гуманизированного антитела 5E10 с Th1-, Th17- и Th2-активированными T-клетками по сравнению с контролями. Поляризованные T-клетки активировали посредством PMA/иономицина в течение 24 ч. Меченное биотином антитело против LIGHT или контрольное антитело инкубировали с клетками в течение 40 минут при комнатной температуре. После промывания PBS два раза определяли связывание антитела с LIGHT, экспрессированным на активированных T-клетках, проточной цитометрией с использованием стрептавидина, конъюгированного с PE. Пунктирные линии на фигуре указывают на связывание гуманизированного антитела против LIGHT. Сплошная заливка указывает на связывание контрольного антитела.
На фигурах 11A и B представлено выравнивание последовательностей вариабельного домена тяжелой цепи (A) и вариабельного домена легкой цепи (B) из антител мыши против LIGHT-кандидатов (5E10, 13C7, 14G8 и 18B1). Рамками на фигуре обозначены домены CDR в каждой последовательности.
На фигурах 11C и D представлено выравнивание последовательностей для вариабельного домена VH тяжелой цепи (C) и вариабельного домена легкой цепи VK (D) 5E10 мыши с тремя наиболее сходными последовательностями эмбрионального вариабельного домена тяжелой цепи (VH) и вариабельного домена легкой цепи (VK) человека.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Определения
Следует отметить, что форма единственного числа для объекта относится к одному или нескольким объектам; например, подразумевают, что "антиген-связывающий полипептид" соответствует одному или нескольким антиген-связывающим полипептидам. По существу форму единственного числа, термины "один или более" и "по меньшей мере один" можно использовать в настоящем документе взаимозаменяемо.
Как используют в настоящем документе, подразумевают, что термин "полипептид" охватывает единичный "полипептид", а также множество "полипептидов", и он относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термин "полипептид" относится к любой цепи или цепям из двух или более аминокислот, и не относится к конкретной длине продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды, "белок", "цепь аминокислот" или любой другой термин, используемый для обозначения цепи или цепей из двух или более аминокислот, включены в определение "полипептид", и термин "полипептид" можно использовать вместо любого из этих терминов или взаимозаменяемо с ними. Также подразумевают, что термин "полипептид" относится к продуктам модификаций полипептида после экспрессии, включая, но ими не ограничиваясь, гликозилирование, ацетилирование, фосфорилирование, амидацию, преобразование в производное посредством известных защитных/блокирующих групп, протеолитическое расщепление или модификацию посредством не встречающихся в природе аминокислот. Полипептид может происходить из природного биологического источника или он может быть получен рекомбинантной технологией, однако он не обязательно транслирован с указанной последовательности нуклеиновой кислоты. Он может быть получен любым способом, в том числе химическим синтезом.
Под "выделенным" полипептидом или его фрагментом, вариантом или производным понимают полипептид, который лишен своей природной среды. Не требуется конкретного уровня очистки. Например, выделенный полипептид может быть удален из его нативного или природного окружения. Рекомбинантно продуцированные полипептиды и белки, экспрессированные в клетках-хозяевах, считаются выделенными для целей изобретения, как и нативные или рекомбинантные полипептиды, которые отделены, фракционированы или частично или по существу очищены любым подходящим способом.
Подразумевают, что термин "полинуклеотид" охватывает единичную нуклеиновую кислоту, а также множество нуклеиновых кислот, и он относится к выделенной молекуле нуклеиновой кислоты или конструкции, например, матричной РНК (мРНК) или плазмидной ДНК (пДНК). Полинуклеотид может содержать традиционную фосфодиэфирную связь или нетрадиционную связь (например, амидную связь, такую как встречается в пептидных нуклеиновых кислотах (PNA)). Термин "нуклеиновая кислота" относится к любому одному или нескольким сегментам нуклеиновых кислот, например, фрагментам ДНК или РНК, присутствующим в полинуклеотиде. Под "выделенной" нуклеиновой кислотой или полинуклеотидом понимают молекулу нуклеиновой кислоты, ДНК или РНК, которая извлечена из ее нативного окружения. Например, рекомбинантный полинуклеотид, кодирующий антитело по настоящему изобретению, содержащееся в векторе, считается выделенным для целей настоящего изобретения. Следующие примеры выделенного полинуклеотида включают рекомбинантные полинуклеотиды, поддерживаемые в гетерологичных клетках-хозяевах или очищенные (частично или существенно) полинуклеотиды в растворе. Выделенные молекулы РНК включают РНК-транскрипты полинуклеотидов по настоящему изобретению in vivo или in vitro. Выделенные полинуклеотиды или нуклеиновые кислоты в соответствии с настоящим изобретением, кроме того, включают такие молекулы, полученные синтетически. Кроме того, полинуклеотид или нуклеиновая кислота могут представлять собой или могут включать регуляторный элемент, такой как промотор, участок связывания рибосом или терминатор транскрипции.
Как используют в настоящем документе, "кодирующая область" представляет собой часть нуклеиновой кислоты, которая состоит из кодонов, транслируемых в аминокислоты. Хотя "стоп-кодон" (TAG, TGA или TAA) не транслируется в аминокислоту, его можно считать частью кодирующей области, однако какие-либо фланкирующие последовательности, например, промоторы, участки связывания рибосом, терминаторы транскрипции, интроны и т.п., не являются частью кодирующей области. В одной полинуклеотидной конструкции могут находиться две или более кодирующих областей по настоящему изобретению, например, на одном векторе, или в отдельных полинуклеотидных конструкциях, например, на отдельных (различных) векторах. Более того, любой вектор может содержать одну кодирующую область или он может содержать две или более кодирующих областей, например, один вектор может отдельно кодировать вариабельную область тяжелой цепи иммуноглобулина и вариабельную область легкой цепи иммуноглобулина. Кроме того, вектор, полинуклеотид или нуклеиновая кислота по изобретению могут кодировать гетерологичные кодирующие области, либо слитые, либо неслитые с нуклеиновой кислотой, кодирующей антиген-связывающий полипептид по настоящему изобретению или его вариант или производное. Гетерологичные кодирующие области включают, но ими не ограничиваются, специализированные элементы или мотивы, такие как секреторный сигнальный пептид или гетерологичный функциональный домен.
В определенных вариантах осуществления полинуклеотид или нуклеиновая кислота представляют собой ДНК. В случае ДНК, полинуклеотид, содержащий нуклеиновую кислоту, которая обычно кодирует полипептид, может включать промотор и/или другие элементы контроля транскрипции или трансляции, функционально связанные с одной или несколькими кодирующими областями. Функциональная связь представляет собой связь, когда кодирующая область для продукта гена, например, полипептида, связана с одной или несколькими регуляторными последовательностями таким образом, чтобы экспрессия продукта гена находилась под влиянием или контролем регуляторной последовательности(ей). Два фрагмента ДНК (такие как кодирующая полипептид область и промотор, связанный с ней) являются "функционально связанными", если индукция функции промотора приводит к транскрипции мРНК, кодирующей желаемый продукт гена, и если природа связи между этими двумя фрагментами ДНК не препятствует способности регулирующих экспрессию последовательностей направлять экспрессию продукта гена или не препятствует способности ДНК-матрицы к транскрипции. Таким образом, промоторная область может быть функционально связана с нуклеиновой кислотой, кодирующей полипептид, если промотор способен обеспечивать транскрипцию этой нуклеиновой кислоты. Промотор может представлять собой клеточно-специфичный промотор, который обеспечивает транскрипцию ДНК по существу только в заданных клетках. Помимо промотора, для обеспечения клеточно-специфичной транскрипции с полинуклеотидом могут быть функционально связаны другие элементы контроля транскрипции, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции. Подходящие промоторы и другие участки контроля транскрипции описаны в настоящем документе.
Специалистам в данной области известно множество участков контроля транскрипции. К ним относятся, но ими не ограничиваются, участки контроля транскрипции, которые функционируют в клетках позвоночных, такие как, но ими не ограничиваясь, промоторные и энхансерные сегменты из цитомегаловирусов (предранний промотор совместно с интроном-A), вируса обезьян 40 (ранний промотор) и ретровирусов (таких как вирус саркомы Рауса). Другие участки контроля транскрипции включают участки, происходящие из генов позвоночных, таких как гены актина, белка теплового шока, бычьего гормона роста и β-глобина кролика, а также другие последовательности, способные контролировать экспрессию генов в эукариотических клетках. Дополнительные подходящие участки контроля транскрипции включают тканеспецифические промоторы и энхансеры, а также индуцируемые лимфокинами промоторы (например, промоторы, индуцируемые интерферонами или интерлейкинами).
Аналогично специалистам в данной области известно множество элементов контроля трансляции. К ним относятся, но ими не ограничиваются, участки связывания рибосом, кодоны инициации и терминации трансляции и элементы, происходящие из пикорнавирусов (в частности, участок внутренней посадки рибосомы, или IRES, также обозначаемый как последовательность CITE).
В других вариантах осуществления полинуклеотид по настоящему изобретению представляет собой РНК, например, в форме матричной РНК (мРНК).
Полинуклеотиды и нуклеиновые кислоты кодирующих областей по настоящему изобретению могут быть связаны с дополнительными кодирующими областями, которые кодируют секреторные или сигнальные пептиды, которые направляют секрецию полипептида, кодируемого полинуклеотидом по настоящему изобретению. Согласно сигнальной гипотезе, белки, секретируемые клетками млекопитающих, имеют сигнальный пептид или секреторную лидерную последовательность, которая отщепляется от зрелого белка после начала экспорта растущей белковой цепи через шероховатую эндоплазматическую сеть. Специалистам в данной области известно, что полипептиды, секретируемые клетками позвоночных, обычно имеют сигнальный пептид, слитый с N-концом полипептида, который отщепляется от полного или "полноразмерного" полипептида с образованием секретируемой или "зрелой" формы полипептида. В определенных вариантах осуществления используют нативный сигнальный пептид, например, сигнальный пептид тяжелой цепи или легкой цепи иммуноглобулина или функциональное производное этой последовательности, которые сохраняют способность обеспечивать секрецию полипептида, который функционально связан с ними. Альтернативно можно использовать гетерологичный сигнальный пептид млекопитающего или его функциональное производное. Например, лидерная последовательность дикого типа может быть замещена лидерной последовательностью тканевого активатора плазминогена (TPA) человека или β-глюкуронидазы мыши.
"Антитело" или "молекула антитела", как описано в настоящем документе, относятся к полноразмерной (т.е., природной или образованной обычными процессами рекомбинации фрагментов генов иммуноглобулинов) молекуле иммуноглобулина (например, антитела IgG).
Настоящее изобретение включает определенные антиген-связывающие полипептиды, которые связывают LIGHT, включая антитела, их антитело- или антиген-связывающие фрагменты, варианты или производные. Если конкретно указываются полноразмерные антитела, как описано выше, термин "антиген-связывающий полипептид" охватывает полноразмерные антитела, а также "антиген-связывающие фрагменты", варианты, аналоги или производные таких антител, например, природные молекулы антител или иммуноглобулинов или сконструированные молекулы антител или их фрагменты, которые связывают антиген, аналогично молекулам антител: Fab-фрагменты, молекулы scFv и т.д. Фрагменты антител, содержащие одноцепочечные антитела, могут содержать вариабельную область(и) отдельно или в комбинации со следующими полными структурами или их частями: шарнирный, CH1-, CH2- и CH3-домены. Также к изобретению относятся антиген-связывающие фрагменты, также содержащие любую комбинацию вариабельной области(ей) с шарнирным, CH1-, CH2- и CH3-доменами.
Термины "фрагмент антитела" или "антиген-связывающий фрагмент", как используют в настоящем документе, представляют собой часть антитела, такую как F(ab')2, F(ab)2, Fab', Fab, Fv, scFv и т.п. Независимо от структуры, фрагмент антитела связывается с тем же антигеном, который распознает целое антитело. Термин "фрагмент антитела" включает аптамеры, шпигельмеры и диатела. Термин "фрагмент антитела" также включает любой синтетический или полученный способами генетической инженерии белок, который действует подобно антителу путем связывания со специфическим антигеном с образованием комплекса. Например, фрагменты антител включают выделенные фрагменты, состоящие из вариабельных областей, такие как "Fv"-фрагменты, состоящие из вариабельных областей тяжелой и легкой цепей, рекомбинантных одноцепочечных полипептидных молекул, в которых вариабельные области легкой и тяжелой цепей соединены пептидным линкером ("белки scFv"), слитые полипептиды scFv-HSA, в которых scFv экспрессируется в качестве слитой конструкции либо с N-, либо с C-концом HSA, слитые полипептиды Fab'-HSA, в которых VH-CH1 или VK-CK продуцируют в качестве слитых с HSA конструкций, которые затем сворачиваются с их собственной легкой цепью VK-CK или тяжелой цепью VH-CH1, соответственно, с образованием Fab', и минимальные элементы для распознавания, состоящие из аминокислотных остатков, которые имитируют гипервариабельную область.
Термины "антиген-связывающий полипептид" и "иммуноглобулин" используют в настоящем документе взаимозаменяемо. Антиген-связывающий полипептид или иммуноглобулин содержит по меньшей мере вариабельный домен тяжелой цепи и обычно содержит по меньшей мере вариабельные домены тяжелой цепи и легкой цепи. Основные структуры иммуноглобулинов в системах позвоночных относительно хорошо понятны. См., например, Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988).
Как более подробно рассмотрено ниже, термин "антиген-связывающий полипептид" включает различные широкие классы полипептидов, которые могут быть отличены друг от друга биохимически. Специалистам в данной области понятно, что тяжелые цепи классифицируют как гамма, мю, альфа, дельта или эпсилон (γ, μ, α, δ, ε) с некоторыми подклассами среди них (например, γ1-γ4). Также природа этой цепи определяет "класс" антитела как IgG, IgM, IgA IgG или IgE, соответственно. Подклассы иммуноглобулинов (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgG5 и т.д., хорошо охарактеризованы и известно, что они обеспечивают функциональную специализацию. Модифицированные версии каждого из этих классов и изотипов будут понятны специалисту в данной области с учетом настоящего описания и, таким образом, они входят в объем настоящего изобретения. Все классы иммуноглобулинов, безусловно, находятся в объеме настоящего изобретения; представленное ниже описание, главным образом, относится к классу IgG молекул иммуноглобулинов. Что касается IgG, стандартная молекула иммуноглобулина содержит два идентичных полипептида легкой цепи с молекулярной массой приблизительно 23000 дальтон, и два идентичных полипептида тяжелой цепи с молекулярной массой 53000-70000. Эти четыре цепи, как правило, связаны дисульфидными связями в конфигурации "Y", где легкие цепи обхватывают тяжелые цепи, начиная у раздвоения "Y" и продолжая через вариабельную область.
Легкие цепи классифицируют как каппа или лямбда (K, λ). Каждый класс тяжелых цепей может быть связан либо с легкой цепью каппа, либо с легкой цепью лямбда. Как правило, легкая и тяжелая цепи ковалентно связаны друг с другом и "хвостовые" части двух тяжелых цепей связаны друг с другом ковалентными дисульфидными связями или нековалентными связями, когда иммуноглобулины получают с помощью гибридом, B-клеток или генетически сконструированных клеток-хозяев. В тяжелой цепи аминокислотные последовательности располагаются с N-конца на вилкообразных концах Y-конфигурации до C-конца внизу каждой цепи.
Как легкие, так и тяжелые, цепи разделяют на области структурной и функциональной гомологии. Термины "константный" и "вариабельный" используют функционально. В этом отношении понятно, что вариабельные домены частей как легкой (VK), так и тяжелой (VH) цепей, определяют распознавание антигена и специфичность. Напротив, константные домены легкой цепи (CK) и тяжелой цепи (CH1, CH2 или CH3) придают важные биологические свойства, такие как секреция, способность проходить через плаценту, связывание Fc-рецептора, связывание комплемента и т.п. Обычно нумерация доменов константной области возрастает по мере того, как они становятся более дистальными от антиген-связывающего центра или N-конца антитела. N-концевая часть представляет собой вариабельную область и на C-концевой части находится константная область; CH3- и CK-домены в действительности содержат C-конец тяжелой и легкой цепей, соответственно.
Как указано выше вариабельная область позволяет антителу селективно распознавать и специфично связывать эпитопы на антигенах. Значит, VK-домен и VH-домен, или подгруппа определяющих комплементарность областей (CDR) антитела объединяются с образованием вариабельной области, которая определяет трехмерный антиген-связывающий центр. Эта четвертичная структура антитела образует антиген-связывающий центр, находящийся на конце каждого плеча Y. Более конкретно, антиген-связывающий центр определяется тремя CDR на каждой из цепей VH и VK (т.е. CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3). В некоторых случаях, например, в случае определенных молекул иммуноглобулинов, происходящих из видов верблюжьих или сконструированных на основе иммуноглобулинов верблюжьих, полноразмерная молекула иммуноглобулина может состоять только из тяжелых цепей, без легких цепей. См., например, Hamers-Casterman et al., Nature 363:446-448 (1993).
В природных антителах шесть "определяющих комплементарность областей" или "CDR", присутствующих в каждом антиген-связывающем домене, являются короткими несмежными последовательностями аминокислот, которые расположены определенным образом так, чтобы образовывать антиген-связывающий домен, когда антитело принимает его трехмерную конфигурацию в водной среде. Остальные аминокислоты в антиген-связывающих доменах, называемые "каркасными" областями, демонстрируют меньшую внутримолекулярную вариабельность. Каркасные области по большей части принимают конформацию β-слоя, а CDR образуют петли, которые соединяют и в некоторых случаях формируют часть структуры β-слоя. Таким образом, каркасные области образуют остов, который обеспечивает расположение CDR в правильной ориентации посредством межцепочечных нековалентных взаимодействий. Антиген-связывающий домен, образованный ориентированными CDR, определяет комплементарность поверхности эпитопу на иммунореактивном антигене. Эта комплементарная поверхность обеспечивает нековалентное связывание антитела с его собственным эпитопом. Специалист в данной области может легко идентифицировать аминокислоты, составляющие CDR и каркасные области, соответственно, для любой данной вариабельной области тяжелой цепи или легкой цепи, поскольку они были точно определены (см. "Sequences of Proteins of Immunological Interest", Kabat, E., et al., U.S. Department of Health and Human Services, (1983); и Chothia and Lesk, J. Mol. Biol., 196:901-917 (1987), которые включены в настоящий документ в качестве ссылок в полном объеме).
В случае, когда существует два или более определений термина, который используют и/или который принят в данной области, подразумевают, что определение термина, как используют в настоящем документе, включает все такие значения, если ясно не указано иное. Конкретным примером является применение термина "определяющая комплементарность область" ("CDR") для описания несмежных антиген-связывающих центров, находящихся в вариабельной области полипептидов как тяжелой, так и легкой цепей. Эта конкретная область была описана Kabat et al., U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983) и Chothia et al., J. Mol. Biol. 196:901-917 (1987), которые включены в настоящий документ в качестве ссылок в полном объеме. Определения CDR согласно Kabat и Chothia включают перекрывания подгрупп аминокислотных остатков при сравнении друг против друга. Тем не менее, подразумевают, что применение любого определения для обозначения CDR антитела или его вариантов входит в объем термина, определенного и применяемого в настоящем документе. Подходящие аминокислотные остатки, которые охватывают CDR, как определено в каждой из цитированных выше ссылок, указаны ниже в таблице 1 в качестве сравнения. Точные номера остатков, которые охватывают конкретную CDR, варьируют, в зависимости от последовательности и размера CDR. Специалисты в данной области могут обычными способами определить, какие остатки составляют конкретную CDR, учитывая аминокислотную последовательность вариабельной области антитела.
Kabat et al. также определили систему нумерации для последовательностей вариабельных доменов, которая применима к любому антителу. Специалист в данной области может недвусмысленно применить эту систему "нумерации по Kabat" к любой последовательности вариабельного домена, не полагаясь на какие-либо экспериментальные данные помимо самой последовательности. Как используют в настоящем документе, "нумерация по Kabat" относится к системе нумерации, представленной Kabat et al., U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983).
В дополнение к таблице 1 выше, система нумерации Kabat описывает области CDR следующим образом: CDR-H1 начинается приблизительно на аминокислоте 31 (т.е., приблизительно через 9 остатков после первого остатка цистеина), включает приблизительно 5-7 аминокислот, и заканчивается на следующем остатке триптофана. CDR-H2 начинается на пятнадцатом остатке после окончания CDR-H1, включает приблизительно 16-19 аминокислот и оканчивается на следующем остатке аргинина или лизина. CDR-H3 начинается приблизительно на тридцать третьем аминокислотном остатке после окончания CDR-H2; включает 3-25 аминокислот; и оканчивается на последовательности W-G-X-G, где X представляет собой любую аминокислоту. CDR-L1 начинается приблизительно на остатке 24 (т.е., после остатка цистеина); включает приблизительно 10-17 остатков; и оканчивается на следующем остатке триптофана. CDR-L2 начинается приблизительно на шестнадцатом остатке после окончания CDR-L1 и включает приблизительно 7 остатков. CDR-L3 начинается приблизительно на тридцать третьем остатке после окончания CDR-L2 (т.е., после остатка цистеина); включает приблизительно 7-11 остатков и оканчивается на последовательности F или W-G-X-G, где X представляет собой любую аминокислоту.
Антиген-связывающие полипептиды, их варианты или производные по изобретению включают, но ими не ограничиваются, поликлональные, моноклональные, полиспецифические, человеческие, гуманизированные, приматизированные или химерные антитела, одноцепочечные антитела, связывающие эпитоп фрагменты, например, Fab, Fab' и F(ab')2, Fd, Fv, одночепочечные Fv (scFv), одноцепочечные антитела, связанные дисульфидной связью Fv (sdFv), фрагменты, содержащие либо VK-домен, либо VH-домен, фрагменты, продуцируемые экспрессирующей Fab библиотекой, и антиидиотипические (анти-Id) антитела (включая, например, анти-Id антитела к антителам против LIGHT, описанным в настоящем документе). Молекулы scFv известны в данной области и описаны, например, в патенте США 5892019. Молекулы иммуноглобулинов или антител по изобретению могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса молекул иммуноглобулинов.
Антиген-связывающие полипептиды, описанные в настоящем документе, могут быть из любого животного, включая птиц и млекопитающих. Предпочтительно, антитела представляют собой антитела человека, мыши, осла, кролика, козы, морской свинки, верблюда, ламы, лошади или цыпленка. В другом варианте осуществления, вариабельная область может иметь происхождение из хордовых (например, из акул).
Как используют в настоящем документе, термин "константная область тяжелой цепи" включает аминокислотные последовательности, происходящие из тяжелой цепи иммуноглобулина. Полипептид, содержащий константную область тяжелой цепи, содержит по меньшей мере одно из: CH1-домен, шарнирный (например, верхний, средний и/или нижний шарнирный) домен, CH2-домен, CH3-домен, или их вариант или фрагмент. Например, антиген-связывающий полипептид для использования в изобретении может содержать полипептидную цепь, содержащую CH1-домен; полипептидную цепь, содержащую CH1-домен, по меньшей мере часть шарнирного домена, и CH2-домен; полипептидную цепь, содержащую CH1-домен и CH3-домен; полипептидную цепь, содержащую CH1-домен, по меньшей мере часть шарнирного домена и CH3-домен, или полипептидную цепь, содержащую CH1-домен, по меньшей мере часть шарнирного домена, CH2-домен и CH3-домен. В другом варианте осуществления полипептид по изобретению содержит полипептидную цепь, содержащую CH3-домен. Кроме того, антиген-связывающий полипептид для использования в изобретении может быть лишен по меньшей мере части CH2-домена (например, всего CH2-домена или его части). Как указано выше, специалистам в данной области понятно, что константная область тяжелой цепи может быть модифицирована так, чтобы ее аминокислотная последовательность варьировала относительно природной молекулы иммуноглобулина.
Константная область тяжелой цепи антиген-связывающих полипептидов, описанных в настоящем документе, может происходить из различных молекул иммуноглобулинов. Например, константная область тяжелой цепи полипептида может содержать CH1-домен, происходящий из молекулы IgG1, и шарнирную область, происходящую из молекулы IgG3. В другом примере константная область тяжелой цепи может содержать шарнирную область, происходящую, частично, из молекулы IgG1 и, частично, из молекулы IgG3. В другом примере часть тяжелой цепи может содержать химерную шарнирную область, происходящую, частично, из молекулы IgG1 и, частично, из молекулы IgG4.
Как используют в настоящем документе, термин "константная область легкой цепи" включает аминокислотные последовательности, происходящие из легкой цепи антитела. Предпочтительно, константная область легкой цепи содержит по меньшей мере один из константного домена каппа или константного домена лямбда.
Как указано выше, субъединичные структуры и трехмерная конфигурация константных областей различных классов иммуноглобулинов хорошо известны. Как используют в настоящем документе, термин "VH-домен" включает N-концевой вариабельный домен тяжелой цепи иммуноглобулина и термин "CH1-домен" включает первый домен (наиболее N-концевой) константной области тяжелой цепи иммуноглобулина. CH1-домен является соседним с VH-доменом и является N-концевым для шарнирной области молекулы тяжелой цепи иммуноглобулина.
Как используют в настоящем документе, термин "CH2-домен" включает часть молекулы тяжелой цепи, которая располагается, например, приблизительно от остатка 244 до остатка 360 антитела при использовании общепринятых схем нумерации (остатки с 244 по 360, система нумерации Kabat; и остатки 231-340, система нумерации EU; см. Kabat et al., U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983). CH2-домен является уникальным в том, что он не спарен тесно с другим доменом. Вместо этого, между двумя CH2-доменами интактной нативной молекулы IgG расположены две N-связанные разветвленные углеводные цепи. Также убедительно документально подтверждено, что CH3-домен располагается от CH2 домена до C-конца молекулы IgG и содержит приблизительно 108 остатков.
Как используют в настоящем документе, термин "шарнирная область" включает часть молекулы тяжелой цепи, которая связывает CH1-домен с CH2-доменом. Эта шарнирная область содержит приблизительно 25 остатков и является подвижной, таким образом, позволяя двум N-концевым антиген-связывающим участкам двигаться независимо. Шарнирные области можно подразделить на три отдельных домена: верхний, средний и нижний шарнирный домены (Roux et al., J. Immunol 161:4083 (1998)).
Как используют в настоящем документе, термин "дисульфидная связь" включает ковалентную связь, образованную между двумя атомами серы. Аминокислота цистеин содержит тиольную группу, которая может образовывать дисульфидную связь или мостик со второй тиольной группой. В большинстве природных молекул IgG, области CH1 и CK связаны дисульфидной связью и две тяжелые цепи связаны двумя дисульфидными связями в положениях, соответствующих 239 и 242 при использовании системы нумерации Kabat (положение 226 или 229, система нумерации EU).
Как используют в настоящем документе, термин "химерное антитело" означает любое антитело, где иммунореактивная область или участок получены или происходят из первого вида, а константная область (которая может быть интактной, частичной или модифицированной согласно настоящему изобретению) получена из второго вида. В предпочтительных вариантах осуществления заданная связывающая область или участок может быть из источника, не являющегося человеком (например, из мыши или примата), а константная область является человеческой.
Как используют в настоящем документе, "процент гуманизации" вычисляют путем определения количества отличий каркасных аминокислот (т.е. отличий не в CDR) между гуманизированным доменом и эмбриональным доменом, вычитания этого количества из общего количества аминокислот, а затем делением полученного результата на общее количество аминокислот и умножением на 100.
Под "специфично связывает", главным образом, понимают, что антиген-связывающий полипептид связывается с эпитопом через его антиген-связывающий домен, и что связывание предполагает некоторую комплементарность между антиген-связывающим доменом и эпитопом. Согласно этому определению, говорят, что антиген-связывающий полипептид "специфично связывается" с эпитопом, если он связывается с этим эпитопом через его антиген-связывающий домен легче, чем он бы связывался со случайным независимым эпитопом. Термин "специфичность" используют в настоящем документе для качественного определения относительной аффинности, с которой определенный антиген-связывающий полипептид связывается с определенным эпитопом. Например, антитело "A" можно считать имеющим более высокую специфичность к данному эпитопу, чем антитело "B", или антитело "A" можно называть связывающим эпитоп "C" с более высокой специфичностью, чем оно имеет к родственному эпитопу "D".
Под "предпочтительно, связывает" подразумевают, что антиген-связывающий полипептид специфично связывается с эпитопом легче, чем он связывался бы с родственным, сходным, гомологичным или аналогичным эпитопом. Таким образом, антиген-связывающий полипептид, который "предпочтительно, связывается" с данным эпитопом с большей вероятностью связывается с этим эпитопом, чем с родственным эпитопом, даже несмотря на то, что антитело может перекрестно реагировать с родственным эпитопом.
В качестве неограничивающего примера, антиген-связывающий полипептид можно считать, предпочтительно, связывающимся с первым эпитопом, если он связывает указанный первый эпитоп с константой диссоциации (KD), которая является меньшей, чем KD антиген-связывающего полипептида в отношении второго эпитопа. В другом неограничивающем примере антиген-связывающий полипептид можно считать, предпочтительно, связывающим первый антиген, если он связывает первый эпитоп с аффинностью, которая по меньшей мере на один порядок величины меньше, чем KD антиген-связывающего полипептида в отношении второго эпитопа. В другом неограничивающем примере антиген-связывающий полипептид можно считать, предпочтительно, связывающим первый эпитоп, если он связывает первый эпитоп с аффинностью, которая по меньшей мере на два порядка величины ниже, чем KD антиген-связывающего полипептида в отношении второго эпитопа.
Антиген-связывающие полипептиды или их варианты или производные по изобретению также могут быть описаны или указаны с точки зрения их аффинности связывания с полипептидом LIGHT. Предпочтительная аффинность связывания включает аффинность с константой диссоциации или KD менее 5×10-2 M, 10-2 M, 5×10-3 M, 10-3 M, 5×10-4 M, 10-4 M, 5×10-5 M, 10-5 M, 5×10-6 M, 10-6 M, 5×10-7 M, 10-7 M, 5×10-8 M, 10-8 M, 5×10-9 M, 10-9 M, 5×10-10 M, 10-10 M, 5×10-11 M, 10-11 M, 5×10-12 M, 10-12 M, 5×10-13 M, 10-13 M, 5×10-14 M, 10-14 M, 5×10-15 M или 10-15 M.
В другом неограничивающем примере антиген-связывающий полипептид можно считать, предпочтительно, связывающим первый эпитоп, если он связывает первый эпитоп с константной диссоциации (k(off)), которая ниже k(off) антиген-связывающего полипептида в отношении второго эпитопа. В другом неограничивающем примере антиген-связывающий полипептид можно считать, предпочтительно, связывающим первый эпитоп, если он связывает первый эпитоп с аффинностью, которая по меньшей мере на один порядок величины меньше, чем k(Off) антиген-связывающего полипептида в отношении второго эпитопа. В другом неограничивающем примере антиген-связывающий полипептид можно считать, предпочтительно, связывающим первый эпитоп, если он связывает первый эпитоп с аффинностью, которая по меньшей мере на два порядка величины меньше, чем k(off) антиген-связывающего полипептида в отношении второго эпитопа.
Можно сказать, что антиген-связывающий полипептид или вариант, или производное, описанные в настоящем документе, связывает полипептид LIGHT-мишень, описанный в настоящем документе, или его фрагмент или вариант с константой диссоциации (k(off)), меньшей или равной 5×10-2 с-1, 10-2 с-1, 5×10-3 с-1 или 10-3 с-1. Более предпочтительно, можно сказать, что антиген-связывающий полипептид по изобретению связывает полипептид LIGHT-мишень, описанный в настоящем документе, или его фрагмент или вариант, с константой диссоциации (k(off)), меньшей или равной 5×10-4 с-1, 10-4 с-1, 5×10-5 с-1, или 10-5 с-1, 5×10-6 с-1, 10-6 с-1, 5×10-7 с-1 или 10-7 с-1.
Можно сказать, что антиген-связывающий полипептид или вариант, или производное, описанные в настоящем документе, связывает полипептид LIGHT-мишень, описанный в настоящем документе, или его фрагмент или вариант, с константой ассоциации (kon)), большей или равной 103 M-1с-1, 5×103 M-1с-1, 104 M-1с-1 или 5×104 M-1с-1. Более предпочтительно, можно сказать, что антиген-связывающий полипептид по изобретению связывает полипептид LIGHT-мишень, описанный в настоящем документе, или его фрагмент или вариант, с константой ассоциации (k(on)), большей или равной 105 M-1с-1, 5×105 M-1с-1, 106 M-1с-1, 5×106 M-1с-1 или 107 M-1с-1, 5×107 M-1с-1.
Антиген-связывающий полипептид называют конкурентно ингибирующим связывание эталонного антиген-связывающего полипептида с данным эпитопом, если он, предпочтительно, связывается с этим эпитопом так, что он блокирует, в некоторой степени, связывание эталонного антиген-связывающего полипептида с эпитопом. Конкурентное ингибирование можно определять любым способом, известным в данной области, например, конкурентными анализами ELISA. Может быть указано, что антиген-связывающий полипептид конкурентно ингибирует связывание эталонного антитела с данным эпитопом по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, или по меньшей мере на 50%.
Как используют в настоящем документе, термин "аффинность" относится к мере прочности связывания отдельного эпитопа с CDR молекулы иммуноглобулина. См., например, Harlow et al., Antibodies; A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988) на стр. 27-28. Как используют в настоящем документе, термин "авидность" относится к общей стабильности комплекса между совокупностью антиген-связывающих полипептидов и антигена, т.е. к функциональной совокупной прочности смеси иммуноглобулинов с антигеном. См., например, Harlow на стр. 29-34. Авидность связана как с аффинностью отдельных антиген-связывающих полипептидов в популяции к конкретным эпитопам, так и с валентностью антиген-связывающих полипептидов и антигена. Например, взаимодействие между двухвалентным моноклональным антителом и антигеном с высоко повторяющейся эпитопной структурой, такой как полимер, представляет собой взаимодействие с высокой авидностью.
Как используют в настоящем документе, термин "сконструированное антитело" относится к антителу, в котором вариабельный домен либо в тяжелой цепи, либо легкой цепи, либо в обеих из них, изменен по меньшей мере частичной заменой одной или нескольких CDR из антитела с известной специфичностью и, если необходимо, частичной заменой и изменением последовательности каркасной области. Хотя CDR могут происходить из антитела того же класса или даже подкласса, что и антитело, из которого происходят каркасные области, предусматривается, что CDR происходят из антитела отличающегося класса и, предпочтительно, из антитела отличающегося вида. Сконструированное антитело, в котором одна или несколько "донорных" CDR из не являющегося человеческим антитела известной специфичности пересажена в каркасную область тяжелой или легкой цепи человека, называют в настоящем документе "гуманизированным антителом". Замена всех CDR полными CDR из донорной вариабельной области для переноса антиген-связывающей способности одного с вариабельного домена на другой может не быть необходимой. Вместо этого, может быть необходимым только перенос тех остатков, которые необходимы для поддержания активности заданного участка связывания. Учитывая объяснения, указанные, например, в патентах США No. 5585089, 5693761, 5693762 и 6180370, в пределах компетенции специалистов в данной области находится получение функционального сконструированного или гуманизированного антитела либо путем проведения общепринятого экспериментирования, либо путем тестирования методом "проб и ошибок".
Как используют в настоящем документе термин "надлежащим образом свернутый полипептид" включает полипептиды (например, антиген-связывающие полипептиды), в которых все функциональные домены, составляющие полипептид, являются четко активными. Как используют в настоящем документе, термин "ненадлежащим образом свернутый полипептид" включает полипептиды, в которых по меньшей мере один из функциональных доменов полипептида является неактивным. В одном из вариантов осуществления надлежащим образом свернутый полипептид содержит полипептидные цепи, связанные по меньшей мере одной дисульфидной связью.
Как используют в настоящем документе, термин "сконструированный" включает манипулирование с молекулами нуклеиновых кислот или полипептидов способами синтеза (например, рекомбинантными способами, пептидным синтезом in vitro, ферментативным или химическим связыванием пептидов или некоторой комбинацией этих способов).
Как используют в настоящем документе, термины "связанный", "конъюгированный", "слитый" или "слияние" используют взаимозаменяемо. Эти термины относятся к связыванию вместе двух или более элементов или компонентов, любыми способами, включающими химическую конъюгацию или рекомбинантные способы. "Слияние в рамке считывания" относится к связыванию двух или более открытых рамок считывания (ORF) полинуклеотида с образованием непрерывной более длинной ORF так, чтобы сохранялась правильная трансляционная рамка считывании исходных ORF. Таким образом, рекомбинантный слитый белок представляет собой единый белок, содержащий два или более сегментов, которые соответствуют полипептидам, кодируемым исходными ORF (эти сегменты в природе обычно не связаны друг с другом). Хотя рамка считывания, полученная таким образом, является непрерывной на протяжении слитых сегментов, сегменты могут быть физически или пространственно разделены, например, линкерной последовательностью, находящейся в рамке считывания. Например, полинуклеотиды, кодирующие CDR вариабельной области иммуноглобулина могут быть слитыми в рамке считывания, но разделенными полинуклеотидом, кодирующим по меньшей мере одну каркасную область иммуноглобулина или дополнительные области CDR, при условии что "слитые" CDR транслируются совместно в качестве части непрерывного полипептида.
Термин "экспрессия" или "экспрессировать", как используют в настоящем документе, относится к процессу, посредством которого с гена продуцируется биохимическое соединение, например, РНК или полипептид. Этот процесс включает любое проявление функционального присутствия гена в клетке, включая, но ими не ограничиваясь, нокдаун гена, а также как временную экспрессию, так и стабильную экспрессию. К нему относятся, но ими не ограничивается, транскрипция гена в матричную РНК (мРНК), транспортная РНК (тРНК), малая шпилечная РНК (shRNA), малая интерферирующая РНК (siRNA) или любой другой РНК-продукт, и трансляция такой мРНК в полипептид(ы). Если конечным желаемым продуктом является биохимическое соединение, экспрессия включает создание этого биохимического соединения и любых предшественников.
Как используют в настоящем документе, термины "лечить" или "лечение" относятся как к терапевтическим, так и к профилактическим или предупреждающим мерам, где задачей является профилактика или замедление (уменьшение) нежелательного физиологического изменения или нарушения, такого как прогрессирование рассеянного склероза. Благоприятные и желаемые клинические результаты включают, но ими не ограничиваются, смягчение симптомов, уменьшение степени заболевания, стабилизированное (т.е., не ухудшающееся) состояние заболевания, отсрочивание или замедление прогрессирования заболевания, ослабление или смягчение болезненного состояния и ремиссию (как частичную, так и общую), как поддающиеся выявлению, так и не поддающиеся выявлению. "Лечение" также можно означать продление выживания по сравнению с ожидаемым выживанием без проведения лечения. Индивидуумы, нуждающиеся в лечении, включают индивидуумов, уже имеющих состояние или нарушение, а также индивидуумов, предрасположенных к состоянию или нарушению или индивидуумов, у которых состояние или нарушение подлежит профилактике.
Под "индивидом" или "индивидуумом" или "животным" или "пациентом" или "млекопитающим" подразумевают любого индивида, в частности, индивида-млекопитающего, для которого является желательной диагностика, прогнозирование или терапия. Индивиды-млекопитающие включают людей, домашних животных, сельскохозяйственных животных, животных зоопарков, спортивных животных или животных-компаньонов, таких как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, крупный рогатый скот, коровы и т.д.
Как используют в настоящем документе, выражения, такие как "пациенту, нуждающемуся в лечении," или "индивид, нуждающийся в лечении," включают индивидов, таких как индивиды-млекопитающие, для которых было бы эффективным введение антиген-связывающего полипептида или композиции по настоящему изобретению, используемых, например, для обнаружения, для диагностической процедуры и/или для лечения.
Антитела против LIGHT
Описаны антиген-связывающие полипептиды, которые специфично связываются с полипептидом TNF-подобного цитокина, известного как LIGHT (см. регистрационный номер GenBank no. AF036581, включенный в настоящий документ в качестве ссылки в полном объеме). Определенные антиген-связывающие полипептиды по настоящему изобретению включают полипептиды гуманизированной тяжелой цепи, полипептиды гуманизированной легкой цепи, гуманизированные вариабельные области тяжелой цепи, гуманизированные вариабельные области легкой цепи, а также гуманизированные полипептиды тяжелой и легкой цепи, которые содержат определяющие комплементарность области антител против LIGHT, описанных в настоящем документе. В определенных вариантах осуществления антиген-связывающие полипептиды функционируют в качестве антагонистов активности LIGHT и/или взаимодействия LIGHT с рецепторами LIGHT.
Например, определенные антиген-связывающие полипептиды по настоящему изобретению включают каркасные (FR) области вариабельных областей легкой и тяжелой цепей антитела человека, при по существу сохранении антиген-связывающей специфичности исходного моноклонального антитела. Гуманизированная вариабельная область тяжелой цепи и/или гуманизированная вариабельная область легкой цепи являются по меньшей мере приблизительно на 87% гуманизированными, по меньшей мере приблизительно на 88% гуманизированными, по меньшей мере приблизительно на 89% гуманизированными, по меньшей мере приблизительно на 90% гуманизированными, по меньшей мере приблизительно на 91% гуманизированными, по меньшей мере приблизительно на 92% гуманизированными, по меньшей мере приблизительно на 93% гуманизированными, по меньшей мере приблизительно на 94% гуманизированными, по меньшей мере приблизительно на 95% гуманизированными, по меньшей мере приблизительно на 96% гуманизированными, по меньшей мере приблизительно на 97% гуманизированными, по меньшей мере приблизительно на 98% гуманизированными, по меньшей мере приблизительно на 99% гуманизированными, или по меньшей мере приблизительно на 100% гуманизированными, не включая определяющие комплементарность области (CDR).
Молекулы антиген-связывающих полипептидов по настоящему изобретению включают, но ими не ограничиваются, поликлональные, моноклональные, полиспецифические, человеческие, гуманизированные, химерные, одноцепочечные антитела, Fab-фрагменты, F(ab')-фрагменты и антиидиотипические (анти-Id) антитела. Антиген-связывающие полипептиды по настоящему изобретению также включают, но ими не ограничиваются, Fab, Fab' и F(ab')2, Fv, одноцепочечные Fv (scFV), одноцепочечные антитела, связанные дисульфидной связью Fv (sdFv) и фрагменты, содержащие либо вариабельный домен легкой цепи, либо вариабельный домен тяжелой цепи. Антиген-связывающие полипептиды по настоящему изобретению, включая одноцепочечные антитела, могут содержать вариабельную область(и) отдельно или в комбинации с полной константной областью тяжелой цепи или константной областью легкой цепи, шарнирной областью, CH1-, CH2- и CH3-доменами или их частью.
Антиген-связывающие полипептиды по настоящему изобретению могут происходить из любого животного, включая человека, мышь, осла, овцу, кролика, козу, свинью, верблюда, лошадь или курицу. Например, антиген-связывающий полипептид по настоящему изобретению может происходить из моноклональных антител-доноров (например, моноклональные антитела-доноры мыши) и он может включать CDR из моноклональных антител (например, CDR моноклональных антител мыши).
В определенных вариантах осуществления настоящее изобретение относится к антиген-связывающим полипептидам или их вариантам или производным. В частности, настоящее изобретение включает антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT и включают, по существу состоят или состоят из гуманизированной вариабельной области тяжелой цепи, содержащей, по существу состоящей или состоящей из аминокислотных последовательностей, описанных ниже в таблице 2:
Аминокислотная последовательность вариабельных доменов тяжелой цепи гуманизированных антител против LIGHT
X
2
= Y, L или W
X
3
= I или M
X
4
= Y, H, E или N
X
5
= Y, M, V или W
X
6
= D, N, H или F
X
7
= Y, G или S
X
8
= N, S, T или D
X
9
= G, S или D
X
10
= G, D, E или I
X
11
= T или S
X
12
= K или R
X
13
= Y или L
X
14
= Q или E
X
15
= K или N
X
16
= K, I или R
X
17
= G, A или D
X'2 = M или I
X'3 = K или R
X'4 = V или A
X'5= M, L или I
X'6= V или R
X'7= T или K
X'8= A, I или T
X'9= V или A
X'10= R или S
X'11= D или E
X
19
= R или Y
X
2
= Y, L или W
X
3
= I или M
X
4
= Y, H, E или N
X
5
= Y, M, V или W
X
6
= D, N, H или F
X
7
= Y, G или S
X
8
= N, S, T или D
X
9
= G, S или D
X
10
= G, D, E или I
X
11
= T или S
X
12
= K или R
X
13
= Y или L
X
14
= Q или E
X
15
= K или N
X
16
= K, I или R
X
17
= G, A или D
X
18
= D или N
X
19
= R или Y
X
20
= E, T, или G
X'2 = M или I
X'3 = K или R
X'4 = V или A
X'5= M, L или I
X'6= V или R
X'7= T или K
X'8= A, I или T
X'9= V или A
X'10= R или S
X'11= D или E
X
22
= Y или G
X
23
= G, S или V
X
24
= I, S или W
X
25
= S, W или A
X
26
= T, F или M
X
27
= Y, P или D
X
28
= S или Y
X
20
X
21
X
22
X
23
X
24
X
25
X
26
X
27
X
28
AMDF
WGQGTLVTVSS
X
2
= Y, L или W
X
3
= I или M
X
4
= Y, H, E или N
X
5
= Y, M, V или W
X
6
= D, N, H или F
X
7
= Y, G или S
X
8
= N, S, T или D
X
9
= G, S или D
X
10
= G, D, E или I
X
11
= T или S
X
12
= K или R
X
13
= Y или L
X
14
= Q или E
X'2 = M или I
X'3 = K или R
X'4 = V или A
X'5= M, L или I
X'6= V или R
X'7= T или K
X'8= A, I или T
X'9= V или A
X'10= R или S
X'11= D или E
X
16
= K, I или R
X
17
= G, A или D
X
18
= D или N
X
19
= R или Y
X
20
= E, T, или G
X
21
= D, S или N
X
22
= Y или G
X
23
= G, S или V
X
24
= I, S или W
X
25
= S, W или A
X
26
= T, F или M
X
27
= Y, P или D
X
28
= S или Y
VH1
VH1
VH1
Области CDR каждой гуманизированной вариабельной области тяжелой цепи указаны полужирным шрифтом и подчеркнуты.
В определенных вариантах осуществления антиген-связывающий полипептид по настоящему изобретению относится к вариабельной области тяжелой цепи гуманизированного антитела, содержащей, по существу состоящей из или состоящей из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1; SEQ ID NO:2; SEQ ID NO:3; SEQ ID NO:4; SEQ ID NO:5; SEQ ID NO:6; SEQ ID NO:7; и SEQ ID NO:8. В частности, определенные антиген-связывающие полипептиды по настоящему изобретению содержат, по существу состоят или состоят из вариабельной области тяжелой цепи, содержащей, по существу состоящей или состоящей из аминокислотной последовательности SEQ ID NO:4.
В одном из вариантов осуществления антиген-связывающий полипептид по настоящему изобретению относится к полностью гуманизированному антителу против LIGHT, содержащему вариабельные области тяжелой цепи, описанные в настоящем документе, с полной тяжелой цепью (т.е. константные области).
В другом варианте осуществления, настоящее изобретение относится антиген-связывающему полипептиду, который специфично связывается с полипептидом LIGHT, содержащим, по существу состоящим или состоящим из гуманизированной вариабельной области тяжелой цепи, содержащей область CDR-H1, CDR-H2 и CDR-H3. В определенных вариантах осуществления области CDR содержат, по существу состоят или состоят из аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, описанных ниже в таблице 3.
Аминокислотная последовательность CDR тяжелой цепи гуманизированных антител против LIGHT
X1 = D, S, T или N
X2 = Y, L или W
X3 = I или M
X4 = Y, H, E или N
X5 = Y, M, V или W
X6 = D, N, H или F
X7 = Y, G или S
X8 = N, S, T или D
X9= G, S или D
X10 = G, D, E или I
X11 = T или S
X12 = K или R
X13 = Y или L
X14= Q или E
X15 = K или N
X17 = G, A или D
X18 = D или N
X19 = R или Y
X20 = E, T, или G
X21 = D, S или N
X22 = Y или G
X23 = G, S или V
X24 = I, S или W
X25 = S, W или A
X26 = T, F или M
X27 = Y, P или D
X28 = S или Y
X20 = E, T, или G
X21 = D, S или N
X22 = Y или G
X23 = G, S или V
X24 = I, S или W
X25 = S, W или A
X26 = T, F или M
X27 = Y, P или D
X28 = S или Y
В другом варианте осуществления настоящее изобретение относится к антиген-связывающему полипептиду, который специфично связывается с полипептидом LIGHT, содержащему, по существу состоящему или состоящему из гуманизированной вариабельной области тяжелой цепи, содержащей область CDR-H1, CDR-H2 и CDR-H3. В определенных вариантах осуществления область CDR-H1 содержит, по существу состоит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:18; SEQ ID NO:23; SEQ ID NO:26; SEQ ID NO:29; SEQ ID NO:32 и SEQ ID NO:35. В определенных вариантах осуществления область CDR-H2 содержит, по существу состоит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:19; SEQ ID NO:24; SEQ ID NO:27; SEQ ID NO:30; SEQ ID NO:33; и SEQ ID NO:36. В определенных вариантах осуществления область CDR-H3 содержит, по существу состоит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:20; SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:25; SEQ ID NO:28; SEQ ID NO:31; SEQ ID NO:34 и SEQ ID NO:37.
В конкретных вариантах осуществления настоящее изобретение включает антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий, по существу состоящий или состоящий из гуманизированной вариабельной области тяжелой цепи, содержащей область CDR-H1, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:23, область CDR-H2, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:24, и область CDR-H3, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:25.
Антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT, могут содержать, по существу состоять или состоять из гуманизированной вариабельной области тяжелой цепи, содержащей любую из областей CDR тяжелых цепей, описанных в настоящем документе, в любой комбинации.
Также настоящее изобретение включает антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий, по существу состоящий или состоящий из гуманизированной вариабельной области легкой цепи, содержащей, по существу состоящей или состоящей из аминокислотной последовательности, описанной ниже в таблице 4.
Аминокислотная последовательность вариабельных доменов легкой цепи гуманизированных антител против LIGHT
X
30
= A или S
X
31
= Q или K
X
32
= D, S или N
X
33
= V, I или L
X
34
= G, S, V или L
X
35
= T, N или H
X
36
= A, N или S
X
37
= V, L, N или G
X
38
= A, H, G или Y
X
39
= N или T
X
40
= T или Y
X
41
= Y или M
X
42
= F или H
X'13= I или V
X'14= V или Q
X'15= M или L
X'16= S или T
X'17= S, D, A или L
X'18= S, T или F
X'19= L или Q
X'20= A, S или P
X'21= V или A
X'22= S или T
X'23= P, L или V
X'24= G или K
X'25= E, Q или D
X
44
= A, T или V
X
45
= S или Y
X
46
= T, Q или N
X
47
= R, S или L
X
48 =
H, I, F или E
X
49
= T или S
X
50
= Q или S
X
51
= Q или H
X
52
= S или Y
X
53
= S, N, T или R
X
54
= S, R, H или E
X
55
= Y, W, V или L
X
56
= L или Y
X'27= A или V
X'28= T или S
X'29= I или L
X'30= S, T или N
X'31= F или Y
X'32= Q или L
X'33= K или R
X'34= G или D
X'35= Q или K
X'36= A, S или P
X'37= K, R или Q
X'38= L или R
X'39= Y или K
X'40= V или I
X'41= S, A или D
X'42= D или E
X'43= K или T
X'44= S или N
X'45= S или R
X'46= V или L
X'47= Q или E
X'48= P, A или S
X'49= F, A или V
X'50= A или G
X'51= T или V
X
30
= A или S
X
31
= Q или K
X
32
= D, S или N
X
33
= V, I или L
X
34
= G, S, V или L
X
35
= T, N или H
X
36
= A, N или S
X
37
= V, L, N или G
X
38
= A, H, G или Y
X
39
= N или T
X
40
= T или Y
X
41
= Y или M
X
42
= F или H
X
43
= W, Y, K или I
X
44
= A, T или V
X
45
= S или Y
X
46
= T, Q или N
X
47
= R, S или L
X
48 =
H, I, F или E
X'13= I или V
X'14= V или Q
X'15= M или L
X'16= S или T
X'17= S, D, A или L
X'18= S, T или F
X'19= L или Q
X'20= A, S или P
X'21= V или A
X'22= S или T
X'23= P, L или V
X'24= G или K
X'25= E, Q или D
X'26= R, K или P
X'27= A или V
X'28= T или S
X'29= I или L
X'30= S, T или N
X'31= F или Y
X
50
= Q или S
X
51
= Q или H
X
52
= S или Y
X
53
= S, N, T или R
X
54
= S, R, H или E
X
55
= Y, W, V или L
X
56
= L или Y
X'33= K или R
X'34= G или D
X'35= Q или K
X'36= A, S или P
X'37= K, R или Q
X'38= L или R
X'39= Y или K
X'40= V или I
X'41= S, A или D
X'42= D или E
X'43= K или T
X'44= S или N
X'45= S или R
X'46= V или L
X'47= Q или E
X'48= P, A или S
X'49= F, A или V
X'50= A или G
X'51= T или V
X'52= R или K
X
30
= A или S
X
31
= Q или K
X
32
= D, S или N
X
33
= V, I или L
X
34
= G, S, V или L
X
35
= T, N или H
X
36
= A, N или S
X
37
= V, L, N или G
X
38
= A, H, G или Y
X
39
= N или T
X
40
= T или Y
X
41
= Y или M
X
42
= F или H
X
43
= W, Y, K или I
X
44
= A, T или V
X
45
= S или Y
X
46
= T, Q или N
X
47
= R, S или L
X
48 =
H, I, F или E
X
49
= T или S
X
50
= Q или S
X
51
= Q или H
X
52
= S или Y
X
53
= S, N, T или R
X'13= I или V
X'14= V или Q
X'15= M или L
X'16= S или T
X'17= S, D, A или L
X'18= S, T или F
X'19= L или Q
X'20= A, S или P
X'21= V или A
X'22= S или T
X'23= P, L или V
X'24= G или K
X'25= E, Q или D
X'26= R, K или P
X'27= A или V
X'28= T или S
X'29= I или L
X'30= S, T или N
X'31= F или Y
X'32= Q или L
X'33= K или R
X'34= G или D
X'35= Q или K
X'36= A, S или P
X'37= K, R или Q
X
55
= Y, W, V или L
X
56
= L или Y
X'39= Y или K
X'40= V или I
X'41= S, A или D
X'42= D или E
X'43= K или T
X'44= S или N
X'45= S или R
X'46= V или L
X'47= Q или E
X'48= P, A или S
X'49= F, A или V
X'50= A или G
X'51= T или V
X'52= R или K
VK1
VK1
Области CDR каждой гуманизированной вариабельной области легкой цепи указаны полужирным шрифтом и подчеркнуты.
В определенных вариантах осуществления антиген-связывающий полипептид по настоящему изобретению относится к вариабельной области легкой цепи гуманизированного антитела, содержащей, по существу состоящей или состоящей из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:9; SEQ ID NO:10; SEQ ID NO:11; SEQ ID NO:12; SEQ ID NO:13; SEQ ID NO:14; SEQ ID NO:15; SEQ ID NO:16 и SEQ ID NO:17. В частности, определенные антиген-связывающие полипептиды по настоящему изобретению содержат, по существу состоят или состоят из вариабельной области легкой цепи, содержащей, по существу состоящей или состоящей из аминокислотной последовательности SEQ ID NO:12.
В одном из вариантов осуществления антиген-связывающий полипептид по настоящему изобретению относится к полностью гуманизированному антителу против LIGHT, содержащему вариабельные области легкой цепи, описанные в настоящем документе, с полной легкой цепью (т.е. константными областями).
В другом варианте осуществления настоящее изобретение относится антиген-связывающему полипептиду, который специфично связывается с полипептидом LIGHT, содержащему, по существу состоящему или состоящему из гуманизированной вариабельной области легкой цепи, содержащей области CDR-L1, CDR-L2 и CDR-L3, описанные в таблице 5 ниже.
Аминокислотная последовательность CDR легкой цепи гуманизированных антител против LIGHT
X29 = K или R
X30 = A или S
X31 = Q или K
X32 = D, S или N
X33 = V, I или L
X34= G, S, V или L
X35 = T, N или H
X36 = A, N или S
X37 = V, L, N или G
X38 = A, H, G или Y
X29 = K или R
X30 = A или S
X31 = Q или K
X33 = V, I или L
X34= G, S, V или L
X35 = T, N или H
X36 = A, N или S
X37 = V, L, N или G
X38 = A, H, G или Y
X39 = N или T
X40 = T или Y
X41= Y или M
X42= F или H
X29 = K или R
X30 = A или S
X31 = Q или K
X32 = D, S или N
X33 = V, I или L
X34= G, S, V или L
X35 = T, N или H
X36 = A, N или S
X37 = V, L, N или G
X38 = A, H, G или Y
X39 = N или T
X43 = W, Y, K или I
X45 = S или Y
X46= T, Q или N
X47 = R, S или L
X48 = H, I, F или E
X49 = T или S
X50 = Q или S
X51 = Q или H
X52 = S или Y
X53 = S, N, T или R
X54= S, R, H или E
X55= Y, W, V или L
X56= L или Y
В другом варианте осуществления настоящее изобретение относится к антиген-связывающему полипептиду, который специфично связывается с полипептидом LIGHT, содержащему, по существу состоящему или состоящему из гуманизированной вариабельной области легкой цепи, содержащей область CDR-L1, CDR-L2 и CDR-L3. В определенных вариантах осуществления область CDR-L1 содержит, по существу состоит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:38; SEQ ID NO:39; SEQ ID NO:40; SEQ ID NO:43; SEQ ID NO:46; SEQ ID NO:49; SEQ ID NO:52; и SEQ ID NO:55. В определенных вариантах осуществления область CDR-L2 содержит, по существу состоит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:41; SEQ ID NO:44; SEQ ID NO:47; SEQ ID NO:50; и SEQ ID NO:53. В определенных вариантах осуществления область CDR-L3 содержит, по существу состоит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:42; SEQ ID NO:45; SEQ ID NO:48; SEQ ID NO:51; и SEQ ID NO:54.
В конкретных вариантах осуществления настоящее изобретение относится к антиген-связывающему полипептиду, который специфично связывается с полипептидом LIGHT, содержащему, по существу состоящему или состоящему из гуманизированной вариабельной области легкой цепи, содержащей область CDR-L1, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:43, область CDR-L2, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:44 и область CDR-L3, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:45.
Антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT, могут содержать, по существу состоять или состоять из гуманизированной вариабельной области легкой цепи, содержащей любую из областей CDR легкой цепи, описанных в настоящем документе.
В других вариантах осуществления изобретения антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT, содержат, по существу состоят или состоят из гуманизированной вариабельной области тяжелой цепи и гуманизированной вариабельной области легкой цепи, выбранной из группы, состоящей из:
i. SEQ ID NO:1 и SEQ ID NO:9;
ii. SEQ ID NO:2 и SEQ ID NO:10;
iii. SEQ ID NO:3 и SEQ ID NO:11;
iv. SEQ ID NO:4 и SEQ ID NO:12;
v. SEQ ID NO:5 и SEQ ID NO:13;
vi. SEQ ID NO:6 и SEQ ID NO:14;
vii. SEQ ID NO:7 и SEQ ID NO:15;
viii. SEQ ID NO:7 и SEQ ID NO:16;
ix. SEQ ID NO:8 и SEQ ID NO:17; и
x. их комбинаций.
В других вариантах осуществления изобретения антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT, включают, по существу состоят из или состоят из гуманизированной вариабельной области тяжелой цепи и гуманизированной вариабельной области легкой цепи, содержащей, по существу состоящей или состоящей из CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3, выбранной из группы, состоящей из:
i. SEQ ID NO:18, 19, 20 и SEQ ID NO:38, 41, 42;
ii. SEQ ID NO:18, 19, 21 и SEQ ID NO:39, 41, 42;
iii. SEQ ID NO:18, 19, 22 и SEQ ID NO:40, 41, 42;
iv. SEQ ID NO:23, 24, 25 и SEQ ID NO:43, 44, 45;
v. SEQ ID NO:26, 27, 28 и SEQ ID NO:46, 47, 48;
vi. SEQ ID NO:29, 30, 31 и SEQ ID NO:49, 50, 51;
vii. SEQ ID NO:32, 33, 34 и SEQ ID NO:52, 53, 54;
viii. SEQ ID NO:35, 36, 37 и SEQ ID NO:55, 50, 51; и
ix. их комбинаций.
Любые из полипептидов, описанных выше, кроме того, могут включать дополнительные полипептиды, например, сигнальный пептид для направления секреции кодируемого полипептида, константных областей антител, как описано в настоящем документе, или других гетерологичных полипептидов, как описано в настоящем документе.
Также специалисту в данной области понятно, что антиген-связывающие полипептиды, описанные в настоящем документе, можно модифицировать так, чтобы они отличались по аминокислотной последовательности от природного полипептида, из которого они происходят. Например, полипептид или аминокислотная последовательность, происходящие из указанного белка, могут быть сходными, например, могут иметь определенную процентную идентичность с исходной последовательностью, например, они могут быть на 60%, 70%, 75%, 80%, 85%, 90% или 95% идентичны исходной последовательности.
Более того, можно вносить нуклеотидные или аминокислотные замены, делеции или инсерции, приводящие к консервативным заменам или изменениям, в "не необходимые" аминокислотные области. Например, полипептид или аминокислотная последовательность, происходящие из указанного белка, могут быть идентичны исходной последовательности, за исключением одной или нескольких отдельных аминокислотных замен, инсерций или делеций, например, одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, пятнадцати, двадцати или более отдельных аминокислотных замен, инсерций или делеций. В определенных вариантах осуществления, полипептид или аминокислотная последовательность, происходящие из указанного белка, имеют от одной до пяти, от одной до десяти, от одной до пятнадцати, или от одной до двадцати отдельных аминокислотных замен, инсерций или делеций относительно исходной последовательности.
Определенные антиген-связывающие полипептиды по настоящему изобретению содержат, по существу состоят или состоят из аминокислотной последовательности, происходящей из аминокислотной последовательности человека. Однако определенные антиген-связывающие полипептиды могут содержать одну или несколько смежных аминокислот, происходящих из других видов млекопитающих. Например, антиген-связывающие полипептиды по настоящему изобретению могут включать часть тяжелой цепи приматов, часть шарнирной области или антиген-связывающую область. В определенных терапевтических применениях антиген-связывающие полипептиды или их антиген-связывающие фрагменты, варианты или аналоги сконструированы так, чтобы они не были иммуногенными у животного, которому вводят антитело.
В определенных вариантах осуществления антиген-связывающий полипептид содержит аминокислотную последовательность или одну или несколько частей, в норме не связанных с антителом. Характерные модификации более подробно описаны ниже. Например, одноцепочечный Fv-фрагмент антитела по изобретению может содержать подвижную линкерную последовательность, или он может быть модифицирован для добавления функциональной части (например, PEG, лекарственное средство, токсин или метка).
Антиген-связывающий полипептид по изобретению может содержать, по существу состоять или состоять из слитого белка. Слитые белки представляют собой химерные молекулы, которые содержат, например, антиген-связывающий домен иммуноглобулина по меньшей мере с одним связывающим мишень участком, и по меньшей мере одну гетерологичную часть, т.е. часть, с которой он не связан в природе. Аминокислотные последовательности в норме могут существовать в отдельных белках, которые объединяют в слитом полипептиде, или они в норме могут существовать в одном белке, но помещены в новом расположении в слитом полипептиде. Слитые белки можно создавать, например, химическим синтезом или путем создания и трансляции полинуклеотида, в котором пептидные области кодируются в желаемом взаимном расположении.
Термин "гетерологичный", применяемый к полинуклеотиду или полипептиду, означает, что полинуклеотид или полипептид происходит из структуры, отличающейся от остальной части структуры, с которой его сравнивают. Например, как используют в настоящем документе, "гетерологичный полипептид", подлежащий слиянию с антиген-связывающим полипептидом, его вариантом или аналогом, по настоящему изобретению, происходит из не являющегося иммуноглобулином полипептида того же вида, или полипептида, являющегося или не являющегося иммуноглобулином, отличающегося вида.
Антиген-связывающие полипептиды, их варианты или производные по изобретению, кроме того, могут быть слиты с гетерологичным полипептидом на N- или C-конце или химически конъюгированы (включая ковалентную и нековалентную конъюгацию) с полипептидами или другими композициями. Например, гуманизированные антиген-связывающие полипептиды против LIGHT, которые специфично связываются с полипептидом LIGHT, могут быть слиты или конъюгированы с молекулами, подходящими в качестве меток в детектирующих анализах, и эффекторными молекулами, такими как гетерологичные полипептиды, лекарственные средства, радионуклиды или токсины. См., например, публикации PCT WO 92/08495; WO 91/14438; WO 89/12624; патент США No. 5314995; и EP 396387, которые включены в настоящий документ в качестве ссылок в полном объеме.
Антиген-связывающие полипептиды, их варианты или производные по изобретению включают производные, которые модифицированы, т.е. путем ковалентного присоединения любого типа молекулы к антителу, так чтобы это ковалентное присоединение не препятствовало связыванию антиген-связывающего полипептида с полипептидом LIGHT. Например, но этим не ограничиваясь, антиген-связывающие полипептиды включают антитела, которые модифицированы, например, гликозилированием, ацетилированием, пегилированием, фосфорилированием, фосфорилированием, амидацией, преобразованием в производное известными защитными/блокирующими группами, протеолитическим расщеплением, связыванием с клеточным лигандом или другим белком и т.д. Любые из множества химических модификаций можно проводить известными способами, включая, но ими не ограничиваясь, специфичное химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и т.д. Кроме того, антиген-связывающие полипептиды могут содержать одну или несколько неклассических аминокислот.
Антиген-связывающие полипептиды, или их варианты или производные, по изобретению могут состоять из аминокислот, связанных друг с другом пептидными связями или модифицированными пептидными связями, т.е., пептидных изостер, и могут содержать аминокислоты, отличные от 20 кодируемых генами аминокислот. Антиген-связывающие полипептиды по настоящему изобретению могут быть модифицированы с помощью природных процессов, таких как посттрансляционный процессинг, или способами химической модификации, которые хорошо известны в данной области. Такие модификации хорошо описаны в основных руководствах и в более подробных монографиях, а также в многотомной научной литературе. Модификации могут происходить в любой части полипептида, включая пептидный остов, боковые цепи аминокислот и N- или C-концы, или в таких частях, как углеводы. Понятно, что один тип модификации может присутствовать в одинаковой или в различной степени в нескольких участках в данном антиген-связывающем полипептиде по изобретению. Также данный антиген-связывающий полипептид может содержать множество типов модификаций. Антиген-связывающие полипептиды могут быть разветвленными, например, в результате убиквитинилирования, и они могут быть циклическими с ветвлением или без него. Циклические, разветвленные и разветвленные циклические антиген-связывающие полипептиды могут быть результатом посттрансляционных природных процессов или их можно получать синтетическими способами. Модификации включают ацетилирование, ацилирование, ADP-рибозилирование, амидацию, ковалентное присоединение флавина, ковалентное присоединение группы гема, ковалентное присоединение нуклеотида или производного нуклеотида, ковалентное присоединение липида или производного липида, ковалентное присоединение фосфотидилинозитола, сшивание, циклизацию, образование дисульфидных связей, деметилирование, образование ковалентных сшивок, образование цистеина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, образование GPI-якоря, гидроксилирование, йодирование, метилирование, миристоилирование, окисление, пегилирование, протеолитический процессинг, фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфатацию, опосредуемое транспортной РНК добавление аминокислот к белкам, такое как аргинилирование и убиквитинилирование. (см., например, Proteins - Structure And Molecular Properties, T. E. Creighton, W. H. Freeman and Company, New York 2nd Ed., (1993); Posttranslational Covalent Modification Of Proteins, B. C. Johnson, Ed., Academic Press, New York, pgs. 1-12 (1983); Scifter et al., Meth Enzymol 182:626-646 (1990); Rattan et al., Ann NY Acad Sci 663:48-62 (1992)).
Также настоящее изобретение относится к слитым белкам, содержащим антиген-связывающий полипептид, его вариант или производное, и гетерологичный полипептид. Гетерологичный полипептид, с которым проводят слияние антитела, может подходить для функции или подходит для нацеливания в конкретную область организма в ходе лечения. В одном из вариантов осуществления слитый белок по изобретению содержит, по существу состоит или состоит из полипептида с аминокислотной последовательностью любой одной или нескольких из вариабельных областей тяжелой цепи антиген-связывающего полипептида по изобретению или аминокислотную последовательность любой одной или нескольких из вариабельных областей легкой цепи антиген-связывающего полипептида по изобретению или его вариантов, и последовательность гетерологичного полипептида. В другом варианте осуществления слитый белок, описанный в настоящем документе содержит, по существу состоит или состоит из полипептида, имеющего аминокислотную последовательность любой одной, двух, трех из CDR вариабельной области тяжелой цепи антиген-связывающего полипептида, его вариантов или производных, описанных в настоящем документе, или аминокислотную последовательность любой одной, двух, трех из CDR вариабельной области легкой цепи антиген-связывающего полипептида, его вариантов или производных, описанных в настоящем документе, и последовательность гетерологичного полипептида.
В одном из вариантов осуществления слитый белок содержит полипептид с аминокислотной последовательностью CDR вариабельной области тяжелой цепи антиген-связывающего полипептида по настоящему изобретению или его производного или варианта, и последовательность гетерологичного полипептида, причем слитый белок специфично связывается с полипептидом LIGHT. В другом варианте осуществления, слитый белок содержит полипептид с аминокислотной последовательностью по меньшей мере одной вариабельной области тяжелой цепи антиген-связывающего полипептида по изобретению и аминокислотную последовательность по меньшей мере одной вариабельной области легкой цепи антиген-связывающего полипептида по изобретению или его производных или вариантов, и последовательность гетерологичного полипептида. Предпочтительно, вариабельные области тяжелой цепи и вариабельные области легкой цепи слитого белка соответствуют антителу из одного источника (или scFv- или Fab-фрагменту), которое специфично связывает LIGHT. В другом варианте осуществления слитый белок, описанный в настоящем документе, содержит полипептид, имеющий аминокислотную последовательность любой одной, двух, трех или более из CDR вариабельной области тяжелой цепи антиген-связывающего полипептида и аминокислотную последовательность любой одной, двух, трех или более из CDR вариабельной области легкой цепи антиген-связывающего полипептида, или его вариантов или производных, и последовательность гетерологичного полипептида. Предпочтительно, две, три, четыре, пять, шесть или более из CDR вариабельной области тяжелой цепи или CDR вариабельной области легкой цепи соответствуют антителу из одного источника (или scFv- или Fab-фрагменту) по изобретению. Также настоящее изобретение охватывает молекулы нуклеиновых кислот, кодирующие эти слитые белки.
Характерные слитые белки, описанные в литературе, включают слитые белки T-клеточного рецептора (Gascoigne et al., Proc. Natl. Acad. Sci. USA 54:2936-2940 (1987)); CD4 (Capon et al., Nature 337:525-531 (1989); Traunecker et al., Nature 339:68-70 (1989); Zettmeissl et al., DNA Cell Biol. USA 9:347-353 (1990); и Byrn et al., Nature 344:667-670 (1990)); L-селектина (рецептор хоминга) (Watson et al., J. Cell. Biol. 110:2221-2229 (1990); и Watson et al., Nature 349:164-167 (1991)); CD44 (Aruffo et al., Cell (57:1303-1313 (1990)); CD28 и B7 (Linsley et al., J. Exp. Med. 773:721-730 (1991)); CTLA-4 (Lisley et al., J. Exp. Med. 174:561-569 (1991)); CD22 (Stamenkovic et al., Cell 66: 1133-1144 (1991)); рецептор TNF (Ashkenazi et al., Proc. Natl. Acad. Sa USA 55:10535-10539 (1991); Lesslauer et al., Eur. J. Immunol. 27:2883-2886 (1991); и Peppel et al., J. Exp. Med. 774: 1483-1489 (1991)); и рецептора IgE (Ridgway and Gorman, J. Cell. Biol. Vol. 115, Abstract No. 1448 (1991)).
Слитые белки можно получать с использованием способов, которые хорошо известны в данной области (см., например, патенты США No. 5116964 и 5225538). Точный участок, по которому проводят слияние, можно выбирать эмпирически для оптимизации секреции или связывающих характеристик слитого белка. Затем ДНК, кодирующую слитый белок, трансфицируют в клетку-хозяина для экспрессии.
В определенных вариантах осуществления антиген-связывающий полипептид по настоящему изобретению представляет собой молекулу одноцепочечного Fv (scFv). Конкретно, определенные молекулы scFv по настоящему изобретению включают, по существу состоят из или состоят из полипептида с формулой, выбранной из группы, состоящей из: NH2-L-VH-X-VK-COOH и NH2-L-VK-X-VH-COOH; где L представляет собой лидерную последовательность; VH представляет собой вариабельную область тяжелой цепи гуманизированного антитела; X представляет собой линкерный полипептид; и VK представляет собой вариабельную область легкой цепи гуманизированного антитела.
В других вариантах осуществления антиген-связывающий полипептид по настоящему изобретению представляет собой молекулу одноцепочечного Fv (scFv), слитую с сывороточным альбумином человека (HSA) с получением слитой молекулы scFV-HSA, которая специфично связывается с полипептидом LIGHT. В конкретных вариантах осуществления scFV в слитой молекуле scFv-HSA слит или связан с N-концом HSA. В других вариантах осуществления, scFv слит или связан с C-концом HSA в слитой молекуле scFv-HSA. В других вариантах осуществления слитая молекула scFv-HSA имеет формулу, выбранную из группы, состоящей из: NH2-L-VH-X-VK-HSA-COOH; NH2-L-VK-X-VH-HSA-COOH, NH2-HSA-VH-X-VK-COOH и NH2-HSA-VK-X-VH-COOH, где L представляет собой лидерную последовательность; VH представляет собой вариабельную область тяжелой цепи гуманизированного антитела; X представляет собой линкерный полипептид; HSA представляет собой сывороточный альбумин человека; и VK представляет собой вариабельную область легкой цепи гуманизированного антитела.
В определенных вариантах осуществления антиген-связывающий полипептид по настоящему изобретению представляет собой Fab-фрагмент. В других вариантах осуществления антиген-связывающий полипептид по настоящему изобретению представляет собой Fab-фрагмент, слитый или связанный с сывороточным альбумином человека (HSA), с образованием слитой молекулы Fab-HSA, которая специфично связывается с полипептидом LIGHT. В конкретных вариантах осуществления часть тяжелой цепи Fab-фрагмента слита или связана с N- или C-концом HSA в слитой молекуле Fab-HSA. В других вариантах осуществления часть легкой цепи Fab-фрагмента слита или связана с N- или C-концом HSA в слитой молекуле Fab-HSA. В других вариантах осуществления слитая молекула Fab-HSA имеет формулу, выбранную из группы, состоящей из: NH2-VH-CH1-HSA-COOH; NH2-HSA-VH-CH1-COOH, NH2-VK-CK-HSA-COOH и NH2-HSA-VK-CK-COOH, где VH представляет собой вариабельную область тяжелой цепи гуманизированного антитела; HSA представляет собой сывороточный альбумин человека; VK представляет собой вариабельную область легкой цепи гуманизированного антитела; CH1 представляет собой константный домен тяжелой цепи 1; и CK представляет собой константный домен легкой цепи. Часть тяжелой или легкой цепи Fab-фрагмента или слитой молекулы Fab-HSA сворачивается с родственным ей партнером (например, гуманизированной вариабельной областью тяжелой цепи или гуманизированной вариабельной областью легкой цепи антиген-связывающих полипептидов, описанных в настоящем документе) с образованием полной слитой молекулы Fab-HSA или HSA-Fab.
В других вариантах осуществления антиген-связывающие полипептиды по настоящему изобретению могут содержать консервативные аминокислотные замены.
"Консервативная аминокислотная замена" представляет собой замену, в которой аминокислотный остаток заменен аминокислотным остатком со сходной боковой цепью. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, несущественный аминокислотный остаток в полипептиде иммуноглобулина, предпочтительно, заменяют другим аминокислотным остатком из того же семейства боковых цепей. В другом варианте осуществления участок аминокислоты может быть заменен структурно сходным участком, который отличается порядком и/или составом представителей семейства боковых цепей.
Конъюгация с терапевтическим или диагностическим средством
В частности, антиген-связывающие полипептиды, их варианты или производные, по изобретению можно конъюгировать с лекарственными средствами, пролекарствами, пептидами, белками, ферментами, вирусами, липидами, модификаторами биологического ответа, фармацевтическими средствами или PEG.
Антиген-связывающие полипептиды, описанные в настоящем документе, можно конъюгировать или подвергать слиянию с лекарственным средством, которое может включать радиоактивные метки, иммуномодулятор, гормон, фермент, олигонуклеотид, фотоактивное терапевтическое или диагностическое средство, цитотоксическое средство, которое может представлять собой лекарственное средство или токсин, усиливающее действие ультразвука средство, нерадиоактивную метку, их комбинацию и другие такие средства, известные в данной области.
Лекарственные средства могут включать лекарственные средства, которые обладают фармацевтическим свойством, выбранным из группы, состоящей из антимитотических, антикиназных, алкилирующих, антиметаболических, антибиотических, алкалоидных, антиангиогенных, апоптотических средств и их комбинаций. Более конкретно, эти лекарственные средства выбраны из группы, состоящей из азотистых ипритов, производных этиленимина, алкилсульфонатов, нитрозомочевины, триазенов, аналогов фолиевой кислоты, ингибиторов COX-2, аналогов пиримидина, аналогов пурина, антибиотиков, ферментов, эпиподофиллотоксинов, координационных комплексов платины, алкалоидов барвинка, замещенных соединений мочевины, производных метилгидразина, адренокортикальных супрессоров, антагонистов, эндостатина, таксолов, камптотецинов, антрациклинов, таксанов и их аналогов, и их комбинации. Токсины, охватываемые настоящим изобретением, могут быть выбранны из группы, состоящей из рицина, абрина, альфа-токсина, сапорина, рибонуклеазы (РНКазы), например, онконазы, ДНКазы I, стафилококкового энтеротоксина-A, противовирусного белка лаконоса, гелонина, дифтерийного токсина, экзотоксина Pseudomonas и эндотоксина Pseudomonas.
Иммуномодуляторы могут быть выбраны из группы, состоящей из цитокина, фактора роста стволовых клеток, лимфотоксина, гемопоэтического фактора, колониестимулирующего фактора (CSF), интерферона (IFN), эритропоэтина, тромбопоэтина и их комбинации. Особенно подходящими являются лимфотоксины, такие как фактор некроза опухоли (TNF), гемопоэтические факторы, такие как интерлейкин (IL), колониестимулирующий фактор, такой как гранулоцитарный колониестимулирующий фактор (G-CSF) или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF)), интерферон, такой как интерфероны-альфа, -бета или -гамма, и фактор роста стволовых клеток, такой как фактор, обозначаемый как "S1-фактор". Более конкретно, иммуномодуляторы могут включать IL-1, IL-2, IL-3, IL-6, IL-10, IL-12, IL-18, IL-21, интерферон-гамма, TNF-альфа или их комбинацию.
В определенных вариантах осуществления антиген-связывающие полипептиды, описанные в настоящем документе, кроме того, могут включать нацеливающую часть. Нацеливающие части включают белок или пептид, который обеспечивает локализацию в определенной части организма, например, в конкретных областях воспаления.
Как рассмотрено в настоящем документе, антиген-связывающие полипептиды или их варианты или производные по изобретению можно подвергать слиянию с гетерологичными полипептидами для увеличения времени полужизни полипептидов in vivo или для применения в иммуноанализах с использованием способов, известных в данной области. Например, в одном из вариантов осуществления PEG можно конъюгировать с антителами против LIGHT по изобретению для увеличения их времени полужизни in vivo. Leong, S.R., et al., Cytokine 16 106 (2001), Adv. in Drug Deliv. Rev. 54 531 (2002), или Weir et al., Biochem. Soc. Transactions 30 512 (2002).
Более того, антиген-связывающие полипептиды, их варианты или производные по изобретению можно подвергать слиянию с маркерными последовательностями, такими как пептид, для упрощения их очистки или детекции. В предпочтительных вариантах осуществления маркерная аминокислотная последовательность представляет собой гексагистидиновый пептид, такой как маркер, предоставленный в векторе pQE (QIAGEN, Inc., 9259 Eton Avenue, Chatsworth, Calif., 91311), помимо прочих, многие из которых коммерчески доступны. Как описано в Gentz et al., Proc. Natl. Acad. Sci. USA 55:821-824 (1989), например, гексагистидин обеспечивает удобную очистку слитого белка. Другие пептидные метки, подходящие для очистки, включают, но ими не ограничиваются, "HA"-метку, которая соответствует эпитопу, происходящему из белка гемагглютинина вируса гриппа (Wilson et al., Cell 37:161 (1984)), и "flag"-метку (Brizzard et al., Biotechniques 16(4) 730-735 (1994)).
Специалистам в данной области понятно, что конъюгаты также можно формировать с использованием различных способов, в зависимости от выбранного агента, подлежащего конъюгации. Например, конъюгаты с биотином получают, например, путем реакции связывающего полипептида с активированным сложным эфиром биотина, таким как N-гидроксисукцинимидный эфир биотина. Аналогично, конъюгаты с флуоресцентным маркером можно получать в присутствии присоединяющего агента, например, агентов, перечисленных в настоящем документе, или посредством реакции с изотиоцианатом, предпочтительно, флуоресцеин-изотиоцианатом. Конъюгаты антиген-связывающих полипетидов, их фрагментов, вариантов или производных по изобретению получают аналогичным образом.
Кроме того, настоящее изобретение относится к антиген-связывающим полипептидам, их вариантам или производным, по изобретению, конъюгированным с диагностическим или лекарственным средством. Конъюгированные полипептиды можно использовать в диагностических целях, например, для мониторинга развития или прогрессирования заболевания в качестве части процедуры клинического исследования, например, для определения эффективности данного режима лечения и/или профилактики. Детекцию можно облегчать путем связывания антиген-связывающего полипептида, его фрагмента, варианта или производного, с поддающимся детекции веществом. Примеры поддающихся детекции веществ включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы, радиоактивные материалы, позитронно-активные металлы при использовании различных способов позитронно-эмиссионной томографии, и нерадиоактивных ионов парамагнитных металлов. См., например, патент США No. 4741900 для ионов металлов, которые можно конъюгировать с антителами для использования в качестве диагностических средств в соответствии с настоящим изобретением. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеина изотиоцианат, родамин, дихлортриазиниламинфлуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного материала включает люминол; примеры биолюминесцентных материалов включают люциферазу, люциферин и экворин; и примеры подходящего радиоактивного материала включают 125I, 131I, 111In или 99Tc.
Антиген-связывающий полипептид, его вариант или производное также можно метить детектируемой меткой путем присоединения его к хемилюминесцентному соединению. Затем присутствие меченого хемилюминесцентным соединением антиген-связывающего полипептида определяют путем детекции наличия люминесценции, которая появляется в ходе химической реакции. Примерами особенно подходящих хемилюминесцентных соединений для мечения являются люминол, изолюминол, тероматический сложный эфир акридиния, имидазол, соль акридиния и сложный эфир щавелевой кислоты.
Антиген-связывающий полипептид, его вариант или производное, также можно метить детектируемой меткой с использованием испускающих флуоресценцию металлов, таких как 152Eu или другие металлы серии лантаноидов. Эти металлы можно присоединять к антителу с использованием таких хелатирующих металлы групп, как диэтилентриаминпентаксусная кислота (DTPA) или этилендиаминтетрауксусная кислота (EDTA). Способы конъюгации различных частей с антителом хорошо известны, см., например, Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. (1985); Hellstrom et al., "Antibodies For Drug Delivery", Controlled Drug Delivery (2nd Ed.), Robinson et al., (eds.), Marcel Dekker, Inc., pp. 623-53 (1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al. (eds.), pp. 475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds,), Academic Press pp. 303-16 (1985), и Thorpe et al., "The Preparation And Cytotoxic Properties Of Antibody-Toxin Conjugates", Immunol. Rev. (52:119-58 (1982)).
Антиген-связывающие полипептиды, описанные в настоящем документе, также можно конъюгировать или подвергать слиянию с другими диагностическими средствами, включая, но ими не ограничиваясь, фотоактивные диагностические средства или радиоактивные метки, имеющие энергию от 60 до 4000 кэВ, или нерадиоактивные метки. Радиоактивная метка, предпочтительно, представляет собой гамма-, бета- или позитрон-испускающий изотоп и ее выбирают из группы, состоящей из 125I, 131I, 123I, 124I, 86Y, 186Re, 188Re, 62Cu, 64Cu, 111In, 67Ga, 68Ga, 99mTc, 94mTc, 18F, 11C, 13N, 15O, 76Br и их комбинации. Диагностические средства также могут включать контрастные средства, например, такие как марганец, железо или гадолиний.
Полинуклеотиды, кодирующие антиген-связывающие полипептиды
Также настоящее изобретение относится к выделенным полинуклеотидам или молекулам нуклеиновых кислот, кодирующим антиген-связывающие полипептиды, их варианты или производные, по изобретению.
В одном из вариантов осуществления полинуклеотиды по настоящему изобретению кодируют антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT и содержат, по существу состоят или состоят из гуманизированной вариабельной области тяжелой цепи, содержащей, по существу состоящей или состоящей из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:1; SEQ ID NO:2; SEQ ID NO:3; SEQ ID NO:4; SEQ ID NO:5; SEQ ID NO:6; SEQ ID NO:7 и SEQ ID NO:8. Конкретно, определенные полинуклеотиды по настоящему изобретению кодируют антиген-связывающий полипептид, который специфично связывает полипептид LIGHT и содержит, по существу состоит или состоит из гуманизированной вариабельной области тяжелой цепи, содержащей, по существу состоящей или состоящей из аминокислотной последовательности SEQ ID NO:4.
В другом варианте осуществления полинуклеотид по настоящему изобретению кодирует полностью гуманизированное антитело против LIGHT, содержащее вариабельные области тяжелой цепи, описанные в настоящем документе, с полной тяжелой цепью (т.е. константными областями).
В другом варианте осуществления настоящее изобретение относится к полинуклеотиду, кодирующему антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий, по существу состоящий или состоящий из гуманизированной вариабельной области тяжелой цепи, содержащей область CDR-H1, CDR-H2 и CDR-H3. В определенных вариантах осуществления полинуклеотид кодирует область CDR-H1, содержащую, по существу состоящую или состоящую из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:18; SEQ ID NO:23; SEQ ID NO:26; SEQ ID NO:29; SEQ ID NO:32 и SEQ ID NO:35. В определенных вариантах осуществления полинуклеотид кодирует область CDR-H2, содержащую, по существу состоящую или состоящую из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:19; SEQ ID NO:24; SEQ ID NO:27; SEQ ID NO:30; SEQ ID NO:33 и SEQ ID NO:36. В определенных вариантах осуществления полинуклеотид кодирует область CDR-H3, содержащую, по существу состоящую или состоящую из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:20; SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:25; SEQ ID NO:28; SEQ ID NO:31; SEQ ID NO:34 и SEQ ID NO:37.
В конкретных вариантах осуществления настоящее изобретение включает полинуклеотид, кодирующий антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий, по существу состоящий или состоящий из гуманизированной вариабельной области тяжелой цепи, содержащей область CDR-H1, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:23, область CDR-H2, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:24, и область CDR-H3, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:25.
Также настоящее изобретение включает полинуклеотид, который кодирует антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, и содержит, по существу состоит или состоит из гуманизированной вариабельной области легкой цепи, содержащей, по существу состоящей или состоящей из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:9; SEQ ID NO:10; SEQ ID NO:11; SEQ ID NO:12; SEQ ID NO:13; SEQ ID NO:14; SEQ ID NO:15; SEQ ID NO:16 и SEQ ID NO:17. В частности, определенные полинуклеотиды по настоящему изобретению кодируют антиген-связывающий полипептид, который специфично связывает полипептид LIGHT и содержит, по существу состоит или состоит из гуманизированной вариабельной области легкой цепи, содержащей, по существу состоящей или состоящей из аминокислотной последовательности SEQ ID NO:12.
В другом варианте осуществления полинуклеотид по настоящему изобретению кодирует полностью гуманизированное антитело против LIGHT, содержащее вариабельные области легкой цепи, описанные в настоящем документе, с полной легкой цепью (т.е. константными областями).
В другом варианте осуществления настоящее изобретение относится к полинуклеотиду, кодирующему антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий, по существу состоящий или состоящий из гуманизированной вариабельной области легкой цепи, содержащей область CDR-L1, CDR-L2 и CDR-L3. В определенных вариантах осуществления полинуклеотид кодирует область CDR-L1, содержащую, по существу состоящую или состоящую из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:38; SEQ ID NO:39; SEQ ID NO:40; SEQ ID NO:43; SEQ ID NO:46; SEQ ID NO:49; SEQ ID NO:52 и SEQ ID NO:55. В определенных вариантах осуществления область CDR-L2 содержит, по существу состоит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:41; SEQ ID NO:44; SEQ ID NO:47; SEQ ID NO:50 и SEQ ID NO:53. В определенных вариантах осуществления область CDR-L3 содержит, по существу состоит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO:42; SEQ ID NO:45; SEQ ID NO:48; SEQ ID NO:51 и SEQ ID NO:54.
В конкретных вариантах осуществления настоящее изобретение включает полинуклеотид, кодирующий антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий, по существу состоящий или состоящий из гуманизированной вариабельной области легкой цепи, содержащей область CDR-L1, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:43, область CDR-L2, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:44, и область CDR-L3, содержащую, по существу состоящую или состоящую из аминокислотной последовательности SEQ ID NO:45.
В других вариантах осуществления изобретения полинуклеотиды по изобретению кодируют антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT, содержащие, по существу состоящие или состоящие из гуманизированной вариабельной области тяжелой цепи и гуманизированной вариабельной области легкой цепи, выбранной из группы, состоящей из:
i. SEQ ID NO:1 и SEQ ID NO:9;
ii. SEQ ID NO:2 и SEQ ID NO:10;
iii. SEQ ID NO:3 и SEQ ID NO:11;
iv. SEQ ID NO:4 и SEQ ID NO:12;
v. SEQ ID NO:5 и SEQ ID NO:13;
vi. SEQ ID NO:6 и SEQ ID NO:14;
vii. SEQ ID NO:7 и SEQ ID NO:15;
viii. SEQ ID NO:7 и SEQ ID NO:16
ix. SEQ ID NO:8 и SEQ ID NO:17; и
x. их комбинаций.
Другие варианты осуществления изобретения включают полинуклеотиды, кодирующие антиген-связывающие полипептиды, которые специфично связываются с полипептидом LIGHT, содержащие, по существу состоящие или состоящие из гуманизированной вариабельной области тяжелой цепи и гуманизированной вариабельной области легкой цепи, содержащей, по существу состоящей или состоящей из CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3, выбранных из группы, состоящей из:
i. SEQ ID NO:18, 19, 20 и SEQ ID NO:38, 41, 42;
ii. SEQ ID NO:18, 19, 21 и SEQ ID NO:39, 41, 42;
iii. SEQ ID NO:18, 19, 22 и SEQ ID NO:40, 41, 42;
iv. SEQ ID NO:23, 24, 25 и SEQ ID NO:43, 44, 45;
v. SEQ ID NO:26, 27, 28 и SEQ ID NO:46, 47, 48;
vi. SEQ ID NO:29, 30, 31 и SEQ ID NO:49, 50, 51;
vii. SEQ ID NO:32, 33, 34 и SEQ ID NO:52, 53, 54;
viii. SEQ ID NO:35, 36, 37 и SEQ ID NO:55, 50, 51; и
ix. их комбинаций.
Полинуклеотиды по настоящему изобретению могут кодировать полноразмерные вариабельные области тяжелой и легкой цепей антиген-связывающих полипептидов, их вариантов или производных на одной полинуклеотидной молекуле или на отдельных полинуклеотидных молекулах. Кроме того, полинуклеотиды по настоящему изобретению могут кодировать участки вариабельных областей тяжелой и легкой цепей антиген-связывающих полипептидов, их вариантов или производных на одной полинуклеотидной молекуле или на отдельных полинуклеотидных молекулах.
Способ получения антиген-связывающих полипептидов
Способы получения антител или антиген-связывающих полипептидов хорошо известны в данной области и описаны в настоящем документе. В определенных вариантах осуществления, как вариабельные, так и константные области антиген-связывающих полипептидов по настоящему изобретению, являются полностью человеческими. Полностью человеческие антитела можно получать с использованием способов, описанных в данной области и как описано в настоящем документе. Например, полностью человеческие антитела против определенного антигена можно получать введением антигена трансгенному животному, которое модифицировано для продукции таких антител в ответ на антигенную нагрузку, но у которого эндогенные локусы заблокированы. Характерные способы, которые можно использовать для получения таких антител, описаны в патентах США: 6150584; 6458592; 6420140, которые включены в качестве ссылок в полном объеме.
В определенных вариантах осуществления антиген-связывающие полипептиды, их варианты или производные, по изобретению не индуцируют вредоносный иммунный ответ у животного, подлежащего лечению, например, у человека. В одном из вариантов осуществления антиген-связывающие полипептиды, их варианты или производные по изобретению модифицированы для снижения их иммуногенности с использованием известных в данной области способов. Например, можно получать гуманизированные, приматизированные, деимунизированные или химерные антитела. Эти типы антител происходят из не являющегося человеческим антитела, как правило, антитела мыши или примата, которое сохраняет или по существу сохраняет антиген-связывающие свойства исходного антитела, но которое является менее иммуногенным у человека. Этого можно достигать различными способами, включая (a) пересадку полных не являющихся человеческими вариабельных доменов в константные области человека с получением химерных антител; (b) пересадку по меньшей мере части одной или нескольких не являющихся человеческими определяющих комплементарность областей (CDR) человека в каркасную область и константные области человека с сохранением критических остатков каркасной области или без их сохранения; или (c) трансплантацию полных не являющихся человеческими вариабельных доменов, но "маскируя" их подобным человеческому сегментом путем замены поверхностных остатков. Такие способы описаны в Morrison et al., Proc. Natl. Acad. Sci. USA 57:6851-6855 (1984); Morrison et al., Adv. Immunol. 44:65-92 (1988); Verhoeyen et al., Science 239:1534-1536 (1988); Padlan, Molec Immun. 25:489-498 (1991); Padlan, Molec. Immun. 31: 169-217 (1994), и патенты США No: 5585089, 5693761, 5693762 и 6190370, все из которых включены в настоящий документ в качестве ссылок в полном объеме.
Также для снижения иммуногенности антитела можно использовать деиммунизацию. Как используют в настоящем документе, термин "деиммунизация" включает изменение антитела для модификации T-клеточных эпитопов (см., например, международные публикации заявок No.: WO/9852976 A1 и WO/0034317 A2). Например, последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи из исходного антитела анализируют и создают и "карту" эпитопов T-клеток человека из каждой V-области, демонстрирующей расположение эпитопов относительно определяющих комплементарность областей (CDR) и других ключевых остатков в последовательности. Индивидуальные T-клеточные эпитопы из карты T-клеточных эпитопов анализируют для идентификации альтернативных аминокислотных замен с низким риском изменения активности конечного антитела. Конструируют ряд альтернативных последовательностей вариабельной области тяжелой цепи и вариабельной области легкой цепи, содержащих комбинации аминокислотных замен и эти последовательности затем включают в ряд связывающих полипептидов. Как правило, получают от 12 до 24 вариантов антител и тестируют их в отношении связывания и/или функции. Затем полные гены тяжелой и легкой цепей, содержащих модифицированные вариабельные области и константные области человека, клонируют в векторы экспрессии, а затем плазмиды вводят в клеточные линии для продукции целого антитела. Затем антитела сравнивают в подходящих биохимических и биологических анализах и идентифицируют оптимальный вариант.
Моноклональные антитела можно получать с использованием широкого множества способов, известных в данной области, включая применение технологий гибридом, рекомбинантных технологий и технологий фагового дисплея или их комбинацию. Например, моноклональные антитела можно получать с использованием способов гибридом, включая способы, известные в данной области и описанные, например, в Harlow et al., Antibodies: A Laboratory Manual Cold Spring Harbor Laboratory Press, 2nd ed. (1988); Hammerling et al., Monoclonal Antibodies and T-Cell Hybridomas, Elsevier, N. Y., 563-681 (1981) (указанные ссылки включены в качестве ссылок в полном объеме). Термин "моноклональное антитело", как используют в настоящем документе, не ограничивается антителами, продуцируемыми технологией гибридом. Термин "моноклональные антитело" относится к антителу, которое происходит из одного клона, включая любой эукариотический, прокариотический или фаговый клон, а не к способу, которым его получают. Таким образом, термин "моноклональное антитело" не ограничивается антителами, продуцируемыми технологией гибридом. Моноклональные антитела можно получать с использованием широкого множества способов, известных в данной области, включая применение технологии гибридом и рекомбинантной технологии и технологии фагового дисплея.
Специфичность связывания антиген-связывающих полипептидов по настоящему изобретению можно определять в анализах in vitro, таких как иммунопреципитация, радиоиммунный анализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
Альтернативно для продукции антител по настоящему изобретению можно адаптировать способы, описанные для продукции одноцепочечных антител (патент США No. 4694778; Bird, Science 242:423-442 (1988); Huston et al., Proc. Natl. Acad. Sci. USA 55:5879-5883 (1988); и Ward et al., Nature 334:544-554 (1989)). Одноцепочечные антитела образуются связыванием фрагментов тяжелой и легкой цепей Fv-области через аминокислотный мостик, что приводит к одноцепочечному антителу. Также можно использовать способы сборки функциональных Fv-фрагментов в E. coli (Skerra et al., Science 242: 1038-1041 (1988)).
Фрагменты антител, например, Fab- и F(ab')2-фрагменты, можно получать известными способами, включающими протеолитическое расщепление молекул иммуноглобулинов с использованием ферментов, таких как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab')2-фрагментов). F(ab')2-фрагменты содержат вариабельную область, константную область легкой цепи и CH1-домен тяжелой цепи.
Примеры способов, которые можно использовать для продукции одноцепочечных Fv (scFv) и антител, включают способы, описанные в патентах США No. 4946778 и 5258498; Huston et al., Methods in Enzymology 203: 46-88 (1991); Shu et al., Proc. Natl. Sci. USA 90: 1995-1999 (1993); и Skerra et al., Science 240: 1038-1040 (1988). Для некоторых применений, включая применение антител у человека in vivo и в детектирующих анализах in vitro, может быть предпочтительным применение химерных, гуманизированных антител или антител человека. Химерное антитело представляет собой молекулу, в которой различные части антитела происходят из различных видов животных, такую как антитела, имеющие вариабельную область, происходящую из моноклонального антитела мыши и константной области иммуноглобулина человека. Способы получения химерных антител известны в данной области. См., например, Morrison, Science 229:1202 (1985); Oi et al., BioTechniques 4:214 (1986); Gillies et al., J. Immunol. Methods 125:191-202 (1989); патенты США No. 5807715; 4816567; и 4816397, которые включены в настоящий документ в качестве ссылок в полном объеме.
Гуманизированные антитела представляют собой молекулы антител, происходящие из антитела не человека, которые связывают желаемый антиген, имеющие одну или несколько определяющих комплементарность областей (CDR) из не являющихся человеком видов и каркасные области из молекулы иммуноглобулина человека. Часто, каркасные остатки в каркасных областях человека заменяют соответствующим остатком из антитела-донора CDR для изменения, предпочтительно, улучшения, связывания антигена. Эти замены каркасной области идентифицируют способами, хорошо известными в данной области, например, посредством моделирования взаимодействий остатков CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена, и сравнения последовательностей для идентификации необычных каркасных остатков в конкретных положениях. (См., например, Queen et al., патент США No. 5585089; Riechmann et al., Nature 332:323 (1988), которые включены в настоящий документ в качестве ссылок в полном объеме). Антитела можно гуманизировать с использованием различных способов, известных в данной области, включающих, например, пересадку CDR (EP 239400; публикация PCT WO 91/09967; патенты США No. 5225539; 5530101 и 5585089), гиперхимеризацию и изменение поверхности (EP 592106; EP 519596; Padlan, Molecular Immunology 28(4/5):489-498 (1991); Studnicka et al., Protein Engineering 7(6):805-814 (1994); Roguska. et al., Proc. Natl. Sci. USA 91 :969-973 (1994)), и перетасовку цепей (патент США No. 5565332, который включен в качестве ссылки в полном объеме).
Полностью человеческие антитела являются особенно желательными для терапевтического лечения пациентов-людей. Антитела человека можно получать различными способами, известными в данной области, включая способы фагового дисплея с использованием библиотек антител, происходящих из последовательностей иммуноглобулинов человека. Также см. патенты США No. 4444887 и 4716111; и публикации PCT WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741; все из которых включены в настоящий документ в качестве ссылок в полном объеме.
Антитела человека также можно получать с использованием трансгенных мышей, которые неспособны экспрессировать функциональные эндогенные иммуноглобулины, но которые могут экспрессировать гены иммуноглобулинов человека. Например, комплексы генов иммуноглобулинов тяжелой и легкой цепей человека можно встраивать случайным образом или посредством гомологичной рекомбинации в эмбриональные стволовые клетки мыши. Альтернативно, в дополнение к генам тяжелой цепи и легкой цепи человека в эмбриональные стволовые клетки мыши можно вводить вариабельную область, константную область человека и обеспечивающую разнообразие область. Гены тяжелой и легкой цепей иммуноглобулинов мыши можно делать нефункциональными отдельно или одновременно с внесением локусов иммуноглобулинов человека посредством гомологичной рекомбинации. В частности, гомозиготная делеция области JH препятствует эндогенной продукции антитела. Модифицированные эмбриональные стволовые клетки размножают и проводят их микроинъекцию в бластоцисты с получением химерных мышей. Затем химерных мышей скрещивают с получением гомозиготного потомства, которое экспрессирует антитела человека. Трансгенных мышей иммунизируют обычным образом выбранным антигеном, например, всем желаемым полипептидо-мишенью или его частью. Моноклональные антитела, направленные против антигена, можно получать из иммунизированных трансгенных мышей с использованием общепринятой технологии гибридом. Трансгены иммуноглобулинов человека, которыми обладают трансгенные мыши, подвергаются реаранжировке в ходе дифференцировки B-клеток, а затем подвергаются переключению классов и соматической мутации. Таким образом, с использованием такой технологии можно получать терапевтически полезные антитела IgG, IgA, IgM и IgE. Для обзора этой технологии продукции антител человека см. Lonberg and Huszar Int. Rev. Immunol. 73:65-93 (1995). Для подробного обсуждения этой технологии продукции антител человека и моноклональных антител и протоколов продукции таких антител см., например, публикации PCT WO 98/24893; WO 96/34096; WO 96/33735; Патент США Nos. 5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318 и 5939598, которые включены в настоящий документ в качестве ссылок в полном объеме. Кроме того, в компаниях, таких как Abgenix, Inc. (Freemont, Calif.) и GenPharm (San Jose, Calif.) можно заказать антитела человека, направленные против выбранного антигена, полученные с использованием технологии, сходной с технологией, описанной выше.
Получение человеческих или по существу человеческих антиген-связывающих полипептидов по настоящему изобретению также можно осуществлять в трансгенных животных (например, мышах), которые неспособны к продукции эндогенных иммуноглобулинов (см. например, патенты США No. 6075181, 5939598, 5591669 и 5589369 все из которых включены в настоящий документ в качестве ссылок). Например, описано, что гомозиготная делеция области присоединения тяжелой цепи антитела у химерных мутантных мышей и мутантных мышей зародышевой линии приводит к полному ингибированию эндогенной продукции антител. Перенос набора генов иммуноглобулинов человека таким мутантным мышам зародышевой линии приводит к продукции антител человека при нагрузке антигеном. Другой предпочтительный способ получения антител человека с использованием мышей SCID описан в патенте США No. 5811524, который включен в настоящий документ в качестве ссылки. Понятно, что генетический материал, связанный с этими антителами человека, также можно выделять и подвергать манипулированию, как описано в настоящем документе.
Полностью человеческие антитела, которые распознают выбранный эпитоп, также можно получать с использованием способа, называемого "направленной селекцией". В этом подходе выбранное не являющееся человеческим моноклональное антитело, например, антитело мыши, используют для направления селекции полностью человеческого антитела, распознающего тот же эпитоп. (Jespers et al., Bio/Technology 72:899-903 (1988). См. также патент США No. 5565332, который включен в качестве ссылки в полном объеме).
В другом варианте осуществления ДНК, кодирующую желаемые моноклональные антитела, можно легко выделять и секвенировать с использованием общепринятых способов (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелую и легкую цепи антител мыши). Выделенные и субклонированные гибридомные клетки служат в качестве предпочтительного источника такой ДНК. После выделения ДНК можно помещать в векторы экспрессии, которые затем переносят в прокариотические или эукариотические клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомяка (CHO) или клетки миеломы, которые в ином случае не продуцируют иммуноглобулины. Более конкретно, выделенную ДНК (которая может быть синтетической, как описано в настоящем документе) можно использовать для клонирования последовательностей константной и вариабельной области для производства антител, как описано в Newman et al., патент США No. 5658570, поданный 25 января 1995 года, который включен в настоящий документ в качестве ссылки. По существу, это охватывает экстракцию РНК из выбранных клеток, превращение ее в кДНК и амплификацию способом ПЦР с использованием специфичных к Ig праймеров. Подходящие для этой цели праймеры также описаны в патенте США No. 5658570. Как более подробно описано ниже, трансформированные клетки, экспрессирующие желаемое антитело, можно выращивать в относительно больших количествах для обеспечения клинических и коммерческих поставок иммуноглобулина.
Кроме того, с использованием общепринятых способов рекомбинантных ДНК, одну или несколько CDR антиген-связывающих полипептидов по настоящему изобретению можно встраивать в каркасные области, например, в каркасные области человека, для гуманизации не являющегося человеческим антитела. Каркасные области могут представлять собой природные или консенсусные каркасные области, и предпочтительно, каркасные области человека (см., например, Chothia et al., J. Mol. Biol. 278:457-479 (1998) для перечня каркасных областей человека). Предпочтительно, полинуклеотид, полученный комбинированием каркасных областей и CDR, кодирует антитело, которое специфично связывается по меньшей мере с одним эпитопом желаемого полипептида, например, LIGHT. Предпочтительно, в каркасные области можно вносить одну или несколько аминокислотных замен, и, предпочтительно, эти аминокислотные замены улучшают связывание антитела с его антигеном. Кроме того, такие способы можно использовать для внесения аминокислотных замен или делеций одного или нескольких остатков цистеина вариабельной области, участвующих в образовании межцепочечных дисульфидных связей с получением молекул антител, лишенных одной или нескольких межцепочечных дисульфидных связей. Настоящее изобретение охватывает другие изменения полинуклеотида и они находятся в пределах знаний в данной области.
Кроме того, можно использовать способы, разработанные для продукции "химерных антител" (Morrison et al., Proc. Natl. Acad. Sci. USA:851-855 (1984); Neuberger et al., Nature 372:604-608 (1984); Takeda et al., Nature 314:452-454 (1985)) посредством сплайсинга генов из молекулы антитела мыши, с подходящей антигенной специфичностью, с генами из молекулы антитела человека с подходящей биологической активностью. Как используют в настоящем документе, химерное антитело представляет собой молекулу, различные части которой происходят из различных видов животных, таких как животные, имеющие вариабельную область, происходящую из моноклонального антитела мыши, и константную область иммуноглобулина человека.
Другой высокоэффективный способ получения рекомбинантных антител описан Newman, Biotechnology 10: 1455-1460 (1992). В частности, этот способ приводит к получению приматизированных антител, которые содержат вариабельные домены обезьяны и константные последовательности человека. Эта ссылка включена в настоящий документ в качестве ссылки в полном объеме. Более того, этот способ также описан в принадлежащих одному и тому же правообладателю патентах США No. 5658570, 5693780 и 5756096, все из которых включены в настоящий документ в качестве ссылок.
Альтернативно антителопродуцирующие клеточные линии можно отбирать и культивировать с использованием способов, хорошо известных квалифицированному специалисту. Такие способы описаны в различных лабораторных справочниках и основных публикациях. В этом отношении, способы, подходящие для применения в изобретении, как описано ниже, описаны в Current Protocols in Immunology, Coligan et al., Eds., Green Publishing Associates and Wiley-Interscience, John Wiley and Sons, New York (1991), которые включены в настоящий документ в качестве ссылок в полном объеме, включая дополнения.
Антитела для использования в диагностических и терапевтических способах, описанных в настоящем документе, можно получать любым известным в данной области способом синтеза антител, в частности, химическим синтезом или, предпочтительно, способами рекомбинантной экспрессии, как описано в настоящем документе.
Кроме того, для внесения мутаций в нуклеотидную последовательность, кодирующую антиген-связывающий полипептид по настоящему изобретению, можно использовать стандартные способы, известные специалистам в данной области, включая, но ими не ограничиваясь, сайт-направленный мутагенез и ПЦР-опосредуемый мутагенез, которые приводят к аминокислотным заменам. Предпочтительно, варианты (включая производные) кодируют менее 50 аминокислотных замен, менее 40 аминокислотных замен, менее 30 аминокислотных замен, менее 25 аминокислотных замен, менее 20 аминокислотных замен, менее 15 аминокислотных замен, менее 10 аминокислотных замен, менее 5 аминокислотных замен, менее 4 аминокислотных замен, менее 3 аминокислотных замен или менее 2 аминокислотных замен относительно эталонной вариабельной области тяжелой цепи, CDR-H1, CDR-H2, CDR-H3, вариабельной области легкой цепи, CDR-L1, CDR-L2 или CDR-L3. Альтернативно мутации можно вносить случайным образом вдоль всей или части кодирующей последовательности, например, мутагенезом с насыщением, и полученные мутанты можно подвергать скринингу в отношении биологической активности для идентификации мутантов, которые сохраняют активность (например, способность связывать полипептид LIGHT).
Например, можно вносить мутации только в каркасные области или только в области CDR молекулы антитела. Внесенные мутации могут быть молчащими или нейтральными миссенс-мутациями, т.е. они могут не иметь эффекта или иметь небольшой эффект на способность антитела связывать. Эти типы мутаций могут быть подходящими для оптимизации использования кодонов или повышения продукции антитела гибридомой. Альтернативно не являющиеся нейтральными миссенс-мутации могут изменять способность антитела связывать антиген. Большинство молчащих и нейтральных миссенс-мутаций, вероятно, могут располагаться в каркасных областях, в то время как большинство не являющихся нейтральными миссенс-мутаций, вероятно, могут располагаться в CDR, хотя это не является абсолютным требованием. Специалист в данной области способен сконструировать и протестировать мутантные молекулы с желаемыми свойствами, такими как отсутствие изменения антиген-связывающей активности или изменение активности связывания (например, улучшение антиген-связывающей активности или изменение специфичности антитела). После мутагенеза кодирумый белок можно экспрессировать общепринятыми способами и функциональную и/или биологическую активность кодируемого белка (например, способность иммуноспецифично связывать по меньшей мере один эпитоп полипептида LIGHT) можно определять с использованием способов, описанных в настоящем документе, или путем стандартной модификации способов, известных в данной области.
После манипулирования выделенным генетическим материалом для получения антиген-связывающих полипептидов, их вариантов или производных, по изобретению, полинуклеотиды, кодирующие антиген-связывающие полипептиды по настоящему изобретению, как правило, встраивают в вектор экспрессии для введения в клетки-хозяева, которые можно использовать для получения желаемого количества антиген-связывающих полипептидов.
Рекомбинантная экспрессия антиген-связывающего полипептида, его производного или варианта, например, тяжелой или легкой цепи антитела, которое связывает молекулу-мишень, описанную в настоящем документе, например, LIGHT, требует конструирования вектора экспрессии, содержащего полинуклеотид, который кодирует антиген-связывающий полипептид. После получения полинуклеотида, кодирующего антиген-связывающий полипептид или тяжелую или легкую цепь антиген-связывающего полипептида, или его части (предпочтительно, содержащей вариабельный домен тяжелой или легкой цепи) по изобретению, можно получать вектор для продукции молекулы антитела с помощью технологии рекомбинантных ДНК с использованием способов, хорошо известных в данной области. Таким образом, способы получения белка посредством экспрессии полинуклеотида, содержащего антитело, кодирующее нуклеотидную последовательность, описаны в настоящем документе. Способы, которые хорошо известны специалистам в данной области, можно использовать для конструирования векторов экспрессии, содержащих кодирующие антитело последовательности и подходящие сигналы контроля транскрипции и трансляции. Эти способы включают, например, способы рекомбинантных ДНК in vitro, синтетические способы и генетическую рекомбинацию in vivo. Таким образом, изобретение относится к реплицирующимся векторам, содержащим нуклеотидную последовательность, кодирующую молекулу антитела по изобретению, или его тяжелую или легкую цепь, или вариабельный домен тяжелой или легкой цепи, функционально связанные с промотором. Такие векторы могут включать нуклеотидную последовательность, кодирующую константную область молекулы антитела (см., например, публикацию PCT WO 86/05807; публикацию PCT WO 89/01036; и патент США No. 5122464) и в такой вектор можно клонировать вариабельный домен антитела для экспрессии всей тяжелой или легкой цепи.
Клетку-хозяина можно одновременно трансфицировать двумя векторами экспрессии по изобретению, причем первый вектор кодирует полипептид, происходящий из тяжелой цепи, а второй вектор кодирует полипептид, происходящий из легкой цепи. Эти два вектора могут содержать идентичные селективные маркеры, которые обеспечивают равную экспрессию полипептидов тяжелой и легкой цепей. Альтернативно можно использовать один вектор, который кодирует оба полипептида: как тяжелой, так и легко цепей. В таких ситуациях легкую цепь преимущественно помещают перед тяжелой цепью, чтобы избежать избытка токсичной свободной тяжелой цепи (Proudfoot, Nature 322:52 (1986); Kohler, Proc. Natl. Acad. Sci. USA 77:2197 (1980)). Кодирующие последовательности для тяжелой и легкой цепей могут содержать кДНК или геномную ДНК.
Термин "вектор" или "вектор экспрессии" используют в настоящем документе для обозначения векторов, используемых в соответствии с настоящим изобретением, в качестве носителей для введения в клетку-хозяина и экспрессии в клетке-хозяине желаемого гена. Как известно специалистам в данной области, такие векторы можно легко выбирать из группы, состоящей из плазмид, фагов, вирусов и ретровирусов. Как правило, векторы, подходящие для практики настоящего изобретения, содержат селективный маркер и подходящие участки рестрикции для облегчения клонирования желаемого гена и способности проникать в эукариотические или прокариотические клетки и/или реплицироваться в них.
Для целей этого изобретения можно использовать множество систем векторов экспрессии. Например, в одном классе векторов используются элементы ДНК, которые происходят из вирусов животных, таких как вирус папилломы крупного рогатого скота, вирус полиомы, аденовирус, вирус осповакцины, бакуловирус, ретровирусы (RSV, MMTV или MOMLV) или вирус SV40. Другие векторы вовлекают применение полицистронных систем с внутренними участками связывания рибосом. Кроме того, клетки, в хромосомы которых встроилась ДНК, можно отбирать с использованием одного или нескольких маркеров, которые позволяют селекцию трансфицированных клеток-хозяев. Маркер может обеспечить фототрофность для ауксотрофного хозяина, устойчивость к биоцидам (например, антибиотикам) или устойчивость к тяжелым металлам, таким как медь. Ген селективного маркера можно либо прямо связывать с последовательностями ДНК, подлежащими экспрессии, либо вводить в ту же клетку способом котрансформации. Также для оптимального синтеза мРНК могут потребоваться дополнительные элементы. Эти элементы включают сигнальные последовательности, сигналы сплайсинга, а также промоторы транскрипции, энхансеры и сигналы терминации.
В особенно предпочтительных вариантах осуществления клонированные гены вариабельной области встраивают в вектор экспрессии совместно с генами константной области тяжелой и легкой цепи (предпочтительно, человеческими), как описано выше. В настоящем изобретении можно использовать любой вектор экспрессии, который способен обеспечивать экспрессию в эукариотических клетках. Примеры подходящих векторов включают, но ими не ограничиваются, плазмиды pcDNA3, pHCMV/Zeo, pCR3.1, pEF I/His, pEMD/GS, pRc/HCMV2, pSV40/Zeo2, pTRACER-HCMV, pUB6/V5-His, pVAX1 и pZeoSV2 (доступные от Invitrogen, San Diego, CA), и плазмиду pCI (доступную от Promega, Madison, WI). Как правило, скрининг больших количеств трансформированных клеток в отношении клеток, которые экспрессируют подходящие высокие уровни тяжелой и легкой цепей иммуноглобулинов, является стандартным экспериментированием, которое проводят, например, с помощью роботизированных систем. Векторные системы также описаны в патентах США No. 5736137 и 5658570, все из которых включены в настоящий документ в качестве ссылок в полном объеме. Эта система обеспечивает высокие уровни экспрессии, например, > 30 пг/клетка/сутки. Другие характерные векторные системы описаны, например, в патенте США 6413777.
В других предпочтительных вариантах осуществления антиген-связывающие полипептиды, их варианты или производные по изобретению, можно экспрессировать с использованием полицистронных конструкций, таких как конструкции, описанные в публикации патентной заявки США No. 2003-0157641 A1, поданной 18 ноября 2002 года и включенной в настоящий документ в полном объеме. В этих новых экспрессирующих системах из одной полицистронной конструкции можно продуцировать множество представляющих интерес продуктов генов, таких как тяжелые и легкие цепи антител. В этих системах преимущественно используется участок внутренней посадки рибосомы (IRES) для обеспечения относительно высоких уровней антиген-связывающих полипептидов в эукариотических клетках-хозяевах. Совместимые последовательности IRES описаны в патенте США No. 6193980, который также включен в настоящий документ в качестве ссылки. Специалистам в данной области будет понятно, что такие экспрессирующие системы можно использовать для эффективной продукции полного диапазона антиген-связывающих полипептидов, описанных в настоящей заявке.
В более общем смысле, после получения вектора или последовательности ДНК, кодирующей мономерную субъединицу антиген-связывающего полипептида, вектор экспрессии можно вводить в подходящую клетку-хозяина. Введение плазмиды в клетку-хозяина можно проводить различными способами, хорошо известными специалистам в данной области. К ним относятся, но ими не ограничиваются, трансфекция (включая электрофорез и электропорацию), слияние протопластов, осаждение фосфатом кальция, слияние клеток с заключенной в оболочку ДНК, микроинъекцию и инфекцию неизмененным вирусом. См., Ridgway, A, A. G. "Mammalian Expression vectors" Vectors, Rodriguez and Denhardt, Eds., Butterworths, Boston, Mass., Chapter 24.2, pp. 470-472 (1988). Как правило, плазмиду вводят в хозяина электропорацией. Клетки-хозяева, содержащие экспрессирующую конструкцию, выращивают в условиях, подходящих для продукции легких цепей и тяжелых цепей, и анализируют в отношении синтеза белков тяжелой и/или легкой цепей. Характерные способы анализа включают твердофазный иммуноферментный анализ (ELISA), радиоиммунный анализ (RIA), или анализ посредством активированной флуоресценцией сортировки клеток (FACS), иммуногистохимию и т.п.
Вектор экспрессии переносят в клетку-хозяина общепринятыми способами, а затем перенесенные клетки культивируют общепринятыми способами для получения антитела для использования в способах, описанных в настоящем документе. Таким образом, изобретение относится к клеткам-хозяевам, содержащим полинуклеотид, кодирующий антитело по изобретению, или его тяжелую или легкую цепь, функционально связанные с гетерологичным промотором. В предпочтительных вариантах осуществления для экспрессии двухцепочечных антител векторы, кодирующие как тяжелую, так и легкую, цепи, можно коэкспрессировать в клетке-хозяине для экспрессии полноразмерной молекулы иммуноглобулина, как подробно описано ниже.
Как используют в настоящем документе, термин "клетки-хозяева" относится к клеткам, которые содержат векторы, сконструированные с использованием способов рекомбинантных ДНК и кодирующие по меньшей мере один гетерологичный ген. В описаниях способов выделения антител из рекомбинантных хозяев термины "клетка" и "клеточная культура" используют взаимозаменяемо для обозначении источника антитела, если явно не указано иное. Иными словами, выделение полипептида из "клеток" может означать выделение либо из осажденных целых клеток, либо из клеточной культуры, содержащей как среду, так и суспендированные клетки.
Для экспрессии антиген-связывающих полипептидов можно использовать множество систем хозяин-вектор экспрессии. Такие системы хозяин-вектор экспрессии представляют собой носители, посредством которых можно получать и затем очищать представляющие интерес кодирующие последовательности, а также они представляют собой клетки, которые могут, при трансформации или трансфекции подходящими нуклеотидными кодирующими последовательностями, экспрессировать антиген-связывающий полипептид по изобретению in situ. К ним относятся, но ими не ограничиваются, микроорганизмы, такие как бактерии (например, E. coli, B. subtilis), трансформированные рекомбинантными векторами экспрессии с бактериофаговой ДНК, плазмидной ДНК или космидной ДНК, содержащими кодирующие антитело последовательности; дрожжи (например, Saccharomyces, Pichia), трансформированные рекомбинантными векторами экспрессии дрожжей, содержащими кодирующие антитело последовательности; системы клеток насекомых, инфицированных рекомбинантными вирусными векторами экспрессии (например, бакуловирусом), содержащими кодирующие антитело последовательности; системы клеток растений, инфицированных рекомбинантными вирусными векторами экспрессии (например, вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV) или трансформированных рекомбинантыми плазмидными векторами экспрессии (например, плазмидой Ti), содержащими кодирующие антитело последовательности; или системы клеток млекопитающих (например, клетки COS, CHO, BLK, 293, 3T3), содержащие рекомбинантные экспрессирующие конструкции, содержащие промоторы, происходящие из генома клеток млекопитающих (например, промотор металлотеонеина) или из вирусов млекопитающих (например, поздний промотор аденовируса; промотор 7.5K вируса осповакцины). Предпочтительно, для экспрессии рекомбинантной молекулы антитела используют бактериальные клетки, такие как Escherichia coli, и, более предпочтительно, эукариотические клетки, особенно для экспрессии полноразмерной рекомбинантной молекулы антитела. Например, эффективной экспрессирующей системой для антител являются клетки млекопитающих, такие как клетки яичника китайского хомяка (CHO), вместе с вектором, такой как вектор, содержащий основной средне-ранний промоторный элемент из цитомегаловируса (Foecking et al., Gene 5:101 (1986); Cockett et al., Bio/Technology 8:2 (1990)).
Линия клеток-хозяев, используемая для экспрессии белков, часто происходит из млекопитающих; специалисты в данной области способны, предпочтительно, определить конкретные линии клеток-хозяев, которые наилучшим образом подходят для экспрессии в них желаемого продукта гена. Характерные линии клеток-хозяев включают, но ими не ограничиваются, клетки CHO (яичник китайского хомячка), DG44 и DUXBII (линии яичника китайского хомячка, DHFR-минус), HELA (карцинома шейки матки человека), CVI (линия почки обезьяны), COS (производное CVI с T-антигеном SV40), VERY, BHK (почки детенышей хомячка), MDCK, 293, WI38, R1610 (фибробласты китайского хомячка) BALBC/3T3 (фибробласты мыши), HAK (линия почки хомяка), SP2/0 (миелома мыши), P3x63-Ag3.653 (миелома мыши), BFA-Ic IBPT (эндотелиальные клетки крупного рогатого скота), RAJI (лимфоциты человека) и 293 (почка человека). Линии клеток-хозяев, как правило, доступны от коммерческих служб, American Tissue Culture Collection или из опубликованной литературы.
Кроме того, можно выбирать линию клеток-хозяев, которая модулирует экспрессию встроенных последовательностей или модифицирует и процессирует продукт гена определенным желаемым образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут быть важны для функции белка. Различные клетки-хозяева обладают характерными специфическими механизмами посттрансляционного процессинга и модификации белков и продуктов генов. Для обеспечения правильной модификации и процессинга чужеродного экспрессируемого белка можно выбирать подходящие клеточные линии или системы хозяев. Для этого, можно использовать эукариотические клетки-хозяева, которые обладают клеточным аппаратом для надлежащего процессинга первичного транскрипта, гликозилирования и фосфорилирования продукта гена.
Для длительной продукции рекомбинантных белков с высоким выходом предпочтительной является стабильная экспрессия. Например, можно конструировать клеточные линии, которые стабильно экспрессируют молекулу антитела. Вместо применения векторов экспрессии, которые содержат вирусные ориджины репликации, клетки-хозяева можно трансформировать посредством ДНК, контролируемой соответствующими элементами контроля экспрессии (например, промоторной, энхансерной последовательностями, терминаторами транскрипции, участками полиаденилирования и т.д.), с селективным маркером. После введения чужеродной ДНК сконструированным клеткам можно позволять расти в течение 1-2 суток в обогащенной среде, а затем их можно переключать на селективную среду. Селективный маркер в рекомбинантной плазмиде придает устойчивость при селекции и позволяет клеткам стабильно встраивать плазмиду в их хромосомы и расти с образованием очагов, которые, в свою очередь, можно клонировать и размножать в клеточные линии. Этот способ можно преимущественно использовать для конструирования клеточных линий, которые стабильно экспрессируют антиген-связывающие полипептиды по настоящему изобретению.
Можно использовать ряд систем для селекции, включая, но ими не ограничиваясь, гены тимидинкиназы вируса простого герпеса (Wigler et al., Cell 11: 223 (1977)), гипоксантин-гуанин-фосфорибозилтрансферазы (Szybalska & Szybalski, Proc. Natl. Acad. Sci. USA 48:202 (1992)), и аденин-фосфорибозилтрансферазы (Lowy et al., Cell 22:817 1980) в tk-, hgprt- или aprt-клетках, соответственно. Также можно использовать гены, придающие устойчивость к антиметаболитам, в качестве основы для селекции с помощью следующих генов: dhfr, который придает устойчивость к метотрексату (Wigler et al., Natl. Acad. Sci. USA 77:357 (1980); O'Hare et al., Proc. Natl. Acad. Sci. USA 78: 1527 (1981)); gpt, который придает устойчивость к микофеноловой кислоте (Mulligan & Berg, Proc. Natl. Acad. Sci. USA 78:2072 (1981)); neo, который придает устойчивость к аминогликозиду G-418 (Wu and Wu, Biotherapy 3:87-95 (1991)); и hygro, который придает устойчивость к гигромицину (Santerre et al., Gene 30:147 (1984)). Способы, широко известные в области технологии рекомбинантных ДНК, которые можно использовать, описаны в Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990); и в главах 12 и 13, Dracopoli et al. (eds), Current Protocols in Human Genetics. John Wiley & Sons, NY (1994); Colberre-Garapin et al., J. Mol. Biol. 150:1 (1981), которые включены в настоящий документ в качестве ссылок в полном объеме.
Уровни экспрессии антиген-связывающего полипептида можно увеличивать посредством амплификации вектора (для обзора см. Bebbington and Hentschel, The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning. Academic Press, New York, Vol. 3. (1987)). Когда маркер в векторной системе, экспрессирующей антитело, является амплифицируемым, увеличение уровня ингибитора, присутствующее в культуре клеток-хозяев приведет к увеличению количества копий маркерного гена. Поскольку амплифицированная область связана с геном антитела, продукция антитела также будет возрастать (Grouse et al., Mol. Cell. Biol. 3:257 (1983)).
Гены, кодирующие антиген-связывающие полипептиды или их варианты или производные по изобретению, также можно экспрессировать в клетках не млекопитающих, таких как клетки бактерий или дрожжей или растений. Бактерии, которые легко захватывают нуклеиновые кислоты, включают представителей enterobacteriaceae, таких как штаммы Escherichia coli или Salmonella; Bacillaceae, такие как Bacillus subtilis; Pneumococcus; Streptococcus и Haemophilus influenzae. Кроме того, понятно, что при экспрессии в бактериях гетерологичные полипептиды, как правило, становятся частью телец включения. Гетерологичные полипептиды необходимо выделять, очищать, а затем собирать в функциональные молекулы.
В бактериальных системах количество векторов экспрессии можно преимущественно выбирать, в зависимости от предполагаемого применения экспрессируемой молекулы антитела. Например, когда намереваются продуцировать большое количество такого белка для получения фармацевтических композиций молекулы антитела, могут быть желательными векторы, которые направляют экспрессию высоких уровней слитых белковых продуктов. Такие векторы включают, но ими не ограничиваются, вектор экспрессии E. coli pUR278 (Ruther et al., EMBO J. 2: 1791 (1983)), в котором кодирующая антитело последовательность может быть лигирована индивидуально в вектор в рамке считывания с кодирующей lacZ областью, так чтобы продуцировался слитый белок; векторы pIN (Inouye & Inouye, Nucleic Acids Res. 73: 3101-3109 (1985); Van Heeke & Schuster, J. Biol Chem. 24:5503-5509 (1989)); и т.п. Также можно использовать векторы pGEX для экспрессии чужеродных полипептидов в качестве слитых белков с глутатион-S-трансферазой (GST). Как правило, такие слитые белки являются растворимыми и их можно легко очищать из лизированных клеток путем адсорбции и связывания с гранулами на основе матрицы из глутатион-агарозы, с последующим элюированием в присутствии свободного глутатиона. Векторы pGEX конструируют так, чтобы они включали участки расщепления тромбином или фактором Xa, так чтобы продукт клонированного гена-мишени мог высвобождаться из группы GST.
В дополнение к прокариотам также можно использовать эукариотические микроорганизмы. Saccharomyces cerevisiae или обычные пекарские дрожжи наиболее часто используются среди эукариотических микроорганизмов, хотя широко доступен ряд других штаммов, например, Pichia pastoris.
Для экспрессии в Saccharomyces обычно используют, например, плазмиду YRp7 (Stinchcomb et al., Nature 252:39 (1979); Kingsman et al., Gene 7: 141 (1979); Tschemper et al., Gene 10:157 (1980)). Эта плазмида уже содержит ген trpl, который обеспечивает селективный маркер для мутантного штамма дрожжей, лишенного способности расти на триптофане, например, ATCC No. 44076 или PEP4-1 (Jones, Genetics 85:12 (1977)). Затем присутствие повреждения trpl в качестве характеристики генома дрожжевых клеток-хозяев обеспечивает эффективную окружающую среду для обнаружения трансформации по росту в отсутствие триптофана.
В системе насекомых, как правило, в качестве вектора для экспрессии чужеродных генов используют вирус ядерного полиэдроза Autographa californica (AcNPV). Этот вирус растет в клетках Spodoptera frugiperda. Кодирующую антитело последовательность можно клонировать индивидуально в не являющиеся необходимыми области (например, ген полиэдрина) вируса и помещать под контроль промотора AcNPV (например, промотора полиэдрина).
После рекомбинантной экспрессии антиген-связывающего полипептида по изобретению его можно очищать любым известным в данной области способом очистки молекулы иммуноглобулина, например, посредством хроматографии (например, ионообменной, аффинной, в частности, на основе аффинности к специфическому антигену после хроматографии с белком A, и колоночной хроматографии по размеру), центрифугирования, дифференциальной растворимости или любым другим стандартным способом очистки белков. Альтернативно, предпочтительный способ увеличения аффинности антител по изобретению описан в US 2002-0123057 A1, Zauderer et al., выданном 14 ноября 2001 года.
Способы лечения и диагностики
Как описано в настоящем документе, антиген-связывающие полипептиды, варианты или производные по настоящему изобретению можно использовать в определенных способах лечения и диагностики, связанных с воспалительными, иммунными или злокачественными заболеваниями или состояниями. В частности, определенные антиген-связывающие полипептиды по настоящему изобретению могут быть антагонистами активности LIGHT. Например, определенный антиген-связывающий полипептид может представлять собой антагонист активности LIGHT, такой как стимуляция T-клеток, стимуляция провоспалительных цитокинов, таких как IFN-γ и IL-8, и стимуляция продукции IL-17 CD3- и Th17-клетками. Кроме того, антиген-связывающие полипептиды против LIGHT по изобретению могут препятствовать способности LIGHT связывать рецептор LTβ, рецептор HVEM и рецептор-ловушку 3/TR6, а также другие рецепторы, с которыми связывается LIGHT.
Кроме того, настоящее изобретение относится к способам лечения на основе антиген-связывающего полипептида, которые вовлекают введение антиген-связывающих полипептидов по изобретению пациенту, такому как животное, млекопитающее и человек, для лечения одного или нескольких из нарушений или состояний, описанных в настоящем документе. Терапевтические соединения по изобретению включают, но ими не ограничиваются, антиген-связывающие полипептиды по изобретению (включая их варианты и производные, как описано в настоящем документе) и нуклеиновые кислоты или полинуклеотиды, кодирующие антиген-связывающие полипептиды по изобретению (включая их варианты и производные, как описано в настоящем документе).
Антиген-связывающие полипептиды по изобретению можно использовать для лечения, ингибирования или профилактики заболеваний, нарушений или состояний, включая, но ими не ограничиваясь, любое одно или несколько из заболеваний, нарушений или состояний, описанных в настоящем документе, например, таких как иммунные или воспалительные заболевания, нарушения или состояния, связанные с такими заболеваниями или нарушениями (включая, но ими не ограничиваясь, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопению новорожденных, идиопатическую тромбоцитопеническую пурпуру, аутоиммуноцитопению, гемолитическую анемию, антифосфолипидный синдром, дерматит, аллергический энцефаломиелит, миокардит, рецидивирующий полихондрит, ревматическую болезнь сердца, гломерулонефрит (например, IgA-нефропатию), рассеянный склероз, неврит, увеит, офтальмию, полиэндокринопатии, пурпуру (например, пурпуру Геноха-Шенлейна), болезнь Рейтера, синдром ригидности мышц, аутоиммунное воспаление легких, синдром Гийена-Барре, инсулинзависимый сахарный диабет и аутоиммунное воспаление глаза, аутоиммунный тиреоидит, гипотиреоз (т.е., тиреоидит Хашимото), системную красную волчанку, синдром Гудпасчера, пемфигус, связанные с рецепторами аутоиммунные заболевания, например, такие как (a) болезнь Грэйвса, (b) миастения и (c) резистентность к инсулину, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопеническую пурпуру, ревматоидный артрит, слеродерермию с антителами против коллагена, смешанное заболевание соединительной ткани, полимиозит/дерматомиозит, пернициозную анемию, идиопатическую болезнь Аддисона, бесплодие, гломерулонефрит, такой как первичный гломерулонефрит и IgA-нефропатия, буллезный пемфигоид, синдром Шегрена, сахарный диабет и устойчивость к адренэргическим лекарственным средствам (включая устойчивость к адренергическим лекарственным средствам в случае астмы или кистозного фиброза), хронический активный гепатит, первичный биллиарный цирроз, другие типы недостаточности эндокринных желез, витилиго, васкулит, посткардиотомный синдром после инфаркта миокарда, крапивницу, атопический дерматит, астму, воспалительные миопатии и другие воспалительные, гранулематозные, дегенеративные и атрофические нарушения), и иммунодефициты или состояния, связанные с такими заболеваниями или нарушениями (включая, но ими не ограничиваясь, X-сцепленный тяжелый комбинированный иммунодефицит (SCID), аутосомный SCID, дефицит аденозиндезаминазы (дефицит ADA), X-сцепленную агаммаглобулинемию (XLA), болезнь Брутона, врожденную агаммаглобулинемию, X-сцепленную агаммаглобулинемию новорожденных, приобретенную агаммаглобулинемию, агаммаглобулинемию с началом во взрослом возрасте, агаммаглобулинемию с поздним началом, дисгаммаглобулинемию, гипогаммаглобулинемию, временную гипогаммаглобулинемию новорожденных, неуточненную гипогаммаглобулинемию, агаммаглобулинемию, вариабельный неклассифицируемый иммунодефицит (CVID) (приобретенный), синдром Вискотта-Олдрича (WAS), X-сцепленный иммунодефицит c гипер-IgM, не X-сцепленный иммунодефицит с гипер-IgM, селективный дефицит IgA, дефицит подклассов IgG (с или без дефицита IgA), дефицит антител с нормальными или повышенными Ig, иммунодефицит с тимомой, делеции тяжелых цепей Ig, дефицит каппа-цепи, B-клеточное лимфопролиферативное нарушение (BLPD), селективный IgM-иммунодефицит, рецессивную агаммаглобулинемию (шведского типа), ретикулярную дисгенезию, нейтропению новорожденных, тяжелую врожденную лейкопению, алимфоплазию-аплазию тимуса или дисплазию с иммунодефицитом, атаксию-телеангиэктазию, синдром "карлика-коротконожки", X-сцепленный лимфопролиферативный синдром (XLP), синдром Незелофа-комбинированный иммунодефицит с Ig, дефицит пуриннуклеозидфосфорилазы (PNP), дефицит MHC класса II (синдром голых лимфоцитов), тяжелый комбинированный иммунодефицит, синдром Ди Джорджи, гипоплазию тимуса, хронический кожно-слизистый кандидоз, дефицит естественных киллеров, идиопатическую CD4+ T-лимфоцитопению, и иммунодефицит с преобладающим дефектом T-клеток).
Антиген-связывающие полипептиды по изобретению также можно применять для лечения, ингибирования или профилактики заболеваний, нарушений или состояний, включающих злокачественные заболевания, нарушения или состояния, связанные с такими заболеваниями или нарушениями, такие как заболевания, связанные с увеличенным выживанием клеток или ингибированием апоптоза, например, злокачественные опухоли (такие как фолликулярные лимфомы, карциномы с мутациями p53, и гормон-зависимые опухоли, включая, но ими не ограничиваясь, рак толстого кишечника, опухоли сердца, рак поджелудочной железы, меланому, ретинобластому, глиобластому, рак легкого, рак кишечника, рак яичка, рак желудка, нейробластоме, миксому, миому, лимфому, эндотелиому, остеобластому, остеокластому, остеосаркомуе, хондросаркому, аденому, рак молочной железы, рак предстательной железы, саркоме Капоши и рак яичника); аутоиммунные нарушения (такие как рассеянный склероз, синдром Шегрена, болезнь Грэйвса, тиреоидит Хашимото, аутоиммунный диабет, билиарный цирроз, болезнь Бехчета, болезнь Крона, полимиозит, системная красная волчанка и связанный с нарушением иммунной системы гломерулонефрит, аутоиммунный гастрит, аутоиммунная тромбоцитопеническая пурпура и ревматоидный артрит) и вирусные инфекции (такие как инфекции вирусами герпеса, поксвирусами и аденовирусами), воспаление, реакцию "трансплантат против хозяина" (острую и/или хроническую), острое отторжение трансплантата и хроническое отторжение трансплантата. Антиген-связывающие полипептиды, их варианты или производные по настоящему изобретению используют для ингибирования роста, прогрессирования и/или метастазирования злокачественных опухолей, в частности, злокачественных опухолей, приведенных выше или в следующем абзаце.
Дополнительные заболевания или состояния, связанные с увеличенным выживанием клеток, которые можно лечить, предупреждать, диагностировать и/или прогнозировать с помощью антиген-связывающих полипептидов или их вариантов или производных по изобретению включают, но ими не ограничиваются, прогрессирование и/или метастазирование злокачественных опухолей и родственных им нарушений, таких как лейкоз (включая острые лейкозы (например, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз (включая миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный и эритролейкоз)) и хронические лейкозы (например, хронический миелоцитарный (гранулоцитарный) лейкоз и хронический лимфоцитарный лейкоз)), истинную полицитемию, лимфомы (например, болезнь Ходжкина и неходжкинскую лимфому), множественную миелому, макроглобулинемию Вальденстрема, болезнь тяжелых цепей, и солидные опухоли, включая, но ими не ограничиваясь, саркомы и карциномы, такие как фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома, хордома, ангиосаркома, эндотелиосаркома, лимфангиосаркома, лимфангиоэндотелиосаркома, синовиома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, карцинома толстого кишечника, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточная карцинома, базально-клеточная карцинома, аденокарцинома, карцинома потовых желез, карцинома сальных желез, папиллярная карцинома, папиллярные аденокарциномы, цистаденокарцинома, медуллярная карцинома, бронхогенная карцинома, почечноклеточный рак, гепатома, карцинома желчных протоков, хориокарцинома, семинома, эмбриональная карцинома, опухоль Вильмса, рак шейки матки, опухоль семенников, карцинома легкого, мелкоклеточная карцинома легкого, карцинома мочевого пузыря, эпителиальная карцинома, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, геманиобластома, невринома слухового нерва, олигоденроглиома, менангиома, меланома, нейробластома и ретинобластома.
Заболевания, связанные с повышенным апоптозом, которые можно лечить, предупреждать, диагностировать и/или прогнозировать с помощью антиген-связывающих полипептидов или их вариантов или производных по изобретению, включают, но ими не ограничиваются, СПИД; нейродегенеративные нарушения (такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, пигментный ретинит, мозжечковая дегенерация и опухоль головного мозга или связанные с ними заболевания); аутоиммунные нарушения (такие как рассеянный склероз, синдром Шегрена, болезнь Грэйвса, тиреоидит Хашимото, аутоиммунный диабет, билиарный цирроз, болезнь Бехчета, болезнь Крона, полимиозит, системная красная волчанка, связанный с нарушением иммунной системы гломерулонефрит, аутоиммунный гастрит, тромбоцитопеническая пурпура и ревматоидный артрит), миелодиспластические синдромы (такие как апластическая анемия), реакцию "трансплантат против хозяина" (острую и/или хроническую), ишемическое повреждение (такое как повреждение, вызываемое инфарктом миокарда, инсультом и реперфузионным повреждением), повреждение или заболевание печени (например, связанное с гепатитом повреждение печени, цирроз, повреждение при ишемии/реперфузии, холестаз (повреждение желчных протоков) и рак печени); индуцируемое токсином заболевание печени (например, вызываемое алкоголем), септический шок, язвенный колит, кахексию и анорексию.
Конкретные примеры заболеваний, нарушений или состояний, при которых антиген-связывающие полипептиды по настоящему изобретению могут быть полезны в способах лечения или диагностики, включают, но ими не ограничиваются, аутоиммунное заболевание, воспалительное заболевание кишечника (IBD); хроническое обструктивное заболевание легких (COPD); артрит; ревматоидный артрит; рассеянный склероз; отторжение трансплантата; реакцию трансплантат против хозяина (GVHD); повреждение центральной нервной системы; Th1-опосредуемые заболевания кишечника; болезнь Крона; псориаз; лейкоз; лимфому; хронический лимфоцитарный лейкоз; атеросклероз; карциному легкого; карциному толстого кишечника и гепатит.
Конкретная дозировка и режим лечения для конкретного пациента могут зависеть от различных факторов, включая конкретный используемый антиген-связывающий полипептид, его вариант или производное, возраст пациента, массу тела, общее состояние здоровья, пол и режим питания, и время введения, скорость экскреции, комбинацию лекарственных средств, и тяжесть конкретного подвергаемого лечению заболевания. Усмотрение таких факторов медицинскими специалистами лежит в пределах знаний в данной области. Количество также зависит от конкретного подвергаемого лечению пациента, пути введения, типа состава, характеристик используемого соединения, тяжести заболевания и желаемого эффекта. Используемое количество можно определять с помощью фармакологических и фармакокинетических принципов, хорошо известных в данной области.
Способы введения антиген-связывающих полипептидов или их вариантов включают, но ими не ограничиваются, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный и пероральный пути. Антиген-связывающие полипептиды или композиции можно вводить любым удобным путем, например, посредством инфузии или болюсной инъекции, посредством всасывания через эпителиальные или кожно-слизистые выстилки (например, слизистую оболочку полости рта, слизистую оболочку прямой кишки или кишечника и т.д.) и их можно вводить вместе с другими биологически активными агентами. Таким образом, фармацевтические композиции, содержащие антиген-связывающие полипептиды по изобретению, можно вводить перорально, ректально, парентерально, интрацистернально, внутривагинально, внутрибрюшинно, местно (например, посредством порошков, мазей, капель или чрескожного пластыря), буккально или в качестве перорального или назального спрея.
Термин "парентерально", как используют в настоящем документе, относится к способам введения, которые включают внутривенную, внутримышечную, внутрибрюшинную, внутригрудинную, подкожную и внутрисуставную инъекцию и инфузию.
Введение может быть системным или местным. Кроме того, может быть желательным введение фармацевтических соединений или композиций по изобретению в центральную нервную систему любым подходящим путем, включая внутрижелудочковую и интратекальную инъекцию; внутрижелудочковую инъекцию можно упрощать с помощью внутрижелудочкового катетера, например, присоединенного к резервуару, такому как резервуар Омайя. Также можно использовать легочное введение, например, с использованием ингалятора или небулайзера или состава с распыляющим агентом.
Может быть желательным введение антиген-связывающих полипептидов или композиций по изобретению местно или в область, подлежащую лечению; это можно осуществлять, например, и этим не ограничиваясь, местной инфузией в процессе хирургической операции, местным нанесением, например, вместе с перевязкой раны после хирургической операции, посредством инъекции, с помощью катетера, с помощью суппозитория, или с помощью имплантата, где указанный имплантат является пористым, непористым или гелеобразным материалом, включая мембраны, такие как силастиковые мембраны, или волокна. Предпочтительно, при введении белка, включая антитело, по изобретению, необходимо стараться использовать материалы, которые не поглощают белок.
В другом варианте осуществления антиген-связывающий полипептид или композицию можно доставлять в носителе, в частности, липосоме (см. Langer, 1990, Science 249: 1527-1533; Treat et al., Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989); Lopez-Berestein, там же., pp. 317-327; см., главным образом, там же).
В другом варианте осуществления антиген-связывающий полипептид или композицию можно доставлять в системе с контролируемым высвобождением. В одном из вариантов осуществления можно использовать насос (см. Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:201; Buchwald et al., 1980, Surgery 88:507; Saudek et al., 1989, N. Engl. J. Med. 321 :574). В другом варианте осуществления можно использовать полимерные материалы (см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, J., 1983, Macromol. Sci. Rev. Macromol. Chem. 23:61; см. также Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J Neurosurg. 71:105). В другом варианте осуществления систему с контролируемым высвобождением можно помещать вблизи терапевтической мишени, т.е. головного мозга, что приводит к тому, что требуется только часть системной дозы (см., например, Goodson, Medical Applications of Controlled Release, выше, vol. 2, pp. 115-138 (1984)). Другие системы с контролируемым высвобождением рассмотрены в обзоре Langer (1990, Science 249:1527-1533).
В конкретном варианте осуществления, где композиция по изобретению содержит нуклеиновую кислоту или полинуклеотид, кодирующий белок, нуклеиновую кислоту можно вводить in vivo для обеспечения экспрессии кодируемого ей белка, путем конструирования ее в качестве части соответствующего экспрессирующего нуклеиновую кислоту вектора и введения ее так, чтобы она становилась внутриклеточной, например, с использованием ретровирусного вектора (см. патент США No. 4980286), или путем прямой инъекции или с использованием бомбардировки микрочастицами (например, генная пушка; Biolistic, Dupont), или покрытия липидами или рецепторами клеточной поверхности или агентами для трансфекции, или путем введения его, связанного с гомеобокс-подобным пептидом, известным тем, что он проникает в ядро (см., например, Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88:1864-1868), и т.д. Альтернативно нуклеиновую кислоту можно вводить внутриклеточно и встраивать в ДНК клетки-хозяина для экспрессии посредством гомологичной рекомбинации.
Количество антиген-связывающего полипептида по изобретению, которое является эффективным для лечения, ингибирования и профилактики воспалительного, иммунного или злокачественного заболевания, нарушения или состояния, можно определять стандартными клиническими способами. Кроме того, необязательно можно использовать анализы in vitro для облегчения идентификации оптимальных диапазонов дозировок. Точная доза, используемая в составе, также зависит от пути введения, тяжести заболевания, нарушения или состояния, и она должна быть установлена в соответствии с мнением врача и обстоятельств для каждого пациента. Эффективные дозы можно экстраполировать из кривых доза-эффект, полученных в тест-системах in vitro или в моделях на животных.
В качестве общего предложения, вводимая пациенту дозировка антиген-связывающих полипептидов по настоящему изобретению, как правило, составляет от 0,1 мг/кг до 100 мг/кг массы тела пациента, от 0,1 мг/кг до 20 мг/кг массы тела пациента или от 1 мг/кг до 10 мг/кг массы тела пациента. Как правило, антитела человека имеют более длительное время полужизни в организме человека, чем антитела из других видов, вследствие иммунного ответа на чужеродные полипептиды. Таким образом, часто являются возможными более низкие дозировки антител человека и менее частое их введение. Кроме того, дозировку и частоту введения антител по изобретению можно снижать путем увеличения захвата и проникновения в ткани (например, в головной мозг) антител с помощью модификаций, например, таких как липидация.
При лечении ревматоидного артрита способы введения антиген-связывающих полипептидов по настоящему изобретению включают внутрикожную, подкожную и внутрисуставную инъекцию и инфузию. Доза антиген-связывающих полипептидов, вводимых внутрисуставным или внутрикожным путем, может находиться в диапазоне от приблизительно 0,1 мг/кг до приблизительно 100 мг/кг массы тела пациента.
Композиции по изобретению можно вводить отдельно или в комбинации с другими лекарственными средствами (например, костимуляторной молекулой). Лекарственные средства, которые можно вводить в комбинации с композициями по изобретению, включают, но ими не ограничиваются, другие представители семейства TNF, химиотерапевтические средства, антибиотики, стероидные и нестероидные противовоспалительные средства, общепринятые иммунные лекарственные средства, цитокины и/или факторы роста. Комбинации можно вводить одновременно, например, в качестве смеси, раздельно, но синхронно или одновременно; или последовательно. Это включает случаи, когда комбинированные средства вводят вместе в качестве терапевтической смеси, а также процедуры, в которых комбинированные средства вводят раздельно, синхронно, например, через отдельные внутривенные линии одному индивидууму. Кроме того, введение "в комбинации" включает раздельное введение, при котором вводят сначала одно из соединений или средств, а затем вводят второе. Таким образом, в сущности, лекарственные средства можно вводить индивидуумам либо одновременно, либо в разное время. В большинстве случаев, когда лекарственные средства вводят индивидуумам в разное время, им, как правило, проводят введение так, чтобы терапевтические эффекты этих средств перекрывались в течение некоторого периода времени. Специалисту в данной области известно, как использовать антиген-связывающие полипептиды по настоящему изобретению для целей диагностики, мониторинга или терапии.
Перед применением у человека способы лечения воспалительного, иммунного или злокачественного заболевания, состояния или нарушения, включающие введение антиген-связывающего полипептида, его варианта или производного, по изобретению, как правило, тестируют in vitro, а затем in vivo в приемлемой модели на животных, в отношении желаемой терапевтической или профилактической активности. Подходящие модели на животных, включая трансгенных животных, хорошо известны специалистам в данной области. Например, анализы in vitro для демонстрации терапевтической применимости антиген-связывающего полипептида, описанного в настоящем документе, включают эффект антиген-связывающего полипептида на клеточную линию или образец ткани пациента. Эффект антиген-связывающего полипептида на клеточную линию и/или образец ткани можно определять с использованием способов, известных специалистам в данной области, таких как анализы, описанные в настоящем документе. В соответствии с изобретением, анализы in vitro, которые можно использовать для определения того, является ли показанным введение конкретного антиген-связывающего полипептида, включают анализы в культуре клеток in vitro, в которых образец ткани пациента выращивают в культуре и подвергают воздействию соединения или иным образом применяют соединение, и наблюдают эффект такого соединения на образец ткани.
Композиции
Известны различные системы для доставки, и их можно использовать для введения антиген-связывающего полипептида по изобретению или полинуклеотида, кодирующего антиген-связывающий полипептид по изобретению, например, инкапсулирование в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать соединение, рецептор-опосредуемый эндоцитоз (см., например, Wu and Wu, 1987, J. Biol. Chem. 262:4429-4432), конструирование нуклеиновой кислоты в качестве части ретровирусного или другого вектора и т.д.
В следующем варианте осуществления композиции по изобретению вводят в сочетании с антивирусным средством, антибактериальным или антибиотическим средством или противогрибковыми средствами. Любое из этих средств, известное в данной области, можно вводить в композициях по настоящему изобретению.
В дополнительном варианте осуществления композиции по изобретению вводят самостоятельно или в сочетании с противовоспалительным средством. Противовоспалительные средства, которые можно вводить с композициями по изобретению, включают, но ими не ограничиваются, глюкокортикоиды и нестероидные противовоспалительные средства, производные аминоарилкарбоновой кислоты, производные арилуксусной кислоты, производные арилмасляной кислоты, арилкарбоновые кислоты, производные арилпропионовой кислоты, пиразолы, пиразолоны, производные салициловой кислоты, тиазинкарбоксамиды, e-ацетамидокапроевую кислоту, S-аденозилметионин, 3-амино-4-гидроксимасляную кислоту, амиксетрин, бендазак, бензидамин, буколом, дифенпирамид, дитазол, эморфазон, гвайазулен, набуметон, нимезулид, орготеин, оксацепрол, паранилин, перизоксал, пифоксим, проквазон, проксазол и тенидап.
В другом варианте осуществления композиции по изобретению вводят в сочетании с химиотерапевтическим средством. Химиотерапевтические средства, которые можно вводить с композициями по изобретению, включают, но ими не ограничиваются, производные антибиотиков (например, доксорубицин, блеомицин, даунорубицин и дактиномицин); антиэстрогены (например, тамоксифен); антиметаболиты (например, фторурацил, 5-FU, метотрексат, флоксуридин, интерферон альфа-2b, глутаминовая кислота, пликамицин, меркаптопурин и 6-тиогуанин); цитотоксические средства (например, кармустин, BCNU, ломустин, CCNU, цитозина арабинозид, циклофосфамид, эстрамустин, гидроксимочевина, прокарбазин, митомицин, бусульфан, цисплатин и винкристина сульфат); гормоны (например, медроксипрогестерон, эстрамустина натрия фосфат, этинил эстрадиол, эстрадиол, магестрола ацетат, метилтестостерон, диэтилстилбестрола дифосфат, хлортрианизен и тестолактон); производные азотистых ипритов (например, мефален, хлорамбуцил, мехлорэтамин (азотистый иприт) и тиотепа); стероиды и их комбинации (например, бетаметазона натрия фосфат); и другие (например, дикарбазин, аспарагиназа, митотан, винкристина сульфат, винбластина сульфат и этопозид).
В другом варианте осуществления композиции по изобретению вводят в комбинации с цитокинами. Цитокины, которые можно вводить с композициями по изобретению, включают, но ими не ограничиваются, IL-2, IL-3, IL-4, IL-5, 1L-6, IL-7, IL-10, IL-12, IL-13, IL-15, anti-CD40, CD40L и TNF-α.
В дополнительных вариантах осуществления композиции по изобретению вводят в комбинации с другими терапевтическими или профилактическими режимами, например, такими как лучевая терапия.
Также настоящее изобретение относится к фармацевтическим композициям. Такие композиции содержат терапевтически эффективное количество антиген-связывающего полипептида и фармацевтически приемлемый носитель. В конкретном варианте осуществления термин "фармацевтически приемлемый" означает одобренный регуляторным органом федерального или штатного правительства или приведенный в фармакопее США и других общепризнанных фармакопеях для применения у животных, и более конкретно у человека. Кроме того, "фармацевтически приемлемый носитель" обычно представляет собой нетоксичный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или добавку в состав любого типа.
Термин "носитель" относится к разбавителю, адъюванту, эксципиенту или переносчику, с которым вводят терапевтическое средство. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Вода является предпочтительным носителем, когда фармацевтическую композицию вводят внутривенно. Также в качестве жидких носителей можно использовать солевые растворы и водные растворы декстрозы и глицерина, в частности, для инъецируемых растворов. Подходящие фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропилен, гликоль, воду, этанол и т.п. Композиция, если желательно, также может содержать небольшие количества смачивающих веществ или эмульгаторов, или pH-буферных средств, таких как ацетаты, цитраты или фосфаты. Также предусматриваются антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; и средства для коррекции тоничности, такие как хлорид натрия или декстроза. Эти композиции могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, составов с замедленным высвобождением и т.п. Композиция может быть изготовлена в качестве суппозитория с традиционными связующими веществами и носителями, такими как триглицериды. Пероральный состав может включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и т.д. фармацевтической категории. Примеры подходящих фармацевтических носителей описаны в Remington's Pharmaceutical Sciences, E. W. Martin, включенной в настоящий документ в качестве ссылки. Такие композиции могут содержать терапевтически эффективное количество антиген-связывающего полипептида, предпочтительно, в очищенной форме, вместе с подходящим количеством носителя, так чтобы обеспечить форму для надлежащего введения пациенту. Состав должен соответствовать способу введения. Исходный состав может быть заключен в ампулы, одноразовые шприцы или флаконы для многократных доз, изготовленные из стекла или пластмассы.
В предпочтительном варианте осуществления композицию получают в соответствии с общепринятыми процедурами в качестве фармацевтической композиции, адаптированной для внутривенного введения человеку. Как правило, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. Если это необходимо, то композиция также может включать солюбилизирующее средство и местный анестетик, такой как лигнокаин, для облегчения боли в области инъекции. Как правило, ингредиенты предоставляют либо по отдельности, либо смешанными в единичную дозированную форму, например, в качестве сухого лиофилизированного порошка или не содержащего воды концентрата в герметично закрытом контейнере, таком как ампула или саше, на которых указано количество активного вещества. Если композиция подлежит введению путем инфузии, ее можно распределять с помощью бутыли для инфузии, содержащей стерильную воду или солевой раствор фармацевтической категории. Если композицию вводят путем инъекции, может быть предоставлена ампула стерильной воды для инъекции, или может быть предоставлен солевой раствор, так чтобы ингредиенты можно было смешивать перед введением.
Соединения по изобретению могут быть получены в качестве нейтральных или солевых форм. Фармацевтически приемлемые соли включают соли, образованные с анионами, такие как соли, образованные из хлористоводородной, фосфорной, уксусной, щавелевой, виннокаменной кислот и т.д. и соли, образованные с катионами, такими как катионы, образованные из натрия, калия, аммония, кальция, гидроксидов железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д.
ПРИМЕРЫ
Пример 1
Способ получения антител против LIGHT с использованием технологии гибридом
Мышей BALB/c иммунизировали рекомбинантным белком LIGHT (фрагмент внеклеточного домена, аминокислоты от Leu Ile Glu до Phe Met Val в последовательности с регистрационным номером Genbank No. AF036581). В типичной процедуре мышам подкожно инъецировали 10 мг белка в 50 мл полного адъюванта Фрейнда (Sigma, St. Louis, MO). От двух до четырех дополнительных инъекций в неполном адъюванте Фрейнда проводили с интервалами 2 недели, а последующую конечную вспомогательную инъекцию проводили в PBS. Альтернативно, инъекции можно проводить в подушечки лап. Через трое суток после конечной инокуляции мышей умерщвляли и их селезенки или подколенные лимфатические узлы собирали. Из селезенок или лимфатических узлов выделяли лимфоциты для слияния. Лимфоциты подвергали слиянию с клетками плазмацитомы P3X63Ag8.653 в соотношении лимфоцитов и клеток плазмацитомы 5:1 с использованием PEG/DMSO (Sigma) в качестве агента для слияния. После слияния клетки ресуспендировали в селективной среде HAT и высевали в количестве 106 клеток на лунке в 96-луночные планшеты. Супернатанты гибридомы, которые выжили после селекции на HAT, подвергали скринингу посредством ELISA прямого связывания в отношении присутствия связывающих LIGHT антител. Гибридомы, секретирующие связывающие LIGHT антитела, идентифицировали и их супернатанты далее подвергали скринингу посредством ELISA в отношении антител, которые ингибируют связывание LIGHT с его 3 известными рецепторами: HVEM, LTβR и DcR3. Затем гибридомы, идентифицированные в качестве положительных в отношении ингибирования связывания LIGHT, подвергали скринингу в отношении ингибирования опосредуемого LIGHT уничтожения клеток HT-29 для идентификации антагонистических антител против LIGHT.
Создавали панель моноклональных антител мыши и лучшие антитела мыши (например, 10D11, 5E10, 13C7, 14G8 и 18B1) отбирали для гуманизации на основе анализов связывания и ингибирования связывания LIGHT с рецепторами HVEM, LTβR и ловушкой DcR3 (фигура 3). Например, данные о связывания для антитела мыши 10D11 представлены в таблице 6 ниже.
IC-50 нМ
IC-50 нМ
IC-50 нМ
Клонирование и секвенирование VH- и VK-доменов мыши против LIGHT из гибридомных клеточных линий
Гибридомные клетки осаждали, промывали 3X посредством PBS и экстрагировали из них РНК с использованием реагента Trizol (Invitrogen, каталожный номер No. 15596-026) в соответствии с протоколом изготовителя. Общую РНК превращали в кДНК с использованием набора 5' RACE (Rapid Amplification of cDNA Ends, Invitrogen, каталожный номер No. 18374-058) в соответствии с протоколом изготовителей. В кратком изложении, РНК лигировали со случайным гексамерным праймером, Random N6, и 1 цепь кДНК получали с использованием негативной по РНК-азе H обратной транскриптазы superscript II. кДНК очищали с использованием кассеты для центрифугирования GlassMax, предоставляемой с набором, а затем подвергали реакции с TdT (терминальная дезоксинуклеотидилтрансфераза) в присутствии dCTP для присоединения к кДНК пар оснований C на 5'-конце. кДНК с dC-хвостом подвергали амплификации способом ПЦР с использованием якорного праймера, специфичного к dC-хвосту, и ген-специфического праймера, который гибридизуется с высоко консервативной последовательностью ДНК в константной области тяжелой цепи 1 (CH1) мыши для VH и константной области каппа (CK) мыши для VK. Полученный продукт ПЦР анализировали гель-электрофорезом в отношении правильного размера, соответствующего интактным доменам VH или VK, затем очищали и лигировали в вектор TOPO TA (Invitrogen, Carlsbad, CA, каталожный номер No. K4575-01) в соответствии с протоколом изготовителя. После трансформации в бактерии, из клонов, содержавших вставку правильного размера, получали ДНК, и последовательность ДНК определяли с использованием реакционной смеси для секвенирования Big Dye terminator (Applied Biosystems, серия No. 4336699) и анализатора ДНК 3700 ABI/Prism в соответствии с протоколом изготовителя.
Стратегия гуманизации антител
Одной из целей гуманизации антител против LIGHT было получение гуманизированных на 70-100% вариабельных доменов тяжелой цепи (VH) и вариабельных доменов легкой цепи (VK), которые сохраняют 90-100% от исходной аффинности и специфичности связывания.
Гуманизацию проводили пересадкой CDR и анализом на основе структуры, и изменением поверхности вариабельной области. (См. Jones et al., NATURE (1986) May 29-Jun. 4; 321(6069):522-5; Roguska et al., PROTEIN ENGINEERING, 1996, 9(10):895-904; и Studnicka et al., Humanizing Mouse Antibody Frameworks While Preserving 3-D Structure. PROTEIN ENGINEERING, 1994, Vol.7, pg 805). Для идентификации ключевых остатков каркасной области, требуемых для поддержания аффинности и специфичности связывания, использовали первичную последовательность антитела и данные о 3-D-структуре. Для идентификации наибольшего совпадения с областями VH и VK мыши, используемыми в этом исследовании использовали web-сайт "Blast for Ig sequences", спонсируемый NCBI. Эмбриональные гены VH и VK человека были выбраны в качестве наилучшим образом соответствующих последовательностям VH и VK мыши. Альтернативно, последовательности из экспрессируемого в природе репертуара антител человека можно использовать в качестве матрицы для гуманизации либо отдельно, либо в комбинации с наилучшим образом соответствующим эмбриональным геном человека.
После выравнивания вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела против LIGHT мыши с ближайшими эмбриональными последовательностями человека или экспрессируемым набором генов, аминокислоту в каждом положении оценивали в отношении потенциального влияния на связывание и иммуногенность. Эту информацию использовали для присвоения уровня низкого, умеренного или высокого риска для мутации в каждом положении.
Для конструирования гуманизированных антител 10D11, 5E10, 14G8 и 18B1, например, большинство положений низкого, умеренного или высокого риска подвергали одновременной мутации с получением конечных гуманизированных антител.
Гуманизация антител мыши против LIGHT
Антитела против LIGHT мыши идентифицировали на основе данных о связывании и данных о последовательности, полученных, как описано выше. Аминокислотную последовательность доменов VH и VK из этих антител выравнивали с эмбриональными доменами VH и VK человека с использованием доступных в настоящее время общих баз данных (т.е., BLAST для IgG в NCBI и V-base в MRC). В положениях в каркасной области, где последовательность мыши отличалась от эмбриональной последовательности человека, использовали повторяющийся процесс для преобразования или мутации каркасной области человека так, чтобы она соответствовала соответствующей эмбриональной каркасной области человека. В случае, если аффинность связывания утрачивается вследствие определенных мутаций в каркасной области, определенные аминокислотные остатки CDR как для VH, так и VK, можно подвергать мутации путем замены тирозином или другими подходящими аминокислотами (т.е., подвергнутыми созреванию аффинности) для компенсации этих потерь. Подвергнутые созреванию аффинности и гуманизированные домены VH и VK мыши можно получать способом полимеразной цепной реакции с использованием панели перекрывающихся синтетических ДНК-олигонуклеотидов. Аминокислотные последовательности вариабельного домена тяжелой цепи и вариабельного домена легкой цепи моноклональных антител мыши против LIGHT, которые гуманизировали, как описано в настоящем документе, представлены ниже в таблицах 7 и 8. CDR-части вариабельных доменов подчеркнуты.
Аминокислотная последовательность вариабельных доменов тяжелой цепи антител мыши против LIGHT
VH
VH
VH
VH
VH
Аминокислотная последовательность вариабельных доменов легкой цепи антител мыши против LIGHT
VK
VK
VK
VK
VK
В качестве части процесса конструирования синтетического гена использовали стратегию оптимизации кодонов. В каждое положение VH и VK включали триплетный код для каждой аминокислоты, который, предпочтительно, используется клетками млекопитающих для экспрессии гена. Затем синтетические домены VH и VK клонировали в специализированные векторы экспрессии млекопитающих, которые позволяют экспрессию соответствующих доменов VH и VK в контексте полностью человеческих каркасов антител IgG1, G4 или каппа. Мелкомасштабную продукцию гуманизированных антител обеспечивали путем котрансфекции конструкции IgG1 или G4 с конструкцией Kappa в клетки 293F с помощью липофектамина (Invitrogen, Carlsbad, CA) в соответствии с протоколом изготовителя. Супернатанты после временной трансфекции пропускали через смолу с белком A или G и IgG очищали до гомогенного состояния для тестирования в клеточных анализах.
Аминокислотные последовательности вариабельных доменов тяжелой цепи и вариабельных доменов легкой цепи характерного гуманизированного моноклонального антитела мыши против LIGHT получали, как описано в настоящем документе выше в таблицах 2 и 4.
Пример 2
В этом примере описан протокол анализа для измерения ингибирования индуцируемого LIGHT уничтожения клеток HT-29, и он основан на активности LIGHT в отношении индукции апоптоза в клетках HT-29. Клетки HT-29 открепляли трипсинизацией и промывали два раза средой RPMI с 10% FBS и ресуспендировали в количестве 1×106 клеток/мл в среде RPMI с 1% FBS. Клетки предварительно обрабатывали 100 нг/мл IFN-γ при 37°C в течение 6 часов. Получали различные концентрации серийно разбавленного (4X) в 5 раз антитела против LIGHT, LTβR-Fc и контроль-Fc, начиная с 40 г/мл. 25 мкл 4X реагентов переносили в 96-луночный планшет в трех экземплярах и 25 мкл LIGHT в количестве 400 нг/мл (4X) добавляли и инкубировали в течение 15 минут при комнатной температуре. LIGHT человека, а также LIGHT яванского макака использовали в отдельных экспериментах. См., например, фигуры 9A и B. Добавляли 50 мкл 1×106/мл клеток HT-29 (предварительно инкубированных с IFN-γ) и культивировали в течение 72 ч в инкубаторе для культивирования клеток. Жизнеспособность клеток определяли путем добавления 100 мкл реагента Cell Titer Glo (Promega). Люминесценцию считывали с помощью флуориметра Victor2 (Perkin-Elmer, Waltham, MA). Результаты применения этого анализа с различными антителами против LIGHT представлены на фигурах 5A-C, 9A и 9B.
Пример 3
В этом примере описан протокол анализа для определения связывания антитела LIGHT с LIGHT, экспрессированным на поверхности активированных T-клеток, проточной цитометрией. Поляризованные Th1-, Th2- и Th17-клетки активировали посредством 50 нг/мл PMA и 0,5 мкг/мл иономицина в течение ночи при 37°С. Один миллион активированных T-клеток переносили в 5-мл пробирки для FACS и центрифугировали при 1200 об./мин. в течение 5 минут. Клеточный осадок ресуспендировали в буфере для окрашивания FACS и инкубировали с антителом против LIGHT или контрольным антителом при комнатной температуре в течение 40 минут. После промывания два раза посредством 2 мл PBS, клетки инкубировали с конъюгированными с PE вторичными реагентами в течение 1 часа. Клетки промывали 3 раза посредством 2 мл PBS и ресуспендировали в 0,5 мл PBS и анализировали проточной цитометрией. Результаты использования этого анализа представлены на фигурах 10A и B.
Объем настоящего изобретения не ограничивается конкретными описанными вариантами осуществления, которые представлены в качестве отдельных иллюстраций отдельных аспектов изобретения, и любые композиции или способы, которые являются функционально эквивалентными, находятся в объеме этого изобретения. Специалистам в данной области, очевидно, что различные модификации и изменения можно вносить в способы и композиции по настоящему изобретению без отклонения от сущности или объема изобретения. Таким образом, подразумевается, что настоящее изобретение охватывает модификации и варианты этого изобретения, при условии, что они находятся в объеме прилагаемой формулы изобретения и ее эквивалентов.
Все публикации и патентные заявки, упомянутые в этом описании, включены в настоящий документ в качестве ссылок в той же степени, как если бы каждая отдельная публикация или патентная заявка были конкретно и индивидуально указаны, как включенные в качестве ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОДНОЛИНКЕРНЫЕ АНТИТЕЛА FabFv И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2714159C2 |
| ГУМАНИЗАЦИЯ АНТИТЕЛ КРОЛИКА С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАРКАСА АНТИТЕЛА | 2018 |
|
RU2696202C1 |
| ГУМАНИЗАЦИЯ АНТИТЕЛ КРОЛИКА С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАРКАСА АНТИТЕЛА | 2014 |
|
RU2652907C2 |
| ГУМАНИЗАЦИЯ АНТИТЕЛ КРОЛИКА С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАРКАСА АНТИТЕЛА | 2009 |
|
RU2567006C2 |
| СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2470941C2 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2011 |
|
RU2605928C2 |
| КОНСТРУКЦИИ, НАПРАВЛЕННЫЕ НА КОМПЛЕКСЫ ПЕПТИДА AFP/МНС, И ВИДЫ ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2754041C2 |
| АНТИТЕЛА ПРОТИВ СИГЛЕКА-15 ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С ПОТЕРЕЙ КОСТНОЙ МАССЫ | 2010 |
|
RU2596392C2 |
| АНТИТЕЛА ПРОТИВ KIT И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2681730C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2610663C2 |



































































































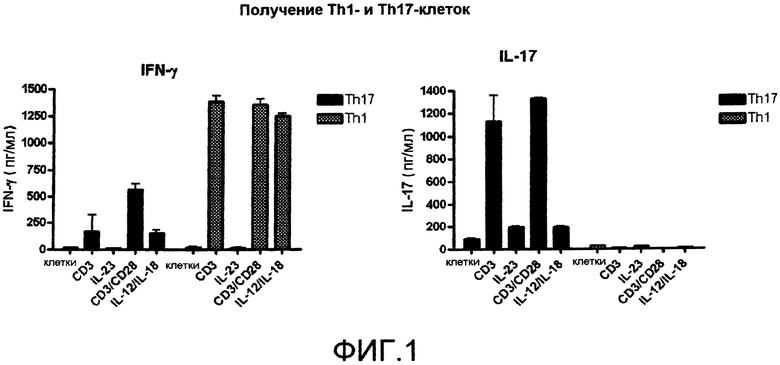





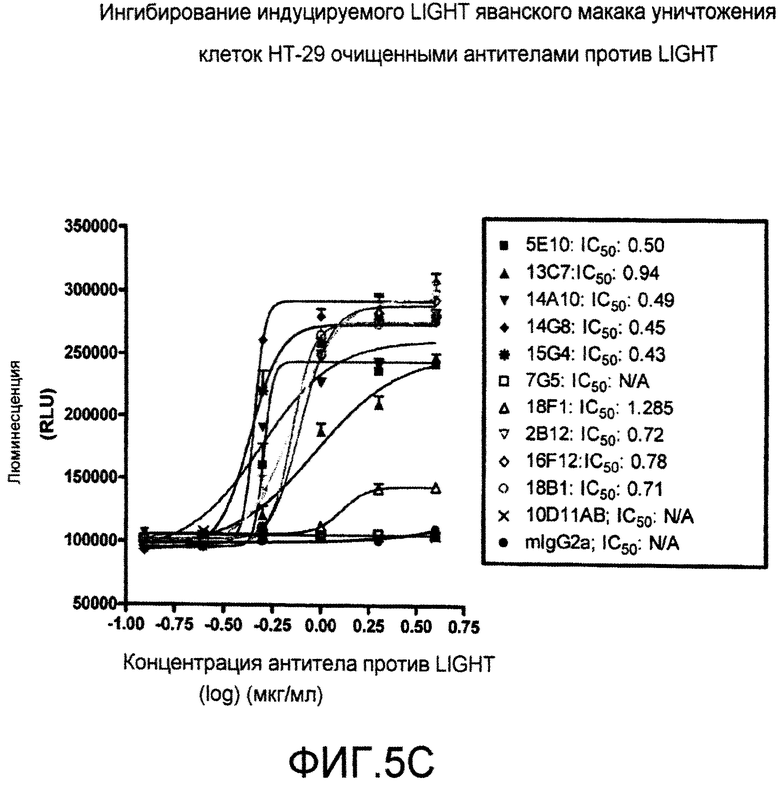



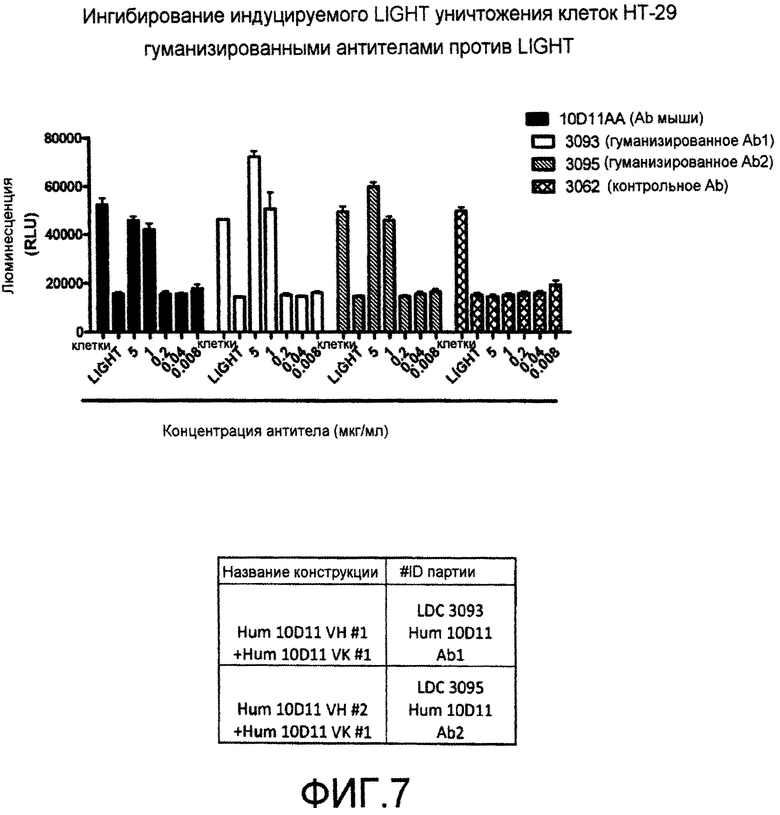



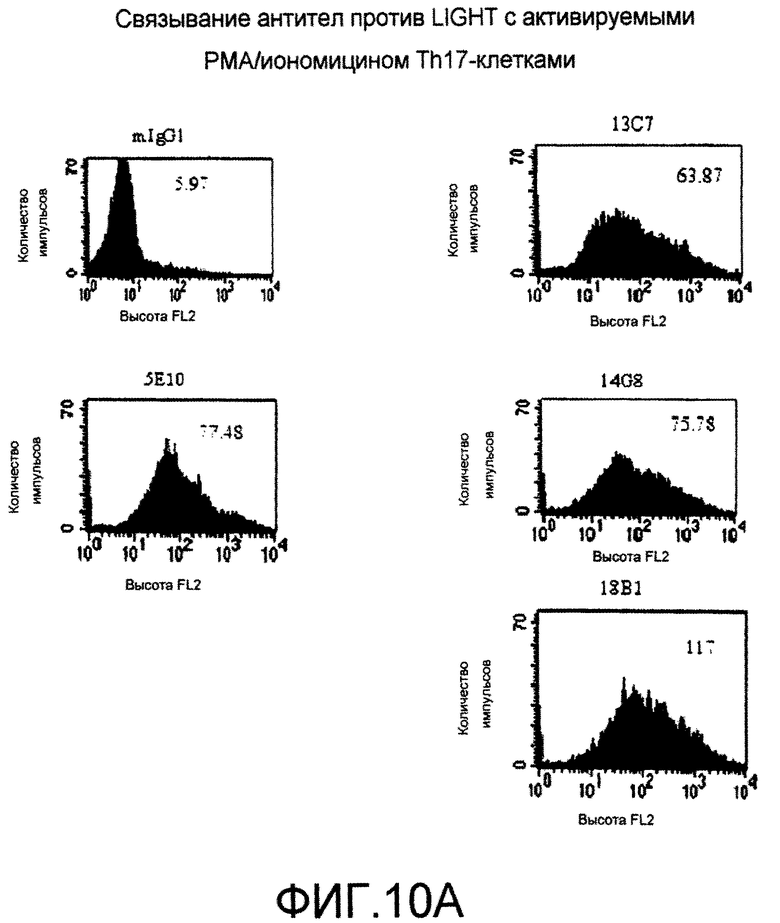
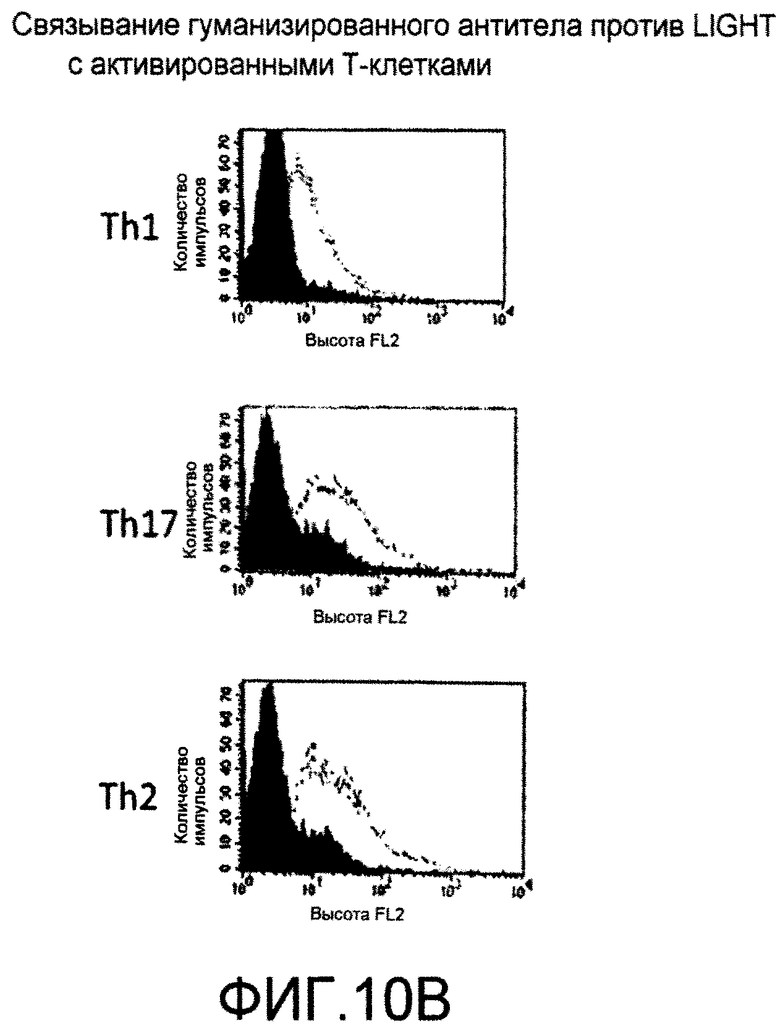




Изобретение относится к биотехнологии. Предложены варианты антиген-связывающего полипептида, специфичного к полипептиду LIGHT, характеризующиеся наличием вариабельной области тяжелой и легкой цепей, а также варианты конъюгатов на их основе для лечения заболевания или состояния. Описана фармацевтическая композиция для ингибирования апоптоза, индуцированного LIGHT человека, на основе терапевтически эффективного количества полипептида. Раскрыты: способ лечения или диагностики заболевания или состояния на основе композиции. Описаны варианты выделенного полинуклеотида и клетка, трансформированная полинуклеотидом, для получения антиген-связывающего полипептида, а также способ получения антиген-связывающего полипептида на основе клетки. Использование изобретения обеспечивает антитела, которые блокируют взаимодействие LIGHT человека или макаки с рецепторами LIGHT, что может найти применение в лечении различных заболеваний, связанных с повышенной активностью Т-клеток. 11 н. и 12 з.п. ф-лы, 11 ил., 8 табл., 3 пр.
1. Антиген-связывающий полипептид, который специфично связывается с полипептидом LIGHT, содержащий:
(А) вариабельную область тяжелой цепи гуманизированного антитела, содержащую:
(1) CDR-H1, которая содержит аминокислотную последовательность SYYIH (SEQ ID NO:23);
(2) CDR-H2, которая содержит аминокислотную последовательность WIFPGSDITKYNEKFKG (SEQ ID NO:24); и
(3) CDR-H3, которая содержит аминокислотную последовательность EDYGISTYSAMDF (SEQ ID NO:25); и
(В) вариабельную область легкой цепи гуманизированного антитела, содержащую:
(1) CDR-L1, которая содержит аминокислотную последовательность KASQDVGTAVA (SEQ ID NO:43);
(2) CDR-L2, которая содержит аминокислотную последовательность WASTRHT (SEQ ID NO:44); и
(3) CDR-L3, которая содержит аминокислотную последовательность QQYSSYPLT (SEQ ID NO:45).
2. Антиген-связывающий полипептид по п.1, где вариабельная область тяжелой цепи гуманизированного антитела содержит аминокислотную последовательность:
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYIHWVRQAPGQRLEWMGWIFPGSDITKYNEKFKGRVTITRDTSASTAYMELSSLRSEDTAVYYCAREDYGISTYSAMDFWGQGTLVTVSS (SEQ ID NO:4).
3. Антиген-связывающий полипептид по п.1, где вариабельная область легкой цепи гуманизированного антитела содержит аминокислотную последовательность:
DIQLTQSPSFLSASVGDRVTITCKASQDVGTAVAWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQYSSYPLTFGQGTKVEIKR (SEQ ID NO:12).
4. Антиген-связывающий полипептид, который специфично связывается с LIGHT, содержащий гуманизированную тяжелую цепь по п.2 и гуманизированную легкую цепь по п.3.
5. Антиген-связывающий полипептид по любому из пп.1-4, где антиген-связывающий полипептид выбран из группы, состоящей из молекулы антитела, Fab-фрагмента, Fab'-фрагмента, F(ab')2-фрагмента и молекулы scFv.
6. Антиген-связывающий полипептид по п.5, содержащий:
(a) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность: QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYIHWVRQAPGQRLEWMGWIFPGSDITKYNEKFKGRVTITRDTSASTAYMELSSLRSEDTAVYYCAREDYGISTYSAMDFWGQGTLVTVSS (SEQ ID NO:4); и
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность: DIQLTQSPSFLSASVGDRVTITCKASQDVGTAVAWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQYSSYPLTFGQGTKVEIKR (SEQ ID NO:12).
7. Антиген-связывающий полипептид по п.6, где молекула антитела содержит константную область тяжелой цепи человека и константную область легкой цепи человека.
8. Антиген-связывающий полипептид по п.6, где молекула антитела представляет собой молекулу IgG.
9. Антиген-связывающий полипептид по п.7, где молекула антитела представляет собой молекулу IgG.
10. Антиген-связывающий полипептид по п.5, где:
(a) антиген-связывающий полипептид представляет собой молекулу scFv; или
(b) антиген-связывающий полипептид представляет собой слитую молекулу scFv-HSA; или
(c) антиген-связывающий полипептид представляет собой слитую молекулу Fab-HSA.
11. Антиген-связывающий полипептид по п.10, где:
(a) молекула scFv по п.10(a) содержит полипептид с формулой, выбранной из группы, состоящей из: (i) NH2-L-VH-X-VK-COOH и (ii) NH2-L-VK-X-VH-COOH; где L представляет собой лидерную последовательность; VH представляет собой вариабельную область тяжелой цепи гуманизированного антитела; X представляет собой линкерный полипептид; и VK представляет собой вариабельную область легкой цепи гуманизированного антитела;
(b) scFv-часть слитой молекулы scFv-HSA по п.10(b) экспрессируется на N-конце HSA и полипептид имеет формулу, выбранную из группы, состоящей из: (i) NH2-L-VH-X-VK-HSA-COOH и (ii) NH2-L-VK-X-VH-HSA-COOH, где L представляет собой лидерную последовательность; VH представляет собой вариабельную область тяжелой цепи гуманизированного антитела; X представляет собой линкерный полипептид; HSA представляет собой сывороточный альбумин человека; и VK представляет собой вариабельную область легкой цепи гуманизированного антитела;
(c) scFv-часть слитой молекулы scFv-HSA по п.10(b) экспрессируется на C-конце HSA и полипептид имеет формулу, выбранную из группы, состоящей из: (i) NH2-HSA-VH-X-VK-COOH и (ii) NH2-HSA-VK-X-VH-COOH, где L представляет собой лидерную последовательность; VH представляет собой вариабельную область тяжелой цепи гуманизированного антитела; X представляет собой линкерный полипептид; HSA представляет собой сывороточный альбумин человека; и VK представляет собой вариабельную область легкой цепи гуманизированного антитела;
(d) антиген-связывающий полипептид по п.10(c), где часть тяжелой цепи слитой молекулы Fab-HSA экспрессируется на N- или C-конце HSA и полипептид имеет формулу, выбранную из группы, состоящей из: (i) NH2-VH-CH1-HSA-COOH и (ii) NH2-HSA-VH-CH1-COOH, где VH представляет собой вариабельную область тяжелой цепи гуманизированного антитела; CH1 представляет собой константный домен тяжелой цепи 1; и HSA представляет собой сывороточный альбумин человека; или
(e) антиген-связывающий полипептид по п.10(c), где часть легкой цепи слитой молекулы Fab-HSA экспрессируется на N- или C-конце HSA и полипептид имеет формулу, выбранную из группы, состоящей из: (i) NH2-VK-CK-HSA-COOH и (ii) NH2-HSA-VK-CK-COOH, где VK представляет собой вариабельную область легкой цепи гуманизированного антитела; CK представляет собой константный домен легкой цепи; и HSA представляет собой сывороточный альбумин человека.
12. Антиген-связывающий полипептид по любому из пп.1-4, конъюгированный с терапевтическим средством, выбранным из группы, состоящей из цитотоксического средства; радиоактивной метки; иммуномодулятора; гормона; фермента; олигонуклеотида; фотоактивного терапевтического средства; и их комбинации; и где конъюгат предназначен для лечения заболевания или состояния, выбранного из группы, состоящей из воспалительного заболевания или состояния, иммунного заболевания или состояния, злокачественного заболевания или состояния, аутоиммунного заболевания; воспалительного заболевания кишечника (IBD); хронического обструктивного заболевания легких (COPD); артрита; ревматоидного артрита; рассеянного склероза; отторжения трансплантата; реакции "трансплантат против хозяина" (GVHD); повреждения центральной нервной системы; Th1-опосредуемых заболеваний кишечника; болезни Крона; псориаза; лейкоза; лимфомы; хронического лимфоцитарного лейкоза; атеросклероза; карциномы легкого; карциномы толстого кишечника и гепатита.
13. Антиген-связывающий полипептид по любому из пп.1-4, конъюгированный с диагностическим средством, выбранным из группы, состоящей из радиоактивной метки; фотоактивного диагностического средства; усиливающего действие ультразвука средства; и нерадиоактивной метки; и
где конъюгат предназначен для лечения заболевания или состояния, выбранного из группы, состоящей из воспалительного заболевания или состояния, иммунного заболевания или состояния, злокачественного заболевания или состояния, аутоиммунного заболевания; воспалительного заболевания кишечника (IBD); хронического обструктивного заболевания легких (COPD); артрита; ревматоидного артрита; рассеянного склероза; отторжения трансплантата; реакции "трансплантат против хозяина" (GVHD); повреждения центральной нервной системы; Th1-опосредуемых заболеваний кишечника; болезни Крона; псориаза; лейкоза; лимфомы; хронического лимфоцитарного лейкоза; атеросклероза; карциномы легкого; карциномы толстого кишечника и гепатита.
14. Антиген-связывающий полипептид по любому из пп.1-4, где:
(a) полипептид представляет собой антагонист LIGHT; или
(b) полипептид не является агонистом LIGHT.
15. Антиген-связывающий полипептид по любому из пп.1-4, где полипептид связывается с LIGHT с Kd, предпочтительно от приблизительно 108 M-1 до приблизительно 1010 M-1.
16. Фармацевтическая композиция для ингибирования апоптоза, индуцированного LIGHT человека, содержащая терапевтически эффективное количество антиген-связывающего полипептида по любому из пп.1-14 и фармацевтически приемлемый носитель.
17. Фармацевтическая композиция по п.16, кроме того, содержащая дополнительное терапевтическое или диагностическое средство.
18. Способ лечения заболевания или состояния, включающий введение композиции по п.16 или 17 пациенту, нуждающемуся в этом, где заболевание или состояние выбрано из группы, состоящей из воспалительного заболевания или состояния, иммунного заболевания или состояния, злокачественного заболевания или состояния, аутоиммунного заболевания; воспалительного заболевания кишечника (IBD); хронического обструктивного заболевания легких (COPD); артрита; ревматоидного артрита; рассеянного склероза; отторжения трансплантата; реакции "трансплантат против хозяина" (GVHD); повреждения центральной нервной системы; Th1-опосредуемых заболеваний кишечника; болезни Крона; псориаза; лейкоза; лимфомы; хронического лимфоцитарного лейкоза; атеросклероза; карциномы легкого; карциномы толстого кишечника и гепатита.
19. Способ диагностики заболевания или состояния, включающий введение композиции по п.16 или 17 пациенту, нуждающемуся в этом, где заболевание или состояние выбрано из группы, состоящей из воспалительного заболевания или состояния, иммунного заболевания или состояния, злокачественного заболевания или состояния, аутоиммунного заболевания; воспалительного заболевания кишечника (IBD); хронического обструктивного заболевания легких (COPD); артрита; ревматоидного артрита; рассеянного склероза; отторжения трансплантата; реакции "трансплантат против хозяина" (GVHD); повреждения центральной нервной системы; Th1-опосредуемых заболеваний кишечника; болезни Крона; псориаза; лейкоза; лимфомы; хронического лимфоцитарного лейкоза; атеросклероза; карциномы легкого; карциномы толстого кишечника и гепатита.
20. Выделенный полинуклеотид, кодирующий любой из антиген-связывающих полипептидов по пп.1-15.
21. Выделенный полинуклеотид, содержащий промоторную последовательность, функционально связанную с полинуклеотидом по п.20, для получения антиген-связывающего полипептида по любому из пп.1-15.
22. Выделенная клетка, трансформированная полинуклеотидом по п.20 или 21, для получения антиген-связывающего полипептида по любому из пп.1-15.
23. Способ получения антиген-связывающего полипептида, кодируемого полинуклеотидом по п.20 или 21, включающий:
a) культивирование клетки по п.22, трансформированной полинуклеотидом по п.20 или 21, для экспрессии кодируемого антиген-связывающего полипептида; и
b) выделение антиген-связывающего полипептида по любому из пп.1-15, экспрессированного таким образом.
| WO2008027338 A2, 06.03.2008 | |||
| WO2003089575 A2, 30.10.2003 | |||
| РОЙТ и др., "Иммунология", пер | |||
| с англ.-М.: Мир, 2000, стр.111, 150 |
Авторы
Даты
2015-02-20—Публикация
2010-03-22—Подача