Настоящее изобретение относится к некоторым мультиспецифическим конструкциям, фармацевтическим составам, содержащим эти конструкции, к ДНК, кодирующим конструкции, и к векторам, содержащим конструкции. Изобретение также относится к способам экспрессии конструкций, например, в клетке-хозяине, и к способам получения фармацевтических композиций, содержащих указанные конструкции. Кроме того, изобретение также относится к способам применения конструкций и составов для лечения.
В WO 2009/040562 и WO 2010/035012 описаны некоторые биспецифические молекулы, которые можно использовать в качестве терапевтических средств, известные как Fab-Fv, или Fab-dsFv, соответственно. Молекулы такого типа обладают высоким сродством связывания к антигенам, в отношении которых они специфичны, и в таком формате никакой существенной окклюзии антигенсвязывающих участков не происходит. Хотя высокий процент этих молекул антител экспрессируется в виде функционального мономера, часть их образует агрегаты, из которых нужно выделять мономер.
Авторы настоящего изобретения реконструируют указанные молекулы с получением молекул, обладающих такими же функциональными характеристиками при минимизации агрегации на стадии экспрессии, что таким образом, существенно повышает выход мономера.
В одном из вариантов осуществления изобретение относится к молекуле мультиспецифического антитела, содержащей или состоящей из трех полипептидов:
а) полипептидной цепи формулы (I):
(Vxx)nVx-Cx-X-V1; и
b) полипептидной цепи формулы (II):
(Vyy)nVy-Cy;
c) полипептида формулы (III):
V2,
где
Vx обозначает вариабельный домен,
Vxx обозначает вариабельный домен,
Cx обозначает домен константной области,
Х обозначает линкер,
V1 обозначает вариабельный домен,
Vy обозначает вариабельный домен,
Vyy обозначает вариабельный домен,
Cy обозначает домен константной области,
V2 обозначает вариабельный домен,
n независимо равен 0 или 1,
и где полипептидную цепь формулы (I) и полипептидную цепь формулы (II) выравнивают таким образом, чтобы происходило спаривание константных областей Cx и Cy и вариабельных доменов Vx и Vy с образованием связывающего домена и, необязательно, дисульфидной связи между V1 и V2, в частности, если дисульфидная связь присутствует.
В одном из вариантов осуществления Vxx и Vyy также спариваются с образованием связывающего домена.
В одном из вариантов осуществления между V1 и V2 присутствует дисульфидная связь.
В одном из вариантов осуществления изобретение относится к молекуле биспецифического антитела, содержащей или состоящей из трех полипептидов:
a) тяжелой цепи формулы (Ia):
VH-CH1-X-V1; и
b) легкой цепи формулы (IIa):
VL-CL;
c) полипептида формулы (III):
V2;
где
VH обозначает вариабельный домен тяжелой цепи,
CH1 обозначает домен 1 константной области тяжелой цепи,
Х обозначает линкер,
V1 обозначает вариабельный домен,
VL обозначает вариабельный домен легкой цепи,
CL обозначает константную область легкой цепи,
V2 обозначает вариабельный домен,
где между V1 и V2, необязательно, присутствует дисульфидная связь, в частности, если дисульфидная связь присутствует.
В одном из вариантов осуществления изобретение относится к молекуле биспецифического антитела, содержащей или состоящей из трех полипептидов:
a) тяжелой цепи формулы (Ib):
VH-CH1; и
b) легкой цепи формулы (IIb):
VL-CL-X-V2;
c) полипептида формулы (III):
V1;
где
VH обозначает вариабельный домен тяжелой цепи,
CH1 обозначает домен 1 константной области тяжелой цепи,
Х обозначает линкер,
V1 обозначает вариабельный домен,
VL обозначает вариабельный домен легкой цепи,
CL обозначает константную область легкой цепи,
V2 обозначает вариабельный домен,
где между V1 и V2, необязательно, присутствует дисульфидная связь, в частности, если дисульфидная связь присутствует.
В одном из вариантов осуществления между V1 и V2 присутствует дисульфидная связь.
Предпочтительно, конструкция по настоящему изобретению сводит к минимуму количество агрегатов, образующихся в процессе экспрессии, и делает максимальным количество полученного мономера, которое может составлять, например, 50%, 60%, 70%, 75% или больше, например, 80, 90% или более от количества экспрессированного белка.
Краткое описание чертежей
На фигуре 1 показаны разные последовательности конструкций Fab-Fv по настоящему изобретению, содержащие один линкер, и последовательности сравнения Fabdsscfv и FabdsFv.
На фигуре 2 показаны результаты анализа SDS-PAGE разных конструкций.
На фигуре 3 показаны результаты анализа гель-хроматографии разных конструкций.
На фигуре 4 приведено схематическое изображение примеров разных конструкций по настоящему изобретению.
На фигуре 5 показана временная экспрессия конструкций Fab-dsFv, содержащих один линкер, экспрессируемых плазмидами, несущими три гена, в клетках СНО.
На фигуре 6 показаны результаты анализа SDS-PAGE разных конструкций Fab-dsFv, содержащих один линкер, экспрессируемых плазмидами, несущими три гена.
На фигуре 7 показаны результаты анализа гель-хроматографии разных конструкций Fab-dsFv, содержащих один линкер, экспрессируемых плазмидами, несущими три гена.
Подробное описание изобретения
Термин мультиспецифическое антитело в настоящем описании относится к раскрытой в настоящем описании молекуле антитела, которая содержит два или более связывающих доменов, например, два или три связывающих домена. В одном из вариантов осуществления конструкция представляет собой триспецифическое антитело. Термин триспецифическая молекула в настоящем описании относится к молекуле, содержащей три антигенсвязывающих участка, которые могут независимо друг от друга связывать одинаковые или разные антигены.
В одном из вариантов осуществления конструкция представляет собой биспецифическое антитело. Термин биспецифическая молекула в настоящем описании относится к молекуле, содержащей два антигенсвязывающих участка, которые могут связывать одинаковые или разные антигены.
В одном из вариантов осуществления все домены связываются с одним и тем же антигеном, в том числе они могут связываться с одним эпитопом антигена, или с разными эпитопами одного антигена.
В одном из вариантов осуществления присутствуют три связывающих домена, причем каждый из трех связывающих доменов связывает разные (отличные друг от друга) антигены.
В одном из вариантов осуществления присутствуют три связывающих домена, и два связывающих домена связываются с одним и тем же антигеном, в том числе они могут связываться с одним и тем же эпитопом антигена, или с разными эпитопами одного антигена, а третий связывающий домен связывается с другим (отличающимся от вышеуказанного) антигеном.
В одном из вариантов осуществления настоящее изобретение относится к биспецифическому антителу, содержащему или состоящему из трех полипептидных цепей.
Мультиспецифические молекулы по настоящему изобретению присутствуют в виде димера тяжелой и легкой цепей:
формулы (I) и (II), соответственно, где часть Vx-Сх вместе с частью Vy-Cy образует функциональный фрагмент Fab или Fab', или, альтернативно,
формула (Ia) и (IIa), где часть VH-CH1 вместе с VL-CL образует функциональный фрагмент Fab или Fab'.
В одном из вариантов осуществления конструкция по настоящему изобретению содержит только два антигенсвязывающих участков.
Термин “антигенсвязывающий участок”, как используется в настоящем описании, относится к части молекулы, которая содержит пару вариабельных участков, в частности, родственную пару, которая специфически взаимодействует с антигеном-мишенью.
Конкретно, в настоящем описании этот термин используется для обозначения связывающего участка, который только распознает антиген, в отношении которого он специфичен, или связывающего участка, сродство которого к антигену, к которому он специфичен, значительно превышает сродство к антигенам, в отношении которого он не является специфичным, например, в 5, 6, 7, 8, 9, 10 раз.
Сродство связывания можно измерить стандартным анализом, например, поверхностным плазмонным резонансом, например, BIAcore.
В одном из вариантов осуществления в функциональном фрагменте Fab или Fab' присутствует одна или несколько природных или введенных рекомбинантным способом межцепочечных (т.е. между легкой и тяжелой цепями) дисульфидных связей.
В одном из вариантов осуществления "природная" дисульфидная связь присутствует между CH1 и CL, или между соответствующими компонентами Cx и Cy полипептидных цепей формул (I) и (II). Приведенные ниже ссылки на CH1 в равной степени могут относиться к Cx. Приведенные ниже ссылки на CL в равной степени могут относиться к Cy.
Если домен CL получают из цепи каппа или лямбда, то природным положением связь-образующего цистеина является положение 214 цепи cKappa и cLambda человека (нумерация Kabat, 4ое издание, 1987).
Точное расположение цистеина, образующего дисульфидную связь, в CH1, зависит от фактически используемого конкретного домена. Так, например, в цепи гамма-1 человека природным положением дисульфидной связи является положение 233 (нумерация Kabat, 4ое издание, 1987). Положение связь-образующего цистеина в молекулах других изотипов человека, таких как гамма 2, 3, 4, IgM и IgD, известно, например, в IgM, IgE, IgG2, IgG3, IgG4 человека указанный остаток цистеина находится в положении 127, а в тяжелой цепи IgD и IgA2B человека в положении 128.
Дисульфидная связь (связи) в константном домене молекулы может присутствовать в дополнение к необязательной дисульфидной связи между парой вариабельных доменов V1 и V2.
В одном из вариантов осуществления мультиспецифическое антитело по настоящему изобретению содержит дисульфидную связь в положении, эквивалентном или соответствующем природному положению, между CH1 и CL.
В одном из вариантов осуществления константный домен, содержащий CH1, и такой константный домен, как CL, содержат дисульфидную связь в положении, отличном от природного. Такую связь можно ввести в молекулу рекомбинантным способом, в том числе введение остатка (остатков) цистеина в аминокислотную цепь в нужное положение, или нужные положения. Такая неприродная дисульфидная связь является дополнением или альтернативой природной дисульфидной связи, присутствующей между CH1 и CL.
Остатки цистеина можно вводить с помощью любых рекомбинантных методов, известных в данной области. Такие методы включают, без ограничения, мутагенез методом ПЦР с удлинением и перекрыванием, направленный мутагенез или кассетный мутагенез (общие сведения можно найти в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, NY, 1989; Ausbel et al., Current Protocols in Molecular Biology, Greene Publishing & Wiley-Interscience, NY, 1993). Наборы для направленного мутагенеза являются коммерчески доступными, например, набор для направленного мутагенеза QuikChange® Stratagene, La Jolla, CA). Кассетный мутагенез можно проводить по методу Wells et al., 1985, Gene, 34:315-323. Альтернативно, мутанты могут быть получены путем полного синтеза гена с последующим отжигом, лигированием, ПЦР-амплификацией и клонированием перекрывающихся олигонуклеотидов.
В одном из вариантов осуществления дисульфидная связь между CH1 и CL полностью отсутствует, например, остатки цистеина, образующие межцепочечную связь, могут быть заменены другой аминокислотой, такой как серин. В результате межцепочечные дисульфидные связи в функциональном фрагменте Fab молекулы не образуются. В WO 2005/003170, который включен в настоящий документ в качестве ссылки, описаны способы получения фрагментов Fab, не содержащих межцепочечную дисульфидную связь.
В одном из вариантов осуществления n равен 1 в полипептидной цепи формулы (I).
В одном из вариантов осуществления n равен 1 в полипептидной цепи формулы (II).
В одном из вариантов осуществления n равен 1 в полипептидной цепи формулы (I) и (II).
В одном из вариантов осуществления n равен 0 в полипептидной цепи формулы (I) и (II).
Vxx может быть получен из вариабельного домена тяжелой цепи, вариабельного домена легкой цепи, или их сочетания, и может содержать аминокислотный линкер размером от 1 до 20 аминокислот, например, как описано ниже. В одном из вариантов осуществления Vxx включает вариабельный домен, в частности, вариабельны домен, полученный из тяжелой цепи. В одном из вариантов осуществления Vxx обозначает вариабельный домен легкой цепи. В одном из вариантов осуществления Vxx обозначает химерный вариабельный домен, то есть содержит компоненты, полученные, по меньшей мере, из двух видов, например, каркасный участок человека и CDR не являющийся человеческим. В одном из вариантов осуществления Vxx является гуманизированным.
Vx может быть получен из вариабельного домена тяжелой цепи, вариабельного домена легкой цепи или их сочетания, предпочтительно, из вариабельного домена тяжелой цепи. В одном из вариантов осуществления Vx обозначает вариабельный домен легкой цепи. В одном из вариантов осуществления Vx обозначает химерный вариабельный домен, то есть, он содержит компоненты, полученные по меньшей мере из двух видов, например, каркасный участок человека и CDR не являющийся человеческим. В одном из вариантов осуществления Vx является гуманизированным.
Vx в полипептидах формулы (I) соответствует VH полипептидной цепи (Ia).
VH обозначает вариабельный домен, например, вариабельный домен тяжелой цепи. В одном из вариантов осуществления VH представляет собой вариабельный домен тяжелой цепи. В одном из вариантов осуществления VH обозначает химерный вариабельный домен, то есть, содержит компоненты, полученные по меньшей мере из двух видов, например, каркасный участок человека и CDR не являющийся человеческим. В одном из вариантов осуществления VH является гуманизированным.
V1 обозначает вариабельный домен, например, вариабельный домен тяжелой цепи или легкой цепи. В одном из вариантов осуществления V1 обозначает вариабельный домен тяжелой цепи. В одном из вариантов осуществления V1 обозначает вариабельный домен легкой цепи. В одном из вариантов осуществления V1 представляет собой химерный вариабельный домен, то есть, содержит компоненты, полученные по меньшей мере из двух видов, например, каркасный участок человека и CDR не являющийся человеческим. В одном из вариантов осуществления V1 является гуманизированным.
Vyy может быть получен из тяжелой цепи, легкой цепи, или их сочетания, и может содержать аминокислотный линкер от 1 до 20 аминокислот, например, как описано ниже. В одном из вариантов осуществления Vyy включает вариабельный домен, в частности, вариабельный домен, полученный из легкой цепи. В одном из вариантов осуществления Vyy обозначает вариабельный домен тяжелой цепи. В одном из вариантов осуществления Vyy обозначает химерный вариабельный домен, то есть, содержит компоненты, полученные по меньшей мере из двух видов, например, каркасный участок человека и CDR не являющийся человеческим. В одном из вариантов Vyy является гуманизированным.
Vy может быть получен из вариабельного домена тяжелой цепи, вариабельного домена легкой цепи или их сочетания, предпочтительно, из вариабельного домена легкой цепи. В одном из вариантов осуществления Vy обозначает вариабельный домен тяжелой цепи. В одном из вариантов осуществления Vy обозначает химерный вариабельный домен, то есть, содержит компоненты, полученные по меньшей мере из двух видов, например, каркасный участок человека и CDR не являющийся человеческим. В одном из вариантов осуществления Vy является гуманизированным.
Vy в полипептидах формулы (II) соответствует VL полипептидов формулы (IIa).
VL обозначает вариабельный домен, например, вариабельный домен легкой цепи. В одном из вариантов осуществления VL обозначает вариабельный домен легкой цепи. В одном из вариантов осуществления VL обозначает химерный вариабельный домен, то есть, содержит компоненты, полученные по меньшей мере из двух видов, например, каркасный участок человека и CDR не являющийся человеческим. В одном из вариантов VL является гуманизированным.
V2 обозначает вариабельный домен, например, вариабельный домен тяжелой цепи или легкой цепи. В одном из вариантов осуществления V2 обозначает вариабельный домен легкой цепи. В одном из вариантов осуществления V2 обозначает вариабельный домен тяжелой цепи. В одном из вариантов осуществления V2 обозначает химерный вариабельный домен, то есть содержит компоненты, полученные по меньшей мере из двух видов, например, каркасный участок человека и CDR не являющийся человеческим. В одном из вариантов V2 является гуманизированным.
Обычно Vxx и Vyy вместе образуют антигенсвязывающий домен. В одном из вариантов осуществления Vxx и Vyy вместе представляют собой родственную пару.
Обычно Vx и Vy вместе образуют антигенсвязывающий домен. В одном из вариантов осуществления Vx и Vy вместе представляют собой родственную пару.
В одном из вариантов осуществления связывающий домен, образованный VH и VL, является специфичным к первому антигену.
В одном из вариантов осуществления VH и VL образуют родственную пару.
Обычно V1 и V2 вместе образуют антигенсвязывающий домен. В одном из вариантов осуществления V1 и V2 представляют собой родственную пару.
В одном из вариантов осуществления V1 и V2 образуют антигенсвязывающий домен, специфичный к первому антигену (т.е. два связывающих домена молекулы могут быть специфичными к одному и тому же антигену, например, они могут связываться с одним и тем же эпитопом, или с разными эпитопами одного антигена).
В одном из вариантов осуществления V1 и V2 вместе образуют домен, связывающийся с сывороточным альбумином человека.
В одном из вариантов осуществления V1 и V2 образуют антигенсвязывающий домен, специфичный ко второму антигену (т.е. два связывающих домена молекулы являются специфичными к разным антигенам).
В одном из вариантов осуществления дисульфидная связь между V1 и V2 образуется двумя указанными ниже остатками (если из контекста не следует иное, в приведенном ниже списке используется нумерация Kabat). Ссылка на нумерацию Kabat делается в соответствии с Kabat et al., 1987, in Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA. В одном из вариантов осуществления дисульфидная связь присутствует в положении, выбранном из группы, включающей:
- VH37 + VL95C, см., например, Protein Science 6, 781-788 Zhu et al (1997);
- VH44 + VL100, см., например, Biochemistry 33, 5451-5459 Reiter et al (1994); или Journal of Biological Chemistry Vol. 269 № 28 pp. 18327-18331 Reiter et al (1994); или Protein Engineering, vol. 10 no. 12 pp. 1453-1459 Rajagopal et al (1997);
- VH44 + VL105, см., например, J Biochem. 118, 825-831 Luo et al (1995);
- VH45 + VL87, см., например, Protein Science 6, 781-788 Zhu et al (1997);
- VH55 + VL101, см., например, FEBS Letters 377 135-139 Young et al (1995);
- VH100 + VL50, см., например, Biochemistry 29 1362-1367 Glockshuber et al (1990);
- VH100b + VL49;
- VH98 + VL46, см., например, Protein Science 6, 781-788 Zhu et al (1997);
- VH101 + VL46;
- VH105 + VL43, см., например; Proc. Natl. Acad. Sci. USA Vol. 90 pp. 7538-7542 Brinkmann et al (1993); или Proteins 19, 35-47 Jung et al (1994),
- VH106 + VL57, см., например, FEBS Letters 377 135-139 Young et al (1995),
а также в положении, соответствующем указанному, в паре вариабельных участков, присутствующих в молекуле.
Перечисленные выше пары аминокислот находятся в положениях, предпочтительно используемых для замены на цистеин для получения дисульфидных связей. Остатки цистеина можно ввести в указанные желательные положения известными рекомбинантными способами. Следовательно, в одном из вариантов осуществления термин “остаток цистеина, введенный рекомбинантным методом” в соответствии с настоящим изобретением относится к замене природного остатка в заданном аминокислотном положении на остаток цистеина.
Введение остатков цистеина можно проводить любым рекомбинантным способом, известным в данной области. Такие методы включают, без ограничения, мутагенез с использованием ПЦР с удлинением и перекрыванием, направленный мутагенез или кассетный мутагенез (общее описание можно найти в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, NY, 1989; Ausbel et al., Current Protocols in Molecular Biology, Greene Publishing & Wiley-Interscience, NY, 1993). Существуют коммерчески доступные наборы для направленного мутагенеза, например, QuikChange® (Stratagen, La Jolla, CA). Кассетный мутагенез можно проводить по способу Wells et al., 1985, Gene, 34: 315-323. Альтернативно, мутанты могут быть получены с помощью полного генного синтеза путем отжига, лигирования, ПЦР-амплификации и клонирования перекрывающихся олигонуклеотидов.
Соответственно, в одном из вариантов осуществления пара вариабельных доменов (V1/V2) по настоящему изобретению может быть связана дисульфидной связью, образованной двумя остатками цистеина, один из которых находится в V1, а другой в V2, где положение пары цистеиновых остатков выбрано из группы, включающей VH37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VL50 и VH100, VH100b и VL49, VL46 и VH98, VH101 и VL46, VH105 и VL43, VH106 и VL57.
В одном из вариантов осуществления пара вариабельных доменов (V1/V2) по настоящему изобретению может быть связана дисульфидной связью, образованной двумя остатками цистеина, один из которых находится в V1, а другой в V2, причем оба находятся за пределами CDR, где положение пары остатков цистеина выбрано из группы, включающей VH37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VH100 и VL50, VH98 и VL46, VH105 и VL43, VH106 и VL57.
В одном из вариантов осуществления V1 представляет собой вариабельный домен тяжелой цепи, а V2 представляет собой вариабельный домен легкой цепи, причем V1 и V2 связаны дисульфидной связью, образованной двумя остатками цистеина, введенными рекомбинантным методом, один из которых находится в положении VH44 V1, а другой в положении VL100 V2.
В одном из вариантов осуществления VH и V1 представляют собой вариабельные участки, оба из которых могут быть получены из тяжелой цепи (тяжелых цепей) или легкой цепи (легких цепей), в частности, оба они могут быть получены из вариабельных участков двух разных тяжелых цепей.
В одном из вариантов осуществления VL и V2 представляют собой вариабельные участки, оба из которых могут быть получены из тяжелой цепи (тяжелых цепей) или легкой цепи (легких цепей), в частности, оба они могут быть получены из вариабельных участков двух разных легких цепей.
Термин “родственное пара” в настоящем описании относится к паре вариабельных доменов одного антитела, которые образуются in vivo, то есть, к природной паре вариабельных доменов, выделенных из хозяина. Следовательно, родственная пара представляет собой VH и VL. В одном из примеров члены родственной пары связывают антиген совместно.
Термин “вариабельный участок” в настоящем описании относится к участку цепи антитела, включающему CDR и соответствующий каркасный участок.
Вариабельные участки, подходящие для применения в настоящем изобретении, как правило, получают из антитела, которое можно продуцировать любым способом, известным в данной области.
Термин “полученный из” в соответствии с данным описанием означает, что используемую последовательность, или последовательность, в высокой степени подобную используемой последовательности, получают из исходного генетического материала, такого как легкая или тяжелая цепь антитела.
Используемый в настоящем описании термин “высокая степень подобия” относится к аминокислотным последовательностям, степень подобия которых на протяжении всей их длины составляет 95% или более, например, 96, 97, 98 или 99%.
Антитела против антигенного полипептида можно получить, если иммунизация животного является необходимой, путем введения полипептидов в организм животного, предпочтительно отличного от человека животного, с использованием хорошо известных и рутинных методов, описанных, например, в Handbook of Experimental Immunology, D. M. Weir (ed.) Vol 4, Blackwell Scientific Publishers, Oxford, England, 1986). Для иммунизации можно использовать разных теплокровных животных, таких как кролики, мыши, крысы, овцы, коровы, свиньи или верблюды. Однако наиболее подходящими, как правило, являются мыши, кролики, свиньи и крысы.
Моноклональные антитела можно получить любым известным в данной области методом, например, гибридомным методом (Kohler & Milstein, 1975, Nature, 256: 495-497), триомным методом, гибридомным методом с использованием В-клеток человека (Kozbor et al., 1983, Immunology Today, 4:72) и EBV-гибридомным методом (Cole et al., Monoclonal Antibodies and Cancer Therapy, pp77-96, Alan R Liss, Inc., 1985).
Антитела также можно получить с помощью методов, позволяющих получать антитела из отдельных лимфоцитов, путем клонирования и экспрессии кДНК вариабельных участков иммуноглобулина, полученных из отдельных лимфоцитов, выбранных для продукции специфических антител, например, методами, описанными в Babcook, J. et al., 1996, Proc. Natl. Acad. Sci. USA 93(15): 7843-78481; WO 92/02551; WO 2004/051268 и WO 2004/106377.
Антитела для применения в настоящем изобретении также можно получить разными методами фаговых дисплеев, известных в данной области и включающих методы, описанные Brinkman et al. (in J. Immunol. Methods, 1995, 182: 41-50), Ames et al. (J. Immunol. Methods, 1995, 184:177-186), Kettleborough et al. (Eur. J. Immunol. 1994, 24: 952-958), Persic et al. (Gene, 1997 1879-18), Burton et al. (Advances in Immunology, 1994, 57: 191-280) и WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; и США 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743; 5969108, и WO 20011/30305.
В одном из вариантов осуществления биспецифические молекулы по настоящему изобретению являются гуманизированными.
Термин “гуманизированные” (который включает антитела с привитыми CDR) в настоящем описании относится к молекулам, содержащим один или несколько гипервариабельных участков (CDR), полученных из отличных от человека видов, и каркасный участок молекулы иммуноглобулина человека (см., например, US 5585089; WO 91/09967). Следует иметь в виду, что иногда можно переносить только остатки CDR, определяющие специфичность, а не весь CDR (см., например, Kashmiri et al., 2005, Methods, 36, 25-34). Гуманизированные антитела могут необязательно содержать один или несколько каркасных остатков, полученных из отличного от человека вида, из которого получены CDR.
В настоящем описании термин “гуманизированная молекула антитела” относится к молекуле антитела, в которой тяжелая и/или легкая цепь содержит один или несколько CDR (в том числе, если это необходимо, один или несколько модифицированных CDR) донорного антитела (например, мышиного моноклонального антитела), привитых на каркасный участок вариабельного домена тяжелой и/или легкой цепи акцепторного антитела (например, антитела человека). Обзор можно найти в Vaughan et al, Nature Biotechnology, 16, 535-539, 1998. В одном из вариантов осуществления на каркасный участок антитела человека переносят не весь CDR, а только один или несколько специфичность-определяющих остатков одного из описанных выше CDR (см, например, Kashmiri et al., 2005, Methods, 36, 25-34). В одном из вариантов осуществления только специфичность-определяющие остатки одного или нескольких из описанных выше CDR переносят на каркасный участок антитела человека. В другом варианте осуществления только специфичность-определяющие остатки каждого из описанных выше CDR переносят на каркасный участок антитела человека.
Для прививки CDR или специфичность-определяющих остатков можно использовать любую подходящую каркасную последовательность акцепторного вариабельного домена, выбранную с учетом класса/типа донорного антитела, из которого получены CDR, и включающую каркасные участки мышей, приматов и человека. Соответственно, в состав гуманизированного антитела по настоящему изобретению входит вариабельный домен, содержащий акцепторные каркасные области человека, а также один или несколько из описанных здесь CDR.
Примеры каркасных участков человека, подходящих для применения в настоящем изобретении, включают KOL, NEWM, REI, EU, TUR, TEI, LAY и POM (Kabat et al., выше). Например, для тяжелой цепи можно использовать KOL и NEWM, для легкой цепи можно использовать REI, а EU, LAY и РОМ можно использовать как для тяжелой цепи, так и для легкой цепи. В качестве альтернативы можно использовать последовательности зародышевой линии человека; их можно найти на сайте http://vbase.mrc-cpe.cam.ac.uk/.
Акцепторные тяжелые и легкие цепи, входящие в состав гуманизированного антитела по настоящему изобретению, не обязательно должны быть получены из одного и того же антитела и, при необходимости, они могут содержать составные цепи, каркасные участки которых получены из разных цепей.
Каркасные участки не обязательно имеют точно такую же последовательность, как и каркасные участки акцепторного антитела. Например, необычные остатки можно заменить на остатки, более часто встречающиеся в акцепторной цепи данного класса или типа. Альтернативно выбранные остатки акцепторных каркасных участков можно изменить так, чтобы они соответствовали остаткам, присутствующим в том же положении донорного антитела (см. Reichmann et al., 1998, Nature, 332, 323-324). Такие изменения должны быть сведены к минимуму, необходимому для восстановления аффинности донорного антитела. Схема выбора остатков в акцепторных каркасных участках, которые должны быть изменены, описана в WO 91/09967.
В одном из вариантов осуществления биспецифические антитела по настоящему изобретению являются полностью человеческими, в частности, один или несколько вариабельных доменов являются полностью человеческими.
Полностью человеческие молекулы представляют собой молекулы, в которых все вариабельные участки и константные области (если они присутствует) тяжелых и легких цепей являются человеческими последовательностями, не обязательно полученными из одного и того же антитела, или по существу идентичными человеческим последовательностям. Примеры полностью человеческих антител могут включать антитела, полученные, например, с помощью описанных выше методов фаговых дисплеев, и антитела, продуцируемые мышами, у которых гены мышиных вариабельных и, необязательно, константных областей иммуноглобулина заменены их человеческими аналогами, например, как описано в общих чертах в EP 0546073 B1, US 5545806, US 5569825, US 5625126, US 5633425, US 5661016, US 5770429, ЕР 0438474 и EP 0463151.
Сх представляет собой константный домен легкой или тяжелой цепи, в частности, тяжелой цепи.
Сх в полипептиде формулы (I) соответствует CH1 из полипептида формулы (Ia). В одном из вариантов осуществления Сх эквивалентен CH1.
В одном из вариантов осуществления домен CH1 представляет собой природный домен 1 тяжелой цепи, или его производное. В одном из вариантов осуществления фрагмент СН включает домен CH1.
Cy представляет собой константный домен легкой или тяжелой цепи, в частности, легкой цепи.
Cy в полипептиде формулы (II) соответствует CL из полипептида формулы (IIa). В одном из вариантов осуществления Cy эквивалентен CL.
В одном из вариантов осуществления фрагмент CL легкой цепи представляет собой последовательность константного домена каппа, или последовательность константного домена лямбда, или ее производное.
Производное природного домена, в соответствии с настоящим описанием, представляет собой последовательность, полученную из природной последовательности путем замены или удаления одной, двух, трех, четырех или пяти аминокислот, например, с целью оптимизации свойств домена, включающей устранение нежелательных свойств при сохранении характеристической функции (функций).
В одном из вариантов осуществления Х обозначает линкер, такой как пептид, подходящий для соединения фрагментов CH1 и V1.
В одном из вариантов осуществления Х обозначает линкер, такой как пептид, подходящий для соединения фрагментов CL и V2.
В одном из вариантов осуществления пептидный линкер содержит в длину 50 аминокислот или менее, например, 20 аминокислот или менее.
В одном из вариантов осуществления линкер выбран из последовательностей 13-77.
В одном из вариантов осуществления линкер выбран из последовательностей SEQ ID NO: 103 или SEQ ID NO: 104.
Последовательности шарнирных линкеров
Последовательности гибких линкеров
(S) является необязательным в последовательностях 24-28.
Примеры жестких линкеров включают пептидные последовательности GAPAPAAPAPA (SEQ ID NO: 62), PPPP (SEQ ID NO: 63) и PPP.
В одном из вариантов осуществления пептидный линкер представляет собой пептид, связывающий альбумин.
Примеры пептидов, связывающих альбумин, приведены в WO 2007/106120 и включают:
Преимущество применения альбумин-связывающих пептидов в качестве линкеров включает увеличение периода полужизни биспецифической молекулы антитела.
Во избежание сомнений, V2 еще присутствует в молекуле антитела и удерживается в ней благодаря спариванию с V1, в том числе, посредством дисульфидной связи, присутствующей между V1 и V2.
В одном из вариантов осуществления биспецифические молекулы антител по настоящему изобретению способны селективно связываться с двумя разными представляющими интерес антигенами.
В одном из вариантов осуществления представляющие интерес антигены, связываемые Vxx/Vyy, Vx/Vy, VH/VL и V1/V2, независимо выбирают из ассоциированных с клетками белков, например, белков клеточной поверхности, присутствующих на таких клетках, как бактериальные клетки, дрожжевые клетки, Т-клетки, эндотелиальные клетки или опухолевые клетки, и растворимых белков.
Представляющий интерес антиген также может включать любой белок, имеющий отношение к медицине, такой как белок, подвергающийся повышающей регуляции при болезни или инфекции, например, рецептор и/или его соответствующий лиганд.
Конкретные примеры белков клеточной поверхности включают адгезионные молекулы, например, интегрины, такие как интегрины β1, например, VLA-4, Е-селектин, Р-селектин или L-селектин, CD2, CD3, CD4, CD5, CD7, CD8, CD11a, CD11b, CD18, CD19, CD20, CD23, CD25, CD33, CD38, CD40, CD45, CDW52, CD69, CD134 (OX40), ICOS, BCMP7, CD137, CD27L, CDCP1, DPCR1, DPCR1, dudulin2, FLJ20584, FLJ40787, HEK2, KIAA0634, KIAA0659, KIAA1246, KIAA1455, LTBP2, LTK, MAL2, MRP2, нектин-подобный белок 2, NKCC1, PTK7, RAIG1, TCAM1, SC6, BCMP101, BCMP84, BCMP11, DTD, карциноэмбриональный антиген (СЕА), глобулин молочного жира человека (HMFG1 и 2), антигены МНС класса I и МНС класса II, VEGF, и, когда это уместно, их рецепторы.
Растворимые антигены включают интерлейкины, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-12, IL-16 или IL-17, IL-23, вирусные антигены, например, антигены респираторно-синцитиального вируса или цитомегаловируса, иммуноглобулины, такие как IgE, интерфероны, такие как интерферон α, интерферон β или интерферон γ, фактор некроза опухоли α, фактор некроза опухоли β, колониестимулирующие факторы, такие как G-CSF или GM-CSF, и тромбоцитарный фактор роста, такой как PDGF-α и PDGF-β и, когда это уместно, их рецепторы. Другие антигены включают поверхностные антигены бактериальных клеток, бактериальные токсины, вирусы, такие как вирус гриппа, EBV, HepA, B и C, биотеррористические агенты, радионуклиды и тяжелые металлы, а также яды и токсины змей и пауков.
В одном из вариантов осуществления гибридный белок антитела по настоящему изобретению можно использовать для функционального изменения активности представляющего интерес антигена. Например, гибридный белок антитела может непосредственно или косвенно нейтрализовать активность указанного антигена, противодействовать или способствовать такой активности.
В одном из вариантов осуществления представляющий интерес антиген, связываемый VH и VL, включает OX40. В одном из вариантов осуществления фрагмент Vx-Cx или VHCH1 мультиспецифического антитела имеет последовательность SEQ ID NO: 3. В одном из вариантов осуществления фрагмент Vy-Cy или VL-CL мультиспецифического антитела имеет последовательность SEQ ID NO: 7.
В одном из вариантов осуществления представляющий интерес антиген, связываемый VH/VL или V1/V2, обеспечивает способность выполнять эффекторные функции, такие как активация пути комплемента и/или рекрутинг эффекторных клеток.
Рекрутинг как эффекторная функция может непосредственно осуществляться в отношении клетки, несущей на поверхности молекулу рекрутинга. Косвенное осуществление рекрутинга может происходить в том случае, когда связывающий домен (например, V1/V2) молекулы по настоящему изобретению связывается с полипептидом рекрутинга, вызывая высвобождение, например, фактора, который, в свою очередь, может прямо или косвенно способствовать выполнению эффекторной функции, в том числе посредством активации сигнального пути. Примеры включают TNFα, IL2, IL6, IL8, IL17, IFNγ, гистамин, C1q, опсонин и другие члены классических и альтернативных каскадов активации комплемента, такие как С2, С4, С3-конвертазы и С5-С9.
В настоящем описании "полипептид рекрутинга" включает FcγR, например FcγRI, FcγRII и FcγRIII, белок пути комплемента, включающий, без ограничения, C1q и С3, маркерный белок CD (маркер кластера дифференциации), включающий, без ограничения, CD68, CD115, CD16, CD80, CD83, CD86, CD56, CD64, CD3, CD4, CD8, CD28, CD45, CD19, CD20 и CD22. Другие полипептиды рекрутинга, относящиеся к маркерным белкам CD, включают CD1, CD1d, CD2, CD5, CD8, CD9, CD10, CD11, CD11a, CD11b, CD11c, CD13, CD14, CD15, CD16, CD18, CD19, CD20, CD21, CD22, CD23, CD24, CD25, CD26, CD27, CD28, CD29, CD30, CD31, CD32, CD33, CD34, CD35, CD36, CD37, CD38, CD40, CD43, CD44, CD45, CD46, CD49, CD49a, CD49b, CD49c, CD49d, CD52, CD53, CD54, CD55, CD56, CD58, CD59, CD61, CD62, D62E, CD62L, CD62P, CD63, CD64, CD66e, CD68, CD70, CD71, CD72, CD79, CD80, CD81, CD82, CD83, CD84, CD85, CD86, CD88, CD89, CD90, CD94, CD95, CD98, CD106, Cd 114, CD116, CD117, CD118, CD120, CD122, CD130, CD131, CD132, CD133, CD134, CD135, CD137, CD138, CD141, CD142, CD143, CD146, CD147, CD151, CD152, CD153, CD154, CD155, CD162, CD164, CD169, CD184, CD206, CD209, CD257, CD278, CD281, CD282, CD283 и CD304, или фрагмент любого из указанных белков, который сохраняет способность прямо или косвенно осуществлять эффекторную функцию, опосредованную рекрутингом клеток. Полипептид рекрутинга также включает молекулы иммуноглобулинов, такие как IgG1, IgG2, IgG3, IgG4, IgE и IgA, способные выполнять эффекторную функцию.
В одном из вариантов осуществления связывающий домен (например, V1/V2) молекулы по настоящему изобретению обладает специфичностью к белку пути комплемента, особенно предпочтительно, к C1q.
Кроме того, молекулы по настоящему изобретению можно использовать для образования хелатных комплексов с радионуклидами посредством однодоменного антитела, способного связываться с белком-хелатором нуклидов. Такие гибридные белки можно использовать для визуализации или в терапевтических методах с использованием радионуклидов.
В одном из вариантов осуществления один связывающий домен молекулы по настоящему изобретению (например, V1/V2) обладает специфичностью к маркерному белку CD, наиболее предпочтительно, к CD68, CD80, CD86, CD64, CD3, CD4, CD8, CD45, CD16 и CD35.
В одном из вариантов осуществления связывающий домен молекулы настоящего изобретения (например, V1/V2) обладает специфичностью к сывороточному белку-носителю, циркулирующей в кровотоке молекуле иммуноглобулина, или CD35/CR1, что позволяет, например, увеличить период полужизни фрагмента антитела, обладающего специфичностью к указанному представляющему интерес антигену, в результате связывания с указанным сывороточным белком-носителем, циркулирующей в кровотоке молекулой иммуноглобулина или CD35/CR1.
В настоящем описании термин “сывороточные белки-носители” включает тироксин-связывающий белок, транстиретин, α1-кислый гликопротеин, трансферрин, фибриноген и альбумин, или фрагмент любого из них.
В настоящем описании термин “циркулирующая в кровотоке молекула иммуноглобулина” включает IgG1, IgG2, IgG3, IgG4, sIgA, IgM и IgD, или фрагмент любого из них.
CD35/CR1 представляет собой белок, присутствующий на красных кровяных клетках, с периодом полужизни 36 дней (обычный диапазон от 28 до 47 дней; Lanaro et al, 1971, Cancer, 28 (3): 658-661).
В одном из вариантов осуществления белок, к которому специфичен V1/V2, представляет собой сывороточный белок-носитель, такой как сывороточный белок-носитель человека. В наиболее предпочтительном варианте осуществления сывороточный белок-носитель представляет собой сывороточный альбумин человека.
Альбумин-связывающие вариабельные участки и CDR раскрыты в конструкциях, показанных на фиг. 1.
Так, в одном из вариантов осуществления изобретение относится к биспецифической молекуле антитела, содержащей или состоящей из трех полипептидов:
a) тяжелой цепи формулы (Ia):
VH-CH1-X-V1; и
b) легкой цепи формулы (IIa):
VL-CL;
c) полипептида формулы (III):
V2;
где
VH обозначает вариабельный домен тяжелой цепи,
CH1 обозначает домен 1 константной области тяжелой цепи,
Х обозначает линкер,
V1 обозначает вариабельный домен,
VL обозначает вариабельный домен легкой цепи,
CL обозначает константную область легкой цепи,
V2 обозначает вариабельную область,
где VH и VL представляют собой родственную пару вариабельных участков, расположенных так, чтобы образовать связывающий домен, и V1 и V2 представляют собой родственную пару вариабельных участков, расположенных так, чтобы образовать связывающий домен, причем между ними необязательно присутствует дисульфидная связь, например, где V1 и V2 способны связывать альбумин in vivo, в частности, сывороточный альбумин человека.
В одном из вариантов осуществления V1 или V2 содержит последовательность, выбранную из группы, включающей SEQ ID NO: 4, SEQ ID NO: 8, SEQ ID NO: 83 и SEQ ID NO: 86. В одном из вариантов осуществления V1 имеет последовательность SEQ ID NO: 4, а V2 имеет последовательность SEQ ID NO: 8. В одном из вариантов осуществления V1 имеет последовательность SEQ ID NO: 86, а V2 имеет последовательность SEQ ID NO: 83.
В одном примере V1 или V2, в частности V1, представляет собой домен VH, содержащий последовательность SEQ ID NO: 87 как CDRH-1, последовательность SEQ ID NO: 88 как CDRH2, и последовательность SEQ ID NO: 89 как CDRH-3. В одном примере V1 или V2, в частности V1, представляет собой домен VH, содержащий последовательность SEQ ID NO: 93 как CDRH-1, последовательность SEQ ID NO: 94 как CDRH2, и последовательность SEQ ID NO: 95 как CDRH-3.
В одном из вариантов осуществления V1 или V2, в частности V2, представляет собой домен VL, содержащий последовательность SEQ ID NO: 90 как CDRL-1, последовательность SEQ ID NO: 91 как CDRL2, и последовательность SEQ ID NO: 92 как CDRL-3. В одном из вариантов осуществления V1 или V2, в частности V2, представляет собой домен VL, содержащий последовательность, приведенную в SEQ ID NO: 96 как CDRL-1, последовательность SEQ ID NO: 97 как CDRL2, и последовательность SEQ ID NO: 98 как CDRL-3.
В одном примере V1 или V2, в частности V1, представляет собой домен VH, содержащий последовательность SEQ ID NO: 4, SEQ ID NO: 86, SEQ ID NO: 99 или SEQ ID NO: 100.
В одном примере V1 или V2, в частности V2, представляет собой домен VL, содержащий последовательность SEQ ID NO: 8, SEQ ID NO: 83, SEQ ID NO: 101 или SEQ ID NO: 102.
В одном примере V1 представляет собой домен VH, содержащий последовательность SEQ ID NO: 99, а V2 представляет собой домен VL, содержащий последовательность SEQ ID NO: 101.
В одном примере V1 представляет собой домен VH, содержащий последовательность SEQ ID NO: 100, а V2 представляет собой домен VL, содержащий последовательность SEQ ID NO: 102.
В одном примере полипептид Ia имеет последовательность SEQ ID NO: 6.
В одном примере полипептид IIa имеет последовательность SEQ ID NO: 7.
В одном примере полипептид Ib имеет последовательность SEQ ID NO: 3.
В одном примере полипептида IIb имеет последовательность SEQ ID NO: 5.
В одном примере полипептида Ia имеет последовательность SEQ ID NO: 6, IIa имеет последовательность SEQ ID NO: 7, а V2 имеет последовательность SEQ ID NO: 8.
В одном примере полипептид Ib имеет последовательность SEQ ID NO: 3, полипептид IIb имеет последовательность SEQ ID NO: 5, а V1 имеет последовательность SEQ ID NO: 4.
Изобретение также предлагает последовательности, на 80%, 90%, 91%, 92%, 93% 94%, 95% 96%, 97%, 98% или 99% подобные раскрытой здесь последовательности антитела.
Термин "идентичность", в соответствии с данным описанием, означает, что в любом конкретном положении выравниваемых последовательностей аминокислотные остатки сравниваемых последовательностей являются идентичными. Термин "подобие", в соответствии с данным описанием, означает, что в любом конкретном положении выравниваемых последовательностей, аминокислотные остатки сравниваемых последовательностей являются подобными. Например, лейцин может быть заменен на изолейцин или валин. Другие аминокислоты, которые часто могут замещать одна другую, включают, без ограничения:
- фенилаланин, тирозин и триптофан (аминокислоты, содержащие ароматические боковые цепи);
- лизин, аргинин и гистидин (аминокислоты, содержащие основные боковые цепи);
- аспартат и глутамат (аминокислоты, содержащие кислые боковые цепи);
- аспарагин и глутамин (аминокислоты, содержащие амидные боковые цепи); и
- цистеин и метионин (аминокислоты, имеющие серосодержащие боковые цепи). Степени идентичности и подобия можно легко рассчитать (Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing. Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987, Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991, программное обеспечение BLAST™, которое можно приобрести в NCBI, Altschul, S.F. et al., 1990, J. Mol. Biol. 215: 403-410; Gish, W. & States, DJ. 1993, Nature Genet. 3: 266-272. Madden, T.L. et al., 1996, Meth. Enzymol. 266: 131-141; Altschul, S.F. et al., 1997, Nucleic Acids Res. 25: 3389-3402; Zhang, J. & Madden, T.L. 1997, Genome Res. 7: 649-656).
В альтернативном аспекте настоящее изобретение относится к фрагменту Fab или Fab', связанному с дисульфид-стабилизированным ScFv, где дисульфид-стабилизированный ScFv (dsscFv) связан с С-концом тяжелой или легкой цепи фрагмента Fab или Fab' непосредственно или через линкер, такой как описанный в настоящем описании линкер. Предпочтительно, гибридный белок Fab-dsscFv является биспецифичным. В одном из примеров dsscFv связывает сывороточный белок-носитель, такой как сывороточный альбумин человека. В одном примере dsscFv связан с С-концом тяжелой цепи фрагмента Fab или Fab' через линкер, имеющий последовательность SEQ ID NO: 78. В одном примере dsscFv связан с С-концом легкой цепи фрагмента Fab или Fab' через линкер, имеющий последовательность SEQ ID NO: 103. В одном из примеров тяжелая цепь Fab-dsscFv имеет последовательность SEQ ID NO: 9, а легкая цепь имеет последовательность SEQ ID NO: 10. В одном примере тяжелая цепь Fab-dsscFv имеет последовательность SEQ ID NO: 11, а легкая цепь имеет последовательность SEQ ID NO: 12.
В одном из вариантов осуществления биспецифические молекулы антител по настоящему изобретению модифицируют, чтобы повысить сродство к антигену-мишени или антигенам-мишеням. Такие варианты можно получить с помощью ряда методов созревания аффинности, включающих введение мутаций в CDR (Yang et al., J. Mol. Biol., 254, 392-403, 1995), перетасовку цепей (Marks et al., Bio/Technology, 10, 779-783, 1992), использование мутаторных штаммов E. coli (Low et al., J. Mol, Biol., 250, 359-368, 1996), перетасовку ДНК (Patten et al., Curr. Opin. Biotechnol., 8, 724-733, 1997), методы фаговых дисплеев (Thompson et al., J. Mol. Biol., 256, 77-88, 1996) и половой ПЦР (Crameri et al., Nature, 391, 288-291, 1998). Vaughan et al. (выше) описывают указанные методы созревания аффинности.
Используемый здесь термин “повышенное сродство” в контексте настоящего описания относится к повышению сродства по сравнению с исходной молекулой.
При желании антитело, используемое в соответствии с настоящим изобретением, можно конъюгировать с одной эффекторной молекулой или с несколькими эффекторными молекулами. Следует иметь в виду, что эффекторная молекула может включать одну эффекторную молекулу, или две такие молекулы или более, связанные между собой с образованием единого фрагмента, который может быть присоединен к антителу по настоящему изобретению. Фрагмент антитела можно присоединить к эффекторной молекулой с помощью стандартных химических способов или методов рекомбинантных ДНК, в которых фрагмент антитела присоединяют к эффекторной молекуле непосредственно или с помощью конденсирующего средства. Методы присоединения таких эффекторных молекул к антителам хорошо известны в данной области (см., Hellstrom et al., Controlled Drug Delivery, 2nd Ed., Robinson et al., eds., 1987, pp. 623-53; Thorpe et al., 1982, Immunol. Rev., 62: 119-58 and Dubowchik et al., 1999, Pharmacology and Therapeutics, 83, 67-123). Конкретные химические способы включают, например, способы, описанные в WO 93/06231, WO 92/22583, WO 89/00195, WO 89/01476 и WO 03031581. Альтернативно, если эффекторная молекула представляет собой белок или полипептид, присоединение можно осуществлять методом рекомбинантных ДНК, например, как описано в WO 86/01533 и EP0392745.
Термин “эффекторная молекула”, в соответствии с данным описанием, включает, например, биологически активные белки, такие как ферменты, другие антитела или фрагменты антител, синтетические или природные полимеры, нуклеиновые кислоты и их фрагменты, например, ДНК, РНК и их фрагменты, радионуклиды, в частности, радиоактивный йод, радиоизотопы, хелатные комплексы металлов, наночастицы и репортерные группы, такие как флуоресцентные соединения или соединения, которые можно детектировать методом ЯМР- или ЭПР-спектроскопии.
Другие эффекторные молекулы могут включать хелатные комплексы радионуклидов, таких как 111In и 90Y, Lu177, висмут 213, калифорний 252, иридий 192 и вольфрам 188/рений 188; или препараты, включающие, без ограничения, алкилфосохолины, ингибиторы топоизомеразы I, таксоиды и сурамин.
Другие эффекторные молекулы включают белки, пептиды и ферменты. Представляющие интерес ферменты включают, без ограничения, протеолитические ферменты, гидролазы, лиазы, изомеразы, трансферазы. Представляющие интерес белки, полипептиды и пептиды включают, без ограничения, иммуноглобулины, токсины, такие как абрин, рицин A, экзотоксин Pseudomonas, или дифтерийный токсин, белки, такие как инсулин, фактор некроза опухоли, α-интерферон, β-интерферон, фактор роста нервов, фактор роста тромбоцитов, или тканевый активатор плазминогена, тромботические средства или антиангиогенные средства, например, ангиостатин или эндостатин, или, модификаторы биологической реакции, такие как лимфокины, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста нервов (NGF), или другие факторы роста и иммуноглобулины.
Другие эффекторные молекулы могут включать детектируемые вещества, используемые, например, в диагностике. Примеры детектируемых веществ включают разные ферменты, простетические группы, флуоресцентные вещества, люминесцентные вещества, биолюминесцентные вещества, радиоактивные нуклиды, позитрон-испускающие металлы (для применения в позитронно-эмиссионной томографии), и нерадиоактивные парамагнитные ионы металлов. Общую информацию по ионам металлов, которые можно конъюгировать с антителами для применения в качестве диагностических средств, можно найти в US 4741900. Подходящие ферменты включают пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразу; подходящие простетические группы включают стрептавидин, авидин и биотин; подходящие флуоресцентные вещества включают умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазиниламина флуоресцеин, дансилхлорид и фикоэритрин; подходящие люминесцентные вещества включают люминол; подходящие биолюминесцентные вещества включают люциферазу, люциферин и экворин; и подходящие радионуклиды включают 125I, 131I, 111In и 99Tc.
В другом примере эффекторная молекула может увеличивать период полужизни антитела in vivo, и/или уменьшать иммуногенность антитела, и/или повышать доставку антитела через эпителиальный барьер к иммунной системе. Примеры подходящих эффекторных молекул данного типа включают полимеры, альбумин, альбумин-связывающие белки или альбумин-связывающие соединения, такие как соединения, описанные в WO 05/117984.
Если эффекторная молекула представляет собой полимер, она может, в целом, представлять собой синтетический или природный полимер, например, необязательно замещенный полиалкиленовый, полиалкениленовый или полиоксиалкиленовый полимер с прямой или разветвленной цепью, или разветвленный или неразветвленный полисахарид, например гомо- или гетерополисахарид.
Конкретные необязательные заместители, которые могут присутствовать на указанных выше синтетических полимерах, включают одну или несколько гидроксильных, метильных или метоксильных групп.
Конкретные примеры синтетических полимеров включают необязательно замещенные поли(этиленгликоль), поли(пропиленгликоль) поли(виниловый спирт) с прямой или разветвленной цепью, или их производные, предпочтительно необязательно замещенный поли(этиленгликоль), такой как метоксиполи(этиленгликоль), или его производные. Конкретные природные полимеры включают лактозу, амилозу, декстран, гликоген, или их производные. Термин "производные" в настоящем описании включает реакционноспособные производные, такие как тиол-селективные реакционноспособные группы, например, малеимиды и т.п. Реакционноспособная группа может быть присоединена к полимеру непосредственно или через линкерный сегмент. Следует иметь в виду, что остаток такой группы будет в некоторых случаях образовывать часть продукта в качестве связующей группы между фрагментом антитела и полимером. Размер полимера может варьировать, по необходимости, однако обычно он находится в диапазоне средней молекулярной массы от 500 Да до 50000 Да, например, от 5000 до 40000 Да, например, от 20000 до 40000 Да. Размер полимера может быть выбран, в частности, на основании предполагаемого применения продукта, например, с учетом способности локализоваться в определенных тканях, таких как опухоли, или увеличивать период полужизни в кровотоке (обзор можно найти в Chapman, 2002, Advanced Drug Delivery Reviews, 54, 531-545). Так, например, если продукт предназначен для выведения из кровотока и проникновения в ткани, например, в случае применения для лечения опухоли, может быть предпочтительным использовать низкомолекулярный полимер, например, с молекулярной массой примерно 5000 Да. В случае применений, при которых продукт остается в кровотоке, может быть выгодно использовать полимер с более высокой молекулярной массой, например, полимер с молекулярной массой в диапазоне от 20000 Да до 40000 да.
Подходящие полимеры включают полиалкиленовый полимер, такой как поли(этиленгликоль) или, предпочтительно, метоксиполи(этиленгликоль), или его производные, главным образом, с молекулярной массой в диапазоне примерно от 15000 Да до 40000 Да.
В одном из примеров антитела, используемые в настоящем изобретении, присоединяют к фрагментам поли(этиленгликоля) (ПЭГ). В одном конкретном примере антитело представляет собой фрагмент антитела и молекулы ПЭГ могут быть присоединены через любую доступную боковую цепь аминокислоты, или через функциональную группу концевой аминокислоты фрагмента антитела, например, через любую свободную аминогруппу, иминогруппу, тиольную группу, гидроксильную группу или карбоксильную группу. Такие аминокислоты могут встречаться во фрагменте антитела в природе, или они могут быть введены во фрагмент с помощью методов рекомбинантных ДНК (см., например, US 5219996; US 5667425; WO 98/25971, WO 2008/038024). В одном из примеров молекула антитела по настоящему изобретению представляет собой модифицированный фрагмент Fab, в котором модификация представляет собой добавление к С-концу его тяжелой цепи одной или нескольких аминокислот, чтобы обеспечить присоединение эффекторной молекулы. Предпочтительно добавленные аминокислоты образуют модифицированный шарнирный участок, содержащий один или несколько остатков цистеина, к которым можно присоединить эффекторную молекулу. Для присоединения двух или более молекул ПЭГ можно использовать несколько участков.
Соответственно, молекулы ПЭГ ковалентно присоединяют через тиольную группу, по меньшей мере, одного остатка цистеина, присутствующего во фрагменте антитела. Каждую молекулу полимера можно присоединить к модифицированному фрагменту антитела путем образования ковалентной связи с атомом серы остатка цистеина, присутствующего во фрагменте. Ковалентная связь обычно представляет собой дисульфидную связь, или, в частности, связь сера-углерод. Если тиольную группу используют в качестве точки прикрепления соответственно активированных эффекторных молекул, можно использовать, например, тиол-селективные производные, такие как малеимиды и производные цистеина. Активированный полимер можно использовать в качестве исходного материала для получения полимер-модифицированных фрагментов антитела, как описано выше. Активированный полимер может представлять собой любой полимер, содержащий группу, способную взаимодействовать с тиолом, такую как α-галогенкарбоновая кислота, или ее сложный эфир, например, иодацетамид, имид, например малеимид, винилсульфон или дисульфид. Такие исходные вещества можно приобрести на коммерческой основе (например, от Nektar, ранее Shearwater Polymers Inc., Huntsville, AL, USA), или их можно получить из коммерчески доступных исходных веществ с помощью стандартных химических способов. Конкретные молекулы ПЭГ включают 20K метокси-ПЭГ-амин (который можно получить от Nektar, ранее Shearwater; Rapp Polymere и SunBio) и M-ПЭГ-SPA (который можно получить от Nektar, ранее Shearwater).
В одном из вариантов осуществления входящий в состав молекулы фрагмент Fab или Fab' является пегилированным, т.е. содержит ковалентно присоединенный к нему ПЭГ (поли(этиленгликоль)), например, по способу, описанному в ЕР 0948544 или ЕР 1090037 [см. также "Poly(ethyleneglycol) Chemistry, Biotechnical and Biomedical Applications", 1992, J. Milton Harris (ed), Plenum Press, New York, "Poly(ethyleneglycol) Chemistry and Biological Applications", 1997, J. Milton Harris and S. Zalipsky (eds), American Chemical Society, Washington DC and "Bioconjugation Protein Coupling Techniques for the Biomedical Sciences", 1998, M. Aslam and A. Dent, Grove Publishers, New York; Chapman, A. 2002, Advanced Drug Delivery Reviews 2002, 54: 531-545]. В одном примере ПЭГ присоединяют к остатку цистеина, расположенному в шарнирном участке. В одном примере ПЭГ-модифицированный фрагмент Fab содержит малеимидную группу, ковалентно связанную с одной тиольной группой, присутствующей в модифицированном шарнирном участке. Остаток лизина можно ковалентно присоединить к малеимидной группе, а к каждой аминогруппе остатка лизина можно присоединить метоксиполи(этиленгликолевый) полимер, молекулярная масса которого составляет примерно 20000 Да. Следовательно, общая молекулярная масса ПЭГ, присоединенного к фрагменту Fab, может составлять примерно 40000 Да.
Конкретные молекулы ПЭГ включают 2-[3-(N-малеимидо)пропионамидо]этиламид N,N'-бис(метоксиполи(этиленгликоль) МВ 20000)-модифицированный лизин, также известный как PEG2MAL40K (получают от Nektar, ранее Shearwater).
Альтернативные источники ПЭГ-линкеров включают NOF, который поставляет GL2-400MA2 (где m в приведенной ниже структуре равен 5) и GL2-400MA (где m равен 2), а n примерно равен 450:

m равен 2 или 5.
То есть, масса каждой молекулы ПЭГ составляет примерно 20000 Да.
Другие альтернативные ПЭГ-эффекторные молекулы следующего типа:
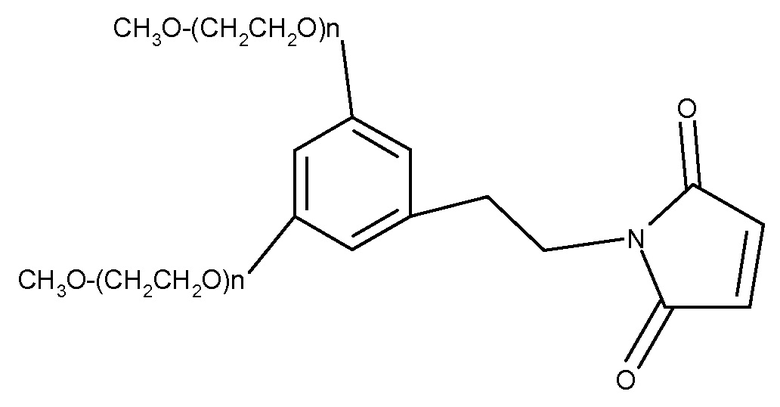
Можно получить от Dr Reddy, NOF и Jenkem.
В одном из вариантов осуществления изобретение относится к антителу, к которому молекула ПЭГ (например, описанная здесь молекула ПЭГ) присоединена через остаток цистеина, находящийся в положении 226 аминокислотной цепи, или вблизи этого положения, например, в положении 226 тяжелой цепи (при последовательной нумерации).
В одном из вариантов осуществления изобретение относится к полинуклеотидной последовательности, кодирующей молекулу по настоящему изобретению, такую как последовательность ДНК.
В одном из вариантов осуществления изобретение относится к полинуклеотидной последовательности, кодирующей один или несколько, например, два или более полипептидных компонентов молекулы по настоящему изобретению, например,
полипептидную цепь формулы (I):
(Vxx)nVx-Cx-X-V1,
полипептидную цепь формулы (II):
(Vyy)nVy-Cy,
полипептид формулы (III):
V2,
где
Vx обозначает вариабельный домен,
Vxx обозначает вариабельный домен,
Cx обозначает константную область домена,
Х обозначает линкер,
V1 обозначает вариабельный домен,
Vy обозначает вариабельный домен,
Vyy обозначает вариабельный домен,
Cy обозначает константную область домена,
V2 обозначает вариабельный домен,
n независимо обозначает 0 или 1.
В одном из вариантов осуществления полинуклеотид, такой как ДНК, входит в состав вектора.
Общие методы, с помощью которых можно сконструировать векторы, методы трансфекции и методы культивирования хорошо известны специалистам в данной области техники. Описание таких методов можно найти в "Current Protocols in Molecular Biology", 1999, F. M. Ausubel (ed), Wiley Interscience, New York и Maniatis Manual, Cold Spring Harbor Publishing.
Изобретение также относится к клетке-хозяину, содержащей один или несколько векторов клонирования или экспрессии, включающих одну или несколько последовательностей ДНК, кодирующих антитело по настоящему изобретению. Для экспрессии последовательностей ДНК, кодирующих молекулу антитела по настоящему изобретению, можно использовать любую подходящую систему клетка-хозяин/вектор. Можно использовать бактериальные, такие как E.coli, и другие микробные системы экспрессии, или эукариотические системы экспрессии, например, клетки млекопитающих. Клетки млекопитающих, подходящие для применения в качестве клеток-хозяев, включают CHO, клетки миеломы или гибридомы.
Настоящее изобретение также относится к способу получения молекулы антитела по настоящему изобретению, включающему культивирование клетки-хозяина, содержащей вектор по настоящему изобретению, в условиях, обеспечивающих экспрессию белка из ДНК, кодирующей молекулу антитела по настоящему изобретению, и выделение молекулы антитела.
Для получения продуктов, содержащих как тяжелую, так и легкую цепи, клеточную линию можно трансфицировать двумя векторами, где первый вектор кодирует полипептид легкой цепи, а второй вектор кодирует полипептид тяжелой цепи. В качестве альтернативы можно использовать один вектор, содержащий последовательности, кодирующие полипептиды легкой цепи и тяжелой цепи. В одном из примеров клеточную линию можно трансфицировать тремя векторами, каждый из которых кодирует полипептидную цепь молекулы антитела по настоящему изобретению. В одном из примеров клеточную линию трансфицируют тремя векторами, кодирующими разные полипептиды, каждый из которых выбран из
a) полипептидной цепи формулы (I):
(Vxx)nVx-Cx-X-V1,
b) полипептидной цепи формулы (II):
(Vyy)nVy-Cy,
полипептида формулы (III):
V2,
где
Vx обозначает вариабельный домен,
Vxx обозначает вариабельный домен,
Cx обозначает константную область домена,
Х обозначает линкер,
V1 обозначает вариабельный домен,
Vy обозначает вариабельный домен,
Vyy обозначает вариабельный домен,
Cy обозначает константную область домена,
V2 обозначает вариабельный домен,
n независимо обозначает 0 или 1.
Следует иметь в виду, что долю каждого вектора, трансфицированного в клетку-хозяина, можно изменять с целью оптимизации экспрессии продукта - мультиспецифического антитела. В одном из вариантов осуществления отношение векторов составляет 1:1:1. Специалист в данной области может определить оптимальное соотношение путем рутинного анализа уровней экспрессии белка после трансфекции.
Следует также иметь в виду, что, когда два или более, в частности, три или более полипептидых компонентов, кодируются полинуклеотидами, присутствующими в одном векторе, относительную экспрессию каждого полипептидного компонента можно изменить путем применения разных промоторов для каждого полинуклеотида, кодирующего полипептидный компонент по настоящему изобретению.
В одном из вариантов осуществления вектор содержит одну полинуклеотидную последовательность, кодирующую всех три полипептидные цепи молекулы мультиспецифическогой антитела по настоящему изобретению под контролем одного промотора.
В одном из вариантов осуществления вектор содержит одну полинуклеотидную последовательность, кодирующую все три полипептидные цепи молекулы мультиспецифического антитела по настоящему изобретению, в которой каждая полинуклеотидная последовательность, кодирующая отдельную полипептидную цепь, находится под контролем другого промотора.
Антитела и фрагменты по настоящему изобретению экспрессируются в клетках-хозяевах на высоких уровнях. Следовательно, свойства антител и/или их фрагментов, по всей вероятности, поддаются оптимизации и позволяют получать их промышленными способами.
Антитела по настоящему изобретению можно использовать для лечения и/или профилактики патологического состояния.
Настоящее изобретение также относится к фармацевтической или диагностической композиции, содержащей молекулу антитела по настоящему изобретению в сочетании с одним или несколькими фармацевтически приемлемыми наполнителями, разбавителями или носителями. Соответственно, изобретение предлагает применение антитела в терапии и для промышленного получения лекарственного средства.
Композицию обычно поставляют в виде части стерильной фармацевтической композиции, которая, как правило, содержит фармацевтически приемлемый носитель. Фармацевтическая композиция по настоящему изобретению может дополнительно содержать фармацевтически приемлемое вспомогательное средство.
Настоящее изобретение также относится к способу получения фармацевтической или диагностической композиции, включающему смешивание молекулы антитела по настоящему изобретению с одним или несколькими фармацевтически приемлемыми наполнителями, разбавителями или носителями.
Молекула антитела может представлять собой единственный активный ингредиент в фармацевтической или диагностической композиции, или она может находиться в сочетании с другими активными ингредиентами, включающими другие антитела, например, антитела против TNF, против IL-1β, против Т-клеток, против IFNγ или против LPS, или отличные от антител ингредиенты, такие как ксантины. Другие подходящие активные ингредиенты включают антитела, способные вызывать толерантность, например, антитела против CD3 или против CD4.
В другом варианте осуществления антитело, его фрагмент или композицию по настоящему изобретению используют в сочетании с другим фармацевтически активным средством, таким как кортикостероид (например, пропионат флутиказона) и/или агонист бета-2 (например, сальбутамол, сальметерол или формотерол), или ингибиторы роста и пролиферации клеток (например, рапамицин, циклофосфамид, метотрексат), или, альтернативно, ингибитор CD28 и/или CD40. В одном из вариантов осуществления ингибитор представляет собой маленькую молекулу. В другом варианте осуществления ингибитор представляет собой антитело, специфичное к мишени.
Фармацевтические композиции соответственно содержат терапевтически эффективное количество антитела по настоящему изобретению. Термин "терапевтически эффективное количество" в настоящем описании относится к количеству терапевтического средства, необходимому для лечения, ослабления или предотвращения целевого заболевания или состояния, или для достижения детектируемого терапевтического или профилактического эффекта. Терапевтически эффективное количество любого антитела можно предварительно определить путем анализов, проводимых на клеточных культурах или на животных моделях, которые обычно получают с использованием грызунов, кроликов, собак, свиней или приматов. Животную модель также можно использовать для определения соответствующего диапазона концентраций и способа введения. Полученные результаты затем можно использовать для определения подходящих доз и способов их введения человеку.
Точное количество, терапевтически эффективное для индивидуума-человека, зависит от тяжести патологического состояния, общего состояния здоровья индивидуума, возраста, веса и пола индивидуума, диеты, времени и частоты введения, сочетания (сочетаний) лекарственных средств, чувствительности к препарату и переносимости терапии/ответа на терапию. Данное количество можно определить с помощью рутинных экспериментов, что относится к компетенции врача-клинициста. Как правило, терапевтически эффективное количество составляет от 0,01 мг/кг до 50 мг/кг, например от 0,1 мг/кг до 20 мг/кг. Альтернативно, доза может составлять от 1 до 500 мг в день, например от 10 до 100, 200, 300 или 400 мг в день. Фармацевтические композиции удобно получать в виде стандартных лекарственных форм, содержащих заранее определенное количество активного средства по настоящему изобретению.
Композиции можно вводить пациенту отдельно или в сочетании (например, одновременно, последовательно или раздельно) с другими лекарственными средствами или гормонами.
Доза, в которой вводят молекулу антитела по настоящему изобретению, зависит от природы состояния, подлежащего лечению, степени воспаления, а также от того, используется ли молекула антитела для профилактики, или для лечения существующего состояния.
Частота введения дозы зависит от периода полужизни молекулы антитела и продолжительности ее действия. Если молекула антитела имеет короткий период полужизни (например, от 2 до 10 часов), может потребоваться введение одной или нескольких доз в день. Альтернативно, если молекула антитела имеет длинный период полужизни (например, от 2 до 15 дней) может потребоваться введение только одной раз в день, раз в неделю или даже один раз каждые 1 или 2 месяца.
Фармацевтически приемлемый носитель не должен сам по себе индуцировать продукцию антител, вредных для индивидуума, получающего композицию, и не должен быть токсичным. Подходящие носители могут представлять собой большие, медленно метаболизируемые макромолекулы, такие как белки, полипептиды, липосомы, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры и неактивные вирусные частицы.
Можно использовать фармацевтически приемлемые соли, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты, или соли органических кислот, такие как ацетаты, пропионаты, малонаты и бензоаты.
Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, такие как вода, физиологический раствор, глицерин и этанол. Кроме того, в таких композициях могут присутствовать вспомогательные вещества, включающие смачивающие или эмульгирующие средства или рН-забуферивающие вещества. Такие носители позволяют получать фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей и суспензий, предназначенных для приема внутрь.
Подходящие для введения формы включают формы, подходящие для парентерального введения, например, путем инъекции или инфузии, например, путем болюсной инъекции или непрерывной инфузии. Продукт, предназначенный для инъекции или инфузии, может находиться в виде суспензии, раствора или эмульсии в масляной или водной среде и может содержать вспомогательные средства, такие как суспендирующие, консервирующие, стабилизирующие и/или диспергирующие средства. Альтернативно, молекула антитела может находиться в сухой форме, предназначенной для восстановления перед применением с помощью соответствующей стерильной жидкости.
После получения композиции по настоящему изобретению можно сразу вводить индивидууму. Индивидуумы, подлежащие лечению, могут представлять собой животных. Однако в одном или нескольких вариантах осуществления композиции адаптируют для введения человеку.
В одном из вариантов осуществления значение рН состава по настоящему изобретению не равно значению изоэлектрической точки антитела или его фрагмента, например, если рН состава равен 7, то pI может составлять 8-9 или выше. Без связи с какой-либо теорией полагают, что в итоге это может обеспечить повышенную стабильность конечного состава, например, антитело или его фрагмент может оставаться в растворе.
Фармацевтические композиции по настоящему изобретению можно вводить с помощью любого числа способов, включающих, без ограничения, пероральное, внутривенное, внутримышечное, внутриартериальное, костномозговое, интратекальное, внутрижелудочковое, трансдермальное, чрескожное (например, см. WO 98/20734), подкожное, внутрибрюшинное, интраназальное, энтеральное, местное, сублингвальное, интравагинальное или ректальное введение. Для введения фармацевтических композиций по настоящему изобретению также можно использовать безыгольные шприцы. Обычно терапевтические композиции получают в виде инъецируемых препаратов, например, в виде жидких растворов или суспензий. Кроме того, можно получить твердые формы, подходящие для растворения или суспендирования в жидких средах перед инъекцией. Предпочтительно молекулы антител по настоящему изобретению вводят подкожно, путем ингаляции или местно.
Непосредственную доставку композиций обычно осуществляют путем подкожной, внутрибрюшинной, внутривенной или внутримышечной инъекции, или доставляют в интерстициальное пространство ткани. Композиции также можно вводить в конкретную представляющую интерес ткань. Введение доз можно осуществлять однократно или многократно.
Следует понимать, что активный ингредиент в композиции представляет собой молекулу антитела. Как таковая, она может подвергаться деградации в желудочно-кишечном тракте. Следовательно, композиция, предназначенная для введения через желудочно-кишечный тракт, должна содержать средства, которые защищают антитело от деградации, но которые высвобождают антитело после абсорбции из желудочно-кишечного тракта.
Подробное описание фармацевтически приемлемых носителей можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Company, NJ. 1991).
В одном из вариантов осуществления состав получают в виде препарата для местного введения, например, путем ингаляции.
Препараты, подходящие для ингаляций, включают порошки для вдыхания, дозированные аэрозоли, содержащие газы-пропелленты или растворы для ингаляций, не содержащие газ-пропеллент (например, распыляемые растворы или суспензии). Вдыхаемые порошки по настоящему изобретению могут содержать только указанные выше активные вещества, или смеси указанных выше активных веществ с физиологически приемлемым наполнителем.
Эти вдыхаемые порошки могут содержать моносахариды (такие как глюкоза или арабиноза), дисахариды (такие как лактоза, сахароза, мальтоза), олиго- и полисахариды (такие как декстраны), многоатомные спирты (например, сорбит, маннит, ксилит), соли (например, хлорид натрия, карбонат кальция) или смеси указанных соединений друг с другом.
Моно- или дисахариды удобно использовать в виде гидратов, при применении лактозы или глюкозы это предпочтительно, но не обязательно.
Размер частиц, предназначенных для осаждения в легких, должен составлять менее 10 мкм, например, 1-9 мкм, например от 0,1 до 5 мкм, предпочтительно от 1 до 5 мкм. Размер частиц активного вещества (например, антитела или его фрагмента) имеет первостепенное значение.
Газы-пропелленты, которые можно использовать для получения ингаляционных аэрозолей, известны в данной области техники. Подходящие газы-пропелленты могут быть выбраны из группы, включающей углеводороды, такие как н-пропан, н-бутан или изобутан, и галогенсодержащие углеводороды, такие как хлорированные и/или фторированные производные метана, этана, пропана, бутана, циклопропана или циклобутана. Указанные газы-пропелленты можно использовать по отдельности или в смеси друг с другом.
Особенно подходящие газы-пропелленты включают галогенированные производные алканов, выбранные из TG 11, TG 12, TG 134а и TG 227. Среди вышеуказанных галогенированных углеводородов особенно предпочтительными являются TG134a (1,1,1,2-тетрафторэтан) и TG227 (1,1,1,2,3,3,3-гептафторпропан) и их смеси.
Ингаляционные аэрозоли, содержащие газ-пропеллент, также могут содержать другие ингредиенты, такие как сорастворители, стабилизаторы, поверхностно-активные вещества (ПАВ), антиоксиданты, смазывающие средства и средства, регулирующие рН. Все указанные ингредиенты известны в данной области.
Ингаляционные аэрозоли по настоящему изобретению, содержащие газ-пропеллент, могут содержать до 5% по массе активного вещества. Аэрозоли по настоящему изобретению содержат, например, от 0,002 до 5% по массе, от 0,01 до 3% по массе, от 0,015 до 2% по массе, от 0,1 до 2% по массе, от 0,5 до 2% по массе или от 0,5 до 1% по массе активного вещества.
Альтернативно, местное введение в легкие также можно осуществлять путем введения состава в виде жидкого раствора или суспензии, например с использованием такого устройства, как небулайзер, например, небулайзер, соединенный с компрессором (такой как небулайзер Pari LC-Jet Plus(R), соединенный с компрессором Pari Master(R), производимый Pari Respiratory Equipment, Inc., Richmond, Va).
В одном из вариантов осуществления состав предоставляют в отдельных ампулах, содержащих единичную дозу для доставки путем распыления.
В одном из вариантов осуществления антитело получают в виде лиофилизированной формы, предназначенной для разведения, или, альтернативно, в виде суспензии.
Антитело по настоящему изобретению можно доставлять в виде формы, распределенной в растворителе, например, в виде раствора или суспензии. Его можно суспендировать в соответствующем физиологическом растворе, таком как физиологический солевой раствор, фармакологически приемлемый растворитель или буферный раствор. Буферные растворы, известные в данной области, могут содержать от 0,05 мг до 0,15 мг динатрия эдетата, от 8,0 мг до 9,0 мг NaCl, от 0,15 мг до 0,25 мг полисорбата, от 0,25 мг до 0,30 мг безводной лимонной кислоты и от 0,45 мг до 0,55 мг цитрата натрия на 1 мл воды, так, чтобы достичь рН примерно от 4,0 до 5,0. Как указано выше, для получения суспензии можно использовать, например, лиофилизированное антитело.
Терапевтические составы в виде суспензий или растворов также могут содержать один или несколько наполнителей. Наполнители хорошо известны в данной области и включают буферы (например, цитратный буфер, фосфатный буфер, ацетатный буфер и бикарбонатный буфер), аминокислоты, мочевину, спирты, аскорбиновую кислоту, фосфолипиды, белки (например, сывороточный альбумин), ЭДТА, хлорид натрия, липосомы, маннит, сорбит и глицерин. Растворы или суспензии могут быть заключены в липосомы или биоразлагаемые микросферы. Состав обычно получают в виде практически стерильной формы в результате применения стерильных процессов производства.
Такие процессы могут включать получение и стерилизацию фильтрованием раствора в буферном растворителе, используемом для получения состава, получение асептической суспензии антитела в стерильном буферном растворе, и помещение состава в стерильные сосуды, с использованием методов, известных специалистам в данной области.
Распыляемый состав по настоящему изобретению можно получить, например, в виде стандартных лекарственных форм (таких как герметично закрытые пластиковые контейнеры или флаконы), упакованных в конверты из фольги. Каждый флакон содержит разовую дозу в объеме растворителя/буферного раствора, составляющем, например, 2 мл.
Предполагается, что антитела по настоящему изобретению можно использовать для доставки путем распыления. Предполагается также, что антитела по настоящему изобретению можно вводить методом генной терапии. Для этого последовательности ДНК, кодирующие тяжелую и легкую цепи молекулы антитела под контролем соответствующих компонентов ДНК, вводят пациенту таким образом, чтобы цепи антитела экспрессировались из последовательностей ДНК с последующей сборкой антитела in situ.
Патологическое состояние или расстройство может быть выбрано, например, из группы, состоящей из инфекций (вирусные, бактериальные, грибковые и паразитарные), эндотоксического шока, связанного с инфекцией, артрита, такой как ревматоидный артрит, астмы, такой как тяжелая астма, хронической обструктивной болезни легких (ХОБЛ), воспаления тазовых органов, болезни Альцгеймера, воспалительных заболеваний кишечника, болезни Крона, язвенного колита, болезни Пейрони, целиакии, болезней желчного пузыря, пилонидальной болезни, перитонита, псориаза, васкулита, хирургических спаек, инсульта, диабета типа I, болезни Лайма, менингоэнцефалита, аутоиммунного увеита, опосредованных иммунным ответом воспалительных заболеваний центральной и периферической нервной системы, таких как рассеянный склероз, волчанка (например, системная красная волчанка) и синдром Гийена-Барра, атопического дерматита, аутоиммунного гепатита, фиброзирующего альвеолита, болезни Грейвса, IgA нефропатии, идиопатической тромбоцитопенической пурпуры, болезни Меньера, пузырчатки, первичного билиарного цирроза печени, саркоидоза, склеродермии, гранулематоза Вегенера, других аутоиммунных заболеваний, панкреатита, травмы (операционной), реакции трансплантат против хозяина, отторжения трансплантата, болезней сердца, включающих ишемические заболевания, такие как инфаркт миокарда, а также атеросклероза, внутрисосудистой коагуляции, резорбции кости, остеопороза, остеоартрита, периодонтита и гипохлоргидрии.
Настоящее изобретение также относится к молекуле антитела по настоящему изобретению для лечения или профилактики боли, особенно боли, связанной с воспалением.
Таким образом, изобретение относится к антителу для применения в медицине и способы лечения, в которых используется указанное антитело.
В одном из вариантов осуществления изобретение относится к способу очистки антитела (предпочтительно антитела по настоящему изобретению или его фрагмента).
В одном из вариантов осуществления изобретение относится к способу очистки антитела (предпочтительно антитела по настоящему изобретению или его фрагмента), включающий следующие стадии: проведение анионообменной хроматографии в несвязывающем режиме, в котором примеси задерживается на колонке, а антитело элюируется в несвязанной фракции. Данную стадию можно проводить, например, при рН в диапазоне 6-8.
Способ может дополнительно включать начальную стадию улавливания с использованием катионообменной хроматографии, которую проводят, например, при рН в диапазоне примерно от 4 до 5.
Способ также может включать дополнительную хроматографическую стадию (стадии), которая обеспечивает отделение примесей, связанных с продуктом и процессом, от потока продукта.
Процесс очистки может также включать одну или несколько стадий ультрафильтрации, таких как концентрирование и диафильтрация.
Как указано выше, очищенная форма характеризуется степенью чистоты, составляющей, по меньшей мере, 90%, например, 91, 92, 93, 94, 95, 96, 97, 98, 99% масс/масс, или более.
Выражение “практически не содержит эндотоксина”, как правило, означает, что содержание эндотоксина составляет 1 EU на мг продукта-антитела или менее, например, 0,5 или 0,1 EU на мг продукта.
Выражение “практически не содержит белок или ДНК клетки-хозяина”, как правило, означает, что содержание белка и/или ДНК клетки-хозяина составляет 400 мкг на мг продукта-антитела или менее, например, 100 мкг на мг или менее, предпочтительно 20 мкг на мг, в зависимости от обстоятельств.
Молекулу антитела по настоящему изобретению также можно использовать для диагностики, например, для диагностики и визуализации in vivo болезненных состояний, связанных с OX40.
Термин “содержащий” в контексте настоящего описания означает включающий.
В тех случаях, когда это технически возможно, варианты осуществления настоящего изобретения можно объединять.
Варианты осуществления описаны в настоящем документе как содержащие определенные признаки/элементы. Изобретение также охватывает отдельные варианты осуществления, содержащие или в основном содержащие указанные признаки/элементы.
Далее настоящее изобретение описывается только в качестве иллюстрации посредством нижеследующих примеров со ссылкой на прилагаемые чертежи.
Примеры
Пример 1: Однолинкерный Fab-dsFv
Конструирование плазмид, обеспечивающих экспрессию однолинкерного A26Fab-645dsFv, A26Fab-645dsFv и A26Fab-645dsscFv в клетках млекопитающих
Гибридные белки A26Fab для экспрессии однолинкерных A26Fab-645dsFv и A26Fab-645dsFv, см. фиг. 1, конструируют путем гибридизации 645vL с С-концом константной области каппа легкой цепи А26 аллотипа KM3 человека с использованием гибкого линкера SGGGGSGGGGSGGGGS (SEQ ID NO: 103), или путем гибридизации 645vH с С-концом CH1 константной области тяжелой цепи А26 изотипа гамма 1 человека с использованием гибкого линкера SGGGGSGGGGTGGGGS (SEQ ID NO: 78). Кроме того, в последовательности ДНК вводят точечные мутации, соответствующие выбранным остаткам каркасного участка как 645vL, так и 645vH. Мутации (G44C в тяжелой цепи и G100C в легкой цепи) вводят, чтобы создать межцепочечную дисульфидную связь между тяжелой и легкой цепями 645Fv. Гибридные белки A26Fab для экспрессии A26Fab-645dsscFv, фиг. 1, конструируют следующим образом. Одноцепочечный Fv (ScFv) получают путем соединения N-конца 645vL с С-концом 645vH через гибкий линкер GGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 79). В последовательность ДНК вводят точечные мутации, соответствующие каркасным остаткам G100C в 645vL и G44C в 645vH, чтобы получить ScFv, содержащий дисульфидную связь (dsscFv). Затем 645dsscFv соединяют либо с С-концом константной области каппа легкой цепи А26 аллотипа KM3 человека с использованием гибкого линкера SGGGGSGGGGS (SEQ ID NO: 104), либо с С-концом CH1 константной области тяжелой цепи А26 изотипа гамма 1 человека с использованием гибкого линкера SGGGGTGGGGS (SEQ ID NO: 80). Легкая цепь A26Fab-645dsvL, тяжелая цепь A26Fab-645dsvH, легкая цепь A26Fab, тяжелая цепь A26Fab, свободный домен 645dsvL, свободный домен 645dsvH, легкая цепь A26Fab-645dsscFv и тяжелая цепь A26Fab-645dsscFv получают химическим способом и по отдельности клонируют в векторах, обеспечивающих экспрессию в клетках млекопитающих, под контролем промотора HCMV-MIE и последовательности поли A SV40E.
Экспрессия однолинкерного A26Fab-645dsFv, A26Fab-645dsFv и A26Fab-645dsscFv в клетках НЕК293
НЕК293 трансфицируют соответствующими плазмидами с использованием реагента для трансфекции 293fectin, Invitrogen, в соответствии с инструкциями производителя. Чтобы обеспечить экспрессию разных конструкций, плазмиды смешивают следующим образом; для экспрессии A26Fab-645dsFv используют плазмиды A26Fab Heavy-(S, 3xG4S/T)-645dsvH и A26Fab Light-(S, 3xG4S)-645dsvL; для экспрессии однолинкерного A26Fab-645dsFv (получают путем соединения LC-vL) используют плазмиды A26Fab Heavy, 645dsvH и A26Fab Light-(S, 3xG4S)-645dsvL; для экспрессии однолинкерного A26Fab-645dsFv (получают путем соединения HC-vH) используют плазмиды A26Fab Heavy-(S, 3xG4S/T)-645dsvH, A26Fab Light и 645dsvL; для экспрессии A26Fab-645dsscFv (HC-ScFv), используют плазмиды A26Fab Heavy-(S, 2xG4S/Т)-645dsscFv(vH-4xG4S-vL) и A26Fab Light; и для экспрессии A26Fab-645dsscFv (LC-ScFv), используют плазмиды A26Fab Heavy и A26Fab Light-(S, 2xG4S)-645dsscFv(vH-4xG4S-vL). Кроме того соотношение плазмид, используемых для трансфекции, также варьирует, для сочетаний из 2 плазмид их соотношение составляет 1:1, тогда как для сочетаний из 3 плазмид тестируют разные соотношения. В общей сложности 50 мкг плазмидной ДНК инкубируют в присутствии 125 мкл 293fectin + 4,25 мл среды Optimem в течение 20 мин при комнатной температуре. Затем смесь добавляют к 50 мл суспензии клеток НЕК293 с концентрацией 1×106 клеток/мл и инкубируют при встряхивании при 37°С. Супернатанты собирают на 7-й день путем центрифугирования при 1500 g для удаления клеток и пропускают через фильтр 0,22 мкм. Уровень экспрессии определяют методом ВЭЖХ на белке G.
Все конструкции характеризуются сравнимым уровнем экспрессии, см. таблицу 4, находящемся в диапазоне 3-15 мкг/мл. Уровень экспрессии Fab-dsFv составляет 13-14 мкг/мл, уровень экспрессии Fab-dsscFv составляет 7-15 мкг/мл и уровень экспрессии однолинкерного Fab-dsFv составляет 3-13 мкг/мл. В литературе описаны данные, свидетельствующие о том, что экспрессия участков Fv, в которых отсутствует либо линкер между vL и vH, либо мотив димеризации, обеспечивающий связывание vL и vH, характеризуется значительно более низкими уровнями, чем экспрессия связанных Fv. В литературе отсутствуют данные, свидетельствующие об отсутствии существенной разницы между наивысшей экспрессией конструкций разных типов.
Анализ экспрессии однолинкерного A26Fab-645dsFv, A26Fab-645dsFv и A26Fab-645dsscFv в клетках HEK293 методом BIAcore
Сродство связывания и кинетические параметры взаимодействия конструкций Fab-dsFv, Fab-dsscFv и однолинкерного Fab-dsFv определяют с помощью поверхностного плазмонного резонанса (SPR), проводимого на BIAcore T100 с использованием сенсорных чипов СМ5 и рабочего буфера HBS-EP (10 мМ HEPES (рН 7,4), 150 мМ NaCl, 3 мМ ЭДТА, 0,05% об/об поверхностно-активного вещества Р20). Образцы однолинкерного Fab-dsFv улавливают на поверхности сенсорного чипа либо с использованием козьих Fab, специфичных к F(ab')2 человека (Jackson ImmunoResearch, 109-006-097), или с использованием полученного в собственной лаборатории моноклонального антитела против CH1 человека. Ковалентную иммобилизацию улавливающего антитела проводят с использованием стандартной химии аминной конденсации.
Каждый цикл анализа включает улавливание конструкций Fab-dsFv, Fab-dsscFv или однолинкерного FAB-dsFv путем введения в течение 1 мин, затем фазу ассоциации, включающую пропускание антигена в течение 3 мин, и регистрацию диссоциации в течение 5 мин. После каждого цикла улавливающую поверхность регенерируют путем пропускания 2×1 мин 40 мм HCl и затем 5 мМ NaOH в течение 30 сек. Скорость потока составляет 10 мкл/мин на стадии улавливания, 30 мкл/мин на стадиях ассоциации и диссоциации, и 10 мкл/мин на стадии регенерации. Для проведения кинетических анализов используют либо титрование сывороточного альбумина человека 50-6,25 нМ, либо одну концентрацию OX40, равную 25 нМ. Поток пустых клеток используют для вычитания контроля, а поток буфера используют для вычитания шума и дрейфа прибора. Кинетические параметры определяют путем одновременной общей подгонки полученных сенсограмм к стандартной модели связывания 1:1 с использованием программного обеспечения BIAcore Т100 Evaluation.
Значения скоростей ассоциации, скоростей диссоциации и сродства всех образцов являются сходными в отношении обоих антигенов, сывороточного альбумина человека (HSA), и OX40 человека, таблица 5. Следовательно, наличие и положение разных линкеров в разных конструкциях не оказывает существенного влияния на сродство вариабельного участка к его антигену.
(начальный)
(HC-scFv)
(LC-scFv)
(отношение 1:1:1 LC-vL:HC:vH)
(отношение 1:1:2 LC-vL:HC:vH)
(отношение 2:1:2 LC-vL:HC:vH)
(отношение 1:1:1 LC-vL:HC:vH)
(отношение 1:1:1 HC-vH:LC:vL)
(отношение 1:1:2 HC-vH:LC:vL)
(отношение 2:1:2 HC-vH:LC:vL)
(конечный)
Очистка на белке G однолинкерного A26Fab-645dsFv, A26Fab-645dsFv и A26Fab-645dsscFv, экспрессированных в клетках HEK293
~50 мл супернатантов HEK293 концентрируют в ~25 раз до объема ~2 мл с использованием центрифужных концентраторов с отсечением 10 кДа по молекулярной массе. Концентрированные супернатанты наносят на колонку с белком-G HiTrap FF объемом 1 мл (GE Healthcare), уравновешенную в 20 мМ фосфате в 40 мМ NaCl, рН 7,4. Колонку промывают раствором, содержащим 20 мМ фосфат, 40 мМ NaCl, pH 7,4, и связанное вещество элюируют 0,1 М глицином/HCl, pH 2,7. Пик элюции собирают и рН доводят до pH ~7 с помощью 2 М Трис/HCl pH 8,5. Элюаты с откорректированным pH концентрируют и буфер заменяют на PBS, рН 7,4, используя центрифужные концентраторы с отсечением по молекулярной массе 10 кДа.
Анализ методом SDS-PAGE очищенных на белке G однолинкерного A26Fab-645dsFv, A26Fab-645dsFv и A26Fab-645dsscFv, экспрессированных в клетках HEK293
Образцы разводят водой, если это необходимо, и затем добавляют до 26 мкл 10 мкл 4x Bis-Tris буфера LDS для образцов и 4 мкл 10х восстанавливающего реагента для восстановления образцов. Образцы перемешивают на вортексе, инкубируют при температуре 100°С в течение 3 мин, охлаждают и центрифугируют при 12500 оборотах в минуту в течение 30 секунд. Полученные образцы загружают на 4-20% акриламидный гель трис/глицин SDS и прогоняют в течение 110 минут при постоянном напряжении 125 В. Гели окрашивают красителем для белка кумасси голубым, фиг. 2.
Полосы образцов, полученные в геле методом восстанавливающего SDS-PAGE, оценивают на положение и интенсивность окрашивания, постоянную для всех правильно экспрессированных конструкций. Для Fab-dsFv, полоса 2, должно быть 2 полосы, соответствующие ~36 и ~37 кДа, примерно с одинаковой интенсивностью окрашивания. Для Fab-dsscFv (LC-ScFv), полоса 3, должно быть 2 полосы, соответствующие ~51 и ~23 кДа, причем окрашивание верхней полосы примерно в два раза интенсивнее. Для Fab-dsscFv (НС-ScFv), полоса 4, должно быть 2 полосы, соответствующие ~50 и ~26 кДа, причем окрашивание верхней полосы примерно в два раза интенсивнее. Для однолинкерного Fab-dsFv (LC-vL), полосы 6-9, должно быть 3 полосы, соответствующие ~36, ~23 и ~13 кДа, с соотношением интенсивностей окрашивания примерно 3:2:1 от верхней к нижней полосе. Для однолинкерного Fab-dsFv (HC-VH), полосы 10-12, должно быть 3 полосы, соответствующие ~37, ~26 и ~12 кДа, с соотношением интенсивностей окрашивания примерно 3:2:1 от верхней к нижней полосе.
Анализ методом SEC-ВЭЖХ G3000 очищенных на белке G однолинкерного A26Fab-645dsFv, A26Fab-645dsFv и A26Fab-645dsscFv, экспрессированных в клетках HEK293
50 мкг образцов вводят на колонку TSK Gel G3000SWXL, 7,8×300 мм, (Tosoh), и проводят анализ в изократическом градиенте 200 мМ фосфата рН 7,0 со скоростью 1 мл/мин. Сигнал детектируют по поглощению при 280 нм, фиг. 3. После очистки на белке G определяют, что A26Fab 645dsFv содержит ~45% мономера, A26Fab-645dsscFv содержит немного больше мономера в диапазоне 55-60%, тогда как все однолинкерные A26Fab-645dsFv содержат более 80% мономера, причем некоторые из них на 100% состоят из мономера.
Пример 2
Конструирование плазмид, содержащих тройной ген и обеспечивающих экспрессию однолинкерных A26Fab-645dsFv и A26Fab-648dsFv в клетках млекопитающих
Плазмиды, содержащие тройные гены, конструируют путем получения, в первую очередь, промежуточного вектора, содержащего двойной ген, из отдельных генных компонентов форматов однолинкерных FAB-dsFv, как описано в примере 1/фиг. 1. Фрагмент гена, кодирующий экспрессию тяжелой цепи, который содержит промотор hCMV-MIE, последовательность, кодирующую тяжелую цепь и участок полиА SV40, субклонируют ниже гена легкой цепи в векторе, обеспечивающем экспрессию в клетках млекопитающих. Тяжелая цепь представляет собой либо тяжелую цепь А26 Fab, либо тяжелую цепь А26 Fab, связанную с 645dsvH или 648dsvH через линкер (S, 3xG4S), а легкая цепь представляет собой либо легкую цепь А26 Fab, связанную с 645dsvL или 648dsvL через линкер (S, 3xG4S), либо легкую цепь А26 Fab, соответственно. В результате для каждого формата получают промежуточные плазмиды, содержащие двойной ген. Затем чтобы сконструировать плазмиду, содержащую тройной ген, фрагмент, кодирующий экспрессию свободного родственного v-участка (645dsvL, 648dsvL, 645dsvH или 648dsvH), субклонируют в уникальном участке рестрикции ниже гена тяжелой цепи в промежуточном векторе. И наконец, чтобы получить стабильное поколение клеточной линии, маркер селекции клеток млекопитающих субклонируют в экспрессионных плазмидах. В результате получают набор плазмид, которые содержат соответствующие гены, обеспечивающие экспрессию однолинкерного Fab-dsFv, при равных соотношениях генов, в присутствии или в отсутствии маркера селекции клеток млекопитающих. Указанные плазмиды используют для начального анализа систем, обеспечивающих временную экспрессию в клетках млекопитающих, по сравнению с % мономера (фиг. 3) однолинкерного Fab-dsFv, экспрессированного с использованием плазмид, содержащих один ген.
Временная экспрессия однолинкерных A26Fab-645dsFv и A26Fab-648dsFv из плазмид, содержащих тройных ген, в клетках CHO
Клетки СНО выращивают в среде CD CHO, содержащей 1х L-GlutaMAX (Life Technologies), до экспоненциальной фазы роста при жизнеспособности >99%. Клетки промывают сбалансированным солевым раствором Эрла (Life Technologies) и затем в них вводят плазмидную ДНК методом электропорации в соответствии с рекомендациями, разработанными в лаборатории. Трансфицированные клетки переносят в среду CD-CHO, содержащую 1х L-GlutaMAX и 1х противогрибковый раствор (Life Technologies), после чего инкубируют в орбитальном шейкере в течение 24 ч при 37°С, 8% CO2 и 140 об/мин. После инкубации, или когда культуры достигнут плотности жизнеспособных клеток, по меньшей мере, 2×106 кл мл-1, температуру снижают до 32°C. Затем, через 72 ч после трансфекции, добавляют 3 мМ бутират натрия (Sigma Aldrich), и культуры повторно инкубируют в течение еще 11 дней при 32°С и 8% CO2, встряхивая при 140 оборотах в минуту. Супернатант собирают центрифугированием и затем фильтруют через стерильные фильтры 0,45 мкм и 0,22 мкм. Титры экспрессии количественно определяют методом ВЭЖХ на белке G по сравнению с фрагментом Fab, используемым в качестве стандарта.
Уровень экспрессии из плазмид, содержащих тройной ген, зависит от присутствия маркера селекции млекопитающих, см. фиг. 5. Уровень экспрессии однолинкерных белков A26 FAB-dsFv, экспрессированных из плазмид, не содержащих маркера селекции млекопитающих, выше, чем уровень экспрессии из плазмид, содержащих маркер селекции млекопитающих, как и следовало ожидать вследствие метаболической нагрузки, необходимой для экспрессии дополнительного гена, хотя указанные уровни являются сравнимыми. Кроме того, более высокие уровни экспрессии наблюдаются в случае белков, содержащих А26 Fab light, связанный с цепью 645dsvL или 648dsvL.
Очистка на белке G однолинкерного A26Fab-645dsFv и A26Fab-648dsFv, экспрессированного из плазмид, содержащих тройной ген в клетках CHO
200 мл супернатантов концентрируют в ~20 раз с использованием центрифужных концентраторов с отсечением по молекулярной массе 10 кДа. Концентрированные супернатанты наносят на колонку HiTrap Protein-G FF объемом 1 мл (GE Healthcare), уравновешенную 20 мМ фосфата, 40 мМ NaCl, pH 7,4. Колонку промывают раствором, содержащим 20 мМ фосфат, 40 мМ NaCl, pH 7,4 после чего связанное вещество элюируют 0,1 М глицин/HCl, pH 2,7. Фракции, соответствующие пику элюирования, собирают и рН доводили до ~7, используя Трис/HCl, pH 8,5. После доведения pH элюаты концентрируют и буфер заменяют на PBS, рН 7,4, с помощью центрифужных концентраторов с отсечением по молекулярной массе 10 кДа. Концентрацию белка определяют методом спектрофотометрии при A 280.
Анализ методом SDS-PAGE очищенных на белке G однолинкерных A26Fab-645dsFv и A26Fab-648dsFv, экспрессированных из плазмид, содержащих тройные гены, в клетках CHO
При необходимости образцы белка разводят PBS. Чтобы восстановить образцы, к 8,25 мкл следующего образца добавляют 3,75 мкл 4х буфера для образцов бис-трис LDS (Life Technologies), 1,5 мкл 100 мМ N-этилмалеимида и 1,5 мкл 10х восстанавливающего реагента. Образцы перемешивают на вортексе, инкубируют при температуре 100°С в течение 3 мин, охлаждают и центрифугируют при 13200 об/мин в течение 30 секунд. Полученные образцы загружают на 4-20% акриламидный гель в трис/глицине + SDS (Life Technologies) и проводят электрофорез в трис-глициновом буфере в течение ~150 минут при постоянном напряжении 125 В. В качестве стандартного маркера для SDS-PAGE используют белок Seeblue2 (Life Technologies). Гели окрашивают красителем для белка кумасси синим InstantBlue (Expedeon), краситель удаляют дистиллированной водой, фиг. 6.
Полосы в геле для восстанавливающего SDS-PAGE характеризуют с точки зрения положения и интенсивности окрашивания, которая является постоянной для всех правильно экспрессированных конструкций. Все однолинкерные FAB-dsFv характеризуются 3 полосами, соответствующими ~36-37 (I), ~24-26 (II) и ~12-13 кДа (III), интенсивность окрашивания которых находится в соотношении примерно 3:2:1 от верхней к нижней полосе.
Анализ методом SEC-ВЭЖХ G3000 очищенных на белке G однолинкерных A26Fab-645dsFv и A26Fab-648dsFv, экспрессированных из плазмид, содержащих тройные гены, в клетках CHO
50 мкл образцов вводят на колонку G3000SWXL с гелем TSK, 7,8×300 мм, (Tosoh) и проводят хроматографию в изократическом градиенте 200 мМ фосфата рН 7,0 со скоростью 1 мл/мин. Детекцию проводят путем измерения поглощения при 280 нм, фиг. 7. Все однолинкерные A26Fab-645dsFv экспрессируются из плазмид, содержащих тройной ген, независимо от присутствия маркера селекции млекопитающих или уровня экспрессии, с достижением доли мономера более 90%, причем в большинстве случаев доля мономера составляет 100%. Эти данные хорошо согласуются с экспрессией мономерных однолинкерных A26Fab-dsFv из плазмид, содержащих один ген, фиг. 3. Полученные результаты также свидетельствуют о том, что равное отношение соответствующих генов, кодирующих формат и присутствующих в конфигурации плазмиды, содержащей тройной ген, является оптимальным для экспрессии однолинкерных Fab-dsFv с высоким уровнем мономера.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИИ ПОЛИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2015 |
|
RU2725812C2 |
| КОНСТРУКЦИИ ПОЛИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2015 |
|
RU2784673C2 |
| КОНСТРУКЦИИ МУЛЬТИСПЕЦИФИЧНЫХ АНТИТЕЛ | 2015 |
|
RU2710730C2 |
| МОЛЕКУЛЫ СО СПЕЦИФИЧНОСТЬЮ К CD45 И CD79 | 2015 |
|
RU2747980C2 |
| ТРИ- ИЛИ ТЕТРАСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2010 |
|
RU2570633C2 |
| ПОЛИСПЕЦИФИЧНЫЕ АНТИТЕЛА, ВКЛЮЧАЮЩИЕ АНТИТЕЛА ПОЛНОЙ ДЛИНЫ И ОДНОЦЕПОЧЕЧНЫЕ ФРАГМЕНТЫ FAB | 2010 |
|
RU2598248C2 |
| МУЛЬТИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО СО СПЕЦИФИЧНОСТЬЮ СВЯЗЫВАНИЯ IL-13 И IL-17 ЧЕЛОВЕКА | 2020 |
|
RU2827946C1 |
| ПОЛИПЕПТИДЫ ДЛЯ СВЯЗЫВАНИЯ С "РЕЦЕПТОРОМ КОНЕЧНЫХ ПРОДУКТОВ ГЛИКИРОВАНИЯ", А ТАКЖЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ, В КОТОРЫХ ОНИ ПРИНИМАЮТ УЧАСТИЕ | 2010 |
|
RU2558301C2 |
| МОЛЕКУЛЫ СО СПЕЦИФИЧНОСТЬЮ В ОТНОШЕНИИ CD79 И CD22 | 2015 |
|
RU2743590C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ВЕКТОРЫ ЭКСПРЕССИИ МЛЕКОПИТАЮЩИХ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2502800C2 |



















































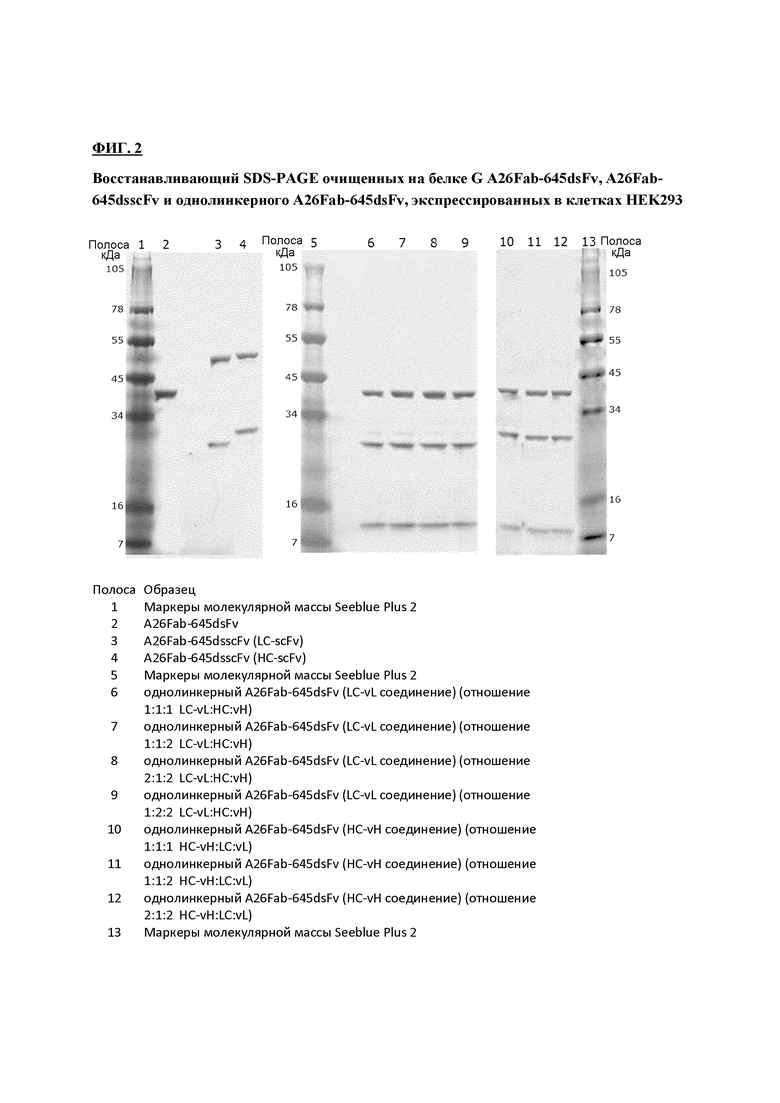

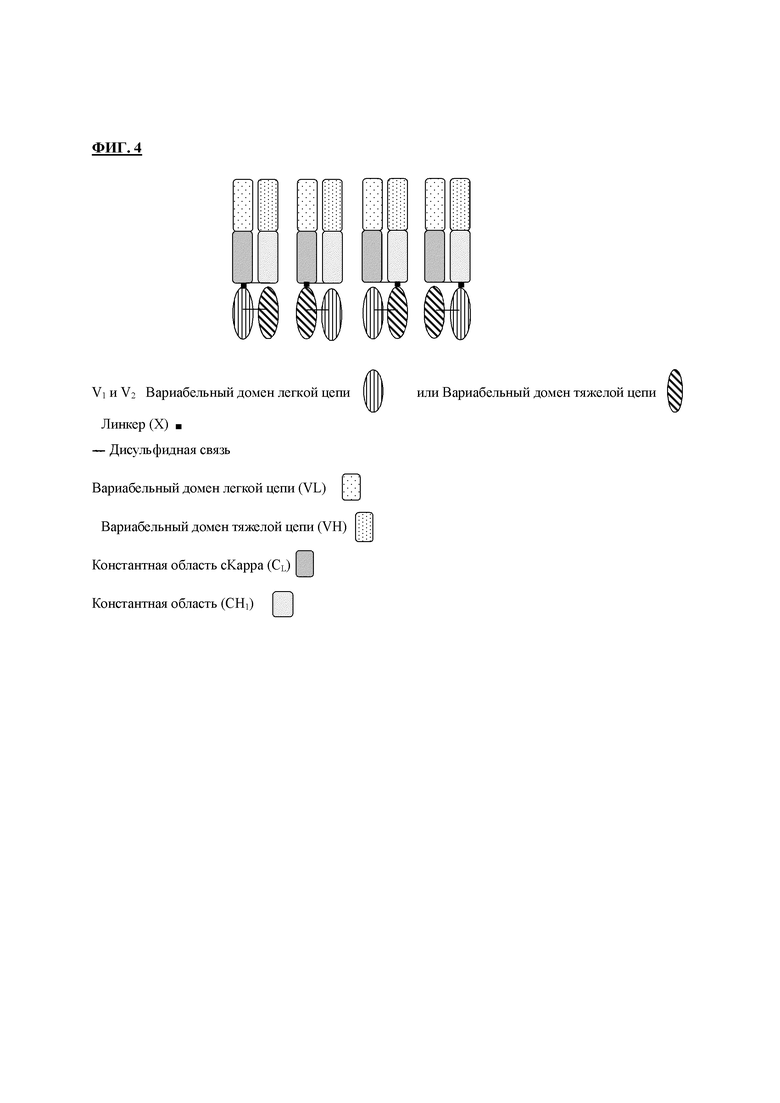
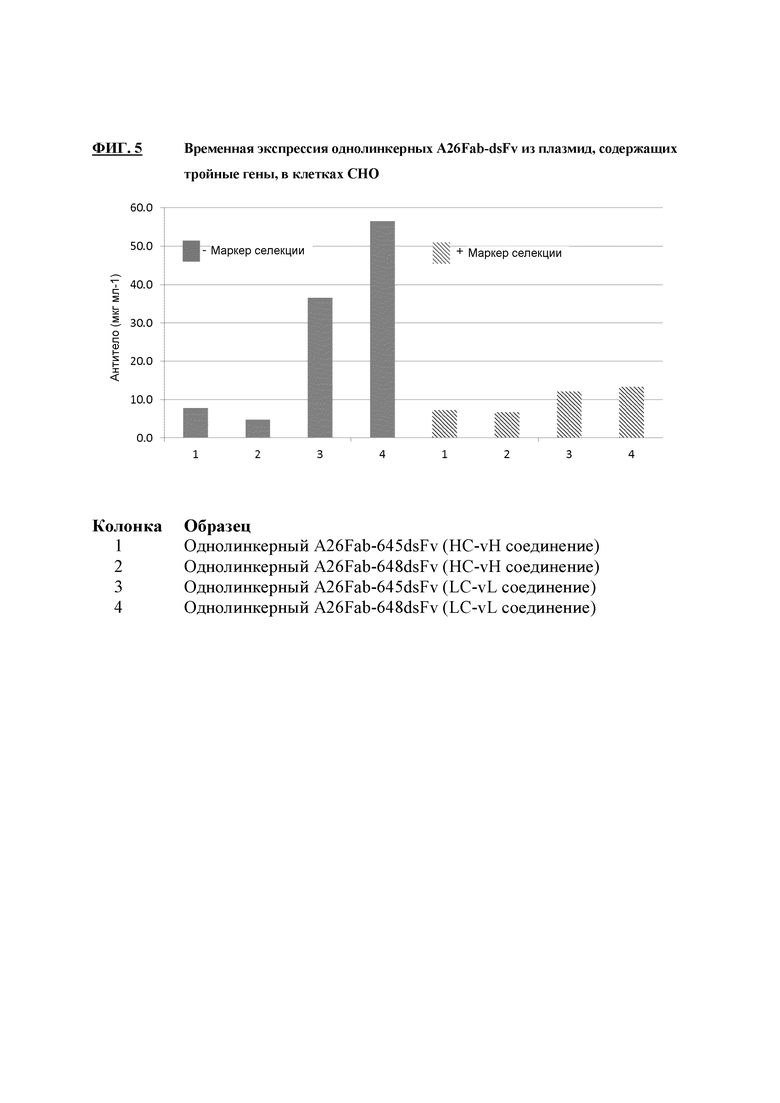
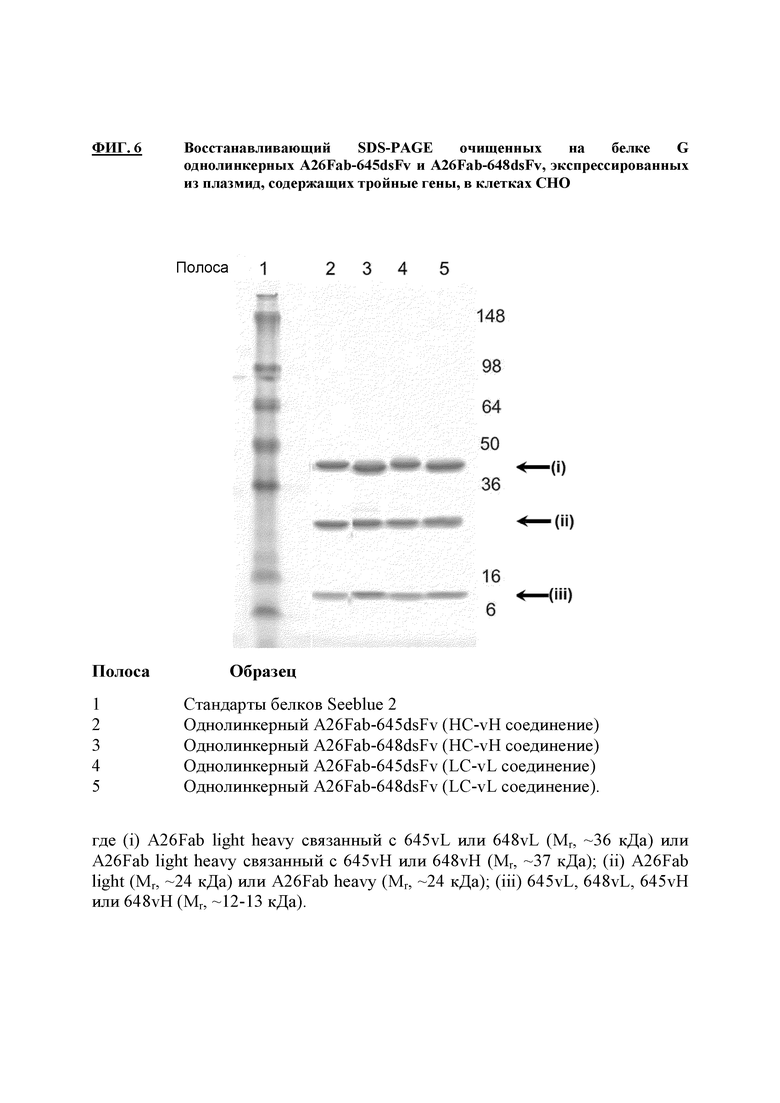

Настоящее изобретение относится к получению мультиспецифических конструкций. Предложены полинуклеотиды, вектор экспрессии, клетка-хозяин и способ получения мультиспецифического или биспецифического антитела. Получаемое антитело состоит из трех полипептидных цепей: (Vxx)nVx-Cx-X-V1; (Vyy)nVy-Cy и V2, где Vx, Vxx, V1, V2, Vy и Vyy обозначают вариабельные домены, Cx и Сy – константные области, Х - линкер, n независимо обозначает 0 или 1. Данное изобретение может найти применение в получении терапевтических препаратов. 6 н. и 22 з.п. ф-лы, 7 ил., 5 табл., 2 пр.
1. Полинуклеотид, кодирующий молекулу мультиспецифического антитела, состоящую из трех полипептидов:
а) полипептидной цепи формулы (I):
(Vxx)nVx-Cx-X-V1; и
b) полипептидной цепи формулы (II):
(Vyy)nVy-Cy;
c) полипептида формулы (III):
V2,
где
Vx обозначает вариабельный домен тяжелой цепи,
Vxx обозначает вариабельный домен тяжелой цепи,
Cx обозначает константную область тяжелой цепи,
Х обозначает линкер,
V1 обозначает вариабельный домен тяжелой цепи,
Vy обозначает вариабельный домен легкой цепи,
Vyy обозначает вариабельный домен легкой цепи,
Cy обозначает константную область легкой цепи,
V2 обозначает вариабельный домен легкой цепи,
n независимо равен 0 или 1,
где полипептидная цепь формулы (I) и полипептидная цепь формулы (II) выровнены так, что происходит спаривание константных областей Cx и Cy и спаривание вариабельных доменов Vx и Vy с образованием связывающего домена и, необязательно, дисульфидной связи между V1 и V2, в частности, если дисульфидная связь присутствует.
2. Полинуклеотид, кодирующий молекулу биспецифического антитела, состоящую из трех полипептидов:
a) тяжелой цепи формулы (Iа):
VH-CH1-X-V1; и
b) легкой цепи формулы (IIa):
VL-CL;
c) полипептида формулы (III):
V2,
где
VH обозначает вариабельный домен тяжелой цепи,
CH1 обозначает домен 1 константной области тяжелой цепи,
Х обозначает линкер,
V1 обозначает вариабельный домен тяжелой цепи,
VL обозначает вариабельный домен легкой цепи,
СL обозначает константную область легкой цепи,
V2 обозначает вариабельный домен легкой цепи,
где между V1 и V2 необязательно присутствует дисульфидная связь, в частности, если дисульфидная связь присутствует.
3. Полинуклеотид, кодирующий молекулу биспецифического антитела, состоящую из трех полипептидов:
a) тяжелой цепи формулы (Ib):
VH-CH1; и
b) легкой цепи формулы (IIb):
VL-CL-X-V2;
c) полипептида формулы (III):
V1,
где
VH обозначает вариабельный домен тяжелой цепи,
CH1 обозначает домен 1 константной области тяжелой цепи,
Х обозначает линкер,
V1 обозначает вариабельный домен тяжелой цепи,
VL обозначает вариабельный домен легкой цепи,
СL обозначает константную область легкой цепи,
V2 обозначает вариабельный домен легкой цепи,
где между V1 и V2 необязательно присутствует дисульфидная связь, в частности, если дисульфидная связь присутствует.
4. Полинуклеотид по любому из пп.1-3, где каждый связывающий домен специфичен для антигена, выбранного из группы, включающей интегрин, CD2, CD3, CD4, CD5, CD7, CD8, CD11a, CD11b, CD18, CD19, CD20, CD23, CD25, CD33, CD38, CD40, CD45, CDW52, CD69, CD134 (OX40), ICOS, BCMP7, CD137, CD27L, CDCP1, DPCR1, DPCR1, dudulin2, FLJ20584, FLJ40787, HEK2, KIAA0634, KIAA0659, KIAA1246, KIAA1455, LTBP2, LTK, MAL2, MRP2, нектин-подобный белок 2, NKCC1, PTK7, RAIG1, TCAM1, SC6, BCMP101, BCMP84, BCMP11, DTD, карциноэмбриональный антиген (CEA), глобулин молочного жира человека (HMFG1 и 2), MHC класса I и антигены MHC класса II, VEGF, интерлейкин, вирусный антиген, иммуноглобулин, интерферон, фактор некроза опухоли-α, фактор некроза опухоли-β, колониестимулирующий фактор, фактор роста тромбоцитов, бактериальный клеточный поверхностный антиген, бактериальные токсины, биотеррористический агент, яды и токсины змеи и паука, OX40, гистамин, C1q, опсонин, член каскадов активации классического и альтернативного комплемента, FcγR, белок пути комплемента, маркерный белок CD (маркер кластера дифференциации), сывороточный белок-носитель, молекула циркулирующего в кровотоке иммуноглобулина и CD35/CR1.
5. Полинуклеотид по п.4, где иммуноглобулин представляет собой IgE.
6. Полинуклеотид по п.4, где интерферон выбран из группы, выбранной из интерферона α, интерферона β или интерферона γ.
7. Полинуклеотид по п.4, где колониестимулирующий фактор выбран из группы, состоящей из G-CSF и GM-CSF.
8. Полинуклеотид по п.4, где вирусный антиген выбран из группы, состоящей из респираторно-синцитиального вируса или цитомегаловируса, гриппа, EBV, HepA, B и C-антигена.
9. Полинуклеотид по п.4, где член каскадов активации классического и альтернативного комплемента выбран из группы, состоящей из C2, C4, C3-конвертазы, C5, C6, C7, C8 и C9.
10. Полинуклеотид по п.4, где FcγR выбран из группы, состоящей из FcγRI, FcγRII и FcγRIII.
11. Полинуклеотид по п.4, где белок пути комплемента выбран из группы, состоящей из C1q и C3.
12. Полинуклеотид по п.4, где интегрин выбран из группы, состоящей из интегрина β1, VLA-4, E-селектина, P-селектина или L-селектина.
13. Полинуклеотид по п.4, где интерлейкин выбран из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-12, IL-16, IL-17 и IL-23.
14. Полинуклеотид по п.4, где маркерный белок CD выбран из группы, состоящей из CD68, CD115, CD16, CD80, CD83, CD86, CD56, CD64, CD3, CD4, CD8, CD28, CD45, CD19, CD20, CD22, CD1, CD1d, CD2, CD5, CD8, CD9, CD10, CD11, CD11a, CD11b, CD11c, CD13, CD14, CD15, CD16, CD18, CD19, CD20, CD21, CD22, CD23, CD24, CD25, CD26, CD27, CD28, CD29, CD30, CD31, CD32, CD33, CD34, CD35, CD36, CD37, CD38, CD40, CD43, CD44, CD45, CD46, CD49, CD49a, CD49b, CD49c, CD49d, CD52, CD53, CD54, CD55, CD56, CD58, CD59, CD61, CD62, D62E, CD62L, CD62P, CD63, CD64, CD66e, CD68, CD70, CD71, CD72, CD79, CD80, CD81, CD82, CD83, CD84, CD85, CD86, CD88, CD89, CD90, CD94, CD95, CD98, CD106, CD114, CD116, CD117, CD118, CD120, CD122, CD130, CD131, CD132, CD133, CD134, CD135, CD137, CD138, CD141, CD142, CD143, CD146, CD147, CD151, CD152, CD153, CD154, CD155, CD162, CD164, CD169, CD184, CD206, CD209, CD257, CD278, CD281, CD282, CD283 и CD304.
15. Полинуклеотид по п.4, где сывороточный белок-носитель выбран из группы, состоящей из тироксинсвязывающего белка, транстиретина, α1-кислого гликопротеина, трансферрина, фибриногена, альбумина и человеческого сывороточного альбумина.
16. Полинуклеотид по п.4, где молекула циркулирующего в кровотоке иммуноглобулина выбрана из группы, состоящей из IgG1, IgG2, IgG3, IgG4, sIgA, IgM и IgD.
17. Полинуклеотид по любому из пп.1-16, где пара вариабельных доменов V1/V2 связана дисульфидной связью между двумя остатками цистеина, введенными рекомбинантным методом, один в V1 и один в V2, где положение пары остатков цистеина, введенных рекомбинантным методом, выбрано из группы, состоящей из VH37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VH100 и VL50, VH100b и VL49, VH98 и VL46, VH101 и VL46, VH105 и VL43 и VH106 и VL57.
18. Полинуклеотид по любому из пп.1-17, где пара вариабельных доменов V1/V2 обладает специфичностью в отношении сывороточного белка-носителя.
19. Полинуклеотид по п.18, где V1 содержит последовательность SEQ ID NO:87 для CDRH-1, последовательность SEQ ID NO:88 для CDRH2 и последовательность SEQ ID NO:89 для CDRH-3, и V2 содержит последовательность SEQ ID NO:90 для CDRL-1, последовательность SEQ ID NO:91 для CDRL2 и последовательность SEQ ID NO:92 для CDRL-3.
20. Полинуклеотид по п.18, где V1 содержит последовательность SEQ ID NO:93 для CDRH-1, последовательность SEQ ID NO:94 для CDRH2 и последовательность SEQ ID NO:95 для CDRH-3, и V2 содержит последовательность SEQ ID NO:96 для CDRL-1, последовательность SEQ ID NO:97 для CDRL2 и последовательность SEQ ID NO:98 для CDRL-3.
21. Полинуклеотид по любому из пп.1-20, где Х имеет последовательность SEQ ID NO:78.
22. Полинуклеотид по любому из пп.1-20, где Х имеет последовательность SEQ ID NO:103.
23. Полинуклеотид по любому из пп.1-22, где каждая полинуклеотидная последовательность каждой полипептидной цепи находится под контролем общего промотора.
24. Полинуклеотид по любому из пп.1-22, где каждая полинуклеотидная последовательность каждой полипептидной цепи находится под контролем разных промоторов.
25. Вектор экспрессии, содержащий полинуклеотид по любому из пп.1-24.
26. Клетка-хозяин для получения мультиспецифического антитела или биспецифического антитела, как определено в любом из пп.1-24, содержащая вектор по п.25.
27. Клетка-хозяин по п.26, где клетка-хозяин содержит три вектора, где каждый вектор содержит полинуклеотид, кодирующий отдельную полипептидную цепь молекулы мультиспецифического или биспецифического антитела, как определено в любом одном из пп.1-24.
28. Способ получения мультиспецифического антитела или биспецифического антитела по любому из пп.1-24, включающий экспрессию молекулы мультиспецифического или биспецифического антитела в клетке-хозяине по п.26 или 27.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| LU DAN et al | |||
| "Fab-scFv fusion protein: an efficient approach to production of bispecific antibody fragments." Journal of immunological methods, 2002, 267(2): 213-226 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2020-02-12—Публикация
2013-12-20—Подача