ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка является непредварительной заявкой, по которой испрашивается приоритет заявки США с номером No. 60/742185, поданной 2 декабря 2005, и заявки США с номером No. 60/805553, поданной 22 июня 2006, все указанные заявки приведены в настоящем описании в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение, в целом, относится к вариантам CDR, разнообразие которых создано с использованием высокоограниченного набора аминокислот, и к библиотекам, содержащим множество таких последовательностей. Изобретение также относится к слитым полипептидам, содержащим указанные варианты CDR. Изобретение также относится к способам и композициям, которые могут быть использованы для идентификации новых связывающих полипептидов для терапевтического применения или применения в качестве реагентов.
УРОВЕНЬ ТЕХНИКИ
Методика фагового дисплея является эффективным средством для создания и отбора новых белков, которые связываются с лигандом, таким как антиген. Применение методики фагового дисплея позволяет создавать большие библиотеки белковых вариантов, которые можно быстро сортировать по последовательностям, которые связываются с антигеном-мишенью с высокой аффинностью. Нуклеиновые кислоты, кодирующие варианты полипептидов, сливают с последовательностью нуклеиновой кислоты, кодирующей белок оболочки вируса, такой как белок гена III или белок гена VIII. Разработаны моновалентные системы фагового дисплея, в которых последовательность нуклеиновой кислоты, кодирующую белок или полипептид, сливают с последовательностью нуклеиновой кислоты, кодирующей часть белка гена III (Bass, S., Proteins, 8:309 (1990); Lowman and Wells, Methods: A Companion to Methods in Enzymology, 3:205 (1991)). В моновалентной системе фагового дисплея слияние генов экспрессируется на низких уровнях, и также экспрессируются белки гена III дикого типа, так что инфекционность частиц сохраняется. Способы создания пептидных библиотек и скрининга таких библиотек описаны во многих патентах (например, в патенте США No. 5723286, патенте США No. 5432018, патенте США No. 5580717, патенте США No. 5427908 и в патенте США No. 5498530).
Осуществление экспрессии пептидов на поверхности нитчатого фага и экспрессии функциональных фрагментов антител в периплазме E. coli важно для разработки библиотек антител в фаговом дисплее (Smith et al., Science (1985), 228:1315; Skerra and Pluckthun, Science (1988), 240:1038). Библиотеки антител или антигенсвязывающих полипептидов получены несколькими способами, включая изменение одного гена посредством инсерции случайных последовательностей ДНК или клонирование семейства родственных генов. Способы предоставления антител или антигенсвязывающих фрагментов с использованием фагового дисплея описаны в патентах США No. 5750373, 5733743, 5837242, 5969108, 6172197, 5580717 и 5658727. После этого проводят скрининг библиотеки в отношении экспрессии антител или антигенсвязывающих белков с требуемыми свойствами.
Методика фагового дисплея имеет несколько преимуществ по сравнению с обычными способами, основанными на гибридомах и методах рекомбинации, для получения антител с требуемыми свойствами. Указанная методика позволяет создавать большие библиотеки антител с различными последовательностями за меньший период времени и без использования животных. Для получения гибридом или получения гуманизированных антител, несомненно, может потребоваться несколько месяцев. Кроме того, в отсутствие необходимости иммунизации фаговые библиотеки антител могут быть созданы для антигенов, которые являются токсичными или имеют низкую антигенность (Hogenboom, Immunotechniques (1988), 4:1-20). Фаговые библиотеки антител также могут быть использованы для создания и идентификации новых антител человека.
Антитела стали очень эффективными в качестве терапевтических средств для широкого круга заболеваний. Например, гуманизированные антитела против HER-2, опухолевого антигена, могут использоваться для диагностики и лечения рака. Другие антитела, такие как анти-INF-γ-антитело, могут использоваться для лечения воспалительных заболеваний, таких как болезнь Крона. Библиотеки на основе фагового дисплея использовали для создания наборов антител человека, полученных у иммунизированных и неиммунизированных людей, последовательностей зародышевой линии или наборов наивных Ig B-клеток (Barbas and Burton, Trends Biotech (1996), 14:230; Griffiths et al., EMBO J. (1994), 13:3245; Vaughan et al., Nat. Biotech. (1996), 14:309; Winter EP 0368684 B1). Наивные, или неиммунные, антигенсвязывающие библиотеки были созданы с использованием большого числа лимфоидных тканей. Некоторые из таких библиотек коммерчески доступны, например библиотеки, разработанные Cambridge Antibody Technology and Morphosys (Vaughan et al., Nature Biotech 14:309 (1996); Knappik et al., J. Mol. Biol. 296:57 (1999)). Однако многие такие библиотеки имеют ограниченное разнообразие.
Возможность идентифицировать и выделять высокоаффинные антитела из библиотеки на основе фагового дисплея имеет важное значение для выделения новых антител человека для терапевтического применения. Традиционно считается, что выделение высокоаффинных антител из библиотеки зависит по меньшей мере частично от размера библиотеки, эффективности продуцирования в бактериальных клетках и разнообразия библиотеки. Смотри, например, Knappik et al., J. Mol. Biol. (1999), 296:57. Размер библиотеки снижается вследствие неэффективности продуцирования из-за неправильной укладки антитела или антигенсвязывающего белка и присутствия стоп-кодонов. Экспрессия в бактериальных клетках может быть ингибирована, если антитело или антигенсвязывающий домен подвергается неправильной укладке. Экспрессия может быть улучшена посредством мутирования остатков по очереди на поверхности зоны контакта вариабельных/константных областей или выбранных остатков CDR (Deng et al., J. Biol. Chem. (1994), 269:9533, Ulrich et al., PNAS (1995), 92:11907-11911; Forsberg et al., J. Biol. Chem. (1997), 272:12430). Последовательность каркасной области является фактором, обеспечивающим правильную укладку в том случае, если фаговая библиотека антител продуцируется в бактериальных клетках.
Создание библиотеки разнообразных антител или антигенсвязывающих белков также имеет значение для выделения высокоаффинных антител. Библиотеки с расширенным разнообразием ограниченных CDR были созданы с использованием различных способов. Смотри, например, Tomlinson, Nature Biotech. (2000), 18: 989-994. Области CDR3 представляют интерес отчасти из-за того, что они, как обнаружено, как правило, принимают участие в связывании антигена. Области CDR3 тяжелой цепи сильно изменяются по размеру, последовательности и структурной конформации.
Другие авторы также создавали разнообразие посредством рандомизации областей CDR вариабельных тяжелых и легких цепей с использованием всех 20 аминокислот в каждом положении. Предполагалось, что использование всех 20 аминокислот может привести к большому разнообразию последовательностей вариантов антител и увеличить возможность идентификации новых антител (Barbas, PNAS 91:3809 (1994); Yelton, DE, J. Immunology, 155:1994 (1995); Jackson, J.R., J. Immunology, 154:3310 (1995) и Hawkins, RE, J. Mol. Biology, 226:889 (1992)).
Также были предприняты попытки создания разнообразия путем ограничения группы аминокислотных замен в некоторых CDR, чтобы отразить распределение аминокислот в природных антителах. Смотри Garrard and Henner, Gene (1993), 128:103; Knappik et al., J. Mol. Biol. (1999), 296:57. Однако такие попытки имели переменный успех и применялись бессистемно и неколичественно. Создание разнообразия областей CDR при минимизации количества аминокислотных изменений было сложной проблемой. Кроме того, в некоторых случаях после создания первой библиотеки согласно одному набору критериев может быть необходимым дополнительное увеличение разнообразия первой библиотеки. Однако для этого требуется, чтобы первая библиотека имела достаточное разнообразие и при этом оставалась достаточно небольшой по размеру, так чтобы можно было ввести дополнительное разнообразие без существенного увеличения практических ограничений, таких как ограничения выхода и т.д.
Некоторые группы исследователей сообщали о теоретическом и практическом анализах минимального количества аминокислот в наборе, которое необходимо для создания белков. Однако такие анализы в целом были ограничены по своему объему и сущности, и сохранялось значительное скептическое отношение и вопросы относительно возможности создания полипептидов, обладающих сложными функциями, с использованием ограниченного набора типов аминокислот. Смотри, например, See, e.g., Riddle et al., Nat. Struct. Biol. (1997), 4(10):805-809; Shang et al., Proc. Natl. Acad. Sci. USA (1994), 91:8373-8377; Heinz et al., Proc. Natl. Acad. Sci. USA (1992), 89:3751-3755; Regan & Degrado, Science (1988), 241:976-978; Kamteker et al., Science (1993), 262:1680-1685; Wang & Wang, Nat. Struct. Biol. (1999), 6(11):1033-1038; Xiong et al., Proc. Natl. Acad. Sci. USA (1995), 92:6349-6353; Heinz et al., Proc. Natl. Acad. Sci. USA (1992), 89:3751-3755; Cannata et al., Bioinformatics (2002), 18(8):1102-1108; Davidson et al., Nat. Struct. Biol. (1995), 2(10):856-863; Murphy et al., Prot. Eng. (2000), 13(3):149-152; Brown & Sauer, Proc. Natl. Acad. Sci. USA (1999), 96:1983-1988; Akanuma et al., Proc. Natl. Acad. Sci. (2002), 99(21):13549-13553; Chan, Nat. Struct. Biol. (1999), 6(11):994-996.
Таким образом, сохраняется необходимость в усовершенствовании способов создания библиотек, которые содержат функциональные полипептиды с достаточной степенью разнообразия последовательностей и при этом в достаточной степени поддающиеся дополнительной обработке, направленной на дальнейшее увеличение разнообразия, высокий выход экспрессии и тому подобное. Изобретение, предложенное в настоящем описании, удовлетворяет указанную потребность и обеспечивает другие преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к упрощенным и гибким способам создания полипептидов, содержащих варианты CDR, которые содержат последовательности с ограниченным разнообразием, но при этом сохраняющие способность связывать антиген-мишень. В отличие от традиционных способов, которые основаны на предположении, что адекватное разнообразие связывающих мишень агентов может быть создано только в том случае, если конкретная область CDR (области CDR) или все CDR различаются, и в отличие от традиционных представлений о том, что адекватное разнообразие зависит от того, насколько широк диапазон аминокислотных замен (обычно путем замены с использованием всех или большинства из 20 аминокислот), изобретение относится к способам, позволяющим создавать связывающие мишень агенты высокого качества, которые необязательно зависят от разнообразия конкретной области CDR (областей CDR) или от конкретного количества CDR эталонного полипептида или исходного антитела. Изобретение основано по меньшей мере частично на неожиданном обнаружении, что высококачественные библиотеки с большим разнообразием, содержащие функциональные полипептиды, способные связывать антигены-мишени, могут быть созданы изменением минимального количества положений аминокислот с использованием значительно ограниченного количества аминокислотных остатков. Способы по изобретению являются быстрыми, удобными и гибкими способами, основанными на использовании ограниченных наборов кодонов, которые кодируют небольшое количество аминокислот. Ограниченное разнообразие последовательностей и, соответственно, в целом меньший размер популяций (например, библиотек) полипептидов, созданных способами по изобретению, позволяют дополнительно увеличивать разнообразие таких популяций, при необходимости или если желательно. Такое преимущество, как правило, традиционные способы не обеспечивают. Полипептиды, являющиеся кандидатами в качестве связывающих агентов, созданные в соответствии с изобретением, обладают высококачественными параметрами связывания мишени и имеют структурные особенности, которые обеспечивают высокий выход в культуре клеток. Изобретение относится к способам создания таких связывающих полипептидов, способам применения таких полипептидов и композициям, содержащим такие полипептиды.
В одном из аспектов изобретение относится к слитым полипептидам, содержащим различную область CDR (области CDR) и гетерологичную полипептидную последовательность (в некоторых вариантах осуществления последовательность по меньшей мере части вирусного полипептида), в виде единичных полипептидов и в виде представителя множества отдельных уникальных полипептидов, которые являются кандидатами агентов, связывающих представляющие интерес мишени. Композиции (такие, как библиотеки), содержащие такие полипептиды, могут использоваться во многих случаях, например в качестве пулов кандидатов иммуноглобулиновых полипептидов (например, антител и фрагментов антител), которые связываются с представляющими интерес мишенями. Такие полипептиды также могут быть созданы с использованием неиммуноглобулиновых каркасов (например, белков, таких как гормон роста человека и т.д.). Изобретение имеет различные аспекты, включая полинуклеотиды и полипептиды, созданные в соответствии с предлагаемым в изобретении способом, и системы, наборы и изделия производства для практического осуществления способов по изобретению и/или применение полипептидов/полинуклеотидов и/или композиций по изобретению.
В одном из аспектов изобретение относится к способу создания полипептида, содержащего по меньшей мере один, два, три, четыре, пять или все варианты CDR, выбранные из группы, состоящей из H1, H2, H3, L1, L2 и L3, при этом указанный полипептид способен связывать представляющий интерес антиген-мишень, и указанный способ включает (i) идентификацию по меньшей мере одного (или любого количества вплоть до всех) доступного для растворителя и имеющего большое разнообразие аминокислот положения в эталонной области CDR, соответствующей варианту CDR; и (ii) изменение аминокислоты в доступном для растворителя и имеющем большое разнообразие положении посредством создания вариантных копий CDR с использованием ограниченного набора кодонов (определение «ограниченный набор кодонов» приведено ниже).
Различные аспекты и варианты осуществления способов по изобретению применимы для создания и/или применения пула, содержащего множество полипептидов по изобретению, в частности для отбора и идентификации кандидатов в качестве агентов, связывающих представляющие интерес антигены-мишени. Например, изобретение относится к способу создания композиции, содержащей множество полипептидов, где каждый полипептид содержит по меньшей мере один, два, три, четыре, пять или все варианты CDR, выбранные из группы, состоящей из H1, H2, H3, L1, L2 и L3, при этом указанный полипептид способен связывать представляющий интерес антиген-мишень, и указанный способ включает (i) идентификацию по меньшей мере одного (или любого количества вплоть до всех) доступного для растворителя и имеющего большое разнообразие аминокислот положения в эталонной области CDR, соответствующей варианту CDR; и (ii) изменение аминокислоты в доступном для растворителя и имеющем большое разнообразие положении посредством создания вариантных копий CDR с использованием ограниченного набора кодонов; при этом множество полипептидов создают посредством амплификации матричного полинуклеотида с использованием набора олигонуклеотидов со значительно ограниченной вырожденностью последовательности, кодирующей вариант аминокислоты, при этом указанная ограниченная вырожденность отражает ограниченное количество последовательностей кодонов из ограниченного набора кодонов.
В другом примере изобретение относится к способу, включающему: конструирование экспрессирующего вектора, содержащего полинуклеотидную последовательность, которая кодирует вариабельные домены легкой цепи, тяжелой цепи или и легкой цепи и тяжелой цепи исходного антитела, содержащие по меньшей мере одну, две, три, четыре, пять или все CDR, выбранные из группы, состоящей из CDR L1, L2, L3, H1, H2 и H3; и мутирование по меньшей мере одной, двух, трех, четырех, пяти или всех CDR исходного антитела по меньшей мере в одном (или любом количестве, вплоть до всех) доступном для растворителя и имеющем большое разнообразие аминокислот положении с использованием ограниченного набора кодонов.
В другом примере изобретение относится к способу, включающему: конструирование библиотеки фаговых или фагмидных частиц для дисплея множества полипептидов по изобретению; осуществление контакта библиотеки частиц с антигеном-мишенью в условиях, подходящих для связывания частиц с антигеном-мишенью; и отделение частиц, которые связаны, от частиц, которые не связаны с антигеном-мишенью.
В любом из способов по изобретению, описанном в настоящем описании, доступном для растворителя и/или имеющем большое разнообразие положением аминокислоты, может быть любое положение, которое удовлетворяет критериям, которые описаны в настоящем описании, в частности может представлять собой любую комбинацию положений, указанных в настоящем описании, например любую комбинацию положений, описанных для полипептидов по изобретению (которые более подробно описаны в настоящем описании). Подходящие варианты аминокислот могут быть любыми, если они удовлетворяют критериям, указанным в настоящем описании, например вариантами аминокислот в полипептидах по изобретению, которые более подробно описаны ниже.
Конструирование различных CDR может заключаться в конструировании разнообразия по длине и/или по последовательности CDR. Например, CDRH3 может быть сделана разной по длине, например длиной от 7 до 21 аминокислот, и/или по ее последовательности, например путем изменения имеющих большое разнообразие и/или доступных для растворителя положений с использованием аминокислот, кодируемых ограниченным набором кодонов. В некоторых вариантах осуществления часть CDRH3 имеет длину от 5 до 21, от 7 до 20, от 9 до 15 или от 11 до 13 аминокислот и имеет вариант аминокислоты в одном или нескольких положениях, кодируемых ограниченным набором кодонов, который кодирует ограниченное количество аминокислот, например наборами кодонов, кодирующих не более 19, 15, 10, 8, 6, 4 или 2 аминокислот. В некоторых вариантах осуществления C-конец имеет аминокислотную последовательность AM, AMDY или DY.
В некоторых вариантах осуществления полипептиды по изобретению могут быть в разных формах, при условии что функция полипептидов в связывании мишени сохраняется. В некоторых вариантах осуществления полипептид по изобретению представляет собой слитый полипептид (т.е. слияние двух или более последовательностей из гетерологичных полипептидов). Полипептиды с разнообразными CDR по изобретению могут быть получены в виде полипептидов, слитых по меньшей мере с частью белка оболочки вируса, например, для применения в фаговом дисплее. Белки оболочки вируса, которые могут быть использованы для дисплея полипептидов по изобретению, включают белок pIII, основной белок оболочки pVIII, Soc (фаг T4), Hoc (фаг T4), gpD (фаг лямбда), pVI или их варианты или фрагменты. В некоторых вариантах осуществления слитый полипептид сливают по меньшей мере с частью белка оболочки вируса, такого как белок оболочки вируса, выбранный из группы, состоящей из pIII, pVIII, Soc, Hoc, gpD, pVI и их вариантов или фрагментов.
В некоторых вариантах осуществления, в которых полипептид с разнообразными CDR представляет собой один или несколько вариабельных доменов антител, вариабельные домены антител могут быть представлены на поверхности вируса в разных формах, включая ScFv, Fab, ScFv2, F(ab')2 и F(ab)2. Для дисплея полипептидов бивалентным образом слитый белок в некоторых вариантах осуществления содержит домен димеризации. Домен димеризации может содержать последовательность димеризации и/или последовательность, содержащую один или несколько остатков цистеина. Домен димеризации может быть связан, напрямую или опосредованно, с C-концом вариабельного или константного домена тяжелой цепи (например, CH1). Структура домена димеризации может изменяться в зависимости от того, продуцируется ли вариабельный домен антитела в виде компонента слитого белка с компонентом, представленным белком оболочки вируса (например, без амбер-стоп-кодона после домена димеризации), или продуцируется ли вариабельный домен антитела преимущественно без компонента, представленного белком оболочки вируса (например, с амбер-стоп-кодоном после домена димеризации). Если вариабельный домен антитела продуцируется преимущественно в виде белка, слитого с компонентом, представленным белком оболочки вируса, то одна или несколько дисульфидных связей и/или одна последовательность димеризации обеспечивают бивалентный дисплей. В случае вариабельных доменов антител, преимущественно продуцируемых без слияния с компонентом в виде белка оболочки вируса (например, с амбер-стоп-кодоном), домен димеризации может содержать как остаток цистеина, так и последовательность димеризации.
Кроме того, необязательно слитый полипептид может содержать метку, которая может быть удобной для очистки, выявления и/или скрининга, такую как FLAG, поли-his, gD-метка, c-myc, флуоресцирующий белок или B-галактозидаза. В одном из вариантов осуществления слитый полипептид содержит вариабельный или константный домен легкой цепи, слитый с полипептидной меткой.
В другом аспекте изобретения полипептид, такой как вариабельный домен антитела, получают из одной исходной или матричной молекулы. Исходная или матричная молекула может быть выбрана или сконструирована для обеспечения таких свойств, как хороший выход и стабильность в случае продуцирования в культуре прокариотических или эукариотических клеток, и/или для размещения областей CDRH3 различной длины. Последовательность матричной молекулы может быть изменена для улучшения укладки и/или дисплея вариабельного домена, если он находится в виде слитого белка с компонентом, представленным белком оболочки фага. Например, исходное антитело может содержать аминокислотную последовательность вариабельных доменов гуманизированного антитела 4D5 (вариабельный домен легкой цепи (фиг.1; SEQ ID NO:1)); (вариабельный домен тяжелой цепи (фиг.1; SEQ ID NO:2)). Например, в вариабельном домене антитела тяжелой или легкой цепи остатки каркасной области могут быть модифицированы или изменены по сравнению с исходной или матричной молекулой для улучшения укладки, выхода, представления или аффинности вариабельного домена антитела. В некоторых вариантах осуществления остатки каркасной области выбирают так, чтобы модифицировать область по сравнению с исходной или матричной молекулой в том случае, когда аминокислота в положении каркасной области исходной молекулы отличается от аминокислоты или аминокислот, обычно находящихся в данном положении в природных антителах или в консенсусной последовательности подгруппы. Аминокислоты в таких положениях могут быть заменены на аминокислоты, в большинстве случаев находящиеся в природных антителах или в консенсусной последовательности подгруппы в данном положении. В одном из вариантов осуществления каркасным остатком 71 тяжелой цепи может быть R, V или A. В другом примере каркасным остатком 93 тяжелой цепи может быть S или A. В еще одном примере каркасным остатком 94 может быть R, K или T или может кодироваться MRT. В другом примере каркасным остатком 93 является A, и каркасным остатком 94 является R. В еще одном примере каркасным остатком 49 в тяжелой цепи может быть аланин или глицин. Каркасные остатки в легкой цепи могут быть также изменены. Например, аминокислота в положении 66 может представлять собой аргинин или глицин. Каркасные области последовательностей легкой цепи и тяжелой цепи гуманизированного антитела 4D5-8 дикого типа показаны на фиг.6 (SEQ ID NO:6-9 и 10-13 соответственно). Каркасные области вариантов последовательностей легкой цепи и тяжелой цепи гуманизированного антитела 4D5-8, в котором легкая цепь модифицирована в положении 66, а тяжелая цепь модифицирована в положениях 71, 73 и 78, показаны на фиг.7 (SEQ ID NO:14-17 и 18-21 соответственно).
Способы по изобретению обеспечивают возможность создания большого разнообразия полипептидов, содержащих разнообразный набор последовательностей CDR. В одном из вариантов осуществления создают одну или несколько библиотек, используя способы по изобретению, которые описаны в настоящем описании. Проводят скрининг библиотек в отношении связывания с антигенами-мишенями, например DR5 и HER-2 человека.
Изобретение также относится к вариабельным доменам тяжелой цепи иммуноглобулина, рандомизированным для обеспечения разнообразия. В одном из вариантов осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, а X1 находится в положении 28 согласно системе нумерации Кабата; где X1 выбран из S и Y; где X2 выбран из Y и S; где X3 выбран из Y и S; где X4 выбран из Y и S; и где X5 выбран из Y и S;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где X1 выбран из Y и S; где X2 выбран из Y и S; где X3 выбран из Y и S; где X4 выбран из Y и S; где X5 выбран из Y и S; и где X6 выбран из Y и S; и
(iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-D-Y (SEQ ID NO:31), где X1 находится в положении 95 согласно системе нумерации Кабата; и где X1 выбран из R, Y и M; X2 выбран из Y и R; X3 выбран из Y, S, R, P и G; X4 выбран из Y и S; X5 выбран из Y, S, R и H; X6 выбран из R, Y и S; X7 выбран из G, Y и S; X8 выбран из R, Y и S; X9 выбран из G, Y и S; X10 выбран из R, Y и S; X11 выбран из G, Y и S; X12 выбран из S, Y, R, G и A; X13 выбран из G и Y; X14 выбран из L, M, R, G и A; и X15 выбран из G, F и L или отсутствует; и X16 означает F или отсутствует.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, а X1 находится в положении 28 согласно системе нумерации Кабата; где X1 выбран из Y и S; где X2 выбран из Y и S; где X3 выбран из Y и S; где X4 выбран из Y и S; и где X5 выбран из Y и S;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где X1 выбран из Y и S; где X2 выбран из Y и S; где X3 выбран из Y и S; где X4 выбран из Y и S; где X5 выбран из Y и S; и где X6 выбран из Y или S; и
(iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:24), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G или отсутствуют; где X18 выбран из G и A; и где X19 выбран из I, M, L и F.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где X1 выбран из Y и S; где X2 выбран из Y и S; где X3 выбран из Y и S; где X4 выбран из Y и S; и где X5 выбран из Y и S;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где X1 выбран из Y и S; где X2 выбран из Y и S; где X3 выбран из Y и S; где X4 выбран из Y и S; где X5 выбран из Y и S; и где X6 выбран из Y и S; и
(iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:26), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:27), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:28), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% K, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% T, 1% V и 1% W; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% K, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% T, 1% V и 1% W или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В одном из аспектов CDRH1 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:524-540 и 189-294, или по меньшей мере одну аминокислотную последовательность CDR1, выбранную из последовательностей, показанных на фиг.11A или фиг.15. CDRH2 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:541-557 и 295-400, или по меньшей мере одну аминокислотную последовательность CDHR2, выбранную из последовательностей, показанных на фиг.11A или фиг.15. CDRH3 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:558-574 и 401-506, или по меньшей мере одну аминокислотную последовательность CDHR3, выбранную из последовательностей, показанных на фиг.11A или фиг.15.
В другом аспекте CDRH3 содержит X1, выбранную из R и Y; X3 означает S; X8 означает S; X9 означает Y; и X10 означает Y или R. В другом варианте осуществления CDRH3 содержит аминокислотную последовательность X1-R-S-Y-R-Y-G-S-Y-X10-G-S-Y-X14-F-D-Y (SEQ ID NO:575).
В другом аспекте полипептид связывается с DR5 человека или связывается с DR5 человека и DR5 мыши. В некоторых вариантах осуществления полипептид представляет собой антитело.
В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи, содержащий: (i) CDRH1, содержащую аминокислотную последовательность GFYISSSSIH (SEQ ID NO:576); ii) CDRH2, содержащую аминокислотную последовательность SISPSSGSTYYADSVKG (SEQ ID NO:577); и iii) CDRH3, содержащую аминокислотную последовательность YRSYRYGSYYGSYGFDY (SEQ ID NO:578). В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи, содержащий: i) CDRH1, содержащую аминокислотную последовательность GFYIYSSSIH (SEQ ID NO:579); ii) CDRH2, содержащую аминокислотную последовательность SISPSSGYTSYADSVKG (SEQ ID NO:580); и iii) CDRH3, содержащую аминокислотную последовательность RRSYRYGSYRGSYAFDY (SEQ ID NO:581).
В другом аспекте полипептид дополнительно содержит вариабельный домен легкой цепи, в котором
(i) CDRL3 содержит аминокислотную последовательность Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:25); где X1 находится в положении 91 и выбран из Y, H и S; Х2 выбран из Y и S; Х3 выбран из Y, S и T; Х4 выбран из Y, S и T; и Х5 выбран из S, P и Y. В одном из вариантов осуществления CDRL1 содержит аминокислотную последовательность RASQDVNTAVA (SEQ ID NO:29). В одном из вариантов осуществления CDRL2 содержит аминокислотную последовательность SASSLYS (SEQ ID NO:30).
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22); где X1 находится в положении 28 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; (ii) CDRH2 содержит аминокислотную последовательность X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23); где X1 находится в положении аминокислоты 50 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; Х5 выбран из S и Y; и Х6 выбран из S и Y; и (iii) CDRH3 содержит аминокислотную последовательность X1-X2-X3-X4-X5-X6-X7-D-Y (SEQ ID NO:582), где X1 находится в положении аминокислоты 95 согласно нумерации Кабата и выбран из Y и R; Х2 выбран из Y, S и R; Х3 выбран из S, G, Y и H; Х4 выбран из S, G, Y и R; Х5 выбран из G и A; Х6 выбран из F, M, L и A; и Х7 выбран из F, M, и L или отсутствует.
В одном из аспектов CDRH1 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:189-198. CDRH2 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:295-304. CDRH3 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:401-410.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22); где X1 находится в положении 28 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; (ii) CDRH2 содержит аминокислотную последовательность X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:22); где X1 находится в положении аминокислоты 50 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; и (iii) CDRH3 содержит аминокислотную последовательность X1-X2-X3-X4-X5-X6-X7-X8-D-Y (SEQ ID NO:583), где X1 находится в положении аминокислоты 95 согласно нумерации Кабата и выбран из Y, S и G; Х2 выбран из Y, S, G, R, A и M; Х3 выбран из G, Y, S и R; Х4 выбран из G, Y и F; Х5 выбран из Y, S, N и G; Х6 выбран из Y, R, H и W; Х7 выбран из G и A; и Х8 выбран из F, M, L и I.
В одном из аспектов CDRH1 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:199-216. CDRH2 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:305-322. CDRH3 содержит по меньшей мере одну аминокислотную последовательность, выбранную из SEQ ID NO:411-428.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22); где X1 находится в положении 28 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y;
(ii) CDRH2 содержит аминокислотную последовательность X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23); где X1 находится в положении аминокислоты 50 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; и
(iii) CDRH3 содержит аминокислотную последовательность X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:584), где X1 находится в положении аминокислоты 95 и выбран из Y, S, R, G и E; Х2 выбран из Y, S, R и G; Х3 выбран из S, Y, G и W; Х4 выбран из S, Y, G и Q; Х5 выбран из G, Y и S; Х6 выбран из G, Y, S, R и V; Х7 выбран из S, Y, G и R; Х8 выбран из Y, S, G, R, P и V; Х9 выбран из G, A, Y, S и R; Х10 выбран из M, F, G, Y, S и R; Х11 выбран из A, Y, S, G и R или отсутствует; Х12 выбран из I, M, F, L, A, G, S, Y, R и T или отсутствует; Х13 выбран из F, M, L, G, A, Y, T и S или отсутствует; Х14 выбран из L, M, F, I, G, Y, A и T или отсутствует; Х15 выбран из M, L, Y, G и R или отсутствует; Х16 выбран из Y и G или отсутствует; Х17 выбран из R, M и G или отсутствует; Х18 выбран из P и A или отсутствует; и X19 означает L или отсутствует.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H, где G находится в положении 26 и X1 находится в положении 28 согласно системе нумерации Кабата; и где X1-X5 являются природными аминокислотами, отличными от цистеина;
(ii) CDRH2 содержит аминокислотную последовательность: X6-I-X7-P-X8-X9-G-X10-T-X11-Y-A-D-S-V-K-G, где X6 находится в положении 50 согласно системе нумерации Кабата, и где X6-X11 являются природными аминокислотами, отличными от цистеина; и
(iii) CDRH3 содержит аминокислотную последовательность: X12-X13-X14-X15-X16-(X17)n-X18-X19-D-Y, где X12 находится в положении 95 согласно системе нумерации Кабата, и где n означает подходящее число, в случае которого может сохраняться функциональная активность вариабельного домена тяжелой цепи, и где X12-X19 являются природными аминокислотами, отличными от цистеина.
В одном из аспектов n равно 1-12. В одном из аспектов Х1 выбран из Y и S; Х2 выбран из Y и S; Х3 выбран из Y и S; Х4 выбран из Y и S; Х5 выбран из Y и S, и Х6 выбран из Y и S. В одном из аспектов Х6 выбран из Y и S; Х7 выбран из Y и S; Х8 выбран из Y и S; Х9 выбран из Y и S; Х10 выбран из Y и S; и Х11 выбран из Y и S. В одном из аспектов аминокислоты в каждом из положений X12-X17 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G, Х18 выбран из G и A, и Х19 выбран из I, M, L и F. В альтернативном аспекте аминокислоты в каждом из положений X12-X17 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R, Х18 выбран из G и A, и Х19 выбран из I, M, L и F. В другом альтернативном аспекте аминокислоты в каждом из положений X12-X17 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R, Х18 выбран из G и A, и Х19 выбран из I, M, L и F. В другом альтернативном аспекте аминокислоты в каждом из положений X12-X17 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% K, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% T, 1% V и 1% W, Х18 выбран из G и A, и Х19 выбран из I, M, L и F. В одном из аспектов CDRH1 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:217-294 или из любых последовательностей CDRH1, показанных на фиг.11. В одном из аспектов CDRH2 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:323-400 или из любых последовательностей CDRH2, показанных на фиг.11. В одном из аспектов CDRH3 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:429-506 или из любых последовательностей CDRH3, показанных на фиг.11.
В другом варианте осуществления предлагается полипептид, содержащий вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; и где X1-X5 являются природными аминокислотами, отличными от цистеина;
(ii) CDRH2 содержит аминокислотную последовательность: X6-I-X7-P-X8-X9-S-X10-T-X1-Y-A-D-S-V-K-G (SEQ ID NO:), где X6 находится в положении 50 согласно системе нумерации Кабата, и где X6-X11 являются природными аминокислотами, отличными от цистеина; и
(iii) CDRH3 содержит аминокислотную последовательность: X12-X13-X14-(X15)n-X16-X17 (SEQ ID NO:), где X14 находится в положении 95 согласно системе нумерации Кабата, и где n является подходящим числом, в случае которого может сохраняться функциональная активность вариабельного домена тяжелой цепи, и где X12-X17 являются природными аминокислотами, отличными от цистеина.
В одном из аспектов n равно 1-14. В другом аспекте Х1 выбран из Y и S; Х2 выбран из Y и S; Х3 выбран из Y и S; Х4 выбран из Y и S; и Х5 выбран из Y и S. В другом аспекте Х1 выбран из W и S; Х2 выбран из W и S; Х3 выбран из W и S; Х4 выбран из W и S; и Х5 выбран из W и S. В другом аспекте Х1 выбран из R и S; Х2 выбран из R и S; Х3 выбран из R и S; Х4 выбран из R и S; и Х5 выбран из R и S. В другом аспекте Х1 выбран из F и S; Х2 выбран из F и S; Х3 выбран из F и S; Х4 выбран из F и S; и Х5 выбран из F и S. В другом аспекте Х6 выбран из Y и S; Х7 выбран из Y и S; Х8 выбран из Y и S; Х9 выбран из Y и S; Х10 выбран из Y и S; и Х11 выбран из Y и S. В другом аспекте Х6 выбран из W и S; Х7 выбран из W и S; Х8 выбран из W и S; Х9 выбран из W и S; Х10 выбран из W и S; и Х11 выбран из W и S. В другом аспекте Х6 выбран из R и S; Х7 выбран из R и S; Х8 выбран из R и S; Х9 выбран из R и S; Х10 выбран из R и S; и Х11 выбран из R и S. В другом аспекте Х6 выбран из F и S; Х7 выбран из F и S; Х8 выбран из F и S; Х9 выбран из F и S; Х10 выбран из F и S; и Х11 выбран из F и S. В другом аспекте Х12 выбран из Y и S; Х13 выбран из Y и S; Х14 выбран из Y и S; Х15 выбран из Y и S; Х16 выбран из G и A; и Х17 выбран из F, L, I и M. В другом аспекте Х12 выбран из W и S; Х13 выбран из W и S; Х14 выбран из W и S; Х15 выбран из W и S; Х16 выбран из G и A; и Х17 выбран из F, L, I и M. В другом аспекте Х12 выбран из R и S; X13 выбран из R и S; Х14 выбран из R и S; X15 выбран из R и S; Х16 выбран из G и A; и Х17 выбран из F, L, I, и M. В другом аспекте Х12 выбран из F и S; X13 выбран из F и S; Х14 выбран из F и S; Х15 выбран из F и S; Х16 выбран из G и A; и X17 выбрана из F, L, I и M.
В другом аспекте аминокислоты в каждом из положений X12-X15 выбраны из S и одной из A, C, F, G, I, L, N, P, R, T, W и Y; Х16 выбран из G и A; и Х17 выбран из F, L, I и M.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H, где G находится в положении 26 и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G, где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19, где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X17 выбраны из S и одной из A, C, F, G, I, L, N, P, R, T, W или Y или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из F, L, I и M.
В одном из аспектов CDRH1 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:816-842, или по меньшей мере одну аминокислотную последовательность CDRH1, выбранную из любых последовательностей, указанных на фиг.21A. CDRH2 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:843-869, или по меньшей мере одну аминокислотную последовательность CDRH2, выбранную из любых последовательностей, указанных на фиг.21A. CDRH3 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:870-896, или по меньшей мере одну аминокислотную последовательность CDRH3, выбранную из любых последовательностей, указанных на фиг.21A.
В другом варианте осуществления полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H, где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где аминокислота в каждом из положений X1-Х5 выбрана из S и одной из Y, W, R или F;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G, где X1 находится в положении 50 согласно системе нумерации Кабата; где аминокислота в каждом из положений X1-Х6 выбрана из S и одной из Y, W, R или F; и
(iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19, где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X19 выбраны из S и одной из Y, W, R или F или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из F, L, I и M.
В одном из аспектов CDRH1 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:924-950, или по меньшей мере одну аминокислотную последовательность CDRH1, выбранную из любых последовательностей, указанных на фиг.24A. CDRH2 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:951-977, или по меньшей мере одну аминокислотную последовательность CDRH2, выбранную из любых последовательностей, указанных на фиг.24A. CDRH3 содержит по меньшей мере одну аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:978-1004, или по меньшей мере одну аминокислотную последовательность CDRH3, выбранную из любых последовательностей, указанных на фиг.24A.
В одном из аспектов полипептид связывает HER-2 человека. В некоторых вариантах осуществления полипептид включает антитело. В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи, содержащий:
i) CDRH1, содержащую аминокислотную последовательность GFSIYSSYIH (SEQ ID NO:821);
ii) CDRH2, содержащую аминокислотную последовательность SIYPYSGYTSYADSVKG (SEQ ID NO:848); и
iii) CDRH3, содержащую аминокислотную последовательность WWSSAFDY (SEQ ID NO:875). В другом варианте осуществления антитело содержит вариабельный домен тяжелой цепи, содержащий:
i) CDRH1, содержащую аминокислотную последовательность GFSIWWSWIH (SEQ ID NO:932);
ii) CDRH2, содержащую аминокислотную последовательность SISPSSGWTSYADSVKG (SEQ ID NO:959); и
iii) CDRH3, содержащую аминокислотную последовательность WWSSAMDY (SEQ ID NO:986). В другом варианте осуществления антитело содержит вариабельный домен тяжелой цепи, содержащий:
i) CDRH1, содержащую аминокислотную последовательность GFSISSSYIH (SEQ ID NO:944);
ii) CDRH2, содержащую аминокислотную последовательность SIYPYSGYTSYADSVKG (SEQ ID NO:971); и
iii) CDRH3, содержащую аминокислотную последовательность YYSYALDY (SEQ ID NO:998). В другом варианте осуществления антитело содержит вариабельный домен тяжелой цепи, содержащий:
i) CDRH1, содержащую аминокислотную последовательность GFYISSSSIH (SEQ ID NO:230);
ii) CDRH2, содержащую аминокислотную последовательность YIYPSSGYTSYADSVKG (SEQ ID NO:336); и
iii) CDRH3, содержащую аминокислотную последовательность GYYYSYYSGYALDY (SEQ ID NO:442).
В другом аспекте антитело дополнительно содержит вариабельный домен легкой цепи, содержащий последовательность CDRL3, причем CDRL3 содержит аминокислотную последовательность Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:25), где X1 находится в положении 91 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S, Y и F; Х3 выбран из Y, S и F; Х4 выбран из Y и S; Х5 выбран из S и Y.
В другом варианте осуществления изобретение относится к полипептиду, содержащему вариабельный домен легкой цепи иммуноглобулина, в котором CDRL3 содержит аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:), где X1 находится в положении 91 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S. В другом варианте осуществления полипептид содержит вариабельный домен легкой цепи иммуноглобулина, в котором CDRL3 содержит аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T, где X1 находится в положении 91 согласно системе нумерации Кабата, и где аминокислоты в каждом из положений X1-X5 выбраны из S и одной из Y, W, R или F. В одном из аспектов CDRL3 содержит аминокислотную последовательность, выбранную из SEQ ID NO:83-188, 507-523, 789-815 и 897-923 или любых последовательностей CDRL3, показанных на фиг.11, 15, 21 или 24.
В другом варианте осуществления изобретение относится к полипептиду, содержащему вариабельный домен легкой цепи иммуноглобулина, в котором:
(i) CDRL1 содержит первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2 содержит вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3 содержит аминокислотную последовательность: Q-Q-Xl-X2-X3-(X4)n-X5-X6-T (SEQ ID NO:), где X1-X6 означают любую природную аминокислоту, отличную от цистеина, и где X1 находится в положении 91 согласно системе нумерации Кабата.
В одном из аспектов X1 находится в положении 91 согласно системе нумерации Кабата, Х1 выбран из Y и S; Х2 выбран из Y и S; Х3 выбран из Y и S; Х4 выбран из Y и S; Х5 выбран из P и L; и Х6 выбран из F, L, I и V. В одном из аспектов n равно 1-3. В одном из аспектов CDRL3 содержит аминокислотную последовательность, выбранную из SEQ ID NO:83-188, 507-523, 789-815 и 897-923 или любой из последовательностей CDRL3, показанных на фиг.11, 15, 21 или 24. В одном из аспектов первой консенсусной гипервариабельной последовательностью является R-A-S-Q-D-V-N-T-A-V-A (SEQ ID NO:29). В одном из аспектов второй консенсусной гипервариабельной последовательностью является S-A-S-S-L-Y-S (SEQ ID NO:30).
В другом варианте осуществления изобретение относится к полипептиду, содержащему вариабельный домен легкой цепи иммуноглобулина, в котором:
(i) CDRL1 содержит первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2 содержит вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3 содержит аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:), где X1-X5 означают любую природную аминокислоту, отличную от цистеина, и X1 находится в положении 91 согласно системе нумерации Кабата.
В одном из аспектов X1 находится в положении 91 согласно системе нумерации Кабата, Х1 выбран из Y и S; Х2 выбран из Y и S; Х3 выбран из Y и S; Х4 выбран из Y и S; и Х5 выбран из Y и S. В другом аспекте X1 находится в положении 91 согласно системе нумерации Кабата, и аминокислоты в каждом из положений X1-X5 выбраны из S и одной из Y, W, R и F. В одном из аспектов CDRL3 содержит аминокислотную последовательность, выбранную из SEQ ID NO:83-188, 507-523, 789-815 и 897-923 или любых последовательностей CDRL3, показанных на фиг.11, 15, 21 или 24. В другом аспекте первой консенсусной гипервариабельной последовательностью является R-A-S-Q-D-V-N-T-A-V-A (SEQ ID NO:29). В другом аспекте второй консенсусной гипервариабельной последовательностью является S-A-S-S-L-Y-S (SEQ ID NO:30).
В некоторых вариантах осуществления изобретение относится к полипептиду, содержащему по меньшей мере два вариабельных домена антитела, содержащих: (a) вариабельный домен тяжелой цепи антитела, содержащий любой из указанных выше полипептидов тяжелой цепи, и (b) вариабельный домен легкой цепи антитела, содержащий любой из указанных выше полипептидов легкой цепи.
В некоторых вариантах осуществления изобретение относится к антителу, содержащему полипептид, включающий вариабельный домен тяжелой цепи иммуноглобулина, соответствующий любому из указанных выше полипептидов тяжелой цепи, и полипептид, включающий вариабельный домен легкой цепи иммуноглобулина, соответствующий любому из указанных выше полипептидов легкой цепи.
В некоторых аспектах указанные выше полипептиды и антитела дополнительно содержат домен димеризации, связанный с C-концевой областью вариабельного домена тяжелой цепи антитела. В некоторых таких аспектах домен димеризации содержит домен лейциновой молнии или последовательность, содержащую по меньшей мере один остаток цистеина. В некоторых таких аспектах домен димеризации содержит область шарнира из антитела и лейциновую молнию. В некоторых других аспектах доменом димеризации является один остаток цистеина.
В одном из вариантов осуществления изобретение относится к слитому полипептиду, содержащему любой из указанных выше полипептидов, в котором вариабельный домен антитела, содержащий указанный выше полипептид, слит по меньшей мере с частью белка оболочки вируса. В одном из аспектов белок оболочки вируса выбран из группы, состоящей из белка pIII, основного белка оболочки pVIII, Soc, Hoc, gpD, pv1 и их вариантов. В одном из аспектов слитый полипептид дополнительно содержит домен димеризации между вариабельным доменом и белком оболочки вируса. В одном из таких аспектов вариабельным доменом является вариабельный домен тяжелой цепи. В другом аспекте слитый полипептид дополнительно содержит вариабельный домен, слитый с пептидной меткой. В одном из таких аспектов вариабельным доменом является вариабельный домен легкой цепи. В другом таком аспекте пептидная метка выбрана из группы, состоящей из gD, c-myc, поли-his, флуоресцирующего белка и β-галактозидазы.
В одном из вариантов осуществления один или несколько из описанных выше полипептидов содержат каркасные области FR1, FR2, FR3 и/или FR4 вариабельного домена антитела, соответствующего варианту CDRH1, CDRH2, CDRH3 и/или CDRL3, при этом каркасные области получены из одной матрицы антитела. В некоторых таких вариантах осуществления каждая из каркасных областей содержит аминокислотную последовательность, соответствующую аминокислотным последовательностям каркасной области антитела 4D5 (SEQ ID NO:6-9 и 10-13) или варианта антитела 4D5 (SEQ ID NO:14-17 и 18-21).
В одном из вариантов осуществления изобретение относится к библиотеке, которая содержит множество из одного или нескольких описанных выше полипептидов, при этом библиотека имеет по меньшей мере 1×104 различных последовательностей вариабельных доменов антител.
В другом варианте осуществления изобретение относится к способу создания композиции, содержащей множество полипептидов, включающему:
(a) создание множества полипептидов, содержащих:
(i) CDRH1, содержащую аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:), где G находится в положении 26 и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2, содержащую аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3, содержащую аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В одном из аспектов способ дополнительно включает:
(b) создание множества полипептидов, содержащих:
(i) CDRL1, содержащую первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2, содержащую вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3, содержащую аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:), где X1 находится в положении 91 согласно системе нумерации Кабата; и где Х1 выбран из Y и S, где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S.
В одном из аспектов множество полипептидов кодируются множеством полинуклеотидов.
В другом варианте осуществления изобретение относится к способу создания композиции, содержащей множество полипептидов, включающему:
(a) создание множества полипептидов, содержащих:
(i) CDRH1, содержащую аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2, содержащую аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3, содержащую аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:), где Xl находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В одном из аспектов способ дополнительно включает:
(b) создание множества полипептидов, содержащих:
(i) CDRL1, содержащую первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2, содержащую вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3, содержащую аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:), где X1 находится в положении 91 согласно системе нумерации Кабата, и где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S.
В одном из аспектов множество полипептидов кодируются множеством полинуклеотидов.
В другом из вариантов осуществления изобретение относится к способу создания композиции, содержащей множество полипептидов, включающему:
(a) создание множества полипептидов, содержащих:
(i) CDRH1, содержащую аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2, содержащую аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3, содержащую аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:), где X1 находится в положении 95 согласно системе нумерации Кабата, и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В одном из аспектов способ дополнительно включает:
(b) создание множества полипептидов, содержащих:
(i) CDRL1, содержащую первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2, содержащую вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3, содержащую аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:), где X1 находится в положении 91 согласно системе нумерации Кабата; и где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S.
В одном из аспектов множество полипептидов кодируется множеством полинуклеотидов.
В другом варианте осуществления изобретение относится к способу создания композиции, содержащей множество полипептидов, включающему:
(a) создание множества полипептидов, содержащих:
(i) CDRH1, содержащую аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2, содержащую аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3, содержащую аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% K, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% T, 1% V и 1% W; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% K, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% T, 1% V и 1 % W или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В одном из аспектов способ дополнительно включает:
(b) создание множества полипептидов, содержащих:
(i) CDRL1, содержащую первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2, содержащую вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3, содержащую аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:), где X1 находится в положении 91 согласно системе нумерации Кабата, и где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S.
В одном из аспектов первая консенсусная гипервариабельная последовательность содержит консенсусную последовательность CDRL1 Кабата. В одном из таких аспектов первой консенсусной гипервариабельной последовательностью является последовательность R-A-S-Q-D-V-N-T-A-V-A (SEQ ID NO:29). В одном из аспектов вторая консенсусная гипервариабельная последовательность содержит консенсусную последовательность CDRL2 Кабата. В одном из таких аспектов второй консенсусной гипервариабельной последовательностью является последовательность S-A-S-S-L-Y-S (SEQ ID NO:30). В одном из аспектов множество полипептидов кодируется множеством полинуклеотидов.
В одном из вариантов осуществления изобретение относится к способу создания композиции, содержащей множество полипептидов, включающему:
(a) создание множества полипептидов, содержащих:
(i) CDRH, содержащую аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2, содержащую аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3, содержащую аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:24), где X1 находится в положении 95 согласно системе нумерации Кабата, и где Х1 выбран из Y, S, G, R и E; Х2 выбран из Y, S, G, R, M и A; Х3 выбран из G, Y, S, R, W и H, Х4 выбран из Y, S, G, R, F и Q; Х5 выбран из G, Y, N, A и S; Х6 выбран из F, M, L, A, R, G, H, W, V, Y и S; Х7 выбран из M, L, G, A, R, F, Y и S или отсутствует; Х8 выбран из M, L, F, I, R, G, P, V, Y и S или отсутствует; Х9 выбран из G, Y, R и S или отсутствует; Х10 выбран из M, F, G, Y, R и S или отсутствует; Х11 выбран из A, G, Y, R и S или отсутствует; Х12 выбран из I, M, L, F, A, G, R, T, Y и S или отсутствует; Х13 выбран из F, M, L, G, A, T, Y и S или отсутствует; Х14 выбран из L, F, M, I, G, A, T и Y или отсутствует; Х15 выбран из M, Y, G, L и R или отсутствует; Х16 выбран из Y и G или отсутствует; Х17 выбран из R, M и G или отсутствует; Х18 выбран из P и A или отсутствует; и X19 означает L или отсутствует.
В одном из аспектов CDRH1 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:189-294. В одном из аспектов CDRH2 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:295-400. В одном из аспектов CDRH3 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:401-506.
В одном из аспектов способ дополнительно включает:
(b) создание множества полипептидов, содержащих:
(i) CDRL1, содержащую первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2, содержащую вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3, содержащую аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:25), где X1 находится в положении 91 согласно системе нумерации Кабата, и где Х1 выбран из Y и S, где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S.
В одном из аспектов множество полипептидов кодируется множеством полинуклеотидов.
В одном из вариантов осуществления изобретение относится к способу создания композиции, содержащей множество полипептидов, включающему:
(a) создание множества полипептидов, содержащих:
(i) CDRH1, содержащую аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
(ii) CDRH2, содержащую аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и
(iii) CDRH3, содержащую аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19 (SEQ ID NO:), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X17 выбраны из S и одной из A, C, F, G, I, L, N, P, R, T, W или Y или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из F, L, I и M.
В одном из аспектов способ дополнительно включает:
(b) создание множества полипептидов, содержащих:
(i) CDRL1, содержащую первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2, содержащую вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3, содержащую аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:), где X1 находится в положении 91 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S.
В одном из вариантов осуществления изобретение относится к способу создания композиции, содержащей множество полипептидов, включающему:
(a) создание множества полипептидов, содержащих:
(i) CDRH1, содержащую аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где аминокислота в каждом из положений X1-Х5 выбрана из S и одной из Y, W, R или F;
(ii) CDRH2, содержащую аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:), где X1 находится в положении 50 согласно системе нумерации Кабата; где аминокислота в каждом из положений X1-Х6 выбрана из S и одной из Y, W, R или F; и
(iii) CDRH3, содержащую аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19 (SEQ ID NO:), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X17 выбраны из S и одной из Y, W, R или F или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из F, L, I и M.
В другом аспекте способ дополнительно включает:
(b) создание множества полипептидов, содержащих:
(i) CDRL1, содержащую первую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью;
(ii) CDRL2, содержащую вторую консенсусную гипервариабельную последовательность или ее вариант, содержащий замену в одном или нескольких положениях по сравнению с соответствующей консенсусной гипервариабельной последовательностью; и
(iii) CDRL3, содержащую аминокислотную последовательность: Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:), где X1 находится в положении 91 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X5 выбраны из S и одной из Y, W, R и F.
В одном из вариантов осуществления изобретение относится к способу создания одной или нескольких из описанных выше последовательностей CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3, включающему:
(a) конструирование экспрессирующего вектора, содержащего полинуклеотидную последовательность, которая кодирует вариабельный домен легкой цепи, вариабельный домен тяжелой цепи или оба указанных домена исходного антитела, содержащие по меньшей мере один, два, три, четыре, пять или все CDR исходного антитела, выбранные из группы, состоящей из CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и CDRH3; и
(b) мутирование по меньшей мере одного, двух, трех, четырех, пяти или всех CDR исходного антитела для создания одной или нескольких из описанных выше гипервариабельных областей.
В одном из вариантов осуществления изобретение относится к способу отбора полипептида, который связывается с антигеном-мишенью, включающему:
(a) создание композиции с множеством полипептидов из одного или нескольких описанных выше полипептидов;
(b) отбор одного или нескольких полипептидов из композиции, который связывается с антигеном-мишенью;
(c) отделение одного или нескольких полипептидов, которые связываются с антигеном-мишенью, из полипептидов, которые не связываются с антигеном-мишенью; и
(d) идентификацию одного или нескольких полипептидов, которые связываются с антигеном-мишенью, которые имеют требуемую аффинность по отношению к антигену-мишени.
В одном из вариантов осуществления изобретение относится к способу отбора антигенсвязывающего вариабельного домена, который связывается с антигеном-мишенью, из библиотеки вариабельных доменов антител, включающему:
(a) осуществление контакта одной или нескольких из описанных выше библиотек с антигеном-мишенью;
(b) отделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, от полипептидов, которые специфично не связываются с антигеном-мишенью, выделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, и инкубацию одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, в серии раствором, содержащих снижающиеся количества антигена-мишени в концентрации примерно от 0,1 нМ до примерно 1000 нМ; и
(c) отбор одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью и которые могут связываться с антигеном-мишенью в наименьшей концентрации или которые имеют аффинность примерно от 0,1 нМ до примерно 200 нМ.
В одном из аспектов антигеном-мишенью является HER2 или DR5. В одном из аспектов концентрация антигена-мишени составляет примерно от 100 до 250 нМ. В одном из аспектов концентрация антигена-мишени составляет примерно от 25 до 100 нМ. В некоторых вариантах осуществления проводят скрининг одной или нескольких библиотек, клонов или полипептидов против панели антигенов, включая антиген-мишень. В некоторых вариантах осуществления отбирают такие клоны или полипептиды, которые специфично связываются с антигеном-мишенью и по существу перекрестно не взаимодействуют с любым другим антигеном на панели. Панель антигенов может включать по меньшей мере три и вплоть до 100 разных антигенов. В некоторых случаях панель антигенов содержит от 3 до 100, от 3 до 50, от 3 до 25 или от 3 до 10 разных антигенов.
В одном из вариантов осуществления изобретение относится к способу отбора полипептида, который связывается с антигеном-мишенью, из библиотеки полипептидов, включающему:
(a) выделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, в результате контактирования библиотеки, содержащей множество любых описанных выше полипептидов, с иммобилизованным антигеном-мишенью в условиях, подходящих для связывания;
(b) отделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, от полипептидов, которые специфично не связываются с антигеном-мишенью, и выделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, чтобы получить субпопуляцию, обогащенную одним или нескольким полипептидами, которые специфично связываются с антигеном-мишенью; и
(c) необязательно повторение стадий (a)-(b) по меньшей мере дважды, при этом каждое повторение осуществляют с использованием субпопуляции, обогащенной одним или несколькими полипептидами, которые специфично связываются с антигеном-мишенью, полученной в результате предыдущего раунда селекции.
В одном из аспектов способ дополнительно включает:
(d) инкубацию субпопуляции с меченым антигеном-мишенью в диапазоне концентраций примерно от 0,1 нМ до примерно 1000 нМ с образованием смеси в условиях, подходящих для связывания;
(e) контактирование смеси с иммобилизованным агентом, который связывается с меткой на антигене-мишени;
(f) выявление одного или нескольких полипептидов, которые специфично связываются с меченым антигеном-мишенью, и отделение одного или нескольких полипептидов, которые специфично связываются с меченым антигеном-мишенью, от меченого антигена-мишени; и
(g) необязательно повторение стадий (d)-(f) по меньшей мере дважды, при этом каждое повторение осуществляют с использованием субпопуляции, обогащенной одним или несколькими полипептидами, которые специфично связываются с меченым антигеном-мишенью, полученной в результате предыдущего раунда селекции и с использованием более низкой концентрации меченого антигена-мишени, чем в предыдущем раунде селекции.
В одном из аспектов способ дополнительно включает добавление избытка немеченого антигена-мишени к смеси и инкубацию смеси в течение периода времени, достаточного для выделения одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью с низкой аффинностью. В некоторых вариантах осуществления в любом из способов, описанных в настоящем описании, проводят скрининг одной или нескольких библиотек, клонов или полипептидов против панели антигенов, включая антиген-мишень. В некоторых вариантах осуществления отбирают такие клоны или полипептиды, которые специфично связываются с антигеном-мишенью и по существу перекрестно не взаимодействуют с любым другим антигеном на панели. Панель антигенов может содержать по меньшей мере три и вплоть до 100 разных антигенов. В некоторых случаях панель антигенов содержит от 3 до 100, от 3 до 50, от 3 до 25 или от 3 до 10 разных антигенов.
В одном из вариантов осуществления изобретение относится к способу выделения одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью с высокой аффинностью, включающему:
(a) осуществление контакта библиотеки, содержащей множество любых описанных выше полипептидов, с антигеном-мишенью в концентрации, составляющей по меньшей мере примерно от 0,1 нМ до примерно 1000 нМ, для выделения одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью;
(b) отделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, от антигена-мишени, чтобы получить субпопуляцию, обогащенную одним или несколькими полипептидами, которые специфично связываются с антигеном-мишенью; и
(c) необязательно повторение стадий (a) и (b) по меньшей мере дважды, при этом каждое повторение осуществляют с использованием субпопуляции, полученной в предыдущем раунде селекции, и с использованием уменьшенной концентрации антигена-мишени по сравнению с концентрацией, используемой в предыдущем раунде, чтобы выделить один или несколько полипептидов, которые связываются специфично с антигеном-мишенью при наиболее низкой концентрации антигена-мишени.
В одном из вариантов осуществления изобретение относится к анализу для отбора одного или нескольких полипептидов, которые связываются с антигеном-мишенью, из библиотеки, содержащей множество любых описанных выше полипептидов, включающему:
(a) контактирование библиотеки с меченым антигеном-мишенью в диапазоне концентраций примерно от 0,1 нМ до примерно 1000 нМ в условиях, подходящих для образования одного или нескольких комплексов между меченым антигеном-мишенью и одним или несколькими полипептидами, которые специфично связывают антиген-мишень;
(b) выделение одного или нескольких комплексов и отделение одного или нескольких полипептидов, которые специфично связывают антиген-мишень, от меченого антигена-мишени с получением субпопуляции, обогащенной одним или несколькими полипептидами, которые специфично связывают антиген-мишень; и
(c) необязательно, повторение стадий (a) и (b) по меньшей мере дважды, при этом каждый раз используя субпопуляцию, полученную в предыдущем раунде селекции, и используя более низкую концентрацию антигена-мишени, чем концентрация, используемая в предыдущем раунде. В одном из аспектов анализ дополнительно включает добавление избытка немеченого антигена-мишени к одному или нескольким комплексам. В одном из аспектов стадии (a) и (b) повторяют дважды, при этом концентрация антигена-мишени в первом раунде селекции составляет примерно от 100 нМ до 250 нМ, концентрация антигена-мишени во втором раунде селекции составляет примерно от 25 нМ до 100 нМ, и концентрация антигена-мишени в третьем раунде селекции составляет примерно от 0,1 нМ до 25 нМ.
В одном из вариантов осуществления изобретение относится к способу скрининга библиотеки, содержащей множество любых описанных выше полипептидов, включающему:
(a) инкубацию первого образца библиотеки с антигеном-мишенью в условиях, подходящих для связывания полипептидов с антигеном-мишенью;
(b) инкубацию второго образца библиотеки в отсутствие антигена-мишени;
(c) контактирование первого образца и второго образца с иммобилизованным антигеном-мишенью в условиях, подходящих для связывания полипептида с иммобилизованным антигеном-мишенью;
(d) выявление полипептида, связанного с иммобилизованным антигеном-мишенью, в случае каждого образца; и
(e) определение аффинности полипептида по отношению к антигену-мишени посредством расчета отношения количеств связанного полипептида из первого образца к количеству связанного полипептида из второго образца.
В одном из аспектов антигеном-мишенью является DR5 или HER-2. В одном из аспектов концентрация антигена-мишени составляет примерно от 100 до примерно 250 нМ. В одном из аспектов концентрация антигена-мишени составляет примерно от 25 до примерно 100 нМ. В некоторых вариантах осуществления проводят скрининг одной или нескольких библиотек, клонов или полипептидов против панели антигенов, включающей антиген-мишень. В некоторых вариантах осуществления отбирают такие клоны или полипептиды, которые специфично связываются с антигеном-мишенью и по существу перекрестно не взаимодействуют с любым другим антигеном на панели. Панель антигенов может содержать по меньшей мере три и вплоть до 100 разных антигенов. В некоторых случаях панель антигенов содержит от 3 до 100, от 3 до 50, от 3 до 25 или от 3 до 10 разных антигенов.
В одном из вариантов осуществления один или несколько из описанных выше полипептидов специфично связывают DR5 человека. В одном из аспектов полипептид представляет собой антитело, которое специфично связывает DR5 человека. В одном из таких аспектов антитело содержит каркасные области антитела 4D5. В одном из таких аспектов антитело содержит каркасные области варианта антитела 4D5. В одном из таких аспектов антитело является моноклональным антителом. В одном из таких аспектов антитело является биспецифичным антителом. В одном из таких аспектов антитело является синтетическим антителом.
В одном из вариантов осуществления анти-DR5-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, где: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из S и Y; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S;
ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-D-Y (SEQ ID NO:31), где X1 находится в положении 95 согласно системе нумерации Кабата, и где Х1 выбран из R, Y и M; Х2 выбран из Y и R; Х3 выбран из Y, S, R, P и G, Х4 выбран из Y и S; Х5 выбран из Y, S, R и H; Х6 выбран из R, Y и S; Х7 выбран из G, Y и S; Х8 выбран из R, Y и S; Х9 выбран из G, Y и S; Х10 выбран из R, Y и S; Х11 выбран из G, Y и S; Х12 выбран из S, Y, R, G и A; Х13 выбран из G и Y; Х14 выбран из L, M, R, G и A; и Х15 выбран из G, F и L или отсутствует; и X16 означает F или отсутствует.
В другом варианте осуществления анти-DR5-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:24), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В другом варианте осуществления анти-DR5-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:26), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В другом варианте осуществления анти-DR5-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:27), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В другом варианте осуществления анти-DR5-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:28), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% K, 1% L, 1% M, 1%N, 1% P, 1% Q, 1% T, 1% V и 1% W; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1%H, 1% I, 1% K, 1% L, 1% M, 1% N, 1% P, 1% Q, 1%T, 1% V и 1% W или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В некоторых вариантах осуществления анти-DR5-антитело содержит CDRH1, содержащую аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:524-540, которые показаны на фиг.15. Анти-DR5-антитело также может содержать CDRH2, содержащую аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:541-557, которые показаны на фиг.15. Анти-DR5-антитело также может содержать CDRH3, содержащую аминокислотную последовательность, выбранную из последовательностей SEQ ID NO:558-574, которые показаны на фиг.15. В одном из аспектов антитело, которое специфично связывает DR5 человека, содержит последовательности CDRH1, CDRH2, CDRH3 и CDRL3, соответствующие последовательностям CDRH1, CDRH2, CDRH3 и CDRL3, указанным на фиг.15, для любых Fab 1-17.
В некоторых вариантах осуществления анти-DR5-антитело содержит область CDRH3, в которой положение аминокислоты X1 соответствует положению 95, и Х1 выбран из R и Y; X3 находится в положении 97 и является S; X8 соответствует положению аминокислоты 100b и представляет собой S; X9 соответствует положению аминокислоты 100c и представляет собой Y; и X10 находится в положении аминокислоты 100d и представляет собой Y или R. В одном из вариантов осуществления CDRH3 содержит аминокислотную последовательность X1-R-S-Y-R-Y-G-S-Y-X10-G-S-Y-X14-F-D-Y (SEQ ID NO:575). В конкретном варианте анти-DR5-антитело содержит вариабельный домен тяжелой цепи, включающий: i) CDRH1, содержащую аминокислотную последовательность GFYISSSSIH (SEQ ID NO:576); ii) CDRH2, содержащую аминокислотную последовательность SISPSSGSTYYADSVKG (SEQ ID NO:577); и iii) CDRH3, содержащую аминокислотную последовательность YRSYRYGSYYGSYGFDY (SEQ ID NO:578). В другом конкретном варианте анти-DR5-антитело содержит вариабельный домен тяжелой цепи, включающий: i) CDRH1, содержащую аминокислотную последовательность GFYIYSSSIH (SEQ ID NO:579); ii) CDRH2, содержащую аминокислотную последовательность SISPSSGYTSYADSVKG (SEQ ID NO:580); и iii) CDRH3, содержащую аминокислотную последовательность RRSYRYGSYRGSYAFDY (SEQ ID NO:581).
В некоторых вариантах осуществления анти-DR5-антитело содержит CDRH1, содержащую аминокислотную последовательность GFX1IX2SSSIH (SEQ ID NO:598), в которой X1 и X2 представляют собой Y или S. В других вариантах анти-DR5-антитело содержит CDRH2, содержащую аминокислотную последовательность X1ISPX3X4GYTX6YADSKVG (SEQ ID NO:599), в которой X1, X3, X4 и X6 означают Y или S. В другом варианте осуществления анти-DR5-антитело содержит CDRH3, содержащую аминокислотную последовательность YRX3YRYGX8X9X10GSYX14X15DY (SEQ ID NO:596), в которой Х3 выбран из Y, S, R, P и G; Х8 выбран из R, Y и S; Х9 выбран из G, Y и S; Х10 выбран из S, Y и R; Х14 выбран из G и A; и Х15 выбран из L и F.
В некоторых вариантах осуществления анти-DR5-антитело связывается с DR5 человека с IC50, составляющей от 1 до 20 нМ. В других вариантах анти-DR5-антитело связывается с DR5 человека и мыши.
Анти-DR5-антитела необязательно могут дополнительно содержать вариабельный домен легкой цепи, в котором (i) CDRL3 содержит аминокислотную последовательность Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:25); где X1 находится в положении 91 и выбран из Y, H и S; Х2 выбран из Y и S; Х3 выбран из Y, S и T; Х4 выбран из Y, S и T; и Х5 выбран из S, P и Y. Анти-DR5-антитела также необязательно могут содержать вариабельный домен легкой цепи, в котором CDRL3 содержит аминокислотную последовательность QQX1X2X3SPST (SEQ ID NO:597), где X1, X2 и X3 означают Y или S. Вариабельный домен легкой цепи дополнительно может содержать CDRL3, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:507-523, которые показаны на фиг.15. Антитело также дополнительно может содержать CDRL1, которая содержит аминокислотную последовательность RASQDVNTAVA (SEQ ID NO:29). Антитело также дополнительно может содержать CDRL2, которая содержит аминокислотную последовательность SASSLYS (SEQ ID NO:30).
В одном из аспектов проводят скрининг антител, специфичных к DR5, в отношении агонистической или антагонистической активности. Скрининг таких антител может быть проведен с помощью анализа передачи сигнала рецептора DR5, например с помощью анализа апоптоза, который описан в настоящем описании. Агонистические антитела усиливают апоптоз по сравнению с контролем, а антагонистические антитела снижают апоптоз.
В одном из вариантов осуществления изобретение относится к выделенному полинуклеотиду, кодирующему любое из описанных выше антител, которое специфично связывает DR5 человека. В одном из вариантов осуществления изобретение относится к вектору, содержащему выделенный полинуклеотид, кодирующий любое из описанных выше антител, которое специфично связывает DR5 человека. В одном из вариантов осуществления изобретение относится к клетке-хозяину, трансформированному вектором, содержащим выделенный полинуклеотид, кодирующий любое из описанных выше антител, которые специфично связывают DR5 человека. В одном из вариантов осуществления изобретение относится к способу получения антитела, включающему культивирование клетки-хозяина, трансформированной вектором, содержащим выделенный полинуклеотид, кодирующий любое из описанных выше антител, которые специфично связывают DR5 человека, так чтобы полинуклеотид экспрессировался. В одном из аспектов способ дополнительно включает выделение антитела из культуры клеток-хозяев. В одном из аспектов способ дополнительно включает выделение антитела из среды культивирования клеток-хозяев.
В одном из вариантов осуществления изобретение относится к способу применения одного или нескольких из описанных выше антител, которые специфично связывают DR5 человека, для лечения расстройства, связанного с патологическим ангиогенезом, у млекопитающего, включающему стадию введения млекопитающему одного или нескольких антител. В некоторых вариантах осуществления антитела к DR5, которые ингибируют апоптоз, могут быть использованы при состояниях, при которых требуется ингибирование гибели клеток (например, при дегенерации желтого пятна). В одном из аспектов расстройством является рак. В некоторых вариантах осуществления анти-DR5-антитело усиливает апоптоз. В одном из таких аспектов рак выбран из рака молочной железы, рака прямой и ободочной кишки, немелкоклеточного рака легкого, неходжкинской лимфомы (NHL), рака почек, рака простаты, рака печени, рака головы и шеи, меланомы, рака яичника, мезотелиомы и множественной миеломы. В другом аспекте лечение дополнительно включает стадию введения второго терапевтического средства одновременно или последовательно с антителом. В одном из таких аспектов второе терапевтическое средство выбрано из антиангиогенного средства, антинеопластического средства, химиотерапевтического средства и цитотоксического средства.
В одном из вариантов осуществления изобретение относится к способу лечения млекопитающего, которое страдает или у которого существует риск развития воспалительного или иммунного расстройства, включающему стадию лечения млекопитающего одним или несколькими Fab одного или нескольких из описанных выше антител, которые специфично связывают DR5 человека. В одном из аспектов воспалительным или иммунным расстройством является ревматоидный артрит. В некоторых вариантах осуществления анти-DR5-антитело усиливает апоптоз.
Способы, описанные в данном документе, также относятся к выделению анти-HER-2-антител. В одном из вариантов осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где X1 находится в положении 28 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; (ii) CDRH2 содержит аминокислотную последовательность X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23); где X1 находится в положении аминокислоты 50 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; Х5 выбран из S и Y; и Х6 выбран из S и Y; и (iii) CDRH3 содержит аминокислотную последовательность X1-X2-X3-X4-X5-X6-X7-D-Y (SEQ ID NO:582), где X1 находится в положении аминокислоты 95 согласно нумерации Кабата и выбран из Y и R; Х2 выбран из Y, S и R; Х3 выбран из S, G, Y и H; Х4 выбран из S, G, Y и R; Х5 выбран из G и A; Х6 выбран из F, M, L и A; и Х7 выбран из F, M и L или отсутствует.
В другом варианте осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где X1 находится в положении 28 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; (ii) CDRH2 содержит аминокислотную последовательность X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении аминокислоты 50 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; и (iii) CDRH3 содержит аминокислотную последовательность X1-X2-X3-X4-X5-X6-X7-X8-D-Y (SEQ ID NO:583), где X1 находится в положении аминокислоты 95 согласно нумерации Кабата и выбран из Y, S и G; Х2 выбран из Y, S, G, R, A и M; Х3 выбран из G, Y, S и R; Х4 выбран из G, Y и F; Х5 выбран из Y, S, N и G; Х6 выбран из Y, R, H и W; Х7 выбран из G и A; и Х8 выбран из F, M, L и I.
В другом варианте осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где X1 находится в положении 28 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; (ii) CDRH2 содержит аминокислотную последовательность X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении аминокислоты 50 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S и Y; Х3 выбран из S и Y; Х4 выбран из S и Y; и Х5 выбран из S и Y; и (iii) CDRH3 содержит аминокислотную последовательность X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:584), где X1 находится в положении аминокислоты 95 и выбран из Y, S, R, G и E; Х2 выбран из Y, S, R и G; Х3 выбран из S, Y, G и W; Х4 выбран из S, Y, G и Q; Х5 выбран из G, Y и S; Х6 выбран из G, Y, S, R и V; Х7 выбран из S, Y, G и R; Х8 выбран из Y, S, G, R, P и V; Х9 выбран из G, A, Y, S и R; Х10 выбран из M, F, G, Y, S и R; Х11 выбран из A, Y, S, G и R или отсутствует; Х12 выбран из I, M, F, L, A, G, S, Y, R и T или отсутствует; Х13 выбран из F, M, L, G, A, Y, T и S или отсутствует; Х14 выбран из L, M, F, I, G, Y, A и T или отсутствует; Х15 выбран из M, L, Y, G и R или отсутствует; Х16 выбран из Y и G или отсутствует; Х17 выбран из R, M и G или отсутствует; Х18 выбран из P и A или отсутствует; и X18 означает L или отсутствует.
В еще одном варианте осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:24), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В еще одном варианте осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:26), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В еще одном варианте осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:27), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В другом варианте осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO:28), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1 % A, 1 % D, 1% E, 1% F, 1% H, 1% I, 1% K, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% T, 1% V и 1% W; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% K, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% T, 1% V и 1% W или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из I, M, L и F.
В другом варианте осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19 (SEQ ID NO:), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X19 выбраны из S и одной из A, C, F, G, I, L, N, P, R, T, W или Y или отсутствуют; где Х18 выбран из G и A или отсутствует; и где Х19 выбран из F, L, I и M или отсутствует.
В другом варианте осуществления анти-HER-2-антитело содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором: (i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO:22), где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; и где Х5 выбран из Y и S; (ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO:23), где X1 находится в положении 50 согласно системе нумерации Кабата; где Х1 выбран из Y и S; где Х2 выбран из Y и S; где Х3 выбран из Y и S; где Х4 выбран из Y и S; где Х5 выбран из Y и S; и где Х6 выбран из Y и S; и (iii) CDRH3 содержит аминокислотную последовательность: X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19 (SEQ ID NO:), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X19 выбраны из S и одной из Y, W, R или F или отсутствуют; где Х18 выбран из G и A; и где Х19 выбран из F, L, I и M.
В некоторых вариантах осуществления анти-HER-2-антитело может содержать CDRH1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:189-294, которые показаны на фиг.11. Анти-HER-2-антитело также может содержать CDRH2, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:295-400, которые показаны на фиг.11. Анти-HER-2-антитело также может содержать CDRH3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:401-506, которые показаны на фиг.11. В некоторых вариантах осуществления анти-HER-2-антитело может содержать CDRH1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:816-842, которые показаны на фиг.21A. Анти-HER-2-антитело также может содержать CDRH2, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:843-869, которые показаны на фиг.21A. Анти-HER-2-антитело также может содержать CDRH3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:870-896, которые показаны на фиг.21A. В некоторых вариантах осуществления анти-HER-2-антитело может содержать CDRH1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:924-950, которые показаны на фиг.24A. Анти-HER-2-антитело также может содержать CDRH2, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:951-977, которые показаны на фиг.24A. Анти-HER-2-антитело также может содержать CDRH3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:978-1004, которые показаны на фиг.24A.
В одном из аспектов антитело, которое специфично связывает HER2 человека, содержит последовательности CDRH1, CDRH2, CDRH3 и CDRL3, соответствующие последовательностям CDRH1, CDRH2, CDRH3 и CDRL3, указанным на фиг.11 для любого из Fab 1-106. В одном из аспектов антитело, которое специфично связывает HER2 человека, содержит последовательности CDRH1, CDRH2, CDRH3 и CDRL3, соответствующие последовательностям CDRH1, CDRH2, CDRH3 и CDRL3, указанным на фиг.21A для любого из клонов B1-B28. В другом аспекте антитело, которое специфично связывает HER2 человека, содержит последовательности CDRH1, CDRH2, CDRH3 и CDRL3, соответствующие последовательностям CDRH1, CDRH2, CDRH3 и CDRL3, указанным на фиг.24A для любого из клонов G29-G61.
В некоторых вариантах осуществления анти-HER-2-антитело содержит CDRH1, содержащую аминокислотную последовательность GFSIX2X3SYIH (SEQ ID NO:588), где X2 и X3 означают Y или S. Анти-HER-2-антитело также может содержать CDRH2, которая содержит аминокислотную последовательность SIYPX3SGYTSYADSKVG (SEQ ID NO:589), где X3 означает Y или S. Анти-HER-2-антитело может дополнительно содержать вариабельный домен легкой цепи, который содержит CDRL3, которая имеет аминокислотную последовательность QQSYYX4PST (SEQ ID NO:587), где X4 означает Y или S.
В некоторых вариантах осуществления анти-HER-2-антитело содержит аминокислотную последовательность GFX1ISYSSIH (SEQ ID NO:590), где X1 означает Y или S. Анти-HER-2-антитело дополнительно может содержать CDRH2, которая имеет аминокислотную последовательность SIYPX3YGX5TX6YADSKVG (SEQ ID NO:591), где X3, X5 и X6 означают Y или S.
В другом варианте осуществления анти-HER-2-антитело содержит CDRH1, которая имеет аминокислотную последовательность GFX1ISSSSIH (SEQ ID NO:593), где X1 означает Y или S. Анти-HER-2-антитело может дополнительно содержать CDRH2, которая имеет аминокислотную последовательность X1IХ2PSSGYTX6YADSKVG (SEQ ID NO:594), где X1, X2 и X6 означают Y или S. Анти-HER-2-антитело дополнительно может содержать CDRH3, которая имеет аминокислотную последовательность X1X2X3X4YYSYYX10GX12X13X14DY (SEQ ID NO:592), где Х1 выбран из Y, S и R; Х2 выбран из Y и S; Х3 выбран из G, Y и S; Х4 выбран из G, Y и S; Х4 выбран из Y, S, R и G; Х10 выбран из Y, S и G; Х12 выбран из Y, S, G и R; Х13 выбран из G и A, и Х14 выбран из I, F, M и L.
В некоторых вариантах осуществления анти-HER-2-антитело необязательно может дополнительно содержать вариабельный домен легкой цепи, содержащий последовательность CDRL3, при этом CDRL3 имеет аминокислотную последовательность Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO:25), где X1 находится в положении 91 согласно нумерации Кабата и выбран из S и Y; Х2 выбран из S, Y и F; Х3 выбран из Y, S и F; Х4 выбран из Y и S; Х5 выбран из S и Y. Вариабельный домен легкой цепи может дополнительно содержать CDRL3, которая имеет аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:83-188, которые показаны на фиг.11, SEQ ID NO:789-815, показанных на фиг.21A, и SEQ ID NO:897-923, показанных на фиг.24A. Антитело также может дополнительно содержать CDRL1, которая имеет аминокислотную последовательность RASQDVNTAVA (SEQ ID NO:29). Антитело также может дополнительно содержать CDRL2, которая имеет аминокислотную последовательность SASSLYS (SEQ ID NO:30).
В одном из аспектов полипептид представляет собой антитело, которое специфично связывает HER2. В одном из таких аспектов антитело содержит каркасные области антитела 4D5. В одном из таких аспектов антитело содержит каркасные области варианта антитела 4D5. В одном из таких аспектов антитело является моноклональным антителом. В одном из таких аспектов антитело является биспецифичным антителом.
В одном из вариантов осуществления изобретение относится к выделенному полинуклеотиду, кодирующему любое из описанных выше антител, которое специфично связывает HER2. В одном из вариантов осуществления изобретение относится к вектору, содержащему выделенный полинуклеотид, кодирующий любое из описанных выше антител, которое специфично связывает HER2. В одном из вариантов осуществления изобретение относится к клетке-хозяину, трансформированному вектором, содержащим выделенный полинуклеотид, кодирующий любое из описанных выше антител, которые специфично связывают HER2. В одном из вариантов осуществления изобретение относится к способу получения антитела, включающему культивирование клетки-хозяина, трансформированной вектором, содержащим выделенный полинуклеотид, кодирующий любое из описанных выше антител, которые специфично связывают HER2 и, таким образом экспрессируют полинуклеотид. В одном из аспектов способ дополнительно включает выделение антитела из культуры клеток-хозяев. В одном из аспектов способ дополнительно включает выделение антитела из среды культивирования клеток-хозяев.
В одном из вариантов осуществления изобретение относится к способу применения одного или нескольких из описанных выше антител, которые специфично связывают HER2, для лечения связанного с HER2 расстройства, включающему стадию введения млекопитающему одного или нескольких антител. В другом аспекте лечение дополнительно включает стадию введения второго терапевтического средства одновременно или последовательно с антителом. В одном из таких аспектов второе терапевтическое средство выбрано из антиангиогенного средства, антинеопластического средства, химиотерапевтического средства и цитотоксического средства.
В одном из вариантов осуществления изобретение относится к способу лечения млекопитающего, которое страдает или у которого существует риск развития связанного с HER2 расстройства, включающему стадию лечения млекопитающего одним или несколькими Fab одного или нескольких из описанных выше антител, которые специфично связывают HER2. В одном из вариантов осуществления один или несколько из описанных выше полипептидов специфично связывают HER2.
В одном из аспектов полипептид по изобретению содержит по меньшей мере один или оба вариабельных домена тяжелой цепи и легкой цепи антитела, при этом вариабельный домен антитела содержит одну, две или три вариантных CDR, которые описаны в настоящем описании (например, которые описаны выше).
В некоторых вариантах осуществления полипептид по изобретению (в частности, полипептиды, содержащие вариабельный домен антитела) дополнительно содержит каркасную последовательность антитела, например FR1, FR2, FR3 и/или FR4 для вариабельного домена антитела, соответствующего вариантной CDR, при этом FR-последовательности получены из одной матрицы антитела. В одном из вариантов осуществления FR-последовательности получают из антитела человека. В одном из вариантов осуществления FR-последовательности получают из консенсусной последовательности человека (например, консенсусной последовательности подгруппы III). В одном из вариантов осуществления каркасные последовательности содержат модифицированную консенсусную последовательность, которая описана в настоящем описании (например, содержащую модификации в положении 49, 71, 93 и/или 94 в тяжелой цепи и/или в положении 66 в легкой цепи). В одном из вариантов осуществления каркасные области имеют последовательности каркасных областей из легкой цепи и тяжелой цепи гуманизированного антитела 4D5-8 дикого типа (показанные на фиг.16 (SEQ ID NO:6-9 и 10-13 соответственно)). В одном из вариантов осуществления каркасные области имеют последовательности каркасных областей из вариантной версии легкой цепи и тяжелой цепи гуманизированного антитела 4D5-8, где легкая цепь модифицирована в положении 66, а тяжелая цепь модифицирована в положениях 71, 73 и 78 (показанные на фиг.17 (SEQ ID NO:14-17 и 18-21)).
В некоторых вариантах осуществления полипептид по изобретению содержит вариабельный домен легкой цепи и тяжелой цепи антитела, причем вариабельный домен легкой цепи содержит по меньшей мере 1, 2 или 3 вариантных CDR, выбранных из группы, состоящей из CDR L1, L2 и L3, и вариабельный домен тяжелой цепи содержит по меньшей мере 1, 2 или 3 вариантных CDR, выбранных из группы, состоящей из CDRH1, H2 и H3.
В некоторых вариантах осуществления полипептид по изобретению представляет собой ScFv. В некоторых вариантах осуществления полипептид представляет собой Fab-фрагмент. В некоторых вариантах осуществления полипептид представляет собой F(ab)2 или F(ab')2. Соответственно в некоторых вариантах осуществления полипептид по изобретению дополнительно содержит домен димеризации. В некоторых вариантах осуществления домен димеризации расположен между вариабельным доменом тяжелой цепи или легкой цепи антитела и по меньшей мере частью белка оболочки вируса. Домен димеризации может содержать последовательность димеризации и/или последовательность, содержащую один или несколько остатков цистеина. Домен димеризации может быть связан, прямо или опосредованно, с C-концом вариабельного или константного домена тяжелой цепи. Структура домена димеризации может изменяться в зависимости от того, продуцируется ли вариабельный домен антитела в виде компонента белка, слитого с компонентом, представляющим собой белок оболочки вируса (без амбер-стоп-кодона после домена димеризации), или продуцируется ли вариабельный домен антитела преимущественно без компонента, представленного белком оболочки вируса (например, с амбер-стоп-кодоном после домена димеризации). В том случае если вариабельный домен антитела продуцируется преимущественно в виде белка, слитого с компонентом, представленным белком оболочки вируса, то одна или несколько дисульфидных связей и/или одна последовательность димеризации обеспечивают бивалентный дисплей. В случае вариабельных доменов антител, продуцируемых главным образом без слияния с компонентом, представленным белком оболочки вируса (например, амбер-стоп-кодон), предпочтительно, но необязательно, наличие домена димеризации, содержащего как остаток цистеина, так и последовательность димеризации. В некоторых вариантах осуществления тяжелые цепи F(ab)2 димеризуются в домене димеризации, не содержащем шарнирную область. Домен димеризации может содержать последовательность лейциновой молнии (например, последовательность GCN4, такую как GRMKQLEDKVEELLSKNYHLENEVARLKKLVGERG (SEQ ID NO:3)).
В некоторых вариантах осуществления полипептид по изобретению дополнительно содержит константный домен легкой цепи, слитый с вариабельным доменом легкой цепи, который в некоторых вариантах осуществления содержит по меньшей мере одну, две или три вариантных CDR. В некоторых вариантах осуществления полипептидов по изобретению полипептид содержит константный домен тяжелой цепи, слитый с вариабельным доменом тяжелой цепи, который в некоторых вариантах осуществления содержит по меньшей мере одну, две или три вариантных CDR.
В некоторых случаях может быть предпочтительной мутация каркасного остатка с получением варианта по сравнению с эталонным полипептидом или исходным антителом. Например, каркасный остаток 71 тяжелой цепи может представлять собой аминокислоту R, V или A. В другом примере каркасным остатком 93 тяжелой цепи может быть аминокислота S или A. В еще одном примере каркасным остатком 94 тяжелой цепи может быть аминокислота R, K или T или кодируемая MRT. В еще одном примере каркасным остатком 49 тяжелой цепи может быть аминокислота A или G. Каркасные остатки в легкой цепи также могут быть мутированы. Например, каркасным остатком 66 в легкой цепи может быть аминокислота R или G.
Как указано в настоящем описании вариант CDR относится к CDR с изменением последовательности по сравнению с соответствующей CDR одного эталонного полипептида/исходного антитела. Соответственно CDR одного полипептида по изобретению в некоторых вариантах осуществления могут соответствовать набору CDR одного эталонного полипептида или исходного антитела. Полипептиды по изобретению могут содержать любой один вариант или комбинации вариантов CDR. Например, полипептид по изобретению может содержать вариант CDRH1 и вариант CDRH2. Полипептид по изобретению может содержать вариант CDRH1, вариант CDRH2 и вариант CDRH3. В другом примере полипептид по изобретению может содержать вариант CDRH1, вариант CDRH2, вариант CDRH3 и вариант CDRL3. В другом примере полипептид по изобретению содержит вариант CDRL1, вариант CDRL2 и вариант CDRL3. Любой полипептид по изобретению дополнительно может содержать вариант CDRL3. Любой полипептид по изобретению дополнительно может содержать вариант CDRH3.
В одном из вариантов осуществления полипептид по изобретению содержит одну или несколько вариантных последовательностей CDR, которые изображены на фиг.7, 19 и 22. В одном из вариантов осуществления полипептид по изобретению содержит одну или несколько вариантных последовательностей CDR, которые изображены на фиг.11A. В одном из вариантов осуществления полипептид по изобретению содержит одну или несколько вариантных последовательностей CDR, которые изображены на фиг.15. В другом варианте осуществления полипептид по изобретению содержит одну или несколько вариантных последовательностей CDR, которые изображены на фиг.21A-21B. В другом варианте осуществления полипептид по изобретению содержит одну или несколько вариантных последовательностей CDR, которые изображены на фиг.24A.
Полипептиды по изобретению могут быть в комплексе друг с другом. Например, изобретение относится к комплексу полипептидов, содержащему два полипептида, при этом каждый полипептид представляет собой полипептид по изобретению, и при этом один из указанных полипептидов содержит по меньшей мере одну, две или все вариантные CDRH1, H2 и H3, а другой полипептид содержит вариантную CDR легкой цепи (например, CDRL3). Комплекс полипептидов может содержать первый и второй полипептиды (где первый и второй полипептиды представляют собой полипептиды по изобретению), при этом первый полипептид содержит по меньшей мере одну, две или три вариантных CDR легкой цепи, а второй полипептид содержит по меньшей мере одну, две или три вариантных CDR тяжелой цепи. Изобретение также относится к комплексу полипептидов, которые содержат одинаковые вариантные последовательности CDR. Комплексообразование может быть осуществлено любым подходящим способом, включая димеризацию/мультимеризацию в домене димеризации/мультимеризации, таком как домены, описанные в настоящем описании, или посредством ковалентных взаимодействий (таких, как взаимодействие посредством дисульфидной связи) (которые в некоторых ситуациях являются частью домена димеризации, например домен димеризации может содержать последовательность лейциновой молнии и цистеин).
В другом аспекте изобретение относится к композициям, содержащим полипептиды и/или полинуклеотиды по изобретению. Например, изобретение относится к композиции, содержащей множество любых полипептидов по изобретению, описанных в настоящем описании. Указанное множество может содержать полипептиды, кодируемые множеством полинуклеотидов, созданных с использованием набора олигонуклеотидов, имеющих вырожденность в последовательности, кодирующей вариант аминокислоты, при этом указанная вырожденность означает множество последовательностей кодонов ограниченного набора кодонов, кодирующих вариант аминокислоты. Композиция, содержащая полинуклеотид или полипептид, или библиотека по изобретению могут быть в виде набора или изделия производства (необязательно упакованного вместе с инструкциями, буферами и т.д.).
В одном из аспектов изобретение относится к полинуклеотиду, кодирующему полипептид по изобретению, который описан в настоящем описании. В другом аспекте изобретение относится к вектору, содержащему последовательность, кодирующую полипептид по изобретению. Вектор может представлять собой, например, реплицируемый вектор экспрессии (например, реплицируемым вектором экспрессии может быть фаг M13, fl, fd, Pf3 или его производное или лямбдоидный фаг, такой как лямбда, 21, phi80, phi81, 82, 424, 434 и т.д. или его производное). Вектор может содержать область промотора, связанную с последовательностью, кодирующей полипептид по изобретению. Промотор может быть любым, подходящим для экспрессии полипептида, например промоторная система lac Z, промотор щелочной фосфатазы pho A (Ap), промотор бактериофага lPL (чувствительный к температуре промотор), промотор tac, триптофановый промотор и промотор бактериофага T7. Таким образом, изобретение также относится к вектору, содержащему промотор, выбранный из группы, состоящей из указанных выше промоторных систем.
Полипептиды по изобретению могут быть представлены в любой подходящей форме в соответствии с необходимостью и желанием практикующего специалиста. Например, полипептид по изобретению может быть представлен на поверхности вируса, например фаговой или фагмидной вирусной частице. Соответственно, изобретение относится к вирусным частицам, содержащим полипептид по изобретению и/или полинуклеотид, кодирующий полипептид по изобретению.
В одном из аспектов изобретение относится к популяции, содержащей множество полипептидов или полинуклеотидов по изобретению, в которой каждый тип полипептида или полинуклеотида представляет собой полипептид или полинуклеотид по изобретению, который описан в настоящем описании.
В некоторых вариантах осуществления полипептиды и/или полинуклеотиды предлагаются в виде библиотеки, например библиотеки, содержащей множество, состоящее по меньшей мере примерно из 1×104, 1×105, 1×106, 1×107, 1×108 отдельных полипептидных и/или полинуклеотидных последовательностей по изобретению. В другом аспекте изобретение также относится к библиотеке, содержащей множество вирусов или вирусных частиц по изобретению, при этом на каждом вирусе или вирусной частице представлен полипептид по изобретению. Библиотека по изобретению может содержать вирусы или вирусные частицы, на которых представлено любое количество различных полипептидов (последовательностей), например, по меньшей мере примерно 1×104, 1×105, 1×106, 1×107, 1×108 различных полипептидов.
В другом аспекте изобретение относится к клеткам-хозяевам, содержащим полинуклеотид или вектор, содержащий последовательность, кодирующую полипептид по изобретению.
В другом аспекте изобретение относится к способам селекции высокоаффинных агентов, связывающих конкретные антигены-мишени. В некоторых таких вариантах конкретные антигены-мишени включают без ограничения HER2 или DR5.
Способы по изобретению обеспечивают популяции полипептидов (например, библиотеки полипептидов (например, вариабельных доменов антител)) с одной или несколькими областями CDR, разнообразие которых повышено. Такие библиотеки подвергают сортировке (селекции) и/или скринингу для идентификации высокоаффинных агентов, связывающих антиген-мишень. В одном из аспектов полипептидные связывающие агенты библиотеки отбирают в отношении связывания с антигенами-мишенями и в отношении аффинности. Полипептидные связывающие агенты, отобранные с использованием одного или нескольких из таких способов селекции, затем можно подвергнуть скринингу на аффинность и/или специфичность (связывание только с антигеном-мишенью, но не с антигенами, отличными от антигена-мишени).
В одном из аспектов способ по изобретению включает создание множества полипептидов с одной или несколькими измененными областями CDR, сортировку множества полипептидов в отношении агентов, связывающих антиген-мишень, посредством осуществления контакта множества полипептидов с антигеном-мишенью в условиях, подходящих для связывания; отделение агентов, связывающих антиген-мишень, от несвязывающих агентов; выделение связывающих агентов; и идентификацию высокоаффинных связывающих агентов (или любых связывающих агентов, имеющих требуемую аффинность связывания). Аффинность связывающих агентов, которые связываются с антигеном-мишенью, можно определить с использованием различных способов, известных в данной области, например конкурентным ELISA, который описан в настоящем описании. Необязательно полипептиды могут быть слиты с полипептидной меткой, такой как gD, поли-his или FLAG, которые могут быть использованы для сортировки связывающих агентов в комбинации с сортировкой в отношении антигена-мишени.
В другом варианте осуществления изобретение относится к способу выделения или селекции вариабельного домена антитела, который связывается с антигеном-мишенью, из библиотеки вариабельных доменов антител, при этом указанный способ включает: a) осуществление контакта популяции, содержащей множество полипептидов по изобретению, с иммобилизованным антигеном-мишенью в условиях, подходящих для связывания, чтобы выделить полипептидные агенты, связывающие антиген-мишень; b) отделение полипептидных связывающих агентов от несвязывающих агентов и элюирование связывающих агентов с антигена-мишени; c) необязательно повторение стадий a-b по меньшей мере один раз (в некоторых вариантах осуществления по меньшей мере дважды).
В некоторых вариантах осуществления способ дополнительно может включать: d) инкубацию полипептидных связывающих агентов с меченым антигеном-мишенью в диапазоне концентраций от 0,1 нМ до 1000 нМ в условиях, подходящих для связывания, с образованием смеси; e) осуществление контакта смеси с иммобилизованным агентом, который связывается с меткой на антигене-мишени; f) элюирование полипептидных связывающих агентов с меченого антигена-мишени; g) необязательно повторение стадий d)-f) по меньшей мере один раз (в некоторых вариантах осуществления по меньшей мере дважды), каждый раз последовательно используя более низкую концентрацию меченого антигена-мишени. Необязательно, способ может включать добавление к смеси избытка немеченого антигена-мишени и инкубацию в течение периода времени, достаточного для элюирования низкоаффинных связывающих агентов с меченого антигена-мишени.
В другом аспекте изобретение относится к способу выделения или селекции высокоаффинных связывающих агентов (или связывающих агентов, имеющих требуемую аффинность связывания) с антигеном-мишенью. В одном из вариантов осуществления указанный способ включает: a) осуществление контакта популяции, содержащей множество полипептидов по изобретению, с антигеном-мишенью, при этом антиген находится в диапазоне концентраций примерно от 0,1 нМ до 1000 нМ, чтобы выделить полипептидные агенты, связывающие антиген-мишень; b) отделение полипептидных связывающих агентов от антигена-мишени; c) необязательно, повторение стадий a-b по меньшей мере один раз (в некоторых вариантах осуществления по меньшей мере дважды), при этом каждый раз последовательно с более низкой концентрацией антигена-мишени, чтобы выделить полипептидные связывающие агенты, которые связываются с антигеном-мишенью с наиболее низкой концентрацией; d) отбор полипептидного связывающего агента, который связывается с антигеном-мишенью в самой низкой концентрации, в отношении высокой аффинности (или любой требуемой аффинности) посредством инкубации полипептидных связывающих агентов с несколькими разными разведениями антигена-мишени и определения IC50 полипептидного связывающего агента; и e) идентификацию полипептидного связывающего агента, который имеет требуемую аффинность по отношению к антигену-мишени. Указанная аффинность может составлять, например, примерно от 0,1 нМ до 200 нМ, от 0,5 нМ до 150 нМ, от 1 нМ до 100 нМ и/или от 25 нМ до 75 нМ.
В другом из вариантов осуществления изобретение относится к анализу для выделения или селекции полипептидных связывающих агентов, включающему (a) осуществление контакта популяции, содержащей множество полипептидов по изобретению с меченым антигеном-мишенью, при этом меченый антиген-мишень присутствует в диапазоне концентраций от 0,1 нМ до 1000 нМ, в условиях, подходящих для связывания, с образованием комплекса полипептидного связывающего агента и меченого антигена-мишени; b) выделение комплексов и отделение полипептидного связывающего агента от меченого антигена-мишени; c) необязательно, повторение стадий a-b по меньшей мере один раз, при этом каждый раз используют более низкую концентрацию антигена-мишени. Необязательно, способ дополнительно может включать осуществление контакта комплекса полипептидного связывающего агента и антигена-мишени с избытком меченого антигена-мишени. В одном из вариантов осуществления стадии способа повторяют дважды, и концентрация мишени в первом раунде селекции находится в диапазоне примерно от 100 нМ до 250 нМ, а во втором раунде селекции (если его осуществляют) находится в диапазоне примерно от 25 нМ до 100 нМ, и в третьем раунде селекции (если таковой осуществляют) - в диапазоне примерно от 0,1 нМ до 25 нМ.
Изобретение также относится к способу скрининга популяции, содержащей множество полипептидов по изобретению, при этом указанный способ включает: a) инкубацию первого образца популяции полипептидов с антигеном-мишенью в условиях, подходящих для связывания полипептидов с антигеном-мишенью; b) осуществление сходной инкубации второго образца популяции полипептидов, но в отсутствие антигена-мишени; (c) осуществление контакта первого и второго образцов с иммобилизованным антигеном-мишенью в условиях, подходящих для связывания полипептидов с иммобилизованным антигеном-мишенью; d) определение количества полипептидов, связанных с иммобилизованным антигеном-мишенью для каждого образца; e) определение аффинности конкретного полипептида по отношению к антигену-мишени посредством расчета отношения количества конкретного полипептида, которое связано в первом образце, к количеству конкретного полипептида, которое связано во втором образце.
Библиотеки, созданные как описано в настоящем описании, также могут быть подвергнуты скринингу на связывание с конкретной мишенью и на отсутствие связывания с антигеном, отличным от антигена-мишени. В одном из аспектов изобретение относится к способу скрининга полипептида, такого как вариабельный домен антитела по изобретению, который связывается с конкретным антигеном-мишенью, из библиотеки вариабельных доменов антител, при этом указанный способ включает: a) создание популяции, содержащей множество полипептидов по изобретению; b) осуществление контакта популяции полипептидов с антигеном-мишенью в условиях, подходящих для связывания; c) отделение связывающего полипептида в библиотеке от несвязывающих полипептидов; d) идентификацию специфичного для антигена-мишени связывающего полипептида посредством определения того, связывается ли связывающий полипептид с антигеном, отличным от антигена-мишени; и e) выделение специфичного для антигена-мишени связывающего полипептида. В некоторых вариантах осуществления стадия (e) заключается в элюировании связывающего полипептида с антигена-мишени и амплификации реплицируемого экспрессирующего вектора, кодирующего указанный связывающий полипептид. В некоторых вариантах осуществления проводят скрининг одной или нескольких библиотек, клонов или полипептидов против панели антигенов, включая антиген-мишень. В некоторых вариантах осуществления отбирают такие клоны или полипептиды, которые специфично связываются с антигеном-мишенью и по существу перекрестно не взаимодействуют с любым другим антигеном на панели. Панель антигенов может содержать по меньшей мере три и вплоть до 100 разных антигенов. В некоторых случаях панель антигенов содержит от 3 до 100, от 3 до 50, от 3 до 25 или от 3 до 10 разных антигенов.
Комбинации любых из описанных выше способов сортировки/селекции можно использовать вместе со способами скрининга. Например, в одном из вариантов осуществления полипептидные связывающие агенты сначала подвергают селекции на связывание с иммобилизованным антигеном-мишенью. Полипептидные связывающие агенты, которые связываются с иммобилизованным антигеном-мишенью, затем могут быть подвергнуты скринингу на связывание с антигеном-мишенью и на отсутствие связывания с антигенами, отличными от антигена-мишени. Полипептидные связывающие агенты, которые специфично связываются с антигеном-мишенью, могут быть при необходимости амплифицированы. Такие полипептидные связывающие агенты могут быть подвергнуты селекции на более высокую аффинность посредством контакта с меченым антигеном-мишенью в определенной концентрации с образованием комплекса, при этом диапазон концентраций меченого антигена-мишени составляет примерно от 0,1 нМ до примерно 1000 нМ, и комплексы выделяют посредством контакта с агентом, который связывается с меткой на антигене-мишени. Полипептидный связывающий агент затем может быть элюирован с меченого антигена-мишени, и, необязательно, раунды селекции повторяют и каждый раз используют более низкую концентрацию меченого антигена-мишени. Связывающие полипептиды, которые могут быть выделены с использованием такого способа селекции, затем могут быть подвергнуты скринингу на высокую аффинность с использованием, например, анализа ELISA в растворе, как описано, например, в примерах 2 и 4, или другими обычными способами, известными в данной области. Популяции полипептидов по изобретению, используемые в способах, предлагаемых в изобретении, могут быть представлены в любой форме, подходящей для стадий селекции/скрининга. Например, полипептиды могут находиться в свободной растворимой форме, связанными с матрицей или присутствовать на поверхности вирусной частицы, такой как фаговая или фагмидная частица. В некоторых вариантах осуществления способов по изобретению множество полипептидов кодируется множеством реплицируемых векторов, представленных в форме библиотеки. В способах селекции/скрининга, описанных в настоящем описании, векторы, кодирующие связывающий полипептид, могут быть дополнительно амплифицированы для получения достаточных количеств полипептида для применения при повторах стадий селекции/скрининга (которые, как указано выше, являются необязательными в способах по изобретению).
В одном из вариантов осуществления изобретение относится к способу отбора полипептида, который связывается с антигеном-мишенью, включающему:
a) создание композиции, содержащей множество полипептидов по изобретению, которые описаны в настоящем описании;
b) отбор полипептидного связывающего агента, который связывается с антигеном-мишенью, из композиции;
c) отделение полипептидного связывающего агента от не связывающих агентов;
d) идентификацию связывающих агентов с требуемой аффинностью среди выделенных полипептидных связывающих агентов.
В другом варианте осуществления изобретение относится к способу отбора антигенсвязывающего вариабельного домена, который связывается с антигеном-мишенью, из библиотеки вариабельных доменов антител, включающему:
a) осуществление контакта библиотеки вариабельных доменов антител по изобретению (которые описаны в настоящем описании) с антигеном-мишенью;
b) отделение связывающих агентов от несвязывающих агентов и элюирование связывающих агентов с антигена-мишени, инкубацию связывающих агентов в растворе с уменьшающимися количествами антигена-мишени в концентрации примерно от 0,1 нМ до 1000 нМ;
c) отбор связывающих агентов, которые могут связываться с антигеном-мишенью в наименьшей концентрации и которые имеют аффинность примерно от 0,1 нМ до 200 нМ.
В некоторых вариантах осуществления концентрация антигена-мишени составляет примерно от 100 до 250 нМ или примерно от 25 до 100 нМ.
В одном из вариантов осуществления изобретение относится к способу отбора полипептида, который связывается с антигеном-мишенью, из библиотеки полипептидов, включающему:
a) выделение полипептидных агентов, связывающихся с антигеном-мишенью, посредством осуществления контакта библиотеки, содержащей множество полипептидов по изобретению (которые описаны в настоящем описании), с иммобилизованным антигеном-мишенью в условиях, подходящих для связывания;
b) отделение полипептидных связывающих агентов в библиотеке от несвязывающих агентов и элюирование связывающих агентов с антигена-мишени для получения субпопуляции, обогащенной связывающими агентами; и
c) необязательно, повторение стадий a-b по меньшей мере один раз (в некоторых вариантах осуществления по меньшей мере дважды), при этом каждое повторение осуществляют с использованием субпопуляции связывающих агентов, полученных в предыдущем раунде селекции.
В некоторых вариантах осуществления способы по изобретению дополнительно включают стадии:
d) инкубации субпопуляции полипептидных связывающих агентов с меченым антигеном-мишенью в диапазоне концентраций от 0,1 нМ до 1000 нМ в условиях, подходящих для связывания, с образованием смеси;
e) осуществления контакта смеси с иммобилизованным агентом, который связывается с меткой на антигене-мишени;
f) выявления полипептидных связывающих агентов, связанных с мечеными антигенами-мишенями, и элюирования полипептидных связывающих агентов с меченого антигена-мишени;
g) необязательно, повторение стадий d)-f) по меньшей мере один раз (в некоторых вариантах осуществления по меньшей мере дважды), при этом каждое повторение осуществляют с использованием субпопуляции связывающих агентов, полученных в предыдущем раунде селекции, и с использованием более низкой концентрации меченого антигена-мишени, чем в предыдущем раунде.
В некоторых вариантах осуществления указанные способы дополнительно включают добавление к смеси избытка немеченого антигена-мишени и инкубацию в течение периода времени, достаточного для элюирования низкоаффинных связывающих агентов с меченого антигена-мишени.
В другом варианте осуществления изобретение относится к способу выделения высокоаффинных агентов, связывающих антиген-мишень, включающему:
a) осуществление контакта библиотеки, содержащей множество полипептидов по изобретению (которые описаны в настоящем описании), с антигеном-мишенью в концентрации, составляющей по меньшей мере примерно от 0,1 нМ до 1000 нМ, для выделения полипептидных агентов, связывающих антиген-мишень;
b) отделение полипептидных связывающих агентов от антигена-мишени с получением субпопуляции, обогащенной полипептидными связывающими агентами; и
c) необязательно, повторение стадий a) и b) по меньшей мере один раз (в некоторых вариантах осуществления по меньшей мере дважды), при этом каждое повторение осуществляют с использованием субпопуляции связывающих агентов, полученной в предыдущем раунде селекции, и с использованием более низкой концентрации антигена-мишени, чем в предыдущем раунде, для выделения полипептидных связывающих агентов, которые связываются с антигеном-мишенью в наиболее низкой концентрации.
В одном из аспектов изобретение относится к анализу для отбора полипептидных связывающих агентов из библиотеки, содержащей множество полипептидов по изобретению (которые описаны в настоящем описании), включающему:
a) осуществление контакта библиотеки с меченым антигеном-мишенью в диапазоне концентраций от 0,1 нМ до 1000 нМ в условиях, подходящих для связывания, с образованием комплекса полипептидного связывающего агента и меченого антигена-мишени;
b) выделение комплексов и отделение полипептидных связывающих агентов от меченого антигена-мишени с получением субпопуляции, обогащенной связывающими агентами;
c) необязательно, повторение стадий a-b по меньшей мере один раз (в некоторых вариантах осуществления по меньшей мере дважды), каждый раз с использованием субпопуляции связывающих агентов, полученной в предыдущем раунде селекции, и с использованием более низкой концентрации антигена-мишени, чем в предыдущем раунде.
В некоторых вариантах осуществления способ дополнительно включает добавление избытка немеченого антигена-мишени к комплексу полипептидного связывающего агента и антигена-мишени. В некоторых вариантах осуществления указанные выше стадии повторяют по меньшей мере один раз (в некоторых вариантах осуществления по меньшей мере дважды), и концентрация мишени в первом раунде селекции составляет примерно от 100 нМ до 250 нМ, и во втором раунде селекции - примерно от 25 нМ до 100 нМ, и в третьем раунде селекции - примерно от 0,1 нМ до 25 нМ.
В другом аспекте изобретение относится к способу скрининга библиотеки, содержащему множество полипептидов по изобретению, при этом указанный способ включает:
a) инкубацию первого образца библиотеки с антигеном-мишенью в определенной концентрации в условиях, подходящих для связывания полипептидов с антигеном-мишенью;
b) инкубацию второго образца библиотеки без антигена-мишени;
c) осуществление контакта первого и второго образцов с иммобилизованным антигеном-мишенью в условиях, подходящих для связывания полипептида с иммобилизованным антигеном-мишенью;
d) выявление полипептида, связанного с иммобилизованным антигеном-мишенью в случае каждого образца;
e) определение аффинности полипептида по отношению к антигену-мишени посредством вычисления отношения количества связанного полипептида из первого образца к количеству связанного полипептида из второго образца.
Изобретение относится к диагностическому и терапевтическому применению связывающих полипептидов по изобретению. Для диагностического применения в изобретении предлагается способ определения присутствия представляющего интерес белка, включающий воздействие на образец, в котором предполагается наличие белка, связывающего полипептид по изобретению, и регистрацию связывания связывающего полипептида с образцом. Для такого применения в изобретении предлагается набор, содержащий связывающий полипептид и инструкции по применению связывающего полипептида для выявления белка.
Кроме того, изобретение относится к выделенной нуклеиновой кислоте, кодирующей связывающий полипептид; вектору, содержащему нуклеиновую кислоту, необязательно, функционально связанную с регуляторными последовательностями, узнаваемыми клеткой-хозяином, трансформированной вектором; к клетке-хозяину, трансформированной вектором; к способу получения связывающего полипептида, включающему культивирование такой клетки-хозяина и, таким образом, экспрессии нуклеиновой кислоты, и, необязательно, выделение связывающего полипептида из культуры клеток-хозяев (например, из среды культивирования клеток-хозяев).
Изобретение также относится к композиции, содержащей связывающий полипептид по изобретению и носитель (например, фармацевтически приемлемый носитель) или разбавитель. Указанная композиция для терапевтического применения является стерильной и может быть лиофилизованной. Также изобретение относится к применению связывающего полипептида по настоящему изобретению для получения лекарственного средства для лечения состояния, описанного в настоящем описании. Композиция может дополнительно содержать второе терапевтическое средство, такое как химиотерапевтическое средство, цитотоксическое средство или антиангиогенное средство.
Кроме того, изобретение относится к способу лечения млекопитающего, включающему введение млекопитающему эффективного количества связывающего полипептида по изобретению. Млекопитающим, которого необходимо подвергнуть лечению таким способом, может быть млекопитающее, отличное от человека, например примат, подходящий для сбора данных доклинических испытаний, или грызун (например, мышь, крыса или кролик). Млекопитающее, отличное от человека, может быть здоровым (например, в токсикологических исследованиях) или может страдать от расстройства, на которое направлено лечение представляющим интерес связывающим полипептидом. В одном из вариантов осуществления млекопитающее страдает от связанного с DR5 расстройства. В другом варианте осуществления млекопитающее страдает от связанного с HER2 расстройства.
В одном из вариантов осуществления млекопитающее страдает от или у него имеется риск развития патологического ангиогенеза. В одном из конкретных вариантов осуществления расстройством является рак, выбранный из группы, состоящей из рака прямой и ободочной кишки, почечноклеточной карциномы, рака яичника, рака легкого, немелкоклеточного рака легкого (NSCLC), бронхоальвеолярной карциномы и рака поджелудочной железы. В другом варианте осуществления расстройством является заболевание, вызванное неоваскуляризацией глаза, например диабетическая слепота, ретинопатии, первичная диабетическая ретинопатия, старческая дегенерация желтого пятна и покраснение радужки. В другом варианте осуществления млекопитающее, подвергаемое лечению, страдает или для него существует риск развития отека (например, отека, связанного с опухолями головного мозга, отека, связанного с инсультом, или отека головного мозга). В другом варианте осуществления млекопитающее страдает или для него существует риск развития расстройства или болезни, выбранной из группы, состоящей из ревматоидного артрита, воспалительного заболевания кишечника, рефрактерного асцита, псориаза, саркоидоза, артериального артериосклероза, сепсиса, ожогов и пакреатита. Согласно другому варианту осуществления млекопитающее страдает или у него существует риск развития мочеполовой болезни, выбранной из группы, состоящей из поликистоза яичников (POD), эндометриоза и фиброидов матки. В одном из вариантов осуществления расстройством является заболевание, вызванное нарушением регуляции жизнеспособности клеток (например, аномальная величина гибели клеток), включая, но ими не ограничиваясь, злокачественную опухоль, расстройства иммунной системы, расстройства нервной системы и расстройства сосудистой системы. Количество связывающего полипептида по изобретению, которое вводят, будет представлять собой количество, терапевтически эффективное при лечении расстройства. В исследованиях с увеличением дозы млекопитающему можно вводить различные дозы связывающего полипептида. В другом варианте осуществления терапевтически эффективное количество связывающего полипептида вводят человеку для лечения расстройства у такого пациента.
В одном из вариантов осуществления связывающими полипептидами по настоящему изобретению, которые можно использовать для лечения опухолей, рака и других расстройств, связанных с патологическим ангиогенезом, включая воспалительные или иммунологические расстройства и/или диабет или другие связанные с инсулином расстройства, описанные в настоящем описании, являются Fab- или scFv-антитела. Соответственно, такие связывающие полипептиды можно использовать для производства лекарственного средства для лечения воспалительного или иммунного заболевания. Млекопитающего, которое страдает или для которого существует риск развития расстройства или болезни, описанной в настоящем описании, можно лечить введением второго терапевтического средства одновременно, последовательно или в комбинации с полипептидом (например, антителом) по настоящему изобретению. Следует понимать, что другие терапевтические средства, кроме второго терапевтического средства, можно вводить млекопитающему или использовать для получения лекарственного средства, необходимого при имеющихся показаниях.
Указанные полипептиды можно использовать для понимания роли совместной работы стромальных клеток хозяина в росте имплантируемых опухолей другого организма, отличного от хозяина, например на мышиных моделях, которым были имплантированы опухоли человека. Такие полипептиды могут быть использованы в способах идентификации опухолей человека, которые могут ускользать от терапевтического лечения, посредством наблюдения или мониторинга роста опухоли, имплантированной грызуну или кролику, после лечения полипептидом по настоящему изобретению. Полипептиды по настоящему изобретению также можно использовать для исследования и оценки комбинированной терапии полипептидом по настоящему изобретению и другими терапевтическими средствами. Полипептиды по настоящему изобретению можно использовать для исследования роли представляющей интерес молекулы-мишени в других заболеваниях посредством введения полипептидов животному, страдающему заболеванием или связанным заболеванием, и определения того, происходит ли ослабление одного или нескольких симптомов заболевания.
Для ясности в приведенном описании, если иное не оговорено отдельно или не следует из контекста, все номера аминокислот указаны согласно Kabat et al. (см. дополнительное уточнение в разделе «Определения» ниже).
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 изображены последовательности вариабельного домена легкой цепи и тяжелой цепи 4D5 (SEQ ID NO:1 и 2 соответственно).
На фиг.2 показана смоделированная 3-D-структура гуманизированного 4D5, показывающая остатки CDR, которые образуют непрерывные участки. Непрерывные участки образованы аминокислотными остатками 28, 29, 30, 31 и 32 в CDRL1; аминокислотными остатками 50 и 53 CDRL2; аминокислотными остатками 91, 92, 93, 94 и 96 CDRL3; аминокислотными остатками 28, 30, 31, 32, 33 в CDRH1; и аминокислотными остатками 50, 52, 53, 54, 56 и 58 в CDRH2.
На фиг.3 показана частота аминокислот (указанных однобуквенным кодом) в последовательностях CDR легкой цепи антитела человека на основе базы данных Кабата. Частота встречаемости каждой аминокислоты в конкретном положении аминокислоты показана, начиная с наиболее часто встречающейся аминокислоты в данном положении слева и продолжая направо до наиболее редко встречающейся аминокислоты. Число, указанное снизу аминокислоты, означает количество природных последовательностей из базы данных Кабата, которые имеют такую аминокислоту в данном положении.
На фиг.4 показана частота аминокислот (указанных однобуквенным кодом) в последовательностях CDR тяжелой цепи антитела человека на основе базы данных Кабата. Частота встречаемости каждой аминокислоты в конкретном положении аминокислоты показана, начиная с наиболее часто встречающейся аминокислоты в данном положении слева и продолжая направо до наиболее редко встречающейся аминокислоты. Число, указанное снизу аминокислоты, означает количество природных последовательностей из базы данных Кабата, которые имеют такую аминокислоту в данном положении. Также показаны положения аминокислот каркаса 71, 93 и 94.
Фиг.5 схематично иллюстрирует бицистронный вектор, обеспечивающий экспрессию отдельных транскриптов для дисплея F(ab)2. Подходящий промотор управляет экспрессией первого и второго цистронов. Первый цистрон кодирует последовательность сигнала секреции (malE или stII), вариабельный и константный домен легкой цепи и gD-метку. Второй цистрон кодирует сигнал секреции, последовательность, кодирующую вариабельный домен и константный домен 1 (CH1) тяжелой цепи, и цистеиновый домен димеризации и по меньшей мере часть белка оболочки вируса.
На фиг.6 изображены последовательности каркасных областей легкой и тяжелой цепей huMAb4D5-8. Цифры, указанные надстрочным/жирным шрифтом, означают положения аминокислот согласно Кабату.
На фиг.7 изображены модифицированные/вариантные последовательности каркасных областей легкой и тяжелой цепей huMAb4D5-8. Цифры, указанные надстрочным/жирным шрифтом, означают положения аминокислот согласно Кабату.
Фиг.8 иллюстрирует схему рандомизации для каждого измененного положения CDR в библиотеках YSGR-A, YSGR-B, YSGR-C и YSGR-D, которая описана в примере 1.
На фиг.9A-9D показаны мутагенные олигонуклеотиды, используемые для конструирования библиотек YSGR-A, YSGR-B, YSGR-C и YSGR-D, которые описаны в примере 3. Эквимолярная вырожденность ДНК представлена наборами кодонов (W=A/T, K=G/T, M=A/C, N=A/C/G/T, R=A/G, S=G/C, Y=T/C). Наборы кодонов представлены IUB-кодом. Обозначение «XXX» в олигонуклеотидах H3-A6-H3-A17 означает Tyr/Ser/Gly-кодирующие кодоны в молярном соотношении 50/25/25 соответственно. Обозначение «XXX» в олигонуклеотидах H3-B6-H3-B17 означает Tyr/Ser/Arg-кодирующие кодоны в молярном соотношении 25/50/25 соответственно. Обозначение «XXX» в олигонуклеотидах H3-C6-H3-C17 означает Tyr/Ser/Gly/Arg-кодирующие кодоны в молярном соотношении 38/25/25/12 соответственно. Обозначение «XXX» в олигонуклеотидах H3-D6 - H3-D17 означает кодоны, кодирующие Tyr/Ser/Gly/Arg/Ala/Asp/Glu/Phe/His/Ile/Lys/Leu/Met/Asn/Pro/Gln/Thr/Val/Trp в молярном соотношении 20/26/26/13/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1 соответственно.
На фиг.10 показана степень обогащения библиотеки YSGR-A-D после 5 раундов селекции против DR5 человека или HER-2 человека, как описано в примере 2. Значения показаны в виде X/Y, где X означает количество уникальных клонов, а Y означает количество клонов, которые специфично связываются с DR5 человека или HER-2 человека. Специфичные клоны идентифицированы как клоны, проявляющие связывание с DR5 человека или с HER-2 человека, которое по меньшей мере в десять раз выше (на основании сигнала в ELISA, регистрируемого при 450 нм), чем связывание с бычьим сывороточным альбумином (БСА).
На фиг.11A показаны последовательности CDRH1, CDRH2, CDRH3 и CDRL3 для 106 клонов, которые связываются с HER-2 человека. На фиг.11B показаны результаты анализов ELISA для каждого из клонов, указанных на фиг.11A. Цифрами, приведенными жирным шрифтом, показано сильное связывание (сигнал от 2 до 10).
На фиг.12 показаны аминокислотные последовательности CDRL3, CDRH1, CDRH2 и CDRH3 из специфичных связывающих агентов к HER-2 человека с короткими (например, 6-7 остатков) областями CDRH3, выделенных из библиотеки YSGR-A-D, как описано в примере 2. Консенсусные последовательности показаны для CDRL3, CDRH1 и CDRH2. (Номера клонов соответствуют номерам, указанным на фиг.11).
На фиг.13 показаны аминокислотные последовательности CDRH1, CDRH2 и CDRH3 из специфичных связывающих агентов к HER-2 человека с CDRH3, имеющими 8 аминокислот, выделенных из библиотеки YSGR-A-D, как описано в примере 2. Консенсусные последовательности показаны для CDRH1, CDRH2 и CDRH3. (Номера клонов 1-19 соответствовали следующим номерам клонов, показанных на фиг.11: 17, 97, 18, 19, 98, 99, 100, 20, 21, 22, 23, 24, 101, 102, 25, 103, 26, 27 и 28 соответственно).
На фиг.14 показаны аминокислотные последовательности CDRH1, CDRH2 и CDRH3 из специфичных связывающих агентов к HER-2 человека с областями CDRH3 средней длины (например, около 12-14 аминокислот), выделенных из библиотеки YSGR-A-D, как описано в примере 2. Консенсусные последовательности показаны для CDRH1, CDRH2 и CDRH3. Консенсусную последовательность определяли для CDRH3 сдвигом некоторых последовательностей CDRH3 на две аминокислоты так, чтобы последовательность CDRH3 начиналась в положении 97, а не в положении 95.
На фиг.15 показаны последовательности CDRL3, CDRH1, CDRH2 и CDRH3 связывающих агентов к DR5 человека и IC50 для некоторых связывающих агентов к DR5 человека.
На фиг.16 показаны аминокислотные последовательности CDRL3, CDRH1, CDRH2 и CDRH3 специфичных связывающих агентов к DR5 человека, выделенных из библиотеки YSGR-A-D, как описано в примере 2. Показаны IC50 клонов для связывания с DR5 человека. Также идентифицированы клоны, которые перекрестно взаимодействуют с мышиным DR5. Консенсусные последовательности показаны для CDRL3, CDRH1, CDRH2 и CDRH3. (Номера клонов 1-11 соответствовали номерам клонов 10, 11, 12, 8, 7, 13, 5, 9, 6, 15 и 14, показанных на фиг.15).
На фиг.17 показаны кривые связывания для специфичных связывающих агентов к DR5 человека, выделенных из библиотеки YSGR-A-D. Некоторые специфичные связывающие агенты также связываются с мышиным DR-5.
На фиг.18 показана 3D-модель, изображающая места, в которых лиганд Apo-2L, антитело YSD1 и антитело BFD1 связываются с рецептором DR5. Области связывания антител перекрываются друг с другом. Участок связывания таких антител отличается от большинства остатков участка связывания лиганда Apo-2L.
На фиг.19A и 19B показана схема рандомизации для каждого измененного положения CDR в бинарной библиотеке H3 (SAH3, SCH3, SFH3, SGH3, SIH3, SLH3, SNH3, SPH3, SRH3, STH3, SWH3 и SYH3), как описано в примере 4. Указанные положения аминокислот пронумерованы согласно Кабату.
На фиг.20A-20L показаны мутагенные олигонуклеотиды, используемые для конструирования бинарной библиотеки H3 (SAH3 (фиг.20A), SCH3 (фиг.20B), SFH3 (фиг.20C), SGH3 (фиг.20D), SIH3 (фиг.20E), SLH3 (фиг.20F), SNH3 (фиг.20G), SPH3 (фиг.20H), SRH3 (фиг.20I), STH3 (фиг.20J), SWH3 (фиг.20K) и SYH3 (фиг.20L)), как описано в примере 4 (SEQ ID NO:618-788). Эквимолярная вырожденность ДНК представлена наборами кодонов (W=A/T, K=G/T, M=A/C, N=A/C/G/T, R=A/G, S=G/C, Y=T/C). Наборы кодонов представлены кодом IUB.
На фиг.21A показаны аминокислотные последовательности CDRL3, CDRH1, CDRH2 и CDRH3 специфичных связывающих агентов к HER2, выделенных из объединенной бинарной библиотеки H3 (SXH3), как описано в примере 5 (SEQ ID NO:789-896). На фиг.21B показаны результаты анализов ELISA для каждого из клонов, указанных на фиг.21A. Темная штриховка указывает сильное связывание (сигнал от 2 до 10).
На фиг.22 показана схема рандомизации для каждого измененного положения CDR в бинарных поверхностных библиотеках (SY, SW, SR и SF), как описано в примере 6. Указанные положения аминокислот пронумерованы согласно Кабату.
На фиг.23 показаны мутагенные олигонуклеотиды, используемые для конструирования некоторых бинарных поверхностных библиотек (SW, SR и SF), которые описаны в примере 6 (SEQ ID NO:1005-1013). Эквимолярная вырожденность ДНК представлена наборами кодонов (W=A/T, K=G/T, M=A/C, N=A/C/G/T, R=A/G, S=G/C, Y=T/C). Наборы кодонов представлены кодом IUB.
На фиг.24A показаны аминокислотные последовательности CDRL3, CDRH1, CDRH2 и CDRH3 специфичных связывающих агентов к HER2, выделенных из объединенной поверхностной бинарной библиотеки (SX-поверхностная), которые описаны в примере 8 (SEQ ID NO:897-1004). На фиг.24B показаны результаты анализов ELISA для каждого из клонов, указанных на фиг.24A. Темная штриховка показывает сильное связывание (сигнал от 2 до 10), а светлая штриховка показывает слабое связывание (сигнал от 0,25 до 2).
На фиг.25 графически изображена специфичность Fab, содержащих разные бинарные комбинации аминокислот (Ser:Tyr, Ser:Trp, Ser:Arg или Ser:Phe), полученные из бинарной библиотеки SXH3 или бинарной SX-поверхностной библиотеки.
На фиг.26A и B изображены анализы связывания, основанные на резонансе поверхностного плазмона, растворимых белков Fab из трех HER2-связывающих клонов (клон B11, клон G54 и клон YSGR-A-42) с иммобилизованным HER2. Клон B11 имел ka 1,9×106 М-1сек-1, kd 1,7×10-3 сек-1 и KD 890 пМ. Клон G54 имел ka 2,0×105 М-1сек-1, kd 2,2×10-3 сек-1 и KD 11 нМ. Клон YSGR-A-42 имел ka 2,7×106 М-1сек-1, kd 1,5×10-3 сек-1 и KD 570 пМ.
На фиг.27 показаны результаты проточно-цитометрических анализов связывания анти-HER2-fab, выделенных из библиотеки YSGR (клон A-42), SX-поверхностной библиотеки (клоны G37 и G54) и библиотеки SXH3 (клон B11), с клетками NR6 или H2NR6-4D5, которые описаны в примере 7.
На фиг.28 показаны последовательности CDRH1, CDRH2, CDRH3 и CDRL3 для каждого HER2-связывающего IgG B11, G37, G54, YSGR-A-42, YSGR-A-27, B27, G43 и YSGR-D-104. На фиг.28 также показаны значения IC50 для Fab-варианта каждого клона.
На фиг.29 показаны результаты анализов конкурентного связывания, описанных в примере 7, для определения способности каждого из указанных HER2-специфичных IgG конкурировать за связывание с HER2 с омнитаргом, герцептином и каждым из других IgG.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение относится к новым, нетрадиционным, в значительной степени упрощенным и гибким способам повышения разнообразия последовательностей CDR (включая последовательности вариабельных доменов антител) и библиотекам, содержащим многообразие, как правило, огромное многообразие, измененных CDR (включая последовательности вариабельных доменов антител). Такие библиотеки обеспечивают комбинаторные библиотеки, применимые, например, для селекции и/или скрининга клонов синтетических антител с требуемыми активностями, такими как аффинность связывания и авидность. Такие библиотеки можно использовать для идентификации полипептидных последовательностей иммуноглобулинов, которые способны взаимодействовать с любым из широкого множества антигенов-мишеней. Например, библиотеки, содержащие измененные полипептиды иммуноглобулинов по изобретению, экспрессированные в виде фагового дисплея, особенно применимы и обеспечивают высокопроизводительные, эффективные и автоматизируемые системы селекции и/или скрининга в отношении представляющих интерес антигенсвязывающих молекул. Способы по изобретению предназначены для получения высокоаффинных агентов, связывающих антигены-мишени, с минимальными изменениями в исходной или матричной молекуле и дают хорошие выходы продукции в том случае, когда антитело или антигенсвязывающие фрагменты продуцируются в культуре клеток.
Способы и композиции по изобретению обеспечивают многочисленные дополнительные преимущества. Например, могут быть созданы относительно простые варианты последовательностей CDR с использованием наборов кодонов, кодирующих ограниченное количество аминокислот (в отличие от обычного способа использования наборов кодонов, кодирующих максимальное количество аминокислот), сохраняя при этом достаточное разнообразие уникальных связывающих мишень последовательностей. Упрощенная природа (и, в общем, относительно меньший размер) популяций последовательностей, созданных по изобретению, позволяет дополнительно повышать разнообразие после того, как было выявлено, что популяция или ее субпопуляция обладает требуемыми свойствами.
Упрощенная природа последовательностей связывающих антигены-мишени агентов, полученных способами по изобретению, оставляет значительно большую возможность для дополнительных индивидуальных модификаций последовательностей, чтобы достичь требуемых результатов. Например, такие модификации последовательностей обычно осуществляют в процессе созревания аффинности, гуманизации и т.д. В случае когда повышение разнообразия основано на ограниченных наборах кодонов, которые кодируют только ограниченное количество аминокислот, можно в качестве мишеней выбирать разные эпитопы, используя разные ограниченные наборы кодонов, тем самым обеспечивая специалисту больший контроль способа повышения разнообразия по сравнению с рандомизацией, основанной на максимальном количестве аминокислот. Дополнительное преимущество использования ограниченных наборов кодонов состоит в том, что нежелательные аминокислоты могут быть исключены из процесса, например метионин или стоп-кодоны, таким образом улучшая общее качество и продуктивность библиотеки. Кроме того, в некоторых случаях может быть желательным ограничение конформационного разнообразия потенциальных связывающих агентов. Способы и композиции по изобретению обеспечивают гибкость при достижении такой цели. Например, присутствие некоторых аминокислот, таких как тирозин, в последовательности приводит к меньшим ротационным конформационным изменениям.
ОПРЕДЕЛЕНИЯ
Аминокислоты в настоящем описании обозначены либо однобуквенным кодом, либо в виде трехбуквенного кода, или и тем и другим кодом.
Термин «аффинная очистка» означает очистку молекулы, основанную на специфичном притяжении или связывании молекулы с химическим или связывающим партнером с образованием комбинации или комплекса, который позволяет отделять молекулу от примесей, сохраняя ее при этом связанной или притянутой к остатку, являющемуся партнером.
Термин «антитело» используют в самом широком смысле, и термин специально охватывает отдельные моноклональные антитела (включая агонистические и антагонистические антитела), композиции антител с полиэпитопной специфичностью, антитела со зрелой аффинностью, гуманизированные антитела, химерные антитела, а также антигенсвязывающие фрагменты (например, Fab, F(ab')2, scFv и Fv), при условии что они проявляют требуемую биологическую активность. В одном из вариантов осуществления термин «антитело» также включает антитела человека. В используемом в настоящем описании смысле «вариабельный домен антитела» относится к частям легких и тяжелых цепей молекул антител, которые содержат аминокислотные последовательности определяющих комплементарность областей (CDR; т.е. CDR1, CDR2 и CDR3) и каркасные области (FR). VH относится к вариабельному домену тяжелой цепи. VL относится к вариабельному домену легкой цепи. В случае композиций и способов, применяемых в настоящем изобретении, положения аминокислот, относящиеся к CDR и FR, могут быть определены согласно Кабату (Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md., 1987 и 1991)). Нумерация антител или антигенсвязывающих фрагментов также соответствует нумерации, предложенной Кабатом.
В используемом в настоящем описании смысле термин «определяющие комплементарность области» (CDR; т.е. CDR1, CDR2 и CDR3) относится к аминокислотным остаткам вариабельного домена антитела, присутствие которых необходимо для связывания антигена. Каждый вариабельный домен обычно имеет три области CDR, называемые CDR1, CDR2 и CDR3. Каждая определяющая комплементарность область может содержать аминокислотные остатки из «определяющей комплементарность области», которая определена Кабатом (т.е. примерно остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из «гипервариабельной петли» (т.е. примерно остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). В некоторых случаях определяющая комплементарность область может содержать аминокислоты как из области CDR, определенной согласно Кабату, так и из гипервариабельной петли. Например, CDRH1 тяжелой цепи антитела 4D5 содержит аминокислоты 26-35. Консенсусная последовательность CDRL1 (согласно определению Кабата) в антителе 4D5 представляет собой R-A-S-Q-D-V-N-T-A-V-A (SEQ ID NO:29). Консенсусная последовательность CDRL2 (согласно определению Кабата) в антителе 4D5 представляет собой S-A-S-S-L-Y-S (SEQ ID NO:30).
«Каркасные области» (в дальнейшем «FR») представляют собой другие остатки вариабельного домена, отличные от остатков CDR. Каждый вариабельный домен обычно имеет четыре FR, называемые FR1, FR2, FR3 и FR4. Если CDR определяют согласно Кабату, то остатки FR легкой цепи расположены примерно в положениях остатков 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) и 98-107 (LCFR4), а остатки FR тяжелой цепи расположены примерно в положениях остатков 1-30 (HCFR1), 36-49 (HCFR2), 66-94 (HCFR3) и 103-113 (HCFR4) тяжелой цепи. Если CDR содержат аминокислотные остатки из гипервариабельной петли, то остатки FR легкой цепи расположены примерно в положениях остатков 1-25 (LCFR1), 33-49 (LCFR2), 53-90 (LCFR3) и 97-107 (LCFR4) в легкой цепи, а остатки FR тяжелой цепи расположены примерно в положениях остатков 1-25 (HCFR1), 33-52 (HCFR2), 56-95 (HCFR3) и 102-113 (HCFR4) в тяжелой цепи. В некоторых случаях, когда CDR содержит аминокислоты и из CDR, которые определены Кабатом, и из гипервариабельной петли, остатки FR могут быть соответственно скорректированы. Например, когда CDRH1 содержит аминокислоты H26-H35, остатки FR1 тяжелой цепи находятся в положениях 1-25, а остатки FR2 находятся в положениях 36-49.
В используемом в настоящем описании смысле «набор кодонов» относится к набору разных триплетных нуклеотидных последовательностей, используемых для кодирования требуемых вариантов аминокислот. Набор олигонуклеотидов может быть синтезирован, например, посредством твердофазного синтеза, включая последовательности, которые представляют все возможные комбинации нуклеотидных триплетов, которые дает набор кодонов и которые будут кодировать требуемую группу аминокислот. Стандартной формой обозначения кодонов является форма кода IUB, который известен в данной области и описан в настоящем описании. Набор кодонов обычно представляют 3 заглавными буквами курсивом, например, NNK, NNS, XYZ, DVK и тому подобные. Синтез олигонуклеотидов с выбранной «вырожденностью» нуклеотидов в определенных положениях хорошо известен в данной области, например способ TRIM (Knappek et al., J. Mol. Biol. (1999), 296: 57-86); Garrard and Henner, Gene (1993), 128:103). Такие наборы олигонуклеотидов, имеющих определенные наборы кодонов, могут быть синтезированы с использованием коммерческих синтезаторов нуклеиновых кислот (доступных, например, из Applied Biosystems, Foster City, CA) или могут быть получены коммерчески (например, из Life Technologies, Rockville, MD). Поэтому набор синтезированных олигонуклеотидов, имеющих конкретный набор кодонов, обычно будет содержать множество олигонуклеотидов с разными последовательностями, при этом различие определяется набором кодонов в общей последовательности. Олигонуклеотиды, которые используют по изобретению, имеют последовательности, которые обеспечивают гибридизацию с матричной нуклеиновой кислотой вариабельного домена, а также могут, но необязательно, содержать сайты для ферментов рестрикции, применимые, например, в целях клонирования.
Термин «ограниченный набор кодонов» и его варианты в используемом в настоящем описании смысле относится к набору кодонов, который кодирует намного более ограниченное количество аминокислот, чем наборы кодонов, обычно используемые в данной области в способах создания разнообразия последовательностей. В одном из аспектов изобретения ограниченные наборы кодонов, используемые для повышения разнообразия последовательностей, кодируют от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 4 или только 2 аминокислоты. В некоторых вариантах осуществления ограниченный набор кодонов, используемый для повышения разнообразия последовательностей, кодирует по меньшей мере 2, или 10 или меньше, 8 или меньше, 6 или меньше, 4 или меньше аминокислот. В типичном примере используют тетраномиальный набор кодонов. Примеры тетраномиальных наборов кодонов включают RMC, RMG, RRC, RSA, MKC, YMT, RST, KMT, SRC, MRT и WMT, которые известны в данной области. В другом типичном примере используют биномиальный набор кодонов. Примеры биномиальных наборов кодонов включают TMT, KAT, YAC, WAC, TWC, TYT, YTC, WTC, KTT, YCT, MCG, SCG, MGC, SGT, GRT, GKT и GYT. Определение подходящих ограниченных кодонов и идентификация конкретных аминокислот, кодируемых конкретных ограниченным кодоном, хорошо известны и будут очевидны для специалиста в данной области. Определение подходящих наборов аминокислот, используемых для повышения разнообразия последовательности CDR, может быть эмпирическим и/или осуществляемым в соответствии с критериями, известными в данной области (например, включение комбинации гидрофобных и гидрофильных типов аминокислот и т.д.).
Фрагмент «Fv» является фрагментом антитела, который содержит полный сайт узнавания и связывания антигена. Такая область состоит из димера вариабельного домена тяжелой цепи и легкой цепи в тесной ассоциации, которая может быть ковалентной по природе, например, в scFv. В такой конфигурации три CDR каждого вариабельного домена взаимодействуют, определяя участок связывания антигена на поверхности димера VH-VL. Вместе шесть CDR или их подгруппа придают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных по отношению к антигену) обладает способностью узнавать и связывать антиген, хотя обычно с более низкой аффинностью, чем полный участок связывания.
Фрагмент «Fab» содержит вариабельный и константный домены легкой цепи и вариабельный домен и первый константный домен (CH1) тяжелой цепи. F(ab')2-фрагменты антитела содержат пару Fab-фрагментов, которые обычно ковалентно связаны вблизи карбоксильных концов расположенными между ними шарнирными цистеинами. Другие химические связи фрагментов антител также известны в данной области.
«Одноцепочечные Fv» или «scFv» фрагменты антител содержат VH- и VL-домены антитела, при этом такие домены присутствуют в одной полипептидной цепи. Обычно Fv-полипептид дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать структуру, необходимую для связывания антигена. Обзор, посвященный scFv, смотри в Pluckthun in The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, p. 269-315 (1994).
Термин «диантитела» относится к небольшим фрагментам антител с двумя участками связывания антигенов, и такие фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH и VL). Используя линкер, который является слишком коротким, чтобы обеспечить спаривание между двумя доменами на одной и той же цепи, домены заставляют образовывать пару с комплементарными доменами другой цепи и создавать два участка связывания антигена. Диантитела более полно описаны, например, в EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
Выражение «линейные антитела» относится к антителам, описанным в Zapata et al., Protein Eng., 8(10):1057-1062 (1995). Коротко, такие антитела содержат пару тандемных участков Fd (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифичными или моноспецифичными.
Термин «моноклональное антитело» в используемом в настоящем описании смысле относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Кроме того, в отличие от традиционных препаратов (поликлональных) антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене.
Определение «моноклональное» указывает на характер антитела как антитела, полученного по существу из гомогенной популяции антител, и его не следует толковать как требование получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые по настоящему изобретению, могут быть получены способом, основанным на гибридомах, впервые описанным в Kohler et al., Nature 256:495 (1975), или могут быть получены способами, основанными на рекомбинантной ДНК (смотри, например, патент США No. 4816567). «Моноклональные антитела» также могут быть выделены из фаговых библиотек антител с использованием способа, описанного, например, в Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991).
Моноклональные антитела по изобретению конкретно включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида или относящихся к конкретному классу или подклассу антител, при этом остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии что они проявляют требуемую биологическую активность (патент США No. 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Гуманизированные» формы антител животных, отличных от человека (например, мышей), представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. Главным образом гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области вида, отличного от человека (донорного антитела), такого как мышь, крыса, кролик или отличный от человека примат, обладающей требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области Fv (FR) иммуноглобулина человека заменяют соответствующими остатками вида, отличного от человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или в донорном антителе. Такие модификации получают для того, чтобы дополнительно повысить эффективность антитела. В общем, гуманизированное антитело будет содержать по существу все, по меньшей мере один и обычно два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям иммуноглобулина вида, отличного от человека, и все или по существу все области FR являются областями последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Более подробное описание смотри в Jones et al., Nature 321:522-525 (1986); Riechmann et al. Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
«Зависимым от вида антителом» является антитело, которое имеет более высокую аффинность связывания в случае антигена первого вида млекопитающего, чем в случае гомолога данного антигена второго вида млекопитающего. Обычно зависимое от вида антитело «специфично связывается» с антигеном человека (т.е. имеет значение аффинности связывания (Kd) не более чем примерно 1×10-7 М, например не более чем примерно 1×10-8 М, и в качестве следующего примера не более чем примерно 1×10-9 М), но имеет аффинность связывания с гомологом антигена от второго вида млекопитающего, отличного от человека, которая составляет по меньшей мере примерно в 50 раз, или по меньшей мере примерно в 500 раз, или по меньшей мере примерно в 1000 раз слабее, чем его аффинность связывания с антигеном человека. Зависимым от вида антителом может быть любое из различных типов антител, которые определены выше, но предпочтительно является гуманизированным антителом или антителом человека.
В используемом в настоящем описании смысле «мутант антитела» или «вариант антитела» относится к варианту аминокислотной последовательности зависимого от вида антитела, в котором один или несколько аминокислотных остатков зависимого от вида антитела были модифицированы. Такие мутанты необязательно имеют менее чем 100% идентичность или сходство последовательностей с зависимым от вида антителом. В одном из вариантов осуществления мутант антитела будет иметь аминокислотную последовательность, имеющую по меньшей мере 75% идентичность или сходство аминокислотной последовательности с аминокислотными последовательностями вариабельного домена либо тяжелой, либо легкой цепи зависимого от вида антитела, например по меньшей мере 80%, например по меньшей мере 85%, например по меньшей мере 90% и например по меньшей мере 95%. Идентичность или сходство по последовательности определяют в виде процентного содержания аминокислотных остатков в выбранной для исследования последовательности, которые являются идентичными (т.е. такими же остатками) или сходными (т.е. аминокислотный остаток из той же самой группы на основании общих свойств боковых цепей, смотри ниже) с остатками зависимого от вида антитела после выравнивания последовательностей и введения пробелов, если таковые необходимы, чтобы достичь максимального процента идентичности последовательностей. Ни одно из N-концевых, C-концевых или внутренних удлинений, делеций или инсерций в последовательности антитела вне вариабельного домена не следует считать влияющими на идентичность или сходство последовательностей.
«Выделенным» антителом является антитело, которое было идентифицировано и отделено и/или выделено из компонентов его природного окружения. Примесные компоненты его природного окружения представляют собой вещества, которые могут мешать диагностическим или терапевтическим применениям антитела и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах осуществления антитело будет очищено (1) более чем до 95% мас. антитела, определяемого способом Лоури, например более чем до 99% мас., (2) в степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом, или (3) до гомогенности с помощью SDS-ПААГ в восстанавливающих или невосстанавливающих условиях с использованием Кумасси синего или предпочтительно окраски серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, так как по меньшей мере один компонент из природного окружения антитела не будет присутствовать. Однако обычно выделенное антитело будет получено по меньшей мере на одной стадии очистки.
Термин «антагонист» используют в наиболее широком смысле, и термин включает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует одну или несколько биологических активностей молекул-мишеней, описанных в настоящем описании (например, DR5 или HER-2), in vitro, in situ или in vivo. Примеры таких биологических активностей DR5 включают связывание Apo2L/TRAIL с DR5, индукцию апоптоза, а также активности, дополнительно описанные в литературе. Примеры таких биологических активностей HER-2 включают связывание лигандов, таких как херегулины, фосфорилирование тирозина HER-2, индукцию пролиферации, а также апоптоз, а также другие, о которых дополнительно сообщалось в литературе. Антагонист может функционировать прямым и непрямым способом. Например, антагонист может функционировать, частично или полностью блокируя, ингибируя или нейтрализуя одну или несколько биологических активностей лиганда молекулы-мишени in vitro, in situ или in vivo в результате его прямого связывания с молекулой-мишенью. Антагонист также может функционировать опосредованно, частично или полностью блокируя, ингибируя или нейтрализуя одну или несколько биологических активностей молекулы-мишени in vitro, in situ или in vivo в результате, например, блокирования или ингибирования другой эффекторной молекулы. Молекула антагониста может обладать активностью «двойного» антагониста, при этом молекула способна частично или полностью блокировать, ингибировать или нейтрализовать биологическую активность молекулы-мишени.
Термин «агонист» используют в наиболее широком смысле, и термин охватывает любую молекулу, которая частично или полностью усиливает, стимулирует или активирует одну или несколько биологических активностей молекулы-мишени, описанной в настоящем описании (например, DR5 или HER-2), in vitro, in situ или in vivo. Примеры таких биологических активностей DR5 включают связывание Apo-2L и апоптоз, а также активности, дополнительно описанные в литературе. Примеры таких биологических активностей HER-2 включают связывание лигандов, таких как херегулины, фосфорилирование тирозина рецептора, индукцию пролиферации, а также апоптоз, а также активности, дополнительно описанные в литературе. Агонист может функционировать прямым или непрямым способом. Например, агонист может функционировать, частично или полностью усиливая, стимулируя или активируя одну или несколько биологических активностей молекулы-мишени in vitro, in situ или in vivo в результате его прямого связывания с молекулой-мишенью, которое вызывает активацию рецептора или трансдукцию сигнала. Агонист также может функционировать опосредованно, частично или полностью усиливая, стимулируя или активируя одну или несколько биологических активностей молекулы-мишени in vitro, in situ или in vivo в результате, например, стимуляции другой эффекторной молекулы, которая затем вызывает активацию молекулы-мишени или трансдукцию сигнала. Предполагается, что агонист может действовать в качестве молекулы-усилителя, которая функционирует опосредованно, усиливая или увеличивая активацию или активность молекулы-мишени. Например, агонист может усиливать активность эндогенного Apo-2L у млекопитающего. Это можно осуществить, например, посредством предварительного образования комплекса DR5 или посредством стабилизации комплексов соответствующего лиганда с рецептором DR5.
Термины «клетка», «линия клеток» и «культура клеток» используют в настоящем описании взаимозаменяемо, и такие определения включают все потомство клетки или линии клеток. Таким образом, например, термины, подобные терминам «трансформанты» и «трансформированные клетки», включают первичную рассматриваемую клетку и культуры, полученные из такой клетки, независимо от количества переносов. Также понятно, что все потомство может быть неточно идентичным по содержанию ДНК вследствие преднамеренных или случайных мутаций. Включено мутантное потомство, которое имеет такую же функцию или биологическую активность, которая обнаружена при скрининге для исходной трансформированной клетки. Там, где подразумеваются другие определения, будет ясно из контекста.
«Регуляторные последовательности» по отношению к экспрессии означают последовательности ДНК, необходимые для экспрессии функционально связанной кодирующей последовательности в организме конкретного хозяина. Регуляторные последовательности, которые подходят для прокариот, например, включают промотор, необязательно последовательность оператора, сайт связывания рибосомы и возможно другие, еще плохо понятные последовательности. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Термин «белок оболочки» означает белок, по меньшей мере часть которого присутствует на поверхности вирусной частицы. Исходя из функциональной концепции белком оболочки является любой белок, который связывается с вирусной частицей в ходе процесса сборки вируса в клетке-хозяине и остается связанным с собранным вирусом вплоть до инфицирования вирусом другой клетки-хозяина. Белок оболочки может представлять собой основной белок оболочки или может представлять собой минорный белок оболочки. «Основной» белок оболочки обычно является белком оболочки, который присутствует в оболочке вируса по меньшей мере примерно в 5, по меньшей мере примерно в 7, по меньшей мере примерно в 10 копиях белка или более. Основной белок оболочки может присутствовать в десятках, сотнях или даже тысячах копиях на вирион. Примером основного белка оболочки является белок p8 нитчатого фага.
«Пределом определения» для химического объекта в конкретном анализе является минимальная концентрация данного объекта, которая может быть выявлена выше уровня фона в данном анализе. Например, в ELISA фага «пределом определения» конкретного фага, на котором представлен конкретный антигенсвязывающий фрагмент, является концентрация фага, при которой конкретный фаг дает сигнал в ELISA выше, чем сигнал, создаваемый контрольным фагом, на котором не представлен антигенсвязывающий фрагмент.
«Рецептор DR5» или «DR5» при использовании в настоящем описании охватывает рецептор с нативной последовательностью и варианты рецептора. Указанные термины охватывают рецептор DR5, экспрессируемый у различных млекопитающих, включая человека. Рецептор DR5 может быть эндогенно экспрессированным, который встречается в природе во многих линиях тканей человека, или может быть экспрессирован рекомбинантными или синтетическими способами. «Рецептор DR5 с нативной последовательностью» содержит полипептид, имеющий такую же аминокислотную последовательность, как и природный рецептор DR5. Таким образом, рецептор DR5 с нативной последовательностью может иметь аминокислотную последовательность природного рецептора DR5 любого млекопитающего. Такой рецептор DR5 с нативной последовательностью может быть выделен из природного источника или может быть получен рекомбинантными или синтетическими способами. Термин «рецептор DR5 с нативной последовательностью» специально охватывает природные укороченные или секретируемые формы рецептора (например, растворимую форму, содержащую, например, последовательность внеклеточного домена), природные формы вариантов (например, альтернативно сплайсированные формы) и природные аллельные варианты. Варианты рецептора могут включать фрагменты или делеционные мутанты рецептора DR5 с нативной последовательностью. Состоящая из 411 аминокислот последовательность DR5 человека показана в таблице 1, представлена на фиг.3A и опубликована в WO 98/51793 19 ноября 1998. Вариант транскрипционного сплайсинга DR5 человека известен в данной области. Такой вариант сплайсинга DR5 кодирует 440-аминокислотную последовательность DR5 человека, показанную на фиг.3B и 3C, которые опубликованы в WO 98/35986 20 августа 1998. Полипептидные последовательности мышиного DR5 и внеклеточного домена DR5 также показаны в таблице 1 ниже.
Биологические активности DR5 включают (a) наличие способности индуцировать, или стимулировать, или передавать сигнал апоптоза по меньшей мере в одном типе злокачественных клеток млекопитающих или инфицированных вирусом клетках in vivo или ex vivo, (b) способность связывать природный полипептид Apo2L/TRAIL. Анализы для определения биологической активности, такой как апоптоз, можно провести, используя способы, известные в данной области, такие как фрагментация ДНК (смотри, например, Marsters et al., Curr. Biology, 6:1669 (1996)), инактивация каспазы, связывание DR5 (смотри, например, WO 98/51793, опубликованную 19 ноября 1998). Термины «апоптоз» и «апоптозная активность» используют в широком смысле, и термины относятся к упорядоченной и контролируемой форме гибели клеток у млекопитающих, которая обычно сопровождается одним или несколькими характерными событиями в клетке, включая конденсацию цитоплазмы, потерю микроворсинок плазматической мембраны, сегментацию ядра, разрушение хромосомной ДНК или утрату митохондриальной функции. Такую активность можно определить и измерить, например, в анализах жизнеспособности клеток (таких, как анализы с использованием Alamar синего или MTT-анализах), используя FACS-анализ, анализы активации каспазы, фрагментации ДНК (смотри, например, Nicoletti et al., J. Immunol. Methods, 139:271-279 (1991)) и расщепления поли-ADP-рибозо-полимеразой, «PARP», известные в данной области.
«Антитело к рецептору DR5», «DR5-антитело» или «анти-DR5-антитело» используют в широком смысле по отношению к антителам, которые связываются по меньшей мере с одной формой рецептора DR5. Необязательно, DR5-антитело сливают или связывают с гетерологичной последовательностью или молекулой. Предпочтительно гетерологичная последовательность позволяет или способствует тому, что антитело образует комплексы более высокого порядка или олигомерные комплексы. Необязательно DR5-антитело связывается с рецептором DR5, но не связывается или перекрестно не взаимодействует с любым дополнительным рецептором Apo-2L (например, DR4, DcR1 или DcR2). Необязательно, антитело является агонистом активности в передаче сигнала DR5. Необязательно, DR5-антитело по изобретению связывается с рецептором DR5 в диапазоне концентраций примерно от 0,1 нМ до примерно 20 мМ, как измерено в анализе связывания BIAcore (который описан в настоящем описании). Необязательно, в некоторых вариантах осуществления антитела по изобретению имеют значение IC50, составляющее примерно от 1 нМ до примерно 20 нМ, как измерено в анализе связывания (таком, как конкурентный ELISA фага, который описан в примерах ниже).
Термины «Apo2L/TRAIL», «Apo-2L» и «TRAIL» используют в настоящем описании по отношению к полипептидной последовательности, которая содержит аминокислотные остатки 114-281 включительно, 95-281 включительно, остатки 92-281 включительно, остатки 91-281 включительно, остатки 41-281 включительно, остатки 15-281 включительно или остатки 1-281 включительно аминокислотной последовательности, показанной в таблице 1, а также биологически активные фрагменты, делеционные, инсерционные или содержащие замены варианты указанных выше последовательностей. Полипептиды Apo-2L могут кодироваться нативной нуклеотидной последовательностью, которая описана и показана на фиг.1 в WO 2005100399.
«Слитый белок» и «слитый полипептид» относятся к полипептиду, имеющему две части, ковалентно связанные вместе, при этом каждые части представляют собой полипептиды, обладающие разными свойствами. Свойством может быть биологическое свойство, такое как активность in vitro или in vivo. Свойством также может быть простое химическое или физическое свойство, такое как связывание с антигеном-мишенью, катализ реакции и т.д. Две части могут быть связаны непосредственно одной пептидной связью или через пептидный линкер, содержащий один или несколько аминокислотных остатков. Как правило, две части и линкер будут в рамке считывания друг с другом. В некоторых вариантах осуществления две части полипептида получают из гетерологичных или разных полипептидов.
«Гетерологичной ДНК» является любая ДНК, которую вводят в клетку-хозяина. ДНК может быть получена из разных источников, включая геномную ДНК, кДНК, синтетическую ДНК и их слияния или комбинации. ДНК может включать ДНК из той же самой клетки или клеточного типа, что и клетка-хозяин или реципиентная клетка, или ДНК из другого типа клеток, например клеток млекопитающего или растения. ДНК необязательно может содержать маркерные или селектируемые гены, например гены резистентности к антибиотикам, гены резистентности к температуре и т.д.
В используемом в настоящем описании смысле «положение с высоким разнообразием» относится к положению аминокислоты, расположенной в вариабельных областях легких или тяжелых цепей, которые имеют ряд разных аминокислот, выявленных в данном положении при сравнении аминокислотных последовательностей известных и/или природных антител или антигенсвязывающих фрагментов. Положения с высоким разнообразием обычно находятся в областях CDR. В одном из аспектов способность определять положения с высоким разнообразием в известных и/или природных антителах облегчается при использовании данных, представленных Кабатом, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md., 1987 и 1991). База данных в Интернете, размещенная на сайте http/www.bioinf.org.uk.abs.structures.html, содержит широкое множество и обеспечивает выравнивание последовательностей легких (http/www.bioinf.org.uk.abs.lc.align) и тяжелых цепей (http/www.bioinf.org.uk.abs.hc.align) и облегчает определение положений с высоким разнообразием в таких последовательностях. Согласно изобретению положение аминокислоты имеет высокое разнообразие, если в данном положении находится примерно от 2 до примерно 11, примерно от 4 до примерно 9 и/или примерно от 5 до примерно 7 разных возможных вариантов аминокислотных остатков. В некоторых вариантах осуществления положение аминокислоты является высокоразнообразным, если в данном положении находится по меньшей мере примерно 2, по меньшей мере примерно 4, по меньшей мере примерно 6 и/или по меньшей мере примерно 8 разных возможных вариантов аминокислотных остатков.
В используемом в настоящем описании смысле «библиотека» относится к множеству последовательностей антител, или фрагментов антител (например, полипептидов по изобретению), или нуклеиновых кислот, которые кодируют такие последовательности, при этом последовательности различаются комбинациями вариантов аминокислот, которые введены в такие последовательности способами по изобретению.
«Лигирование» означает процесс образования фосфодиэфирных связей между двумя фрагментами нуклеиновой кислоты. Для лигирования двух фрагментов концы фрагментов должны быть совместимыми друг с другом. В некоторых случаях концы будут непосредственно совместимы после эндонуклеазного расщепления. Однако может быть необходимо сначала превратить выступающие концы, обычно образуемые после расщепления эндонуклеазой, в тупые концы, чтобы сделать их совместимыми для лигирования. Для затупления концов ДНК обрабатывают в подходящем буфере в течение по меньшей мере 15 минут при 15°C примерно с 10 единицами фрагмента Кленова ДНК-полимеразы I или ДНК-полимеразы T4 в присутствии четырех дезоксирибонуклеотидтрифосфатов. Затем ДНК очищают экстракцией фенолом-хлороформом и преципитацией этанолом или очищают на диоксиде кремния. Фрагменты ДНК, которые необходимо лигировать вместе, помещают в раствор примерно в эквимолярных количествах. Раствор также будет содержать АТФ, буфер для лигазы и лигазу, такую как ДНК-лигаза T4 примерно по 10 единиц на 0,5 мкг ДНК. Если ДНК необходимо лигировать в вектор, то вектор сначала линеаризуют расщеплением соответствующей эндонуклеазой(ами) рестрикции. Линеаризованный фрагмент затем обрабатывают бактериальной щелочной фосфатазой или фосфатазой из кишечника теленка, чтобы предотвратить самолигирование во время стадии лигирования. Другие способы лигирования хорошо известны в данной области.
«Мутация» представляет собой делецию, инсерцию или замену нуклеотида(ов) по сравнению с эталонной нуклеотидной последовательностью, такой как последовательность дикого типа.
В используемом в настоящем описании смысле «природные» или «встречающиеся в природе» антитела относятся к антителам, полученным из несинтетического источника, например из дифференцированной антигенспецифичной B-клетки, полученной ex vivo, или соответствующей линии клеток гибридомы, или из антител, полученных из сыворотки животного. Такие антитела могут включать антитела, созданные при любом типе иммунного ответа, либо естественного, либо индуцированного иным образом. Природные антитела включают аминокислотные последовательности и нуклеотидные последовательности, которые определяют или кодируют такие антитела, например, идентифицированные в базе данных Кабата. В используемом в настоящем описании смысле природные антитела отличаются от «синтетических антител», при этом синтетические антитела относятся к последовательностям антител, которые были изменены по сравнению с исходной или матричной последовательностью, например, посредством замены, делеции или добавления аминокислоты или более чем одной аминокислоты, и имеют в определенном положении другую аминокислоту, при этом другая аминокислота делает последовательность антитела, отличающуюся от последовательности исходного антитела.
«Функционально связанные» в отношении нуклеиновых кислот означает, что нуклеиновые кислоты расположены в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или лидера секреции функционально связана с ДНК для полипептида, если он экспрессируется в виде пребелка, который принимает участие в секреции полипептида; промотор или энхансер являются функционально связанными с кодирующей последовательностью, если влияют на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, что облегчает трансляцию. В общем, «функционально связанные» означает, что последовательности ДНК, которые связаны, являются смежными и, в случае лидера секреции, близко расположенными и в рамке считывания. Однако энхансеры не должны располагаться рядом. Связывание осуществляют лигированием в обычных сайтах рестрикции. Если таких сайтов нет, то используют синтетические олигонуклеотидные адаптеры или линкеры согласно обычной практике.
«Фаговый дисплей» представляет собой способ, посредством которого варианты полипептидов представляют в виде белков, слитых по меньшей мере с частью белка оболочки на поверхности фаговых частиц, например частиц нитчатого фага. Применение фагового дисплея основано на том факте, что большие библиотеки рандомизированных вариантов белков можно быстро и эффективно сортировать в отношении таких последовательностей, которые связываются с антигеном-мишенью с высокой аффинностью. Дисплей пептидных и белковых библиотек на фаге использовали для скрининга миллионов полипептидов в отношении полипептидов со специфичными свойствами связывания. Способы, основанные на поливалентном фаговом дисплее, использовали для дисплея малых случайных пептидов и малых белков посредством слияния либо с геном III, либо с геном VIII нитчатого фага. Wells and Lowman, Curr. Opin. Struct. Biol, 3:355-362 (1992), и ссылки, цитированные в указанной работе. В моновалентном фаговом дисплее библиотеку белков или пептидов сливают с геном III или его частью и экспрессируют на низком уровне в присутствии белка гена III дикого типа, так чтобы на фаговых частицах была представлена одна копия или ни одного из слитых белков. Влияние авидности снижено по сравнению с поливалентным фагом, так что сортировку осуществляют на основе аффинности, присущей лиганду, и используют фагмидные векторы, которые упрощают обработку ДНК. Lowman and Wells, Methods: A companion to methods in Enzymology, 3:205-0216 (1991).
«Фагмида» представляет собой плазмидный вектор, имеющий бактериальное начало репликации, например ColEl, и копию межгенной области бактериофага. Фагмиду можно использовать в любом известном бактериофаге, включая нитчатый бактериофаг и лямбдоидный бактериофаг. Плазмида в общем также будет содержать селектируемый маркер резистентности к антибиотикам. Участки ДНК, клонированные в таких векторах, могут быть размножены в виде плазмид. Когда клетки, несущие такие векторы, имеют все гены, необходимые для продукции фаговых частиц, способ репликации фагмиды изменяется на репликацию по типу «катящегося кольца», с образованием копий одной нити плазмидной ДНК и упаковкой фаговых частиц. Фагмида может образовывать инфекционные или неинфекционные фаговые частицы. Указанный термин включает фагмиды, которые содержат ген белка оболочки фага или его фрагмент, связанный с геном гетерологичного полипептида в виде слияния генов, так что гетерологичный полипептид представлен в виде дисплея на поверхности фаговой частицы.
Термин «фаговый вектор» означает двунитевую репликативную форму бактериофага, содержащую гетерологичный ген и способную к репликации. Фаговый вектор имеет начало репликации фага, обеспечивающее репликацию фага и образование фаговых частиц. В некоторых вариантах осуществления фаг является нитчатым бактериофагом, таким как фаг M13, fl, fd, Pf3, или его производным, или лямбдоидным фагом, таким как лямбда, 21, phi80, phi81, 82, 424, 434 и т.д., или его производным.
«Олигонуклеотиды» являются короткими, одно- или двунитевыми полидезоксинуклеотидами, которые синтезируют химически известными способами (например, используя химию фосфотриэфиров, фосфитов или фосфорамидитов, используя твердофазный способ, такой как способ, описанный в EP 266032, опубликованной 4 мая 1988, или через дезоксинуклеозид-H-фосфонатные промежуточные соединения, как описано в Froeshler et al., Nucl. Acids, Res., 14:5399-5407 (1986)). Дополнительные способы включают полимеразную цепную реакцию, которая определена ниже, и другие способы автопраймирования и синтез олигонуклеотидов на твердых подложках. Все указанные способы описаны в Engels et al., Agnew. Chem. Int. Ed. Engl., 28:716-734 (1989). Такие способы применяют, если известна полная последовательность нуклеиновой кислоты гена или доступна последовательность нуклеиновой кислоты, комплементарная кодирующей нити. Альтернативно, если известна аминокислотная последовательность мишени, то можно рассчитать возможные последовательности нуклеиновой кислоты, используя известные и предпочтительные кодирующие остатки для каждого аминокислотного остатка. Олигонуклеотиды могут быть очищены на полиакриламидных гелях или на колонках для разделения молекул по размеру или посредством преципитации.
ДНК «очищена» в том случае, когда ДНК отделена от примесей, отличных от нуклеиновых кислот. Примеси могут быть полярными, неполярными, ионными и т.д.
«Исходное антитело» в используемом в настоящем описании смысле относится к антителу или антигенсвязывающему фрагменту, антигенсвязывающая последовательность которого служит в качестве матричной последовательности, на которой осуществляют изменение согласно критериям, описанным в настоящем описании. В некоторых вариантах осуществления антигенсвязывающая последовательность, в общем, включает вариабельную область антитела и по меньшей мере одну CDR, включая каркасные области.
В используемом в настоящем описании смысле «положение, доступное для растворителя» относится к положению аминокислотного остатка в вариабельных областях тяжелой и легкой цепей исходного антитела или антигенсвязывающего фрагмента, которое определяют на основании структуры, набора структур и/или смоделированной структуры антитела или антигенсвязывающего фрагмента в качестве потенциально доступного для растворителя и/или контакта с молекулой, такой как специфичный для антитела антиген. Такие положения обычно находятся в CDR и на наружной поверхности белка. Доступные для растворителя положения в антителе или антигенсвязывающем фрагменте, которые определены в настоящем описании, можно определить с использованием любого из множества алгоритмов, известных в данной области. В некоторых вариантах осуществления доступные для растворителя положения определяют, используя координаты из 3-мерной модели антитела (или его части, например, вариабельного домена антитела или участка (участков) CDR), с помощью компьютерной программы, такой как программа Insight II (Accelrys, San Diego, CA). Доступные для растворителя положения также можно определить, используя алгоритмы, известные в данной области (например, Lee and Richards, J. Mol. Biol. 55, 379 (1971) и Connolly, J. Appl. Cryst. 16, 548 (1983)). Определение доступных для растворителя положений можно осуществить, используя компьютерную программу, подходящую для моделирования белков, и информацию о 3-мерной структуре, полученную для антитела (или его части). Компьютерные программы, которые можно использовать для указанных целей, включают компьютерную программу SYBYL Biopolymer Module (Tripos Associates). В общем, в некоторых вариантах осуществления, в которых алгоритм (программа) требует, чтобы пользователь вводил параметр размера, «размер» зонда, который используют для расчета, устанавливают примерно равным 1,4 ангстрема или меньше в радиусе. Кроме того, определение доступных для растворителя областей и способы с использованием компьютерной программы для персональных компьютеров описаны в Pacios ((1994) "ARVOMOL/CONTOUR: molecular surface areas and volumes on Personal Computers." Comput. Chem. 18(4):377-386, (1995) и "Variations of Surface Areas and Volumes in Distinct Molecular Surfaces of Biomolecules." J. Mol. Model. 1:46-53).
«Элемент регуляции транскрипции» будет содержать один или несколько из следующих компонентов: энхансерный элемент, промотор, последовательность оператора, ген-репрессор и последовательность терминации транскрипции. Указанные компоненты хорошо известны в данной области. Патент США No. 5667780.
«Трансформант» представляет собой клетку, которая захватила и в которой сохраняется ДНК, о чем свидетельствует экспрессия фенотипа, связанного с ДНК (например, резистентность к антибиотику, придаваемая белком, кодируемым ДНК).
«Трансформация» означает процесс, при котором клетка захватывает ДНК и становится «трансформантом». Захват ДНК может быть постоянным и временным.
«Антителом человека» является антитело, которое имеет аминокислотную последовательность, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком, и/или было получено с использованием любого способа получения антител человека, которые описаны в настоящем описании. Такое определение антитела человека, в частности, включает гуманизированное антитело, содержащее антигенсвязывающие остатки животного, отличного от человека.
Антитело «с созревшей аффинностью» означает антитело с одним или несколькими изменениями в одной или нескольких CDR, которые приводят к улучшению аффинности антитела по отношению к антигену по сравнению с исходным антителом, в котором нет такого изменения(ий). В некоторых вариантах осуществления антитела с созревшей аффинностью будут иметь наномолярные или даже пикомолярные аффинности по отношению к антигену-мишени. Антитела с созревшей аффинностью получают способами, известными в данной области. Marks et al. Bio/Technology 10:779-783 (1992) описывает созревание аффинности посредством перетасовки доменов VH и VL. Случайный мутагенез остатков CDR и/или каркаса описан в: Barbas et al. Proc. Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al. J. Immunol. 154(7):3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
«Kd» или «значение Kd» означает константу диссоциации для взаимодействия одной молекулы с другой. В одном из вариантов осуществления значение Kd измеряют с помощью анализа связывания радиоактивно меченого белка (РИА). В одном из вариантов осуществления РИА для DR5 или HER-2 можно осуществить с использованием варианта Fab анти-DR5-антитела или анти-HER-2-антитела и молекулы DR5 или HER-2 соответственно, как описано, посредством следующего анализа, в котором измеряют аффинность связывания в растворе Fab к DR5 или HER-2 при уравновешивании Fab с минимальной концентрацией (125I)-меченного DR5 или HER-2 в присутствии используемых для титрования серийных разведений немеченых молекул DR5 или HER-2 соответственно, и затем улавливания связанных молекул DR5 или HER-2 соответственно на планшете, покрытом анти-Fab-антителом (Chen, et al., (1999) J. Mol. Biol. 293:865-881). Чтобы создать условия для анализа планшеты для микротитрования (Dynex) покрывают в течение ночи 5 мкг/мл улавливающего анти-Fab-антитела (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6) и затем блокируют 2% (мас./об.) бычьим сывороточным альбумином в PBS в течение двух-пяти часов при комнатной температуре (примерно 23ºC). В неадсорбирующем планшете (Nunc №269620), 100 пМ или 26 пМ [125I]-DR5 или [125I]-HER-2 смешивают с серийными разведениями представляющего интерес Fab, например Fab-12 (Presta et al., (1997) Cancer Res. 57:4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубацию можно продолжать в течение 65 часов, чтобы гарантировать достижение равновесия. Затем смеси переносят в улавливающий планшет для инкубации при комнатной температуре в течение одного часа. Затем раствор удаляют и планшет промывают восемь раз 0,1% твин-20 в PBS. Когда планшет высохнет, добавляют 150 мкл/лунку сцинтиллятора (MicroScint-20; Packard) и просчитывают планшеты на гамма-счетчике с верхним счетом (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают связывание меньше или равное 20% от максимального связывания, выбирают для использования в анализах конкурентного связывания.
Согласно другому варианту Kd или значение Kd можно измерить с применением анализов резонанса поверхностного плазмона, используя прибор BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ). В одном из вариантов осуществления значение Kd анти-DR5-антител или анти-HER-2-антител по отношению к молекулам DR5 или HER-2 соответственно определяют, используя анализ BIAcoreTM согласно следующему протоколу. Коротко, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Молекулы DR5 или HER-2 человека разбавляют в 10 мМ ацетате натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) перед инъекцией при низкой скорости потока 5 мкл/минуту, чтобы достичь примерно 10 единиц сигнала (RU) связанного белка. После инъекции DR5 или HER-2 человека инъецируют 1 М этаноламин, чтобы блокировать непрореагировавшие группы. Для кинетических измерений двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) инъецируют в PBS с 0,05% Твин-20 (PBST) при 25ºC со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания Ленгмюра «один к одному» (компьютерная программа оценки BIAcore, версия 3.2) при одновременной подгонке сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывали в виде отношения koff/kon. Смотри, например, Chen, Y., et al., (1999) J. Mol. Biol. 293: 865-881.
«Расстройством» является любое состояние, при котором может быть эффективно лечение веществом/молекулой или способом по изобретению. Расстройства включают хронические и острые расстройства или заболевания, включая такие патологические состояния, которые вызывают предрасположенность млекопитающего к данному расстройству. Неограничивающие примеры расстройств, которые можно лечить по изобретению, включают злокачественные и доброкачественные опухоли; нелейкозные и лимфоидные злокачественные новообразования; нейронные, глиальные, астроцитарные, гипоталамические и другие расстройства желез, макрофагов, эпителия, стромы и бластоцеля; и воспалительные, связанные с иммунной системой расстройства.
Термины «расстройство пролиферации клеток» и «пролиферативное расстройство» относятся к расстройствам, которые связаны с некоторой степенью аномальной пролиферации клеток. В одном из вариантов осуществления расстройством пролиферации клеток является злокачественная опухоль.
«Опухоль» в используемом в настоящем описании смысле относится к любому неопластическому росту клеток и пролиферации, либо злокачественным, либо доброкачественным, и ко всем предзлокачественным и злокачественным клеткам и тканям. Термины «злокачественная опухоль», «злокачественный» «расстройство пролиферации клеток», «пролиферативное расстройство» и «опухоль» не являются взаимно исключающими при использовании в настоящем описании.
Термины «рак» и «злокачественная опухоль» относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом/пролиферацией. Примеры злокачественной опухоли включают без ограничения карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, рак брюшины, гепатоклеточный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, рак прямой и ободочной кишки, карциному эндометрия или матки, карциному слюнных желез, рак почек, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карциному печени и различные типы рака головы и шеи.
Термин «связанное с иммунной системой заболевание» означает заболевание, при котором компонент иммунной системы млекопитающего вызывает, опосредует или иным образом вносит вклад в заболевание у млекопитающего. Также термин включает заболевания, при которых стимуляция или вмешательство в иммунную систему оказывает усиливающее влияние на прогрессирование заболевания. Указанный термин включает аутоиммунные заболевания, опосредованные иммунной системой воспалительные заболевания, не опосредованные иммунной системой воспалительные заболевания, инфекционные болезни и иммунодефицитные заболевания. Примеры связанных с иммунной системой и воспалительных заболеваний, некоторые из которых являются опосредованными иммунной системой или опосредованными T-клетками, которые можно лечить по изобретению, включают системную красную волчанку, ревматоидный артрит, ювенильный хронический артрит, спондилоартропатии, системный склероз (склеродерму), идиопатические воспалительные миопатии (дерматомиозит, полимиозит), синдром Шегрена, системный васкулит, саркоидоз, аутоиммунную гемолитическую анемию (иммунную панцитопению, пароксизмальную ночную гемоглобинурию), аутоиммунную тромбоцитопению (идиопатическую тромбоцитопеническую пурпуру, опосредованную иммунной системой тромбоцитопению), тиреоидит (диффузный токсический зоб, тиреоидит Хашимото, ювенильный лимфоцитарный тиреоидит, атрофический тиреоидит), сахарный диабет, опосредованное иммунной системой почечное заболевание (гломерулонефрит, тубулоинтерстициальный нефрит), демиелинизирующие заболевания центральной и периферической нервной систем, такие как рассеянный склероз, идиопатическая демиелинизирующая полиневропатия или синдром Гийена-Барре и хроническая воспалительная демиелинизирующая полиневропатия, гепатобилиарные заболевания, такие как инфекционный гепатит (гепатит A, B, C, D, E и другие негепатотропные вирусы), аутоиммунный хронический активный гепатит, первичный билиарный цирроз, гранулематозный гепатит и склерозирующий холангит, воспалительные и фиброзные заболевания легких, воспалительное заболевание кишечника (язвенный колит: болезнь Крона), глютензависимая энтеропатия и болезнь Уиппла, аутоиммунные или опосредованные иммунной системой кожные болезни, включая буллезные кожные болезни, экссудативную многоформную эритему и контактный дерматит, псориаз, аллергические болезни, такие как астма, аллергический ринит, атопический дерматит, гиперчувствительность к пищевым продуктам и крапивница, и иммунологические болезни легких, такие как эозинофильная пневмония.
«Аутоиммунное заболевание» в настоящем описании используют в широком, общем смысле по отношению к расстройствам или состояниям у млекопитающих, при которых деструкция нормальной или здоровой ткани возникает в результате гуморальных или клеточных иммунных ответов в организме млекопитающего на его или ее собственные тканевые компоненты. Примеры включают без ограничения системную красную волчанку, тиреоидит, ревматоидный артрит, псориаз, рассеянный склероз, аутоиммунный диабет и воспалительное заболевание кишечника (IBD).
В используемом в настоящем описании смысле «лечение» относится к клиническому вмешательству при попытке изменить природные события в организме или клетке, подвергаемой лечению, и лечение может быть осуществлено либо для профилактики, либо в процессе протекания клинической патологии. Требуемые эффекты лечения включают предотвращение появления или рецидива болезни, ослабление симптомов, уменьшение любых прямых или непрямых патологических последствий болезни, предотвращение метастазов, снижение скорости прогрессирования заболевания, ослабление или временное облегчение состояния болезни, ремиссию или улучшенный прогноз. В некоторых вариантах осуществления антитела по изобретению используют для замедления развития заболевания или расстройства.
«Эффективное количество» относится к количеству, эффективному в необходимых дозах и в течение определенных периодов времени для достижения требуемого терапевтического или профилактического результата.
«Терапевтически эффективное количество» вещества/молекулы по изобретению, агониста или антагониста может изменяться в зависимости от таких факторов, как патологическое состояние, возраст, пол и масса пациента и способность вещества/молекулы, агониста или антагониста вызывать требуемый ответ у пациента. Терапевтически эффективным количеством также является количество, в случае которого любые токсические или вредные эффекты вещества/молекулы, агониста или антагониста перевешиваются терапевтически полезными эффектами. «Профилактически эффективное количество» относится к количеству, эффективному в необходимых дозах и в течение определенных периодов времени в достижении требуемого профилактического результата. Обычно, но необязательно, в связи с тем, что профилактическую дозу используют для субъектов до заболевания или на ранней стадии заболевания, то профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
«Млекопитающее» в целях лечения относится к любому животному, относящемуся к классу млекопитающих, включая человека, домашних и сельскохозяйственных животных, приматов, отличных от человека, и животных в зоопарке, спортивных или комнатных животных, таких как собаки, лошади, кошки, коровы и т.д.
Термин «антинеопластическая композиция» относится к композиции, применимой для лечения злокачественной опухоли, содержащей по меньшей мере одно активное терапевтическое средство, например «средство против злокачественной опухоли». Примеры терапевтических средств (противораковых средств) включают без ограничения, например, химиотерапевтические средства, ингибирующие рост средства, цитотоксические средства, средства, используемые в лучевой терапии, средства против ангиогенеза, апоптозные средства, средства против тубулина и другие средства для лечения злокачественной опухоли, такие как анти-CD20-антитела, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR (например, эрлотиниб (TarcevaTM)), ингибиторы полученного из тромбоцитов фактора роста (например, GleevecTM (мезилат иматиниба)), ингибитор ЦОГ-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одним или несколькими из следующих мишеней ErbB3, ErbB4, PDGFR-бета, BlyS, APRIL, BCMA или рецептор(ры) VEGF, TRAIL/Apo2, и другие биоактивные и органические химические средства и т.д. Их комбинации также включены в изобретение.
Термин «меченный эпитопом» при использовании в настоящем описании относится к мутанту антитела, слитому с «эпитопной меткой». Полипептид эпитопной метки имеет достаточное количество остатков, чтобы обеспечить эпитоп, против которого может быть создано антитело, но еще является достаточно коротким, чтобы не мешать активности мутанта антитела. Эпитопная метка предпочтительно также является довольно уникальной, так чтобы антитело против нее по существу перекрестно не реагировало с другими эпитопами. Подходящие полипептиды метки обычно имеют по меньшей мере 6 аминокислотных остатков и обычно примерно 8-50 аминокислотных остатков (в некоторых вариантах осуществления примерно 9-30 остатков). Примеры включают без ограничения полипептид метки flu HA и его антитело 12CA5 (Field et al. Mol. Cell Biol. 8:2159-2165 (198S)); метку c-myc и антитела против нее 8F9, 3C7, 6E10, G4, B7 и 9E10 (Evan et al., Mol. Cell. Biol. 5(12):3610-3616 (1985)) и метку в виде гликобелка D (gD) вируса простого герпеса и антитело к ней (Paborsky et al., Protein Engineering 3(6):547-553 (1990)). В некоторых вариантах осуществления эпитопная метка представляет собой «эпитоп, связывающий рецептор спасения».
Термин «цитотоксическое средство» в используемом в настоящем описании смысле относится к веществу, которое ингибирует или предотвращает функционирование клеток и/или вызывает разрушение клеток. Подразумевается, что термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические средства, например метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактерий, грибов, растений или животных, включая их фрагменты и/или варианты, и различные противоопухолевые или противораковые средства, описанные ниже. Другие цитотоксические средства описаны ниже. Тумороцидное средство вызывает разрушение опухолевых клеток.
«Химиотерапевтическим средством» является химическое соединение, которое можно использовать для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилмеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности калихеамицин гамма II и калихеамицин омега II (смотри, например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеинов - энедииновые антибиотики), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMICIN® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства, подавляющие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; гликозид альдофосфамид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазихон; элфорнитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; мейтанзиноиды, такие как мейтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («ara-C»); тиотепа; таксоиды, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, N.J.), не содержащий кремофора препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц ABRAXANETM (American Pharmaceutical Partners, Schaumberg, Illinois) и доксетаксел TAXOTERE® (Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (XELODA®); фармацевтически приемлемые соли, кислоты и производные любого агента, указанного выше; а также комбинации двух или более указанных выше средств, такие как CHOP, сокращенное название комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином.
Также в указанное определение включены противогормональные средства, которые действуют, регулируя, уменьшая, блокируя или ингибируя эффекты гормонов, которые могут стимулировать рост злокачественной опухоли, и часто их используют в форме системного лечения или лечения на уровне целого организма. Они сами могут являться гормонами. Примеры включают антиэстрогены и избирательные модуляторы рецепторов эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен EVISTA®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; антипрогестероны; понижающие регуляторы рецептора эстрогена (ERD); средства, которые функционируют, подавляя или прекращая работу яичников, например агонисты рилизинг-гормона лютеинизирующего гормона (LHRH), такие как ацетат лейпролида LUPRON® и ELIGARD®, ацетат гозерелина, ацетат бузерелина и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола MEGASE®, эксеместан AROMASIN®, форместан, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®. Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат DIDROCAL®, NE-58095, золедроновую кислоту/золедронат ZOMETA®, алендронат FOSAMAX®, памидронат AREDIA®, тилудронат SKELID® или ризедронат ACTONEL®; а также троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, вовлеченных в аномальную пролиферацию клеток, таких как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELIX®; дитозилат лапатиниба (низкомолекулярный двойной ингибитор тирозинкиназ ErbB-2 и EGFR, также известный как GW572016); и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств.
«Ингибирующее рост средство» при использовании в настоящем описании относится к соединению или композиции, которая ингибирует рост клетки, рост которой зависит от активности представляющей интерес молекулы-мишени, либо in vitro, либо in vivo. Таким образом, ингибирующим рост средством может быть средство, которое в значительной степени уменьшает процентное содержание зависимых от молекулы-мишени клеток в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют прохождение клеточного цикла (в другом месте, отличном от S-фазы), такие как средства, которые индуцируют задержку в G1-фазе и задержку в M-фазе. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, которые задерживают в G1, также распространяют свое действие на задержку в S-фазе, например ДНК-алкилирующе агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., в главе 1, озаглавленной «Cell cycle regulation, oncogenes, and antineoplastic drugs», Murakami et al. (WB Saunders: Philadelphia, 1995), особенно на стр. 13. Таксаны (паклитаксел и доцетаксел) являются противоопухолевыми лекарственными средствами, полученными из тиса. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из европейского тиса, является полусинтетическим аналогом паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки, предотвращая деполимеризацию, что приводит к ингибированию митоза в клетках.
«Доксорубицин» является антрациклиновым антибиотиком. Полное химическое название доксорубицина (8S-цис)-10-[(3-амино-2,3,6-тридезокси-α-L-ликсогексапиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендион.
Термин «пролекарство», используемый в настоящей заявке, относится к форме предшественника или производного фармацевтически активного вещества, которая является менее цитотоксичной по отношению к опухолевым клеткам по сравнению с исходным лекарственным средством и способно подвергаться ферментативной активации или превращению с более активную исходную форму. Смотри, например, Wilman, «Prodrugs in Cancer Chemotherapy» Biochemical Society Transactions, 14, p. 375-382, 615th Meeting Belfast (1986) и Stella et al., «Prodrugs: A Chemical Approach to Targeted Drug Delivery», Directed Drug Delivery, Borchardt et al., (ed.), p. 247-267, Humana Press (1985). Пролекарства по изобретению включают без ограничения содержащие фосфат пролекарства, содержащие тиофосфат пролекарства, содержащие сульфат пролекарства, содержащие пептид пролекарства, модифицированные D-аминокислотами пролекарства, гликозилированные пролекарства, содержащие β-лактам пролекарства, содержащие необязательно замещенный феноксиацетамид пролекарства или содержащие необязательно замещенный фенилацетамид пролекарства, 5-фторцитозин-содержащие и другие 5-фторуридинсодержащие пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примеры цитотоксических лекарственных средств, которые могут быть дериватизованы в пролекарственную форму для применения в настоящем изобретении, включают без ограничения химиотерапевтические средства, описанные выше.
Для лечения ревматоидного артрита («РА») пациента можно лечить антителом по изобретению вместе с одним или несколькими из следующих лекарственных средств: DMARD (модифицирующие заболевание противоревматические лекарственные средства (например, метотрексат), НПВ или НПВС (нестероидные противовоспалительные лекарственные средства), HUMIRATM (адалимумаб; Abbott Laboratories), ARAVA® (лефлуномид), REMICADE® (инфликсимаб; Centocor Inc., of Malvern, Pa), ENBRELTM (этанерцепт; Immunex, WA), ингибиторы ЦОГ-2. DMARD, обычно используемыми при РА, являются гидроксихлорохин, сульфасалазин, метотрексат, лефлуномид, этанерцепт, инфликсимаб, азатиоприн, D-пеницилламин, золото (пероральное), золото (внутримышечное), миноциклин, циклоспорин и иммуносорбция белка A Staphylococcal. Адалимумаб является моноклональным антителом человека, которое связывается с TNF. Инфликсимаб является химерным моноклональным антителом, которое связывается с TNF. Этанерцепт является слитым белком «иммуноадгезином», состоящим из внеклеточной связывающей лиганд части рецептора фактора некроза опухолей человека с молекулярной массой 75 кД (p75) (TNFR), связанной с Fc-частью IgG1 человека. Описание традиционного лечения РА смотри, например, в «Guidelines for the management of rheumatoid arthritis» Arthritis and Rheumatism 46(2):328-346 (February, 2002). В конкретном варианте пациента с РА лечат CD20-антителом по изобретению в сочетании с метотрексатом (MTX). Примерная доза MTX составляет примерно 7,5-25 мг/кг/неделю. MTX можно вводить перорально и подкожно.
Для лечения анкилозирующего спондилита, псориатического артрита и болезни Крона пациента можно лечить антителом по изобретению в сочетании, например, с Remicade® (инфликсимабом; из Centocor Inc., of Malvern, Pa.) и/или ENBREL (этанерцептом; Immunex, WA)
Для лечения СКВ пациента можно лечить антителом по изобретению в сочетании, например, с высокими дозами кортикостероидов и/или циклофосфамида (HDCC).
Для лечения псориаза пациентам можно вводить антитело по настоящему изобретению в сочетании с местным лечением, например местными стероидами, антралином, кальципотриеном, клобетасолом и тазаротеном, или с метотрексатом, ретиноидами, циклоспорином, PUVA и UVB-терапией. В одном из вариантов осуществления пациента с псориазом лечат антителом последовательно или одновременно с циклоспорином.
«Выделенной» молекулой нуклеиновой кислоты является молекула нуклеиновой кислоты, которую идентифицируют и отделяют по меньшей мере от одной примесной молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике нуклеиновой кислоты антитела. Выделенная молекула нуклеиновой кислоты имеет другую форму или окружение, отличные от той формы и окружения, в которых она встречается в природе. Поэтому выделенные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, в виде которой они существуют в природных клетках. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, которая содержится в клетках, которые обычно экспрессируют антитело, в которых молекула нуклеиновой кислоты находится, например, в положении хромосомы, отличном от положения в хромосоме природных клеток.
Выражение «регуляторные последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в организме конкретного хозяина. Регуляторные последовательности, которые подходят для прокариот, например, включают промотор, необязательно последовательность оператора и участок связывания рибосомы. Эукариотические клетки, как известно, используют промоторы, сигналы полиаденилирования и энхансеры.
«Вариант» или «мутант» исходного или эталонного полипептида (например, исходного антитела или его вариабельного домена(ов)/CDR), такой как слитый белок (полипептид) или гетерологичный полипептид (гетерологичный по отношению к фагу), представляет собой полипептид, который 1) имеет аминокислотную последовательность, отличную от аминокислотной последовательности исходного или эталонного полипептида; и 2) получен из исходного или эталонного полипептида посредством либо естественного, либо искусственного (проведенного человеком) мутагенеза. Такие варианты включают, например, делеции, и/или инсерции, и/или замены остатков в аминокислотной последовательности представляющего интерес полипептида. Например, слитый полипептид по изобретению, созданный с использованием олигонуклеотида, содержащего ограниченный набор кодонов, который кодирует последовательность с вариантами аминокислот (по сравнению с аминокислотой, встречающейся в соответствующем положении в исходном антителе/антигенсвязывающем фрагменте), может представлять собой вариант полипептида по сравнению с исходным антителом, и/или антигенсвязывающим фрагментом, и/или CDR. Таким образом, вариант CDR относится к CDR, содержащей вариант последовательности по сравнению с исходной или эталонной полипептидной последовательностью (такой, как последовательность исходного антитела, и/или антигенсвязывающего фрагмента, и/или CDR). Вариант аминокислоты в данном контексте относится к аминокислоте, отличной от аминокислоты в соответствующем положении в исходной или эталонной полипептидной последовательности (такой, как последовательности исходного антитела, и/или антигенсвязывающего фрагмента, и/или CDR). Может быть осуществлена комбинация делеции, инсерции и замены, чтобы достичь конечного варианта или мутантной конструкции, при условии, что конечная конструкция обладает требуемыми функциональными свойствами. В некоторых примерах, приведенных в настоящем описании, последовательности связывающего агента содержат точечные мутации, такие как делеции или добавления. Аминокислотные замены также могут изменять посттрансляционный процессинг полипептида, например изменять количество или положение сайтов гликозилирования. Способы создания вариантов аминокислотных последовательностей полипептидов описаны в патенте США No. 5534615, специально включенном в данное описание в виде ссылки.
Последовательность «дикого типа», или «эталонная» последовательность, или последовательность белка/полипептида «дикого типа или «эталонного» белка/полипептида, такого как белок оболочки, или CDR, или вариабельного домена исходного антитела может представлять собой эталонную последовательность, из которой получают варианты полипептидов посредством введения мутаций. В общем, последовательность «дикого типа» для данного белка представляет собой последовательность, которая наиболее распространена в природе. Подобным образом, последовательность гена «дикого типа» представляет собой последовательность данного гена, которая наиболее распространена в природе. Мутации могут быть введены в ген «дикого типа» (и, следовательно, в белок, который он кодирует) либо в результате естественных процессов, либо искусственно. Продуктами таких процессов являются «вариантные» или «мутантные» формы исходного белка или гена «дикого типа».
«Множество» веществ, таких как полипептид или полинуклеотид по изобретению, в используемом в настоящем описании смысле, в общем, относится к совокупности двух или более типов или видов веществ. Существует два или более типов или видов веществ, если два или более веществ отличаются друг от друга конкретной характеристикой, например вариантом аминокислоты, находящимся в конкретном положении аминокислоты. Например, существует множество полипептидов по изобретению, если существуют два или более полипептидов по изобретению, которые являются по существу одинаковыми или идентичными по последовательности, за исключением последовательности варианта CDR или за исключением варианта аминокислоты в конкретном доступном для растворителя и имеющем высокое разнообразие положении аминокислоты. В другом примере имеется множество полинуклеотидов по изобретению, если имеется два или более полинуклеотидов по изобретению, которые являются по существу одинаковыми или идентичными по последовательности, за исключением последовательности, которая кодирует вариант CDR, или за исключением последовательности, которая кодирует вариант аминокислоты для конкретного доступного для растворителя и имеющего высокое разнообразие положения аминокислоты.
Изобретение относится к способам создания и выделения новых связывающих антиген-мишень полипептидов, таких как антитела или антигенсвязывающие фрагменты, которые могут иметь высокую аффинность по отношению к выбранному антигену. Множество разных связывающих полипептидов получают посредством мутирования (разнообразия) одного или нескольких выбранных положений аминокислот в вариабельном домене легкой цепи и/или вариабельном домене тяжелой цепи исходного антитела с использованием ограниченных наборов кодонов, чтобы создать библиотеку связывающих полипептидов с вариантами аминокислот по меньшей мере в одной последовательности CDR, при этом количество типов вариантов аминокислот сохраняется минимальным (т.е. 19 или меньше, 15 или меньше, 10 или меньше, 8 или меньше, 6 или меньше, 4 или меньше или только 2, но обычно по меньшей мере 2). Положения аминокислот включают такие положения, которые доступны для растворителя, например, как определено в анализе структуры исходного антитела, и/или которые являются высокоразнообразными среди известных и/или природных иммуноглобулиновых полипептидов. Следующим преимуществом, которое дает ограниченная природа разнообразия по изобретению, является то, что дополнительные положения аминокислот, отличные от положений, которые имеют высокое разнообразие и/или являются доступными для растворителя, также могут различаться в соответствии с необходимостью или желанием специалиста; примеры таких вариантов осуществления изобретения описаны в настоящем описании.
Положениями аминокислот, которые являются доступными для растворителя и имеют высокое разнообразие, в некоторых вариантах осуществления являются положения в областях CDR вариабельных доменов антител, выбранных из группы, состоящей из CDRL1, CDRL2, CDRL3, CDRH1, CDRH2, CDRH3 и их смесей. Каждое из положений аминокислот подвергают мутациям с использованием ограниченного набора кодонов, кодирующих ограниченное количество аминокислот, при этом выбор аминокислот, как правило, не зависит от обычно встречающихся аминокислот в каждом положении. В некоторых вариантах осуществления, когда необходимо подвергнуть мутации доступное для растворителя и имеющее высокое разнообразие положение в области CDR, выбирают набор кодонов, который кодирует от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 4 и/или только 2 аминокислоты. В некоторых вариантах осуществления, когда необходимо подвергнуть мутации доступное для растворителя и имеющее высокое разнообразие положение в области CDR, выбирают набор кодонов, который кодирует от 2 до 19, от 2 до 15, от 2 до 10, от 3 до 9, от 4 до 8 и/или от 5 до 7 аминокислот. В некоторых вариантах осуществления набор кодонов кодирует по меньшей мере 2, но может кодировать 19 или меньше, 15 или меньше, 10 или меньше, 8 или меньше, 6 или меньше, 4 или меньше аминокислот. Разнообразие последовательностей CDR также может быть повышено посредством варьирования по длине. Например, в случае CDRH3 могут быть созданы варианты областей CDRH3, которые имеют разные длины и/или рандомизированы в выбранных положениях с использованием ограниченного набора кодонов.
Разнообразие библиотеки полипептидов, содержащих варианты CDR, создают, используя наборы кодонов, которые кодируют только ограниченное количество аминокислот, так что в CDR вводят минимальное, но достаточное разнообразие последовательностей. Количество положений, мутированных в CDR, минимизируют и конструируют варианты аминокислот в каждом положении так, чтобы включить ограниченное количество аминокислот, независящих от аминокислот, которые, как считается, широко встречаются в данном положении в известных и/или природных CDR. В некоторых вариантах осуществления в качестве исходного антитела используют одно антитело, содержащее по меньшей мере одну CDR. Неожиданным является тот факт, что библиотека вариабельных доменов антител, имеющих разнообразие по последовательностям и размеру, может быть создана с использованием одного исходного антитела в качестве матрицы и целенаправленным созданием разнообразия в конкретных положениях с использованием необычно ограниченного количества аминокислотных замен.
Конструирование разнообразия вариабельных доменов антител
В одном из аспектов изобретения создают библиотеки вариабельных доменов антител высокого качества. Библиотеки имеют ограниченное разнообразие разных последовательностей в последовательностях CDR, например разнообразие вариабельных доменов антитела. Библиотеки включают вариабельные домены антител с высокоаффинным связыванием с одним или несколькими антигенами, включая, например, DR5 и HER-2 человека. Разнообразие библиотеки конструируют посредством отбора положений аминокислот, которые доступны для растворителя и имеют высокое разнообразие, в одном исходном антителе и создания мутаций в таких положениях по меньшей мере в одной CDR с использованием ограниченного набора кодонов. Ограниченный набор кодонов в некоторых вариантах осуществления может кодировать менее 19, 15, 10, 8, 6 или 4 аминокислот или кодирует только 2 аминокислоты.
Одним исходным антителом является гуманизированное антитело 4D5, но способы повышения разнообразия могут быть применены к другим исходным антителам, последовательность которых известна. Исходным антителом может быть природное антитело, синтетическое антитело, рекомбинантное антитело, гуманизированные антитело, полученное из зародышевой линии антитело, химерное антитело, антитело с созревшей аффинностью или их антигенсвязывающие фрагменты. Антитела могут быть получены из различных видов млекопитающих, включая человека, мышей и крыс. В некоторых вариантах осуществления исходным антителом является антитело, которое получают после одного или нескольких начальных раундов скрининга в отношении аффинности, но до стадии(ий) созревания аффинности. Исходное антитело может быть выбрано или модифицировано так, чтобы получить высокий выход и стабильность в случае продуцирования в культуре клеток.
Антитело 4D5 является гуманизированным антителом, специфичным по отношению к связанному со злокачественной опухолью антигену, названному HER-2 (erbB2). Антитело содержит вариабельные домены, имеющие консенсусные каркасные области; некоторые положения были снова возвращены к мышиной последовательности в ходе процесса повышения аффинности гуманизированного антитела. Последовательность и кристаллическая структура гуманизированного антитела 4D5 описаны в патенте США 6054297, Carter et al., PNAS 89:4285 (1992), кристаллическая структура показана в J. Mol. Biol. 229:969 (1993) и в прямом доступе на сайтах
,
http://www.ncbi.nlm.nih.gov/Structure/mmdb/mmdbsrv.cgi?form=6&db=t&Dopt=s&uid=991 и
.
Критерием создания разнообразия в вариабельных доменах антител является мутирование остатков в положениях, которые являются доступными для растворителя (которые определены выше). Такие положения обычно встречаются в CDR и обычно на наружной поверхности белка. В некоторых вариантах осуществления доступные для растворителя положения определяют, используя координаты из 3-мерной модели антитела, с помощью компьютерной программы, такой как программа InsightII (Accelrys, San Diego, CA). Доступные для растворителя положения также можно определить, используя алгоритмы, известные в данной области (например, Lee and Richards, J. Mol. Biol. 55, 379 (1971) и Connolly, J. Appl. Cryst. 16, 548 (1983)). Определение доступных для растворителя положений можно осуществить, используя компьютерную программу, подходящую для моделирования белка, и 3-мерную структурную информацию, полученную для антитела. Компьютерные программы, которые могут быть использованы для таких целей, включают компьютерную программу SYBYL Biopolymer Module (Tripos Associates). В общем, в некоторых вариантах осуществления, в которых алгоритм (программа) требует, чтобы пользователь вводил параметр размера, «размер» зонда, который используют для расчета, устанавливают примерно равным 1,4 ангстрема или меньше в радиусе. Кроме того, определение доступных для растворителя областей и способы с использованием компьютерной программы для персональных компьютеров описаны в Pacios ((1994) "ARVOMOL/CONTOUR: molecular surface areas and volumes on Personal Computers." Comput. Chem. 18(4):377-386, (1995) и "Variations of Surface Areas and Volumes in Distinct Molecular Surfaces of Biomolecules." J. Mol. Model. 1:46-53).
В некоторых случаях отбор доступных для растворителя остатков дополнительно улучшается посредством выбора доступных для растворителя остатков, которые вместе образуют минимальный непрерывный участок, например, когда эталонный полипептид или исходное антитело находится в своей упакованной 3-D-структуре. Например, как показано на фиг.2, компактный (минимальный) непрерывный участок образован остатками, выбранными для CDRH1/H2/H3/L1/L2/L3 гуманизированного 4D5. Компактный (минимальный) непрерывный участок может содержать только подгруппу (например, 2-5 CDR) полной области CDR, например CDRH1/H2/H3/L3. Доступные для растворителя остатки, которые не вносят вклад в образование такого участка, необязательно могут быть исключены из разнообразия. Улучшение отбора благодаря такому критерию позволяет специалисту минимизировать при желании количество остатков, которые необходимо изменить. Например, остаток 28 в H1 необязательно может быть исключен из разнообразия, так как он находится на границе участка. Однако также можно использовать критерий отбора, когда это требуется, чтобы выбрать остатки, которые необходимо изменить, которые необязательно должны быть доступными для растворителя. Например, остаток, который не считается доступным для растворителя, но образует непрерывный участок в упакованной 3-D-структуре с другими остатками, которые считаются доступными для растворителя, может быть выбран для разнообразия. Таким примером является CDRL1-29. Отбор таких остатков может быть очевидным для специалиста в данной области, и их пригодность также можно определить эмпирически и в соответствии с необходимостью и желанием специалиста.
Доступными для растворителя положениями, идентифицированными на основании кристаллической структуры гуманизированного антитела 4D5 для каждого CDR являются следующие положения (положение остатков согласно Кабату):
CDRL1: 28, 30, 31, 32,
CDRL2: 50, 53,
CDRL3: 91, 92, 93, 94, 96,
CDRH1: 28, 30, 31, 32, 33,
CDRH2: 50, 52, 52A, 53, 54, 55, 56, 57, 58.
Кроме того, в некоторых вариантах осуществления остаток 29 CDRL1 также может быть выбран на основе того, что он входит в непрерывный участок, содержащий другие доступные для растворителя остатки. Все или подгруппа доступных для растворителя положений, которые указаны выше, могут различаться в способах и композициях по изобретению. Например, в некоторых вариантах осуществления рандомизированы только положения 50, 52, 52a, 53-56 и 58 в CDRH2.
Другим критерием для выбора положений, которые необходимо подвергнуть мутациям, является отбор таких положений, в которых наблюдается вариабельность в аминокислотной последовательности при сравнении последовательностей известных и/или природных антител. Положение с высоким разнообразием представляет собой положение аминокислоты, локализованной в вариабельных областях легкой или тяжелой цепей, которые имеют несколько разных аминокислот, встречающихся в данном положении при сравнении аминокислотных последовательностей известных и/или природных антител/антигенсвязывающих фрагментов. Положения с высоким разнообразием могут быть в областях CDR. Все положения CDRH3 считаются высокоразнообразными. В некоторых вариантах осуществления положения аминокислотных остатков имеют высокое разнообразие, если в данном положении имеется примерно от 2 до примерно 19 (хотя количество может быть в диапазоне, который описан в настоящем описании) разных возможных вариантов аминокислотных остатков.
В одном из аспектов идентификация положений с высоким разнообразием в известных и/или природных антителах облегчается при использовании данных, представленных Кабатом, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md., 1987 и 1991). База данных в Интернете, размещенная на сайте http/www.bioinf.org.uk.abs.structures.html, содержит широкое множество и обеспечивает выравнивание последовательностей легких (http/www.bioinf.org.uk.abs.lc.align) и тяжелых цепей (http/www.bioinf.org.uk.abs.hc.align) и облегчает определение положений с высоким разнообразием в таких последовательностях. Разнообразие в доступных для растворителя положениях гуманизированного антитела 4D5 в известных и/или природных легких и тяжелых цепях показано на фиг.3 и 4.
В одном из аспектов изобретения имеющие высокое разнообразие и доступные для растворителя остатки по меньшей мере в одной, двух, трех, четырех, пяти или во всех CDR, выбранных из группы, состоящей из CDRL1, CDRL2, CDRL3, CDRH1, CDRH2, CDRH3 и их смесей, подвергают мутациям (т.е. рандомизируют, используя ограниченные наборы кодонов, которые описаны в настоящем описании). Например, популяция полипептидов может быть создана посредством повышения разнообразия по меньшей мере одного доступного для растворителя и/или имеющего высокое разнообразие остатка в CDRL3 и CDRH3 с использованием ограниченных кодонов. Соответственно, изобретение относится к большому количеству новых последовательностей антител, образованных заменой по меньшей мере одного доступного для растворителя и имеющего высокое разнообразие положения по меньшей мере одной CDR вариабельного домена исходного антитела вариантами аминокислот, кодируемых ограниченным набором кодонов. Например, вариант CDR или вариабельного домена антитела может содержать вариант аминокислоты в одном или нескольких положениях аминокислот 28, 30, 31, 32, 33 и/или 34 CDRH1; и/или в одном или нескольких положениях аминокислот 50, 52, 52a, 53, 54, 55, 56 и/или 58 CDRH2; и/или в одном или нескольких положениях аминокислот 95-100, 100a, 100b и 100c CDRH3; и/или в одном или нескольких положениях аминокислот 28, 29, 30 и/или 31 CDRL1; и/или в одном или нескольких положениях аминокислот 50 и/или 53 в CDRL2; и/или в одном или нескольких положениях аминокислот 91, 92, 93, 94, 95 и/или 96 в CDRL3. В другом примере вариант CDR или вариабельного домена антитела может содержать вариант аминокислоты в одном или нескольких положениях аминокислот 28, 30, 31, 32 и/или 33 CDRH1; и/или в одном или нескольких положениях аминокислот 50, 52, 53, 54, 56 и/или 58 CDRH2; и/или в одном или нескольких положениях аминокислот 95-100, 100a, 100b и 100c CDRH3; и/или в одном или нескольких положениях аминокислот 28, 29, 30 и/или 31 CDRL1; и/или в одном или нескольких положениях аминокислот 50 и/или 53 в CDRL2; и/или в одном или нескольких положениях аминокислот 91, 92, 93, 94 и/или 96 в CDRL3. Варианты аминокислот в указанных положениях кодируются ограниченными наборами кодонов, которые описаны в настоящем описании.
Как обсуждается выше, варианты аминокислот кодируются ограниченным набором кодонов. Набор кодонов представляет собой набор разных триплетных нуклеотидных последовательностей, которые могут быть использованы для образования набора олигонуклеотидов, используемых для кодирования требуемой группы аминокислот. Может быть синтезирован набор олигонуклеотидов, например, твердофазным синтезом, содержащий последовательности, которые представляют все возможные комбинации нуклеотидных триплетов, обеспечиваемые набором кодонов, и которые будут кодировать требуемую группу аминокислот. Синтез олигонуклеотидов с выбранной «вырожденностью» нуклеотидов в некоторых положениях хорошо известен в данной области. Такие группы нуклеотидов, составляющие определенные наборы кодонов, могут быть синтезированы с использованием коммерческих синтезаторов нуклеиновых кислот (доступных, например, из Applied Biosystems, Foster City, CA) или могут быть получены коммерчески (например, из Life Technologies, Rockville, MD). Поэтому набор синтезированных олигонуклеотидов, имеющих конкретный набор кодонов, в обычном случае будет включать множество олигонуклеотидов с разными последовательностями, при этом различия определяются набором кодонов в полной последовательности. Олигонуклеотиды, которые используются по изобретению, имеют последовательности, которые обеспечивают возможность гибридизации с матрицей нуклеиновой кислоты вариабельного домена, а также могут содержать сайты ферментов рестрикции в целях клонирования.
В одном из аспектов ограниченный набор аминокислот, предназначенных для того, чтобы занимать одно или несколько доступных для растворителя и имеющих высокое разнообразие положений в CDR гуманизированного антитела 4D5, определяют (по желанию специалиста, которое может быть основано на любом из критериев, включая конкретные аминокислоты, требуемые для конкретных положений, конкретную аминокислоту(ты), которые должны отсутствовать в конкретном положении, размер требуемой библиотеки, характерных особенностей связывающих антиген агентов, которые необходимо найти, и т.д.).
CDR3 тяжелой цепи (CDRH3) в известных антителах имеют разнообразные последовательности, структурные конформации и длину. CDRH3 часто находятся в середине антигенсвязывающего кармана и часто принимают участие в контакте с антигеном. Таким образом, конструирование CDRH3 может быть осуществлено отдельно от конструирования других CDR, поскольку может быть трудно предсказать структурную конформацию CDRH3, и разнообразие аминокислот в данной области особенно широко в известных антителах. По настоящему изобретению CDRH3 конструируют так, чтобы создать разнообразие в конкретных положениях в CDRH3, например в положениях 95, 96, 97, 98, 99, 100, 100a, 100b и 100c (например, согласно нумерации Кабата в антителе 4D5). В некоторых вариантах осуществления разнообразие также создают варьированием длины CDRH3 с использованием ограниченных наборов кодонов. Разнообразие по длине может быть любого диапазона, определяемого эмпирически, который подходит для создания популяции полипептидов, содержащих значительные части антигенсвязывающих белков. Например, могут быть созданы полипептиды, содержащие вариант CDRH3, имеющий последовательность X1-X2-X3-X4-X5-(X6)n-X7-X8-X9-D-Y (SEQ ID NO:4), где X1-X9 означают аминокислоты, кодируемые ограниченными наборами кодонов, и n означает разную длину, например n=1-11, 5-11 или 7-11. Другими примерами возможных значений n являются значения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и 11. Иллюстративные варианты олигонуклеотидов, которые могут быть использованы для получения многообразия длины последовательностей CDRH3, включают примеры, показанные на фиг.9A-9D, фиг.20A-L и фиг.23.
Предполагается, что разнообразие последовательностей в библиотеке, созданной введением вариантов аминокислот в конкретную область CDR, например CDRH3, можно увеличить комбинированием данного варианта CDR с другими CDR, содержащими вариации в других областях антитела, в частности в других CDR вариабельных последовательностей либо легкой, либо тяжелой цепи. Предполагается, что разнообразие последовательностей нуклеиновых кислот, которые кодируют представителей данного набора, может быть дополнительно увеличено введением других вариантов аминокислот в CDR последовательностей либо легкой, либо тяжелой цепи посредством наборов кодонов. Таким образом, например, в одном из вариантов осуществления последовательности CDRH3 из слитых полипептидов, которые связывают антиген-мишень, можно комбинировать с измененными последовательностями CDRL3, CDRH1 или CDRH2 или любой комбинацией измененных CDR.
Следует отметить, что в некоторых случаях каркасные остатки можно варьировать по сравнению с последовательностью исходного антитела или антигенсвязывающего фрагмента, например, чтобы отразить консенсусную последовательность или повысить стабильность или улучшить дисплей. Например, можно варьировать каркасные остатки 49, 93, 94 или 71 в тяжелой цепи. Каркасный остаток 93 тяжелой цепи может представлять собой серин или аланин (который находится в консенсусной последовательности аминокислот человека в данном положении). Каркасный остаток 94 тяжелой цепи может быть изменен, чтобы отразить консенсусную последовательность каркаса, с треонина на аргинин или лизин. Другим примером каркасного остатка, который может быть изменен, является каркасный остаток 71 тяжелой цепи, который представляет собой R примерно в 1970 полипептидах, V примерно в 627 полипептидах и A примерно в 527 полипептидах, которые обнаружены в базе данных Кабата. Каркасный остаток 49 тяжелой цепи может представлять собой аланин или глицин. Кроме того, необязательно 3 N-концевые аминокислоты вариабельного домена тяжелой цепи могут быть удалены. В легкой цепи необязательно аргинин в положении аминокислоты 66 может быть заменен на глицин. В одном из вариантов осуществления каркасным остатком 93 тяжелой цепи является аланин, а каркасным остатком 94 тяжелой цепи является аргинин.
В одном из аспектов изобретение относится к конструкциям векторов для создания слитых полипептидов, которые связываются с достаточно высокой аффинностью с возможными лигандами. Такие конструкции содержат димеризуемый домен, который в случае его присутствия в слитом полипептиде обеспечивает повышенную тенденцию к димеризации тяжелых цепей с образованием димеров фрагментов/частей антитела Fab или Fab'. Такие домены димеризации могут включать, например, последовательность шарнира тяжелой цепи (например, последовательность, содержащую TCPPCPAPELLG (SEQ ID NO:5), которая может присутствовать в слитом полипептиде). Домены димеризации в слитых фаговых полипептидах сводят вместе две группы слитых полипептидов (LC/HC-фаговый белок/фрагмент (такой, как pIII)), таким образом обеспечивая образование подходящих связей (таких, как дисульфидные мостики между тяжелыми цепями) между двумя группами слитых полипептидов. Конструкции векторов, содержащие такие домены димеризации, можно использовать для получения дивалентного фагового дисплея вариабельных доменов антитела, например измененных слитых белков, описанных в настоящем описании. В некоторых вариантах осуществления присущая каждому мономерному фрагменту антитела (слитому полипептиду) аффинность существенно не изменяется при слиянии с доменом димеризации. В некоторых вариантах осуществления димеризация приводит к дивалентному фаговому дисплею, который обеспечивает повышенную авидность связывания с фагом при существенно уменьшенной скорости распада комплекса, что можно определить способами, известными в данной области, и способами, которые описаны в настоящем описании. Содержащие домен димеризации векторы по изобретению могут содержать или могут не содержать амбер-стоп-кодон после домена димеризации.
Димеризацию можно изменять, чтобы достичь разных характеристик дисплея. Домены димеризации могут содержать последовательность, содержащую остаток цистеина, шарнирную область из полноразмерного антитела, последовательность димеризации, такую как последовательность лейциновой молнии или последовательность молнии GCN4 или их смеси. Последовательности димеризации известны в данной области и включают, например, последовательность молнии GCN4 (GRMKQLEDKVEELLSKNYHLENEVARLKKLVGERG) (SEQ ID NO:3). Домен димеризации в некоторых вариантах осуществления локализован на C-конце последовательности вариабельного или константного домена тяжелой цепи и/или между последовательностью вариабельного или константного домена тяжелой цепи и любой последовательностью компонента, представленного белком оболочки вируса. Амбер-стоп-кодон также может присутствовать на C-конце или после C-конца домена димеризации. В одном из вариантов осуществления, когда присутствует амбер-стоп-кодон, домен димеризации кодирует по меньшей мере один цистеин и последовательность димеризации, такую как лейциновая молния. В другом варианте осуществления, когда амбер-стоп-кодон отсутствует, домен димеризации может содержать один остаток цистеина.
Полипептиды по изобретению также могут быть слиты с другими типами полипептидов, чтобы получить дисплей вариантов полипептидов или обеспечить очистку, скрининг или сортировку и выявление полипептида. В случае варианта, который заключается в фаговом дисплее, полипептиды по изобретению сливают с полным или с частью белка оболочки вируса. Примеры белка оболочки вируса включают белок PIII, основной белок оболочки, pVIII, Soc, Hoc, gpD, pVI и их варианты. Кроме того, варианты полипептидов, созданные способами по изобретению, необязательно могут быть слиты с полипептидным маркером или меткой, такой как FLAG, полигистидин, gD, c-myc, B-галактозидаза и тому подобные.
Способы создания библиотек рандомизированных вариабельных доменов
Способы замены выбранных аминокислот в матричной нуклеиновой кислоте хорошо разработаны в данной области, некоторые из них описаны в настоящем описании. Например, библиотеки могут быть созданы в результате целенаправленной обработки доступных для растворителя и/или имеющих высокое разнообразие положений по меньшей мере в одной области CDR для замены аминокислоты вариантами аминокислот с применением способа Kunkel. Смотри, например, Kunkel et al., Methods Enzymol. (1987), 154:367-382. Создание рандомизированных последовательностей также описано ниже в примерах.
Последовательность олигонуклеотидов содержит один или несколько сконструированных ограниченных наборов кодонов для получения разной длины CDRH3 или для доступных для растворителя и имеющих высокое разнообразие положений в CDR. Набор кодонов представляет собой набор разных триплетных нуклеотидных последовательностей, используемых для кодирования требуемых вариантов аминокислот. Наборы кодонов могут быть представлены с использованием символов для обозначения конкретных нуклеотидов или эквимолярных смесей нуклеотидов в соответствии с IUB, как показано ниже. Обычно набор кодонов представляют тремя заглавными буквами, например KMT, TMT и тому подобные.
КОДЫ IUB
G - гуанин
A - аденин
T - тимин
C - цитозин
R (A или G)
Y (C или T)
M (A или C)
K (G или T)
S (C или G)
W (A или T)
H (A, или C, или T)
B (C, или G, или T)
V (A, или C, или G)
D (A, или G, или T)
N (A, или C, или G, или T)
Например, в кодоне TMT T означает нуклеотид тимин; а M может представлять собой A или C. Такой набор кодонов может представлять собой несколько кодонов и может кодировать только ограниченное количество аминокислот, а именно тирозин и серин.
Наборы олигонуклеотидов или праймеров могут быть синтезированы с использованием стандартных способов. Набор олигонуклеотидов может быть синтезирован, например, посредством твердофазного синтеза, включая последовательности, которые представляют все возможные комбинации нуклеотидных триплетов, которые дает набор кодонов и которые будут кодировать требуемую ограниченную группу аминокислот. Синтез олигонуклеотидов с выбранной «вырожденностью» нуклеотидов в определенных положениях хорошо известен в данной области. Такие наборы олигонуклеотидов, имеющих определенные наборы кодонов, могут быть синтезированы с использованием коммерческих синтезаторов нуклеиновых кислот (доступных, например, из Applied Biosystems, Foster City, CA) или могут быть получены коммерчески (например, из Life Technologies, Rockville, MD). Поэтому набор синтезированных олигонуклеотидов, имеющих конкретный набор кодонов, обычно будет содержать множество олигонуклеотидов с разными последовательностями, при этом различие определяется набором кодонов в полной последовательности. Олигонуклеотиды, которые используют по изобретению, имеют последовательности, которые обеспечивают гибридизацию с матричной нуклеиновой кислотой CDR (например, входящей в вариабельный домен), а также могут содержать сайты для ферментов рестрикции в целях клонирования.
В одном способе последовательности нуклеиновых кислот, кодирующие варианты аминокислот, могут быть созданы опосредованным олигонуклеотидами мутагенезом последовательности нуклеиновой кислоты, кодирующей исходный или матричный полипептид, такой как вариабельный домен антитела 4D5. Такой способ хорошо известен в данной области и описан в Zoller et al. Nucleic Acids Res. 10:6487-6504(1987). Коротко, последовательности нуклеиновых кислот, кодирующие варианты аминокислот, создают гибридизацией набора олигонуклеотидов, кодирующих требуемые ограниченные наборы кодонов, с матрицей ДНК, при этом матрица представляет собой однонитевую форму плазмиды, содержащей последовательность матрицы нуклеиновой кислоты вариабельной области. После гибридизации используют ДНК-полимеразу, чтобы синтезировать полную вторую комплементарную нить матрицы, которая соответственно будет содержать олигонуклеотидный праймер и будет содержать ограниченные наборы кодонов, которые обеспечивает набор олигонуклеотидов. Нуклеиновые кислоты, кодирующие другие исходные или матричные молекулы, известны и могут быть легко определены.
В общем, используют олигонуклеотиды длиной по меньшей мере 25 нуклеотидов. Оптимальный олигонуклеотид будет иметь по меньшей мере от 12 до 15 нуклеотидов, которые полностью комплементарны матрице с любой стороны от нуклеотида(ов), кодирующего мутацию(ии). Это гарантирует, что олигонуклеотид будет правильно гибридизоваться с однонитевой молекулой ДНК-матрицы. Олигонуклеотиды легко синтезируют с применением способов, известных в данной области, таких как способ, описанный в Crea et al., Proc. Natl. Acad. Sci. USA, 75:5765 (1978).
ДНК-матрицу создают с помощью таких векторов, которые получены либо из векторов, основанных на бактериофаге M13 (подходящими являются коммерчески доступные векторы M13mp18 и M13mp19), либо векторов, которые содержат начало репликации однонитевого фага, которые описаны в Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, ДНК, которую необходимо подвергнуть мутациям, можно встроить в один из таких векторов, чтобы создать однонитевую матрицу. Получение однонитевой матрицы описано в разделах 4.21-4.41 Sambrook et al., выше.
Чтобы изменить нативную последовательность ДНК, олигонуклеотид гибридизуют с однонитевой матрицей в подходящих условиях гибридизации. Затем добавляют полимеризующий ДНК фермент, обычно ДНК-полимеразу T7 или фрагмент Кленова ДНК-полимеразы I, чтобы синтезировать комплементарную нить матрицы, используя олигонуклеотид в качестве праймера для синтеза. Гетеродуплексную молекулу образуют таким образом, что одна нить ДНК кодирует мутантную форму гена 1, а другая нить (исходная матрица) кодирует нативную неизмененную последовательность гена 1. Такой гетеродуплексной молекулой затем трансформируют подходящую клетку-хозяина, обычно прокариотическую, такую как E. coli JM101. После выращивания клеток их помещают на чашки с агарозой и проводят скрининг с использованием олигонуклеотидного праймера, радиоактивно меченного 32-фосфатом, чтобы идентифицировать бактериальные колонии, которые содержат мутантную ДНК.
Описанный выше способ может быть модифицирован так, чтобы создать гомодуплексную молекулу, в которой обе нити плазмиды содержат мутацию(ии). Модификации заключаются в следующем: однонитевой олигонуклеотид отжигают с однонитевой матрицей, как описано выше. Смесь трех дезоксирибонуклеотидов, дезоксирибоаденозина (dATP), дезоксирибогуанозина (dGTP) и дезоксириботимидина (dTT), объединяют с модифицированным тиодезоксирибоцитозином, названным dCTP-(aS) (который может быть получен из Amersham). Такую смесь добавляют к комплексу матрица-олигонуклеотид. После добавления ДНК-полимеразы к данной смеси создают нить ДНК, идентичную матрице, за исключением мутированных оснований. Кроме того, такая новая нить ДНК будет содержать dCTP-(aS) вместо dCTP, который служит для ее защиты от расщепления эндонуклеазами рестрикции. После того как в матричной нити двунитевого гетеродуплекса делают одноцепочечный разрыв соответствующим ферментом рестрикции, матричную нить можно расщепить нуклеазой ExoIII или другой подходящей нуклеазой после области, которая содержит сайт (сайты), которые необходимо подвергнуть мутациям. Затем реакцию останавливают, чтобы оставить молекулу, которая является однонитевой только частично. Затем образуют полный двунитевой гомодуплекс ДНК, используя ДНК-полимеразу в присутствии всех четырех дезоксирибонуклеотидтрифосфатов, АТФ и ДНК-лигазы. Затем такой гомодуплексной молекулой трансформируют подходящую клетку-хозяина.
Как указано ранее, последовательность набора олигонуклеотидов имеет достаточную длину, чтобы гибридизоваться с матричной нуклеиновой кислотой, также, но необязательно, может содержать сайты рестрикции. Матрица ДНК может быть создана с помощью таких векторов, которые получены либо из векторов, основанных на бактериофаге M13, либо векторов, которые содержат начало репликации однонитевого фага, которые описаны в Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, ДНК, которую необходимо подвергнуть мутациям, должна быть встроена в один из таких векторов, чтобы создать однонитевую матрицу. Получение однонитевой матрицы описано в разделах 4.21-4.41 Sambrook et al., выше.
Согласно другому способу библиотека может быть создана благодаря получению наборов выше и ниже расположенных олигонуклеотидов, при этом каждый набор имеет множество олигонуклеотидов с разными последовательностями, а разные последовательности определяются наборами кодонов, представленными в последовательности олигонуклеотидов. Наборы выше и ниже расположенных олигонуклеотидов, наряду с последовательностью матричной нуклеиновой кислоты вариабельного домена, можно использовать в полимеразной цепной реакции, чтобы создать «библиотеку» продуктов ПЦР. Продукты ПЦР могут быть названы «кассетами нуклеиновых кислот», так как они могут быть слиты с другими родственными или неродственными последовательностями нуклеиновых кислот, например, для компонентов белка оболочки вируса и домена димеризации, с использованием разработанных способов молекулярной биологии.
Последовательность праймеров ПЦР содержит один или несколько сконструированных наборов кодонов для доступных для растворителя и имеющих высокое разнообразие положений в области CDR. Как описано выше, набор кодонов представляет собой набор разных триплетных нуклеотидных последовательностей, используемых для кодирования требуемых вариантов аминокислот.
Наборы олигонуклеотидов могут быть использованы в полимеразной цепной реакции с использованием последовательности матричной нуклеиновой кислоты вариабельной области в качестве матрицы для создания кассет нуклеиновых кислот. Последовательность матричной нуклеиновой кислоты вариабельной области может представлять любую часть легкой или тяжелой цепи иммуноглобулина, содержащую последовательности нуклеиновой кислоты-мишени (т.е. последовательности нуклеиновой кислоты, кодирующие аминокислоты, которые являются мишенью для замены). Последовательность матричной нуклеиновой кислоты вариабельной области представляет собой часть двунитевой молекулы ДНК, имеющей первую нить нуклеиновой кислоты и комплементарную вторую нить нуклеиновой кислоты. Последовательность матричной нуклеиновой кислоты вариабельной области содержит по меньшей мере часть вариабельного домена и имеет по меньшей мере одну CDR. В некоторых случаях последовательность матричной нуклеиновой кислоты вариабельной области содержит более чем одну CDR. Расположенная выше часть и расположенная ниже часть последовательности матричной нуклеиновой кислоты вариабельной области могут быть мишенью для гибридизации с представителями набора расположенных выше олигонуклеотидов и набора расположенных ниже олигонуклеотидов.
Первый олигонуклеотид из набора выше расположенных праймеров может гибридизоваться с первой нитью нуклеиновой кислоты, а второй олигонуклеотид из набора ниже расположенных праймеров может гибридизоваться со второй нитью нуклеиновой кислоты. Олигонуклеотидные праймеры могут содержать один или несколько наборов кодонов и могут быть сконструированы для гибридизации с частью последовательности матричной нуклеиновой кислоты вариабельной области. В случае применения таких олигонуклеотидов можно ввести два или несколько наборов кодонов в продукт ПЦР (т.е. кассету нуклеиновой кислоты) после ПЦР. Олигонуклеотидный праймер, который гибридизуется с областями последовательности нуклеиновой кислоты, кодирующей вариабельный домен антитела, содержит части, которые кодируют остатки CDR, которые выбирают в качестве мишеней для аминокислотной замены.
Наборы расположенных выше и расположенных ниже олигонуклеотидов также могут быть синтезированы так, чтобы включить сайты рестрикции в олигонуклеотидную последовательность. Такие сайты рестрикции могут облегчить инсерцию кассет нуклеиновой кислоты [т.е. продуктов реакции ПЦР] в вектор экспрессии, имеющий дополнительные последовательности антитела. В некоторых вариантах осуществления конструируют сайты рестрикции, чтобы облегчить клонирование кассет нуклеиновой кислоты без введения чужеродных последовательностей нуклеиновой кислоты или удаления исходной CDR или каркасных последовательностей нуклеиновой кислоты.
Кассеты нуклеиновой кислоты могут быть клонированы в подходящем векторе для экспрессии части или полной последовательности легкой или тяжелой цепи, содержащей созданные целевые аминокислотные замены. Согласно способам, подробно изложенным в изобретении, кассету нуклеиновой кислоты клонируют в векторе, обеспечивающем продукцию части или полной последовательности легкой или тяжелой цепи, слитой с полным или частью белка оболочки вируса (т.е. создание слитого белка), и представляют на поверхности частицы или клетки. Хотя доступны несколько типов векторов и они могут быть использованы при практическом осуществлении изобретения, подходящими являются фагмидные векторы, так как их можно относительно легко сконструировать и можно легко амплифицировать. Фагмидные векторы обычно содержат несколько компонентов, включая промоторы, сигнальные последовательности, гены для фенотипической селекции, начала репликации и другие необходимые компоненты, которые известны специалистам в данной области.
В другом варианте осуществления, в котором необходимо экспрессировать конкретную комбинацию вариантов аминокислот, кассета нуклеиновой кислоты содержит последовательность, которая способна кодировать весь или часть вариабельного домена тяжелой или легкой цепи и способна кодировать комбинации вариантов аминокислот. Для продуцирования антител, содержащих такие варианты аминокислот или комбинации вариантов аминокислот, как в библиотеке, кассеты нуклеиновой кислоты могут быть встроены в вектор экспрессии, содержащий дополнительную последовательность антитела, например полные или части вариабельных или константных доменов вариабельных областей легкой и тяжелой цепей. Такие дополнительные последовательности антител также могут быть слиты с другими последовательностями нуклеиновой кислоты, такими как последовательности, которые кодируют компоненты в виде белка оболочки вируса и поэтому обеспечивают продукцию слитого белка.
Векторы
Один аспект изобретения относится к реплицируемому экспрессирующему вектору, содержащему последовательность нуклеиновой кислоты, кодирующую генное слияние, при этом генное слияние кодирует слитый белок, включающий CDR-содержащий полипептид (такой, как вариабельный домен антитела) или вариабельный домен и константный домен антитела, слитый с полным или частью белка оболочки вируса. Также в изобретение включена библиотека разнообразных реплицируемых экспрессирующих векторов, содержащих множество генных слияний, кодирующих множество разных слитых белков, включая множество слитых полипептидов, созданных с разнообразными последовательностями, которые описаны выше. Векторы могут содержать несколько компонентов и могут быть сконструированы так, чтобы они позволяли перемещать вариабельный домен антитела из одного вектора в другой и/или создавать дисплей слитых белков в разных формах.
Примеры векторов включают фаговые векторы и фагмидные векторы (примеры которых приведены в настоящем описании и более подробно описаны выше). Фаговый вектор обычно имеет начало репликации фага, обеспечивающее репликацию фага и образование фаговых частиц. Обычно фаг представляет собой нитчатый бактериофаг, такой как M13, fl, fd, фаг Pf3 или их производные, или лямбдоидный фаг, такой как лямбда, 21, phi80, phi81, 82, 424, 434 и т.д., или его производное.
Примеры белков оболочки вируса включают белок инфекционности PIII (иногда также называемый p3), основной белок оболочки PVIII, Soc (T4), Hoc (T4), gpD (бактериофага лямбда), минорный белок оболочки бактериофага 6 (pVI) (нитчатый фаг; J. Immunol. Methods. 1999 Dec 10; 231(1-2):39-51), варианты основного белка оболочки бактериофага M13 (PS) (Protein Sci. 2000 Apr; 9(4):647-54). Слитый белок может быть представлен в виде дисплея на поверхности фага, и подходящие фаговые системы включают хелперный фаг M13KO7, M13R408, M13-VCS и Phi X 174, фаговую систему pJuFo (J. Virol. 2001 Aug; 75(15):7107-13.v), гиперфаг (Nat. Biotechnol. 2001 Jan; 19(1):75-8). В некоторых вариантах осуществления хелперным фагом является M13KO7, а белок оболочки представляет собой белок оболочки гена III фага M13. В некоторых вариантах осуществления хозяином является E. coli и дефицитные по протеазе штаммы E. coli. Векторы, такие как вектор fthl (Nucl. Acids Res. 2001 May 15; 29(10):E50-0), могут быть применимы для экспрессии слитого белка.
Вектор экспрессии также может иметь сигнальную последовательность секреции, слитую с ДНК, кодирующей CDR-содержащий слитый полипептид (например, каждая субъединица антитела или его фрагмент). Такая последовательность обычно локализована непосредственно с 5'-стороны от гена, кодирующего слитый белок, и поэтому будет транскрибироваться на амино-конце слитого белка. Однако в некоторых случаях показано, что сигнальная последовательность расположена в других положениях, отличных от положения с 5'-стороны от гена, кодирующего секретируемый белок. Мишенью такой последовательности является белок, с которым она связывается во внутренней мембране бактериальной клетки. ДНК, кодирующая сигнальную последовательность, может быть получена в виде фрагмента, вырезанного эндонуклеазой рестрикции из любого гена, кодирующего белок, который имеет сигнальную последовательность. Подходящие прокариотические сигнальные последовательности могут быть получены из генов, кодирующих, например, LamB или OmpF (Wong et al., Gene, 68:1931 (1983), MaIE, PhoA и другие гены. В одном из вариантов осуществления прокариотической сигнальной последовательностью для практического осуществления настоящего изобретения является сигнальная последовательность термостабильного энтеротоксина II E. coli (STII), которая описана в Chang et al., Gene 55:189 (1987), и/или malE.
Как указано выше, вектор также обычно содержит промотор для управления экспрессией слитого полипептида. Промоторы, в большинстве случаев используемые в прокариотических векторах, включают промоторную систему lac Z, промотор щелочной фосфатазы pho A (Ap), промотор бактериофага lPL (чувствительный к температуре промотор), промотор tac (гибридный промотор trp-lac, который регулируется репрессором lac), триптофановый промотор и промотор бактериофага T7. Общее описание промоторов приведено в разделе 17 Sambrook et al., выше. Хотя указанные промоторы являются наиболее широко используемыми промоторами, также могут быть использованы другие подходящие промоторы.
Вектор также может содержать другие последовательности нуклеиновой кислоты, например последовательности, кодирующие метки gD, эпитопы c-Myc, полигистидиновые метки, флуоресцирующие белки (например, GFP) или белок бета-галактозидазы, которые могут быть применимы для выявления или очистки слитого белка, экспрессированного на поверхности фага или клетки. Последовательности нуклеиновой кислоты, кодирующие, например, метку gD, также способствуют позитивной или негативной селекции клеток или вируса, экспрессирующего слитый белок. В некоторых вариантах осуществления метку gD сливают с вариабельным доменом антитела, который не слит с компонентом в виде белка оболочки вируса. Последовательности нуклеиновой кислоты, кодирующие, например, полигистидиновую метку, применимы для идентификации слитых белков, содержащих вариабельные домены антител, которые связываются с конкретным антигеном, с применением иммуногистохимии. Метки, применимые для выявления связывания с антигеном, могут быть слиты либо с вариабельным доменом антитела, не слитого с компонентом, представленным белком оболочки вируса, либо с вариабельным доменом антитела, слитым с компонентом, представленным белком оболочки вируса.
Другим полезным компонентом векторов, используемых при практическом осуществлении настоящего изобретения, являются гены для фенотипической селекции. Типичными генами для фенотипической селекции являются гены, кодирующие белки, которые придают клетке-хозяину резистентность к антибиотикам. В качестве иллюстрации для данной цели используют ген резистентности к ампициллину (ampr) и ген резистентности к тетрациклину (tetr).
Вектор также может включать последовательности нуклеиновой кислоты, содержащие уникальные сайты рестрикции и супрессируемые стоп-кодоны. Уникальные сайты рестрикции применимы для перемещения вариабельных доменов антител между разными векторами и системами экспрессии, особенно применимы для получения полноразмерных антител или антигенсвязывающих фрагментов в культурах клеток. Супрессируемые стоп-кодоны применимы для регулирования уровня экспрессии слитого белка и для облегчения очистки растворимых фрагментов антител. Например, амбер-стоп-кодон может быть считан как Gln в хозяине supE, делая возможным фаговый дисплей, хотя в хозяине без supE он считывается как стоп-кодон, давая растворимые фрагменты антител без слияния с белками оболочки фага. Такие синтетические последовательности могут быть слиты с одним или несколькими вариабельными доменами антител в векторе.
Иногда полезно применение векторных систем, которые позволяют легко выделять нуклеиновую кислоту, кодирующую представляющую интерес последовательность антитела, например CDR, имеющую варианты аминокислот, из векторной системы и помещать в другую векторную систему. Например, в векторной системе могут быть сконструированы подходящие сайты рестрикции для облегчения выделения последовательности нуклеиновой кислоты, кодирующей антитело или вариабельный домен антитела, имеющий варианты аминокислот. Последовательности рестрикции обычно выбирают так, чтобы они были уникальными в векторах, чтобы облегчить эффективное вырезание и лигирование в новые векторы. Антитела или вариабельные домены антител затем могут быть экспрессированы с векторов без чужеродных слитых последовательностей, таких как белки оболочки вируса или другие последовательности меток.
Между нуклеиновой кислотой, кодирующей вариабельный или константный домен антитела (ген 1) и компонент в виде белка оболочки вируса (ген 2), может быть встроена ДНК, кодирующая кодон терминации или стоп-кодон, такие кодоны терминации включают UAG (амбер), UAA (охра) и UGA (опал) (Microbiology, Davis et al., Harper and Row, New York, 1980, p. 237, 245-47 и 374). Кодон терминации или стоп-кодон, экспрессированный в клетке-хозяине дикого типа, приводит к синтезу белкового продукта гена 1 без связанного белка гена 2. Однако рост в супрессорной клетке-хозяине приводит к синтезу регистрируемых количеств слитого белка. Такие супрессорные клетки-хозяева хорошо известны и описаны, например супрессорный штамм E. coli (Bullock et al., BioTechniques 5:376-379 (1987)). Можно использовать любой приемлемый способ вместо такого кодона терминации в мРНК, кодирующей слитый полипептид.
Супрессируемый кодон может быть встроен между первым геном, кодирующим вариабельный или константный домен антитела, и вторым геном, кодирующим по меньшей мере часть белка оболочки фага. Альтернативно супрессируемый кодон терминации может быть встроен вблизи сайта слияния заменой последнего аминокислотного триплета в вариабельном домене антитела или первой аминокислоты в белке оболочки фага. Супрессируемый кодон терминации может быть локализован на C-конце домена димеризации или после него. Когда плазмиду, содержащую супрессируемый кодон, выращивают в супрессорной клетке-хозяине, она обеспечивает регистрируемую продукцию слитого полипептида, содержащего полипептид и белок оболочки. Когда плазмиду выращивают в несупрессорной клетке-хозяине, вариабельный домен антитела синтезируется по существу без слияния с белком оболочки фага вследствие терминации на встроенном супрессируемом триплете UAG, UAA или UGA. В несупрессорной клетке вариабельный домен антитела синтезируется и секретируется из клетки-хозяина вследствие отсутствия слитого белка оболочки фага, который в противном случае заякоривает его на мембране хозяина.
В некоторых вариантах осуществления CDR, подвергаемые разнообразию (рандомизации), могут иметь стоп-кодон, сконструированный в матричной последовательности (называемой в настоящем описании «стоп-матрицей»). Указанный признак обеспечивает выявление и селекцию успешно измененных последовательностей на основании успешного восстановления стоп-кодона(ов) в матричной последовательности благодаря включению олигонуклеотида(ов), содержащего последовательность(ти) из представляющих интерес вариантов аминокислот. Указанная особенность дополнительно проиллюстрирована в примерах ниже.
Вариабельные или константные домены легкой и/или тяжелой цепи антитела также могут быть слиты с дополнительной пептидной последовательностью, при этом дополнительные пептидные последовательности обеспечивают взаимодействие одного или нескольких слитых полипептидов на поверхности вирусной частицы или клетки. Такие пептидные последовательности в настоящем описании называют «доменами димеризации». Домены димеризации могут содержать по меньшей мере одну или несколько последовательностей димеризации, или по меньшей мере одну последовательность, содержащую остаток цистеина, или и то и другое. Подходящие последовательности димеризации включают последовательности белков, имеющих амфипатические альфа-спирали, в которых гидрофобные остатки равномерно распределены и позволяют образовывать димер благодаря взаимодействию гидрофобных остатков каждого белка; такие белки и части белков включают, например, области лейциновых молний. Домены димеризации также могут содержать один или несколько остатков цистеина (например, полученных в результате включения шарнирной последовательности антитела в домен димеризации). Остатки цистеина могут обеспечивать димеризацию благодаря образованию одной или нескольких дисульфидных связей. В одном из вариантов осуществления, в котором стоп-кодон присутствует после домена димеризации, домен димеризации содержит по меньшей мере один остаток цистеина. В некоторых вариантах осуществления домены димеризации расположены между вариабельным или константным доменом антитела и компонентом, представленным белком оболочки вируса.
В некоторых случаях вектор кодирует один полипептид антитело-фаг в форме одной цепи, содержащей, например, вариабельные области тяжелой и легкой цепей, слитые с белком оболочки. В таких случаях вектор считают «моноцистронным», экспрессирующим один транскрипт под контролем определенного промотора. Например, в векторе может быть использован промотор (такой, как промотор щелочной фосфатазы (AP) или Tac) для управления экспрессией моноцистронной последовательности, кодирующей домены VL и VH с линкерным пептидом между доменами VL и VH. Такая цистронная последовательность может быть связана на 5'-конце с сигнальной последовательностью (такой, как сигнальная последовательность malE E. coli или термостабильного энтеротоксина II (STII)) и на 3'-конце с полным или с частью белка оболочки вируса (такого, как белок бактериофага pIII). Слитый полипептид, кодируемый вектором согласно данному варианту, называют в настоящем описании «ScFv-pIII». В некоторых вариантах осуществления вектор дополнительно может содержать последовательность, кодирующую домен димеризации (такой, как лейциновая молния) на 3'-конце, между второй последовательностью вариабельного домена (например, VH) и последовательностью белка оболочки вируса. Слитые полипептиды, содержащие домен димеризации, способны димеризоваться с образованием комплекса двух полипептидов scFv (называемого в настоящем описании «(ScFv)2-pIII)»).
В других случаях вариабельные области тяжелой и легкой цепей могут быть экспрессированы в виде отдельных полипептидов, соответственно такой вектор является «бицистронным», обеспечивающим возможность экспрессии отдельных транскриптов. В таких векторах используют подходящий промотор, такой как промотор Ptac или PhoA, для управления экспрессией бицистронной матрицы. Первый цистрон, кодирующий, например, вариабельный и константный домен легкой цепи, может быть связан на 5'-конце с сигнальной последовательностью, такой как сигнальная последовательность malE E. coli или термостабильного энтеротоксина II (STII), и на 3'-конце с последовательностью нуклеиновой кислоты, кодирующей последовательность метки, такой как метка gD. Второй цистрон, кодирующий, например, вариабельный домен и константный домен CH1 тяжелой цепи, связан на 5'-конце с сигнальной последовательностью, такой как сигнальная последовательность malE E. coli или термостабильного энтеротоксина II (STII), и на 3'-конце с полным или с частью белка оболочки вируса.
В одном из вариантов осуществления вектора, который дает бицистронную матрицу и обеспечивает дисплей F(ab')2-pIII, подходящий промотор, такой как промотор Ptac или PhoA (AP), управляет экспрессией первого цистрона, кодирующего вариабельный и константный домен легкой цепи, функционально связанный на 5'-конце с сигнальной последовательностью, такой как сигнальная последовательность malE E. coli или термостабильного энтеротоксина II (STII), и на 3'-конце с последовательностью нуклеиновой кислоты, кодирующей последовательность метки, такой как метка gD. Второй цистрон кодирует, например, вариабельный и константный домен тяжелой цепи, функционально связанный на 5'-конце с сигнальной последовательностью, такой как сигнальная последовательность malE E. coli или термостабильного энтеротоксина II (STII), и на 3'-конце имеет домен димеризации, содержащий последовательность шарнира IgG и последовательность лейциновой молнии, за которой следует по меньшей мере часть белка оболочки вируса.
Дисплей слитых полипептидов
Слитые полипептиды CDR-содержащего полипептида (например, вариабельного домена антитела) могут быть представлены в виде дисплея на поверхности клетки, вируса или фагмидной частицы в различных формах. Такие формы включают одноцепочечный фрагмент Fv (scFv), F(ab)-фрагмент и мультивалентные формы таких фрагментов. Например, мультивалентные формы включают димеры ScFv, Fab или F(ab'), называемые в настоящем описании (ScFv)2, F(ab)2 и F(ab')2 соответственно. Мультимерные формы дисплея имеют преимущества в некоторых ситуациях, отчасти потому, что имеют более одного антигенсвязывающего сайта, что обычно приводит к идентификации клонов с более низкой аффинностью, а также обеспечивает возможность более эффективной сортировки редких клонов в ходе процесса селекции.
Способы представления слитых полипептидов, содержащих фрагменты антител, на поверхности бактериофага, хорошо известны в данной области, например описаны в описании патента номер WO 92/01047 и в настоящем описании. В других патентных публикациях WO 92/20791; WO 93/06213; WO 93/11236 и WO 93/19172 описаны родственные способы, и все публикации включены в данное описание в виде ссылки. В других публикациях показана идентификация антител с подвергнутым искусственной реаранжировке набором V-генов против различных антигенов, представленных на поверхности фага (например, H. R. Hoogenboom and G. Winter, J. Moд. Biol. 227 381-388 (1992); и как описано в WO 93/06213 и WO 93/11236).
Когда конструируют вектор для дисплея в форме scFv, в него включают последовательности нуклеиновой кислоты, кодирующие вариабельный домен легкой цепи антитела и вариабельный домен тяжелой цепи антитела. Обычно последовательность нуклеиновой кислоты, кодирующую вариабельный домен тяжелой цепи антитела, сливают с компонентом, представленным белком оболочки вируса. Один или оба вариабельных домена антитела могут иметь варианты аминокислот по меньшей мере в одной области CDR. Последовательность нуклеиновой кислоты, кодирующую вариабельный домен легкой цепи антитела, связывают с последовательностью вариабельного домена тяжелой цепи антитела последовательностью нуклеиновой кислоты, кодирующей пептидный линкер. Пептидный линкер обычно содержит примерно от 5 до 15 аминокислот. Необязательно, другие последовательности, кодирующие, например, метки, применимые для очистки или выявления, могут быть слиты на 3'-конце любой из последовательностей нуклеиновой кислоты, кодирующих вариабельный домен легкой цепи антитела или вариабельны домен тяжелой цепи антитела, или и с той и с другой последовательностью.
Когда конструируют вектор для дисплея F(ab), в него включают последовательности нуклеиновой кислоты, кодирующие вариабельные домены антитела и константные домены антитела. Нуклеиновую кислоту, кодирующую вариабельный домен легкой цепи, сливают с последовательностью нуклеиновой кислоты, кодирующей константный домен легкой цепи. Последовательность нуклеиновой кислоты, кодирующую вариабельный домен тяжелой цепи антитела, сливают с последовательностью нуклеиновой кислоты, кодирующей константный домен CH1 тяжелой цепи. Обычно последовательности нуклеиновой кислоты, кодирующие вариабельный и константные домены тяжелой цепи, сливают с последовательностью нуклеиновой кислоты, кодирующей полный или часть белка оболочки вируса. Один или оба вариабельных домена легкой или тяжелой цепи антитела могут иметь варианты аминокислот по меньшей мере в одной CDR. В некоторых вариантах осуществления вариабельный и константные домены тяжелой цепи экспрессируются в виде слияния по меньшей мере с частью белка оболочки вируса, а вариабельный и константные домены легкой цепи экспрессируются отдельно от белка оболочки вируса, слитого с тяжелой цепью. Тяжелые и легкие цепи связываются друг с другом ковалентными или нековалентными связями. Необязательно, другие последовательности, кодирующие, например, полипептидные метки, применимые для очистки или выявления, могут быть слиты на 3'-конце любой из последовательностей нуклеиновой кислоты, кодирующих константный домен легкой цепи антитела или константный домен тяжелой цепи антитела, или на концах обоих последовательностей.
В некоторых вариантах осуществления бивалентный компонент, например димер F(ab)2 или димер F(ab')2, используют для представления фрагментов антител с заменами вариантами аминокислот на поверхности частицы. Обнаружено, что димеры F(ab')2 в общем имеют такую же аффинность, как и димеры F(ab), в анализе связывания антигенов в растворе, но скорость распада комплекса для F(ab')2 снижена из-за более высокой авидности. Поэтому бивалентная форма (например, F(ab')2) является особенно применимой формой, так как позволяет идентифицировать клоны с более низкой аффинностью, а также обеспечивает возможность более эффективной сортировки редких клонов в ходе процесса селекции.
Введение векторов в клетки-хозяева
Векторы, сконструированные, как описано в изобретении, вводят в клетку-хозяина для амплификации и/или экспрессии. Векторы могут быть введены в клетки-хозяева с использованием стандартных способов трансформации, включая электропорацию, преципитацию фосфатом кальция и тому подобное. Если вектор представляет собой инфекционную частицу, такую как вирус, то вектор сам по себе обеспечивает проникновение в клетку-хозяина. Трансфекция клеток-хозяев, содержащих реплицируемый вектор экспрессии, который кодирует слияние генов и продукцию фаговых частиц, согласно стандартным способам дает фаговые частицы, в которых слитый белок представлен на поверхности фаговой частицы.
Реплицируемые экспрессирующие векторы вводят в клетки-хозяева, используя различные способы. В одном из вариантов осуществления векторы могут быть введены в клетки с использованием электропорации, как описано в WO/00106717. Клетки выращивают в культуре в стандартном культуральном бульоне, необязательно, в течение примерно 6-48 часов (или до OD600=0,6-0,8) примерно при 37ºC, и затем бульон центрифугируют и надосадок удаляют (например, сливают). В некоторых вариантах осуществления начальная очистка заключается в ресуспендировании осадка клеток в буферном растворе (например, 1,0 мМ HEPES, pH 7,4) с последующим повторным центрифугированием и удалением надосадка. Полученный в результате осадок клеток ресуспендируют в разбавленном глицерине (например, 5-20% об./об.) и снова центрифугируют с образованием клеточного осадка, а надосадок удаляют. Конечную концентрацию клеток получают ресуспендированием осадка клеток в воде или разбавленном глицерине до требуемой концентрации.
В некоторых вариантах осуществления реципиентной клеткой является компетентный по электропорации штамм E. coli по настоящему изобретению, который представляет собой штамм E. coli SS320 (Sidhu et al., Methods Enzymol. (2000), 328:333-363). Штамм SS320 получили скрещиванием клеток MC 1061 с клетками XL1-BLUE в условиях, достаточных для переноса эписомного фактора фертильности (плазмиды F') или XL1-BLUE в клетки MC1061. Штамм SS320 депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Virginia USA, 18 июня 1998, и депозит имеет номер доступа No. 98795. Любую эписому F', которая делает возможной репликацию фага в штамме, можно использовать в изобретении. Подходящие эписомы доступны из штаммов, депонированных в ATCC, или являются коммерчески доступными (CJ236, CSH18, DHF', JM101, JM103, JM105, JM107, JM109, JM110, KS1000, XL1-BLUE, 71-18 и другие).
Применение более высоких концентраций ДНК во время электропорации (примерно 10X) повышает эффективность трансформации и увеличивает количество ДНК, перенесенной при трансформации в клетки-хозяева. Применение высоких концентраций клеток также повышает эффективность (примерно 10X). Большие количества перенесенной ДНК дают большие по размеру библиотеки, имеющие более высокое разнообразие и представляющие большее количество уникальных представителей комбинаторной библиотеки. Трансформированные клетки обычно отбирают по росту на среде, содержащей антибиотики.
Селекция (сортировка) и скрининг агентов, связывающихся с выбранными мишенями
Применение фагового дисплея для идентификации агентов, связывающих антиген-мишень, с различными изменениями и вариантами в методике хорошо разработано в данной области. Один из способов заключается в конструировании семейства вариантов реплицируемых векторов, содержащих элемент регуляции транскрипции, функционально связанный с генным слиянием, кодирующим слитый полипептид, трансформации подходящих клеток-хозяев, культивировании трансформированных клеток с образованием фаговых частиц, при этом слитый полипептид представлен на поверхности фаговой частицы, с последующим осуществлением способа, который обеспечивает селекцию или сортировку посредством контакта рекомбинантных фаговых частиц с антигеном-мишенью, так что по меньшей мере часть популяции частиц связывается с мишенью, с целью увеличения и обогащения подгруппы частиц такими частицами, которые связываются, по сравнению с частицами, которые не связываются в процессе селекции. Отобранный пул может быть амплифицирован посредством инфицирования клеток-хозяев, таких как свежие клетки XL1-Blue, для другого раунда сортировки на той же самой мишени при другой или такой же жесткости. Затем проводят скрининг полученного в результате пула вариантов против антигенов-мишеней, чтобы идентифицировать новые связывающие белки с высокой аффинностью. Такие новые связывающие белки с высокой аффинностью могут быть использованы в качестве терапевтических средств, в качестве антагонистов или агонистов и/или в качестве диагностических средств и реагентов для исследования.
Слитые полипептиды, такие как вариабельные домены антител, содержащие варианты аминокислот, могут быть экспрессированы на поверхности фага, фагмидной частицы или клетки и затем подвергнуты селекции и/или скринингу в отношении способности представителей группы слитых полипептидов связываться с антигеном-мишенью, который обычно является представляющим интерес антигеном. Способы селекции в отношении связывающих мишень агентов также могут включать сортировку с использованием общего белка, обладающего аффинностью к вариабельным доменам антител, такого как белок L, или специфичного для метки антитела, которое связывается с антителом или фрагментами антитела, представленными в фаговом дисплее, которую можно использовать для обогащения библиотеки представителями, которые представляют подвергнутые правильной укладке фрагменты антитела (слитые полипептиды).
Белки-мишени, такие как рецептор DR5 и HER-2, могут быть выделены из природных источников или получены способами рекомбинации, известными в данной области. Последовательности DR5 человека и мыши представлены в таблице 1. Последовательность и получение HER-2 ECD описаны в Franklin MC., Carey KD., Vajdos FF., Leahy DJ., de Vos AM., Sliwkowski MX., Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex, Cancer Cell. 5(4):317-28, 2004. Последовательность аминокислот внеклеточного домена 23-646 HER-2 представлена в Protein DataBank Record 1S78 (2004). Антигены-мишени могут включать некоторые молекулы, представляющие терапевтический интерес.
Можно использовать различные способы селекции (сортировки) в отношении аффинности. Одним из примеров является способ с применением твердой подложки или сортировки на планшетах или сортировки на иммобилизованной мишени. Другим примером является способы связывания в растворе.
В случае способа с использованием твердой подложки белок-мишень может быть связан с подходящей твердой или полутвердой матрицей. Такие матрицы известны в данной области, такие как агарозные шарики, акриламидные шарики, стеклянные шарики, целлюлоза, различные акриловые сополимеры, гидроксиалкилметакрилатные гели, полиакриловые и полиметакриловые сополимеры, нейлон, нейтральные и ионные носители и тому подобное. Связывание белка-мишени с матрицей можно осуществить способами, описанными, например, в Methods in Enzymology, 44 (1976), или другими способами, известными в данной области.
После связывания антигена-мишени с матриксом иммобилизованную мишень подвергают контакту с библиотекой, экспрессирующей слитые полипептиды, в условиях, подходящих для связывания по меньшей мере подгруппы из популяции фаговых частиц с иммобилизованным антигеном-мишенью. Обычно условия, включая pH, ионную силу, температуру и тому подобное, будут имитировать физиологические условия. Частицы («связывающие агенты»), связанные с иммобилизованной мишенью, отделяют от частиц, которые не связаны с мишенью, промывкой. Условия промывки можно корректировать, чтобы выделить все связывающие агенты с высокой аффинностью. Комплекс агентов, связанных с иммобилизованной мишенью, можно диссоциировать разными способами. Такие способы включают конкурентную диссоциацию с использованием лиганда дикого типа (например, избытка антигена-мишени), изменение pH и/или ионной силы и способы, известные в данной области. Отбор связывающих агентов обычно заключается в элюировании с аффинной матрицы подходящим веществом для элюирования, таким как кислота, подобная 0,1 М HCl, или лиганд. Используя элюирование возрастающими концентрациями лиганда, можно элюировать представленные связывающие молекулы, имеющие возрастающую аффинность.
Связывающие агенты могут быть выделены и затем повторно амплифицированы в подходящих клетках-хозяевах посредством инфицирования клеток вирусными частицами, которые являются связывающими агентами (и при необходимости хелперным фагом, например, когда вирусной частицей является фагмидная частица), и клетки-хозяева культивируют в условиях, подходящих для амплификации частиц, на которых в виде дисплея представлен требуемый слитый полипептид. Затем фаговые частицы собирают и повторяют процесс селекции один или несколько раз вплоть до обогащения агентами, связывающими антиген-мишень. Можно использовать любое количество раундов селекции или сортировки. Один из способов селекции или сортировки может заключаться в выделении связывающих агентов, которые связываются с общим аффинным белком, таким как белок L, или антителом к полипептидной метке, присутствующей в представленном в дисплее полипептиде, таким как антитело к белку gD или полигистидиновой метке. Противоположная селекция может заключаться в одном или нескольких раундах селекции или сортировки для выделения связывающих агентов, которые проявляют нежелательное связывание с одним или несколькими антигенами, не являющимися мишенями.
Один аспект изобретения относится к селекции для библиотек по изобретению с использованием нового способа селекции, который назван «способ связывания в растворе». Изобретение обеспечивает сортировку в жидкой фазе с намного более высокой эффективностью по сравнению с обычными способами сортировки в растворе. Способ связывания в растворе можно использовать для поиска исходных связывающих агентов из случайной библиотеки или поиска улучшенных связывающих агентов в библиотеке, которая была сконструирована для повышения аффинности конкретного связывающего клона или группы клонов. Способ включает осуществление контакта множества полипептидов, таких как полипептиды, представленные в фаговом дисплее или фагмидных частицах (библиотеке), с антигеном-мишенью, меченым или слитым с молекулой метки. Меткой может быть биотин или другие остатки, для которых имеются специфичные связывающие агенты. Жесткость жидкой фазы можно варьировать, используя снижающиеся концентрации меченого антигена-мишени в первой жидкой фазе для связывания. Чтобы дополнительно увеличить жесткость после первой жидкой фазы для связывания, может следовать вторая жидкая фаза, имеющая высокую концентрацию немеченого антигена-мишени после начального связывания с меченой меткой в первой жидкой фазе. Обычно во второй фазе (если таковую включают) используют 100-1000-кратный избыток немеченой метки по сравнению с меченой меткой. Длительность периода инкубации первой жидкой фазы может изменяться от нескольких минут до одного-двух часов или более, чтобы достичь равновесия. Использование более короткого времени для связывания в указанной первой фазе может смещать отбор в сторону связывающих агентов, которые имеют высокую скорость образования комплекса. Продолжительность времени и температура инкубации во второй фазе можно варьировать, чтобы увеличить жесткость. Это обеспечивает смещение отбора в сторону связывающих агентов, которые имеют низкую скорость отсоединения мишени (скорость распада). После осуществления контакта множества полипептидов (представленных в фаговом дисплее/фагмидных частицах) с антигеном-мишенью фаговые или фагмидные частицы, которые связаны с мечеными мишенями, отделяют от фага, который не связан. Смесь частиц-мишеней из жидкой фазы для связывания выделяют посредством осуществления контакта смеси с компонентом в виде меченой мишени и обеспечения возможности для ее связывания с молекулой, которая связывает компонент в виде меченой мишени, в течение короткого периода времени (например, 2-5 минут). Начальная концентрация меченого антигена-мишени может быть в диапазоне примерно от 0,1 нМ до примерно 1000 нМ. Связанные частицы элируют, и они могут быть размножены для следующего раунда сортировки. В некоторых вариантах осуществления осуществляют несколько раундов сортировки, используя более низкую концентрацию меченого антигена-мишени при каждом раунде сортировки.
Например, начальная сортировка или селекция с использованием примерно от 100 до 250 нМ меченого антигена-мишени должна быть достаточной для улавливания в широком диапазоне аффинности, хотя такой фактор может быть определен эмпирически и/или может соответствовать требованию специалиста. Во втором раунде селекции можно использовать примерно от 25 до 100 нМ меченого антигена-мишени. В третьем раунде селекции можно использовать примерно от 0,1 до 25 нМ меченого антигена-мишени. Например, чтобы повысить аффинность связывающего агента, составляющую 100 нМ, может быть желательным начинать с 20 нМ и затем продолжать до 5 и 1 нМ меченой мишени, после чего следуют более низкие концентрации, такие как примерно 0,1 нМ меченого антигена-мишени.
Обычная сортировка в растворе заключается в применении шариков, подобных шарикам, покрытым стрептавидином, которая является очень громоздкой при использовании и часто приводит к очень низкой эффективности выделения фагового связывающего агента. Обычная сортировка в растворе с использованием шариков занимает намного больше чем 2-5 минут, и ее адаптация к высокопроизводительной автоматизации мало осуществима по сравнению с изобретением, описанным выше.
Как описано в настоящем описании, предпочтительно можно использовать комбинации способов с использованием твердой подложки и сортировки в растворе для выделения связывающих агентов, обладающих требуемыми свойствами. После селекции/сортировки на антигене-мишени в течение нескольких раундов обычно осуществляют скрининг отдельных клонов из выбранного пула, чтобы идентифицировать специфичные связывающие агенты с требуемыми свойствами/характеристиками. В некоторых вариантах осуществления способ скрининга осуществляют с помощью автоматизированных систем, чтобы обеспечить высокопроизводительный скрининг кандидатов в библиотеке.
Ниже описаны два основных способа скрининга. Однако другие способы, известные в данной области, также могут быть использованы в способах по изобретению. Первый способ скрининга включает ELISA-анализ фага с иммобилизованным антигеном-мишенью, который обеспечивает идентификацию конкретного связывающего клона в отличие от несвязывающего клона. Специфичность можно определить одновременным анализом клона на покрытой мишенью лунке и лунках, покрытых БСА или другим белком, отличным от мишени. Такой анализ можно автоматизировать для высокопроизводительного скрининга.
Один вариант относится к способу селекции вариабельного домена антитела, который связывается со специфичным антигеном-мишенью, из библиотеки вариабельных доменов антител посредством создания библиотеки реплицируемых экспрессирующих векторов, содержащей множество полипептидов; осуществления контакта библиотеки с антигеном-мишенью и по меньшей мере одним антигеном, отличным от антигена-мишени, в условиях, подходящих для связывания; отделения полипептидных связывающих агентов в библиотеке от несвязывающих агентов; идентификации связывающих агентов, которые связываются с антигеном-мишенью и не связываются с антигеном, отличным от антигена-мишени; элюирования связывающих агентов с антигена-мишени; и амплификации реплицируемых экспрессирующих векторов, содержащих полипептидный связывающий агент, который связывается с конкретным антигеном.
Второй скрининговый анализ представляет собой скрининговый анализ аффинности, который позволяет проводить скрининг в отношении клонов, которые обладают высокой аффинностью, в отличие от клонов, которые имеют низкую аффинность, высокопроизводительным способом. В анализе каждый клон анализируют либо с использованием, либо без первичной инкубации с антигеном-мишенью в определенной концентрации в течение периода времени (например, 30-60 минут) до нанесения кратковременно на покрытые мишенью лунки (например, на 5-15 минут). Затем связанный фаг измеряют обычным способом ELISA фага, например, с использованием конъюгатов анти-M13-HRP. Отношение сигнала связывания в двух лунках, из которых одну лунку предварительно инкубировали с мишенью, а другую лунку предварительно не инкубировали с антигеном-мишенью, является показателем аффинности. Выбор концентрации мишени для первой инкубации зависит от представляющего интерес диапазона аффинности. Например, если требуются связывающие агенты с аффинностью более высокой чем 10 нМ, то для первой инкубации часто используют 100 нМ мишени. После того как обнаружены связывающие агенты в конкретном раунде сортировки (селекции), может быть проведен скрининг таких клонов с помощью скринингового анализа аффинности, чтобы идентифицировать связывающие агенты с более высокой аффинностью.
Комбинации любых способов сортировки/селекции, описанных выше, могут быть использованы в способах скрининга. Например, в одном из вариантов осуществления полипептидные связывающие агенты сначала отбирают в отношении связывания с иммобилизованным антигеном-мишенью. Полипептидные связывающие агенты, которые связываются с иммобилизованным антигеном-мишенью, затем могут быть амплифицированы и подвергнуты скринингу в отношении связывания с антигеном-мишенью и в отношении отсутствия связывания с антигеном, отличным от антигена-мишени. Полипептидные связывающие агенты, которые специфично связываются с антигеном-мишенью, амплифицируют. Такие полипептидные связывающие агенты затем можно отобрать в отношении более высокой аффинности посредством осуществления контакта с меченым антигеном-мишенью в определенной концентрации, чтобы образовать комплекс, при этом диапазоны концентрации меченого антигена-мишени составляют примерно от 0,1 нМ до примерно 1000 нМ, комплексы выделяют, осуществляя контактирование с агентом, который связывается с меткой на антигене-мишени. Полипептидные связывающие агенты затем элюируют с меченого антигена-мишени и необязательно раунды селекции повторяют, при этом каждый раз используют более низкую концентрацию меченого антигена-мишени. Высокоаффинные полипептидные связывающие агенты, выделенные с использованием такого способа селекции, затем могут быть подвергнуты скринингу в отношении высокой аффинности, используя различные способы, известные в данной области, некоторые из которых описаны в настоящем описании.
Такие способы могут обеспечить возможность поиска клонов с высокой аффинностью без необходимости осуществлять длительные и сложные конкурентные анализы аффинности на большом количестве клонов. Напряженное проведение сложных анализов множества клонов часто создает существенные помехи для нахождения наилучших клонов при селекции. Указанный способ особенно применим при попытках повышения аффинности, когда несколько связывающих агентов со сходной аффинностью могут быть выделены в результате способа селекции. Разные клоны могут иметь очень разные эффективности экспрессии/представления на фаговых или фагмидных частицах. Существует большая вероятность выделения тех клонов, которые экспрессируются на более высоком уровне. То есть селекция может быть смещена в зависимости от уровня дисплея и экспрессии вариантов. Способ сортировки на основе связывания в растворе по изобретению может улучшить процесс селекции для нахождения связывающих агентов с высокой аффинностью. Такой способ представляет собой скрининговый анализ аффинности, который дает существенное преимущество быстрого и простого скрининга наилучших связывающих агентов.
Может быть проведен дополнительный отбор антител или антигенсвязывающих фрагментов в отношении функциональной активности, например активности антагониста или агониста. Например, анти-HER-2-антитела могут быть отобраны в отношении способности ингибировать фосфорилирование тирозина HER-2, пролиферацию злокачественных клеток или индуцировать апоптоз злокачественных клеток. Анализы для идентификации и измерения таких активностей описаны, например, в WO 98/17797.
Кроме того, анти-DR5-антитела могут быть отобраны в отношении способности индуцировать апоптоз злокачественных клеток и/или ингибировать функцию воспалительных клеток. В других вариантах анти-DR5-антитела отбирают в отношении способности конкурировать с Apo-2L за связывание с DR5. В других вариантах антитела против DR5 человека отбирают в отношении связывания с DR5 мыши и/или макак-крабоедов. Анализы для определения биологической активности могут быть проведены с использованием способов, известных в данной области, таких как фрагментация ДНК (смотри, например, Marsters et al., Curr. Biology, 6:1669 (1996)), инактивация каспазы, связывание DR5 (смотри, например, WO 98/51793, опубликованную 19 ноября 1998). Апоптоз может быть измерен с помощью идентификации конденсации цитоплазмы, отсутствия микроворсинок плазматической мембраны, сегментации ядра, деградации хромосомной ДНК или отсутствия митохондриальной функции. Такая активность может быть определена и измерена, например, в анализах жизнеспособности клеток (таких, как анализ с использованием Alamar синего или MTT-анализы), в анализе FACS, анализе инактивации каспазы, фрагментации ДНК (смотри, например, Nicoletti et al., J. Immunol. Methods, 139:271-279 (1991) и поли-АДФ-рибозополимеразы, «PARP», анализах расщепления, известных в данной области.
В одном из вариантов осуществления анализ апоптоза заключается в приготовлении двухкратных серийных разведений контрольного стандарта и анти-DR5-антитела в 96-луночных планшетах для культуры тканей. Лиганд Apo-2 (аминокислоты 114-281, описанный в PCT US00/17579) тестируют для сравнения. Клетки карциномы ободочной кишки человека Colo-205 (ATCC) (20000 клеток/лунку) высевают в 96-луночные планшеты. Планшеты инкубируют при 37º в течение 24 часов. В лунки добавляют AlamazBlue (Trek Diagnostic Systems, Inc.) в последние 3 часа 24-часового периода времени инкубации. Флуоресценцию регистрируют, используя флуориметр для 96-луночных планшетов при длине волны возбуждения 530 нМ и длине волны эмиссии 590 нМ. Результаты выражают в относительных единицах флуоресценции (RFU).
После того как связывающие агенты идентифицированы по связыванию с антигеном-мишенью и/или функциональным анализам, может быть экстрагирована нуклеиновая кислота. Затем экстрагированную ДНК можно непосредственно использовать для трансформации клеток-хозяев E. coli, или альтернативно могут быть амплифицированы кодирующие последовательности, например, с использованием ПЦР с подходящими праймерами и секвенированы любым обычным способом секвенирования. Вариабельный домен ДНК связывающих агентов может быть расщеплен ферментом рестрикции и затем встроен в вектор для экспрессии белка.
Популяции, содержащие полипептиды, имеющие CDR с ограниченным разнообразием последовательностей, созданные способами по изобретению, можно использовать для выделения связывающих агентов к различным мишеням, включая мишени, перечисленные на фиг.11, 15, 21A и 24A. Такие связывающие агенты могут содержать один или несколько вариантов CDR, содержащих разнообразные последовательности, созданные с использованием ограниченных кодонов. В некоторых вариантах осуществления изобретения вариантом CDR является CDRH3, имеющая разнообразие последовательностей, созданное аминокислотной заменой с помощью ограниченных наборов кодонов, и/или аминокислотными инсерциями, возникающими в результате варьирования длины CDRH3. Иллюстративные олигонуклеотиды, применимые для создания слитых полипептидов по изобретению, включают олигонуклеотиды, перечисленные на фиг.9A-D, фиг.20A-L и фиг.23. Можно комбинировать один или несколько вариантов CDR. В некоторых вариантах осуществления изменена только CDRH3. В других вариантах две или более CDR тяжелой цепи, включая CDRH3, являются вариантными. В других вариантах одна или несколько CDR тяжелой цепи, исключая CDRH3, являются вариантными. В некоторых вариантах осуществления по меньшей мере одна CDR тяжелой цепи и по меньшей мере одна CDR легкой цепи являются вариантными. В некоторых вариантах осуществления по меньшей мере одна, две, три, четыре, пять или все CDR H1, H2, H3, L1, L2 и L3 являются вариантными.
В некоторых случаях может быть полезным комбинирование одной или нескольких измененных CDR легкой цепи с новыми связывающими агентами, выделенными из популяции полипептидов, содержащих одну или несколько измененных CDR тяжелой цепи. Указанный способ может быть назван 2-стадийным способом. Пример 2-стадийного способа включает сначала определение связывающих агентов (в общем, связывающих агентов с более низкой аффинностью) в одной или нескольких библиотеках, созданных рандомизацией одной или нескольких CDR, при этом рандомизируемые CDR в каждой библиотеке отличаются или рандомизируют одну и ту же CDR, которую рандомизируют для создания разных последовательностей. Связывающие агенты из библиотеки тяжелой цепи затем можно рандомизировать, создавая разнообразие CDR среди CDR легкой цепи, например, способом мутагенеза, таким как способ Kunkel, или клонированием (монтажом (например, лигированием вместе разных последовательностей CDR)) новой библиотеки легкой цепи в существующие связывающие агенты тяжелой цепи, которые имеют только неизменную легкую цепь. Затем пул можно подвергнуть дополнительной сортировке, используя одну или несколько мишеней, чтобы идентифицировать связывающие агенты, имеющие повышенную аффинность. Например, связывающие агенты (например, связывающие агенты с низкой аффинностью), полученные в результате сортировки H1/H2/H3, могут быть слиты с библиотекой, имеющей разнообразие L1/L2/L3, чтобы заменить исходные фиксированные L1/L2/L3, при этом новые библиотеки затем дополнительно подвергают сортировке, используя представляющую интерес мишень, чтобы получить другой набор связывающих агентов (например, связывающих агентов с высокой аффинностью). Могут быть идентифицированы новые последовательности антител, которые имеют аффинность связывания с любым из множества антигенов-мишеней.
В некоторых вариантах осуществления библиотеки, содержащие полипептиды по изобретению, подвергают нескольким раундам сортировки, при этом каждый раунд сортировки включает осуществление контакта связывающих агентов, полученных в предыдущем раунде, с антигеном-мишенью, отличным от антигена-мишени в предыдущем раунде(ах). Предпочтительно, но необязательно, антигены-мишени являются гомологичными по последовательности, например являются представителями семейства родственных, но различающихся полипептидов, таких как без ограничения цитокины (например, подтипы интерферона альфа).
Создание библиотек, содержащих варианты CDR-содержащих полипептидов
Библиотеки вариантов полипептидов CDR могут быть созданы мутагенезом доступных для растворителя и/или имеющих высокое разнообразие положений по меньшей мере в одной CDR вариабельного домена антитела. Некоторые или все CDR могут быть мутированы с использованием способов по изобретению. В некоторых вариантах осуществления предпочтительным может быть создание библиотек разнообразных антител посредством мутирования положений в CDRH1, CDRH2 и CDRH3 с образованием одной библиотеки, или посредством мутирования положений в CDRL3 и CDRH3 с образованием одной библиотеки, или посредством мутирования положений в CDRL3 и CDRH1, CDRH2 и CDRH3 с образованием одной библиотеки.
Может быть создана библиотека вариабельных доменов антител, имеющих, например, мутации в доступных для растворителя и/или имеющих высокое разнообразие положениях в CDRH1, CDRH2 и CDRH3. Может быть создана другая библиотека, имеющая мутации в CDRL1, CDRL2 и CDRL3. Такие библиотеки также можно использовать в сочетании друг с другом, чтобы создать связывающие агенты с требуемыми аффинностями. Например, после одного или нескольких раундов селекции библиотек тяжелой цепи в отношении связывания с антигеном-мишенью в популяции связывающих агентов тяжелой цепи в следующих раундах селекции можно путем замены ввести библиотеку легкой цепи, чтобы повысить аффинность связывающих агентов.
В одном из вариантов осуществления библиотеку создают заменой исходных аминокислот ограниченным набором вариантов аминокислот в области CDRH1, CDRH2 и/или CDRH3 вариабельной области последовательности тяжелой цепи и/или в области CDRL3 вариабельной области последовательности легкой цепи. По изобретению такая библиотека может содержать множество последовательностей антител, при этом разнообразие последовательностей главным образом создано в области CDRH3 последовательности тяжелой цепи.
В одном из аспектов библиотеку создают в контексте последовательности гуманизированного антитела 4D5 или последовательности каркасных аминокислот последовательности гуманизированного антитела 4D5. В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52-54, 56 и 58 CDRH2, остатков 95, 96, 97, 98, 99, 100, 100a, 100b и 100c CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, показанными на фиг.8 для библиотеки «YSGR-A». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52-54, 56 и 58 CDRH2, остатков 95, 96, 97, 98, 99, 100, 100a, 100b и 100c CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.8 для библиотеки «YSGR-B». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52-54, 56 и 58 CDRH2, остатков 95, 96, 97, 98, 99, 100, 100a, 100b и 100c CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.8 для библиотеки «YSGR-C». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52-54, 56 и 58 CDRH2, остатков 95, 96, 97, 98, 99, 100, 100a, 100b и 100c CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.8 для библиотеки «YSGR-D». Положения аминокислот 100b и 100c могут иметь идентификационные обозначения разными буквами алфавита в зависимости от длины CDRH3, но такие положения являются последними двумя положениями CDRH3 перед положением 101. Примеры подходящих олигонуклеотидных последовательностей включают без ограничения последовательности, перечисленные на фиг.9A-D, и могут быть определены специалистом в данной области согласно критериям, указанным в настоящем описании.
В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19A для библиотеки «SAH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19A для библиотеки «SCH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19A для библиотеки «SFH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19A для библиотеки «SGH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19A для библиотеки «SIH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19A для библиотеки «SLH3». Так как длина CDRH3 варьирует, то последние два положения перед положением 101 могут иметь идентификационные обозначения разными буквами алфавита в зависимости от длины CDRH3, но такие положения являются двумя последними положениями CDRH3 перед положением 101. Примеры подходящих олигонуклеотидных последовательностей включают без ограничения последовательности, перечисленные на фиг.20A-20L, и могут быть определены специалистом в данной области согласно критериям, указанным в настоящем описании.
В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19B для библиотеки «SNH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19B для библиотеки «SPH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19B для библиотеки «SRH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19B для библиотеки «STH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19B для библиотеки «SWH3». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.19B для библиотеки «SYH3». Так как длина CDRH3 варьирует, то последние два положения перед положением 101 могут иметь идентификационные обозначения разными буквами алфавита в зависимости от длины CDRH3, но такие положения являются последними двумя положениями CDRH3 перед положением 101. Примеры подходящих олигонуклеотидных последовательностей включают без ограничения положения, перечисленные на фиг.20A-20L, и могут быть определены специалистом в данной области согласно критериям, указанным в настоящем описании.
В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.22 для библиотеки «SY». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.22 для библиотеки «SW». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.22 для библиотеки «SR». В некоторых вариантах осуществления библиотеку создают заменой по меньшей мере остатков 28 и 30-33 CDRH1, остатков 50, 52, 53, 54, 56 и 58 CDRH2, остатков 95-100m CDRH3 и остатков 91-94 и 96 CDRL3 аминокислотами, которые показаны на фиг.22 для библиотеки «SF». Так как длина CDRH3 варьирует, то последние два положения перед положением 101 могут иметь идентификационные обозначения разными буквами алфавита в зависимости от длины CDRH3, но такие положения являются последними двумя положениями CDRH3 перед положением 101. Примеры подходящих олигонуклеотидных последовательностей включают без ограничения последовательности, перечисленные на фиг.23, и могут быть определены специалистом в данной области согласно критериям, указанным в настоящем описании.
В некоторых вариантах осуществления библиотеку создают, объединяя разные библиотеки. В одном из вариантов осуществления библиотека «SXH3» в используемом в настоящем описании смысле включает библиотеки SAH3, SCH3, SFH3, SGH3, SIH3, SLH3, SNH3, SPH3, SRH3, STH3, SWH3 и SYH3. В другом варианте осуществления библиотека «SX-поверхностная» содержит библиотеки «SY», «SW», «SR» и «SF».
В другом варианте осуществления используют разные конструкции CDRH3 для выделения высокоаффинных связывающих агентов и для выделения связывающих агентов для различных эпитопов. Для получения разнообразия в CDRH3 могут быть сконструированы несколько библиотек по отдельности с разными длинами H3 и затем объединены для отбора связывающих агентов к антигенам-мишеням. Диапазон длин CDRH3, созданных в такой библиотеке, может составлять 10-21, 11-21, 12-21, 13-21, 14-21, 15-21, 16-21, 17-21, 18-21, 19-21, 20-21 аминокислот, хотя также могут быть созданы длины, отличные от указанных. Разнообразие также может быть создано в CDRH1 и CDRH2, как указано выше. В одном из вариантов осуществления библиотеки разнообразие в H1 и H2 создают, используя олигонуклеотиды, показанные на фиг.9A-D, 20A-L и фиг.23. Также можно использовать другие олигонуклеотиды с разными последовательностями. Олигонуклеотиды могут быть использованы по отдельности или объединены в виде любой из множества комбинаций, в зависимости от необходимости и желаний специалиста. В некоторых вариантах осуществления рандомизированные положения в CDR тяжелой цепи включают положения, перечисленные на фиг.8, 9, 11, 15, 19, 21, 22, 23 и 24.
Несколько библиотек могут быть объединены и подвергнуты сортировке с использованием способов селекции на твердой подложке и сортировки в растворе, которые описаны в настоящем описании. Можно применять различные способы сортировки. Например, один вариант заключается в сортировке на мишени, связанной с твердым материалом, с последующей сортировкой в отношении метки, которая может присутствовать на слитом полипептиде (например, анти-gD-метка), и следующей другой сортировкой на мишени, связанной с твердым материалом. Альтернативно библиотеки сначала могут быть подвергнуты сортировке на мишени, связанной с твердой поверхностью, затем элюированные связывающие агенты сортируют, используя связывание в растворе со снижающимися концентрациями антигена-мишени. Использование комбинаций разных способов сортировки обеспечивает минимизацию селекции только высокоэкспрессируемых последовательностей и обеспечивает селекцию ряда разных высокоаффинных клонов.
При исследовании связывающих агентов, выделенных из объединенных библиотек, которые описаны выше, обнаружено, что в некоторых случаях аффинность может быть дополнительно повышена благодаря получению ограниченного разнообразия в легкой цепи. Разнообразие легкой цепи может быть создано, но необязательно, изменением положений аминокислот 91-96 в CDRL3 или их подгруппы. В одном из вариантов осуществления рандомизированными положениями являются положения, перечисленные на фиг.8, 9, 11, 15, 19, 21, 22, 23 и 24.
Высокоаффинные связывающие агенты, выделенные из библиотек согласно указанным вариантам, легко получают в бактериальных и эукариотических культурах клеток с высоким выходом. Векторы могут быть сконструированы для того, чтобы легко выделять последовательности, такие как метки gD, последовательности компонента в виде белка оболочки вируса, и/или добавлять в последовательности константной области, чтобы получить продукцию полноразмерных антител или антигенсвязывающих фрагментов с высоким выходом. Любую комбинацию наборов кодонов и CDR можно изменить способами по изобретению.
Векторы, клетки-хозяева и способы рекомбинации
Для рекомбинантного получения полипептида антитела по изобретению кодирующую его нуклеиновую кислоту выделяют и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую антитело, легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела). Имеется множество векторов. Выбор вектора отчасти зависит от используемой клетки-хозяина. В общем, клетки-хозяева имеют либо прокариотическое, либо эукариотическое (обычно от млекопитающих) происхождение.
Создание антител с использованием прокариотических клеток-хозяев:
Конструирование векторов
Полинуклеотидные последовательности, кодирующие полипептидные компоненты антитела по изобретению, могут быть получены с использованием стандартных способов рекомбинации. Требуемые полинуклеотидные последовательности могут быть выделены и секвенированы из продуцирующих антитела клеток, таких как клетки гибридомы. Альтернативно полинуклеотиды могут быть синтезированы с использованием синтезатора нуклеотидов или способов ПЦР. После получения последовательности кодирующие полипептиды встраивают в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в прокариотических хозяевах. Множество векторов, которые доступны и известны в данной области, можно использовать в целях настоящего изобретения. Отбор подходящего вектора главным образом будет зависеть от размера нуклеиновых кислот, встраиваемых в вектор, и конкретной клетки-хозяина, которую необходимо трансформировать вектором. Каждый вектор содержит различные компоненты, в зависимости от его функции (амплификация или экспрессия гетерологичного полинуклеотида или и то и другое) и его совместимости с конкретной клеткой-хозяином, в которой он находится. Компоненты вектора обычно включают без ограничения: начало репликации, маркерный ген для селекции, промотор, участок связывания с рибосомой (RBS), сигнальную последовательность, вставку гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
В общем, плазмидные векторы, содержащие репликон и регуляторные последовательности, которые получают из вида, совместимого с клеткой-хозяином, используют с такими хозяевами. Вектор обычно несет сайт репликации, а также маркерные последовательности, которые способны обеспечивать фенотипическую селекцию в трансформированных клетках. Например, E. coli обычно трансформируют, используя pBR322, плазмиду, получаемую из вида E. coli. pBR322 содержит гены, кодирующие резистентность к ампициллину (Amp) и тетрациклину (Tet) и поэтому обеспечивает простые способы идентификации трансформированных клеток. pBR322, ее производные или другие плазмиды микроорганизмов или бактериофаги также могут содержать или могут быть модифицированы так, чтобы они содержали промоторы, которые могут быть использованы микроорганизмом для экспрессии эндогенных белков. Примеры производных pBR322, используемых для экспрессии конкретных антител, подробно описаны в Carter et al., патент США No. 5648237.
Кроме того, фаговые векторы, содержащие репликон и регуляторные последовательности, которые совместимы с микроорганизмом-хозяином, могут быть использованы в качестве трансформирующих векторов с такими хозяевами. Например, бактериофаг, такой как λGEM.TM.-11, можно использовать для получения рекомбинантного вектора, который можно применять для трансформации чувствительных клеток-хозяев, таких как E. coli LE392.
Вектор экспрессии по изобретению может содержать две или более пар промотор-цистрон, каждая из которых кодирует полипептидные компоненты. Промотор представляет собой нетранслируемую регуляторную последовательность, расположенную выше (5') от цистрона, которая модулирует его экспрессию. Прокариотические промоторы обычно делят на два класса, индуцируемые и конститутивные. Индуцируемым промотором является промотор, который инициирует повышенные уровни транскрипции цистрона, находящегося под его контролем, в ответ на изменения условий культивирования, например присутствие или отсутствие питательного вещества или изменение температуры.
Большое количество промоторов, узнаваемых различными возможными клетками-хозяевами, хорошо известно. Выбранный промотор может быть функционально связан с ДНК цистрона, кодирующей легкую или тяжелую цепь, посредством выделения промотора из исходной ДНК с помощью расщепления ферментами рестрикции и встраивания выделенной промоторной последовательность в вектор по изобретению. И нативную промоторную последовательность, и многие гетерологичные промоторы можно использовать для управления амплификацией и/или экспрессией генов-мишеней. В некоторых вариантах осуществления используют гетерологичные промоторы, так как они в общем обеспечивают более высокую транскрипцию и более высокие уровни экспрессированного гена-мишени по сравнению с нативным промотором полипептида-мишени.
Промоторы, подходящие для применения в случае прокариотических хозяев, включают промотор PhoA, промоторные системы β-галактамазы и лактозы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac или trc. Однако подходящими также являются и другие промоторы, которые являются функциональными в бактериях (такие, как другие известные бактериальные или фаговые промоторы). Их нуклеотидные последовательности опубликованы, поэтому специалисты могут функционально лигировать их с цистронами, кодирующими легкие и тяжелые цепи мишени (Siebenlist et al. (1980) Cell 20:269), используя линкеры или адапторы, чтобы получить любые требуемые сайты рестрикции.
В одном из аспектов изобретения каждый цистрон в рекомбинантном векторе содержит компонент в виде последовательности сигнала секреции, который управляет перемещением экспрессированных полипептидов через мембрану. В общем, сигнальная последовательность может быть компонентом вектора, или она может быть частью ДНК полипептида-мишени, которую встраивают в вектор. Сигнальная последовательность, выбранная для цели настоящего изобретения, должна представлять собой последовательность, которая узнается и процессируется (т.е. отщепляется сигнальной пептидазой) в клетке-хозяине. Для прокариотических клеток-хозяев, которые не узнают и не процессируют сигнальные последовательности, нативные по отношению к гетерологичным полипептидам, сигнальную последовательность заменяют выбранной прокариотической сигнальной последовательностью, например, из группы, состоящей из лидеров щелочной фосфатазы, пенициллазы, Ipp или термостабильного энтеротоксина II (STII), LamB, PhoE, PelB, OmpA и MBP. В одном из вариантов осуществления изобретения сигнальными последовательностями, используемыми в обоих цистронах системы экспрессии, являются сигнальные последовательности STII или их варианты.
В другом аспекте продуцирование иммуноглобулинов по изобретению может происходить в цитоплазме клетки-хозяина и поэтому не требуется присутствие сигнальных последовательностей секреции в каждом цистроне. В этом отношении легкие и тяжелые цепи иммуноглобулинов экспрессируются, подвергаются укладке и сборке с образованием функциональных иммуноглобулинов в цитоплазме. Некоторые штаммы-хозяева (например, штаммы E. coli trxB -) обеспечивают условия в цитоплазме, которые благоприятны для образования дисульфидной связи, таким образом обеспечивая правильную укладку и сборку экспрессированных субъединиц белка. Proba and Pluckthun Gene, 159:203 (1995).
Настоящее изобретение относится к системе экспрессии, в которой количественное отношение экспрессированных полипептидных компонентов можно модулировать, чтобы максимизировать выход секретированных и правильно собранных антител по изобретению. Такое модулирование осуществляют по меньшей мере частично благодаря одновременному модулированию интенсивности трансляции полипептидных компонентов.
Один из способов модулирования интенсивности трансляции описан в Simmons et al., патент США No. 5840523. В способе используют варианты области инициации трансляции (TIR) в цистроне. Для данной TIR может быть создана серия вариантов аминокислотных последовательностей или последовательностей нуклеиновых кислот с определенным диапазоном интенсивностей трансляции, таким образом обеспечивая удобные средства регулирования указанного фактора для получения требуемого уровня экспрессии конкретной цепи. Варианты TIR могут быть созданы обычными способами мутагенеза, которые приводят к изменениям кодонов, которые могут изменять аминокислотную последовательность, хотя предпочтительны молчащие изменения в нуклеотидной последовательности. Изменения в TIR могут включать, например, изменения количества или расположения последовательностей Шайна-Далгарно наряду с изменениями сигнальной последовательности. Одним из способов создания мутантных сигнальных последовательностей является создание «банка кодонов» в начале кодирующей последовательности, который не изменяет аминокислотную последовательность сигнальной последовательности (т.е. изменения являются молчащими). Это можно осуществить благодаря изменению третьего положения нуклеотида в каждом кодоне; кроме того, некоторые аминокислоты, такие как лейцин, серин и аргинин, имеют множественные первые и вторые положения, которые могут добавлять сложность при получении банка. Такой способ мутагенеза подробно описан в Yansura et al. (1992) Methods: A Companion to Methods in Enzymol. 4:151-158.
В некоторых вариантах осуществления создают набор векторов с диапазоном интенсивности TIR для каждого цистрона. Такой ограниченный набор обеспечивает сравнение уровней экспрессии каждой цепи, а также выхода требуемых продуктов в виде антител при разных комбинациях силы TIR. Силу TIR можно определить количественным анализом уровня экспрессии репортерного гена, как подробно описано в Simmons et al., патент США No. 5840523. На основании сравнения интенсивности трансляции отбирают требуемые отдельные TIR, которые необходимо объединить в экспрессирующих векторных конструкциях по изобретению.
Прокариотические клетки-хозяева, подходящие для экспрессии антител по изобретению, включают Archaebacteria и Eubacteria, такие как грамотрицательные или грамположительные организмы. Примеры применимых бактерий включат Escherichia (например E. coli), Bacilli (например, B. subtilis), Enterobacteria, виды Pseudomonas (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном из вариантов осуществления используют грамотрицательные клетки. В одном из вариантов осуществления для изобретения используют клетки E. coli в качестве хозяев. Примеры штаммов E. coli включат штамм W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, D C: American Society for Microbiology, 1987), p. 1190-1219; ATCC депозит No. 27325) и его производные, включая штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA) ptr3 lac Ig lacL8 ΔompTΔ(nmpc-fepE) degP41 kanR (патент США No. 5639635). Также подходящими являются другие штаммы и их производные, такие как E. coli 294 (ATCC 31446), E. coli B, E. coliλ 1776 (ATCC 31537) и E. coli RV308 (ATCC 31608). Приведенные примеры являются иллюстративными, а не ограничивающими. Способы конструирования производных любой из указанных выше бактерий, имеющих определенные генотипы, известны в данной области и описаны, например, в Bass et al., Proteins, 8:309-314 (1990). Обычно необходимо отбирать подходящие бактерии, принимая во внимание способность репликона к репликации в клетках бактерии. Например, E. coli, Serratia или виды Salmonella могут подходить для использования в качестве хозяина, когда используют хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410 для введения репликона. Обычно клетка-хозяин должна секретировать минимальные количества протеолитических ферментов и желательно могут быть введены дополнительные ингибиторы протеаз в культуру клеток.
Продукции антител
Клетки-хозяева трансформируют описанными выше экспрессирующими векторами и культивируют в подходящей питательной среде, модифицированной соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
Трансформация означает введение ДНК в прокариотического хозяина так, чтобы ДНК была реплицируемой либо в виде внехромосомного элемента, либо в виде интегрированного в хромосому элемента. В зависимости от используемой клетки-хозяина трансформацию осуществляют, используя стандартные способы, подходящие для таких клеток. Обработку кальцием с использованием хлорида кальция обычно применяют в случае бактериальных клеток, которые имеют прочные барьеры в виде клеточных стенок. В другом способе трансформации используют полиэтиленгликоль/ДМСО. В еще одном способе используют электропорацию.
Прокариотические клетки, используемые для получения полипептидов по изобретению, выращивают в средах, известных в данной области и подходящих для культивирования выбранных клеток-хозяев. Примеры подходящих сред включают бульон Луриа (LB) плюс необходимые добавки питательных веществ. В некоторых вариантах осуществления среда также содержит агент для селекции, выбранный на основе конструкции экспрессирующего вектора, избирательно позволяющий расти прокариотическим клеткам, содержащим вектор экспрессии. Например, в среду добавляют ампициллин для роста клеток, экспрессирующих ген резистентности к ампициллину.
Другие необходимые добавки, кроме источников углерода, азота и неорганического фосфата, также могут быть включены в подходящих концентрациях посредством введения по отдельности или в виде смеси с другой добавкой или средой, такой как комплексный источник азота. Необязательно, культуральная среда может содержать один или несколько восстановителей, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликоллата, дитиоэритритола и дитиотреитола.
Прокариотические клетки-хозяева культивируют при подходящих температурах. Для роста E. coli можно использовать, например, диапазоны температур примерно от 20ºC до примерно 39ºC, примерно от 25ºC до примерно 37ºC и/или примерно 30ºC. Значение pH среды может быть любым в диапазоне pH примерно от 5 до примерно 9, главным образом в зависимости от организма-хозяина. Для E. coli pH может составлять примерно от 6,8 до примерно 7,4 и может составлять примерно 7,0.
Если в экспрессирующем векторе по изобретению используют индуцируемый промотор, то экспрессию белка индуцируют в условиях, подходящих для активации промотора. В одном из аспектов по изобретению используют промоторы PhoA для регулирования транскрипции полипептидов. Соответственно трансформированные клетки-хозяева культивируют в ограниченной по фосфату среде для индукции. Ограниченной по фосфату средой может быть среда C.R.A.P (смотри, например, Simmons et al., J. Immunol. Methods (2002), 263:133-147). Можно использовать множество других индукторов в соответствии с используемой векторной конструкцией, как известно в данной области.
В одном из вариантов осуществления экспрессированные полипептиды по настоящему изобретению секретируются и извлекаются из периплазмы клеток-хозяев. Выделение белка обычно заключается в разрушении микроорганизма, обычно такими способами, как осмотический шок, обработка ультразвуком или лизис. После разрушения клеток клеточные обломки или целые клетки могут быть удалены центрифугированием или фильтрованием. Белки могут быть дополнительно очищены, например, аффинной хроматографией на смоле. Альтернативно белки могут быть транспортированы в культуральную среду и выделены из нее. Клетки могут быть удалены из культуры, и надосадок культуры может быть профильтрован и сконцентрирован для дополнительной очистки полученных белков. Экспрессированные полипептиды могут быть затем выделены и идентифицированы с использованием широко известных способов, таких как электрофорез в полиакриламидном геле (ПААГ) и Вестерн-блот-анализ.
В одном из аспектов изобретения продуцирование антител осуществляют в больших количествах способом ферментации. Доступны различные крупномасштабные способы ферментации с подпиткой для получения рекомбинантных белков. Крупномасштабные ферментеры имеют емкость по меньшей мере 1000 литров; в некоторых вариантах осуществления крупномасштабные ферментеры имеют емкость примерно от 1000 до 100000 литров. В таких ферментерах используют лопастные мешалки для распределения кислорода и питательных веществ, особенно глюкозы (общий источник углерода/энергии). Ферментация в малом масштабе обычно относится к ферментации в ферментере, емкость которого составляет не более чем примерно 100 литров и может составлять примерно от 1 литра до примерно 100 литров.
В способе ферментации индукцию экспрессии белка обычно инициируют после того, как клетки были выращены в подходящих условиях до требуемой плотности, например, до OD550, составляющей примерно 180-220, на такой стадии клетки находятся в ранней стационарной фазе. Можно использовать множество индукторов в соответствии с используемой векторной конструкцией, как известно в данной области и описано выше. Клетки можно выращивать в течение более коротких периодов до индукции. Клетки обычно индуцируют примерно в течение 12-50 часов, хотя можно использовать более длительные или более короткие периоды времени инкубации.
Чтобы повысить выход продукции и качество полипептидов по изобретению, можно модифицировать различные условия ферментации. Например, чтобы улучшить правильную сборку и укладку секретируемых полипептидов антител, можно использовать дополнительные векторы, сверхэкспрессирующие белки шапероны, такие как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил-цис,транс-изомераза с активностью шаперона), для котрансфекции прокариотических клеток-хозяев. Показано, что белки-шапероны облегчают правильную укладку и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al. (1999) J. Bio. Chem. 274:19601-19605; Georgiou et al., патент США No. 6083715; Georgiou et al., патент США No. 6027888; Bothmann and Plucktthun (2000) J. Biol Chem. 275:17100-17105; Ramm and Pluckthun (2000) J. Biol. Chem. 275:17106- 17113; Arie et al. (2001) Mol. Microbiol. 39:199-210.
Чтобы минимизировать протеолиз экспрессированных гетерологичных белков (особенно белков, которые являются протеолитически чувствительными), для настоящего изобретения можно использовать некоторые штаммы-хозяева, дефицитные по протеолитическим ферментам. Например, штаммы клеток-хозяев могут быть модифицированы, чтобы осуществить генетическую мутацию(ии) в генах, кодирующих известные бактериальные протеазы, такие как протеаза III, Ompt, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их комбинации. Некоторые дефицитные по протеазам штаммы E. coli доступны и описаны, например, в Joly et al. (1998), выше; Georgiou et al., патент США No. 5264365; Georgiou et al., патент США No. 5508192; Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
В одном из вариантов осуществления штаммы E. coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, сверхэкспрессирующими один или несколько белков-шаперонов, используют в качестве клеток-хозяев в системе экспрессии по изобретению.
Очистка антител
В одном из вариантов осуществления белок антитела, полученный по изобретению, дополнительно очищают, чтобы получить препараты, которые в значительной степени гомогенны, для дальнейших анализов и применений. Можно использовать стандартные способы очистки белков, известные в данной области. Примерами подходящих способов очистки являются следующие способы: фракционирование на иммуноаффинной или ионообменной колонке, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния или на катионообменной смоле, такой как DEAE, хроматофокусировка, SDS-ПААГ, преципитация сульфатом аммония и гель-фильтрация с использованием, например, сефадекса G-75.
В одном из аспектов белок A, иммобилизованный на твердой фазе, используют для иммуноаффинной очистки продуктов в виде антител по изобретению. Белок A представляет собой белок клеточной стенки с молекулярной массой 41 кД Staphylococcus aureus, который связывается с высокой аффинностью с областью Fc антител. Lindmark et al. (1983) J. Immunol. Meth. 62:1-13. В некоторых вариантах осуществления твердой фазой, на которой иммобилизован белок A, является колонка, имеющая стеклянную поверхность или поверхность из диоксида кремния. В некоторых вариантах осуществления твердой фазой, на которой иммобилизован белок A, является стеклянная колонка с контролируемым размером пор или колонка с кремниевой кислотой. В некоторых применениях колонка покрыта реагентом, таким как глицерин, чтобы попытаться предотвратить неспецифичную адгезию загрязняющих веществ.
В качестве первой стадии очистки препарат, полученный из культуры клеток, как описано выше, наносят на твердую фазу с иммобилизованным белком A, обеспечивая специфичное связывание представляющего интерес антитела с белком A. Затем твердую фазу промывают, чтобы удалить примеси, неспецифично связанные с твердой фазой. Наконец, представляющее интерес антитело извлекают с твердой фазы элюированием.
Создание антител с использованием эукариотических клеток-хозяев:
Компоненты векторов обычно включают без ограничения один или несколько из следующих компонентов: сигнальную последовательность, начало репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(i) Компонент - сигнальная последовательность
Вектор для применения в эукариотической клетке-хозяине также может содержать сигнальную последовательность или другой полипептид, имеющий специфичный сайт расщепления на N-конце представляющего интерес зрелого белка или полипептида. В некоторых вариантах осуществления выбранная гетерологичная сигнальная последовательность обычно представляет собой последовательность, которая узнается и процессируется (т.е. отщепляется сигнальной пептидазой) клеткой-хозяином. Для экспрессии в клетках млекопитающих имеются сигнальные последовательности млекопитающих, а также вирусные лидеры секреции, например, сигнал простого герпеса gD.
ДНК для такой области предшественника лигируют в рамке считывания с ДНК, кодирующей антитело.
(ii) Начало репликации
В общем, компонент, представленный началом репликации, не является необходимым для экспрессирующих векторов млекопитающих. Например, начало SV40 обычно можно использовать только потому, что оно содержит ранний промотор.
(iii) Компонент - ген для селекции
Экспрессирующие и клонирующие векторы могут содержать ген для селекции, также называемый селектируемым маркером. Обычно селектируемые гены кодируют белки, которые (a) придают резистентность к антибиотикам или другим токсинам, например к ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют ауксотрофные дефициты в соответствующем случае или (c) снабжают необходимыми питательными веществами, недоступными из сложных сред.
В одном примере схемы селекции используют лекарственное средство для задержки роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, придающий резистентность к лекарственному средству, и таким образом выживают в режиме селекции. В примерах такой доминантной селекции используют лекарственные средства неомицин, микофеноловую кислоту и гигромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются маркеры, которые обеспечивают возможность идентификации клеток, компетентных в отношении поглощения нуклеиновой кислоты антитела, такие как гены DHFR, тимидинкиназы, металлопротеина-I и -II (например, гены металлопротеинов приматов), аденозиндезаминазы, орнитиндекарбоксилазы и т.д.
Например клетки, трансформированные селектируемым геном DHFR, сначала идентифицируют культивированием всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином при использовании DHFR дикого типа является линия клеток яичника китайского хомячка (CHO), дефицитных по активности DHFR (например, ATCC CRL-9096).
Альтернативно клетки-хозяева (особенно хозяева дикого типа, которые содержат эндогенную DHFR), трансформированные или котрансфицированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), можно отбирать по росту клеток в среде, содержащий агент для селекции, соответствующий селектируемому маркеру, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418. Смотри патент США No. 4965199.
(iv) Промоторный компонент
Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей полипептид антитела. Известны промоторные последовательности для эукариот. Практически все эукариотические гены имеют AT-богатую область, расположенную примерно на 25-30 оснований выше сайта инициации транскрипции. Другой последовательностью, обнаруживаемой на 70-80 оснований выше страта транскрипции многих генов, является область CNCAAT (SEQ ID NO:585), где N может быть любым нуклеотидом. На 3'-конце большинства эукариотических генов находится последовательность AATAAA (SEQ ID NO:586), которая может быть сигналом для добавления поли-A-хвоста к 3'-концу кодирующей последовательности. Все такие последовательности соответствующим образом встраивают в эукариотические экспрессирующие векторы.
Транскрипция полипептидов антител с векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, поксвирус птиц, аденовирус (такой, как аденовирус 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита-B и вирус обезьян 40 (SV40), гетерологичными промоторами млекопитающих, например промотором актина или промотором иммуноглобулина, промоторами теплового шока, при условии что такие промоторы совместимы с системами клеток-хозяев.
Ранний и поздний промоторы вируса SV40 легко получают в виде рестрикционного фрагмента SV40, который также содержит начало репликации вируса SV40. Немедленный ранний промотор цитомегаловируса человека легко получают в виде фрагмента рестрикции HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса бычьей папилломы в качестве вектора описана в патенте США No. 4419446. Модификация такой системы описана в патенте США No. 4601978. Смотри также Reyes et al., Nature 297:598-601 (1982) в отношении экспрессии кДНК β-интерферона человека в мышиных клетках под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.
(v) Компонент - энхансерный элемент
Транскрипцию ДНК, кодирующей полипептид антитела по настоящему изобретению, высшими эукариотами часто повышают встраиванием последовательности энхансера в вектор. В настоящее время известно много энхансерных последовательностей генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако, как правило, используют энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40, расположенный после начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы, расположенный после начала репликации, и аденовирусные энхансеры. Смотри также Yaniv, Nature 297:17-18 (1982) в отношении усиливающих элементов для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5'- или 3'- по отношению к последовательности, кодирующей полипептид. В некоторых вариантах осуществления энхансер расположен в сайте с 5'-стороны от промотора.
(vi) Компонент для терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах, обычно также будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5'- и иногда 3'-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Указанные области содержат нуклеотидные участки, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним из применимых компонентов для терминации транскрипции является область полиаденилирования бычьего гормона роста. Смотри WO94/11026 и описанные в заявке экспрессирующие векторы.
(vii) Селекция и трансформация клеток-хозяев
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах по изобретению включают клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (культуре ткани) стало рутинной процедурой. Примерами применимых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen. Virol. 36:59 (1977)); клетки почки сирийского хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мышей (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крыс Buffalo (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4 и линия клеток гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для продукции антител и культивируют в обычных питательных средах, соответствующим образом модифицированных для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
(viii) Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела по изобретению, можно культивировать во многих средах. Коммерчески доступные среды, такие как среда Хама F10 (Sigma), минимальная питательная среда ((MEM), Sigma), RPMI-1640 (Sigma) и модифицированная Дульбекко среда Игла ((DMEM), Sigma), подходят для культивирования клеток-хозяев. Кроме того, любую из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem.102:255 (1980), патентах США No. 4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или в патенте США Re. 30985, можно использовать в качестве культуральной среды для клеток-хозяев. Любая из указанных сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими, как инсулин, трансферрин или эпидермальный фактор роста), солями (такими, как хлорид натрия, кальций, магний и фосфат), буферами (такими, как HEPES), нуклеотидами (такими, как аденозин и тимидин), антибиотиками (такими, как лекарственное средство GENTAMYCINTM), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые могут быть известны специалистам в данной области. Условия культивирования, такие как температура, pH и тому подобное, представляют собой условия, описанные ранее для клеток-хозяев, отобранных для экспрессии, и условия будут известны специалисту в данной области.
ix) Очистка антител
При использовании способов рекомбинации антитело может быть получено внутриклеточно или непосредственно секретировано в среду. Если антитело продуцируется внутриклеточно, то в качестве первой стадии частицы обломков или целые клетки или лизированные фрагменты удаляют, например центрифугированием или ультрацентрифугированием. Когда антитело секретируется в среду, надосадки из таких систем экспрессии обычно сначала концентрируют, используя коммерчески доступный фильтр для концентрации белков, например блок для ультрафильтрации Amicon или Millipore Pellicon. На любой из последующих стадий может включен ингибитор протеаз, такой как PMSF, чтобы ингибировать протеолиз, и могут быть введены антибиотики, чтобы предотвратить рост случайных загрязнений.
Композиция антител, полученных из клеток, может быть очищена с использованием, например, хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок A можно использовать для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для γ3 человека (Guss et al., EMBO J. 5:1567-1575 (1986)). Матрицей, с которой связывают аффинный лиганд, наиболее часто является агароза, но имеются и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают возможность более высоких скоростей потока и более коротких периодов времени обработки, чем можно достичь в случае агарозы. В том случае когда антитело содержит домен CH3, для очистки применима смола Bakerbond ABXTM (J. T. Baker, Phillipsburg, NJ). Также доступны другие способы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния, хроматография на гепарин-сефарозе, хроматография на анионообменной или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусировка, SDS-ПААГ и преципитация сульфатом аммония, в зависимости от антитела, которое необходимо выделить.
После какой-либо предварительной стадии (стадий) очистки смесь, содержащую представляющее интерес антитело и загрязняющие примеси, подвергают хроматографии, основанной на гидрофобном взаимодействии, при низком значении pH, используя буфер для элюирования с pH в диапазоне примерно 2,5-4,5. В некоторых вариантах осуществления хроматографию, основанную на гидрофобном взаимодействии при низком pH, осуществляют при низких концентрациях соли (например, при концентрации соли 0-0,25 М).
Анализы активности
Антитела по настоящему изобретению могут быть охарактеризованы по своим физическим/химическим свойствам и биологическим функциям различными анализами, известными в данной области.
Очищенные иммуноглобулины могут быть дополнительно охарактеризованы посредством серии анализов, включая без ограничения N-концевое секвенирование, аминокислотный анализ, высокоэффективную жидкостную эксклюзионную хроматографию по размеру в неденатурирующих условиях (ВЭЖХ), масс-спектрометрию, ионообменную хроматографию и расщепление папаином.
В некоторых вариантах осуществления иммуноглобулины, полученные по изобретению, анализируют в отношении их биологической активности. В некоторых вариантах осуществления иммуноглобулины по настоящему изобретению тестируют в отношении их антигенсвязывающей активности. Анализы связывания антигенов, которые известны в данной области и могут быть использованы в настоящем изобретении, включают без ограничения любые анализы прямого или конкурентного связывания с использованием таких способов, как Вестерн-блоты, радиоиммуноанализы, ELISA (твердофазный иммуноферментный анализ), иммуноанализы типа «сэндвич», анализы иммунопреципитации, флуоресцентные иммуноанализы и иммуноанализы с использованием белка A.
Антитела или антигенсвязывающие фрагменты могут быть дополнительно подвергнуты селекции в отношении функциональной активности, например антагонистической или агонистической активности. Например, анти-HER-2-антитела могут быть отобраны по их способности ингибировать фосфорилирование тирозина HER-2, ингибировать пролиферацию злокачественных клеток или индуцировать апоптоз злокачественных клеток. Анализы для идентификации и измерения таких активностей описаны, например, в WO98/17797.
Кроме того, анти-DR5-антитела могут быть подвергнуты селекции в отношении способности индуцировать апоптоз злокачественных клеток и/или ингибировать функцию воспалительных клеток. В других вариантах анти-DR5-антитела подвергают селекции в отношении способности конкурировать с Apo-2L за связывание с DR5. В других вариантах антитела против DR5 человека подвергают селекции в отношении связывания с DR5 мыши и/или макаки-крабоеда. Анализы для определения биологической активности могут быть проведены с использованием способов, известных в данной области, таких как фрагментация ДНК (смотри, например, Marsters et al., Curr. Biology, 6:1669 (1996)), инактивация каспазы, связывание DR5 (смотри, например, WO 98/51793, опубликованную 19 ноября 1998). Апоптоз может быть измерен с помощью идентификации конденсации цитоплазмы, отсутствия микроворсинок плазматической мембраны, сегментации ядра, деградации хромосомной ДНК или отсутствия митохондриальной функции. Такая активность может быть определена и измерена, например, в анализах жизнеспособности клеток (таких, как анализ с использованием Alamar синего или MTT-анализы), в анализе FACS, анализе инактивации каспазы, фрагментации ДНК (смотри, например, Nicoletti et al., J. Immunol. Methods, 139:271-279 (1991)) и поли-АДФ-рибозополимеразы, «PARP», анализах расщепления, известных в данной области.
В одном из вариантов осуществления анализ апоптоза заключается в приготовлении двухкратных серийных разведений контрольного стандарта и анти-DR5-антитела в 96-луночных планшетах для культуры тканей. Лиганд Apo-2 (аминокислоты 114-281, описанный в PCT US00/17579) тестируют для сравнения. Клетки карциномы ободочной кишки человека Colo-205 (ATCC) (20000 клеток/лунку) высевают в 96-луночные планшеты. Планшеты инкубируют при 37º в течение 24 часов. В лунки добавляют AlamazBlue (Trek Diagnostic Systems, Inc.) в последние 3 часа 24-часового периода времени инкубации. Флуоресценцию регистрируют, используя флуориметр для 96-луночных планшетов при длине волны возбуждения 530 нМ и длине волны эмиссии 590 нМ. Результаты выражают в относительных единицах флуоресценции (RFU).
В одном из вариантов осуществления настоящее изобретение относится к измененному антителу, которое обладает некоторыми, но не всеми эффекторными функциями, которые делают его требуемым кандидатом для многих применений, при которых важным является время полужизни антитела, однако некоторые эффекторные функции (такие, как комплемент и ADCC) являются необязательными или вредными. В некоторых вариантах осуществления измеряют Fc-активности полученного иммуноглобулина, чтобы удостовериться, что сохраняются только требуемые свойства. Могут быть проведены анализы цитотоксичности in vitro и/или in vivo, чтобы подтвердить уменьшение/ослабление активностей CDC и/или ADCC. Например, могут быть проведены анализы связывания Fc-рецептора (FcR), чтобы удостовериться, что отсутствует связывание антитела с FcγR (следовательно, вероятно отсутствует активность ADCC), но сохраняется способность связывания FcRn. Основные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Пример анализа in vitro для оценки активности ADCC представляющей интерес молекулы описан в патентах США No. 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и клетки природные киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в Clynes et al. PNAS (USA) 95:652-656 (1998). Также могут быть осуществлены анализы связывания C1q для подтверждения того, что антитело неспособно связывать C1q и поэтому не имеет CDC-активности. Чтобы оценить активацию комплемента можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Связывание FcRn и определение клиренса/времени полужизни in vivo также можно осуществить, используя способы, известные в данной области, например способы, описанные в разделе «Примеры».
Гуманизированные антитела
Настоящее изобретение охватывает гуманизированные антитела. В данной области известны различные способы гуманизации антител животных, отличных от человека. Например, гуманизированное антитело может иметь один или несколько аминокислотных остатков, введенных в него из источника, который отличен от человека. Указанные аминокислотные остатки животного, отличного от человека, часто называют «импортируемыми» остатками, которые обычно берут из «импортируемого» вариабельного домена. Гуманизацию можно по существу выполнить, следуя способу Винтера и соавторов (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), заменой последовательностями гипервариабельных областей соответствующих областей антитела человека. Соответственно такие «гуманизированные» антитела являются химерными антителами (патент США No. 4816567), в которых значительно меньшая часть, чем интактный вариабельный домен человека, заменена соответствующей последовательностью вида, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки гипервариабельной области и возможно некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
Выбор вариабельных доменов человека как легкой, так и тяжелой цепи, используемых для получения гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому способу «оптимальной подгонки» последовательность вариабельного домена антитела грызуна подвергают скринингу по сравнению с полной библиотекой известных последовательностей вариабельных доменов человека. Последовательность человека, которая наиболее близка последовательности грызуна, затем берут в качестве каркаса (FR) человека для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). В другом способе используют конкретный каркас, полученный из консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких разных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других благоприятных биологических свойств. Для достижения указанной цели согласно одному из способов гуманизированные антитела получают, проводя анализ исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и показывают возможные трехмерные конформационные структуры выбранных для исследования последовательностей иммуноглобулина. Исследование таких изображений позволяет проанализировать вероятную роль остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность выбранного для исследования иммуноглобулина связывать соответствующий ему антиген. Таким образом, могут быть выбраны и объединены остатки FR из реципиентных и импортируемых последовательностей так, чтобы достичь требуемых характеристик антитела, таких как повышенная аффинность по отношению к антигену-мишени. В общем, остатки гипервариабельной области непосредственно и в наибольшей степени влияют на связывание антигена.
Варианты антител
В одном из аспектов изобретение относится к фрагментам антител, содержащим модификации на границе раздела Fc-полипептидов, содержащих Fc-область, при этом модификации способствуют и/или стимулируют гетеродимеризацию. Такие модификации включают введение выступа в первый Fc-полипептид и впадины во второй Fc-полипептид, при этом выступ может помещаться во впадине, так что стимулирует образование комплекса первого и второго Fc-полипептидов. Способы создания антител с такими модификациями известны в данной области, например описаны в патенте США No. 5731168.
В некоторых вариантах осуществления предполагается модификация(ии) аминокислотной последовательности антител, описанные в настоящем описании. Например, может быть желательным повышение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела получают введением соответствующих изменений нуклеотидов в нуклеиновую кислоту антитела или в результате синтеза пептидов. Такие модификации включают, например, делеции, и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Осуществляют любую комбинацию делеции, инсерции и замены, чтобы достичь конечной конструкции, при условии, что конечная конструкция обладает требуемыми характеристиками. Аминокислотные изменения могут быть введены в аминокислотную последовательность рассматриваемого антитела во время получения такой последовательности.
Чтобы увеличить время полужизни антител или полипептида, содержащего аминокислотные последовательности по настоящему изобретению, можно связать эпитоп связывания рецептора спасения с антителом (особенно с фрагментом антитела), как описано, например, в патенте США 5739277. Например, молекула нуклеиновой кислоты, кодирующая эпитоп связывания рецептора спасения, может быть связана в рамке с нуклеиновой кислотой, кодирующей последовательность полипептида по настоящему изобретению, так чтобы слитый белок, экспрессированный сконструированной молекулой нуклеиновой кислоты, содержал эпитоп связывания рецептора спасения и последовательность полипептида по настоящему изобретению. В используемом в настоящем описании смысле термин «эпитоп связывания рецептора спасения» относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который ответственен за увеличение времени полужизни молекулы IgG в сыворотке in vivo (например, Ghetie, V et al., (2000) Ann. Rev. Immunol. 18:739-766, таблица 1). Антитела с заменами в Fc-области и увеличенным временем полужизни также описаны в WO 00/42072 (Presta, L.), WO 02/060919; Shields, R.L., et al., (2001) JBC 276(9):6591-6604; Hinton, P.R., (2004) JBC 279(8):6213-6216. В другом варианте осуществления время полужизни в сыворотке также можно увеличить, например, связыванием других полипептидных последовательностей. Например, антитела по настоящему изобретению или другой полипептид, содержащий аминокислотные последовательности по настоящему изобретению, могут быть связаны с сывороточным альбумином, или частью сывороточного альбумина, которая связывается с FcRn-рецептором, или со связывающим сывороточный альбумин пептидом, так чтобы сывороточный альбумин связывался с антителом или полипептидом, например, такие полипептидные последовательности описаны в WO 01/45746. В одном из вариантов осуществления пептид сывороточного альбумина, который необходимо связать, содержит аминокислотную последовательность DICLPRWGCLW (SEQ ID NO:608). В другом варианте осуществления такими способами увеличивают время полужизни Fab по настоящему изобретению. Смотри также Dennis, M.S., et al., (2002) JBC 277(38):35035-35043 в отношении пептидных последовательностей, связывающих сывороточный альбумин.
Применимый способ идентификации определенных остатков или областей антитела, которые являются предпочтительными местами для мутагенеза, называют «мутагенезом на основе сканирования аланином», который описан в Cunningham and Wells (1989) Science, 244:1081-1085. В данном случае остаток или группу остатков-мишеней идентифицируют (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют нейтральными или отрицательно заряженными аминокислотами (например, аланином или полиаланином), чтобы повлиять на взаимодействие аминокислот с антигеном. Те положения аминокислот, которые проявляют функциональную чувствительность к заменам, затем улучшают введением дополнительных или других вариантов в сайты замены. Таким образом, хотя сайт для введения варианта аминокислотной последовательности определяют предварительно, природа мутации, как таковой, не нуждается в предварительном определении. Например, чтобы проанализировать эффективность мутации, в данном участке проводят сканирование аланином или случайный мутагенез в кодоне или области-мишени и осуществляют скрининг экспрессированных иммуноглобулинов в отношении требуемой активности.
Инсерции в аминокислотной последовательности включают слияния на амино- и/или карбоксильном конце, диапазон длины которых составляет от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых инсерций включают антитело с N-концевым остатком метионила или антитело, слитое с цитотоксическим полипептидом. Другие инсерционные варианты молекулы антитела включают слияние N- или C-конца антитела с ферментом (например, ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Другим типом варианта является вариант с аминокислотной заменой. Такие варианты имеют по меньшей мере один аминокислотный остаток в молекуле антитела, замененный другим остатком. Участки, представляющие наибольший интерес для основанного на заменах мутагенеза, включают гипервариабельные области, но также предполагаются изменения FR. Консервативные замены показаны в таблице 2 под заголовком «предпочтительные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены более существенные изменения, показанные в таблице ниже под заголовком «примеры замен» или дополнительно описанные ниже при описании классов аминокислот, и продукты подвергают скринингу.
Существенные модификации биологических свойств антитела осуществляют посредством отбора замен, которые в значительной степени отличаются по своему влиянию на сохранение (a) структуры полипептидного остова в области замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в сайте-мишени или (c) объема боковой цепи. Аминокислоты могут быть сгруппированы в соответствии со сходством в свойствах их боковых цепей (в A. L. Lehninger, Biochemistry, second ed., p. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M);
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q);
(3) кислые: Asp (D), Glu (E);
(4) основные: Lys (K), Arg (R), His(H).
Альтернативно природные остатки могут быть разделены на группы на основе общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены повлекут за собой обмен представителя одного из указанных классов представителем другого класса. Такие остатки, используемые для замены, также могут быть введены в участки консервативных замен или в остальные участки (неконсервативные).
Один тип варианта с заменами включает замену одного или нескольких остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или антитела человека). В общем, полученный в результате вариант(ты), отобранный для дальнейшей разработки, будет иметь улучшенные биологические свойства по сравнению с исходным антителом, из которого они были созданы. Подходящий способ создания таких вариантов с заменами заключается в созревании аффинности с использованием фагового дисплея. Коротко, несколько участков гипервариабельной области (например, 6-7 участков) подвергают мутациям, чтобы создать все возможные аминокислотные замены в каждом участке. Созданные таким образом антитела представляют на частицах нитчатого фага в виде слияний с продуктом гена III M13, упакованного в каждой частице. Затем проводят скрининг вариантов в фаговом дисплее в отношении их биологической активности (например, аффинности связывания), как описано в настоящем описании. Чтобы идентифицировать участки гипервариабельной области - возможные кандидаты для модификации, можно осуществить мутагенез на основании сканирования аланином, чтобы выявить остатки гипервариабельной области, которые вносят существенный вклад в связывание антигена. Альтернативно или дополнительно может быть полезным анализ кристаллической структуры комплекса антиген-антитело, чтобы идентифицировать точки контакта между антителом и антигеном. Такие контактирующие остатки и соседние остатки являются кандидатами для замены способами, разработанными в данном изобретении. После создания таких вариантов панель вариантов подвергают скринингу, который описан в настоящем описании, и антитела с лучшими свойствами в одном или нескольких соответствующих анализах могут быть отобраны для дальнейшей разработки.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей антитела, получают различными способами, известными в данной области. Такие способы включают без ограничения выделение из природного источника (в случае природных вариантов аминокислотной последовательности) или получение опосредованным олигонуклеотидами (или сайт-специфичным) мутагенезом, мутагенезом на основе ПЦР и кассетным мутагенезом заранее полученного варианта или невариантной версии антитела.
Может быть желательным введение одной или нескольких аминокислотных модификаций в Fc-область полипептидов иммуноглобулина по изобретению, таким образом создавая вариант Fc-области. Вариант Fc-области может содержать последовательность Fc-области человека (например, Fc-области IgG1, IgG2, IgG3 или IgG4 человека), содержащую аминокислотную модификацию (например, замену) в одном или нескольких положениях аминокислот, включая положение шарнирного цистеина.
В соответствии с описанием и руководствами, имеющимися в данной области, предполагается, что в некоторых вариантах осуществления антитело, применяемое в способах по изобретению, может содержать одно или несколько изменений по сравнению с эквивалентным антителом дикого типа, например, в Fc-области. Такие антитела, тем не менее, могут сохранять по существу такие же характеристики, которые требуются для терапевтической применимости, по сравнению с их эквивалентом дикого типа. Например, считается, что в Fc-области могут быть осуществлены некоторые изменения, которые могут привести к измененному (т.е. либо повышенному, либо пониженному) связыванию C1q и/или зависимой от комплемента цитотоксичности (CDC), например, как описано в WO 99/51642. Смотри также Duncan and Winter, Nature 322:738-40 (1988); патент США No. 5648260, патент США No. 5624821 и WO 94/29351, касающиеся других примеров вариантов Fc-области.
Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам или конъюгатам антитело-лекарственное средство (ADC), содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, лекарственное средство, ингибирующее рост средство, токсин (например, ферментативно активный токсин, происходящий из клеток бактерий, грибов, растений или животных, или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических средств, т.е. лекарственных средств для убивания или ингибирования опухолевых клеток при лечении злокачественной опухоли (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg. Del. Rev. 26:151-172; патент США 497527S), теоретически обеспечивает возможность целенаправленной доставки компонента, представленного лекарственным средством, к опухолям и внутриклеточного накопления в опухоли, когда системное введение таких неконъюгированных лекарственных средств может приводить к недопустимым уровням токсичности по отношению к нормальным клеткам, так же как к опухолевым клеткам, которые стремятся удалить (Baldwin et al., (1986) Lancet (Mar. 15, 1986):603-05; Thorpe, (1985) «Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review» в Monoclonal Antibodies '84: Biological and Clinical Applications, A. Pinchera et al. (eds.), p. 475-506). При этом добиваются максимальной эффективности при минимальной токсичности. Сообщалось, что и поликлональные антитела и моноклональные антитела применимы в таких способах (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, применимые в таких способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986), выше). Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al. (2000) Jour. of the Nat. Cancer Inst. 92(19):1573-1581; Mandler et al. (2000) Bioorganic and Med. Chem. Letters 10:1025-1028; Mandler et al. (2002) Bioconjugate Chem. 13:786-791), мейтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93: 8618-8623) и калихеамицин (Lode et al., (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342). Токсины могут осуществлять свое цитотоксическое и цитостатическое влияние посредством механизмов, включая связывание тубулина, связывание ДНК или ингибирование топоизомераз. Некоторые цитотоксические лекарственные средства склонны к инактивации или становятся менее активными при конъюгировании с крупными антителами или белковыми лигандами рецепторов.
ZEVALIN® (ибритумомаб тиуксетан, Biogen/Idec) является конъюгатом антитело-радиоизотоп, состоящим из мышиного моноклонального антитела IgG1 каппа, направленного против антигена CD20, находящегося на поверхности нормальных и злокачественных B-лимфоцитов, и радиоактивного изотопа 111In или 90Y, связанного посредством тиомочевинного линкера-хелатора (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al. (2002) Blood 99(12):4336-42; Witzig et al. (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al. (2002) J. Clin. Oncol. 20(15):3262-69). Хотя зевалин обладает активностью против B-клеточной неходжкинской лимфомы (NHL), введение приводит к тяжелым и продолжительным цитопениям у большинства пациентов. MYLOTARGTM (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящий из антитела hu-CD33, связанного с калихеамицином, одобрен в 2000 году для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7): 686; патенты США No. 4970198, 5079233, 5585089, 5606040, 5693762, 5739116, 5767285, 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, связанного посредством дисульфидного линкера SPP с компонентом в виде мейтанзиноидного лекарственного средства, DM1, прошел в фазу II испытаний в отношении лечения злокачественных опухолей, которые экспрессируют CanAg, таких как злокачественные опухоли ободочной кишки, поджелудочной железы, желудка и другие. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела против специфичного для простаты мембранного антигена (PSMA), связанного с компонентом в виде мейтанзиноидного лекарственного средства, DM1, разрабатывается для возможного лечения опухолей простаты. Ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали с химерными моноклональными антителами cBR96 (специфичными к Y Льюиса на карциномах) и cAC10 (специфичными к CD30 на гематологических злокачественных новообразованиях) (Doronina et al. (2003) Nature Biotechnology 21(7):778-784), и конъюгаты используются для разработки терапевтических средств.
Химиотерапевтические средства, применимые для создания таких иммуноконъюгатов, были описаны выше. Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают цепь A дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модекцина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolacca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трикотецены. Множество радионуклидов доступно для получения радиоконъюгированных антител. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического средства получают, используя множество бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие, как диметиладипимидат·HCl), активные сложные эфиры (такие, как дисукцинимидилсуберат), альдегиды (такие, как глутаровый альдегид), бис-азидосоединения (такие, как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие, как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие, как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие, как 1,5-дифтор-2,4-динитробензол). Например иммунотоксин рицин может быть получен, как описано в Vitetta et al. Science 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгирования радионуклида с антителом. Смотри WO 94/11026.
Конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, мейтанзиноиды, трихотецен и CC1065, и производные таких токсинов, которые обладают активностью токсинов, также рассматриваются в данном изобретении.
Мейтанзин и мейтанзиноиды
В одном из вариантов осуществления антитело (полноразмерное или фрагменты) по изобретению конъюгируют с одной или несколькими молекулами мейтанзиноидов.
Мейтанзиноиды являются ингибиторами митоза, которые действуют, ингибируя полимеризацию тубулина. Мейтанзин впервые был выделен из восточно-африканского кустарника Maytenus serrata (патент США No. 3896111). Затем было обнаружено, что некоторые микроорганизмы также продуцируют мейтанзиноиды, такие как мейтанзинол и сложные C-3-мейтанзиноловые эфиры (патент США No. 4151042). Синтетический мейтанзинол и его производные и аналоги описаны, например, в патентах США No. 4137230, 4248870, 4256746, 4260608, 4265814, 4294757, 4307016, 4308268, 4308269, 4309428, 4313946, 4315929, 4317821, 4322348, 4331598, 4361650, 4364866, 4424219, 4450254, 4362663 и 4371533, описания которых специально включены в данное описание в виде ссылки.
Конъюгаты мейтанзиноид-антитело
Пытаясь улучшить терапевтический индекс, мейтанзин и мейтанзиноиды конъюгировали с антителами, специфично связывающимися с антигенами опухолевых клеток. Иммуноконъюгаты, содержащие мейтанзиноиды, и их терапевтическое применение описаны, например, в патентах США No. 5208020, 5416064 и европейском патенте 0425235 B1, описания которых специально включены в данное описание в виде ссылки. Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описали иммуноконъюгаты, содержащие мейтанзиноид, называемый DM1, связанный моноклональным антителом C242, направленным против рака прямой и ободочной кишки человека. Обнаружено, что конъюгат является высокоцитотоксичным по отношению к культивируемым клеткам рака ободочной кишки и проявлял противоопухолевую активность в анализе опухолевого роста in vivo. Chari et al., Cancer Research 52:127-131 (1992) описывают иммуноконъюгаты, в которых мейтанзиноид конъюгировали посредством дисульфидного линкера с мышиным антителом A7, связывающимся с антигеном в линиях клеток рака ободочной кишки человека, или с другим мышиным моноклональным антителом TA.1, которое связывает онкоген HER.-2/neu. Цитотоксичность конъюгата TA.1-мейтанзиноид тестировали in vitro на линии клеток рака молочной железы человека SK-BR-3, которые экспрессируют 3×105 поверхностных антигенов HER-2 на клетку. Конъюгат лекарственного средства давал степень цитотоксичности, сходную со степенью токсичности свободного мейтанзиноидного лекарственного средства, которая может быть повышена увеличением количества молекул мейтанзиноида на молекулу антитела. Конъюгат A7-мейтанзиноид показал низкую системную цитотоксичность у мышей.
Конъюгаты антитело-мейтанзиноид (иммуноконъюгаты)
Конъюгаты антитело-мейтанзиноид получают химическим связыванием антитела с молекулой мейтанзиноида без существенного снижения биологической активности антитела и молекулы мейтанзиноида. Показано, что в среднем 3-4 молекулы мейтанзиноида, конъюгированные на молекулу антитела, эффективны для усиления цитотоксичности для клеток-мишеней без негативного влияния на функцию или растворимость антитела, хотя можно ожидать, что даже одна молекула токсин/антитело усиливает цитотоксичность по сравнению с применением «голого» антитела. Мейтанзиноиды хорошо известны в данной области и могут быть синтезированы известными способами или выделены из природных источников. Подходящие мейтанзиноиды описаны например в патенте США No. 5208020 и в других патентах и непатентных публикациях, ссылки на которые указаны выше. В некоторых вариантах осуществления мейтанзиноиды представляют собой мейтанзинол и аналоги мейтанзинола, модифицированные в ароматическом цикле или в других положениях молекулы мейтанзинола, такие как различные сложные мейтанзиноловые эфиры.
Существует много связывающих групп, известных в данной области, для получения конъюгатов антитело-мейтанзиноид, включая, например, группы, описанные в патенте США No. 5208020 или патенте EP 0425235 B1 и в Chari et al., Cancer Research 52:127-131 (1992). Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, неустойчивые к действию пептидазы группы или неустойчивые к действию эстеразы группы, которые описаны в указанных выше патентах.
Конъюгаты антитела и мейтанзиноида могут быть получены с использованием множества бифункциональных, связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие, как диметиладипимидат·HCl), активные сложные эфиры (такие, как дисукцинимидилсуберат), альдегиды (такие, как глутаровый альдегид), бис-азидосоединения (такие, как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие, как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие, как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие, как 1,5-дифтор-2,4-динитробензол). В некоторых вариантах осуществления связывающие агенты включают N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для образования дисульфидной связи.
Линкер может быть связан с молекулой мейтанзиноида в разных положениях, в зависимости от типа связи. Например, сложноэфирная связь может быть образована при взаимодействии с гидроксильной группой с использованием обычных способов связывания. Реакция может осуществляться в положении C-3, имеющем гидроксильную группу, в положении C-14, модифицированном гидроксиметилом, в положении C-15, модифицированном гидроксильной группой, и в положении C-20, имеющем гидроксильную группу. В одном из вариантов осуществления связь образуется в положении C-3 мейтанзинола или аналога мейтанзинола.
Калихеамицин
Другой представляющий интерес иммуноконъюгат содержит антитело, конъюгированное с одной или несколькими молекулами калихеамицина. Калихеамициновое семейство антибиотиков способно образовывать двунитевые разрывы ДНК в субпикомолярных концентрациях. Получение конъюгатов семейства калихеамицина смотри в патентах США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все American Cyanamid Company). Структурные аналоги калихеамицина, которые могут быть использованы, включают без ограничения γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θI 1 (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и указанные выше патенты США, принадлежащие American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано антитело, является QFA, который представляет собой антифолат. Как калихеамицин, так и QFA имеют внутриклеточные места действия и с трудом проходят через плазматическую мембрану. Поэтому поглощение клетками указанных средств благодаря опосредованной антителами интернализации значительно усиливает их цитотоксическое действие.
Другие цитотоксические средства
Другие противоопухолевые средства, которые могут быть конъюгированы с антителами по изобретению, включают BCNU, стрептозоицин, винкристин, 5-фторурацил, семейство агентов, вместе известных как комплекс LL-E33288, описанных в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают цепь A дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модекцина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolacca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трикотецены. Смотри, например, WO 93/21232, опубликованную 28 октября 1993.
Настоящее изобретение, кроме того, охватывает иммуноконъюгат, образованный между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для избирательного разрушения опухоли антитело может содержать высокорадиоактивный атом. Множество радиоактивных изотопов доступно для получения радиоконъюгированных антител. Примеры включают 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 212Pb и радиоактивные изотопы Lu и т.д. В том случае когда конъюгат используют для диагностики, он может содержать радиоактивный атом для сцинтиографических исследований, например 99mTc или 123I, или спиновую метку для ядерной магнитно-резонансной (ЯМР) визуализации (также известной как магнитно-резонансная визуализация, MRI), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в конъюгат известными способами. Например, пептид может быть биологически синтезирован или может быть синтезирован посредством химического синтеза из аминокислот с использованием подходящих предшественников аминокислот, содержащих, например, фтор-19 вместо водорода. Такие метки, как 99mTc или 123I, 186Re, 188Re и 111In, могут быть связаны с пептидом через остаток цистеина. Иттрий-90 может быть связан через остаток лизина. Способ IODOGEN (Fraker et al. Biochem. Biophys. Res. Commun. 80:49-57 (1978)) можно использовать для включения йода-123. В «Monoclonal Antibodies in Immunoscintigraphy (Chatal, CRC Press 1989) подробно описаны другие способы.
Конъюгаты антитела и цитотоксического средства могут быть получены с использованием множества бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие, как диметиладипимидат·HCl), активные сложные эфиры (такие, как дисукцинимидилсуберат), альдегиды (такие, как глутаровый альдегид), бис-азидосоединения (такие, как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие, как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие, как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие, как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al. Science 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгирования радионуклида с антителом. Смотри WO 94/11026. Линкер может представлять собой «отщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, линкер на основе диметила или линкер, содержащий дисульфид (Chari et al., Cancer Research. 52:127-131 (1992); патент США No. 5208020).
Соединения по изобретению, в частности, включают, но не ограничены указанным, ADC, приготовленный с использованием поперечно-сшивающих реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, STA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, из Pierce Biotechnology, Inc., Rockford, IL., USA). Смотри страницы 467-498, 2003-2004 Applications Handbook and Catalog.
Получение конъюгатов антитело-лекарственное средство
В конъюгатах антитело-лекарственное средство (ADC) по изобретению антитело (Ab) конъюгируют с одним или несколькими остатками лекарственного средства (D), например примерно от 1 до примерно 20 остатков лекарственного средства на антитело, через линкер (L). ADC формулы I может быть получен несколькими путями с использованием реакций органической химии, условий и реагентов, известных специалистам в данной области, включая: (1) взаимодействие нуклеофильной группы антитела с бивалентным линкерным реагентом с образованием Ab-L посредством ковалентной связи с последующим взаимодействием с остатком лекарственного средства D; и (2) взаимодействие нуклеофильной группы остатка лекарственного средства с бивалентным линкерным реагентом с образованием D-L посредством ковалентной связи с последующим взаимодействием с нуклеофильной группой антитела.
Нуклеофильные группы антител включают без ограничения: (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например, лизина, (iii) тиольные группы боковых цепей, например, цистеина и (iv) гидроксил сахара или аминогруппы, в которых антитело гликозилируется. Аминогруппы, тиольные и гидроксильные группы являются нуклеофильными и способны взаимодействовать с образованием ковалентных связей с электрофильными группами на линкерных остатках и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные NHS-эфиры, сложные HOBt-эфиры, галогенформиаты и галогенангидриды; (ii) алкилгалогениды и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливаемые межцепочечные дисульфидные, т.е. цистеиновые, мостики. Антитела могут быть сделаны химически активными для конъюгирования с линкерными реагентами обработкой восстановителем, таким как DTT (дитиотреитол). Таким образом, каждый цистеиновый мостик теоретически будет образовывать два химически активных тиольных нуклеофила. Дополнительные нуклеофильные группы могут быть введены в антитела посредством взаимодействия лизинов с 2-иминотиоланом (реагентом Трота), приводящего к превращению амина в тиол.
Конъюгаты антитело-лекарственное средство по изобретению также могут быть получены при модификации антитела с введением электрофильных остатков, которые могут взаимодействовать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител могут быть окислены, например, окисляющими реагентами на основе периодата, с образованием альдегидной или кетоновой группы, которые могут взаимодействовать с аминогруппой линкерных реагентов или остатков лекарственных средств. Полученные в результате иминогруппы основания Шиффа могут образовывать стабильную связь или могут быть восстановлены, например, борогидридными реагентами с образованием стабильных аминных связей. В одном из вариантов осуществления взаимодействие углеводной части гликозилированного антитела либо с оксидазой галактозы, либо с мета-периодатом натрия может давать карбонильные (альдегидные и кетоновые) группы в белке, которые могут взаимодействовать с подходящими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте осуществления белки, содержащие N-концевые остатки серина или треонина, могут взаимодействовать с мета-периодатом натрия, приводя к получению альдегида вместо первой аминокислоты (Geoghegan and Stroh, (1992) Bioconjugate Chem. 3:138-146; US 5362852). Такой альдегид может быть подвергнут взаимодействию с остатком лекарственного средства или нуклеофильным линкером.
Подобным образом, нуклеофильные группы на остатке лекарственного средства включают без ограничения: аминогруппу, тиол, гидроксил, группы гидразида, оксима, гидразина, тиосемикарбазона, карбоксилата гидразина и арилгидразида, способные взаимодействовать с образованием ковалентных связей с электрофильными группами на линкерных остатках и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные NHS-эфиры, сложные HOBt-эфиры, галогенформиаты и галогенангидриды; (ii) алкилгалогениды и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Альтернативно слитый белок, содержащей антитело и цитотоксическое средство, может быть получен, например, способами на основе рекомбинации или пептидным синтезом. В длину ДНК могут быть включены соответствующие области, кодирующие две части конъюгата, либо расположенные рядом друг с другом, либо разделенные областью, кодирующей линкерный пептид, который не нарушает требуемые свойства конъюгата.
В других вариантах антитело может быть конъюгировано с «рецептором» (например, стрептавидином) в случае применения для предварительного направления к опухоли, когда конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязанного конъюгата из кровообращения с использованием хелатирующего агента и затем введением «лиганда» (например, авидина), который конъюгируют с цитотоксическим средством (например, радионуклидом).
Производные антител
Антитела по настоящему изобретению могут быть дополнительно модифицированы так, чтобы они содержали дополнительные небелковые компоненты, которые известны в данной области и легко доступны. В некоторых вариантах осуществления компонентами, подходящими для дериватизации антитела, являются водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают без ограничения полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или гомополимеры поли(н-винилпирролидон)полиэтиленгликоля, пропиленгликоля, сополимеры полипропиленоксид/этиленоксид, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропионовый альдегид полиэтиленгликоля может иметь преимущества при производстве вследствие его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, связанных с антителом, может изменяться, и если связывают более одного полимера, то они могут быть одинаковыми или разными молекулами. В общем, количество и/или тип полимеров, используемых для дериватизации, можно определить на основе рассмотрения ряда факторов, включая без ограничения конкретные свойства или функции улучшаемого антитела, будет ли производное антитела использовано в терапии при определенных состояниях и т.д.
Фармацевтические препараты
Терапевтические препараты, содержащие антитело по изобретению, готовят для хранения смешиванием антитела, имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме водных растворов, лиофилизованных или других высушенных препаратов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат, гистидин и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие, как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); полипептиды с низкой молекулярной массой (примерно меньше 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как твин, плюроники или полиэтиленгликоль (ПЭГ).
Препарат по изобретению также может содержать более одного активного соединения, которое необходимо для лечения конкретного состояния. В некоторых таких вариантах соединения обладают комплементирующими активностями, но не оказывают неблагоприятного влияния друг на друга. Такие молекулы соответственно присутствуют в комбинации в количествах, которые являются эффективными для предполагаемой цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, приготовленные, например, способами коацервации или полимеризации на границе фаз, например микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметакрилата), соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980).
Препараты, используемые для введения in vivo, должны быть стерильными. Это легко осуществить, например, фильтрованием через стерильные фильтрующие мембраны.
Могут быть приготовлены препараты длительного высвобождения. Подходящие примеры препаратов длительного высвобождения включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие иммуноглобулин по изобретению, и такие матрицы имеют форму определенных изделий, например пленки или микрокапсулы. Примеры матриц для длительного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США No. 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, не разрушаемый этилен-винилацетат, разрушаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота. В то время как такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы в течение более 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. В том случае когда инкапсулированные иммуноглобулины остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37ºC, что приводит к потере биологической активности и возможным изменениям иммуногенности. Могут быть разработаны стандартные методики для стабилизации, в зависимости от вовлекаемого механизма. Например, если обнаружено, что механизмом агрегации является образование межмолекулярной S-S-связи в результате тиодисульфидного обмена, то стабилизация может быть достигнута посредством модификации сульфгидрильных остатков, лиофилизацией из кислых растворов, регуляцией влагосодержания, использованием соответствующих добавок и разработкой специальных композиций на основе полимерной матрицы.
Применения
Антитело по настоящему изобретению можно применять, например, в терапевтических способах in vitro, ex vivo и in vivo. Антитела по изобретению можно применять в качестве антагониста, чтобы частично или полностью блокировать специфичную активность антигена in vitro, ex vivo и/или in vivo. Кроме того, по меньшей мере некоторые из антител по изобретению могут нейтрализовать активность антигена от другого вида. Соответственно, антитела по изобретению можно применять для ингибирования специфичной активности антигена, например, в культуре клеток, содержащей антиген, в организме человека или другого вида млекопитающего, имеющих антиген, с которым антитело по изобретению перекрестно реагирует (например, шимпанзе, павиан, мартышка, макака-крабоед и резус, свинья или мышь). В одном из вариантов осуществления антитело по изобретению можно применять для ингибирования активностей антигена, осуществляя контакт антитела с антигеном так, чтобы активность антигена была ингибирована. В некоторых вариантах осуществления антигеном является молекула белка человека.
В одном из вариантов осуществления антитело по изобретению можно применять в способе ингибирования антигена у субъекта, страдающего от расстройства, при котором активность антигена является вредной, включающем введение субъекту антитела по изобретению, при этом активность антигена у субъекта ингибируется. В некоторых вариантах осуществления антигеном является молекула белка человека, и субъектом является человек. Альтернативно субъектом может быть млекопитающее, экспрессирующее антиген, с которым связывается антитело по изобретению. Еще одним субъектом может быть млекопитающее, в организм которого был введен антиген (например, посредством введения антигена или посредством экспрессии трансгена антигена). Антитело по изобретению можно вводить человеку в терапевтических целях. Кроме того, антитело по изобретению можно вводить млекопитающему, отличному от человека, экспрессирующему антиген, с которым иммуноглобулин перекрестно взаимодействует (например, примату, свинье или мыши), в ветеринарных целях или в качестве модели заболевания человека на животных. Что касается последнего, то такие модели на животных можно использовать для оценки терапевтической эффективности антител по изобретению (например, для тестирования доз и временных курсов введения).
Блокирующие или антагонистические антитела по изобретению, которые применимы в терапии, включают без ограничения анти-HER-2-антитела. Например, анти-HER-2-антитела по изобретению можно использовать для лечения, ингибирования, замедления прогрессирования, предотвращения/замедления рецидива, ослабления или предотвращения заболеваний, расстройств или состояний, связанных с аномальной экспрессией и/или активностью одной или нескольких молекул антигенов, включая без ограничения злокачественные и доброкачественные опухоли; нелейкозные и лимфоидные злокачественные новообразования; нейронные, глиальные, астроцитарные, гипоталамические и другие расстройства желез, макрофагов, эпителия, стромы и бластоцеля; и воспалительные, ангиогенные и иммунные расстройства.
В одном из аспектов блокирующее антитело по изобретению является специфичным по отношению к антигену-лиганду и ингибирует активность антигена благодаря блокированию или созданию препятствий для взаимодействия лиганд-рецептор, в которое вовлечен антиген-лиганд, тем самым ингибируя соответствующий сигнальный путь и другие молекулярные или клеточные события. Характерным признаком изобретения также являются специфичные к рецепторам антитела, которые необязательно предотвращают связывание лиганда, но мешают активации рецептора, тем самым ингибируя любые ответы, которые обычно могут быть инициированы связыванием лиганда. В некоторых вариантах осуществления изобретение также охватывает антитела, которые либо предпочтительно, либо исключительно связываются с комплексами лиганд-рецептор. Антитело по изобретению также может действовать в качестве агониста конкретного рецептора антигена, таким образом стимулируя, усиливая или активируя либо все, либо частичные активности опосредованной лигандом активации рецептора.
Связанные с HER-2 расстройства или состояния и диагностические анализы описаны в патенте США No. 6387371, который включен в данное описание в виде ссылки. Смотри также WO 98/17797. Введение пациенту терапевтически эффективного количества антитела против рецептора HER-2 ингибирует рост опухолевых клеток, и антитела применимы для лечения злокачественной опухоли. Трастузумаб (Genentech, Inc.) является рекомбинантным гуманизированным моноклональным антителом, направленным к внеклеточному домену HER-2, для лечения злокачественной опухоли со сверхэкспрессией HER-2/амплификацией гена HER-2, особенно метастатического рака молочной железы (MBC). Такие антитела применимы для лечения других злокачественных опухолей, особенно опухолей, которые сверхэкспрессируют HER-2. Антитело также можно вводить пациентам в комбинации с другими терапевтическими средствами, например паклитакселом или Tarceva®.
В некоторых вариантах осуществления анти-DR5-антитело индуцирует апоптоз злокачественных клеток. В некоторых вариантах осуществления анти-DR5-антитело является агонистом DR5. В других вариантах антитело конкурирует за связывание с DR5 с Apo-2L.
Как указано выше, DR5-антитела по изобретению имеют разные применения. Например, DR5-агонистические антитела можно применять в способах лечения патологических состояний у млекопитающих, таких как злокачественная опухоль или связанные с иммунной системой заболевания. Связанные с иммунной системой состояния включают ревматоидный артрит, системную красную волчанку, склеродерму, идиопатические воспалительные миопатии, синдром Шегрена, системный васкулит, саркоидоз, аутоиммунные гемолитические анемии, тиреоидит, связанное с иммунной системой почечное заболевание, такое как гломерулонефрит, демиелинизирующее заболевание, такое как рассеянный склероз, аутоиммунные кожные болезни, такие как псориаз, воспалительная и инфильтрационная болезнь легких, и аллергическое заболевание, такое как астма.
Диагностика у млекопитающих различных патологических состояний, описанных в настоящем описании, может быть осуществлена специалистом. В данной области имеются способы диагностики, которые обеспечивают, например, диагностику или выявление злокачественной опухоли или связанного с иммунной системой заболевания у млекопитающего. Например, злокачественные опухоли могут быть идентифицированы способами, включая без ограничения, пальпацию, анализ крови, рентгеновское излучение, ЯМР и тому подобное. Связанные с иммунной системой заболевания также могут быть легко идентифицированы. Например, при системной красной волчанке основным медиатором заболевания является продукция аутореактивных антител к собственным белкам/тканям и последующее формирование опосредованного иммунной системой воспаления. Клинически поражаются многие органы и системы, включая почки, легкие, костно-мышечную систему, слизисто-кожную ткань, глаза, центральную нервную систему, сердечно-сосудистую систему, желудочно-кишечный тракт, костный мозг и кровь. Врачам-практикам известны многие заболевания, при которых полезно вмешательство в иммунный и/или воспалительный ответ.
В некоторых вариантах осуществления пациенту вводят иммуноконъюгат, содержащий антитело, конъюгированное с цитотоксическим средством. В некоторых вариантах осуществления иммуноконъюгат и/или антиген, с которым он связан, интернализуется клеткой, что приводит к повышенной терапевтической эффективности иммуноконъюгата в убивании клетки-мишени, с которой он связывается. В одном из вариантов осуществления цитотоксическое средство целенаправленно воздействует или влияет на нуклеиновую кислоту в клетке-мишени. Примеры таких цитотоксических средств включают любое из химиотерапевтических средств, указанных в настоящем описании (такое, как мейтанзиноид или калихеамицин), радиоактивный изотоп, или рибонуклеазу, или ДНК-эндонуклеазу.
Антитела по изобретению можно применять в терапии либо отдельно, либо в комбинации с другими композициями. Например, антитело по изобретению можно вводить совместно с другим антителом, химиотерапевтическим средством (средствами) (включая смеси химиотерапевтических средств), другим цитотоксическим средством (средствами), антиангиогенным средством (средствами), цитокинами и/или ингибирующим рост средством (средствами). В том случае когда антитело по изобретению ингибирует рост опухоли, может быть особенно желательным его комбинирование с одним или несколькими другими терапевтическим средствами, которые ингибируют рост опухоли. Например, антитело по изобретению можно комбинировать с анти-VEGF-антителом (например, авастином) и/или анти-ErbB-антителами (например, анти-HER-2-антителом HERCEPTIN®) в схеме лечения, например, при лечении любого из заболеваний, описанных в настоящем описании, включая рак прямой и ободочной кишки, метастатический рак молочной железы и рак почек. Альтернативно или дополнительно пациент может получать комбинированную лучевую терапию (например, наружное облучение или терапия радиоактивно меченым средством, таким как антитело). Такая комбинированная терапия, которая указана выше, включает совместное введение (когда два или более средств включены в один и тот же или в разные препараты) и раздельное введение, при котором введение антитела по изобретению может происходить до и/или после введения вспомогательного терапевтического средства или терапевтических средств.
Антитело по изобретению (и вспомогательное терапевтическое средство) вводят соответствующими способами, включая парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное и, если требуется местное лечение, введение внутрь пораженной ткани. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Кроме того, антитело в соответствующих случаях вводят импульсной инфузией, особенно со снижающимися дозами антитела. Дозирование можно осуществлять любым подходящим путем, например инъекциями, такими как внутривенные или подкожные инъекции, отчасти в зависимости от того, является ли введение краткосрочным или хроническим.
Композиция антитела по изобретению будет приготовлена, дозирована и введена таким образом, который совместим с правильной медицинской практикой. Факторы, которые учитываются в таком контексте, включают конкретное расстройство, подвергаемое лечению, конкретного млекопитающего, подвергаемого лечению, клиническое состояние пациента, причину расстройства, место доставки средства, способ введения, схему введения и другие факторы, известные лечащим врачам. Антитело необязательно готовят с одним или нескольким средствами, используемыми в настоящее время для профилактики или лечения рассматриваемого расстройства. Эффективное количество таких других средств зависит от количества антител по изобретению, присутствующих в препарате, типа расстройства или лечения и других факторов, обсуждаемых выше. Средства обычно используют в таких же дозах и такими же путями введения, как использовали прежде, или примерно от 1 до 99% от используемых прежде доз.
Подходящая для профилактики или лечения заболевания доза антитела по изобретению (при использовании отдельно или в комбинации с другими средствами, такими как химиотерапевтические средства) будет зависеть от типа заболевания, подвергаемого лечению, типа антитела, тяжести и течения заболевания, от того, вводят ли антитело для профилактических или терапевтических целей, предыдущей терапии, истории болезни пациента и ответа на антитело и решения лечащего врача. Антитело соответствующим образом вводят пациенту за один раз или используя серию обработок. В зависимости от типа и тяжести заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг - 10 мг/кг) антитела составляет начальную выбираемую дозу для введения пациенту, например, либо в виде одного или нескольких отдельных введений, либо посредством непрерывной инфузии. Одна из типичных суточных доз может быть в диапазоне примерно от 1 мкг/кг до 100 мг/кг или более, в зависимости от указанных выше факторов. В случае многократных введений на протяжении нескольких дней или дольше, в зависимости от состояния, лечение продолжают вплоть до наступления требуемого подавления симптомов заболевания. Одним из примеров дозы антитела может быть доза в диапазоне примерно от 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту можно вводить одну или несколько доз, составляющих примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или их любые комбинации). Такие дозы можно вводить периодически, например каждую неделю или каждые три недели (например, так чтобы пациент получал примерно от двух до примерно двадцати, например примерно шесть доз антитела). Может быть введена начальная более высокая ударная доза с последующим введением одной или нескольких более низких доз. Примерная схема дозирования включает введение начальной ударной дозы примерно 4 мг/кг с последующей еженедельной поддерживающей дозой примерно 2 мг/кг антитела. Однако могут быть применимы другие схемы дозирования. Успешность такой терапии легко контролировать обычными способами и анализами.
Изделия производства
В другом аспекте изобретения предлагается изделие производства, содержащее вещества, применимые для лечения, профилактики и/или диагностики расстройств, описанных выше. Изделие производства содержит емкость и этикетку или вкладыш в упаковку, находящиеся на емкости или прикрепленные к емкости. Подходящие емкости включают, например, бутылки, флаконы, шприцы и т.д. Емкости могут быть сделаны из множества материалов, таких как стекло или пластмасса. В емкости находится композиция, которая сама по себе или в комбинации с другой композицией является эффективной для лечения, профилактики и/или диагностики состояния и может иметь стерильное входное отверстие (например, емкость может представлять собой мешок с внутривенным раствором или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). По меньшей мере одним активным средством в композиции является антитело по изобретению. Ярлык или вкладыш в упаковку указывает, что композиция применима для лечения выбранного состояния, такого как злокачественная опухоль. Кроме того, изделие производства может содержать (a) первую емкость с находящейся в ней композицией, при этом композиция содержит антитело по изобретению; и (b) вторую емкость с находящейся в ней композицией, при этом композиция содержит дополнительное цитотоксическое средство. Изделие производства согласно данному варианту осуществления изобретения дополнительно может содержать вкладыш в упаковку, указывающий, что первую и вторую композиции антител можно применять для лечения конкретного состояния, например злокачественной опухоли. Альтернативно или дополнительно изделие производства дополнительно может содержать вторую (или третью) емкость, содержащую фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Изделие производства дополнительно может содержать другие материалы, желательные с коммерческой точки зрения и точки зрения пользователя, включая другие буферы, разбавители, наполнители, иглы и шприцы.
После знакомства с описанием изобретения в общем его будет легче понять при обращении к следующим примерам, которые приведены с целью иллюстрации и не предназначены для ограничения.
Пример 1. Конструирование представленной в фаговом дисплее Fab-библиотеки с остатками CDR, обогащенными Tyr, Ser, Gly и Arg
Представленные в фаговом дисплее Fab-библиотеки конструировали, используя фагмидный вектор, Fab-C, который приводит к дисплею бивалентных остатков Fab, димеризованных свободным цистеином, встроенным между тяжелой цепью Fab и C-концевым доменом минорного белка оболочки гена-3 (P3C). Указанный вектор конструировали, как описано в публикации заявки на выдачу патента США No. US20050119455 и в Lee et al., J. Immunol. Meth. 284:119-132 (2004). Вектор (схематично показанный на фиг.5) содержит вариабельные домены гуманизированного антитела 4D5 под контролем IPTG-индуцируемого промотора Ptac. Гуманизированное антитело 4D5 главным образом имеет каркасные области консенсусной последовательности человека в тяжелой и легкой цепях и CDR-области из мышиного моноклонального антитела, специфичного к HER-2. Способы получения анти-HER-2-антитела и особенности последовательностей вариабельных доменов представлены в патентах США No. 5821337 и 6054297.
Конструировали четыре библиотеки: YSGR-A, YSGR-B, YSGR-C и YSGR-D. Библиотеки конструировали с рандомизированными остатками во всех трех CDR тяжелой цепи и CDR3 легкой цепи. Каждую библиотеку рандомизировали в положениях 91-94 и 96 CDRL3, положениях 28 и 30-33 CDRH1, положениях 50, 52-54, 56 и 58 CDRH2 и положениях 95-100, 100a, 100b и 100c CDRH3. Тип и соотношение аминокислот, допустимых для каждого рандомизированного положения, описаны на фиг.8. Кроме того, длину CDRH3 варьировали, используя олигонуклеотиды, которые заменяли семь кодонов дикого типа от положения 95 до 100a шестью-семнадцатью кодонами. Таким образом, в некоторых случаях кодон, соответствующий положению 100a тяжелой цепи, отсутствует (например, когда мутагенез осуществляли с использованием мутагенных олигонуклеотидов H3-A6 (SEQ ID NO:35), H3-B6 (SEQ ID NO:47), H3-C6 (SEQ ID NO:59) или H3-D6 (SEQ ID NO:71), которые описаны ниже. Смотри фиг.9A-D. Тип и соотношения аминокислот, допустимых в таких положениях, такие же, как тип и соотношение аминокислот, описанные на фиг.8 для положений 95-100a CDRH3.
Библиотеки конструировали, используя способ Kunkel (Kunkel, T. A., Roberts, J.D. and Zakour, R.A., Methods Enzymol. (1987), 154, 367-382) и ранее описанные способы (Sidhu, S. S., Lowman, H.B., Cunningham, B. C. and Wells, J.A., Methods Enzymol. (2000), 328, 333-363). Уникальный вариант «стоп-матрицы» вектора Fab-C для Fab-дисплея использовали для создания всех четырех библиотек, как описано в примере 1.
Мутагенные олигонуклеотиды с вырожденными кодонами в положениях, подвергаемых разнообразию, использовали для того, чтобы одновременно (a) вводить разнообразие CDR и (b) восстанавливать стоп-кодоны. Последовательности таких мутагенных олигонуклеотидов показаны на фиг.9A-9D. Для всех библиотек разнообразие вводили в CDR-H1, CDR-H2 и CDR-H3, используя олигонуклеотиды H1, H2 и L3 соответственно (SEQ ID NO:). В случае библиотеки YSGR-A разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-A6, H3-A7, H3-A8, H3-A9, H3-A10, H3-A11, H3-A12, H3-A13, H3-A14, H3-A15, H3-A16 и H3-A17 (SEQ ID NO:35-46). В случае библиотеки YSGR-B разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-B6, H3-B7, H3-B8, H3-B9, H3-B10, H3-B11, H3-B12, H3-B13, H3-B14, H3-B15, H3-B16 и H3-B17 (SEQ ID NO:47-58). В случае библиотеки YSGR-C разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-C6, H3-C7, H3-C8, H3-C9, H3-C10, H3-C11, H3-C12, H3-C13, H3-C14, H3-C15, H3-C16 и H3-C17 (SEQ ID NO:59-70). В случае библиотеки YSGR-D разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-D6, H3-D7, H3-D8, H3-D9, H3-D10, H3-D11, H3-D12, H3-D13, H3-D14, H3-D15, H3-D16 и H3-D17 (SEQ ID NO:71-82). Каждый из мутагенных олигонуклеотидов от H3-A6 до H3-A17 (SEQ ID NO:35-46), от H3-B6 до H3-B17 (SEQ ID NO:47-58), от H3-C6 до H3-C17 (SEQ ID NO:59-70) и от H3-D6 до H3-D17 (SEQ ID NO:71-82) кодировал аланин в положении 93 тяжелой цепи. Мутагенные олигонуклеотиды для всех CDR, подвергаемых рандомизации, вводили одновременно в одной реакции мутагенеза для того, чтобы одновременно введение всех мутагенных олигонуклеотидов приводило к введению требуемого разнообразия в каждое положение и одновременно восстанавливало все стоп-кодоны TAA. Таким образом, создавали открытую рамку считывания, которая кодировала представитель Fab-библиотеки, слитый с гомодимеризующим цистеиновым мостиком и P3C. После мутагенеза четыре библиотеки объединяли, чтобы создать одну библиотеку, названную библиотекой YSGR-A-D.
Продукты реакции мутагенеза посредством электропорации вводили в E. coli SS320 (Sidhu et al., выше). Трансформированные клетки выращивали в течение ночи в присутствии хелперного фага M13-KO7 (New England Biolabs, Beverly, MA), чтобы получить фаговые частицы, которые инкапсулировали фагмидную ДНК и представляли Fab-фрагменты в виде дисплея на своей поверхности. Объединенная библиотека содержала более 3×1010 уникальных представителей.
Пример 2. Селекция специфичных антител из нативной библиотеки YSGR-A-D
Фаг из библиотеки YSGR-A-D (описанной в примере 1, выше) подвергали повторяющимся раундам селекции в отношении связывания, чтобы обогатить клонами, связывающимися с DR5 или HER-2 человека. Селекции в отношении связывания проводили, используя ранее описанные способы (Sidhu et al., выше).
Последовательность DR5 человека показана в таблице 1. Внеклеточный домен DR5, который показан в таблице 1, использовали для селекции в отношении связывания. Подобным образом внеклеточный домен последовательности HER-2 человека получали, как описано в Franklin MC. Carey KD. Vajdos FF. Leahy DJ. de Vos AM. Sliwkowski MX. Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex. Cancer Cell. 5(4):317-28, 2004. Последовательность HER-2 ECD человека (аминокислоты 23-646) представлена в Protein DataBank Record 1S78 (2004).
96-луночные планшеты для иммуноанализа NUNC Maxisorp покрывали в течение ночи при 4ºC 5 мкг/мл белка-мишени (DR5 человека или HER-2 человека) и блокировали в течение 2 часов раствором PBT (фосфатно-солевой буфер, дополнительно содержащий 0,2% БСА и 0,05% твин-20 (Sigma)). После выращивания в течение ночи при 37ºC фаг концентрировали преципитацией ПЭГ/NaCl и ресуспендировали в PBT, как описано ранее (Sidhu et al., выше). Растворы фага (примерно 1012 фагов/мл) добавляли в покрытые планшеты для иммуноанализа. После двухчасовой инкубации, обеспечивающей связывание фага, планшеты промывали десять раз PBT. Связанный фаг элюировали 0,1 М HCl в течение десяти минут и элюант нейтрализовали основанием 1,0 М трис. Элюированный фаг амплифицировали в E. coli XL1-blue и использовали для последующих раундов селекции.
Библиотеки подвергали пяти раундам селекции против каждого белка-мишени. Отдельные клоны из каждого раунда селекции выращивали в 96-луночном планшете в 500 мкл бульона 2YT с добавлением карбенициллина и M13-K07. Надосадки культуры непосредственно использовали в ELISA фага (Sidhu et al., выше), чтобы выявить представленные в фаговом дисплее Fab, которые связывались с планшетами, покрытыми белком-мишенью, но не с планшетами, покрытыми БСА. Специфичные связывающие агенты определяли как такие фаговые клоны, которые давали сигнал в ELISA по меньшей мере в 10 раз выше на покрытых мишенью планшетах по сравнению с покрытыми БСА планшетами. Отдельные клоны подвергали скринингу после 4 и 5 раундов селекции на связывание с DR5 человека или HER-2 человека. Специфичные связывающие агенты подвергали анализу последовательностей. Специфичные связывающие агенты также анализировали, используя анализ аффинности с помощью spot-ELISA, ELISA специфичности и анализ аффинности по отношению к HER2, способами, которые описаны в настоящем описании (смотри фиг.11B). Как показано на фиг.10, библиотека YSGR-A-D давала специфичные связывающие агенты к обоим белкам-мишеням.
Из 240 идентифицированных клонов, которые специфично связывались с HER-2 человека, 106 имели уникальные последовательности CDR (смотри фиг.11). Уникальные последовательности относились к трем категориям: 1) последовательности CDRH3 из 6-7 остатков; 2) последовательности CDRH3 из восьми остатков; и 3) последовательности CDR средней длины с тирозином, серином и глицином в последовательности.
Вариабельные домены тяжелой цепи анти-HER-2 предпочтительно имели короткие последовательности CDRH3 (например, 6-7 аминокислот в положениях, соответствующих 95-100a), не включенные в олиго-библиотеку (смотри фиг.12). CDRH3 имела консервативный остаток тирозина на N-конце в положении 95. Другое консервативное положение обнаружено в положении 99, которое преимущественно занимает глицин. Консенсусные последовательности показаны для CDRL3: QQSYYX4PST (SEQ ID NO:587); CDRH1: GFSIX2X3SYIH (SEQ ID NO:588) и CDRH2: SIYPX3SGYTSYADSKVG (SEQ ID NO:589), где X означает аминокислотное положение, в котором консенсусный остаток не идентифицирован, и где положения X в каждой CDR заняты Y или S.
Вариабельные домены тяжелой цепи, имеющие CDRH3 из восьми аминокислот, имеют консервативные глицины на N- и C-концах CDRH3 (в положениях 95 и 100a). Положение 98 также является консервативным и занято тирозином. Положение 99 восьмиаминокислотной CDRH3 предпочтительно занято небольшой аминокислотой, такой как G, S, A или T. После указанного положения следует крупная аминокислота в положении 100, такая как R, H, Y и W. Консенсусные последовательности показаны для CDRH1: GFX1ISYSSIH (SEQ ID NO:590) и CDRH2: SIYPX3YGX5TX6YADSKVG(SEQ ID NO:591), где X означает аминокислотное положение, в котором консенсусный остаток не идентифицирован и означает Y или S.
Анализ вариабельных доменов тяжелой цепи с областями CDRH3 умеренной длины (например, около 12-14 аминокислот) показал консенсусную последовательность CDRH3 X1X2X3X4YYSYYX10GX12X13X14DY (SEQ ID NO:592), где X означает аминокислотное положение, для которого консенсусный остаток не идентифицирован, где Х1 выбран из Y, S и R; Х2 выбран из Y и S; Х3 выбран из G, Y и S; Х4 выбран из Y, S, R и G; Х10 выбран из Y, S и G; Х12 выбран из Y, S, G и R; Х13 выбран из G и A; и Х14 выбран из I, F, F и L (смотри фиг.14). Так как CDRH3 образует петлю, то консенсус для CDRH3 получали сдвигом последовательности для некоторых клонов на две аминокислоты, так что положение 95 последовательности может при выравнивании совпадать с положением 97 эталонной последовательности, которая в данном случае представляла собой последовательность клона 52. Консенсусные последовательности также показаны для CDRH1: GFX1ISSSSIH (SEQ ID NO:593) и CDRH2: X1IX2PSSGYTX6YADSKVG (SEQ ID NO:594), где X означает аминокислотное положение, в котором консенсусный остаток не идентифицирован и означает Y или S.
Как описано на фиг.11B, несколько клонов связывались с HER2 с IC50 от 0,1 до 10 нМ. В основном такие высокоаффинные связывающие агенты имели небольшую или не имели перекрестной реактивности с другими антигенами, такими как VEGF, DR5, инсулин, нейтравидин, гормон роста человека или IGF-1.
Как показано на фиг.10, идентифицировали 144 клонов, которые экспрессировали Fab, которые представляли собой специфичные агенты, связывающие DR5 человека. Анализ последовательностей выявил 18 уникальных аминокислотных последовательностей из указанных 144 клонов, показанных на фиг.15.
IC50 каждого из указанных связывающих агентов определяли в конкурентном ELISA фага следующим образом. 96-луночные планшеты для иммуноанализа NUNC Maxisorp покрывали в течение ночи при 4ºC hDR5-ECD (5 мкг/мл) и блокировали БСА. Представленные в фаговом дисплее Fab амплифицировали в E. coli XL1-blue с добавлением хелперного фага M13-KO7. После выращивания в течение ночи при 37ºC в среде 2YT фаг концентрировали преципитацией ПЭГ/NaCl и ресуспендировали в фосфатно-солевом буфере (PBS), 0,5% (мас./об.) БСА, 0,1% (об./об.) твин-20 (буфер PBT). Фаг серийно разбавляли в буфере PBT и измеряли связывание, чтобы определить концентрацию фага, дающую сигнал, составляющий ~50% от сигнала при насыщении. Постоянную субнасыщающую концентрацию фага предварительно инкубировали в течение 2 часов с серийными разведениями hDR5-ECD и затем переносили в планшеты для анализа, покрытые hDR5-ECD. После инкубации в течение 15 мин планшеты промывали PBS, 0,05% твин-20 и инкубировали 30 мин с конъюгатом пероксидаза хрена/анти-M13-антитело (разведение 1:5000 в буфере PBT). Планшеты промывали, проявляли, используя субстрат TMB, гасили 1,0 М H3PO4 и регистрировали спектрофотометрически при 450 нм. Аффинности связывания лигандов анти-hDR5 определяли в виде значений IC50, определяемых как концентрация hDR5-ECD, которая блокировала на 50% связывание фага с иммобилизованным hDR5-ECD.
Клоны анализировали в отношении связывания с внеклеточными доменами DR5 человека (SEQ ID NO:595). Связывающие агенты с наименьшей IC50 преимущественно имели серин в CDRH1 и аргинин в CDRH3 в положениях 96 и 99. Анализ CDRH3-областей вариабельных доменов тяжелой цепи дает консенсусную последовательность CDRH3 YRX3YRYGX8X9X10GSYX14X15DY (SEQ ID NO:596), где Х3 выбран из Y, S, R, P и G; Х8 выбран из R, Y и S; Х9 выбран из G и Y; Х10 выбран из S, Y и R, Х14 выбран из G и A; и Х15 выбран из L и F, где X означает аминокислотное положение, для которого консенсусный остаток не идентифицирован (смотри фиг.16). Консенсусные последовательности также показаны для CDRL3: QQX1X2X3SPST (SEQ ID NO:597), где X1, X2 и X3 означают Y или S; CDRH1: GFX1IX2SSSIH (SEQ ID NO:598) и CDRH2: X1ISPX3X4GYTX6YADSKVG (SEQ ID NO:599), где X означает аминокислотное положение, для которого консенсусный остаток не идентифицирован и означает Y или S. Консенсусные последовательности могут быть использованы наряду с прочим для образования новых библиотек вариабельных доменов антител. В CDRH3 аминокислоты в положениях 97, 100b, 100c, 100h и 100i могут вносить вклад в более высокую аффинность.
Клоны также анализировали в отношении связывания с мышиным DR5, используя конкурентный ELISA фага, описанный выше. Выделили несколько клонов из библиотеки YSGR A-D, которые связывали как DR5 человека, так и DR5 мыши, хотя связывание с мышиным DR5 было с меньшей аффинностью (смотри фиг.17). Такая библиотека обеспечивала выделение антител, которые могут связываться как с мышиным, так и с человеческим DR5, что свидетельствует о том, что идентифицированные связывающие агенты были уникальными по сравнению с общим случайным CDRH3 (все двадцать аминокислот) и библиотекой CDRH3 YS. Изменение разнообразия аминокислот, возможного в каждом положении, может давать антитела, которые связываются с разными эпитопами и обладают уникальными биологическими функциями. Анти-DR5-антитела, которые связываются как с мышиными, так и с человеческими CDR, могут связываться с другими эпитопами, отличными от эпитопов анти-DR5-антител из ранее разработанных библиотек.
Пример 3. Анализ агентов, связывающихся с DR5
Сайт связывания лиганда Apo 2L с DR5 человека был картирован ранее, и определена кристаллическая структура сайта связывания (смотри Hymowitz et al., Molecular Cell 4:564 (1999); WO 01/19861). Кристаллическая структура и модели могут быть использованы для картирования связывания анти-DR5-антител.
В предыдущих исследованиях идентифицированы антитела, которые связываются с DR5 человека. Такие антитела названы BDF1 и YSD1. Антитело BDF1 выделяли из библиотеки, в которой CDR рандомизировали, используя все 20 аминокислот, и антитело имеет последовательности CDR: 1) последовательность CDRH1: IGKSGIH (SEQ ID NO:600); 2) последовательность CDR2: YAVIYPHDGNTAYA (SEQ ID NO:601) и 3) последовательность CDRH3: RLALVRMWMD (SEQ ID NO:602). Антитело YSD1 выделяли из библиотеки, в которой положения CDR варьировали, используя тирозин и серин, и антитело имеет последовательность CDRH3: YSSYYSYYYSSSSYSY (SEQ ID NO:603). Сайт связывания указанных антител на DR5 человека расположен на N-конце молекулы и имеет небольшое перекрывание с сайтом связывания лиганда Apo 2L, который преимущественно располагается на C-конце (аминокислоты петли 50, например аминокислоты 50-65, и аминокислоты петли 90, например аминокислоты 91-104 DR5). Модель, показывающая связывание областей CDRH3 каждого из указанных антител, показана на фиг.18. CDRH3 BDF1 и YSD1 перекрываются и образуют «горячую точку» для связывания с DR5. Связывание CDRH3 YSD1 опосредовано тирозинами, а связывание BFD1 опосредовано последовательностью LAL. В связывание YSD1 с DR5 вовлечены остатки лейцина, глутамина, аланина, фенилаланина и аргинина DR5.
Пример 4. Конструирование представленных в фаговом дисплее библиотек Fab с остатками CDRH1, H2 и L3, обогащенными Tyr и Ser, и остатками CDRH3, обогащенными Ser и Ala, Cys, Phe, Gly, Ile, Leu, Asn, Pro, Arg, Thr, Trp или Tyr
Представленные в фаговом дисплее библиотеки Fab конструировали, используя фагмидный вектор, Fab-C, который приводит к дисплею бивалентных остатков Fab, димеризованных свободным цистеином, встроенным между тяжелой цепью Fab и C-концевым доменом минорного белка оболочки гена-3 (P3C), который описан ранее в примере 1.
Сконструировали двенадцать библиотек: SAH3, SCH3, SFH3, SGH3, SLH3, SNH3, SPH3, SRH3, STH3, SWH3 и SYH3. Библиотеки конструировали с рандомизированными остатками во всех трех CDR тяжелой цепи и CDR3 легкой цепи. Каждую библиотеку рандомизировали в положениях 91-94 и 96 CDRL3, положениях 28 и 30-33 CDRH1, положениях 50, 52-54, 56 и 58 CDRH2 и положениях 95-100, 100a-100m CDRH3. Тип и соотношение аминокислот, допустимых в каждом из рандомизированных положений, описаны на фиг.19A-19B. Кроме того, длину CDRH3 варьировали, используя олигонуклеотиды, с помощью которых заменяли шесть кодонов дикого типа между положениями 95 и 100 4-17 кодонами. Тип и соотношение аминокислот, допустимых в таких положениях, были такими же, как тип и соотношение аминокислот, описанные на фиг.19A-19B, для положений 95-100 CDRH3.
Библиотеки конструировали, используя способ Kunkel (Kunkel et al., Methods Enzymol. (1987) 154:367-382) и описанные ранее способы (Sidhu et al., Methods Enzymol. (2000) 328:333-363). Уникальный вариант «стоп-матрицы» вектора Fab-C для Fab-дисплея использовали для создания всех четырех библиотек, как описано в примере 1.
Мутагенные олигонуклеотиды с вырожденными кодонами в положениях, подвергаемых разнообразию, использовали для того, чтобы одновременно (a) вводить разнообразие CDR и (b) восстанавливать стоп-кодоны. Последовательности таких мутагенных олигонуклеотидов показаны на фиг.20A-20L. Для всех библиотек разнообразие вводили в CDRH1, CDRH2 и CDRL3, используя олигонуклеотиды H1, H2 и L3 соответственно (SEQ ID NO:).
В случае библиотеки SAH3 разнообразие вводили в CDRH3, используя эквимолярную смесь олигонуклеотидов H3-SA4, H3-SA5, H3-SA6, H3-SA7, H3-SA8, H3-SA9, H3-SA10, H3-SA11, H3-SA12, H3-SA13, H3-SA14, H3-SA15, H3-SA16 и H3-SA17 (SEQ ID NO:621-634).
В случае библиотеки SCH3 разнообразие вводили в CDRH3, используя эквимолярную смесь олигонуклеотидов H3-SC4, H3-SC5, H3-SC6, H3-SC7, H3-SC8, H3-SC9, H3-SC10, H3-SC11, H3-SC12, H3-SC13, H3-SC14, H3-SC15, H3-SC16 и H3-SC17 (SEQ ID NO:635-648).
В случае библиотеки SFH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SF4, H3-SF5, H3-SF6, H3-SF7, H3-SF8, H3-SF9, H3-SF10, H3-SF11, H3-SF12, H3-SF13, H3-SF14, H3-SF15, H3-SF16 и H3-SF17 (SEQ ID NO:649-662).
В случае библиотеки SGH3 разнообразие вводили в CDRH3, используя эквимолярную смесь олигонуклеотидов H3-SG4, H3-SG5, H3-SG6, H3-SG7, H3-SG8, H3-SG9, H3-SG10, H3-SG11, H3-SG12, H3-SG13, H3-SG14, H3-SG15, H3-SG16 и H3-SG17 (SEQ ID NO:663-676).
В случае библиотеки SIH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SI4, H3-SI5, H3-SI6, H3-SI7, H3-SI8, H3-SI9, H3-SI10, H3-SI11, H3-SI12, H3-SI13, H3-SI14, H3-SI15, H3-SI16 и H3-SI17 (SEQ ID NO:677-690).
В случае библиотеки SLH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SL4, H3-SL5, H3-SL6, H3-SL7, H3-SL8, H3-SL9, H3-SL10, H3-SL11, H3-SL12, H3-SL13, H3-SL14, H3-SL15, H3-SL16 и H3- SL17 (SEQ ID NO:691-704).
В случае библиотеки SNH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SN4, H3-SN5, H3-SN6, H3-SN7, H3-SN8, H3-SN9, H3-SN10, H3-SN11, H3-SN12, H3-SN13, H3-SN14, H3-SN15, H3-SN16 и H3-SN17 (SEQ ID NO:705-718).
В случае библиотеки SPH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SP4, H3-SP5, H3-SP6, H3-SP7, H3-SP8, H3-SP9, H3-SP10, H3-SP11, H3-SP12, H3-SP13, H3-SP14, H3-SP15, H3-SP16 и H3-SP17 (SEQ ID NO:719-732).
В случае библиотеки SRH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SR4, H3-SR5, H3-SR6, H3-SR7, H3-SR8, H3-SR9, H3-SR10, H3-SR11, H3-SR12, H3-SR13, H3-SR14, H3-SR15, H3-SR16 и H3-SR17 (SEQ ID NO:733-746).
В случае библиотеки STH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-ST4, H3-ST5, H3-ST6, H3-ST7, H3-ST8, H3-ST9, H3-ST10, H3-ST11, H3-ST12, H3-ST13, H3-ST14, H3-ST15, H3-ST16 и H3-ST17 (SEQ ID NO:747-760).
В случае библиотеки SWH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SW4, H3-SW5, H3-SW6, H3-SW7, H3-SW8, H3-SW9, H3-SW10, H3-SW11, H3-SW12, H3-SW13, H3-SW14, H3-SW15, H3-SW16 и H3-SW17 (SEQ ID NO:761-774).
В случае библиотеки SYH3 разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SY4, H3-SY5, H3-SY6, H3-SY7, H3-SY8, H3-SY9, H3-SY10, H3-SY11, H3-SY12, H3-SY13, H3-SY14, H3-SY15, H3-SY16 и H3-SY17 (SEQ ID NO:775-788).
Мутагенные олигонуклеотиды для всех рандомизируемых CDR вводили в одной реакции мутагенеза так, чтобы одновременное введение всех мутагенных олигонуклеотидов давало введение требуемого разнообразия в каждое положение и восстанавливало все стоп-кодоны TAA. Таким образом, создавали открытую рамку считывания, которая кодировала представителя библиотеки Fab, слитого с гомодимеризующим цистеиновым мостиком и P3C. После мутагенеза двенадцать библиотек объединяли, чтобы создать одну библиотеку, названную библиотекой SXH3.
Продукты реакции мутагенеза с помощью электропорации вводили в E. coli SS320 (Sidhu et al., выше). Трансформированные клетки выращивали в течение ночи в присутствии хелперного фага M13-K07 (New England Biolabs, Beverly, MA), получая фаговые частицы, которые инкапсулировали фагмидную ДНК и представляли Fab-фрагменты в виде дисплея на своей поверхности. Объединенная библиотека содержала более 3×1010 уникальных представителей.
Пример 5. Селекция специфичных антител из нативной библиотеки SXH3
Фаг из библиотеки SXH3 (описанной в примере 4, выше) подвергали повторяющимся раундам селекции на связывание, чтобы обогатить клонами, связывающимися с HER-2 человека. Селекции на связывание проводили, используя ранее описанные способы (Sidhu et al., выше).
96-луночные планшеты для иммуноанализа NUNC Maxisorp покрывали в течение ночи при 4ºC 5 мкг/мл белка-мишени (HER2) и блокировали в течение двух часов раствором PBT (Sigma). После выращивания в течение ночи при 37ºC фаг концентрировали преципитацией ПЭГ/NaCl и ресуспендировали в PBT, как описано ранее (Sidhu et al., выше). Растворы фага (примерно 1012 фагов/мл) добавляли в покрытые планшеты для иммуноанализа. После двухчасовой инкубации, обеспечивающей связывание фага, планшеты промывали десять раз PBT. Связанный фаг элюировали 0,1 М HCl в течение десяти минут и элюант нейтрализовали основанием 1,0 М трис. Элюированный фаг амплифицировали в E. coli XL1-blue и использовали для последующих раундов селекции.
Библиотеки подвергали шести раундам селекции против каждого белка-мишени. Отдельные клоны из каждого раунда селекции выращивали в 96-луночном планшете в 500 мкл бульона 2YT с добавлением карбенициллина и M13-K07. Надосадки культуры непосредственно использовали в ELISA фага (Sidhu et al., выше), чтобы выявить представленные в фаговом дисплее Fab, которые связывались с планшетами, покрытыми белком-мишенью, но не с планшетами, покрытыми БСА. Специфичные связывающие агенты определяли как такие фаговые клоны, которые давали сигнал в ELISA по меньшей мере в 10 раз выше на покрытых мишенью планшетах по сравнению с покрытыми БСА планшетами. Отдельные клоны подвергали скринингу после 4, 5 и 6 раундов селекции на связывание с HER-2 человека. Специфичные связывающие агенты подвергали анализу последовательностей. Как показано на фиг.21, библиотека SXH3 давала специфичные связывающие агенты к белку-мишени.
Из 72 идентифицированных клонов, которые специфично связывались с HER-2, 27 имели уникальные последовательности CDR (смотри фиг.21A). Уникальные последовательности относились к трем категориям: (1) последовательности CDR с рандомизированными положениями, ограниченными парой Tyr/Ser (клоны No. B1-5 и B28); (b) последовательности CDR с рандомизированными положениями, ограниченными парой Trp/Ser (клоны No. B6-24); (c) последовательности CDR с рандомизированными положениями, ограниченными парой Phe/Ser (клоны No. B25-27). Указанные клоны также были высокоспецифичными по отношению к HER2 и не давали перекрестной реактивности к пяти другим контрольным белкам, VEGF человека, DR5 человека, инсулину человека, нейтравидину, IGF-1 человека или HGH (смотри фиг.21B). Ингибирующая концентрация для каждого клона показана на фиг.21B.
ELISA фага использовали для тестирования способности всех клонов перекрестно взаимодействовать с панелью из шести антигенов, отличных от антигена-мишени. Фаг получали в 96-луночных планшетах, как описано, и надосадки фага разбавляли в 3 раза в буфере PBT. Разбавленный надосадок фага переносили в планшеты, покрытые VEGF человека, HER2, DR5 человека, инсулином человека, нейтравидином, IGF-1 человека, HGH или БСА, и инкубировали в течение одного часа при осторожном встряхивании при комнатной температуре. Планшеты промывали PBS, содержащим 0,05% твина-20, и инкубировали в течение 30 минут с конъюгатом пероксидаза хрена/анти-M13-антитело (разбавленным 1:5000 в буфере PT) (Pharmacia). Планшеты промывали, проявляли субстратом тетраметилбензидином (TMB) (Kirkegaard and Perry Laboratories) и гасили 1,0 М H3PO4. Оптическую плотность определяли спектрофотометрически при 450 нм. Слабую перекрестную реактивность определяли на основании сигнала 0,2-2,0, а сильную перекрестную реактивность определяли на основании сигнала, примерно составляющего 2,0. Результаты для клонов, связывающих HER2, показаны на фиг.21B. Как показано на фиг.25, среди выделенных клонов SXH3 клоны S:R имели наибольшее среднее неспецифичное связывание (0,5-0,6 OD при 450 нм при анализе ELISA), тогда как клоны S:W, S:Y и S:F имели сходные низкие уровни среднего неспецифичного связывания (0-0,1 OD при 450 нм при анализе ELISA).
Конкурентный ELISA фага использовали для оценки аффинностей связывания представленных в фаговом дисплее Fab, связывающих HER2. Фаг получали в 96-луночном планшете, как описано, и надосадки фага серийно разбавляли в буфере PBT, затем инкубировали на планшетах, покрытых HER2, в течение 15 минут. Планшеты промывали PBS, содержащим 0,05% твина-20, и инкубировали в течение 30 минут с конъюгатом пероксидаза хрена/анти-M13-антитело (разведение 1:5000 в буфере PT) (Pharmacia). Планшеты промывали, проявляли, используя субстрат тетраметилбензидин (TMB) (Kirkegaard and Perry Laboratories), и гасили 1,0 М H3PO4. Оптическую плотность измеряли спектрофотометрически при 450 нм, чтобы определить концентрацию фага, которая дает сигнал, составляющий примерно 50% от сигнала при насыщении. Постоянную субнасыщающую концентрацию фага разбавляли в два раза в буфере PBT или в буфере PBT, содержащем двукратные серийные разведения белка HER2 от 250 нМ HER2 до 0,12 нМ HER2. Смеси инкубировали в течение одного часа при осторожном встряхивании при комнатной температуре, переносили в планшеты, покрытые HER2, и планшеты инкубировали в течение 15 минут. Планшеты промывали и обрабатывали так же, как описано выше. Аффинности связывания оценивали в виде значений IC50 (определяемых как концентрация антигена, которая блокировала на 50% связывание фага с иммобилизованным антигеном). Результаты показаны на фиг.21B.
Пример 6. Конструирование представленных в фаговом дисплее библиотек Fab с остатками CDR, обогащенными Ser и Phe, Arg, Trp, или Tyr
Представленные в фаговом дисплее библиотеки Fab конструировали, используя фагмидный вектор, Fab-C, который приводит к дисплею бивалентных остатков Fab, димеризованных свободным цистеином, встроенным между тяжелой цепью Fab и C-концевым доменом минорного белка оболочки гена-3 (P3C), который описан ранее в примере 1.
Сконструировали четыре библиотеки: SFH3, SRH3, SWH3 и SYH3. Библиотеки конструировали с рандомизированными остатками во всех трех CDR тяжелой цепи и CDR3 легкой цепи. Каждую библиотеку рандомизировали в положениях 91-94 и 96 CDRL3, положениях 28 и 30-33 CDRH1, положениях 50, 52-54, 56 и 58 CDRH2 и положениях 95-100, 100a-100m CDRH3. Тип и соотношение аминокислот, допустимых в каждом из рандомизированных положений, описаны на фиг.22. Кроме того, длину CDRH3 варьировали, используя олигонуклеотиды, с помощью которых заменяли шесть кодонов дикого типа между положениями 95 и 100 4-17 кодонами. Тип и соотношение аминокислот, допустимых в таких положениях, были такими же, как тип и соотношение аминокислот, описанные на фиг.22, для положений 95-100 CDRH3.
Библиотеки конструировали, используя способ Kunkel (Kunkel, T.A., Roberts, J.D. and Zakour, R.A., Methods Enzymol. (1987) 154:367-382) и описанные ранее способы (Sidhu, S.S., Lowman, H.B., Cunningham, B. C. and Wells, J.A., Methods Enzymol. (2000) 328:333-363). Уникальный вариант «стоп-матрицы» вектора Fab-C для Fab-дисплея использовали для создания всех четырех библиотек, как описано в примере 1.
Мутагенные олигонуклеотиды с вырожденными кодонами в положениях, подвергаемых разнообразию, использовали для того, чтобы одновременно (a) вводить разнообразие CDR и (b) восстанавливать стоп-кодоны. Последовательности таких мутагенных олигонуклеотидов показаны на фиг.20 и 23. Для SF-поверхностной библиотеки разнообразие создавали в CDR-L3, CDR-H1 и CDR-H2, используя олигонуклеотиды L3-SF, H1-SF и H2-SF соответственно (SEQ ID NO:) (фиг.23), и разнообразие вводили в CDR-H3, используя эквимолярную смесь олигонуклеотидов H3-SF4, H3-SF5, H3-SF6, H3-SF7, H3-SF8, H3-SF9, H3-SF10, H3-SF11, H3-SF12, H3-SF13, H3-SF14, H3-SF15, H3-SF16 и H3-SF17 (SEQ ID NO:649-662) (фиг.20C).
В случае SR-поверхностной библиотеки разнообразие вводили в CDR-L3, CDR-H1 и CDR-H2, используя олигонуклеотиды L3-SR, H1-SR и H2-SR соответственно (SEQ ID NO:) (фиг.23), и в CDR-H3 разнообразие вводили, используя эквимолярную смесь олигонуклеотидов H3-SR4, H3-SR5, H3-SR6, H3-SR7, H3-SR8, H3-SR9, H3-SR10, H3-SR11, H3-SR12, H3-SR13, H3-SR14, H3-SR15, H3-SR16 и H3-SR17 (SEQ ID NO:733-746) (фиг.20I).
В случае SW-поверхностной библиотеки разнообразие вводили в CDR-L3, CDR-H1 и CDR-H2, используя олигонуклеотиды L3-SW, H1-SW и H2-SW соответственно (SEQ ID NO:747-760) (фиг.23), и в CDR-H3 разнообразие вводили, используя эквимолярную смесь олигонуклеотидов H3-SW4, H3-SW5, H3-SW6, H3-SW7, H3-SW8, H3-SW9, H3-SW10, H3-SW11, H3-SW12, H3-SW13, H3-SW14, H3-SW15, H3-SW16 и H3-SW17 (SEQ ID NO:761-774) (фиг.20K).
В случае SY-поверхностной библиотеки разнообразие вводили в CDR-L3, CDR-H1 и CDR-H2, используя олигонуклеотиды L3, H1 и H2 соответственно (SEQ ID NO:) (фиг.20A), и в CDR-H3 разнообразие вводили, используя эквимолярную смесь олигонуклеотидов H3-SY4, H3-SY5, H3-SY6, H3-SY7, H3-SY8, H3-SY9, H3-SY10, H3-SY11, H3-SY12, H3-SY13, H3-SY14, H3-SY15, H3-SY16 и H3-SY17 (SEQ ID NO:775-788) (фиг.20L).
Мутагенные олигонуклеотиды для всех рандомизируемых CDR вводили в одной реакции мутагенеза так, чтобы одновременное введение всех мутагенных олигонуклеотидов давало введение требуемого разнообразия в каждое положение и восстанавливало все стоп-кодоны TAA. Таким образом, создавали открытую рамку считывания, которая кодировала представителя библиотеки Fab, слитого с гомодимеризующим цистеиновым мостиком и P3C. После мутагенеза четыре библиотеки объединяли, чтобы создать одну библиотеку, названную SX-поверхностной библиотекой.
Продукты реакции мутагенеза с помощью электропорации вводили в E. coli SS320 (Sidhu et al., выше). Трансформированные клетки выращивали в течение ночи в присутствии хелперного фага M13-K07 (New England Biolabs, Beverly, MA), получая фаговые частицы, которые инкапсулировали фагмидную ДНК и представляли Fab-фрагменты в виде дисплея на своей поверхности. Объединенная библиотека содержала более 3×1010 уникальных представителей.
Пример 7. Селекция специфичных антител из нативной SX-поверхностной библиотеки
Фаг из SX-поверхностной библиотеки (описанной в примере 6, выше) подвергали повторяющимся раундам селекции на связывание, чтобы обогатить клонами, связывающимися с HER-2 человека. Селекции на связывание проводили, используя ранее описанные способы (Sidhu et al., выше).
96-луночные планшеты для иммуноанализа NUNC Maxisorp покрывали в течение ночи при 4ºC 5 мкг/мл белка-мишени (HER2 человека) и блокировали в течение 2 часов раствором PBT (Sigma). После выращивания в течение ночи при 37ºC фаг концентрировали преципитацией ПЭГ/NaCl и ресуспендировали в PBT, как описано ранее (Sidhu et al., выше). Растворы фага (примерно 1012 фагов/мл) добавляли в покрытые планшеты для иммуноанализа. После двухчасовой инкубации, обеспечивающей связывание фага, планшеты промывали десять раз PBT. Связанный фаг элюировали 0,1 М HCl в течение десяти минут и элюант нейтрализовали основанием 1,0 М трис. Элюированный фаг амплифицировали в E. coli XL1-blue и использовали для последующих раундов селекции.
Библиотеки подвергали шести раундам селекции против каждого белка-мишени. Отдельные клоны из каждого раунда селекции выращивали в 96-луночном планшете в 500 мкл бульона 2YT с добавлением карбенициллина и M13-K07. Надосадки культуры непосредственно использовали в ELISA фага (Sidhu et al., выше), чтобы выявить представленные в фаговом дисплее Fab, которые связывались с планшетами, покрытыми белком-мишенью, но не с планшетами, покрытыми БСА. Специфичные связывающие агенты определяли как такие фаговые клоны, которые давали сигнал в ELISA по меньшей мере в 10 раз выше на покрытых мишенью планшетах по сравнению с покрытыми БСА планшетами. Отдельные клоны подвергали скринингу после 4, 5 и 6 раундов селекции на связывание с HER-2 человека. Специфичные связывающие агенты подвергали анализу последовательностей. Как показано на фиг.24, SX-поверхностная библиотека давала специфичные связывающие агенты к белку-мишени.
Из 81 идентифицированного клона, которые специфично связывались с HER-2, 27 имели уникальные последовательности CDR (смотри фиг.24A). Уникальные последовательности относились к двум категориям: (a) последовательности CDR с рандомизированными положениями, ограниченными парой Tyr/Ser (клоны No. G49-61), (b) последовательности CDR с рандомизированными положениями, ограниченными парой Trp/Ser (клоны No. G29-48). Tyr/Ser-клоны также были высокоспецифичными по отношению к HER2 и не давали перекрестной реактивности к пяти другим контрольным белкам, VEGF человека, DR5 человека, инсулину человека, нейтравидину, IGF-1 человека или HGH (смотри фиг.24B). Однако некоторые Trp/Ser-клоны были перекрестно реактивными (смотри фиг.24B). Ингибирующая концентрация для каждого клона показана на фиг.24B.
ELISA фага использовали для тестирования способности всех клонов перекрестно взаимодействовать с панелью из шести антигенов, отличных от антигена-мишени. Фаг получали в 96-луночных планшетах, как описано выше, и надосадки фага разбавляли в 3 раза в буфере PBT. Разбавленный надосадок фага переносили в планшеты, покрытые VEGF человека, HER2, DR5 человека, инсулином человека, нейтравидином, IGF-1 человека, HGH или БСА, и инкубировали в течение одного часа при осторожном встряхивании при комнатной температуре. Планшеты промывали PBS, содержащим 0,05% твина-20, и инкубировали в течение 30 минут с конъюгатом пероксидаза хрена/анти-M13-антитело (разбавленным 1:5000 в буфере PT) (Pharmacia). Планшеты промывали, проявляли субстратом тетраметилбензидином (TMB) (Kirkegaard and Perry Laboratories) и гасили 1,0 М H3PO4. Оптическую плотность определяли спектрофотометрически при 450 нм. Слабую перекрестную реактивность определяли на основании сигнала 0,2-2,0, а сильную перекрестную реактивность определяли на основании сигнала выше 2,0. Результаты для SX-поверхностных клонов показаны на фиг.24B. Как показано на фиг.27, среди выделенных SX-поверхностных клонов клоны S:R и S:W имели наибольшее среднее неспецифичное связывание (0,5-0,6 OD и примерно 4,0 OD соответственно при 450 нм при анализе ELISA), тогда как клоны S:Y и S:F имели сходные низкие уровни среднего неспецифичного связывания (0-0,1 OD при 450 нм при анализе ELISA).
Конкурентный ELISA фага также использовали для оценки аффинностей связывания представленных в фаговом дисплее Fab, связывающих HER2. Фаг получали в 96-луночном планшете, как описано выше, и надосадки фага серийно разбавляли в буфере PBT, затем инкубировали на планшетах, покрытых HER2, в течение 15 минут. Планшеты промывали PBS, содержащим 0,05% твина-20, и инкубировали в течение 30 минут с конъюгатом пероксидаза хрена/анти-M13-антитело (разведение 1:5000 в буфере PT) (Pharmacia). Планшеты промывали, проявляли, используя субстрат тетраметилбензидин (TMB) (Kirkegaard and Perry Laboratories), и гасили 1,0 М H3PO4. Оптическую плотность измеряли спектрофотометрически при 450 нм, чтобы определить концентрацию фага, которая дает сигнал, составляющий примерно 50% от сигнала при насыщении. Постоянную субнасыщающую концентрацию фага разбавляли в два раза в буфере PBT или в буфере PBT, содержащем двукратные серийные разведения белка HER2 от 250 нМ HER2 до 0,12 нМ HER2. Смеси инкубировали в течение одного часа при осторожном встряхивании при комнатной температуре, переносили в планшеты, покрытые HER2, и планшеты инкубировали в течение 15 минут. Планшеты промывали и обрабатывали так же, как описано выше. Аффинности связывания оценивали в виде значений IC50 (определяемых как концентрация антигена, которая блокировала на 50% связывание фага с иммобилизованным антигеном). Результаты показаны на фиг.24B.
На основании данного анализа, анализа HER2-связывающих клонов из библиотеки SXH3 (пример 6) и библиотеки YSGR-A-D (пример 1) растворимые Fab-белки из трех клонов (клоны No. 42(YSGR-A), B11(SXH3) и G54(SX-поверхностный)) очищали и подвергали анализу, основанному на резонансе поверхностного плазмона, связывания с HER2 человека. Данные BIAcore® получали согласно Chen et al., J. Mol. Biol. (1999), 293(4):865-81. Коротко, аффинности связывания очищенных Fab по отношению к HER2 человека рассчитывали на основании констант скоростей ассоциации и диссоциации, измеренных с использованием системы регистрации резонанса поверхностного плазмона BIAcore®-A100 (BIACORE, Inc., Piscataway, N.J.). HER2 ковалентно связывали с биосенсорным чипом в двух разных концентрациях, используя гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимид (NHS) согласно инструкциям поставщика (BIAcore, Inc., Piscataway, N.J.). Буфер в HER2 заменяли 10 мМ ацетатом натрия, pH 5,0, и разбавляли примерно до 2,5 или 5,0 мкг/мл. Аликвоты HER2 инъецировали со скоростью потока 5 мкл/мин, чтобы достичь сигнала связанного белка примерно 50-170 единиц (RU). Инъецировали 1 М раствор этаноламина в качестве блокирующего агента. Для кинетических измерений двукратные серийные разведения каждого Fab инъецировали в HBT при 25ºC со скоростью потока 10 мкл/минуту в каждую проточную кювету. Значения kon и koff определяли на основании кривых связывания с помощью пакета компьютерных программ BIAevaluation (BIACORE, Inc., Piscataway, N.J.), используя двухточечную глобальную подгонку и объединение данных из обеих проточных кювет. Равновесную константу диссоциации, KD, вычисляли в виде отношения Koff/Kon. Данные BIAcore® суммированы на фиг.26A и B. Клон B11 имел ka 1,9×106 М-1сек-1, kd 1,7×10-3 сек-1 и KD 890 пМ. Rmax1 для экспериментов с клоном B11 составлял 19 RU, и Rmax2 для экспериментов с клоном B11 составлял 29 RU (фиг.26A). Клон G54 имел ka 2,0×105 М-1сек-1, kd 2,2×10-3 сек-1 и KD 11 нМ. Rmax1 для экспериментов с клоном G54 составлял 21 RU, и Rmax2 для экспериментов с клоном G54 составлял 34 RU (фиг.26A). Клон YSGR-A-42 имел ka 2,7×106 М-1 сек-1, kd 1,5×10-3 сек-1 и KD 570 пМ. Rmax1 для экспериментов с клоном 42 составлял 25 RU, и Rmax2 для экспериментов с клоном 42 составлял 38 RU (фиг.26B). Содержащий триптофан клон (B11) имел более быструю kon и соответственно меньшую KD, чем тирозин-содержащий клон (G54).
Чтобы исследовать связывание анти-HER2-антител с HER2, экспрессированным на клетках млекопитающих, исследовали связывание очищенного Fab-белка клонов 42 (YSGR-A), B11 (SXH3), G54 (SX-поверхностный) и G37 (SX-поверхностный) с фибробластными клетками NR6, сверхэкспрессирующими HER2 (NR6-HER2), с помощью проточной цитометрии. Один миллион клеток NR6-HER2 инкубировали с 10 мкг/мл Fab в течение 1 часа с последующей инкубацией с мышиным антителом против IgG человека, конъюгированным с Alexa488, в течение 1 часа. В качестве негативного контроля исследовали связывание Fab с неэкспрессирующими клетками NR6. В качестве позитивного контроля использовали Fab 4D5. Как показано на фиг.27, клоны 42, B11, G54 и G37 специфично связываются с Her2 на клетках NR6.
Конкурентный ELISA использовали для тестирования конкуренции при связывании с герцептином и омнитаргом и между несколькими HER2-клонами в форме IgG (на фиг.28 смотри последовательности CDR соответствующих клонов). Биотинилированный белок HER2 серийно разбавляли от 200 нМ до 0,39 нМ в буфере PBT, затем инкубировали на планшетах, покрытых очищенными белками IgG, в течение 15 минут. Планшеты промывали PBS, содержащим 0,05% твин-20, и инкубировали в течение 30 минут с конъюгатом пероксидаза хрена/анти-M13-антитело (разбавленным 1:5000 в буфере PT) (Pharmacia). Планшеты промывали, проявляли субстратом тетраметилбензидином (TMB) (Kirkegaard and Perry Laboratories) и гасили 1,0 М H3PO4. Оптическую плотность измеряли спектрофотометрически при 450 нм, определяя концентрацию биотинилированного HER2, которая дает сигнал, составляющий примерно 50% от сигнала при насыщении. Постоянную субнасыщающую концентрацию биотинилированного HER2 разбавляли в два раза в буфере PBT или в буфере PBT, содержащем 100 пМ очищенных белков IgG. Смеси инкубировали в течение одного часа при осторожном встряхивании при комнатной температуре, переносили в планшеты, покрытые белками IgG, и планшеты инкубировали в течение 15 минут. Планшеты промывали и обрабатывали так же, как описано выше. Как показано на фиг.29, ни один из связывающих HER2 IgG не блокировал связывание биотинилированного HER2 ни с омнитаргом, ни с герцептином. IgG не блокировали связывание друг с другом в двух группах. В одной из групп, состоящей из клонов B11, G37, G54 и YSGR-A-42, клоны конкурировали за один и тот же эпитоп и блокировали связывание с биотинилированным HER2, который предварительно инкубировали с любым из указанных клонов. Во второй группе, состоящей из клонов YSGR-A-27, B27, G43 и YSGR-D-104, клоны конкурировали за один и тот же эпитоп на HER2 и блокировали связывание с биотинилированным HER2. Все клоны группы один представляли собой связывающие агенты с более высокой аффинностью, чем клоны группы два.
Все публикации (включая патенты и заявки на выдачу патентов), цитированные в настоящем описании, включены в описание в виде ссылки в полном объеме.
EDGRDCISCKYGQDYSTHWNDLLFCLRCTRCDSGEVELSPCTTTRNTVCQCEEGTFREED
SPEMCRKCRTGCPRGMVKVGDCTPWSDIECVHKESGTKHSGEAPAVEETVTSSPGTPASP
CSLS (SEQ ID NO:595)
ylegnadsal s (SEQ ID NO:604)
(SEQ ID NO:605)

| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ СИГЛЕКА-15 ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С ПОТЕРЕЙ КОСТНОЙ МАССЫ | 2010 |
|
RU2596392C2 |
| АНТИТЕЛА С ДВОЙНОЙ СПЕЦИФИЧНОСТЬЮ | 2014 |
|
RU2732032C2 |
| Новая форма IL33, мутировавшие формы IL33, антитела, анализы и способы их применения | 2016 |
|
RU2736299C2 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПОСОБНЫЕ СВЯЗЫВАТЬ CD137 И ОПУХОЛЕВЫЕ АНТИГЕНЫ, И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2805648C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2731202C2 |
| АНТИТЕЛА, СПОСОБНЫЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАТЬСЯ С HER2 | 2014 |
|
RU2628094C2 |
| НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА ПРОТИВ ВИРУСА ГРИППА А И ИХ ИСПОЛЬЗОВАНИЕ | 2009 |
|
RU2553325C2 |
| АНТИТЕЛА ПРОТИВ ПРОПЕРДИНА И ИХ ПОЛУЧЕНИЕ | 2021 |
|
RU2830308C1 |
| ВЫСОКОАФФИННЫЕ АНТИТЕЛА К CD3 И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2020 |
|
RU2831840C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С ЛИГАНДОМ ЗАПРОГРАММИРОВАННОЙ КЛЕТОЧНОЙ СМЕРТИ 1 (PD-L1) | 2013 |
|
RU2689953C2 |













































































































































































































































































































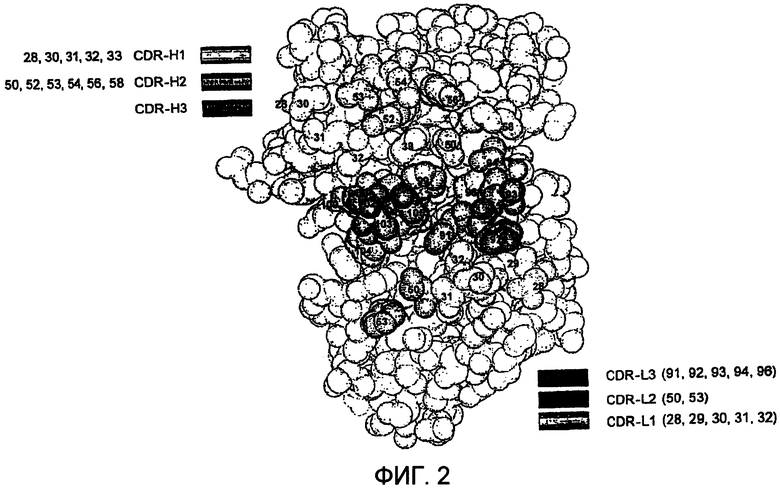


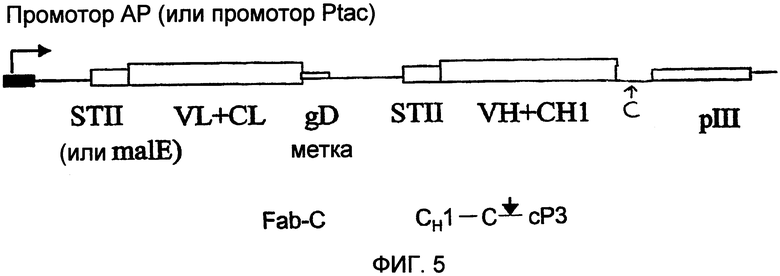










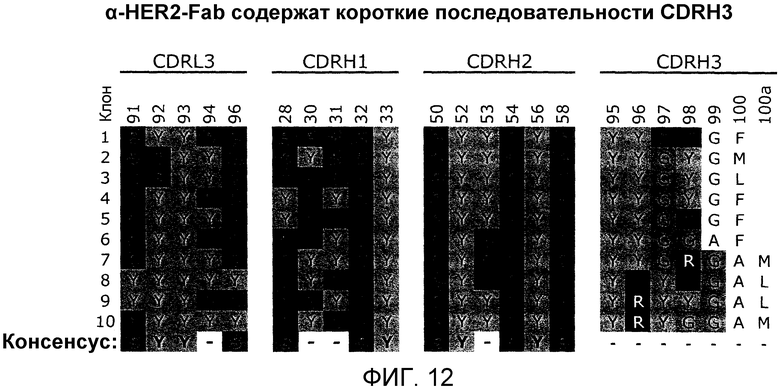

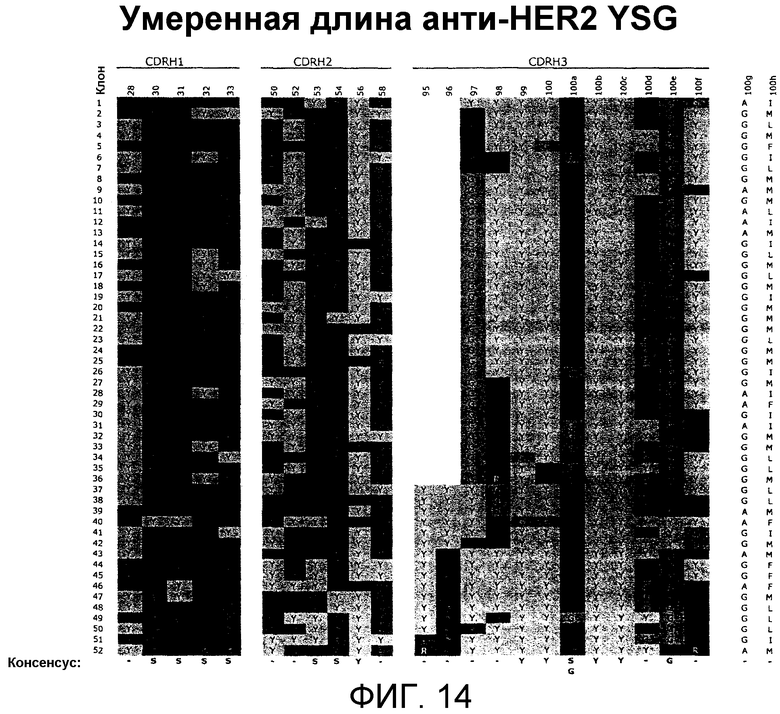
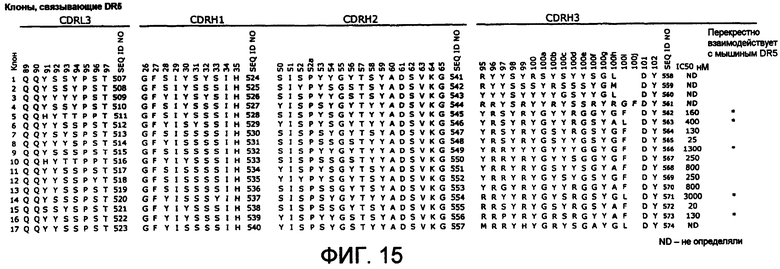

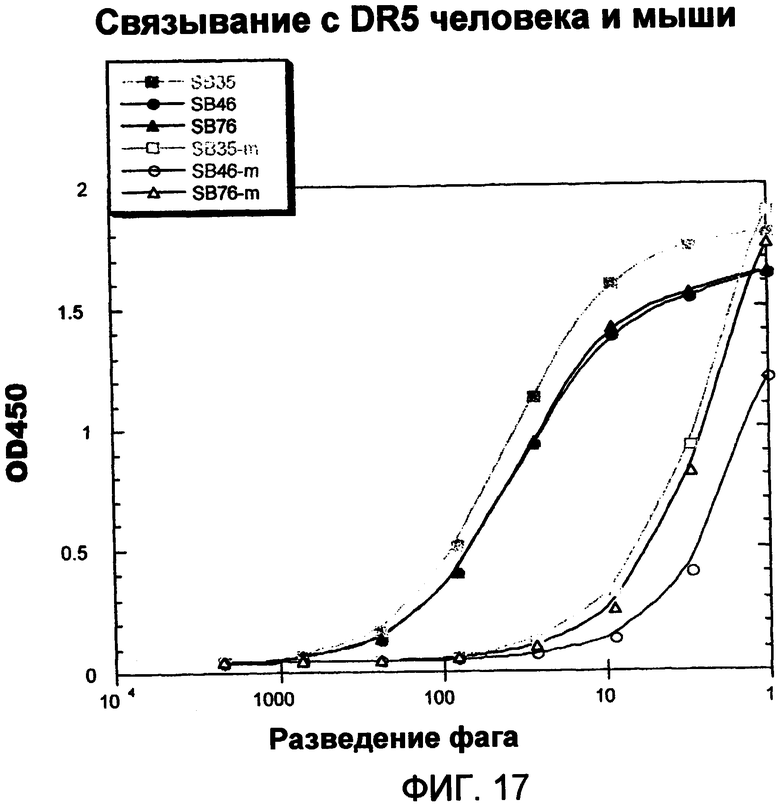















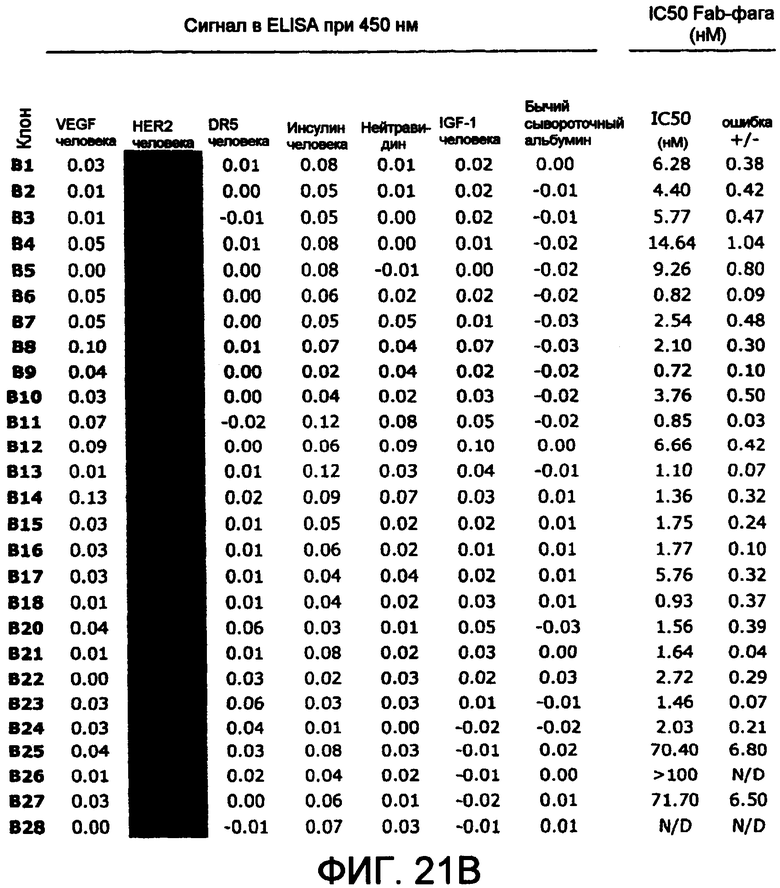
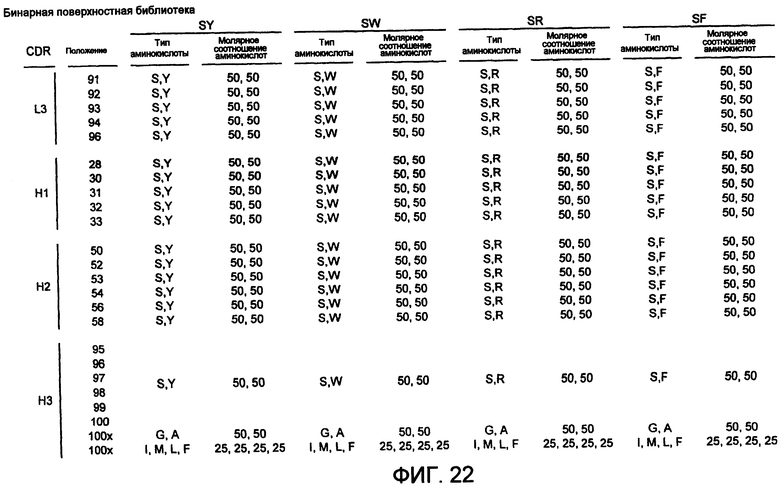


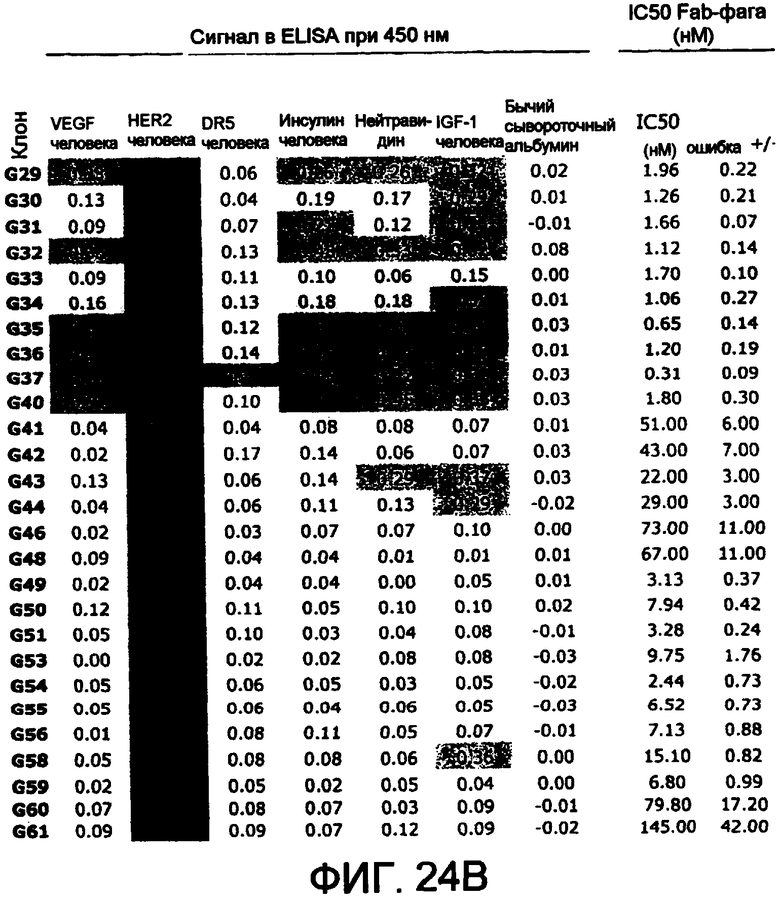
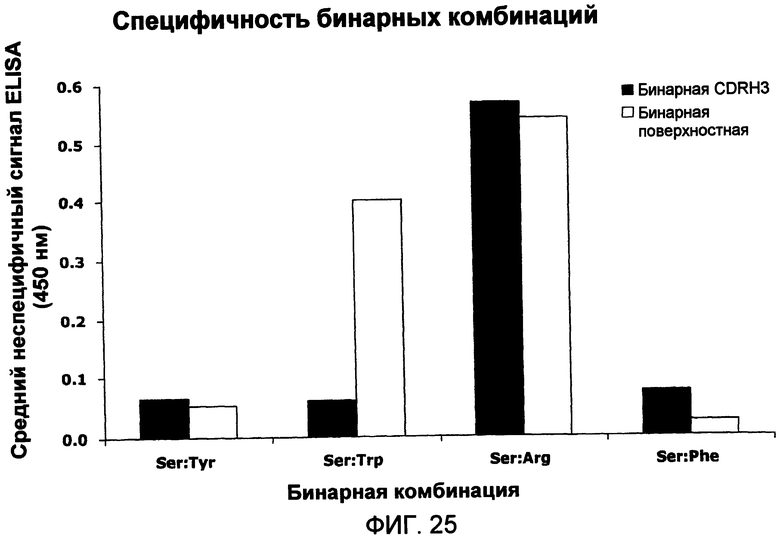
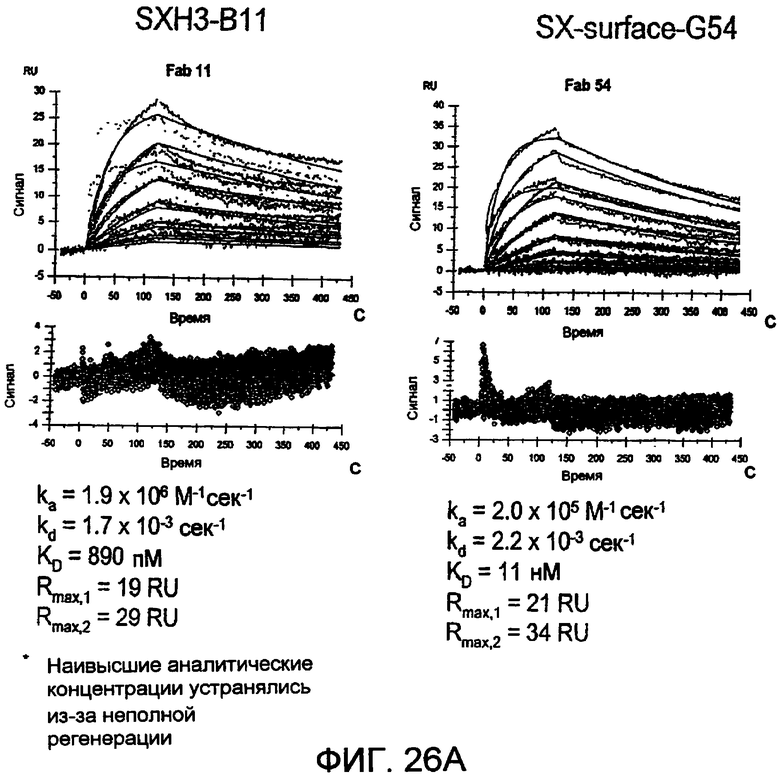
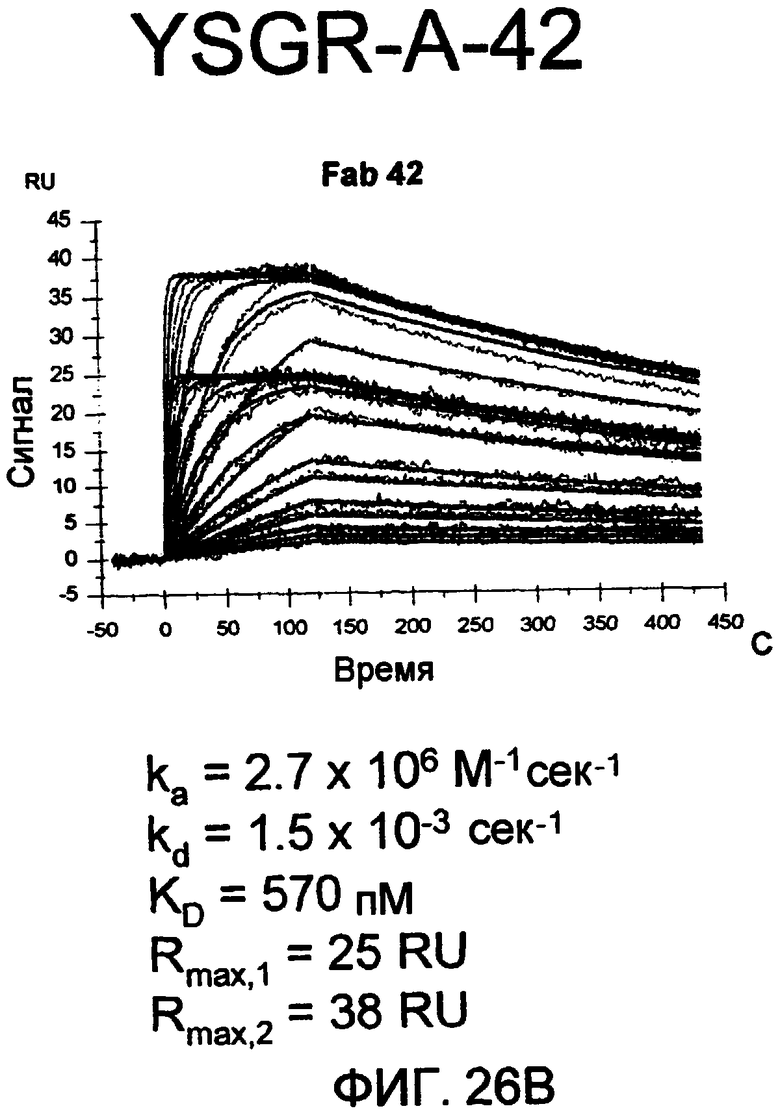
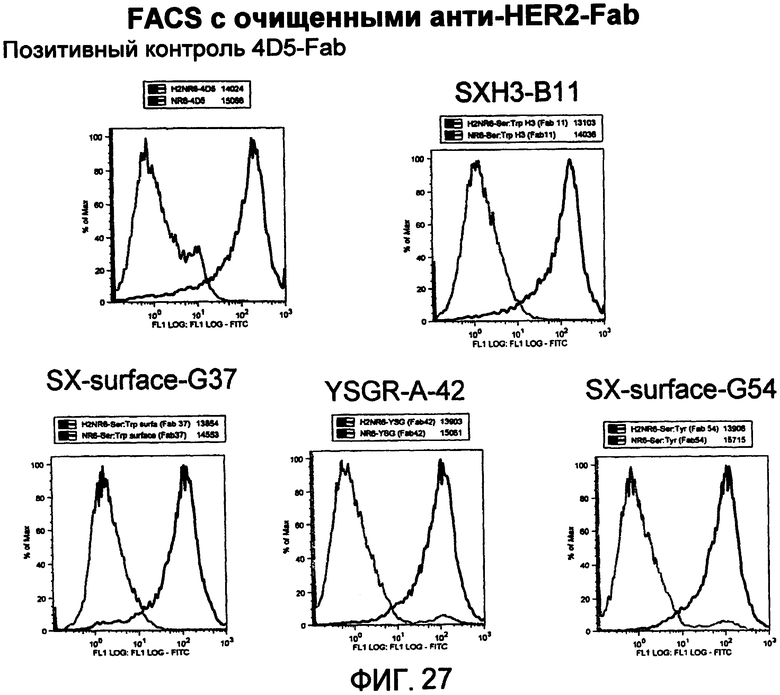


Предложенное изобретение относится к области иммунологии. Описаны варианты полипептидов, специфически связывающих DR5 человека, каждый из которых содержит варианты CDR, содержащих высокоограниченное разнообразие аминокислотных последовательностей. Описаны варианты полипептидов, слитых по меньшей мере с частью белков оболочки вируса, специфически связывающие DR5 человека. Предложены: кодирующая нуклеиновая кислота, вектор экспрессии, а также клетка для экспрессии полипептида, содержащая вектор. Описан способ получения полипептида путем культивирования клетки и способ селекции антигенсвязывающего вариабельного домена, использующий полипептид. Кроме того, предлагаются композиции и способы применения для лечения злокачественной опухоли и связанных с иммунной системой состояний. Использование изобретения может найти применение в медицине в лечении и диагностике опухолевых заболеваний. 14 н. и 74 з.п. ф-лы, 29 ил., 2 табл., 6 пр.
1. Полипептид, который специфически связывается с DR5 человека, где полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина и первый константный домен (СН1) тяжелой цепи и вариабельный домен легкой цепи иммуноглобулина и константный домен легкой цепи, где в вариабельном домене тяжелой цепи:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H (SEQ ID NO: 22), где G находится в положении 26, а X1 находится в положении 28 согласно системе нумерации Кабата; где X1 выбран из S или Y; где X2 выбран из Y или S; где X3 выбран из Y или S; где X4 выбран из Y или S; и где X5 выбран из Y или S;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G (SEQ ID NO: 23), где X1 находится в положении 50 согласно системе нумерации Кабата; где X1 выбран из Y или S; где X2 выбран из Y или S; где X3 выбран из Y или S; где X4 выбран из Y или S; где X5 выбран из Y или S; и где X6 выбран из Y или S; и
(iii) CDRH3 содержит аминокислотную последовательность: Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-D-Y (SEQ ID NO: 31), где X1 находится в положении 95 согласно системе нумерации Кабата, и где X1 выбран из R, Y или M; X2 выбран из Y или R; X3 выбран из Y, S, R, Р или G; X4 выбран из Y или S; X5 выбран из Y, S, R или H; X6 выбран из R, Y или S; X7 выбран из G, Y или S; X8 выбран из R, Y или S; X9 выбран из G, Y или S; X10 выбран из R, Y или S; X11 выбран из G, Y или S; X12 выбран из S, Y, R, G или А; Х13 выбран из G или Y; X14 выбран из L, М, R, G или А; и X15 выбран из G, F или L или отсутствует; и X16 означает F или отсутствует;
и в вариабельном домене легкой цепи:
(i) CDRL1 содержит аминокислотную последовательность RASQDVNTAVA (SEQ ID NO: 29);
(ii) CDRL2 содержит аминокислотную последовательность SASSLYS (SEQ ID NO: 30); и
(iii) CDRL3 содержит аминокислотную последовательность Q-Q-X1-X2-X3-X4-Р-X5-Т (SEQ ID NO: 25); где X1 находится в положении 91 и выбран из Y, Н или S; X2 выбран из Y или S; X3 выбран из Y, S или Т; X4 выбран из Y, S или Т; и X5 выбран из S, P или Y.
2. Полипептид по п.1, в котором последовательность CDRH3 содержит аминокислотную последовательность: Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO: 24), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G или отсутствуют; где X18 выбран из G или А; и где X19 выбран из I, М, L или F.
3. Полипептид по п.1, в котором последовательность CDRH3 содержит аминокислотную последовательность: Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO: 26), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R или отсутствуют; где X18 выбран из G или А; и где X19 выбран из I, M, L или F.
4. Полипептид по п.1, в котором последовательность CDRH3 содержит аминокислотную последовательность: Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO: 27), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R или отсутствуют; где X18 выбран из G или А; и где X19 выбран из I, M, L или F.
5. Полипептид по п.1, в котором последовательность CDRH3 содержит аминокислотную последовательность: Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO: 28), где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X6 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% К, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% Т, 1% V и 1% W; где аминокислоты в каждом из положений X7-X17 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% К, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% Т, 1% V и 1% W или отсутствуют; где Х18 выбран из G или А; и где X19 выбран из I, M, L или F.
6. Полипептид по п.1, в котором CDRH1 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 524-540 и 189-294.
7. Полипептид по п.1, в котором CDRH2 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 541-557 и 295-400.
8. Полипептид по п.1, в котором CDRH3 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 558-574 и 401-506.
9. Полипептид по п.1, в котором в CDRH3 положение аминокислоты X1 является положением 95, и X1 выбран из R или Y; X3 находится в положении 97 и представляет собой S; X8 находится в положении аминокислоты 100b и представляет собой S; X9 находится в положении аминокислоты 100c и представляет собой Y; и Х10 находится в положении аминокислоты 100d и представляет собой Y или R.
10. Полипептид по п.1, в котором CDRH3 содержит аминокислотную последовательность X1-R-S-Y-R-Y-G-S-Y-X10-G-S-Y-X14-F-D-Y (SEQ ID NO: 575).
11. Полипептид по п.1, в котором полипептид связывается с DR5 человека.
12. Полипептид по п.11, в котором полипептид представляет собой антитело.
13. Полипептид по п.12, в котором вариабельный домен тяжелой цепи содержит
i) CDRH1, содержащую аминокислотную последовательность GFYISSSSIH (SEQ ID NO: 576);
ii) CDRH2, содержащую аминокислотную последовательность
SISPSSGSTYYADSVKG (SEQ ID NO: 577); и
iii) CDRH3, содержащую аминокислотную последовательность
YRSYRYGSYYGSYGFDY (SEQ ID NO: 578).
14. Полипептид по п.12, в котором вариабельный домен тяжелой цепи содержит:
i) CDRH1, содержащую аминокислотную последовательность GFYIYSSSIH (SEQ ID NO: 579);
ii) CDRH2, содержащую аминокислотную последовательность
SISPSSGYTSYADSVKG (SEQ ID NO: 580); и
iii) CDRH3, содержащую аминокислотную последовательность
RRSYRYGSYRGSYAFDY (SEQ ID NO: 581).
15. Полипептид по п.1, который связывается с DR5 человека и мыши.
16. Полипептид по п.1, который связывается с DR5 человека с IC50, равным 1-20 нМ.
17. Полипептид по п.16, дополнительно содержащий CDRL1, которая содержит аминокислотную последовательность RASQDVNTAVA (SEQ ID NO: 29).
18. Полипептид по п.16, дополнительно содержащий CDRL2, которая содержит аминокислотную последовательность SASSLYS (SEQ ID NO: 30).
19. Полипептид по п.1, в котором последовательность CDRH3 содержит аминокислотную последовательность X1-X2-X3-X4-X5-X6-X7-D-Y (SEQ ID NO: 582), где X1 находится в положении аминокислоты 95 согласно нумерации Кабата и выбран из Y или R; X2 выбран из Y, S или R; X3 выбран из S, G, Y или Н; X4 выбран из S, G, Y или R; X5 выбран из G или А; X6 выбран из F, M, L или А; и X7 выбран из F, М или L или отсутствует.
20. Полипептид по п.19, в котором CDRH1 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 189-198.
21. Полипептид по п.19, в котором CDRH2 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 295-304.
22. Полипептид по п.19, в котором CDRH3 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 401-410.
23. Полипептид по п.1, в котором последовательность CDRH3 содержит аминокислотную последовательность X1-X2-X3-X4-X5-X6-X7-X8-D-Y (SEQ ID NO: 583), где X1 находится в положении аминокислоты 95 согласно нумерации Кабата и выбран из Y, S или G; X2 выбран из Y, S, G, R, А или М; X3 выбран из G, Y, S или R; X4 выбран из G, Y или F; X5 выбран из Y, S, N или G; X6 выбран из Y, R, Н или W; X7 выбран из G или А, и X8 выбран из F, М, L или I.
24. Полипептид по п.23, в котором CDRH1 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 199-216.
25. Полипептид по п.23, в котором CDRH2 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 305-322.
26. Полипептид по п.23, в котором CDRH3 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 411-428.
27. Полипептид по п.1, в котором последовательность CDRH3 содержит аминокислотную последовательность Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-D-Y (SEQ ID NO: 584), где X1 находится в положении аминокислоты 95 и выбран из Y, S, R, G или Е; X2 выбран из Y, S, R или G; X3 выбран из S, Y, G или W; X4 выбран из S, Y, G или Q; X5 выбран из G, Y или S; X6 выбран из G, Y, S, R или V; X7 выбран из S, Y, G или R; X8 выбран из Y, S, G, R, P или V; X9 выбран из G, А, Y, S или R; X10 выбран из М, F, G, Y, S или R; X11 выбран из А, Y, S, G или R или отсутствует; X12 выбран из I, М, F, L, A, G, S, Y, R или Т или отсутствует; Х13 выбран из F, М, L, G, A, Y, Т или S или отсутствует; X14 выбран из L, М, F, I, G, Y, А или Т или отсутствует; X15 выбран из М, L, Y, G или R или отсутствует; X16 выбран из Y или G или отсутствует; X17 выбран из R, М или G или отсутствует; X18 выбран из Р или А или отсутствует; и X19 означает L или отсутствует.
28. Полипептид, который специфически связывается с DR5 человека, где полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H, где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; и где X1-X5 являются природными аминокислотами, отличными от цистеина;
(ii) CDRH2 содержит аминокислотную последовательность: X6-I-X7-P-X8-X9-G-X10-T-X11-Y-A-D-S-V-K-G, где X6 находится в положении 50 согласно системе нумерации Кабата, и где X6-X11 являются природными аминокислотами, отличными от цистеина; и
(iii) CDRH3 содержит аминокислотную последовательность:
X12-X13-X14-X15-X16-(X17)n-X18-X19-D-Y, где Х12 находится в положении 95 согласно системе нумерации Кабата, и где n равно 1-12, и где X12-X19 являются природными аминокислотами, отличными от цистеина;
и в вариабельном домене легкой цепи:
(i) CDRL1 содержит аминокислотную последовательность RASQDVNTAVA (SEQ ID NO: 29);
(ii) CDRL2 содержит аминокислотную последовательность SASSLYS (SEQ ID NO: 30); и
(iii) CDRL3 содержит аминокислотную последовательность Q-Q-X1-X2-Х3-X4-Р-X5-Т (SEQ ID NO: 25); где X1 находится в положении 91 и выбран из Y, Н или S; X2 выбран из Y или S; X3 выбран из Y, S или Т; X4 выбран из Y, S или Т; и X5 выбран из S, P или Y.
29. Полипептид по п.28, в котором X1 выбран из Y или S; в котором X2 выбран из Y или S; в котором X3 выбран из Y или S; в котором X4 выбран из Y или S; в котором X5 выбран из Y или S, и в котором X6 выбран из Y или S.
30. Полипептид по п.28, в котором X6 выбран из Y или S; в котором X7 выбран из Y или S; в котором X8 выбран из Y или S; в котором X9 выбран из Y или S; в котором X10 выбран из Y или S; и в котором X11 выбран из Y или S.
31. Полипептид по п.28, в котором аминокислоты в каждом из положений X12-X17 выбраны из пула аминокислот в молярном соотношении 50% Y, 25% S и 25% G, в котором X18 выбран из G или А, и в котором X19 выбран из I, M, L или F.
32. Полипептид по п.28, в котором аминокислоты в каждом из положений Х12-X17 выбраны из пула аминокислот в молярном соотношении 25% Y, 50% S и 25% R, в котором X18 выбран из G или А, и в котором X19 выбран из I, M, L или F.
33. Полипептид по п.28, в котором аминокислоты в каждом из положений Х12-X17 выбраны из пула аминокислот в молярном соотношении 38% Y, 25% S, 25% G и 12% R, в котором X18 выбран из G или А, и в котором Х19 выбран из I, M, L или F.
34. Полипептид по п.28, в котором аминокислоты в каждом из положений Х12-X17 выбраны из пула аминокислот в молярном соотношении 20% Y, 26% S, 26% G, 13% R, 1% A, 1% D, 1% E, 1% F, 1% H, 1% I, 1% К, 1% L, 1% M, 1% N, 1% P, 1% Q, 1% Т, 1% V и 1% W, в котором Х18 выбран из G или А, и в котором Х19 выбран из I, M, L или F.
35. Полипептид по п.27, в котором CDRH1 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 217-294.
36. Полипептид по п.27, в котором CDRH2 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 323-400.
37. Полипептид по п.27, в котором CDRH3 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 429-506.
38. Полипептид по п.1, в котором последовательность CDRH3 содержит аминокислотную последовательность: Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19, где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X17 выбраны из S и одной из аминокислот А, С, F, G, I, L, N, P, R, Т, W или Y или отсутствуют; где X18 выбран из G или А; и где X19 выбран из F, L, I или М.
39. Полипептид по п.37, в котором CDRH1 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 816-842.
40. Полипептид по п.37, в котором CDRH2 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 843-869.
41. Полипептид по п.37, в котором CDRH3 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 870-896.
42. Полипептид, который специфически связывается с DR5 человека, где полипептид содержит вариабельный домен тяжелой цепи иммуноглобулина, в котором:
(i) CDRH1 содержит аминокислотную последовательность G-F-X1-I-X2-X3-X4-X5-I-H, где G находится в положении 26, и X1 находится в положении 28 согласно системе нумерации Кабата; где аминокислоты в каждом из положений X1-X5 выбраны из S и одной из аминокислот Y, W, R или F;
(ii) CDRH2 содержит аминокислотную последовательность: X1-I-X2-P-X3-X4-G-X5-T-X6-Y-A-D-S-V-K-G, где X1 находится в положении 50 согласно системе нумерации Кабата; где аминокислоты в каждом из положений X1-X6 выбраны из S и одной из аминокислот Y, W, R или F; и
(iii) CDRH3 содержит аминокислотную последовательность: Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19, где X1 находится в положении 95 согласно системе нумерации Кабата; и где аминокислоты в каждом из положений X1-X17 выбраны из S и одной из аминокислот Y, W, R или F или отсутствуют; где X18 выбран из G или А; и где X19 выбран из F, L, I или М;
и в вариабельном домене легкой цепи:
(i) CDRL1 содержит аминокислотную последовательность RASQDVNTAVA (SEQ ID NO: 29);
(ii) CDRL2 содержит аминокислотную последовательность SASSLYS (SEQ ID NO: 30); и
(iii) CDRL3 содержит аминокислотную последовательность Q-Q-X1-X2-Х3-X4-Р-X5-Т (SEQ ID NO: 25); где X1 находится в положении 91 и выбран из Y, Н или S; X2 выбран из Y или S; X3 выбран из Y, S или Т; X4 выбран из Y, S или Т; и X5 выбран из S, Р или Y.
43. Полипептид по п.42, в котором CDRH1 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 924-950.
44. Полипептид по п.42, в котором CDRH2 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 951-977.
45. Полипептид по п.42, в котором CDRH3 содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 978-1004.
46. Полипептид по п.38, в котором вариабельный домен тяжелой цепи содержит
i) CDRH1, содержащую аминокислотную последовательность GFSIYSSYIH (SEQ ID NO: 821);
ii) CDRH2, содержащую аминокислотную последовательность
SIYPYSGYTSYADSVKG (SEQ ID NO: 848); и
iii) CDRH3, содержащую аминокислотную последовательность WWSSAFDY (SEQ ID NO: 875).
47. Полипептид по п.38, в котором вариабельный домен тяжелой цепи содержит
i) CDRH1, содержащую аминокислотную последовательность GFSIWWSWIH (SEQ ID NO: 932);
ii) CDRH2, содержащую аминокислотную последовательность
SISPSSGWTSYADSVKG (SEQ ID NO: 959); и
iii) CDRH3, содержащую аминокислотную последовательность WWSSAMDY (SEQ ID NO: 986).
48. Полипептид по п.38, в котором вариабельный домен тяжелой цепи содержит
i) CDRH1, содержащую аминокислотную последовательность GFSISSSYIH (SEQ ID NO: 944);
ii) CDRH2, содержащую аминокислотную последовательность
SIYPYSGYTSYADSVKG (SEQ ID NO: 971); и
iii) CDRH3, содержащую аминокислотную последовательность YYSYALDY (SEQ ID NO: 998).
49. Полипептид по п.38, в котором вариабельный домен тяжелой цепи содержит
i) CDRH1, содержащую аминокислотную последовательность GFYISSSSIH (SEQ ID NO: 230);
ii) CDRH2, содержащую аминокислотную последовательность
YIYPSSGYTSYADSVKG (SEQ ID NO: 336); и
iii) CDRH3, содержащую аминокислотную последовательность GYYYSYYSGYALDY (SEQ ID NO: 442).
50. Полипептид по п.19, дополнительно содержащий вариабельный домен легкой цепи, в котором i) CDRL3 содержит аминокислотную последовательность Q-Q-X1-X2-X3-X4-P-X5-T (SEQ ID NO: 25), в котором X1 находится в положении 91 согласно нумерации Кабата и выбран из S или Y; X2 выбран из S, Y или F; X3 выбран из Y, X4 выбран из Y или S; и X5 выбран из S или Y.
51. Полипептид по п.1, который является одноцепочечным Fv.
52. Полипептид по п.1, который представляет собой полипептид Fab.
53. Полипептид по п.1, который полностью является полипептидом человека.
54. Полипептид по п.1, дополнительно содержащий каркасные области FR1, FR2, FR3 и/или FR4 для полипептида вариабельного домена, соответствующего варианту CDRH1, CDRH2, CDRH3 и/или CDRL3, в котором каркасные области получены из одной полипептидной матрицы.
55. Полипептид по п.54, в котором каждая из каркасных областей содержит аминокислотную последовательность, соответствующую аминокислотным последовательностям каркасных областей полипептида 4D5 (SEQ ID NO: 1 и 2).
56. Полипептид по п.54, в котором полипептид содержит каркасные области, соответствующие аминокислотным последовательностям вариантов каркасных областей антитела 4D5 (SEQ ID NO: 14-17 и 18-21).
57. Полипептид по п.1, дополнительно содержащий домен димеризации, связанный с C-концевой областью полипептида вариабельного домена тяжелой цепи.
58. Полипептид по п.57, в котором домен димеризации содержит домен лейциновой молнии или последовательность, содержащую по меньшей мере один остаток цистеина.
59. Полипептид по п.57, в котором домен димеризации содержит область шарнира из полипептида и лейциновую молнию.
60. Полипептид по п.57, в котором домен димеризации представляет собой один остаток цистеина.
61. Слитый полипептид, который специфически связывается с DR5 человека, где полипептид содержит полипептид по п.1, в котором полипептид вариабельного домена слит по меньшей мере с частью белка оболочки вируса.
62. Слитый полипептид по п.61, в котором белок оболочки вируса выбран из группы, состоящей из белка pIII, основного белка оболочки pVIII, Soc, Hoc, gpD, pvl или их вариантов.
63. Слитый полипептид по п.62, дополнительно содержащий домен димеризации между вариабельным доменом и белком оболочки вируса.
64. Слитый полипептид по п.61, дополнительно содержащий пептидную метку.
65. Слитый полипептид по п.64, в котором пептидная метка выбрана из группы, состоящей из gD, c-myc, поли-his, флуоресцирующего белка и B-галактозидазы.
66. Композиция, которая блокирует, ингибирует или нейтрализует одну или несколько биологических активностей DR5, содержащая полипептид по п.1 и эффективное количество носителя.
67. Полинуклеотид, кодирующий полипептид по п.1.
68. Вектор экспрессии, содержащий полинуклеотид по п.67.
69. Клетка-хозяин, содержащая вектор по п.68 и экспрессирующая полипептид по п.1.
70. Способ получения полипептида, включающий: культивирование клетки-хозяина по п.69 в условиях, подходящих для продуцирования полипептида, и выделение полипептида или его антигенсвязывающего фрагмента.
71. Способ селекции в отношении антигенсвязывающего вариабельного домена, который связывается с антигеном-мишенью, из библиотеки вариабельных доменов антител, включающий:
(a) осуществление контакта полипептида по пп.1, 28 и 42 с антигеном-мишенью;
(b) отделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, от полипептидов, которые специфично не связываются с антигеном-мишенью, выделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, и инкубацию одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, в серии растворов, содержащих снижающиеся количества антигена-мишени в концентрации примерно от 0,1 нМ до примерно 1000 нМ; и
(c) отбор одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью и которые могут связываться с антигеном-мишенью в наименьшей концентрации или которые имеют аффинность, составляющую от примерно 0,1 нМ до примерно 200 нМ.
72. Способ по п.71, в котором антигеном-мишенью является DR5.
73. Способ по п.71, в котором концентрация антигена-мишени составляет от примерно 100 нМ до примерно 250 нМ.
74. Способ по п.71, в котором концентрация антигена-мишени составляет от примерно 25 нМ до примерно 100 нМ.
75. Способ селекции в отношении полипептида, который связывается с антигеном-мишенью, из библиотеки, состоящей из полипептидов по п.4, включающий:
(a) выделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, посредством осуществления контакта библиотеки, содержащей множество полипептидов по п.4, с иммобилизованным антигеном-мишенью в условиях, подходящих для связывания;
(b) отделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, от полипептидов, которые специфично не связываются с антигеном-мишенью, и выделение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, с получением субпопуляции, обогащенной одним или несколькими полипептидами, которые специфично связываются с антигеном-мишенью; и
(c) необязательно, повторение стадий (a)-(b) по меньшей мере дважды, при этом каждое повторение осуществляют с использованием субпопуляции, обогащенной одним или несколькими полипептидами, которые специфично связываются с антигеном-мишенью, полученной в предыдущем раунде селекции.
76. Способ по п.75, дополнительно включающий:
(d) инкубацию субпопуляции с меченым антигеном-мишенью в диапазоне концентраций примерно от 0,1 нМ до примерно 1000 нМ с образованием смеси в условиях, подходящих для связывания;
(e) осуществление контакта смеси с иммобилизованным агентом, который связывается с меткой на антигене-мишени;
(f) выявление одного или нескольких полипептидов, которые специфично связываются с меченым антигеном-мишенью, и отделение одного или нескольких полипептидов, которые специфично связываются с меченым антигеном-мишенью, от меченого антигена-мишени; и
(g) необязательно, повторение стадий (d)-(f) по меньшей мере дважды, при этом каждое повторение осуществляют с использованием субпопуляции, обогащенной одним или несколькими полипептидами, которые специфично связываются с меченым антигеном-мишенью, полученной в предыдущем раунде селекции, и с использованием более низкой концентрации меченого антигена-мишени, чем в предыдущем раунде селекции.
77. Способ по п.76, дополнительно включающий добавление к смеси избытка немеченого антигена-мишени и инкубацию смеси в течение периода времени, достаточного для выделения одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью.
78. Способ выделения одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, из библиотеки, состоящей из полипептидов по п.3, включающий:
(a) приведение в контакт библиотеки с антигеном-мишенью в концентрации, составляющей по меньшей мере от примерно 0,1 нМ до примерно 1000 нМ, чтобы выделить один или несколько полипептидов, которые специфично связываются с антигеном-мишенью;
(b) освобождение одного или нескольких полипептидов, которые специфично связываются с антигеном-мишенью, от антигена-мишени, чтобы получить субпопуляцию, обогащенную одним или несколькими полипептидами, которые специфично связываются с антигеном-мишенью; и
(c) необязательно, повторение стадий (a)-(b) по меньшей мере дважды, при этом каждое повторение осуществляют с использованием субпопуляции, полученной в предыдущем раунде селекции, и с использованием пониженной концентрации антигена-мишени по сравнению с концентрацией, используемой в предыдущем раунде, чтобы выделить один или несколько полипептидов, которые специфично связываются с антигеном-мишенью при наименьшей концентрации антигена-мишени.
79. Способ лечения злокачественной опухоли, связанной с DR5, у млекопитающего, включающий введение млекопитающему полипептида по п.1.
80. Способ по п.79, в котором злокачественная опухоль выбрана из рака молочной железы, рака прямой и ободочной кишки, немелкоклеточного рака легкого, неходжкинской лимфомы (NHL), рака почек, рака простаты, рака печени, рака головы и шеи, меланомы, рака яичника, мезотелиомы и множественной миеломы.
81. Способ по п.79, в котором антителом является анти-DR5-антитело.
82. Способ по п.79, в котором лечение дополнительно включает стадию введения второго терапевтического средства одновременно или последовательно с антителом.
83. Способ по п.82, в котором второе терапевтическое средство выбрано из антиангиогенного средства, антинеопластического средства, химиотерапевтического средства и цитотоксического средства.
84. Способ по п.83, в котором антиангиогенным средством является анти-hVEGF-антитело.
85. Способ лечения млекопитающего, которое болеет или для которого существует риск развития воспалительного или иммунного расстройства, связанного с DR5, включающий стадию лечения млекопитающего полипептидом по п.1.
86. Способ по п.85, в котором воспалительным или иммунным расстройством является ревматоидный артрит.
87. Способ по п.85, в котором антителом является анти-DR5-антитело.
88. Полипептид по п.1, где последовательность CDR3 содержит аминокислотную последовательность: Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-D-Y (SEQ ID NO: 31), где X1 находится в положении 95 согласно системе нумерации Кабата, и где X1 выбран из R, Y или М; X2 выбран из Y или R; X3 выбран из Y, S, R, Р или G; X4 выбран из Y или S; X5 выбран из Y, S, R или Н; X6 выбран из R, Y или S; X7 выбран из G, Y или S; X8 выбран из R, Y или S; X9 выбран из G, Y или S; X10 выбран из R, Y или S; X11 выбран из G, Y или S; X12 выбран из S, Y, R, G или А; Х13 выбран из G или Y; X14 выбран из L, М, R, G или А; и X15 выбран из G, F или L или отсутствует; и X16 означает F или отсутствует.
| WO 200450895 A, 17.06.2004 | |||
| FELLOUSE et al., "Molecular recognition by a binary code", Journal of molecular biology, vol.348, no.5, 20.05.2005, с.1153-1162 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| РОЙТ и др | |||
| Иммунология | |||
| - М.: Мир, 2000, с.110-116. | |||
Авторы
Даты
2012-12-27—Публикация
2006-12-01—Подача