Изобретение относится к медицине, в частности к онкологии и молекулярной биологии, и может быть использовано для эрадикации (уничтожения) популяции раковых клеток, обладающих инициирующими свойствами (стволовые-туморогенные раковые клетки).
Онкологические заболевания занимают второе место по общей смертности после сердечно-сосудистых заболеваний, а страх перед возможностью возникновения злокачественного новообразования имеет глубокий социальный резонанс. Статистические данные свидетельствуют о том, что заболеваемость онкологическими заболеваниями ежегодно растет, при этом прослеживается явная тенденция к «омоложению рака».
Недавние статистические исследования демонстрируют, что смертность от рака в США в последнее время снизилась [1-3]. Подобное снижение отмечается и в странах ЕС [3-5]. Тем не менее причиной этого снижения являются главным образом ранний диагноз и начало лечения, резкое снижение курения и потребления алкоголя, и незначительную долю в этом снижении играют улучшение терапевтических результатов в лечении отдельных видов рака [6]. В целом смертность от рака в 21 веке такая же, как и 50 лет назад, тогда как смертность от сердечных, церебрососудистых и инфекционных болезней уменьшилась за это время на 2/3 [7].
В мировой практике разработаны и переведены в стандарты основные способы лечения больных со злокачественными новообразованиями.
Общепринятой терапией, вне зависимости от происхождения рака, является использование различных схем циторедуцирующего воздействия. В случае солидных опухолей применяют хирургическое удаление опухолевого очага с последующим продолжением химиотерапии. В последние годы бурно развиваются подходы иммунотерапии рака с использованием противораковых вакцин различного происхождения (дендритноклеточные вакцины, вакцины на основе вирусов, размножающихся в раковых клетках, вакцины на основе чистых раковых антигенов (например, Her-2), ДНК-вакцины) и методов in vivo вакцинации с применением мощных адъювантов, стимулирующих развитие адаптивного противоракового иммунитета непосредственно в организме больного (CpG ODN, Panagen) [8-11]. Широко используется облучение и терапия гормонами в случае гормонозависимых опухолей.
Методы неиммунной и не гормонзависимой противораковой терапии могут быть разделены на две широкие категории: традиционные методы химиотерапии и методы молекулярной терапии, в которых действие лекарства направлено на определенную молекулярную мишень, которая, как предполагается, важна для жизнеспособности раковой клетки и опухоли в целом [12].
Циторедуцирующая терапия с применение цитостатиков, являющаяся основой лечения раков, направлена на удаление видимой массы опухоли. Как следует из огромной клинической практики, угроза рецидивов в ближайшие 5 лет при такой терапии достигает 30-50%. Этот факт связан с присутствием в неотрансформированной ткани популяции клеток, обладающих потенциалом стволовых клеток [13, 14].
За последние годы описано много различных молекулярных факторов, определяющих превращение нераковой клетки в раковую. С этим связано развитие направления так называемой таргетной терапии, направленной на определенный специфический фактор раковой клетки. Тем не менее доведение до клинического применения с сохранением эффективности лечения человека таргетных препаратов, направленных на определенную мишень, важную для существования ракового потенциала, оказывается в высшей степени сложной задачей, связанной с огромной дистанцией между модельными системами и реальной болезнью.
Как показывают исследования последних лет, болезнь гораздо более сложна, чем представлялось ранее. Основное в непредсказуемости ответа болезни на различные терапевтические воздействия связано с существованием, как уже отмечалось выше, стволовых инициирующих раковых клеток [13, 14]. Свойства этих клеток таковы, что с трудом просматривается эффективная терапия, способная преодолеть «видимую неубиваемость» этого типа клеток (циркулирующие опухолевые клетки, диссеминированные раковые клетки, визикулярные щиты, обратный эффект Варбурга) [15, 16]. Раковые стволовые клетки, как полагают, участвуют в повторном появлении рака благодаря своим туморогенным свойствам и поддержании резистентности ко многим обычным терапевтическим воздействиям. Это подкрепляет предположение, что они могут не реагировать на традиционную терапию и вызывать постоянное появление рака. Показано, что стволовые клетки рака груди, растущие в культуре, оказались резистентными к химиотерапевтическим агентам [17], а раковые стволовые клетки из лейкемии оказались резистентными к химиотерапевтическим лекарствам, daunorubicin и Ara-C [18]. Раковые стволовые клетки из поджелудочной железы и толстого кишечника также резистентны к химиотерапии [19, 20], а некоторые раковые стволовые клетки резистентны к радиации [21, 22]. Более того, пациенты с раком груди обнаруживали более высокий процент клеток со свойствами стволовых клеток рака груди после химиотерапии [23], указывая тем самым, что терапия может оказаться менее эффективной в отношении убийства раковых стволовых клеток, хотя она элиминирует остальные раковые клетки. Механизмы резистентности к лекарствам у раковых стволовых клеток изучены недостаточно, но возможные объяснения включают избыточную экспрессию белков, которые откачивают лекарство из клеток, энзимы, которые метаболизируют лекарства, или антиапоптические белки [24].
В этой связи разработка таргетных, направленных на стволовые инициирующие раковые клетки способов, и создание новых препаратов, позволяющих провести конечную эрадикацию стволовых раковых клеток, является актуальной задачей, а нахождение адекватных методов терапии позволит сделать скачок в лечении злокачественных раков.
В клинической практике известны лекарства, которые находят раковые стволовые клетки, указывая тем самым, что эти клетки могут быть элиминированы у пациентов. Например, parthenolide и rapamycin, по-видимому, убивают раковые стволовые клетки при острой миелоидной лейкемии [25, 26]. Также temozolomide преимущественно элиминирует раковые стволовые клетки в glioblastoma [27], а стволовые клетки рака мозга под воздействием bevacizumab снижают свою туморогенность [28, 29]. Ограниченность применения этих лекарств связана, в первую очередь, с их специфичностью к определенным строго детермепированным опухолям.
Известен способ лечения, основанный на применении препарата тиоридазина (который блокирует рост стволовых клеток острой миелоидной лейкимии) в сочетании со стандартной химиотерапией [30]. Тиоридазин, известный как препарат нейролептического или антипсихотического действия, взаимодействует с рецепторами нейротрапсмитора допамина. Эти рецепторы находятся на стволовых лейкозных клетках и стволовых клетках рака молочной железы, что ограничивает область применения этого способа, поскольку он может быть использован, если на клетках опухоли присутствуют допаминовые рецепторы. В случае их отсутствия стволовые раковые клетки будут резистентны к проводимому лечению тиридазином.
Известен способ уничтожения стволовых раковых клеток с использованием генномодифицированных бактерий [31]. Установлено, что при данном способе происходит взаимодействие измененных бактерий и стволовой раковой клетки таким образом, что в раковую клетку доставляются специфические белковые факторы бактерий, снимающие устойчивость раковых клеток к медикаментозной терапии.
Указанный способ имеет ограниченную область применения, поскольку не для всех опухолей известны адекватные лекарственные средства, которые будут действовать синергично в ассоциации с генномодифицированным штаммом бактерий.
Другой способ основан на применении специфических антител Н90, блокирующий CD44v на раковых клетках острого миелолейкоза [32]. CD44 является ключевым регулятором, необходимым для хоуминга стволовых клеток опухоли и их дальнейшего поддержания и недифференцированном состоянии. Н90 влияет на обе функции этой молекулы, нарушая как хоуминг, так и приводя к дифференцировке лейкемических бластов и их последующей гибели. Н90 блокирует хоуминг примитивных CD34+CD38-клеток как в костный мозг, так и в селезенку, а также препятствует трансмиграции лейкемических клеток через стенки капилляров.
Недостаточная эффективность данного способа связана с тем, что указанный маркер CD44 специфичен для узкого круга опухолей и, следовательно, его антагонист Н90 будет неэффективен для лечения множества других раков. В силу указанных причин этот способ также обладает относительно узкой областью применения.
Наиболее близким к предложенному является способ избирательного убийства раковых, но не нормальных клеток [33], приводящий к синтезу токсинов внутри раковых клеток, включающий доставку в опухоль генной конструкции, состоящей из гена фермента, способного превращать внутри раковой клетки нетоксическое соединение - пролекарство в токсин, и многопрофильного промотора, обеспечивающего внутри раковых клеток экспрессию гена фермента, способного превращать внутри раковых клеток, но не в нормальных клетках, нетоксичное соединение - пролекарство в токсин, содержащий измененную или расширенную, по сравнению с известными промоторами, совокупность участков узнавания белков-факторов транскрипции, необходимый набор которых существует в большинстве раковых, но не в нормальных клетках, и представляющий тандемную комбинацию BIRC5 и TERT промогоров или производное тандемной комбинации BIRC5 и TERT промоторов, образованное в результате делеции, замены, инсерции или иной мутации промотора, не влияющих на активность промотора, но при этом меняющих его структуру, или доставку двух генных конструкций, одна из которых состоит из гена фермента, способного превращать внутри раковой клетки нетоксичное соединение - пролекарство в токсин, и блокированного промотора, при деблокировании обеспечивающего экспрессию этого гена, а вторая является деблокирующей конструкцией, содержащей охарактеризованный выше многопрофильный промотор, присоединенный к гену деблокатора, кодирующего белок деблокатора и способный деблокировать неактивный блокированный промотор, при этом синтезируемый внутри раковой клетки токсин диффундирует в окружающие раковые клетки. Там же предложен экспрессирующий вектор, содержащий описанный выше многофункциональный промотор, соединенный с транскрибируемой последовательностью, которая при транскрипции продуцирует информационную РНК, кодирующую фермент, превращающий нетоксичное - пролекарство во внутриклеточный токсин.
Изобретение обеспечивает системы транскрипционного контроля экспрессии генов-убийц, позволяющие создавать новые технологии генной терапии рака.
Однако этот способ обладает относительно низкой эффективностью, поскольку при его использовании отсутствуют гарантии доставки вектора, содержащего ген-убийцу, к стволовой раковой клетке и, более того, нет никаких проявлений того, что генные конструкции доставлены к клетке мишени и производят эффективный транзитный трансгенез или вирусную инфекцию раковых клеток.
В описании известного способа приведен пример, предполагающий использование генов, экспрессирующих токсины, направленные на ингибирование системы репликации. Однако помимо активно пролиферирующих раковых клеток существуют клетки спящих метастазов, которые сами могут являться спящими метастазами. Клетки спящих метастазов не пролиферируют, что делает предлагаемый способ неэффективным по отношению к таким клеткам. Кроме того, уровень транскрипции в этих клетках полностью не изучен, а «законсервированное» состояние спящих метастазов и образующих их клеток подвергает сомнению эффективную транскрипцию в таких клетках искусственных генноинжененрных конструкций.
Задача, решаемая в настоящем изобретении, направлена на повышение эффективности эрадикации стволовых инициирующих раковых клеток с целью повышения эффективности лечения раковых заболеваний.
Требуемый технический результат заключается в повышении эффективности эрадикации стволовых инициирующих раковых клеток.
Поставленная задача решается, а требуемый технический результат достигается в способе эрадикации стволовых инициирующих раковых клеток, основанном на совместном воздействии цитостатика циклофосфана (ЦФ) и препарата двуцепочечной ДНК (дцДНК), при котором мышам линии СВА весом 20-35 г, несущим развитый асцит, парентерально вводится цитостатик ЦФ в дозе 200 мг/кг и далее в течение 12 часов каждый час после введения ЦФ мыши получают интраперитониальные инъекции препарата ДНК, состоящего из смеси препаратов дцДНК и кросс-линкированной дцДНК в соотношении 3:1 в количестве 0.5 мг на инъекцию, независимо от веса мышей-опухоленосов, суммарно 6 мг.
Кроме того, требуемый технический результат достигается тем, что в качестве препарата ДНК используется смесь препаратов дцДНК и кросс-линкированной ДНК размером 300-6000 пар оснований, при этом в препарате кросслинкированной дцДНК на 1000 пар оснований приходится 80-120 межцепочечных сшивок.
Предложенный способ основан на естественной способности стволовых (инициирующих) раковых клеток интернализовать экзогенные экстраклеточные не объединенные в компартменты фрагменты двуцепочечной ДНК и на участии интернализованных фрагментов в репаративном процессе при репарации межцепочечных сшивок в фазе NER после действия цитостатических препаратов кросслинкирующего ряда.
В современной литературе отсутствуют указания на предлагаемый способ убийства стволовых раковых клеток. Следовательно, предложение отвечает критериям новизны и изобретательского уровня.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает критерию практической (промышленной) применимости.
На чертеже представлены:
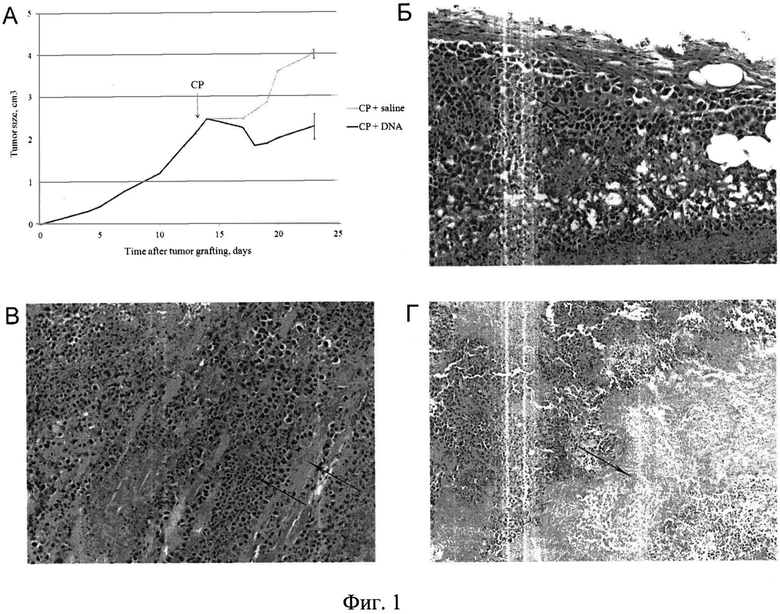
на фиг.1 - результаты патологоанатомичсского анализа органов и тканей экспериментальных мышей в агонистической фазе развития симптома. А) График динамики роста солидной опухоли в группах после обработки ЦФ+ДНК (18-30 часов) и физ. раствором. На 25 сутки эксперимента экспериментальные мыши, находящиеся в агонистической фазе развития симптома, и контрольные мыши были забиты для патологоанатомического исследования. На рисунке приведены характерные срезы опухолевой ткани, а также области с обширными некротическими зонами. Б) Ткань опухоли (стрелка) отчетливо выявляется среди элементов дермы и подкожной клетчатки благодаря выраженной клеточной атипии и агрессивному характеру роста. Увеличение ×200. В) Перемежение клеточных тяжей опухоли с профилями фрагментов мышечных волокон (отмечено стрелками). Увеличение ×200. Г) Обширный некроз опухолевой ткани. Увеличение ×100.
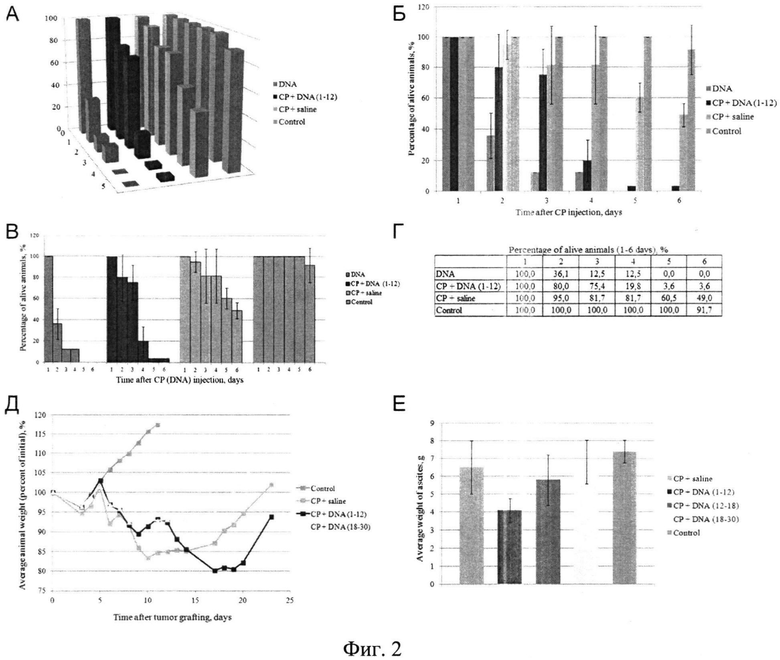
на фиг.2 - обобщенная характеристика гибели мышей при различных обработках и сравнение эффектов различных обработок на развитие перевитого асцитного трансплантата. Динамика гибели животных с асцитной опухолью Кребс-2 после обкалывания их препаратом дцДНК, ЦФ, физ. раствором или дцДНК в сочетании с ЦФ в режиме 1-12 (1-12 часов после инъекции ЦФ). Приведены три графика: общий вид гибели мышей при различных обработках (А), сравнение по группам (Б), сравнение по дням в каждой группе (В). Приведены обобщенные результаты по 5 экспериментам (Г, таблица). Отсутствие доверительного интервала свидетельствует о том, что во всех экспериментах в рассматриваемой точке всегда выживала одна или две мыши, что не позволило провести статистический обсчет. Тем не менее эти точки взяты в рассмотрение, так как они характеризуют максимальный токсический эффект проведенных обработок. Д) Динамика изменения веса животных с асцитной формой опухоли Кребс-2 после обработки ЦФ и препаратом дцДНК. 100% - исходный вес животных. Приводится средний вес в расчете на одну мышь после общего взвешивания. Е) Вес асцита у животных с асцитной формой опухоли Кребс-2 после обработки ЦФ и препаратом дцДНК в различные промежутки времени. Полученные графики демонстрируют, что введение препарата дцДНК в режиме 1-12 часов после инъекции ЦФ является наиболее эффективным режимом, максимально тормозящим рост перевитого графта. Также из полученных результатов следует, что наиболее эффективный режим приводит к длительной ремиссии в развитии опухолевого трансплантата (Д, красная линия).
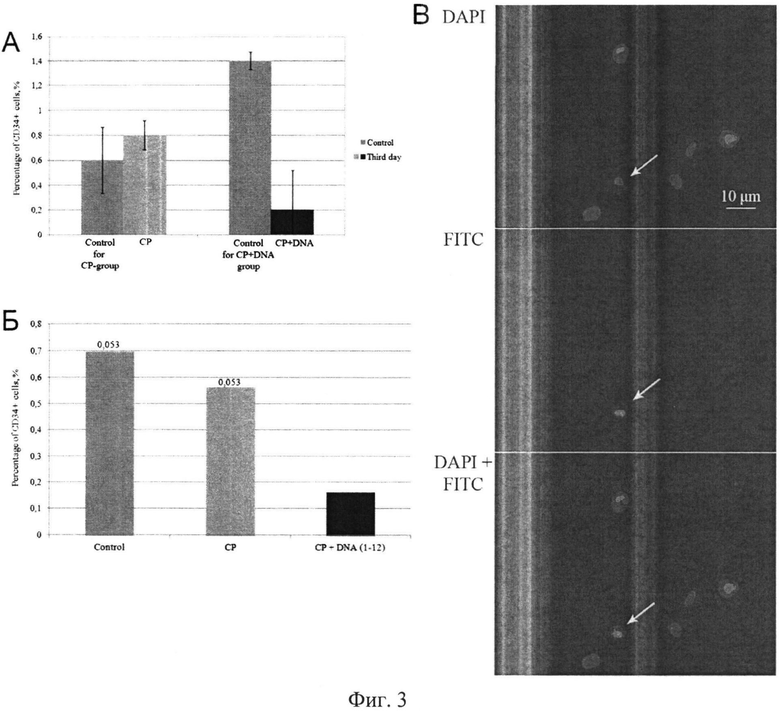
на фиг.3 - результаты анализа эффективности элиминации CD34+ клеток асцита Кребс-2, одновременно характеризующихся способностью интернализовать фрагменты экстраклеточной дцДНК. Цитологический анализ и анализ в проточной цитометрии. А) Количество (%) CD34+ клеток в асците Кребс-2 у мышей в контроле (до инъекций) и на 3-и сутки после инъекций цитостатика (СР) и цитостатика совместно с препаратом дцДНК (CP+DNA). Результаты получены при помощи проточного цитофотометра. Б) Количество (%) CD34+ клеток в асците Кребс-2 у мышей в контроле (до инъекций) и через 24 часа после инъекций цитостатнка (СР) или цитостатика совместно с ДНК человека (CP+DNA). Результаты получены при анализе цитологических препаратов. В) Общий цитологический план препаратов клеток асцита Кребс-2, окрашенных антителами против CD34+. DAPI - окраска на хроматин, FITC - маркер CD34+ клеток, DAPI+FITC - наложение двух (DAPI+FITC) изображений.
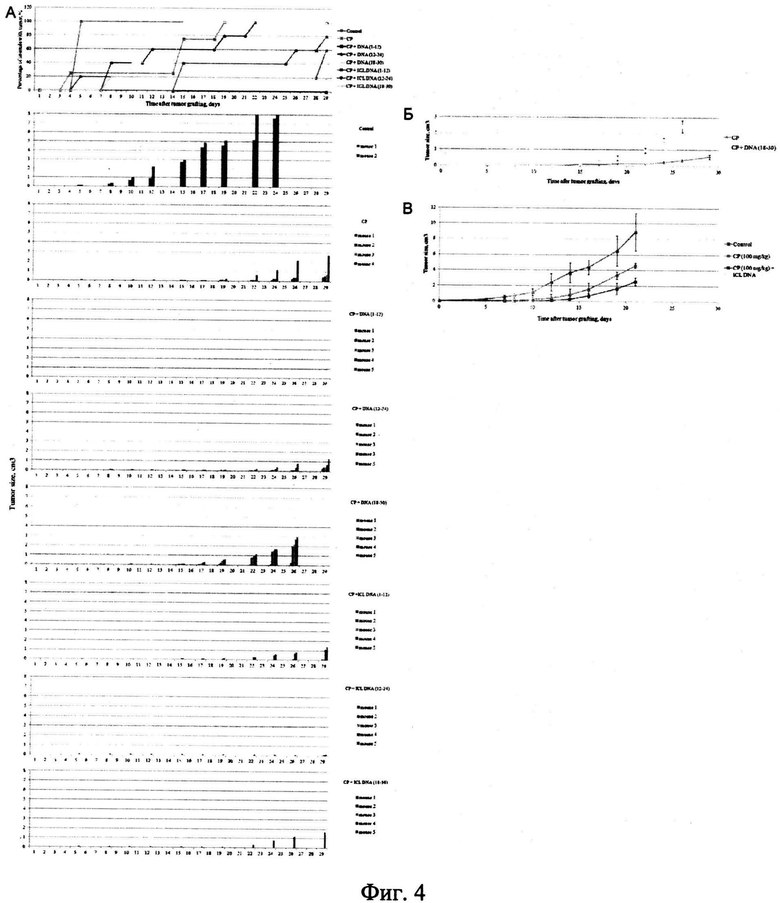
на фиг.4 - in vivo анализ эффективности элиминации CD34+ клеток асцита Кребс-2, одновременно характеризующихся способностью интернализовать фрагменты экстраклеточной дцДНК. Выбранным группам мышей внутримышечно перевивались асцитные клетки, взятые из асцита мышей, обработанных ЦФ в сочетании с различными препаратами дцДПК. Клетки асцита забирались и перевивались немедленно после проведенных обработок. Каждой мыши было привито 1.5×106 асцитных клеток, взятых от обработанных мышей. На графиках приведена динамика появления опухоли и динамика изменения размера трансплантата (А). 13 группе ЦФ+ДНК (1-12) трансплантат не прижился. Б) Сравнение динамики развития опухолевого графта в группах мышей, обработанных одним ЦФ и ЦФ+ДМК (18-30). Из сравнения удалены выпадающие точки. Четко прослеживается эффект положительного влияния указанного режима на рост экспериментальной опухоли. В) Динамика развития опухолевого трансплантата, обработанного ЦФ и препаратом кросс-линкированной дцДНК (1-12) немедленно после инокуляции клеток. В эксперимент были взяты 250 тысяч клеток асцита. Прослеживается достоверная задержка в росте опухолевого графта в группе кросс-линкированной дцДНК (1-12).
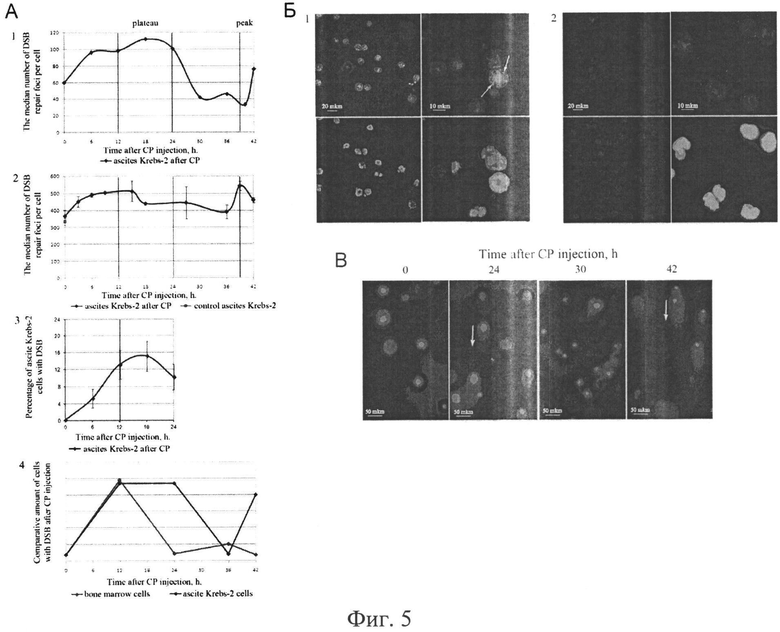
на фиг.5 - результаты анализа динамики появления и исчезновения двуцепочечных разрывов в асцитных клетках опухоли Кребс-2, индуцированных обработкой экспериментальных мышей цитостатиком ЦФ. А) Результаты трех независимых экспериментов (1, 2, 3) по оценке количества фокусов репарации, образованных гистоном γН2Х и характеризующих присутствие двуцепочечных разрывов. Оценка проводилась как с помощью проточной цитомегрии, так и с помощью анализа цитологических препаратов. 4 - сравнение схематичных графиков динамики формирования и репарации двуцепочечных разрывов в стволовых клетках крови (красная линия [34]) и в клетках асцита Кребс-2 (синяя линия). Б) Характерная цитологическая картина клеток асцита Кребс-2, окрашенных антителами к гистону γН2Х (1). (2) Контрольные клетки, обработанные вторичными антителами, мечеными FITC. В) Результаты дополнительных экспериментов с использованием метода комет по оценке времени появления и исчезновения двуцепочечных разрывов в асцитных клетках Кребс-2. Прослеживается соответствие времени появления и исчезновения характерного шлейфа и времени максимального и минимального количества двуцепочечных разрывов, обозначенных на обобщенном графике.
Актуальность данного изобретения подтверждается описанными в современной научной литературе свойствами нуклеиновых кислот принимать участие в разнообразных клеточных и молекулярных процессах.
Двуцепочечная фрагментированная экстраклеточная экзогенная и эндогенная ДНК является участником, индуктором и индикатором различных процессов, протекающих в организме. В первую очередь, экзогенные нуклеиновые кислоты являются патоген-ассоциированными молекулярными паттернами, активирующими различные звенья иммунной системы, направленные на удаление патогена. Экстраклеточная дцДНК эндогенного происхождения также может выступать в качестве активатора адаптивного иммунного ответа организма [11, 35-41]. Кроме этого количество эндогенной экстраклеточной дцДНК, присутствующей в плазме крови и интерстициальных жидкостях, отражает функциональное состояние организма и может являться индикатором патологических процессов [42-45]. Известно, что дцДНК является индуктором аутоиммунных процессов [46-51] и представляет собой один из сигналов эффекта свидетеля [52]. Также показано, что катастрофическое увеличение концентрации ДНК в плазме крови сопровождает системную воспалительную реакцию и сепсис [51, 53-58]. На клеточном уровне фрагменты дцДНК, доставляемые во внутренние компартменты клетки, принимают участие в различных клеточных процессах. В первую очередь, присутствие фрагментов экстраклеточной ДНК в клетке активирует арест клеточного цикла и индуцирует репаративные процессы [59-61]. Фрагменты дцДНК при определенных условиях становятся участниками репаративного процесса, интерферируя его корректное прохождение [34]. Фрагменты дцДНК, доставленные в цитоплазму соматических клеток, активируют палитру цитозольных сенсоров и индуцируют начальные этапы развития адаптивного иммунного ответа [62-65]. Представлены данные, что за счет экзогенной ДНК может осуществляться перенос генетического материала разрушенных раковых клеток другим клеткам организма, в результате чего происходит раковая трансформация этих клеток. Процесс назван «генометастазирование» [66, 67]. Показано, что нуклеиновые кислоты, включая дцДНК, входят в состав экзосом и, как предполагается, могут являться камертоном функционального состояния организма, по которому определенные популяции клеток настраивают свои физиологические и молекулярные процессы. В настоящее время формируется позиция, предполагающая, что экстраклеточные нуклеиновые кислоты, включая дцДНК, представляют собой новый тип регуляторной системы организма со сложными механизмами регуляции клеточных процессов [68-78].
Предлагаемый способ прямого цитотоксического действия препарата дцДНК в синергизме с цитостатиком ЦФ на стволовые инициирующие раковые клетки на примере асцитных клеток экспериментальной опухоли мыши Кребс-2 реализуется следующим образом.
Основываясь на обнаруженном свойстве стволовых (инициирующих) раковых клеток интернализовать экзогенные экстраклеточные фрагменты двуцепочечной ДНК [79] и основываясь на данных, полученных в источнике [34] о способности фрагментов дцДНК интерферировать процесс репарации межцепочечных сшивок, проводится сочетанное воздействие цитостатика ЦФ и препарата дцДНК таким образом, что экспериментальные мыши, несущие развитый асцит, обрабатываются цитостатиком ЦФ в дозе 200 мг/кг и далее в течение 12 часов каждый час после введения ЦФ мыши получают интраперитонеальные инъекции препарата ДНК и количестве 0.5 мг на инъекцию, суммарно 6 мг. В качестве препарата ДНК используется смесь препаратов дцДНК и кросс-линкированной ДНК в соотношении 3:1. При указанном способе обеспечивается интернализация фрагментов ДНК препарата в стволовые инициирующие раковые клетки вследствие их естественного свойства захватывать экстраклеточную дцДНК [79], что создает непрерывную интерференцию репаративного процесса фазы NER репарации индуцированных ЦФ межцепочечных сшивок, приводящую к гибели стволовых раковых клеток.
Ниже приводятся экспериментальные доказательства обнаружения прямого цитотоксического действия препарата дцДНК в синергизме с цитостатиком ЦФ на стволовые инициирующие раковые клетки на примере асцитных клеток экспериментальной опухоли мыши Кребс-2.
Используемые методики.
Гистологоанатомический анализ тканей и органов мышей
Кусочки органов фиксировали в 4% параформ альдегиде, обезвоживали в спиртах возрастающей концентрации, просветляли ксилолом, заливали в парафин. Парафиновые срезы толщиной до 5 мкм окрашивали гематоксилином и эозином. Просмотр препаратов и микрофотосъемку проводили на световом микроскопе AxioImager ZI (Zeiss, Германия).
Экспериментальные животные
В экспериментах использовались мыши линии CBA/Lac, которые разводились в условиях вивария при Институте цитологии и генетики СО РАН. Животные содержались в клетках, по 5-10 особей в каждой и имели свободный доступ к воде и пище.
Опухолевая модель
В экспериментах была использована опухоль Кребс-2. Для получения асцитной формы опухоли клетки перевивали мышам внутрибрюшинно (в/б), по 200 мкл, в разведении физиологическим раствором 1:15. Для получения солидной опухоли Кребс-2 клетки перевивали внутримышечно в количестве 1,5 млн. Измерение размера солидной опухоли в см3 производили стандартным способом, измеряя три параметра штангенциркулем и перемножая полученные значения между собой.
Введение препаратов ЦФ и экзогенной ДНК
Цитостатик ЦФ вводился мышам внутрибрюшинно (в/б) в дозе 200 мг/кг массы тела. Затем в зависимости от эксперимента в/б вводили препараты фрагментированной ДНК человека и кросс-линкированной ДНК человека, обработанной нитроген-мустардом в дозе 0,5 мг на инъекцию. Использовали следующие схемы введения: каждый час в промежуток времени 1-12, 12-24 и 18-30 часов после инъекции ЦФ (суммарно по 6 мг ДНК на мышь). В качестве контроля вводили физиологический раствор в таком же объеме, как и экзогенную ДНК (200 мкл на инъекцию).
Анализ количества двуцепочечных разрывов в клетках асцита Кребс-2
Мышам с нарощенным асцитом Кребс-2 делали инъекцию ЦФ (200 мг/кг). В дальнейшем через каждые 6 часов производился забор клеток асцита. Клетки дважды промывали фосфатно-солевым буфером (PBS, Медиген), затем часть клеток наносили на чистые обезжиренные стекла, часть клеток фиксировали в суспензии 2%-ного раствора параформальдегида в PBS. Клетки, нанесенные на стекла, также предварительно фиксировали 15 мин в 2%-ном растворе параформальдегида в PBS. Затем отмывали 0,5% бычьим сывороточным альбумином (BSA) в PBS.
В дальнейшем обработки проводили либо на цитологическом стекле во влажной камере (для получения цитологических препаратов), либо в пробирке в объеме жидкости (для анализа на проточном цитофотометре). Клетки обрабатывали 2 мин 0,1%-ным Тритоном Х-100 в PBS. Промывали 0,5% БСА в PBS. Затем клетки обрабатывали кроличьими антителами к модифицированному гистону (anti-phospho-histone Sigma, США) γН2АХ в разведении 1:1000 в PBS, рН 7,4, с 0,15%-ным глицином (Sigma, США) и 0,5% BSA в течение часа при комнатной температуре. Клетки промывали PBS с 0,5% BSA и обрабатывали меченными FITC козьими антителами против IgG кролика (goat anti rabbit IgG FITC-conjugate Sigma, США) в течение часа при комнатной температуре в разведении 1:500 в таком же растворе, что и предыдущие антитела. Обработку проводили в темноте. Затем клетки еще раз промывали PBS с 0,5% BSA. После отмывки клетки либо ресуспендировали в небольшом объеме PBS и анализировали на проточном цитофотометре BD FACSAria (Becton Dickinson, США), либо на препарат наносили ~10 мкл Antifade DABCO, покрывали покровным стеклом и анализировали при помощи флюоресцентного микроскопа Axioskop 2 Plus с использованием программы AxioVision.
Метод комет для оценки количества клеток, содержащих двуцепочечные разрывы
Мышам с нарощенным асцитом Кребс-2 делали инъекцию ЦФ (200 мг/кг). В дальнейшем в контрольные точки (0,24, 30, 42 часа после инъекции цитостатика) производили забор клеток асцита. Клетки промывали PBS и заливали в блоки легкоплавкой агарозы (Low Melt Ultra-Pure DNA Grade Agarose, Bio-Rad) в PBS объемом 80 мкл и в количестве 1000 клеток на блок. Затем блоки обрабатывали лизирующим буфером (50 мМ ЭДТА, 1% N-Lauroylsarcosine (Serva) и 1 мг/мл протеиназы К) в течение 30 мин при 50°С и переносили в 0,5 М ЭДТА. Перед дальнейшими обработками клетки, фиксированные в агарозе, отмывали в ТЕ буфере (10 мМ Tris-HCl, pH 7,6; 1 мМ ЭДТА) в течение 15-30 мин. Затем блоки устанавливали в одинаковом направлении и проводили электрофорез (30 мин, 1 В/см). Затем блоки окрашивали DAPI, помещая их в 500 мкл раствора DAPI (0,5 мкг/мл) в дистиллированной воде, помещали на предметное стекло и анализировали при помощи инвертированного флюоресцентного микроскопа.
Анализ количества CD34+ клеток в асците Кребс-2 при помощи проточной цитометрии и анализа цитологических препаратов
Отобранные клетки асцита промывали PBS и осаждали при 4°С, 400 g в течение 5 мин. После осаждения центрифугированием клетки ресуспендировали в PBS с 0,1% NaN3, 1% FBS (Fetal Bovine Serum). К 1 млн клеток добавляли 4 мкг антител (FITC Rat anti-Mouse CD34, BD Pharmingen) и, соответственно, 4 мкг изотип контроля (FITC Ral IgG2a, к Isotype Control, BD Pharmingen) и инкубировали в течение 40 мин при 4°С. Процент клеток CD34+ определяли либо при помощи проточного цитофотометра BD FACSAria относительно результатов изотип контроля в каждом образце либо обработанные указанным выше способом клетки асцита Кребс-2 промывали PBS и наносили цитоспином на предметное стекло (1000 об/мин в течение 1 мин). Затем на полученный препарат капали ~10 мкл Antifade DABCO, покрывали покровным стеклом и анализировали при помощи флуоресцентного микроскопа Axioskop 2 Plus с использованием программы AxioVision.
Рассмотрим более подробно первый поисковый этап, где было показано существование прямого цитотоксического действия препарата дцДНК в синергизме с цитостатиком ЦФ на экспериментальную опухоль Кребс-2.
В наших исследованиях при анализе воздействия экстраклеточной экзогенной дцДНК на активацию профессиональных свойств антигенпрезентирующих дендритных клеток и формирования противоракового CD8+ опосредованного иммунного ответа были зафиксированы труднообъяснимые эффекты (не связанные с развитием иммунного ответа) задержки роста опухолевого трансплантата, перевитого как в солидной, так и в асцитной формах [80-84]. Наблюдалось, что при совместном введении ЦФ и препарата дцДНК существует ранний и средний промежутки времени после введения ЦФ (введение препарата дцДНК осуществлялось сразу после введения ЦФ каждый час на протяжении 1-12 часов или 18-30 часов), когда препарат ДНК, по-видимому, оказывает прямое токсическое действие на клетки сформированного графта. Два основных предположения могли объяснить прямое токсическое действие дцДНК и связанную с этим задержку роста перевитой опухоли. Первое, прямой токсический эффект связан с участием дцДНК в репаративном процессе при репарации межцепочечных сшивок, как это наблюдалось для стволовых клеток крови мыши [34]. Второе, эффектором прямого токсического действия на развитие опухоли является не исходный препарат дцДНК, а дцДНК, подвергающаяся кросслинкирующему действию фосфорамид мустарда во время ее нахождения в мышином организме. Фосфорамид мустард является алкилирующим производным ЦФ, который образуется в результате гидролиза цитостатика в печени на протяжении того же промежутка времени, что и ранний промежуток времени введения препарата дцДНК (1-12 часов). Также прямое токсическое действие ДНК на клетки опухоли могло быть связано с неизвестным типом воздействия ДНК на эукариотическую клетку.
Была проведена серия пилотных экспериментов. Первоначально на солидной форме опухоли Кребс-2 был оценен прямой токсический эффект синергичного действия ЦФ и препарата дцДНК при инъекциях препарата ДНК непосредственно в опухоль в промежутки времени 1-12 и 18-30 часов после инъекции ЦФ. Клиническая картина действия такой обработки на протяжении последующих 7 суток после проведенных обработок характеризовалась четкой регрессией размеров опухоли (с ~3.0 см3 до ~1.0 см3) при обработке ЦФ в сочетании с препаратом дцДНК и ростом физических размеров опухоли при обработке одним цитостатиком (~4.0 см3) (фиг.1А). Уменьшение размеров опухоли сопровождалось лизисом опухолевой и прилегающих тканей и обильными гнойными выделениями. Был отмечен случай отмирания конечности, в которую был привит трансплантат. У животного через 7 суток лапка отсохла, а опухоль превратилась в небольшой валик, который прекратил свой рост. Также в группах ЦФ+дцДНК в различных экспериментах наблюдался массовый падеж животных в течение 1-3 суток после проведенной терапии ЦФ и препаратом дцДНК. Клиническая картина свидетельствовала о том, что в области инъекций ДНК идут процессы разложения тканей и, в первую очередь, ткани опухоли, что может сопровождаться интоксикацией, несопоставимой с жизнью.
Для определения возможных причин наблюдаемых эффектов и причины массовой одновременной гибели экспериментальных животных был проведен патологоанатомический анализ внутренних органов и ткани очага опухолевого роста солидной опухоли животных, обработанных ЦФ и физ. раствором и ЦФ и препаратом дцДНК, находящихся в агонистической фазе. Животные с опухолью размером 2.5 см3 получали инъекции ЦФ в дозе 200 мг/кг, после чего в интервал времени 18-30 часов им вводился либо препарат дцДНК (по 250 мкг 12 раз), либо физ. раствор непосредственно в опухолевый трансплантат. На 3 сутки после инъекции цитостатика и препарата ДНК было забито одно животное, на следующие сутки еще 2, на следующие - одно. Все животные были забиты в предсмертном состоянии. Одновременно были забиты контрольные животные, получавшие инъекции физ. раствора. У всех мышей были забраны практически все органы, а также образцы ткани опухоли из мест предположительного некроза.
Патологоанатомическое заключение вскрытия мышей.
У всех обследованных животных отмечены изменения со стороны печени и селезенки.
В печени наблюдалась очаговая дистрофия гепатоцитов по типу зернистой или баллонной. Воспалительно-клеточная реакция проявлялась, главным образом, в увеличении количества лимфоцитов в просветах гемокапилляров. У отдельных животных формировались преимущественно круглоклеточные инфильтраты в области портальных трактов и центральных вен. Некроза печеночной паренхимы не выявлено ни у одного из животных.
Со стороны селезенки у всех животных стабильно прослеживалась резко выраженная редукция лимфоидных фолликулов.
Отдельно следует отметить умеренно выраженную дистрофию миокарда у одной мыши-опухоленосителя в группе ЦФ+ДНК, а также наличие предположительно метастаза опухоли под эпикардом у другой мыши из той же группы. У других животных подобных находок в миокарде или других внутренних органах не обнаружено.
Ткань опухоли отчетливо выявлялась среди элементов дермы и подкожной клетчатки благодаря выраженной клеточной атипии и агрессивному характеру роста. Последнее было особенно заметно в местах, где клеточные тяжи опухоли перемежались с профилями фрагментов мышечных волокон. Для группы ЦФ+ДНК характерным явлением были обширные некрозы опухолевой ткани, что соответствовало клинической картине симптомов. Зона демаркации была представлена узким ободком полиморфноклеточного инфильтрата (фиг.1, Б-Г).
Чтобы избежать эффекта гибели экспериментальных животных и определить временные промежутки наиболее эффективного синергичного редуцирующего действия ЦФ и препарата дцДНК на опухолевый трансплантат, была проведена серия экспериментов, где терапия препаратами проводилась при размере опухолевого графта ~0.25 см3. Наибольшее редуцирующее действие оказала обработка ЦФ в сочетании с введением препарата дцДНК в промежуток времени 1-12 часов после инъекции цитостатика.
Анализ результатов проведенных экспериментов, выполненных на солидной опухоли Кребс-2, предполагал, что наибольший редуцирующий эффект на развитие солидной перевитой опухоли обнаруживается при введении препарата дцДНК в промежуток времени 1-12 часов после введения ЦФ. Кроме этого четко прослеживались некротические процессы в области опухоли после обработки ЦФ и препаратом дцДНК. Также в проведенных экспериментах был выявлен эффект быстрой синхронной гибели опытных животных после обработки ЦФ и препаратом дцДНК.
Солидная опухоль Кребс-2 имеет плотную структуру, покрыта соединительнотканной капсулой и имеет не развитую сеть капиллярных сосудов. В связи с этим доставка любых высокомолекулярных соединений (в частности, молекул дцДНК) непосредственно в опухоль затруднена [85]. Невозможность равномерного воздействия на все клетки опухоли в солидной форме и связанная с этим сложность оценки закономерностей поведения опухолевого трансплантата в ответ на терапию ЦФ и препаратом дцДНК определили экспериментальный подход, в котором в качестве модельной опухоли использовалась та же опухоль Кребс-2, однако перевитая в асцитной форме.
Первоначально были предприняты попытки оценить динамику регрессии асцита у мышей после обработки ЦФ или ЦФ+ДПК при сроках развития асцита в течение 8-10 суток после перевивки. Стремительная синхронная гибель животных, также наблюдаемая в аналогичных экспериментах с солидной опухолью, не позволила провести какой-либо достоверный анализ изменений размера графта. Характерная картина гибели животных представлена на фиг.2. В результате было установлено, что мыши с асцитом, перевитым за 5 суток до инъекций, более устойчивы к обработкам. В одном из проведенных экспериментов мышам-самцам линии CC57BR внутрибрюшинно прививалась асцитная форма опухоли Кребс-2. На 6 день трем группам мышей в/в вводился ЦФ в дозе 200 мг/кг. Из них одной группе внутрибрюшинно в течение 12 часов вводили препарат ДНК по 500 мкг/инъекцию. Другой группе аналогично вводили ДНК через 18 часов после инъекции ЦФ в течение 12 часов. Контрольным мышам после инъекции ЦФ вводили физ. раствор каждые 2 часа в промежуток времени 0-30 часов. Динамика веса в относительных процентах и динамика гибели мышей приведены на фиг.2. В другом эксперименте этой серии эффект воздействия обработок оценивался по весу асцита у животных через 2 недели после начала эксперимента. Были получены следующие результаты. ЦФ-6,5+/-1,51; ЦФ+ДНК(1-12)-4,1+/-0,66; ЦФ+ДНК(12-18)-5,8+/-1,42; ЦФ+ДНК(18-30)-6,8+/-1,25; Контроль - 7,4+/-0,64 (забиты на 10-е сутки). Приведен вес в граммах (фиг.2Д, Е).
Проведенная серия пилотных экспериментов, выполненных на асцитной и солидной формах опухоли Кребс-2, выявила четыре четко оформленных закономерности:
1. Наблюдалась быстротечная, часто синхронная гибель животных, обработанных ЦФ и препаратами дцДНК (дцДНК и кросс-линкированной ДЦДНК).
2. Фиксировалось или значительное уменьшение веса тела экспериментальных мышей, или уменьшение количества асцита, или наблюдался лизис опухолевой ткани солидной формы графта у животных, обработанных ЦФ и препаратами дцДНК.
3. Наиболее эффективной оказалась схема при инъекциях препарата дцДНК в промежуток времени 1-12 часов после введения ЦФ.
4. При обработке мышей препаратом ДНК в промежуток времени 1-12 часов после инъекции ЦФ выявлялся протяженный по времени промежуток ремиссии или существенная задержка развития перепитого графта (фиг.2Д).
Последний вывод мог означать, что при сипергичном действии ЦФ и препарата дцДПК осуществляется воздействие на причинное звено растущей опухоли, которым по современным представлениям могут являться стволовые инициирующие раковые клетки.
Рассмотрим причины и охарактеризуем клеточные механизмы, определяющие длительный период ремиссии опухолевого роста при терапии ЦФ в сочетании с препаратом дцДНК
Обработка мышей препаратом ДНК в промежуток времени 1-12 часов после инъекции ЦФ характеризуется длинным промежутком ремиссии роста асцита или существенной задержкой в развитии перевитого графта в случае солидной опухоли. Этот факт предполагал, что оказываемое терапевтическое воздействие ЦФ и препарата дцДНК затрагивает основное свойство раковых клеток инициировать развитие опухоли. Как известно, инициирующим развитие опухоли свойством обладают стволовые инициирующие раковые клетки [13, 14]. В наших недавних исследованиях, выполненных на модельной опухоли Кребс-2, растущей как в аспитной, так и солидной формах, было обнаружено, что в массе асцитных клеток существует незначительная популяция клеток, характеризующаяся свойством инициировать развитие опухоли. Эти клетки обладали двумя характерными чертами: они были способны интернализовать фрагменты дцДНК, кроме этого более 90% этих клеток несли маркер гемопоэтических стволовых клеток крови мыши CD34+ [79]. В нашей ранней работе было установлено, что аналогично с раковыми клетками способностью интернализовать экстраклеточную дцДНК обладают CD34+ стволовые клетки крови мыши. Также было показано, что синергичное действие ЦФ и дцДНК может менять моду стволовых клеток крови таким образом, что они теряют часть своих плюрипотентных свойств [34]. Базируясь на этих результатах, было сделано предположение, что обработка ЦФ в сочетании с инъекциями препарата дцДНК, в добавление к описанным феноменам, охарактеризованным в предыдущем разделе, может приводить к угнетению функции или физической элиминации стволовых инициирующих раковых клеток Кребс-2, что, как предполагалось, сопровождается увеличением времени ремиссии вследствие существенного уменьшения количества стволовых раковых клеток. Для анализа изменения количества стволовых раковых клеток в популяции асцитных клеток, вызванного обработкой ЦФ и препаратом дцДНК, был выбран следующий подход. Как уже было упомянуто, нами было показано, что интернализация фрагментов дцДНК (на примере меченого TAMRA Alu повтора человека) является характерным признаком стволовых инициирующих раковых клеток. Также подавляющее большинство этих клеток несет маркер CD34+ [79]. Чередуя эти две обработки (дцДНК и CD34+), в случае, если предположение о воздействии ЦФ и ДИК на стволовые раковые клетки правомерно, можно за счет одного свойства (интернализация фрагментов дцДНК) в сочетании с действием ЦФ элиминировать стволовые инициирующие раковые клетки, а за счет другого свойства (окрашивание на маркер CD34) оценить эффективность элиминации этой популяции. В рамках этой задачи была проведена серия экспериментов по оценке количества CD34+ клеток в массе асцитных клеток Кребс-2 после обработки мышей ЦФ и препаратом дцДНК. Было использовано два подхода. Количество CD34+ клеток оценивалось в проточной цитометрии. Также оценка количества CD34+ клеток после проведенных обработок оценивалась на цитологических препаратах. Результаты проведенных экспериментов представлены на фиг.3. Установлено, что обработка ЦФ как монопрепаратом не влияет на количество CD34+. Синергичное действие ЦФ и препарата дцДНК в режиме инъекций 1-12 часов приводит к практически 5-кратному снижению количества CD34+ клеток. Зная, что 90% CD34+ клеток являются TAMRA+ стволовыми раковыми клетками, можно сделать вывод, что происходит элиминация именно стволовых инициирующих раковых клеток, являющихся основным туморогенным фактором.
Полученные результаты по определению количества CD34+ туморогенных клеток в асцитной жидкости различных групп экспериментальных мышей нашли достоверное подтверждение в экспериментах по перевивке асцитных клеток в форме мышечного трансплантата.
Постоянно повторяющаяся быстротечная синхронная гибель экспериментальных животных в течение двух-трех суток после обработки не давала возможности сопоставить элиминацию популяции стволовых раковых клеток, несущих маркер CD34+ и динамику развития асцита с целью оценки эффективности противоракового действия терапии. В этой связи был разработан подход, позволяющий оценить биологический эффект воздействия ЦФ+ДНК на стволовые раковые клетки. Для этого у обработанных животных после проведенных обработок в определенные промежутки времени забирали асцитную жидкость. После промывки клетки перевивали внутримышечно в бедро правой лапки мышам той же линии. Эксперимент был повторен пять раз с различным количеством перевиваемых клеток. Результаты наиболее демонстративного эксперимента представлены на фиг.4.
Результаты проведенных экспериментов свидетельствуют о том, что обработка мышей, несущих асцит, в промежуток времени 1-12 часов после введения ЦФ действует на туморогенные свойства клеток таким образом, что внутримышечный трансплантат не развивается даже при количестве перевиваемых клеток 1.5×106, тогда как перевивка 5×104 клеток асцита (содержат 1-4% стволовых инициирующих раковых клеток) [79], уже приводит к развитию опухолевого графта. Также в проведенных экспериментах установлено, что обработка мышей препаратом кросс-линкированной дцДНК в режиме 18-30 действует угнетающе на туморогенные свойства перевиваемых клеток, однако до конца их не элиминирует. Неожиданным оказался факт положительного влияния на туморогенные свойства перевиваемых асцитных клеток режима обработки ЦФ+дцДНК 18-30 часов (фиг.4Б). Сравнение графиков динамики роста трансплантата после обработки одним ЦФ и ЦФ+дцДНК 18-30 демонстрирует существенно более высокий темп роста графта в образце ЦФ+дцДНК 18-30. Следует отметить, что обработка опухоли дцДНК и вызываемый этой обработкой масштабный апоптоз раковых клеток, по-видимому, также как и апоптоз, вызванный действием одного ЦФ, не затрагивает жизнеспособность стволовых инициирующих раковых клеток. Это заключение следует из анализа результатов проведенных экспериментов (не приводятся), где показано, что инъекции препаратов дцДНК и ЦФ в монорежиме не влияют на перевивочный потенциал асцитных клеток.
Промежутки времени рассматриваемой серии экспериментов исходно были выбраны на основании данных, полученных в исследованиях, выполненных нами на клетках костного мозга мышей. Поскольку эффект редуцирующего на CD34+ (TAMRA+ стволовые раковые клетки) действия дцДНК обнаруживается только на фоне действия ЦФ, было сделано предположение, что в случае асцитных клеток Кребс-2, также, как и в случае стволовых клеток крови [34], происходит интерференция репаративных процессов фрагментами дцДНК, интернализованных в ядре стволовых раковых клеток. В этой связи была проведена серия экспериментов, результаты которых позволили привязать эффект элиминации туморогенных стволовых раковых клеток к фазам репаративного процесса репарации межцепочечных сшивок.
Мыши, несущие асцит, обрабатывались ЦФ. Через каждые 3-6 часов у обработанных мышей отбирался асцит, и проводилась оценка количества фокусов репарации с помощью антител к гистону γН2Х. Было проведено 4 серии экспериментов. Фокусы репарации оценивались или с помощью проточной цитометрии или непосредственно на препаратах. Дополнительно присутствие двуцепочечных разрывов оценивались методом «комет» [86-90]. Результаты проведенного анализа свидетельствовали, что процесс репарации двуцепочечных разрывов как интермедиатов репарации межцепочечных сшивок существенно отличается от такового, наблюдаемого в клетках костного мозга. Фаза накопления двуцепочечных разрывов по длительности не отличается от таковой в клетках костного мозга (0-12 часов). Главным отличием является то, что после формирования всей совокупности двуцепочечных разрывов в клетках костного мозга немедленно следует их репарация, тогда как в асцитных клетках наблюдается длительный (12-24 часа) промежуток времени «ожидания», когда количество двуцепочечных разрывов не меняется. Далее с 24 до 36 часов после инъекции ЦФ идет фаза репарации двуцепочечных разрывов, которая по своей продолжительности также не отличается от таковой в клетках костного мозга (фиг.5).
Результаты экспериментов настоящего раздела можно суммировать в следующем заключении. Фрагменты экстраклеточной экзогенной дцДНК доставляются во внутренние компартменты стволовых инициирующих раковых клеток, несущих маркер стволовых клеток крови CD34+ [79]. На фоне действия ЦФ происходит интерференция репаративного процесса на отрезке времени 1-12 часов, что приводит к прямой элиминации стволовых раковых клеток асцитной опухоли Кребс-2. Результатом такого воздействия является то, что перевивка 1.5×106 клеток асцита из обработанных мышей не приводит к развитию опухолевого трансплантата.
Рассмотрим свойство избирательного воздействия на клетки асцита Кребс-2 обработок препаратом дцДНК и цитостатиком ЦФ в сочетании с препаратом дцДНК в разрезе имеющихся литературных данных.
В многочисленных экспериментах, сопровождающих данное исследование, несмотря на впервые обнаруженный масштабный апоптоз клеток асцита Кребс-2 при обработке мышей препаратом дцДНК в монорежиме, существенных отличий от контроля в развитии опухолевого трансплантата при перевивке в варианте «обработанный асцит - солидный трансплантат» обнаружено не было. Также многочисленные эксперименты свидетельствовали, что обработка только ЦФ незначительно тормозит развитие опухолевого графта. При этом было выявлено, что при синергичном действии ЦФ и препарата дцДНК в режиме 1-12 ч в развитии асцитного опухолевого трансплантата формируется устойчивая фаза ремиссии, а в развитии солидной опухоли Кребс-2 наблюдается существенное торможение роста опухоли. Эти факты могли означать, что в структуре опухоли существуют клетки, ответственные за развитие опухоли, и что именно эти клетки подвержены деструктивному влиянию синергичного действия ЦФ и дцДНК, которые при этом остаются интактными при воздействии препаратов в монорежиме. Другая популяция асцитных клеток подвергается апоптозу при воздействии или ДНК, или ЦФ. В литературе известны факты избирательного действия некоторых факторов на низкодифференцированные клетки и дифференцированные соматические клетки. Так, показано, что низкодифференцированные стволовые клетки не подвергаются эффекту свидетеля, тогда как дифференцированные клетки в одних и тех же условиях подвергаются апоптозу в байстандартной манере [91]. В нашей работе [79] был охарактеризован новый признак низкодифференцированных клеток, в том числе раковых клеток, интернализовать фрагменты дцДНК. Также в указанном исследовании показано, что такие клетки обладают свойствами стволовых инициирующих раковых клеток. Было сделано предположение, что наблюдаемое регрессирующее действие двойной обработки на опухоль связано с элиминацией именно этой популяции клеток. Проведенный анализ изменения количества CD34+ стволовых раковых клеток после обработок подтвердил это предположение. Другое подтверждение предположения о том, что CD34+/TAMRA+ клетки асцита обладают туморогенными качествами и что именно эти клетки элиминируются обработкой ЦФ в сочетании с ДНК, было получено после перевивки асцитных клеток из обработанного in vivo асцита ЦФ в сочетании с препаратом дцДНК. Перевивка 1.5×106 клеток не привела к развитию графта, тогда как известно, что 4×104 клеток достаточно для получения устойчивого трансплантата.
Мы полагаем, что синергичность действия ЦФ и фрагментов дцДНК связана со специфическим свойством ЦФ формировать межцепочечные сшивки, стремлением клетки репарировать это повреждение и присутствием в клеточном ядре фрагментов дцДНК по ходу развития репаративного процесса [92]. Из наших ранних работ известно, что фрагменты дцДНК, доставляемые во внутренние компартменты, например стволовых клеток крови, становятся участниками определенных фаз репаративного процесса репарации межцепочечных сшивок и могут его интерферировать [34]. Было проведено сравнение продолжительности различных фаз этого процесса и эффективности действия обработок в зависимости от фазы репаративного процесса. Оказалось, что процесс репарации межцепочечных сшивок в части репарации двуцепочечных разрывов на 12 часов продолжительней аналогичного для стволовых клеток крови. Также установлено, что фаза репарации, связанная с NER (1-12 часов после введения ЦФ), является определяющей в элиминации CD34+/TAMRA+ асцитных клеток, а при появлении в клетке фрагментов дцДНК в фазе репарации двуцепочечных разрывов наблюдается противоположный эффект стимуляции роста опухоли [92]. Участие фрагментов дцДНК в NER может быть связано с фазой процесса, когда репарируется брешь, возникшая в результате выворачивания аддукта, проходящая с привлечением клешней гомологичной последовательности. Можно предположить, что фрагменты дцДНК длительное время динамически конкурируют за сайт отжига в области вывернутого аддукта с гомологичным участком второй хромосомы. Длительное неразрешение или некорректное разрешение интермедиата может являться причиной губительных для стволовых инициирующих раковых клеток последствий [93].
Таким образом, благодаря введению новых экспериментально доказанных процедур достигается требуемый технический результат, который заключается в повышении эффективности эрадикации стволовых инициирующих раковых клеток, поскольку благодаря обработке цитостатиком ЦФ в дозе 200 мг/кг и далее инъекциям в течение 12 часов каждый час после введения ЦФ препарата ДНК в количестве 0,5 мг на инъекцию, суммарно 6 мг, где в качестве препарата ДНК используется смесь препаратов дцДНК и кросс-линкированной ДНК в соотношении 3:1, происходит эффективная эрадикация стволовых инициирующих раковых клеток в асцитной опухоли Кребс-2, полностью элиминирующая способность асцита к перевивке в форме внутримышечного трансплантата.
Список использованных источников
1. Winer E, Gralow J, Diller L, Karlan B, Loehrer P, Pierce L, Demetri G, Ganz P, Kramer B, Kris M, Markman M, Mayer R, Pfister D, Raghavan D, Ramsey S, Reaman G, Sandier H, Sawaya R, Schuchter I., Sweetenham J, Vahdat L, Schilsky RL; American Society of Clinical Oncology. Clinical cancer advances 2008: major research advances in cancer treatment, prevention, and screening - a report from the American Society of Clinical Oncology. J Clin Oncol. 2009 Feb 10; 27(5): 812-26.
2. Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009 Jul-Aug; 59(4): 225-49.
3. Malvezzi M, Arfe A, Bertuccio P, Levi F, La Vecchia C, Negri E. European cancer mortality predictions for the year 2011. Ann Oncol. 2011 Apr; 22(4):947-56.
4. La Vecchia С, Bosetti С, Lucchini F, Bertuccio P, Negri E, Boyle P, Levi F. Cancer mortality in Europe, 2000-2004, and an overview of trends since 1975. Ann Oncol. 2010 Jun; 21(6): 1323-60.
5. Gondos A, Bray F, Hakulinen T, Brenner H; EUNICE Survival Working Group. Trends in cancer survival in 11 European populations from 1990 to 2009: a model-based analysis. Ann Oncol. 2009 Mar; 20(3): 564-73.
6. Brennan R, Federico S, Dyer MA. The war on cancer: have we won the battle but lost the war? Oncotarget. 2010 Jun; 1(2): 77-83.
7. Varmus H. The new era in cancer research. Science. 2006 May 26; 312(5777): 1162-5.
8. Прокопович С.К., Винницкий В.Б. Дендритные клетки и перспективы их использования в иммунотерапии злокачественных новообразований. Онкология. 2001. Т.3. №2-3. С.126-131.
9. Барышников А.Ю. Принципы и практика вакцинотерапии рака. Бюл. СО РАМН. 2004. Т.112, №2. С.59-63.
10. Олишевский С.В., Козак В.В., Яниш Ю.В., Рыбалко С.Л., Шляховенко В.А. Иммуностимулирующая CpG-ДНК: перспективы клинического применения в онкологии. Онкология 2006 Т.8, №2, 209-217.
11. Krieg AM. Development of TLR9 agonists for cancer therapy. J Clin Invest. 2007 May; 117(5): 1184-94.
12. Hellerstein MK. A critique of the molecular target-based drug discovery paradigm based on principles of metabolic control: advantages of pathway-based discovery. Metab Eng. 2008 Jan; 10(1):1-9.
13. Lapidot T, Sirard C, Vormoor J, Murdoch B, Hoang T, Caceres-Cortes J, Minden M, Paterson B, Caligiuri MA, Dick JE. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 1994 Feb 17; 367(6464): 645-8.
14. Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997 Jul; 3(7): 730-7.
15. Тупицын Н.Н. Циркулирующие и диссеминироваиные раковые клетки при раке молочной железы и раке яичников. Онкогинекология. 2013. №1. С.12-18.
16. Jinesh GG, Choi W, Shah JB, Lee EK, Willis DL, Kamat AM. Blebbishields, the emergency program for cancer stem cells: sphere formation and tumorigenesis after apoptosis. Cell Death Differ. 2013 Mar; 20(3): 382-95.
17. Wright MH, Calcagno AM, Salcido CD, Carlson MD, Ambudkar SV, Varticovski L. Brcal breast tumors contain distinct CD44+/CD24- and CD133+ cells with cancer stem cell characteristics. Breast Cancer Res. 2008; 10(1): R10.
18. Allies LE, Weissman IL. Cancer stem cells in solid tumors. Curr Opin Biotechnol. 2007 Oct; 18(5): 460-6.
19. Hermann PC, Huber SL, Herrler T, Aicher A, Ellwart JW, Guba M, Bruns CJ, Heeschen C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 2007 Sep 13; 1(3): 313-23.
20. Dylla SJ, Beviglia L, Park IK, Chartier C, Raval J, Ngan L, Pickell K, Aguilar J, Lazetic S, Smith-Berdan S, Clarke MF, Hoey Т, Lewicki J, Gumey AL. Colorectal cancer stem cells are enriched in xenogeneic tumors following chemotherapy. PLoS One. 2008 Jun 18; 3(6):e2428.
21. Bao S, Wu Q, McLendon RE, Hao Y, Shi Q, Hjelmeland AB, Dewhirst MW, Bigner DD, Rich JN. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 2006 Dec 7; 444(7120): 756-60.
22. Phillips TM, McBride WH, Pajonk F. The response of CD24(-/low)/CD44+ breast cancer-initiating cells to radiation. J Nail Cancer Inst. 2006 Dec 20; 98(24): 1777-85.
23. Yu F, Yao H, Zhu P, Zhang X, Pan Q, Gong C, Huang Y, Hu X, Su F, Lieberman J, Song E. let-7 regulates self renewal and tumorigenicity of breast cancer cells. Cell. 2007 Dec 14; 131(6): 1109-23.
24. Wicha MS. Cancer stem cell heterogeneity in hereditary breast cancer. Breast Cancer Res. 2008; 10(2): 105.
25. Guzman ML, Rossi RM, Neelakantan S, Li X, Corbett CA, Hassane DC, Becker MW, Bennett JM, Sullivan E, Lachowicz JL, Vaughan A, Sweeney CJ, Matthews W, Carroll M, Liesveld JL, Crooks PA, Jordan CT. An orally bioavailable parthenolide analog selectively eradicates acute myelogenous leukemia stem and progenitor cells. Blood. 2007 Dec 15; 110(13): 4427-35.
26. Yilmaz OH, Morrison SJ. The PI-3kinase pathway in hematopoietic stem cells and leukemia-initiating cells: a mechanistic difference between normal and cancer stem cells. Blood Cells Mol Dis. 2008 Jul-Aug; 41(1): 73-6.
27. Beier D, Rohrl S, Pillai DR, Schwarz S, Kunz-Schughart LA, Leukel P, Proescholdt M, Brawanski A, Bogdahn U, Trampe-Kieslich A, Giebel B, Wischhusen J, Reifenberger G, Hau P, Beier CP. Temozolomide preferentially depletes cancer stem cells in glioblastoma. Cancer Res. 2008 Jul 15; 68(14): 5706-15.
28. Calabrese С, Poppleton H, Kocak M, Hogg TL, Fuller C, Hamner B, Oh EY, Gaber MW, Finklestein D, Alien M, Frank A, Bayazitov IT, Zakharenko SS, Gajjar A, Davidoff A, Gilbertson RJ. A perivascular niche for brain tumor stem cells. Cancer Cell. 2007 Jan; 11(1): 69-82.
29. Marotta LL, Polyak K. Cancer stem cells: a model in the making. Curr Opin Genet Dev. 2009 Feb; 19(1): 44-50.
30. www.54rus.org/more/14808
31. http://health.obozrevatel.com/diseases/08431-sozdanyi-plombyi-ubijtsyi-bakterij.htm
32. www.cmbt.su/rus/science/sciencel35.html
33. RU 2476596, C12N 15/00, 27.02.2013
34. Dolgova EV, Proskurina AS, Nikolin VP, Popova NA, Alyamkina EA, Orishchenko KE, Rogachev VA, Efremov YR, Dubatolova TD, Prokopenko AV, Chernykh ER, Ostanin AA, Taranov OS, Oinigov VV, Zagrebelniy SN, Bogachev SS, Shurdov MA. “Delayed death” phenomenon: A synergistic action of cyclophosphamide and exogenous DNA. Gene. 2012; 495: 134-145.
35. Medzhitov R. Recognition of microorganisms and activation of the immune response. Nature, 2007, Vol.449, pp.819-826.
36. Takeshita F., Ishii K.J. Intracellular DNA sensors in immunity. Curr. Opin. ImmunoL, 2008, Vol.20, no. 4, pp.383-388.
37. Xiao T. Innate immune recognition of nucleic acids. ImmunoL Res., 2009, Vol.43, no.1-3, pp.98-108.
38. Iwasaki A., Medzhitov R. Regulation of adaptive immunity by the innate immune system. Science, 2010, Vol.327, no.5963, pp.291-295.
39. Kumagai Y., Akira S. Identification and functions of pattern-recognition receptors. J. Allergy Clin. ImmunoL, 2010, Vol.125, no.5, pp.985-992.
40. Barbalat R., Ewald S.E., Mouchess M.L., Barton G.M Nucleic acid recognition by the innate immune system. Annu. Rev. Immunol., 2011, Vol.29, pp.185-214.
41. Bode С., Zhao G., Steinhagen F., Kinjo Т., Klinman D.M. CpG DNA as a vaccine adjuvant. Expert Rev. Vaccines, 2011, Vol.10, no.4, pp.499-511.
42. Anker P., Mulcahy H., Chen X.Q., Stroun M. Detection of circulating tumour DNA in the blood (plasma/serum) of cancer patients // Cancer Metastasis Rev. 1999. Vol.18(1). P.65-73.
43. Jahr S, Hentze H, Englisch S, Hardt D, Fackelmaycr FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15; 61(4): 1659-65.
44. Laktionov PP, Tamkovich SN, Rykova EY, Bryzgunova OE, Starikov AV, Kuznetsova NP, Sumarokov SV, Kolomiets SA, Sevostianova NV, Vlassov VV. Extracellular circulating nucleic acids in human plasma in health and disease. Nucleosides Nucleotides Nucleic Acids. 2004 Oct; 23(6-7): 879-83.
45. Туаева И.О., Софронов В.В., Емикеева В.А., Абрамова З.И., Винтер В.Г., Мустафина Д.M., Туточкина К.В. Взаимосвязь концентрации внеклеточной ДНК в плазме крови и содержания антител к нативной ДНК у новорожденных с пневмопатией // Казанский мед.ж.. 2006. Т.87. №4. С.254-257.
46. Guiducci С, Tripodo С, Gong M, Sangaletti S, Colombo MP, Coffman RE, Barrat FJ. Autoimmune skin inflammation is dependent on plasmacytoid dendritic cell activation by nucleic acids via TLR7 and TLR9. J Exp Med. 2010 Dec 20; 207(13): 2931-42.
47. Pisetsky DS, Ullal AJ. The blood nucleome in the pathogenesis of SLE. Autoimmun Rev. 2010 Nov; 10(1): 35-7.
48. Almqvist N, Winkler TH, Mårtensson IL. Autoanti bodies: Focus on anti-DNA antibodies. Self Nonself. 2011 Jan; 2(1): 11-18.
49. Agrawal A, Sridharan A, Prakash S, Agrawal H. Dendritic cells and aging: consequences for autoimmunity. Expert Rev Clin Immunol. 2012 Jan; 8(1): 73-80.
50. Choubey D. DNA-responsive inflammasomes and their regulators in autoimmunity. Clin Immunol. 2012 Mar; 142(3): 223-31.
51. Kaczorowski DJ, Scott MJ, Pibris JP, Afrazi A, Nakao A, Edmonds RD, Kim S, Kwak JH, Liu Y, Fan J, Billiar TR. Mammalian DNA is an endogenous danger signal that stimulates local synthesis and release of complement factor B. Mol Med. 2012 Jul 18; 18: 851-60.
52. Ermakov AV, Konkova MS, Kostyuk SV, Egolina NA, Efremova LV, Veiko NN. Oxidative stress as a significant factor for development of an adaptive response in irradiated and nonirradiated human lymphocytes after inducing the bystander effect by low-dose X-radiation. Mutat Res. 2009 Oct 2; 669(1-2): 155-61.
53. Rhodes A, Wort SJ, Thomas H, Collinson P, Bennett ED. Plasma DNA concentration as a predictor of mortality and sepsis in critically ill patients. Crit Care. 2006; 10(2): R60.
54. Козлов В.К. Сепсис: Этиология, иммулопатогенез, концепция современной иммунотерапии. - К.: «АННА-Т», 2007. - 296 с.
55. Saukkonen К, Lakkisto P, Varpula M, Varpula Т, Voipio-Pulkki LM, Pettila V, Pulkki K. Association of cell-free plasma DNA with hospital mortality and organ dysfunction in intensive care unit patients. Intensive Care Med. 2007 Sep; 33(9): 1624-7.
56. Castellheim A, Brekke OL, Espevik T, Harboe M, Mollnes ТЕ. Innate immune responses to danger signals in systemic inflammatory response syndrome and sepsis. Scand J Immunol. 2009 Jun; 69(6): 479-91.
57. Arnalich F, Maldifassi MC, Ciria E, Quesada A, Codoceo R, Herruzo R, Garcia-Cerrada C, Montoya F, Vazquez JJ, López-Collazo E, Montiel C. Association of cell-free plasma DNA with perioperative mortality in patients with suspected acute mesenteric ischemia. Clin Chim Acta. 2010 Sep 6; 411(17-18): 1269-74.
58. Kung CT, Hsiao SY, Tsai TC, Su CM, Chang WN, Huang CR, Wang HC, Lin WC, Chang HW, Lin YJ, Cheng ВС, Su BY, Tsai NW, Lu CH. Plasma nuclear and mitochondrial DNA levels as predictors of outcome in severe sepsis patients in the emergency room. J Transi Med. 2012 Jun 21; 10: 130.
59. Huang L.C., Clarkin K.C., Wahl G.M. Sensitivity and selectivity of the DNA damage sensor responsible for activating p53-dependent G1 arrest // Proc Nati Acad Sci USA. 1996. V.93. №10. P.4827-4832.
60. MacDougall C.A., Byun T.S., Van C., Yee M.C., Cimprich K.A. The structural determinants of checkpoint activation // Genes Dcv. 2007. V.21. №8. P.898-903.
61. Zou L. Single- and double-stranded DNA: building a trigger of ATR-mediated DNA damage response // Genes Dev. 2007. V.21. №8. P.879-885.
62. Barber G.N. Cytoplasmic DNA innate immune pathways. Immunol. Rev., 201 la, Vol.243, no.1, pp.99-108.
63. Barber G.N. Innate immune DNA sensing pathways: STING, AIMII and the regulation of interferon production and inflammatory responses. Curr. Opin. Immunol., 2011b, Vol.23, no.1, pp.10-20.
64. Patel SJ, Jindal R, King KR, Tilles AW, Yarmush ML. The inflammatory response to double stranded DNA in endothelial cells is mediated by NFκB and TNFα. PLoS One. 2011; 6(5): e19910.
65. Sharma S., Fitzgerald K.A. Innate immune sensing of DNA. PLoS Pathog., 2011, Vol.7, no.4, e1001310.
66. Yakubov LA, Rogachev VA, Likhacheva AC, Bogachev SS, Sebeleva ТЕ, Shilov AG, Baiborodin SI, Petrova NA, Mechetina LV, Shurdov MA, Wickstrom E. Natural human gene correction by small extracellular genomic DNA fragments. Cell Cycle. 2007 Jul; 6(18): 2293-301.
67. García-Olmo D, García-Olmo DC, Domínguez-Berzosa C, Guadalajara H, Vega L, Garcfa-Arranz M. Oncogenic transformation induced by cell-free nucleic acids circulating in plasma (genometastasis) remains after the surgical resection of the primary tumor: a pilot study. Expert Opin Biol Ther. 2012 Jun; 12 Suppl 1: S61-8.
68. Ledoux L. Uptake of DNA by living cells // Prog. Nucleic Acid Res. Mol. Biol. - 1965. - V.4. - P.231-267.
69. Ratajczak J, Wysoczynski M, Hayek F, Janowska-Wieczorek A, Ratajczak MZ. Membrane-derived microvesicles: important and underappreciated mediators of cell-to-cell communication. Leukemia. 2006 Sep; 20(9): 1487-95.
70. Cocucci E, Racchetti G, Meldolesi J. Shedding microvesicles: artefacts no more. Trends Cell Biol. 2009 Feb; 19(2): 43-51.
71. Pap E, Pállinger E, Pásztói M, Falus A. Highlights of a new type of intercellular communication: microvesicle-based information transfer. Inflamm Res. 2009 Jan; 58(1): 1-8.
72. Simons M, Raposo G. Exosomes-vesicular carriers for intercellular communication. Curr Opin Cell Biol. 2009 Aug; 21 (4): 575-81.
73. Balaj L, Lessard R, Dai L, Cho YJ, Pomeroy SL, Breakefield XO, Skog J. Tumour microvesicles contain retrotransposon elements and amplified oncogene sequences. Nat Commun. 2011 Feb 1; 2:180.
74. Camussi G, Deregibus MC, Bruno S, Grange C, Fonsato V, Tetta C. Exosome/microvesicle-mediated epigenetic reprogramming of cells. Am J Cancer Res. 2011; 1(1): 98-110.
75. Record M, Subra C, Silvente-Poirot S, Poirot M. Exosomes as intercellular signalosomes and pharmacological effectors. Biochem Pharmacol. 2011 May 15; 81(10): 1171-82.
76. Tetta C, Bruno S, Fonsato V, Deregibus MC, Camussi G. The role of microvesicles in tissue repair. Organogenesis. 2011 Apr-Jun; 7(2): 105-15.
77. Ludwig AK, Giebel B. Exosomes: small vesicles participating in intercellular communication. Int J Biochem Cell Biol. 2012 Jan; 44(1):1 1-5.
78. Ronquist GK, Larsson A, Stavreus-Evers A, Ronquist G. Prostasomes are heterogeneous regarding size and appearance but affiliated to one DNA-containing exosome family. Prostate. 2012 Dec 1; 72(16): 1736-45.
79. Приоритет №2013113328/20 «Способ детекции стволовых раковых клеток»
80. Alyamkina EA, Dolgova EV, Likhacheva AS, Rogachev VA, Sebeleva ТЕ, Nikolin VP, Popova NA, Orishchenko ICE, Strunkin DN, Chemykh ER, Zagrebelniy SN, Bogachev SS, Shurdov МЛ. Combined therapy with cyclophosphamide and DNA preparation inhibits the tumor growth in mice. Genet Vaccines Ther. 2009 Aug 14; 7(1): 12. http://www.gvt-joumal.com/content/7/1/12.
81. Alyam.kina EA, Dolgova EV, Likhacheva AS, Rogachev VA, Sebeleva ТЕ, Nikolin VP, Popova NA, Kiseleva EV, Orishchenko ICE, Sakhno LV, Gel'fgat EL, Ostanin AA, Chernykh ER, Zagrebelniy SN, Bogachev SS, Shurdov MA. Exogenous allogenic fragmented double-stranded DNA is internalized into human dendritic cells and enhances their allostimulatory activity. Cell Immunol. 2010; 262: 120-126.
82. Alyamkina EA, Leplina OY, Sakhno LV, Chemykh ER, Ostanin AA, Efremov YR, Shilov AG, Proskurina AS, Orishchenko ICE, Dolgova EV, Rogachev VA, Nikolin VP, Popova NA, Zagrebelniy SN, Bogachev SS, Shurdov MA. Effect of double-stranded DNA on maturation of dendritic cells in vitro. Cell Immunol. 2010; 266: 46-51.
83. Alyamkina EA, Nikolin VP, Popova NA, Dolgova EV, Proskurina AS, Orishchenko KE, Efremov YR, Chemykh ER, Ostanin AA, Sidorov SV, Ponomarenko DM, Zagrebelniy SN, Bogachev SS, Shurdov MA. A strategy of tumor treatment in mice with doxorubicin-cyclophosphamide combination based on dendritic cell activation by human double-stranded DNA preparation. Genet Vaccines Ther. 2010 Nov 1; 8(1): 7. http://www.gvt-iournal.com/content/8/1/7.
84. Alyamkina EA, Leplina OY, Ostanin AA, Chernykh ER, Nikolin VP, Popova NA, Proskurina AS, Gvozdeva TS, Dolgova EV, Orishchenko ICE, Rogachev VA, Sidorov SV, Varaksin NA, Ryabicheva TG, Bogachev SS, Shurdov MA. Effects of human exogenous DNA on production of perforin-containing CD8+ cytotoxic lymphocytes in laboratory setting and clinical practice. Cell Immunol. 2012; 276: 59-66.
85. Алямкина Е.А., Лихачева А.С., Николин В.П., Попова Н.А., Долгова Е.В., Рогачев В.А., Себелева Т.Е., Стрункин Д.Н., Богачев С.С., Шурдов М.А. Действие экзогенной ДНК, ассоциированной с протамином, на рост экспериментальных опухолей мыши. Вопросы онкологии. 2009. Т.55, №6, стр.765-768.
86. Olive PL, Wlodek D, Banáth JP. DNA double-strand breaks measured in individual cells subjected to gel electrophoresis. Cancer Res. 1991 Sep 1; 51(17): 4671-6.
87. Klaude M, Eriksson S, Nygren J, Ahnström G. The comet assay: mechanisms and technical considerations. MutatRes. 1996 Jun 12; 363(2): 89-96.
88. Collins AR, Dobson VL, Dusinska M, Kennedy G, Stětina R. The comet assay: what can it really tell us? Mutat Res. 1997 Apr 29; 375(2): 183-93.
89. McKelvey-Martin VJ, Ho ET, McKeown SR, Johnston SR, McCarthy PJ, Rajab NF, Downes CS. Emerging applications of the single cell gel electrophoresis (Comet) assay. I. Management of invasive transitional cell human bladder carcinoma. II. Fluorescent in situ hybridization Comets for the identification of damaged and repaired DNA sequences in individual cells. Mutagenesis. 1998 Jan; 13(1): 1-8.
90. Rojas E, Lopez MC, Valverde M. Single cell gel electrophoresis assay: methodology and applications. J Chromatogr В Biomed Sci Appl. 1999 Feb 5; 722(1-2): 225-54.
91. Sokolov MV, Neumann RD. Radiation-induced bystander effects in cultured human stem cells. PLoS One. 2010 Dec 2; 5(12): e14195.
92. Долгова Е.В., Лихачева А.С., Орищенко К.Е., Алямкина Е.А., Богачев С.С., Шурдов М.А. Репарация межцепочечных сшивок молекулы ДНК. Информационный вестник ВОГиС. 2010. Т.14, №2, стр.332-356.
93. Тронов В.А., Крамаренко И.И., Карпухин А.В. Рак толстой кишки: дифицит репарации, нестабильность генома, устойчивость к апоптозу, оценка риска развития заболевания. Вопросы онкологии. 2005. Т.51. №9. С.159-166.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ АСЦИТНОЙ ФОРМЫ РАКА | 2015 |
|
RU2595864C1 |
| СПОСОБ ДЕТЕКЦИИ СТВОЛОВЫХ РАКОВЫХ КЛЕТОК | 2013 |
|
RU2530170C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2662354C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2489169C2 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2345792C2 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2008 |
|
RU2387456C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2429019C2 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2675233C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2490028C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2322264C1 |
Изобретение относится к медицине, а именно к онкологии, и касается эрадикации стволовых инициирующих раковых клеток. Для этого экспериментальным животным, несущим развитый асцит, парентерально вводят циклофосфан в дозе 200 мг/кг. Затем в течение 12 часов каждый час после введения циклофосфана вводят препарат ДНК интраперитонеально. При этом препарат ДНК состоит из смеси препаратов фрагментированной ДНК человека и кросс-линкированной ДНК человека, обработанной нитроген-мустардом. Способ обеспечивает эффективную эрадикацию стволовых раковых клеток за счет синергетического действия цитостатика и препарата ДНК. 2 з.п. ф-лы, 5 ил.
1. Способ эрадикации стволовых раковых клеток, основанный на совместном воздействии цитостатика циклофосфана и препарата фрагментированной ДНК человека, при котором мышам линии СВА весом 20-35 г, несущим развитый асцит, парентерально вводится циклофосфан в дозе 200 мг/кг и далее в течение 12 часов каждый час после введения циклофосфана вводят интраперитонеально препарат ДНК, состоящий из смеси препаратов фрагментированной ДНК человека и кросс-линкированной ДНК человека, обработанной нитроген-мустардом.
2. Способ по п. 1, отличающийся тем, что в качестве препарата ДНК используют смеси препаратов фрагментированной ДНК человека и кросс-линкированной ДНК человека размером 300-6000 пар оснований.
3. Способ по п. 1, отличающийся тем, что в препарате кросс-линкированной ДНК на 1000 пар оснований приходится 80-120 межцепочечных сшивок.
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2429019C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА ПИЩЕВОДА | 2011 |
|
RU2474420C1 |
| US 2008241834 A1 02.10.2008 | |||
| АЛЯМКИНА Е.А | |||
| "Влияние фрагментированной экзогенной ДНК на рост экспериментальных опухолей мыши и активацию антигенпрезентирующих дендритных клеток" | |||
| Автореферат дис | |||
| К б н, 2012, [найдено 04.07.2014], найдено из Интернет:http://dissers.ru/1 | |||
Авторы
Даты
2015-02-20—Публикация
2013-09-27—Подача