Изобретение относится к медицине, в частности к методам лечения пациентов препаратами, содержащими генетический материал, и может быть использовано для лечения нарушенного гемопоэза, связанного с дефектами хромосом и последующей гибелью стволовых клеток крови (СКК) при терапии цитостатиками или высокими дозами радиации, для лечения заболеваний, связанных с нарушением базовых механизмов дифференцировки СКК, без деления в сторону специфических гемопоэтических элементов, которые возникают при гемобластозах вследствие злокачественного изменения клеток гемопоэза, которые становятся не способными к нормальной дифференцировке, в результате чего наблюдается их неконтролируемая пролиферация, а также заболеваний, связанных с дефектами хромосом СК, вылечивание которых зависит от появления в организме генетически, фенотипически и физиологически здоровых стволовых клеток (СК).
Известен способ лечения, основанный на исправлении точечных мутаций в клетках [1].
Способ отличается относительно низкой эффективностью лечения и ограниченностью применения, поскольку согласно этому способу мутации должны быть точно определены еще до начала лечения.
Ввиду того, что ни для одной мутации нет достоверного доказательства того, что именно эта мутация привела к гибели СК или является причиной злокачественного перерождения клеток гемопоэза, развитие этого метода требует скрупулезных и длительных исследований по выявлению конкретных мутаций, требующих коррекции, а следовательно, существует необходимость в создании методов, которые могли бы применяться на основе уже имеющихся знаний о механизмах коррекции генома, не делая акцента на конкретных мутациях, приведших к гибели СКК или их злокачественному перерождению.
Известны также способы лечения, основанные на локальном применении ДНК (дезоксирибонуклеиновая кислота) фрагментов для лечения предраковых состояний в коже пациентов [2, 3].
Эти способы также имеет ограниченную применимость, поскольку ни конкретные последовательности, ни источники ДНК в указанных патентах не определены. В них предлагаются использовать как природную, так и синтетическую ДНК из «любых подходящих источников», например ДНК лосося длиной от 200 до мононуклеотидов и нуклеозидов, включая димеры, что в соответствии с тестами авторов является наиболее эффективным. Однако действие и последствия применения ДНК иной природы на человеческий организм пока не полностью изучены, что предопределяет определенную опасность применения способов.
Наиболее близким по своей сущности к предлагаемому является способ, основанный на применении препарата Полидан, представляющего собой высокоочищенную стандартизированную смесь натриевых солей полихлоргидратов дериватов ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота), получаемую из молок осетровых рыб, дозу которого вводят подкожно или внутримышечно медленно в течение 1,5-2 минут с предварительным согреванием флакона с препаратом в руке до температуры тела пациента [4].
Недостатком наиболее близкого технического решения является ограниченная область применения, поскольку активная субстанция препарата выделена из тканей ксеногенного организма и содержит как ДНК, так и РНК молекулы. Несмотря на то, что активная субстанция препарата Полидан действует на геном СКК схожим с ДНК человека образом, а именно мимикрирует наличие разрывов хромосом присутствием двуцепочечных концов, доставленных в ядро фрагментов ДНК, чем активирует СКК к терминальной дифференцировке, а также создает условия за счет нахождения частичной гомологии между ДНК препарата Полидан и ДНК хромосом человека для осуществления актов гомологической рекомбинации и сохранения физической длины и структуры хромосом, достаточных для цепи последовательных митозов, субстанция препарата Полидан при этом привносит в реципиентный геном чужеродные последовательности.
Такое действие препарата Полидан спасает гемопоэтичесую функцию СКК за счет восстановления и поддержания функционального размера хромосом этих клеток и, по-видимому, в целом не затрагивает высокоспециализированные свойства дифференцированных клеток крови, причем одновременно активируя их к терминальной дифференцировке своим мимикрирующим действием, тем не менее такие спасенные СКК нельзя считать в полной мере вернувшими свое исходное генетическое состояние, поскольку любое другое направление дифференцировки, где принимают участие задетые рекомбирнацией с чужеродным генетическим материалом хромосомные локусы, неизбежно приведет к дефектам этого пути развития СКК. Внутренняя структура хромосом при такой рекомбинации приобретает абсолютно непредсказуемые черты и до сих пор не исследован долгосрочный прогноз лейкостимуляции с использованием препаратов чужеродной ДНК.
Требуемая задача заключается в расширении области применения и лечения нарушенного гемопоэза, связанного с дефектами хромосом и последующей гибелью стволовых клеток крови (СКК), например, при терапии цитостатиками или высокими дозами радиации, для лечения пациентов с заболеваниями, связанными с нарушением базовых механизмов дифференцировки СКК без деления в сторону специфических гемопоэтических элементов, которые возникают при гемобластозах вследствие злокачественного изменения клеток гемопоэза, которые становятся не способными к нормальной дифференцировке, в результате чего наблюдается их неконтролируемая пролиферация, а также для лечения пациентов с заболеваниями, связанными с дефектами хромосом СК, вылечивание которых зависит от появления в организме генетически, фенотипически и физиологически здоровых стволовых клеток (СК).
Требуемый результат достигается тем, что в способе лечения заболеваний, основанном на введении в организм пациента фрагментированной ДНК, фрагментированная ДНК является аллогенной и состоит из фрагментов, длина которых соответствует 1-10 нуклеосомным единицам, составляющих полный геном пациента в ассоциации с белками ядерного матрикса, при этом количество фрагментированной ДНК принимают равным или превышающим количество собственно ДНК плазмы крови и тканевых жидкостей пациента, но не более 1500 нг/мл.
Способ основан на способности СКК отвечать на воздействие препаратов фрагментированной ДНК. Фрагменты ДНК, доставленные в ядерное пространство СКК, вследствие естественного механизма гомологической рекомбинации (ГР) замещают мутантные участки генов или восстанавливают исходную физическую длину хромосом, что явилось причиной утраты СК их жизнеспособности, и тем самым нежизнеспособная или мутантная СКК становится жизнеспособной. При этом хромосомы СКК приобретают физические параметры, позволяющие СКК осуществлять цепь последовательных митозов, а в оптимальном варианте геном обработанной СКК полностью исправляется и становится идентичным геному исходной здоровой СК. В тот же самый момент доставленные в ядерное пространство фрагменты экстраклеточной ДНК своими двуцепочечными концами создают иллюзию появления функциональных разрывов в хромосомах СКК, являющихся индуктором их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцировки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
На чертеже представлены: на фиг.1 - характеристика влияния ДНК мыши и человека на выживаемость мышей после их γ-облучения в летальной дозе, на фиг.2 и фиг.3 - характеристика радиозащитного действия аллогенной ДНК при внутрибрюшинном введении мышам до и после летального γ-облучения, на фиг.4,а представлены дессектированные селезенки мышей после γ-облучения и терапии экстраклеточной фрагментированной ДНК человека и мыши. Наблюдается большое количество эндогенных селезеночных колоний (см. таблица 1), образованных потомками спасенных СКК. На фиг.4,б представлены дессектированные селезенки мышей после γ-облучения без терапии экстраклеточной фрагментированной ДНК человека и мыши. Наблюдается практическое отсутствие (см. таблица 1) колоний, что свидетельствует о разрушении механизмов восстановления СКК.
Предложенный способ лечения реализуется следующим образом.
Для его осуществления в организм пациента известными путями и способами (внутривенно, внутримышечно, путем внутрикожной инъекции, подкожно, внутрибрюшинно, нанесением на различные слизистые оболочки, приемом через рот (с или без предварительной нейтрализации кислой среды желудка либо с использованием специальной нерастворимой в желудке оболочки), через прямую кишку, интравагинально, интрокулярно, через нос, путем интроокулярной инъекции или ингаляцией вводятся специальным образом обработанные фрагменты аллогенной ДНК, полученной от генетически и физиологически здоровых доноров.
Количество вводимого препарата должно быть таким, что бы концентрация фрагментированной ДНК в крови и тканевых жидкостей пациента не превышала максимально допустимого количества, равного 1500 нг/мл.
В случае обработки СКК ex vivo для последующей автотрансплантации СКК должны быть обработаны препаратом фрагментированной ДНК в концентрации не превышающей 30 мкг/мл.
При этом фрагментированная ДНК, будучи введенная в организм пациента, доставляется в активно делящиеся клетки организма, в том числе и к СКК, при помощи естественного механизма доставки (кровоток, специфические рецепторы, расположенные на поверхности активно делящихся клеток).
Далее фрагментированная экстраклеточная ДНК, доставленная во внутриклеточное пространство, депонируется в межхромосомном компартменте ядра и подвергается внутриядерному процессингу.
В этом случае фрагменты ДНК, будучи депонированными в межхромосомном компартменте ядра, вследствие естественного механизма гомологической рекомбинации (ГР) замещают мутантные участки хромосом мутации, в которых привели к нежизнеспособности СКК. В результате указанных событий происходит реверсивное полое или частичное восстановление функций СКК, активация митотического процесса и вступление СКК на путь дифференцировки. В указанном процессе воздействия экзогенной фрагментированной ДНК на СКК важным является свойство СКК (и других типов СК, в том числе и ЭСК) в ходе нескольких (1-3) первых митозов полностью перестраивать свой геном, приводя его к кометированному состоянию. При этом в геноме СКК возникают многочисленные разрывы хроматина, являющиеся неотъемлемой частью процесса перестройки генома. Если в этот момент в ядре СК находится гомологичная ДНК требуемого размера в комплексе с белками ядерного матрикса, то она становится доступной для интеграции в геном по типу гомологической рекомбинации, при этом активность данного процесса за счет появлений в хроматине многочисленных физиологичных, функциональных разрывов многократно увеличивается. Кроме этого активирующее влияние фрагментов ДНК на дифференцировку СКК связано с их мимикрирующим действием. Доставленные в ядерное пространство фрагменты экстраклеточной ДНК привносят в ядро клетки большое количество двуцепочечных концов, которые клетка воспринимает как свои собственные функциональные разрывы хромосом, которые образуются и быстро репарируются в ходе их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцирвки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
Таким образом, при введении в организм препарата фрагментированной аллогенной ДНК, полученной от физиологически и генетически здоровых доноров, происходит ее поглощение СКК в процессе деления посредством естественного механизма доставки, свойственного активно делящимся клеткам (рецептор-опосредованный пиноцитоз). Доставленная в ядерный компартмент - межхромосомное пространство - фрагментированная ДНК депонируется и вступает в процесс гомологического обмена с соответствующими локусами хромосом в момент перестройки генома СКК и связанного с этим временного появления в хроматине многочисленных разрывов. Вследствие естественного механизма гомологической рекомбинации депонированные в межхромосомном пространстве фрагменты ДНК замещают мутантные участки хроматина, мутации в которых привели к нежизнеспособности СКК, а также могут замещать любые мутантные локусы генов СК на немутантные. Вследствие указанных событий геном СКК претерпевает частичную или полную коррекцию, что приводит к восстановлению митотического потенциала СКК или же к полному восстановлению поврежденного генома СКК. В тот же самый момент доставленные в ядерное пространство фрагменты экстраклеточной ДНК привносят в ядро клетки большое количество двуцепочечных концов, которые клетка воспринимает как свои собственные функциональные разрывы хромосом, которые образуются и быстро репарируются в ходе их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцировки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
Эффект, достигаемый при использовании предлагаемого изобретения, может быть обоснован следующими теоретическими данными.
Согласно современной классификации к стволовым клеткам относятся тотипотентные клетки морулы, плюрипотентные клетки бластоцисты, из которых в организме формируются все ткани организма, и мультипотентные региональные герминативные клетки [5]. Региональные или тканеспецифические стволовые клетки сохраняются в течение всей жизни организма, самоподдерживаются и обеспечивают постоянное пополнение утраченных клеточных популяций. Тканеспецифичекие СК вносят вклад в регенерацию и поддержание многочисленных, если не всех тканей млекопитающих, включая кровь, печень, кишечник, скелетную мускулатуру и центральную нервную систему. До последнего времени считалось, что тканеспецифические СК детерминируются в определенные типы клеток и распределяются в тканях, из которых они произошли. Тем не менее, в последнее время появилось большое количество работ, свидетельствующих о гораздо большей пластичности региональных СК [6, 7]. Например, подтверждено, что СК нейронов, выделенные из тканей мозга мышей, дифференцируются в клетки крови, скелетной мускулатуры и эндотелиальные клетки, что СК клетки жировой ткани человека дифференцируются в клетки кости, мышц и хряща и также что СК дермы кожи млекопитающих дифференцируются в клетки скелетных мышц, нейроны, глиальные и жировые клетки. Показано, что некоторые редкие популяции клеток, так называемые мультипотентные прогениторные клетки способны дифференцироваться в дериваты всех трех зародышевых листков. Также возможность дифференцироваться в клетки неродственных тканей были продемонстрированы для СК костного мозга, исходно участвующих в формировании и поддержании популяции клеток крови.
Открытие феномена пластичности стволовых клеток и возможности их дифференцировки в клетки тканей экто-, мезо- и эндодермального происхождения, а также способность СК мигрировать из костного мозга и пополнять пулы стволовых клеток различных тканей позволило сформулировать концепцию об общем регенеративном механизме тканей, где основную роль играют СК. Это послужило основой для возникновения и бурного развития нового направления - регенеративной медицины, основанного на применении СК клеток с целью восстановления клеточного состава органов и тканей, поврежденных вследствие заболеваний, воздействия химических агентов, травм или возрастных дегенеративных изменений.
Одним из основных и наиболее часто встречаемых негативных типов воздействия на регенеративные процессы организма является лучевая и химиотерапии, применяемые в онкологической практике. Вследствие применения жесткого излучения или цитостатиков различной природы наряду с раковыми клетками погибают все активно пролиферирующие клетки, в том числе и стволовые. В частности, следствием такого воздействия является частичное или полное нарушение гемопоэза, что приводит к негативному прогнозу. Как известно, постэмбриональный гемопоэз представляет собой процесс физиологической регенерации крови, который компенсирует физиологическое разрушение дифференцированных клеток.
Особенно сильнорегенерирующий потенциал крови затрагивает высокодозная химиотерапия, которая без компенсирующего воздействия дает высокий процент токсической смертности. В настоящее время получил широкое применение метод высокодозной химиотерапии (ВДХТ) совместно с трансплантацией аутологичных клеток-предшественников гемопоэза. Единственным источником восстановления кроветворения являются гемопоэтические СК, находящиеся в костном мозге. Для процедуры аутотрансплантации стволовые клетки (CD34+) выделяют из костного мозга или периферической крови, замораживают в присутствии криостабилизатора (DMSO) и используют для восстановления кроветворной функции костного мозга, поврежденной радиацией или высокими дозами цитостатиков [8].
Предлагаемый способ лечения принципиально отличается от способа, основанного на воздействии медиаторных, колониестимулирующих молекул, являющихся факторами роста, стимулирующими активность стволовых клеток. Под активностью СКК следует понимать увеличение пролиферативного потенциала СКК, сохранение способности к дифференцировки и развитию конкретных видов клеток, и именно эти качества СКК регулируют факторы роста. Факторы роста включают колониестимулирующие факторы (КСФ), интерлейкины и ингибирующие факторы. Все они являются гликопротеинами с молекулярной массой около 20 КД и действуют и как циркулирующие гормоны и как местные медиаторы, регулирующие гемопоэз и дифференцировку специфических типов клеток. Действие факторов роста распространяется на СКК, колониеобразующие единицы (КОЕ), кометированные и зрелые клетки. Так, например, при уменьшении количества эритроцитов и соответственно снижения парциального давления кислорода (Po2) является сигналом для продукции эритропоэтина. Эритропоэтин действует на чувствительные к нему КОЕ-Э, стимулируя из пролиферацию и дифференцировки. Интерлейкины действуют на полипотентную СК, большинство КОЕ и иногда на терминально дифференцирующиеся клетки. Ингибирующие факторы дают противоположный эффект - тормозят гемопоэз. Их недостаток может быть одной из причин лейкимии, характеризующейся значительным увеличением числа лейкоцитов в крови. Выделен ингибирующий лейкимию фактор, который тормозит пролиферацию и дифференцировку моноцитов-макрофагов. Все указанные воздействия являются регуляторными и определяются медиаторными молекулами факторов роста, которые воздействуют на различные клеточные механизмы, запускающие или регулирующие процессы репликации хроматина и транскрипции различных белков, опосредующих метаболизм пролиферирующей и дифференцирующейся СКК. При этом факторы роста используются для восстановления гемопоэтической функции крови.
В случае лечения по предлагаемому способу происходит восстановление поврежденного хроматина СК и тем самым стволовая клетка становится в состоянии осуществлять полноценный митоз и отвечать на воздействие факторов роста. Коротко можно сказать, что если нечего стимулировать, то не помогут никакие факторы роста. В тот же самый момент при лечении по предлагаемому способу доставленные в ядерное пространство фрагменты экстраклеточной ДНК своими двуцепочечными концами создают иллюзию появления функциональных разрывов в хромосомах СКК, являющихся индуктором их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцировки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
Механизм возникновения и поддержания мутаций в СК, связанных с применением мутагенов, процессом старения, по нашему мнению, выглядит следующим образом.
Геномная ДНК любого организма подвержена мутагенному воздействию факторов внешней среды, таких как ионизирующее излучение, химические мутагены, так же как и внутренних факторов, включая ошибки репаративных систем клетки. Известный репаративный механизм клетки устраняет повреждения ДНК или неправильные замены нуклеотидов и ковалентно соединяет одноцепочечные и двуцепочечные разрывы (ОЦР, ДЦР) после мутационных событий [9]. В случае, когда повреждения затрагивают обе цепи ДНК и имеют заметную протяженность, репарация таких участков становится проблематичной и повреждения часто приводят к мутациям. ДЦР являются примером повреждений, которые практически невозможно исправить известным механизмом репарации, поскольку они затрагивают как хромосомную целостность, так и непосредственно целостность молекулы ДНК. Известен быстрый механизм репарации двухцепочечных разрывов, включающий использование клеткой белков KU70/KU-86 и ядерную ДНК зависимую протеинкиназу, которые объединяют концы ДНК и восстанавливают геномную целостность [10]. Невозможно восстановить нуклеотиды или короткие ДНК фрагменты, которые были утрачены при одновременных множественных разрывах молекулы ДНК. И как следствие таких потерь после восстановления целостности хромосомы возникают хромосомные аберрации, а ДЦР при этом выступают источником мутаций.
В современной онкологической практике широко применяются химические цитостатики и жесткое γ-облучение, нарушающие целостность двуцепочечной ДНК за счет алкилирующего воздействия в первом случае, и непосредственного воздействия лучей и действия возникающих при ионизации свободных радикалов - во втором. Множественные двуцепочечные разрывы, возникающие в ДНК при такого рода воздействиях, приводят к остановке синетических процессов в ядре и к нарушению клеточного цикла. В конечном счете включается программа самоуничтожения, и клетка либо подвергается апоптозу либо в ней возникают глубокие генетические изменения. Именно такие повреждения ДНК, возникающие во всех клетках организма и особенно в активно пролиферирующих приводят либо к гибели этих клеток либо к возникновению мутантных потомков.
К сожалению, вместе с раковыми клетками гибнут или мутируют и другие активно делящиеся клетки организма, такие как клетки эпителия, лейкоциты, стволовые клетки красного и белого кровяных ростков, клетки волосяных фолликул и другие. Наиболее опасным является уничтожение клеток крови, поддерживающих активный иммунный ответ организма. В ряде работ была высказана гипотеза о существовании естественного механизма, который может влиять на генетическую составляющую клетки многоклеточных организмов, используя внеклеточную геномную ДНК из биологических жидкостей как внешний геномный стандарт [11, 12]. Согласно предложенному механизму ДНК связывающие рецепторы, располагающиеся на клеточной поверхности, доставляют фрагменты геномной ДНК из внешней среды в ядро, где они замещают соответствующие гомологичные фрагменты в клеточной геномной ДНК через механизм гомологической рекомбинации.
Далее мы рассмотрим вопрос о том, каким образом могут быть использованы мутированные фрагменты ДНК из клеток, подверженных мутагенным воздействием в прогрессивном развитии мутационных изменений в организме.
Элементы оборота ДНК в организме, такие как внеклеточная ДНК кровяного русла, транспорт ДНК в ядро и соматическая гомологическая рекомбинация могут составлять суть механизма, способного удалять любые фиксированные или вновь образованные мутации из клеточного генома. Эффективность этого процесса в полной мере зависит от качества и свойств внешнего ДНК стандарта. С одной сторон, данный механизм может удалять мутации, замещая их экзогенными немутантными последовательностями; с другой стороны, указанный механизм может вводить мутации в клетку, замещая здоровые клеточные последовательности на мутантные экзогенные гомологичные фрагменты. Последние особенно применимо к ситуации, возникающей в организме сразу после воздействия сильного мутагенного агента. Известно, что химические мутагены так же как и жесткое облучение индуцируют апоптоз, вследствие чего идет выброс в кровь фрагментов ДНК с большим количеством разнообразных дефектов, включая летальные [13, 14].
Механизм транспорта ДНК доставляет все эти фрагменты в клетки, а ГР инкорпорирует их в клеточный геном. Далее, клетки, получившие ДНК фрагменты, несущие летальные мутации, погибают и последовательно выделяют свою геномную ДНК, содержащую мутантные последовательности, в окружающую среду. Клетки, которые получили ДНК, не несущие летальные мутации, выживают и далее могут составлять стартовую популяцию для селекции, например, ракового клона. Среди апоптозных фрагментов ДНК могут присутствовать такие, которые образовались в результате репарации без учета гомологии. Такие фрагменты будут содержать объединенные фрагменты ДНК из различных районов генома из одной или различных хромосом. Эти «химерные» фрагменты будут встроены в геном реципиентной клетки с учетом гомологии концевых участков фрагмента. Поскольку эти концы могут принадлежать разным участкам хромосомы или разным хромосомам, то рекомбинационные события могут привести к различным хромосомным аберрациям. Предполагается, что мутантные фрагменты ДНК клеток, подвергшихся воздействию сильного мутагена, будут повторно доставлены от погибших клеток к живым. Эти фрагменты будут индуцировать те же самые мутации и хромосомные аберрации в живых клетках и в ходе многочисленных раундов гибели клеток эти фрагменты будут распространять дефект, возникший при первичном воздействии мутагена.
Согласно существующих теоретических и экспериментальных предпосылок, на которых базируются наши рассуждения, если в кровяном русле организма, подвергающегося воздействию сильного мутагена или высокой дозы радиации, будут присутствовать здоровые фрагменты ДНК, составляющие весь геном, гомологичный геному реципиента, то они будут конкурировать системе оборота ДНК с фрагментами, выброшенными в кровь, в результате описанных выше событий после действие мутагена. Здоровые фрагменты будут являться субстратом для репаративной гомологической рекомбинации, протекающей в ядре, и их участие в репаративных процессах приведет к исправлению мутантных локусов и как следствие к появлению здоровой популяции соответствующей группы клеток. Препарат фрагментированной ДНК содержит в своем составе пул здоровых фрагментов специально обработанной ДНК человека, за счет которых идет прямое воздействие на поврежденный геном СК, приводящий с восстановлению целостности хромосом и восстановлению способности СКК осуществлять цепи последовательных митозов с последующей дифференцировкой.
Предлагаемый способ лечения, основанный на воздействии на СКК, можно применять при любом генетическом нарушении, исправляя его в пуле СКК, которые затем трансплантируются в тот же самый организм.
Эффект, достигаемый при использовании предлагаемого изобретения, может быть обоснован следующими теоретическими данными.
Каждая клетка организма имеет геномную ДНК, в которой закодирована информация как обо всех белках всех клеток организма, так и о пространственной организации генов в ядре, необходимой для корректной пространственно-временной экспрессии этих белков. В итоге геномная ДНК представляет собой матрицу жизни организма, включающую информацию как об организме в целом, так информацию о его развитии. Изначально геномная ДНК идентична во всех клетках организма. Однако по мере роста организма геномная ДНК каждой клетки подвергается мутационным воздействиям, вызванным факторами окружающей среды и ошибками, возникающими при клеточной репликации и репарации. Известно, что механизмы репарации замещают неправильные или ущербные основания ДНК и снова замыкают концы молекулы ДНК после одно- и двухзвенных разрывов (ДЦР) цепей сразу же после мутационных событий. Для этого в качестве матрицы они могут использовать вторую цепь ДНК. В случаях, когда участки поражения очень длинные и затрагивают обе цепи ДНК, репарация становиться проблематичной, а результатом нарушение может явиться мутация. Таким образом, мутагенные факторы окружающей среды и ошибки клеточной репарации и репликации являются источниками соматических мутаций в клетках. Наиболее важными для восстановительного потенциала организма являются плюрипотентные СК. Дефекты в структуре генома этих клеток влекут за собой возникновение дефектной ткани и формированию патологии. Единственным патогенетически обоснованным подходом к лечению заболеваний, связанных с генетическими нарушениями, в том числе и структуре генома СК, является изменение тем или иным способом генома этих клеток организма индивида и восстановления исходного, свойственного здоровой клетке генетического гомеостаза.
В современной экспериментальной медицине были разработаны многочисленные методы генной терапии, однако все они имеют серьезные недостатки и малоэффективны в рамках сложного эукариотического организма.
Классические методы генной терапии (gene-targeting, ген-таргетинг) направлены на исправление хромосомных мутаций, с использованием вирусных конструкций, способных эффективно ввести работающие копии генов в клеточный геном. Тем не менее, обеспечивая случайную встройку гена и регуляторных областей, эти подходы связаны с рядом проблем, включающих зависимость генной экспрессии от места интеграции, сайленсинг введенного вирусного генома и инсерционный мутагенез, ассоциированный с карциногенезом |15, 16]. Привлекательной альтернативой этим методам могла бы стать коррекция или замещение мутантного гена в составе хромосомы путем естественной гомологичной рекомбинации с доставленной в клетку ДНК матрицей, не содержащей мутации, если бы не чрезвычайно низкая эффективность метода, обнаруженная в ранних попытках его использования [17, 18] Исторически стратегия генного замещения (gene replacement), разработанная с целью преодоления проблемы инсерционного мутагенеза на дрожжах и позже на клетках млекопитающих, включала использование линейной рекомбинантной ДНК, в которой два конца гомологичны районам, фланкирующим замещаемый ген, а сам ген замещен селектируемым маркером [19]. Такой тип генного таргетинга называется «ends-out», поскольку концы конструкции соответствуют двум расходящимся (от целевого гена) последовательностям хромосомальной ДНК. При этом концы «ends-out» ген-таргетинг конструкции рекомбинагенны и облегчают замещение генной последовательности, заключенной между концевыми гомологиями. Недавно было показано, что у дрожжей при замещении целого гена гетерологичной последовательностью или замещении единственной мутантной пары оснований этим методом процесс инициируется двумя независимыми "strand invasions" (внедрение цепей), что подразумевает поиск гомологии и рекомбинационные события, осуществляемые двумя концевыми сегментами терапевтической конструкции [20]. Ранее подобный механизм был предложен для объяснения «ends-out» ген-таргетинга в клетках млекопитающих [21]. Соматическая ГР судя по тому, что она сохранилась в эволюции миллиарды лет от простейших до млекопитающих, должна очевидно выполнять абсолютно необходимую и универсальную во всех царствах живого функцию, и исполнять ее эффективно. Поскольку соматическая гомологическая рекомбинации (ГР) у одноклеточных дрожжей является основным механизмом прецизионной репарации ДЦР, ее эффективность должна быть очень высокой, чтобы обеспечить спасение индивида. Ранние эксперименты с микроинъекциями плазмид в клеточное ядро привели к открытию того, что плазмиды всегда интегрировали в клеточный геном в форме одного конкатемера, состоящего из всех (часто более ста) инъецированных плазмид, собранных в единую молекулу - хвост к голове, и что результатом этого была удивительно эффективная работа механизма ГР [22]. Причиной же низкой эффективности классического ген-таргетинга, предполагающего использование ГР в клетках млекопитающих, может служить несоответствие между задачей, ставящейся перед ГР, и ее свойствами и возможностями, отобранными эволюцией для исполнения ее собственной хотя и неизвестной функции. Данные, описанные в литературе, позволяют идентифицировать некоторые факторы, являющиеся критическими для работы ГР механизма.
Важным для эффективной работы механизма ГР является линейный размер доставленных к месту расположения рекомбинационного комплекса фрагментов ДНК. Так описан 100-кратный экспоненциальный рост эффективности ген-таргетинга при увеличении длины гомологии в корректирующей конструкции с 2 т.п.о до 14,5 т.п.о. и при этом достигнутая эффективность, 10-5 событий генной коррекции на клетку, оставалась все же недостаточной для применения метода без селекции [23]. Разительный контраст приведенным выше данным представляют результаты по использованию для коррекции мутантного гена коротких фрагментов гомологичной ДНК (SFHR, small fragments homologous replacement) с эффективностью исправления на клетку 1-20% [24]. Полученная в этих экспериментах эффективность ген-таргетинга может означать, что ГР предпочитает работать либо с короткими фрагментами либо формирует из коротких фрагментов при помощи лигирования фрагментов ДНК лигазой IV по типу голова-хвост мультимерные фрагменты, которые наиболее эффективны в использовании в рекомбинационных событиях.
Необходимым условием для получения рекомбинантного продукта в клетках млекопитающих является длина концевой гомологии фрагментов, которая составляет около 200 bp (пар оснований) [25, 26].
Принципиальным для осуществления ГР является линейная форма доставленных терапевтических ДНК как источника двуцепочечных концов. Кольцевые формы терапевтических плазмид практически не участвуют в гомологическом обмене. Генерация ДЦР и образование двуцепочечных концов молекулы ДНК локально активирует и усиливает хромосомальную и экстрахромосомальную рекомбинацию и ген-таргетинг [27]. Этот принцип был использован для индукции коррекции гена IL2R, точечная мутация в 5-ом экзоне которого вызывает смертельную наследственную болезнь, связанный с Х-хромосомой тяжелый комбинированный иммунодефицит (severe combined immunodeficiency, SCID). Путем трансфекции клетки генетическими конструкциями, экспрессирующими синтетические цинк-фингер нуклеазы, способные специфически расщепить последовательность вблизи мутации в гене IL2R в геномной ДНК клеток и плазмидой, содержащей немутантный фрагмент этого же гена, перекрывающий район SCID мутации, продемонстрировали высокий, до 20% уровень генной коррекции [28].
Можно полагать, что принципиально способность ГР очень эффективно осуществлять генную коррекцию связана с инициирующим началом появления в ядерном пространстве свободных двухцепочечных концов ДНК независимо будь то концы разорванной хромосомы, образовавшиеся в результате ДЦР, или двухцепочечные концы фрагментов ДНК, доставленных в ядро и являющихся типичными «ends-out» структурами. Любой немодифицированный фрагмент геномной ДНК, имея два конца, гомологичных двум последовательностям хромосомальной ДНК, и среднюю часть, способную заместить геномный фрагмент и соответственно исправить имеющуюся мутацию, представляет собой типичную «ends-out» конструкцию. Это означает, что концы фрагмента будут инициировать поиск гомологии и ГР с геномной ДНК, приводящую к замещению фрагмента геномной ДНК центральной частью фрагмента, доставленного из внешней по отношению к клетке среды. В условиях использования генетически корректной экзогенной ДНК эти события будут приводить к исправлению генетического дефекта [29].
Еще одним существенным моментом, по-видимому, влияющим на эффективность гомологической рекомбинации и исправления дефектных локусов хромосом, является обнаруженный несколькими группами ученых, но оставленный без достаточного внимания эффект "вскрытия генома", наблюдаемый в СК и других дифференцирующихся клетках при их вступлении на путь дифференцировки [30, 31, 32].
При исследовании активности рибозилтрансферазы было описано явление появления многочисленных одноцепочечных разрывов хроматина в дифференцирующихся клетках, появление которых предполагает вовлечение генетического материала в реорганизацию, которая является обязательной и неотъемлемой частью дифференцировки и последовательного изменения экспрессии генов. В различных тканях одного организма (одной персоны) обнаруживается различная организация генетического материала после реорганизации хроматина в результате произошедших одноцепочечных (или двухцепочечных) разрывов. Количество разрывов на гаплоидный геном дифференцирующихся клеток в разных работах оценивается несколькими сотнями (100-300 разрывов на галоидный геном). При этом показано, что это явление не является дефектом в системе репарации, а необходимый обязательный шаг в процессе терминальной дифференцировки клетки. Так, при индукции порядка 600 дополнительных разрывов в момент наибольшего количества имманентных разрывов в клетке, используя жесткое облучении клеток, скорость репарация этих 600 дополнительных разрывов была такая же, как и у клеток, не находящихся в стадии дифференцировки. При этом количество разрывов опустилось до исходного уровня. Важным для объяснения сути предлагаемого изобретения является обнаруженный факт, что в момент терминальной дифференцировки и возникновения разрывов хроматина количество перестроек в геноме возрастает очень существенно. Так показано, что уровень сестринских хроматидных обменов в 5-6 раз выше в предимплантационный период, то есть в то время, когда наблюдается реорганизация хроматина с выявлением функциональных разрывов хроматина. В течение первых трех митозов, когда обнаруживается драматическая реорганизация генома, также происходят и другие рекомбинационные события, такие как перетасовка минисателлитов и удлинение цепочки простых повторов. Предполагаемый механизм для такого рода обменов в геноме это - гомологическая рекомбинация. Тем не менее, во всех указанных событиях первый шаг - это появление функциональных разрывов в ДНК хроматина.
Можно полагать, что в присутствии в ядерном пространстве терапевтической фрагментированной ДНК в момент реорганизации хроматина в первые три митоза СК, происходит гомологическая рекомбинация между экстраклеточными экзогенными фрагментами терапевтической ДНК и ставшими доступными участками хроматина СК, при которой восстанавливаются дефектные локусы. Это приводит к спасению СК от гибели. При этом восстанавливаются исходные свойства стволовой клетки осуществлять цепь последовательных митозов и определять направление терминальной дифференцировки. В тот же самый момент доставленные в ядерное пространство фрагменты экстраклеточной ДНК своими двухцепочечными концами создают иллюзию появления функциональных разрывов в хромосомах СКК, являющихся индуктором их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцировки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
Поставленная техническая задача достигается тем, что в ее основе лежит разработанная теоретическая концепция оборота экстраклеточной ДНК в организме, подтвержденная многочисленными экспериментами. Ниже сформулированы основные положения концепции оборота экстраклеточной ДНК в эукариотическом организме.
Экстраклеточная фрагментированная геномная ДНК, содержащая мутантные последовательности в пропорциях, соответствующих встречаемости конкретных мутаций в клетках, образуется в результате программируемой клеточной смерти или апоптоза клеток организма и всегда присутствует в межклеточном пространстве и плазме крови [33, 34]. Клетки способны захватывать образующиеся фрагменты ДНК или хроматина рецепторопосредованным механизмом и транспортировать их в клеточные ядра [35, 36]. Доставленные фрагменты рекомбинируют с геномной ДНК в ядрах по механизму гомологической рекомбинации (ГР) и сами способны инициировать этот процесс. Можно предполагать, что в совокупности эти три процесса составляют механизм, способный контролировать генетику соматических клеток на организменном уровне, исправляя мутации или индуцируя генетические изменения в клетках, используя экстраклеточную ДНК тканевых жидкостей и плазмы крови как внешний геномный стандарт. Работа такого механизма могла бы служить основой геномного единства клеток организма. Этот механизм мог бы элиминировать возникшие и установившиеся мутации, а также внедрять мутации в клетки, используя мутантные последовательности экстраклеточного стандарта ДНК. В том случае, если бы механизм мог использовать стандарт ДНК, практически лишенный вредных мутаций, его работой было бы исключительно устранение мутаций из клеток тела. Поскольку аллельные гены обычно обладают высокой степенью гомологии и часто отличаются лишь относительно небольшими участками измененных последовательностей, другим аспектом работы предполагаемого механизма могло бы стать замещение последовательностей аллельных генов в хромосоме на альтернативные, подобно замещению мутантных последовательностей на немутантные.
Поставленная техническая задача так же достигается тем, что полный геном индивидуума вводится в организм в форме набора молекул полинуклеотидов определенной длины, являющихся фрагментами геномной ДНК, циркулирует и захватывается СК, попадает в ядро, где происходит его депонирование и гомологичная рекомбинация с геномной ДНК клетки в процессе реорганизации генома СК, сопровождающегося возникновением физиологических одноцепочечных разрывов. Таким образом, появляется возможность корректировать генетические дефекты, имеющиеся в СК путем введения в организм полного генома в форме молекул полинуклеотидов определенной длины, являющихся фрагментами геномной ДНК, не имеющей генетических дефектов.
В заявленном способе лечения используются препарат фрагментированной гомологической ДНК, представленной набором фрагментов, составляющих полный геном физиологически и генетически здорового индивида и находящихся в ассоциации с белками ядерного матрикса. Размер экзогенных фрагментов соответствует размеру фрагментов, циркулирующих в плазме крови пациента, возникающих в ходе апоптотического нуклеолиза (1-30 нуклеосомных единиц). В прототипах используются ксеногенный материал ДНК в смеси с молекулами РНК. Эта ДНК является неродственной, не находится в ассоциации с белками ядерного матрикса и не соответствует размеру естественной апоптозной ДНК организма, составляющей 1-30 нуклеосомных единиц.
Приведенные отличительные свойства заявляемого способа лечения на основе свойства СКК отвечать на воздействие препарата фрагментированной ДНК были исследованы на лабораторной линии мышей (in vivo). Заявляемый способ лечения с использованием свойства СКК отвечать на воздействие препарата фрагментированной ДНК был исследован на экспериментально выделенных столовых клетках человека (ex vivo).
Восстановление гемопоэза, спасение СКК и как следствие спасение мышей от гибели после летального облучения жестким излучением исследовалось на мышах (в системе in vivo). Была проведена серия экспериментов по исследованию защитного действия препарата фрагментированной ДНК при различных дозах облучения. Существуют ранние классические эксперименты, в которых смертельно облученным мышам (утратившим собственные кроветворные клетки) вводили взвесь клеток костного мозга или фракции обогащенной СКК. При этом в селезенке появлялись колонии клеток, потомки донорских СКК. Каждая СКК в селезенке образует одну колонию и называется колониеобразующей единицей селезенки. Пролиферативную активность модулируют колониестимулирующие факторы и интерлейкины. Подсчет колоний позволяет судить о количестве стволовых клеток, доставленных в кровоток инфузией. Таким образом было установлено, что на 105 клеток костного мозга приходится 50 СК, из селезенки 3,5 и среди лейкоцитов крови - 1.4 СК. Исследование очищенных СКК в электронном микроскопе позволяет считать, что СКК по своей ультраструктуре близки к малым темным лимфоцитам.
Исследование клеточного состава колоний селезенки позволило выявить две линии дифференцировки исследуемых СК. Одна линия дает начало мультипотентной клетке - родоначальнице гранулоцитарного, эритроцитарного, моноцитарного и мегакариоцитарного рядов гемопоэза (КОЕ-ГЭММ). Вторая линия дает начало мультипотентной клетке - родоначальнице лимфопоэза (КОЕ-Л).
Согласно рассматриваемой в настоящей заявке теоретической концепции в проведенных экспериментах наряду с интеграцией живых СК в лимфоидные органы и формированием колоний в селезенке другим воздействием, приводящим к таким же результатам, могло быть воздействие экстраклеточной ДНК, находящейся в интродуцированном образце СКК. Эта ДНК генетически соответствовала геному здоровых СКК и ее воздействие на поврежденные имманентные СК мышей могло приводить к восстановлению жизнеспособности СК за счет механизма гомологической рекомбинации, описываемого в настоящем изобретении. Мы проверили данное предположение в аналогичных условия, используя в качестве терапевтического агента либо ДНК, выделенную из мыши (аллогенную), либо препарат фрагментированной ДНК плаценты человека.
Материалы и методы.
В экспериментах использовали трехмесячных мышей-самок линии CBA/Lac разводки вивария Института цитологии и генетики СО РАН. Животных содержали в пластиковых клетках по 9-10 особей в каждой со свободным доступом к пище и воде. Мыши получали гранулированный корм ПК 120-1 (Лабораторснаб, Москва). Мышей облучали на γ-установке ИГУР-1 (Cs137). Проведено 4 эксперимента.
В первых трех экспериментах были испробованы различные дозы нуклеиновых кислот и ДНК различного происхождения (выделенная из органов мыши, плаценты человека).
Кроме того, варьировалось время введения относительно облучения (до/после).
Регистрировалась продолжительность жизни мышей в каждой группе.
В 4-ом эксперименте рассматривалось влияние ДНК плаценты человека на стволовые кроветворные клетки при введении мышам, облученным сублетальной дозой гамма-лучей. Поскольку костный мозг является радиочувствительной тканью, то при облучении гамма-лучами СКК гибнут. Предполагалось, что экзогенная ДНК, проникая в клетку и включаясь в репаративные процессы, позволяет СКК выжить. Сохранившиеся СКК мигрируют и заселяют лимфоидные органы, такие как лимфатические узлы, селезенку, тимус и т.п. Это способствует в дальнейшем восстановлению кроветворения и сохранению жизни мышей.
Эксперимент 1
Мышей облучали 9,6 Гр при мощности дозы 1,4 Гр/мин. 10 Мышам (с меткой) за 30 мин до облучения внутрибрюшинно ввели по 1 мг ДНК, выделенной из органов мышей СВА (2-я группа). Остальных мышей после облучения случайным образом разделили еще на 3 группы:
1-й группе через 30 мин после облучения и в последующие 2 дня вводили физиологический раствор внутрибрюшинно по 0,2 мл;
3-й группе вводили ДНК мышей СВА по 1 мг в 0,2 мл физраствора через 30 мин после облучения и в последующие 2 дня - по 0,5 мг;
4-й группе мышей аналогичным образом вводили ДНК из плаценты человека.
На фиг. 1 приведены данные о влиянии ДНК мыши и человека на выживаемость мышей после их γ-облучения в летальной дозе.
Эксперимент 2
Мышей облучили на гамма-установке (Cs137) дозой 9,5 Гр при мощности дозы 1,3 Гр/мин. Одной группе мышей (п=10) внутрибрюшинно вводили ДНК из органов мышей линии СВА: за 20 мин до облучения по 1 -2 мг, через 30 мин после облучения, а также через 24 ч и 48 ч после облучения - по 1/2 первоначальной дозы. Контрольной группе мышей вводили физиологический раствор в/б по 0,5 мл (по схеме ДНК).
На фиг. 2 приведены характеристики радиозащитного действия аллогенной ДНК при внутрибрюшинном введении мышам до и после летального γ-облучения.
Эксперимент 3
Мыши СВА  облучены на гамма-установке дозой 9,5 Гр (мощность дозы 1,3 Гр/мин). Контрольным мышам (n=10) за 10 мин до и через 30 мин после облучения, а также следующие 2 дня внутрибрюшинно вводили по 0,2 мл физиологического раствора. Препарат ДНК плаценты человека вводили за 20 мин до облучения по 1 мг; через 30 мин после облучения, а также через 24 ч и 48 ч после облучения - по 0,5 мг. Аналогично вводили ДНК мышей - либо только до облучения либо только после облучения.
облучены на гамма-установке дозой 9,5 Гр (мощность дозы 1,3 Гр/мин). Контрольным мышам (n=10) за 10 мин до и через 30 мин после облучения, а также следующие 2 дня внутрибрюшинно вводили по 0,2 мл физиологического раствора. Препарат ДНК плаценты человека вводили за 20 мин до облучения по 1 мг; через 30 мин после облучения, а также через 24 ч и 48 ч после облучения - по 0,5 мг. Аналогично вводили ДНК мышей - либо только до облучения либо только после облучения.
На фиг.3 приведена характеристика радиозащитного действия аллогенной ДНК при внутрибрюшинном введении мышам до и после летального γ-облучения.
Эксперимент 4
Мыши (n=20) линии СВА были облучены на гамма-установке дозой 800 Р (8,21 Гр). Опытной группе мышей (n=10) за 30 мин до облучения в/б ввели 1000 мкг фрагментированной ДНК плаценты человека через 30 мин после облучения еще по 500 мкг, на 2-й день - 250 мкг и на 3-й день после облучения ввели 170 мкг ДНК. Аналогично контрольным мышам (n=10) вводился физраствор по 0,2 мл. На 10-й день животные забивались и проводилось определение числа селезеночных кроветворных колоний.
Несмотря на малый объем выборки и высокую вариабельность признака в опытной группе, различия между данными выборками достоверны с вероятностью >0,95. В среднем число селезеночных колоний увеличилось в 18 раз при в/б введении ДНК по сравнению с контролем. Но этот процесс индивидуален: он либо протекает либо нет у каждой конкретной особи. Положительный ответ на введение ДНК наблюдается ˜ у 50% мышей (фиг.4).
Таким образом, введение мышам аллогенной ДНК и ксеногенной ДНК плаценты человека позволяет животным выжить при летальных дозах облучения, то есть специальным образом обработанная фрагментированная ДНК в составе с белками ядерного матрикса обладает ярковыраженным радиопротекторным действием. Такое выживание опытных животных связано с сохранением в результате воздействия препаратов ДНК жизнеспособности СКК, за счет чего происходит эндогенное колониеобразование в селезенке мышей. Разброс в индивидуальной чувствительности как в экспериментах по выживанию, так и в эксперименте по подсчету КОЕ-С, по-видимому, связан с тем, была ли доступна терапевтическая ДНК стволовым клеткам крови в тот момент, когда в клетке возникли функциональные разрывы, манифестирующие переход СК в фазу терминальной дифференцировки или нет.
Использование свойства СКК отвечать на воздействие препарата фрагментированной ДНК, определенная в заявленном способе лечения, было исследовано на экспериментально выделенных столовых клетках человека (ex vivo).
Чрезвычайно удобными объектами для изучения лечебно-восстановительных свойств препарата фрагментированной ДНК являются стволовые клетки костного мозга больных гемобластозами, поврежденные в результате лейкемизации костного мозга и проведения высокодозовой программной химиотерапии цитостатическими препаратами. Это диктуется тем, что СК способны, с одной стороны, давать начало всем росткам кроветворения, а с другой - поддерживать постоянство своего количественного и качественного состава без притока клеток извне. При этом механизм саморепродукции и дифференцировки клеток этой группы является одновременно и механизмом регуляции кинетического равновесия во всем пуле гемопоэтических клеток. При гемобластозах происходит глубокое нарушение базовых механизмов клеточного гомеостаза СК, причины которых как раз и определяются как наличием первичных генетических дефектов СК, вызывающих развитие злокачественных гемобластозов, так и вторичных повреждений их генетического аппарата, связанных с применением для лечения этой группы патологии высоких доз цитостатических препаратов.
Исходя из вышесказанного, цель настоящего исследования была сформулирована как изучение модулирующего влияния препарата фрагментировааной ДНК человека на пролиферативную активность мононуклеарных клеток и дифференцировку стволовых кроветворных клеток костного мозга больных гемобластозами, подвергнутых программной химиотерапии.
Основная задача данного этапа работы заключалась в оценке в ех vivo влияния экзогенной ДНК человека на различные функциональные параметры клеток костного мозга у больных гемобластозами, подвергнутых программной полихимиотерапии. Программа этапа исследования включала изучение действия препарата фрагментированой ДНК на пролиферативную активность мононуклеарных клеток костного мозга и генерацию гемопоэтических колоний стволовыми кроветворными клетками.
Результаты исследований
Объектом исследования являлись мононуклеарные клетки (МНК) костного мозга. Фракцию МНК получали из аспирата костного мозга методом сепарации на градиенте плотности фиколл-верографина (ρ=1,078 г/см3). Исследуемую группу составили 10 больных гемобластозами, получивших курсы ПХТ второй линии.
Забор костного мозга осуществляли путем трепанобиопсии, которую проводили во время планового диагностического обследования пациентов, после прохождения программной высокодозовой терапии цитостатическими препаратами. Трепанобиопсия костного мозга осуществлялась в специализированном отделении гематологии и трансплантации костного мозга Клиники иммунопатологии Института клинической иммунологии СО РАМН (таблица 2).
После биопсии костный мозг суспендировали в среде RPMI-1640 с 5% эмбриональной телячьей сыворотки (ЭТС). Для получения фракции МНК полученную суспензию наслаивали на градиент плотности фиколл-верографина, затем центрифугировали при 400 G 30 мин. Интерфазный слой, содержащий МНК, собирали и трижды отмывали средой RPMI-1640 с 5% ЭТС центрифугированием при 200 G по 10 мин. После последнего центрифугирования надосадочную жидкость замещали средой RPMI-1640, содержащей 20% ЭТС. Конечную концентрацию МНК доводили до 1 х 105 жизнеспособных клеток в 1 мл питательной среды.
МНК костного мозга, полученные от части больных, подвергали криоконсервации с использованием метода программного охлаждения клеток до -80°С в присутствии криостабилизатора (диметилсульфоксида). В дальнейшем криоконсервированные клетки хранились при температуре -80°С до момента использования, при этом срок хранения не превышал 2 месяца. Перед использованием клетки размораживались и трижды отмывались с помощью центрифугирования средой RPMI-1640 с 5% ЭТС. После ресуспедирования осадка концентрация жизнеспособных мононуклеаров (МНК), как и в случае нативных костномозговых клеток, доводилась до 1×105 клеток в 1 мл полной питательной среды.
Проведем оценку влияния препарата экзогенной фрагментированной ДНК человека на пролиферативную активность мононуклеарных клеток костного мозга.
Моделью для изучения влияния экзогенной ДНК на митотическую активность МНК является оценка интенсивности их пролиферации. Оценка пролиферативной активности мононуклеаров костного мозга проводилась в тестах спонтанной и индуцированной пролиферативной активности с использованием стандартной техники. В качестве индуктора пролиферации МНК костного мозга использовали анти-СD3 моноклональные антитела. Инкубированные с фрагментированной ДНК (опыт) и неинкубированные с экзогенной фрагментированной ДНК клетки (контроль) исследовали в триплетах. Активность пролиферации тестировалась на 3-и сутки культивирования в 96 луночных планшетах для иммунологических реакций. Интенсивность клеточной пролиферации оценивали по включению в ДНК пролиферирующих клеток Н3-тимидина. Активность пролиферации выражали в количестве импульсов в минуту (имп/мин).
Результаты изучения влияния экзогенной фрагментированной ДНК на спонтанную и стимулированную анти-СD3 моноклональными антителами пролиферацию представлены в табл. 3 и 4. Как следует из полученных данных, после 1-часовой преинкубации с ДНК наблюдается значительное снижение митотической активности мононуклеаров костного мозга (р<0.05). При этом важно отметить, что данный феномен регистрируется не только в условиях дополнительной стимуляции пролиферативной активности анти-CD3 моноклональными антителами, но и наблюдается в отношении показателя спонтанной митотической активности МНК, обогащенных гемопоэтическими предшественниками. Исходя из рассчитанного индекса влияния (ИВ), характеризующего изменение, интенсивность пролиферации клеток в "опыте" относительно "контроля", уровень митотической активности мононуклеаров костного мозга после обработки экзогенной ДНК снижается примерно в 4 раза и составляет не более 30% (14-35%) от ее исходного уровня у больных гемобластозами.
индекс влияния ДНК.
Таким образом, полученные нами результаты свидетельствуют об активном, четко выраженном влиянии экзогенной ДНК на пролиферативный статус мононуклеаров костного мозга, в том числе и стволовых гемопоэтических клеток.
Переходя к обсуждению полученного результата, будем исходить из хорошо известного механизма самоподдержания пула СК, который заставляет определенное в единицу времени число покоящихся стволовых клеток приступать к дифференцировке без деления в направлении специфических гемопоэтических элементов - коммитированных предшественников эритроидного, ганулоцитарно-макрофагального и прочих ростков кроветворения. Дифференцировка, в свою очередь, вызывает "возбуждение" в таком же (в единицу времени) числе покоящихся клеток. "Возбужденные" клетки переходят из фазы G0 в митотический цикл и не способны к дифференцировке, пока не завершат деление. После деления дочерние клетки входят опять в фазу G0, пополняя собой группу клеток, потенциально способных как к дифференцировке, так и к возвращению в митотический цикл. Эти базовые механизмы при гемобластозах нарушаются, вследствие чего наблюдается неконтролируемая пролиферация злокачественно измененных клеток гемопоэза, которые не способны к нормальной дифференцировке.
В то же время количество включенного в клетки меченого тимидина характеризует долю делящихся клеток в данный момент времени, то есть, по сути, отражает число активных - "возбужденных" стволовых клеток, находящихся в митотическом цикле и не способных к дифференцировке. Следовательно, значительное снижение митотической активности мононуклеаров костного мозга при их обработке экзогенной ДНК позволяет предполагать изменение (увеличение) пропорции стволовых клеток, находящихся в состоянии покоя (G0-фазе митотического цикла), которые становятся способны к дифференцировке в сторону коммитированных специфических гемопоэтических элементов. Такое успокоение СК связано с воздействием препарата Панагенум на генетические локусы хромосом клеток, прошедших раковое перерождение. При этом, как было показано в нашем другом изобретении [37], механизм данного явления может быть связан с замещением мутантных локусов хромосом на немутантные, в процессе которого злокачественно метаплазированные клетки теряют полностью или частично статус злокачественно перерожденных.
Проверка данного предположения может быть осуществлена на основе оценки изменений дифференцировки стволовых гемопоэтических клеток, содержащихся во мононуклеарной фракции костного мозга.
Проведем оценку влияния экзогенной фрагментированной ДНК человека на дифференцировку стволовых кроветворных клеток костного мозга.
Моделями для изучения дифференцировки гемопоэтических стволовых клеток может служить метод образования эритроидных и гранулоцитарно-макрофагальных колоний на полужидкой среде [38, 39]. С помощью хромосомных маркеров было показано, что клетки одной колонии развиваются из единственной клетки-предшесвенницы. При этом возможность получения вторичных колоний данного типа при перенесении первичной эритроидной или гранулоцитарно-макрофагальной колонии на новую среду свидетельствует о том, что источником развития колоний in vitro являются коммитированные стволовые гемопоэтические клетки [40].
Таким образом, число вырастающих колоний на полужидкой среде, с одной стороны, характеризует общее число стволовых клеток, способных дифференцироваться в направлении коммитированных специфических гемопоэтических элементов, а с другой - характеризует направленность такой дифференцировки, о чем можно судить по соотношению гемопоэтических колоний различного типа.
Обусловленное препаратом фрагментированной ДНК изменение митотической активности может по-разному отразиться на способности к дифференцировке стволовых клеток в направлении эритроидного и гранулоцитарно-макрофагальных ростков кроветворения. Это, в частности, определяется тем, что по своей естественной митотической активности коммитированные предшественники эритропоэза существенно отличаются от других коммитированных предшественников. Если в общем пуле предшественников ДНК синтезирует всего 10% стволовых клеток, то среди коммитированных эритропоэтинчувствительных элементов их доля составляет более 75%. Нахождение основной части эритропоэтинчувствительных клеток в митотическом цикле позволяет предполагать, что изменение пролиферативной активности мононуклеаров костного мозга при действии экзогенной ДНК может прежде всего сказаться на повышении числа коммитированных стволовых клеток, дифференцирующихся в направлении эритропоэза [41].
Проведем оценку влияния экзогенной фрагментированной ДНК человека на формирование эритроидных колоний.
Для культивирования и подсчета функционально активных стволовых гемопоэтических клеток, способных к дифференцировке в эритроидном направлении, использовали полужидкие среды, приготовленные на основе метилцеллюлозы с добавлением эритропоэтина (ЭП), рекомбинантного интерлейкина 3 (ИЛ-3), а также ряда дополнительных индукторов пролиферации и дифференцировки эритроидных клеток [42].
При проведении данного этапа исследования были использованы только криоконсервированные мононуклеары костного мозга. Размороженные и отмытые, как описано выше, делили на 2 аликвоты. В опытной серии мононуклеары (МНК) костного мозга в течение 1 часа проинкубировали при 37°С с экзогенной ДНК, которая добавлялась в инкубационную смесь в дозе 100 мкг/мл. В контроле вместо ДНК в соответствующем количестве добавляли среду для культивирования клеток. После окончания преинкубации МНК без отмывания, в количестве 1×10 жизнеспособных CD34+ клеток вносили в полужидкую среду для культивирования и помещали в 24-луночные планшеты в дозе 0,25 мл на лунку (0,25×10 клеток/мл). Инкубированные с фрагментированной ДНК (опыт) и неинкубированные с ДНК клетки (контроль) исследовали в тетраплетах (4 лунках), суммарно содержащих 1×10 мононуклеаров костного мозга. Планшеты культивировали в CO2 инкубаторе (37°С) при 100% влажности, в течение 8-14 суток. Оценку числа эритроидных колоний проводили в динамике и фиксировали на 8 и 14 сутки культивирования. К эритроидным колониям (БОЕ-Э) относили образовавшиеся в процессе культивирования клеточные агрегаты, содержащие более 100 эритроидных элементов различной степени зрелости или группы (до 50 клеток) небольших рядом расположенных клеток с характерными для эритроидных элементов морфологическими признаками.
Результаты подсчета количества эритроидных колоний на 8 и 14 сутки, в виде диапазона колебаний числа выросших колоний в лунках тетраплета для каждого исследованного пациента представлены в таблицах 5, 6.
Как следует из результатов исследования, количественно охарактеризованных в таблицах, после преинкубации МНК с экзогенной ДНК регистрируется значительное, статистически достоверное увеличение числа генерируемых эритроидных колоний (р<0.001). При этом наиболее демонстративно повышение числа эритроидных колоний после обработки препаратом фрагментированной ДНК определяются на ранних сроках - на 8 сутки культивирования, когда возрастание числа формирующихся эритроидных колоний в опыте превышает количество таковых в контроле в 3-4 и более раз.
Таким образом, фактура полученных данных в определенной мере подтверждает предположение о стимулирующем влиянии экзогенной ДНК на способность СКК к дифференцировке в эритроидном направлении. Вместе с тем, учитывая, что резкое возрастание числа эритроидных колоний у больных после перенесенной высокодозовой химиотерапии происходит на ранних сроках культивирования, можно полагать, что действие экзогенной ДНК не исчерпывается влиянием на митотический цикл, но определяется и другими механизмами.
Одним из таких механизмов может быть участие экзогенной ДНК в репарации поврежденного цитостатическими препаратами генетического аппарата стволовых клеток. Исходя из результатов проведенного исследования, участие экзогенной ДНК в репарации гененома стволовых клеток может предполагаться по меньшей мере в 2 из 5 исследованных образцов мононуклеаров костного мозга (40%), когда на фоне практически полного отсутствия образования эритроидных колоний в «контроле» после преинкубации с фрагментированной ДНК происходит восстановление способности стволовых клеток дифференцироваться в эритроидные предшественники.
Таким образом, при использовании модели эритроидного колониеобразования действие препарата фрагментированной ДНК человека на поврежденные гемопоэтические предшественники в 40% случаев носит не количественный, а качественный характер, который с высокой степенью вероятности опосредован включением экзогенной ДНК в генетический аппарат стволовой клетки.
К другим косвенным признакам включения экзогенной ДНК в геном стволовых клеток могут быть отнесены морфофизиологические особенности формирующихся после преинкубации с препаратом фргаментированной ДНК человека эритроидных колоний. Так, в процессе регистрации результатов исследования было отмечено, что в «опытных» лунках планшетов по сравнению с «контрольными» начинают преобладать незрелые - BFU-E эритроидные колонии (70 - 90%). Формирование последних характерно для молодых высокоактивных стволовых клеток, нетипичных для исходных стволовых предшественников, полученных от больных гемобластозами после проведения программной терапии цитостатическими препаратами (<5-10%).
Недостатком модели эритроидного колониеобразования является невозможность анализа сложных конкурентных взаимоотношений между различными ростками кроветворения, в процессе которых стволовые клетки костного мозга могут не только существенно изменять характер своей дифференцировки, но и выраженность ответа на различные регуляторно-восстановительные воздействия. С учетом данного обстоятельства на следующем этапе исследования эффектов препарата фрагментированной ДНК нами была использована более сложная модель изучения функционального состояния стволовых клетки - модель одновременного культивирования эритроидных и гранулоцитарно-макрофагальных колоний.
Проведем оценку влияния экзогенной фрагментированной ДНК человека на одновременное формирование эритроидных и гранулоцитарно-макрофагальных колоний.
Для одновременного изучения дифференцировки коммитированных стволовых предшественников в эритроидные и гранулоцитарно-макрофагальные элементы использовали полную коммерческую метилцеллюлозную среду MethoCult ® H 4434 (Stem Cell Technology, Canada, Cat №04434). Полная метилцеллюлозная среда H 4434 содержит более широкий набор факторов роста. Помимо эритропоэтина (ЕРО) и интерлейкина-3 (IL-3) в полной среде содержится фактор роста стволовых клеток (SCF), интерлейкин-6 (IL-6), фактор роста гранулоцитарно-макрофагальных клеток (GM-CSF) и другие биологически активные компоненты, поддерживающие пролиферацию и дифференцировку коммитированных стволовых предшественников.
Исследования проведены в 4-х сериях экспериментов, на МНК, выделенных из костного мозга больных гемабластозами, после проведения курсов программной цитостатической терапии. Техника проведения эксперимента и концентрация мононуклеаров костного мозга в «опыте», то есть после 1-часовой преинкубации клеток с препаратом фргаментированной ДНК человека и «контроле», были идентичны таковым при изучении дифференцировки коммитированных предшественников в эритроидные клетки (см. предыдущий раздел). Отличие состояло лишь в том, что кроме размороженных криоконсервированных клеток для изучения формирования эритроидных и гранулоцитарно-макрофагальных колоний использовались также и свежевыделенные МНК.
Гранулоцитарно-макрофагальные (КОЕ-ГМ), эритроидные (БОЕ-Э) и колонии смешанного типа, то есть колонии, содержащие клеточные элементы обоего типа (КОЕ-ГЭММ), идентифицировали и подсчитывались под микроскопом по завершении 14-дневной инкубации при температуре 37°С, во влажной атмосфере, содержащей 5% CO2.
Результаты подсчета числа коммитированных стволовых клеток, формирующих колонии различного типа, суммированы в таблице 7. Существенные отклонения числа формируемых гемопоэтических колоний после обработки мононуклеаров экзогенной ДНК помечены надстрочными знаками «+» и «-», соответственно маркирующих случаи повышения и снижения показателей в «опыте» относительно величины «контроля».
Как следует из полученных данных, в присутствии экзогенной ДНК достоверное 2-3-кратное увеличение общего количества формируемых колоний как эритроидного, так и гранулоцитарно-макрофагального типа, наблюдается только при использовании размороженных криоконсервированных клеток костного мозга, характеризующихся исходно низким количеством колониеобразующих клеток. Это подтверждает ранее сделанное нами предположение о возможном участии экзогенной ДНК в процессах восстановления дефектов, являющихся следствием не только ПХТ, но и процедуры криоконсервации стволовых предшественников костного мозга. Последнее, учитывая широкое применение криоконсервированных стволовых клеток при лечении не только гематологических, но и многих других заболеваний, представляет не только научный, но и большой практический интерес. В этом плане фрагментированная экзогенная ДНК человека в комплексе с белками ядерного матрикса может рассматриваться как новый перспективный препарат для увеличения числа функционально активных стволовых клеток после их криоконсервации, имеющий очевидную патентоспособность.
Эффекты влияния препарата фрагментированной ДНК человека на свежевыделенные стволовые клетки более сложны для интерпретации. Вместе с тем, как видно из результатов исследования, экзогенная ДНК исследуемого препарата, без сомнения, оказывает влияние на дифференцировку стволовых клеток. Это проявляется в избирательном, конкурентном увеличении/снижении коммитированных предшественников, участвующих в формировании эритроидных (БОЕ-Э) или гранулоцитарно-макрофагальных (КОЕ-ГМ) колоний, а также повышении числа незрелых стволовых предшественников, образующих гемопоэтические колонии смешанного типа (КОЕ-ГЭММ).
Любая клеточная дифференцировка - это глубокие изменения всего генома клетки, при котором происходит выбор пути специфического развития плюрипотентной клетки.
Выявленные феномены могут рассматриваться как косвенное свидетельство активного участия экстраклеточной экзогенной ДНК в генезе стволовых клеток крови.
Для реализации предложенного способа приведем пример расчета необходимого количества препарата фрагментированной ДНК для создания в плазме крови и интерстициальных жидкостях человека диапазона концентрации, равной или превышающий собственно ДНК плазмы крови, но не более 1500 нг/мл.
Известно, что основное количество свободно циркулирующей жидкости организма численно складывается из объема крови 5-6 л (1/10-12 от массы тела человека) и объема лимфы 1/5-6 от объема крови или 1-2 л. Следовательно, общее количество свободно циркулирующей жидкости в организме взрослого человека 6-8 л. Максимальное количество препарата фрагментированной ДНК, которую без видимого и срытого ущерба для организма можно ввести пациенту, составляет 9 мг. При этом минимальное терапевтическое количество препарата составляет 0,06 мг.
Источники информации
1. [U.S, No. 5,795,972, 18.08. 1998].
2. [US, No. 5,955,059, 21.09.1999]
3. [US, No. 5,470,577, 28.11. 1995].
4. http://www.polidan.ru; per. №95/292.8; per. №000552/01-2001.
5. Orkin S.H., Morrison S.J. Stem-sell competition. Ibid. 2002.V. 418. #. 6893. P.25-27.
6. Bedada F.B. Technau A., Ebelt Y., Schulze M., Beaun T. Activation of myogenic differentiation pathways in adult bone marrow-derived stem cells. Moll. Cell. Biology. 2005. V.25. №21. P.9509-9519
7. Kues W.A., Petersen В., Mysegades W., Camwath J.W., Niemann H. Isolation of murine and porcine fetal stem cells from somatic tissue. Biology ofreprodaction. V.72. 1020-1028. 2005.
8. Blume K.G., Thomas E.D. A review of autologus hematopoietic cell transplantation. American Society for blood and marrow transplantation. 2000. P.1-12.
9. Hoeijmakers J.H. Genome maintenance mechanisms for preventing cancer // Nature. 2001. V.411. P.366-374.
10.Pfeifer P. The mutagenic potential of DNA double-strand break repair // Toxicol. Lett. 1998. 96. 97. V.119. P.119-129.
11. Yakubov, L.A., Petrova N.A., Popova K.A., Semenov D.V., Nikolin V.P., Oskina I.N. Role of extracellular DNA in maintaining of stability and variability of cellular genomes. Doklady Biochemistry and Biophysics 382, 31-34, (2002).
12. Yakubov J.A., Popova N.A., Nikolin, D.V.Semenov, S.S.Bogachev and I.N.Oskina. Extracellular genomic DNA protects mice against radiation and chemical mutagens // Genom Biol. 2003.V.5. P.3.
13. Leon S.A., Shapiro В., Sklaroff D.M., Yaros M.J. Free DNA in the serum of cancer patients and the effect of therapy // Cancer Res. - 1977. - Vol.37. - P. 646-650.
14. Nikolin V.P., Kaledin V.I., Matienko N.A., Gruntenko E.V. Cis-Diamminedichloroplatinurn (II) as a potential chemotherapeutic agent against neoplastic lesions in the liver. J. Clinical Hemat. Oncol. 1979. Vol.9. - P.198-207.
15. Khon, D.В., Sadelain M., Glorioso J.C. Occurrence of leukaemia following gene therapy of X-linked SCID. Nature Rev. Cancer, 477-88 (2003).
16. Persons D.A., Nienhuis, A.W. Gene therapy of hemoglobin disorders. Hematol. Rep. 2, 348-355 (2003).
17. Yanez R.J., Porter., ACG. Therapeutic gene targeting. Gene therapy. 5, 149-159 (1998).
18. Rothstein R.J. One-steplgene disruption in yeast. Methods Enzymol. 101:202-11 (1983).
19. Thomas K.R., Capecchi M.R. Site-directed mutagenesis by gene targeting in mouse embryo-derived stem cells. Cell. 1987, 51(3): 503-12.
20. Langston LD, Symingtom LS. Gene targeting in yeast is initiated by two independent strand invasions. Proc NM Acad Sci USA. 2004, 101(43): 15392-7.
21. Li J., Read L.R., Baker M.D. The mechanism of mammalian gene replacement is consistent with the formation of long regions oi heteroduplex DNA associated with two crossing-over events. Mol Cell Biol 2001 Jan; 21(2): 501-10.
22. Capecchi M. Generating n\ice with targeted mutations. Nature Medicine 7, 1086-1090 (2001).
23. Deng С. and Capecchi M. K. Reexamination of gene targeting frequency as a function of the extent of homology between the targeted vector and the target locus. Mol. Cell Biol. 12.3365-3371 (1992).
24. Gruenert D., Bruscia E., Novelli G., Colosimo A., Dallapiccola В., Sangiuolo F., Goncz K. Sequence-specific modification ofgenomic DNA by small DNA fragments. Clin. Invest. 112, 637-641 (2003).
25. Lin Y., Lukacsovich Т., Waldman A.S. Multiple pathways for repair of DNA double-strand breaks in mammalian chromosomes. Mol. Cell Biol. 19, 8353-60 (1999).
26. NassifN., Engels W. DNA homology requirements for mitotic gap repair in Drosophila. Proc. Nail, Acad. Sci. USA 1993 Feb 15; 90 (4): 1262-6.
27. Kucherlapati R.S., Eves Е.М., Song K.Y., Morse B.S., Smithies O. Homologous recombination between plasmids in mammalian cells can be enhanced by treatment of input DNA. Proc NatlAcadSci USA. 81, 3153-7 (1984).
28. Urnov F.D., Miller J.C., Lee Y.L., Beausejour C.M., Rock J.M., Augustus S, Jamieson A.C., Proteus M.H., Gregory P.D., Holmes M.C. Highly efficient endogenous human gene correction using designed zinc-finger nucleases. Nature 435, 646-51 (2005).
29. Yakubov L., Popova N., Nikolin V., Semenov D., Bogachev S., Oskina I. Extracellular genomic DNA protects mice against radiation and chemical mutagens. Genome Biology, 2003,5:P3
30. Farzaneh F., Zaiin R, Brill D., Shall S. DNA strand breaks and ADP-ribosyI tranferase activation during cell differentiation. Nature. V. 300. P.362-366.
31. Johnstone A.P., Williams G.T. Role of DNA breaks and ADP-ribosil transferase activity in eukaryotic differentiation demonstrated in human lymphocytes. Nature. V.300. P.368-370.
32. Vatolin A.Y., Okhapkina E.V., Matveeva N.M., Shilov A.G., Baiborodin S.I., Philimonenko V.V., Zhdanova N.S., Serov O.L. Scheduled perturbation in DNA during in vivo differentiation of mouse embryo-derived cells. Mol. Reprod. Develop. V.47. P.1-10. 1997.
33. Anker P, Mulcahy H, Chen XQ, Stroun M. Detection of circulating tumour DNA in the blood (plasma/serum) of cancer patients. Cancer Metastasis Rev. 18, 65-73 (1999).
34. Giacona M.B. Ruben G.C., Iczkowski K. Roots Т., Porter D., Sorenson G. Cell-free DNA in human blood plasma: length measurements in patients with pancreatic cancer and healthy controls // Pancreas. 1998. V.17. P.89-97.
35. Yakubov, L.A., Deeva, E.A., Zarytova V.F., Ivanova E.M., Ryte A.S., Yurchenko L.Y., Vlassov V.V. Mechanisms of oligonucleotide uptake by cells: Involvement of specific receptors? Proc. Nail. Acad. Sci. USA 86, 6454-6458, (1989).
36. Шестова О.Е., Андреева А.Ю., Власов В.В. Якубов Л.А. Транспорт комплексов олигонуклеотидов с белками клеточной поверхности в клеточное ядро // ДАН. 1999. Т.368. С.264-267.
37. 3аявка на изобретение №2006100561.
38. Pluzniik D.H., Sachs L. The cloning of normal "mast" cell in tissue culture. J. cell. сотр. Phisiol. - 1965. - V.66. - P.319.
39. Bradley T.R., Metcalf D. The growth of mouse bone marrow cell in vitro." Aust. J. exp. Biol. med. Sci. - 1966. - V.44. - P.287.
40. Metcalf D., Foester R. Behavior on transfer of serum stimulated bone marrow colonies. Proc. Soc. exp. Biol. - 1967. - V.126. - P.758.
41. Lajtha L.G., Schofield R. Proliferative capacity ofhemopoietic stem cells. - In: Sympos. on normal and malignant cell growth: New York. - 1969. - P.10.
42. Гольдберг Е.Д., Дыгай A.M., Шахов В.М. // Методы культуры ткани в гематологии: Изд-во Томского гос. университета. - Томск, 1992. - 272 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2345792C2 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2313349C2 |
| Биомедицинский клеточный продукт для лечения онкологических, нейродегенеративных, аутоимунных заболеваний и травм головного и спинного мозга | 2021 |
|
RU2798554C2 |
| Персонализированный способ реституции костного мозга для борьбы с прогрессированием и рецидивами различных болезней цивилизации, профилактики старения и внезапной смерти | 2023 |
|
RU2817892C1 |
| СПОСОБ ДЕТЕКЦИИ СТВОЛОВЫХ РАКОВЫХ КЛЕТОК | 2013 |
|
RU2530170C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТИМУЛИРОВАННЫХ ДЕНДРИТНЫХ КЛЕТОК ДЛЯ ИНДУКЦИИ ИММУННОГО ОТВЕТА ПРОТИВ ТУБЕРКУЛЕЗА ЧЕЛОВЕКА | 2009 |
|
RU2401664C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2490028C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2008 |
|
RU2387456C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2429019C2 |
| СПОСОБ ЭРАДИКАЦИИ СТВОЛОВЫХ ИНИЦИИРУЮЩИХ РАКОВЫХ КЛЕТОК | 2013 |
|
RU2542410C1 |
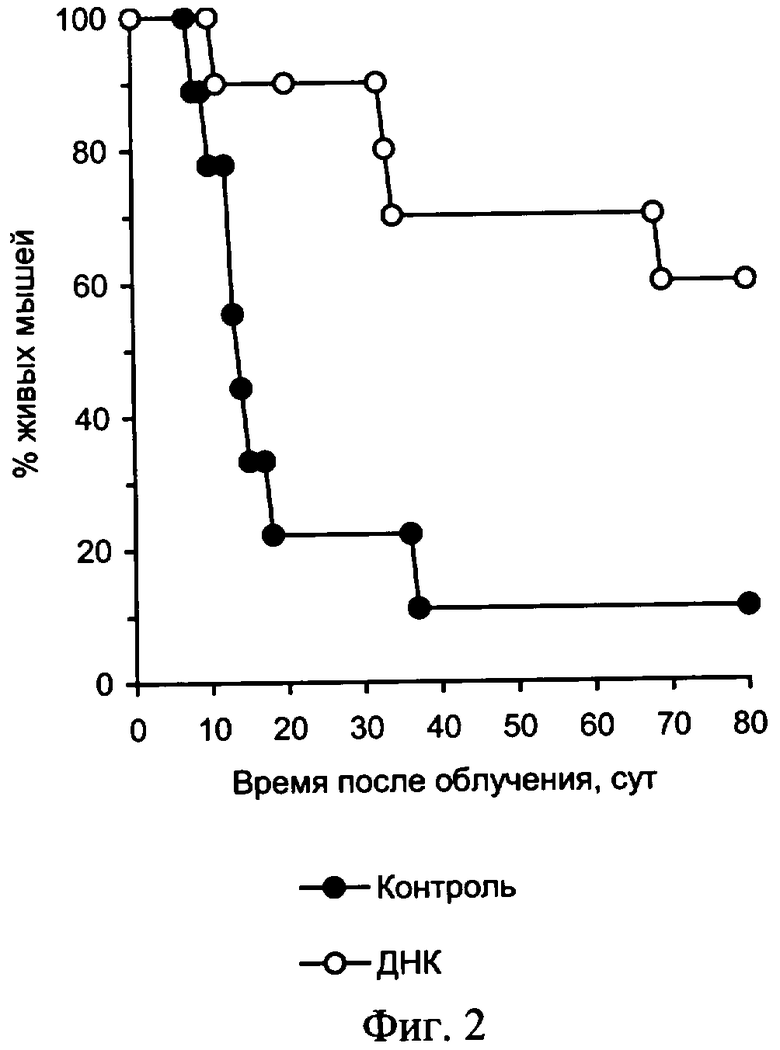
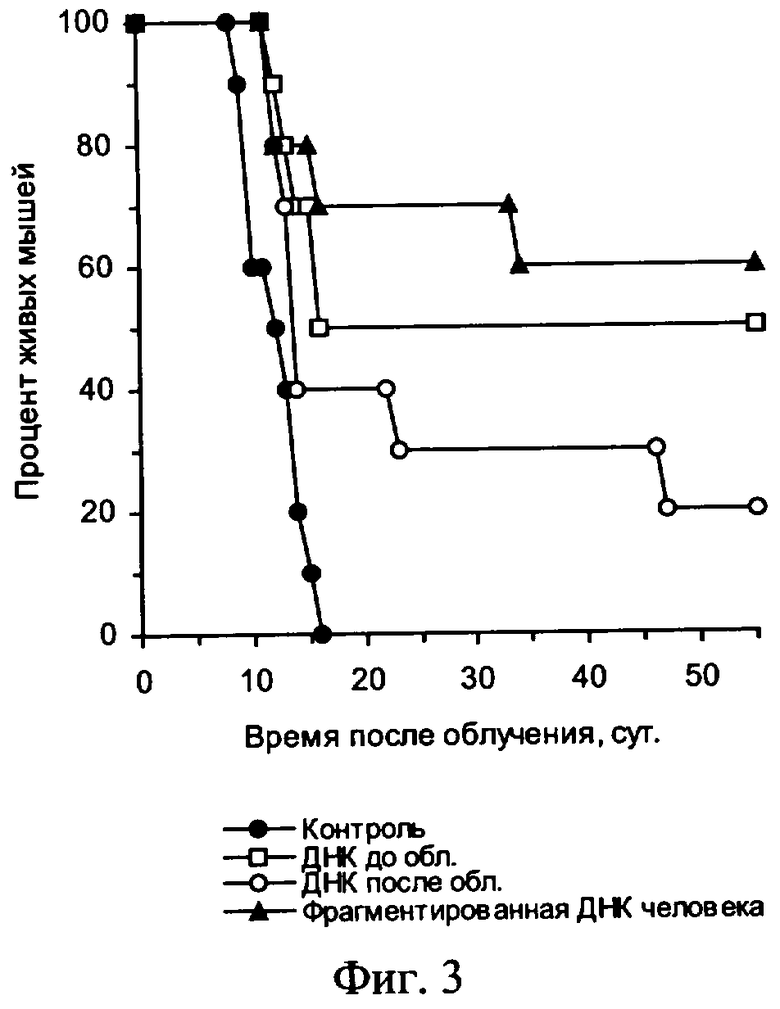
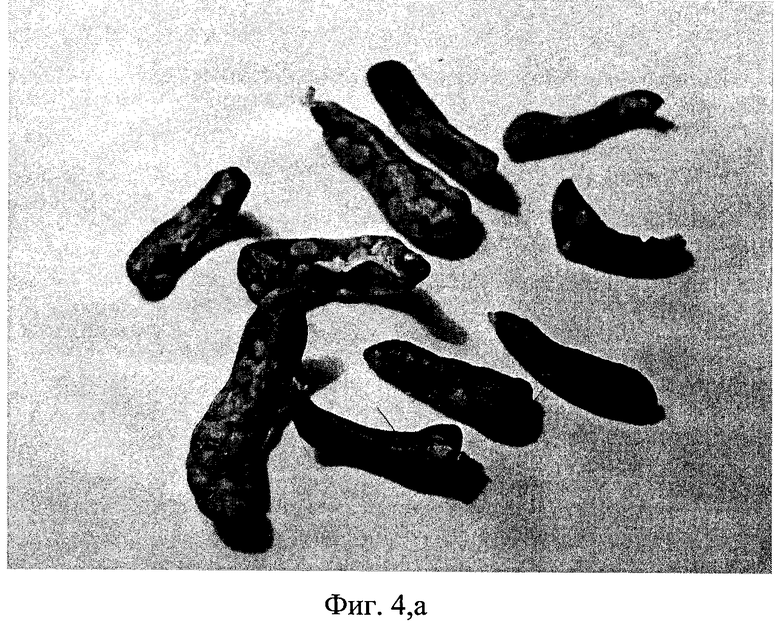
Изобретение относится к медицине, в частности к методам лечения нарушений гемопоэза, связанных с дефектами хромосом и последующей гибелью стволовых клеток крови (СКК) при терапии цитостатиками или высокими дозами радиации, лечения заболеваний, связанных с нарушением механизмов дифференцировки СКК. Способ основан на введении в организм пациента фрагментированной ДНК, которая является аллогенной, получена от генетически и физиологически здоровых доноров и состоит из фрагментов, длина которых соответствует 1-10 нуклеосомным единицам, составляющих полный геном пациента, в ассоциации с белками ядерного матрикса. Вводят такое количество фрагментированной ДНК, чтобы достичь концентрации фрагментированной ДНК в плазме крови пациента, равной или превышающей концентрацию собственной ДНК плазмы крови, но не более 1500 нг/мл. Способ позволяет восстанавливать ДНК пациента путем замещения мутантных участков хромосом - гомологической рекомбинации и обеспечивает расширение области применения препарата фрагментированной ДНК. 4 ил., 7 табл.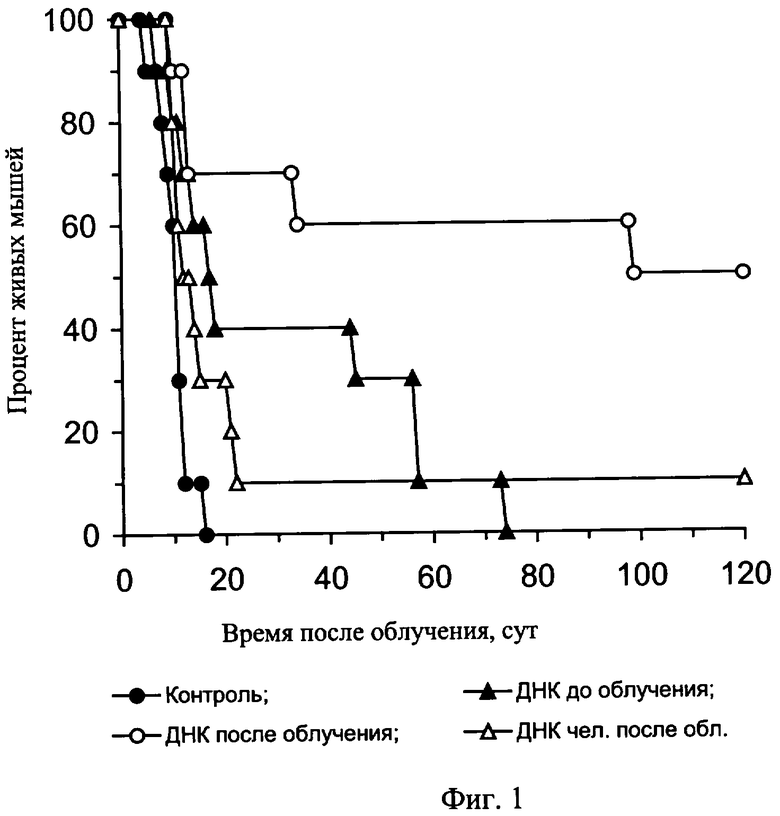
Способ лечения заболеваний, основанный на введении в организм пациента фрагментированной ДНК, отличающийся тем, что фрагментированная ДНК является аллогенной, получена от генетически и физиологически здоровых доноров и состоит из фрагментов, длина которых соответствует 1-10 нуклеосомным единицам, составляющих полный геном пациента, в ассоциации с белками ядерного матрикса, при этом вводят такое количество фрагментированной ДНК, чтобы достичь концентрации фрагментированной ДНК в плазме крови пациента, равной или превышающей концентрацию собственной ДНК плазмы крови, но не более 1500 нг/мл.
| YAKUBOV L.A | |||
| et al | |||
| Extracellular cenomic DNA protects mice against radiation and chemical mutagens// Genome Biology, 2003; 5:P3, он-лайн [Найдено в Интернет на http://genomebiology.com/content/pdf/gb-2003-5-2-p3.pdf ] [найдено 26.04.2007], см | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ПРЕПАРАТ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВЫМ, АНТИТОКСИЧЕСКИМ И РАДИОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ | 2003 |
|
RU2234323C1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2008-04-20—Публикация
2006-07-27—Подача