Изобретение относится к медицине, в частности к онкологии, и может быть использовано для лечения различных форм онкологических заболеваний.
Онкологические заболевания занимают второе место по общей смертности после сердечно-сосудистых заболеваний, а страх перед возможностью возникновения злокачественного новообразования имеет глубокий социальный резонанс. Статистические данные свидетельствуют о том, что заболеваемость онкологическими заболеваниями ежегодно растет, при этом прослеживается явная тенденция к «омоложению рака».
В мировой практике разработаны и переведены в стандарты основные способы лечения больных со злокачественными новообразованиями.
Общепринятой терапией, вне зависимости от происхождения рака, является использование различных схем циторедуцирующего воздействия. В случае солидных опухолей применяют хирургическое удаление опухолевого очага с последующим продолжением химиотерапии. В последние годы бурно развиваются подходы иммунотерапии рака с использованием противораковых вакцин различного происхождения (дендритноклеточные вакцины, вакцины на основе вирусов, размножающихся в раковых клетках, вакцины на основе чистых раковых антигенов (например, Her-2), ДНК-вакцины) и методов in vivo вакцинации с применением мощных адъювантов, стимулирующих развитие адаптивного противоракового иммунитета непосредственно в организме больного (CpG ODN, Panagen) [1-5], гуманизированных моноклональных антител [6] и CAR технологий [7]. Широко используется облучение и терапия гормонами в случае гормонозависимых опухолей.
Методы неиммунной и не гормонзависимой противораковой терапии могут быть разделены на две широкие категории: традиционные методы химиотерапии и методы молекулярной терапии, в которых действие лекарства направлено на определенную молекулярную мишень, которая, как предполагается, важна для жизнеспособности раковой клетки и опухоли в целом [8]. Эффективность противоопухолевого лечения определяют по двум основным параметрам: по воздействию на опухолевую ткань, оценивая степень ее регрессии, и по воздействию на опухолевую туморогенную клетку, оценивая частоту возникновения рецидивов и генерализацию.
Известен способ лечения асцита, основанный на комбинированном применении двух препаратов, диоксадэта и цисплатина [9].
Недостатком этого способа лечения является относительно низкая эффективность, поскольку, как подтвердили результаты экспериментальных исследований, при его применении не удается полностью остановить развитие асцита, а лишь тормозится его рост.
Известен также способ лечения распространенного рака яичника [10], основанный на внутрибрюшинном введенных цитостатиков в сочетании с рихлокаином.
Способ позволяет повысить противоопухолевое действие внутрибрюшинно введенных цитостатиков в сочетании с рихлокаином.
Однако недостаточная эффективность и ограниченность области применения этого способа связана с тем, что оценка и выбор эффективности цитостатического лекарственного средства определяется при ex vivo обработке асцита прямым добавлением цитостатика, значительно сужая, тем самым, спектр лекарственных препаратов цитостатического ряда, часть которых проявляет свою противораковую активность в форме метаболитов, генерируемых в печени, например, циклофосфан.
Известны и способы лечения онкологических заболеваний, основанные на применении синергичного действия химиотерапевтических препаратов, различных групп: алкилирующие препараты, антиметаболиты, противоопухолевые антибиотики, алкалоиды и другие биологические активные вещества растительного происхождения, а также ферментные и гормональные препараты [11-13].
Биотерапевтические лекарственные средства активируют защитные компоненты иммунной системы и стимулируют их противоопухолевое действие, а также воздействуют на факторы и механизмы, контролирующие процессы пролиферации и гибели клеток, благодаря чему достигается синергичный эффект от сочетанного применения в схеме лечения цитостатика и биопрепарата, поскольку биопрепарат выполняет одновременно функции модификатора, усиливающего эффективность противоопухолевого средства, и протектора, защищающего организм от иммуносупрессивного (иммунотоксического) действия цитостатика.
Кроме того, известен синергичный способ лечения [14], основанный на введении синергически терапевтически эффективного количества агента, выбранного из группы, состоящей из цитотоксических агентов и цитостатических агентов и соединения формулы (I) или его фармацевтически приемлемой соли.
Недостатком такого способа является относительно низкая эффективность, в связи с воздействием на ограниченное число метаболических путей раковой клетки.
Известен и способ синергичного лечения рака [15], при котором вводят один или несколько цитостатиков от 1/4 до 1/2 стандартной терапевтической дозы, после чего подкожно вводят (ГМДП-А).
Способ также имеет относительно низкую эффективность, поскольку использует ограниченный спектр лекарственных препаратов.
При этом известно, что при любом лечении рака угроза рецидивов в ближайшие 5 лет достигает 30-50%. Этот факт связан с присутствием в неотрансформированной ткани популяции клеток, обладающих потенциалом стволовых клеток [16, 17]. Свойства этих клеток таковы, что с трудом просматривается эффективная терапия, способная преодолеть «видимую неубиваемость» этого типа клеток (циркулирующие опухолевые клетки, диссеминированные раковые клетки, визикулярные щиты, обратный эффект Варбурга) [18, 19]. Раковые стволовые клетки, как полагают, участвуют в повторном появлении рака благодаря своим туморогенным свойствам и поддержании резистентности ко многим обычным терапевтическим воздействиям. Это подкрепляет предположение, что они могут не реагировать на традиционную терапию и вызывать постоянное появление рака.
В [20] показано, что стволовые клетки рака груди, растущие в культуре, оказались резистентными к химотерапевтическим агентам, а раковые стволовые клетки из лейкемии оказались резистентными к химотерапевтическим лекарствам, daunorubicin и Ara-C [21].
Раковые стволовые клетки из поджелудочной железы и толстого кишечника также резистентны к химиотерапии [22, 23], а некоторые раковые стволовые клетки резистентны к радиации [24, 25]. Более того, пациенты с раком груди обнаруживали более высокий процент клеток со свойствами стволовых клеток рака груди после химиотерапии [26], указывая, тем самым, что терапия может оказаться менее эффективной в отношении убийства раковых стволовых клеток, хотя она элиминирует остальные раковые клетки.
Механизмы резистентности к лекарствам у раковых стволовых клеток изучены недостаточно, но возможные объяснения включают избыточную экспрессию белков, которые откачивают лекарство из клеток, энзимы, которые метаболизируют лекарства, или анти-апоптические белки [27].
В клинической практике известны лекарства, которые находят раковые стволовые клетки, указывая, тем самым, что эти клетки могут быть элиминированы у пациентов. Например, parthenolide и rapamycin, по-видимому, убивают раковые стволовые клетки при острой миелоидной лейкемии [28, 29]. Также temozolomide преимущественно элиминирует раковые стволовые клетки в глиобластоме [30], а стволовые клетки рака мозга под воздействием bevacizumab снижают свою туморогенность [31, 32].
Помимо указанных выше, известен способ лечения [33], основанный на применении препарата тиоридазина (который блокирует рост стволовых клеток острой миелоидной лейкимии) в сочетании со стандартной химиотерапией.
Другой из аналогов предложенного способа основан на применении специфических антител Н90, блокирующий CD44v на раковых клетках острого миелолейкоза [34].
Ограниченность применения этих способов связана, в первую очередь, с их специфичностью к строго определенным опухолям и неэффективностью для лечения множества других онкологических заболеваний.
Кроме того, известен способ лечения [35], в котором обеспечивается совместное воздействие цитостатика циклофосфана и препарата фрагментированной ДНК человека.
Способ основан на воздействии на стволовые инициирующие раковые клетки асцитной формы опухоли (на примере Кребс-2), при котором происходит эрадикация (уничтожение) популяции раковых клеток, обладающих инициирующими свойствами (стволовые-туморогенные раковые клетки). Для этого используется эффект совместного воздействия цитостатика циклофосфана и препарата двуцепочечной ДНК.
Однако, это техническое решение обладает относительно низкой эффективностью лечения, поскольку при его использовании применяются многоразовые инъекции препарата ДНК, что вызывает токсический эффект, а временной интервал действия препарата не ориентирован на интерференцию репаративного процесса гомологичной рекомбинации в стволовых инициирующих раковых клетках.
Наиболее близким к предложенному является способ лечения асцитной формы рака [36], основанный на совместном воздействии цитостатика циклофосфана и препарата двуцепочечной ДНК, согласно которому мышам-опухоленосам линии СВА весом 20-35 г, несущим развитый асцит, парентерально вводят цитостатик циклофосфан в 0, 36, 72 часа каждый раз в дозе 100 мг/кг, а через 18, 54, 90 часов после каждой инъекции циклофосфана, соответственно, вводят интраперитонеально препарат ДНК, состоящий из композиции препаратов нативной двуцепочечной ДНК человека в дозе 3.0 мг и смеси нативной и кросс-линкированной двуцепочечной ДНК спермы лосося в соотношении 5:3 в дозе 3 мг суммарно в количестве 6.0 мг на инъекцию, независимо от веса мышей-опухоленосов.
Особенностью способа является то, что для достижения максимального терапевтического действия на восьмые сутки после первой инъекции циклофосфана вводят дополнительно циклофосфан в дозе 100 мг/кг и через 18 часов препарат ДНК суммарно в количестве 6 мг, причем, интраперитонеально препарат ДНК в количестве 6 мг на инъекцию вводят однократно в объеме 500 мкл из расчета половины объема четырехсуточного асцита, соответствующего 1 мл и 1/20 веса животного, содержащего ~ 200 млн раковых клеток.
Наиболее близкое техническое решение обладает относительно узкой областью применения, поскольку оно привязано к одной экспериментальной нозологической форме рака и не обладает признаками универсальности по отношению к другим ракам животных и человека. Еще одним недостатком наиболее близкого технического решения является относительно низкая эффективность лечения.
Задача, решаемая в настоящем изобретении, направлена на расширение области применения способа лечения и повышение эффективности лечения.
Требуемый технический результат заключается в расширении области применения способа лечения и повышении эффективности лечения.
Поставленная задача решается, а требуемый технический результат достигается тем, что, в способе лечения онкологических заболеваний, основанном на введении пациенту цитостатика циклофосфана и препарата двуцепочечной ДНК, согласно изобретению, вначале вводят клетки опухоли в первичную культуру и однократно обрабатывают кросслинкирующим цитостатиком в дозе, соответствующей 1/3 от полной однократной клинической дозы цитостатика, и определяют профиль репаративного цикла клеток опухоли пациента, полученной из биопсийного материала, после чего определяют день синхронизации в чувствительной G1/S фазе клеточного цикла и максимального накопленного количества стволовых инициирующих раковых клеток опухоли пациента, как признак их синхронного ареста, используя в качестве основы найденный временной профиль цикла репарации межцепочечных сшивок, индуцированных кросслинкирующим цитостатиком после трехкратной обработки цитостатиком, каждый раз в дозе, соответствующей 1/3 от полной однократной клинической дозы в последний час каждого из трех последовательных завершающихся репаративных циклов, необходимой для индукции масштабного апоптоза комметированных раковых клеток и запирания в определенной G2/M фазе клеточного цикла основной массы стволовых инициирующих раковых клеток, при этом, количество стволовых инициирующих раковых клеток и распределение по клеточному циклу определяют ежедневно FACS анализом и цитотлогически по интернализации специфического TAMRA меченного ДНК зонда в эти клетки, на основе чего определяют день максимально накопления TAMRA позитивных клеток, который соответствует их синхронизации в чувствительной для терапии фазе клеточного цикла и днем терминальной эрадицирующей стволовые инициирующие раковые клетки терапевтической обработки, определяют терапевтическое расписание «3+1» введения цитостатика в дозе, соответствующей 1/3 от полной однократной клинической дозы, и режим введения сложнокомпозиционного препарата на основе двуцепочечной ДНК, при этом, цитостатик вводят четырехкратно тремя обработками в указанных дозах и в определенное предварительно время, необходимое для запирания стволовых инициирующих раковых клеток и индукции апоптоза комметированных раковых клеток, а четвертую инъекцию в дозе 1/3 от однократной дозы в день, определенный как финальный день эрадицирующей стволовые инициирующие раковые клетки терапии, а препарат ДНК также вводят четырехкратно после каждой инъекции цитостатика во временную точку демаркации двух фаз процесса репарации межцепочечных сшивок, индуцированных цитостатиком, а именно - в точку между максимумом двуцепочечных разрывов и началом их залечивания, причем, препарат двуцепочечной ДНК вводится каждый раз в дозе 10-20 мг на 1 кг веса (~ 1 г на 70 кг) или внутрибрюшинно, или внутримышечно или внутрь опухоли несколькими прицельными дозовыми инъекциями.
В современной литературе отсутствуют указания на предлагаемый способ лечения онкологических заболеваний, что подтверждает его новизну.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает критерию практической (промышленной) применимости.
На чертеже представлены следующие иллюстрирующие материалы.
На фиг. 1 - Лечение солидной опухоли Кребс-2 (зима 2016). а) - схема инъекций. Препарат DNAmix вводился либо непосредственно в опухоль по 1 мг/мышь (первая инъекция 0,5 мг), либо по 0,1 мг в комплексе с протамином (1 к 0,8 по количеству), внутривенно, б) - динамика изменения размера опухоли и количества животных с опухолью при лечении трансплантата размером 0,5 см3, в) - динамика изменения размера опухоли и количества животных с опухолью при лечении стабилизированного трансплантата, г) - животное с опухолью исходного размера 0,5 см3 (до лечения) и тоже животное через 210 дней от начала лечения (полное вылечивание).
На фиг. 2 - Лечение солидной опухоли Кребс-2 размером 0,5 см3 (лето 2016). а) - схема инъекций, б) - динамика изменения размера опухоли и количества животных с опухолью.
На фиг. 3 - Лечение солидной опухоли Кребс-2 в зимнее время, а) - репаративный цикл клеток асцита, приведены средние значение по 2 мышам и стандартное отклонение, б) - схема инъекций для интервала введения циклофосфана в 36 и 24 часов, в) - динамика изменения размера опухоли, количества животных с опухолью и количества живых мышей, г) - визуальное состояние животных, 1 - мышь из группы «циклофосфан 36 ч», у которой на 85 сутки от прививки опухоли возник рецидив, 2 - мышь из группы «циклофосфан 24 ч» без рецидивов.
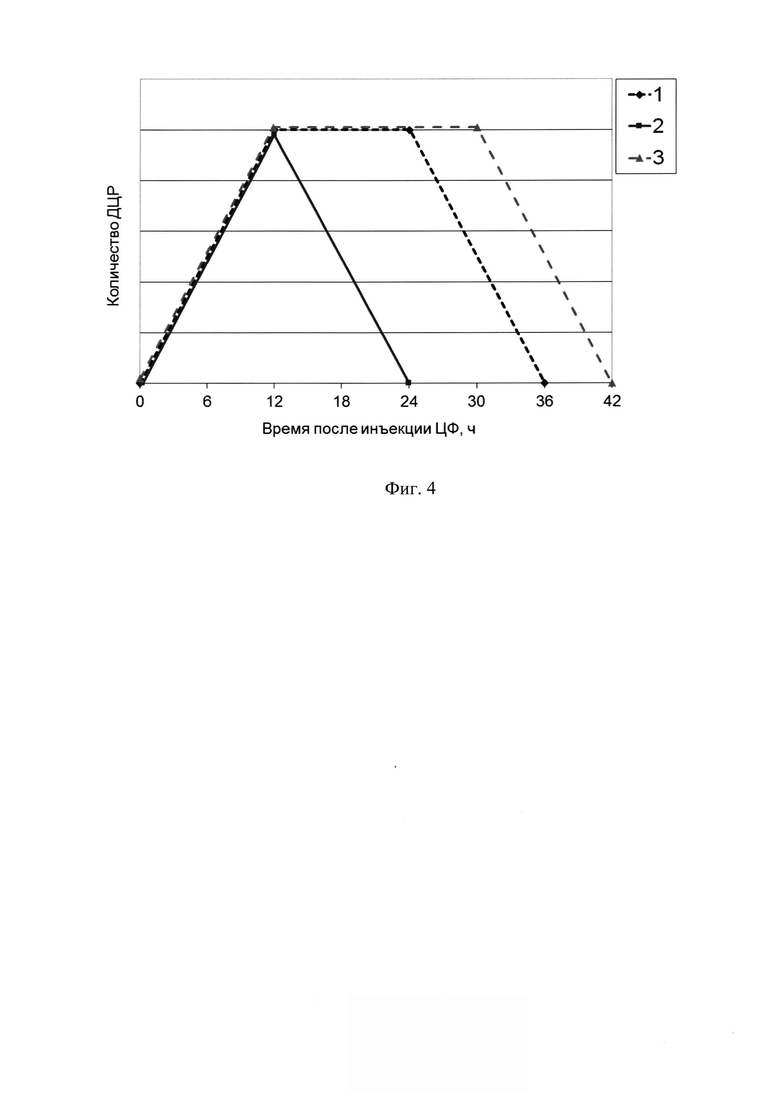
На фиг. 4 - Схематичное изображение динамики количества двуцепочечных разрывов. 1 - как в работе [37]; 2 - летом 2016 года; 3 - зимой 2017 года.
На фиг. 5 - Анализ характера развития вторичного асцита у мышей с гепатомой Г-29, обработанных циклофосфаном и препаратом ДНК.
На фиг. 6 - Схема обработки культур клеток человеческой глиобластомы К и Ж, полученных с операционного материала, цитостатиком митомицином С и композиционным препаратом ДНК. Обработку клеток проводили in vitro.
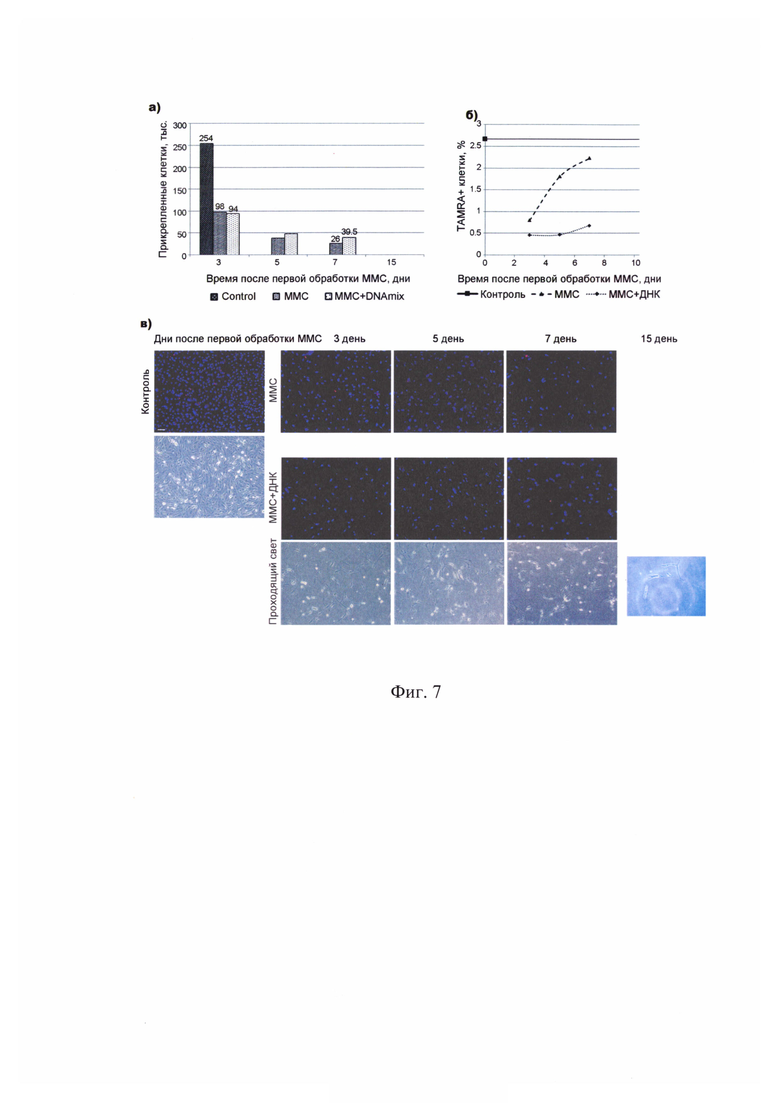
На фиг. 7 - Анализ количества прикрепленных клеток, а также TAMRA+ клеток культуры человеческой глиобластомы К. после обработки цитостатиком митомицином С и композиционным препаратом ДНК. а) - график количества прикрепленных клеток на 3, 5, 7 и 15 сутки с момента первой обработки митомицином С; б) - график процента TAMRA+ клеток; в) - цитологические препараты клеток до обработки митомицином С (Контроль), на 3, 5, 7 и 15 сутки с начала обработок. На рисунке приведено объединенное изображение в каналах DAPI (хроматин) и TAMRA (сигнал экзогенной ДНК). Митомицин С - группа, которую обрабатывали только цитостатиком; Митомицин С + ДНК - группа, которую обрабатывали цитостатиком и препаратом ДНК. Для групп «Контроль» и «Митомицин С + ДНК» приведено изображение клеток в проходящем свете. Бар соответствует 100 мкм.
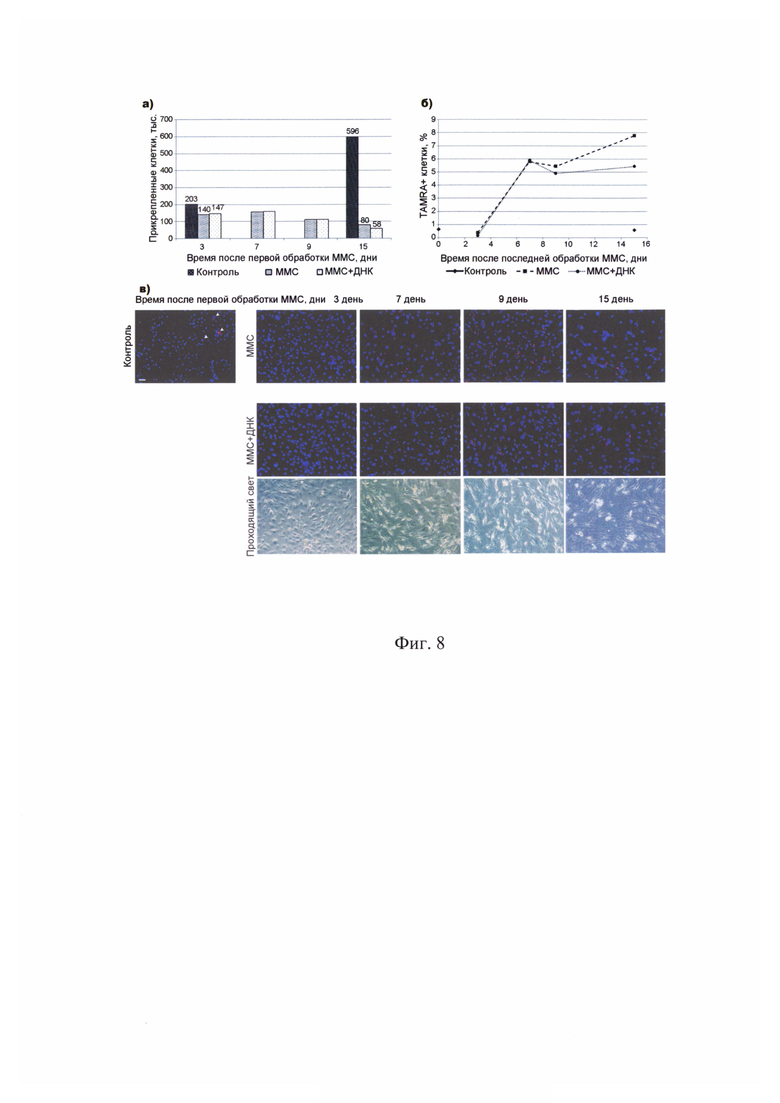
На фиг. 8 - Анализ количества прикрепленных клеток, а также TAMRA+ клеток культуры человеческой глиобластомы Ж. после обработки цитостатиком митомицином С и композиционным препаратом ДНК. а) - график количества прикрепленных клеток на 3, 7, 9 и 15 сутки с момента первой обработки митомицином С; б) - график процента TAMRA+ клеток; в) - цитологические препараты клеток до обработки митомицином С (Контроль), на 3, 7, 9 и 15 сутки с начала обработок. На рисунке приведено объединенное изображение в каналах DAPI (хроматин) и TAMRA (сигнал экзогенной ДНК). Митомицин С - группа, которую обрабатывали только цитостатиком; Митомицин С + ДНК - группа, которую обрабатывали цитостатиком и препаратом ДНК. Для группы «Митомицин С + ДНК» приведено изображение клеток в проходящем свете. Бар соответствует 100 мкм.
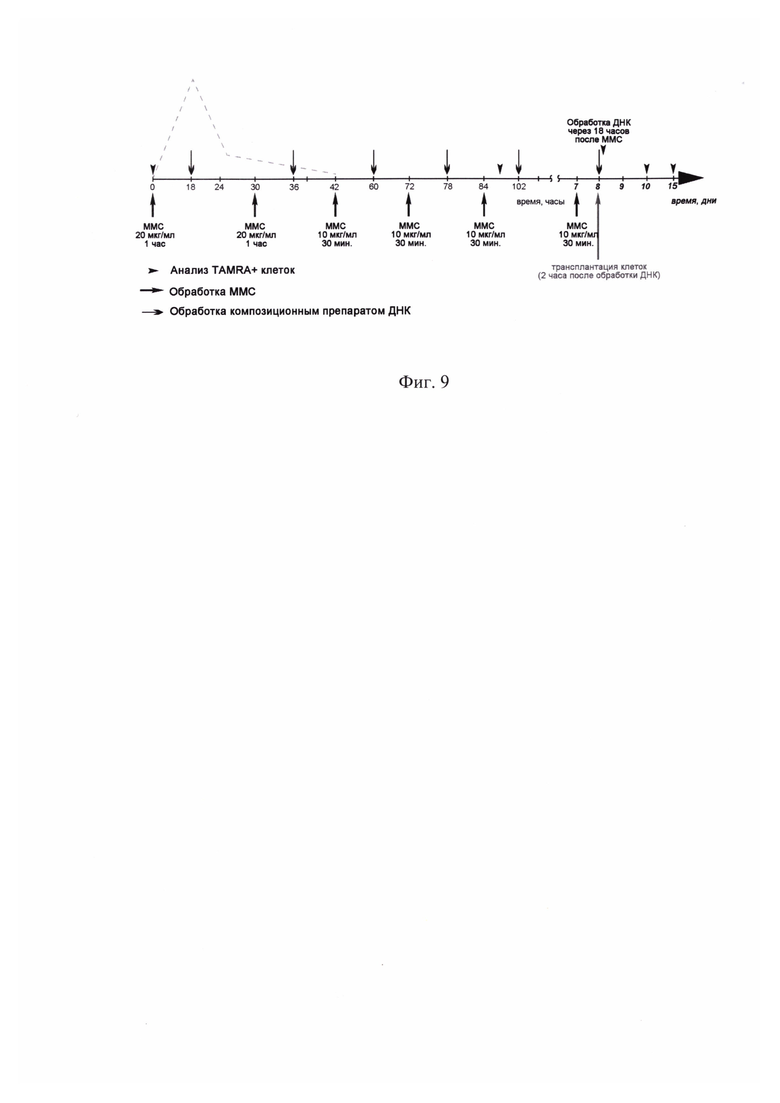
На фиг. 9 - Схема обработки культуры клеток человеческой глиобластомы U87 цитостатиком митомицином С и композиционным препаратом ДНК. Пунктирной линией схематично обозначен график образования и репарации двуцепочечных разрывов ДНК после обработки культуры U87 цитостатиком.
На фиг. 10 - Анализ количества прикрепленных клеток, а также TAMRA+ клеток культуры U87 после обработки цитостатиком митомицином С и композиционным препаратом ДНК. а) - график количества прикрепленных клеток на 3, 7, 10 и 15 сутки с момента первой обработки митомицином С; б) - график процента TAMRA+ клеток; в) - цитологические препараты клеток до обработки митомицином С (Контроль), на 3, 7, 10 и 15 сутки с начала обработок. На рисунке приведено объединенное изображение в каналах DAPI (хроматин) и TAMRA (сигнал экзогенной ДНК). Митомицин С - группа, которую обрабатывали только цитостатиком; Митомицин С + ДНК - группа, которую обрабатывали цитостатиком и препаратом ДНК. Для групп «Контроль» и «Митомицин С + ДНК» приведено изображение клеток в проходящем свете.
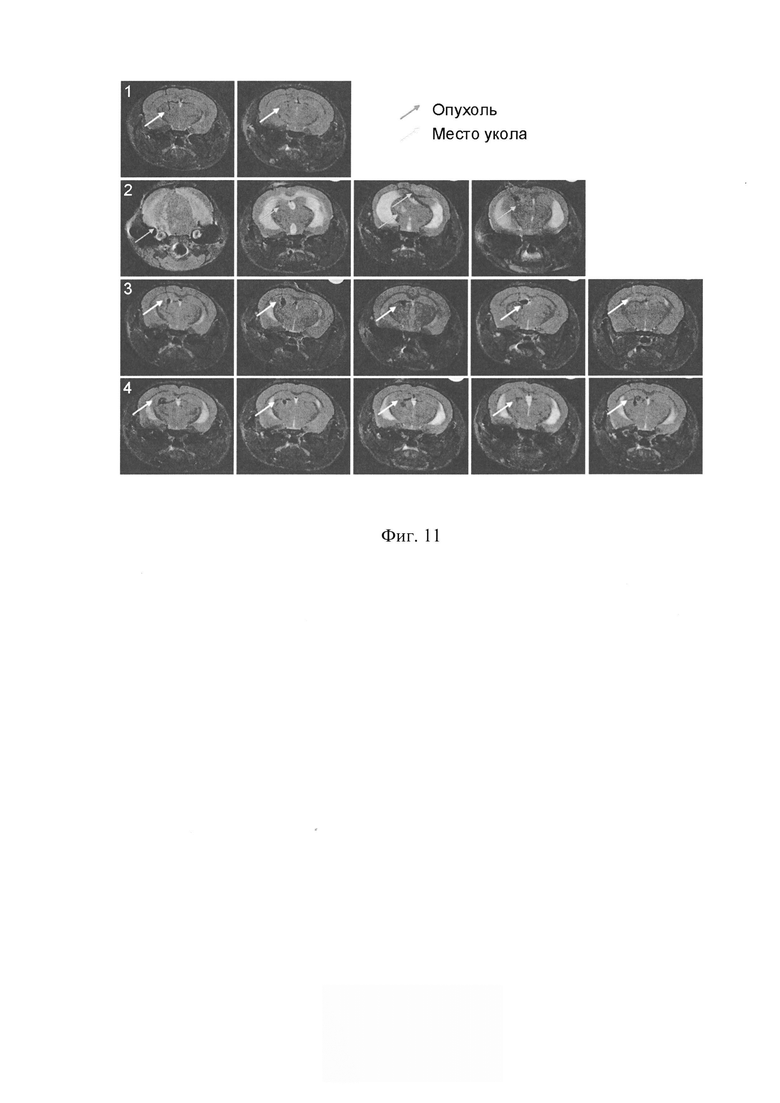
На фиг. 11 - МРТ анализ головного мозга NOD/SCID мышей через 15 суток после интрацеребральной перевивки клеток человеческой глиобластомы U87. 1 - отрицательный контроль, перевивка физиологического раствора в том же объеме что и клетки; 2 - положительный контроль, перевивка необработанных U87 клеток; 3 - перевивка клеток, обработанных только цитостатиком митомицином С; 4 - перевивка клеток, обработанных митомицином С и препаратом ДНК. Графт детектируется только у животных из группы 2.
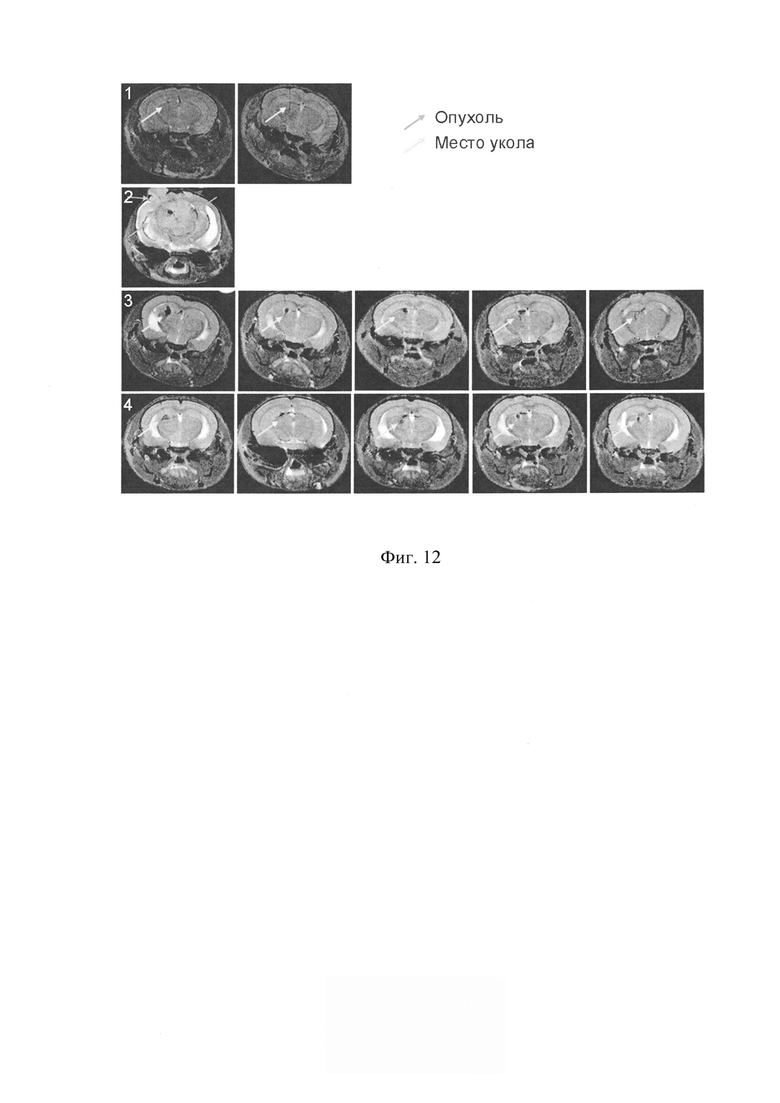
На фиг. 12 - МРТ анализ головного мозга NOD/SCID мышей через 37 суток после интрацеребральной перевивки клеток человеческой глиобластомы U87. 1 - отрицательный контроль, перевивка физиологического раствора в том же объеме что и клетки; 2 - положительный контроль, перевивка необработанных U87 клеток; 3 - перевивка клеток, обработанных только цитостатиком митомицином С; 4 - перевивка клеток, обработанных митомицином С и препаратом ДНК. Графт детектируется только у животного из группы 2, остальные три мыши из этой группы к 37-м суткам пали.
Предложенный способ лечения онкологических заболеваний реализуется следующим образом.
Предварительно отметим теоретические предпосылки предложенного способа.
Способ основан на двух открытых относительно недавно общебиологических феноменах: 1) способность низкодифференцированных клеток различного генеза интернализовать фрагменты экстраклеточной двуцепочечной ДНК естественным механизмом интернализации и 2) способность фрагментов двуцепочечной ДНК, доставленных во внутренние компартменты стволовых инициирующих раковых клеток, интерферировать процесс репарации межцепочечных сшивок, индуцированных действием кросслинкирующего цитостатика. В результате такой интерференции стволовые инициирующие раковые клетки или погибают, или необратимо утрачивают свои туморогенные свойства. Таким образом, обнаружен универсальный для одной из двух наиболее крупных системных групп (низко/высокодифференцированные) туморогенных раковых клеток молекулярный маркер, и экспериментально обнаружен однотипный способ эрадикации туморогенных клеток.
В основе предложенного способа лежит два технических момента.
Во-первых, это определенная последовательность обработки опухоли кросслинкирующим цитостатиком, которая позволяет индуцировать гибель дифференцированных раковых клеток через механизм апоптоза, а также синхронизировать стволовые инициирующие раковые клетки в фазе клеточного цикла, наиболее чувствительной для последующего (финального) терапевтического воздействия.
Во-вторых, введение сложнокомпозиционного препарата на основе двуцепочечной ДНК в точку демаркации двух фаз процесса репарации межцепочечных сшивок, а именно NER и гомологичной рекомбинации.
Основным лейтмотивом способа являлся анализ следующих параметров:
1) идентификация в полученной из биопсийного материала культуре опухолевых клеток субпопуляции TAMRA+ стволовых инициирующих раковых клеток;
2) исследование цикла репарации межцепочечных сшивок по времени возникновения/исчезновения двуцепочечных разрывов;
3) ежедневный анализ клеточного цикла после проведенной обработки цитостатиком с целью определения момента синхронизации клеток в G1/S фазе клеточного цикла, наиболее чувствительной к терапевтическому воздействию;
4) ежедневная после проведенной обработки цитостатиком оценка количества TAMRA позитивных клеток с целью определения дня после первой инъекции цитостатика, на который произошло накопление, а значит синхронизация в определенной фазе клеточного цикла выживших после обработки опухолевых клеток, включая TAMRA+ стволовые инициирующие раковые клетки.
Оценка этих параметров позволяет определить конкретный метрономный режим терапевтических воздействий цитостатика и двуцепочечной ДНК на тот или иной тип опухоли, и использовать его с целью повышения эффективности лечения рака в качестве новой стратегии эрадикации стволовых инициирующих раковых клеток и нового способа лечения злокачественных новообразований.
Предложенный способ лечения онкологических заболеваний основан на синергичном действии кросслинкирующих цитостатиков (циклофосфан, митомицин С, цисплатин и др.) и сложнокомпозиционного препарата двуцепочечной ДНК, технической базой которого являются экспериментально определенный профиль репаративного цикла конкретного рака, стратегия введения цитостатика и сложнокомпозиционного препарата двуцепочечной ДНК («3+1), привязанная к определенному профилю репаративного цикла и экспериментально определенный день терминального эрадицирующего воздействия препаратов на стволовые инициирующие раковые клетки конкретного рака.
Реализация предложенного способа условно может быть разбита на этапы.
На первом этапе определяют профиль репаративного цикла клеток конкретной опухоли, полученной из биопсийного материала после выведения клеток опухоли в первичную культуру и однократной обработки цитостатиком в дозе соответствующей 1/3 от полной однократной клинической дозы цитостатика, используя метод комет или антитела к гистону γН2Х как маркеров двуцепочечных разрывов, характеризующих фазы NER и гомологичной рекомбинации репаративного цикла. Характер профиля зависит от сезонности и определяться каждый раз перед лечением.
На втором этапе определяют день синхронизации в чувствительной G1/S фазе клеточного цикла и максимального накопленного количества стволовых инициирующих раковых клеток конкретной опухоли как признак их синхронного ареста, используя в качестве основы найденный временной профиль цикла репарации межцепочечных сшивок, индуцированных кросслинкирующим цитостатиком (циклофосфан, митомицин С, цисплатин и др.) после трехкратной обработки цитостатиком, каждый раз в дозе соответствующей 1/3 от полной однократной клинической дозы в последний час каждого из трех последовательных завершающихся репаративных циклов, необходимой для индукции масштабного апоптоза комметированных раковых клеток и запирания в определенной G2/M фазе клеточного цикла основной массы стволовых инициирующих раковых клеток. Количество стволовых инициирующих раковых клеток и распределение по клеточному циклу определяется ежедневно FACS анализом и цитологически по интернализации специфического TAMRA меченного ДНК зонда в эти клетки, при этом день максимально накопления TAMRA позитивных клеток будет соответствовать их синхронизации в чувствительной для терапии фазе клеточного цикла, и является днем терминальной эрадицирующей стволовые инициирующие раковые клетки терапевтической обработки.
На третьем этапе разрабатывают терапевтическое расписание «3+1» введения цитостатика в дозе, соответствующей 1/3 от полной однократной клинической дозы и режим введения сложнокомпозиционного препарата на основе двуцепочечной ДНК, которые проводятся четырехкратно и характеризуются: для цитостатика - тремя обработками в указанных дозах и в определенное на втором этапе время, необходимое для запирания стволовых инициирующих раковых клеток и индукции апоптоза комметированных раковых клеток, и четвертой инъекции в дозе 1/3 от однократной дозы в день, определенный как финальный день эрадицирующей стволовые инициирующие раковые клетки терапии, и для препарата ДНК - четырехкратно после каждой инъекции цитостатика во временную точку демаркации двух фаз процесса репарации межцепочечных сшивок, индуцированных цитостатиком, а именно в точку между максимумом двуцепочечных разрывов и началом их залечивания, определенных на втором этапе, причем, сложнокомпозиционный препарат на основе двуцепочечной ДНК вводится каждый раз в дозе 10-20 мг на 1 кг веса (~ 1 г на 70 кг) интрапарантерально или внутрь опухоли несколькими прицельными дозовыми инъекциями.
Актуальность данного изобретения подтверждается тем, что, несмотря на достигнутые успехи в терапии злокачественных опухолей, существует проблема, не позволяющая сформировать четкое законченное представление о правильности выбранной стратегии лечения и средств воздействия на малегнизированные клетки. Такой проблемой является отсутствие понимания всей совокупности биологических свойств опухолевых клеток и в первую очередь стволовых инициирующих раковых клеток.
В этой связи наиболее важным является вопрос чувствительности туморогенных стволовых клеток к выбранной терапии. Все цитостатики, так или иначе, разрушают комметированные раковые клетки и, при этом, в настоящее время не существует адекватного, простого подхода в определении эффективности воздействия выбранного лечения на стволовые инициирующие раковые клетки.
В этой связи, подходы, позволяющие контролировать процесс эрадикации стволовых инициирующих раковых клеток и строящие свою стратегическую платформу на четком знании определенных биологических закономерностей стволовых инициирующих раковых клеток, являются тем важным инструментом, позволяющим осознанно применять терапевтические процедуры, основной целью которых является эрадикация стволовых инициирующих раковых клеток и тем самым лишение опухоли туморогенного начала. Кроме этого, оценка состояния популяции стволовых инициирующих раковых клеток позволяет следить за эффективностью терапии и корректировать лечебную тактику.
В этой связи, разработка новых терапевтических стратегий эрадикации туморогенного начала опухоли, основанных на знании принципиально новых биологических свойств стволовых инициирующих раковых клеток является актуальной задачей, а нахождение адекватных методов терапии позволит сделать скачок в лечении раков.
Ниже приводятся экспериментальные доказательства возможности эрадикации стволовых инициирующих раковых клеток на четырех моделях рака мыши и человека и как следствие лишение туморогенного потенциала перевиваемого трансплантата.
Используемые методики.
Опухолевая модель.
Опухоль Кребс-2 мыши и гепатокарцинома мыши Г-29 были получены из коллекции ИЦиГ СО РАН. Для получения трансплантата клетки опухоли выделяли от мышей с 10-дневным асцитом, разводили физиологическим раствором и перевивали экспериментальным животным в количестве 2 млн/мышь (для формирования асцитной формы опухоли) или 1 млн/мышь (для формирования солидного трансплантата).
Препарат ДНК.
Сложнокомпозиционный препарат ДНК (DNAmix®) представлял собой смесь в равном количестве ДНК человека и ДНК лосося (3 : 5 = кросс-линкированная: нативная), в некоторых случаях соплиментированной стабилизирующим белком протамином.
Схемы инъекций мышам препаратов.
Терапия «3+1 зима 2016».
Графт прививался в правую заднюю лапку в мышцу над коленным суставом. В январе 2016 года 6-месячным мышам-самкам СВА было привито в/м по 300 тыс.клеток 7-суточного асцита Кребс-2 (в 100 мкл физ. р-ра). Через 7 дней после прививки, когда опухоль достигла размера ~ 0,5 см3, или через 2 суток, когда опухоль еще не пальпировалась, мыши получали три инъекции циклофосфана в дозе 100 мг/кг веса животного с интервалом в 36 часов и инъекции препарата DNAmix через 18 часов после каждой инъекции цитостатика. Одна группа животных получала только инъекции циклофосфана (n=7), другая (n=7) - препарат ДНК непосредственно в опухоль в 3-4 точки по 1 мг/мышь (первая инъекция 0,5 мг), третья группа животных (n=7) - внутривенно по 0,1 мг препарата ДНК, смешанной с протамином (1 к 0,8 по количеству). На 8 сутки после первой инъекции циклофосфана животные получали дополнительную инъекцию цитостатика (100 мг/кг) и препарата ДНК через 18 часов в аналогичных дозах. Контрольная группа (n=5) с привитой опухолью не получала никаких инъекций.
Терапия «3+1 лето 2016».
В конце мая 2016 года 4-месячным мышам-самкам СВА было привито в/м по 400 тыс.клеток асцита Кребс-2 (в 100 мкл физ. р-ра). Через 8 дней после прививки, когда опухоль достигла размера ~ 0,5 см3, мышам провели терапию по разработанной схеме - три инъекции циклофосфана в дозе 100 мг/кг веса животного с интервалом в 36 часов, и инъекции препарата ДНК через 18 часов после каждой инъекции цитостатика. Инъекции ДНК делали непосредственно в опухоль в 3-4 точки по 1 мг/мышь. На 8 сутки после первой инъекции циклофосфана животные получили дополнительную инъекцию цитостатика (100 мг/кг) и препарата ДНК через 18 часов в аналогичных дозах. Были взяты группы: «циклофосфан», «циклофосфан + ДНКмикс», «циклофосфан + чДНК», «циклофосфан + лДНКмикс», «циклофосфан + ДНКмикс в другую лапу» (n=9). Контрольная группа (n=5) с привитой опухолью не получала никаких инъекций.
Анализ интернализации TAMRA-меченой ДНК выполняли по методике, описанной в статье [37].
Приготовление суспензии клеток глиобластомы, а также первичных культур из операционного материала.
Забор операционного материала и все последующие исследования проводили после получения письменного информированного согласия пациентов. Суспензию клеток глиобластомы получали из фрагмента ткани опухоли, взятого во время хирургической операции у больных К. (жен., 61 г., диагноз: рецидив глиобластомы, теменная и затылочная доли левого полушария) и Ж. (жен., 60 лет, диагноз: рецидив глиобластомы, лобная и теменная доли левого полушария). Ткань опухоли механически измельчали с помощью скальпеля, затем дважды отмывали в PBS. Далее опухолевый материал инкубировали в течение 30 минут в 0.1% растворе коллагеназы (тип IA, Sigma-Aldrich) при 37°C. Через 30 минут добавляли среду DMEM (Gibco) (с 10% сыворотки эмбиональной бычьей - FBS (HyClone)), как стоп-раствор для коллагеназы, и затем отмывали средой DMEM, дополненной 10% FBS. Клетки помещали в культуральный флакон. Через 5-7 суток неприкрепленные к пластику клетки переносили в свежий флакон и культивировали еще 3-5 дней в DMEM, дополненной 10% FBS. Затем окончательно неприкрепленные к пластику клетки удаляли. Фракцию адгезивных клеток во всех флаконах продолжали вести до покрытия клетками 70-80% площади флакона с полной заменой культуральной среды 1-2 раза в неделю. Пассирование клеток осуществляли с использованием раствора трипсина/ЭДТА в течение 5-10 минут.
Анализ TAMRA + клеток в первичных культурах клеток глиобластомы.
Клетки рассаживали в чашки Петри (диаметр 3.5 см). Прикрепленные клетки промывали PBS, в чашку Петри добавляли среду без сыворотки, Alu-TAMRA ДНК в количестве 0.5 мкг/мл, инкубировали 20 мин. Затем добавляли ядерный краситель Hoechst (Termo Fisher Scientific) и инкубировали еще 15 мин. Клетки анализировали при помощи инвентированного флуоресцентного микроскопа AxioObserver Zl (Zeiss) и программы ZEN. В каждой точке было проанализировано 2000-4000 клеток.
Интрацеребральная перевивка клеток мышам.
Проверку роста клеток проводили в модели ортотопической ксенотрансплантации клеток глиобластомы человека иммунодефицитным мышам SPF статуса линии NOD/SCID (Charles river). Животные содержались в SPF-виварии Института цитологии и генетики СО РАН, в индивидуально вентилируемых клетках (IVC) системы OptiMice (Animal Care Systems), в стандартных условиях со свободным доступом к корму Ssniff (Германия) и воде. Животным интрацеребрально в левое полушарие вводили 5 мкл суспензии клеток. После инъекции появление новообразований в мозге животных отслеживали через 25-33 дня на высокопольном (11.7 Тл) ЯМР томографе «BioSpec 117/16USR» (Bruker, Германия) с использованием Т2-взвешенного изображения (weighted techniques).
Анализ репарации двуцепочечных разрывов.
Культуру клеток глиобластомы человека в виде суспензии (300 тыс.клеток) инкубировали в 1 мл с ММС (SIGMA-Aldrich) (7.2 мМ) при 37°C. После инкубирования с цитостатиком клетки осаждали, один раз промывали средой с сывороткой, ресуспендировали в этой же среде и разносили по лункам в 24-х луночном планшете. Каждые 6 часов клетки отбирали и заливали в блоки с легкоплавкой агарозой. Блоки застывали при 4°C, затем их переносили в 0.5 М ЭДТА. Перед нанесением на электрофорез блоки отмывали в ТЕ-буфере, переносили в лизирующий буфер (1% лаурилсаркозил, 50 мМ ЭДТА, протеиназа К 1 мг/мл), лизировали блоки при 50°C в течение 15 мин. Электрофорез блоков проводили в течение 30 мин, 0.75 В/см в трис-ацетатном буфере с добавлением бромистого этидия. Затем блоки высушивали и анализировали с помощью флуоресцентного микроскопа Axiolmager (Zeiss), программа ISIS. Анализ содержания двуцепочечных разрывов производили с использованием параметра Tail Moment (ТМ) (ТМ = длина хвоста кометы × процент ДНК в кометном хвосте) в программе CASP.
Анализ распределения клеток по клеточному циклу.
Культуры клеток человеческой глиобластомы обрабатывали цитостатиком митомицином С 20 мкг/мл трехкратно через каждые 36 часов. До обработки цитостатиком, через 18, 54, 90 часов, а также на 6-е сутки с момента первой обработки клетки отбирали на анализ распределения по клеточному циклу. Анализ проводили при помощи обработки клеток пропидий йодидом (SIGMA-Adrich) и проточного цитофотометра BD FACSAria (Becton Dickinson, USA) по протоколу, описанному в работе [38].
Обработка культур клеток человеческой глиобластомы К. и Ж. цитостатиком и препаратом ДНК, подсчет абсолютного количества TAMRA+ клеток.
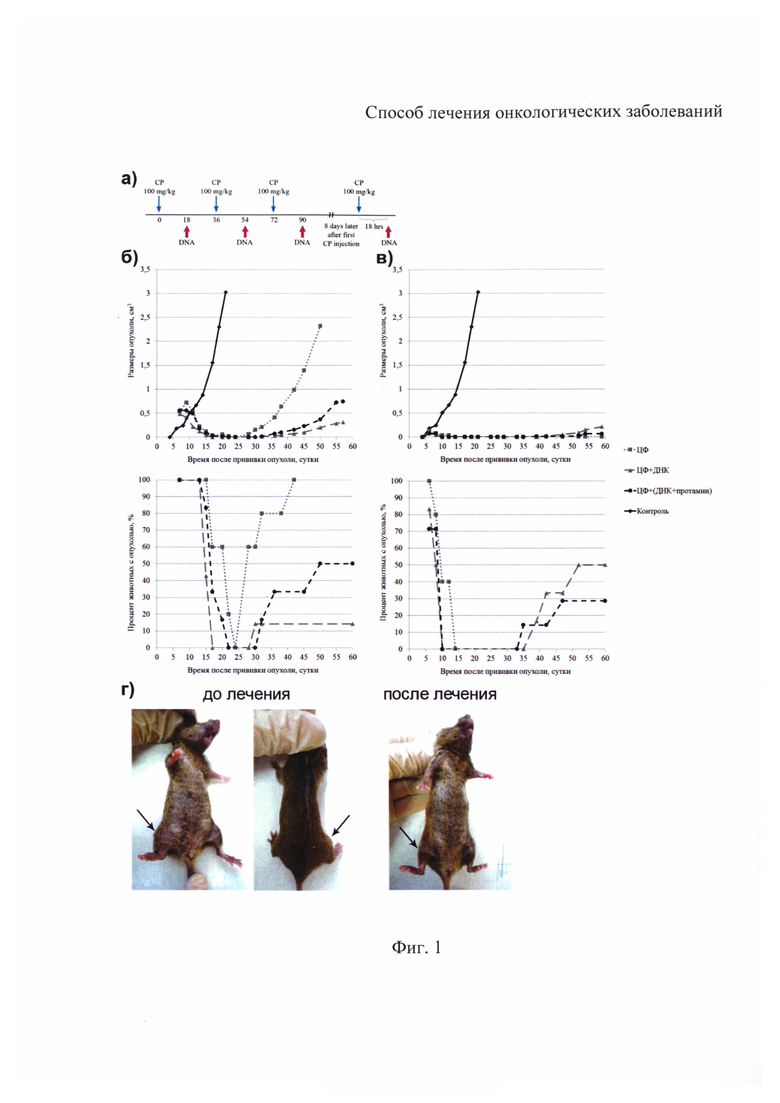
Клетки рассадили в чашки Петри (3.5 см) по 185 тыс. для культуры К. и 200 тыс.в случае культуры Ж. В прикрепленном виде клетки обрабатывали митомицином С и препаратом ДНК. При этом клетки промывали PBS, помещали в среду без сыворотки с добавлением либо цитостатика в количестве 20 или 10 мкг/мл, либо препарата ДНК в количестве 0.5 мкг/мл. Обработку проводили в течение часа. Затем клетки промывали PBS и помещали в среду DMEM с добавлением 10% FBS. В контрольные точки из каждой группы забирали по чашке Петри и считали в ней процент TAMRA+ клеток, как это описано выше. Затем клетки снимали трипсином/ЭДТА и считали их количество (N) при помощи камеры Горяева. Абсолютное количество TAMRA+ клеток (X) считали по формуле 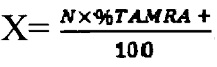 .
.
Подкожная перевивка культуры U87 NOD/SCID мышам.
В эксперименте использовали мышей линии SCID (SHO-PrkdcscidHrhr) SPF статуса в возрасте 6-7 недель. Животных содержали в ЦКП «SPF-виварии» (RFMEFI61914X0005 и RFMEFI62114X0010) Института цитологии и генетики СО РАН однополыми семейными группами по 2-5 особей в индивидуально вентилируемых клетках (IVC) системы OptiMice (Animal Care Systems) в контролируемых условиях, при температуре 22-26°C, относительной влажности 30-60% и световом режиме свет/темнота 14/10 ч. Корм Ssniff (Германия) и воду, обогащенную минеральной смесью Северянка (Санкт-Петербург), животным предоставляли at libitum.
За 2-3 недели до начала эксперимента на животных культуру клеток глиобластомы человека U87, которая хранится в криобанке ЦКП «SPF-виварий» ИЦиГ СО РАН в жидком азоте, размораживали и культивировали в течение 5-7 пассажей на среде DMEM/F12 (1:1) с 10% фетальной сыворотки (FBS) фирмы Invitrogen. Перед инъекцией клетки снимали с подложки раствором трипсин/версен и после центрифугирования при 1000 об/мин в течение 5 мин осадок тщательно ресуспендировали в среде DMEM/F12 без сыворотки, доводя до необходимой концентрации.
Для получения солидной опухоли глиомы U87 мышам подкожно в межлопаточную область вводили по 6,3 млн клеток в объеме 100 мкл среды DMEM/F12 без сыворотки. Рост опухоли отслеживали 1 раз в 2-3 дня и измеряли с использованием штангенциркуля в продольном и поперечном направлении при появлении под кожей характерных уплотнений.
Все процедуры характеристики, обработки культуры U87 препаратами митомицином С и композиционным препаратом ДНК, а также анализа эффективности проведенной терапии, использованные в настоящем экспериментальном исследовании, полностью описаны в соответствующем разделе первой статьи цикла исследований.
В работах использовались услуги ЦКП проточной цитометрии ИЦиГ СО РАН, ЦКП микроскопического анализа биологических объектов СО РАН, ЦКП «SPF-виварий» ИЦиГ СО РАН.
Статистический анализ.
Статистический анализ проводили при помощи программы Statistica 10, достоверность полученных результатов оценивали при помощи критерия Манна-Уитни. На графиках, если специально не указано, приведены достоверные отклонения для р<0.05.
Рассмотрим более подробно базовые экспериментальные подтверждения предлагаемого подхода.
Разработанная стратегия «3+1» была применена к 4 различным экспериментальным ракам, а именно к солидной форме недифференцированной карциномы мыши Кребс-2, асцитной форме гепатокарциномы мыши Г-29, первичной культуре глиобластомы человека, иммортализованной культуре глиобластомы человека U-87.
Рассмотрим режим полного вылечивания экспериментальных мышей от солидной формы Кребс-2.
Используя новую стратегию эрадикации стволовых инициирующих раковых клеток Кребс-2, базирующуюся на их синхронизации в чувстивтельной для терапевтических обработок фазе клеточного цикла [39-43], была вылечена солидная форма карциномы Кребс-2 (фиг. 1, фиг. 3). Установлено, что механизм синхронизации, последующее разрушающее действие, направленное на стволовые инициирующие раковые клетки Кребс-2 и вылечивание мышей от солидного трансплантата, зависит от временной конфигурации (временного профиля) цикла репарации межцепочечных сшивок, составляющей одну из платформ стратегии. Также установлено, что временная конфигурация цикла репарации межцепочечных сшивок Кребс-2 имеет выраженную сезонную цикличность в месте проведения экспериментов (фиг. 4). (г. Новосибирск, Россия, январь-апрель 2016, май-сентябрь 2016, март 2017). В зимнее время (октябрь - апрель) между накоплением двуцепочечных разрывов (фаза NER, 12 часов) и их «залечиванием» (фаза гомологичной рекомбинации, 12 часов) формируется ~ 12-18 часовой латентный отрезок времени. В летний период (май-сентябрь) фаза NER и фаза гомологичной рекомбинации следуют непосредственно друг за другом и формируют 24 часовую конфигурацию репаративного цикла. Терапевтический эффект, основанный на применении описанной стратегии, первоначально разработанной для «зимнего репаративного цикла», полностью элиминируется в летнее время (май-сентябрь) (фиг. 2).
Рассмотрим режим вылечивания мышей от первичного асцита Г-29.
На опухоли Кребс-2 для солидной и асцитной форм был найден режим синхронизации, эрадикации и вылечивания рака («3+1»). С использованием аналогичной стратегии лечения были проведены исследования на мышиной модели Г-29 (гепатокарцинома), также растущей как в асцитной, так и в солидной формах. В результате проведенной работы удалось полностью избавиться от первичного асцита экспериментальных мышей. Результаты экспериментов свидетельствуют о том, что стратегия введения препаратов в режиме «3+1» с финальным терапевтическим воздействием цитостатика циклофосфана и сложнокомпозиционного препарата двуцепочечной ДНК на шестые и одиннадцатые сутки обладает наибольшим терапевтическим воздействием. Средняя продолжительность жизни в экспериментальных группах составила около 36 дней, в контрольной группе - 27 дней. Установлено, что регламентированные стратегией инъекции одного циклофосфана обладают ярко выраженным терапевтическим действием на растущий асцит. Экспериментально показано, что в случае асцитной формы опухоли Г-29 при синергичном действии цитостатика и препарата двуцепочечной ДНК вторичный асцит возникает после появления перитонеального канцероматозного солидного образования и, по-видимому, является его производным (таблица, фиг. 5).

Рассмотрим режим эрадикации стволовых инициирующих раковых клеток TAMRA+ из первичной культуры клеток глиобластомы человека.
Из фрагмента ткани опухоли, взятого во время хирургической операции у больных К. (жен., 61 г., диагноз: рецидив глиобластомы) и Ж. (жен., 60 лет, диагноз: рецидив глиобластомы) были получены первичные культуры клеток глиобластомы человека. Основываясь на новой стратегии синхронизации стволовых инициирующих раковых клеток и используя разработанный режим их эрадикации «3+1», была оценена эффективность нового терапевтического подхода, направленного на разрушение ракового клеточного сообщества, на первичных клеточных линиях глиобластомы человека. Основными элементами стратегии являлись следующие индикаторные результаты. 1. Оценка присутствия TAMRA+ клеток (стволовых инициирующих раковых клеток) в популяции клеток анализируемых культур. 2. Определение реперных временных точек цикла репарации межцепочечных сшивок ДНК, индуцированных кросслинкирующим цитостатиком митомицином С. 3. Оценка синхронизации клеток в фазах клеточного цикла. 4. Определение дня после начала терапии, на который TAMRA+ клетки синхронно присутствуют в G1/S фазе клеточного цикла, чувствительной для обработок. 5. Определение режима эрадикации TAMRA+ клеток (стволовых инициирующих раковых клеток). Обработка культур проводилась кросслинкирующим цитостатиком митомицином С и сложнокомпозиционным препаратом ДНК. Показано, что после проведенных обработок клетки перестают делиться и культуры деградируют. Клеточная линия К. к 30-м суткам наблюдения полностью деградировала. Количество клеток культуры Ж. к 15-м суткам наблюдения упало от исходного практически в 3 раза. При этом данный показатель по отношению к контролю на 15 день измерения составил 1/7,45 для митомицина С и 1/10,28 для митомицина С + ДНК. Основное действие комбинация препаратов митомицин С + ДНК оказывает на TAMRA+ стволовые инициирующие раковые клетки клеточных популяций глиобластом. Использование митомицина С как в изолированном виде, так и в комбинации с ДНК демонстрирует эффективное элиминирующее действие на первичные культуры глиобластом человека (фиг. 6, фиг. 7, фиг. 8).
Рассмотрим режим эрадикации стволовых инициирующих раковых клеток TAMRA+ из иммортализованной культуры клеток глиобластомы человека U-87 и связанной с этим потерей графта способности давать церебральный трансплантат.
В работе была оценена эффективность нового терапевтического подхода, направленного на разрушение ракового клеточного сообщества, на примере иммортализованной клеточной линии глиобластомы человека U87. Первоначально были охарактеризованы реперные элементы новой стратегии эрадикации стволовых инициирующих раковых клеток. Основными элементами стратегии являлись: 1) оценка присутствия TAMRA+ клеток (стволовых инициирующих раковых клеток) в популяции клеток анализируемой культуры; 2) определение реперных временных точек цикла репарации межцепочечных сшивок, индуцированных кросслинкирующим цитостатиком митомицином С; 3) оценка синхронизации клеток в фазах клеточного цикла; 4) определение дня после начала терапии, на который TAMRA+ клетки накапливаются и синхронно присутствуют в G1/S фазе клеточного цикла, чувствительной для обработок. На основании полученных данных был определен терапевтический режим, направленный на эрадикацию TAMRA+ клеток (стволовых инициирующих раковых клеток). Обработка культуры проводилась кросслинкирующим цитостатиком митомицином С и сложнокомпозиционным препаратом ДНК. Показано, что после проведенных обработок клетки перестают делиться, и культура деградирует. Наиболее сильное разрушительное воздействие на TAMRA+ стволовые инициирующие раковые клетки глиобластомы U87 оказывает комбинация препаратов митомицин С + ДНК. Эксперименты по трансплантации обработанной как митомицином С, так и митомицином С + ДНК культуры клеток глиобластомы U87 демонстрируют полное разрушение ее перевивочного потенциала (фиг. 9, фиг. 10, фиг. 11, фиг. 12).
Представим обобщенную характеристику новой стратегии в лечении злокачественных онкологических заболеваний «3+1».
Полученные результаты экспериментально подтверждают универсальность разработанного способа и его применимости для широкого спектра опухолей, а также эффективность новой стратегии эрадикации стволовых инициирующих раковых клеток, направленной на повышение эффективности лечения различных форм рака.
Основным положением стратегии предложенного способа является концепция эрадикации стволовых раковых клеток in vivo.
Компоненты стратегии.
1) Найдено, что стволовая раковая клетка способна захватывать экстраклеточные фрагменты двуцепочечной ДНК естественным природным механизмом.
Следствие 1. Возможность таргетного воздействия на этот тип клеток in vivo, включая эрадикацию стволовых инициирующих раковых клеток.
Следствие 2. Является новым универсальным маркером стволовых раковых клеток. Позволяет проводить мониторинг количества стволовых инициирующих раковых клеток и оценивать эффективность противоопухолевой терапии.
2) Найдено, что опухолевые клетки того или иного типа характеризуются строго специфическим, «индивидуальным» циклом репарации двуцепочечных разрывов, индуцированных действием кросслинкирующего цитостатика циклофосфана.
3) Найдено, что трехкратное введение циклофосфана в конечную фазу трех последовательных отрезков времени, соответствующих времени репаративного цикла, характерного для основной массы опухолевых клеток, приводит а) к апоптозу значительной части дифференцированных раковых клеток и б) к синхронизации стволовых инициирующих раковых клеток в G2/M фазе клеточного цикла.
4) Найдено, что «выжившие», синхронизированные в G2/M стволовые инициирующие раковые клетки одновременно выходят из ареста в G1/S фазу клеточного цикла. Время выхода зависит от типа рака и индивидуальных особенностей организма и приходится на 5-12 сутки после начала терапии.
5) Найдено, что фрагменты двуцепочечной ДНК интерферируют процесс репарации межцепочечных сшивок, индуцированных в стволовых инициирующих раковых клетках действием кросслинкирующего цитостатика. В результате такой интерференции стволовые инициирующие раковые клетки или погибают, или необратимо утрачивают свои туморогенные свойства. При этом фрагменты нативной двуцепочечной ДНК интерферируют NER фазу репаративного процесса, тогда как фрагменты модифицированной двуцепочечной ДНК интерферируют фазу гомологичной рекомбинации [37].
6) Найдено, что G1/S фаза клеточного цикла является чувствительной для воздействия экстраклеточной двуцепочечной ДНК, интернализованной в стволовые инициирующие раковые клетки [44].
7) Найдено, что однократное введение сложнокомпозиционного препарата, состоящего из фрагментов нативной и модифицированной двуцепочечной ДНК в точку демаркации двух фаз репаративного процесса приводит к интерференции остаточного процесса NER и начинающегося процесса гомологичной рекомбинации и, как следствие, к гибели стволовых инициирующих раковых клеток. Такая обработка, повторенная трижды в соответствии с тремя инъекциями циклофосфана, полностью перекрывает всякую возможность подавляющему большинству стволовых инициирующих раковых клеток ускользнуть от воздействия терапевтических фрагментов ДНК. Введение в терапевтический режим финальной обработки животных кросслинкирующим цитостатиком циклофосфаном и препаратом двуцепочечной ДНК в момент их синхронного выхода из G2/M и нахождения в G1/S фазе клеточного цикла приводит к полной эрадикации стволовых инициирующих раковых клеток и вылечиванию опытных животных от экспериментального рака (на примере Кребс-2) в асцитной и солидной формах [43, 45].
Проведенные эксперименты на различных моделях злокачественных опухолей свидетельствуют о следующем.
1. Новая стратегия, в которой используется синергичное воздействие циклофосфана и препарата ДНК в строго заданные временные отрезки, позволяет элиминировать клеточную систему свободно расположенных раковых клеток, растущих или в культуре (три типа глиобластом человека) или представленных асцитной формой рака (гепатокарцинома Г-29) или солидного трансплантата Кребс-2.
2. Использование кросслинкирующего цитостатика в форме монопрепарата (циклофосфан, митомицин С и др.) в рамках временной парадигмы стратегии также приводит к элиминации или культуры раковых клеток (на примере трех культур глиобластом человека) или к элиминации первичного асцита на примере гепатокарциномы Г-29 или к полному подавлению роста солидного графта Кребс-2.
3. При использовании стратегии в обязательном порядке должна учитываться биология опухоли и, в частности, способность стволовых инициирующих раковых клеток находиться в глубине ткани и давать солидные образования. Доставка препарата ДНК к стволовым инициирующим раковым клеткам, расположенным в ткани, должна осуществляться в отредактированной для данного рака временной парадигме несколькими пространственно прицельными терапевтическими инъекциями.
Полученные результаты могут стать основой административно очень простого первого шага в лечении раков, а именно использования любой регламентированной химиотерапии в привязке к репаративному циклу конкретного рака с финальным «добивающим ударом» в промежуток времени синхронизации TAMRA позитивных клеток в G1/S фазах клеточного цикла. Предложенный терапевтический подход с использованием дополнительных инъекций препарата ДНК требует разносторонней валидации.
Таким образом, благодаря введенным усовершенствованиям известного способа и введению дополнительных операций, достигается требуемый технический результат, заключающийся в расширении арсенала средств лечения онкологических заболеваний за счет расширения области применения способа лечения и в повышении эффективности лечения.
Список использованных источников
1. Прокопович С.К., Винницкий В.Б. Дендритные клетки и перспективы их использования в иммунотерапии злокачественных новообразований. Онкология. 2001; (2-3): 126-131.
2. Барышников А.Ю. Принципы и практика вакцинотерапии рака. Бюл. СО РАМН. 2004; 112(2): 59-63.
3. Олишевский С.В., Козак В.В., Яниш Ю.В., Рыбалко С.Л., Шляховенко В.А. Иммуностимулирующая CpG-ДНК: перспективы клинического применения в онкологии. Онкология. 2006; 8(2): 209-217.
4. Krieg A.M. Development of TLR9 agonists for cancer therapy. J Clin Invest. 2007; 117(5): 1184-1194. doi: 10.1172/JCI31414.
5. Proskurina AS, Gvozdeva TS, Alyamkina EA, Dolgova EV, Orishchenko KE, Nikolin VP, Popova NA, Sidorov SV, Chernykh ER, Ostanin AA, Leplina OY, Dvornichenko VV, Ponomarenko DM, Soldatova GS, Varaksin NA, Ryabicheva TG, Uchakin PN, Zagrebelniy SN, Rogachev VA, Bogachev SS, Shurdov MA. Results of multicenter double-blind placebo-controlled phase II clinical trial of Panagen preparation to evaluate its leukostimulatory activity and formation of the adaptive immune response in patients with stage II-IV breast cancer. BMC Cancer. 2015; 15(1): 122.
6. Никитин E.A., Глазкова О.И. «Волшебные пули»: моноклональные антитела в онкологии. Лечащий врач. https://www.lvrach.ru/2007/06/4535331/.
7. http://dislife.ru/materials/883.
8. Hellerstein MK. A critique of the molecular target-based drug discovery paradigm based on principles of metabolic control: advantages of pathway-based discovery. Metab Eng. 2008 Jan; 10(1): 1-9.
9. Беспалов В.Г., Жабин A.A., Стуков A.H., Беляева О.А., Муразов Я.Г., Семенов А.Л., Коньков С.А., Крылова И.М. Синергизм противоопухолевого действия диоксадэта и цисплатина на модели асцитной опухоли яичника. Сибирский онкологический журнал. 2013. №1 (55), стр. 42-46
10. RU 2163152, C1, A61M 31/00, A61K 31/00, 20.02.2001
11. Машковский М.Д. Лекарственные средства. М., Медицина, 1984, часть 2, стр. 425-475.
12. Gonzalez АВ, Jimenez RB, Delgado PJR, et al. Biochemotherapy in the treatment of metastatic melanoma in selected patients. Clin Transl Oncol 2009; 11(6): 382-6.
13. Cohen DJ, Hochster HS, Rationale for combining biotherapy in the treatment of advanced colon cancer. Gastrointest Cancer Res 2008; 2(3): 145-151.
14. RU 2264217, C2, A61K 31/5513, A61P 35/00, 22.03.2001
15. RU 2571551, C1, A61P 35/00, A61K38/14, 2012.2015.
16. Bonnet D., Dick J.E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997; 3: 730-737.
17. Lapidot Т., Sirard C., Vormoor J., Murdoch В., Hoang Т., Caceres-Cortes J., Minden M., Paterson В., Caligiuri M.A., Dick J.E. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 1994; 367: 645-648. doi: 10.1038/367645a0.
18. Jinesh G.G., Choi W., Shah J.B, Lee E.K., Willis D.L., Kamat A.M. Blebbishields, the emergency program for cancer stem cells: sphere formation and tumorigenesis after apoptosis. Cell Death Differ. 2013; 20(3): 382-395. doi: 10.1038/cdd.2012.140.
19. Тупицын H.H. Циркулирующие и диссеминированные раковые клетки при раке молочной железы и раке яичников. Онкогинекология. 2013; 1: 12-18.
20. Wright М.Н., Calcagno A.M., Salcido CD., Carlson M.D., Ambudkar S.V., Varticovski L. Brcal breast tumors contain distinct CD44+/CD24- and CD133+ cells with cancer stem cell characteristics. Breast Cancer Res. 2008; 10(1): R10. doi: 10.1186/bcr1855.
21. Ailles L.E., Weissman I.L. Cancer stem cells in solid tumors. Curr Opin Biotechnol. 2007; 18(5):460-466. doi: 10.1016/j.copbio.2007.10.007.
22. Hermann P.C., Huber S.L., Herrler Т., Aicher A., Ellwart J.W., Guba M., Bruns C.J., Heeschen C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 2007; 1(3): 313-323. doi: 10.1016/j.stem.2007.06.002.
23. Dylla S.J., Beviglia L., Park I.K., Chartier C, Raval J., Ngan L., Pickell K., Aguilar J., Lazetic S., Smith-Berdan S., Clarke M.F., Hoey Т., Lewicki J., Gurney A.L. Colorectal cancer stem cells are enriched in xenogeneic tumors following chemotherapy. PLoS One. 2008; 3(6): e2428. doi: 10.1371/journal.pone.0002428.
24. Bao S., Wu Q., McLendon R.E., Hao Y., Shi Q., Hjelmeland A.B., Dewhirst M.W., Bigner D.D., Rich J.N. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 2006;444(7120):756-760. doi: 10.1038/nature05236.
25. Phillips T.M., McBride W.H., Pajonk F. The response of CD24(-/low)/CD44+ breast cancer-initiating cells to radiation. J Natl Cancer Inst. 2006; 98(24): 1777-1785. doi: 10.1093/jnci/djj495.
26. Yu F., Yao H., Zhu P., Zhang X., Pan Q., Gong C, Huang Y., Hu X., Su F., Lieberman J., Song E. let-7 regulates self renewal and tumorigenicity of breast cancer cells. Cell. 2007; 131(6): 1109-1123. doi: 10.1016/j.cell.2007.10.054
27. Wicha M.S. Cancer stem cell heterogeneity in hereditary breast cancer. Breast Cancer Res. 2008; 10(2): 105. doi: 10.1186/bcr1990.
28. Guzman ML, Rossi RM, Neelakantan S, Li X, Corbett CA, Hassane DC, Becker MW, Bennett JM, Sullivan E, Lachowicz JL, Vaughan A, Sweeney CJ, Matthews W, Carroll M, Liesveld JL, Crooks PA, Jordan CT. An orally bioavailable parthenolide analog selectively eradicates acute myelogenous leukemia stem and progenitor cells. Blood. 2007 Dec 15;110(13): 4427-4435.
29. Yilmaz OH, Morrison SJ. The PI-3kinase pathway in hematopoietic stem cells and leukemia-initiating cells: a mechanistic difference between normal and cancer stem cells. Blood Cells Mol Dis. 2008 Jul-Aug; 41(1):73-76
30. Beier D, 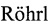 S, Pillai DR, Schwarz S, Kunz-Schughart LA, Leukel P, Proescholdt M, Brawanski A, Bogdahn U, Trampe-Kieslich A, Giebel B, Wischhusen J, Reifenberger G, Hau P, Beier CP. Temozolomide preferentially depletes cancer stem cells in glioblastoma. Cancer Res. 2008 Jul 15;68(14):5706-5715.
S, Pillai DR, Schwarz S, Kunz-Schughart LA, Leukel P, Proescholdt M, Brawanski A, Bogdahn U, Trampe-Kieslich A, Giebel B, Wischhusen J, Reifenberger G, Hau P, Beier CP. Temozolomide preferentially depletes cancer stem cells in glioblastoma. Cancer Res. 2008 Jul 15;68(14):5706-5715.
31. Calabrese C, Poppleton H, Kocak M, Hogg TL, Fuller C, Hamner B, Oh EY, Gaber MW, Finklestein D, Allen M, Frank A, Bayazitov IT, Zakharenko SS, Gajjar A, Davidoff A, Gilbertson RJ. A perivascular niche for brain tumor stem cells. Cancer Cell. 2007 Jan;l l(l):69-82.
32. Marotta LL, Polyak K. Cancer stem cells: a model in the making. Curr Opin Genet Dev. 2009 Feb; 19(l):44-50
33. www.54rus.org/more/14808
34. Jin L, Hope KJ, Zhai Q, Smadja-Joffe F, Dick JE. Targeting of CD44 eradicates human acute myeloid leukemic stem cells. Nat Med. 2006; 12(10): 1167-1174.
35. RU 2542410, C1, A61K 31/675, A61K 31/711, A61P 35/00, 20.02.2015.
36. RU 2595864, C1, A61K 31/535, A61K 31/711, A61P 35/00, 27.08.2016.
37. Dolgova EV, Alyamkina EA, Efremov YR, Nikolin VP, Popova NA,Tyrinova TV, Kozel AV, Minkevich AM, Andrushkevich O M, Zavyalov EL, Romaschenko AV, Bayborodin SI, Taranov OS, Omigov VV, Shevela EY, Stupak VV, Mishinov SV, Rogachev VA, Proskurina AS, Mayorov VI, Shurdov MA, Ostanin AA, Chernykh ER, Bogachev SS. Identification of cancer stem cells and a strategy for their elimination. Cancer Biol Ther. 2014; 15(10): 1378-1394.
38. Dolgova EV, Proskurina AS, Nikolin VP, Popova NA, Alyamkina EA, Orishchenko KE, Rogachev VA, Efremov YR, Dubatolova TD, Prokopenko AV, Chernykh ER, Ostanin AA, Taranov OS, Omigov VV, Zagrebelniy SN, Bogachev SS, Shurdov MA. "Delayed death" phenomenon: A synergistic action of cyclophosphamide and exogenous DNA. Gene. 2012; 495: 134-145.
39. Поттер E.A., Долгова E.B., Минкевич A.M., Ефремов Я.Р., Таранов О.С., Омигов В.В., Николин В.П., Попова Н.А., Проскурина А.С., Верещагин Е.И., Козел А.В., Рогачев В.А., Петров Д.Б., Останин А.А., Черных Е.Р., Колчанов Н.А., Богачев С.С. Терапевтические эффекты воздействия циклофосфана, препаратов двуцепочечной ДНК и их сочетания на раковые клетки асцита Кребс-2 и различные формы трансплантатов. Вавиловский журнал генетики и селекции. 2016;20(1):96-107.
40. Поттер Е.А., Долгова Е.В., Минкевич A.M., Николин В.П., Попова Н.А., Ефремов Я.Р., Байбородин СИ., Рогачев В.А., Проскурина А.С, Козел А.В., Таранов О.С, Омигов В.В., Верещагин Е.И., Петров Д.Б., Останин А.А., Черных Е.Р., Колчанов Н.А., Богачев С.С.Характеристика режимов терапевтического воздействия циклофосфана и препаратов двуцепочечной ДНК на опухоль Кребс-2, растущую в асцитной форме, приводящих к эрадикации первичного асцита. Вавиловский журнал генетики и селекции. 2016; 20(1): 108-124.
41. Поттер Е.А., Долгова Е.В., Минкевич A.M., Николин В.П., Попова Н.А., Ефремов Я.Р., Байбородин СИ., Рогачев В.А., Проскурина А.С, Таранов О.С, Верещагин Е.И., Останин А.А., Черных Е.Р., Колчанов Н.А., Богачев С.С.Режим однократной инъекции препарата двуцепочечной ДНК после каждой инъекции циклофосфана, приводящий к эрадикации первичного асцита Кребс-2. Вавиловский журнал генетики и селекции. 2016; 20(5): 716-722.
42. Поттер Е.А., Долгова Е.В., Проскурина А.С, Ефремов Я.Р., Таранов О.С, Николин В.П., Попова Н.А., Дубатолова Т.Д., Петрова Д.Д., Верещагин Е.И., Минкевич A.M., Андрушкевич О.М., Байбородин СИ., Рогачев В.А., Останин А.А., Черных Е.Р., Колчанов Н.А., Богачев С.С.Разработка регламента терапевтического режима, основанного на синергичном действии циклофосфана и препаратов двуцепочечной ДНК, приводящего к полному вылечиванию экспериментальных животных от асцитной формы опухоли мыши Кребс-2. Вавиловский журнал генетики и селекции. 2016; 20(5): 723-735.
43. Potter Е.А., Dolgova E.V., Proskurina A.S., Minkevich A.M., Efremov Y.R., Taranov O.S., Omigov V.V., Nikolin V.P., Popova N.A, Bayborodin S.I., Ostanin A.A., Chernykh E.R., Kolchanov N.A., Shurdov M.A., Bogachev S.S. A strategy to eradicate well-developed Krebs-2 ascites in mice. Oncotarget. 2016;7(10): 11580-11594.
44. Dolgova EV, Shevela EY, Tyrinova TV, Minkevich AM, Proskurina AS, Potter EA, Orishchenko KE, Zavjalov EL, Bayborodin SI, Nikolin VP, Popova NA, Pronkina NV, Ostanin AA, Chernykh ER, Bogachev SS. Nonadherent spheres with multiple myeloma surface markers contain cells that contribute to the sphere formation and are capable of internalizing extracellular double-stranded DNA. Clin Lymphoma Myeloma Leuk. 2016; 16(10): 563-576.
45. Potter E.A., Dolgova E.V., Proskurina A.S., Efremov Y.R., Minkevich A.M., Rozanov A.S., Peltek S.E., Nikolin V.P., Popova N.A., Seledtsov I.A., Molodtsov V.V., Zavyalov E.L., Taranov O.S., Baiborodin S.I., Ostanin A.A., Chernykh E.R., Kolchanov N.A., Bogachev S.S. Gene expression profiling of tumor-initiating stem cells from mouse Krebs-2 carcinoma using a novel marker of poorly differentiated cells. Oncotarget. 2017; 8(6): 9425-9441.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лечения распространенного рака молочной железы в терминальной стадии прогрессии | 2024 |
|
RU2837589C1 |
| СПОСОБ ЛЕЧЕНИЯ АСЦИТНОЙ ФОРМЫ РАКА | 2015 |
|
RU2595864C1 |
| СПОСОБ ЭРАДИКАЦИИ СТВОЛОВЫХ ИНИЦИИРУЮЩИХ РАКОВЫХ КЛЕТОК | 2013 |
|
RU2542410C1 |
| СПОСОБ ДЕТЕКЦИИ СТВОЛОВЫХ РАКОВЫХ КЛЕТОК | 2013 |
|
RU2530170C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2675233C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2429019C2 |
| СПОСОБ ТОРМОЖЕНИЯ РОСТА ПОДКОЖНОГО ТРАНСПЛАНТАТА ЭКСПЕРИМЕНТАЛЬНОЙ ГЛИОБЛАСТОМЫ ЧЕЛОВЕКА U-87, ПЕРЕВИТОГО ИММУНОДЕФИЦИТНЫМ МЫШАМ NU/J | 2019 |
|
RU2717218C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2345792C2 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2489169C2 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2008 |
|
RU2387456C1 |




Изобретение относится к области медицины. Предложен способ лечения онкологических заболеваний. Вначале вводят клетки опухоли в первичную культуру и однократно обрабатывают кросслинкирующим цитостатиком в дозе, соответствующей 1/3 от полной однократной клинической дозы цитостатика. Определяют профиль репаративного цикла клеток опухоли пациента. Определяют день синхронизации в чувствительной G1/S фазе клеточного цикла и максимально накопленного количества стволовых инициирующих раковых клеток опухоли. Количество стволовых инициирующих раковых клеток и распределение по клеточному циклу определяют ежедневно FACS анализом и цитологически по интернализации TAMRA меченного ДНК зонда в эти клетки, на основе чего определяют день максимально накопления TAMRA позитивных клеток, который соответствует их синхронизации в чувствительной для терапии фазе клеточного цикла. Цитостатик вводят четырехкратно тремя обработками в указанных дозах. Препарат двуцепочечной ДНК вводят четырехкратно после каждой инъекции цитостатика во временную точку демаркации в дозе 10-20 мг на 1 кг веса или внутрибрюшинно, или внутримышечно, или внутрь опухоли. Изобретение обеспечивает расширение области применения способа лечения и повышение эффективности лечения. 1 табл., 12 ил.
Способ лечения онкологических заболеваний, основанный на введении пациенту цитостатика циклофосфана и препарата двуцепочечной ДНК, отличающийся тем, что вначале вводят клетки опухоли в первичную культуру и однократно обрабатывают кросслинкирующим цитостатиком в дозе, соответствующей 1/3 от полной однократной клинической дозы цитостатика, и определяют профиль репаративного цикла клеток опухоли пациента, полученной из биопсийного материала, после чего определяют день синхронизации в чувствительной G1/S фазе клеточного цикла и максимального накопленного количества стволовых инициирующих раковых клеток опухоли пациента как признак их синхронного ареста, используя в качестве основы найденный временной профиль цикла репарации межцепочечных сшивок, индуцированных кросс-линкирующим цитостатиком после трехкратной обработки цитостатиком, каждый раз в дозе, соответствующей 1/3 от полной однократной клинической дозы в последний час каждого из трех последовательных завершающихся репаративных циклов, необходимой для индукции масштабного апоптоза комметированных раковых клеток и запирания в определенной G2/M фазе клеточного цикла основной массы стволовых инициирующих раковых клеток, при этом количество стволовых инициирующих раковых клеток и распределение по клеточному циклу определяют ежедневно FACS анализом и цитологически по интернализации TAMRA меченного ДНК зонда в эти клетки, на основе чего определяют день максимально накопления TAMRA позитивных клеток, который соответствует их синхронизации в чувствительной для терапии фазе клеточного цикла и днем терминальной эрадицирующей стволовые инициирующие раковые клетки терапевтической обработки, определяют терапевтическое расписание «3+1» введения цитостатика в дозе, соответствующей 1/3 от полной однократной клинической дозы, и режим введения сложнокомпозиционного препарата на основе двуцепочечной ДНК, при этом цитостатик вводят четырехкратно тремя обработками в указанных дозах и в определенное предварительно время, необходимое для запирания стволовых инициирующих раковых клеток и индукции апоптоза комметированных раковых клеток, а четвертую инъекцию в дозе 1/3 от однократной дозы в день, определенный как финальный день эрадицирующей стволовые инициирующие раковые клетки терапии, а препарат ДНК также вводят четырехкратно после каждой инъекции цитостатика во временную точку демаркации двух фаз процесса репарации межцепочечных сшивок, индуцированных цитостатиком, а именно в точку между максимумом двуцепочечных разрывов и началом их залечивания, причем препарат двуцепочечной ДНК вводится каждый раз в дозе 10-20 мг на 1 кг веса или внутрибрюшинно, или внутримышечно, или внутрь опухоли несколькими прицельными дозовыми инъекциями.
| СПОСОБ ЛЕЧЕНИЯ АСЦИТНОЙ ФОРМЫ РАКА | 2015 |
|
RU2595864C1 |
| ПОТТЕР Е.А | |||
| и др | |||
| Разработка регламента терапевтического режима, основанного на синергичном действии циклофосфана и препаратов двуцепочечной ДНК, приводящего к полному вылечиванию экспериментальных животных от асцитной формы опухоли мыши Кребс-2 | |||
| Вавиловский журнал генетики и селекции | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| DOLGOVA E.V | |||
| et al | |||
| Identification of cancer stem cells and a strategy for their elimination | |||
| Cancer Biol Ther | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ФИРСОВ А.А | |||
| и др | |||
| Методические указания по проведению доклинических исследований фармакокинетики фармакологических веществ и лекарственных средств | |||
| Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ | |||
| Москва, 2000 | |||
| Счетный сектор | 1919 |
|
SU107A1 |
Авторы
Даты
2018-07-25—Публикация
2017-09-20—Подача