ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данная заявка утверждает приоритет Предварительной Заявки США с серийным номером 61/232152, поданной 7 августа 2009 года, полное содержание которой настоящим включено ссылкой. Изобретение, раскрытое в данном документе, относится к области пестицидов и их применению для контроля вредителей.
УРОВЕНЬ ИЗОБРЕТЕНИЯ
Вредители каждый год вызывают во всем мире миллионы человеческих смертей. Кроме того, имеется более десяти тысяч видов сельскохозяйственных вредителей, которые вызывают потери в сельском хозяйстве. Данные сельскохозяйственные потери каждый год составляют миллиарды долларов США. Термиты наносят повреждения различным структурам, таким как дома. Данные потери от повреждения термитами каждый год составляют миллиарды долларов США. И, наконец, многие вредители хранящихся продуктов питания поедают и портят хранящиеся продукты питания. Данные потери хранящихся продуктов питания каждый год составляют миллиарды долларов США, но более важно, отнимают у людей необходимые продукты питания.
Существует острая потребность в новых пестицидах. Насекомые развивают устойчивость к пестицидам, применяющимся в настоящее время. Сотни видов насекомых являются устойчивыми к одному или нескольким пестицидам. Развитие устойчивости к некоторым из более старых пестицидов, таким как ДДТ, карбаматы и органические фосфаты, хорошо известно. Но устойчивость даже развилась к некоторым из более новых пестицидов. Поэтому существует потребность в новых пестицидах и особенно в пестицидах, которые имеют новые механизмы действия.
ЗАМЕСТИТЕЛИ (НЕПОЛНЫЙ ПЕРЕЧЕНЬ)
Примеры, приведенные для заместителей, являются неполными (кроме галогена) и не должны рассматриваться как ограничение изобретения, раскрытого в данном документе.
“Алкенил” означает ациклический, ненасыщенный (содержащий, по меньшей мере, одну углерод-углеродную двойную связь), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
“Алкенилокси” означает алкенил, дополнительно содержащий одинарную углерод-кислородную связь, например аллилокси, бутенилокси, пентенилокси, гексенилокси, гептенилокси, октенилокси, ноненилокси и деценилокси.
“Алкокси” означает алкил, дополнительно содержащий одинарную углерод-кислородную связь, например метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и декокси.
“Алкил” означает ациклический, насыщенный, разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
“Алкинил” означает ациклический, ненасыщенный (содержащий, по меньшей мере, одну углерод-углеродную тройную связь и любые двойные связи), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
“Алкинилокси” означает алкинил, дополнительно содержащий одинарную углерод-кислородную связь, например пентинилокси, гексинилокси, гептинилокси, октинилокси, нонинилокси и децинилокси.
“Арил” означает циклический, ароматический заместитель, состоящий из водорода и углерода, например фенил, нафтил и бифенил.
“Циклоалкенил” означает моноциклический или полициклический, ненасыщенный (содержащий, по меньшей мере, одну двойную углерод-углеродную связь) заместитель, состоящий из углерода и водорода, например циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклодеценил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
“Циклоалкенилокси” означает циклоалкенил, дополнительно содержащий одинарную углерод-кислородную связь, например циклобутенилокси, циклопентенилокси, циклогексенилокси, циклогептенилокси, циклооктенилокси, циклодеценилокси, норборненилокси и бицикло[2.2.2]октенилокси.
“Циклоалкил” означает моноциклический или полициклический, насыщенный заместитель, состоящий из углерода и водорода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборнил, бицикло[2.2.2]октил, декагидронафтил.
“Циклоалкокси” означает циклоалкил, дополнительно содержащий одинарную углерод-кислородную связь, например циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси, циклооктилокси, циклодецилокси, норборнилокси и бицикло[2.2.2]октилокси.
“Галоген” означает фтор, хлор, бром и иод.
“Галогеналкил” означает алкил, дополнительно состоящий из одного до максимального возможного числа, одинаковых или различных галогенов, например фторметил, дифторметил, трифторметил, 1-фторметил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
“Гетероциклил” означает циклический заместитель, который может быть полностью замещенным, частично незамещенным или полностью незамещенным, где циклическая структура содержит по меньшей мере один углерод и по меньшей мере один гетероатом, где упомянутый гетероатом представляет собой азот, серу или кислород, например бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, 1,2,3,4-тетразолил, тиазолинил, тиазолил, тиенил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил и 1,2,4-триазолил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения данного изобретения имеют следующую формулу:
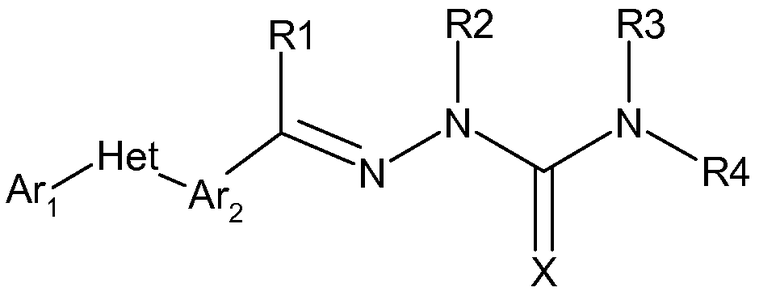
в которой:
(а) Ar1 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил,
где указанный замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6-галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил и фенокси;
(b) Het представляет собой 5 или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или несколько гетероатомов, независимо выбираемых из азота, серы или кислорода, и где Ar1 и Ar2 не находятся в орто-положении друг к другу (но могут быть в мета или пара, а именно, для пятичленного кольца они находятся в 1,3 и для 6-членного кольца они находятся либо в 1,3- либо в 1,4-положениях), и где указанное гетероциклическое кольцо может быть также замещено одним или несколькими заместителями, независимо выбираемыми из следующих: H, ОН, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6-алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=О)Н, С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил и фенокси;
(с) Ar2 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил,
где упомянутый замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6гидроксициклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=О)Н, С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), С(=О)(С1-С6галогеналкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил и фенокси;
(d) Х представляет собой О или S;
(е) R1 выбран из заместителей: Н, CN, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6-алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси;
(f) R2, R3 и R4 выбраны из заместителей: Н, C1-C6алкил, С3-С6циклоалкил, С2-С6алкенил, С2-С6алкинил, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), С(=О)фенил, фенил, С1-С6алкилфенил, С1-С6алкилфенокси, инданил, С(=О)Het-1, Het-1, (C1-C6алкил)Het-1 или С1-С6алкил-О-Het-1,
где каждый алкил, циклоалкил, циклоалкокси, галогенциклоалкокси, алкокси, галогеналкокси, алкенил, алкинил, С1-С6алкилфенил, фенил, фенокси и Het-1 необязательно замещены одним или несколькими заместителями, независимо выбираемыми из следующих: F, Cl, Br, I, CN, NO2, NRxRy, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкенил, C3-C6-циклоалкенил, С2-С6-алкинил, С3-С6-циклоалкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), S(=O)2N(C1-C6алкил)2, OSO2(С1-С6-алкил), OSO2(С1-С6-галогеналкил), С(=О)Н, С(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6-алкенил), (C1-С6-алкил)О(C1-C6-алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил), фенил, фенокси, О-Het-1 и Het-1,
где Het-1 представляет собой 5- или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или несколько гетероатомов, выбираемых из азота, серы и кислорода;
где R3 и R4 вместе необязательно могут образовывать 3-8-членную насыщенную или ненасыщенную циклическую группу, которая может содержать один или несколько гетероатомов, выбираемых из азота, серы и кислорода;
(g) n=0, 1 или 2;
(h) Rx и Ry независимо выбраны из заместителей: Н, C1-C6алкил, С1-С6галогеналкил, С3-С6циклоалкил, С3-С6галогенциклоалкил, С2-С6алкенил, С2-С6алкинил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), OSO2(С1-С6алкил), OSO2(С1-С6галогеналкил), С(=O)Н, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), С(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), С(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), С(=O)O(C2-C6алкенил), (C1-С6алкил)О(C1-C6алкил), (C1-С6алкил)S(C1-C6алкил), С(=O)(C1-C6алкил)С(=О)О(C1-C6алкил) и фенил.
В другом варианте осуществления Ar1 представляет собой замещенный фенил, где указанный замещенный фенил имеет один или несколько заместителей, независимо выбираемых из С1-С6алкила, С1-С6галогеналкила и С1-С6галогеналкокси. В более предпочтительном варианте осуществления Ar1 представляет собой замещенный фенил, где указанный замещенный фенил имеет один или несколько заместителей, независимо выбираемых из OCF3, OCF2CF3, CF3.
В другом варианте осуществления Het представляет собой триазолил, имидазолил, пирролил или пиразолил.
В другом варианте осуществления Het представляет собой замещенный пиразолил, где указанный замещенный пиразолил имеет один или несколько заместителей, независимо выбираемых из Н, С(=О)О(С1-С6алкил) или С(=О)NRxRy.
В другом варианте осуществления Ar2 представляет собой фенил.
В другом варианте осуществления R1 представляет собой H или С1-С6алкил.
В другом варианте осуществления R2 представляет собой H или С1-С6-алкил.
В другом варианте осуществления R3 представляет собой H.
В другом варианте осуществления Х представляет собой S.
В другом варианте осуществления R4 представляет собой С1-С6алкил, С3-С6циклоалкил, С2-С6алкенил, С(=О)фенил, С1-С6алкилфенил, Het-1 или (C1-C6алкил)Het-1.
В другом варианте осуществления R4 представляет собой С1-С6алкил, С1-С6алкилфенил, фенил или Het-1, где каждый замещен одним или несколькими заместителями, независимо выбираемыми из следующих: F, Cl, Br, I, CN, NO2, NRxRy, C1-C6алкил, С1-С6галогеналкил, С1-С6алкокси, С1-С6галогеналкокси, C3-C6циклоалкенил, S(=O)n(С1-С6алкил), S(=O)n(С1-С6галогеналкил), S(=O)2N(C1-C6алкил)2, C(=O)(C1-C6алкил), С(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), (C1-С6алкил)О(C1-C6алкил), фенил, О-Het-1 и Het-1.
Хотя были представлены данные варианты осуществления, возможны другие варианты осуществления и комбинации данных показанных вариантов осуществления и других вариантов осуществления.
ПОЛУЧЕНИЕ ТРИАРИЛЬНЫХ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ
Соединения данного изобретения могут быть получены приготовлением триарильного промежуточного продукта, Ar1-Het-Ar2, и затем присоединением его к требуемому промежуточному продукту для образования целевого соединения. Большое разнообразие триарильных промежуточных продуктов может быть использовано для получения соединений данного изобретения при условии, что такие триарильные промежуточные продукты содержат подходящую функциональную группу на Ar2, к которой может быть присоединен остаток целевого промежуточного продукта. Подходящие функциональные группы включают оксоалкильную или формильную группу. Данные триарильные промежуточные продукты могут быть получены способами, ранее описанными в химической литературе. Некоторые из данных способов описаны ниже.
Промежуточные продукты, в которых 'Het' представляет собой дизамещенный пиридин, пиримидин, пиразин или пиридизин, могут быть получены связыванием галоген- или алкилтиозамещенного пиридина, пиримидина или пиразина с арилбороновой кислотой или боратным сложным эфиром, в условиях арилирования Сузуки. См., например, следующее.
Для пиридинов: Couve-Bonnaire et al. Tetrahedron 2003, 59, 2793 и Puglisi et al. Eur. J. Org. Chem. 2003, 1552.
Для пиразинов: Schultheiss and Bosch Heterocycles 2003, 60, 1891.
Для пиримидинов: Qing et al. J. Fluorine Chem. 2003, 120, 21 и Ceide and Montalban Tetrahedron Lett. 2006, 47, 4415.
Для 2,4-диарилпиримидинов: Schomaker and Delia, J. Org. Chem. 2001, 66, 7125.
Таким образом, успешные арилирования, катализируемые палладием, с использованием 4-формилфенилбороновой кислоты и 4-трифторметоксифенилбороновой кислоты, могут приводить к фактически конкретным образцам замещения, как показано на схеме ниже:


условия:
а): 4-трифторметоксифенилбороновая кислота, (Ph3P)4Pd;
b): 4-формилфенилбороновая кислота, (Ph3P)4Pd
Подобно, диарилпиридины и пиразины и другие дигалогенированные гетероциклические ароматические соединения могут быть получены из дигалогенированных пиридинов и пиразинов и других дигалогенированных гетероциклических ароматическиих соединений при использовании аналогичного протокола:
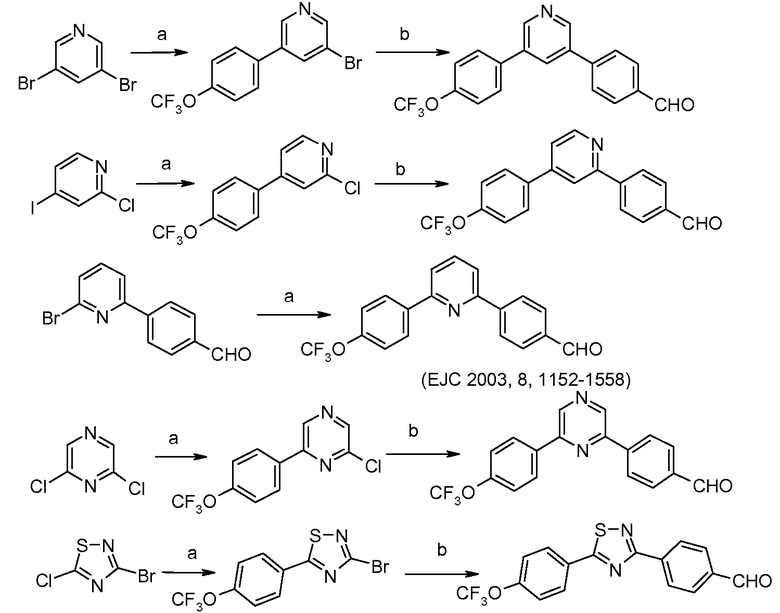
условия:
а): 4-трифторметоксифенилбороновая кислота, (Ph3P)4Pd;
b): 4-формилфенилбороновая кислота, (Ph3P)4Pd.
Галоген- или алкилтиопиримидиновые и пиридиновые предшественники являются коммерчески доступными или могут быть синтезированы способами, описанными в литературе (Rorig and Wagner U.S. Patent 3149109, 1964; Kreutzberger and Tesch Arzneim.-Forsch. 1978, 28, 235).
Промежуточные соединения, в которых 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазол, могут быть получены по одной из следующих схем.
Путь А: 1,3-Диарил-1,2,4-триазолы были получены из соответствующих-NH 3-арил-1,2,4-триазолов по опубликованному способу для N-арилирования имидазолов (Lin et al. J. Org. Chem. 1979, 44, 4160). Связывание 1,2,4-триазолов с арилгалогенидами было проведено при термальных условиях или, предпочтительно, в условиях микроволнового облучения (Antilla et al. J. Org. Chem. 2004, 69, 5578), (DIBAL представляет собой гидрид диизобутилалюминия).
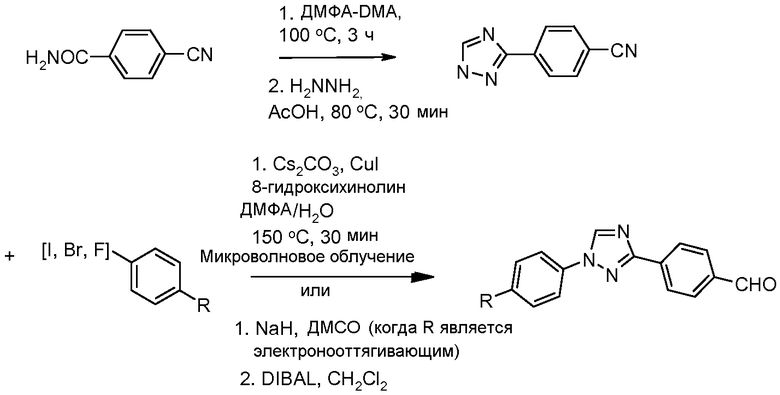
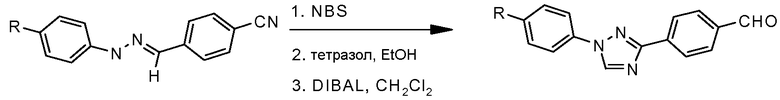
Путь В: Бромирование гидразонов с последующей обработкой бромгидразона тетразолом приводит к образованию 1,3-диарил-1,2,4-триазола (Butler and Fitzgerald J. Chem. Soc., Perkin Trans. 1 1988, 1587).
Соединения, где 'Het' представляет собой имидазол, могут быть получены по одной из следующих схем:
Путь А (Стадия 1: Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030. Стадия 2: Liu et al. J. Chem. Soc. 2005, 70, 10135):
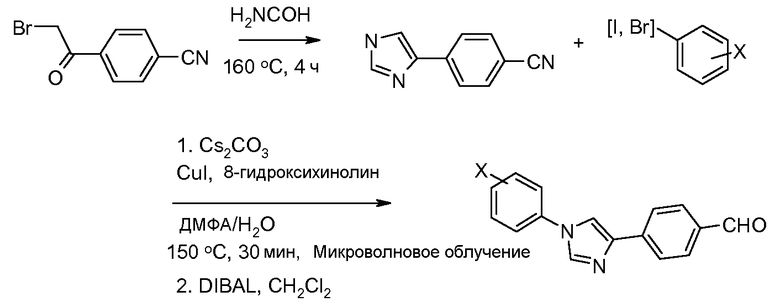
Путь В. Для галогенарильных групп, которые также содержат активирующую группу, такую как нитро или циано, замещение арилгалогенида имидазолом при использовании основания, такого как карбонат калия, в полярном апротонном растворителе, таком как N,N-диметилформамид (ДМФА) или диметилсульфоксид (ДМСО/DMSO), может быть выполнено следующим способом (Bouchet et al. Tetrahedron 1979, 35, 1331):

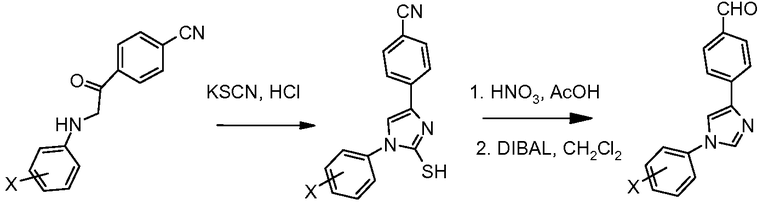
Путь С: По процедуре, впервые описанной Porretta et al. (Farmaco, Edizione Scientifica 1985, 40, 404), N-фенациланилин обработан тиоцианатом калия в кислой среде (HСl), и образовавшийся 2-меркаптоимидазол затем превращен в десульфурированный диарилимидазол обработкой азотной кислотой в уксусной кислоте.
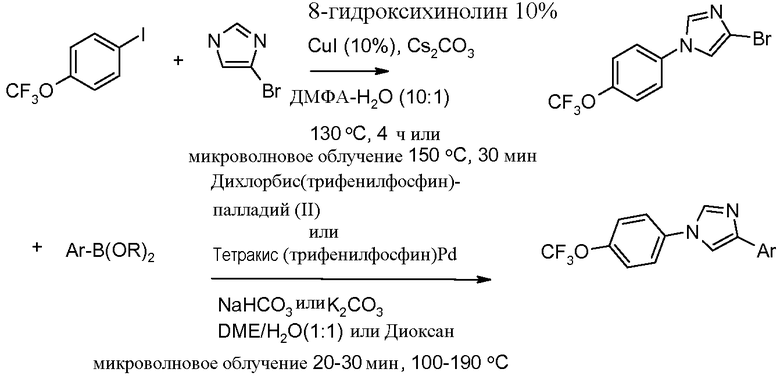
Путь D. N-Арилирование 4-бромимидазола в условиях микроволнового облучения (путь А, стадия 2) приводило к промежуточному продукту, 1-арил-4-бромимидазолу, который был превращен в триарильные промежуточные продукты обработкой арилбороновыми кислотами в условиях, катализируемых палладием.
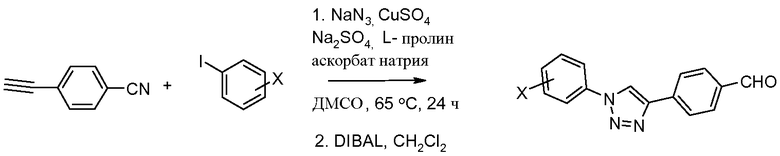
Соединения, где 'Het' представляет собой 1,4-дизамещенный 1,2,3-триазол, могут быть получены по следующей схеме (Feldman et al. Org. Lett. 2004, 6, 3897):
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазол, могут быть получены по следующей схеме (Yeung et al. Tetrahedron Lett. 2005, 46, 3429).
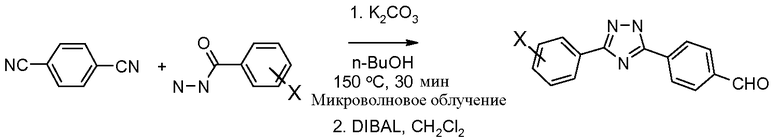
Соединения, где 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазолин-5-он, могут быть получены по следующей схеме (Pirrung and Tepper J. Org. Chem. 1995, 60, 2461 и Lyga Synth. Commun. 1986, 16, 163). (DPPA представляет собой дифенилфосфорилазид):
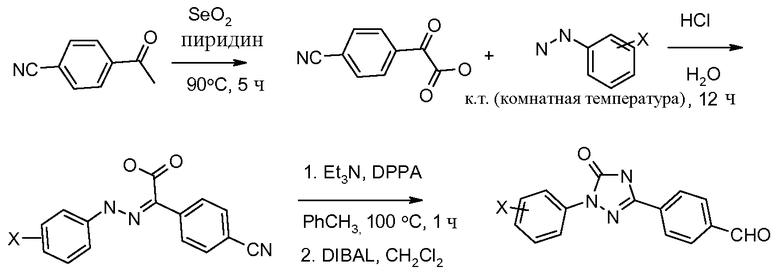
Соединения, где 'Het' представляет собой 1,3-диарилпиразолин, могут быть получены по следующей схеме. Моногидразон терефтальальдегида обрабатывают N-хлорсукцинимидом (NCS) в изопропиловом спирте (изо-PrOH) и образовавшийся хлоргидразоновый промежуточный продукт обрабатывают непосредственно основанием и замещенным олефином для образования пиразолина:
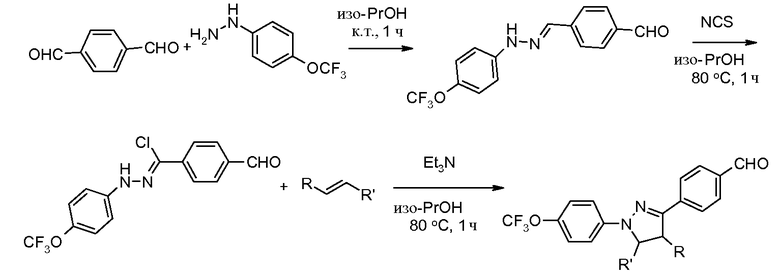
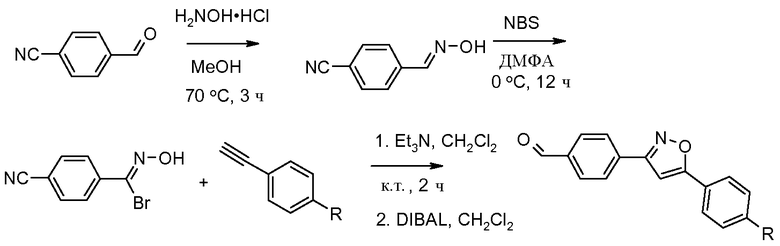
Соединения, где 'Het' представляет собой 3,5-дизамещенный изоксазол, могут быть получены по следующей схеме:
Соединения, где 'Het' представляет собой 1,3-дизамещенный пиразол, могут быть получены по следующей схеме. Связывание пиразола с галогенированной ароматикой выполняли при использовании условий микроволнового облучения, описанных Liu et al., путь А, вышеприведенная стадия 2. (DMA представляет собой диметилацеталь).


Соединения, где 'Het' представляет собой 1,4-дизамещенный пиразол, могут быть получены по следующей схеме. 4-Вромпиразол сначала связывают с иодфенильным аналогом и образовавшийся 1-арил-4-бромпиразол затем связывают с фенилбороновой кислотой при использовании условий, описанных ранее для арилирования имидазолов.

Соединения, где 'Het' представляет собой 2,4-дизамещенный тиазол, получены конденсацией тиоамида с α-галогенацетофеноном в протонном растворителе, таком как этанол (например, Potts and Marshall J. Org. Chem. 1976, 41, 129).

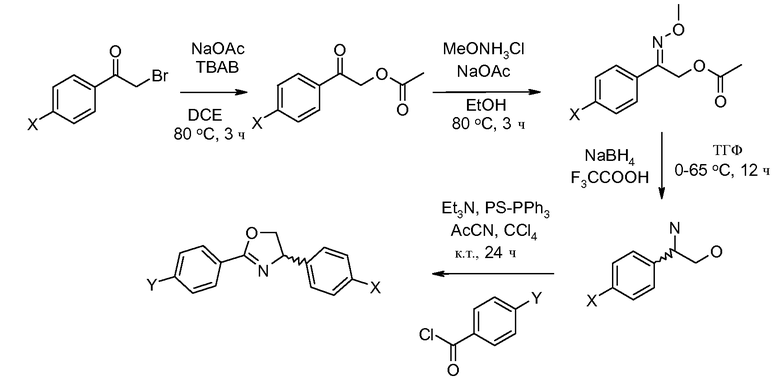
Соединения, где 'Het' представляет собой 2,4-дизамещенный оксазолин, получены, исходя из α-бромацетофенона по следующей схеме (Periasamy et al. Synthesis 2003, 1965 и Liu et al. J. Am. Chem. Soc. 2007, 129, 5834).
Соединения, где 'Het' представляет собой 2,5-дизамещенный оксазолин, получены по следующей схеме (Favretto et al. Tetrahedron Lett. 2002, 43, 2581 и Liu et al. J. Am. Chem. Soc. 2007, 129, 5834):

Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазин, получены по следующей схеме (Reid et al. Bioorg. Med. Chem. Lett. 2008, 18, 2455 и Saraswathi and Srinivasan Tetrahedron Lett. 1971, 2315):

ПОЛУЧЕНИЕ ГИДРАЗОНОВЫХ ПРОИЗВОДНЫХ
Гидразовые производные могут быть получены из соответствующих арилальдегидов или кетонов одним из трех способов: (А) взаимодействием с гидразином с последующим взаимодействием с арилизотиоцианатом в тетрагидрофуране (ТГФ/THF) при температурах от 0 до 100°С; (В) взаимодействием с метиловым эфиром гидразиндитиокарбоновой кислоты с последующим взаимодействием с амином в полярном апротонном растворителе, таком как ДМФА, при температурах от 25 до 150°С; или (С) взаимодействием с алкил или арилсемикарбазидом или тиосемикарбазидом, который является коммерчески доступным или может быть получен специалистом в данной области, в полярном протонном растворителе, таком как этиловый спирт (EtOH), при температуре от 0 до 100°С.


ПРИМЕРЫ
Примеры даются для целей иллюстрации и не должны рассматриваться как ограничение данного изобретения, описанного в настоящем документе, только до вариантов осуществления, раскрытых в данных примерах.
Исходные продукты, реагенты и растворители, которые были получены от коммерческих источников, использовали без дополнительной очистки. Безводные растворители были приобретены в виде Sure/Seal™ от Aldrich и были использованы как общепринято. Температуры плавления были получены на капиллярном приборе Thomas Hoover для определения температуры плавления или в автоматизированной системе для определения температуры плавления OptiMelt Automated Melting Point System от Sanford Research Systems и не откорректированы.
Пример 1: Получение 4-[1-(4-трифторметоксифенил)-1Н-пиррол-3-ил]-бензальдегида
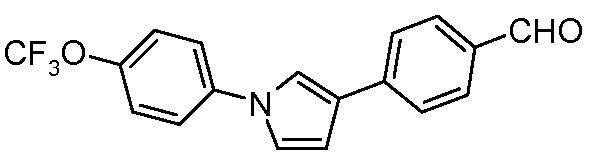
Стадия 1. 1-(4-Трифторметоксифенил)-1Н-пиррол. Данное соединение получали по Colotta et al. J. Am. Med. Chem. 2006, 49, 6015. Раствор 4-трифторметоксифениламина (500 миллиграммов (мг), 2,82 миллимолей (ммоль), 1,00 эквивалент (экв.)) и 2,5-диэтокситетрагидрофурана (452 мг, 2,82 ммоль, 1,00 экв.) в ледяной уксусной кислоте (20 миллилитров (мл)) нагревали при 90°С в течение 1 часа (ч) перед сушкой на силикагеле. Остаток затем суспендировали в гексане при кипячении с обратным холодильником, отфильтровывали и концентрировали досуха c получением целевого промежуточного продукта (519 мг, 81%).
Стадия 2. 3-Бром-1-(4-трифторметоксифенил)-1Н-пиррол. Соединение получали по Bray et al. J. Org. Chem. 1990, 55, 6317. К раствору 1-(4-трифторметоксифенил)-1Н-пиррола (519 мг, 2,29 ммоль, 1,00 экв.) в ТГФ (250 мл) при -78°С добавляли 0,05 М раствор N-бромсукцинимида (NBS; 408 мг, 2,29 ммоль, 1,00 экв.) в ТГФ в течение 45 минут (мин). Сосуд медленно нагревали до комнатной температуры перед концентрированием для получения сырого бромпиррола, который, как показано с помощью ГХ-МС, состоит из 55% целевого промежуточного продукта. Продукт использовали на последующей стадии без дополнительной очистки.
Стадия 3. 4-[1-(4-Трифторметоксифенил)-1Н-пиррол-3-ил]-бензальдегид. Суспензию сырого 3-бром-1-(4-трифторметоксифенил)-1Н-пиррола (356 мг, 1,26 ммоль, 1,00 экв.), 4-формилфенилбороновой кислоты (283 мг, 1,89 ммоль, 1,50 экв.), дихлорида бис(трифенилфосфин)палладия(II) (27 мг, 0,04 ммоль, 0,03 экв.), 2 М Na2CO3 (водн.) (1,26 мл, 2,52 ммоль, 2,0 экв.) и 1,4-диоксана (5 мл) нагревали при 150°С в реакционном сосуде с микроволновым облучением в течение 45 мин. Охлажденный раствор затем разбавляли с помощью EtOAc (20 мл), фильтровали через целит®, концентрировали досуха и очищали хроматографией (2:2:1, гексан:EtOAc:ацетон) с получением целевого промежуточного продукта (79 мг, 21%).
Пример 2: Получение 4-[1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразол-3-ил]-бензальдегида
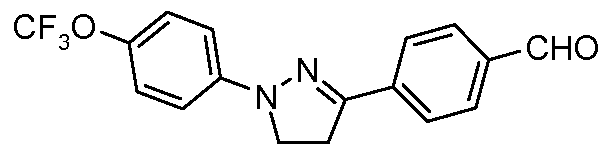
Стадия 1. 1-(4-Трифторметоксифенил)-пиразолидин-3-он: Данное соединение получали по Rees and Tsoi Chem. Commun. 2000, 415. Суспензию гидрохлорида (4-трифторметоксифенил)гидразина (300 мг, 1,32 ммоль, 1,00 экв.), 3-хлорпропионилхлорида (167 мг, 1,32 ммоль, 1,00 экв.) и PS-DIEA (1,30 грамм (г), 5,28 ммоль, 4,00 экв.) в ТГФ (20 мл) перемешивали при температуре окружающей среды в течение 12 ч. Раствор затем фильтровали, концентрировали досуха и очищали хроматографией (2:2:1, гексан:EtOAc:ацетон) с получением целевого промежуточного продукта (120 мг, 37%).
Стадия 2. 3-Хлор-1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразол: Общую процедуру использовали по Wang et al. Tetrahedron Lett. 2005, 46, 2631. К раствору 1-(4-трифторметоксифенил)пиразолидин-3-она (120 мг, 0,49 ммоль, 1,00 экв.) в толуоле (20 мл) медленно добавляли фосфорилхлорид (22,5 мг, 1,47 ммоль, 3,00 экв.). Смесь затем нагревали при 80°С в течение 1 ч перед охлаждением до комнатной температуры и гашением с помощью Н2О (10 мл). Содержимое сосуда затем перемешивали в атмосфере азота (N2) в течение 8 ч перед тем, как продукт экстрагировали в EtOAc (200 мл), сушили (MgSO4) и концентрировали при пониженном давлении. ГХ-МС давала 88% образование целевого промежуточного продукта, который использовали в последующих реакциях без дополнительной очистки.
Стадия 3. 4-[1-(4-Трифторметоксифенил)-4,5-дигидро-1Н-пиразол-3-ил]-бензальдегид: Суспензию 3-хлор-1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразола (114 мг, 0,43 ммоль, 1,00 экв.), 4-формилфенилбороновой кислоты (97 мг, 0,65 ммоль, 1,50 экв.), дихлорида бис(трифенилфосфин)палладия(II) (10 мг, 0,01 ммоль, 0,03 экв.), 2 М Na2CO3 (водн.) (0,43 мл, 0,86 ммоль, 2,0 экв.) и 1,4-диоксана (5 мл) нагревали при 150°С в реакционном сосуде с микроволновым облучением в течение 45 мин. Охлажденный раствор затем разбавляли с помощью EtOAc (20 мл), фильтровали через целит®, концентрировали досуха и очищали хроматографией (2:2:1, гексан:EtOAc:ацетон) с получением целевого промежуточного продукта (50 мг, 0,15 ммоль, 31%).
Пример 3: Получение 4-[1-(4-трифторметоксифенил)-1Н-пиразол-4-ил]-бензальдегида
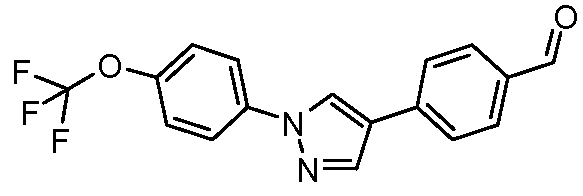
Стадия 1. 4-Бром-1-(4-трифторметоксифенил)-1Н-пиразол. 4-Бромпиразол (1,5 г, 10 ммоль) и 4-иодтрифторметоксибензол (3,0 г, 10,3 ммоль) перемешивали в ДМФА (8 мл) и обрабатывали фосфатом калия (6,3 г, 30 ммоль) и CuI (0,5 г, 2,6 ммоль). Раствор перемешивали и нагревали до 130°С в течение 30 мин, затем его охлаждали при температуре окружающей среды и выливали в 1 н. NH4OH (50 мл). Твердый осадок выделяли фильтрованием, перерастворяли в простом эфире, фильтровали и концентрировали до желтовато-коричневого твердого вещества. Перекристаллизация из EtOH давала не совсем белое твердое вещество (2,1 г): т.пл. 63-65°С; ЖХМС 308,6 (М+1).
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1Н-пиразол-4-ил]-бензальдегид. Суспензию бромпиразола (0,31 г, 1 ммоль) и 4-формилбороновой кислоты (0,15 г, 1 ммоль), 2 М водного раствора карбоната калия (1 мл) и тетракис(трифенилфосфин)палладия(0) (35 мг, каталитический) в диоксане (6 мл) нагревали до 150°С в реакторе с микроволновым облучением. Остаток затем концентрировали в вакууме и очищали хроматографией (0-100% EtOAc-гексаны) с получением указанного в заголовке соединения (175 мг) в виде желтовато-коричневого твердого вещества: т.пл. 107-109°С; ЖХМС 332,8 (М+1).
Пример 4: Получение 4-[5-(4-пропилфенил)изоксазол-3-ил]-бензальдегида

Стадия 1. 4-(Гидроксииминометил)бензонитрил. Данное соединение получали по Biasotti et al. Bioorg. Med. Chem. 2003, 11, 2247. Суспензию 4-формилбензонитрила (500 мг, 3,81 ммоль, 1,00 экв.), гидрохлорида гидроксиламина (290 мг, 4,19 ммоль, 1,10 экв.) и ацетата натрия (1,56 г, 19,05 ммоль, 5,00 экв.) в МеОН (50 мл) нагревали при 70°С в течение 4 ч перед концентрированием досуха. Остаток затем суспендировали в Et2O, фильтровали и концентрировали с получением целевого промежуточного продукта (496 мг, 3,39 ммоль, 89%).
Стадия 2. 4-(Гидроксииминобромметил)бензонитрил. Данное соединение получали по Tanaka et al. Bull. Chem. Soc. Jpn. 1984, 57, 2184. 0,05 М раствор N-бромсукцинимида (724 мг, 4,07 ммоль, 1,20 экв.) в СН2Сl2 добавляли по каплям при 0°С к раствору 4-(гидроксииминометил)бензонитрила (496 мг, 3,39 ммоль, 1,00 экв.) в СН2Сl2 (50 мл). Раствор нагревали до комнатной температуры перед распределением по объему между двумя различными реакционными сосудами. Содержимое каждого сосуда затем концентрировали и сырые остатки использовали без дополнительной очистки.
Стадия 3. 4-[5-(4-Пропилфенил)изоксазол-3-ил]-бензонитрил. Раствор 4-(гидроксииминобромметил)бензонитрила (381 мг, 1,7 ммоль), триэтиламина (0,71 мл, 5,10 ммоль, 3,0 экв.) и 1-этинил-4-пропилбензола (1,24 г, 8,50 ммоль, 5,0 экв.) в толуоле (20 мл) нагревали при 100°С в течение 1 ч перед концентрированием досуха. Очистка хроматографией с нормальной фазой давала целевой промежуточный продукт (108 мг, 22%). Восстановление нитрила до соответствующего альдегида выполняли по методике с использованием DIBAL, описанной ранее.
Пример 5: Получение 4-{1-[4-(1-гидроксипропил)фенил]-1H-пиразол-3-ил}-бензальдегида
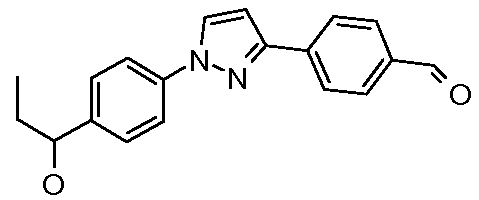
Стадия 1. 3-(4-Цианофенил)пиразол. В круглодонную колбу, снабженную механической мешалкой и парциальным конденсатором горячего орошения, добавляли п-цианоацетофенон (5 г, 34,44 ммоль) и диметилформамид-диметилацеталь (ДМФА-DMA; 40 мл). Смесь перемешивали при кипячении с обратным холодильником в течение 5 ч перед концентрированием при пониженном давлении с получением сырого промежуточного продукта, диметиламиноакрилоилбензонитрила. Остаток затем суспендировали в минимальном объеме EtOH (~20 мл), загружали моногидратом гидразина (1,67 мл, 34,4 ммоль) и нагревали при 80°С в течение 30 мин перед концентрированием. Сырой продукт, 3-(4-цианофенил)пиразол (5,59 г, 33 ммоль, 96%), который выделяли, был достаточной чистоты для использования в следующей реакции.
Стадия 2. 4-[1-(4-Пропионилфенил)-1H-пиразол-3-ил]бензонитрил. 4-(1Н-Пиразол-3-ил)бензонитрил (100 мг, 0,59 ммоль), 1-(4-бромфенил)пропан-1-он (126 мг, 0,591 ммоль), Cs2CO3 (770 мг, 2,364 ммоль), CuI (4 мг, 0,018 ммоль), 8-гидроксихинолин (3 мг, 0,018 ммоль) и ДМФА/Н2О (2 мл; раствор при соотношении 10:1) объединяли в 10 мл СЕМ реакционном сосуде с микроволновым облучением, снабженном магнитной мешалкой, и подвергали микроволновому облучению при 150°С в течение 30 мин. Затем содержимое фильтровали и концентрировали досуха с получением нитрила (158 мг, 0,508 ммоль, 86%). Восстановление нитрила до соответствующего альдегида выполняли по методике с использованием DIBAL, описанной ранее.
Пример 6: Получение диэтилового сложного эфира 5-(4-формилфенил)-2-(4-трифторметоксифенил)-3,4-дигидро-2Н-пиразол-3,4-дикарбоновой кислоты.
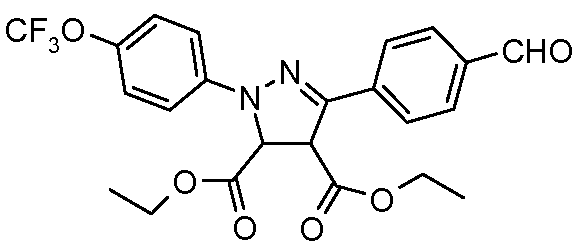
Стадия 1. Получение 4-[(4-трифторметоксифенил)гидразонометил]бензальдегида. Данное соединение получали по Paulvannan et al. Tetrahedron 2000, 56, 8071. К перемешиваемому раствору бензол-1,4-дикарбальдегида (1,50 г, 11,2 ммоль, 1,0 экв.) в изо-PrOH (250 мл) добавляли порциями гидрохлорид 4-трифторметоксифенилгидразина (2,55 г, 11,2 ммоль, 1,0 экв.) в течение 5 мин. Раствор перемешивали при температуре окружающей среды в течение 1 ч перед концентрированием досуха и очисткой хроматографией (2:2:1 гексан:EtOAc:ацетон) с получением промежуточного продукта (2,48 г, 72%).
Стадия 2. Синтез хлоргидразона. Данный промежуточный продукт получали по Lokanatha Rai and Hassner Synth. Commun. 1989, 19, 2799. Раствор 4-[(4-трифторметоксифенил)гидразонометил]бензальдегида (2,48 г, 8,05 ммоль, 1,0 экв.) и N-хлорсукцинимида (1,61 г, 12,08 ммоль, 1,5 экв.) в изо-PrOH (100 мл) нагревали при 80°С в течение 1 ч. Затем раствор охлаждали и распределяли по объему равномерно между шестью различными реакционными сосудами с содержанием в каждом 1,34 ммоля промежуточного продукта.
Стадия 3. Пиразолиновый синтез. Данные соединения получали по Paulvannan et al. Tetrahedron 2000, 56, 8071. В каждый реакционный сосуд добавляли триэтиламин (0,56 мл, 4,02 ммоль, 3,00 экв.) и соответствующие акрилаты (6,70 ммоль, 5,00 экв.). Реакционную смесь затем нагревали при 70°С в течение 90 мин перед концентрированием досуха и очисткой хроматографией (2:2:1, гексан:EtOAc:ацетон). Восстановление нитрилов до соответствующих альдегидов выполняли по методике с использованием DIBAL, описанной ранее.
Пример 7: Получение 4-{1-[4-(2,2,2-трифторэтокси)фенил]-1Н-имидазол-4-ил}бензальдегида

4-(2-Бромацетил)бензонитрил (58 мг, 0,21 ммоль) и 4-(2,2,2-трифторэтокси)фениламин (50 мг, 0,21 ммоль) объединяли в 100 мл колбе Эрленмейера, снабженной магнитной мешалкой. Содержимое растворяли в EtOH (1 мл) и перемешивали при температуре окружающей среды в течение 2 ч. Сырой промежуточный продукт затем переносили в 100 мл круглодонную колбу, содержащую KSCN (21 мг, 0,21 ммоль) и конц. HCl (18 мкл, 0,21 ммоль). Сосуд нагревали при 80°С в течение 1 ч, прежде чем его содержимое выливали в раствор 1:1 Н2О/NH4OH (5 мл). Раствор выдерживали при стоянии в течение 24 ч, затем твердое вещество фильтровали и промывали простым эфиром с получением промежуточного имидазолтиола (32 мг, 0,086 ммоль, 33%). Затем к суспензии имидазолтиола в уксусной кислоте (2 мл) добавляли по каплям водный раствор HNO3 (1,35 мл, 0,837 ммоль) и KNO3 (1 мг, 0,003 ммоль) в течение 10 мин. После перемешивания в течение 2 ч при температуре окружающей среды раствор выливали в измельченный лед и нейтрализовали (рН 7) 0,1 Н гидроксидом натрия (NaOH, водн.). Промежуточный нитрил выделяли фильтрованием в вакууме и сушили в вакуумной печи при 45°С в течение 12 ч (23 мг, 78%), т.пл. 179°С. Восстановление до соответствующего альдегида выполняли с использованием DIBAL в условиях, описанных ранее.
Пример 8: Получение 4-[1-(4-пропилфенил)-1Н-имидазол-4-ил]бензальдегида

4-Пропиланилин (2,70 г, 20 ммоль) добавляли по каплям к раствору 4-цианофенацилбромида (2,20 г, 10 ммоль) в ДМФА (5 мл). Данный раствор затем добавляли к нагретому (180°С) формамиду (20 мл) в течение 5 мин и объединенному раствору позволяли перемешиваться при 180°С в течение 2 ч. Охлажденный раствор затем выливали в ледяную воду (100 мл) и экстрагировали простым эфиром (2×75 мл). После сушки и концентрирования образовавшееся темное масло очищали хроматографией (3:1:2, гексаны:EtOAc:CH2Cl2). Первый продукт идентифицировали как 4-(5-пропил-1Н-индол-3-ил)бензонитрил, т.пл. 140°С. Вторую фракцию (275 мг) идентифицировали как целевой имидазол: т.пл. 133°С; 1H ЯМР (400 МГц, CDCl3) δ 7,95 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,70 (д, J=6 Гц, 2H), 7,68 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Гц, 2H), 1,68 (м, 2H), 0,98 (т, J=7,5 Гц, 3H); ESIMC m/z 288,1 (М+Н).
Восстановление до соответствующего альдегида выполняли с использованием DIBAL, в условиях, описанных ранее: т.пл. 97°С; 1H ЯМР (300 МГц, CDCl3) δ 10,02 (с, 1H), 8,03 (д, J=6 Гц, 2H), 7,92 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,72 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Гц, 2H), 1,68 (м, 2H), 0,98 (т, J=7,5 Гц, 3H); ESIMC m/z 291,1 (М+Н).
Пример 9. Получение 4-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]бензальдегида

4-Трифторметоксианилин (2,20 г, 12,4 ммоль) добавляли по каплям к раствору 4-цианофенацилбромида (1,50 г, 6,7 ммоль) в ДМФА (5 мл). Данный раствор затем добавляли к нагретому (180°С) формамиду (20 мл) в течение 5 мин и объединенному раствору позволяли перемешиваться при 180°С в течение 2 ч. Охлажденный раствор затем выливали в ледяную воду (100 мл) и экстрагировали простым эфиром (2×75 мл). После сушки и концентрирования образовавшееся полутвердое вещество кристаллизовали из МеОН/Н2О. Вторая перекристаллизация из МеОН/Н2О удаляла следы примеси форманилида и давала чистый продукт (200 мг): т.пл. 155°С. Вычислено для С17Н10F3N3O: C, 62,01; H, 3,06; N, 12,76. Найдено: C, 61,53; H, 3,13; N, 12,55. Восстановление до соответствующего альдегида выполняли с использованием DIBAL в условиях, описанных ранее: т.пл. 112°С; 1H ЯМР (300 МГц, CDCl3) δ 10,0 (с, 1H), 8,05-7,90 (м, 5H), 7,70 (с, 1H), 7,50 (д, J=6 Гц, 2H), 7,42 (д, J=6 Гц, 2H); ESIMC m/z 333,0 (М+Н).
Пример 10. Получение 4-[4-(4-трифторметилфенил)-1Н-имидазол-1-ил]бензальдегида

4-Трифторметилфенилимидазол (4,0 г, 19 ммоль), 4-фторбензонитрил (1,2 г, 8,5 ммоль) и карбонат калия (1,5 г, 10,9 ммоль) объединяли в ДМСО (15 мл) и нагревали при 100°С в течение 6 ч. Охлажденный раствор затем выливали в воду (Н2О; 100 мл) и образовавшееся твердое вещество фильтровали и сушили на воздухе с получением имидазолнитрила (4,65 г) в виде белого твердого вещества: т.пл. 252°С; 1H ЯМР (300 МГц, CDCl3) δ 8,05 (с, 1H), 7,95 (д, J=8 Гц, 2H), 7,85 (д, J=8 Гц, 2H), 7,72 (с, 1H), 7,72 (д, J=8 Гц, 2H), 7,62 (д, J=8 Гц, 2H); ESI-MС m/z 314,1 (М+Н). Вычислено для С16Н10F3N3O2: C, 65,18; H, 3,22; N, 13,41. Найдено: C, 64,49; H, 3,23; N, 13,08. Часть нитрила (3,8 г) восстанавливали с использованием DIBAL в условиях, описанных ранее, с получением соответствующего альдегида (2,41 г): т.пл. 141°С; 1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,10 (д, J=8 Гц, 2H), 8,05 (с, 1H), 7,95 (д, J=8 Гц, 2H), 7,75 (с, 1H), 7,7 (м, 4H); ESIMC m/z 317,1 (М+Н).
Пример 11. Получение 4-бром-1-(4-трифторметоксифенил)-1Н-имидазола

В круглодонную колбу помещали 4-бромимидазол (1,15 г, 7,81 ммоль), CuI (0,07 г, 0,36 ммоль), 8-гидроксихинолин (0,05 г, 0,36 ммоль), карбонат цезия (3,39 г, 10,4 ммоль) и 4-трифторметоксииодбензол (1,50 г, 5,21 ммоль). К реакционной смеси добавляли 10:1 смесь ДМФА (15 мл) и Н2О (1,5 мл) и раствор нагревали при 130°С в течение 4 ч. Реакционную смесь затем разбавляли EtOAc и промывали последовательно Н2О, хлоридом аммония (NH4Cl, насыщенный), Н2О и бикарбонатом натрия (NaHCO3). Органику сушили над MgSO4, фильтровали и очищали колоночной хроматографией с обращеннной фазой с получением имидазола (820 мг) в виде белого твердого вещества: т.пл. 139-141°С; ESI-МС m/z 308,0 (M+H).
Пример 12. Получение 4-метокси-2-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]бензальдегида
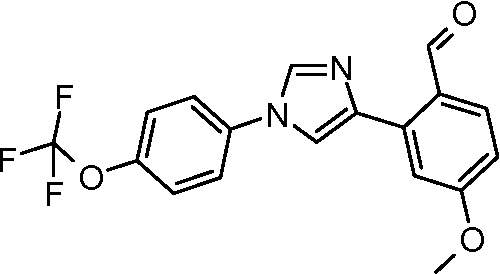
4-Бром-1-(4-трифторметоксифенил)-1Н-имидазол (100 мг, 0,326 ммоль), 2-формил-5-метоксифенилбороновую кислоту (73 мг, 0,41 ммоль), дихлорид бис(трифенилфосфин)палладия (2 мг, 0,003 ммоль), NaHCO3 (49 мг, 0,59 ммоль) и 1:1 DME/H2О ((8:8 мл) объединяли и добавляли в емкость с микроволновым облучением. Реакционную смесь нагревали при микроволновом облучении с перемешиванием при 100°С в течение 12 мин. Микроволновое облучение давалось 5 мин для достижения 100°С, затем сохранялось при 100°С в течение 12 мин, и затем было охлаждение. ТСХ (1:1 EtOAc:циклогексан) показала присутствие исходных продуктов, поэтому образец нагревали до 100°С в течение дополнительных 8 мин. При охлаждении образовался осадок, его фильтровали и промывали с помощью Н2О, получая серое твердое вещество (86 мг): ESI-МС m/z 363,0 (M+H).
Следующие промежуточные продукты также получали при использовании данной процедуры:
Пример 13. Получение 2-фтор-4-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]бензальдегида
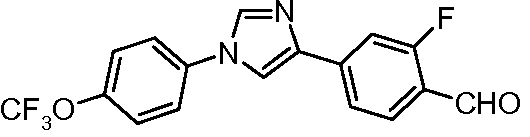
ESI-МС m/z 351,0 (M+H).
Пример 14. Получение 1-{4-фтор-3-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]фенил}этанона
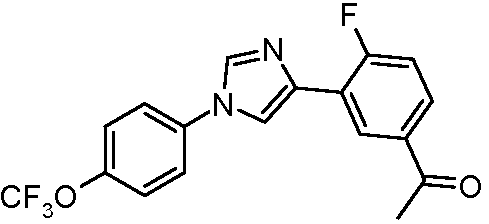
4-Бром-1-(4-трифторметоксифенил)-1Н-имидазол (200 мг, 0,651 ммоль), 5-ацетил-2-фторфенилбороновую кислоту (178 мг, 0,977 ммоль), тетракис(трифенилфосфин)палладий(0) (7 мг, 0,007 ммоль), 2 н. водный раствор карбоната калия (0,651 мл) и диоксан (8 мл) объединяли и добавляли в емкость с микроволновым облучением. Реакционную смесь нагревали при микроволновом облучении с перемешиванием при 150°С в течение 20 мин. ЖХ-МС показала 88% ожидаемого продукта; ТСХ (1:1 гексаны:EtOAc) показала присутствие исходного продукта плюс 3 других продукта. В реакционную смесь добавляли EtOAc и Н2О. Водный слой экстрагировали с помощью EtOAc и органические экстракты промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме. Сырой продукт очищали хроматографией с градиентным элюированием (100% гексаны до 100% EtOAc), получая не совсем белое твердое вещество (90 мг): т.пл. 129°С; ESI-МС m/z 265,0 (M+H).
Пример 15. Получение 4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]бензальдегида

Стадия 1. 4-(1Н-[1,2,4]Триазол-3-ил)бензонитрил. Использовали общую процедуру, обозначенную Lin et al. (J. Org. Chem. 1979, 44, 4163), для получения 3-(4-нитрофенил)-1Н-[1,2,4]триазола. 4-Цианобензамид (21,63 г, 0,148 моль) растворяли в ДМФА-DMA (100 мл) и перемешивали при кипячении с обратным холодильником в атмосфере N2 в течение 8 ч. Смесь концентрировали досуха и суспендировали в AcOH (50 мл). В сосуд затем помещали моногидрат гидразина (7,18 мл, 0,148 ммоль) и перемешивали при кипячении с обратным холодильником в течение 1 ч перед концентрированием. Целевой 4-(1Н-[1,2,4]триазол-3-ил)бензонитрил получали с 98% чистотой растиранием в порошок с Et2O c последующим фильтрованием (12,17 г, 0,072 моль, 48%).
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]бензонитрил. Триазол (70 мг, 0,41 ммоль), 1-иод-4-трифторметоксибензол (142 мг, 0,493 ммоль), Cs2CO3 (535 мг, 1,644 ммоль), CuI (3 мг, 0,012 ммоль), 8-гидроксихинолин (2 мг, 0,012 ммоль) и ДМФА/Н2О (2 мл; 10:1 раствор) объединяли в 10 мл СЕМ микроволновом реакционном сосуде, снабженном магнитной мешалкой, и подвергали микроволновому облучению при 150°С в течение 30 мин. Затем содержимое фильтровали и концентрировали досуха с получением 1,3-дифенитриазольного промежуточного продукта, (18 мг, 13%).
Стадия 3. 4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]бензальдегид. Нитрил восстанавливали с использованием DIBAL в условиях, описанных ранее: т.пл. 137-140°С; 1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,61 (с, 1H), 8,37 (д, J=9 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,8 (д, J=9 Гц, 2H), 7,4 (д, J=8,4 Гц, 2H); ESI-MC m/z 334,2 (М+Н).
Пример 16: Получение 4-[1-(4-пентафторэтилсульфанилфенил)-1Н-[1,2,4]триазол-3-ил]бензальдегида

Стадия 1. 1-Бром-4-пентафторэтилсульфанилбензол. Указанное в заголовке соединение получали, применяя условия перфторалкилирования, первоначально описанные Popov et al. J. Fluorine Chem. 1982, 21, 365. В раствор 4-бромбензолтиола (500 мг, 2,64 ммодь, 1,0 экв.) и хлорида триэтилбензиламмония (60 мг, 0,26 ммоль, 0,10 экв.) в 10 мл 1:1 Et2O/NaOH (25% водн.) при 0°С барботировали газ 1,1,1,2,2-пентафтор-2-иодэтана в течение 30 мин (>5 экв.). В течение данного времени на реакционный сосуд направляли УФ-лампу, хотя температуру поддерживали ниже 10°С периодическим использованием ледяной бани. Содержимое затем нагревали до комнатной температуры, экстрагировали в Et2O (300 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Часть данного сырого продукта использовали для последующих реакций без дополнительной очистки (остаток 200 мг: 120 мг продукта, 0,39 ммоль, 1,2 экв.).
Стадия 2. 4-[1-(4-Пентафторэтилсульфанилфенил)-1Н-[1,2,4]триазол-3-ил]бензонитрил. Связывание с 4-(1Н-[1,2,4]триазол-3-ил)бензонитрилом, как описано выше, давало 4-[1-(4-пентафторэтилсульфанилфенил)-1Н-[1,2,4]триазол-3-ил]бензонитрил (70 мг, 46%). Восстановление с помощью DIBAL, как описано ранее, давало соответствующий альдегид.
Пример 17: Получение 4-[1-(4-пентафторэтилоксифенил)-1Н-[1,2,4]триазол-3-ил]бензальдегида
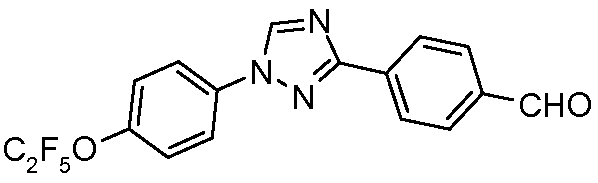
Стадия 1. Раствор 3-п-толил-1Н-[1,2,4]триазола (4,85 г, 30,5 ммоль), 4-бромфенилпентафторэтилового простого эфира (10 г, 34,4 ммоль), Cs2CO3 (25 мг, 77 ммоль), CuI (1,25 г, 6,5 ммоль) и 8-гидроксихинолина (0,35 г, 2,4 ммоль) в 9:1 ДМФА/Н2О (50 мл) интенсивно перемешивали и нагревали до 130°С (внутренняя температура) в течение 20 ч. Раствор затем охлаждали, выливали в Н2О и подкисляли с помощью 2 н. HCl до рН 2. Затем добавляли простой эфир (250 мл) и раствор встряхивали и фильтровали перед разделением слоев. Органический слой сушили и концентрировали, и образовавшееся вязкое твердое вещество нагревали с гексанами (100 мл). Теплый гексановый слой декантировали от нерастворимого остатка, образовавшийся раствор охлаждали до 0°С и осажденное твердое вещество фильтровали и сушили на воздухе с получением 1-(4-пентафторэтилоксифенил)-3-п-толил-1Н-[1,2,4]триазола (7,0 г, 61% в расчете на исходный триазол) в виде не совсем белого твердого вещества: т.пл. 130-132°С; ESI-МС m/z 370,8 (M+H).
Стадия 2. Продукт со стадии 1 (7,0 г, 18,7 ммоль) растворяли в ацетонитриле (200 мл) и перемешивали при температуре окружающей среды, в то время как добавляли порциями нитрат аммония церия (32 г, 58 ммоль) в Н2О (60 мл) в течение 10 мин. Затем раствор нагревали при кипячении с обратным холодильником в течение 4 ч, охлаждали и разбавляли с помощью Н2О (200 мл). Раствор экстрагировали простым эфиром (2×200 мл), и объединенный органический слой сушили и концентрировали с получением оранжевого масла. Данный продукт растворяли в диоксане (40 мл) и обрабатывали раствором гидроксида калия (КОН; 5 г, 90 ммоль) в Н2О (20 мл). Раствор нагревали при кипячении с обратным холодильником в течение 2 ч, затем охлаждали и разбавляли с помощью Н2О (100 мл). Осаждался альдегид и его собирали фильтрованием. Перекристаллизация из МеОН/Н2О давала чистый альдегид в виде белого твердого вещества (2,2 г, 30%): т.пл. 137-144°С; 1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H); ESI-MC m/z 384,2 (М+Н).
Пример 18: Получение 4-[1-(4-бутилфенил)-1Н-[1,2,4]триазол-3-ил]бензальдегида

Стадия 1. 4-[1-(4-Бутилфенил)-1Н-[1,2,4]триазол-3-ил]бензонитрил. Раствор 4-н-бутилфенилгидразина (1,0 г, 5 ммоль) и 4-цианобензальдегида (0,8 г, 6,0 ммоль) в изо-PrOH (15 мл) нагревали на паровой бане в течение 2 ч и затем охлаждали и разбавляли с помощью Н2О (5 мл). Образовавшееся оранжевое твердое вещество фильтровали и сушили на воздухе с получением гидразона (1,30 г) в виде желтого твердого вещества, т.пл. 107°С. Раствор данного гидразона (1,1 г, 4,0 ммоль) и NCS (0,67 г, 5 ммоль) в изо-PrOH (20 мл) перемешивали в атмосфере азота при температуре окружающей среды в течение 2 ч, в течение данного времени первоначальное твердое вещество растворялось и образовалось новое твердое вещество. Полученный оранжевый раствор затем обрабатывали тетразолом (0,45 г, 6,4 ммоль) и триэтиламином (960 мкл, 7,0 ммоль). Оранжево-коричневый раствор нагревали при кипячении с обратным холодильником в течение 2 ч. Затем раствор охлаждали, разбавляли с помощью Н2О (250 мл), экстрагировали с помощью EtOAc, сушили, концентрировали и очищали хроматографией (Biotage, 4:1 гексан:EtOAc) с получением триазола (0,42 г, 35%) в виде не совсем белого твердого вещества: т.пл. 124°С; 1H ЯМР (300 МГц, CDCl3) δ 8,58 (с, 1H), 8,33 (д, J=8 Гц, 2H), 7,78 (д, J=8 Гц, 2H), 7,64 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (м, 2H), 1,38 (м, 2H), 0,95 (т, J=7,5 Гц, 3H); ESI-MC m/z 303,1.
Стадия 2. 4-[1-(4-Бутилфенил)-1Н-[1,2,4]триазол-3-ил]бензальдегид. Восстановление с использованием DIBAL, как описано ранее, давало соответствующий альдегид: т.пл. 124°С; 1H ЯМР (300 МГц, CDCl3) δ 10,08 (с, 1H), 8,58 (с, 1H), 8,37 (д, J=8 Гц, 2H), 7,98 (д, J=8 Гц, 2H), 7,62 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (м, 2H), 1,38 (м, 2H), 0,95 (т, J=7,5 Гц, 3H); ESI-MC m/z 306,1.
Пример 19: Получение 4-[1-(4-пентафторэтилфенил)-1Н-[1,2,4]триазол-3-ил]бензальдегида

Стадия 1. 1-(4-Пентафторэтилфенил)-3-п-толил-1Н-[1,2,4]триазол. Пентафторэтилиодид (521 мг, 2,12 ммоль) подвергали конденсации в сосуде, содержащем 1-бром-4-иодбензол (300 мг, 1,06 ммоль), порошок меди(0) (135 мг, 2,12 ммоль) и ДМСО (5 мл). Сосуд затем герметизировали и подвергали микроволновому облучению при 150°С в течение 60 мин. ГХ-МС контролировала потребление исходного продукта, приводящее как к 1-бром-4-пентафторэтилбензольному, так и к 1-иод-4-пентафторэтилбензольному промежуточным продуктам. Cмесь (1,06 ммоль) переносили в 250 мл круглодонную колбу и добавляли 3-п-толил-1Н-[1,2,4]триазол (169 мг, 1,06 ммоль), Cs2CO3 (1,38 г, 4,24 ммоль), CuI (202 мг, 1,06 ммоль), 8-гидроксихинолин (2 мг, 0,011 ммоль) и ДМФА/Н2О (12 мл; раствор 10:1). Раствор перемешивали при кипячении с обратным холодильником при 160° в течение 6 ч. После завершения охлажденное содержимое выливали в Н2О и оставляли для осаждения на 1 ч. Осадок собирали фильтрованием в вакууме и сушили в течение ночи в вакуумной печи при 45°С. Сырой промежуточный продукт, 1-(4-пентафторэтилфенил)-3-п-толил-1Н-[1,2,4]триазол, использовали на стадии 2 без дополнительной очистки.
Стадия 2. Окисление до альдегида. Нитрат аммония церия(IV) (3,32 г, 4,24 ммоль) и промежуточный продукт со стадии 1 объединяли в круглодонной колбе с ацетонитрилом и Н2О (20 мл; 1:1). Раствор перемешивали при кипячении с обратным холодильником при 110° в течение 4 ч, получая смесь промежуточных продуктов, 3-(4-нитрооксиметилфенил-1-(4-пентафторэтилфенил)-1Н-[1,2,4]триазола и 4-[1-(4-пентафторэтилфенил)-1Н-[1,2,4]триазол-3-ил]бензальдегида. Ацетонитрил удаляли в вакууме и сырые осадки промежуточных продуктов собирали фильтрованием. Продукт затем объединяли с порошкообразным КОН (178 мг, 3,18 ммоль) в диоксане и Н2О (10 мл; 1:1) и перемешивали при кипячении с обратным холодильником при 105° в течение 90 мин, перед тем как диоксан удаляли в вакууме с предоставлением возможности для освобождения промежуточного продукта от Н2О. Промежуточный продукт, 4-[1-(4-пентафторэтилфенил)-1Н-[1,2,4]триазол-3-ил]бензальдегид, собирали фильтрованием (35 мг, 0,095 ммоль, 9% суммарно от 4-толилтриазола).
Пример 20: Получение сложного 4-[3-(4-формилфенил)[1,2,4]триазол-1-ил]фенилового эфира трифторметансульфоновой кислоты
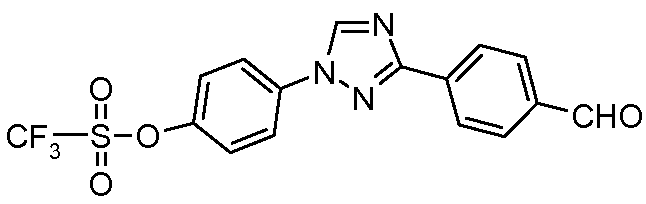
Стадия 1. 1-(4-Метоксифенил)-3-п-толил-1Н-[1,2,4]триазол получали конденсацией 3-п-толил-1Н-[1,2,4]триазола с 4-иоданизолом в условиях, описанных для стадии 1 предыдущего примера. Данный продукт затем деметилировали при использовании условий, описанных Hitchcock et al. Synlett 2006, 2625. Трибромид бора (1 М раствор в гексанах; 1,67 мл, 1,67 ммоль) добавляли по каплям к раствору 1-(4-метоксифенил)-3-п-толил-1Н-[1,2,4]триазола (300 мг, 1,28 ммоль) в СН2Сl2 (10 мл) при 0°С в атмосфере N2. После завершения добавления сосуд нагревали до температуры окружающей среды перед кипячением с обратным холодильником при 40°С в течение 6 ч. Охлажденное содержимое затем гасили с помощью Н2О перед удалением СН2Сl2 и распределением между EtOAc и Н2О. Органический слой собирали, промывали насыщенным солевым раствором, сушили (MgSO4), концентрировали и очищали хроматографией (3:1:1, гексаны:EtOAc:ацетон) с получением промежуточного продукта, 4-(3-п-толил[1,2,4]триазол-1-ил)фенола (219 мг, 0,872 ммоль, 68%). Ангидрид трифторметансульфоновой кислоты (0,16 мл, 0,96 ммоль) добавляли по каплям к раствору фенола и 4-трет-бутил-2,6-диметилпиридина (142 мг, 0,872 ммоль) в СН2Сl2 (10 мл) при 0°С в атмосфере N2. Сосуд нагревали до температуры окружающей среды, перед тем как растворитель удаляли при пониженном давлении и остаток очищали хроматографией (2:2:1, гексаны:EtOAc:ацетон), получая промежуточный продукт, сложный 4-(3-п-толил[1,2,4]триазол-1-ил)фениловый эфир трифторметансульфоновой кислоты (304 мг, 0,794 ммоль, 91%).
Стадия 2. Окисление 4-метильного промежуточного продукта, приведенного выше, до соответствующего альдегида проводили, используя нитрат аммония церия(IV) в условиях, описанных на стадии 2 предыдущего примера.
Пример 21: Получение 4-[5-(4-трифторметилфенил)-1Н-[1,2,4]триазол-3-ил]бензальдегида
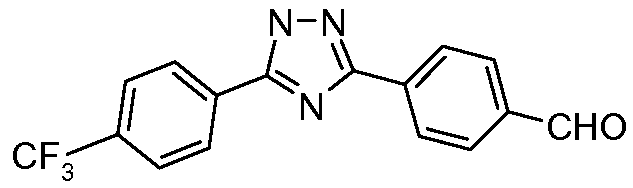
Терефталонитрил (115 мг, 0,90 ммоль), гидразид 4-трифторметилбензойной кислоты (92 мг, 0,450 ммоль), К2СО3 (31 мг, 0,225 ммоль) и н-бутиловый спирт (~2 мл) объединяли в 10 мл СЕМ реакционном сосуде с микроволновым облучением, снабженном магнитной стержневой мешалкой, и подвергали микроволновому облучению при 150°С в течение 30 мин. Затем содержимое фильтровали и концентрировали досуха. Хроматография (3:1 гексаны/EtOAc) давала 1,2,4-триазолнитрил (72 мг, 0,230 ммоль, 51%). Восстановление с использованием DIBAL затем приводило к соответствующему альдегиду.
Пример 22: Получение 4-[1-(3,4-дихлорфенил)-5-оксо-4,5-дигидро-1Н-[1,2,4]триазол-3-ил]бензальдегида
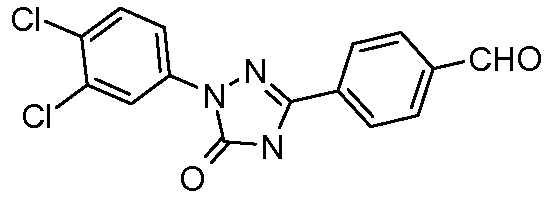
Стадия 1. 4-Цианофенилоксоуксусная кислота. В круглодонную колбу, снабженную механической мешалкой и парциальным конденсатором горячего орошения, помещали п-цианоацетофенон (5 г, 34,44 моль), диоксид селена (SeO2; 9,55 г, 86,1 ммоль) и пиридин (~100 мл). Смесь перемешивали при кипячении с обратным холодильником в течение 6 ч, перед тем как осадки удаляли фильтрованием и в фильтрат загружали 10% HCl (водн.) (20 мл). Фильтрат экстрагировали в EtOAc (3×50 мл) и объединенные органические слои дополнительно экстрагировали в почти насыщенный раствор NaHCO3. Водный слой затем осторожно подкисляли (рН 1) конц. HCl c получением небольшого выхода целевого продукта. Остаток оксоуксусной кислоты получали экстракцией в EtOAc, сушкой (MgSO4) и концентрированием (1,69 г, 28%).
Стадия 2. 4-[1-(3,4-Дихлорфенил)-5-оксо-4,5-дигидро-1Н-[1,2,4]триазол-3-ил]бензонитрил. Суспензию 4-цианофенилоксоуксусной кислоты (100 мг, 0,571 ммоль), гидрохлорида (3,4-дихлорфенил)гидразина (122 мг, 0,571 ммоль), 12,1 н. HCl (5 мкл, 0,057 ммоль) и Н2О (~10 мл) в 25 мл реакционном сосуде интенсивно перемешивали при температуре окружающей среды в течение 24 ч. Гидразон получали фильтрованием в вакууме и помещали в 100 мл круглодонную колбу с магнитной стержневой мешалкой. Затем колбу заполняли триэтиламином (0,08 мл, 0,571 ммоль), дифенилфосфорилазидом (157 мг, 0,571 ммоль) и толуолом (20 мл) перед нагреванием при 110°С в течение 1 ч. После охлаждения содержимое гасили с помощью 10% NaOH (водн.) и подкисляли (рН 1) конц. HCl. В течение 15 мин предоставляли возможность для осаждения, перед тем как получить промежуточный продукт фильтрованием в вакууме, и сушили в течение ночи в вакуумной печи при 45°С (16 мг, 8%). Нитрил восстанавливали до альдегида с применением DIBAL в условиях, описанных ранее.
Пример 23: Получение 4-[1-(4-хлорфенил)-1Н-[1,2,3]триазол-4-ил]бензальдегида
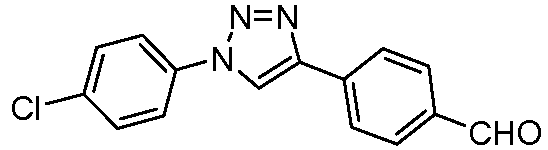
По процедуре, опубликованной Feldman et al. (Org. Lett. 2004, 6, 3897), суспензию 4-этинилбензонитрила (50 мг, 0,393 ммоль), 1-хлор-4-иодбензола (94 мг, 0,393 ммоль), L-пролина (9 мг, 0,079 ммоль), аскорбиновой кислоты (7 мг, 0,039 ммоль), NaN3 (31 мг, 0,472 ммоль), CuSO4 (3 мг, 0,020 ммоль) и Na2SO4 (11 мг, 0,079 ммоль) в ДМСО (1,5 мл) нагревали при 65°С в течение 24 ч. После охлаждения смесь разбавляли с помощью Н2О и перемешивали в течение 30 мин при температуре окружающей среды. Промежуточный 4-[1-(4-хлорфенил)-1Н-[1,2,3]триазол-4-ил]бензонитрил (54 мг, 48%) затем получали фильтрованием в вакууме после промывания большими объемами Н2О и 20% NH4OH (~20 мл). Затем проводили восстановление до альдегида в условиях, описанных ранее.
Пример 24: Получение 4-[5-(4-трифторметилфенил)тетразол-2-ил]бензальдегида
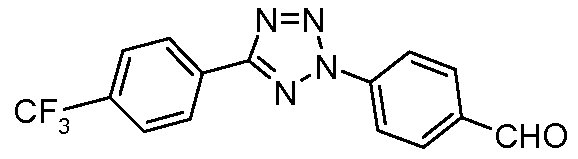
Данный альдегид получали из 4-трифторметилбензальдегида способом, описанным Roppe et al. J. Med. Chem. 2004, 47, 4645.
Пример 25: Получение 4-[5-(4-трифторметоксифенил)пиридин-3-ил]бензальдегида

Стадия 1. 1,3-Дибромпиридин (4,4 ммоль), 4-трифторметоксифенилбороновую кислоту (5,1 ммоль), тетракис(трифенилфосфин)палладий(0) (0,04 ммоль), 2 М карбонат калия (8,44 ммоль) и диоксан (21 мл) объединяли в сосуде и нагревали при микроволновом облучении в течение 10 мин при 150°С. Реакционную смесь экстрагировали простым эфиром и промывали насыщенным солевым раствором. Эфирный слой сушили над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Сырую смесь очищали хроматографией с силикагелем с получением 3-бром-5-(4-трифторметоксифенил)пиридина (130 мг) в виде желтого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,71 (м, 2H), 8,00 (т, J=2,1 Гц, 1H), 7,58 (д, J=8,8 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H); EI-MC m/z 317 (М+).
Стадия 2. Соединение получали арилированием, катализируемым палладием, продукта со стадии 1 4-формилфенилбороновой кислотой.
Пример 26: Получение 4-[4-(4-трифторметоксифенил)пиридин-2-ил]бензальдегида

Стадия 1. Соединение получали арилированием, катализируемым палладием, 2-хлор-4-иодпиридина с 4-трифторметоксифенилбороновой кислотой.
Стадия 2. 2-Хлор-4-(4-трифторметоксифенил)пиридин (0,55 ммоль), происходящий от 2-хлор-4-иодпиридина, 4-формилфенилбороновую кислоту (0,82 ммоль), тетракис(трифенилфосфин)палладий(0) (0,005 ммоль), 2 М карбонат калия (0,55 мл) и диоксан (3 мл) объединяли в сосуде и нагревали при микроволновом облучении в течение 15 мин при 150°С. Реакционную смесь поглощали в EtOAc и промывали насыщенным солевым раствором. Органический слой сушили над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Очистка хроматографией с силикагелем (EtOAc/гексаны) давала продукт (120 мг) в виде не совсем белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,81 (д, J=4,8 Гц, 1H), 8,24 (д, J=8,7 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,96 (м, 1H), 7,73 (д, J=9,0 Гц, 2H), 7,49 (дд, J=5,3, 1,8 Гц, 1H), 7,37 (д, J=8,1 Гц, 2H); EIMC m/z 343 (М+).
Пример 27: Получение 4-[6-(4-трифторметоксифенил)пиридин-2-ил]бензальдегида

Стадия 1. 4-(6-Бромпиридин-2-ил)бензальдегид (0,31 ммоль) получали по Puglisi et al. Eur. J. Org. Chem. 2003, 8, 1552-1558.
Стадия 2. 4-[6-(4-Трифторметоксифенил)пиридин-2-ил]бензальдегид. 4-(6-Бромпиридин-2-ил)бензальдегид (0,31 ммоль), 4-трифторметоксифенилбороновую кислоту (0,46 ммоль), тетракис(трифенилфосфин)палладий(0) (0,003 ммоль), 2 М карбонат калия (0,31 мл) и диоксан (2 мл) объединяли в сосуде и нагревали при микроволновом облучении в течение 10 мин при 150°С. Реакционную смесь поглощали в простой эфир и промывали насыщенным солевым раствором. Органический слой сушили над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Очистка хроматографией с силикагелем (EtOAc/гексаны) давала продукт (80 мг) в виде не совсем белого твердого вещества: т.пл. 109-112°С; 1H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,32 (д, J=8,5 Гц, 2H), 8,19 (д, J=8,1 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,89 (т, J=7,9 Гц, 1H), 7,79 (д, J=7,7 Гц, 1H), 7,74 (д, J=8,0 Гц, 1H), 7,35 (д, J=8,3 Гц, 2H); EIMC m/z 343 (М+).
Пример 28: Получение 4-[6-(4-трифторметоксифенил)пиримидин-4-ил]бензальдегида

Стадия 1. 4-Хлор-6-(4-трифторметоксифенил)пиримидин получали арилированием, катализируемым палладием, 4,6-дихлорпиримидина и 4-трифторметоксифенилбороновой кислоты: 1H ЯМР (400 МГц, CDCl3) δ 9,05 (с, 1H), 8,14 (д, J=9,8 Гц, 2H), 7,74 (м, 1H), 7,36 (д, J=8,4 Гц, 2H); EIMC m/z 274 (М+).
Стадия 2. Соединение получали арилированием, катализируемым палладием, продукта со стадии 1 с 4-формилфенилбороновой кислотой: 1H ЯМР (400 МГц, CDCl3) δ 10,15 (с, 1H), 9,38 (д, J=0,9 Гц, 1H), 8,33 (д, J=8,4 Гц, 2H), 8,23 (д, J=8,5 Гц, 2H), 8,16 (д, J=0,8 Гц, 1H), 8,08 (д, J=8,8 Гц, 2H), 7,40 (д, J=8,1 Гц, 2H); EIMC m/z 344 (М+).
Пример 29: Получение 4-[2-(4-трифторметоксифенил)пиримидин-4-ил]бензальдегида
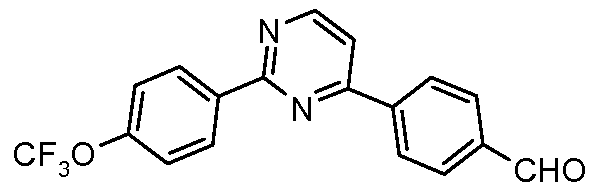
Стадия 1. 4-Хлор-2-(4-трифторметоксифенил)пиримидин. Указанное в заголовке соединение получали арилированием, катализируемым палладием, 2,4-дихлорпиримидина и 4-трифторметоксифенилбороновой кислоты: т.пл. 70-73°С; 1Н ЯМР (400 МГц, CDCl3) δ 8,68 (д, J=5,6 Гц, 1H), 8,16 (д, J=9,1 Гц, 2H), 7,65 (д, J=5,3 Гц, 1H), 7,36 (дд, J=9,2, 0,9 Гц, 2H); EIMC m/z 274 (М+).
Стадия 2. Соединение получали арилированием, катализируемым палладием, продукта со стадии 1 с 4-формилфенилбороновой кислотой: 1H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 8,91 (д, J=4,8 Гц, 1H), 8,74 (д, J=8,5 Гц, 2H), 8,28 (д, J=8,4 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,65 (д, J=5,3 Гц, 1H), 7,39 (д, J=8,6 Гц, 2H); EIMC m/z 344 (М+).
Пример 30: Получение 4-[4-(4-трифторметоксифенил)пиримидин-2-ил]бензальдегида
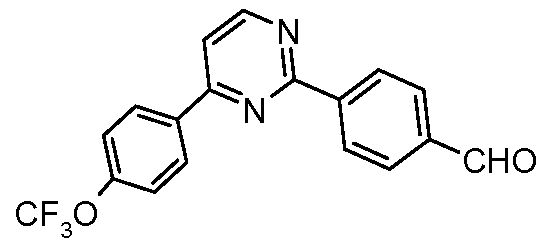
Стадия 1. 4-(4-Хлорпиримидин-2-ил)бензальдегид. Данное соединение получали арилированием, катализируемым палладием, 2,4-дихлорпиримидина и 4-формилфенилбороновой кислоты: 1Н ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 8,74 (д, J=5,0 Гц, 1H), 8,27 (д, J=7,8 Гц, 2H), 8,04 (д, J=7,9 Гц, 2H), 7,74 (м, 1H); EIMC m/z 218 (М+).
Стадия 2. Соединение получали арилированием, катализируемым палладием, продукта со стадии 1 с 4-трифторметоксифенилбороновой кислотой: 1H ЯМР (400 МГц, CDCl3) δ 10,14 (с, 1H), 8,91 (д, J=4,2 Гц, 1H), 8,63 (д, J=8,5 Гц, 2H), 8,37 (д, J=8,4 Гц, 2H), 8,06 (д, J=8,8 Гц, 2H), 7,67 (д, J=5,4 Гц, 1H), 7,35 (д, J=8,7 Гц, 2H); EIMC m/z 344 (М+).
Пример 31: Получение 4-[6-(4-трифторметоксифенил)пиразин-2-ил]бензальдегида

Стадия 1. 2-Хлор-6-(4-трифторметоксифенил)пиразин. Данное соединение получали арилированием, катализируемым палладием, 2,6-дихлорпиразина и 4-трифторметоксифенилбороновой кислоты: т.пл. 58-60°С; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (с, 1H), 8,57 (с, 1H), 8,10 (д, J=9,0 Гц, 2H), 7,37 (д, J=8,4 Гц, 2H); EIMC m/z 274 (М+).
Стадия 2. Соединение получали арилированием, катализируемым палладием, продукта со стадии 1 с 4-формилфенилбороновой кислотой: 1H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 9,07 (с, 1H), 9,03 (с, 1H), 8,33 (д, J=8,1 Гц, 2H), 8,21 (д, J=8,7 Гц, 2H), 8,07 (д, J=7,6 Гц, 2H), 7,40 (д, J=8,3 Гц, 2H); EIMC m/z 344 (М+).
Пример 32: Получение 4-[2-(4-трифторметоксифенил)пиримидин-5-ил]бензальдегида

Стадия 1. 4-(2-Хлорпиримидин-5-ил)бензальдегид. Данное соединение получали арилированием, катализируемым палладием, 2,5-дихлорпиримидина и 4-формилфенилбороновой кислоты.
Стадия 2. 4-(2-Хлорпиримидин-5-ил)бензальдегид (0,92 ммоль), 4-трифторметоксифенилбороновую кислоту (1,10 ммоль), дихлорбис(трифенилфосфин)палладий(0) (0,01 ммоль), 2 М карбонат калия (0,92 мл) и диоксан (5 мл) объединяли в сосуде и нагревали при микроволновом облучении в течение 10 мин при 150°С. Органический слой из реакционной смеси помещали непосредственно на силикагель и сушили в вакууме. Очистка хроматографией с силикагелем (EtOAc/гексаны) давала продукт (140 мг) в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 9,07 (с, 2H), 8,57 (д, J=9,0 Гц, 2H), 8,07 (д, J=8,5 Гц, 2H), 7,82 (д, J=8,3 Гц, 2H), 7,35 (д, J=8,3 Гц, 2H); EIMC m/z 344 (М+).
Пример 33: Получение 4-[5-(4-трифторметоксифенил)пиримидин-2-ил]бензальдегида

Стадия 1. 2-Хлор-5-(4-трифторметоксифенил)пиримидин. Данное соединение получали арилированием, катализируемым палладием, 2,5-дихлорпиримидина с 4-трифторметоксифенилбороновой кислотой.
Стадия 2. 2-Хлор-5-(4-трифторметоксифенил)пиримидин (4,22 ммоль), 4-формилфенилбороновую кислоту (5,1 ммоль), дихлорбис(трифенилфосфин)палладий(II) (0,05 ммоль), 2 М карбонат калия (4,2 мл) и диоксан (21 мл) объединяли в сосуде и нагревали при микроволновом облучении в течение 20 мин при 150°С. Органический слой из реакционной смеси помещали непосредственно на силикагель и сушили в вакууме. Очистка хроматографией с силикагелем (EtOAc/гексаны) давала продукт (75 мг) в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 9,06 (с, 2H), 8,68 (д, J=8,8 Гц, 2H), 8,03 (д, J=8,3 Гц, 2H), 7,68 (д, J=8,8 Гц, 2H), 7,40 (д, J=8,7 Гц, 2H); EIMC m/z 344 (М+).
Пример 34: Получение (Е)-N-(4-диметиламино)фенил)-2-(4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)бензилиден)гидразинкарботиоамида (соединение 1) [способ синтеза А]
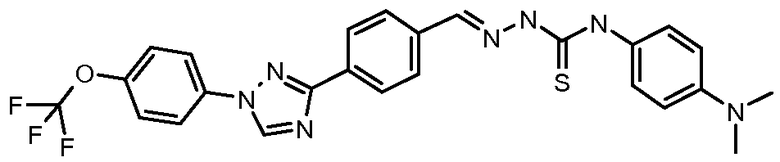
Стадия 1. (Е)-3-(4-Гидразонометил)фенил)-1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол. В 250 мл круглодонную колбу, содержащую гидрат гидразина (64% водн. раствор; 7,27 мл, 15,0 ммоль) в EtOH (100 мл), при 80°С добавляли порциями 4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]бензальдегид (5,00 г, 1,50 ммоль) в течение 5 мин. Раствор перемешивали при кипячении с обратным холодильнмком в течение дополнительных 3 ч перед разбавлением Н2О (300 мл) и охлаждали до 0°С. Выпавший в осадок продукт собирали фильтрованием в вакууме в виде белого твердого вещества (4,89 г, 93%), т.пл. 222-226°С; 1H ЯМР (400 МГц, ДМСО-d6) δ 8,59 (с, 1H), 8,22 (д, J=8,2 Гц, 2H), 7,84-7,79 (м, 2H), 7,66 (д, J=8,3 Гц, 2H), 7,41 (д, J=8,2 Гц, 2H), 7,29 (с, 1H), 5,63 (шир.с, 2H); ESIMC m/z 348 (М+Н).
Стадия 2. В 25 мл круглодонную колбу, содержащую (Е)-3-(4-(гидразонометил)фенил)-1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол (250 мг, 0,720 ммоль) в ТГФ (10 мл), добавляли 4-изотиоцианато-N,N-диметиланилин (385 мг, 2,16 ммоль). Содержимое нагревали при 65°С с перемешиванием в течение 2 ч, перед тем как удаляли растворитель при пониженном давлении. Остаток суспендировали в CH2Cl2 (10 мл), что приводило к осаждению продукта. Целевой продукт получали в виде желтого твердого вещества путем фильтрования в вакууме (350 мг, 93%): т.пл. 205-208°С; 1H ЯМР (400 МГц, ДМСО-d6) δ 11,78 (с, 1H), 10,02 (с, 1H), 9,42 (с, 1H), 8,19-7,99 (м, 6H), 7,64 (д, J=8,3 Гц, 2H), 7,28 (д, J=8,3 Гц, 2H), 7,73 (д, J=8,3 Гц, 2H), 2,92 (с, 6H); ESIMC m/z 526 (М+Н).
Пример 35: Получение N-(3-(диметиламино)фенил)-2-(4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)бензилиден)гидразинкарботиоамида (соединение 2) [способ синтеза В]

Стадия 1. (Е)-Метил 2-(4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)бензилиден)гидразинкарбодитиоат. В 250 мл круглодонную колбу, содержащую метиловый сложный эфир гидразиндитиокарбоновой кислоты (2,38 г, 1,95 ммоль) в EtOH (100 мл), добавляли 4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]бензальдегид (5,00 г, 1,50 ммоль). Сосуд нагревали при 80°С в течение 3 ч перед разбавлением Н2О (300 мл) и охлаждали до 0°С. Выпавший в осадок продукт собирали фильтрованием в вакууме в виде не совсем белого твердого вещества (6,13 г, 93%), т.пл. 204-206°С; 1H ЯМР (400 МГц, ДМСО-d6) δ 13,39 (с, 1H), 9,43 (с, 1H), 8,38 (с, 1H), 8,21 (д, J=8,3 Гц, 2H), 8,09 (д, J=8,4 Гц, 2H), 7,88 (д, J=8,4 Гц, 2H), 7,62 (д, J=8,3 Гц, 2H), 2,57 (с, 3H); ESIMC m/z 438 (М+Н).
Стадия 2. В 50 мл круглодонную колбу, содержащую (Е)-метил 2-(4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)бензилиден)гидразинкарбодитиоат (250 мг, 0,571 ммоль) в ДМФА (3 мл), добавляли N1,N1-диметилбензол-1,3-диамин (195 мг, 1,43 ммоль). Содержимое нагревали при 150°С с перемешиванием в течение 5 ч, перед тем как раствору предоставляли возможность охлаждаться в течение ночи. Смесь фильтровали и фильтрат очищали через ОФ-ВЭЖХ с получением целевого продукта (235 мг, 78%) в виде не совсем белого твердого вещества: т.пл. 192-194°С; 1H ЯМР (400 МГц, ДМСО-d6) δ 11,82 (с, 1H), 10,04 (с, 1H), 9,41 (с, 1H), 8,19 (с, 1H), 8,16-7,99 (м, 6H), 7,61 (д, J=8,3 Гц, 2H), 7,16 (т, J=7,2 Гц, 1H), 7,01 (м, 1H), 6,87 (м, 1H), 6,58 (м, 1H), 2,88 (с, 6H); ESIMC m/z 526 ([M+H]+).
Пример 36: Получение N-бензил-2-(4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)бензилиден)гидразинкарботиоамида (соединение 3) [способ синтеза С]

В 50 мл круглодонную колбу, содержащую 4-[1-[4-(трифторметокси)фенил]-1,2,4-триазол-3-ил]бензальдегид (500 мг, 1,5 ммоль) в EtOH (3 мл), добавляли 4-бензилтиосемикарбазид (650 мг, 3,6 ммоль). Реакционную смесь нагревали при 80°С в течение ночи. После завершения реакции добавляли Н2О и сырой продукт выделяли фильтрованием в вакууме. Указанное в заголовке соединение выделяли через ОФ-ВЭЖХ в виде белого твердого вещества (390 мг, выход 52%), т.пл. 220-224°С; 1H ЯМР (400 МГц, CDCl3) δ 9,29 (с, 1H), 8,59 (с, 1H), 8,21 (д, J=8,4 Гц, 2H), 7,85-7,79 (м, 3H), 7,71 (д, J=8,4 Гц, 2H), 7,46-7,30 (м, 8H), 5,01 (д, J=5,8 Гц, 2H); ESIMC 497,2 (М+Н).
Соединения 4-159 в таблице 1 были синтезированы в соответствии с примерами, приведенными выше.
Соединения были испытаны против совки малой и совки хлопковой при использовании методик, описанных в следующих примерах, и представлены в таблице 2.
В каждом случае таблицы 2 шкала оценок представляет собой следующее:
Пример 37: Исследование инсектицидной активности на совке малой (Spodoptera exigua)
Биоанализы на совке малой (BAW; Spodoptera exigua: Lepidoptera) проводили, используя анализ на 128-луночном планшете с кормом. От трех до пяти личинок BAW на второй возрастной стадии помещали в каждую лунку (3 мл) на планшете с кормом, которая заранее была заполнена 1 мл искусственного корма, к которому было добавлено 50 мкг/см2 испытуемого соединения (растворенного в 50 мкл смеси ацетон-вода 90:10) (в каждую из восьми лунок), и затем предоставляли возможность для сушки. Планшеты покрывали прозрачным самоклеящимся покрытием и выдерживали при 25°С в условиях свет-темнота 14:10 в течение шести суток. Регистрировали процент смертности для личинок в каждой лунке, затем усредняли активность в восьми лунках. Результаты для обоих биоанализов показаны в таблице 2.
Пример 38: Исследование инсектицидной активности на совке хлопковой (Helicoverpa zea)
Биоанализы на совке хлопковой (CEW; Helicoverpa zea: Lepidoptera) проводили, используя анализ на 128-луночном планшете с кормом. От трех до пяти личинок CEW на второй возрастной стадии помещали в каждую лунку (3 мл) на планшете с кормом, которая заранее была заполнена 1 мл искусственного корма, к которому было добавлено 50 мкг/см2 испытуемого соединения (растворенного в 50 мкл смеси ацетон-вода 90:10) (в каждую из восьми лунок), и затем предоставляли возможность для сушки. Планшеты покрывали прозрачным самоклеящимся покрытием и выдерживали при 25°С в условиях свет-темнота 14:10 в течение шести суток. Регистрировали процент смертности для личинок в каждой лунке, затем усредняли активность в восьми лунках. Результаты для обоих биоанализов показаны в таблице 2.
Соединения были также испытаны против тли персиковой зеленой при использовании процедуры, описанной в следующем примере, и представлены в таблице 2.
В каждом случае таблицы 2 шкала оценок представляет собой следующее:

Пример 39: Исследование инсектицидной активности на тле персиковой зеленой (Myzus persicae) в анализе с лиственным опрыскиванием
Рассаду капусты, выращенную в 7,5-см горшочках, с 2-3-маленькими (3-5 см) настоящими листьями, использовали в качестве тест-субстрата. Рассаду заражали 20-50 особями персиковой зеленой тли (бескрылые взрослые особи и нимфы) за 1 день до применения химических веществ. Четыре горшка с индивидуальной рассадой использовали для каждой обработки. Соединения (2 мг) растворяли в 2 мл смесевого растворителя ацетон/метанол (1:1), образующего исходные растворы с концентрацией 1000 ч/млн. Исходные растворы разбавляли 5X 0,025% раствором Tween 20 в H2O c получением тест-раствора с концентрацией действующего вещества 200 ч/млн. Для применения растворов опрыскиванием с обеих сторон листьев капусты до стекания раствора использовали ручной опрыскиватель типа Devilbiss. Контрольные растения (проверка растворителя) опрыскивали только растворителем. Обработанные растения выдерживали в помещении в течение трех суток при температуре приблизительно 25оC и относительной влажности (RH) 40% до регистрации. Оценку проводили подсчетом количества живых особей тли на каждом растении под микроскопом. Данные по инсектицидной активности, определенные с использованием скорректированной формулы Абботта, представлены в таблице 2:
Скорректированный % контроля = 100*(X-Y)/X
где Х = количество живых особей тли на контрольных растениях, обработанных растворителем;
Y = количество живых особей тли на растениях, обработанных соединениями.
КИСЛОТЫ И СОЛЕВЫЕ ПРОИЗВОДНЫЕ И СОЛЬВАТЫ
Соединения, раскрытые в настоящем изобретении, могут быть представлены в форме пестицидно приемлемых кислотно-аддитивных солей.
Например, но без ограничения, аминная функция может образовывать соли с хлористоводородной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, винной, молочной, глюконовой, аскорбиновой, малеиновой, аспаргиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксиметансульфоновой и гидроксиэтансульфоновой кислотами.
В качестве дополнительного примера, но без ограничения, кислотная функция может образовывать соли, включая соли щелочных или щелочно-земельных металлов, а также соли аммония и аминные соли. Примеры предпочтительных катионов включают катионы натрия, калия, магния и аминия.
Соли получают контактированием соединения в форме свободного основания с количеством желательной кислоты, которое достаточно для получения соли. Формы свободного основания могут регенерироваться обработкой соли подходящим разбавленным водным раствором основания, таким как разбавленный водный раствор NaOH, карбоната калия, аммиака и бикарбоната натрия. В некоторых случаях пестицид превращают в более растворимую форму, например диметиламинная соль 2,4-дихлорфеноксиуксусной кислоты является более растворимой формой 2,4-дихлорфеноксиуксусной кислоты, которая является хорошо известным гербицидом.
Соединения, раскрытые в данном изобретении, могут также образовывать стабильные комплексы с молекулами растворителя, которые остаются интактными после удаления из соединений молекул растворителя, не входящих в состав комплекса. Указанные комплексы часто называют “сольватами”.
СТЕРЕОИЗОМЕРЫ
Некоторые соединения, раскрытые в данном изобретении, могут существовать в виде одного или нескольких стереоизомеров. Различные стереоизомеры включают геометрические изомеры, диастереомеры и энантиомеры. Таким образом, соединения, раскрытые в данном изобретении, включают рацемические смеси, отдельные стереоизомеры и оптически активные смеси. Специалисту в данной области техники будет понятно, что один стереоизомер может быть более активным, чем другие. Отдельные стереоизомеры и оптически активные смеси могут быть получены в соответствии с методиками селективного синтеза, обычными методами синтеза с использованием разделенных исходных веществ или с помощью стандартных методик разделения.
СЕЛЬСКОХОЗЯЙСТВЕННЫЕ ВРЕДИТЕЛИ
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля сельскохозяйственных вредителей.
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к типу Нематоды (Phylum Nematoda).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к типу Членистоногие (Phylum Arthropoda).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к подтипу Хелицеровые (Subphylum Chelicerata).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к классу Арахниды (Class Arachnida).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к подклассу Многоножки (Subphylum Myriapoda).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к классу Симфилы (Class Symphyla).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к подклассу Шестиногие (Subphylum Hexapoda).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к классу Насекомые (Class Insecta).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Жесткокрылые (Coleoptera) (жуки). Неполный перечень этих вредителей включает, но без ограничения, Acanthoscelides spp. (долгоносики), Acanthoscelides obtectus (зерновка фасолевая), Agrilus planipennis (златка узкотелая), Agriotes spp. (проволочники), Anoplophora glabripennis (усач азиатский), Anthonomus spp. (долгоносики), Anthonomus grandis (долгоносик хлопковый), Aphidius spp. (тли), Apion spp. (апионы), Apogonia spp. (трибы), Ataenius spretulus (жук черный корневой рода Ataenius), Atomaria linearis (крошка свекловичная), Aulacophore spp., Bothynoderes punctiventris (долгоносик свекловичный обыкновенный), Bruchus spp. (зерновки), Bruchus pisorum (зерновка гороховая), Cacoesia spp., Callosobruchus maculatus (зерновка пятнистая), Carpophilus hemipteras (плодоед короткокрылый), Cassida vittata (щитоноска крапивная), Cerosterna spp., Cerotoma spp. (листоеды), Cerotoma trifurcata (листоед фасолевый), Ceutorhynchus spp. (скрытнохоботники), Ceutorhynchus assimilis (скрытнохоботник капустный стручковый), Ceutorhynchus napi (скрытнохоботник рапсовый стеблевой), Chaetocnema spp. (листоеды), Colaspis spp. (жуки почвенные), Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar (долгоносик плодорый), Cotinus nitidis (хрущ блестящий зеленый), Crioceris asparagi (трещалка спаржевая), Cryptolestes ferrugineus (мукоед рыжий короткоусый), Cryptolestes pusillus (мукоед малый), Cryptolestes turcicus (Turkish grain beetle/жук турецкий), Ctenicera spp. (щелкуны), Curculio spp. (долгоносики), Cyclocephala spp. (личинки червовидные), Cylindrocopturus adspersus (sunflower stem weevil/долгоносик), Deporaus marginatus (долгоносик манговый), Dermestes lardarius (кожеед ветчинный), Dermestes maculates (кожеед пятнистый), Diabrotica spp. (жуки диабротика, листоеды), Epilachna varivestis (коровка мексиканская божья), Faustinus cubae, Hylobius pales (жук-долгоносик), Hypera spp. (долгоносики), Hypera postica (долгоносик люцерновый), Hyperdoes spp. (Hyperodes weevil/долгоносик), Hypothenemus hampei (жук кофейный), Ips spp. (заболонники), Lasioderma serricorne (жук табачный), Leptinotarsa decemlineata (жук колорадский), Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus (долгоносик рисовый водяной), Lyctus spp. (древесные жуки/древогрызы), Maecolaspis joliveti, Megascelis spp., Melanotus communis, Meligethes spp., Meligethes aeneus (цветоед рапсовый), Melolontha melolontha (хрущ майский западный), Oberea brevis, Oberea linearis, Oryctes rhinoceros (жук-носорог пальмовый), Oryzaephilus mercator (мукоед ложносуринамский), Oryzaephilus surinamensis (рисоед суринамский), Otiorhynchus spp. (скосари), Oulema melanopus (листоед-пьявица), Oulema oryzae, Pantomorus spp. (жуки-долгоносики), Phyllophaga spp. (жук майский/июньский), Phyllophaga cuyabana, Phyllotreta spp. (листоеды), Phynchites spp., Popillia japonica (хрущик японский), Prostephanus truncates (точильщик зерновой большой), Rhizopertha dominica (точильщик зерновой), Rhizotrogus spp. (хрущи), Rhynchophorus spp. (долгоносики), Scolytus spp. (жуки древесные), Shenophorus spp. (долгоносики), Sitona lineatus (слоник гороховый полосатый), Sitophilus spp. (долгоносики зерновые), Sitophilus granaries (долгоносик амбарный), Sitophilus oryzae (долгоносик рисовый), Stegobium paniceum (точильщик хлебный), Tribolium spp. (хрущаки мучные), Tribolium castaneum (хрущак каштановый), Tribolium confusum (хрущак мучной малый), Trogoderma variabile (трогодерма изменчивая) и Zabrus tenebioides.
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Кожистокрылые Dermaptera (уховертки).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Dictyoptera (тараканы). Неполный перечень этих вредителей включает, но без ограничения, Blattella germanica (таракан рыжий), Blatta orientalis (таракан черный), Parcoblatta pennylvanica, Periplaneta americana (таракан американский), Periplaneta australoasiae (таракан австралийский), Periplaneta brunnea (таракан коричневый), Periplaneta fuliginosa (таракан дымчато-коричневый), Pyncoselus suninamensis (таракан суринамский) и Supella longipalpa (таракан коричневополосый).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Двукрылые (Diptera) (мухи настоящие). Неполный перечень этих вредителей включает, но без ограничения, Aedes spp. (комары), Agromyza frontella (моли-перстянки люцерновые), Agromyza spp. (мушки минирующие), Anastrepha spp. (мушки плодовые), Anastrepha suspensa (мушка плодовая карибская), Anopheles spp. (комары), Batrocera spp. (мушки плодовые), Bactrocera cucurbitae (муха дынная), Bactrocera dorsalis (муха восточная плодовая), Ceratitis spp. (мухи плодовые), Ceratitis capitata (муха средиземноморская плодовая), Chrysops spp. (мухи оленьи), Cochliomyia spp. (личинки мясной мухи), Contarinia spp. (галлицы), Culex spp. (комары), Dasineura spp. (галлицы), Dasineura brassicae (галлица капустная), Delia spp., Delia platura (личинка мухи ростковой), Drosophila spp. (дрозофиллы), Fannia spp. (мухи комнатные), Fannia canicularis (муха комнатная малая), Fannia scalaris (муха лестничная), Gasterophilus intestinalis (овод-крючок), Gracillia perseae, Haematobia irritans (жигалка коровья малая), Hylemyia spp. (личинки мух настоящих), Hypoderma lineatum (личинка овода бычьего полосатого), Liriomyza spp. (мушки минирующие), Liriomyza brassica (муха минирующая змеевидная), Melophagus ovinus (рунец овечий), Musca spp. (мухи настоящие), Musca autumnalis (муха осенняя), Musca domestica (муха комнатная), Oestrus ovis (овод овечий), Oscinella frit (мушка шведская), Pegomyia betae (муха свекловичная), Phorbia spp., Psila rosae (муха морковная), Rhagoletis cerasi (муха вишневая), Rhagoletis pomonella (муха яблонная), Sitodiplosis mosellana (галлица оранжевая зерновая), Stomoxys calcitrans (жигалка осенняя), Tabanus spp. (мухи лошадиные) и Tipula spp. (долгоножки).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Полужесткокрылые (Hemiptera) (клопы). Неполный перечень этих вредителей включает, но без ограничения, Acrosternum hilare (клоп-щитник), Blissus leucopterus (клоп-черепашка), Calocoris norvegicus (клопик картофельный), Cimex hemipterus (клоп тропический постельный), Cimex lectularius (клоп постельный), Dagbertus fasciatus, Dichelops furcatus, Dysdercus suturellus (красноклоп хлопковый), Edessa meditabunda, Eurygaster maura (клоп-черепашка маврская), Euschistus heros, Euschistus servus (клоп коричневый вонючий), Helopeltis antonii, Helopeltis theivora (слепняк чайный индийский), Lagynotomus spp. (клопы вонючие), Leptocorisa oratorius, Leptocorisa varicornis, Lygus spp. (слепняки, клопы), Lygus hesperus (слепняк западный матовый), Maconellicoccus hirsutus, Neurocolpus longirostris, Nezara viridula (клоп овощной зеленый), Phytocoris spp. (слепняки), Phytocoris californicus, Phytocoris relativus, Piezodorus guildingi, Poecilocapsus lineatus (слепняк четырехполосный), Psallus vaccinicola, Pseudacysta perseae, Scaptocoris castanea и Triatoma spp. (клопы триатомовые: клопы кровососущие/триатомиды).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей Homoptera (тли, щитовки, белокрылки, цикадки). Неполный перечень этих вредителей включает, но без ограничения, Acrythosiphon pisum (тля гороховая), Adelges spp. (хермесы), Aleurodes proletella (белокрылка капустная), Aleurodicus disperses, Aleurothrixus floccosus (белокрылка шерстистая), Aluacaspis spp., Amrasca bigutella bigutella, Aphrophora spp. (кобылочки), Aonidiella aurantii (щитовка красная померанцевая), Aphis spp. (тли), Aphis gossypii (тля хлопковая), Aphis pomi (тля яблоневая), Aulacorthum solani (тля картофельная), Bemisia spp. (белокрылки), Bemisia argentifolii, Bemisia tabaci (белокрылка табачная), Brachycolus noxius (тля ячменная), Brachycorynella asparagi (тля аспарагусовая), Brevennia rehi, Brevicoryne brassicae (тля капустная), Ceroplastes spp. (щитовки), Ceroplastes rubens (ложнощитовка рубиновая), Chionaspis spp. (щитовки), Chrysomphalus spp. (щитовки), Coccus spp. (щитовки), Dysaphis plantaginea (тля розовая яблонная), Empoasca spp. (цикадки), Eriosoma lanigerum (тля кровяная яблонная), Icerya purchasi (червец австралийский желобчатый), Idioscopus nitidulus (цикадка манговая), Laodelphax striatellus (цикадка темная малая), Lepidosaphes spp., Macrosiphum spp., Macrosiphum euphorbiae (тля картофельная), Macrosiphum granarium (тля зерновая), Macrosiphum rosae (тля розанная зеленая), Macrosteles quadrilineatus (цикадка астровая), Mahanarva frimbiolata, Metopolophium dirhodum (тля розанно-злаковая), Mictis longicornis, Myzus persicae (тля персиковая), Nephotettix spp. (цикадки), Nephotettix cinctipes (цикадка зеленая), Nilaparvata lugens (цикадка коричневая), Parlatoria pergandii (щитовка соломенная), Parlatoria ziziphi (щитовка черная грушевидная), Peregrinus maidis (дельфацида кукурузная), Philaenus spp. (пенницы), Phylloxera vitifoliae (филлоксера виноградная), Physokermes piceae (ложнощитовка еловая), Planococcus spp. (червецы мучнистые), Pseudococcus spp. (червецы мучнистые), Pseudococcus brevipes (червец мучнистый ананасовый), Quadraspidiotus perniciosus (щитовка калифорнийская), Rhapalosiphum spp. (тли), Rhapalosiphum maida (тля кукурузная листовая), Rhapalosiphum padi (тля черемуховая), Saissetia spp. (щитовки), Saissetia oleae (ложнощитовка маслинная), Schizaphis graminum (тля обыкновенная злаковая), Sitobion avenae (тля большая злаковая), Sogatella furcifera (цикадка белоспинная), Therioaphis spp. (тли), Toumeyella spp. (червецы), Toxoptera spp. (тли), Trialeurodes spp. (белокрылки), Trialeurodes vaporariorum (белокрылка тепличная), Trialeurodes abutiloneus (белокрылка с полосатыми крыльями), Unaspis spp. (щитовки), Unaspis yanonensis (щитовка восточная цитрусовая) и Zulia entreriana.
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Перепончатокрылые (Hymenoptera) (муравьи, осы и пчелы). Неполный перечень этих вредителей включает, но без ограничения, Acromyrrmex spp., Athalia rosae, Atta spp. (муравьи-листорезы), Camponotus spp. (муравьи-древоточцы), Diprion spp. (пилильщики), Formica spp. (муравьи), Iridomyrmex humilis (муравей аргентинский), Monomorium spp., Monomorium minumum (муравей маленький черный), Monomorium pharaonis (муравей фараонов), Neodiprion spp. (пилильщики), Pogonomyrmex spp. (муравьи-жнецы американские), Polistes spp. (осы бумажные), Solenopsis spp. (муравьи огненные), Tapoinoma sessile (муравей домашний пахучий), Tetranomorium spp. (муравьи дерновые), Vespula spp. (осы) и Xylocopa spp. (пчелы-плотники).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Одинаковокрылые (Isoptera) (термиты). Неполный перечень этих вредителей включает, но без ограничения, Coptotermes spp., Coptotermes curvignathus, Coptotermes frenchii, Coptotermes formosanus (термит тайваньский подземный), Cornitermes spp. (термиты-солдаты с рострумом), Cryptotermes spp. (термиты суходревесные), Heterotermes spp. (подземные термиты пустыни), Heterotermes aureus, Kalotermes spp. (термиты суходревесные), Incistitermes spp. (термиты суходревесные), Macrotermes spp. (термиты “грибных садов”), Marginitermes spp. (термиты суходревесные), Microcerotermes spp. (термиты урожая), Microtermes obesi, Procornitermes spp., Reticulitermes spp. (термиты подземные), Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes (термит желтоногий), Reticulitermes hageni, Reticulitermes hesperus (термит западный подземный), Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis, Reticulitermes virginicus, Schedorhinotermes spp. и Zootermopsis spp. (термиты гнилой древесины).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Чешуекрылые (Lepidoptera) (моли и бабочки). Неполный перечень этих вредителей включает, но без ограничения, Achoea janata, Adoxophyes spp., Adoxophyes orana, Agrotis spp. (гусеницы озимой совки), Agrotis ipsilon (совка ипсилон), Alabama argillacea (гусеница совки хлопковой американской), Amorbia cuneana, Amyelosis transitella (моль цитрусовая), Anacamptodes defectaria, Anarsia lineatella (моль фруктовая полосатая), Anomis sabulifera (jute looper/совка), Anticarsia gemmatalis (совка), Archips argyrospila (листовертка плодовых деревьев), Archips rosana (листовертка розанная), Argyrotaenia spp. (листовертки), Argyrotaenia citrana (листовертка цитрусовая), Autographa gamma, Bonagota cranaodes, Borbo cinnara (огневка рисовая), Bucculatrix thurberiella (моль кривоусая турберии), Caloptilia spp. (моли-минеры), Capua reticulana, Carposina niponensis (плодожорка персиковая), Chilo spp., Chlumetia transversa (mango shoot borer/точильщик манговый), Choristoneura rosaceana (oblique banded leafroller/листовертка), Chrysodeixis spp., Cnaphalocerus medinalis (grass leafroller/листовертка), Colias spp., Conpomorpha cramerella, Cossus cossus (древоточец), Crambus spp. (мотыльки луговые), Cydia funebrana (плодожорка сливовая), Cydia molesta (плодожорка восточная), Cydia nignicana (листовертка гороховая), Cydia pomonella (плодожорка яблонная), Darna diducta, Diaphania spp. (сверлильщики стволовые), Diatraea spp. (сверлильщики стебля), Diatraea saccharalis (сверлильщик стебля сахарного тростника), Diatraea graniosella (огневка кукурузная юго-западная), Earias spp. (коробочные черви), Earias insulata (червь шиповатый), Earias vittella (rough northern boll worm/коробочный червь хлопчатника), Ecdytopopha aurantianum, Elasmopalpus lignosellus (точильщик зерновой), Epiphysias postruttana (light brown apple moth/листовертка), Ephestia spp. (огневки мельничные), Ephestia cautella (огневка сухофруктовая), Ephestia elutella (огневка табачная), Ephestia kuehniella (огневка мельничная), Epimeces spp., Epinotia aporema, Erionota thrax (banana skipper/толстоголовка), Eupoecilia ambiguella (листовертка двулетняя), Euxoa auxiliaris (совка), Feltia spp. (совки), Gortyna spp. (сверлильщики стеблевые), Grapholita molesta (плодожорка восточная), Hedylepta indicata (мотылек соевый), Helicoverpa spp. (совки), Helicoverpa armigera (совка хлопковая), Helicoverpa zea (совка хлопковая/червь коробочный), Heliothis spp. (совки), Heliothis verescent (гусеница совки табачной), Hellula undalis (гусеница огневки капустной), Indarbela spp. (сверлильщики корневые), Keiferia lycopersicella (моль выемчатокрылая), Leucinodes orbonalis (сверлильщик плодов баклажана), Leucoptera malifoliella, Lithocollectis spp., Lobesia botrana (листовертка гроздевая), Loxagrotis spp. (совки), Loxagrotis albicosta (гусеница совки бобовой), Lymantria dispar (шелкопряд непарный), Lyonetia clerkella (моль-крошка яблонная белая), Mahasena corbetti (oil palm bagworm/мешочница), Malacosoma spp. (гусеницы коконопрядов, строящие общие паутинные гнезда), Mamestra brassicae (гусеница совки капустной), Maruca testulalis (огневка бобовая), Metisa plana (мешочница), Mythimna unipuncta (гусеница совки одноточечной), Neoleucinodes elegantalis (small tomato borer/точильщик), Nymphula depunctalis (rice caseworm/куколка), Operophthera brumata (пяденица зимняя), Ostrinia nubilalis (мотылек стеблевой), Oxydia vesulia, Pandemis cerasana (листовертка кривоусая смородинная), Pandemis heparana (листовертка кривоусая ивовая), Papilio demodocus, Pectinophora gossypiella (моль хлопковая), Peridroma spp. (гусеницы), Peridroma saucia (совка маргаритковая или совка грязно-бурая земляная), Perileucoptera coffeella (моль белая кофейная), Phthorimaea operculella (моль картофельная минирующая), Phyllocnisitis citrella, Phyllonorycter spp. (моли-минеры), Pieris rapae (рептица), Plathypena scabra, Plodia interpunctella (огневка амбарная), Plutella xylostella (моль серпокрылая капустная), Polychrosis viteana (листовертка виноградная), Prays endocarpa, Prays oleae (моль маслинная), Pseudaletia spp. (совки), Pseudaletia unipunctata (ратный червь совки луговой), Pseudoplusia includens (soybean looper/пяденица), Rachiplusia nu, Scirpophaga incertulas, Sesamia spp. (точильщики стеблевые), Sesamia inferens (точильщик стеблевой розовый), Sesamia nonagrioides, Setora nitens, Sitotroga cerealella (моль зерновая амбарная), Sparganothis pilleriana, Spodoptera spp. (черви “ратные”), Spodoptera exigua (карадрина - совка наземная малая), Spodoptera fugiperda (точильщик розовый стеблевой), Spodoptera eridania (совка южная), Synanthedon spp. (сверлильщики корневые), Thecla basilides, Thermisia gemmatalis, Tineola bisselliella (моль платяная), Trichoplusia ni (капустная металловидка, совка ни), Tuta absoluta, Yponomeuta spp., Zeuzera coffeae (red branch borer/точильщик) и Zeuzera pyrina (древесница въедливая).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Пухоеды (Mallophaga). Неполный перечень этих вредителей включает, но без ограничения, Bovicola ovis (власоед), Menacanthus stramineus (пухоед птичий) и Menopon gallinea (пухоед куриный).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Прямокрылые (Orthoptera) (кобылки, цикадки и сверчки). Неполный перечень этих вредителей включает, но без ограничения, Anabrus simplex (кузнечик-мормон бескрылый), Gryllotalpidae (медведки), Locusta migratoria, Melanoplus spp. (кузнечики), Microcentrum retinerve (кузнечик узкокрылый), Pterophylla spp. (кузнечики североамериканские), Chistocerca gregaria, Scudderia furcata (кузнечик вилохвостый) и Valanga nigricorni.
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Phthiraptera (вши). Неполный перечень этих вредителей включает, но без ограничения, Haematopinus spp. (кровохлебки бычья и свиная), Linognathus ovillus (вошь овечья), Pediculus humanus capitis (вошь человеческая головная), Pediculus humanus humanus (вошь человеческая платяная) и Pthirus pubis (вошь лобковая).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Siphonaptera (блохи). Неполный перечень этих вредителей включает, но без ограничения, Ctenocephalides canis (блоха собачья), Ctenocephalides felis (блоха кошачья) и Pulex irritans (блоха человеческая).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Thysanoptera (трипсы). Неполный перечень этих вредителей включает, но без ограничения, Frankliniella fusca (трипс табачный), Frankliniella occidentalis (трипс цветочный западный), Frankliniella shultzei, Frankliniella williamsi (трипс кукурузный), Heliothrips haemorrhaidalis (трипс тепличный), Riphiphorothrips cruentatus, Scirtothrips spp., Scirtothrips citri (трипс цитрусовый), Scirtothrips dorsalis (трипс желтый чайный), Taeniothrips rhopalantennalis и Thrips spp.
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Thysanura (щетинохвостки). Неполный перечень указанных вредителей включает, но без ограничения, Lepisma spp. (чешуйницы) и Thermobia spp. (термобии).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Паукообразные (Acarina) (клещи). Неполный перечень этих вредителей включает, но без ограничения, Acarapsis woodi (трахеальный клещ рабочих пчел), Acarus spp. (клещи амбарные), Acarus siro (клещ мучной), Aceria mangiferae (клещик манговый), Aculops spp., Aculops lycopersici (клещ ржавый), Aculops pelekasi, Aculus pelekassi, Aculus schlechtendali (клещ ржавый яблонный), Amblyomma americanum (клещ одинокой звезды или звездообразный клещ), Boophilus spp. (клещи кольчатые), Brevipalpus obovatus (плоскотелка оранжерейная), Brevipalpus phoenicis (клещ красно-черный плоский), Demodex spp. (клещи подкожные), Dermacentor spp. (клещи твердые иксодовые), Dermacentor variabilis (клещ иксодовый изменчивый), Dermatophagoides pteronyssinus (клещ домашней пыли), Eotetranycus spp., Eotetranychus carpini (клещ желтый грабовый паутинный), Epitimerus spp., Eriophyes spp., Ixodes spp. (клещи иксодовые), Metatetranycus spp., Notoedres cati, Oligonychus spp., Oligonychus coffee, Oligonychus ilicus (клещ плодовый бурый паутинный), Panonychus spp., Panonychus citri (клещ цитрусовый красный), Panonychus ulmi (клещ плодовый красный), Phyllocoptruta oleivora (клещик цитрусовый ржавый), Polyphagotarsonemun latus (клещ оранжерейный прозрачный), Rhipicephalus sanguineus (клещ собачий бурый), Rhizoglyphus spp. (клещи луковичные), Sarcoptes scabiei (клещ чесоточный), Tegolophus perseaflorae, Tetranychus spp., Tetranychus urticae (клещ двупятнистый паутинный) и Varroa destructor (верратозный клещ рабочей пчелы).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей класса Nematoda (нематоды). Неполный перечень этих вредителей включает, но без ограничения, Aphelenchoides spp. (стеблевые и листовые и сосновые древесные нематоды), Belonolaimus spp. (нематоды жалящие), Criconemella spp. (нематоды кольцевые), Dirofilaria immitis (червь сердечный), Ditylenchus spp. (нематоды стеблевые и луковичные), Heterodera spp. (гетеродериды), Heterodera zeae (нематода цистообразующая), Hirschmanniella spp. (нематоды корневые), Hoplolaimus spp. (нематоды ланцетовидные), Meloidogyne spp. (нематоды корневые галлообразующие), Meloidogyne incognita (нематода южная корневая галловая), Onchocerca volvulus (онхоцерка), Pratylenchus spp. (нематоды корневые или луговые), Radopholus spp. (струнцы или сверлящие нематоды) и Rotylenchus reniformis (нематода почковидная).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей класса Symphyla (многоножки). Неполный перечень указанных вредителей включает, но без ограничения, Scutigerella immaculata.
Более подробную информацию можно найти в публикации “Handbook of Pest Control - The Behavior, Life History, and Control of Household Pests”, Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
СМЕСИ
Изобретение, раскрытое в данном описании, также может применяться с разными инсектицидами как по соображениям экономии, так и для получения синергического эффекта. Такие инсектициды включают, но без ограничения, антибиотические инсектициды, макроциклические лактоновые инсектициды (например, авермектиновые инсектициды, мильбемициновые инсектициды и спиносиновые инсектициды), мышьяксодержащие инсектициды, растительные инсектициды, карбаматные инсектициды (например, бензофуранилметилкарбаматные инсектициды, диметилкарбаматные инсектициды, оксимкарбаматные инсектициды и фенилметилкарбаматные инсектициды), диамидные инсектициды, десикантные инсектициды, динитрофеноловые инсектициды, фторсодержащие инсектициды, формамидиновые инсектициды, фумигантные инсектициды, неорганические инсектициды, регуляторы роста насекомых (например, ингибиторы синтеза хитина, имитаторы ювенильного гормона, ювенильные гормоны, агонисты гормона линьки, гормоны линьки, ингибиторы линьки, прекоцены и другие неклассифицированные регуляторы роста насекомых), инсектициды-аналоги нерейстоксина, никотиноидные инсектициды (например, нитрогуанидиновые инсектициды, нитрометиленовые инсектициды и пиридилметиламиновые инсектициды), хлорорганические инсектициды, фосфорорганические инсектициды, оксадиазиновые инсектициды, оксадиазолоновые инсектициды, фталимидные инсектициды, пиразоловые инсектициды, пиретроидные инсектициды, пиримидинаминовые инсектициды, пирроловые инсектициды, инсектициды на основе тетрамовой кислоты, инсектициды на основе тетроновой кислоты, тиазоловые инсектициды, тиазолидиновые инсектициды, тиомочевинные инсектициды, мочевинные инсектициды, а также другие неклассифицированные инсектициды.
Некоторые из конкретных инсектицидов, которые могут преимущественно использоваться в сочетании с изобретением, раскрытом в данном описании, включают, но без ограничения, следующие действующие вещества: 1,2-дихлорпропан, 1,3-дихлорпропен, абамектин, ацефат, ацетамиприд, ацетион, ацетопрол, акринатрин, акрилонитрил, аланикарб, альдикарб, альдоксикарб, альдрин, аллетрин, аллосамидин, алликсикарб, альфа-циперметрин, альфа-эндосульфан, амидитион, аминокарб, амитон, амитраз, анабазин, атидатион, азадикахтин, азаметифос, азинфос-этил, азинфос-метил, азотоат, гексафторсиликат бария, бартрин, бендиокарб, бенфуракарб, бенсултап, бэта-цифлутрин, бэта-циперметрин, бифентрин, биоаллетрин, биоэтанометрин, биоперметрин, биоресметрин, бистрифлурон, боракс, борная кислота, бромфенвинфос, бромоциклен, бром-ДДТ, бромофос, бромофос-этил, буфенкарб, бупрофезин, бутакарб, бутатиофос, бутокарбоксим, бутонат, бутоксикарбоксим, кадусафос, арсенат кальция, полисульфид кальция, камфехлор, карбанолат, карбарил, карбофуран, дисульфид углерода, тетрахлорид углерода, карбофенотион, карбосульфан, картап, хлорантранилипрол, хлорбициклен, хлордан, хлордекон, хлордимеформ, хлорэтоксифос, хлорфенапир, хлорфенвинфос, хлорфлуазурон, хлормефос, хлороформ, хлоропикрин, хлорфоксим, хлорпразофос, хлорпирифос, хлорпирифос-метил, хлортиофос, хромафенозид, цинерин I, цинерин II, цисметрин, клоэтокарб, клосантел, клотианидин, ацетоарсенит меди, арсенат меди, нафтенат меди, олеат меди, кумафос, кумитоат, кротамитон, кротоксифос, круфомат, криолит, цианофенфос, цианофос, циантоат, циантранилипрол, циклетрин, циклопротрин, цифлутрин, цигалотрин, циперметрин, цифенотрин, циромазин, цитиоат, ДДТ, декарбофуран, дельтаметрин, демефион, демефион-O, демефион-С, деметон, деметон-метил, деметон-O, деметон-O-метил, деметон-С, деметон-С-метил, деметон-С-метилсульфон, диафентиурон, диалифос, диатомовая земля, диазинон, дикаптон, дихлофентион, дихлорвос, дикрезил, дикротофос, дицикланил, диэльдрин, дифлубензурон, дилор, димефлутрин, димефокс, диметан, диметоат, диметрин, диметилвинфос, диметилан, динекс, динопроп, диносам, динотефуран, диофенолан, диоксабензофос, диоксакарб, диоксатион, дисульфотон, дитикрофос, д-лимонен, DNOC, дорамектин, экдистерон, эмамектин, EMPC, эмпентрин, эндосульфан, эндотион, эндрин, EPN, эпофенонан, эприномектин, эсфенвалерат, этафос, этиофенкарб, этион, этипрол, этоат-метил, этопрофос, этилформат, этил-ДДД, этилендибромид, этилендихлорид, этиленоксид, этофенпрокс, этримфос, EXD, фамфур, фенамифос, феназафлор, фенхлорфос, фенетакарб, фенфлутрин, фенитротион, фенобукарб, феноксакрим, феноксикарб, фенпиритрин, фенпропатрин, фенсульфотион, фентион, фентион-этил, фенвалерат, фипронил, флоникамид, флубендиамид, флукофурон, флуциклоксурон, флуцитринат, флуфенерим, флуфеноксурон, флуфенпрокс, флувалинат, фонофос, форметанат, формотион, формпаранат, фосметилан, фоспират, фостиэтан, фуратиокарб, фуретрин, гамма-цигалотрин, гамма-HCH, галфенпрокс, галофенозид, HCH, HEOD, гептахлор, гептенофос, гетерофос, гексафлумурон, HHDN, гидраметилнон, гидроцианид (синильная кислота), гидропрен, гихинкарб, имидаклоприд, имипротрин, индоксакарб, йодометан, IPSP, исазофос, исобензан, изокарбофос, изодрин, изофенфос, изопрокарб, изопротиолан, изотиоат, изоксатион, ивермектин, жасмолин I, жасмолин II, йодфенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, келеван, кинопрен, лямбда-цигалотрин, арсенат свинца, лепимектин, лептофос, линдан, лиримфос, луфенурон, литидатион, малатион, малонобен, мазидокс, мекарбам, мекарфон, меназон, мефосфолан, хлорид ртути, месульфенфос, метафлумизон, метакрифос, метамидофос, метидатион, метиокарб, метокротофос, метомил, метопрен, метоксихлор, метоксифенозид, метилбромид, метилхлороформ, метиленхлорид, метофлутрин, метолкарб, метоксадиазон, мевинфос, мексакарбат, мильбемектин, мильбемицин-оксим, мипафокс, мирекс, монокротофос, морфотион, моксидектин, нафталофос, налед, нафталин, никотин, нифлуридид, нитенпирам, нитиазин, нитрилакарб, новалурон, новифлумурон, ометоат, оксамил, оксидеметон-метил, оксидепрофос, оксидисульфотон, пара-дихлорбензол, паратион, паратион-метил, пенфлурон, пентахлорфенол, перметрин, фенкаптон, фенотрин, фентоат, форат, фосалон, фосфолан, фосмет, фоснихлор, фосфамидон, фосфин, фоксим, фоксим-метил, пириметафос, пиримикарб, пиримифос-этил, пиримифос-метил, арсенит калия, тиоцианат калия, пп'-ДДТ, праллетрин, прекоцен I, прекоцен II, прекоцен III, примидофос, профенофос, профлутрин, промацил, промекарб, пропафос, пропетамфос, пропоксур, протидатион, протиофос, протоат, протрифенбут, пираклофос, пирафлупрол, пиразофос, пиресметрин, пиретрин I, пиретрин II, пиридабен, пиридалил, пиридафентион, пирифлуквиназон, пиримидифен, пиримитат, пирипрол, пирипроксифен, квассия, квиналфос, квиналфос-метил, квинотион, рафоксанид, ресметрин, ротенон, рианиа, сабадилла, шрадан, селамектин, силафлуофен, силикагель, арсенит натрия, фторид натрия, гексафторсиликат натрия, тиоцианат натрия, софамид, спинеторам, спиносад, спиромесифен, спиротетрамат, сулькофурон, сульфоксафлор, сульфлурамид, сульфотеп, сульфурилфторид, сульпрофос, тау-флувалинат, тазимкарб, TDE, тебуфенозид, тебуфенпирад, тебупиримфос, тефлубензурон, тефлутрин, темефос, TEPP, тераллетрин, тербуфос, тетрахлорэтан, тетрахлорвинфос, тетраметрин, тэта-циперметрин, тиаклоприд, тиаметоксам, тикрофос, тиокарбоксим, тиоциклам, тиодикарб, тиофанокс, тиометон, тиосультап, турингиенсин, толфенпирад, тралометрин, трансфлутрин, трансперметрин, триаратен, триазамат, триазофос, трихлорфон, трихлорметафос-3, трихлоронат, трифенофос, трифлумурон, триметакарб, трипрен, вамидотион, ванилипрол, XMC, ксилилкарб, зэта-циперметрин, золапрофос и α-экдисон.
Кроме того, могут использоваться любые сочетания указанных выше инсектицидов.
Изобретение, раскрытое в данном описании, по экономическим соображениям и для получения синергического эффекта также может применяться в сочетании с акарицидами, альгицидами, антифидантами, авицидами, бактерицидами, репеллентами для птиц, хемостерилизаторами, фунгицидами, антидотами от гербицидов, гербицидами, аттрактантами для насекомых, репеллентами для насекомых, репеллентами для млекопитающих, разобщителями спаривания, моллюскицидами, активаторами растений, регуляторами роста растений, родентицидами, синергистами, дефолиантами, десикантами, дезинфектантами, семихимикатами и вирусоцидами (указанные категории не являются обязательно взаимоисключающими).
Для получения дополнительной информации следует обратиться к источнику "Compendium of Pesticide Common Names", выложенному на http:/www.alanwood.net/pesticides/index.html. Следует также обращаться к публикациии "The Pesticide Manual" 14th Edition, ed. C.D.S Tomlin, copyright 2006 by British Crop Production Council.
СИНЕРГИЧЕСКИЕ СМЕСИ
Изобретение, раскрытое в настоящем документе, может применяться с другими соединениями, указанными в разделе “Смеси” для получения синергических смесей, в которых механизмы действия соединений являются одинаковыми, схожими или различающимися.
Образцы соединений по механизму действия включают, но без ограничения, ингибитор ацетилхолинэстеразы; модулятор натриевых каналов; ингибиротор биосинтеза хитина; ГАМК/GABA-управляемый антагонист хлоридных каналов; ГАМК/GABA- и глютамат-управляемый агонист хлоридных каналов; агонист ацетилхолиновых рецепторов; ингибитор MET I; Mg-стимулированный ингибитор АТФазы; никотиновый ацетилхолиновый рецептор; разрушитель мембраны средней кишки; разрушитель окислительного фосфорилирования и рианодиновый рецептор (RyRs).
Кроме того, следующие соединения: пиперонилбутоксид, пипротал, пропилисом, сесамекс, сесамолин и сульфоксид, известные как синергисты, могут применяться с изобретением, раскрытым в данном описании:
ПРЕПАРАТЫ
Пестицид редко подходит для применения его в чистом виде. Для того чтобы пестицид можно было использовать в нужной концентрации и в соответствующей форме, которая сделает его применение, работу с ним, транспортировку и хранение удобными и позволит получить максимальную пестицидную активность, обычно необходимо добавлять к пестициду другие вещества. Поэтому пестициды готовят как препарат, например, в виде приманок, концентрированных эмульсий, дустов, эмульгирующихся концентратов, фумигантов, гелей, гранул, микрокапсул, препаратов для обработки семян, суспензионных концентратов, суспоэмульсий, таблеток, водорастворимых жидкостей, вододиспергируемых гранул и сухих текучих препаратов, смачивающихся порошков и растворов для ультрамалообъемного опрыскивания.
Для получения дополнительной информации по типам препаратов следует обратиться к публикации “Catalogue of pesticide formulation types и international coding system” Technical Monograph № 2, 5th Edition by CropLife International (2002).
Чаще всего пестициды применяются в форме водных суспензий или эмульсий, приготовленных из концентрированных препаратов таких пестицидов. Такие водорастворимые, водосуспендируемые или эмульгируемые препараты представляют собой либо твердые препараты, обычно известные как смачивающиеся порошки или вододиспергируемые гранулы, либо жидкие препараты, обычно известные как эмульгирующиеся концентраты или водные суспензии. Смачивающиеся порошки, которые могут подвергаться прессованию для получению вододиспергируемых гранул, содержат однородную смесь пестицида, носителя и поверхностно-активных веществ. Концентрация пестицида обычно составляет от примерно 10% до примерно 90% по массе. Носитель обычно выбран из аттапульгитовых глин, монтмориллонитовых глин, диатомовой земли или очищенных силикатов. Эффективные поверхностно-активные вещества, составляющие от примерно 0,5% до примерно 10% смачивающегося порошка, выбраны из сульфонированных лигнинов, конденсированных нафталинсульфонатов, нафталинсульфонатов, алкилбензолсульфонатов, алкилсульфатов и неионогенных поверхностно-активных веществ, таких как этиленоксидные аддукты алкилфенолов.
Эмульгирующиеся концентраты пестицидов содержат пестицид подходящей концентрации, которая составляет от примерно 50 до примерно 500 граммов на литр жидкости, растворенной в носителе, который представляет собой смешивающийся с водой растворитель или смесь не смешивающегося с водой органического растворителя и эмульгаторов. Применимые органические растворители включают ароматические растворители, в частности ксилолы, и петролейные фракции, в частности высококипящие нафталиновые и олефиновые фракции нефти, такие как тяжелый ароматический лигроин. Могут также использоваться другие органические растворители, такие как терпеновые растворители, включая производные древесной смолы, алифатические кетоны, такие как циклогексанон, и сложные спирты, такие как 2-этоксиэтанол. Подходящие эмульгаторы для эмульгирующихся концентратов выбраны из традиционных анионогенных и неионогенных поверхностно-активных веществ.
Водные суспензии содержат суспензии нерастворимых в воде пестицидов, диспергированных в водном носителе в концентрации в интервале от примерно 5% до примерно 50% по массе. Суспензии получают тонким измельчением пестицида и тщательным смешиванием его с носителем, состоящим из воды и поверхностно-активных веществ. Для повышения плотности и вязкости водного носителя могут также добавляться ингредиенты, такие как неорганические соли и синтетические или природные смолы. Зачастую наиболее эффективно измельчать и смешивать пестицид одновременно с приготовлением водной смеси и гомогенизированием ее в таком аппарате, как песчаная мельница, шаровая мельница или гомогенизатор поршневого типа.
Пестициды также могут применяться как гранулированные композиции, которые особенно подходят для почвенного применения. Гранулированные композиции обычно содержат от примерно 0,5% до примерно 10% по массе пестицида, диспергированного в носителе, который содержит глину или подобное вещество. Такие композиции обычно готовят растворением пестицида в подходящем растворителе и нанесением его на гранулированный носитель, который предварительно формуют в частицы подходящего размера в интервале от примерно 0,5 до примерно 3 мм. Такие композиции также могут быть получены приготовлением густой массы или пасты носителя и соединения с последующим дроблением и сушкой для получения гранул нужного размера.
Дусты, содержащие пестицид, получают тщательным смешиванием пестицида в порошкообразной форме с подходящим порошкообразным сельскохозяйственным носителем, таким как каолиновая глина, измельченная вулканическая порода и т.п. Подходящие дусты могут содержать от примерно 1% до примерно 10% пестицида. Они могут применяться для протравливания семян или наноситься на листву с помощью машины для распыления дуста.
В равной степени практически применимо также нанесение пестицида в форме раствора в соответствующем органическом растворителе, обычно в минеральном масле, таком как масла для опрыскивания, которые широко используются в химических препаратах для сельского хозяйства.
Пестициды также могут применяться в форме аэрозольной композиции. В таких композициях пестицид растворен или диспергирован в растворителе, который представляет собой смесь пропеллентов под давлением. Композиция для применения в форме аэрозоля помещается в контейнер, из которого смесь распределяется через форсунку.
Пестицидные приманки получают смешиванием пестицида с кормом или аттрактантом или с тем и другим одновременно. Когда вредители едят приманку, они также проглатывают пестицид. Приманки могут иметь форму гранул, гелей, текучих порошков, жидкостей или твердых веществ. Они применяются в местах обитания вредителей.
Фумиганты представляют собой пестициды, которые характеризуются относительно высоким давлением паров и, следовательно, могут существовать в виде газа в концентрациях, достаточных для поражения вредителя в почве или закрытых пространствах. Токсичность фумиганта пропорциональна его концентрации и времени экспозиции. Фумиганты характеризуются хорошей способностью диффундировать и действовать посредством проникновения в дыхательную систему вредителя или абсорбции через кутикулу вредителя. Фумиганты применяются для контроля вредителей в продуктах питания, хранящихся на газонепроницаемых листах, в газонепроницаемых комнатах, или зданиях, или в специальных камерах.
Пестициды могут микроинкапсулироваться суспендированием пестицидных частиц или капель в пластиковые полимеры различных типов. Посредством подбора химического строения полимера или изменением ряда факторов технологической обработки могут быть получены микрокапсулы различных размеров, различной растворимости, с различной толщиной стенки и степенями проницаемости. Эти факторы влияют на скорость, с которой активный ингредиент высвобождается из капсулы, что, в свою очередь, влияет на остальные характеристики, такие как скорость действия и запах продукта.
Концентраты масляных растворов получают растворением пестицида в растворителе, который будет удерживать пестицид в растворе. Масляные растворы пестицида обычно обеспечивают более быстрое поражение и уничтожение вредителей, чем другие препараты, поскольку сами растворители в этом случае обладают пестицидным действием и растворение воскообразного покрытия оболочки вредителя повышает скорость поглощения пестицида. Другими преимуществами масляных растворов являются лучшая стабильность при хранении, лучшее проникновение в трещины и лучшая адгезия к маслянистым поверхностям.
Другим вариантом осуществления является эмульсия типа “масло-в-воде”, где эмульсия включает маслянистые сферические частицы, каждая из которых обеспечена ламинарным жидким кристаллическим покрытием и диспергирована в водной фазе, где каждая маслянистая сферическая честица включает, по меньшей мере, одно сельскохозяйственно активное соединение и отдельно покрыта монослойным или многослойным покрытием, включающим: (1) по меньшей мере, одно неионогенное липофильное поверхностно-активное вещество, (2) по меньшей мере, одно неионогенное гидрофильное поверхностно-активное вещество и (3) по меньшей мере, одно ионогенное поверхностно-активное вещество, где средний диаметр сферических частиц составляет менее 800 нанометров. Дополнительная информация по вариантам осуществления представлена в Патентной публикации США 20070027034 от 1 февраля 2007 года с Сер. № Заявки на Патент 11/495228. Для простоты применения данный вариант осуществления будет называться “OIWE”.
Для дополнительной информации следует обращаться к публикации "Insect Pest Management" 2nd Edition by D. Dent, copyright CAB International (2000). Кроме того, для более подробной информации см. "Handbook of Pest Control - The Behavior, Life History and Control of Household Pests" by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ДРУГИЕ КОМПОНЕНТЫ ПРЕПАРАТОВ
Обычно, когда изобретение, раскрытое в данном описании, применяется в препарате, такой препарат может также содержать другие компоненты. Эти компоненты включают, но без ограничения (данный перечень является неполным и не взаимноисключающим перечнем дополнительных компонентов), смачивающие агенты, распределители по поверхности, связующие вещества, добавки, повышающие проницаемость, буферы, комплексообразующие добавки, добавки, снижающие снос активного ингредиента, добавки, повышающие совместимость компонентов, пеногасители, осветляющие добавки и эмульгаторы. Некоторые из указанных компонентов описаны ниже.
Смачивающий агент представляет собой вещество, которое при добавлении к жидкости повышает способность жидкости распределяться по поверхности и проникать через нее снижением поверхностного натяжения между жидкостью и поверхностью, на которой она распределяется. Смачивающие агенты применяются для двух основных функций в сельскохозяйственных препаратах: в процессе технологической обработки и производства для повышения скорости смачивания порошков в воде при получении концентратов в растворимых жидкостях или суспензионных концентратов; и в процессе смешивания продукта с водой в емкости опрыскивателя для снижения времени смачивания смачивающихся порошков и для повышения проницаемости воды в вододиспергируемые гранулы. Примерами смачивающих агентов, используемых в смачивающемся порошке, суспензионном концентрате и в препаратах вододиспергируемых гранул, являются: натрийлаурилсульфат; натрийдиоктилсульфосукцинат; алкилфенолэтоксилаты; и этоксилаты алифатических спиртов.
Диспергирующий агент представляет собой вещество, которое адсорбируется на поверхности частиц, способствует сохранению дисперсного состояния частиц и предохраняет частицы от повторной агрегации. Диспергирующие агенты добавляются в сельскохозяйственные препараты для облегчения получения дисперсии и суспензии в процессе их производства и для гарантирования того, что частицы снова диспергируются в воде в емкости, из которой будет производиться опрыскивание. Они широко используются в смачивающихся порошках, суспензионных концентратах и вододиспергируемых гранулах. Поверхностно-активные вещества, которые используются в качестве диспергирующих агентов, обладают способностью абсорбироваться на поверхности частицы и обеспечивать заряд или стерический барьер, препятствующий повторной агрегации частиц. Чаще всего используемые поверхностно-активные вещества являются анионогенными, неионогенными или представляют собой смеси поверхностных веществ этих двух типов. Для препаратов в форме смачивающихся порошков наиболее часто применяющимися диспергирующими агентами являются натрийлигносульфонаты. Для концентратов суспензий очень хорошая адсорбция и стабилизация достигается при применении полиэлектролитов, таких как конденсаты натрийнафталинсульфоната и формальдегида. Применяются также сложные тристирилфенолэтоксилатфосфатные эфиры. Иногда для получения суспензионных концентратов неионогенные поверхностно-активные вещества, такие как конденсаты алкиларилэтиленоксида и ЭО-ПО блок-сополимеры, объединяются с аниноногенными соединениями в качестве диспергирующих агентов. В последние годы для применения в качестве диспергирующих агентов были разработаны новые типы полимерных поверхностно-активных веществ с очень высокой молекулярной массой. Они содержат очень длинные гидрофобные основные цепи макромолекулы и большое количество этиленоксидных цепей, образующих “зубы” поверхностно-активной “гребенки”. Эти высокомолекулярные полимеры могут обеспечивать очень хорошую длительную стабильность концентратов суспензий, поскольку гидрофобные цепи макромолекул содержат множество точек прикрепления к поверхностям частиц. Примерами диспергирующих агентов, используемых в сельскохозяйственных препаратах, являются лигносульфонаты натрия; конденсаты натрийнафталинсульфоната с формальдегидом; сложные тристирилфенолэтоксилатфосфатные эфиры; этоксилаты алифатических спиртов; алкилэтоксилаты; блок-сополимеры ЭО-ПО; и графт-сополимеры.
Эмульгирующий агент (эмульгатор) представляет собой вещество, которое стабилизирует суспензию капель одной жидкой фазы в другой жидкой фазе. Без эмульгирующего агента эти две жидкости разделились бы на две несмешивающиеся жидкие фазы. Наиболее часто используемые смеси эмульгаторов содержат алкилфенол или алифатический спирт, включающий двенадцать или большее количество этиленоксидных фрагментов, и растворимую в масле кальциевую соль додецилбензолсульфоновой кислоты. Значения гидрофильно-липофильного баланса (“ГЛБ”) в интервале от 8 до 18 обычно будут давать хорошие стабильные эмульсии. Иногда стабильность эмульсии может повышаться добавлением небольшого количество ЭО-ПО блок-сополимерного поверхностно-активного вещества.
Солюбилизирующий агент представляет собой поверхностно-активное вещество, которое будет образовывать мицеллы в воде в концентрациях выше критической концентрации мицеллообразования. После этого мицеллы способны растворять или солюбилизировать нерастворимые в воде материалы внутри гидрофобной части мицеллы. Обычно используемые для солюбилизации поверхностно-активные вещества представляют собой вещества неионогенного типа: сорбитанмоноолеаты, сорбитанмоноолеатэтоксилаты и сложные метилолеатные эфиры.
Иногда поверхностно-активные вещества используются сами по себе или в сочетании с другими добавками, такими как минеральные или растительные масла, в качестве адъювантов для смесей в емкостях для опрыскивания для повышения эффективности биологического действия пестицида на мишень. Типы поверхностно-активных веществ, используемых для повышения биологического действия, обычно зависят от природы и механизма действия пестицида. Однако зачастую они представляют собой поверхностно-активные вещества неионогенного типа, такие как алкилэтоксилаты; этоксилаты линейных алифатических спиртов; этоксилаты алифатических аминов.
Носитель или разбавитель в сельскохозяйственном препарате представляет собой продукт, добавленный к пестициду для получения пестицида требуемой эффективности. Носители обычно представляют собой продукты с высокой абсорбционной способностью, в то время как разбавители представляют собой продукты с низкой абсобционной способностью. Носители и разбавители используются в препаратах в форме дустов, смачивающихся порошков, гранул и вододиспергируемых гранул.
Органические растворители используются, главным образом, в препаратах эмульгирующихся концентратах для УМО/ULV (ультрамалобъемное опрыскивание) и в препаратах с меньшей степенью гранулирования. Иногда используются смеси растворителей. Первыми основными группами растворителей являются алифатические парафиновые масла, такие как керосин или очищенные парафины. Вторая основная группа и наиболее частая включает ароматические растворители, такие как ксилол и ароматические растворители из более высокомолекулярных С9 и C10 фракций. В качестве сорастворителей для предотвращения кристаллизации пестицидов при эмульгировании препарата в воде применяются хлорированные углеводороды. Иногда для повышения силы растворяющей способности растворителя в качестве сорастворителей используются спирты.
Загустители или гелеобразующие агенты используются, главным образом, в препаратах в форме суспензионных концентратов, эмульсий и суспоэмульсий для модификации реологических свойств или текучести жидкости и для предотвращения разделения и осаждения диспергированных частиц или капель. Загустители, гелеобразующие агенты и добавки, препятствующие осаждению, обычно подразделяют на две категории: а именно нерастворимые в воде частицы и растворимые в воде полимеры. Можно получить препараты в форме суспензионного концентрата при использовании глин и диоксидов кремния. Примеры материалов этих типов включают, но без ограничения, монтмориллонит, например бентонит; алюмосиликат магния; и аттапульгит. В течение многих лет в качестве загущающих-гелеобразующих агентов использовались растворимые в воде полисахариды. Наиболее часто используемыми типами полисахаридов являются природные экстракты семян и морских водорослей или синтетические производные целлюлозы. Примеры материалов этих типов включают, но без ограничения, гуаровую смолу; смолу плодов рожкового дерева; каррагенан; альгинаты; метилцеллюлозу; натрийкарбоксиметилцеллюлозу (SCMC); гидроксиэтилцеллюлозу (HEC). Другие типы добавок, предотвращающих осаждение, основаны на модифицированных крахмалах, полиакрилатах, поливиниловом спирте и полиэтиленоксиде. Еще одной хорошей добавкой, предотвращающей осаждение, является ксантановая камедь.
Микроорганизмы вызывают повреждение препаратов. Поэтому для предотвращения или уменьшения их действия применяются консерванты. Примеры таких добавок включают, но без ограничения, пропионовую кислоту и ее натриевую соль; сорбиновую кислоту и ее натриевую или калиевую соли; бензойную кислоту и ее натриевую соль; натриевую соль п-гидроксибензойной кислоты; метил-п-гидроксибензоат и 1,2-бензизотиазалин-3-он (BIT).
Присутствие поверхностно-активных веществ, которые снижают поверхностное натяжение, зачастую вызывает образование пены в препаратах на водной основе в процессе смешивания при получении и применении с использование емкости для опрыскивания. Для снижения тенденции пенообразования в процессе получения или перед розливом в бутыли в препараты зачастую добавляются пеногасители. Обычно существует два типа пеногасителей, в частности силиконы и несиликоны. Силиконы обычно представляют собой водные эмульсии диметилполисилоксана, а несиликоновые пеногасители представляют собой нерастворимые в воде масла, такие как октанол и нонанол или диоксид кремния. В обоих случая функция пеногасителя заключается в замене им поверхностно-активного вещества на границе раздела фаз “воздух-вода”.
Для дополнительной информации см. "Chemistry and Technology of Agrochemical Formulations" edited by D.A. Knowles, copyright 1998 by Kluwer Academic Publishers. См. также "Insecticides in Agriculture and Environment - Retrospects and Prospects" by A.S. Perry, I. Yamamoto, I. Ishaaya and R. Perry, copyright 1998 by Springer-Verlag.
ПРИМЕНЕНИЕ
Фактическое количество пестицида, предназначенное для нанесения на место обитания вредителей, обычно не является критическим и легко может быть определено специалистом данной области техники. Обычно ожидается, что дозы от примерно 0,01 грамма пестицида на гектар до примерно 5000 граммов пестицида на гектар обеспечивают хороший контроль вредителя.
Участок, на который наносится пестицид, может представлять собой любой участок, на котором обитает вредитель, например участок овощных культур, фруктовые и ореховые деревья, виноградники, декоративные растения, домашние животные, внутренние или внешние поверхности зданий и почва вокруг зданий. Контроль вредителей обычно означает, что численность вредителя либо его активность или и численность и активность снижены на указанном участке. Это может происходить, примерно когда популяции вредителя удаляются с указанного участка; когда вредители становятся неспособными к нанесению ущерба в очаге или вокруг очага; или когда вредители истребляются, полностью или частично, в очаге или вокруг очага. Разумеется, может иметь место сочетание перечисленных выше результатов. Обычно популяции вредителей либо их активность или и то и другое в соответствии с желанием снижаются более чем на пятьдесят процентов, предпочтительно более чем на 90 процентов.
При применении приманок они обычно вносятся в почву, где, например, термиты могут контактировать с приманкой. Приманки также могут наноситься на поверхность здания (горизонтральную, вертикальную или наклонную поверхность), на которой, например, муравьи, термиты, тараканы и мухи могут контактировать с приманкой.
Ввиду того что яйца некоторых вредителей обладают уникальной резистентностью к действию пестицидов, могут быть желательными повторные применения для контроля вновь появившихся личинок.
Системное движение пестицидов в растениях может использоваться для контроля вредителей на одной части растения нанесением пестицидов на другую часть растения. Например, контроль насекомых, поедающих листья, может осуществляться капельным орошением или применением в борозды либо обработкой семян перед их посадкой. Обработка семян может применяться для семян всех типов, включая семена, из которых будут выращены растения, генетически трансформированные для экспрессии особых характерных признаков. Типичные примеры включают растения, экспрессирующие белки, токсичные для беспозвоночных вредителей, такие как Bacillus thuringiensis или другие инсектицидные токсины, которые экспрессируют гербицидную резистентность, такие как семена растений, устойчивых к применению раундапа (“Roundup Ready”), или семена со “сложенными” чужеродными генами, экспрессирующими инсектицидные токсины, резистентность к гербициду, повышенную питательную ценность или любые другие полезные признаки. Кроме того, такие обработки семян с помощью изобретения, раскрытого в данном описании, могут дополнительно повышать способность растения противостоять стрессовым условиям роста. Это приводит к получению более здорового, более жизнестойкого растения, что может привести к более высокому выходу продукции во время сбора урожая.
Должно быть понятно, что изобретение может применяться к растениям, генетически преобразованным для экспрессии особых признаков, а именно Bacillus thuringiensis или других инсектицидных токсинов, к растениям, которые экспрессируют резистентность к действию гербицида, к растениям со “сложенными” чужеродными генами, экспрессирующими инсектицидные токсины, резистентность к гербициду, повышенную питательную ценность или любые другие полезные признаки.
Изобретение, раскрытое в данном описании, подходит для контроля эндопаразитов и эктопаразитов в ветеринарии или в области ухода за животными. Соединения применяются известным образом, таким как пероральное введение в форме, например таблеток, капсул, напитков, гранул, нанесением на кожу посредством, например, погружения, опрыскивания, розлива на поверхности, нанесения в виде пятна, опылением и парентеральным введением в форме, например, инъекции.
Изобретение, раскрытое в данном описании, может также применяться при содержании домашнего скота, например крупного рогатого скота, овец, свиней, кур и гусей. Подходящие препараты вводятся животным перорально с питьевой водой или кормом. Дозы и препараты, которые являются подходящими, зависят от видов животных.
Применению пестицида или поступлению его в коммерческую продажу предшествует длительная проверка его различными уполномоченными органами (местными, региональными, государственными, национальными, международными). Обширные требования к показателям пестицидов определяются контролирующими органами и должны быть адресованы сбору и рассмотрению данных по пестициду органом, регистрирующим продукт, или другим органом, действующим от его имени. Эти уполномоченные правительством органы рассматривают полученные данные и, если выносится заключение о безопасности продукта, предоставляют потенциальному пользователю или продавцу продукт с подтвержденной регистрацией. После этого в том регионе, где регистрация продукта признается законной и доказанной, указанный пользователь или продавец может использовать или продавать такой пестицид.
Заголовки в этом документе представлены только для удобства и не должны использоваться для интерпретации любой его части.




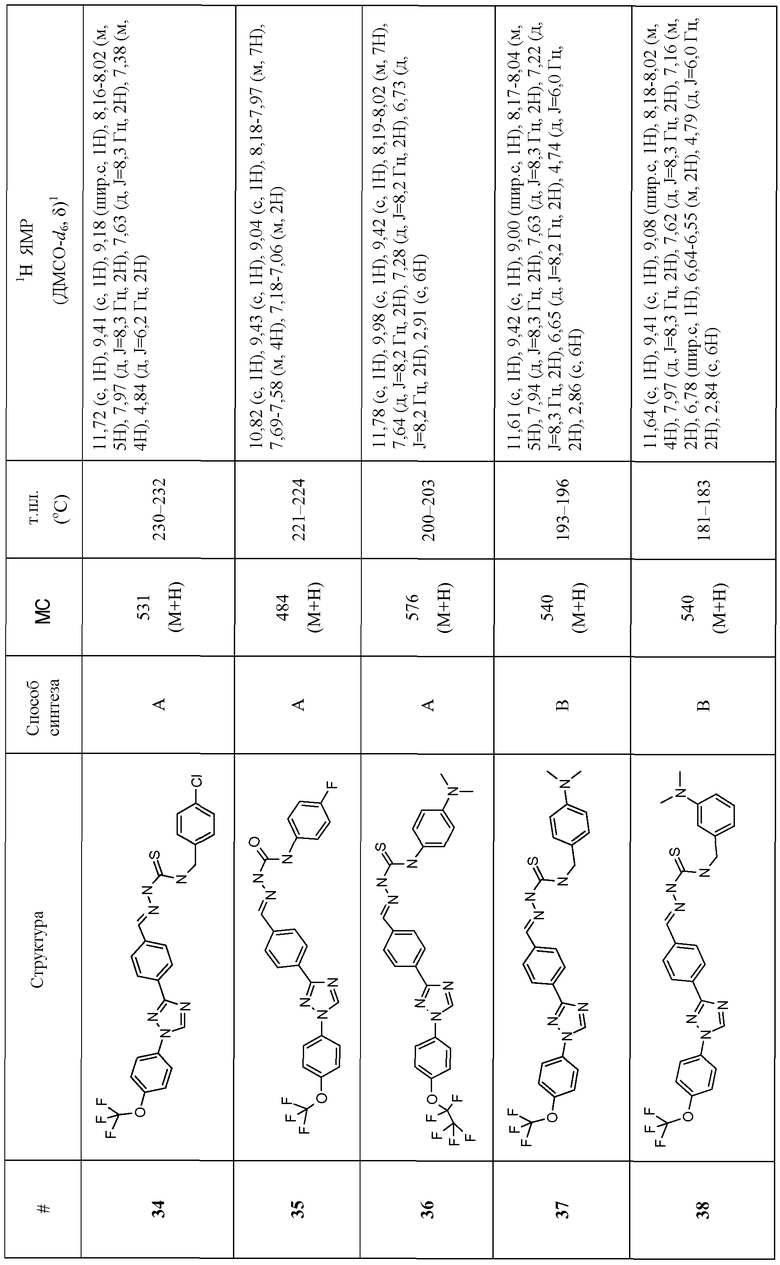

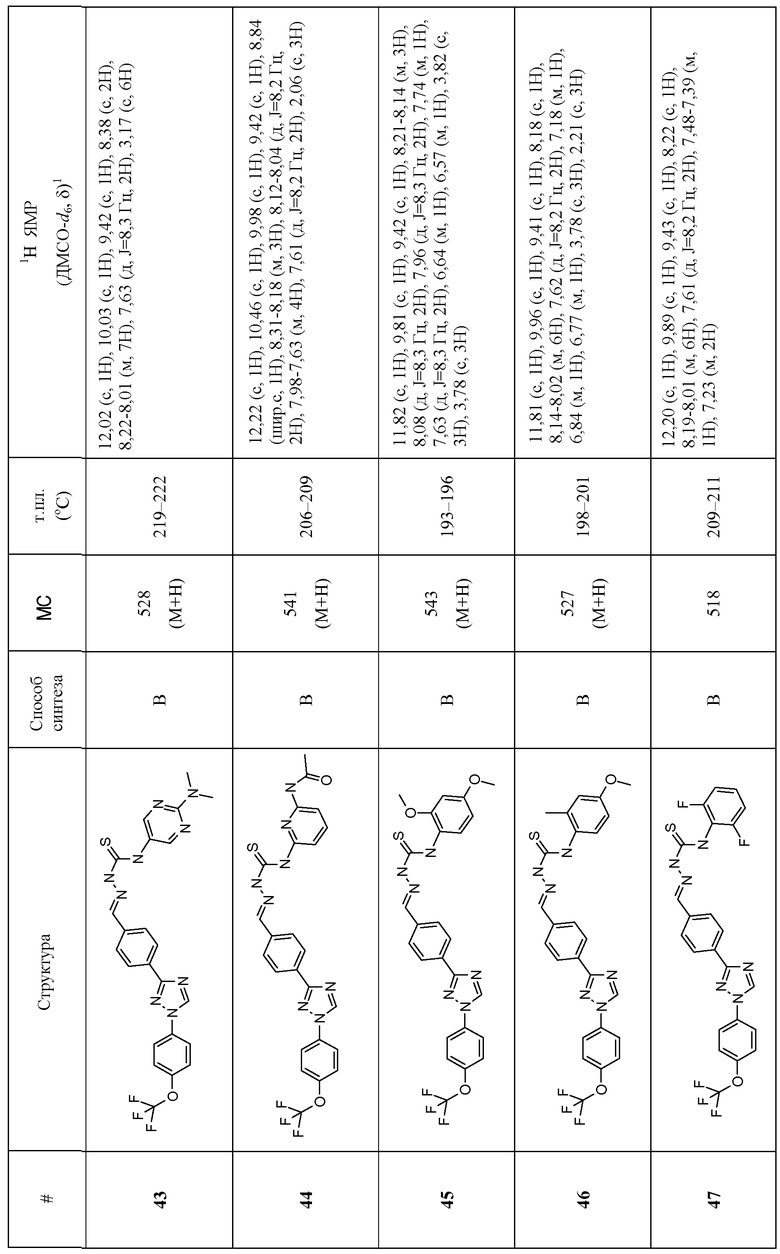

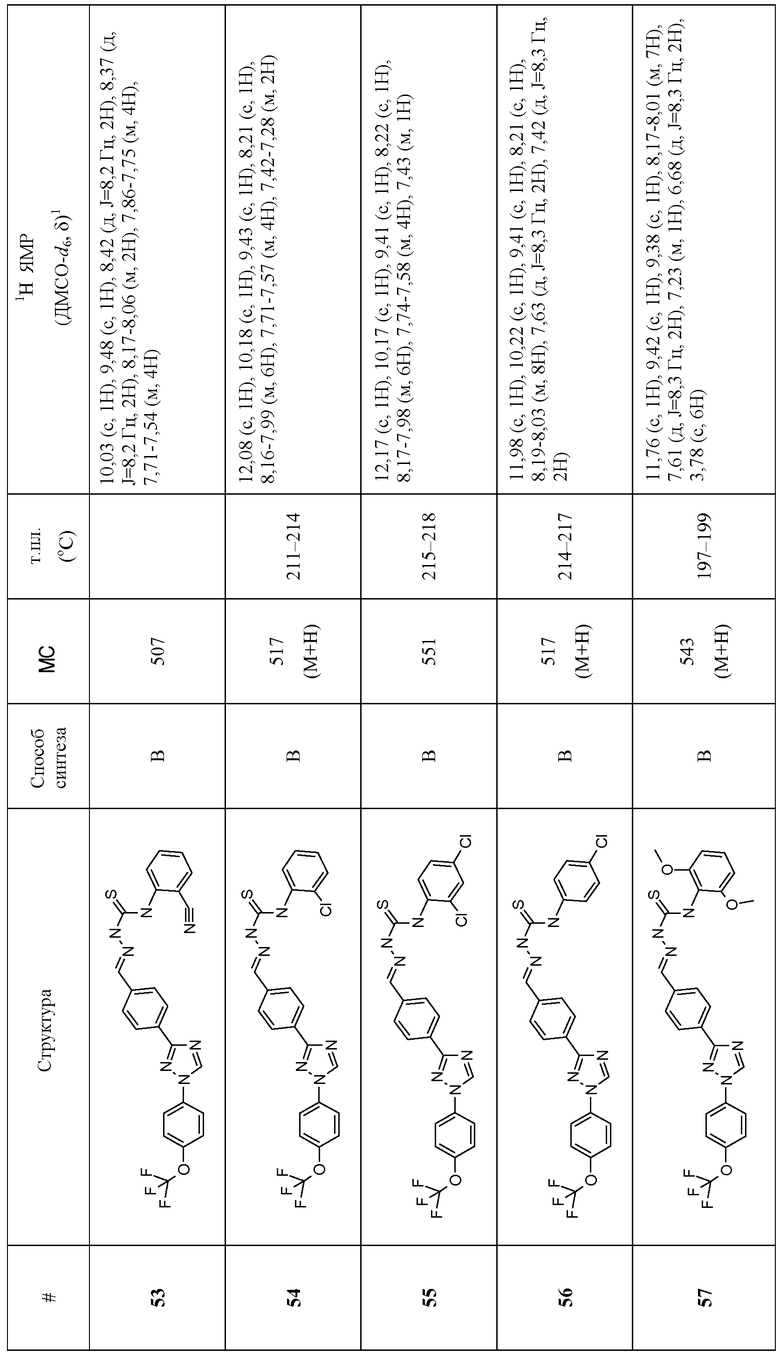



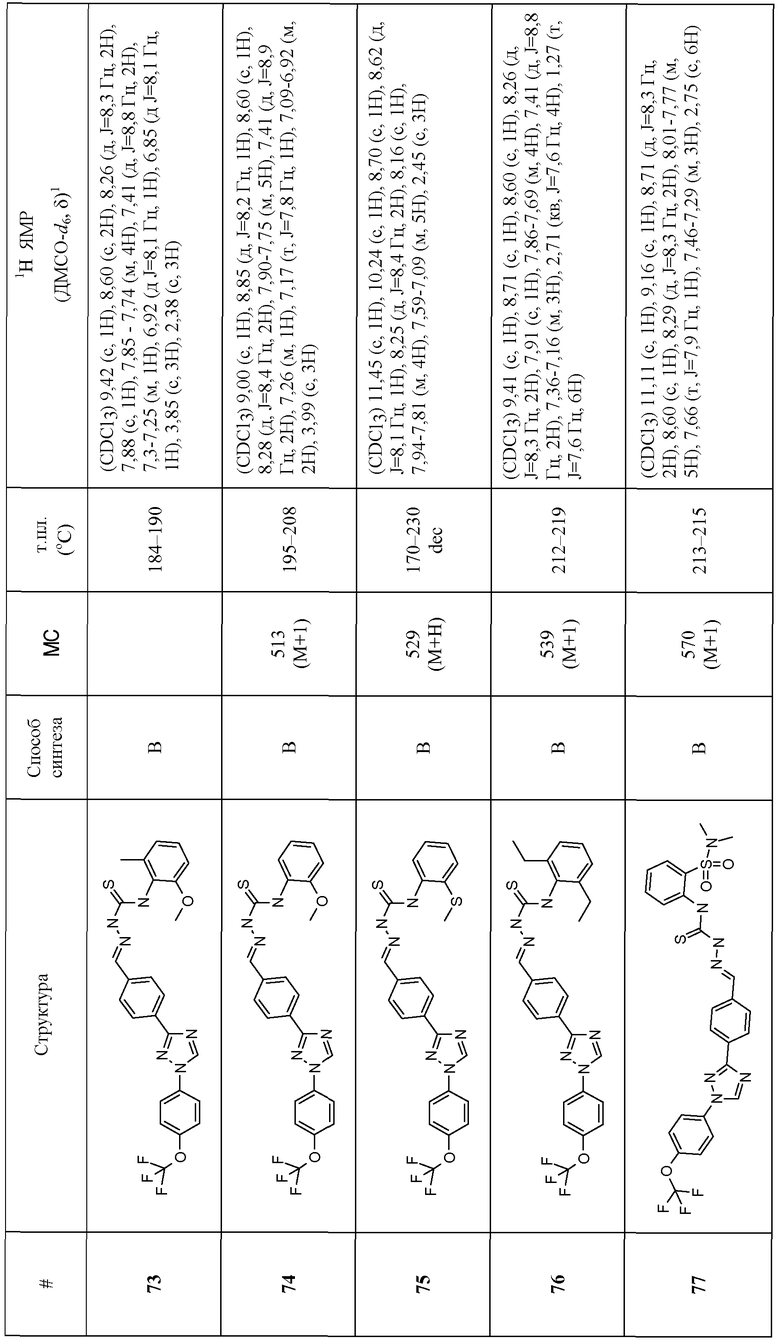
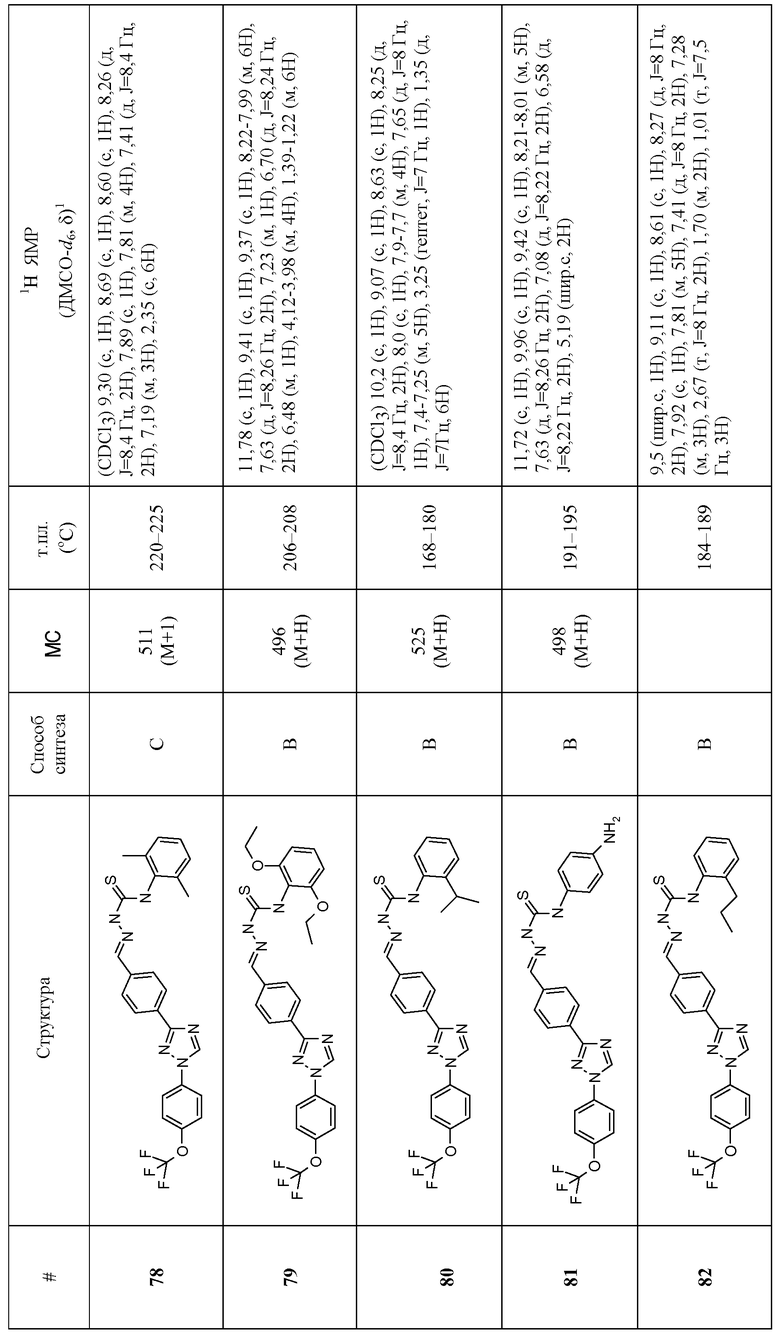


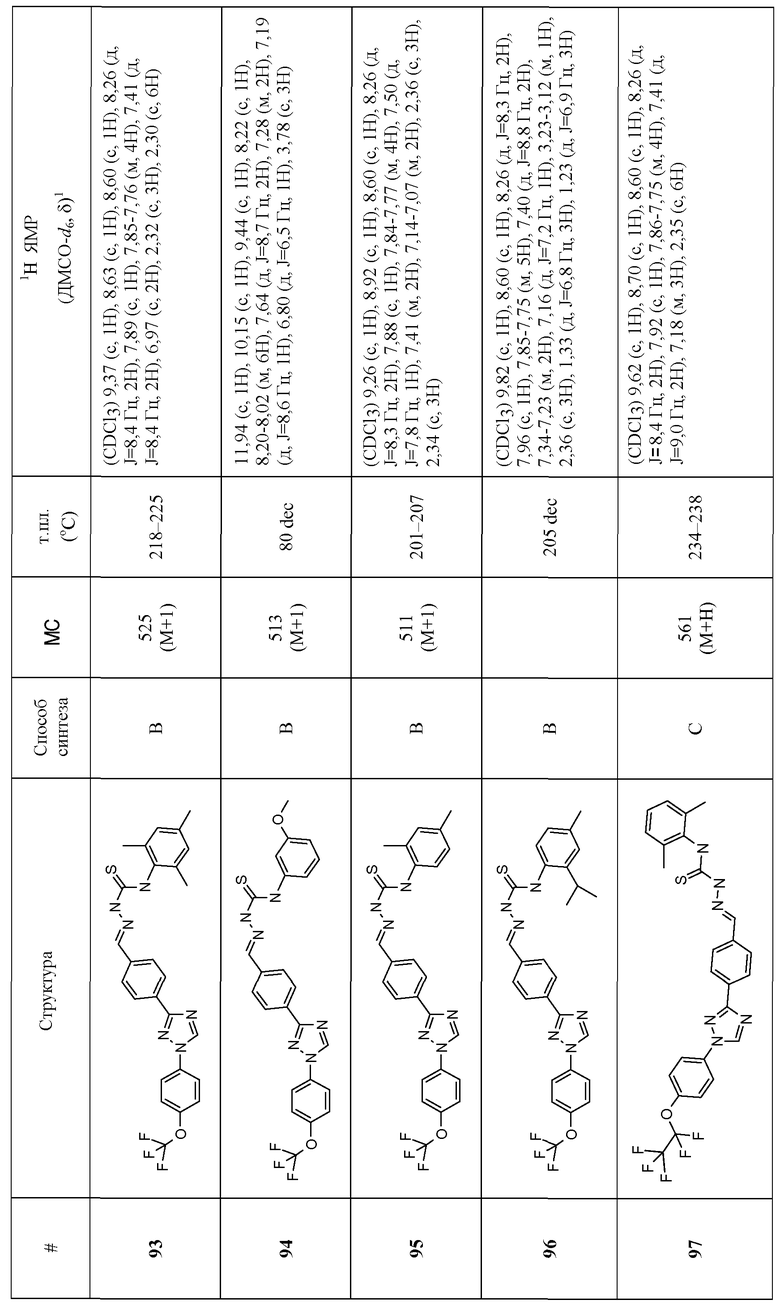
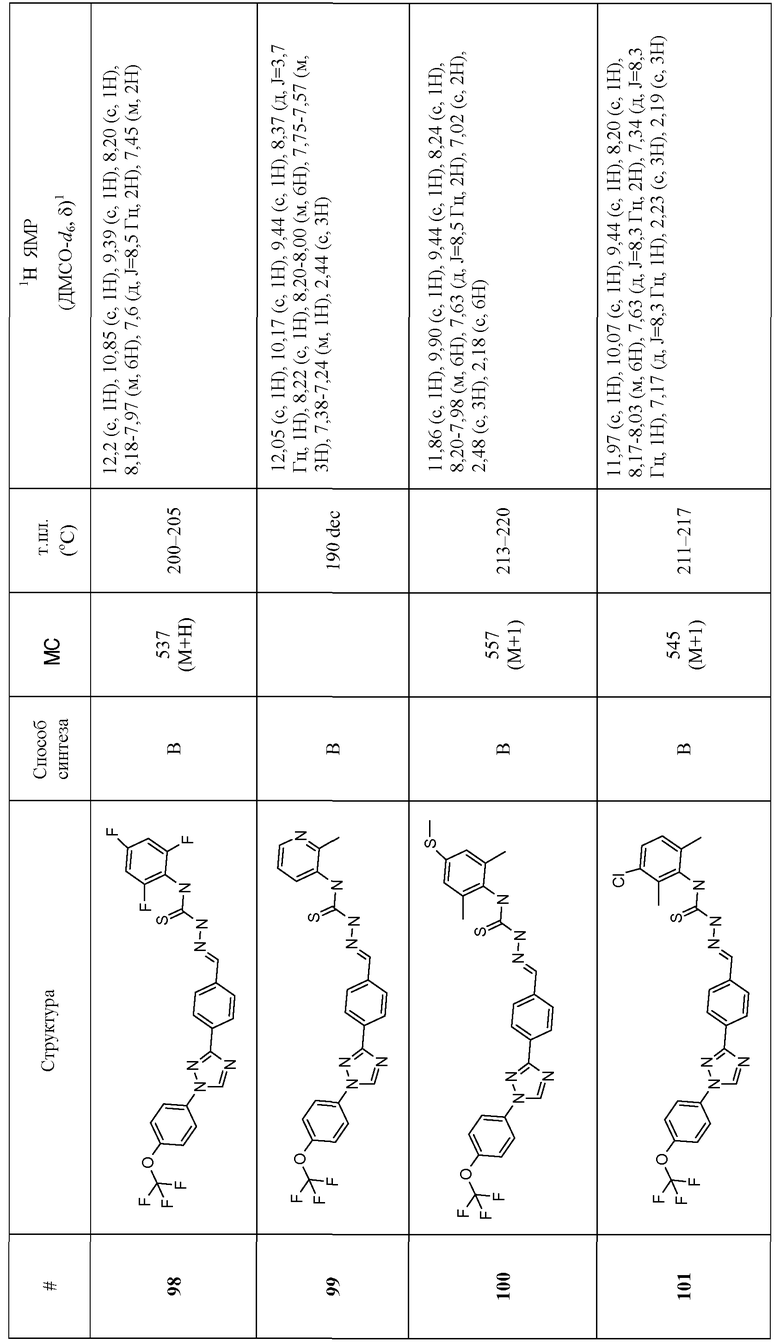


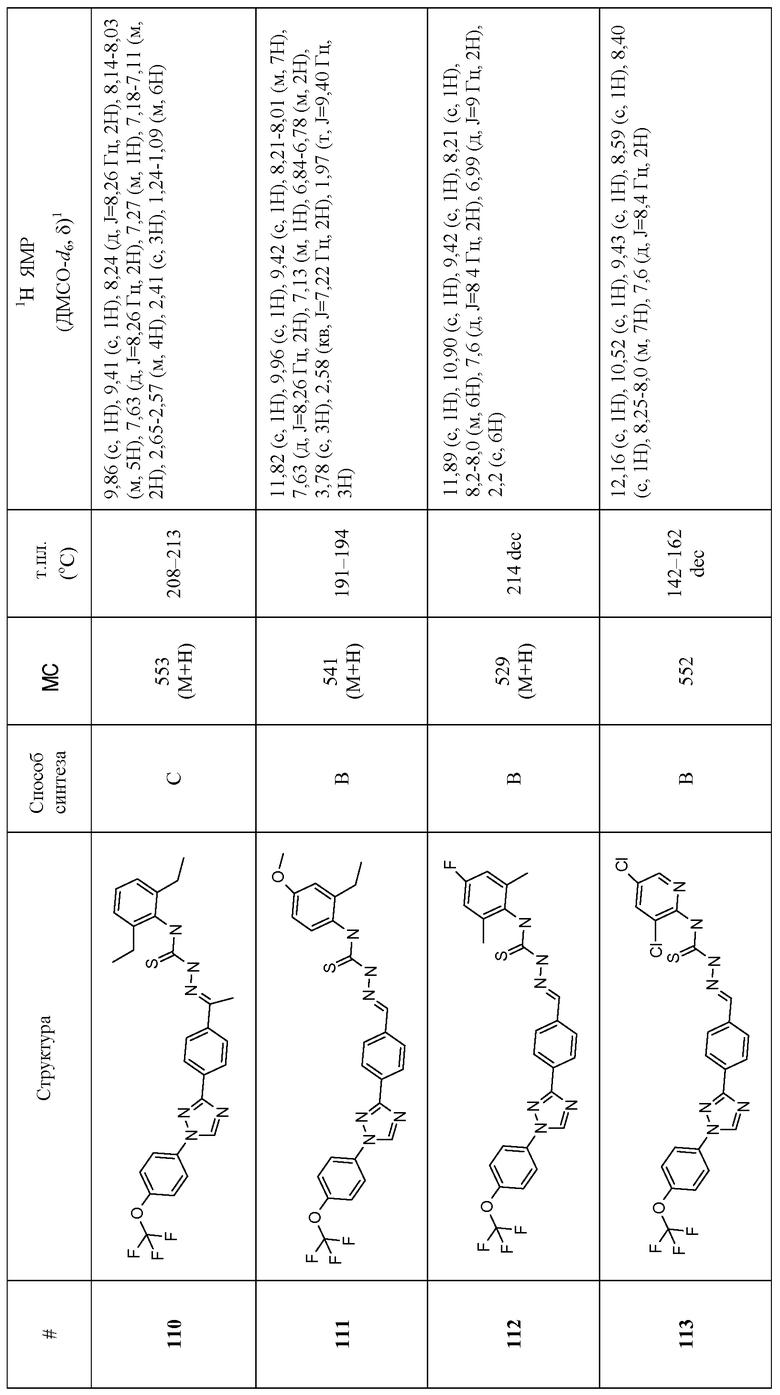


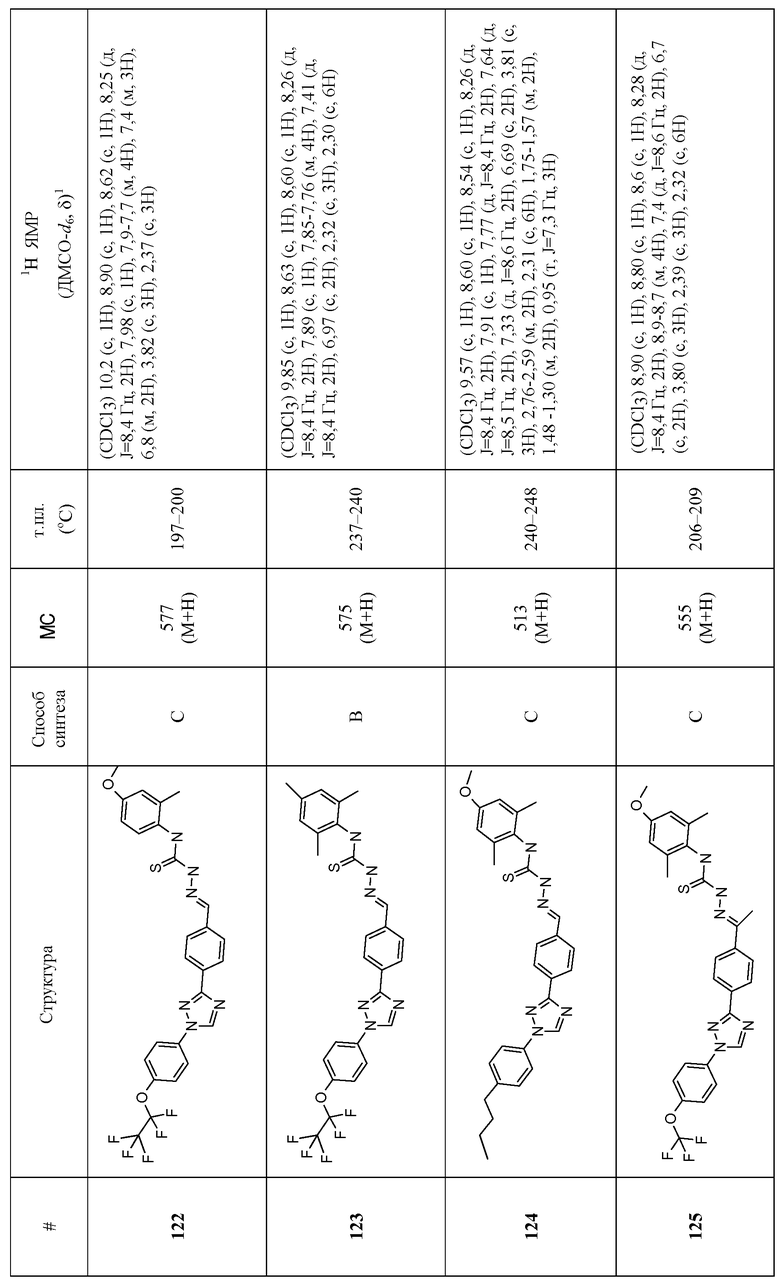
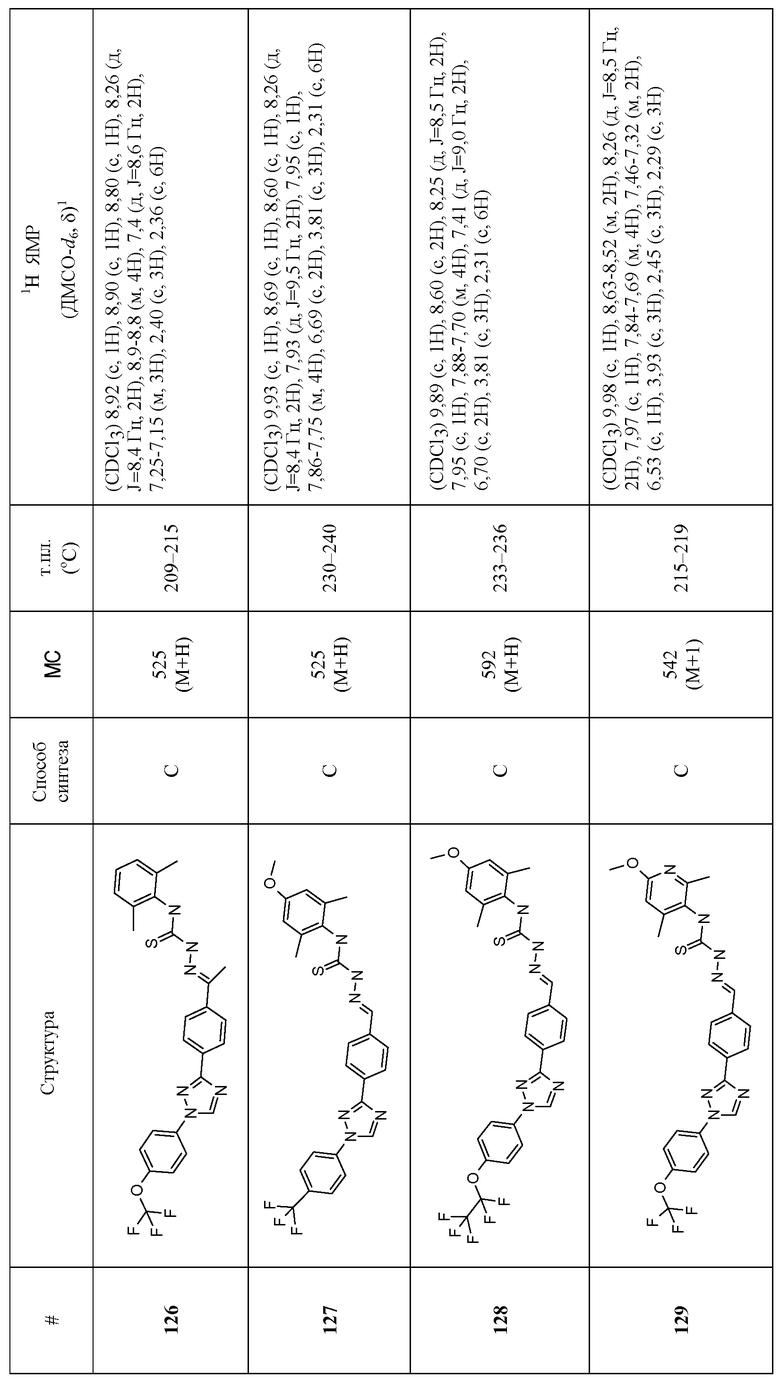


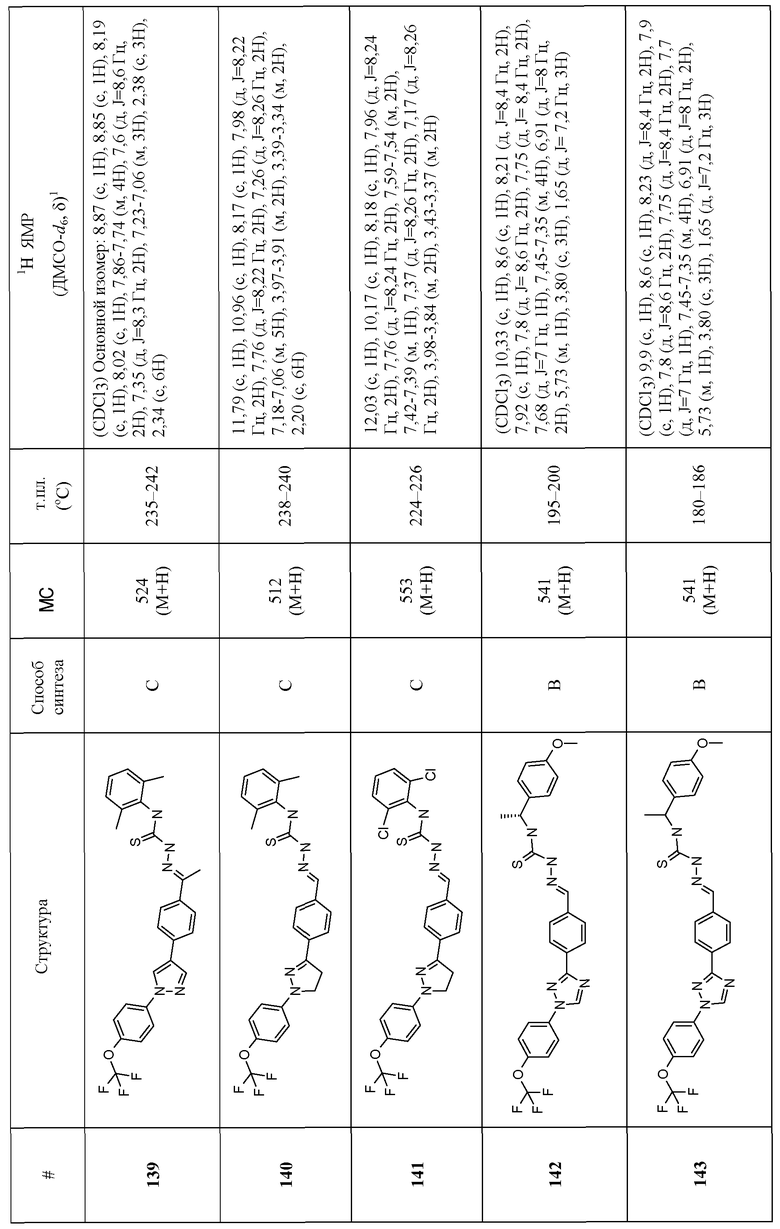


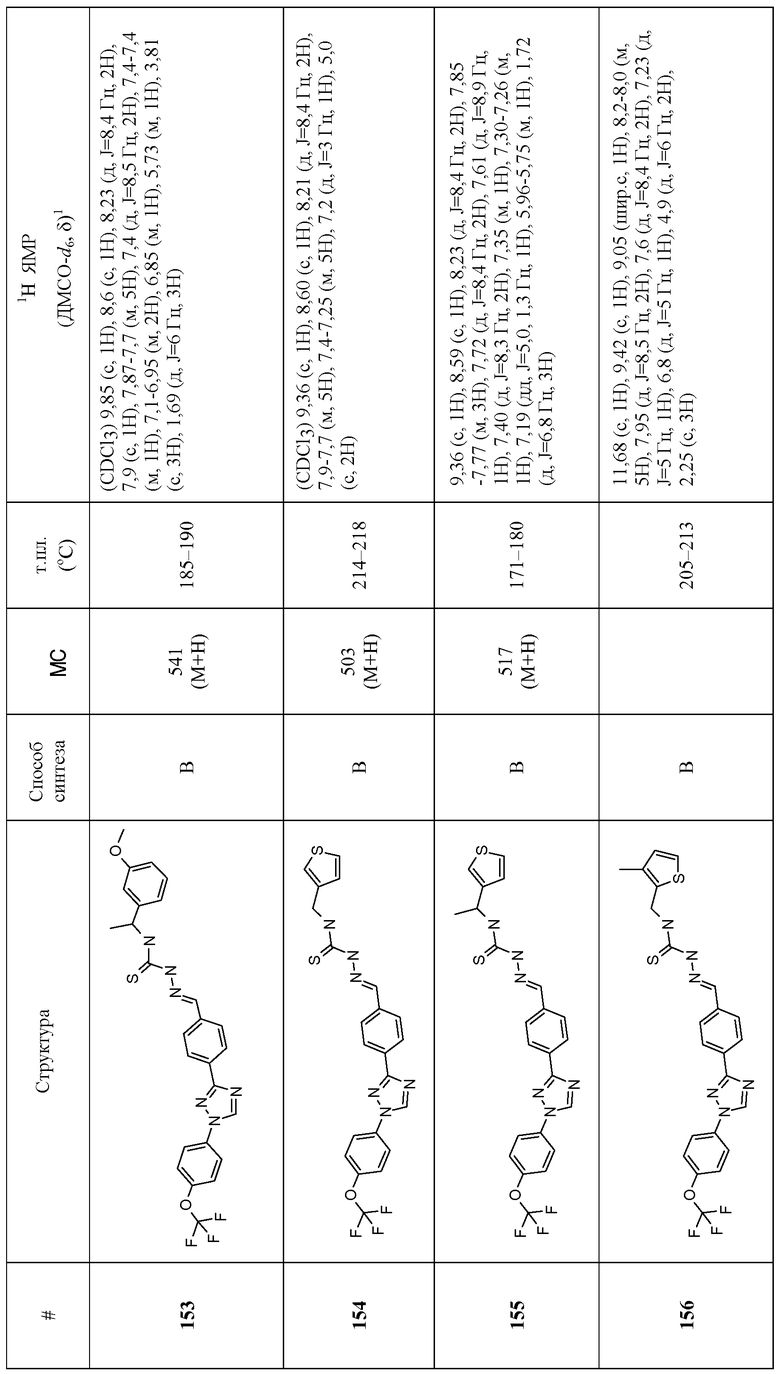
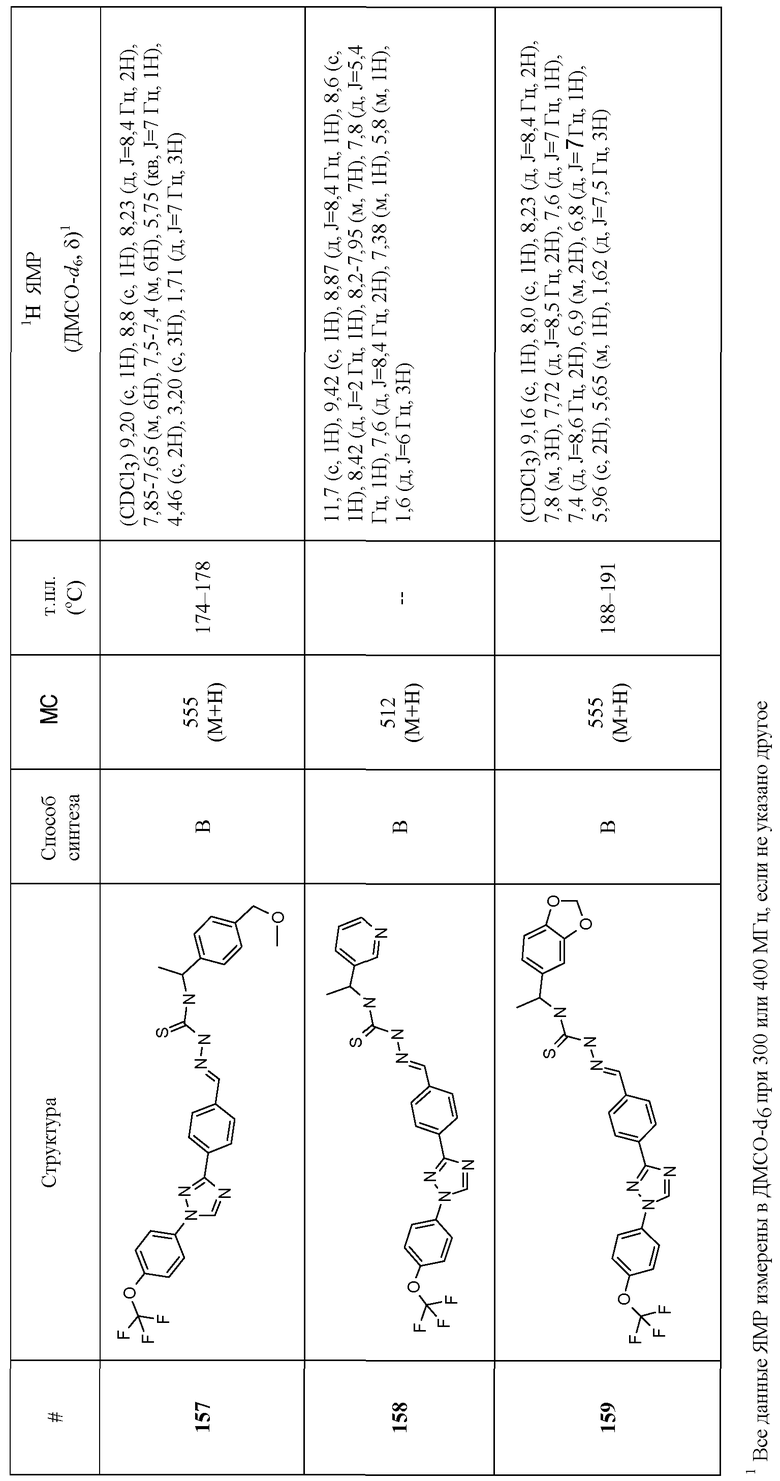


| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2011 |
|
RU2566189C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2009 |
|
RU2513723C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2010 |
|
RU2532470C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2012 |
|
RU2592542C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2012 |
|
RU2596946C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2013 |
|
RU2616812C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2012 |
|
RU2597421C2 |
| МОЛЕКУЛЫ С ОПРЕДЕЛЕННОЙ ПЕСТИЦИДНОЙ АКТИВНОСТЬЮ И ОТНОСЯЩИЕСЯ К НИМ ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ, КОМПОЗИЦИИ И СПОСОБЫ | 2014 |
|
RU2650498C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2013 |
|
RU2616808C2 |
| ПЕСТИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ КОНТРОЛЯ ВРЕДИТЕЛЕЙ, СПОСОБ КОНТРОЛЯ ЭНДОПАРАЗИТОВ, ЭКТОПАРАЗИТОВ ИЛИ ОБОИХ И СПОСОБ УСИЛЕНИЯ ЖИЗНЕСТОЙКОСТИ РАСТЕНИЙ | 2011 |
|
RU2576316C2 |
Изобретение относится к сельскому хозяйству и ветеринарии. Молекула формулы:
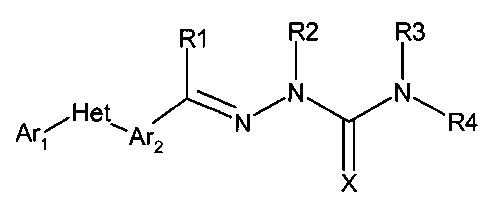
в которой (a) Ar1 представляет собой: (1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или (2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил; (b) Het представляет собой 5 или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или несколько гетероатомов, независимо выбираемых из азота, серы или кислорода; (с) Ar2 представляет собой: (1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или (2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил; (d) X представляет собой О или S; (e), (f) и (h) R1-R4, Rx , Ry представляют собой углеводородные заместители; (g) n=0, 1 или 2. Изобретение позволяет повысить эффективность борьбы с вредителями. 6 н. и 6 з.п. ф-лы, 2 табл., 39 пр.
1. Молекула следующей формулы:

в которой:
(a) Ar1 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил,
где указанный замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-С6алкил, C1-С6галогеналкил, C3-С6циклоалкил, C3-С6галогенциклоалкил, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенил, C2-С6алкинил, S(=O)n(C1-С6алкил), S(=O)n (C1-С6галогеналкил), OSO2 (C1-С6алкил), OSO2 (C1-С6галогеналкил), C(=O)NRxRy, (C1-С6алкил) NRxRy, C(=O)(C1-С6 алкил), С (=O)O(C1-С6 алкил), С(=O)(C1-С6галогеналкил), C(=O)O(C1-С6галогеналкил), С(=O)(C3-С6циклоалкил), С(=O)О(C3-С6циклоалкил), С(=O)(C2-С6алкенил), С(=O)О(C2-С6алкенил), (C1-С6алкил) О (C1-С6алкил), (C1-С6алкил) S(C1-С6алкил), С(=O) (C1-С6алкил) С (=O) О (C1-С6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-С6 алкил, C1-С6 галогеналкил, C3-С6циклоалкил, C3-С6галогенциклоалкил, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенил, C2-С6алкинил, S(=O)n (C1-С6алкил), S(=O)n(C1-С6галогеналкил), OSO2 (C1-С6алкил), OSO2 (C1-С6галогеналкил), C(=O)NRxRy, (C1-С6алкил) NRxRy, С(=O)(C1-С6алкил), C(=O)O(C1-С6алкил), C(=O) (C1-С6галогеналкил), С (=O)О (C1-С6галогеналкил), С(=O) (C3-С6циклоалкил), С(=O)О(C3-С6циклоалкил), С(=O)(C2-С6алкенил), С(=O)О(C2-С6алкенил), (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил) S (C1-С6алкил), С (=O) (C1-С6алкил) С(=O)О(C1-С6алкил), фенил и фенокси;
(b) Het представляет собой 5 или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или несколько гетероатомов, независимо выбираемых из азота, серы или кислорода, и где Ar1 и Ar2 не находятся в орто-положении друг к другу (но могут быть в мета или пара, а именно для пятичленного кольца они находятся в 1,3 и для 6-членного кольца они находятся либо в 1,3- либо в 1,4-положениях), и где указанное гетероциклическое кольцо может быть также замещено одним или несколькими заместителями, независимо выбираемыми из следующих: Н, ОН, F, Cl, Br, I, CN, NO2, оксо, C1-С6алкил, C1-С6галогеналкил, C3-С6циклоалкил, C3-С6галогенциклоалкил, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенил, C2-С6алкинил, S(=O)n (C1-С6алкил), S(=O)n(C1-С6галогеналкил), OSO2(C1-С6алкил), OSO2(C1-С6галогеналкил),C(=O)NRxRy, (C1-С6 алкил) NRxRy, С(=O)(C1-С6алкил), C(=O)O(C1-С6алкил), С(=O)(C1-С6галогеналкил), С(=O)О(C1-С6галогеналкил), С(=O)(C3-С6циклоалкил), С(=O)О(C3-С6циклоалкил), С(=O)(C2-С6алкенил), С(=O)О(C2-С6алкенил), (C2-С6алкил)О(C1-С6алкил), (C1-С6алкил)S(C1-С6алкил), С(=O)(C1-С6алкил) С(=O)О(C1-С6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-С6алкил, C1-С6галогеналкил, C3-С6циклоалкил, C3-С6галогенциклоалкил, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6алкокси, C1-С6 галогеналкокси, C2-С6алкенил, C2-С6алкинил, S(=O)n (C1-С6алкил), S(=O)n(C1-С6галогеналкил), OSO2 (C1-С6алкил), OSO2 (C1-С6галогеналкил), С(=O)Н, C(=O)NRxRy, (C1-С6алкил)NRxRy, С(=O)(C1-С6алкил), С(=O)O(C1-С6алкил), С(=O)(C1-С6галогеналкил), С(=O)О(C1-С6галогеналкил), С(=O)(C3-С6циклоалкил), С(=O)О(C3-С6циклоалкил), С(=O)(C2-С6алкенил), С(=O)О(C2-С6алкенил), (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил) S (C1-С6алкил), С(=O)(C1-С6алкил) С(=O)О(C1-С6алкил), фенил и фенокси;
(с) Ar2 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил,
где упомянутый замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-С6алкил, C1-С6галогеналкил, C3-С6циклоалкил, C3-С6галогенциклоалкил, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенил, C2-С6алкинил, S(=O)n(C1-С6алкил), S(=O)n(C1-С6 галогеналкил), OSO2(C1-С6алкил), OSO2(C1-С6галогеналкил), C(=O)NRxRy, (C1-С6алкил) NRxRy, C(=O)(C1-С6алкил), С(=O)О(C1-С6алкил), С(=O)(C1-С6галогеналкил), C(=O)O(C1-С6галогеналкил), С(=O)(C3-С6циклоалкил), С(=O)О(C3-С6циклоалкил), С(=O)(C2-С6 алкенил), С(=O)О(C2-С6алкенил), (C1-С6алкил )О(C1-С6алкил), (C1-С6алкил)S(C1-С6алкил), С(=O)(C1-С6алкил)С(=O)О(C1-С6алкил), фенил, фенокси, замещенный фенил и замещенный фенокси,
где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбираемых из следующих: H, F, Cl, Br, I, CN, NO2, C1-С6 алкил, C1-С6галогеналкил, C1-С6циклоалкил, C3-С6галогенциклоалкил, C3-С6гидроксициклоалкил, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенил, C2-С6алкинил, S(=O)n(C1-С6лкил), S(=O)n(C1-С6галогеналкил), OSO2(C3-С6алкил), OSO2(C1-С6алогеналкил), C(=O)H, C(=O)NRxRy, (C1-С6алкил)NRxRy, C(=O)(C1-С6алкил), С(=O)О(C1-С6алкил), С(=O)(C1-С6галогеналкил), C(=O)O(C1-С6галогеналкил), С(=O)(C3-С6циклоалкил), С(=O)О(C3-С6циклоалкил), С(=O)(C1-С6галогеналкил), С(=O)(C2-С6алкенил), С(=O)O(C2-С6алкенил), (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил)S(C1-С6алкил), С(=O)(C1-С6алкил)С(=O)О(C1-С6алкил), фенил и фенокси;
(d) X представляет собой О или S;
(e) R1 выбран из заместителей: H, CN, C1-С6алкил, C1-С6галогеналкил, C3-С6циклоалкил, C3-С6галогенциклоалкил, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенил, C2-С6алкинил, S(=O)n(C1-С6алкил), S(=O)n(C1-С6галогеналкил), OSO2(C1-С6алкил}, OSO2(C1-С6галогеналкил), C(=O)NRxRy, (C1-С6алкил)NRxRy, С(=O)(C1-С6алкил), С(=O)О(C1-С6алкил), С(=O)(C1-С6галогеналкил), C(=O)O(C1-С6галогеналкил), С(=O)(C3-С6циклоалкил), С(=O)О(C3-С6циклоалкил), С(=O)(C2-С6алкенил), С(=O)О(C2-С6алкенил), (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил)S(C1-С6алкил), С(=O)(C1-С6алкил)С(=O)О(C1-С6алкил), фенил, фенокси;
(f) R2, R3 и R4 выбраны из заместителей: Н, C1-С6алкил, C3-С6циклоалкил, C2-С6алкенил, C2-С6алкинил, С(=O)(C1-С6алкил), С(=O)О(C1-С6алкил), С(=O)(C3-С6циклоалкил), С(=O)O(C1-С6циклоалкил), С(=O)(C2-С6алкенил), С(=O)О(C2-С6алкенил), (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил)S(C1-С6алкил), C(=O)(C1-С6алкил)С(=O)О(C1-С6алкил), С(=O)фенил, фенил, C1-С6алкилфенил, C1-С6алкилфенокси, инданил, C(=O)Het-l, Het-1, (C1-С6алкил)Het-1 или C1-С6алκил-O-Het-l,
где каждый алкил, циклоалкил, циклоалкокси,
галогенциклоалкокси, алкокси, галогеналкокси, алкенил, алкинил, C1-С6 алкилфенил, фенил, фенокси и Het-1 необязательно замещены одним или несколькими заместителями, независимо выбираемыми из следующих: F, Cl, Br, I, CN, NO2, NRxRy, C1-С6алкил, C1-С6галогеналкил, C3-С6циклоалкил, C3-С6галогенциклоалкил, C3-С6циклоалкокси, C3-С6галогенциклоалкокси, C1-С6алкокси, C1-С6галогеналкокси, C2-С6алкенил, C3-С6-циклоалкенил, C2-С6-алкинил, C3-С6 -циклоалкинил, S(=O)n(C1-С6алкил), S(=O)n(C1-С6галогеналкил), S(=O)2Ν(C1-С6алкил)2, OSO2(C1-С6-алкил), OSO2(C1-С6-галогеналкил), C(=O)H, C(=O)NRxRy, (C1-С6алкил)NRxRy, С(=O)(C1-С6алкил), С(=O)O(C1-С6алкил), С(=O)(C1-С6галогеналкил), C(=O)O(C1-С6галогеналкил), С(=O)(C3-С6циклоалкил), С(=O)O(C3-С6циклоалкил), С(=O)(C2-С6алкенил), С(=O)О(C2-С6-алкенил), (C1-С6-алкил)О(C1-С6-алкил), (C1-С6алкил)S(C1-С6алкил), С(=O)(C1-С6алкил)С(=O)О(C1-С6алкил), фенил, фенокси, O-Het-1 и Het-1,
где Het-1 представляет собой 5- или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или несколько гетероатомов, выбираемых из азота, серы или кислорода;
где R3 и R4 вместе необязательно могут образовывать 3-8-членную насыщенную или ненасыщенную циклическую группу, которая может содержать один или несколько гетероатомов, выбираемых из азота, серы и кислорода;
(g) n=0, 1 или 2;
(h) Rx и Ry независимо выбраны из заместителей: H, C1-С6алкил, C1-С6 галогеналкил, C3-С6циклоалкил, C3-С6галогенциклоалкил, C2-С6алкенил, C2-С6алкинил, S(=O)n(C1-С6алкил), S(=O)n(C1-С6галогеналкил), OSO2(C1-С6алкил), OSO2(C1-С6галогеналкил), С(=O)Н, С(=O)(C1-С6алкил), С(=O)О(C1-С6алкил), С(=O)(C1-С6галогеналкил), С(=O)О(C1-С6галогеналкил), С(=O)(C3-С6циклоалкил), С(=O)О(C3-С6циклоалкил), С(=O)(C2-С6алкенил), С(=O)О(C2-С6алкенил), (C1-С6алкил)О(C1-С6алкил), (C1-С6алкил)S(C1-С6алкил), С(=O)(C1-С6алкил)С(=O)О(C1-С6алкил) и фенил.
2. Молекула по п. 1, в которой Ar1 представляет собой замещенный фенил, где указанный замещенный фенил имеет один или несколько заместителей, независимо выбранных из C1-С6алкила, C1-С6галогеналкила и C1-С6галогеналкокси.
3. Молекула по п. 1, в которой Het представляет собой триазолил, имидазолил, пирролил или пиразолил.
4. Молекула по п. 1, в которой Ar2 представляет собой фенил.
5. Молекула по п. 1, в которой R4 представляет собой C1-С6алкил, C3-С6циклоалкил, C2-С6алкенил, С(=O)фенил, C1-С6алкилфенил, Het-1 или (C1-С6алкил) Het-1.
6. Молекула по п. 1, в которой R4 представляет собой C1-С6алкил, C1-С6 алкилфенил, фенил или Het-1, где каждый замещен одним или несколькими заместителями, независимо выбираемыми из следующих: F, Cl, Br, I, CN, NO2, NRxRy, C1-С6алкил, C1-С6галогеналкил, C1-С6алкокси, C1-С6галогеналкокси, C3-С6циклоалкенил, S(=O)n(C1-С6алкил), S(=O)n(C1-С6галогеналкил ), S(=O)2Ν(C1-С6алкил)2, С(=O)(C1-С6алкил), С(=O)О(C1-С6алкил), С(=O)(C1-С6галогеналкил), (C1-С6алкил)О(C1-С6алкил), фенил, O-Het-1 и Het-1.
7. Молекула по п. 1, содержащая одну из следующих структур:
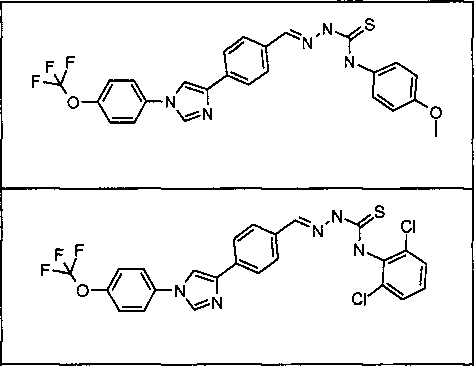
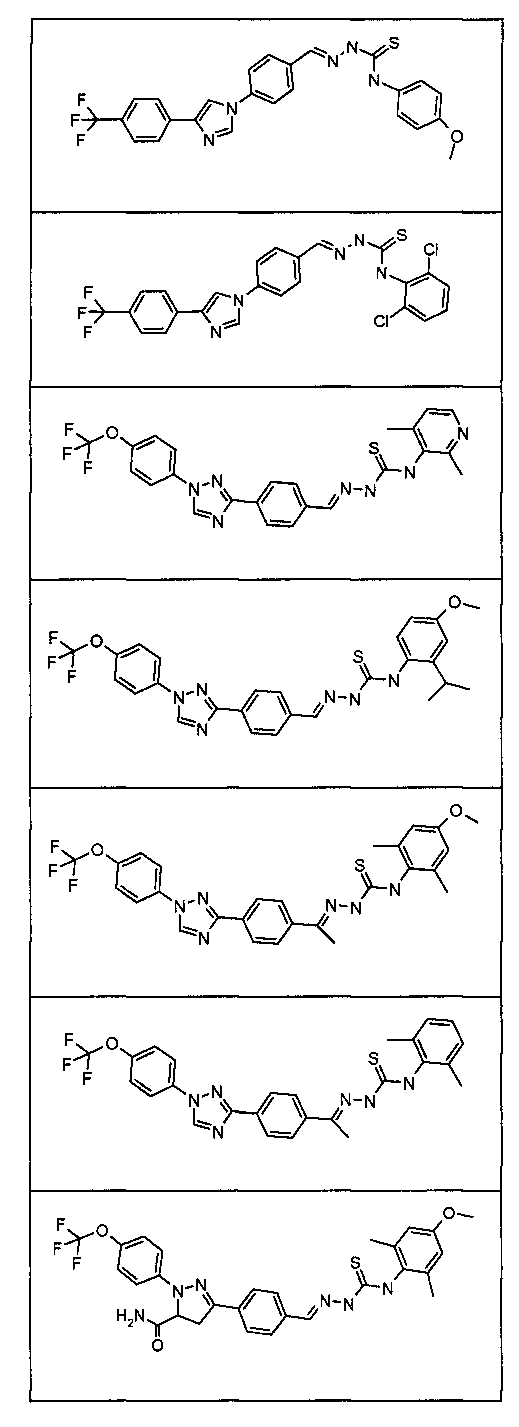

8. Способ применения молекулы по п. 1, где указанный способ включает применение молекулы по п. 1 к площади для контроля вредителей в эффективном количестве для контроля вредителей.
9. Композиция, содержащая молекулу по п. 1 и по меньшей мере одно другое соединение, обладающее инсектицидной, гербицидной, акарицидной, нематицидной или фунгицидной активностью.
10. Композиция, содержащая молекулу по п. 1 и семя.
11. Способ, включающий применение молекулы по п. 1 к генетически модифицированному растению или генетически модифицированному семени, которые были генетически модифицированы для приобретения одного или нескольких определенных признаков.
12. Способ, включающий пероральное введение или локальное применение молекулы по п. 1 животному, не являющемуся человеком, для контроля эндопаразитов, эктопаразитов или и тех и других паразитов,
| US 6417187 B2 09.07.2002 | |||
| PEDERSEN ET AL | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Sci, 1984, v.25, p.462-470 | |||
| ПРОИЗВОДНЫЕ ТРИАЗИНА, КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ И КЛЕЩАМИ И СПОСОБ БОРЬБЫ С НИМИ | 2000 |
|
RU2252217C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛА, АГЕНТ ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА, И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2265603C2 |
Авторы
Даты
2015-03-10—Публикация
2010-08-05—Подача