Изобретение относится к химии лекарственных веществ, в частности к получению γ-аминокислот и их производных, а именно к способу получения (S)-3-(аминометил)-5-метилгексановой кислоты (прегабалина).
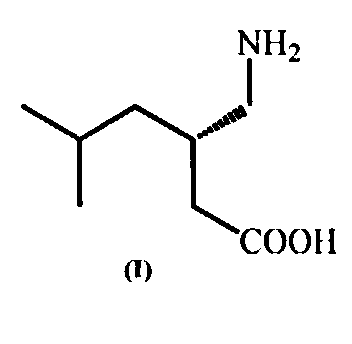
(S)-3-Аминометил-5-метилгексановая кислота (прегабалин) (I)
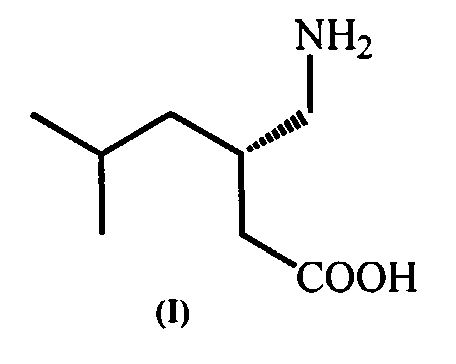
представляет собой действующее вещество препарата, выпускаемого под торговым название Lyrica® (Лирика®) (Pfizer, Inc.), который обладает противоэпилептической и противосудорожной активностью (The Art of Drug Synthesis. Edited by Douglas S. Johnson and Jie Jack Li, 2007, John Wiley & Sons, Inc. pp. 225-227).
Механизм действия препарата основан на его способности связываться с альфа-2-дельта субъединицами кальциевых каналов нейронов (кальциевыми каналами N- и Р/O-типа), вследствие чего отмечается снижение транспорта кальция в клетки нейронов в ответ на потенциал действия. Для препарата характерна высокая степень сродства к альфа-2-дельта протеину, находящемуся в тканях центральной нервной системы. Применение препарата приводит к снижению высвобождения нейротрансмиттеров боли (в том числе глутамата, норадреналина и субстанции Р) в синаптическую щель при возбуждении нейронов. Вследствие таких изменений под действием препарата избирательно подавляется проведение импульса, следует отметить, что препарат Lyrica® подавляет возбудимость сети нейронов только при патологических состояниях.
Препарат оказывает анальгетическое действие при болях нейропатической этиологии и постоперационном болевом синдроме, в том числе при таких состояниях, как гиперальгезия и алодиния.
Препарат в терапевтической дозе хорошо переносится пациентами, при применении препарата в дозах, в 2 раза превышающих терапевтические, отмечается отсутствие тератогенного действия. Показано также, что прегабалин не обладает канцерогенным и генотоксическим действием.
Известен ряд способов получения прегабалина, например, описанные в монографии (The Art of Drug Synthesis. Edited by Douglas S. Johnson and Jie Jack Li, 2007, John Wiley & Sons, Inc. pp. 225-227, 234-240). В некоторых известных способах синтезируют рацемическую смесь 3-аминометил-5-метилгексановой кислоты и затем разделяют ее на R- и S-энантиомеры. В таких способах могут быть использованы азидное промежуточное соединение, малонатное промежуточное соединение или синтез по Гофману (патент США №5563175, патенты США №6046353, №5840956 и №5637767 и патенты США №5629447 и №5616793, соответственно). В каждом из этих способов рацемат подвергают взаимодействию с хиральной кислотой (разделяющим агентом) с образованием пары диастереоизомерных солей, которые разделяют известными способами, такими как фракционная кристаллизация и хроматография.
Известны способы получения непосредственно (S)-3-аминометил-5-метилгексановой кислоты (прегабалина), в таких способах используют хиральное вспомогательное вещество, например, (4R,5S)-4-метил-5-фенил-2-оксазолидинон (патенты США №№6359169, 6028214, 5847151, 5710304, 5684189, 5608090 и 5599973). Эти способы обеспечивают получение прегабалина с высокой энантиомерной чистотой, но они менее предпочтительны для осуществления крупномасштабного синтеза, так как в них используют дорогостоящие реагенты (например, вспомогательное хиральное вещество) и специальное криогенное оборудование, необходимое для работы при низких температурах (до -78°C).
Известен способ получения прегабалина путем асимметрического гидрирования цианозамещенного олефина, которое приводит к образованию хирального цианозамещенного предшественника (S)-3-аминометил-5-метилгексановой кислоты (заявка на патент США №2003/0212290А). Полученный предшественник затем восстанавливают, получая прегабалин. При проведении асимметрического гидрирования используют хиральный катализатор, который состоит из переходного металла, связанного с бисфосфиновым лигандом, например, (R,R)-Me-DUPHOS ((-)-1,2-бис((2R,5R)-2,5-диметилфосфолано)бензол). Этот способ делает возможным получение 3-(аминометил)-5-метилгексановой кислоты с существенным преобладанием (S)-энантиомера-(S)-(3-(аминометил)-5-метилгексановой кислоты (прегабалина).
Такой подход к получению прегабалина, в котором используется асимметрический катализ, является весьма удобным, однако хиральные катализаторы на основе фосфора отличаются высокой стоимостью и низкой стабильностью. Следовательно, существует потребность в способах, которые используют более дешевые реагенты и не требуют применения специального оборудования.
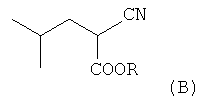
В связи с этим по-прежнему вызывают интерес способы, включающие получение прегабалина в рацемической форме и последующее разделение энантиомеров. Такой подход делает возможным использование более дешевых и доступных реагентов. Известен способ (WO 2012/059797 А1), в котором предшественники прегабалина получают в виде рацемата многостадийным синтезом из эфира цианоуксусной кислоты NC-CH2-COOR (А), где R=СН3; С2Н5, и затем выделяют нужный энантиомер (см. схему 1).
Схема 1
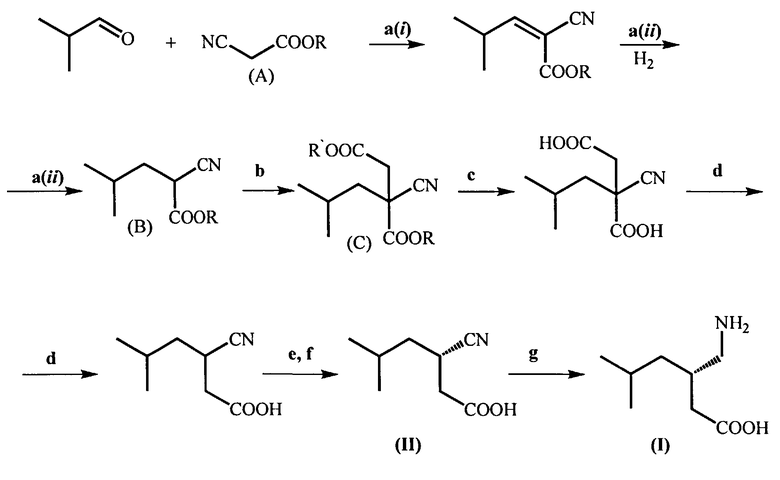
Вышеуказанный способ получения прегабалина (I) был выбран в качестве прототипа, так как он наиболее близок по существенным признакам к заявляемому способу.
Способ-прототип включает:
a) (i) конденсацию изобутиральдегида с алкиловым эфиром цианоуксусной кислоты (А) в присутствии основания, такого, как пиперидинацетат, ацетат цезия, и (ii) последующее гидрирование, катализируемое металлами группы платины (оксид платины, палладий на угле, гидроксид палладия на угле) или никелем Ренея, в полярном растворителе (таком, как метанол, этанол, вода, 1,4-диоксан, тетрагидрофуран, диметоксиэтан и диглим) при давлении водорода 1-5 атм, с образованием соответствующего алкилового эфира 2-циано-4-метилпентановой кислоты (В);
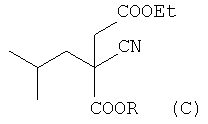
b) взаимодействие соединения (В) с этиловым эфиром альфа-галогенуксусной кислоты, где галоген представляет собой хлор, бром или йод, в присутствии основания, предпочтительно карбоната цезия, которое проводят в растворителе, выбранном из N,N-диметилформамида (ДМФА), тетрагидрофурана, 1,4-диоксана, диметилсульфоксида (ДМСО) и диметоксиэтана, или без растворителя при температуре 10-90°C, которое приводит к получению 4-этил-1-алкил-2-циано-2-изобутилсукцината (С)
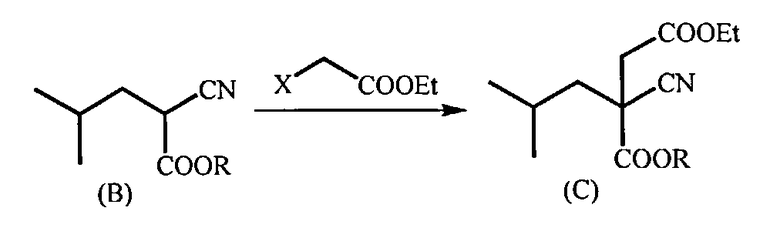
с) Гидролиз соединения (С) в присутствии основания, предпочтительно гидроксида лития, при температуре 20-80°C (предпочтительно при 65-70°C) с образованием 2-циано-2-изобутилянтарной кислоты
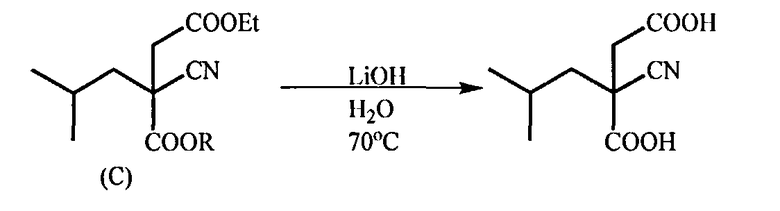
d) Декарбоксилирование полученной 2-циано-2-изобутилянтарной кислоты под действием минеральной кислоты, например, серной кислоты, в органическом растворителе (например, в этилацетате), при 70-80°C, которое приводит к образованию 3-циано-5-метилгексановой кислоты в виде рацемата
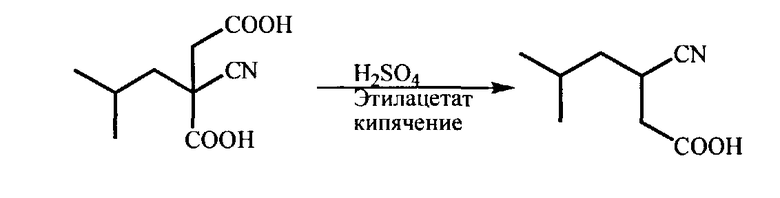
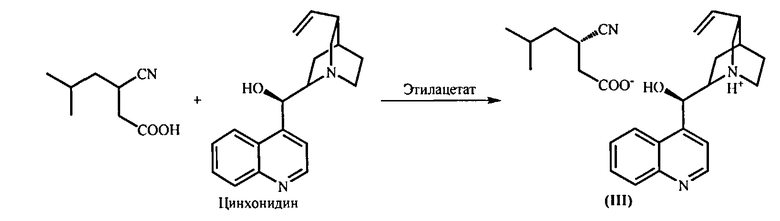
е) Разделение энантиомеров 3-циано-5-метилгексановой кислоты через образование ее цинхонидиновой соли (III), полученной взаимодействием с цинхонидином в органическом растворителе, таком, как этанол, метанол, 1,4-диоксан, этилацетат, тетрагидрофуран, 2-метилтетрагидрофуран, диметоксиэтан или диглим, при температуре 20-80°С. Цинхонидиновую соль (S)-3-циано-5-метилгексановой кислоты (III) выделяют известными приемами и дополнительно очищают;
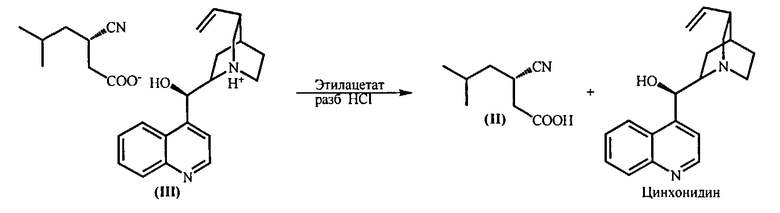
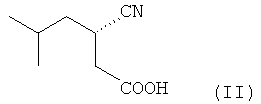
(f) Обработку полученной соли (III) смесью этилацетата и разбавленной соляной кислоты (1:1) при комнатной температуре, которая приводит к образованию (S)-3-циано-5-метилгексановой кислоты (II) в органическом слое. Цинхонидин регенерируют из водной фазы путем подщелачивания.
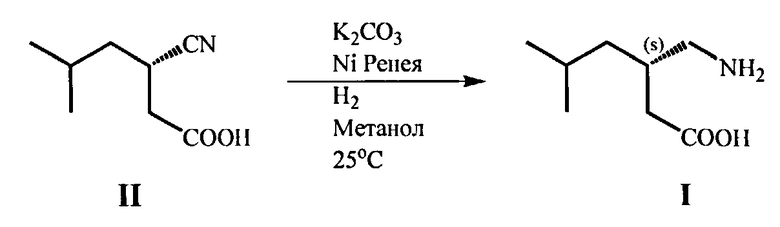
(g) Гидрирование оптически чистой (S)-3-циано-5-метилгексановой кислоты (II) в присутствии никеля Ренея с образованием целевого продукта - (S)-(3-(аминометил)-5-метилгексановой кислоты (I) (прегабалина)
На каждой стадии продукты выделяют и дополнительно очищают соответствующими способами.
Способ-прототип имеет ряд преимуществ по сравнению с другими известными способами получения прегабалина, в нем используются простые синтезы и доступные исходные соединения.
Однако прототип имеет ряд недостатков. Во-первых, стадия (а) фактически состоит из двух стадий: а(i) конденсации изобутиральдегида с алкиловым эфиром цианоуксусной кислоты (А) в присутствии основания (пиперидинацетата или ацетата цезия) в метаноле и a(ii) восстановления продукта конденсации. Необходимо выделять продукт конденсации перед восстановлением. В качестве восстановителя используют взрывоопасный водород, высокая текучесть которого может создавать дополнительные проблемы в части безопасной эксплуатации оборудования (легко образуются течи в установке). Использование больших количеств пиперидина и уксусной кислоты в реакции конденсации увеличивает количество отходов. В качестве катализаторов для гидрирования необходимо использовать соединения металлов группы платины в значительных количествах. Таким образом, реализация способа-прототипа в промышленности требует больших затрат и решения возникающих экологических проблем.
Известен еще один способ получения интермедиата (В) реакцией алкилцианацетатов с галогенпроизводными (WO 2011141923 А2), такой способ также не лишен недостатков: в этом случае необходима более тщательная и трудоемкая очистка конечного продукта от используемых исходных веществ из-за высокой токсичности галогенпроизводных. Кроме того, образование кислот, попадающих в стоки, небезопасно для окружающей среды.
Таким образом, существует потребность в способах получения прегабалина, которые могут быть использованы в промышленности для широкомасштабного производства этого препарата.
Задачей настоящего изобретения является разработка более технологичного и экологически безопасного способа получения прегабалина для использования в промышленности.
Задача решается заявляемым способом получения (S)-3-аминометил-5-метилгексановой кислоты (прегабалина) формулы (I)
включающим
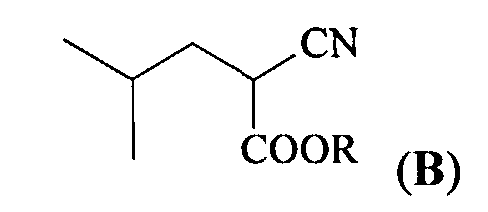
(а) взаимодействие алкилового эфира циануксусной кислоты CNCH2COOR и изобутиральдегида, приводящее к получению алкилового эфира 2-циано-4-метилпентановой кислоты (В)
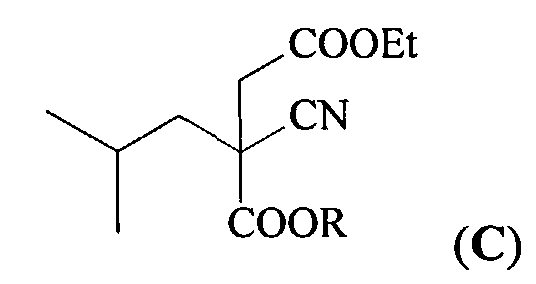
(b) взаимодействие полученного эфира (В) с этиловым эфиром альфа-галогенуксусной кислоты (Hal=Cl, Br, I) в присутствии основания при температуре 10-90°C, которое проводят или без растворителя, или в растворителе, таком как N,N-диметилформамид, тетрагидрофуран, 1,4-диоксан, диметилсульфоксид и диметоксиэтан, с образованием 4-этил-1-метил-2-циано-2-изобутилсукцината (C)
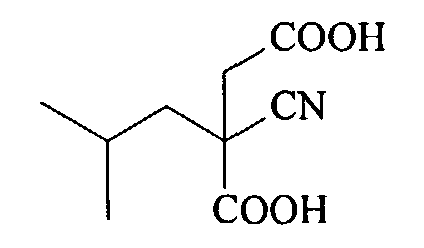
(с) Гидролиз соединения (С) под действием основания, такого, как гидроксид щелочного металла, при температуре 20-80°С, который дает 2-циано-2-изобутилянтарную кислоту
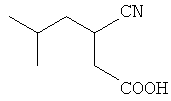
(d) Декарбоксилирование полученной 2-циано-2-изобутилянтарной кислоты в присутствии минеральной кислоты, например, серной или соляной кислоты, в органическом растворителе, например, этилацетате, при 70-80°C с образованием (RS)-3-циано-5-метилгексановой кислоты
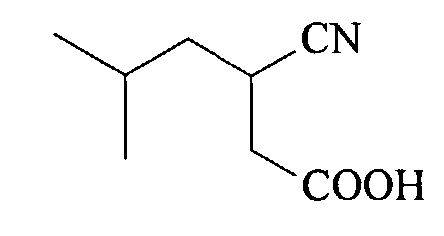
(e) Разделение энантиомеров полученной (RS)-3-циано-5-метилгексановой кислоты через образование соответствующей соли с цинхонидином в органическом растворителе, таком, как этанол, метанол, 1,4-диоксан, этилацетат, тетрагидрофуран, 2-метилтетрагидрофуран, диметоксиэтан и диглим, при температуре от 20 до 80°C, выделение цинхонидиновой соли (S)-3-циано-5-метилгексановой кислоты и ее дополнительную очистку путем повторного солеобразования в этилацетате;
(f) Обработку полученной цинхонидиновой соли (S)-3-циано-5-метилгексановой кислоты (III) смесью этилацетата и разбавленной соляной кислоты (1:1) при комнатной температуре и выделение образовавшейся (S)-3-циано-5-метилгексановой кислоты (II) из органического слоя и регенерирование цинхонидина из водной фазы
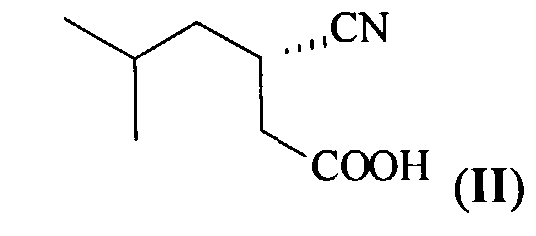
(g) Гидрирование выделенной оптически чистой (S)-3-циано-5-метилгексановой кислоты (II), катализируемое никелем Ренея, с образованием целевого продукта - (S)-3-аминометил-5-метилгексановой кислоты (прегабалина) (I),
причем на стадии (а) взаимодействие алкилового эфира цианоуксусной кислоты CNCH2COOR, где R=С1-С4-алкил, с изобутиральдегидом, приводящее к получению алкилового эфира 2-циано-4-метил-пентановой кислоты (В), осуществляют под действием монооксида углерода при давлении от 1 до 200 атм и температуре от 20 до 200°C, в полярном растворителе, таком, как метанол, этанол, вода, 1,4-диоксан, тетрагидрофуран, ацетонитрил, диметоксиэтан и диглим, а в качестве катализатора используют соединения кобальта, никеля, рутения или родия;
на стадии (б) в качестве основания используют гидрид натрия.
Заявляемый способ представлен ниже на схеме 2.
Схема 2
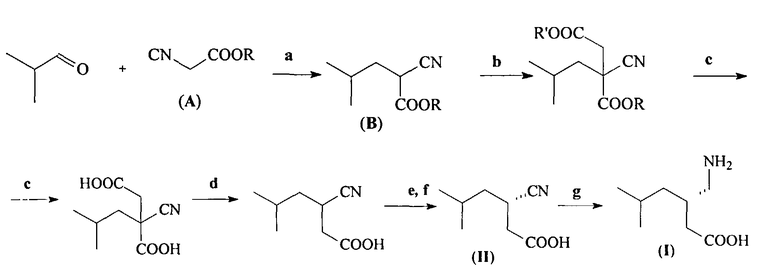
На стадии (а) происходит образование основного интермедиата - алкилового эфира 2-циано-4-метилпентановой кислоты (В) в результате взаимодействия изобутиральдегида, эфира (А) и монооксида углерода.
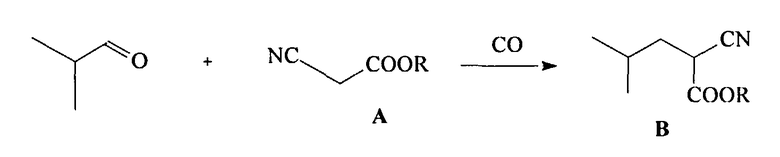
Реакцию проводят при давлении монооксида углерода 1-100 атм в интервале температур от 20-200°C или без растворителя, или в полярном растворителе, таком, как метанол, этанол, изопропанол, ТГФ, диоксан, ацетонитрил и т.п., под действием катализаторов, содержащих в качестве активного компонента производные родия, рутения, кобальта, никеля. Получение эфира В проводят в одну стадию при использовании катализатора в небольших количествах (до 1 мол.%).
Известно, что монооксид углерода является потенциальным восстановителем, но область применения этого восстановителя до сих пор была ограничена в основном неорганической химией, в частности металлургией, где его применяют для восстановления оксидов металлов. В органической химии монооксид углерода используют только для восстановления ароматических нитрогрупп. Другие примеры применения CO в качестве восстановителя в органическом синтезе до сих пор не были известны. Неожиданно оказалось, что CO является эффективным восстановителем в реакции получения алкиловых эфиров 2-циано-4-метилпентановой кислоты (В) из изобутиральальдегида в одну стадию с высоким выходом (80-95%).
Изобретение иллюстрируется приведенными ниже примерами.
Спектры 1H ЯМР записывали на ЯМР-спектрометрах «Bruker Avance 300» и «Bruker Avance 400». Химические сдвиги приведены в м.д. относительно тетраметилсилана, откалиброванные на соответствующий пик растворителя. Для исследования энантиомерной чистоты продукта использовали хроматограф «Perkin-Elmer» с хиральной колонкой IB-3 4×100 мм с размером частиц 3 мкм.
ПРИМЕРЫ
Пример 1. Получение (S)-3-аминометил-5-метилгексановой кислоты (прегабалина)
(а) Взаимодействие метилового эфира цианоуксусной кислоты (A, R=CH3), изобутиральдегида и монооксида углерода при катализе димером диацетата родия
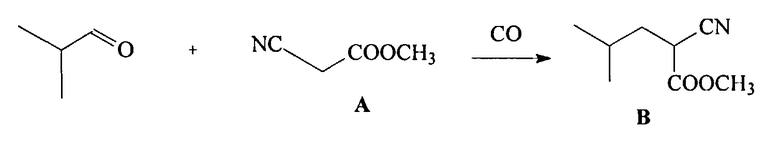
В стеклянную ампулу помещают 23 мг (44,2 мкмоль) диацетата родия, 2,1 мл метанола, 400 мкл (4,42 ммоль) изобутиральдегида, 380 мкл (4,42 ммоль) метилового эфира цианоуксусной кислоты. Ампулу помещают в автоклав. Автоклав закрывают, продувают монооксидом углерода и нагревают при 110°C в течение 24 часов. Реакционную массу фильтруют через тонкий слой силикагеля. Выход метилового эфира 2-циано-4-метилпентановой кислоты (В, R=CH3) 95%.
1H ЯМР (400 МГц, CDCl3) δ 3.81 (с, 3Н), 3.54 (дд, J=9.3, 5.9 Гц, 1Н), 1.93-1.73 (м, 3Н), 0.98 (дд, J=10.3, 5.9 Гц, 6Н).
(b) Получение 4-этил-1-метил-2-циано-2-изобутилсукцината
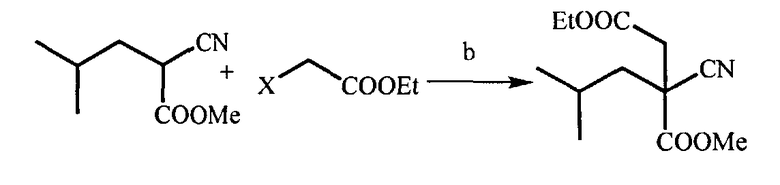
В реактор помещают 50 мл ДМФА, прибавляют гидрид натрия (3,08 г, 77 ммоль) в виде 60% эмульсии в парафине небольшими порциями в атмосфере азота. Смесь охлаждают до 10-15°C и медленно прибавляют раствор метилового эфира 2-циано-4-метилпентановой кислоты (10 г, 64 ммоль), полученного на стадии (а), в ДМФА (20 мл), поддерживая температуру реакционной смеси ниже 20°C. Затем реакционную смесь нагревают до 50°C и продолжают перемешивание еще в течение 1 часа и медленно прибавляют раствор этилбромацетата (12,9 г, 77 ммоль) в 25 мл ДМФА. Затем температуру понижают до комнатной и продолжают перемешивание еще в течение 24 часов. Прибавляют 20 мл воды. Водный слой экстрагируют дихлорметаном (5×50 мл). Органические слои отделяют, объединяют, сушат сульфатом натрия и упаривают при пониженном давлении, получая 4-этил-1-метил-2-циано-2-изобутилсукцинат (14,1 г) с выходом 90%.
1H ЯМР (300 МГц, CDCl3) δ 0.88 (д, 3Н), 0.96 (д, 3Н), 1.05 (т, 3Н), 1.70-1.89 (м, 3Н), 2.8 (д, 1Н), 3.02 (д, 1Н), 3,84 (с, 3Н), 4.18 (кв, 2Н).
(с) Получение 2-циано-2-изобутилянтарной кислоты
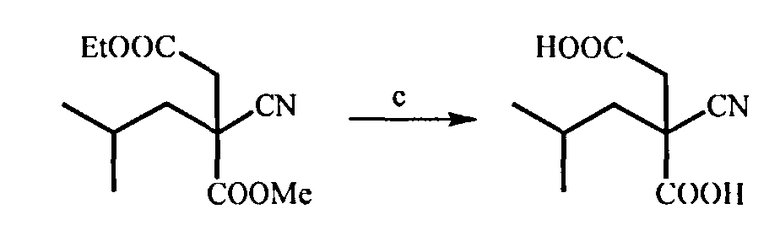
В колбу помещают 4-этил-1-метил-2-циано-2-изобутилсукцинат (10 г) и воду (15 мл). При перемешивании прибавляют по каплям водный раствор гидроксида лития (3,6 г LiOH в 15 мл H2O). Затем реакционную смесь перемешивают в течение 12 ч при 70°С. После этого реакционную смесь охлаждают и непрореагировавший эфир экстрагируют диизопропиловым эфиром. Водный слой подкисляют соляной кислотой (до pH=2) и экстрагируют этилацетатом (3×35 мл). Объединенные органические слои сушат сульфатом натрия, удаляют растворитель при пониженном давлении и получают 2-циано-2-изобутилянтарную кислоту (7,2 г) с выходом 87% в виде твердого белого вещества.
1Н ЯМР (400 МГц, DMCO-d6) δ 0.82-0.89 (д, 3Н), 0.96-0.97 (д, 3Н), 1.64-1.75 (м, 3Н), 2.86 (с, 2Н), 13,15 (с, 2Н).
(d) Получение (RS)-3-циано-5-метилгексановой кислоты декарбоксилированием 2-циано-2-изобутилянтарной кислоты
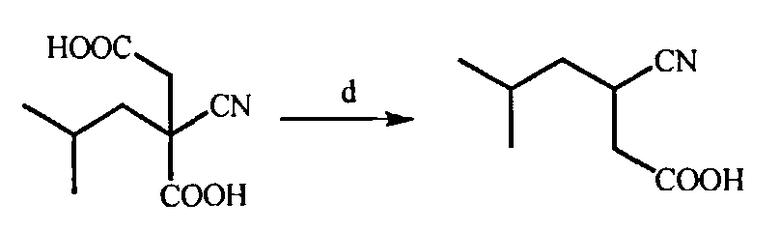
В реактор помещают 6,0 г 2-циано-2-изобутилянтарной кислоты, 60 мл этилацетата и 0,6 г концентрированной серной кислоты. Реакционную смесь кипятят в течение 4 ч. После окончания реакции растворитель удаляют при пониженном давлении и получают неочищенную (RS)-3-циано-5-метилгексановую кислоту, которую суспендируют в воде и перемешивают в течение 30 минут. Водный слой экстрагируют этилацетатом (2×25 мл). Органические слои объединяют и сушат сульфатом натрия, затем растворитель испаряют при пониженном давлении и получают 3,1 г (RS)-3-циано-5-метилгексановой кислоты в виде желтого масла. Выход 66%.
1Н ЯМР (300 МГц, CDCl3) δ 0,95 (д, 3Н), 0.96 (д, 3Н), 1.36-1.38 (д, 1Н), 1,59-1,66 (м, 1Н), 1,79-1,85 (м, 1Н), 2,59-2,61 (дд, 1Н), 2,69-2,75 (дд, 1Н), 2,98-3,04 (м, 1Н).
(e) Разделение энантиомеров (RS)-3-циано-5-метилгексановой кислоты и
(f) выделение (S)-3-циано-5-метилгексановой кислоты (II) из цинхонидиновой соли (III)
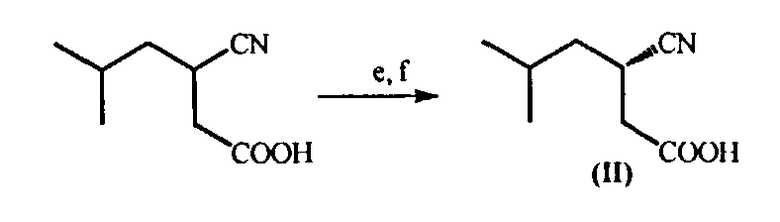
(е) В реактор помещают цинхонидин (1,9 г, 6,4 ммоль) и этилацетат (50 мл), полученную смесь нагревают до 70°С. Затем при перемешивании прибавляют раствор (RS)-3-циано-5-метилгексановой кислоты (2 г, 12,9 ммоль) в течение 15-20 минут, реакционную смесь перемешивают еще 5 ч при кипячении и охлаждают в течение 12 часов. Полученную цинхонидиновую соль (S)-3-циано-5-метилгексановой кислоты (III) отфильтровывают в виде белого твердого вещества (2,3 г, 95% ее) (согласно хиральному ВЭЖХ анализу). Если необходимо, полученный продукт (III) дополнительно перекристаллизовывают из этилацетата.
1Н ЯМР (DMCO-D6, 300 МГц): δ 0.89 (д, 3Н), 0.91 (д, 3Н), 1.30-1,45 (м, 1Н), 1.52-1.59 (м, 3Н), 1.69-1.82 (м, 4Н), 2.38 (ушир.с, 1Н), 2.43-2.55 (дд, 3Н), 2.60-2,68 (м, 2Н), 2;97-3.07 (м, 2Н), 3.25 (с, 1Н), 3.49 (с, 1Н), 4.93 (д, 1Н), 4.99 (д, 1Н), 5.64 (д, 1Н), 5.78-5.87 (м, 1Н), 7.60-7.64 (м, 2Н), 7.75 (т, 1Н), 8.04 (д, 1Н), 8.36 (д, 1Н), 8.86 (д, 1Н).
(f) В реактор помещают цинхонидиновую соль (S)-3-циано-5-метилгексановой кислоты (III) (2,0 г), дихлорметан (100 мл) и водный раствор соляной кислоты (10 мл). Полученную двухфазную систему перемешивают в течение часа, органический слой отделяют, водный слой несколько раз промывают дихлорметаном. Объединенные органические фазы сушат сульфатом натрия, фильтруют, удаляют растворитель при пониженном давлении и получают (S)-3-циано-5-метилгексановую кислоту (II) (750 мг).
1Н ЯМР (CD3OD, 300 МГц): 0.91-0.96 (м, 6Н), 1.22-1.23 (кв, 2Н), 1.64-1.74 (кв, 1Н), 2.20-2-48 (м, 3Н), 2.79-3.00 (м, 2Н).
(g) Восстановление (S)-3-циано-5-метилгексановой кислоты (II)
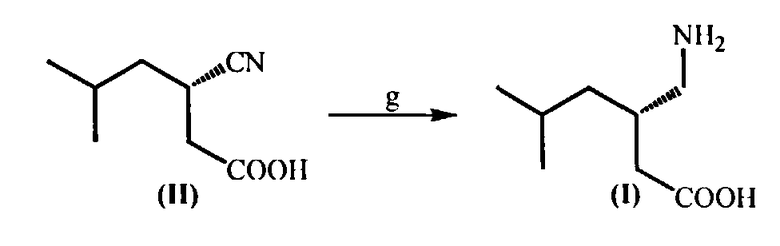
Раствор (S)-3-циано-5-метилгексановой кислоты (II) (2 г, 13 ммоль) в 100 мл смеси метанол-вода (70:30) прибавляют к раствору карбоната калия (720 мг, 13 ммоль) в 20 мл воды при комнатной температуре и перемешивают в течение 2 ч.
Полученную смесь помещают в автоклав и добавляют 1 г никеля Ренея. Автоклав закрывают и продувают водородом (2×3 атм). Затем давление доводят до 10 атм и оставляют на 24 часа. Реакционную смесь извлекают из автоклава и фильтруют через целит. Фильтрат подкисляют уксусной кислотой (0,85 мл, 13 ммоль) и перемешивают 10 минут. Растворитель удаляют при пониженном давлении, получая пастообразное вещество, которое суспендируют в диметоксиэтане (10 мл) и перемешивают в течение 2 ч при температуре 70°C, затем охлаждают и перемешивают еще 5 ч при 5°С. Получают (S)-3-аминометил-5-метилгексановую кислоту (прегабалин) (I) (1,2 г, 99,7% ее по данным хирального ВЭЖХ) в виде белого твердого вещества. Выход 60%.
Пример 2. Получение (S)-3-аминометил-5-метилгексановой кислоты (прегабалина)
(а) Взаимодействие метилового эфира цианоуксусной кислоты, изобутиральдегида и монооксида углерода в присутствии катализатора осуществляют по методике, аналогичной описанной в примере 1 (а), при этом в качестве катализатора используют трихлорид рутения, а в качестве растворителя - ацетонитрил. Температура 140°C. Выход метилового эфира 2-циано-4-метилпентановой кислоты 83%.
Последующие стадии (b)-(е) осуществляют, как описано в примере 1.
Пример 3. Получение (S)-3-аминометил-5-метилгексановой кислоты (прегабалина)
(а) Взаимодействие метилового эфира цианоуксусной кислоты, изобутиральдегида и монооксида углерода в присутствии катализатора осуществляют по методике, аналогичной описанной в примере 1(а), при этом в качестве катализатора используют карбонил кобальта, а в качестве растворителя - тетрагидрофуран. Температура 160°C. Выход метилового эфира 2-циано-4-метилпентановой кислоты 79%.
Последующие стадии (b)-(е) осуществляют, как описано в примере 1.
Пример 4. Получение (S)-3-аминометил-5-метилгексановой кислоты (прегабалина)
(а) Взаимодействие метилового эфира цианоуксусиой кислоты, изобутиральдегида и монооксида углерода в присутствии катализатора осуществляют по методике, аналогичной описанной в примере 1(а), причем в качестве катализатора используют дихлорид никеля, в качестве растворителя - тетрагидрофуран. Температура 160°C. Выход метилового эфира 2-циано-4-метилпентановой кислоты 80%.
Последующие стадии (b)-(е) осуществляют, как описано в примере 1.
Пример 5. Получение (S)-3-аминометил-5-метилгексановой кислоты (прегабалина)
(а) Взаимодействие этилового эфира цианоуксусной кислоты, изобутиральдегида и монооксида углерода в присутствии катализатора
В стеклянную ампулу помещают 23 мг (44,2 мкмоль) диацетата родия, 2,1 мл этанола, 400 мкл (4,42 ммоль) изобутиральдегида, 470 мкл (4,42 ммоль) этилового эфира цианоуксусной кислоты. Ампулу помещают в автоклав. Автоклав закрывают, продувают монооксидом углерода (3×10 атм) и нагревают при 110°C в течение 24 часов. Реакционную смесь фильтруют через тонкий слой силикагеля. Выход этилового эфира 2-циано-4-метилпентановой кислоты 92%.
1Н ЯМР (400 МГц, CDCl3) δ 4,24 (кв, J=7,1 Гц, 2Н), 3.50 (дд, J=9.3, 5.9 Гц, 1Н), 1.71-1,92 (м, 3Н), 1.31 (т, J=7,1 Гц, 3Н), 0,96 (д. 1=6,2, 3Н), 0,95 (д. J=6,2, 3Н).
Последующие стадии (b)-(е) осуществляют аналогично описанным в примере 1.
Таким образом, заявляемое изобретение позволяет усовершенствовать известный способ получения прегабалина, сократить общее количество стадий за счет проведения синтеза промежуточного алкилового эфира (В) в одну стадию, используя ранее неизвестную реакцию восстановительного алкилирования монооксидом углерода. В результате увеличивается выход целевого продукта и устраняется необходимость использования вспомогательных соединений, например, оснований, которые приводят к образованию побочных продуктов, загрязняющих основной продукт и увеличивающих количество отходов. Замена водорода на монооксид углерода позволяет снизить вероятность появления течи в реакторе и таким образом снизить вероятность образования взрывоопасной газовоздушной смеси. Способ позволяет использовать монооксид углерода с низкой степенью чистоты (технический), который может содержать такие примеси как: азот, диоксид углерода, гелий, аргон, водород, метан, этан, пропан, бутан, неон, криптон, радон и прочие газообразные соединения. В способе используют катализаторы на основе соединений более дешевых металлов (рутения, родия, никеля, кобальта и др.), чем в прототипе, и в меньших количествах (не более 1 моль%, в прототипе не менее 2%). Способ не требует применения сокатализаторов. Уменьшение загрузки металла-катализатора и отсутствие сокатализаторов делает способ более безопасным для окружающей среды. На стадии получения диэфира дикарбоновой кислоты (b) в качестве основания используется дешевый и доступный гидрид натрия.
Техническим результатом является сокращение числа стадий при получении основного интермедиата (В), уменьшение количества продуктов, поступающих в отходы, и повышение экологической безопасности.
Так как CO применяют для промышленного получения исходного изобутиральдегида, его использование на стадии (а) является несомненным достоинством способа с технологической точки зрения и может привести к созданию логистически эффективной технологии получения прегабалина.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ и промежуточные соединения для получения прегабалина | 2014 |
|
RU2628298C2 |
| СПОСОБ ПОЛУЧЕНИЯ (S)-3-(АМИНОМЕТИЛ)-5-МЕТИЛГЕКСАНОВОЙ КИСЛОТЫ | 2015 |
|
RU2643373C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА И ПИРРОЛОПИРИДИНА, ЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКОЙ АМИНОГРУППОЙ КАК АНТАГОНИСТЫ CRF | 2005 |
|
RU2385321C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛА | 2014 |
|
RU2632884C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНКАРБОНОВОЙ КИСЛОТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2091373C1 |
| C-СИММЕТРИЧНЫЕ БИСФОСФИНОВЫЕ ЛИГАНДЫ И ИХ ПРИМЕНЕНИЕ В АСИММЕТРИЧЕСКОМ СИНТЕЗЕ ПРЕГАБАЛИНА | 2005 |
|
RU2335342C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА И ПИРРОЛОТРИАЗИНА | 2005 |
|
RU2367663C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-3-ХИНОЛИНКАРБОНИТРИЛОВ | 2004 |
|
RU2345069C2 |
| СПОСОБ ЭНАНТИОСЕЛЕКТИВНОГО СИНТЕЗА (S)-ПРЕГАБАЛИНА | 2012 |
|
RU2529996C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО АРОМАТИЧЕСКОГО АМИДА КАРБОНОВОЙ КИСЛОТЫ | 2012 |
|
RU2556004C2 |
Изобретение относится к способу получения (S)-(+)-3-аминометил-5-метилгексановой кислоты (прегабалина) формулы (I). Способ включает стадии (a)-(g). На стадии (a) происходит взаимодействие алкилового эфира циануксусной кислоты CNCH2COOR (A) и изобутиральдегида с получением алкилового эфира 2-циано-4-метилпентановой кислоты (В). На стадии (b) полученный эфир (В) взаимодействует с этиловым эфиром альфа-галогенуксусной кислоты (Hal=Cl, Br, I) в присутствии основания при температуре 10-90°С в растворителе, таком как N,N-диметилформамид, тетрагидрофуран, 1,4-диоксан, диметилсульфоксид и диметоксиэтан, или без растворителя с образованием 4-этил-1-метил-2-циано-2-изобутилсукцината (С). На стадии (c) осуществляют гидролиз соединения (С) под действием основания, такого как гидроксид щелочного металла, при температуре 20-80°С, который дает 2-циано-2-изобутилянтарную кислоту. На стадии (d) проводят декарбоксилирование полученной 2-циано-2-изобутилянтарной кислоты в присутствии минеральной кислоты, например серной или соляной, в органическом растворителе, например этилацетате, при температуре 70-80°С с образованием (RS)-3-циано-5-метилгексановой кислоты. На стадии (e) разделяют энантиомеры полученной (RS)-3-циано-5-метилгексановой кислоты через образование соответствующей соли с цинхонидином в органическом растворителе, таком как этанол, метанол, 1,4-диоксан, этилацетат, тетрагидрофуран, 2-метилтетрагидрофуран, диметоксиэтан и диглим, при температуре 20-80°С, выделяют цинхонидиновую соль (S)-3-циано-5-метилгексановой кислоты и дополнительную очищают ее путем повторного солеобразования в этилацетате. На стадии (f) цинхонидиновую соль (S)-3-циано-5-метилгексановой кислоты обрабатывают смесью этилацетата и разбавленной соляной кислоты (1:1) при комнатной температуре и выделяют образовавшуюся (S)-3-циано-5-метилгексановую кислоту (II) из органического слоя. На стадии (g) осуществляют гидрирование выделенной оптически чистой (S)-3-циано-5-метилгексановой кислоты (II), катализируемое никелем Ренея, с образованием (S)-(+)-3-аминометил-5-метилгексановой кислоты (прегабалина) (I). Способ характеризуется тем, что на стадии (а) взаимодействие алкилового эфира циануксусной кислоты CNCH2COOR, где R=С1-С4-алкил, с изобутиральдегидом осуществляют под действием монооксида углерода при давлении от 1 до 200 атм и температуре от 20 до 200°С в полярном растворителе, таком как метанол, этанол, вода, 1,4-диоксан, тетрагидрофуран, ацетонитрил, диметоксиэтан и диглим, а в качестве катализатора используют соединения кобальта, никеля, рутения или родия; на стадии (b) в качестве основания используют гидрид натрия. Предлагаемый способ позволяет сократить число стадий при получении интермедиата (B), уменьшить количество отходов и повысить экологическую безопасность. 5 пр.
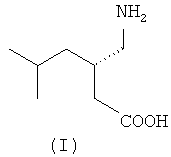
Способ получения (S)-(+)-3-аминометил-5-метилгексановой кислоты (прегабалина) формулы (I)
 ,
,
включающий
(a) взаимодействие алкилового эфира циануксусной кислоты CNCH2COOR (A) и изобутиральдегида, приводящее к получению алкилового эфира 2-циано-4-метилпентановой кислоты (В)
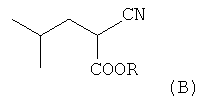 ;
;
(b) взаимодействие полученного эфира (В) с этиловым эфиром альфа-галогенуксусной кислоты (Hal=Cl, Br, I) в присутствии основания при температуре 10-90°С, которое проводят или без растворителя, или в растворителе, таком как N,N-диметилформамид, тетрагидрофуран, 1,4-диоксан, диметилсульфоксид и диметоксиэтан, с образованием 4-этил-1-метил-2-циано-2-изобутилсукцината (С)
 ;
;
(c) гидролиз соединения (С) под действием основания, такого как гидроксид щелочного металла, при температуре 20-80°С, который дает 2-циано-2-изобутилянтарную кислоту
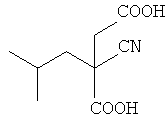 ;
;
(d) декарбоксилирование полученной 2-циано-2-изобутилянтарной кислоты в присутствии минеральной кислоты, например серной или соляной кислоты, в органическом растворителе, например этилацетате, при температуре 70-80°С с образованием (RS)-3-циано-5-метилгексановой кислоты
 ;
;
(e) разделение энантиомеров полученной (RS)-3-циано-5-метилгексановой кислоты через образование соответствующей соли с цинхонидином в органическом растворителе, таком как этанол, метанол, 1,4-диоксан, этилацетат, тетрагидрофуран, 2-метилтетрагидрофуран, диметоксиэтан и диглим, при температуре 20-80°С, выделение цинхонидиновой соли (S)-3-циано-5-метилгексановой кислоты и ее дополнительную очистку путем повторного солеобразования в этилацетате;
(f) обработку полученной цинхонидиновой соли (S)-3-циано-5-метилгексановой кислоты смесью этилацетата и разбавленной соляной кислоты (1:1) при комнатной температуре, выделение образовавшейся (S)-3-циано-5-метилгексановой кислоты (II) из органического слоя
 ;
;
(g) гидрирование выделенной оптически чистой (S)-3-циано-5-метилгексановой кислоты (II), катализируемое никелем Ренея, с образованием целевого продукта - (S)-(+)-3-аминометил-5-метилгексановой кислоты (прегабалина) (I),
отличающийся тем, что
на стадии (а) взаимодействие алкилового эфира циануксусной кислоты CNCH2COOR, где R=С1-С4-алкил, с изобутиральдегидом, приводящее к получению алкилового эфира 2-циано-4-метилпентановой кислоты (В), осуществляют под действием монооксида углерода при давлении от 1 до 200 атм и температуре от 20 до 200°С в полярном растворителе, таком как метанол, этанол, вода, 1,4-диоксан, тетрагидрофуран, ацетонитрил, диметоксиэтан и диглим, а в качестве катализатора используют соединения кобальта, никеля, рутения или родия;
на стадии (b) в качестве основания используют гидрид натрия.
| B | |||
| N | |||
| ROY et al., Eco-friendly, industrial process for synthesis of (S)-3-(aminomethyl)-5-methylhexanoic acid [pregabalin], INDIAN J | |||
| CHEM., SECT | |||
| B, 2012, Vol | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
Авторы
Даты
2015-03-20—Публикация
2013-12-20—Подача