Область техники, к которой относится изобретение
Настоящее изобретение касается нового соединения, обладающего ингибирующей активностью в отношении ксантиноксидазы, и способа его получения, а также ингибитора ксантиноксидазы, содержащего данное соединение в качестве действующего вещества.
В частности, настоящее изобретение касается производного пиразола, которое может применяться в качестве терапевтического средства или профилактического средства для заболеваний, связанных с ксантиноксидазой, таких как подагра, гиперурикемия, синдром лизиса опухоли, уролиты, гипертония, дислипидемия, диабет, сердечно-сосудистые заболевания, такие как артериосклероз или сердечная недостаточность, заболевания почек, такие как диабетическая нефропатия, заболевания органов дыхания, такие как хроническое обструктивное заболевание легких, воспалительные заболевания кишечника или аутоиммунные заболевания.
Уровень техники
Ксантиноксидаза представляет собой фермент, катализирующий превращение гипоксантина в ксантин и далее в мочевую кислоту в ходе метаболизма нуклеиновых кислот.
Ингибитор ксантиноксидазы ингибирует синтез мочевой кислоты, снижая концентрацию мочевой кислоты в крови, влияя на активность ксантиноксидазы. То есть, ингибитор ксантиноксидазы эффективен в качестве терапевтического средства для гиперурикемии и различных заболеваний, вызванных гиперурикемией. С другой стороны, существуют подагрический артрит и подагрический узел, называемые подагрой как клиническое состояние, являющееся результатом отложения кристаллов уратов после длительной гиперурикемии. Кроме того, считают, что гиперурикемия является важным фактором заболеваний, обусловленных образом жизни, связанных с ожирением, гипертонией, дислипидемией и диабетом или метаболическими синдромами, и недавно стало известно, что гиперурикемия является фактором риска для нарушения работы почек, уролитов и сердечно-сосудистых заболеваний, согласно эпидемиологическим исследованиям (Guideline for the Management of Hyperuricemia and Gout, 2nd edition). Кроме того, ожидается, что ингибитор ксантиноксидазы может применяться для лечения заболеваний, вызванных активными соединениями кислорода, благодаря подавлению генерирования активных соединений кислорода, например, для лечения сердечно-сосудистых заболеваний благодаря активному улучшению состояния сосудов (Circulation. 2006; 114: 2508-2516).
Аллопуринол и фебуксостат используют клинически в качестве терапевтического средства для лечения гиперурикемии, но сообщалось, что аллопуринол имеет побочный эффект, такой как синдром Стивенса-Джонсона, токсический эпидермальный некролиз, нарушение работы печени и почечная дисфункция (Nippon Rinsho, 2003; 61, Suppl. 1: 197-201).
В качестве соединения, обладающего ингибирующим воздействием на ксантиноксидазу, было описано, например, производное фенилпиразола (Патентные документы 1-3), и производное триарилкарбоновой кислоты (Патентные документы 4-7), и тому подобные, такие как производное пиразола, в котором центральный ароматический цикл представляет собой бензольное кольцо. Кроме того, сообщалось о производном пиразола, которое имеет центральный бициклический гетероцикл, таком как производное 6-индолпиразола (Патентный документ 8).
С другой стороны, в Непатентных документах 1 и 2 описано производное пиразолкарбоновой кислоты, содержащее в центре пиридиновый цикл.
Список литературы
Патентная литература
PTL 1: Нерассмотренная заявка на патент Японии S59-95272
PTL 2: Международная заявка №98/18765
PTL 3: Нерассмотренная заявка на патент Японии H10-310578
PTL 4: Международная заявка №2007/043457
PTL 5: Международная заявка №2007/097403
PTL 6: Международная заявка №2008/126770
PTL 7: Международная заявка №2008/126772
PTL 8: Международная заявка №2011/043568
Непатентная литература
NPL 1: Bioorganic Medicinal Chemistry Letters, 2006, Vol. 16 (21), p. 5616-5620
NPL2: Bioorganic Medicinal Chemistry Letters, 2006, Vol. 16 (21), p. 5687-5690
Раскрытие изобретения
Техническая проблема
Целью настоящего изобретения является разработка нового соединения, обладающего ингибирующей активностью в отношении ксантиноксидазы. Кроме того, целью настоящего изобретения является разработка соединения, обладающего отличным эффектом снижения концентрации мочевой кислоты. Кроме того, целью настоящего изобретения является разработка соединения, которое может применяться в качестве терапевтического средства или профилактического средства для заболеваний, связанных с ксантиноксидазой, таких как подагра, гиперурикемия, синдром лизиса опухоли, уролиты, гипертония, дислипидемия, диабет, сердечно-сосудистые заболевания, такие как артериосклероз или сердечная недостаточность, заболевания почек, такие как диабетическая нефропатия, заболевания органов дыхания, такие как хроническое обструктивное заболевание легких, воспалительные заболевания кишечника или аутоиммунные заболевания.
Решение проблемы
В результате серьезных исследований соединений, обладающих ингибирующей активностью в отношении ксантиноксидазы, авторы настоящего изобретения завершили разработку настоящего изобретения на основании следующих открытий: что соединение, имеющее формулу (I)
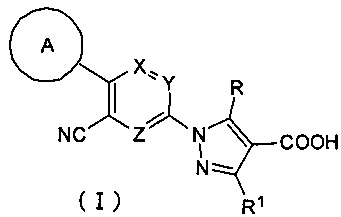
т.е. производное пиразола, имеющее трициклическую триарильную структуру и имеющее в качестве центрального цикла пиридиновый цикл, содержащий один атом азота и замещенный циано-группой, обладает ингибирующей активностью в отношении ксантиноксидазы; кроме того, что оно обладает новой ингибирующей активностью в отношении ксантиноксидазы вкупе с отличным эффектом снижения концентрации мочевой кислоты; и кроме того, что оно в течение длительного времени сохраняет ингибирующую активность в отношении ксантиноксидазы, что обеспечивает особенно хороший эффект снижения концентрации мочевой кислоты в течение длительного времени. Кроме того, авторы настоящего изобретения завершили разработку настоящего изобретения на основании открытия того факта, что производное пиразола может представлять собой хорошее терапевтическое средство или профилактическое средство для подагры, гиперурикемии, синдрома лизиса опухоли, уролита, гипертонии, дислипидемии, диабета, сердечно-сосудистых заболеваний, таких как артериосклероз или сердечная недостаточность, почечные заболевания, такие как диабетическая нефропатия, заболеваний органов дыхания, таких как хроническое обструктивное заболевание легких, воспалительных заболеваний кишечника, аутоиммунных заболеваний и т.д.
Настоящее изобретение касается соединения, имеющего формулу (I):
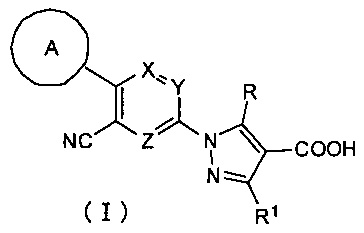
где:
А представляет собой C6-10 арильную группу или гетероарильную группу, которые могут быть незамещенными или замещены 1-3 группами Q, которые идентичны или отличаются друг от друга и выбраны из группы, состоящей из атома галогена, -CN, -NO2, C1-6 алкильной группы, C3-7 циклоалкильной группы, C1-6 галогеналкильной группы, фенильной группы, -CH2-O-R2, -O-R2, -O-C1-6 галогеналкила, -О-бензила, -О-фенила, -О-CO-R2, -NR3R4, -NH-CO-R2, -CO2-R2, -CO-R2, -CO-NR3R4, -NH-SO2-R2, -СО-арила, -S-R2, -SO2-C1-6 алкила и -SO2-фенила;
X, Y и Z представляют собой CR5 или атом азота, где один из X, Y и Z представляет собой атом азота, а оставшиеся два элемента представляют собой CR5;
R представляет собой атом водорода или C1-6 алкильную группу;
R1 представляет собой атом водорода, аминогруппу или C1-6 алкильную группу;
R2 представляет собой атом водорода или C1-6 алкильную группу;
R3 и R4 идентичны или отличаются друг от друга и представляют собой атом водорода или C1-6 алкильную группу, где R3 и R4 могут быть объединены с атомом азота, к которому они присоединены, с образованием азотсодержащего насыщенного моноциклического гетероцикла; и
R5 представляет собой атом водорода, атом галогена или C1-6 алкильную группу;
или его фармацевтически приемлемые соли.
Настоящее изобретение также касается фармацевтической композиции, содержащей соединение, имеющее формулу (I), или его фармацевтически приемлемые соли, и фармацевтически приемлемый носитель.
Настоящее изобретение также касается ингибитора ксантиноксидазы, содержащего соединение, имеющее формулу (I), или его фармацевтически приемлемые соли, в качестве действующего вещества.
Настоящее изобретение также касается терапевтического средства или профилактического средства для заболеваний, связанных с ксантиноксидазой, таких как подагра, гиперурикемия, синдром лизиса опухоли, уролит, гипертония, дислипидемия, диабет, сердечно-сосудистые заболевания, такие как артериосклероз или сердечная недостаточность, почечные заболевания, такие как диабетическая нефропатия, заболевания органов дыхания, такие как хроническое обструктивное заболевание легких, воспалительные заболевания кишечника или аутоиммунные заболевания, содержащего соединение, имеющее формулу (I), или его фармацевтически приемлемые соли, в качестве действующего вещества.
Кроме того, настоящее изобретение касается соединения, имеющего формулу (II), которое можно использовать в качестве интермедиата при получении соединения, имеющего формулу (I):
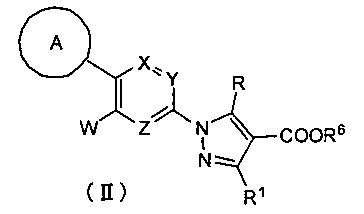
где:
А представляет собой C6-10 арильную группу или гетероарильную группу, где арильная группа или гетероарильная группа может быть незамещенной или замещена 1-3 группами Q, которые идентичны или отличаются друг от друга, и выбраны из группы, состоящей из атома галогена, -CN, -NO2, C1-6 алкильной группы, C3-7 циклоалкильной группы, C1-6 галогеналкильной группы, фенильной группы, -CH2-O-R2, -O-R2, -O-C1-6 галогеналкила, -О-бензила, -О-фенила, -O-CO-R2, -NR3R4, -NH-CO-R2, -CO2-R2, -CO-R2, -CO-NR3R4, -NH-SO2-R2, -СО-арила, -S-R2, -SO2-C1-6 алкила и -SO2-фенила;
X, Y и Z представляют собой CR5 или атом азота, где один из X, Y и Z представляет собой атом азота, а оставшиеся два элемента представляют собой CR5;
R представляет собой атом водорода или C1-6 алкильную группу;
R1 представляет собой атом водорода, аминогруппу или C1-6 алкильную группу;
R2 представляет собой атом водорода или C1-6 алкильную группу;
R3 и R4 идентичны или отличаются друг от друга и представляют собой атом водорода или C1-6 алкильную группу, где R3 и R4 могут быть объединены с атомом азота, к которому они присоединены, с образованием азотсодержащего насыщенного моноциклического гетероцикла; и
R5 представляет собой атом водорода, атом галогена или C1-6 алкильную группу;
R6 представляет собой защитную группу для карбоксильной группы; и
W представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу или циано-группу.
Кроме того, настоящее изобретение касается соединения, имеющего формулу (III), которое можно использовать в качестве интермедиата при получении соединения, имеющего формулу (I):

где
X, Y и Z представляют собой CR5 или атом азота, где один из X, Y и Z представляет собой атом азота, а оставшиеся два элемента представляют собой CR5;
R представляет собой атом водорода или C1-6 алкильную группу;
R1 представляет собой атом водорода, аминогруппу или C1-6 алкильную группу;
R5 представляет собой атом водорода, атом галогена или C1-6 алкильную группу;
R6 представляет собой защитную группу для карбоксильной группы;
V представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу, гидроксильную группу или бензилокси-группу; и
W представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу или циано-группу.
Кроме того, настоящее изобретение касается соединения, имеющего формулу (IV), которое можно использовать в качестве интермедиата при получении соединения, имеющего формулу (I):
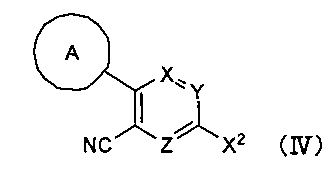
где
А представляет собой C6-10 арильную группу или гетероарильную группу, где арильная группа или гетероарильная группа может быть незамещенной или замещена 1-3 группами Q, которые идентичны или отличаются друг от друга, и выбраны из группы, состоящей из атома галогена, -CN, -NO2, C1-6 алкильной группы, C3-7 циклоалкильной группы, C1-6 галогеналкильной группы, фенильной группы, -CH2-O-R2, -O-R2, -O-C1-6 галогеналкила, -О-бензила, -О-фенила, -O-CO-R2, -NR3R4, -NH-CO-R2, -CO2-R2, -CO-R2, -CO-NR3R4, -NH-SO2-R2, -СО-арила, -S-R2, -SO2-C1-6 алкила и -SO2-фенила;
X, Y и Z представляют собой CR5 или атом азота, где один из X, Y и Z представляет собой атом азота, а оставшиеся два элемента представляют собой CR5;
R2 представляет собой атом водорода или C1-6 алкильную группу;
R3 и R4 идентичны или отличаются друг от друга и представляют собой атом водорода или C1-6 алкильную группу, где R3 и R4 могут быть объединены с атомом азота, к которому они присоединены, с образованием азотсодержащего насыщенного моноциклического гетероцикла; и
R5 представляет собой атом водорода, атом галогена или C1-6 алкильную группу; и
X2 представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу или трифторметансульфонилокси-группу.
Преимущества настоящего изобретения
В настоящем изобретении описано новое соединение, обладающее высокой ингибирующей активностью в отношении ксантиноксидазы, и способ получения данного соединения. Кроме того, соединение по настоящему изобретению может применяться в качестве терапевтического средства или профилактического средства для заболеваний, связанных с ксантиноксидазой, в частности таких как подагра, гиперурикемия, синдром лизиса опухоли, уролиты, гипертония, дислипидемия, диабет, сердечно-сосудистые заболевания, такие как артериосклероз или сердечная недостаточность, почечные заболевания, такие как диабетическая нефропатия, заболевания органов дыхания, такие как хроническое обструктивное заболевание легких, воспалительные заболевания кишечника или аутоиммунные заболевания.
Описание вариантов осуществления
Термины, используемые в настоящем описании по отдельности или в комбинации, имеют приведенные ниже определения. Если не указано иное, значение каждого заместителя является общим для всех мест его расположения. Необходимо отметить, что при наличии переменной в любом количестве заместителей, значение переменной является независимым для каждого элемента. Кроме того, комбинации заместителей и переменных допустимы только в том случае, если эти комбинации дают химически устойчивые соединения.
Термин "ксантиноксидаза" используется как в широком понимании его как фермента для катализирования реакции окисления гипоксантина до ксантина и далее до мочевой кислоты, так и в узком понимании его как ксантиноксиредуктазы оксидазного типа, которая является одним из ферментов, катализирующих ту же реакцию. В настоящем изобретении, если не указано иное, термин "ксантиноксидаза" собирательно означает фермент, который катализирует реакцию окисления гипоксантина до ксантина и далее до мочевой кислоты. Среди ксантиноксиредуктаз, которые ответственны за указанную реакцию, имеется два типа оксидазы, оксидоредуктаза и дегидрогеназа, и оба типа включены в термин ксантиноксидазы по настоящему изобретению. Если не указано иное, термин "ксантиноксидаза" в терминах "ингибирующая активность в отношении ксантиноксидазы", "ингибитор ксантиноксидазы" и т.п. имеет то же значение, как указано выше.
В контексте настоящего изобретения, термин "арильная группа" означает группу, образованную удалением одного из атомов водорода, соединенных с ароматическим углеводородным циклом. C6-10 арильные группы включают, например, фенильные, нафтильные, инденильные, тетрагидронафтильные, инданильные, азуленильные группы и т.п.
В контексте настоящего изобретения, термин "гетероарильная группа" означает 3-10-членную моноциклическую или бициклическую гетероциклическую кольцевую систему ароматического характера, содержащую 1-5 гетероатомов, выбранных из группы, состоящей из атомов кислорода, атомов серы и атомов азота. Термин "3-10-членная моноциклическая или бициклическая гетероциклическая кольцевая система ароматического характера" означает одновалентную группу, полученную удалением атома водорода из 3-10-членного моноциклического или бициклического ароматического гетероцикла, и содержащую 1-5 гетероатомов, выбранных из группы, состоящей из атомов кислорода, атомов серы и атомов азота. В случае бициклической гетероарильной группы, если один из циклов представляет собой ароматический цикл или ароматический гетероцикл, второй цикл может иметь циклическую структуру, отличную от ароматической. Количество соответствующих гетероатомов и их комбинация в указанной гетероарильной группе конкретно не ограничены, при условии, что они могут формировать часть цикла с заданным количеством членов и быть химически устойчивыми. Такие гетероарильные группы включают, например, пиридильные, пиразильные, пиримидильные, пиридазинильные, фурильные, тиенильные, пиразолильные, 1,3-диоксаинданильные, изоксазолильные, изотиазолильные, бензофуранильные, изобензофурильные, бензотиенильные, индолильные, изоиндолильные, хроманильные, бензотиазолильные, бензимидазолильные, бензоксазолильные, пиранильные, имидазолильные, оксазолильные, тиазолильные, триазинильные, триазолильные, фуразанильные, тиадиазолильные, дигидробензофурильные, дигидроизобензофурильные, дигидрохинолильные, дигидроизохинолильные, дигидробензоксазолильные, дигидроптеридинильные, бензоксазолильные, бензизоксазолильные, бензодиоксазолильные, хинолильные, изохинолильные, бензотриазолильные, птеридинильные, пуринильные, хиноксалинильные, хиназолинильные, циннолинильные, тетразолильные группы и т.п.
В контексте настоящего изобретения, термин "атом галогена" означает атом фтора, хлора, брома или йода.
В контексте настоящего изобретения, термин "алкильная группа" означает одновалентную насыщенную линейную или разветвленную алифатическую углеводородную группу. C1-6 алкильные группы включают, например, метальные, этильные, н-пропильные, н-бутильные, н-пентильные, н-гексильные, изопропильные, изобутильные, втор-бутильные, трет-бутильные, изопентильные, 2-метилбутильные, неопентильные, 1-этилпропильные, 4-метилпентильные, 3-метилпентильные, 2-метилпентильные, 1-метилпентильные, 3,3-диметилбутильные, 2,2-диметилбутильные, 1,1-диметилбутильные, 1,2-диметилбутильные, 1,3-диметилбутильные, 2,3-диметилбутильные, 1-этилбутильные, 2-этилбутильные, трет-пентильные, изогексильные группы и т.п.
В контексте настоящего изобретения, термин "алкиленовая группа" означает двухвалентную насыщенную линейную или разветвленную алифатическую углеводородную группу, содержащую 1-6 атомов углерода. C1-6 алкиленовые группы включают, например, метиленовые, этиленовые, н-пропиленовые, изопропиленовые, н-пентиленовые, н-гексиленовые группы и т.п.
В контексте настоящего изобретения, термин "циклоалкильная группа" означает циклическую насыщенную углеводородную группу. C3-7 циклоалкильные группы включают, например, циклопропильные, циклобутильные, циклопентильные, циклогексильные, циклогептильные группы и т.п.
В контексте настоящего изобретения, термин "галогеналкильная группа" означает алкильную группу, замещенную одним или более атомами галогенов. С1-6 галогеналкильные группы включают, например, трифторметильные, дифторметильные группы и т.п.
В контексте настоящего изобретения, термин "азотсодержащий насыщенный моноциклический гетероцикл" означает 5-8-членный насыщенный или частично ненасыщенный моноциклический гетероцикл, который содержит один атом азота и также может содержать один гетероатом, выбранный из группы, состоящей из атомов азота, атомов серы и атомов кислорода, и включает, например, пирролидиновые, пиперидиновые, пиперазиновые, азепановые, диазепановые, азокановые, морфолиновые, тиоморфолиновые, тетрагидропиридиновые циклы и т.п.
В вышеописанном "азотсодержащем насыщенном моноциклическом гетероцикле" атом серы, который является атомом в цикле, может быть окислен с образованием оксида или диоксида, или атом азота может быть окислен с образованием оксида.
В настоящем изобретении, термин "защитная группа для карбоксильной группы" означает, например, общую защитную группу для карбоксильной группы, которая описана в книге PROTECTIVE GROUPS IN ORGANIC SYNTHESIS, THIRD EDITION, John Wiley&Sons. Inc. Примеры защитных групп включают метильную группу, этильную группу, изопропильную группу, гептильную группу, трет-бутильную группу, метоксиметильную группу, метилтиометильную группу, метоксиэтоксиметильную группу, метоксиэтильную группу, бензильную группу, трет-бутилдиметилсилильную группу и т.п.
В формуле (I), А представляет собой C6-10 арильную группу или гетероарильную группу, где арильная группа или гетероарильная группа может быть незамещенной или замещена 1-3 группами Q, которые идентичны или отличаются друг от друга, и выбраны из группы, состоящей из атома галогена, -CN, -NO2, C1-6 алкильной группы, С3-7 циклоалкильной группы, C1-6 галогеналкильной группы, фенильной группы, -СН2-O-R2, -O-R2, -O-C1-6 галогеналкила, -О-бензила, -О-фенила, -O-CO-R2, -NR3R4, -NH-CO-R2, -CO2-R2, -CO-R2, -CO-NR3R4, -NH-SO2-R2, -СО-арила, -S-R2, -SO2-C1-6 алкила и -SO2-фенила;
Несмотря на то, что частные примеры "арильной группы" и "гетероарильной группы" соответствуют описанным выше, предпочтительные "арильные группы" или "гетероарильные группы" для А включают фенильные, пиридильные, пиразильные, пиримидильные, фурильные, тиенильные, изоксазолильные, изотиазолильные, бензофуранильные, бензотиенильные, бензотиазолильные, бензимидазолильные, бензоксазолильные, пиранильные, имидазолильные, оксазолильные, тиазолильные, триазинильные, триазолильные, бензоксазолильные, бензизоксазолильные группы и т.п., и более предпочтительными являются фенильные и тиенильные группы.
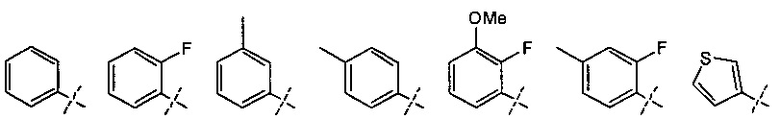
А может быть незамещенным или замещен 1-3 группами Q, которые идентичны или отличаются друг от друга, и выбраны из группы, состоящей из атома галогена, -CN, -NO2, С1-6 алкильной группы, С3-7 циклоалкильной группы, С1-6 галогеналкильной группы, фенильной группы, -CH2-O-R2, -O-R2, -О-C1-6 галогеналкила, -О-бензила, -О-фенила, -О-CO-R2, -NR3R4, -NH-CO-R2, -CO2-R2, -CO-R2, -CO-NR3R4, -NH-SO2-R2, -СО-арила, -S-R2, -SO2-C1-6 алкила и -SO2-фенила. В случае, когда А замещен заместителем Q, количество Q предпочтительно составляет 1 или 2, Предпочтительно, А незамещен или замещен группой (группами) Q, выбранными из группы, состоящей из атома галогена, С1-6 алкильной группы, С3-7 циклоалкильной группы, C1-6 галогеналкильной группы, фенильной группы, -O-R2 и -O-C1-6 галогеналкила. Более предпочтительно, А незамещен или замещен группой (группами) Q, выбранными из группы, состоящей из атома галогена, метальной группы и метокси-группы. В качестве атома галогена предпочтительным является атом фтора.
Особенно предпочтительный А может быть представлен, например, следующими структурными формулами.
В формуле (I), R представляет собой атом водорода или C1-6 алкильную группу. Несмотря на то, что частные примеры "C1-6 алкильной группы" соответствуют описанным выше, предпочтительные "C1-6 алкильные группы" включают метальные, этильные, н-пропильные, н-бутильные, н-пентильные, н-гексильные, изопропильные, изобутильные, втор-бутильные, третбутильные, изопентильные, 2-метилбутильньге, неопентильные, 1-этилпропильные, 4-метилпентальные, 3-метилпентильные, 2-метилпентильньге, 1-метилпентильные, 3,3-диметилбутильные, 2,2-диметилбутильные, 1,1-диметилбутильные, 1,2-диметилбутильные, 1,3-диметилбутильные, 2,3-диметилбутильные, 1-этилбутильные, 2-этилбутильные, трет-пентильные, изогексильные группы и т.п. R более предпочтительно представляет собой атом водорода или метильную группу, и особенно предпочтительно атом водорода.
В формуле (I), R1 представляет собой атом водорода, аминогруппу или С1-6 алкильную группу. Несмотря на то, что частные примеры "С1-6 алкильной группы" такие, как указано выше, предпочтительные "С1-6 алкильные группы" включают метильную, этильную, н-пропильную, н-бутильную, н-пентильную, н-гексильную, изопропильную, изобутильную, втор-бутильную, трет-бутильную, изопентильную, 2-метилбутильную, неопентильную, 1-этилпропильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 1,2-диметилбутильную, 1,3-диметилбутильную, 2,3-диметалбутильную, 1-этилбутальную, 2-этилбутильную, трет-пентильную, изогексильную группы и т.п. R1 более предпочтительно представляет собой атом водорода, аминогруппу или метильную группу, и особенно предпочтительно атом водорода.
В формуле (I), R2 представляет собой атом водорода, аминогруппу или С1-6 алкильную группу. Несмотря на то, что частные примеры "С1-6 алкильной группы" такие, как указано выше, предпочтительные "С1-6 алкильные группы" включают метильную, этильную, н-пропильную, н-бутильную, н-пентильную, н-гексильную, изопропильную, изобутильную, втор-бутильную, трет-бутильную, изопентильную, 2-метилбутильную, неопентильную, 1-этилпропильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентальную, 1-метилпентильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 1,2-диметалбутильную, 1,3-диметилбутильную, 2,3-диметилбутильную, 1-этилбутильную, 2-этилбутильную, трет-пентильную, изогексильную группы и т.п. R2 более предпочтительно представляет собой атом водорода или метильную группу, и особенно предпочтительно метильную группу.
В формуле (I), R3 и R4 идентичны или отличаются друг от друга, и представляют собой атом водорода или C1-6 алкильную группу, где R3 и R4 могут быть объединены с атомом азота, к которому они присоединены, с образованием азотсодержащего насыщенного моноциклического гетероцикла. Несмотря на то, что частные примеры "С1-6 алкильной группы" и "азотсодержащего насыщенного моноциклического гетероцикла" такие, как указано выше, предпочтительные "C1-6 алкильные группы" включают метильную, этильную, н-пропильную, н-бутильную, н-пентильную, н-гексильную, изопропильную, изобутильную, втор-бутильную, трет-бутильную, изопентильную, 2-метилбутильную, неопентильную, 1-этилпропильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 1,2-диметалбутильную, 1,3-диметилбутильную, 2,3-диметилбутильную, 1-этилбутильную, 2-этилбутильную, трет-пентильную, изогексильную группы и т.п., а предпочтительные "азотсодержащие насыщенные моноциклические гетероциклы" включают пирролидиновый, пиперидиновый, пиперазиновый, азепановый, диазепановый, азокановый, морфолиновый, тиоморфолиновый, тетрагидропиридиновый циклы и т.п. Более предпочтительными в качестве R3, R4 и "азотсодержащих насыщенных моноциклических гетероциклов" являются атом водорода, метальная группа, пирролидин, пиперидин, пиперазин и морфолин, и особенно предпочтительными являются атом водорода, метальная группа и морфолин.
В формуле (I), X, Y и Z представляют собой CR5 или атом азота, где один из X, Y и Z представляет собой атом азота, а оставшиеся два элемента представляют собой CR5. Три случая, в которых каждый из X, Y и Z представляет собой атом азота, могут быть представлены следующими структурными формулами. Среди них предпочтительной является формула, в которой Y представляет собой атом азота.

R5 включает атом водорода, атом галогена или C1-6 алкильную группу, и атом водорода является предпочтительным.
В формуле (I), в качестве комбинации A, Q, R, R1, R2, R3, R4, R5, X, Y и Z, комбинация предпочтительных групп, каждая из которых описана выше, является предпочтительной, и комбинация групп, которые описаны как более предпочтительные, является более предпочтительной. Особенно предпочтительна комбинация, в которой А и R1 в структуре формулы (I) представляют собой комбинации групп, которые описаны как более предпочтительные, и замещены особенно предпочтительными группами.
Соединения по настоящему изобретению представляют собой соединения, которые демонстрируют прекрасную ингибирующую активность в отношении ксантиноксидазы. Кроме того, соединения по настоящему изобретению эффективно снижают содержание мочевой кислоты. Кроме того, соединения по настоящему изобретению обладают пролонгированным эффектом снижения концентрации мочевой кислоты.
Частные примеры предпочтительных соединений могут включать следующие соединения.
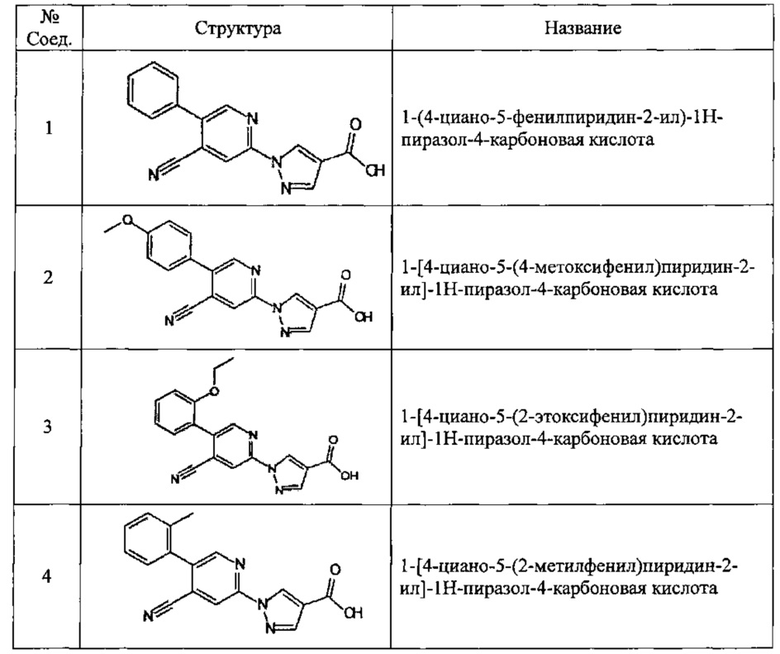

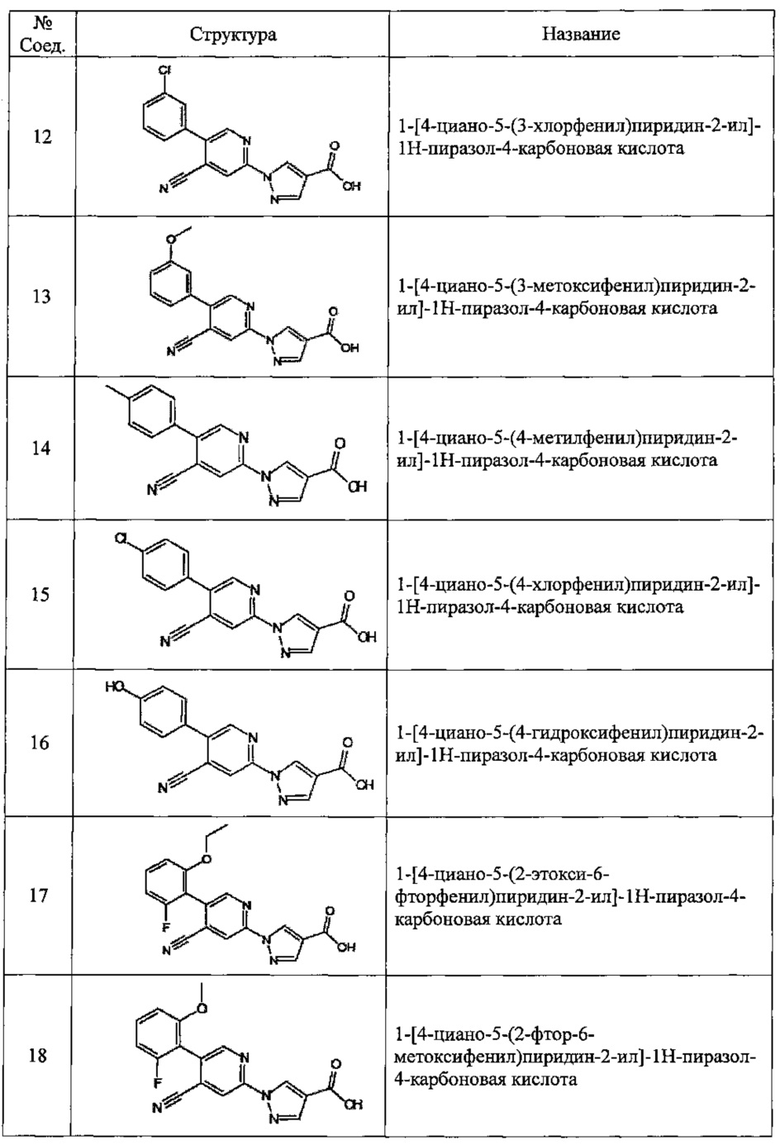
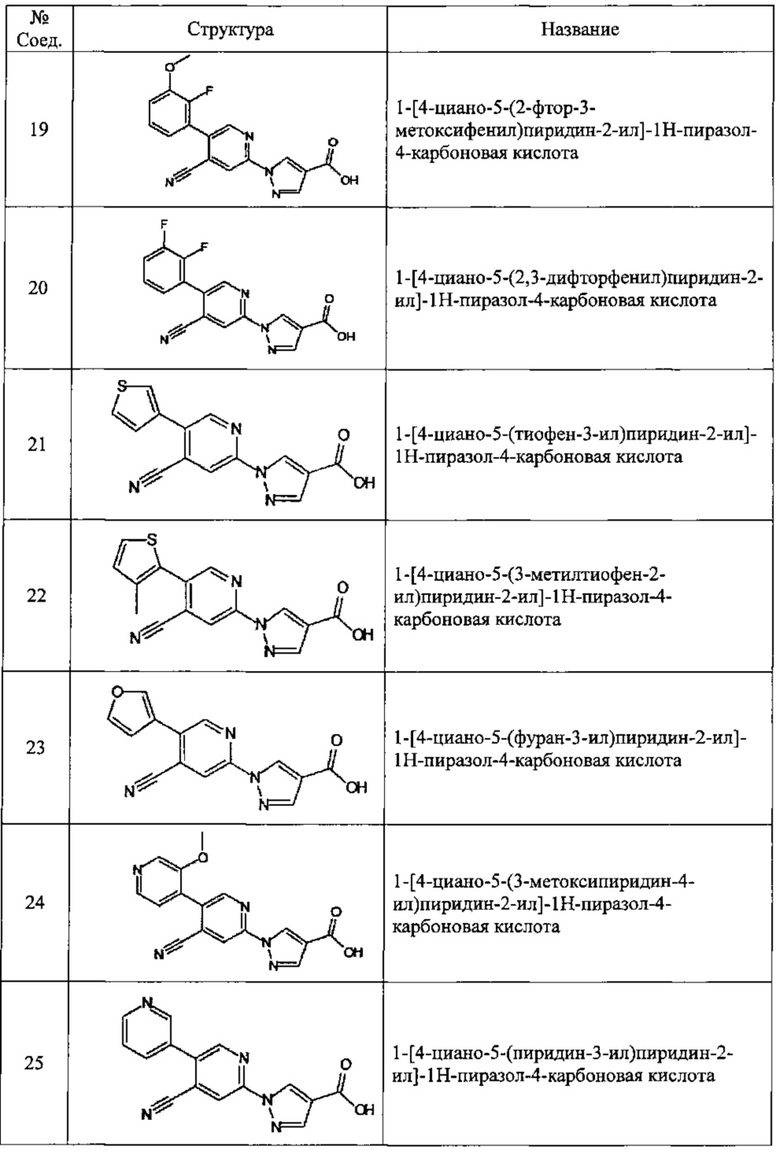
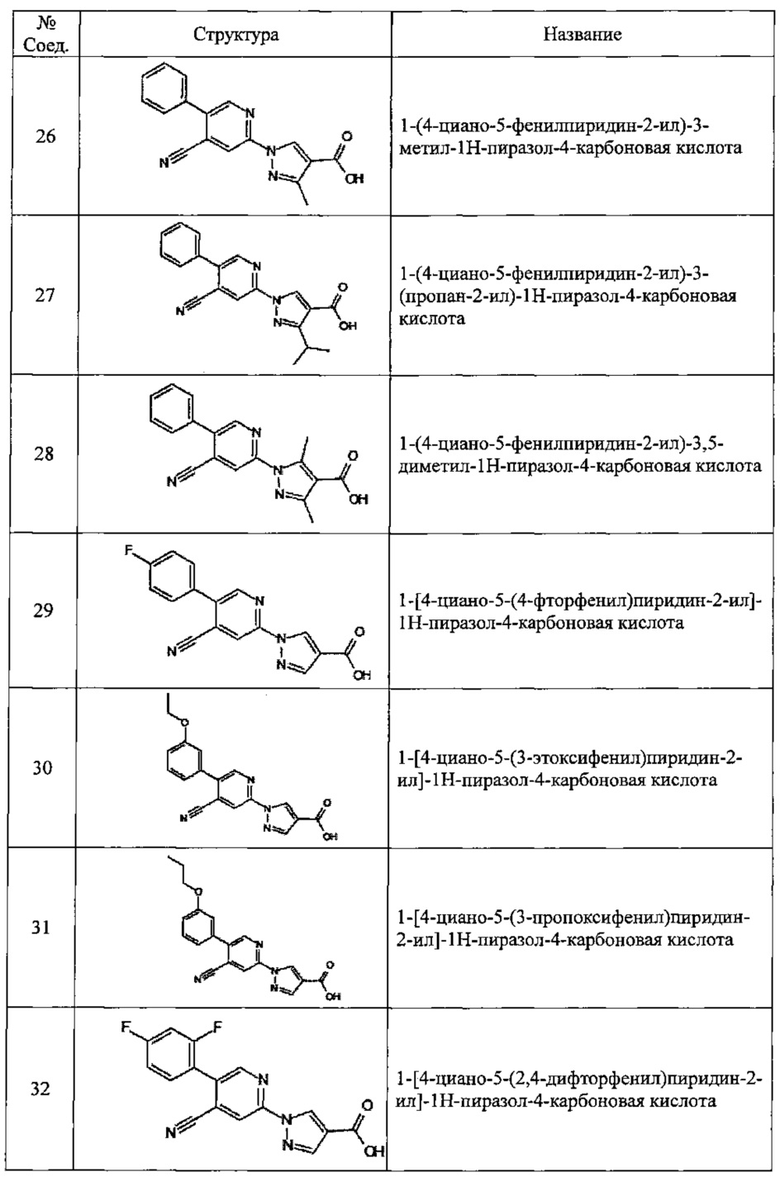

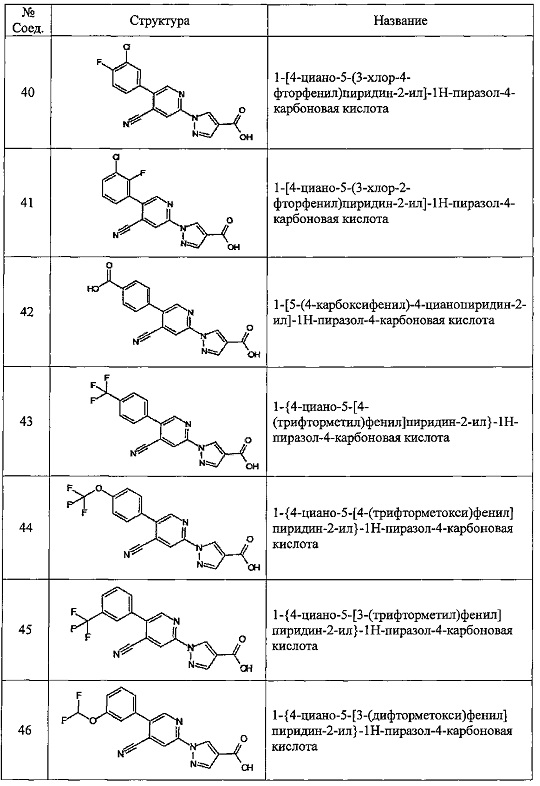
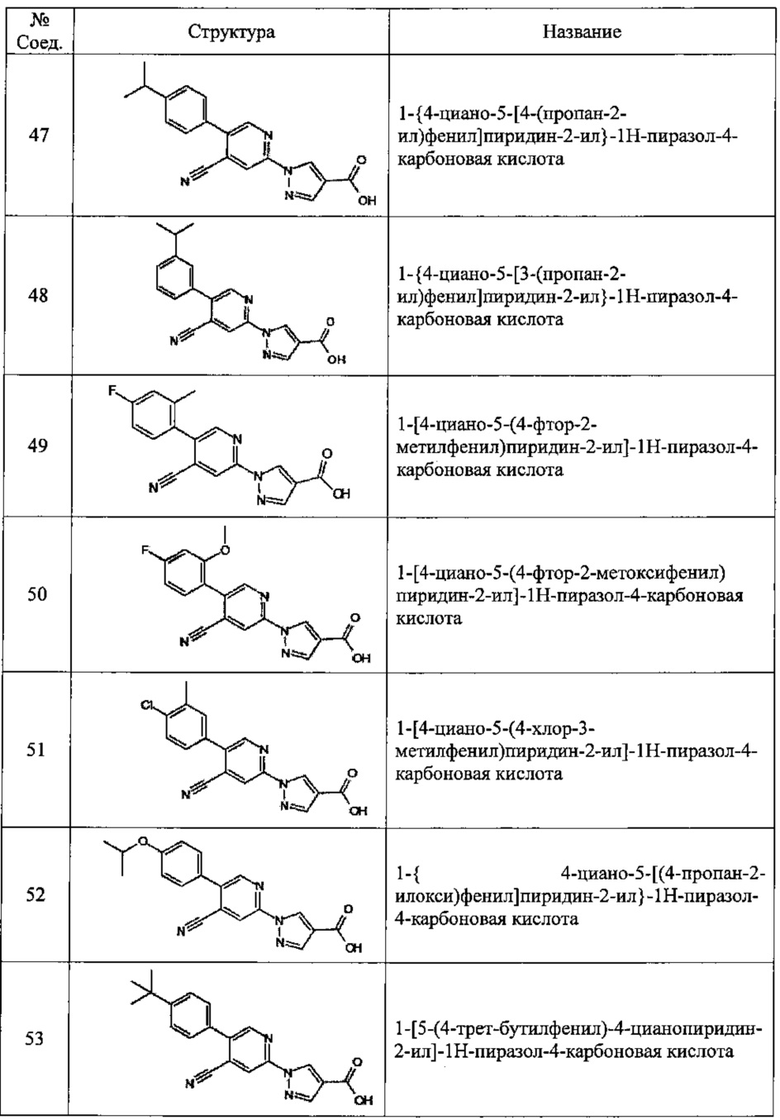
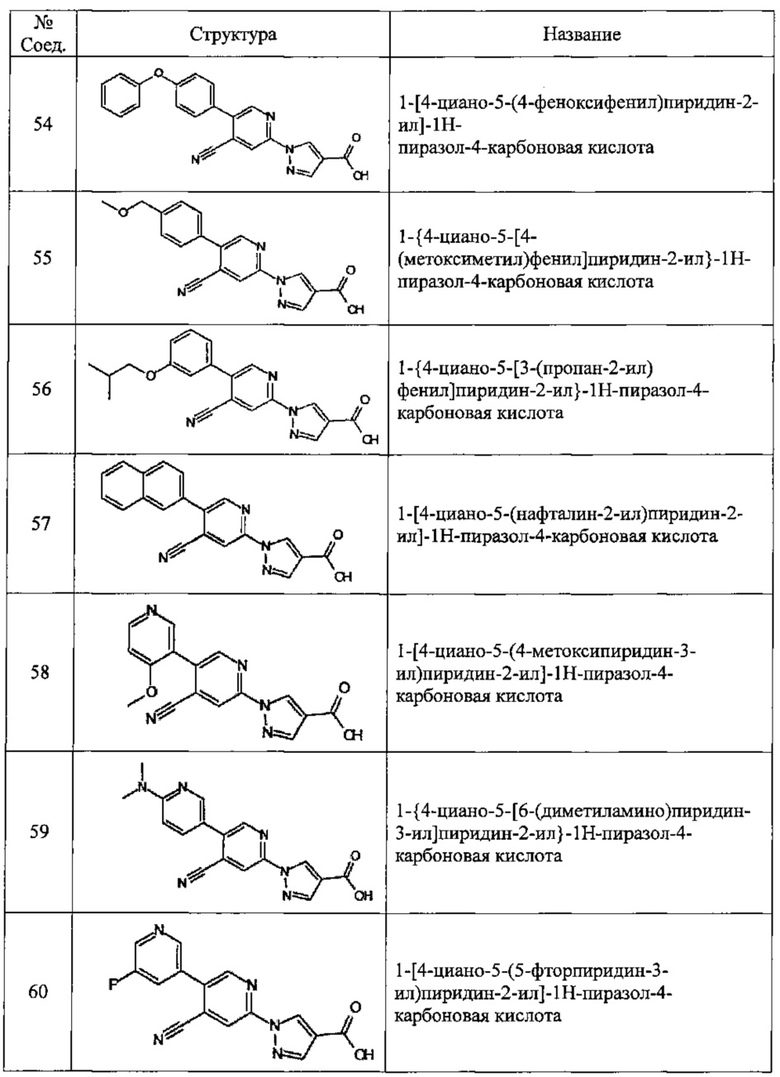

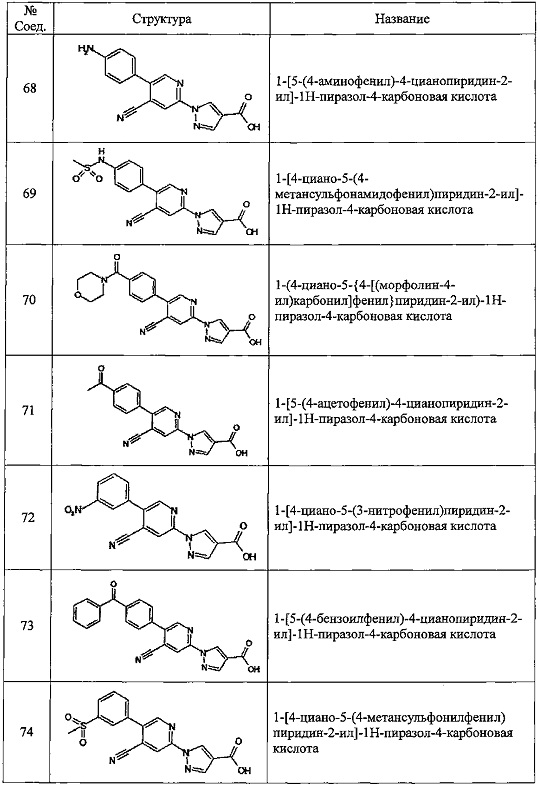
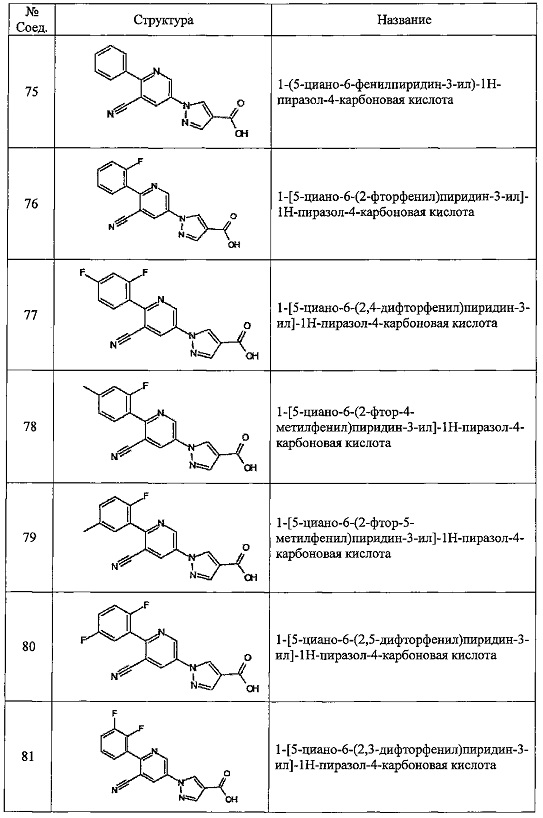
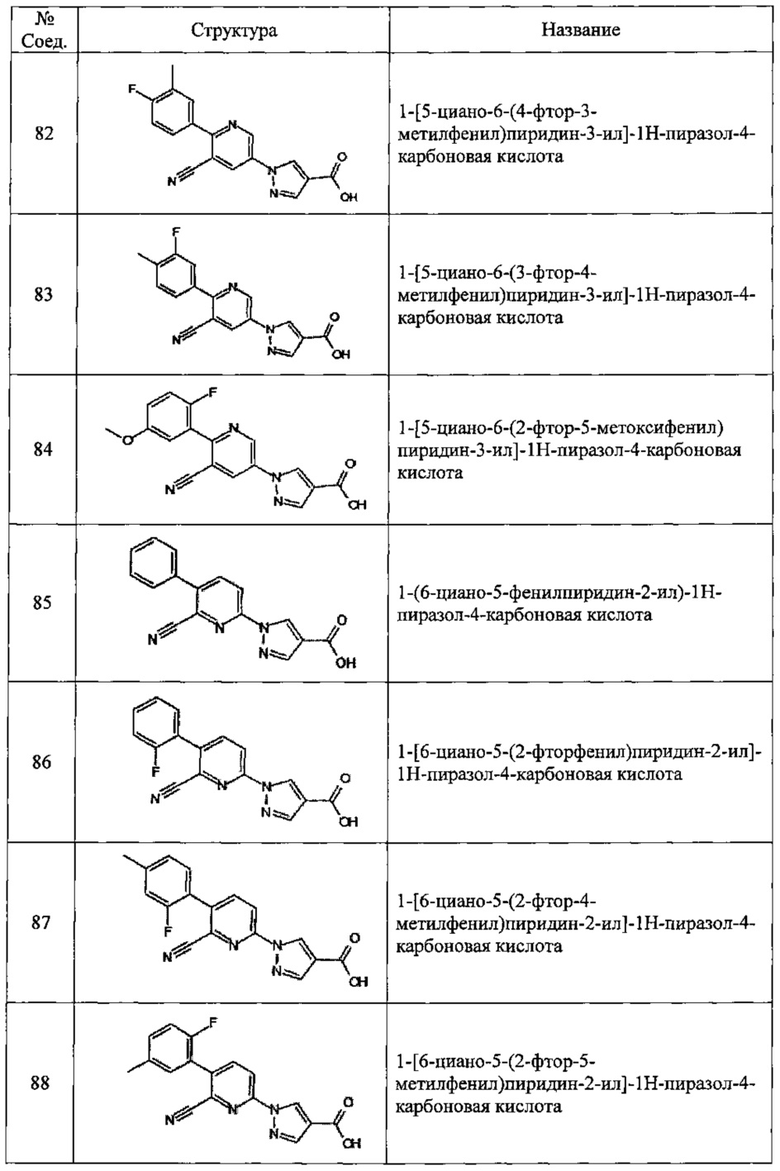
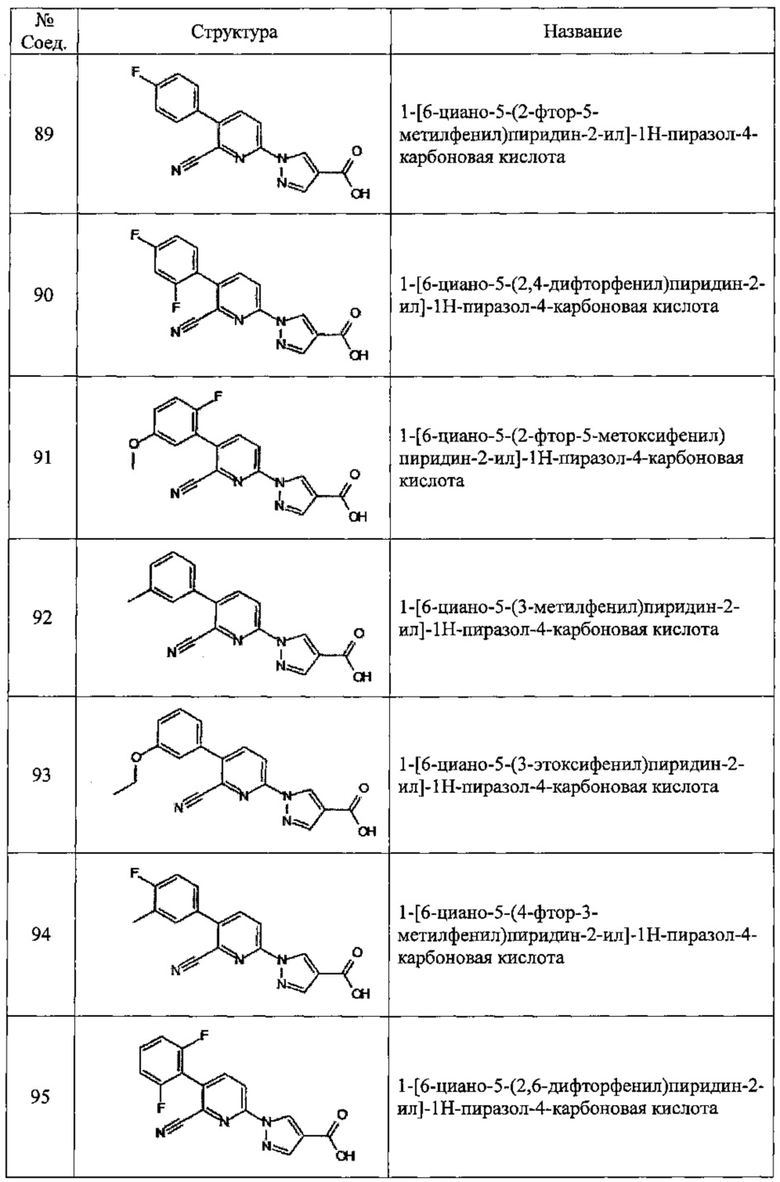


№ Соед. обозначает номер соединения в приведенных выше таблицах.
Из перечисленных соединений, более предпочтительными являются соединения 1, 2, 5, 6, 7, 10, 13, 14, 15, 16, 19, 20, 21, 22, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 41, 42, 43, 44, 47, 48, 50, 51, 52, 53, 54, 55, 57, 59, 61, 63, 64, 65, 66, 68, 69, 70, 71, 73, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106 и 107, и еще более предпочтительными являются соединения 1, 5, 10, 14, 19, 21, 33, 97 и 98,
В соединении, имеющем формулу (II), которое можно использовать в качестве интермедиата при получении соединений, имеющих формулу (I) по настоящему изобретению, определения A, Q, R, R1, R2, R3, R4, R5, X, Y и Z такие же, как для формулы (I). W представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу или циано-группу. W более предпочтительно представляет собой атом галогена или циано-группу, и особенно предпочтительно циано-группу. R6 представляет собой защитную группу для карбоксила. Определение защитной группы для карбоксила такое же, как приведено выше, и она предпочтительно представляет собой метильную, этильную или бензильную группу.
Кроме того, в соединении, имеющем формулу (III), которое можно использовать в качестве интермедиата при получении соединений, имеющих формулу (I) по настоящему изобретению, определения R, R1, R5, X, Y и Z такие же, как для формулы (I). V представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу, гидроксильную группу или бензилокси-группу. V предпочтительно представляет собой атом галогена, трифторметансульфонилокси-группу, гидроксильную группу или бензилокси-группу. W представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу или циано-группу. W более предпочтительно представляет собой атом галогена или циано-группу, и особенно предпочтительно циано-группу. R6 представляет собой защитную группу для карбоксила. Определение защитной группы для карбоксила такое же, как приведено выше, и она предпочтительно представляет собой метильную, этильную или бензильную группу.
В соединении, имеющем формулу (IV), которое можно использовать в качестве интермедиата при получении соединений, имеющих формулу (I) по настоящему изобретению, определения A, Q, R2, R3, R4, R5, X, Y и Z такие же, как для формулы (I). X2 представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу или трифторметансульфонилокси-группу. Атом галогена является предпочтительным.
Общие методы синтеза
Соединения формулы (I) по настоящему изобретению и интермедиаты можно синтезировать согласно, например, любому из описанных ниже методов синтеза. Необходимо отметить, что в каждой формуле A, R, R1, Q, X, Y и Z имеют такие же определения, как для формулы (I). Кроме того, реагенты, растворители и т.д., показанные в химических формулах как условия, являются только иллюстративными, что также указано в тексте. При необходимости, каждый заместитель может быть защищен подходящей защитной группой, и защитная группа может быть снята на подходящей стадии. Необходимо отметить, что в качестве подходящих защитных групп и способов их удаления можно использовать защитные группы для каждого заместителя, которые широко используются в данной области техники, и известные методы, например, описанные в книге PROTECTIVE GROUPS in ORGANIC SYNTHESIS, THIRD EDITION, John Wiley & Sons, Inc.
Кроме того, при использовании аббревиатур для заместителей, реагентов и растворителей в тексте или в таблицах, они имеют следующие значения.
ДМФА: N,N-диметилформамид
ТГФ: тетрагидрофуран
Ph: фенил
ТФУК: трифторуксусная кислота
Метод синтеза (А)
Синтез соединения (А-2)
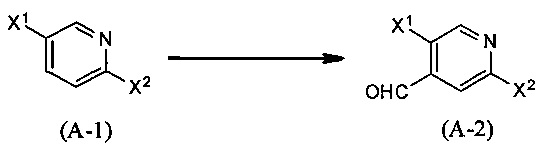
(В приведенных формулах X1 и X2 представляют собой уходящие группы). Уходящие группы, представленные X1 и X2, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данная реакция является методом синтеза соединения (А-2) посредством введения лития или натрия в положение 4 пиридинового цикла в соединении (А-1) с использованием основание, с последующим формилированием с помощью формилирующего агента. Основания включают диизопропиламин лития (LDA), полученный из диизопропиламина и н-бутиллития, и т.п. Формилирующие агенты включают N,N-диметилформамид (ДМФА), N-формилморфолин и т.п. Данную реакцию проводят путем взаимодействия соединения (А-1) с эквивалентным количеством или небольшим избытком основания в инертном растворителе при температуре от -78°С до 0°С, добавляя затем формилирующий агент в эквивалентном количестве или в избытке, и оставляя реакцию обычно на 0,5-5 часов. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими) например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, или смеси перечисленных растворителей и т.п.
Синтез соединения (А-4)
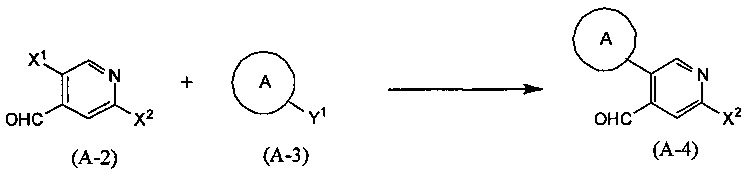
(В приведенных формулах X1 и X2 представляют собой уходящие группы, и Y1 представляет собой -В(ОН)2 или -B(OR7)OR8, где R7 и R8 идентичны или отличаются друг от друга и представляют собой C1-6 алкильные группы, или R7 и R8 объединены с образованием C1-6 алкиленовой группы.) Данная реакция является методом синтеза соединения (А-4) посредством сочетания соединений (А-2) и (А-3). Уходящие группы, представленные X1 и X2, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п.. Данную реакцию проводят, используя эквивалентные количества соединений (А-2) и (А-3) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основания и палладиевого катализатора при температуре между комнатной температурой кипения, обычно в течение 0,5-2 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими) например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, спирты, такие как метанол, этанол, 2-пропанол и бутанол, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), воду или смеси перечисленных растворителей, и т.п. Основания включают гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия, карбонат калия, карбонат цезия и трикалийфосфат, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или растворы, полученные разбавлением данных оснований водой и т.д., и т.п. В качестве палладиевого катализатора предпочтительными являются тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, палладия хлорид-1,1'-бис(дифенилфосфино)ферроцен и т.д.
Синтез соединения (А-5)

(В приведенных формулах X2 представляет собой уходящую группу.) Уходящие группы, представленные X2, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п.. Данная реакция представляет собой реакцию превращения формильной группы в циано-группу, и проводится посредством взаимодействия ароматического альдегидного производного, имеющего формулу (А-4), с гидроксиламином. В качестве гидроксиламина можно использовать его гидрохлорид; в этом случае, однако, предпочтительно добавлять подходящее основное вещество. Кроме того, можно ускорить данную реакцию добавлением 1,0-3,0 эквивалентов уксусного ангидрида, ацетилхлорида, трихлорацетилхлорида и т.п. Количество гидроксиламина или его солей, используемое в данной реакции, обычно составляет 1 или более эквивалентов, и предпочтительно 1,0-2,0 эквивалента. При использовании основного вещества, применяют 1,0-3,0 эквивалентов относительно соли гидроксиламина. В качестве основного вещества используют карбоксилат, такой как формиат натрия, формиат калия или ацетат натрия, карбонат, такой как карбонат калия, карбонат натрия или гидрокарбонат натрия, или основание, представляющее собой органический амин, такое как триэтиламин, пиридин или 4-аминопиридин. Реакцию проводят в инертном растворителе в присутствии основания при температуре между комнатной и температурой кипения, обычно в течение от 0,5 часа до 3 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. Растворители, используемые в данной реакции, включают такие растворители, как уксусная кислота, муравьиная кислота, толуол, бензол, пиридин, этилацетат, дихлорметан, 1,2-дихлорэтан, хлороформ, тетрахлорид углерода, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, 1,2-диэтоксиэтан, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), метанол, этанол и 2-пропанол.
Синтез соединения (А-7)
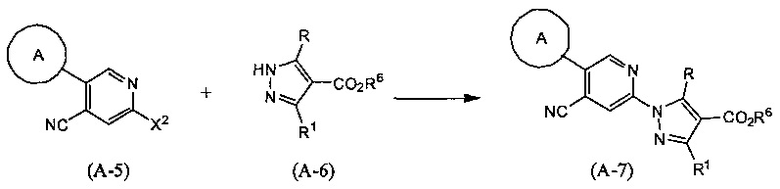
(В приведенных формулах R6 представляет собой защитную группу для карбоксила, и X2 представляет собой уходящую группу.) Уходящие группы, представленные X2, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данную реакцию проводят, применяя соединения (А-5) и (А-6) в эквивалентных количествах, или применяя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основного катализатора, при температуре между комнатной и температурой кипения, обычно в течение 0,5-3 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают, но не ограничены только ими, например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО) или смеси данных растворителей, и т.п. Основания включают гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия, карбонат калия, карбонат цезия, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или основание, представляющее собой органический амин, такое как триэтиламин, N-этил-N,N-диизопропиламин (DIPEA) или 1,8-диазабицикло[5,4,0)-7-ундецен (DBU), и т.п.
Синтез соединения (А-8)
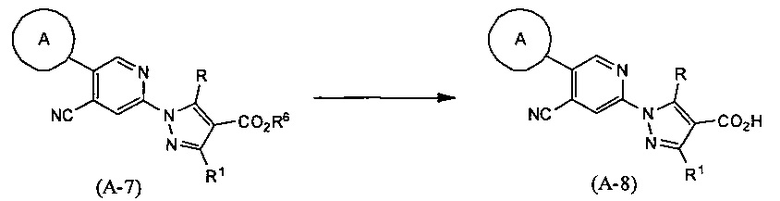
(В приведенных формулах R6 представляет собой защитную группу для карбоксила.) Данный метод синтеза представляет собой метод синтеза соединения (А-8) по настоящему изобретению путем снятия защитной группы R6 в соединении (А-7) с использованием кислоты или основания и т.д.
Данную реакцию проводят путем взаимодействия соединения (А-7) с эквивалентным количеством или избытком кислоты или основания в инертном растворителе, при температуре между комнатной и температурой кипения, обычно в течение 0,5-5 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими) например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, спирты, такие как метанол, этанол, 2-пропанол и бутанол, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), воду или смеси перечисленных растворителей, и т.п. Кислоты включают неорганические кислоты, такие как хлороводород, бромоводород, серная кислота, азотная кислота, фосфорная кислота или раствор данных кислот в воде или органических растворителях. Основания включают гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия, карбонат калия, карбонат цезия и трикалийфосфат, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или растворы, полученные разбавлением данных оснований водой и т.д., и т.п.
Соединение (А-7), например, можно синтезировать также согласно описанному ниже Методу синтеза (В).
Метод синтеза (В)
Синтез соединения (В-1)
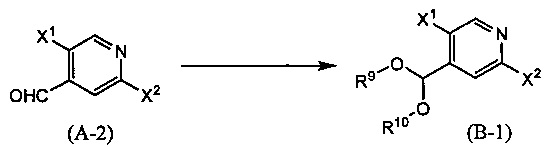
(В приведенных формулах Х1 и X2 представляют собой уходящие группы. R9 и R10 идентичны или отличаются друг от друга и представляют собой C1-6 алкильные группы, или R9 и R10 объединены с образованием C1-6 алкиленовой группы.) Уходящие группы, представленные X1 и X2, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данную реакцию проводят путем взаимодействия соединения (А-2) с эквивалентным количеством или избытком спирта или триалкилортоформиата в инертном растворителе в присутствии кислоты при температуре между комнатной и температурой кипения, обычно в течение 0,5-2 дней. В данном случае в качестве кислоты используют кислоту Брэнстеда, такую как хлороводород, трифторуксусная кислота, тозилсульфокислота или камфорасульфокислота, кислоту Льюиса, такую как триметилсилилтрифторсульфонат или трифторборан, и т.п. Используемые в данной реакции растворители включают, например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и тетрахлорид углерода, спирты, такие как метанол, этанол и 2-пропанол, или смеси перечисленных растворителей и т.п.
Синтез соединения (В-2)
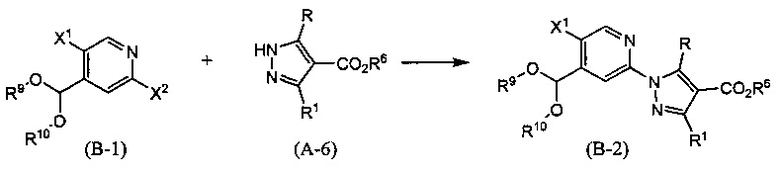
(В приведенных формулах R6 представляет собой защитную группу для карбоксила, и X1 и X2 представляют собой уходящие группы. R9 и R10 идентичны или отличаются друг от друга и представляют собой C1-6 алкильные группы, или R9 и R10 могут быть объединены с образованием C1-6 алкиленовой группы.) Уходящие группы, представленные X1 и X2, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данную реакцию проводят, применяя эквивалентные количества соединений (В-1) и (А-6) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основного катализатора при температуре между комнатной и температурой кипения, обычно в течение от 0,5 часа до 3 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими) например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО) или смеси перечисленных растворителей, и т.п. Основания включают гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или основание, представляющее собой органический амин, такое как триэтиламин, N-этил-N,N-диизопропиламин (DEPEA) или 1,8-диазабицикло(5,4,0)-7-ундецен (DBU), и т.п.
Синтез соединения (В-3)
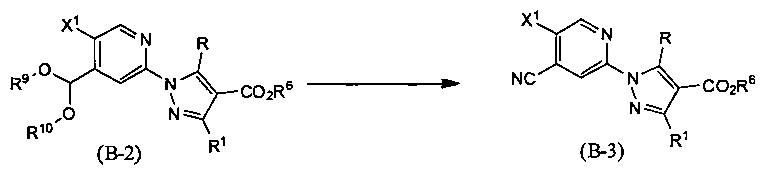
(В приведенных формулах R6 представляет собой защитную группу для карбоксила, и X1 представляет собой уходящие группы. R9 и R10 идентичны или отличаются друг от друга и представляют собой С1-6 алкильные группы, или R9 и R10 могут быть объединены с образованием С1-6 алкиленовой группы.) Данный метод синтеза представляет собой метод синтеза соединения (В-3) цианированием соединения (В-2). Уходящая группа, представленная X1, включает атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. В данной реакции цианирование осуществляют превращением ароматического диалкоксиацетального производного, имеющего формулу (В-2), в альдегидное производное посредством реакции снятия защитной группы и последующим взаимодействием с гидроксиламином. Данная реакция представляет собой реакцию превращения формильной группы в циано-группу и проводится путем взаимодействия ароматического альдегидного производного, имеющего формулу (А-4), с гидроксиламином. В качестве гидроксиламина можно использовать соли, такие как гидрохлорид; в данном случае, однако, предпочтительно добавлять подходящее основное вещество. Кроме того, можно ускорить данную реакцию добавлением 1,0-3,0 эквивалентов уксусного ангидрида, ацетилхлорида, трихлорацетилхлорида и т.п. Используемое в данной реакции количество гидроксиламина или его солей обычно составляет 1 или более эквивалентов, и предпочтительно 1,0-2,0 эквивалента. При использовании основного вещества применяют 1,0-3,0 его эквивалентов относительно соли гидроксиламина. В качестве основного вещества используют карбоксилат, такой как формиат натрия, формиат калия или ацетат натрия, карбонат, такой как карбонат калия, карбонат натрия или гидрокарбонат натрия, или соль органического амина, такого как триэтиламин, пиридин или 4-аминопиридин. Данную реакцию проводят в инертном растворителе в присутствии основания при температуре между комнатной и температурой кипения, обычно в течение от 0,5 часа до 3 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. Растворители, используемые в данной реакции, включают такие растворители, как уксусная кислота, муравьиная кислота, толуол, бензол, пиридин, этилацетат, дихлорметан, 1,2-дихлорэтан, хлороформ, тетрахлорид углерода, диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан, 1,2-диэтоксиэтан, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), метанол, этанол и 2-пропанол или смеси перечисленных растворителей.
Синтез соединения (А-7)
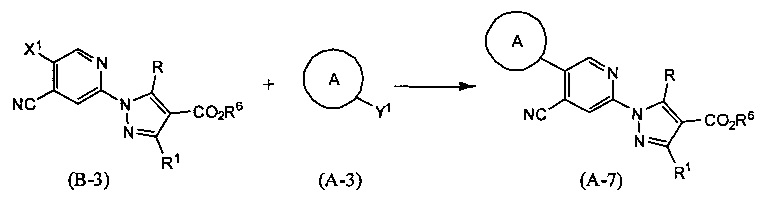
(В приведенных формулах R6 представляет собой защитную группу для карбоксила, и X1 представляет собой уходящую группу. Y1 представляет собой -В(ОН)2 или -B(OR7)OR8, где R7 и R8 идентичны или отличаются друг от друга и представляют собой C1-6 алкильные группы, или R7 и R8 могут быть объединены с образованием C1-6 алкиленовой группы.) Данная реакция представляет собой метод синтеза соединения (А-7) сочетанием соединений (В-3) и (А-3). Уходящие группы, представленные X1, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данную реакцию проводят, применяя эквивалентные количества соединений (В-3) и (А-3) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основания и палладиевого катализатора при температуре между комнатной и температурой кипения, обычно в течение 0,5-2 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, спирты, такие как метанол, этанол, 2-пропанол и бутанол, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), воду или смеси данных растворителей, и т.п. Основания включают гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия, карбонат калия, карбонат цезия и трикалийфосфат, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или растворы, полученные разбавлением данных оснований водой и т.д., и т.п. В качестве палладиевого катализатора предпочтителен тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, палладий хлорид-1,1'-бис(дифенилфосфино)ферроцен и т.д.
Метод синтеза (С)
Синтез соединения (С-2)
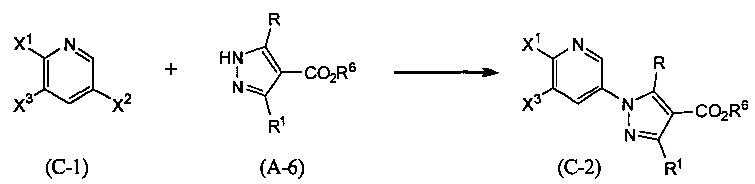
(В приведенных формулах R6 представляет собой защитную группу для карбоксила. X1, X2 и X3 представляют собой уходящие группы.) Уходящие группы, представленные X1, X2 и X3, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данную реакцию проводят, применяя эквивалентные количества соединений (С-1) и (А-6) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основания при температуре между комнатной и температурой кипения, обычно в течение от 0,5 часа до 3 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО) или смеси перечисленных растворителей, и т.п. Основания включают неорганические соли, такие как гидроксид натрия, гидроксид калия, гидроксид лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или основание, представляющее собой органический амин, такое как триэтиламин, N-этил-N,N-диизопропиламин (DIPEA) или 1,8-диазабицикло(5,4,0)-7-ундецен (DBU), и т.п.
Синтез соединения (С-3)
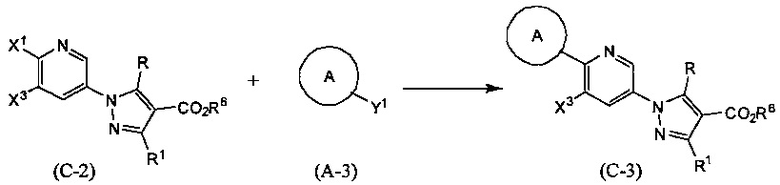
(В приведенных формулах R6 представляет собой защитную группу для карбоксила, и X1 и Х3 представляет собой уходящую группу. Y1 представляет собой -В(ОН)2 или -B(OR7)OR8, где R7 и R8 идентичны или отличаются друг от друга и представляют собой C1-6 алкильные группы, или R7 и R8 могут быть объединены с образованием C1-6 алкиленовой группы.) Данная реакция представляет собой метод синтеза соединения (С-3) сочетанием соединений (С-2) и (А-3). Уходящие группы, представленные X1 и X3, включают атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данную реакцию проводят, применяя эквивалентные количества соединений (С-2) и (А-3) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основания и палладиевого катализатора при температуре между комнатной и температурой кипения, обычно в течение 0,5-2 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, спирты, такие как метанол, этанол, 2-пропанол и бутанол, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), воду или смеси перечисленных растворителей, и т.п. Основания включают гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия, карбонат калия, карбонат цезия и трикалийфосфат, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или растворы, полученные разбавлением данных оснований водой и т.д., и т.п. В качестве палладиевого катализатора предпочтителен тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, палладия хлорид-1,1'-бис(дифенилфосфино)ферроцен и т.д.
Синтез соединения (С-4)

(В приведенных формулах R6 представляет собой защитную группу для карбоксила. X3 представляет собой уходящую группу.) Данный метод синтеза представляет собой метод синтеза соединения (С-4) цианированием соединения (С-3). Уходящая группа, представленная X3, включает атом галогена и т.п. Данная реакция представляет собой реакцию, в которой уходящая группа X3 заменяется циано-группой, и проводится путем взаимодействия соединения, имеющего формулу (С-3), с цианирующим реагентом. Данную реакцию проводят, применяя эквивалентные количества соединения (С-3) и цианирующего реагента или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе, опционально в присутствии основания и палладиевого или медного катализатора, при температуре между комнатной и температурой кипения, обычно в течение от 0,5 часа до 2 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В качестве цианирующего реагента используют такой цианирующий реагент, как цианид калия, цианид натрия, цианид меди или цианид цинка. Количество цианирующего реагента обычно составляет 1 или более эквивалентов, и предпочтительно 1,0-2,0 эквивалента. При использовании основного соединения, используют 1,0-3,0 его эквивалентов относительно соединения (С-3). В качестве основного соединения используют карбоксилат, такой как формиат натрия, формиат калия или ацетат натрия, карбонат, такой как карбонат калия, карбонат натрия или гидрокарбонат натрия, или соль органического амина, такого как триэтиламин, пиридин или 4-аминопиридин. Растворители, используемые в данной реакции, включают такие растворители, как уксусная кислота, муравьиная кислота, толуол, бензол, пиридин, этилацетат, дихлорметан, 1,2-дихлорэтан, хлороформ, тетрахлорид углерода, диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан, 1,2-диэтоксиэтан, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО) или смеси перечисленных растворителей. В качестве палладиевого катализатора предпочтителен тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, палладия хлорид-1,1'-бис(дифенилфосфино)ферроцен и т.д. В качестве медного катализатора предпочтителен иодид меди и т.п.
Синтез соединения (С-5)
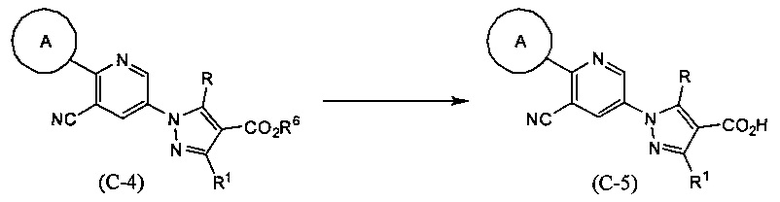
(В приведенных формулах R6 представляет собой защитную группу для карбоксила.) Данный метод синтеза представляет собой метод синтеза соединения (С-5) по настоящему изобретению путем снятия защитной группы R6 в соединении (С-4) с использованием кислоты или основания и т.д.
Данную реакцию проводят путем взаимодействия соединения (С-4) с эквивалентным количеством или избытком кислоты или основания в инертном растворителе при температуре между комнатной и температурой кипения, обычно в течение 0,5-5 дней. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, спирты, такие как метанол, этанол, 2-пропанол и бутанол, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), воду или смеси данных растворителей, и т.п. Кислоты включают неорганические кислоты, такие как хлороводород, бромоводород, серная кислота, азотная кислота, фосфорная кислота, или раствор перечисленных кислот в воде или органических растворителях. Основания включают гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия, карбонат калия, карбонат цезия и трикалийфосфат, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или растворы, полученные разбавлением данных оснований водой и т.д., и т.п.
Метод синтеза (D)
Синтез соединения (D-2)
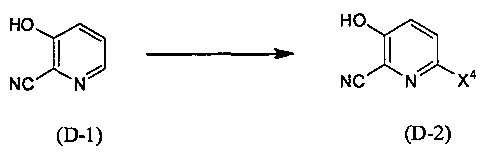
(В приведенных формулах X4 представляет собой уходящую группу.) Данный метод синтеза представляет собой метод синтеза соединения (D-2) галогенированием соединения (D-1). Уходящая группа, представленная X4, включает атомы йода, брома и хлора. Данную реакцию проводят путем взаимодействия соединения (D-1) с эквивалентным количеством или избытком галогенирующего средства в инертном растворителе, при температуре от 0°С до температуры кипения, обычно в течение от 0,5 часа до 3 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, этилацетат, воду или смеси данных растворителей. Галогенирующие средства включают хлор, бром, N-хлорсукцинимид, N-бромсукцинимид, N-йодсукцинимид, воду или смеси перечисленных растворителей, и т.п.
Синтез соединения (D-4)
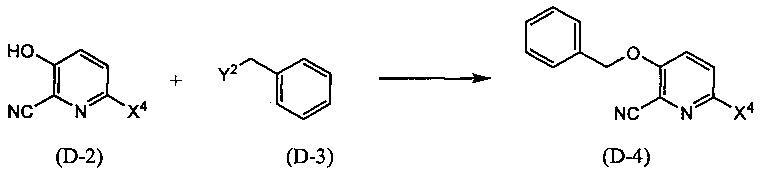
(В приведенных формулах X4 и Y2 представляют собой уходящие группы.) Данный метод синтеза представляет собой метод синтеза соединения (D-4) реакцией соединений (D-2) и (D-3). Уходящая группа, представленная X4, включает атом йода, атом брома, атом хлора, а уходящая группа, представленная Y2, включает атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данную реакцию проводят, применяя эквивалентные количества соединений (D-2) и (D-3) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основания при температуре между комнатной и температурой кипения, обычно в течение от 0,5 часов до 3 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан, и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), пиридин, этилацетат или смеси перечисленных растворителей и т.п. Основания включают неорганические соли, такие как гидрид натрия, гидроксид калия, гидроксид лития, карбонат натрия, карбонат калия, карбонат цезия, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или основание, представляющее собой органический амин, такое как триэтиламин, N-этил-N,N-диизопропиламин (DIPEA) или 1,8-диазабицикло(5,4,0)-7-ундецен (DBU), пиридин и т.п.
Синтез соединения (D-5)
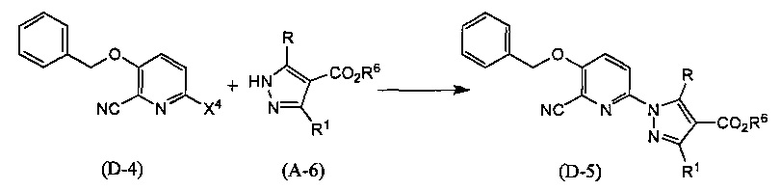
(В приведенных формулах R6 представляет собой защитную группу для карбоксила, и X4 представляет собой уходящую группу.) Данная реакция представляет собой метод синтеза соединения (D-5) сочетанием соединений (D-4) и (А-6). Уходящая группа, представленная X4, включает атом йода, атом брома и атом хлора. Данную реакцию проводят, применяя эквивалентные количества соединений (D-4) и (А-6) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основания, медного катализатора и лиганда при температуре между комнатной и температурой кипения, обычно в течение от 0,5 часов до 3 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), этилацетат или смеси перечисленных растворителей, и т.п. Основания включают неорганические соли, такие как гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид лития, карбонат натрия, карбонат калия, карбонат цезия, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или основание, представляющее собой органический амин, такое как триэтиламин, N-этил-N,N-диизопропиламин (DIPEA) или 1,8-диазабицикло(5,4,0)-7-ундецен (DBU), и т.п. Медные катализаторы включают хлорид меди, бромид меди, иодид меди, оксид меди и т.п. Лиганды включают пролин, транс-N,N'-диметилциклогексан-1,2-диамин, N,N-диметиламиноуксусную кислоту, 1,10-фенантролин и т.п.
Синтез соединения (D-6)
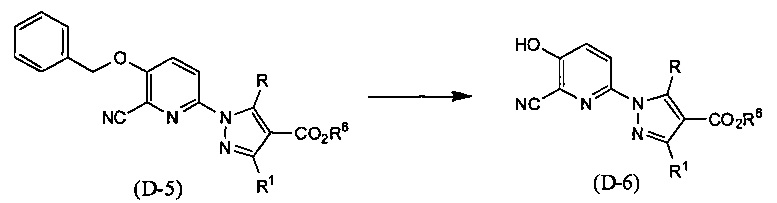
(В приведенных формулах R6 представляет собой защитную группу для карбоксила.) Данный метод синтеза представляет собой метод синтеза соединения (D-6) дебензилированием соединения (D-5). Данную реакцию проводят путем взаимодействия соединения (D-5) в инертном растворителе в присутствии палладиевого катализатора в атмосфере водорода, при температуре между комнатной и температурой кипения, обычно в течение 0,5-2 дней. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, спирты, такие как метанол, этанол, 2-пропанол и бутанол, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), этилацетат или смеси перечисленных растворителей, и т.п. В качестве палладиевого катализатора предпочтителен палладий на угле, гидроксид палладия, палладиевая чернь и т.д.
Синтез соединения (D-8)
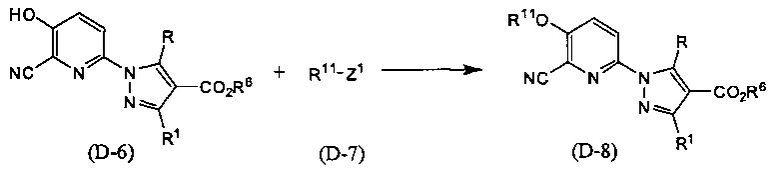
(В приведенных формулах R6 представляет собой защитную группу для карбоксила. R11 представляет собой незамещенную или замещенную С1-9 алкилсульфонильную группу или незамещенную или замещенную фенилсульфонильную группу. Z1 представляет собой уходящую группу.) Данный метод синтеза представляет собой метод синтеза соединения (D-8) сульфонил-эстерификацией фенольной гидроксильной группы соединения (D-6). Сульфонильные группы, представленные R11, включают метансульфонильные, трифторметансульфонильные, п-толуолсульфонильные группы и т.п. Уходящая группа, представленная Z1, включает атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу и т.п. Данную реакцию проводят, применяя эквивалентные количества соединений (D-6) и (D-7) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основания, при температуре от 0°С до температуры кипения, обычно в течение от 0,5 часа до 2 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), пиридин, этилацетат или смеси перечисленных растворителей, и т.п. Предпочтительно проводить данную реакцию в атмосфере инертного газа. Основания включают неорганические соли, такие как гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид лития, карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия, или основание, представляющее собой органический амин, такое как триэтиламин, N-этил-N,N-диизопропиламин (DIPEA) или 1,8-диазабицикло(5,4,0)-7-ундецен (DBU), пиридин и т.п.
Синтез соединения (D-9)
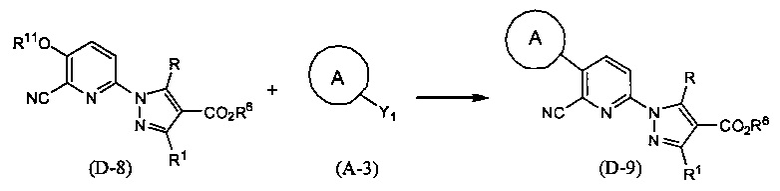
(В приведенных формулах R6 представляет собой защитную группу для карбоксила. R11 представляет собой незамещенную или замещенную С1-9 алкилсульфонильную группу или незамещенную или замещенную фенилсульфонильную группу. Y1 представляет собой -В(ОН)2 или -B(OR7)OR8, где R7 и R8 идентичны или отличаются друг от друга и представляют собой С1-6 алкильные группы, или R7 и R8 могут быть объединены с образованием С1-6 алкиленовой группы.) Данная реакция представляет собой метод синтеза соединения (D-9) сочетанием соединений (D-8) и (А-3). Сульфонильная группа, представленная R11, включает метансульфонильную группу, трифторметансульфонильную группу, п-толуолсульфонильную группу и т.п. Данную реакцию проводят, применяя эквивалентные количества соединений (D-8) и (А-3) или используя какое-то из них в избытке, и проводя реакцию в инертном растворителе в присутствии основания и палладиевого катализатора, при температуре между комнатной и температурой кипения, обычно в течение 0,5-2 дней. Предпочтительно, данную реакцию проводят в атмосфере инертного газа, такого как азот. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, спирты, такие как метанол, этанол, 2-пропанол и бутанол, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), воду или смеси перечисленных растворителей, и т.п. Основания включают гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия, карбонат калия, карбонат цезия и фосфат калия, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или растворы, полученные разбавлением данных оснований водой и т.д., и т.п. В качестве палладиевого катализатора предпочтителен тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, палладия хлорид-1,1'-бис(дифенилфосфино)ферроцен и т.д.
Синтез соединения (D-10)
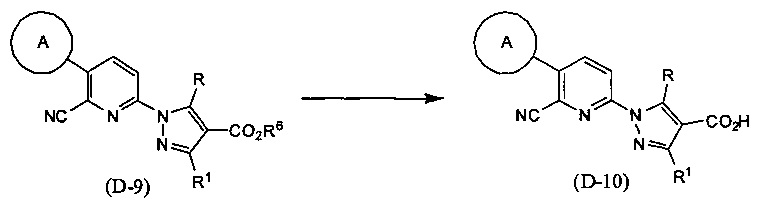
(В приведенных формулах R6 представляет собой защитную группу для карбоксила.) Данный метод синтеза представляет собой метод синтеза соединения (D-10) по настоящему изобретению путем снятия защитной группы R6 в соединении (D-9) с использованием кислоты или основания и т.д. Данную реакцию проводят путем взаимодействия соединения (D-9) с эквивалентным количеством или избытком кислоты или основания в инертном растворителе при температуре между комнатной и температурой кипения, обычно в течение 0,5-5 дней. В данном случае растворители включают (хотя и не ограничены конкретно только ими), например, ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан и 1,2-диэтоксиэтан, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, спирты, такие как метанол, этанол, 2-пропанол и бутанол, N,N-диметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид (ДМСО), воду или смеси перечисленных растворителей, и т.п. Кислоты включают неорганические кислоты, такие как хлороводород, бромоводород, серная кислота, азотная кислота, фосфорная кислота, или раствор перечисленных кислот в воде или органических растворителях. Основания включают гидроксид натрия, гидроксид калия, гидроксид лития, неорганические соли, такие как карбонат натрия и карбонат калия, алкоксиды металлов, такие как этоксид натрия и метоксид натрия, или растворы, полученные разбавлением данных оснований водой и т.д., и т.п.
Далее по тексту, соли, описанные в качестве предпочтительных соединений и их фармацевтически приемлемых солей, среди соединений, имеющих формулу (I), включают (хотя не ограничены конкретно только ими, при условии, что соли являются фармацевтически приемлемыми), например, соли неорганических кислот, таких как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и угольная кислота; соли органических кислот, таких как малеиновая кислота, фумаровая кислота, лимонная кислота, яблочная кислота, винная кислота, молочная кислота, янтарная кислота, бензойная кислота, щавелевая кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, трифторуксусная кислота и муравьиная кислота; соли аминокислот, таких как глицин, лизин, аргинин, гистидин, орнитин, глутаминовая кислота и аспарагиновая кислота; соли щелочных металлов, таких как натрий, калий и литий; соли щелочноземельных металлов, таких как кальций и магний; соли таких металлов, как алюминий, цинк и железо, соли с органическими ониевыми ионами, такими как тетраметиламмоний, холин и т.д.; и соли с органическими основаниями, такими как аммиак, пропандиамин, пирролидин, пиперидин, пиридин, этаноламин, N,N-диметилэтаноламин, 4-гидроксипиперидин, трет-октиламин, дибензиламин, морфолин, глюкозамин, фенилглицил-алкиловый эфир, этилендиамин, N-метилглюкамин, гуанидин, диэтиламин, триэтиламин, дициклогексиламин, N,N'-дибензилэтилендиамин, хлорпрокаин, прокаин, диэтаноламин, N-бензилфениламин, пиперазин и трис(гидроксиметил)аминометан.
Кроме того, соединения, имеющие формулу (I), и их соли включают различные гидраты и сольваты.
Перечисленные выше различные фармацевтически приемлемые соли соединений, имеющих формулу (I, можно подходящим образом получать, основываясь на общих знаниях в данной области техники.
Соединения по настоящему изобретению также включают стереоизомеры, рацематы и все возможные оптически активные формы соединений, имеющих формулу (I).
Соединения, имеющие формулу (I) по настоящему изобретению, и их фармацевтически приемлемые соли обладают особенно высокой ингибирующей активностью в отношении ксантиноксидазы. Ввиду их высокой ингибирующей активности в отношении ксантиноксидазы, соединения, имеющие формулу (I) по настоящему изобретению, и их фармацевтически приемлемые соли могут применяться в качестве ингибиторов ксантиноксидазы.
Соединения, имеющие формулу (I) по настоящему изобретению, и их фармацевтически приемлемые соли можно использовать в качестве лекарственных средств для лечения или профилактики заболеваний, связанных с ксантиноксидазой, таких как подагра, гиперурикемия, синдром лизиса опухоли, уролит, гипертония, дислипидемия, диабет, сердечно-сосудистые заболевания, такие как артериосклероз или сердечная недостаточность, почечные заболевания, такие как диабетическая нефропатия, заболевания органов дыхания, такие как хроническое обструктивное заболевание легких, воспалительные заболевания кишечника или аутоиммунные заболевания, для которых они могут применяться клинически в качестве ингибиторов ксантиноксидазы.
Соединения, имеющие формулу (I), и их фармацевтически приемлемые соли можно вводить в состав фармацевтической композиции вместе с фармацевтически приемлемым носителем и/или растворителем. Фармацевтическая композиция может иметь вид различных дозированных форм для перорального или парентерального введения. Парентеральное введение включает, например, внутривенное, подкожное, внутримышечное, чрезкожное или ректальное введение.
Препараты, содержащие одно или более соединений, имеющих формулу (I) по настоящему изобретению, или их солей в качестве действующего вещества, готовят с использованием носителей, вспомогательных веществ и других добавок, которые обычно используются в производстве лекарств. Носители и вспомогательные вещества для лекарственного препарата могут быть твердыми или жидкими и включают, например, лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, аравийскую камедь, оливковое масло, кунжутное масло, масло какао, этиленгликоль и т.д., и другие обычно применяемые компоненты. Введение можно осуществлять перорально в виде таблеток, пилюль, капсул, гранул, порошков, жидких готовых форм и т.д., или парентерально посредством инъекций, таких как внутривенные и внутримышечные инъекции, суппозиториев, готовых форм для чрезкожного введения и т.д.
В целом, можно вводить взрослому человеку дозировку от 0,01 до 1000 мг соединения, имеющего формулу (I) по настоящему изобретению, или его фармацевтически приемлемой соли, в сутки, однократно или разделив на несколько приемов, хотя дозировка варьируется в зависимости от типа заболевания, способа введения, симптомов, возраста, пола и массы тела пациента, и т.д. Однако, поскольку дозировка варьируется в зависимости от разных условий, бывают случаи, когда достаточно количество ниже вышеуказанной дозировки, и другие случаи, когда требуется превышение вышеуказанного диапазона дозирования.
Примеры
Настоящее изобретение будет далее описано на конкретных примерах; однако оно не ограничивается только данными примерами.
Структуры выделенных новых соединений подтверждали методами 1Н-ЯМР и/или масс-спектрометрии с использованием одноквадрупольного прибора с электрораспылением, или другими подходящими способами анализа.
В случае соединений, для которых регистрировали 1H-ЯМР спектры (400 МГц, ДМСО-d6 или CDCl3), приведены значения химических сдвигов (δ: м.д.) и констант спин-спинового взаимодействия (J: Гц). В случае результатов масс-спектрометрии, приведены значения М++Н, т.е. полученная величина, представляющая собой значение молекулярной массы соединения (М), к которой добавляется протон (H+). Необходимо отметить, что перечисленные далее сокращения имеют следующие значения, соответственно:
с = синглет, д = дублет, т = триплет, кв = квартет, ушир. с = уширенный синглет, м = мультиплет.
Для соединений, синтезированных методами из описанных далее примеров, проводили дальнейший анализ методом высокоэффективной жидкостной хроматографии (ВЭЖХ) и масс-спектрометрии с использованием времяпролетного масс-спектрометра (TOF-MS), оснащенного источником электрораспыления ионов.
Время удерживания (в минутах) соединения в ВЭЖХ анализе при использовании описанных ниже условий анализа, приведено как ВЭЖХ время удерживания.
Условия измерения для ВЭЖХ:
Прибор: Hewlett-Packard 1100HPLC
Колонка: Imtakt Cadenza CD-C18 100 мм × 4,6 мм 3 мкм
УФ: детектор с фотодиодной матрицей (254 нм)
Температура колонки: 40 градусов Цельсия
Условия градиента:
Растворитель: А: Н2О/ацетонитрил = 95/5
0,05% ТФУК (трифторуксусная кислота)
В: Н2О/ацетонитрил = 5/95
0,05% ТФУК (трифторуксусная кислота)
Скорость потока: 1,0 мл/мин
Градиент:
Для результатов масс-спектрометрии, вместе со значением "М++Н", полученном с использованием описанного ниже приборе и условий анализа (Наблюдаемая масса: т.е. наблюдаемое значение молекулярной массы соединения (М) с добавлением протона (Н+)), и рассчитанным значением "М++Н" (Рассчитанная масса), приведена также брутто-формула (Формула), рассчитанная по полученному значению "М++Н".
Условия анализа для TOF-MS
Масс-спектрометр: Shimadzu LCMS-IT-TOF
Жидкостной хроматограф: Prominence
Колонка: Phenomenex Synergi Hydro-RP 4,0 мм × 20 мм 2,5 мкм
УФ: детектор с фотодиодной матрицей (254 нм)
Скорость потока: 0,6 мл/мин
Температура колонки: 40 градусов Цельсия
Напряжение детектора: 1,63 кВ
Условия градиента:
Растворитель: А: Н2О/ацетонитрил = 95/5
0,1% НСООН
В: Н2О/ацетонитрил = 5/95
0,1% НСООН
Скорость потока: 0,5 мл/мин
Градиент:
Справочный Пример
Синтез 5-бром-2-хлорпиридин-4-карбальдегида (соединение для справочного примера)
После охлаждения до -78°С раствора, полученного растворением 10,6 мл диизопропиламина в 100 мл ТГФ, медленно добавляли по каплям 22,7 мл н-бутиллития. После перемешивания реакционного раствора в течение 1 часа, медленно добавляли по каплям раствор, полученный растворением 9,7 г 5-бром-2-хлорпиридина в 50 мл ТГФ, и реакционный раствор перемешивали еще один час. Затем медленно добавляли по каплям 10 мл N,N-диметилформамида (ДМФА). После перемешивания полученного раствора в течение 1 часа при -78°С, добавляли 30 мл 2 М соляной кислоты, и температуру медленно повышали до комнатной температуры, с последующим перемешиванием в течение 30 минут при комнатной температуре. В реакционную смесь добавляли воду, затем экстрагировали смесь этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме. Добавляли к остатку 10 мл дихлорметана, очистку проводили обычным способом, получая 3,23 г 5-бром-2-хлорпиридин-4-карбальдегида. Кроме того, после упаривания фильтрата в вакууме, остаток очищали хроматографией на силикагеле (гексан : этилацетат = 9:1), получая 6,34 г 5-бром-2-хлорпиридин-4-карбальдегида.
1Н-ЯМР (400 МГц, CDCl3) δ (м.д.): 7,72 (1H, с), 8,68 (1Н, с), 10,30 (1H, с).
Пример 1
Синтез 1-(4-циано-5-фенилпиридин-2-ил)-1Н-пиразол-4-карбоновой кислоты (соединение №1) (метод синтеза (А))
(1) В суспензию, полученную добавлением 8,80 г 5-бром-2-хлорпиридин-4-карбальдегида, 5,36 г фенилбороновой кислоты и 11,06 г карбоната калия в 100 мл смеси растворителей 4-диоксан/вода = 4/1, добавляли 924 мг тетракис(трифенилфосфин)палладия, и полученную реакционную смесь нагревали при 80°С в течение 5 часов в атмосфере азота. В реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая 10,80 г 2-хлор-5-фенилпиридин-4-карбальдегида.
1Н-ЯМР (400 МГц, CDCl3) δ (м.д.): 7,3-7,42 (2Н, м), 7,50-7,60 (3Н, м), 7,81 (1H, д, J=0,6 Гц), 8,61 (1H, д, J=0,6 Гц), 9,99 (1H, с).
ESI/MS m/e: 218,0, 220,0 (М++Н, C12H8ClNO).
(2) В суспензию, полученную добавлением 10,80 г 2-хлор-5-фенилпиридин-4-карбальдегида, 5,56 г гидроксиламина моногидрохлорида и 5,44 г формиата натрия в 100 мл муравьиной кислоты, добавляли 12,2 г уксусного ангидрида, и полученную реакционную смесь нагревали при 100°С в течение 2 часов в атмосфере азота. Добавляли 100 мл воды и проводили очистку традиционным способом, получая 6,34 г 2-хлор-5-фенилпиридин-4-карбонитрила.
1Н-ЯМР (400 МГц, CDCl3) δ (м.д.): 7,27 (1H, с), 7,5-7,6 (5Н, м), 7,67 (1H, с), 8,63 (1Н, с).
ESI/MS m/e: 215,0, 217,0 (М++Н, C12H7ClN2).
(3) Реакционную смесь, полученную суспендированием 3,22 г 2-хлор-5-фенилпиридин-4-карбонитрила, 2,31 г этил 1Н-пиразол-4-карбоксилата и 3,11 г карбоната калия в 40 мл диметилсульфоксида, нагревали при 120°С в течение 2,5 часов в атмосфере азота. Добавляли 50 мл воды и проводили очистку традиционным способом, получая 3,97 г этил 1-(4-циано-5-фенилпиридин-2-ил)-1Н-пиразол-4-карбоксилата.
1Н-ЯМР (400 МГц, ДМСО d6) δ (м.д.): 1,31 (3Н, т, J=8,0 Гц), 4,28 (2Н, кв, J=8,0 Гц), 7,55-7,62 (3Н, м), 7,70-7,72 (2Н, м), 8,32 (1H, с), 8,43 (1H, с), 8,86 (1Н, с), 9,05 (1H, с).
ESI/MS m/e: 319,1 (M++Н, C18H14N4O2).
(4) В раствор, полученный растворением 3,97 г этил 1-(4-циано-5-фенилпиридин-2-ил)-1Н-пиразол-4-карбоксилата в 30 мл смеси растворителей тетрагидрофуран/метанол = 1/1, добавляли 30 мл 6 М соляной кислоты, и полученную реакционную смесь нагревали при 80°С в течение 48 часов. Проводили очистку традиционным способом, получая 3,71 г 1-(4-циано-5-фенилпиридин-2-ил)-1Н-пиразол-4-карбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО d6) δ (м.д.): 7,54-7,62 (3Н, м), 7,70-7,72 (2Н, м), 8,26 (1H, с), 8,41 (1Н, с), 8,85 (1Н, с), 8,98 (1H, с), 12,91 (1H, с).
ВЭЖХ время удерживания: 10,48 мин.
Наблюдаемая масса (М++Н): 291,0880
Рассчитанная масса (М++Н): 291,0877
Формула (М): C16H10N4O2
Примеры 2-70
Используя описанное выше соединение из справочного примера в качестве исходного вещества, синтезировали соединения №2-70 таким же способом, как описано в примере 1.


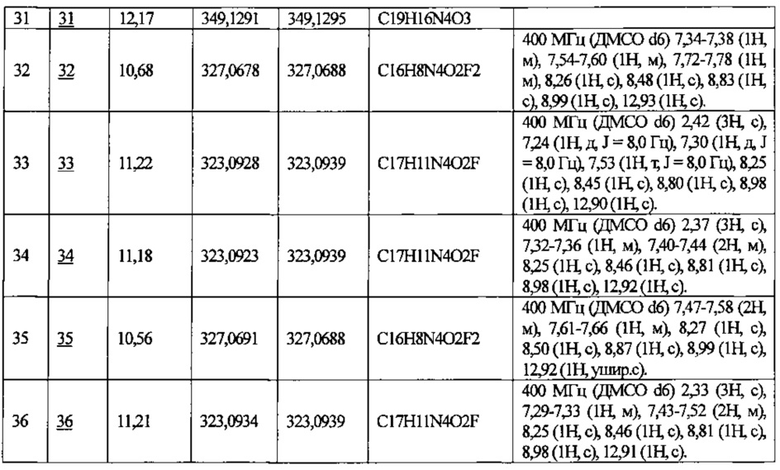
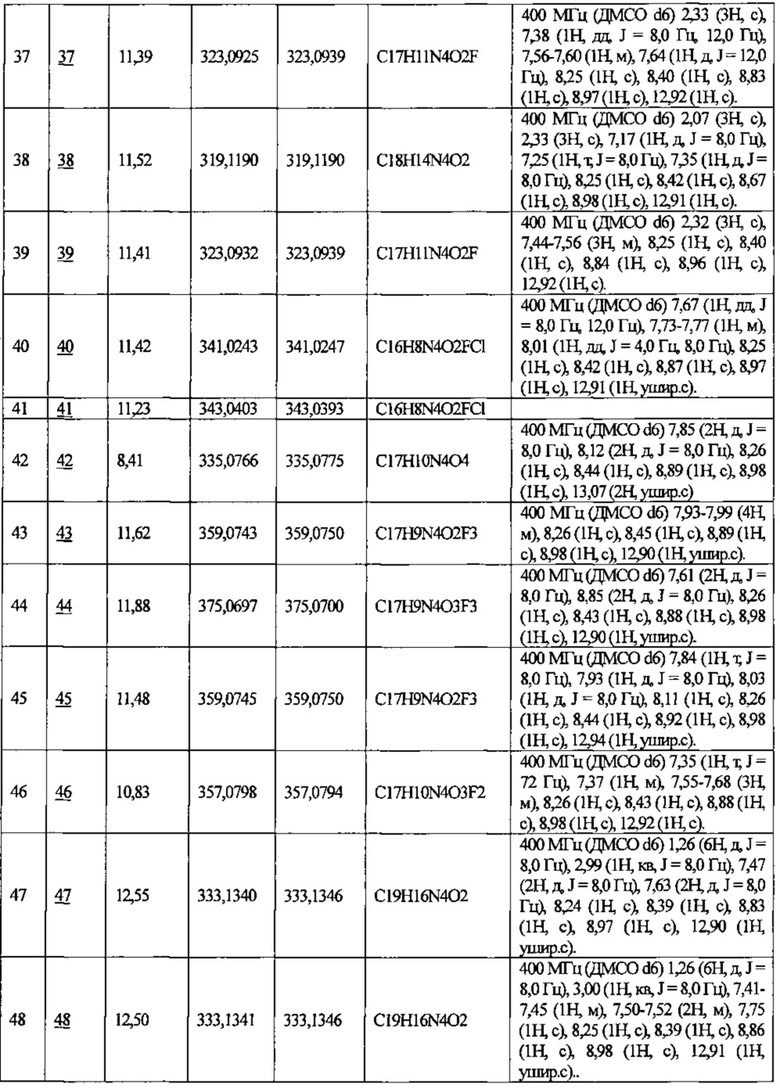
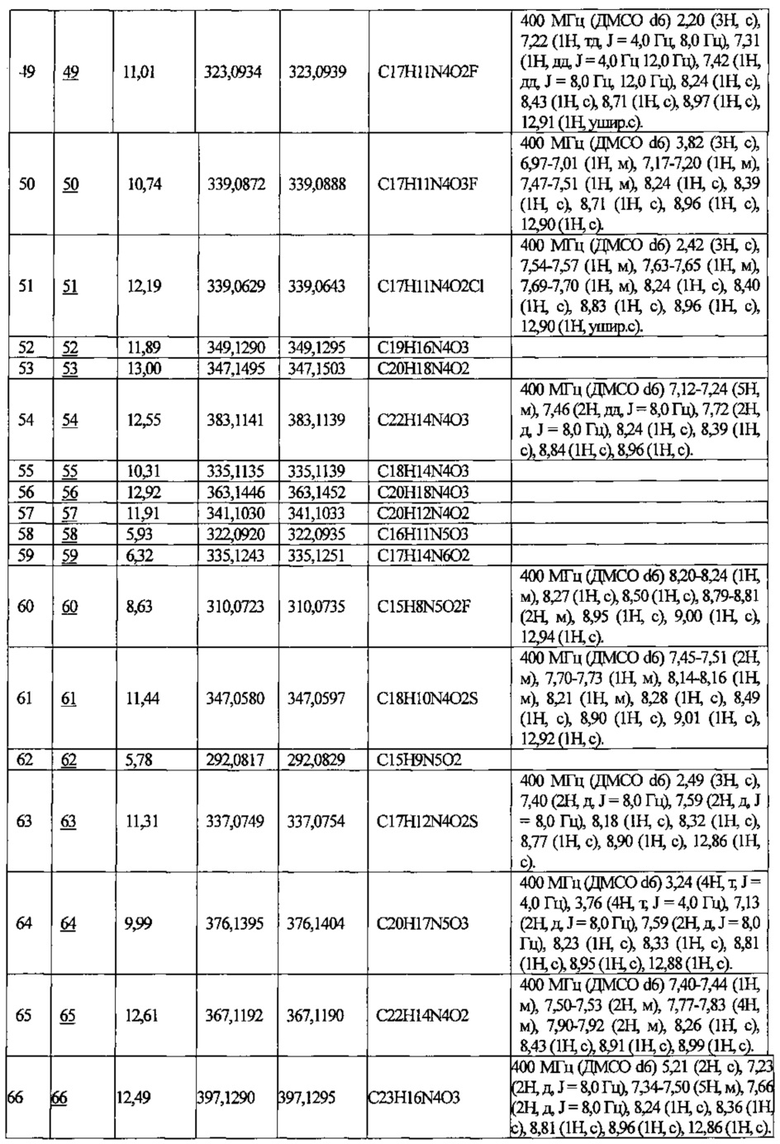
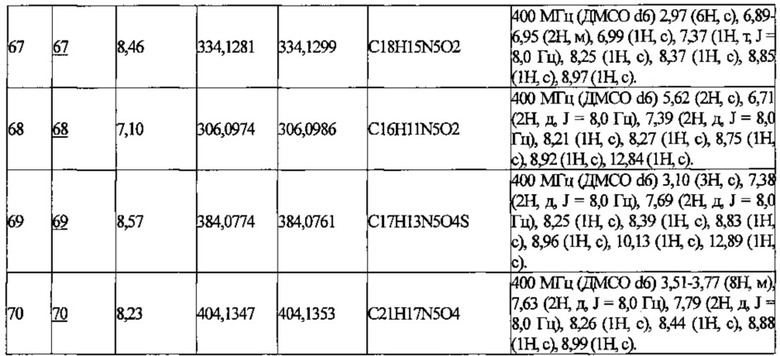
В приведенной выше таблице Пр. обозначает Пример, и № Соед. обозначает номер соединения, как и во всех последующих таблицах.
Пример 71
Синтез 1-[4-циано-5-(3-метилсульфонилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновой кислоты (соединение №71) (метод синтеза (В))
(1) Реакционную смесь, полученную суспендированием 5,51 г 5-бром-2-хлорпиридин-4-карбальдегида, 26,5 г триметил ортоформиата и 4,75 г моногидрата п-толуолсульфоновой кислоты в 50 мл метанола, нагревали при 70°С в течение 4 часов. В реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая 5,48 г 5-бром-2-хлор-4-(диметоксиметил)-пиридина.
1Н-ЯМР (400 МГц, CDCl3) δ (м.д.): 3,39 (6Н, с), 5,46 (1Н, с), 7,57 (1Н, с), 8,49 (1H, с).
(2) Реакционную смесь, полученную суспендированием 5,33 г 5-бром-2-хлор-4-(диметоксиметил)-пиридина, 2,33 г этил 1Н-пиразол-4-карбоксилата и 4,14 г карбоната калия в 50 мл диметилформамида, нагревали при 90°С в течение 7 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, в реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая неочищенный продукт - этил 1-(5-бром-4-(диметоксиметил)пиридин-2-ил)-1Н-пиразол-4-карбоксилат.
Смесь, полученную суспендированием полученного выше неочищенного продукта в 25 мл муравьиной кислоты, и последующим добавлением 2,78 г гидроксиламина моногидрохлорида, нагревали при 70°С в течение 30 минут в атмосфере азота. После подтверждения образования оксима, реакционную смесь, полученную добавлением 2,72 г формиата натрия и 10,2 г уксусного ангидрида к описанной выше смеси, нагревали при 110°С в течение 15 часов. После охлаждения реакционной смеси до комнатной температуры, добавляли 25 мл воды, затем промывали водой (100 мл), получая 2,26 г этил 1-(5-бром-4-цианопиридин-2-ил)-1Н-пиразол-4-карбоксилата.
1Н-ЯМР (400 МГц, CDCl3) δ (м.д.): 1,38 (3Н, т, J=8,0 Гц), 4,35 (2Н, кв, J=8,0 Гц), 8,14 (1H, с), 8,29 (1Н, с), 8,71 (1H, с), 8,97 (1H, с).
(3) Реакционную смесь, полученную суспендированием 80,3 мг этил 1-(5-бром-4-цианопиридин-2-ил)-1Н-пиразол-4-карбоксилата, 75,0 мг 3-(метилсульфонил)фенилбороновой кислоты, 10,2 мг палладия хлорид-1,1'-бис(дифенилфосфино)ферроцена и 106,1 мг трикалийфосфата в 0,8 мл смеси растворителей 1,4-диоксан/вода = 3/1, нагревали при 90°С в течение 15 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, добавляли 2 мл воды и 4 мл этилацетата, с последующим перемешиванием. Органическую фазу упаривали и сушили в вакууме, получая неочищенный продукт - этил 1-[4-циано-5-(3-метилсульфонилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоксилат.
Реакционную смесь, полученную растворением описанного выше неочищенного продукта в 0,8 мл 4 М раствора соляной кислоты в 1,4-диоксане и добавлением 0,2 мл 6 М соляной кислоты, нагревали при 100°С в течение 14 часов. Реакционную смесь охлаждали до комнатной температуры и затем упаривали, получая неочищенный продукт - 1-[4-циано-5-(3-метилсульфонилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновую кислоту. Полученный продукт очищали методом обращенно-фазной ВЭЖХ, получая 18,1 мг 1-[4-циано-5-(3-метилсульфонилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновой кислоты.
1Н-ЯМР (400 МГц, ДМСО d6) δ (м.д.): 3,30 (3Н, с), 7,89 (1H, дд, J=8,0 Гц, 8,0 Гц), 8,09 (1H, д, J=8,0 Гц), 8,11 (1H, д, J=8,0 Гц), 8,27 (2Н, с), 8,46 (1Н, с), 8,95 (1Н, с), 9,00 (1Н, с), 12,91 (1H, с).
ВЭЖХ время удерживания: 8,60 мин.
Наблюдаемая масса (М++Н): 369,0645
Рассчитанная масса (М++Н): 369,0652
Формула (М): C17H12N4O4S
Примеры 72-74
Используя описанное выше соединение из справочного примера в качестве исходного вещества, соединения №72-74 синтезировали таким же образом, как описано в примере 71.
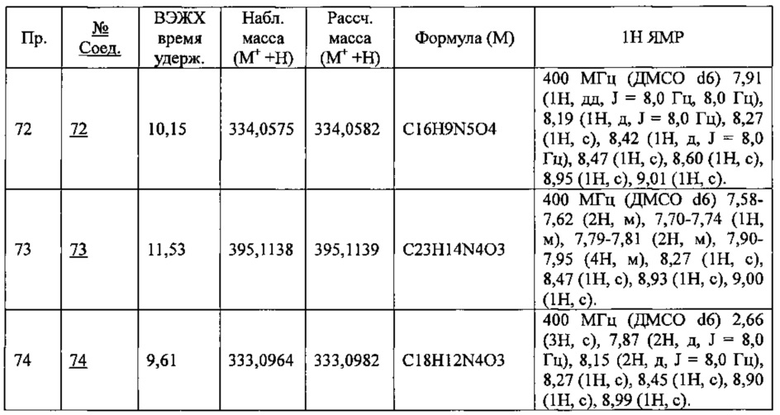
Пример 75
Синтез 1-(5-циано-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоновой кислоты (соединение №75) (метод синтеза (С))
(1) Реакционную смесь, полученную суспендированием 255 мг 2,3-дибром-5-фторпиридина, 168 мг этил 1H-пиразол-4-карбоксилата и 207 мг карбоната калия в 2 мл диметилсульфоксида, нагревали при 120°С в течение 2 часов в атмосфере азота. В реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая неочищенный продукт - этил 1-(5,6-дибромпиридин)-1Н-пиразол-4-карбоксилат. Полученный продукт очищали колоночной хроматографией (гексан/этилацетат = 9/1), получая 164 мг этил 1-(5,6-дибромпиридин)-1Н-пиразол-4-карбоксилата.
1Н-ЯМР (400 МГц, CDCl3) δ (м.д.): 1,39 (3Н, т, J=8,0 Гц), 4,36 (2Н, кв, J=8,0 Гц), 8,15 (1Н, с), 8,37 (1H, д, J=4,0 Гц), 8,43 (1H, с), 8,72 (1Н, д, J=4,0 Гц).
ESI/MS m/e: 373,9, 375,9, 377,9 (М++Н, С11Н10Вr2N3O2).
(2) Суспензию, полученную добавлением 82,0 мг этил 1-(5,6-дибромпиридин)-1H-пиразол-4-карбоксилата, 29,3 мг фенилбороновой кислоты и 60,5 мг карбоната калия, суспендировали в 1,5 мл смеси растворителей 1,4-диоксан/вода = 4/1, Реакционную смесь, полученную добавлением в суспензию 12,6 мг тетракис(трифенилфосфин)палладия, нагревали при 80°С в течение 7 часов в атмосфере азота. В реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая неочищенный продукт - этил 1-(5-бром-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоксилат. Полученный продукт очищали колоночной хроматографией (гексан/этилацетат = 3/1), получая 82,2 мг этил 1-(5-бром-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоксилата.
ESI/MS т/е: 372,0, 374,0 (М++Н, C17H15BrN3O2).
(3) Реакционную смесь, полученную суспендированием 82,2 мг этил 1-(5-бром-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоксилата и 31,3 мг цианида меди(I) в 1,5 мл диметилформамида, нагревали при 160°С в течение 6 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, нерастворимый осадок удаляли фильтрованием через целит, в фильтрат добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая неочищенный продукт - этил 1-(5-циано-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоксилат. Полученный продукт очищали колоночной хроматографией (гексан/этилацетат = 3/1), получая 54,2 мг этил 1-(5-циано-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоксилата.
ESI/MS m/e: 319,1 (М++Н, C18H15N4O2).
(4) Реакционную смесь, полученную суспендированием 54,2 мг этил 1-(5-циано-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоксилата в 1,0 мл смеси растворителей тетрагидрофуран/метанол = 1/1 и добавлением 0,2 мл 2 М водного раствора гидроксида натрия, нагревали при 50°С в течение 2 часов в атмосфере азота. В реакционную смесь добавляли 0,2 мл 2 М соляной кислоты, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая неочищенный продукт - 1-(5-циано-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоновую кислоту. Полученный продукт очищали методом обращенно-фазной ВЭЖХ, получая 6,35 мг 1-(5-циано-6-фенилпиридин-3-ил)-1Н-пиразол-4-карбоновой кислоты.
1Н-ЯМР (400 МГц, ДМСО d6) δ (м.д.): 7,58-7,59 (3Н, м), 7,89-7,91 (2Н, м), 8,22 (1Н, с), 8,97 (1H, д, J=4,0 Гц), 9,27 (1H, с), 9,50 (1H, д, J=4,0 Гц), 12,93 (1Н, ушир. с).
ВЭЖХ время удерживания: 9,76 мин.
Наблюдаемая масса (М++Н): 291,0875
Рассчитанная масса (М++Н): 291,0877
Формула (М): C16H10N4O2
Примеры 76-84
Используя описанный выше этил 1-(5,6-дибромпиридин-1Н-пиразол-4-карбоксилат в качестве исходного вещества, синтезировали соединения №76-84 таким же образом, как описано в примере 75.
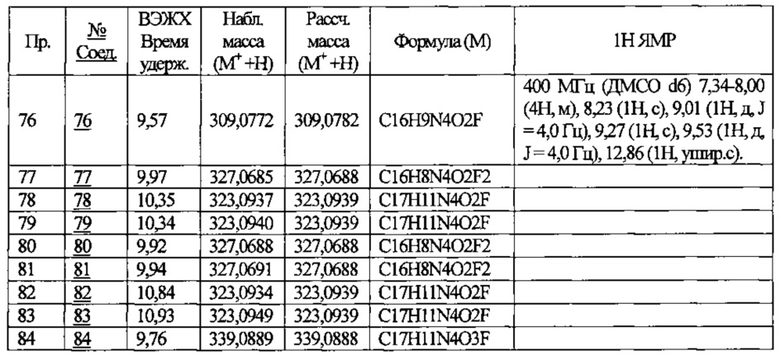
Пример 85
Синтез 1-(6-циано-5-фенилпиридин-2-ил)-1Н-пиразол-4-карбоновой кислоты (соединение №85) (метод синтеза (D))
(1) Суспензию, полученную добавлением 2,73 г 2-циано-3-гидроксипиридина в 60 мл смеси растворителей ацетонитрил/вода = 5/1, охлаждали до 0°С. Реакционную смесь, полученную медленным добавлением в суспензию 4,85 г N-бромсукцинимида, перемешивали в течение 2 часов в атмосфере азота. В реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая 5,39 г неочищенного продукта - 6-бром-2-циано-3-гидроксипиридина.
(2) Реакционную смесь, полученную суспендированием 5,39 г 6-бром-2-циано-3-гидроксипиридина и 4,71 г карбоната калия в 60 мл диметилформамида с последующим добавлением 4,66 г бензилбромида, нагревали при 60°С в течение 12 часов. После охлаждения реакционной смеси до комнатной температуры, добавляли 60 мл воды и проводили очистку традиционным способом, получая 4,73 г 3-бензилокси-6-бром-2-цианопиридина.
1Н-ЯМР (400 МГц, CDCl3) δ (м.д.): 5,26 (2Н, с), 7,24 (1Н, д, J=8,0 Гц), 7,36-7,44 (5Н, м), 7,57 (1Н, д, J=8,0 Гц).
(3) Реакционную смесь, полученную суспендированием 2,64 г 3-бензилокси-6-бром-2-цианопиридина, 1,44 г этил 1Н-пиразол-4-карбоксилата, 98 мг иодида меди и 2,29 г карбоната калия в 20 мл толуола, с последующим добавлением 236 мг транс-N,N'-диметилциклогексан-1,2-диамина, нагревали при 100°С в течение 12 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры, туда добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме. Полученный неочищенный продукт отделяли и очищали колоночной хроматографией на силикагеле, получая 1,30 г этил 1-(5-бензилокси-6-цианопиридин-2-ил)-1Н-пиразол-4-карбоксилата.
(4) Реакционную смесь, полученную суспендированием 1,39 г этил 1-(5-бензилокси-6-цианопиридин-2-ил)-1Н-пиразол-4-карбоксилата в 30 мл смеси растворителей тетрагидрофуран/этанол = 1/1, с последующим добавлением 409 мг палладия на угле (10% вес.), перемешивали при комнатной температуре в течение 14 часов в атмосфере водорода. Реакционную смесь фильтровали, и фильтрат упаривали в вакууме, получая 1,02 г этил 1-(6-циано-5-гидроксипиридин-2-ил)-1Н-пиразол-4-карбоксилата.
(5) В смесь, полученную суспендированием 46 мг этил 1-(6-циано-5-гидроксипиридин-2-ил)-1Н-пиразол-4-карбоксилата в 1 мл дихлорметана, добавляли 35 мг N,N-диизопропилэтиламина, с последующим охлаждением до 0°С. Реакционную смесь, полученную добавлением 76 мг трифторметансульфонового ангидрида в полученную суспензию, перемешивали при комнатной температуре в течение 4 часов в атмосфере азота. В реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме. Полученный неочищенный продукт отделяли и очищали колоночной хроматографией на силикагеле, получая 45,3 мг этил 1-[6-циано-5-(трифторметилсульфонилокси)пиридин-2-ил]-1Н-пиразол-2-карбоксилата.
1H-ЯМР (400 МГц, CDCl3) δ (м.д.): 1,40 (3Н, т, J=8,0 Гц), 4,37 (2Н, кв, J=8,0 Гц), 8,00 (1Н, д, J=8,0 Гц), 8,15 (1H, с), 8,39 (1Н, д, J=8,0 Гц), 8,98 (1H, с).
(6) Реакционную смесь, полученную суспендированием 46,8 мг этил 1-[6-циано-5-(трифторметилсульфонилокси)пиридин-2-ил]-1Н-пиразол-2-карбоксилата, 17,6 мг фенилбороновой кислоты и 7,8 мг палладия хлорид-1,1'-бис(дифенилфосфино)ферроцен-дихлорметанового комплекса в 1,0 мл 1,2-диметоксиэтана и последующим добавлением 0,12 мл 1 М водного раствора карбоната калия, нагревали при 80°С в течение 3 часов в атмосфере азота. В реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и упаривали в вакууме, получая неочищенный продукт - этил 1-(6-циано-5-фенилпиридин-2-ил)-1Н-пиразол-4-карбоксилат.
Реакционную смесь, полученную суспендированием вышеуказанного неочищенного продукта в 1,5 мл смеси растворителей тетрагидрофуран/метанол = 2/1 и последующим добавлением 0,24 мл 2 М водного раствора гидроксида натрия, нагревали при 50°С в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры, добавляли 0,24 мл 2М соляной кислоты, с последующим экстрагированием этилацетатом и концентрацией в вакууме. Полученный неочищенный продукт очищали методом обращенно-фазной ВЭЖХ, получая 18,8 мг 1-(6-циано-5-фенилпиридин-2-ил)-1Н-пиразол-4-карбоновой кислоты.
1Н-ЯМР (400 МГц, ДМСО d6) δ (м.д.): 7,56-7,61 (3Н, м), 7,70-7,71 (2Н, д, J=4,0 Гц), 8,25 (1Н, с), 8,30-8,37 (2Н, м), 8,97 (1Н, с), 12,95 (1H, с).
ВЭЖХ время удерживания: 10,40 мин.
Наблюдаемая масса (М++Н): 291,0874
Рассчитанная масса (М++Н): 291,0877
Формула (М): C16H10N4O2
Примеры 86-96
Используя в качестве исходного вещества этил 1-[6-циано-5-(трифторметалсульфонилокси)пиридин-2-ил]-1Н-пиразол-2-карбоксилат, полученный выше в п. (5) примера 85, соединения №86-96 синтезировали таким же образом, как описано в примере 85.
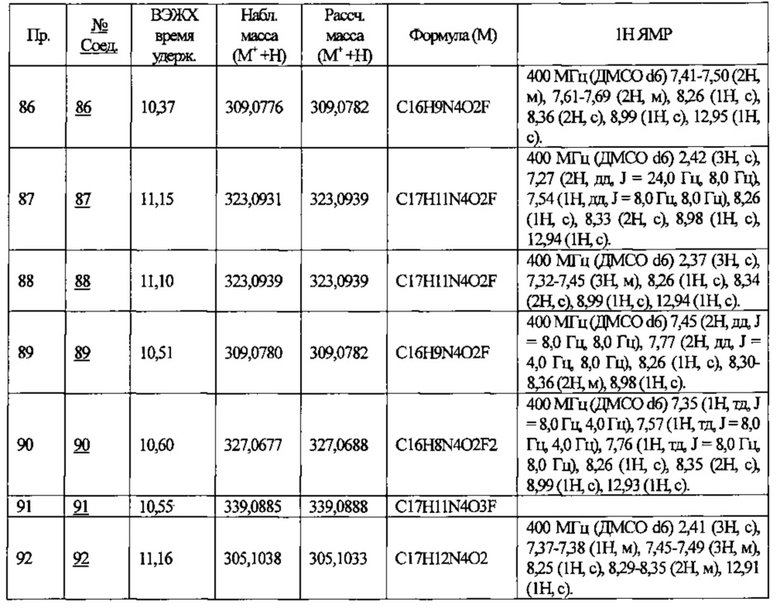
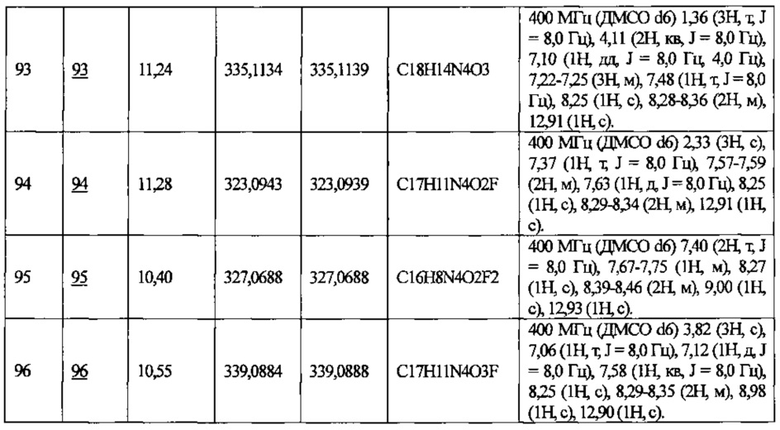
Примеры 97-107
Используя соединение из описанного выше справочного примера в качестве исходного вещества, соединения №97-107 синтезировали таким же образом, как описано в примере 1.
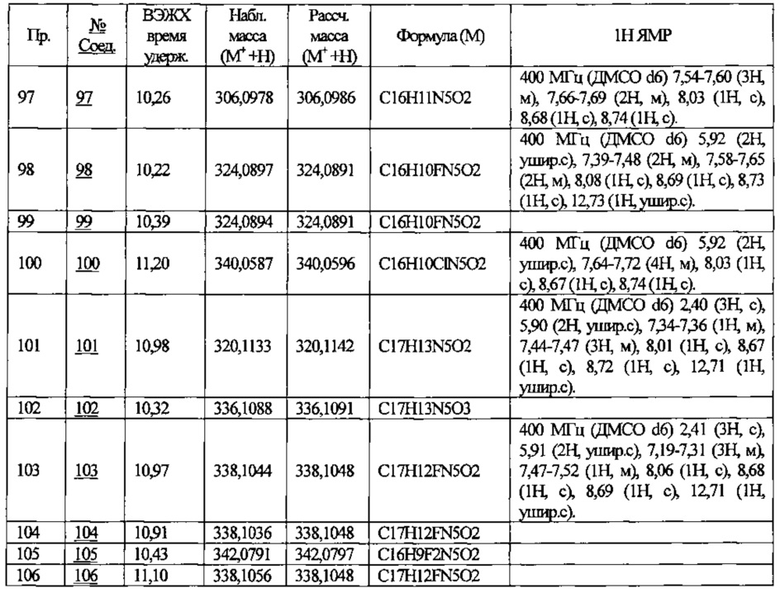

Пример 108
Ингибирующую активность в отношении ксантиноксидазы измеряли для соединений, синтезированных согласно приведенным выше примерам.
(1) Получение тестируемых соединений
Растворением тестируемого соединения в ДМСО (производства Sigma Со.) в концентрации 20 мМ получали раствор тестируемого соединения, и использовали его в требуемой концентрации во время теста.
(2) Метод оценки
Оценку ингибирующей активности в отношении ксантиноксидазы для соединений по настоящему изобретению проводили, частично модифицируя метод, описанный в литературе (Method Enzymatic Analysis, 1, 521-522, 1974). Оценка по настоящему изобретению основана на оценке ингибирующей активности в отношении ксантиноксидазы оксидазного типа. То есть, раствор ксантина (производства Sigma Co.), заранее приготовленный в концентрации 10 мМ с использованием 20 мМ раствора гидроксида натрия, доводили до концентрации 30 мкМ с помощью 100 мМ фосфатно-буферного раствора, и добавляли 75 мкл/лунка каждого раствора в 96-луночный планшет. Аликвоты (1,5 мкл/лунка) каждого тестируемого образца, который был разбавлен ДМСО до 100-кратной концентрации от финальной, добавляли в 96-луночный планшет, и после перемешивания измеряли поглощение при 290 нм посредством планшет-ридера SPECTRA MAX Plus 384 (производства Molecular Devices, LLC). Затем готовили раствор ксантиноксидазы оксидазного типа (получена из пахты, приобретена в Calbiochem Novabiochem Corp.) с концентрацией 30,6 мЕд/мл с помощью 100 мМ фосфатно-буферного раствора, и добавляли в каждый раствор в количестве 73,5 мкл/лунка. Сразу после перемешивания измеряли изменение в поглощении при 290 нм в течение 5 минут. Активность фермента при использовании ДМСО вместо раствора тестируемого соединения определяли как 100%, вычисляли уровень ингибирования для испытуемых соединений и определяли концентрацию, на 50% ингибирующую ксантиноксидазу оксидазного типа, путем построения кривой зависимости ответа от дозировки.
Результаты представлены в следующей таблице. Отметим, что символы (+, ++, +++) в таблице соответствуют величине ингибирующей активности, как показано ниже.
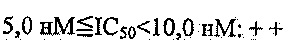
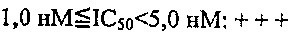
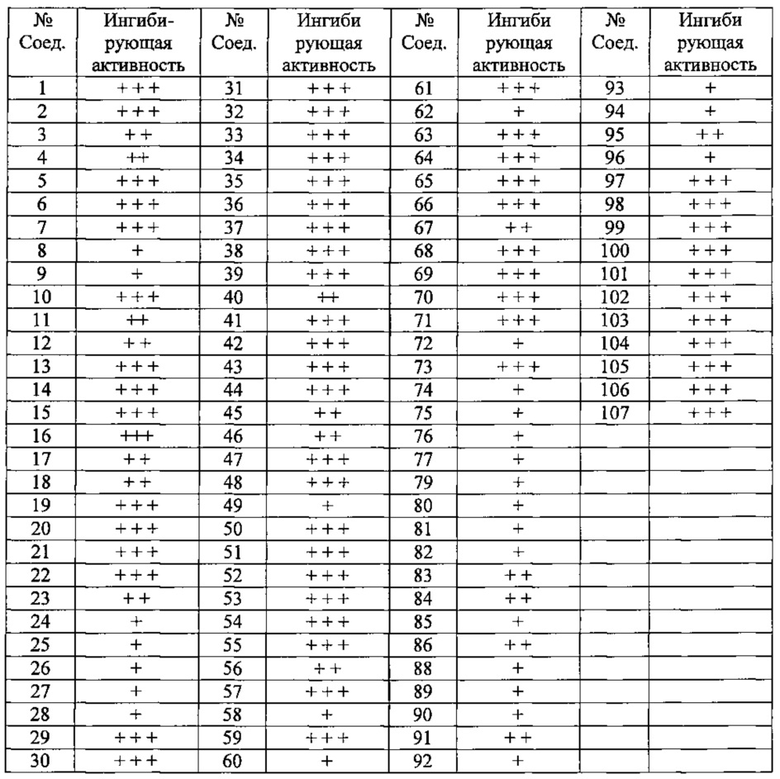
Пример 109
Гипоурикемический эффект (нормальные мыши)
Самцам мышей Crlj:СБ1-типа в возрасте 7-8 недель (Charles River Laboratories Japan, Inc.) вводили испытуемые соединения, суспендированные в 0,5%-ном растворе метилцеллюлозы, через желудочный зонд посредством иглы для принудительного кормления. Через 6, 16 и 24 часа после введения осуществляли забор крови из сердца, после чего отделяли сыворотку крови. Концентрации мочевой кислоты в крови измеряли уреазным методом на абсорбциометре (Hitachi Autoanalyzer 7180), используя набор для измерения концентрации мочевой кислоты (Autosera SUA: Sekisui Medical), и определяли процент гипоурикемического эффекта согласно следующему уравнению.
Процент гипоурикемического эффекта (%) = (концентрация мочевой кислоты у контрольного животного - концентрация мочевой кислоты у животного, которому вводили испытуемое соединение) × 100 / концентрация мочевой кислоты у контрольного животного.
В данном тесте был подтвержден отличный гипоурикемический эффект соединений по настоящему изобретению. Например, соединения №1, 5, 10, 14, 19, 21 и 33 показали процент гипоурикемического эффекта 70% или более через 6 часов после перорального введения в дозировке 1 мг/кг.
Описанные выше результаты показали, что соединения по настоящему изобретению обладают сильным гипоурикемическим эффектом.
Пример 110
Гипоурикемический эффект (нормальные крысы)
Самцам Sprague-Dawley крыс (Japan Charles River Со.) в возрасте 8-9 недель перорально вводили испытуемое соединение, суспендированное в 0,5% растворе метилцеллюлозы, через желудочный зонд посредством иглы для принудительного кормления. После забора крови из хвостовой вены через 6 часов и 24 часа после введения, отделяли плазму крови. Концентрацию мочевой кислоты в образце крови измеряли уреазным методом на абсорбциометре, а также используя набор для измерения концентрации мочевой кислоты (L type Wako UA F: Wako Pure Chemical Industries, Ltd.). Процент гипоурикемического эффекта определяли по следующей формуле:
Процент гипоурикемического эффекта (%) = (концентрация мочевой кислоты у контрольного животного - концентрация мочевой кислоты у животного, которому вводили испытуемое соединение) × 100 / концентрация мочевой кислоты у контрольного животного.
Соединение №1 продемонстрировало гипоурикемический эффект 70% или более при дозировке 1 мг/кг через 6 часов и 24 часа после введения. Также, соединения №97 и 98 продемонстрировали гипоурикемический эффект 50% или более при дозировке 10 мг/кг через 6 часов и 24 часа после введения. Описанные выше результаты показали, что соединения по настоящему изобретению обладают сильным и продолжительным гипоурикемическим эффектом.
Пример 111
Гипоурикемический эффект (обезьяны Cebus apella)
Обезьянам Cebus apella вводили испытуемые соединения, суспендированные в 0,5% растворе метилцеллюлозы, с помощью желудочного зонда через носовую полость с использованием одноразового катетера и шприца. Забор крови из подкожной вены осуществляли через 4 часа и 24 часа после введения, после чего отделяли плазму крови. Концентрацию мочевой кислоты в крови измеряли с помощью набора для определения концентрации мочевой кислоты (L type Wako UA F: Wako Pure Chemical Industries, Ltd.) уреазным методом на абсорбциометре, и процент гипоурикемического эффекта определяли по следующей формуле:
Процент гипоурикемического эффекта (%) = (концентрация мочевой кислоты у контрольного животного - концентрация мочевой кислоты у животного, которому вводили испытуемое соединение) × 100 / концентрация мочевой кислоты у контрольного животного.
Соединение №1 продемонстрировало гипоурикемический эффект 50% или более при дозировке 1 мг/кг через 4 часа и 24 часа после введения. Описанные выше результаты показали, что соединения по настоящему изобретению обладают сильным и продолжительным гипоурикемическим эффектом также у обезьян Cebus apella.
Пример 112
Гипоурикемический эффект (собаки породы бигль)
Был подтвержден гипоурикемический эффект соединения (I) у собак породы бигль. Собакам породы бигль перорально вводили испытуемое соединение, суспендированное в 0,5% растворе метилцеллюлозы, с помощью желудочного зонда (Kitayama Labes). Забор крови из головной вены осуществляли через 24 часа после введения, и отделяли плазму крови. Концентрацию мочевой кислоты в образце плазмы измеряли методом LC-MS/MS, и процент гипоурикемического эффекта определяли по следующей формуле:
Процент гипоурикемического эффекта (%) = (концентрация мочевой кислоты у контрольного животного - концентрация мочевой кислоты у животного, которому вводили испытуемое соединение) × 100 / концентрация мочевой кислоты у контрольного животного.
Соединение №1 продемонстрировало гипоурикемический эффект 50% или более при дозировке 3 мг/кг через 24 часа после введения.
Описанные выше результаты показали, что соединения по настоящему изобретению обладают сильным и продолжительным гипоурикемическим эффектом также у собак.
Учитывая вышеприведенные результаты, можно ожидать, что соединения по настоящему изобретению оказывают сильный гипоурикемический эффект даже при введении один раз в сутки или с более продолжительными интервалами. В клинике, при лечении или профилактике гиперурикемии и различных связанных с ней заболеваний, особенно хронических заболеваний, важно непрерывно понижать концентрацию мочевой кислоты, и можно ожидать, что настоящее изобретение оказывает отличный эффект при данных заболеваниях.
Промышленная применимость
Соединения, имеющие формулу (I) по настоящему изобретению, и их фармацевтически приемлемые соли обладают ингибирующей активностью в отношении ксантиноксидазы, и могут быть использованы в качестве терапевтических средств или профилактических средств для заболеваний, связанных с ксантиноксидазой, особенно подагры, гиперурикемии, синдрома лизиса опухоли, уролита, гипертонии, дислипидемии, диабета, сердечно-сосудистых заболеваний, таких как артериосклероз или сердечная недостаточность, почечных заболеваний, таких как диабетическая нефропатия, заболеваний органов дыхания, таких как хроническое обструктивное заболевание легких, воспалительных заболеваний кишечника, аутоиммунных заболеваний и т.д., при которых они клинически применимы в качестве ингибиторов ксантиноксидазы.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗОЛОВЫЕ ПРОИЗВОДНЫЕ БЕНЗОЛА | 2014 |
|
RU2641891C2 |
| ПРОИЗВОДНОЕ ПИРИДИНА | 2013 |
|
RU2640588C2 |
| ПИРАЗОЛЬНОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2012 |
|
RU2617678C2 |
| ИНСЕКТИЦИД, АКАРИЦИД И НЕМАТОЦИД, СОДЕРЖАЩИЕ В КАЧЕСТВЕ АКТИВНОГО КОМПОНЕНТА ПРОИЗВОДНОЕ 3-ТРИАЗОЛИЛФЕНИЛСУЛЬФИДА | 2005 |
|
RU2394819C2 |
| СОДЕРЖАЩЕЕ КОНДЕНСИРОВАННУЮ КОЛЬЦЕВУЮ СТРУКТУРУ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2009 |
|
RU2512547C2 |
| ПРОИЗВОДНОЕ ИЗОКСАЗОЛИНА И ГЕРБИЦИД, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2002 |
|
RU2286989C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРАЗОЛА | 2014 |
|
RU2682247C2 |
| ПРОИЗВОДНЫЕ 2-БЕНЗОИЛ-ИМИДАЗО[1,2-a]ПИРИДИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2008 |
|
RU2442785C1 |
| АНТАГОНИСТ КИСЛОТНОГО НАСОСА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ПАТОЛОГИЧЕСКИМ НАРУШЕНИЕМ МОТОРИКИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2010 |
|
RU2586276C2 |
| НОВОЕ ПРОИЗВОДНОЕ БЕНЗОАЗЕПИНА И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2642783C2 |
Изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли, а также к лекарственному средству или фармацевтической композиции, которая содержит данное соединение в качестве действующего вещества, обладающего ингибирующим эффектом в отношении ксантиноксидазы. Это соединение особенно хорошо подходит для лечения или профилактики заболеваний, связанных с ксантиноксидазой. К ним относятся такие заболевания, как подагра, гиперурикемия, синдром лизиса опухоли, камни в мочевых путях, гипертония, дислипидемия, диабет, сердечно-сосудистое заболевание, такое как сердечная недостаточность и артериосклероз, почечное заболевание, такое как диабетическая нефропатия т.п., заболевание дыхательных путей, такое как хроническое обструктивное заболевание легких и т.п., аутоиммунные заболевания, воспалительное заболевание кишечника и т.п. В приведенной формуле (I) А представляет собой фенильную группу, которая может быть незамещенной или замещена 1-3 группами Q, которые идентичны или отличаются друг от друга и выбраны из группы, состоящей из атома галогена, C1-6алкила, C3-7циклоалкила, С1-6галогеналкила, фенила, -O-R2 и -O-C1-6галогеналкила; X и Z представляют собой СН и Y представляет собой атом азот; R представляет собой атом водорода; R1 представляет собой атом водорода и R2 представляет собой атом водорода или C1-6алкильную группу. 8 н. и 2 з.п. ф-лы, 7 табл., 112 пр.
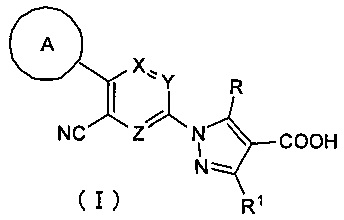
1. Соединение, имеющее формулу (I)
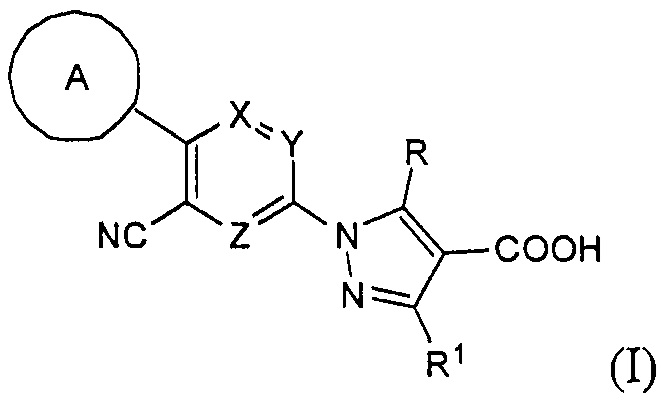
где А представляет собой фенильную группу, которая может быть незамещенной или замещена 1-3 группами Q, которые идентичны или отличаются друг от друга и выбраны из группы, состоящей из атома галогена, C1-6алкила, C3-7циклоалкила, С1-6галогеналкила, фенила, -O-R2 и -O-C1-6галогеналкила;
X и Z представляют собой СН и Y представляет собой атом азот;
R представляет собой атом водорода;
R1 представляет собой атом водорода; и
R2 представляет собой атом водорода или C1-6алкильную группу,
или его фармацевтически приемлемая соль.
2. Соединение п. 1 или его фармацевтически приемлемая соль, где А является незамещенным.
3. Соединение по п. 1 или 2 или его фармацевтически приемлемая соль, где А замещен 1-3 Q группами, которые являются одинаковыми или различными, выбранными из группы, состоящей из атома галогена, метильной группы и метокси-группы.
4. Соединение, выбранное из следующих соединений (1)-(46):
(1) 1-(4-циано-5-фенилпиридин-2-ил)-1Н-пиразол-4-карбоновая кислота;
(2) 1-[4-циано-5-(4-метоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(3) 1-[4-циано-5-(2-этоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(4) 1-[4-циано-5-(2-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(5) 1-[4-циано-5-(2-фторфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(6) 1-[4-циано-5-(2-хлорфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(7) 1-[4-циано-5-(2-метоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(8) 1-{4-циано-5-[2-(трифторметил)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(9) 1-{4-циано-5-[2-(трифторметокси)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(10) 1-[4-циано-5-(3-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(11) 1-[4-циано-5-(3-фторфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(12) 1-[4-циано-5-(3-хлорфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(13) 1-[4-циано-5-(3-метоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(14) 1-[4-циано-5-(4-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(15) 1-[4-циано-5-(4-хлорфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(16) 1-[4-циано-5-(4-гидроксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(17) 1-[4-циано-5-(2-этокси-6-фторфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(18) 1-[4-циано-5-(2-фтор-6-метоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(19) 1-[4-циано-5-(2-фтор-3-метоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(20) 1-[4-циано-5-(2,3-дифторфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(21) 1-[4-циано-5-(4-фторфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(22) 1-[4-циано-5-(3-этоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(23) 1-[4-циано-5-(3-пропоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(24) 1-[4-циано-5-(2,4-дифторфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(25) 1-[4-циано-5-(2-фтор-4-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(26) 1-[4-циано-5-(2-фтор-5-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(27) 1-[4-циано-5-(2,5-дифторфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(28) 1-[4-циано-5-(2-фтор-3-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(29) 1-[4-циано-5-(4-фтор-3-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(30) 1-[4-циано-5-(2,3-диметилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(31) 1-[4-циано-5-(3-фтор-4-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(32) 1-[4-циано-5-(3-хлор-4-фторфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(33) 1-{4-циано-5-[4-(трифторметил)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(34) 1-{4-циано-5-[4-(трифторметокси)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(35) 1-{4-циано-5-[3-(трифторметил)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(36) 1-{4-циано-5-[3-(дифторметокси)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(37) 1-{4-циано-5-[4-(пропан-2-ил)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(38) 1-{4-циано-5-[3-(пропан-2-ил)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(39) 1-[4-циано-5-(4-фтор-2-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(40) 1-[4-циано-5-(4-фтор-2-метоксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(41) 1-[4-циано-5-(4-хлор-3-метилфенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(42) 1-{4-циано-5-[(4-пропан-2-илокси)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(43) 1-[5-(4-трет-бутилфенил)-4-цианопиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(44) 1-[4-циано-5-(4-феноксифенил)пиридин-2-ил]-1Н-пиразол-4-карбоновая кислота;
(45) 1-{4-циано-5-[4-(метоксиметил)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота;
(46) 1-{4-циано-5-[3-(2-метилпропокси)фенил]пиридин-2-ил}-1Н-пиразол-4-карбоновая кислота,
или его фармацевтически приемлемая соль.
5. Фармацевтическая композиция, обладающая ксантиоксидазной ингибирующей активностью, содержащая соединение по любому из пп. 1-4 или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
6. Ингибитор ксантиноксидазы, содержащий соединение по любому из пп. 1-4 или его фармацевтически приемлемую соль в качестве действующего вещества.
7. Терапевтическое или профилактическое средство для подагры, гиперурикемии, синдрома лизиса опухоли, уролита, гипертонии, дислипидемии, диабета, сердечно-сосудистых заболеваний, таких как артериосклероз или сердечная недостаточность, почечных заболеваний, таких как диабетическая нефропатия, заболеваний органов дыхания, таких как хроническое обструктивное заболевание легких, воспалительных заболеваний кишечника или аутоиммунных заболеваний, содержащее соединение по любому из пп. 1-4 или его фармацевтически приемлемую соль в качестве действующего вещества.
8. Терапевтическое или профилактическое средство для подагры или гиперурикемии, содержащее соединение по любому из пп. 1-4 или его фармацевтически приемлемую соль в качестве действующего вещества.
9. Соединение, имеющее формулу (II)
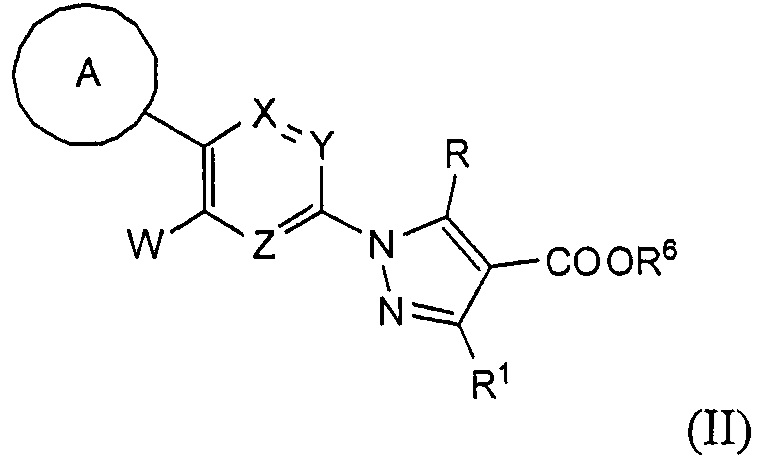
где А представляет собой фенильную группу, которая может быть незамещенной или замещена 1-3 группами Q, которые идентичны или отличаются друг от друга и выбраны из группы, состоящей из атома галогена, C1-6алкила, С3-7циклоалкила, С1-6галогеналкила, фенила, -O-R2 и -O-C1-6 галогеналкила;
X и Z представляют собой СН и Y представляет собой атом азота;
R представляет собой атом водорода;
R1 представляет собой атом водорода;
R2 представляет собой атом водорода или C1-6-алкильную группу;
R6 представляет собой защитную группу для карбоксильной группы; и
W представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу или циано-группу, причем защитная группа карбоксильной группы, выбрана из метильной, этильной, изопропильной, гептильной, трет-бутильной, метоксиметильной, метилтиометильной, метоксиэтоксиметильной, метоксиэтильной, бензильной и трет-бутилдиметилсилильно групп.
10. Соединение, имеющее формулу (III)
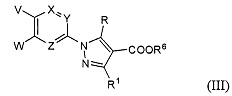
где X и Z представляют собой СН и Y представляет собой атом азота;
R представляет собой атом водорода;
R1 представляет собой атом водорода;
R6 представляет собой защитную группу для карбоксильной группы;
V представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу, гидроксильную группу или бензилокси-группу; и
W представляет собой атом галогена, метансульфонилокси-группу, п-толуолсульфонилокси-группу, трифторметансульфонилокси-группу или циано-группу, причем защитная группа карбоксильной группы выбрана из метильной, этильной, изопропильной, гептильной, трет-бутильной, метоксиметильной, метилтиометильной, метоксиэтоксиметильной, метоксиэтильной, бензильной и трет-бутилдиметилсилильной групп.
| EP 1932832 A1, 18.06.2008 | |||
| О.Н | |||
| ЗЕФИРОВ, Н.С.Зефиров, Об истории возникновения и развития концепции биоизостеризма, ВЕСТНИК МОСКОВСКОГО УНИВЕРСИТЕТА, сер | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ модулирования для радиотелефона | 1921 |
|
SU251A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| CAILLY, T, BEGTRUP, M., Regioselective functionalization of 2-(2'-fluorophenyl)-3- cyanopyridine and its cyclization to benzo[h] -1,6-naphthyridines, TETRAHEDRON, 2010, vol | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Пустотелый металлический винт | 1924 |
|
SU1299A1 |
| TUTONDA, M | |||
| ET AL., Diels-Alder reactions of the heterodiene system in 2(lH)-pyrazinones", TETRAHEDRON LETTERS, 1986, vol | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Котел для центрального водяного отопления | 1925 |
|
SU2509A1 |
| Запорное устройство для соединения изделий | 1985 |
|
SU1346544A1 |
| ПОЛИМОРФНЫЕ ФОРМЫ 2-(3-ЦИАН-4-ИЗОБУТИЛОКСИФЕНИЛ)-4-МЕТИЛ-5-ТИАЗОЛКАРБОНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1999 |
|
RU2198169C2 |
Авторы
Даты
2017-10-11—Публикация
2014-03-28—Подача