Предложение относится к области аналитической химии, а именно к способу изготовления пластинок для тонкослойной (планарной) хроматографии (ТСХ, ПТСХ), и может быть использовано для хирального распознавания стереоизомеров органических соединений в аналитической химии, фармакологии, медицине, биохимии и других областях.
В настоящее время известны способы получения сорбентов для колоночной высокоэффективной жидкостной хроматографии (ВЭЖХ) высокого давления и капиллярного электрофореза (КЭ), несущие различные хиральные селекторы [US 4919803, 1990; RU 2348455, 2006]. Однако методы ВЭЖХ и КЭ имеют ряд недостатков по сравнению с высокоэффективной ТСХ (ВЭТСХ) - требуется сложное оборудование, значительные усилия (давление) для проведения и оптимизации процесса разделения. В дополнение к вышесказанному только один образец можно исследовать за один процесс ВЭЖХ (КЭ)-анализа. Для рутинных исследований и, в особенности, в промышленных (например, фармацевтических) процессах необходим массовый скрининг аналитов, который реализуется методами ТСХ.
Известно, что перенос хиральных фаз из колоночной ВЭЖХ в планарную хроматографию не является простым процессом, т.к. химическая структура связующего для сорбента и подложки, необходимого для получения планарных пластин для ТСХ, оказывает существенное влияние ни разделение [US 54399792, 1995]. Любые взаимодействия между органическим (крахмал, полиакриламид, полиакрилат, поливиниловый спирт) [US 5439979, 1975; J. Chromatography, 448, 1988; Germany 1598382, 1965; Germany 1517929, 1966] или неорганическим (силиказоль, гипс) [US 3594217, 1971; RU 2037826, 1992; RU 2139533, 2004; RU 2175767, 2001] связующим и хроматографически активными группами аналита приводят к взаимодействиям между разделяемыми энантиомерами и хиральная сепарация может быть нарушена [Klaus К Unger 'Takings and Stationary Phases in Chromatographic Techniques" N 13: "Theory in Chromatographic Separation of Enantiomers" by William H. Pirkle and Thomas C. Pochapsky, 1990].
Кроме того, особенностью тонкослойной хроматографии является открытый слой сорбента. Поэтому влияние кислорода воздуха и изменение состава подвижной фазы за счет испарения вносит свои коррективы при переносе техники хроматографирования от ВЭЖХ к высокоэффективной ТСХ (ВЭТСХ).
Известны сорбенты для разделения оптически активных соединений на основе кремнеземов, модифицированных низкомолекулярными хиральными селекторами: производными хинина [SU 1429016, 1988]; производными фенилаланининола и тиооксамида [Mendeleev Commun. 2005, v. 15, №4, p.143]; производными нафталеинуксусной кислоты (напроксена) [US 4191803, 1990]; хитозаном и его производными [Вестник МГУ, стр.2, Химия, 2004, Т.45, №3, с.180]; высокомолекулярными хиральными селекторами: полианилином [US 62656115, 2001]; полиметилакриламидом [US 5439979, 1995].
Известно применение макроциклических антибиотиков как сепарационных агентов (например, ванкомицин, стрептомицин, рифамицин, 3,5-диметилфенил производные ванкомицина для энантиомерных разделений [US 5964999, 1999].
Известны хроматографические носители на основе силикагеля с химически привитыми гликопептидными антибиотиками, такими как ванкомицин, тейкопланин, тейкопланин агликон и ристомицин [US 6669842, 2003].
Известны промышленно выпускаемые хиральные тонкослойные пластины Macherey-Nagel (DUREN, Germany), состоящие из гидрофобного силикагеля (RP-18) с поливиниловым спиртом в качестве связующего, импрегнированного (2S,4R,2'RS)-N-(2'-гидрокси-додецил)-4-гидроксипролином и ионами меди (II) (пластины Chiralplate) [J. Chrom., V. 448, pp.11-30, 1988].
Недостатком указанных аналогов является то обстоятельство, что известные хроматографические сорбенты для ВЭЖХ, КХ и ТСХ, полученные разными способами физической и химической модификации поверхности слоев кремнеземных матриц известными хиральными агентами, обладают энантиоселективностью лишь к определенным классам веществ или обладают недостаточной энантиоселективностью, кроме того, процесс получения многостадиен и сложен. Существенным недостатком указанных аналогов является то обстоятельство, что в процессе модификации силикагелевых слоев пластин не учитывается влияние связующего в силикагелевом слое ТСХ-пластин.
Наиболее близким по технической сущности и достигаемому результату является способ получения сорбента для разделения оптических изомеров с химически привитым гликопептидным антибиотиком эремомицином [RU 2255802, 2005]. Хроматографическая хиральная фаза проявляет хорошую селективность в разделении широкого круга энантиомеров. Способ получения известного сорбента заключается в обработке силикагелевой матрицы 3-глицидооксипропилтриалкоксисиланом с последующим ковалентным связыванием эремомицина в водном или водно-органическом щелочном растворе при температуре не выше 40°С и высушиванием после отмывки при температуре 50°С. Эремомицин имеет следующую структурную формулу:
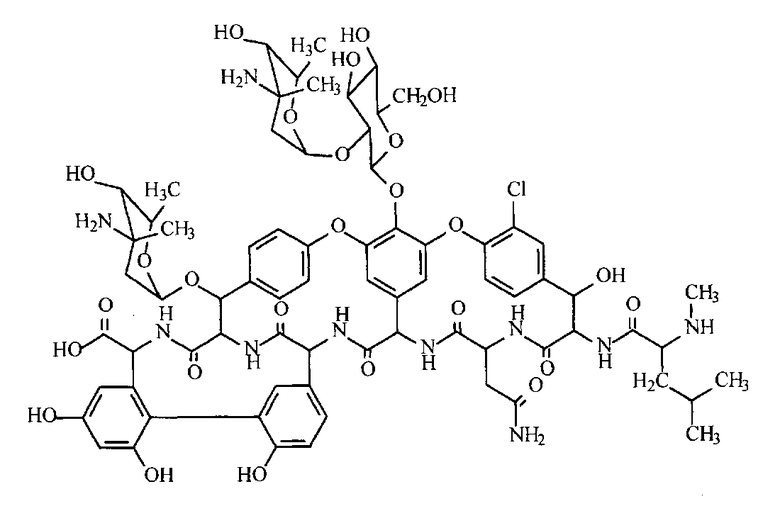
Существенным недостатком известного способа получения хроматографического кремнеземного слоя является сложный многостадийный процесс химической иммобилизации хирального селектора при повышенной температуре до 50°С, что может привести к частичному или полному разрушению молекулы антибиотика. Неконтролируемое изменение структуры молекулы хирального селектора при иммобилизации может привести к неконтролируемому изменению селективности или полной потере энантиоселективности сорбента. Данный способ модификации кремнеземов не учитывает влияние связующего в тонкослойной пластине.
Технической задачей и положительным результатом заявляемого технического решения является разработка низкотемпературного способа получения планарных хиральных пластинок на основе кремнеземов с различными органическими или неорганическими связующими для разделения и анализа оптических изомеров методами ТСХ.
Указанная задача и технический результат достигается в описываемом способе получения хиральных кремнеземных пластинок для тонкослойной хроматографии оптических изомеров за счет введения методом низкотемпературной иммобилизации в водной среде при комнатной температуре (не выше 25°С) в кремнеземный слой со связующим гликопептидного антибиотика эремомицина.
Способ получения хиральной планарной пластины для тонкослойной хроматографии оптических изомеров заключается в химической иммобилизации гликопептидного антибиотика эремомицина с помощью кремнийорганического модификатора на поверхность силикагеля, где вначале силикагель со связующим обрабатывают γ-глицидоксипропилтриалкоксисиланом, затем в щелочном водном растворе иммобилизуют в качестве селектора антибиотик эремомицин при температуре не выше 25°С, при этом в качестве связующего используют золь кремневой кислоты, а спейсер прививают к слою силикагеля и к связующему ковалентными связями.
В заявленном способе наилучшие результаты показал эремомицин, полученный с использованием штамма-продуцента Amicolatopsis orientalis subsp [RU 2110578, 1988].
Поставленная задача решается также описываемым способом получения хроматографического слоя хиральных планарных пластин, который включает химическую иммобилизацию гликопептидного антибиотика методом поверхностной сборки, сущность которой состоит в том, что на первой стадии иммобилизуют спейсер - кремнеорганический модификатор) γ-глицидоксипропилтриалкоксисилан на поверхность кремнезема со связующим, а затем, на второй стадии, прививается эремомицин в щелочном водном растворе при комнатной (20°С) температуре.
Предпочтительно в качестве связующего используют поливиниловый спирт с молекулярной массой 15 KDa или неорганический вариант связующего в виде устойчивого золя кремневой кислоты.
Излагаемая сущность данного способа раскрывается ниже на примерах его экспериментального осуществления.
Пример 1 описывает методику получения хиральных кремнеземных планарных пластин с неорганическим связующим (силиказоль) и иммобилизованным эремомицином, который получен биотехнологическими методами с использованием штамма-продуцента Amicolatopsis orientalis subsp [RU 2110578, 1998].
Прививку спейсера к кремнеземной матрице со связующим осуществляли следующим образом.
Тонкослойная пластина с силиказолевым связующим получена на основании патентов [SU 1736541, 1992; RU 2037826, 1995].
ТСХ-пластину с кремнеземным слоем и силиказолевым связующим переводили в Н-форму путем промывки в течение 12 часов водным раствором 2М азотной кислоты с последующей отмывкой дистиллированной водой до рН 6-7 с целью достижения максимальной плотности протоноакцепторных активных силанольных групп (до 68 мкмоль/мг) на поверхности силикагеля.
Тонкослойные пластины (10 шт.) размером 10×10 см помещали в 1700 мл раствора ацетатного буфера (0,1М водный раствор ацетата натрия, доведенного до рН 5,5 ледяной уксусной кислотой) с добавлением 50 мл γ-глицидоксипропилтриалкоксисилана. Реакционную смесь с ТСХ-пластинами выдерживали при комнатной температуре (20°С) в течение 5 суток. После прививки спейсера к кремнезему со связующим ТСХ-пластины отмывали дистиллированной водой, этанолом и снова водой. По данным элементного анализа содержание углерода составляет 5,11%.
Затем полученные ТСХ-пластины, модифицированные эпоксидными группами, помещали в 1700 мл раствора эремомицина (концентрация 1 мг/мл) в воде, доведенного 1М раствором гидроксида натрия до рН 8,5. Полученную реакционную смесь оставляли в течение 7 суток для иммобилизации низкомолекулярного гликопептидного антибиотика на поверхность кремнеземного слоя ТСХ-пластин с неорганическим связующим. После окончания процесса иммобилизации пластины отмывали дистиллированной водой и сушили на воздухе при комнатной температуре. По данным элементного анализа содержание углерода составляет 12,51%.
Таким образом, получены ТСХ-пластины с привитым хиральным селектором.
Пример 2. Тонкослойные кремнеземные пластины с полимерным связующим (поливиниловый спирт с молекулярной массой 15 KDa) получены согласно [FRG 1598382, 16.06.65; SU 1736541, 1992).
Силикагель с полимерным связующим в адсорбционном слое ТСХ-пластины, модифицированный силанольными группами путем гидроксилирования, получен, как в примере 1.
Силикагелевый слой с полимерным связующим, модифицированный эпоксигруппами с последующей иммобилизацией эремомицина, получен, как в примере 1.
По данным элементного анализа содержание углерода составляет 9,5%.
Пример 3. В таблице 1 представлены данные по содержанию углерода, определенного в кремнеземном слое ТСХ-пластин с силикагелевым связующим в зависимости от времени иммобилизации гликопептидного антибиотика эремомицина, определенного методом элементного анализа.
Пример 4. Хроматографический анализ осуществляли методом восходящей планарной хроматографии; в качестве стереоизомеров использовались основные D,L-аминокислоты: фениаланин, триптофан, лейцин, метионин, аланин, валин, аспариновая кислота, треонин, лизин, серин.
Хроматографические пики детектировали в видимом диапазоне путем постхроматографической дереватизации разделенных оптических изомеров аминокислот. Хроматографические зоны регистрировали при помощи видеоденситометра «ДенСкан». Запись хроматограмм и расчет факторов удерживания (Rf), разделения (Rs) и селективности проводили с помощью программно-аппаратного комплекса «Dens-Мультихром» (Ленхром-Амперсенд, Россия).
В качестве подвижной фазы использовали водно-метанольные и водно-метанольные смеси с добавками солей. В таблице 2 представлен состав подвижных фаз и результаты хроматографического разделения аминокислот на ТСХ-пластинах, полученных с силикагелевым связующим, как в примере 1, где:
Rf(L) - коэффициент удерживания L-стереоизомеров аминокислот
Rf(D) - коэффициент удерживания D-стереоизомеров аминокислот
Rs - фактор разрешения, указывающий на селективность разделения
1=8 см
Хроматограммы разделения некоторых оптических изомеров аминокислот приведены на прилагаемой фигуре, где представлено разделение D- и L- изомеров аминокислот: 1-D,L-фенилаланин, 2-D,L-триптофан, 3-D,L-лейцин, 4-D,L-метионин, 5-D,L-аланин, 6-D,L-валин, 7-D,L-аспарагиновая кислота, 8-D,L-треонин, 9-D,L-лизин, 10-D,L-серин на хиральной фазе - силикагель с силиказолевым связующим, иммобилизованный эремомицином; элюент: метанол - вода (1:1, объемн.); детектирование - 0,2% раствор нингидрина в ацетоне.
Пример 5. В таблице 3 представлены хроматографические данные разделения D- и L-аминокислот, полученные на коммерческих пластинах Chiralplate с органическим связующим поливиниловым спиртом фирмы Macherey-Nagel (Германия).
L=13cm
Из полученных данных видно, что энантиоселективность хиральных планарных пластин с силиказолевым связующим и иммобилизованным эремомицином значительно выше, чем энантиоселективность планарных пластин, полученных другими методами.
Таким образом, разработанный способ получения хиральной планарной пластины для тонкослойной хроматографии стереоизомеров позволяет получить пластины, обладающие хорошими физико-химическими свойствами, позволяющими проводить высокоэффективное разделение и аналитический контроль изомеров оптически активных соединений, что свидетельствует о соответствии данного технического решения всем требуемым критериям, защищаемым патентом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТОНКОСЛОЙНЫХ ХИРАЛЬНЫХ ПЛАСТИН ДЛЯ ПЛАНАРНОЙ ХРОМАТОГРАФИИ СТЕРЕОИЗОМЕРОВ И ИХ РАЦЕМИЧЕСКИХ СМЕСЕЙ | 2013 |
|
RU2541524C2 |
| СОРБЕНТ ДЛЯ РАЗДЕЛЕНИЯ ОПТИЧЕСКИХ ИЗОМЕРОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2255802C1 |
| СОРБЕНТ ДЛЯ ХРОМАТОГРАФИИ ОПТИЧЕСКИХ ИЗОМЕРОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2348455C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОСЕЛЕКТИВНОГО СОРБЕНТА | 2008 |
|
RU2363538C1 |
| СОРБЕНТ ДЛЯ РАЗДЕЛЕНИЯ ОПТИЧЕСКИХ ИЗОМЕРОВ ВЕЩЕСТВ И ИХ АНАЛИЗА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ МЕТОДОМ ВЭЖХ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2592893C2 |
| Способ селективного разделения рацемической смеси сальбутамола | 2017 |
|
RU2667002C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХИРАЛЬНЫХ СОРБЕНТОВ | 2007 |
|
RU2339445C1 |
| СПОСОБ РАЗДЕЛЕНИЯ И ДЕТЕКТИРОВАНИЯ АМИНОКИСЛОТ | 1994 |
|
RU2095808C1 |
| СПОСОБ РАЗДЕЛЕНИЯ АМИНОКИСЛОТ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 1993 |
|
RU2078342C1 |
| ХИМЕРНЫЕ АНТИБИОТИКИ НА ОСНОВЕ АЗИТРОМИЦИНА И ГЛИКОПЕПТИДНЫХ АНТИБИОТИКОВ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2578604C1 |
Изобретение относится к способу получения хиральной планарной пластины для тонкослойной хроматографии и может быть использовано для анализа оптически активных соединений. Сущность изобретения состоит в том, что разработан новый тип кремнеземных планарных пластин со связующим для разделения изомеров оптически активных соединений, который в качестве хирального селектора содержит макроциклический гликопептидный антибиотик эремомицин. Разработан способ иммобилизации эремомицина методом поверхностной сборки, который заключается в том, что вначале кремнезем с неорганическим связующим в водном буферном растворе обрабатывают γ-глицидоксипропилтриалкоксисиланом, а затем в щелочном водном растворе к кремнезему и неорганическому связующему (золь кремневой кислоты), модифицированным эпоксигруппами, прививается макроциклический гликопептидный антибиотик эремомицин. Техническим результатом является получение высокоэффективных хиральных планарных пластин для тонкослойной хроматографии с высоким значением энантиоселективности. 3 табл., 1 ил.
Способ получения хиральной планарной пластины для тонкослойной хроматографии оптических изомеров, включающий химическую иммобилизацию гликопептидного антибиотика эремомицина с помощью кремнийорганического модификатора на поверхность силикагеля, отличающийся тем, что вначале силикагель со связующим обрабатывают γ-глицидоксипропилтриалкоксисиланом, затем в щелочном водном растворе иммобилизуют в качестве селектора антибиотик эремомицин при температуре не выше 25°С, при этом в качестве связующего используют золь кремневой кислоты, а спейсер прививают к слою силикагеля и к связующему ковалентными связями.
| Беленький Б.Г | |||
| и др., Применение пластинок со слоем микрофракционированного силикагеля, закрепленного золем кремневой кислоты, для анализа липидов, Биоорганическая химия, Том N2, стр | |||
| Нагревательный прибор для центрального отопления | 1920 |
|
SU244A1 |
| СОРБЕНТ ДЛЯ РАЗДЕЛЕНИЯ ОПТИЧЕСКИХ ИЗОМЕРОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2255802C1 |
| РАЗРАБОТКА ЭНАНТИОСЕЛЕКТИВНЫХ ТСХ-ПЛАСТИН С | |||
| ИММОБИЛИЗОВАННЫМ МАКРОЦИКЛИЧЕСКИМ | |||
| ГЛИКОПЕПТИДНЫМ АНТИБИОТИКОМ ЭРЕМОМИЦИНОМ. | |||
Авторы
Даты
2015-03-27—Публикация
2012-10-10—Подача