УРОВЕНЬ ТЕХНИКИ
[001]
Биологический датчик (сенсор) означает аналитическое устройство для обнаружения молекулы-мишени путем взаимодействия биомолекулы с молекулой-мишенью. По сравнению с культивированием или полимеразной цепной реакцией (ПЦР) биологический датчик может обнаруживать существование молекулы-мишени в течение относительно короткого периода времени. Некоторые биологические датчики используют хроматографические методы иммунологических анализов. Однако эти хроматографические биологические датчики на основе иммуноанализа имеют ограничения при внедрении. Например, большинство хроматографических биологических датчиков на основе иммуноанализа обнаруживают антитела, которые вырабатываются пациентами по истечении последней стадии инфекции/болезни.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
[002] На фиг.1 представлен иллюстративный вариант осуществления датчика для обнаружения целевой мишени (например, биомолекулы);
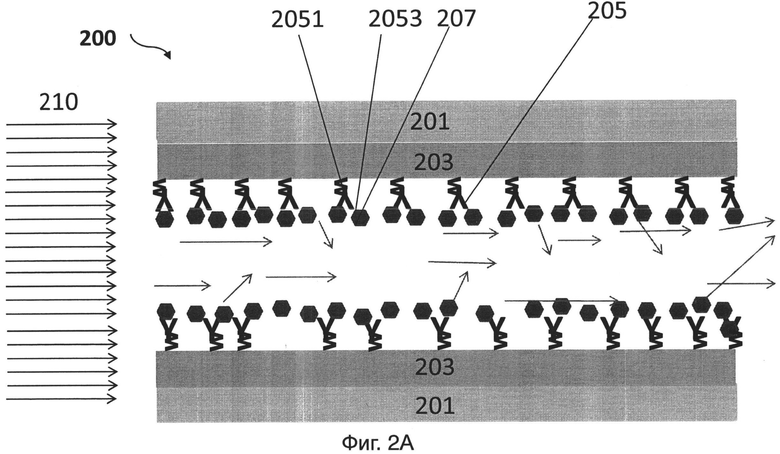
На фиг.2А представлен иллюстративный вариант осуществления контейнера датчика для обнаружения целевой мишени (например, биомолекулы);
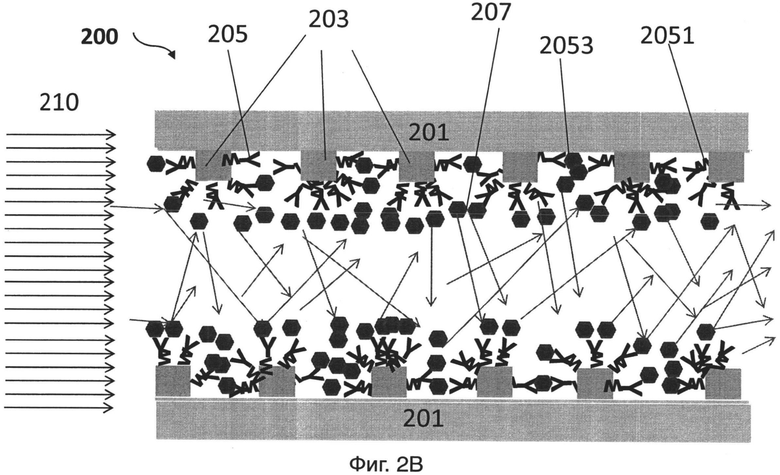
На фиг.2В представлен другой иллюстративный вариант осуществления контейнера датчика для обнаружения целевой мишени (например, биомолекулы);
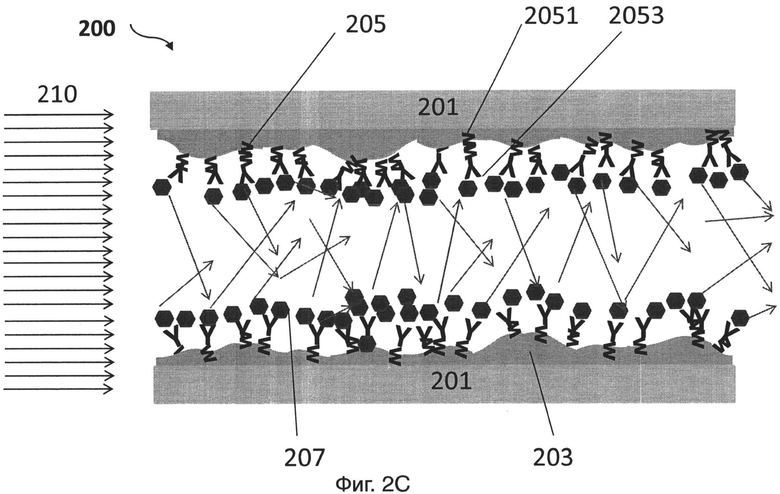
На фиг.2С представлен еще один иллюстративный вариант осуществления контейнера датчика для обнаружения целевой мишени (например, биомолекулы);
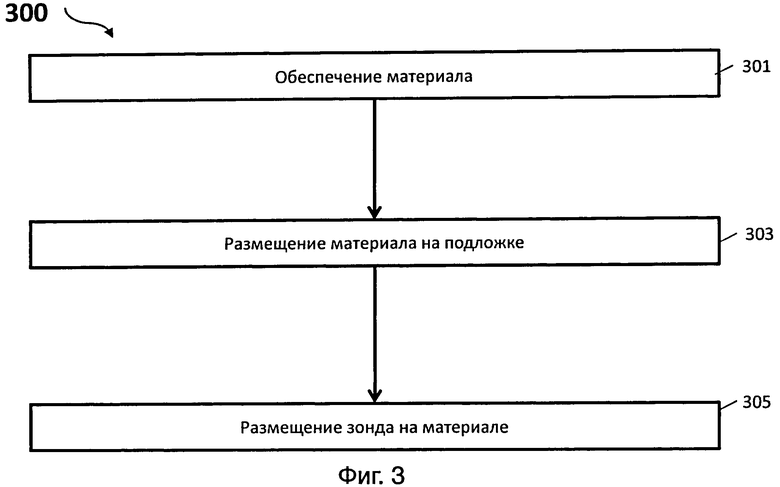
На фиг.3 представлен иллюстративный вариант осуществления способа получения датчика;
На фиг.4А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком энтеровируса 71 в 10%-ной разбавленной пробе, полученной от инфицированного пациента;
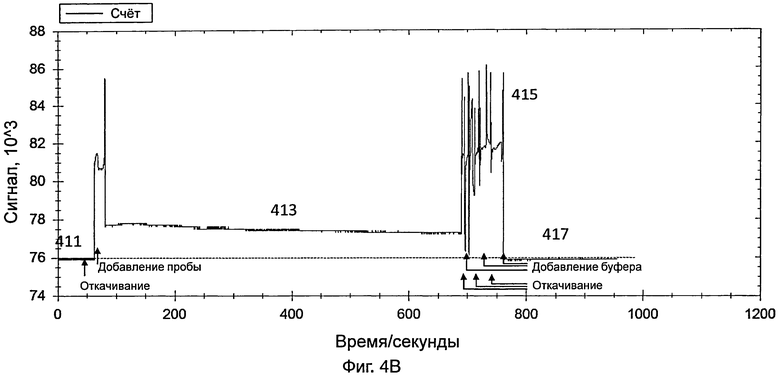
На фиг.4В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком энтеровируса 71 в контрольной пробе, полученной от здорового пациента;
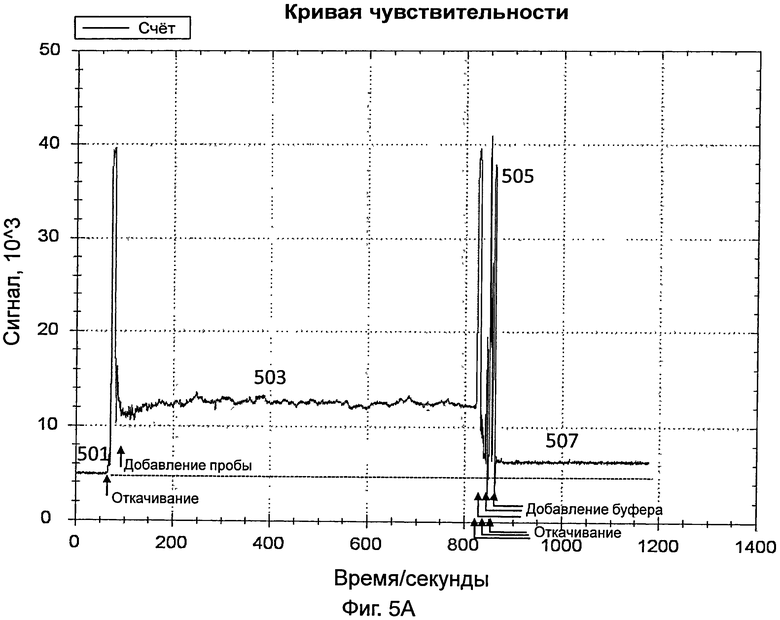
На фиг.5А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком вируса гриппа А в 10%-ной разбавленной пробе, полученной от инфицированного пациента;
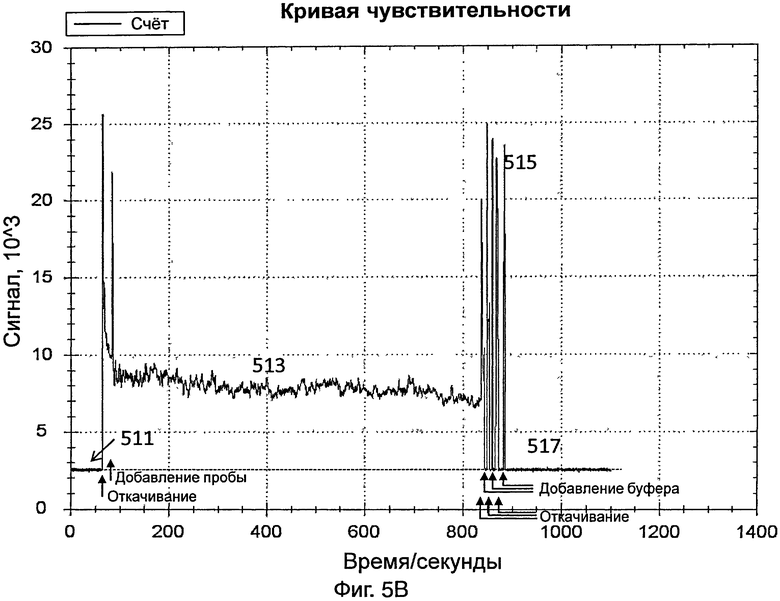
На фиг.5В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком вируса гриппа А в контрольной пробе, полученной от здорового пациента;
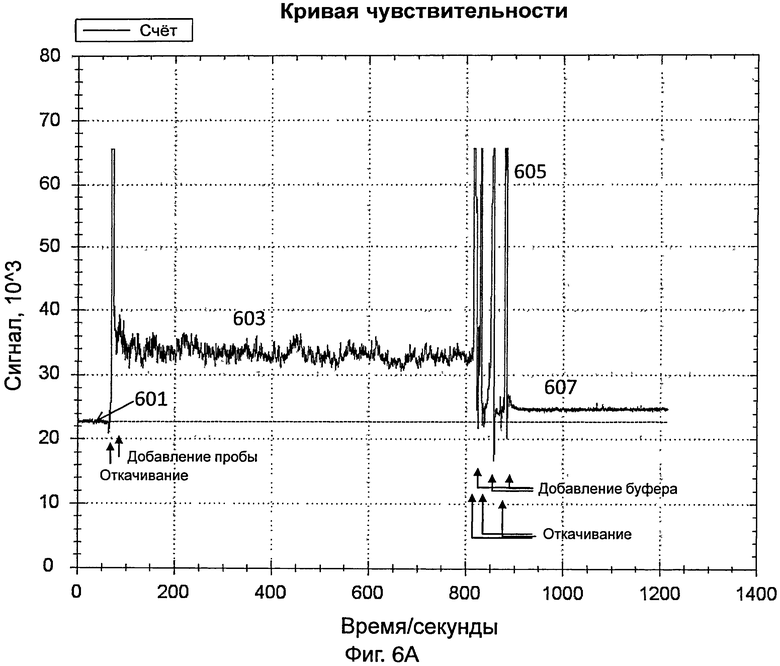
На фиг.6А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком вируса гриппа В в 10%-ной разбавленной пробе, полученной от инфицированного пациента;
На фиг.6В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком вируса гриппа В в контрольной пробе, полученной от здорового пациента, соответственно вариантам данного раскрытия.
На фиг.7А представлен вид сверху иллюстративного варианта осуществления сливного устройства датчика для обнаружения целевой мишени (например, биомолекулы);
На фиг.7В представлен вид спереди иллюстративного варианта осуществления сливного устройства датчика для обнаружения целевой мишени (например, биомолекулы) на фиг.7А;
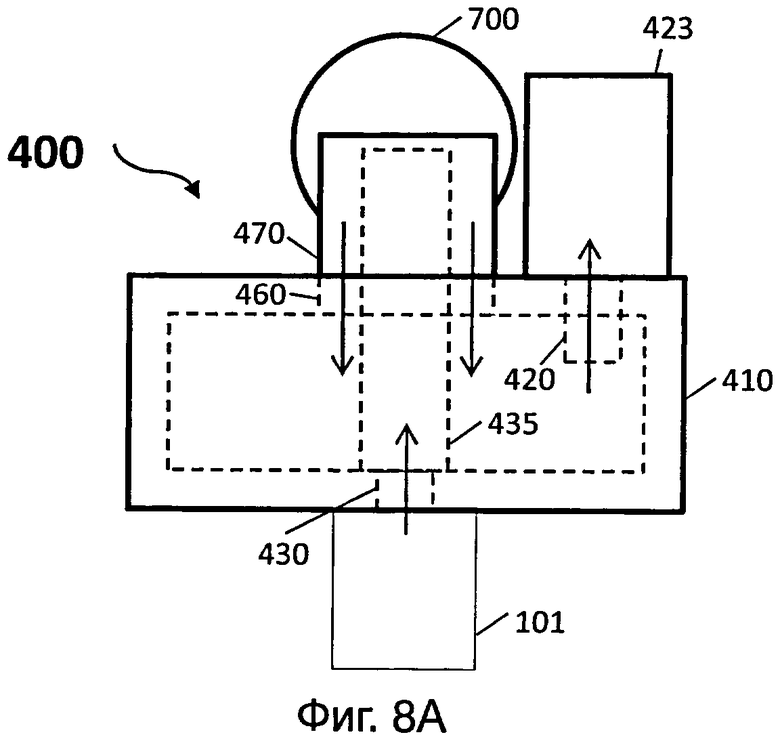
На фиг.8А представлен вид сверху другого иллюстративного варианта осуществления сливного устройства датчика для обнаружения целевой мишени (например, биомолекулы);
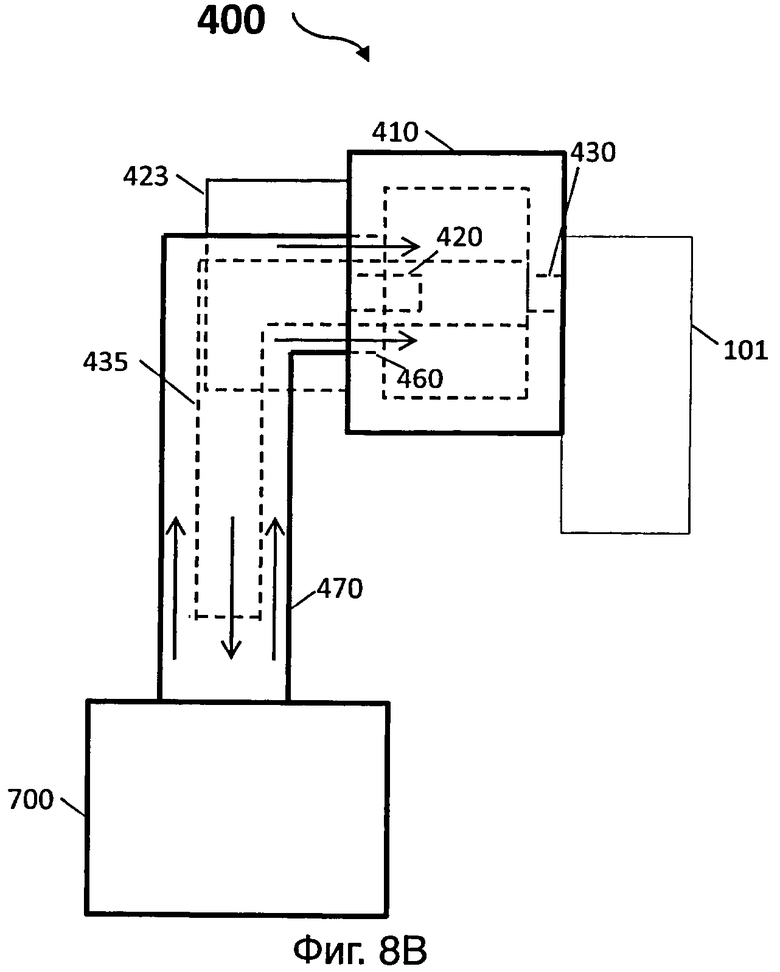
На фиг.8В представлен вид сбоку иллюстративного варианта осуществления сливного устройства датчика для обнаружения целевой мишени (например, биомолекулы) на фиг.8А;
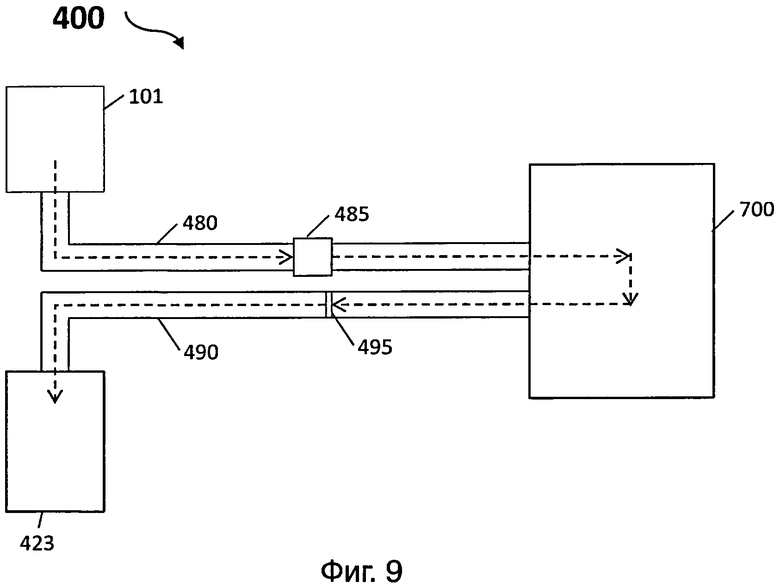
На фиг.9 представлен еще один иллюстративный вариант осуществления сливного устройства датчика для обнаружения целевой мишени (например, биомолекулы);
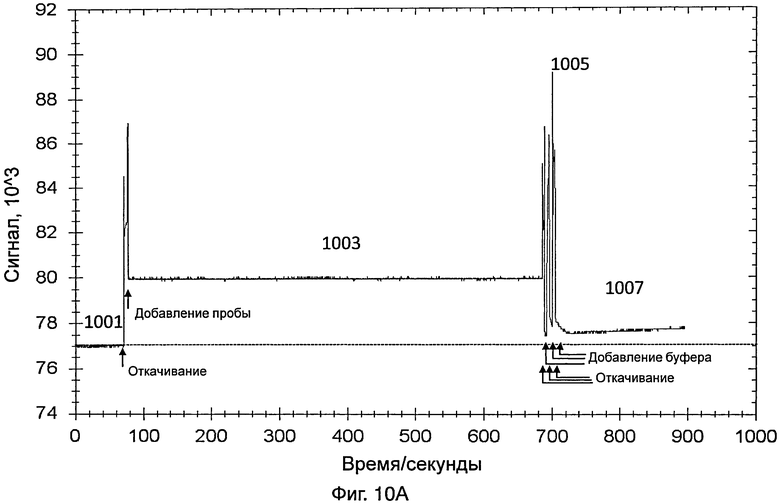
На фиг.10А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком, который содержит насос, изображенный на фиг.7А и 7В, 10%-ной разбавленной пробы, содержащей энтеровирус 71 типа, полученной от инфицированного пациента;
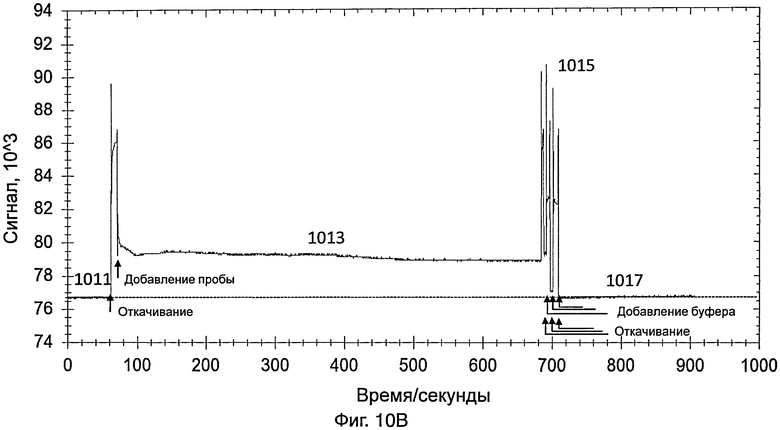
На фиг.10В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком, который содержит насос, изображенный на фиг.7А и 7В, контрольной пробы, полученной от здорового пациента;
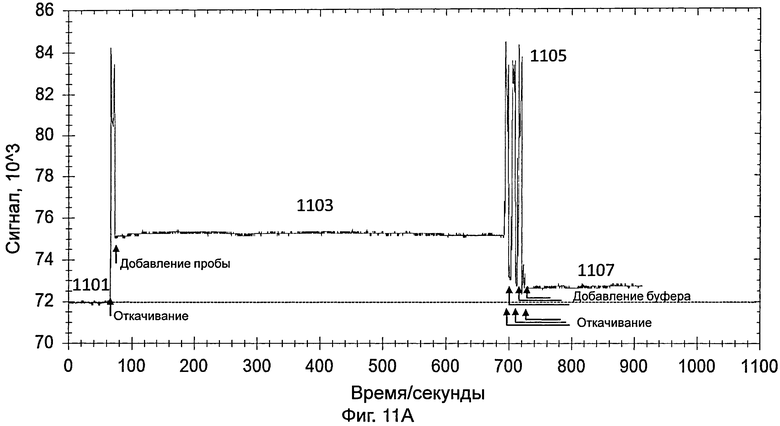
На фиг.11А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком, который содержит насос, изображенный на фиг.8А и 8В, 10%-ной разбавленной пробы, содержащей энтеровирус 71 типа, полученной от инфицированного пациента;
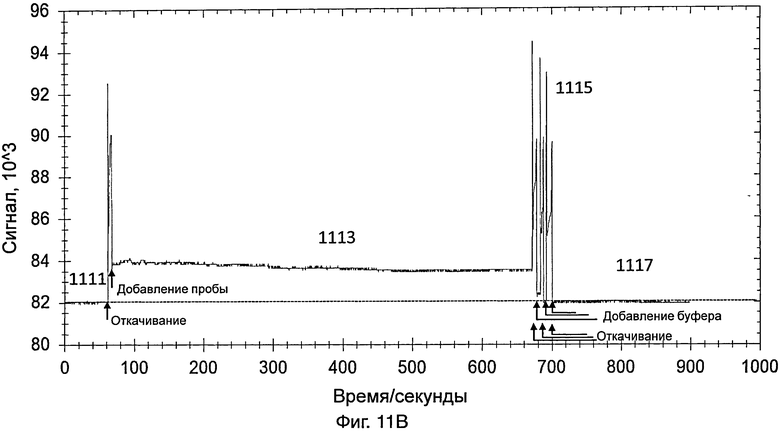
На фиг.11В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком, который содержит насос, изображенный на фиг.8А и 8В, контрольной пробы, полученной от здорового пациента;
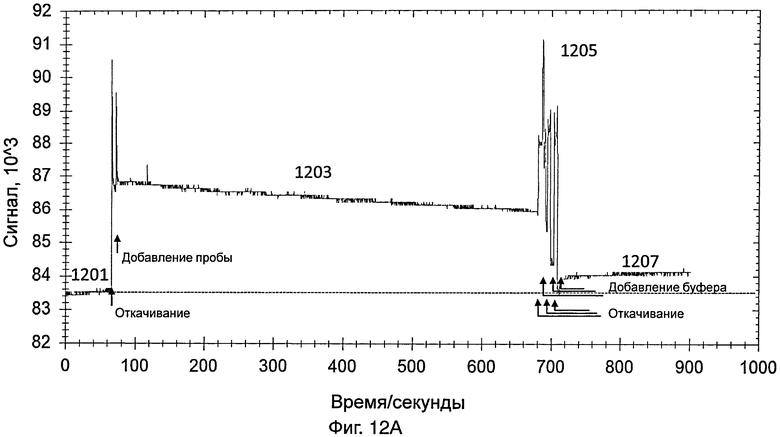
На фиг.12А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком, который содержит насос, изображенный на фиг.9, 10%-ной разбавленной пробы, содержащей энтеровирус 71 типа, полученной от инфицированного пациента; и
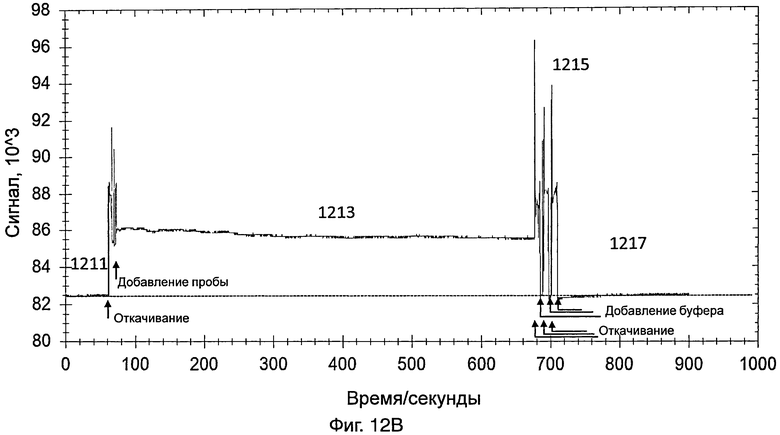
На фиг.12В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения датчиком, который содержит насос, изображенный на фиг.9, контрольной пробы, полученной от здорового пациента, все расположены в соответствии с вариантами данного раскрытия.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
[003] Некоторые варианты раскрытия данного изобретения могут обычно относиться к датчику для связывания целевой мишени. Один пример датчика может содержать устройство для связывания целевой мишени и сливное устройство для слива жидкости из устройства. Устройство может содержать подложку, материал, расположенный на подложке, и зонд, расположенный на материале, и сконфигурированный для связывания с целевой мишенью. Зонд конфигурируют на материале для рассеяния света, излучаемого источником света при связывании целевой мишени с зондом.
[004] Приведенное выше краткое изложение носит исключительно иллюстративный характер и не предназначено для какого-либо ограничения. В дополнение к иллюстративным аспектам, варианты осуществления и признаки, описанные выше, дополнительные аспекты, варианты осуществления и отличительные признаки станут очевидными со ссылкой на графический материал и следующее подробное описание.
ПОДРОБНОЕ ОПИСАНИЕ
[005] В следующем подробном описании сделаны ссылки на прилагаемые фигуры, которые являются частью данного описания. На фигурах сходные символы обычно обозначают сходные компоненты, если в контексте не указано иначе. Иллюстративные варианты осуществления, описанные в подробном описании, фигурах и формуле изобретения, не предназначены для ограничения. Могут быть использованы другие варианты осуществления и могут быть произведены другие изменения, если при этом не нарушаются пределы сущности или объем изобретения, представленного здесь. Легко можно понять, что аспекты данного раскрытия изобретения, как в основном описано здесь и показано на фигурах, могут быть упорядочены, заменены, объединены и сконструированы в большом разнообразии различных конфигураций, все из которых явно рассматриваются и составляют часть данного раскрытия.
[006] В данном раскрытии термин "зонд" ("probe") обычно относится к веществу (например, биомолекуле), которое способно связываться с целевой мишенью (например, биомолекулой). Например, зонд может иметь аффинность связывания с мишенью приблизительно от 100 пиконьютонов (пН) до приблизительно 500 пН. Неограничивающие примеры зондов включают в себя антитела, фрагменты антител, которые сохраняют способность связываться с целевой мишенью, нуклеиновые кислоты (например, ДНК, РНК, аптамеры), антигены и ферменты. Как описано здесь, в датчике может быть использован единственный зонд, который узнает единственную представляющую интерес мишень, или может быть использовано два или несколько зондов, которые узнают единственную мишень, или множество представляющих интерес мишеней.
[007] Термин "мишень" ("target") обычно относится к любой молекуле, которая является обнаруживаемой с помощью датчика, как описано здесь. Мишень может включать в себя, но не ограничивается ею, биомолекулу. Примеры мишеней, которые являются обнаруживаемыми в описанных здесь датчиках, включают в себя, но не ограничиваются ими, биомолекулы (например, вирусы, белки, нуклеиновые кислоты, углеводы, липиды) и другие типы молекул (например, небольшие молекулы), такие как гаптены и токсины. В некоторых вариантах, мишень означает биомолекулу, которая присутствует в физиологической жидкости и/или ткани.
[008] В некоторых вариантах осуществления, датчик для обнаружения целевой мишени (например, биомолекулы) включает в себя источник света, контейнер и приемник света, имеющий фотоэлемент, который генерирует электрический сигнал, пропорциональный количеству света, принимаемому приемником света. По меньшей мере одна внутренняя поверхность контейнера включает в себя зонды, иммобилизованные на материале, который располагают на поверхности контейнера. Источник света конфигурируют для генерирования света, который проходит через контейнер, и в конце концов (попадает) на фотоэлемент. Длина световой волны может быть специфической. Таким образом, в зависимости от мишени, подлежащей обнаружению, определенная длина волны может быть изменена. Конкретная длина волны может быть определена любыми технически выполнимыми подходами. В некоторых вариантах осуществления, конкретную длину волны определяют сканированием мишени с использованием спектра видимого излучения или спектра УФ-излучения. Длина волны максимума поглощения мишени в спектре видимого излучения может быть специфической длиной волны. Например, любой из энтеровируса 71, вируса гриппа А и вируса гриппа В имеет максимум поглощения при длине волны приблизительно 560 нанометров (нм) в спектре видимого излучения и имеет относительно большее поглощение при длине волны приблизительно 280 нм в ультрафиолетовой области спектра. Аденовирус имеет максимум поглощения при длине волны приблизительно 340 нм в спектре видимого излучения и имеет относительно большее поглощение при длине волны приблизительно 280 нм в ультрафиолетовой области спектра. Если мишень присутствует и связывается с зондами, то свет рассеивается при прохождении через контейнер, усиливая сигнал, что приводит к более высокому уровню света, достигающего приемника света, и к большей величине электрического сигнала, генерируемого фотоэлементом.
[009] В некоторых вариантах осуществления, источник света может генерировать видимый свет или ультрафиолетовое излучение. Светофильтр может быть размещен между источником света и контейнером таким образом, что свет, попадающий в контейнер, имеет специфическую длину волны. Альтернативно, светофильтр может быть размещен между контейнером и фотоэлементом таким образом, что свет, попадающий на фотоэлемент, имеет определенную длину волны. Альтернативно, некоторые оптические элементы (например, щель, решетка, зеркало и линейный прибор с зарядовой связью) могут быть размещены между контейнером и фотоэлементом для продуцирования монохроматического света, имеющего определенную длину волны видимого света, который проходит через контейнер, что приводит к попаданию монохроматического света на фотоэлемент. Альтернативно источник света может быть монохроматическим источником света.
[0010] В некоторых вариантах, контейнер включает в себя подложку, материал, расположенный на подложке и один (зонд) или несколько зондов, расположенных на материале. Зонд иммобилизуют на материале. Зонд может быть биологическим веществом, например, антителом, фрагментом антитела, нуклеиновой кислотой, аптамером, антигеном или ферментом, или любым веществом, которое способно связываться с целевой мишенью таким образом, что при связывании мишени с зондом рассеяние света происходит в большей степени, чем тогда, когда мишень не связана. Материал совместим с зондом, и зонд может быть иммобилизован на материале. Материал может быть, например, металлом, таким как золото, серебро, медь и никель. Подложка может состоять из любой композиции, которая является технически обоснованной для материала, который будет расположен на ней, и которая не препятствует обнаружению целевой мишени, как описано здесь. Некоторые примеры подходящих подложек могут включать в себя, без ограничения, стекло, метал, силикон или полимеры.
[0011] Материал включает в себя структуру, сконфигурированную для усиления рассеяния света при связывании мишени с зондом. В некоторых вариантах осуществления, сама по себе структура сконфигурирована для рассеяния света при прохождении света через структуру. В некоторых вариантах осуществления, структура может быть пленкой, нанесенной на подложку. В некоторых других вариантах осуществления, нанесенная пленка может быть отожжена. Отжиг приводит к тому, что поверхность нанесенной пленки становится неровной. Неровная поверхность может усиливать рассеяние света, проходящего через контейнер, и может обеспечивать увеличение площади поверхности, доступной для депонирования зонда.
[0012] В некоторых вариантах, структура может быть массивом (array) металлических стержней, расположенных на подложке. Трехмерное свойство массива металлических стержней может также обеспечивать увеличение площади поверхности, доступной для депонирования зонда. Размер металлического стержня в массиве металлических стержней связан с указанной выше специфической длиной волны. Длина любого из металлических стержней не является ни кратной (длине волны), ни фактором специфической длины волны. Толщина любого из металлических стержней не является ни кратной (длине волны), ни фактором специфической длины волны. Расстояние между двумя смежными стержнями не является ни кратной (длине волны), ни фактором специфической длины волны.
[0013] Зонд располагают или иммобилизуют на материале путем одной или нескольких химических связей (например, ковалентной связью) с материалом. Зонд может образовывать взаимосвязь по типу "замок и ключ" с мишенью, подлежащей обнаружению датчиком. Например, зонд может быть ДНК, РНК, белком, антителом, фрагментом антитела, аптамером, антигеном или ферментом. В некоторых вариантах, зонд представляет собой антитело и мишень представляет собой антиген, с которым антитело связывается.
[0014] Пробу, в том числе потенциальную мишень, вводят в датчик, и проба затем обтекает зонд. Если мишень существует в пробе, то количество фотонов, проходящих через контейнер до внесения пробы в датчик, может быть отличным от количества фотонов, проходящих через контейнер после внесения пробы в датчик, поскольку мишень, связанная с зондом, рассеивает фотоны. Если мишень не присутствует в пробе, то количество фотонов, проходящих через контейнер, остается по существу одним и тем же, поскольку не существует связанной мишени для рассеивания фотонов. В некоторых вариантах, количество фотонов, поглощенных пробой, является выше в присутствии связанной мишени, чем в отсутствие мишени, приводящее к различию между световым сигналом, обнаруженным в присутствии мишени, и световым сигналом, обнаруженным в отсутствие мишени.
[0015] В некоторых вариантах осуществления, раскрывают способ изготовления датчика. Способ включает в себя обеспечение материала, который включает в себя структуру, сконфигурированную для рассеяния света или усиления рассеяния света, связанного с целевой мишенью, и увеличение площади поверхности, доступной для связывания с зондами, расположение материала на подложке и расположение зондов, сконфигурированных для взаимодействия с целевой мишенью на материале.
[0016] В некоторых вариантах осуществления, материал представляет собой пленку. Подложка может быть очищена перед нанесением материала на подложку. В некоторых вариантах осуществления, перед нанесением материала на подложку, сначала на подложку наносят адгезионный слой. Затем материал наносят на адгезионный слой. Адгезионный слой может быть хромом.
[0017] В некоторых других вариантах, материал представляет собой отожженную пленку, которая имеет структуру с неровной поверхностью. Материал может быть отожжен при температуре от приблизительно 300 градусов Цельсия (°C) до приблизительно 500°C, после чего материал наносят на адгезионный слой.
[0018] В некоторых других вариантах осуществления, материал включает в себя структуру массива стержней. Фоторезист наносят на подложку и выполняют способ фотолитографии для образования массива стержней. Размер каждого стержня в массиве стержней и расстояние между двумя смежными стержнями связано по меньшей мере с одним из показателей, таких как специфическая длины волны, размер зонда и размер целевой мишени.
[0019] В некоторых вариантах осуществления раскрывают способ обнаружения целевой мишени с использованием описанного здесь датчика. Датчик включает в себя источник света, контейнер и фотоэлемент. Контейнер включает в себя подложку, материал, расположенный на подложке, и зонд, сконфигурированный для взаимодействия с целевой мишенью. Зонд располагают и иммобилизуют на материале. Способ включает в себя передачу света от источника света через контейнер и получение первого сигнала на основе света, полученного фотоэлементом датчика.
[0020] Способ также включает в себя внесение в датчик пробы, которая потенциально включает в себя представляющую интерес мишень, и получение второго сигнала на основе света, полученного фотоэлементом датчика после внесения пробы в контейнер. Способ дополнительно включает в себя сравнение первого и второго сигналов и определение вероятности присутствия мишени в пробе на основе сравнения.
[0021] Фиг.1А представляет собой иллюстративный вариант датчика 100 для обнаружения целевой мишени. Датчик 100 включает в себя контейнер 101. Контейнер образует устройство для связывания целевой мишени, и включает в себя материал 111, расположенный на подложке 110 (например, одной или нескольких стенок контейнера), и зонды 113, которые способны связываться с мишенью, расположенной на материале. Свет 112 передается от источника света датчика 100 к приемнику света датчика 100 через контейнер 101. Зонды 113, расположенные на материале 111, конфигурируют на пути света, излучаемого источником света. Зонды 113 конфигурируют так, чтобы свет, проходящий через устройство, рассеивался при связывании целевой мишени с зондами 113.
[0022] Раствор, который не содержит мишень, такой как буферный раствор, вводят в контейнер 101. Свет 112 конфигурируется для прохождения через контейнер 101 в первый отрезок времени и принимается приемником света. Приемник света дополнительно включает в себя фотодиодный детектор, сконфигурированный для генерирования первого электронного сигнала на основе количества света 112, которое принимается приемником света в первый отрезок времени. Приемник света дополнительно включает в себя процессор для обработки первого электронного сигнала.
[0023] Затем пробу 900, потенциально включающую в себя представляющую интерес мишень 901, помещают в контейнер 101. Заданному количеству времени дают истечь, так что если представляющая интерес мишень 901 существует в пробе 900, то представляющая интерес мишень 901 может связаться с зондами 113 на материале 111. После истечения заданного периода времени, помещенную пробу 900 в контейнер 101, в том числе примеси 902, удаляют из контейнера 101 сливным устройством 400 через первое отверстие 107, канал 109 и второе отверстие 108, без разрыва связи между целевой мишенью 901 и зондами 113. Затем контейнер 101 промывают буферным раствором заданное число раз. Например, свежий буферный раствор может быть повторно введен в контейнер 101 и откачан из контейнера 101 несколько раз.
[0024] Если будет обнаружено рассеяние света, которое происходит при связывании молекулы-мишени с зондами 113 в устройстве, то это указывает на присутствие мишени 901 в пробе 900. Свет 112 конфигурируется для прохождения через контейнер 101 во второй отрезок времени и принимается приемником света. Фотодиодный детектор приемника света конфигурируют для генерирования второго электронного сигнала на основе количества света, которое принимается приемником света во второй отрезок времени. Процессор приемника света конфигурируют для дальнейшей обработки второго электронного сигнала. Если интенсивность второго сигнала значительно отличается от первого сигнала, то процессор определяет, что представляющая интерес мишень присутствует в пробе. Например, если второй сигнал значительно сильнее, чем первый сигнал, то процессор определяет, что представляющая интерес мишень присутствует в пробе.
[0025] На фиг.2А представлен иллюстративный вариант осуществления устройства для связывания целевой мишени. Устройство 200 включает в себя подложку 201, пленку 203, расположенную на подложке, и зонд 205, расположенный на пленке 203. Толщина пленки 203 может быть, например, по существу одинаковой толщины от приблизительно 5 нм до приблизительно 200 нм. Первую поверхность 2051 зонда 205 размещают на материале 203. Вторую поверхность 2053 зонда 205, имеющего аффинность связывания с мишенью 207, конфигурируют так, что поверхность зонда доступна для соединения с мишенью 207, при наличии мишени 207. Зонды 205 конфигурируют на пленке 203 так, что свет 210 (показанный в виде стрелки на фиг.2А) рассеивается при связывании мишени 207 со второй поверхностью 2053 зондов 205.
[0026] На фиг.2В представлен иллюстративный вариант осуществления устройства для связывания целевой мишени. Устройство 200 включает в себя подложку 201, массив стержней 203, расположенных на подложке, и зонд 205, расположенный на массиве стержней 203. Толщина и длина любого стержня в массиве стержней 203 и расстояние между двумя смежными стержнями, связаны по меньшей мере с одной из длин волн света, передаваемого от источника света датчика, с размером зонда 205 и целевой мишенью 207. Длина волны является специфической для целевой мишени 207. Расстояние между двумя смежными стержнями также связано с такой длиной волны. В некоторых вариантах осуществления, толщина, длина и расстояние, все показатели не являются ни кратными длине волны, ни фактором длины волны. В некоторых вариантах осуществления, стержень массива стержней 203 может иметь длину от 200 до 900 нм, ширину от 200 до 900 нм и высоту от 15 до 1500 нм. Расстояние между каждым стержнем в массиве стержней может быть от 200 до 900 нм. В некоторых вариантах, стержень массива стержней может иметь длину приблизительно 500 нм, ширину приблизительно 500 нм и высоту приблизительно 100 нм, и расстояние между каждым стержнем может быть приблизительно 500 нм. Первую поверхность 2051 зонда 205 располагают на массиве стержней 203. Вторую поверхность 2053 зонда 205, имеющую аффинность связывания с мишенью 207, конфигурируют так, что она способна соединяться с мишенью 207 при наличии мишени 207. Зонды 205 конфигурируют на массиве стержней 203, так что свет 210 (показано стрелкой на фиг.2В) рассеивается при связывании мишени 207 со второй поверхностью 2053 зондов 205.
[0027] На фиг.2С представлен иллюстративный вариант осуществления устройства для связывания целевой мишени. Устройство 200 включает в себя подложку 201, пленку 203, расположенную на подложке, и зонд 205, расположенный на пленке 203. Пленка 203 имеет неодинаковую толщину. В некоторых вариантах, пленка может быть сначала нанесена на подложку 201 и затем отожжена до образования неодинаковой толщины. В некоторых вариантах, толщина пленки 203 может варьировать от приблизительно 0,5 нм до приблизительно 30 нм. Первую поверхность 2051 зонда 205 располагают на пленке 203. Вторую поверхность 2053 зонда 205, имеющего аффинность связывания с мишенью 207, конфигурируют так, что она является доступной для связывания с мишенью 207 при присутствии мишени 207. Зонды 205 конфигурируют на материале 203 так, что свет 210 (показано стрелкой на фиг.2С) рассеивается при связывании мишени 207 со второй поверхностью 2053 зондов 205.
[0028] На фиг.3 представлена схема иллюстративного варианта способа 300 изготовления устройства для связывания целевой мишени. Способ 300 включает в себя стадии 301, 303 и 305. На стадии 301 обеспечивают материал. На стадии 303 материал размещают на подложке. Материал может быть расположен на подложке в виде структуры, сконфигурированной для увеличения площади поверхности, доступной для расположения зондов, и для обеспечения и/или усиления рассеяния света, излучаемого источником света, и прохождения через устройство при связывании целевой мишени с зондом, который располагают на материале. Структура может быть, например, пленкой, пленкой неодинаковой толщины или массивом стержней. На стадии 305 зонд, который способен связываться с целевой мишенью, размещают на материале. Зонд конфигурируют для взаимодействия с мишенью, для обнаружения которой конфигурируют датчик. В некоторых вариантах осуществления, до размещения зонда на материале, материал может быть очищен и предварительно обработан. Например, материал может быть очищен кислым раствором, щелочным раствором и/или очищенной водой. В некоторых вариантах, материал может быть предварительно обработан одним или несколькими соединениями. В одном варианте материал может быть предварительно обработан одним (соединением) или несколькими соединениями, которые включают в себя (которое включает в себя) по меньшей мере одну функциональную группу, совместимую с материалом. В другом варианте материал может быть предварительно обработан одним (соединением) или несколькими соединениями, которые включают в себя (которое включает в себя) по меньшей мере одну функциональную группу, совместимую с зондом. Функциональную группу конфигурируют для образования первой устойчивой связи со свободными электронами вокруг поверхности материала и образования второй устойчивой связи с зондом. Некоторые примеры функциональных групп включают в себя, но не ограничиваются ими, тиольную группу и гидроксильную группу.
[Пример 1]
[Иммобилизация зонда]
[0029] Стеклянный контейнер, сконфигурированный для содержания пробы, помещали в пластиковый держатель, и затем стеклянный контейнер и пластиковый держатель помещали в датчик pTricordei® (Vsense Medtech. Co., Ltd., Taipei, Taiwan). Золото располагали на внутренней поверхности контейнера в форме пленки, имеющей неодинаковую толщину от приблизительно 5 нм до приблизительно 20 нм. Перед внесением зондов в контейнер пленку золота очищали последовательно 0,1М раствором соляной кислоты, очищенной водой, 0,1 М гидроксидом натрия и очищенной водой.
[0030] После очистки в контейнер добавляли водный раствор, содержащий 110 мкл цистамина (20 мМ в фосфатно-солевом буферном растворе (PBS) при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности цистамину связаться с золотом на поверхности стенки контейнера. Затем оставшийся раствор цистамина удаляли из контейнера. Затем в контейнер добавляли водный раствор, содержащий 110 мкл глутаральдегида (2,5% в растворе PBS при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности глутаральдегиду связаться с цистамином.
[0031] После удаления из контейнера оставшегося раствора глутаральдегида, в контейнер добавляли 110 мкл водного раствора коммерчески доступных моноклональных антител против энтеровируса 71 и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности моноклональным антителам против энтеровируса 71 связаться со сшивающим агентом глутаральдегида. Затем несвязанное моноклональное антитело против энтеровируса 71 удаляли из контейнера отсасывающим насосом датчика через отверстие внизу стеклянного контейнера. Затем в контейнер добавляли водный 0,5М раствор глицина для взаимодействия с остаточным несвязанным глутаральдегидом. В конце из контейнера удаляли глицин и добавляли в контейнер PBS.
[Обнаружение пробы]
[0032] Датчик дополнительно включает в себя источник видимого света и фотоэлемент для обнаружения энтеровируса 71. Видимый свет передавался от источника видимого света и проходил через светофильтр. Светофильтр конфигурировали для отфильтровывания видимого света и только свет, имеющий длину волны 560 нм, может проходить через светофильтр. Затем свет (т.е., имеющий длину волны 560 нм) пропускали через стеклянный контейнер, указанный выше. После прохождения через стеклянный контейнер, свет, в конце концов, принимался фотоэлементом. На фиг.4А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения энтеровируса 71 в 10%-ной разбавленной пробе, полученной от инфицированного пациента. Пробу получали мазком из зева (throat swab) от инфицированного пациента.
[0033] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS, как указано выше. Сигнал, обнаруженный с использованием PBS (как показывает 401 на фиг.4А), использовали в качестве базового.
[0034] Приблизительно через 1 минуту PBS удаляли из контейнера и добавляли в контейнер 10%-ную разбавленную пробу энтеровируса 71. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 403 на фиг.4А. Через 10 минут разбавленную пробу энтеровируса 71 удаляли из контейнера.
[0035] PBS добавляли для промывки контейнера, для удаления неспецифически связанного энтеровируса 71. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 405 на фиг.4А. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 407 на фиг.4А). Разница между световым сигналом, обнаруженным в виде 407, и сигналом, обнаруженным в виде 401, указывала на присутствие энтеровируса 71 в пробе.
[Сравнительный пример 1]
[0036] На фиг.4В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения контрольной пробы, полученной от здорового пациента. Способ обнаружения был одним и тем же, что и способ обнаружения 10%-ной разбавленной пробы энтеровируса 71, как указано выше.
[0037] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS. Сигнал, обнаруженный с использованием PBS (как показывает 411 на фиг.4В), использовали в качестве базового.
[0038] Приблизительно через 1 минуту из контейнера удаляли PBS и добавляли в контейнер контрольную пробу. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 413 на фиг.4В. Через 10 минут контрольную пробу удаляли из контейнера.
[0039] PBS добавляли для промывки контейнера, для удаления неспецифически связанного материала. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 415 на фиг.4В. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 417 на фиг.4В). Сходная интенсивность сигнала 411 и 417 не показала существование энтеровируса 71 в контрольной пробе.
[Пример 2]
[Иммобилизация зонда]
[0040] Стеклянный контейнер, сконфигурированный для содержания пробы, помещали в пластиковый держатель, и затем стеклянный контейнер и пластиковый держатель помещали в датчик pTricorder® (ххх, Taipei, Taiwan). Золото располагали на внутренней поверхности контейнера в форме пленки, имеющей неодинаковую толщину от приблизительно 5 нм до приблизительно 20 нм. Перед внесением зондов в контейнер пленку золота очищали последовательно 0,1М раствором соляной кислоты, очищенной водой, 0,1М гидроксидом натрия и очищенной водой.
[0041] После очистки в контейнер добавляли водный раствор, содержащий 110 мкл цистамина (20 мМ в фосфатно-солевом буферном растворе (PBS) при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности цистамину связаться с золотом на поверхности стенки контейнера. Затем оставшийся раствор цистамина удаляли из контейнера. Затем в контейнер добавляли водный раствор, содержащий 110 мкл глутаральдегида (2,5% в растворе PBS при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности глутаральдегиду связаться с цистамином.
[0042] После удаления из контейнера оставшегося раствора глутаральдегида в контейнер добавляли 110 мкл водного раствора коммерчески доступного антитела против вируса гриппа А (20 мкг/мл в растворе PBS при pH 7,2) и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности антителу против вируса гриппа А связаться со сшивающим агентом глутаральдегида. Затем несвязанное антитело против вируса гриппа А удаляли из контейнера отсасывающим насосом датчика через отверстие внизу стеклянного контейнера. Затем в контейнер добавляли водный 0,5 М раствор глицина для взаимодействия с остаточным несвязанным глутаральдегидом. В конце из контейнера удаляли глицин и добавляли в контейнер PBS.
[Обнаружение пробы]
[0043] Датчик дополнительно включает в себя источник видимого света и фотоэлемент для обнаружения вируса гриппа А. Видимый свет передавался от источника видимого света и проходил через светофильтр. Светофильтр конфигурировали для отфильтровывания видимого света и только свет, имеющий длину волны 560 нм, может проходить через светофильтр. Затем свет (т.е., имеющий длину волны 560 нм) пропускали через стеклянный контейнер, указанный выше. После прохождения через стеклянный контейнер, свет, в конце концов, принимался фотоэлементом. На фиг.5А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения вируса гриппа А в 10%-ной разбавленной пробе, полученной от инфицированного пациента. Пробу получали мазком из зева (throat swab) от инфицированного пациента.
[0044] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS, как указано выше. Сигнал, обнаруженный с использованием PBS (как показывает 501 на фиг.5А), использовали в качестве базового.
[0045] Приблизительно через 1 минуту из контейнера удаляли PBS и добавляли в контейнер разбавленную пробу вируса гриппа А. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 503 на фиг.5А. Через 10 минут разбавленную пробу вируса гриппа А удаляли из контейнера.
[0046] PBS добавляли для промывки контейнера, для удаления неспецифически связанного материала. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 505 на фиг.5А. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 507 на фиг.5А). Разница между световым сигналом, обнаруженным в виде 507, и сигналом, обнаруженным в виде 501, указывала на присутствие вируса гриппа А в пробе.
[Сравнительный пример 2]
[0047] На фиг.5В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения контрольной пробы, полученной от здорового пациента. Способ обнаружения был одним и тем же, что и способ обнаружения разбавленной пробы вируса гриппа А, как указано выше.
[0048] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS. Сигнал, обнаруженный с использованием PBS (как показывает 511 на фиг.5В), использовали в качестве базового.
[0049] Приблизительно через 1 минуту из контейнера удаляли PBS и добавляли в контейнер контрольную пробу. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 513 на фиг.5В. Через 10 минут контрольную пробу удаляли из контейнера.
[0050] Добавляли PBS для промывки контейнера, для удаления неспецифически связанного материала. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показывает 515 на фиг.5В. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 517 на фиг.5В). Сходная интенсивность сигнала 511 и 517 не показала существование вируса гриппа А в контрольной пробе.
[Пример 3]
[Иммобилизация зонда]
[0051] Стеклянный контейнер, сконфигурированный для содержания пробы, помещали в пластиковый держатель, и затем стеклянный контейнер и пластиковый держатель помещали в датчик pTricorder® (Vsense Medtech Taipei, Taiwan). Золото располагали на внутренней поверхности контейнера в форме пленки, имеющей неодинаковую толщину от приблизительно 5 нм до приблизительно 20 нм. Перед внесением зондов в контейнер пленку золота очищали последовательно 0,1М раствором соляной кислоты, очищенной водой, 0,1М гидроксидом натрия и очищенной водой.
[0052] После очистки в контейнер добавляли водный раствор, содержащий 110 мкл цистамина (20 мМ в фосфатно-солевом буферном растворе (PBS) при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности цистамину связаться с золотом на стенке контейнера. Затем оставшийся раствор цистамина удаляли из контейнера. Затем в контейнер добавляли водный раствор, содержащий 110 мкл глутаральдегида (2,5% в растворе PBS при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности глутаральдегиду связаться с цистамином.
[0053] После удаления из контейнера оставшегося раствора глутаральдегида в контейнер добавляли 110 мкл водного раствора коммерчески доступного антитела против вируса гриппа В (20 мкг/мл в растворе PBS при pH 7,2) и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности антителу против вируса гриппа В связаться со сшивающим агентом глутаральдегида. Затем несвязанное антитело против вируса гриппа В удаляли из контейнера отсасывающим насосом датчика через отверстие внизу стеклянного контейнера. Затем в контейнер добавляли водный 0,5 М раствор глицина для взаимодействия с остаточным несвязанным глутаральдегидом. В конце из контейнера удаляли глицин и добавляли в контейнер PBS.
[Обнаружение пробы]
[0054] Датчик дополнительно включает в себя источник видимого света и фотоэлемент для обнаружения вируса гриппа В. Видимый свет передавался от источника видимого света и проходил через светофильтр. Светофильтр конфигурировали для отфильтровывания видимого света и только свет, имеющий длину волны 560 нм, может проходить через светофильтр. Затем свет (т.е., имеющий длину волны 560 нм) пропускали через стеклянный контейнер, указанный выше. После прохождения через стеклянный контейнер, свет, в конце концов, принимался фотоэлементом. На фиг.6А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения вируса гриппа В в 10%-ной разбавленной пробе, полученной от инфицированного пациента. Пробу получали мазком из зева (throat swab) от инфицированного пациента.
[0055] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS, как указано выше. Сигнал, обнаруженный с использованием PBS (как показывает 601 на фиг.6А), использовали в качестве базового.
[0056] Приблизительно через 1 минуту из контейнера удаляли PBS и добавляли в контейнер 10%-ную разбавленную пробу вируса гриппа В. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 603 на фиг.6А. Через 10 минут разбавленную пробу вируса гриппа В удаляли из контейнера.
[0057] PBS добавляли для промывки контейнера, для удаления неспецифически связанного материала. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 605 на фиг.6А. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 607 на фиг.6А). Разница между световым сигналом, обнаруженным в виде 607, и сигналом, обнаруженным в виде 601, указывала на присутствие вируса гриппа В в пробе.
[Сравнительный пример 3]
[0058] На фиг.6В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения контрольной пробы, полученной от здорового пациента. Способ обнаружения был тем же, что и способ обнаружения разбавленной пробы вируса гриппа В, как указано выше.
[0059] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS. Сигнал, обнаруженный с использованием PBS (как показывает 611 на фиг.6В), использовали в качестве базового.
[0060] Приблизительно через 1 минуту из контейнера удаляли PBS и добавляли в контейнер контрольную пробу. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 613 на фиг.6В. Через 10 минут контрольную пробу удаляли из контейнера.
[0061] PBS добавляли для промывки контейнера, для удаления неспецифически связанного материала. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 615 на фиг.6В. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут, для сбора данных для света, обнаруженного в контейнере (как показывает 617 на фиг.6В). Сходная интенсивность сигнала 611 и 617 не показала присутствие вируса гриппа В в контрольной пробе.
[0062] На фиг.7А и 7В представлен вид сверху и вид спереди, соответственно, иллюстративного варианта осуществления сливного устройства 400 датчика для обнаружения целевой мишени (например, биомолекулы). Сливное устройство 400 может включать в себя закрытую камеру 410. Камера 410 может содержать по меньшей мере первое отверстие 420, сконфигурированное для образования воздухонепроницаемого соединения с насосом 423, и второе отверстие 430, сконфигурированное для образования воздухонепроницаемого соединения со вторым отверстием 108 контейнера 101. Первое отверстие 420 и второе отверстие 430 делают на противоположных стенках камеры 410 и смещают относительно друг друга так, чтобы два отверстия 420 и 430 не перекрывались. Насос 423, соединенный с первым отверстием 420, может быть сконфигурирован для отсасывания жидкости из контейнера 101 через второе отверстие 430.
[0063] В некоторых вариантах, насос 423 конфигурируют для создания всасывания для отсасываемого воздуха в контейнере 101 в камеру 410 через второе отверстие 430, и затем в насос 423 через первое отверстие 420. При поступлении воздуха из контейнера 101 в насос 423, жидкость в контейнере 101 засасывается в камеру 410 через второе отверстие 430 и сливается в блок для сбора отходов через третье отверстие 450. Камера 410 дополнительно включает в себя устройство блокировки 440 между первым отверстием 420 и вторым отверстием 430. Устройство блокировки 440 может простираться от стенки, содержащей второе отверстие 430, к противоположной стенке, для предотвращения затекающей в камеру 410 жидкости от засасывания в насос 423.
[0064] На фиг.8А и 8В представлен вид сверху и вид сбоку, соответственно, другого иллюстративного варианта сливного устройства датчика для обнаружения целевой мишени (например, биомолекулы). Сливное устройство 400 может включать в себя камеру 410. Камера 410 может содержать по меньшей мере первое отверстие 420, сконфигурированное для образования герметичного соединения с насосом 423, и второе отверстие 430, сконфигурированное для образования герметичного соединения со вторым отверстием 108 контейнера 101. Первое отверстие 420 и второе отверстие 430 могут быть образованы на одной и той же стенке или различных стенках камеры 410.
[0065] Третье отверстие 460 может быть образовано на стенке камеры 410, и сливное устройство 400 может дополнительно включать в себя первую трубку 470 для соединения камеры 410, через третье отверстие 460, с блоком для сбора отходов 700. Кроме того, сливное устройство 400 может включать в себя вторую трубку 435, соединенную со вторым отверстием 430 изнутри камеры 410, и которая проходит к блоку для сбора отходов 700 внутри первой трубки 470. Вторая трубка 435 может иметь меньший диаметр, чем диаметр первой трубки 470. Насос 423, соединенный с первым отверстием 420, может быть сконфигурирован для отсасывания жидкости из контейнера 101 через второе отверстие 430.
[0066] В некоторых вариантах, воздух (показанный в виде стрелки на фиг.8А и 8В) в контейнере 101 может поступать во вторую трубку 435 через второе отверстие 430, в камеру 410 через по меньшей мере первую трубку 470, и в насос 423 через первое отверстие 420. При поступлении воздуха из контейнера 101 в насос 423, жидкость в контейнере 101 также всасывается во вторую трубку 435 через второе отверстие 430 и сливается в блок для сбора отходов 700. Вторая трубка 435, которая сливает жидкость из контейнера 101 в блок для сбора отходов 700, может предотвращать жидкость от засасывания в насос 423.
[0067] На фиг.9 представлен еще один иллюстративный вариант сливного устройства 400 датчика для обнаружения целевой мишени (например, биомолекулы). Сливное устройство 400 может включать в себя первую трубку 480, с одним концом, соединенным с блоком для сбора отходов 700, и с другим концом, сконфигурированным для образования герметичного соединения со вторым отверстием 108 контейнера 101 датчика. Сливное устройство 400 может дополнительно включать в себя вторую трубку 490 с одним концом, соединенным с блоком для сбора отходов 700, и с другим концом, сконфигурированным для образования герметичного соединения с насосом 423.
[0068] Воздух (показанный в виде стрелки на фиг.9) в контейнере 101 может поступать в блок для сбора отходов 700 через первую трубку 480 и затем в насос 423 через вторую трубку 490. При поступлении воздуха из контейнера 101 в насос 423, жидкость в контейнере 101 также всасывается в блок для сбора отходов 700 через первую трубку 480, но не засасывается во вторую трубку 490. Сливное устройство 400 может дополнительно включать в себя клапан 485, расположенный на пути первой трубки 480, и сконфигурированный для позволения потоку жидкости и воздуха поступать в направлении, указанном стрелкой, но не в обратном направлении, для предотвращения обратного тока жидкости в блок для сбора отходов 700.
[0069] Кроме того, водоблокирующее устройство 495 может быть расположено во второй трубке 490, сконфигурированное для позволения потоку воздуха поступать из блока для сбора отходов 700 в насос 423, наряду с предотвращением воды и пара в блоке для сбора отходов 700 от попадания в насос 423. Водоблокирующее устройство 495 может содержать водонепроницаемую и воздухопроницаемую мембрану, такую как гидрофобная микропористая полимерная мембрана, содержащая полиуретан (PU), политетрафторэтилен (PTFE), расширенный политетрафторэтилен (ePTFE) или ePTFE с PU. Примеры коммерчески доступной водонепроницаемого и воздухопроницаемого материала могут включать в себя, но не ограничиваются ими, MemBrain® компании Marmot (PU), POWERTEX® компании Salewa (PU), EFMaflon® компании EMF (PTFE), gore tex performance shell™ компании GORE-TEX® (ePTFE) или eVent Direct Venting™ компании eVent (ePTFE с PU).
[Пример 4]
[Иммобилизация зонда]
[0070] Контейнер, сконфигурированный для содержания пробы, помещали в пластиковый держатель, и затем контейнер и пластиковый держатель помещали в датчик pTricorder® (Vsense Medtech. Co., Ltd., Taipei, Taiwan). Золото располагали на внутренней поверхности контейнера в форме пленки, имеющей толщину приблизительно 100 нм. Перед внесением зондов в контейнер пленку золота очищали последовательно 0,1М раствором соляной кислоты, очищенной водой, 0,1М гидроксидом натрия и дистиллированной водой.
[0071] После очистки в контейнер добавляли водный раствор, содержащий 110 мкл цистамина (20 мМ в фосфатно-солевом буферном растворе (PBS) при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности цистамину связаться с золотом на стенки контейнера. Затем оставшийся раствор цистамина удаляли из контейнера. Затем в контейнер добавляли водный раствор, содержащий 110 мкл глутаральдегида (2,5% в растворе PBS при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности глутаральдегиду связаться с цистамином.
[0072] После удаления из контейнера оставшегося раствора глутаральдегида, в контейнер добавляли 110 мкл водного раствора коммерчески доступных моноклональных антител против энтеровируса 71 типа и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности моноклональным антителам против энтеровируса 71 типа связаться со сшивающим агентом глутаральдегида. Затем несвязанное моноклональное антитело против энтеровируса 71 типа удаляли из контейнера отсасывающим насосом датчика, как показано на фиг.7А и 7В, через отверстие внизу контейнера. Затем водный раствор 0,5М глицина добавляли в контейнер для взаимодействия с остаточным несвязанным глутаральдегидом. В заключение, из контейнера удаляли глицин и добавляли в контейнер PBS.
[Обнаружение пробы]
[0073] Датчик дополнительно включает в себя источник видимого света и фотоэлемент для обнаружения энтеровируса 71 типа. Видимый свет передавался от источника видимого света и проходил через светофильтр. Светофильтр конфигурировали для отфильтровывания видимого света и только свет, имеющий длину волны 560 нм, может проходить через светофильтр. Затем свет (т.е., имеющий длину волны 560 нм) пропускали через контейнер, указанный выше. После прохождения через контейнер, свет, в конце концов, принимался фотоэлементом. На фиг.10А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения энтеровируса 71 типа в 10%-ной разбавленной пробе, полученной от инфицированного пациента. Пробу получали мазком из зева (throat swab) от инфицированного пациента.
[0074] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS, как указано выше. Сигнал, обнаруженный с использованием PBS (как показывает 1001 на фиг.10А), использовали в качестве базового.
[0075] Приблизительно через 1 минуту PBS удаляли из контейнера и добавляли в контейнер 10%-ную разбавленную пробу энтеровируса 71 типа с последующим взаимодействием с зондом. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 1003 на фиг.10А. Через 10 минут пробу, содержащую энтеровирус 71 типа, удаляли из контейнера.
[0076] PBS добавляли для промывки контейнера, для удаления неспецифически связанного энтеровируса 71 типа и других примесей. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 1005 на фиг.10А. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут, для сбора данных для света, обнаруженного в контейнере (как показывает 1007 на фиг.10А). Разница между световым сигналом, обнаруженным в виде 1007, и сигналом, обнаруженным в виде 1001, указывала на присутствие энтеровируса 71 типа в пробе.
[Сравнительный пример 4]
[0077] На фиг.10В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения контрольной пробы, полученной от здорового пациента. Способ обнаружения был одним и тем же, что и способ обнаружения 10%-ной разбавленной пробы, содержащей энтеровирус 71 типа, как указано выше.
[0078] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS. Сигнал, обнаруженный с использованием PBS (как показывает 1011 на фиг.10В), использовали в качестве базового.
[0079] Приблизительно через 1 минуту из контейнера удаляли PBS и добавляли в контейнер контрольную пробу. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 1013 на фиг.10В. Через 10 минут контрольную пробу удаляли из контейнера.
[0080] PBS добавляли для промывки контейнера, для удаления неспецифически связанного материала. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 1015 на фиг.10В. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 1017 на фиг.10В). Сходная интенсивность сигнала 1011 и 1017 не показала существование энтеровируса 71 типа в контрольной пробе.
[Пример 5]
[Иммобилизация зонда]
[0081] Контейнер, сконфигурированный для содержания пробы, помещали в пластиковый держатель, и затем контейнер и пластиковый держатель помещали в датчик pTricorder® (Vsense Medtech. Co., Ltd., Taipei, Taiwan). Золото располагали на внутренней поверхности контейнера в форме пленки, имеющей неодинаковую толщину, которая варьируется от приблизительно 0,5 нм до приблизительно 30 нм. Перед внесением зондов в контейнер пленку золота очищали последовательно 0,1 М раствором соляной кислоты, дистиллированной водой, 0,1 М гидроксидом натрия и дистиллированной водой.
[0082] После очистки в контейнер добавляли водный раствор, содержащий 110 мкл цистамина (20 мМ в фосфатно-солевом буферном растворе (PBS) при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности цистамину связаться с пленкой золота на стенке контейнера. Затем оставшийся раствор цистамина удаляли из контейнера. Затем в контейнер добавляли водный раствор, содержащий 110 мкл глутаральдегида (2,5% в растворе PBS при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности глутаральдегиду связаться с цистамином.
[0083] После удаления из контейнера оставшегося раствора глутаральдегида, в контейнер добавляли 110 мкл водного раствора коммерчески доступных моноклональных антител против энтеровируса 71 типа и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности моноклональным антителам против энтеровируса 71 типа связаться со сшивающим агентом глутаральдегида. Затем несвязанное моноклональное антитело против энтеровируса 71 удаляли из контейнера отсасывающим устройством датчика, как показано на фиг.8А и 8В, через отверстие в нижней части контейнера. Затем водный раствор 0,5М глицина добавляли в контейнер для взаимодействия с остаточным несвязанным глутаральдегидом. В заключение, из контейнера удаляли глицин и добавляли в контейнер PBS.
[Обнаружение пробы]
[0084] Датчик дополнительно включает в себя источник видимого света и фотоэлемент для обнаружения энтеровируса 71 типа. Видимый свет передавался от источника видимого света и проходил через светофильтр. Светофильтр конфигурировали для отфильтровывания видимого света и только свет, имеющий длину волны 560 нм, может проходить через светофильтр. Затем свет (т.е., имеющий длину волны 560 нм) пропускали через стеклянный контейнер, указанный выше. После прохождения через стеклянный контейнер, свет, в конце концов, принимался фотоэлементом. На фиг.11А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения энтеровируса 71 в 10%-ной разбавленной пробе, содержащей энтеровирус 71 типа, полученной от инфицированного пациента. Пробу получали мазком из зева (throat swab) от инфицированного пациента.
[0085] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS, как указано выше. Сигнал, обнаруженный с использованием PBS (как показывает 1101 на фиг.11А), использовали в качестве базового.
[0086] Приблизительно через 1 минуту PBS удаляли из контейнера и добавляли в контейнер 10%-ную разбавленную пробу, содержащую энтеровирус 71 типа. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 1103 на фиг.11А. Через 10 минут разбавленную пробу удаляли из контейнера.
[0087] PBS добавляли для промывки контейнера, для удаления неспецифически связанного энтеровируса 71 типа и других примесей. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 1105 на фиг.11А. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 1107 на фиг.11А). Разница между световым сигналом, обнаруженным в виде 1107, и сигналом, обнаруженным в виде 1101, указывала на присутствие энтеровируса 71 типа в пробе.
[Сравнительный пример 5]
[0088] На фиг.11В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения контрольной пробы, полученной от здорового пациента. Способ обнаружения был одним и тем же, что и способ обнаружения 10%-ной разбавленной пробы, содержащей энтеровирус 71 типа, как указано выше.
[0089] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS. Сигнал, обнаруженный с использованием PBS (как показывает 1111 на фиг.11В), использовали в качестве базового.
[0090] Приблизительно через 1 минуту из контейнера удаляли PBS и добавляли в контейнер контрольную пробу. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 1113 на фиг.11В. Через 10 минут контрольную пробу удаляли из контейнера.
[0091] PBS добавляли для промывки контейнера, для удаления неспецифически связанного материала. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 1115 на фиг.11В. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 1117 на фиг.11В). Сходная интенсивность сигнала 1111 и 1117 не показала существование энтеровируса 71 типа в контрольной пробе.
[Пример 6]
[Иммобилизация зонда]
[0092] Контейнер, сконфигурированный для содержания пробы, помещали в пластиковый держатель, и затем контейнер и пластиковый держатель помещали в датчик pTricorder® (Vsense Medtech. Co., Ltd., Taipei, Taiwan). Золото располагали на внутренней поверхности контейнера в форме пленки, имеющей структуру массива (array) стержней. Стержень массива стержней имеет длину приблизительно 500 нм, ширину приблизительно 500 нм и высоту приблизительно 100 нм, и каждый стержень отстоит от другого стержня (на расстоянии) приблизительно 500 нм. Перед внесением зондов в контейнер пленку золота очищали последовательно 0,1М раствором соляной кислоты, дистиллированной водой, 0,1М гидроксидом натрия и дистиллированной водой.
[0093] После очистки в контейнер добавляли водный раствор, содержащий 110 мкл цистамина (20 мМ в фосфатно-солевом буферном растворе (PBS) при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности цистамину связаться с пленкой золота на стенке контейнера. Затем оставшийся раствор цистамина удаляли из контейнера. Затем в контейнер добавляли водный раствор, содержащий 110 мкл глутаральдегида (2,5% в растворе PBS при pH 7,2), и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности глутаральдегиду связаться с цистамином.
[0094] После удаления из контейнера оставшегося раствора глутаральдегида, в контейнер добавляли 110 мкл водного раствора коммерчески доступных моноклональных антител против энтеровируса 71 типа и инкубировали в течение 20 минут при комнатной температуре для предоставления возможности моноклональным антителам против энтеровируса 71 типа связаться со сшивающим агентом глутаральдегида. Затем несвязанное моноклональное антитело против энтеровируса 71 удаляли из контейнера отсасывающим устройством датчика, как показано на фиг.9, через отверстие в нижней части контейнера. Затем водный раствор 0,5М глицина добавляли в контейнер для взаимодействия с остаточным несвязанным глутаральдегидом. В заключение, из контейнера удаляли глицин и добавляли в контейнер PBS.
[Обнаружение пробы]
[0095] Датчик дополнительно включает в себя источник видимого света и фотоэлемент для обнаружения энтеровируса 71 типа. Видимый свет передавался от источника видимого света и проходил через светофильтр. Светофильтр конфигурировали для отфильтровывания видимого света и только свет, имеющий длину волны 560 нм, может проходить через светофильтр. Затем свет (т.е., имеющий длину волны 560 нм) пропускали через контейнер, указанный выше. После прохождения через контейнер, свет, в конце концов, принимался фотоэлементом. На фиг.12А представлен график, иллюстрирующий интенсивность сигнала во время обнаружения энтеровируса 71 типа в 10%-ной разбавленной пробе, полученной от инфицированного пациента. Пробу получали мазком из зева (throat swab) от инфицированного пациента.
[0096] Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS, как указано выше. Сигнал, обнаруженный с использованием PBS (как показывает 1201 на фиг.12А), использовали в качестве базового.
[0097] Приблизительно через 1 минуту PBS удаляли из контейнера и добавляли в контейнер 10%-ную разбавленную пробу, содержащую энтеровирус 71 типа, с последующим взаимодействием с зондом. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 1203 на фиг.12А. Через 10 минут пробу, содержащую энтеровирус 71 типа, удаляли из контейнера.
[0098] PBS добавляли для промывки контейнера, для удаления неспецифически связанного энтеровируса 71 типа и других примесей. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 1205 на фиг.12А. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 1207 на фиг.12А). Разница между световым сигналом, обнаруженным в виде 1207, и сигналом, обнаруженным в виде 1201, указывала на присутствие энтеровируса 71 типа в пробе.
[Сравнительный пример 6]
[0099] На фиг.12В представлен график, иллюстрирующий интенсивность сигнала во время обнаружения контрольной пробы, полученной от здорового пациента. Способ обнаружения был одним и тем же, что и способ обнаружения 10%-ной разбавленной пробы, содержащей энтеровирус 71 типа, как указано выше.
[00100]Датчик включали так, что свет, переданный от источника света датчика, проходил через контейнер и через зонды на внутренней поверхности контейнера. На этой стадии контейнер содержал PBS. Сигнал, обнаруженный с использованием PBS (как показывает 1211 на фиг.12В), использовали в качестве базового.
[00101] Приблизительно через 1 минуту из контейнера удаляли PBS и добавляли в контейнер контрольную пробу. Данные собирали в течение 10 минут. Свет, обнаруженный в контейнере, показан в виде 1213 на фиг.12В. Через 10 минут контрольную пробу удаляли из контейнера.
[00102] PBS добавляли для промывки контейнера, для удаления неспецифически связанного материала. Промывку повторяли несколько раз. Промывка вызывала различные острые пики, как показано в виде 1215 на фиг.12В. После промывки в контейнер добавляли PBS и собирали данные в течение 3 минут для сбора данных для света, обнаруженного в контейнере (как показывает 1217 на фиг.12В). Сходная интенсивность сигнала 1211 и 1217 не показала существование энтеровируса 71 типа в контрольной пробе.
[00103] Несмотря на то, что изложенное выше изобретение было описано более подробно путем иллюстрации и примеров для целей ясности понимания, специалистам в данной области будет очевидно, что конкретные модификации и изменения могут быть осуществлены без отклонения от сущности и объема настоящего изобретения. Таким образом, описание не следует истолковывать как ограничивающие объем данного изобретения.
[00104] Все публикации, патенты и патентные заявки, цитируемые здесь, включены в данное описание посредством ссылки полностью для всех целей и в той же степени, как если бы каждая отдельная публикация, патент или патентная заявка были конкретно и отдельно указаны, будучи включенными посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДАТЧИК ДЛЯ ОБНАРУЖЕНИЯ ЦЕЛЕВОЙ МИШЕНИ | 2013 |
|
RU2553369C2 |
| ДАТЧИК ДЛЯ ОБНАРУЖЕНИЯ ЦЕЛЕВОЙ МИШЕНИ | 2013 |
|
RU2553626C2 |
| ДАТЧИК ДЛЯ ОБНАРУЖЕНИЯ ЦЕЛЕВОЙ МИШЕНИ | 2013 |
|
RU2553371C2 |
| БИОСЕНСОР | 2012 |
|
RU2546018C2 |
| СПОСОБ ДЕТЕКЦИИ БЕЛКОВ | 2012 |
|
RU2606852C2 |
| НАНОДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ ВИРУСА ГЕПАТИТОВ | 2004 |
|
RU2315999C2 |
| СПОСОБ ДИАГНОСТИКИ ВИРУСОВ И ЛУНКА ДЛЯ ПРИМЕНЕНИЯ В ДАННОМ СПОСОБЕ | 2006 |
|
RU2450055C2 |
| ВЕЩЕСТВА, ВКЛЮЧАЮЩИЕ КЕРАМИЧЕСКИЕ ЧАСТИЦЫ ДЛЯ ДОСТАВКИ БИОМОЛЕКУЛ | 2011 |
|
RU2600841C2 |
| СПОСОБ ОБНАРУЖЕНИЯ АНТИТЕЛА В ПРОБЕ С ИСПОЛЬЗОВАНИЕМ ХЕМИЛЮМИНЕСЦЕНТНОГО СОЕДИНЕНИЯ И СПОСОБ ИЗМЕРЕНИЯ КОНЦЕНТРАЦИИ И/ИЛИ ОТНОСИТЕЛЬНОГО СОДЕРЖАНИЯ СПЕЦИФИЧЕСКОГО АНТИТЕЛА В ПРОБЕ | 1993 |
|
RU2132070C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ ИММУННОГО ОТВЕТА (ВАРИАНТЫ) | 1996 |
|
RU2197733C2 |





Изобретение относится к области иммунологического анализа и предназначено для обнаружения целевой мишени путем взаимодействия биомолекулы с молекулой-мишенью. Датчик для обнаружения целевой мишени включает в себя устройство для связывания целевой мишени и сливное устройство для слива жидкости из устройства. При этом устройство для связывания целевой мишени содержит контейнер с подложкой, материал, содержащий металл, расположенный на подложке, представляющий собой пленку или массив стержней, конфигурированных для рассеяния света, и зонд, расположенный на материале и сконфигурированный для связывания с целевой мишенью, а также сконфигурированный для рассеяния света, излучаемого источником света при связывании целевой мишени с зондом. Сливное устройство содержит первое отверстие для соединения с насосом, второе отверстие для соединения с выходом устройства, при этом отверстия расположены на противоположенных стенках камеры и смещены относительно друг друга. Сливное устройство также содержит устройство блокировки, которое простирается от стенки, содержащей второе отверстие, к противоположной стенке. Заявленный датчик обеспечивает обнаружение молекулы-мишени в течение относительно короткого периода времени. 17 з.п. ф-лы, 12 ил., 6 пр.
1. Датчик для обнаружения целевой мишени, содержащий:
устройство для связывания целевой мишени, устройство, содержащее:
контейнер;
подложку, конфигурированную в контейнере;
материал, содержащий металл, расположенный на подложке; где материал имеет структуру пленки или массив стержней, конфигурированных для рассеяния света, испускаемого источником света, и
зонд, расположенный на материале и конфигурированный для связывания с целевой мишенью, где зонд конфигурируют на материале для рассеяния света, излучаемого источником света при связывании целевой мишени с зондом;
сливное устройство для отсасывания жидкости из устройства, которое содержит
первое отверстие для соединения с насосом; и
второе отверстие для соединения с выходом устройства;
при этом насос конфигурируют для создания всасывания всасываемого воздуха из устройства в камеру сливного устройства и затем по направлению к насосу, при этом первое и второе отверстия делают на противоположных стенках камеры и смещают друг относительно друга и устройство блокировки между первым отверстием и вторым отверстием, при этом устройство блокировки простирается от стенки, содержащей второе отверстие, к противоположной стенке.
2. Датчик по п. 1, где камера дополнительно содержит: сливное отверстие для слива жидкости из камеры в блок для сбора отходов.
3. Датчик по п. 1, где сливное устройство дополнительно содержит:
камеру, содержащую первое и второе отверстия;
первую трубку для соединения камеры с блоком для сбора отходов; и
вторую трубку внутри камеры, простирающейся от второго отверстия и внутрь первой трубки.
4. Датчик по п. 1, где сливное устройство дополнительно содержит:
первую трубку для соединения устройства с блоком для сбора отходов; и
вторую трубку для соединения насоса и блок для сбора отходов.
5. Датчик по п. 4, где сливное устройство дополнительно содержит:
набор устройства для блокирования обратного потока в первой трубке, и которое конфигурируют для того, чтобы позволить воздуху и жидкости вытекать из устройства в блок для сбора отходов и блокировать вытекание жидкости из блока для сбора отходов в устройство.
6. Датчик по п. 5, где устройство блокирования обратного потока содержит клапан.
7. Датчик по п. 4, где сливное устройство дополнительно содержит:
набор для водоблокирующего устройства во второй трубке, и которое конфигурируют для того, чтобы позволить воздуху вытекать из блока для сбора отходов в насос и блокировать поступление воды из блока для сбора отходов в насос.
8. Датчик по п. 7, где водоблокирующее устройство содержит водостойкую и воздухопроницаемую полимерную мембрану.
9. Датчик по п. 8, где полимерная мембрана содержит гидрофобную микропористую полимерную мембрану, содержащую по меньшей мере один из полимеров, таких как полиуретан (PU), политетрафторэтилен (PTFE) и расширенный политетрафторэтилен (ePTFE).
10. Датчик по п. 1, где зонд содержит ДНК, РНК, белок, антитело, фрагмент антитела, аптамер или антиген.
11. Датчик по п. 1, где целевая мишень представляет собой биомолекулу.
12. Датчик по п. 1, где мишень содержит вирус, белок, нуклеиновую кислоту, углевод, липид, гаптен или токсин.
13. Датчик по п. 1, где зонд связывается с целевой мишенью с аффинностью приблизительно от 100 пиконьютонов до приблизительно 500 пиконьютонов.
14. Датчик по п. 1, где пленка содержит по существу одинаковую толщину или неодинаковую толщину.
15. Датчик по п. 14, где по существу одинаковая толщина находится в диапазоне от 5 нм до 200 нм, или неодинаковая толщина изменяется от 0,5 нм до 30 нм.
16. Датчик по п. 1, где размер стержня в массиве стержней связан с размером зонда и размером целевой мишени, для которой конфигурируют зонд для связывания.
17. Датчик по п. 1, где стержень массива стержней имеет длину от 200 до 900 нм, ширину от 200 до 900 нм и высоту от 15 до 1500 нм.
18. Датчик по п. 1, дополнительно содержащий:
источник света, который излучает свет;
приемник света для приема света; и
детектор, конфигурированный для генерирования электрического сигнала, величина которого отражает количество света, которое принимается приемником света,
где устройство размещают между источником света и приемником света, и
где устройство конфигурируют так, что зонд находится на пути света, излучаемого источником света.
| US 2010068824 A1, 18.03.2010 | |||
| US 2005226129 A1, 13.10.2005 | |||
| WO 2011078794 A1, 30.06.2011 | |||
| WO 9822808 A1, 28.05.1998 | |||
| WO 2011053794 A1, 03.03.2011 |
Авторы
Даты
2015-04-10—Публикация
2013-06-06—Подача