Изобретение касается способа обнаружения антитела в пробе при помощи хемилюминесцентной метки, а также способа измерения концентрации и/или относительного содержания антитела в пробе.
Более конкретно, изобретение касается применения хемилюминесцентного сложноэфирного соединения, содержащего акридин, связанного с авидином или стрептавидином, и лиганда, связанного с биотином, в двухсайтовом иммуноанализе, в котором афинный комплекс улавливается на парамагнитных частицах, что позволяет осуществить быстрое обнаружение и/или количественное измерение иммунологически активных веществ, таких как антитела, в таких пробах, как биологические пробы жидкости и ткани, пробы молока и пищевых продуктов, напитки, вода или промышленные сточные воды.
Способ обнаружения и количественного определения иммуноглобулиновых E-антител в сыворотке описан в брошюре "Specific IgE, Magic® Lite SQTM", опубликованной Ciba Corning Diagnostics Corp. and ALK Laboratories в сентябре 1990 г. В этом способе специфический аллерген, ковалентно связанный с парамагнитными частицами, реагирует с аллерген-специфическим IgE-антителом в пробе сыворотки или плазмы. После первого периода инкубирования и отмывания несвязавшегося неспецифического IgE, добавляют антитело против IgE, меченое хемилюминесцентным, содержащим акридин, сложным эфиром. После второго периода инкубирования связанное с твердой фазой и меченое антитело измеряют в анализаторе Magic Lite® Analyses (Cat. N 472733 или Cat. N 472270), который автоматически вводит реагенты, инициирующие хемилюминесцентную реакцию. При использовании этого способа только конечная стадия инициации и измерения хемилюминесценции может быть автоматизирована. Хемилюминесцентное, содержащее акридин сложноэфирное соединение описано в патенте США N 4745181.
Патент США N 4946958 описывает хемилюминесцентный, содержащий акридин, сложный эфир, связанный с N-сукцинимидильной группой, которая может быть дополнительно связана с белком или полипептидом для обеспечения иммунологически реакционноспособного люминесцентного реагента. Этот реагент можно использовать в иммуноанализе, который может предусматривать одновременное связывание твердофазного антитела, молекулы антигена и меченого антитела, отделение и промывание твердой фазы и количественное измерение люминесценции твердой фазы. Strasburer et al. описывает в Methods in Enzymology, 184 (1990), pp. 481-496 применение двухсайтового хемилюминесцентного иммуноанализа, в котором гормоны LGH и LCG улавливаются антителами, иммобилизованными на микротитровальных чашках и меченными хемилюминесцентным агентом, связанным с авидином через меченное биотином второе антитело. Антигенные аналиты, такие как белковые гормоны, могут анализироваться непосредственно из проб сыворотки и сравниваться со стандартными кривыми. Однако концентрация иммуноглобулинов, таких как IgE, чрезвычайно зависит от конкретного больного, и анализ специфического IgE следует сравнивать с индивидуальным уровнем общего IgE этого больного, и, следовательно, требуется анализ, имеющий больший динамический диапазон, чем получаемый в анализе по Страсбургеру.
EP A 0425217 описывает гибридизационный анализ, в котором образуется хемилюминесцентный комплекс, содержащий нуклеиновую кислоту, гибридизированную с первым меченым нуклеотидным зондом, связанным с парамагнитными частицами, и второй нуклеотидный зонд, меченный биотином и связанный с авидин-акридиновым эфиром. Однако специалист в данной области, знакомый с проблемой обеспечения полностью автоматизированного способа детектирования антител, будет искать способ, который можно проводить в контейнере для одной реакции и предпочтительно в условиях окружающей среды. Анализ, представленный здесь, существенно отличается, т.к. он применяет детектирование специфических нуклеотидных последовательностей, которые не являются антигенами, против которых могут быть выработаны антитела. Более конкретно, в этом анализе необходимо использовать повышенные температуры для гибридизации и гаптен-олигонуклеотидный зонд, который не является ни обязательным, ни желательным в иммуноанализах.
До настоящего времени иммуноанализы для количественного определения иммунологически активных молекул, таких как иммуноглобулины (например, специфический иммуноглобулин-E), в биологических жидкостях, таких как сыворотка, осуществляли вручную, например твердофазный иммуноферментный анализ (ELISA), или полуавтоматически. Обычная продолжительность полуавтоматического иммуноанализа, такого как Magic® Lite SQTM специфического анализа для IgE, указанного выше, равна приблизительно 2 часам.
Кроме того, коммерческие специфические тесты на IgE (CAP, RAST, поставляемые Pharmacia Uppsala) и специфический тест на IgE Magic® Lite 5Q используют стандартный анализ общего (тотального) IgE, имеющий неидентичный протокол, что приводит к неточным данным. Можно сравнивать только анализы, использующие одинаковые процедуры связывания и детектирования. Например, все кривые ответной реакции специфического IgE должны идти параллельно кривым ответа общего IgE. Причиной является то, что требуемый динамический диапазон для анализа специфического (или общего?) IgE составляет 2 декады, а требуемый динамический диапазон для анализа общего IgE составляет 2 - 7 декад, а существующие иммуноанализы не позволяют измерять концентрации во всем диапазоне. Поэтому до настоящего времени было необходимо использовать разные протоколы анализов на специфический и общий иммуноглобулин, с применением различных реагентов.
Вследствие растущего интереса к безопасности лабораторных процедур возникла потребность в полностью автоматизированном способе обнаружения веществ, таких как антитела, в биологических жидкостях, таких как сыворотка человека, плазма, кровь, молоко, моча или слюна, который бы снизил до минимума риск контакта с вредными жидкостями. Кроме того, распространение лабораторных тестов в диагностике требует способов короткой продолжительности, предпочтительно всего лишь несколько минут.
Таким образом, задачей изобретения является обеспечение такого способа обнаружения антитела в пробе, который является безопасным, быстрым и может быть полностью автоматизирован.
Эта задача решается способом по изобретению, предусматривающим: a) смешивание лиганда-антигена, антитела или гаптена, связанного с биотином или его функциональным производным, с антителом, направленным против упомянутого детектируемого антитела, связанным с парамагнитными частицами; с хемилюминесцентным соединением акридина, связанного с авидином, стрептавидином или его функциональным производным, и с пробой с образованием связанного с твердой фазой комплекса; b) магнитное отделение твердой фазы от жидкой фазы; c) инициирование хемилюминесцентной реакции и анализ отделенной твердой фазы на присутствие хемилюминесцентного комплекса, причем наличие хемилюминесценции является указанием на присутствие антитела в данной пробе.
Хотя способ по изобретению можно проводить по описанным выше стадиям (a), (b) и (c), предпочтительно добавлять меченое соединение в отдельной стадии, и поэтому способ предпочтительно осуществлять со следующими стадиями: i) смешивание лиганда-антигена, антитела или гаптена, связанного с биотином или его функциональным производным, с пробой и антигеном против детектируемого антитела, связанным с парамагнитными частицами, для образования первого твердофазного комплекса; ii) добавление хемилюминесцентного соединения акридина, ковалентно связанного с авидином, стрептавидином или его функциональным производным для образования второго твердофазного комплекса; iii) магнитное отделение твердой фазы от жидкой фазы; iv) инициирование хемилюминесцентной реакции и анализ отделенной твердой фазы на присутствие хемилюминесцентного комплекса.
Особой задачей изобретения является обеспечение полностью автоматизированного иммуноанализа для количественного определения специфических антител, таких как иммуноглобулины, в котором в качестве стандарта используют истинно параллельный стандартный иммуноанализ, применяющий идентичный протокол.
Задача количественного определения специфических антител с применением истинно параллельного стандартного иммуноанализа решается посредством способа измерения концентрации и/или относительного содержания специфического антитела в жидкой пробе, в котором измеренную эмиссию света отделенной твердой фазы, содержащей захваченное специфическое антитело, связанное с хемилюминесцентной меткой, сравнивают с измеренной эмиссией света, полученной в параллельном стандартном иммуноанализе, в котором измеряют общее содержание того же класса антител в пробе, к которому принадлежит детектируемое специфическое антитело, причем этот способ предусматривает следующие стадии:
a) смешивание лиганда-антигена или гептена, к которому направляется измеряемое антитело, связанное с биотином или его функциональным производным; антитела, направленного против константной части измеряемого антитела, связанного с парамагнитными частицами; и хемилюминесцентного соединения акридина, связанного с авидином, стрептавидином или его функциональным производным, с пробой для образования первого трведофазного комплекса; b) магнитное отделение указанной первой твердой фазы от жидкой фазы; c) инициирование хемилюминесцентной реакции и измерение эмиссии света отделенной первой твердой фазы; g) смешивание лигандного антитела, направленного против класса измеряемых антител, связанного с биотином или его функциональным производным; антитела, направленного на константную область измеряемых антител, связанного с парамагнитными частицами; и хемилюминесцентного соединения акридина, связанного с авидином, стрептавидином или его функциональным производным, с пробой для образования второго твердофазного комплекса; e) магнитное отделение второй твердой фазы от жидкой фазы, f) инициирование хемилюминесцентной реакции и измерение эмиссии света отделенной второй твердой фазой и g) сравнение эмиссии света отделенной первой твердой фазы с эмиссией света отделенной второй твердой фазы.
В предпочтительном варианте, стадию a) описанного выше способа выполняют путем (i) смешивания лиганда-антигена или гаптена, связанного с биотином или его функциональным производным, с пробой и антителом, связанным с парамагнитными частицами для образования твердофазного комплекса, и (ii) добавления хемилюминесцентного соединения акридина, связанного с авидином, стрептавидином или его функциональным производным, для образования первого твердофазного комплекса, а стадию (d) выполняют путем (i) смешивания лигандного антитела, связанного с биотином или его функциональным производным, с пробой и антителом, связанным с парамагнитными частицами, для образования твердофазного комплекса, и (ii) добавления хемилюминесцентного соединения акридина, ковалентно связанного с авидином, стрептавидином или его функциональным производным, для образования второго твердофазного комплекса.
Измеряемое специфическое антитело в пробе представляет собой предпочтительно специфический иммуноглобулин, выбранный из группы, состоящей из IgA, IgD, IgE, IgG и IgM и их изотипов, а лиганд-антиген, антитело или гаптен, направленный против изменяющейся части этого антитела, представляет собой аллерген, а класс антител предпочтительно является классом иммуноглобулинов, выбранных из группы, состоящей из общего (тотального) IgA, общего IgD, общего IgE, общего IgG, общего IgM и их изотипов, и лигандные антиген, антитело или гаптен представляют собой антитело, направленное против этого класса иммуноглобулина.
Более предпочтительно, специфический иммуноглобулин является специфическим IgE, а класс антител представляет собой общий IgE.
Антитело, направленное против измеряемого антитела, связанное с парамагнитными частицами, предпочтительно выбирают из группы, состоящей из поликлональных антител, моноклональных антител, в том числе рекомбинантных антител, фрагментированных антител, предпочтительно моноклонального мышиного антииммуноглобулина.
Настоящее изобретение имеет следующие преимущества: все реагенты можно смешивать одновременно в одной реакционной емкости, что уменьшает опасность загрязнения, ошибки и количество операций, значительно уменьшает продолжительность иммуноанализа, существенно облегчает автоматизацию процесса и улучшает его точность, сравни пример 6; количественное определение специфических антител, например, в пробе сыворотки можно выполнять в сравнении с истинно параллельным анализом общих атнтител с использованием идентичного протокола, сравни пример 3; полученные большая эффективность и чувствительность позволяют детектировать даже очень низкие концентрации иммуноглобулинов и низкие концентрации специфических иммуноглобулинов, сравни примеры 1, 2 и 7.
В предпочтительном варианте изобретение предлагает способ иммуноанализа для обнаружения антител, таких как специфические иммуноглобулины (IgA, IgE, IgG, IgM и их изотипы), в пробе, такой как сыворотка или слюна.
В частности, изобретение можно использовать в анализе для обнаружения и количественного определения специфического IgE в пробе. Если проба является жидкой, например, такой как сыворотка или плазма, она может быть добавлена непосредственно в реакционный контейнер, содержащий предпочтительно моноклональное мышиное анти-IgE антитело, связанное с суспендированными парамагнитными частицами, и специфический аллерген (лиганд), связанный с биотином, в водной среде. Биотин предпочтительно представляет собой биотин-амидокапроат-N-гидроксисукцинимида (сложный эфир) (Sigma Catalog N B2643). Если проба не жидкая, например, такая как проба ткани, ее предпочтительно гомогенизируют и суспендируют в водной жидкости. Одновременная реакция между специфическим IgE в пробе, аллергеном и моноклональным антителом против IgE в водной среде приводит к образованию конъюгата. Хемилюминесцентное меченое соединение, предпочтительно сложный эфир акридина, соединенный со стрептавидином (Sigma Catalog N 4762 (авидин-DMAE), добавляют к реакционному контейнеру, где происходит реакция связывания между авидин-DMAE и биотином, связанным с конъюгатом, и неконъюгированным аллерген-связанным биотионом. Связавшуюся с конъюгатом метку отделяют от несвязавшегося DMAE-меченого антитела магнитным разделением реакционной смеси и декантированием супернатанта. Хемилюминесценцию отделенного конъюгата измеряют, как описано в Pazzagli, M. et. al. (eds). Studies and applocations in "Biology and Medicine", J. of Bioluminescence and Chemiluminescence 4(1), 1-646, 1989.
Одновременно выполняют, как эталон (стандарт), истинно параллельный иммуноанализ общего IgE, отличающийся только тем, что в качестве лиганда применяют предпочтительно поликлональное анти-IgE антитело, связанное с биотином.
На фиг. 1 дана схема анализа специфического IgE в соответствии с изобретением, предусматривающего параллельный анализ общего IgE в качестве стандарта. Здесь (1) обозначает детектируемое специфическое IgE - антитело, (2) обозначает специфический аллерген, связанный с биотином, (3) обозначает моноклональный мышиный анти-IgE, связанный с парамагнитными частицами, (4) обозначает авидин-акридиниевый эфир и (5) обозначает стадию образования твердофазного меченого комплекса, образуемого между (1), (2), (3) и (4), которая включает в себя необязательное инкубирование, отделение и необязательное промывание, а (6) представляет собой конечную стадию инициирования хемилюминесцентной реакции и измерения эмиссии света.
В анализе стандартов общего IgE на фиг. 1 (7) обозначает IgE (WHO 75/502 ME/мл), (8) обозначает поликлональный анти-IgE связанный с биотином, (9) обозначает моноклональный анти-IgE мышей, связанный с суспендированными парамагнитными частицами, (10) обозначает авидинакридиниевый эфир и (11) обозначает стадию образования твердофазного меченого комплекса, образуемого из (7), (8), (9) и (10), которая включает в себя необязательную стадию инкубирования, стадию отделения и необязательную стадию промывания, а (12) представляет собой конечную стадию инициирования хемилюминесцентной реакции и измерения эмиссии света.
Более конкретно, иммуноанализ по изобретению может быть выполнен в полностью автоматизированном анализаторе (ACS:180), производимом Ciba Corning Diagnostics Corp., Medfield, Mass, USA.
В предпочтительном варианте иммунологически активное детектируемое вещество является антителом, например, против пенициллина или его производных, таких как бензилпенициллин, пенициллоил и т.д., а лиганд, связанный с биотином, является гаптеном, таким как пенициллин или его производные.
Определение.
В способах по изобретению детектируемое антитело представляет собой специфический иммуноглобулин, предпочтительно специфический IgA, IgD, IgE, IgG, IgM и их изотипы, более предпочтительно специфический IgE. или класс антител, таких как иммуноглобулины, предпочтительно выбранные из группы, состоящей из общего IgA, общего IgD, общего IgE, общего IgG, общего IgM и их изотипов, наиболее предпочтительно общего IgE.
Под пробой подразумевают жидкую или ожиженную пробу, в том числе растворы, эмульсии, дисперсии и суспензии.
Лигандным антигеном, антителом или гаптеном, связанным с биотином, может быть любое иммунологически активное вещество, такое как аллерген, антитела, такие как поликлональные антитела, моноклональные антитела, в том числе рекомбинантные антитела или фрагментированные антитела, предпочтительно аллерген и/или поликлональный антииммуноглобулин, такой как козлиная античеловеческая поликлональная сыворотка, поставляемая Ventrex Laboratories, Inc. , Portland, Maine, Catalog N 77660. В эталонном иммуноанализе антитело предпочтительно направлено против константной части класса измеряемых антител, т.е. антитело, направленно против IgE-антител.
Под биологической жидкостью подразумевают любую клиническую пробу, такую как кровь, плазма, сыворотка, моча или слюна, а также любую биологическую жидкость, которая выделяется, секретируется или транспортируется внутри организма. Под парамагнитными частицами (РМР) подразумевают частицы, которые могут быть диспергированы или суспендированы в жидкой среде. Во всех примерах используют частицы BioMag (частицы оксида железа, покрытые группами, имеющими на конце амин), продаваемые Magnetics Inc., Cambridge, Massachusets. Антитела, связанные с РМР, предпочтительно направлены против константной части детектируемых антител или измеряемых антител и могут быть поликлональными или моноклональными атнителами, в том числе рекомбинантными или фрагментированными антителами, предпочтительно моноклональным антителом, MAb A 5697-IA3(920325), поставляемым Biolnvent International AB, Lund, Sweden.
Хемилюминесцентным акридиновым соединением является предпочтительно N-гидроксисукцинимид-диметилакридиновый сложный эфир, ковалентно связанный с авидином или стрептавидином (авидин-DMAE). Авидин и DMAE соединяют по методам Weeks et al., Clin. Chem. 29/8, 1474-1479 (1983). В способе по изобретению могут быть применены другие несущие люминесцентную метку соединения, которые могут быть связаны с авидином или стрептавидином, например люминол, люцигенин или лофин.
Получение биотинилированных антител.
Биотинилированные анти-IgE и Phleum pratense
Козлиную античеловеческую поликлональную сыворотку (Ventrex Laboratories, Inc. MA, USA) очищают аффинной хроматографией на CNBr-активированной сеферозе 4B (Pharmacia, Uppsala, Sweden) с миеломными IgE (CEM Concepts, USA) в качестве лиганда. Анти-IgE биотинилируют с молярным отношением биотин: -анти-IgE = 41:1.
9 мкл Биотина (Биотин-амидокапроат-N-гидроксисукцинимид (эфир) (Sigma) 25 мг/мл в диметилформамиде (Merck) добавляют к 0,4 мл анти-IgE 4,5 мг/мл в 0,01 M NaHCO3 (Merck). Реагенты инкубируют в "end over end" ("конец над концом") миксере в течение 2 часов при 25oC. 0,9 мл Раствора лизина (Sigma) 20 мг/мл в NaHCO3 добавляют. Раствор фильтруют и биотинилированное антитело очищают гель-фильтрацией на супердексе 75 Hiload 16/60 (Phasmacia, Uppsala, Sweden). Объединенные фракции разводят в содержащем буфер солевом растворе PBS, pH 7,2, содержащем 0,1% человеческий сывороточный альбумин (Sigma), 0,1% NaN3 (Sigma).
Экстракт Phleum pratense (ALK Laboratories A/S, Hyrsholm, Demnark) биотинилируют в молярном отношении 10:1. 0,65 мл биотина 10 мг/мл добавляют к 0,43 мл 10 мг/мл Phleum pratense в 0,1 М NaHCO3. Реагенты инкубируют в течение 2 часов при 25oC в "end over end" миксере, после инкубирования добавляют раствор лизина (Sigma), 40 мкл, 50 мг/мл. Раствор фильтруют и биотинилированное антитело очищают от избытка биотина гельфильтрацией на супердексе 75 Hiload 16/60 (Pharmacia). Фракции, содержащие аллергены, объединяют. Биотинилированный Phleum pratense разводят PBS pH 7,2, содержащим 0,1% человеческий сывороточный альбумин (Sigma) и 0,1% NaN3 (Sigma).
Получение метки, содержащей стрептавидин-акридиновый эфир
Стрептавидин конъюгировали в DMAE-NHS [2',6'-диметил-4-(N- сукцинимидилоксикарбонил)фенил-10-10-метилакридин-9-карбоксилат- метосульфат] при помощи способов Weeks, et. al., Clin. Chem. 29/8, 1474-1479 (1983).
Получение метки, содержащей стрептавидинакридиновый эфир.
0,96 мг N-Гидроксисукцинимид-диметилакридинового эфира DMAE (Ciba Corning Diagnostics Corp. Medfield. MA, USA) разводили в 1,92 мл диметилформамида, 250 мкл этого раствора пипеткой к 2,5 мл 1 мг/мл стрептавидина (Sigma) в 0,1 М первичном кислом фосфате натрия, 0,15 М NaCl pH 8,15.
Воздух над раствором во флаконе (пробирке) заменяли азотом (AGA). Реагенты инкубировали в течение 30 минут при 25oC при перемешивании, после инкубирования добавляли 2250 мкл 10 мг/мл лизина, 0,1 М первичного кислого фосфата натрия (Merck), 0,15 М NaCl (Merck) pH 8,15. Для удаления несвязавшегося DMAE раствор наносили на колонку PD-10 (Pharmacia, Uppsala, Sweden). Элюат собирали и очищали ультрафильтрацией с применением целлюлозных Minitan-5 фильтров 10.000 NМWL (Millipore). Фильтрацию проводили с 1,5 л содержащего фосфатный буфер солевого раствора, PBS pH 7,2. Ретентат (удерживаемую часть) концентрировали до 25 мл и добавляли 25 мл PBS pH 7,2, содержащего 0,5% HSA (человеческий сывороточный альбумин, Sigma) и 0,1% NaN3 (Sigma).
Изобретение будет детально описано в следующих примерах.
Иммобилизация антитела с парамагнитными частицами.
6,5 г Парамагнитных частиц (Ciba Corning Diagnostics Corp., MA, USA) промывают в 650 мл метанола (Merck) 3 раза с применением магнитного разделения. Промывание 650 мл 0,01 М ацетатного буфера pH 5,5 выполняют дважды. Частицы активируют в 6,25% глутаральдегиде (Merck), 0,01 М ацетатном буфере pH 5,5 в течение 3 часов при 25oC. Частицы промывают 3 раза в 650 мл 0,01 М ацетатного буфера pH 5,5. Эти частицы соединяют с 1083 мг моноклонального анти-IgE антитела (ALK Laboratories, Horsholm, Denmark), специфического в отношении Fc домена IgE, в течение 24 часов при 25oC. Частицы промывают дважды в 0,01 М ацетатном буфере pH 5,5. Блокирование избыточных активных групп выполняют при помощи 200 мл 10% освобожденной от IgE сыворотки (ALK Laboratories, Horsholm, Denmark) в течение 24 часов при 25oC. Эти частицы промывают в 650 мл 0,01 М фосфатном буфере (Merck) с последующими 3 промывками в 650 мл IgM NaCl (Merck). Частицы промывают 3 раза в 0,01 М фосфатном буфере, ресуспендируют в 650 мл PBS pH 7,2, 0,1% (вес./об.) бычьем сывороточном альбумине (Sigma), 0,001% бычьем γ -глобулине (Sigma) и нагревают в течение 18 часов при 50oC. Эти частицы промывают 3 раза в 650 мл PBS pH 7,2, 0,1% (вес/об. ) бычьем сывороточном альбумине (Sigma), 0,001% бычьем γ -альбумине (Sigma). Затем частицы нагревают в течение 7 дней при 37oC. Частицы промывают в 0,01 М фосфатном буфере, разводят до 0,5 г/л в PBS pH 7,2, 0,5% человеческом сывороточном альбумине (Sigma).
Пример 1. Детектирование и количественное определение антигена (общего IgE).
Определение общих IgE антител согласно данному изобретению проводили на анализаторе Ciba Corning ACS:180 Benchtop Immunoassay analyzer, описанном в Clinical Chemistry, 36/9, 1598-1602 (1990), с применением следующего протокола.
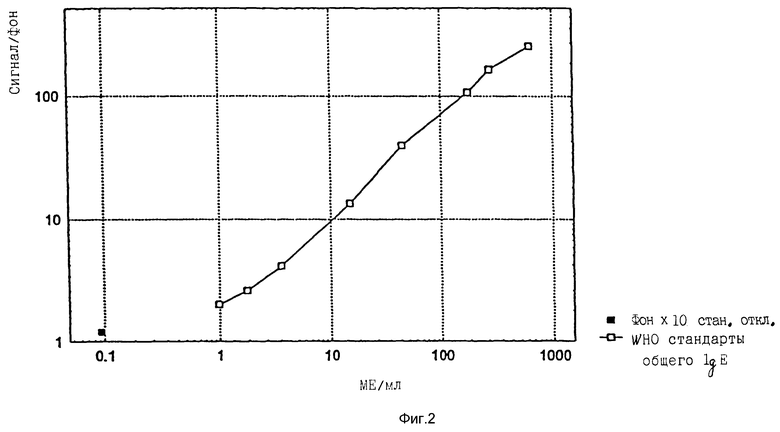
50 мкл Пробы и 50 мкл биотинилированного анти-IgE заливают при помощи зонда (пробника) в кювету. Кювета доходит до первого реагентного зонда R1, где 100 мкл парамагнитных частиц с иммобилизованным моноклональным анти-IgE антителом (ALK Laboratories A/S, Horsholm, Denmark), специфическим против Fc домена IgE, сливают вместе с 200 мкл метки стрептавидин-акридиновый эфир (ALK Laboratories A/S, Horsholm, Denmark). Кювета движется далее по пути к магниту и промывной зоне. Дважды выполняют промывку 750 мкл деионизованной воды. После завершения промывного цикла частицы ресуспендируют в 300 мкл 0,5 г/л H2O2 в 0,1 М HNO3. Далее кювета входит в камеру люменметра (прибора для измерения светового потока) и перед фотоумножителем в нее добавляют 300 мкл 25 мМ раствора NaOH и фотоны испускаемого света измеряют, определяют количество и выражают в виде относительных световых единиц (RLU). Количество RLU прямо пропорционально количеству IgE в пробе. Время от введения пробы до первого результата равно 15 минутам и следующий результат следует каждые 20 секунд. Результаты выражали в виде отношения эксперимента/RLU фона, где RLU фона представляет собой хемилюминесцентную реакцию, наблюдаемую в отсутствие общего IgE.
Девять стандартов общего IgE, калиброванных в Magic Lite Тotal IgE Kit (ALK Laboratories A/S, Horsholm, Denmark) против WHO 2nd IRP N 75/502 для IgE человеческой сыворотки, анализировали при помощи описанного выше протокола. Было показано, что можно было детектировать 0,1 ME/мл общего сывороточного IgE (как определено по фон х 10 стандартных отклонений), см. фиг. 2.
Пример 2. Детектирование и количественное определение специфического антитела (специфического IgE).
Определение специфических для Phleum pratense IgE антител (специфических для тимофеевки луговой IgE) в соответствии с изобретением проводили на анализаторе Ciba Corning ACS: 180 Benchtop Immunoassay analyzer, описанном в Clinical Chemistry, 36/9, 1598-1602 (1990), при помощи следующего протокола:
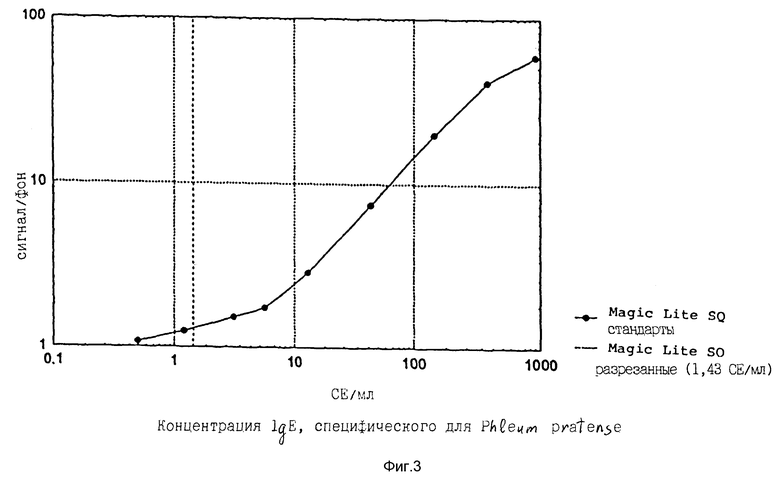
50 мкл Пробы и 50 мкл биотинилированного Phleum Pratense вводили в кювету при помощи зонда (пробника). Кювета доходит до первого реагентного зонда R1, где 100 мкл парамагнитных частиц с иммобилизованным моноклональным анти-IgE антителом (ALK Laboratories A/S, Horsholm, Denmark), специфическим против Fc домена IgE, вводят вместе с 200 мкл метки стрептавидин-акридиниевый эфир (ALK Laboratories A/S, Horsholm, Denmark). Кювета движется далее по пути к магниту и промывной зоне (станции). Дважды поводят промывку 750 мкл деионизованной воды. После завершения цикла промывки частицы ресуспендируют в 300 мкл 0,5 г/л H2O2 в 0,1 М HNO3. Кювета входит в камеру люминметра и перед фотоумножителем в нее добавляют 300 мкл раствора 25 мМ NaOH и измеряют фотоны испускаемого света, определяют количественно и выражают в виде относительных световых единиц (RLU). Количество RLU прямо пропорционально количеству IgE в пробе. Время от введения пробы до первого результата равно 15 минутам и новый результат следует каждые 20 секунд. Результаты выражали в виде отношения RLU эксперимента/RLU фона, где RLU фона представлял собой хемилюминесцентную реакцию, наблюдаемую в отсутствии общего IgE.
Десять специфических для Phleum pratence стандартов IgE, калиброванных в Magic hite SQ specific IgE Kit (ALK Laboratories A/K, Horsholm, Denmark) против проб клинически охарактеризованных аллергических к Phleum pratense больных и выраженных в виде CE/мл (стандартизированных единиц), анализировали при помощи описанного выше протокола. Показано, что между 1,43 и 800 CE/мл специфического для Phleum pratense IgE можно измерить согласно Magic Lite SQ specific IgE анализу, см. фиг. 3.
Пример 3. Количественное определение специфического IgE по сравнению с WHO стандартном общего IgE.
Количественное определение специфических IgE антител в пробах сыворотки выполняли по отношению к общим IgE антителам или специфическому IgE антителу при помощи идентичных протоколов анализа, описанных в примерах 1 и 2 соответственно.
Пробы тридцати пяти больных анализировали на специфический для Phleum pratense IgE параллельно с 10 специфическими для Phleum pratense стандартами IgE, калиброванными в Magic Lite SQ specific IgE Kit (ALK Laboratories A/S, Horsholm, Denmark), против проб клинически охарактерированных аллергических к Pleum pratense больных и выраженных в виде CE/мл (протокол описан в примере 2).
Девять стандартов IgE WHO 2nd IRP N 75/502 (Национальная биологическая коллегия по стандартам) анализировали параллельно против общего IgE (протокол, описанный в примере 1).
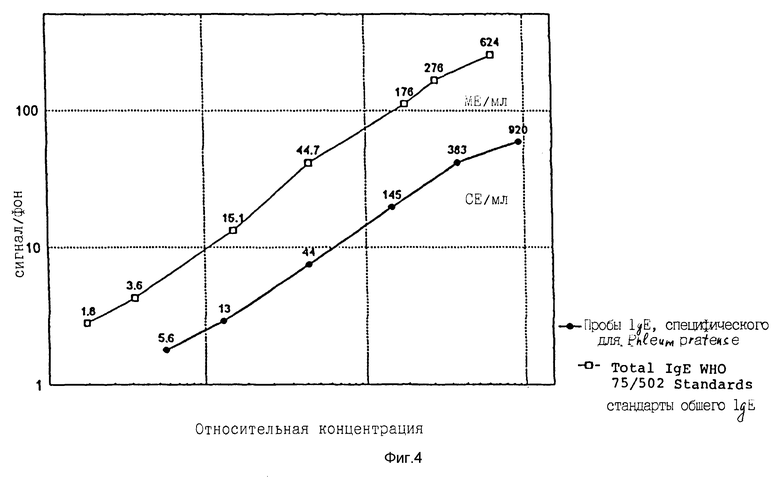
Фиг. 4 дает сравнение двух кривых зависимости ответа от дозы анализа общего IgE и специфического для Phleum pratense IgE соответственно. Параллельный анализ не обнаружил значительного различия в наклонах между этими двумя кривыми зависимости ответной реакции от концентрации, указывая, что специфический IgE в пробах больных можно калибровать против WHO стандарта общего IgE и выражать в ME/мл.
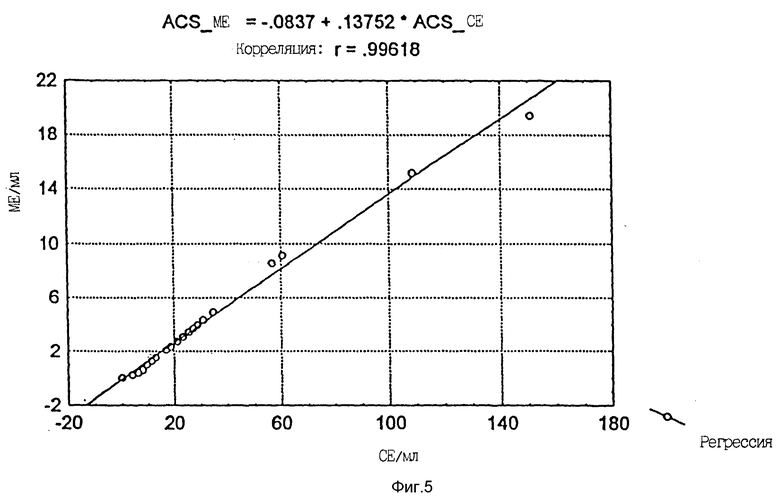
Фиг. 5 дает сравнение результатов для проб из 35 больных, калиброванных против WHO стандартов общего IgE (выраженных в ME/мл) или специфических для Phleum pratense стандартов IgE (выраженных в CE/мл), и это сравнение показывает очень хорошую корреляцию между этими двумя единицами.
Концентрацию (дозу) неизвестной пробы рассчитывали при помощи некубической сплайн-интерполяции после преобразования log vs. log. сигнал/фон и концентрации (дозы) соответственно.
Из кривой линейной регрессии рассчитали, что одна стандартизованная единица (СЕ) соответствует 0,14 международным единицам (МЕ).
В заключении можно отметить, что аллерген-специфический IgE может быть измерен по изобретению и калиброван, исходя непосредственно из анализа общего IgE кривой калиброванных WHO стандартов IgE.
Пример 4. Сравнение способов для общего IgE.
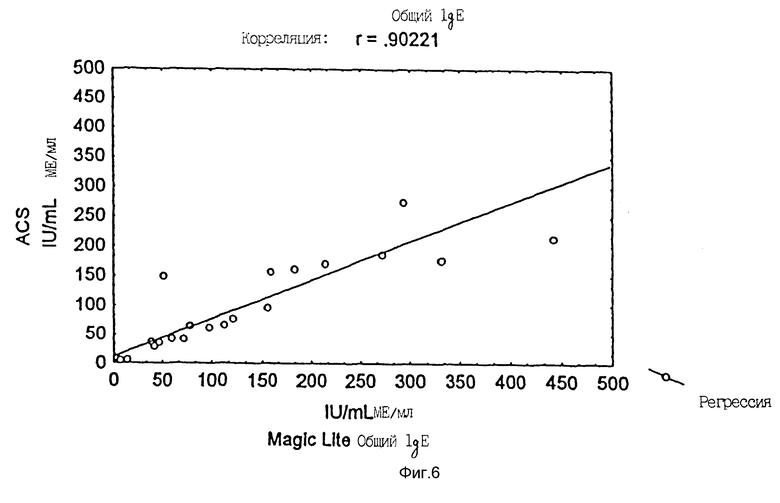
Пробы тридцати трех больных анализировали на общий сывороточный IgE в Magic Lite Тotal IgE Kit (ALK Laboratories A/S, Horsholm, Denmark).
Анализ выполняли в соответствии с инструкцией изготовителя. Те же самые пробы измеряли на общий сывороточный IgE на ACS:180 в соответствии с протоколом, описанным в примере 1.
Фиг. 6 дает диаграмму разброса для сравнения способов измерения общего сывороточного IgE. Была обнаружена корреляция r = 0,90.
Пример 5. Сравнение способов для специфического IgE.
Пробы тридцати пяти больных измеряли на специфический для Phleum pratence IgE в Magic Lite SQ specific IgE Kit (ALK Laboratories A/S, Horsholm, Denmark).
Анализ проводили в соответствии с инструкцией изготовителя, те же самые пробы анализировали на специфический для Phleum pratense IgE на ACS:180 в соответствии с протоколом, описанным в примере 2.
Фиг. 7 дает диаграмму разброса для сравнения способов измерения специфического для Phleum pratense IgE. Была обнаружена корреляция с r = 0,80.
Пример 6. Сравнение точности анализов.
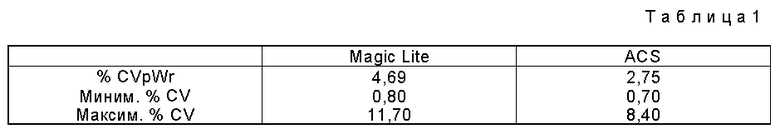
Неточность внутри одной серии измерений для ACS общего IgE с применением протокола, описанного в примере 1, сравнивали с таковой для Magic Lite Total IgE. Пробы больных измеряли в трех повторностях в тестах, описанных в примере 4. Объединенный коэффициент вариации внутри серии измерений (cvpwr) рассчитывали согласно Krouwer and Rabinowitz, Clinical Chemistry, 30, 290 (1984). Были получены следующие результаты (см. табл. 1 в конце описания).
Как видно из этих результатов, автоматизация и уменьшение числа стадий улучшает точность анализа (согласно F - тесту: F = 1,71, p = 0,049).
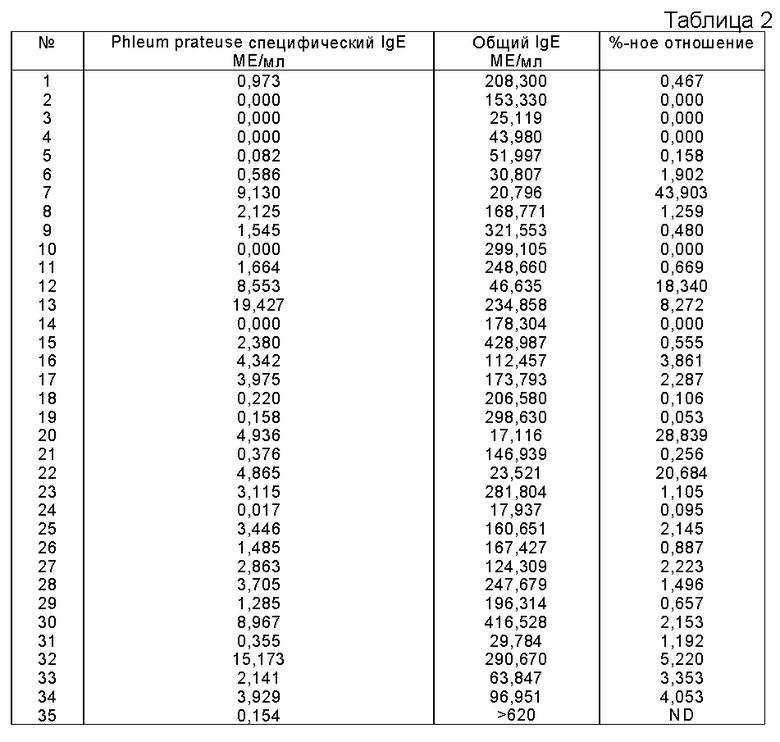
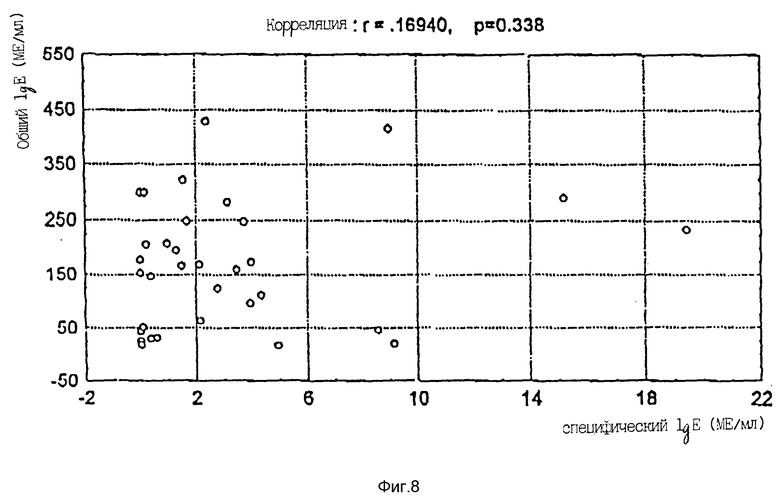
Пример 7. Сравнение содержания общего и специфического IgE в пробах больных.
Пробы, измеренные на специфический для Phleum pratense IgE на ACS:180 согласно протоколу, описанному в примере 2, и калиброванные по стандарту общего IgE (WHO 75/502), как описано в примере 3, анализировали также на общий IgE, как описано в примере 1. Отношение между измеренными специфическим IgE и общим IgE рассчитывали для каждой пробы и выражали в виде %-ного отношения (специф. МЕ/общий МЕ* 100).
Были получены следующие результаты (см. табл. 2 в конце описания).
Как видно из этих результатов, анализ специфического для Phleum pratense IgE способен измерять даже такие малые количества, как 0,05%, специфического для Phleum pratense IgE в общем IgE. Относительно малые количества специфического для Phleum pratense IgE показывают, что в этих пробах присутствуют IgE, специфические для других аллергенов. Обнаружено, что в пробе одного больного до 44% общего IgE является специфическим против Phleum pratense. Не было обнаружено корреляции между концентрацией общего IgE и концентрацией IgE, специфического для Phleum pratense, как видно на фиг. 8.
Пример 8. Определение сывороточных общих IgA антител при помощи парамагнитных частиц и метки, состоящей из авидин-акридинового эфира. Определение общих IgA антител проводили с применением следующего протокола.
25 мкл Пробы больного или калибровочного стандарта пипетировали в 12 х 75 мм тест-пробирку. К каждой пробирке добавляли 50 мкл биотинилированного поликлонального анти-IgA антитела DAKO E484 (поставляемого DAKO, Glostrup Denmark) в 0,05 М фосфатном буфере, pH 7,4, содержащем 0,1% азид натрия, 0,01% Tween® 20 и 0,1% человеческий сывороточный альбумин, и реакцию проводили 15 минут при температуре окружающей среды, 400 мкл суспензии парамагнитных частиц с иммобилизованным поликлональным анти-IgA антителом DAKO A 262 (поставляемой DAKO, Glostrup Denmark) добавляли к каждой пробирке и инкубировали в течение 5 минут. После этого второго инкубирования 50 мкл стрептавидин-акридиновый эфир содержащей метки, разведенной в том же буфере, который описан выше, добавляли к каждой пробирке и пробирки инкубировали еще 5 минут при температуре окружающей среды. Парамагнитные части промывали дважды 0,2 М фосфатным буфером, pH 7,4, содержащим 0,1% Tween® 20, после отделения магнитных частиц от жидкости при помощи магнитного сепаратора и перемешивания отдельных частиц при помощи вортекса с промывным буфером, описанным выше. Содержимое пробирок измеряли в люменметре, где свет испускался при 426 нм, определяли количество и выражали в виде относительных световых единиц (RLU).
Стандарты общего IgA, калиброванные против WHO N 67/86 для человеческого сывороточного IgA DAKO X908 (поставляемого DAKO, Glostrup, Denmark), анализировали с применением описанного выше протокола.
Стандарты:
Концентрация (мкг/мл) - RLU
0 - 370937
0,02 - 417000
0,23 - 557563
2,32 - 1252260
23,2 - 1872357
Специалистам в данной области должно быть ясно, что возможны многочисленные вариация без отхода от сущности и объема данного изобретения, определенного исключительно прилагаемой формулой.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОБНАРУЖЕНИЯ ПАТОГЕННЫХ МИКРООРГАНИЗМОВ | 2009 |
|
RU2408734C1 |
| ДЕТЕКТИРОВАНИЕ МОЛЕКУЛ-МИШЕНЕЙ В ПРОБЕ | 2007 |
|
RU2444736C2 |
| СПОСОБ ОБНАРУЖЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКОГО СВЯЗЫВАЮЩЕГО АГЕНТА | 2013 |
|
RU2636822C2 |
| Антитела для лабораторной диагностики концентрации интерлейкина-11 | 2020 |
|
RU2763178C2 |
| АНТИТЕЛА ПРОТИВ IgG1 ЧЕЛОВЕКА | 2011 |
|
RU2603284C2 |
| СПОСОБЫ ОДНОВРЕМЕННОГО ВЫЯВЛЕНИЯ ОБОИХ КОМПОНЕНТОВ СВЯЗЫВАЮЩЕЙСЯ ПАРЫ | 2000 |
|
RU2251111C2 |
| ДЕТЕКЦИЯ ТЕРАПЕВТИЧЕСКОГО АНТИТЕЛА У ЭКСПЕРИМЕНТАЛЬНОГО ЖИВОТНОГО | 2005 |
|
RU2393483C2 |
| АНАЛИЗЫ ОПРЕДЕЛЕНИЯ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ТЕРАПЕВТИЧЕСКИМ АНТИТЕЛАМ ПРОТИВ IgE, И ИХ ПРИМЕНЕНИЕ ПРИ АНАФИЛАКСИИ | 2010 |
|
RU2642295C2 |
| Способ твердофазного каталитического анализа содержания аналита в образце с использованием серебряных нанопроволок | 2022 |
|
RU2808559C1 |
| ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ С ПОДАВЛЕНИЕМ ИНТЕРФЕРЕНЦИИ ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ЛЕКАРСТВАМ В ОБРАЗЦАХ СЫВОРОТКИ | 2014 |
|
RU2674996C2 |

Изобретение относится к области медицины и касается способа обнаружения антитела в пробе с использованием хемилюминесцентного соединения в качестве метки. Проводят иммуноанализ, предусматривающий смешивание лигандного антигена, антитела или гаптена, связанного с биотином или его функциональным производным, антитела, направленного против детектируемого антитела, связанного с парамагнитными частицами, и хемилюминесцентного акридинового соединения, связанного с авидином или стрептавидином, с пробой для образования твердофазного комплекса, после чего проводят магнитное отделение твердой фазы от жидкой фазы, инициирование хемилюминесцентной реакции и анализ отделенной твердой фазы на присутствие хемилюминесцентного комплекса, причем присутствие хемилюминесценции является указанием на присутствие антитела в пробе. Измерение же концентрации и/или относительного содержания специфического антитела осуществляют путем измерения эмиссии света отделенной твердой фазы, содержащей захваченное специфическое антитело, связанное с хемилюминесцентной меткой, сравнивают с измеренной эмиссией света, полученной в параллельном стандартном иммуноанализе, в котором измеряют общее содержание того класса антител в пробе, к которому принадлежит специфическое антитело. Способ обеспечивает безопасность лабораторных процедур, является быстрым и может быть полностью автоматизирован. 2 с. и 12 з.п. ф-лы, 8 ил., 2 табл.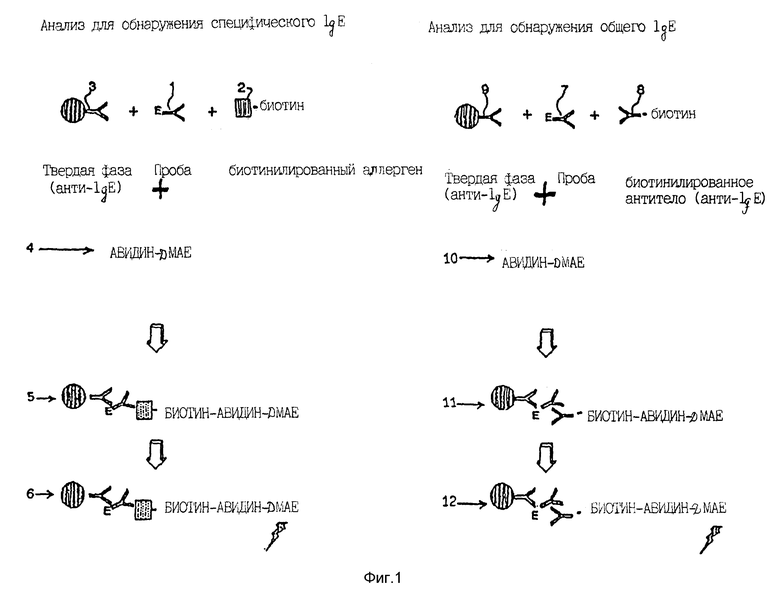
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ твердофазного иммуноферментного определения антител к вирусу иммунодефицита человека и меченный биотином синтетический пептид для его осуществления | 1989 |
|
SU1612264A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ определения антител к Н @ V - 1 | 1988 |
|
SU1802871A3 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Specific IgE, Magis Lite SQ, Ciba Corning Diagnosties Corp | |||
| and ALK Laboratories | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
Авторы
Даты
1999-06-20—Публикация
1993-11-15—Подача