ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ИЗОБРЕТЕНИЯ
Настоящая заявка истребует приоритет, заявленный в предварительных заявках на патент США №№ 61/171658 и 61/171649, поданных 22 апреля 2009 года, которые полностью включены в настоящий документ путем ссылки.
ИСПОЛЬЗОВАЛОСЬ ЛИ В ДАННОМ ИССЛЕДОВАНИИ ФЕДЕРАЛЬНОЕ ФИНАНСИРОВАНИЕ
Для исследований и разработки описанного ниже изобретения не привлекалось федеральное финансирование.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Cannabis sativa (конопля посевная) в течение многих лет используется в качестве болеутоляющего. Δ9-тетрагидроканнабиол, основной активный ингредиент, получаемый из Cannabis sativa, является агонистом рецепторов каннабиноидов (Pertwee, Brit J Pharmacol, 2008, 153, 199-215). Было проведено клонирование двух сопряженных с G-белком рецепторов каннабиноидов, каннабиноидный рецептор первого типа (CB1 Matsuda et al., Nature, 1990, 346, 561-4) и каннабиноидный рецептор второго типа (CB2 Munro et al., Nature, 1993, 365, 61-5). CB1 экспрессируется центрально в таких зонах мозга как гипоталламус и прилежащее ядро, а также периферически в печени, желудочно-кишечном тракте, поджелудочной железе, жировой ткани и скелетных мышцах (Di Marzo et al., Curr Opin Lipidol, 2007, 18, 129-140). CB2 экспрессируется, главным образом, в иммунных клетках, таких как моноциты (Pacher et al., Amer J Physiol, 2008, 294, H1133-H1134), и, при определенных условиях, в головном мозге (Benito et al., Brit J Pharmacol, 2008, 153, 277-285), а также в скелетных (Cavuoto et al., Biochem Biophys Res Commun, 2007, 364, 105-110) и сердечной (Hajrasouliha et al., Eur J Pharmacol, 2008, 579, 246-252) мышцах. Множество фармакологических, анатомических и электрофизиологических данных, полученных при использовании синтетических агонистов, указывает на то, что увеличение передачи сигналов через каннабиноидные рецепторы CB1/CB2 способствует обезболиванию в испытаниях острой ноцицепции и подавляет гипералгезию в моделях хронических нейропатических и воспалительных болей (Cravatt et al., J Neurobiol, 2004, 61, 149-60; Guindon et al., Brit J Pharmacol, 2008, 153, 391-334).
Эффективность синтетических агонистов каннабиноидных рецепторов убедительно подтверждена документальными доказательствами. Более того, исследования с использованием антагонистов каннабиноидных рецепторов и нокаутных мышей также подтвердили важность системы эндоканнабиноидов как модулятора ноцицепции. Двумя основными эндоканнабиноидами являются анандамид (AEA) (Devane et al., Science, 1992, 258, 1946-9) и 2-арахидиноилглицерин (2-AG) (Mechoulam et al., Biochem Pharmacol, 1995, 50, 83-90; Sugiura et al., Biochem Biophys Res Commun, 1995, 215, 89-97). AEA гидролизуется под действием гидролазы амидов жирных кислот (FAAH), 2-AG гидролизуется под действием моноацилглицеринлипазы (MGL) (Piomelli, Nat Rev Neurosci, 2003, 4, 873-884). Генетическая абляция FAAH повышает уровень эндогенного AEA и приводит к развитию CB1-зависимой анальгезии в моделях острых и воспалительных болей (Lichtman et al., Pain, 2004, 109, 319-27), что позволяет предположить, что система эндоканнабиноидов естественным образом подавляет боль (Cravatt et al., J Neurobiol, 2004, 61, 149-60). В отличие от конститутивного повышения уровня эндоканнабиноидов у мышей с отсутствием FAAH, использование специфических ингибиторов FAAH временно повышает уровень AEA, что приводит к развитию антиноцицепции in vivo (Kathuria et al., Nat Med, 2003, 9, 76-81. Дополнительным доказательством возникновения антиноцицептивного тона, опосредованного эндоканнабиноидами, является образование AEA в околоводопроводном сером веществе в результате болевой стимуляции на периферическом уровне (Walker et al., Proc Natl Cad Sci USA, 1999, 96, 12198-203) и, наоборот, индукция гипералгезии после антисмыслового РНК-ингибирования CB1 в спинном мозге (Dogrul et al., Pain, 2002, 100, 203-9).
Что касается 2-AG, его внутривенное введение приводит к аналгезии в испытании с отдергиванием хвоста (Mechoulam et al., Biochem Pharmacol, 1995, 50, 83-90 и испытании с горячей пластиной (Lichtman et al., J Pharmacol Exp Ther, 2002, 302, 73-9). С другой стороны, было показано, что сам по себе 2-AG не оказывает аналгезирующего действия в испытании с горячей пластиной, однако при использовании его в сочетании с другими 2-моноалкилглицеринами (например, 2-линолеоилглицерином и 2-пальмитоилглицерином) достигается значительный уровень аналгезии, это явление носит название «эффект окружения» (Ben-Shabat et al., Eur J Pharmacol, 1998, 353, 23-31. Представляющие такое «окружение» 2-моноацилглицерины представляют собой эндогенные липиды, выделяемые совместно с 2-AG и усиливающие проведение сигнала эндоканнабиноидными рецепторами, в частности, путем ингибирования распада 2-AG, скорее всего, вследствие конкуренции за активный центр на MGL. Это позволяет предположить, что синтетические ингибиторы MGL будут оказывать аналогичный эффект. Действительно, URB602, относительно слабый синтетический ингибитор MGL, показал антиноцицептивное действие в модели острого воспаления на мышах (Comelli et al., Brit J Pharmacol, 2007, 152, 787-794).
Хотя применение синтетических агонистов каннабиноидных рецепторов убедительно показало, что усиление передачи сигнала каннабиноидными рецепторами оказывает обезболивающий и противовоспалительный эффект, представляется сложным отделить эти благоприятные эффекты от нежелательных побочных эффектов данных соединений. Альтернативный подход заключается в повышении сигнализации системы эндоканнабиноидов путем повышения уровня 2-AG, наиболее часто встречающегося в центральной нервной системе (ЦНС) и желудочно-кишечном тракте эндоканнабиноида, которого можно добиться путем ингибирования MGL. Следовательно, ингибиторы MGL могут быть полезны при лечении боли, воспаления и нарушений ЦНС (Di Marzo et al., Curr Pharm Des, 2000, 6, 1361-80; Jhaveri et al., Brit J Pharmacol, 2007, 152, 624-632; McCarberg Bill Et al., Amer J Ther, 2007, 14, 475-83), а также глаукомы и болезненных состояний, обусловленных повышением внутриглазного давления (Njie, Ya Fatou; He, Fang; Qiao, Zhuanhong; Song, Zhao-Hui, Exp. Eye Res., 2008, 87(2):106-14).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению формулы (I)
Формула (I)
где
Y и Z независимо выбраны из группы a) или b) таким образом, что один из Y или Z выбран из группы a), а другой - из группы b);
группа a) представляет собой
i) замещенный C6-10арил;
ii) C3-8циклоалкил;
iii) трифторметил; или
iv) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила, пирролила, пиридинила, изоксазолила, имидазолила, фуразан-3-ила, бензотиенила, тиено[3,2-b]тиофен-2-ила, пиразолила, триазолила, тетразолила и [1,2,3]тиадиазолила;
где C6-10арил замещен; и гетероарил необязательно замещен одним или двумя заместителями, независимо выбираемыми из группы, состоящей из фтора, хлора, брома, C1-4алкила, циано и трифторметила;
группа b) представляет собой
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из тиазолила, пиридинила, индолила, индазолила, пирролила, бензоксазолила, бензотиазолила, бензотиенила, бензофурила, имидазо[1,2-а] пиридин-2-ила, фуро[2,3-b]пиридинила, фуразана-3-ила, пирроло[2,3-b]пиридинила, пирроло[3,2-b] пиридинила, тиено[2,3-b] пиридинила, хинолинила, хиназолина, тиенила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; C3-7циклоалкилсульфонила; фенила; фенилкарбонила; тиенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; (C1-4алкил)аминокарбонила; C1-6алкилкарбонила; C1-6алкилкарбонил-C1-4алкила; C1-6алкилсульфонила; пиримидинила; пиридинила и C1-4алкоксикарбонила; при этом C3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом либо одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 заместителями, выбранными из группы, состоящей из фенила, тиенила, брома и C1-4алкила; при этом фенил и тиенил каждый необязательно замещен трифторметилом или хлор-заместителем;
iv) феноксатиинил;
v) 10-оксо-10H-10λ4-феноксатиин-2-ил;
vi) флуорен-9-он-2-ил;
vii) 9,9-диметил-9H-флуоренил;
viii) 1-хлорнафто[2,1-b]тиофен-2-ил;
ix) ксантен-9-он-3-ил;
x) 9-метил-9H-карбазол-3-ил;
xi) 6,7,8,9-тетрагидро-5H-карбазол-3-ил;
xii) 3-метил-6,7-дигидро-5H-1-тиа-4a,8-диаза-s-индацен-4-он-2-ил;
xiii) 3-метил-2-фенил-4-оксохромен-8-ил;
xiv) 1,3-дигидробензимидазол-2-он-5-ил, необязательно замещенный 1-фенилом, 1-(2,2,2-трифторэтилом), 1-(3,3,3-трифторпропилом) или 1-(4,4-дифторциклогексилом), при этом 1-фенил необязательно замещен одним или двумя фтор-заместителями или трифторметилом; или
xv) 4-(3-хлорфенил)-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолин-8-ил;
где C6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) C2-4алкенила;
iii) C3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) 4,4-дифторциклогексилкарбонила;
v) C1-4алкокси;
vi) 2-метоксиэтокси;
vii) C1-4алкилтио;
viii) трифторметила;
ix) 2,2,2-трифторэтила;
x) 2,2-дифторэтила;
xi) 3,3,3-трифторпропила;
xii) трифторметокси;
xiii) 2,2,2-трифторэтоксиметила;
xiv) 2,2,2-трифторэтокси;
xv) трифторметилтио;
xvi) ди(C1-4алкил)аминосульфонила;
xvii) N-фенил-N-метиламиносульфонила;
xviii) пиперидин-1-ил-сульфонила;
xix) хлора;
xx) циано;
xxi) гидрокси;
xxii) фтора;
xxiii) брома;
xxiv) йода;
xxv) NRaRb, где Ra представляет собой водород или C1-6алкил; и Rb представляет собой C1-6алкил, фенил, C3-8циклоалкил, C3-8циклоалкилкарбонил, C3-8циклоалкил(C1-2алкил), C1-6алкилкарбонил, необязательно замещенный одним-тремя фтор-заместителями, C1-4алкоксикарбонил, C6-10арил(C1-2)алкил, фенилкарбонил или фенил(C1-2)алкилкарбонил;
при этом C3-8циклоалкил, C3-8циклоалкилкарбонил, C6-10арил C6-10арил(C1-2)алкила, фенилкарбонил и фенил Rb необязательно замещены 1-2 заместителями, выбранными из C1-4алкила, трифторметила, хлора или фтора;
или Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного 1-2 заместителя, выбранными из группы, состоящей из оксо, 1-2 фтор-заместителей и C1-3алкила; и необязательно содержащего один дополнительный гетероатом с образованием морфолинила, тиоморфолинила или пиперазинила; при этом указанное гетероциклическое кольцо является необязательно бензоконденсированным; и гетероциклическое кольцо необязательно замещено на атоме азота, присутствующем в указанном кольце, C1-6алкоксикарбонилом;
xxvi) (1-R2)пирролидин-3-ил-окси; в котором R2 представляет собой пирролидин-1-ил-сульфонил, диметиламинокарбонил, диметиламиносульфонил, пирролидин-1-ил-карбонил, фенилкарбонил, C3-7циклоалкилкарбонил, C1-4алкилкарбонил, морфолин-4-ил-карбонил или C1-4алкоксикарбонил;
xxvii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен C1-4алкоксикарбонилом или C1-4алкилкарбонилом;
xxviii) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила, хлора и фтора;
xxix) пиридинилкарбонила, необязательно замещенного хлор-заместителем;
xxx) фенилкарбонила;
xxxi) пиперидин-1-ил-сульфонила;
xv) фенилсульфонила, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями;
xxxii) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, трифторметила и хлора;
xxxiii) фенилтио, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями;
xxxiv) C3-8циклоалкилокси;
xxxv) C1-3алкилкарбонилокси;
xxxvi) этиламинокарбонилметокси;
xxxvii) 2-метилкарбониламиноэтокси;
xxxviii) C1-6алкилсульфонила; и
xxxix) 2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ила;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой C3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; фенилтио; или C3-8циклоалкилокси;
s равно 0, 1 или 2; при условии, что когда s равно 2, R1 независимо выбирают из группы, состоящей из фенила, C1-3алкила и C6-10арил(C1-3)алкила;
R1 представляет собой C6-10арил, C1-3алкил, бензилоксиметил, гидрокси(C1-3)алкил, аминокарбонил, карбокси, трифторметил, спироконденсированный циклопропил, 3-оксо или арил(C1-3)алкил; или когда s равно 2 и R1 представляет собой C1-3алкил, заместители C1-3алкил берут с пиперазинильным кольцом с образованием 3,8-диазабицикло[3.2.1]октаниловой или 2,5-диазабицикло[2.2.2]октаниловой кольцевой системы;
при условии, что гетероарил группы b) замещен не C1-4алкокси или C1-4алкилтио;
при условии, что когда фенил замещен в пара-положении NRaRb или когда 2- или 3-пиридинил замещен в 5 или 6 положении, соответственно, NRaRb, то Rb отличен от C1-6алкила, фенила или C6-10арил(C1-2)алкила;
и при условии, что когда Ra представляет собой C1-6алкил и фенил замещен в пара-положении NRaRb или когда 2- или 3-пиридинил замещен в 5 или 6 положении, соответственно, NRaRb, то Rb отличен C1-6алкилкарбонила; или
при условии, что соединение формулы (I) отлично от
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-гидрокси-3-метилкарбониламинофенил, и s равно 0;
соединения, где Y представляет собой 2-метоксифенил, Z представляет собой 4-циклогексилфенил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3H-бензимидазол-2-ил, s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1H-бензимидазол-2-ил и s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-хлорбензофуран-2-ил, s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1H-индол-2-ил, s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-бромфуро[2,3-b]пиридин-2-ил, s равно 0;
соединения, где Y представляет собой 5-бромфуро[2,3-b]пиридин-2-ил, Z представляет собой тиазол-4-ил и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-трифторметил-1H-пирроло[3,2-b]пиридин-2-ил и s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-бром-7-метилимидазо[1,2-a]пиридин-2-ил и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 8-бром-6-хлоримидазо[1,2-a]пиридин-2-ил, и s равно 0; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилимидазо[1,2-a]пиридин-2-ил, и s равно 0; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-гидрокси-3-метилкарбониламинофенил, и s равно 0; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0; соединения, в котором Y представляет собой трифторметил, Z представляет собой 4-(3-трифторметилфенилсульфонил)фенил, и s равно 0; соединения, в котором Y представляет собой трифторметил, Z представляет собой 6-(2-хлорфенилокси)пиридин-3-ил, и s равно 0;
и их энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Настоящее изобретение далее относится к соединениям формулы (I)
Формула (I)
где
Y и Z независимо выбраны из группы a) или b) таким образом, что один из Y или Z выбран из группы a), а другой - из группы b);
группа a) представляет собой
i) трифторметил; или
ii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила, пирролила, пиридинила и [1,2,3]тиадиазолила;
при этом гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
группа b) представляет собой
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из тиазолила, пиридинила, индолила, пирролила, бензоксазолила, бензолиазолила, бензотиенила, бензофуранила, пирроло[2,3-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила, тиенила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; C3-7циклоалкилсульфонила; фенила; фенилкарбонила; тиенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; (C1-4алкил)аминокарбонила; C1-6алкилкарбонила; C1-6алкилкарбонил-C1-4алкила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом C3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 заместителями, выбранными из группы, состоящей из фенила, брома и C1-4алкила; при этом фенил и тиенил каждый необязательно замещен трифторметилзаместителем;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил;
vii) ксантен-9-он-3-ил;
viii) 9-метил-9H-карбазол-3-ил;
ix) 6,7,8,9-тетрагидро-5H-карбазол-3-ил; или
x) 4-(3-хлорфенил)-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолин-8-ил;
при этом C6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) C2-4алкенила;
iii) C3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) C1-4алкокси;
v) 2-метоксиэтокси;
vi) C1-4алкилтио;
vii) трифторметила;
viii) 2,2,2-трифторэтила;
ix) 2,2-дифторэтила;
x) 3,3,3-трифторпропила;
xi) трифторметокси;
xii) 2,2,2-трифторэтоксиметила;
xiii) 2,2,2-трифторэтокси;
xiv) трифторметилтио;
xv) ди(C1-4алкил)аминосульфонила;
xvi) хлора;
xvii) циано;
xviii) фтора;
xix) брома;
xx) йода;
xxi) NRaRb, где Ra представляет собой водород или C1-6алкил; и Rb представляет собой C1-6алкил, фенил, C3-8циклоалкил, C3-8циклоалкилкарбонил, C3-8циклоалкил(C1-2алкил), C1-6алкилкарбонил, необязательно замещенный одним-тремя фтор-заместителями, C1-4алкоксикарбонил, C6-10арил(C1-2)алкил, фенилкарбонил или фенил(C1-2)алкилкарбонил;
при этом C3-8циклоалкил, C3-8циклоалкилкарбонил, C6-10арил C6-10арил(C1-2)алкила, фенилкарбонил и фенил Rb необязательно замещены 1-2 заместителями, выбранными из C1-4алкила, трифторметила, хлора или фтора;
или Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей и C1-3алкила; и необязательно содержащего один дополнительный гетероатом с образованием пиперазинила; при этом указанное гетероциклическое кольцо необязательно бензоконденсировано; и гетероциклическое кольцо необязательно замещено на атоме азота, присутствующем в указанном кольце, C1-6алкоксикарбонилом;
xxii) (1-R2)пирролидин-3-ил-окси; в котором R2 представляет собой пирролидин-1-ил-сульфонил, диметиламинокарбонил, диметиламиносульфонил, пирролидин-1-ил-карбонил, фенилкарбонил, C3-7циклоалкилкарбонил, C1-4алкилкарбонил, морфолин-4-ил-карбонил или C1-4алкоксикарбонил;
xxiii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен C1-4алкоксикарбонилом или C1-4алкилкарбонилом;
xxiv) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила, хлора и фтора;
xv) фенилсульфонила, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями;
xxv) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, трифторметила и хлора;
xxvi) фенилтио, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями; и
xxvii) 2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ила;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой C3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; фенилтио; или C3-8циклоалкилокси;
s равно 0 или 1;
R1 представляет собой C6-10арил, C1-3алкил или трифторметил;
при условии, что гетероарил группы b) замещен не C1-4алкокси или C1-4алкилтио;
при условии, что когда фенил замещен в пара-положении NRaRb или когда 2- или 3-пиридинил замещен в 5 или 6 положении, соответственно, NRaRb, то Rb отличен от C1-6алкила, фенила или C6-10арил(C1-2)алкила;
и, при условии, что когда Ra представляет собой C1-6алкил, и фенил замещен в пара-положении NRaRb или когда 2- или 3-пиридинил замещен в 5 или 6 положении, соответственно, NRaRb, то Rb отличен C1-6алкилкарбонила; или
при условии что соединение формулы (I) отлично от
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3H-бензимидазол-2-ил, и s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1H-бензимидазол-2-ил, и s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1H-индол-2-ил, и s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-гидрокси-3-метилкарбониламинофенил, и s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0; а также их энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Настоящее изобретение также относится к соединению формулы (I)
Формула (I)
где
Y и Z независимо выбраны из группы a) или b) таким образом, что один из Y или Z выбран из группы a), а другой - из группы b);
группа a) представляет собой
i) трифторметил; или
ii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, пирролила, пиридинила и [1,2,3]тиадиазолила;
при этом гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
группа b) представляет собой
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из пиридинила, индолила, бензотиазолила, бензотиенила, бензофуранила, пирроло[2,3-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила, тиенила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; C3-7циклоалкилсульфонила; фенила; фенилкарбонила; тиенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; (C1-4алкил)аминокарбонила; C1-6алкилкарбонила; C1-6алкилкарбонил-C1-4алкила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом C3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 заместителями, выбранными из группы, состоящей из фенила, брома и C1-4алкила;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил;
vii) ксантен-9-он-3-ил;
viii) 9-метил-9H-карбазол-3-ил;
ix) 6,7,8,9-тетрагидро-5H-карбазол-3-ил; или
x) 4-(3-хлорфенил)-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолин-8-ил;
где C6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) C2-4алкенила;
iii) C3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) C1-4алкокси;
v) C1-4алкилтио;
vi) трифторметила;
vii) 2,2,2-трифторэтила;
viii) 2,2-дифторэтила;
ix) 3,3,3-трифторпропила;
x) трифторметокси;
xi) 2,2,2-трифторэтоксиметила;
xii) 2,2,2-трифторэтокси;
xiii) трифторметилтио;
xiv) ди(C1-4алкил)аминосульфонила;
xv) хлора;
xvi) циано;
xvii) фтора;
xviii) брома;
xix) йода;
xx) NRaRb, где Ra представляет собой водород или C1-6алкил; и Rb представляет собой C1-6алкил, фенил, C3-8циклоалкил, C3-8циклоалкилкарбонил, C3-8циклоалкил(C1-2алкил), C1-6алкилкарбонил, необязательно замещенный одним-тремя фтор-заместителями, C1-4алкоксикарбонил, C6-10арил(C1-2)алкил, фенилкарбонил или фенил(C1-2)алкилкарбонил;
при этом C3-8циклоалкил, C3-8циклоалкилкарбонил, C6-10арил C6-10арил(C1-2)алкила, фенилкарбонил и фенил Rb необязательно замещены 1-2 заместителями, выбранными из C1-4алкила, трифторметила, хлора или фтора;
или Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей и C1-3алкила; и необязательно содержащего один дополнительный гетероатом с образованием пиперазинила; при этом указанное гетероциклическое кольцо необязательно бензоконденсировано; и гетероциклическое кольцо необязательно замещено на атоме азота, присутствующем в указанном кольце, C1-6алкоксикарбонилом;
xxi) (1-R2)пирролидин-3-ил-окси; в котором R2 представляет собой пирролидин-1-ил-сульфонил, диметиламинокарбонил, диметиламиносульфонил, пирролидин-1-ил-карбонил, фенилкарбонил, C3-7циклоалкилкарбонил, C1-4алкилкарбонил, морфолин-4-ил-карбонил или C1-4алкоксикарбонил;
xxii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен C1-4алкоксикарбонилом или C1-4алкилкарбонилом;
xxiii) пиридинилоксила, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила, хлора и фтора;
xv) фенилсульфонила, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями;
xxiv) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, трифторметила и хлора;
xxv) фенилтио, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями; и
xxvi) 2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ила;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой C3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; фенилтио; или C3-8циклоалкилокси;
s равно 0 или 1;
R1 представляет собой фенил, C1-3алкил или трифторметил;
при условии, что гетероарил группы b) замещен не C1-4алкокси или C1-4алкилтио;
при условии, что когда фенил замещен в пара-положении NRaRb или когда 2- или 3-пиридинил замещен в 5 или 6 положении, соответственно, NRaRb, то Rb отличен от C1-6алкила, фенила или C6-10арил(C1-2)алкила;
и при условии, что когда Ra представляет собой C1-6алкил и фенил замещен в пара-положении NRaRb или когда 2- или 3-пиридинил замещен в 5 или 6 положении, соответственно, NRaRb, то Rb отличен C1-6алкилкарбонила;
при условии, что соединение формулы (I) отлично от
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3H-бензимидазол-2-ил, s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1H-бензимидазол-2-ил и s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1H-индол-2-ил, s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, s равно 0;
соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0; а также его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Настоящее изобретение относится к соединению формулы (I)
Формула (I)
где
Y и Z независимо выбраны из группы a) или b) таким образом, что один из Y или Z выбран из группы a), а другой - из группы b);
группа a) представляет собой
i) трифторметил; или
ii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила и пирролила;
при этом гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
группа b) представляет собой
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из пиридинила, индолила, бензолиазолила, бензотиенила, пирроло[2,3-b]пиридинила и тиено[2,3-b]пиридинила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; C3-7циклоалкилсульфонила; фенила; фенилкарбонила; тиенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом C3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен одним или двумя дополнительными заместителями, выбранными из группы, состоящей из фенила;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил; или
vii) 4-(3-хлорфенил)-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолин-8-ил;
где C6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) C2-4алкенила;
iii) C3-6циклоалкила;
iv) C1-4алкокси;
v) трифторметила;
vi) трифторметокси;
vii) 2,2,2-трифторэтоксиметила;
viii) ди(C1-4алкил)аминосульфонила;
ix) хлора;
x) фтора;
xi) брома;
xii) йода;
xiii) NRaRb в котором Ra представляет собой C1-6алкил; и Rb представляет собой C1-6алкил, C3-8циклоалкил, C3-8циклоалкил(C1-2алкил), C1-6алкилкарбонил, необязательно замещенный 1-3 фтор-заместителями, C1-4алкоксикарбонилом, фенилкарбонилом или фенил(C1-2)алкилкарбонилом;
при этом C3-8циклоалкил, C3-8циклоалкилкарбонил, C6-10арил C6-10арил(C1-2)алкила, фенилкарбонил и фенил Rb необязательно замещены 1-2 заместителями, выбранными из трифторметила, хлора или фтора;
или Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей и C1-3алкила; и необязательно содержащего один дополнительный гетероатом с образованием пиперазинила; при этом указанное гетероциклическое кольцо необязательно бензоконденсировано; и гетероциклическое кольцо необязательно замещено на атоме азота, присутствующем в указанном кольце, C1-6алкоксикарбонилом;
xiv) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен C1-4алкоксикарбонилом или C1-4алкилкарбонилом;
xv) пиридинилоксила, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила и хлора;
xv) фенилсульфонила, необязательно замещенного C1-4алкилом или трифторметилом;
xvi) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, трифторметила и хлора; и
xvii) фенилтио, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой C3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; фенилтио; или C3-8циклоалкилокси;
s равно 0 или 1;
R1 представляет собой фенил;
при условии, что гетероарил группы b) замещен не C1-4алкокси или C1-4алкилтио;
при условии, что когда фенил замещен в пара-положении NRaRb или когда 2- или 3-пиридинил замещен в 5 или 6 положении, соответственно, NRaRb, то Rb отличен от C1-6алкила, фенила или C6-10арил(C1-2)алкила;
и при условии, что когда Ra представляет собой C1-6алкил и фенил замещен в пара-положении NRaRb или когда 2- или 3-пиридинил замещен в 5 или 6 положении, соответственно, NRaRb, то Rb отличен C1-6алкилкарбонила;
при условии, что соединение формулы (I) отлично от
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3H-бензимидазол-2-ил, s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1H-бензимидазол-2-ил и s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1H-индол-2-ил, s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, s равно 0;
соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0; а также его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Настоящее изобретение относится к соединению формулы (I)
Формула (I)
выбранному из группы, состоящей из:
соединения, где Y представляет собой фуран-2-ил, Z представляет собой 4-циклогексилфенил, и s равно 0;
соединения, где Y представляет собой 1-метил-1H-имидазол-2-ил, Z представляет собой 4-циклогексилфенил, и s равно 0;
соединения, где Y представляет собой пиридин-2-ил, Z представляет собой 4-циклогексилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-бром-3-метоксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-бром-2-хлорфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-феноксифенил, и s равно 1, и R1 представляет собой 2-метил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-феноксифенил, и s равно 0, и R1 представляет собой 3-метил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-феноксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бромфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-бромнафт-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-1H-бензимидазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-3-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-трифторметилбензотиен-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-трифторметил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 7-трифторметил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-бром-3-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-трифторметил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-трифторметил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1H-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-трифторметилфенилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(циклопропилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(циклогексилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метансульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(метансульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(циклобутилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(фенилсульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-трифторметилфенилсульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-фторфенилсульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенилсульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(фенилметил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенилметил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-фенил-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(пиримидин-2-ил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-трифторметилфенил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метилкарбонил)-6-бром-1,2,3,4-тетрагидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(метилкарбонил)-6-бром-1,2,3,4-тетрагидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(4-хлорфенокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3,4-дихлорфенокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-трифторметилфенокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенилтио)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(3-хлорфенилтио)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-трифторметилфенилтио)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(3-трифторметилфенилтио)фенил, и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 3-йод-4-(1-(пирролидин-1-ил-карбонил)пирролидин-3-ил-окси)фенил STEREOCHEM, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-метилкарбонилоксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-4-окси-2-фенилхромен-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-(4-метилфенилтио)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метокси-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-трифторметил-7-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-трифторметилфенил-сульфонил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(4-трифторметилпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-фтор-6-трифторметил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой феноксатиин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-н-пропилфенил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 4-(N,N-(дипропил)аминосульфонил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-5-трифторметил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-(3-трифторметилфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(пиридин-2-ил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-фтор-4-(3-хлорфенокси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлор-5-трифторметилпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-трифторметил-6-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(тиен-2-ил-карбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-5-фтор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенил)-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолин-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(пиримидин-2-ил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пирролидин-1-ил-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-трифторметил-7-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4,4-дифторпиперидин-1-ил)-бензотиазол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-трет-бутил-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-трифторметил-5-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 3-бром-6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил), и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(3-хлорфенилтио)-фенил, и s равно 0;
соединения, где Y представляет собой пиррол-2-ил, Z представляет собой феноксатиин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(3-трифторметилкарбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фенилметил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-бром-1-метил-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-бром-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-(3-хлорфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилциклогексилкарбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6-трифторметилтиено[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-н-пропилиндол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-хлор-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-(3-трифторметилфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(пиррол-2-ил-карбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-трифторметил-6-метил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-4-трифторметоксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(2,2,2-трифторэтоксиметил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-циклобутил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1,3-диметил-5-хлориндол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-фтор-7-трифторметил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой флуорен-9-он-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-трифторметил-6-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метокси-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-метил-3-йодиндол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(2-хлор-5-фторфенилкарбониламино)-фенил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой изотиазол-5-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 4-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-трифторметил-6-метил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-(2-хлорфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(циклогексилкарбониламино)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой ксантен-9-он-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(2,2-дифторэтил)-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-трифторметил-6-метил-бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-(фенилметиламино)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-циклопропил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(6-фторпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(5-хлорпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-трифторметилбензотиазол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-фтор-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(3-хлор-5-трифторметилпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6-метоксибензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой 1H-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-бром-4-метилтиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой (1-фенилкарбонил)-2,3-дигидро-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-этилфенил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бром-3-метилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-хлорбензотиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4,4-дифторциклогексилкарбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(2,2,2-трифторэтокси)-фенил, и s равно 0;
соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-циклогексил-2-метилбензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 1,3-диметил-5-хлориндол-2-ил, Z представляет собой 1H-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пиридин-3-ил-оксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-циклогексил-1H-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фенилкарбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-трифторметил-5-метилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(3-трифторметилфенилсульфонил)-фенил, и s равно 0;
соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 3-бром-6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил), и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-изопропил-2-трифторметилбензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой 1H-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6,7-дихлорхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(2,3-диметилфениламино)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бром-5-метилтиен-2-ил, и s равно 0;
соединения, где Y представляет собой 3-бром-6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметил-1H-индол-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой 1H-пиррол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-6-трифторметилтиено[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 9-метил-9H-карбазол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-фторбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-4-(пиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой 1,2,3-тиадиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(3-фторфениламино)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-5-хлор-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметил-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(5-хлорпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1,3-диметил-5-хлориндол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-7-метокси-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(2,2,2-трифторэтил)-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 1,3-диметил-5-хлориндол-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6,7,8,9-тетрагидро-5H-карбазол-3-ил, и s равно 0;
соединения, где Y представляет собой 5-хлорбензотиазол-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(5-бромпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2,2-диметил-2,3-дигидробензофуран-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 9-метил-9H-карбазол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(3-трифторметилфениламино)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(4-трифторметилпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3,4-дигидро-2H-бензо[b][1,4]диоксепин-7-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметил-1H-индол-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(циклопропилкарбонил)-2,3-дигидро-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-бром-6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фенилметиламино)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3,5-ди-трет-бутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метил-1-(3,3,3-трифторпропил)-1H-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, s равно 1, и R1 представляет собой 2-трифторметил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-хлор-2-трифторметилхинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3,3,3-трифторпропил)-1H-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фениламино)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(2-метоксиэтокси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метилбензотиазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(6-фторпиридин-2-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой 5-хлорбензофуран-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бром-2-метилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-хлорхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2,6-диметил-1-(2,2,2-трифторэтил)пиррол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метил-1-(2,2,2-трифторэтил)-1H-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(3-трифторметилфенилтио)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-хлор-2-метилхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой 1-циклогексил-2-метил-1H-бензимидазол-5-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-фтор-3-метилбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фенилметиламино)-тиазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1,2-диметил-1H-индол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-хлорхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-циклогексил-1H-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, s равно 1, и R1 представляет собой 2(R,S)-трифторметил;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(3-хлор-5-трифторметилпиридин-2-илoкси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-(3-хлорфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бромтиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 10-оксо-10H-10λ4-феноксантиин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой 5-хлорбензофуран-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой пиридин-2-ил, Z представляет собой 3-хлор-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-(2-хлорфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-бромбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(2,2-дифторэтил)-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой 4-трифторметилтиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(морфолин-4-ил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(этиламинокарбонилметокси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6,7,8,9-тетрагидро-5H-карбазол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-хлорбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(пиримидин-2-ил)-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1H-индазол-5-ил, и s равно 0;
соединения, где Y представляет собой 5-хлорбензотиазол-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(фенилсульфонил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5,7-дихлор-2-метилхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6,7-дигидро-5H-1-тиа-4a,8-диаза-s-индацен-4-он-2-ил, и s равно 0;
соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-бром-3-метилимидазо[1,2-a]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-хлор-2-метилхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой 2-циклогексил-1H-бензимидазол-5-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-трифторметил-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2,3-дигидро-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметил-1H-пирроло[3,2-b]пиридин-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(изопропил)-2-трифторметилбензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(циклогексил)-2-метилбензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, s равно 1, и R1 представляет собой 3-трифторметил;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-хлор-2-метилхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(2-метилкарбониламиноэтокси)-фенил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(4-трифторметилпиридин-2-ил-oкси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-метилиндол-3-ил, и s равно 0;
соединения, где Y представляет собой 1,3-диметил-5-хлориндол-2-ил, Z представляет собой 1H-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-7-метокси-1H-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(2,2,2-трифторэтил)-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 4-хлор-2-трифторметилхинолин-6-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(1,1-диоксотиоморфолин-4-ил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метил-7-метоксихинолин-3-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-7-метокси-1H-индол-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-гидроксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-хлор-2-трифторметилхинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метокси-5-трет-бутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-6-метоксибензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(3,3,3-трифторпропил)-1H-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-7-метилимидазо[1,2-a]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой 2-циклогексил-1H-бензимидазол-5-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-2-фенил-4-оксохромен-8-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-хлорбензотиазол-2-ил, и s равно 0;
соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-7-метокси-1H-индол-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(2,2,2-трифторэтил)-2-метилбензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 4-хлор-2-трифторметилхинолин-6-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-трет-бутоксикарбонил-3,4-дигидро-1H-изoхинолин-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3-метилбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-трифторметил-1H-пирроло[3,2-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-бромфуро[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(3,3,3-трифторпропил)-2-метил-1H-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-3-метилимидазо[1,2-a]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(пиридин-2-ил-oкси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 7-фтор-3-метилбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(5-бромпиридин-2-ил-oкси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бромимидазо[1,2-a]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-фенилкарбонил-1H-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенокси)-3-фторфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенилсульфонил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(5-бромпиридин-2-ил-oкси)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-(2-фтор-5-трифторметилфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(3-трифторметилфенилметил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4-трифторметилфенилметил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-трифторметилфенилметил)-2,3-дигидро-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенилметил)-2,3-дигидро-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенил-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-фторфенил)-2,3-дигидро-1H-индол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-фторфенил)-2,3-дигидро-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой феноксатиин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(1,1-диметилпропил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-азепан-1-ил-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-циклогексилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-хлорнафто[2,1-b]тиофен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-изобутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-гептилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пентилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-н-бутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-фтор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-хлор-3-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-5-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-5-фтор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-5-трифторметил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-фтор-7-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(1-т-бутоксикарбонилпиперидин-4-ил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(5-метоксипиридин-3-ил-окси)-фенил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(циклогексилсульфонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4-трифторметилфенилкарбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пиридин-2-ил-окси-3-фторфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-бром-5-трифторметилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-бром-5-фторфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пиридин-2-ил-оксифенил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(3-хлорфенилсульфонил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фтор-5-бромфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2H-изохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метилкарбонил)-6-(3-трифторметилфенил)-3,4-дигидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-оксо-1,3-дигидроиндол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метилкарбонил)-6-(4-трифторметилфенил)-3,4-дигидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метилкарбонил)-6-(5-хлортиен-2-ил)-3,4-дигидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой фуразан-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-пиридин-2-ил-оксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-бром-5-трифторметилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метилкарбонил)-6-фенил-3,4-дигидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-фтор-5-бромфенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-фтор-5-бромфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фенилсульфонил)-3,4-дигидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4-трифторметилфенилсульфонил)-3,4-дигидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(3-хлорфенокси)-3-фторфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4,4-дифторциклогексил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-фенил-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-фторфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3,4-дифторфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(2,2,2-трифторэтил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3,3,3-трифторпропил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-фенил-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(4-фторфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(3,4-дифторфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(4-трифторметилфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(2,2,2-трифторэтил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(3,3,3-трифторпропил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(4,4-дифторциклогексил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(N-фенил-N-метиламиносульфонил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(пиперидин-1-ил-сульфонил)-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-(4,4-дифторциклогексилкарбонил)-1H-индол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-(6-хлорпиридин-3-илкарбонил)-1H-индол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-(пиридин-3-ил-карбонил)-1H-индол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-тиоморфолин-4-ил-хиназолин-7-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 9,9-диметил-9H-флуорен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилбензотиен-2-ил, s = 2, и R1 представляет собой цис-2,6-диметил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилбензотиен-2-ил, s = 2, и R1 представляет собой цис-3,5-диметил;
либо их сольватов или фармацевтически приемлемых солей.
В настоящем изобретении также предложена, помимо прочего, фармацевтическая композиция, содержащая, состоящая из и (или) по существу состоящая из фармацевтически приемлемого носителя, фармацевтически приемлемого эксципиента и (или) фармацевтически приемлемого разбавителя, и соединения формулы (I) или его фармацевтически приемлемой соли.
В настоящей заявке также предложены технологии изготовления фармацевтической композиции, включающие, состоящие из и (или) состоящие преимущественно из смешивания соединения формулы (I) и фармацевтически приемлемого носителя, фармацевтически приемлемого эксципиента и (или) фармацевтически приемлемого разбавителя.
В настоящем изобретении далее, в числе прочего, предложены способы лечения или облегчения расстройств, регулируемых MGL, у пациентов, включая человека или других млекопитающих, у которых заболевание, синдром или состояние зависят от модуляции фермента MGL (например, боль и заболевания, ведущие к возникновению такой боли, воспаления и нарушения ЦНС), с применением соединения формулы (I).
В настоящем изобретении также, в числе прочего, предложены способы получения рассматриваемых соединений и фармацевтических композиций, а также лекарственных препаратов, изготовленных на их основе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В отношении замещающих групп термин «независимо» относится к ситуациям, при которых когда возможно наличие более одной замещающей группы, указанные заместители могут быть как одинаковыми, так и разными.
Термин «алкил», используемый самостоятельно или для обозначения заместителя, обозначает прямую или разветвленную углеродную цепь, включающую от 1 до 8 атомов углерода. Следовательно, указанные количества атомов углерода (например, C1-8) независимо обозначают количество атомов углерода в алкильном фрагменте или алкильной части более крупного алкил-содержащего заместителя. В группах заместителей, содержащих несколько алкильных групп, например, (C1-6алкил)2амино, C1-6алкильные группы диалкиламино могут быть одинаковыми или могут различаться.
Термин «алкокси» обозначает -O-алкильную группу, в которой термин «алкил» соответствует приведенному выше определению.
Термины «алкенил» и «алкинил» обозначают прямые и разветвленные углеродные цепи, включающие 2 или более атомов углерода, где алкениловая цепь содержит по меньшей мере одну двойную связь, а алкиниловая цепь содержит по меньшей мере одну тройную связь.
Термин «циклоалкил» обозначает насыщенное или частично насыщенное, моноциклическое или полициклическое углеводородное кольцо, включающее от 3 до 14 атомов углерода. Примеры таких колец включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и адамантил.
Термин «бензоконденсированный циклоалкил» обозначает 5-8-членное моноциклическое циклоалкильное кольцо, конденсированное с бензольным кольцом. Атомы углерода, образующие циклоалкильное кольцо, могут быть полностью или частично насыщенными.
Термин «гетероциклил» обозначает неароматическую моноциклическую или бициклическую кольцевую систему, включающую от 3 до 10 атомов и содержащую атомы углерода и от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из N, O и S. Определение термина «гетероциклил» также включает неароматическое циклическое кольцо, состоящее из 5-7 атомов, из которых 1-2 атома - атомы азота, или неароматическое циклическое кольцо, состоящее из 5-7 атомов, из которых атомы 0, 1 или 2 представляют собой атомы азота, а до 2 атомов представляют собой атомы кислорода или серы и по меньшей мере один атом должен быть атомом азота, кислорода или серы; где (необязательно) кольцо содержит от нуля до одной ненасыщенной связи и (необязательно, когда кольцо состоит из 6 или 7 атомов) оно содержит до 2 ненасыщенных связей. Атомы углерода, образующие гетероциклическое кольцо, могут быть полностью насыщенными или частично насыщенными. Определение термина «гетероциклил» также включает две 5-членные моноциклические гетероциклоалкильные группы, соединенные мостиковой связью с образованием бициклического кольца. Такие группы не считаются полностью ароматическими и не обозначаются как гетероарильные группы. В случае если гетероциклил является бициклическим, оба кольца гетероциклила и по меньшей мере одно из колец содержит член с гетероциклическим ядром. Примеры гетероциклических групп без ограничений включают пирролинил (включая 2H-пиррол, 2-пирролинил или 3-пирролинил), пирролидинил, имидазолинил, имидазолидинил, пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил и пиперазинил. Если не указано иное, гетероциклил присоединен к своей боковой группе на любом гетероатоме или атоме углерода с образованием стабильной структуры.
Термин «бензоконденсированный гетероциклил» обозначает 5-7-членное моноциклическое гетероциклическое кольцо, конденсированное с бензольным кольцом. Гетероциклическое кольцо содержит атомы углерода и от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из N, O и S. Атомы углерода, образующие гетероциклическое кольцо, могут быть полностью насыщенными или частично насыщенными. Если не указано иное, бензоконденсированное гетероциклическое кольцо присоединено к своей боковой группе на атоме углерода бензольного кольца.
Термин «арил» обозначает ненасыщенное ароматическое моноциклическое или бициклическое кольцо, включающее от 6 до 10 атомов углерода. Примеры арильных колец включают фенил и нафталенил. Термин «гетероарил» обозначает ароматическую моноциклическую или бициклическую кольцевую систему, содержащую от 5 до 10 атомов-членов кольца и содержащую атомы углерода и от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из N, O и S. Определение термина «гетероарил» включает 5- или 6-членные ароматическое кольца, в которых кольцо состоит из атомов углерода и содержит по меньшей мере один гетероатом. Гетероатомы включают азот, кислород и серу. В случае 5-членных колец гетероарильное кольцо предпочтительно содержит один атом азота, кислорода или серы и, кроме того, до 3 дополнительных атомов азота. В случае 6-членных колец гетероарильное кольцо предпочтительно содержит от 1 до 3 атомов азота. В случае когда 6-членное кольцо имеет 3 атома азота, чаще всего 2 атома азота являются смежными. Если гетероарил является бициклическим, в каждом кольце присутствует по меньшей мере один гетероатом. Примеры гетероарильных групп включают фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил и пиразинил. Если не указано иное, гетероарил присоединен к своей боковой группе на любом гетероатоме или атоме углерода с образованием стабильной структуры.
Если не указано иное, термин «бензоконденсированный гетероарил» обозначает 5-6-членное моноциклическое гетероарильное кольцо, конденсированное с бензольным кольцом. Гетероарильное кольцо содержит атомы углерода и от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из N, O и S. Примеры гетероарильных групп с необязательно конденсированными бензольными кольцами включают индолил, изоиндолил, индолинил, бензофурил, бензотиенил, индазолил, бензимидазолил, бензотиазолил, бензоксазолил, бензизоксазолил, бензотиадиазолил, бензотриазолил, хинолинил, изохинолинил и хиназолинил. Если не указано иное, бензоконденсированный гетероарил присоединен к своей боковой группе на любом гетероатоме или атоме углерода с образованием стабильной структуры.
Термин «галоген» или «гало» обозначает фтор, хлор, бром и йод.
Термин «формил» обозначает группу -C(=O)H.
Термин «оксо» обозначает группу (=O).
Если термин «алкил» или «арил», либо любой из образованных от этих корней префиксов появляется в названии заместителя (например, арилалкил, алкиламино), при этом подразумевается, что все оговоренные выше ограничения для терминов «алкил» и «арил» переносятся и на производные названия. Указание числа атомов углерода (например, C1-C6) относится независимо к числу атомов углерода в алкильном фрагменте, в арильном фрагменте или алкильной части более крупного заместителя, в названии которого корень алкил используется в качестве префикса. Для алкильных и алкокси-заместителей указанное количество атомов углерода включает все независимые атомы-члены кольца, входящие в указанный диапазон. Например, C1-6 алкил включает по отдельности метил, этил, пропил, бутил, пентил и гексил, а также их подкомбинации (например, C1-2, C1-3, C1-4, C1-5, C2-6, C3-6, C4-6, C5-6, C2-5 и т. д.).
В целом, в рамках используемой в раскрытии настоящего изобретения стандартной номенклатуры первой указывается концевая часть описываемой боковой цепи, затем перечисляются следующие функциональные группы в направлении к точке присоединения заместителя. Так, например, описание заместителя C1-C6алкилкарбонила относится к группе следующей формулы:
Описанная ниже система нумерации используется для описания позиции R1 заместителей на пиперазинильном кольце формулы (I):
Термин «R» в стереоцентре означает, что стереоцентр имеет абсолютную R-конфигурацию согласно определению, принятому в отрасли; аналогично, термин «S» означает, что стереоцентр имеет абсолютную S-конфигурацию. Используемые в настоящей заявке термины «*R» или «*S» в стереоцентре используются для обозначения того, что стереоцентр имеет абсолютную, но неизвестную конфигурацию. Используемый в настоящей заявке термин «RS» обозначает стереоцентр, существующий в форме смеси R- и S-конфигураций. Аналогичным образом, термины «*RS» или «*SR» обозначают стереоцентры, существующие в форме смеси R- и S-конфигураций и имеющие неизвестную конфигурацию относительно другого стереоцентра в молекуле.
Соединения, содержащие один стереоцентр без обозначения стереосвязи, представляют собой смесь двух энантиомеров. Соединения, содержащие 2 стереоцентра без обозначения стереосвязи для обоих из них, представляют собой смесь четырех диастереомеров. Соединения с двумя стереоцентрами, оба из которых обозначены «RS» и имеют обозначения стереосвязи, представляют собой 2-компонентную смесь, обладающую соответствующими стереохимическими характеристиками, как показано в структурной формуле. Соединения с двумя стереоцентрами, оба из которых обозначены «*RS» и имеют обозначения стереосвязи, представляют собой 2-компонентную смесь с соответствующими неизвестными стереохимическими характеристиками. Необозначенные стереоцентры, указанные в структурной формуле без обозначения стереосвязей, представляют собой смесь R- и S-конфигураций. Для необозначенных стереоцентров, структурная формула которых приводится с обозначениями стереосвязей, абсолютные стереохимические характеристики соответствуют изображенной формуле.
Если не указано иное, предполагается, что определение какого-либо заместителя или переменной на определенной позиции в молекуле не зависит от соответствующих определений на других участках молекулы. При этом заместители и модели замещения, используемые в соединениях формулы (I), указанных в настоящем документе, могут выбираться средним специалистом отрасли для получения химически стабильных соединений, которые можно легко синтезировать с применением известных в отрасли технологий, а также методик, описанных в настоящей заявке.
Термин «пациент» обозначает животное, предпочтительно млекопитающее, наиболее предпочтительно человек, являющееся объектом лечения, наблюдения или эксперимента.
Термин «терапевтически эффективное количество» обозначает количество активного соединения или фармацевтической субстанции, включая соединение, предлагаемое в настоящем изобретении, которое вызывает биологическую или медицинскую реакцию в системе тканей (животного или человека), необходимую исследователю, ветеринару, врачу или другому клиницисту, включая облегчение или частичное облегчение симптомов заболевания, синдрома, состояния или расстройства, требующего лечения.
Термин «композиция» обозначает препарат, включающий указанные ингредиенты в терапевтически эффективных количествах, а также любой препарат, полученный (прямо или косвенно) из комбинаций указанных ингредиентов в указанных количествах.
Термин «ингибитор MGL» призван охватить соединение, взаимодействующее с MGL с целью существенно сократить или ликвидировать его каталитическую активность, тем самым повышая концентрацию его субстрата(-ов). Термин «регулируемый MGL» используется для обозначения состояния, зависящего от модуляции фермента MGL, включая состояние, зависящее от ингибирования фермента MGL, например, боль и заболевания, ведущие к возникновению такой боли, воспаления и нарушения ЦНС.
Если не указано иное, используемый в настоящей заявке термин «зависеть» или «зависящий» (в отношении заболевания, синдрома, состояния или расстройства, зависящего от ингибирования MGL) включает снижение частоты и (или) уменьшение тяжести одного или нескольких симптомов или проявлений упомянутого заболевания, синдрома, состояния или расстройства; и (или) включает профилактику развития одного или нескольких симптомов или проявлений указанного заболевания, синдрома, состояния или расстройства либо развития заболевания, синдрома, состояния или расстройства.
Соединения формулы (I) полезны для применения в способах лечения, облегчения и (или) профилактики заболеваний, синдромов, состояний или расстройств, зависящих от ингибирования MGL. Такие способы включают, состоят из и (или) по существу состоят из назначения пациенту (включая животных, млекопитающих и человека), нуждающемуся в таком лечении, облегчении и (или) профилактике, терапевтически эффективного количества соединения формулы (I), указанного в настоящем документе, или его энантиомера, диастереомера, сольвата или фармацевтически приемлемой соли. В частности, соединения формулы (I), определенной в настоящей заявке, могут найти применение для лечения, облегчения и (или) предотвращения боли; болезней, синдромов, состояний или расстройств, вызывающих такую боль; воспаления и (или) расстройства центральной нервной системы. В частности, соединения формулы (I), указанные в настоящем документе, полезны при лечении, облегчении и (или) профилактике воспалительной боли, состояний повышенной чувствительности при воспалениях и (или) нейропатической боли. Такое лечение, облегчение и (или) профилактика включает назначение пациенту, нуждающемуся в лечении, терапевтически эффективного количества соединения формулы (I), указанного в настоящем документе.
Примеры воспалительной боли включают боли в связи с болезнью, состоянием, синдромом, расстройством или болевое состояние, включающее воспалительное заболевание кишечника, внутренние боли, мигрень, послеоперационные боли, остеоартрит, ревматоидный артрит, боль в спине, боль в нижней части спины, боль в суставах, брюшную боль, боль в груди, боли при родовых схватках, костно-мышечные заболевания, заболевания кожи, зубную боль, пирез, ожоги, солнечные ожоги, укусы змей, укусы ядовитых змей, укусы пауков, укусы насекомых, нейрогенный мочевой пузырь, интерстициальный цистит, инфекции мочевых путей, ринит, контактный дерматит/аллергию, зуд, экзему, фарингит, воспаление слизистой оболочки, энтерит, синдром раздраженной толстой кишки, холеоцистит, панкреатит, болевой синдром после мастэктомии, менструальные боли, эндометриоз, боли вследствие физической травмы, головную боль, синусоидальную головную боль, гипертоническую головную боль или арахноидит.
Одним из видов воспалительной боли является воспалительная гипералгезия или гиперчувствительность. Примеры воспалительной гипералгезии включают болезни, синдромы, состояния, расстройства или болевые состояния, включая воспаление, остеоартрит, ревматоидный артрит, боли в спине, суставах, брюшной области, костно-мышечные заболевания, заболевания кожи, послеоперационную боль, головные боли, зубную боль, ожоги, солнечные ожоги, укусы насекомых, нейрогенный мочевой пузырь, недержание мочи, интерстициальный цистит, инфекции мочевых путей, кашель, астму, хроническое обструктивное заболевание легких, ринит, контактный дерматит/аллергию, зуд, экзему, фарингит, энтерит, синдром раздраженной толстой кишки, воспалительные заболевания кишечника, включая болезнь Крона, язвенный колит, недержание мочи, доброкачественную простатическую гипертрофию, кашель, астму, ринит, повышенную чувствительность носа, зуд, контактные дерматиты и (или) кожную аллергию и хроническое обструктивное заболевание легких.
В одном варианте осуществления настоящее изобретение относится к способу лечения, облегчения и (или) профилактики висцеральной гипералгезии с повышенной висцеральной чувствительностью, включающему, состоящему из и (или) по существу состоящему из этапа назначения пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, соли или сольвата формулы (I), указанных в настоящем документе. В дальнейшем осуществлении настоящее изобретение направлено на способ лечения воспалительной соматической гипералгезии, при которой имеет место повышенная чувствительность к температурным, механическим и (или) химическим раздражителям, включающий назначение нуждающемуся в таком лечении млекопитающему терапевтически эффективной дозы соединения формулы (I) либо его энантиомера, диастереомера, сольвата или фармацевтически допустимой соли.
Дальнейший вариант реализации настоящего изобретения относится к способу лечения, смягчения или предотвращения нейропатической боли. К примерам нейропатической боли относятся боль, вызванная заболеванием, синдромом, состоянием, расстройством, или болезненное состояние, в том числе рак, неврологические расстройства, операции спинного мозга и периферических нервов, опухоль головного мозга, черепно-мозговая травма (ЧМТ), травмы спинного мозга, синдром хронической боли, фибромиалгия, синдром хронической усталости, волчанка, саркоидоз, периферическая невропатия, двусторонняя периферическая невропатия, диабетическая нейропатия, центральная боль, невропатия, связанная с повреждением спинного мозга, инсульт, боковой амиотрофический склероз (БАС), болезнь Паркинсона, рассеянный склероз, воспаление седалищного нерва, невралгия нижнечелюстного сустава, периферический неврит, полиневрит, боль после ампутации, фантомная боль в конечностях, переломы костей, нейропатическая боль во рту, боли Шарко, комплексный регионарный болевой синдром I и II (КРБС I/II), радикулопатия, синдром Гийена-Барре, парестетический ишиас, синдром жжения во рту, неврит зрительного нерва, постфебрильный неврит, мигрирующий неврит, сегментарный неврит, неврит Гомбо, нейронит, шейно-плечевая невралгия, черепная невралгия, невралгия коленных суставов, языкоглоточная невралгия, мигренозная невралгия, идиопатическая невралгия, межреберная невралгия, невралгия молочных желез, невралгия Мортона, назоцилиарная невралгия, затылочная невралгия, постгерпетическая невралгия, каузалгия, красная невралгия, невралгия Сладера, невралгия крылонебного узла, надглазничная невралгия, невралгия тройничного нерва, вульводиния или невралгия Видиана.
Один вид нейропатической боли представляет собой нейропатическую холодовую аллодинию, которая характеризуется наличием связанного с нейропатией аллодинического состояния с повышенной чувствительностью к холодовым раздражителям. Примеры невропатической холодовой аллодинии включают аллодинию вследствие заболевания, состояния, синдрома, расстройства или болевого состояния, включая невропатическую боль (невралгию), боль, возникающую после операции или травмы спинного или периферического нерва, травматические повреждения мозга (ТПМ), тригеминальную невралгию, постгерпетичекую невралгию, каузалгию, периферическую невропатию, диабетическую невропатию, центральную боль, приступы, периферический неврит, полиневрит, комплексный регионарный болевой синдром I и II степени (КРБС I/II) и радикулопатию.
В другом варианте осуществления настоящее изобретение относится к способу лечения, облегчения и (или) профилактики нейропатической холодовой аллодинии с повышенной чувствительностью к холодовым раздражителям, включающему, состоящему из и (или) состоящему преимущественно из этапа назначения пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), указанного в настоящем документе, или его энантиомера, диастереомера, сольвата или фармацевтически приемлемой соли.
Дальнейший вариант реализации настоящего изобретения относится к способу лечения, смягчения или предотвращения расстройств ЦНС. Примеры расстройств центральной нервной системы включают беспокойства, такие как социальное беспокойство, посттравматический стресс, фобии, социофобия, особые фобии, паническое расстройство, обсессивно-компульсивное расстройство, острый стресс, расстройство, тревожное расстройство, вызванное разлукой и генерализированное тревожное расстройство, а также депрессии, такие как большая депрессия, биполярное расстройство, зимняя депрессия, послеродовая депрессия, маниакально-депрессивный психоз и биполярная депрессия.
Настоящее изобретение включает фармацевтическую композицию, содержащую соединение формулы (I), где:
Формула (I)
где
a) группа a) представляет собой
i) замещенный C6-10арил,
ii) трифторметил; или
iii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила, пирролила, пиридинила и [1,2,3]тиадиазолила;
где C6-10арил замещен; а гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
b) группа a) представляет собой
ii) замещенный C6-10арил,
iii) трифторметил; или
iv) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила и пирролила;
где C6-10арил замещен; а гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
c) группа a) представляет собой
i) замещенный C6-10арил или
ii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила и пирролила;
где C6-10арил замещен; а гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
d) группа b) представляет собой:
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из тиазолила, пиридинила, индолила, пирролила, бензоксазолила, бензолиазолила, бензотиенила, бензофуранила, пирроло[2,3-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила, тиенила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; C3-7циклоалкилсульфонила; фенила; фенилкарбонила; тиенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; (C1-4алкил)аминокарбонила; C1-6алкилкарбонила; C1-6алкилкарбонил-C1-4алкила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом C3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 заместителями, выбранными из группы, состоящей из фенила, брома и C1-4алкила; при этом фенил и тиенил каждый необязательно замещен трифторметилзаместителем;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил;
vii) ксантен-9-он-3-ил;
viii) 9-метил-9H-карбазол-3-ил;
ix) 6,7,8,9-тетрагидро-5H-карбазол-3-ил; или
x) 4-(3-хлорфенил)-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолин-8-ил;
где C6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) C2-4алкенила;
iii) C3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) C1-4алкокси;
v) 2-метоксиэтокси;
vi) C1-4алкилтио;
vii) трифторметила;
viii) 2,2,2-трифторэтила;
ix) 2,2-дифторэтила;
x) 3,3,3-трифторпропила;
xi) трифторметокси;
xii) 2,2,2-трифторэтоксиметила;
xiii) 2,2,2-трифторэтокси;
xiv) трифторметилтио;
xv) ди(C1-4алкил)аминосульфонила;
xvi) хлора;
xvii) циано;
xviii) фтора;
xix) брома;
xx) йода;
xxi) NRaRb, где Ra представляет собой водород или C1-6алкил; и Rb представляет собой C1-6алкил, фенил, C3-8циклоалкил, C3-8циклоалкилкарбонил, C3-8циклоалкил(C1-2алкил), C1-6алкилкарбонил, необязательно замещенный одним-тремя фтор-заместителями, C1-4алкоксикарбонил, C6-10арил(C1-2)алкил, фенилкарбонил или фенил(C1-2)алкилкарбонил;
при этом C3-8циклоалкил, C3-8циклоалкилкарбонил, C6-10арил C6-10арил(C1-2)алкила, фенилкарбонил и фенил Rb необязательно замещены 1-2 заместителями, выбранными из C1-4алкила, трифторметила, хлора или фтора;
или Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей и C1-3алкила; и необязательно содержащего один дополнительный гетероатом с образованием пиперазинила; при этом указанное гетероциклическое кольцо необязательно бензоконденсировано; и гетероциклическое кольцо необязательно замещено на атоме азота, присутствующем в указанном кольце, C1-6алкоксикарбонилом;
xxii) (1-R2)пирролидин-3-ил-окси; в котором R2 представляет собой пирролидин-1-ил-сульфонил, диметиламинокарбонил, диметиламиносульфонил, пирролидин-1-ил-карбонил, фенилкарбонил, C3-7циклоалкилкарбонил, C1-4алкилкарбонил, морфолин-4-ил-карбонил или C1-4алкоксикарбонил;
xxiii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен C1-4алкоксикарбонилом или C1-4алкилкарбонилом;
xxiv) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила, хлора и фтора;
xv) фенилсульфонила, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями;
xxv) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, трифторметила и хлора;
xxvi) фенилтио, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями; и
xxvii) 2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ила;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой C3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; фенилтио; или C3-8циклоалкилокси;
e) группа b) представляет собой:
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из пиридинила, индолила, бензотиазолила, бензотиенила, бензофуранила, пирроло[2,3-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила, тиенила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; C3-7циклоалкилсульфонила; фенила; фенилкарбонила; тиенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; (C1-4алкил)аминокарбонила; C1-6алкилкарбонила; C1-6алкилкарбонил-C1-4алкила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом C3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 заместителями, выбранными из группы, состоящей из фенила, брома и C1-4алкила;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил;
vii) ксантен-9-он-3-ил;
viii) 9-метил-9H-карбазол-3-ил;
ix) 6,7,8,9-тетрагидро-5H-карбазол-3-ил; или
x) 4-(3-хлорфенил)-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолин-8-ил;
где C6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) C2-4алкенила;
iii) C3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) C1-4алкокси;
v) C1-4алкилтио;
vi) трифторметила;
vii) 2,2,2-трифторэтила;
viii) 2,2-дифторэтила;
ix) 3,3,3-трифторпропила;
x) трифторметокси;
xi) 2,2,2-трифторэтоксиметила;
xii) 2,2,2-трифторэтокси;
xiii) трифторметилтио;
xiv) ди(C1-4алкил)аминосульфонила;
xv) хлора;
xvi) циано;
xvii) фтора;
xviii) брома;
xix) йода;
xx) NRaRb, где Ra представляет собой водород или C1-6алкил; и Rb представляет собой C1-6алкил, фенил, C3-8циклоалкил, C3-8циклоалкилкарбонил, C3-8циклоалкил(C1-2алкил), C1-6алкилкарбонил, необязательно замещенный одним-тремя фтор-заместителями, C1-4алкоксикарбонил, C6-10арил(C1-2)алкил, фенилкарбонил или фенил(C1-2)алкилкарбонил;
при этом C3-8циклоалкил, C3-8циклоалкилкарбонил, C6-10арил C6-10арил(C1-2)алкила, фенилкарбонил и фенил Rb необязательно замещены 1-2 заместителями, выбранными из C1-4алкила, трифторметила, хлора или фтора;
или Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей и C1-3алкила; и необязательно содержащего один дополнительный гетероатом с образованием пиперазинила; при этом указанное гетероциклическое кольцо необязательно бензоконденсировано; и гетероциклическое кольцо необязательно замещено на атоме азота, присутствующем в указанном кольце, C1-6алкоксикарбонилом;
xxi) (1-R2)пирролидин-3-ил-окси; в котором R2 представляет собой пирролидин-1-ил-сульфонил, диметиламинокарбонил, диметиламиносульфонил, пирролидин-1-ил-карбонил, фенилкарбонил, C3-7циклоалкилкарбонил, C1-4алкилкарбонил, морфолин-4-ил-карбонил или C1-4алкоксикарбонил;
xxii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен C1-4алкоксикарбонилом или C1-4алкилкарбонилом;
xxiii) пиридинилоксила, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила, хлора и фтора;
xv) фенилсульфонила, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями;
xxiv) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, трифторметила и хлора;
xxv) фенилтио, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями; и
xxvi) 2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ила;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой C3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; фенилтио; или C3-8циклоалкилокси;
f) группа b) представляет собой:
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из пиридинила, индолила, бензолиазолила, бензотиенила, пирроло[2,3-b]пиридинила и тиено[2,3-b]пиридинила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; C3-7циклоалкилсульфонила; фенила; фенилкарбонила; тиенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом C3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен одним или двумя дополнительными заместителями, выбранными из группы, состоящей из фенила;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил; или
vii) 4-(3-хлорфенил)-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолин-8-ил;
где C6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) C2-4алкенила;
iii) C3-6циклоалкила;
iv) C1-4алкокси;
v) трифторметила;
vi) трифторметокси;
vii) 2,2,2-трифторэтоксиметила;
viii) ди(C1-4алкил)аминосульфонила;
ix) хлора;
x) фтора;
xi) брома;
xii) йода;
xiii) NRaRb в котором Ra представляет собой C1-6алкил; и Rb представляет собой C1-6алкил, C3-8циклоалкил, C3-8циклоалкил(C1-2алкил), C1-6алкилкарбонил, необязательно замещенный 1-3 фтор-заместителями, C1-4алкоксикарбонилом, фенилкарбонилом или фенил(C1-2)алкилкарбонилом;
при этом C3-8циклоалкил, C3-8циклоалкилкарбонил, C6-10арил C6-10арил(C1-2)алкила, фенилкарбонил и фенил Rb необязательно замещены 1-2 заместителями, выбранными из трифторметила, хлора или фтора;
или Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей и C1-3алкила; и необязательно содержащего один дополнительный гетероатом с образованием пиперазинила; при этом указанное гетероциклическое кольцо необязательно бензоконденсировано; и гетероциклическое кольцо необязательно замещено на атоме азота, присутствующем в указанном кольце, C1-6алкоксикарбонилом;
xiv) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен C1-4алкоксикарбонилом или C1-4алкилкарбонилом;
xv) пиридинилоксила, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила и хлора;
xv) фенилсульфонила, необязательно замещенного C1-4алкилом или трифторметилом;
xvi) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, трифторметила и хлора; и
xvii) фенилтио, необязательно замещенного C1-4алкилом, трифторметилом или одним или двумя хлор-заместителями;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой C3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; фенилтио; или C3-8циклоалкилокси;
g) s равно 0 или 1;
h) R1 представляет собой C6-10арил, C1-3алкил или трифторметил;
i) R1 представляет собой фенил, C1-3алкил или трифторметил;
j) R1 представляет собой фенил;
и любое сочетание описанных выше вариантов осуществления изобретения от a) до j), при этом предполагается, что сочетания, которые требуют различных вариантов одного и того же заместителя, исключаются;
при условии, что соединение формулы (I) отлично от
соединения, где Y представляет собой 2-метоксифенил, Z представляет собой 4-циклогексилфенил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3H-бензимидазол-2-ил, s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1H-бензимидазол-2-ил и s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-хлорбензофуран-2-ил, s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1H-индол-2-ил, s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-бромфуро[2,3-b]пиридин-2-ил, s равно 0;
соединения, где Y представляет собой 5-бромфуро[2,3-b]пиридин-2-ил, Z представляет собой тиазол-4-ил и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-трифторметил-1H-пирроло[3,2-b]пиридин-2-ил и s равно 0; соединения, где Y представляет собой 1H-пиррол-2-ил, Z представляет собой 6-бром-7-метилимидазо[1,2-a]пиридин-2-ил и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 8-бром-6-хлоримидазо[1,2-a]пиридин-2-ил, и s равно 0; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилимидазо[1,2-a]пиридин-2-ил, и s равно 0; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-гидрокси-3-метилкарбониламинофенил, и s равно 0; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0; а также его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Используемые в медицинских целях соли соединений формулы (I), указанных в настоящем документе, относятся к нетоксичным «фармацевтически приемлемым солям». Однако для получения соединений формулы (I), указанных в настоящем документе, или их фармацевтически приемлемых солей могут использоваться другие соли. Соответствующие фармацевтически приемлемые соли соединений формулы (I), указанных в настоящем документе, включают кислотно-аддитивные соли, полученные, например, путем смешивания раствора соединения с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, серная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, виннокаменная кислота, угольная кислота или фосфорная кислота. Кроме того, в случаях когда соединения формулы (I), указанные в настоящем документе, имеют кислотный фрагмент, его соответствующие фармацевтически приемлемые соли могут включать соли щелочных металлов, например, соли натрия или калия; соли щелочноземельных металлов, например, соли кальция или магния; а также соли, образованные соответствующими органическими лигандами, например, четвертичные аммониевые соли. Таким образом, типичные примеры фармацевтически приемлемых солей включают в себя следующие соли: ацетаты, бензолсульфонаты, бензоаты, бикарбонаты, бисульфаты, битартраты, бораты, бромиды, кальция эдетаты, камсилаты, карбонаты, хлориды, клавуланаты, цитраты, дигидрохлориды, эдетаты, эдисилаты, эстолаты, эсилаты, фумараты, глуцептаты, глюконаты, глутаматы, гликоллиларсанилаты, гексилрезорцинаты, гидрабамины, гидробромиды, гидрохлориды, гидроксинафтоаты, йодиды, изотионаты, лактаты, лактобионаты, лаураты, малаты, малеаты, манделаты, мезилаты, метилбромиды, метилнитраты, метилсульфаты, мукаты, напсилаты, нитраты, N-метилглюкамина аммониевые соли, олеаты, памоаты (эмбонаты), пальмитаты, пантотенаты, фосфаты/дифосфаты, полигалактуронаты, салицилаты, стеараты, сульфаты, субацетаты, сукцинаты, таннаты, тартраты, теоклаты, тозилаты, триэтиодиды и валераты.
Примеры кислот и оснований, которые могут использоваться при получении фармацевтически приемлемых солей, включают следующие кислоты: уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамиобензойную кислоту, (+)-камфорную кислоту, камфорсульфоновую кислоту, (+)-(1S)-камфор-10-сульфоновую кислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламиновую кислоту, додецилсерную кислоту, этан-1,2-дисульфоновую кислоту,этансульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкуроновую кислоту, L-глутаминовую кислоту, α-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромоводородную кислоту, хлороводородную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 1-гидрокси-2-нафтоевую кислоту, никотиновую кислоту, азотную кислоту, масляную кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, фосфорную кислоту, L-пироглютамовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-виннокаменную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту и ундециленовую кислоту; и следующие основания: аммиак, L-аргинин, бенетамин, бензатин, кальция гидроксид, холин, деанол, диэтаноламин, диэтиламин, 2-(диэтиламино)-этанол, этаноламин, этилендиамин, N-метилглютамин, гидрабамин, 1H-имидазол, L-лизин, магния гидроксид, 4-(2-гидроксиэтил)-морфолин, пиперазин, калия гидрохлорид, 1-(2-гидроксиэтил)-пирролидин, вторичный амин, натрия гидроксид, триэтаноламин, трометамин и цинка гидроксид.
Варианты осуществления настоящего изобретения включают пролекарства соединений формулы (I), указанных в настоящем документе. В целом подобные пролекарства представляют собой функциональные производные соединений, составляющих предмет настоящего изобретения, которые in vivo легко превращаются в требуемое соединение. Таким образом, в вариантах осуществления настоящего изобретения, относящихся к способам лечения или профилактики, термин «применение» («прием», «назначение») охватывает лечение или профилактику различных заболеваний, состояний, синдромов и расстройств, упоминаемых в описании соединения, являющегося предметом настоящего изобретения, или соединения, не упоминаемого в настоящем описании, но преобразующегося в указанное соединение in vivo после его приема пациентом. Общепринятые процедуры отбора и приготовления соответствующих производных пролекарственных форм описаны, например, в работе Design of Prodrugs, ed. H. Bundgaard, Elsevier, 1985.
Если соединения в соответствии с вариантами осуществления настоящего изобретения имеют по меньшей мере один хиральный центр, они могут соответственно существовать в форме энантиомеров. В тех случаях, когда соединения обладают двумя или более хиральными центрами, они дополнительно могут существовать в форме диастереомеров. Необходимо понимать, что все подобные изомеры и их смеси попадают в рамки настоящего изобретения. Кроме того, некоторые из кристаллических форм соединений настоящего изобретения могут существовать в виде полиморфов, и в таком качестве они попадают под действие настоящего изобретения. Кроме того, некоторые из соединений могут образовывать сольваты с водой (т.е. гидраты) или широко распространенными органическими растворителями, при этом такие сольваты также попадают в рамки настоящего изобретения. Специалисты в данной области понимают, что используемый в настоящей заявке термин «соединение» считается включающим сольватированные соединения формулы I.
В тех случаях, когда процессы получения соединений в соответствии с вариантами осуществления настоящего изобретения приводят к образованию смеси стереоизомеров, эти изомеры могут быть изолированы при помощи стандартных способов, таких как препаративная хроматография. Соединения могут быть получены в форме рацематов, либо индивидуальные энантиомеры могут быть получены в результате энантиоспецифического синтеза либо посредством разделения. Соединения могут, например, быть разделены на составляющие энантиомеры с помощью стандартных способов, таких как формирование диастереометрических пар путем образования солей с оптически активными кислотами, например, (-)-ди-п-толуоил-D-виннокаменная кислота и (или) (+)-ди-п-толуоил-L-виннокаменная кислота, с последующей фракционной кристаллизацией и восстановлением свободного основания. Соединения могут также быть разделены с помощью образования диастереомерных эфиров или амидов с последующим хроматографическим разделением и удалением хирального партнера. В другом варианте осуществления настоящего изобретения такие соединения могут быть разделены при помощи хиральной колонки для ВЭЖХ.
Один вариант осуществления настоящего изобретения относится к композиции (включая фармацевтическую композицию), включающей, состоящей из и (или) по существу состоящей из (+)-энантиомера соединения формулы (I), указанного в настоящем документе, где указанная композиция по существу не содержит (-)-изомера указанного соединения. В контексте настоящего документа термин «по существу не содержит» означает содержание (-)-изомера в концентрации менее приблизительно 25%, предпочтительно менее приблизительно 10%, предпочтительнее менее приблизительно 5%, еще более предпочтительно менее приблизительно 2%, а еще более предпочтительно - менее приблизительно 1% при вычислении по следующей формуле.
.
Другой вариант осуществления настоящего изобретения представляет собой композицию, в том числе фармацевтическую композицию, включающую, состоящую из и по существу состоящую из (-)-энантиомера соединения формулы (I), указанного в настоящем документе, где указанная композиция по существу не содержит (+)-изомера указанного соединения. В контексте настоящего документа термин «по существу не содержит» означает содержание (+)-изомера в концентрации менее приблизительно 25%, предпочтительно менее приблизительно 10%, предпочтительнее менее приблизительно 5%, еще более предпочтительно менее приблизительно 2%, а еще более предпочтительно - менее приблизительно 1% при вычислении по следующей формуле.
.
В ходе процессов получения соединений в соответствии с вариантами осуществления настоящего изобретения может возникнуть необходимость в защите чувствительных или реакционных групп любой из рассматриваемых молекул. Для этих целей могут использоваться традиционные защитные группы, например, описанные в документах Protective Groups in Organic Chemistry, Second Edition, J.F.W. McOmie, Plenum Press, 1973; T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991; и T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, Third Edition, John Wiley & Sons, 1999. Введенные защитные группы могут быть впоследствии удалены на любой удобной для этого стадии с применение известных специалистам способов.
Даже хотя соединения в соответствии с вариантами осуществления настоящего изобретения (включая их фармацевтически приемлемые соли и фармацевтически приемлемые сольваты) могут применяться самостоятельно, они, как правило, применяются в смеси с фармацевтически приемлемым носителем, фармацевтически приемлемым эксципиентом и (или) фармацевтически приемлемым разбавителем, выбранным с учетом предполагаемого способа приема и принятыми стандартами фармацевтической или ветеринарной практики. Следовательно, частные варианты осуществления настоящего изобретения относятся к фармацевтическим и ветеринарным композициям, включающим соединения формулы (I), указанные в настоящем документе, и по меньшей мере один фармацевтически приемлемый носитель, фармацевтически приемлемый эксципиент и (или) фармацевтически приемлемый разбавитель.
Например, в фармацевтических композициях в соответствии с вариантами осуществления настоящего изобретения соединения формулы (I), указанные в настоящем документе, могут быть смешаны с любым подходящим связывающим веществом (связывающими веществами), скользящим веществом (скользящими веществами), суспендирующим веществом (суспендирующими веществами), веществом (веществами) для нанесения оболочки, солюбилизирующим веществом (солюбилизирующими веществами), а также комбинациями указанных веществ.
Твердые лекарственные формы для перорального применения, такие как таблетки или капсулы, содержащие соединения в соответствии с настоящим изобретением, могут приниматься по меньшей мере по одной за раз, в зависимости от ситуации. Указанные соединения также возможно применять в виде композиций с замедленным высвобождением.
Дополнительные лекарственные формы для перорального применения, в которых могут применяться соединения в соответствии с настоящим изобретением, включают эликсиры, растворы, сиропы и суспензии; каждая из таких форм необязательно может содержать вкусовые добавки и красители.
В другом варианте осуществления настоящего изобретения соединения формулы (I), указанные в настоящем документе, могут применяться в виде ингаляций (интратрахеальных или интраназальных) либо в форме суппозиториев или пессариев, а также могут наноситься местно в виде лосьонов, растворов, кремов, мазей или присыпок. Например, их можно включить в крем, содержащий, состоящий из и (или) по существу состоящий из водной эмульсии полиэтиленгликолей или жидкого парафина. Данные соединения также могут вводиться (в концентрации от приблизительно 1% до приблизительно 10% от массы крема) в состав мази, включающей, состоящей из и (или) по существу состоящей из белого воска или белого полутвердого парафина в качестве основы вместе с любыми стабилизаторами и консервантами при необходимости. Альтернативные способы применения включают трансдермальное применение с использованием накожного или трансдермального пластыря.
Фармацевтические композиции в соответствии с настоящим изобретением (а также соединения в соответствии с настоящим изобретением по отдельности) также могут вводиться парентерально в виде инъекций, например, путем внутрикавернозного, внутривенного, внутримышечного, подкожного, внутрикожного или спинального введения. В этих случаях композиции также будут включать по меньшей мере один соответствующий носитель, соответствующий эксципиент и соответствующий разбавитель.
Для парентерального введения фармацевтические композиции в соответствии с настоящим изобретением лучше всего использовать в форме стерильных водных растворов, которые могут содержать другие вещества, например, соли и моносахариды в достаточном количестве, чтобы раствор был изотоническим относительно крови.
Для защечного или подъязычного применения фармацевтические композиции в соответствии с настоящим изобретением могут применяться в форме таблеток или пастилок с традиционным составом.
Кроме того, как пример, фармацевтические композиции, содержащие в качестве активного ингредиента по меньшей мере одно из соединений формулы (I), указанных в настоящем документе, могут изготавливаться путем смешивания данного соединения (соединений) с фармацевтически приемлемым носителем, фармацевтически приемлемым разбавителем и (или) фармацевтически приемлемым эксципиентом в соответствии с методиками составления композиций, принятыми в фармацевтической промышленности. Носитель, эксципиент и разбавитель могут использоваться в самых различных формах в зависимости от планируемого способа применения (например, перорально, парентерально и т.д.). Таким образом, для жидких пероральных лекарственных форм, таких как суспензии, сиропы, эликсиры и растворы, подходящие носители, эксципиенты и разбавители включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, стабилизаторы, красители и тому подобные вещества; для твердых пероральных лекарственных форм, таких как порошки, капсулы и таблетки, подходящие носители, эксципиенты и разбавители включают крахмалы, сахара, разбавители, гранулирующие вещества, скользящие вещества, связывающие вещества, вещества для улучшения распадаемости таблеток и тому подобные. Твердые пероральные лекарственные формы также необязательно могут быть покрыты оболочкой из таких веществ, как сахара, либо могут быть покрыты кишечнорастворимой оболочкой для изменения основного места всасывания и растворения лекарства. Для парентерального применения носитель, эксципиент и разбавитель, как правило, включают стерильную воду. Кроме того, для улучшения растворимости и консервирования композиции также могут добавляться другие ингредиенты. Суспензии или растворы для инъекций также могут изготавливаться с использованием носителей на водной основе вместе с соответствующими добавками, такими как солюбилизаторы и консерванты.
Терапевтически эффективное количество соединения формулы (I), указанного в настоящем документе, или фармацевтической композиции в соответствии с настоящим изобретением включает дозу в интервале от приблизительно 0,1 мг до приблизительно 3000 мг или любое особое количество или диапазон доз в указанных пределах, в частности, от приблизительно 1 мг до приблизительно 1000 мг, или любое особое количество или диапазон доз в указанных пределах, или, конкретнее, от приблизительно 10 мг до приблизительно 500 мг, или любое особое количество или диапазон доз в указанных пределах для активного ингредиента при режиме приема от приблизительно 1 до приблизительно 4 раз в день для среднего человека (массой 70 кг); тем не менее специалисту очевидно, что терапевтически эффективное количество соединения формулы (I), указанного в настоящем документе, будет варьировать в зависимости от имеющихся заболеваний, синдромов, состояний и расстройств, для лечения которых применяется данное соединение.
Для перорального применения фармацевтическая композиция предпочтительно предлагается в форме таблеток, содержащих приблизительно 0,01, приблизительно 10, приблизительно 50, приблизительно 100, приблизительно 150, приблизительно 200, приблизительно 250 и приблизительно 500 миллиграммов соединения формулы (I), указанного в настоящем документе.
Соединение формулы (I), указанное в настоящем документе, предпочтительно может применяться в однократной суточной дозировке, либо общая суточная доза может быть разделена на два, три или четыре приема.
Оптимальные дозировки соединения формулы (I), указанного в настоящем документе, легко определяются специалистом и варьируются в зависимости от конкретного применяемого соединения, способа применения, концентрации препарата и стадии развития заболевания, синдрома, состояния или расстройства. Кроме того, на необходимость корректировки дозы для достижения соответствующего терапевтического уровня и желаемого терапевтического эффекта влияют факторы, связанные с конкретным пациентом, проходящим лечение, включая пол, возраст, массу тела, особенности диеты, а также время приема лекарственного препарата. Поэтому приведенные выше дозировки являются примерными для некоторого среднего случая. Разумеется, могут существовать отдельные случаи, требующие применения более высокого или более низкого диапазона доз, и такие случаи входят в объем настоящего изобретения.
Соединения формулы (I), указанные в настоящем документе, могут применяться в любых из вышеописанных композиций и схемах приема либо в любых композициях и схемах приема, принятых в отрасли, во всех случаях, когда для лечения пациента требуется применение соединения формулы (I), указанного в настоящем документе.
В качестве ингибиторов MGL соединения формулы (I), указанные в настоящем документе, полезны в способах лечения и профилактики заболеваний, синдромов, состояний или расстройств у пациентов (включая животных, млекопитающих и человека), у которых заболевание, синдром, состояние или расстройство зависит от модуляции фермента MGL. Такие способы включают, состоят из и (или) по существу состоят из назначения пациенту (включая животных, млекопитающих и человека), нуждающемуся в таком лечении или профилактике, терапевтически эффективного количества соединения, соли или сольвата формулы (I), указанных в настоящем документе. В частности, соединения формулы (I), указанные в настоящем документе, полезны для профилактики или лечения боли, заболеваний, синдромов, состояний или расстройств, вызывающих такую боль, либо для лечения воспалений или нарушений ЦНС.
Примеры воспалительной боли включают боль, вызванную заболеванием, состоянием, синдромом, расстройством или болезненным состоянием, в том числе воспалительные заболевания кишечника, висцеральную боль, мигрень, послеоперационную боль, остеоартрит, ревматоидный артрит, боль в спине, люмбаго, суставную боль, боль в животе, боль в груди, родовые схватки, мышечно-скелетные заболевания, кожные заболевания, зубную боль, нагноения, ожоги, солнечные ожоги, укусы змей, укусы ядовитых змей, укусы пауков, укусы насекомых, нейрогенный мочевой пузырь, интерстициальный цистит, инфекции мочевыводящих путей, ринит, контактный дерматит (повышенную чувствительность), зуд, экзему, фарингит, мукозит, энтерит, синдром раздраженного кишечника, холецистит, панкреатит, постмастэктомический болевой синдром, менструальную боль, эндометриозную боль, боль, вызванную физическими травмами, головную боль, синусовую головную боль, тензионную головную боль или арахноидит.
Примеры нарушений ЦНС включают тревожные состояния, например, социальное беспокойство, посттравматическое стрессовое расстройство, фобии, социофобия, особые фобии, панический синдром, обсессивно-компульсивное расстройство, острое стрессовое расстройство, тревожное расстройство, вызванное разлукой, и генерализованное тревожное расстройство, а также депрессии, например, большая депрессия, биполярное аффективное расстройство, сезонное аффективное расстройство, послеродовая депрессия, маниакально-депрессивный психоз и биполярное расстройство.
ОБЩИЕ СПОСОБЫ СИНТЕЗА
Типичные примеры соединений настоящего изобретения могут быть синтезированы в соответствии с общими способами синтеза, описанными ниже и показанными на приведенных далее схемах и примерах. Поскольку схемы приводятся в качестве иллюстрации, настоящее изобретение не следует толковать как ограниченное химическими реакциями и условиями, описанными на схемах. Различные исходные вещества, указанные на схемах и используемые в примерах, имеются в продаже или могут быть получены способами, хорошо известными специалистам отрасли. Фрагменты соответствуют описанию, приведенному в настоящем документе.
В настоящем описании, в частности, в схемах и примерах, используются следующие сокращения:
На схеме А показан путь синтеза соединений формулы (I)-A, где R1, s, Y и Z соответствуют определениям, приведенным в настоящем документе.
Схема A
Соединение формулы A1, в котором PG представляет собой традиционную защитную группу для амина, например, Boc, Fmoc, Cbz и тому подобные, имеется в продаже либо может быть получено известными способами, описанными в научной литературе. Соединение формулы A1 в присутствии ненуклеофильного основания, например, пиридина, обрабатывают трифторуксусным ангидридом для получения соединения формулы A2. При удалении защитной группы (PG) обычными способами получают соединение формулы A3. Соединение формулы A3 обрабатывают соединением формулы A4 в присутствии основания пространственно затрудненного амина, например, DIPEA, для получения соединения формулы A5. Обработка соединения формулы A5 1-хлорэтилхлорформиатом с последующим метанолизом позволяет получить соответствующий амин формулы A6. Аналогичным образом, если заместитель R1 соединения формулы A5 представляет собой гидрокси(C1-3)алкил, бензгидрильную группу удаляют путем гидрогенизации в присутствии палладиевого катализатора с получением амина формулы A6. Соединение формулы A6 соединяют с карбоновой кислотой формулы A7, где Q представляет собой гидрокси, в присутствии соответствующего связывающего агента, например, HATU, DCC, EDC, HBTU, PyBrOP и тому подобных; необязательно в присутствии основания, например, DIPEA, с получением амида формулы A8. Аналогичным образом, для ацилирования соединения формулы А6 используют хлорангидрид формулы A7, где Q представляет собой хлор. В этом случае для получения амида формулы А8 добавляют ненуклеофильное основание, например, пиридин. Удаление трифторацетильной группы соединения формулы A8 осуществляют под действием карбоната калия или TEA в присутствии спиртового растворителя, например, метанола, с получением соединения формулы A9. Соединение формулы A9 ацилируют карбоновой кислотой или хлорангидридом формулы A10, где Q представляет собой гидрокси или хлорид соответственно. Соответствующие условия связывания при использовании соединения формулы A10 (где Q представляет собой OH) включают использование связывающего вещества, например, HATU, DCC, EDC, HBTU, PyBrOP и тому подобных; и основания, например, DIPEA, с получением соединения формулы (I)-A. При ацилировании путем добавления соответствующего хлорангидрида добавление ненуклеофильного основания, например, пиридина, позволяет получить соединение формулы (I)-A.
На схеме B показан альтернативный путь синтеза соединений формулы (I)-A, где R1, s, Y и Z соответствуют определениям, приведенным в настоящем документе.
Схема B
Соединение формулы A1, в котором PG представляет собой традиционную защитную группу для амина, например, Boc, Fmoc, Cbz и тому подобные, имеется в продаже либо может быть получено известными способами, описанными в научной литературе. Для получения соединения формулы B1 соединение формулы A1 ацилируют соединением формулы A10 с применением способов и реагентов, указанных выше в описании Схемы A. После удаления защитной группы (PG) обычным способом соединение формулы B2 обрабатывают соединением формулы A4 в присутствии основания пространственно затрудненного амина, например, DIPEA, с применением способов, описанных на схеме А, для получения соединения формулы B3. Обработка соединения формулы B3 1-хлорэтилхлорформиатом с последующим метанолизом позволяет получить соответствующий амин формулы B4. Аналогичным образом, если заместитель R1 соединения формулы B3 представляет собой гидрокси(C1-3)алкил, бензгидрильную группу удаляют путем гидрогенизации в присутствии палладиевого катализатора с получением амина формулы B4. В результате реакции ацилирования с соединением формулы A7 с применением способов, описанных на схеме A, получают соответствующее соединение формулы (I)-A.
На схеме C показан альтернативный путь синтеза соединений формулы (I)-A, где R1, s, Y и Z соответствуют определениям, приведенным в настоящем документе.
Схема C
Соединение формулы B2 обрабатывают кетоном формулы C1 в присутствии декаборана или восстановителя, например, триацетоксиборогидрида натрия, с получением соединения формулы C2. В результате удаления Boc-защиты для амина с помощью традиционных реагентов и способов получают соединение формулы B4. В результате связывания с соединением формулы А7, как описано в данном документе, образуется соединение формулы (I)-A.
На схеме D показан способ синтеза соединений формулы (I)-A, где R1, s, Y и Z соответствуют определению, приведенному в данном документе.
Схема D
Соединение формулы A1, в котором PG представляет собой традиционную защитную группу для амина, например, Boc, Fmoc, Cbz и тому подобные, имеется в продаже либо может быть получено известными способами, описанными в научной литературе. Соединение формулы A1 можно обработать соединением формулы A4 для получения соединения формулы D1. После удаления защитной группы PG традиционным способом соединение формулы D2 можно связать с соединением формулы A10 (где Q представляет собой OH) в присутствии связывающего агента, например, HATU, DCC, EDC, HBTU, PyBrOP и т.п.; необязательно в присутствии основания, например, DIPEA, для получения соединения формулы B3. При проведении ацилирования путем введения хлорида соответствующей кислоты, добавление ненуклеофильного основания, например, пиридина, позволяет получить соединение формулы B3. Удаление бензгидрильной группы описанным способом с последующим ацилированием соединением формулы A7 позволяет получить соединение формулы (I)-A.
Специалисту в данной области будет ясно, что последовательности синтеза в схемах A, B, C и D можно изменить так, чтобы ацилирование соединением формулы A7 предшествовало удалению бензгидрильной группы с последующим ацилированием соединением формулы A10, и, таким образом, ввести группы Y и Z в обратном порядке.
На схеме E показан способ синтеза соединений формулы (I)-E, где R1, s и Y соответствуют определению, приведенному в данном документе, а Z представляет собой C6-10арильное кольцо или гетероарильную группу, замещенную необязательно замещенной C6-10арильной или гетероарильной группой, как указано в данном документе.
Схема E
Удалить защиту соединения формулы C1 можно традиционными способами с получением соответствующего свободного амина формулы E1. В результате связывания с карбоновой кислотой формулы E2 (где ArE представляет собой C6-10арил или гетероарильную группу, а указанное ArE замещено одним замещающим атомом брома, хлора или йода) в присутствии связывающего агента, например, HATU, DCC, EDC, HBTU, PyBrOP и т.п.; необязательно в присутствии основания, например, DIPEA, образуется соединение формулы E3. Кетон формулы E3 может быть подвергнут восстановительному аминированию соединением формулы A1 в присутствии декаборана, триацетоксиборгидрида натрия и т.п., с образованием соединения формулы E4. После удаления защитной группы PG традиционным способом свободный амин формулы E5 можно ацилировать соединением формулы A10, как описано в данном документе, и получить соединение формулы E6. Замещенный ArE заместитель формулы E6 можно обработать соответствующим образом замещенной ArE1-бороновой кислотой или эфиром (E7), либо соответствующим образом замещенным триалкилоловом, триалкилсиланом и т.п. (где ArE1 представляет собой необязательно замещенный C6-10арил или гетероарил, как указано в данном документе) путем одной или нескольких реакций связывания (например, реакций Сузуки, Штилле и Хиямы), хорошо известных специалистам в данной области, в присутствии подходящего катализатора, а также в присутствии основания, например, карбоната цезия, бикарбоната натрия, фторида калия и т.п., с образованием соединения формулы (I)-E.
На схеме F показан способ синтеза соединений формулы (I)-F, где R1, s и Y соответствуют определению, приведенному в данном документе, а Z представляет собой необязательно замещенную C6-10арил(C1-6)алкильную или C6-10арил(C2-6)алкенильную группу, где L представляет собой (C1-6)алкил или (C2-6)алкенил, соответственно.
Схема F
Соединение формулы B4 можно связать с имеющимся в продаже соединением формулы F2 (где ArF представляет собой необязательно замещенный заместитель C6-10арил согласно определению, приведенному в данном документе) в присутствии связывающего агента, например, HATU, DCC, EDC, HBTU, PyBrOP и т.п.; необязательно в присутствии основания, например, DIPEA, с получением соединения формулы (I)-F.
На схеме G показан способ синтеза соединений формулы (I)-G и формулы (I)-G1, где R1, s и Y соответствуют определению, приведенному в данном документе, а Z представляет собой либо необязательно замещенный C6-10арил (ArG), замещенный фенил(C2-6)алкинилом (формула (I)-G), либо необязательно замещенный C6-10арил, замещенный фенил(C1-6)алкилом.
Схема G
Соединение формулы G1 можно получить в соответствии со способами, описанными в данном документе, где ArG представляет собой C6-10арил, а X представляет собой заместитель, выбранный из брома или йода. X-замещенное кольцо ArG можно перекрестно связать с соединением формулы G2 в присутствии палладиевого катализатора, йодида меди и основания, например, треэтиламина, и получить соединение формулы (I)-G. Алкинильную функциональность соединения формулы (I)-G можно понизить до соответствующей алкильной группы путем катализированного гидрирования переходного металла, например, палладия на угле, гидроксида палладия (II) или платины, в водородной газовой среде, с получением соединения формулы (I)-G1.
На схеме H показан способ синтеза соединений формул (I)-H, H1, H2 и H3, где R1, s и Y соответствуют определению, приведенному в данном документе, а Z представляет собой аннелированный с бензольным кольцом гетероциклил, в котором гетероциклильная часть содержит атом азота, и в котором атом азота является необязательно замещенным. Только в качестве иллюстрации была выбрана 1,2,3,4-тетрагидроизохинолинильная группа, представляющая собой аннелированный с бензольным кольцом гетероциклил настоящего изобретения.
Схема H
Соединение формулы B4 можно связать с замещенным карбоновой кислотой гетероциклилом, аннелированным с бензольным кольцом, формулы H1 (где PG представляет собой традиционную защитную группу для амина), с получением соединения формулы H2. При снятии защитных групп для амина с соединения формулы H2 образуется соответствующий амин формулы (I)-H, который можно получить различными способами синтеза для образования дополнительных соединений настоящего изобретения. Например, соединение формулы (I)-H можно обработать соответствующим образом замещенным сульфонилхлоридом формулы H3 в присутствии органического основания с образованием соединения формулы (I)-H1 (где RH2 представляет собой фенил или C1-6алкил. Кроме того, соединение формулы (I)-H2 можно получить алкилированием аминогруппы соединения формулы (I)-H с помощью алкилирующего агента формулы H4 (где RH3 представляет собой фенил или C1-6алкилкарбонил) в присутствии основания. LG в соединении формулы H4 представляет собой обычную уходящую группу, например, бромид, йодид, тозилат, мезилат и т.п. Соединение формулы (I)-H2 можно также получить путем восстановительного аминирования соединением формулы H5 в присутствии восстановителя, например, триацетоксиборгидрида натрия. Соединение формулы (I)-H3 можно получить в результате реакции связывания пептида между соединением формулы (I)-H и соответствующим образом замещенной карбоновой кислотой формулы H6 (где RH представляет собой необязательно замещенный циклогексил, C1-6алкил или фенил, согласно определению, приведенному в данном документе) в присутствии подходящего связывающего агента. Наконец, соединения формулы (I)-H4 настоящего изобретения, где ArH представляет собой пиримидин или соответствующим образом замещенную фенильную группу, можно получить путем обработки соединения формулы (I)-H соединением формулы H7 (где XH представляет собой группу, например, хлор, бром или йод, а ArH соответствует определению, приведенному в данном документе) в присутствии катализатора на основе переходного металла, например, ацетата палладия, подходящего лиганда фосфина, например, BINAP, и основания, например, трет-бутоксида калия.
На схеме I показан способ синтеза соединений формулы (I)-I, где R1, s и Y соответствуют определению, приведенному в данном документе, а Z представляет собой C6-10арил, замещенный C6-10арил(C1-4)алкокси, как указано в данном документе. Только в качестве иллюстрации Z-C6-10арильное кольцо показано в виде фенильной группы.
Схема I
Имеющееся в продаже соединение формулы I1 можно преобразовать в соединение формулы I2 под воздействием хлорирующего агента, например, оксалилхлорида, тионилхлорида и т.п. Соединение формулы B4 можно ацилировать соединением формулы I2 с получением соединения формулы I3. Удаление ацетильной группы из соединения формулы I3 путем гидролиза в присутствии нуклеофильного основания, например, гидроксида лития, позволяет получить соответствующее соединение формулы I4. В результате алкилирования соединением формулы I5 (где ArI представляет собой необязательно замещенную C6-10арильную группу, а XI представляет собой I, Br, Cl или тозилат) образуется соединение формулы (I)-I. Аналогичным образом для получения соединения формулы (I)-I можно использовать реакции Мицунобу с участием соединения формулы I6 (где XI представляет собой гидрокси).
На схеме J показан способ синтеза соединений формулы (I)-J, где R1, s и Y соответствуют определениям, приведенным в данном документе, а Z представляет собой C6-10арил, замещенный C6-10арил(C1-4)алкилтио, как указано в данном документе. Только в качестве иллюстрации Z C6-10арильное кольцо показано в виде фенильной группы.
Схема J
Соединение формулы J1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение формулы J1 можно алкилировать соединением формулы I5 (где XI представляет собой I, Br, Cl или тозилат) с получением соединения формулы J2. В результате щелочного гидролиза соединения формулы J2 образуется соединение формулы J3 (где QJ представляет собой гидрокси), которое можно связать с соединением формулы B4; либо можно сначала преобразовать карбоновую кислоту в соответствующий хлорангидрид формулы J3 (где QJ представляет собой хлор), а затем алкилировать соединение формулы B4 и получить соединение формулы (I)-J.
На схеме K показан способ синтеза соединений формулы (I)-K, где R1, s и Y соответствуют определениям, приведенным в данном документе, а Z представляет собой необязательно замещенный C6-10арил, дополнительно замещенный фенилокси-группой, и где фенилокси-группа необязательно замещена C1-4алкилом, трифторметилом или одним-двумя хлор-заместителями, как указано в настоящем документе. Только в качестве иллюстрации Z C6-10арильное кольцо показано в виде фенильной группы.
Схема K
Соединение формулы К1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение формулы K1 или его необязательно замещенную производную можно связать с арилбороновой кислотой формулы K2 (где ArK представляет собой фенил, необязательно замещенный C1-4алкилом, трифторметилом или одним-двумя хлор-заместителями), в присутствии катализатора на основе меди, например, иодида меди или ацетата меди (II), подходящих лигандов, например, пиридина, 1,10-фенантролина, этилендиамина и т.п., и органического основания, например, триэтиламина, с образованием соединения формулы K3. В другом варианте осуществления настоящего изобретения соединения формулы K3 можно получить путем ароматического нуклеофильного замещения соответствующим образом замещенной производной метилгалобензоата, где предпочтительным галогеновым заместителем является фтор, на ArK-OH, где ArK соответствует приведенному ранее определению, в присутствии основания. Щелочной гидролиз с последующей необязательной обработкой подходящим хлорирующим агентом позволяет получить соединение формулы K4, где QK представляет собой гидрокси или хлор. В результате ацилирования соединения формулы B4 соединением формулы K4 образуется соединение формулы (I)-K.
На схеме L показан способ синтеза соединений формулы (I)-L, где R1, s и Y соответствуют определениям, приведенным в данном документе, а Z представляет собой необязательно замещенный C6-10арил, замещенный фенилтио-группой, где фенилтио-группа необязательно замещена C1-4алкилом, трифторметилом или одним-двумя хлор-заместителями, как указано в настоящем документе. Только в качестве иллюстрации Z C6-10арильное кольцо показано в виде фенильной группы.
Схема L
Соединение формулы L1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Арилбромид формулы L1 или его необязательно замещенную производную можно перекрестно связать с соединением формулы L2 (где ArL представляет собой фенил, необязательно замещенный C1-4алкилом, трифторметилом или одним-двумя хлор-заместителями), в присутствии катализатора на основе палладия, например, тетракис(трифенилфосфин) палладия, подходящих лигандов, например, трифенилфосфина, и основания, например трет-бутоксида калия, с образованием соединения формулы L3. В результате щелочного гидролиза сложного метилового эфира образуется соединение формулы L4. Соединение формулы B4 можно связать с соединением формулы L4 в присутствии подходящего связывающего пептиды агента, например, DCC, EDC, HBTU, PyBrOP и т.п., с образованием соединения формулы (I)-L.
На схеме M показан способ синтеза соединений формулы (I)-M, где R1, s и Y соответствуют определениям, приведенным в данном документе, а Z представляет собой C6-10арил, замещенный фенилсульфонилом. Только в качестве иллюстрации Z C6-10арильное кольцо показано в виде фенильной группы.
Схема M
Соединение формулы M1 можно получить способами, описанными на схеме L. Окисление тиоэфирной группы может произойти под воздействием соответствующего окислителя, например, mCPBA, перекиси водорода и т.п., с образованием соединения формулы M2. После щелочного гидролиза с последующим пептидным связыванием с соединением формулы B4 можно получить соединение формулы (I)-M.
На схеме N показан способ синтеза соединений формулы (I)-N, где R1, s и Y соответствуют определениям, приведенным в данном документе, а Z представляет собой C6-10арил, замещенный 5-8-членным гетероциклилокси, в котором атом азота необязательно замещен фенилкарбонилом, C1-4алкилкарбонилом или C1-4алкоксикарбонилом. Только в качестве иллюстрации Z-C6-10арильное кольцо показано в виде фенильной группы.
Схема N
Соединение формулы I4 можно связать с соединением формулы N1 (где RN представляет собой фенил, C1-4алкил, C1-4алкокси, C1-4алкиламино, C1-4диалкиламино или N-содержащий гетероциклил, присоединенный через атом азота) в условиях реакции Мицунобу в апротонном органическом растворителе, например, THF, с образованием соединения формулы (I)-N. Связывание по реакции Мицунобу можно также осуществить между соединением формулы I4 и соединением формулы N2, где PG представляет собой традиционную защитную группу для амина, например, Boc, Fmoc, Cbz и т.п. Затем традиционными способами удаляют защитную группу (PG), в результате чего образуется соединение формулы N3, которую можно дериватизировать с помощью различных способов синтеза для получения дополнительных соединений настоящего изобретения. Например, соединение формулы N3 можно связать с карбоновой кислотой (Q представляет собой гидрокси, RN представляет собой фенил или C1-4алкил), хлорангидридом (Q представляет собой хлорид, RN представляет собой фенил или C1-4алкил), хлорформиатом (Q представляет собой хлорид, RN представляет собой C1-4алкокси) или карбамоилхлоридом (Q представляет собой хлорид, RN представляет собой C1-4алкиламино, C1-4диалкиламино или N-содержащий гетероциклил, присоединенный через атом азота), либо соединением формулы N4, как указано в данном документе, с образованием соединения формулы (I)-N. Кроме того, соединение формулы N3 можно ввести в реакцию с сульфамоилхлоридом формулы N5, где RN2 представляет собой C1-4алкиламино, C1-4диалкиламино или N-содержащий гетероциклил, присоединенный через атом азота, с образованием соединения формулы (I)-N2.
На схеме O показан способ синтеза соединений формулы (I)-O, где R1, s и Y соответствуют определениям, приведенным в данном документе, а Z представляет собой необязательно замещенный C6-10арил, дополнительно замещенный RO, где RO представляет собой (1-R2)пирролидин-3-илокси, C1-4алкил или C6-10арил(C1-4)алкил. Только в качестве иллюстрации Z-C6-10арильное кольцо показано в виде фенильной группы.
Схема O
Соединение формулы O1 можно связать с соединением формулы O2 (где XO представляет собой гидрокси) в условиях реакции Мицунобу с образованием соединения формулы O3. Алкилирование можно также произвести путем реакции нуклеофильного замещения с соединением формулы O2 (где XO представляет собой I, Br, Cl или тозилат) в присутствии основания с образованием соединения формулы O3. В результате щелочного гидролиза сложного метилового эфира в соединении формулы O3 образуется соответствующая карбоновая кислота формулы O4. Соединение формулы O4 можно связать с соединением формулы B4, как описано в данном документе, и получить соединение формулы (I)-O. Кроме того, с соединения формулы O3, где RO представляет собой (1-R2)пирролидин-3-ил-окси, а R2 представляет собой традиционную защитную группу для амина, можно снять защиту и дополнительно дериватизировать его по азоту пирролидина, как описано в данном документе, преобразовать полученное соединение в соединение формулы О4, связать его с соединением формулы В4 и получить, таким образом, соединение формулы (I)-O.
На схеме P показан способ синтеза соединений формулы (I)-P, где R1, s и Y соответствуют определениям, приведенным в данном документе, а Z представляет собой C6-10арил, замещенный фенил-(Q)-C1-6алкилом, в котором Q представляет собой O, S или NH, а фенил из фенил-(Q)-C1-6алкила необязательно независимо замещен одним-двумя заместителями, выбранными из брома, хлора, фтора, йода, C1-4алкила, C1-4алкокси и трифторметила.
Схема P
Соединение формулы P1 (где XP представляет собой гидрокси, хлор или бром) можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение формулы P1 может быть подвергнуто алкилированию реакцией Мицунобу или реакцией нуклеофильного замещения с соединением формулы P2 для получения соединения формулы P3. В результате щелочного гидролиза сложного метилового эфира из соединения формулы Р3 образуется соответствующая карбоновая кислота формулы P4. Соединение формулы P4 можно связать с соединением формулы B4, как описано в данном документе, с образованием соединения формулы (I)-P.
На схеме Q показано получение некоторых полезных промежуточных соединений формулы A7 (Q представляет собой гидрокси), где Z является гетероарилом, замещенным необязательно замещенной арильной группой (ArQ). Только в качестве иллюстрации гетероарильное кольцо представлено индолом.
Схема Q
Соединение формулы Q1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение Q1 можно обработать арилиодидом формулы Q2 в присутствии иодида меди, транс-N, N'-диметилциклогексан-1,2-диамина и фосфата калия с образованием соединения формулы Q3. Последующий щелочной гидролиз позволяет получить полезные промежуточные соединения на основе карбоновой кислоты формулы Q4.
На схеме R показано получение некоторых полезных промежуточных соединений формулы A7 (Q представляет собой гидрокси), где Z является бензимидазолилом или бензоксазолилом, и где Z замещено необязательно замещенным арилом или гетероарильной группой (ArR), или ArR(C1-4)алкилом.
Схема R
Соединение формулы R1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение R1 можно обработать арил- или гетероарил-замещенной карбоновой кислотой формулы R2 в присутствии связывающего агента, например, DCC, и затрудненного основания, например, DMAP, в апротонном органическом растворе, с образованием соединения формулы R3. Катализированное кислотой замыкание кольца в соединении формулы R3 приводит к образованию замещенного бензимидазола или бензоксазола формулы R4 или R6, соответственно. Последующий щелочной гидролиз позволяет получить полезные промежуточные соединения на основе карбоновой кислоты формулы R5 или R7.
На схеме S показано получение некоторых полезных промежуточных соединений формулы A7 (Q представляет собой гидрокси), где Z является необязательно замещенной бензотиенильной группой, а RS представляет собой подходящие заместители в соответствии с формулой (I).
Схема S
Соединение формулы S1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение формулы S1 можно обработать тионилхлоридом в апротонном органическом растворителе, а затем обработать метанолом, в результате чего образуется соединение формулы S2. Последующий щелочной гидролиз позволяет получить полезные промежуточные соединения на основе карбоновой кислоты формулы S3. Специалистам в данной области известно, что в результате циклизации таких асимметрично замещенных соединений формулы S1 тионилхлоридом можно получить смеси позиционных изомеров. Затем эти изомеры можно выделить и изолировать с помощью обычной хроматографии, известной специалистам в данной области.
На схеме T показано получение некоторых полезных промежуточных соединений формулы A7 (Q представляет собой гидрокси), где Z является C6-10арилом (ArT), замещенным необязательно замещенной C6-10арилметиловой группой.
Схема T
Соединение формулы T1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение формулы T1 можно обработать подходящим образом замещенным органометаллическим реагентом, например, хлоридом ArT1-метилцинка формулы T2 в присутствии катализатора на основе палладия с образованием соединения формулы T3. Последующий щелочной гидролиз позволяет получить полезные промежуточные соединения на основе карбоновой кислоты формулы T4.
На схеме U показано получение некоторых полезных промежуточных соединений формулы A7 (Q представляет собой гидрокси), где Z является бензотиенильной группой, замещенной фтор-заместителем и необязательно замещенной C6-10арилом или гетероарильной группой (ArE1).
Схема U
Соединение формулы U1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение формулы U1 можно перекрестно связать с бороновой кислотой или сложным эфиром (E7) в присутствии катализатора на основе палладия и в присутствии подходящего основания, например, карбоната калия, с образованием соединения формулы U2. В результате щелочного гидролиза образуется соответствующая карбоновая кислота U3, которую можно обработать N-фторбензолсульфонимидом в присутствии органометаллического основания, например, н-бутиллития, с образованием фторированного соединения формулы U4.
На схеме V показано получение некоторых полезных промежуточных соединений формул V6, V8 и V10 (Q представляет собой гидрокси), где Z является бензимидазолильной группой, замещенной ArV группой (в которой ArV представляет собой необязательно замещенный арильный или гетероарильный заместитель в соответствии с формулой (I)), и необязательно замещенной метил- или оксогруппой на второй позиции.
Схема V
Соединение формулы V1 можно приобрести либо в готовом виде, либо получить известными способами, описанными в научной литературе. Соединение формулы V1 можно обработать соединением формулы V2 с образованием соединения формулы V3. Аминогруппу можно сократить путем воздействия на нее хлоридом олова в спиртовом растворе или путем гидрирования, катализированного палладием, с образованием диамина формулы V4. В результате обработки триметилортоформиатом образуется бензимидазол формулы V5, который можно подвергнуть щелочному гидролизу для получения соединения формулы V6.
Соединение формулы V4 можно обработать триметилортоацетатом, а затем подвергнуть щелочному гидролизу для получения соответствующего 2-метилзамещенного бензимидазола, V8. Аналогичным образом, соединение формулы V4 можно обработать 1,1'-карбонилдиимидазолом в DMF, а затем подвергнуть щелочному гидролизу для получения соответствующего 2-оксозамещенного бензимидазола, V10.
Пример 1
A. Сложный трет-бутиловый эфир 4-(2,2,2-трифторацетил)-пиперазин-1-карбоновой кислоты, 1с. В раствор трет-бутилового эфира пиперазин-1-карбоновой кислоты (1a, 10 г, 53,69 ммоль) и пиридина (8,7 мл, 107,57 ммоль) в CH2Cl2 (100 мл) по каплям ввели соединение 1b (10,5 мл, 75,54 ммоль) при температуре 0°C. Смесь перемешивали при температуре 0°C в течение 2 часов. К смеси добавили 2N HCl (60 мл). Органические слой высушили над MgSO4, профильтровали и сконцентрировали. Полученное соединение 1c использовали в следующей реакции без дополнительной очистки. МС m/z (MH+-Boc) 183,1, (MH+-C4H9) 227,1; 1H ЯМР (300 МГц, CDCl3): δ 3,45-3,7 (м, 8H), 1,5 (с, 9H).
B. 2,2,2-Трифтор-1-пиперазин-1-ил-этанон, 1d. В раствор соединения 1c (15,15 г, 53,69 ммоль) в CH2Cl2 (60 мл) ввели трифторуксусную кислоту (18 мл) при комнатной температуре. Смесь перемешивали 18 часов при комнатной температуре. Растворитель удалили выпариванием. К остатку добавили эфир (100 мл). Твердое вещество белого цвета собрали фильтрованием, промыли эфиром и высушили в вакууме. Полученное соединение 1d использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 183,1.
C. 1-[4-(1-Бензгидрилазетидин-3-ил)-пиперазин-1-ил]-2,2,2-трифторэтанон, 1f. В раствор соединения 1d (6 г, 32,94 ммоль) и соединения 1e (12,5 г, 39,38 ммоль) в CH3CN (60 мл) ввели DIPEA (12 мл, 68,89 ммоль) при комнатной температуре. Смесь нагревали с обратным холодильником в течение 2 часов. Растворитель удалили выпариванием, а остаток разделили между CH2Cl2 и водным раствором NaHCO3. Органический слой промыли водным раствором NaHCO3 (2 раза), а затем экстрагировали 1Н HCl (2 раза). Водный слой охладили, после чего довели уровень рН до основного (рН=10) с помощью 1Н NaOH. Смесь экстрагировали CH2Cl2 (2 раза). Органический слой высушили над MgSO4 и сконцентрировали. Соединение 1f очистили обращенно-фазовой хроматографией. МС m/z (M+H+) 404,2.
D. 1-(4-Азетидин-3-ил-пиперазин-1-ил)-2,2,2-трифторэтанон, 1g. В раствор соединения 1f (2,11 г, 5,23 ммоль) в CH2Cl2 (60 мл) ввели 1-хлорэтилхлорформиат (2,0 мл, 18,35 ммоль) при температуре 0°C в атмосфере N2. Смесь перемешивали при температуре 0°C в течение 90 минут, а затем добавили в нее MeOH (4 мл). Смесь нагревали с обратным холодильником в течение 1 ч. После охлаждения к смеси добавили Et2O (50 мл). Полученное твердое вещество собрали фильтрованием и высушили. Полученное соединение 1g использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 238,1.
E. 1-{4-[1-(4-Циклогексилбензоил)-азетидин-3-ил]-пиперазин-1-ил}-2,2,2-трифторэтанон, 1i. В раствор соединения 1g (2,5 г, 10,54 ммоль) и HATU (4 г, 10,52 ммоль) в DMF (25 мл) ввели DIPEA (5 мл, 28,70 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут, а затем соединение 1h (2 г, 9,79 ммоль) добавили к смеси. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. В реакционную смесь добавили воду (40 мл). Смесь экстрагировали с помощью EtOAc (2×20 мл). Органический слой высушили над MgSO4, отфильтровали и сконцентрировали. Полученное соединение 1i очистили обращенно-фазовой хроматографией. МС m/z (M+H+) 424,2.
F. (4-Циклогексилфенил)-(3-пиперазин-1-ил-азетидин-1-ил)-метанон, 1j. В раствор соединения 1i (0,95 г, 2,24 ммоль) в CH3OH (16 мл) и H2O (4 мл) ввели K2CO3 (0,8 г, 5,79 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Смесь профильтровали и удалили растворитель выпариванием. Полученное соединение 1j использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 328,2.
G. 1-{1-[(4-Циклогексилфенил)карбонил]азетидин-3-ил}-4-(фенилкарбонил)пиперазин, соединение 1. В раствор соединения 1j (0,08 г, 0,24 ммоль) и HATU (0,093 г, 0,24 ммоль) в DMF (3 мл) ввели DIPEA (0,1 мл). Смесь перемешивали при комнатной температуре в течение 30 минут, а затем добавили к смеси соединение 1k (0,03 г, 0,25 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. К смеси добавили воду (6 мл). Смесь экстрагировали с помощью EtOAc (2×6 мл). Органический слой высушили над MgSO4, отфильтровали и сконцентрировали. Полученное соединение 1 очистили хроматографией с обращенной фазой. 1H ЯМР (300 МГц, CD3OD): δ 7,58 (д, 2H), 7,44-7,53 (м, 5H), 7,34 (д, 2H), 4,6 (м, 1H), 4,42 (м, 2H), 4,27 (м, 1H), 3,85 (м, 5H), 3,05 (м, 4H), 2,57 (м, 1H), 1,85 (м, 5H), 1,45 (м, 5H). МС m/z (M+H+) 432,3.
Следуя процедуре, описанной выше для примера 1, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
1H ЯМР (300 МГц, CD3OD): δ 7,71 (д, 1H), 7,59 (д, 2H), 7,34 (д, 2H), 7,13 (д, 1H), 6,62 (дд, 1H), 4,62 (м, 1H), 4,52 (м, 1H), 4,42 (м, 1H), 4,31 (м, 1H), 4,05 (м, 4H), 3,98(м, 1H), 3,18 (м, 4H), 2,58 (м, 1H), 1,84 (м, 5H), 1,24-1,52 (м, 5H)
МС m/z (M+H+) 422,2
МС m/z (M+H+) 436,2
МС m/z (M+H+) 433,2
1H ЯМР (300 МГц, CD3OD): δ 7,65 (м, 4H), 7,56 (д, 2H), 7,25-7,46 (м, 8H), 4,58 (м, 1H), 4,49 (м, 1H), 4,35 (м, 1H), 4,26 (м, 1H), 3,92 (м, 1H), 3,78 (м, 4H), 3,09 (м, 4H)
МС m/z (M+H+) 426,1
1H ЯМР (300 МГц, CD3OD): δ 7,66 (м, 4H), 7,62 (д, 1H), 7,56 (д, 2H), 7,38 (т, 2H), 7,30 (м, 1H), 7,03 (д, 1H), 6,51 (дд, 1H), 4,56 (м, 1H), 4,44 (м, 1H), 4,33 (м, 1H), 4,22 (м, 1H), 3,95 (м, 4H), 3,81 (м, 1H), 3,01 (м, 4H)
МС m/z (M+H+) 416,2
1H ЯМР (300 МГц, CD3OD): δ 8,97 (с, 1H); 8,14 (с, 1H), 7,66 (м, 4H); 7,56 (д, 2H); 7,37 (т, 2H); 7,30 (м, 1H); 4,60 (м, 1H); 4,49 (м, 1H); 4,37 (м, 1H); 4,27 (м, 1H); 4,08 (м, 4H); 3,95 (м, 1H); 3,14 (м, 4H)
МС m/z (M+H+) 433,2
1H ЯМР (300 МГц, CD3OD): δ 9,08 (с, 1H); 8,11 (с, 1H); 7,66 (м, 4H); 7,56 (д, 2H); 7,38 (т, 2H); 7,30 (м, 1H); 4,54 (м, 1H); 4,39 (м, 1H); 4,31 (м, 1H); 4,17 (м, 1H); 3,84 (м, 4H); 3,73 (м, 1H); 2,92 (м, 4H)
МС m/z (M+H+) 433,2
1H ЯМР(300 МГц, CD3OD): δ 7,88 (д, 1H); 7,78 (д, 1H); 7,66 (м, 4H); 7,57 (д, 2H); 7,38 (т, 2H); 7,30 (м, 1H); 4,62 (м, 3H); 4,48 (м, 1H); 4,37 (м, 1H); 4,26 (м, 1H); 3,91 (м, 3H); 3,13 (м, 4H)
МС m/z (M+H+) 433,2
МС m/z (M+H+) 447,1
МС m/z (M+H+) 429,3
1H ЯМР (300 МГц, CD3OD): δ 7,76 (м, 4H); 7,66 (д, 2H); 7,47 (т, 2H); 7,39 (м, 1H); 7,11 (д, 1H); 6,64 (д, 1H); 4,66 (м, 1H); 4,57 (м, 1H); 4,44 (м, 1H); 4,34 (м, 1H); 3,91-4,10 (м, 5H); 3,17 (м, 4H)
МС m/z (M+H+) 494,1/496,0
1H ЯМР (300 МГц, CD3OD): δ 7,75 (м, 4H); 7,61-7,72 (м, 3H); 7,34-7,52 (м, 4H); 7,14 (т, 1H); 4,65 (м, 1H); 4,52 (м, 1H); 4,42 (м, 1H); 4,29 (м, 1H); 3,96 (м, 4H); 3,90 (м, 1H); 3,07 (м, 4H)
МС m/z (M+H+) 432,1 (расчет для C25H25N3O2S, 431,56)
МС m/z (M+H+) 446,1
МС m/z (M+H+) 510,1/512,1
МС m/z (M+H+) 466,1/467,1
МС m/z (M+H+) 510,0/512,1
МС m/z (M+H+) 510,0/512,1
МС m/z (M+H+) 488,1
MС m/z (M+H+) 482,1
МС m/z (M+H+) 462,1
МС m/z (M+H+) 442,22/444,19
МС m/z (M+H+) 465,0/467,1
МС m/z (M+H+) 458,1/460,0
МС m/z (M+H+) 469,04/471,04
МС m/z (M+H+) 462,11/464,11
МС m/z (M+H+)500
МС m/z (M+H+)474
МС m/z (M+H+) 507
МС m/z (M+H+) 507
Пример 1а
H. Метил 1-(4-фторфенил)-индол-5-карбоксилат, 1m. Смесь метил индол-5-карбоксилата 1j (0,5 г, 2,85 ммоль), 1-бром-4-фторбензола 1k (2 мл, 18,21 ммоль), CuI (0,544 г, 2,85 ммоль) и K2CO3 (0,591 г, 4,28 ммоль) нагревали в микроволновой печи при температуре 220oC в течение 2,5 часов. Реакционную смесь разбавили CH2Cl2 и профильтровали. Раствор сконцентрировали, а остаток очистили колоночной флеш-хроматографией (силикагель, 15% EtOAc/гептан) и получили соединение 1m (0,58 г).
I. 1-(4-Фторфенил)-индол-5-карбоновая кислота, 1n. Смесь метил 1-(4-фторфенил)-индол-5-карбоксилата 1m (0,58 г, 2,15 ммоль) и LiOH.H2O (0,36 г, 8,6 ммоль) в THF (15 мл) и H2O (10 мл) перемешивали при комнатной температуре в течение 5 суток. Водный 10%-ный раствор HCl добавили в реакционную смесь для доведения уровня pH до 3~4. Полученную смесь экстрагировали с помощью EtOAc (2 раза). Органический раствор промыли водным NaCl, высушили над Na2SO4 и сконцентрировали, получив в результате соединение 1n (0,5 г).
J. 1-(4-Фторфенил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 487. Названное соединение 487 получили в соответствии с примером 1 с использованием промежуточного соединения 1n из примера 1a и промежуточного соединения 1g из примера 1 в качестве исходных материалов. 1H ЯМР (400 МГц, CD3OD): δ 8,00 (д, J=1,2 Гц, 1H); 7,88 (д, J=3 Гц, 1H); 7,55 (м, 2H); 7,46 (м, 3H); 7,34 (м, J=3 Гц, 1H); 7,27-7,21 (м, 2H); 6,74 (д, J=3 Гц, 1H); 4,52 (уш.с, 1H); 4,43-4,20 (м, 4H); 4,14 (м, 1H); 3,95-3,80 (м, 2H); 3,25 (м, 1H); 2,60-2,40 (м, 4H). МС m/z (M+H+) 490.
Следуя процедуре, описанной выше для примера 1а, стадии H и I, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 1а, стадия J, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
1H ЯМР (400 МГц, CD3OD): д 7,99 (с, 1H); 7,55-7,21 (м, 12H); 6,73 (с, 1H); 4,37 (уш.с, 1H); 4,25 (м, 2H); 4,10 (уш.с, 1H); 3,90 (уш.с, 1H); 3,75 (уш.с, 1H); 3,48 (уш.с, 2H); 3,24 (м, 1H); 2,50-2,20 (м, 4H).
МС m/z (M+H+) 483
МС m/z (M+H+) 466
МС m/z (M+H+) 501
МС m/z (M+H+) 540
МС m/z (M+H+) 540
1H ЯМР (400 МГц, CD3OD): д 8,00 (с, 1H); 7,88 (д, J=3 Гц, 1H); 7,81 (д, J=8,6 Гц, 2H); 7,64 (д, J=8,6 Гц, 2H); 7,59 (с, 2H); 7,54 (д, J=3 Гц, 1H); 7,41 (д, J=3,5 Гц, 1H); 6,79 (д, J=3,5 Гц, 1H); 4,53 (уш.с, 1H); 4,43 (м, 2H); 4,28 (м, 2H); 4,14 (уш.с, 1H); 3,86 (м, 2H); 3,26 (м, 1H); 2,50 (м, 4H).
МС m/z (M+H+) 540
МС m/z (M+H+) 490
МС m/z (M+H+) 540
МС m/z (M+H+) 473
1H ЯМР (400 МГц, CD3OD): д 8,27 (с, 1H); 8,11 (с, 1H); 7,88 (д, J=3 Гц, 1H); 7,77 (м, 2H); 7,72 (д, J=8 Гц, 2H); 7,56 (м, 3H); 7,41 (т, J=8 Гц, 1H); 4,53 (уш.с, 1H); 4,44-4,28 (м, 4H); 4,15 (м, 1H), 3,86 (м, 2H); 3,28 (м, 1H); 2,50 (м, 4H). MС m/z 490 (M+H+)
МС m/z (M+H+) 473
МС m/z (M+H+) 508
1H ЯМР (CDCl3, 400 МГц): д = 8,79 (д, J=2,0 Гц, 1H); 7,93-8,09 (м, 2H); 7,39-7,64 (м, 2H); 7,18-7,34 (м, 2H); 6,98-7,16 (м, 2H); 6,76 (д, J=3,1 Гц, 1H); 4,20-4,51 (м, 3H); 4,13 (д, J=3,9 Гц, 1H); 3,92 (уш.с., 3H); 3,67-3,84 (м, 1H); 3,18-3,32 (м, 1H); 2,49 (уш.с., 4H).
МС m/z (M+H+) 508
МС m/z (M+H+) 490
Следуя процедуре, описанной выше для примера 1а, стадии H и I, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 1a, стадия J, за исключением использования диоксана в качестве растворителя на стадии А, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего соединения:
МС m/z (M+H+) 467
МС m/z (M+H+) 485
1H ЯМР (CDCl3, 400 МГц): д = 8,83 (д, J=8,6 Гц, 1H); 8,73 (д, J=4,7 Гц, 2H); 8,33 (д, J=3,9 Гц, 1H); 7,80-8,02 (м, 2H); 7,64 (дд, J=8,8, 1,8 Гц, 1H); 7,54 (д, J=3,1 Гц, 1H); 7,10 (т, J=4,9 Гц, 1H); 6,75 (д, J=3,5 Гц, 1H); 4,03-4,72 (м, 6H); 3,86 (м, 2H); 3,08-3,37 (м, 1H); 2,31-2,68 (м, 3H).
МС m/z (M+H+) 474
МС m/z (M+H+) 474
МС m/z (M+H+) 492
МС m/z (M+H+) 492
Пример 1b
K. Метил 1-(3,4-дифторфенил)-индол-5-карбоксилат, 1р. Смесь метил индол-5-карбоксилата 1j (2 г, 11,4 ммоль), 1-йод-3,4-дифторбензола 1o (1,5 мл, 12,5 ммоль), CuI (0,22 г, 1,14 ммоль), транс-N, N'-диметилциклогексан-1,2-диамина (0,54 мл, 3,43 ммоль) и K3PO4 (6,06 г, 28,5 ммоль) в толуоле (12 мл) подогревали при температуре 110oC в течение 7 часов. Реакционную смесь разбавили CH2Cl2 и профильтровали. Раствор сконцентрировали и остаток очистили колоночной флеш-хроматографией (силикагель, 20% EtOAc/гептан), получив соединение 1р (3,0 г).
L. 1-(3,4-Дифторфенил)-индол-5-карбоновая кислота, 1q. Смесь метил 1-(3,4-дифторфенил)-индол-5-карбоксилата 1p (3,0 г, 10,4 ммоль) и LiOH (1,0 г, 41,8 ммоль) в THF (120 мл) и H2O (60 мл) перемешивали при комнатной температуре в течение 5 суток. Водный 10%-ный раствор HCl добавили в реакционную смесь для доведения уровня pH до 3~4. Полученную смесь экстрагировали с помощью EtOAc (2 раза). Органический раствор промыли водным NaCl, высушили над Na2SO4 и сконцентрировали, получив в результате соединение 1q (2,85 г).
M. 1-(3,4-Дифторфенил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 1362. Названное соединение 1362 получили в соответствии с примером 1 с использованием промежуточного соединения 1q из примера 1b и промежуточного соединения 1g из примера 1 в качестве исходных материалов. 1H ЯМР (CDCl3, 400 МГц): д = 7,99 (д, J=1,6 Гц, 1H); 7,88 (д, J=3,1 Гц, 1H); 7,44-7,64 (м, 3H); 7,18-7,44 (м, 4H); 6,75 (д, 1H); 4,47-4,63 (м, 1H); 4,19-4,47 (м, 4H); 4,07-4,19 (м, 1H); 3,89 (уш.с., 2H); 3,18-3,33 (м, 1H); 2,50 (т, J=5,1 Гц, 4H). МС m/z (M+H+) 508.
Следуя процедуре, описанной выше для примера 1b, стадии K и L, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 1b, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
1H ЯМР (CDCl3, 400 МГц): д = 8,79 (д, J=2,0 Гц, 1H); 8,00 (дд, J=11,5, 1,8 Гц, 2H); 7,44-7,65 (м, 2H); 7,18-7,42 (м, 4H); 6,75 (д, J=3,5 Гц, 1H); 4,20-4,46 (м, 3H); 4,13 (уш.с., 1H); 3,93 (уш.с., 3H); 3,67-3,85 (м, 1H); 3,17-3,36 (м, 1H); 2,49 (уш.с., 4H)
MС m/z 508 (M+H+)
1H ЯМР(CDCl3, 400 МГц): д = 9,42-9,61 (м, 1H); 7,99 (с, 1H); 7,54-7,64 (м, 1H); 7,45-7,54 (м, 1H); 7,15-7,43 (м, 4H); 6,93 (с, 1H); 6,75 (д, J=3,1 Гц, 1H); 6,52 (уш.с., 1H); 6,18-6,31 (м, 1H); 4,19-4,42 (м, 3H); 4,08-4,19 (м, 1H); 3,90 (уш.с., 4H); 3,24 (с, 1H); 2,34-2,56 (м, 4H)
MС m/z 490 (M+H+)
МС m/z (M+H+) 466,1
МС m/z (M+H+) 480,1
МС m/z (M+H+) 473,2
МС m/z (M+H+) 456,3
МС m/z (M+H+) 473,0
МС m/z (M+H+) 503,2
МС m/z (M+H+) 485,4
МС m/z (M+H+) 487,3
МС m/z (M+H+) 469,3
МС m/z (M+H+) 523,2
МС m/z (M+H+) 541,3
МС m/z (M+H+) 503,0
МС m/z (M+H+) 474,1
МС m/z (M+H+) 487,0
МС m/z (M+H+) 534,1
МС m/z (M+H+) 484,0
МС m/z (M+H+) 473,2
МС m/z (M+H+) 455,2
МС m/z (M+H+) 509,0
МС m/z (M+H+) 487,3
МС m/z (M+H+) 487,2
МС m/z (M+H+) 488,0
МС m/z (M+H+) 541,0
МС m/z (M+H+) 491,0
МС m/z (M+H+) 487,1
1H ЯМР (400 МГц, CDCl3): δ 9,06 (с, 1H); 8,4 (с, 1H); 7,9-7,68 (м, 8H); 7,4 (аром., 1H); 4,97 (м, 2H); 4,45 (м, 2H); 4,16 (уш.с., 1H);
МС m/z (M+H+) 508,0
1H ЯМР (400 МГц, CDCl3): δ 7,91 (м, 1H); 7,81 (м, 4H); 7,70 (м, 2H); 7,60 (м, 2H); 7,30 (м, 1H); 6,75 (м, 1H); 5,01-4,84 (м, 2H); 4,37 (м, 2H); 4,09 (уш. м, 1H)
МС m/z (M+H+) 540,2
МС m/z (M+H+) 522,2
1H ЯМР (400 МГц, CDCl3): δ 8,44 (с, 1H); 7,94 (с, 1H); 7,80 (м, 2H); 7,69 (м, 2H); 7,59 (м, 2H); 7,49 (м, 2H); 6,77 (м,1H); 4,65-4,15 (уш. м., 3H); 3,81 (уш. м., 4H); 3,0 (уш. м., 4H)
МС m/z (M+H+) 540,2
МС m/z (M+H+) 504,1
1H ЯМР (400 МГц, CDCl3): δ 7,92 (д, 1H); 7,78 (д, 1H); 7,69 (м, 1H); 7,42 (м, 3H); 7,21 (м, 6H); 4,94 (м, 1H); 4,40 (дд, 1H); 4,25 (дд, 1H); 4,0 (уш. м., 1H); 3,85 (уш. м., 3H); 3,15 (уш. м., 3H); 2,3 (с, 3H)
МС m/z (M+H+) 504,1
МС m/z (M+H+) 522,1
1H ЯМР (400 МГц, CDCl3): δ 8,0 (с, 1H); 7,86 (с, 1H); 7,80 (с, 1H); 7,62-7,42 (м, 3H); 7,36 (м, 3H); 5,05 (м, 1H); 4,5 (м, 1H); 4,35 (м, 1H); 4,08 (уш. м., 1H); 3,94 (уш. м., 4H); 3,24 (м, 3H)
МС m/z (M+H+) 522,2
МС m/z (M+H+) 465,1
Пример 1с
N. 1-(5-Метилпиридин-2-ил)-5-({3-[4-(трифторацетил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол; соединение 1184. Названное соединение 1184 получили в соответствии с примером 1 с использованием промежуточного соединения 1r из примера 1b и промежуточного соединения 1g из примера 1 в качестве исходных материалов. МС m/z (M+H+) 472,1.
Следуя процедуре, описанной выше для примера 1с, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 492,1
МС m/z (M+H+) 472,1
МС m/z (M+H+) 500,1
МС m/z (M+H+) 475,2
Пример 1d
O. Метил 2-фенил-бензооксазол-6-карбоксилат, 1u. Смесь метил 4-амино-3-гидроксибензоата 1s (0,3 г, 1,8 ммоль) и бензоилхлорида 1t (0,23 мл, 2,0 ммоль) в диоксане (2,5 мл) нагревали при температуре 210oC в микроволновой печи в течение 15 минут. Реакционную смесь разбавили CH2Cl2 и промыли водным раствором NaHCO3. Органический раствор высушили над Na2SO4, сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 20% EtOAc/гептан), получив в результате соединение 1u (0,39 г).
P. 2-Фенилбензооксазол-6-карбоновая кислота, 1v. Смесь метил 2-фенил-бензооксазол-6-карбоксилата 1u (0,37 г, 1,46 ммоль) и LiOH (0,10 г, 4,2 ммоль) в THF (4 мл), MeOH (4 мл) и H2O (4 мл) перемешивали при комнатной температуре в течение 6 часов. Для установления pH раствора на уровне 3~4 к смеси добавили 1N раствора HCl. Полученную смесь экстрагировали с помощью EtOAc (2 раза). Органический раствор промыли водным NaCl, высушили над Na2SO4 и сконцентрировали, получив в результате соединение 1t (0,34 г).
Следуя процедуре, описанной выше в примере 1d, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, получили следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 1, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 474
МС m/z (M+H+) 542
МС m/z (M+H+) 542
Пример 1e
Q. Этил 2-фенилбензотиазол-6-карбоксилат, 1y. Смесь этил 2-бромбензотиазол-6-карбоксилата 1w (300 мг, 1,05 ммоль), фенилбороновой кислоты 1x (192 мг, 1,57 ммоль), K2CO3 (188 мг, 1,36 ммоль) и Pd(dppf)Cl2.CH2Cl2 (43 мг, 0,05 ммоль) в диоксане (2 мл) и H2O (0,4 мл) нагревали при температуре 120oC в микроволновой печи в течение 25 минут. Реакционную смесь разбавили CH2Cl2, промыли H2O, высушили над Na2SO4 и сконцентрировали. В результате очистки колоночной флеш-хроматографией (силикагель, 15% EtOAc/гептан) было получено соединение 1y (220 мг).
R. 2-Фенилбензотиазол-6-карбоновая кислота, 1z. Этил 2-фенилбензотиазол-6-карбоксилат 1y (220 мг, 0,78 ммоль) перемешивали с LiOH (74 мг, 3,1 ммоль) в THF (4 мл) и H2O (4 мл) в течение 16 часов. Для установления pH раствора на уровне 3~4 к смеси добавили 1N раствора HCl. Полученную смесь экстрагировали с помощью EtOAc (2 раза). Органический раствор промыли водным NaCl, высушили над Na2SO4 и сконцентрировали, получив в результате соединение 1z (200 мг).
Следуя процедуре, описанной выше для примера 1e, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 1, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 483
1H ЯМР (400 МГц, CD3OD): д 8,25 (с, 1H); 8,12-8,06 (м, 3H); 7,88 (д, J=3 Гц, 1H); 7,74 (д, J=8 Гц, 1H); 7,53 (м, 4H); 4,53 (уш.с., 1H); 4,4-4,26 (м, 4H); 4,15 (м, 1H); 3,86 (м, 2H); 3,27 (м, 1H); 2,50 (м, 4H)
МС m/z (M+H+) 490
MС m/z 490 (M+H+)
Пример 1f
Q. Метил 1-(5-хлорпиридин-2-ил)-1H-индол-5-карбоксилат, 1bb. Смесь соединений 1j (1,14 ммоль, 200 мг), 1aa (1,14 ммоль, 150 мг), K2CO3 (2,28 ммоль, 315 мг) и NMP (1,5 мл) нагревали при температуре 200oC в микроволновом реакторе в течение 2 часов. Смесь влили в воду (50 мл) и экстрагировали с помощью EtOAc. Органический слой промыли солевым раствором, высушили над Na2SO4 и сконцентрировали в вакууме. Очистку производили колоночной флеш-хроматографией (силикагель, 15% EtOAc/гептан) с образованием 290 мг соединения 1bb (290 мг).
R. (5-Хлорпиридин-2-ил)-1H-индол-5-карбоновая кислота, 1cc. Смесь соединения 1bb (0,942 ммоль, 270 мг), LiOH (3,77 ммоль, 90 мг), THF (3 мл), MeOH (3 мл) и H2O (3 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь подкислили 1N водного раствора HCl до уровня pH = 5. Твердый осадок отфильтровали, промыли EtOAc и высушили в вакууме, получив в результате 202 мг соединения 1cc.
Следуя процедуре, описанной выше для примера 1, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
1H ЯМР (CDCl3) д: 8,52 (д, J=2,2 Гц, 1H); 8,21 (д, J=8,6 Гц, 1H); 7,96 (с, 1H); 7,88 (д, J=3,2 Гц, 1H); 7,81 (дд, J=8,6, 2,4 Гц, 1H); 7,70 (д, J=3,4 Гц, 1H); 7,60 (д, J=8,8 Гц, 1H); 7,54 (Д, J=2,9 Гц, 1H); 7,44 (д, J=8,6 Гц, 1H); 6,77 (д, J=3,4 Гц, 1H); 4,51 (уш.с., 1H); 4,19-4,47 (м, 4H); 4,12 (к, J=7,1 Гц, 2H); 3,74-3,95 (м, 2H); 3,25 (т, J=5,6 Гц, 1H); 2,49 (уш.с., 4H)
МС m/z (M+H+) 508,0
МС m/z (M+H+) 501,0
1H ЯМР (CDCl3) д: 8,79 (с, 1H); 8,49 (с, 1H); 8,21 (д, J=8,6 Гц, 1H); 7,95 (с, 1H); 8,00 (с, 1H); 7,78 (д, J=8,6 Гц, 1H); 7,68 (д, J=2,9 Гц, 1H); 7,59 (д, J=8,6 Гц, 1H); 7,42 (д, J=8,6 Гц, 1H); 6,75 (д, J=2,9 Гц, 1H); 4,31-4,47 (м, 1H); 4,16-4,31 (м, 1H); 4,11 (к, J=7,0 Гц, 1H); 3,84-4,04 (м, 3H); 3,80 (уш.с., 1H); 3,18-3,31 (м, 1H); 2,47 (уш.с., 3H); 2,40 (уш.с., 1H)
МС m/z (M+H+) 507,0
Пример 2
A. [4-(1-Бензгидрилазетидин-3-ил)-пиперазин-1-ил]-фенил-метанон, 2b. Названное соединение 2b получили способом, описанным в примере 1, при использовании соединения 2а вместо соединения 1d на стадии C. Полученное соединение 2b очистили колоночной флеш-хроматографией. МС m/z (M+H+) 412,2.
B. (4-Азетидин-3-ил-пиперазин-1-ил)-фенил-метанон, 2c. Названное соединение 2c получили способом, описанным в примере 1, при использовании соединения 2b вместо соединения 1f на стадии D. Полученное соединение 2c использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 246,1.
С. 1-{1-[(4-Бромфенил)карбонил]азетидин-3-ил}-4-(фенилкарбонил)пиперазин, соединение 27. Названное соединение 27 получили способом, описанным в примере 1, при использовании соединения 2с вместо соединения 1g и при использовании соединения 2d вместо соединения 1h на стадии E. Полученное соединение 27 очистили обращенно-фазовой хроматографией. МС m/z (M+H+) 428,1/430,0.
Следуя процедуре, описанной выше для примера 2, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 415,2
МС m/z (M+H+) 419,2
ЖХ/МС m/z (M+H+) 421,2
МС m/z (M+H+) 393,2
ЖХ/МС m/z (M+H+) 442,2
ЖХ/МС m/z (M+H+) 444,1
ЖХ/МС m/z (M+H+) 456,1
ЖХ/МС (m/z) (M+H+) 456,1
ЖХ/МС m/z (M+H+) 460,2
ЖХ/МС m/z (M+H+) 486,3
ЖХ/МС m/z (M+H+) 500,3
1H ЯМР (300 МГц, CD3OD): δ 7,73 (д, 1H), 7,65 (м, 4H), 7,50 (м, 2H), 7,35-7,46 (м, 5H), 4,55 (м, 2H), 4,35 (м, 2H), 4,01 (м, 1H), 3,80 (м, 4H), 3,17 (м, 4H); ЖХ/МС m/z (M+H+) 494,1 (расчет для C27H25Cl2N3O2, 494,43)
1H ЯМР (300 МГц, CD3OD): δ 7,45-7,56 (м, 7H), 7,41 (т, 2H), 7,22 (м, 3H), 6,80 (д, 2H), 4,27-4,75 (м, 4H), 4,07 (м, 1H), 3,88 (м, 4H), 3,34 (с, 3H), 3,25 (м, 4H); ЖХ/МС m/z (M+H+) 455,3 (расчет для C28H30N4O2, 454,58)
1H ЯМР (300 МГц, CD3OD): δ 7,45-7,57 (м, 7H), 6,73 (д, 2H), 4,28-4,73 (м, 4H), 4,12 (м, 1H), 3,89 (м, 4H), 3,30 (м, 8H), 1,80 (м, 4H), 1,54 (м, 4H); ЖХ/МС m/z (M+H+) 447,3 (расчет для C27H34N4O2, 446,6)
ЖХ/МС m/z (M+H+) 431,1
1H ЯМР (400 МГц, MeOD): δ 7,86-7,95 (м, 1H), 7,73-7,79 (м, 1H), 7,62-7,68 (м, 2H), 7,53-7,59 (м, 2H), 7,47-7,52 (м, 2H), 7,41-7,47 (м, 2H), 7,33-7,41 (м, 4H), 7,21-7,33 (м, 2H), 5,67 (уш.с, 1H), 4,51-4,62 (м, 2H), 4,19-4,38 (м, 1H), 4,01-4,12 (м, 1H), 3,71-3,81 (м, 1H), 3,54-3,67 (м, 1H), 3,32 (м, 1H), 2,98-3,12 (м, 2H), 2,79-2,90 (м, 1H), 2,44-2,56 (м, 1H);
МС m/z (M+H+) 509,2 (расчет для C30H28N4O2S, 508,65)
1H ЯМР (400 МГц, MeOD): δ 7,67-7,75 (м, 2H), 7,59-7,67 (м, 4H), 7,53-7,58 (м, 2H), 7,40-7,53 (м, 9H), 7,31-7,40 (м, 2H), 5,73 (уш.с, 1H), 4,34-4,57 (м, 1H), 4,23-4,34 (м, 1H), 4,02-4,18 (м, 2H), 3,69-3,88 (м, 1H), 3,55-3,68 (м, 1H), 3,35-3,46 (м, 2H), 3,07 (м, 1H), 2,81-2,93 (м, 1H), 2,43-2,63 (м, 1H);
MС m/z (M+) 502,2 (расчет для C33H31N3O2, 502,23)
МС m/z (M+H+) 447,29 (расчет для C25H26N4O2S, 446,58)
МС m/z (M+H+) 463,2 (расчет для C25H26N4O3S, 462,57)
МС m/z (M+H+) 461,0 (расчет для C26H28N4O2S, 460,60)
МС m/z (M+H+) 466,3 (расчет для C28H27N5O2, 465,56)
МС m/z (M+H+) 368,2 (расчет для C21H22FN3O2, 367,43)
МС m/z (M+H+) 453,3 (расчет для C28H28N4O2, 452,56)
МС m/z (M+H+) 455,3 (расчет для C28H4N30O2, 454,58)
МС m/z (M+H+) 433,3 (расчет для C26H32N4O2, 432,57)
МС m/z (M+H+) 421,2 (расчет для C25H32N4O2, 420,56)
МС (m/z) (M+H+) 443,3 (расчет для C27H30N4O2, 442,57)
МС m/z (M+H+) 467,2 (расчет для C29H30N4O2, 466,59)
МС m/z (M+H+) 509,1 (расчет для C28H27F3N4O2, 508,55)
МС m/z (M+H+) 441,2 (расчет для C27H28N4O2, 440,55)
МС m/z (M+H+) 459,2 (расчет для C27H27FN4O2, 458,54)
МС m/z (M+H+) 469,2 (расчет для C29H32N4O2, 468,60)
МС m/z (M+H+) 456,221
МС m/z (M+H+) 442,3
МС m/z (M+H+) 442,3
МС m/z (M+H+) 434,161
МС m/z (M+H+) 458,1
МС m/z (M+H+) 414,151
МС m/z (M+H+) 394,205
МС m/z (M+H+) 506,086
МС m/z (M+H+) 408,221
МС m/z (M+H+) 396,167
МС m/z (M+H+) 415,136
МС m/z (M+H+) 428,157
МС m/z (M+H+) 475,2
МС m/z (M+H+) 484,0
МС m/z (M+H+) 455,1
МС m/z (M+H+) 457,1
МС m/z (M+H+) 491,1
МС m/z (M+H+) 415,2
МС m/z (M+H+) 435,1
МС m/z (M+H+) 436,0
МС m/z (M+H+) 516,1
МС m/z (M+H+) 502,0
МС m/z (M+H+) 509,1
МС m/z (M+H+) 523,1
МС m/z (M+H+) 523,3
МС m/z (M+H+) 523,2
МС m/z (M+H+) 509,0
Пример 3
A. (4-Бензилфенил)-пиперазин-1-ил-метанон, 3b. В раствор соединения 1a (1 г, 5,36 ммоль), соединения 3a (1,14 г, 5,36 ммоль) и DIPEA (1,38 г, 10,7 ммоль) в ацетонитриле (20 мл) ввели HBTU (2,64 г, 7,0 ммоль). Реакционную смесь перемешивали в течение 18 часов и за это время растворитель удалили при пониженном давлении, а полученный продукт очистили методом обращенно-фазовой ВЭЖХ. По окончании лиофилизации оставшееся твердое вещество растворили в DCM (20 мл) и медленно ввели трифторуксусную кислоту (15 мл). После перемешивания при комнатной температуре в течение 2 часов растворители удалили, а остаток разделили между 1N водного раствора NaOH и CHCl3. Органический слой отделили, высушили (MgSO4), отфильтровали и сконцентрировали, получив, таким образом, соединение 3b (1,21 г).
B. [4-(1-Бензгидрилазетидин-3-ил)-пиперазин-1-ил]-4-бензилфенилметанон, 3c. Названное соединение 3c получили способом, описанным в примере 1, при использовании соединения 3b вместо соединения 1d на стадии C.
C. (4-Азетидин-3-ил-пиперазин-1-ил)-4-бензилфенилметанон, 3d. Названное соединение 3d получили способом, описанным в примере 1, при использовании соединения 3c вместо соединения 1f на стадии D.
D. 1-[(4-Бензилфенил)карбонил]-4-[1-(фенилкарбонил)азетидин-3-ил]пиперазин, соединение 61. Соединение 3d преобразовали в указанное соединение 61 способом, описанным в примере 2, при использовании соединения 3d вместо соединения 2c, бензойную кислоту (соединение 1k) вместо соединения 2d и HBTU вместо HATU на стадии D. 1H ЯМР (400 МГц, MeOD): δ 7,64 (д, J=1,7 Гц, 2H), 7,51-7,58 (м, 1H), 7,48 (уш.с, 2H), 7,38 (с, 2H), 7,33 (д, J=8,1 Гц, 2H), 7,25 (уш.с, 2H), 7,20 (д, J=7,3 Гц, 3H), 4,51-4,64 (м, 1H), 4,33-4,51 (м, 2H), 4,20-4,33 (м, 1H), 4,01 (с, 2H), 3,86-3,96 (м, 2H), 3,69-3,86 (м, 3H), 3,07 (уш.с, 4H); МС m/z (M+H+) 440,2 (расчет для C28H29N3O2, 439,56).
Следуя процедуре, описанной выше для примера 3, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 433,1
МС m/z (M+H+) 433,2
МС m/z (M+H+) 444,1
МС m/z (M+H+) 433,2
МС m/z (M+H+) 414,0
МС m/z (M+H+) 434,0
МС m/z (M+H+) 413,0
МС m/z (M+H+) 428,1
МС m/z (M+H+) 417,0
МС m/z (M+H+) 481,1
МС m/z (M+H+) 462,1
МС m/z (M+H+) 461,0
МС m/z (M+H+) 481,0
МС m/z (M+H+) 481,0
МС m/z (M+H+) 466,1
МС m/z (M+H+) 482,2
МС m/z (M+H+) 501,0
МС m/z (M+H+) 483,0
МС m/z (M+H+) 483,0
МС m/z (M+H+) 509,0
МС m/z (M+H+) 509,0
Пример 4
A. Трет-бутиловый эфир 3-(4-бензоилпиперазин-1-ил)-азетидин-1-карбоновой кислоты, 4b. В раствор 1-Boc-азетидин-3-она (соединение 4a) и соединения 2a в CH3OH ввели декаборан при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Растворитель удалили при пониженном давлении и полученное соединение 4b использовали в последующей реакции без дополнительной очистки. МС m/z (M+H+) 346,2.
B. (4-Азетидин-3-ил-пиперазин-1-ил)-фенилметанон, 2c. Названное соединение 2c получили способом, описанным в примере 1, при использовании соединения 4b вместо соединения 1c на стадии B. Полученное соединение 2c использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 246,1.
C. 1-{1-[(4-Метил-2-фенил-1,3-тиазол-5-ил)карбонил]азетидин-3-ил}-4-(фенилкарбонил)пиперазин, соединение 62. Названное соединение 62 получили способом, описанным в примере 1, при использовании соединения 2c вместо соединения 1g и при использовании соединения 4c вместо соединения 1h на стадии E. Полученное соединение 62 очистили обращенно-фазовой хроматографией. МС m/z (M+H+) 447,1.
Следуя процедуре, описанной выше для примера 4, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
ЖХ/МС m/z (M+H+) 453,1
ЖХ/МС m/z (M+H+) 461,2
ЖХ/МС m/z (M+H+) 515,1
ЖХ/МС m/z (M+H+) 432,1
ЖХ/МС m/z (M+H+) 432,1
ЖХ/МС m/z (M+H+) 427,2
ЖХ/МС m/z (M+H+) 427,2
ЖХ/МС m/z (M+H+) 427,2
ЖХ/МС m/z (M+H+) 427,2
1H ЯМР (300 МГц, CD3OD): δ 7,81 (д, 1H), 7,64-7,77 (м, 3H), 7,59 (т, 1H), 7,42-7,54 (м, 7H), 7,36 (д, 1H), 4,70 (м, 1H), 4,58 (м, 1H), 4.47 (м, 1H), 4,35 (м, 1H), 4,04 (м, 1H), 3,86 (м, 4H), 3,19 (м, 4H); ЖХ/МС m/z (M+H+) 494,2 (расчет для C28H26F3N3O2, 493,53)
ЖХ/МС m/z (M+H+) 494,2
ЖХ/МС m/z (M+H+) 494,2
1H ЯМР (300 МГц, CD3OD): δ 7,74-7,89 (м, 8H), 7,46-7,54 (м, 5H), 4,68 (м, 1H), 4,61 (м, 1H), 4,47 (м, 1H), 4,38 (м, 1H), 4.07 (м, 1H), 3,88 (м, 4H), 3,23 (м, 4H)); ЖХ/МС m/z (M+H+) 494,2 (расчет для C28H26F3N3O2, 493,53)
ЖХ/МС m/z (M+H+) 451,0
1H ЯМР (300 МГц, DМСO-d6): δ 7,77-7,86 (м, 3H), 7,68-7,76 (м, 3H), 7,43-7,58 (м, 7H), 4,60 (м, 2H), 4,39 (м, 1H), 4,28 (м, 1H), 4,08 (м, 1H), 3,29-3,94 (м, 6H), 3,06 (м, 2H); ЖХ/МС m/z (M+H+) 460,0 (расчет для C27H26ClN3O2, 459,98)
ЖХ/МС m/z (M+H+) 460,0
1H ЯМР (300 МГц, DМСO-d6): δ 7,87 (д, 2H), 7,81 (д, 2H), 7,73 (д, 2H), 7,67 (т, 1H), 7,48 (м, 5H), 4,67 (м, 1H), 4,58 (т, 1H), 4.43 (м, 1H), 4,29 (т, 1H), 4,10 (м, 1H), 3,25-3,93 (м, 6H), 3,06 (м, 2H); ЖХ/МС m/z (M+H+) 494,1 (расчет для C27H25Cl2N3O2, 494,43)
ЖХ/МС m/z (M+H+) 427,2
ЖХ/МС m/z (M+H+) 444,1
ЖХ/МС m/z (M+H+) 451,2
1H ЯМР (300 МГц, CD3OD): δ 7,25-7,74 (м, 13H), 4,08-4,59 (м, 4H), 3,43-3,97 (м, 5H), 2,92 (м, 4H); ЖХ/МС m/z (M+H+) 504,0/506,1 (расчет для C27H26BrN3O2, 504,43)
МС m/z (M+H+) 477,2
МС m/z (M+H+) 392,3
ЖХ/МС m/z (M+H+) 412,21 (расчет для C23H26ClN3O2, 411,92)
ЖХ/МС m/z (M+H+) 456,15 (расчет для C23H26BrN3O2, 456,38)
ЖХ/МС m/z (M+H+) 446,23 (расчет для C24H26F3N3O2, 445,48)
ЖХ/МС m/z (M+H+) 412,18 (расчет для C23H26ClN3O2, 411,92)
ЖХ/МС m/z (M+H+) 412,21 (расчет для C23H26ClN3O2, 411,92)
ЖХ/МС m/z (M+H+) 446,16 (расчет для C23H25Cl2N3O2, 446,37)
ЖХ/МС m/z (M+H+) 422,2 (расчет для C24H27N3O4, 421,49)
ЖХ/МС m/z (M+H+) 476,20 (расчет для C24H24F3N3O2S, 475,54
ЖХ/МС m/z (M+H+) 514,18 (расчет для C25H25F6N3O2, 514,18)
ЖХ/МС m/z (M+H+) 428,27 (расчет для C27H29N3O2, 427,54)
ЖХ/МС m/z (M+H+) 470,29 (расчет для C29H31N3O3, 469,59)
ЖХ/МС m/z (M+H+) 414,21 (расчет для C22H24ClN3O3, 413,91)
ЖХ/МС m/z (M+H+) 488,32 (расчет для C31H41N3O2, 487,69)
ЖХ/МС m/z (M+H+) 458,18 (расчет для C23H26BrN3O2, 456,39)
ЖХ/МС m/z (M+H+) 464,26 (расчет для C23H24F3N3O4, 475,54)
ЖХ/МС m/z (M+H+) 497,23 (расчет для C26H32N4O4S, 496,21)
ЖХ/МС m/z (M+H+) 503,37 (расчет для C31H42N4O2, 502,71)
ЖХ/МС m/z (M+H+) 406,2 (расчет для C23H23N3O2S, 405,52)
ЖХ/МС m/z (M+H+) 410,29 (расчет для C23H24ClN3O2, 409,92
ЖХ/МС m/z (M+H+) 456,16 (расчет для C23H24BrN3O2, 454,37)
ЖХ/МС m/z (M+H+) 426,32 (расчет для C27H27N3O2, 425,54)
ЖХ/МС m/z (M+H+) 432,38 (расчет для C27H33N3O2, 431,58)
ЖХ/МС m/z (M+H+) 508,31 (расчет для C31H29N3O4, 507,59)
ЖХ/МС m/z (M+H+) 460,35 (расчет для C28H33N3O3, 459,59)
1H ЯМР (300 МГц, MeOD): δ 7,55 (ар, 2H), 7,4 (м, 5H), 7,25 (ар, 2H), 4,5 (м, 2H), 4,3 (м, 2H), 4,1 (м, 3H), 3,7 (уш. м, 4H), 3,0 (уш. м, 4H), 2,7 (м, 4H), 1,7 (м, 2H), 1,5 (м, 2H), 1,4 (с, 9H).
ЖХ/МС m/z (M+H+) 533,33 (расчет для C31H40N4O4, 532,69)
ЖХ/МС m/z (M+H+) 519,35 (расчет для C30H38N4O4, 518,66)
1H ЯМР (400 МГц, CDCl3): δ 7,57 (д, J=8,8 Гц, 2H), 7,44 (д, J=8,8 Гц, 2H), 7,36-7,42 (м, 4H), 7,20 (с, 1H), 4,25-4,34 (м, 1H), 4,17-4,26 (м, 1H), 4,13 (с, 1H), 3,97-4,08 (м, 1H), 3,81-3,95 (м, 1H), 3,68-3,80 (м, 1H), 3,32-3,61 (м, 2H), 3,15-3,27 (м, 1H), 2,16-2,59 (м, 4H), 1,50 (с, 9H)
МС (m/z) (M+H+) 465,2
МС m/z (M+H+) 481,0
МС m/z (M+H+) 515,1
МС m/z (M+H+) 481,0
МС m/z (M+H+) 465,1
МС m/z (M+H+) 485,1
МС m/z (M+H+) 430,2
МС m/z (M+H+) 484,0
МС m/z (M+H+) 511,1
МС m/z (M+H+) 484,2
Пример 5
A. 4-(1-Бензгидрилазетидин-3-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир, 5a. Названное соединение 5a получили способом, описанным в примере 1, при использовании соединения 1a вместо соединения 1d на стадии C. Полученное соединение 5a использовали в следующей реакции без очистки. МС m/z (M+H+) 408,1.
B. 1-(1-Бензгидрилазетидин-3-ил)-пиперазин, 5b. Названное соединение 5b получили способом, описанным в примере 1, при использовании соединения 5a вместо соединения 1c на стадии B. Полученное соединение 5b использовали в следующей реакции без очистки. МС m/z (M+H+) 208,1.
C. [4-(1-Бензгидрилазетидин-3-ил)-пиперазин-1-ил]-тиазол-2-ил-метанон, 5d. Названное соединение 5d получили способом, описанным в примере 1, при использовании соединения 5b вместо соединения 1g и соединения 5c вместо соединения 1h на стадии E. Полученное соединение 5d очистили испарительной колоночной хроматографией. МС m/z (M+H+) 419,2.
D. (4-Азетидин-3-ил-пиперазин-1-ил)-тиазол-2-ил-метанон, 5e. Названное соединение 5е получили способом, описанным в примере 1, при использовании соединения 5d вместо соединения 1f на стадии D. Полученное соединение 5e использовали в следующей реакции без очистки. МС m/z (M+H+) 253,2.
E. 1-{1-[(4-Метил-2-фенил-1,3-тиазол-5-ил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 133. Названное соединение 133 получили способом, описанным в примере 1, при использовании соединения 5e вместо соединения 1g и при использовании соединения 4c вместо соединения 1h на стадии E. Полученное соединение 133 очистили обращенно-фазовой хроматографией. 1H ЯМР (300 МГц, CD3OD): δ 7,98 (м, 3H), 7,89 (д, 1H), 7,46-7,55 (м, 3H), 4,80 (м, 1H), 4.41-4,69 (м, 4H), 4,09 (м, 3H), 3,35 (м, 5H), 2,68 (с, 3H); ЖХ/МС m/z (M+H+) 454,2 (расчет для C22H23N5O2S2, 453,59).
Следуя процедуре, описанной выше для примера 5, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (300 МГц, CD3OD): δ 7,98 (с, 1H), 7,88 (с, 1H), 7,67 (м, 2H), 7,16 (м, 1H), 4,79 (м, 1H), 4,35-4,69 (м, 4H), 4,07 (м, 3H), 3,33 (м, 5H), 2,62 (с, 3H); ЖХ/МС m/z (M+H+) 460,0 (расчет для C20H21N5O2S3, 459,61)
1H ЯМР (300 МГц, CD3OD): δ 7,98 (д, 1H), 7,82-7,91 (м, 3H), 7,32 (д, 2H), 4,80 (м, 1H), 4,40-4,66 (м, 4H), 4,08 (м, 3H), 3,34 (м, 5H), 2,66 (с, 3H), 2,46 (с, 3H); ЖХ/МС m/z (M+H+) 468,1 (расчет для C23H25N5O2S2, 467,62)
1H ЯМР (300 МГц, CD3OD): δ 8,19 (д, 2H), 7,97 (д, 1H), 7,86 (д, 1H), 7,82 (д, 2H), 4,25-4,76 (м, 5H), 3,95 (м, 2H), 3,76 (м, 1H), 3,33 (м, 2H), 2,99 (м, 3H), 2,69 (с, 3H); ЖХ/МС m/z (M+H+) 522,2 (расчет для C23H22F3N5O2S2, 521,59)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,91 (т, 1H), 7,88 (д, 1H), 7,83 (дт, 1H), 7,54 (м, 2H), 7,47 (дд, 2H), 7,13 (дд, 1H), 4,30-4,79 (м, 5H), 4,02 (м, 3H), 3,24 (м, 5H); ЖХ/МС m/z (M+H+) 439,0 (расчет для C22H22N4O2S2, 438,57)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,89 (д, 1H), 7,75 (м, 4H), 7,51 (м, 2H), 7,14 (м, 1H), 4,28-4,82 (м, 5H), 4,02 (м, 3H), 3,25 (м, 5H); ЖХ/МС m/z (M+H+) 439,1 (расчет для C22H22N4O2S2, 438,57)
ЖХ/МС m/z (M+H+) 434,0
ЖХ/МС m/z (M+H+) 434,0
ЖХ/МС m/z (M+H+) 434,0
ЖХ/МС m/z (M+H+) 434,0
ЖХ/МС m/z (M+H+) 435,0
ЖХ/МС m/z (M+H+) 435,0
ЖХ/МС m/z (M+H+) 435,0
ЖХ/МС m/z (M+H+) 435,0
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,88 (д, 1H), 7,81 (д, 1H), 7,74 (д, 2H), 7,68 (т, 1H), 7,59 (т, 1H), 7,45 (д, 2H), 7,37 (д, 1H), 4,33-4,82 (м, 5H), 4.04 (м, 3H), 3,27 (м, 5H); ЖХ/МС m/z (M+H+) 501,0 (расчет для C25H23F3N4O2S, 500,55)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,88 (д, 1H), 7,81 (д, 1H), 7,73 (дт, 1H), 7,67 (д, 1H), 7,49-7,64 (м, 4H), 7,39 (д, 1H), 4,30-4,81 (м, 5H), 4,03 (м, 3H), 3,25 (м, 5H); ЖХ/МС m/z (M+H+) 501,0 (расчет для C25H23F3N4O2S, 500,55)
ЖХ/МС m/z (M+H+) 501,0
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,76-7,89 (м, 9H), 4,62-4,77 (м, 5H), 3,97 (м, 3H), 3,13(м, 5H); ЖХ/МС m/z (M+H+) 501,0 (расчет для C25H23F3N4O2с, 500,55)
1H ЯМР (300 МГц, CD3OD): δ 8,34 (т, 1H), 8,21 (дт, 1H), 7,97 (д, 1H), 7,94 (дд, 1H), 7,87 (д, 1H), 7,72-7,82 (м, 2H), 7,54-7,67 (м, 2H), 4,26-4,68 (м, 6H), 3,84-4,06 (м, 3H), 3,13 (м, 4H); ЖХ/МС m/z (M+H+) 512,0/513,9 (расчет для C23H22BrN5O2S, 512,43)
ЖХ/МС m/z (M+H+) 479,0
ЖХ/МС m/z (M+H+) 479,0
ЖХ/МС m/z (M+H+) 452,0
ЖХ/МС m/z (M+H+) 458,0
ЖХ/МС m/z (M+H+) 458,0
ЖХ/МС m/z (M+H+) 507,9
1H ЯМР (300 МГц, CD3OD): δ 8,31 (с, 1H), 7,89 (м, 3H), 7,79 (д, 1H), 7,52 (т, 1H), 5,01 (м, 1H), 4,84 (м, 2H), 4,65 (м, 1H), 4,38 (дд, 1H), 4,26 (дд, 1H), 3,93 (м, 3H), 3,17 (м, 4H); ЖХ/МС m/z (M+H+) 507,9 (расчет для C21H19Cl2N5O2S2, 508,45)
ЖХ/МС m/z (M+H+) 470,0
ЖХ/МС m/z (M+H+) 440,0
1H ЯМР (300 МГц, DМСO-d6): δ 8,10 (д, 1H), 8,06 (д, 1H), 7,78-7,86 (м, 3H), 7,68-7,77 (м, 3H), 7,46-7,58 (м, 2H), 4,62 (м, 2H), 4,40 (м, 1H), 4,30 (м, 1H), 4,08 (м, 1H), 4,27-3,87 (м, 6H), 3,12 (м, 2H); ЖХ/МС m/z (M+H+) 458,1 (расчет для C25H23N5O2S, 457,56)
1H ЯМР (300 МГц, DМСO-d6): δ 8,10 (д, 1H), 8,06 (д, 1H), 7,78-7,86 (м, 3H), 7,68-7,77 (м, 3H), 7,46-7,58 (м, 2H), 4,61 (м, 2H), 4,37 (м, 1H), 4,29 (м, 1H), 4,05 (м, 1H), 4,30-3,84 (м, 6H), 3,08 (м, 2H); ЖХ/МС m/z (M+H+) 467,1 (расчет для C24H23ClN4O2S, 466,99)
1H ЯМР (300 МГц, CD3OD): δ 7,98 (д, 1H), 7,88 (д, 1H), 7,76 (м, 4H), 7,66 (м, 2H), 7,48 (м, 2H), 4,71 (м, 3H), 4,58 (м, 1H), 4,47 (м, 1H), 4,36 (м, 1H), 4,02 (м, 3H), 3,23 (м, 4H); ЖХ/МС m/z (M+H+) 467,1 (расчет для C24H23ClN4O2S, 466,99)
1H ЯМР (300 МГц, CD3OD): δ 7,88 (д, 1H), 7,78 (д, 1H), 7,68 (м, 4H), 7,55 (д, 2H), 7,39 (т, 1H), 4,57 (м, 3H), 4,45 (м, 1H), 4,35 (м, 1H), 4,23 (м, 1H), 3,91 (м, 2H), 3,81 (м, 1H), 3,03 (м, 4H); ЖХ/МС m/z (M+H+) 501,0 (расчет для C24H22Cl2N4O2S, 501,44)
ЖХ/МС m/z (M+H+) 434,1
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,37-7,67 (м, 8H), 4,66 (м, 3H), 4,53 (м, 1H), 4,42 (м, 1H), 4,30 (м, 1H), 3,98 (м, 2H), 3,85 (м, 1H), 3,07 (м, 4H); ЖХ/МС m/z (M+H+) 451,0 (расчет для C24H23FN4O2S, 450,54)
1H ЯМР (300 МГц, CD3OD): δ 7,98 (д, 1H), 7,77-7,92 (м, 9H), 4,63-4,79 (м, 3H), 4,57 (м, 1H), 4,46 (м, 1H), 4,35 (м, 1H), 3,90- 4,13 (м, 3H), 3,19 (м, 4H); ЖХ/МС m/z (M+H+) 458,1 (расчет для C25H23N5O2S, 457,56)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,76 (м, 4H), 7,62 (дд, 4H), 4,67 (м, 3H), 4,51 (м, 1H), 4,44 (м, 1H), 4,30 (м, 1H), 3,98 (м, 2H), 3,88 (м, 1H), 3,10 (м, 4H); ЖХ/МС m/z (M+H+) 511,0/513,0 (расчет для C24H23BrN4O2S, 511,44)
ЖХ/МС m/z (M+H+) 434,1
1H ЯМР (300 МГц, CD3OD): δ 9.06 (с, 1H), 8,22 (с, 1H), 7,37-7,67 (м, 8H), 4,70 (м, 1H), 4,57 (м, 1H), 4.45 (м, 1H), 4,34 (м, 1H), 4,11 (м, 4H), 3,99 (м, 1H), 3,17 (м, 4H); ЖХ/МС m/z (M+H+) 451,0 (расчет для C24H23FN4O2S, 450,54)
ЖХ/МС m/z (M+H+) 458,1
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,22 (с, 1H), 7,76 (м, 4H), 7,61 (дд, 4H), 4,68 (м, 1H), 4,57 (м, 1H), 4,46 (м, 1H), 4,36 (м, 1H), 4,15 (м, 4H), 4,04 (м, 1H), 3,22 (м, 4H); ЖХ/МС m/z (M+H+) 511,0/513,0 (расчет для C24H23BrN4O2S, 511,44)
МС m/z (M+H+) 439,2
МС m/z (M+H+) 515,2
МС m/z (M+H+) 381,1
МС m/z (M+H+) 467,2
МС m/z (M+H+) 480,1
ЖХ/МС m/z (M+H+) 436,2
МС m/z (M+H+) 463,2 (расчет для C25H26N4O3S, 462,57)
МС m/z (M+H+) 463,2 (расчет для C25H26N4O3S, 462,57)
МС m/z (M+H+) 509,0 (расчет для C30H28N4O2S, 508,65)
МС m/z (M+H+) 461,0 (расчет для C26H28N4O2S, 460,60)
МС m/z (M+H+) 446,9 (расчет для C25H26N4O2S, 446,58)
МС m/z (M+H+) 447,3 (расчет для C25H26N4O2S, 446,58)
1H ЯМР (300 МГц, CD3OD): δ 7,81-8,02 (м, 4H), 7,52 (д, 2H), 4,30-4,64 (м, 6H) 3,84-4,09 (м, 3H), 3,10-3,29 (м, 4H), 2,67 (с, 3H); ЖХ/МС m/z (M+H+) 488,1 (расчет для C22H22ClN5O2S2, 488,03)
1H ЯМР (300 МГц, CD3OD): δ 7,95-8,05 (м, 2H), 7,84-7,94 (м, 2H), 7,45-7,60 (м, 2H), 4,32-4,84 (м, 6H) 3,92-4,09 (м, 3H), 3,15-3,27 (м, 4H), 2,68(с, 3H); ЖХ/МС m/z (M+H+) 488,1 (расчет для C22H22ClN5O2S2, 488,03)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,16-8,36 (м, 3H), 7,79-7,89 (м, 1H), 7,66-7,78 (м, 1H), 4,23-4,76 (м, 4H) 3,84-4,22 (м, 5H), 3,04-3,22 (м, 4H), 2,70 (с, 3H); ЖХ/МС m/z (M+H+) 522,2 (расчет для C23H22F2N5O2S2, 521,59)
МС m/z (M+H+) 476,1
МС m/z (M+H+) 499,1
МС m/z (M+H+) 516,2
МС m/z (M+H+) 448,0
МС m/z (M+H+) 552,0/554,0
МС m/z (M+H+) 452,1
МС m/z (M+H+) 466,0
МС m/z (M+H+) 615,0
МС m/z (M+H+) 479,1
МС m/z (M+H+) 469,1
МС m/z (M+H+) 499,1
МС m/z (M+H+) 472,1
МС m/z (M+H+) 490,0
МС m/z (M+H+) 442,0
МС m/z (M+H+) 491,1
МС m/z (M+H+) 424,0
МС m/z (M+H+) 465,1
МС m/z (M+H+) 450,1
МС m/z (M+H+) 460,2
МС m/z (M+H+) 469,0
МС m/z (M+H+) 519,0
МС m/z (M+H+) 491,4
МС m/z (M+H+) 438,3
МС m/z (M+H+) 469,4
МС m/z (M+H+) 473,2
МС m/z (M+H+) 413,3
МС m/z (M+H+) 426,3
МС m/z (M+H+) 427,2
МС m/z (M+H+) 399,3
МС m/z (M+H+) 454,4
МС m/z (M+H+) 439,2
МС m/z (M+H+) 497,1
МС m/z (M+H+) 413,3
МС m/z (M+H+) 455,3
МС m/z (M+H+) 427,2
МС m/z (M+H+) 399,1
МС m/z (M+H+) 413,3
МС m/z (M+H+) 443,2
МС m/z (M+H+) 539,4
МС m/z (M+H+) 517,3
МС m/z (M+H+) 515,4
МС m/z (M+H+) 461,1
МС m/z (M+H+) 534,2
МС m/z (M+H+) 500,1
МС m/z (M+H+) 516,2
МС m/z (M+H+) 587,3
МС m/z (M+H+) 575,2
МС m/z (M+H+) 475,0
МС m/z (M+H+) 560,2
МС m/z (M+H+) 550,0
МС m/z (M+H+) 584,1
МС m/z (M+H+) 547,3
МС m/z (M+H+) 515,2
МС m/z (M+H+) 607,3
МС m/z (M+H+) 456,1
МС m/z (M+H+) 442,2
МС m/z (M+H+) 442,2
МС m/z (M+H+) 456,1
МС m/z (M+H+) 476,1
МС m/z (M+H+) 584,1
МС m/z (M+H+) 447,1/449,1
МС m/z (M+H+) 447,1/449,1
МС m/z (M+H+) 427,2
МС m/z (M+H+) 520,2
МС m/z (M+H+) 458,3
МС m/z (M+H+) 450,1
МС m/z (M+H+) 584,1
МС m/z (M+H+) 472,2
МС m/z (M+H+) 601,0
МС m/z (M+H+) 456,1
МС m/z (M+H+) 529,0
МС m/z (M+H+) 429,1
МС m/z (M+H+) 428,1
МС m/z (M+H+) 469,2
МС m/z (M+H+) 458,3
МС m/z (M+H+) 455,1
МС m/z (M+H+) 533,1
МС m/z (M+H+) 506,2
МС m/z (M+H+) 561,0
МС m/z (M+H+) 455,1
МС m/z (M+H+) 548,2
МС m/z (M+H+) 485,1
МС m/z (M+H+) 475,1
МС m/z (M+H+) 490,0
МС m/z (M+H+) 431,3
МС m/z (M+H+) 459,1
МС m/z (M+H+) 535,2
МС m/z (M+H+) 470,1
МС m/z (M+H+) 452,2
МС m/z (M+H+) 518,1
МС m/z (M+H+) 526,0
МС m/z (M+H+) 574,0
МС m/z (M+H+) 544,0
МС m/z (M+H+) 504,1
МС m/z (M+H+) 542,2
МС m/z (M+H+) 473,0
1H ЯМР (300 МГц, CD3OD): d 8,28 (с, 1H), 8,23 (д, 1H), 7,98 (д, 1H), 7,88 (д, 1H), 7,82 (д, 1H), 7,72 (т, 1H), 4,35-4,81 (м, 6H), 3,92-4,13 (м, 3H), 3,19-3,27 (м, 4H), 2,71 (с, 3H)
МС m/z (M+H+) 522,2
МС m/z (M+H+) 488,1
МС m/z (M+H+) 488,1
МС m/z (M+H+) 472,0
МС m/z (M+H+) 472,0
МС m/z (M+H+) 492,1
МС m/z (M+H+) 437,1
МС m/z (M+H+) 491,1
МС m/z (M+H+) 518,1
МС m/z (M+H+) 491,1
МС m/z (M+H+) 492,1
МС m/z (M+H+) 437,1
МС m/z (M+H+) 491,1
МС m/z (M+H+) 518,1
МС m/z (M+H+) 491,1
МС m/z (M+H+) 507,9/508,8
МС m/z (M+H+) 503/505
МС m/z (M+H+) 503/505
МС m/z (M+H+) 453/455
МС m/z (M+H+) 453/455
МС m/z (M+H+) 453/455
МС m/z (M+H+) 453/455
МС m/z (M+H+) 472,2
МС m/z (M+H+) 472,2
МС m/z (M+H+) 507,1
МС m/z (M+H+) 507,1
МС m/z (M+H+) 476,1
МС m/z (M+H+) 550,03
МС m/z (M+H+) 584,34
МС m/z (M+H+) 422,06
МС m/z (M+H+) 433,2
МС m/z (M+H+) 466,2
МС m/z (M+H+) 486,3
МС m/z (M+H+) 424
МС m/z (M+H+) 466,2
МС m/z (M+H+) 432,9
МС m/z (M+H+) 424
МС m/z (M+H+) 466
МС m/z (M+H+) 483,3
МС m/z (M+H+) 431,29
МС m/z (M+H+) 473,27
МС m/z (M+H+) 509,28
МС m/z (M+H+) 557,14
1H ЯМР (CDCl3): δ 9,02 (д, 1H); 8,31 (с, 1H); 8,22 (с, 1H); 8,12 (м, 1H); 7,77 (с, 1H); 7,69 (м, 1H); 7,50 (м, 5H); 7,35 (м, 1H); 5,91 (уш. м, 1H); 4,83 (м, 1H); 4,64 (м, 1H); 4,48-4,46 (м, 2H); 4,14 (м, 1H); 3,86 (м, 1H); 3,87 (м, 1H); 3,51 (м, 1H); 3,12 (т, 1H); 2,97 (м, 1H).
МС m/z (M+H+) 557,18
МС m/z (M+H+) 591,26
МС m/z (M+H+) 591,24
МС m/z (M+H+) 256
1H ЯМР (CDCl3): δ 7,99 (д, 1H), 7,88 (д, 1H); 7,71 (м, 2H); 7,52-7,32 (м, 4H); 4,75 (уш., 4H); 4,0 (уш. м, 3H); 3,22 (шм, 4H)
МС m/z (M+H+) 439,16
МС m/z (M+H+) 458,13
МС m/z (M+H+) 410,12
МС m/z (M+H+) 424,21
МС m/z (M+H+) 323,13
МС m/z (M+H+) 486
МС m/z (M+H+) 441,1
МС m/z (M+H+) 441,1
МС m/z (M+H+) 429,1
МС m/z (M+H+) 429,1
МС m/z (M+H+) 440,1
МС m/z (M+H+) 440,1
МС m/z (M+H+) 415
МС m/z (M+H+) 439,7/440,3
МС m/z (M+H+) 428,8
МС m/z (M+H+) 440,1
МС m/z (M+H+) 444,1
МС m/z (M+H+) 415,2
МС m/z (M+H+) 428,8
1H ЯМР (CDCl3): δ 7,88 (д, 1H); 7,78 (д, 1H); 7,5 (м, 1H); 7,27 (м, 1H); 7,12 (м, 1H); 4,16 (уш. м, 1H); 4,32 (уш. м, 2H); 3,16 (м, 3H); 2,36 (с, 3H)
МС m/z (M+H+) 443,1
МС m/z (M+H+) 472,83
МС m/z (M+H+) 473,1
МС m/z (M+H+) 473,1
МС m/z (M+H+) 473,1
МС m/z (M+H+) 493,2
МС m/z (M+H+) 493,2
МС m/z (M+H+) 563,1
МС m/z (M+H+) 479,1
МС m/z (M+H+) 479,1
МС m/z (M+H+) 479,1
МС m/z (M+H+) 479,1
МС m/z (M+H+) 473,1
МС m/z (M+H+) 473,1
МС m/z (M+H+) 473,1
МС m/z (M+H+) 431
МС m/z (M+H+) 431
МС m/z (M+H+) 430,86
МС m/z (M+H+) 430,93
МС m/z (M+H+) 501,1
МС m/z (M+H+) 486,9
МС m/z (M+H+) 447,6
МС m/z (M+H+) 501,1
МС m/z (M+H+) 448
МС m/z (M+H+) 448
МС m/z (M+H+) 487
МС m/z (M+H+) 487
МС m/z (M+H+) 448,1
МС m/z (M+H+) 5,1
МС m/z (M+H+) 509,72
МС m/z (M+H+) 510
МС m/z (M+H+) 510
МС m/z (M+H+) 463,81
МС m/z (M+H+) 463,81
МС m/z (M+H+) 463,81
МС m/z (M+H+) 464,1
МС m/z (M+H+) 464,1
МС m/z (M+H+) 494,97
МС m/z (M+H+) 477,02
МС m/z (M+H+) 477,02
МС m/z (M+H+) 466,1
МС m/z (M+H+) 465,98
МС m/z (M+H+) 448,2
МС m/z (M+H+) 466
1H ЯМР (CDCl3): δ 7,38 (м, 2H); 7,19-6,84 (м, 5H); 6,88 (м, 1H); 6,56 (м, 1H); 6,13 (м, 1H); 4,67-4,21 (м, 3H); 4,12-3,90 (уш. д, 4H); 3,25 (уш. м, 3H)
МС m/z (M+H+) 461,2
МС m/z (M+H+) 465,2
МС m/z (M+H+) 465,1
МС m/z (M+H+) 447,1
МС m/z (M+H+) 477,1
МС m/z (M+H+) 477,1
МС m/z (M+H+) 477,1
МС m/z (M+H+) 458,2
МС m/z (M+H+) 458,1
МС m/z (M+H+) 485,1
МС m/z (M+H+) 440,2
МС m/z (M+H+) 543,1
МС m/z (M+H+) 440,2
МС m/z (M+H+) 543,1
МС m/z (M+H+) 525,2
МС m/z (M+H+) 543
МС m/z (M+H+) 465,1
МС m/z (M+H+) 465,1
МС m/z (M+H+) 465,1
МС m/z (M+H+) 428,3
МС m/z (M+H+) 495,1
МС m/z (M+H+) 472,8
МС m/z (M+H+) 472,8
МС m/z (M+H+) 465,1
МС m/z (M+H+) 488,1
МС m/z (M+H+) 490,1
МС m/z (M+H+) 475
МС m/z (M+H+) 471,1
МС m/z (M+H+) 476,1
МС m/z (M+H+) 509,0
Пример 6
A. Азетидин-3-он, 6a. Названное соединение 6а получили способом, описанным в примере 1, используя соединение 4а вместо соединения 1c на стадии B. Полученное соединение 6a использовали в следующей реакции без дополнительной очистки. МС m/z (M+H++CF3CO2H) 186,1.
B. 1-(4-Бромбензоил)-азетидин-3-он, 6b. Названное соединение 6b получили способом, описанным в примере 1, используя соединение 6a вместо соединения 1g и соединение 2d вместо соединения 1h на стадии E. Полученное соединение 6b использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 419,2.
C. Трет-бутиловый эфир 4-[1-(4-бромбензоил)-азетидин-3-ил]-пиперазин-1-карбоновой кислоты, 6c. Названное соединение 6c получили способом, описанным в примере 4, используя соединение 6b вместо соединения 4а и соединение 1а вместо соединения 2а на стадии А. Полученное соединение 6c очистили колоночной флеш-хроматографией. МС m/z (M+H+) 424,0; 426,1
D. (4-Бромфенил)-(3-пиперазин-1-ил-азетидин-1-ил)-метанон, 6d. Названное соединение 6d получили способом, описанным в примере 1, используя соединение 6c вместо соединения 1c на стадии B. Полученное соединение 6d использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 324,08/326,08
E. 1-{1-[(4-Бромфенил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 173. Названное соединение 173 получили способом, описанным в примере 1, используя соединение 6d вместо соединения 1g и соединение 5c вместо соединения 1h на стадии E. Полученное соединение 173 использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 435,0; 437,0
F. 1-{1-[(4'-Фтордифенил-4-ил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 174. К суспензии соединения 173 (0,05 г, 0,115 ммоль), соединения 6e (0,0193 г, 0,14 ммоль) и Cs2CO3 (0,094 г, 0,288 ммоль) в диоксане (3 мл) и EtOH (1 мл) добавили соединение Pd(dppf)Cl2 (0,0084 г, 0,0115 ммоль). Реакционную смесь перемешивали при 80°C в течение 3 часов. После охлаждения твердый осадок отделили путем фильтрации и промыли CH3OH. Полученный фильтрат сконцентрировали. Полученное соединение 174 очистили обращенно-фазовой хроматографией. 1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,65-7,79 (м, 6H), 7,21 (т, 2H), 4,67 (м, 3H), 4,52 (м, 1H), 4,43 (м, 1H), 4,31 (м, 1H), 3,98 (м, 2H), 3,89 (м, 1H), 3,11 (м, 4H); МС m/z (M+H+) 451,2 (расчет для C24H23FN4O2S, 450,54).
Следуя процедуре, описанной выше для примера 6, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (300 МГц, CD3OD): δ 7,98 (д, 1H), 7,88 (д, 1H), 7,85 (д, 1H), 7,77 (м, 4H), 7,62 (м, 2H), 4,54-4,81 (м, 4H) 4,46 (м, 1H), 4,38 (м, 1H), 4,04 (м, 3H), 3,25 (м, 4H); ЖХ/МС m/z (M+H+) 501,0/503,1 (расчет для C24H22Cl2N4O2, 501,44)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,74 (м, 4H), 7,45 (м, 2Н), 7,35 (т, 1H), 7,22 (д, 1H), 4,68 (м, 3Н), 4,53 (м, 1H), 4,44 (м, 1H), 4,32 (м, 1H), 3,87-4,05 (м, 3H), 3,15 (м, 4Н); ЖХ/МС m/z (M+H+) 447,1 (расчет для C25H26N4O2S, 446,58)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,76 (д, 2H), 7,46 (д, 2H), 7,30 (дд, 1H), 7,02 (тд, 1H), 6,94 (дд, 1H), 4,68 (м, 3H), 4,55 (м, 1H), 4,44 (м, 1H), 4,33 (м, 1H), 4,01 (м, 2H), 3,92 (м, 1H), 3,14 (м, 4H); ЖХ/МС m/z (M+H+) 465,1 (расчет для C25H25FN4O2S, 464,57)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,80 (дд, 1H), 7,76 (м, 4H), 7,64 (м, 1H), 7,36 (т, 1H), 4,68 (м, 3H), 4,52 (м, 1H), 4,45 (м, 1H), 4,32 (м, 1H), 3,89-4,06 (м, 3H), 3,16 (м, 4H); ЖХ/МС m/z (M+H+) 485,1 (расчет для C24H22ClFN4O2S, 484,98)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87(д, 1H), 7,77 (д, 2H), 7,65 (д, 2H), 7,55 (м, 1H), 7,10 (м, 2H), 4,65 (м, 3H), 4,50 (м, 1H), 4,42 (м, 1H), 4,30 (м, 1H), 3,97 (м, 2H), 3,86 (м, 1H), 3,07 (м, 4H); ЖХ/МС m/z (M+H+) 469,0 (расчет для C24H22F2N4O2S, 468,53)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,75 (м, 4H), 7,39 (т, 1H), 7,22 (д, 1H), 7,18 (т, 1H), 6,97 (дд, 1H), 4,67 (м, 3H), 4,51 (м, 1H), 4,43 (м, 1H), 4,32 (м, 1H), 3,96 (м, 3H), 3,86 (с, 3H), 3,15 (м, 4H); ЖХ/МС m/z (M+H+) 463,2 (расчет для C25H26N4O3S, 462,57)
1H ЯМР (300 МГц, CD3OD): δ 7,98 (д, 1H), 7,87 (д, 1H), 7,70 (м, 4H), 7,16 (м, 2H), 6,92 (д, 1H), 6,01 (с, 2H), 4,69 (м, 3H), 4,54 (м, 1H), 4,44 (м, 1H), 4,33(м, 1H), 3,97 (м, 3H), 3,17 (м, 4H); ЖХ/МС m/z (M+H+) 477,1 (расчет для C25H24N4O4S, 476,56)
1H ЯМР (300 МГц, CD3OD): δ 7,79-8,01 (м, 11H), 7,50-7,56 (м, 2H), 4,60 (м, 1H), 4.49 (м, 1H), 4,37 (м, 1H), 4,27 (м, 1H), 4,08 (м, 4H), 3,95 (м, 1H), 3,14 (м, 4H); ЖХ/МС m/z (M+H+) 483,1 (расчет для C28H26N4O2S, 482,61)
1H ЯМР (300 МГц, CD3OD): δ 8,53 (т, 1H), 8,29 (м, 1H), 8,10 (м, 1H), 7,97 (д, 1H), 7,82-7,90 (м, 5H), 7,75 (т, 1H), 4,69 (м, 3H), 4,55 (м, 1H), 4,46 (м, 1H), 4,34 (м, 1H), 3,88-4,07 (м, 3H), 3,15 (м, 4H); ЖХ/МС m/z (M+H+) 478,2 (расчет для C24H23N5O4S, 477,55)
1H ЯМР (300 МГц, CD3OD): δ 9,14 (д, 1H), 8,80 (д, 1H), 8,24 (д, 1H), 8,13 (дд, 1H), 7,97 (д, 1H), 7,89 (м, 5H), 7,68 (м, 2H), 4,70 (м, 3H), 4,60 (м, 1H), 4,47 (м, 1H), 4,36 (м, 1H), 4,00 (м, 2H), 3,91 (м, 1H), 3,12 (м, 4H); ЖХ/МС m/z (M+H+) 484,2 (расчет для C27H25N5O2S, 483,6)
ЖХ/МС m/z (M+H+) 486,1
1H ЯМР (300 МГц, CD3OD): δ 7,94 (м, 2H), 7,80 (м, 4H), 7,70 (м, 2H), 7,45-7,53 (м, 5H), 4,66 (м, 1H), 4,52 (м, 1H), 4,44 (м, 1H), 4,31 (м, 1H), 3,95 (м, 1H), 3,84 (м, 4H), 3,10 (м, 4H); ЖХ/МС m/z (M+H+) 494,1 (расчет для C28H26F3N3O2, 493,53)
ЖХ/МС m/z (M+H+) 444,1
1H ЯМР (300 МГц, CD3OD): δ 7,73 (м, 4H), 7,48 (м, 5H), 7,36 (т, 1H), 7,19 (д, 1H), 7,14 (т, 1H), 6,94 (дд, 1H), 4,19-4,82 (м, 5H), 3,83 (м, 5H), 2,98 (м, 4H), 1,34 (д, 6H); ЖХ/МС m/z (M+H+) 484,2 (расчет для C30H33N3O3, 483,62)
ЖХ/МС m/z (M+H+) 510,1
ЖХ/МС m/z (M+H+) 445,2
ЖХ/МС m/z (M+H+) 474,1
ЖХ/МС m/z (M+H+) 484,2
ЖХ/МС m/z (M+H+) 480,1
ЖХ/МС m/z (M+H+) 525,3
1H ЯМР (300 МГц, CD3OD): δ 7,76 (м, 4H), 7,38-7,54 (м, 8H), 7,13 (м, 1H), 4,66 (м, 1H), 4,53 (м, 1H), 4.43 (м, 1H), 4,31 (м, 1H), 3,95 (м, 1H), 3,83 (м, 4H), 3,11 (м, 4H); ЖХ/МС m/z (M+H+) 444,1 (расчет для C27H26FN3O2, 443,53)
1H ЯМР (300 МГц, CD3OD): δ 7,77 (д, 2H), 7,60 (д, 2H), 7,39-7,55 (м, 9H), 4,68 (м, 1H), 4,57 (м, 1H), 4,45 (м, 1H), 4,33 (м, 1H), 3,97 (м, 1H), 3,83 (м, 4H), 3,13 (м, 4H); ЖХ/МС m/z (M+H+) 510,1 (расчет для C28H26F3N3O3, 509,53)
ЖХ/МС m/z (M+H+) 440,2
ЖХ/МС m/z (M+H+) 484,2
ЖХ/МС m/z (M+H+) 484,2
ЖХ/МС m/z (M+H+) 474,3
ЖХ/МС m/z (M+H+) 486,3
ЖХ/МС m/z (M+H+) 462,1
ЖХ/МС m/z (M+H+) 474,3
ЖХ/МС m/z (M+H+) 462,1
1H ЯМР (300 МГц, CD3OD): δ 7,73 (дд, 4H), 7,33-7,54 (м, 8H), 7,23 (дт, 1H), 4,18-4,72 (м, 4H), 3,83 (м, 5H), 3,01 (м, 4H), 2,80 (с, 6H); ЖХ/МС m/z (M+H+) 548,3 (расчет для C29H33N5O4S, 547,68)
ЖХ/МС m/z (M+H+) 477,1
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,78 (м, 4H), 7,65 (м, 2H), 7,51 (т, 1H), 7,42 (д, 1H), 4,25-4,76 (м, 6H), 4,00 (с, 2H), 3,86-4,03 (м, 3H), 3,13 (м, 4H); ЖХ/МС m/z (M+H+) 472,2 (расчет для C26H25N5O2S, 471,59)
1H ЯМР (300 МГц, CD3OD): δ 8,22 (м, 1H), 7,95-8,07 (м, 3H), 7,71-7,90 (м, 6H), 4,31-4,81 (м, 6H), 4,03 (м, 3H), 3,21-3,36 (м, 4H), 3,19 (с, 3H); ЖХ/МС m/z (M+H+) 511,2 (расчет для C25H26N4O4S2, 510,64)
1H ЯМР (300 МГц, CD3OD): δ 8,11 (д, 2H), 7,97 (д, 1H), 7,76-7,91 (м, 7H), 4,70 (м, 3H), 4,55 (м, 1H), 4,45 (м, 1H), 4,34 (м, 1H), 3,98 (м, 3H), 3,16 (м, 4H), 2,65 (с, 3H); ЖХ/МС m/z (M+H+) 475,2 (расчет для C26H26N4O3S, 474,59)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,76 (м, 4H), 7,72 (м, 1H), 7,65 (м, 1H), 7,49 (м, 2H), 4,69 (м, 3H), 4,53 (м, 1H), 4,44 (м, 1H), 4,32 (м, 1H), 3,96 (м, 3H), 3,15 (м, 4H); ЖХ/МС m/z (M+H+) 461,2 (расчет для C25H24N4O3S, 460,56)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,86 (д, 1H), 7,69 (м, 4H), 7,52 (д, 2H), 6,88 (д, 2H), 4,66 (м, 3H), 4,51 (м, 1H), 4,42 (м, 1H), 4,29 (м, 1H), 3,98 (м, 2H), 3,86 (м, 1H), 3,09 (м, 4H); ЖХ/МС m/z (M+H+) 449,2 (расчет для C24H24N4O3S, 448,55)
1H ЯМР (300 МГц, CD3OD): δ 8,03 (д, 1H), 7,97 (д, 1H), 7,92 (дд, 1H), 7,86 (д, 1H), 7,80 (м, 4H), 7,73 (д, 1H), 4,62 (м, 3H), 4,45 (м, 2H), 4,28 (м, 1H), 3,96 (м, 2H), 3,82 (м, 1H), 3,03 (м, 4H); ЖХ/МС m/z (M+H+) 535,0 (расчет для C25H22ClF3N4O2S, 534,99)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,78-7,95 (м, 9H), 4,70 (м, 3H), 4,55 (м, 1H), 4,45 (м, 1H), 4,34 (м, 1H), 3,97 (м, 3H), 3,17 (м, 4H), 2,72 (с, 6H); ЖХ/МС m/z (M+H+) 540,2 (расчет для C26H29N5O4S2, 539,68)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,88 (д, 1H), 7,71 (д, 2H), 7,69 (д, 2H), 7,26 (дд, 1H), 7,08 (дд, 1H), 4,70 (м, 3H), 4,56 (м, 1H), 4,46 (м, 1H), 4,35 (м, 1H), 3,99 (м, 3H), 3,20 (м, 4H); ЖХ/МС m/z (M+H+) 499,2 (расчет для C25H24F2N4O3S, 498,56)
1H ЯМР (300 МГц, CD3OD): δ 8,36 (д, 2H), 7,78-7,99 (м, 8H), 4,67 (м, 3H), 4,52 (м, 1H), 4,44 (м, 1H), 4,31 (м, 1H), 3,98 (м, 2H), 3,99 (м, 1H), 3,12 (м, 4H); ЖХ/МС m/z (M+H+) 478,2 (расчет для C24H23N5O4S, 477,55)
1H ЯМР (300 МГц, CD3CN): δ 10,38 (с, 1H), 7,96 (д, 1H), 7,84-7,91 (м, 2H), 7,59-7,69 (м, 5H), 7,19 (д, 1H), 4,33-4,64 (м, 4H), 4,23 (м, 2H), 3,91 (с, 3H), 3,89 (м, 1H), 3,74 (м, 2H), 3,02 (м, 4H); ЖХ/МС m/z (M+H+) 491,2 (расчет для C26H26N4O4S, 490,59)
ЖХ/МС m/z (M+H+) 476,1
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,72 (м, 4H), 7,28 (т, 1H), 7,11 (д, 1H), 7,06 (т, 1H), 6,82 (дд, 1H), 4,64 (м, 3H), 4,49 (м, 1H), 4,40 (м, 1H), 4,28 (м, 1H), 3,96 (м, 2H), 3,81 (м, 1H), 3,03 (м, 4H); ЖХ/МС m/z (M+H+) 449,2 (расчет для C24H24N4O3S, 448,55)
1H ЯМР (300 МГц, CD3OD): δ 7,98 (д, 1H), 7,88 (д, 1H), 7,76 (м, 4H), 7,55 (т, 1H), 7,45 (м, 2H), 7,28 (м, 1H), 4,73 (м, 3H), 4,60 (м, 1H), 4,47 (м, 1H), 4,38 (м, 1H), 4,03 (м, 3H), 3,26 (м, 4H), 3,00 (с, 1H); ЖХ/МС m/z (M+H+) 526,2 (расчет для C25H27N5O4S2, 525,65)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,80 (м, 1H), 7,75 (м, 4H), 7,37 (м, 2H), 7,30 (м, 1H), 4,69 (м, 3H), 4,52 (м, 1H), 4,44 (м, 1H), 4,31 (м, 1H), 3,85-4,07 (м, 3H), 3,13 (м, 4H), 1,53 (с, 9H); ЖХ/МС m/z (M+H+) 548,3 (расчет для C29H33N5O4S, 547,68)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,75 (м, 4H), 7,37 (т, 1H), 7,21 (д, 1H), 7,17 (т, 1H), 6,96 (дд, 1H), 4,67 (м, 3H), 4,52 (м, 1H), 4,43 (м, 1H), 4,30 (м, 1H), 3,76-4,04 (м, 5H), 3,10 (м, 4H), 2,08 (м, 1H), 1,06 (д, 6H); ЖХ/МС m/z (M+H+) 505,2 (расчет для C28H32N4O3S, 504,66)
ЖХ/МС m/z (M+H+) 529,2
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 8,14 (с, 1H), 7,89 (м, 1H), 7,86 (д, 1H), 7,79 (м, 4H), 7,76 (м, 1H), 7,50-7,69 (м, 2H), 6,36 (д, 1H), 4,62 (м, 3H), 4,48 (м, 1H), 4,40 (м, 1H), 4,27 (м, 1H), 4,95 (м, 2H), 3,77 (м, 1H), 3,00 (м, 4H); ЖХ/МС m/z (M+H+) 484,2 (расчет для C27H25N5O2S, 483,6)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,79 (м, 4H), 7,74 (м, 5H), 6,60 (д, 1H), 4,66 (м, 3H), 4,53 (м, 1H), 4,43 (м, 1H), 4,31 (м, 1H), 3,98 (м, 2H), 3,88 (м, 1H), 3,80 (с, 3H), 3,11 (м, 4H); ЖХ/МС m/z (M+H+) 517,2 (расчет для C28H28N4O4S, 516,62)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,22 (с, 1H), 7,74 (м, 4H), 7,69 (дд, 2H), 7,21 (т, 2H), 4,67 (м, 1H), 4,56 (м, 1H), 4,45 (м, 1H), 4,34 (м, 1H), 3,94-4,22 (м, 5H), 3,18 (м, 4H); ЖХ/МС m/z (M+H+) 451,2 (расчет для C24H23FN4O2S, 450,54)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,22 (с, 1H), 7,77 (д, 2H), 7,65 (д, 2H), 7,55 (м, 1H), 7,12 (м, 1H), 7,08 (д, 1H), 4,69 (м, 1H), 4,57 (м, 1H), 4,45 (м, 1H), 4,36 (м, 1H), 3,94-4,22 (м, 5H), 3,20 (м, 4H); ЖХ/МС m/z (M+H+) 469,1 (расчет для C24H22F2N4O2S, 468,53)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,22 (с, 1H), 7,79 (дд, 1H), 7,76 (м, 4H), 7,63 (м, 1H), 7,35 (т, 1H), 4,67 (м, 1H), 4,56 (м, 1H), 4,46 (м, 1H), 4,35 (м, 1H), 3,95-4,23 (м, 5H), 3,21 (м, 4H); ЖХ/МС m/z (M+H+) 485,1 (расчет для C24H22ClFN4O2S, 484,98)
1H ЯМР (300 МГц, CD3OD): δ 8,96 (с, 1H), 8,12 (с, 1H), 7,75 (д, 1H), 7,67 (м, 4H), 7,52 (м, 2H), 4,57 (м, 1H), 4,50 (м, 1H), 4,37 (м, 1H), 4,27 (м, 1H), 3,88-4,15 (м, 5H), 3,13 (м, 4H); ЖХ/МС m/z (M+H+) 501,1 (расчет для C24H22Cl2N4O2S, 501,44)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,23 (с, 1H), 7,94 (м, 2H), 7,80 (м, 4H), 7,70 (м, 2H), 4,67 (м, 2H), 4,45 (м, 2H), 4,01-4,29 (м, 5H), 3,30 (м, 4H); ЖХ/МС m/z (M+H+) 501,1 (расчет для C25H23F3N4O2S, 500,55)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,79 (м, 4H), 7,75 (д, 1H), 7,63 (м, 2H), 7,38 (д, 1H), 4,52-4,80 (м, 4H), 4,45 (м, 1H), 4,38 (м, 1H), 3,89-4,10 (м, 3H), 3,17 (м, 4H); ЖХ/МС m/z (M+H+) 448,0 (расчет для C24H25N5O2S, 447,56)
ЖХ/МС m/z (M+H+) 504,0
1H ЯМР (300 МГц, DМСO-d6): δ 8,21 (с, 1H), 8,10 (д, 1H), 7,97 (д, 1H), 7,89 (д, 2H), 7,79 (м, 3H), 7,48 (м, 4H), 4,62 (м, 2H), 4,40 (м, 1H), 4,30 (м, 1H), 4,10 (м, 1H), 3,86 (м, 4H), 3,55 (м, 2H), 3,06 (м, 2H); ЖХ/МС m/z (M+H+) 528,0 (расчет для C28H25ClF3N3O2, 527,98)
ЖХ/МС m/z (M+H+) 483,3
1H ЯМР (300 МГц, DМСO-d6): δ 8,10 (д, 1H), 8,06 (д, 1H), 8,00 (м, 1H), 7,75 (д, 2H), 7,70 (д, 2H), 7,57 (дт, 1H), 7,34-7,46 (м, 2H), 4,61 (м, 2H), 4,37 (м, 1H), 4,29 (м, 1H), 4,05 (м, 1H), 3,35-3,82 (м, 6H), 3,09 (м, 2H), 2,07 (с, 3H); ЖХ/МС m/z (M+H+) 490,2 (расчет для C26H27N5O3S, 489,6)
ЖХ/МС m/z (MH+) 490,2
ЖХ/МС m/z (M+H+) 511,2
1H ЯМР (300 МГц, DМСO-d6): δ 8,01-8,14 (м, 4H), 7,88 (д, 2H), 7,67-7,83 (м, 4H), 4,60 (м, 2H), 4,39 (м, 1H), 4,28 (м, 1H), 4,06 (м, 2H), 3,22-3,85 (м, 5H), 3,10 (м, 2H); ЖХ/МС m/z (M+H+) 501,1 (расчет для C25H23F3N4O2S, 500,55)
1H ЯМР (300 МГц, CD3OD): δ 7,85-7,94 (м, 2H), 7,40-7,73 (м, 10H), 4,42 (м, 1H), 4,26 (м, 2H), 4,16 (м, 1H), 3,61-3,96 (м, 5H), 2,99 (м, 4H), 2,47 (с, 3H); ЖХ/МС m/z (M+H+) 508,2 (расчет для C29H28F3N3O2, 507,56)
1H ЯМР (300 МГц, CD3OD): δ 7,85-8,01 (м, 4H), 7,54-7,72 (м, 4H), 7,45 (д, 1H), 4,69 (м, 2H), 4,44 (м, 1H), 4,29 (м, 2H), 4,20 (м, 1H), 3,99 (м, 2H), 3,90 (м, 1H), 3,10 (м, 4H), 2,49 (с, 3H); ЖХ/МС m/z (M+H+) 515,1 (расчет для C26H25F3N4O2S, 514,57)
1H ЯМР (300 МГц, CD3OD): δ 9,04 (с, 1H), 8,21 (с, 1H), 7,89 (м, 2H), 7,51-7,72 (м, 4H), 7,45 (д, 1H), 3,87-4,54 (м, 9H) 3,14 (м, 4H), 2,48 (с, 3H); ЖХ/МС m/z (M+H+) 515,1 (расчет для C26H25F3N4O2S, 514,57)
1H ЯМР (300 МГц, CD3OD): δ 7,98 (д, 1H), 7,88 (д, 1H), 7,54-7,77 (м, 6H), 7,36 (д, 1H), 4,64-4,80 (м, 3H), 4,59 (м,H), 4,48 (м, 1H), 4,38 (м, 1H), 3,92-4,12 (м, 3H), 3,27 (м, 4H), 2,30 (с, 3H); ЖХ/МС m/z (M+H+) 515,1 (расчет для C26H25F3N4O2S, 514,57)
1H ЯМР (300 МГц, CD3OD): δ 9,07 (с, 1H), 8,22 (с, 1H), 7,49-7,78 (м, 6H), 7,34 (д, 1H), 4,66 (м, 1H), 4,39-4,58 (м, 2H), 4,33 (м, 1H), 3,87-4,20 (м, 5H), 3,14 (м, 4H), 2,31 (с, 3H); ЖХ/МС m/z (M+H+) 515,1 (расчет для C26H25F3N4O2S, 514,57)
1H ЯМР (300 МГц, CD3OD): δ 7,44-7,75 (м, 11H), 7,34 (д, 1H), 4,64 (м, 1H), 4,34-4,55 (м, 2H), 4,29 (м, 1H), 3,66-3,97(м, 5H), 3,03 (м, 4H), 2,30 (с, 3H); ЖХ/МС m/z (M+H+) 508,2 (расчет для C29H28F3N3O2, 507,56)
1H ЯМР (300 МГц, CD3OD): δ 7,91-8,05 (м, 3H), 7,87 (д, 1H), 7,56-7,80 (м, 5H), 4,60-4,77 (м, 2H), 4,38-4,51 (м, 2H), 4,24-4,38 (м, 2H), 3,84-4,09 (м, 3H), 3,10 (м, 4H); ЖХ/МС m/z (M+H+) 519,2 (расчет для C25H22F4N4O2S, 518,54)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,20 (с, 1H), 7,95 (м, 2H), 7,55-7,80 (м, 5H), 4,38-4,51 (м, 2H), 4,25-4,38 (м, 2H), 3,86-4,19 (м, 5H), 3,08 (м, 4H); ЖХ/МС m/z (M+H+) 519,2 (расчет для C25H22F4N4O2S, 518,54)
1H ЯМР (300 МГц, CD3OD): δ 7,90-8,01 (м, 2H), 7,56-7,80 (м, 5H), 7,42-7,56 (м, 5H), 4,35-4,50 (м, 2H), 4,20-4,35 (м, 2H), 3,66-3,98 (м, 5H), 3,00 (м, 4H); ЖХ/МС m/z (M+H+) 512,1 (расчет для C28H25F4N3O2, 511,52)
1H ЯМР (300 МГц, CD3OD): δ 7,79 (д, 1H), 7,88 (д, 1H), 7,71-7,82 (м, 2H), 7,56-7,69 (м, 2H), 7,45 (д, 1H), 7,39 (д, 1H), 7,34 (дд, 1H), 4,61-4,78 (м, 3H), 4,57 (м, 1H), 4,46 (м, 1H), 4,34 (м, 1H), 3,87-4,06 (м, 3H), 3,89 (с, 3H), 3,17 (м, 4H); ЖХ/МС m/z (M+H+) 531,2 (расчет для C26H25F3N4O3S, 530,57)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,22 (с, 1H), 7,71-7,81 (м, 2H), 7,55-7,69 (м, 2H), 7,45 (д, 1H), 7,38 (с, 1H), 7,33 (дд, 3H), 4,70 (м, 1H), 4,58 (м, 1H), 4,47 (м, 1H), 4,36 (м, 1H), 3,94-4,25 (м, 5H), 3,89 (с, 3H), 3,21 (м, 4H); ЖХ/МС m/z (M+H+) 531,2 (расчет для C26H25F3N4O3S, 530,57)
1H ЯМР (300 МГц, CD3OD): δ 7,72-7,84 (м, 2H), 7,56-7,71 (м, 2H), 7,27-7,56 (м, 8H), 4,66 (м, 1H), 4,37-4,59 (м, 2H), 4,32 (м, 1H), 3,66-4,03 (м, 8H), 3,08 (м, 4H); ЖХ/МС m/z (M+H+) 524,3 (расчет для C29H28F3N3O3, 523,56)
1H ЯМР (300 МГц, CD3OD): δ 7,90-8,03 (м, 3H), 7,82-7,90 (м, 2H), 7,62-7,79 (м, 3H), 7,57 (д, 1H), 4,62-4,78 (м, 2H), 4,41-4,54 (м, 1H), 4,20-4,40 (м, 3H), 3,90-4,10 (м, 3H), 3,02-3,24 (м, 4H); ЖХ/МС m/z (M+H+) 535,0 (расчет для C25H22ClF3N4O2S, 534,99)
1H ЯМР (300 МГц, CD3OD): δ 9,05 (с, 1H), 8,20 (с, 1H), 7,90-8,02 (м, 2H), 7,85 (с, 1H), 7,63-7,81 (м, 3H), 7,56 (д, 1H), 4,40-4,54 (м, 1H), 4,17-4,38 (м, 3H), 3,85-4,17 (м, 5H), 2,98-3,15 (м, 4H); ЖХ/МС m/z (M+H+) 535,0 (расчет для C25H22ClF3N4O2S, 534,99)
1H ЯМР (300 МГц, CD3OD): δ 7,87-7,97 (м, 2H), 7,84 (д, 1H), 7,64-7,79 (м, 3H), 7,55 (д, 1H), 7,41-7,52 (м, 5H), 4,41 (дд, 1H), 4,21-4,34 (м, 2H), 4,17 (дд, 1H), 3,65-3,99 (м, 5H), 2,94 (м, 4H); ЖХ/МС m/z (M+H+) 528,2 (расчет для C28H25ClF3N3O2, 527,98)
1H ЯМР (300 МГц, CD3OD): δ 9,05 (с, 1H), 8,19 (д, 1H), 7,75 (дд, 1H), 7,55-7,66 (м, 2H), 7,51 (дд, 1H), 7,27-7,45 (м, 2H), 4,42 (дд, 1H), 4,21-4,34 (м, 2H), 3,95-4,21 (м, 5H), 3,88 (м, 1H), 2,94-3,15 (м, 4H), 2,46 (с, 3H); ЖХ/МС m/z (M+H+) 499,0 (расчет для C25H24ClFN4O2S, 499,01)
1H ЯМР (300 МГц, CD3OD): δ 9,05 (с, 1H), 8,19 (д, 1H), 7,98 (д, 1H), 7,88 (дд, 1H), 7,71 (д, 1H), 7,63 (м, 1H), 7,57 (дд, 1H), 7,45 (д, 1H), 4,44 (дд, 1H), 4,23-4,35 (м, 2H), 3,85-4,23 (м, 6H), 2,96-3,19 (м, 4H), 2,48 (с, 3H); ЖХ/МС m/z (M+H+) 549,2 (расчет для C26H24ClF3N4O2S, 549,02)
1H ЯМР (300 МГц, CD3OD): δ 7,75 (дд, 1H), 7,28-7,65 (м, 10H), 4,38 (дд, 1H), 4,16-4,29 (м, 2H), 4,10(м, 1H), 3,60-3,95 (м, 5H), 2,91 (м, 4H), 2,45 (с, 3H); ЖХ/МС m/z (M+H+) 492,1 (расчет для C28H27ClFN3O2, 492,00)
1H ЯМР (300 МГц, CD3OD): δ 7,97 (м, 1H), 7,87 (дд, 1H), 7,71 (д, 1H), 7,62 (м, 1H), 7,56 (м, 1H), 7,38-7,52 (м, 6H), 4,39 (дд, 1H), 4,16-4,28 (м, 2H), 4,11 (м, 1H), 3,63-3,93 (м, 5H), 2,91 (м, 4H), 2,47 (с, 3H); ЖХ/МС m/z (M+H+) 542,1 (расчет для C29H27ClF3N3O2, 542,01)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,20 (с, 1H), 7,49-7,67 (м, 2H), 7,44 (дд, 1H), 7,20-7,37 (м, 3H), 4,63 (м, 1H), 4,37-4,56 (м, 2H), 4,31 (м, 1H), 3,84-4,19 (м, 5H), 3,12 (м, 4H), 2,30(с, 3H); ЖХ/МС m/z (M+H+) 499,0 (расчет для C25H24ClFN4O2S, 499,01)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,20 (с, 1H), 7,66-7,76 (м, 2H), 7,51-7,65 (м, 3H), 7,36 (д, 1H), 4,63 (м, 1H), 4,37-4,56 (м, 2H), 4,29 (м, 1H), 3,84-4,21 (м, 5H), 3,09 (м, 4H), 2,30(с, 3H); ЖХ/МС m/z (M+H+) 549,2 (расчет для C26H24ClF3N4O2S, 549,02)
1H ЯМР (300 МГц, CD3OD): δ 7,59 (м, 1H), 7,40-7,57 (м, 7H), 7,23-7,39 (м, 3H), 4,65 (м, 1H), 4,37-4,58 (м, 2H), 4,32 (м, 1H), 3,67-4,05 (м, 5H), 3,11 (м, 4H), 2,30 (с, 3H); ЖХ/МС m/z (M+H+) 492,1 (расчет для C28H27ClFN3O2, 492,00)
1H ЯМР (300 МГц, CD3OD): δ 7,70-7,80 (м, 3H), 7,42-7,68 (м, 7H), 7,35 (д, 1H), 4,63 (м, 1H), 4,34-4,55 (м, 2H), 4,28 (м, 1H), 3,67-3,98 (м, 5H), 3,02 (м, 4H), 2,30 (с, 3H); ЖХ/МС m/z (M+H+) 542,1 (расчет для C29H27ClF3N3O2, 542,01)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,20 (с, 1H), 7,61 (д, 1H), 7,20-7,50 (м, 5H), 4,67 (м, 1H), 4,55 (м, 1H), 4,43 (м, 1H), 4,31 (м, 1H), 3,90-4,25 (м, 5H), 3,90 (с, 3H), 3,11 (м, 4H); ЖХ/МС m/z (M+H+) 515,1 (расчет для C25H24ClFN4O3S, 515,01)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,17 (с, 1H), 7,88 (с, 1H), 7,74 (дд, 1H), 7,66 (д, 1H), 7,45 (д, 1H), 7,38 (м, 1H), 7,33 (дд, 1H), 4,65 (м, 1H), 4,33-4,56 (м, 2H), 4,26 (м, 1H), 3,89-4,12 (м, 5H), 3,89 (с, 3H), 2,97 (м, 4H); ЖХ/МС m/z (M+H+) 565,0 (расчет для C26H24ClF3N4O3S, 565,02)
1H ЯМР (300 МГц, CD3OD): δ 7,61 (дд, 1H), 7,38-7,57 (м, 7H), 7,35 (д, 1H), 7,23-7,33 (м, 2H), 4,65 (м, 1H) 4,36-4,57 (м, 2H), 4,30 (м, 1H), 3,88 (с, 3H), 3,67-3,97 (м, 5H), 3,05 (м, 4H); ЖХ/МС m/z (M+H+) 508,0 (расчет для C28H27ClFN3O3, 508,00)
1H ЯМР (300 МГц, CD3OD): δ 7,88 (д, 1H), 7,74 (дд, 1H), 7,66 (д, 1H), 7,42-7,57 (м, 6H), 7,38 (м, 1H), 7,32 (дд, 1H), 4,58-4,69 (м, 1H), 4,36-4,58 (м, 2H), 4,20- 4,33 (м, 1H), 3,89 (с, 3H), 3,60-4,04 (м, 5H), 3,03 (м, 4H); ЖХ/МС m/z (M+H+) 558,2 (расчет для C29H27ClF3N3O3, 558,01)
1H ЯМР (300 МГц, CD3OD): δ 9,05 (с, 1H), 8,18 (с, 1H), 7,77-7,83 (м, 2H), 7,68 (дд, 1H), 7,58-7,67 (м, 1H), 7,53 (д, 1H), 7,36 (т, 1H), 4,42 (дд, 1H), 4,22- 4,35 (м, 2H), 4,18 (дд, 1H), 3,80-4,13 (м, 5H), 2,90-3,11 (м, 4H); ЖХ/МС m/z (M+H+) 519,0 (расчет для C24H21Cl2FN4O2S, 519,43)
1H ЯМР (300 МГц, CD3OD): δ 9,05 (с, 1H), 8,18 (с, 1H), 8,01 (м, 1H), 7,81-7,98 (м, 2H), 7,74 (д, 2H), 7,56 (д, 1H), 4,36-4,49 (дд, 1H), 4,22- 4,35 (м, 2H), 4,19 (дд, 1H), 3,80-4,13 (м, 5H), 2,90-3,11 (м, 4H); ЖХ/МС m/z (M+H+) 569,0 (расчет для C25H21Cl2F3N4O2S, 569,44)
1H ЯМР (300 МГц, CD3OD): δ 7,77-7,84 (м, 2H), 7,58-7,71 (м, 2H), 7,42-7,57 (м, 6H), 7,36 (т, 1H), 4,42 (дд, 1H) 4,13-4,34 (м, 3H), 3,62-4,01 (м, 5H), 2,98 (м, 4H); ЖХ/МС m/z (M+H+) 512,1 (расчет для C27H24Cl2FN3O2, 512,42)
1H ЯМР (300 МГц, CD3OD): δ 8,01 (д, 1H), 7,90 (дд, 1H), 7,85 (д, 1H), 7,74 (д, 2H), 7,56 (д, 1H), 7,41-7,53 (м, 5H), 4,43 (дд, 1H), 4,14-4,35 (м, 3H), 3,63-4,04 (м, 5H), 2,99 (м, 4H); ЖХ/МС m/z (M+H+) 562,0 (расчет для C28H24Cl2F3N3O2, 562,42)
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,22 (с, 1H), 7,30-7,71 (м, 8H), 3,92-4,57 (м, 9H) 3,11-3,29 (м, 4H), 2,46(с, 3H); ЖХ/МС m/z (M+H+) 447,1 (расчет для C25H26N4O2S, 446,58)
МС m/z (M+H+) 518,9
МС m/z (M+H+) 434,9
Пример 7
A. 2,2,2-Трифтор-1-[4-(тиазол-2-карбонил)-пиперазин-1-ил]-этанон, 7a. К раствору соединения 1d (5 г, 0,027 моль) в DMF (50 мл) и DIPEA (19,5 мл, 0,11 моль) было добавлено соединение 5c (3,3 г, 0,0255 моль) и HATU (12,6 г, 0,033 моль). Реакция протекала при перемешивании в течение 4 часов, затем реакционную смесь вылили в воду и экстрагировали с помощью EtOAc. Органическую часть промыли водой и солевым раствором и высушили над MgSO4. Растворитель выпарили в вакууме. Остаток пропустили через силикагелевую колонку (30-10%: EtOAc-гептан) для получения соединения 7a (3,8 г). МС m/z (M+H+) 294,1.
B. Пиперазин-1-ил-тиазол-2-ил-метанон, 7b. Раствор соединения 7a (3,8 г, 0,013 моль) и K2CO3 (3,5 г, 0,026 моль) в MeOH (40 мл) и воде (10 мл) перемешивали в течение 4 часов. Твердый осадок отделили путем фильтрации, растворитель выпарили in vacuo и получили соединение 7b (6,12 г). МС m/z (M+H+) 198,1.
С. 3-[4-(Тиазол-2-карбонил)-пиперазин-1-ил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир, 7c. Раствор соединения 7b (6,1 г, 0,031 моль) и соединения 4a (5,1 г, 0,03 моль) в MeOH (30 мл) перемешивали в течение 15 минут. Затем к раствору добавили декаборан (1 г, 0,008 моль). Реакция протекала при перемешивании в течение 18 часов. Растворитель выпарили в вакууме. Остаток использовали в следующей стадии без дополнительной очистки. МС m/z (M+H+) 353,1.
D. (4-Азетидин-3-ил-пиперазин-1-ил)-тиазол-2-ил-метанон, 5e. К раствору соединения 7c в CH2Cl2 (100 мл) была добавлена TFA (30 мл). Реакционную смесь перемешивали в течение 3,5 ч, растворитель выпарили in vacuo. Остаток очистили препаративной обращенно-фазовой ВЭЖХ и получили соединение 5e (5,15 г). МС m/z (M+H+) 253,1.
E. 1-{1-[3-(4-Хлорфенил)пропаноил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 269. К раствору соединения 5e (150 мг, 0,52 ммоль) в DMF (5 мл) и DIPEA (0,40 мл, 2,2 ммоль) добавили соединение 7d (125 мг, 0,067 ммоль) и HATU (0,25 г, 0,067 ммоль). Реакция протекала при перемешивании в течение 4 часов, затем реакционную смесь вылили в воду и экстрагировали с использованием EtOAc. Объединенные экстракты концентрировали in vacuo. Полученный остаток очистили обращенно-фазовой ВЭЖХ и получили соединение 269 (20,2 мг). ЖХ/МС m/z (M+H+) 419,15 (расчет для C20H23ClN4O2S, 418,95).
Следуя процедуре, описанной выше для примера 7, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
ЖХ/МС m/z (M+2H+) 465,05 (расчет для C20H23BrN4O2S, 463,40)
ЖХ/МС m/z (M+H+) 453,15 (расчет для C21H23F3N4O2S, 452,50)
ЖХ/МС m/z (M+H+) 419,17 (расчет для C20H23ClN4O2S, 418,95)
1H ЯМР (300 МГц, MeOD): δ 8,0 (д, 1H), 7,9 (д, 2H), 4,7 (шм, 2H), 4,4 (м, 2H), 4,3-4,1 (м, 2H), 4,0 (шм, 2H), 3,25 (м, 5H), 3,0 (м, 2H), 2,5 (м, 2H)
ЖХ/МС m/z (M+H+) 419,16 (расчет для C20H23ClN4O2S, 418,95)
1H ЯМР (300 МГц, MeOD): δ 8 (д, 1H), 7,9 (д, 1H), 7,4 (ар, 2H), 7,2 (м, 1H), 4,75 (м, 2H), 4,5-4,1 (м, 5H), 4,0 (м, 3H), 3,2 (м, 5H), 2,4 (м, 3H)
ЖХ/МС m/z (M+2H+) 455,10 (расчет для C20H22Cl2N4O2S, 453,39)
ЖХ/МС m/z (M+H+) 421,19 (расчет для C20H22F2N4O2S, 420,48)
ЖХ/МС m/z (M+H+) 399,23 (расчет для C21H26N4O2S, 398,53)
ЖХ/МС m/z (M+H+) 415,23 (расчет для C21H26N4O3S, 414,53)
ЖХ/МС m/z (M+H+) 521,14 (расчет для C22H22F6N4O2S, 520,50)
ЖХ/МС m/z (M+H+) 435,22 (расчет для C24H26N4O2S, 434,56)
ЖХ/МС m/z (M+H+) 477,20 (расчет для C28H26N4O3S, 476,60)
1H ЯМР (300 МГц, MeOD) д 8,0 (ар, 1H), 7,9 (ар, 1H), 7,4 (м, 2H), 7,2 (м, 1H), 4,4 (дд, 1H), 4,3-4,2 (м, 2H), 4,1 (м, 1H), 3,9 (м, 1H), 3,3 (м, 3H), 3,2 (м, 4H), 3,0 (шс, 1H), 2,9 (м, 2H), 2,5 (м, 2H)
ЖХ/МС m/z (M+2H+) 455,10 (расчет для C20H22Cl2N4O2S, 453,39)
1H ЯМР (300 МГц, MeOD): δ 7,9 (ар, 1H), 7,7 (ар, 1H), 7,13 (ар, 1H), 7,0 (ар, 1H), 6,9 (ар, 1H), 4,2-4,1 (м, 2H), 4,1-4,0 (м, 1H), 3,9, (шс, 1H), 3,8 (м, 1H), 3,2 (м, 2H), 3,11 (м, 4H), 2,7 (т, 2H), 2,3 (т, 2H), 1,5 (с, 4H), 1,1 (дд, 12H).
ЖХ/МС m/z (M+H+) 495,24 (расчет для C28H38N4O2S, 494,70)
ЖХ/МС m/z (M+H+) 483,18 (расчет для C21H21F3N4O2S2, 482,55)
ЖХ/МС m/z (M+H+) 421,12 (расчет для C19H21ClN4O3S, 420,92)
ЖХ/МС m/z (M+H+) 421,12 (расчет для C19H21ClN4O3S, 420,92)
ЖХ/МС m/z (M+2H+) 465,07 (расчет для C20H23BrN4O2S, 463,40)
ЖХ/МС m/z (M+H+) 479,29 (расчет для C25H30N6O2S, 478,62)
ЖХ/МС m/z (M+2H+) 457,13 (расчет для C19H20Cl2N4O3S, 455,37)
ЖХ/МС m/z (M+H+) 471,16 (расчет для C20H21F3N4O4S, 470,47)
1H ЯМР (300 МГц, MeOD) д 8,0 (д, 1H); 7,9 (д, 1H); 7,4 (м, 4H); 4,7 (шс, 2H), 4,4-4,1 (м, 3H), 4,1-3,9 (м, 3H), 3,8 (м, 1H), 3,1 (м, 3H), 3,0 (т, 2H), 2,5 (т, 2H), 2,1 м, 1H), 0,5 (м, 4H)
ЖХ/МС m/z (M+H+) 504,20 (расчет для C23H29N5O4S2, 503,65)
1H ЯМР (300 МГц, MeOD): δ 8,0 (д, 1H), 7,9 (д, 1H), 7,5 (м, 4H), 4,4 (шм, 2H), 4,25-4,0 (м, 4H), 3,8 (м, 1H), 3,4 (д, 2H), 3,2 (с, м, 3H), 3,1 (шс, 3H), 3,0 (т, 2H), 2,5 (т, 2H), 1,7 (м, 5H), 1,1 (м, 5H)
ЖХ/МС m/z (M+H+) 510,32 (расчет для C28H39N5O2S, 509,72)
ЖХ/МС m/z (M+H+) 471,18 (расчет для C20H21F3N4O2S2, 470,54)
ЖХ/МС m/z (M+H+) 413,20 (расчет для C20H20N4O2S2, 412,54)
ЖХ/МС m/z (M+H+) 429,27 (расчет для C22H28N4O3S, 428,56)
ЖХ/МС m/z (M+H+) 417,0 (расчет для C20H21ClN4O2S, 416,93)
ЖХ/МС m/z (M+H+) 462,9 (расчет для C20H21BrN4O2S, 461,38)
ЖХ/МС m/z (M+H+) 433,29 (расчет для C24H24N4O2S, 432,55)
Пример 8
A. Бензиловый эфир 4-(1-бензгидрил-азетидин-3-ил)-пиперазин-1-карбоновой кислоты, 8b. К раствору соединения 8a (1,4 г, 6,3 ммоль) и соединения 1e (2 г, 6,3 ммоль) в CH3CN (30 мл) добавили DIPEA (1,5 мл, 8,1 ммоль) при комнатной температуре. Смесь нагревали в колбе с обратным холодильником в течение 18 часов. Растворитель удалили при пониженном давлении. Остаток разделили на водную фазу и фазу, растворимую в CHCl3. Органический слой высушили над K2CO3, профильтровали и сконцентрировали для получения неочищенного соединения 8b (2,65 г). МС m/z (M+H+) 442.
B. Бензиловый эфир 4-азетидин-3-ил-пиперазин-1-карбоновой кислоты, 8c. К раствору соединения 8b (3,4 г, 7,7 ммоль) в CH2Cl2 добавили 1-хлорэтилхлороформат (2,5 мл, 23,1 ммоль) при 0°C в атмосфере N2. Реакционную смесь извлекли из сосуда со льдом и перемешивали в течение 2 часов. Органическую фазу сконцентрировали при пониженном давлении и к полученному остатку добавили MeOH. Реакционную смесь нагрели в колбе с обратным холодильником в течение 2 часов и удалили растворитель при пониженном давлении. Остаток разделили на фазу, растворимую в хлороформе и фазу, растворимую в водной HCl (1N). Водный слой отделили, привели к основности с помощью водного NaOH (3N) и экстрагировали с помощью хлороформа. Затем органический слой высушили (K2CO3), профильтровали и сконцентрировали для получения соединения 8c (2,65 г). МС m/z (M+H+) 276.
С. Бензиловый эфир 4-[1-(дифенил-4-карбонил)-азетидин-3-ил]-пиперазин-1-карбоновой кислоты, 8e. К раствору соединения 8c (2,6 г, 9,4 ммоль), соединения 8d (1,87 г, 9,4 ммоль) и DIPEA (2,43 г, 18,9 ммоль) в ацетонитриле добавили HBTU (4,6 г, 12,3 ммоль). Реакционную смесь перемешивали в течение 18 часов и за это время растворитель удалили при пониженном давлении, а сырой продукт очистили методом обращенно-фазовой ВЭЖХ. Путем лиофилизации получили соединение 8e (1,74 г). МС m/z (M+H+) 456,2.
D. Дифенил-4-ил-(3-пиперазин-1-ил-азетидин-1-ил)-метанон, 8f. Смесь соединения 8e (1,7 г, 2,9 ммоль) и 10% палладиевой черни (300 мг) была гидрирована (0,34 МПа (50 фунтов на кв.дюйм) газообразного водорода) с использованием прибора Parr в течение 18 ч. Катализатор удалили путем фильтрования, растворитель концентрировали при пониженном давлении для получения неочищенного соединения 8f (1,5 г). МС m/z (M+H+) 322.
E. 1-[1-(Бифенил-4-ил-карбонил)азетидин-3-ил]-4-[(4-фторфенил)-карбонил]пиперазин, соединение 299 . К раствору соединения 8f (100 мг, 0,3 ммоль), соединения 8g (44 мг, 0,31 ммоль) и DIPEA (80 мг, 0,6 ммоль) в диметилформамиде добавили HBTU (141 мг, 0,37 ммоль). После перемешивания в течение 18 часов реакционную смесь очистили препаративной обращенно-фазовой ВЭЖХ для получения соединения 299. 1H ЯМР (400 МГц, MeOD): δ 7,93-8,03 (м, 1H), 7,61-7,71 (м, 4H), 7,54-7,61 (м, 2H), 7,43-7,50 (м, 2H), 7,35-7,43 (м, 2H), 7,27-7,35 (м, 1H), 7,07-7,20 (м, 2H), 4,55-4,67 (м, 1H), 4,43-4,53 (м, 1H), 4,32-4,43 (м, 1H), 4,19-4,32 (м, 1H), 3,89-4,00 (м, 1H), 3,66-3,89 (м, 4H), 3,08 (шс, 4H); МС m/z (M+H+) 444,2 (расчет для C27H26FN3O2, 443,53).
Следуя процедуре, описанной выше для примера 8, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 444,2 (расчет для C27H26FN3O2, 443,53)
МС m/z (M+H+) 432,1 (расчет для C25H25N3O2S, 431,56)
МС m/z (M+2H+) 416,2 (расчет для C25H26N4O2, 414,51)
МС m/z (M+H+) 390,23 (расчет для C24H27N3O2, 389,5)
МС m/z (M+H+) 444,2 (расчет для C27H26FN3O2, 443,53)
МС m/z (M+H+) 417,2 (расчет для C24H24N4O3, 416,48)
МС m/z (M+H+) 434,1 (расчет для C23H23N5O2S, 433,54)
МС m/z (M+H+) 417,2 (расчет для C24H24N4O3, 416,48)
МС m/z (M+H+) 418,2 (расчет для C23H23N5O3, 417,47)
МС m/z (M+H+) 457,2 (расчет для C26H24N4O2S, 456,57)
1H ЯМР (400 МГц, MeOD): δ 8,44 (с, 1H), 7,65 (с, 4H), 7,53-7,58 (м, 2H), 7,47 (д, J=1,71 Гц, 1H), 7,34-7,40 (м, 2H), 7,26-7,32 (м, 1H), 4,49-4,60 (м, 1H), 4,37-4,49 (м, 1H), 4,27-4,37 (м, 1H), 4,15-4,27 (м, 1H), 3,72-3,88 (м, 5H), 2,92-3,02 (м, 4H);
МС m/z (M+H+) 433,2 (расчет для C24H24N4O2S, 432,55)
1H ЯМР (400 МГц, MeOD): δ 7,66 (с, 4H), 7,56-7,59 (м, 1H), 7,54-7,56 (м, 1H), 7,35-7,41 (м, 2H), 7,26-7,33 (м, 1H), 7,08-7,15 (м, 1H), 6,64-6,75 (м, 1H), 6,24-6,31 (м, 1H), 4,54-4,64 (м, 1H), 4,43-4,51 (м, 1H), 4,32-4,41 (м, 1H), 4,20-4,28 (м, 1H), 3,85-3,97 (м, 5H), 3,06 (шс, 4H);
МС m/z (M+H+) 415,2 (расчет для C25H26N4O2, 414,51)
1H ЯМР (400 МГц, MeOD): δ 7,66 (с, 4H), 7,54-7,59 (м, 2H), 7,38 (д, J=7,58 Гц, 2H), 7,26-7,33 (м, 1H), 7,05 (д, J=3,67 Гц, 1H), 6,42 (д, J=3,42 Гц, 1H), 4,50-4,63 (м, 1H), 4,40-4,48 (м, 1H), 4,28-4,39 (м, 1H), 4,17-4,28 (м, 1H), 3,87-3,97 (м, 4H), 3,78-3,87 (м, 1H), 2,97-3,07 (м, 4H);
МС m/z (M+H+) 450,1 (расчет для C25H24ClN3O3, 449,94)
МС m/z (M+H+) 490,2
МС m/z (M+H+) 428,0
МС m/z (M+H+) 418,2
МС m/z (M+H+) 431,3
МС m/z (M+H+) 485,0
МС m/z (M+H+) 417,1
МС m/z (M+H+) 417,0
МС m/z (M+H+) 417,0
МС m/z (M+H+) 426,0
МС m/z (M+H+) 416,2
МС m/z (M+H+) 416,2
МС m/z (M+H+) 404,2
МС m/z (M+H+) 465,3
МС m/z (M+H+) 481,0
МС m/z (M+H+) 483,1
МС m/z (M+H+) 499,4
МС m/z (M+H+) 485,0
МС m/z (M+H+) 560,0/562,0
МС m/z (M+H+) 576,0/578,0
МС m/z (M+H+) 518,2
МС m/z (M+H+) 485,1
МС m/z (M+H+) 519,2
МС m/z (M+H+) 485,2
МС m/z (M+H+) 535,2
МС m/z (M+H+) 485,1
МС m/z (M+H+) 494,2
МС m/z (M+H+) 458,3
МС m/z (M+H+) 516,3
МС m/z (M+H+) 523,2
МС m/z (M+H+) 501,2
МС m/z (M+H+) 507,1
МС m/z (M+H+) 474,1
МС m/z (M+H+) 488,1
МС m/z (M+H+) 507,1
МС m/z (M+H+) 474,1
МС m/z (M+H+) 474,1
Пример 9
A. Трет-бутиловый эфир 4-(тиазол-2-карбонил)-пиперазин-1-карбоновой кислоты, 9a. К раствору соединения 5c (2,0 г, 15,50 ммоль), соединения 1a (3,2 г, 17,20 ммоль) и Et3N (8,6 мл, 61,2 ммоль) в CH2Cl2 (100 мл) добавили HATU (6,5 г, 17,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Затем смесь разбавили CH2Cl2 и промыли водой NaHCO3. Органическую фазу высушили над Na2SO4, профильтровали и сконцентрировали. Путем очистки колоночной флеш-хроматографией (силикагель, 30% EtOAc/гептан) получили соединение 9a (4,0 г).
B. Соль пиперазин-1-ил-тиазол-2-ил-метанон трифторуксусной кислоты, 9b. К раствору соединения 9a (3,5 г, 11,78 ммоль) в CH2Cl2 (40 мл) добавили TFA (10 мл). Реакционную смесь перемешивали 2 часа при комнатной температуре. Затем смесь сконцентрировали для получения соединения 9b, которое использовали для следующей реакции без дополнительной очистки.
С. 3-[4-(Тиазол-2-карбонил)-пиперазин-1-ил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир, 7c. К раствору соединения 9b (11,78 ммоль) и соединения 4a (2,2 г, 12,87 ммоль) в 1,2-DCE (35 мл) и уксусной кислоты (2 мл) добавили Na(OAc)3BH (2,75 г, 12,97 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавили водный NaHCO3. Полученную смесь экстрагировали с помощью CH2Cl2. Органический слой высушили над Na2SO4 и сконцентрировали. Путем очистки с использованием колоночной флеш-хроматографии (силикагель, 80% EtOAc/гептан) получили соединение 7c (3,78 г).
D. (4-Азетидин-3-ил-пиперазин-1-ил)-тиазол-2-ил-метанон, 5e. К раствору соединения 7c (1,2 г, 3,41 ммоль) в CH2Cl2 (12 мл) добавили TFA (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4,5 часов, затем смесь сконцентрировали, а к полученному остатку добавили воду NaHCO3. Смесь экстрагировали с помощью 2% MeOH/CH2Cl2 (3x). Органический раствор высушили над Na2SO4 и сконцентрировали для получения соединения 5e, которое использовали в следующей реакции без дополнительной очистки.
E. 1-{1-[(5-Бромнафталин-2-ил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 313. К раствору соединения 5e (63 мг, 0,25 ммоль), соединения 9c (95 мг, 0,38 ммоль) и Et3N (0,14 мл, 1,01 ммоль) в CH2Cl2 (3 мл) добавили HATU (143 мг, 0,38 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, затем разбавили диэтиловым эфиром и промыли водным NaHCO3 и водным NaCl. Органический слой высушили над Na2SO4 и сконцентрировали. Путем очистки с использованием колоночной флеш-хроматографии (силикагель, 3% MeOH/CH2Cl2) получили соединение 313. 1H ЯМР (400 МГц, CD3OD): δ 8,28 (д, J=9 Гц, 1H), 8,14 (д, J=1,6 Гц, 1H), 7,88-7,85 (м, 3H), 7,81 (д, J=8,4 Гц, 1H), 7,54 (д, J=3 Гц, 1H), 7,39 (т, J=7,8 Гц, 1H), 4,53 (шс, 1H), 4,45 (шс, 1H), 4,34 (м, 2H), 4,26 (м, 1H), 4,16 (м, 1H), 3,95-3,80 (м, 2H), 3,28 (м, 1H), 2,60-2,40 (м, 4H). МС m/z (M+H+) 485/487.
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CD3OD): δ 8,40 (д, J=7,8 Гц, 1H), 7,95 (с, 1H), 7,88 (д, J=3 Гц, 1H), 7,83-7,80 (м, 2H), 7,69 (д, J=8 Гц, 1H), 7,55 (д, J=3 Гц, 1H), 4,53 (м, 1H), 4,45-4,25 (м, 4H), 4,16 (м, 1H), 3,95-3,80 (м, 2H), 3,27 (м, 1H), 2,60-2,40 (м, 4H).
МС m/z (M+H+) 542
МС m/z (M+H+) 475/477
1H ЯМР (400 МГц, CD3OD): δ 8,13 (с, 1H), 7,98 (д, J=8,6 Гц, 1H), 7,89 (д, J=3 Гц, 1H), 7,75 (с, 1H), 7,65 (д, J=8,6 Гц, 1H), 7,56 (д, J=3 Гц, 1H), 4,62-4,40 (м, 4H), 4,31 (м, 1H), 4,16 (м, 1H), 3,35 (м, 1H), 2,60-2,40 (м, 4H).
МС m/z (M+H+) 481
1H ЯМР (400 МГц, CD3OD): δ 8,26 (м, 2H), 8,00 (с, 1H), 7,88 (д, J=3 Гц, 1H), 7,76 (д, J=8,6 Гц, 1H), 7,63 (д, J=8,6 Гц, 1H), 7,60-7,52 (м, 4H), 4,60-4,40 (м, 2H), 4,38 (м,1H), 4,28 (м, 2H), 4,15 (м, 1H), 3,86 (м, 2H), 3,27 (м, 1H), 2,50 (м, 4H).
МС m/z (M+H+) 474
1H ЯМР (400 МГц, CD3OD): δ 8,28 (м, 2H), 7,92 (с, 1H), 7,88 (д, J=3,2 Гц, 1H), 7,79 (д, J=8 Гц, 1H), 7,66 (д, J=8 Гц, 1H), 4,60-4,20 (м, 5H), 4,15 (м, 1H), 3,86 (м, 2H), 3,28 (м, 1H), 2,50 (м, 4H).
МС m/z (M+H+) 474
1 H ЯМР (CDCl3): δ 7,44-7,39 (м, 7H), 7,13 (д, J=0,02, 1H), 4,59 (с, 2H), 4,27 (м, 2H), 4,15 (м, 1H), 4,06 (м, 1H), 3,90 (м, 1H), 3,74 (м, 1H), 3,65 (м, 2H), 3,46 (м, 2H), 3,22 (м, 1H), 2,85 (м, 2H), 2,27-2,23 (м, 4H), 1,49 (с, 9H)
МС m/z 405,0 (M-Boc), 449,0 (M-Bu-t), 527 (M+Na), 1009,2 (2M+H)
МС m/z (M+H+) 511,8, 513,8, 514,8
1 H ЯМР (CDCl3): δ 7,42-7,38 (м, 5H), 7,33-7,29 (м, 3H), 7,26 (м, 3H), 6,78 (д, J=0,01, 1H), 4,41 (м, 1H), 4,24 (м, 2H), 4,13 (с, 2H), 4,03 (м, 1H), 3,92-3,74 (м, 2H), 3,47 (м, 2H), 3,24 (м, 1H), 2,42-2,29 (м, 4H)
МС m/z (M+H+) 446,6
МС m/z (M+H+) 432,4; 434,4
МС m/z (M+H+) 493,0
МС m/z (M+H+) 615,0
МС m/z (M+H+) 465,1
МС m/z (M+H+) 491,1
МС m/z (M+H+) 499,2
МС m/z (M+H+) 479,1
МС m/z (M+H+) 460,0
МС m/z (M+H+) 497,1
МС m/z (M+H+) 450,1
МС m/z (M+H+) 462,3
МС m/z (M+H+) 462,3
МС m/z (M+H+) 486,1
МС m/z (M+H+) 412,1
1H ЯМР (400 МГц, CD3OD): δ 7,99 (д, 1H), 7,89 (д, 1H), 7,57 (с, 1H), 7,52 (д, J=8,1 Гц, 1H), 7,03 (д, J=8,1 Гц, 1H), 4,28-4,90 (м, 6H), 4,01-4,22 (м, 3H), 3,73 (т, J=8,2 Гц, 2H), 3,37 (шс, 4H), 3,19 (т, J=8,2 Гц, 2H)
МС m/z (M+H+) 398,1
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,2 Гц, 1H), 7,50-7,57 (м, 2H), 7,42-7,48 (м, 2H), 7,38 (д, J=3,2 Гц, 1H), 7,33 (д, J=7,3 Гц, 1H), 7,18-7,26 (м, 3H), 6,99 (д, J=3,2 Гц, 1H), 4,05-4,63 (м, 6H), 3,75-3,99 (м, 2H), 3,22-3,32 (м, 1H), 2,37-2,62 (м, 4H)
МС m/z (M+H+) 490,1
МС m/z (M+) 440,0, (M+2+) 442,0
MС m/z 482 (M+H+)
1H ЯМР (CDCl3, 400 МГц): δ 7,98 (с, 1H), 7,88 (д, J=3,1 Гц, 1H), 7,47-7,58 (м, 2H), 7,38-7,47 (м, 3H), 7,16-7,26 (м, 2H), 7,12 (с, 1H), 4,47-4,64 (м, 1H), 4,38 (шс, 4H), 4,07-4,19 (м, 1H), 3,74-3,97 (м, 2H), 3,17-3,33 (м, 1H), 2,50 (т, J=4,9 Гц, 4H), 2,39 (с, 3H).
MС m/z 504 (M+H+)
MС m/z 508 (M+H+)
MС m/z 486 (M+H+)
MС m/z 486 (M+H+)
MС m/z 526 (M+H+)
1H ЯМР (CDCl3, 400 МГц): δ 8,27 (с, 1H), 8,12 (с, 1H), 7,88 (шс, 1H), 7,67-7,85 (м, 2H), 7,42-7,67 (м, 3H), 7,36 (кв, J=8,7 Гц, 1H), 4,49-4,62 (м, 1H), 4,20-4,48 (м, 4H), 4,05-4,20 (м, 1H), 3,84 (шс, 2H), 3,20-3,38 (м, 1H), 2,51 (м, 4H).
MС m/z 509 (M+H+)
MС m/z 509 (M+H+)
MС m/z 526 (M+H+)
MС m/z 510 (M+H+)
MС m/z 510 (M+H+)
MС m/z 504 (M+H+)
MС m/z 556 (M+H+)
MС m/z 556 (M+H+)
MС m/z 508 (M+H+)
MС m/z 570 (M+H+)
MС m/z 491 (M+H+)
MС m/z 523 (M+H+)
MС m/z 508 (M+H+)
MС m/z 491 (M+H+)
МС m/z (M+H+) 455; 457
МС m/z (M+H+) 468, 470
МС m/z (M+H+) 488, 490
МС m/z (M+H+) 455, 457
МС m/z (M+H+) 475, 477
МС m/z (M+H+) 490
МС m/z (M+H+) 490
МС m/z (M+H+) 490
МС m/z (M+H+) 490
МС m/z (M+H+) 474,1
МС m/z (M+H+) 452,4
МС m/z (M+H+) 459,3
МС m/z (M+H+) 272
1H ЯМР (400 МГц, CDCl3): δ 3,34-3,48 (м, 1H), 3,89 (шс, 3H), 4,08-4,66 (м, 8H), 7,55 (д, J=8,8 Гц, 1H), 7,62 (д, J=3,2 Гц, 1H), 7,66 (дд, J=8,8, 1,5 Гц, 1H), 7,89 (д, J=3,2 Гц, 1H), 8,04 (с, 1H), 8,09 (с, 2H)
МС m/z (M+H+) 397,2
1H ЯМР (400 МГц, CDCl3): δ 2,92-3,16 (м, 4H), 3,76 (т, J=5,3 Гц, 1H), 4,06 (шс, 2H), 4,39 (шс, 1H), 4,49-4,93 (м, 5H), 7,23 (д, J=3,2 Гц, 1H), 7,30-7,38 (м, 2H), 7,44-7,54 (м, 2H), 7,60 (д, J=3,2 Гц, 1H), 7,89 (д, J=3,2 Гц, 1H), 7,97 (д, J=3,2 Гц, 1H), 8,63 (с, 1H), 9,12 (с, 1H)
МС m/z (M+H+) 491,2
1H ЯМР (400 МГц, CDCl3): δ 3,75 (с, 1H), 4,11 (шс, 2H), 4,32-5,02 (м, 10H), 6,75 (д, J=3,6 Гц, 1H), 7,23 (д, J=8,9 Гц, 2H), 7,53 (д, J=3,7 Гц, 1H), 7,61 (д, J=3,2 Гц, 1H), 7,65 (м, J=9,0, 4,7 Гц, 2H), 7,89 (д, J=3,2 Гц, 1H), 8,33 (д, J=2,0 Гц, 1H), 8,60 (д, J=1,7 Гц, 1H)
МС m/z (M+H+) 491,2
1H ЯМР (400 МГц, CDCl3): δ 3,83-4,34 (м, 9H), 4,41-4,70 (м, 2H), 5,14 (д, J=5,8 Гц, 2H), 6,90 (шс, 1H), 7,28 (д, J=8,2 Гц, 2H), 7,38-7,51 (м, 2H), 7,62 (д, J=3,2 Гц, 1H), 7,65 (д, J=2,9 Гц, 1H), 7,85 (д, J=8,6 Гц, 1H), 7,90 (д, J=3,2 Гц, 1H), 7,99 (д, J=8,6 Гц, 1H)
МС m/z (M+H+) 491,2
1H ЯМР (400 МГц, CD3OD): δ 2,14 (дд, J=22,7, 10,5 Гц, 1H), 2,43 (дд, J=41,6, 11,7 Гц, 1H), 2,87-3,18 (м, 1H), 3,18-3,44 (м, 1,5H), 3,58-3,81 (м, 0,5H), 3,95-4,17 (м, 1H), 4,18-4,40 (м, 2H), 4,49 (м, 1,5H), 5,43 (д, J=26,4 Гц, 1H), 6,95 (шс, 0,5H), 7,33-7,43 (м, 1H), 7,43-7,51 (м, 2H), 7,66 (д, J=7,6 Гц, 2H), 7,70-7,80 (м, 4H), 7,88 (шс, 1H), 7,93-8,03 (м, 1H)
МС m/z (M+H+) 501,1
МС m/z (M+H+) 378
Основной: 1-[3-Хлор-5-(трифторметил)пиридин-2-ил]-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол
МС m/z (M+H+) 575,1
Дополнительный: 1-[2-Фтор-5-(трифторметил)пиридин-3-ил]-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол
МС m/z (M+H+) 559,0
МС m/z (M+H+) 474,1
Пример 9b
1-{1-[(6-Бромнафталин-2-ил)карбонил]азетидин-3-ил}-4-(фенилкарбонил)пиперазин, соединение 118. Названное соединение получили способом, аналогичным способу получения соединения 313 в примере 9, за исключением того, что в качестве исходного материала использовался готовый N-бензоилпиперазин (вместо промежуточного соединения 9b). МС 478/480 (M+H+).
Следуя процедуре, описанной выше для примера 9b, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 479/481
1H ЯМР (400 МГц, CD3OD): δ 7,74 (д, J=2 Гц, 1H), 7,71 (д, J=8,6 Гц, 1H), 7,43-7,36 (м, 6H), 4,28 (м, 2H), 4,20-4,00 (м, 2H), 4,00-3,70 (м, 2H), 3,48 (м, 2H), 3,24 (м, 1H), 2,58 (с, 3H), 2,50-2,20 (м, 4H).
МС m/z (M+H+) 454
МС m/z (M+H+) 467
МС m/z (M+H+) 421
МС m/z (M+H+) 497
МС m/z (M+H+) 474
МС m/z (M+H+) 484/486
1H ЯМР (400 МГц, CD3OD): δ 8,00 (с, 1H), 7,81 (д, J=8,2 Гц, 2H), 7,63 (д, J=8,6 Гц, 2H), 7,58 (с, 2H), 7,40 (м, 6H), 6,78 (д, J=3,5 Гц, 1H), 4,37 (м, 1H), 4,30-4,20 (м, 2H), 4,11 (м, 1H), 3,60-3,40 (м, 2H), 3,24 (м, 1H), 2,50-2,20 (м, 4H).
МС m/z (M+H+) 533
МС m/z (M+H+) 500
1H ЯМР (400 МГц, CD3OD): δ 7,98 (с, 1H), 7,56-7,37 (м, 13H), 6,73 (д, J=3,2 Гц, 1H), 4,37 (м, 1H), 4,29-4,20 (м, 2H), 4,10 (шс, 1H), 3,90 (шс, 1H), 3,74 (шс, 1H), 3,38 (м, 2H), 3,23 (м, 1H), 2,50-2,20 (м, 4H).
МС m/z (M+H+) 465
1H ЯМР (400 МГц, CD3OD): δ 8,00 (с, 1H), 7,76 (с, 1H), 7,72-7,64 (м, 3H), 7,58-7,50 (м, 2H), 7,41 (м, 6H), 6,78 (д, J=3 Гц, 1H), 4,37 (м, 1H), 4,30-4,20 (м, 2H), 4,11 (м, 1H), 3,91 (шс, 1H), 3,75 (шс, 1H), 3,48 (м, 2H), 3,25 (м, 1H), 2,55-2,20 (м, 4H).
МС m/z (M+H+) 533
МС m/z (M+H+) 529
1H ЯМР (400 МГц, CD3OD): δ 8,54 (с, 1H), 8,45 (д, J=8,2 Гц, 1H), 7,94 (д, J=1,2 Гц, 1H), 7,82 (м, 2H), 7,69 (м, 2H), 7,41 (м, 5H), 4,38 (м, 1H), 4,32-4,22 (м, 2H), 4,12 (м, 1H), 3,90 (шс, 1H), 3,76 (шс, 1H), 3,50 (шс, 2H), 3,27 (м, 1H), 2,50-2,20 (м, 4H).
МС m/z (M+H+) 535
МС m/z (M+H+) 467
MС m/z 484 (M+H+)
1H ЯМР (CDCl3, 400 МГц): δ 7,99 (с, 1H), 7,53-7,63 (м, 1H), 7,45-7,53 (м, 1H), 7,16-7,45 (м, 9H), 6,74 (д, J=3,1 Гц, 1H), 4,37 (шс, 1H), 4,16-4,32 (м, 2H), 4,11 (шс, 1H), 3,83-4,00 (м, 1H), 3,65-3,83 (м, 1H), 3,48 (шс, 2H), 3,17-3,31 (м, 1H), 2,44 (шс, 4H)
MС m/z 501 (M+H+)
MС m/z 497 (M+H+)
MС m/z 501 (M+H+)
MС m/z 497 (M+H+)
MС m/z 479 (M+H+)
MС m/z 519 (M+H+)
MС m/z 549 (M+H+)
MС m/z 501 (M+H+)
MС m/z 517 (M+H+)
MС m/z 501 (M+H+)
MС m/z 502 (M+H+)
Пример 9c
Следуя процедуре, описанной выше для примера 1b, за исключением использования 1,10-фенантролина вместо транс-N,N'-диметилциклогексан-1,2-диамина в качестве лиганда на стадии K, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, было получено следующее промежуточное соединение:
Следуя процедуре, описанной выше для примера 9, стадия D, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 511
МС m/z (M+H+) 511
МС m/z (M+H+) 504
Пример 9d
E. Метил 1-(4-цианфенил)-индол-5-карбоксилат (9d) получили способом, описанным в примере 1a, на стадии H.
F. 1-(4-Цианфенил)-индол-5-карбоновая кислота, 9e и 1-(4-карбамоил-фенил)-индол-5-карбоновая кислота, 9f. Смесь метил 1-(4-цианфенил)-индол-5-карбоксилата, 9d (156 мг, 0,57 ммоль), LiOH (54 мг, 2,26 ммоль) в THF (4 мл) и H2O (2 мл) перемешивали при комнатной температуре в течение 4 дней. Водный 10%-ный раствор HCl добавили в реакционную смесь для доведения уровня pH до 3~4. Полученную смесь экстрагировали с помощью EtOAc (2x). Органический раствор промыли водным Соль NaCl, высушили над Na2SO4 и сконцентрировали. Путем очистки с использованием колоночной флеш-хроматографии (силикагель, 4-8% MeOH/CH2Cl2) получили соединение 9e (75 мг), а затем соединение 9f (27 мг).
Следуя процедуре, описанной выше для примера 9d, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 497
МС m/z (M+H+) 515
МС m/z (M+H+) 497
МС m/z (M+H+) 497
МС m/z (M+H+) 497
МС m/z (M+H+) 497
МС m/z (M+H+) 515
Следуя процедуре, описанной выше для примера 9b, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 490
МС m/z (M+H+) 490
МС m/z (M+H+) 508
Пример 9e
G. Этил-1-(3-трифторметил-фенил)-1H-индазол-5-карбоксилат (9i) и этил-1-(3-трифторметил-фенил)-1H-индазол-5-карбоксилат (9j). Смесь этил-1H-индазол-5-карбоксилата 9 г (150 мг, 0,79 ммоль), 1-бром-3-трифторметилбензола 9 г (0,13 мл, 0,95 ммоль), CuI (22,5 мг, 0,12 ммоль), транс-N, N'-диметилциклогексан-1,2-диамина (0,056 мл, 0,36 ммоль) и K3PO4 (0,37 г, 1,74 ммоль) в толуоле (1,5 мл) нагревали при температуре 110oC в течение 16 часов. Реакционную смесь разбавили CH2Cl2 и профильтровали. Раствор сконцентрировали, остаток очистили с использованием колоночной флеш-хроматографии (силикагель, 10% EtOAc/гептан) для получения соединения 9i (190 мг), а затем соединения 9j (37 мг).
H. 1-(3-Трифторметил-фенил)-1H-индазол-5-карбоновая кислота (9k) и 1-(3-трифторметил-фенил)-1H-индазол-5-карбоновая кислота (9l). Соединения 9k и 9l получили способом, описанным в примере 1b, на стадии L, из соединений 9i и 9j соответственно.
Следуя процедуре, описанной выше для примера 9e, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 541
МС m/z (M+H+) 557
МС m/z (M+H+) 557
МС m/z (M+H+) 541
МС m/z (M+H+) 541
МС m/z (M+H+) 557
Следуя процедуре, описанной выше для примера 9b, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 534
МС m/z (M+H+) 550
Пример 9f
I. Метил 1-(4-циан-3-фторфенил)-индол-5-карбоксилат (9m) получили способом, описанным в примере 9e, на стадии H.
J. Метил 1-(4-циан-3-метоксифенил)-индол-5-карбоксилат, 9n. Раствор 95 мг (0,32 ммоль) соединения 9m объединили с раствором 120 мг (0,87 ммоль) K2CO3 в 8 мл MeOH и нагревали при температуре 75ºC в течение 5 часов. Смесь охладили, разбавили водой и экстрагировали с помощью CH2Cl2. Органический раствор сконцентрировали для получения 100 мг (100%) соединения 9n в виде белого твердого вещества.
K. 1-(4-Циан-3-метоксифенил)-индол-5-карбоновая кислота (93) и 1-(4-карбамоил-фенил)-индол-5-карбоновая кислота (9o). Смесь 100 мг (0,33 ммоль) соединения 9m и LiOH (31 мг, 1,3 ммоль) в THF (4 мл) и H2O (2 мл) перемешивали при комнатной температуре в течение 3 дней. Водный 10%-ный раствор HCl добавили в реакционную смесь для доведения уровня pH до 3~4. Полученную смесь экстрагировали с помощью EtOAc (2 раза). Органический раствор промыли водным Соль NaCl, высушили над Na2SO4 и сконцентрировали для получения 90 мг (94%) соединения 9o в виде белого твердого вещества.
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 527
МС m/z (M+H+) 520
Пример 9g
L. Этил 2-(тиазол-2-ил)бензо[d]тиазол-6-карбоксилат, 9q. Смесь этил 2-бром-бензотиазол-6-карбоксилата 1w (150 мг, 0,53 ммоль), 2-трибутилстаннилтиазола 9p (0,25 мл, 0,79 ммоль) и Pd(PPh3)4 (30 мг, 0,03 ммоль) в диоксане (2 мл) нагревали при температуре 130oC в течение 30 минут в микроволновой печи. Реакционную смесь разбавили CH2Cl2, затем промыли водным NaHCO3, высушили над Na2SO4 и сконцентрировали. Путем очистки с использованием колоночной флеш-хроматографии (силикагель, 10% EtOAc/гептан) получили соединение 9q (130 мг).
M. 2-(Тиазол-2-ил)бензо[d]тиазол-6-карбоновая кислота, 9r. Этил 2-фенил-бензотиазол-6-карбоксилат 9q (130 мг, 0,45 ммоль) перемешивали с раствором LiOH (43 мг, 1,8 ммоль) в THF (4 мл) и H2O (2 мл) в течение 6 часов. 1N раствора HCl добавили в реакционную смесь для доведения уровня pH до 3~4. Полученную смесь экстрагировали с помощью EtOAc (2x). Органический раствор промыли водным Соль NaCl, высушили над Na2SO4 и сконцентрировали для получения соединения 9r (110 мг).
Следуя процедуре, описанной выше для примера 9g, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 497
МС m/z (M+H+) 491
Пример 9h
N. Метил 2-(пиримидин-2-ил)-1,2,3,4-тетрагидроизохинолин-8-карбоксилат, 9u. Смесь метил-1,2,3,4-тетрагидроизохинолин-8-карбоксилата 9s (100 мг, 0,44 ммоль), 2-бромпиримидина 9t (77 мг, 0,48 ммоль) и Et3N (0,13 мл, 0,92 ммоль) в ацетонитриле (5 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь обработали для получения соединения 9v (187 мг).
M. 2-(Пиримидин-2-ил)-1,2,3,4-тетрагидроизохинолин-8-карбоновая кислота, 9v. Соединение 9u (187 мг, 0,44 ммоль) нагрели в колбе с обратным холодильником с 3N вводного NaOH (0,25 мл мг, 0,75 ммоль) в THF (6 мл) в течение ночи. Концентрированный раствор HCl добавили в реакционную смесь для доведения уровня pH до 3~4. Полученную смесь сконцентрировали для получения соединения 9v (350 мг) в виде соли трис-HCl.
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, было получено следующее соединение, составляющее предмет настоящего изобретения:
МС m/z (M+H+) 490,1
Пример 9i
N. Метил-3-амино-2-бензоиламино-бензоат, 9y: к раствору 500 мг (3,0 ммоль) of метил-2,3-диаминобензоата 9w и 730 мг (6,0 ммоль) бензойной кислоты 9x в 8 мл CH2Cl2 добавили 620 мг (3,0 ммоль) дициклогексилкарбодиимида (DCC) и 4 мг (0,033 ммоль) DMAP. Реакционную смесь перемешивали в течение ночи, затем отфильтровали осадок. Осадок очистили с использованием колоночной флеш-хроматографии (силикагель, 10-30% градиент EtOAc в гептане) для получения 220 мг (27%) метил 3-амино-2-бензоиламино-бензоата, 9y. МС m/z (M+H+) 271,2
O. Метил-2-фенил-1H-бензо[d]имидазол-7-карбоксилат, 9z. Раствор 810 мг (3,0 ммоль) метил-3-амино-2-бензоиламино-бензоата 9y в 15 мл уксусной кислоты нагревали при температуре 125°C в течение 1,5 часов. Реакционную смесь охладили и вылили в лед/воду. Водный слой довели до щелочной реакции с помощью NaHCO3 и экстрагировали с помощью CH2Cl2. Органическую часть раствора высушили над Na2SO4 и выпарили для получения 540 мг (71%) метил-2-фенил-1H-бензо[d]имидазол-7-карбоксилата, 9z. МС m/z (M+H+) 253,2
P. Фенил-1H-бензо[d]имидазол-7-карбоновая кислота, 9aa. Смесь из 540 мг (2,1 ммоль) метил-2-фенил-1H-бензо[d]имидазол-7-карбоксилата 9z и 3 мл (9 ммоль) 3N водного NaOH нагревали с обратным холодильником в 8 мл THF в течение ночи. После охлаждения смесь вылили в ледяную воду и подкислили концентрированным раствором HCl. Полученный твердый осадок профильтровали и высушили для получения 440 мг (86%) фенил-1H-бензо[d]имидазол-7-карбоновой кислоты, 9aa. МС m/z (M+H+) 238,9.
Следуя процедуре, описанной выше для примера 9i, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 500,3
МС m/z (M+H+) 484,3
МС m/z (M+H+) 484,3
МС m/z (M+H+) 500,3
МС m/z (M+H+) 466,3
МС m/z (M+H+) 507,2
МС m/z (M+H+) 463,2
МС m/z (M+H+) 473,2
МС m/z (M+H+) 474,3
МС m/z (M+H+) 463,3
МС m/z (M+H+) 463,3
МС m/z (M+H+) 491,2
МС m/z (M+H+) 491,2
МС m/z (M+H+) 491,2
МС m/z (M+H+) 507,2
МС m/z (M+H+) 507,2
МС m/z (M+H+) 487
МС m/z (M+H+) 505,2
МС m/z (M+H+) 505,2
МС m/z (M+H+) 521,2
МС m/z (M+H+) 488,2
Пример 9j
Q. Метил-2-(4-фтор-бензоиламино)-3-гидрокси-бензоат, 9dd. Раствор 1,0 г (4,9 ммоль) метил 2-амино-3-гидроксибензоата 9bb, 1,03 г (7,4 ммоль) 4-фторбензойной кислоты 9cc, 10 мл DMF и 2,9 мл (20,6 ммоль) TEA поместили в колбу и перемешивали в течение 10 минут. Затем добавили HATU (7,4 ммоль, 2,8 г), после чего реакционную смесь перемешивали в течение ночи. Реакционную смесь вылили в воду и экстрагировали с помощью EtOAc. Органическую часть промыли водой и солевым раствором, растворитель выпарили для получения 1,2 г неочищенного продукта, метил-2-(4-фтор-бензоиламино)-3-гидрокси-бензоата, 9dd, который использовали без дополнительной очистки. МС m/z (M+H+) 290,1.
R. Метил 2-(4-фторфенил)бензо[d]оксазол-4-карбоксилат, 9ee. Mетил-2-(4-фтор-бензоиламино)-3-гидрокси-бензоат 9dd (7,4 ммоль, 1,2 г неочищ.) и 1,3 г (7,5 ммоль) p-толуолсульфоновой кислоты нагревали с обратным холодильником в 10 мл ксилола в течение ночи. После охлаждения к смеси добавили насыщенный раствор NaHCO3, полученную смесь экстрагировали с помощью EtOAc. Органический растворитель выпарили для получения 1,1 г (55%) метил 2-(4-фторфенил)бензо[d]оксазол-4-карбоксилата, 9ee. МС m/z (M+H+) 272,0.
S. 2-(4-Фторфенил)-бензо[d]оксазол-4-карбоновая кислота, 9ff. Смесь 1,1 г (4,0 ммоль) метил 2-(4-фторфенил)бензо[d]оксазол-4-карбоксилата 9ee и 3,7 мл 3N водного NaOH в 10 мл THF нагревали в колбе с обратным холодильником в течение ночи. После охлаждения реакционную смесь вылили в воду и подкислили концентрированным раствором HCl. Полученный твердый осадок отфильтровали и высушили для получения 830 мг (79%) 2-(4-фторфенил)-бензо[d]оксазол-4-карбоновой кислоты, 9ff. МС m/z (M+H+) 258,1.
Следуя процедуре, описанной выше для примера 9j, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 8,32 (м, 2H); 7,95 (м, 2H); 7,85 (м, 1H); 7,71-7,49 (м, 5H); 4,85-4,44 (шм, 3H); 4,15-3,91 (шм, 3H); 3,23 (шм, 3H)
МС m/z (M+H+) 474,2
МС m/z (M+H+) 492,1
МС m/z (M+H+) 492,1
МС m/z (M+H+) 507,9
1H ЯМР (400 МГц, CDCl3): δ 9,05 (шс, 1H); 8,3 (д, 2H); 8,2 (м, 1H); 7,95 (д, 1H); 7,66 (т, 3H); 7,44 (т, 1H); 4,69-4,52 (м, 1H); 4,44 (м, 2H); 4,10 (шм, 2H); 3,20 (м, 4H).
МС m/z (M+H+) 507,9
МС m/z (M+H+) 474
МС m/z (M+H+) 492,2
МС m/z (M+H+) 492,2
МС m/z (M+H+) 508,2
МС m/z (M+H+) 508,2
МС m/z (M+H+) 508,9
МС m/z (M+H+) 474,2
МС m/z (M+H+) 475,1
Пример 10
A. 6-Трифторметил-бензо[b]тиофен-2-карбонила хлорид, 10b. К соединению 10a (0,13 г, 0,53 ммоль) в CH2Cl2 (5 мл) при комнатной температуре добавили (COCl)2 (0,051 мл, 0,58 ммоль), а затем 2 капли DMF. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Затем реакционную смесь сконцентрировали для получения соединения 10b, которое использовалось в следующей реакции без дополнительной очистки.
B. 1-(1,3-Тиазол-2-ил-карбонил)-4-(1-{[6-(трифторметил)-1-бензотиофен-2-ил]карбонил}азетидин-3-ил)пиперазин. К раствору соединения 5e (60 мг, 0,24 ммоль) и Et3N (0,08 мл, 0,58 ммоль) в CH2Cl2 (3 мл) при 0°C добавили раствор соединения 10b (0,53 ммоль) в CH2Cl2 (1 мл). Реакционную смесь медленно нагревали до комнатной температуры в течение 4,5 часов, разбавили CH2Cl2 и промыли водой NaHCO3. Органический слой высушили над Na2SO4 и сконцентрировали. Путем очистки с использованием колоночной флеш-хроматографии (силикагель, 3% MeOH/CH2Cl2) получили соединение 323. 1H ЯМР (400 МГц, CD3OD): δ 8,15 (с, 1H), 7,94 (д, J=8,6 Гц, 1H), 7,89 (д, J=3 Гц, 1H), 7,74 (с, 1H), 7,62 (д, J=8,6 Гц, 1H), 7,56 (д, J=3 Гц, 1H), 4,60 (м, 2H), 4,45 (м, 2H), 4,30 (м, 1H), 4,16 (м, 1H), 3,95-3,89 (м, 2H), 3,35 (м, 1H), 2,55 (шс, 4H). МС m/z (M+H+) 481.
Следуя процедуре, описанной выше для примера 10, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CD3OD): δ 8,13 (с, 1H), 8,01 (д, J=8 Гц, 1H), 7,88 (д, J=3 Гц, 1H), 7,73 (д, J=8 Гц, 1H), 7,55 (д, J=3 Гц, 1H), 4,53 (шс, 1H), 4,46 (шс, 1H), 4,31 (м, 2H), 4,22 (м, 1H), 4,16 (м, 1H), 3,33 (м, 1H), 2,60-2,40 (м, 4H).
МС m/z (M+H+) 515
1H ЯМР (400 МГц, CD3OD): δ 8,15 (с, 1H), 7,94 (д, J=8,6 Гц, 1H), 7,73 (с, 1H), 7,62 (д, J=8,6 Гц, 1H), 7,42 (м, 5H), 4,58 (м, 1H), 4,42 (м, 1H), 4,28 (м, 1H), 4,12 (м, 1H), 3,93 (шс, 1H), 3,77 (шс, 1H), 3,51 (шс, 2H), 3,34 (м, 1H), 2,60- 2,30 (м, 4H).
МС m/z (M+H+) 474
МС m/z (M+H+) 496
МС m/z (M+H+) 496
МС m/z (M+H+) 583,0
МС m/z (M+H+) 583,0
1H ЯМР (400 МГц, CD3OD): δ 2,13 (д, J=13,2 Гц, 1H), 2,41 (д, J=47,2 Гц, 1H), 2,8-3,3 (м, 2,5H), 3,69 (д, J=13,7 Гц, 0,5H), 3,98-4,42 (м, 4H), 4,51 (т, J=13,4 Гц, 0,5H), 5,27-5,54 (м, 1H), 6,93 (шс, 0,5H), 7,83 (д, J=8,6 Гц, 1H), 7,88 (шс, 1H), 7,97 (т, J=6,8 Гц, 1H), 8,11 (д, J=8,8 Гц, 1H), 8,42 (с, 1H)
МС m/z (M+H+) 583,0
Пример 10а
C. Метил 3-хлор-5-фтор-6-трифторметил-бензо[b]тиофен-2-карбоксилат (10d) и метил 3-хлор-6-трифторметил-7-фтор-бензо[b]тиофен-2-карбоксилат (10e). Смесь 3-фтор-4-(трифторметил)-коричной кислоты 10c (1,5 г, 6,4 ммоль), SOCl2 (2,33 мл, 32 ммоль), DMF (0,05 мл, 0,64 ммоль) и пиридина (0,05 мл, 0,64 ммоль) в хлорбензоле (5 мл) нагревали в колбе с обратным холодильником в течение 24 часов. Реакционную смесь охладили до комнатной температуры и сконцентрировали. Полученный остаток растворили в MeOH (50 мл) и перемешивали при комнатной температуре в течение 16 часов. Раствор сконцентрировали, разбавили CH2Cl2 и промыли H2O. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. Путем рекристаллизации гептанами с последующей колоночной флеш-хроматографией (силикагель, 2% EtOAc/гептан) получили соединения 10d (580 мг) и 10e (380 мг).
D. 3-Хлор-5-фтор-6-трифторметил-бензо[b]тиофен-2-карбоновая кислота, 10f. Метил 3-хлор-5-фтор-6-трифторметил-бензо[b]тиофен-2-карбоксилат 10d (180 мг, 0,58 ммоль) перемешивали с раствором LiOH (55 мг, 2,3 ммоль) в THF (5 мл) и H2O (2,5 мл) в течение 4 часов. 1N раствора HCl добавили в реакционную смесь для доведения уровня pH до 3~4. Полученную смесь экстрагировали с помощью EtOAc (2 раза). Органический раствор промыли водным Соль NaCl высушили над Na2SO4 и сконцентрировали для получения соединения 10f (150 мг).
E. 3-Хлор-6-трифторметил-7-фтор-бензо[b]тиофен-2-карбоновая кислота, 10g. Соединение 10g получили из соединения 10e, следуя процедуре, описанной выше для стадии D.
Следуя процедуре, описанной выше для примера 10, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 533
МС m/z (M+H+) 533
МС m/z (M+H+) 533
МС m/z (M+H+) 533
Пример 10b
F. 3-Хлор-5-трифторметил-6-фтор-бензо[b]тиофен-2-карбоновая кислота (10h) и 3-хлор-6-фтор-7-трифторметил-бензо[b]тиофен-2-карбоновая кислота (10i). Соединения 10h и 10i получили способом, описанным в примере 10a, используя соединение 4-фтор-3-(трифторметил)-коричной кислоты вместо соединения 10c. Данные соединения получены в виде смеси ~2:1.
G. 3-Хлор-5-трифторметил-6-фтор-бензо[b]тиофен-2-карбонил хлорид (10j) и 3-хлор-6-фтор-7-трифторметил-бензо[b]тиофен-2- карбонил хлорид (10k). Соединения 10j и 10k получили способом, описанным в примере 10a, используя соединения 10h и 10i. Данные соединения были получены в виде смеси ~2:1.
H. 1-(1-{[3-Хлор-6-фтор-5-(трифторметил)-1-бензотиофен-2-ил]карбонил}азетидин-3-ил)-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 901, и 1-(1-{[3-хлор-6-фтор-7-(трифторметил)-1-бензотиофен-2-ил]карбонил}азетидин-3-ил)-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 902. Соединение 901 и соединение 902 получили способом, описанным в примере 10, используя двойную HCl соль 5e (0,31 ммоль, 150 мг), смесь 10j и 10k (0,24 ммоль, 76 мг) и Et3N (1,44 моль, 0,2 мл) в 7 мл CH2Cl2. После обработки и очистки с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/CH2Cl2) получили 50 мг (39%) соединения 901 и затем 18 мг (14%) соединения 902 . Соединение 901: МС m/z (M+H+) 533. Соединение 902: МС m/z (M+H+) 533.
Следуя процедуре, описанной выше для примера 10b, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 533
МС m/z (M+H+) 533
Пример 11
A. 1-{4-[1-(6-Бром-3-хлор-бензо[b]тиофен-2-карбонил)-азетидин-3-ил]-пиперазин-1-ил}-2,2,2-трифтор-этанон, 11b. К раствору соединения 1g (0,19 г, 0,61 ммоль) и Et3N (0,51 мл, 3,67 ммоль) в CH2Cl2 (4 мл) при 0°C добавили раствор соединения 11a (полученного аналогично соединению 10b в примере 10) (0,69 ммоль) в CH2Cl2 (2 мл). Реакционную смесь медленно нагревали до комнатной температуры в течение 18 часов. Реакционную смесь разбавили CH2Cl2 и промыли водным раствором NaHCO3. Органический слой высушили над Na2SO4 и сконцентрировали. Путем очистки с использованием колоночной флеш-хроматографии (силикагель, 3% MeOH/CH2Cl2) получили соединение 11b (0,3 г).
B. (6-Бром-3-хлор-бензо[b]тиофен-2-ил)-(3-пиперазин-1-ил-азетидин-1-ил)-метанон, 11c. Раствор соединения 11b (0,3 г, 0,59 ммоль) в Et3N (1 мл) и метаноле (9 мл) перемешивали 3 дня при комнатной температуре. Затем [раствор] концентрировали, получив соединение 11c, которое использовали в следующей реакции без дополнительной очистки.
C. 1-{1-[(6-Бром-3-хлор-1-бензотиофен-2-ил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 326. К смеси соединения 11c (0,2 ммоль), соединения 5c (31 мг, 0,24 ммоль) и Et3N (0,08 мл, 0,58 ммоль) в CH2Cl2 (3 мл) при комнатной температуре добавили HATU (91 мг, 0,24 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Смесь разбавили диэтиловым эфиром, промыли водн. NaHCO3 и водн. NaCl, высушили над Na2SO4, отфильтровали и сконцентрировали. После очистки с использованием колоночной флеш-хроматографии (силикагель, 3% MeOH/CH2Cl2) получили соединение 326 (57 мг). 1H ЯМР (400 МГц, CD3OD): δ 7,98 (с, 1H), 7,88 (д, J=3 Гц, 1H), 7,75 (д, J=8,6 Гц, 1H), 7,61 (д, J=8,6 Гц, 1H), 7,55 (д, J=3 Гц, 1H), 4,53 (шс, 1H), 4,44 (шс, 1H), 4,30 (шс, 2H), 4,21(шс, 1H), 4,13 (шс,1H), 3,89 (шс, 1H), 3,84 (шс, 1H), 3,31 (м, 1H), 2,60-2,40 (м, 4H). МС m/z (M+H+) 525/527/529.
Следуя процедуре, описанной выше для примера 11, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CD3OD): δ 8,05 (д, J=8,2 Гц, 1H), 7,89 (д, J=3 Гц, 1H), 7,85 (с, 1H), 7,72 (д, J=7,4 Гц, 1H), 7,55 (д, J=3 Гц, 1H), 7,51 (т, J=7,8 Гц, 1H), 4,60 (м, 2H), 4,45 (м, 2H), 4,31 (м, 1H), 4,17 (м, 1H), 3,95-3,80 (м, 2H), 3,35 (м, 1H), 2,56 (шс, 4H).
МС m/z (M+H+) 481
МС m/z (M+H+) 481
1H ЯМР (400 МГц, CD3OD): δ 8,02 (д, J=8,2 Гц, 1H), 7,80 (с, 1H), 7,73 (д, J=7,4 Гц, 1H), 7,51 (т, J=8,2 Гц, 1H), 7,42 (м, 5H), 4,60 (м, 1H), 4,43 (м, 1H), 4,28 (м, 1H), 4,12 (м, 1H), 3,94 (шс, 1H), 3,76 (шс, 1H), 3,51 (шс, 2H), 3,33 (м, 1H), 2,60-2,30 (м, 4H).
МС m/z (M+H+) 474
1H ЯМР (400 МГц, CD3OD): δ 8,05 (д, J=8 Гц, 1H), 7,84 (с, 1S), 7,71 (д, J=8 Гц, 1H), 7,50 (т, J=8 Гц, 1H), 7,42 (м, 5H), 4,59 (м, 1H), 4,42 (м, 1H), 4,29 (м, 1H), 4,13 (м, 1H), 3,92 (шс, 1H), 3,79 (шс, 1H), 3,51 (шс, 1H), 3,34 (м, 1H), 2,60-2,30 (м, 4H).
МС m/z (M+H+) 474
МС m/z (M+H+) 518/520/522
1H ЯМР (400 МГц, CD3OD): δ 8,80 (с, 1H), 8,04 (с, 1H), 8,02 (д, J=8 Гц, 1H), 7,81 (с, 1H), 7,73 (д, J=7,6 Гц, 1H), 7,51 (т, J=7,6 Гц, 1H), 4,60 (м, 1H), 4,45 (м, 1H), 4,30 (м, 1H), 4,15 (м, 1H), 4,02 (шс, 1H), 3,95 (м, 2H), 3,82 (шс, 1H), 3,35 (м, 1H), 2,60-2,40 (м, 4H).
МС m/z (M+H+) 481
1H ЯМР (400 МГц, CD3OD): δ 8,80 (с, 1H), 8,02 (с, 1H), 7,97 (с, 1H), 7,74 (м, 1H), 7,60 (м, 1H), 4,30 (м, 2H), 4,21 (шс, 1H), 4,12 (шс, 1H), 4,00 (шс, 1H), 3,92 (м, 2H), 3,81 (шс, 1H), 3,31 (м, 1H), 2,50- 2,30 (м, 4H).
МС m/z (M+H+) 525/527/529
1H ЯМР (400 МГц, CD3OD): δ 8,80 (с, 1H), 8,05 (д, J=8Hz, 1H), 8,04 (с, 1H), 7,85 (м, 1H), 7,72 (д, J=8 Гц, 1H), 7,51 (т, J=7,6 Гц, 1H), 4,60 (м, 1H), 4,44 (м, 1H), 4,30 (м, 1H), 4,16 (м, 1H), 4,10-3,80 (м, 4H), 3,36 (м, 1H), 2,60-2,40 (м, 4H).
МС m/z (M+H+) 481
1H ЯМР (400 МГц, CD3OD): δ 8,80 (д, J=2Hz, 1H), 8,13 (т, J=0,8 Гц, 1H), 8,03 (д, J=2 Гц, 1H), 8,01 (д, J=8,6 Гц, 1H), 7,73 (дд, J=1,2 Гц, 8,6 Гц, 1H), 4,31 (м, 2H), 4,21 (м, 1H), 4,15 (м, 1H), 4,01 (м, 1H), 3,93 (м, 2H), 3,81 (м, 1H), 3,33 (м, 1H), 2,55-2,40 (м, 4H).
МС m/z (M+H+) 515
МС m/z (M+H+) 508
МС m/z (M+H+) 481
МС m/z (M+H+) 488
МС m/z (M+H+) 458
МС m/z (M+H+) 438
МС m/z (M+H+) 481
МС m/z (M+H+) 495
МС m/z (M+H+) 495
МС m/z (M+H+) 465
МС m/z (M+H+) 465
МС m/z (M+H+) 459
МС m/z (M+H+) 445
МС m/z (M+H+) 445
Пример 12
1-{1-[(5-Фенилнафталин-2-ил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 338. Смесь соединения 313 (48 мг, 0,1 ммоль), соединения 12a (24 мг, 0,2 ммоль), K2CO3 (27 мг, 0,2 ммоль) и Pd(dppf)Cl2.CH2Cl2 (4 мг, 0,005 ммоль) в EtOH (1 мл) и H2O (0,2 мл) нагревали в микроволновом реакторе при 130°C в течение 30 минут. Реакционную смесь охладили до комнатной температуры, разбавили CH2Cl2 и промыли H2O. Органический слой высушили над Na2SO4 и сконцентрировали. После очистки с использованием колоночной флеш-хроматографии (силикагель, 3% MeOH/CH2Cl2) получили соединение 338 (28 мг). 1H ЯМР (400 МГц, CD3OD): δ 8,20 (д, J=1,6 Гц, 1H), 7,93 (т, J=9,6 Гц, 2H), 7,88 (д, J=3 Гц, 1H), 7,66-7,43 (м, 9H), 4,52 (шс, 1H), 4,50-4,20 (м, 4H), 4,16 (м, 1H), 3,88 (шс, 1H), 3,83 (шс, 1H), 3,28 (м, 1H), 2,60-2,40 (м, 4H). МС m/z (M+H+) 483.
Следуя процедуре, описанной выше для примера 12, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 476
МС m/z (M+H+) 477
МС m/z (M+H+) 550
1H ЯМР (400 МГц, CD3OD): δ 8,05 (с, 1H), 7,88 (д, J=8,6 Гц, 1H), 7,70 (с, 1H), 7,66-7,62 (м, 3H), 7,49-7,36 (м, 8H), 4,58 (м, 1H), 4,42 (м, 1H), 4,28 (м, 1H), 4,11 (м, 1H), 3,92 (шс, 1H), 3,76 (шс, 1H), 3,49 (шс, 2H), 3,31 (м, 1H), 2,60-2,25 (м, 4H).
МС m/z (M+H+) 482
Пример 13
1-{1-[(3-Хлор-6-фенил-1-бензотиофен-2-ил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, cоединение 343. Названное соединение получили аналогичным способом, описанным для соединения 338 в примере 12, используя 1 эквивалент соединения 12а с заменой соединения 313 соединением 326. Реакционную смесь нагревали в микроволновом реакторе при 120 °C в течение 20 мин. 1H ЯМР (400 МГц, CD3OD): δ 8,01 (д, J=1,2 Гц, 1H), 7,95 (д, J=8,6 Гц, 1H), 7,88 (д, J=3 Гц, 1H), 7,74 (д, J=8,6 Гц, 1H), 7,66 (д, J=8,2 Гц, 2H), 7,55 (д, J=3Hz, 1H), 7,49 (м, 2H), 7,41 (м, 1H), 4,54 (шс, 1H), 4,46 (шс, 1H), 4,33 (м, 2H), 4,25 (м, 1H), 4,14 (м, 1H), 3,89 (шс, 1H), 3,84 (шс, 1H), 3,32 (м, 1H), 2,50 (м, 4H). МС m/z (M+H+) 523.
Следуя процедуре, описанной выше для примера 13, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 516 (M+H+).
МС m/z (M+H+) 523
МС m/z (M+H+) 550
МС m/z (M+H+) 514
МС m/z (M+H+) 528
Пример 14
1-(Фенилкарбонил)-4-{1-[(5-фенилтиофен-2-ил)карбонил]азетидин-3-ил}пиперазин, соединение 346. Смесь соединения 322 (40 мг), соединения 12a (16 мг), Pd(dppf)Cl2.CH2Cl2 (8 мг) и Na2CO3 (19 мг), в смеси диоксан (0,8 мл)/вода (0,2 мл) поместили в закрытый сосуд и нагревали при 80°C в течение 4 часов. Затем реакционную смесь разбавили EtOAc и водой. Органический слой концентрировали при пониженном давлении, остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 5% MeOH/EtOAc), получив соединение 346 (17 мг). МС m/z (M+H+) 432,6.
Следуя процедуре, описанной выше для примера 14, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 500,0
МС m/z (M+H+) 530,0
МС m/z (M+H+) 598,0
МС m/z (M+H+) 598,0
МС m/z (M+H+) 570,1
МС m/z (M+H+) 457,0
МС m/z (M+H+) 457,0
МС m/z (M+H+) 507,0
МС m/z (M+H+) 466
МС m/z (M+H+) 483
МС m/z (M+H+) 473
МС m/z (M+H+) 541
МС m/z (M+H+) 471
МС m/z (M+H+) 521
МС m/z (M+H+) 504
МС m/z (M+H+) 504
МС m/z (M+H+) 554
МС m/z (M+H+) 521
МС m/z (M+H+) 471
МС m/z (M+H+) 521
МС m/z (M+H+) 490
МС m/z (M+H+) 471
Пример 14а
Следуя процедуре, описанной выше для примера 14, используя cоединение 682 из примера 5 вместо cоединения 322 и используя соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 7,93 (ар, 1H); 7,82 (ар, 1H); 7,76 (ар, 1H); 7,64 (м, 2H); 7,46 (м, 2H); 7,15 (м, 2H); 4,47-4,0 (шм, 6H); 3,82 (ш, 2H); 2,5 (с, 3H)
МС m/z (M+H+) 504,1
1H ЯМР (400 МГц, CDCl3): δ 8,09-7,97 9м, 2H); 7,88 (ар, 1H); 7,82-7,72 (м, 2H); 7,42 (ар, 2H); 7,31 (м, 1H); 7,62 (шм, 1H); 4,48 (шм, 1H); 4,35 (шм, 2H); 3,96 (шм, 2H); 3,14 (м, 4H); 2,44 (с, 3H)
МС m/z (M+H+) 505,2
МС m/z (M+H+) 517,2
МС m/z (M+H+) 490,2
Пример 14b
Следуя процедуре, описанной выше для примера 14, используя cоединение 792 из примера 5 вместо cоединения 322 и используя соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 491,1
МС m/z (M+H+) 477,3
МС m/z (M+H+) 491,2
МС m/z (M+H+) 491,1
МС m/z (M+H+) 503,1
Пример 14c
Следуя процедуре, описанной выше для примера 14, используя cоединение 864 из примера 5 вместо cоединения 322 и используя соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 492,1
МС m/z (M+H+) 474,1
Пример 14d
Следуя процедуре, описанной выше для примера 14, используя cоединение 315 из примера 5 вместо cоединения 322 и используя соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 415,2
МС m/z (M+H+) 492,1
МС m/z (M+H+) 494,97
МС m/z (M+H+) 491,1
Пример 15
1-(Фенилкарбонил)-4-(1-{[5-(фенилэтинил)тиофен-2-ил]карбонил}азетидин-3-ил)пиперазин, соединение 348. К раствору соединения 322 (100 мг), соединения 15a (0,46 ммоль, 0,05 мл), CuI (4,4 мг) и Pd(PPh3)2Cl2 (16 мг) в THF (1 мл) добавили TEA (0,25 мл), смесь нагревали при 40°C в течение 1 часа. Далее реакционную смесь разбавили этилацетатом и водой. Органический слой концентрировали при пониженном давлении, остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 5% MeOH/EtOAc), получив соединение 348 (75 мг). МС m/z (M+H+) 456,6.
Пример 16
1-(Фенилкарбонил)-4-(1-{[5-(2-фенилэтил)тиофен-2-ил]карбонил}азетидин-3-ил)пиперазин, соединение 349. К раствору соединения 348 (30 мг) в EtOH (20 мл) добавили 10% Pd/C (10 мг), смесь подвергли гидрированию (0,31 МПа (45 фунтов на кв.дюйм) H2) в течение 1,5 часов. Реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении, получив соединение 349 (30 мг). МС m/z (M+H+) 460,6.
Пример 17
A. 6-({3-[4-(Фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидроизохинолин, 17a. К раствору соединения 319 (500 мг) в CH2Cl2 (6 мл) добавили TFA (4 мл) при комнатной температуре. Смесь перемешивали 1,5 часа и затем концентрировали при пониженном давлении. Остаток разбавили CH2Cl2 и подщелочили 2N водного раствора NaOH. Органический слой промыли водой и насыщенным раствором соли, высушили над безводным K2CO3, отфильтровали, сконцентрировали, получив соединение 17a, которое использовали без дополнительной очистки.
B. 2-(Циклогексилкарбонил)-6-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидроизохинолин, соединение 350. Смесь соединения 17a (31 мг, 0,03 мл), HATU (100 мг) и TEA (0,11 мл) в DCM (1 мл) перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь разбавляли DCM и водой. Органический слой концентрировали, остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 8% MeOH/EtOAc), получив соединение 350 (65 мг). 1H ЯМР(CDCl3): δ 7,47-7,39 (м, 7H), 7,17 (д, J=0,02, 1H), 4,74 (с, 1,2H), 4,48 (с, 0,8H), 4,25 (м, 2H), 4,10 (м, 2H), 3,92-3,71 (м, 4H), 3,43 (м, 2H), 3,19 (м, 1H), 2,93 (м, 1,2H), 2,86 (м, 0,8H), 2,55 (м, 1H), 2,42-2,24 (м, 4H), 1,83-1,57 (м, 8H), 1,26 (м, 2H). МС m/z (M+H+) 515,7,
Следуя процедуре, описанной выше для примера 17, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 503,7
МС m/z (M+H+) 509,6
МС m/z (M+H+) 463,6
МС m/z (M+H+) 583,7
МС m/z (M+H+) 475,2
МС m/z (M+H+) 461,2
МС m/z (M+H+) 516,2
Пример 17а
D. 6-{3-[4-(Тиазол-2-карбонил)-пиперазин-1-ил]-азетидин-1-карбонил}-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты трет-бутиловый эфир, 17c. К раствору соединения 5e (651 мг, 2 ммоль), 2-трет-бутилового эфира 3,4-дигидро-1Н-изохинолин-2,6-дикарбоновой кислоты 17b (555 мг, 2 ммоль) и EDC (466 мг, 3 ммоль) в CH2Cl2 (20 мл) добавили Et3N (0,84 мл, 6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь экстрагировали CH2Cl2 и H2O после подкисления водного слоя до рН~6 водным 1Н раствором HCl. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. Остаток очистили с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/EtOAc) и получили 17c (826 мг). МС m/z (M+H+) 512,1.
Следуя процедуре, описанной выше для примера 17a, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 17а, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 533,4
МС m/z (M+H+) 540,1
МС m/z (M+H+) 512,2
Пример 17b
E. 6-({3-[4-(1,3-Тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидроизохинолин, соединение 916. К раствору соединения 17c (826 мг, 1,61 ммоль) в CH2Cl2 (5 мл) добавили трифторуксусную кислоту (1 мл) при комнатной температуре. Смесь перемешивали 18 часов при комнатной температуре. Смесь экстрагировали CH2Cl2 и H2O после подщелачивания водного слоя до рН~8 водным 1N раствора NaOH. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. Остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/EtOAc), получив cоединение 916 (675 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,55 (д, J=3,3 Гц , 1H), 7,41 (с, 1H), 7,37 (д, J=8,03 Гц, 1H), 7,05 (д, J=8,3 Гц, 1H), 4,54 (шс, 1H), 4,44 (шс, 1H), 4,01-4,35 (м, 6H), 3,75-3,95 (м, 2H), 3,12-3,31 (м, 2H), 2,85 (т, J=5,8 Гц, 1H), 2,49 (шс, 4H). МС m/z (M+H+) 412,0.
Следуя процедуре, описанной выше для примера 17b, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Пример 18
2-Бензил-6-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидроизохинолин, соединение 355. К суспензии соединения 17a (100 мг) и K2CO3 (69 мг) в MeCN добавили соединение 18a (0,0353 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь сконцентрировали, остаток разбавили EtOAc и водой. Органический слой концентрировали при пониженном давлении, остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 8% MeOH/EtOAc), получив соединение 355 (85 мг). МС m/z (M+H+) 495,6.
Пример 19
N-Трет-бутил-6-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-3,4-дигидроизохинолин-2(1H)-карбоксамид, соединение 356. К раствору соединения 17a (75 мг) в DCM (1 мл) по каплям добавили соединение 19a (0,026 мл) при 0°C. Через 30 мин к реакционной смеси добавили DCM и воду при 0oC. Органическую часть сконцентрировали и очистили с использованием колоночной флеш-хроматографии (силикагель, 5% MeOH/EtOAc) для получения соединения 356 (60 мг). МС m/z (M+H+) 504,7,
Пример 20
A. 6-({3-[4-(Трифторацетил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидрохинолин, 20b. К раствору соединения 1g (308 мг, 1 ммоль), соединения 20а (177 мг, 1 ммоль) и Et3N (0,42 мл, 3 ммоль) в CH2Cl2 (10 мл) при комнатной температуре добавили HATU (570 мг, 1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Полученную смесь разбавили CH2Cl2 и промыли водн. NaHCO3. Органическую фазу сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. После очистки с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/EtOAc + 0,5% Et3N) получили соединение 20b (279 мг). ЖХ/МС m/z (M+H+) 397,0.
B. 6-([3-Пиперазин-1-ил]-азетидин-1-ил)карбонил-1,2,3,4-тетрагидрохинолин, 20c. К раствору соединения 20b (529 мг, 1,33 ммоль) в MeOH (10 мл) добавили K2CO3 (368 мг, 2,66 ммоль). Реакционную смесь перемешивали 30 мин при комнатной температуре. Полученную смесь отфильтровывали, концентрировали при пониженном давлении и полученный остаток распределили между CH2Cl2 и H2O. Органическую фазу сушили над Na2SO4, отфильтровывали, концентрировали при пониженном давлении и получили соединение 20с (370 мг). ЖХ/МС m/z (M+H+) 301,0.
C. 6-(3-[4-(1,3-Тиазол-2-ил-карбонил)пиперазин-1-ил]-азетидин-1-ил)карбонил-1,2,3,4-тетрагидрохинолин, соединение 357. К раствору соединения 20c (370 мг, 1,23 ммоль), соединения 5c (160 мг, 1,24 ммоль) и Et3N (0,51 мл, 3,69 ммоль) в CH2Cl2 (10 мл) добавили HATU (703 мг, 1,85 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Полученную смесь разбавили CH2Cl2 и промыли водн. NaHCO3. Органическую фазу сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/EtOAc + 0,5% Et3N), получив cоединение 357 (483 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,0 Гц, 1H), 7,53-7,58 (м, 1H), 7,33 (с, 1H), 7,24-7,30 (м, 1H), 6,39 (д, J=8,1 Гц, 1H), 3,97-4,66 (м, 6H), 3,86 (д, J=18,4 Гц, 2H), 3,35 (т, J=5,4 Гц, 2H), 3,16-3,26 (м, 1H), 2,77 (т, J=6,2 Гц, 2H), 2,39-2,59 (м, 4H), 1,94 (дт, J=11,8, 6,1 Гц, 2H); ЖХ/МС m/z (M+H+) 412,0.
Пример 21
6-(3-[4-(1,3-Тиазол-2-ил-карбонил)пиперазин-1-ил]-азетидин-1-ил)карбонил 1-[3-(трифторметил)фенил]карбонил-1,2,3,4-тетрагидрохинолин, соединение 358. К раствору соединения 357 (30 мг, 0,073 ммоль) в CH2Cl2 (1 мл), при 0°C, добавили соединение 1f (0,013 мл, 0,088 ммоль), затем Et3N (0,03 мл, 0,22 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 часов. Полученную смесь распределили между CH2Cl2 и H2O. Органическую фазу сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/EtOAc + 0,5% Et3N), получив cоединение 358 (42 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,65 (д, J=7,8 Гц, 1H), 7,61 (с, 1H), 7,52-7,59 (м, 3H), 7,41-7,49 (м, 1H), 7,12 (дд, J=8,3, 1,8 Гц, 1H), 6,73 (д, J=7,8 Гц, 1H), 4,35-4,59 (м, 2H), 4,18-4,26 (м, 2H), 4,01-4,16 (м, 2H), 3,75-3,95 (м, 4H), 3,17-3,26 (м, 1H), 2,90 (т, J=6,6 Гц, 2H), 2,37-2,57 (м, 4H), 2,02-2,12 (м, 2H); ЖХ/МС m/z (M+H+) 584,0.
Следуя процедуре, описанной выше для примера 21, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,55 (д, J=3,3 Гц, 1H), 7,50 (с, 1H), 7,43-7,47 (м, 2H), 4,05-4,62 (м, 6H), 3,75 - 3,97 (м, 4H), 3,21 - 3,31 (м, 1H), 2,78 (т, J=6,6 Гц, 2H), 2,38-2,59 (м, 4H), 1,90-2,03 (м, 3H), 1,13-1,21 (м, 2H), 0,80-0,86 (м, 2H); ЖХ/МС m/z (M+H+) 480,0.
1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=3,0 Гц, 1H), 7,55 (д, J=3,3 Гц, 1H), 7,50 (с, 1H), 7,44 (дд, J=8,2, 1,6 Гц, 1H), 7,28-7,33 (м, 1H), 4,04-4,62 (м, 6H), 3,73-3,96 (м, 4H), 3,21-3,30 (м, 1H), 2,72-2,82 (м, 3H), 2,40-2,59 (м, 4H), 1,98 (квин, J=6,6 Гц, 2H), 1,71-1,83 (м, 4H), 1,49-1,70 (м, 2H), 1,10-1,36 (м, 4H); ЖХ/МС m/z (M+H+) 522,2.
1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=3,0 Гц, 1H), 7,74 (д, J=8,6 Гц, 1H), 7,55 (д, J=3,3 Гц, 1H), 7,51 (д, J=1,8 Гц, 1H), 7,40 (дд, J=8,6, 2,3 Гц, 1H), 4,03-4,61 (м, 6H), 3,78-3,96 (м, 4H), 3,21-3,29 (м, 1H), 2,95 (с, 3H), 2,89 (т, J=6,6 Гц, 2H), 2,40-2,59 (м, 4H), 1,97-2,08 (м, 2H); ЖХ/МС m/z (M+H+) 490,0.
1H ЯМР (400 МГц, CDCl3): δ 8,79 (д, J=2,0 Гц, 1H), 8,02 (д, J=2,3 Гц, 1H), 7,73 (д, J=8,6 Гц, 1H), 7,49 (с, 1H), 7,39 (дд, J=8,7, 2,1 Гц, 1H), 3,72-4,37 (м, 10H), 3,19-3,30 (м, 1H), 2,94 (с, 3H), 2,87 (т, J=6,6 Гц, 2H), 2,33-2,56 (м, 4H), 1,96-2,04 (м, 2H); ЖХ/МС m/z (M+H+) 490,0.
1H ЯМР (400 МГц, CDCl3): δ 7,73 (д, J=8,6 Гц, 1H), 7,49 (с, 1H), 7,35-7,44 (м, 6H), 4,00-4,36 (м, 4H), 3,64-3,97 (м, 4H), 3,48 (шс, 2H), 3,18-3,27 (м, 1H), 2,91-2,97 (м, 3H), 2,87 (т, J=6,6 Гц, 2H), 2,19-2,56 (м, 4H), 1,97-2,04 (м, 2H); ЖХ/МС m/z (M+H+) 483,0.
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,0 Гц, 1H), 7,55 (д, J=3,3 Гц, 1H), 7,48 (с, 1H), 7,39-7,44 (м, 1H), 7,24-7,28 (м, 1H), 4,01-4,63 (м, 6H), 3,78-3,97 (м, 2H), 3,67-3,76 (м, 2H), 3,48 (квин., J=8,4 Гц, 1H), 3,20-3,30 (м, 1H), 2,76 (т, J=6,3 Гц, 2H), 2,34-2,60 (м, 6H), 2,08 (м, 2H), 1,83-2,02 (м, 4H); ЖХ/МС m/z (M+H+) 494,0.
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,52-7,61 (м, 4H), 7,49 (д, J=8,1 Гц, 2H), 7,12-7,18 (м, 1H), 6,75-6,85 (м, 1H), 4,00-4,60 (м, 6H), 3,76-3,95 (м, 4H), 3,18-3,27 (м, 1H), 2,90 (т, J=6,6 Гц, 2H), 2,37-2,57 (м, 4H), 2,02-2,12 (м, 2H); ЖХ/МС m/z (M+H+) 584,0.
МС m/z (M+H+) 558,0
1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=3,3 Гц, 1H), 7,70-7,79 (м, 2H), 7,63-7,68 (м, 1H), 7,57-7,62 (м, 1H), 7,55 (д, J=3,3 Гц, 1H), 7,50 (с, 1H), 7,45 (шс, 1H), 7,26 (с, 1H), 4,94 (шс, 1H), 4,48-4,66 (м, 2H), 4,44 (шс, 1H), 3,97-4,36 (м, 5H), 3,75-3,96 (м, 2H), 3,65 (шс, 1H), 3,19-3,33 (м, 1H), 2,85-3,12 (м, 2H), 2,37-2,62 (м, 4H)
МС m/z (M+H+) 584,0
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,72 (д, J=7,6 Гц, 2H), 7,58 (д, J=7,6 Гц, 2H), 7,55 (д, J=3,3 Гц, 1H), 7,38-7,52 (м, 2H), 7,21-7,27 (м, 1H), 4,94 (шс, 1H), 4,48-4,65 (м, 2H), 4,43 (шс, 1H), 3,95-4,36 (м, 5H), 3,73-3,95 (м, 2H), 3,62 (шс, 1H), 3,19-3,32 (м, 1H), 2,85-3,10 (м, 2H), 2,38-2,59 (м, 4H)
МС m/z (M+H+) 584,0
МС m/z (M+H+) 590,0
МС m/z (M+H+) 516,0
МС m/z (M+H+) 522,0
МС m/z (M+H+) 505
Пример 22
1-(Фенилсульфонил)-6-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидрохинолин, соединение 366. К раствору соединения 357 (60 мг, 0,015 ммоль) в пиридине (1 мл) добавили соединение 22a (0,023 мл, 0,017 ммоль). Реакционную смесь перемешивали 2 часа при комнатной температуре. Полученную смесь концентрировали при пониженном давлении, остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/EtOAc + 0,5% Et3N), получив соединение 366 (66 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=3,3 Гц, 1H), 7,84 (д, J=8,3 Гц, 1H), 7,61-7,67 (м, 2H), 7,52-7,59 (м, 2H), 7,36-7,47 (м, 4H), 4,03-4,61 (м, 6H), 3,78-3,93 (м, 4H), 3,20-3,30 (м, 1H), 2,41-2,58 (м, 6H), 1,63-1,71 (м, 2H); ЖХ/МС m/z (M+H+) 552,0.
Следуя процедуре, описанной выше для примера 22, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 7,87-7,91 (м, 2H), 7,78-7,86 (м, 3H), 7,57-7,63 (м, 1H), 7,54-7,57 (м, 1H), 7,39-7,45 (м, 2H), 4,07-4,61 (м, 6H), 3,77-3,95 (м, 4H), 3,20-3,30 (м, 1H), 2,41-2,59 (м, 6H), 1,70 (квин., J=6,3 Гц, 2H); ЖХ/МС m/z (M+H+) 620,0.
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,0 Гц, 1H), 7,81 (д, J=8,3 Гц, 1H), 7,55 (д, J=3,0 Гц, 1H), 7,38-7,47 (м, 4H), 7,32-7,37 (м, 1H), 7,22-7,29 (м, 1H), 4,02-4,61 (м, 6H), 3,77-3,96 (м, 4H), 3,20-3,30 (м, 1H), 2,40-2,60 (м, 6H), 1,65-1,77 (м, 2H); ЖХ/МС m/z (M+H+) 570,0.
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,80-7,85 (м, 1H), 7,73-7,79 (м, 2H), 7,68-7,73 (м, 2H), 7,55 (д, J=3,3 Гц, 1H), 7,39-7,44 (м, 2H), 4,02-4,61 (м, 6H), 3,77-3,95 (м, 4H), 3,21-3,29 (м, 1H), 2,39-2,59 (м, 6H), 1,65-1,73 (м, 2H); ЖХ/МС m/z (M+H+) 620,0
МС m/z (M+H+) 552,0
МС m/z (M+H+) 619,8
МС m/z (M+H+) 558,0
Пример 23
1-Бензил-6-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидрохинолин, соединение 370. К раствору соединения 357 (30 мг, 0,0073 ммоль) в CH3CN (1 мл) добавили соединение 18a (0,01 мл, 0,0088 ммоль), и затем добавили K2CO3 (20 мг, 0,015 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Полученную смесь распределили между CH2Cl2 и H2O. Органический раствор сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 1% MeOH/EtOAc + 0,5% Et3N), получив cоединение 370 (14 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,54 (д, J=3,0 Гц, 1H), 7,38 (д, J=2,0 Гц, 1H), 7,30-7,36 (м, 2H), 7,19-7,30 (м, 4H), 6,44 (д, J=8,6 Гц, 1H), 4,54 (с, 2H), 3,97-4,52 (м, 6H), 3,77-3,96 (м, 2H), 3,40-3,47 (м, 2H), 3,15-3,24 (м, 1H), 2,83 (т, J=6,2 Гц, 2H), 2,38-2,59 (м, 4H), 1,98-2,05 (м, 2H); ЖХ/МС m/z (M+H+) 502,2.
Следуя процедуре, описанной выше для примера 23, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,0 Гц, 1H), 7,59 (д, J=8,3 Гц, 2H), 7,54 (д, J=3,0 Гц, 1H), 7,39 (с, 1H), 7,34 (д, J=8,1 Гц, 2H), 7,23-7,29 (м, 1H), 6,35 (д, J=8,6 Гц, 1H), 4,58 (с, 2H), 3,97-4,54 (м, 6H), 3,74-3,97 (м, 2H), 3,39-3,49 (м, 2H), 3,15-3,26 (м, 1H), 2,85 (т, J=6,1 Гц, 2H), 2,38-2,59 (м, 4H), 1,99-2,10 (м, 2H); ЖХ/МС m/z (M+H+) 570,0.
МС m/z (M+H+) 570,0.
МС m/z (M+H+) 570,0.
Пример 23а
2-Бензил-6-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидроизохинолин, соединение 680. Раствор соединения 916 (50 мг, 0,121 ммоль) и бензальдегида 23a (0,014 мл, 0,134 ммоль) в CH2Cl2 (2 мл) перемешивали при комнатной температуре в течение 30 минут. Затем добавили натрия триацетоксиборогидрид (38,6 мг, 0,182 ммоль) и перемешивали смесь в течение ночи. К полученной смеси добавили CH2Cl2 и H2O; pH водного слоя довели до рН~8, добавляя 1Н водный раствор NaOH. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. Остаток очистили с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/EtOAc), получив cоединение 680 (38,6 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=3,2 Гц, 1H), 7,55 (д, J=3,2 Гц, 1H), 7,32-7,44 (м, 6H), 7,3 (д, J=8,1 Гц, 1H), 7,02 (д, J=8,1 Гц, 1H), 4,33-4,63 (м, 2H), 3,99-4,34 (м, 4H), 3,75-3,98 (м, 2H), 3,70 (с, 2H), 3,65 (с, 2H), 3,16-3,30 (м, 1H), 2,93 (т, J=5,7 Гц, 2H), 2,76 (т, J=5,7 Гц, 2H), 2,37-2,60 (м, 4H). МС m/z (M+H+) 502,0.
Следуя процедуре, описанной выше для примера 23a, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 502,3
Пример 24
1-Фенил-6-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидрохинолин, cоединение 372. В сухой сосуд Шленка добавили смесь соединения l1 (30 мг, 0,0073 ммоль), ацетат палладия (II) (1 мг; 0,00037 ммоль), BINAP (3 мг; 0,00044 ммоль) и KOtBu (12 мг, 0,01 ммоль). Из сосуда, снабженного резиновой пробкой с тефлоновым покрытием, удалили воздух и заполнили его аргоном. Бромбензол (14 мг, 0,0088 ммоль) и толуол (0,8 мл) добавили к реакционной смеси с помощью шприца. Реакционную смесь нагревали при 110°C в течение 21 часа. Полученную смесь разбавили CH2Cl2 и последовательно промыли насыщенным NH4Cl (водн.) и H2O. Органическую фазу высушили над Na2SO4, профильтровали и сконцентрировали. Остаток очистили препаративной ТСХ (силикагель, 2% MeOH/EtOAc + 0,5% Et3N), получив cоединение 372 (1,3 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,55 (д, J=3,0 Гц, 1H), 7,36-7,45 (м, 3H), 7,14-7,26 (м, 4H), 6,55 (д, J=8,6 Гц, 1H), 3,98-4,64 (м, 6H), 3,74-3,96 (м, 2H), 3,61-3,72 (м, 2H), 3,16-3,27 (м, 1H), 2,88 (т, J=6,3 Гц, 2H), 2,37-2,61 (м, 4H), 2,05-2,13 (м, 2H); ЖХ/МС m/z (M+H+) 488,0.
Следуя процедуре, описанной выше для примера 24, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=3,3 Гц, 1H), 7,60 (д, J=8,3 Гц, 2H), 7,55 (д, J=3,0 Гц, 1H), 7,46 (с, 1H), 7,33 (д, J=8,3 Гц, 2H), 7,24 (дд, J=8,7, 2,1 Гц, 1H), 6,84 (д, J=8,6 Гц, 1H), 4,01-4,62 (м, 6H), 3,75-3,98 (м, 2H), 3,64-3,73 (м, 2H), 3,18-3,30 (м, 1H), 2,87 (т, J=6,3 Гц, 2H), 2,36-2,62 (м, 4H), 2,02-2,12 (м, 2H); ЖХ/МС m/z (M+H+) 556,0.
1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J=3,0 Гц, 1H), 7,55 (д, J=3,0 Гц, 1H), 7,37-7,52 (м, 5H), 7,22 (дд, J=8,6, 2,0 Гц, 1H), 6,66 (д, J=8,6 Гц, 1H), 4,03-4,59 (м, 6H), 3,74-3,96 (м, 2H), 3,61-3,72 (м, 2H), 3,18-3,27 (м, 1H), 2,89 (т, J=6,3 Гц, 2H), 2,37-2,60 (м, 4H), 2,03-2,14 (м, 2H); ЖХ/МС m/z (M+H+) 556,0.
1H ЯМР (400 МГц, CDCl3): δ 8,46 (д, J=4,8 Гц, 2H), 7,89 (д, J=3,0 Гц, 1H), 7,83 (д, J=8,6 Гц, 1H), 7,55 (д, J=3,3 Гц, 1H), 7,50 (с, 1H), 7,41 (дд, J=8,6, 2,0 Гц, 1H), 6,75 (т, J=4,8 Гц, 1H), 4,06-4,61 (м, 6H), 3,99-4,06 (м, 2H), 3,77-3,96 (м, 2H), 3,18-3,29 (м, 1H), 2,83 (т, J=6,4 Гц, 2H), 2,39-2,59 (м, 4H), 1,99-2,07 (м, 2H); ЖХ/МС m/z (M+H+) 490,0.
МС m/z (M+H+) 488,1
МС m/z (M+H+) 490,0
МС m/z (M+H+) 489,0
МС m/z (M+H+) 490,1
Пример 25
A. 1-Ацетил-6-бром-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты метиловый эфир, 25b. К раствору соединения 25а (100 мг, 0,37 ммоль) в CH2Cl2 (5 мл) добавили ацетилхлорид (0,1 мл) и пиридин (0,1 мл). Реакционную смесь перемешивали 2 часа при комнатной температуре. Полученную смесь распределили между CH2Cl2 и H2O. Органическую фазу сушили над Na2SO4, отфильтровывали, концентрировали и получили соединение 25b (116 мг), которое использовали в следующей стадии без дополнительной очистки. ЖХ/МС m/z 312,0 (M+H+), 314,0 (M+2H+).
B. 1-Ацетил-6-бром-1,2,3,4-тетрагидрохинолин-2-карбоновая кислота, 25c. К раствору соединения 25b (116 мг, 0,37 ммоль) в THF/MeOH/H2O (2/2/2 мл) добавили LiOH (62 мг, 1,48 ммоль). Реакционную смесь перемешивали 3 часа при комнатной температуре. Полученную смесь концентрировали при пониженном давлении, распределяли между CH2Cl2 и H2O; довели рН водной фазы до 5, добавляя 2N HCl (водн). Органическую фазу сушили над Na2SO4, отфильтровывали, концентрировали при пониженном давлении и получили соединение 25с, которое использовали в следующей стадии без дополнительной очистки. ЖХ/МС m/z 298,0 (M+H+), 300,0 (M+2H+).
C. 1-Ацетил-6-бром-2-({3-[4-(трифторацетил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидрохинолин, 25г. К раствору соединения 1g (228 мг, 0,74 ммоль), соединения 25c (22 мг, 0,74 ммоль) и Et3N (0,3 мл, 2,22 ммоль) в CH2Cl2 (7 мл) добавили HATU (338 мг, 0,89 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Полученную смесь разбавили CH2Cl2 и промыли водным раствором NaHCO3. Органическую фазу сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с использованием колоночной флеш-хроматографии (силикагель, 2% MeOH/EtOAc + 0,5% Et3N), получив соединение 25d (265 мг). ЖХ/МС m/z (M+H+), 517,0 (M+2H+), 519,0.
D. 1-Ацетил-6-бром-2-({3-[пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидрохинолин, 25e. К раствору соединения 25d (261 мг, 0,505 ммоль) в MeOH (3 мл) добавили K2CO3 (140 мг, 1,01 ммоль). Реакционную смесь перемешивали 30 минут при комнатной температуре. Полученную смесь отфильтровывали, фильтрат концентрировали при пониженном давлении и полученный остаток распределили между CH2Cl2 и H2O. Органическую фазу сушили над Na2SO4, отфильтровывали, концентрировали при пониженном давлении и получили соединение 25e (158 мг). ЖХ/МС m/z (M+H+) 421,0, (M+2H+) 423,0.
E. 1-Ацетил-6-бром-2-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,2,3,4-тетрагидрохинолин, соединение 376. Названное соединение получили способом, аналогичным способу получения соединения 357, используя соединение 25e вместо соединения 20c. ЖХ/МС m/z (M+H+) 532,0, (M+2H+) 534,0.
Следуя процедуре, описанной выше для примера 25, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
ЖХ/МС m/z (M+H+) 532,0, (M+2H+) 534,0.
ЖХ/МС m/z (M+H+) 525,0, (M+2H+) 527,0.
Пример 26
A. Трет-бутил 3-(4-бензоил-пиперазин-1-ил)-азетидин-1-карбоксилат, 4b. К раствору соединения 2а (5 г) и соединения 4а (6,75 г) в 1,2-дихлорэтане (50 мл) добавили уксусную кислоту (1,0 мл) и молекулярные сита 4Å. Полученную смесь перемешивали в течение 2 часов, добавив за это время NaBH(OAc)3 (11 г) в три приема. Смесь перемешивали 18 часов, вылили в 2N КОН (водн., 50 мл), а затем экстрагировали EtOAc (3 раза). Объединенные органические экстракты сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с использованием колоночной флеш-хроматографии (5% MeOH/CH2Cl2), получив соединение 4b (11,6 г).
B. 3-(4-Бензоил-пиперазин-1-ил)-азетидин, гидрохлорид 2c. К раствору соединения 4b (5,1 г) в CH2Cl2 (20 мл) добавили TFA (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Растворители удалили при пониженном давлении. Полученный остаток растворили в CH2Cl2 (5 мл) и добавили к смеси 4M HCl в диоксане (3,67 мл). Полученный осадок отфильтровали, промыли эфиром, высушили при пониженном давлении и получили соединение 2c в виде гидрохлорида (4,0 г).
C. 4-Ацетоксибензоилхлорид, 26b. К раствору соединения 26a (200 мг, 1,11 ммоль) в THF (5 мл) добавили оксалилдилорид (97 мкл, 1,11 ммоль) по каплям, при 0°C, и затем добавили 2 капли DMF. Полученную смесь перемешивали при 0°C в течение 3 часов и затем нагрели до комнатной температуры в течение 18 часов. Растворители упарили при пониженном давлении и полученный остаток, неочищенное соединение 26b, сушили 2 часа при пониженном давлении, а затем использовали в следующей реакции без дальнейшей очистки.
D. 4-({3-[4-(Фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)фенилацетат (26c). К смеси солянокислой соли соединения 2c (373 мг, 1,33 ммоль), Et3N (0,5 мл) и CH2Cl2 (5 мл) добавили раствор соединения 26b вCH2Cl2 (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель упарили при пониженном давлении, остаток растворили в CH2Cl2 (1 мл), а затем очистили с использованием колоночной флеш-хроматографии (силикагель, 5% MeOH/CH2Cl2), получив соединение 26с (442 мг).
E. 4-({3-[4-(Фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)фенол, 26d. Смесь соединения 26c (420 мг, 1,03 ммоль) и LiOH (100 мг, 4,0 ммоль) в смеси растворителей THF/MeOH/H2O (2/2/2 мл) перемешивали 4 часа при комнатной температуре, а затем подкислили до pH 5 добавлением 2N HCl (водн). Смесь экстрагировали EtOAc (3 раза). Объединенные экстракты сушили над Na2SO4, отфильтровывали и упаривали при пониженном давлении. Полученный остаток (неочищенное соединение 26d) сушили 18 часов при пониженном давлении и использовали в следующей реакции без дальнейшей очистки.
F. 1-[1-({4-[(3,4-Дихлорбензил)окси]фенил}карбонил)азетидин-3-ил]-4-(фенилкарбонил)пиперазин, соединение 379. Смесь соединения 26d (70 мг, 0,191 ммоль), K2CO3 (53 мг, 0,382 ммоль), соединения 26e (68 мг, 0,287 ммоль) и DMF (3 мл) перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавили воду и смесь экстрагировали EtOAc (3 раза). Объединенные органические экстракты высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Полученный остаток очистили с использованием колоночной флеш-хроматографии, элюирование проводилось 5% MeOH/CH2Cl2 для получения соединения 379 (83 мг). 1H ЯМР (CDCl3): δ 7,59-7,64 (д, J=8,8 Гц, 2H), 7,53 (д, J=2,0 Гц, 1H), 7,455 (д, J=8,0 Гц, 1H), 7,37-7,44 (м, 5H), 7,23-7,28 (м, 2H), 6,955 (д, J=8,84 Гц, 2H), 5,05 (с, 2H), 4,31 (шс, 1H), 4,11-4,27 (м, 2H), 4,00-4,10 (м, 1H), 3,91 (шс, 1H), 3,64-3,82 (м, 1H), 3,48 (шс, 2H), 3,18-3,27 (м, 1H), 2,42 (шс, 4H). МС m/z (M+H+) 524,0.
Следуя процедуре, описанной выше для примера 26, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (CDCl3): δ 7,80-7,88 (м, 4H), 7,59-7,64 (м, J=8,8 Гц, 2H), 7,45-7,53 (м, 3H), 7,36-7,43 (м, 5H), 7,00 (д, J=8,8 Гц, 2H), 5,22 (с, 2H), 4,24-4,32 (м, 1H), 4,08-4,24 (м, 2H), 4,03 (шс, 1H), 3,60-3,79 (м, 1H), 3,31-3,52 (м, 2H), 3,10-3,22 (м, 1H), 2,38 (шс, 4H).
МС m/z (M+H+) 506,2
1H ЯМР (CDCl3): δ 7,625 (д, J=8,4 Гц, 2H), 7,44 (дд, J=8,0, 2,1 Гц, 2H), 7,37-7,41 (м, 5H), 7,23 (т, J=8,1, 1H), 6,97(д, J=8,8 Гц, 2H), 5,18 (с, 2H), 4,26-4,36 (м, 1H), 4,12-4,26 (м, 2H), 4,07 (шс, 1H), 3,88 (шс, 1H), 3,74 (шс, 1H), 3,47 (шс, 2H), 3,14-3,27 (м, 1H), 2,41 (шс, 3H), 2,22 (с, 1H).
МС m/z (M+H+) 524,0
МС m/z (M+H+) 474,2
МС m/z (M+H+) 524,2
МС m/z (M+H+) 490,2
МС m/z (M+H+) 524,1
МС m/z (M+H+) 481,2
МС m/z (M+H+) 504,2
МС m/z (M+H+) 488,2
МС m/z (M+H+) 556,2
МС m/z (M+H+) 540,2
МС m/z (M+H+) 490,2
МС m/z (M+H+) 508,2
МС m/z (M+H+) 540,2
МС m/z (M+H+) 605,2
МС m/z (M+H+) 542,2
МС m/z (M+H+) 457,2
Пример 27
A. Метил-4-(3-хлорбензилокси)-3-хлорбензоат, 27c. Смесь соединения 27а (500 мг, 2,7 ммоль), соединения 27b (0,53 мл, 4,03 ммоль) и K2CO3 (745 мг, 5,4 ммоль) в DMF перемешивали 18 часов при комнатной температуре. К реакционной смеси добавили воду и смесь экстрагировали EtOAc (3 раза). Объединенные органические экстракты сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Полученный остаток очищали с использованием колоночной флеш-хроматографии на силикагеле, элюируя [смесью] 30% EtOAc/гексан и получили соединение 27c (662 мг).
B. 4-(3-Хлорбензилокси)-3-хлорбензойная кислота, 27d. Смесь соединения 27c (662 мг, 2,0 ммоль) и LiOH (192 мг, 8 ммоль) в смеси растворителей THF/MeOH/H2O (3/3/3 мл) перемешивали при комнатной температуре в течение 4 часов, а затем подкислили раствором 15% лимонной кислоты в H2O. Смесь экстрагировали EtOAc (3 раза) и объединенные экстракты промыли последовательно водой и насыщенным раствором соли. Экстракты сушили над Na2SO4, отфильтровывали и упаривали при пониженном давлении. Полученное неочищенное соединение 3b сушили при пониженном давлении в течение 18 часов и использовали в следующей реакции без дальнейшей очистки.
C. 4-(3-Хлорбензилокси)-3-хлорбензоилхлорид, 27e. К раствору соединения 27d (67 мг, 0,33 ммоль) в THF (2 мл) добавили оксалилдихлорид (43 мкл, 0,50 ммоль) по каплям при 0°C, и затем добавили 2 капли DMF. Полученную смесь перемешивали при 0°C в течение 3 часов и затем нагревали до комнатной температуры в течение 18 часов. Растворители удалили при пониженном давлении. Полученный остаток неочищенного соединения 27e сушили при пониженном давлении в течение 2 часов и использовали в последующей реакции без дальнейшей очистки.
D. 1-[1-({3-Хлор-4-[(3-хлорбензил)окси]фенил}карбонил)азетидин-3-ил]-4-(фенилкарбонил)пиперазин, соединение 397. К смеси соединения 2c (84 мг, 0,30 ммоль), Et3N (0,5 мл) и CH2Cl2 (2,5 мл) добавили раствор соединения 27e в CH2Cl2 (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель удалили при пониженном давлении. Полученный остаток растворили в CH2Cl2 (1 мл), нанесли на колонку с силикагелем и очистили с использованием колоночной флеш-хроматографии, элюируя смесью 5% MeOH/CH2Cl2, получив соединение 397 (32 мг). 1H ЯМР (CDCl3): δ 7,695 (д, 1H, J= 2,0 Гц), 7,515 (дд, 1H, J1= 2,0 Гц, J2= 8,6 Гц), 7,44 (с, 1H), 7,38-7,43 (м, 5H), 7,30-7,35 (м, 3H), 6,91-6,97 (д, 1H, J= 8,6 Гц), 5,15 (с, 2H), 4,26-4,37 (м, 1H), 4,15-4,26 (м, 2H), 3,84-3,98 (м, 1H), 3,68-3,82 (м, 1H), 3,48 (шс, 2H), 3,18-3,29 (м, 1H), 2,56-2,16 (м, 4H). МС m/z (M+H+) 524,0.
Следуя процедуре, описанной выше для примера 27, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (CDCl3): δ 8,64 (д, J=5,8 Гц, 2H), 7,2(д, J=2,0 Гц, 1H), 7,53 (дд, J1s=2,1, 8,4 Гц, 1H), 7,36-7,45 (м, 7H), 6,88-6,95 (д, J=8,6 Гц, 1H), 5,19 (с, 2H), 4,27-4,37 (м, 1H), 4,11-4,27 (м, 2H), 3,99-4,08 (м, 1H), 3,81-3,96 (м, 1H), 3,73 (шс, 1H), 3,48 (шс, 2H), 3,17-3,30 (м, 1H), 2,41 (шс, 4H).МС m/z (M+H+) 498,0
1H ЯМР (CDCl3): δ 7,70 (д, J=2,0 Гц, 1H), 7,56 (с, 1H), 7,53 (дд, J=8,6, 2,0 Гц, 1H), 7,48 (д, J=8,2 Гц, 1H), 7,37-7,44 (м, 5H), 7,28-7,32 (м, 1H), 6,93 (д, J=8,2 Гц, 1H), 5,14 (с, 2H), 4,28-4,37 (м, 1H), 4,12-4,27 (м, 2H), 4,05 (шс, 1H), 3,91 (шс, 1H), 3,74 (шс, 1H), 3,49 (шс, 2H), 3,16-3,27 (м, 1H), 2,42 (шс, 4H).
МС m/z (M+H+) 558,0
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,53-7,57 (м, 2H), 7,41-7,48 (м, 2H), 7,39 (дд, J=8,5, 1,1 Гц, 1H), 7,25-7,30 (м, 1H), 6,97 (т, J=8,3 Гц, 1H), 5,12 (с, 2H), 4,52 (уш. д, J=33,8 Гц, 1H), 4,37-4,47 (м, 1H), 4,32 (д, J=6,8 Гц, 1H), 4,15-4,28 (м, 2H), 4,07 (д, J=8,3 Гц, 1H), 3,85 (д, J=17,4 Гц, 2H), 3,20-3,28 (м, 1H), 2,48 (т, J=4,8 Гц, 4H).
МС m/z (M+H+) 549,0.
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,71 (д, J=2,0 Гц, 1H), 7,50-7,57 (м, 2H), 7,45 (с, 1H), 7,30-7,35 (м, 3H), 6,95 (д, J=8,6 Гц, 1H), 5,17 (с, 2H), 4,43 (шс, 1H), 4,28-4,38 (м, 1H), 4,17-4,28 (м, 1H), 4,03-4,15 (м, 2H), 3,85 (д, J=19,5 Гц, 2H), 3,19-3,29 (м, 1H), 2,48 (м, 4H).
МС m/z (M+H+) 531,0
1H ЯМР (CDCl3): δ 8,71 (с, 1H), 8,61 (д, J=3,5 Гц, 1H), 7,88 (д, J=3,0 Гц), 1H), 7,84 (д, J=7,8 Гц, 1H), 7,72 (д, J=2,3 Гц, 1H), 7,56 (д, J=2,0 Гц, 1H), 7,55 (д, J=3,6 Гц, 1H), 7,36 (дд, J=7,8, 4,8 Гц, 1H), 7,00 (д, J=8,6 Гц, 1H), 5,21 (с, 2H), 4,52 (шс, 1H), 4,43 (ш. с, 1H), 4,32 (м, 1H), 4,16-4,29 (м, 2Н), 4,03-4,16 (м, 1H), 3,76-3,95 (м, 2Н), 3,20-3,30 (м, 1H), 2,57-2,36 (м, 4H).
МС m/z (M+H+) 498,0.
1H ЯМР (CDCl3): δ 8,63 (д, J=5,8 Гц, 2H), 7,88 (д, J=3,0 Гц, 1H), 7,63 (д, J=8,8 Гц, 2H), 7,55 (д, J=3,3 Гц, 1H), 7,36 (д, J=6,1 Гц, 2H), 6,96 (д, J=8,84 Гц, 2H), 5,14 (с, 2H), 4,52 (шс, 1H), 4,43 (шс, 1H), 4,36-4,29 (м, 1H), 4,16-4,29 (м, 2H), 4,04-4,16 (м, 1H), 3,75-3,93 (м, 2H), 3,18-3,28 (м, 1H), 2,37-2,58 (м, 4H).
МС m/z (M+H+) 464,0
1H ЯМР (CDCl3): δ 7,88 (д, J=3,0 Гц, 1H), 7,71 (д, J=2,0 Гц, 1H), 7,51-7,58 (м, 3H), 7,47 (дд, J=8,3, 4,0 Гц, 1H), 7,30 (дд, J=8,1, 2,0 Гц, 1H), 6,94 (д, J=8,6 Гц, 1H), 5,14 (с, 2H), 4,52 (шс, 1H), 4,37 (шс, 1H), 4,29-4,37 (м, 1H), 4,22 (шс, 2H), 4,01-4,14 (м, 1H), 3,88 (шс, 2H), 3,19-3,32 (м, 1H), 2,40-2,55 (м, 4H)
МС m/z (M+H+) 564,6; 566,8
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,55 (д, J=3,3 Гц, 1H), 7,50 (д, J=7,8 Гц, 1H), 7,47 (с, 1H), 7,43-7,46 (м, 1H), 7,40 (дд, J=8,6, 1,3 Гц, 1H), 7,28 (д, J=2,3 Гц, 1H), 7,25 (д, J=7,8 Гц, 1H), 7,00 (т, J=8,3 Гц, 1H), 5,28 (с, 2H), 4,49 (д, J=33,2 Гц, 2H), 4,31-4,39 (м, 1H), 4,22 (шс, 2H), 4,03-4,16 (м, 1H), 3,88 (шс, 2H), 3,19-3,31 (м, 1H), 2,40-2,58 (м, 4H).
МС m/z (M+H+) 549,0
1H ЯМР (CDCl3): δ 8,59 (д, J=4,5 Гц, 1H), 7,76 (дд, J=1,5, 7,6 Гц, 1H), 7,73 (д, J=2,0 Гц, 1H), 7,61 (д, J=7,8 Гц, 1H), 7,50 (дд, J=8,6, 2,0 Гц, 1H), 7,37-7,44 (м, 5H), 7,25 (дд, J=6,9, 5,2 Гц, 1H), 7,00 (д, J=8,6 Гц, 1H), 5,28-5,35 (м, 2H), 4,27-4,37 (м, 1H), 4,12-4,27 (м, 2H), 3,99-4,12 (м, 1H), 3,89 (шс, 1H), 3,74 (шс, 1H), 3,47 (шс, 2H), 3,17-3,27 (м, 1H), 2,42 (шс, 3H), 2,27 (шс, 1H).
1H ЯМР (CDCl3): δ 8,54 (шс, 1H), 8,49 (шс, 1H), 7,62-7,68 (м, 1H), 7,53 (д, J=8,6 Гц, 2H), 7,37-7,44 (м, 5H), 7,29 (д, J=9,1 Гц, 2H), 7,23 (дд, J=7,8, 4,8 Гц, 1H), 4,17-4,32 (м, 2H), 4,09-4,17 (м, 3H), 4,00- 4,08 (м, 1H), 3,89 (шс, 1H), 3,74 (шс, 1H), 3,47 (шс, 2H), 3,15-3,28 (м, 1H), 2,41 (шс, 3H), 2,17 (шс, 1H)
МС m/z (M+H+) 498,0
МС m/z (M+H+) 491,2
МС m/z (M+H+) 491,2
МС m/z (M+H+) 508,2
МС m/z (M+H+) 542,1
МС m/z (M+H+) 542,1
МС m/z (M+H+) 616,1
МС m/z (M+H+) 496,0
МС m/z (M+H+) 507,0
МС m/z (M+H+) 535,0
МС m/z (M+H+) 497,0
МС m/z (M+H+) 503,0
МС m/z (M+H+) 514,0
МС m/z (M+H+) 543,8
МС m/z (M+H+) 497,0
МС m/z (M+H+) 503,0
МС m/z (M+H+) 514,0
МС m/z (M+H+) 542,0
Пример 27а
E. Метиловый эфир 4-((5-хлорпиридин-3-ил)метокси)бензойной кислоты, 27b. К охлажденному на ледяной бане раствору метилового эфира 4-гидроксибензойной кислоты 29а (2,35 ммоль, 358 мг), (5-хлорпиридин-3-ил)метанола 27а (1,57 ммоль, 225 мг) и Ph3P (2,35 ммоль, 616 мг) в 8 мл THF добавили DIAD (2,35 ммоль, 0,45 мл). Смесь перемешивали 1 час при 0ºС и в течение ночи при комнатной температуре. Реакционную смесь разбавили водой, неочищенный продукт очистили с использованием колоночной флеш-хроматографии (силикагель, смесь 20% EtOAc/гексан), получив 27b (300 мг, 68%).
F. 4-((5-Хлорпиридин-3-ил)метокси)бензойная кислота, 27c. Соединение 27b (1,22 ммоль, 340 мг) смешали с LiOH (4,9 ммоль, 118 мг) в 3 мл THF, 3 мл MeOH и 3 мл воды. Смесь перемешивали 4 часа при комнатной температуре, добавили к ней 15% водный раствор лимонной кислоты, а затем экстрагировали EtOAc. Экстракты промыли водой и насыщенным раствором соли, высушили над Na2SO4, упарили в вакууме, получив 288 мг соединения 27c.
Следуя процедуре, описанной выше для примера 1 или примера 27, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 491,0
МС m/z (M+H+) 498,0
МС m/z (M+H+) 498,0
Пример 27b
Следуя процедуре, описанной выше для примера 1c, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 482,0
МС m/z (M+H+) 488,0
МС m/z (M+H+) 499,0
МС m/z (M+H+) 535,0
Пример 28
A. Метиловый эфир 4-(3-хлорбензилсульфанил)бензойной кислоты, 28b. Названное соединение 28c получили способом, описанным в примере 27, используя соединение 28а вместо соединения 27а на стадии А.
B. 4-(3-Хлорбензилсульфанил)бензойная кислота, 28c. Названное соединение 28c получили способом, описанным в примере 27, используя соединение 28b вместо соединения 27c на стадии B.
C. 4-(3-Хлорбензилсульфанил)бензоилхлорид, 28d. Названное соединение 28d получили способом, описанным в примере 27, используя соединение 28c вместо соединения 27d на стадии C.
D. 1-[1-({4-[(3-Хлорбензил)сульфанил]фенил}карбонил)азетиди-3-ил]-4-(фенилкарбонил)пиперазин, соединение 410. Названное соединение 410 получили способом, описанным в примере 27, используя соединение 28d вместо соединения 27e на стадии D. 1H ЯМР (CDCl3): δ 7,52 (д, J=8,6 Гц, 2H), 7,37-7,44 (м, 5H), 7,24-7,29 (м, 3H), 7,18-7,24 (м, 3H), 4,18-4,33 (м, 2H), 4,09-4,17 (м, 3H), 4,01-4,08 (м, 1H), 3,92 (ш с, 1H), 3,74 (шс, 1H), 3,35-3,63 (м, 2Н), 3,17-3,29 (м, 1H), 2,20-2,50 (м, 4Н); MС m/z (M+H+) 506,0.
Следуя процедуре, описанной выше для примера 28, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (CDCl3): δ 7,52 (д, J=8,3 Гц, 2H), 7,38-7,43 (м, 5H), 7,29 (д, J=8,6 Гц, 2H), 7,27 (д, J=7,1 Гц, 1H), 7,2 (д, J=7,4 Гц, 1H), 7,11 (q, J=7,8 Гц, 1H), 4,24-4,38 (м, 4H), 4,22 (шс, 1H), 4,12-4,21 (м, 1H), 4,02-4,12 (м, 1H), 3,91 (шс, 1H), 3,77 (шс, 1H), 3,47 (с, 2H), 3,15-3,29 (м, 1H), 2,44 (шс, 4H).
МС m/z (M+H+) 540,0
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,49-7,57 (м, 3H), 7,25-7,30 (м, 3H), 7,18-7,25 (м, 3H), 4,51 (шс, 2H), 4,21-4,34 (м, 2H), 4,03-4,21 (м, 4H), 3,72-3,94 (м, 2H), 3,18- 3,29 (м, 1H), 2,35-2,59 (м, 4H).
МС m/z (M+H+) 513,0
1H ЯМР (CDCl3): δ 7,88 (д, J=3,0 Гц, 1H), 7,50-7,57 (м, 3H), 7,38 (дд, J=7,8, 1,5 Гц, 1H), 7,26-7,33 (м, 3H), 7,22 (дд, J=7,7, 1,4 Гц, 1H), 7,11 (т, J=7,8 Гц, 1H), 4,44 (уш. д, J=32,6 Гц, 2H), 4,22-4,35 (м, 4H), 4,15-4,22 (м, 1H), 4,04-4,15 (м, 1H), 3,85 (д, J=17,4 Гц, 2H), 3,19-3,29 (м, 1H), 2,37-2,56 (м, 4H).
МС m/z (M+H+) 547,0.
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,54 (д, J=3,3 Гц, 2H), 7,51-7,53 (м, 1H), 7,40 (д, J=2,0 Гц, 1H), 7,36 (д, J=8,3 Гц, 1H), 7,24-7,29 (м, 3H), 7,13-7,17 (м, 1H), 4,48-4,59 (м, 1H), 4,35-4,48 (м, 1H), 4,20-4,34 (м, 2H), 4,13-4,20 (м, 1H), 4,01-4,13 (м, 4H), 3,79-3,94 (м, 2H), 3,19- 3,29 (м, 1H), 2,37-2,57 (м, 4H).
МС m/z (M+H+) 547,0.
1H ЯМР (CDCl3): δ 7,87 (д, J=3,3 Гц, 1H), 7,55 (д, J=3,3 Гц, 1H), 7,53 (д, J=8,6 Гц, 2H), 7,27-7,29 (м, 2H), 7,24-7,27 (м, 4H), 4,51 (шс, 1H), 4,35-4,47 (м, 1H), 4,20-4,33 (м, 2H), 4,02-4,20 (м, 4H), 3,76-3,93 (м, 2H), 3,18-3,28 (м, 1H), 2,38-2,54 (м, 4H).
МС m/z (M+H+) 513,0
1H ЯМР (CDCl3): δ 8,55(с, 1H), 8,48 (с, 1H), 7,82-7,93 (м, 1H), 7,65 (шс, 1H), 7,47-7,60 (м, 3H), 7,18-7,36 (м, 3H), 4,44 (д, J=33,9 Гц, 2H), 4,03-4,32 (м, 5H), 3,86 (шс, 2H), 3,23 (шс, 1H), 2,47 (шс, 4H)
МС m/z (M+H+) 540,1
МС m/z (M+H+) 506,2
МС m/z (M+H+) 473,0
МС m/z (M+H+) 540,0
МС m/z (M+H+) 547,0
МС m/z (M+H+) 531,8
Пример 28а
Следуя процедуре, описанной выше для примера 1с, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 532,0
Пример 29
A. Метил-4-(3-трифторметил-фенокси)-бензоат, 29c. К раствору соединения 29a (400 мг, 2,63 ммоль) и соединения 29b (1,0 г, 5,26 ммоль) в CH2Cl2 (24 мл) добавили Cu(OAc)2 (714 мг, 3,94 ммоль), сито 4Å (400 мг, порошок, активированный), пиридин (2 мл) и Et3N (2 мл). Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 дней. К смеси добавили воду и отфильтровали. Фильтрат экстрагировали с помощью EtOAc (3 раза), объединенные органические фазы высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Остаток очистили с использованием колоночной флеш-хроматографии на силикагеле, элюируя с помощью 20% EtOAc/гексана с получением соединения 29c (470 мг).
B. 4-(3-Трифторметил-фенокси)-бензойная кислота (29d). Смесь соединения 29c (577 мг, 1,95 ммоль) с LiOH (187 мг, 7,80 ммоль) в THF/MeOH/H2O (4/4/4 мл) перемешивали в течение 4 часов. Добавили 15% раствор лимонной кислоты (20 мл), затем смесь экстрагировали с помощью EtOAc (3 раза). Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Остаток, соединение 29d, высушивали при пониженном давлении в течение 18 часов и использовали без очистки.
C. 4-(3-Трифторметил-фенокси)-бензоилхлорид, 29e. К раствору соединения 29d (100 мг, 0,35 ммоль) в THF (2 мл) добавили по каплям оксалилдихлорид (46 мкл, 0,53 ммоль) при 0oC с последующим добавлением 2 капель DMF. Полученную смесь перемешивали при 0oC в течение 3 часов и оставили нагреваться до комнатной температуры в течение ночи. Растворители удалили при пониженном давлении; остаток, соединение 29e, высушивали при пониженном давлении в течение 2 часов и затем использовали в следующей стадии без дополнительной очистки.
D. 1-(Фенилкарбонил)-4-[1-({4-[3-(трифторметил)фенокси]фенил}карбонил)азетидин-3-ил]пиперазин, соединение 419. К смеси соединения 2c (80 мг, 0,32 ммоль), Et3N (0,5 мл) и CH2Cl2 (2,5 мл) добавили раствор соединения 29e в CH2Cl2 (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель удалили при пониженном давлении, полученный остаток растворили в CH2Cl2 (1 мл), загруженном непосредственно в колонку с силикагелем и очистили с использованием колоночной флеш-хроматографии на силикагеле, элюируя с помощью 5% MeOH/CH2Cl2, с получением соединения 419 (53 мг). 1H ЯМР (CDCl3): δ 7,65 (д, J=8,6 Гц, 2H), 7,45-7,53 (м, 1H), 7,41 (шс, 6H), 7,25-7,34 (м, 1H), 7,17-7,25 (м, 1H), 7,01 (д, J=7,3 Гц, 2H), 4,17-4,38 (м, 3H), 4,11 (шс, 1H), 3,92 (шс, 1H), 3,78 (шс, 1H), 3,49 (шс, 2H), 3,19-3,32 (м, 1H), 2,45 (шс, 4H). МС m/z (M+H+) 510,0.
Следуя процедуре, описанной выше для примера 29, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (CDCl3): δ 7,88 (д, J=3,0 Гц, 1H), 7,64 (д, J=8,6 Гц, 2H), 7,55 (д, J=3,0 Гц, 1H), 7,33 (д, J=8,8 Гц, 2H), 6,98 (д, J=8,8 Гц, 4H), 4,52 (шс, 1H), 4,38-4,48 (ш с, 1H); 4,15-4,37 (м, 3H); 4,10 (шс, 1H); 3,88 (шс, 1H); 3,82 (шс, 1H); 3,19-3,31 (м, 1H); 2,35-2,60 (м, 4H).
МС m/z (M+H+) 483,1
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,65 (тт, J1=2 Гц, J2=8,8 Гц, 2H), 7,545 (д, J=3,3 Гц, 1H), 7,26-7,30 (м, 1H), 7,14 (дт, J=8,1, 1,0 Гц, 1H), 6,98-7,06 (м, 3H), 6,93-6,95 (м, 1H), 6,91-6,95 (м, 1H), 4,56 (шс, 1H), 4,43 (шс, 1H), 4,17-4,38 (м, 3H), 4,04-4,16 (м, 1H), 3,75-3,96 (м, 2H), 3,20-3,31 (м, 1H), 2,39-2,60 (м, 4H).
МС m/z (M+H+) 483,0
1H ЯМР (CDCl3): δ 7,65 (д, J=8,6 Гц, 2H), 7,37-7,46 (м, 6H), 7,12 (д, J=2,8 Гц, 1H), 7,00 (д, J=8,8 Гц, 2H), 6,89 (дд, J=8,8, 2,8 Гц, 1H), 4,16-4,37 (м, 3H), 4,10 (шс, 1H), 3,92 (шс, 1H), 3,68-3,84 (м, 1H), 3,46 (с, 2H), 3,19-3,30 (м, 1H), 2,44 (шс, 4H).
МС m/z (M+H+) 510,0
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,66 (д, J=8,8 Гц, 2H), 7,55 (д, J=3,3 Гц, 1H), 7,42 (d J=8,8 Гц, 1H), 7,13 (д, J=2,8 Гц, 1H), 7,0(д, J=8,6 Гц, 2H), 6,90 (дд, J=8,8, 2,8 Гц, 1H), 4,53 (шс, 1H), 4,44 (ш с, 1H); 4,17-4,38 (м, 3H); 4,11 (дд, J=9,0, 4,7 Гц, 1H); 3,88 (шс, 1H); 3,83 (шс, 1H); 3,20-3,32 (м, 1H); 2,50 (т, J=4,7 Гц, 4H).
МС m/z (M+H+) 517,0
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,67 (д, J=8,6 Гц, 2H), 7,55 (д, J=3,0 Гц, 1H), 7,49 (т, J=8,0 Гц, 1H), 7,41 (д, J=7,8 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 7,03 (д, J=8,6 Гц, 2H), 4,53 (шс, 1H), 4,44 (шс, 1H), 4,17-4,38 (м, 3H), 4,16-4,05 (м, 1H), 3,86 (д, J=19,2 Гц, 2H), 3,20-3,33 (м, 1H), 2,37-2,60 (м, 4H).
МС m/z (M+H+) 517,0
МС m/z (M+H+) 476,2
МС m/z (M+H+) 476,2
МС m/z (M+H+) 500,8
Пример 29а
Следуя процедуре, описанной выше для примера 1с, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 485,8
Пример 30
A. Метил 4-(3-хлорфенилсульфанил)-бензоат (30c). Смесь соединения 30a (400 мг, 1,86 ммоль), соединения 30b (321 мг, 2,23 ммоль), Pd(PPh3)4 (215 мг, 0,186 ммоль), KOtBu (2,23 мл, 2,23 ммоль, 1M раствора в THF) и THF (3,5 мл) нагревали в микроволновом реакторе при 130°C в течение 2 часов, а затем прилили к воде (50 мл). Смесь экстрагировали EtOAc (3 раза). Объединенные органические экстракты сушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении. Остаток очистили колоночной флеш-хроматографией на силикагеле, элюируя с помощью 5% EtOAc/гексана с получением соединения 30c (220 мг).
B. 4-(3-Хлорфенилсульфанил)бензойная кислота (30d). Смесь соединения 30c (320 мг, 1,15 ммоль) и LiOH (110 мг, 4,59 ммоль) в THF/MeOH/H2O (3/3/3 мл) перемешивали в течение 4 часов. Добавили 15% водный раствор лимонной кислоты (10 мл). Затем смесь экстрагировали с помощью EtOAc (3 раза). Объединенные органические фазы промыли солевым раствором, отфильтровали, высушили над Na2SO4 и сконцентрировали при пониженном давлении. Полученный остаток (соединение 30d, 290 мг) высушивали при пониженном давлении в течение 18 часов и использовали без дополнительной очистки.
C. 4-(1-{[4-(3-Хлорфенилсульфанил)фенил]карбонил}азетидин-3-ил)-1-(фенилкарбонил)-пиперазин, соединение 427. Смесь соединения 30d (60 мг, 0,23 ммоль), соединения 2c (83 мг, 0,29 ммоль) и HATU (129 мг, 0,34 ммоль) в Et3N и DMF (1 мл/3 мл) перемешивали в течение 18 часов и затем прилили к воде (10 мл). Затем смесь экстрагировали с помощью EtOAc (3 раза). Объединенные органические фазы промыли солевым раствором (2 раза), высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Полученный остаток очистили на силикагеле, элюируя 5% MeOH/CH2Cl2 с получением соединения 427 (33 мг). МС m/z (M+H+) 492,1.
Следуя процедуре, описанной выше для примера 30, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 499,1
МС m/z (M+H+) 499,1
МС m/z (M+H+) 526,2
МС m/z (M+H+) 533,1
МС m/z (M+H+) 533,1
Пример 30а
Следуя процедуре, описанной выше для примера 1с, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 483,8
МС m/z (M+H+) 517,9
Пример 31
A. Метиловый эфир 4-(3-хлорбензолсульфонил)-бензойной кислоты (31a).
К раствору соединения 30c (200 мг, 0,72 ммоль) в CH2Cl2 (5 мл) добавили mCPBA (320 мг, 1,43 ммоль) при 0°C. Через 2 часа смесь вылили в 2N раствора KOH (20 мл) и экстрагировали с использованием EtOAc (3 раза). Объединенные органические экстракты сушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении. Остаток очистили колоночной флеш-хроматографией на силикагеле, элюируя с помощью 5% EtOAc/гексана с получением соединения 31a (138 мг).
B. 4-(3-Хлорбензолсульфонил)-бензойная кислота (31b). Смесь соединения 31a (138 мг, 0,44 ммоль) и LiOH (42 мг, 1,77 ммоль) в THF/MeOH/H2O (2/2/2 мл) перемешивали в течение 4 часов. Добавили 15% раствор лимонной кислоты (10 мл). Затем смесь экстрагировали с помощью EtOAc (3 раза). Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Полученный остаток, соединение 31b (130 мг), высушивали при пониженном давлении в течение 18 часов и использовали без дополнительной очистки.
C. 1-[1-({4-[(3-Хлорфенил)сульфонил]фенил}карбонил)азетидин-3-ил]-4-(фенилкарбонил)пиперазин, соединение 433. Смесь соединения 31b (40 мг, 0,14 ммоль), соединения 2c (49 мг, 0,18 ммоль) и HATU (80 мг, 0,20 ммоль) в Et3N (1 мл) и DMF (2 мл) перемешивали в течение 18 часов и затем прилили к воде (10 мл). Затем смесь экстрагировали с помощью EtOAc (3 раза). Объединенные органические экстракты промыли солевым раствором (2 раза), высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Остаток очистили колоночной флеш-хроматографией на силикагеле, элюируя с помощью 5% MeOH/CH2Cl2с получением соединения 428 (29 мг). МС m/z (M+H+) 524,1.
Следуя процедуре, описанной выше для примера 31, заменив соответствующие реагенты, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 558,0
МС m/z (M+H+) 530,8
МС m/z (M+H+) 564,8
МС m/z (M+H+) 578,8
МС m/z (M+H+) 564,6
Пример 31а
Следуя процедуре, описанной выше для примера 31, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 31, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (CDCl3): δ 7,80-7,97 (м, 4H), 7,63-7,73 (м, 1H), 7,56 (дд, J=5,7, 2,4 Гц, 2H), 7,18 (д, J=8,1 Гц, 2H), 4,34-4,60 (м, 3H), 4,20-4,33 (м, 2H), 4,03-4,20 (м, 2H), 3,86 (уш. с, 2H), 3,15-3,32 (м, 1H), 2,37-2,60 (м, 4H).
МС m/z (M+H+) 578,8
МС m/z (M+H+) 572,0
1H ЯМР (CDCl3): δ 7,88 (д, J=3,3 Гц, 1H), 7,65-7,77 (м, 4H), 7,52-7,65 (м, 2H), 7,35-7,52 (м, 2H), 7,24 (с, 1H), 4,39 (с, 4H), 4,17-4,33 (м, 2H), 4,12 (кв, J=7,1 Гц, 2H), 3,86 (шс, 2H), 3,19-3,34 (м, 1H), 2,38-2,59 (м, 4H).
МС m/z (M+H+) 578,8
МС m/z (M+H+) 578,6
Пример 31b
D. 10-Оксидофеноксатиин-2-карбоновая кислота, 31d. Смесь феноксатиин-2-карбоновой кислоты 31c (0,41 ммоль, 100 мг) и натрия пербората тетрагидрата (0,82 ммоль, 126 мг) в 3 мл HOAc перемешивали в течение 6 дней при комнатной температуре. ТСХ показала 90% превращение в 31d. Добавили воду, полученный осадок отфильтровали и высушили, получив 65 мг соединение 31d 90% чистоты.
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 495,1
Пример 31c
Следуя процедуре, описанной выше для примера 1с, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 516,8
МС m/z (M+H+) 550,5
МС m/z (M+H+) 563,8
Пример 32
Трет-бутил-(3S)-3-[4-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)фенокси]пирролидин-1-карбоксилат, соединение 434. К раствору соединения 26d (100 мг, 0,273 ммоль) и (R)-N-Boc-3-гидроксипролина в THF добавили DIAD при 0°C. Полученную реакционную смесь перемешивали в течение 18 часов. После разбавления водой и экстрагирования с помощью EtOAc (3 раза) объединенные органические экстракты высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Полученный остаток очистили колоночной флеш-хроматографией на силикагеле, используя 5% MeOH/CH2Cl2, с получением соединения 434 (95 мг). 1H ЯМР (CDCl3): δ 7,52 (д, J=8,6 Гц, 2H), 7,37-7,44 (м, 5H), 7,24-7,29 (м, 3H), 7,18-7,24 (м, 3H), 4,18-4,33 (м, 2H), 4,09-4,17 (м, 3H), 4,01-4,08 (м, 1H), 3,92 (уш.с, 1H), 3,74 (уш.с, 1H), 3,35-3,63 (м, 2Н), 3,17-3,29 (м, 1H), 2,20-2,50 (м, 4Н); MС m/z (M+H+) 506,0.
Следуя процедуре, описанной выше для примера 32, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (CDCl3): δ 7,58 (д, J=8,8 Гц, 2H), 7,36-7,44 (м, 5H), 6,88 (д, J=8,8 Гц, 2H), 4,26-4,38 (м, 2H), 4,25-4,12 (м, 2H), 4,07 (уш. с, 1H), 3,82-3,99 (м, 1H), 3,48 (уш. с, 2H), 3,15-3,26 (м, 1H), 2,17-2,54 (м, 4H), 1,93-2,03 (м, 1H), 1,75-1,89 (м, 2H), 1,46-1,63 (м, 2H), 1,31-1,46 (м, 3H), 1,21-1,31 (м, 2H).
МС m/z (M+H+) 448,0
МС m/z (M+H+) 434,2
МС m/z (M+H+) 549,3
МС m/z (M+H+) 535,3
Пример 33
A. (3S)-3-[4-({3-[4-(Фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)фенокси]пирролидин, 33a. К раствору соединения 434 (87,7 мг, 0,164 ммоль) в CH2Cl2 (1 мл) добавили TFA (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь сконцентрировали при пониженном давлении с получением соединения 33a, которое использовали без дополнительной очистки.
B. (3S)-N,N-Диметил-3-[4-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)фенокси]пирролидин-1-сульфонамид, соединение 439. Раствор соединения 33a (0,164 ммоль) и Et3N (0,5 мл) в CH2Cl2 (2 мл) обработали N,N-диметилсульфамоилхлоридом (26 мкл, 0,246 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов, затем растворитель удалили при пониженном давлении. Полученный остаток напрямую загрузили в силикагелевую колонку и очистили колоночной флеш-хроматографией, элюирование проводили с применением 5% MeOH/CH2Cl2 для получения соединения 439 (51,5 мг). 1H ЯМР (CDCl3): δ 7,61 (д, J=8,21 Гц, 2H), 7,36-7,46 (м, 5H), 6,86 (д, J=8,6 Гц, 2H), 4,98 (м, 1H), 4,31 (уш.с, 1H), 4,11-4,26 (м, 2H), 4,05 (уш.с, 1H), 3,87-3,96 (м, 1H), 3,84 (м, 1H), 3,70-3,79 (м, 1H), 3,66 (дд, J=11,4, 4,8 Гц, 1H), 3,39-3,58 (м, 4H), 3,21-3,26 (м, 1H), 2,82 (с, 6H), 2,42 (уш.с, 4H), 2,19-2,29 (м, 2H); МС m/z (M+H+) 542,0.
Следуя процедуре, описанной выше для примера 33, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 553,3
МС m/z (M+H+) 491,3
МС m/z (M+H+) 539,3
МС m/z (M+H+) 545,3
МС m/z (M+H+) 539,3
МС m/z (M+H+) 519,3
МС m/z (M+H+) 506,3
МС m/z (M+H+) 568,3
МС m/z (M+H+) 532,3
МС m/z (M+H+) 548,3
Пример 34
A. Трет-бутил 3-(2-йод-4-метоксикарбонилфенокси)-пирролидин-1-карбоксилат, 34b. К раствору соединения 34a (500 мг, 1,8 ммоль), соединения 32a (504 мг, 2,7 ммоль) и PPh3 (707 мг, 2,7 ммоль) в THF (10 мл) добавили DIAD (0,52 мл, 2,7 ммоль) при 0°C. Полученную смесь перемешивали при 0°C в течение 1 часа, затем нагрели до комнатной температуры и перемешивали в течение 18 часов. Смесь прилили к воде и экстрагировали с помощью EtOAc (3 раза). Объединенные органические экстракты сушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении. Остаток очистили колоночной флеш-хроматографией, элюируя с помощью 50% EtOAc/гексана, с получением соединения 34b (704 мг).
B. Метил 3-йод-4-[1-(пиролидин-1-карбонил)-пирролидин-3-ил-окси]-бензоат, 34d. К раствору соединения 34b (210 мг, 0,47 ммоль) в CH2Cl2 (3 мл) добавили TFA (1,5 мл) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель удалили при пониженном давлении. Полученный остаток высушивали при пониженном давлении в течение 2 часов. К остатку добавили CH2Cl2 (3 мл) и Et3N (1 мл) с последующим добавлением соединения 34c (77 мкл, 0,7 ммоль). Полученную смесь перемешивали в течение 2 часов, затем прилили к воде (50 мл) и экстрагировали с помощью EtOAc (3 раза). Объединенные органические фазы высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Остаток очистили колоночной флеш-хроматографией, элюируя с помощью 80% EtOAc/гексана, с получением соединения 34d (180 мг).
C. 3-Йод-4-[1-(пирролидин-1-карбонил)-пирролидин-3-ил-окси]-бензойная кислота, 34e. Смесь соединения 34d (180 мг, 0,41 ммоль), LiOH (39 мг, 1,62 ммоль), THF (3 мл), MeOH (3 мл) и H2O (3 мл) перемешивали при комнатной температуре в течение 4 часов. Смесь подкислили 15% водным раствором лимонной кислоты и экстрагировали EtOAc (3 раза). Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Полученный остаток высушивали при пониженном давлении в течение 2 часов с получением соединения 34e (166 мг).
D. 3-Йод-4-[1-(пирролидин-1-карбонил)-пирролидин-3-ил-окси]-бензоилхлорид, 34f. К раствору соединения 34e (166 мг, 0,39 ммоль) в THF (4 мл) добавили оксалилдихлорид (43 мкл, 0,50 ммоль) по каплям при 0°C и затем добавили 2 капли DMF. Полученную смесь перемешивали при 0°C в течение 3 часов, затем нагрели до комнатной температуры и перемешивали в течение 18 часов. Растворитель удалили при пониженном давлении. Полученный остаток, соединение 34f, высушивали при пониженном давлении в течение 2 часов и использовали в следующей стадии без дополнительной очистки.
E. 1-{1-[(3-Йод-4-{[(3S)-1-(пирролидин-1-ил-карбонил)пирролидин-3-ил]окси}фенил)карбонил]азетидин-3-ил}-4-(фенилкарбонил)пиперазин, соединение 450. К смеси соединения 2c (61 мг, 0,25 ммоль), Et3N (0,5 мл) и CH2Cl2 (2,5 мл) добавили раствор соединения 34f в CH2Cl2 (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель удалили при пониженном давлении. Остаток растворили в CH2Cl2 (1 мл), загруженном непосредственно в колонку с силикагелем, и очистили колоночной флеш-хроматографией, элюируя с помощью 5% MeOH/CH2Cl2 с получением соединения 451 (56 мг). 1H ЯМР (CDCl3): δ 8,06 (д, J=2,3 Гц, 1H), 7,60 (дд, J=8,5, 2,1 Гц, 1H), 7,34-7,48 (м, 5H), 6,80 (д, J=8,6 Гц, 1H), 5,01 (уш.с, 1H), 3,66-4,36 (м, 8H), 3,28-3,64 (м, 8H), 3,12-3,27 (м, 1H), 2,05-2,56 (м, 6H), 1,55-1,97 (м, 4H).
Следуя процедуре, описанной выше для примера 34, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 632,2
МС m/z (M+H+) 665,2
Пример 35
A. Метил 4-[(3-хлорфенокси)метил]бензоат, 35c. К смеси соединения 35a (300 мг, 1,31 ммоль) и K2CO3 (400 мг, 2,88 ммоль) в DMF (1 мл) добавили соединение 35b (251 мг, 2,0 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Смесь прилили к воде (50 мл) и экстрагировали с помощью EtOAc (3 раза). Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Полученный остаток очистили колоночной флеш-хроматографией на силикагеле, элюируя с помощью 20% EtOAc/гексана, с получением соединения 35c (340 мг).
B. 4-[(3-Хлорфенокси)метил]бензойная кислота, 35d. Смесь соединения 35c (340 мг, 1,18 ммоль) и LiOH (114 мг, 4,74 ммоль) в THF/MeOH/H2O (3/3/3 мл) перемешивали в течение 4 часов. Добавили 15% раствор лимонной кислоты (10 мл). Затем смесь экстрагировали с помощью EtOAc (3 раза). Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4 и сконцентрировали при пониженном давлении. Полученный остаток, соединение 35d (230 мг), высушивали при пониженном давлении в течение 18 часов и использовали без дополнительной очистки.
C. 1-[1-({4-[(3-Хлорфенокси)метил]фенил}карбонил)азетидин-3-ил]-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 453. Смесь соединения 35d (77 мг, 0,29 ммоль), соединения 5e (108 мг, 0,38 ммоль) и HATU (165 мг, 0,44 ммоль) в Et3N (1 мл) и DMF (3 мл) перемешивали в течение 18 ч и затем прилили к воде (10 мл). Затем смесь экстрагировали с помощью EtOAc (3 раза). Объединенные органические фазы промыли солевым раствором (2 раза), высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении. Полученный остаток очистили колоночной флеш-хроматографией, элюируя с помощью 5% MeOH/CH2Cl2, с получением соединения 453 (67 мг). МС m/z (M+H+) 497,1. 1H ЯМР (CD3OD): δ 7,95 (д, J=2,0 Гц, 1H), 7,8(д, J=2,0 Гц, 1H), 7,65 (д, J=8,1 Гц, 2H), 7,51 (д, J=8,1 Гц, 2H), 7,25 (т, J=8,0 Гц, 1H), 7,02 (с, 1H), 6,90-6,98 (м, 2H), 5,15 (с, 2H), 4,32-4,45 (м, 2H), 4,15-4,25 (м, 2H), 4,00-4,10 (м, 1H), 3,70-3,82 (уш.с, 2H), 2,47 (уш.с, 4H).
Следуя процедуре, описанной выше для примера 35, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 513,1
МС m/z (M+H+) 496,1
МС m/z (M+H+) 490,0
МС m/z (M+H+) 497,0
Пример 35а
Следуя процедуре, описанной выше для примера 35, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 35 или примера 1, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие вещества, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 506,0
МС m/z (M+H+) 489,0
МС m/z (M+H+) 513,0
МС m/z (M+H+) 496,0
Пример 35b
Следуя процедуре, описанной выше для примера 1с, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 498,0
МС m/z (M+H+) 481,0
Пример 36
1-(Фенилкарбонил)-4-{1-[(2-пирролидин-3-ил-фенил)карбонил]азетидин-3-ил}пиперазин, соединение 456. К раствору соединения 111 (300 мг, 0,58 ммоль) в 1,4-диоксане (10 мл) добавили 6N раствора HCl (3 мл). После перемешивания в течение 4 часов растворитель выпарили в вакууме. Остаток распределили между EtOAc и 3N NaOH, органическую фазу отделили и высушили над MgSO4. Смесь профильтровали, фильтрат сконцентрировали при пониженном давлении, остаток очистили обращенно-фазовой ВЭЖХ с получением соединения 456 (52,3 мг). ЖХ/МС m/z (M+H+) 419,36 (расчет для C25H30N4O4, 418,54).
Пример 37
A. Трет-бутил 4-[1-(дифенилметил)азетидин-3-ил]-3-(гидроксиметил)пиперазин-1-карбоксилат, 37b. Соединение 37a (811 мг, 3,21 ммоль) добавили к одной части для перемешивания суспензии безводного K2CO3 (1,07 г, 7,9 ммоль) в MeOH (4 мл). Смесь перемешивали в течение 1,5 часов при комнатной температуре, затем удалили MeOH при пониженном давлении до почти сухого состояния. Полученную белую суспензию растерли в порошок с CH2Cl2 (40 мл) и профильтровали через пористую стеклянную воронку средней пористости. Сухой остаток промыли дополнительным количеством CH2Cl2, объединенные фильтраты сконцентрировали и высушили при пониженном давлении с получением соединения 37a (733 мг) в виде белого твердого вещества-свободного основания соли 37a и HCl.
Вещество суспендировали в CH3CN (8 мл) с соединением 1e (1,07 г, 3,37 ммоль). К суспензии добавили диизопропилэтиламин (1,23 мл, 7,06 ммоль), смесь нагревали при 60°C в течение 14 часов. Добавили EtOAc (100 мл) и промыли органическую фазу водой (20 мл) и солевым раствором (20 мл), высушили над Na2SO4, отфильтровали и сконцентрировали при пониженном давлении с получением сырого остатка (1,42 г) в виде бледно-оранжевой пены. Вещество очистили жидкостной хроматографией среднего давления (MPLC), используя систему ISCO CombiFlash (силикагель, 10-50% EtOAc/гексан), с получением соединения 37b (979 мг) в виде белой пены. 1H ЯМР (400 МГц, CDCl3): δ 7,39 (д, J=8,1 Гц, 4H), 7,23-7,33 (м, 4H), 7,14-7,23 (м, 2H), 4,34 (с, 1H), 3,28-3,58 (м, 8H), 2,76-2,95 (м, 2H), 2,26-2,75 (м, 4H), 2,20 (дт, J=12,3, 4,9 Гц, 1H), 1,44 (с, 9H); ЖХ/МС m/z (M+H+) 438,5, (M+Na+) 460,5.
B. {1-[1-(Дифенилметил)азетидин-3-ил]-пиперазин-2-ил}метанол, 37c. Соединение 37b (450 мг, 1,03 ммоль) растворили в CH2Cl2 (6 мл) и TFA (3 мл) и перемешивали при 20°C в течение 2,5 ч. Реакционную смесь сконцентрировали при пониженном давлении до сухого состояния с получением TFA-соли соединения 37c в виде оранжевой пены. Соединение 37c использовали в следующей стадии без дополнительной очистки. МС m/z (M+H+) 338,2.
С. {1-[1-(Дифенилметил)азетидин-3-ил]-4-(фенилкарбонил)пиперазин-2-ил}метанол, 37е. Соединение 37c (1,03 ммоль) растворили в CH2Cl2 (5 мл) и охладили при 0ºC в емкости с ледяной водой. Добавили 10% водный раствор Na2CO3 (5 мл) и добавили по каплям раствор соединения 37d (143 мкл, 1,23 ммоль), растворенный в CH2Cl2 (1 мл). Полученной смеси дали нагреться до температуры 20°C и затем перемешивали на высокой скорости в течение 62 часов. К реакционной смеси добавили CH2Cl2 (10 мл), затем водную фазу экстрагировали с помощью CH2Cl2 (2×20 мл). Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, отфильтровали и сконцентрировали с получением соединения 37e (465 мг) в виде белой пены. Соединение 37e использовали в следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, CDCl3): δ 7,39 (м, 9H), 7,22-7,32 (м, 4H), 7,14-7,23 (м, 2H), 4,35 (с, 1H), 4,07 (уш.с, 1H), 3,30-3,71 (комплекс, 8H), 2,2-3,0 (комплекс, 6H); ЖХ/МС m/z (M+H+) 442,2.
D. [1-Азетидин-3-ил-4-(фенилкарбонил)пиперазин-2-ил]метанол, 37f. Соединение 37e (450 мг, 1,02 ммоль) поместили в реактор Парра объемом 500 мл и растворили в абсолютном EtOH (6 мл). Добавили 12N конц. HCl (95 мкл, 1,14 ммоль), емкость продули N2. Добавили 10% раствор Pd/C (264 мг) и встряхивали смесь в атмосфере H2 0,41 МПа (60 фунтов на кв.дюйм) в течение 14 часов. Добавили дополнительную порцию 10% раствора Pd/C (430 мг), вернули смесь в атмосферу H2 0,41 МПа (60 фунтов на кв.дюйм) и продолжали встряхивание еще в течение 5 часов. Смесь профильтровали через диатомитовую прокладку, сухой остаток тщательно промыли с помощью MeOH. Фильтрат сконцентрировали при пониженном давлении до сухого состояния с получением первичного соединения 37f в виде вязкой маслянистой жидкости (428 мг), которое использовали в следующей стадии без дополнительной очистки. ЖХ/МС m/z (M+H+) 276,3.
E. [1-{1-[(4-Бензилфенил)карбонил]азетидин-3-ил}-4-(фенилкарбонил)пиперазин-2-ил]метанол, соединение 457. Соединение 3a (142 мг, 0,67 ммоль) и HATU (256 мг, 0,67 ммоль) суспендировали в CH2Cl2 (1 мл) и DMF (0,2 мл). Добавили Et3N (195 мкл, 1,4 ммоль) и перемешивали раствор в течение 15 минут при 20°C. Неочищенное соединение 37f (214 мг, приблизительно 0,56 ммоль) растворили в смеси 1:1 CH2Cl2/DMF (3 мл) и добавили по частям к раствору соединения 3a, полученную смесь перемешивали в течение 64 часов. Органический раствор разбавили EtOAc (50 мл) и промыли последовательно водой (3×10 мл) и солевым раствором (10 мл). Органическую фазу высушили над Na2SO4, отфильтровали, фильтрат сконцентрировали при пониженном давлении с получением желтой маслянистой жидкости (310 мг). Первичное масло очистили при помощи ЖХСД (картридж Silicycle SiO2 4 г, 15-80% ацетон/гексан) с получением соединения 457 в виде белой пены (104 мг). 1H ЯМР (400 МГц, CDCl3) δ: 7,53 (д, J=7,8 Гц, 2H), 7,42 (уш.с, 5H), 7,11-7,37 (м, 7H), 4,26 (м, 5H), 4,00 (с, 2H), 3,71-3,89 (м, 1H), 3,54-3,71 (м, 3H), 3,25-3,54 (м, 3H), 2,92 (уш.с, 1H), 2,64 (уш.с, 1H), 2,41 (уш.с, 1H); ЖХ/МС m/z (M+H+) 470,5.
Следуя процедуре, описанной выше для примера 37, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 7,65-7,73 (м, 2H), 7,61 (дд, J=11,6, 8,1 Гц, 4H), 7,33-7,50 (м, 10H), 3,96-4,49 (м, 5H), 3,76-3,91 (м, 1H), 3,63 (м, 3H), 3,32-3,53 (м, 1H), 2,95 (уш. с, 1H), 2,64 (уш. с, 1H), 2,45 (уш. с, 1H)
ЖХМС m/z (M+H+) 456,5
1H ЯМР (400 МГц, CDCl3): δ 7,55 (д, J=8,1 Гц, 2H), 7,35-7,46 (м, 5H), 7,10-7,34 (м, 7H), 4,82 (уш. с, 1H), 4,01 (с, 2H), 3,72-4,40 (м, 5H), 3,52 (уш. с, 1H), 3,16 (уш. с, 1H), 2,54-3,04 (м, 2H), 1,93-2,30 (м, 4H)
ЖХМС m/z (M+H+) 470,5
1H ЯМР (400 МГц, CDCl3): δ 7,67-7,75 (д, J=8,3 Гц, 2H), 7,55-7,67 (м, 4H), 7,34-7,52 (м, 8H), 3,39-4,96 (м, 9H), 3,20 (квин., 1H), 2,51-3,05 (м, 3H), 2,22 (уш. с, 1H), 2,04 (уш. с, 1H)
ЖХМС m/z (M+H+) 456,5
Пример 38
4,4,4-Трифтор-N-[4-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)фенил]бутанамид, соединение 497. Смесь соединения 495 (65 мг, получено согласно описанию в примере 9), 4,4,4-трифторбутановой кислоты (30 мг), HATU (116 мг) и TEA (0,12 мл) в DCM 1,5 мл) перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь разбавили DCM и водой. Стандартное выполнение с последующей хроматографией привело к получению соединения 497 (71 мг). МС m/z (M+H+) 489,5.
Следуя процедуре, описанной выше для примера 38, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 483,6
МС m/z (M+H+) 475,6
МС m/z (M+H+) 463,6+
МСm/z (M+H+) 469,2
Пример 39
A. N-(Нафталин-2-ил-метил)-4-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)анилин, соединение 495. Соединение 496 растворили в CH2Cl2 и TFA и перемешивали при 20°C. Реакционную смесь концентрировали до сухого состояния при пониженном давлении для получения соединения 495, которое использовали для следующей стадии без дополнительной очистки. МС m/z (M+H+) 365.
B. N-(Нафталин-2-ил-метил)-4-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)анилин, соединение 491. Смесь соединения 495 (100 мг, 0,27 ммоль), соединения 39a (75 мг, 0,48 ммоль) и AcOH (0,5 мл) в 1,2-дихлорэтане (3 мл) перемешивали в течение 1 часа, затем добавили NaBH(OAc)3 (136 мг, 0,64 ммоль). Полученную смесь перемешивали в течение ночи, после чего прилили к 2N водного раствора KOH (20 мл) и экстрагировали с помощью EtOAc. Объединенные фазы высушили над Na2SO4 и сконцентрировали при пониженном давлении. Остаток очистили колоночной флеш-хроматографией, элюируя с помощью 5% MeOH/CH2Cl2 с получением 33,2 мг соединения 491. 1H ЯМР (400 МГц, CDCl3): δ 7,75-7,85 (м, 4H), 7,43-7,53 (м, 5H), 7,35-7,42 (м, 5H), 6,61 (д, J=8,8 Гц, 2H), 4,64 (уш.с, 1H), 4,51 (с, 2H), 4,27 (уш.с, 1H), 4,08-4,35 (м, 3H), 4,02 (с,1H), 3,89 (с, 1H), 3,71 (уш.с, 1H), 3,34-3,55 (м, 2H), 3,10-3,22 (м, 1H), 2,13-2,49 (м, 3H); МС m/z (M+H+) 505,3.
Следуя процедуре, описанной выше для примера 39, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС (m/z) (M+H+) 489,2
МС (m/z) (M+H+) 523,2
МС (m/z) (M+H+) 541,2
Пример 40
1-(1,3-Тиазол-4-ил-карбонил)-4-(1-{[(1RS,2RS)-2-{4-[(трифторметил)сульфанил]фенил}циклопропил]карбонил}азетидин-3-ил)пиперазин, соединение 645 (рацемическое, транс). Триметилсульфоксония иодид 40a (1,15 ммоль, 253 мг) и гидрид натрия (60% дисперсия в минеральном масле, 1,1 ммоль, 44 мг) соединили в 3 мл высушенного DМСO и перемешивали 20 минут при комнатной температуре. К смеси добавили соединение 648, полученное в примере 5, и перемешивали ее при комнатной температуре в течение 15 минут, затем нагревали при 50ºC в течение ночи. После охлаждения смесь распределили между EtOAc и водой, органический слой отделили и сконцентрировали с получением первичного продукта, который очистили препаративной обращенно-фазовой хроматографией с получением 9,1 мг (2%) соединения 645 в виде моно-соли TFA. МС m/z (M+H+) 497,2.
Следуя процедуре, описанной выше для примера 40, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 431,1
Пример 41
Данная страница оставлена пустой намеренно
Пример 42
A. Метил 4-(4-(трифторметил)бензил)бензоат, 42b. Через смесь метил-4-бромбензоата 42a (9,3 ммоль, 2,0 г), 2 мл THF и 4-трифторметилбензилцинкхлорида (0,5 M в THF, 46,5 ммоль, 93 мл) в течение 5 минут пропускали аргон. Добавили Pd(dffp)Cl2 • CH2Cl2(0,5 моль, 409 мг), реакционную трубку запечатали и нагревали при 70ºC в течение 16 часов. Смесь охладили и профильтровали через целит. К фильтрату добавили воду, полученный осадок отфильтровали. Органический раствор высушили над MgSO4 и сконцентрировали. Полученный продукт очистили флеш-хроматографией (силикагель, 0-10% EtOAc в гептане) с получением 1,5 г (55%) метил 4-(4-(трифторметил)бензил)бензоата, 42b.
B. 4-(4-(Трифторметил)бензил)бензойная кислота, 42c. Следуя процедуре, описанной в примере 9i, стадия Р, метил 4-(4-(трифторметил)бензил)бензоат 42b (1,5 г, 5,1 ммоль) превратили в метиловый эфир 4-(4-(трифторметил)бензил)бензойной кислоты, 42c, 1,31 г (92%). MС m/z (M+H+) 279,1
Следуя процедуре, описанной выше для примера 42, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Промежуточные соединения были получены одним из альтернативных способов:
C. Метил 4-(4-(трифторметил)бензил)бензоат, 42b. Смесь метилового эфира 4-бромметил-бензойной кислоты 42d (1,0 г, 4,37 ммоль), 4-трифторфенилборной кислоты 42e (0,995 г, 5,24 ммоль) и Pd(PPh3)4 (50 мг, 0,044 ммоль) в диоксане (15 мл) перемешивали при комнатной температуре в течение 1 минуты. Затем добавили 4 мл 2 М водного раствора Na2CO3. Полученный раствор нагревали при 90ºC в течение 5 часов, затем охладили до комнатной температуры. К реакционной смеси добавили EtOAc и воду. Органические продукты сконцентрировали и очистили флеш-хроматографией (силикагель, 5% EtOAc/гексан) с получением метил 4-(4-(трифторметил)бензил)бензоата, 42b.
Следуя процедуре, описанной выше для примера 2, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 9,23 (с, 1H); 8,44 (с, 1H); 8,0-7,8 (м, 2H); 7,76-7,63 (м, 2H); 7,5 (д, 1H); 7,44-7,32 (м, 3H); 4,9-4,7 (м, 3H); 4,3-4,2 (м, 2H); 4,19-4,04 (м, 3H)
МС m/z (M+H+) 515,1
1H ЯМР (400 МГц, CDCl3): δ 8,12 (м, 2H); 7,68 (м, 2H); 7,5 (м, 2H); 7,4 (м, 4H); 4,85 (уш. с, 2H); 4,47-4,26 (уш. м, 3H); 3,52 (уш. с, 4H); 3,02 (уш. с, 2H).
МС m/z (M+H+) 495,1
МС m/z (M+H+) 533,1
МС m/z (M+H+) 529,2
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 526,1
1H ЯМР (400 МГц, CDCl3): δ 7,89 (с, 1H); 7,78 (с, 1H); 7,50 (м, 5H); 7,82 (м, 2H); 7,12 (т, 1H); 4,69 (уш. м, 2H); 4,48 (уш. м, 2H); 4,32 (уш. м, 2H); 4,0 (с, уш. м, 5H); 3,5 (уш. м, с 2H)
МС m/z (M+H+) 533,1
МС m/z (M+H+) 529,2
МС m/z (M+H+) 529,2
МС m/z (M+H+) 511,2
МС m/z (M+H+) 529,2
МС m/z (M+H+) 529,2
МС m/z 515 (M+H+)
МС m/z (M+H+) 515
МС m/z (M+H+) 515
МС m/z (M+H+) 515
МС m/z (M+H+) 508
МС m/z (M+H+) 508
Пример 43
A. Метил 3-(4-фторбензоил)-1H-индол-6-карбоксилат, 43c. Раствор 4-фторбензоилхлорида 43b (2 ммоль, 0,24 мл) в 8 мл DCE по каплям добавили к ледяному раствору метил 1H-индол-6-карбоксилата 43a (1,43 ммоль, 250 мг) и диэтилалюминийхлорида (1 М в гексане, 1,86 ммоль, 1,86 мл) в 8 мл DCE. После выстаивания 2 часа при 0ºC смесь нагрели до комнатной температуры и перемешивали в течение ночи. К смеси добавили буфер pH 7, полученный осадок отфильтровали и промыли CH2Cl2с получением 162 мг (38%) метил 3-(4-фторбензоил)-1H-индол-6-карбоксилата 43c. МС m/z (M+H+) 298,0.
B. 3-(4-Фторбензоил)-1H-индол-6-карбоновая кислота, 43d. В соответствии с процедурой, описанной в примере 9i, стадия P, получили 110 мг (72%) 3-(4-фторбензоил)-1H-индол-6-карбоновой кислоты.
Следуя процедуре, описанной выше для примера 43, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 518,2
МС m/z (M+H+) 542,1
МС m/z (M+H+) 535,0
МС m/z (M+H+) 501,0
Пример 44
A. Метил 4-(пиридин-2-ил-окси)-бензоат, 44b. Смесь 29a (433 мг, 2,85 ммоль), 44a (300 мг, 1,90 ммоль), Cu(biPy)2BF4 (88 мг, 0,19 ммоль), K3PO4 (805 мг, 3,80 ммоль) и DMF (1,5 мл) нагревали при 140oC в течение 1 часа. Через 0,5 часа смесь прилили к воде (60 мл) и экстрагировали с помощью EtOAc. Объединенные фазы промыли солевым раствором, высушили над Na2SO4 и сконцентрировали. Первичный продукт очистили колоночной флеш-хроматографией (силикагель, 20% EtOAc/гексан) с получением 298 мг соединение 44b.
B. 4-(Пиридин-2-ил-окси)-бензойная кислота, 44c. Смесь соединения 44b (430 мг, 1,87 ммоль), LiOH (180 мг, 7,5 ммоль), THF (3 мл), MeOH (3 мл) и H2O (3 мл) перемешивали при комнатной температуре в течение 4 часов. Затем реакционную смесь подкислили 15% лимонной кислотой (10 мл). Смесь экстрагировали с помощью EtOAc. Органический слой промыли солевым раствором, высушили над Na2SO4 и сконцентрировали с получением соединения 44c (350 мг).
C. 1-(1-{[4-(Пиридин-2-ил-окси)фенил]карбонил}азетидин-3-ил)-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 913. Смесь соединения 44c (60 мг, 0,28 ммоль), соединение 5e (105 мг, 0,36 ммоль), HATU (159 мг, 0,42 ммоль), Et3N (1 мл) и DMF (3 мл) перемешивали при комнатной температуре в течение ночи и затем прилили к воде (10 мл). Смесь экстрагировали с помощью EtOAc. Экстракты промыли солевым раствором, высушили над Na2SO4 и сконцентрировали. Остаток очистили колоночной флеш-хроматографией (силикагель, 7% MeOH/CH2Cl2) с получением 98 мг соединения 913. МС m/z (M+H+) 450,0
Следуя процедуре, описанной выше для примера 44, стадии А и В, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения.
Следуя процедуре, описанной выше для примера 44 (стадия С), и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие вещества, составляющие предмет настоящего изобретения.
МС m/z (M+H+) 443,0
МС m/z (M+H+) 545,0
МС m/z (M+H+) 497,0
МС m/z (M+H+) 443,0
МС m/z (M+H+) 500,8
МС m/z (M+H+) 551,8
МС m/z (M+H+) 450,0
МС m/z (M+H+) 480,0
МС m/z (M+H+) 522,8
МС m/z (M+H+) 461,0
МС m/z (M+H+) 477,0
МС m/z (M+H+) 477,0
МС m/z (M+H+) 504,0
МС m/z (M+H+) 511,0
МС m/z (M+H+) 529,8
МС m/z (M+H+) 529,8
МС m/z (M+H+) 468,0
МС m/z (M+H+) 484,0
МС m/z (M+H+) 484,0
МС m/z (M+H+) 468,0
МС m/z (M+H+) 518,0
Пример 44а
Следуя процедуре, описанной выше для примера 1с, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 503,0
МС m/z (M+H+) 435,0
МС m/z (M+H+) 512,8
МС m/z (M+H+) 536,8
Пример 44b
Следуя процедуре, описанной выше для примера 1, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 450,0
МС m/z (M+H+) 484,0
МС m/z (M+H+) 468,0
МС m/z (M+H+) 518,0
МС m/z (M+H+) 551,8
Пример 45
A. Метил 6-(3-хлорфенокси)-никотинат, 5c. Смесь соединения 45a (200 мг, 0,926 ммоль), соединения. 45b (178 мг, 1,39 ммоль), Cu(biPy)2BF4 (43 мг, 0,09 ммоль), K3PO4 (392 мг, 1,85 ммоль) и DMF (1,0 мл) нагревали при 140oC в течение 1 часа. Затем реакционную смесь прилили к воде (30 мл) и экстрагировали с помощью EtOAc. Экстракты промыли солевым раствором, высушили над Na2SO4 и сконцентрировали. Первичный продукт очистили колоночной флеш-хроматографией (силикагель, 20% EtOAc /гексан) с получением 202 мг соединения 45c.
B. 6-(3-Хлорфенокси)-никотиновая кислота, 5d. Смесь соединения 45c (202 мг, 0,766 ммоль), LiOH (74 мг, 3,06 ммоль), THF (2 мл), MeOH (2 мл) и H2O (2 мл) перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь подкислили 15% лимонной кислотой (10 мл), а затем экстрагировали с помощью EtOAc. Экстракты промыли солевым раствором, высушили над Na2SO4 и сконцентрировали, получив 177 мг соединение 45d.
C. 1-(1-{[6-(3-Хлорфенокси)пиридин-3-ил]карбонил}азетидин-3-ил)-4-(фенилкарбонил)пиперазин, соединение 519. Смесь соединения 45d (60 мг, 0,24 ммоль), соединения 2c (101 мг, 0,36 ммоль), HATU (137 мг, 0,36 ммоль), Et3N (0,5 мл) и DMF (3 мл) перемешивали при комнатной температуре в течение ночи. Смесь влили в воду (30 мл) и экстрагировали с помощью EtOAc. Экстракты промыли солевым раствором, высушили над Na2SO4 и сконцентрировали. Полученный остаток очистили испарительной колоночной хроматографией (силикагель, 5%MeOH/CH2Cl2), получив 50 мг соединения 519. 1H ЯМР (CDCl3): δ 8,35-8,49 (м, 1H), 8,06 (дд, J=8,5, 2,1 Гц, 1H), 7,32-7,49 (м, 6H), 7,14-7,27 (м, 2H), 6,94-7,11 (м, 2H), 4,24 (уш.с, 1H), 4,15 (уш.с., 2H), 4,00-4,14 (м, 2H), 3,65-3,94 (м, 2H), 3,37-3,60 (м, 2H), 3,16-3,33 (м, 1H), 2,44 (уш.с., 4H). МС m/z (M+H+) 477,0
Следуя процедуре, описанной выше для примера 45, стадии А и В, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения.
Следуя процедуре, описанной выше для примера 45, стадия С, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 511,0
МС m/z (M+H+) 477,0
МС m/z (M+H+) 484,0
МС m/z (M+H+) 518,0
МС m/z (M+H+) 484,0
МС m/z (M+H+) 536,0
Пример 45а
Следуя процедуре, описанной выше для примера 1, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 504,0
МС m/z (M+H+) 518,0
МС m/z (M+H+) 484,0
Пример 46
A. 1-(4-Хлорфенил)-2-метилпент-1-ен-3-он, 46b. К раствору 4-хлорбензальдегида 46a (99,6 ммоль, 14 г) в воде (44 мл) добавили KOH (44,6 ммоль, 2,5 г). Смесь нагревали при 65oC в течение 10 минут и по каплям добавляли 3-пентанон (99,6 ммоль, 8,58 г). После нагревания в колбе с обратным холодильником в течение 8 часов реакционную смесь охладили до комнатной температуры и перемешивали в течение ночи. Затем добавили 260 мл 1N водного HCl и полученную смесь экстрагировали с помощью EtOAc. Органический слой высушили над Na2SO4 и сконцентрировали. Полученный продукт очистили колоночной флеш-хроматографией (силикагель, 5% EtOAc/гептан), получив 8,59 г соединения 46b.
B. Этил 6-(4-хлорфенил)-3,5-диметил-2,4-диоксогекс-5-енат, 46c. В раствор LiHMDS (1N раствора в THF, 5,48 ммоль, 5,17 мл) в THF (16 мл) при температуре -78oC по каплям добавили раствор соединения 46b (4,98 ммоль, 1,04 г) в THF (2,5 мл). После перемешивания при температуре -78oC в течение 1 часа смесь обработали раствором диэтилоксалата (4,98 ммоль, 0,73 г) в THF (2,5 мл). После перемешивания при температуре -78oC в течение 1 часа смесь нагрели до комнатной температуры и перемешивали в течение ночи. Растворитель выпарили, а полученный продукт поместили в EtOAc и промыли 1N раствора HCl и соляного раствора. Органический слой высушили над Na2SO4 и сконцентрировали, получив 1,5 г соединение. 46c.
С. 5-[2-(4-Хлорфенил)-1-метилвинил]-1-(2,4-дихлорфенил)-4-
метил-1H-пиразол-3-карбоксилат, 46e. Смесь соединения 46c (15,6 ммоль, 4,82 г), 2,4-дихлорфенилгидразина 46d (17,2 ммоль, 3,67 г), K2CO3 (17,2 ммоль, 2,37 г) и EtOH (137 мл) перемешивали при температуре 70oC в течение ночи. Выпавший твердый осадок отфильтровали и промыли в EtOH. Фильтраты сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 5% EtOAc/гептан), получив 2,25 г соединения 46е.
D. 5-[2-(4-Хлорфенил)-1-метилвинил]-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоновая кислота, 46f. Смесь соединения 46e (3,34 ммоль, 1,5 г), LiOH (13,3 ммоль, 319 мг), THF (7 мл), MeOH (7 мл) и H2O (37 мл) перемешивали при комнатной температуре в течение 4 часов. Смесь подкислили 1N раствора HCl до pH = 5 и экстрагировали с помощью EtOAc. Органический слой высушили над Na2SO4 и сконцентрировали, получив соединение 46f (202 мг).
E. 5-[2-(4-Хлорфенил)-1-метилвинил]-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоновая кислота, соединение 1010. К раствору соединения 46f (0,138 ммоль, 60 мг) в CH2Cl2 и THF добавили SOCl2 (2N раствора в THF, 0,414 ммоль, 0,212 мл). После нагревания в колбе с обратным холодильником в течение 4 часов смесь сконцентрировали и высушили в вакууме в течение 1 часа. В другую колбу добавили соединение 5e (0,18 ммоль, 52 мг), CH2Cl2 (3 мл) и диизопропилэтиламин (0,69 ммоль, 0,12 мл). К этому раствору добавили полученный продукт из реакции SOCl2, растворенный в CH2Cl2 (1 мл). После перемешивания при комнатной температуре в течение 1 часа смесь разбавили CH2Cl2 (15 мл), промыли водным раствором 3Н NaOH (30 мл) и соляным раствором (30 мл), высушили над Na2SO4 и сконцентрировали. Неочищенный продукт очистили с помощью колоночной флеш-хроматографии (силикагель, 4% MeOH/CH2Cl2) для получения 74 мг соединения 1010. 1H ЯМР (CDCl3): δ 7,87 (д, J=3,5 Гц, 1H), 7,55 (т, J=2,3 Гц, 2H), 7,33-7,36 (м, 2H), 7,30 (д, J=8,6 Гц, 2H), 7,13 (д, J=8,6 Гц, 2H), 6,41 (с, 1H), 4,49-4,62 (м, 2H), 4,41 (дд, J=10,4, 5,3 Гц, 2H), 4,22 (дд, J=10,0, 7,2 Гц, 1H), 4,04-4,10 (м, 1H), 3,87 (уш.с., 1H), 3,82 (уш.с., 1H), 3,18-3,26 (м, 1H), 2,41-2,58 (м, 4H), 2,39 (с, 3H), 1,88 (с, 3H). МС m/z (M+H+) 657,0
Следуя процедуре, описанной выше для примера 46 (стадии A-D или B-D), и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие промежуточные продукты.
Следуя процедуре, описанной выше для примера 46 (стадия Е) или для примера 1, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие вещества, составляющие предмет настоящего изобретения.
МС m/z (M+H+) 639,2
МС m/z (M+H+) 669,0
МС m/z (M+H+) 651,2
МС m/z (M+H+) 671,0
МС m/z (M+H+) 651,2
МС m/z (M+H+) 645,2
МС m/z (M+H+) 627,2
МС m/z (M+H+) 669,1
МС m/z (M+H+) 545,2
Пример 46а
Следуя процедуре, описанной выше для примера 1с, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 642,9
МС m/z (M+H+) 654,0
МС m/z (M+H+) 654,1
МС m/z (M+H+) 530,2
Пример 47
4-(((2-Фторфенил)амино)метил)бензойная кислота, 47с. Смесь 4-формилбензойной кислоты 47a (3,33 ммоль, 500 мг), 2-фтороанилина 47b (3,33 ммоль, 370 мг) и декаборана (1 ммоль, 122 мг) в 8 мл MeOH перемешивали при комнатной температуре в течение 15 минут. Полученную смесь сконцентрировали и очистили препаративной обращенно-фазовой хроматографией, получив 0,81 г (99%) соединения 47c.
Следуя процедуре, описанной выше для примера 47, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были подготовлены следующие промежуточные соединения.
Следуя процедуре, описанной выше для примера 1 или примера 9, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения.
МС m/z (M+H+) 473,1
МС m/z (M+H+) 520,2
МС m/z (M+H+) 483,2
МС m/z (M+H+) 473,1
МС m/z (M+H+) 491,0
МС m/z (M+H+) 581,0
МС m/z (M+H+) 509,2
МС m/z (M+H+) 480,3
Пример 48
4-(Циклогексанкарбоксамидо)бензойная кислота, 48d. Смесь 4-аминобензойной кислоты 48a (1,98 ммоль, 300 мг), циклогексанкарбонилхлорида 48b (1,98 ммоль, 291 мг) и Et3N (2,52 ммоль, 0,43 мл) в 6 мл THF перемешивали при комнатной температуре в течение ночи. 1N водного раствора NaOH (7,9 ммоль, 7,9 мл) добавили к смеси (содержащей метил 4-(циклогексанкарбоксамидо)бензоат 48c). Реакционную смесь перемешивали при комнатной температуре в течение 5 часов. THF удалили в роторном испарителе и добавили 1N водного раствора HCl для осаждения продукта, который отфильтровали для получения 480 мг (92%) соединения 48d.
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующее соединение, составляющее предмет настоящего изобретения.
МС m/z (M+H+) 482,1
Пример 49
2-(4,4-Дифторпиперидин-1-ил)бензо[d]тиазол-6-карбоновая кислота, 49d. Смесь 2-бромэтилбензо[d]тиазол-6-карбоксилата 49a (1,75 ммоль, 500 мг), 4,4-дифторпиперидина 49b (1,92 ммоль, 303 мг) и Cs2CO3 (5,24 ммоль, 1,71 г) в 15 мл CH3CN нагревали в колбе с обратным холодильником в течение ночи. Суспензию охладили до комнатной температуры и к смеси добавили 15 мл воды (содержащую этил 2-(4,4-дифторпиперидин-1-ил)бензо[d]тиазол-6-карбоксилат, 49с). Реакционную смесь нагревали при 60ºC в течение 18 часов. После охлаждения смесь подкислили 3N водного раствора HCl, полученный осадок отфильтровали для получения 575 мг (99%) соединения 49d. МС m/z (M+H+) 299,1
Следуя процедуре, описанной выше для примера 9, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующее соединение, составляющее предмет настоящего изобретения.
МС m/z (M+H+) 533,2
Пример 50
3-Хлор-1-(4-фторфенил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 1365. К раствору соединения 487 (0,2 ммоль, 100 мг) в CCl4 (4 мл) и CH2Cl2 (4 мл) добавили NCS (0,25 ммоль, 33 мг). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Затем ее разбавили CH2Cl2и промыли 1N водного NaOH и H2O, высушили над Na2SO4 и сконцентрировали. Осадок очистили колоночной флеш-хроматографией (силикагель, 3% MeOH/CH2Cl2), получив 51 мг соединения 1365. МС m/z (M+H+) 524.
Пример 51
A. 1-(3-Циано-4-фторфенил)-индол-5-карбоновая кислота (51a) и 1-(3-карбамоил-4-фторфенил)-индол-5-карбоновая кислота (51b). Промежуточные соединения 51a и 51b получили способом, описанным в примере 9e в пропорции ~1:1.
B. 2-Фтор-5-[5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол-1-ил]бензонитрил, соединение 1417, и 2-фтор-5-[5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол-1-ил]бензамид, соединения 1418. Cоединение 1417 и соединение 1418 получили способом, описанным в примере 9 из дигидрохлорида соединения 5а (0,22 ммоль, 72 мг), смеси ~1:1 соединений 51a и 51b (0,19 ммоль, 54 мг), HATU (0,22 ммоль, 85 мг) и Et3N (1,11 ммоль, 0,15 мл) в 4 мл CH2Cl2. После отработки и очистки колоночной флеш-хроматографией (силикагель, 3-4% MeOH/CH2Cl2) получили 28 мг (59%) соединения 1417 с последующим образованием 15 мг (31%) соединения 1418. Соединение 1417: МС m/z (M+H+) 515. Соединение 1418: МС m/z (M+H+) 533.
Пример 52
A. Метил 5-фенилбензо[b]тиофен-2-карбоксилат, 52b. Смесь соединения 52a (542,3 мг, 2 ммоль), фенилбороновой кислоты 1x (268,2 мг, 2,2 ммоль), Pd(dppf)Cl2.CH2Cl2 (98 мг, 0,12 ммоль) и K2CO3 (414,6 мг, 3 ммоль) в смеси диоксан (4 мл)/вода (1 мл) поместили в закрытый сосуд и нагревали при 80°C в течение ночи. Затем реакционную смесь разбавили EtOAc и водой. Органический слой сконцентрировали при пониженном давлении и очистили колоночной флеш-хроматографией (силикагель, 2-10% EtOAc/гептан), получив соединение 52b (510 мг). МС m/z (M+H+) 269,1
B. 5-Фенилбензо[b]тиофен-2-карбоновая кислота, 52c. Раствор соединения 52b (510 мг, 1,9 ммоль) и LiOH.H2O (319 мг, 7,6 ммоль) в THF/H2O (10/10 мл) перемешивали при комнатной температуре в течение ночи. Образовавшуюся смесь сконцентрировали и разбавили водой. Слой воды подкислили 1N водного раствора HCl до pH~4 и экстрагировали с помощью CH2Cl2. Органический раствор высушили над Na2SO4 и сконцентрировали, получив соединение 52c (479 мг), которое использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 255,0
С. 3-Фтор-5-фенилбензо[b]тиофен-2-карбоновая кислота, 52d. К раствору соединения 52c (507 мг, 1,99 ммоль) в THF (8 мл) при -70°C добавили н-бутиллитий (1,6 M в гексане, 2,62 мл, 4,19 ммоль). Смесь перемешивали при -70°C в течение 1 часа; затем медленно добавили раствор N-фторбензолсульфонимида (817,3 мг, 2,59 ммоль) в THF (2 мл). Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение ночи. Полученную смесь экстрагировали с помощью EtOAc из разбавленной водной HCl. Органический раствор промыли водой и соляным раствором, высушили над Na2SO4 и сконцентрировали. Остаток растерли из CH2Cl2, отфильтровали и высушили выпавший осадок, получив соединение 52d (391,9 мг). МС m/z (M+H+) 273,0
D. 3-Фтор-5-фенилбензо[b]тиофен-2-карбонилхлорид, 52e. К раствору соединения. 52d (136,2 мг, 0,5 ммоль) в CH2Cl2 (5 мл) при комнатной температуре добавили (COCl)2 (0,064 мл, 0,75 ммоль) с последующим образованием DMF (0,01 мл, 0,125 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали для получения соединения 52e (светло-розовый порошок), которое использовали в следующей реакции без дополнительной очистки.
E. 1-{1-[(3-Фтор-5-фенил-1-бензотиофен-2-ил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 1315. К раствору соединения 5e (42,7 мг, 0,131 ммоль) и Et3N (0,07 мл, 0,5 ммоль) в CH2Cl2 (2 мл) при 0°C медленно добавили раствор соединения 52e (36,3 мг, 0,125 ммоль) в CH2Cl2 (1 мл). Реакционную смесь перемешивали при 0°C в течение 2 часов, разбавили CH2Cl2 и промыли водным раствором NaHCO3. Органический слой высушили над Na2SO4 и сконцентрировали. Остаток очистили колоночной флеш-хроматографией (силикагель, 2% MeOH/EtOAc), получив соединение 1315 (16,7 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,98 (д, J=1,2 Гц, 1H), 7,89 (д, J=3,2 Гц, 1H), 7,80-7,86 (м, 1H), 7,73 (дд, J=8,6, 1,7 Гц, 1H), 7,62-7,68 (м, 2H), 7,55 (д, J=3,2 Гц, 1H), 7,46-7,53 (м, 2H), 7,37-7,44 (м, 1H), 4,22-4,67 (м, 5H), 4,05-4,20 (м, 1H), 3,77-4,01 (м, 2H), 3,25-3,37 (м, 1H), 2,42-2,68 (м, 4H). МС m/z (M+H+) 507,0
Следуя процедуре, описанной выше для примера 52, заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 575,1
МС m/z (M+H+) 575,1
Пример 53
A. 1-Трет-бутил 6-метил-3-(4-фторфенил)-1H-индол-1,6-дикарбоксилат, 53c. Смесь соединения 53a (1,00 г, 2,49 ммоль), 4-фторфенилбороновой кислоты 53b (523 мг, 3,74 ммоль), Pd(OAc)2 (44,8 мг, 0,2 ммоль), 2-дициклогексилфосфин-2',6'-диметоксибифенила (SPhoс, 204,7 мг, 0,5 ммоль) и K3PO4 (1,06 г, 4,99 ммоль) в толуоле (5 мл) поместили в закрытый сосуд и нагревали при 90°C в атмосфере N2 в течение 3 часов. Затем реакционную смесь разбавили EtOAc и водой. Органический слой промыли в соляном растворе, сконцентрировали при пониженном давлении и очистили колоночной флеш-хроматографией (силикагель, 2-10% EtOAc/гептан), получив соединение 53c в виде светло-желтого твердого вещества, которое затем перекристаллизовали из гептана, получив твердое соединение белого цвета (707 мг). МС m/z (M+H+) 370,2.
B. Метил 3-(4-фторфенил)-1H-индол-6-карбоксилат, 53d. К раствору соединения 53с (705 мг, 1,91 ммоль) в CH2Cl2 (4 мл) при комнатной температуре добавили трифторуксусную кислоту (1,5 мл). Смесь перемешивали при комнатной температуре в течение 2 часов. Полученную смесь сконцентрировали, получив соединение 53d (603,3 мг) в виде твердого вещества белого цвета. МС m/z (M+H+) 270,1.
С. 3-(4-Фторфенил)-1H-индол-6-карбоновая кислота, 53e. Раствор соединения 53d (303 мг, 0,79 ммоль) и LiOH.H2O (132,7 мг, 3,16 ммоль) в THF/H2O (10 мл/10 мл) перемешивали при 45°C в течение 5 часов. Образовавшуюся смесь сконцентрировали и разбавили водой. Слой воды подкислили 1N водного раствора HCl до pH~4 и экстрагировали с помощью CH2Cl2. Органический раствор высушили над Na2SO4 и сконцентрировали, получив соединение 53e (249 мг), которое использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 256,0.
D. 3-(4-Фторфенил)-6-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 1317. К смеси соединения 5e (42,9 мг, 0,132 ммоль), соединения 53e (30,6 мг, 0,12 ммоль) и Et3N (0,084 мл, 0,6 ммоль) в CH2Cl2 (1 мл) при комнатной температуре добавили HATU (70 мг, 0,168 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавили CH2Cl2 и H2O, промыли водным NaHCO3 и соляным раствором, высушили над Na2SO4, отфильтровали и сконцентрировали. Остаток очистили колоночной флеш-хроматографией (силикагель, 2-4% MeOH/EtOAc), получив соединение 1317 (45,4 мг). 1H ЯМР (400 МГц, CDCl3): δ 8,56 (уш.с, 1H), 7,83-7,94 (м, 3H), 7,57-7,65 (м, 2H), 7,55 (д, J=3,2 Гц, 1H), 7,46 (д, J=2,4 Гц, 1H), 7,40-7,45 (м, 1H), 7,13-7,20 (м, 2H), 4,07-4,66 (м, 6H), 3,76-4,01 (м, 2H), 3,21-3,36 (м, 1H), 2,38-2,64 (м, 4H). МС m/z (M+H+) 490,2.
Следуя процедуре, описанной выше для примера 53, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 53, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 472,2.
МС m/z (M+H+) 490,2.
Пример 53а
E. Метил 3-(4-фторфенил)-1-метил-1H-индол-6-карбоксилат, 53f. К раствору соединения 53d (300 мг, 0,78 ммоль) в DMF (3 мл) добавили NaH (60% в минеральном масле, 68,9 мг, 1,72 ммоль) при 0°C. Смесь перемешивали при 0°C в течение 30 минут, затем добавили CH3I (0,053 мл, 0,86 ммоль) и продолжили перемешивание при 0°C еще в течение 1 часа. Полученную смесь разбавили EtOAc и водой. Органический слой промыли в соляном растворе и сконцентрировали. Остаток перекристаллизовали из гептана, отфильтровали и промыли выпавший осадок, получив соединение 53f (265 мг) в форме светло-желтого твердого вещества. МС m/z (M+H+) 284,1.
F. 3-(4-Фторфенил)-1-метил-1H-индол-6-карбоновая кислота, 53g. Раствор соединения 53f (264 мг, 0,93 ммоль) и LiOH.H2O (156,4 мг, 3,73 ммоль) в THF/H2O (10 мл/10 мл) перемешивали при 45°C в течение 5 часов. Образовавшуюся смесь сконцентрировали и разбавили водой. Слой воды подкислили 1N водного раствора HCl до pH~4 и экстрагировали с помощью CH2Cl2. Органический раствор высушили над Na2SO4 и сконцентрировали, получив соединение 53g (252 мг), которое использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 270,1.
Следуя процедуре, описанной выше для примера 53а, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 53, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=2,9 Гц, 1H), 7,79-7,87 (м, 2H), 7,51-7,63 (м, 3H), 7,39 (д, J=8,3 Гц, 1H), 7,31 (с, 1H), 7,15 (т, J=8,7 Гц, 2H), 4,21-4,67 (м, 5H), 4,08-4,21 (м, 1H), 3,89 (с, 3H), 3,77-3,98 (м, 2H), 3,19-3,35 (м, 1H), 2,36-2,65 (м, 4H)
МС m/z (M+H+) 504,1
МС m/z (M+H+) 504,1
Пример 54
A. Этил 1-метил-3-фенил-1H-индазол-5-карбоксилат, 54b. Смесь соединения 54a (300 мг, 0,91 ммоль), фенилбороновой кислоты 1x (133 мг, 1,09 ммоль), Pd(dppf)Cl2.CH2Cl2 (40 мг, 0,055 ммоль) и K2CO3 (251,2 мг, 1,82 ммоль) в смеси толуол (2 мл)/вода (0,4 мл) поместили в закрытый сосуд и нагревали при 90°C в течение ночи. Затем реакционную смесь разбавили EtOAc и водой. Органический слой сконцентрировали при пониженном давлении и очистили колоночной флеш-хроматографией (силикагель, 2-10% EtOAc/гептаны), получив соединение 54b (231 мг). МС m/z (M+H+) 281,1.
B. 1-Метил-3-фенил-1H-индазол-5-карбоновая кислота, 54c. Раствор соединения 54b (230 мг, 0,58 ммоль) и LiOH.H2O (98 мг, 2,33 ммоль) в THF/H2O (10/10 мл) перемешивали при 45°C в течение 8 часов. Образовавшуюся смесь сконцентрировали и разбавили водой. Слой воды подкислили 1N водного раствора HCl до pH~4 и экстрагировали с помощью CH2Cl2. Органический раствор высушили над Na2SO4 и сконцентрировали, получив соединение 54c (206 мг), которое использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 253,1.
С. 1-Метил-3-фенил-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индазол, соединение 1137. К смеси соединения 5e (42,9 мг, 0,132 ммоль), соединения 54c (30,3 мг, 0,12 ммоль) и Et3N (0,084 мл, 0,6 ммоль) в CH2Cl2 (1 мл) при комнатной температуре добавили HATU (70 мг, 0,168 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавили CH2Cl2 и H2O, промыли водным NaHCO3 и соляным раствором, высушили над Na2SO4, отфильтровали и сконцентрировали. Остаток очистили колоночной флеш-хроматографией (силикагель, 2-4% MeOH/EtOAc), получив соединение 1137 (48,1 мг). 1H ЯМР (400 МГц, CDCl3): δ 8,32 (с, 1H), 7,94 (д, J=7,3 Гц, 2H), 7,88 (д, J=3,2 Гц, 1H), 7,74 (д, J=9,5 Гц, 1H), 7,49-7,58 (м, 3H), 7,39-7,48 (м, 2H), 4,16 (с, 3H), 4,09-4,62 (м, 6H), 3,86 (м, 2H), 3,21-3,33 (м, 1H), 2,39-2,63 (м, 4H). МС m/z (M+H+) 487,2.
Следуя процедуре, описанной выше для примера 54, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 54, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 505,2
МС m/z (M+H+) 505,2
МС m/z (M+H+) 485
МС m/z (M+H+) 553
МС m/z (M+H+) 478
МС m/z (M+H+) 546
Пример 55
A. Метил 2,3-дигидро-1H-индол-5-карбоксилат, 55a. К раствору метил 1H-индол-5-карбоксилата 1j (2 г, 11,4 ммоль) в ледяной уксусной кислоте (15 мл) при 0°C медленно добавили натрия цианоборгидрид (1,08 г, 17,2 ммоль). Смеси дали нагреться и затем перемешивали при комнатной температуре в течение 2 часов. К полученной смеси при 0°C добавили воду и рН раствора довели до ~12, добавив 1N водного раствора NaOH. Смесь экстрагировали с помощью CH2Cl2, органический слой промыли в соляном растворе и высушили над Na2SO4. Раствор сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 15% EtOAc/гептан), получив соединение 55a (1,79 г). МС m/z (M+H+) 178,1.
B. Метил 1-(4-фторфенил)-2,3-дигидро-1H-индол-5-карбоксилат (55b) и 1-(4-фторфенил)-2,3-дигидро-1H-индол-5-карбоновая кислота (55c). Смесь соединения 55a (500 мг, 2,82 ммоль), 1-бром-4-фторбензола 1k (0,31 мл, 2,82 ммоль), Pd2(dba)3 (129 мг, 0,14 ммоль), BINAP (132 мг, 0,21 ммоль) и трет-бутоксида натрия (325 мг, 3,39 ммоль) в толуоле (25 мл) поместили в закрытый сосуд и нагревали при 80°C в течение ночи. Затем реакционную смесь разбавили EtOAc и водой; с помощью 1Н водного NaOH основность слоя воды была повышена до pH~8. Органический слой сконцентрировали при пониженном давлении и очистили колоночной флеш-хроматографией (силикагель, 5-30% EtOAc/гептан), получив соединение 55b (145 мг), МС m/z (M+H+) 272,1, и соединение 55c (232 мг), МС m/z (M+H+) 258,0.
С. 1-(4-Фторфенил)-2,3-дигидро-1H-индол-5-карбоновая кислота, 55d. Раствор соединения 55b (144 мг, 0,53 ммоль) и LiOH.H2O (89,1 мг, 2,12 ммоль) в THF/H2O (5 мл/5 мл) перемешивали при 45°C в течение ночи. Образовавшуюся смесь сконцентрировали и разбавили водой. Слой воды подкислили 1N водного раствора HCl до pH~4 и экстрагировали с помощью CH2Cl2. Органический раствор высушили над Na2SO4 и сконцентрировали, получив соединение 55d (138 мг), которое использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 258,0.
D. 1-(4-Фторфенил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1}-ил-карбонил)-2,3-дигидро-1H-индол, соединение 885. К смеси соединения 5e (42,9 мг, 0,132 ммоль), соединения 55d (30,9 мг, 0,12 ммоль) и Et3N (0,084 мл, 0,6 ммоль) в CH2Cl2 (1 мл) добавили HATU при комнатной температуре (70 мг, 0,168 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавили CH2Cl2и промыли H2O, водным NaHCO3 и солевым раствором, а затем высушили над Na2SO4, отфильтровали и сконцентрировали. Остаток очистили колоночной флеш-хроматографией (силикагель, 2-4% MeOH/EtOAc), получив соединение 885 (44,4 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=3,2 Гц, 1H), 7,55 (д, J=3,2 Гц, 1H), 7,51 (д, J=1,2 Гц, 1H), 7,38 (дд, J=8,3, 1,7 Гц, 1H), 7,16-7,25 (м, 2H), 7,03-7,12 (м, 2H), 6,88 (д, J=8,3 Гц, 1H), 4,05-4,67 (м, 6H), 3,99 (т, J=8,6 Гц, 2H), 3,76-3,94 (м, 2H), 3,20-3,30 (м, 1H), 3,16 (т, J=8,6 Гц, 2H), 2,37-2,64 (м, 4H); МС m/z (M+H+) 492,1.
Следуя процедуре, описанной выше для примера 55, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 55, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 492,1
МС m/z (M+H+) 492,1
МС m/z (M+H+) 474,1
Пример 55а
E. Метил 1-бензил-2,3-дигидро-1H-индол-5-карбоксилат, 55e. Раствор метил 2,3-дигидро-1H-индол-5-карбоксилата соли гидрохлорида 55a (88,6 мг, 0,42 ммоль) и бензальдегида 23a (0,060 мл, 0,55 ммоль) в CH2Cl2 (4 мл) перемешивали при комнатной температуре в течение 30 минут. Затем к смеси добавили триацетоксиборгидрид натрия (159 мг, 0,75 ммоль) и перемешивали еще в течение 2 часов. К полученной смеси при 0°C добавили воду и рН раствора довели до~8, добавив 1N водного раствора NaOH. Смесь экстрагировали с помощью CH2Cl2, органический слой промыли в соляном растворе и высушили над Na2SO4. Раствор сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 10-25% EtOAc/гептаны), получив соединение 55е (81,3 мг). МС m/z (M+H+) 268,0.
F. 1-Бензил-2,3-дигидро-1H-индол-5-карбоновая кислота, 55f. Раствор соединения 55e (80,2 мг, 0,3 ммоль) и LiOH.H2O (50,4 мг, 1,2 ммоль) в THF/H2O (1,2/1,2 мл) перемешивали при комнатной температуре в течение ночи. Образовавшуюся смесь сконцентрировали и разбавили водой. Слой воды подкислили 1N водн. HCl до pH ~4 и экстрагировали с помощью CH2Cl2. Органический раствор высушили над Na2SO4 и сконцентрировали, получив соединение 55f (60 мг), которое использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 254,1.
G. 1-Бензил-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1}-ил-карбонил)-2,3-дигидро-1H-индол, соединение 994. К раствору соединения 5e (89,5 мг, 0,261 ммоль), соединения 55f (60 мг, 0,237 ммоль) и 1,2-дихлорэтана (EDC) (68,1 мг, 0,356 ммоль) в CH2Cl2 (5 мл) добавили Et3N (0,1 мл, 0,711 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавили CH2Cl2 и H2O; с помощью 1N водной HCl слой воды подкислили до pH ~6. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. Остаток очистили обращенно-фазовой хроматографией, получив соединение 994 в виде трифторуксусной соли (40,4 мг). 1H ЯМР (400 МГц, CD3OD): δ 7,98 (д, J=3,2 Гц, 1H), 7,89 (д, J=3,2 Гц, 1H), 7,36-7,44 (м, 2H), 7,29-7,36 (м, 4H), 7,22-7,29 (м, 1H), 6,52 (д, J=8,3 Гц, 1H), 4,39-4,91 (м, 6H), 4,38 (с, 2H), 3,99-4,23 (м, 3H), 3,48 (т, J=8,6 Гц, 2H), 3,42 (уш.с, 4H), 3,01 (т, J=8,6 Гц, 2H). МС m/z (M+H+) 488,1.
Следуя процедуре, описанной выше для примера 55а, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 55a, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 556,0
МС m/z (M+H+) 556,0
Пример 55b
H. Метиловый эфир 1-бензоил-2,3-дигидро-1H-индол-5-карбоновой кислоты, 55g. К раствору метил 2,3-дигидро-1H-индол-5-карбоксилата хлороводородной соли 55a (64,1 мг, 0,3 ммоль) и бензоилхлорида 1t (0,042 мл, 0,36 ммоль) в CH2Cl2 (1 мл) добавили Et3N (0,13 мл, 0,9 ммоль) при 0°C. Реакционную смесь перемешивали при 0°C в течение 2 часов. Полученную смесь разделили между СН2Cl2 и H2O. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. В результате очистки остатка колоночной флеш-хроматографией (силикагель, 10-20% EtOAc/гептаны) получили соединение 55g (88 мг). МС m/z (M+H+) 282,0.
I. 1-Бензоил-2,3-дигидро-1H-индол-5-карбоновая кислота, 55h. Раствор соединения 55g (87 мг, 0,31 ммоль) и LiOH.H2O (52 мг, 1,24 ммоль) в THF/H2O (2/2 мл) перемешивали при комнатной температуре в течение ночи. Образовавшуюся смесь сконцентрировали и разбавили водой. Водный слой подкислили 1N водного раствора HCl до pH ~6 и экстрагировали с помощью CH2Cl2. Органический раствор высушили над Na2SO4 и сконцентрировали, получив соединение 55h (82 мг), которое использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 268,0.
J. 1-(Фенилкарбонил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-2,3-дигидро-1H-индол, соединение 724. К раствору соединения 5e (115,9 мг, 0,34 ммоль), соединения 55h (82 мг, 0,31 ммоль) и 1,2-дихлорэтана (EDC) (87,9 мг, 0,46 ммоль) в CH2Cl2 (5 мл) добавили Et3N (0,13 мл, 0,92 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавили CH2Cl2 и H2O; с помощью 1Н водной HCl слой воды подкислили до pH ~6. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. Остаток очистили колоночной флеш-хроматографией (силикагель, 2% MeOH/EtOAc), получив соединение 724 (64,4 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=3,2 Гц, 1H), 7,31-7,63 (м, 9H), 4,38-4,63 (м, 2H), 4,03-4,37 (м, 6H), 3,74-3,96 (м, 2H), 3,20-3,29 (м, 1H), 3,16 (т, J=8,3 Гц, 2H), 2,38-2,61 (м, 4H). МС m/z (M+H+) 502,0.
Следуя процедуре, описанной выше для примера 55b, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 55b, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 466,0
Пример 56
A. Метил 3-бензил-1-метил-1H-индол-6-карбоксилат, 56c. К раствору соединения 56a (500 мг, 2,64 ммоль) и бензилхлорида 56b (0,33 мл, 2,91 ммоль) в диоксане (5 мл) добавили оксид серебра (673,6 мг, 2,91 ммоль). Смесь перемешивали при температуре 80°C в течение ночи. Полученную смесь отфильтровали через целит и промыли EtOAc. Фильтрат сконцентрировали и остаток очистили колоночной флеш-хроматографией (силикагель, 20-60% CH2Cl2/гептаны), получив соединение 56c (168 мг). МС m/z (M+H+) 280,2.
B. 3-Бензил-1-метил-1H-индол-6-карбоновая кислота, 56d. Раствор соединения 56c (168 мг, 0,60 ммоль) и LiOH.H2O (101 мг, 2,41 ммоль) в THF/H2O (3/3 мл) перемешивали при комнатной температуре в течение 6 часов. Конечную смесь сконцентрировали, остаток экстрагировали с помощью CH2Cl2, H2O, cлой воды подкислили 1N HCl (водн.) до pH~4. Органический раствор высушили над Na2SO4 сконцентрировали, получив соединение 56d (172,2 мг), которое использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 266,2.
C. 3-Бензил-1-метил-6-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 753. К смеси соединения 5e (71,6 мг, 0,22 ммоль), соединения 56d (53,1 мг, 0,2 ммоль) и Et3N (0,14 мл, 1,0 ммоль) в CH2Cl2 (1 мл) при комнатной температуре добавили HATU (106,5 мг, 0,28 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавили CH2Cl2 и H2O, промыли водным NaHCO3 и соляным раствором, высушили над Na2SO4, отфильтровали и сконцентрировали. Остаток очищали колоночной флеш-хроматографией (силикагель, 2-4% MeOH/EtOAc) и получили cоединение 753 (20,8 мг). 1H ЯМР (400 МГц, CDCl3): δ 7,89 (д, J=2,4 Гц, 1H), 7,74 (с, 1H), 7,55 (д, J=2,7 Гц, 1H), 7,49 (д, J=8,3 Гц, 1H), 7,15-7,35 (м, 6H), 6,89 (с, 1H), 4,06-4,60 (м, 8H), 3,79-3,98 (м, 2H), 3,78 (с, 3H), 3,17-3,31 (м, 1H), 2,35-2,64 (м, 4H). МС m/z (M+H+) 500,3.
Следуя процедуре, описанной выше для примера 56, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 56, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 518,1
МС m/z (M+H+) 518,1
МС m/z (M+H+) 500,1
m/z (M+H+) 518,2
Пример 57
5-({3-[4-(1,3-Тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,3,3-трис[3-(трифторметил)бензил]-1,3-дигидро-2Н-индол-2-он, соединение 1430. К раствору соединения 918 (из примера 9) (25 мг, 0,061 ммоль) и K2CO3 (16,9 мг, 0,122 ммоль) в DMF (0,8 мл) добавили 3-трифторметилбензил бромид (20,4 мг, 0,085 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Полученную смесь экстрагировали с помощью EtOAc и H2O. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. Остаток очистили обращенно-фазовой хроматографией, получив соединение 1430 в виде трифторуксусной соли (3,6 мг), МС m/z (M+H+) 885,9.
Следуя процедуре, описанной выше для примера 57, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 682,0
МС m/z (M+H+) 728,0
Пример 58
5-({3-[4-(1,3-Тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 911, и 1-(2,3-дигидро-1H-индол-5-ил-карбонил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 988. К раствору соединения 5e (300 мг, 0,92 ммоль), смеси 2,3-дигидро-1H-индол-5-карбоновой кислоты хлороводородной соли 58a (101 мг, 0,51 ммоль) и 1H-индол-5-карбоновой кислоты хлороводородной соли 58b (100 мг, 0,51 ммоль) и EDC (265 мг, 1,38 ммоль) в CH2Cl2 (10 мл) добавили Et3N (0,39 мл, 2,77 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученную смесь экстрагировали с помощью CH2Cl2 и промыли H2O. Органическую часть раствора высушили над Na2SO4 и сконцентрировали. Остаток очистили обращенно-фазовой хроматографией, получив соединение 911 в виде трифторуксусной соли (89,4 мг) и соединение 988 в виде трифторуксусной соли (13,8 мг).
Соединение 911: 1H ЯМР (400 МГц, CD3OD): δ 10,93 (уш.с, 1H), 7,98 (д, J=3,2 Гц, 1H), 7,95 (с, 1H), 7,89 (д, J=3,2 Гц, 1H), 7,47 (с, 2H), 7,36 (д, J=3,2 Гц, 1H), 6,57 (д, J=2,9 Гц, 1H), 4,25-4,84 (м, 6H), 3,91-4,15 (м, 4H), 2,80 (уш.с, 4H). МС m/z (M+H+) 396,0.
Соединение 988: 1H ЯМР (400 МГц, CD3OD): δ 7,98 (д, J=3,2 Гц, 1H), 7,88 (д, J=3,2 Гц, 1H), 7,85 (д, J=1,0 Гц, 1H), 7,58 (с, 1H), 7,27-7,56 (м, 5H), 6,56 (д, J=3,2 Гц, 1H), 4,29-4,89 (м, 6H), 4,20 (т, J=8,3 Гц, 2H), 3,96-4,15 (м, 3H), 3,32-3,43 (м, 4H), 3,17 (т, J=8,3 Гц, 2H). МС m/z (M+H+) 541,0.
Пример 59
A. 3-Метил-[1,1'-дифенил]-4-карбоновая кислота, 59b. Названное соединение 59b получили способом, описанным в примере 6 (стадия F), при использовании 4-бром-2-метилбензойной кислоты (59a) вместо соединения 173 и фенилборной кислоты 1х вместо соединения 6e. Полученное соединение 59b очистили обращенно-фазовой хроматографией. МС m/z (M+H+) 213,1.
B. 1-{1-[(3-Метилдифенил-4-ил)карбонил]азетидин-3-ил}-4-(фенилкарбонил)пиперазин, соединение 619. Названное соединение 619 получили способом, описанным в примере 9, при использовании соединения 59b вместо соединения 9c и соединения 2c вместо соединения 5e. Полученное соединение 619 очистили обращенно-фазовой хроматографией. МС m/z (M+H+) 440,1.
Следуя процедуре, описанной выше для примера 59, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 59, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 440,2
МС m/z (M+H+) 444,1
МС m/z (M+H+) 456,1
МС m/z (M+H+) 460,2
МС m/z (M+H+) 495,3
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,33-7,66 (м, 8H), 4,62-4,76 (м, 2H), 4,38-4,51 (м, 1H), 4,13-4,35 (м, 3H), 3,84-4,07 (м, 3H), 3,02-3,19 (м, 4H), 2,47 (с, 1H)
МС m/z (M+H+) 447,1
1H ЯМР (300 МГц, CD3OD): δ 7,98 (д, 1H), 7,88 (д, 1H), 7,59 (с, 1H), 7,54 (дд, 1H), 7,27-7,49 (м, 6H), 4,61-4,78 (м, 3H), 4,39-4,61 (м, 2H), 4,33 (м, 1H), 3,88-4,11 (м, 3H), 3,10-3,26 (м, 4H), 2,30 (с, 3H)
МС m/z (M+H+) 447,1
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,36-7,73 (м, 8H), 4,23-4,76 (м, 6H), 3,85-4,07 (м, 3H), 3,04-3,20 (м, 4H)
МС m/z (M+H+) 451,2
МС m/z (M+H+) 463,2
МС m/z (M+H+) 467,1
МС m/z (M+H+) 447,1
1H ЯМР (300 МГц, CD3OD): δ 9,06 (с, 1H), 8,22 (д, 1H), 7,38-7,71 (м, 8H), 4,28-4,53 (м, 4H), 3,94-4,25 (м, 5H), 3,16-3,27 (м, 4H)
МС m/z (M+H+) 451,1
МС m/z (M+H+) 463,2
МС m/z (M+H+) 467,1
МС m/z (M+H+) 501,0
МС m/z (M+H+) 501,0
МС m/z (M+H+) 563,0
МС m/z (M+H+) 463,0
МС m/z (M+H+) 501,0
МС m/z (M+H+) 451,0
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,87 (д, 1H), 7,80 (д, 1H), 7,66-7,75 (м, 2H), 7,50-7,64 (м, 2H), 7,05-7,16 (д, 1H), 4,24-4,75 (м, 6H), 3,83-4,06 (м, 3H), 3,02-3,18 (м, 4H)
МС m/z (M+H+) 469,0
МС m/z (M+H+) 501,0
МС m/z (M+H+) 451,0
МС m/z (M+H+) 469,0
МС m/z (M+H+) 451,0
МС m/z (M+H+) 467,0
МС m/z (M+H+) 463,0
МС m/z (M+H+) 447,0
МС m/z (M+H+) 451,0
МС m/z (M+H+) 467,0
МС m/z (M+H+) 463,0
МС m/z (M+H+) 447,0
МС m/z (M+H+) 451,0
МС m/z (M+H+) 451,0
1H ЯМР (300 МГц, CD3OD): δ 8,12 (с, 1H), 8,07 (с, 1H), 7,96 (д, 1H), 7,92 (с, 1H), 7,86 (д, 1H), 7,67-7,74 (м, 2H), 7,42-7,57 (м, 3H), 4,57-4,74 (м, 3H), 4,38-4,55 (м, 2H), 4,33 (м, 1H), 3,91-4,02 (м, 2H), 3,85 (м, 1H), 3,01-3,13 (м, 4H)
МС m/z (M+H+) 501,0
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,88 (д, 1H), 7,64-7,74 (м, 3H), 7,56-7,63 (дт, 1H), 7,35-7,53 (м, 4H), 4,31-4,83 (м, 6H), 3,94-4,10 (м, 3H), 3,19-3,27 (м, 4H)
МС m/z (M+H+) 451,0
МС m/z (M+H+) 501,0
МС m/z (M+H+) 451,0
1H ЯМР (400 МГц, CDCl3): δ 8,56 (д, 1H); 7,92 (д, 1H); 7,78-7,56 (м, 5H); 7,46 (м, 1H); 4,45 (м, 1H); 4,41-4,19 (м, 3H); 3,94 (уш. с, 5H); 3,12 (уш. с, 4H); 2,5 (с, 3H)
МС m/z (M+H+) 515,2
МС m/z (M+H+) 489
МС m/z (M+H+) 507,1
Пример 59а
Следуя процедуре, описанной выше для примера 2, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 515,12
МС m/z (M+H+) 507,05
МС m/z (M+H+) 515,2
МС m/z (M+H+) 507,1
МС m/z (M+H+) 489,2
Пример 60
A. Метил 4-((4-фторфенил)амино)-3-нитробензоат, 60c. Смесь метил 4-фтор-3-нитробензоата 60a (1 г, 5,02 ммоль), 4-фторанилина 60b (4,34 мл, 5,02 ммоль) и диизопропилэтиламина (1,04 мл, 6,03 ммоль) в DMF (10 мл) перемешивали при комнатной температуре в течение 2 часов. В смесь добавили воду. Образовавшийся осадок отфильтровали, промыли водой и высушили. Полученное соединение 60с использовали в следующей реакции без очистки.
B. Метил 3-амино-4-((4-фторфенил)амино)бензоат, 60d. Смесь соединения 60c (1,4 г, 4,8 ммоль) и SnCl2.2H2O (4,9 г, 21,7 ммоль) в EtOH (50 мл) перемешивали при 80oC. Через 4 ч смесь охладили до комнатной температуры и медленно добавили насыщенный водный раствор NaHCO3. Выпавший осадок отфильтровали и промыли H2O. Выпавший осадок измельчили с EtOAc, фильтрат сконцентрировали. Полученное соединение 60d использовали в следующей реакции без очистки. МС m/z (M+H+) 261,1.
C. Метил 1-(4-фторфенил)-1H-безо[d]имидазол-5-карбоксилат, 60e. Смесь соединения 60d (0,18 г, 0,693 ммоль) и триметилортоформата (0,7 мл, 6,39 ммоль) в DMF (2 мл) нагревали в колбе с обратным холодильником в течение 5 часов, а затем охладили до комнатной температуры. В смесь добавили воду. Образовавшийся осадок отфильтровали, промыли водой и высушили. Полученное соединение 60e использовали в следующей реакции без очистки. МС m/z (M+H+) 271,1.
D. 1-(4-Фторфенил)-1H-бензо[d]имидазол-5-карбоновая кислота, 60f. В раствор соединения 60e (0,18 г, 0,666 ммоль) в EtOH (10мл) добавили 1Н водного NaOH (2,5 мл, 2,5 ммоль). Смесь перемешивали при комнатной температуре в течение 4 дней. Растворитель выпарили и добавили 1N водн. HCl с последующим экстрагированием с помощью EtOAc. Органический слой высушили над MgSO4 и сконцентрировали. Полученное соединение 60f использовали в следующей реакции без очистки. МС m/z (M+H+) 257,1.
E. 1-(4-Фторфенил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-бензимидазол, соединение 1167. К раствору соединения 5e (0,058 г, 0,178 ммоль) и HATU (0,081 г, 0,214 ммоль) в CH2Cl2 (3 мл) добавили Et3N (0,099 мл, 0,713 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут, а затем добавили соединение 60f (0,050 г, 0,196 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавили воду (6 мл), после чего смесь экстрагировали с помощью EtOAc. Органический слой высушили над MgSO4 и сконцентрировали. Полученное соединение 1167 очистили препаративной обращенно-фазовой хроматографией. МС m/z (M+H+) 491,2.
Следуя процедуре, описанной выше в примере 60, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, получили следующие промежуточные соединения.
Следуя процедуре, описанной выше для примера 60, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения.
МС m/z (M+H+) 509,2
1H ЯМР (300 МГц, CD3OD): д 8,82 (с, 1H), 8,14 (с, 1H), 7,96-8,03 (м, 3H), 7,86-7,95 (м, 3H), 7,76-7,85 (м, 2H), 7,08 (д, 1H), 4,36-4,86 (м, 6H), 3,97-4,16 (м, 3H), 3,32-3,42 (м, 4H)
МС m/z (M+H+) 541,2
МС m/z (M+H+) 479,1
МС m/z (M+H+) 493,2
МС m/z (M+H+) 515,2
МС m/z (M+H+) 473,2
МС m/z (M+H+) 491,2
МС m/z (M+H+) 509,1
МС m/z (M+H+) 541,2
МС m/z (M+H+) 493,2
МС m/z (M+H+) 515,2
МС m/z (M+H+) 473
Пример 60а
F. Метил 2-метил-1-(4-фторфенил)-1H-бензо[d]имидазол-5-карбоксилат, 60g. Названное соединение 60g получили способом, описанным в примере 60, при использовании триметилортоформиата вместо триэтоксиэтана на стадии С. Полученное соединение 60g использовали в следующей реакции без очистки. МС m/z (M+H+) 285,1.
G. 2-Метил-1-(4-фторфенил)-1H-бензо[d]имидазол-5-карбоксилат, 60h. Названное соединение 60h получили способом, описанным в примере 60, использовав на стадии D соединение 60g вместо 60e. Полученное соединение 60h использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 271,2.
H. Соединение 1227. Названное соединение 1227 получили способом, описанным в примере 60, использовав соединение 60h вместо соединения 60f на стадии E. Полученное соединение 1227 очистили препаративной обращенно-фазовой хроматографией. МС m/z (M+H+) 505,2.
Следуя процедуре, описанной выше для примера 60a, и заменив соответствующие реактивы, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения.
Следуя процедуре, описанной выше для примера 60a, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения.
МС m/z (M+H+) 487,2
МС m/z (M+H+) 523,2
МС m/z (M+H+) 555,2
МС m/z (M+H+) 493,2
МС m/z (M+H+) 507,2
МС m/z (M+H+) 529,2
МС m/z (M+H+) 505,2
МС m/z (M+H+) 487,2
МС m/z (M+H+) 523,2
МС m/z (M+H+) 555,2
МС m/z (M+H+) 493,2
МС m/z (M+H+) 507,1
МС m/z (M+H+) 529,2
МС m/z (M+H+) 480
Пример 60b
I. Метил 1-(4-фторфенил)-2-оксо-2,3-дигидро-1H-бензо[d]мидазол-5-карбоксилат, 60i. Cмесь соединения 60d (0,20 г, 0,826 ммоль) и 1,1'-карбонилдиимидазола (0,535 г, 3,3 ммоль) в DMF (8 мл) нагревали при температуре 90oC в течение 2 часов. Растворитель удалили, остаток измельчили в воде (15 мл). Образовавшийся осадок собрали фильтрованием и промыли водой несколько раз. Полученное соединение 60i использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 287,1.
J. 1-(4-Фторфенил)-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбоксилат, 60j. Названное соединение 60j получили способом, описанным в примере 60, использовав на стадии D соединение 60i вместо 60e. Полученное соединение 60j использовали в следующей реакции без дополнительной очистки. МС m/z (M+H+) 273,1.
K. 1-(4-Фторфенил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1,3-дигидро-2H-бензимидазол-2-он, соединение 934. Названное соединение 934 получили способом, описанным в примере 60, использовав на стадии E соединение 60j вместо 60f. Полученное соединение 934 очистили препаративной обращенно-фазовой хроматографией. МС m/z (M+H+) 507,1.
Следуя процедуре, описанной выше для примера 60b, и заменив соответствующие реактивы, исходные материалы и способы очистки, известные специалистам в данной области, получили следующие промежуточные соединения.
Следуя процедуре, описанной выше для примера 60b, и заменив соответствующие реактивы, исходные материалы и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения.
1H ЯМР (300 МГц, CD3OD): δ 7,97 (д, 1H), 7,88 (д, 1H), 7,56-7,66 (м, 2H), 7,46-7,55 (м, 4H), 7,42 (дд, 1H), 7,08 (д, 1H), 4,26-4,81 (м, 6H), 3,93-4,10 (м, 3H), 3,18-3,27 (м, 4H)
МС m/z (M+H+) 489,1
МС m/z (M+H+) 531,0
МС m/z (M+H+) 525,1
МС m/z (M+H+) 557,0
МС m/z (M+H+) 495,1
МС m/z (M+H+) 509,1
МС m/z (M+H+) 489,1
МС m/z (M+H+) 507,1
МС m/z (M+H+) 525,2
МС m/z (M+H+) 557,2
МС m/z (M+H+) 495,2
МС m/z (M+H+) 509,2
МС m/z (M+H+) 531,2
Пример 61
A. 3-Фтор-6-трифторметилбензо[b]тиофен-2-карбоновая кислота, 61a. Раствор 6-трифторметилбензо[b]тиофен-2-карбоновой кислоты 10a (2,031 ммоль, 0,50 г) в THF (8 мл) обработали при температуре -70ºC 1,6-молярным раствором н-бутиллития в гексане (4,26 ммоль, 2,66 мл). Через 1 час при температуре -70ºC постепенно добавили N-фторбензолсульфонимид (2,64 ммоль, 0,833 г) в THF (2 мл) и реакционную смесь нагрели до комнатной температуры. Через 1 час смесь экстрагировали с помощью EtOAc из разбавленной водной HCl. Органический слой промыли водой и соляным раствором, а затем сконцентрировали. Остаток растерли в CH2Cl2. Осадок недостаточно белого цвета отфильтровали и собрали для получения соединения. 61a.
B. 3-Фтор-6-трифторметилбензо[b]тиофен-2-карбонилхлорид, 61b. Названное соединение 61b получили способом, описанным в примере 10, при использовании на стадии A соединения 61a вместо соединения 10a.
С. 1-(1-{[3-Фтор-6-(трифторметил)-1-бензотиофен-2-ил]карбонил}азетидин-3-ил)-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 895. Названное соединение 895 получили способом, описанным в примере 10, при использовании на стадии B соединения 61b вместо соединения 10b. МС m/z (M+H+) 499.
Следуя процедуре, описанной выше для примера 61, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 499
МС m/z (M+H+) 492
Пример 62
A. 1-Трет-бутил 6-метил 3-фенил-1H-индол-1,6-дикарбоксилат, 62b. Смесь 1-трет-бутил 6-метил 3-йод-1H-индол-1,6-дикарбоксилата 62a (5,02 ммоль, 2,016 г), фенилбороновой кислоты 1x (7,53 ммоль, 0,92 г), Pd(OAc)2 (0,402 ммоль, 90 мг), Sphos (0,904 ммоль, 0,37 г) и K3PO4 (10,1 ммоль, 2,13 г) в толуоле (10 мл) в закрытом реакционном сосуд перемешивали при комнатной температуре в течение 2 минут и затем нагревали при 90ºC в атмосфере N2 в течение 4 часов. Реакционную смесь погасили EtOAc и водой. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 8% EtOAc/гексаны). Желаемый продукт в виде светло-желтого твердого вещества промыли в небольшом количестве гексанов, получив соединение 62b в виде твердого вещества белого цвета.
B. Метил 3-фенил-1Н-индол-6-карбоксилата трифторацетат, 62с. К раствору 1-третбутил 6-метил-3-фенил-1Н-индол-1,6-дикарбоксилата 62b(4,04 ммоль; 1,42 г) в СН2Cl2(8 мл) добавили 6 мл трифторуксусной кислоты. Полученный раствор перемешивали в течение 3 часов. Затем смесь сконцентрировали и промыли гексаном, получив соединение 62с.
C. Метил 1-метил-3-фенил-1Н-индол-6-карбоксилат, 62d. NaH (60%-ая дисперсия в минеральном масле; 4,52 ммоль, 186 мг) порциями добавляли к раствору метил 3-фенил-1Н-индол-6-карбоксилата трифторацетата, соединение 62с (2,07 ммоль, 757 мг), в DMF при температуре 0ºC и перемешивали в течение 20 минут. Далее к смеси добавляли йодистый метил (2,28 ммоль; 0,14 мл) и в течение часа выдерживали полученную реакционную смесь при температуре 0ºC. Затем добавили воду и экстрагировали полученную смесь этилацетатом. Органические фракции сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 15% этилацетат/гексаны), получив соединение 62d.
D. 1-Метил-3-фенил-1Н-индол-6-карбоновая кислота, 62е. Названное соединение 62е получили способом, описанным в примере 29, использовав соединение 62d вместо соединения 29с на стадии B.
E. 1-Метил-3-фенил-6-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 1132. Названное соединение 1132 получили способом, описанным в примере 9, при использовании соединения 62d вместо соединения 9c на стадии D. МС m/z (M+H+) 486.
Следуя процедуре, описанной выше для примера 62, и заменив соответствующие реактивы, исходные материалы и способы очистки, известные специалистам в данной области, получили следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 62, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 536
МС m/z (M+H+) 554
МС m/z (M+H+) 554
МС m/z (M+H+) 554
МС m/z (M+H+) 554
МС m/z (M+H+) 486
МС m/z (M+H+) 547
МС m/z (M+H+) 479
Пример 62а
F. 1-Трет-бутил 6-метил-3-(3-(трифторметил)фенил)-1H-индол-1,6-дикарбоксилат, 62g. Названное соединение 62g получили способом, описанным в примере 62, при использовании на стадии A соединения 62f вместо соединения 1x.
G. Метил 3-(3-(трифторметил)фенил)-1H-индол-6-карбоксилата трифторацетат, 62h. Названное соединение 62h получили способом, описанным в примере 62, при использовании соединения 62g вместо соединения 62b на стадии B.
H. 3-(3-(Трифторметил)фенил)-1H-индол-6-карбоновая кислота, 62i. Названное соединение получили способом, описанным в примере 62, при использовании соединения 62h вместо соединения 62e на стадии D.
E. 6-({3-[4-(1,3-Тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1ил}карбонил)-3-[3-(трифторметил)фенил]-1H-индол, соединение 1341. Названное соединение 1341 получили способом, описанным в примере 9, при использовании соединения 62i вместо соединения 9c на стадии D. МС m/z (M+H+) 540.
Следуя процедуре, описанной выше для примера 62a, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 62a, и заменив соответствующие реактивы, исходные материалы и способы очистки, известные специалистам в данной области, получили следующие вещества, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 533
МС m/z (M+H+) 533
МС m/z (M+H+) 540
МС m/z (M+H+) 540
МС m/z (M+H+) 540
Пример 63
A. Метил 4-(гидрокси(4-(трифторметил)фенил)метил)бензоат, 63c. К раствору метил 4-йодбензоата 63a (8 ммоль, 2,1 г) в 10 мл безводного THF добавили i-пропилмагния хлорид (2M в THF, 8,4 ммоль, 4,2 мл) по каплям, в атмосфере N2 при -20ºC. Раствор перемешивали в течение 30 минут. Затем полученный реактив Гриньяра в THF постепенно добавили к раствору 4-трифторметилбензальдегида (8 ммоль; 1,1 мл) в THF (20 мл) при температуре -40ºC. Через 20 минут реакционную смесь постепенно нагрели до комнатной температуры. Протекание реакции остановили насыщенным водным раствором NH4Cl и готовое соединение экстрагировали с помощью этилацетата. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 15% этилацетат/гексаны), получив соединение 63с в виде белого твердого остатка.
B. 4-Метил 4-(фтор(4-(трифторметил)фенил)метил)бензоат, 63d. К раствору соединения 63c (0,97 ммоль, 300 мг) в CH2Cl2 по каплям добавили DAST (1,015 ммоль; 0,133 мл); реакцию проводили при температуре -78ºC в атмосфере N2. Реакционную смесь выдержали 30 минут при температуре -78ºC и затем остановили реакцию водным раствором NaHCO3 при низкой температуре. В реакционную смесь ввели дополнительное количество CH2Cl2, а затем органический раствор сконцентрировали. Сырой материал очистили колоночной флеш-хроматографией (силикагель, 10% этилацетат/гексаны), получив соединение 63d.
C. 4-(Фтор(4-(трифторметил)фенил)метил)бензойная кислота, 63e. Названное соединение получили способом, описанным в примере 29, использовав на стадии B соединение 63d вместо соединения 29c.
D. 1-{1-[(4-{Фтор[4-(трифторметил)фенил]метил}фенил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-илкарбонил)пиперазин, соединение 982. Названное соединение 982 получили способом, описанным в примере 9, при использовании соединения 63e вместо соединения 9c на стадии D. МС m/z (M+H+) 533.
Пример 64
A. Метил 4-(2-фенил-1,3-дитиолан-2-ил)бензоат, 64b. Метил 4-бензилбензоат 64a (2,08 ммоль, 0,50 г) и BF3.(OAc)2 (5,2 ммоль; 0,73 мл) растворили в сухом CH2Cl2 в атмосфере N2. К смеси добавили этан-1,2-дитиол (3,95 ммоль; 0,333 мл) и раствор перемешивали в течение ночи. Полученную реакционную смесь разделили между CH2Cl2 и водой. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 10% этилацетат/гексаны), получив соединение 64b.
B. Метил 4-(дифтор(фенил)метил)бензоат, 64c. Selectfluor (1,07 ммоль, 381 мг) и HF-пиридиновый реактив (1,5 мл, HF: пиридин = 70:30 % по массе ) растворили в CH2Cl2 (4 мл) в полиэтиленовом флаконе и охладили до 0ºC. Раствор соединения 64b (0,512 ммоль, 162 мг) в CH2Cl2 (2 мл) постепенно добавили к реагентам и получившуюся смесь перемешивали в течение 45 минут при комнатной температуре. Когда результаты TLC показали, что все соединение 64b прореагировало, реакционную смесь разбавили CH2Cl2. Объединенные органические фракции высушили над безводным Na2SO4 и сконцентрировали. Полученный материал очистили колоночной флеш-хроматографией (силикагель, 5% этилацетат/гексаны), получив соединение 64c в виде прозрачного масла.
C. 4-(Дифтор(фенил)метил)бензойная кислота, 64d. Названное соединение 64d получили способом, описанным в примере 29, использовав на стадии B соединение 64c вместо соединения 29c.
D. 1-[1-({4-[Дифтор(фенил)метил]фенил}карбонил)азетидин-3-ил]-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 986. Названное соединение 986 получили способом, описанным в примере 9, при использовании соединения 64d вместо соединения 9c на стадии D. МС m/z (M+H+) 483.
Пример 65
A. Метил 3-циклопропил-6-фторбензо[b]тиофен-2-карбоксилат, 65c. Смесь метил 3-хлор-6-фторбензо[b]тиофен-2-карбоксилата 65a (0,613 ммоль, 150 мг), циклопропилборной кислоты 65b (0,92 ммоль, 79 мг), Pd(OAc)2 (0,09 ммоль, 20 мг), SPhos (0,215 ммоль, 88мг) и K3PO4 (1,23 ммоль; 0,26 г) в толуоле (2 мл) выдерживали в герметичном реакционном сосуде в течение 3 часов при температуре 100ºC. Реакционную смесь разбавили EtOAc и водой. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 10% этилацетат/гексаны), получив соединение 65c.
B. 3-Циклопропил-6-фторбензо[b]тиофен-2-карбоновая кислота, 65d. Названное соединение 65d получили способом, описанным в примере 29, при использовании на стадии B соединение 65c вместо соединения 29c.
C. 3-Циклопропил-6-фторбензо[b]тиофен-2-карбонилхлорид, 65e. Названное соединение 65e получили способом, описанным в примере 10, при использовании на стадии A соединения 65d вместо соединения 10a.
D. 1-{1-[(3-Циклопропил-6-фтор-1-бензотиофен-2-ил)карбонил]азетидин-3-ил}-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 714. Названное соединение 714 получили способом, описанным в примере 10, при использовании соединения 65e вместо соединения 10b на стадии B. МС m/z (M+H+) 471.
Следуя процедуре, описанной выше для примера 65, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 65, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 485
МС m/z (M+H+) 464
МС m/z (M+H+) 478
ЯМР (CDCl3) : δ 7,96 (д, J=1,2 Гц, 1H), 7,84-7,93 (м, 2H), 7,62-7,74 (м, 3H), 7,55 (д, J=3,2 Гц, 1H), 7,49 (м, 2H), 7,34-7,44 (м, 1H), 4,12-4,47 (м, 6H), 3,87 (м, 2H), 3,19-3,35 (м, 1H), 2,69 (с, 3H), 2,50 (м, 4H)
МС m/z (M+H+) 503
Пример 66
A. Метил 4-тиоморфолинхиназолин-7-карбоксилат, 66c. Раствор метил 4-хлорхиназолин-7-карбоксилата 66a (1,01 ммоль, 225 мг) и тиоморфолина 66b (2,02 ммоль, 208 мг) в MeOH (1,6 мл) нагревали с обратным холодильником в течение ночи. После очистки соединение 66c было выделено в количестве 30 мг.
B. 4-Тиоморфолинхиназолин-7-карбоновая кислота, 66d. Названное соединение 66d получили способом, описанным в примере 29, использовав на стадии B соединение 66c вместо соединения 29c.
C. 7-({3-[4-(1,3-Тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-4-тиоморфолин-4-ил-хиназолин, соединение 951. Названное соединение 951 получили способом, описанным в примере 9, при использовании соединения 66d вместо соединения 9c на стадии D. МС m/z (M+H+) 510.
Пример 67
A. 1-(5-Хлор-2-фторфенил)-2,2,2-трифторэтанон, 67c. К раствору LDA (2,0 M в THF/гептан/этилбензол; 25,3 ммоль, 12,6 мл) в сухом THF постепенно добавили 1-фтор-4-хлорбензол 67a (23,0 ммоль; 2,45 мл); реакцию проводили при температуре -78ºC. Смесь перемешивали в течение 1 часа при температуре -78ºC, а затем добавили этилтрифторацетат 67b (25,3 ммоль, 3,02 мл). Реакционную смесь прогревали в течение ночи до комнатной температуры, а затем реакцию остановили насыщенным водным раствором NH4Cl. Смесь экстрагировали с помощью EtOAc. Органические экстракты сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 15% этилацетат/гексаны), получив смесь соединения 67c с регио-изомерным побочным продуктом, 1-(5-фтор-2-хлорфенил)-2,2,2-трифторэтаноном, в соотношении 5:1 (67c - основное соединение).
B. Метил 5-хлор-3-(трифторметил)бензо[b]тиофен-2-карбоксилат, 67e. Раствор соединения 67c (6,62 ммоль; 1,5 г), метил-2-меркаптоацетата 67d (6,62 ммоль; 0,6 мл) и Et3N (8,6 ммоль, 1,2 мл) в ацетонитриле (12 мл) выдержали в течение 4 часов при температуре 75ºC. Далее реакционную смесь разбавили этилацетатом и водой. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 10% этилацетат/гексаны), получив соединение 67e.
C. 5-Хлор-3-трифторметил-бензо[b]тиофен-2-карбоновая кислота, 67f. Названное соединение 67f получили способом, описанным в примере 29, использовав на стадии B соединение 67e вместо соединения 29c.
D. 5-Хлор-3-трифторметил-бензо[b]тиофен-2-карбонилхлорид, 67g. Названное соединение 65e получили способом, описанным в примере 10, при использовании на стадии A соединения 67f вместо соединения 10a.
E. 1-(1-{[5-Хлор-3-(трифторметил)-1-бензотиофен-2-ил]карбонил}азетидин-3-ил)-4-(1,3-тиазол-2-ил-карбонил)пиперазин. Названное соединение 896 получили способом, описанным в примере 10, при использовании соединения 67g вместо соединения 10b на стадии B. МС m/z (M+H+) 515.
Следуя процедуре, описанной выше для примера 67, но заменив соответствующие реагенты, исходные материалы и способы очистки, известными специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 515
МС m/z (M+H+) 508
Пример 67а
F. 1-(4-Хлор-2-фторфенил)-2,2,2-трифторэтанон, 67i. К раствору н-бутиллития (1,6 M в гексане, 4,68 ммоль, 2,93 мл) в сухом THF постепенно добавили 4-хлор-2-фтор-1-йодбензол 67h (3,9 ммоль; 1,0 г); реакцию проводили при температуре -78ºC в атмосфере N2. Реакционную смесь перемешивали в течение 1 часа при температуре -78ºC, а затем добавили этилтрифторацетат 67b (0,51 мл, 4,29 ммоль). Реакционную смесь прогревали в течение ночи до комнатной температуры, а затем реакцию остановили насыщенным водным раствором NH4Cl. Смесь экстрагировали с помощью EtOAc. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 15% этилацетат/гексаны), получив соединение 67i.
G. Метил 6-хлор-3-(трифторметил)бензо[b]тиофен-2-карбоксилат, 67j. Названное соединение 67j получили способом, описанным в примере 67, использовав соединение 67i вместо соединения 67c на стадии B.
Следуя процедуре, описанной выше для примера 67 (стадии С-E), и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 515
МС m/z (M+H+) 515
МС m/z (M+H+) 508
Пример 67b
H. Метил 6-хлор-3-(трифторметил)бензо[b]тиофен-2-карбоксилат, 67l. Названное соединение 67l получили способом, описанным в примере 67, использовав соединение 67k вместо соединения 67c, NaH вместо Et3N, а также THF и DMSO вместо CH3CN на стадии B.
Следуя процедуре, описанной выше для примера 67 (стадии С-E), и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (CDCl3): δ 8,41 (ар, 1H); 8,22 (ар, 1H); 7,98 (м, 1H); 7,65 (м, 1H); 7,48, (м, 1H); 3,83 (уш. м, 5H); 3,0 1(уш. м, 4H); 2,5 (с, 3H)
МС m/z (M+H+) 477,0
МС m/z (M+H+) 488
1H ЯМР (CDCl3, 400 МГц): δ 8,11 (с, 1H), 7,83-7,95 (м, 2H), 7,65 (д, J=8,6 Гц, 1H), 7,55 (д, J=3,1 Гц, 1H), 3,99-4,67 (м, 6H), 3,87 (уш. с, 2H), 3,16-3,41 (м, 1H), 2,66 (с, 3H), 2,50 (уш. с, 4H).
МС m/z (M+H+) 495
1H ЯМР (CDCl3, 400 МГц): δ 8,79 (с, 1H), 8,10 (с, 1H), 8,03 (с, 1H), 7,89 (д, J=8 Гц, 1H), 7,65 (д, J=8 Гц, 1H), 3,80-4,40 (м, 8H), 3,28 (м, 1H), 2,66 (с, 3H), 2,49 (уш. с, 4H).
МС m/z (M+H+) 495
1H ЯМР (400 МГц, CDCl3): δ 8,33 (д, 1H); 8,09 (д, 1H); 7,72 (д, 1H); 6,95 (с, 1H); 6,67 (с, 1H); 6,23 (дд, 1H); 4,59 (уш. м, 3H); 4,26 (м, 1H); 3,40 (м, 3H); 2,68 (с, 3H)
МС m/z (M+H+) 477,1
Пример 68
A. Метил 3-гидрокси-6-трифторметилбензо[b]тиофен-2-карбоксилат, 68b. LiOH (4,5 ммоль, 0,11 г) добавили к раствору метил 2-фтор-4-трифторметилбензоата 68a (2,25 ммоль, 0,50 г) и метил 2-меркаптоацетата 67d (2,25 ммоль, 0,21 мл) в DMF (3 мл) при 0oC. Смесь перемешивали при 0oC в течение 30 минут, затем нагрели до комнатной температуры и перемешивали 1 час. Затем добавили воду и конечный раствор подкислили 1N водного раствора HCl. Полученный осадок профильтровали, промыли водой и высушили, получив соединение 68b.
B. Метил 3-метокси-6-трифторметилбензо[b]тиофен-2-карбоксилат, 68c. Смесь соединения 68b (0,543 ммоль, 150 мг), диметилсульфата (0,608 ммоль; 0,058 мл) и бикарбоната натрия (0,57 ммоль, 48 мг) в ацетоне кипятили с обратным холодильником в течение ночи. Затем реакционную смесь охладили и профильтровали. Фильтрат сконцентрировали и остаток разделили между этилацетатом и водой. Органический раствор сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 10% этилацетат/гексаны), получив соединение 68c.
C. 3-Метокси-6-трифторметилбензо[b]тиофен-2-карбоновая кислота, 68d. Названное соединение 68d получили способом, описанным в примере 29, использовав на стадии B соединение 68c вместо соединения 29c.
D. 3-Метокси-6-трифторметилбензо[b]тиофен-2-карбонилхлорид, 68e. Названное соединение 68e получили способом, описанным в примере 10, при использовании на стадии A соединения 68d вместо соединения 10a.
E. 1-(1-{[3-Метокси-6-(трифторметил)-1-бензотиофен-2-ил]карбонил}азетидин-3-ил)-4-(1,3-тиазол-2-ил-карбонил)пиперазин, соединение 649. Названное соединение 649 получили способом, описанным в примере 10, при использовании соединения 68e вместо соединения 10b на стадии B. 1H ЯМР (CDCl3): δ 8,05 (с, 1H), 7,83-7,96 (м, 2H), 7,62 (дд, J=8,4, 1,1 Гц, 1H), 7,55 (д, J=3,2 Гц, 1H), 4,55-4,45 (м, 2H), 4,24-4,37 (м, 2H), 4,11-4,24 (м, 2H), 4,07 (с, 3H), 3,88 (м, 2H), 3,29 (м, 1H), 2,50 (м, 4H). МС m/z (M+H+) 511.
Следуя процедуре, описанной выше для примера 68, но заменив соответствующие реагенты, исходные материалы и способы очистки, известными специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 511
Пример 68а
Следуя процедуре, описанной выше для примера 2, заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 495,1
МС m/z (M+H+) 495,1
Пример 69
A. Метил 3-фтор-1H-индол-6-карбоксилат, 69a. Раствор метил 1H-индол-6-карбоксилата 1j (11,4 ммоль; 2,0 г) и N-фтор-2,4,6-триметилпиридинийтрифлата (14,8 ммоль; 4,3 г) в MeOH (100 мл) нагревали с обратным холодильником в течение 18 часов. Реакционную смесь сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 15-20% этилацетат/гексаны), получив соединение 69a в виде серовато-белого твердого вещества.
B. Метил 3-фтор-1-(4-фторфенил)-1H-индол-6-карбоксилат, 69c. Смесь соединения 69a (0,264 ммоль, 51 мг), CuI (0,0264 ммоль, 5 мг) и K3PO4 (0,66 ммоль, 40 мг) поместили в закрытый реакционный сосуд, который затем промыли обратным потоком N2. Используя шприц, в смесь ввели 4-фторйодбензол 69b (0,264 ммоль; 0,0394 мл) и N,N'-диметилциклогексан-1,2-диамин (0,0792 ммоль; 0,0125 мл), с последующим добавлением толуола. Полученную смесь выдерживали при температуре 95ºC в течение 6 часов. Реакционную смесь разбавили EtOAc и водой. Реакционную смесь сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 20% этилацетат/гексаны), получив соединение 69c.
C. 3-Фтор-1-(4-фторфенил)-1H-индол-6-карбоновая кислота, 69d. Названное соединение 69d получили способом, описанным в примере 29, использовав на стадии B соединение 69c вместо соединения 29c.
D. 3-Фтор-1-(4-фторфенил)-5-({3-[4-(фенилкарбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 574. Названное соединение 574 получили способом, описанным в примере 9, использовав соединение 69d вместо соединения 9c и соединение 2с вместо соединения 5е на стадии D. МС m/z (M+H+) 501.
Следуя процедуре, описанной выше для примера 69, но заменив соответствующие реагенты, исходные материалы и способы очистки известными специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 490
Пример 70
A. Метил 4-фтор-1-триизопропилсиланил-1H-индол-5-карбоксилат, 70b. К раствору 4-фтор-1-триизопропилсиланил-1H-индол-5-карбоновой кислоты 70a (8,08 ммоль; 2,71 г), полученной способом, описанным в работе Eur. J. Org. Chem., Chem. 2006, 2956, в сухом CH2Cl2 (20 мл) добавили оксалилхлорид (9,69 ммоль; 0,82 мл) с последующим введением DMF (0,81 ммоль; 0,063 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, а затем сконцентрировали. Остаток растворили в CH2Cl2 (20 мл) и охладили до 0oC. Добавили Et3N (40,4 ммоль, 5,6 мл), затем медленно добавили MeOH. Реакционную смесь перемешивали в течение 30 минут при температуре 0oC, затем сконцентрировали. Остаток разделили между этилацетатом и водой. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 5% этилацетат/гексаны), получив соединение 70b.
B. Метил 4-фтор-1H-индол-5-карбоксилат, 70c. TBAF (1 М раствора в THF, 15,8 ммоль, 15,8 мл) добавили к раствору соединения 70b (7,9 ммоль, 2,76 г) в THF при 0oC. После выстаивания при комнатной температуре в течение 10 минут реакционную смесь разбавили EtOAc, промыли солевым раствором, насыщенным NaHCO3 и водой. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 35% этилацетат/гексаны), получив соединение 70c.
C. Метил 4-фтор-1-(4-фторфенил)-1H-индол-5-карбоксилат, 70d. Названное соединение 70d получили способом, описанным в примере 69, использовав на стадии B соединение 70c вместо соединения 69a.
D. 4-Фтор-1-(4-фторфенил)-1H-индол-5-карбоновая кислота, 70e. Названное соединение 70е получили способом, описанным в примере 29, использовав на стадии B соединение 70d вместо соединения 29c.
E. 4-Фтор-1-(4-фторфенил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1ил}карбонил)-1H-индол, соединение 1348. Названное соединение 1348 получили способом, описанным в примере 9, при использовании соединения 70e вместо соединения 9c на стадии D. 1H ЯМР (CDCl3): δ 7,87 (д, J=3,2 Гц, 1H), 7,54 (д, J=3,2 Гц, 1H), 7,36-7,47 (м, 3H), 7,30 (д, J=3,2 Гц, 1H), 7,19-7,27 (м, 3H), 6,81 (д, J=3,2 Гц, 1H), 4,52-4,43 (м, 2H), 4,28 (дд, J=9,9, 7,7 Гц, 1H), 4,16-4,24 (м, 1H), 4,05-4,16 (м, 2H), 3,75-3,95 (м, 2H), 3,27 (м, 1H), 2,38-2,58 (м, 4H). МС m/z (M+H+) 508.
Следуя процедуре, описанной выше для примера 70, но заменив соответствующие реагенты, исходные вещества и способы очистки известными специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 70, но заменив соответствующие реагенты, исходные материалы и способы очистки, известными специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 508
МС m/z (M+H+) 508
МС m/z (M+H+) 501
МС m/z (M+H+) 501
Пример 70а
F. 7-Фтор-1H-индол-5-карбоновая кислота, 70h. К раствору 5-бром-7-фториндола 70f (1,71 ммоль, 365 мг) в THF добавили н-бутиллитий (1,6 M раствора в гексане; 5,2 ммоль; 3,2 мл); реакцию проводили при температуре -60ºC. Раствор выдержали 4 часа при температуре -60ºC и затем вылили в емкость с большим количеством только что измельченного сухого льда. В смесь добавили воду и подкислили среду до pH = 4. Органическую фазу сконцентрировали, остаток очистили колоночной флеш-хроматографией (силикагель, 35% этилацетат/гексаны), получив соединение 70h.
Следуя процедуре, описанной выше для примера 70, но заменив соответствующие реагенты, исходные вещества и способы очистки известными специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 70, но заменив соответствующие реагенты, исходные материалы и способы очистки, известными специалистам в данной области, были получены следующие соединения настоящего изобретения:
1H ЯМР (CDCl3): δ 7,88 (д, J=3,2 Гц, 1H), 7,76 (д, J=1,2 Гц, 1H), 7,55 (д, J=3,2 Гц, 1H), 7,42 (м, 2H), 7,22-7,31 (м, 2H), 7,12-7,22 (м, 2H), 6,69-6,81 (м, 1H), 4,53-4,27 (м, 5H), 4,12 (м, 1H), 3,89-3,83 (м, 2H), 3,26 (м, 1H), 2,50 (м, 4H)
МС m/z (M+H+) 508
МС m/z (M+H+) 508
Пример 70b
G. Метил 7-метил-1H-индол-5-карбоксилат, 70k. Названное соединение получили способом, описанным в примере 65, использовав соединение 70i вместо соединения 65a и соединение 70j вместо соединения 65b на стадии А.
Следуя процедуре, описанной выше для примера 70, но заменив соответствующие реагенты, исходные вещества и способы очистки известными специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 70, но заменив соответствующие реагенты, исходные материалы и способы очистки, известными специалистам в данной области, были получены следующие соединения настоящего изобретения:
1H ЯМР (CDCl3): δ 7,88 (д, J=2,4 Гц, 1H), 7,81 (с, 1H), 7,54 (д, J=2,4 Гц, 1H), 7,36 (м, 2H), 7,28 (с, 1H), 7,10-7,21 (м, 3H), 6,67 (д, J=2,4 Гц, 1H), 4,55-4,26 (м, 5H), 4,12 (м, 1H), 3,89 (м, 2H), 3,25 (м, 1H), 2,50 (м, 4H), 2,02 (с, 3H)
МС m/z (M+H+) 504
МС m/z (M+H+) 504
Пример 70с
H. Метил 4-амино-2-хлорбензоат, 70m. Ацетилхлорид (35,2 ммоль; 2,5 мл) добавили по каплям к перемешиваемому раствору 4-амино-2-хлорбензойной кислоты 70l (12,9 ммоль; 2,22 г) в метаноле (50 мл). Смесь нагревали с обратным холодильником в течение 18 часов, затем охладили и сконцентрировали под вакуумом. Полученный остаток поместили в этилацетат, промыли насыщенным водным раствором NaHCO3 и насыщенным солевым раствором, затем высушили и сконцентрировали под вакуумом. Полученный продукт очистили колоночной флеш-хроматографией (силикагель, 30% этилацетат/гексаны), получив соединение 70m.
I. Метил 4-амино-2-хлор-5-йодбензоат, 70n. К суспензии соединения 70m (1,18 г; 6,38 ммоль) и CaCO3 (12,8 ммоль; 1,28 г) в MeOH (13 мл) при комнатной температуре по каплям добавили раствор монохлорида йода (6,70 ммоль; 1,09 г) в CH2Cl2 (6 мл). Полученную реакционную смесь перемешивали в течение полутора часов при комнатной температуре. Затем смесь сконцентрировали и разделили между этилацетатом и водой. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 20-25% этилацетат/гексаны), получив метил 4-амино-2-хлор-5-йодбензоат 70n в качестве главного соединения и метил 4-амино-2-хлор-3-йодбензоат 70o в качестве побочного соединения.
J. Метил 4-амино-2-хлор-5-((триметилсилил)этинил)бензоат, 70p. К смеси соединения 70n (0,642 ммоль, 200 мг), CuI (0,064 ммоль; 12,2 мг) и Pd(PPh3)2Cl2 (0,064 ммоль, 45мг) в THF (2 мл) добавили этинилтриметилсилан (0,963 ммоль, 95 мг), а затем ввели Et3N (7,19 ммоль, 1 мл); реакцию проводили в атмосфере N2. Полученную реакционную смесь перемешивали в течение полутора часов при комнатной температуре, а затем разделили между этилацетатом и водой. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 15% этилацетат/гексаны), получив соединение 70p.
K. Метил 6-хлор-1H-индол-5-карбоксилат, 70q. Смесь соединения 70p (0,532 ммоль, 150 мг) и CuI (0,32 ммоль, 60 мг) в DMF (1,5 мл) выдерживали в течение 5 часов при температуре 110oC, а затем охладили до комнатной температуры. Реакцию остановили водой и провели экстракцию этилацетатом. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 15% этилацетат/гексаны), получив соединение 70q.
Следуя процедуре, описанной выше для примера 70c и 70, но заменив соответствующие реактивы, исходные вещества и способы очистки, известными специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 70, но заменив соответствующие реагенты, исходные материалы и способы очистки, известными специалистам в данной области, были получены следующие соединения настоящего изобретения:
МС m/z (M+H+) 525
МС m/z (M+H+) 504
1H ЯМР (CDCl3): δ 7,87 (д, J=3,2 Гц, 1H), 7,54 (д, J=3,2 Гц, 1H), 7,40-7,46 (м, 2H), 7,34-7,39 (м, 2H), 7,19-7,29 (м, 3H), 6,83 (д, J=3,2 Гц, 1H), 4,52 (м, 1H), 4,35-4,48 (м, 1H), 4,30 (дд, J=9,9, 7,5 Гц, 1H), 4,08-4,18 (м, 1H), 3,75-4,05 (м, 4H), 3,23-3,33 (м, 1H), 2,37-2,57 (м, 4H)
МС m/z (M+H+) 525.
Пример 71
A. Метил 1-(2,2-дифторэтил)-1H-индол-5-карбоксилат, 71b. К суспензии NaH (60%-ная дисперсия в минеральном масле, 1,48 ммоль, 59 мг) в DMF (2 мл) медленно добавили раствор метилового эфира 1H-индол-5-карбоновой кислоты 1j (1,14 ммоль, 200 мг) в DMF (1 мл) при 0oC. Полученный раствор перемешивали при 0oC в течение 20 минут, затем добавили 1,1-дифтор-2-йодэтан 71a (1,37 ммоль, 263 мг). Смесь нагрели до комнатной температуры и перемешивали в течение 2 часов. Реакцию остановили водой и провели экстракцию этилацетатом. Органический слой сконцентрировали и очистили колоночной флеш-хроматографией (силикагель, 20% этилацетат/гексаны), получив соединение 71b.
B. 1-(2,2-Дифторэтил)-1H-индол-5-карбоновая кислота, 71c. Названное соединение 71c получили способом, описанным в примере 29, использовав на стадии B соединение 71b вместо соединения 29c.
C. 1-(2,2-Дифторэтил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индол, соединение 711. Названное соединение 711 получили способом, описанным в примере 9, при использовании соединения 71с вместо соединения 9c на стадии D. 1H ЯМР (CDCl3): δ 7,94 (с, 1H), 7,88 (д, J=2,9 Гц, 1H), 7,59 (д, J=8,6 Гц, 1H), 7,54 (д, J=2,9 Гц, 1H), 7,36 (д, J=8,6 Гц, 1H), 7,17 (д, J=2,9 Гц, 1H), 6,63 (д, J=2,9 Гц, 1H), 6,01 (м, 1H), 4,51-4,24 (м, 7H), 4,12 (м, 1H), 3,85(м, 2H), 3,24 (м, 1H), 2,49 (м, 4H). МС m/z (M+H+) 460.
Следуя процедуре, описанной выше в примере 71, и заменив соответствующие реагенты, исходные соединения и методы очистки, известные специалистам в данной области, получили следующие промежуточные соединения:
Следуя процедуре, описанной выше в примере 71, и заменив соответствующие реагенты, исходные соединения и методы очистки, известные специалистам в данной области, получили следующие соединения, составляющие предмет настоящего изобретения:
МС m/z (M+H+) 460
МС m/z (M+H+) 543
МС m/z (M+H+) 543
МС m/z (M+H+) 507
МС m/z (M+H+) 487
МС m/z (M+H+) 487
МС m/z (M+H+) 487
Пример 72
A. Этил 1-(4-фторбензил)-1H-индазол-5-карбоксилат, 72c, и этил 2-(4-фторбензил)-2H-индазол-5-карбоксилат, 72d. Этил 1H-индазол-5-карбоксилат 72a (0,79 ммоль, 150 мг) и Cs2CO3 (0,96 ммоль, 312 мг) смешали с 2 мл DMF, получив прозрачный красно-коричневый раствор. В раствор по каплям добавили чистый 1-(бромметил)-4-фторбензол 72b (0,87 ммоль; 0,11 мл) и смесь оставили на ночь перемешиваться при комнатной температуре. Затем добавили этилацетат, органический слой промыли водой и насыщенным солевым раствором. Органический раствор высушили над Na2SO4 и сконцентрировали, получив 260 мг твердого вещества оранжевого цвета. Полученный продукт очистили колоночной флеш-хроматографией (силикагель, 15-50% этилацетат/гексаны), получив 133 мг (57%) соединения 72c в виде твердого вещества оранжевого цвета и 67 мг (28%) соединения 72d в виде твердого вещества белого цвета.
Соединение 72c: 1H ЯМР (400 МГц, CDCl3): δ 1,41 (т, J=7,1 Гц, 3H), 4,40 (кв, J=7,1 Гц, 2H), 5,58 (с, 2H), 6,99 (т, J=8,7 Гц, 2H), 7,19 (дд, J=8,8, 5,3 Гц, 2H), 7,36 (дт, J=8,9, 0,8 Гц, 1H), 8,04 (дд, J=8,9, 1,5 Гц, 1H), 8,15 (д, J=0,9 Гц, 1H), 8,53 (дд, J=1,5, 0,8 Гц, 1H). МС m/z (M+H+) 299,1.
Соединение 72d: 1H ЯМР (400 МГц, CDCl3): δ 1,41 (т, J=7,1 Гц, 3H), 4,39 (кв, J=7,1 Гц, 2H), 5,59 (с, 2H), 7,07 (т, J=8,7 Гц, 2H), 7,27-7,34 (м, 2H), 7,72 (дт, J=9,1, 0,9 Гц, 1H), 7,92 (дд, J=9,1, 1,6 Гц, 1H), 8,02-8,06 (м, 1H), 8,48 (дд, J=1,5, 0,9 Гц, 1H). МС m/z (M+H+) 299,1.
B. 1-(4-Фторбензил)-1H-индазол-5-карбоксилат, 72e. К перемешиваемому раствору соединения 72c (0,43 ммоль, 128 мг) в 2,5 мл THF и 0,5 мл MeOH добавили 3N водного раствора NaOH (2,62 ммоль; 0,87 мл) и 0,5 мл воды. Смесь перемешивали в течение ночи при комнатной температуре, а затем сконцентрировали под вакуумом. Полученный желтый остаток растворили в 10 мл воды и подкислили водным раствором HCl до pH 2-3. Получившийся осадок отфильтровали под вакуумом на бумажном фильтре и промыли водой. Оставшийся материал просушили под высоким вакуумом, получив 108 мг (93%) соединения 72e в виде бледно-желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 1,41 (т, J=7,1 Гц, 3H), 4,39 (кв, J=7,1 Гц, 2H), 5,59 (с, 2H), 7,07 (т, J=8,7 Гц, 2H), 7,27-7,34 (м, 2H), 7,72 (дт, J=9,1, 0,9 Гц, 1H), 7,92 (дд, J=9,1, 1,6 Гц, 1H), 8,02-8,06 (м, 1H), 8,48 (дд, J=1,5, 0,9 Гц, 1H). МС m/z (M+H+) 271,2.
C. 1-(4-Фторбензил)-5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индазол, соединение 1029. Названное соединение 1029 получили способом, описанным в примере 9, использовав соединение 72е вместо соединения 9c и HBTU вместо HATU на стадии D. 1H ЯМР (400 МГц, CDCl3): δ 1,41 (т, J=7,1 Гц, 3H), 4,39 (кв, J=7,1 Гц, 2H), 5,59 (с, 2H), 7,07 (т, J=8,7 Гц, 2H), 7,27-7,34 (м, 2H), 7,72 (дт, J=9,1, 0,9 Гц, 1H), 7,92 (дд, J=9,1, 1,6 Гц, 1H), 8,02-8,06 (м, 1H), 8,48 (дд, J=1,5, 0,9 Гц, 1H). МС m/z (M+H+) 505,2.
Следуя процедуре, описанной выше для примера 72, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие промежуточные соединения:
Следуя процедуре, описанной выше для примера 72, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
1H ЯМР (400 МГц, CD3OD): δ 3,19-3,30 (м, 4H); 4,05 (д, J=5,6 Гц, 3H); 4,25-4,88 (м, 6H); 5,66 (с, 2H); 7,09 (т, J=8,4 Гц, 2H); 7,33-7,43 (м, 2H); 7,57 (д, J=9,0 Гц, 1H); 7,69 (д, J=9,0 Гц, 1H); 7,88 (м, J=2,9 Гц, 1H); 7,97 (д, J=2,7 Гц, 1H); 8,12 (с, 1H); 8,49 (с, 1H)
МС m/z (M+H+) 505,2
1H ЯМР (400 МГц, CD3OD): δ 3,24 (уш. с., 4H); 3,89-4,12 (м, 3H); 4,25-4,85 (м, 6H); 5,78 (с, 2H); 7,37 (м, J=8,1 Гц, 2H); 7,60 (м, J=8,1 Гц, 2H); 7,66 (д, J=8,8 Гц, 1H); 7,72 (дд, J=8,8, 1,5 Гц, 1H); 7,88 (д, J=3,0 Гц, 1H); 7,97 (д, J=3,3 Гц, 1H); 8,18 (с, 1H); 8,23 (с, 1H)
МС m/z (M+H+) 555,2
1H ЯМР (400 МГц, CD3OD): δ 3,18-3,41 (м, 4H); 3,92-4,18 (м, 3H); 4,27-4,86 (м, 6H); 5,79 (с, 2H); 7,47 (д, J=8,1 Гц, 2H); 7,58 (дд, J=9,1, 1,5 Гц, 1H); 7,66 (д, J=8,1 Гц, 2H); 7,70 (д, 1H); 7,88 (д, J=3,0 Гц, 1H); 7,97 (д, J=3,0 Гц, 1H); 8,14 (с, 1H); 8,56 (с, 1H)
МС m/z (M+H+) 555,2
1H ЯМР (400 МГц, CD3OD): δ 3,25 (уш. с., 4H); 3,89-4,13 (м, 3H); 4,22-4,82 (м, 6H); 5,78 (с, 2H); 7,40-7,54 (м, 3H); 7,58 (м, J=7,3 Гц, 1H); 7,69 (м, J=8,6 Гц, 1H); 7,73 (д, J=8,8 Гц, 1H); 7,88 (д, J=3,3 Гц, 1H); 7,97 (д, J=3,3 Гц, 1H); 8,18 (с, 1H); 8,24 (с, 1H)
МС m/z (M+H+) 555,2
1H ЯМР (400 МГц, CD3OD): δ 3,30 (уш. с., 4H); 4,04 (д, J=6,8 Гц, 3H); 4,29-4,84 (м, 6H); 5,78 (с, 2H); 7,58 (т, J=7,1 Гц, 3H); 7,64 (уш. с., 2H); 7,70 (д, J=9,1 Гц, 1H); 7,88 (д, J=3,0 Гц, 1H); 7,97 (д, J=3,0 Гц, 1H); 8,14 (с, 1H); 8,56 (с, 1H)
МС m/z (M+H+) 555,2
1H ЯМР (400 МГц, ацетон-д6): δ 2,01 (д, J=7,1 Гц, 3H); 3,35 (уш. с., 4H); 4,07 (уш. с., 2H); 4,11-4,19 (м, 1H); 4,25-4,53 (м, 2H); 6 4,60 (уш. с., 1H); 4,68-4,96 (м, 3H); 6,07 (к, J=7,1 Гц, 1H); 7,24 (д, J=7,1 Гц, 1H); 7,30 (т, J=7,3 Гц, 2H); 7,33-7,39 (м, 2H); 7,58-7,68 (м, 2H); 7,92 (д, J=3,3 Гц, 1H); 7,98 (д, J=3,0 Гц, 1H); 8,12 (с, 1H); 8,18 (с, 1H)
МС m/z (M+H+) 501,1
1H ЯМР (400 МГц, CD3OD): δ 2,04 (д, J=7,1 Гц, 3H); 3,20 (уш. с., 4H); 3,91-4,05 (м, 3H); 4,25-4,63 (м, 4H); 4,72 (уш. с., 2 4H); 5,94 (к, J=6,9 Гц, 1H); 7,25-7,39 (м, 5H); 7,57 (дд, J=9,0; 1,4 Гц, 1H); 7,69 (д, J=9,1 Гц, 1H); 7,88 (д, J=3,0 Гц, 1H); 7,97 (д, J=3,3 Гц, 1H); 8,12 (с, 1H); 8,51 (с, 1H)
МС m/z (M+H+) 501,3
1H ЯМР (400 МГц, CDCl3): δ 3,49 (уш. с., 4H); 4,12 (уш. с., 2H); 4,23-4,33 (м, 1H); 4,34-5,17 (м, 6H); 5,56 (с, 2H); 6,61 (д, J=3,5 Гц, 1H); 7,08 (т, J=8,7 Гц, 2H); 7,38 (дд, J=8,6; 5,6 Гц, 2H); 7,63 (д, J=3,5 Гц, 1H); 7,93 (д, J=3,3 Гц, 1H); 7,99 (д, J=3,3 Гц, 1H); 8,27 (д, J=1,8 Гц, 1H); 8,61 (д, J=1,8 Гц, 1H)
МС m/z (M+H+) 505,2
1H ЯМР (400 МГц, ацетон-д6): δ 3,24 (т, J=7,2 Гц, 2H); 3,40 (уш. м., 4H); 4,09 (уш. с., 2H); 4,16-4,23 (м, 1H); 4,31-4,65 (м, 4H); 6 4,69 (т, J=7,2 Гц, 2H); 4,85 (уш. с., 2H); 6,96 (т, J=8,8 Гц, 2H); 7,19 (дд, J=8,3, 5,6 Гц, 2H); 7,49 (д, J=8,8 Гц, 1H); 7,62 (дд, J=8,8; 1,3 Гц, 1H); 7,93 (д, J=3,0 Гц, 1H); 8,00 (д, J=3,0 Гц, 1H); 8,09 (с, 1H); 8,12 (с, 1H)
МС m/z (M+H+) 519,2
1H ЯМР (400 МГц, ацетон-д6): δ 3,35 (т, J=7,1 Гц, 2H), 3,38-3,43 (м, 4H); 4,09 (уш. с., 2H); 4,12-4,20 (м, 1H); 4,31-4,69 (м, 4 6H); 4,74 (т, J=7,2 Гц, 2H); 4,84 (уш. с., 2H); 7,01 (т, J=8,7 Гц, 2H); 7,21 (дд, J=8,3, 5,6 Гц, 2H); 7,55 (дд, J=9,1; 1,5 Гц, 1H); 7,66 (д, J=9,1 Гц, 1H); 7,93 (д, J=3,0 Гц, 1H); 8,00 (д, J=3,3 Гц, 1H); 8,03 (с, 1H); 8,23 (с, 1H)
МС m/z (M+H+) 519,2
1H ЯМР (400 МГц, ацетон-д6): δ 3,14-3,23 (м, 4H); 3,91-4,00 (м, 1H); 4,01-4,12 (м, 2H); 4,26-4,56 (м, 3H); 4,57-4,92 (м, 3 6H); 5,74 (с, 2H); 7,09 (т, J=8,8 Гц, 2H); 7,37-7,46 (м, 3H); 7,84 (д, J=8,3 Гц, 1H); 7,89-7,95 (м, 2H); 7,99 (д, J=3,0 Гц, 1H); 8,12 (с, 1H)
МС m/z (M+H+) 505,2
1H ЯМР (400 МГц, ацетон-д6): δ 3,21-3,30 (м, 4H); 3,94-4,15 (м, 3H); 4,28-4,52 (м, 2H); 4,52-4,68 (м, 1H); 4,68-4,93 (м, 3 6H); 5,72 (с, 2H); 7,15 (т, J=8,8 Гц, 2H); 7,34 (дд, J=8.6; 1,3 Гц, 1H); 7,45-7,52 (м, 2H); 7,75 (д, J=8,6 Гц, 1H); 7,91 (с, 1H); 7,92 (д, J=3,3 Гц, 1H); 7,99 (д, J=3,3 Гц, 1H); 8,42 (с, 1H)
МС m/z (M+H+) 505,2
Пример 72а
D. Метил 1-(4-цианобензил)-1H-индазол-5-карбоксилат, 72f. Названное соединение 72f получили способом, описанным в примере 72, при использовании метил 1H-индазол-5-карбоксилата вместо соединения 72a и 4-(бромметил)бензонитрила вместо соединения 72b. 1H ЯМР (400 МГц, CDCl3): δ 3,95 (с, 3H); 5,67 (с, 2H); 7.26 (д, J=8,2 Гц, 2H); 7,33 (д, J=8,9 Гц, 1H); 7,61 (д, J=8,3 Гц, 2H); 8,06 (дд, J=8,9; 1,4 Гц, 1H); 8,18 (с, 1H); 8,55 (с, 1H). (M+H+) 292,2
E. 1-(4-Цианобензил)-1H-индазол-5-карбоновая кислота, 72g, и 1-(4-карбамоилбензил)-1H-индазол-5-карбоновая кислота, 72h. К перемешиваемому раствору соединения 72f (0,35 ммоль, 102 мг) в 2 мл THF и 0,5 мл MeOH добавили 3N водного раствора NaOH (2,45 ммоль; 0,82 мл). Смесь оставили на ночь перемешиваться при комнатной температуре, а затем сконцентрировали под вакуумом. Полученный желтый остаток растворили в 15 мл воды и подкислили водным раствором HCl до pH 1-2. Получившийся осадок отфильтровали под вакуумом на бумажном фильтре и промыли водой. Оставшийся материал просушили под высоким вакуумом, получив 87 мг смеси 3:1 соединений 72g и 72h (по результатам ЖХ/МС) в виде твердого вещества серовато-белого цвета.
Соединение 72g (с меньшей полярностью): МС m/z (M+H+) 278,1. Соединение 72h (с большей полярностью): МС m/z (M+H+) 296.
F. 4-{[5-({3-[4-(1,3-Тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индазол-1-ил]метил}бензонитрил, соединение 1045, и 4-{[5-({3-[4-(1,3-тиазол-2-ил-карбонил)пиперазин-1-ил]азетидин-1-ил}карбонил)-1H-индазол-1-ил]метил}бензамид, соединение 1044. Названные соединения 1045 и 1044 получили способом, описанным в примере 9, использовав смесь соединений 72g и 72h, синтезированных ранее на стадии Е, вместо соединения 9c, а также HBTU вместо HATU на стадии D. Полученные соединения разделили методом препаративной хроматографии на обращенной фазе, получив 64 мг соединения 1045 (с меньшей полярностью) и 6,4 мг соединения 1044 (с большей полярностью).
Соединение 1045: 1H ЯМР (400 МГц, ацетон-д6): δ 3,24-3,49 (м, 4H); 4,00-4,11 (м, 2H); 4,11-4,20 (м, 1H); 4,26-4,96 (м, 6H); 5,85 (с, 2H); 7,45 (д, J=8,3 Гц, 2H); 7,66-7,72 (м, 2H); 7,74 (д, J=8,3 Гц, 2H); 7,92 (д, J=3,3 Гц, 1H); 7,99 (д, J=3,0 Гц, 1H); 8,16 (с, 1H); 8,20 (с, 1H).
Соединение 1044: 1H ЯМР (400 МГц, ацетон-в6): δ 3,14 (уш.с., 4H); 3,87-3,96 (м, 1H); 3,96-4,08 (м, 2H); 4,35 (уш.с., 2H); 4,47-4,85 (м, 4H); 5,78 (с, 2H); 7,35 (д, J=8,3 Гц, 2H), 7,66 (с, J=8,8 Гц, 1H); 7,70 (д, J=8,6; 1,5 Гц, 1H); 7,88 (д, J=8,1 Гц, 2H); 7,91 (д, J=3,3 Гц, 1H); 7,98 (д, J=3,3 Гц, 1H); 8,16 (с, 1H); 8,18 (с, 1H)
Биологические исследования
Способы исследования In Vitro
Пример 1
Анализ активности фермента MGL
Все представленные исследования проводились в 384-луночных черных полипропиленовых микропланшетах для полимеразной цепной реакции (ПЦР) компании Abgene с суммарным объемом 30 мкл. Субстрат, 4-метилумбеллиферил-бутират (4MU-B; Sigma), и либо очищенный мутантный фермент MGL (mut-MGLL 11-313 L179S L186S), либо очищенный исходный фермент MGL (wt-MGLL 6H-11-313) по отдельности растворили в 20 ммоль буферного раствора (pH = 7,0) 1,4-пиперазиндиэтансульфоновой кислоты (PIPES), содержащем 150 ммоль NaCl и 0,001% полисорбата 20. Соединения формулы (I) предварительно поместили (по 50 нл) в планшет для анализа, используя систему Cartesian Hummingbird, и затем добавили 4MU-B (25 мкл 1,2X раствора до конечной концентрации 10 мкM) и затем фермент (5 мкл 6X раствора до конечной концентрации 5 нМ) для инициирования реакции. Концентрация конечного продукта находилась в диапазоне от 17 до 0,0003 мкM. Было зафиксировано изменение спектра флюоресценции, обусловленное расщеплением 4MU-B; длины волн возбуждения и эмиссии составили 335 нм и 440нм, соответственно, при ширине полосы 10 нм (спектрометр Safire2, Tecan); исследование проводили при температуре 37°C в течение 5 минут.
Величины IC50 для соединений формулы (I) определяли с помощью программы Excel по результатам подгонки уравнения к концентрационной зависимости дробной активности в зависимости от концентрации ингибитора.
Биологические данные
пример
Пример 2
Исследование накопления 2-AG
Для измерения накопления 2-AG вследствие ингибирования MGL 1 грамм ткани мозга крысы гомогенизировали на гомогенизаторе Polytron (компании Brinkmann, PT300) в 10 мл буферного раствора HEPES (20 ммоль, pH = 7,4), содержащего 125 ммоль NaCl, 1 ммоль EDTA, 5 ммоль KCl и 20 ммоль глюкозы. Соединения формулы (I) (10 мкM) предварительно инкубировали в среде гомогената мозговой ткани крысы (50 мг). После 15-минутной инкубации при температуре 37°C добавили CaCl2 (до конечной концентрации 10 ммоль) и продолжили инкубацию еще 15 минут при температуре 37°C с общим объемом смеси 5 мл. Протекание реакций останавливали добавлением 6 мл раствора для экстракции органическими растворителями, содержащего хлороформ и метанол в соотношении 2:1. Накопленный 2-AG в органической фазе измеряли по методу ВЭЖХ/МС согласно следующему уравнению:
процент содержания в несущей среде = (аккумуляция 2-AG в присутствии соединения/аккумуляция 2-AG в несущей среде)×100.
Биологические данные
пример
Пример 3
Исследование мутантного фермента MGL методом ThermoFluor®
Метод исследования ThermoFluor (TF) представляет собой анализ связывания, проводимый с помощью 384-луночного планшета и определяющий термостойкость белков.1,2 Эксперименты проводили с использованием инструментов, поставляемых компанией Johnson & Johnson Pharmaceutical Research & Development, LLC. Во всех экспериментах использовали TF краситель 1,8-ANS (Invitrogen: A-47). TF-исследования фермента MGL проводили при следующих конечных условиях: 0,07 мг/мл мутантного фермента MGL, 100 мкM ANS, 200 ммоль NaCl, 0,001% полисорбат-20 в 50 ммоль PIPES (pH = 7,0).
Подготовленные для анализа планшеты содержали 1Х растворы исследуемых соединений в 100% DMSO. Для последующих концентрационных исследований соединения помещали в лунки планшета (Greiner Bio-one: 781280) в последовательных разведениях в 100% DMSO, используя 11 колонок лунок для каждой из серии исследований. Столбцы 12 и 24 использовали как DMSO-контроль, и они не содержали соединений. Как в однократных, так и во множественных экспериментах определения зависимости от концентрации аликвоты соединения (46 нл) автоматически распределяли непосредственно в черный 384-луночный планшет для исследований (Abgene: TF-0384/k) с помощью робота для распределения жидкостей Hummingbird. Далее туда же поместили растворы белка и красителя, в результате чего конечный исследуемый объем составил 3 мкл. Растворы, предназначенные для анализа, были покрыты 1 мкл силиконового масла (Fluka, тип DC 200: 85411) для предотвращения испарения.
Планшеты для анализа, снабженные штрих-кодом, автоматически подавали в термоблок ПЦР-типа с регулируемой температурой и нагревали до температуры от 40 до 90°C со скоростью 1°C в минуту для всех экспериментов. Флюоресценцию измеряли с помощью непрерывного источника ультрафиолетового излучения (Hamamatsu LC6), подаваемого через оптоволокно и пропускаемого через полосовой фильтр (380-400 нм; граница пропускания >6 ОП). Флуоресцентные эмиссии всей 384-луночной пластины определялись путем измерения интенсивности света с использованием ПЗС-камеры (Sensys, Roper Scientific) с применением фильтров для обнаружения 500±25 нм, что позволяло одновременно и независимо считывать все 384 лунки. Для каждого значения температуры получали один снимок со временем экспозиции 20 сек., сумму интенсивности пикселей в данной области исследуемого планшета подставляли в стандартное уравнение, получая величину Tm 1.
1. Pantoliano, M. W., Petrella, E. C., Kwasnoski, J. D., Lobanov, V. S., Myslik, J., Graf, E., Carver, T., Asel, E., Springer, B. A., Lane, P. и Salemme, F. R. (2001) J Biomol Screen 6, 429-40.
2. Matulis, D., Kranz, J. K., Salemme, F. R. и Todd, M. (2005) J. Biochemistry 44, 5258-66.
Величины Kd для соединений формулы (I) определяли на основе результатов подгонки уравнения к концентрационной зависимости дробной активности в зависимости от величины Tm. В некоторых экспериментах для измерения концентраций исходных растворов веществ в 100% DMSO использовали метод количественной ЯМР спектроскопии (кЯМР), и величины qKd были определены с использованием того же способа подгонки уравнения.
Биологические данные
Способы исследования in vivo
Пример 4
Измерение вызванной реагентом CFA гиперчувствительности крыс к тепловому воздействию.
Каждую крысу поместили в камеру для проведения исследований на теплую стеклянную поверхность и оставили приблизительно на 10 минут для привыкания к новым условиям. Затем на подошвенную поверхность каждой из задних лапок крыс по очереди подействовали сквозь стекло тепловым раздражителем (лучом света). Тепловое воздействие автоматически прекращали фотоэлектрическим реле, если лапка двигалась или если завершался период воздействия (20 с теплового облучения при ~5 амп.). Для каждой из крыс был зафиксирован начальный (естественный) период ответа на термический раздражитель, после чего животным был введен полный адъювант Фрейнда (CFA). По прошествии 24 часов после введения CFА период реагирования животных на термический раздражитель снова был измерен и сравнен с начальным. Анализ продолжали только для крыс, у которых имело место по меньшей мере 25%-ное сокращение латентного периода реакции (то есть имела место гипералгезия). Сразу по завершении оценки продолжительности латентного периода после введения CFA крысам перорально вводили указанное исследуемое лекарственное вещество или несущую среду. Затем, по прошествии определенных промежутков времени (обычно 30, 60, 120, 180 и 300 минут) оценивали латентный период реакции (отдергивания лапы) после прекращения введения указанного вещества.
Процент обращения (%R) гиперчувствительности рассчитывали одним из двух способов: 1) используя среднегрупповые показатели или 2) используя индивидуальные показатели животного. А именно:
Способ 1. Для всех соединений в каждый конкретный момент времени величину %R гиперчувствительности вычисляли на основе средних показателей по группе животных, используя следующую формулу:
% обращения = [(реакция группы после введения соединения - реакция группы после введения CFA)/(начальная реакция группы - реакция после введения CFA)]×100
Представлены результаты для максимального процентного обращения для каждого соединения в конкретный момент времени.
Способ 2. Для ряда соединений величину %R гиперчувствительности вычисляли отдельно для каждого животного, используя следующую формулу:
% обращения = [(индивидуальная реакция после введения соединения - индивидуальная реакция после введения CFA)/(начальная индивидуальная реакция - индивидуальная реакция после введения CFA)]×100.
Результаты представлены в виде средних величин максимального процентного обращения, рассчитанного для каждого индивидуального животного.
Биологические данные
CFA-термическая гиперчувствительность
(мг/кг, перорально)
Пример 5
Индуцированная CFA гиперчувствительность к надавливанию на лапу
Перед проведением эксперимента крыс приучали к будущей процедуре дважды в день на протяжении двух дней. Эксперимент заключался в размещении левой задней лапы животного на платформе с тефлоновым (политетрафторэтиленовым) покрытием и надавливании на нее с линейно растущим усилием (скорость увеличения 1,67 кПа/с ( 12,5 мм рт. ст./с)) между третьей и четвертой плюсневой костью с тыльной стороны инструментом с куполовидным наконечником (радиусом 0,7 мм), измеряя аналгезию с помощью специального прибора (компания Stoelting, Чикаго, штат Иллинойс), известного как аппарат Рэндалла-Селитто. Конечная точка была автоматически достигнута при снятии задней лапы, при этом фиксировали предельную силу (в граммах). Перед введением полного адъюванта Фрейнда (CFA) для каждого животного фиксировали начальный (базовый) порог чувствительности к механическим раздражителям. Через 40 часов после введения CFA снова определяли порог реакции животного на механический раздражитель и сравнивали его с начальным значением. Реакцией считалось отдергивание лапы, попытка одернуть лапу или подача голоса. Анализ продолжали только для крыс, у которых имело место по меньшей мере 25%-ное сокращение порога реакции (то есть имела место гипералгезия). Сразу по завершению оценки порога реакции после введения CFA крысам вводили указанное соединение или несущую среду. Пороги реакции (заключающейся в отдергивании лапы) после прекращения введения соединения оценивали спустя 1 час. Изменение порога реакции (отдергивания лапы) пересчитывали в процент изменения гиперчувствительности, используя следующую формулу:
% обращения = [(реакция после введения соединения - реакция до введения соединения)/(начальная реакция - реакция до введения соединения)]×100.
Биологические данные
CFA-индуцированная гиперчувствительность лапы к давлению
Пример 6
Модель индуцирования невропатической боли посредством хронического компрессионного повреждения нерва (CCI); тест на гиперчувствительность с использованием холодного ацетона
Для оценки способности анализируемых соединений изменять вызванную CCI гиперчувствительность к холоду проводили эксперимент с крысами-самцами линии Sprague-Dawley (225-450 г). Вокруг левого седалищного нерва под ингаляционной анестезией делали нетугую перевязку с помощью 4 швов хромированного кетгута, как описано в работе Bennett et al. (Bennett GJ, Xie YK. Pain 1988, 33(1): 87-107). Через 14-35 дней после операции CCI экспериментальное животное помещали в приподнятую клетку для наблюдения с проволочным дном, после чего с интервалом примерно в 5 минут пять раз на подошвенную часть лапы с помощью многодозового шприца наносили по 0,05 мл ацетона. Положительной реакцией считалось резкое отдергивание или поднятие лапы. Для каждого животного фиксировали количество положительных реакций на 5 доз ацетона. После определения начальной реакции указанным способом вводили исследуемое соединение в указанной несущей среде (см. табл. 6). Через 1-4 часа после введения соединения снова определяли количество отдергиваний лапы. Результаты фиксировали в виде процента уменьшения реакции, который вычисляли для каждого животного по формуле: [1-(количество отдергиваний после введения исследуемого соединения/количество отдергиваний до введения соединения)]×100, после чего находили среднее значение между показателями всех животных, получивших соединение.
Биологические данные
CCI-индуцированная чувствительность к холоду
Пример 7
Модель индуцирования невропатической боли посредством лигирования спинномозгового нерва (SNL); эксперимент с тактильной аллодинией
Для исследований с лигированием пятого (L5) корешка спинномозгового нерва проводили анестезию с помощью ингаляции изофлурана. Со спинной области таза срезали шерсть и выполняли 2-см разрез кожи слева от срединной линии над спинной частью корешков L4-S2 спинномозгового нерва с последующим отделением параспинальных мышц от остистого отростка. Затем аккуратно удаляли поперечный отросток корешка L6 и открывали корешок L5 спинномозгового нерва. После этого туго лигировали левый корешок L5 спинномозгового нерва с помощью шелковой нити 6-0; на мышцу накладывали шов из Викрила 4-0, а разрез кожи затягивали с помощью скоб для соединения краев раны. После операции подкожно вводили физраствор (5 мл).
Через 4 недели после лигирования проводили поведенческий тест. После начальной оценки чувствительности по методу фон Фрея для проверки наличия механической аллодинии крысам с SNL (L5) перорально вводили указанную несущую среду или соединение. Тактильную аллодинию определяли через 30, 60, 100, 180 и 300 мин после введения вещества, фиксируя усилие, при котором происходило отдергивание лапы, ипсилатеральной по отношению к области лигирования, в ответ на стимулирование различными нитями фон Фрея (0,4, 0,6, 1,0, 2.0, 4, 6, 8 и 15 г; компания Stoelting; Вуд-Дейл, штат Иллинойс). Начиная с нитей средней плотности (2,0 г), нити прикладывали к середине подошвенной области задней лапы примерно на 5 секунд для определения порога реакции; в случае резкого отдергивания лапы продолжали использовать менее жесткие нити, а при отсутствии реакции - более плотные. После определения начального порога реакции порог фиксировали еще четыре раза. 50% порогов отдергивания лапы были интерполированы по методу Диксона, описанному в обзоре Efficient analysis of experimental observations. Annu. Rev. Pharmacol. Toxicol. 20:441-462(1980), модифицированному Chaplan et.al. как описано в Quantitative assessment of tactile allodynia in the rat paw, J. Neurosci. Methods. 53(1):55-63 (1994); когда порог ответа попадал выше или ниже диапазона обнаружения, были определены значения 15,0 или 0,25 г, соответственно. Результаты оценки порога реакции по методу нитей фон Фрея приводятся как пороги отдергивания лапы в граммах. Данные были нормированы, а результаты представлены в виде % MPE (максимально возможный эффект) соединения, который вычисляли по следующей формуле:

Биологические данные
Лигирование спинномозгового нерва - тактильная аллодиния
Приведенное выше техническое описание содержит сведения о принципах, лежащих в основе настоящего изобретения, и иллюстрирующие его примеры, однако необходимо понимать, что практическое применение изобретения распространяется на все обычные вариации, адаптации и (или) модификации в соответствии с приведенными ниже пунктами формулы и их аналогами.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗЕТИДИНИЛДИАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ МОНОАЦИЛГЛИЦЕРИН-ЛИПАЗЫ | 2010 |
|
RU2569298C2 |
| ГЕТЕРОАРОМАТИЧЕСКИЕ И АРОМАТИЧЕСКИЕ ПИПЕРАЗИНИЛАЗЕТИДИНИЛАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ МОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ | 2010 |
|
RU2558141C2 |
| ИНГИБИТОРЫ ФЕРМЕНТА ДИАЦИЛГЛИЦЕРИН О-АЦИЛТРАНСФЕРАЗЫ ТИПА 1 | 2008 |
|
RU2497816C2 |
| ПИРАЗИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2543484C2 |
| АЗААДАМАНТАНОВЫЕ ПРОИЗВОДНЫЕ И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2450002C2 |
| ПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2568434C2 |
| ХИНОКСАЛИНЫ И АЗАХИНОКСАЛИНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА CRTH | 2011 |
|
RU2589709C2 |
| 4-ЗАМЕЩЕННЫЕ-2-ФЕНОКСИФЕНИЛАМИНОВЫЕ МОДУЛЯТОРЫ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2553453C2 |
| ЗАМЕЩЕННЫЕ ХРОМАНЫ | 2015 |
|
RU2718060C2 |
| ПРОИЗВОДНЫЕ 3-АМИНОПИРРОЛИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРОВ ХЕМОКИНОВ | 2003 |
|
RU2355679C2 |
Изобретение относится к соединению формулы (I)
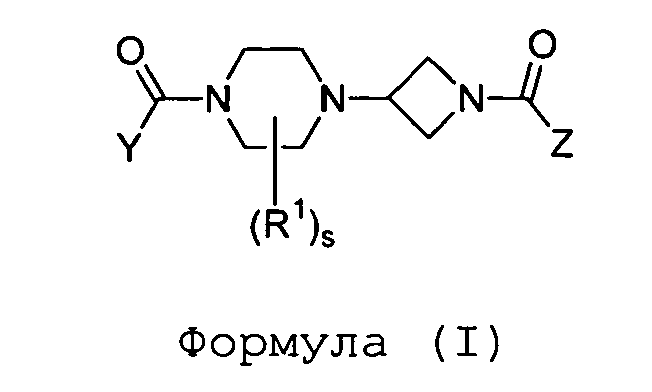
где Y и Z независимо выбраны из группы а) или b) таким образом, что один из Y или Z выбран из группы а), а другой - из группы b); группа а) представляет собой i) замещенный С6-10арил; ii) С3-8циклоалкил; iii) трифторметил или iv) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила, пирролила, пиридинила, изоксазолила, имидазолила, фуразан-3-ила, бензотиенила, тиено[3,2-b]тиофен-2-ила, пиразолила, триазолила, тетразолила и [1,2,3]тиадиазолила; группа b) представляет собой i) С6-10арил; ii) гетероарил, выбранный из группы, состоящей из тиазолила, пиридинила, индолила, пирролила, бензоксазолила, бензотиазолила, бензотиенила, бензофуранила, имидазо[1,2-а]пиридин-2-ила, фуро[2,3-b]пиридинила, пирроло[2,3-b]пиридинила, пирроло [3,2-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила, хиназолинила, тиенила и бензимидазолила; iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из С3-7циклоалкилкарбонила; С3-7циклоалкилсульфонила; фенила; фенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(С1-4)алкила; С1-6алкилкарбонила; С1-6алкилсульфонила; пиримидинила и пиридинила; при этом С3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(С1-4)алкил и фенилсульфонил необязательно замещены трифторметилом либо одним или двумя фтор-заместителями; iv) феноксатиинил; vi) флуорен-9-он-2-ил; vii) 9,9-диметил-9Н-флуоренил; viii) 1-хлорнафто[2,1-b]тиофен-2-ил; ix) ксантен-9-он-3-ил; х) 9-метил-9Н-карбазол-3-ил; xi) 6,7,8,9-тетрагидро-5Н-карбазол-3-ил; xiii) 3-метил-2-фенил-4-оксохромен-8-ил; или xiv) 1,3-дигидробензимидазол-2-он-5-ил, необязательно замещенный 1-фенилом, 1-(2,2,2-трифторэтилом), 1-(3,3,3-трифторпропилом) или 1-(4,4-дифторциклогексилом), при этом 1-фенил необязательно замещен одним или двумя фтор-заместителями или трифторметилом; или xv) 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил; R1 представляет собой С6-10арил, С1-3алкил, бензилоксиметил, гидрокси(С1-3)алкил, аминокарбонил, карбокси, трифторметил, спироконденсированный циклопропил, 3-оксо или арил(С1-3)алкил; или когда s равно 2 и R1 представляет собой С1-3алкил, заместители С1-3алкил берут с пиперазинильным кольцом с образованием 3,8-диазабицикло[3.2.1]октаниловой или 2,5-диазабицикло[2.2.2]октаниловой кольцевой системы, и его фармацевтическим композициям. 7 н. и 13 з.п. ф-лы, 7 табл., 72 пр.
1. Соединение формулы (I)

где
Y и Z независимо выбраны из группы а) или b) таким образом, что один из Y или Z выбран из группы а), а другой - из группы b);
группа а) представляет собой
i) замещенный С6-10арил;
ii) С3-8циклоалкил;
iii) трифторметил или
iv) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила, пирролила, пиридинила, изоксазолила, имидазолила, фуразан-3-ила, бензотиенила, тиено[3,2-b]тиофен-2-ила, пиразолила, триазолила, тетразолила и [1,2,3]тиадиазолила;
при этом С6-10арил замещен, а гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома, С1-4алкила, циано и трифторметила;
группа b) представляет собой
i) С6-10арил;
ii) гетероарил, выбранный из группы, состоящей из тиазолила, пиридинила, индолила, пирролила, бензоксазолила, бензотиазолила, бензотиенила, бензофуранила, имидазо[1,2-а]пиридин-2-ила, фуро[2,3-b]пиридинила, пирроло[2,3-b]пиридинила, пирроло [3,2-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила, хиназолинила, тиенила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из С3-7циклоалкилкарбонила; С3-7циклоалкилсульфонила; фенила; фенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(С1-4)алкила; С1-6алкилкарбонила; С1-6алкилсульфонила; пиримидинила и пиридинила; при этом С3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(С1-4)алкил и фенилсульфонил необязательно замещены трифторметилом либо одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 дополнительными заместителями, выбранными из группы, состоящей из фенила, тиенила, брома и С1-4алкила; при этом фенил и тиенил каждый необязательно замещен трифторметилом или хлор-заместителем;
iv) феноксатиинил;
vi) флуорен-9-он-2-ил;
vii) 9,9-диметил-9Н-флуоренил;
viii) 1-хлорнафто[2,1-b]тиофен-2-ил;
ix) ксантен-9-он-3-ил;
х) 9-метил-9Н-карбазол-3-ил;
xi) 6,7,8,9-тетрагидро-5Н-карбазол-3-ил;
xiii) 3-метил-2-фенил-4-оксохромен-8-ил; или
xiv) 1,3-дигидробензимидазол-2-он-5-ил, необязательно замещенный 1-фенилом, 1-(2,2,2-трифторэтилом), 1-(3,3,3-трифторпропилом) или 1-(4,4-дифторциклогексилом), при этом 1-фенил необязательно замещен одним или двумя фтор-заместителями или трифторметилом; или
xv) 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил;
где С6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) С1-8алкила;
ii) С2-4алкенила;
iii) С3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) 4,4-дифторциклогексилкарбонила;
v) С1-4алкокси;
vi) 2-метоксиэтокси;
viii) трифторметила;
ix) 2,2,2-трифторэтила;
х) 2,2-дифторэтила;
xi) 3,3,3-трифторпропила;
xii) трифторметокси;
xiii) 2,2,2-трифторэтоксиметила;
xiv) 2,2,2-трифторэтокси;
xviii) пиперидин-1-ил-сульфонила;
xix) хлора;
хх) циано;
xxi) гидрокси;
xxii) фтора;
xxiii) брома;
xxiv) йода;
xxv) NRaRb, где Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного 1-2 заместителями, выбранными из группы, состоящей из оксо-, 1-2 фтор-заместителей и C1-3алкила; и необязательно содержащего один дополнительный гетероатом с образованием морфолинила или тиоморфолинила;
xxvi) (1-R2)пирролидин-3-ил-окси, в котором R2 представляет собой пирролидин-1-ил-карбонил;
xxvii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен С1-4алкилкарбонилом;
xxviii) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-2алкокси, брома, трифторметила, хлора и фтора;
xxix) пиридинилкарбонила, необязательно замещенного хлор-заместителем;
ххх) фенилкарбонила;
xxxi) N-фенил-N-метиламиносульфонила;
xxxii) пиперидин-1-ил-сульфонила;
xv) фенилсульфонила;
xxxiii) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, трифторметила и хлора;
xxxviii) 2-метилкарбониламинэтокси; и
xl) 2,2,6,6-тетраметил-3,6-дигидро-2Н-пиран-4-ила;
при условии, что не более одного заместителя на С6-10ариле или гетероариле представляют собой С3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси или С3-8циклоалкилокси;
s равно 0, 1 или 2; при условии, что когда s равно 2, R1 независимо выбирают из группы, состоящей из фенила, С1-3алкила и С6-10арил (С1-3) алкила;
R1 представляет собой С6-10арил, С1-3алкил, бензилоксиметил, гидрокси(С1-3)алкил, аминокарбонил, карбокси, трифторметил, спироконденсированный циклопропил, 3-оксо или арил(С1-3)алкил; или когда s равно 2 и R1 представляет собой С1-3алкил, заместители С1-3алкил берут с пиперазинильным кольцом с образованием 3,8-диазабицикло[3.2.1]октаниловой или 2,5-диазабицикло[2.2.2]октаниловой кольцевой системы;
при условии, что гетероарил группы b) не замещен С1-4алкокси;
при условии, что когда фенил замещен в пара-положении группой NRaRb или когда 2- или 3-пиридинил замещен в положении 5 или 6, соответственно, группой NRaRb, то Rb отличен от C1-6алкила, фенила или C6-10арил (С1-2) алкила;
и при условии, что когда Ra представляет собой C1-6алкил и фенил замещен в пара-положении группой NRaRb или 2- или 3-пиридинил замещен в положении 5 или 6, соответственно, группой NRaRb, то Rb отличен C1-6алкилкарбонила; или
при условии, что соединение формулы (I) отлично от
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-гидрокси-3-метилкарбониламинофенил, и s равно 0;
соединения, где Y представляет собой 2-метоксифенил, Z представляет собой 4-циклогексилфенил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)-бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3Н-бензимидазол-2-ил, s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1Н-бензимидазол-2-ил и s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-хлорбензофуран-2-ил, s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1Н-индол-2-ил, s равно 0; соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, s равно 0; соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 6-трифторметил-1Н-пирроло[2,3-b]пиридин-2-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-бромфуро[2,3-b]пиридин-2-ил, s равно 0;
соединения, где Y представляет собой 5-бромфуро[2,3-b]пиридин-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-трифторметил-1H-пирроло[3,2-b]пиридин-2-ил, и s равно 0; соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 6-бром-7-метилимидазо[1,2-а]пиридин-2-ил, из равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 8-бром-6-хлоримидазо[1,2-а]пиридин-2-ил, и s равно 0; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилимидазо[1,2-а]пиридин-2-ил, и s равно 0; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-гидрокси-3-метилкарбониламинофенил, и s равно 0; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0; соединения, в котором Y представляет собой трифторметил, Z представляет собой 4-(3-трифторметилфенилсульфонил)фенил, и s равно 0; соединения, в котором Y представляет собой трифторметил, Z представляет собой 6-(2-хлорфенилокси)пиридин-3-ил, из равно 0;
и его фармацевтически приемлемые соли.
2. Соединение по п. 1, где
группа а) представляет собой
i) замещенный C6-10арил;
ii) трифторметил; или
iii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила, пирролила, пиридинила и [1,2,3]тиадиазолила;
где C6-10арил замещен, а гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила.
3. Соединение по п. 2, где
группа а) представляет собой
i) замещенный C6-10арил;
ii) трифторметил или
iii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила и пирролила;
где C6-10арил замещен, а гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила.
4. Соединение по п. 3, где
группа а) представляет собой
i) замещенный C6-10арил; или
ii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, оксазолила и пирролила;
где C6-10арил замещен, а гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила.
5. Соединение по п. 1, где
группа b) представляет собой
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из тиазолила, пиридинила, индолила, пирролила, бензоксазолила, бензотиазолила, бензотиенила, бензофуранила, пирроло[2,3-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; С3-7циклоалкилсульфонила; фенила; фенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; С1-6алкилкарбонила; C1-6алкилсульфонила; пиримидинила и пиридинила; при этом С3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 дополнительными заместителями, выбранными из группы, состоящей из фенила, брома и С1-4алкила; при этом фенил и тиенил каждый необязательно замещен трифторметилзаместителем;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил;
vii) ксантен-9-он-3-ил;
viii) 9-метил-9Н-карбазол-3-ил;
ix) 6,7,8,9-тетрагидро-5Н-карбазол-3-ил или
х) 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил;
где C6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) С2-4алкенила;
iii) С3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) С1-4алкокси;
v) 2-метоксиэтокси;
vii) трифторметила;
viii) 2,2,2-трифторэтила;
ix) 2,2-дифторэтила;
х) 3,3,3-трифторпропила;
xi) трифторметокси;
xii) 2,2,2-трифторэтоксиметила;
xiii) 2,2,2-трифторэтокси;
xvi) хлора;
xvii) циано;
xviii) фтора;
xix) брома;
xx) йода;
xxi) NRaRb, где Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей;
xxii) (1-R2)пирролидин-3-ил-окси, в котором R2 представляет собой пирролидин-1-ил-карбонил;
xxiii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен C1-4алкилкарбонилом;
xxiv) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-2алкокси, брома, трифторметила, хлора и фтора;
xv) фенилсульфонила;
xxv) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, трифторметила и хлора;
xxvii) 2,2,6,6-тетраметил-3,6-дигидро-2Н-пиран-4-ила;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой С3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси или С3-8циклоалкилокси.
6. Соединение по п. 5, где
группа b) представляет собой
i) C6-10арил;
ii) гетероарил, выбранный из группы, состоящей из пиридинила, индолила, бензотиазолила, бензотиенила, бензофуранила, пирроло[2,3-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и если гетероциклильный компонент содержит атом азота, этот атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из C3-7циклоалкилкарбонила; C3-7циклоалкилсульфонила; фенила; фенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4) алкила; C1-6алкилкарбонила; C1-6алкилсульфонила;пиримидинила; и пиридинила; при этом C3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(С1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 дополнительными заместителями, выбранными из группы, состоящей из фенила, брома и C1-4алкила;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил;
vii) ксантен-9-он-3-ил;
viii) 9-метил-9Н-карбазол-3-ил;
ix) 6,7,8,9-тетрагидро-5Н-карбазол-3-ил или
х) 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил;
где С6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) С1-8алкила;
ii) С2-4алкенила;
iii) С3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) С1-4алкокси;
vi) трифторметила;
vii) 2,2,2-трифторэтила;
viii) 2,2-дифторэтила;
ix) 3,3,3-трифторпропила;
x) трифторметокси;
xi) 2,2,2-трифторэтоксиметила;
xii) 2,2,2-трифторэтокси;
xv) хлора;
xvi) циано;
xvii) фтора;
xviii) брома;
xix) йода;
хх) NRaRb, где Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей;
xxi) (1-R2)пирролидин-3-ил-окси; в котором R2 представляет собой пирролидин-1-ил-карбонил;
xxii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен С1-4алкилкарбонилом;
xxiii) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила, хлора и фтора;
xv) фенилсульфонила;
xxiv) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, трифторметила и хлора;
при условии, что не более одного заместителя на C6-10ариле или гетероариле представляют собой С3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; или С3-8циклоалкилокси.
7. Соединение по п. 6, где
группа b) представляет собой
i) С6-10арил;
ii) гетероарил, выбранный из группы, состоящей из пиридинила, индолила, бензотиазолила, бензотиенила, пирроло[2,3-b]пиридинила и тиено[2,3-b]пиридинила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и если гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из С3-7циклоалкилкарбонила; С3-7циклоалкилсульфонила; фенила; фенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; C1-6алкилсульфонила; пиримидинила и пиридинила; при этом С3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил (С1-4) алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен одним или двумя дополнительными заместителями, выбранными из группы, состоящей из фенила;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил или
vii) 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил;
где С6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) С1-8алкила;
ii) С2-4алкенила;
iii) С3-6циклоалкила;
iv) С1-4алкокси;
v) трифторметила;
vi) трифторметокси;
vii) 2,2,2-трифторэтоксиметила;
ix) хлора;
х) фтора;
xi) брома;
xii) йода;
xiii) NRaRb, где Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей;
xiv) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен С1-4алкилкарбонилом;
xv) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-2алкокси, брома, трифторметила и хлора;
xvi) фенилсульфонила; и
xvii) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, трифторметила и хлора;
при условии, что не более одного заместителя на С6-10ариле или гетероариле представляют собой С3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2)пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси; или С3-8циклоалкилокси.
8. Соединение по п. 1, где s равно 1 или 0.
9. Соединение по п. 1, где R1 представляет собой С6-10арил, С1-3алкил или трифторметил.
10. Соединение по п. 9, где R1 представляет собой фенил, С1-3алкил или трифторметил.
11. Соединение по п. 10, где R1 представляет собой фенил.
12. Соединение формулы (I):
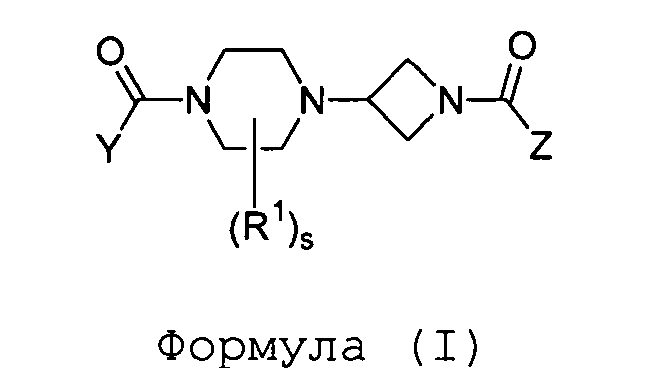
где Y и Z независимо выбраны из группы а) или b) таким образом, что один из Y или Z выбран из группы а), а другой - из группы b);
группа а) представляет собой
i) трифторметил; или
ii) гетероарил, выбранный из группы, включающей тиенил, фуранил, тиазолил, изотиазолил, оксазолил, пирролил, пиридинил и [1,2,3]тиадиазолил;
при этом гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
группа b) представляет собой
i) С6-10арил;
ii) гетероарил, выбранный из группы, состоящей из тиазолила, пиридинила, индолила, пирролила, бензоксазолила, бензотиазолила, бензотиенила, бензофуранила, пирроло[2,3-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и если гетероциклильный компонент содержит атом азота, этот атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из С3-7циклоалкилкарбонила; С3-7циклоалкилсульфонила; фенила; фенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; C1-6алкилкарбонила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом С3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 дополнительными заместителями, выбранными из группы, состоящей из фенила, брома и С1-4алкила; при этом фенил и тиенил каждый необязательно замещен трифторметилзаместителем;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил;
vii) ксантен-9-он-3-ил;
viii) 9-метил-9Н-карбазол-3-ил;
ix) 6,7,8,9-тетрагидро-5Н-карбазол-3-ил или
х) 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил;
где С6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из;
i) С1-8алкила;
ii) С2-4алкенила;
iii) С3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) С1-4алкокси;
v) 2-метоксиэтокси;
vii) трифторметила;
viii) 2,2,2-трифторэтила;
ix) 2,2-дифторэтила;
х) 3,3,3-трифторпропила;
xi) трифторметокси;
xii) 2,2,2-трифторэтоксиметила;
xiii) 2,2,2-трифторэтокси;
xvi) хлора;
xvii) циано;
xviii) фтора;
xix) брома;
xx) йода;
xxi) NRaRb, где Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей;
xxii) (1-R2)пирролидин-3-ил-окси; в котором R2 представляет собой пирролидин-1-ил-карбонил;
xxiii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен С1-4алкилкарбонилом;
xxiv) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкокси, брома, трифторметила, хлора и фтора;
xxv) фенилсульфонила;
xxv) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, трифторметила и хлора;
xxvii) 2,2,6,6-тетраметил-3,6-дигидро-2Н-пиран-4-ила;
при условии, что не более одного заместителя на С6-10ариле или гетероариле представляют собой С3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2) пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси или С3-8циклоалкилокси;
s равно 0 или 1;
R1 представляет собой С6-10арил, С1-3алкил или трифторметил;
при условии, что гетероарил группы b) не замещен С1-4алкокси;
при условии, что когда фенил замещен в пара-положении группой NRaRb или когда 2- или 3-пиридинил замещен в положении 5 или 6, соответственно, группой NRaRb, то Rb отличен от C1-6алкила, фенила или С6-10арил (С1-2) алкила;
и при условии, что когда Ra представляет собой C1-6алкил и фенил замещен в пара-положении группой NRaRb или когда 2- или 3-пиридинил замещен в положении 5 или 6, соответственно, группой NRaRb, то Rb отличен C1-6алкилкарбонила; или
при условии, что соединение формулы (I) отлично от
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3Н-бензимидазол-2-ил, s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1Н-бензимидазол-2-ил и s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1Н-индол-2-ил, s равно 0; соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 6-трифторметил-1Н-пирроло [2, 3-b] пиридин-2-ил, s равно 0;
соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-гидрокси-3-метилкарбониламинофенил, и s равно 0; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0;
или его фармацевтически приемлемые соли.
13. Соединение формулы (I):

где
Y и Z независимо выбраны из группы а) или b) таким образом, что один из Y или Z выбран из группы а), а другой - из группы b);
группа а) представляет собой
i) трифторметил; или
ii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила, пирролила, пиридинила и [1,2,3]тиадиазолила;
при этом гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
группа b) представляет собой
i) С6-10арил;
ii) гетероарил, выбранный из группы, состоящей из пиридинила, индолила, бензотиазолила, бензотиенила, бензофуранила, пирроло[2,3-b]пиридинила, тиено[2,3-b]пиридинила, хинолинила и бензимидазолила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из С3-7циклоалкилкарбонила; С3-7циклоалкилсульфонила; фенила; фенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил(C1-4)алкила; C1-6алкилкарбонила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом С3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(С1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен 1-2 дополнительными заместителями, выбранными из группы, состоящей из фенила, брома и С1-4алкила;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил;
vii) ксантен-9-он-3-ил;
viii) 9-метил-9Н-карбазол-3-ил;
ix) 6,7,8,9-тетрагидро-5Н-карбазол-3-ил или
х) 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил;
где С6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) C1-8алкила;
ii) С2-4алкенила;
iii) С3-6циклоалкила, необязательно замещенного одним или двумя фтор-заместителями;
iv) С1-4алкокси;
vi) трифторметила;
vii) 2,2,2-трифторэтила;
viii) 2,2-дифторэтила;
ix) 3,3,3-трифторпропила;
х) трифторметокси;
xi) 2,2,2-трифторэтоксиметила;
xii) 2,2,2-трифторэтокси;
xv) хлора;
xvi) циано;
xvii) фтора;
xviii) брома;
xix) йода;
хх) NRaRb, где Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей;
xxi) (1-R2)пирролидин-3-ил-окси; в котором R2 представляет собой пирролидин-1-ил-карбонил;
xxii) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен С1-4алкилкарбонилом;
xxiii) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-2алкокси, брома, трифторметила, хлора и фтора;
xv) фенилсульфонила;
xxiv) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, трифторметила и хлора;
xxvi) 2,2,6,6-тетраметил-3,6-дигидро-2Н-пиран-4-ила;
при условии, что не более одного заместителя на С6-10ариле или гетероариле представляют собой С3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2) пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси или С3-8циклоалкилокси;
s равно 0 или 1;
R1 представляет собой фенил, С1-3алкил или трифторметил;
при условии, что гетероарил группы b) не замещен С1-4алкокси;
при условии, что когда фенил замещен в пара-положении группой NRaRb или когда 2- или 3-пиридинил замещен в положении 5 или 6, соответственно, группой NRaRb, то Rb отличен от C1-6алкила, фенила или С6-10арил (C1-2) алкила;
и при условии, что когда Ra представляет собой C1-6алкил и фенил замещен в пара-положении группой NRaRb или когда 2- или 3-пиридинил замещен в положении 5 или 6, соответственно, группой NRaRb, то Rb отличен C1-6алкилкарбонила;
при условии, что соединение формулы (I) отлично от
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3Н-бензимидазол-2-ил, s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1Н-бензимидазол-2-ил и s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1Н-индол-2-ил, s равно 0; соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 6-трифторметил-1H-пирроло [2,3-b] пиридин-2-ил, s равно 0;
соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0;
и его фармацевтически приемлемые соли.
14. Соединение формулы (I):

где
Y и Z независимо выбраны из группы а) или b) таким образом, что один из Y или Z выбран из группы а), а другой - из группы b);
группа а) представляет собой
i) трифторметил или
ii) гетероарил, выбранный из группы, состоящей из тиенила, фуранила, тиазолила, изотиазолила и пирролила;
при этом гетероарил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из фтора, хлора, брома и трифторметила;
группа b) представляет собой
i) С6-10арил;
ii) гетероарил, выбранный из группы, состоящей из пиридинила, индолила, бензотиазолила, бензотиенила, пирроло[2,3-b]пиридинила и тиено[2,3-b]пиридинила;
iii) бензоконденсированный гетероциклил, присоединенный через атом углерода, и когда гетероциклильный компонент содержит атом азота, то атом азота необязательно замещен одним заместителем, выбранным из группы, состоящей из С3-7циклоалкилкарбонила; С3-7циклоалкилсульфонила; фенила; фенилкарбонила; пирролилкарбонила; фенилсульфонила; фенил (C1-4)алкила; C1-6алкилсульфонила; пиримидинила; и пиридинила; при этом С3-7циклоалкилкарбонил, фенил, фенилкарбонил, фенил(C1-4)алкил и фенилсульфонил необязательно замещены трифторметилом или одним или двумя фтор-заместителями;
и где бензоконденсированный гетероциклил необязательно замещен по атому углерода оксогруппой и необязательно независимо замещен одним или двумя дополнительными заместителями, выбранными из группы, состоящей из фенила;
iv) феноксатиинил;
v) флуорен-9-он-2-ил;
vi) 1-хлорнафто[2,1-b]тиофен-2-ил или
vii) 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил;
где С6-10арил и гетероарил группы b) необязательно независимо замещены 1-3 заместителями, выбранными из группы, состоящей из:
i) С1-8алкила;
ii) С2-4алкенила;
iii) С3-6циклоалкила;
iv) С1-4алкокси;
v) трифторметила;
vi) трифторметокси;
vii) 2,2,2-трифторэтоксиметила;
ix) хлора;
х) фтора;
xi) брома;
xii) йода;
xiii) NRaRb, где Ra и Rb взяты вместе с атомом азота, к которому они присоединены, с образованием 5-8-членного гетероциклического кольца, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из одного или двух фтор-заместителей;
xiv) 5-8-членного гетероциклила, связанного через атом углерода, в котором, если гетероциклил содержит атом азота, этот атом азота необязательно замещен С1-4алкилкарбонилом;
xv) пиридинилокси, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-2алкокси, брома, трифторметила и хлора;
xv) фенилсульфонила; и
xvi) фенилокси, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, трифторметила и хлора;
при условии, что не более одного заместителя на С6-10ариле или гетероариле представляют собой С3-6циклоалкил; гетероциклилокси; пиридинилокси; NRaRb; (1-R2) пирролидин-3-ил-окси; фенилкарбонил; фенилсульфонил; фенилокси или С3-8циклоалкилокси;
s равно 0 или 1;
R1 представляет собой фенил;
при условии, что гетероарил группы b) не замещен С1-4алкокси;
при условии, что когда фенил замещен в пара-положении группой NRaRb или когда 2- или 3-пиридинил замещен в положении 5 или 6, соответственно, группой NRaRb, то Rb отличен от C1-6алкила, фенила или С6-10арил (С1-2) алкила;
и при условии, что когда Rа представляет собой C1-6алкил и фенил замещен в пара-положении группой NRaRb или когда 2- или 3-пиридинил замещен в положении 5 или 6, соответственно, группой NRaRb, то Rb отличен C1-6алкилкарбонила;
при условии, что соединение формулы (I) отлично от
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)бензимидазол-5-ил, и s равно 0; соединения, где Y представляет собой 3-метил-2-фенилхромен-4-он-8-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, s равно 0; соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3Н-бензимидазол-2-ил, s равно 0; соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-фтор-1Н-бензимидазол-2-ил и s равно 0; соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 6-трифторметил-1Н-индол-2-ил, s равно 0; соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 6-трифторметил-1Н-пирроло [2,3-b] пиридин-2-ил, s равно 0;
соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил; соединения, в котором Y представляет собой тиазол-4-ил, Z представляет собой 2-фенилметил-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0;
и его фармацевтически приемлемые соли.
15. Соединение формулы (I):
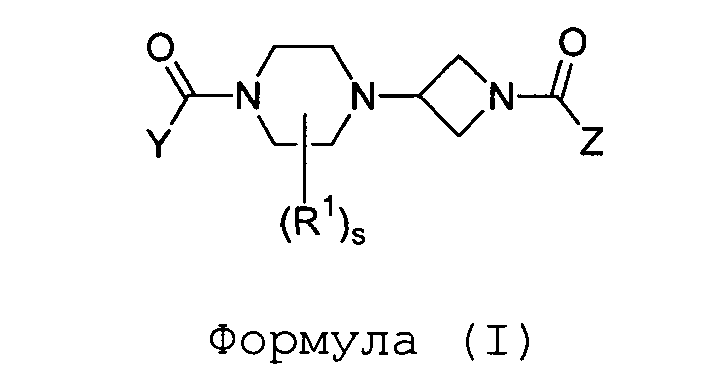
выбранное из группы, состоящей из:
соединения, где Y представляет собой фуран-2-ил, Z представляет собой 4-циклогексилфенил, и s равно 0;
соединения, где Y представляет собой 1-метил-1Н-имидазол-2-ил, Z представляет собой 4-циклогексилфенил, и s равно 0;
соединения, где Y представляет собой пиридин-2-ил, Z представляет собой 4-циклогексилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-бром-3-метоксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-бром-2-хлорфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-феноксифенил, и s равно 1, и R1 представляет собой 2-метил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-феноксифенил, и s равно 0, и R1 представляет собой 3-метил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-феноксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бромфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой бензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-бромнафт-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-1Н-бензимидазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-3-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-трифторметилбензотиен-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 7-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-бром-3-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1Н-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-трифторметилфенилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(циклопропилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(циклогексилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метансульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(метансульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(циклобутилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенилкарбонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(фенилсульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-трифторметилфенилсульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-фторфенилсульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенилсульфонил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(фенилметил)-1,2,3,4-тетрагидрохинолин-6-ил, из равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенилметил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-фенил-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(пиримидин-2-ил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-трифторметилфенил)-1,2,3,4-тетрагидрохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метилкарбонил)-6-бром-1,2,3,4-тетрагидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(метилкарбонил)-6-бром-1,2,3,4-тетрагидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(4-хлорфенокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3,4-дихлорфенокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-трифторметилфенокси)фенил, и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 3-йод-4-(1-(пирролидин-1-ил-карбонил)-пирролидин-3-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-4-окси-2-фенилхромен-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метокси-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-трифторметил-7-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-трифторметилфенилсульфонил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(4-трифторметилпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-фтор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой феноксатиин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-н-пропилфенил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-5-трифторметил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-(3-трифторметилфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(пиридин-2-ил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-фтор-4-(3-хлорфенокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4 - (3-хлор-5-трифторметилпиридин-2-ил-окси) фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-трифторметил-6-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-5-фтор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенил)-3а,4,5,9b-тетрагидро-3Н-циклопента[с]хинолин-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(пиримидин-2-ил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пирролидин-1-ил-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-трифторметил-7-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4,4-дифторпиперидин-1-ил)бензотиазол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-трет-бутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-трифторметил-5-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 3-бром-6-трифторметил-1Н-пирроло[2,3-b]пиридин-2-ил), и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой пиррол-2-ил, Z представляет собой феноксатиин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(3-трифторметилкарбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фенилметил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-бром-1-метил-1Н-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-бром-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-(3-хлорфенокси)- пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилциклогексилкарбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6-трифторметилтиено[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-н-пропилиндол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-хлор-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-(3-трифторметилфенокси)пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(пиррол-2-ил-карбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-трифторметил-6-метилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой изотиазол-5-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-4-трифторметоксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(2,2,2-трифторэтоксиметил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-циклобутил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1,3-диметил-5-хлориндол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-фтор-7-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой флуорен-9-он-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-трифторметил-6-хлорбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метокси-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-метил-3-йодиндол-6-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой изотиазол-5-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, в котором Y представляет собой тиазол-2-ил, Z представляет собой 4-(2,2,6,6-тетраметил-3,6-дигидро-2Н-пиран-4-ил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-трифторметил-6-метилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-(2-хлорфенокси)- пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой ксантен-9-он-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(2,2-дифторэтил)-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-трифторметил-6-метилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-циклопропил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(6-фторпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4 -(5-хлорпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-трифторметилбензотиазол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-фтор-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(3-хлор-5-трифторметилпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6-метоксибензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой 1Н-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой (1-фенилкарбонил)-2,3-дигидро-1Н-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-этилфенил, и s равно 0;
соединения, где Y представляет собой 3-метил-6- трифторметилбензотиен-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бром-3-метилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-хлорбензотиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4,4-дифторциклогексилкарбонил)-1,2,3,4- тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4 -(2,2,2-трифторэтокси)фенил, и s равно 0;
соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-циклогексил-2-метилбензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 1,3-диметил-5-хлориндол-2-ил, Z представляет собой 1Н-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пиридин-3-ил-оксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-циклогексил-1Н-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фенилкарбонил)-1,2,3,4- тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-трифторметил-5-метилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(3-трифторметилфенилсульфонил)фенил, и s равно 0;
соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 3-бром-6-трифторметил-1Н-пирроло [2,3-b]пиридин-2-ил), и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-изопропил-2-трифторметилбензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой 1Н-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6,7-дихлорхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(2,3-диметилфениламино)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бром-5-метилтиен-2-ил, и s равно 0;
соединения, где Y представляет собой 3-бром-6-трифторметил-1H-пирроло[2,3-b]пиридин-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметил-1H-индол-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой 1H-пиррол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-6-трифторметилтиено[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 9-метил-9Н-карбазол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-фторбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-4-(пиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой 1,2,3-тиадиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(3-фторфениламино)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-5-хлор-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметил-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(5-хлорпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1,3-диметил-5-хлориндол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4,4-дифторциклогексил)бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-7-метокси-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(2,2,2-трифторэтил)бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 1,3-диметил-5-хлориндол-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6,7,8,9-тетрагидро-5Н-карбазол-3-ил, и s равно 0;
соединения, где Y представляет собой 5-хлорбензотиазол-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(5-бромпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2,2-диметил-2,3-дигидробензофуран-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 9-метил-9Н-карбазол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(3-трифторметилфениламино)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(4-трифторметилпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3,4-дигидро-2Н-бензо[b][1,4]диоксепин-7-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметил-1Н-индол-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(циклопропилкарбонил)-2,3-дигидро-1Н-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-бром-6-трифторметил-1Н-пирроло[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3,5-ди-трет-бутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метил-1-(3,3,3-трифторпропил)-1Н-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, s равно 1, и R1 представляет собой 2-трифторметил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-хлор-2-трифторметилхинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3,3,3-трифторпропил)-1Н-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(2-метоксиэтокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метилбензотиазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4 -(б-фторпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой 5-хлорбензофуран-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-бром-2-метилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-хлорхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2,б-диметил-1-(2,2,2-трифторэтил)-пиррол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метил-1-(2,2,2-трифторэтил)-1Н-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-хлор-2-метилхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой 1-циклогексил-2-метил-1Н-бензимидазол-5-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-фтор-3-метилбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1,2-диметил-1Н-индол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-хлорхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метил-1-(4,4-дифторциклогексил)бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметил-1Н-пирроло[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-циклогексил-1Н-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, s равно 1, и R1 представляет собой 2(R,S)-трифторметил;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(3-хлор-5-трифторметилпиридин-2-илокси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-(3-хлорфенокси)- пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенил-1,2,3,4-тетрагидроизохинолин-в-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 10-оксо-10Н-10λ4-феноксантиин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой 5-хлорбензофуран-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой пиридин-2-ил, Z представляет собой 3-хлор-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-(2-хлорфенокси)- пиридин-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-бромбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(2,2-дифторэтил) -1Н-индол-5-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-6-трифторметилбензотиен-2-ил, Z представляет собой 4-трифторметилтиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6,7,8,9-тетрагидро-5Н-карбазол-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-хлорбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(пиримидин-2-ил)-1,2,3,4-тетрагидроизохинолин-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1Н-индазол-5-ил, и s равно 0;
соединения, где Y представляет собой 5-хлорбензотиазол-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(фенилсульфонил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5,7-дихлор-2-метилхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 6-бром-3-метилимидазо[1,2-а]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 7-хлор-2-метилхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой 2-циклогексил-1Н-бензимидазол-5-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-трифторметил-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2, 3-дигидро-1Н-индол-5-ил, и s равно 0;
соединения, где Y представляет собой 5-трифторметил-1Н-пирроло[3,2-b]пиридин-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(изопропил)-2-трифторметилбензимидазол-5-ил, из равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(циклогексил)-2-метилбензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-трифторметилбензотиен-2-ил, s равно 1, и R1 представляет собой 3-трифторметил;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(4,4-дифторциклогексил)бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-хлор-2-метилхинолин-3-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(4-трифторметилпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-метилиндол-3-ил, и s равно 0;
соединения, где Y представляет собой 1,3-диметил-5-хлориндол-2-ил, Z представляет собой 1Н-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-7-метокси-1Н-индол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(2,2,2-трифторэтил)бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой 4-хлор-2-трифторметилхинолин-6-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(1,1-диоксотиоморфолин-4-ил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метил-7-метоксихинолин-3-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-7-метокси-1Н-индол-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-гидроксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-хлор-2-трифторметилхинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-метокси-5-трет-бутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-6-метоксибензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(3,3,3-трифторпропил)-1Н-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-7-метилимидазо[1,2-а]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой 2-циклогексил-1Н-бензимидазол-5-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-2-фенил-4-оксохромен-8-ил, Z представляет собой тиазол-2-ил, s равно 1, и R1 представляет собой 3-фенил;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-хлорбензотиазол-2-ил, и s равно 0;
соединения, где Y представляет собой 1Н-пиррол-2-ил, Z представляет собой 1Н-индол-5-ил, и s равно 0;
соединения, где Y представляет собой 3-метил-7-метокси-1Н-индол-2-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(2,2,2-трифторэтил)-2-метилбензимидазол-5-ил, из равно 0;
соединения, где Y представляет собой 4-хлор-2-трифторметилхинолин-6-ил, Z представляет собой тиазол-4-ил, и s равно 0;
соединения, где Y представляет собой 6-трифторметилфуро[2,3-b]пиридин-2-ил, Z представляет собой тиазол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-трет-бутоксикарбонил-3,4-дигидро-1Н- изохинолин-8-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-фтор-3-метилбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-трифторметил-1H-пирроло [3, 2-b] пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-бромфуро[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 6-трифторметил-1Н-пирроло[2,3-b]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(3,3,3-трифторпропил)-2-метил-1Н-бензимидазол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бром-3-метилимидазо[1,2-а]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(пиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 7-фтор-3-метилбензофуран-2-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(5-бромпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-бромимидазо[1,2-а]пиридин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-фенилкарбонил-1Н-пиррол-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенокси)-3-фторфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(3-хлорфенилсульфонил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(5-бромпиридин-2-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-(2-фтор-5-трифторметилфенокси)-пиридин-3-ил, из равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(3-трифторметилфенилметил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4-трифторметилфенилметил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3-трифторметилфенилметил)-2,3-дигидро-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенилметил)-2,3-дигидро-1H-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фенил-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-фторфенил)-2,3-дигидро-1Н-индол-4-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-фторфенил) -2,3-дигидро-1Н-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой феноксатиин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(1,1-диметилпропил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-азепан-1-ил-фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-циклогексилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-хлорнафто[2,1-b]тиофен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-изобутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-гептилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пентилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-н-бутилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-фтор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 5-хлор-3-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-5-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-метил-5-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-метил-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-5-фтор-6-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-5-трифторметил-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-фтор-7-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-(1-трет-бутоксикарбонилпиперидин-4- ил) фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(5-метоксипиридин-3-ил-окси)фенил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой тиазол-4-ил, s равно 1, и R1 представляет собой 3-фенил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(циклогексилсульфонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4-трифторметилфенилкарбонил)-1,2,3,4-тетрагидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 5-трифторметилбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пиридин-2-ил-окси-3-фторфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-бром-5-трифторметилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1Н-индол-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-бром-5-фторфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-пиридин-2-ил-оксифенил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(3-хлорфенилсульфонил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-фтор-5-бромфенил, и s равно 0;
соединения, где Y представляет собой 5-трифторметилбензотиен-2-ил, Z представляет собой фуразан-3-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 4-пиридин-2-ил-оксифенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-бром-5-трифторметилфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(метилкарбонил)-6-фенил-3,4-дигидрохинолин-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 2-фтор-5-бромфенил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-фтор-5-бромфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(фенилсульфонил)-3,4-дигидроизохинолин-6-ил, из равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 2-(4-трифторметилфенилсульфонил)-3,4-дигидроизохинолин-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 3-хлор-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-хлор-6-фторбензотиен-2-ил, и s равно 0;
соединения, где Y представляет собой трифторметил, Z представляет собой 4-(3-хлорфенокси)-3-фторфенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4,4-дифторциклогексил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-фенил-!,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-фторфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3,4-дифторфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-трифторметилфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(2,2,2-трифторэтил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(3,3,3-трифторпропил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-фенил-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(4-фторфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(3,4-дифторфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(4-трифторметилфенил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(2,2,2-трифторэтил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(3,3,3-трифторпропил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-4-ил, Z представляет собой 1-(4,4-дифторциклогексил)-1,3-дигидробензимидазол-2-он-5-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4 -(N-фенил-N-метиламиносульфонил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 4-(пиперидин-1-ил-сульфонил)фенил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-(4,4-дифторциклогексилкарбонил)-1H-индол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-(6-хлорпиридин-3-илкарбонил)-1H-индол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 3-(пиридин-3-ил-карбонил)-1H-индол-6-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 1-(4-тиоморфолин-4-ил-хиназолин-7-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 9,9-диметил-9Н-флуорен-2-ил, и s равно 0;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилбензотиен-2-ил, s равно 2, и R1 представляет собой цис-2,6-диметил;
соединения, где Y представляет собой тиазол-2-ил, Z представляет собой 6-трифторметилбензотиен-2-ил, s равно 2, и R1 представляет собой цис-3,5-диметил;
или их фармацевтически приемлемых солей.
16. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении моноацилглицеринлипазы (MGL), содержащая соединение по п. 1 или 14 и по меньшей мере один из фармацевтически приемлемого носителя, фармацевтически приемлемого эксципиента или фармацевтически приемлемого разбавителя.
17. Фармацевтическая композиция по п. 16, где композиция представляет собой твердую дозированную форму для перорального введения.
18. Фармацевтическая композиция по п. 16, где композиция представляет собой сироп, эликсир или суспензию.
19. Способ лечения воспалительной боли у нуждающегося в лечении пациента, включающий введение пациенту терапевтически эффективного количества соединения по п. 1 или 14.
20. Способ по п. 19, где воспалительная боль связана с воспалительным заболеванием кишечника, висцеральной болью, мигренью, послеоперационными болями, остеоартрозом, ревматоидным артритом, болями в спине, в пояснице, в суставах, в животе, в груди, родовыми схватками, заболеванием опорно-двигательного аппарата, кожным заболеванием, зубной болью, пирексией, ожогом, солнечным ожогом, укусом змеи, укусом ядовитой змеи, паука или насекомого, нейрогенным мочевым пузырем, интерстициальным циститом, инфекцией мочевыводящих путей, ринитом, контактным дерматитом/гиперчувствительностью, зудом, экземой, фарингитом, мукозитом, энтеритом, синдромом раздраженной толстой кишки, холециститом, панкреатитом, болевым синдромом после мастэктомии, менструальными болями, эндометриозом, болями по причине физической травмы, головной болью, синусовой головной болью, головной болью напряжения или арахноидитом.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| 3-АЗЕТИДИНИЛАЛКИЛПИПЕРИДИНЫ ИЛИ ПИРРОЛИДИНЫ В КАЧЕСТВЕ АНТАГОНИСТОВ ТАХИКИНИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1996 |
|
RU2158264C2 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| FR 2915199, A1, 22.01.2008 | |||
Авторы
Даты
2015-04-27—Публикация
2010-04-22—Подача