Перекрестные ссылки на смежные изобретения
Настоящая заявка испрашивает приоритет, заявленный в предварительной заявке на патент США № 61/256405, поданной 30 октября 2009 года, содержание которой полностью включено в настоящий документ путем ссылки.
Область применения изобретения
Настоящее изобретение относится к созданию новых модуляторов опиоидных рецепторов формулы (I). Настоящее изобретение также относится к способам получения таких соединений, фармацевтических композиций, содержащих такие соединения, а также к их применению для терапии расстройств, модулируемых опиоидными рецепторами.
Предпосылки создания изобретения
Термин «опиат» применяется для обозначения фармакологически активных алкалоидов, получаемых из опия, например, морфина, кодеина, и многих полусинтетических аналогов морфина. После выделения пептидных соединений с аналогичным морфину действием был введен термин «опиоид» для обобщенного обозначения любых препаратов с аналогичным морфину действием. В класс опиоидов входят различные пептиды с аналогичным морфину действием, такие как эндорфины, энкефалины и динорфины. Однако в ряде источников термин «опиат» используется в обобщенном смысле, и в таких контекстах термины «опиат» и «опиоид» являются взаимозаменяемыми. Кроме того, термин «опиоид» также применяется для обозначения антагонистов морфиноподобных препаратов, а также для охарактеризования рецепторов или сайтов связывания, которые могут взаимодействовать с такими агентами.
Опиоиды широко применяются как анальгетики, однако они также могут иметь и множество других фармакологических действий. Морфин и родственные опиоиды оказывают наиболее выраженное действие на центральную нервную и пищеварительную системы. Спектр действия достаточно широк и включает обезболивающее воздействие, сонливость, смену настроения, угнетение дыхательной функции, головокружение, помутнение рассудка, дисфорию, кожный зуд, повышение давления в желчных путях, угнетение моторики желудочно-кишечного тракта, тошноту, рвоту, а также изменения в эндокринной и вегетативной нервной системах.
При введении пациентам с болями морфина в терапевтических дозировках отмечается снижение интенсивности болей, снижение связанного с болями дискомфорта или полное исчезновение болей. Помимо облегчения патологического состояния ряд пациентов также испытывает чувство эйфории. Однако при введении морфина в рекомендованных для достижения обезболивающего эффекта дозировках пациентам, не страдающим от болей, эффект не всегда благоприятный, нередко отмечается тошнота и даже рвота. Возможны также сонливость, неспособность к концентрации, снижение умственной активности, апатия, снижение физической активности, снижение остроты зрения и заторможенность.
С опиоидными рецепторами могут связываться два класса опиоидных молекул: указанные выше опиоидные пептиды (например, энкефалины, динорфины и эндорфины) и алкалоидные опиаты (например, морфин, эторфин, дипренорфин и налоксон). После первой демонстрации сайтов связывания опиатов (Pert, C.B. и Snyder, S. H., Science (1973) 179:1011-1014) для классификации множества опиоидных рецепторов были использованы различия в фармакологических и физиологических действиях пептидных аналогов опиоидов и алкалоидных опиатов. Соответственно, были описаны три в молекулярном и фармакологическом отношении разных типа опиоидных рецепторов: дельта, каппа и мю. Более того, в каждом типе принято также выделять подтипы (Wollemann, M., J Neurochem (1990) 54:1095-1101; Lord, J. A., et al., Nature (1977) 267:495-499).
Опиоидные рецепторы трех указанных типов имеют общие функциональные механизмы на клеточном уровне. Например, опиоидные рецепторы вызывают ингибирование аденилатциклазы и секреции нейромедиатора путем как активации калиевых каналов, так и ингибирования Ca2+-каналов (Evans, C. J., In: Biological Basis of Substance Abuse, S. G. Korenman & J. D. Barchas, eds., Oxford University Press (in press); North, A. R., et al., Proc Natl Acad Sci USA (1990) 87:7025-29; Gross, R. A., et al., Proc Natl Acad Sci USA (1990) 87:7025-29; Sharma, S. K., et al., Proc Natl Acad Sci USA (1975) 72:3092-96). Несмотря на то, что указанные функциональные механизмы одинаковы, поведенческие проявления селективных к типу рецептора препаратов значительно различаются (Gilbert, P. E. & Martin, W. R., J Pharmacol. Exp. Ther (1976) 198:66-82). Такие различия могут быть частично связаны с анатомической локализацией рецепторов различного типа.
Рецепторы типа дельта распределены в ЦНС млекопитающих более дискретно, чем рецепторы типа мю и каппа, их концентрации высоки в миндалевидном теле, полосатом теле, черной субстанции, обонятельной луковице, обонятельных бугорках, гиппокампальной формации и коре головного мозга (Mansour, A., et al., Trends in Neurosci (1988) 11:308-14). Примечательным является полное отсутствие опиоидных рецепторов, включая дельта-опиоидные рецепторы, в мозжечке крысы.
Есть постоянная потребность в разработке новых модуляторов дельта-опиоидных рецепторов для использования их в качестве анальгетиков. Также есть потребность в разработке селективных агонистов дельта-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами. Кроме того, есть потребность в антагонистах дельта-опиоидных рецепторов для использования их в качестве иммунодепрессантов, противовоспалительных агентов, агентов для терапии неврологических и психиатрических состояний, агентов для терапии урологических состояний и расстройств репродуктивной системы, препаратов для лечения алкогольной и наркотической зависимости, агентов для терапии гастрита и диареи, агентов для терапии сердечно-сосудистой системы и агентов для терапии респираторных заболеваний со сниженными побочными эффектами.
Есть постоянная потребность в разработке новых модуляторов опиоидных рецепторов для использования их в качестве анальгетиков. Также есть потребность в разработке агонистов дельта- и мю-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами. Также есть потребность в разработке агонистов мю-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами при терапии болевого синдрома, модуляции иммунной функции, терапии желудочно-пищеводного рефлюкса и кашля. Кроме того, также есть потребность в агонистах дельта-опиоидных рецепторов для использования их в качестве обезболивающих агентов, агентов для терапии респираторных заболеваний, агентов для терапии сердечно-сосудистой системы, агентов для терапии урологических расстройств и агентов для терапии неврологических и психиатрических состояний. Также есть потребность в разработке агонистов двойного действия для дельта- и мю-опиоидных рецепторов.
Краткое описание изобретения
Настоящее изобретение относится к соединению формулы I
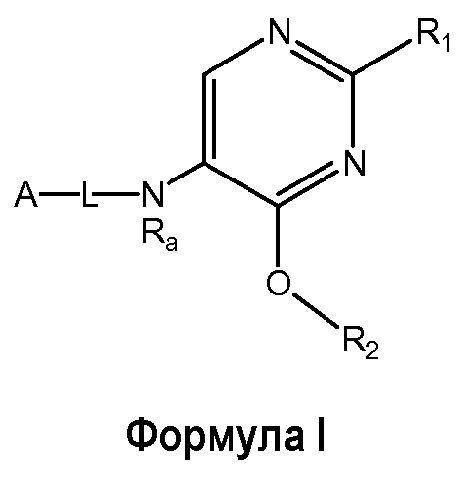
где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C2-4алкенила, C2-4алкинила, C1-4алкокси, C1-4алкилтио, гидрокси, хлоро и фторо; или фенила, необязательно замещенного одним амино, C1-4алкиламино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, C1-4алкиламинокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, C1-4алкоксикарбониламино, уреидо, C1-4алкилуреидо, ди(C1-4алкил)уреидо, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом, бромо, пиперазин-1-илом, необязательно замещенным 4-C1-4алкилом, морфолин-4-илом, фенилом, формамидо или пиридинилом;
в котором заместители фенил и пиридинил в R1-фениле необязательно замещены одним заместителем, выбранным из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, фторо, хлоро, циано, амино и гидрокси;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио и гидрокси; или пиримидинила, необязательно замещенного одним амино, C1-4алкиламино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, C1-4алкиламинокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, C1-4алкоксикарбониламино, уреидо, C1-4алкилуреидо, ди(C1-4алкил)уреидо, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом, бромо, пиперазин-1-илом, который необязательно замещен 4-C1-4алкилом, морфолин-4-илом, формамидо, пиррол-1-илом, фенилом, пиридинилом или пиперидин-1-илом;
и в котором заместители фенил и пиридинил в R1-пиримидиниле необязательно независимо замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, фторо, хлоро, циано, амино и гидрокси;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, C1-4алкиламино, ди(C1-4алкил)амино, C1-4алкилсульфонилом, аминокарбонилом, C1-4алкиламинокарбонилом, ди(C1-4алкил)аминокарбонилом, C1-4алкилкарбониламино, C1-4алкоксиаминокарбонилом, уреидо, C1-4алкилуреидо, ди(C1-4алкил)уреидо, пиперазин-1-илом, морфолин-4-илом, фенилом или пиридинилом;
и в котором заместители фенил и пиридинил в R1-пиридиниле необязательно независимо замещены одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, фторо, хлоро, циано, амино и гидрокси;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, бензимидазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, изохинолинила, хиноксалинила, хиназолинила, изоксазолила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила, бензотиофенила, индазолила и 2,3-дигидробензо[1,4]диоксинила;
в котором G необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, фторо, хлоро, бромо, циано, C1-4алкилкарбонила, амино, C1-4алкиламино и ди(C1-4алкил)амино;
R2 представляет собой:
(i) фенил, необязательно замещенный от одного до трех заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, фторо, хлоро и гидрокси; и фенил R2, необязательно замещенный одним амино, C1-4алкиламино, ди(C1-4алкил)амино, фторметилом, дифторметилом, трифторметилом, фторметокси, дифторметокси, трифторметокси, формамидино, аминокарбонилом, C1-4алкиламинокарбонилом, ди(C1-4)алкиламинокарбонилом, C1-4алкилкарбониламино, 2,2,2-трифторэтокси, циано, C3-7циклоалкилкарбониламино, гидрокси(C1-4)алкилом, C1-4алкокси(C1-4)алкилом, C1-4алкокси-(C1-4)алкокси, C1-4алкилкарбонилокси, C1-4алкилсульфониламино, C1-4алкилсульфонилом, пиридинил(C1-4)алкилом, бензилоксикарбониламино, 4-метилпиперазин-1-илкарбонилом, пирролидин-1-илкарбонилом, карбокси, пиперидин-1-илкарбонилом, морфолин-4-илкарбонилом, C3-7циклоалкилом, C3-7циклоалкил-(C1-3)алкилом или C3-7циклоалкил-(C1-3)алкокси;
(ii) 1,2-дигидробензофуранил, связанный с атомом O соединения формулы (I) в бензольной части кольца; в котором бензольная часть 1,2-дигидробензофуранила необязательно независимо замещена одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, фторо, хлоро, бромо, циано, C1-4алкилкарбонила, амино, C1-4алкиламина и ди(C1-4алкил)амино;
или
(iii) гетероарил, выбранный из группы, состоящей из бензотиазолила, бензооксазолила, пиридинила, пиримидинила, индазолила, хинолинила, хиназолинила, бензимидазолила, пиразинила, триазинила, бензотиофенила, бензофуранила и изохинолинила;
в котором гетероарил R2 необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, фторо, хлоро, бромо, циано, C1-4алкилкарбонила, амино, C1-4алкиламина и ди(C1-4алкиламина;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4-; и a5-L5-; при этом L1 отсутствует или представляет собой C1-4алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода C1-4алкилом, амино, C1-4алкиламино, ди(C1-4алкил)амино, аминометилом, гидрокси, циано, C1-4алкокси, C1-4алкоксикарбонилом или одним или двумя фторо; в котором пирролидинил необязательно замещен при атоме азота C1-4алкилом, фенил(C1-4)алкилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом или фенил(C1-4)алкоксикарбонилом;
ii) пиперидинила, необязательно замещенного C1-4алкилом, фенилом, амино, C1-4алкиламино, ди(C1-4алкил)амино, аминометилом, гидрокси, циано, C1-4алкокси, C1-4алкоксикарбонилом, фенил(C1-4)алкилом, C1-4алкилкарбонилом или фенил(C1-4)алкоксикарбонилом;
и
iii) азетидинила, необязательно замещенного 3-амино, 3-гидрокси, 3-C1-4алкокси, C1-4алкилом или аминометилом;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
и при условии, что a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота a1;
L2 представляет собой C1-4алкил;
a2 связан через атом углерода с L2 и выбран из группы, состоящей из
i) пиперазинила, необязательно замещенного при атоме углерода C1-4алкилом, аминометилом, циано или C1-4алкоксикарбонилом; в котором пиперазинил необязательно замещен при атоме азота C1-4алкилом, фенил(C1-4)алкилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом или фенил(C1-4)алкоксикарбонилом;
и
ii) морфолинила, необязательно независимо замещенного фенил(C1-4)алкилом или одним или двумя C1-4алкилами;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя C1-4алкилзаместителями;
L4 представляет собой (C2-6)алкил; и если L4 представляет собой C3-6алкил, L4 необязательно замещен хлоро, гидрокси или C1-4алкокси; при условии, что хлоро, гидрокси и C1-4алкокси не находятся в альфа-положении относительно несущего азот атома углерода;
a4 выбран из группы, состоящей из амино и C1-4алкиламино;
при условии, что a4 присоединен к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой C1-4алкил;
a5 представляет собой C3-7циклоалкил, замещенный RB; в котором RB выбран из группы, состоящей из амино, C1-4алкиламино, ди(C1-4алкил)амино, аминометила, C1-4алкиламинометила и ди(C1-4алкил)аминометила;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C3-7циклоалкилу, присоединение осуществляется к атому углерода, отличному от альфа-атома относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидинила, в котором пирролидинил необязательно замещен C1-4алкилом, амино, C1-4алкиламино, ди(C1-4алкил)амино, аминометилом, циано, C1-4алкокси, C1-4алкоксикарбонилом или фенилом;
ii) пиперазинила, необязательно замещенного 4-C1-4алкилом; в котором пиперазинил необязательно независимо замещен при атоме углерода одним или двумя C1-4алкилами, 2-оксо, 3-оксо, трифторметилом, аминометилом или гидроксиметилом;
iii) пиперидинила, необязательно замещенного одним или двумя C1-4алкилами, амино, C1-4алкиламино, ди(C1-4алкил)амино, аминометилом, гидрокси, циано, C1-4алкокси, C1-4алкоксикарбонилом, фенилом, фенил(C1-4)алкилом или одним или двумя фторо;
в котором фенил и фенильная часть фенил(C1-4)алкила необязательно замещена C1-4алкилом, C1-4алкокси, C1-4алкилтио, фторо, хлоро, циано, амино или гидрокси;
iv) азетидинила, необязательно замещенного 3-амино или 3-аминометилом;
v) [1,4]диазепан-1-ила, необязательно замещенного одним или двумя C1-4алкилами;
и
vi) 3,6-диазобицикло[3.1.1]гепт-3-ила, необязательно независимо замещенного одним или двумя C1-4алкилами;
Ra представляет собой водород или C1-4алкилкарбонил;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой H, а X представляет собой O;
и
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Настоящее изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение формулы (I) или его фармацевтически приемлемую соль.
Также в настоящем изобретении предложены способы получения фармацевтической композиции, включающие смешивание соединения формулы (I) и фармацевтически приемлемого носителя.
Настоящее изобретение также относится к способам терапии или облегчения симптомов расстройств, модулируемых опиоидными рецепторами. В частности, способы настоящего изобретения направлены на терапию или облегчение симптомов расстройств, модулируемых опиоидными рецепторами, включая, помимо прочего, воспалительные боли; боли, опосредуемые центральной нервной системой; боли, опосредуемые периферической системой; висцеральные боли; боли, связанные со структурными нарушениями; онкологические боли; боли, связанные с травмой мягких тканей; боли, связанные с прогрессирующим заболеванием; невропатические боли и острые боли, связанные с острым поражением; острые боли, связанные с травмой; острые боли, связанные с хирургическим вмешательством; хронические головные боли, хронические боли при невропатических состояниях, хронические боли при постинсультных состояниях и хронические боли при мигрени.
В настоящем изобретении также предложены способы получения указанных соединений и фармацевтических композиций, а также лекарственных препаратов, изготовленных на их основе.
Подробное описание изобретения
Для целей настоящего документа следующие термины имеют следующие определения:
«Ca-b» (где a и b являются целыми значениями) относится к радикалу, содержащему от a до b атомов углерода включительно. Например, C1-3 обозначает радикал, содержащий 1, 2 или 3 атома углерода.
По отношению к заместителям термин «независимо» обозначает, что при возможности ввести более одного из таких заместителей вводимые заместители могут быть одинаковыми или разными. Таким образом, указанное число атомов углерода (например, C1-8) независимо обозначает количество атомов углерода в алкильном или циклоалкильном фрагменте или алкильной части более крупного заместителя, в названии которого присутствует корень «алкил».
Если особо не указано иное, термин «алкил», используемый в настоящем документе, самостоятельно или в составе названия заместителя, относится к линейной или разветвленной углеродной цепи, содержащей от 1 до 8 атомов углерода, либо любое число атомов углерода в пределах обозначенного диапазона. Используемый в настоящей заявке термин «алкокси» относится к заместителю типа -O-алкил, где «алкил» применяется в указанном выше смысле. Аналогичным образом, используемые в настоящей заявке термины «алкенил» и «алкинил» относятся к линейной или разветвленной углеродной цепи, содержащей от 2 до 8 атомов углерода или любое число атомов углерода в пределах обозначенного диапазона, при этом алкенильная цепь содержит по меньшей мере одну двойную связь в цепи, а алкинильная цепь содержит по меньшей мере одну тройную связь в цепи. Алкильная и алкоксильная цепи могут быть замещены по атому углерода. В заместителях, содержащих несколько алкильных групп, например, (C1-6алкил)-2-амино-C1-6, алкильные группы диалкиламиногрупп могут быть одинаковыми или различаться.
Термин «галогензамещенный алкил» относится к насыщенному алкильному радикалу с разветвленной или линейной цепью, полученному путем отрыва одного атома водорода от материнской молекулы алкана. Материнская алкильная цепь содержит от 1 до 8 атомов углерода, при этом 1 или несколько атомов водорода замещены на атомы галогена, вплоть до и включая замену всех атомов водорода на атомы галогена. Предпочтительные галогензамещенные алкильные группы включают трифторметил-замещенные алкилы, дифторметил-замещенные алкилы и перфторалкилы, более предпочтительные фторированные алкилы включают трифторметил и дифторметил.
Термин «галогензамещенный алкокси» относится к радикалу, полученному из галогензамещенного алкильного радикала путем его присоединения к атому кислорода, при этом атом кислорода имеет одну свободную валентность для присоединения к материнской структуре.
Используемый в настоящей заявке термин «циклоалкил» относится к насыщенному или частично ненасыщенному моноциклическому или полициклическому углеводороду, содержащему от 3 до 20 атомов углерода (предпочтительно от 3 до 14 атомов углерода). Примеры таких групп, помимо прочего, включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и адамантил. Термин «циклоалкил» также включает циклоалкильные кольца, конденсированные с бензольным кольцом (бензоконденсированный циклоалкил) или 5- или 6-членным гетероароматическим кольцом (содержащим один из O, S или N и необязательно еще один атом азота) с образованием гетероарилконденсированного циклоалкила.
Термин «гетероциклил» относится к 5-10-членному неароматическому моноциклическому кольцу, в котором от 1 до 4 членов представляют собой атомы азота; либо к 5-10-членному неароматическому моноциклическому кольцу, в котором ни одного, один или два члена представляют собой атомы азота и до двух членов представляют собой атомы кислорода или серы, при этом кольцо необязательно содержит от нуля до двух ненасыщенных связей. Термин «гетероциклил» включает гетероциклическое кольцо, конденсированное с бензольным кольцом (бензоконденсированный гетероциклил), 5- или 6-членное гетероароматическое кольцо (содержащее один из O, S или N и необязательно еще один атом азота), 5-7-членное циклоалкильное или циклоалкенильное кольцо, 5-7-членное гетероциклильное кольцо (в определенном выше смысле, за исключением дополнительного конденсированного кольца) либо конденсированное по одному атому углерода циклоалкильного, циклоалкенильного или гетероциклильного кольца с образованием спирофрагмента. Для соединений, составляющих предмет настоящего изобретения, кольцевые атомы углерода, образующие гетероциклильное кольцо, являются полностью насыщенными. Другие соединения в соответствии с настоящим изобретением могут иметь частично насыщенное гетероциклильное кольцо. Кроме того, термин «гетероциклил» также включает гетероциклические кольца с мостиком, образующим бициклические кольца. Предпочтительные частично насыщенные гетероциклильные кольца могут иметь от одной до двух двойных связей. Такие соединения не считаются полностью ароматическими и не входят в понятие гетероароматического соединения. Примеры гетероциклильных групп, помимо прочего, включают пирролинил (в том числе 2H-пиррол, 2-пирролинил или 3-пирролинил), пирролидинил, 2-имидазолинил, имидазолидинил, 2-пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил и пиперазинил.
Используемый в настоящей заявке термин «арил» относится к ненасыщенному ароматическому моноциклическому кольцу из 6 атомов углерода или к ненасыщенному ароматическому полициклическому кольцу из 10-14 атомов углерода. Примеры таких арильных колец, помимо прочего, включают фенил, нафталенил и антраценил. Предпочтительными арильными группами для практического осуществления настоящего изобретения являются фенил и нафталенил.
Используемый в настоящей заявке термин «гетероарил» относится к 5- или 6-членному ароматическому кольцу, при этом указанное кольцо состоит из атомов углерода и содержит по меньшей мере один гетероатом. Соответствующие гетероатомы включают азот, кислород или серу. В случае 5-членных колец гетероарильное кольцо содержит один атом азота, кислорода или серы, а также может содержать до трех дополнительных атомов азота. В случае 6-членных колец указанное гетероарильное кольцо может содержать от одного до трех атомов азота. В том случае, когда указанное 6-членное кольцо содержит три атома азота, не более двух атомов азота находятся в соседних положениях. Термин «гетероарил» включает гетероарильное кольцо, конденсированное с бензольным кольцом (бензоконденсированный гетероарил), 5- или 6-членным гетероарильным кольцом (содержащим один из O, S или N и необязательно еще один атом азота), 5-7-членным циклоалкильным кольцом или 5-7-членным гетероциклильным кольцом (в определенном выше смысле, за исключением дополнительного конденсированного кольца). Примеры гетероарильных групп, помимо прочего, включают фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил; конденсированные гетероарильные группы включают индолил, изоиндолил, бензофурил, бензотиенил, индазолил, бензимидазолил, бензотиазолил, бензоксазолил, бензизоксазолил, бензотиадиазолил, бензотриазолил, хиноксалинил, хинолинил, изохинолинил или хиназолинил.
Термин «арилалкил» обозначает алкильную группу, замещенную арильной группой (например, бензил, фенэтил). Аналогичным образом, используемый в настоящей заявке термин «арилалкокси» обозначает алкоксильную группу, замещенную арильной группой (например, бензилокси).
Используемый в настоящей заявке термин «галоген» относится к фтору, хлору, брому и йоду. Заместители, замещенные галогенами по нескольким положениям, замещаются таким образом, чтобы получить в итоге устойчивое соединение.
Термин «оксо», используемый самостоятельно или в названии заместителя, относится к фрагменту O=, связанному с атомом углерода или серы. Например, фталимид и сахарин представляют собой примеры соединений с оксозаместителями.
Если термин «алкил» или «арил» или любой из образованных от этих корней префиксов есть в названии заместителя (например, арилалкил, алкиламино), то предполагается, что все описанные выше ограничения для терминов «алкил» и «арил» применимы также и к производным названиям. Указание количества атомов углерода (например, C1-C6) относится независимо к количеству атомов углерода в алкильном фрагменте или алкильной части более крупного заместителя, в названии которого корень «алкил» используется в качестве префикса. Для алкильных и алкоксильных заместителей указанное количество атомов углерода включает все независимые члены приведенного диапазона по отдельности, а также любые сочетания диапазонов в указанных границах. Например, C1-6 алкил включает по отдельности метил, этил, пропил, бутил, пентил и гексил, а также их подкомбинации (например, C1-2, C1-3, C1-4, C1-5, C2-6, C3-6, C4-6, C5-6, C2-5 и т.д.).
Используемый в настоящей заявке термин «пациент» обозначает животное, предпочтительно млекопитающее, наиболее предпочтительно человека, являющееся объектом лечения, наблюдения или эксперимента.
Используемый в настоящей заявке термин «терапевтически эффективное количество» обозначает такое количество активного соединения или фармацевтического агента, которое вызывает биологически или медицински значимый ответ со стороны системы тканей, организма животного или человека, ожидаемый исследователем, ветеринаром, врачом или иным клиницистом, который включает облегчение симптоматики заболевания или патологического состояния, лечение которого проводится.
Используемый в настоящей заявке термин «композиция» относится к любому продукту, содержащему указанные компоненты в указанных количествах, а также к любым продуктам, которые могут быть получены, прямо или косвенно, из сочетаний указанных компонентов в указанных количествах.
Используемый в настоящей заявке термин «ацил» относится к алкилкарбонильным заместителям.
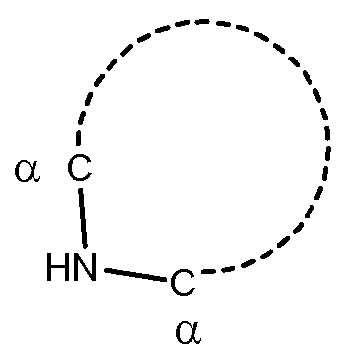
Используемый в настоящей заявке термин «атом углерода, находящийся в альфа-положении (α) относительно атома азота» обозначает атом углерода, соседствующий с атомом азота и ковалентно связанный с ним, как показано ниже.
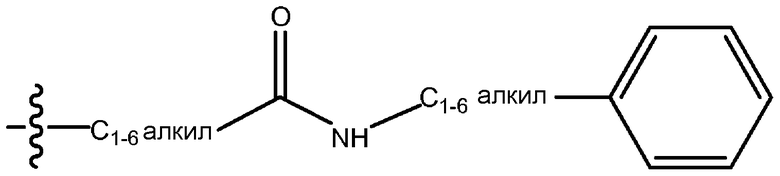
В рамках настоящего документа первой указывают концевую часть описываемой боковой цепи, а затем перечисляют функциональные группы по направлению к точке присоединения заместителя. Например, заместитель «фенил(C1-6)алкиламинокарбонил(C1-6)алкил» обозначает группу следующей формулы:
Если не указано иное, предполагается, что определение какого-либо заместителя или переменной на определенной позиции в молекуле не зависит от соответствующих определений на других участках молекулы. Принимается, что заместители и схемы замещения соединений формулы (I) могут выбираться специалистом в данной области для обеспечения химически стабильных соединений, которые легко синтезировать по известным в данной области методикам, а также по методикам, изложенным в настоящем документе.
Для целей настоящего изобретения термин «модулируемый опиоидным рецептором» используется для обозначения состояния зависимости от модуляции опиоидного рецептора, включая, помимо прочего, опосредование опиоидным рецептором.
Подробное описание изобретения
Варианты осуществления настоящего изобретения включают соединения формулы (I), в которых
а) R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, гидрокси, хлоро и фтора; и фенила, необязательно замещенного одним амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, C1-4алкилтио и гидрокси; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, амино, ди(C1-4алкил)амино или пиперазин-1-илом, необязательно замещенным заместителем 4-C1-4алкил;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, аминокарбонилом, C1-4алкилсульфонилом или пиридинилом;
в котором заместитель пиридинил в R1-пиридиниле необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из хлоро и метила;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
где G необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, фторо и хлоро;
b) R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, гидрокси, хлоро и фтора; и фенила, необязательно замещенного одним амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, C1-4алкилтио и гидрокси; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, амино, ди(C1-4алкил)амино или пиперазин-1-илом, необязательно замещенным заместителем 4-C1-4алкил;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, C1-4алкилсульфонилом или пиридинилом;
при этом заместитель пиридинил в R1-пиридиниле необязательно независимо замещен одним или двумя заместителями, выбранными из хлоро и метила;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
где G необязательно независимо замещен одним или двумя C1-4алкилами;
c) R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-2алкокси, гидрокси, хлоро и фторо; и фенила, необязательно замещенного одним амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и C1-4алкилтио; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, ди(C1-4алкил)амино или пиперазин-1-илом, необязательно замещенным 4-C1-4алкилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, C1-4алкилсульфонилом или пиридинилом;
при этом заместитель пиридинил в R1-пиридиниле необязательно независимо замещен одним или двумя заместителями, выбранными из хлоро и метила;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
где G необязательно независимо замещен одним C1-4алкилом;
d) R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-2алкокси, гидрокси и фторо; и фенила, необязательно замещенного одним амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро или трифторметилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и C1-4алкилтио; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, ди(C1-4алкил)амино или пиперазин-1-илом, необязательно замещенным 4-C1-4алкилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом или амино;
и
iv) G-заместителя, выбранного из группы, состоящей из пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, бензо[1,3]диоксол-5-ила и бензо[1,2,5]оксадиазолила;
в котором G необязательно независимо замещен одним C1-4алкилом;
e) R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного заместителем, выбранным из группы, состоящей из C1-2алкила, C1-2алкокси, гидрокси и фторо; и фенила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонила, гидроксиметила, аминокарбонила, C1-4алкилкарбониламино, циано, трифторметокси, C1-2алкилсульфонила, нитро и трифторметила;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкокси и C1-4алкилтио; или пиримидинила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из морфолин-4-ила, ди(C1-4алкил)амино и пиперазин-1-ила, необязательно замещенного 4-метилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо и хлоро; или пиридинила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из циано, гидроксиметила и амино;
и
iv) G-заместителя, выбранного из группы, состоящей из пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, бензо[1,3]диоксол-5-ила и бензо[1,2,5]оксадиазолила;
в котором G необязательно независимо замещен одним C1-4алкилом;
f) R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил, необязательно замещенный одним амино, фторметилом, трифторметилом, фторметокси, дифторметокси, трифторметокси, формамидино, аминокарбонилом, ди(C1-4)алкиламинокарбонилом, C1-4алкилкарбониламино, 2,2,2-трифторэтокси, циано, C3-7циклоалкилкарбониламино, гидрокси(C1-4)алкилом, C1-4алкокси(C1-4)алкилом, C1-4алкокси-(C1-4)алкокси, C1-4алкилкарбонилокси, C1-4алкилсульфониламино, C1-4алкилсульфонилом, пиридинил(C1-4)алкилом, бензилоксикарбониламино, 4-метилпиперазин-1-илкарбонилом, пирролидин-1-илкарбонилом, карбокси, пиперидин-1-илкарбонилом или морфолин-4-илкарбонилом;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила, бензоксазолила и пиридинила; при этом гетероарил необязательно независимо замещен одним или двумя C1-4алкилами;
g) R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-2алкокси, C1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен одним амино, фторметилом, трифторметилом, фторметокси, дифторметокси, трифторметокси, формамидино, аминокарбонилом, C1-4алкилкарбониламино, C1-4алкилкарбонилокси, 2,2,2-трифторэтокси, бензилоксикарбониламино, гидрокси(C1-4)алкилом или C1-4алкокси(C1-4)алкилом;
или (ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил необязательно независимо замещен одним или двумя C1-4алкилами;
h) R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, C1-2алкокси, C1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен одним амино, фторметокси, дифторметокси, трифторметокси, формамидино, аминокарбонилом, C1-4алкилкарбониламино, C1-4алкилкарбонилокси, 2,2,2-трифторэтокси или C1-4алкокси(C1-4)алкилом;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил необязательно независимо замещен одним или двумя C1-4алкилами;
i) R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкила, C1-2алкокси, C1-2алкилтио, фторо, 3-хлоро, 4-хлоро и гидрокси; и фенил необязательно замещен одним заместителем, выбранным из группы, состоящей из амино, дифторметокси, трифторметокси, аминокарбонила, C1-4алкилкарбониламино, C1-4алкилкарбонилокси и 2,2,2-трифторэтокси;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил R2 необязательно независимо замещен одним или двумя C1-2алкилами;
j) R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкила, C1-2алкокси, C1-2алкилтио, одного или двух фторо, 3-хлоро, 4-хлоро и гидрокси; или фенил необязательно замещен одним заместителем, выбранным из группы, состоящей из амино, дифторметокси, трифторметокси, аминокарбонила, C1-4алкилкарбониламино, C1-4алкилкарбонилокси и 2,2,2-трифторэтокси;
или
(ii) R2 представляет собой гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил R2 необязательно независимо замещен одним или двумя C1-2алкилами;
k) A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-;
L1 отсутствует или представляет собой C1-4алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода амино, гидрокси или одним или двумя фторо;
ii) пиперидинила;
и
iii) азетидинила;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
при условии, что a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой C1-4алкил;
a2 связан через атом углерода с L2, а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя C1-4алкилзаместителями;
L4 представляет собой (C2-6)алкил;
a4 выбран из группы, состоящей из амино и C1-4алкиламино;
при условии, что a4 присоединен к атому углерода (C2-6)алкила, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой C1-4алкил;
a5 представляет собой C3-7циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C3-7циклоалкилу, место присоединения представляет собой атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, в котором пирролидин-1-ил необязательно замещен C1-4алкилом, амино или аминометилом;
ii) пиперазин-1-ила, необязательно замещенного 4-C1-4алкилом; в котором пиперазин-1-ил необязательно независимо замещен при атоме углерода одним или двумя C1-4алкилами, 2-оксо или 3-оксо;
iii) пиперидин-1-ила, необязательно замещенного одним или двумя C1-4алкилами или амино;
iv) азетидин-1-ила, необязательно замещенного 3-амино или 3-аминометилом;
v) [1,4]диазепан-1-ила;
и
vi) 3,6-диазобицикло[3.1.1]гепт-3-ила;
l) A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-;
L1 отсутствует или представляет собой C1-2алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода гидрокси или одним или двумя фторо;
ii) пиперидин-3-ила;
и
iii) азетидинила;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
при условии, что a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой C1-2алкил;
a2 связан через атом углерода с L2, а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя C1-2алкилами;
L4 представляет собой (C2-4)алкил;
a4 выбран из группы, состоящей из амино и C1-4алкиламино;
при условии, что a4 присоединен к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой C1-4алкил;
a5 представляет собой C4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино или аминометилом;
ii) пиперазин-1-ила, необязательно замещенного 4-C1-4алкилом; при этом пиперазин-1-ил необязательно независимо замещен при атоме углерода одним или двумя C1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
iv) азетидин-1-ила, необязательно замещенного 3-аминометилом;
и
v) [1,4]диазепан-1-ила;
при условии, что положением заместителя, содержащего азотный радикал в качестве точки присоединения к азот-связанному гетероциклилу, является атом углерода, отличный от атома, который является альфа-атомом относительно атома азота гетероциклила;
m) A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-;
L1 отсутствует или представляет собой C1-2алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода гидрокси или одним или двумя фторо;
и
ii) пиперидин-3-ила;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
при условии, что a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой C1-2алкил;
a2 связан через атом углерода с L2 , а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно замещенный одним или двумя метилами;
L4 представляет собой (C2-3)алкил;
a4 представляет собой амино, при условии, что a4 присоединен к атому углерода, отличному от альфа-атома относительно N(Ra); L2 представляет собой метилен;
L5 отсутствует или представляет собой C1-2алкил;
a5 представляет собой C4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя C1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
и
iv) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азот-связанному гетероциклилу, является атом азота, отличный от альфа-атома относительно атома азота гетероциклила
n) A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-;
L1 отсутствует или представляет собой C1-2алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода гидрокси или одним или двумя фторо;
и
ii) пиперидин-3-ила;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
при условии, что a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой метилен;
a2 связан через атом углерода с L2, а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно замещенный одним или двумя метилами;
L4 представляет собой (C2-3)алкил;
a4 представляет собой амино, при условии, что a4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно к N(Ra);
L5 отсутствует или представляет собой C1-2алкил;
a5 представляет собой C4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя C1-2алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
и
iv) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азот-связанному гетероциклилу, является атом азота, отличный от атома, который является альфа-атомом относительно атома азота гетероциклила;
o) Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой H, а X представляет собой O;
и
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
и любого сочетания описанных выше вариантов осуществления а)-i), при условии, что предполагается, что те сочетания, в которых должны комбинироваться различные варианты осуществления одного и того же заместителя, должны быть исключены;
и их энантиомеры, диастереомеры, сольваты и фармацевтически приемлемые соли.
Следующий вариант осуществления настоящего изобретения относится к соединению формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранного из группы, состоящей из C1-4алкила, C1-4алкокси, гидрокси, хлоро и фторо; и фенил необязательно замещен одним амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, C1-4алкилтио и гидрокси; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, амино, ди(C1-4алкил)амино или пиперазин-1-илом, необязательно замещенным заместителем 4-C1-4алкил;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, аминокарбонилом, C1-4алкилсульфонилом или пиридинилом;
при этом заместитель пиридинил в R1-пиридиниле необязательно независимо замещен одним или двумя заместителями, выбранными из хлоро и метила;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
где G необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, фторо и хлоро;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен амино, фторметилом, трифторметилом, фторметокси, дифторметокси, трифторметокси, формамидино, аминокарбонилом, ди(C1-4)алкиламинокарбонилом, C1-4алкилкарбониламино, 2,2,2-трифторэтокси, циано, C3-7циклоалкилкарбониламино, гидрокси(C1-4)алкилом, C1-4алкокси(C1-4)алкилом, C1-4алкокси-(C1-4)алкокси, C1-4алкилкарбонилокси, C1-4алкилсульфониламино, C1-4алкилсульфонилом, пиридинил(C1-4)алкилом, бензилоксикарбониламино, 4-метилпиперазин-1-илкарбонилом, пирролидин-1-илкарбонилом, карбокси, пиперидин-1-илкарбонилом или морфолин-4-илкарбонилом;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила, бензоксазолила и пиридинила; при этом гетероарил необязательно независимо замещен одним или двумя C1-4алкилами;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-;
L1 отсутствует или представляет собой C1-4алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода амино, гидрокси или одним или двумя фторо;
ii) пиперидинила;
и
iii) азетидинила;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
и если a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой C1-4алкил;
a2 связан через атом углерода с L2, а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя C1-4алкилзаместителями;
L4 представляет собой (C2-6)алкил;
a4 выбран из группы, состоящей из амино и C1-4алкиламино;
при условии, что a4 присоединен к атому углерода (C2-6)алкила, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой C1-4алкил;
a5 представляет собой C3-7циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C3-7циклоалкилу, место присоединения представляет собой атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, в котором пирролидин-1-ил необязательно замещен C1-4алкилом, амино или аминометилом;
ii) пиперазин-1-ила, необязательно замещенного 4-C1-4алкилом; в котором пиперазин-1-ил необязательно независимо замещен при атоме углерода одним или двумя C1-4алкилами, 2-оксо или 3-оксо;
iii) пиперидин-1-ила, необязательно замещенного одним или двумя C1-4алкилами или амино;
iv) азетидин-1-ила, необязательно замещенного 3-амино или 3-аминометилом;
v) [1,4]диазепан-1-ила;
и
vi) 3,6-диазобицикло[3.1.1]гепт-3-ила;
Ra представляет собой водород или метилкарбонил;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой H, а X представляет собой O;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Следующий вариант осуществления настоящего изобретения относится к соединению формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, гидрокси, хлоро и фторо; и фенил необязательно замещен одним амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, C1-4алкилтио и гидрокси; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, амино, ди(C1-4алкил)амино или пиперазин-1-илом, необязательно замещенным заместителем 4-C1-4алкил;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, C1-4алкилсульфонилом или пиридинилом;
при этом заместитель пиридинил в R1-пиридиниле необязательно независимо замещен одним или двумя заместителями, выбранными из хлоро и метила;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила; где G необязательно независимо замещен одним или двумя C1-4алкилами;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-2алкокси, C1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен амино, фторметилом, трифторметилом, фторметокси, дифторметокси, трифторметокси, формамидино, аминокарбонилом, C1-4алкилкарбониламино, C1-4алкилкарбонилокси, 2,2,2-трифторэтокси, бензилоксикарбониламино, гидрокси(C1-4)алкилом или C1-4алкокси(C1-4)алкилом;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил необязательно независимо замещен одним или двумя C1-4алкилами;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-;
L1 отсутствует или представляет собой C1-2алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода гидрокси или одним или двумя фторо;
ii) пиперидин-3-ила;
и
iii) азетидинила;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
при условии, что a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой C1-2алкил;
a2 связан через атом углерода с L2, а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя C1-2алкилами;
L4 представляет собой (C2-4)алкил;
a4 выбран из группы, состоящей из амино и C1-4алкиламина;
при условии, что a4 присоединен к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой C1-4алкил;
a5 представляет собой C4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино или аминометилом;
ii) пиперазин-1-ила, необязательно замещенного 4-C1-4алкилом; при этом пиперазин-1-ил необязательно независимо замещен при атоме углерода одним или двумя C1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
iv) азетидин-1-ила, необязательно замещенного 3-аминометилом;
и
v) [1,4]диазепан-1-ила;
при условии, что положением заместителя, содержащего азотный радикал в качестве точки присоединения к азот-связанному гетероциклилу, является атом углерода, отличный от альфа-атома относительно атома азота гетероциклила;
Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой H, а X представляет собой O;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Следующий вариант осуществления настоящего изобретения относится к соединению формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-2алкокси, гидрокси, хлоро и фтора; и фенила, необязательно замещенного одним амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и C1-4алкилтио; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, ди(C1-4алкил)амино или пиперазин-1-илом, необязательно замещенным 4-C1-4алкилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, C1-4алкилсульфонилом или пиридинилом;
при этом заместитель пиридинил в R1-пиридиниле необязательно независимо замещен одним или двумя заместителями, выбранными из хлоро и метила;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
где G необязательно независимо замещен одним C1-4алкилом;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, C1-2алкокси, C1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен одним амино, фторметокси, дифторметокси, трифторметокси, формамидино, аминокарбонилом, C1-4алкилкарбониламино, C1-4алкилкарбонилокси, 2,2,2-трифторэтокси или C1-4алкокси(C1-4)алкилом;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил необязательно независимо замещен одним или двумя C1-4алкилами;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-;
L1 отсутствует или представляет собой C1-2алкил;
a1 связан через атом углерода с L1 и представляет собой
i) пирролидинил, необязательно замещенный при атоме углерода гидрокси или одним или двумя фторо;
ii) пиперидин-3-ил;
или
iii) азетидинил;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
при условии, что a1 замещен заместителем, содержащим азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой метилен;
a2 связан через атом углерода с L2, а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя C1-4алкилзаместителями;
L4 представляет собой (C2-3)алкил;
a4 представляет собой амино, при условии, что a4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно к N(Ra);
L5 отсутствует или представляет собой C1-2алкил;
a5 представляет собой C4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино или аминометилом;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя C1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
iv) азетидин-1-ила, необязательно замещенного 3-аминометилом;
и
v) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азотсвязанному гетероциклилу, является атом азота, отличный от атома, который является альфа-атомом относительно атома азота гетероциклила;
Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой H, а X представляет собой O;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Следующий вариант осуществления настоящего изобретения относится к соединению формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-2алкокси, гидрокси и фторо; кроме того, фенил необязательно замещен одним амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро или трифторметилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и C1-4алкилтио; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, ди(C1-4алкил)амино или пиперазин-1-илом, необязательно замещенным 4-C1-4алкилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо, хлоро и циано; кроме того, пиридинил необязательно замещен гидроксиметилом или амино;
и
iv) G-заместителя, выбранного из группы, состоящей из пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, бензо[1,3]диоксол-5-ила и бензо[1,2,5]оксадиазолила;
в котором G необязательно независимо замещен одним C1-4алкилом;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкила, C1-2алкокси, C1-2алкилтио, фторо, 3-хлоро, 4-хлоро и гидрокси; или фенил необязательно замещен одним заместителем, выбранным из группы, состоящей из амино, дифторметокси, трифторметокси, аминокарбонила, C1-4алкилкарбониламино, C1-4алкилкарбонилокси и 2,2,2-трифторэтокси;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил R2 необязательно независимо замещен одним или двумя C1-2алкилами;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-, a4-L4- и a5-L5-;
L1 отсутствует или представляет собой C1-2алкил;
a1 связан через атом углерода с L1 и представляет собой
i) пирролидинил, необязательно замещенный при атоме углерода гидрокси или одним или двумя фторо;
или
ii) пиперидин-3-ил;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
при условии, что a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой метилен;
a2 связан через атом углерода с L2, а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно замещенный одним или двумя метилами;
L4 представляет собой (C2-3)алкил;
a4 представляет собой амино, при условии, что a4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно к N(Ra);
L5 отсутствует или представляет собой C1-2алкил;
a5 представляет собой C4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя C1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
и
iv) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азот-связанному гетероциклилу, является атом азота, отличный от альфа-атома относительно атома азота гетероциклила
Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой H, а X представляет собой O;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Следующий вариант осуществления настоящего изобретения относится к соединению формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного заместителем, выбранным из группы, состоящей из C1-2алкила, C1-2алкокси, гидрокси и фторо; и фенила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из амино, ди(C1-4алкил)амино, ди(C1-4алкил)аминокарбонила, гидроксиметила, аминокарбонила, C1-4алкилкарбониламино, циано, трифторметокси, C1-2алкилсульфонила, нитро и трифторметила;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкокси и С1-4алкилтио; или пиримидинил необязательно замещен одним заместителем, выбранным из группы, состоящей из морфолин-4-ила, ди(C1-4алкил)амино и пиперазин-1-ила, необязательно замещенного 4-метилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фторо и хлоро; или пиридинила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из циано, гидроксиметила и амино;
и
iv) G-заместителя, выбранного из группы, состоящей из пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, бензо[1,3]диоксол-5-ила и бензо[1,2,5]оксадиазолила;
в котором G необязательно независимо замещен одним C1-4алкилом;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1-2алкила, C1-2алкокси, C1-2алкилтио, одного или двух фторо, 3-хлоро, 4-хлоро и гидрокси; или фенил необязательно замещен одним заместителем, выбранным из группы, состоящей из амино, дифторметокси, трифторметокси, аминокарбонила, C1-4алкилкарбониламино, C1-4алкилкарбонилокси и 2,2,2-трифторэтокси;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил R2 необязательно независимо замещен одним или двумя C1-2алкилами;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и 5-L5-;
L1 отсутствует или представляет собой C1-2алкил;
a1 связан через атом углерода с L1 и представляет собой
i) пирролидинил, необязательно замещенный при атоме углерода гидрокси или одним или двумя фторо;
или
ii) пиперидин-3-ил;
при условии, что L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
при условии, что a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой метилен;
a2 связан через атом углерода с L2, а a2 представляет собой морфолинил;
L3 представляет собой метилен;
a3 представляет собой имидазолил, необязательно замещенный одним или двумя метилами;
L4 представляет собой (C2-3)алкил;
a4 представляет собой амино, при условии, что a4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно к N(Ra);
L5 отсутствует или представляет собой C1-2алкил;
a5 представляет собой C4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что RB содержит азотный радикал в качестве точки присоединения к C5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя C1-2алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
и
iv) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азот-связанному гетероциклилу, является атом азота, отличный от альфа-атома относительно атома азота гетероциклила
Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой H, а X представляет собой O;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой H, а X представляет собой O;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой H, а X представляет собой O;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Следующий вариант осуществления настоящего изобретения относится к соединению формулы (I),

выбранному из группы, состоящей из:
соединения формулы (I), в котором R1 представляет собой 4-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой фенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой нафт-1-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой нафт-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой тиен-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой фуран-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-трифторметоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-аминокарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метилкарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-гидроксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой хинолин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой хинолин-8-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метилхинолин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 4-бифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой хинолин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой дибензотиофен-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2,6-дигидроксипиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-цианофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-нитрофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-аминокарбонилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-N,N-диэтиламинокарбонилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-метансульфонилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 4-гидроксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой индол-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 4H-[1,2,4]оксодиазол-5-он-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-фторфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 4-фторфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 2-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 2-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-диэтиламинофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-метилкарбониламинофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 4-метилкарбониламинофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 4-аминофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-аминофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-аминофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой бензотиазол-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой тиазол-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой бензотиофен-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-трифторметилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-трифторметоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метилтиопиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метоксипиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-дифторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3,4-дифторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-дифтор-4-гидроксиметилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2,4-диметоксипиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 4-гидроксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-этоксипиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиразол-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-диметилизоксазол-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2,3-дигидробензофуран-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-фтор-4-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиразол-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метилтиопиримидин-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 1-метилпиразол-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-фтор-5-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-фтор-5-метилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-аминопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фтор-6-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-гидроксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-гидроксипиридин-3-ил, R2 представляет собой 4-гидроксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой хиноксалин-6-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 1H-пирроло[2,3-b]пиридин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой бензо[1,2,5]оксадиазол-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4,4-дифторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S, 4R)
соединения формулы (I), в котором R1 представляет собой 2-аминопиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-диметиламинопиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-(морфолин-4-ил)пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-(4-метилпиразин-1-ил)-пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой бензотиазол-6-ил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой бензотиазол-6-ил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 2-метилбензоксазол-6-ил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилбензоксазол-6-ил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S, 4S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилбензотиазол-6-ил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 2-метилбензотиазол-6-ил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-диметилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой бензо[1,3]диоксол-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-дихлорфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3,5-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 3,5-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 3-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 2,3-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-этоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-этоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-этоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метансульфонилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-дифторметоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-дифторметоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-дифторметоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-н-пропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-н-пропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-н-пропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой индол-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой индол-6-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой индол-7-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиразин-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2-цианопиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-(2,2,2-трифторэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-(2,2,2-трифторэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(2,2,2-трифторэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-н-бутоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-н-бутоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-н-бутоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-фтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-фтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 3-фтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-цианофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-цианофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-фтор-4-цианофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-циклопропилкарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-изопропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-изопропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-изопропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 3-циано-5-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-гидроксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-гидроксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-гидроксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-фторфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метилтиофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метилтиофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метилтиофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-гидроксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-пирролидин-1-илкарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-карбоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-пиперидин-1-илкарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-(морфолин-4-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-карбоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-карбоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-карбоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой (3-пирролидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой (3-пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-(морфолин-4-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-(пирролидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-(пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-(морфолин-4-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(пирролидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-бензилоксикарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой метилкарбонил; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-фтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-фтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 3-фтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-фтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-бензилоксикарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-бензилоксикарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-аминофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 3-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метил-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-метил-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-фторметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-4-ил, L1 отсутствует, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-(пиридин-3-илметил)-фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 3-метил-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-метил-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метилкарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метансульфониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метансульфониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой азетидин-3-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-формамидофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-фторметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метил-4-фторфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-метил-4-фторфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-трифторметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-трифторметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метансульфонилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-формамидофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой азетидин-3-ил, L1 отсутствует, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метилкарбонилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 2-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-гидроксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 2-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 2-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S,4S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-(2-метоксиэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-(2-метоксиэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-(2-метоксиэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-(2-метоксиэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 3-метилкарбонилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 3-гидроксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 3-метилкарбонилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 3-метилкарбонилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H;(3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-фторметоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, а Ra представляет собой H; (3R)
соединения формулы (I), в котором R1 представляет собой 6-фтор-5-метилпиримидин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 2,5-диметилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6'-хлор-3,5'-диметил[2,3']бипиридинил-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-хлор-4-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 6-хлор-5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2R)
соединения формулы (I), в котором R1 представляет собой 2-хлор-5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-гидроксиметилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-гидроксипирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (транс 2S,4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой гидроксипирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (цис 2R,4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-гидроксипирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (цис 2S,4S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-гидроксипирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H, (транс 2S, 4R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-гидроксипирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой H; (цис 2R,4R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой морфолин-2-ил, L2 представляет собой метил, а Ra представляет собой H; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой морфолин-2-ил, L2 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой морфолин-2-ил, L2 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой морфолин-3-ил, L2 представляет собой метил, а Ra представляет собой H; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой морфолин-3-ил, L2 представляет собой метил, а Ra представляет собой H; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой морфолин-3-ил, L2 представляет собой метил, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой морфолин-3-ил, L2 представляет собой метил, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, a2 представляет собой морфолин-3-ил, L2 представляет собой метил, а Ra представляет собой H; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой имидазол-2-ил, L3 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой 5-метил-3H-имидазол-4-ил, L3 представляет собой метил, R и Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой 3-метил-3H-имидазол-4-ил, L3 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой 2-этил-5-метил-3H-имидазол-4-ил, L3 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, a3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, a4 представляет собой 2-амино, L4 представляет собой пропил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, a4 представляет собой 2-амино, L4 представляет собой этил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, a4 представляет собой 2-амино, L4 представляет собой 4-метилпентил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, a4 представляет собой 2-амино, L4 представляет собой 4-метилпентил, а Ra представляет собой H; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, a4 представляет собой 2-амино, L4 представляет собой этил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, a4 представляет собой 2-метиламино, L4 представляет собой этил, а Ra представляет собой H;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 представляет собой метил, а Ra представляет собой H; (2S,1R)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 представляет собой метил, а Ra представляет собой H; (2S,1R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклобутил, L5 представляет собой метил, а Ra представляет собой H; (транс)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклобутил, L5 представляет собой метил, а Ra представляет собой H; (транс)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклобутил, L5 отсутствует, а Ra представляет собой H; (смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклобутил, L5 отсутствует, а Ra представляет собой H; (смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (цис)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (рацемический, смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (1RS,3SR рацемический цис)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (1RS, 2SR рацемический одиночный стереоизомер, не известный цис/транс)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; рацемический, смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (рацемический, смесь цис и транс)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (цис 1R,3S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (цис 1S,3R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (рацемический, смесь цис и транс)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (цис 1S,3R)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (цис 1R,3S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-циклопропилфенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (цис 1S,3R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (цис 1R,3S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, a5 представляет собой циклогексил, L5 отсутствует, а Ra представляет собой H; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой фенил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопирролидин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra вместе образуют 3-аминопирролидин-1-ил; 3S
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопиперидин-1-ила; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопиперидин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминометилазетидин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для образования 2-аминометилпирролидин-1-ила; (2R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 4-аминопиперидин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для образования 2-аминометилпирролидин-1-ила; (2R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-оксопиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения [1,4]диазепан-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-оксопиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3,6-диазабицикло[3.1.1]гепт-3-иламино;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, 3-аминопирролидин-1-ил; (3R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминоазетидин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-метилпиперазин-1-ила; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-метилпиперазин-1-ила; (2R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-метилпиперазин-1-ила; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения [1,4]-диазепан-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения [1,4]диазепан-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопирролидин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопирролидин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3,3-диметилпиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопирролидин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 4-метилпиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-метилпиперазин-1-ила; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3,3-диметилпиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-метилпиперазин-1-ила; (3S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-метилпиперазин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения [1,4]диазепан-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3,5-диметилпиперазин-1-ила; (цис)
соединения формулы (I),в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-этилпиперазин-1-ила; (2S)
и
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, а A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-этилпиперазин-1-ила; (3R).
Для использования в медицинских целях соли соединений формулы (I) относятся к нетоксичным «фармацевтически приемлемым солям». Однако для получения соединений формулы (I) или их фармацевтически приемлемых солей могут использоваться и другие соли. Соответствующие целям настоящего изобретения фармацевтически приемлемые соли соединений формулы (I) включают соли присоединения кислоты, которые, например, могут быть получены при смешивании раствора одного из соединений, составляющих предмет настоящего изобретения, с раствором фармацевтически приемлемой кислоты, например, соляной кислоты, серной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты, уксусной кислоты, бензойной кислоты, лимонной кислоты, винной кислоты, углекислоты или фосфорной кислоты.
Кроме того, когда соединения формулы (I) имеют кислотный фрагмент, их допустимые фармацевтически приемлемые соли могут также включать соли щелочных металлов, например, натриевые или калиевые соли, соли щелочноземельных металлов, например, кальциевые или магниевые соли, а также соли с соответствующими органическими лигандами, например, четвертичные аммонийные соли. Таким образом, типичные примеры фармацевтически приемлемых солей включают следующие соли: ацетаты, бензолсульфонаты, бензоаты, бикарбонаты, бисульфаты, битартраты, бораты, бромиды, кальция эдетаты, камсилаты, карбонаты, хлориды, клавуланаты, цитраты, дигидрохлориды, эдетаты, эдисилаты, эстолаты, эсилаты, фумараты, глуцептаты, глюконаты, глутаматы, гликоллиларсанилаты, гексилрезорцинаты, гидрабамины, гидробромиды, гидрохлориды, гидроксинафтоаты, йодиды, изотионаты, лактаты, лактобионаты, лаураты, малаты, малеаты, манделаты, мезилаты, метилбромиды, метилнитраты, метилсульфаты, мукаты, напсилаты, нитраты, N-метилглюкамина аммониевые соли, олеаты, памоаты (эмбонаты), пальмитаты, пантотенаты, фосфаты/дифосфаты, полигалактуронаты, салицилаты, стеараты, сульфаты, субацетаты, сукцинаты, таннаты, тартраты, теоклаты, тозилаты, триэтиодиды и валераты.
Типичные примеры кислот и оснований, которые могут применяться для получения фармацевтически приемлемых солей, включают следующее: кислоты, в том числе уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, (+)-камфорную кислоту, камфорсульфокислоту, (+)-(1S)-камфор-10-сульфокислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, додецилсерную кислоту, этан-1,2-дисульфокислоту, этансульфокислоту, 2-гидроксиэтансульфокислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкороновую кислоту, L-глютаминовую кислоту, α-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромистоводородную кислоту, соляную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфокислоту, нафталин-2-сульфокислоту, нафталин-1,5-дисульфокислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, фосфорную кислоту, L-пироглютаминовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-виннокаменную кислоту, тиоциановую кислоту, п-толуолсульфокислоту и ундециленовую кислоту;
и основания, в том числе аммиак, L-аргинин, бенетамин, бензатин, кальция гидроксид, холин, деанол, диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин, 1H-имидазол, L-лизин, магния гидроксид, 4-(2-гидроксиэтил)морфолин, пиперазин, калия гидроксид, 1-(2-гидроксиэтил)пирролидин, натрия гидроксид, триэтаноламин, трометамин и цинка гидроксид.
Варианты осуществления настоящего изобретения включают пролекарства соединений формулы (I). Как правило, такие пролекарства представляют собой функциональные производные соединений, составляющих предмет настоящего изобретения, которые in vivo превращаются в требуемое соединение. Таким образом, в вариантах осуществления настоящего изобретения, относящихся к способам лечения, термин «введение» охватывает лечение различных заболеваний, указанных в описании соединения, являющегося предметом настоящего изобретения, или соединения, не указанного в настоящем описании, но преобразующегося в указанное соединение in vivo после его введения пациенту. Общепринятые методики отбора и приготовления соответствующих производных пролекарственных форм описаны, например, в работе «Design of Prodrugs», Ed. H. Bundgaard, Elsevier, 1985.
Если соединения в соответствии с вариантами осуществления настоящего изобретения имеют по меньшей мере один хиральный центр, они могут соответственно существовать в форме энантиомеров. В тех случаях, когда соединения обладают двумя или более хиральными центрами, они дополнительно могут существовать в форме диастереомеров. Необходимо понимать, что все такие изомеры и их смеси попадают в рамки настоящего изобретения. Кроме того, некоторые из кристаллических форм соединений настоящего изобретения могут существовать в виде полиморфов, и в таком качестве они попадают под действие настоящего изобретения. Кроме того, некоторые из соединений могут образовывать сольваты с водой (то есть гидраты) или с широко распространенными органическими растворителями, при этом такие сольваты также попадают в рамки настоящего изобретения. Специалисты в данной области понимают, что используемый в настоящей заявке термин «соединение» считается включающим сольватированные соединения формулы I.
В тех случаях, когда процессы получения соединений в соответствии с вариантами осуществления настоящего изобретения приводят к образованию смеси стереоизомеров, эти изомеры могут быть изолированы при помощи стандартных способов, таких как препаративная хроматография. Соединения могут быть получены в форме рацематов, либо индивидуальные энантиомеры могут быть получены в результате энантиоспецифического синтеза либо посредством разделения. Соединения могут, например, быть разделены на составляющие энантиомеры с помощью стандартных способов, таких как формирование диастереометрических пар путем образования солей с оптически активными кислотами, например, (-)-ди-п-толуоил-D-виннокаменная кислота и (или) (+)-ди-п-толуоил-L-виннокаменная кислота, с последующей фракционной кристаллизацией и восстановлением свободного основания. Соединения могут также быть разделены с помощью образования диастереомерных эфиров или амидов с последующим хроматографическим разделением и удалением хирального партнера. В другом варианте осуществления настоящего изобретения такие соединения могут быть разделены при помощи хиральной колонки для ВЭЖХ.
Один вариант осуществления настоящего изобретения относится к композиции, содержащей (+)-энантиомер соединения формулы (I), при этом указанная композиция по существу не содержит (-)-изомера указанного соединения. В данном контексте фраза «по существу не содержит» обозначает содержание (-)-изомера менее 25%, предпочтительно - менее 10%, более предпочтительно - менее 5%, еще более предпочтительно - менее 2% и еще более предпочтительно - менее 1%, рассчитанное следующим образом.

Другой вариант осуществления настоящего изобретения представляет собой композицию, содержащую (-)-энантиомер соединения формулы (I), при этом указанная композиция по существу не содержит (+)-изомера указанного соединения. В данном контексте фраза «по существу не содержит» обозначает содержание (+)-изомера менее 25%, предпочтительно - менее 10%, более предпочтительно - менее 5%, еще более предпочтительно - менее 2% и еще более предпочтительно - менее 1%, рассчитанное следующим образом.
 .
.
Во время процессов получения соединений в соответствии с вариантами осуществления настоящего изобретения может возникнуть необходимость в защите чувствительных или реакционных групп на любой из рассматриваемых молекул. Для этих целей могут использоваться стандартные защитные группы, например, описанные в публикациях Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Presc, 1973; и T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991. Введенные защитные группы могут быть впоследствии удалены на любой удобной для этого стадии с применением известных специалистам способов.
Хотя составляющие предмет настоящего изобретения соединения (включая их фармацевтически приемлемые соли и фармацевтически приемлемые сольваты) могут вводиться пациенту отдельно, как правило, они будут вводиться в виде смеси с фармацевтически приемлемым носителем, вспомогательным веществом или разбавителем, выбираемым с учетом предполагаемого способа введения и стандартной фармацевтической практики. Таким образом, конкретные варианты осуществления настоящего изобретения относятся к фармацевтическим композициям, содержащим соединения формулы (I) и один или несколько фармацевтически приемлемых носителей, вспомогательных веществ или разбавителей.
В качестве примера в фармацевтических и ветеринарных композициях в соответствии с вариантами осуществлениями настоящего изобретения соединения формулы (I) могут присутствовать в виде смеси с любым(-и) соответствующим(-и) связующим(-и) веществом(-ами), смазывающим(-и) веществом(-ами), суспендирующим(-и) веществом(-ами), покрывающим(-и) веществом(-ами) и/или солюбилизирующим(-и) веществом(-ами).
Таблетки или капсулы с композициями могут вводиться по одной или по две и более за один прием, в зависимости от ситуации. Указанные соединения также можно применять в виде композиций с замедленным высвобождением.
В другом варианте осуществления настоящего изобретения соединения формулы (I) могут использоваться в виде ингаляций (интратрахеальных или интраназальных) либо в форме суппозиториев или пессариев, а также могут наноситься местно в виде лосьонов, растворов, кремов, мазей или присыпок. Например, описываемые соединения могут быть введены в состав крема, состоящего из водной эмульсии полиэтиленгликолей или жидкого парафина. Их также можно вводить в концентрации от 1 до 10% вес. в состав мази, имеющей в качестве основы белый воск или белый мягкий парафин и содержащей также необходимые стабилизаторы и консерванты. Альтернативным способом трансдермального введения является использование пластыря.
Для ряда вариантов применения предпочтительно пероральное введение композиций в форме таблеток, содержащих такие наполнители, как крахмал или лактоза, либо в форме капсул или драже, в чистом виде или в смеси с наполнителями, либо в форме эликсиров, растворов или суспензий, содержащих ароматизаторы или красители.
Композиции (а также соединения в отдельности) также можно вводить парентерально в виде инъекций, например, путем внутрикавернозного, внутривенного, внутримышечного, подкожного, внутрикожного или спинального введения. В этом случае композиции будут содержать соответствующий носитель или разбавитель.
Наилучшей формой композиций для парентерального введения является стерильный водный раствор, в состав которого могут также входить и другие компоненты, например, достаточное количество солей или моносахаридов для получения изотоничного крови раствора.
Для трансбуккального или сублингвального способа введения композицию можно вводить пациенту в виде таблеток или пастилок, изготавливаемых стандартными способами.
В качестве дополнительного примера фармацевтические и ветеринарные композиции, содержащие в качестве активного компонента одно или несколько соединений формулы (I), могут быть получены путем смешивания соединения или соединений с фармацевтическим носителем в соответствии со стандартными фармацевтическими методиками. Носитель может иметь разные формы, в зависимости от предполагаемого способа введения (например, пероральный, парентеральный и т.д.). Таким образом, для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы, приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, стабилизаторы, красители и т.д.; для твердых пероральных лекарственных форм, таких как порошки, капсулы и таблетки, приемлемые носители и добавки включают крахмалы, сахара, разбавители, гранулообразующие агенты, лубриканты, связующие вещества, добавки для улучшения распадаемости таблеток и т.д. Твердые пероральные лекарственные формы также могут быть покрыты оболочкой из таких веществ, как сахара, либо могут быть покрыты кишечнорастворимой оболочкой для изменения основного места всасывания и растворения лекарства. Для парентерального введения носитель, как правило, состоит из стерильной воды, при этом для улучшения растворимости или консервации могут быть добавлены другие ингредиенты. Инъекционно вводимые суспензии или растворы также могут быть изготовлены с использованием водных носителей с соответствующими добавками.
Терапевтически эффективное количество соединений формулы (I) или включающей их фармацевтической композиции составляет дозировки в диапазоне от приблизительно 0,1 до приблизительно 3000 мг, более конкретно - от приблизительно 1 до приблизительно 1000 мг, более конкретно - от приблизительно 10 до приблизительно 500 мг активного компонента при периодичности приема приблизительно от 1 до 4 раз в день для среднего (70 кг) человека. Однако специалисту в данной области будет понятно, что терапевтически эффективное количество для соединений, составляющих предмет настоящего изобретения, будет варьироваться в зависимости от заболевания.
Для перорального введения фармацевтическая композиция предпочтительно используется в виде таблеток, содержащих 0,01, 10,0, 50,0, 100, 150, 200, 250 и 500 мг активного компонента для симптоматической коррекции дозировки у пациента, получающего лечение.
Соединения формулы (I) преимущественно могут назначаться в виде однократной дневной дозы, или суммарная дневная доза может назначаться многократными дозами дважды, трижды или четырежды в день. Более того, соединения формулы (I) можно вводить интраназально при помощи местного использования соответствующих интраназальных средств доставки или с помощью трансдермальных кожных пластырей, хорошо известных специалистам в данной области.
Специалисту в этой области также очевидно, что терапевтически эффективная доза активных соединений формулы (I) или содержащих их фармацевтических композиций будет варьироваться в зависимости от желаемого эффекта. Поэтому оптимальные назначаемые дозы могут быть легко определены специалистами и варьируются в зависимости от конкретно используемого соединения, способа введения, силы препарата и степени выраженности патологического состояния. Кроме того, факторы, связанные с индивидуальным проходящим курс лечения пациентом, такие как возраст, вес, диета, время введения, также должны учитываться при корректировке дозировки для достижения требуемого терапевтического уровня. Поэтому приведенные выше дозировки являются примерными для некоторого среднего случая. Разумеется, в некоторых отдельных случаях требуется использование более высокого или более низкого диапазона доз, и такие случаи входят в сферу действия настоящего изобретения.
Соединения формулы (I) можно вводить пациенту в форме любой из описанных выше композиций и при любом описанном выше режиме приема или с использованием любых общепринятых в данной области композиций и режимов приема в любых случаях, когда нуждающемуся в этом пациенту требуется введение соединения формулы (I).
Примеры болей, входящих в сферу действия настоящего изобретения, помимо прочего, включают воспалительные боли, боли, опосредуемые центральной нервной системой; боли, опосредуемые периферической системой, висцеральные боли; боли, вызванные структурными нарушениями или травмой мягких тканей; боли, связанные с прогрессирующим заболеванием, невропатические боли и острые боли, такие как боли, связанные с острым поражением, травмой или хирургическим вмешательством, а также хронические боли, такие как хронические головные боли и хронические боли, вызванные невропатическими состояниями, постинсультными состояниями, раком и мигренью.
Соединения, составляющие предмет настоящего изобретения, также могут применяться в качестве иммунодепрессантов, противовоспалительных агентов, агентов для терапии и профилактики неврологических и психиатрических состояний, например, депрессии и болезни Паркинсона, агентов для терапии урологических состояний и расстройств репродуктивной системы, например, недержания мочи и преждевременного семяизвержения; препаратов для лечения алкогольной и наркотической зависимости, агентов для терапии гастрита и диареи, агентов для терапии сердечно-сосудистой системы и кардиозащитных агентов и агентов для терапии респираторных заболеваний.
Соединения, составляющие предмет настоящего изобретения, применимы при лечении боли, вызванной следующими причинами: остеоартрит, ревматоидный артрит, фибромиалгия, мигрень, головная боль, зубная боль, ожог, солнечный ожог, укус змеи (в частности, укус ядовитой змеи), укус паука, укус насекомого, нейрогенный мочевой пузырь, доброкачественная гипертрофия предстательной железы, интерстициальный цистит, ринит, контактный дерматит/гиперчувствительность, зуд, экзема, фарингит, мукозит, энтерит, целлюлит, каузалгия, неврит седалищного нерва, невралгия в височно-нижнечелюстном суставе, периферический неврит, полиневрит, культевая боль, фантомная боль в конечностях, послеоперационная кишечная непроходимость, холецистит, болевой синдром после мастэктомии, нейропатическая боль в ротовой полости, синдром Шарко, рефлекторная симпатическая дистрофия, синдром Гийена-Барре, парестетическая мералгия, синдром жжения в полости рта, кластерная головная боль, двусторонняя периферическая нейропатия, диабетическая нейропатия, неврит зрительного нерва, постфебрильный неврит, мигрирующий неврит, сегментарный неврит, неврит Гомбо, нейронит, шейно-плечевая невралгия, черепная невралгия, невралгия коленчатого узла, невралгия языкоглоточного нерва, мигренозная невралгия, идиопатическая невралгия, межреберная невралгия, невралгия в области молочных желез, невралгия Мортона, синдром носоресничного нерва, затылочная невралгия, эритромелалгия, невралгия Слудера, невралгия крылонебного узла, невралгия надглазничного нерва, невралгия видиева нерва, воспалительные заболевания кишечника, синдром раздраженного кишечника, синусовая головная боль, головная боль напряжения, схватки, роды, менструальные боли и рак.
В отношении применения настоящих соединений в терапии заболеваний и патологических состояний, подобных указанным выше, терапевтически эффективные дозировки могут быть определены специалистами в данной области путем использования стандартных моделей для животных. Терапевтически эффективная дозировка для соединений формулы (I) при использовании во время терапии находится в диапазоне от приблизительно 0,001 до приблизительно 300 мг/кг/день. Более конкретно, указанный диапазон составляет от приблизительно 0,5 до приблизительно 5,0 мг/кг веса тела в день, более конкретно - от приблизительно 1,0 до приблизительно 3,0 мг/кг веса тела в день. Соединения могут назначаться с режимом приема от 1 до 4 раз в день.
Общие способы синтеза
Типичные примеры соединений настоящего изобретения могут быть синтезированы в соответствии с общими способами синтеза, описанными ниже и показанными на приведенных далее схемах и примерах. Поскольку схемы приведены в качестве иллюстрации, настоящее изобретение не следует интерпретировать как ограниченное химическими реакциями и условиями, описанными на схемах. Различные исходные вещества, указанные на схемах и используемые в примерах, имеются в продаже или могут быть получены способами, хорошо известными специалистам в данной области. Фрагменты соответствуют описанию, приведенному в настоящем документе.
В настоящем описании, в частности, в схемах и примерах, используются следующие сокращения:
На схеме A показан способ получения соединений формулы (I)-A, где A-L представляет собой a1-L1- или a2-L2-.
Схема A
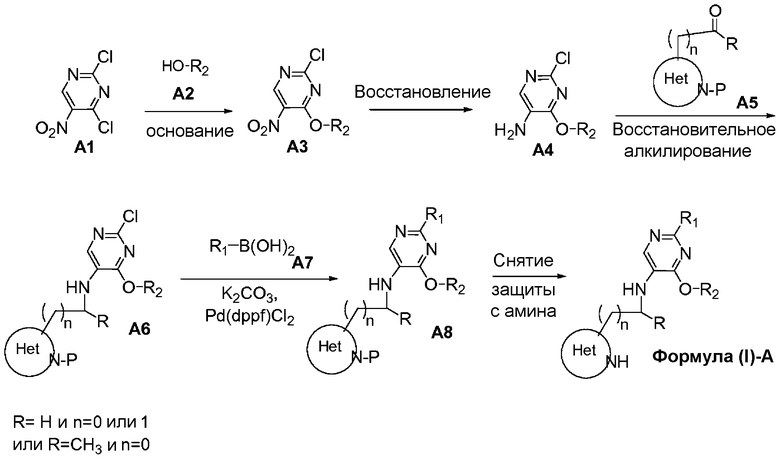
Соединение формулы A1 можно приобрести в готовом виде или получить известными способами, включая способы, описанные в научной литературе. Соединение формулы A1 можно обработать соединением формулы A2 при основных условиях с образованием соединения формулы A3. Нитрогруппа соединения формулы A3 может быть восстановлена до соответствующей первичной аминогруппы формулы A4 под воздействием восстанавливающего агента, такого как цинк, олово или железо, в уксусной кислоте или путем каталитической гидрогенизации. Полученная аминогруппа соединения формулы A4 может подвергнуться восстановительному алкилированию амино-защищенным альдегидом (R представляет собой H) или кетоном (R представляет собой метил) формулы A5 (в которой P представляет собой защитную аминогруппу) в присутствии источника водорода, такого как триацетоксиборгидрид натрия для создания A-L-части соединений, составляющих предмет настоящего изобретения. Соединение формулы A6 может быть соединено с R1-замещенной бороновой кислотой формулы A7 в присутствии катализатора на основе переходного металлического катализатора, такого как Pd(dppf)Cl2 и основания, такого как калия карбонат, для получения соединения формулы A8. Аналогичным образом, R1-заместители могут быть введены в соединение в обычных условиях реакции соединения Стилле с использованием соответствующим образом замещенных оловосодержащих реактивов. С аминогруппы соединения формулы A8 может быть снята защита в соответствующих условиях, известных специалистам в данной области, для получения соединения формулы (I)-A, являющегося предметом настоящего изобретения. Например, защита с Boc-защищенных аминов может быть снята в кислотных условиях с использованием таких реактивов как HCl, TFA и т.д. Аналогичным образом, защита с Cbz-защищенных аминов может быть снята в кислотных условиях или путем каталитической гидрогенизации.
На схеме B показан способ получения соединений формулы (I)-B, где A-L представляет собой a1-L1- или a3-L3-, а L отсутствует.
Схема B
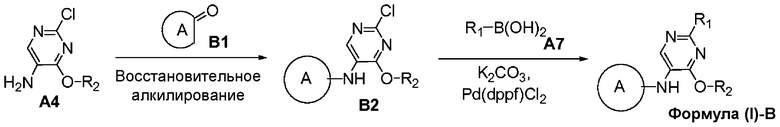
Соединения формулы B1 можно приобрести в готовом виде и получить известными способами, включая способы, описанные в научной литературе. Кетон формулы B1, в котором A-кольцо представляет собой a1 или a3, может вступить в реакцию с соединением формулы A4 способами, описанными на схеме A, для получения соединения формулы B2.
Схема C иллюстрирует путь синтеза конкретных A-L-промежуточных соединений, используемых в процессе получения соединений, являющихся предметом настоящего изобретения, в которых A-L- представляет собой a3-L3-, а L3 представляет собой C1-2алкил.
Схема C
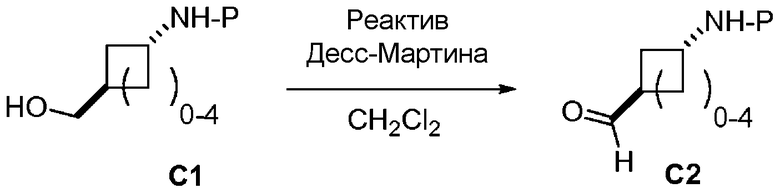
Соединения формулы C1 доступны в продаже или могут быть получены известными способами, описанными в научной литературе. Соединение формулы C1 (P представляет собой защитную группу аминогруппы), в котором A-кольцо представляет собой C3-7циклоалкил, может быть подвергнуто окислению с использованием окислителя, например, реактива Десс-Мартина, для получения соответствующего альдегида формулы C2. Соединения формулы C2 могут использоваться аналогичным образом в отношении соединения формулы A5 на схеме A.
Схема D иллюстрирует путь синтеза соединений формулы (I)-D, где R1 представляет собой 4H-[1,2,4]оксадиазол-5-онил.
Схема D
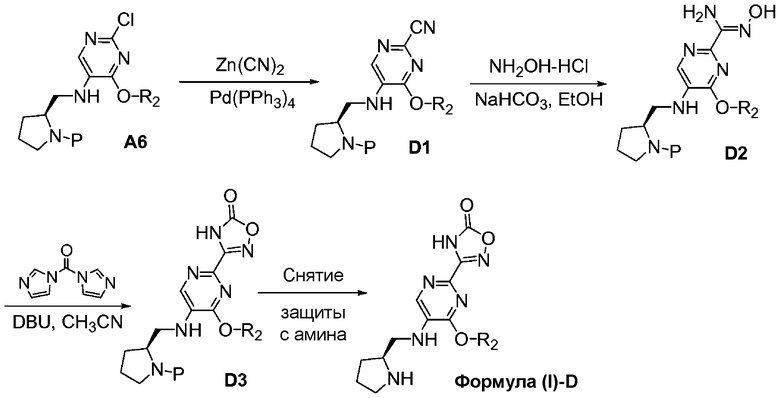
Соединение формулы A6 может быть преобразовано в соответствующий цианид формулы D1 под действием цианида цинка (II) в присутствии палладиевого катализатора и DMF. Последующая обработка соединения формулы D1 гидроксиламином при воздействии микроволнового облучения позволяет получить соединение формулы D2. Соединение формулы D2 может быть преобразовано в соединение формулы D3 путем конденсации с CDI в присутствии соответствующего связующего вещества, такого как DBU и т.д. Снятие защиты с аминогруппы традиционными химическими способами позволяет получить соединения формулы (I)-D.
Схема E иллюстрирует путь синтеза соединений формулы (I)-E, где Ra представляет собой C1-4алкилкарбонил.
Схема E
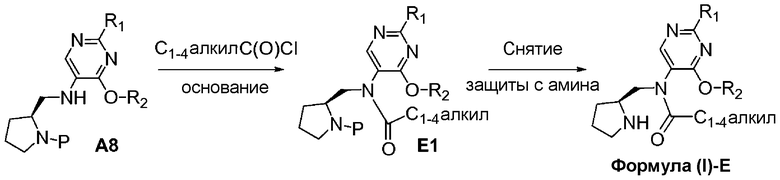
Соединение формулы A8 может быть ацилировано под действием подходящего ацилирующего агента, такого как хлорангидрид, ангидрат и т.д., для получения соединения формулы E1. Снятие защиты с аминогруппы стандартными способами, обсуждение которых приведено в настоящем документе, позволяет получить соединение формулы (I)-E.
Схема F иллюстрирует путь синтеза соединений формулы (I)-F, где R2 представляет собой фенил, замещенный аминогруппой, или его производные.
Схема F
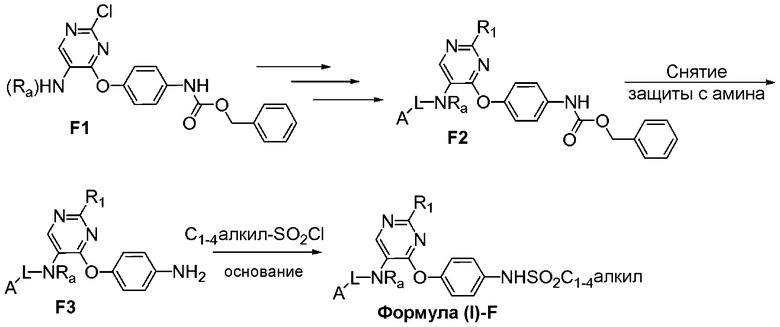
Соединения формулы F1 могут быть получены аналогично соединению формулы A4 с использованием способов, описанных в научной литературе. Соединение формулы F1 может быть преобразовано в соединение формулы F2 с помощью последовательности реакций, представленных на схеме A. Защитная группа Cbz-амино может быть удалена с помощью катализируемой палладиевым катализатором реакции гидрирования для получения соответствующего первичного амино-соединения формулы F3. На данном этапе аминогруппа может быть обработана различными электрофильными реактивами для получения желаемых R2-замещенных соединений, являющихся предметом настоящего изобретения. Например, обработка C1-4алкилсульфонилхлоридом позволяет получить соединение формулы (I)-F. Аналогичным образом, аминогруппа соединения формулы F3 может быть ацилирована с использованием традиционных ацилирующих агентов или путем обработки алкилирующим агентов для получения дополнительных производных аминосодержащих соединений.
На схеме G проиллюстрирован альтернативный способ синтеза промежуточных соединений формулы A8.
Схема G
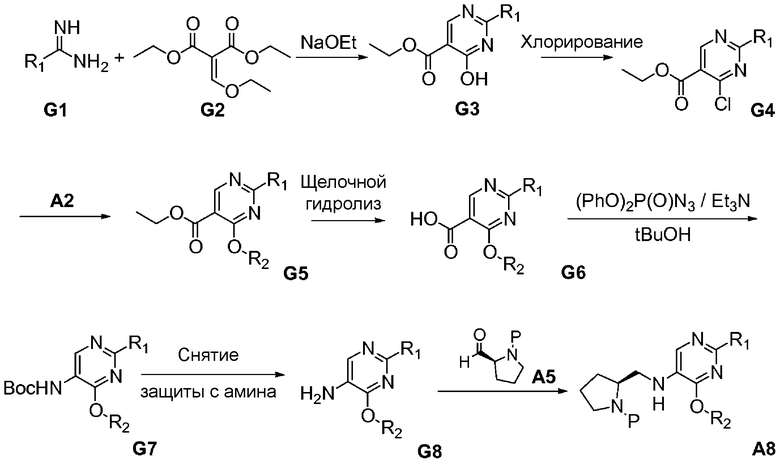
Соединения формулы G1 доступны в продаже или могут быть получены известными способами, описанными в научной литературе. Соединение формулы G1 можно сконденсировать с соединением формулы G2 в присутствии алкоксида с получением пиримидина формулы G3. Гидроксигруппа может быть преобразована в соответствующий хлорид формулы G4 под действием хлорирующего агента, такого как тионилхлорид, фосфора трихлорид и т.п. Реакция нуклеофильного присоединения с соединением формулы A2 позволяет получить соединение формулы G5, которое может быть подвергнуто омылению путем обработки гидроксидом для получения карбоновой кислоты формулы G6. Обработка дифенилфосфорилазидом в трет-бутаноле приводит к перегруппировке Курциуса для получения Boc-защищенного амина формулы G7. Удаление защитной Boc-группы позволяет получить амин формулы G8, который может после этого вступить в реакцию восстановительного алкилирования с соединением формулы A5 для получения соединения формулы A8.
На схеме H проиллюстрирован способ синтеза промежуточных соединений формулы H5, которые можно использовать для получения соединений формулы (I), в которой R2 представляет собой ди(C1-4алкил)аминокарбонил-замещенный фенил.
Схема H
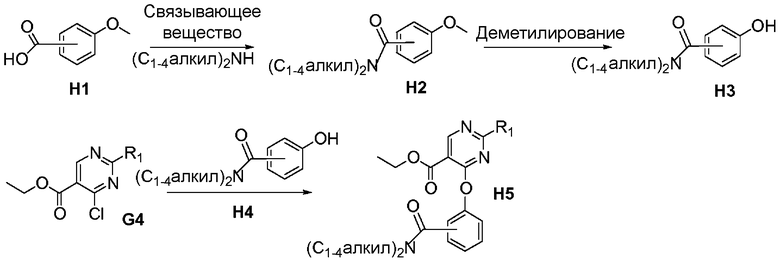
Соединения формулы H1 представлены в продаже или могут быть получены известными способами, описанными в научной литературе. Соединение формулы I1 можно соединить с соответствующим образом замещенным амином в присутствии подходящего связывающего агента, такого как HATU, для получения амида формулы H2. При традиционном снятии защиты с фенольной группы соединение формулы H3 может вступить в реакцию с соединением формулы G4 для получения соединения формулы H4, в котором R2 представляет собой аминокарбонил-замещенное фенильное кольцо. Способом, аналогичным способу, описанному для промежуточного соединения G5, соединение формулы H4 может быть преобразовано в желательное соединение формулы H5 способами, изображенными на схеме G.
На схеме I проиллюстрирован способ получения соединений формул I2, I3 и I4, где R2 представляет собой фенил, замещенный гидрокси(C1-4)алкилом, фтор(C1-4)алкилом или пиридинил(C1-4)алкилом соответственно.
Схема I
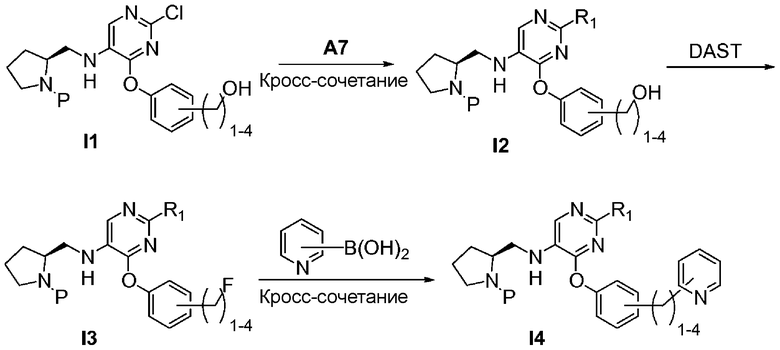
Соединение формулы I1 можно получить в соответствии со способами, изложенными в настоящем документе, с использованием традиционных реактивов. Соединение формулы I1 можно связать с соединением формулы A7, как описано в настоящем документе, с образованием R1-замещенного соединения формулы I2. Соединение формулы I2 можно обработать соответствующими реактивами для получения соединений формулы (I) без защитной аминогруппы, где R2 представляет собой фенил, замещенный гидрокси(C1-4)алкилом. Соединение формулы I2 можно преобразовать во фторалкил-замещенное соединение формулы I3 под действием DAST. Последующее удаление защитной группы P позволяет получить необходимые соединения формулы (I), где R2 представляет собой фенил, замещенный фтор-C1-4алкилом.
Кроме того, с соединением формулы I3 может быть проведена катализируемая палладиевым катализатором реакция перекрестного соединения с пиридинбороновой кислотой для получения соединений формулы I4, которые после удаления защитной группы P дают соединения формулы (I), где R2 представляет собой фенил, замещенный пиридинил(C1-4)алкилом.
На схеме J проиллюстрирован способ получения соединений формулы (I)-J, где A-L- берется с Ra и атомом азота, к которому присоединены обе группы, для получения азот-связанного гетероциклила, описанного в настоящем документе.
Схема J
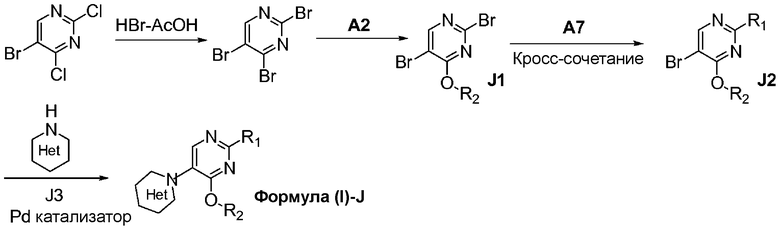
Доступный в продаже 2,4-дихлор-5-бромпиримидин можно обработать раствором HBr в кислотной среде для получения 2,4,5-трибромпиримидина, который затем может вступить в реакцию с соединением формулы A2 для получения соединения формулы J1. Соединение формулы J1 можно заменить соединением формулы A7, как описано в настоящей заявке, с помощью катализированного палладия, с получением соединения формулы J2. Соединение формулы J2 может вступать во вторую катализируемую палладиевым катализатором реакцию замещения с аминосодержащим гетероциклом (Het), как описано в настоящем документе, для получения соединения формулы (I)-J.
На схеме K проиллюстрирован способ получения соединений формулы (I)-K, где A-L- представляет собой a3L3, а L3 отсутствует.
Схема K
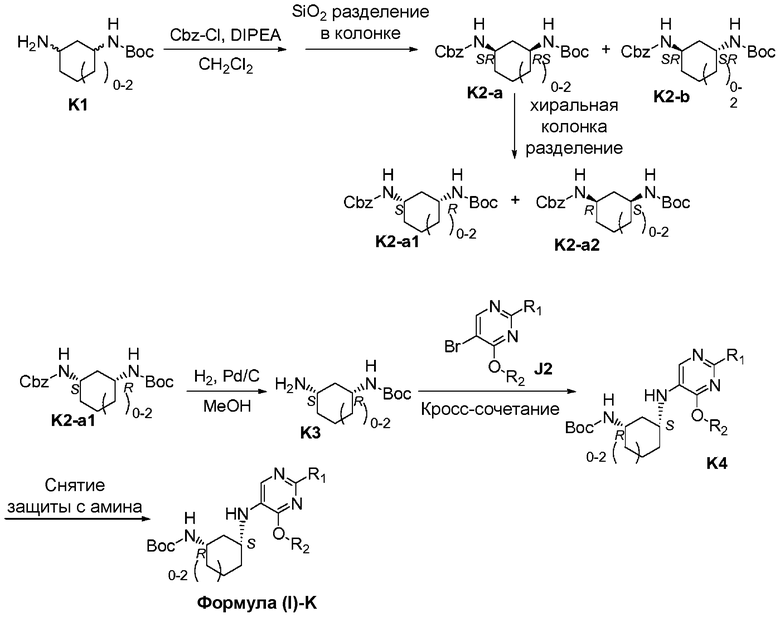
Смесь соединения формулы K1 можно приобрести в готовом виде или получить известными способами, описанными в научной литературе. Свободный амин соединения формулы K1 можно защитить Cbz-группой традиционными способами синтеза, а затем разделить на диастереометрические пары формул K2-a и K2-b с помощью нормально-фазовой колоночной хроматографии. Диастереометрическая пара формулы K2-a дополнительно может быть разделена на отдельные энантиомеры K2-a1 и K2-a2 с помощью хиральной колоночной хроматографии. На данном этапе с каждого энантиомера (показано соединение формулы K2-a1) можно снять защитную Cbz-группу с помощью стандартной реакции гидрирования с палладиевым катализатором для получения соединения формулы K3. Соединение формулы K3 может быть соединено с соединением формулы J2, как описано в настоящем документе, для получения соединения формулы K4, которое при удалении защитной аминогруппы позволяет получить соединение формулы (I)-K.
Конкретные примеры
Все реактивы были приобретены из доступных на рынке источников. Спектры ядерного магнитного резонанса (ЯМР) для атомов водорода были сняты в указанном растворителе с использованием тетраметилсилана (TMS) в качестве внутреннего стандарта на спектрометре Bruker Avance или Varian (300 или 400 МГц). Полученные значения приведены в миллионных долях в сторону низкого поля от сигнала TMS. Масс-спектры (МС) были получены на спектрометре Micromass Platform LC или Agilent 1100 LCMS в виде ЭРИ m/z (M+H+) с использованием электрораспылительной ионизации. Ускоряемые СВЧ-нагревом реакции проводили с использованием микроволновых приборов CEM Discover или Biotage, при этом, если не указано иное, реакционную смесь помещали в герметически закрытый сосуд. Стереоизомерные соединения можно охарактеризовать как рацемические смеси или как отдельные диастереомеры и энантиомеры с использованием рентгеновской кристаллографии и других известных специалистам способов. Если не указано иное, все использованные в приведенных ниже примерах материалы были получены от стандартных коммерческих поставщиков реактивов или были синтезированы стандартными способами, известными специалистам в области химического синтеза. Если не указано иное, заместители, которые варьируются между примерами, представляют собой атомы водорода.
Пример 1
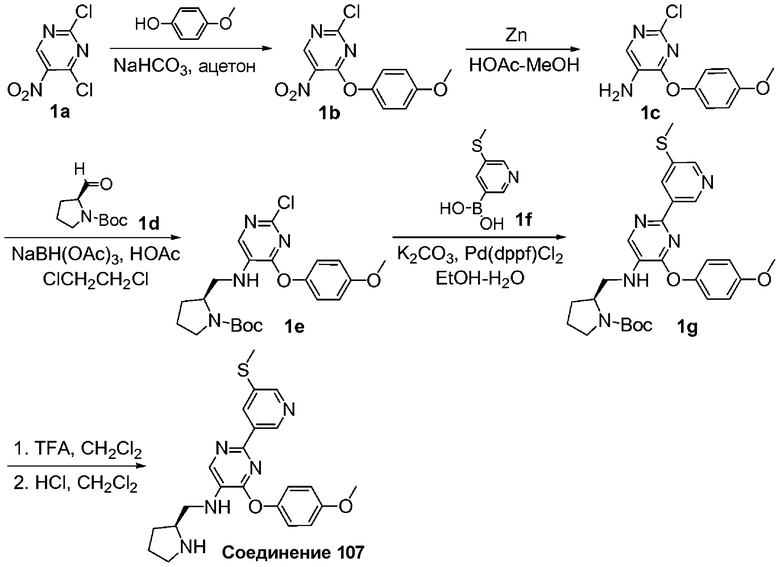
A. 2-Хлор-4-(4-метоксифенокси)-5-нитропиримидин (1b). К раствору 2,4-дихлор-5-нитропиримидина (соединение 1a) (5,82 г, 30,0 ммоль) в ацетоне (480 мл), охлажденному до 0°C, добавили раствор 4-метоксифенола (3,75 г, 30,0 ммоль) в смеси из 1н NaHCO3 (водн.) (30 мл) и H2O (120 мл) по каплям через капельную воронку. После добавления реакционную смесь нагрели до температуры окружающей среды, а затем перемешивали при комнатной температуре в течение 3 часов. Полученную смесь выпарили in vacuo, остаток последовательно промыли EtOAc, 1н NaOH (водн.) и H2O. Органическую фазу последовательно промыли H2O и соляным раствором, а затем высушили над Na2SO4.
Затем смесь отфильтровали, растворитель упарили при пониженном давлении и получили исходный материал. Исходный материал перекристаллизовали из Et2O-гексанов и получили соединение 1b (7,70 г, выход 91%) в виде твердого вещества желтого цвета. 1H-ЯМР (400 МГц, CDCl3): δ 9,17 (с, 1H), 7,13-7,15 (м, 2H), 6,98-7,01 (м, 2H), 3,87 (с, 3H); МС: m/z 282,0 (M+H)+.
B. 2-Хлор-4-(4-метоксифенокси)пиримидин-5-иламин (1c). К перемешанному раствору соединения 1b (7,72 г, 27,4 ммоль) в смеси ледяной уксусной кислоты (60 мл) и MeOH (120 мл) порциями добавляли цинковую пыль (5,38 г, 82,2 моль) при комнатной температуре. Реакционную смесь перемешивали 20 часов при комнатной температуре. Полученную смесь профильтровали через стеклянный фильтр, фильтрат нейтрализовали до pH 7 с помощью 2н KOH (водн.).
Смесь распределили между CH2Cl2 и H2O. Органическую фазу последовательно промыли H2O и соляным раствором, а затем высушили над Na2SO4.
Затем смесь отфильтровали, растворитель удалили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 1c (5,52 г, выход 80%) в виде твердого вещества красно-оранжевого цвета. 1H-ЯМР (400 МГц, CDCl3): δ 7,94 (с, 1H), 7,12-7,14 (м, 2H), 6,95-6,97 (м, 2H), 3,85 (с, 3H); МС: m/z 252,0 (M+H)+.
C. Трет-бутиловый эфир 2-(S)-{[2-хлор-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (1e). К раствору соединения 1c (4,45 г, 17,7 ммоль) в 1,2-дихлорэтане (80 мл) при нормальной температуре добавили Boc-L-пролиналь (соединение 1d) (5,0 г, 24,4 ммоль) и ледяную уксусную кислоту (4,5 мл), а затем смесь перемешивали в течение 3 часов в атмосфере азота. После этого ее обработали NaB(OAc)3H (9,37 г, 44,2 ммоль) и непрерывно перемешивали при комнатной температуре в течение 20 часов. Полученную смесь разбавили CH2Cl2, промыли насыщенным водным раствором NaHCO3 и H2O. Органическую фазу последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент Et2O-CH2Cl2, и получили соединение 1e (6,54 г, выход 85%) в виде твердого вещества бледно-желтого цвета. 1H-ЯМР (400 МГц, CDCl3): δ 7,73-7,79 (м, 1H), 7,07-7,14 (м, 2H), 6,91-6,98 (м, 2H), 5,73 (ушир.с, 0,6H), 4,77 (ушир.с, 0,4H), 4,20-4,30 (м, 1H), 3,85 (с, 3H), 3,21-3,58 (м, 4H), 1,81-2,11 (м, 4H), 1,46-1,49 (м, 9H); МС: m/z 435,1 (M+H)+.
D. Трет-бутиловый эфир 2-(S)-{[4-(4-метоксифенокси)-2-(5-метилсульфанилпиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (1g).
В пробирку Шленка, закрытую септой с тефлоновым покрытием, добавили смесь соединения 1e (4,0 г, 9,20 ммоль), 5-(метилтио)пиридин-3-илбороновой кислоты (соединение 1f) (2,32 г, 13,7 ммоль), K2CO3 (2,50 г, 18,1 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (0,45 г, 0,55 ммоль) в смеси этанола (18 мл) и H2O (4,5 мл), которую подвергли облучению в микроволновом реакторе при 130°C в течение 30 минут. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органическую фазу промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 1g (3,45 г, выход 72%) в виде твердого вещества бледно-желтого цвета. 1H-ЯМР (400 МГц, CDCl3): δ 9,00 (с, 1H), 8,40 (д, 1H), 8,21 (с, 1H), 7,99 (ушир.с, 1H), 7,12-7,18 (м, 2H), 6,93-6,96 (м, 2H), 5,77 (ушир.с, 0,6H), 4,90 (ушир.с, 0,4H), 4,22-4,32 (м, 1H), 3,86 (с, 3H), 3,18-3,56 (м, 4H), 2,47 (с, 3H), 1,80-2,15 (м, 4H), 1,46-1,52 (м, 9H); МС: m/z 524,2 (M+H)+.
E. Соединение 107: [4-(4-метоксифенокси)-2-(5-метилсульфанилпиридин-3-ил)пиримидин-5-ил]пирролидин-2-(S)-илметиламин. К раствору соединения 1g (3,45 г, 6,59 ммоль) в CH2Cl2 (20 мл) при температуре окружающей среды добавили трифторуксусную кислоту (4,9 мл, 66 ммоль). Реакционную смесь перемешивали 20 часов при комнатной температуре. Полученную смесь довели до pH 12, используя 1н водного раствора NaOH. Полученную смесь экстрагировали CH2Cl2 и H2O. Органическую фазу промыли H2O и высушили над Na2SO4. После этого смесь отфильтровали, а фильтрат сконцентрировали при пониженном давлении. Полученный остаток растворили в CH2Cl2 (35 мл) и обработали 1,0 М раствором HCl в Et2O (6,6 мл, 6,6 ммоль) при температуре окружающей среды. Реакционную смесь перемешивали 20 часов при комнатной температуре. Полученную смесь концентрировали in vacuo, затем взяли небольшую порцию остатка MeOH/CH2Cl2 и растерли его с Et2O. Твердое вещество собрали путем фильтрования, высушили и получили соединение 107 (2,33 г, выход 77%) в виде твердого вещества бледно-желтого цвета. Соль HCl: 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,06 (ушир.с, 1H), 8,83 (д, 1H), 8,66 (ушир.с, 1H), 8,42 (д, 1H), 8,25 (с, 1H), 8,05 (т, 1H), 7,25-7,29 (м, 2H), 7,04-7,09 (м, 2H), 6,36 (т, 1H), 3,83-3,87 (м, 1H), 3,81 (с, 3H), 3,56 (т, 2H), 3,35 (с, 3H), 3,17-3,26 (м, 2H), 2,12-2,18 (м, 1H), 1,87-2,01 (м, 2H), 1,70-1,76 (м, 1H); МС: m/z 424,2 (M+H)+.
Следуя процедуре, описанной выше для примера 1, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
Соединение 44:
Указанное соединение получили аналогично соединению 107 из примера 1, заменив 4-метоксифенол на трет-бутиловый эфир (4-гидроксифенил)карбаминовой кислоты на стадии A и заменив 5-(метилтио)пиридин-3-илбороновую кислоту на 4-метоксипиридин-3-илбороновую кислоту на стадии D. МС: m/z 393,2 (M+H)+.
Соединение 46:
Указанное соединение получили аналогично соединению 107 из примера 1, заменив 4-метоксифенол на трет-бутиловый эфир (4-гидроксифенил)карбаминовой кислоты на стадии A и заменив 5-(метилтио)пиридин-3-илбороновую кислоту на пиридин-3-илбороновую кислоту на стадии D. МС: m/z 363,2 (M+H)+.
Соединение 60:
Указанное соединение получили аналогично соединению 107 из примера 1 с заменой 5-(метилтио)пиридин-3-илбороновой кислоты на 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)пиримидин-2-карбонитрил на стадии D. Соль TFA-1H-ЯМР (400 МГц, ДМСО-d6): δ 8,95 (с, 2H), 8,53 (ушир.с, 1H), 8,21 (с, 1H), 7,23-7,26 (м, 2H), 7,04-7,07 (м, 2H), 6,23 (т, 1H), 4,36 (кв, 2H), 3,81-3,86 (м, 1H), 3,81 (с, 3H), 3,48-3,53 (м, 2H), 3,15-3,26 (м, 2H), 2,10-2,17 (м, 1H), 1,87-2,00 (м, 2H), 1,65-1,74 (м, 1H), 1,32 (т, 3H); МС: m/z 423,1 (M+H)+.
Соединение 92: 1H-ЯМР (400 МГц, CDCl3) δ 7,92 (1H, с), 7,60 (2H, с), 7,16-7,14 (2H, м), 6,94 (1H, с), 6,90-6,87 (2H, м), 3,86-3,80 (4H, м), 3,61-3,50 (2H, м), 3,29-3,23 (2H, м), 3,20-2,95 (1H, ушир.с), 2,27 (6H, с), 2,14-2,09 (1H, м), 2,03-2,00 (1H, м), 1,95-1,90 (1H, м), 1,79-1,74 (1H, м); МС: m/z 405,2 (M+H)+.
Соединение 93: 1H-ЯМР (400 МГц, CDCl3) δ 7,90 (1H, с), 7,62-7,60 (1H, м), 7,52-7,51 (1H, м), 7,15-7,13 (2H, м), 6,94-6,91 (2H, м), 6,76-6,74 (1H, м), 5,94 (2H, с), 4,86-4,83 (1H, м), 3,84 (3H, с), 3,68-3,62 (1H, м), 3,42-3,26 (2H, м), 3,12-3,08 (2H, м), 2,10-2,02 (1H, м), 1,97-1,91 (1H, м), 1,89-1,80 (1H, м), 1,69-1,60 (1H, м); МС: m/z 421,2 (M+H)+.
Соединение 94: 1H-ЯМР (400 МГц, CD3OD) δ 8,12 (1H, с), 7,90-7,89 (2H, м), 7,37-7,36 (1H, м), 7,19-7,17 (2H, м), 7,05-7,03 (2H, м), 4,03-3,94 (1H, м), 3,68-3,56 (2H, м), 3,42-3,32 (2H, м), 3,31-3,29 (1H, м), 2,36-2,28 (1H, м), 2,19-2,05 (2H, м), 1,93-1,81 (1H, м); МС: m/z 445,0 & 447,0 (M+H)+.
Соединение 95: 1H-ЯМР (400 МГц, CDCl3) δ 9,33 (1H, с), 8,42-8,40 (1H, м), 8,00 (1H, м), 7,64-7,62 (1H, м), 7,16-7,12 (2H, м), 6,98-6,95 (2H, м), 5,94 (2H, с), 5,03-5,01 (1H, м), 3,87 (3H, с), 3,59-3,55 (1H, м), 3,35-3,29 (1H, м), 3,18-3,10 (1H, м), 3,05-2,94 (2H, м), 2,07-1,99 (1H, м), 1,92-1,79 (2H, м), 1,60-1,54 (1H, м); МС: m/z 403,2 (M+H)+.
Соединение 121: Указанное соединение получили аналогично соединению 107 из примера 1, заменив 5-(метилтио)пиридин-3-илбороновую кислоту на 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)пиримидин-2-карбонитрил и заменив этанол на CH3CN на стадии D. Соль TFA: 1H-ЯМР (400 МГц, CDCl3): δ 9,33 (с, 2H), 7,98 (с, 1H), 7,09-7,13 (м, 2H), 6,91-6,96 (м, 2H), 5,59 (т, 1H), 3,85-3,88 (м, 1H), 3,85 (с, 3H), 3,60-3,62 (м, 2H), 3,21-3,26 (м, 2H), 2,18-2,24 (м, 1H), 1,95-2,09 (м, 2H), 1,75-1,85 (м, 1H); МС: m/z 404,2 (M+H)+.
Соединение 260: Указанное соединение получили аналогично соединению 107 из примера 1, заменив 4-метоксифенол на 4-фторметоксифенол1 на стадии A и 5-(метилтио)пиридин-3-илбороновую кислоту на 5-метилпиридин-3-илбороновую кислоту на стадии D. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,36 (ушир.с, 1H), 9,02 (ушир.с, 1H), 8,86 (с, 1H), 8,42-8,43 (м, 1H), 8,24-8,28 (м, 1H), 8,16-8,19 (м, 1H), 6,86-7,38 (м, 4H), 6,34-6,43 (м, 1H), 5,85-5,98 (м, 1H), 5,76 (с, 2H), 3,81-4,14 (м, 1H), 3,52-3,61 (м, 2H), 3,15-3,27 (м, 2H), 2,33 (с, 3H), 2,11-2,19 (м, 1H), 1,84-2,03 (м, 2H), 1,63-1,77 (м, 1H); МС: m/z 410,0 (M+H)+.
14-Фторметоксифенол получили в соответствии со следующей схемой синтеза и методикой.
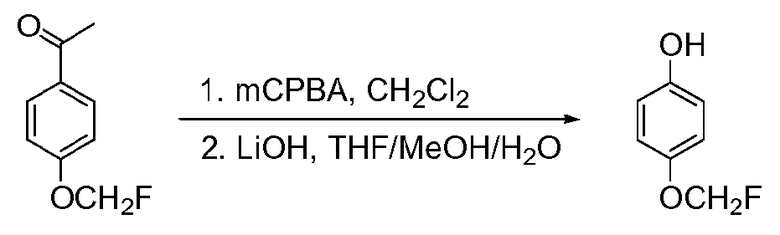
A. 4-Фторметоксифенол. К раствору 1-(4-фторметоксифенил)этанона (1,5 г, 8,9 ммоль) в дихлорметане (30 мл) добавили соединение mCPBA (4,0 г, 17,8 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 часов, затем промыли насыщенным раствором NaHCO3 (3X). Органический слой высушили над Na2SO4 и сконцентрировали при пониженном давлении для получения исходного материала (3,77 г). Исходный материал (3,77 г) растворили в THF/MeOH/H2O (5/5/5 мл), а затем обрабатывали LiOH (4,0 г, 108 ммоль) при комнатной температуре в течение 4 часов. Реакционную смесь подкислили 2н раствора HCl до pH 5. Смесь экстрагировали EtOAc (3 раза). Органические фазы соединили, высушили над Na2SO4 и сконцентрировали при пониженном давлении для получения указанного соединения (1,3 г). Данное соединение использовали непосредственно без дополнительной очистки.
Соединение 264:
Указанное соединение получили аналогично соединению 107 из примера 1, заменив 5-(метилтио)пиридин-3-илбороновую кислоту на 4-хлор-5-метилпиридин-3-илбороновую кислоту на стадии D. Указанное соединение получили в качестве побочного продукта при получении соединения 266. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,44 (ушир.с, 1H), 9,05 (ушир.с, 1H), 8,96 (д, 1H), 8,46 (д, 1H), 8,27 (с, 1H), 8,23 (д, 1H), 8,04 (д, 1H), 7,27-7,31 (м, 2H), 7,04-7,08 (м, 2H), 6,41 (ушир.с, 1H), 3,83-3,90 (м, 1H), 3,57-3,94 (м, 2H), 3,15-3,27 (м, 2H), 2,40 (с, 3H), 2,38 (с, 3H), 2,11-2,19 (м, 1H), 1,85-2,03 (м, 2H), 1,67-1,77 (м, 1H); МС: m/z 517,2 (M+H)+.
Пример 2
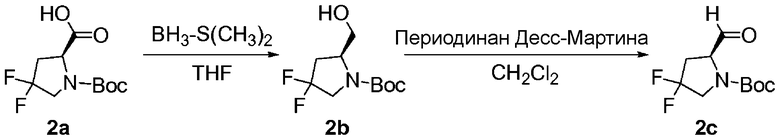
A. Трет-бутиловый эфир 4,4-дифтор-2-(S)-гидроксиметилпирролидин-1-карбоновой кислоты (2b).
К раствору 1-трет-бутилового эфира 4,4-дифторпирролидин-1,2-дикарбоновой кислоты (соединение 2a) (1,5 г, 6,0 ммоль) в тетрагидрофуране (15 мл) добавили боран-диметилсульфидный комплекс (3,79 мл, 7,58 ммоль) по каплям при температуре окружающей среды. Полученную смесь нагревали с обратным холодильником в течение 2 часов. Полученную смесь остудили до комнатной температуры. Смесь распределили между EtOAc и H2O. Органическую фазу промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 2b (1,2 г, выход 84%) в виде бесцветного масла. 1H-ЯМР (400 МГц, CDCl3): δ 4,08-4,23 (м, 2H), 3,61-3,87 (м, 4H), 2,45-2,57 (м, 1H), 2,15 (ушир.с, 1H), 1,49 (с, 9H).
B. Трет-бутиловый эфир 4,4-дифтор-2-(S)-формилпирролидин-1-карбоновой кислоты (2c).
К раствору соединения 2b (1,33 г, 5,61 ммоль) в CH2Cl2 (20 мл) при температуре окружающей среды добавили 3,3,3-триацетокси-3-йодофталид (3,56 г, 8,39 ммоль). Реакционную смесь перемешивали 2 часа при комнатной температуре. Полученную смесь разбавили EtOAc и последовательно промыли насыщенным водным раствором NaHCO3 и H2O. Органическую фазу промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 2c (0,58 г, выход 44%) в виде бесцветного масла. 1H-ЯМР (400 МГц, CDCl3): δ 9,59 (д, 1H), 4,28-4,45 (м, 1H), 3,77-3,89 (м, 2H), 2,43-2,63 (м, 2H), 1,46-1,51 (м, 9H).
Следуя процедуре, описанной выше в примере 2, и заменив соответствующие реактивы и способы очистки, известные специалистам в данной области, получили следующие альдегиды:
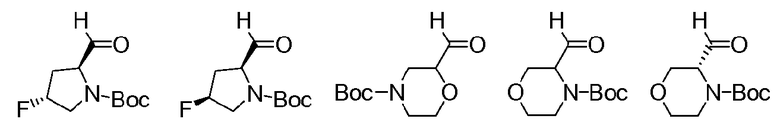
Пример 3
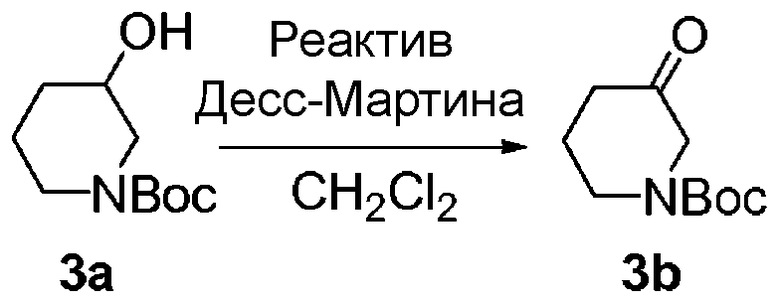
A. Трет-бутиловый эфир 3-оксопиперидин-1-карбоновой кислоты (3b). К раствору трет-бутилового эфира 3-гидроксипиперидин-1-карбоновой кислоты (соединение 3a) (0,25 г, 1,24 ммоль) в безводном дихлорметане (9,0 мл) при 0°C добавили 1,1,1-трис(актилокси)-1,1-дигидро-1,2-бензодиоксол-3-(1H)-он (1,58 г, 3,72 ммоль). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 часов. Затем к ней добавили дополнительную порцию 1,1,1-трис(актилокси)-1,1-дигидро-1,2-бензодиоксол-3-(1H)-она (0,5 г, 1,18 ммоль). После перемешивания в течение 20 часов при комнатной температуре реакционную смесь разделили между дихлорметаном и солевым раствором. Органический слой промыли солевым раствором, высушили над Na2SO4 и профильтровали. Затем растворитель выпарили in vacuo для получения неочищенного масла. Неочищенное масло очистили с помощью колоночной флэш-хроматографии при элюировании 40% этилацетата в гексанах с получением соединения 3b в виде масла (0,24 г, выход 97%). 1H ЯМР (400 МГц, CDCl3): δ 4,0 (2H, ушир.с.), 3,60-3,57 (2H, м), 2,49-2,45 (2H, м), 2,01-1,95 (1H, м), 1,46 (9H, с).
Пример 4
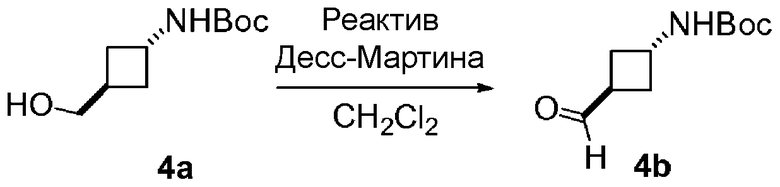
A. Трет-бутиловый эфир транс-(3-формилциклобутил)карбаминовой кислоты (4b). К раствору трет-бутилового эфира транс-(3-гидроксиметилциклобутил)карбаминовой кислоты (соединение 4a) (0,2 г, 1,0 ммоль) в безводном дихлорметане (8,0 мл) при 0°C добавили 1,1,1-трис(ацетилокси)-1,1-дигидро-1,2-бензодиоксол-3-(1H)-он (0,84 г, 2,0 ммоль). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 3 часов перед разделением реакционной смеси между дихлорметаном и солевым раствором. Органический слой промыли солевым раствором, высушили над Na2SO4 и профильтровали. Затем растворитель выпарили in vacuo для получения неочищенного масла. Неочищенное масло очистили колоночной флэш-хроматографией при элюировании 30% этилацетата в гексанах с получением соединения 4b в виде пены (0,2 г, выход 88%). 1H ЯМР (400 МГц, CDCl3): δ 9,82 (1H, д), 4,77 (1H, ушир.с.), 4,16-4,11 (1H, ушир.с.), 3,04-3,03 (1H, м), 2,69-2,64 (2H, м), 2,21-2,13 (2H, м), 1,44 (9H, с).
Следуя процедуре, описанной выше в примере 4, и заменив соответствующие реактивы и способы очистки, известные специалистам в данной области, получили следующие альдегиды:
1H ЯМР (400 МГц, CDCl3): δ 9,58 (1H, д), 4,53 (1H, ушир.с.), 3,75 (1H, ушир.с.), 2,12-2,0 (2H, м), 1,84-1,73 (2H, м), 1,54-1,15 (13H, м).
1H ЯМР (400 МГц, CDCl3): δ 9,59 (1H, ушир.с.), 4,9 (1H, ушир.с), 4,26-4,24 (1H, м), 1,79-1,62 (2H, м), 1,45 (9H, с), 1,44-1,36 (1H, м), 0,98-0,96 (6H, м).
Следуя процедуре, описанной выше для примера 1, и заменив соответствующие реактивы, исходные материалы (включая альдегиды или кетоны, полученные в примерах 2, 3 и 4) и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
Дополнительные соединения с данными ЯМР (таблица ниже):
Соединение 109: 1H ЯМР (400 МГц, CDCl3): δ 9,30 (1H, с), 9,12 (2H, с), 8,07 (1H, с), 7,16-7,13 (2H, м), 6,97-6,95 (2H, м), 4,74-4,72 (1H, м), 3,87 (3H, с), 3,63-3,55 (1H, м), 3,30-3,26 (1Н, м), 2,95-2,91 (1H, м), 2,81-2,71 (2H, м), 2,05-1,99 (1H, м), 1,84-1,77 (1H, м), 1,68-1,57 (2H, м); МС: m/z 379,2 (M+H)+.
Соединение 196: соль HCl: 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,90 (ушир.с, 1H), 9,79 (ушир.с, 1H), 9,06 (д, 1H), 8,59 (дд, 1H), 8,34 (д, 1H), 8,32 (с, 1H), 7,53 (дд, 1H), 7,27-7,32 (м, 2H), 7,04-7,08 (м, 2H), 6,45 (т, 1H), 5,48 (дт, 1H), 4,04-4,11 (м, 1H), 3,81 (с, 3H), 3,42-3,80 (м, 5H), 1,91-2,09 (м, 1H); МС: m/z 396,2 (M+H)+.
Соединение 292: 1H ЯМР (400 МГц, CDCl3): δ 9,42 (1H, д), 8,76 (1H, д), 8,57 (1H, т), 7,99 (1H, с), 7,15-7,13 (2H, м), 6,98-6,96 (2H, м), 4,98 (1H, т), 3,87 (3H, с), 3,33-3,26 (2H, м), 3,09-3,04 (1H, м), 1,26 (3H, д); МС m/z 377,0 (M+H)+.
Соединение 293: 1H ЯМР (400 МГц, CDCl3): δ 9,42 (1H, д), 8,76 (1H, д), 8,57 (1H, т), 8,0 (1H, с), 7,15-7,13 (2H, м), 6,98-6,96 (2H, м), 4,93 (1H, т), 3,88 (3H, с), 3,37-3,33 (2H, м), 3,12-3,09 (2H, м); МС: m/z 363,0 (M+H)+.
Соединение 294: 1H ЯМР (400 МГц, CDCl3): δ 9,42 (1H, д), 8,76 (1H, д), 8,58-8,57 (1H, м), 7,98 (1H, с), 7,16-7,14 (2H, м), 6,98-6,96 (2H, м), 5,0 (1H, ушир.с), 3,87 (3H, с), 3,35-3,30 (1H, м), 3,19-3,14 (1H, м), 3,03-2,97 (1H, м), 1,84-1,77 (1H, м), 1,39-1,36 (2H, м), 1,0-0,95 (6H, дд); МС: m/z 419,2 (M+H)+.
Соединение 295: 1H ЯМР (400 МГц, CDCl3): δ 9,31 (2H, с), 9,12 (1H, с), 7,99 (1H, с), 7,16-7,14 (2H, м), 6,97-6,94 (2H, м), 5,0 (1H, ушир.с), 3,87 (3H, с), 3,35-3,31 (1H, м), 3,2-3,14 (1H, м), 3,02-2,97 (1H, м), 1,84-1,77 (1H, м), 1,4-1,35 (2H, м), 1,0-0,95 (6H, дд); МС: m/z 395,2 (M+H)+.
Соединение 298: 1H ЯМР (400 МГц, CDCl3): δ 9,41-9,40 (2H, м), 8,76-8,75 (2H, м), 8,56-8,55 (2H, м), 7,98-7,96 (2H, д), 7,15-7,12 (4H, м), 6,99-6,96 (4H, м), 4,61-4,56 (1H, м), 4,35-4,33 (1H, м), 3,88-3,87 (6H, д), 3,70-3,65 (1H, м), 3,42-3,37 (2H, м), 3,02-2,98 (1H, м), 2,84-2,77 (2H, м), 2,25-2,22 (2H, м), 2,02-1,90 (4H, м), 1,86-1,75 (4H, м), 1,42-1,25 (8H, м); МС: m/z 417,2 (M+H)+.
Соединение 299: 1H ЯМР (400 МГц, CDCl3): δ 9,41 (1H, д), 8,75 (1H, д), 8,57 (1H, т), 7,99 (1H, с), 7,15-7,13 (2H, м), 6,98-6,96 (2H, м), 6,11 (1H, ушир.с), 3,87 (3H, с), 3,37-3,34 (1H, м), 3,29-3,26 (1H, м), 2,54-2,48 (1H, м), 1,92-1,87 (2H, м), 1,77-1,74 (2H, м), 1,55-1,19 (5H, м); МС: m/z 431,0 (M+H)+.
Соединение 300: 1H ЯМР (400 МГц, CDCl3): δ 9,31 (2H, с), 9,11 (1H, с), 8,0 (1H, с), 7,15-7,13 (2H, м), 6,96-6,94 (2H, м), 5,98 (1H, ушир.с), 3,86 (3H, с), 3,39-3,34 (1H, м), 3,29-3,25 (1H, м), 2,54-2,48 (1H, м), 1,91-1,88 (2H, м), 1,76-1,74 (2H, м), 1,55-1,19 (5H, м); МС: m/z 407,0 (M+H)+.
Соединение 301: 1H ЯМР (400 МГц, CDCl3): δ 9,41 (1H, с), 8,76 (1H, с), 8,57 (1H, с), 7,97 (1H, с), 7,14-7,12 (2H, м), 6,98-6,96 (2H, м), 4,43-4,40 (1H, м), 3,87 (3H, с), 3,73-3,69 (1H, ушир.с), 3,36-3,33 (2H, м), 2,61-2,57 (1H, м), 2,30-2,22 (2H, м), 2,01-1,94 (2H, м); МС: m/z 403,2 (M+H)+.
Соединение 302: 1H ЯМР (400 МГц, CDCl3): δ 9,31 (2H, с), 9,12 (1H, с), 7,98 (1H, с), 7,14-7,12 (2H, м), 6,97-6,94 (2H, м), 4,40-4,37 (1H, м), 3,86 (3H, с), 3,71-3,65 (1H, ушир.с), 3,36-3,32 (2H, м), 2,61-2,57 (1H, м), 2,30-2,22 (2H, м), 2,01-1,93 (2H, м); МС: m/z 379,2 (M+H)+.
Соединение 303: 1H ЯМР (400 МГц, CDCl3): δ 9,42 (4H, д), 8,76 (2H, д), 8,57-8,56 (2H, м), 7,88 (1H, с), 7,81 (1H, с), 7,15-7,12 (4H, м), 6,99-6,96 (4H, м), 4,63-4,59 (1H, м), 4,19-4,13 (1H, м), 3,88-3,81 (7H, м), 3,69-3,64 (1H, м), 3,38-3,34 (1H, м), 3,00-2,94 (1H, м), 2,39-2,33 (4H, м), 2,30-2,24 (4H, м); МС: m/z 389,2 (M+H)+.
Соединение 304: 1H ЯМР (400 МГц, CDCl3): δ 9,31 (4H, с), 9,12 (2H, с), 7,88 (1H, с), 7,81 (1H, с), 7,15-7,12 (4H, м), 6,98-6,95 (4H, м), 4,59-4,55 (1H, м), 4,17-4,13 (1H, м), 3,88-3,81 (7H, м), 3,68-3,66 (1H, м), 3,38-3,34 (1H, м), 3,00-2,94 (1H, м), 2,39-2,33 (4H, м), 2,29-2,23 (4H, м); МС: m/z 365,2 (M+H)+.
Пример 5
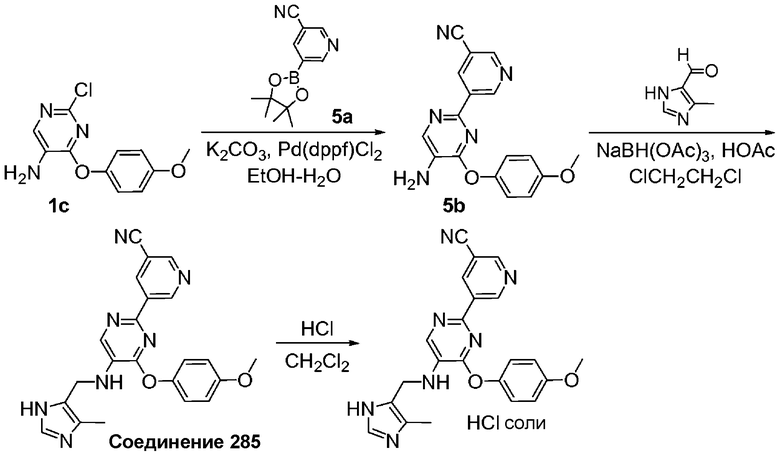
A. 5-[5-Амино-4-(4-метоксифенокси)пиримидин-2-ил]никотинонитрил (5b). Используя адаптацию способа, описанного для стадии D примера 1, и заменив соединение 1f на соединение 5a, получили соединение 5b. МС: m/z 320,1 (M+H)+.
B. Соединение 285: 5-{4-(4-метоксифенокси)-5-[(5-метил-3H-имидазол-4-илметил)амино]пиримидин-2-ил}никотинонитрил.
Используя адаптацию способа, описанного для стадии C примера 1, и заменив соединение 1c на соединение 5b, а также заменив соединение 1d на 5-метил-3H-имидазол-4-карбальдегид, получили соединение 285 в виде свободного основания. 1H-ЯМР (400 МГц, ДМСО-d6): δ 11,79 (ушир.с, 1H), 9,21 (с, 1H), 8,94 (с, 1H), 8,51 (с, 1H), 8,31 (с, 1H), 7,47 (с, 1H), 7,27 (д, 2H), 7,05 (д, 2H), 6,44 (ушир.с, 1H), 4,03 (м, 2H), 3,81 (с, 3H), 2,23 (с, 3H); МС: m/z 414,0 (M+H)+.
Следуя процедуре, описанной выше для примера 5, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 6
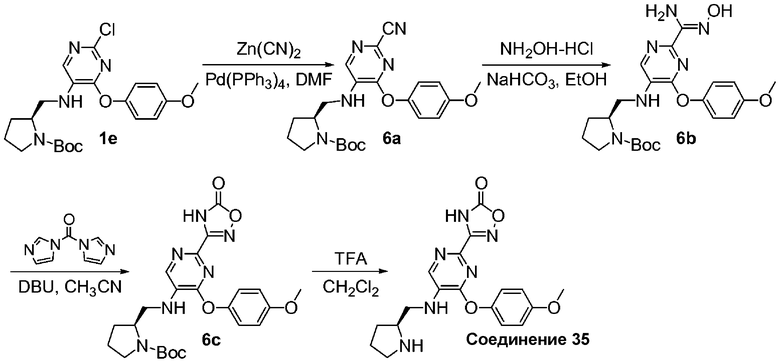
A. Трет-бутиловый эфир 2-(S)-{[2-циано-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (6a).
Смесь соединения 1e (0,4 г, 0,92 ммоль), Zn(CN)2 (0,11 г, 0,92 ммоль) и Pd(PPh3)4 (0,106 г, 0,092 ммоль) в DMF (2,4 мл) подвергли облучению при 160°C в микроволновом реакторе CEM в течение 16 минут. После очистки путем препаративной ТСХ с элюированием смеси 1/1 EtOAc/ гексаны получили продукт 6a (0,059 г, выход 15%). МС: m/z 426,2 (M+H)+.
B. Трет-бутиловый эфир 2-(S)-{[2-N-гидроксикарбамимидоил)-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (6b).
В сосуд для микроволновой обработки добавили NaHCO3 (0,03 г, 0,354 ммоль), гидроксиламина гидрохлорид (0,016 г, 0,236 ммоль) и H2O (0,2 мл).
В сосуд добавили суспензию соединения 6a (0,05 г, 0,118 ммоль) в EtOH (0,5 мл), затем реакционную смесь подвергли облучению при 130°C в микроволновом реакторе CEM в течение 32 минут. После очистки путем препаративной ТСХ с элюированием смеси 1/1 EtOAc/гексаны получили продукт 6b (0,053 г, выход 98%). МС: m/z 456,2 (M+H)+.
C. Трет-бутиловый эфир 2-(S)-{[4-(4-метоксифенокси)-2-(5-оксо-4,5-дигидро[1,2,4]оксадиазол-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (6c).
К раствору соединения 6b (0,038 г, 0,0828 ммоль) и 1,1'-карбонилдиимидазола (0,015 г, 0,091 ммоль) в CH3CN (1 мл) добавили 1,8-диазабицикло[5.4.0]ундец-7-ена (0,05 мл, 0,33 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. Органический слой промыли солевым раствором, высушили над Na2SO4, профильтровали, затем растворитель выпарили in vacuo для получения соединения 6c. МС: m/z 485,3 (M+H)+.
D. Соединение 35: 3-{4-(4-метоксифенокси)-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-2-ил}-4H-[1,2,4]оксадиазол-5-он.
К раствору соединения 6c (150 мг, 0,31 ммоль) в CH2Cl2 (4 мл) добавили TFA (1 мл) и перемешивали смесь в течение 2 часов при комнатной температуре. Реакционную смесь сконцентрировали, полученный остаток очистили путем обращенно-фазовой ВЭЖХ для получения соединения 35 в виде соли TFA. 1H-ЯМР (300 МГц, CD3OD): δ 8,16 (с, 1H), 7,18 (д, 2H), 7,00 (д, 2H), 3,97 (м, 1H), 3,83 (с, 3H), 3,61-3,66 (м, 2H), 3,34-3,40 (м, 2H), 2,27-2,35 (м, 1H), 2,04-2,19 (м, 2H), 1,82-1,92 (м, 1H); МС: m/z 385,2 (M+H)+.
Пример 7
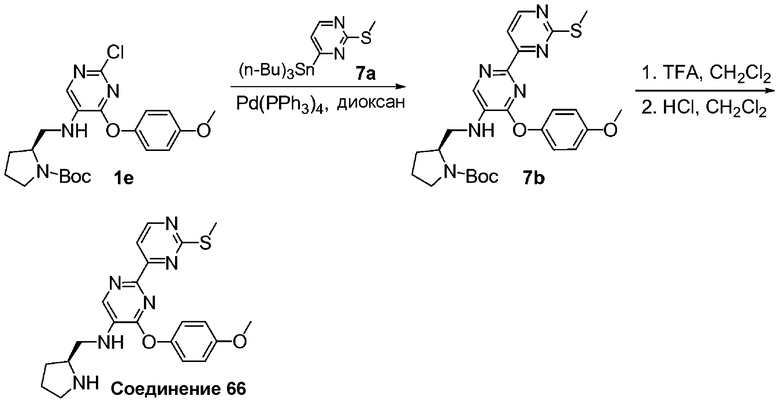
A. Трет-бутиловый эфир 2-(S)-{[4-(4-метоксифенокси)-2'-метилсульфанил-[2,4']-бипиримидинил-5-иламино]метил}пирролидин-1-карбоновой кислоты (7b).
В пробирку Шленка, закрытую септой с тефлоновым покрытием, добавили смесь соединения 1e (213 мг, 0,49 ммоль), 2-метилсульфанил-4-трибутилстаннанилпиримидина (соединение 7a) (305 мг, 0,735 ммоль) и тетракис-(трифенилфосфин)палладия(0) (57 мг, 0,049 ммоль) в диоксане (1,0 мл), затем смесь облучили в микроволновом реакторе при 150°C в течение 30 минут. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органическую фазу промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 7b (129 мг, выход 50%). 1H-ЯМР (400 МГц, CDCl3): δ 8,48-8,50 (м, 1H), 8,08-8,12 (м, 1H), 7,54-7,57 (м, 1H), 7,16-7,23 (м, 2H), 6,96-7,01 (м, 2H), 6,27 (ушир.с, 0,7H), 5,18 (ушир, 0,3H), 4,25-4,36 (м, 1H), 3,88 (с, 3H), 3,24-3,59 (м, 4H), 2,68 (с, 3H), 1,79-2,16 (м, 4H), 1,44-1,54 (м, 9H); МС: m/z 525,2 (M+H)+.
B. Соединение 66: [4-(4-метоксифенокси)-2'-метилсульфанил-[2,4']бипиримидинил-5-ил]пирролидин-2-(S)-илметиламин.
Используя адаптацию способа, описанного для стадии E примера 1, и заменив соединение 1g на соединение 7b, получили соединение 66 в виде гидрохлорида. 1H-ЯМР (400 МГц, ДМСО-d 6): δ 8,89 (ушир.с, 1H), 8,62 (д, 1H), 8,31 (с, 1H), 7,59 (д, 1H), 7,29-7,31 (м, 2H), 7,02-7,04 (м, 2H), 6,66 (т, 1H), 3,83 (т, 1H), 3,80 (с, 3H), 3,57-3,60 (м, 2H), 3,11-3,25 (м, 2H), 2,45 (с, 3H), 2,08-2,15 (м, 1H), 1,84-1,99 (м, 2H), 1,66-1,74 (м, 1H); МС: m/z 425,1 (M+H)+.
Следуя процедуре, описанной выше для примера 8, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 8
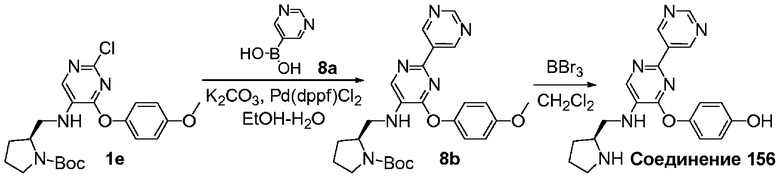
A. Трет-бутиловый эфир 2-(S)-{[4-(4-метоксифенокси)-[2,5']бипиримидинил-5-иламино]метил}пирролидин-1-карбоновой кислоты (8b).
Используя адаптацию способа, описанного для стадии D примера 1, и заменив соединение 1f на пиримидин-5-бороновую кислоту (соединение 8a), получили соединение 8b в виде твердого вещества бледно-желтого цвета. 1H-ЯМР (400 МГц, CDCl3): δ 9,31 (с, 2H), 9,11 (с, 1H), 8,00-8,03 (м, 1H), 7,10-7,15 (м, 2H), 6,93-6,96 (м, 2H), 5,89 (ушир.с, 0,7H), 4,98 (ушир.с, 0,3H), 4,21-4,35 (м, 1H), 3,86 (с, 3H), 3,19-3,56 (м, 4H), 1,80-2,14 (м, 4H), 1,43-1,46 (м, 9H); МС: m/z 479,2 (M+H)+.
B. Соединение 156: 4-{5-[(пирролидин-2-(S)-илметил)амино]-[2,5']бипиримидинил-4-илокси}фенол.
К раствору соединения 8b (100 мг, 0,21 ммоль) в CH2Cl2 (10 мл), охлажденному до 0°C, добавили BBr3-S(CH3)2 в CH2Cl2 (1,0 M, 1,5 мл) по каплям. Смесь нагрели до температуры окружающей среды, а затем подвергли нагреванию с обратным холодильником при 70°C в течение 5 часов. Затем, после достижения комнатной температуры, к реакционной смеси добавили дополнительную порцию BBr3-S(CH3)2 в CH2Cl2 (1,0 M, 1,5 мл). Реакционную смесь нагревали с обратным холодильником при температуре 70°C в течение 20 часов. pH реакционной смеси установили на уровне 6 с помощью 1н NaOH (водн.), а затем органическую фазу сконцентрировали. Полученный остаток очистили обращенно-фазовой ВЭЖХ, используя в качестве элюента градиент CH3CN-H2O, и получили соединение 156 (29,7 мг, выход 27%) в виде соли HBr. 1H-ЯМР (400 МГц, ДМСО-d 6): δ 9,54 (с, 1H), 9,17 (с, 1H), 9,16 (с, 1H), 8,97 (ушир.с, 1H), 8,55 (ушир.с, 1H), 7,27 (д, 1H), 7,12-7,15 (м, 2H), 6,86-6,89 (м, 2H), 6,42 (т, 1H), 3,85 (ушир.с, 1H), 3,53-3,57 (м, 2H), 3,18-3,26 (м, 2H), 2,11-2,18 (м, 1H), 1,88-1,98 (м, 2H), 1,67-1,72 (м, 1H); МС: m/z 365,1 (M+H)+.
Пример 9
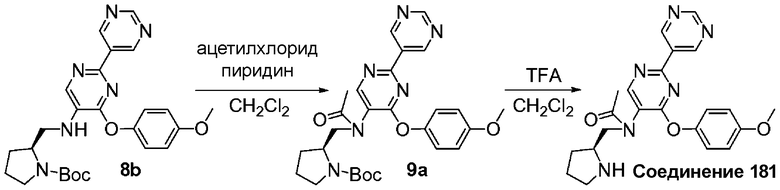
A. Трет-бутиловый эфир 2-(S)-({ацетил-[4-(4-метоксифенокси)-[2,5']-бипиримидинил-5-ил)амино}метил)пирролидин-1-карбоновой кислоты (9a).
К раствору соединения 8b (89 мг, 0,19 ммоль) при температуре окружающей среды в CH2Cl2 (7 мл) добавили ацетилхлорид (0,1 мл) и пиридин (0,1 мл). Смесь перемешивали при комнатной температуре в течение 3 часов. Полученную смесь разбавили CH2Cl2. Органическую фазу последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4.
Смесь отфильтровали, фильтрат упарили при пониженном давлении и получили соединение 9a. Неочищенный продукт использовали в следующей реакции без дополнительной очистки. МС: m/z 521,3 (M+H)+.
B. Соединение 181: N-[4-(4-метоксифенокси)-[2,5']бипиримидинил-5-ил]-N-пирролидин-2-(S)-илметилацетамид.
К раствору соединения 9a в CH2Cl2 (3 мл) при температуре окружающей среды добавили трифторуксусную кислоту (0,4 мл). Смесь перемешивали при комнатной температуре в течение 20 часов. Растворитель выпарили при пониженном давлении. Исходный материал очистили обращенно-фазовой ВЭЖХ, используя в качестве элюента градиент CH3CN-H2O, и получили соединение 181 (71,1 мг, выход 71%) в качестве соли TFA. 1H-ЯМР (400 МГц, ДМСО-d 6): δ 9,34 (с, 1H), 9,32 (с, 2H), 9,09 (ушир.с, 0,6H), 9,00 (с, 0,4H), 8,99 (с, 1H), 8,42 (ушир.с, 1H), 7,32 (д, 2H), 7,08 (д, 2H), 4,25-4,31 (м, 0,6H), 4,10-4,13 (м, 0,4H), 3,82 (с, 3H), 3,64-3,79 (м, 2H), 3,17-3,31 (м, 2H), 1,85-2,14 (м, 6H), 1,61-1,68 (м, 1H); МС: m/z 421,2 (M+H)+.
Пример 10
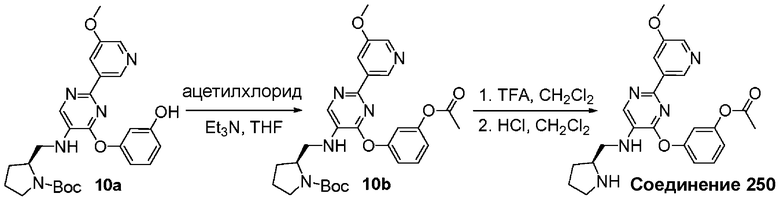
A. Трет-бутиловый эфир 2-(S)-{[4-(3-гидроксифенокси)-2-(5-метоксипиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (10a).
Указанное соединение приготовили аналогично соединению 1g в примере 1. Используя адаптацию способа, описанного для стадий A-D, и заменив 4-метоксифенол на 3-гидроксифенол на стадии A и заменив соединение 1f на 5-метоксипиридин-3-илбороновую кислоту на стадии D, получили указанное соединение 10a. МС: m/z 494,2 (M+H)+.
B. Трет-бутиловый эфир 2-(S)-{[4-(3-ацетоксифенокси)-2-(5-метоксипиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (10b).
К раствору соединения 10a (50 мг, 0,1 ммоль) в тетрагидрофуране (5 мл), охлажденному до -78°C, добавили ацетилхлорид (0,009 мл, 0,12 ммоль) и триэтиламин (0,035 мл, 0,25 ммоль). Смесь перемешивали при температуре -78°C в течение 1 часа. Полученную смесь разбавили EtOAc и H2O. Органическую фазу последовательно промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 10b (43 мг, выход 80%). МС: m/z 536,0 (M+H)+.
C. Соединение 250: 3-{2-(5-метоксипиридин-3-ил)-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-4-илокси}фениловый эфир уксусной кислоты.
Используя адаптацию способа, описанного для стадии E примера 1, и заменив соединение 1g на соединение 10b, получили соединение 250 в виде гидрохлорида. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,67 (ушир.с, 1H), 9,37 (ушир.с, 1H), 8,75 (с, 1H), 8,44 (с, 1H), 8,35 (с, 1H), 7,99 (с, 1H), 7,55 (т, 1H), 7,31 (д, 1H), 7,26 (с, 1H), 7,11 (д, 1H), 6,63 (ушир.с, 1H), 3,88 (с, 3H), 3,84 (м, 1H), 3,62-3,68 (м, 2H), 3,13-3,25 (м, 2H), 2,28 (с, 3H), 2,10-2,18 (м, 1H), 1,85-2,02 (м, 2H), 1,68-1,76 (м, 1H); МС: m/z 436,0 (M+H)+.
Следуя процедуре, описанной выше для примера 10, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 11
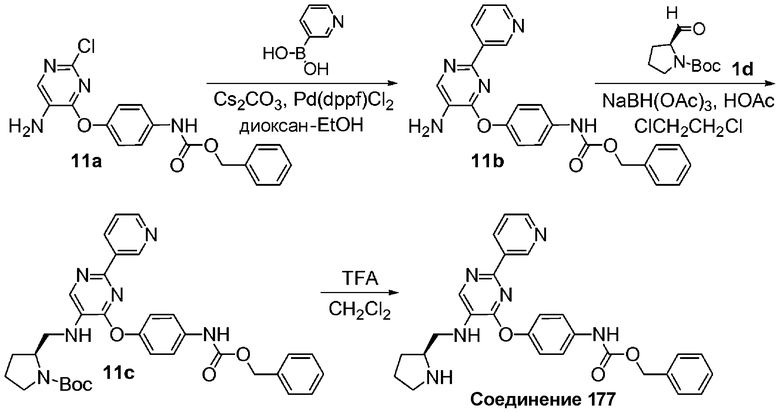
A. Бензиловый эфир [4-(5-Амино-2-хлорпиримидин-4-илокси)фенил]карбаминовой кислоты (11a). Указанное соединение приготовили аналогично соединению 1c в примере 1. Используя адаптацию способа, описанного на стадиях A и B, и заменив 4-метоксифенол на бензиловый эфир (4-гидроксифенил)карбаминовой кислоты (полученный в соответствии с методикой, описанной в патенте США № US3933470) на стадии A, получили указанное соединение 11a. МС: m/z 371,2 (M+H)+.
B. Бензиловый эфир [4-(5-амино-2-пиридин-3-илпиримидин-4-илокси)фенил]карбаминовой кислоты (11b).
В пробирку Шленка, закрытую септой с тефлоновым покрытием, добавили смесь соединения 11a (1,0 г, 2,7 ммоль), пиридин-3-илбороновой кислоты (0,83 г, 6,75 ммоль), Cs2CO3 (2,60 г, 8,1 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (0,49 г, 0,6 ммоль) в смеси диоксана (15 мл) и EtOH (1 мл), смесь подвергли облучению в микроволновом реакторе при 150°C в течение 55 минут. Реакционную смесь вылили в воду, разбавленную EtOAc, твердую фазу отделили путем фильтрации. Органическую фазу изолировали и высушили над MgSO4, после чего реакционную смесь сконцентрировали при пониженном давлении. Полученную смесь очистили обращенно-фазовой ВЭЖХ с использованием в качестве элюента градиента CH3CN-H2O (0,5% TFA) для получения соединения 11b (0,72 г, выход 42% в расчете на ди-TFA). 1H-ЯМР (300 МГц, MeOH-d4): δ 9,2 (с, 1H), 8,9 (д, 1H), 8,7 (д, 1H), 8,2 (с, 1H), 8,0 (м, 1H), 7,5 (д, 2H), 7,5-7,3 (м, 6H), 7,2 (м, 2H), 5,2 (с, 2H); МС: m/z 414,2 (M+H)+.
C. Трет-бутиловый эфир 2-(S)-{[4-(4-бензилоксикарбониламинофенокси)-2-пиридин-3-илпиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (11c).
К раствору соединения 11b (0,55 г, 1,3 ммоль) в 1,2-дихлорэтане (25 мл) добавили Boc-L-пролиналь (0,37 мл, 1,9 ммоль). Затем к реакционной смеси порционно добавляли NaBH(OAc)3 (0,4 г, 1,9 ммоль). Смесь непрерывно перемешивали при комнатной температуре в течение 5 часов. Полученную смесь разбавили водой. После перемешивания в течение 10 минут органическую фазу изолировали, промыли солевым раствором и высушили над MgSO4. Растворитель выпарили in vacuo для получения соединения 11c. Соединение использовали в следующей стадии без дополнительной очистки.
D. Соединение 177: бензиловый эфир (4-{2-пиридин-3-ил-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-4-илокси}фенил)карбаминовой кислоты (11d).
К раствору соединения 11c (80 мг, 0,13 ммоль) в CH2Cl2 (3 мл) добавили трифторуксусную кислоту (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, затем растворитель выпарили in vacuo для получения неочищенного остатка. Исходный материал очистили обращенно-фазовой ВЭЖХ, используя в качестве элюента градиент CH3CN-H2O, и получили соединение 177 (31,6 мг, выход 46%). 1H-ЯМР (300 МГц, MeOH-d4): δ 8,7 (д, 1H), 8,6 (д, 1H), 8,2 (с, 1H), 7,7 (м, 1H), 7,6 (м, 2H), 7,5-7,25 (м, 7H), 7,2 (м, 2H), 5,2 (с, 2H), 4,0 (м, 1H), 3,7 (м, 2H), 3,5-3,3 (м, 4H), 2,4 (м, 1H), 2,2 (м, 2H) 1,9 (м, 1H); МС: m/z 497,2 (M+H)+.
Следуя процедуре, описанной выше для примера 11, и заменив соответствующие реактивы, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
Пример 12
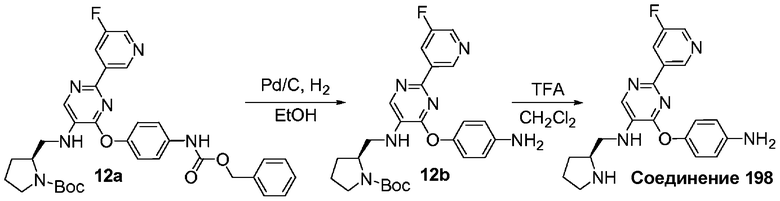
A. Трет-бутиловый эфир 2-(S)-{[4-(4-бензилоксикарбониламинофенокси)-2-(5-фторпиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (12a).
Указанное соединение приготовили в соответствии со способом, описанным для соединения 11c в примере 11. Используя адаптацию способа, описанного на стадиях A-C, и заменив пиридин-3-илбороновую кислоту на 5-фторпиридин-3-илбороновую кислоту на стадии B, получили указанное соединение 12a. МС: m/z 615,2 (M+H)+.
B. Трет-бутиловый эфир 2-(S)-{[4-(4-аминофенокси)-2-(5-фторпиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (12b).
В колбу Парра поместили 10% Pd/C (100 мг), соединение 12a (1,2 г, 1,9 ммоль) и EtOH (35 мл). Реакционную смесь поместили под давление 0,34 мПа (50 фунтов на дюйм) в атмосфере H2 и встряхивали в течение 20 часов. Катализатор отделили путем вакуумной фильтрации, фильтрат выпарили in vacuo для получения соединения 12b. Соединение использовали в следующей стадии без дополнительной очистки. МС: m/z 481,0 (M+H)+.
C. Соединение 198: [4-(4-аминофенокси)-2-(5-фторпиридин-3-ил)пиримидин-5-ил]пирролидин-2-(S)-илметиламин.
Используя адаптацию способа, описанного для стадии D примера 11, и заменив соединение 11c на соединение 12b, получили соединение 198 (выход 100% в расчете на соль TFA). 1H-ЯМР (300 МГц, MeOH-d4): δ 8,8 (с, 1H), 8,3 (с, 1H), 8,2 (с, 1H), 8,0 (м, 1H), 7,6-7,4 (м, 4H), 4,0 (ушир.м, 1H), 3,6 (м, 2H), 3,5-3,2 (м, 4H), 2,2 (м, 1H), 2,0 (м, 2H), 1,8 (м, 1H); МС: m/z 381,2 (M+H)+.
Пример 13
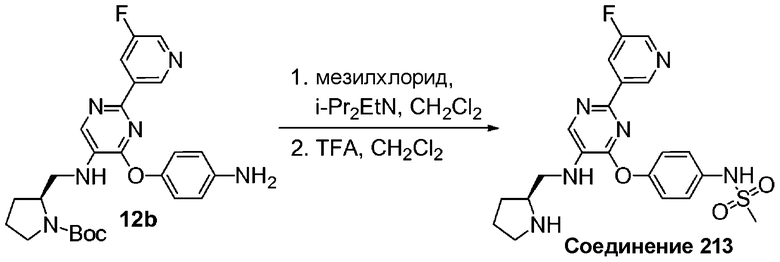
A. Соединение 213: N-(4-{2-(5-фторпиридин-3-ил)-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-4-илокси}фенил)метансульфонамид.
К раствору соединения 12b (30 мг, 0,062 ммоль) и i-Pr2EtN (0,044 мл, 0,25 ммоль) в CH2Cl2 (4 мл), охлажденному до 0°C, добавили раствор мезилхлорида (0,0044 мл, 0,062 ммоль) в CH2Cl2 (2 мл) в течение 2 часов. Реакционную смесь нагрели до комнатной температуры и перемешивали при комнатной температуре в течение 20 часов. Затем добавили воду, органическую фазу изолировали, высушили над MgSO4 и профильтровали, а к фильтрату добавили TFA (0,5 мл). Смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель упарили in vacuo. Остаток очистили обращенно-фазовой ВЭЖХ, используя в качестве элюента градиент CH3CN-H2O, и получили соединение 213 (3,4 мг, выход 7%). 1H-ЯМР (300 МГц, ДМСО-d6): δ 8,9 (м, 1H), 8,6 (д, 1H), 8,45 (м, 1H), 8,3 (м, 2H), 7,7 (д, 2H), 7,5 (м, 1H), 7,25 (д, 2H), 3,85 (м, 1H), 3,5 (м, 2H), 3,2 (м, 2H), 3,1-2,7 (м, 2H), 2,6 (с, 3H), 2,1 (м, 1H), 1,95 (м, 1H), 1,7 (м, 1H); МС: m/z 459,1 (M+H)+.
Следуя процедуре, описанной выше для примера 13, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 14
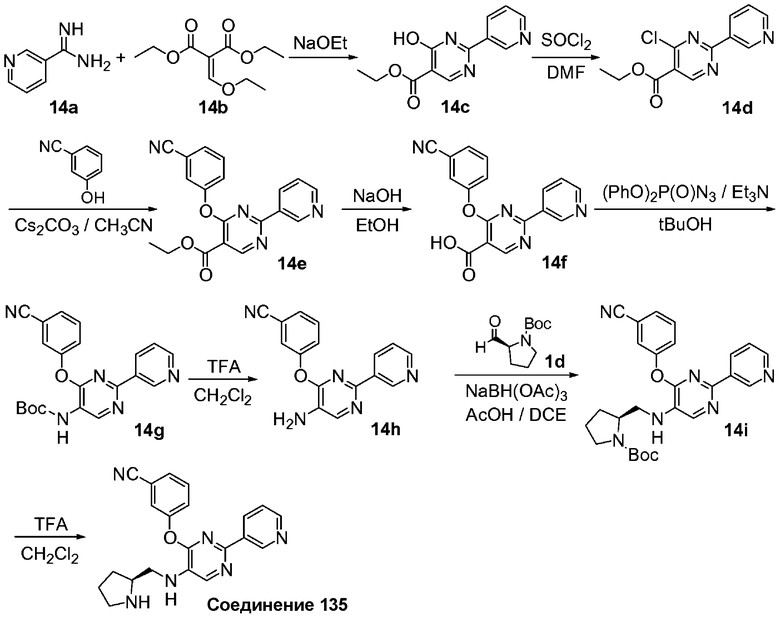
A. Этиловый эфир 4-гидрокси-2-пиридин-3-илпиримидин-5-карбоновой кислоты (14c). Суспензию соединения 14a (6,1 г, 38,64 ммоль) в растворе натрия этоксида (21% по массе в денатурированном этаноле) (100 мл) перемешивали при комнатной температуре в течение 10 минут. К смеси добавили соединение 14b (7,81 мл, 38,65 ммоль) при 0°C.
Полученную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавили воду (100 мл), pH установили на уровне 5 с помощью 2н HCl. Водную фазу подвергли экстракции с помощью CH2Cl2 (3×150 мл). Комбинированные органические фазы высушили в присутствии MgSO4 и сконцентрировали. К остатку добавили Et2O (100 мл). Твердое вещество (соединение 14c) собрали фильтрованием и высушили. 1H ЯМР (300 МГц, CDCl3): δ 9,80 (с, 1H), 9,10 (с, 1H), 7,75-8,90 (м, 2H), 7,50 (дд, 1H), 4,50 (кв, 2H), 1,50 (т, 3H); МС: m/z 246,1 (M+H)+.
B. Этиловый эфир 4-хлор-2-пиридин-3-илпиримидин-5-карбоновой кислоты (14d).
К суспензии соединения 14c (5,05 г, 20,59 ммоль) в DMF (70 мл) добавили SOCl2 (3 мл, 41,23 ммоль) по каплям при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 30 минут, затем прилили к суспензии K2CO3 (3,41 г) в ледяной воде. Полученное вещество (соединение 14d) собрали фильтрованием и высушили. 1H ЯМР (300 МГц, CDCl3): δ 9,70 (с, 1H), 9,20 (с, 1H), 7,70-8,85 (м, 2H), 7,50 (дд, 1H), 4,50 (кв., 2H), 1,45 (т, 3H); МС: m/z 264,1 (M+H)+.
C. Этиловый эфир 4-(3-цианофенокси)-2-пиридин-3-илпиримидин-5-карбоновой кислоты (14e).
Смесь соединения 14d (1,0 г, 3,79 ммоль), 3-цианофенола (0,587 г, 4,93 ммоль) и Cs2CO3 (4,93 г, 15,13 ммоль) в CH3CN (25 мл) перемешивали при комнатной температуре в течение 2 часов. Суспензию вылили в ледяную воду и экстрагировали с помощью CH2Cl2 (3×50 мл). Объединенную органическую фазу высушили над MgSO4 и сконцентрировали для получения соединения 14e. 1H ЯМР (300 МГц, CDCl3): δ 9,40 (с, 1H), 9,25 (с, 1H), 8,70 (д, 1H), 8,45 (м, 1H), 7,45-7,65 (м, 4H), 7,35 (м, 1H), 4,50 (кв, 2H), 1,45 (т, 3H); МС: m/z 347,2 (M+H)+.
D. Этиловый эфир 4-(3-цианофенокси)-2-пиридин-3-илпиримидин-5-карбоновой кислоты (14f).
К суспензии соединения 14e (1,06 г, 3,06 ммоль) в EtOH (50 мл) добавили 0,5н NaOH (9 мл, 4,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. pH реакционной смеси был установлен на уровне 2 с использованием 1н HCl. Полученный белый нерастворимый остаток отфильтровали для получения соединения 14f. 1H ЯМР (300 МГц, ДМСО d 6): δ 9,21 (с, 1H), 9,18 (д, 1H), 8,70 (д, 1H), 8,35 (дд, 1H), 7,95 (с, 1H), 7,85 (дд, 1H), 7,75 (м, 2H), 7,50 (дд, 1H); МС: m/z 319,2 (M+H)+.
E. Трет-бутиловый эфир [4-(3-цианофенокси)-2-пиридин-3-илпиримидин-5-ил]карбаминовой кислоты (14g).
К раствору Et3N (0,058 мл, 0,42 ммоль) в tBuOH (9,35 мл) добавили молекулярные сита 4Å (3 г). Смесь нагревали с обратным холодильником в течение 30 минут в атмосфере N2. К смеси добавили соединение 14f (0,1 г, 0,31 ммоль) и дифенилфосфорилазид (0,085 мл, 0,39 ммоль), после чего смесь нагревали с обратным холодильником в течение 3 часов в атмосфере N2 . Реакционную смесь остудили до комнатной температуры, профильтровали и сконцентрировали. Полученный остаток суспендировали в EtOAc (10 мл), промыли водой (10 мл) и солевым раствором (10 мл), высушили над MgSO4 и сконцентрировали. Исходный продукт очистили обращенно-фазовой ВЭЖХ для получения соединения 14g. 1H ЯМР (300 МГц, CD3OD): δ 9,30 (с, 1H), 9,20 (с, 1H), 8,80 (д, 1H), 8,65 (д, 1H), 7,80 (дд, 1H), 7,70 (с, 1H), 7,65 (м, 3H), 1,50 (с, 9H); МС: m/z 390,3 (M+H)+.
F. 3-(5-Амино-2-пиридин-3-илпиримидин-4-илокси)бензонитрил (15h).
К раствору соединения 14g (0,78 г, 2,0 ммоль) в CH2Cl2 (20 мл) добавили TFA (4 мл). Смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель выпарили при пониженном давлении для получения соединения 14h. Неочищенный продукт использовали в следующей реакции без дополнительной очистки. МС: m/z 290,3 (M+H)+.
G. Трет-бутиловый эфир 2-(S)-{[4-(3-цианофенокси)-2-пиридин-3-илпиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (14i).
К суспензии соединения 14h (0,52 г, 1,8 ммоль) и соединения 1d (0,505 мл, 2,69 ммоль) в 1,2-дихлорэтане (10 мл) добавили уксусную кислоту (0,103 мл, 1,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. К смеси добавили натрия триацетоксиборгидрид (0,46 г, 2,17 ммоль). Смесь перемешивали при комнатной температуре в течение 20 часов. К смеси добавили дополнительную порцию натрия триацетоксиборгидрида (0,92 г, 4,34 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 6 часов, затем разбавили EtOAc (50 мл) и промыли H2O (2×20 мл). Органический слой высушили над MgSO4 и сконцентрировали. Исходный продукт очистили обращенно-фазовой ВЭЖХ для получения соединения 14i. 1H ЯМР (300 МГц, MeOH-d4): δ 9,20 (с, 1H), 8,95 (д, 1H), 8,20 (д, 1H), 8,45 (с, 1H), 8,00 (дд, 1H), 7,65-7,8 (м, 4H), 4,20 (м, 1H), 3,3-3,6 (м, 4H), 1,9-2,1 (м, 4H), 1,5 (с, 9H); МС: m/z 473,4 (M+H)+.
H. Соединение 135: 3-{2-пиридин-3-ил-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-4-илокси}бензонитрил.
К раствору соединения 14i (0,05 г, 0,106 ммоль) в CH2Cl2 (2 мл) добавили TFA (0,4 мл). Смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель выпарили при пониженном давлении. Исходный продукт очистили обращенно-фазовой ВЭЖХ для получения соединения 135 в виде соли TFA. 1H ЯМР (300МГц, MeOH-d4): δ 9,20 (с, 1H), 8,95 (д, 1H), 8,75 (д, 1H), 8,35 (с, 1H), 8,00 (дд, 1H), 7,60-7,80 (м, 4H), 4,00 (м, 1H), 3,70 (м, 2H), 3,40 (м, 2H), 2,4 (м, 1H), 2,15 (м, 2H), 1,9 (м, 1H); МС: m/z 373,2 (M+H)+.
Следуя процедуре, описанной выше для примера 14, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 15
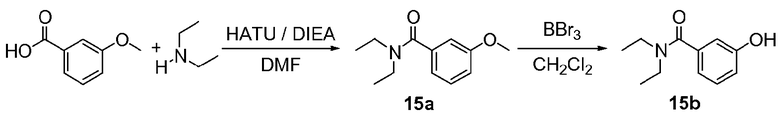
A. N,N-Диэтил-3-метоксибензамид (15a).
К раствору m-анисовой кислоты (0,5 г, 3,29 ммоль) и HATU (1,4 г, 3,68 ммоль) в DMF (5 мл) добавили N,N-диизопропилэтиламин (2 мл, 11,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. К реакционной смеси добавили диэтиламин (0,377 мл, 3,62 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 дней, затем разбавили H2O (5 мл) и экстрагировали с помощью EtOAc (2×5 мл). Органический слой высушили над MgSO4, сконцентрировали и получили соединение 15a. Исходный продукт использовали в следующей реакции без дополнительной очистки. МС: m/z 208,2 (M+H)+.
B. N,N-Диэтил-3-гидроксибензамид (15b).
К раствору соединения 15a (0,68 г, 3,28 ммоль) в CH2Cl2 (50 мл) по каплям добавили BBr3 (1,0 М в CH2Cl2 (16 мл; 16 ммоль) при температуре 0°С.
Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Смесь погасили насыщенным водным раствором NaHCO3. Органический слой высушили над MgSO4, сконцентрировали и получили соединение 15b. Исходный продукт использовали в следующей реакции без дополнительной очистки. МС m/z 194,2 (M+H)+.
Следуя процедуре, описанной выше для примера 15, и заменив диэтиламин на пирролидин на стадии A, получили соединение 15c:
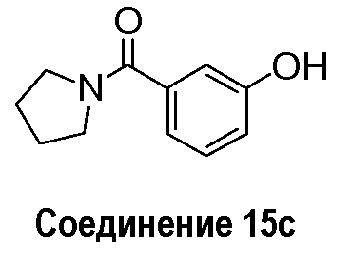
Следуя процедуре, описанной выше для примера 14, и заменив соединение 14c на соединение 15c, а также используя соответствующие реактивы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
Пример 16
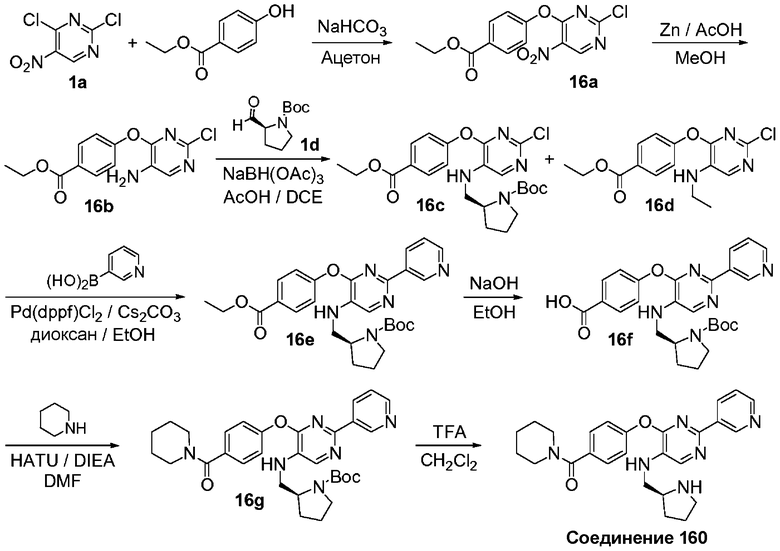
A. Этиловый эфир 4-(2-хлор-5-нитропиримидин-4-илокси)бензойной кислоты (16a).
К суспензии соединения 1a (2,0 г, 10,31 ммоль) и 0,5 Н NaHCO3 (20 мл, 10 ммоль) в ацетоне (60 мл) добавили раствор 4-гидроксибензойной кислоты этилового эфира (1,71 г, 10,29 ммоль) в ацетоне (20 мл) по каплям при 0°C.
Смесь перемешивали при температуре 0°C в течение 1 часа. Реакционную смесь сконцентрировали при пониженном давлении. Полученный остаток экстрагировали с использованием EtOAc (2×20 мл). Органический слой промыли солевым раствором, высушили над MgSO4 и сконцентрировали. Исходный продукт очистили нормально-фазовой хроматографией (SiO2) для получения соединения 16a. 1H ЯМР (300 МГц, CDCl3): δ 9,20 (с, 1H), 8,20 (д, 2H), 7,25 (д, 2H), 4,45 (кв, 2H), 1,4 (т, 3H); МС: m/z 324,1 (M+H)+.
B. Этиловый эфир 4-(5-амино-2-хлорпиримидин-4-илокси)-бензойной кислоты (16b).
К раствору соединения 16a (2,12 г, 6,55 ммоль) в AcOH (15 мл) и CH3OH (20 мл) добавили Zn (2,57 г, 39,31 ммоль) порциями при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Твердое вещество отделили путем фильтрации и промыли CH3OH. Полученный фильтрат сконцентрировали. Остаток погасили с помощью водного раствора NaOH (<1Н), pH установили на уровне ~7, а затем экстрагировали с помощью EtOAc (2×20 мл). Органический слой высушили над MgSO4 и сконцентрировали. Исходный продукт очистили нормально-фазовой хроматографией (SiO2) для получения соединения 16b. 1H ЯМР (300 МГц, CDCl3): δ 8,15 (д, 2H), 7,95 (с, 1H), 7,25 (д, 2H), 4,45 (кв, 2H), 1,4 (т, 3H); МС: m/z 294,1 (M+H)+.
C. Трет-бутиловый эфир 2-(S)-{[2-хлор-4-(4-этоксикарбонилфенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (16c) и этиловый эфир 4-(2-хлор-5-этиламинопиримидин-4-илокси)бензойной кислоты (16d).
К суспензии соединения 16b (0,82 г, 2,79 ммоль) и Boc-L-пролиналя (соединение 1d) (0,67 г, 3,36 ммоль) в 1,2-дихлорэтане (10 мл) добавили уксусную кислоту (0,16 мл, 2,79 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. К смеси добавили натрия триацетоксиборгидрид (0,89 г, 4,20 ммоль). Смесь перемешивали при комнатной температуре в течение 20 часов. К смеси добавили дополнительную порцию натрия триацетоксиборгидрида (0,89 г, 4,20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 дней, затем разбавили EtOAc (50 мл) и промыли H2O (2×20 мл). Органический слой высушили над MgSO4 и сконцентрировали. Исходный продукт очистили нормально-фазовой хроматографией (SiO2) для получения соединений 16c и 16d. Соединение 16c- МС: m/z 477,3 (M+H)+. Соединение 16d- МС: m/z 322,2 (M+H)+.
D. Трет-бутиловый эфир 2-(S)-{[4-(4-этоксикарбонилфенокси)-2-пиридин-3-илпиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (16e).
К суспензии соединения 16c (0,76 г, 1,59 ммоль), пиридин-3-илбороновой кислоты (0,235 г, 1,91 ммоль) и Cs2CO3 (1,30 г, 3,99 ммоль) в смеси диоксан (10 мл)/EtOH (2 мл) добавили комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) хлорид с дихлорметаном (0,116 г, 0,159 ммоль). Смесь перемешивали при температуре 80°C в течение 4 часов, а затем охладили до комнатной температуры. Твердое вещество отделили путем фильтрации и промыли CH3OH. Полученный фильтрат сконцентрировали. Исходный продукт очистили обращенно-фазовой ВЭЖХ для получения соединения 16e. МС: m/z 520,3 (M+H)+.
E. Трет-бутиловый эфир 2-(S)-{[4-(4-карбоксифенокси)-2-пиридин-3-илпиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (16f).
К суспензии соединения 16e (0,4 г, 0,77 ммоль) в EtOH (10 мл) добавили 0,5н NaOH (2,3 мл, 1,15 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавили дополнительную порцию 0,5н NaOH (6 мл, 3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. pH установили на уровне 2 с помощью 1н HCl. Белый нерастворимый остаток отфильтровали для получения соединения 16f. МС: m/z 492,3 (M+H)+.
F. Трет-бутиловый эфир 2-(S)-{[4-(4-пиперидин-1-карбонил)-фенокси]-2-пиридин-3-илпиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (16g).
К раствору соединения 16f (0,08 г, 0,16 ммоль) и HATU (0,065 г, 0,17 ммоль) в DMF (3 мл) добавили N,N-диизопропилэтиламин (0,115 мл, 0,66 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавили пиперидин (0,017 мл, 0,17 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа, добавили в H2O (3 мл) и экстрагировали с помощью EtOAc (2×5 мл). Органический слой высушили над MgSO4, сконцентрировали и получили соединение 16g. Исходный продукт использовали в следующей реакции без дополнительной очистки. МС: m/z 559,3 (M+H)+.
G. Соединение 160: пиперидин-1-ил-(4-{2-пиридин-3-ил-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-4-илокси}фенил)метанон.
К раствору соединения 16g (0,089 г, 0,16 ммоль) в CH2Cl2 (4 мл) добавили TFA (0,8 мл). Смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель выпарили при пониженном давлении. Исходный продукт очистили обращенно-фазовой ВЭЖХ для получения соединения 160 в виде соли TFA. 1H ЯМР (300 МГц, MeOH-d4): δ 9,21 (с, 1H), 8,95 (д, 1H), 8,75 (д, 1H), 8,35 (с, 1H), 7,95 (дд, 1H), 7,55 (д, 2H), 7,40 (д, 2H), 4,05 (м, 1H), 3,6-3,85 (м, 4H), 3,3-3,55 (м, 4H), 2,35 (м, 1H), 2,20 (м, 2H), 1,9 (м, 1H), 1,55-1,85 (м, 6H); МС: m/z 459,3 (M+H)+.
Следуя процедуре, описанной выше для примера 16, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Соединение 159:
Провели снятие защиты с соединения 16f с помощью TFA/CH2Cl2, как описано на стадии G примера 16, для получения соединения 159 в виде соли TFA. МС: m/z 392,3 (M+H)+.
Соединение 163:
Указанное соединение получили аналогично соединению 159, заменив этиловый эфир 4-гидроксибензойной кислоты на этиловый эфир 3-гидроксибензойной кислоты на стадии A примера 16. МС: m/z 392,3 (M+H)+.
Соединение 164:
Указанное соединение получили аналогично соединению 159, заменив этиловый эфир 4-гидроксибензойной кислоты на этиловый эфир 3-гидроксибензойной кислоты на стадии A и заменив пиридин-3-илбороновую кислоту на 5-фторпиридин-3-илбороновую кислоту на стадии D примера 16. МС: m/z 410,2 (M+H)+.
Соединение 165: Указанное соединение получили аналогично соединению 159, заменив пиридин-3-илбороновую кислоту на 5-фторпиридин-3-илбороновую кислоту на стадии D примера 16. МС: m/z 410,2 (M+H)+.
Пример 17
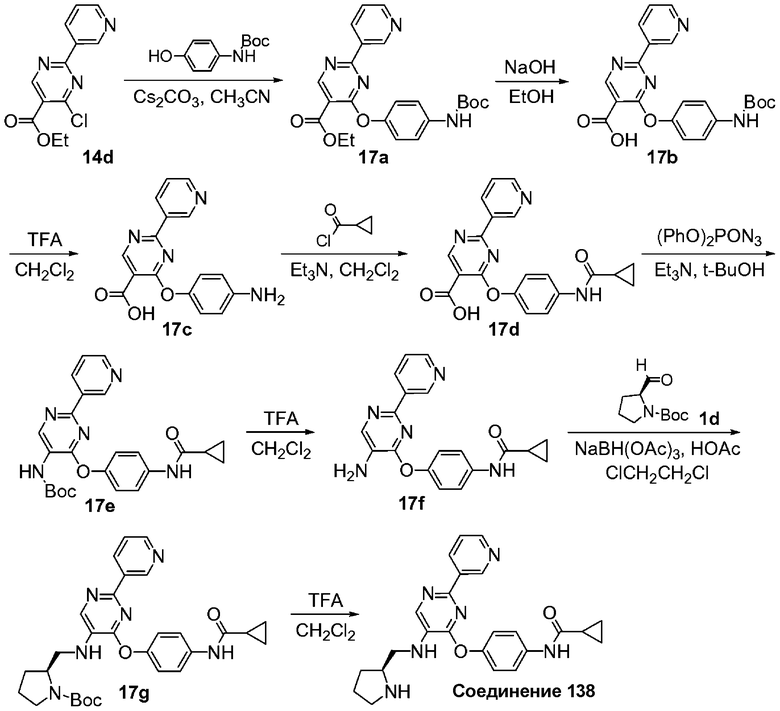
A. Этиловый эфир 4-(4-трет-бутоксикарбониламинофенокси)-2-пиридин-3-илпиримидин-5-карбоновой кислоты (17a).
Используя адаптацию способа, описанного для стадии C примера 14, и заменив 3-цианофенол на (4-гидроксифенил)карбаминовую кислоту, получили указанное соединение 17a. МС: m/z 437,3 (M+H)+.
B. 4-(4-Трет-бутоксикарбониламинофенокси)-2-пиридин-3-илпиримидин-5-карбоновая кислота (17b).
Используя адаптацию способа, описанного для стадии D примера 14, и заменив соединение 14e на соединение 17a, получили указанное соединение 17b. МС: m/z 409,2 (M+H)+.
C. 4-(4-Аминофенокси)-2-пиридин-3-илпиримидин-5-карбоновая кислота (17c).
К раствору соединения 17b (1,5 г, 3,6 ммоль) в CH2Cl2 (30 мл) добавили TFA (10 мл). Раствор перемешивали при комнатной температуре в течение 1,5 часов, а затем выпарили in vacuo. Остаток измельчили в порошок с Et2O, твердую фазу отделили и высушили для получения указанного соединения 17c (2,25 г, выход 96% в расчете на соль три-TFA). МС: m/z 309,2 (M+H)+.
D. 4-[4-(Циклопропанкарбониламино)фенокси]-2-пиридин-3-илпиримидин-5-карбоновая кислота (17d). К раствору соединения 17c (0,5 г, 1,6 ммоль) в CH2Cl2 (6 мл) добавили Et3N (0,72 г, 6,4 ммоль) и хлорид циклопропилкарбонила (0,19 мл, 2,1 ммоль). Раствор перемешивали при комнатной температуре в течение 1 часа, а затем реакционную смесь вылили в воду. Смесь профильтровали для отделения твердой фазы и высушили для получения соединения 17d (410 мг, выход 68%). МС: m/z 376,1 (M+H)+.
E. Трет-бутиловый эфир {4-[4-(циклопропанкарбониламино)фенокси]-2-пиридин-3-илпиримидин-5-ил}карбаминовой кислоты (17e).
Используя адаптацию способа, описанного для стадии E примера 14, и заменив соединение 14f на соединение 17d, получили соединение 17e (выход 16%). МС: m/z 448,2 (M+H)+.
F. [4-(5-Амино-2-пиридин-3-илпиримидин-4-илокси)фенил]амид циклопропанкарбоновой кислоты (17f).
Используя адаптацию способа, описанного для стадии F примера 14, и заменив соединение 14g на соединение 17e, получили соединение 17f (выход 78%). Неочищенный продукт использовали в следующей реакции без дополнительной очистки. МС: m/z 347,3 (M+H)+.
G. Трет-бутиловый эфир 2-(S)-({4-[4-(циклопропанкарбониламино)фенокси]-2-пиридин-3-илпиримидин-5-иламино}метил)пирролидин-1-карбоновой кислоты (17g).
Используя адаптацию способа, описанного для стадии G примера 14, и заменив соединение 14h на соединение 17f, получили соединение 17g. МС: m/z 531,3 (M+H)+.
H. Соединение 138: (4-{2-пиридин-3-ил-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-4-илокси}фенил)амид циклопропанкарбоновой кислоты.
Используя адаптацию способа, описанного для стадии H примера 15, и заменив соединение 14i на соединение 17g, получили соединение 138 (выход 15% на основе соли ди-TFA). 1H-ЯМР (300 МГц, ДМСО-d6): δ 8,6 (д, 2H), 8,5 (м, 1H), 8,3 (м, 2H), 7,7 (м, 2H), 7,5 (м, 1H), 7,25 (м, 2H), 6,3 (м, 1H), 3,9 (м, 1H), 3,5 (м, 2H), 3,2 (м, 2H) 3,1-2,8 (м, 2H), 2,15 (м, 1H), 1,9 (м, 2H), 1,8-1,6 (м, 3H), 0,9 (д, 2H); МС: m/z 431,3 (M+H)+.
Пример 18

A. Трет-бутиловый эфир 2-(S)-{[2-хлор-4-(4-гидроксиметилфенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (18a).
Указанное соединение приготовили аналогично соединению 1e в примере 1. Используя адаптацию способа, описанного для стадий A-C, и заменив 4-метоксифенол на 4-гидроксиметилфенол на стадии A, получили указанное соединение 18a. МС: m/z 435,2 (M+H)+.
B. Трет-бутиловый эфир 2-(S)-{[4-(4-гидроксиметилфенокси)-2-пиридин-3-илпиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (18b).
Используя адаптацию способа, описанного для стадии D примера 1, и заменив соединение 1e на соединение 18a и соединение 1f на пиридин-3-илбороновую кислоту, получили указанное соединение 18b (выход 73%). МС: m/z 478,2 (M+H)+.
C. Трет-бутиловый эфир 2-(S)-{[4-(4-фторметилфенокси)-2-пиридин-3-илпиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (18c).
К раствору трифторида (диэтиламино)серы (0,036 мл, 0,28 ммоль) в CH2Cl2 (2 мл), охлажденному до -78°C, добавили раствор соединения 18b (100 мг, 0,21 ммоль) в CH2Cl2 (1 мл). Реакционную смесь перемешивали при температуре -78°C в течение 20 минут. Полученную смесь разделили между EtOAc и H2O. Органическую фазу промыли водой и высушили над Na2SO4.
Затем смесь отфильтровали, растворитель удалили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 18c (50 мг, выход 50%). МС: m/z 480,2 (M+H)+.
D. Соединение 217: [4-(4-фторметилфенокси)-2-пиридин-3-илпиримидин-5-ил]пирролидин-2-(S)-илметиламин.
Используя адаптацию способа, описанного для стадии E примера 1, и заменив соединение 1g на соединение 18c, получили соединение 217 в виде гидрохлорида. 1H-ЯМР (400 МГц, MeOH-d4): δ 9,21 (ушир.с, 1H), 8,73-8,74 (м, 1H), 8,63 (ушир.с, 1H), 8,27-8,29 (м, 1H), 7,75 (ушир.с, 1H), 7,45-7,58 (м, 2H), 7,30-7,39 (м, 2H), 5,36-5,51 (м, 2H), 4,02-4,05 (м, 1H), 3,67-3,73 (м, 2H), 3,41-3,48 (м, 2H), 2,32-2,38 (м, 1H), 2,09-2,21 (м, 2H), 1,86-1,95 (м, 1H); МС: m/z 380,2 (M+H)+.
Следуя процедуре, описанной выше для примера 18, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 19
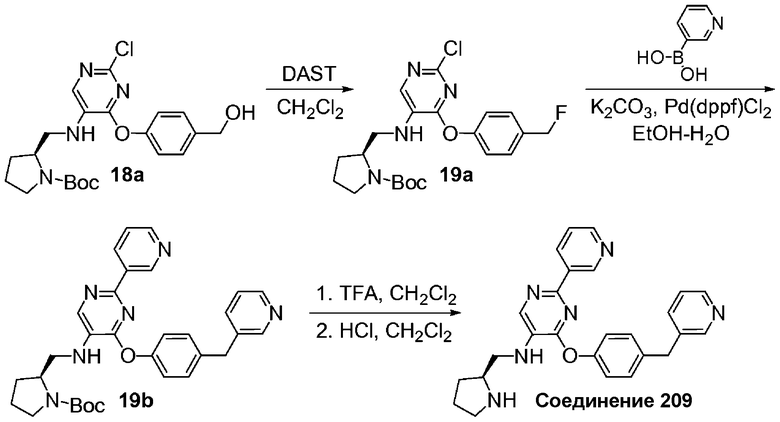
A. Трет-бутиловый эфир 2-(S)-{[2-хлор-4-(4-фторметилфенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (19a).
Используя адаптацию способа, описанного для стадии C примера 18, и заменив соединение 18b на соединение 18a, получили соединение 19a (выход 23%). МС: m/z 437,2 (M+H)+.
B. Трет-бутиловый эфир 2(S)-{[2-пиридин-3-ил-4-(4-пиридин-3-илметилфенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (19b).
Используя адаптацию способа, описанного для стадии D примера 1, и заменив соединение 1e на соединение 19a и соединение 1f на пиридин-3-илбороновую кислоту, получили указанное соединение 19b (выход 22%). 1H-ЯМР (400 МГц, CDCl3): δ 9,26 (с, 1H), 8,55 (д, 1H), 8,51 (дд, 2H), 8,32 (д, 1H), 8,01-8,06 (м, 1H), 7,53 (д, 1H), 7,18-7,27 (м, 6H), 5,78 (ушир.с, 0,7H), 4,85 (ушир.с, 0,3 H), 4,21-4,32 (м, 1H), 4,04 (с, 2H), 3,21-3,54 (м, 4H), 1,84-2,14 (м, 4H); МС: m/z 539,3 (M+H)+.
C. Соединение 209: [2-пиридин-3-ил-4-(4-пиридин-3-илметилфенокси)пиримидин-5-ил]пирролидин-2-(S)-илметиламин.
Используя адаптацию способа, описанного для стадии E примера 1, и заменив соединение 1g на соединение 19b, получили соединение 209 в виде гидрохлорида. 1H-ЯМР (400 МГц, MeOH-d4): δ 9,12 (ушир.с, 1H), 8,44-8,57 (м, 4H), 8,23 (с, 1H), 7,94 (д, 1H), 7,47-7,57 (м, 2H), 7,41 (д, 2H), 7,29 (д, 2H), 4,17 (с, 2H), 4,01-4,04 (м, 1H), 3,67-3,70 (м, 2H), 3,45-3,54 (м, 2H), 2,31-2,39 (м, 1H), 2,08-2,21 (м, 2H), 1,85-1,95 (м, 1H); МС: m/z 439,2 (M+H)+.
Пример 20
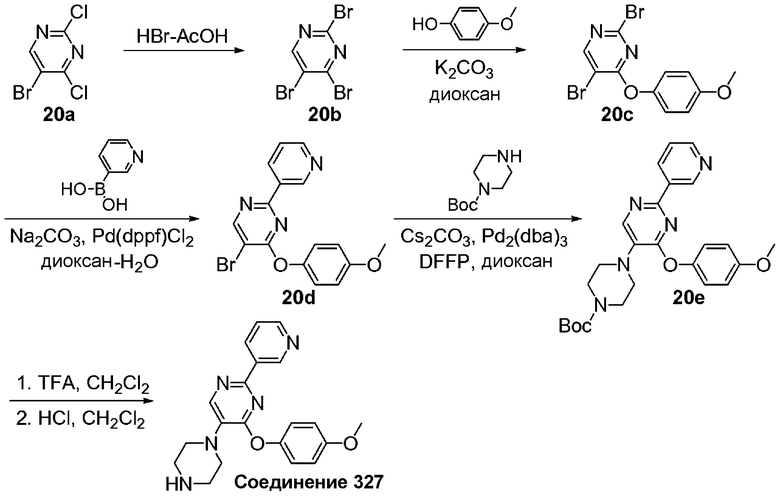
A. 2,4,5-Трибромпиримидин (20b). В сосуде высокого давления нагревали суспензию 2,4-дихлор-5-бромпиримидина (соединение 20a) (3,0 г, 13,2 ммоль) в растворе HBr (33% по массе в AcOH) (35 мл) до 50°C в течение 4 часов с последующим охлаждением на ледяной бане. Реакционную смесь вылили в воду со льдом (двукратный объем) и экстрагировали с помощью EtOAc. Органическую фазу последовательно промыли H2O и соляным раствором, а затем высушили над Na2SO4.
Смесь отфильтровали, растворитель упарили при пониженном давлении и получили исходный материал. Исходный материал перекристаллизовали из EtOAc-гексанов и получили соединение 20b (3,75 г, выход 90%) в виде твердого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,58 (с, 1H); МС: m/z 314,8 (M+H)+.
B. 2,5-Дибром-4-(4-метоксифенокси)пиримидин (26c). Смесь соединения 20b (0,39 г, 1,23 ммоль), K2CO3 (0,25 г, 1,85 ммоль) и 4-метоксифенола (0,15 г, 1,23 ммоль) в диоксане (4 мл) нагревали при температуре 65°C в течение 20 часов. Реакционную смесь профильтровали, а фильтрат разбавили EtOAc и H2O. Органическую фазу последовательно промыли H2O и соляным раствором, а затем высушили над Na2SO4.
Смесь отфильтровали, растворитель упарили при пониженном давлении и получили исходный материал. Исходный материал перекристаллизовали из смеси EtOAc-гексан для получения соединения 20c (0,42 г, выход 95%) в виде белого нерастворимого вещества. 1H-ЯМР (400 МГц, CDCl3): δ 8,49 (с, 1H), 7,10 (д, 2H), 6,95 (д, 2H), 3,84 (с, 3H); МС: m/z 359,0 (M+H)+.
C. 5-Бром-4-(4-метокси-фенокси)-2-пиридин-3-илпиримидин (20d).
Под давлением в атмосфере аргона смесь соединения 20c (2,27 г, 6,31 ммоль), пиридин-3-бороновой кислоты (853 мг, 6,94 ммоль), Na2CO3 (1,34 г, 12,6 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (258 мг, 0,32 ммоль) в диоксане (32 мл) перемешивали при комнатной температуре в течение 5 минут, а затем добавили деионизированную воду (8 мл). Всю смесь нагревали при температуре 55°C под давлением в атмосфере аргона в течение 20 часов. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органическую фазу последовательно промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 20d (1,44 г, выход 64%) в виде твердого вещества беловатого цвета. 1H-ЯМР (400 МГц, CDCl3): δ 9,33 (дд, 1H), 8,77 (с, 1H), 8,64 (дд, 1H), 8,41 (дт, 1H), 7,32 (тд, 1H), 7,16 (дд, 2H), 6,97 (дд, 2H), 3,87 (с, 3H); МС: m/z 358,0 (M+H)+.
D. Трет-бутиловый эфир 4-[4-(4-метоксифенокси)-2-пиридин-3-илпиримидин-5-ил]пиперазин-1-карбоновой кислоты (20e).
В сухую пробирку Шленка добавили смесь соединения 20d (100 мг, 0,28 ммоль), трет-бутилового эфира пиперазин-1-карбоновой кислоты (52 мг, 0,56 ммоль), Cs2CO3 (227 мг, 0,70 ммоль), (дифенилфосфино)ферроцена (54 мг, 0,10 ммоль) и трис(дибензилиденацетон)дипалладия(0) (25,6 мг, 0,028 ммоль). Колбы закрыли септой с тефлоновым покрытием, откачали и заполнили аргоном. К смеси с помощью шприца добавили диоксан (0,3 мл, реакционная концентрация >0,75 M). Полученную смесь выдерживали при температуре 95°C в течение 3 часов. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органическую фазу последовательно промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 20e (104 мг, выход 80%). 1H-ЯМР (400 МГц, CDCl3): δ 9,28 (д, 1H), 8,58 (дд, 1H), 8,35 (дт, 1H), 8,22 (с, 1H), 7,29 (тд, 1H), 7,14 (дд, 2H), 6,98 (дд, 2H), 3,87 (с, 3H), 3,66 (т, 4H), 3,25 (т, 4H), 1,56 (с, 9H); МС: m/z 464,2 (M+H)+.
E. Соединение 327: 4-(4-метоксифенокси)-5-пиперазин-1-ил-2-пиридин-3-илпиримидин.
Используя адаптацию способа, описанного для стадии E примера 1, и заменив соединение 1g на соединение 20e, получили соединение 327 в виде гидрохлорида. Свободное основание: 1H-ЯМР (400 МГц, CDCl3): δ 9,28 (д, 1H), 8,57 (дд, 1H), 8,34 (дт, 1H), 8,23 (с, 1H), 7,28 (тд, 1H), 7,15 (дд, 2H), 6,97 (дд, 2H), 3,87 (с, 3H), 3,28 (т, 4H), 3,11 (т, 4H); МС: m/z 364,2 (M+H)+.
Следуя процедуре, описанной выше для примера 20, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Следуя процедуре, описанной выше для примера 20, и заменив соответствующие реактивы, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения, в качестве смесей, содержащих 4 изомера.
С использованием способов очистки, известных специалистам в данной области, указанные выше смеси, составляющие предмет настоящего изобретения, подвергли дальнейшему разделению на соответствующие диастереоизомеры и/или одиночный стереоизомер.
2С использованием Boc-защищенных смесей провели хиральное разделение для получения Boc-защищенных одиночных изомеров, с которых затем удалили защиту для получения примеров соединений.
Пример 21
(альтернативный способ получения соединений, описанных в примере 20)
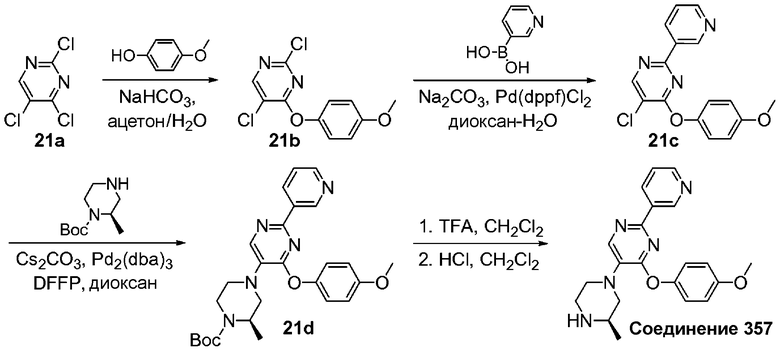
A. 2,5-Дихлор-4-(4-метоксифенокси)пиримидин (21b).
К раствору соединения 21a (5 г, 27,26 ммоль) в ацетоне (480 мл), охлажденному до 0°C, добавили раствор 4-метоксифенола (3,38 г, 27,26 ммоль) в смеси 1н NaHCO3 (водн.) (27,3 мл) и H2O (120 мл) по каплям с помощью капельной воронки. После добавления реакционную смесь нагрели до температуры окружающей среды, а затем смесь перемешивали при комнатной температуре в течение 3 часов. Полученную смесь сконцентрировали in vacuo, остаток разбавили EtOAc, затем последовательно промыли 1н NaOH (водн.) и H2O. Органическую фазу последовательно промыли H2O и соляным раствором, а затем высушили над Na2SO4.
Смесь отфильтровали, фильтрат упарили при пониженном давлении и получили исходный материал. Исходный материал перекристаллизовали из EtOAc-гексанов и получили соединение 21b (7,0 г, выход 94%). 1H-ЯМР (400 МГц, CDCl3): δ 8,46 (с, 1H), 7,09-7,27 (м, 2H), 6,94-6,98 (м, 2H), 3,85 (с, 3H); МС: m/z 271,0 (M+H)+.
B. 5-Хлор-4-(4-метоксифенокси)-2-пиридин-3-илпиримидин (21c).
Под давлением в атмосфере аргона смесь соединения 21b (2,43 г, 8,98 ммоль), пиридин-3-илбороновой кислоты (1,43 г, 11,67 ммоль), Na2CO3 (1,90 г, 17,96 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (370 мг, 0,45 ммоль) в диоксане (35 мл) перемешивали при комнатной температуре в течение 5 минут, затем добавили деионизированную воду (7 мл). Смесь нагревали при 75°C в атмосфере аргона в течение 20 часов. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органическую фазу последовательно промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 23c (2,10 г, выход 75%). 1H-ЯМР (400 МГц, CDCl3): δ 9,34 (дд, 1H), 8,6 (с, 1H), 8,65 (дд, 1H), 8,42 (дт, 1H), 7,31-7,34 (м, 1H), 7,15-7,19 (м, 2H), 6,97-7,01 (м, 2H), 3,88 (с, 3H); МС: m/z 314,0 (M+H)+.
C. Трет-бутиловый эфир 4-[4-(4-метоксифенокси)-2-пиридин-3-илпиримидин-5-ил]-2-(R)-метилпиперазин-1-карбоновой кислоты (21d).
Используя адаптацию способа, описанного для стадии D примера 22, и заменив трет-бутиловый эфир пиперазин-1-карбоновой кислоты на трет-бутиловый эфир 2-(R)-метилпиперазин-1-карбоновой кислоты, получили указанное соединение 23d. 1H-ЯМР (400 МГц, CDCl3): δ 9,30 (ушир.с, 1H), 8,58 (ушир.с, 1H), 8,36 (д, 1H), 8,20 (с, 1H), 7,25-7,32 (м, 1H), 7,13-7,18 (м, 2H), 6,96-7,00 (м, 2H), 4,40 (ушир.с, 1H), 4,02-4,05 (м, 1H), 3,88 (с, 3H), 3,59-3,62 (м, 1H), 3,30-3,51 (м, 1H), 2,89-2,96 (м, 2H), 1,50 (с, 9H), 1,40 (д, 3H); МС: m/z 478,0 (M+H)+.
D. Соединение 357: 4-(4-метоксифенокси)-5-[3-(R)-метилпиперазин-1-ил]-2-пиридин-3-илпиримидин.
Используя адаптацию способа, описанного для стадии E примера 1, и заменив соединение 1g на соединение 21d, получили соединение 357 в виде гидрохлорида. Свободное основание: 1H-ЯМР (400 МГц, CDCl3): δ 9,29 (д, 1H), 8,58 (дд, 1H), 8,36 (дт, 1H), 8,23 (с, 1H), 7,25-7,30 (м, 1H), 7,14-7,18 (м, 2H), 6,96-7,00 (м, 2H), 3,88 (с, 3H), 3,60-3,67 (м, 2H), 3,12-3,18 (м, 3H), 2,85-2,92 (м, 1H), 2,53-2,58 (м, 1H), 1,18 (д, 3H); МС: m/z 378,0 (M+H)+.
Следуя процедуре, описанной выше для примера 21, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Соединение 320:
Указанное соединение получили аналогично соединению 21e из примера 21, заменив 4-метоксифенол на 4-циклопропилфенол4 на стадии A и заменив трет-бутиловый эфир 2-(R)-метилпиперазин-1-карбоновой кислоты на трет-бутиловый эфир пиперазин-1-карбоновой кислоты на стадии C. 1H-ЯМР (400 МГц, MeOH-d4): δ 9,11 (д, 1H), 8,49 (дд, 1H), 8,40 (дт, 1H), 8,29 (с, 1H), 7,42 (дд, 1H), 7,15-7,20 (м, 2H), 7,10-7,12 (м, 2H), 3,29-3,32 (м, 4H), 3,04-3,06 (м, 4H), 1,94-2,01 (м, 1H), 0,98-1,03 (м, 2H), 0,70-0,74 (м, 2H); МС: m/z 374,2 (M+H)+.
44-Циклопропилфенол получили в соответствии с приведенной ниже схемой синтеза и методикой.
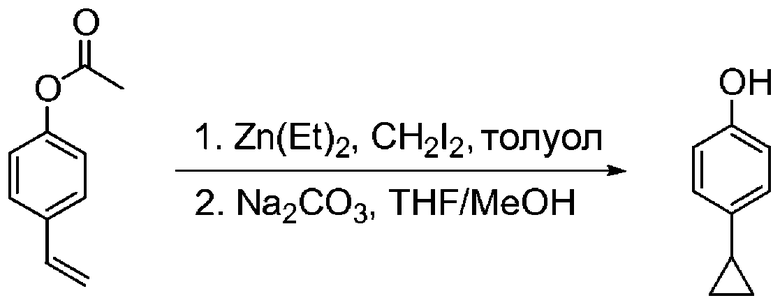
A. 4-Циклопропилфенол. К раствору диэтилцинка (59 мл, 65,9 ммоль) в толуоле (80 мл) добавили 4-винилфенилэфир уксусной кислоты (5 мл, 32,7 ммоль) и дийодметан (6,86 мл, 85 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 часов, а затем нагревали с обратным холодильником в течение 12 часов. Реакционную смесь погасили 2н раствором HCl, органический слой отделили, промыли солевым раствором, высушили над Na2SO4 и концентрировали для получения коричневого масла (4,5 г). Коричневое масло (4,5 г) растворили в MeOH/THF (20/20 мл), затем обрабатывали Na2CO3 (5,41 г, 51,1 ммоль) при комнатной температуре в течение 2 часов. Реакционную смесь разбавили EtOAc, последовательно промыли насыщенным раствором NH4Cl (водн.) и H2O и экстрагировали с помощью EtOAc (3X). Органические экстракты объединили, высушили над Na2SO4 и сконцентрировали при пониженном давлении для получения указанного соединения (3,2 г, выход 94%), которое использовали без дополнительной очистки.
Пример 22
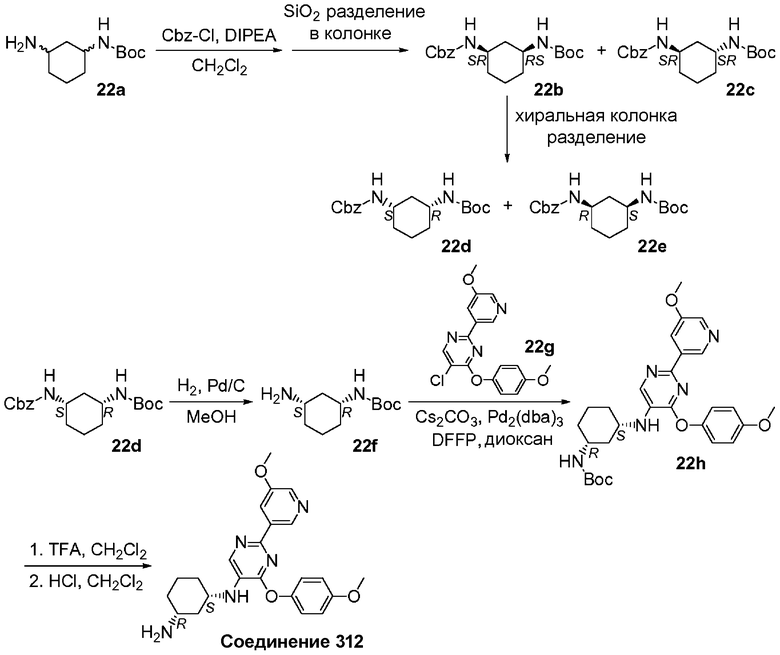
A. Трет-бутиловый эфир (3-бензилоксикарбониламиноциклогексил)карбаминовой кислоты (22b, 22c). К смеси трет-бутилового эфира (3-аминоциклогексил)карбаминовой кислоты (22a) (1,5 г, 7 ммоль) и бензилоксикарбонилхлорида (1,1 мл, 7,7 ммоль) в CH2Cl2 (30 мл) при -20°C добавили диизопропилметиламин (2,4 мл, 14 ммоль) по каплям в атмосфере аргона. Реакционную смесь перемешивали в течение 15 минут при этой же температуре, затем дали ей нагреться до комнатной температуры и перемешивали еще в течение 2 часов. Реакционную смесь разбавили CH2Cl2 и промыли солевым раствором. Органическую фазу высушили и сконцентрировали для получения исходного материала. Исходный материал очистили колоночной флэш-хроматографией (SiO2) с элюированием градиента гептан-EtOAc для получения соединения 22b (вторая фракция, 1,3-цис рацемическая смесь) (1,8 г, выход 74%) и соединения 22c (первая фракция, 1,3-транс рацемическая смесь). Соединение 22b: 1H-ЯМР (400 МГц, CDCl3): δ 7,30-7,40 (м, 5H), 5,09 (с, 2H), 4,59 (ушир.с, 1H), 4,37 (ушир.с, 1H), 3,54 (ушир.с, 2H), 2,29-2,31 (м, 1H), 1,99 (ушир.с, 2H), 1,76-1,81 (м, 1H), 1,44 (с, 9H), 1,34-1,44 (м, 1H), 0,90-1,05 (м, 3H); МС: m/z 249,0 (M+H-Boc)+. Соединение 22c: 1H-ЯМР (400 МГц, CDCl3): δ 7,30-7,40 (м, 5H), 5,09 (с, 2H), 4,78 (ушир.с, 1H), 4,56 (ушир.с, 1H), 3,77-3,85 (м, 2H), 1,68-1,79 (м, 4H), 1,53-1,62 (м, 2H), 1,38-1,49 (м, 2H), 1,45 (с, 9H); МС: m/z 249,0 (M+H-Boc)+.
B. Трет-бутиловый эфир [3-(S)-бензилоксикарбониламино-циклогексил]-1-(R)-карбаминовой кислоты (27d) и трет-бутиловый эфир [3-(R)-бензилоксикарбониламино-циклогексил]-1-(S)-карбаминовой кислоты (22e). Соединение 22b (850 мг) разделили на два энантиомерно чистых соединения - соединение 22d (340 мг, первая фракция) и соединение 22e (365 мг, вторая фракция) - с помощью колонки CHIRALPAK® ADTM (подвижная фаза: 9% изопропанол в гексанах, скорость потока 60 мл/мин). Соединение 22d: 1H-ЯМР (400 МГц, CDCl3): δ 7,30-7,39 (м, 5H), 5,09 (с, 2H), 4,60 (ушир.с, 1H), 4,38 (ушир.с, 1H), 3,54 (ушир.с, 2H), 2,28-2,31 (м, 1H), 1,99 (ушир.с, 2H), 1,75-1,81 (м, 1H), 1,44 (с, 9H), 1,34-1,44 (м, 1H), 0,89-1,05 (м, 3H); МС: m/z 249,0 (M+H-Boc)+. Соединение 22e: 1H-ЯМР (400 МГц, CDCl3): δ 7,30-7,39 (м, 5H), 5,09 (с, 2H), 4,60 (ушир.с, 1H), 4,39 (ушир.с, 1H), 3,54 (ушир.с, 2H), 2,28-2,32 (м, 1H), 1,99 (ушир.с, 2H), 1,75-1,81 (м, 1H), 1,44 (с, 9H), 1,34-1,44 (м, 1H), 0,91-1,05 (м, 3H); МС: m/z 249,0 (M+H-Boc)+; [α]D=-9,0 (c=1,2 в CHCl3). Абсолютные стереохимические характеристики соединения 22e определили путем сравнения оптического вращения синтетического трет-бутилового эфира (3R-аминоциклогексил)-1S-карбаминовой кислоты3 с веществом, полученным во время хиральной ВЭЖХ-сепарации.
3 Альтернативный подход к синтезу энантиомерно чистого трет-бутилового эфира [3-(R)-аминоциклогексил]-1-(S)-карбаминовой кислоты описан в следующей схеме и методике.
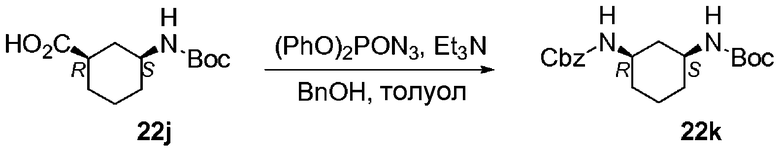 .
.
B1. Трет-бутиловый эфир [3-(R)-аминоциклогексил]-1-(S)-карбаминовой кислоты (22k).
К раствору соединения 22j (полученному в соответствии с методикой, описанной в литературе, в «Bioorganic & Medicinal Chemistry» 2005, 13, 2509) (294 мг, 1,21 ммоль) и Et3N (0,185 мл, 1,33 ммоль) в толуоле (7 мл) добавили (PhO)2P(O)N3 (0,29 мл, 1,34 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 1 часа с последующим добавлением BnOH (0,5 мл, 4,8 ммоль). Реакционную смесь нагревали с обратным холодильником еще в течение 7 часов. Смесь сконцентрировали и очистили колоночной флэш-хроматографией (SiO2, 30% EtOAc/гептан) для получения соединения 22k (0,1 г; выход 24%). 1H-ЯМР (400 МГц, CDCl3): δ 7,35 (м, 5H), 5,08 (с, 2H), 4,67 (д, 1H), 4,42 (с, 1H), 3,53 (м, 2H), 2,29 (д, 1H), 1,97 (с, 2H), 1,75 (м, 1H), 1,43 (с, 9H), 1,39 (м, 1H), 0,98 (м, 3H); МС: m/z 371 (M+Na)+; [α]D=-6,3 (c=1,1 в CHCl3).
C. Трет-бутиловый эфир [3-(S)-аминоциклогексил]-1-(R)-карбаминовой кислоты (22f).
Во флакон Парра добавили порцию 10% Pd/C (42 мг), соединение 22d (214 мг, 0,61 ммоль) и MeOH (35 мл). Реакционную смесь встряхивали под давлением 0,28 мПа (40 фунт/дюйм) в атмосфере H2 в течение 2 часов. Полученную смесь пропустили через слой диатомовой земли, фильтрат выпарили in vacuo для получения соединения 22f (90 мг) в виде белого твердого вещества. Соединение использовали в следующей реакции без дополнительной очистки. 1H-ЯМР (400 МГц, CDCl3): δ 4,55-4,66 (м, 1H), 3,48-3,50 (м, 1H), 2,75-2,81 (м, 1H), 2,08-2,14 (м, 1H), 1,91-1,94 (м, 1H), 1,74-1,82 (м, 2H), 1,45 (с, 9H), 1,26-1,45 (м, 1H), 0,89-1,05 (м, 3H); МС: m/z 215,2 (M+H)+.
D. 5-Хлор-4-(4-метоксифенокси)-2-(5-метоксипиридин-3-ил)пиримидин (22g).
Соединение 22g получили аналогично соединению 21c в примере 21 с заменой пиридин-3-илбороновую кислоту на 3-метокси-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)пиридин на стадии B примера 23.
E. Трет-бутиловый эфир {3-(S)-[4-(4-метоксифенокси)-2-пиридин-3-илпиримидин-5-иламино]циклогексил}-1-(R)-карбаминовой кислоты (22h).
В сухую пробирку Шленка добавили смесь соединения 22g (116 мг, 0,34 ммоль), соединения 22f (60 мг, 0,28 ммоль), Cs2CO3 (182 мг, 0,56 ммоль), (дифенилфосфино)ферроцена (54 мг, 0,10 ммоль) и трис(дибензилиденацетон)дипалладия(0) (26 мг, 0,028 ммоль). Колбу закрыли септой с тефлоновым покрытием, откачали и заполнили аргоном. К смеси с помощью шприца добавили диоксан (0,35 мл, реакционная концентрация >0,75M), после чего смесь нагревали при 95°C в течение 3 часов. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органическую фазу последовательно промыли H2O, а затем высушили над Na2SO4.
Смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 22h (110 мг, выход 93%). 1H-ЯМР (400 МГц, CDCl3): δ 8,84 (д, 1H), 8,24 (д, 1H), 8,01 (с, 1H), 7,89-7,90 (м, 1H), 7,14-7,18 (м, 1H), 6,94-6,98 (м, 2H), 4,48-4,50 (м, 1H), 4,23-4,25 (м, 1H), 3,86 (с, 6H), 3,62 (ушир.с, 1H), 3,43-3,51 (м, 1H), 2,52-2,55 (м, 1H), 2,20-2,23 (м, 1H), 2,04-2,07 (м, 1H), 1,89-1,94 (м, 1H), 1,46 (с, 9H), 1,41-1,46 (м, 1H), 1,08-1,21 (м, 3H); МС: m/z 522,2 (M+H)+.
E. Соединение 312: N-[4-(4-метоксифенокси)-2-(5-метоксипиридин-3-ил)пиримидин-5-ил]циклогексан-(1R,3S)-1,3-диамин.
Используя адаптацию способа, описанного для стадии E примера 1, и заменив соединение 1g на соединение 22h, получили соединение 312 в виде гидрохлорида (92 мг). Свободное основание: 1H-ЯМР (400 МГц, CDCl3): δ 8,86 (с, 1H), 8,24 (д, 1H), 7,99 (с, 1H), 7,88-7,89 (м, 1H), 7,16-7,19 (м, 2H), 6,95-6,98 (м, 2H), 4,44-4,46 (м, 1H), 3,87 (с, 3H), 3,86 (с, 3H), 3,43-3,51 (м, 1H), 2,89-2,95 (м, 1H), 2,34-2,37 (м, 1H), 2,15-2,19 (м, 1H), 1,88-1,95 (м, 2H), 1,41-1,51 (м, 3H), 1,10-1,26 (м, 3H); МС: m/z 422,0 (M+H)+.
Следуя процедуре, описанной выше для примера 22, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Соединение 311:
Указанное соединение получили аналогично соединению 312 из примера 22, заменив соединение 22d на соединение 22e на стадии C. Свободное основание: 1H-ЯМР (400 МГц, CDCl3): δ 8,86 (д, 1H), 8,24 (д, 1H), 7,99 (с, 1H), 7,88-7,89 (м, 1H), 7,15-7,20 (м, 2H), 6,94-6,98 (м, 2H), 4,44-4,46 (м, 1H), 3,87 (с, 3H), 3,86 (с, 3H), 3,42-3,51 (м, 1H), 2,89-2,96 (м, 1H), 2,34-2,37 (м, 1H), 2,15-2,18 (м, 1H), 1,88-1,95 (м, 2H), 1,40-1,51 (м, 3H), 1,10-1,25 (м, 3H); МС: m/z 422,0 (M+H)+.
Соединение 316:
Указанное соединение получили аналогично соединению 312 из примера 22, заменив 5-хлор-4-(4-метоксифенокси)-2-(5-метилсульфанилпиридин-3-ил)пиримидина (полученного аналогично соединению 21c из примера 21, и заменив пиридин-3-илбороновую кислоту на 5-(метилтио)пиридин-3-бороновую кислоту на стадии B) на соединение 22g на стадии D. Свободное основание: 1H-ЯМР (400 МГц, CDCl3): δ 8,99 (д, 1H), 8,40 (д, 1H), 8,20-8,21 (м, 1H), 7,98 (с, 1H), 7,14-7,18 (м, 2H), 6,94-6,98 (м, 2H), 4,47-4,49 (м, 1H), 3,86 (с, 3H), 3,41-3,51 (м, 1H), 2,87-2,94 (м, 1H), 2,47 (с, 3H), 2,32-2,35 (м, 1H), 2,14-2,17 (м, 1H), 1,87-1,92 (м, 2H), 1,37-1,50 (м, 3H), 1,08-1,27 (м, 3H); МС: m/z 438,2 (M+H)+.
Пример 23

A. Соединение 355: 4-(4-метоксифенокси)-5-(4-метилпиперазин-1-ил)-2-пиридин-3-илпиримидин.
Используя адаптацию способа, описанного для стадии D примера 22, проверить, есть ли данный способ в примерах, и заменив трет-бутиловый эфир пиперазин-1-карбоновой кислоты на 1-метилпиперазин, получили указанное соединение 355 в виде свободного основания. Соль HCl: 1H-ЯМР (400 МГц, ДМСО-d6): δ 11,24 (ушир.с, 1H), 9,12 (д, 1H), 8,81 (дд, 1H), 8,64 (д, 1H), 8,54 (с, 1H), 7,87 (дд, 1H), 7,26-7,30 (м, 2H), 7,03-7,08 (м, 2H), 3,86-3,91 (м, 2H), 3,81 (с, 3H), 3,52-3,55 (м, 2H), 3,22-3,40 (м, 4H), 2,83 (д, 3H); МС: m/z 378,0 (M+H)+.
Следуя процедуре, описанной выше для примера 23, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 24
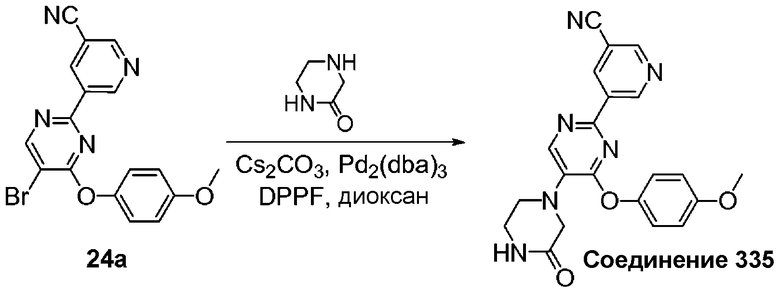
A. 5-Бром-2-(5-цианопиридин-3-ил)-4-(4-метоксифенокси)пиримидин (24a).
Используя адаптацию способа, описанного для стадии C примера 22, и заменив пиридин-3-илбороновую кислоту на 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)никотинонитрил, получили указанное соединение 24a в виде белого порошка. 1H-ЯМР (400 МГц, CDCl3): δ 9,50 (д, 1H), 8,91 (д, 1H), 8,80 (с, 1H), 8,69 (т, 1H), 7,14 (д, 2H), 6,99 (д, 2H), 3,88 (с, 3H); МС: m/z 383,0 (M+H)+.
B. Соединение 335: 5-[4-(4-метоксифенокси)-5-(3-оксопиперазин-1-ил)пиримидин-2-ил]никотинонитрил.
Используя адаптацию способа, описанного для стадии D примера 22, заменив соединение 22d на соединение 24a и заменив трет-бутиловый эфир пиперазин-1-карбоновой кислоты на пиперазин-2-он, получили указанное соединение 335 (выход 10%) в виде свободного основания после очистки путем препаративной ТСХ. 1H-ЯМР (400 МГц, CDCl3): δ 9,44 (д, 1H), 8,84 (д, 1H), 8,63 (т, 1H), 8,24 (с, 1H), 7,12 (д, 2H), 6,98 (д, 2H), 6,03 (ушир.с, 1H), 4,04 (с, 2H), 3,88 (с, 3H), 3,61-3,64 (м, 4H); МС: m/z 403,0 (M+H)+.
Пример 25
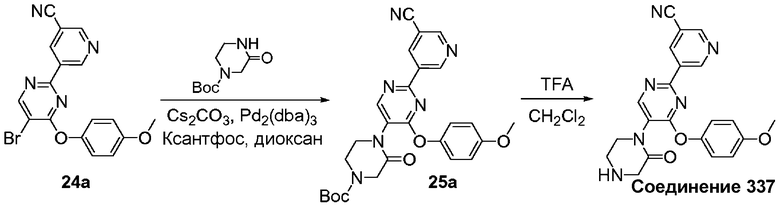
A. Трет-бутиловый эфир 4-[2-(5-цианопиридин-3-ил)-4-(4-метоксифенокси)пиримидин-5-ил]-3-оксопиперазин-1-карбоновой кислоты (25a).
Используя адаптацию способа, описанного для стадии D примера 22, заменив соединение 22d на соединение 24a, заменив трет-бутиловый эфир пиперазин-1-карбоновой кислоты на трет-бутиловый эфир 3-оксопиперазин-1-карбоновой кислоты и заменив (дифенилфосфино)ферроцен на ксантфос, получили указанное соединение 25a (выход 85%) . 1H-ЯМР (400 МГц, CDCl3): δ 9,51 (д, 1H), 8,90 (д, 1H), 8,71 (т, 1H), 8,65 (с, 1H), 7,11 (д, 2H), 6,97 (д, 2H), 4,34 (с, 2H), 3,88 (с, 3H), 3,87-3,90 (м, 2H), 3,82-3,85 (м, 2H); МС: m/z 503,0 (M+H)+.
B. Соединение 337: 5-[4-(4-метоксифенокси)-5-(2-оксопиперазин-1-ил)пиримидин-2-ил]никотинонитрил.
К раствору соединения 24a в CH2Cl2 (3 мл) добавили TFA (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, растворитель выпарили in vacuo для получения исходного материала. Исходный материал очистили препаративной ТСХ для получения соединения 337 в виде соли TFA. 1H-ЯМР (400 МГц, CDCl3): δ 9,52 (д, 1H), 8,93 (д, 1H), 8,74 (т, 1H), 8,68 (с, 1H), 7,09 (д, 2H), 6,98 (д, 2H), 4,11 (ушир.с, 4H), 3,87 (с, 3H), 3,72 (ушир.с, 2H); МС: m/z 403,0 (M+H)+.
Пример 26
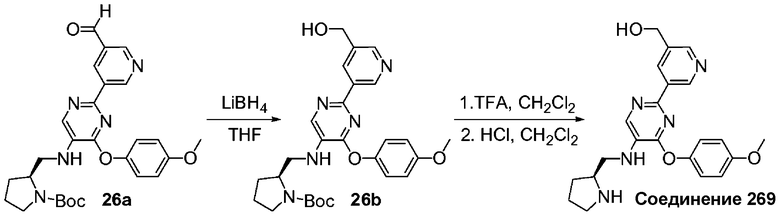
A. Трет-бутиловый эфир 2-(S)-{[2-(5-формилпиридин-3-ил)-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (26a).
Указанное соединение получили аналогично соединению 1g из примера 1 с заменой соединения 1f на 5-формилпиридин-3-илбороновую кислоту на стадии D.
B. Трет-бутиловый эфир 2-(S)-{[2-(5-гидроксиметилпиридин-3-ил)-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (26b).
К раствору соединения 26a (200 мг, 0,40 ммоль) в THF (5 мл) при 0°C по каплям добавляли раствор LiBH4 (2,0 M в THF) (0,3 мл). Реакционную смесь перемешивали при температуре 0°C в течение 0,5 часа, а затем довели до комнатной температуры в течение более 2 часов. Полученную смесь разбавили водой. Смесь экстрагировали с помощью EtOAc (3X), органические фазы соединили, высушили над Na2SO4 и сконцентрировали при пониженном давлении для получения исходного материала. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 26b (71,5 мг, выход 35%). 1H-ЯМР (400 МГц, CDCl3): δ 9,00 (с, 1H), 8,43 (с, 1H), 8,39 (с, 1H), 7,80-7,94 (м, 1H), 7,13-7,16 (м, 2H), 6,91-6,94 (м, 2H), 5,83 (ушир.с, 0,6H), 5,06 (ушир.с, 0,4H), 4,71 (с, 2H), 4,18-4,26 (м, 1H), 3,84 (с, 3H), 3,86 (ушир.с, 0,6H), 3,50 (ушир.с, 0,4H), 3,37-3,40 (м, 2H), 3,15-3,20 (м, 2H), 2,06-2,15 (м, 1H), 1,90-1,98 (м, 2H), 1,77-1,86 (м, 1H), 1,43-1,49 (м, 9H); МС: m/z 508,2 (M+H)+.
C. Соединение 269: (5-{4-(4-метоксифенокси)-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-2-ил}пиридин-3-ил)метанол.
Раствор соединения 26b (71,5 мг) в дихлорметане (2 мл) обрабатывали TFA (1 мл) при комнатной температуре в течение 2 часов. Затем pH среды довели до pH 12, используя 1Н водного раствора NaOH. Полученную смесь экстрагировали с помощью CH2Cl2 (3X). Органические экстракты объединили, высушили над Na2SO4 и сконцентрировали при пониженном давлении для получения свободного основания (52 мг). Свободное основание растворили в CH2Cl2 (2 мл) и обработали 1,0 М раствора HCl в Et2O (0,25 мл) при температуре окружающей среды в течение 2 часов. Твердое вещество собрали и высушили вакуумным фильтрованием, получив соединение 269 в виде гидрохлорида. Свободное основание: 1H-ЯМР (400 МГц, MeOH-d4): δ 8,95-9,05 (м, 1H), 8,55-8,70 (м, 1H), 8,36-8,42 (м, 1H), 8,06-8,11 (м, 1H), 7,15-7,21 (м, 2H), 6,98-7,02 (м, 2H), 4,72 (с, 1H), 4,63 (с, 1H), 3,83 (д, 3H), 3,74-3,83 (м, 1H), 3,45-3,58 (м, 2H), 3,13-3,28 (м, 2H), 2,15-2,25 (м, 1H), 1,93-2,08 (м, 2H), 1,68-1,79 (м, 1H); МС: m/z 408,2 (M+H)+.
Пример 27
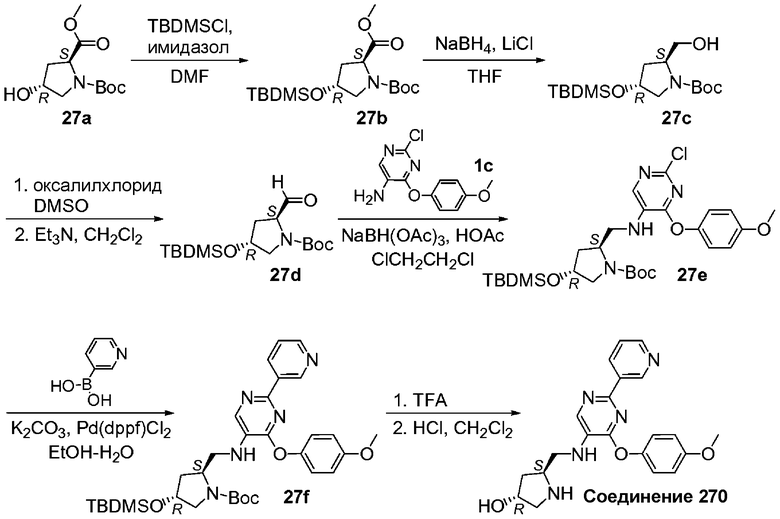
A. 4-(R)-(Трет-бутилдиметилсиланилокси)пирролидин-2-(S)-1,2 дикарбоновой кислоты 1-трет-бутилового эфира 2-метиловый эфир (27b).
Раствор соединения 27a (2,64 г, 10,8 ммоль) в DMF (12 мл) обрабатывали трет-бутилдиметилсилилхлоридом (1,78 г, 11,84 ммоль) и имидазолом (1,2 г, 17,64 ммоль) при комнатной температуре в течение 2 часов. Полученную смесь сконцентрировали в вакууме и разделили между EtOAc и H2O. Органическую фазу последовательно промыли 0,1н раствора HCl (водн.), насыщенным раствором NaHCO3 (водн.) и солевым раствором, после чего высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 27b. 1H-ЯМР (400 МГц, CDCl3): δ 4,32-4,45 (м, 2H), 3,74-3,75 (д, 3H), 3,58-3,64 (м, 1H), 3,32-3,43 (м, 1H), 2,16-2,19 (м, 1H), 2,00-2,06 (м, 1H), 1,42-1,47 (д, 9H), 0,88 (с, 9H), 0,07 (с, 6H). МС: m/z 360,2 (M+H)+.
B. Трет-бутиловый эфир 4-(R)-(трет-бутилдиметилсиланилокси)-2-(S)-гидроксиметилпирролидин-1-карбоновой кислоты (27c).
К раствору соединения 27b (392 мг, 1,09 ммоль) в THF/MeOH (3/3 мл) при 0°C добавили NaBH4 (148 мг, 3,92 ммоль) и LiCl (166 мг, 3,92 ммоль). Реакционную смесь перемешивали при температуре 0°C в течение 0,5 часа, а затем довели до комнатной температуры в течение более 2 часов. Полученную смесь разбавили 0,5н раствора HCl (водн.).
Смесь экстрагировали с помощью EtOAc (3X), органические экстракты объединили, высушили над Na2SO4 и сконцентрировали при пониженном давлении для получения исходного материала. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 27c (345 мг, выход 95%). 1H-ЯМР (400 МГц, CDCl3): δ 4,90 (ушир.с, 1H), 4,28 (м, 1H), 4,10-4,16 (м, 1H), 3,69-3,72 (м, 1H), 3,53-3,57 (м, 1H), 3,43-3,46 (м, 1H), 3,33-3,37 (м, 1H), 1,94-1,98 (м, 1H), 1,53-1,63 (м, 1H), 1,48 (с, 9H), 0,88 (с, 9H), 0,07 (с, 6H); МС: m/z 332,2 (M+H)+.
C. Трет-бутиловый эфир 4-(R)-(трет-бутилдиметилсиланилокси)-2-(S)-формилпирролидин-1-карбоновой кислоты (27d).
К раствору оксалилхлорида (0,16 мл, 1,785 ммоль) в CH2Cl2 (2 мл) при -78°C добавили ДМСО (0,25 мл; 3,55 ммоль) по каплям. Смесь перемешивали в течение 10 минут. Смесь обработали раствором соединения 27c (395 мг, 1,19 ммоль) в CH2Cl2 (3 мл), добавленного по каплям, с последующим перемешиванием в течение 20 минут. К полученной смеси добавили Et3N (0,5 мл, 3,55 ммоль) по каплям; смесь перемешивали при -78°C в течение 30 минут. Смесь нагрели до температуры окружающей среды при постоянном перемешивании в течение 20 минут. Реакционную смесь погасили насыщенным раствором NH4Cl (водн.), экстрагировали с помощью EtOAc, промыли водой и солевым раствором. Объединенные органические экстракты высушили над Na2SO4 и сконцентрировали при пониженном давлении для получения исходного материала. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 27d (250 мг, выход 64%). 1H-ЯМР (400 МГц, CDCl3): δ 9,44-9,57 (м, 1H), 4,20-4,39 (м, 1H), 3,35-3,57 (м, 1H), 1,89-2,09 (м, 1H), 1,44-1,49 (м, 9H), 0,88 (с, 9H), 0,08 (с, 6H); МС: m/z 330,2 (M+H)+.
D. Трет-бутиловый эфир 4-(R)-(трет-бутилдиметилсиланилокси)-2-(S)-{[2-хлор-4-(4-метоксифенокси)пиримидин-5-иламино)метил}пирролидин-1-карбоновой кислоты (27e).
К раствору соединения 1c (191 мг, 0,759 ммоль) в 1,2-дихлорэтане (4 мл) при температуре окружающей среды добавили соединение 27d (250 г, 0,759 ммоль) и уксусную кислоту (0,2 мл) и смесь перемешивали в течение 1,5 часов при комнатной температуре. Затем смесь обработали NaB(OAc)3H (240 мг, 1,14 ммоль) и непрерывно перемешивали при комнатной температуре в течение 4 часов. Полученную смесь разбавили CH2Cl2, промыли насыщенным водным раствором NaHCO3 и водой. Органическую фазу последовательно промыли водой и насыщенным солевым раствором, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 27e. 1H-ЯМР (400 МГц, CDCl3): δ 7,70-7,75 (м, 1H), 7,10-7,13 (м, 2H), 6,94-7,01 (м, 2H), 5,79 (ушир.с, 0,6H), 4,73 (ушир.с, 0,4H), 4,30-4,39 (м, 2H), 3,84 (с, 3H), 3,12-3,69 (м, 4H), 2,06-2,16 (м, 1H), 1,80-1,87 (м, 1H), 1,45-1,48 (м, 9H), 0,88 (с, 9H), 0,08 (с, 6H); МС: m/z 565,2 (M+H)+.
E. Трет-бутиловый эфир 4-(R)-(трет-бутилдиметилсиланилокси)-2-{[4-(4-метоксифенокси)-2-(S)-(пиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (27f).
В закрытую септой с тефлоновым покрытием колбу Шленка поместили смесь соединения 27e (130 мг, 0,23 ммоль), пиридин-3-илбороновой кислоты (56,5 мг, 0,46 ммоль), K2CO3 (64 мг, 0,46 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (11,3 мг, 0,014 ммоль) в смеси этанола (0,5 мл) и H2O (0,1 мл). Реакционную смесь обрабатывали в микроволновом приборе при 130°C в течение 30 минут. Полученную смесь разбавили EtOAc, а затем промыли насыщенным водным раствором NH4Cl и водой. Органическую фазу промыли H2O, а затем высушили над Na2SO4.
После этого смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент гептан-EtOAc, и получили соединение 27f (100 мг, выход 71%). 1H-ЯМР (400 МГц, CDCl3): δ 9,27 (с, 1H), 8,52-8,53 (м, 1H), 8,33-8,35 (м, 1H), 7,99-8,02 (м, 1H), 7,26-7,28 (м, 1H), 7,13-7,19 (м, 2H), 6,95-6,97 (м, 2H), 5,77 (ушир.с, 0,6H), 4,84 (ушир.с, 0,4H), 4,35-4,42 (м, 2H), 3,87 (с, 3H), 3,28-3,69 (м, 4H), 2,12-2,18 (м, 1H), 1,86-1,91 (м, 1H), 1,47-1,51 (м, 9H), 0,88 (с, 9H), 0,08 (с, 6H); МС: m/z 608,1 (M+H)+.
F. Соединение 270:
5-(S)-{[4-(4-метоксифенокси)-2-(пиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-3-(R)-ол.
Соединение 27f (100 мг, 0,165 ммоль) в трифторуксусной кислоте (1 мл) перемешивали при комнатной температуре в течение 20 часов. pH реакционной смеси установили на уровне 12 путем добавления 1н раствора NaOH (водн.). Полученную смесь экстрагировали CH2Cl2 и H2O. Органическую фазу промыли H2O и высушили над Na2SO4. После этого смесь отфильтровали, а фильтрат сконцентрировали при пониженном давлении. Остаток растворили в CH2Cl2 (3 мл), обработали 1,0 M HCl в Et2O (0,33 мл, 0,33 ммоль) при комнатной температуре, после чего реакционную смесь перемешивали в течение 20 часов. Смесь выпарили in vacuo, остаток измельчили в порошок с Et2O. Твердое вещество собрали и высушили вакуумным фильтрованием, получив соединение 270 (63 мг, выход 81%) в виде гидрохлорида. Соединение 270 (свободное основание 1H-ЯМР (400 МГц, CDCl3): δ 9,26 (д, 1H), 8,53 (дд, 1H), 8,32 (дт, 1H), 7,99 (с, 1H), 7,24-7,27 (м, 1H), 7,15-7,19 (м, 2H), 6,95-6,99 (м, 2H), 4,85-4,88 (м, 1H), 4,54-4,55 (м, 1H), 3,88 (с, 3H), 3,82-3,88 (м, 2H), 3,28-3,34 (м, 1H), 3,06-3,13 (м, 1H), 3,03-3,04 (м, 2H), 2,04-2,09 (м, 1H), 1,73-1,80 (м, 1H), 1,6 (ушир.с, 1H); МС: m/z 394,0 (M+H)+.
Следуя процедуре, описанной выше для примера 27, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 28
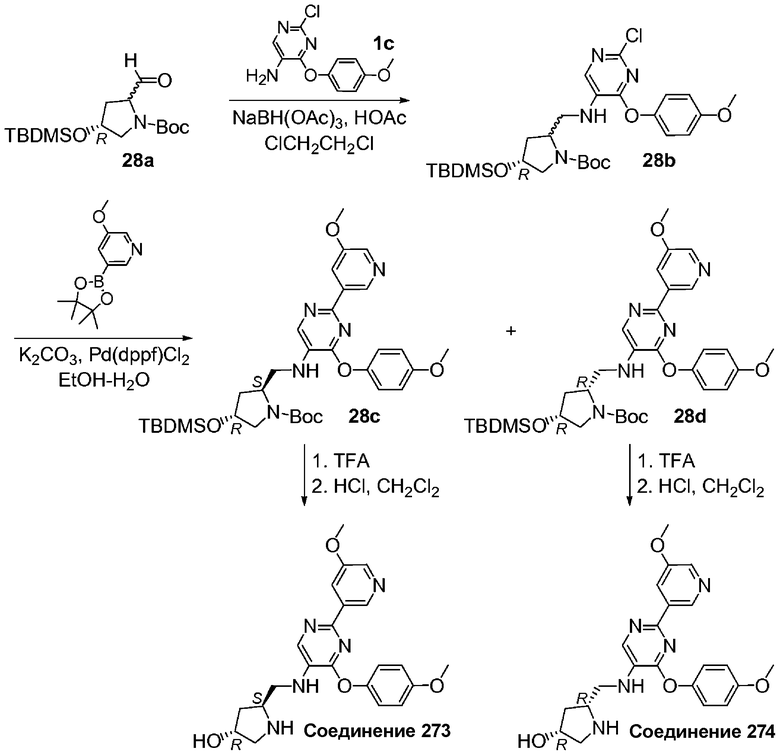
A. Трет-бутиловый эфир 4-(R)-(трет-бутилдиметилсиланилокси)-2-{[2-хлор-4-(4-метоксифенокси)пиримидин-5-иламино)метил}пирролидин-1-карбоновой кислоты (28b).
Используя адаптацию способа, описанного для стадии D примера 27, и заменив соединение 27d на (доступное в продаже) соединение 28a, получили соединение 28b. 1H-ЯМР (400 МГц, CDCl3): δ 7,70-7,75 (м, 1H), 7,06-7,13 (м, 2H), 6,91-6,95 (м, 2H), 5,74-5,79 (м, 0,6H), 4,73-4,82 (м, 0,4H), 4,38-4,44 (м, 2H), 3,83 (с, 3H), 3,12-3,69 (м, 4H), 2,10-2,24 (м, 1H), 1,78-1,88 (м, 1H), 1,44-1,48 (м, 9H), 0,88-0,92 (м, 9H), 0,08-0,10 (м, 6H); МС: m/z 565,0 (M+H)+.
B. Трет-бутиловый эфир 4-(R)-(трет-бутилдиметилсиланилокси)-2-{[4-(4-метоксифенокси)-2-(S)-(5-метоксипиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (34c) и трет-бутиловый эфир 4-(R)-(трет-бутилдиметилсиланилокси)-2-{[4-(4-метоксифенокси)-2-(R)-(5-метоксипиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (28d).
Используя адаптацию способа, описанного для стадии E примера 27, заменив соединение 27e на соединение 28b и заменив пиридин-3-илбороновую кислоту на 3-метокси-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин, отдельно получили указанное соединение 28c и соединение 28d после колоночной флэш-хроматографии (SiO2). Соединение 28c: 1H-ЯМР (400 МГц, CDCl3): δ 8,87 (с, 1H), 8,24 (с, 1H), 7,98 (с, 1H), 7,89 (с, 1H), 7,13-7,20 (м, 2H), 6,94-6,96 (м, 2H), 5,78 (ушир.с, 0,6H), 4,86 (ушир.с, 0,4H), 4,34-4,42 (м, 2H), 3,86 (с, 6H), 3,29-3,51 (м, 4H), 2,12-2,18 (м, 1H), 1,86-1,94 (м, 1H), 1,47-1,51 (м, 9H), 0,87-0,89 (м, 9H), 0,08 (с, 6H); МС: m/z 638,2 (M+H)+. Соединение 28d: 1H-ЯМР (400 МГц, CDCl3): δ 8,86 (ушир.с, 1H), 8,23 (ушир.с, 1H), 7,98-7,99 (м, 1H), 7,89 (с, 1H), 7,12-7,20 (м, 2H), 6,92-6,96 (м, 2H), 5,84 (ушир.с, 0,6H), 4,97 (ушир.с, 0,4H), 4,27-4,43 (м, 2H), 3,85 (с, 6H), 3,57-3,81 (м, 2H), 3,29-3,39 (м, 2H), 2,18-2,25 (м, 1H), 1,82-1,91 (м, 1H), 1,45-1,50 (м, 9H), 0,91-0,92 (м, 9H), 0,10-0,11 (м, 6H); МС: m/z 638,2 (M+H)+.
C. Соединение 273:
5-(S)-{[4-(4-метоксифенокси)-2-(5-метоксипиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-3-(R)-ол.
Используя адаптацию способа, описанного для стадии F примера 27, и заменив соединение 27f на соединение 28c, получили соединение 273 в виде гидрохлорида. Соединение 273, свободное основание: 1H-ЯМР (400 МГц, CDCl3): δ 8,87 (д, 1H), 8,25 (д, 1H), 8,00 (с, 1H), 7,89 (дд, 1H), 7,16-7,20 (м, 2H), 6,94-6,98 (м, 2H), 4,83-4,86 (м, 1H), 4,53-4,55 (м, 1H), 3,87 (с, 3H), 3,86 (с, 3H), 3,79-3,87 (м, 1H), 3,26-3,32 (м, 1H), 3,04-3,11 (м, 1H), 3,01-3,02 (м, 2H), 2,02-2,08 (м, 1H), 1,72-1,79 (м, 1H), 1,25-1,27 (м, 1H); МС: m/z 424,0 (M+H)+.
D. Соединение 274:
5-(R)-{[4-(4-метоксифенокси)-2-(5-метоксипиридин-3-ил)пиримидин-5-иламино]метил}пирролидин-3-(R)-ол.
Используя адаптацию способа, описанного для стадии F примера 27, и заменив соединение 27f на соединение 28d, получили соединение 274 в виде гидрохлорида. Свободное основание: 1H-ЯМР (400 МГц, CDCl3): δ 8,85 (д, 1H), 8,24 (д, 1H), 7,99 (с, 1H), 7,88 (дд, 1H), 7,16-7,20 (м, 2H), 6,93-6,97 (м, 2H), 5,08-5,10 (м, 1H), 4,46-4,50 (м, 1H), 3,86 (с, 3H), 3,86 (с, 3H), 3,62-3,69 (м, 1H), 3,42-3,49 (м, 1H), 3,31-3,38 (м, 1H), 3,01-3,14 (м, 2H), 2,28-2,37 (м, 1H), 1,66-1,73 (м, 1H), 1,25-1,27 (м, 1H); МС: m/z 424,0 (M+H)+.
Следуя процедуре, описанной выше для примера 28, и заменив соответствующие реактивы, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Используя описанные выше методики, синтезировали приведенные ниже в таблице соединения 1-319 и 321-323 формулы (I).

ксазол-4-ил
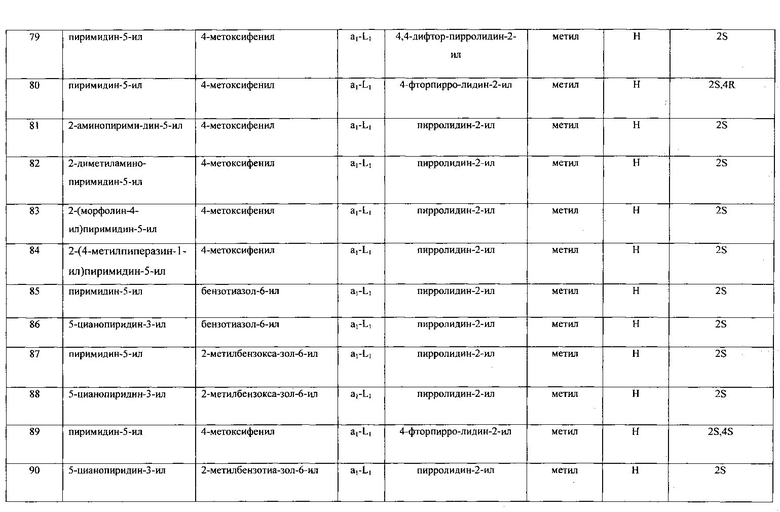
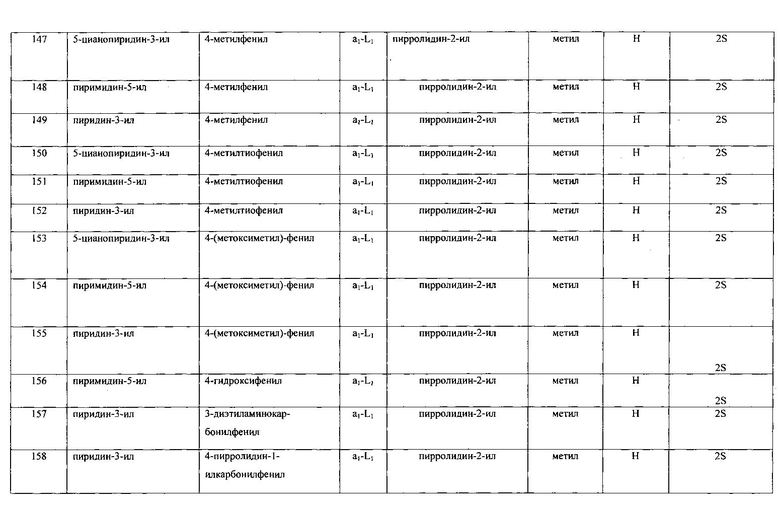
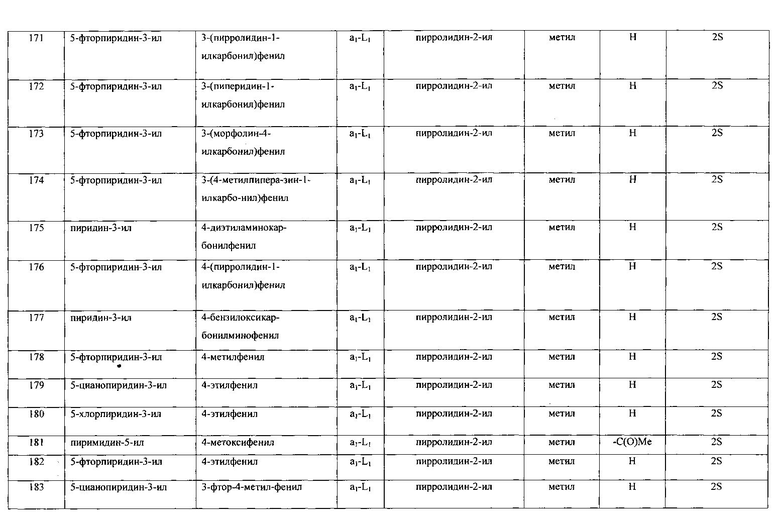
Используя описанные выше методики, были синтезированы приведенные в таблице ниже соединения 320 и 324-361 формулы (I).

Биологические исследования
Исследования in vitro
Пример 1
24-луночный анализ связывания с дельта-опиоидными рецепторами на клетках линии NG108-15
Способ: клеточные мембраны NG108-15 приобрели в компании Applied Cell Sciences (г.Роквилль, штат Мэриленд). 5 мг/мл мембранных белков суспендировали в 10 мМ буферного раствора TRIS-HCl c pH 7,2, 2 мМ ЭДТК, 10% сахарозы. Содержимое каждого флакона гомогенизировали в 5 мл 50 мМ буферного раствора Tris при pH 7,4 с помощью нескольких коротких импульсов на гомогенизаторе Polytron. Полученный гомогенат разбавили в 50 мМ буферном растворе Tris, содержащем 5 мМ MgCl2 до концентрации 330 мкг/мл в рабочем растворе с получением итоговой концентрации белка 133 мкг/лунка. Полученный препарат использовали для проведения 24-луночного анализа связывания с дельта-опиоидными рецепторами.
После инкубирования с дельта-селективным лигандом пептида ~0,2 нМ [3H]налтриндола при температуре 25°C в течение 2,5 часов на 24-луночном планшете с суммарным объемом 1 мл содержимое планшета профильтровали через фильтр UniFilter24, GF/B. Планшет предварительно замочили в 0,3% PEI и профильтровали через 24-луночную систему сбора клеток. Указанный фильтр UniFilter24 трижды промыли 2 мл 10 мМ буферного раствора HEPES (pH 7,4) и высушили в печи при температуре 37°C в течение 1,5 часов. В каждую лунку добавили по 150 мкл Scint0 (компания PerkinElmer, № по кат. 6013611). Затем планшеты анализировали на сканере TopCount.
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). В качестве отрицательного контроля использовали неспецифическое связывание (н.с. - 1 мМ налоксона), в качестве положительного контроля использовали суммарное связывание (с.с. - только мембрана и лиганд). При анализе одной концентрации процентную степень ингибирования рассчитывали как (количество отсчетов в мин для суммарного связывания минус количество отсчетов в мин для тестируемого соединения), разделенное на (количество отсчетов в мин для суммарного связывания минус количество отсчетов в мин для неспецифичного связывания). Каждую приведенную процентную степень ингибирования получали усреднением результатов трех измерений. При работе с несколькими концентрациями полученные значения анализировали с помощью программы нелинейной регрессии для связывания по одному сайту из программного пакета Prism для получения значений Ki. Максимальные и минимальные величины использовали как глобально доступные. Каждое приведенное значение Ki получали путем усреднения по результатам трех измерений.
Полученные данные приведены в таблице 2 ниже.
Пример 2
Анализ связывания с дельта-опиоидными рецепторами на мозге крысы
Методика: самцов крыс линии Wistar (150-250 г, VAF, компания Charles River, г. Кингстон, штат Нью-Йорк) умерщвляли CO2, мозг извлекали и немедленно помещали в ледяной буферный раствор Tris HCl (50 мМ, pH 7,4). Передние отделы отделяли от остального мозга с использованием коронального сечения, начиная сверху у холмиков и проводя разрез вниз через соединение среднего мозга с мостом. После вскрытия передний мозг гомогенизировали в буферном растворе Tris в тефлон®-стеклянном гомогенизаторе. Полученный гомогенат разбавляли до концентрации 1 г ткани переднего мозга на 80 мл буферного раствора и центрифугировали на скорости 39000×g в течение 10 минут. Полученный осадок ресуспендировали в таком же объеме буферного раствора Tris с добавлением 5 мМ MgCl2 с помощью нескольких небольших импульсов на гомогенизаторе Polytron. Полученный препарат использовали для проведения анализа связывания с дельта-опиоидными рецепторами. После инкубирования с дельта-селективным пептидным лигандом, ~4 нМ [3H]DPDPE или 0,25 нМ [3H]налтриндола, при температуре 25°C в течение 2,5 часов на 96-луночном планшете с суммарным объемом 1 мл содержимое планшета профильтровали через плоские фильтры Wallac B на 96-луночной системе сбора клеток Tomtec. Указанные фильтры трижды промыли 2 мл 10 мМ буферного раствора HEPES (pH 7,4) и дважды просушили в микроволновой печи мощностью 650 Вт в течение 1,75 минут. На каждую зону с образцом поместили 2×50 мкл сцинтилляционной жидкости Betaplate Scint (компания LKB) и количественно определили радиоактивность с использованием жидкостного сцинтилляционного счетчика компании LKB (Wallac) 1205 BetaPlate.
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). Процентную степень ингибирования рассчитывали как [(количество распадов в минуту для суммарного связывания - количество распадов в минуту для тестируемого соединения)/(количество распадов в минуту для суммарного связывания - количество распадов в минуту для неспецифического связывания)]*100. Величины Kd и Ki рассчитывали с помощью программы для анализа данных GraphPad PRISM. Полученные данные приведены в таблице 2 ниже.
Пример 3
Анализ связывания с мю-опиоидными рецепторами на мозге крысы
Методика: самцов крыс линии Wistar (150-250 г, VAF, компания Charles River, г.Кингстон, штат Нью-Йорк) умерщвляли CO2, мозг извлекали и немедленно помещали в ледяной буферный раствор Tris HCl (50 мМ, pH 7,4). Передние отделы отделяли от остального мозга с использованием коронального сечения, начиная сверху у холмиков и проводя разрез вниз через соединение среднего мозга с мостом. После вскрытия передний мозг гомогенизировали в буферном растворе Tris в тефлон®-стеклянном гомогенизаторе. Полученный гомогенат разбавляли до концентрации 1 г ткани переднего мозга на 80 мл буферного раствора и центрифугировали на скорости 39000×g в течение 10 минут. Полученный осадок ресуспендировали в таком же объеме буферного раствора Tris с добавлением 5 мМ MgCl2 с помощью нескольких небольших импульсов на гомогенизаторе Polytron. Полученный препарат использовали для проведения анализа связывания с мю-опиоидными рецепторами. После инкубирования с мю-селективным пептидным лигандом, ~0,8 нМ [3H]DAMGO, при температуре 25°C в течение 2,5 часов на 96-луночном планшете с суммарным объемом 1 мл содержимое планшета профильтровали через плоские фильтры Wallac B на 96-луночной системе сбора клеток Tomtec. Указанные фильтры трижды промыли 2 мл 10 мМ буферного раствора HEPES (pH 7,4) и дважды просушили в микроволновой печи мощностью 650 Вт в течение 1,75 минут. На каждую зону с образцом поместили 2×40 мкл сцинтилляционной жидкости Betaplate Scint (компания LKB) и количественно определили радиоактивность с помощью жидкостного сцинтилляционного счетчика компании LKB (Wallac) 1205 BetaPlate.
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). Процентную степень ингибирования рассчитывали как [(количество распадов в минуту для суммарного связывания - количество распадов в минуту для тестируемого соединения)/(количество распадов в минуту для суммарного связывания - количество распадов в минуту для неспецифического связывания)]*100. Значения Kd и Ki рассчитывали с помощью программы для анализа данных GraphPad PRISM. Полученные данные приведены в таблице 2 ниже.
Данные по связыванию с дельта- и мю-опиоидными рецепторами
3,139
Пример 4
[ 35 S]GTPγS-анализ связывания на мембранах клеток линии NG108-15 (функциональный тест на дельта-опиоидные рецепторы) - скрининг при концентрации 200 нМ
Способ: клеточные мембраны NG108-15 приобрели в компании Applied Cell Sciences (г.Роквилль, штат Мэриленд). 5 мг/мл мембранных белков суспендировали в 10 мМ буферного раствора TRIS-HCl c pH 7,2, 2 мМ ЭДТК, 10% сахарозы. Мембраны хранили при температуре 4-8°C. 1 мл препарата мембран добавили в 10 мл холодного буферного раствора для проведения теста. Буферный раствор для проведения теста включал 50 мМ буферного раствора Tris, pH 7,6, 5 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT и 1 мМ EGTA. Суспензию мембран дважды гомогенизировали на гомогенизаторе Polytron и центрифугировали на скорости 3000 об/мин в течение 10 минут. Затем собранный супернатант центрифугировали на скорости 18000 об/мин в течение 20 минут. В пробирку с осадком добавили десять мл буферного раствора для проведения теста. Осадок и буфер перемешали с помощью гомогенизатора Polytron.
Методика инкубирования: осажденные мембраны (75 мкг/мл) предварительно инкубировали с частицами для сцинтилляционного анализа сближения (SPA) (10 мг/мл) при температуре 25°C в течение 45 минут в буферном растворе для теста. Затем связавшиеся с мембранами (37,5 мкг/мл) SPA-частицы (5 мг/мл) инкубировали с 0,1 нМ [35S] GTPγS в том же буферном растворе Tris, содержащем 100 мкМ GDP, в общем объеме 200 мкл.
Для стимулирования связывания [35S]-GTPγS добавляли 200 нМ агонистов рецептора. Базовый уровень связывания тестировали в отсутствие агонистов, а уровень неспецифического связывания тестировали в присутствии 10 мкМ немеченого GTPγS. Данные анализировали на счетчике Packard Top Count, результаты приведены в таблице 3 ниже.
Данные
% от базового = (стимулированный - неспецифичный)*100/(базовый - неспецифичный).
Относительная эффективность соединения при концентрации 200 нМ = (% от базового для тестируемого соединения при 200 нМ)/(рассчитанный максимум кривой зависимости эффекта от дозы для SNC80; кривая в пакете prism).
Пример 5
[ 35 S]GTPγS-анализ связывания на мембранах клеток линии CHO-hMOR (функциональный тест на мю-опиоидные рецепторы)
Способы: мембраны клеток линии CHO-hMOR можно приобрести в компании Receptor Biology, Inc. (г.Балтимор, штат Мэриленд). Мембранный белок можно суспендировать в концентрации приблизительно 10 мг/мл в 10 мМ буферном растворе TRIS-HCl при pH 7,2 с добавкой 2 мМ EDTA, 10% сахарозы, суспензию хранили на льду. 1 мл препарата мембран можно добавить в 15 мл холодного буферного раствора для проведения теста, который содержал 50 мМ буферного раствора HEPES, pH 7,6, 5 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT и 1 мМ EDTA. Суспензию мембран можно гомогенизировать на гомогенизаторе Polytron и центрифугировать при скорости 3000 об/мин в течение 10 минут. Затем супернатант можно центрифугировать при скорости 18000 об/мин в течение 20 минут. Полученный осадок можно ресуспендировать в 10 мл буферного раствора для проведения теста на гомогенизаторе Polytron. Мембраны можно предварительно инкубировать с покрытыми агглютинином из проростков пшеницы SPA-частицами (компания Amersham) при температуре 25°C в течение 45 минут в буферном растворе для теста. Связавшиеся с мембранами (10 мкг/мл) SPA-частицы (5 мг/мл) затем можно инкубировать с 0,5 нМ [35S]GTPγS в буферном растворе для теста. Базовое связывание, которое может происходить в отсутствие добавленного тестируемого соединения, принимали за 100%, при этом стимулированное агонистом связывание может достигать уровня, значительно превышающего данное значение. Для стимулирования связывания [35S]GTPγS можно использовать диапазон концентраций агонистов рецептора. Как базовое, так и неспецифическое связывание можно тестировать в отсутствие агониста. Для определения уровня неспецифичного связывания использовали 10 мкМ немеченого GTPγS.
Соединения можно тестировать на активность как антагониста путем оценки их потенциала по ингибированию стимулированного агонистом связывания GTPγS. Радиоактивность можно определять количественно на счетчике Packard TopCount. Можно рассчитать следующие параметры:

% ингибирования = (% стимуляции 1 мкМ DAMGO - % стимуляции тестируемым соединением)×100
(% стимуляции 1 мкМ DAMGO - 100)
Значения EC50 можно рассчитать в программе GraphPad Prism. Они приведены в таблице 3 ниже.
0,069
Исследования в vivo
Пример 6
Измерение вызванной реактивом CFA гиперчувствительности крыс к тепловому воздействию
Каждую крысу помещали в испытательную камеру на теплую стеклянную поверхность и акклиматизировали в течение приблизительно 10 минут. Затем через стекло подавали лучевой тепловой стимул (луч света), фокусируемый на подошвенной поверхности каждой из задних конечностей по очереди. Тепловое воздействие автоматически прекращалось фотоэлектрическим реле, если лапка начинала двигаться или если завершался период воздействия (20 с теплового облучения при ~5 амп.). Для каждой из крыс зафиксировали начальный (естественный) период ответа на тепловой раздражитель, после чего животным ввели полный адъювант Фрейнда (CFA). По прошествии двадцати четырех часов после введения CFA период ответа животных на тепловой раздражитель снова измерили и сравнили с начальным. Анализ продолжали только для крыс, у которых произошло по меньшей мере 25% сокращение латентного периода реакции (то есть гипералгезия). Непосредственно после оценки латентного периода после введения CFA крысам вводили испытываемое соединение или носитель (как правило, Солютол, гидроксипропилметилцеллюлозу (HPMC), гидроксипропил-бета-циклодекстрин (HPβCD) или ПЭГ-400) интраперитонеально или перорально. Затем, по прошествии определенных периодов времени (обычно 30, 60, 100, 120, 180 и 300 мин) оценивали латентный период реакции (отдергивание лапы) после прекращения введения указанного вещества. После этого вычисляли процент обратного развития (%R) гиперчувствительности по следующей формуле:
% обратного развития = [(ответ после введения испытываемого вещества - ответ после введения CFA)]/[(базовый ответ - ответ после введения CFA)]×100.
Результаты выражали в виде среднего значения в % обратного развития для индивидуальных животных, +/- СКВ (среднеквадратическое отклонение).
Значения ED50 и соответствующие статистические данные рассчитывали с помощью программного обеспечения PharmTools Pro (The McCary Group Inc., г.Шнексвилль, штат Пенсильвания).
Исследование динамики: термином «Алгос» обозначены фрагменты исследования, проведенные во внешней лаборатории в таких же условиях, что и внутренние исследования
Исследования зависимости между дозой и реакцией
Пример 7
Градационный абдоминальный тест раздражителя на мышах (GrAIT)
Мышам вводили исследуемое соединение или носитель подкожно. По окончании времени предварительной обработки проводили интраперитонеальную инъекцию 0,6% уксусной кислоты в 0,5 мл. Через 5 минут после введения уксусной кислоты мышей помещали в прозрачные камеры, далее наблюдения фиксировали каждые 5 минут. Проводили учет поведенческих реакций, включая вращение и вытягивание тела и задних конечностей, данные усредняли по группам животных за период наблюдений.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-ЗАМЕЩЕННЫЕ-2-ФЕНОКСИФЕНИЛАМИНОВЫЕ МОДУЛЯТОРЫ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2553453C2 |
| ПИРАЗИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2543484C2 |
| ФЕНОКСИЗАМЕЩЕННЫЕ ПИРИМИДИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2554870C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617424C2 |
| ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ | 2010 |
|
RU2541571C2 |
| (АЛЬФА-ЗАМЕЩЕННЫЕ АРАЛКИЛАМИНО- И ГЕТЕРОАРИЛАЛКИЛАМИНО)ПИРИМИДИНИЛ- И 1, 3, 5-ТРИАЗИНИЛБЕНЗИМИДАЗОЛЫ, ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2608742C2 |
| ХИНОЛИНКАРБОКСАМИДНЫЕ И ХИНОЛИНКАРБОНИТРИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ mGLuR2-НЕГАТИВНЫХ АЛЛОСТЕРИЧЕСКИХ МОДУЛЯТОРОВ, КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2610262C2 |
| ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2571662C2 |
| ГЕТЕРОАРОМАТИЧЕСКИЕ И АРОМАТИЧЕСКИЕ ПИПЕРАЗИНИЛАЗЕТИДИНИЛАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ МОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ | 2010 |
|
RU2558141C2 |
| ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗ | 2009 |
|
RU2445314C9 |
Изобретение относится к новым соединениям формулы I, которые обладают способностью модулировать дельта-опиоидные рецепторы. Соединения могут найти применение при лечении боли при заболеваниях или состояниях, модулируемых опиоидными рецепторами, таких как остеоартрит, ревматоидный артрит, фибромиалгия, мигрень, головная боль, зубная боль, ожоги, укус змеи, укус паука, укус насекомого, нейрогенный мочевой пузырь и др., а также при лечении болезни или состояния, выбранных из группы, состоящей из депрессии, болезни Паркинсона, наркотической зависимости, алкогольной зависимости, гастрита, недержания мочи, преждевременного семяизвержения, диареи и др. В соединениях формулы I

R1 выбран из группы, состоящей из i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, хлоро и фторо; или фенила, необязательно замещенного одним амино, С1-4алкиламино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, C1-4алкиламинокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, С1-4алкилсульфонилом, нитро, трифторметилом, фенилом или формамидо; ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио и гидрокси; или пиримидинила, необязательно замещенного одним амино, С1-4алкиламино, ди(С1-4алкил)амино, циано, пиперазин-1-илом, который необязательно замещен 4-С1-4алкилом, морфолин-4-илом; iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано;
или пиридинила, необязательно замещенного одним гидроксиметилом, амино, С1-4алкиламино, ди(С1-4алкил) амино, С1-4алкилсульфонилом, C1-4алкилкарбониламино,; и iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, бензимидазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, изохинолинила, хиноксалинила, хиназолинила, изоксазолила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила, бензотиофенила, индазолила и 2,3-дигидробензо[1,4]диоксинила. Другие значения радикалов указаны в формуле изобретения. 10 н. и 19 з.п. ф-лы, 25 табл., 35 пр.
1. Соединение формулы I

где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, хлоро и фторо; или фенила, необязательно замещенного одним амино, С1-4алкиламино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, C1-4алкиламинокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, C1-4алкилкарбониламино, циано, трифторметокси, С1-4алкилсульфонилом, нитро, трифторметилом, фенилом или формамидо;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио и гидрокси; или пиримидинила, необязательно замещенного одним амино, С1-4алкиламино, ди(С1-4алкил)амино, циано, пиперазин-1-илом, который необязательно замещен 4-С1-4алкилом, морфолин-4-илом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; или пиридинила, необязательно замещенного одним гидроксиметилом, амино, С1-4алкиламино, ди(С1-4алкил) амино, С1-4алкилсульфонилом, C1-4алкилкарбониламино; и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, бензимидазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, изохинолинила, хиноксалинила, хиназолинила, изоксазолила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила, бензотиофенила, индазолила и 2,3-дигидробензо[1,4]диоксинила;
причем G необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила;
R2 представляет собой
(i) фенил, необязательно замещенный от одного до трех заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкилтио, фторо, хлоро и гидрокси; и фенил, необязательно замещенный одним амино, С1-4алкиламино, ди(С1-4алкил)амино, трифторметилом, фторметокси, дифторметокси, трифторметокси, С1-4алкиламинокарбонилом, ди(С1-4)алкиламинокарбонилом, С1-4алкилкарбониламино, 2,2,2-трифторэтокси, циано, С3-7циклоалкилкарбониламино, гидрокси(C1-4)алкилом, С1-4алкокси (C1-4)алкилом, С1-4алкокси-(C1-4)алкокси, С1-4алкилкарбонилокси, С1-4алкилсульфонилом, пиридинил(C1-4)алкилом, бензилоксикарбониламино, 4-метилпиперазин-1-илкарбонилом, пирролидин-1-илкарбонилом, карбокси, пиперидин-1-илкарбонилом, морфолин-4-илкарбонилом или С3-7циклоалкилом;
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила, бензоксазолила и пиридинила;
причем гетероарил R2 необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-; при этом L1 отсутствует или представляет собой C1-4алкил;
a1 связан через атом углерода с La и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода С1-4алкилом, амино, С1-4алкиламино, ди(С1-4алкил)амино, аминометилом, гидрокси, циано, С1-4алкокси, С1-4алкоксикарбонилом или одним или двумя фторо; причем пирролидинил необязательно замещен при атоме азота С1-4алкилом, фенил(C1-4)алкилом, С1-4алкилкарбонилом, С1-4алкоксикарбонилом или фенил(C1-4)алкоксикарбонилом;
ii) пиперидинила, необязательно замещенного С1-4алкилом, фенилом, амино, С1-4алкиламино, ди(С1-4алкил)амино, аминометилом, гидрокси, циано, С1-4алкокси, С1-4алкоксикарбонилом, фенил(С1-4)алкилом, С1-4алкилкарбонилом или фенил(C1-4)алкоксикарбонилом;
и
iii) азетидинила, необязательно замещенного 3-амино, 3-гидрокси, 3-С1-4алкокси, С1-4алкилом или аминометилом;
при условии, что, когда L1 отсутствует, а1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
и при условии, что, когда a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота a1;
L2 представляет собой С1-4алкил;
а2 связан через атом углерода с L2 и выбран из группы, состоящей из
i) пиперазинила, необязательно замещенного при атоме углерода С1-4алкилом, аминометилом, циано или C1-4алкоксикарбонилом; причем пиперазинил необязательно замещен при атоме азота С1-4алкилом, фенил(С1-4)алкилом, С1-4алкилкарбонилом, С1-4алкоксикарбонилом или фенил(С1-4)алкоксикарбонилом;
и
ii) морфолинила, необязательно независимо замещенного фенил(C1-4)алкилом или одним или двумя С1-4алкилами;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя С1-4алкилзаместителями;
L4 представляет собой (С2-6)алкил; и если L4 представляет собой С3-6алкил, L4 необязательно замещен хлоро, гидрокси или С1-4алкокси; при условии, что хлоро, гидрокси и С1-4алкокси не находятся в альфа-положении относительно несущего азот атома углерода;
а4 выбран из группы, состоящей из амино и С1-4алкиламино;
при условии, что а4 присоединен к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-4алкил;
а5 представляет собой С3-7циклоалкил, замещенный RB; причем RB выбран из группы, состоящей из амино, С1-4алкиламино, ди(С1-4алкил)амино, аминометила, С1-4алкиламинометила и ди(С1-4алкил)аминометила;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С3-7циклоалкилу, присоединение осуществляется к атому углерода, отличному от альфа-атома относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидинила, причем пирролидинил необязательно замещен С1-4алкилом, амино, С1-4алкиламино, ди(С1-4алкил)амино, аминометилом, циано, С1-4алкокси, С1-4алкоксикарбонилом или фенилом;
ii) пиперазинила, необязательно замещенного 4-С1-4алкилом; причем пиперазинил необязательно независимо замещен при атоме углерода одним или двумя С1-4алкилами, 2-оксо, 3-оксо, трифторметилом, аминометилом или гидроксиметилом;
iii) пиперидинила, необязательно замещенного одним или двумя С1-4алкилами, амино, С1-4алкиламино, ди(С1-4алкил)амино, аминометилом, гидрокси, циано, С1-4алкокси, С1-4алкоксикарбонилом, фенилом, фенил(C1-4)алкилом или одним или двумя фторо;
причем фенил и фенильная часть фенил(C1-4)алкила необязательно замещена С1-4алкилом, С1-4алкокси, С1-4алкилтио, фторо, хлоро, циано, амино или гидрокси;
iv) азетидинила, необязательно замещенного 3-амино или 3-аминометилом;
v) [1,4]диазепан-1-ила;
и
vi) 3,6-диазабицикло[3,1,1]гепт-3-ила;
Ra представляет собой водород или С1-4алкилкарбонил;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1,
a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой а2-L2, а2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой Н;
и
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
2. Соединение по п. 1, в котором R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, гидрокси, хлоро и фторо; и фенила, необязательно замещенного одним амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, С1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, С1-4алкилтио и гидрокси; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, амино, ди(С1-4алкил)амино или пиперазин-1-илом, необязательно замещенным заместителем 4-С1-4алкил;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, С1-4алкилсульфонилом или пиридинилом;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
причем G необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила.
3. Соединение по п. 2, в котором R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, гидрокси, хлоро и фторо; и фенила, необязательно замещенного одним амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, С1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, С1-4алкилтио и гидрокси; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, амино, ди(С1-4алкил)амино или пиперазин-1-илом, необязательно замещенным заместителем 4-С1-4алкил;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, С1-4алкилсульфонилом;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
причем G необязательно независимо замещен одним или двумя С1-4алкилзаместителями.
4. Соединение по п. 3, в котором R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, гидрокси, хлоро и фторо; и фенила, необязательно замещенного одним амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, С1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси и С1-4алкилтио; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, ди(С1-4алкил)амино или пиперазин-1-илом, необязательно замещенным 4-С1-4алкилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, С1-4алкилсульфонилом;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
причем G необязательно замещен одним С1-4алкилзаместителем.
5. Соединение по п. 4, в котором R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-2алкокси, гидрокси и фторо; кроме того, фенил необязательно замещен одним амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, С1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро или трифторметилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и С1-4алкилтио; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, ди(С1-4алкил)амино или пиперазин-1-илом, необязательно замещенным 4-С1-4алкилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом или амино;
и
iv) G-заместителя, выбранного из группы, состоящей из пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, бензо[1,3]диоксол-5-ила и бензо[1,2,5]оксадиазолила;
причем G необязательно замещен одним С1-4алкилзаместителем.
6. Соединение по п. 5, в котором R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного заместителем, выбранным из группы, состоящей из С1-2алкила, С1-2алкокси, гидрокси и фторо; или фенила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонила, гидроксиметила, аминокарбонила, С1-4алкилкарбониламино, циано, трифторметокси, C1-2алкилсульфонила, нитро и трифторметила;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкокси и С1-4алкилтио; или пиримидинила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из морфолин-4-ила, ди(С1-4алкил)амино и пиперазин-1-ила, необязательно замещенного 4-метилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, C1-4алкокси, С1-4алкилтио, гидрокси, фторо и хлоро; или пиридинила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из циано, гидроксиметила и амино;
iv) G-заместителя, выбранного из группы, состоящей из пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, бензо[1,3]диоксол-5-ила и бензо[1,2,5]оксадиазолила;
причем G необязательно замещен одним С1-4алкилзаместителем.
7. Соединение по п. 1, в котором R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил, необязательно замещенный одним амино, трифторметилом, фторметокси, дифторметокси, трифторметокси, ди(C1-4)алкиламинокарбонилом, С1-4алкилкарбониламино, 2,2,2-трифторэтокси, циано, С3-7циклоалкилкарбониламино, гидрокси(C1-4)алкилом, С1-4алкокси(C1-4)алкилом, С1-4алкокси-(C1-4)алкокси, C1-4алкилкарбонилокси, С1-4алкилсульфонилом, пиридинил(C1-4)алкилом, бензилоксикарбониламино, 4-метилпиперазин-1-илкарбонилом, пирролидин-1-илкарбонилом, карбокси, пиперидин-1-илкарбонилом или морфолин-4-илкарбонилом; или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила, бензоксазолила и пиридинила; при этом гетероарил необязательно независимо замещен одним или двумя С1-4алкиламино.
8. Соединение по п. 7, в котором R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-2алкокси, С1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен одним амино, трифторметилом, фторметокси, дифторметокси, трифторметокси, C1-4алкилкарбониламино, С1-4алкилкарбонилокси, 2,2,2-трифторэтокси, бензилоксикарбониламино, гидрокси(C1-4)алкилом или С1-4алкокси(C1-4)алкилом;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил необязательно независимо замещен одним или двумя С1-4алкилами.
9. Соединение по п. 8, в котором R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, C1-2алкокси, С1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен одним амино, фторметокси, дифторметокси, трифторметокси, С1-4алкилкарбониламино, C1-4алкилкарбонилокси, 2,2,2-трифторэтокси или С1-4алкокси(C1-4)алкилом;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил необязательно независимо замещен одним или двумя С1-4алкиламино.
10. Соединение по п. 9, в котором R2 представляет собой фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из С1-2алкила, С1-2алкокси, C1-2алкилтио, фторо, 3-хлоро, 4-хлоро и гидрокси; или фенил, необязательно замещенный одним заместителем, выбранным из группы, состоящей из амино, дифторметокси, трифторметокси, С1-4алкилкарбониламино, С1-4алкилкарбонилокси и 2,2,2-трифторэтокси;
или R2 представляет собой гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил R2 необязательно независимо замещен одним или двумя С1-2алкилами.
11. Соединение по п. 10, в котором R2 представляет собой
(i) фенил, необязательно замещенный одним заместителем, выбранным из группы, состоящей из С1-2алкила, С1-2алкокси, C1-2алкилтио, одного или двух фторо, 3-хлоро, 4-хлоро и гидрокси; или фенил, необязательно замещенный одним заместителем, выбранным из группы, состоящей из амино, дифторметокси, трифторметокси, С1-4алкилкарбониламина, С1-4алкилкарбонилокси и 2,2,2-трифторэтокси;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил R2 необязательно независимо замещен одной или двумя С1-2алкиламиногруппами.
12. Соединение по п. 1, в котором A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-; при этом
L1 отсутствует или представляет собой С1-4алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода амино, гидрокси или одним или двумя фторо;
ii) пиперидинила;
и
iii) азетидинила;
при условии, что, когда L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота а1;
и при условии, что, когда a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота а1;
L2 представляет собой С1-4алкил;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя С1-4алкилзаместителями;
L4 представляет собой (С2-6)алкил;
а4 выбран из группы, состоящей из амино и С1-4алкиламина;
при условии, что а4 присоединен к атому углерода (С2-6)алкила, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-4алкил;
а5 представляет собой С3-7циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С3-7циклоалкилу, место присоединения представляет собой атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, причем пирролидин-1-ил необязательно замещен С1-4алкилом, амино или аминометилом;
ii) пиперазин-1-ила, необязательно замещенного 4-C1-4алкилом; причем пиперазин-1-ил необязательно независимо замещен при атоме углерода одним или двумя С1-4алкилами, 2-оксо или 3-оксо;
iii) пиперидин-1-ила, необязательно замещенного одним или двумя С1-4алкилами или амино;
iv) азетидин-1-ила, необязательно замещенного 3-амино или 3-аминометилом;
v) [1,4]диазепан-1-ила;
и
vi) 3,6-диазабицикло[3.1.1]гепт-3-ила.
13. Соединение по п. 12, в котором A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-; при этом
L1 отсутствует или представляет собой С1-2алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода гидрокси или одним или двумя фторо;
ii) пиперидин-3-ила;
и
iii) азетидинила;
при условии, что, когда L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота а1;
и при условии, что, когда а1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к а1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота а1;
L2 представляет собой С1-2алкил;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя С1-2алкилами;
L4 представляет собой (С2-4)алкил;
а4 выбран из группы, состоящей из амино и С1-4алкиламина;
при условии, что а4 присоединен к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-4алкил;
а5 представляет собой С4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино или аминометилом;
ii) пиперазин-1-ила, необязательно замещенного 4-C1-4алкилом; при этом пиперазин-1-ил необязательно независимо замещен при атоме углерода одним или двумя С1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
iv) азетидин-1-ила, необязательно замещенного 3-аминометилом;
и
v) [1,4]диазепан-1-ила;
при условии, что положением заместителя, содержащего азотный радикал в качестве точки присоединения к азотсвязанному гетероциклилу, является атом углерода, отличный от атома, который является альфа-атомом относительно атома азота гетероциклила.
14. Соединение по п. 13, в котором A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; а3-L3-, a4-L4- и a5-L5-; при этом
L1 отсутствует или представляет собой С1-2алкил;
а1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода гидрокси или одним или двумя фторо;
и
ii) пиперидин-3-ила;
при условии, что, когда L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота а1;
и при условии, что, когда а1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к а1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота a1;
L2 представляет собой метилен;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно замещенный одним или двумя метилами;
L4 представляет собой (С2-3)алкил;
а4 представляет собой амино, при условии, что а4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-2алкил;
а5 представляет собой С4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя С1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
и
iv) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азотсвязанному гетероциклилу, является атом углерода, отличный от альфа-атома относительно атома азота гетероциклила.
15. Соединение по п. 14, в котором A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-, a4-L4- и a5-L5-; при этом
L1 отсутствует или представляет собой С1-2алкил;
а1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода гидрокси или одним или двумя фторо;
и
ii) пиперидин-3-ила;
при условии, что, когда L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
и при условии, что, когда a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к а1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота а1;
L2 представляет собой метилен;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно замещенный одним или двумя метилами;
L4 представляет собой (С2-3)алкил;
а4 представляет собой амино, при условии, что а4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-2алкил;
а5 представляет собой С4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя С1-2алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино,
и
iv) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азотсвязанному гетероциклилу, является атом углерода, отличный от альфа-атома относительно атома азота гетероциклила.
16. Соединение по п. 1, в котором Ra представляет собой водород.
17. Соединение формулы (I)
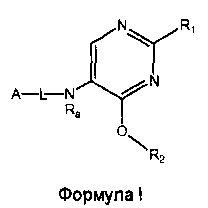
где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, гидрокси, хлоро и фторо; и фенила, необязательно замещенного одним амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, гидрокси(С1-4)алкилом, аминокарбонилом, С1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси, С1-4алкилтио и гидрокси; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, амино, ди(С1-4алкил)амино или пиперазин-1-илом, необязательно замещенным заместителем 4-С1-4алкил;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, С1-4алкилсульфонилом;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
причем G необязательно независимо замещен одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила;
R2 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкилтио, одного или двух фторо, хлоро и гидрокси; кроме того, фенил необязательно замещен амино, трифторметилом, фторметокси, дифторметокси, трифторметокси, ди(C1-4)алкиламинокарбонилом, C1-4алкилкарбониламино, 2,2,2-трифторэтокси, циано, С3-7циклоалкилкарбониламино, гидрокси(C1-4)алкилом, С1-4алкокси(C1-4)алкилом, С1-4алкокси-(C1-4)алкокси, С1-4алкилкарбонилокси, C1-4алкилсульфонилом, пиридинил(C1-4)алкилом, бензилоксикарбониламино, 4-метилпиперазин-1-илкарбонилом, пирролидин-1-илкарбонилом, карбокси, пиперидин-1-илкарбонилом или морфолин-4-илкарбонилом;
или R2 представляет собой гетероарил, выбранный из группы, состоящей из бензотиазолила, бензоксазолила и пиридинила; при этом гетероарил необязательно независимо замещен одним или двумя С1-4алкиламино;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-; при этом
L1 отсутствует или представляет собой С1-4алкил;
a1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода амино, гидрокси или одним или двумя фторо;
ii) пиперидинила;
и
iii) азетидинила;
при условии, что, когда L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота а1;
и при условии, что, когда а1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к а1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота a1;
L2 представляет собой С1-4алкил;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя С1-4алкилзаместителями;
L4 представляет собой (С2-6)алкил;
а4 выбран из группы, состоящей из амино и С1-4алкиламина;
при условии, что а4 присоединен к атому углерода (С2-6)алкила, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-4алкил;
а5 представляет собой С3-7циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С3-7циклоалкилу, место присоединения представляет собой атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, причем пирролидин-1-ил необязательно замещен С1-4алкилом, амино или аминометилом;
ii) пиперазин-1-ила, необязательно замещенного 4-C1-4алкилом; причем пиперазин-1-ил необязательно независимо замещен при атоме углерода одним или двумя С1-4алкилами, 2-оксо или 3-оксо;
iii) пиперидин-1-ила, необязательно замещенного одним или двумя С1-4алкилами или амино;
iv) азетидин-1-ила, необязательно замещенного 3-амино или 3-аминометилом;
v) [1,4]диазепан-1-ила;
и
vi) 3,6-диазабицикло[3.1.1]гепт-3-ила;
Ra представляет собой водород или метилкарбонил;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой а2-L2, а2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, а1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, а1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н; и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой Н;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
18. Соединение формулы (I)
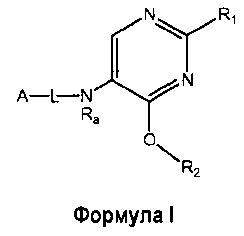
где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, гидрокси, хлоро и фторо; и фенила, необязательно замещенного одним амино, ди(С1-4алкил) амино, ди(С1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, С1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси, С1-4алкилтио и гидрокси; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, амино, ди(С1-4алкил)амино или пиперазин-1-илом, необязательно замещенным заместителем 4-С1-4алкил;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино, С1-4алкилсульфонилом;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, оксазолила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4Н-[1,2,4]оксадиазол-5-онила и бензотиофенила;
причем G необязательно независимо замещен одним или двумя С1-4алкилами;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-2алкокси, С1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен амино, трифторметилом, фторметокси, дифторметокси, трифторметокси, С1-4алкилкарбониламино, С1-4алкилкарбонилокси, 2,2,2-трифторэтокси, бензилоксикарбониламино, гидрокси(C1-4)алкилом или С1-4алкокси(С1-4)алкилом;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил необязательно независимо замещен одним или двумя С1-4алкилами;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-; при этом
L1 отсутствует или представляет собой С1-2алкил;
а1 связан через атом углерода с L1 и выбран из группы, состоящей из
i) пирролидинила, необязательно замещенного при атоме углерода гидрокси или одним или двумя фторо;
ii) пиперидин-3-ила;
и
iii) азетидинила;
при условии, что, когда L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота а1;
и при условии, что, когда а1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к а1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота а1;
L2 представляет собой С1-2алкил;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя С1-2алкилами;
L4 представляет собой (С2-4)алкил;
а4 выбран из группы, состоящей из амино и С1-4алкиламина;
при условии, что а4 присоединен к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-4алкил;
а5 представляет собой С4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино или аминометилом;
ii) пиперазин-1-ила, необязательно замещенного 4-C1-4алкилом; при этом пиперазин-1-ил необязательно независимо замещен при атоме углерода одним или двумя С1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
iv) азетидин-1-ила, необязательно замещенного 3-аминометилом;
и
v) [1,4]диазепан-1-ила;
при условии, что положением заместителя, содержащего азотный радикал в качестве точки присоединения к азотсвязанному гетероциклилу, является атом углерода, отличный от атома, который является альфа-атомом относительно атома азота гетероциклила;
Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S) -пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой а2-L2, а2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой Н;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
19. Соединение формулы (I)
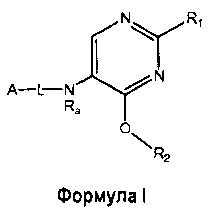
где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-2алкокси, гидрокси, хлоро и фторо; и фенила, необязательно замещенного одним амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, С1-4алкилкарбониламино, циано, трифторметокси, C1-4алкилсульфонилом, нитро, трифторметилом или фенилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и С1-4алкилтио; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, ди(С1-4алкил)амино или пиперазин-1-илом, необязательно замещенным 4-С1-4алкилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; и пиридинила, необязательно замещенного одним гидроксиметилом, амино или С1-4алкилсульфонилом;
и
iv) G-заместителя, выбранного из группы, состоящей из нафтила, пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, пиразинила, хиноксалинила, пирролопиридинила, бензо[1,3]диоксол-5-ила, бензо[1,2,5]оксадиазолила, дибензотиофенила, 4H-[1,2,4]оксадиазол-5-онила и бензотиофенила;
причем G необязательно замещен одним С1-4алкилзаместителем;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, C1-2алкокси, С1-4алкилтио, одного или двух фторо, хлоро и гидрокси; и фенил необязательно замещен одним амино, фторметокси, дифторметокси, трифторметокси, С1-4алкилкарбониламино, C1-4алкилкарбонилокси, 2,2,2-трифторэтокси или С1-4алкокси(C1-4)алкилом;
(ii) или гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил необязательно независимо замещен одним или двумя С1-4алкилами;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-; a4-L4- и a5-L5-; при этом
L1 отсутствует или представляет собой С1-2алкил;
a1 связан через атом углерода с L1 и представляет собой
i) пирролидинил, необязательно замещенный при атоме углерода гидрокси или одним или двумя фторо;
ii) пиперидин-3-ил;
или
iii) азетидинил;
при условии, что, когда L1 отсутствует, а1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота а1;
при условии, что, когда a1 замещен заместителем, содержащим азотный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от альфа-атома относительно атома азота a1;
L2 представляет собой метилен;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно независимо замещенный одним или двумя С1-4алкилзаместителями;
L4 представляет собой (С2-3)алкил;
а4 представляет собой амино,
при условии, что а4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-2алкил;
а5 представляет собой С4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино или аминометилом;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя С1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
iv) азетидин-1-ила, необязательно замещенного 3-аминометилом;
и
v) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азотсвязанному гетероциклилу, является атом углерода, отличный от атома, который является альфа-атомом относительно атома азота гетероциклила;
Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой а2-L2, а2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой Н;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
20. Соединение формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-2алкокси, гидрокси и фтора; кроме того, фенил необязательно замещен одним амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонилом, гидрокси(C1-4)алкилом, аминокарбонилом, С1-4алкилкарбониламино, циано, трифторметокси, С1-4алкилсульфонилом, нитро или трифторметилом;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и С1-4алкилтио; и пиримидинила, необязательно замещенного одним циано, морфолин-4-илом, ди(С1-4алкил)амино или пиперазин-1-илом, необязательно замещенным 4-С1-4алкилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, С1-4алкокси, С1-4алкилтио, гидрокси, фторо, хлоро и циано; кроме того, пиридинил необязательно замещен гидроксиметилом или амино;
и
iv) G-заместителя, выбранного из группы, состоящей из пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, бензо[1,3]диоксол-5-ила и бензо[1,2,5]оксадиазолила;
причем G необязательно замещен одним С1-4алкилзаместителем;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из С1-2алкила, C1-2алкокси, С1-2алкилтио, фторо, 3-хлоро, 4-хлоро и гидрокси; и фенил необязательно замещен одним заместителем, выбранным из группы, состоящей из амино, дифторметокси, трифторметокси, C1-4алкилкарбониламино, С1-4алкилкарбонилокси и 2,2,2-трифторэтокси;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил R2 необязательно независимо замещен одним или двумя С1-2алкилами;
A-L- выбран из группы, состоящей из a1-L1-; a2-L2-; a3-L3-, a4-L4- и a5-L5-; причем
L1 отсутствует или представляет собой С1-2алкил;
a1 связан через атом углерода с L1 и представляет собой
i) пирролидинил, необязательно замещенный при атоме углерода гидрокси или одним или двумя фторо;
или
ii) пиперидин-3-ил;
при условии, что, когда L1 отсутствует, а1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота а1;
и при условии, что, когда a1 замещен заместителем, содержащим кислородный радикал в качестве точки присоединения к a1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота а1;
L2 представляет собой метилен;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно замещенный одним или двумя метилами;
L4 представляет собой (С2-3)алкил;
а4 представляет собой амино, при условии, что а4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-2алкил;
а5 представляет собой С4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя С1-4алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
и
iv) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азотсвязанному гетероциклилу, является атом углерода, отличный от атома, который является альфа-атомом относительно атома азота гетероциклила;
Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой а2-L2, а2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой Н;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
21. Соединение формулы (I)
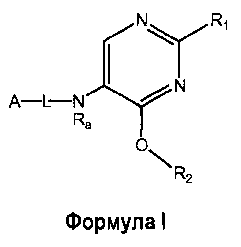
где
R1 выбран из группы, состоящей из
i) фенила, необязательно замещенного заместителем, выбранным из группы, состоящей из С1-2алкила, С1-2алкокси, гидрокси и фторо; или фенила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из амино, ди(С1-4алкил)амино, ди(С1-4алкил)аминокарбонила, гидроксиметила, аминокарбонила, С1-4алкилкарбониламино, циано, трифторметокси, C1-2алкилсульфонила, нитро и трифторметила;
ii) пиримидинила, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкокси и С1-4алкилтио; или пиримидинила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из морфолин-4-ила, ди(С1-4алкил)амино и пиперазин-1-ила, необязательно замещенного 4-метилом;
iii) пиридинила, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из С1-4алкила, C1-4алкокси, С1-4алкилтио, гидрокси, фторо и хлоро; или пиридинила, необязательно замещенного одним заместителем, выбранным из группы, состоящей из циано, гидроксиметила и амино;
и
iv) G-заместителя, выбранного из группы, состоящей из пиразолила, тиенила, бензотиазолила, хинолинила, индолила, тиазолила, фуранила, дигидробензофуранила, бензо[1,3]диоксол-5-ила и бензо[1,2,5]оксадиазолила;
причем G необязательно замещен одним С1-4алкилзаместителем;
R2 представляет собой
(i) фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из С1-2алкила, C1-2алкокси, С1-2алкилтио, одного или двух фторо, 3-хлоро, 4-хлоро и гидрокси; или фенил необязательно замещен одним заместителем, выбранным из группы, состоящей из амино, дифторметокси, трифторметокси, С1-4алкилкарбониламино, С1-4алкилкарбонилокси и 2,2,2-трифторэтокси;
или
(ii) гетероарил, выбранный из группы, состоящей из бензотиазолила и бензоксазолила; при этом гетероарил R2 необязательно независимо замещен одним или двумя С1-2алкилами;
A-L- выбран из группы, состоящей из а1-L1-; a2-L2-; a3-L3-, a4-L4- и a5-L5-; причем
L1 отсутствует или представляет собой С1-2алкил;
a1 связан через атом углерода с L1 и представляет собой
i) пирролидинил, необязательно замещенный при атоме углерода гидрокси или одним или двумя фторо;
или
ii) пиперидин-3-ил;
при условии, что, когда L1 отсутствует, a1 присоединен к N(Ra) через атом углерода, отличный от атома, который является альфа-атомом относительно атома азота a1;
и при условии, что, когда a1 замещен заместителем, содержащим кислородный или азотный радикал в качестве точки присоединения к а1, замещение происходит при атоме углерода, отличном от атома, который является альфа-атомом относительно атома азота a1;
L2 представляет собой метилен;
а2 связан через атом углерода с L2, а а2 представляет собой морфолинил;
L3 представляет собой метилен;
а3 представляет собой имидазолил, необязательно замещенный одним или двумя метилами;
L4 представляет собой (С2-3)алкил;
а4 представляет собой амино, при условии, что а4 присоединен через атом углерода, отличный от атома, который является альфа-атомом относительно N(Ra);
L5 отсутствует или представляет собой С1-2алкил;
а5 представляет собой С4-6циклоалкил, замещенный RB; при этом RB представляет собой амино;
при условии, что, когда RB содержит азотный радикал в качестве точки присоединения к С5-6циклоалкилу, присоединение осуществляется к атому углерода, отличному от атома, который является альфа-атомом относительно N(Ra);
или
A-L- берется с Ra и атомом азота, к которому они присоединены, для формирования азотсвязанного гетероциклила, выбранного из группы, состоящей из
i) пирролидин-1-ила, необязательно замещенного амино;
ii) пиперазин-1-ила, необязательно независимо замещенного при атоме углерода одним или двумя С1-2алкилами;
iii) пиперидин-1-ила, необязательно замещенного амино;
и
iv) [1,4]диазепан-1-ила;
при условии, что положением заместителя, включающего азотный радикал в качестве точки присоединения к азотсвязанному гетероциклилу, является атом углерода, отличный от атома, который является альфа-атомом относительно атома азота гетероциклила;
Ra представляет собой водород;
при условии, что соединение формулы (I) отличается от соединения, выбранного из группы, состоящей из
соединения, в котором R1 представляет собой 4-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой а2-L2, а2 представляет собой (S)-морфолин-3-ил, L2 представляет собой метил, Ra представляет собой Н;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой (S)-пирролидин-2-ил, L1 представляет собой метил, Ra представляет собой Н;
и
соединения, в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, RB представляет собой 2-амино, Ra представляет собой Н;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
22. Соединение формулы (I)
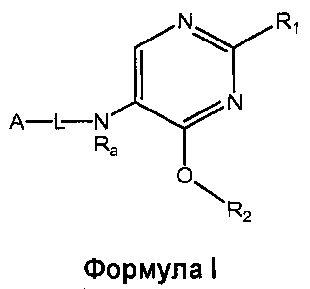
выбранное из группы, состоящей из:
соединения формулы (I), в котором R1 представляет собой 4-метоксифенил, R2 представляет собой 4-метоксифенил, A-L-представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой фенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой нафт-1-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой нафт-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой тиен-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой фуран-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-трифторметоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метилкарбониламинофенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-гидроксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой хинолин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой хинолин-8-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метилхинолин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 4-бифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой хинолин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой дибензотиофен-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2,6-дигидроксипиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-цианофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-нитрофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-аминокарбонилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-N, N-диэтиламинокарбонилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-метансульфонилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 4-гидроксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой индол-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 4H-[1,2,4]оксадиазол-5-он-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-фторфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 4-фторфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 2-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 2-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-диэтиламинофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-метилкарбониламинофенил, R2 представляет собой 4-метоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 4-метилкарбониламинофенил, R2 представляет собой 4-метоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 4-аминофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-аминофенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-аминофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой бензотиазол-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой тиазол-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой бензотиофен-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-трифторметилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-трифторметоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метилтиопиримидин-5-ил, R2 представляет собой 4-метоксифенил, А-L- представляет собой a1-L1, а1 представляет собой пирролидин-2 ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метоксипиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-дифторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3,4-дифторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-дифтор-4-гидроксиметилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2,4-диметоксипиримидин-5-ил, R2 представляет собой 4-метоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-метоксипиридин-3-ил, R2 представляет собой 4-гидроксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-этоксипиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиразол-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-диметилизоксазол-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2,3-дигидробензофуран-5-ил, R2 представляет собой 4-метоксифенил, А-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-фтор-4-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиразол-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-метилтиопиримидин-4-ил, R2 представляет собой 4-метоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 1-метилпиразол-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-фтор-5-метоксифенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-фтор-5-метилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-аминопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фтор-6-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2 ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-гидроксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-гидроксипиридин-3-ил, R2 представляет собой 4-гидроксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой хиноксалин-6-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 1H-пирроло[2,3-b]пиридин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой бензо[1,2,5]оксадиазол-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4,4-дифторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 2-аминопиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-диметиламинопиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-(морфолин-4-ил)-пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-(4-метилпиразин-1-ил)пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой бензотиазол-6-ил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 2-метилбензоксазол-6-ил, А-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилбензоксазол-6-ил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S, 4S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-метилбензотиазол-6-ил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-диметилфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой бензо[1,3]диоксол-5-ил, R2 представляет собой 4-метоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3,5-дихлорфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3,5-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 3,5-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 3-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 2,3-дифтор-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-этоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-этоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-этоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метансульфонилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-дифторметоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-дифторметоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-дифторметоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-н-пропилоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-н-пропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-н-пропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой индол-4-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой индол-6-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой индол-7-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиразин-2-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2-цианопиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-(2,2,2-трифторэтокси)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-(2,2,2-трифторэтокси)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(2,2,2-трифторэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, а Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-н-бутоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-н-бутоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-н-бутоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-фтор-4-метоксифенил, А-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-фтор-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 3-фтор-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S,4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-цианофенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R-2 представляет собой 4-цианофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-циклопропилкарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-изопропилоксифенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-изопропилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-изопропилоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 3-циано-5-фторфенил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-гидроксиметилфенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-гидроксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-гидроксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-фторфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метилфенил, A-L- представляет собой a1-Ll, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метилтиофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метилтиофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метилтиофенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксиметилфенил, А-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксиметилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксиметилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-гидроксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-пирролидин-1-илкарбонилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-карбоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-пиперидин-1-илкарбонилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-(морфолин-4-илкарбонил)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-карбоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-карбоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-карбоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой (3-пирролидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой (3-пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-(морфолин-4-илкарбонил)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-(пирролидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-(пиперидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-(морфолин-4-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-(4-метилпиперазин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-диэтиламинокарбонилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-(пирролидин-1-илкарбонил)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-бензилоксикарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-аминокарбонилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой метилкарбонил; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-фтор-4-метилфенил, А-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-фтор-4-метилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 3-фтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-фтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-бензилоксикарбониламинофенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метилфенил, A-L- представляет собой a1-Ll, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 2,3-дифтор-4-метилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S, 4R)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-этилфенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S, 4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S, 4R)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-бензилоксикарбониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-аминофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 3-метилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-метилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метил-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-метил-4-метоксифенил, A-L- представляет собой a1-Ll, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-фторметилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-4-ил, L1 отсутствует, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-(пиридин-3-илметил)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 3-метил-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 3-метил-4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метилкарбониламинофенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метансульфониламинофенил, A-L- представляет собой a1-Ll, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метансульфониламинофенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой азетидин-3-ил, L1 представляет собой метил, а Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-формамидофенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-фторметилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метил-4-фторфенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 3-метил-4-фторфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-трифторметилфенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-трифторметилфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метансульфонилфенил, А-L- представляет собой a1-Ll, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-формамидофенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой азетидин-3-ил, L1 отсутствует, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой а1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 2-метилфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-метилкарбонилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-хлорпиридин-3-ил, R2 представляет собой 2-хлорфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 2-хлорфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 3-гидроксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 2-хлорфенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 2-хлорфенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S, 4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S,4R)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S,4S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-фторпирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S, 4S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-(2-метоксиэтокси)фенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-(2-метоксиэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-(2-метоксиэтокси)фенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-(2-метоксиэтокси)фенил, А-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 3-метилкарбонилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 3-гидроксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 3-метилкарбонилоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 3-метилкарбонилоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-фторметоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пиперидин-3-ил, L1 отсутствует, a Ra представляет собой Н; (3R)
соединения формулы (I), в котором R1 представляет собой 6-фтор-5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 2,5-диметилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6′-хлор-3,5′-диметил[2,3′]бипиридинил-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-хлор-4-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой а1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 6-хлор-5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пиперидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2R)
соединения формулы (I), в котором R1 представляет собой 2-хлор-5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-гидроксиметилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой пирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-гидроксипирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (транс 2S,4R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой гидроксипирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (цис 2R,4R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, а1 представляет собой 4-гидроксипирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (транс 2S, 4R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a1-L1, a1 представляет собой 4-гидроксипирролидин-2-ил, L1 представляет собой метил, a Ra представляет собой Н; (цис 2R,4R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, а2 представляет собой морфолин-2-ил, L2 представляет собой метил, a Ra представляет собой Н; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, а2 представляет собой морфолин-2-ил, L2 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, а2 представляет собой морфолин-2-ил, L2 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, а2 представляет собой морфолин-3-ил, L2 представляет собой метил, a Ra представляет собой Н; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, а2 представляет собой морфолин-3-ил, L2 представляет собой метил, a Ra представляет собой Н; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, а2 представляет собой морфолин-3-ил, L2 представляет собой метил, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-фторпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, а2 представляет собой морфолин-3-ил, L2 представляет собой метил, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a2-L2, а2 представляет собой морфолин-3-ил, L2 представляет собой метил, a Ra представляет собой Н; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой имидазол-2-ил, L3 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой 5-метил-3H-имидазол-4-ил, L3 представляет собой метил, R и Ra представляют собой Н;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой 3-метил-3H-имидазол-4-ил, L3 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой 2-этил-5-метил-3H-имидазол-4-ил, L3 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a3-L3, а3 представляет собой 3H-имидазол-4-ил, L3 представляет собой метил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, а4 представляет собой 2-амино, L4 представляет собой пропил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, а4 представляет собой 2-амино, L4 представляет собой этил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, а4 представляет собой 2-амино, L4 представляет собой 4-метилпентил, a Ra представляет собой Н; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, а4 представляет собой 2-амино, L4 представляет собой этил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a4-L4, а4 представляет собой 2-метиламино, L4 представляет собой этил, a Ra представляет собой Н;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 представляет собой метил, a Ra представляет собой Н; (2S,1R)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 представляет собой метил, a Ra представляет собой Н; (2S,1R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклобутил, L5 представляет собой метил, a Ra представляет собой Н; (транс)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклобутил, L5 представляет собой метил, a Ra представляет собой Н; (транс)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклобутил, L5 отсутствует, a Ra представляет собой Н; (смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой пиримидин-5-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклобутил, L5 отсутствует, a Ra представляет собой Н; (смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (цис)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (рацемический, смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (1RS, 3SR рацемический цис)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (1RS, 2SR рацемический одиночный стереоизомер, неизвестный цис/транс)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (рацемический, смесь цис/транс)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (рацемический, смесь цис и транс)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (цис 1R, 3S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (цис 1R, 3S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (рацемический, смесь цис и транс)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (цис 1S,3R)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-циклопропилфенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (цис 1S, 3R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (цис 1R,3S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, A-L- представляет собой a5-L5, а5 представляет собой циклогексил, L5 отсутствует, a Ra представляет собой Н; (транс, один энантиомер, абсолютно неизвестен)
соединения формулы (I), в котором R1 представляет собой фенил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопирролидин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra вместе образуют 3-аминопирролидин-1-ил; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопиперидин-1-ила; (3S)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопиперидин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминометилазетидин-1-ила;
соединение формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берут вместе с атомами, к которым они присоединены, для образования 2-аминометилпирролидин-1-ила; (2R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 4-аминопиперидин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для образования 2-аминометилпирролидин-1-ила; (2R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-оксопиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения [1,4]диазепан-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-оксопиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3,6-диазабицикло[3,1,1]гепт-3-иламино;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, 3-аминопирролидин-1-ил; (3R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминоазетидин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, а А-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-метилпиперазин-1-ила; (рацемический)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-метилпиперазин-1-ила; (2R)
соединения формулы (I), в котором R1 представляет собой 5-цианопиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-метилпиперазин-1-ила; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения [1,4]-диазепан-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, а А-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения [1,4]диазепан-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, а А-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопирролидин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопирролидин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метилтиопиридин-3-ил, R2 представляет собой 4-метоксифенил, а А-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3,3-диметилпиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения пиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-аминопирролидин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 4-метилпиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-метилпиперазин-1-ила; (2S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3,3-диметилпиперазин-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-метилпиперазин-1-ила; (3S)
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-метилпиперазин-1-ила; (3R)
соединения формулы (I), в котором R1 представляет собой 5-метилпиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения [1,4]диазепан-1-ила;
соединения формулы (I), в котором R1 представляет собой пиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3,5-диметилпиперазин-1-ила; (цис)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 2-этилпиперазин-1-ила; (2S)
соединения формулы (I), в котором R1 представляет собой 5-метоксипиридин-3-ил, R2 представляет собой 4-метоксифенил, a A-L- и Ra берутся вместе с атомами, к которым они присоединены, для получения 3-этилпиперазин-1-ила; (3R);
и его фармацевтически приемлемые соли.
23. Фармацевтическая композиция, обладающая способностью модулировать дельта-опиоидные рецепторы, содержащая терапевтически эффективное количество соединения по пп. 1 или 17-22 и по меньшей мере один из фармацевтически приемлемого носителя, фармацевтически приемлемого наполнителя и фармацевтически приемлемого разбавителя.
24. Фармацевтическая композиция по п. 23, в которой композиция представляет собой твердую лекарственную форму для перорального введения.
25. Фармацевтическая композиция по п. 23, в которой композиция представляет собой сироп, эликсир или суспензию.
26. Способ лечения боли при заболеваниях или состояниях, модулируемых опиоидными рецепторами, у нуждающегося в таком лечении пациента, включающий введение пациенту терапевтически эффективного количества соединения по пп. 1 или 17-22.
27. Способ по п. 26, в котором заболевание или состояние выбирают из группы, состоящей из остеоартрита, ревматоидного артрита, фибромиалгии, мигрени, головной боли, зубной боли, ожога, солнечного ожога, укуса змеи, укуса паука, укуса насекомого, нейрогенного мочевого пузыря, доброкачественной гипертрофии предстательной железы, интерстициального цистита, ринита, контактного дерматита/гиперчувствительности, зуда, экземы, фарингита, мукозита, энтерита, целлюлита, каузалгии, неврита седалищного нерва, невралгии в височно-нижнечелюстном суставе, периферического неврита, полиневрита, культевой боли, фантомной боли, послеоперационной кишечной непроходимости, холецистита, болевого синдрома после мастэктомии, нейропатической боли в ротовой полости, синдрома Шарко, рефлекторной симпатической дистрофии, синдрома Гийена-Барре, парестетической мералгии, синдрома жжения в полости рта, кластерной головной боли, головной боли при мигрени, периферической нейропатии, двусторонней периферической нейропатии, диабетической нейропатии, неврита зрительного нерва, постфебрильного неврита, мигрирующего неврита, сегментарного неврита, неврита Гомбо, нейронита, шейно-плечевой невралгии, черепной невралгии, невралгии коленчатого узла, невралгии языкоглоточного нерва, мигренозной невралгии, идиопатической невралгии, межреберной невралгии, невралгии в области молочных желез, невралгии Мортона, синдрома носоресничного нерва, затылочной невралгии, эритромелалгии, невралгии Слудера, невралгии крылонебного узла, невралгии надглазничного нерва, невралгии видиева нерва, воспалительных заболеваний кишечника, синдрома раздраженного кишечника, синусовой головной боли, головной боли напряжения, схваток, родов, менструальных болей и рака.
28. Способ по п. 26, в котором боль выбрана из группы, состоящей из воспалительной боли, централизованно-опосредованной боли, периферически-опосредованной боли, висцеральной боли, боли, связанной со структурными нарушениями, онкологической боли, боли, связанной с повреждением мягких тканей, боли, связанной с прогрессирующим заболеванием, нейропатической боли, острой боли, связанной с острым повреждением, острой боли, связанной с травмой, острой боли, связанной с хирургическим вмешательством, хронической головной боли, хронической боли, связанной с нейропатологией, хронической боли в постинсультном периоде и хронической боли от мигрени.
29. Способ лечения или профилактики болезни или состояния, выбранных из группы, состоящей из депрессии, болезни Паркинсона, наркотической зависимости, алкогольной зависимости, гастрита, недержания мочи, преждевременного семяизвержения, диареи, сердечно-сосудистых заболеваний и респираторных заболеваний, причем указанный способ включает этап введения нуждающемуся в подобном лечении млекопитающему терапевтически эффективного количества соединения или соли по пп. 1 или 17-22.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Устройство для реверсирования направления вращения двигателей постоянного тока | 1926 |
|
SU11009A1 |
Авторы
Даты
2015-11-20—Публикация
2010-10-28—Подача