Область техники
Данное изобретение относится к фармацевтическим композициям, содержащим значительные количества соединений, обладающих фармакологическим действием в отношении сигма (σ) рецептора, к способам их получения и к их применению.
Уровень техники
Поиску новых терапевтических средств в последние годы значительно способствует лучшее понимание структуры белков и других биомолекул, связанных с целевыми заболеваниями. Одним из важных классов белков является сигма (σ) рецептор, рецептор поверхности клеток центральной нервной системы (ЦНС), который может иметь отношение к дисфорическому, галлюциногенному и стимулирующему сердечную деятельность эффектам опиоидов. При изучении биологии и функции сигма рецепторов было получено доказательство того, что лиганды сигма рецептора могут быть полезны при лечении психоза и нарушения движений, таких как дистония и поздняя дискинезия, и двигательных расстройств, связанных с хореей Хантингтона или синдромом Туретта, и болезни Паркинсона (Walker, J., et al, Pharmacol. Rev. 1990; 42: 355). Было описано, что известный лиганд сигма рецептора, римказол, при клиническом применении является эффективным при лечении психоза (Snyder, S., Largent, B., J. Neuropsychiatry 1989; 1:7). Места связывания сигма имеют селективное сродство с правовращающими изомерами определенных опиатных бензоморфанов, таких как (+)SKF 10047, (+)циклазоцин и (+)пентазоцин, а также с некоторыми нарколептиками, такими как галогенперидол. Несколько лигандов сигма рецептора описаны в известном уровне техники.
В заявке на патент WO 2006/021462 описано семейство производных пиразола, которые являются особенно селективными в качестве ингибиторов сигма рецептора. Указанные производные имеют пиразольную группу, которая характеризуется замещением, в положении 3, алкоксигруппой, связанной с атомом азота. Эти соединения обладают сильным обезболивающим действием при лечении и профилактике хронической и острой боли и, особенно, невропатической боли.
Однако соединения, описанные в WO 2006/021462, демонстрируют плохие реологические свойства и плохие характеристики прессуемости. Это затрудняет получение из них лекарственных форм, так как к композициям, содержащим активный ингредиент, обычно применяют механическое воздействие, и хорошая прессуемость и реологические свойства способствуют обработке и производству лекарственной формы.
Кроме того, получение лекарственных форм с высоким содержанием активного ингредиента является проблематичным. Лекарственные формы обычно содержат более 20 масс. % наполнителей к общей массе лекарственной формы. Это необходимо для успешного производства лекарственных форм, таких как пеллеты, которое включает несколько механических стадий, и необязательно, применение связующего агента (Hileman, G., et al, Int. J. Pharma. 1993; 100 (1-3): 71-79; Jover, I., et et al, J. Pharma. Sci. 1996; 85: 700-705). В частности, разбавители, связующие агенты и пластификаторы играют важную роль в свойствах конечного продукта, таких как пластические характеристики твердой композиции, необходимые для получения частиц желаемой формы, одинаковый размер и хорошие потребительские свойства и свойства растворения.
Например, полагают, что микрокристаллическая целлюлоза (МКЦ), обычный разбавитель, действует в качестве молекулярной губки, удерживая воду, применяемую во время стадии грануляции влажной массы до тех пор, пока не применяется давление (экструзией или силами сферонизации), которое выталкивает удерживаемую воду на поверхность частицы. Вода, находящаяся на поверхности частицы, действует в качестве смазывающего агента, снижая силы сдвига экструзии и, тем самым, способствуя получению цилиндрического экструдата из влажной массы. Вода, остающаяся внутри экструдата, действует в качестве пластификатора в том, что позволяет МКЦ быть менее структурно жесткой во время сферонизации.
К сожалению, необходимость применения определенных количеств наполнителей, таких как разбавители, ограничивает количество активного ингредиента в конечной лекарственной форме.
В общем, предупреждение и лечение боли требует композиций, которые способны к быстрой доставке обезболивающего средства пациенту. Кроме того, развитие боли часто требует, чтобы высокая доза обезболивающего средства вводилась сразу же после или до наступления боли. Большинство пациентов обычно испытывают эпизоды боли высокой интенсивности в этот момент. Следовательно, в данной области техники существует необходимость в лекарственных формах, превосходящих те, которые описаны в WO 2006/021462, которые также позволяли бы высокое содержание активного ингредиента.
Сущность изобретения
Авторы данного изобретения неожиданно обнаружили, что соединения формулы (I), несмотря на их плохие реологические характеристики и характеристики прессуемости, могут давать лекарственные формы, которые допускают высокое содержание активного ингредиента, свыше 80% от общей сухой массы лекарственной формы, а также обладают хорошими фармацевтическими свойствами, такими как, например, скорость выделения, размер частиц, закругленность или выход после просеивания. Это является неожиданным, так как физические свойства соединений формулы (I) указывают на обратное, а именно, на необходимость применять более высокие, чем обычно, количества наполнителей, таких как разбавители или связующие агенты, для компенсации таких свойств и для получения композиции с подходящими характеристиками.
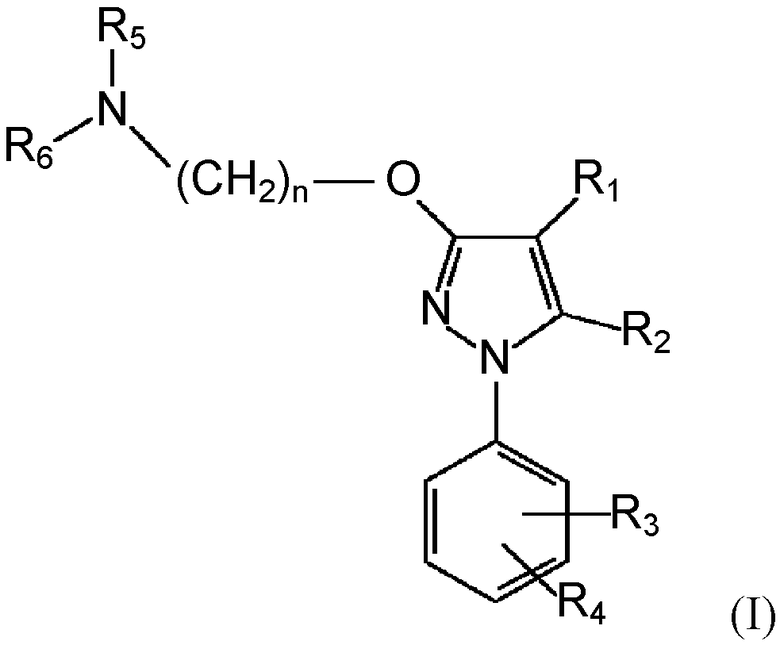
Поэтому первый аспект данного изобретения относится к фармацевтической композиции, которая содержит (i) соединение формулы (I) в качестве активного фармацевтического ингредиента:
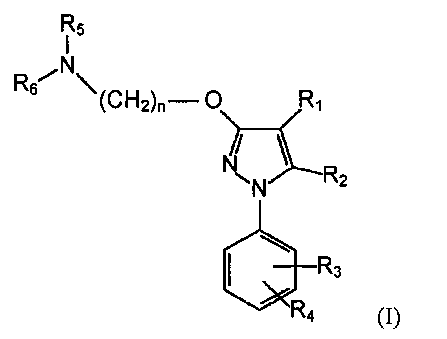
где
R1 выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген;
R2 выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген;
R3 и R4 независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген, или вместе с фенильной группой, к которой они присоединены, образуют конденсированную замещенную или незамещенную арильную группу или конденсированную замещенную или незамещенную гетероциклильную группу;
R5 и R6 независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген; или
вместе с атомом азота, к которому они присоединены, образуют замещенную или незамещенную гетероциклильную группу;
n равен 1, 2, 3, 4, 5, 6, 7 или 8;
t равен 1, 2 или 3;
R8 и R9, каждый независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкокси, замещенный или незамещенный арилокси и галоген;
или его фармацевтически приемлемую соль, изомер, пролекарство или сольват;
и (ii) по меньшей мере фармацевтически приемлемый наполнитель,
где активный фармацевтический ингредиент присутствует в количестве по меньшей мере 80% от общей сухой массы композиции.
Согласно второму аспекту, данное изобретение относится к способу получения фармацевтической композиции в соответствии с данным изобретением, который включает процесс экструзии/сферонизации или плавления гранул.
Третьим аспектом является композиция, полученная в соответствии с данным изобретением, для применения в качестве лекарственного средства.
Четвертым аспектом является композиция в соответствии с данным изобретением для применения при лечении или профилактике заболеваний или состояний, медиированных сигма рецептором. В конкретном варианте заболевание выбирают из группы, включающей диарею; липопротеиновые расстройства; мигрень; ожирение; артрит; гипертонию; аритмию; язву; дефицит способности к обучению, памяти и внимания; расстройства познавательной способности; нейродегенеративные заболевания; демиелинизирующие заболевания; привыкание к лекарственным средства и химическим веществам, включая кокаин, амфетамин, этанол и никотин; позднюю дискинезию; ишемический инсульт; эпилепсию; удар; стресс; рак; психотические состояния, в частности, депрессию, тревогу или шизофрению; воспаление; и аутоиммунные заболевания. В другом конкретном варианте заболеванием является боль, предпочтительно невропатическая боль, воспалительная боль или другие болевые состояния, включающие аллодинию и/или гипералгезию.
Краткое описание рисунков
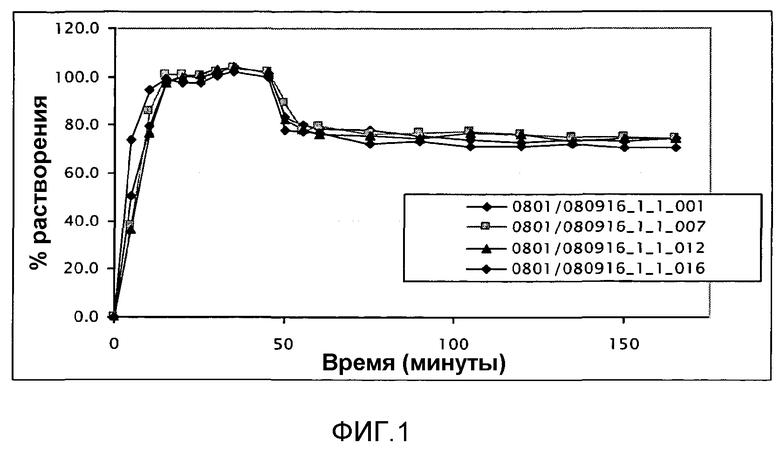
На фиг. 1 показаны профили растворения гранул с немедленным выделением для типовых композиций экспериментальных блоков №№1, 2, 3 и 4, в следующих условиях: кислая среда HCl 0,1 н. pH 1,2 и буферный раствор при pH 5,5 и 6,8, скорость мешалки 50 об./мин и объем 900 мл. Условия полного растворения поддерживают в кислой среде HCl 0,1 н. pH 1,2 и буферный раствор pH 5,5, условия неполного растворения проводят, когда среда изменится до pH 6,8. Последние три номера в надписи относятся к соответствующим номерам примеров.
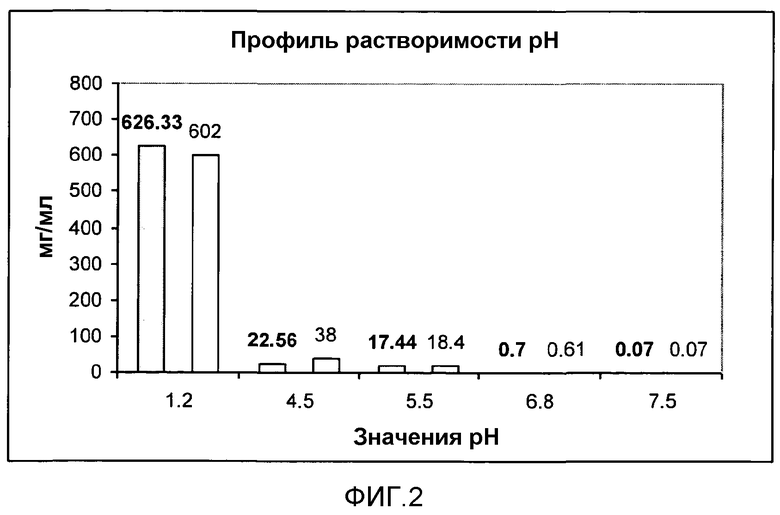
На фиг. 2 показан профиль pH растворимости API-001.
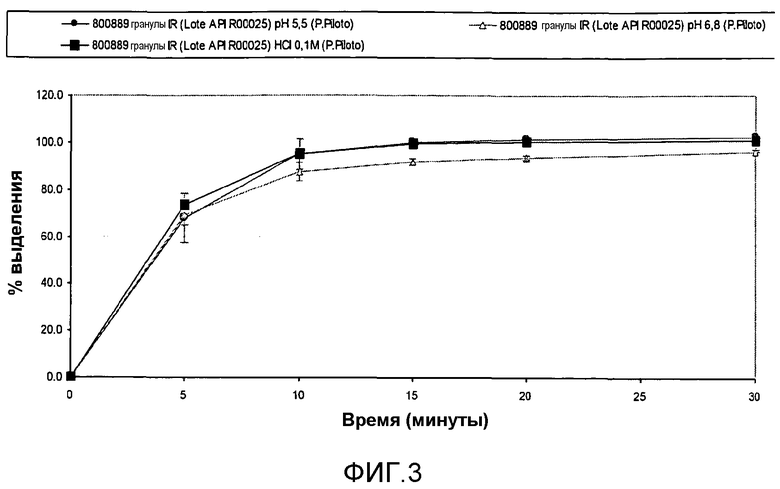
На фиг. 3 показано влияние растворимости лекарственного средства в in vitro профиле выделения экструдированных-сферонизированных гранул API-001 (условия полного растворения поддерживают в течение всего исследования).
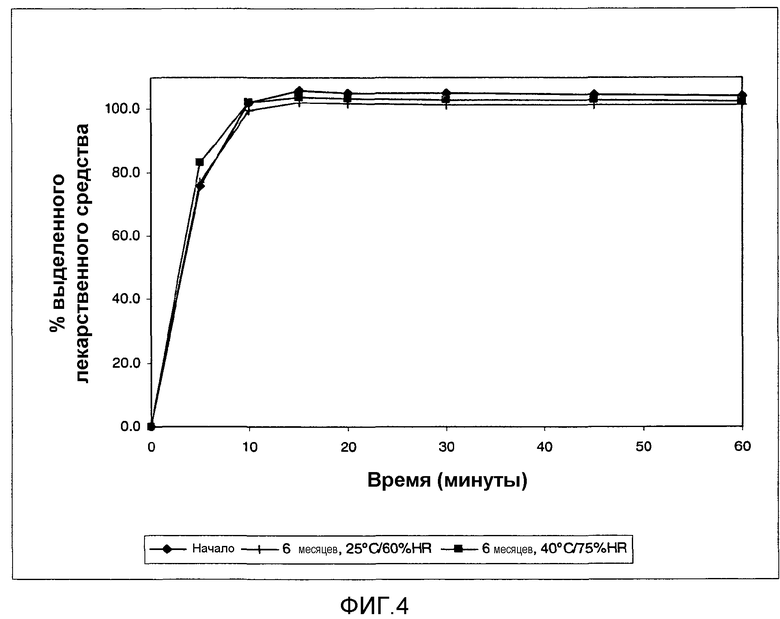
На фиг. 4 показан сравнительный in vitro профиль выделения экструдированных-сферонизированных гранул API-001 в следующих условиях: скорость мешалки 50 об./мин, среда HCl 0,1 н. pH 1,2, объем 900 мл (условия полного растворения поддерживают в течение всего исследования).
Подробное описание изобретения
Фармацевтические композиции в соответствии с данным изобретением содержат по меньшей мере 80 масс. % соединения формулы (I), но, неожиданно, могут быть произведены с применением стандартных фармацевтических способов и демонстрируют хорошие фармацевтические свойства.
Согласно конкретному варианту, активный фармацевтический ингредиент ("API") присутствует в количестве по меньшей мере 85% от общей сухой массы композиции.
В другом варианте фармацевтически приемлемые наполнители, предпочтительно, разбавитель или связующий агент, присутствуют в количестве менее 15%, более предпочтительно менее 10% от общей сухой массы композиции.
В другом варианте массовое соотношение API к фармацевтически приемлемым наполнителям составляет от 4:1 до 40:1, предпочтительно, от 5:1 до 40:1, более предпочтительно, от 8:1 до 30:1.
Фармацевтически приемлемый наполнитель в композиции в соответствии с данным изобретением может быть разбавителем, одним или более соединениями, которые способны уплотнять активное вещество с получением желаемой массы. Предпочтительными разбавителями являются:
- неорганические фосфаты, такие как фосфаты кальция и натрия;
- сахара, такие как гидрированная или безводная декстроза, сахароза, галактоза, мальтоза, лактоза;
- многоатомные спирты, такие как сорбит, ксилит, маннит;
- природные полимеры, включающие:
- полисахариды, такие как декстраты, мальтодекстрин, пектин, каррагинан, хитозан;
- циклодекстрин;
- целлюлоза или производные целлюлозы, такие как микрокристаллическая целлюлоза (например, Avicel®, такая как Avicel® РН101, Avicel® РН102 или Avicel® РН105, Emcocel®, Vivacel®, Ming Tai® или Salka-Floc®), сверхтонкая целлюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза;
- крахмал или производные крахмала, включая прежелатинизированный крахмал (Starch 1500 или National 1551), гликолят крахмала натрия, кукурузный крахмал, картофельный крахмал, рисовый крахмал, пшеничный крахмал.
Фармацевтически приемлемым наполнителем в композиции в соответствии с данным изобретением может быть связующий агент, одно или более соединений, которые способны придавать когезионные свойства материалам. Предпочтительными связующими агентами являются:
- целлюлоза или производные целлюлозы, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлоза;
- синтетические полимеры, такие как поливинилпирролидон, полиэтиленгликоль, глицерид полиэтиленгликоля, оксид полиэтилена;
- кислоты, такие как пектиновая кислота, лимонная кислота, фумаровая кислота, винная кислота;
- восковые или жировые наполнители, такие как гидрированное касторовое масло, пальмитостеарат глицерина (Precirol АТ05), сложные эфиры глицерина насыщенных жирных сложных эфиров (Gelucire), глицерилбегенат (Compritol), глицерилмоностеарат;
- гуаровая камедь, ксантановая камедь, коллоидная двуокись кремния.
В конкретном варианте композиция в соответствии с данным изобретением содержит разбавитель или связующий агент, выбранный из:
- неорганических фосфатов, таких как фосфаты кальция и натрия;
- сахаров, таких как гидрированная или безводная декстроза, сахароза, галактоза, мальтоза, лактоза;
- многоатомных спиртов, таких как сорбит, ксилит, маннит;
- природных полимеров, включающих:
- полисахариды, такие как декстраты, мальтодекстрин, пектин, каррагинан, хитозан;
- циклодекстрины;
целлюлозу или производные целлюлозы, такие как микрокристаллическая целлюлоза (например, Avicel®, такая как Avicel® РН101, Avicel® PH102 или Avicel® PH105, Emcocel®, Vivacel®, Ming Tai® или Salka-Floc®), сверхтонкая целлюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза;
- крахмал или производные крахмала, включая прежелатинизированный крахмал (Starch 1500 или National 1551), гликолят крахмала натрия, кукурузный крахмал, картофельный крахмал, рисовый крахмал, пшеничный крахмал;
- синтетических полимеров, таких как поливинилпирролидон, полиэтиленгликоль, глицерид полиэтиленгликоля, оксид полиэтилена;
- кислот, таких как пектиновая кислота, лимонная кислота, фумаровая кислота, винная кислота;
- восковых или жировых наполнителей, таких как гидрированное касторовое масло, пальмитостеарат глицерина (Precirol АТ05), сложные эфиры глицерина насыщенных жирных сложных эфиров (Gelucire), глицерилбегенат (Compritol), глицерилмоностеарат;
- гуаровой камеди, ксантановой камеди, коллоидной двуокиси кремния;
или их смесей.
В другом варианте композиция в соответствии с данным изобретением содержит разбавитель или связующий агент, выбранный из:
- сахаров, таких как декстроза, сахароза, галактоза, мальтоза, лактоза; и
- полимерных материалов, включающих целлюлозу или производные целлюлозы, такие как микрокристаллическая целлюлоза (например, Avicel®, такая как Avicel® PH101, Avicel® PH102 или Avicel® РН105, Emcocel®, Vivacel®, Ming Tax® или Salka-Floc®), сверхтонкая целлюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза; крахмал или производные крахмала, включая прежелатинизированный крахмал (Starch 1500 или National 1551), гликолят крахмала натрия, кукурузный крахмал, картофельный крахмал, рисовый крахмал, пшеничный крахмал; поливинилпирролидон, полиэтиленгликоль, глицерид полиэтиленгликоля; или их смеси.
В конкретном варианте, если полиэтиленгликоль применяется в композиции в соответствии с данным изобретением, он, предпочтительно, имеет среднюю массу от 3000 до 9000, предпочтительно, от 5000 до 9000, более предпочтительно, от 7000 до 9000.
В другом конкретном варианте глицеридом полиэтиленгликоля предпочтительно является полиоксиглицерид лауроила.
Согласно конкретному варианту, разбавитель или связующий агент выбирают из: лактозы, предпочтительно гидрата лактозы; целлюлозы, предпочтительно микрокристаллической целлюлозы; крахмала; полиэтиленгликоля, предпочтительно, со средней массой от 7000 до 9000; и глицерида полиэтиленгликоля, предпочтительно, полиоксиглицерида лауроила; или их смесей.
В одном варианте связующий агент выбирают из воды, гидроксипропилметилцеллюлозы, карбоксивинилового полимера, кармеллозы натрия (например, Ac-Di-Sol®), альфа крахмала, поливинилпирролидона (например, Polyvidon® CL, Polyvidon® CL-M, Kollidon® CL, Polyplasdone® XL или Polyplasdone® XL-10), аравийской камеди, желатина, пуллулана и подобных.
В предпочтительном варианте связующий агент в композиции, предпочтительно, выбирают из группы, включающей воду, спиртовые растворы, такие как растворы этанола, или самоэмульгирующиеся системы. Более предпочтительно, связующим агентом является вода.
В другом варианте композиция в соответствии с данным изобретением содержит и разбавитель, и связующий агент в качестве фармацевтически приемлемых наполнителей.
Композиции и лекарственные формы в соответствии с данным изобретением могут содержать один или более дополнительных наполнителей.
Термин "наполнитель" имеет то же значение, которое дано в US Pharmacopoeia и National Formulary, т.е. относится к любому компоненту, отличному от активного ингредиента(ов), намеренно добавляемый в композицию или лекарственную форму. Примеры наполнителей включают разрыхлители, которые действуют через набухание и/или впитывание, смазывающие агенты, пластификаторы, связующий агенты, наполнители, красители, агенты, маскирующие вкус, вкусовые добавки, стабилизаторы, вспенивающие агенты, подсластители, порообразующие агенты, кислоты (например, лимонная или винная кислоты), хлорид натрия, бикарбонат (например, натрия или калия), сахара и спирты. Количество наполнителей, которое может применяться, ограничено, так как по меньшей мере 80% общей сухой массы композиции составляет активный ингредиент(ы). Некоторые наполнители могут служить множеству целей, например, быть наполнителем и разрыхлителем одновременно.
Примеры агентов, маскирующих запах, включают нерастворимые в воде полимеры, такие как этилцеллюлоза, нерастворимые в слюне и растворимые в желудочном соке полимеры, такие как сополимер метилметакрилата, бутилметакрилата и диэтиламиноэтилметакрилата, и подобные.
Термин "разрыхлитель" относится к веществу, которое, при добавлении в твердую композицию, способствует ее распаду или разрыхлению после введения и позволяет выделять активный ингредиент настолько эффективно, насколько это возможно, позволяя его быстрое растворение. Примерами разрыхлителей являются крахмалы, такие как кукурузный крахмал и картофельный крахмал, частичный альфа крахмал, карбоксиметиловый крахмал натрия, гидроксипропиловый крахмал; кармеллоза, кармеллоза кальция, кросскармеллоза натрия (например, Ac-Di-Sol®), поливиниловый спирт, кросповидон, гидроксипропилцеллюлоза, кристаллическая целлюлоза (например, Avicel®, такая как Avicel® РН 101, Avicel® РН102 или Avicel® РН 105, Emcocel®, Vivacel®, Ming Tai® или Salka-Floc®) и подобные. Также, альгиновые кислоты или альгинаты и поливинилпирролидон (например, Polyvidon® CL, Polyvidon® CL-M, Kollidon® CL, Polyplasdone® XL или Polyplasdone® XL-10) и подобные могут применяться в качестве разрыхлителей.
Примеры вкусовых добавок включают отдушки, лимон, лимон-лайм, апельсин, ментол, мятное масло, ванилин или их порошки, абсорбированные декстрином или циклодекстрином, и подобные.
Примеры смазывающих агентов или пластификаторов включают жирные кислоты или производные жирных кислот, такие как стеарат магния, стеарилфумарат натрия, стеарат кальция,
глицерилмоностеарат, глицерилпальмитостеарат, лаурилсульфат натрия, стеариновую кислоту или стеарат цинка; гидрированные растительные масла, такие как гидрированное касторовое масло; полналкиленгликоли, такие как полиэтиленгликоль или глицерид полиэтиленгликоля (например, полиоксиглицерид лауроила, такой как Gelucire® 44/14); бензоат натрия; тальк; коллоидную двуокись кремния (Aerosil 200®) и подобные.
Примеры красителей включают пищевые красители, такие как пищевой желтый №5, пищевой красный №3, пищевой голубой №2, пищевой лакообразующий краситель, красный оксид железа и подобные.
Примеры стабилизатора или солюбилизатора включают антиоксиданты, такие как аскорбиновая кислота и токоферол, поверхностно-активные вещества, такие как полисорбат 80 и подобные, в зависимости от применяемого физиологически активного компонента.
Примеры наполнителя включают сахарозу, глюкозу, лактозу (например, высушенную распылением лактозу, α-лактозу, β-лактозу, моногидрированную лактозу, Tablet-tose®, Pharmatose® или Fast-Floe), маннит, ксилит, декстрозу, микрокристаллическую целлюлозу (например, Avicel, такую как Avicel® РН101, Avicel® PH102 или Avicel® PH105, Emcocel®, Vivacel®, Ming Tai® или Salka-Floc®), мальтозу, сорбит, крахмалы (включая кукурузный крахмал, картофельный крахмал и прежелатинизированный крахмал), фосфат натрия, фосфат кальция, сульфат кальция, карбонат кальция и подобные.
Примеры вспенивающего агента включают бикарбонат натрия.
Примеры подсластителей включают сахарин натрия, глицирризин дикалия, аспартам, стевию, тауматин и подобные.
В другом конкретном варианте композиция в соответствии с данным изобретением также содержит смазывающий агент или пластификатор. В предпочтительном варианте смазывающий агент или пластификатор выбирают из полиэтиленгликоля, предпочтительно полиэтиленгликоль со средней массой от 7000 до 9000; глицерид полиэтиленгликоля (например, полиоксиглицерид лауроила, такой как Gelucire® 44/14); или их смеси.
В другом варианте разбавителем или связующим агентом является микрокристаллическая целлюлоза (например, Avicel®, такая как Avicel® РН-101, Avicel® РН-102 или Avicel® РН-105, Emcocel®, Vivacel®, Ming Tai® или Salka-Floc®) или полиоксиглицерид лауроила. Указанные фармацевтические композиции, содержащие микрокристаллическую целлюлозу или полиоксиглицерид лауроила, могут также содержать наполнитель, предпочтительно, выбранный из воды; сахаров, таких как гидрированная или безводная декстроза, сахароза, галактоза, мальтоза и лактоза; крахмал или производные крахмала, включая прежелатинизированный крахмал (Starch 1500 или National 1551), гликолят крахмала натрия, кукурузный крахмал, картофельный крахмал, рисовый крахмал и пшеничный крахмал; этилцеллюлозу; или синтетические полимеры, такие как поливинилпирролидон (например, Polyvidon® CL, Polyvidon® CL-M, Kollidon® CL, Polyplasdone® XL или Polyplasdone® XL-10) и полиэтиленгликоль. Предпочтительно, они также могут включать воду, моногидрат лактозы, прежелатинизированный крахмал, полиэтиленгликоль со средней массой от 7000 до 9000 или их смеси.
Композиция в соответствии с данным изобретением может дополнительно содержать средство, контролирующее выделение. Подходящие контролирующие средства включают производные целлюлозы, такие как этилцеллюлоза, предпочтительно, в виде водных дисперсий (например, Surelease®), гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, сополимер поливинилпирролидона/винилацетата и подобные.
В конкретном варианте композиция в соответствии с данным изобретением предназначена для перорального, местного или парентерального введения; предпочтительно, она имеет форму пероральной лекарственной формы.
В одном варианте композиция в соответствии с данным изобретением имеет форму гранул, пеллет или шариков. В предпочтительном варианте композиция в соответствии с данным изобретением имеет форму пеллет.
В другом варианте композиция в соответствии с данным изобретением включена в стандартную лекарственную форму, такую как капсула, вагинальный суппозиторий, суппозиторий, вафля, минитаблетка, таблетка, включая жевательные таблетки, буккальные таблетки, подъязычные таблетки, быстрорастворимые таблетки, шипучие таблетки, пилюля, саше, опрыскивание, пленка, сухой сироп, восстанавливаемое твердое вещество, микросфера, матрица, гель, дисперсия, раствор, суспензия, пастилка, лепешка, имплантат, порошок, мелкий порошок, пластинка, полоска.
В конкретном варианте композиция в соответствии с данным изобретением имеет форму гранул, содержащихся в капсуле. В другом варианте она имеет форму гранул, спрессованных в таблетку.
В конкретном варианте композиция в соответствии с данным изобретением предназначена для немедленного выделения, что является преимуществом, например, при лечении боли.
Композиции в соответствии с данным изобретением могут быть получены следующими способами, известными в данной области техники (смотрите "Remington, the Science and practice of pharmacy", 21st Edition, 2005, Ed. Lippincott Williams & Wilkins). Например, обзор различных способов получения гранул для фармацевтических целей может быть найден в книге Pharmaceutical Pelletization Technology, под редакцией Isaac Ghebre-Sellassie, Marcel Dekker, Inc., 1989.
Согласно другому аспекту, композиция в соответствии с данным изобретением может быть получена способом прямого прессования, гранулированием, экструзией/сферонизацией или наслаиванием; предпочтительно, способом экструзии/сферонизации или влажного гранулирования.
Производство гранул способом экструзии/сферонизации включает обычно следующие стадии:
1. Гранулирование: получение влажной массы композиции.
2. Экструзия: формование влажной массы композиции в цилиндры.
3. Сферонизация: измельчение экструдата и округление частиц в сферические пеллеты.
Способ сферонизации может быть разделен на различные стадии согласно модификациям в форме экструдата. Следующие формы получают в способе: цилиндр/нить/гантель/полая сфера/сфера.
4. Сушка: высушивание гранул.
5. Просеивание: пропускание высушенных гранул через сито. Производство гранул способом влажного гранулирования
включает следующие стадии:
1. Гранулирование нагреванием смеси композиции.
2. Гранулирование охлаждением гранул.
3. Просеивание высушенных гранул.
Активный фармацевтический ингредиент
Активным фармацевтическим ингредиентом композиции в соответствии с данным изобретением является соединение формулы (I), описанное выше.
В конкретном варианте активным фармацевтическим ингредиентом является соединение формулы (I) или (IB), описанное в WO 2006/021462, или его фармацевтически приемлемая соль, изомер, пролекарство или сольват. WO 2006/0214 62, в которой описаны эти соединения, включена в настоящее описание в качестве ссылки.
Поэтому в первом варианте данное изобретение относится к фармацевтической композиции, которая содержит соединение формулы (IA):
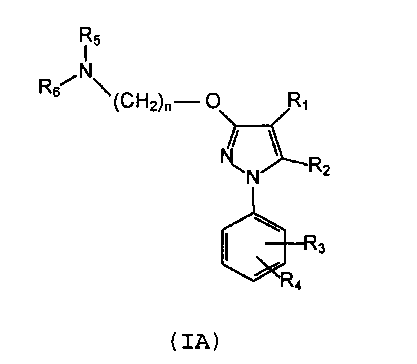
где
R1 выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арилалкил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9; -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(0)R9, - NO2, -N=CR8R9 и галоген;
R2 выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген;
R3 и R4 независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген, или вместе они образуют конденсированную кольцевую систему;
R5 и R6 независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген; или
вместе с атомом азота, к которому они присоединены, образуют замещенную или незамещенную гетероциклильную группу;
n равен 1, 2, 3, 4, 5, 6, 7 или 8;
t равен 1, 2 или 3;
R8 и R9, каждый независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкокси, замещенный или незамещенный арилокси и галоген;
или его фармацевтически приемлемую соль, изомер, пролекарство или сольват.
Во втором варианте данное изобретение относится к фармацевтической композиции, которая содержит соединение формулы (IB):
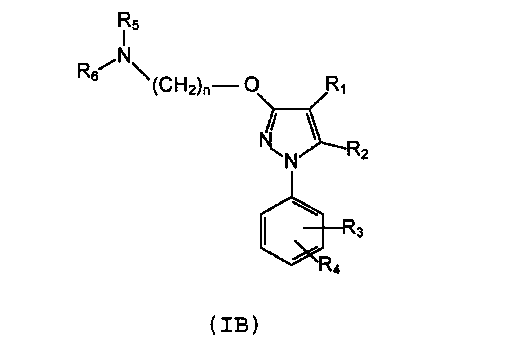
где
R1 выбирают из группы, включающей замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген,
R2 выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген;
R3 и R4 независимо выбирают из группы, включающей замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген, или вместе они образуют конденсированную кольцевую систему;
R5 и R6 независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, -COR8, -C(O)OR8, -C(O)NR8R9, CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9 и галоген; или
вместе с атомом азота, к которому они присоединены, образуют замещенную или незамещенную гетероциклильную группу;
n равен 1, 2, 3, 4, 5, 6, 7 или 8;
t равен 1, 2 или 3;
R8 и R9, каждый независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкенил, замещенный или незамещенный арил, замещенный или незамещенный гетероциклил, замещенный или незамещенный алкокси, замещенный или незамещенный арилокси и галоген;
или его фармацевтически приемлемую соль, изомер, пролекарство или сольват.
В данном описании следующие термины имеют указанное значение:
"Алкил" относится к прямому или разветвленному радикалу, содержащему атомы углерода и водорода, содержащему ненасыщенность, содержащему от одного до восьми атомов углерода, который присоединен к остальной молекуле одинарной связью, например, метилу, этилу, н-пропилу, изопропилу, н-бутилу, трет-бутилу, н-пентилу и т.д. Алкильные радикалы могут быть необязательно замещены одним или более заместителями, такими как арил, галоген, гидрокси, алкокси, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, нитро, меркапто, алкилтио и т.д. Если имеется замещение арилом, получают "аралкильный" радикал, такой как бензил и фенетил.
"Алкенил" относится к алкильному радикалу, содержащему по меньшей мере 2 атома С, имеющих одну или более ненасыщенных связей.
"Циклоалкил" относится к стабильному 3-10-членному моноциклическому или бициклическому радикалу, который насыщен или частично насыщен, и который состоит только из атомов углерода и водорода, такому как циклогексил или адамантил. Если не указано иначе в описании, термин "циклоалкил" включает циклоалкильные радикалы, которые необязательно замещены одним или более заместителями, такими как алкил, галоген, гидрокси, амино, циано, нитро, алкокси, карбокси, алкоксикарбонил и т.д.
"Арил" относится к одинарным или множественным кольцевым радикалам, включая множественные кольцевые радикалы, которые содержат отдельные и/или конденсированные арильные группы. Типовые арильные группы содержат от 1 до 3 разделенных или конденсированных колец и от 6 до приблизительно 18 атомов углерода в кольце, и включают такие группы, как фенил, нафтил, инденил, фенантрил или антрацил. Арильный радикал может быть необязательно замещен одним или более заместителями, такими как гидрокси, меркапто, галоген, алкил, фенил, алкокси, галогеналкил, нитро, циано, диалкиламино, аминоалкил, ацил, алкоксикарбонил и т.д.
"Гетероциклил" относится к стабильному 3-15-членному кольцевому радикалу, который состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы, включающей азот, кислород и серу, предпочтительно, 4-8-членному кольцу с одним или более гетероатомами, более предпочтительно, 5-6-членному кольцу с одним или более гетероатомами. Он может быть ароматическим или неароматическим. Для целей данного изобретения гетероцикл может быть моноциклической, бициклической или трициклической кольцевой системой, которая может включать конденсированные кольцевые системы; и атомы азота, углерода или серы в гетероциклильном радикале могут быть необязательно окислены; атом азота может быть необязательно кватернизирован; и гетероциклильный радикал может быть частично или полностью насыщенным или ароматическим. Примеры таких гетероциклов включают, но не ограничены ими, азепины, бензимидазол, бензотиазол, фуран, изотиазол, имидазол, индол, пиперидин, пиперазин, пурин, хинолин, тиадиазол, тетрагидрофуран, кумарин, морфолин; пиррол, пиразол, оксазол, изоксазол, триазол, имидазол и т.д.
"Алкокси" относится к радикалу формулы -ORa, где Ra является алкильным радикалом, таким как определен выше, например, метокси, этокси, пропокси и т.д.
"Амино" относится к радикалу формулы -NH2, -NHRa или -NRaRb, необязательно кватернизированному.
"Галоген" или "гал" относится к брому, хлору, йоду или фтору.
Имеющиеся здесь ссылки на замещенные группы в соединениях в соответствии с данным изобретением относятся к обозначенной группе, которая может быть замещена в одном или более доступных положениях одной или более подходящими группами, например, галогеном, таким как фтор, хлор, бром и йод/ циано; гидоксилом; нитро; азидо; алканоилом, таким как C1-6 алканоильная группа, такая как ацил и подобные; карбоксамидо; алкильными группами, включающими группы, содержащие от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода и, более предпочтительно, 1-3 атома углерода; алкенильными и алкинильными группами, включающими группы, имеющие одну или более ненасыщенных связей и от 2 до приблизительно 12 атомов углерода, или от 2 до приблизительно 6 атомов углерода; алкоксигруппами, содержащими одну или более кислородных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; арилокси, такой как фенокси; алкилтиогруппами, включающими группы, содержащие одну или более тиоэфирных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; алкилсульфинильными группами, включающими группы, содержащие одну или более сульфинильных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; алкилсульфонильными группами, включающими группы, содержащие одну или более сульфонильных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; аминоалкильными группами, такими как группы, содержащие один или более атомов N и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; карбоциклическим арилом, содержащим 6 или более атомов углерода, предпочтительно, фенилом или нафтилом, и аралкилом, таким как бензил. Если не указано иначе, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, и каждое замещение независимо от других.
Если не указано иначе, соединения, применяемые в качестве активного ингредиента в композиции в соответствии с данным изобретением, также включают соединения, которые отличаются только присутствием одного или более обогащенных изотопами атомов. Например, соединения, имеющие структуры в соответствии с данным изобретением, за исключением замены водорода дейтерием или тритием, или замены углерода 13C- или 14C-обогащенным углеродом или 15N-обогащенным азотом, включены в объем данного изобретения.
Термин "соль" понимается как любая форма активного соединения, применяемого в соответствии с данным изобретением, в которой указанное соединение находится в ионной форме или заряжено и сопряжено с противоионом (катионом или анионом) или находится в растворе. Это определение также включает четвертичные аммониевые соли и комплексы активной молекулы с другими молекулами и ионами, особенно комплексы, полученные ионными взаимодействиями. Определение включает, в частности, физиологически приемлемые соли; этот термин должен пониматься как эквивалент "фармакологически приемлемым солям".
Термин "фармацевтически приемлемые соли" в контексте данного изобретения означает любую соль, которая переносится физиологически (что означает, что она нетоксична, особенно из-за противоиона) при применении надлежащим образом для лечения, наносимая или применяемая, предпочтительно, у человека и/или животных.
Например, фармацевтически приемлемые соли представленных здесь соединений синтезированы из исходного соединения, которое содержит основную или кислотную группу, обычными химическими способами. В общем, такие соли, например, получают взаимодействием свободной кислоты или свободного основания этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе, или в их смеси. В общем, предпочтительная неводная среда, такая как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры кислотно-аддитивных солей включают минеральные кислотно-аддитивные соли, такие как, например, гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат, и органические кислотно-аддитивные соли, такие как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, миндалят, метансульфонат и п-толуолсульфонат. Примеры щелочно-аддитивных солей включают неорганические соли, такие как, например, соли натрия, калия, кальция, аммония, магния, алюминия и лития, и органические щелочные соли, такие как, например, этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин, глюкамин и основные соли аминокислот.
Термин "сольват" в соответствии с данным изобретением понимается как любая форма активного соединения в соответствии с данным изобретением, где указанное соединение связано не ковалентной связью с другой молекулой (обычно, полярным растворителем), включая, предпочтительно, гидраты и алкоголяты, такие как, например, метанолят. Предпочтительным сольватом является гидрат.
Соединения в соответствии с данным изобретением могут быть в кристаллической форме, либо в виде свободных соединений, либо в виде сольватов, и обе формы включены в объем данного изобретения. Способы сольватирования известны в данной области техники. Подходящими сольватами являются фармацевтически приемлемые сольваты. В конкретном варианте сольватом является гидрат.
Любое соединение, которое является пролекарством соединения формулы (I), (IA) или (IB), также включено в объем данного изобретения. Термин "пролекарство" применяют в широчайшем смысле, и он охватывает производные, которые превращаются in vivo в соединения в соответствии с данным изобретением. Примеры пролекарств включают, но не ограничены ими, производные и метаболиты соединений формулы I, которые включают биогидролизуемые группы, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Предпочтительно, пролекарства соединений с карбоксильными функциональными группами включают сложные эфиры низшего алкила карбоновой кислоты. Сложные эфиры карбоксилата подходящим образом получают эстерифицированием любой группы карбоновой кислоты, присутствующей в молекуле. Обычно пролекарства получают с применением хорошо известных способов, таких как описаны у Burger "Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley), "Design and Applications of Prodrugs" (H. Bundgaard ed., 1985, Harwood Academic Publishers) и Krogsgaard-Larsen et al. "Textbook of Drug design and Discovery" Taylor & Francis (April 2002).
Термин "фармацевтически приемлемые соли, сольваты, пролекарства" относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату или любому другому соединению, которые, при введении пациенту, способны давать (прямо или косвенно) описанное здесь соединение. Однако должно быть понятно, что не фармацевтически приемлемые соли также попадают в объем данного изобретения, так как они могут применяться при получении фармацевтически приемлемых солей. Получение солей, пролекарств и производных проводят способами, известными в данной области техники.
Соединения в соответствии с данным изобретением, представленные указанными выше формулами (I), (IA) или (IB), могут включать энантиомеры, в зависимости от присутствия хиральных центров, или изомеры, в зависимости от присутствия множественных связей (например, Z, E). Отдельные изомеры, энантиомеры или диастереоизомеры и их смеси включены в объем данного изобретения
Соединения формулы (I), (IA) или (IB) или их соли или сольваты, предпочтительно, имеют фармацевтически приемлемую или практически чистую форму. Под фармацевтически приемлемой формой подразумевают, кроме прочего, наличие фармацевтически приемлемого уровня очистки за исключением обычных фармацевтических добавок, таких как разбавители и носители, и включая отсутствие веществ, считающихся токсичными в обычных дозах. Степень чистоты лекарственного вещества, предпочтительно, составляет свыше 50%, более предпочтительно, свыше 70%, наиболее предпочтительно, свыше 90%. В предпочтительном варианте она составляет 95% соединения формулы (I), (IA) или (IB), или его солей, сольватов или пролекарств.
В конкретном варианте, R1 выбирают из H, -COR8 или замещенного или незамещенного алкила, предпочтительно, его выбирают из H, метила или ацетила.
В другом варианте, R2 является H или алкилом, предпочтительно, H или метилом.
В другом варианте, R3 и R4 независимо выбирают из галогена или алкила, предпочтительно, из галогена или галогеналкила; или они образуют, вместе с фенильной группой, к которой они присоединены, конденсированную кольцевую систему, предпочтительно, нафтильную группу.
Предпочтительно, чтобы арильные заместители R3 и R4 находились в мета- и/или пара-положениях фенильной группы.
Далее, в предпочтительном варианте n равен, предпочтительно, 2, 3, 4, 5 или 6, наиболее предпочтительно, n равен 2, 3 или 4. Наиболее предпочтительным значением для n является 2.
В другом предпочтительном варианте, R5 и R6 являются алкильной группой, предпочтительно, этилом; или вместе с атомом азота, в которому они присоединены, образуют замещенную или незамещенную 5- или 6-членную гетероциклильную группу, предпочтительно, замещенный или незамещенный пирролидин, пиперидин, пиперазин-4-ил или морфолин-4-ил.
В конкретном варианте активный фармацевтический ингредиент выбирают из:
1-(3,4-дихлорфенил)-5-метил-3-[2-(пирролидин-1-ил)этокси]-1H-пиразола,
1-{2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]этил}-4-метилпиперазина,
1-(4-(2-(1-(3,4-дихлорфенил)-1H-пиразол-3-илокси)этил)пиперидин-1-ил)этанона,
2-[1-(2,4-дихлорфенил)-1H-пиразол-3-илокси]-N,N-диэтилэтанамина,
2-[1-(3,4-дихлорфенил)-4,5-диметил-1H-пиразол-3-илокси]-N,N-диэтилэтанамина,
4-[1-(3,4-дихлорфенил)-1H-пиразол-3-илокси]-N,N-диэтилбутан-1-амина,
1-{2-[5-метил-1-(нафталин-2-ил)-1H-пиразол-3-илокси]этил}пиперидина,
1-(4-(2-(1-(нафталин-2-ил)-1H-пиразол-3-илокси)бутил)пиперазин-1-ил)этанона и
4-{2-[5-метил-1-(нафталин-2-ил)-1H-пиразол-3-илокси]этил}морфолина,
их солей, пролекарств или сольватов. Предпочтительно, в свободной форме или в виде гидрохлорида или оксалата.
В предпочтительном варианте активным фармацевтическим ингредиентом является гидрохлорид 4-{2-[5-метил-1-(нафталин-2-ил)-1H-пиразол-3-илокси]этил}морфолина, далее обозначенный как API-001.
В других предпочтительных вариантах объединены предпочтения, описанные выше для различных заместителей. Данное изобретение также относится к таким сочетаниям предпочтительных замещений общей формулы (I), (IA) и (IB) выше.
Другой аспект данного изобретения относится к фармацевтической композиции в соответствии с данным изобретением для применения в качестве лекарственного средства.
Другой аспект относится к фармацевтической композиции в соответствии с данным изобретением для лечения или профилактики заболевания или состояния, опосредованного сигма рецептором. В конкретном варианте болезнь выбирают из группы, включающей диарею; липопротеиновые расстройства; мигрень; ожирение; артрит; гипертонию; аритмию; язву; дефицит способности к обучению, памяти и внимания; расстройства познавательной способности; нейродегенеративные заболевания; демиелинизирующие заболевания; привыкание к лекарственным средства и химическим веществам, включая кокаин, амфетамин, этанол и никотин; позднюю дискинезию; ишемический инсульт; эпилепсию; удар; стресс; рак; психотические состояния, в частности, депрессию, тревогу или шизофрению; воспаление; и аутоиммунные заболевания. В другом конкретном варианте заболеванием является боль, предпочтительно, невропатическая боль, воспалительная боль или другие болевые состояния, включающие аллодинию и/или гипералгезию.
Другой аспект данного изобретения относится к способу лечения или предупреждения заболевания, медиированного сигма рецептором, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции в соответствии с данным изобретением. Медиированные сигма заболевания, которые могут быть вылечены, включают диарею; липопротеиновые расстройства; мигрень; ожирение; артрит; гипертонию; аритмию; язву; расстройства познавательной способности; привыкание к лекарственным средства и химическим веществам, включая кокаин; позднюю дискинезию; ишемический инсульт; эпилепсию; удар; депрессию; стресс; боль, особенно невропатическую боль или аллодинию; психотическое состояние; или рак. Соединения в соответствии с данным изобретением также могут применяться в качестве фармакологического средства или анксиолитика или иммуносупрессанта.
Представленные ниже примеры даны только для иллюстрации данного изобретения и не должны рассматриваться как ограничивающие изобретение.
ПРИМЕРЫ
Применяют следующие аббревиатуры:
1. общие характеристики гранул
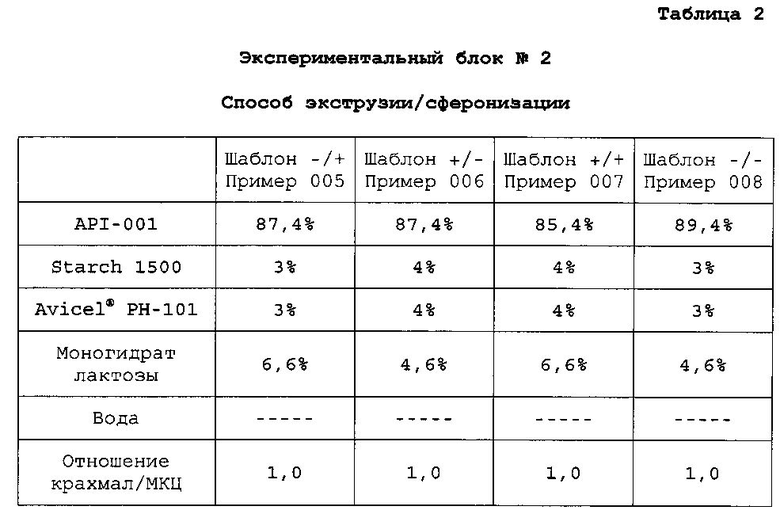
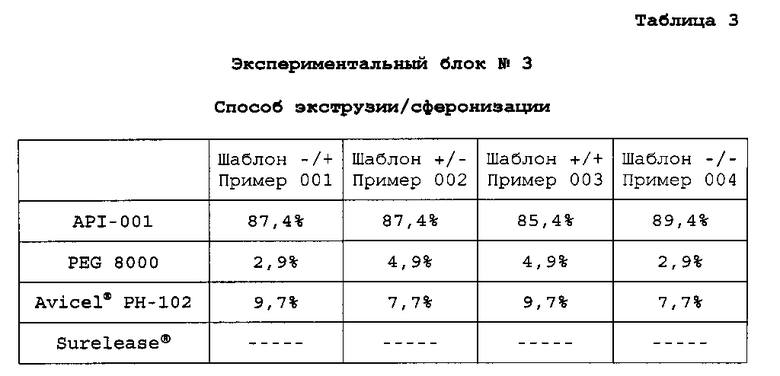
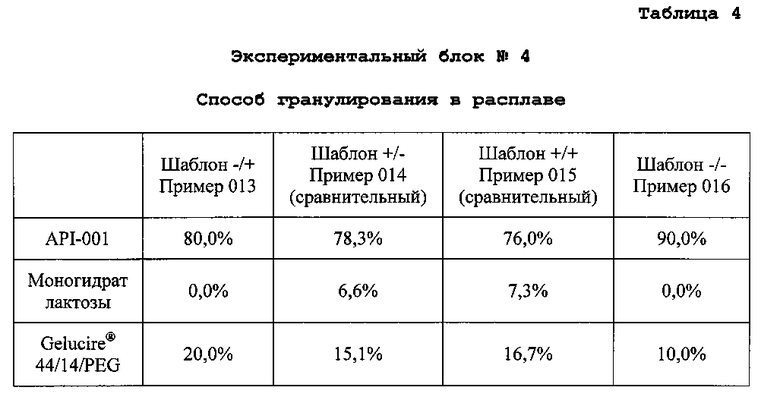
Готовят четыре композиции, содержащие гидрохлорид 4-{2-[5-метил-1-(нафталин-2-ил)-1H-пиразол-3-илокси]этил}морфолин и различные наполнители (экспериментальные блоки). Для каждого экспериментального блока готовят четыре конкретных композиции, содержащие различные доли одних и тех же ингредиентов (примеры). Экспериментальные блоки гранул №№1, 2 и 3 получают способом экструзии/сферониэации. Экспериментальный блок гранул №4 получают способом гранулирования расплава. В следующих таблицах описан процентный состав композиций каждого примера:
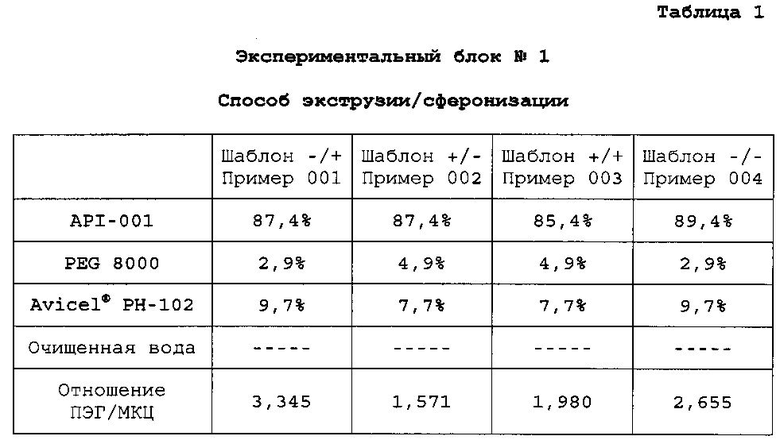
Сердцевину пеллеты модифицируют добавлением водной дисперсии Surelease® с 25% содержанием сухой этилцеллюлозы для обеспечения контроля выделения сердцевины.
2. Описание способов
a) Способ экструзии/сферонизации
Экспериментальные блоки гранул №№1, 2 и 3 получают по следующему протоколу:
1) Смешивание/гранулирование
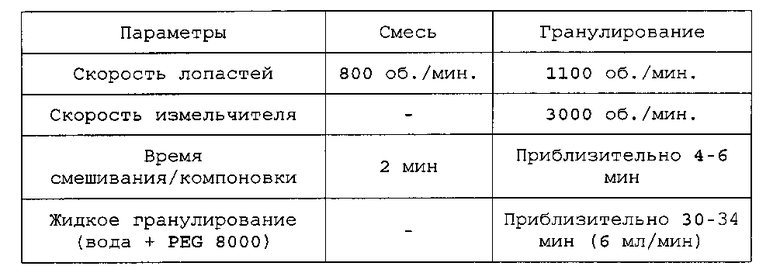
Применяют емкость объемом 900 мл. Готовят 150 г шихты. Шихту смешивают и гранулируют с применением мешалки с высоким сдвигом со следующими параметрами:
2) Экструзия
Пеллеты, полученные на предыдущей стадии, формуют в длинные пруты или экструдаты. Экструдер устанавливают на загрузку 50-70 г и скорость червяка 50 об./мин. Применяют отверстие 1,0 мм.
3) Сферонизация
Экструдат с предыдущей стадии формуют в сферические пеллеты с применением сферонизатора. Экструдер устанавливают на загрузку 50-70 г и скорость вращения пластины 2000 об./мин на 4 минуты. Применяют пластину 3,25 мм. Альтернативно, может быть использована пластина 2,0 мм для увеличения производительности. Добавление МКЦ в качестве смазывающего вещества во время сферонизации является необязательным.
4) Сушка
Пеллеты, полученные способом сферонизации, сушат в сушилке с псевдоожиженным слоем. Сушилку устанавливают на температуру 55°C на 15 минут.
5) Просеивание
После сушки пеллеты просеивают через сито 0,5-1,4 мм.
b) Способ гранулирования в расплаве
Экспериментальный блок №4 получают по следующему протоколу: 1)
Смешивание/гранулирование
Применяют емкость объемом 900 мл. Готовят шихты от 144 до 159,0 г. Шихты смешивают и гранулируют с применением мешалки с высоким сдвигом со следующими параметрами:
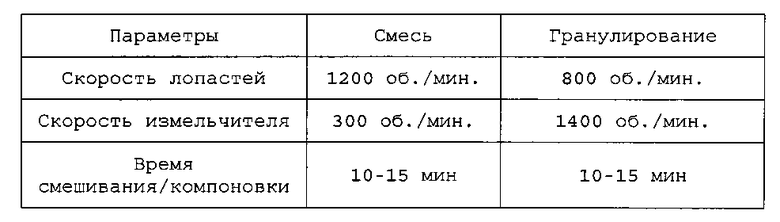
Затем смеси нагревают при 55°C в резервуаре с кожухом в течение от приблизительно 10 до 15 минут. Связующий агент плавится, когда смесь достигает температуры 45-55°C.
2) Гранулирование
Пеллеты, полученные на предыдущей стадии, охлаждают при 5°C в резервуаре с кожухом в течение от приблизительно 10 до 15 минут. Пеллеты образуются, когда пеллеты достигают температуры 25°C.
3) Просеивание
После охлаждения пеллеты просеивают через сито 0,5-1,4 мм.
A. Получение экспериментального блока гранул №1
Композиции получают растворением PEG 8000 в очищенной воде 16,6% (25 мл) с получением связующего раствора. Этот связующий раствор добавляют к смеси API-001 и Avicel® PH-102 микрокристаллической целлюлозы в грануляторе, и смесь месят до конца гранулирования. Гранулы экструдируют, сферонизируют и сушат по общему протоколу экструзии/сферонизации. Полученные пеллеты просеивают через сито 0,5-1,4 мм с получением композиций со следующим содержимым:
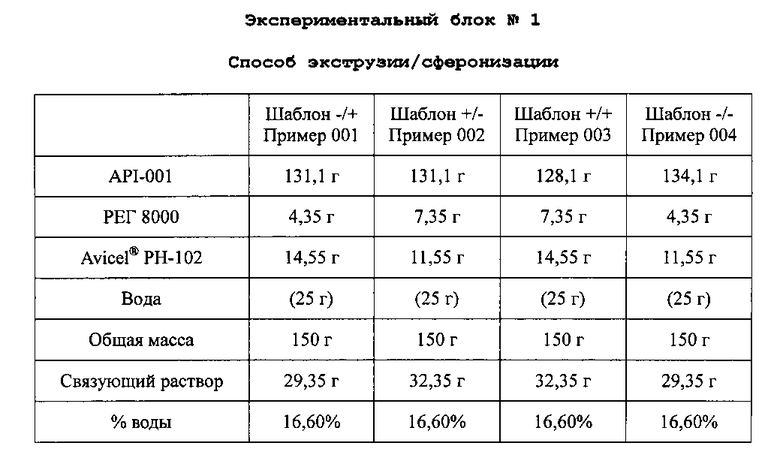
Связующий раствор доводят после первой пробы гранулирования.
B. Получение экспериментального блока гранул №2
Очищенную воду 10,6% (16 мл) применяют в качестве связующего раствора. API-001, Starch 1500, Avicel® PH-101 микрокристаллическую целлюлозу и моногидрат лактозы смешивают в грануляторе, и смесь месят до конца гранулирования. Пеллеты экструдируют, сферонизируют и сушат по общему протоколу экструзии/сферонизации. Полученные пеллеты просеивают через сито 0,5-1,4 мм с получением композиций со следующим содержимым:
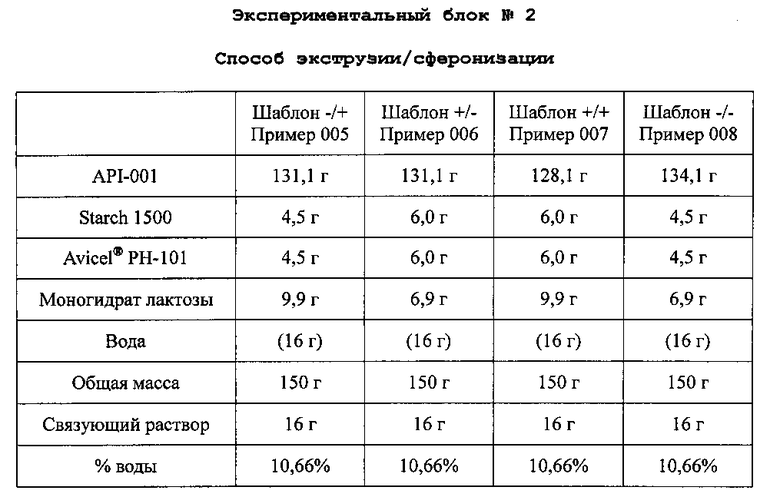
Связующий раствор доводят после первой пробы гранулирования.
C. Получение экспериментального блока гранул №3
Водную дисперсию Surelease® с 25% содержанием сухой этилцеллюлозы (34 мл, 22,64%) применяют в качестве связующего раствора. API-001, PEG 8000 и Avicel® РН-102 микрокристаллическую целлюлозу смешивают в грануляторе, и смесь месят до конца гранулирования. Пеллеты экструдируют, сферонизируют и сушат по общему протоколу экструзии/сферонизации. Полученные пеллеты просеивают через сито 0,5-1,4 мм с получением композиций со следующим содержимым:

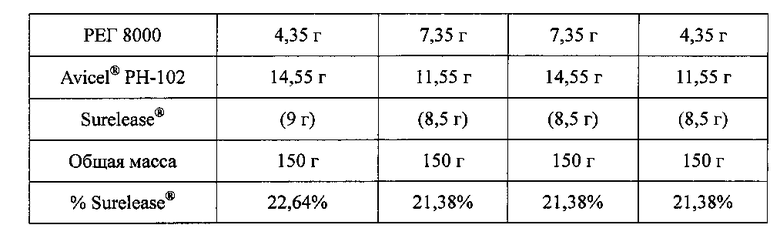
Связующий раствор доводят после первой пробы гранулирования.
D. Получение экспериментального блока гранул №4
Объединяют API-001, моногидрат лактозы и Gelucire® 44/14/PEG. Полученную смесь нагревают в резервуаре с кожухом при 5°C в течение приблизительно 10-15 мин. Связующий агент плавится при температуре смеси приблизительно 45-50°C. Полученные пеллеты охлаждают в резервуаре с кожухом при 5°C в течение приблизительно 10-15 мин. Пеллеты формируются, когда смесь достигает 25°C. Пеллеты просеивают на сите 0,5-1,4 мм с получением композиций со следующим содержимым:
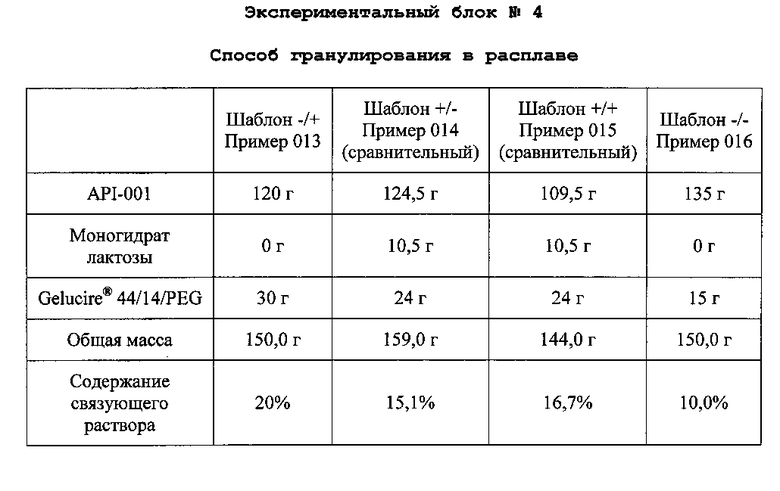
E. Анализы, проведенные для API-001 гранул с немедленным выделением
Типовые представители экспериментального блока анализируют по различным параметрам. В некоторых случаях тестируют всех представителей каждого экспериментального блока. В первом тесте исследуют внешний вид гранул, % примесей, профили растворения при pH 5,5 и pH 6,8 за 15 минут. Смотрите таблицу 5. Во втором анализе оценивают размер частиц, % округленности, % KF и выход после просеивания 500-1400 мкм. Смотрите таблицу 6. В третьем анализе исследуют профили растворения гранул в различных условиях pH. Смотрите фиг. 1.
F. Оптимизация выделения API-001 различными параметрами приготовления
Изучение факторного полного плана (2×2×2×2) проводят для рецептурных смесей с содержанием композиции примеров №№001, 002 и 004. Целью исследования является определение действия изменений определенных выбранных переменных на скорость выделения гранул. Исследуемые переменные:
a) соотношение наполнителей,
b) % связующего раствора,
c) скорость сферонизации и
d) время сферонизации.
Интервалы исследуемых переменных определяют следующим образом:
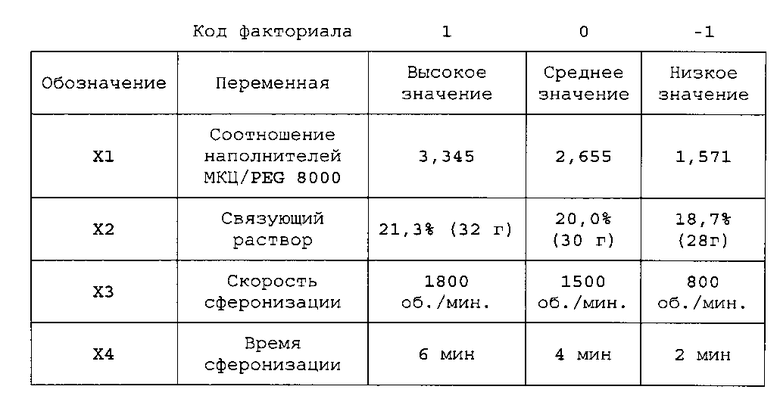
В целях сравнения и анализа, рецептурным смесям, приготовленным согласно примерам №№001, 002 и 004, назначают коды факториала 1, -1 и 0, соответственно.
Примеры №№001, 002 и 004 рецептурных смесей обрабатывают по протоколу экструзии/сферонизации, указанному выше. Применяют следующий протокол модификаций:
Во время гранулирования смеси получают шихты 150 г. шихты Смешивают и гранулируют с применением мешалки с высоким сдвигом при следующих параметрах:
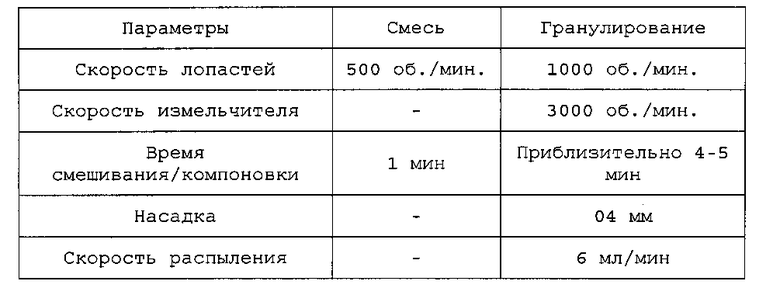
Затем пеллеты, полученные на предыдущей стадии, формуют в длинные прутья или экструдаты на лабораторном экструдере. Экструдер устанавливают на загрузку 150 г и скорость червяка 50 об./мин. Примеряют отверстие 1,0 мм. Полученные экструдаты формуют в сферические пеллеты на лабораторном сферонизаторе. Для этой стадии экструдер устанавливают на загрузку 150 г, различную скорость пластины и различное время сферонизации. Применяют пластину 2,0 мм. Затем пеллеты, полученные в процессе сферонизации, сушат в 5-литровой сушилке с псевдоожиженным слоем. Сушилку устанавливают на температуру 55°C в течение 15 минут.
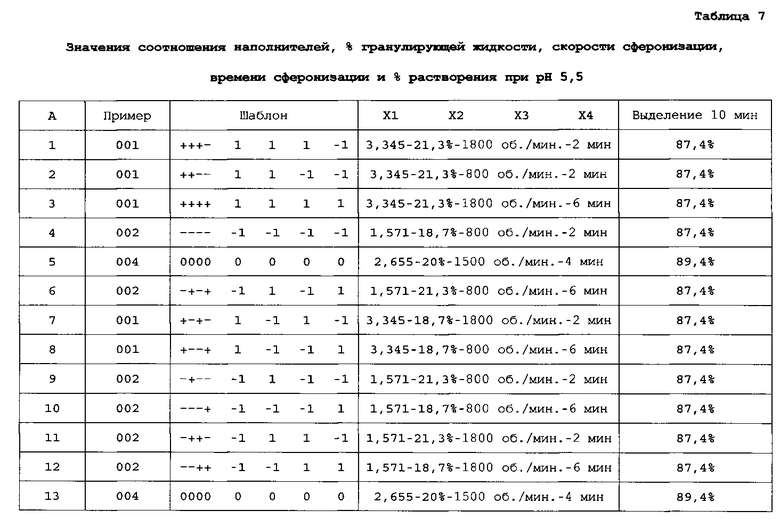
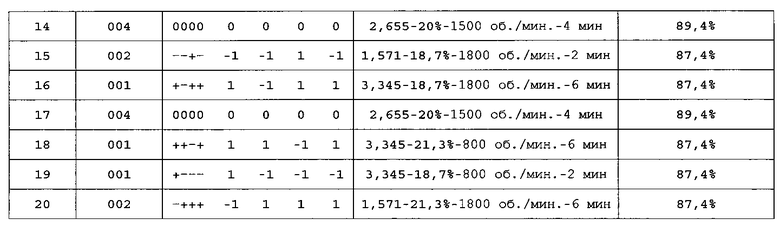
Профиль выделения API-001 различных композиций, полученных для анализа факторного полного плана (2×2×2×2), исследуют через 10 и 15 минут после растворения. В таблице 7 показаны параметры и результаты, полученные через 10 минут после растворения:
Более 85% API-001 выделяется через 15 минут во всех случаях.
3. Профиль выделения in vitro
API-001 имеет КД 6,8, представляя собой слабощелочное лекарственное средство и имея растворимость, сильно зависящую от pH среды. Как понятно из pH профиля растворимости, показанного на фиг. 2, растворимость API-001 снижается при увеличении pH среды.
Известно, что применение микрокристаллической целлюлозы (МКЦ) в гранулах, произведенных экструзией, сожжет модифицировать профиль выделения, задерживая выделение лекарственного средства, особенно для плохо растворимых соединений (Duckic et al, "Production of pellets via extrusion-spheronisation without the incorporation of micro crystalline cellulose: A critical review" European Journal of Pharmaceutics and Biopharmaceutics, vol. 71. no. 1, 2009; Kranz et al. "Drug release from MCC- and carrageenan-based pellets: Experimental and theory" European Journal of Pharmaceutics and Biopharmaceutics, vol. 73, no. 2, 2009).
Однако, неожиданно, исследование выделения лекарственного средства in vitro, проведенные при различных pH (кислота НС1 0,1 н., pH 1,2, буферный раствор pH 5,5 и буферный раствор pH 6,8) показали высокую скорость выделения; независимо от растворимости API-001, более 80% лекарственного средства растворяется в первые 15 минут. Присутствие МКЦ в композиции не увеличивает скорость выделения лекарственного средства, даже если ее применяют в среднем растворе буфера pH 6,8, эквивалентном pH кишечника in vivo, где растворимость API-001 крайне низкая, 0,6 мг/мл (плохо растворимое соединение). Поэтому ожидается, что экструдированные-сферонизированные пеллеты в соответствии с данным изобретением будут абсорбироваться во всем кишечном тракте.
На фиг. 3 показано влияние растворимости лекарственного средства в in vitro профиле выделения экструдированных-сферонизированных гранул API-001 (условия полного растворения поддерживают в течение всего исследования). Более конкретно, тестируемая композиция содержит: 86,6% API-001, 2,9% PEG 8000 в качестве связующего агента, и МКЦ 10,5% в качестве наполнителя или добавки для облегчения процесса экструзии.
4. Долговременная стабильность
Полученная композиция, состоящая из экструдированных сферонизированных гранул с высоким содержанием лекарственного средства 8 6,6%, неожиданно сохраняет быстрый профиль выделения в исследованиях долговременной стабильности в условиях окружающей среды при 25°C/60% ОБ и условиях стресса 40°C/75% ОБ, демонстрируя быструю скорость выделения лекарственного средства, более 85% доставляются в первые 15 минут. Присутствие МКЦ в экструдированных сферонизированных гранулах не задерживает или пролонгирует скорость выделения лекарственного средства API-001 при исследовании долговременной стабильности, проводимом в течение 6 месяцев.
На фиг. 4 показан сравнительный in vitro профиль выделения экструдированных сферонизированных гранул API-001 в следующих условиях: скорость лопастей 50 об./мин., среда HCl 0,1 н. pH 1,2, объем 900 мл (условия полного растворения поддерживают в течение всего исследования). Конкретно, тестируемая композиция содержит: 86,6% API-001, 2,9% PEG 8000 в качестве связующего агента и МКЦ 10,5% в качестве наполнителя или добавки для облегчения процесса экструзии.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ СИГМА-РЕЦЕПТОРА | 2005 |
|
RU2417987C2 |
| 1-АРИЛ-3-АМИНОАЛКОКСИПИРАЗОЛЫ КАК СИГМА-ЛИГАНДЫ, УСИЛИВАЮЩИЕ ОБЕЗБОЛИВАЮЩЕЕ ДЕЙСТВИЕ ОПИОИДОВ И ОСЛАБЛЯЮЩИЕ ЗАВИСИМОСТЬ ОТ НИХ | 2009 |
|
RU2519060C2 |
| ПРИМЕНЕНИЕ СИГМА ЛИГАНДОВ ПРИ БОЛИ, СВЯЗАННОЙ С ДИАБЕТОМ 2 ТИПА | 2012 |
|
RU2608943C2 |
| СИГМА-ЛИГАНДЫ ДЛЯ ПОТЕНЦИРОВАНИЯ АНАЛЬГЕТИЧЕСКОГО ЭФФЕКТА ОПИОИДОВ И ОПИАТОВ ПРИ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ И ДЛЯ ОСЛАБЛЕНИЯ ЗАВИСИМОСТИ ОТ НИХ | 2011 |
|
RU2563460C2 |
| ПРИМЕНЕНИЕ СИГМА-ЛИГАНДОВ ОТ БОЛИ ПРИ РАКЕ КОСТЕЙ | 2011 |
|
RU2585095C2 |
| ЛИГАНДЫ СИГМА-РЕЦЕПТОРОВ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ БОЛИ, ВЫЗВАННОЙ ХИМИОТЕРАПИЕЙ | 2010 |
|
RU2543382C2 |
| ПРИМЕНЕНИЕ СИГМА-ЛИГАНДОВ ПРИ ИНДУЦИРОВАННОЙ ОПИОИДАМИ ГИПЕРАЛГЕЗИИ | 2011 |
|
RU2589899C2 |
| СИГМА-ЛИГАНДЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРОФИЛАКТИКЕ И/ИЛИ ЛЕЧЕНИИ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ | 2011 |
|
RU2569055C2 |
| СОЕДИНЕНИЯ ПИРАЗИНО[1,2-а]ИНДОЛА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ СРЕДСТВАХ | 2014 |
|
RU2660417C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ МОДУЛЯТОР S1Р | 2007 |
|
RU2487703C2 |
Изобретение относится к фармацевтической композиции, которая содержит соединение формулы (I) в качестве активного фармацевтического ингредиента или его фармацевтически приемлемую соль; и по меньшей мере фармацевтически приемлемый наполнитель, где активный фармацевтический ингредиент присутствует в количестве по меньшей мере 80% от общей сухой массы композиции. Композиция обладает хорошей скоростью высвобождения независимо от величины pH. 7 з.п. ф-лы, 4 ил., 7 табл., 4 пр.
1. Фармацевтическая композиция в форме пеллет для лечения и профилактики заболевания или состояния, опосредованного сигма рецептором, содержащая (i) соединение формулы (I) в качестве активного фармацевтического ингредиента:
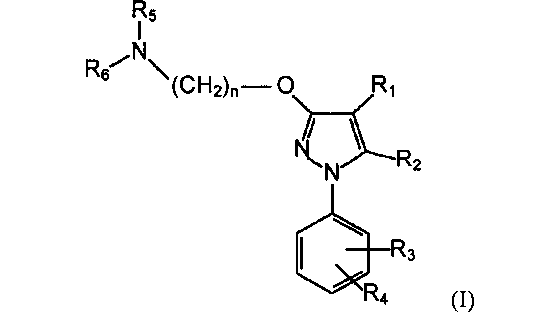
где указанное соединение выбирают из:
1-(3,4-дихлорфенил)-5-метил-3-[2-(пирролидин-1-ил)этокси]-1H-пиразола,
1-{2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-илокси]этил}-4-метилпиперазина,
1-(4-(2-(1-(3,4-дихлорфенил)-1H-пиразол-3-илокси)этил)пиперидин-1-ил)этанона,
2-[1-(2,4-дихлорфенил)-1H-пиразол-3-илокси]-N,N-диэтилэтанамина,
2-[1-(3,4-дихлорфенил)-4,5-диметил-1H-пиразол-3-илокси]-N,N-диэтилэтанамина,
4-[1-(3,4-дихлорфенил)-1H-пиразол-3-илокси]-N,N-диэтилбутан-1-амина,
1-{2-[5-метил-1-(нафталин-2-ил)-1H-пиразол-3-илокси]этил}пиперидина,
1-(4-(2-(1-(нафталин-2-ил)-1H-пиразол-3-илокси)бутил)пиперазин-1-ил)этанона и
4-{2-[5-метил-1-(нафталин-2-ил)-1H-пиразол-3-илокси]этил}морфолина,
или его фармацевтически приемлемую соль;
и (ii) фармацевтически приемлемые наполнители, которые включают полиэтиленгликоль (ПЭГ) в диапазоне от 2,9 до 4,9% и микрокристаллическую целлюлозу (МКК) при соотношении МКК/ПЭГ, равном от 3,345 до 1,571, и при условии, что фармацевтическая композиция не содержит каррагинан,
где активный фармацевтический ингредиент присутствует в количестве по меньшей мере 80% от общей сухой массы композиции и массовое соотношение активного фармацевтического ингредиента к фармацевтически приемлемым наполнителям составляет от 4:1 до 40:1.
2. Фармацевтическая композиция по п. 1, где полиэтиленгликоль имеет среднюю массу от 7000 до 9000.
3. Фармацевтическая композиция по п. 1 или 2, которая дополнительно содержит наполнитель, выбранный из группы, включающей разрыхлители, смазывающие агенты, пластификаторы и наполнители.
4. Фармацевтическая композиция по п. 1, которая включена в лекарственную форму, выбранную из группы, состоящей из капсулы, вагинальных суппозиторий, суппозиторий, вафля, минитаблетки, таблетки, пилюли, саше, опрыскивания, пленки, сухого сиропа, восстанавливаемого твердого вещества, микросферы, матрицы, геля, дисперсии, раствора, суспензии, пастилки, лепешки, имплантата, порошка, мелкого порошка, пластинки, полоски.
5. Фармацевтическая композиция по п. 1, которая составлена для немедленного высвобождения.
6. Фармацевтическая композиция по п. 1, где активным фармацевтическим ингредиентом (i) является 4-{2-[5-метил-1-(нафталин-2-ил)-1H-пиразол-3-илокси]этил}морфолин или его фармацевтически приемлемая соль, предпочтительно гидрохлоридная соль.
7. Фармацевтическая композиция по п. 1, где заболевание выбирают из группы, включающей диарею; липопротеиновые расстройства; мигрень; ожирение; артрит; гипертонию; аритмию; язву; дефицит способности к обучению, памяти и внимания; расстройства познавательной способности; нейродегенеративные заболевания; демиелинизирующие заболевания; привыкание к лекарственным средства и химическим веществам, включая кокаин, амфетамин, этанол и никотин; позднюю дискинезию; ишемический инсульт; эпилепсию; удар; стресс; рак; психотические состояния, в частности депрессию, тревогу или шизофрению; воспаление; и аутоиммунные заболевания.
8. Фармацевтическая композиция по п. 7, где заболеванием является боль, предпочтительно, невропатическая боль, воспалительная боль или другие болевые состояния, включая аллодинию и/или гипералгезию.
| ИНГИБИТОРЫ СИГМА-РЕЦЕПТОРА | 2005 |
|
RU2417987C2 |
| 1-АРИЛ-3-АМИНОАЛКОКСИПИРАЗОЛЫ КАК СИГМА-ЛИГАНДЫ, УСИЛИВАЮЩИЕ ОБЕЗБОЛИВАЮЩЕЕ ДЕЙСТВИЕ ОПИОИДОВ И ОСЛАБЛЯЮЩИЕ ЗАВИСИМОСТЬ ОТ НИХ | 2009 |
|
RU2519060C2 |
| KRANZ H ET AL: "Drug release from MCC- and carrageenan-based pellets: Experiment and theory", EUROPEAN JOURNAL OF PHARMACEUTICS AND BIOPHARMACEUTICS, 2009, vol | |||
| Способ подготовки рафинадного сахара к высушиванию | 0 |
|
SU73A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2015-05-10—Публикация
2010-11-25—Подача