Настоящее изобретение относится к новому одностадийному способу получения нафто[1,2,3-cd]индол-6(2H)-онов общей формулы (I)
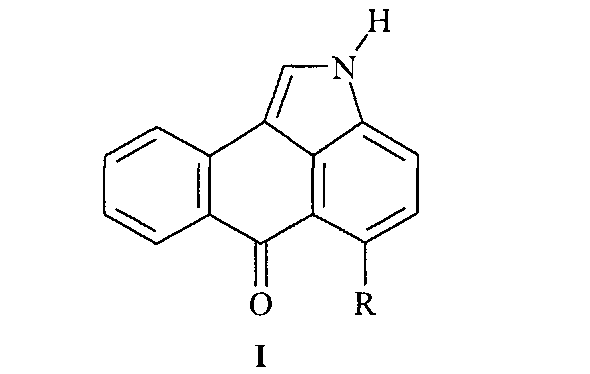
где R - обозначает атом водорода или хлора. Производные нафто[1,2,3-cd]индол-6(2H)-она могут найти применение в качестве компонентов электролюминесцентных композиций.
Известны следующие способы получения незамещенного нафто[1,2,3-cd]индол-6(2H)-она (Ia). Первый способ был запатентован в 1934 году и заключается во взаимодействии 1-амино-10-антрона с муравьиной кислотой в присутствии серной кислоты (DE №594168, 13.03.1934):
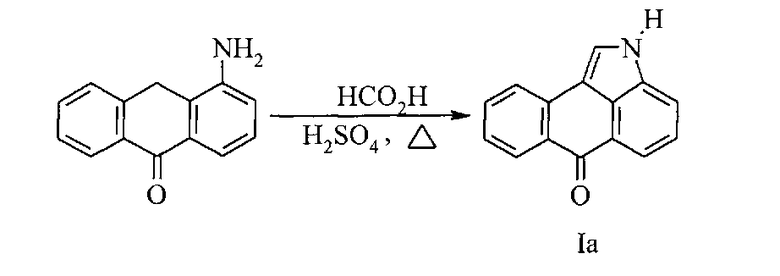
Несмотря на легкость протекания внутримолекулярной циклизации, недостатком данного способа является малая доступность 1-амино-10-антрона.
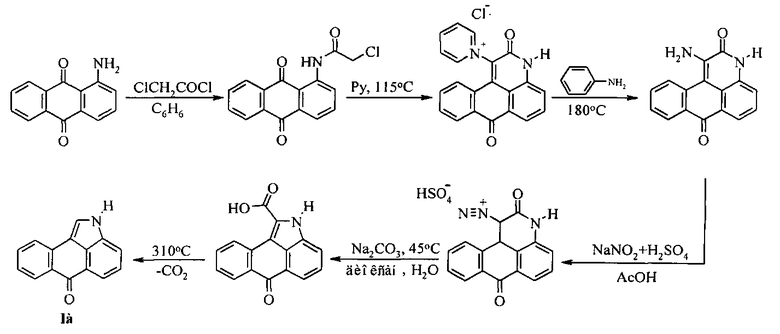
Известен также способ, по которому нафто[1,2,3-cd]индол-6(2H)-он (Ia) может быть получен на основе коммерчески доступного 1-амино-9,10-антрахинона (Казанков М.В. Сужение гетероцикла в 1-диазоантрапиридоне / М.В. Казанков, Н.П. Макшанова, Е.Г. Кузнецова // ХГС. - 1977. - №8. - с. - 1103-1105). Однако многостадийность данного процесса не позволяет получать нафто[1,2,3-cd]индол-6(2H)-он (Ia) с количественным суммарным выходом:
Известен также способ получения нафто[1,2,3-cd]индол-6(2H)-онов, согласно которому сначала при нагревании 6H-6-оксоантра[1,9-cd]изоксазолов получают 1-S,S-диметил-N-(9,10-антрахинон-1-ил)сульфоксимиды [Sutter P. Ring opening reaction of 6H-anthra[1,9-cd]isoxazol-6-ones and related compounds / P. Sutter, C.D. Weis // J. Heterocycl. Chem. - 1982. - Vol.19. - No. 5. - P.997-1011] согласно следующей схеме:
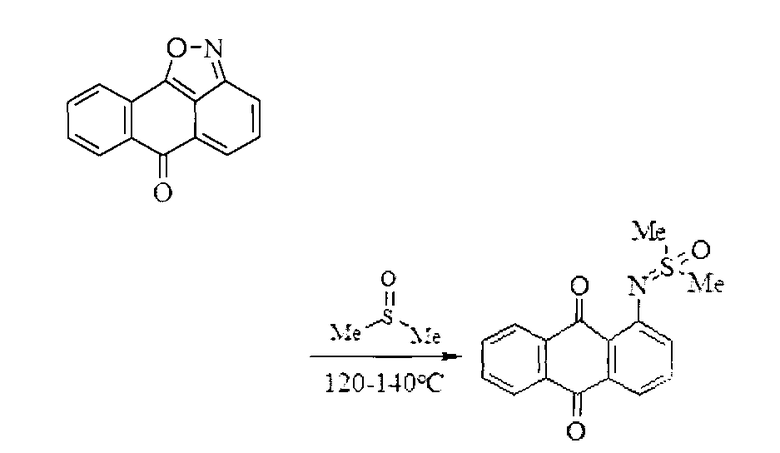
Затем 1-S,S-диметил-N-(9,10-антрахинон-1-ил)сульфоксимиды очищают кристаллизацией и обрабатывают основными реагентами в полярных апротонных растворителях [Горностаев Л.М. Синтез 6-оксо-6Н-нафто[1,2,3-cd]индолов / Л.М. Горностаев, В.А. Береснев, Т.И. Лаврикова, И.Л. Мезрина // ЖОрХ. - 2004. - Т.40. - Вып.4. - С.555-556]. При этом получаются нафто[1,2,3-cd]индол-6(2H)-оны (IIIa, b):
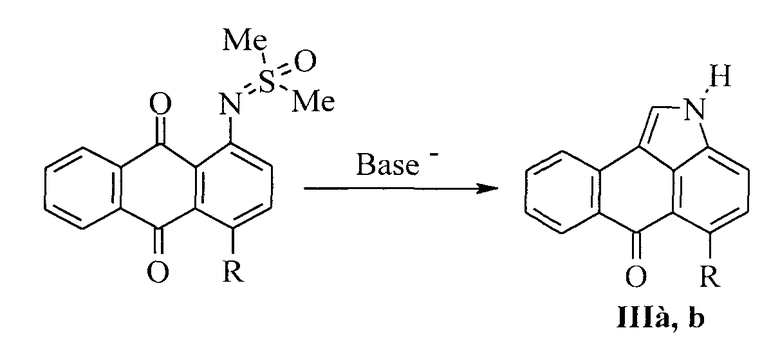
Двустадийное получение нафто[1,2,3-сd]индол-6(2H)-онов требует значительных временных затрат, при этом расходуется большой объем растворителей.
Задачей настоящего изобретения является создание более экономичного и простого способа получения нафто[1,2,3-сd]индол-6(2H)-онов.
При этом достигаемый технический результат заключается в экономии растворителей, сокращении времени на проведение реакций.
Поставленная задача решается тем, что способ получения нафто[1,2,3-сd]индол-6(2H)-онов общей формулы
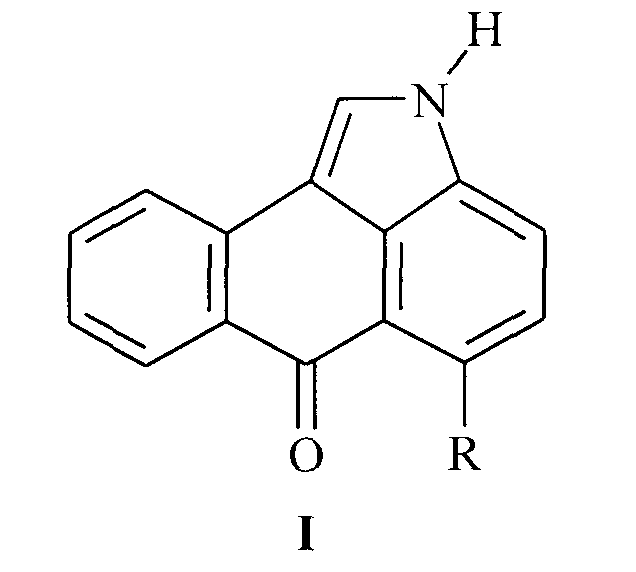
где R обозначает атом водорода или хлора,
из вещества на основе 6Н-6-оксоантра[1,9-сd]изоксазола согласно заявляемому изобретению осуществляют в одну стадию, при этом исходное вещество суспендируют в диметилсульфоксиде (ДМСО), нагревают при температуре не ниже 120°С с воздушным холодильником, по окончании реакции реакционную смесь охлаждают до 50°С, добавляют 10%-ный раствор метилата натрия и выдерживают при 70-80°С 15 мин, далее добавляют водный раствор уксусной кислоты в объеме, равном объему полученной смеси, полученную зелено-желтую суспензию нагревают при 80°С до растворения, приливают воду, нагревают до 95°С и охлаждают до 18-20°С, выпавший осадок нафто[1,2,3-сd]индол-6(2H)-она отфильтровывают, промывают водным спиртом, спиртом, при этом полученный осадок подвергают дополнительной очистке.
Способ может быть реализован с получением нафто[1,2,3-сd]индол-6(2Н)-она из 6Н-6-оксоантра[1,9-сd]изоксазола, при этом суспензию 6H-6-оксоантра[1,9-сd]изоксазола в ДМСО нагревают при 130-140°С с воздушным холодильником в течение 30 мин, а отфильтрованный и промытый водным спиртом, спиртом осадок перекристаллизовывают из ледяной уксусной кислоты.
Способ может быть реализован с получением 5-хлорнафто[1,2,3-cd]индол-6(2H)-она из 5-хлор-6Н-6-оксоантра[1,9-cd]изоксазола, при этом суспензию 5-хлор-6H-6-оксоантра[1,9-cd]изоксазола в ДМСО нагревают при 120-130°C с воздушным холодильником в течение двух часов, а отфильтрованный и промытый водным спиртом, спиртом осадок кипятят в этаноле в течение 30 мин, охлаждают до 15-20°C и отфильтровывают чистый осадок.
Способ осуществляют следующим образом.
В диметилсульфоксиде (ДМСО) суспендируют вещество на основе 6H-6-оксоантра[1,9-cd]изоксазола и нагревают при температуре не ниже 120°C с воздушным холодильником. По окончании реакции реакционную смесь охлаждают до 50°C, добавляют 10%-ный раствор метилата натрия и выдерживают при 70-80°C 15 мин, далее добавляют водный раствор уксусной кислоты в объеме, равном объему полученной смеси, полученную зелено-желтую суспензию нагревают при 80°C до растворения, приливают воду, нагревают до 95°C и охлаждают до 18-20°C, выпавший осадок нафто[1,2,3-cd]индол-6(2H)-она отфильтровывают, промывают водным спиртом, который отфильтровывают и промывают спиртом, полученный при этом осадок подвергают дополнительной очистке.
Ниже приведены примеры получения нафто[1,2,3-cd]индол-6(2H)-она и его хлорпроизводного - 5-хлорнафто[1,2,3-cd]индол-6(2H)-она.
Пример 1
Синтез нафто[1,2,3-cd]индол-6(2H)-она (IIIa) из 6H-6-оксоантра[1,9-cd]изоксазола (IIa) осуществляли согласно следующей схеме реакции:
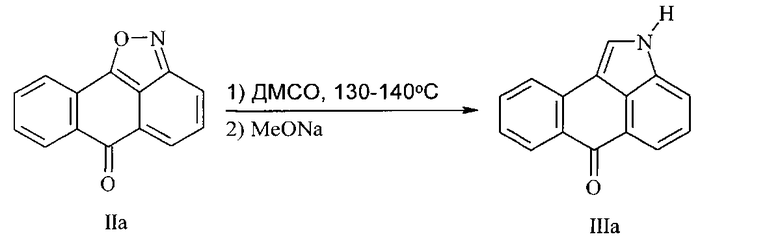
В 30 мл ДМСО суспендировали 2.21 г (0.01 моль) 6H-6-оксоантра[1,9-cd]изоксазола (IIa) и нагревали при 130-140°C с воздушным холодильником в течение 30 мин. По окончании реакции реакционную смесь охлаждали до 50°C, добавляли 2 мл 10%-ного раствора метилата натрия и выдерживали при 70-80°C 15 мин. Далее добавляли 15 мл водного раствора уксусной кислоты (1:1), зелено-желтую суспензию нагревали при 80°C до растворения, приливали 10 мл воды, нагревали до 95°C и охлаждают до 18-20°C. Выпавший осадок нафто[1,2,3-cd]индол-6(2H)-она (IIIa) отфильтровывали, промывали водным спиртом, спиртом. Перекристаллизовывали из ледяной уксусной кислоты. Выход 1.77 г (81%), желтые кристаллы, т.пл. 251-252°C. Спектр ЯМР 1H, δ, м.д.: 7.42 т (1H, H8(9), J 7.5 Гц), 7.53 т (1H, H4, J 8.0 Гц), 7.71 т (1H, H9(8), J 7.0 Гц), 7.88 д (1H, H3, J 7.5 Гц), 7.97 д (1H, H5, J 7.5 Гц), 8.13 д (1H, H10, J 8.0 Гц), 8.32 д (1H, H7, J 8.0 Гц), 8.45 с (1H, H1), 12.00 уш.с (1H, NH). Масс-спектр, m/z (Iотн., %): 219 [M]+ (100), 163 (22), 32 (99). Найдено, %: C 82.18; H 4.14; N 6.39. C15H9NO. Вычислено, %: C 82.19; H 4.14; N 6.39.
Пример 2
Синтез 5-хлорнафто[1,2,3-cd]индол-6(2H)-она (IIIb) из 5-хлор-6H-6-оксоантра[1,9-cd]изоксазола осуществляли согласно следующей схеме реакции:
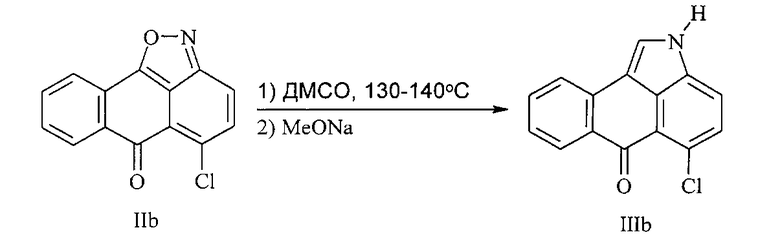
В 30 мл ДМСО суспендировали 2.555 г (0.01 моль) 5-хлор-6H-6-оксоантра[1,9-cd]изоксазола (IIb) и нагревали при 120-130°C с воздушным холодильником 2 ч. По окончании реакции реакционную смесь охлаждали до 50°C, добавляли 2 мл 10%-ного раствора метилата натрия и выдерживали при 70-80°C 15 мин. Далее добавляли 15 мл водного раствора уксусной кислоты (1:1), зелено-желтую суспензию нагревали при 80°C до растворения, приливали 10 мл воды, нагревали до 95°C и охлаждали до 18-20°C. Выпавший осадок 5-хлорнафто[1,2,3-cd]индол-6(2H)-она отфильтровывали, промывали водным спиртом, спиртом, при этом отфильтрованный и промытый спиртом осадок кипятили в этаноле в течение 30 мин, охлаждали до 15-20°C и отфильтровывали чистый осадок. Выход 2.15 г (85%), желтые кристаллы, т.пл. 312-314°C. Спектр ЯМР 1H, δ, м.д.: 7.44 т (1H, H8(9), J 7.5 Гц), 7.48 д (1H, H3, J 7.5 Гц), 7.72 т (1H, H9(8), J 7.0 Гц), 7.85 д (1H, H7, J 8.0 Гц), 8.13 д (1H, H10, J 8.0 Гц), 8.30 д (1H, H7, J 8.0 Гц), 8.52 д (1H, H1, J 3.0 Гц), 12.20 уш.с (1H, NH). Масс-спектр, m/z (Iотн., %): 255 [M+2]+ (31), 254 [M+1]+ (16), 253 [M]+ (100), 163 (44), 81 (18). Найдено, %: C 71.04; H 3.21; N 5.42. C15H8ClNO. Вычислено, %: C 71.01; H 3.16; N 5.52.
Заявляемый способ получения нафто[1,2,3-cd]индол-6(2H)-онов и его хлорпроизводных позволяет получать данные соединения в одну технологическую стадию, сократив при этом время на проведение реакций и расход реагентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НАФТО[1,2,3-cd]ИНДОЛ-6(2Н)-ОНОВ | 2013 |
|
RU2552416C2 |
| 1-R-4,9-ДИОКСО-1H-НАФТО[2,3-d][1,2,3]ТРИАЗОЛ-4-ОКСИМ-2-ОКСИДЫ И ИХ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2545091C1 |
| МОДУЛЯТОРЫ АКТИВНОСТИ НЕС1 И СПОСОБЫ ДЛЯ НИХ | 2011 |
|
RU2576036C2 |
| Способ получения 1-(2-пропаргил)-1Н-нафто[2,3-d][1,2,3]триазол-4,9-дион-4-оксим-2-оксида | 2022 |
|
RU2791249C1 |
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2726622C2 |
| Способ получения 2-замещенных 1-гидроксипирроло[3,4-f]индол-5,7-(1Н,6Н)-дионов | 2015 |
|
RU2613582C1 |
| КОНДЕНСИРОВАННЫЕ ГЕТЕРОАРИЛЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2552114C2 |
| ИНГИБИТОРЫ FXIA, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2020 |
|
RU2802878C1 |
| 5-ЗАМЕЩЕННЫЕ ИНДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2008 |
|
RU2487873C2 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК, ОПОСРЕДОВАННОГО КИНАЗОЙ RAF, ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ МОЧЕВИНЫ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 1998 |
|
RU2232015C2 |
Изобретение относится к области органической химии, а именно к способу получения нафто[1,2,3-cd]индол-6(2H)-онов общей формулы (I), где R обозначает атом водорода или хлора, из вещества на основе 6Н-6-оксоантра[1,9-cd]изоксазола, отличающемуся тем, что синтез осуществляют в одну стадию, при этом исходное вещество суспендируют в диметилсульфоксиде (ДМСО), нагревают при температуре не менее 120°С с воздушным холодильником, по окончании реакции реакционную смесь охлаждают до 50°С, добавляют 10%-ный раствор метилата натрия и выдерживают при 70-80°С 15 мин, далее добавляют водный раствор уксусной кислоты в объеме, равном объему полученной смеси, полученную зелено-желтую суспензию нагревают при 80°С до растворения, приливают воду, нагревают до 95°С и охлаждают до 18-20°С, выпавший осадок нафто[1,2,3-cd]индол-6(2H)-она отфильтровывают, промывают водным спиртом, спиртом, при этом полученный осадок подвергают дополнительной очистке. Технический результат: разработан новый способ получения нафто[1,2,3-cd]индол-6(2H)-онов, отличающийся меньшими затратами растворителей и времени на проведение реакции. 2 з.п. ф-лы, 2 пр.
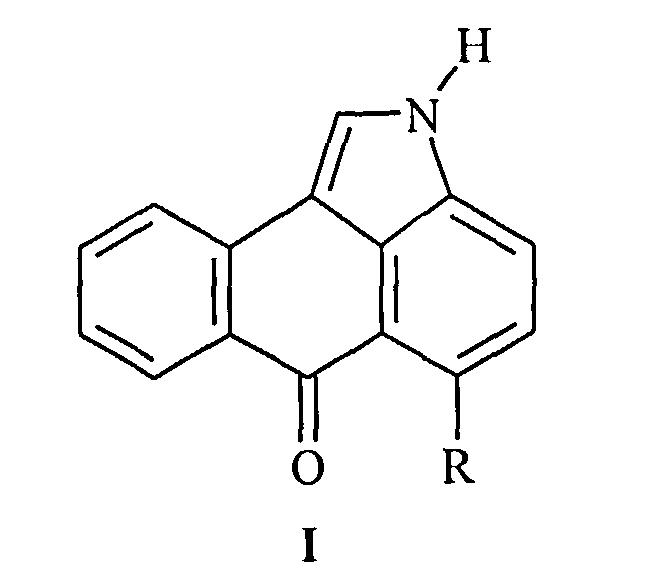
1. Способ получения нафто[1,2,3-cd]индол-6(2H)-онов общей формулы

где R обозначает атом водорода или хлора, из вещества на основе 6Н-6-оксоантра[1,9-cd]изоксазола, отличающийся тем, что синтез осуществляют в одну стадию, при этом исходное вещество суспендируют в диметилсульфоксиде (ДМСО), нагревают при температуре не менее 120°С с воздушным холодильником, по окончании реакции реакционную смесь охлаждают до 50°С, добавляют 10%-ный раствор метилата натрия и выдерживают при 70-80°С 15 мин, далее добавляют водный раствор уксусной кислоты в объеме, равном объему полученной смеси, полученную зелено-желтую суспензию нагревают при 80°С до растворения, приливают воду, нагревают до 95°С и охлаждают до 18-20°С, выпавший осадок нафто[1,2,3-cd]индол-6(2H)-она отфильтровывают, промывают водным спиртом, спиртом, при этом полученный осадок подвергают дополнительной очистке.
2. Способ по п.1, отличающийся тем, что нафто[1,2,3-cd]индол-6(2H)-он синтезируют из 6Н-6-оксоантра[1,9-cd]изоксазола, при этом суспензию 6Н-6-оксоантра[1,9-cd]изоксазола в ДМСО нагревают при 130-140°С с воздушным холодильником в течение 30 мин, а отфильтрованный и промытый водным спиртом, спиртом осадок перекристаллизовывают из ледяной уксусной кислоты.
3. Способ по п.1, отличающийся тем, что 5-хлорнафто[1,2,3-cd]индол-6(2Н)-он синтезируют из 5-хлор-6Н-6-оксоантра[1,9-cd]изоксазола, при этом суспензию 5-хлор-6Н-6-оксоантра[1,9-cd]изоксазола в ДМСО нагревают при 120-130°С с воздушным холодильником в течение двух часов, а отфильтрованный и промытый водным спиртом, спиртом осадок кипятят в этаноле в течение 30 мин, охлаждают до 15-20°С и отфильтровывают чистый осадок.
| Каргина О.И | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Горностаев Л.М | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2015-06-10—Публикация
2013-10-21—Подача