Изобретение относится к медицине, в частности к гематологии, а именно к клиническим методам исследования с помощью автоматизированных морфометрических методов (в том числе с применением компьютеров), и может быть использовано для диагностики поражения фиброзной тканью, в частности, костномозговой ткани (миелофиброз).
В последние годы, благодаря разработке и использованию в клинической практике новых лекарственных препаратов, трансплантации гемопоэтических стволовых клеток и многих других современных методов лечения, удалось существенно увеличить общую выживаемость больных с опухолевыми заболеваниями, в частности кроветворной ткани. Очевидно, что с увеличением продолжительности жизни онкологических пациентов существенно повышается роль надежной качественной диагностики злокачественных новообразований.
Известны обычные методы диагностики миелофиброза с помощью трепанобиопсии костного мозга. Шкала, принятая на Европейском консенсусе в 2005 г. (Thiele J., Kvasnicka Η.Μ, Facchetti F. et al. European consensus for grading of bone marrow fibrosis and assessment of cellularity // Haematilogica. - 2005. - 90:1128 - 1132), позволяет провести качественную и полуколичественную оценку миелофиброза. Качественная оценка миелофиброза заключается в дифференцировке между ретикулином и коллагеном, полуколичественная оценка связана с определением плотности ретикулинового волокна.
Также известен способ количественной автоматизированной оценки миелофиброза при миелопролиферативных заболеваниях, который заключается в определении среднего процентного содержания черных пикселей в 3-х гемопоэтических площадях по 0,5 мм2 (Teman J. Сarolin, 2010).
Однако известные методы диагностики миелофиброза не дают достаточной точности и оперативности получения соответствующих результатов.
Известен также способ диагностики воспалительной патологии верхнечелюстных пазух (патент РФ на изобретение №2234859, публикация от 27.04.2004), который, в частности, включает в себя выполнение обзорных рентгенограмм околоносовых пазух в носоподбородочной проекции, отличающийся тем, что на рентгенограмме выделяют ″зоны интереса″, соответствующие рентгенологическим контурам верхнечелюстной пазухи и одноименной орбиты, строят гистограммы и рассчитывают коэффициент плотности (Кп) как отношение плотности верхнечелюстной пазухи, выраженной в единицах шкалы серого цвета, к плотности одноименной орбиты, выраженной в единицах шкалы серого цвета, причем при ″одногорбой″ кривой зоной интереса является рентгенологический контур всей верхнечелюстной пазухи, а при наличии ″многогорбой″ кривой зонами интереса являются участки пазухи с различной плотностью.
Известный метод, вследствие использования, в частности, рентгеновской техники, также не обладает высокой точностью и достаточной оперативностью диагностики.
Наиболее близким к заявляемому изобретению выявлено решение, известное из публикации (Домникова Н.П. и др. Структурный анализ трепанобиоптантов при агрессивных и индолентных неходкинских лимфомах // Фундаментальные исследования, №9, 2001, с. 27-61 (стр. 58 1 и 2 колонка)), которое, в частности, характеризуется тем, что в нем определяется относительная площадь опухолевой ткани при различных типах лимфомной инфильтрации костного мозга при агрессивных и индолентных неходжкинских лимфомах, что, во всяком случае, облегчает диагностику миелофиброза.
Основным недостатком известного метода, принятого за прототип, является отсутствие возможности автоматизированной морфометрической диагностики миелофиброза, затрудняющее повышение точности постановки соответствующего диагноза.
Целью заявляемого изобретения является устранение указанных выше недостатков и достижение таких технических результатов, как повышение точности и улучшение оперативности диагностики миелофиброза, в частности как при первичном миелофиброзе (хронический идиопатический миелофиброз), так и вторичном миелофиброзе, который развивается при: 1) онкогематологических заболеваниях (истинная полицитемия, эссенциальная тромбоцитемия, хронический миелолейкоз, волосатоклеточный лейкоз, реже - острый лейкоз, миелодиспластический синдром, неходжкинские лимфомы, лимфома Ходжкина, множественная миелома); 2) солидных опухолях с метастазами в костном мозге (рак молочной железы, легких, предстательной железы); 3) диффузных заболеваниях соединительной ткани (системная красная волчанка, системная склеродермия).
Указанная цель достигается тем, что способ автоматизированной морфометрической диагностики миелофиброза, включающий выполнение обзорных изображений биологической ткани, выделение на таких изображениях зон с различными оптическими свойствами, определяемыми фиброзными и гемопоэтическими свойствами биологической ткани, и выполнение расчета отношения площадей этих зон, характеризуется в том числе тем, что обзорные изображения выполняют путем формирования как минимум трех парафиновых срезов трепанобиоптатов, полученные срезы обрабатывают следующим образом: первый импрегнируют серебром по методу Гомори, второй окрашивают по методу ван Гизона и третий окрашивают гематоксилином и эозином, полученные таким образом обзорные изображения подвергают фиксации и анализу так, что в результате этого анализа получают величину площади зон, окрашенных в черный и розовый цвета, соответствующих фиброзной ткани, и величину площади зон, окрашенных в синий и бледно-розовый цвета, соответствующих гемопоэтической ткани; затем вычисляют коэффициент относительной площади как отношение площади фиброзной ткани к площади гемопоэтической ткани по формуле:
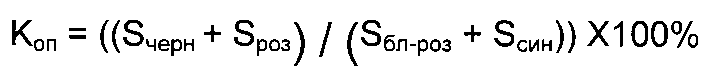
где:
Коп - коэффициент относительной площади (в процентах);
Sчepн - площадь зоны ткани, окрашенной в черный цвет;
Sроз - площадь зоны ткани, окрашенной в розовый цвет;
Sбл-роз - площадь зоны ткани, окрашенной в бледно-розовый цвет;
Sсин - площадь зоны ткани, окрашенной в синий цвет,
причем при значении Коп≥14,5% диагностируют миелофиброз.
Способ автоматизированной морфометрической диагностики миелофиброза может характеризоваться тем, что парафиновые срезы трепанобиоптатов формируют толщиной 4 мкм.
Способ автоматизированной морфометрической диагностики миелофиброза может характеризоваться тем, что фиксация обзорных изображений парафиновых срезов осуществляется с помощью цветной фотовидеокамеры.
Способ автоматизированной морфометрической диагностики миелофиброза может характеризоваться тем, что величину площади зон, окрашенных в черный и розовый цвета, соответствующих фиброзной ткани, и величину площади зон, окрашенных в синий и бледно-розовый цвета, соответствующих гемопоэтической ткани, получают с помощью источника света и соответствующих RGB датчиков определения цвета, так что площадь окрашенных зон соответствует электрическому напряжению на выходе цветовых датчиков.
Способ автоматизированной морфометрической диагностики миелофиброза может характеризоваться тем, что площадь окрашенных зон получают с помощью установленного в цепи после RGB датчиков цифрового сигнального процессора.
Способ автоматизированной морфометрической диагностики миелофиброза может характеризоваться тем, что анализ для получения величин площадей окрашенных зон производят с помощью компьютеризированного микроскопа.
Способ автоматизированной морфометрической диагностики миелофиброза может характеризоваться тем, что в качестве источника света используют RGB светодиодный источник света.
В отдельных случаях поставленная задача, например, решается тем, что выявление данных показателей миелофиброза осуществляется с использованием программы анализа изображений AxioVision 4.6, применяя, например, цветную пятимегапиксельную фото/видео камеру AxioCam, микроскоп Zeiss и стандартный компьютер. В парафиновых срезах трепанобиоптатов, например, подвздошной кости, толщиной 4 мкм, импрегнированных серебром по методу Гомори и окрашенных по методу ван Гизона, при увеличении 200 измеряют абсолютную площадь фиброзной (коллагеновой и ретикулиновой) ткани и гемопоэтической ткани. Изучаются все костномозговые полости одного среза, что соответствует 5-7 полям зрения микроскопа и 20-30 полям зрения камеры (в зависимости от размера среза). Площадь одного поля зрения камеры известна и составляет 364000 мкм2 (0,7 мм2). Сложив площадь фиброзной ткани во всех полях зрения камеры, получают суммарную абсолютную площадь фиброзной ткани в пределах одного среза. Аналогичным образом получают суммарную абсолютную площадь гемопоэтической ткани. Затем вычисляют процент площади фиброзной ткани от гемопоэтической ткани (Коп). Коп отражает выраженность миелофиброза.
Зачастую задачей соответствующей диагностики является расширение возможностей оценки миелофиброза с целью определения такого весьма значимого показателя, как угнетение эритроидного ростка. Состояние эритроидного ростка оценивается в срезах, окрашенных гематоксилином и эозином.
Предлагаемым способом исследованы, к примеру, трепанобиоптаты подвздошной кости 30 пациентов с диффузной В-крупноклеточной лимфомой (ДВККЛ): 20 мужчин, 10 женщин, от 21 до 59 лет, средний возраст - 50,36±14,31 лет, 30 пациентов с хроническим лимфолейкозом (ХЛЛ) и неходжкинскими лимфомами из малых лимфоцитов с опухолевым поражением костного мозга (НХЛ из малых лимфоцитов): 18 мужчин, 12 женщин, от 44 до 78 лет, средний возраст - 59,13±9,57 лет, 10 пациентов с множественной миеломой (ММ): 5 мужчин, 5 женщин, от 50 до 68 лет, средний возраст - 59,67±6,58 лет, находившихся на лечении в ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» с 2010 по 2012 годы.
Диагноз лимфомы устанавливали в соответствии с классификацией REAL (1994) и ВОЗ (2008), диагноз хронического лимфолейкоза устанавливали на основании классификации Binet (Binet J.L. et. al., 1981). Для верификации диагноза множественной миеломы использовали критерии Y. Huang и соавт. (Huang Y.W. etal.,1 999).
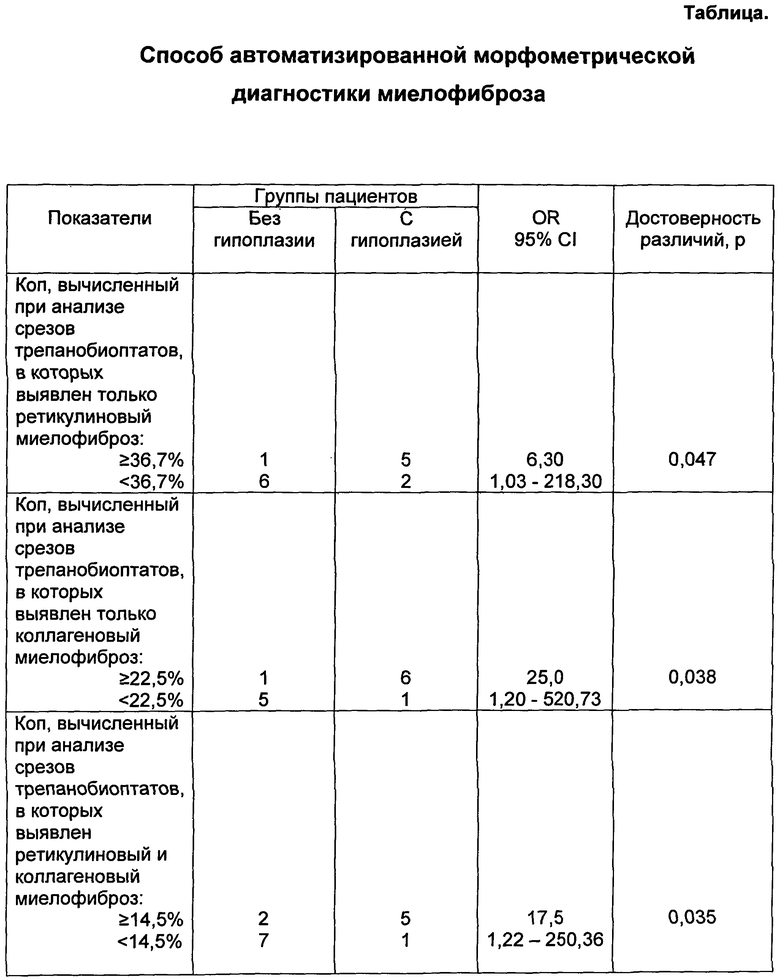
В первую группу вошли срезы 14 трепанобиоптатов, в которых отмечался, скорее всего, только ретикулиновый миелофиброз, во вторую группу - срезы 13 трепанобиоптатов, где наблюдался, вероятнее, только коллагеновый миелофиброз, в третью - срезы 15 трепанобиоптатов, в которых с наибольшей достоверностью был выявлен как коллагеновый, так и ретикулиновый миелофиброз. В остальных 28 трепанобиоптатах - фиброзная ткань не обнаружена. Оценка выраженности миелофиброза осуществлялась в каждой группе.
В Таблице представлен пример показателей миелофиброза, ассоциированных с гипоплазией эритроидного ростка, в частности приведены данные результатов автоматизированной морфометрической оценки миелофиброза при лимфопролиферативных заболеваниях, выявлены показатели, которые ассоциированы с угнетением эритроидного ростка.
Данные таблицы позволяют сделать вывод о том, что к таким показателям относятся: в первой группе - Коп ≥36,7%, во второй группе - Коп ≥22,5%, в третьей группе Коп - ≥14,5%. Таким образом, реализация способа, в части указанных значений, таких как Коп >14,5%, может быть использована в диагностике миелофиброза, без четкого его разделения на группы.
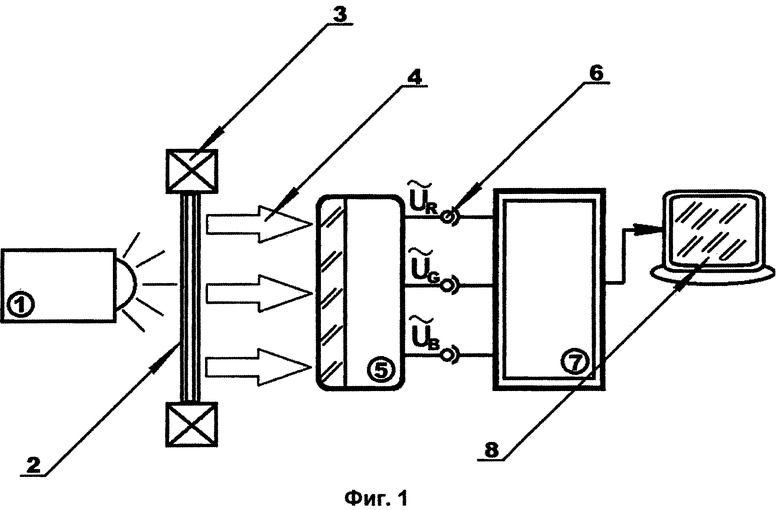
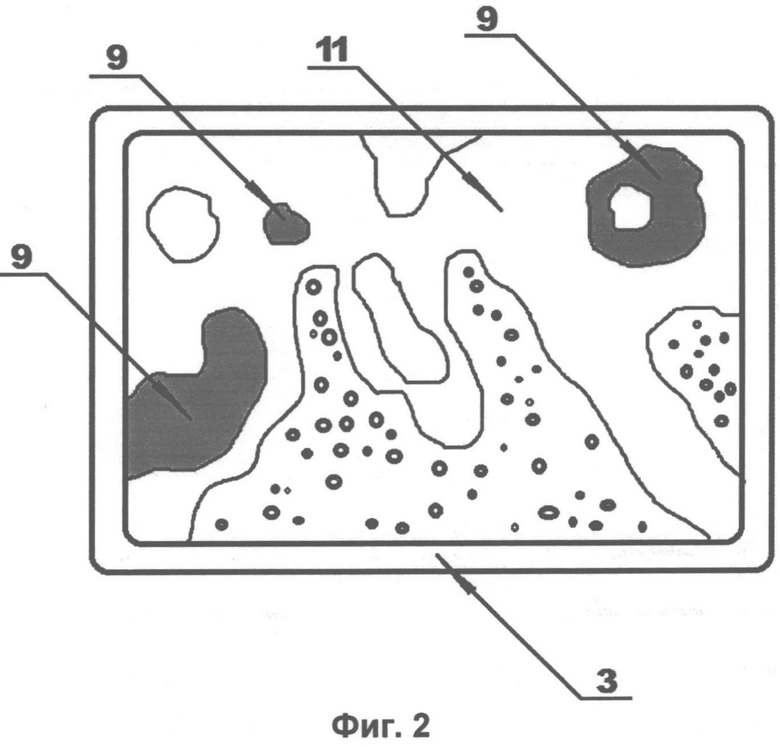
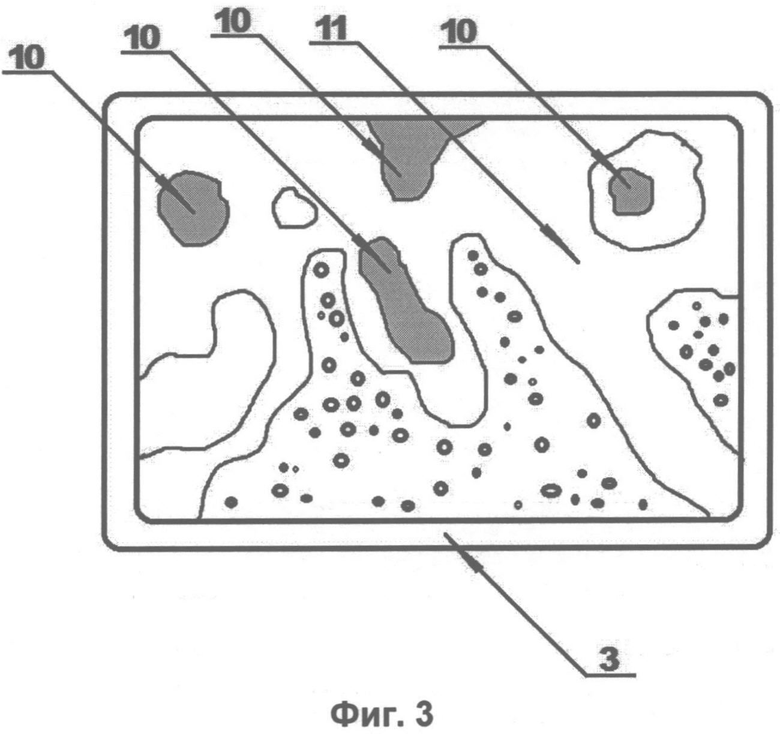
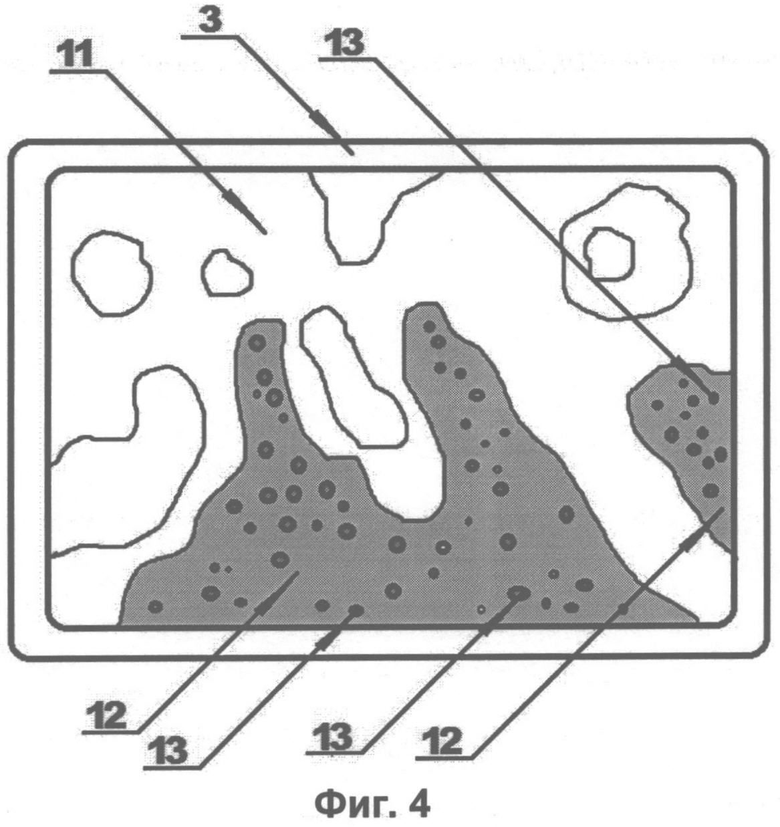
На Фиг. 1 схематично показан пример выполнения установки для анализа парафиновых срезов трепанобиоптата по заявленному способу. На Фиг. 2, Фиг. 3 и Фиг. 4 изображены увеличенные в 200 раз фотоотпечатки парафиновых срезов трепанобиоптата подвздошной кости, подлежащих такому анализу с целью диагностирования поражения ткани миелофиброзом. На представленных фигурах цифрами обозначено следующее:
1. Источник света.
2. Фотоотпечаток препарат среза трепанобиоптата.
3. Рамка фотоотпечатка.
4. Направление света, прошедшего через фото препарата.
5. Матрица датчиков определения цвета.
6. Соединительные разъемы.
7. Цифровой сигнальный процессор.
8. Индикатор.
9. Зоны черного окраса.
10. Зоны розового окраса.
11. Зона ярко-розового окраса.
12. Зона бледно-розового окраса.
13. Зона синего окраса.
В представленном примере величину площадей искомых зон в парафиновых срезах трепанобиоптата определяют следующим образом. Полученные стандартным образом три парафиновые среза трепанобиоптата, например, подвздошной кости, толщиной 4 мкм, последовательно обрабатывают так: первый импрегнируют серебром по методу Гомори, второй окрашивают по методу ван Гизона и третий окрашивают гематоксилином и эозином. Полученные таким образом обзорные изображения фотографируют, тем самым фиксируя полученные окрашенные в различные цвета зоны.
С помощью источника света 1, например в виде матрицы светодиодов, поток белого света направляют на фотоотпечаток препарат среза трепанобиоптата 2, установленный в рамке 3. Далее, проходя через фотоотпечаток препарат среза трепанобиоптата 2, поток света окрашивается в цвета, соответствующие цветам выбранного для анализа фотоотпечатка препарата среза трепанобиоптата 2 по направлению 4, и попадает на RGB матрицу электронных датчиков определения цвета 5 (например, цифровых). На выходе матрицы электронных датчиков определения цвета 5 образуется электрическое напряжение (Ur, Ug, Ub), пропорциональное потокам света соответствующих цветов. С помощью соединительных разъемов 6 выходы матрицы электронных датчиков определения цвета 5 соединяют, в частности, с цифровым сигнальным процессором, с помощью которого определяются площади окрашенных зон анализируемого фотоотпечатка препарата среза трепанобиоптата, на основе пропорциональности от выходных напряжений соответствующих цветов (UR, UG, UB), результаты определения искомых площадей считывают с индикатора 8, например, в виде монитора.
Все три анализируемые среза отделены от исследуемого образца подвздошной кости подряд один за другим, а учитывая, что толщина среза не превышает нескольких единиц микрон, они могут быть признаны практически идентичными препаратами. Первый препарат парафинового среза трепанобиоптата (Фиг. 2) импрегнируют серебром, при этом в черный цвет окрашивается ретикулиновая ткань (зона черного окраса 9). Второй препарат парафинового среза трепанобиоптата (Фиг. 3) окрашивают по методу ван Гизона, при этом коллагеновая ткань окрашивается в розовый цвет (зона розового окраса 10). Третий препарат парафинового среза трепанобиоптата (Фиг. 4) обрабатывают гематоксилином и эозином, при этом гемопоэтическая ткань окрашивается в бледно-розовый (цитоплазма) (зона бледно-розового окраса 12) и в синий (клеточные ядра) (зона синего окраса 13). Костная ткань в препаратах, окрашенных по ван Гизону и гематоксилином-эозином, имеет ярко-розовый оттенок (зона ярко-розовой ткани 11), площадь фиброзной ткани определяется суммой площадей зон черного окраса 9 и зон розового окраса 10. Площадь гемопоэтической ткани определяется суммой площадей зон синего 12 и бледно-розового 13 окрасов.
Далее, для получения окончательного искомого диагноза поражения исследуемого образца миелофиброзом вычисляют коэффициент относительной площади (в процентах) по представленной в заявляемом изобретении формуле. Пусть в предложенном примере Коп, рассчитанный для срезов трепанобиоптата, в которых отмечался только ретикулиновый миелофиброз, равен 37%, тогда по приведенным выше нормативам этот показатель является значимым для угнетения эритроидного ростка. В срезах трепанобиоптатов только с коллагеновым миелофиброзом значимым для угнетения эритроидного ростка является Коп, например, 23%. В срезах как с ретикулиновым, так и с коллагеновым миелофиброзом значимым для угнетения центрального звена эритрона является, например, Коп 15%. Таким образом, при получении Коп ≥14,5% во всяком случае со всей очевидностью диагностируется миелофиброз, хотя бы и без однозначного разделения его на группы.
Высокая точность заявляемого метода обеспечивается применением автоматизированной оценки малых величин отклонения величин площадей фиброзной и гемопоэтической тканей, а оперативность улучшается вследствие применения автоматизированного (компьютерного) способа определения соотношения указанных площадей.
Таким образом, заявленный способ, основанный на автоматизированном морфометрическом исследовании, позволяет при неходжкинских лимфомах, хроническом лимфолейкозе, множественной миеломе и других заболеваниях осуществлять точную и оперативную диагностику миелофиброза.
Заявляемый способ является вполне промышленно применимым, так как он не требует какого-либо специфического сложного технического оборудования, кроме стандартного набора медицинской и компьютерной техники, что позволяет с успехом широко внедрять его в клиниках, исследовательских и учебных учреждениях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛИЗОСОМНЫХ КАТИОННЫХ БЕЛКОВ В ГРАНУЛОЦИТАХ ТКАНЕЙ | 1999 |
|
RU2168938C2 |
| Способ определения синтетической активности полихроматофильных эритробластов и эритроцитов птиц | 2023 |
|
RU2799424C1 |
| СПОСОБ ДИАГНОСТИКИ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ | 2010 |
|
RU2456596C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГРАНУЛЕЗЫ В ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТАХ СКЛЕРОКИСТОЗНЫХ ЯИЧНИКОВ ЖЕНЩИН | 1991 |
|
RU2031407C1 |
| СПОСОБ ПОСТНАТАЛЬНОЙ ДИАГНОСТИКИ ФЕТАЛЬНОГО АЛКОГОЛЬНОГО СИНДРОМА У УМЕРШИХ ДЕТЕЙ РАННЕГО ВОЗРАСТА | 2013 |
|
RU2547568C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ХРОНИЧЕСКОГО ПЫЛЕВОГО БРОНХИТА | 2014 |
|
RU2572724C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ СТЕНОЗА ВЕЗИКОУРЕТРАЛЬНОГО АНАСТОМОЗА ПОСЛЕ РАДИКАЛЬНОЙ ПРОСТАТЭКТОМИИ | 2016 |
|
RU2631606C1 |
| СПОСОБ ПАТОМОРФОЛОГИЧЕСКОЙ ДИАГНОСТИКИ БИФУРКАЦИОННОЙ НЕДОСТАТОЧНОСТИ СОСУДОВ АРТЕРИАЛЬНОГО КРУГА БОЛЬШОГО МОЗГА | 2014 |
|
RU2575588C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОТНОСИТЕЛЬНОЙ ПЛОЩАДИ ВОЛОКОН КОЛЛАГЕНА В ГИСТОЛОГИЧЕСКОМ ПРЕПАРАТЕ | 2006 |
|
RU2332665C1 |
| СПОСОБ ВЫЯВЛЕНИЯ НАЛИЧИЯ СИСТЕМНОЙ РЕАКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ, ОБУСЛОВЛЕННОЙ РАЗВИТИЕМ СИНДРОМА СОЧЕТАННЫХ ДИСТРОФИЧЕСКИ-ДЕГЕНЕРАТИВНЫХ ИЗМЕНЕНИЙ МЕЗЕНХИМАЛЬНЫХ ПРОИЗВОДНЫХ ПРИ ЛОКАЛЬНОМ ХРОНИЧЕСКОМ ВОСПАЛИТЕЛЬНОМ ПРОЦЕССЕ | 2012 |
|
RU2493777C1 |
Изобретение относится к медицине, а именно к способу автоматизированной морфометрической диагностики миелофиброза. Сущность способа состоит в том, что выполняют обзорные изображения биологической ткани с выделением на таких изображениях зон с различными оптическими свойствами c определяемыми фиброзными и гемопоэтическими свойствами биологической ткани. Рассчитывают отношения площадей этих зон как минимум трех парафиновых срезов трепанобиоптантов. Вычисляют коэффициент (Коп) как отношение площади фиброзной ткани к площади гемопоэтической ткани по формуле. При значении Коп≥14,5% диагностируют миелофиброз. Использование заявленного способа позволяет повысить точность и улучшить оперативность диагностики миелофиброза. 6 з.п. ф-лы, 1 табл., 4 ил., 1 пр.
1. Способ автоматизированной морфометрической диагностики миелофиброза, включающий выполнение обзорных изображений биологической ткани, выделение на таких изображениях зон с различными оптическими свойствами, определяемыми фиброзными и гемопоэтическими свойствами биологической ткани, и выполнение расчета отношения площадей этих зон, отличающийся тем, что обзорные изображения выполняют путем формирования как минимум трех парафиновых срезов трепанобиоптатов, полученные срезы обрабатывают следующим образом: первый импрегнируют серебром по методу Гомори, второй окрашивают по методу ван Гизона и третий окрашивают гематоксилином и эозином, полученные таким образом обзорные изображения подвергают фиксации и анализу так, что в результате этого анализа получают величину площади зон, окрашенных в черный и розовый цвета, соответствующих фиброзной ткани, и величину площади зон, окрашенных в синий и бледно-розовый цвета, соответствующих гемопоэтической ткани; затем вычисляют коэффициент относительной площади как отношение площади фиброзной ткани к площади гемопоэтической ткани по формуле:
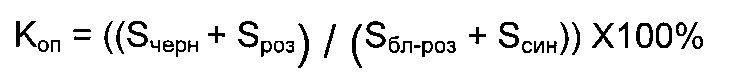
где:
Коп - коэффициент относительной площади (в процентах);
Sчepн - площадь зоны ткани, окрашенной в черный цвет;
Sроз - площадь зоны ткани, окрашенной в розовый цвет;
Sбл-роз - площадь зоны ткани, окрашенной в бледно-розовый цвет;
Sсин - площадь зоны ткани, окрашенной в синий цвет,
причем при значении Коп≥14,5% диагностируют миелофиброз.
2. Способ автоматизированной морфометрической диагностики миелофиброза по п. 1, отличающийся тем, что парафиновые срезы трепанобиоптатов формируют толщиной 4 мкм.
3. Способ автоматизированной морфометрической диагностики миелофиброза по п. 1, отличающийся тем, что фиксация обзорных изображений парафиновых срезов осуществляется с помощью цветной фотовидеокамеры.
4. Способ автоматизированной морфометрической диагностики миелофиброза по п. 1, отличающийся тем, что величину площади зон, окрашенных в черный и розовый цвета, соответствующих фиброзной ткани, и величину площади зон, окрашенных в синий и бледно-розовый цвета, соответствующих гемопоэтической ткани, получают с помощью источника света и соответствующих RGB датчиков определения цвета, так что площадь окрашенных зон соответствует электрическому напряжению на выходе цветовых датчиков.
5. Способ автоматизированной морфометрической диагностики миелофиброза по п. 4, отличающийся тем, что площадь окрашенных зон получают с помощью установленного в цепи после RGB датчиков цифрового сигнального процессора.
6. Способ автоматизированной морфометрической диагностики миелофиброза по п. 4, отличающийся тем, что анализ для получения величин площадей окрашенных зон производят с помощью компьютеризированного микроскопа.
7. Способ автоматизированной морфометрической диагностики миелофиброза по п. 4, отличающийся тем, что в качестве источника света используют RGB светодиодный источник света.
| ДОМНИКОВА Н.П | |||
| и др | |||
| Морфологическое исследование трепанобиоптатов при неходжкинских лимфомах // Сибирский онкологический журнал | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ДОМНИКОВА Н.П | |||
| и др | |||
| Структурный анализ трепанобиоптатов при агрессивных и индолентных неходжкинских лимфомах // Фундаментальные исследования, 9, 2011, с.57-61 | |||
| Tutorial to get started with the | |||
Авторы
Даты
2015-06-10—Публикация
2013-11-01—Подача