[001] Изобретение относится к способу получения оптически чистого пропан-1,2-диола из лактидов.
[002] В промышленном масштабе пропан-1,2-диол получают гидролизом пропиленоксида или из глицерина. Преимущественно он используется в косметической продукции, такой как косметические кремы и зубная паста. Он улучшает абсорбцию различных активных ингредиентов и проявляет антимикробное действие. Кроме того, он представляет собой разрешенную в ЕС пищевую добавку. Также его применяют в качестве носителя и раствора-носителя для красителей, антиоксидантов и эмульгаторов.
[003] В данном случае лактиды представляют собой циклические сложные диэфиры молочной кислоты. Например, при полимеризации молочной кислоты можно получить различные типы лактидов. Такими могут быть чистый L,L-лактид или чистый D,D-лактид. Проблема рацемизации возникает как результат преобладания высоких температур, необходимых для быстрого прохождения реакции, и из-за катионных загрязнителей в молочной кислоте или реакционных емкостях (например, обусловленных коррозией), при этом мезо-лактид образуется в качестве побочного продукта. Подобно L,L-лактиду, мезо-лактид представляет собой циклический сложный диэфир с двумя оптически активными атомами углерода в кольце. Он имеет оптический R- и S-центры и, следовательно, является оптически неактивным. Мезо-лактиды оказывают негативное влияние на полимеризацию, связанную с молочной кислотой, и должны подлежать отделению. Соответственно, их получают в качестве побочного продукта полимеризации молочной кислоты.
[004] Кроме того, существуют rac-лактиды, которые получают из одинаковых количеств D,D-лактида и L,L-лактида, например, с помощью плавления. Отдельные лактиды можно дифференцировать по их температурам плавления. L,L-лактид и D-D-лактид имеют температуру плавления 97°C, в то время как мезо-лактид имеет температуру плавления 54°C, а L,L/D,D-лактид имеет температуру плавления 129°C.
[005] Известно гидрирование сложных алкиловых эфиров молочной кислоты с образованием пропан-1,2-диола. Данное преобразование возможно как с применением гетерогенных катализаторов, так и гомогенных катализаторов.
[006] К примеру, было описано гидрирование сложного этилового эфира молочной кислоты в этаноле с применением катализатора на основе оксида меди и оксида хрома при 125°C и давлении H2 345 бар (Н. Adkins et al, J. Am. Chem. Soc. 1948, 70, 3121-3125). Также успешным было применение катализатора на основе оксида меди и оксида бария катализатора при 250°C и давлении водорода 300 бар (K. Folkers et al, J. Am. Chem. Soc. 1932, 54, 1145-1154). Совсем недавно в WO 2011036189 A1 и WO 2009103682 A1 было описано гидрирование сложных эфиров молочной кислоты с применением силикатов меди в газовой фазе. В WO 2005023737 А1 также предлагали медь на подложке из оксида алюминия для восстановления сложных метиловых эфиров молочной кислоты.
[007] Кроме того, был изучен ряд гетерогенных рутениевых катализаторов. Например, Ru-B, нанесенный на оксид титана, представляющий собой активный катализатор для гидрирования сложного этилового эфира молочной кислоты в воде в качестве раствора при 90°C и 40 бар H2 (G.-Y. Fan et al, Chem. Lett. 2008, 37, 852-853). Катализатор получали путем восстановления RuCl3 с применением NaBH4. RuB на модифицированном оловом молекулярном сите SBA-15 (G. Luo et al, Appl. Catal., A: General 2007, 332, 79-88) и Ru-B на y-оксиде алюминия (G. Luo et al, J. Mol. Catal. A: Chemical 2005, 230, 69-77 und G. Luo et al, Appl. Catal., A: General 2004, 275, 95-102) также приводил в среднем к хорошим выходам при восстановлении сложных этиловых эфиров молочной кислоты. К сожалению, Ru-B катализаторы не являются хемоселективными. Катализатор Нишимуры (Rh/Pt-оксид) доказал свою эффективность при гидрировании сложных этиловых эфиров молочной кислоты при 25°C и давлении водорода 100 бар в МеОН (М. Studer et al, Adv. Synth. Catal. 2001, 343, 802-808). Гомогенные рутениевые катализаторы с модифицированными P,N-лигандами (EP 2161251 А1; W. Kuriyama et al, Adv. Synth. Catal. 2010, 352, 92-96) или P,P-лигандами (ЕР 1970360 A1) с большим успехом применяли при гидрировании сложных эфиров молочной кислоты, при этом реакции проходили при температурах 80-90°C и давлениях H2 30-50 бар.
[008] Лишь недавно достигли успеха в восстановлении лактида до пропандиол-d2 с применением литий-алюминий дейтерида в рамках механистических исследований (R.М. Painter et al, Angew. Chem. Int. Ed. 2010, 49, 9456-9459).
[009] В WO 2006/124899 описывают каталитическое гидрирование лактида в пропиленгликоль. В данном случае гидрирование осуществляют либо в газовой фазе, либо в жидкой фазе в присутствии, например, алифатических спиртов. При этом за основу берут условия реакции от 20°C до 250°C и от 1,4 до 275 бар, а время реакции составляет от 1 до 10 ч. При данной реакции не важно, является ли исходный продукт одним из энантиомеров или их смесью. Однако можно предположить, что рацемизация происходит во время реакции и, следовательно, пропиленгликоль не получают в оптически чистой форме.
[0010] Это является невыгодным для многих применений, так как, несмотря на то, что оба энантиомера характеризуются одинаковыми физическими свойствами, в химических реакциях, в которые вовлечен другой энантночистый реакционный партнер, они оба по-разному вступают в реакцию. В равной степени при применении в сфере фармакологии и при применении в сферах агрохимии ароматов и вкусовых добавок энантиомерные вещества являются причиной различных эффектов при взаимодействии друг с другом.
[0011] Для получения энантиомера в его оптически чистой форме известно динамическое кинетические разделение рацематов (DKR). Для достижения рацемического разделения спиртов требуются весьма малые количества Ru-катализатора (до 0,05 мол.%) (K. Bogar et al, Beilstein J. Org. Chem 2007, 3 (50)), что представляет собой кинетическое разделение рацематов с рацемизацией субстрата in situ. Разделение рацематов происходит ферментативно с помощью биокатализа, а также рацемизация достигается с помощью металлических катализаторов, а также с помощью органокатализаторов, оснований, нагревания, применения ферментов, кислот Льюиса, окислительно-восстановительных и радикальных реакций. Однако применение способа для получения пропан-1,2-диола в оптически чистой форме из лактидов неизвестно.
[0012] С этой целью было бы предпочтительным предложение способа, обеспечивающего образование пропан-1,2-диола в оптически чистой форме. Более того, данный способ должен начинаться с лактида, в частности мезо-лактида, получаемого в виде побочного продукта при полимеризации молочной кислоты, и, следовательно, его можно применять для других применений. Тем не менее, другие формы лактидов, упомянутые выше, также могут быть превращены преимущественно в оптически чистый пропан-1,2-диол.
[0013] Следовательно, целью изобретения является предложение способа, который обеспечивает возможность получения оптически чистого пропан-1,2-диола из лактидов в диапазоне ≥ 99% е.е.
[0014] В изобретении достигают данной цели с помощью способа получения оптически чистого пропан-1,2-диола, включающего следующие этапы способа:
a. гидрирование лактидов посредством металл-катализируемого гетерогенного катализа, который проводят в присутствии водорода, с получением неочищеного продукта, содержащего пропан-1,2-диол, и
b. динамическое кинетическое разделение рацематов, при котором получают оптически чистый пропан-1,2-диола в диапазоне ≥ 99% е.е.
[0015] В данном способе следующая реакция осуществляется на этапе a):
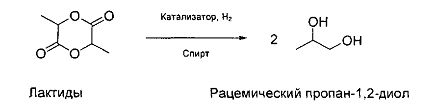
[0016] Спирт выполняет функции как растворителя, так и вещества, вступающего в реакцию, при этом концентрация лактида в спирте не является критичной для получаемого выхода. Присутствие спирта в избытке является предпочтительным.
[0017] Система, применяемая для динамического кинетического разделения рацематов, содержит катализатор, который регулирует ранее установившееся равновесие при рацемизации, и фермент, который выделяет один из энантиомеров из равновесия при рацемизации с помощью этерификации.
[0018] Выражение "оптически чистый" в контексте данной заявки означает энантночистый пропан-1,2-диол. Это значит, что получение оптически чистого пропан-1,2-диола с >99% е.е., как предложено в независимом пункте формулы изобретения, может быть приравнено к 99% энантночистоте. Не имеет значение, получают (R)-энантиомер или (S)-энантиомер.
[0019] В одном варианте осуществления способа в соответствии с изобретением применяют лактиды, выбранные из группы, состоящей из D,D-лактида, L,L-лактида, мезо-лактида и L,L/D,D-лактида. Лактиды представляют собой циклические сложные эфиры молочной кислоты, которые могут встречаться в форме энантиомеров, т.е. в D- или L-форме. L,L-лактид представляет собой сложный эфир, содержащий две L-молочные кислоты, а также упоминается в специальной литературе как S,S-лактид. То же самое относится к D,D-лактиду, который также называют R,R-лактид. Под L,L/D,D- лактидом следует понимать рацемат (в специальной литературе также упоминается как rac-лактид или R,S-лактид), содержащий эквимолярную смесь D,D-лактида и L,L-лактида. В противоположность этому мезо-лактид представляет собой лактид, содержащий D- и L-молочную кислоту. В силу вышесказанного в п. 2 демонстрируют, что все возможные лактиды могут быть подвергнуты способу в соответствии с изобретением. В том числе олиголактиды с различными композициями энантиомеров молочной кислоты и предпочтительно дилактиды.
[0020] Осуществление катализируемого металл-катализируемого гетерогенного катализа в жидкой фазе на этапе a) является предпочтительным. При этом предпочтение отдают жидкой фазе, выбранной из группы растворителей, включающей воду, алифатические или ароматические углеводороды с длиной цепи до 10 С-атомов и их смеси, где алифатические углеводороды предпочтительно представляют собой спирты, при этом особенно предпочтительным является применение метанола и/или этанола.
[0021] В предпочтительном варианте осуществления способа в соответствии с изобретением гетерогенный катализ на этапе a) осуществляют с помощью катализатора из группы металлов, где металл выбирают из группы, включающей рутений, родий, рений, палладий, платину, никель, кобальт, молибден, вольфрам, титан, цирконий, ниобий, ванадий, хром, марганец, осмий, иридий, железо, медь, цинк, серебро, золото, барий и их смеси, при этом предпочтительными являются медь-хромитовые катализаторы и/или медь-хромитовые катализаторы с добавлением бария.
[0022] В дополнительных вариантах осуществления данного способа гетерогенный катализ на этапе a) осуществляют при давлении водорода, составляющем менее 20-300 бар, предпочтительно при давлении водорода, составляющем менее 130-170 бар, и особенно предпочтительно при давлении водорода, составляющем менее 140-160 бар.
[0023] Гетерогенный катализ на этапе a) осуществляют предпочтительно в пределах температурного диапазона от 20°C до 250°C, предпочтительно в пределах температурного диапазона от 130°C до 170°C и особенно предпочтительно в пределах температурного диапазона от 145°C до 155°C.
[0024] Необязательно перед проведением гетерогенного катализа, осуществляемом на этапе a), резервуар высокого давления промывают водородом от 1 до 5 раз, предпочтительно 3 раза.
[0025] В дополнительном варианте данного способа гетерогенный катализ осуществляют на этапе а) в течение от 5 до 20 ч, предпочтительно в течение от 10 до 18 ч, особенно предпочтительно в течение от 12 до 16 ч.
[0026] Предпочтительным в ходе гетерогенного катализа на этапе a) является перемешивание. Также предпочтительным в ходе гетерогенного катализа на этапе a) является непрерывное нагнетание водорода.
[0027] В предпочтительных вариантах осуществления данного способа катализатор отделяют от неочищенного продукта после того, как гетерогенный катализ на этапе a) был завершен.
[0028] В дополнительном варианте осуществления данного способа неочищенный продукт, полученный на этапе a), подвергают этапу концентрирования и/или этапу перегонки, на которых получают фракцию, содержащую пропан-1,2-диол, и фракцию, содержащую растворитель.
[0029] Предпочтительным является то, что растворитель, применяемый для гетерогенного катализа на этапе a), повторно используют согласно способу.
[0030] В дополнительных вариантах осуществления способа пропан-1,2-диол, получаемый на этапе a), снабжают защитной группой и получают 1-O-замещенный пропандиол. Преимущественно защитную группу, способную к рециклизации ахиральную защитную группу, выбирают из группы, включающей трет-бутил, фенил, метил, ацетил, бензоил, тритил, силил и бензил. Это значит, что могут применяться пивалаты, п-метоксибензил, триметилсилил, триэтилсилил, триизопропилсилил, дифенилметилсилил или ди-трет-бутилметилсилил. В принципе, может применяться любая ахиральная защитная группа (T.W. Green et al, Protective Groups in Organic Synthesis, Wiley-lnterscience, New York, 1999). Особое предпочтение отдают трет-бутильной защитной группе для первичной гидроксильной группы пропан-1,2-диола из этапа a).
[0031] В дополнительном варианте осуществления ферментативное разделение рацематов применяют для динамического кинетического разделения рацематов в присутствии металлических катализаторов на этапе b). Предпочтительным является применение липаз. Рутениевые катализаторы являются предпочтительными металлическими катализаторами. Особое предпочтение отдается рутениевым катализаторам с иммобилизированными липазами.
[0032] Динамическое кинетическое разделение рацематов на этапе b) предпочтительно осуществляют в пределах температурного диапазона от 60°C до 90°C. При этом время реакции составляет от 30 до 200 ч, предпочтительно от 40 до 60 ч.
[0033] В дополнительном варианте осуществления динамическое кинетическое разделение рацематов на этапе b) осуществляют в присутствии Na2CO3, при этом Na2CO3 добавляют в количестве от 0,4 ммоль до 5 ммоль на 33 мг фермента, что соответствует 330 единицам. Na2CO3 практически нерастворим в реакционной среде и служит в качестве гетерогенной добавки. Наиболее предпочтительным для этого ферментом является Novozym 435.
[0034] Ниже изобретение более подробно описывают с применением нескольких примеров вариантов осуществления.
[0035] Пример 1: гидрирование rac-лактида с применением Cu/Cr-катализатора
L,L/D,D-лактид (1,00 г, 6,9 ммоль) и хромит меди (1,33 г, 133 вес.%) суспендировали в 5 мл абс. МеОН в 10 мл автоклаве. Автоклав промывали три раза с помощью H2. Далее применяли водород при давлении, составляющем 150 бар. Реакционную смесь перемешивали в течение 15 ч при 150°C. Водород непрерывно нагнетали, поддерживая давление от 148 до 153 бар. После охлаждения и продувки воздухом автоклава реакционную смесь разбавляли с применением 5 мл МеОН и отделяли центрифугированием катализатор (75 мин, 4500 об/мин). Сине-зеленый реакционный раствор декантировали, остаток промывали 3 мл МеОН и концентрировали в вакууме при 40°C и 40 мбар. Неочищеный продукт (2,06 г) имел темно-голубую окраску и содержал пропан-1,2-диол с примесью приблизительно 5% МеОН (13C-ЯМР спектр). Чистый продукт (0,68 г, 68%) получали в виде бесцветной жидкости после перегонки при 101-102°C и 8 мбар. После перегонки количество неорганического остатка составляло приблизительно 30 мг.
[0036] Пример 2: гидрирование rac-лактида с применением Cu/Cr/Ba-катализатора
L,L/D,D-лактид (1,00 г, 6,9 ммоль) и хромит меди (1,33 г, 133 вес.%), легированный барием, суспендировали в 5 мл абс. МеОН или EtOH в 10 мл автоклаве. Автоклав промывали три раза с применением H2. Далее применяли водород при давлении 150 бар. Реакционную смесь перемешивали в течение 12 ч при 150°C. Водород непрерывно нагнетали, поддерживая давление от 148 до 153 бар. После охлаждения и продувки воздухом автоклава реакционную смесь разбавляли 5 мл МеОН и отделяли центрифугированием катализатор (15 мин, 4500 об/мин). Реакционный раствор концентрировали в вакууме при 40°C и 40 мбар. Неочищеный продукт имел светло-голубую окраску и содержал пропан-1,2-диол еще с примесью 5% МеОН. Это определили посредством 13C-ЯМР спектра (не показан). Чистый продукт (0,8 г, 82%) получали в виде бесцветной жидкости путем перегонки при 101-102°C и 8 мбар. В случае с EtOH реакция проходила значительно медленнее, чем с МеОН.
[0037] Преимущество Cu/Cr/Ba-катализатора заключается в том, что реакция проходит быстрее по сравнению с Cu/Cr-катализатором. Это определяли с помощью кривых скорости поглощения водорода, которые регистрировали во время эксперимента. Из этого следует, что гидрирование проходит приблизительно на 20% быстрее с Cu/Cr/Ba-катализатором. Кроме того, при применении Cu/Cr/Ba-катализатора практически ни один катализатор не растворяется в реакционном растворе; это означает, что реакция полностью гетерогенна. Для сравнения, после эксперимента с гидрированием в реакционном растворе содержалось до 30 мг от общего количества 1,3 г Cu/Cr-катализатора.
[0038] Пример 3: гидрирование других форм лактида с применением Cu/Cr/Ba-катализатора
Данный способ соответствует описанному в примере 2 в присутствии 5 мл МеОН при 150 бар H2 и с применением Cu/Cr/Ba-катализатора. Точные условия реакции показаны в табл. 1.
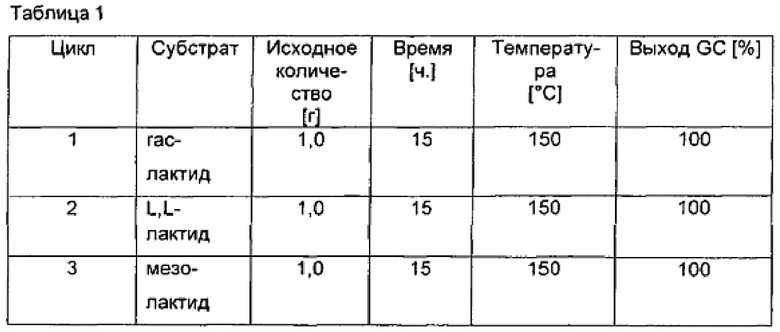
В табл. 1 показано, что все формы лактида, в том числе мезо-лактид, которые получают в качестве побочного продукта при полимеризации молочной кислоты, могут быть превращены на 100%. Это означает, что способ в соответствии с изобретением является подходящим для превращения мезо-лактида в пропан-1,2-диол. Мезо-лактид, который все еще был загрязнен остатками молочной кислоты, не мог быть превращен в пропан-1,2-диол. По этой причине для гидрирования необходимо применять лактиды в чистой или очищенной формах.
[0039] Пример 4: оценка степени рацемизации пропан-1,2-диола, полученного путем гидрирования
Для получения производных пропан-1,2-диола, полученного с помощью способа гидрирования, добавляли 0,28 г (3,7 ммоль) пропан-1,2-диола к 1,2 мл фенилизоцианата (11 ммоль). Реакционную смесь нагревали в течение 30 мин при 100°C и затем охлаждали до комнатной температуры. Добавляли простой диэтиловый эфир (5 мл). Полученные белые кристаллы фильтровали и промывали 50 мл гексана. Полученный продукт применяли для анализа энантиомеров, которые разделяли на колонке CHIRALCEL®OD-H посредством хиральной ВЭЖХ в гептане/EtOH 80:20.
Результаты, полученные при применении L,L-лактида, который получали согласно указаниям в примере 2, показаны в табл. 2.
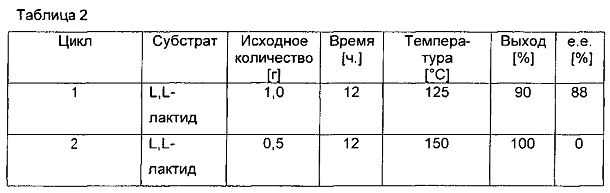
В табл. 2 показана энантиомерная чистота пропандиола, полученного в результате способа гидрирования, в зависимости от температуры. При температуре 150°C получали только рацемическую смесь. При 125°C значение е.е. составляло 88%. Таким образом, при гидрировании лактида получали рацемическую смесь пропан-1,2-диола. При любом дальнейшем понижении температуры существует риск остановки реакции гидрирования.
[0040] Пример 5: динамическое кинетическое разделение рацематов для получения оптически чистого пропан-1,2-диола
В качестве примера трет-бутил вводили в качестве защитной группы и из рацемической смеси пропан-1,2-диола, полученного посредством способа гидрирования, получали трет-бутилоксипропан-2-ол. Ферментативное рацемическое разделение происходило в соответствии со следующей схемой.
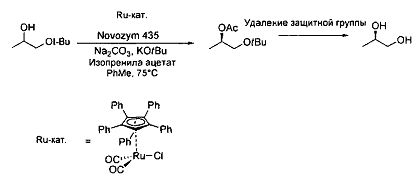
Реакцию проводили в 7,5 мл толуола при 75°C. Смешивали 20 ммоль изопренила ацетата, 19,8 ммоль 1-трет-бутоксипропанола-2, 0,02 ммоль (Ph5Cp)Ru(CO)2Cl, 0,04 ммоль т-BuOK, 50 мг Na2CO3. Результаты показаны в табл. 3:
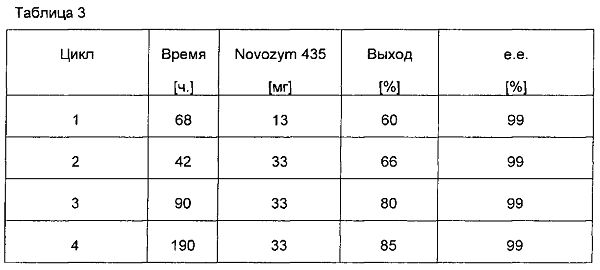
В табл. 3 показано, что всего 13 мг Novozym 435 (цикл 1) достаточно для получения превосходной стереоселективности > 99% е.е. Тем не менее, выход подлежал дальнейшему увеличению, поэтому применяли 2,5-кратное количество фермента (циклы 2-4). Наблюдали, что, несмотря на то, что рутений-катализируемая эпимеризация замедлялась, при больших количествах фермента, выход повышался.
[0041] Пример 6: динамическое кинетическое разделение рацематов для получения оптически чистого пропан-1,2-диола с дополнительным улучшением выхода
Реакцию проводили в 20 мл толуола при 75°C. Смешивали 20 ммоль изопропенила ацетата, 19,8 ммоль 1-трет-бутоксипропанола-2, 0,06 ммоль (Ph5Cp)Ru(CO)2Cl, Novozym 435 33 мг, 0,1 ммоль т-BuOK. Концентрацию Na2CO3 варьировали для исследования влияния Na2CO3 на выход реакции. Результаты показаны в табл/ 4:
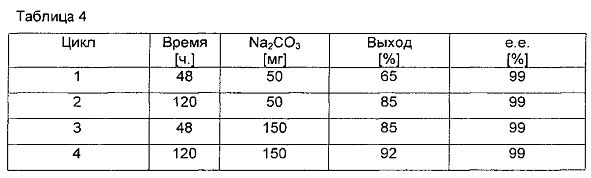
В табл. 4 показано, что реакция в значительной мере проходит быстрее в присутствии больших количеств основания Na2CO3. Таким образом, выход в 65% может быть достигнут через 48 ч в присутствии 50 мг (цикл 1), в то время как с 150 мг Na2CO3 и такими же количествами катализатора и фермента может быть достигнут выход в 85% (цикл 4).
[0042] Пример 7: динамическое кинетическое разделение рацематов 1-трет-бутоксипропанола-2, определяемое в граммах
Хлордикарбонил(1,2,3,4,5-пентафенилциклопентадиенил)рутения (40 мг, 0,06 ммоль), иммобилизированный CALB от Aldrich (33 мг) и Na2CO3 (0,15 г, 1,4 ммоль) добавляли в 50 мл сосуд Шленка с магнитной мешалкой. Из сосуда откачивали воздух и заполняли аргоном. В атмосферу аргона добавляли толуол (20 мл). Реакционную смесь перемешивали при комнатной температуре до растворения комплексного соединения рутения. Затем добавляли раствор mBuOK в THF (1 М) (0,1 мл, 0,1 ммоль) и реакционную смесь перемешивали в течение дополнительных 6 мин. 1-трет-бутоксипропанол-2 (2,62 г, 3 мл, 19,8 моль) добавляли к полученной смеси и реакционную смесь перемешивали в течение дополнительных 4 мин. Затем при комнатной температуре добавляли изопренила ацетат (2,00 г, 20 моль) и реакционную смесь нагревали до 75°C. Через 120 ч отбирали образец и анализировали с помощью GC (НР-5, 50 m). Согласно данному анализу был достигнут выход в 93%. Затем реакционную смесь охлаждали, фильтровали через бумажный фильтр и концентрировали при пониженном давлении 20 мбар. Остаток перегоняли в вакууме (80°C, 5 мбар). 2,15 г (выход 63%, 99,5% е.е.) (R)-2-O-ацетил-1-O-трет-бутил-пропан-1,2-диола получали в виде бесцветной жидкости.
[0043] Преимущества, связанные со способом в соответствии с изобретением:
- получение из лактидов (также возможно получение из мезо-лактидов), образующихся в качестве побочного продукта при полимеризации молочной кислоты, пропан-1,2-диола с оптической чистотой > 99% е.е.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЭФИРОВ СО СВОБОДНЫМИ КИСЛОТНЫМИ ФУНКЦИЯМИ ВНУТРИ ЦЕПИ | 2002 |
|
RU2282638C2 |
| СПОСОБ ПОЛУЧЕНИЯ СМЕСИ ПРОИЗВОДНЫХ ЛАКТИДОВ | 2009 |
|
RU2541567C2 |
| ПОЛУЧЕНИЕ ЧАСТИЧНО ГИДРИРОВАННЫХ АНСА-МЕТАЛЛОЦЕНОВЫХ КОМПЛЕКСОВ | 2003 |
|
RU2333215C2 |
| ГИДРИРОВАНИЕ ИМИНОВ | 2009 |
|
RU2476422C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОСНОВЫ СИНТЕТИЧЕСКИХ МОТОРНЫХ МАСЕЛ | 2019 |
|
RU2731901C1 |
| ПРОСТРАНСТВЕННО-ЗАТРУДНЕННЫЕ АМИНЫ | 2011 |
|
RU2584333C2 |
| СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРА НА ОСНОВЕ ПЕРЕХОДНОГО МЕТАЛЛА И ФОСФИНА | 1996 |
|
RU2167712C2 |
| СПОСОБ НЕПРЕРЫВНОГО ПОЛУЧЕНИЯ СЛОЖНЫХ ПОЛИЭФИРОВ | 2009 |
|
RU2510990C2 |
| СПОСОБ ПОЛУЧЕНИЯ ε-КАПРОЛАКТОНА И 1,6-ГЕКСАНДИОЛА | 2011 |
|
RU2571082C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ АМИНОВ (ВАРИАНТЫ) И ОПТИЧЕСКИ АКТИВНЫЙ АМИД | 2000 |
|
RU2293724C9 |
Изобретение относится к способу оптически чистого пропан-1,2-диола, который используется в косметической продукции, в качестве пищевой добавки, а также в качестве носителя и раствора-носителя для красителей, антиоксидантов и эмульгаторов. Способ включает следующие этапы:
a. гидрирование лактидов, при котором в присутствии водорода осуществляют металл-катализируемый гетерогенный катализ с получением неочищенного продукта, содержащего пропан-1,2-диол, и
b. динамическое кинетическое разделение рацематов, при котором получают оптически чистый пропан-1,2-диол в диапазоне ≥ 99% е.е. 22 з.п. ф-лы, 4 табл., 7 пр.
1. Способ получения оптически чистого пропан-1,2-диола, включающий следующие этапы способа:
a. гидрирование лактидов, при котором в присутствии водорода осуществляют металл-катализируемый гетерогенный катализ с получением неочищенного продукта, содержащего пропан-1,2-диол, и
b. динамическое кинетическое разделение рацематов, при котором получают оптически чистый пропан-1,2-диол в диапазоне ≥ 99% е.е.
2. Способ по п. 1, отличающийся тем, что лактиды выбирают из группы, включающей D,D-лактид, L,L-лактид, мезо-лактид и L,L/D,D-лактид.
3. Способ по любому из пп. 1 или 2, отличающийся тем, что металл-катализируемый гетерогенный катализ на этапе a) осуществляют в жидкой фазе.
4. Способ по п. 3, отличающийся тем, что жидкую фазу выбирают из группы растворителей, включающей воду, алифатические или ароматические углеводороды с длиной цепи до 10 C-атомов и их смесей, причем алифатические углеводороды предпочтительно представляют собой спирты, при этом особенно предпочтительным является применение метанола и/или этанола.
5. Способ по п. 1, отличающийся тем, что гетерогенный катализ на этапе a) осуществляют с применением катализатора из группы металлов, где металл выбирают из группы, включающей рутений, родий, рений, палладий, платину, никель, кобальт, молибден, вольфрам, титан, цирконий, ниобий, ванадий, хром, марганец, осмий, иридий, железо, медь, цинк, серебро, золото, барий и их смеси, при этом предпочтительным является применение медь-хромитовых катализаторов и/или медь-хромитовых катализаторов с добавлением бария.
6. Способ по п. 1, отличающийся тем, что гетерогенный катализ на этапе a) осуществляют при давлении водорода менее 20-300 бар, предпочтительно при давлении водорода менее 130-170 бар и особенно предпочтительно при давлении водорода менее 140-160 бар.
7. Способ по п. 1, отличающийся тем, что гетерогенный катализ на этапе a) осуществляют в пределах температурного диапазона 20-250°C, предпочтительно в пределах температурного диапазона 130-170°C, особенно предпочтительно в пределах температурного диапазона 145-155°C.
8. Способ по п. 1, отличающийся тем, что перед гетерогенным катализом, осуществляемым на этапе a), резервуар высокого давления промывают водородом от 1 до 5 раз, предпочтительно 3 раза.
9. Способ по п. 1, отличающийся тем, что гетерогенный катализ осуществляют на этапе a) в течение от 5 до 20 ч, предпочтительно в течение от 10 до 18 ч, особенно предпочтительно в течение от 12 до 16 ч.
10. Способ по п. 1, отличающийся тем, что перемешивание осуществляют в ходе гетерогенного катализа на этапе a).
11. Способ по п. 1, отличающийся тем, что водород непрерывно нагнетают в ходе гетерогенного катализа на этапе a).
12. Способ по п. 1, отличающийся тем, что катализатор отделяют от неочищенного продукта после того, как гетерогенный катализ на этапе a) был завершен.
13. Способ по п. 1, отличающийся тем, что неочищенный продукт, полученный на этапе a), подвергают этапу концентрирования и/или этапу перегонки, при этом получают фракцию, содержащую пропан-1,2-диол, и фракцию, содержащую растворитель.
14. Способ по п. 1, отличающийся тем, что растворитель, применяемый для гетерогенного катализа на этапе а), повторно используют согласно способу.
15. Способ по п. 1, отличающийся тем, что пропан-1,2-диол, который получают на этапе a), снабжают защитной группой и получают 1-O-замещенный пропандиол.
16. Способ по п. 15, отличающийся тем, что защитной группой является способная к рециклизации ахиральная защитная группа, которую выбирают из группы, включающей трет-бутил, фенил, метил, ацетил, бензоил, тритил, силил и бензил.
17. Способ по п. 1, отличающийся тем, что ферментативное разделение рацематов применяют для динамического кинетического разделения рацематов в присутствии металлического катализатора в ходе этапа b).
18. Способ по п. 17, отличающийся тем, что в ходе ферментативного расщепления рацематов применяют липазы.
19. Способ по любому из пп. 17 или 18, отличающийся тем, что рутениевые катализаторы применяют в качестве металлических катализаторов.
20. Способ по п. 17, отличающийся тем, что динамическое кинетическое разделение рацематов осуществляют с применением рутениевых катализаторов с иммобилизированными липазами.
21. Способ по по п. 1, отличающийся тем, что динамическое кинетическое разделение рацематов на этапе b) осуществляют в пределах температурного диапазона 60-90°C.
22. Способ по п. 1, отличающийся тем, что динамическое кинетическое разделение рацематов на этапе b) осуществляют в течение от 30 до 200 ч, предпочтительно в течение от 40 до 60 ч.
23. Способ по п. 1, отличающийся тем, что динамическое кинетическое разделение рацематов на этапе b) осуществляют в присутствии Na2CO3, при этом Na2CO3 добавляют в количествах от 0,4 ммоль до 5 ммоль на 33 мг фермента.
| WO 2006124899A2, 23.11.2006 | |||
| K.Bogar et al, Large-scale ruthenium- and enzyme-catalyzed dynamic kinetic resolution of (rac)-1-phenylethanol | |||
| Beilstein Journal of Organic Chemistry, 2007, 3, N 50 | |||
| WO 2003083126A2, 09.10.2003 | |||
| КОНДЕНСАТОР С ГАЗООБРАЗНЫМ ИЛИ ВАКУУМНЫМ ДИЭЛЕКТРИКОМ | 1999 |
|
RU2141142C1 |
| СПОСОБ СОВЛ\ЕСТНОГО ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЕйИ МЕТАНОЛА | 0 |
|
SU269925A1 |
Авторы
Даты
2015-06-10—Публикация
2012-06-22—Подача