Изобретение относится к медицине, в частности к офтальмологии, и нацелено на использование в научно-исследовательской практике офтальмологических, геронтологических, гистологических, биологических и фармакологических лабораторий доступного нетрудоемкого и высокоспецифичного способа экспериментального моделирования коркового вида катаракты in vivo, что значительно повысит эффективность проводимых исследований по изучению механизмов формирования и профилактике возрастной корковой катаракты у человека.
По данным Всемирной организации здравоохранения, среди причин слепоты на долю катаракты приходится 43%. Важно отметить крайне высокую заболеваемость (более 97%) среди лиц старше восьмидесяти лет.
Исследования по изучению катарактогенных факторов, биохимических и биофизических аспектов катарактогенеза отстают от темпов совершенствования техники хирургического лечения возрастной катаракты. Различия в распространенности катаракты среди населения разных регионов, в сроках и локализации помутнения, динамике прогрессирования, а также сохранение прозрачности хрусталика у определенной части людей преклонного возраста не позволяют однозначно связывать проблему лечения возрастной катаракты только с возможностями хирургии и подтверждает необходимость поисков способов консервативного лечения данного заболевания.
Не вызывает сомнения, что развитие возрастной катаракты происходит в результате изменений во всем организме. Подтверждением этому является отмеченная многими авторами связь между частотой развития определенного вида возрастной катаракты и общей соматической патологией, а также развитие возрастной катаракты во всех случаях наблюдения на обоих глазах.
Доказано, что у пациентов с возрастной корковой катарактой преобладает тонус симпатического отдела вегетативной нервной системы, которым и определяются специфические патогенетические особенности системных дистрофических изменений в тканях и органах пациентов данной группы (Корсакова Н.В. "Роль вегетативной нервной системы в формировании возрастной катаракты у человека" // Материалы научно-практической конференции, посвященной 75-летию профессора В.Н.Саперова. - Чебоксары, 2006. - С.35-37).
Вопрос о трофической функции нервной системы - важнейший вопрос в актуальной биологической проблеме о факторах поддержания стабильности тканевой дифференцировки и тканевого метаболизма живых организмов. Универсальный механизм патологии А.Д. Сперанский видел в нервно-дистрофических процессах, с которыми связаны самые начальные пусковые стадии болезненных процессов.
Принципиальные отличия нейромедиаторной обеспеченности процессов формирования возрастной корковой и ядерной катаракты (Корсакова Н.В., Сергеева В.Е. "Особенности биоаминного статуса хрусталика в условиях формирования разных видов возрастной катаракты у человека" // Офтальмохирургия. - М., 2007. - №3. - С.44-47) доказывают существование различных патогенетических механизмов, приводящих к формированию различных типов нейродистрофического помутнения в хрусталике человека.
Таким образом, вид возрастной катаракты отражает процесс патологического старения различных отделов вегетативной нервной системы пациента.
Однако высокие финансовые затраты на современные микрохирургические методы лечения катаракты приводят к существенному ограничению их применения. Например, в ряде развивающихся стран оперируются лишь 10% больных катарактой; по данным S.K.West, H.A.Quigley (1998), в Африке насчитывается более 3 млн слепых пациентов с катарактой, не имеющих финансовых возможностей ее хирургического лечения; в Индии оперативному лечению подвергаются только 50% нуждающихся в нем пациентов.
Очевидно, что медикаментозная профилактика и терапевтическое лечение ранних стадий катаракты как альтернатива хирургическим методам приобретает в настоящее время особую ценность. Подсчитано, что сдерживание развития катаракты консервативными методами на 10 лет способно уменьшить количество дорогостоящих операций на 50%, а несвоевременная поздняя диагностика возрастной катаракты во многих странах рассматривается сейчас как неправомерная нагрузка на государственный бюджет, как социально-экономическая проблема государственного значения.
Цель: разработка доступного, нетрудоемкого и высокоспецифичного способа экспериментального моделирования коркового вида катаракты in vivo.
Сущность предлагаемого способа заключается в проведении десимпатизации экспериментального животного.
Положительный эффект: патогенетически обоснованное моделирование патологического процесса in vivo, простота применения, снижение затрат рабочего времени на проведение эксперимента, значительное повышение эффективности исследований по изучению механизмов формирования и мер профилактики коркового вида возрастной катаракты человека.
Наиболее близким к предлагаемому способу является модель катарактогенеза позвоночных животных in vitro (Краснов М.С., Гурмизов Е.П., Гундорова Р.А., Ямскова В.П., Капитонов Ю.А. "Модель катарактогенеза позвоночных животных in vitro" // Офтальмология, 2005. - Том 2. - №2. - С.43-49), примененная указанными выше авторами при разработке и патентовании способа получения лекарственного средства (Ямсков И.А., Ямскова В.П., Наговицын А.В., Краснов М.С. "Способ получения лекарственного средства для лечения катаракты". Патент RU №2315607, МПК А61К 35/44, А61К 38/17, А61Р 27/02). Прототип заключается в следующем: в экспериментах были использованы хрусталики половозрелых позвоночных животных (лягушек, крыс и свежеэнуклеированных глаз крупного рогатого скота). Культивирование хрусталиков позвоночных животных проводили в питательной среде в течение 3-8 дней. Для индукции катарактогенеза был использован раствор пероксида водорода, концентрация которого варьировала в пределах от 0,1 до 100 мМ, и раствор хлорида кальция в диапазоне концентраций от 1,25 до 60 мМ. Индукторы катарактогенеза добавляли в питательную среду в начале культивирования. Степень помутнения хрусталиков определяли спектрофотометрически на приборе MR 700 (Dynatech, Германия), а также визуально, используя разлинованную подложку. В последнем случае полное помутнение хрусталика определяли по исчезновению линий подложки, находящейся под хрусталиком. При индукции катарактогенеза пероксидом водорода у амфибий наблюдали помутнение кортикальных слоев, а ядро оставалось интактным. При индукции катарактогенеза хлоридом кальция у амфибий наблюдали помутнение ядра хрусталика, кортикальные слои оставались прозрачными, в отдельных случаях наблюдали образование легкого налета в виде флера. Полученные результаты отражают зависимость локализации индуцируемой катаракты от природы изучаемых химических агентов у двух видов лягушек. При индукции катарактогенеза в хрусталиках быков как в случае с хлоридом кальция, так и в случае с пероксидом водорода возникало кортикальное помутнение средней степени на 3-4 сутки культивирования. При культивировании хрусталиков крыс с пероксидом водорода возникало помутнение ядра хрусталика и в большей мере кортикальных слоев, то есть развивалось тотальное помутнение. Хлорид кальция вызывал тотальное помутнение хрусталиков крыс на этих же сроках культивирования. Полученные данные указывают на различия в регуляции функционирования кальций-зависимых ферментных систем, а также в состоянии систем перекисного окисления липидов в мембранах клеток и волокон хрусталика у животных изученных видов.
Известная модель катарактогенеза позвоночных животных in vitro, упомянутая выше, не может получить широкое распространение в научно-исследовательской практике офтальмологических, геронтологических, гистологических, биологических и фармакологических лабораторий в связи с ее дороговизной (среды для культивирования, затраты электроэнергии на продолжительное культивирование), трудоемкостью (многоэтапность, многокомпонентность), большими затратами рабочего времени (свыше 8 дней) и вариабельностью в моделировании вида катаракты у разных экспериментальных животных (неспецифичность модели).
Следующие модели экспериментального катарактогенеза близки к предлагаемой модели вследствие изменения условий жизнедеятельности внутри живого организма (in vivo), однако в настоящее время они не поддержаны патентами РФ.
Одна из указанных моделей экспериментального катарактогенеза in vivo основана на применении фотоповреждающего эффекта ультрафиолетового облучения с длиной волны короче 480 нм по отношению к прозрачным преломляющим средам глаза (Линник Л.Ф., Островский М.А. и соавт."Искусственные хрусталики, поглощающие ультрафиолетовые лучи: безопасность, эффективность и перспектива использования в офтальмохирургии (обзор литературы)" // Офтальмохирургия. - М., 1991. - №4. - С.3-7). Особенно опасным для хрусталика является ультрафиолетовый свет с длиной волны 280-315 нм (диапазон В). Клинически доказано, что люди, подвергающиеся такому облучению, независимо от пола и расы чаще заболевают катарактой кортикального типа (Cruickshanks K.J. "Sunlight exposure and risk of lens opacities in an population-based study" // Arch. Ophthal. - 1998. - V.116. - N.12. - P.1666).
Другая модель экспериментального катарактогенеза in vivo основана на применении повышенных концентраций кальция, фтора и кремния в питьевой воде и продуктах питания экспериментальных животных (Сусликов В.Л., Андреев А.Н., Степанов Р.В. и соавт."К вопросу о роли биогеохимических факторов в патогенезе возрастной катаракты" // Офтальмологический журнал. - 1990. - №5. - С.296-299).
Следующая модель экспериментального образования катаракты in vivo, основанная на влиянии TGF-β (трансформирующего фактора роста-β), индуцирует возникновение эпителиально-мезенхимального перехода в клетках хрусталика (De Iongh RU., Wederell E., Lovicu FJ., McAvoy JW. "Transforming growth factor-beta-induced epithelial-mesenchymal transition in the lens: a model for cataract formation" // Cells. Tissues. Organs. - 2005. - V.179. - N.1-2. - P.43-55).
Эти методы, имея такое преимущество, как специфичность модели в отношении конкретного вида катаракты, не могут удовлетворить требования современной медицинской науки, так как являются достаточно трудоемкими, дорогостоящими и требуют значительных затрат рабочего времени.
Таким образом, на сегодняшний день отсутствуют способы максимально эффективного моделирования экспериментальной корковой катаракты in vivo с минимальными затратами.
Предлагаемый способ основан на выявленных принципиальных отличиях в нейротрофическом контроле процессов формирования возрастной корковой и ядерной катаракты (Корсакова Н.В., Сергеева В.Е. "Особенности биоаминного статуса хрусталика в условиях формирования разных видов возрастной катаракты у человека" // Офтальмохирургия. - М., 2007. - №3. - С.44-47; Паштаев Н.П., Корсакова Н.В., Поздеева Н.А., Сергеева В.Е. "Частота и характер общих соматических заболеваний, сопутствующих формированию разных видов возрастной катаракты у человека" // Офтальмохирургия. - М., 2011. - №1. - С.45-49), что свидетельствует о закономерных проявлениях возрастной инволюции различных отделов вегетативной нервной системы пациентов.
Задача изобретения: разработать доступный, нетрудоемкий и высокоспецифичный способ экспериментального моделирования коркового вида катаракты in vivo, который повысит эффективность сравнительной оценки различных антикатарактальных веществ, что позволит проводить более эффективную (патогенетически обоснованную) терапию коркового вида возрастной катаракты и снизить затраты государственного финансирования на лечебные мероприятия.
Предложен способ экспериментального моделирования коркового вида катаракты in vivo, основанный на изменении тонуса симпатического отдела вегетативной нервной системы путем проведения хирургической двусторонней десимпатизации экспериментального животного.
Предлагаемый способ позволяет с высокой эффективностью (80%) инициировать формирование коркового вида помутнения хрусталиков экспериментального животного в обоих глазах и, что особенно важно, позволяет экспериментальным путем воссоздать гистологические и фенотипические изменения клеток хрусталика при возрастной корковой катаракте, выявленные у человека.
Изобретение обладает новизной, соответствует требованиям изобретательского уровня и может найти широкое применение в научно-исследовательской практике офтальмологических, геронтологических, гистологических, биологических и фармакологических лабораторий.
Предложенный способ осуществляется следующим образом. Под общей анестезией произвести двустороннюю симпатэктомию верхнего шейного симпатического ганглия (ganglion cervical superius) хирургическим путем:
- послойно рассечь кожу и подкожную клетчатку по переднему краю m.stemocleidomastoideus;
- вскрыть сосудисто-нервный пучок шеи;
- v.jugularis intema и a.carotis intema сместить медиально;
- на уровне 2-3 шейного позвонка провести выделение n.vagus и ganglion cervical superius, располагающегося медиальнее n.vagus;
- произвести симпатэктомию верхнего шейного симпатического ганглия хирургическим путем;
- произвести гемостаз, наложить послойные швы на рану.
В результате проведенной двусторонней хирургической десимпатизации экспериментального животного уже через 5-7 месяцев при биомикроскопии переднего отрезка обоих глаз видны начальные признаки коркового помутнения хрусталиков преимущественно в нижне-носовом квадранте: интенсивно отражающие свет, спицеобразные помутнения серовато-белого цвета, обращенные основанием к периферии хрусталика и расположенные в области его коры. Через 12-14 месяцев с момента постановки эксперимента площадь описанных выше серовато-белых помутнений коркового отдела хрусталиков обоих глаз значительно увеличивается, формируя ослепительные клиновидные помутнения с основанием, обращенным к периферии хрусталика.
Кроме того, отмечается появление признаков гидратации в области коры хрусталика - диссоциация клеток-волокон хрусталика, формирование водяных щелей и вакуолей (Рис.1, 2).
Описанные макроскопические изменения хрусталиков экспериментального животного полностью соответствуют клинической картине созревающей возрастной катаракты коркового вида у человека, выявляемой при биомикроскопии переднего отрезка глаза в ходе стандартного офтальмологического обследования (Рис.3).
Еще одним важным доказательством высокой специфичности предлагаемой модели является полная идентичность гистологических и иммуногистохимических изменений клеток хрусталика при формировании смоделированной предложенным способом корковой катаракты экспериментального животного и возрастной корковой катаракты человека (по результатам морфологического изучения послеоперационного материала помутневших хрусталиков).
Сравнительный гистологический анализ срезов хрусталиков с возрастной и смоделированной корковой катарактой после их общегистологической окраски гематоксилин-эозином показал идентичные морфологические изменения: отчетливая гидратация коркового отдела хрусталика, диссоциация с хрусталиковых клеток-волокон, клиновидные пространства, заполненные детритом и вакуолями. Ядерный отдел хрусталика сдавлен оводненными корковыми массами, но не имеет структурных отклонений от нормы (Рис.4-6).
Сравнительное иммуногистохимическое окрашивание с моноклональными антителами к нейронспецифической энолазе (NSE), белку S-100 (S-100), виментину (Vim), α-гладкомышечному актину (α-SMA) и панцитокератину (ЕМА) во всех отделах интактного хрусталика человека и экспериментального животного не выявляет специфического окрашивания, так как интактный хрусталик, являясь частью "забарьерного органа" (гематоофтальмический барьер), не имеет иммуногистохимических меток основных типов тканей организма. Однако при формировании в хрусталике возрастной или смоделированной предлагаемым способом корковой катаракты обнаружена выраженная иммуно-позитивная реакция к определенным моноклональным антителам - NSE, Vim и белку S-100, при этом область ее проявления ограничена корковым отделом хрусталика (Табл. 1), что позволяет говорить о формировании идентичных закономерностей трансформации фенотипа клеток хрусталика.
Возможность патогенетически обоснованного экспериментального моделирования коркового вида катаракты, воссоздающего фенотипические изменения клеток хрусталика при возрастной корковой катаракте у человека, подтверждается полным совпадением иммуногистохимических характеристик, представленным в таблице 1.
В таблице 2 приведены преимущества использования предложенного способа по сравнению с известными.
ПОДПИСИ К РИСУНКАМ
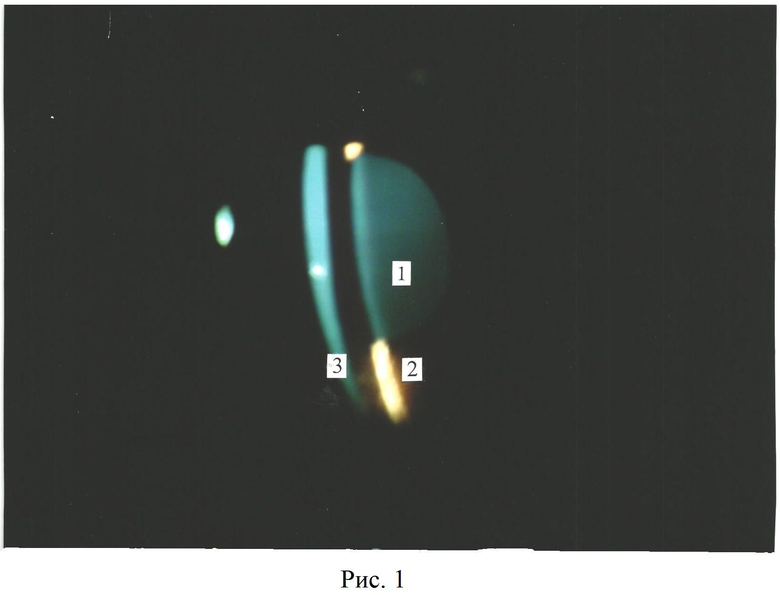
Рис.1. Интактный хрусталик кролика. Метод биомикроскопии переднего отрезка глазного яблока. Щелевая лампа ЩГ-ЗГ-06.
1 - отсутствие помутнений в области коры хрусталика, 2 - радужка, 3 - роговица.
Рис.2. Хрусталик кролика, пораженный экспериментальной корковой катарактой. Метод биомикроскопии переднего отрезка глазного яблока. Щелевая лампа ЩГ-ЗГ-06.
1 - обширное клиновидное серовато-белое помутнение в области коры хрусталика, 2 - радужка.
Рис.3. Возрастная корковая катаракта человека. Метод биомикроскопии переднего отрезка глазного яблока. Щелевая лампа ЩГ-ЗГ-06.
1 - широкое клиновидное серовато-белое помутнение в области коры хрусталика, 2 - радужка.
Рис.4. Сагиттальный срез интактного хрусталика. Окраска гематоксилин-эозином. Ув.: об. 90, ок. 15. Биолам 70. Гомаль 1,7.
1 - капсула хрусталика; 2 - ядра эпителиальных клеток хрусталика; 3 - ядра экваториальных клеток-волокон. Ув.: об. 90, ок. 15.
Рис.5. Сагиттальный срез хрусталика кролика, пораженного экспериментальной корковой катарактой. Окраска гематоксилин-эозином. Ув.: об. 40, ок. 15. Биолам 70. Гомаль 1,7.
1 - кора хрусталика с признаками гидратации (диссоциация клеток-волокон), 2 - клиновидные пространства, заполненные детритом и вакуолями, 3 - ядро хрусталика, сдавленное оводненными корковыми массами.
Рис.6. Сагиттальный срез хрусталика человека, пораженного возрастной корковой катарактой. Окраска гематоксилин-эозином. Ув.: об. 40, ок. 15. Биолам 70. Гомаль 1,7.
1 - кора хрусталика с признаками гидратации (диссоциация клеток-волокон), 2 - клиновидные пространства, заполненные детритом и вакуолями, 3 - ядро хрусталика, сдавленное оводненными корковыми массами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОНСЕРВАТИВНОГО ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ КОРКОВОГО ВИДА ВОЗРАСТНОЙ КАТАРАКТЫ | 2009 |
|
RU2418568C2 |
| СПОСОБ КОНСЕРВАТИВНОГО ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЯДЕРНОГО ВИДА ВОЗРАСТНОЙ КАТАРАКТЫ | 2009 |
|
RU2411926C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВИДА ВОЗРАСТНОЙ КАТАРАКТЫ ДО МОМЕНТА ЕЕ ВОЗНИКНОВЕНИЯ | 2008 |
|
RU2371098C1 |
| Новые глазные капли для консервативного лечения и профилактики возрастной катаракты ядерного вида | 2015 |
|
RU2637875C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ВТОРИЧНОЙ КАТАРАКТЫ ОПРЕДЕЛЕННОГО ВИДА | 2012 |
|
RU2512744C1 |
| ГЛАЗНЫЕ КАПЛИ ДЛЯ ЛЕЧЕНИЯ ВОЗРАСТНОЙ КАТАРАКТЫ ЯДЕРНОГО ВИДА | 2019 |
|
RU2720676C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ГЛАЗНЫЕ КАПЛИ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ РАННИХ ПРОЯВЛЕНИЙ ВОЗРАСТНОЙ КАТАРАКТЫ ЯДЕРНОГО ВИДА | 2020 |
|
RU2748598C1 |
| Способ моделирования катаракты на лабораторных крысах | 2023 |
|
RU2809320C1 |
| УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ ВЫЯВЛЕНИЯ КЛЕТОЧНЫХ СТРУКТУР В ХРУСТАЛИКЕ ГЛАЗА ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 2005 |
|
RU2319132C2 |
| СПОСОБ ЛЕЧЕНИЯ НАЧАЛЬНОЙ КАТАРАКТЫ | 2008 |
|
RU2367387C1 |





Изобретение относится к медицине, в частности к офтальмологии, и касается моделирования коркового вида катаракты in vivo. Для этого у экспериментального животного проводят хирургическую двустороннюю десимпатизацию путем иссечения верхнего шейного симпатического ганглия. При простоте и экономичности моделирования способ обеспечивает формирование коркового помутнения хрусталика, которое по клиническим, морфологическим и иммуногистохимическим характеристикам идентично изменениям клеток хрусталика при возрастном его помутнении у человека. 6 ил., 2 табл.
Способ экспериментального моделирования коркового вида катаракты in vivo, отличающийся тем, что методом хирургической двусторонней десимпатизации экспериментального животного путем иссечения верхнего шейного симпатического ганглия инициируют формирование коркового помутнения хрусталика, которое по клиническим, морфологическим и иммуногистохимическим характеристикам идентично изменениям клеток хрусталика при возрастном его помутнении у человека.
| СПОСОБ МОДЕЛИРОВАНИЯ ВОЗРАСТНОЙ КАТАРАКТЫ | 2007 |
|
RU2336574C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ЗАПОРОВ У ДЕТЕЙ | 2009 |
|
RU2403875C1 |
| СПОСОБ ЛЕЧЕНИЯ АТРОФИИ ЗРИТЕЛЬНОГО НЕРВА У ДЕТЕЙ В ВОЗРАСТЕ ОТ 1 ДО 6 МЕСЯЦЕВ | 2009 |
|
RU2402363C1 |
| JP 4230284 B2, 25.02.2009 | |||
| КОРСАКОВА Н.В | |||
| Роль вегетативной нервной системы в формировании возрастной катаракты у человека | |||
| Материалы научно-практической конференции, посвященной 75-летию профессора В.Н.Саперова, Чебоксары, 2006, С.35-37 | |||
| MORTON JD et al | |||
| A macrocyclic | |||
Авторы
Даты
2015-06-20—Публикация
2011-01-18—Подача