Настоящее изобретение относится к соединениям формулы
 ,
,
где
R представляет собой водород или низший алкил;
R1 представляет собой -(СН2)n-(O)o-гетероциклоалкил или -С(O)-гетероциклоалкил, где указанная гетероциклоалкильная группа возможно замещена низшим алкилом, гидрокси, галогеном или -(СН2)p-арилом;
n равно 0, 1 или 2;
o равно 0 или 1;
p равно 0, 1 или 2;
R2 представляет собой CF3, циклоалкил, возможно замещенный низшим алкокси или галогеном, или представляет собой индан-2-ил, или представляет собой гетероциклоалкил, возможно замещенный гетероарилом,
или представляет собой арил или гетероарил, где указанные ароматические кольца возможно замещены одним или двумя заместителями, выбранными из низшего алкила, галогена, гетероарила, гидрокси, CF3, OCF3, OCH2CF3, ОСН2-циклоалкила, ОСН2С(СН2ОН)(CH2Cl)(СН3), S-низшего алкила, низшего алкокси, СН2-низшего алкокси, низшего алкинила или циано, или замещены -С(O)-фенилом, -O-фенилом, -O-CH2-фенилом, фенилом или -СН2-фенилом, и где указанные фенильные кольца возможно могут быть замещены галогеном, -С(O)-низшим алкилом, -С(O)ОН или -С(O)O-низшим алкилом, или указанные ароматические кольца возможно замещены гетероциклоалкилом, ОСН2-оксетан-3-илом или О-тетрагидропиран-4-илом, возможно замещенными низшим алкилом;
Х представляет собой связь, -NR'-, -CH2NH-, -CHR"-, -(CHR")q-O-, -O-(CHR")q- или -(CH2)2-;
Y представляет собой связь или -CH2-;
R' представляет собой водород или низший алкил;
R" представляет собой водород, низший алкил, CF3, низший алкокси;
q равно 0, 1, 2 или 3;
или к их фармацевтически приемлемой соли присоединения кислоты.
Изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры. Кроме того, настоящим изобретением также охвачены все таутомерные формы соединений формулы I.
Предпочтительным положением для R1 на фенильном кольце является пара-положение.
К настоящему времени установлено, что соединения формулы I обладают высокой аффинностью к рецепторам, ассоциированным со следовыми аминами (TAAR), особенно к TAAR1. Данные соединения можно применять в лечении депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (ADHD), расстройств, вызванных стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, и метаболических расстройств, таких как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройств потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых заболеваний.
Некоторые физиологические эффекты (т.е., воздействия на сердечнососудистую систему, понижение кровяного давления, седативное действие), описанные для соединений, которые могут связываться с адренергическими рецепторами, (WO02/076950, WO97/12874 или ЕР 0717037) могут рассматриваться как нежелательные побочные эффекты в случае лекарственных средств, предназначенных для лечения таких заболеваний центральной нервной системы, которые описаны выше. Поэтому желательно получить лекарственные средства, обладающие селективностью к рецептору TAAR1 по сравнению с адренергическими рецепторами. Объекты по настоящему изобретению демонстрируют селективность к рецептору TAAR1, в частности высокую селективность по сравнению с адренергическими рецепторами альфа1 и альфа2 человека и крысы.
Классические биогенные амины (серотонин, норэпинефрин, эпинефрин, допамин, гистамин) как нейромедиаторы играют важную роль в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их деградация и обратный захват после высвобождения строго регулируются. Известно, что дисбаланс уровней биогенных аминов ответственен за изменение функции головного мозга при многих патологических состояниях [2-5]. Соединения, образующие второй класс эндогенных аминов, так называемые следовые амины (ТА), очень схожи с классическими биогенными аминами по своей структуре, метаболизму и субклеточной локализации. ТА включают п-тирамин, β-фенилэтиламин, триптамин и октопамин, и их уровень в нервной системе млекопитающих существенно ниже уровня классических биогенных аминов [6].
Нарушение их регуляции связано с различными психическими заболеваниями, такими как шизофрения и депрессия [7], и другими состояниями, такими как синдром дефицита внимания и гиперактивности, головная боль типа мигрени, болезнь Паркинсона, злоупотребление веществами, вызывающими зависимость, и расстройства приема пищи [8, 9].
В течение долгого времени существование ТА-специфичных рецепторов являлось всего лишь гипотезой, основанной на присутствии в ЦНС (центральной нервной системе) человека и других млекопитающих анатомически дискретных сайтов связывания, обладающих высокой аффинностью к ТА [10, 11]. Соответственно, считалось, что фармакологическое действие ТА опосредовано хорошо известными механизмами, что и действие классических биогенных аминов, то есть либо стимуляцией их высвобождения, либо ингибированием их обратного захвата, либо "перекрестным связыванием" с их рецепторными системами [9, 12, 13]. В последнее время данная точка зрения претерпела значительные изменения в связи с идентификацией нескольких членов нового семейства GPCR (G-белок-связанных рецепторов), рецепторов, ассоциированных со следовыми аминами (TAAR) [7, 14]. Обнаружено 9 TAAR-генов в геноме человека (включая 3 псевдогена) и 16 генов в геноме мыши (включая 1 псевдоген). TAAR-гены не содержат интронов (за одним исключением, TAAR2 содержит 1 интрон) и расположены рядом на одном и том же хромосомном сегменте. Филогенетическое родство генов этих рецепторов, находящееся в соответствии с высокой степенью их сходства с GPCR-фармакофором и в соответствии с фармакологическими данными, дает возможность предположить, что эти рецепторы образуют три различных подсемейства [7, 14]. TAAR1 относится к первому подклассу, состоящему из четырех генов (TAAR1-4), которые представлены в геномах человека и грызунов высококонсервативными последовательностями. ТА активируют TAAR1 через Ga. Было показано, что нарушение регуляции ТА связано с этиологией различных заболеваний, таких как депрессия, психоз, синдром дефицита внимания и гиперактивности, злоупотребление веществами, вызывающими зависимость, болезнь Паркинсона, головная боль типа мигрени, расстройства приема пищи, метаболические расстройства, и поэтому применение TAAR1-лигандов в лечении данных заболеваний может являться весьма перспективным.
Поэтому получение новых знаний о рецепторах, ассоциированных со следовыми аминами, весьма актуально. Использованные ссылки
1. Deutch, A.Y. and Roth, R.H. (1999) Neurotransmitters. In Fundamental Neuroscience (2nd edn) (Zigmond, M.J., Bloom, F.E., Landis, S.C., Roberts, J.L, and Squire, L.R., eds.), pp.193-234, Academic Press.
2. Wong, M.L. and Licinio, J. (2001) Research and treatment approaches to depression. Nat. Rev. Neurosci. 2, 343-351.
3. Carlsson, A. et al. (2001) Interactions between monoamiens, glutamate, and GABA in schizophrenia: new evidence. Annu. Rev. Pharmacol. Toxicol. 41, 237-260.
4. Tuite, P. and Riss, J. (2003) Recent developments in the pharmacological treatment of Parkinson's disease. Expert Opin. Investig. Drugs 12, 1335-1352.
5. Castellanos, F.X. and Tannock, R. (2002) Neuroscience of attention-deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci. 3, 617-628.
6. Usdin, Earl; Sandier, Merton; Editors. Psychopharmacology Series, Vol.1:
Trace Amines and the Brain. [Proceedings of a Study Group at the 14th Annual Meeting of the American College of Neuropsychoparmacology, San Juan, Puerto Rico] (1976).
7. Lindemann, L. and Hoener, M. (2005) A renaissance in trace amines inspired by a novel GPCR family. Trends in Pharmacol. Sci. 26, 274-281.
8. Branchek, T.A. and Blackburn, T.P. (2003) Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr. Opin. Pharmacol. 3, 90-97.
9. Premont, R.T. et al. (2001) Following the trace of elusive amines. Proc. Natl. Acad. Sci. U. S. A. 98, 9474-9475.
10. Mousseau, D.D. and Butterworth, R.F. (1995) A high-affinity [3H]tryptamine binding site in human brain. Prog. Brain Res. 106, 285-291.
11. McCormack, J.K. et al. (1986) Autoradiographic localization of tryptamine binding sites in the rat and dog central nervous system. J. Neurosci. 6, 94-101.
12. Dyck, L.E. (1989) Release of some endogenous trace amines from rat striatal slices in the presence and absence of a monoamine oxidase inhibitor. Life Sci. 44, 1149-1156.
13. Parker, E.M. and Cubeddu, L.X. (1988) Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J. Pharmacol. Exp.Ther. 245, 199-210.
14. Lindemann, L. et al. (2005) Trace amine associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics 85, 372-385.
Задачей настоящего изобретения являются новые соединения формулы I и их фармацевтически приемлемые соли, их применение в изготовлении лекарственных средств для лечения заболеваний, связанных с биологической функцией рецепторов, ассоциированных со следовыми аминами, их получение и лекарственные средства на основе соединения по изобретению для контроля и предупреждения таких заболеваний, как депрессия, тревожные расстройства, биполярное расстройство, синдром дефицита внимания и гиперактивности, расстройства, вызванные стрессом, психотические расстройства, такие как шизофрения, неврологические заболевания, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, злоупотребление веществами, вызывающими зависимость, метаболические расстройства, такие как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройства и нарушения температурного гомеостаза, нарушения сна и циркадного ритма и сердечно-сосудистые заболевания.
Предпочтительными показаниями к применению соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, диабет, тревога и синдром дефицита внимания и гиперактивности (ADHD).
Используемый в данном описании термин "низший алкил" означает группу с насыщенной прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, mpem-бутил и тому подобное. Предпочтительными алкильными группами являются группы, содержащие 1-4 атома углерода.
Используемый в данном описании термин "низший алкокси" означает группу, где алкильный остаток является таким, как определено выше, и присоединен через атом кислорода.
Используемый в данном описании термин "низший алкил, замещенный галогеном" означает алкильную группу, которая определена выше, где по меньшей мере один атом водорода заменен на атом галогена, например CF3, CHF2, CH2F, CH2CF3, CH2CH2CF3, CH2CF2CF3 и тому подобное.
Используемый в данном описании термин "низший алкокси, замещенный галогеном" означает группу, где алкильный остаток является таким, как определено выше, и присоединен через атом кислорода, и где по меньшей мере один атом водорода заменен на атом галогена.
Термин "алкинил" обозначает углеводородный остаток с прямой или разветвленной цепью, содержащий тройную связь и до 7, предпочтительно до 4, атомов углерода, такой как, например, этинил или 2-пропинил.
Термин "галоген" означает хлор, йод, фтор и бром.
Термин "циклоалкил" относится к алкиленовому кольцу, содержащему от 3 до 6 атомов углерода в кольце.
Термин "арил" относится к ароматическому углеродному кольцу, такому как фенильное или нафтильное кольцо, предпочтительно фенильному кольцу.
Термин "гетероарил" относится к ароматическому 5-6-членному моноциклическому кольцу или 9-10-членному бициклическому кольцу, которое может содержать 1, 2 или 3 гетероатома, выбранных из азота, кислорода и/или серы, такому как фурил, пиридинил, пиридазинил, пиримидинил, пиразинил, тиенил, изоксазолил, оксазолил, оксадиазолил, имидазолил, пирролил, пиразолил, триазолил, тетразолил, тиазолил, изотиазолил, тиадиазолил, бензимидазолил, индолил, инданил, индазолил, бензотиазолил, бензоизотиазолил, бензоксазолил, бензоизоксазолил, хинолинил и изохинолинил. Предпочтительными гетероарильными группами являются пиридинил, пиразолил, пиримидинил, бензимидазолил, хинолинил и изохинолинил.
Термин "гетероциклоалкил" относится к неароматическому 5-7-членному моноциклическому кольцу, которое может содержать 1, 2 или 3 гетероатома, выбранных из азота, кислорода и/или серы, такому как пиперазинил, пиперидинил, морфолинил, пирролидинил, [1.4]оксазепанил или тиоморфолинил.
Термин "фармацевтически приемлемые соли присоединения кислоты" включает в себя соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и тому подобное.
Одним из воплощений изобретения являются соединения формулы I, где Х представляет собой NR', a R' представляет собой водород, например, следующие соединения:
(RS)-1-(4-бутил-2-метил-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевина,
1-(3,4-дихлор-фенил)-3-[4-(4-метил-пиперазин-1-ил)-фенил]-мочевина,
(RS)-1-(3,4-дихлор-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевина,
(RS)-1-(4-хлор-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевина,
(RS)-1-фенил-3-(4-пирролидин-3-ил-фенил)-мочевина,
(RS)-1-(2,4-дихлор-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевина,
(RS)-1-(3-хлор-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевина,
(RS)-1-(4-пирролидин-3-ил-фенил)-3-(4-трифторметил-фенил)-мочевина,
(RS)-1-(5-хлор-пиридин-2-ил)-3-(4-пирролидин-3-ил-фенил)-мочевина,
(RS)-1-(6-хлор-пиридин-3-ил)-3-(4-пиперидин-3-ил-фенил)-мочевина,
(RS)-1-(5-хлор-пиридин-2-ил)-3-(4-пиперидин-3-ил-фенил)-мочевина,
(RS)-1-(5-хлор-пиридин-2-ил)-3-[4-(2-пирролидин-3-ил-этил)-фенил]-мочевина,
(RS)-1-(4-хлор-фенил)-3-[4-(2-пирролидин-3-ил-этил)-фенил]-мочевина,
(RS)-1-(4-хлор-фенил)-3-[4-(2-пиперидин-3-ил-этил)-фенил]-мочевина,
(RS)-1-(4-(морфолин-2-ил)фенил)-3-(4-(трифторметил)фенил)мочевина,
(RS)-1-(4-хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевина,
(RS)-1-(4-(морфолин-2-ил)фенил)-3-п-толилмочевина,
(RS)-1-(6-хлорпиридин-3-ил)-3-(4-(морфолин-2-ил)фенил)мочевина,
(RS)-1-(3-хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевина,
(RS)-1-(4-(морфолин-2-ил)фенил)-3-м-толилмочевина,
(RS)-1-(2-хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевина,
(RS)-1-(4-метилбензил)-3-(4-(морфолин-2-ил)фенил)мочевина,
(R)-1-(4-(морфолин-2-ил)фенил)-3-(4-(трифторметил)фенил)мочевина или
(S)-1-(4-(морфолин-2-ил)фенил)-3-(4-(трифторметил)фенил)мочевина.
Другим воплощением изобретения являются соединения формулы I, где Х представляет собой связь, например:
(RS)-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-4-хлор-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-N-(4-пирролидин-3-ил-фенил)-4-трифторметил-бензамид,
(RS)-2,4-дихлор-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-3-хлор-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-4-хлор-N-[4-(1-метил-пирролидин-3-ил)-фенил]-бензамид,
(RS)-4-хлор-N-[4-(1-этил-пирролидин-3-ил)-фенил]-бензамид,
(RS)-4-хлор-N-[4-(пирролидин-3-илокси)-фенил]-бензамид,
(RS)-5-хлор-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-6-хлор-пиридин-3-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-4-этокси-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-4-пропил-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-4-этинил-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-4-циано-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-3,4-дихлор-N-(4-пирролидин-3-ил-фенил)-бензамид,
4-хлор-N-(4-пиперидин-4-ил-фенил)-бензамид,
(RS)-4-хлор-N-(4-пиперидин-3-ил-фенил)-бензамид,
4-хлор-N-(4-пиперазин-1-ил-фенил)-бензамид,
4-хлор-N-[4-((3RS,4RS)-4-фтор-пирролидин-3-ил)-фенил]-бензамид,
(RS)-4-хлор-N-[3-(пирролидин-3-илокси)-фенил]-бензамид,
(RS)-6-пиразол-1-ил-N-(4-пирролидин-3-ил-фенил)-никотинамид,
(RS)-6-хлор-N-(4-пиперидин-3-ил-фенил)-никотинамид,
(RS)-4-хлор-2-фтор-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-5-хлор-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амид,
(RS)-4-хлор-N-[4-(4-метил-морфолин-2-ил)-фенил]-бензамид,
(RS)-хинолин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-изохинолин-1-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-4-хлор-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-5-бром-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-2-фтор-4-метокси-N-(4-пирролидин-3-ил-фенил)-бензамид,
(RS)-N-(4-пирролидин-3-ил-фенил)-6-(2,2,2-трифтор-этокси)-никотинамид,
(RS)-6-метокси-хинолин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-3-хлор-N-(4-пиперидин-3-ил-фенил)-бензамид,
(RS)-3,4-дихлор-N-(4-пиперидин-3-ил-фенил)-бензамид,
(RS)-4-этокси-N-(4-пиперидин-3-ил-фенил)-бензамид,
(RS)-N-(4-пиперидин-3-ил-фенил)-4-трифторметил-бензамид,
(RS)-4-хлор-2-фтор-N-(4-пиперидин-3-ил-фенил)-бензамид,
(RS)-4-хлор-N-(4-пирролидин-2-илметил-фенил)-бензамид,
(RS)-1-хлор-изохинолин-3-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-4-хлор-N-[4-(2-пирролидин-3-ил-этил)-фенил]-бензамид,
(RS)-4-хлор-N-[4-(2-пиперидин-3-ил-этил)-фенил]-бензамид,
4-хлор-N-((R)-4-пиперидин-3-ил-фенил)-бензамид,
(RS)-5-хлор-пиридин-2-карбоновой кислоты [4-(2-пирролидин-3-ил-этил)-фенил]-амид,
(RS)-N-(4-пиперидин-3-ил-фенил)-4-пропил-бензамид,
(RS)-5-трифторметил-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амид,
(RS)-5-трифторметил-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид,
(RS)-5-трифторметил-пиридин-2-карбоновой кислоты (4-морфолин-2-ил-фенил)-амид,
(RS)-4-хлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамид,
4-хлор-N-((R)-4-морфолин-2-ил-фенил)-бензамид,
4-хлор-N-((S)-4-морфолин-2-ил-фенил)-бензамид,
(RS)-4-хлор-N-[4-(пирролидин-3-илоксиметил)-фенил]-бензамид,
(RS)-4-хлор-2-фтор-N-(4-морфолин-2-ил-фенил)-бензамид,
(RS)-3,4-дихлор-N-(4-морфолин-2-ил-фенил)-бензамид,
(RS)-5-хлор-пиридин-2-карбоновой кислоты (4-морфолин-2-ил-фенил)-амид,
(RS)-4-хлор-N-(4-пирролидин-3-илметил-фенил)-бензамид,
3,4-дихлор-N-((R)-4-пиперидин-3-ил-фенил)-бензамид,
(R)-3-хлор-N-(4-(пиперидин-3-ил)фенил)бензамид,
3,4-дихлор-N-((S)-4-пиперидин-3-ил-фенил)-бензамид,
(S)-3-хлор-N-(4-(пиперидин-3-ил)фенил)бензамид,
(RS)-3,4-дихлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамид,
(RS)-N-[4-(2-пирролидин-2-ил-этил)-фенил]-4-трифторметил-бензамид,
(RS)-4-фтор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамид,
(RS)-3-хлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамид,
(RS)-4-этокси-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамид,
(RS)-5-хлор-пиразин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амид,
(S)-6-хлор-N-(4-(пиперидин-3-ил)фенил)никотинамид,
(R)-5-хлор-N-(4-(пиперидин-3-ил)фенил)picolinamid,
(S)-5-хлор-N-(4-(пиперидин-3-ил)фенил)пиколинамид,
(RS)-4-хлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамид,
(RS)-5-этокси-N-(4-(2-(пирролидин-2-ил)этил)фенил)пиколинамид,
(RS)-N-(4-(2-(пиперидин-2-ил)этил)фенил)-4-(трифторметил)бензамид,
(RS)-3,4-дихлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамид,
(RS)-4-этинил-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамид,
(RS)-N-(4-(пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид,
(RS)-5-этокси-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амид,
(RS)-4-метил-N-(4-(пирролидин-3-ил)фенил)бензамид,
(RS)-4-метил-N-(4-(пиперидин-3-ил)фенил)бензамид,
(RS)-4-метокси-N-(4-(пиперидин-3-ил)фенил)бензамид,
(RS)-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-4-метил-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-4-метокси-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-N-(4-(пиперидин-3-ил)фенил)-5-(2,2,2-трифторэтокси)пиколинамид,
(RS)-4-(бензилокси)-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-6-хлор-N-(4-(морфолин-2-ил)фенил)никотинамид,
(RS)-2-(4-(6-цианоникотинамидо)фенил)морфолин-4-ийхлорид,
(R)-4-метил-N-(4-(морфолин-2-ил)фенил)бензамид,
(S)-4-метил-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-4-этокси-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-4-этил-N-(4-(морфолин-2-ил)фенил)бензамид,
(R)-4-хлор-3-метокси-N-(4-(пиперидин-3-ил)фенил)бензамид,
(S)-4-хлор-3-метокси-N-(4-(пиперидин-3-ил)фенил)бензамид,
(R)-3-хлор-4-метокси-N-(4-(пиперидин-3-ил)фенил)бензамид,
(S)-3-хлор-4-метокси-N-(4-(пиперидин-3-ил)фенил)бензамид,
(R)-N-(4-(пирролидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид,
(S)-N-(4-(пирролидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид,
(RS)-4-(4-хлорфенокси)-N-(4-(морфолин-2-ил)фенил)бензамид,
(R)-6-хлор-N-(4-(морфолин-2-ил)фенил)никотинамид,
(S)-6-хлор-N-(4-(морфолин-2-ил)фенил)никотинамид,
(RS)-3-хлор-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-5-хлор-N-(4-(морфолин-2-ил)фенил)никотинамид,
(RS)-метил-4-((4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)метил)-бензоат,
(RS)-метил-2-хлор-4-(4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)-бензоат,
(RS)-4-циклопропилметокси-N-(4-морфолин-2-ил-фенил)-бензамид,
(RS)-4-(метилтио)-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-2-хлор-N-(4-(морфолин-2-ил)фенил)изоникотинамид,
(RS)-5,6-дихлор-N-(4-(морфолин-2-ил)фенил)никотинамид,
(RS)-4-(2-хлорметил-3-гидрокси-2-метил-пропокси)-N-(4-морфолин-2-ил-фенил)-бензамид,
(RS)-2,6-дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид,
(R)-N-(4-(пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид,
(S)-N-(4-(пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид,
(S)-3-хлор-4-метил-N-(4-(пиперидин-3-ил)фенил)бензамид,
(S)-4-хлор-3-метил-N-(4-(пиперидин-3-ил)фенил)бензамид,
(S)-3,4-диметил-N-(4-(пиперидин-3-ил)фенил)бензамид,
(R)-4-хлор-2-фтор-N-(4-(морфолин-2-ил)фенил)бензамид,
(S)-4-хлор-2-фтор-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-2-фенилтиазол-5-карбоксамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-2-фенилтиазол-4-карбоксамид,
(S)-N-(4-(пиперидин-3-ил)фенил)-3-(трифторметил)бензамид,
(S)-4-(метилтио)-N-(4-(пиперидин-3-ил)фенил)бензамид,
(S)-4-(этилтио)-N-(4-(пиперидин-3-ил)фенил)бензамид,
5-хлор-пиразин-2-карбоновой кислоты ((S)-4-пиперидин-3-ил-фенил)-амид,
5-хлор-пиразин-2-карбоновой кислоты ((К)-4-пиперидин-3-ил-фенил)-амид,
(S)-N-(4-(пиперидин-3-ил)фенил)-6-(трифторметил)никотинамид,
(S)-6-метил^-(4-(пиперидин-3-ил)фенил)никотинамид,
(S)-6-(метилтио)-N-(4-(пиперидин-3-ил)фенил)никотинамид,
(RS)-6-этокси-N-(4-(морфолин-2-ил)фенил)никотинамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-2-фенилоксазол-4-карбоксамид,
(S)-N-(4-(пиперидин-3-ил)фенил)-5-(2,2,2-трифторэтокси)пиразин-2-карбоксамид,
(S)-5-бром-N-(4-(пиперидин-3-ил)фенил)пиразин-2-карбоксамида 2,2,2-трифторацетат,
(S)-6-бром-N-(4-(пиперидин-3-ил)фенил)никотинамида2,2,2-трифторацетат,
(S)-3-метил-N-(4-(пиперидин-3-ил)фенил)бензамид,
(S)-5-(метилтио)-N-(4-(пиперидин-3-ил)фенил)пиразин-2-карбоксамид,
(S)-3-(метилтио)-N-(4-(пиперидин-3-ил)фенил)бензамид,
(R)-3,4-диметил-N-(4-(пиперидин-3-ил)фенил)бензамид,
(R)-N-(4-(пиперидин-3-ил)фенил)-3-(трифторметил)бензамид,
(R)-3-хлор-N-(4-(морфолин-2-ил)фенил)бензамид,
(S)-3-хлор-N-(4-(морфолин-2-ил)фенил)бензамид,
(R)-N-(4-(пиперидин-3-ил)фенил)-6-(трифторметил)никотинамид,
(R)-4-(метилтио)-N-(4-(морфолин-2-ил)фенил)бензамид,
(S)-4-(метилтио)-N-(4-(морфолин-2-ил)фенил)бензамид,
(R)-N-(4-(морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид,
(S)-N-(4-(морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид,
(R)-2,6-дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамид,
(S)-2,6-дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамид,
(RS)-2-хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамид,
(R)-4-этокси-N-(4-(морфолин-2-ил)фенил)бензамид,
(S)-4-этокси-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-3-метил-N-(4-(морфолин-2-ил)фенил)бензамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-6-(пирролидин-1-ил)никотинамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-2-(трифторметил)изоникотинамид,
(S)-2,6-дихлор-N-(4-(пиперидин-3-ил)фенил)изоникотинамид,
(S)-2-хлор-6-метил-N-(4-(пиперидин-3-ил)фенил)изоникотинамид,
(R)-N-(4-(морфолин-2-ил)фенил)-6-(трифторметил)никотинамид,
(S)-N-(4-(морфолин-2-ил)фенил)-6-(трифторметил)никотинамид,
(R)-2-хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамид.
(S)-2-хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-2-(пиразин-2-ил)тиазол-4-карбоксамид,
(S)-N-(4-(пиперидин-3-ил)фенил)-6-пропилникотинамид,
(S)-6-этил-N-(4-(пиперидин-3-ил)фенил)никотинамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-1-фенил-1Н-пиразол-3-карбоксамид,
(RS)-2-этокси-N-(4-(морфолин-2-ил)фенил)изоникотинамид,
(S)-4-хлор-2-йод-N-(4-(морфолин-2-ил)фенил)бензамид,
(S)-N-(4-(1,4-оксазепан-2-ил)фенил)-3-хлорбензамид,
3-хлор-N-(4-((2S,6S)-6-метилморфолин-2-ил)фенил)бензамид,
(R)-4-хлор-N-(4-(морфолин-2-ил)бензил)бензамид,
(R)-6-хлор-N-(4-(морфолин-2-ил)бензил)никотинамид,
3-хлор-N-[4-((2S,5S)-5-метил-морфолин-2-ил)-фенил]-бензамид или
3-хлор-N-[4-((2S,5R)-5-метил-морфолин-2-ил)-фенил]-бензамид. Другим воплощением изобретения являются соединения, где Х представляет собой -(CHR")q-O-, например:
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты фениловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 4-фтор-фениловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 4-хлор-фениловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-фтор-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 4-фтор-бензиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-хлор-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3-хлор-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-трифторметил-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3-трифторметил-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(2,5-дифтор-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-трифторметокси-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3,4-дихлор-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты
(RS)-1-(4-хлор-фенил)-этиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 3-(4-хлор-фенил)-пропиловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты индан-2-иловый эфир,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты
(RS)-1-(4-хлор-фенил)-2,2,2-трифтор-этиловый эфир или
(S)-2,3-дигидро-1Н-инден-2-ил 4-(пиперидин-3-ил)фенилкарбамата 2,2,2-трифторацетат.
Другим воплощением изобретения являются соединения, где Х представляет собой -O(CHR")q-, например:
(S)-2-(4-хлорфенокси)-N-(4-(пиперидин-3-ил)фенил)ацетамид или
(S)-4-хлорбензил-4-(пиперидин-3-ил)фенилкарбамат.
Другим воплощением изобретения являются соединения, где Х представляет собой -CHR"-, например:
(RS)-2-(4-хлор-фенил)-N-(4-пирролидин-3-ил-фенил)-ацетамид,
(RS)-N-((RS)-4-пирролидин-3-ил-фенил)-2-(3-трифторметил-фенил)-пропионамид или
(RS)-N-(4-пирролидин-3-ил-фенил)-2-(3-трифторметокси-фенил)-пропионамид.
Другим воплощением изобретения являются соединения, где Х представляет собой -СН2СН2-, например:
(RS)-3-(2-хлор-фенил)-N-(4-пирролидин-3-ил-фенил)-пропионамидили
(RS)-3-(4-хлор-фенил)-N-(4-пиперидин-3-ил-фенил)-пропионамид.
Соединения формулы
 ,
,
где
R представляет собой водород или низший алкил;
R1 представляет собой -(СН2)n-(O)o-гетероциклоалкил, возможно замещенный низшим алкилом, гидрокси, галогеном или -(CH2)р-арилом;
n равно 0, 1 или 2;
o равно 0 или 1;
p равно 0, 1 или 2;
R2 представляет собой циклоалкил, гетероциклоалкил или представляет собой арил или гетероарил, где указанные ароматические кольца возможно замещены одним или двумя заместителями, выбранными из низшего алкила, галогена, гетероарила, CF3, OCF3, OCH2CF3, низшего алкокси, СН2-низшего алкокси, низшего алкинила или циано;
Х представляет собой связь, -NR'-, -CH2NH-, -CHR"-, -(CHR")q-O- или -(СН2)2-;
R' представляет собой водород или низший алкил;
R" представляет собой водород, низший алкил, низший алкокси;
q равно 0, 1 или 2;
или их фармацевтически приемлемая соль присоединения кислоты представляют собой другое воплощение данного изобретения.
Соединения формулы 1 по настоящему изобретению и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например, способами, описанными ниже, при этом способ включает:
а) отщепление N-защитной группы от соединений формулы
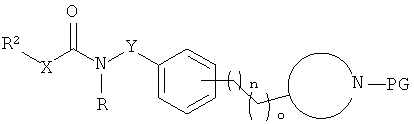
с получением соединения формулы О
 ,
,
где  представляет собой гетероциклическую группу, выбранную из пиперазинила, пиперидинила, морфолинила, пирролидинила или тиоморфолинила, PG представляет собой N-защитную группу, выбранную из -С(O)O-трет-бутила, и
представляет собой гетероциклическую группу, выбранную из пиперазинила, пиперидинила, морфолинила, пирролидинила или тиоморфолинила, PG представляет собой N-защитную группу, выбранную из -С(O)O-трет-бутила, и
при желании, превращение полученных соединений в их фармацевтически приемлемые соли присоединения кислоты, или
б) приведение во взаимодействие соединения формулы

с соединением формулы

с получением соединения формулы
 ,
,
где Х представляет собой связь или -СН2-, а другие определения такие, как описано выше, или
при желании, превращение полученных соединений в их фармацевтически приемлемые соли присоединения кислоты, или
в) приведение во взаимодействие соединения формулы
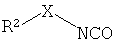
с соединением формулы

с получением соединения формулы
 ,
,
где определения такие, как описано выше, и
при желании, превращение полученных соединений в фармацевтически приемлемые соли присоединения кислоты.
Получение соединений формулы 1 по настоящему изобретению может быть осуществлено путем последовательного или конвергентного синтеза. Синтез соединений по изобретению показан на приведенных далее схемах 1-17 и в описании всех 323 конкретных примеров. Специалистам в данной области известно, какие навыки необходимы для выполнения данной реакции и очистки полученных продуктов. Заместители и индексы, используемые в следующем далее описании способов, имеют значения, приведенные в данном описании ранее, если нет указаний на противоположное.
Более подробно, соединения формулы I могут быть получены способами, приведенными ниже, способами, приведенными в разделе Примеры, или аналогичными способами. Условия реакции, подходящие для отдельных стадий реакции, известны специалисту в данной области. Последовательность реакций не ограничена той, которая показана на схемах 1-17, однако в зависимости от исходных веществ и соответствующей им реакционной способности последовательность реакционных стадий можно легко изменять. Исходные вещества либо имеются в продаже, либо могут быть получены способами, аналогичными способам, приведенным ниже, способами, описанными в ссылках, цитированных в данном описании или в разделе Примеры, или способами, известными в данной области.
ОБЩАЯ МЕТОДИКА
Схема 1
Для случая, когда Х представляет собой NR' или -CH2NH-.

В качестве примера использования:




Заместители такие, как описано выше, а Х представляет собой N или -CH2NH-.
Стадия А. Образование мочевины может быть осуществлено в результате реакции сочетания между амином 3 и алкил- или арилизоцианатными соединениями 2 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF (тетрагидрофуран), DME (1,2-диметоксиэтан) или ТВМЕ (трет-бутил-метиловый эфир), возможно в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин. Примеры соответствующих аминов 3 включают N-защищенные производные пирролидина, такие как 3-a [CAS (Chemical abstract service) 908334-28-1] и 3-f [CAS 889947-54-0], производные пиперидина, такие как 3-b [CAS 875798-79-1], 3-е [CAS 170011-57-1] и 3-д [CAS 908334-26-9], производные пиперазина, такие как 3-d [CAS 170911-92-9], и производные морфолина, такие как 3-e[CAS1002726-96-6].
Предпочтительными условиями является дихлорметан при комнатной температуре в течение 3 часов.
Стадия В. Удаление N-защитной группы ВОС (трет-бутилоксикарбонил) может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н2О, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 2
Для случая, когда Х представляет собой -О- или -CH2-O-.

качестве примера использования:







Заместители такие, как описано выше, а Х представляет собой -О- или -CH2O-.
Стадия А. Образование карбамата может быть осуществлено в результате реакции сочетания между амином 3 и алкил- или арил-хлорформиатными соединениями 5 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин. Примеры соответствующих аминов 3 включают N-защищенные производные пирролидина, такие как 3-а [CAS 908334-28-1] и 3-f [CAS 889947-54-0], производные пиперидина, такие как 3-Ь [CAS 875798-79-1], 3-е [CAS 170011-57-1] и 3-д [CAS 908334-26-9], производные пиперазина, такие как 3-d [CAS 170911-92-9], и производные морфолина, такие как 3-е [CAS 1002726-96-6].
Предпочтительными условиями являются триэтиламин в THF при комнатной температуре в течение 18 часов.
Стадия В. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 3
Для случая, когда Х представляет собой связь.

В качестве примера использования:







Заместители такие, как описано выше, a  представляет собой гетероциклоалкильную группу, которая может содержать несколько дополнительных гетероатомов, таких как N, S или О.
представляет собой гетероциклоалкильную группу, которая может содержать несколько дополнительных гетероатомов, таких как N, S или О.
Стадия А. Образование мочевины может быть осуществлено в результате реакции сочетания между амином 3 и алкил- или арил-хлорформамидными соединениями 5-1 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин. Примеры соответствующих аминов 3 включают N-защищенные производные пирролидина, такие как 3-а [CAS 908334-28-1] и 3-f [CAS 889947-54-0], производные пиперидина, такие как 3-b [CAS 875798-79-1], 3-е [CAS 170011-57-1] и 3-g [CAS 908334-26-9], производные пиперазина, такие как 3-d [CAS 170911-92-9], и производные морфолина, такие как 3-е [CAS 1002726-96-6].
Предпочтительными условиями являются триэтиламин в THF при комнатной температуре в течение 18 часов.
Стадия В. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
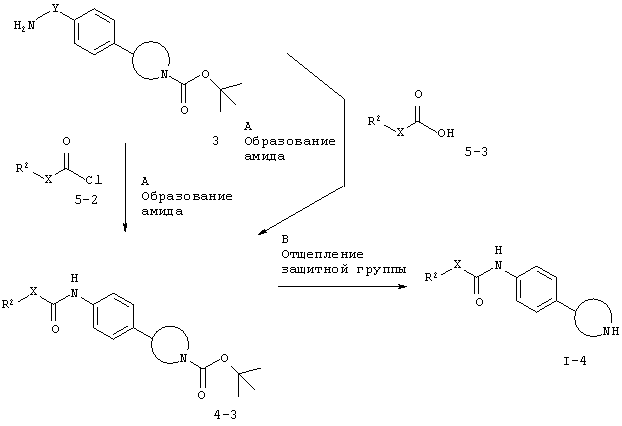
Схема 4
Для случая, когда Х представляет собой связь или -CH2-.
В качестве примера использования:







Заместители такие, как описано выше, а Х представляет собой связь или -СН2-.
Стадия А. Образование амида может быть осуществлено в результате реакции сочетания между амином 3 и соединениями 5-2, представляющими собой алкил- или арил-хлорангидриды кислот, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин. Примеры соответствующих аминов 3 включают N-защищенные производные пирролидина, такие как 3-а [CAS 908334-28-1] и 3-f [CAS 889947-54-0], производные пиперидина, такие как 3-b [CAS 875798-79-1], 3-е [CAS 170011-57-1] и 3-д [CAS 908334-26-9], производные пиперазина, такие как 3-d [CAS 170911-92-9], и производные морфолина, такие как 3-е [CAS 1002726-96-6].
Предпочтительными условиями являются триэтиламин в THF при комнатной температуре в течение 18 часов.
Альтернативно, образование амида может быть осуществлено в результате реакции сочетания между амином 3 и карбоновыми кислотами 5-3 в присутствии реагента сочетания, такого как DCC (дициклогексилкарбодиимид), EDC (1-этил-3-(3-диметиламинопропил)карбодиимид), TBTU (тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония) или HATU (гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония), в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ.
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50°С в течение 18 часов.
Стадия В. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, ЕЮН или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 5
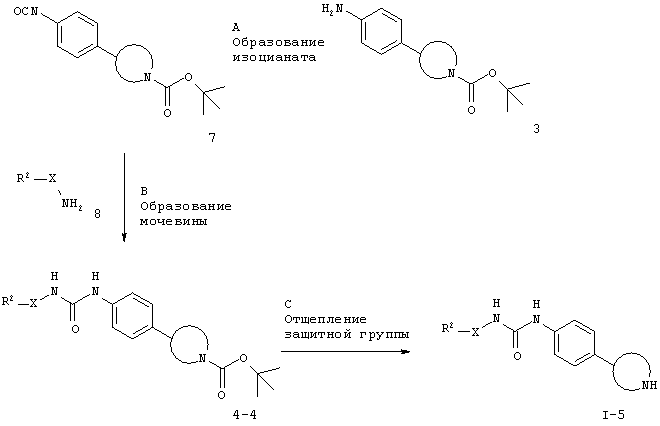
Для случая, когда Х представляет собой связь, CHR' или -(СН2)2-.
В качестве примера использования:







Заместители такие, как описано выше, а Х представляет собой связь, -CHR' или -(СН2)2-.
Стадия А. Образование изоцианата может быть осуществлено в результате обработки амина 3 трифосгеном, дифосгеном или фосгеном в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин. Примеры соответствующих аминов 3 включают N-защищенные производные пирролидина, такие как 3-а [CAS 908334-28-1] и 3-f [CAS 889947-54-0], производные пиперидина, такие как 3-b [CAS 875798-79-1], 3-е [CAS 170011-57-1] и 3-д [CAS 908334-26-9], производные пиперазина, такие как 3-d [CAS 170911-92-9], и производные морфолина, такие как 3-е [CAS 1002726-96-6].
Предпочтительными условиями являются трифосген и триэтиламин в дихлорметане при 45°С в течение 18 часов.
Стадия В. Образование мочевины может быть осуществлено в результате реакции сочетания между изоцианатным соединением 7 и амином 8 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, возможно в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются дихлорметан при комнатной температуре в течение 3 часов.
Стадия С.Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CF3Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 6
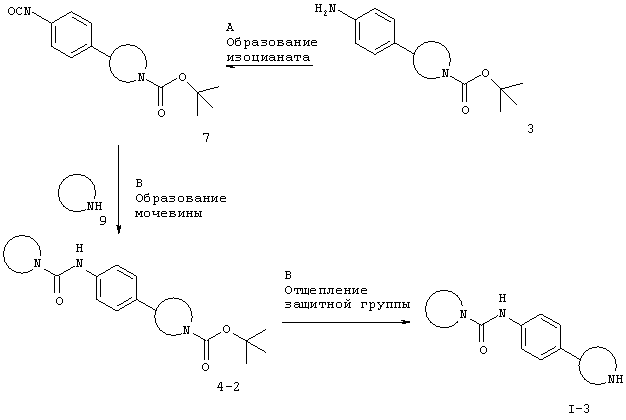
Для случая, когда Х представляет собой связь.
В качестве примера использования:







Заместители такие, как описано выше.
Стадия А. Образование мочевины может быть осуществлено в результате реакции сочетания между изоцианатным соединением 7 (см. схему 5) и амином 9 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, возможно в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются дихлорметан при комнатной температуре в течение 3 часов.
Стадия В. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или W, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 7
Для случая, когда Х представляет собой связь или -СН2-.
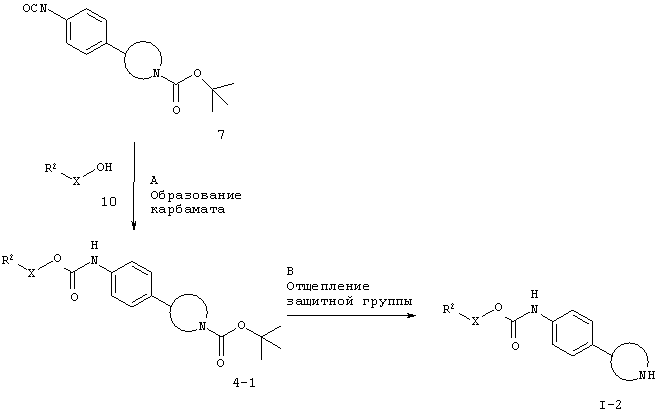
Заместители такие, как описано выше, а Х представляет собой связь или -СН2-.
Стадия А. Образование карбамата может быть осуществлено в результате реакции сочетания между изоцианатным соединением 7 (см. схему 5) и спиртом 10 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, возможно в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются N,N-диизопропилэтиламин в THF при 110°С в течение 18 часов.
Стадия В. Удаление N-защитной группы БОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н2О, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 8
Для случая, когда Х представляет собой связь или -СН2-.

Заместители такие, как описано выше, а Х представляет собой связь или -СН2-.
Стадия А. Образование мочевины может быть осуществлено в результате реакции сочетания между изоцианатом 11 (CAS 879896-39-6) и алкил- или арил-амином 8 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, или полярных органических растворителях, таких как DMF (N,N-диметилформамид), возможно в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются DMF при комнатной температуре в течение 18 часов.
Альтернативно, образование мочевины может быть осуществлено в результате реакции сочетания между амином 13 (CAS 16153-81-4) и алкил- или арилизоцианатными соединениями 12 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как 5 диэтиловый эфир, диоксан, THF, DME или ТВМЕ, или полярных органических растворителях, таких как DMF, возможно в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются DMF при комнатной температуре в течение 2 часов.
Схема 9
Для случая, когда Х представляет собой связь или -CH2-.

В качестве примера использования:





Заместители такие, как описано выше, а Х представляет собой связь или -СН2-.
Стадия А. Образование карбамата может быть осуществлено в результате обработки амина 3 этилхлорформиатом в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин. Примеры соответствующих аминов 3 включают N-защищенные производные пирролидина, такие как 3-a [CAS 908334-28-1], производные пиперидина, такие как 3-b [CAS 875798-79-1] и 3-е [CAS 170011-57-1], производные пиперазина, такие как 3-d [CAS 170911-92-9], и производные морфолина, такие как 3-е [CAS 1002726-96-6].
Предпочтительными условиями являются триэтиламин в THF при комнатной температуре в течение 18 часов.
Стадия В. Восстановление может быть осуществлено в результате обработки карбамата 14 восстанавливающим агентом на основе гидрида алюминия, таким как Red-Al (бис(2-метоксиэтокси)алюмогидрид натрия), в эфирном растворителе, таком как THF или диоксан, при температурах от комнатной температуры до температуры дефлегмации растворителя.
Предпочтительными условиями являются THF при комнатной температуре в течение 5 часов и затем при 50°С в течение 15 минут.
Стадия С.Образование карбамата может быть осуществлено в результате реакции сочетания между амином 15 и алкил- или арил-хлорформиатными соединениями 5 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются триэтиламин в THF при комнатной температуре в течение 18 часов.
Стадия D. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или W, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 10
Когда X представляет собой связь, NR', -CH2NH-, CHR"-, -(CH2)q-O- или -(СН2)2-.

Заместители такие, как описано выше, а Х представляет собой связь, -NR'-, -CH2NH-, -CHR"-, -(CH2)q-O- или -(CH2)2-.
Стадия А. N-алкилирование может быть осуществлено в результате реакции восстановительного аминирования, заключающейся в обработке аминных соединений 1-8 альдегидом, таким как формальдегид, ацетальдегид, бензальдегид или фенилацетальдегид, в присутствии кислоты Бренстеда или Льюиса, с образованием соответствующего соединения имина, с обработкой in situ восстанавливающим агентом, таким как триацетоксиборгидрид натрия или цианоборгидрид натрия.
Предпочтительными условиями при использовании водного раствора формальдегида являются хлорид цинка, ацетат натрия и цианоборгидрид натрия в метаноле при 50°С в течение ночи.
Предпочтительными условиями при использовании ацетальдегида, бензальдегида или фенилацетальдегида являются уксусная кислота, ацетат натрия и триацетоксиборгидрид натрия в 1,2-дихлорэтане при 50°С в течение ночи.
Стадия В: N-арилирование может быть осуществлено в результате обработки аминных соединений 1-8 арилиодидами в присутствии металлического катализатора, например с использованием опосредованной медью реакции Ульмана или катализируемой палладием реакции Бухвальда-Хартвига.
Предпочтительными условиями являются каталитическое количество оксида трехвалентного железа, каталитическое количество L-пролина и трет-бутилат натрия в DMSO (диметилсульфоксид) при 135°С в течение ночи в соответствии с методикой Guo и др. (Org. Lett. 2008, 10, 4513-4516).
Схема 11
Для случая, когда X представляет собой связь или -СН2-.
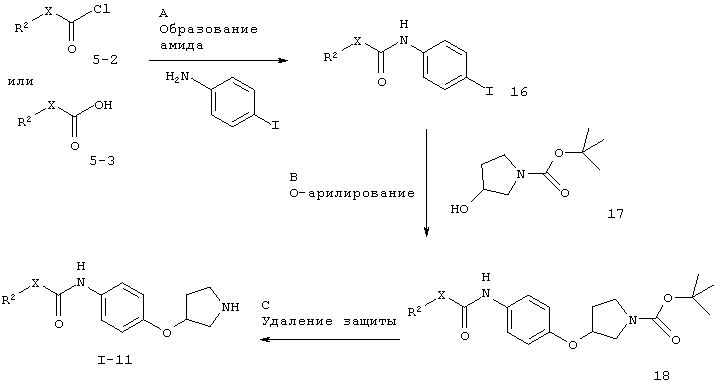
Заместители такие, как описано выше, а Х представляет собой связь или -CH2-.
Стадия А. Образование амида может быть осуществлено в результате реакции сочетания между ариламином и алкил- или арил-хлорангидридом кислоты 5-2 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются триэтиламин в THF при комнатной температуре в течение 4 часов.
Альтернативно, образование амида может быть осуществлено в результате реакции сочетания между ариламином и карбоновыми кислотами 5-3 в присутствии реагента сочетания, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ.
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50°С в течение 18 часов.
Стадия В. O-арилирование может быть осуществлено в результате обработки арилиодидов 16 производным гидроксипирролидина 17 (CAS 103057-44-9) в присутствии металлического катализатора, например с использованием опосредованной медью реакции Ульмана или катализируемой палладием реакции Бухвальда-Хартвига.
Предпочтительными условиями являются каталитическое количество иодида меди(1), каталитическое количество 1,10-фенантролина и карбонат цезия в отсутствие дополнительного растворителя при 130°С в течение ночи согласно методике Бухвальда и соавт.(Org. Lett. 2002, 4, 973-976).
Стадия С.Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 12
Для случая, когда Х представляет собой связь или -СН2-.
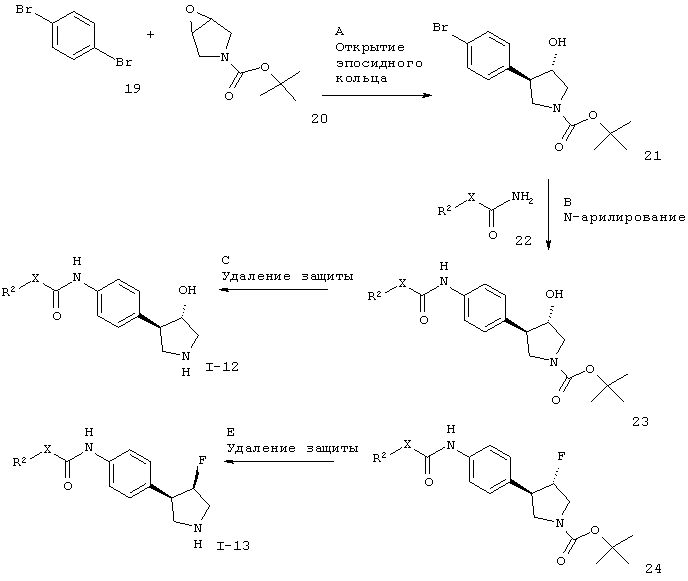
Заместители такие, как описано выше, а Х представляет собой связь или -СН2-.
Стадия А. Производное гидроксипирролидина 21 может быть получено в результате добавления 4-бром-фениллития к эпоксиду 20 (CAS 114214-49-2) в присутствии кислоты Льюиса, такой как эфират трифторида бора, при этом 4-бром-фениллитий может быть предварительно получен in situ путем обработки 1,4-дибромбензола 19 стехиометрическим эквивалентом н-бутиллития. Данная реакция может быть осуществлена в эфирных органических растворителях, таких как диэтиловый эфир или THF, предпочтительно при низкой температуре.
Предпочтительными условиями являются THF при -78°С в течение 30 мин для получения 4-бром-фениллития и затем -78°С в течение 2 часов для реакции раскрытия эпоксидного цикла.
Стадия В. N-арилирование может быть осуществлено в результате обработки арилбромида 21 амидными соединениями 22 в присутствии металлического катализатора, например с использованием опосредованной медью реакции Ульмана или катализируемой палладием реакции Бухвальда-Хартвига.
Предпочтительными условиями являются каталитическое количество иодида меди(1), каталитическое количество N,N'-диметилэтилендиамина и карбонат цезия в диоксане при 120°С в течение ночи согласно методике Бухвальда и соавт.(Org. Lett. 2007, 9, 4749-4751).
Стадия С.Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Стадия D. Фторирование спирта 23 может быть осуществлено в результате обработки фторирующим реагентом, таким как трифторид диэтиламиносеры (DAST), в апротонном органическом растворителе.
Предпочтительными условиями являются DAST в смеси ацетонитрила и 1,2-дихлорэтана при температуре от 0°С до комнатной температуры в течение 1 часа.
Стадия Е. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или W, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 13
Для случая, когда Х представляет собой связь или -CH2-.
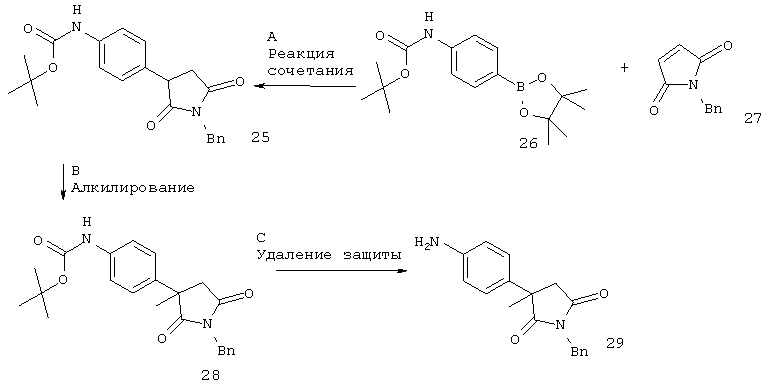
Заместители такие, как описано выше, а Х представляет собой связь или -СН2-.
Стадия А. Арилпирролидиндион 25 может быть получен с применением катализируемой металлом реакции перекрестного сочетания, например используя родий-катализируемое сопряженное присоединение эфира арилбороновой кислоты 26 (CAS 330793-01-6) к малеимиду 27 (CAS 1631-26-1).
Предпочтительными условиями являются каталитическое количество [RhCl(cod)]2, гидроксид калия в водном диоксане при 90°С в течение 5 минут в условиях облучения микроволнами согласно методике lyer и др. (Tetrahedron Lett. 2007, 48,4413-4418).
Стадия В. Алкилирование может быть осуществлено в результате обработки алкилбромидом или алкилиодидом в присутствии неорганического основания, такого как карбонат натрия или карбонат цезия, в полярном апротонном органическом растворителе, таком как DMF, при температуре от комнатной температуры до температуры дефлегмации растворителя.
Предпочтительными условиями являются использование метилиодида и карбоната цезия в DMF при комнатной температуре в течение 1 часа.
Стадия С. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или Н3РО4, или органических кислот, таких как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Стадия D. Восстановление может быть осуществлено в результате обработки карбамата 29 восстанавливающим агентом на основе гидрида алюминия, таким как алюмогидрид лития, в эфирном растворителе, таком как THF или диоксан, при температурах от комнатной температуры до температуры дефлегмации растворителя.
Предпочтительными условиями являются THF при 70°С в течение 1 часа.
Стадия Е. Образование амида может быть осуществлено в результате реакции сочетания между амином 30 и соединениями 5-2, представляющими собой алкил- или арил-хлорангидриды кислот, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются триэтиламин в THF при комнатной температуре в течение 3 часов.
Альтернативно, образование амида может быть осуществлено в результате реакции сочетания между амином 30 и карбоновыми кислотами 5-3 в присутствии реагента сочетания, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ.
Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50°С в течение 18 часов.
Стадия F. Удаление бензильной защитной группы может быть осуществлено в результате гидрирования водородом при нормальном, или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в растворителях, таких как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси.
Предпочтительными условиями являются формиат аммония в присутствии палладия на угле в МеОН при 100°С в течение 1 часа.
Схема 14
Для случая, когда Х представляет собой связь или -СН2-.
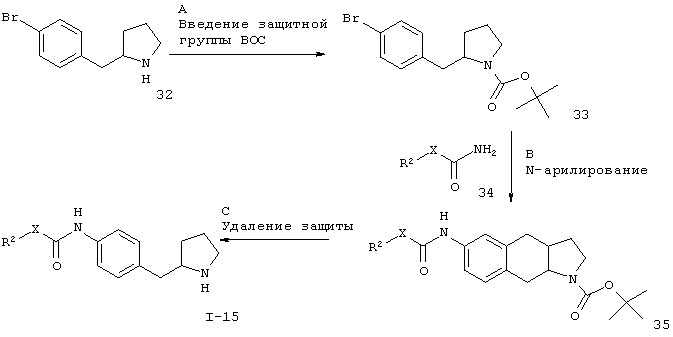
Заместители такие, как описано выше, а Х представляет собой связь или -CH2-.
Стадия А. Введение защитной группы ВОС может быть осуществлено в результате обработки производного бензил-пирролидина 32 (CAS 383127-68-2) ди-трет-бутилдикарбонатом в присутствии органического основания, такого как N,N-диизопропилэтиламин или триэтиламин, в апротонных растворителях, таких как дихлорметан, 1,2-дихлорэтан, диоксан, THF или DMF, или с использованием неорганических оснований, таких как гидроксид натрия или карбонат натрия, в системах водных растворителей, таких как вода, водный этанол или водный метанол.
Предпочтительными условиями являются N,N-диизопропилэтиламин в 1,2-дихлорэтане при комнатной температуре в течение 1 часа.
Стадия В. N-арилирование может быть осуществлено в результате обработки арилбромида 33 амидными соединениями 34 в присутствии металлического катализатора, например с использованием опосредованной медью реакции Ульмана или катализируемой палладием реакции Бухвальда-Хартвига.
Предпочтительными условиями являются каталитическое количество иодида меди(1), каталитическое количество N,N'-диметилэтилендиамина и карбонат цезия в диоксане при 120°С в течение ночи согласно методике Бухвальда и соавт.(Org. Lett. 2007, 9, 4749-4751).
Стадия С. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Схема 15
X представляет собой связь или -СН2-.

Заместители такие, как описано выше, а Х представляет собой связь или -CH2-, и Y представляет собой -CH2- или -CH2CH2-.
Стадия А. Реакция Виттинга-Хорнера между диалкиловым эфиром бензил-замещенной фосфоновой кислоты 36 (CAS 2609-49-6) и альдегидом 37 (например, трет-бутиловым эфиром (RS)-3-формил-пирролидин-1-карбоновой кислоты [CAS 59379-02-1] или mpem-бутиловым эфиром (RS)-3-формил-пиперидин-1-карбоновой кислоты [CAS 118156-93-7]) может быть осуществлена с использованием основания, такого как NaH, KOtBu, NaOMe, NaOEt, н-BuLi, LiHMDS (гексаметилдисилазид лития), NaHMDS, KHMDS, LDA (диизопропиламид лития), в растворителе, таком как THF, диоксан, ацетонитрил, 1,2-диметоксиэтан, DMF, бензол, толуол или их смеси, при температурах от -78°С до 80°С в течение 15 мин -8 ч и, если целесообразно, с возможным добавлением краун-эфира для образования илида и затем конденсацией этого илида с карбонильным соединением в том же растворителе при температуре от 0 до 80°С в течение 1-24 ч. Альтернативно, основание, карбонильное соединение и возможно краун-эфир могут быть добавлены в реакционную смесь одновременно, без предварительного образования илида при температурах от -78°С до 80°С.
Предпочтительными условиями являются образование илида при -78°С с использованием раствора LDA в смеси гексан/ТНР в качестве основания и THF в качестве растворителя, взаимодействие с эфиром фосфоновой кислоты в течение 60 мин при -78°С, далее конденсация с карбонильным компонентом при -78°С и затем перенос с целью нагревания до комнатной температуры в течение ночи.
Стадия В. Одновременное восстановление алкена и функциональной нитрогруппы может быть осуществлено в результате гидрирования водородом при нормальном или повышенном давлении, либо гидрирования с переносом с использованием формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в таких растворителях, как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc, CH2Cl2, CHCl3, DMF или их смеси. Альтернативно, восстановление алкена может быть осуществлено под действием Mg в МеОН или под действием UAIH4 в THF или диэтиловом эфире.
Предпочтительными условиями являются гидрирование в присутствии Pd/C в качестве катализатора с МеОН в качестве растворителя.
Стадия С.Образование амида может быть осуществлено в результате реакции сочетания между амином 39 и алкил- или арил-хлорангидридом кислоты 5-2 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются триэтиламин в THF при комнатной температуре в течение 3 часов.
Альтернативно, образование амида может быть осуществлено в результате реакции сочетания между амином 39 и карбоновыми кислотами 5-3 в присутствии реагента сочетания, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ.
Предпочтительными условиями являются TBTU с использованием N-метилморфолина в THF при 50°С в течение 18 часов.
Стадия D. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Аналогично, осуществление следующих далее стадий A-D, начиная с альдегида 37" (трет-бутилового эфира (RS)-2-формил-пирролидин-1-карбоновой кислоты [CAS 117625-90-8]) вместо альдегида 37, приводит к получению продукта 1-16' вместо 1-16.
Схема 16
X представляет собой -NH- или -CH2NH-.

Заместители такие, как описано выше, и Х представляет собой -NH- или -CH2NH-.
Стадия А. Образование мочевины может быть осуществлено в результате взаимодействия ариламина 39 с трифосгеном и с алкил- или арил-амином 41 в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, или полярных органических растворителях, таких как DMF, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин.
Предпочтительными условиями являются трифосген и триэтиламин в дихлорэтане при 80°С в течение 18 ч.
Стадия В. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н2О, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Аналогично, осуществление следующих далее стадий А и В, начиная с амина 39' вместо амина 39, приводит к получению продукта 1-17' вместо 1-17.
Схема 17
Для случая, когда Х представляет собой связь или -СН2-.

В качестве примера использования:



Заместители такие, как описано выше, а Х представляет собой связь или -СН2-.
Стадия А. Введение защитной группы ВОС может быть осуществлено в результате обработки циклического амина 43 ди-трет-бутилдикарбонатом в присутствии органического основания, такого как N,N-диизопропилэтиламин или триэтиламин, в апротонных растворителях, таких как дихлорметан, 1,2-дихлорэтан, диоксан, THF или DMF, или с использованием неорганических оснований, таких как гидроксид натрия или карбонат натрия, в системах водных растворителей, таких как вода, водный этанол или водный метанол. Примеры соответствующих циклических аминов 43 включают производные пирролидина, такие как 43-а [CAS 328546-98-1], производные пиперидина, такие как 43-b [CAS 769944-72-1], и производные морфолина, такие как 43-с [CAS 83555-73-1].
Предпочтительными условиями являются N,N-диизопропилэтиламин в THF при комнатной температуре в течение 18 часов.
Стадия В. N-арилирование может быть осуществлено в результате обработки арилбромида 44 амидными соединениями 34 в присутствии металлического катализатора, например с использованием опосредованной медью реакции Ульмана или катализируемой палладием реакции Бухвальда-Хартвига.
Предпочтительными условиями являются каталитическое количество иодида меди(1), каталитическое количество N,N'-диметилэтилендиамина и карбонат цезия в диоксане в герметично закрытой пробирке, нагреваемой в микроволновой печи при 180°С в течение 2 часов, согласно модификации (нагревание микроволнами) методики Бухвальда и соавт.(Org. Lett. 2007, 9, 4749-4751).
Стадия С. Удаление N-защитной группы ВОС может быть проведено с использованием минеральных кислот, таких как HCl, H2SO4 или H3PO4, или органических кислот, таких как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или H2O, при 0-80°С.
Предпочтительными условиями являются 4 н. HCl в диоксане и THF при 60°С в течение ночи.
Выделение и очистка соединений
Выделение и очистка соединений и промежуточных соединений, изложенных в данном описании, при желании могут быть осуществлены посредством любой подходящей методики выделения и очистки, такой как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография низкого и высокого давления или комбинация этих методик. Конкретные иллюстрации подходящих методик разделения и выделения могут быть приведены посредством ссылки на подготовительные примеры и примеры, представленные в данном описании ниже. Однако, несомненно, также могут быть использованы другие эквивалентные методики разделения и выделения. Рацемические смеси хиральных соединений формулы I могут быть разделены с использованием хиральной HPLC (жидкостной хроматографии высокого давления).
Соли соединений формулы 1
Соединения формулы 1 являются основными и могут быть преобразованы в соответствующие соли присоединения кислоты. Превращение осуществляется путем обработки по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и тому подобное. Обычно, свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и тому подобное, и кислоту добавляют в том же растворителе. Температуру поддерживают в диапазоне от 0°С до 50°С. Полученная соль выпадает в осадок самопроизвольно или может быть выделена из раствора с использованием менее полярного растворителя.
Полученные присоединением кислоты соли основных соединений формулы 1 могут быть преобразованы в соответствующие свободные основания путем обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Пример 1 (RS)-1-(4-Бутил-2-метил-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевина;
гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 6, используя 4-бутил-2-метил-фенилизоцианат (CAS 306935-81-9) вместо фенилизоцианата. Белое твердое вещество. MS (масс-спектр) (ISP (индуктивно-связанная плазма)): 352,4 ([М+Н]+).
Пример 2 1-(3,4-Дихлор-фенил)-3-[4-(4-метил-пиперазин-1-ил)-фенил]-мочевина

К перемешиваемой суспензии 4-(4-метил-пиперазин-1-ил)-фениламина (195 мг; CAS 16153-81-4) в DMF (5 мл) добавляли 3,4-дихлорфенилизоцианат (191 мг; CAS 102-36-3) и перемешивание продолжали при комнатной температуре в течение 2 ч. Затем смесь разбавляли этилацетатом (20 мл) и водой (20 мл), вследствие чего образовывался осадок. Осадок собирали фильтрацией, промывали этилацетатом и сушили в вакууме, получая 1-(3,4-дихлор-фенил)-3-[4-(4-метил-пиперазин-1-ил)-фенил]-мочевину (317 мг; 82%) в виде беловатого твердого вещества. MS (ISP): 381,1 ([{37}СМ-Н]-), 379,2 ([{37Cl35C}M-H]-), 377,0 ([{35Cl}M-H]-).
Пример 3
(RS)-1-(3,4-Дихлор-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 6, используя 3,4-дихлор-фенилизоцианат (CAS 102-36-3) вместо фенилизоцианата. Белое твердое вещество. MS (ISP): 352,1 ([{37Cl}М-Н]-), 350,2 ([{37Cl35Cl}M-H]-), 348,0 ([{35Cl}M-H]-).
Пример 4
1-[4-(4-Метил-пиперазин-1-ил)-фенил]-3-(4-оксазол-5-ил-фенил)-мочевина

К перемешиваемой суспензии 1-(4-изоцианатофенил)-4-метилпиперазина (75 мг; CAS 879896-39-6) в DMF (2 мл) добавляли 4-(1,3-оксазол-5-ил)анилин (55 мг; CAS 1008-95-3) и перемешивание продолжали при комнатной температуре в течение 17 ч. Затем смесь разбавляли этилацетатом (10 мл) и водой (10 мл), вследствие чего образовывался осадок. Осадок собирали фильтрацией, промывали этилацетатом и сушили в вакууме, получая 1-[4-(4-метил-пиперазин-1-ил)-фенил]-3-(4-оксазол-5-ил-фенил)-мочевину (41 мг; 31%) в виде белого твердого вещества. MS (ISP): 376,1 ([М-Н]-).
Пример 5
(RS)-1-(4-Хлор-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 6, используя 4-хлор-фенилизоцианат (CAS 104-12-1) вместо фенилизоцианата. Белое твердое вещество. MS (ISP): 318,1 ([{37Cl}М+Н]+), 316,1 ([{35Cl}М+Н]+).
Примере
(RS)-1-Фенил-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид
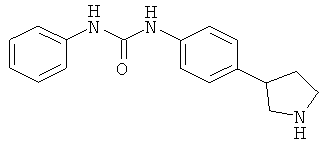
a) (RS)-3-[4-(3-Фенил-уреидо)-фенил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата (70 мг; CAS 908334-28-1) в дихлорметане (2,5 мл) добавляли фенилизоцианат (0,03 мл) и перемешивание продолжали при комнатной температуре в течение 3 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-3-[4-(3-фенил-уреидо)-фенил]-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (102 мг; колич.) в виде светло-желтого твердого вещества. MS (ISP): 404,3 ([M+Na]+), 399,2 ([M+NH4]+), 382,2 ([M+H]+), 326,3 ([М+Н-C4H8]+).
b) (RS)-1-Фенил-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид
К перемешиваемому раствору (RS)-3-[4-(3-фенил-уреидо)-фенил]-пирролидин-1-карбоновой кислоты mpem-бутилового эфира (92 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,60 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и разбавляли диэтиловым эфиром (5 мл). Полученные кристаллы собирали фильтрацией, промывали диэтиловым эфиром и сушили в вакууме при 60°С, что позволило получить (RS)-1-фенил-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид (52 мг; 68%) в виде белого кристаллического твердого вещества. MS (ISP): 282,2 ([M+H]+).
Пример 7
(RS)-1-(2,4-Дихлор-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 6, используя 2,4-дихлор-фенилизоцианат (CAS 2612-57-9) вместо фенилизоцианата. Белое твердое вещество. MS (ISP): 354,1 ([{37Cl}М+Н]+), 352,1 ([{37Cl35Cl}M+H]+), 350,1 ([{35Cl}М+Н]+).
Пример 8
(RS)-1-(3-Хлор-фенил)-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид
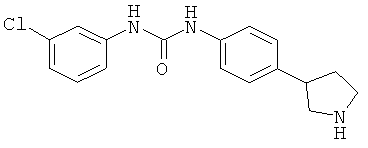
Указанное в заголовке соединение получали аналогично Примеру 6, используя 3-хлор-фенилизоцианат (CAS 2909-38-8) вместо фенилизоцианата. Белое твердое вещество. MS (ISP): 318,1 ([{37Cl}М+Н]+), 316,1 ([{35Cl}М+Н]+).
Пример 9
(RS)-1-Бензил-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид
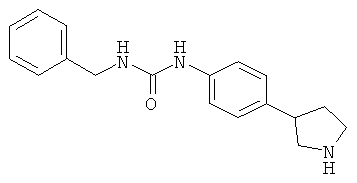
Указанное в заголовке соединение получали аналогично Примеру 6, используя бензилизоцианат вместо фенилизоцианата. Беловатое твердое вещество. MS (ISP): 296,2 ([М+Н]+).
Пример 10
(RS)-1-Циклогексил-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 6, используя циклогексилизоцианат вместо фенилизоцианата. Беловатое твердое вещество. MS (ISP): 288,2 ([М+Н]+).
Пример 11
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты фенилового эфира гидрохлорид
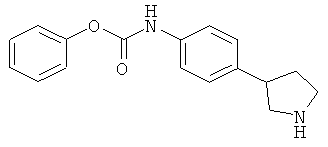
a) (RS)-3-(4-Феноксикарбониламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата (80 мг; CAS 908334-28-1) в THF (2 мл) последовательно добавляли тризтиламин (0,05 мл) и фенилхлорформиат (0,04 мл) и перемешивание продолжали при комнатной температуре в течение 18 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-3-(4-феноксикарбониламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (102 мг; 87%) в виде белого твердого вещества. MS (ISP): 405,3 ([M+Na]+), 400,1 ([M+NH4]+), 327,2 ([M+H-С4Н8]+).
b) (RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты фенилового эфира гидрохлорид
К перемешиваемому раствору (RS)-3-(4-феноксикарбониламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (98 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,64 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и разбавляли диэтиловым эфиром (5 мл). Полученные кристаллы собирали фильтрацией, промывали диэтиловым эфиром и сушили в вакууме при 60°С, что позволило получить (RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты фенилового эфира гидрохлорид (52 мг; 68%) в виде белого кристаллического твердого вещества. MS (ISP): 283,1 ([М+Н]+).
Пример 12
(RS)-2-Фенил-N-(4-пирролидин-3-ил-фенил)-ацетамида гидрохлорид

a) (RS)-3-(4-Фенилацетиламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата (80 мг; САЗ 908334-28-1) в THF (2 мл) последовательно добавляли триэтиламин (0,05 мл) и фенилацетилхлорид (0,04 мл) и перемешивание продолжали при комнатной температуре в течение 18 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-3-(4-фенилацетиламино-фенил)-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (95 мг; 82%) в виде белого твердого вещества. MS (ISP): 403,2 ([M+Na]+), 398,2 ([M+NH4]+), 325,3 ([М+Н-C4H8]+).
b) (RS)-2-Фенил-N-(4-пирролидин-3-ил-фенил)-ацетамида гидрохлорид
К перемешиваемому раствору (RS)-3-(4-фенилацетиламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (91 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,60 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и разбавляли диэтиловым эфиром (5 мл). Полученные кристаллы собирали фильтрацией, промывали диэтиловым эфиром и сушили в вакууме при 60°С, что позволило получить (RS)-2-фенил-N-(4-пирролидин-3-ил-фенил)-ацетамида гидрохлорид (63 мг; 83%) в виде беловатого кристаллического твердого вещества. MS(ISP): 281,1 (M+H]+).
Пример 13
(RS)-N-(4-Пирролидин-3-ил-фенил)-бензамида гидрохлорид
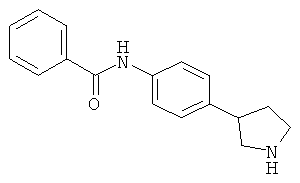
Указанное в заголовке соединение получали аналогично Примеру 12, используя бензоилхлорид вместо фенилацетилхлорида. Белое твердое вещество. MS (ISP): 267,1 ([М+Н]+).
Пример 14
(RS)-1-Метил-1-фенил-3-(4-пирролидин-3-ил-фенил)-мочевина
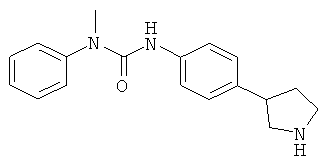
Указанное в заголовке соединение получали аналогично Примеру 11, используя N-метил-N-фенилкарбамоилхлорид вместо фенилхлорформиата. Бесцветное масло. MS (ISP): 296,3 ([М+Н]+).
Пример 15
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 4-фтор-фенилового эфира гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 11, используя 4-фтор-фенилхлорформиат вместо фенилхлорформиата. Белое твердое вещество. MS (ISP): 301,1 ([М+Н]+).
Пример 16
(RS)-4-Хлор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 12, используя 4-хлор-бензоилхлорид вместо фенилацетилхлорида. Белое твердое вещество. MS (ISP): 303,1 ([{37Cl}M+H]+), 301,1 ([{35Cl}M+H]+).
Пример 17
(RS)-2-(4-Хлор-фенил)-N-(4-пирролидин-3-ил-фенил)-ацетамида гидрохлорид
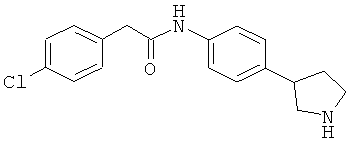
Указанное в заголовке соединение получали аналогично Примеру 12, используя 4-хлор-фенилацетилхлорид вместо фенилацетилхлорида. Белое твердое вещество. MS (ISP): 317,1 ([{37Cl}M+H]+), 315,1 ([{35Cl}М+Н}+]).
Пример 18
(RS)-N-(4-Пирролидин-3-ил-фенил)-4-трифторметил-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 12, используя 4-трифторметил-бензоилхлорид вместо фенилацетилхлорида. Белое твердое вещество. MS (ISP): 335,1 ([М+Н]+).
Пример 19
(RS)-2,4-Дихлор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 12, используя 2,4-дихлор-бензоилхлорид вместо фенилацетилхлорида. Беловатое твердое вещество. MS (ISP): 339,1 ([{37Cl}М+Н]+), 337,1 ([{37Cl35Cl}M+H]+), 335,1 ([{35Cl}М+Н]+).
Пример 20
(RS)-3-Хлор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 12, используя 3-хлор-бензоилхлорид вместо фенилацетилхлорида. Беловатое твердое вещество. MS (ISP): 303,1 ([{37Cl}М+Н]+), 301,1 ([{35Cl}M+H]+).
Пример 21
(RS)-Морфолин-4-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 11, используя 4-морфолинкарбонилхлорид вместо фенилхлорформиата. Беловатое твердое вещество. MS (ISP): 276,2 ([М+Н]+).
Пример 22
(RS)-Метил-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты фениловый эфир

a) (RS)-3-(4-Этоксикарбониламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
Указанное в заголовке соединение получали аналогично Примеру 11 (а), используя этилхлорформиат вместо фенилхлорформиата. Белое твердое вещество. MS (ISP): 357,2 ([M+Na]+), 352,2 ([M+NH4]+), 279,2 ([М+Н-C4H8]+).
b) (RS)-3-(4-Метиламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору (RS)-3-(4-этоксикарбониламино-фенил)-пирролидин-1-карбоновой кислоты mpem-бутилового эфира (690 мг) в THF (9 мл) по каплям добавляли раствор Red-Al (1,77 мл; 3,5 М раствор в толуоле), затем смесь перемешивали при комнатной температуре в течение 5 ч и при 50°С в течение 15 мин. Затем смесь охлаждали до 0°С и гасили, по каплям добавляя 1 М водн. раствор гидроксида натрия. Смесь разбавляли этилацетатом и затем промывали насыщенным рассолом. Органическую фазу отделяли, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), что позволило получить (RS)-3-(4-метиламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (580 мг; колич.) в виде бесцветного масла. MS (ISP): 299,4 ([M+Na]+), 221,3 ([M+H-С4Н8]+).
c) (RS)-3-[4-(Метил-феноксикарбонил-амино)-фенил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
Указанное в заголовке соединение получали аналогично Примеру 11 (а), используя (RS)-3-(4-метиламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата. Бесцветное масло. MS (ISP): 419,3 ([M+Na]+), 414,3 ([М+NH4]+), 341,2 ([М+Н-С4Н8]+).
d) (RS)-Метил-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты фениловый эфир
Указанное в заголовке соединение получали аналогично Примеру 11 (b), используя (RS)-3-[4-(метил-феноксикарбонил-амино)-фенил]-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир вместо (RS)-3-(4-феноксикарбониламино-фенил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира. Бесцветное масло. MS (ISP): 297,3 ([M+NH4]+).
Пример 23
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 4-хлор-фенилового эфира гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 11, используя 4-хлор-фенилхлорформиат вместо фенилхлорформиата. Белое твердое вещество. MS (ISP): 319,1 ([{37Cl}М+Н]+), 317,2 ([{35Cl}М+Н]+).
Пример 24
(RS)-N-(4-Пирролидин-3-ил-фенил)-2-(4-трифторметил-фенил)-ацетамид

Указанное в заголовке соединение получали аналогично Примеру 12, используя 4-трифторметил-фенилацетилхлорид вместо фенилацетилхлорида. Бесцветное масло. MS (ISP): 349,2 ([М+Н]+).
Пример 25
(RS)-2-Фенил-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 12, используя 2-фенилпропионилхлорид вместо фенилацетилхлорида. Бесцветное масло. MS (ISP): 295,3 ([М+Н]+).
Пример 26
(RS)-1-(6-Хлор-пиридин-3-ил)-3-(4-пирролидин-3-ил-фенил)-мочевины
гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 6, используя 2-хлор-5-изоцианатопиридин (САЗ 125117-96-6) вместо фенилизоцианата. Беловатое твердое вещество. MS (ISP): 319,1 ([{37Cl}М+Н]+), 317,2([{35Cl}М+Н]+).
Пример 27
(RS)-1-(4-Пирролидин-3-ил-фенил)-3-(4-трифторметил-фенил)-мочевины гидрохлорид
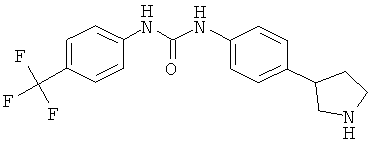
Указанное в заголовке соединение получали аналогично Примеру 6, используя 4-трифторметил-фенилизоцианат вместо фенилизоцианата. Беловатое твердое вещество. MS (ISP): 250,2 ([M+H]+).
Пример 28
(RS)-Пиперидин-1-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амид

Указанное в заголовке соединение получали аналогично Примеру 11, используя 1-пиперидинкарбонилхлорид вместо фенилхлорформиата. Бесцветное аморфное твердое вещество. MS (ISP): 274,3 ([M+H]+).
Пример 29
(R)-2-Фенил-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид

а) (RS)-3-[4-((R)-2-Фенил-пропиониламино)-фенил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата (70 мг; CAS 908334-28-1) в THF (2 мл) последовательно добавляли N-метилморфолин (0,12 мл), TBTU (171 мг) и (R)-2-фенилпропионовую кислоту (60 мг) и смесь нагревали при 50°С в течение 18 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-3-[4-((R)-2-фенил-пропиониламино)-фенил]-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (107 мг; колич.) в виде бесцветного масла. MS (ISP): 417,3 ([M+Na]+), 412,3 ([M+NH4]+), 395,2 ([M+H]+), 339,2 ([M+H-C4H8]+).
b) (R)-2-Фенил-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид
К перемешиваемому раствору (RS)-3-[4-((R)-2-фенил-пропиониламино)-фенил]-пирролидин-1-карбоновой кислоты трет-бутилового эфира (100 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,95 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и подщелачивали, добавляя 5 М водн. раствор гидроксида натрия. Смесь разбавляли этилацетатом/THF (1:1), затем разделяли фазы. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), что позволило получить (R)-2-фенил-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид (63 мг; 83%) в виде аморфного бесцветного твердого вещества. MS (ISP): 295,2 ([М+Н]+).
Пример 30
(S)-2-Фенил-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-2-фенилпропионовую кислоту вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 295,2 ([М+Н]+).
Пример 31
(RS)-3-(2-Хлор-фенил)-N-(4-пирролидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 3-(2-хлор-фенил)пропионовую кислоту вместо (R)-2-фенилпропионовой кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 331,1 ([{37Cl}M+H]+), 329,1 ([{35Cl{M+H]+).
Пример 32 (RS)-4-Хлор-N-[4-(1-метил-пирролидин-3-ил)-фенил]-бензамид
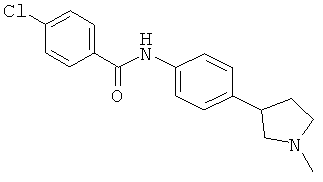
К перемешиваемой суспензии (RS)-4-хлор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорида (100 мг; Пример 16) в метаноле (5 мл) последовательно добавляли ацетат натрия (24 мг), формальдегид (0,11 мл; 37%-ный водный раствор), хлорид цинка (162 мг) и цианоборгидрид натрия (65 мг) и смесь нагревали при 50°С в течение ночи. Затем смесь охлаждали до комнатной температуры и подщелачивали, добавляя по каплям 25%-ный водн. раствор аммиака. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (Isolute® Flash-NH2 от Separtis; градиент: гептан/этилацетат/метанол), что позволило получить (RS)-4-хлор-N-[4-(1-метил-пирролидин-3-ил)-фенил]-бензамид (80 мг; 86%) в виде белого твердого вещества. MS (ISP): 317,2 ([{37Cl}М+Н]+), 315,2 ([{35Cl}М+Н]+).
Пример 33
(RS)-4-Хлор-N-[4-(1-этил-пирролидин-3-ил)-фенил]-бензамид

К перемешиваемой суспензии (RS)-4-хлор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорида (100 мг; Пример 16) в 1,2-дихлорэтане (6 мл) последовательно добавляли ацетат натрия (24 мг), ацетальдегид (0,08 мл), уксусную кислоту (0,02 мл) и триацетоксиборгидрид натрия (189 мг) и смесь нагревали при 50°С в течение ночи. Затем смесь охлаждали до комнатной температуры и подщелачивали, добавляя по каплям 25%-ный водн. раствор аммиака. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (Isolute® Flash-NH2 от Separtis; градиент: гептан/этилацетат/метанол), что позволило получить (RS)-4-хлор-N-[4-(1-этил-пирролидин-3-ил)-фенил]-бензамид (86 мг; 88%) в виде беловатого твердого вещества. MS (ISP): 331,3 ([{37Cl}M+H]+), 329,3 ([{35Cl}М+Н]+).
Пример 34
(RS)-N-[4-(1-Бензил-пирролидин-3-ил)-фенил]-4-хлор-бензамид

Указанное в заголовке соединение получали аналогично Примеру 33, используя бензальдегид вместо ацетальдегида. Белое твердое вещество. MS (ISP): 393,2 ([{37Cl}M+H]+), 391,2 ([{35Cl}M+H]+).
Пример 35
(RS)-N-[4-(1-Бензил-пирролидин-3-ил)-фенил]-4-хлор-бензамид
Указанное в заголовке соединение получали аналогично Примеру 33, используя фенилацетальдегид вместо ацетальдегида. Бесцветное масло. MS (ISP): 407,4 ([{37Cl}М+Н]+), 405,4 ([{35Cl}М+Н]+).
Пример 36
(RS)-4-Хлор-N-[4-(1-фенил-пирролидин-3-ил)-фенил]-бензамид

К перемешиваемому раствору (RS)-4-хлор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорида (200 мг; Пример 16) в DMSO (3 мл) последовательно добавляли иодбензол (242 мг), окись железа (19 мг), L-пролин (27 мг) и трет-бутилат натрия (171 мг) и смесь нагревали при 135°С в течение ночи. Затем смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Смесь последовательно промывали водой и насыщенным рассолом и затем органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-4-хлор-N-[4-(1-фенил-пирролидин-3-ил)-фенил]-бензамид (28 мг; 13%) в виде светло-желтого твердого вещества. MS (ISP): 407,4 ([{37Cl}M+H]+), 405,4 ([{35Cl}М+Н]+).
Пример 37
(RS)-2-(4-Хлор-фенил)-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-хлор-альфа-метилфенилуксусную кислоту вместо (R)-2-фенилпропионовой кислоты. Желтое масло. MS (ISP): 331,1 ([{37Cl}М+Н]+), 329,2 ([{35Cl}М+Н]+).
Пример 38
(RS)-2-Фенил-N-((RS)-4-пирролидин-3-ил-фенил)-бутирамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-2-фенилмасляную кислоту вместо (R)-2-фенилпропионовой кислоты. Желтое масло. MS (ISP): 309,2 ([М+Н]+).
Пример 39
(RS)-4-Хлор-N-[4-(пирролидин-3-илокси)-фенил]-бензамида гидрохлорид

a)4-Хлор-N-(4-иод-фенил)-бензамид
К перемешиваемой суспензии 4-иоданилина (1,50 г) в THF (20 мл) последовательно добавляли триэтиламин (1,90 мл) и 4-хлорбензоилхлорид (0,88 мл) и перемешивание продолжали при комнатной температуре в течение 4 ч. Затем смесь разбавляли этилацетатом и последовательно промывали 0,5 н. водн. раствором гидроксида натрия, насыщенным рассолом, 0,5 н. водн. соляной кислотой и окончательно насыщенным рассолом. Органическую фазу отделяли, сушили над Na2SO4 и концентрировали в вакууме, что позволило получить 4-хлор-N-(4-иод-фенил)-бензамид (2,55 г; колич.) в виде светло-коричневого твердого вещества. MS (EI (ионизация электронным ударом)): 359 ({37Cl}M+), 357 (35Cl}М+), 141 ([{37Cl}M-IC6H4NH]+), 139([35Cl}M-IC6H4NH]+).
b) (RS)-3-[4-(4-Хлор-бензоиламино)-фенокси]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
Перемешиваемую суспензию 4-хлор-N-(4-иод-фенил)-бензамида (500 мг), 1-ВОС-3-гидроксипирролидина (2,10 г; CAS 103057-44-9), иодида меди(1) (27 мг), 1,10-фенантролина (50 мг) и карбоната цезия (0,91 г) нагревали при 130°С в течение ночи. Затем смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Смесь последовательно промывали водой и насыщенным рассолом. Затем фазы разделяли, органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), что позволило получить (RS)-3-[4-(4-хлор-бензоиламино)-фенокси]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (47 мг; 8%) в виде светло-коричневого твердого вещества. MS (ISP): 436,2 ([{37Cl}M+NH4]+), 434,4 ([{35Cl}M+NH4]+), 363,1 ([{37Cl}М+Н-С4Н8]+), 361,2 ([{35Cl}М+Н-C4H8]+).
с) (RS)-4-Хлор-N-[4-(пирролидин-3-илокси)-фенил]-бензамида гидрохлорид
К перемешиваемому раствору (RS)-3-[4-(4-хлор-бензоиламино)-фенокси]-пирролидин-1-карбоновой кислоты mpem-бутилового эфира (45 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,40 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и разбавляли диэтиловым эфиром (5 мл). Полученные кристаллы собирали фильтрацией, промывали диэтиловым эфиром и сушили в вакууме 60°С, что позволило получить (RS)-4-хлор-N-[4-(пирролидин-3-илокси)-фенил]-бензамида гидрохлорид (31 мг; 81%) в виде светло-коричневого кристаллического твердого вещества. MS (ISP): 319,1 ([{37Cl}М+Н]+), 317,2 ([{35Cl}M+H]+).
Пример 40
(RS)-N-[4-(1-Бензил-3-метил-пирролидин-3-ил)-фенил]-4-хлор-бензамид
a) (RS)-[4-(1-Бензил-2,5-диоксо-пирролидин-3-ил)-фенил]-карбаминовой кислоты mpem-бутиловый эфир
Перемешиваемую суспензию 4-(ВОС-амино)бензолбороновой кислоты пинаколового эфира (4,40 г; CAS 330793-01-6), N-бензилмалеимида (2,84 г; CAS 1631-26-1), порошка гидроксида калия (0,77 г) и [RhCl(cod)]2 (0,27 г) в диоксане (48 мл) и воде (8 мл) в герметично закрытой пробирке нагревали при 90°С в течение 5 минут в условиях облучения микроволнами. Затем смесь охлаждали до комнатной температуры и фильтровали через целит.Фильтрат концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-[4-(1-бензил-2,5-диоксо-пирролидин-3-ил)-фенил]-карбаминовой кислоты трет-бутиловый эфир (3,83 г; 73%) в виде беловатого твердого вещества. MS (ISP): 398,2 ([M+NH4]+), 325,3 ([М+Н-C4H8]+).
b) (RS)-[4-(1-Бензил-3-метил-2,5-диоксо-пирролидин-3-ил)-фенил]-карбаминовой кислоты mjpem-бутиловый эфир
К перемешиваемой суспензии (RS)-[4-(1-бензил-2,5-диоксо-пирролидин-3-ил)-фенил]-карбаминовой кислоты трет-бутилового эфира (3,80 г) и карбоната цезия (9,76 г) в DMF (20 мл) при 0°С по каплям добавляли раствор йодистого метила (0,50 мл) в DMF (2 мл) и затем смесь перемешивали при комнатной температуре в течение 1 часа. Далее смесь разбавляли этилацетатом и полученную смесь последовательно промывали водой и насыщенным рассолом. Фазы разделяли, органическую фазу сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-[4-(1-бензил-3-метил-2,5-диоксо-пирролидин-3-ил)-фенил]-карбаминовой кислоты трет-бутиловый эфир (0,95 г; 24%) в виде желтого твердого вещества. MS (ISP): 412,4 ([M+NH4]+), 339,3 ([M+H-С4Н8]+).
c) (RS)-3-(4-Амино-фенил)-1-бензил-3-метил-пирролидин-2,5-дион
К перемешиваемому раствору (RS)-[4-(1-бензил-3-метил-2,5-диоксо-пирролидин-3-ил)-фенил]-карбаминовой кислоты трет-бутилового эфира (0,94 г) в THF (15 мл) по каплям добавляли раствор хлористого водорода в диоксане (8,9 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и разбавляли этилацетатом. Затем смесь подщелачивали, добавляя 5 М водн. раствор гидроксида натрия. Затем фазы разделяли и органический слой промывали насыщенным рассолом. Далее фазы разделяли, органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), что позволило получить (RS)-3-(4-амино-фенил)-1-бензил-3-метил-пирролидин-2,5-дион (0,57 г; 81%) в виде желтого твердого вещества. MS (ISP): 295,3 ([M+H]+).
d) (RS)-4-(1-Бензил-3-метил-пирролидин-3-ил)-фениламин
К перемешиваемому раствору (RS)-3-(4-амино-фенил)-1-бензил-3-метил-пирролидин-2,5-диона (0,56 г) в THF (20 мл) порциями добавляли алюмогидрид лития (0,29 г) и затем смесь перемешивали при 70°С в течение 1 часа. Затем смесь охлаждали до 0°С и гасили, добавляя по каплям 4 М водн. соляную кислоту. Затем смесь подщелачивали, добавляя 5 н. водн. раствор гидроксида натрия, и после этого разбавляли этилацетатом/THF (2:1) и далее промывали насыщенным рассолом. Органическую фазу отделяли, сушили над Na2SO4 и концентрировали в вакууме, что позволило получить (Р8)-4-(1-бензил-3-метил-пирролидин-3-ил)-фениламин (424 мг; 84%) в виде желтого масла. MS (ISP): 267,2 ([M+H]+).
e) (RS)-N-[4-(1-Бензил-3-метил-пирролидин-3-ил)-фенил]-4-хлор-бензамид
К перемешиваемой суспензии (RS)-4-(1-бензил-3-метил-пирролидин-3-ил)-фениламина (420 мг) в THF (5 мл) последовательно добавляли триэтиламин (0,55 мл) и 4-хлорбензоилхлорид (0,30 мл) и перемешивание продолжали при комнатной температуре в течение 3 ч. Затем смесь разбавляли этилацетатом и далее последовательно промывали водой и насыщенным рассолом. Органическую фазу отделяли, сушили над Na2S04 и концентрировали в вакууме. Остаток очищали колоночной хроматографией (Isolute® Flash-NH2 от Separtis; градиент: гептан/этилацетат/метанол), что позволило получить (RS)-N-[4-(1-бензил-3-метил-пирролидин-3-ил)-фенил]-4-хлор-бензамид (262 мг; 41%) в виде беловатого твердого вещества. MS (ISP): 407,4 ([{37Cl}М+Н]+), 405,4 ([{35Cl}M+H]+).
Пример 41
(RS)-N-[4-(3-Метил-пирролидин-3-ил)-фенил]-бензамид

К перемешиваемой суспензии (RS)-N-[4-(1-бензил-3-метил-пирролидин-3-ил)-фенил]-4-хлор-бензамида (36 мг) в метаноле (2 мл) добавляли формиат аммония (90 мг) и палладий на угле (19 мг; 10 масс.%-ный) и смесь нагревали при 100°С в течение 1 часа. Затем смесь охлаждали до комнатной температуры, фильтровали через целит и фильтрат концентрировали в вакууме. Остаток переносили в этилацетат и полученный раствор промывали насыщенным рассолом. Затем органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (Isolute® FIash-NH2 от Separtis; градиент: гептан/дихлорметан/метанол), получая (RS)-N-[4-(3-метил-пирролидин-3-ил)-фенил]-бензамид (12 мг; 48%) в виде желтого твердого вещества. MS (ISP): 281,2([M+H]+).
Пример 42
(RS)-5-Хлор-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 5-хлор-2-пиридинкарбоновую кислоту (САЗ 86873-60-1) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 304,1 ([{37Cl}M+H]+), 302,2 ([{35Cl}М+Н]+).
Пример 43
(RS)-6-Хлор-пиридин-3-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид
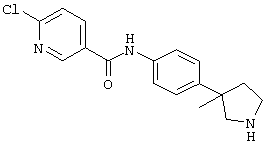
Указанное в заголовке соединение получали аналогично Примеру 29, используя 6-хлорникотиновую кислоту (CAS 5326-23-8) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 304,1 ([{37Cl}М+Н]+), 302,2 ([{35Cl}М+Н]+).
Пример 44
(RS)-1-(5-Хлор-пиридин-2-ил)-3-(4-пирролидин-3-ил-фенил)-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 6, используя 5-хлор-2-изоцианатопиридин (CAS 95735-68-5) вместо фенилизоцианата. Беловатое твердое вещество. MS (ISP): 319,1 ([{37Cl}М+Н]+), 317,2 ([{35М+Н]+).
Пример 45
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 4,4-дифтор-циклогексиловый эфир

а) (RS)-3-(4-Изоцианато-Фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата (500 мг; CAS 908334-28-1) в дихлорметане (8 мл) последовательно добавляли триэтиламин (0,53 мл) и трифосген (209 мг) и смесь нагревали при 45°С в течение 18 ч. Затем смесь концентрировали в вакууме, остаток ресуспендировали в диэтиловом эфире (15 мл) и перемешивали при комнатной температуре в течение 5 мин. Полученные в результате кристаллы извлекали фильтрацией и фильтрат концентрировали в вакууме, что позволило получить (RS)-3-(4-изоцианато-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (600 мг; колич.) в виде желтого масла, которое использовали на следующей стадии без дальнейшей очистки.
b) (RS)-3-[4-(4,4-Дифтор-циклогексилоксикарбониламино)-фенил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (RS)-3-(4-изоцианато-фенил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (110 мг) в THF (1 мл) последовательно добавляли N,N-диизопропилэтиламин (0,13 мл) и 4,4-дифтор-циклогексанол (68 мг; CAS 22419-35-8) и смесь нагревали при 110°С в течение 18 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-3-[4-(4,4-дифтор-циклогексилоксикарбониламино)-фенил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (20 мг; 12%) в виде беловатого твердого вещества. MS (ISP): 447,4 ([M+Na]+), 442,4 ([M+NH4]+), 369,2 ([M+H-C4H8]+).
c) (RS)-(4-Пирролидин-3-ил-Фенил)-карбаминовой кислоты 4.4-дифтор-циклогексиловый эфир
К перемешиваемому раствору (RS)-3-[4-(4,4-дифтор-циклогексилокси-карбониламино)-фенил]-пирролидин-1-карбоновой кислоты трет-бутилового эфира (20 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,18 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и подщелачивали, добавляя 5 М водн. раствор гидроксида натрия. Смесь разбавляли этилацетатом/THF (1:1), затем фазы разделяли. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (Isolate® Flash-NH2 от Separtis; градиент: гептан/дихлорметан/метанол), что позволило получить (RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 4,4-дифтор-циклогексиловый эфир (10 мг; 65%) в виде аморфного желтого твердого вещества. MS (ISP): 325,4 ([М+Н]+).
Пример 46
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-фтор-фенил)-этиловый эфир
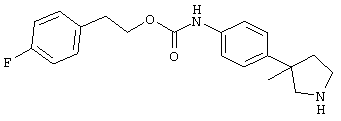
Указанное в заголовке соединение получали аналогично Примеру 45, используя 4-фтор-фенилэтиловый спирт вместо 4,4-дифторциклогексанола. Желтое аморфное твердое вещество. MS (ISP): 329,3 ([М+Н]+).
Пример 47
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 4-фтор-бензилового эфира гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 45, используя 4-фтор-бензиловый спирт вместо 4,4-дифторциклогексанола. Белое твердое вещество. MS (ISP): 351,2 ([М+Н]+).
Пример 48
(S)-2-Метокси-2-фенил-N-((RS)-4-пирролидин-3-ил-фенил)-ацетамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-альфа-метоксифенилуксусную кислоту (CAS 26164-26-1) вместо (R)-2-фенилпропионовой кислоты. Желтое масло. MS (ISP): 311,3 ([М+Н]+).
Пример 49 (R)-2-Метокси-2-фенил]-((RS)-4-пирролидин-3-ил-фенил)-ацетамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-альфа-метоксифенилуксусную кислоту (CAS 3966-32-3) вместо (R)-2-фенилпропионовой кислоты. Бесцветное масло. MS (ISP): 311,3 ([М+Н]+).
Пример 50 (RS)-2-(4-Бром-фенил)-2-метокси-N-((RS)-4-пирролидин-3-ил-фенил)-ацетамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-(4-бром-фенил)-метокси-уксусную кислоту (CAS 16053-90-0) вместо (R)-2-фенилпропионовой кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 391,1 ([{81Br}М+Н]+), 389,0 ([{79Br}М+Н]+).
Пример 51
(RS)-4-Метоксиметил-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-метоксиметил-бензойную кислоту (CAS 67003-50-3) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 311,3 ([М+Н]+).
Пример 52
(RS)-4-Этокси-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-этокси-бензойную кислоту (CAS 619-86-3) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 311,3 ([М+Н]+).
Пример 53
(RS)-4-Пропил-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-пропил-бензойную кислоту (CAS 2438-05-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 309,2 ([M+H]+).
Пример 54
(RS)-4-Этинил-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-этинил-бензойную кислоту (CAS 10602-00-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 291,2 ([M+H]+).
Пример 55
(RS)-4-Циано-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-циано-бензойную кислоту (CAS 619-65-8) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 292,1 ([М+Н]+).
Пример 56
(RS)-3,4-Дихлор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 3,4-дихлор-бензойную кислоту вместо (R)-2-фенилпропионовой кислоты.
Белое твердое вещество. MS (ISP): 339,2 ([{37Cl}М+Н]+), 337,2 ([{37Cl35Cl}M+H]+), 335,1 ([{35Cl}М+Н]+).
Пример 57
4-Хлор-N-(4-пиперидин-4-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя трет-бутил-4-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 170011-57-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-бензойную кислоту вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 317,1 ([{37Cl}М+Н]+), 315,1 ([35Cl}M+H]+).
Пример 58
(RS)-4-Хлор-N-(4-пиперидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-бензойную кислоту вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 317,1 ([{37Cl}M+H]+), 315,1 ([{35Cl}М+Н]+).
Пример 59
4-Хлор-N-(4-пиперазин-1-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя трет-бутил-4-(4-аминофенил)-1-пиперазинкарбоксилат (CAS 170911-92-9) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-бензойную кислоту вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 318,1 ([{37Cl}М+Н]+), 316,1 ([{35Cl}М+Н]+).
Пример 60
(RS)-2-(4-Хлор-фенил)-2-метокси-N-((RS)-4-пирролидин-3-ил-фенил)-ацетамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (4-хлор-фенил)-метокси-уксусную кислоту (CAS 4674-24-2) вместо (R)-2-фенилпропионовой кислоты. Желтое твердое вещество. MS (ISP): 347,2 ([{37Cl}M+H]+), 345,1 ([{35Cl}M+H]+).
Пример 61
(RS)-N-((RS)-4-Пирролидин-3-ил-сренил)-2-(3-трифторметил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-2-(3-трифторметил-фенил)-пропионовую кислоту (CAS 68718-08-1) вместо (R)-2-фенилпропионовой кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 363,3 (М+Н]+).
Пример 62
(RS)-N-(4-Пирролидин-3-ил-фенил)-2-(3-трифторметокси-фенил)-пропионамид
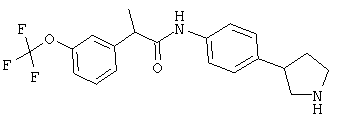
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-2-(3-трифторметокси-фенил)-пропионовую кислоту вместо (R)-2-фенилпропионовой кислоты. Желтое аморфное твердое вещество. MS (ISP): 379,3 (М+Н]+).
Пример 63
4-Хлор-N-[4-((3RS,4SR)-4-гидрокси-пирролидин-3-ил)-фенил]-бензамида гидрохлорид

а} (3RS,4SR)-3-(4-Бром-фенил)-4-гидрокси-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору 1,4-дибромбензола (3,49 г) в безводном THF (30 мл) в атмосфере аргона при -78°С по каплям добавляли раствор н-бутиллития (9,25 мл; 1,6 М раствор в гексане) и перемешивание продолжали в течение 30 мин. Затем по каплям добавляли эфират трифторида бора (1,86 мл) и перемешивание продолжали в течение следующих 10 мин. Затем по каплям добавляли раствор (1R,5S)-6-окса-3-аза-бицикло[3.1.0]гексан-3-карбоновой кислоты mpem-бутилового эфира (1,37 г; CAS 114214-49-2) в THF (4 мл) и смесь перемешивали при -78°С в течение следующих 2 ч, затем гасили, добавляя по каплям водный раствор бикарбоната натрия (20 мл). Смесь оставляли нагреваться до комнатной температуры и затем разбавляли смесью этилацетат/THF (1:1). Смесь промывали насыщенным рассолом, затем фазы разделяли, органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (3RS,4SR)-3-(4-бром-фенил)-4-гидрокси-пирролидин-1-карбоновой кислоты трет-бутиловый эфир в виде бесцветного аморфного твердого вещества. MS (ISP): 344,0 ([{81Br}М+Н]+), 342,0 ([{79Br}М+Н]+), 288,0 ([{81Br}М+Н4Н8]+), 286,0 ([{79Br}М+Н-C4H8]+).
b) (3RS.4SR-3-[4-(4-Хлор-бензоиламино)-фенил]-4-гидрокси-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
Перемешиваемую суспензию (3RS,48R)-3-(4-бром-фенил)-4-гидрокси-пирролидин-1-карбоновой кислоты mpem-бутилового эфира (810 мг), 4-хлорбензамида (552 мг), карбоната цезия (1,54 г), N,N'-диметилэтилендиамина (0,06 мл) и иодида меди(1) (45 мг) в диоксане (8 мл) в атмосфере аргона в герметично закрытой пробирке нагревали при 120°С в течение 18 ч. Затем смесь охлаждали до комнатной температуры, фильтровали через целит и фильтрат концентрировали в вакууме. Остаток переносили в этилацетат и полученный раствор последовательно промывали водой и насыщенным рассолом. Затем органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиенттептан/EtOAc), получая (3RS,4SR)-3-[4-(4-хлор-бензоиламино)-фенил]-4-гидрокси-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (800 мг; 81%) в виде белого твердого вещества. MS (ISP): 441,3 ([{37Cl}M+Na]+), 439,3 ([{35Cl}M+Na]+), 363,1 ([{37Cl}M+H-C4H8]+)HeD, 361,2 ([{35Cl}М+H-C4H8]+).
с) 4-Хлор-N-[4-((3RS.4SR)-4-гидрокси-пирролидин-3-ил)-фенил1-бензамида гидрохлорид
К перемешиваемому раствору (3RS,4SR)-3-[4-(4-хлор-бензоиламино)-фенил]-4-гидрокси-пирролидин-1-карбоновой кислоты mpem-бутилового эфира (47 мг) в THF (1,5 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,42 мл; 4 М раствор) и смесь нагревали при 60° в течение ночи. Затем смесь охлаждали до 0°С и полученные кристаллы собирали фильтрацией, промывая один раз THF и один раз диэтиловым эфиром, и сушили в вакууме при 60°С, что позволило получить 4-хлор-N-[4-((3RS,4SR)-4-гидрокси-пирролидин-3-ил)-фенил]-бензамида гидрохлорид (31 мг; 81%) в виде белого кристаллического твердого вещества. MS (ISP): 319,0 ([{37Cl}М+Н]+), 317,1 ([{35Cl}М+Н]+).
Пример 64
(RS)-2-(3-Бензоил-фенил)-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-кетопрофен (CAS 22071-15-4) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 399,2 (М+Н]+).
Пример 65
(RS)-2-(3-Метокси-фенил)-N-(4-пирролидин-3-ил-фенил)-ацетамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 3-метокси-фенилуксусную кислоту вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 311,2 (М+Н]+).
Пример 66
(RS)-2-(3-Циано-фенил)-N-(4-пирролидин-3-ил-фенил)-ацетамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 3-циано-фенилуксусную кислоту вместо (R)-2-фенилпропионовой кислоты. Бесцветное масло. MS (ISP): 306,2 (М+Н]+).
Пример 67
(RS)-2-(3-Метокси-фенил)-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 2-(3-метокси-фенил)-пропионовую кислоту (CAS 3146-60-9) вместо (R)-2-фенилпропионовой кислоты. Желтое масло. MS (ISP): 325,2 (М+Н]+).
Пример 68
(RS)-2-(3-Циано-фенил)-N-((RS)-4-пирролидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, 20 используя 2-(3-циано-фенил)-пропионовую кислоту вместо (R)-2-фенилпропионовой кислоты. Желтое масло. MS (ISP): 320,2 (М+Н]+).
Пример 69
4-Хлор-N-[4-((3RS,4RS)-4-фтор-пирролидин-3-ил)-фенил]-бензамида гидрохлорид

a) (3RS.4RS)-3-[4-(4-Хлор-бензоиламино)-фенил]-4-фтор-пирролидин-1-карбоновой кислоты люет-бутиловый эфир
К перемешиваемой суспензии (3RS,4SR)-3-[4-(4-хлор-бензоиламино)-фенил]-4-гидрокси-пирролидин-1-карбоновой кислоты трет-бутилового эфира (730 мг; Пример 63(b)) в дихлорэтане (15 мл) и ацетонитриле (15 мл) при 0°С по каплям добавляли трифторид диэтиламиносеры (0,46 мл) и затем смесь перемешивали при комнатной температуре в течение 1 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиенггептан/EtOAc), получая (3RS,4RS)-3-[4-(4-хлор-бензоиламино)-фенил]-4-фтор-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (112 мг; 15%) в виде белого твердого вещества. MS (ISP): 438,4 ([{35Cl}М+NH4]+), 436,3 ([{37Cl}M+H-C4H8]+), 365,1 ([{35Cl}M+H-C4H8]+), 363,0 ([{35Cl}М+Н-C4H8]+).
b) 4-Хлор-N-[4-((3RS,4RS)-4-фтор-пирролидин-3-ил)-фенил]-бензамида гидрохлорид
К перемешиваемому раствору (3RS,4RS)-3-[4-(4-хлор-бензоиламино)-фенил]-4-фтор-пирролидин-1-карбоновой кислоты mpem-бутилового эфира (110 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,98 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и разбавляли этилацетатом. Полученные кристаллы собирали фильтрацией, дважды промывая этилацетатом и дважды диэтиловым эфиром, и затем сушили в вакууме при 60°С, что позволило получить 4-хлор-N-[4-((3RS,4RS)-4-фтор-пирролидин-3-ил)-фенил]-бензамида гидрохлорид (81 мг; 87%) в виде белого кристаллического твердого вещества. MMS (ISP): 321,1 ([{37Cl}М+Н]+), 319,1 ([{37Cl}М+Н]+).
Пример 70
(RS)-4-Хлор-N-[3-(пирролидин-3-илокси)-фенил]-бензамид
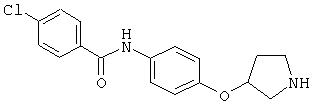
Указанное в заголовке соединение получали аналогично Примеру 39, используя 3-иоданилин вместо 4-иоданилина. Светло-желтая смола. MS (ISP): 319,2 ([{37Cl}М+Н]+), 317,2 ([{35Cl}М+Н]+).
Пример 71
(RS)-4-Хлор-N-(4-морфолин-2-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-бензойную кислоту вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 319,0 ([{37Cl}М+Н]+), 317,2 ([{35Cl}M+H]+).
Пример 72
(RS)-4-Хлор-N-(3-морфолин-2-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(3-аминофенил)морфолин-4-карбоксилат вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-бензойную кислоту вместо (R)-2-фенилпропионовой кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 319,1 ([{37Cl}М+Н]+), 317,2 ([{35Cl}М+Н]+).
Пример 73
(RS)-6-Пиразол-1-ил-N-(4-пирролидин-3-ил-фенил)-никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 6-пиразол-1-илникотиновую кислоту (CAS 253315-22-9) вместо (R)-2-фенилпропионовой кислоты. Светло-коричневое твердое вещество. MS (ISP): 334,2 (М+Н]+).
Пример 74 (RS)-6-Хлор-N-(4-пиперидин-3-ил-фенил)-никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-хлор-никотиновую кислоту (CAS 5326-23-8) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 318,2 ([{37Cl}М+Н]+), 316,2 ([{35Cl}М+Н]+).
Пример 75
(RS)-3,5-Дифтор-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид
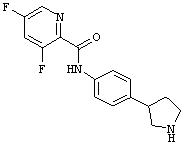
Указанное в заголовке соединение получали аналогично Примеру 29, используя 3,5-дифторпиколиновую кислоту (CAS 745784-04-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 304,1 (М+Н]+).
Пример 76
(RS)-1Н-Бензимидазол-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид
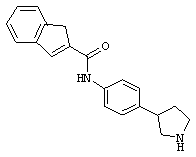
Указанное в заголовке соединение получали аналогично Примеру 29, используя 1Н-бензимидазол-2-карбоновой кислоты (CAS 2849-93-6) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 307,2 (М+Н]+).
Пример 77
(RS)-4-Хлор-2-фтор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-хлор-2-фтор-бензойную кислоту вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 321,1 ([{37Cl}М+Н]+), 319,1 ([{35Cl}M+H]+).
Пример 78
(RS)-5-Хлор-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-хлор-пиколиновую кислоту (CAS 86873-60-1) вместо (R)-2-фенилпропионовой кислоты. Светло-желтое твердое вещество. MS (ISP): 318,3 ([{37Cl}М+Н]+), 316,2 ([{35Cl}М+Н]+).
Пример 79
(RS)-1-(6-Хлор-пиридин-3-ил)-3-(4-пиперидин-3-ил-фенил)-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 6, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2-хлор-5-изоцианатопиридин (CAS 125117-96-6) вместо фенилизоцианата. Беловатое твердое вещество. MS (ISP): 333,1 ([{37Cl}М+Н]+), 331,1 ([{35Cl}M+H]+).
Пример 80
(RS)-4-Хлор-N-[4-(4-метил-морфолин-2-ил)-фенил]-бензамид

Указанное в заголовке соединение получали аналогично Примеру 32, используя 4-хлор-N-(4-морфолин-2-ил-фенил)-бензамида гидрохлорид (Пример 71) вместо (RS)-4-хлор-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорида. Белое твердое вещество. MS (ISP): 333,2 ([{37Cl}М+Н]+), 331,1 ([{35Cl}М+Н]+).
Пример 81
(RS)-1-(4-Пирролидин-3-ил-фенил)-3-хинолин-8-ил-мочевина

Указанное в заголовке соединение получали аналогично Примеру 6, используя 8-аминохинолин (CAS 578-66-5) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и (RS)-3-(4-изоцианато)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (Пример 45а) вместо фенилизоцианата. Беловатое твердое вещество. MS (ISP): 333,2 ([М+Н]+).
Пример 82
(RS)-3-Фтор-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 3-фтор-пиридин-2-карбоновую кислоту (CAS 152126-31-3) вместо (R)-2-фенилпропионовой кислоты. Светло-желтое твердое вещество. MS (ISP): 286,2 ([М+НП.
Пример 83
Указанное в заголовке соединение получали аналогично Примеру 29, используя 3-фтор-пиридин-2-карбоновую кислоту (CAS 152126-31-3) вместо (R)-2-фенилпропионовой кислоты. Светло-желтое твердое вещество. MS (ISP): 286,2 ([М+Н]+).
Пример 83
(RS)-1-(5-Хлор-пиридин-2-ил)-3-(4-пиперидин-3-ил-фенил)-мочевины гидрохлорид
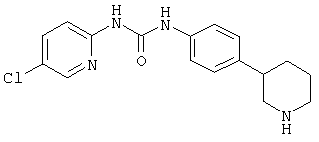
Указанное в заголовке соединение получали аналогично Примеру 6, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-хлор-2-изоцианатопиридин (CAS 95735-68-5) вместо фенилизоцианата. Беловатое твердое вещество. MS (ISP): 333,3 ([{37Cl}М+Н]+), 331,2 ([{35Cl}M+H]+).
Пример 84
(RS)-Хинолин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя хинальдиновую кислоту (CAS 93-10-7) вместо (R)-2-фенилпропионовой кислоты. Желтое твердое вещество. MS (ISP): 318,2 ([М+Н]+).
Пример 85
(RS)-Изохинолин-1-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 1-изохинолинкарбоновую кислоту (CAS 486-73-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 318,2 ([M+H]+).
Пример 86
(RS)-4-Хлор-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид
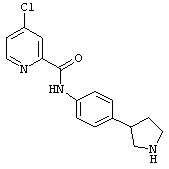
Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-хлорпиколиновую кислоту (CAS 5470-22-4) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 304,1 ([{37Cl}M+Н]+), 302,1 ([{35Cl}М+Н]+).
Пример 87
(RS)-5-Бром-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид
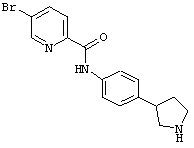
Указанное в заголовке соединение получали аналогично Примеру 29, используя 5-бром-пиридин-2-карбоновую кислоту (CAS 30766-11-1) вместо (R)-2-фенилпропионовой кислоты. Желтое твердое вещество. MS (ISP): 348,2 ([{81Br}М+Н]+), 346,0 ([{79Br}M+H]+).
Пример 88 (RS)-2-Фтор-4-метокси-N-(4-пирролидин-3-ил-фенил)-бензамида гидрохлорид
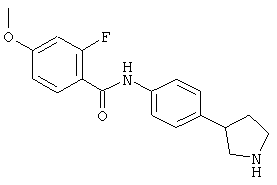
Указанное в заголовке соединение получали аналогично Примеру 29, используя 2-фтор-4-метокси-бензойную кислоту (CAS 394-42-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 315,1 ([М+Н]+).
Пример 89
(RS)-N-(4-Пирролидин-3-ил-фенил)-6-(2,2,2-трифтор-этокси)-никотинамида гидрохлорид
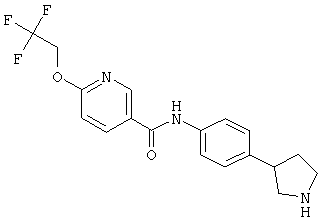
Указанное в заголовке соединение получали аналогично Примеру 29, используя 6-(2,2,2-трифтор-этокси)-никотиновую кислоту (CAS 175204-90-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 366,2 ([М+Н]+).
Пример 90 (RS)-4-Метокси-хинолин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-метокси-2-хинолинкарбоновую кислоту (CAS 15733-83-2) вместо (R)-2-фенилпропионовой кислоты. Желтое твердое вещество. MS (ISP): 348,2 ([М+Н]+).
Пример 91 (RS)-6-Метокси-хинолин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид
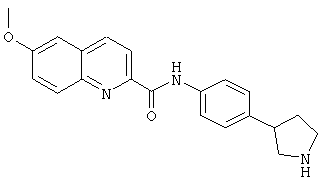
Указанное в заголовке соединение получали аналогично Примеру 29, используя 6-метокси-хинолин-2-карбоновую кислоту (CAS 75433-99-7) вместо (R)-2-фенилпропионовой кислоты. Желтое твердое вещество. MS (ISP): 348,2 ([М+Н]+).
Пример 92
(RS)-3-Хлор-N-(4-пиперидин-3-ил-фенил)-бензамида гидрохлорид
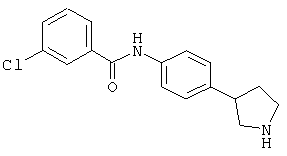
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-хлор-бензойную кислоту (CAS 535-80-8) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 317,2 ([{37Cl}М+Н]+), 315,2 ([{35Cl}М+Н]+).
Пример 93
(RS)-Тиено[2,3-с]пиридин-7-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид
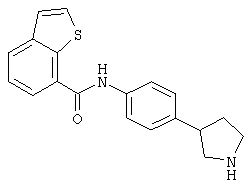
Указанное в заголовке соединение получали аналогично Примеру 29, используя тиено[2,3-с]пиридин-7-карбоновую кислоту (CAS 852532-64-0) вместо (R)-2-фенилпропионовой кислоты. Желтое твердое вещество. MS (ISP): 324,2 ([М+Н]+).
Пример 94
(RS)-5-Метокси-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 5-метокси-пиридин-2-карбоновую кислоту (САЗ 29082-92-6) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 298,2 ([М+Н]+).
Пример 95
(RS)-2,6-Диметокси-N-(4-пирролидин-3-ил-фенил)-никотинамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 2,6-диметокси-никотиновую кислоту (CAS 16727-43-8) вместо (R)-2-фенилпропионовой кислоты. Светло-желтое масло. MS (ISP): 328,2 ([M+H]+).
Пример 96 (RS)-3,4-Дихлор-N-(4-пиперидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3,4-дихлор-бензойную кислоту (CAS 51-44-5) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 353,2 ([{37Cl}М+Н]+), 351,3 ([{37Cl35Cl}M+H]+), 349,2 ([{35Cl}M+H]+).
Пример 97
(RS)-4-Этокси-N-(4-пиперидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-этокси-бензойную кислоту (CAS 619-86-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 325,4 ([M+H]+).
Пример 98
(RS)-N-(4-Пиперидин-3-ил-фенил)-4-трифторметил-бензамида гидрохлорид
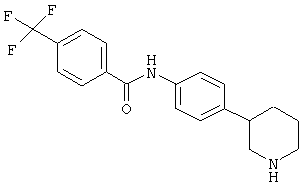
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-трифторметил-бензойную кислоту (CAS 455-24-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 349,2 ([М+Н]+).
Пример 99
(RS)-2,4-Дихлор-N-(4-пиперидин-3-ил-фенил)-бензамида гидрохлорид
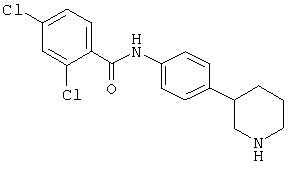
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1 -пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2,4-дихлор-бензойную кислоту (CAS 50-84-0) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 353,2 ([{37Cl}М+Н]+), 351,3 ([{37Cl35Cl}M+H]+), 349,2 ([{35Cl}М+Н]+).
Пример 100
(RS)-4-Хлор-2-фтор-N-(4-пиперидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-2-фтор-бензойную кислоту (CAS 446-30-0) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 335,3 ([{37Cl}М+Н]+), 333,3 ([{35Cl}M+H]+).
Пример 101
(RS)-3-(4-Хлор-фенил)-N-(4-пиперидин-3-ил-фенил)-пропионамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-(4-хлор-фенил)-пропионовую кислоту (CAS 2019-34-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 345,2 ([{37Cl}М+Н]+), 343,2 ([{35Cl}M+H]+).
Пример 102
(RS)-2-(4-Хлор-фенил)-N-(4-пиперидин-3-ил-фенил)-ацетамида гидрохлорид
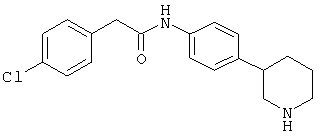
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-(4-хлор-фенил)-уксусную кислоту (CAS 1878-66-6) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 331,2 ([{37Cl}M+H]+), 329,3 ([{35Cl}M+H]+).
Пример 103
(RS)-2-(4-Хлор-фенил)-N-((RS)-4-пиперидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2-(4-хлор-фенил)-пропионовую кислоту (CAS 938-95-4) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 345,2 ([{37Cl}M+H]+), 343,3 ([{37Cl}М+Н]+).
Пример 104
(RS)-N-((RS)-4-Пиперидин-3-ил-фенил)-2-(3-трифторметил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2-(3-трифторметил-фенил)-пропионовую кислоту (CAS 68718-08-1) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 377,4 ([М+Н]+).
Пример 105
(RS)-S-((RS)-4-Пиперидин-3-ил-фенил)-2-(3-трифторметокси-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2-(3-трифторметокси-фенил)-пропионовую кислоту вместо (R)-2-фенилпропионовой кислоты. Бесцветная смола. MS (ISP): 393,2 ([М+Н]+).
Пример 106
(RS)-3,5-Дифтор-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амида гидрохлорид
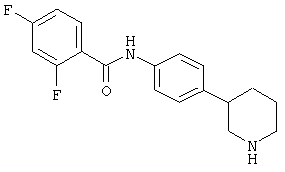
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3,5-дифторпиридин-2-карбоновую кислоту (CAS 745784-04-7) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP); 318,3([М+Н]+).
Пример 107
(RS)-4-Хлор-N-(4-пирролидин-2-илметил-фенил)-бензамида гидрохлорид
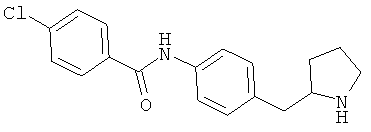
a) (RS)-2-(4-Бром-бензил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору (RS)-2-(4-бром-бензил)-пирролидина (1,00 г; CAS 383127-68-2) в 1,2-дихлорэтане (10 мл) последовательно добавляли N,N-диизопропилэтиламин (0,79 мл) и ди-трет-бутил-дикарбонат (1,02 г) и смесь перемешивали при комнатной температуре в течение 1 часа. Смесь разбавляли дихлорметаном и последовательно промывали водой, разбавленной водн. соляной кислотой, насыщенным водн. раствором бикарбоната натрия и насыщенным рассолом. Затем органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, что позволило получить (RS)-2-(4-бром-бензол)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (1,41 г, колич.) в виде светло-желтого вязкого масла. MS (ISP): 342,1 ([{81Br}М+Н]+), 340,2 ([{79Br}М+Н]+), 286,1 ([{81Br}М+Н-C4H8]+), 284,2 ([{79Br}M+Н-C4H8]+).
b) (RS)-2-[4-(4-Хлор-бензоиламино)-бензил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
Перемешиваемую суспензию (RS)-2-(4-бром-бензил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (400 мг), 4-хлорбензамида (280 мг), карбоната цезия (766 мг), N,N'-диметилэтилендиамина (0,04 мл) и иодида меди(1) (23 мг) в диоксане (3 мл) в атмосфере аргона в герметично закрытой пробирке нагревали при 120°С в течение 18 ч. Затем смесь охлаждали до комнатной температуры, фильтровали через целит и фильтрат концентрировали в вакууме. Остаток переносили в этилацетат и полученный раствор последовательно промывали водой и насыщенным рассолом. Затем органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиенттептан/EtOAc), получая (RS)-2-[4-(4-хлор-бензоиламино)-бензил]-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (19 мг; 4%) в виде светло-желтой смолы. MS (ISP): 417,3 ([{37Cl})М+Н]+), 415,3 ([{35Cl}М+Н]+), 361,1 ([{37Cl}M+H-C4H8]+), 359,1 ([{35Cl}М+Н-C4H8]+).
с) (RS)-4-Хлор-N-(4-пирролидин-2-илметил-фенил)-бензамида гидрохлорид
К перемешиваемому раствору (RS)-2-[4-(4-хлор-бензоиламино)-бензил]-пирролидин-1-карбоновой кислоты трет-бутилового эфира (16 мг) в THF (1,5 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,14 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и полученные кристаллы собирали фильтрацией, промывая один раз этилацетатом и один раз диэтиловым эфиром, и сушили в вакууме при 60°С, что позволило получить (RS)-4-хлор-N-(4-пирролидин-2-илметил-фенил)-бензамида гидрохлорид (3 мг; 22%) в виде беловатого кристаллического твердого вещества. MS (ISP): 317,1 ([{37Cl}М+Н]+), 315,1 ([{35Cl}М+Н]+).
Пример 108 (RS)-1-Хлор-изохинолин-3-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 1-хлор-изохинолин-3-карбоновую кислоту (CAS 1049606-80-5) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 354,2 ([{37Cl}M+H]+), 352,2 ([{35Cl}M+H]+).
Пример 109
(RS)-4-Хлор-N-[4-(2-пирролидин-3-ил-этил)-фенил]-бензамида гидрохлорид

а) (RS)-3-[(Е)-2-(4-Нитро-фенил)-винилъ-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору N,N-диизопропиламина (3,36 мл) в тетрагидрофуране (20 мл) при -78°С по каплям добавляли раствор н-бутиллития (14,9 мл; 1,6 М в гексане) и затем реакционную смесь нагревали до 0°С в течение 15 мин. После повторного охлаждения до -78°С по каплям добавляли раствор диэтил-(4-нитробензил)-фосфоната (5,00 г; CAS 2609-49-6) в тетрагидрофуране (10 мл). Смесь перемешивали при -78°С в течение 60 мин и затем по каплям добавляли в течение 30 мин раствор (RS)-3-формил-пирролидин-1-карбоновой кислоты mpem-бутилового эфира (4,01 г; CAS 59379-02-1) в тетрагидрофуране (10 л). Затем смесь оставляли нагреваться до комнатной температуры и перемешивание продолжали при комнатной температуре в течение 18 часов. Затем смесь разбавляли этилацетатом и подкисляли до рН 6, добавляя водную соляную кислоту (1 н.). Смесь промывали последовательно водой и насыщенным рассолом, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2, градиент: гептан/EtOAc), получая (RS)-3-[(E)-2-(4-нитро-фенил)-винил]-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (3,39 г; 58%) в виде желтого масла.
о) (RS)-3-[2-(4-Амино-фенил)-этил]-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир
К раствору (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира (3,39 г) в метаноле (250 мл) добавляли палладий на угле (10%-ный; 340 мг). Смесь энергично перемешивали в атмосфере водорода в течение 7 суток. Катализатор отфильтровывали и фильтрат упаривали. Неочищенный продукт очищали колоночной хроматографией (SiO2, градиент: гептан/EtOAc), получая (RS)-3-[2-(4-амино-фенил)-этил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (2,44 г; 79%) в виде желтого масла. MS (ISP): 291,2 ([М+Н]+).
с) (RS)-3-{2-[4-(4-Хлор-бензоиламино)-фенил]-этил}-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (RS)-3-[2-(4-амино-фенил)-этил]-пирролидин-1-карбоновой кислоты трет-бутилового эфира (100 мг) в THF (5 мл) последовательно добавляли N-метилморфолин (0,15 мл), TBTU (221 мг) и 4-хлор-бензойную кислоту (70 мг) и смесь нагревали при 50°С в течение 18 ч. Затем смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-3-{2-[4-(4-хлор-бензоиламино)-фенил]-этил}-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (131 мг; 89%) в виде белого твердого вещества. MS (ISP): 431,3 ([{37Cl}М+Н]+), 429,3 ([{35Cl}М+Н]+), 375,5 ([{37Cl}М+Н-C4H8]+), 373,2 ([{35Cl}M+H-C4H8]+).
d) (RS)-4-Хлор-N-[4-(2-пирролидин-3-ил-этил)-фенил]-бензамида гидрохлорид
К перемешиваемому раствору (RS)-3-{2-[4-(4-хлор-бензоиламино)-фенил]-этил}-пирролидин-1-карбоновой кислоты трет-бутилового эфира (130 мг) в THF (3 мл) по каплям добавляли раствор хлористого водорода в диоксане (1,14 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и полученные кристаллы собирали фильтрацией, промывали этилацетатом и сушили в вакууме при 60°С, что позволило получить (RS)-4-хлор-N-[4-(2-пирролидин-3-ил-этил)-фенил]-бензамида гидрохлорид (111 мг; колич.) в виде беловатого кристаллического твердого вещества. MS (ISP): 331,3 ([{37Cl}М+Н]+), 329,1 ([{35Cl}М+Н]+).
Пример 110
(RS)-4-Хлор-N-[4-(2-пиперидин-3-ил-этил)-фенил]-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-3-формил-пиперидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 118156-93-7) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира. Беловатое твердое вещество. MS (ISP): 345,2 ([{37Cl}М+Н]+), 343,2 ([{35Cl}M+H]+).
Пример 111
(RS)-2-(3-Хлор-фенил)-N-((RS)-4-пиперидин-3-ил-фенил)-пропионамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2-(3-хлор-фенил)-пропионовую кислоту (14161-84-3) вместо (R)-2-фенилпропионовой кислоты. Бесцветная смола. MS (ISP): 345,2 ([{37Cl}М+Н]+), 343,2 ([{35Cl}M+H]+).
Пример 112 4-Хлор-N-((8)-4-пиперидин-3-ил-фенил)-бензамид
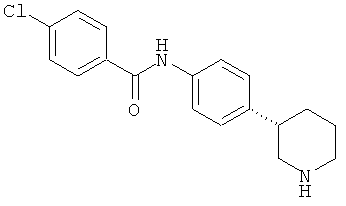
Указанное в заголовке соединение получали аналогично Примеру 29, используя (8)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлорбензойную кислоту (CAS 74-11-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 317,3 ([{37Cl}M+H]+), 315,2 ([{35Cl}M+H]+).
Пример 113
4-Хлор-N-((R)-4-пиперидин-3-ил-фенил)-бензамид
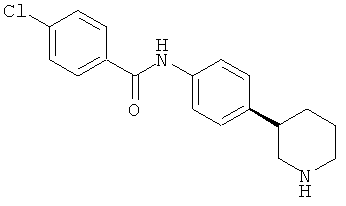
Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1 -карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлорбензойную кислоту (CAS 74-11-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 317,3 ([{37Cl}М+Н]+), 315,2 ([{37Cl}М+Н]+).
Пример 114
(RS)-1-(5-Хлор-пиридин-2-ил)-3-[4-(2-пирролидин-3-ил-этил)-фенил]-мочевины гидрохлорид
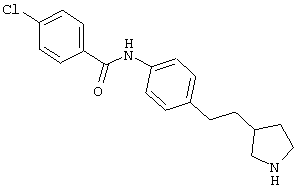
a) (RS)-3-(2-{4-[3-(5-Хлор-пиридин-2-ил)-уреидо 1-фенил}-этил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемой суспензии (RS)-3-[2-(4-амино-фенил)-этил]-пирролидин-1-карбоновой кислоты трет-бутилового эфира (100 мг; Пример 109(b)) в дихлорэтане (3 мл) последовательно добавляли триэтиламин (0,10 мл) и трифосген (38 мг) и смесь нагревали при 80°С в течение 30 мин. К полученной смеси добавляли 2-амино-5-хлорпиридин (44 мг; CAS 1072-98-6) и смесь нагревали при 80°С в течение 18 ч. Затем смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-3-(2-{4-[3-(5-хлор-пиридин-2-ил)-уреидо]-фенил}-этил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (89 мг; 58%) в виде белого твердого вещества. MS (ISP): 447,4 ([{37Cl}М+Н]+), 445,4 ([{35Cl}М+Н]+), 391,2([{37Cl}M+H-C4H8]+), 389,1 ([{35Cl}М+Н-C4H8]+).
b) (RS)-1-(5-Хлор-пиридин-2-ил)-3-[4-(2-пирролидин-3-ил-этил)-фенил]-мочевины гидрохлорид
К перемешиваемому раствору (RS)-3-(2-{4-[3-(5-хлор-пиридин-2-ил)-уреидо]-фенил}-этил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (85 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,72 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С, полученные кристаллы собирали фильтрацией, дважды промывая этилацетатом, и сушили в вакууме при 60°С, что позволило получить (RS)-1-(5-хлор-пиридин-2-ил)-3-[4-(2-пирролидин-3-ил-этил)-фенил]-мочевины гидрохлорид (74 мг; колич.) в виде белого кристаллического твердого вещества. MS (ISP): 347,2 ([{37Cl}M+H]+), 345,2 ([{35Cl}М+Н]+).
Пример 115
(RS)-1-(5-Хлор-пиридин-2-ил)-3-[4-(2-пиперидин-3-ил-этил)-фенил]-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109 стадия (b) и Примеру 114, используя (RS)-3-формил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 118156-93-7) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 361,2 ([{37Cl}М+Н]+), 359,2 ([{35Cl}М+Н]+).
Пример 116
(RS)-1-(4-Хлор-фенил)-3-[4-(2-пирролидин-3-ил-этил)-фенил]-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 114, используя 4-хлор-анилин (CAS 106-47-8) вместо 2-амино-5-хлорпиридина. Белое твердое вещество. MS (ISP): 346,1 ([{37Cl}М+Н]+), 344,2 ([{35Cl}М+Н]+).
Пример 117
(RS)-5-Хлор-пиридин-2-карбоновой кислоты [4-(2-пирролидин-3-ил-этил)-фенил]-амида гидрохлорид
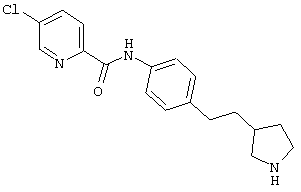
Указанное в заголовке соединение получали аналогично Примеру 109, используя 5-хлор-пиридин-2-карбоновую кислоту (CAS 86873-60-1) вместо 4-хлор-бензойной кислоты. Желтое твердое вещество. MS (ISP): 332,2 ([{37Cl}М+Н]+), 330,2 ([{35Cl}М+Н]+).
Пример 118
(RS)-5-Хлор-пиридин-2-карбоновой кислоты [4-(2-пиперидин-3-ил-этил)-фенил]-амида гидрохлорид
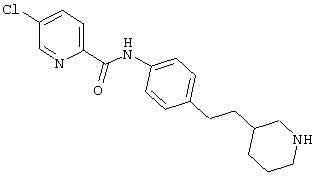
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-3-формил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 118156-93-7) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты mpem-бутилового эфира и 6-хлор-пиридин-2-карбоновую кислоту (CAS 86873-60-1) вместо 4-хлор-бензойной кислоты. Желтое твердое вещество. MS (ISP): 346,1 ([{37Cl}М+Н]+), 344,2 ([{35Cl}М+Н]+).
Пример 119
(RS)-1-(4-Хлор-фенил)-3-[4-(2-пиперидин-3-ил-этил)-фенил]-мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, стадия (b), и Примеру 114, используя (RS)-3-формил-пиперидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 118156-93-7) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 4-хлор-анилин (CAS 106-47-8) вместо 2-амино-5-хлорпиридина. Белое твердое вещество. MS (ISP): 360,2 ([{37Cl}М+Н]+), 358,2 ([35Cl}M+H]+).
Пример 120
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-хлор-фенил)-этиловый эфир
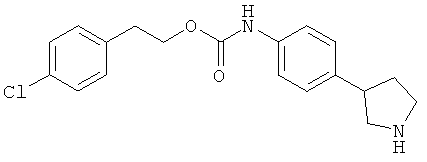
а) (RS)-3-{4-[2-(4-Хлор-фенил)-этоксикарбониламино1-фенил}-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К перемешиваемому раствору (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата (100 мг; CAS 908334-28-1) в дихлорэтане (4 мл) последовательно добавляли триэтиламин (0,62 мл) и трифосген (44 мг) и смесь нагревали при 80°С в течение 1 ч. К полученной смеси добавляли 4-хлорфенетиловый спирт (0,06 мл; CAS 1875-88-3) и смесь нагревали при 100°С в течение 18 ч. Затем смесь охлаждали до комнатной температуры и разбавляли дихлорметаном. Смесь промывали водой, далее фазы разделяли, органическую фазу сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-3-{4-[2-(4-хлор-фенил)-этоксикарбониламино]-фенил}-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (104 мг; 63%) в виде оранжевого твердого вещества. MS (ISP): 464,3 ([{37Cl}М+NH4]+), 462,3 ([{35Cl}M+NH4]+)), 391,2 ([{37Cl}M+H-C4H8]+), 389,2 ([{35Cl}М+Н-C4H8]+).
b) (RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-хлор-фенил)-этиловый эфир
К перемешиваемому раствору (RS)-3-{4-[2-(4-хлор-фенил)-этоксикарбонил-амино]-фенил}-пирролидин-1-карбоновой кислоты mpem-бутилового эфира (100 мг) в THF (2 мл) по каплям добавляли раствор хлористого водорода в диоксане (0,84 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и подщелачивали, добавляя 1 М водн. раствор гидроксида натрия. Смесь дважды экстрагировали этилацетатом, объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (Isolute® FIash-NH2 от Separtis; градиент: гептан/этилацетат/метанол), что позволило получить (RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-хлор-фенил)-этиловый эфир (38 мг; 49%) в виде бесцветной смолы. MS (ISP): 347,1 ([{37Cl{M+H]+), 345,2 ([{35Cl}М+Н]+).
Пример 121
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3-хлор-фенил)-этиловый эфир

Указанное в заголовке соединение получали аналогично Примеру 120, используя 3-хлорфенетиловый спирт вместо 4-хлорфенетилового спирта. Бесцветная смола. MS (ISP): 347,1 ([{37Cl}M+H]+), 345,2 ([{35Cl}М+Н]+).
Пример 122
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-трифторметил-фенил)-этиловый эфир
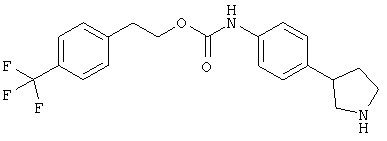
Указанное в заголовке соединение получали аналогично Примеру 120, используя 4-(трифторметил)фенетиловый спирт вместо 4-хлорфенетилового спирта. Бесцветная смола. MS (ISP): 379,3 ([М+Н]+).
Пример 123
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3-трифторметил-фенил)-этиловый эфир

Указанное в заголовке соединение получали аналогично Примеру 120, используя 3-(трифторметил)фенетиловый спирт вместо 4-хлорфенетилового спирта. Бесцветная смола. MS (ISP): 379,3 ([M+H]+).
Пример 124
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(2,5-дифтор-фенил)-этиловый эфир
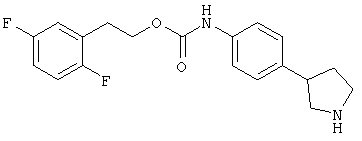
Указанное в заголовке соединение получали аналогично Примеру 120, используя 2,5-дифтор-фенетиловый спирт вместо 4-хлорфенетилового спирта. Бесцветная смола. MS (ISP): 347,2 ([М+Н]+).
Пример 125
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-трифторметокси-фенил)-этиловый эфир

Указанное в заголовке соединение получали аналогично Примеру 120, используя 4-(трифторметокси)-фенетиловый спирт вместо 4-хлорфенетилового спирта. Светло-желтая смола. MS (ISP): 395,2 ([М+Н]+).
Пример 126
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3,4-дихлор-фенил)-этиловый эфир

Указанное в заголовке соединение получали аналогично Примеру 120, используя 3,4-дихлорфенетиловый спирт вместо 4-хлорфенетилового спирта. Оранжевая смола. MS (ISP): 383,1 ([{37Cl}M+H]+), 381,2 ([37Cl}M+H]+), 379,3 ([{35Cl}M+H]+).
Пример 127
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты (RS)-1-(4-хлор-фенил)-этиловый эфир
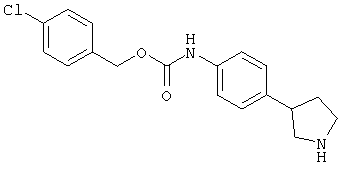
Указанное в заголовке соединение получали аналогично Примеру 120, используя 3-хлорфенетиловый спирт вместо 4-хлорфенетилового спирта. Аморфное бесцветное твердое вещество. MS (ISP): 347,1 ([{37Cl}M+H]+), 345,2 (35Cl}М+Н]+).
Пример 128
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 3-(4-хлор-фенил)-пропиловый эфир

Указанное в заголовке соединение получали аналогично Примеру 120, используя 3-(4-хлорфенил)пропан-1-ол вместо 4-хлорфенетилового спирта. Беловатое твердое вещество. MS (ISP): 361,2 ([{37Cl}М+Н]+), 359,2 ([{35Cl}М+Н]+).
Пример 129
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты индан-2-иловый эфир

Указанное в заголовке соединение получали аналогично Примеру 120, используя 2-инданол вместо 4-хлорфенетилового спирта. Беловатое твердое вещество. MS (ISP): 323,3 ([М+Н]+).
Пример 130
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты (RS)-1-(4-хлор-фенил)-2,2,2-трифтор-этиловый эфир

Указанное в заголовке соединение получали аналогично Примеру 120, используя 1-(4-хлорфенил)-2,2,2-трифторэтанол вместо 4-хлорфенетилового спирта. Беловатое твердое вещество. MS (ISP): 401,2 ([{37Cl}M+H]+), 399,2 ([{35Cl}М+Н]+).
Пример 131
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты (RS)-3,3,3-трифтор-1-метил-пропиловый эфир
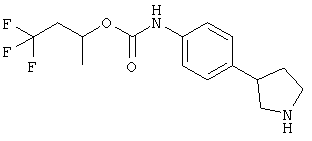
Указанное в заголовке соединение получали аналогично Примеру 120, используя 4,4,4-трифтор-2-бутанол вместо 4-хлорфенетилового спирта. Аморфное коричневое твердое вещество. MS (ISP): 317,3 ([М+Н]+).
Пример 132
(RS)-3-Фтор-пиридин-2-карбоновой кислоты [4-(2-пирролидин-3-ил-этил)-фенил]-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя 3-фтор-пиридин-2-карбоновую кислоту (CAS 152126-31-3) вместо 4-хлор-бензойной кислоты. Желтое твердое вещество. MS (ISP): 314,1 ([М+Н]+).
Пример 133
(RS)-3,5-Дифтор-пиридин-2-карбоновой кислоты [4-(2-пирролидин-3-ил-этил)-фенил]-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя 3,5-дифтор-пиридин-2-карбоновую кислоту (CAS 745784-04-7) вместо 4-хлор-бензойной кислоты. Желтое твердое вещество. MS (ISP): 332,2 ([М+Н]+).
Пример 134
(RS)-3-Фтор-пиридин-2-карбоновой кислоты [4-(2-пиперидин-3-ил-этил)-фенил]-амида гидрохлорид
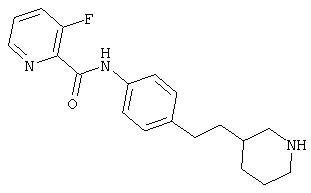
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-3-формил-пиперидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 118156-93-7) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты mpem-бутилового эфира и 3-фтор-пиридин-2-карбоновую кислоту (CAS 152126-31-3) вместо 4-хлор-бензойной кислоты. Желтое твердое вещество. MS (ISP): 328,3 ([М+Н]+).
Пример 135
(RS)-3,5-Дифтор-пиридин-2-карбоновой кислоты [4-(2-пиперидин-3-ил-этил)-фенил]-амида гидрохлорид
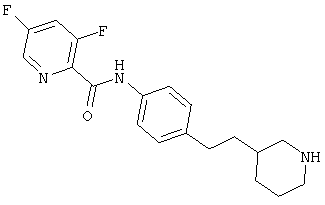
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-3-формил-пиперидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 118156-93-7) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты mpem-бутилового эфир и 3,5-дифтор-пиридин-2-карбоновую кислоту (CAS 745784-04-7) вместо 4-хлор-бензойной кислоты. Желтое твердое вещество. MS (ISP): 346,1 ([М+Н]+).
Пример 136
(RS)-4-Хлор-N-[4-(пирролидин-3-карбонил)-фенил]-бензамида гидрохлорид
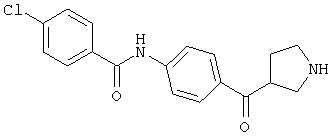
Указанное в заголовке соединение получали аналогично Примеру 141, используя (RS)-3-(4-бром-бензоил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 960402-23-7) вместо (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата и 4-хлор-бензамид (CAS 619-56-7) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Светло-коричневое твердое вещество. MS (ISP): 331,2 ([{37Cl}М+Н]+), 329,3 ([{37Cl}М+Н]+).
Пример 137
(RS)-N-(4-Пиперидин-3-ил-фенил)-4-пропил-бензамида гидрохлорид
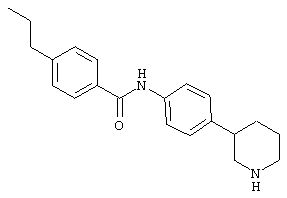
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-н-пропил-бензойную кислоту (CAS 2438-05-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 323,2 ([М+Н]+).
Пример 138
(RS)-5-Трифторметил-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амида гидрохлорид
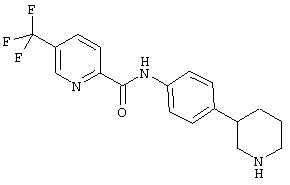
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-трифторметил-2-пиридин-карбоновую кислоту (CAS 80194-69-0) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 350,2 ([М+Н]+).
Пример 139
(RS)-5-Трифторметил-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 5-трифторметил-2-пиридин-карбоновую кислоту (CAS 80194-69-0) вместо (RS)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 336,2 ([М+Н]+).
Пример 140
(RS)-4-Хлор-N-(6-пирролидин-3-ил-пиридин-3-ил)-бензамид

(a) (RS)-2-[1-(4-Метокси-бензил)-пирролидин-3-ил]-5-нитро-пиридин
К перемешиваемому раствору 5-нитро-2-винил-пиридина (400 мг; CAS 119836-85-0) и (4-метокси-бензил)-метоксиметил-триметилсиланилметил-амина (1,43 г; CAS 433289-59-9) в дихлорметане при 0°С добавляли раствор трифторуксусной кислоты (0,02 мл) в дихлорметане (0,3 мл). Смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Далее смесь промывали последовательно насыщ. водн. раствором бикарбоната натрия и насыщенным рассолом. Органическую фазу сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали флэш-хроматографией (SiO2, градиент: гептан/EtOAc), что позволило получить (RS)-2-[1-(4-метокси-бензил)-пирролидин-3-ил]-5-нитро-пиридин (592 мг; 71%) в виде оранжевого вязкого масла. MS (ISP): 314,2 ([М+Н]+).
(b) (RS)-6-[1-(4-Метокси-бензил)-пирролидин-3-ил]-пиридин-3-иламин
К раствору (RS)-2-[1-(4-метокси-бензил)-пирролидин-3-ил]-5-нитро-пиридина (586 мг) в метаноле (2 мл) добавляли палладий на угле (10%-ный; 99 мг). Смесь перемешивали в атмосфере водорода в течение 1 часа. Смесь фильтровали через целит для удаления катализатора, промывая фильтр дихлорметаном, и фильтрат концентрировали в вакууме, что позволило получить (RS)-6-[1-(4-метокси-бензил)-пирролидин-3-ил]-пиридин-3-иламин (532 мг; колич.) в виде красного вязкого масла. MS (ISP): 284,3 ([М+Н]+).
(c) (RS)-4-Хлор-N-{6-N-(4-метокси-бензил)-пирролидин-3-ил}-пиридин-3-ил]-бензамид
Указанное в заголовке соединение получали аналогично Примеру 29, стадия (а), используя (RS)-6-[1-(4-метокси-бензил)-пирролидин-3-ил]-пиридин-3-иламин вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлорбензойную кислоту (CAS 74-11-3) вместо (R)-2-фенилпропионовой кислоты. Оранжевая смола. MS (ISP): 424,2 ([{37Cl}М+Н]+), 422,2 ([{35Cl}М+Н]+).
(d) (Р8)-4-Хлор-N-(6-пирролидин-3-ил-пиридин-3-ил)-бензамид
К перемешиваемому раствору (RS)-4-хлор-N-{6-[1-(4-метокси-бензил)-пирролидин-3-ил]-пиридин-3-ил}-бензамида в дихлорметане (10 мл) при 0°С последовательно добавляли пиридин (0,24 мл) и трифосген (455 мг) и полученную смесь оставляли нагреваться до комнатной температуры, продолжая перемешивание в течение ночи. Затем смесь концентрировали в вакууме и остаток переносили в диоксан (5 мл) и воду (5 мл). Добавляли две капли концентрированной соляной кислоты и полученную смесь затем нагревали при 70°С в течение 18 ч. Реакционную смесь далее охлаждали до комнатной температуры и гасили, добавляя насыщенный водн. раствор бикарбоната натрия. Смесь дважды экстрагировали этилацетатом, объединенные органические фазы сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали флэш-хроматографией (Isolate® Flash-NH2 от Separtis; градиент: гептан/EtOAc/МеОН от 100:0:0 до 0:80:20), что позволило получить (RS)-4-хлор-N-(6-пирролидин-3-ил-пиридин-3-ил)-бензамид (18 мг; 8%) в виде оранжевой смолы. MS (ISP): 304,1 ([{37Cl}М+Н]+), 302,1 ([{35Cl}М+Н]+).
Пример 141
(RS)-5-Трифторметил-пиридин-2-карбоновой кислоты (4-морфолин-2-ил-фенил)-амида гидрохлорид
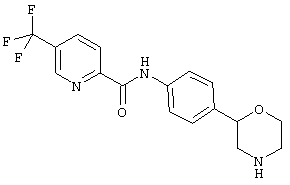
a) (RS)-трет-Бутил-2-(4-бромфенил)морфолин-4-карбоксилат
К перемешиваемому раствору (RS)-2-(4-бром-фенил)-морфолина (1,00 г; CAS 83555-73-1) в THF (12 мл) последовательно добавляли N,N-диизопропилэтиламин (0,84 мл) и ди-трет-бутилдикарбонат (1,08 г) и смесь перемешивали при комнатной температуре в течение 18 часов. Смесь концентрировали в вакууме и остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), что позволило получить (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилат (1,30 г; 92%) в виде бесцветного масла. MS (ISP): 344,2 ([{81Br}M+H]+), 342,2 ([{79Br}М+Н]+), 288,1 ([{81Br}M+H-C4H8]+), 286,1 ([{79Br}М+Н-C4H8]+).
b) (RS)-2-{4-[(5-ТриФторметил-пиридин-2-карбонил)-амино]-фенил}-морфолин-4-карбоновой кислоты mpem-бутиловый эфир
Перемешиваемую суспензию (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата (500 мг), амида 5-трифторметил-пиридин-2-карбоновой кислоты (389 мг; CAS 22245-86-9), карбоната цезия (952 мг), N.N'-диметилэтилендиамина (0,04 мл) и иодида меди(1) (28 мг) в диоксане (10 мл) в атмосфере аргона в герметично закрытой пробирке нагревали в печи для нагрева токами высокой частоты (microwave oven) при 180°С в течение 2 ч. Затем смесь охлаждали до комнатной температуры, фильтровали через целит и фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (RS)-2-{4-[(5-трифторметил-пиридин-2-карбонил)-амино]-фенил}-морфолин-4-карбоновой кислоты трет-бутиловый эфир (366 мг; 55%) в виде белого твердого вещества. MS (ISP): 469,2 ([M+NH4]+), 396,0 ([М+Н-C4H8]+).
с) (RS)-5-Трифторметил-пиридин-2-карбоновой кислоты (4-морфолин-2-ил-фенил)-амида гидрохлорид
К перемешиваемому раствору (RS)-2-{4-[(5-трифторметил-пиридин-2-карбонил)-амино]-фенил}-морфолин-4-карбоновой кислоты трет-бутилового эфира (360 мг) в THF (3 мл) по каплям добавляли раствор хлористого водорода в диоксане (2,99 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С, полученные кристаллы собирали фильтрацией, дважды промывая этилацетатом, и сушили в вакууме при 60°С, что позволило получить (RS)-5-трифторметил-пиридин-2-карбоновой кислоты (4-морфолин-2-ил-фенил)-амида гидрохлорид (263 мг; 85%) в виде белого кристаллического твердого вещества. MS (ISP): 352,3 ([М+Н]+).
Пример 142
(RS)-4-Хлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамида гидрохлорид
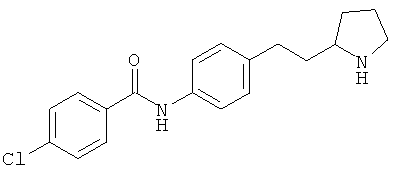
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира. Беловатое твердое вещество. MS (ISP): 331,1 ([{37Cl}М+Н]+), 329,3 ([{35Cl}М+Н]+).
Пример 143
4-Хлор-N-((R)-4-морфолин-2-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя (R)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилат (Пример 207b) вместо (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата и 4-хлор-бензамид (CAS 619-56-7) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 319,2 ([{37Cl}M+H]+), 317,2 ([{35Cl}М+Н]+).
Пример 144
4-Хлор-N-((S)-4-морфолин-2-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя (8)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилат (Пример 208b) вместо (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата и 4-хлор-бензамид (CAS 619-56-7) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 319,2 ([{37Cl}M+H]+), 317,2 ([{35Cl{M+H]+).
Пример 145
(RS)-4-Хлор-N-14-(пирролидин-3-илоксиметил)-фенил]-бензамида гидрохлорид

(а) (RS)-3-(4-Амино-бензилокси)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
К раствору (RS)-3-(4-нитро-бензилокси)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (70 мг; CAS 1121634-39-6) в метаноле (5 мл) добавляли палладий на угле (10%-ный; 12 мг). Смесь энергично перемешивали в атмосфере водорода в течение 18 часов. Катализатор отфильтровывали и фильтрат упаривали. Неочищенный продукт очищали колоночной хроматографией (SiO2, градиент: гептан/EtOAc), получая (RS)-3-(4-амино-бензилокси)-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (33 мг; 52%) в виде светло-желтого вязкого масла. MS (ISP): 315,2 ([М+Na]+).
{b) (RS)-4-Хлор-N-[4-(пирролидин-3-илоксиметил)-фенил]-бензамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-3-(4-амино-бензилокси)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлорбензойную кислоту (CAS 74-11-3) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 333,1 ([{37Cl}M+H]+), 331,1 ([{35Cl}M+H]+).
Пример 146
(RS)-4-Хлор-2-фтор-N-(4-морфолин-2-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя 4-хлор-2-фтор-бензамид (CAS 104326-93-4) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 337,3 ([{37Cl}М+Н]+), 335,3 ([{35Cl}M+H]+).
Пример 147
(RS)-3,4-Дихлор-N-(4-морфолин-2-ил-фенил)-бензамида гидрохлорид
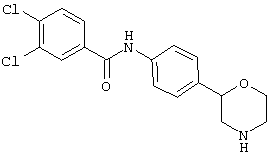
Указанное в заголовке соединение получали аналогично Примеру 141, используя 3,4-дихлор-бензамид (CAS 2670-38-4) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 355,3 ([{37Cl}M+H]+), 353,2 ([{35Cl35Cl}M+H]+), 351,3 ([{35Cl}M+H]+).
Пример 148
(RS)-5-Хлор-пиридин-2-карбоновой кислоты
(4-морфолин-2-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя амид 5-хлор-пиридин-2-карбоновой кислоты (CAS 370104-72-6) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Беловатое твердое вещество. MS (ISP): 320,1 ([{37Cl}M+H]+), 318,2 ([{35Cl}М+Н]+).
Пример 149
(RS)-4-Хлор-N-(4-пирролидин-3-илметил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 107, используя (RS)-3-(4-бром-бензил)-пирролидин (CAS 1158764-56-7) вместо (RS)-2-(4-бром-бензил)-пирролидина. Светло-коричневое твердое вещество. MS (ISP): 317,2 ([{37Cl}M+H]+), 315,1 ([{35Cl}М+Н]+).
Пример 150
3,4-Дихлор-N-((R)-4-пиперидин-3-ил-фенил)-бензамида гидрохлорид
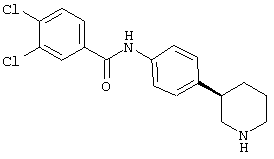
(а) (R)-трет-Бутил-3-(4-аминофенил)пиперидин-1-карбоксилат и (S}-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат
Энантиомеры (RS)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилата (6,00 г; CAS 875798-79-1) разделяли, используя хиральную HPLC (колонка: Chiralpak AD; 5 (50 см; элюент: 10% этанол/гептан; давление: 15 бар (1,5 МПа); скорость потока: 35 мл/мин), получая:
(+)-(Р)-трет-бутил-3-(4-аминоФенил)пиперидин-1-карбоксилат 2,72 г; белое твердое вещество),
время удерживания=62 мин;
(-)-(8)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (2,65 г; белое твердое вещество),
время удерживания=88 мин.
(b) 3,4-Дихлор-N-((R)-4-пиперидин-3-ил-фенил)-бензамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3,4-дихлорбензойную кислоту (CAS 51-44-5) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 353,2 ([{37Cl}M+H]+), 351,3 ([{37Cl35Cl}М+Н]+), 349,2 ([{35Cl}М+Н]+).
Пример 151
(R)-3-Хлор-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-хлорбензойную кислоту (CAS 535-80-8) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 317,3 ([{37Cl}М+Н]+), 315,1 ([{35Cl}М+Н]+).
Пример 152
3,4-Дихлор-N-((S)-4-пиперидин-3-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3,4-дихлорбензойную кислоту (CAS 51-44-5) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 353,2 ([{37Cl}М+Н]+), 351,3 ([{37Cl35Cl}}M+H]+), 349,2 ([{35Cl}М+Н]+).
Пример 153
(S)-3-Хлор-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-хлорбензойную кислоту (CAS 535-80-8) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 317,2 ([{37Cl}М+Н]+), 315,2 ([{35Cl}М+Н]+).
Пример 154
(RS)-3,4-Дихлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамида гидрохлорид
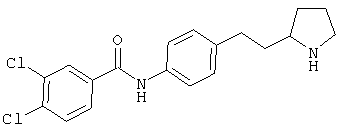
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 3,4-дихлорбензойную кислоту (CAS 51-44-5) вместо 4-хлорбензойной кислоты. Беловатое твердое вещество. MS (ISP): 367,1 ([{37Cl}М+Н]+), 365,2 ([{35Cl}M+H]+), 363,2 ([{35Cl}M+H]+).
Пример 155
(RS)-N-[4-(2-Пирролидин-2-ил-этил)-фенил]-4-трифторметил-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты mpem-бутилового эфира и 4-(трифторметил)бензойную кислоту (CAS 455-24-3) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 363,3 ([М+Н]+).
Пример 156 (RS)-4-Фтор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 4-фторбензойную кислоту (CAS 456-22-4) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 313,3 ([М+Н]+).
Пример 157
(RS)-3-Хлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 3-хлорбензойную кислоту (CAS 535-80-8) вместо 4-хлорбензойной кислоты. Беловатое твердое вещество. MS (ISP): 331,2 ([{37Cl}M+H]+), 329,3 ([{35Cl}М+Н]+).
Пример 158
(RS)-4-Этокси-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты mpem-бутилового эфира и 4-этоксибензойную кислоту (CAS 619-86-3) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 313,3 ([М+Н]+).
Пример 159
(RS)-4-Хлор-N-(4-пиперидин-2-ил-фенил)-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 908334-26-9) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлорбензойную кислоту (CAS 74-11-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 317,2 ([{37Cl}M+H]+), 315,1 ([{35Cl}M+H]+).
Пример 160
(RS)-5-Хлор-пиразин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1 -карбоксилата и 5-хлор-пиразин-2-карбоновую кислоту (CAS 36070-80-1) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 319,2 ([{37Cl}M+H]+), 317,2 ([{35Cl}M+H]+).
Пример 161
(R)-6-Хлор-N-(4-(пиперидин-3-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-хлорникотиновую кислоту (CAS 5326-23-8) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 318,2 ([{37Cl}М+Н]+), 316,2 ([{35Cl}M+H]+).
Пример 162
(S)-6-Хлор-N-(4-(пиперидин-3-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (3)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-хлорникотиновую кислоту (CAS 5326-23-8) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 318,2 ([{37Cl}М+Н]+), 316,2 ([{35Cl}M+H]+).
Пример 163
(RS)-5-Хлор-N-(4-(пирролидин-3-ил)фенил)пиразин-2-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 5-хлор-пиразин-2-карбоновую кислоту (CAS 36070-80-1) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 305,2 ([{37Cl}М+Н]+), 303,3 ([{35Cl}М+Н]+).
Пример 164
(RS)-5-Хлор-N-(4-(2-(пирролидин-2-ил)этил)фенил)пиразин-2-карбоксамида гидрохлорид
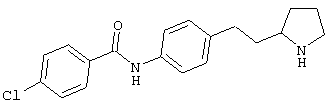
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 5-хлор-пиразин-2-карбоновую кислоту (CAS 36070-80-1) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 333,3 ([{37Cl}М+Н]+), 331,2 ([{35Cl}М+Н]+).
Пример 165
(RS)-5-Циано-N-(4-(пирролидин-3-ил)фенил)пиколинамида гидрохлорид
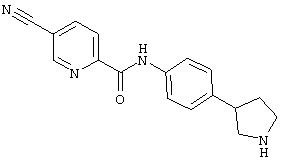
Указанное в заголовке соединение получали аналогично Примеру 29, используя 5-цианопиколиновую кислоту (CAS 53234-55-2) вместо (R)-2-фенилпропионовой кислоты. Светло-коричневого твердое вещество. MS (ISP): 293,2 ([М+Н]+).
Пример 166
(RS)-5-Фтор-N-(4-(2-(пирролидин-2-ил)этил)фенил)пиколинамида гидрохлорид
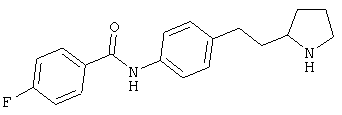
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты mpem-бутилового эфира и 5-фтор-пиридин-2-карбоновую кислоту (CAS 107504-08-5) вместо 4-хлорбензойной кислоты. Желтое твердое вещество. MS (ISP): 314,2 ([М+Н]+).
Пример 167
(R)-5-Хлор-N-(4-(пиперидин-3-ил)фенил)пиколинамида гидрохлорид
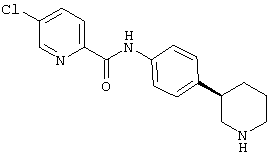
Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-хлорпиколиновую кислоту (CAS 86873-60-1) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 318,2 ([{37Cl}М+Н]+), 316,1 (({35Cl}М+Н]+).
Пример 168
(S)-5-Хлор-N-(4-(пиперидин-3-ил)фенил)пиколинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (3)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-хлорпиколиновую кислоту (CAS 86873-60-1) вместо (RS)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 318,2 ([{37Cl}M+H]+), 316,2 ([{35Cl}М+Н]+).
Пример 169
(RS)-4-Хлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамида гидрохлорид
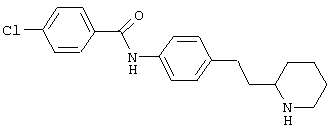
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 157634-02-1) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 345,2 ([{37Cl}M+H]+), 343,2 ([{35Cl}М+Н]+).
Пример 170
(RS)-4-Фтор-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамида гидрохлорид
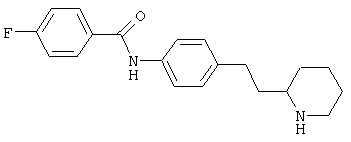
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 157634-02-1) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 4-фторбензойную кислоту (CAS 456-22-4) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 327,2 ([М+Н]+).
Пример 171
(RS)-5-Хлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)пиколинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 157634-02-1) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 5-хлор-пиридин-2-карбоновую кислоту (CAS 86873-60-1) вместо 4-хлорбензойной кислоты. Желтое твердое вещество. MS (ISP): 346,1 ([{37Cl}М+Н]+), 344,2 ([{35Cl}M+H]+).
Пример 172
(RS)-5-Этокси-N-(4-(2-(пирролидин-2-ил)этил)фенил)пиколинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 117625-90-8) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 5-этокси-пиридин-2-карбоновую кислоту (CAS 98353-08-3) вместо 4-хлорбензойной кислоты. Светло-желтое твердое вещество. MS (ISP): 340,2 ([М+Н]+).
Пример 173
(RS)-6-Хлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 157634-02-1) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 6-хлор-пиридин-3-карбоновую кислоту (CAS 5326-23-8) вместо 4-хлорбензойной кислоты. Желтое твердое вещество. MS (ISP): 346,2 ([{37Cl}М+Н]+), 344,2 ([{35Cl}М+Н]+).
Пример 174
(RS)-5-Хлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)пиразин-2-карбоксамида гидрохлорид
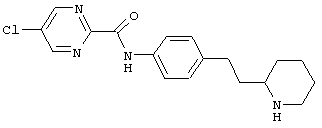
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пиперидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 157634-02-1) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 6-хлор-пиразин-2-карбоновую кислоту (CAS 36070-80-1) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 347,1 ([{37Cl}M+H]+), 345,1 ([{35Cl}М+Н]+).
Пример 175
(RS)-N-(4-(2-(Пиперидин-2-ил)этил)фенил)-4-(трифторметил)бензамида гидрохлорид
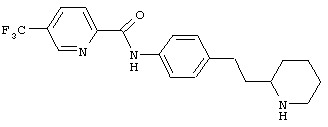
Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пиперидин-1-карбоновой кислоты mpem-бутиловый эфир (CAS 157634-02-1) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты mpem-бутилового эфира и 4-(трифторметил)бензойную кислоту (CAS 455-24-3) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 377,2 ([М+Н]+).
Пример 176
(RS)-3,4-Дихлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (RS)-2-формил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 157634-02-1) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 3,4-дихлорбензойную кислоту (CAS 51-44-5) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 381,1 ([{37Cl}М+Н]+), 379,1 ([{37Cl35Cl}M+H]+), 377,1 ([{35Cl}М+Н]+).
Пример 177
(RS)-4-Этинил-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 109, используя (К3)-2-формил-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (CAS 157634-02-1) вместо (RS)-3-формил-пирролидин-1-карбоновой кислоты трет-бутилового эфира и 4-(этинил)бензойную кислоту (CAS 10602-00-3) вместо 4-хлорбензойной кислоты. Белое твердое вещество. MS (ISP): 333,2 ([M+H]+).
Пример 178
(RS)-N-(4-(Пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1 -пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1 -карбоксилата и 6-(2,2,2-трифтор-этокси)-никотиновую кислоту (CAS 175204-90-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 380,3 ([М+Н]+).
Пример 179
(RS)-5-Этокси-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-этокси-пиридин-2-карбоновую кислоту (CAS 98353-08-3) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 326,3 ([М+Н]+).
Пример 180
(RS)-5-Фтор-N-(4-(пиперидин-3-ил)фенил)пиколинамида гидрохлорид
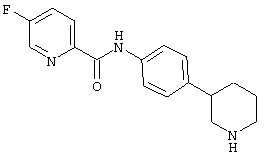
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-фтор-пиридин-2-карбоновую кислоту (CAS 107504-08-5) вместо (R)-2-фенилпропионовой кислоты. Светло-желтое твердое вещество. MS (ISP): 300,3 ([M+H]+).
Пример 181
(RS)-4-Хлор-N-(5-(пирролидин-3-ил)пиридин-2-ил)бензамида гидрохлорид

{а) трет-Бутил-3-(6-аминопиридин-3-ил)-2.5-дигидро-1Н-пиррол-1-карбоксилат
К раствору 3-трифторметансульфонилокси-2,5-дигидро-пиррол-1-карбоновой кислоты трет-бутилового эфира (395 мг; CAS 630121-86-7) в THF (10 мл) в атмосфере аргона при комнатной температуре добавляли карбонат калия (434 мг), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-амин (329 мг; CAS 827614-64-2), тетракис(трифенилфосфин)палладий(0) (14,4 мг) и воду (200 мкл). Реакционную смесь нагревали до 70°С и перемешивали в течение 16 ч. Реакционную смесь выливали в насыщ. водн. раствор NaHCO3 и экстрагировали эфиром. Фазы разделяли и органический слой промывали насыщ. рассолом, затем сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (Isolute(Flash-NH2 от Separtis; градиент: от 0% до 100% EtOAC в гептане, затем от 0% до 10% МеОН в EtOAC), что позволило получить трет-бутил-3-(6-аминопиридин-3-ил)-2,5-дигидро-1Н-пиррол-1-карбоксилат (325 мг; 46%) в виде светло-желтого твердого вещества. MS (ISP): 262,2 ([М+Н])+, 206,1 ([M+H-C4H8]+).
(b) (RS)-трет-Бутил-3-(6-аминопиридин-3-ил)пирролидин-1-карбоксилат
К раствору трет-бутил-3-(6-аминопиридин-3-ил)-2,5-дигидро-1Н-пиррол-1-карбоксилата (145 мг) в метаноле (12 мл) добавляли палладий на угле (10%-ный, 12 мг). Смесь энергично перемешивали в атмосфере водорода в течение 48 часов. Катализатор отфильтровывали и фильтрат упаривали, получая (RS)-трет-бутил-3-(6-аминопиридин-3-ил)пирролидин-1-карбоксилат (167 мг; колич.) в виде светло-желтого твердого вещества. MS (ISP): 264,2 ([М+Н]+), 208,2 ([[M+H-C4H8]+).
(с) (RS)-4-Хлор-N-(5-(пирролидин-3-ил)пиридин-2-ил)бензамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(6-аминопиридин-3-ил)пирролидин-1-карбоксилат вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-бензойную кислоту (CAS 74-11-3) вместо (К)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 304,2 ([{37Cl}М+Н]+), 302,3 (({35Cl}[М+Н]+).
Пример 182
(RS)-4-Метил-N-(4-(пирролидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-метилбензойную кислоту (CAS 99-94-5) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 281,3 ([М+Н]+).
Пример 183 (RS)-4-Метокси-N-(4-(пирролидин-3-ил)фенил)бензамида гидрохлорид
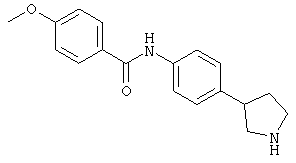
Указанное в заголовке соединение получали аналогично Примеру 29, используя 4-метоксибензойную кислоту (CAS 100-09-4) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 297,4 ([M+H]+).
Пример 184
(RS)-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и бензойную кислоту (CAS 65-85-0) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 281,3 ([М+Н]+).
Пример 185
(RS)-4-Метил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-метилбензойную кислоту (CAS 99-94-5) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 295,3 ([М+Н]+).
Пример 186
(RS)-4-Метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид
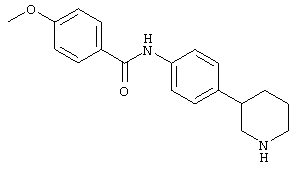
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-метоксибензойную кислоту (CAS 100-09-4) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 311,3 ([М+Н]+).
Пример 187
(RS)-4-Хлор-N-(5-(пиперидин-3-ил)пиридин-2-ил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 181, используя 5-трифторметансульфонилокси-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты трет-бутиловый эфир (CAS 180691-65-0) вместо 3-трифторметан-сульфонилокси-2,5-дигидро-пиррол-1-карбоновой кислоты трет-бутилового эфира. Беловатое твердое вещество. MS (ISP): 318,3 ([{37Cl}М+Н]+), 316,2 ([{35Cl}М+Н]+).
Пример 188
(RS)-N-(4-(Морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя бензамид (CAS 55-21-0) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 283,3 ([M+H]+).
Пример 189
(RS)-4-Метил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя 4-метил-бензамид (CAS 619-55-6) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 297,4 ([М+Н]+).
Пример 190
(RS)-4-Метокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя 4-метокси-бензамид (CAS 3424-93-9) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 313,3 ([М+Н]+).
Пример 191
(RS)-N-(4-(Пиперидин-3-ил)фенил)-5-(2,2,2-трифторэтокси)пиколинамида гидрохлорид
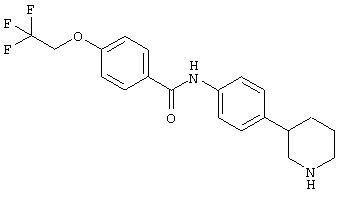
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-3-(4-аминофенил)-1-пиперидинкарбоксилат (CAS 875798-79-1) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-(2,2,2-трифтор-этокси)-пиридин-2-карбоновую кислоту (CAS 881409-53-6) вместо (К)-2-фенилпропионовой кислоты. Светло-желтое твердое вещество. MS (ISP): 380,3 ([М+Н]+).
Пример 192
(RS)-4-(бензилокси)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя 4-бензилокси-бензамид (CAS 56442-43-4) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 389,3 ([М+Н]+).
Пример 193
(RS)-6-хлор-N-(4-(морфолин-2-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя 6-хлор-никотинамид (CAS 6271-78-9) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 318,0 ([М+Н]+).
Пример 194
(RS)-2-(4-(6-цианоникотинамидо)фенил)морфолин-4-ийхлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя 6-циано-никотинамид (CAS 14178-45-1) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Беловатое твердое вещество. MS (ISP): 309,2 ([М+Н]+).
Пример 195
(R)-4-Метил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид
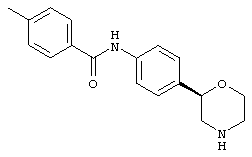
Указанное в заголовке соединение получали аналогично Примеру 141, используя (R)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилат (Пример 207b) вместо (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата и 4-метил-бензамид (CAS 619-55-6) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 297,3 ([М+Н]+).
Пример 196
(S)-4-Метил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя (S)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилат (Пример 208b) вместо (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата и 4-метил-бензамид (CAS 619-55-6) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 297,3 ([М+Н]+).
Пример 197
(RS)-4-Этокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя 4-этокси-бензамид (CAS 55836-71-0) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 327,3 ([М+Н]+).
Пример 198
(RS)-4-Этил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя 4-этил-бензамид (CAS 33695-58-8) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 311,3 ([М+Н]+).
Пример 199
(RS)-4-Гидрокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

a) (RS)-трет-Бутил-2-(4-(4-гидроксибензамидо)фенил)морфолин-4-карбоксилат
(RS)-трет-Бутил-2-(4-(4-(бензилокси)бензамидо)фенил)морфолин-4-карбоксилат (31 мг; 63 мкмоль, промежуточное соединение из Примера 192) растворяли в метаноле (15 мл), обрабатывали 10%-ным Pd/C (10 мг) и гидрировали в течение 1,5 ч при кт (комнатной температуре). Катализатор удаляли фильтрацией и растворитель удаляли в вакууме, получая 25 мг трет-бутил-2-(4-(4-гидроксибензамидо)фенил)морфолин-4-карбоксилата (MS (ISP): 343,2 ([М+Н]+)), который использовали непосредственно на следующей стадии.
b) (RS)-4-Гидрокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид (RS)-трет-Бутил-2-(4-(4-гидроксибензамидо)фенил)морфолин-4-карбоксилат (24 мг; 60,2 мкмоль) растворяли в THF (0,85 мл) и обрабатывали 4 М HCl в диоксане (0,23 мл; 0,9 ммоль). После перемешивания в течение 3,5 ч при 60°C смесь охлаждали до кт, разбавляли этилацетатом, полученные кристаллы собирали фильтрацией, промывая этилацетатом и диэтиловым эфиром, и сушили в высоком вакууме, что позволило получить (RS)-4-гидрокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид (19 мг; 94%) в виде белого кристаллического твердого вещества. MS (ISP): 299,3 ([М+Н]+).
Пример 200
(R)-4-Хлор-3-метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-3-метоксибензойную кислоту (CAS 85740-98-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 347,2 ([{37Cl}M+H]+), 345,2 ([{35Cl}[М+Н]+).
Пример 201
(S)-4-Хлор-3-метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-3-метоксибензойную кислоту (CAS 85740-98-3) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 347,1 ([{37Cl}[M+H]+), 345,2 ([{35Cl}[M+H]+).
Пример 202
(R)-3-Хлор-4-метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-хлор-4-метоксибензойную кислоту (CAS 37908-96-6) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 347,2 ([{35Cl}[M+H]+), 345,2 ([{35Cl}[М+Н]+).
Пример 203
(S)-3-Хлор-4-метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-хлор-4-метоксибензойную кислоту (CAS 37908-96-6) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 347,3 ([{35Cl}[M+H]+), 345,2 ([{35Cl}М+Н]+).
Пример 204
(R)-N-(4-(Пирролидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид
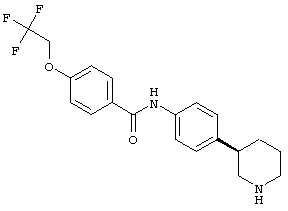
a) (RS)-3-(4-{[6-(2,2,2-Трифтор-этокси)-пиридин-3-карбонил]-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
Указанное в заголовке соединение получали аналогично Примеру 29, стадия (а), используя 6-(2,2,2-трифторэтокси)никотиновую кислоту (САЗ 175204-90-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 466,2 ([M+H]+), 410,2 ([М+Н-C4H8]+).
b) (R)-3-(4-{[6-(2,2,2-Трифтор-этокси)-пиридин-3-карбонил]-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир и (S)-3-(4-{[6-(2,2,2-трифтор-этокси)-пиридин-3-карбонил]-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир
Энантиомеры (RS)-3-(4-{[6-(2,2,2-трифтор-этокси)-пиридин-3-карбонил]-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (310 мг) разделяли, используя хиральную HPLC (колонка: Chiralpak AD, 5×50 см; элюент: 25% изопропанол/гептан; давление: 15 бар (1,5 МПа); скорость потока: 35 мл/мин), получая:
(+)-(R)-3-(4-{[6-(2,2,2-трифтор-этокси)-пиридин-3-карбонил1-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (139 мг; белое твердое вещество),
время удерживания=60 мин;
(-)-(S)-3-(4-{[6-(2,2,2-трифтор-этокси)-пиридин-3-карбонил]-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (138 мг; белое твердое вещество),
время удерживания=81 мин.
c) (R)-N-(4-(Пирролидин-3-ил)Фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид
К перемешиваемому раствору (R)-3-(4-{[6-(2,2,2-трифтор-этокси)-пиридин-3-карбонил]-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира (135 мг; Пример 204b) в THF (3 мл) по каплям добавляли раствор хлористого водорода в диоксане (1,09 мл; 4 М раствор) и смесь нагревали при 60°С в течение ночи. Затем смесь охлаждали до 0°С и полученные кристаллы собирали фильтрацией, дважды промывая этилацетатом, и сушили в вакууме при 60°С, что позволило получить (R)-N-(4-(пирролидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)-никотинамида гидрохлорид (113 мг; 97%) в виде белого кристаллического твердого вещества. MS (ISP): 366,1 ([M+H]+).
Пример 205
(S)-N-(4-(Пирролидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 204 стадия (с), используя (S)-3-(4-{[6-(2,2,2-трифтор-этокси)-пиридин-3-карбонил]-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутиловый эфир (Пример 204b) вместо (Р)-3-(4-{[6-(2,2,2-трифтор-зтокси)-пиридин-3-карбонил]-амино}-фенил)-пирролидин-1-карбоновой кислоты трет-бутилового эфира. Белое твердое вещество. MS (ISP): 366,1 ([M+H]+.
Пример 206 (RS)-4-(4-Хлорфенокси)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

а) 4-(4-Хлорфенокси)бензамид
4-(4-Хлорфенокси)бензойную кислоту (CAS 21120-67-2) (500 мг; 2,01 ммоль) и 1,1-карбонилдиимидазол (504 мг; 3,02 ммоль) растворяли в DMF (5 мл) и перемешивали в течение 1 ч при 50°С. После охлаждения до кт по каплям добавляли 25%-ный водный гидроксид аммония (4,51 г; 4,96 мл; 32,2 ммоль). После перемешивания в течение 3 ч суспензию фильтровали, твердое вещество промывали этилацетатом и диэтиловым эфиром и сушили в высоком вакууме, получая 500 мг белого твердого вещества. MS (ISP): 248,1 ([М+Н]+).
b) (RS)-4-(4-хлорфенокси)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 141, используя 4-(4-хлорфенокси)бензамид вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 409,2 ([М+Н]+).
Пример 207
(R)-6-Хлор-N-(4-(морфолин-2-ил)фенил)никотинамида гидрохлорид
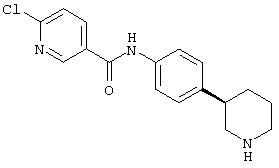
a) (R)-2-(4-БромФенил)морфолин
Энантиомеры (RS)-2-(4-бром-фенил)-морфолина (2,27 г; CAS-1131220-82-0) разделяли, используя хиральную HPLC (колонка: Chiralpak IA, 8 (32 см; элюент: смесь н-гептан/этанол (1:11), содержащая 0,1% DEA (диэтиламин)), получая:
(S)-2-(4-бром-фенил)-морфолин: собран с 7,6 мин по 9,4 мин, выход 0,97 г (42,9%) с 97,4%-ным ее (энантиомерный избыток; от англ. enantiomeric excess);
(R)-2-(4-бром-фенил)-морфолин: собран с 9,8 мин по 13,9 мин, выход 0,99 г (43,6%) с 97,4%-ным ее.
b) (R)-трет-Бутил-2-(4-бромфенил)морфолин-4-карбоксилат
(R)-2-(4-Бромфенил)морфолин (6 г; 24,8 ммоль) и N,N-диизопропилэтил-амин (3,84 г; 5,19 мл; 29,7 ммоль) в THF (60 мл) обрабатывали ди-трет-бутилдикарбонатом (6,49 г; 29,7 ммоль). Реакционную смесь перемешивали в течение 17 ч при кт, концентрировали в вакууме, разбавляли этилацетатом, промывали 1 М водн. лимонной кислотой, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенное вещество кристаллизовали из смеси гептан/этилацетат, что позволило получить 8,48 г (87%) (R)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата в виде белого твердого вещества. MS (ISP): 344,1 ([М+Н]+).
c) (R)-трет-Бутил-2-(4-(диФенилметиленамино)фенил)морфолин-4-карбоксилат
(R)-трет-Бутил-2-(4-бромфенил)морфолин-4-карбоксилат (5,4 г;
15,8 ммоль), дифенилметанимин (3,43 г; 3,17 мл; 18,9 ммоль), BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) (737 мг; 1,18 ммоль) и Pd2(cdba)2 (трис(дибензилиденацетон)дипалладий(О)) (361 мг; 0,39 ммоль) растворяли в атмосфере аргона в безводном и деаэрированном толуоле (108 мл) и обрабатывали mpem-бутилатом натрия (2,12 г; 22,1 ммоль). Темно-коричневую смесь перемешивали при 90°С в течение 18 ч. Желто-коричневую реакционную смесь разбавляли толуолом (100 мл), охлаждали до кт и дважды экстрагировали водой. Органический слой отделяли, сушили над сульфатом магния и концентрировали в вакууме. Неочищенный продукт разбавляли 50 мл гексана, перемешивали в течение 1 ч и отфильтровывали, получая желтое твердое вещество (7,4 г), которое очищали колоночной хроматографией (50 г силикагеля;
5%-15% этилацетат/гептан). Объединенные и сконцентрированные фракции суспендировали в гексане, перемешивали в течение 17 ч, фильтровали и сушили в высоком вакууме, получая 6,15 г (86%) желтого твердого вещества. MS (ISP): 443,4 ([М+НЦ.
d) (R-трет-Бутил-2-(4-аминоФенил)морфолин-4-карбоксилат
Суспензию (R)-трет-бутил-2-(4-(дифенилметиленамино)фенил)морфолин-4-карбоксилата (6 г; 13,6 ммоль), формиата аммония (12,8 г; 203 ммоль) и 5%-ного Pd/C (721 мг; 0,339 ммоль) в метаноле (103 мл) перемешивали при 60°С в течение 2 ч. Реакционную смесь фильтровали и концентрировали. Остаток растворяли в этилацетате и воде. Органическую фазу экстрагировали дважды, используя 0,5 М HCl. Объединенные водные фазы подщелачивали, используя 2 М NaOH, и экстрагировали дважды дихлорметаном. Органические фазы сушили над сульфатом магния, фильтровали и сушили в вакууме, получая 3,04 г беловатого твердого вещества. MS (ISP): 279,1 ([М+Н}+).
e) (R)-6-Хлор-N-(4-(морфолин-2-ил)фенил)никотинамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29, используя (Р)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 6-хлор-никотиновую кислоту (CAS 5326-23-8) вместо (R)-2-фенилпропионовой кислоты и HBTU (гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония) вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 318,1 ([М+Н]+).
Пример 208
(S)-6-Хлор-N-(4-(морфолин-2-ил)фенил)никотинамида гидрохлорид

a) (8)-2-(4-Бромфенил)морфолин
Энантиомеры (RS)-2-(4-бром-фенил)-морфолина (2,27 г; CAS-1131220-82-0) разделяли, используя хиральную HPLC (колонка: Chiralpak IA, 8 (32 см; элюент: смесь н-гептан/этанол (1:11), содержащая 0,1% DEA), получая:
(S)-2-(4-бром-фенил)-морфолин: собран с 7,6 мин по 9,4 мин, выход 0,97 г (42,9%) с 97,4%-ным ее;
(R)-2-(4-бром-фенил)-морфолин: собран с 9,8 мин по 13,9 мин,
выход 0,99 г (43,6%) с 97,4%-ным ее.
b) (8)-трет-Бутил-2-(4-бромфенил)морфолин-4-карбоксилат
(S)-2-(4-Бром-фенил)-морфолин (36,3 г; 150 ммоль) и N,N-диизопропилэтил-амин (23,3 г; 31,4 мл; 180 ммоль) в THF (360 мл) обрабатывали ди-трет-бутилдикарбонатом (39,3 г; 180 ммоль). Реакционную смесь перемешивали в течение 17 ч при кт, концентрировали в вакууме, разбавляли этилацетатом, промывали 1 М водн. лимонной кислотой (2 (100 мл), сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенное вещество кристаллизовали из гексана, что позволило получить 47,1 г (92%) (S)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата в виде беловатого твердого вещества. MS (ISP): 344,1 ([М+Н]+).
c) (S)-трет-Бутил-2-(4-(дифенилметиленамино)фенил)морфолин-4-карбоксилат
(S)-трет-Бутил-2-(4-бромфенил)морфолин-4-карбоксилат (47 г; 137 ммоль), дифенилметанимин (29,9 г; 27,6 мл; 165 ммоль), BINAP (6,41 г; 10,3 ммоль) и Pd2(dba)3 (3,14 г; 3,43 ммоль) растворяли в атмосфере аргона в безводном и деаэрированном толуоле (940 мл) и обрабатывали трет-бутилатом натрия (18,5 г; 192 ммоль). Темно-коричневую смесь перемешивали при 90°С в течение 18 ч. Желто-коричневую реакционную смесь разбавляли толуолом (700 мл), охлаждали до кт и дважды экстрагировали водой. Органический слой отделяли, сушили над сульфатом магния и концентрировали в вакууме. Неочищенный продукт разбавляли 300 мл гексана, перемешивали в течение 1 ч и отфильтровывали, получая оранжевое твердое вещество (68 г), которое очищали колоночной хроматографией (1,3 кг силикагеля, 20%-ный этилацетат/гептан). Объединенные и сконцентрированные фракции суспендировали в гексане, перемешивали в течение 17 ч, фильтровали и сушили в высоком вакууме, получая 54,1 г (89%) желтого твердого вещества. MS (ISP): 443,3 ([M+H}+).
d) (3)-трет-Бутил-2-(4-аминофенил)морфолин-4-карбоксилат
Суспензию (S)-трет-бутил-2-(4-(дифенилметиленамино)фенил)морфолин-4-карбоксилата (54,1 г; 122 ммоль), формиата аммония (116 г; 1,83 моль) и 5%-ного Pd/C (6,5 г; 3,06 ммоль) в метаноле (930 мл) перемешивали при 60°С в течение 2 ч. Реакционную смесь фильтровали и концентрировали. Остаток растворяли в этилацетате и воде. Органическую фазу дважды экстрагировали, используя 0,5 М водн. HCl. Объединенные водные фазы подщелачивали, используя 2 М водн. NaOH, и дважды экстрагировали дихлорметаном. Органические фазы сушили над сульфатом магния, фильтровали и сушили в вакууме, получая 31,95 г беловатого твердого вещества. MS (ISP): 279,1 ([М+Н]+).
e) (S)-6-Хлор-N-(4-(морфолин-2-ил)фенил)никотинамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 6-хлорникотиновую кислоту (CAS 5326-23-8) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 318,1 ([М+Н]+).
Пример 209
(RS)-3-Хлор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид
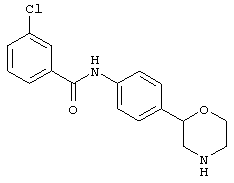
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 3-хлорбензойную кислоту вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 317,1 ([М+Н]]+).
Пример 210
(RS)-5-Хлор-N-(4-(морфолин-2-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 5-хлорникотиновую кислоту вместо (К)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP):
318,1 ([М+Н]+).
Пример 211
(RS)-Метил-4-((4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)метил)бензоата гидрохлорид

a) (RS)-трет-Бутил-2-(4-(4-(4-(метоксикарбонил)бензилокси)бензамидо)-фенил)морфолин-4-карбоксилат
(RS)-трет-Бутил-2-(4-(4-гидроксибензамидо)фенил)морфолин-4-карбоксилат (100 мг; 0,25 ммоль; Пример 199а), метил-4-(бромметил)бензоат (129 мг; 0,565 ммоль), карбонат калия (78 мг; 0,565 ммоль) и иодид калия (6,2 мг; 0,037 ммоль) объединяли в ацетоне (6 мл), получая светло-коричневую суспензию. Реакционную смесь перемешивали при 60°С в течение 17 ч. Неочищенную реакционную смесь концентрировали в вакууме, объединяли с водой и экстрагировали дихлорметаном (3х). Органические слои сушили над сульфатом магния и концентрировали в вакууме. Неочищенное вещество объединяли с метанолом (15 мл), перемешивали в течение 15 минут при температуре дефлегмации, охлаждали до кт и отфильтровывали, получая 99 мг белого твердого вещества. MS (ISP): 547,2 ([М+Н]+).
b) (RS)-Метил-4-((4-(4-(морфолин-2-ил)фенилкарбамоил)Фенокси)метил)-бензоата гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29 (стадия b), исходя из (RS)-трет-бутил-2-(4-(4-(4-(метоксикарбонил)бензилокси)-бензамидо)фенил)морфолин-4-карбоксилата. Белое твердое вещество. MS (ISP): 447,2 ([М+Н]+).
Пример 212
(RS)-4-((4-(4-(Морфолин-2-ил)фенилкарбамоил)фенокси)метил)бензойной кислоты гидрохлорид

(RS)-Метил-4-((4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)метил)-бензоата гидрохлорид (40 мг; 0,083 ммоль; Пример 211) суспендировали в THF (1 мл) и метаноле (0,5 мл) и добавляли 1 М водн. LiOH (0,207 мл; 0,207 ммоль). Этот раствор перемешивали в течение 17 ч при кт, концентрировали в вакууме, суспендировали в воде (2 мл) и подкисляли, используя 1 М водн. HCl. Осадок отфильтровывали и сушили под высоким вакуумом, получая 30 мг белого твердого вещества. MS (ISP): 433,2 ([М+Н]+).
Пример 213
(RS)-Метил-2-хлор-4-(4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)бензоата гидрохлорид
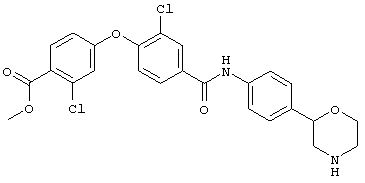
a) (RS)-трет-Бутил-2-(4-(4-(3-хлор-4-(метоксикарбонил)фенокси)-бензамидо)фенил)морфолин-4-карбоксилат
(RS)-трет-Бутил-2-(4-(4-гидроксибензамидо)фенил)морфолин-4-карбоксилат (150 мг; 1,13 ммоль; Пример 199а), 3-хлор-4-(метоксикарбонил)-фенилбороновую кислоту (CAS 603122-82-3) (242 мг; 1,13 ммоль), ацетат меди(И) (205 мг; 1,13 ммоль) и пиридин (149 мг; 1,88 ммоль) объединяли в дихлорметане (3 мл), получая голубую суспензию. Реакционную смесь перемешивали в течение 40 ч, фильтровали через целит и концентрировали. Остаток растворяли в дихлорметане, абсорбировали на SiO2 и хроматографировали (20 г силикагеля; 10-35%-ный этилацетат в гептане), получая 70 мг бесцветного аморфного твердого вещества. MS (ISP): 567,3 ([М+Н]+).
b) (RS)-Метил-2-хлор-4-(4-(4-(морсфолин-2-ил)фенилкарбамоил)фенокси)-бензоата гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29 (стадия b), исходя из (RS)-трет-бутил-2-(4-(4-(3-хлор-4-(метоксикарбонил)-фенокси)бензамидо)фенил)морфолин-4-карбоксилата. Белое твердое вещество. MS (ISP): 467,3 ([М+Н]+).
Пример 214
(RS)-4-Циклопропилметокси-N-(4-морфолин-2-ил-фенил)-бензамида гидрохлорид

a) (RS)-трет-Бутил-2-(4-(4-(циклопропилметокси)бензамидо)Фенил)-морфолин-4-карбоксилат
(RS)-трет-Бутил-2-(4-(4-гидроксибензамидо)фенил)морфолин-4-карбоксилат (60 мг; 0,15 ммоль; Пример 199а), (бромметил)циклопропан (47 мг; 0,339 ммоль), карбонат калия (47 мг; 0,339 ммоль) и иодид калия (3,7 мг; 0,023 ммоль) объединяли с ацетоном (4 мл), получая светло-коричневую суспензию. Реакционную смесь перемешивали при 60°С в течение 17 ч. Неочищенную реакционную смесь концентрировали в вакууме, объединяли с водой и экстрагировали дихлорметаном (3х). Органические слои сушили над сульфатом магния и концентрировали в вакууме. Неочищенное вещество объединяли с метанолом (5 мл), перемешивали в течение 15 минут и отфильтровывали, получая 48 мг белого твердого вещества. MS (ISP): 453,3 ([М+Н]+).
b) (RS)-4-Циклопропилметокси-N-(4-морфолин-2-ил-фенил)-бензамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29 (стадия b), исходя из (RS)-трет-бутил-2-(4-(4-(циклопропилметокси)бензамидо)-фенил)морфолин-4-карбоксилата. Белое твердое вещество. MS (ISP): 353,3 ([M+H]+).
Пример 215
(RS)-2-Хлор-4-(4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)бензойной кислоты гидрохлорид
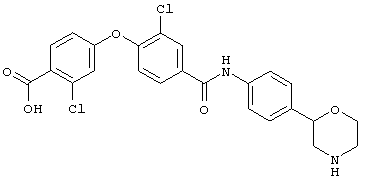
Указанное в заголовке соединение получали аналогично Примеру 212, используя (RS)-метил-4-((4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)метил)-бензоата гидрохлорид. Белое твердое вещество. MS (ISP): 453,2 ([М+Н]+).
Пример 216
(RS)-4-(Метилтио)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 4-(метилтио)бензойную кислоту вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 329,1 ([М+Н]+).
Пример 217
(RS)-2-Метил-N-(4-(морфолин-2-ил)фенил)тиазол-4-карбоксамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 141, используя 2-метилтиазол-4-карбоксамид (CAS 31825-95-3) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Желтое твердое вещество. MS (ISP): 304,2 ([M+H]+).
Пример 218
(RS)-2-Хлор-N-(4-(морфолин-2-ил)фенил)изоникотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-хлоризоникотиновую кислоту вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 318,1 ([M+H]+).
Пример 219
(RS)-5,6-Дихлор-N-(4-(морфолин-2-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 5,6-дихлорникотиновую кислоту вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP); 352,1 ([М+Н]+).
Пример 220
(RS)-4-(2-Хлорметил-3-гидрокси-2-метил-пропокси)-N-(4-морфолин-2-ил-фенил)-бензамид

Указанное в заголовке соединение получали аналогично Примеру 214, используя 3-бромметил-3-метилоксетан (CAS 78385-26-9) вместо (бромметил)циклопропана. Белое твердое вещество. MS (ISP): 419,2 ([М+Н]+.
Пример 221
(RS)-2,6-Дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2,6-дихлоризоникотиновую кислоту (CAS 5398-44-7) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU. Белое твердое вещество. MS (ISP): 352,3 ([M+H]+).
Пример 222
(RS)-N-(4-(Морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 6-(2,2,2-трифторэтокси)никотиновую кислоту (CAS 159783-29-6) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 382,4([М+Н]+).
Пример 223
(R)-N-(4-(Пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-(2,2,2-трифторэтокси)никотиновую кислоту (CAS 175204-90-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 380,3 ([M+H]+).
Пример 224
(S)-N-(4-(Пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-(2,2,2-трифторэтокси)никотиновую кислоту (CAS 175204-90-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 380,3 ([М+Н]+).
Пример 225
(S)-3-Хлор-4-метил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-хлор-4-метил-бензойную кислоту (CAS 5162-82-3) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 331,3 ([{37Cl}М+Н]+), 329,4 ([35Cl}М+Н]+).
Пример 226
(S)-4-Хлор-3-метил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-хлор-3-метил-бензойную кислоту (CAS 7697-29-2) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 331,3 ([{37Cl}М+Н]+), 329,4 ([{35Cl}М+Н]+).
Пример 227
(S)-3,4-Диметил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3,4-диметил-бензойную кислоту (CAS 619-04-5) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 309,4 ([М+Н]+).
Пример 228
(RS)-4-((3-Метилоксетан-3-ил)метокси)-N-(4-(морфолин-2-ил)фенил)бензамид

Указанное в заголовке соединение получали аналогично Примеру 214, используя 3-бромметил-3-метилоксетан (CAS 78385-26-9) вместо (бромметил)-циклопропана и используя 10 экв. TFA (трифторуксусная кислота) при -10°С в дихлорметане (17 ч) для стадии удаления защиты. Белое твердое вещество. MS (ISP): 383,2 ([М+Н]+).
Пример 229
(R)-4-Хлор-2-фтор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя (R)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилат (Пример 207b) вместо (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата и 4-хлор-2-фтор-бензамид (CAS 104326-93-4) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 337,1 ([{37Cl}М+Н]+), 335,1 ([{35Cl}M+H]+).
Пример 230
(S)-4-Хлор-2-фтор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 141, используя (S)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилат (Пример 208b) вместо (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата и 4-хлор-2-фтор-бензамид (CAS 104326-93-4) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 320,1 ([{37Cl}M+H]+), 318,2 ([{35Cl}М+Н]+).
Пример 231
(RS)-N-(4-(Морфолин-2-ил)фенил)-2-фенилтиазол-5-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-ттрет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-фенил-тиазол-5-карбоновую кислоту (САЗ 10058-38-5) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Желтое твердое вещество. MS (ISP): 366,1 ([М+Н]+).
Пример 232
(RS)-N-(4-(Морфолин-2-ил)фенил)-6-(тетрагидро-2Н-пиран-4-илокси)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1 -карбоксилата, 6-(тетрагидро-2Н-пиран-4-илокси)никотиновую кислоту (CAS 886851-55-4) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 384,2 ([М+Н]+).
Пример 233
(RS)-N-(4-(Морфолин-2-ил)фенил)-2-фенилтиазол-4-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-фенилтиазол-4-карбоновую кислоту (CAS 7113-10-2) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 366,2 ([М+Н]+).
Пример 234
(S)-N-(4-(Пиперидин-3-ил)фенил)-3-(трифторметил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-(трифторметил)бензойную кислоту (CAS 454-92-2) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 349,3 ([M+H]+).
Пример 235
(S)-2-(4-Хлорфенокси)-N-(4-(пиперидин-3-ил)фенил)ацетамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2-(4-хлорфенокси)уксусную кислоту (CAS 122-88-3) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 347,2 ([{37Cl}М+Н]+), 345,2 ([{35Cl}M+H]+).
Пример 236
(S)-4-(Метилтио)-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-(метилтио)бензойную кислоту (CAS 13205-48-6) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 327,3 ([М+Н]+).
Пример 237
(S)-4-(Этилтио)-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид
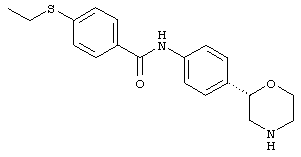
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 4-(этилтио)бензойную кислоту (CAS 13205-49-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 341,3 ([M+H]+).
Пример 238
5-Хлор-пиразин-2-карбоновой кислоты ((S)-4-пиперидин-3-ил-фенил)-амида гидрохлорид
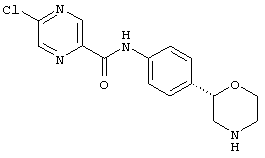
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-хлор-пиразин-2-карбоновую кислоту (CAS 36070-80-1) вместо (RS)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 319,2 ([{37Cl}М+Н]+), 345,2([{35Cl}М+Н]+).
Пример 239
5-Хлор-пиразин-2-карбоновой кислоты ((R)-4-пиперидин-3-ил-фенил)-амида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-хлор-пиразин-2-карбоновую кислоту (CAS 36070-80-1) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 319,2 ([{37Cl}М+Н]+), 317,2([{35Cl}М+Н]+).
Пример 240
(S)-4-Хлорбензил-4-(пиперидин-3-ил)фенилкарбамата гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 120, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и (4-хлорфенил)метанол (CAS 873-76-7) вместо 4-хлорфенетилового спирта. Беловатое твердое вещество. MS (ISP): 347,1 ([{37Cl}М+Н]+), 345,2 ([{35Cl}M+H]+).
Пример 241
(RS)-N-(4-(Морфолин-2-ил)фенил)-6-морфолиноникотинамида гидрохлорид
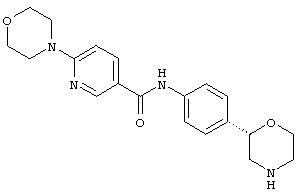
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 6-морфолиноникотиновую кислоту (CAS 120800-52-4) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 369,1 ([М+Н]+).
Пример 242
(S)-N-(4-(Пиперидин-3-ил)фенил)-6-(трифторметил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (3)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-(трифторметил)никотиновую кислоту (CAS 231291-22-8) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 350,4 ([М+Н]+).
Пример 243
(S)-6-Метил-N-(4-(пиперидин-3-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-метилникотиновую кислоту (CAS 3222-47-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 296,4 ([M+H]+).
Пример 244
(S)-6-(Метилтио)-N-(4-(пиперидин-3-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-(метилтио)никотиновую кислоту (CAS 74470-25-0) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 328,4 ([М+Н}+).
Пример 245
(RS)-6-Этокси-N-(4-(морфолин-2-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 6-этоксиникотиновую кислоту (CAS 97455-65-7) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 328,3 ([М+Н}+).
Пример 246
(S)-3-(Этилтио)-N-(4-(пиперидин-3-ил)фенил)бензамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-(этилтио)бензойную кислоту (CAS 5537-74-6) вместо (R)-2-фенилпропионовой кислоты. Бесцветная смола. MS (ISP): 341,1 ([М+НЦ]+)
Пример 247
(S)-5-Метил-N-(4-(пиперидин-3-ил)фенил)пиразин-2-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-метил-пиразин-2-карбоновую кислоту (CAS 5521-55-1) вместо (R)-2-фенил-пропионовой кислоты. Желтое твердое вещество. MS (ISP): 297,4 ([М+Н]+).
Пример 248
(S)-N-(4-(Пиперидин-3-ил)фенил)-5-(трифторметил)пиразин-2-карбоксамида гидрохлорид
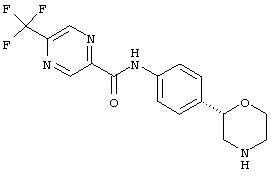
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-(трифторметил)пиразин-2-карбоновую кислоту (CAS 1060814-50-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 351,4 ([M+H]+).
Пример 249
(RS)-N-(4-(Морфолин-2-ил)фенил)-2-фенилоксазол-4-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-фенилоксазол-4-карбоновую кислоту (CAS 23012-16-0) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 350,1 ([М+Н]+).
Пример 250
(S)-N-(4-(Пиперидин-3-ил)фенил)-5-(2,2,2-трифторэтокси)пиразин-2-карбоксамида гидрохлорид
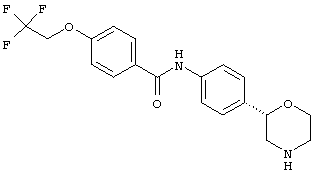
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-(2,2,2-трифторэтокси)пиразин-2-карбоновую кислоту (CAS 1174323-36-4) вместо (Р)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 381,4 ([М+Н]+).
Пример 251
(S)-5-Бром-N-(4-(пиперидин-3-ил)фенил)пиразин-2-карбоксамида 2,2,2-трифторацетат

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-бром-пиразин-2-карбоновую кислоту (CAS 876161-05-6) вместо (RS)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 363,2 ([{81Br}М+Н]+), 361,2([{79Br}M+H}]+).
Пример 252
(S)-6-Бром-N-(4-(пиперидин-3-ил)фенил)никотинамида 2,2,2-трифторацетат

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-бромникотиновую кислоту (CAS 6311-35-9) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 362,2 ([{81Br}М+Н]+), 360,2 ([{79Br}М+Н]+).
Пример 253
(S)-3-Метил-N-(4-(пиперидин-3-ил)фенил)бензамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминосренил)пирролидин-1-карбоксилата и 3-метилбензойную кислоту (CAS 99-04-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 295,2 ([М+Н]+).
Пример 254
цис-(RS)-4-Метокси-N-(4-(морфолин-2-ил)фенил)циклогексанкарбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, смесь цис//транс-4-метоксициклогексанкарбоновых кислот (CAS 95233-12-8) вместо (К)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). цис/транс-Изомеры разделяли, используя хроматографию на силикагеле (гептан/этилацетат, 1:1). Светло-коричневое твердое вещество. MS (ISP): 319,2 ([М+Н]+).
Пример 255
транс-(RS)-4-Метокси-N-(4-(морфолин-2-ил)фенил)циклогексанкарбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, смесь цис/транс-4-метоксициклогексанкарбоновых кислот (CAS 95233-12-8) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). цис/транс-Изомеры разделяли, используя хроматографию на силикагеле (гептан/этилацетат, 1:1). Белое твердое вещество. MS (ISP): 319,2 ([М+Н]+).
Пример 256
(S)-6-Этокси-N-(4-(пиперидин-3-ил)фенил)никотинамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (8)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-этокси-никотиновую кислоту (CAS 97455-65-7) вместо (Р)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 326,4 ([М+Н]+).
Пример 257
(S)-5-(Метилтио)-N-(4-(пиперидин-3-ил)фенил)пиразин-2-карбоксамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-(метилтио)-пиразин-2-карбоновую кислоту (CAS 1174322-69-0) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 329,4 ([М+Н]+).
Пример 258
(S)-2,3-Дигидро-1Н-индан-2-ила 4-(пиперидин-3-ил)фенилкарбамат 2,2,2-трифторацетат

Указанное в заголовке соединение получали аналогично Примеру 120, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2-инданол (CAS 4254-29-9) вместо 4-хлорфенетилового спирта. Беловатое твердое вещество. MS (ISP): 337,5 ([М+Н]+).
Пример 259
(S)-3-(Метилтио)-N-(4-(пиперидин-3-ил)фенил)бензамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (8)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-(метилтио)-бензойную кислоту (CAS 825-99-0) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 327,3 ([M+H]+).
Пример 260
(R)-3,4-Диметил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3,4-диметилбензойную кислоту (CAS 619-04-5) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 309,5 ([М+Н]+).
Пример 261
(R)-N-(4-(Пиперидин-3-ил)фенил)-3-(трифторметил)бензамида гидрохлорид
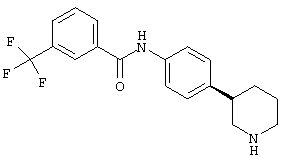
Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 3-(трифторметил)бензойную кислоту (CAS 454-92-2) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 349,3 ([М+Н]+).
Пример 262
(R)-3-Хлор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 207, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 3-хлорбензойную кислоту (CAS 535-80-8) вместо (RS)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 317,1 ([М+Н]+).
Пример 263
(S)-3-Хлор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 208, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 3-хлорбензойную кислоту (CAS 535-80-8) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Беловатое твердое вещество. MS (ISP): 317,1 ([M+H]+).
Пример 264
(R)-6-Метил-N-(4-(пиперидин-3-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-метилникотиновую кислоту (CAS 3222-47-7) вместо (R)-2-фенилпропионовой кислоты. Беловатое твердое вещество. MS (ISP): 296,4 ([М+Н]+).
Пример 265
(R)-N-(4-(Пиперидин-3-ил)фенил)-6-(трифторметил)никотинамида гидрохлорид
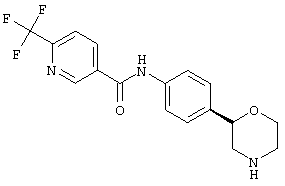
Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-(трифторметил)никотиновую кислоту (CAS 231291-22-8) вместо (R)-2-фенил-пропионовой кислоты. Белое твердое вещество. MS (ISP): 350,4 ([М+Н]+).
Пример 266
(R)-4-(Метилтио)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трелт-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 207, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 4-(метилтио)бензойную кислоту (CAS 13205-48-6) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU. Белое твердое вещество. MS (ISP): 329,1 ([М+Н]+).
Пример 267
(S)-4-(Метилтио)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 208, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 4-(метилтио)бензойную кислоту (CAS 13205-48-6) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 329,1 ([М+Н]+).
Пример 268
(R)-N-(4-(Морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 207, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 6-(2,2,2-трифторэтокси)никотиновую кислоту (CAS 159783-29-6) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 382,1 ([M+H]+).
Пример 269
(S)-N-(4-(Морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 208, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 6-(2,2,2-трифторэтокси)никотиновую кислоту (CAS 159783-29-6) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU. Белое твердое вещество. MS (ISP): 382,1 ([M+H]+).
Пример 270
(R)-2,6-Дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамида гидрохлорид
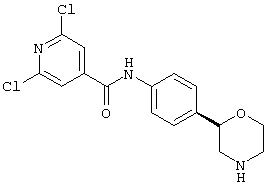
Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 207, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 2,6-дихлоризоникотиновую кислоту (CAS 5398-44-7) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 352,1 ([М+Н]+).
Пример 271
(S)-2,6-Дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамида гидрохлорид
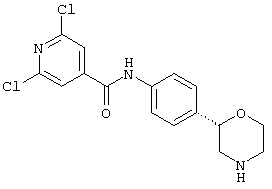
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 208, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 2,6-дихлоризоникотиновую кислоту (CAS 5398-44-7) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 352,1 ([M+H]+).
Пример 272
(RS)-N-(4-(Морфолин-2-ил)фенил)-6-(трифторметил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 6-(трифторметил)никотиновую кислоту (CAS 158063-66-2) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 352,2 ([M+H]+).
Пример 273
(RS)-2-Хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамида гидрохлорид
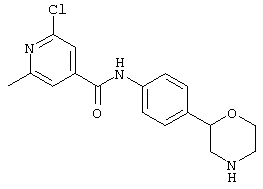
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-хлор-6-метилпиридин-4-карбоновую кислоту (CAS 25462-85-5) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 332,3 ([М+Н]+).
Пример 274
(S)-5-Этил-N-(4-(пиперидин-3-ил)фенил)пиразин-2-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-этил-пиразин-2-карбоновую кислоту (CAS 13534-75-3) вместо (R)-2-фенил-пропионовой кислоты. Желтое твердое вещество. MS (ISP): 311,4 ([М+Н]+).
Пример 275
(R)-4-Этокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 207, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 4-этоксибензойную кислоту (CAS 619-86-3) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 327,2 ([М+Н]+).
Пример 276
(S)-4-Этокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 208, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 4-этоксибензойную кислоту (CAS 619-86-3) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 327,2 ([M+H]+).
Пример 277
(RS)-3-Метил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид
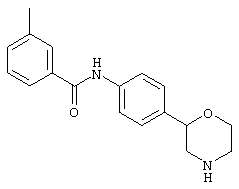
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1 -карбоксилата, 3-метилбензойную кислоту (CAS 99-04-7) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 297,2 ([М+Н]+).
Пример 278
(S)-N-(4-(Пиперидин-3-ил)фенил)-5-пропилпиразин-2-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 5-пропил-пиразин-2-карбоновую кислоту вместо (R)-2-фенилпропионовой кислоты. Желтое твердое вещество. MS (ISP): 325,4 ([М+Н]+).
Пример 279
(RS)-N-(4-(Морфолин-2-ил)фенил)-6-(пирролидин-1-ил)никотинамида гидрохлорид
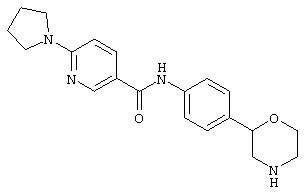
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-треп-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 6-пирролидин-1-ил-никотиновую кислоту (CAS 210963-95-4) вместо (К)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 353,2 ([М+Н]+).
Пример 280
(RS)-N-(4-(Морфолин-2-ил)фенил)-2-(трифторметил)изоникотинамида гидрохлорид
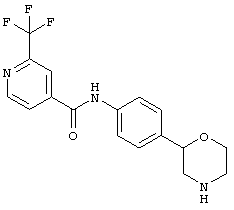
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1- карбоксилата, 2-(трифторметил)изоникотиновую кислоту (CAS 131747-41-6) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 353,2 ([М+Н]+).
Пример 281
(S)-2,6-Дихлор-N-(4-(пиперидин-3-ил)фенил)изоникотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (8)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2,6-дихлоризоникотиновую кислоту (CAS 5398-44-7) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 354,3 ([{37Cl}М+Н]+), 352,3 ([{35Cl}M+H]+), 350,3 ([{35Cl}M+H]+).
Пример 282
(S)-2-Хлор-6-метил-N-(4-(пиперидин-3-ил)фенил)изоникотинамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 2-хлор-6-метилизоникотиновую кислоту (CAS 25462-85-5) вместо (R)-2-фенилпропионовой кислоты. Светло-желтое твердое вещество. MS (ISP): 332,2 ([{37Cl}М+Н]+), 330,3 ([{35Cl}M+H]+).
Пример 283
(R)-N-(4-(Морфолин-2-ил)фенил)-6-(трифторметил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 207, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 6-(трифторметил)никотиновую кислоту (CAS 158063-66-2) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 352,2 ([М+Н]+).
Пример 284
(S)-N-(4-(Морфолин-2-ил)фенил)-6-(трифторметил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 208, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 6-(трифторметил)никотиновую кислоту (CAS 158063-66-2) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 352,2 ([M+H]+).
Пример 285
(R)-2-Хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамида гидрохлорид
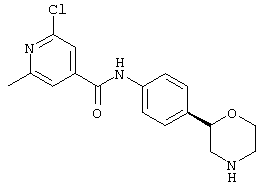
Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 207, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 2-хлор-6-метилпиридин-4-карбоновую кислоту (CAS 25462-85-5) вместо (Р)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 332,1 ([М+Н]+).
Пример 286
(S)-2-Хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 208, стадии a-d) вместо (RS)-трет-бутил-3-(4-аминофенил)-пирролидин-1-карбоксилата, 2-хлор-6-метилпиридин-4-карбоновую кислоту (САЗ 25462-85-5) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 332,1 ([М+Н]+).
Пример 287
(RS)-N-(4-(Морфолин-2-ил)фенил)-1-(пиримидин-4-ил)пиперидин-4-карбоксамида дигидрохлорид
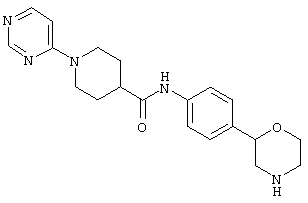
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 1-(пиримидин-4-ил)пиперидин-4-карбоновой кислоты гидрохлорид (CAS 712261-81-9) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Беловатое твердое вещество. MS (ISP): 368,2 ([M+H]+).
Пример 288
(RS)-N-(4-(Морфолин-2-ил)фенил)-2-(пиразин-2-ил)тиазол-4-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1 -карбоксилата, 2-(пиразин-2-ил)тиазол-4-карбоновую кислоту (CAS 115311-44-9) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Желтое твердое вещество. MS (ISP): 368,2 ([М+Н]+).
Пример 289
(S)-N-(4-(Пиперидин-3-ил)фенил)-6-пропилникотинамид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1-карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-пропилникотиновую кислоту (CAS 847046-96-2) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 324,4 ([М+Н]+).
Пример 290
(RS)-N-(4-(Морфолин-2-ил)фенил)-2-(пиримидин-2-ил)тиазол-4-карбоксамида гидрохлорид
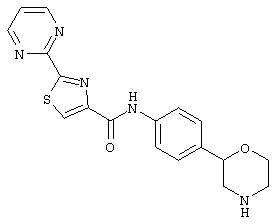
Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-(пиримидин-2-ил)тиазол-4-карбоновую кислоту (CAS 1014631-26-5) вместо (Р)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Светло-коричневое твердое вещество. MS (ISP): 368,2 ([M+H]+).
Пример 291
(RS)-1-(4-(Морфолин-2-ил)фенил)-3-(4-(трифторметил)фенил)мочевины гидрохлорид

a) (RS)-трет-бутил-2-(4-(3-(4-(трифторметил)фенил)уреидо)фенил)-морфолин-4-карбоксилат
(RS)-трет-Бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) (400 мг; 1,44 ммоль), 4-(трифторметил)фенилизоцианат (CAS 1548-13-6) (336 мг; 1,8 ммоль) и триэтиламин (182 мг; 1,8 ммоль) растворяли в DMF (13,3 мл) и перемешивали при 70°С в течение 17 ч. После охлаждения до кт реакционную смесь выливали в воду, дважды экстрагировали этилацетатом, промывали водой и рассолом, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (90 г силикагеля; гептан/этилацетат, 1:1), получая 433 мг светло-желтого твердого вещества. MS (ISP): 410,2 мг ([М+Н]+)-трет-бутил).
b) (RS)-1-(4-(Морфолин-2-ил)фенил)-3-(4-(трифторметил)фенил)мочевины гидрохлорид
(RS)-трет-Бутил-2-(4-(3-(4-(трифторметил)фенил)уреидо)фенил)-морфолин-4-карбоксилат (167 мг; 0,359 ммоль) растворяли в диоксане (1 мл), обрабатывали 4 М HCl в диоксане (1,35 мл; 5,4 ммоль) и перемешивали в течение 2 ч при кт.Полученную суспензию отфильтровали и промывали диэтиловым эфиром, получая 74 мг белого твердого вещества. MS (ISP): 366,1 ([М+Н]+).
Пример 292
(RS)-1-(4-Хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид
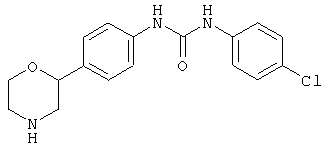
Указанное в заголовке соединение получали аналогично Примеру 291, используя 4-хлорфенилизоцианат (CAS 104-12-1) вместо 4-(трифторметил)-фенилизоцианата (CAS 1548-13-6). Светло-коричневого твердое вещество. MS (ISP): 332,2 ([M+H]+).
Пример 293
(RS)-1-(4-(Морфолин-2-ил)фенил)-3-п-толилмочевины гидрохлорид
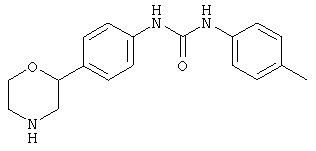
Указанное в заголовке соединение получали аналогично Примеру 291, используя п-толилизоцианат (CAS 374675-64-6) вместо 4-(трифторметил)-фенилизоцианата (CAS 1548-13-6). Белое твердое вещество. MS (ISP): 312,1 ([М+Н]+).
Пример 294
(RS)-2-Метил-N-(4-(морфолин-2-ил)фенил)изоникотинамидадигидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-метилизоникотиновую кислоту (CAS 4021-11-8) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Светло-желтое твердое вещество, MS (ISP): 298,4 ([М+Н]+).
Пример 295
(RS)-2,6-Диметил-N-(4-(морфолин-2-ил)фенил)изоникотинамида дигидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2,6-диметилизоникотиновую кислоту (CAS 54221-93-1) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Желтое твердое вещество. MS (ISP): 312,4 ([М+Н]+).
Пример 296
(RS)-2-(1-Метил-1Н-пиразол-4-ил)-N-(4-(морфолин-2-ил)фенил)тиазол-4-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-(1-метил-1Н-пиразол-4-ил)тиазол-4-карбоновую кислоту (CAS 1152605-07-6) вместо (К)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Белое твердое вещество. MS (ISP): 370,2 ([М+Н]+).
Пример 297
(S)-6-Этил-N-(4-(пиперидин-3-ил)фенил)никотинамид
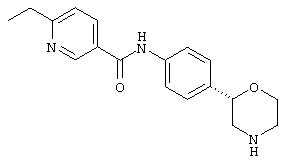
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-3-(4-аминофенил)пиперидин-1 -карбоксилат (Пример 150а) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата и 6-этилникотиновую кислоту (CAS 802828-81-5) вместо (R)-2-фенилпропионовой кислоты. Белое твердое вещество. MS (ISP): 310,4 ([М+Н]+).
Пример 298
(RS)-4-Метил-N-(4-(морфолин-2-ил)фенил)-2-(пиразин-2-ил)тиазол-5-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 4-метил-2-(пиразин-2-ил)тиазол-5-карбоновую кислоту (CAS 216959-92-1) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Желтое твердое вещество. MS (ISP): 382,4 ([M+H]+).
Пример 299
(RS)-N-(4-(Морфолин-2-ил)фенил)-1-фенил-1Н-пиразол-3-карбоксамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1 -карбоксилата, 1-фенил-1Н-пиразол-3-карбоновую кислоту (CAS 4747-46-0) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Беловатое твердое вещество. MS (ISP): 349,2 ([М+Н]+).
Пример 300
(RS)-2-Этокси-N-(4-(морфолин-2-ил)фенил)изоникотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 29, используя (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (CAS 1002726-96-6) вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 2-этоксиизоникотиновую кислоту (CAS 91940-86-2) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU (17 ч при кт). Светло-желтое твердое вещество. MS (ISP): 328,2 ([М+Н]+).
Пример 301
(S)-4-Хлор-2-иод-N-(4-(морфолин-2-ил)фенил)бензамид

Указанное в заголовке соединение получали аналогично Примеру 141, используя (S)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилат (Пример 208b) вместо (RS)-трет-бутил-2-(4-бромфенил)морфолин-4-карбоксилата и 4-хлор-2-иод-бензамид (CAS 942319-20-2) вместо амида 5-трифторметил-пиридин-2-карбоновой кислоты. Белое твердое вещество. MS (ISP): 445,0 ([{37Cl}М+Н]+), 443,0 ([{35Cl}M+H]+).
Пример 302
(RS)-1-(6-Хлорпиридин-3-ил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 291, используя 2-хлор-5-изоцианатопиридин (CAS 125117-96-6) вместо 4-(трифторметил)фенилизоцианата (CAS 1548-13-6). Оранжевое твердое вещество. MS (ISP): 333,3 ([М+Н]+).
Пример 303
(RS)-1-(3-Хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 291, используя 3-хлорфенилизоцианат (CAS 2909-38-8) вместо 4-(трифторметил)-фенилизоцианата (CAS 1548-13-6). Светло-серое твердое вещество. MS (ISP): 332,1 ([M+H]+).
Пример 304
(RS)-1-(4-(Морфолин-2-ил)фенил)-3-м-толилмочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 291, используя м-толилизоцианат (CAS 621-29-4) вместо 4-(трифторметил)-фенилизоцианата (CAS 1548-13-6). Светло-серое твердое вещество. MS (ISP): 312,4 ([М+Н]+).
Пример 305 (RS)-1-(2-Хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 291, используя 2-хлорфенилизоцианат (CAS 3320-83-0) вместо 4-(трифторметил)-фенилизоцианата (CAS 1548-13-6). Светло-серое твердое вещество. MS (ISP): 332,2 ([М+Н]+).
Пример 306 (RS)-1-(4-Метилбензил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 291, используя 4-метилбензилизоцианат (CAS 56651-57-1) вместо 4-(трифторметил)-фенилизоцианата (CAS 1548-13-6). Светло-коричневое твердое вещество. MS (ISP): 326,3 ([М+Н]+).
Пример 307
(RS)-1-Циклогексил-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид
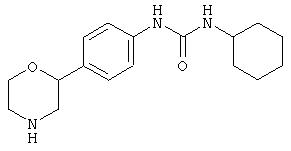
Указанное в заголовке соединение получали аналогично Примеру 291, используя циклогексилизоцианат (CAS 3173-53-3) вместо 4-(трифторметил)-фенилизоцианата (CAS 1548-13-6). Беловатое твердое вещество. MS (ISP): 304,3 ([М+Н]+).
Пример 308
(S)-N-(4-(1,4-Оксазепан-2-ил)фенил)-3-хлорбензамида гидрохлорид

a) (S)-3-(2-Гидрокси-2-(4-нитрофенил)этиламино)пропан-1-ол
(S)-2-(4-Нитрофенил)оксиран (5 г; 30,3 ммоль; CAS 78038-42-3) смешивали с изопропанолом (2,33 мл) и добавляли 3-аминопропан-1-ол (2,27 г; 2,3 мл; 30,3 ммоль). Желтую суспензию перемешивали в течение 17 часов при комнатной температуре. Реакционную смесь гасили, добавляя 150 мл рассола. Добавляли смесь дихлорметана и метанола (9:1; 200 мл), органический слой отделяли и водную фазу дважды экстрагировали смесью дихлорметан/метанол (9:1). Органический слой сушили над MgSO4 и упаривали, получая коричневое твердое вещество, которое перекристаллизовывали из смеси этилацетат/гептан/ТВМЕ, получая (S)-3-(2-гидрокси-2-(4-нитрофенил)этиламино)пропан-1-ол (2,74 г; 38%) в виде светло-желтого твердого вещества. MS (ISP): 241,2 ([М+Н]+).
b) (S)-трет-Бутил-2-гидрокси-2-(4-нитрофенил)этил(3-гидроксипропил)-карбамат
(S)-3-(2-Гидрокси-2-(4-нитрофенил)этиламино)пропан-1-ол (2,4 г; 10 ммоль) суспендировали в 8 мл дихлорметана. По каплям добавляли раствор ди-трет-бутилдикарбоната (2,18 г; 10 ммоль) в 5 мл дихлорметана и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Смесь промывали водой, органический слой промывали рассолом, сушили над MgSO4 и упаривали. Твердое вещество перемешивали в смеси гептана и этилацетата и отфильтровывали, получая (S)-трет-бутил-2-гидрокси-2-(4-нитрофенил)этил(3-гидроксипропил)карбамат (2,1 г; 62%) в виде светло-желтого твердого вещества. MS (ISP): 241,3 (100%, [M-BOC+HD, 341,1 (20%, [М+НЦ.
c) (8)-трет-Бутил-2-(4-нитрофенил)-1,4-оксазепан-4-карбоксилат
(S)-трет-Бутил-2-гидрокси-2-(4-нитрофенил)этил(3-гидроксипропил)-карбамат (2 г; 5,88 ммоль) растворяли в ТВМЕ (8,2 мл) и добавляли трифенилфосфин (1,85 г; 7,05 ммоль). Получали густую белую суспензию. Медленно добавляли диизопропил-диазодикарбоксилат (DIAD; 1,52 г; 1,46 мл; 7,05 ммоль) (твердые вещества растворялись) и смесь перемешивали при комнатной температуре в течение 17 часов. Образовавшееся в процессе реакции белое твердое вещество отфильтровывали и фильтрат упаривали. Неочищенное вещество очищали флэш-хроматографией (силикагель, гептан/этилацетат, градиент от 90:10 до 80:20), получая (S)-трет-бутил-2-(4-нитрофенил)-1,4-оксазепан-4-карбоксилат (369 мг; 20%) в виде светло-желтого масла, которое использовали непосредственно на следующей стадии.
d) (8)-трет-Бутил-2-(4-аминофенил)-1,4-оксазепан-4-карбоксилат
(8)-трет-Бутил-2-(4-нитрофенил)-1,4-оксазепан-4-карбоксилат (0,36 г; 1,12 ммоль) растворяли в метаноле (4 мл) и добавляли палладий на угле (10%-ный; 35,7 мг; 33,5 мкмоль). После вакуумирования реакционную смесь перемешивали при комнатной температуре в атмосфере водорода в течение 45 мин. Катализатор отфильтровывали и фильтрат упаривали, получая (S)-трет-бутил-2-(4-аминофенил)-1,4-оксазепан-4-карбоксилат (288 мг; 88%) в виде светло-желтого масла. MS (ISP): 193,3 (100%, [М-ВОС+Н]+), 293,3 (3%, [M+H]+).
e) (S)-трет-Бутил-2-(4-(3-хлорбензамидо)Фенил)-1,4-оксазепан-4-карбоксилат
В круглодонной колбе емкостью 250 мл объединяли (8)-трет-бутил-2-(4-аминофенил)-1,4-оксазепан-4-карбоксилат (106 мг; 0,36 ммоль), 3-хлорбензойную кислоту (74 мг; 0,47 ммоль), М-метилморфолин (110 мг; 120 мкл; 1,09 ммоль) и HBTU (206 мг; 0,544 ммоль) с тетрагидрофураном (5 мл), получая светло-желтую суспензию. Реакционную смесь перемешивали при комнатной температуре в течение 17 ч. Реакционную суспензию выливали в воду (100 мл) и дважды экстрагировали этилацетатом. Органические слои сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (SiO2; градиент: гептан/EtOAc), получая (S)-трет-бутил-2-(4-(3-хлорбензамидо)фенил)-1,4-оксазепан-4-карбоксилат (143 мг; 92%) в виде светло-коричневой смолы. MS (ISP): 431,3 ([{37Cl}М+Н]+), 433,3 ([{35Cl}M+H]+).
f) (S)-N-(4-(1,4-Оксазепан-2-ил)фенил)-3-хлорбензамида гидрохлорид
(S)-трет-Бутил-2-(4-(3-хлорбензамидо)фенил)-1,4-оксазепан-4-карбоксилат (0,14 г; 0,325 ммоль) растворяли в диоксане (5 мл) и добавляли раствор HCl в диоксане (4 М; 1,22 мл; 4,87 ммоль). Реакционную смесь перемешивали при 60°С в течение ночи. Растворитель выпаривали и остаток растворяли в этаноле. После обработки ультразвуком (sonication) и нагревания получали светло-желтую суспензию. Твердое вещество отфильтровывали и сушили в вакууме при 60°С, что позволило получить (S)-N-(4-(1,4-оксазепан-2-ил)фенил)-3-хлорбензамида гидрохлорид (119 мг) в виде светло-желтого твердого вещества. MS (ISP): 331,2 ([{37Cl}М+Н]+), 333,3 ([{35Cl}М+Н]+).
Пример 309
3-Хлор-N-(4-((28,68)-6-метилморфолин-2-ил)фенил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 308, используя (RS)-1-аминопропан-2-ол вместо 3-аминопропанола на стадии а). Беловатое твердое вещество. MS (ISP): 331,2 ([37Cl}M+H]+), 333,3 ([{34Cl}M+H]+).
Пример 310
6-Хлор-N-(4-((2S,6R)-6-метилморфолин-2-ил)фенил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 308, используя (S)-1-аминопропан-2-ол вместо 3-аминопропанола на стадии а). Беловатое твердое вещество. MS (ISP): 332,2 ([{37Cl}М+Н]+), 334,3 ([{35Cl}М+Н]+).
Пример 311
(R)-1-(4-(Морфолин-2-ил)фенил)-3-(4-(трифторметил)фенил)мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 291, используя (R)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 207, стадии a-d) вместо (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилата (CAS 1002726-96-6). Беловатое твердое вещество. MS (ISP): 366,1 ([М+Н]+).
Пример 312
(S)-1-(4-(Морфолин-2-ил)фенил)-3-(4-(трифторметил)фенил)мочевины гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 291, используя (S)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилат (полученный в Примере 208, стадии a-d) вместо (RS)-трет-бутил-2-(4-аминофенил)морфолин-4-карбоксилата (CAS 1002726-96-6). Беловатое твердое вещество. MS (ISP): 366,1 ([М+Н]+).
Пример 313
(R)-3-Хлор-N-(4-(морфолин-2-ил)бензил)бензамида гидрохлорид

а) (R)-трет-Бутил-2-(4-формилФенил)морфолин-4-карбоксилат
(R)-трет-Бутил-2-(4-бромфенил)морфолин-4-карбоксилат (342 мг; 1 ммоль;
Пример 207, стадия b) в THF (3 мл) охлаждали до -74°С, обрабатывали, добавляя по каплям н-BuLi (0,938 мл; 1,5 ммоль; 1,6 М раствор в гексане), и перемешивали в течение 30 мин при -74°С. По каплям добавляли DMF (0,5 мл; 1 ммоль), смесь перемешивали в течение 2 ч при -74°С и затем оставляли нагреваться до -10°С. Далее смесь гасили насыщ. водным хлоридом аммония (2 мл) и водой (2 мл) и полученную смесь распределяли между водой и этилацетатом. Органический слой промывали водой и рассолом, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали флэш-хроматографией (20 г; силикагель SILICYCLE, гептан/этилацетат 4:1), получая 160 мг беловатого твердого вещества. MS (ISP): 292,3 ([М+Н]+).
b) (R,Е)-трет-Бутил-2-(4-((гидроксиимино)метил)фенил)морфолин-4-карбоксилат
(R)-трет-Бутил-2-(4-формилфенил)морфолин-4-карбоксилат (155 мг; 0,532 ммоль) растворяли в этаноле (0,9 мл). Добавляли молекулярные сита (0,3 нм), затем гидроксиламина гидрохлорид (74 мг; 1,06 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч, охлаждали до кт и распределяли между водой и дихлорметаном. Органический слой промывали водой и рассолом, сушили над сульфатом магния и концентрировали в вакууме, получая 159 мг беловатого твердого вещества, которое использовали на следующей стадии без дальнейшей очистки.
c) (R)-трет-Бутил-2-(4-(аминометил)фенил)морфолин-4-карбоксилат
(R,Е)-трет-Бутил-2-(4-((гидроксиимино)метил)фенил)морфолин-4-карбоксилат (138 мг; 0,45 ммоль) растворяли в метаноле (8,2 мл) и гидрировали над 5%-ным Pd/C (41 мг) в течение 1 ч. Реакционную смесь фильтровали и концентрировали в вакууме, растворяли в этилацетате и экстрагировали, используя 0,5 М водн. HCl (2×1,2 мл). Объединенные водные слои подщелачивали до рН 10, используя 1 М водн. NaOH, и дважды экстрагировали дихлорметаном. Объединенные органические фазы промывали водой, сушили над сульфатом магния и концентрировали в вакууме, получая 63 мг бесцветного масла. MS (ISP): 293,2 ([М+Н]+).
d) (Р)-3-Хлор-N-(4-(морфолин-2-ил)бензил)бензамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29, используя (R)-трет-бутил-2-(4-(аминометил)фенил)морфолин-4-карбоксилат вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 3-хлор-бензойную кислоту (CAS 535-80-8) вместо (R)-2-фенилпропионовой кислоты и HBTU вместо TBTU при 60°С (17 ч) в DMF вместо THF. Бесцветное аморфное твердое вещество. MS (ISP): 331,1 ([М+Н]+).
Пример 314
(R)-4-Хлор-N-(4-(морфолин-2-ил)бензил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 313, используя 4-хлорбензойную кислоту (CAS 74-11-3) вместо 3-хлорбензойной кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 331,1 ([М+Н]+).
Пример 315
(R)-6-Хлор-N-(4-(морфолин-2-ил)бензил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 313, используя 6-хлорникотиновую кислоту (CAS 5326-23-8) вместо 3-хлорбензойной кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 332,2 ([М+Н]+).
Пример 316
(R)-N-(4-(Морфолин-2-ил)бензил)-6-(2,2,2-трифторэтокси)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 313, используя 6-(2,2,2-трифторэтокси)никотиновую кислоту (CAS 159783-29-6) вместо 3-хлорбензойной кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 396,3 ([M+H]+).
Пример 317
(S)-4-Хлор-N-(4-(морфолин-2-ил)бензил)бензамида гидрохлорид

Стадия а). (8)-трет-Бутил-2-(4-формилФенил)морфолин-4-карбоксилат
(S)-трет-Бутил-2-(4-бромфенил)морфолин-4-карбоксилат (5 г; 14,6 ммоль, Пример 208b) в THF (40 мл) охлаждали до -74°С, обрабатывали, добавляя по каплям н-BuLi (13,7 мл; 21,9 ммоль; 1,6М раствор в гексане) и перемешивали в течение 30 мин при -74°С. По каплям добавляли DMF (7,3 мл; 14,6 ммоль) (15 мин), смесь перемешивали в течение 2 ч при -74°С и затем оставляли нагреваться до -10°С. Затем смесь гасили насыщ. водным хлоридом аммония (30 мл) и водой (30 мл) и полученную смесь распределяли между водой и этилацетатом. Органический слой промывали водой и рассолом, сушили над сульфатом магния и концентрировали в вакууме, получая 4,7 г неочищенного продукта. MS (ISP): 292,3 ([М+Н]+).
b) (S,Е)-трет-Бутил-2-(4-((гидроксиимино)метил)фенил)морфолин-4-карбоксилат
(S)-трет-Бутил-2-(4-формилфенил)морфолин-4-карбоксилат (2,2 г;
7,55 ммоль) растворяли в этаноле (13 мл). Добавляли молекулярные сита (0,3 нм) затем гидроксиламина гидрохлорид (1,05 г, 15,1 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч, охлаждали до кт и распределяли между водой и дихлорметаном. Органический слой промывали водой и рассолом, сушили над сульфатом магния и концентрировали в вакууме, получая 1,72 г беловатого твердого вещества, которое использовали на следующей стадии без дальнейшей очистки. MS (ISP): 207,2 ([М+Н]+-ВОС).
c) (S)-трет-Бутил-2-(4-(аминометил)Фенил)морфолин-4-карбоксилат
(S,E)-трет-Бутил-2-(4-((гидроксиимино)метил)фенил)морфолин-4-карбоксилат (1,63 г; 5,32 ммоль) растворяли в метаноле (25 мл) и гидрировали над 5%-ным Pd/C (543 мг; 0,255 ммоль) в течение 1 ч. Реакционную смесь фильтровали и концентрировали в вакууме, растворяли в этилацетате и экстрагировали, используя 0,5 М водн. HCl (2×10 мл). Объединенные водные слои подщелачивали до рН 10, используя 1 М водн. NaOH, и дважды экстрагировали дихлорметаном. Объединенные органические фазы промывали водой, сушили над сульфатом магния и концентрировали в вакууме, получая 991 мг светло-желтого вязкого масла. MS (ISP): 293,2 ([М+Н]+).
d) (S)-4-Хлор-N-(4-(морфолин-2-ил)бензил)бензамида гидрохлорид
Указанное в заголовке соединение получали аналогично Примеру 29, используя (S)-трет-бутил-2-(4-(аминометил)фенил)морфолин-4-карбоксилат вместо (RS)-трет-бутил-3-(4-аминофенил)пирролидин-1-карбоксилата, 4-хлор-бензойную кислоту (CAS 74-11-3) вместо (Р)-2-фенилпропионовой кислоты и HBTU вместо TBTU при 60°(4 ч) в DMF вместо THF. Белое твердое вещество. MS (ISP): 331,2([М+Н]+).
Пример 318
(S)-3-Хлор-N-(4-(морфолин-2-ил)бензил)бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 317, используя 3-хлорбензойную кислоту (CAS 535-80-8) вместо 4-хлорбензойной кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 331,2 ([М+Н]+).
Пример 319
(S)-6-Хлор-N-(4-(морфолин-2-ил)бензил)никотинамида гидрохлорид
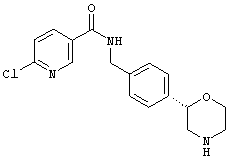
Указанное в заголовке соединение получали аналогично Примеру 317, используя 6-хлорникотиновую кислоту (CAS 5326-23-8) вместо 4-хлорбензойной кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 332,1 ([М+Н]+).
Пример 320
(S)-N-(4-(Морфолин-2-ил)бензил)-6-(трифторметил)никотинамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 317, используя 6-(трифторметил)никотиновую кислоту (CAS 158063-66-2) вместо 4-хлорбензойной кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 366,2 ([М+Н]+).
Пример 321
(R)-N-(4-(Морфолин-2-ил)бензил)-6-(трифторметил)никотинамида гидрохлорид
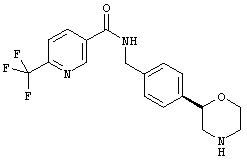
Указанное в заголовке соединение получали аналогично Примеру 313, используя 6-(трифторметил)никотиновую кислоту (CAS 158063-66-2) вместо 3-хлорбензойной кислоты. Бесцветное аморфное твердое вещество. MS (ISP): 366,1 ([М+Н]+).
Пример 322
3-Хлор-N-[4-((28,58)-5-метил-морфолин-2-ил)-фенил]-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 308, используя (S)-2-аминопропанол вместо 3-аминопропанола на стадии а). Беловатое твердое вещество. MS (ISP): 331,2 ([{37Cl}M+H]+), 333,3 ([{35Cl}М+Н]+).
Пример 323
3-Хлор-N-[4-((2S,5R)-5-метил-морфолин-2-ил)-фенил]-бензамида гидрохлорид

Указанное в заголовке соединение получали аналогично Примеру 308, используя (R)-2-аминопропанол вместо 3-аминопропанола на стадии а). Беловатое твердое вещество. MS (ISP): 331,2 ([{35Cl}M+H]+), 333,4 ([{37Cl}М+Н]+).
Соединения формулы I и их фармацевтически приемлемые соли присоединения (кислоты) обладают полезными фармакологическими свойствами. Конкретно, установлено, что соединения по настоящему изобретению обладают высокой аффинностью к рецепторам следовых аминов (TAAR), особенно KTAAR1.
Данные соединения были исследованы в соответствии с приведенным далее тестом.
Материалы и методы
Конструирование TAAR-экспрессирующих плазмид и стабильно трансфицированных клеточных линий
Для конструирования экспрессирующих плазмид амплифицировали последовательности, кодирующие TAAR1, из геномной ДНК человека, крысы и мыши по существу таким способом, как описано Lindemann и др. [14]. Использовали систему ПЦР (полимеразная цепная реация) с высокоточным наращиванием цепи (Roche Diagnostics) с 1,5 мМ Mg2+и очищенные ПЦР-продукты клонировали в клонирующий вектор pCR2.1-TOPO (Invitrogen) в соответствии с инструкциями производителя. ПЦР-продукты субклонировали в вектор plRESneo2 (BD Clontech, Palo Alto, California) и последовательности экспрессирующих векторов подтверждали путем секвенирования перед введением их в клеточные линии.
Клетки НЕК293 (линия 293 клеток почки эмбриона человека) (АТСС (Американская коллекция типовых культур) №CRL-1573) культивировали по существу так, как описано Lindemann и др. (2005). Для получения стабильно трансфицированных клеточных линий клетки НЕК293 трансфицировали экспрессирующими плазмидами plRESneo2, содержащими TAAR-кодирующие последовательности (описанные выше), используя липофектамин 2000 (Invitrogen) в соответствии с инструкциями производителя, и через 24 часа после трансфекции в культуральную среду добавляли G418 (Sigma, Buchs, Switzerland) (1 мг/мл). После культивирования в течение приблизительно 10 сут клоны выделяли, рассевали и тестировали в отношении их восприимчивости к следовым аминам (все соединения приобретены в Sigma), используя систему для иммуноферментного анализа (EIA) "cAMP Biotrak" (Amersham) в соответствии с предоставленной производителем методикой EIA без ацетилирования. Для всех последующих исследований использовали моноклональные клеточные линии, которые показывали стабильную EC50 (концентрацию, требуемую для достижения 50% эффекта) в течение периода культивации, составляющего 15 пассажей.
Анализ связывания радиоактивного лиганда с использованием TAAR1 крысы
Приготовление мембран и связывание радиоактивного лиганда
Клетки НЕК-293, стабильно экспрессирующие TAAR1 крысы, поддерживали при 37°С и 5% CO2 в среде DMEM (модифицированная Дульбекко среда Игла) с высоким содержанием глюкозы, содержащей фетальную телячью сыворотку (10%, инактивированную нагреванием в течение 30 мин при 56°С), пенициллин/стрептомицин (1%) и генетицин (375 мкг/мл) (Gibco). Клетки извлекали из культуральных флаконов, используя трипсин/EDTA (этилендиаминтетраацетат), собирали, дважды промывали охлажденным во льду PBS (забуференным фосфатом физиологическим раствором) (не содержащим Са2+и Mg2+, осаждали путем центрифугирования при 1000 об/мин в течение 5 мин при 4°С, замораживали и хранили при -80°С. Замороженные осадки суспендировали в 20 мл буфера HEPES(N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота)-МаОН (20 мМ; рН 7,4), содержащего 10 мМ EDTA, и гомогенизировали, используя Polytron (РТ 6000, Kinematica) при 14000 об/мин в течение 20 с.Гомогенат центрифугировали при 48000 x g в течение 30 мин при 4°С. После этого супернатант извлекали и отбрасывали, а осадок ресуспендировали в 20 мл буфера HEPES-NaOH (20 мМ; рН 7,4), содержащего 0,1 мМ EDTA, используя Polytron (20 с при 14000 об/мин). Эту процедуру повторяли и конечный осадок ресуспендировали в HEPES-NaOH, содержащем 0,1 мМ EDTA, и гомогенизировали, используя Polytron. Обычно аликвоты по 2 мл препаратов мембран хранили при -80°С. Для каждой новой партии мембран константу диссоциации (Kd) определяли из кривой насыщения. Радиоактивный лиганд для TAAR1 3[Н]-(S)-4-этил-фенил-амино)-метил]-4,56-дигидро-оксазол-2-иламин (описанный в WO 2008/098857) использовали в концентрации, равной рассчитанной величине Kd, обычно составляющей около 2,3 нМ, при которой связывается приблизительно 0,2% радиоактивного лиганда, а специфическое связывание составляет приблизительно 85% от общего связывания. Неспецифическое связывание определяли как количество 3[H]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина, связавшегося в присутствии немеченого лиганда (10 мкМ). Все соединения тестировали в широком диапазоне концентраций (10пМ-10 мкМ) в двух повторах. Тестируемые соединения (20 мкл/лунка) переносили в 96-луночный планшет с глубокими лунками (TreffLab) и добавляли по 180 мкл буфера HEPES-NaOH (20 мМ; рН 7,4), содержащего MgCl2 (10 мМ) и CaCl2 (2 мМ) (буфер для связывания), 300 мкл радиоактивного лиганда 3[H]-(S)-4-этил-фенил-амино)-метил]-дигидро-оксазол-2-иламина в концентрации 3,3 (Kd (в нМ) и 500 мкл мембран (ресуспендированных в количестве 50 мкг белка в одном мл). 96-луночные планшеты с глубокими лунками инкубировали в течение 1 ч при 4°С. Инкубацию останавливали путем быстрой фильтрации через планшеты UniFilter-96 (Packard Instrument Company) и стеклянные фильтры GF/C, которые предварительно вымачивали в течение 1 ч в полиэтиленимине (0,3%-ном) и промывали 3 раза холодным буфером для связывания объемом 1 мл. После добавления по 45 мкл Microscint 40 (PerkinElmer) планшет Unifilter-96 герметично закрывали и через 1 час измеряли радиоактивность, используя сцинтилляционный счетчик для микропланшетов TopCount (Packard Instrument Company).
Анализ связывания радиоактивного лиганда с использованием TAAR1 мыши
Приготовление мембран и связывание радиоактивного лиганда Клетки НЕК-293, стабильно экспрессирующие TAAR1 мыши, поддерживали при 37°С и 5% CO2 в среде DMEM с высоким содержанием глюкозы, содержащей фетальную телячью сыворотку (10%, инактивированную нагреванием в течение 30 мин при 56°С), пенициллин/стрептомицин (1%) и генетицин (375 мкг/мл) (Gibco). Клетки извлекали из культуральных флаконов, используя трипсин/EDTA (этилендиаминтетраацетат), собирали, дважды промывали охлажденным во льду PBS (не содержащим Са2+и Mg2+), осаждали путем центрифугирования при 1000 об/мин в течение 5 мин при 4°С, замораживали и хранили при -80°С. Замороженные осадки суспендировали в 20 мл буфера HEPES-NaOH (20 мМ; рН 7,4), содержащего 10 мМ EDTA, и гомогенизировали, используя Polytron (PT 6000, Kinematica) при 14000 об/мин в течение 20 с. Гомогенат центрифугировали при 48000 (g в течение 30 мин при 4°С. После этого супернатант извлекали и отбрасывали, а осадок ресуспендировали в 20 мл буфера HEPES-NaOH (20 мМ; рН 7,4), содержащего 0,1 мМ EDTA, используя Polytron (20 с при 14000 об/мин). Эту процедуру повторяли и конечный осадок ресуспендировали в HEPES-NaOH, содержащем 0,1 мМ EDTA, и гомогенизировали, используя Polytron. Обычно аликвоты по 2 мл препаратов мембран хранили при -80"С.Для каждой новой партии мембран константу диссоциации (Kd) определяли из кривой насыщения. Радиоактивный лиганд для TAAR1 3[H]-(S)-4-[(этил-фенил-амино)метил]4,5-дигидро-оксазол-2-иламин (описанный в WO 2008/098857) использовали в концентрации, равной рассчитанной величине Kd, обычно составляющей около 0,7 нМ, при которой связывается приблизительно 0,5% радиоактивного лиганда, а специфическое связывание составляет приблизительно 70% от общего связывания. Неспецифическое связывание определяли как количество ^НЦЗ)^-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина, связавшегося в присутствии немеченого лиганда (10 мкМ). Все соединения тестировали в широком диапазоне концентраций (10пМ-10 мкМ) в двух повторах. Тестируемые соединения (20 мкл/лунка) переносили в 96-луночный планшет с глубокими лунками (TreffLab) и добавляли по 180 мкл буфера HEPES-NaOH (20 мМ; рН 7,4), содержащего MgCl2 (10 мМ) и CaCl2 (2 мМ) (буфер для связывания), 300 мкл радиоактивного лиганда 3[H]-(S)-4-этил-фенил-амино)метил]-4,5-дигидро-оксазол-2-иламина в концентрации 3,3 (Kd в нМ и 500 мкл мембран (ресуспендированных в количестве 60 мкг белка в одном мл). 96-луночные планшеты с глубокими лунками инкубировали в течение 1 ч при 4°С. Инкубацию останавливали путем быстрой фильтрации через планшеты UniFilter-96 (Packard Instrument Company) и стеклянные фильтры GF/C, которые предварительно вымачивали в течение 1 ч в полиэтиленимине (0,3%-ном) и промывали 3 раза холодным буфером для связывания объемом 1 мл. После добавления по 45 мкл Microscint 40 (PerkinElmer) планшет Unifilter-96 герметично закрывали и через 1 час измеряли радиоактивность, используя сцинтилляционный счетчик для микропланшетов TopCount (Packard Instrument Company).
Ниже в таблице приведены предпочтительные соединения, которые в анализе с использованием мышиных или крысиных TAAR1 демонстрируют величину Ki (мкМ) менее 0,01 мкМ.
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве лекарственных средств, например в форме фармацевтических препаратов. Эти фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако их также можно вводить ректально, например в форме суппозиториев, или парентерально, например в форме растворов для инъекций.
Для изготовления фармацевтических препаратов соединения формулы I можно обрабатывать, используя фармацевтически инертные неорганические или органические носители. Например, в качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул можно использовать лактозу, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и тому подобное. Подходящими носителями для мягких желатиновых капсул являются, например растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобное. В случае мягких желатиновых капсул носители обычно не требуются, однако это зависит от природы активного вещества. Подходящими носителями для изготовления растворов и сиропов являются, например вода, полиолы, глицерин, растительное масло и тому подобное. Подходящими носителями для суппозиториев являются, например природные или отвержденные жиры, воски, жиры, полужидкие или жидкие полиолы и тому подобное.
Помимо этого фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие дополнительные терапевтически полезные вещества.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также представляют собой предмет настоящего изобретения, как и способ их изготовления, который включает внесение одного или более чем одного соединения формулы I и/или одной или более чем одной фармацевтически приемлемой соли присоединения кислоты и, при желании, одного или более чем одного другого терапевтически полезного вещества в форму галенова препарата для введения вместе с одним или более чем одним терапевтически инертным носителем.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают расстройства центральной нервной системы, например, лечение или предупреждение депрессии, психоза, болезни Паркинсона, тревоги и синдрома дефицита внимания и гиперактивности (ADHD).
Дозировку можно варьировать в широких пределах, и несомненно, в каждом конкретном случае она должна быть подобрана с учетом индивидуальных потребностей. В случае перорального введения дозировка для взрослых может изменяться от примерно 0,01 мг до примерно 1000 мг в сутки для соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточную дозу можно вводить в виде однократной дозы или в виде разделенных доз, и помимо этого также может быть превышен верхний предел, если на то имеется показание.
Таблеточная композиция (влажная грануляция)
Методика изготовления
1. Смешать позиции 1, 2, 3 и 4 и провести гранулирование, используя очищенную воду.
2. Высушить гранулы при 50°С.
3. Пропустить гранулы через подходящее для размола оборудование.
4. Добавить позицию 5 и перемешать в течение трех минут; выполнить прессование на подходящем прессе.
Композиция в виде капсул
Методика изготовления
1. Смешать позиции 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавить позиции 4 и 5 и перемешать в течение 3 минут.
3. Внести в подходящую капсулу.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ОКСАЗОЛИНОВ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2010 |
|
RU2569887C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ РЕЦЕПТОРОВ, АССОЦИИРОВАННЫХ СО СЛЕДОВЫМИ АМИНАМИ (TAARS) | 2013 |
|
RU2621050C2 |
| 2-ОКСА-5-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2015 |
|
RU2697651C2 |
| ПРОИЗВОДНЫЕ МОРФОЛИН-ПИРИДИНА | 2015 |
|
RU2690154C2 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛКАРБОКСАМИДА | 2013 |
|
RU2637938C2 |
| ПРОИЗВОДНОЕ 5-ЭТИЛ-4-МЕТИЛ-ПИРАЗОЛ-3-КАРБОКСАМИДА, ОБЛАДАЮЩЕЕ АКТИВНОСТЬЮ АГОНИСТА TAAR | 2017 |
|
RU2731095C2 |
| ПРОИЗВОДНЫЕ ДИГИДРООКСАЗОЛ-2-АМИНА | 2011 |
|
RU2587512C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛПИРИМИДИНА | 2005 |
|
RU2378277C2 |
| 1-ГИДРОКСИИМИНО-3-ФЕНИЛ-ПРОПАНЫ | 2011 |
|
RU2579114C9 |
| ФЕНОКСИМЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2746481C1 |
Изобретение относится к соединению формулы (I), где R представляет собой водород или С1-7алкил; R1 представляет собой -(СН2)n-(О)o-5-7-членный гетероциклоалкил, содержащий 1-2 гетероатома, выбранных из N и О, за исключением пиперазина, где указанная гетероциклоалкильная группа возможно замещена С1-7алкилом, гидрокси или галогеном; n равно 0, 1 или 2; о равно 0 или 1; R2 представляет собой CF3, С3-6-циклоалкил, возможно замещенный C1-7алкокси или галогеном, или представляет собой индан-2-ил, или представляет собой 6-членный гетероциклоалкил, содержащий 1-2 гетероатома, выбранных из N и О, возможно замещенный пиримидинилом, или представляет собой 5-6 моно- или 9-10-членный бициклический гетероарил, содержащий 1-2 гетероатома, выбранных из N, О и S, где гетероарил не является тиазолом и где указанное ароматическое кольцо возможно замещено одним или двумя заместителями, выбранными из C1-7алкила, галогена, 5-6-членного гетероарила, содержащего 1-2 гетероатома, выбранных из N и О, гидрокси, CF3, OCF3, OCH2CF3, ОСН2-циклоалкила, OCH2C(CH2OH)(CH2Cl)(CH3), S-С1-7алкила, С1-7алкокси, СН2-С1-7алкокси, С2-7алкинила или циано, или замещены -С(O)-фенилом, -О-фенилом, -O-СН2-фенилом, фенилом, и где указанные фенильные кольца возможно могут быть замещены галогеном, -С(O)ОН или -С(O)O-С1-7алкилом, или указанное ароматическое кольцо возможно замещено 5-6-членным гетероциклоалкилом, содержащим 1-2 гетероатома, выбранных из N и О, ОСН2-оксетан-3-илом или О-тетрагидропиран-4-илом, возможно замещенными С1-7алкилом; X представляет собой связь, -CH2NH-, -CHR″-, -(CHR″)q-O-, -O-(CHR″)q- или -(СН2)2-; Y представляет собой связь; R″ представляет собой водород, С1-7алкил, CF3, С1-7алкокси; q равно 0, 1, 2 или 3; или их фармацевтически приемлемая соль присоединения кислоты за исключением соединений, указанных в формуле изобретения. Также изобретение относится к конкретным соединениям, указанным в формуле изобретения. Соединения предназначены для изготовления лекарственных средств, проявляющих аффинность к TAAR1. Технический результат-бензамидные производные, обладающие высокой аффинностью к рецепторам, ассоциированным со следовыми аминами TAAR1. 5 н. и 4 з.п.ф-лы, 1 табл., 323 пр.

1. Соединения формулы

где
R представляет собой водород или С1-7алкил;
R1 представляет собой -(СН2)n-(О)o-5-7-членный гетероциклоалкил, содержащий 1-2 гетероатома, выбранных из N и О, за исключением пиперазина, где указанная гетероциклоалкильная группа возможно замещена С1-7алкилом, гидрокси или галогеном;
n равно 0, 1 или 2;
о равно 0 или 1;
R2 представляет собой CF3, С3-6-циклоалкил, возможно замещенный C1-7алкокси или галогеном, или представляет собой индан-2-ил, или представляет собой 6-членный гетероциклоалкил, содержащий 1-2 гетероатома, выбранных из N и О, возможно замещенный пиримидинилом, или представляет собой 5-6 моно- или 9-10-членный бициклический гетероарил, содержащий 1-2 гетероатома, выбранных из N, О и S, где гетероарил не является тиазолом и где указанное ароматическое кольцо возможно замещено одним или двумя заместителями, выбранными из C1-7алкила, галогена, 5-6-членного гетероарила, содержащего 1-2 гетероатома, выбранных из N и О, гидрокси, CF3, OCF3, OCH2CF3, ОСН2-циклоалкила, OCH2C(CH2OH)(CH2Cl)(CH3), S-С1-7алкила, С1-7алкокси, СН2-С1-7алкокси, С2-7алкинила или циано, или замещены -С(O)-фенилом, -О-фенилом, -O-СН2-фенилом, фенилом, и где указанные фенильные кольца возможно могут быть замещены галогеном, -С(O)ОН или -С(O)O-С1-7алкилом, или указанное ароматическое кольцо возможно замещено 5-6-членным гетероциклоалкилом, содержащим 1-2 гетероатома, выбранных из N и О, ОСН2-оксетан-3-илом или О-тетрагидропиран-4-илом, возможно замещенными С1-7алкилом;
X представляет собой связь, -CH2NH-, -CHR″-, -(CHR″)q-O-, -O-(CHR″)q- или -(СН2)2-;
Y представляет собой связь;
R″ представляет собой водород, С1-7алкил, CF3, С1-7алкокси;
q равно 0, 1, 2 или 3;
или их фармацевтически приемлемая соль присоединения кислоты за исключением соединений:
2,2,2-трифтор-N-[4-(пиперидин-4-илметил)-фенил]ацетамид,
1-пиперазинацетамид, N-[3-(1-пирролидин)фенил]- и
1Н-бензимидазол-2-пропанамид, N-[2-(гексагидро-1Н-азепин-1-ил)фенил]-,
(6-хлор-N-[4-(4-морфолинил)-фенил]-3-пиридинкарбоксамид.
2. Соединения формулы I по п. 1, где X представляет собой связь.
3. Соединения формулы I по п. 1, где X представляет собой -O(CHR″)q-.
4. Соединения формулы I по п. 1, где X представляет собой -CHR″-.
5. Соединения
(RS)-4-хлор-N-(5-(пирролидин-3-ил)пиридин-2-ил)бензамида гидрохлорид или
(RS)-4-хлор-N-(5-(пиперидин-3-ил)пиридин-2-ил)бензамида гидрохлорид.
6. Соединения, выбранные из группы, состоящей из:
(RS)-N-[4-(1-Бензил-пирролидин-3-ил)-фенил]-4-хлор-бензамид,
(RS)-N-[4-(1-Фенэтил-пирролидин-3-ил)-фенил]-4-хлор-бензамид,
(RS)-4-Хлор-N-[4-(1-фенил-пирролидин-3-ил)-фенил]-бензамид,
(RS)-N-[4-(1-Бензил-3-метил-пирролидин-3-ил)-фенил]-4-хлор-бензамид,
(RS)-4-Хлор-N-(6-пирролидин-3-ил-пиридин-3-ил)-бензамид,
(RS)-4-Хлор-N-(5-(пирролидин-3-ил)пиридин-2-ил)бензамида гидрохлорид,
(RS)-4-Хлор-N-(5-(пиперидин-3-ил)пиридин-2-ил)бензамида гидрохлорид,
(RS)-1-(4-(Морфолин-2-ил)фенил)-3-(4-(трифторметил)фенил)мочевины гидрохлорид,
(RS)-1-(4-Хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид,
(RS)-1-(6-Хлорпиридин-3-ил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид,
(RS)-1-(3-Хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид,
(RS)-1-(2-Хлорфенил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид,
(RS)-1-(4-Метилбензил)-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид,
(RS)-1-Циклогексил-3-(4-(морфолин-2-ил)фенил)мочевины гидрохлорид,
(R)-4-Хлор-N-(4-(морфолин-2-ил)бензил)бензамида гидрохлорид,
(R)-6-Хлор-N-(4-(морфолин-2-ил)бензил)никотинамида гидрохлорид,
(RS)-(4-Пирролидин-3-ил-фенил)карбаминовой кислоты фенилового эфира гидрохлорид,
(RS)-N-(4-Пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-(4-Пирролидин-3-ил-фенил)карбаминовой кислоты 4-фтор-фенилового эфира гидрохлорид,
(RS)-4-Хлор-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-2-(4-Хлор-фенил)-N-(4-пирролидин-3-ил-фенил)ацетамида гидрохлорид
(RS)-N-(4-Пирролидин-3-ил-фенил)-4-трифторметилбензамида гидрохлорид,
(RS)-2,4-Дихлор-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-3-Хлор-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-(4-Пирролидин-3-ил-фенил)карбаминовой кислоты 4-хлор-фенилового эфира гидрохлорид,
(RS)-3-(2-Хлор-фенил)-N-(4-пирролидин-3-ил-фенил)пропионамид,
(RS)-4-Хлор-N-[4-(1-метил-пирролидин-3-ил)-фенил]бензамид,
(RS)-4-Хлор-N-[4-(1-этил-пирролидин-3-ил)-фенил]бензамид,
(RS)-4-Хлор-N-[4-(пирролидин-3-илокси)-фенил]бензамида гидрохлорид,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-фтор-фенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 4-фтор-бензилового эфира гидрохлорид,
(RS)-4-Этокси-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-4-Пропил-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-4-Этинил-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-4-Циано-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-3,4-Дихлор-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
4-Хлор-N-(4-пиперидин-4-ил-фенил)бензамида гидрохлорид,
(RS)-4-Хлор-N-(4-пиперидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-N-((RS)-4-Пирролидин-3-ил-фенил)-2-(3-трифторметил-фенил)пропионамид,
(RS)-N-(4-Пирролидин-3-ил-фенил)-2-(3-трифторметокси-фенил)пропионамид,
4-Хлор-N-[4-((3RS,4RS)-4-фтор-пирролидин-3-ил)-фенил]бензамида гидрохлорид,
(RS)-4-Хлор-N-[3-(пирролидин-3-илокси)-фенил]бензамид,
(RS)-4-Хлор-2-фтор-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-4-Хлор-N-[4-(4-метилморфолин-2-ил)-фенил]бензамид,
(RS)-2-Фтор-4-метокси-N-(4-пирролидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-3-Хлор-N-(4-пиперидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-3,4-Дихлор-N-(4-пиперидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-4-Этокси-N-(4-пиперидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-N-(4-Пиперидин-3-ил-фенил)-4-трифторметилбензамида гидрохлорид,
(RS)-4-Хлор-2-фтор-N-(4-пиперидин-3-ил-фенил)бензамида гидрохлорид,
(RS)-3-(4-Хлор-фенил)-N-(4-пиперидин-3-ил-фенил)пропионамида гидрохлорид,
(RS)-4-Хлор-N-(4-пирролидин-2-илметил-фенил)бензамида гидрохлорид,
(RS)-4-Хлор-N-[4-(2-пирролидин-3-ил-этил)-фенил]бензамида гидрохлорид,
(RS)-4-Хлор-N-[4-(2-пиперидин-3-ил-этил)-фенил]-бензамида гидрохлорид,
4-Хлор-N-((R)-4-пиперидин-3-ил-фенил)бензамид,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-хлорфенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3-хлорфенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-трифторметил-фенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3-трифторметилфенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(2,5-дифторфенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(4-трифторметоксифенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 2-(3,4-дихлорфенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты (RS)-1-(4-хлорфенил)-этиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты 3-(4-хлорфенил)-пропиловый эфир,
(RS)-(4-Пирролидин-3-ил-фенил)-карбаминовой кислоты (RS)-1-(4-хлорфенил)-2,2,2-трифтор-этиловый эфир,
(RS)-N-(4-Пиперидин-3-ил-фенил)-4-пропилбензамида гидрохлорид,
(RS)-4-Хлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]-бензамида гидрохлорид,
4-Хлор-N-((R)-4-морфолин-2-ил-фенил)бензамида гидрохлорид,
4-Хлор-N-((S)-4-морфолин-2-ил-фенил)бензамида гидрохлорид,
(RS)-4-Хлор-N-[4-(пирролидин-3-илоксиметил)-фенил]бензамида гидрохлорид,
(RS)-4-Хлор-2-фтор-N-(4-морфолин-2-ил-фенил)бензамида гидрохлорид,
(RS)-3,4-Дихлор-N-(4-морфолин-2-ил-фенил)бензамида гидрохлорид,
(RS)-4-Хлор-N-(4-пирролидин-3-илметил-фенил)бензамида гидрохлорид,
3,4-Дихлор-N-((R)-4-пиперидин-3-ил-фенил)бензамида гидрохлорид,
(R)-3-Хлор-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
3,4-Дихлор-N-((S)-4-пиперидин-3-ил-фенил)бензамида гидрохлорид,
(S)-3-Хлор-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(RS)-3,4-Дихлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]бензамида гидрохлорид,
(RS)-N-[4-(2-Пирролидин-2-ил-этил)-фенил]-4-трифторметилбензамида гидрохлорид,
(RS)-4-Фтор-N-[4-(2-пирролидин-2-ил-этил)-фенил]бензамида гидрохлорид,
(RS)-3-Хлор-N-[4-(2-пирролидин-2-ил-этил)-фенил]бензамид,
(RS)-4-Этокси-N-[4-(2-пирролидин-2-ил-этил)-фенил]бензамида гидрохлорид,
(RS)-4-Хлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамида гидрохлорид,
(RS)-N-(4-(2-(Пиперидин-2-ил)этил)фенил)-4-(трифторметил)бензамида гидрохлорид,
(RS)-3,4-Дихлор-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамида гидрохлорид,
(RS)-4-Этинил-N-(4-(2-(пиперидин-2-ил)этил)фенил)бензамида гидрохлорид,
(RS)-4-Метил-N-(4-(пирролидин-3-ил)фенил)бензамида гидрохлорид,
(RS)-4-Метил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(RS)-4-Метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(RS)-N-(4-(Морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-4-Метил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-4-Метокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-4-(бензилокси)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(R)-4-Метил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(S)-4-Метил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-4-Этокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-4-Этил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(R)-4-Хлор-3-метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(S)-4-Хлор-3-метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(R)-3-Хлор-4-метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(S)-3-Хлор-4-метокси-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(RS)-4-(4-Хлорфенокси)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-3-Хлор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-Метил-4-((4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)метил)бензоата гидрохлорид,
(RS)-Метил-2-хлор-4-(4-(4-(морфолин-2-ил)фенилкарбамоил)фенокси)бензоата гидрохлорид,
(RS)-4-Циклопропилметокси-N-(4-морфолин-2-ил-фенил)бензамида гидрохлорид,
(RS)-4-(Метилтио)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-4-(2-Хлорметил-3-гидрокси-2-метилпропокси)-N-(4-морфолин-2-ил-фенил)бензамид,
(S)-3-Хлор-4-метил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(S)-4-Хлор-3-метил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(S)-3,4-Диметил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(R)-4-Хлор-2-фтор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(S)-4-Хлор-2-фтор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(S)-N-(4-(Пиперидин-3-ил)фенил)-3-(трифторметил)бензамида гидрохлорид,
(S)-2-(4-Хлорфенокси)-N-(4-(пиперидин-3-ил)фенил)ацетамида гидрохлорид
(S)-4-(Метилтио)-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(S)-4-(Этилтио)-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(S)-4-Хлорбензил-4-(пиперидин-3-ил)фенилкарбамата гидрохлорид
(S)-3-Метил-N-(4-(пиперидин-3-ил)фенил)бензамид,
(S)-3-(Метилтио)-N-(4-(пиперидин-3-ил)фенил)бензамид,
(R)-3,4-Диметил-N-(4-(пиперидин-3-ил)фенил)бензамида гидрохлорид,
(R)-N-(4-(Пиперидин-3-ил)фенил)-3-(трифторметил)бензамида гидрохлорид,
(R)-3-Хлор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(S)-3-Хлор-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(R)-4-(Метилтио)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(S)-4-(Метилтио)-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(R)-4-Этокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(S)-4-Этокси-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(RS)-3-Метил-N-(4-(морфолин-2-ил)фенил)бензамида гидрохлорид,
(S)-4-Хлор-2-иод-N-(4-(морфолин-2-ил)фенил)бензамид,
(S)-N-(4-(1,4-Оксазепан-2-ил)фенил)-3-хлорбензамида гидрохлорид,
3-Хлор-N-(4-((2S,6S)-6-метилморфолин-2-ил)фенил)бензамида гидрохлорид,
3-Хлор-N-[4-((2S,5S)-5-метилморфолин-2-ил)-фенил]бензамида гидрохлорид,
3-Хлор-N-[4-((2S,5R)-5-метилморфолин-2-ил)-фенил]бензамида гидрохлорид,
(RS)-5-хлор-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)амид гидрохлорид,
(RS)-6-хлор-пиридин-3-карбоновой кислоты (4-пирролидин-3-ил-фенил)амид гидрохлорид,
(RS)-6-пиразол-1-ил-N-(4-пирролидин-3-ил-фенил)никотинамид гидрохлорид,
(RS)-6-хлор-N-(4-пиперидин-3-ил-фенил)никотинамид гидрохлорид,
(RS)-5-хлор-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)амид гидрохлорид,
(RS)-хинолин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)амид гидрохлорид,
(RS)-изохинолин-1-карбоновой кислоты (4-пирролидин-3-ил-фенил)амид гидрохлорид,
(RS)-4-хлор-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)амид гидрохлорид,
(RS)-5-бром-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)амид гидрохлорид,
(RS)-N-(4-пирролидин-3-ил-фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
(RS)-6-метокси-хинолин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)амид гидрохлорид,
(RS)-1-хлор-изохинолин-3-карбоновой кислоты (4-пиррол идин-3-ил-фенил)амид гидрохлорид,
(RS)-5-хлор-пиридин-2-карбоновой кислоты [4-(2-пирролидин-3-ил-этил)-фенил]амид гидрохлорид,
(RS)-5-трифторметил-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)амид гидрохлорид,
(RS)-5-трифторметил-пиридин-2-карбоновой кислоты (4-пирролидин-3-ил-фенил)амид гидрохлорид,
(RS)-5-трифторметил-пиридин-2-карбоновой кислоты (4-морфолин-2-ил-фенил)амид гидрохлорид,
(RS)-5-хлор-пиридин-2-карбоновой кислоты (4-морфолин-2-ил-фенил)амид гидрохлорид,
(RS)-5-хлор-пиразин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)амид гидрохлорид,
(S)-6-хлор-N-(4-(пиперидин-3-ил)фенил)никотинамид гидрохлорид,
(R)-5-хлор-N-(4-(пиперидин-3-ил)фенил)пиколинамид гидрохлорид,
(S)-5-хлор-N-(4-(пиперидин-3-ил)фенил)пиколинамид гидрохлорид,
(RS)-5-этокси-N-(4-(2-(пирролидин-2-ил)этил)фенил)пиколинамид гидрохлорид,
(RS)-N-(4-(пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
(RS)-5-этокси-пиридин-2-карбоновой кислоты (4-пиперидин-3-ил-фенил)амид гидрохлорид,
(RS)-N-(4-(пиперидин-3-ил)фенил)-5-(2,2,2-трифторэтокси)пиколинамид гидрохлорид,
(RS)-6-хлор-N-(4-(морфолин-2-ил)фенил)никотинамид гидрохлорид,
(RS)-2-(4-(6-цианоникотинамидо)фенил)морфолин-4-ийхлорид,
(R)-N-(4-(пирролидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
(S)-N-(4-(пирролидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
(R)-6-хлор-N-(4-(морфолин-2-ил)фенил)никотинамид гидрохлорид,
(S)-6-хлор-N-(4-(морфолин-2-ил)фенил)никотинамид гидрохлорид,
(RS)-5-хлор-N-(4-(морфолин-2-ил)фенил)никотинамид гидрохлорид,
(RS)-2-хлор-N-(4-(морфолин-2-ил)фенил)изоникотинамид гидрохлорид,
(RS)-5,6-дихлор-N-(4-(морфолин-2-ил)фенил)никотинамид гидрохлорид,
(RS)-2,6-дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамид гидрохлорид,
(RS)-N-(4-(морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
(R)-N-(4-(пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
(S)-N-(4-(пиперидин-3-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
5-хлор-пиразин-2-карбоновой кислоты ((S)-4-пиперидин-3-ил-фенил)амид гидрохлорид,
5-хлор-пиразин-2-карбоновой кислоты ((R)-4-пиперидин-3-ил-фенил)амид гидрохлорид,
(S)-N-(4-(пиперидин-3-ил)фенил)-6-(трифторметил)никотинамид гидрохлорид,
(S)-6-метил-N-(4-(пиперидин-3-ил)фенил)никотинамид гидрохлорид,
(S)-6-(метилтио)-N-(4-(пиперидин-3-ил)фенил)никотинамид гидрохлорид,
(RS)-6-этокси-N-(4-(морфолин-2-ил)фенил)никотинамид гидрохлорид,
(RS)-N-(4-(морфолин-2-ил)фенил)-2-фенилоксазол-4-карбоксамид гидрохлорид,
(S)-N-(4-(пиперидин-3-ил)фенил)-5-(2,2,2-трифторэтокси)пиразин-2-карбоксамид гидрохлорид,
(S)-5-бром-N-(4-(пиперидин-3-ил)фенил)пиразин-2-карбоксамида 2,2,2-трифторацетат,
(S)-6-бром-N-(4-(пиперидин-3-ил)фенил)никотинамида 2,2,2-трифторацетат,
(S)-5-(метилтио)-N-(4-(пиперидин-3-ил)фенил)пиразин-2-карбоксамид,
(R)-N-(4-(пиперидин-3-ил)фенил)-6-(трифторметил)никотинамид гидрохлорид,
(R)-N-(4-(морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
(S)-N-(4-(морфолин-2-ил)фенил)-6-(2,2,2-трифторэтокси)никотинамид гидрохлорид,
(R)-2,6-дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамид гидрохлорид,
(S)-2,6-дихлор-N-(4-(морфолин-2-ил)фенил)изоникотинамид гидрохлорид,
(RS)-2-хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамид гидрохлорид,
(RS)-N-(4-(морфолин-2-ил)фенил)-6-(пирролидин-1-ил)никотинамид гидрохлорид,
(RS)-N-(4-(морфолин-2-ил)фенил)-2-(трифторметил)изоникотинамид гидрохлорид,
(S)-2,6-дихлор-N-(4-(пиперидин-3-ил)фенил)изоникотинамид гидрохлорид,
(S)-2-хлор-6-метил-N-(4-(пиперидин-3-ил)фенил)изоникотинамид гидрохлорид,
(R)-N-(4-(морфолин-2-ил)фенил)-6-(трифторметил)никотинамид гидрохлорид,
(S)-N-(4-(морфолин-2-ил)фенил)-6-(трифторметил)никотинамид гидрохлорид,
(R)-2-хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамид гидрохлорид,
(S)-2-хлор-6-метил-N-(4-(морфолин-2-ил)фенил)изоникотинамид гидрохлорид,
(S)-N-(4-(пиперидин-3-ил)фенил)-6-пропилникотинамид,
(S)-6-этил-N-(4-(пиперидин-3-ил)фенил)никотинамид,
(RS)-N-(4-(морфолин-2-ил)фенил)-1-фенил-1Н-пиразол-3-карбоксамид гидрохлорид,
(RS)-2-этокси-N-(4-(морфолин-2-ил)фенил)изоникотинамид гидрохлорид,
(RS)-(4-пирролидин-3-ил-фенил)-карбаминовой кислоты индан-2-иловый эфир,
(S)-2,3-дигидро-1Н-индан-2-ил-4-(пиперидин-3-ил)фенилкарбамата 2,2,2-трифторацетат.
7. Фармацевтическая композиция, обладающая аффинностью к TAAR1, содержащая эффективное количество соединения по любому из пп. 1-6 и фармацевтический приемлемый носитель и/или адъювант.
8. Соединения по любому из пп. 1-6 для применения в качестве терапевтически активных веществ, обладающих аффинностью к TAAR1.
9. Применение соединения по любому из пп. 1-6 для изготовления лекарственных средств, проявляющих аффинность к TAAR1.
| СПОСОБ ПОЛУЧЕНИЯ ПОЛОСОВОЙ ЗАГОТОВКИ ИЗ АЛЮМИНИЯ И ЕГО СПЛАВОВ | 1992 |
|
RU2009005C1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| JP 2007191471 A, 02.08.2007 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| JP 2001151742 A, 05.06.2001 | |||
| JP 61233678 A, 17.10.1986 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2016-08-27—Публикация
2010-12-17—Подача