ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ИЗОБРЕТЕНИЯ
Настоящая заявка истребует приоритет, заявленный в предварительной заявке на патент США № 61/256394, поданной 30 октября 2009 года, содержание которой полностью включено в настоящий документ путем ссылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к созданию новых модуляторов опиоидных рецепторов формулы (I). Настоящее изобретение также относится к способам получения таких соединений и содержащих их фармацевтических композиций, а также к их применению для лечения расстройств, модулируемых опиоидными рецепторами.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Термин «опиат» применяется для обозначения фармакологически активных алкалоидов, получаемых из опия, например, морфина, кодеина, и многих полусинтетических аналогов морфина. После выделения пептидных соединений с аналогичным морфину действием был введен термин «опиоид» для обобщенного обозначения любых препаратов с аналогичным морфину действием. В класс опиоидов входят различные пептиды с аналогичным морфину действием, такие как эндорфины, энкефалины и динорфины. Однако в ряде источников термин «опиат» используется в обобщенном смысле, и в таких контекстах термины «опиат» и «опиоид» являются взаимозаменяемыми. Кроме того, термин «опиоид» также применяется для обозначения антагонистов морфиноподобных препаратов, а также для описания рецепторов или сайтов связывания, которые могут взаимодействовать с такими веществами.
Опиоиды широко применяются в качестве анальгетиков, однако они также могут иметь и множество других фармакологических действий. Морфин и родственные опиоиды оказывают наиболее выраженное действие на центральную нервную и пищеварительную системы. Спектр действия достаточно широк и включает обезболивающее воздействие, вызывает сонливость, перемену настроения, угнетение дыхательной функции, головокружение, помутнение рассудка, дисфорию, кожный зуд, повышение давления в желчных путях, угнетение двигательной функции желудочно-кишечного тракта, тошноту, рвоту, а также изменения в эндокринной и вегетативной нервной системах.
При введении страдающим от боли пациентам морфина в терапевтических дозировках отмечается снижение интенсивности боли, снижение связанного с болью дискомфорта или полное исчезновение боли. Помимо облегчения патологического состояния ряд пациентов также испытывает чувство эйфории. Однако при введении морфина в рекомендованных для достижения обезболивающего эффекта дозировках пациентам, не страдающим от болей, эффект не всегда является благоприятным, нередко отмечается тошнота и даже рвота. Возможны также сонливость, неспособность к концентрации, снижение умственной активности, апатия, снижение физической активности, снижение остроты зрения и заторможенность.
С опиодными рецепторами могут связываться два класса опиоидных молекул: опиоидные пептиды (например, энкефалины, динорфины и эндорфины) и алкалоидные опиаты (например, морфин, эторфин, дипренорфин и налоксон). После первой демонстрации сайтов связывания опиатов (Pert, C. B. и Snyder, S. H., Science (1973) 179:1011-1014) для классификации множества опиоидных рецепторов были использованы различия в фармакологических и физиологических действиях пептидных аналогов опиоидов и алкалоидных опиатов. Соответственно, были описаны три разных в молекулярном и фармакологическом отношении типа опиоидных рецепторов: дельта, каппа и мю. Более того, в каждом типе принято также выделять подтипы (Wollemann, M., J Neurochem (1990) 54:1095-1101; Lord, J. A., et al., Nature (1977) 267:495-499).
Опиоидные рецепторы трех указанных типов имеют общие функциональные механизмы на клеточном уровне. Например, опиоидные рецепторы вызывают ингибирование аденилатциклазы и секреции нейромедиатора путем активации калиевых каналов и ингибирования Ca2+-каналов (Evans, C. J., In: Biological Basis of Substance Abuse, S. G. Korenman & J. D. Barchas, eds., Oxford University Press (in press); North, A. R., et al., Proc Natl Acad Sci USA (1990) 87:7025-29; Gross, R. A., et al., Proc Natl Acad Sci USA (1990) 87:7025-29; Sharma, S. K., et al., Proc Natl Acad Sci USA (1975) 72:3092-96). Несмотря на то, что указанные функциональные механизмы являются одинаковыми, поведенческие проявления селективных к типу рецептора препаратов значительно различаются (Gilbert, P. E. & Martin, W. R., J Pharmacol Exp Ther (1976) 198:66-82). Такие различия могут быть частично связаны с анатомической локализацией рецепторов различного типа.
Рецепторы типа дельта распределены в ЦНС млекопитающих более дискретно, чем рецепторы типа мю и каппа, их концентрации высоки в миндалевидном теле, полосатом теле, черной субстанции, обонятельной луковице, обонятельных бугорках, гиппокампальной формации и коре головного мозга (Mansour, A., et al., Trends in Neurosci (1988) 11:308-14). Примечательным является полное отсутствие опиоидных рецепторов, включая дельта-опиоидные рецепторы, в мозжечке крысы.
Существует потребность в разработке новых модуляторов дельта-опиоидных рецепторов для использования их в качестве анальгетиков. Также существует потребность в разработке селективных агонистов дельта-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами. Кроме того, существует потребность в антагонистах дельта-опиоидных рецепторов для использования их в качестве иммунодепрессантов, противовоспалительных средств, средств для лечения неврологических и психиатрических заболеваний, средств для лечения урологических заболеваний и заболеваний репродуктивной системы, препаратов для лечения алкогольной и наркотической зависимости, средств для лечения гастрита и диареи, средств для лечения сердечно-сосудистой системы и средств для лечения респираторных заболеваний со сниженными побочными эффектами.
Существует потребность в разработке новых модуляторов опиоидных рецепторов для использования их в качестве анальгетиков. Также существует потребность в разработке агонистов дельта- и мю-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами. Также существует потребность в разработке агонистов мю-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами при лечении болевого синдрома, модуляции иммунной функции, лечении желудочно-пищеводного рефлюкса и кашля. Кроме того, также существует потребность в разработке агонистов дельта-опиоидных рецепторов для использования их в качестве обезболивающих средств, средств для лечения респираторных заболеваний, средств для лечения сердечно-сосудистой системы, средств для лечения урологических расстройств и средств для лечения неврологических и психиатрических заболеваний. Также существует потребность в разработке агонистов двойного действия для дельта- и мю-опиоидных рецепторов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям формулы (I)
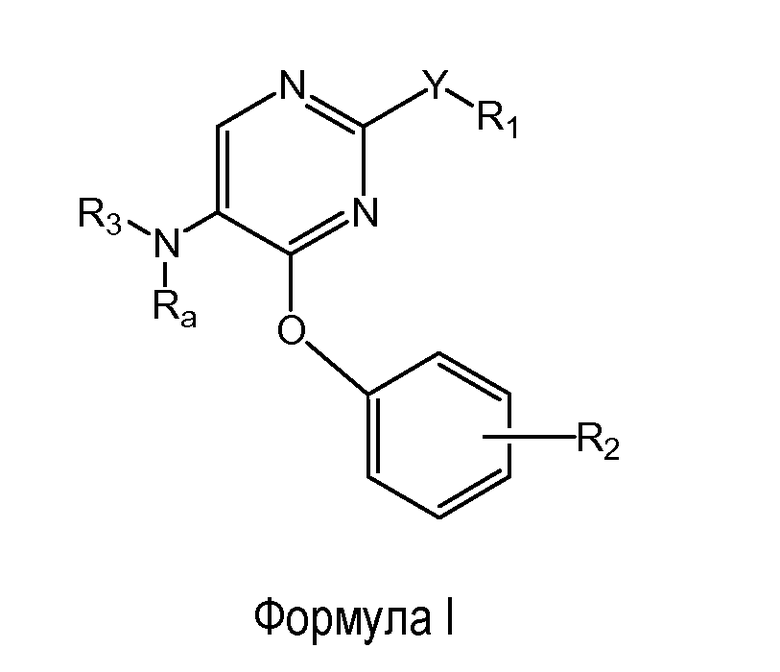
где
R1 выбран из группы, состоящей из фенила, пиридинила и тиазолила; причем R1 необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, атома фтора, атома хлора, атома брома и цианогруппы; кроме этого, R1 необязательно замещен аминогруппой, C1-4алкиламиногруппой, ди(C1-4алкил)аминогруппой, аминокарбонилом, C1-4алкиламинокарбонилом или ди(C1-4алкил)аминокарбонилом;
Y представляет собой O, S, NH, винил, этинил или S(O);
R2 представляет собой заместитель, выбранный из группы, состоящей из водорода, C1-4алкила, C1-4алкокси, C1-4алкилтио, атома фтора, атома хлора, атома брома и гидрокси;
Ra представляет собой водород или метил;
R3 выбран из группы, состоящей из пирролидин-2-илметила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, пиперидин-2-илэтила, пиперидин-3-илэтила, пиперидин-4-илэтила, пиридин-4-ил-(C1-2)алкила, азетидин-3-илметила, морфолин-2-илметила, морфолин-3-илметила, имидазолилметила, тиазолилметила, (амино)-C3-6циклоалкила, 3-гидрокси-2-аминопропила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила, гуанидинилэтила, 4-(имидазол-1-ил)фенилметила, 2-(метиламино)этила, 2-диэтиламиноэтила, 4-диэтиламинобут-2-ила, пиперидин-3-ила, пиперидин-4-ила и пирролидин-3-ила;
и при этом пиперидин-3-ил необязательно замещен на атоме углерода фенилом; и при этом пирролидин-2-ил в пирролидин-2-ил-метиле, пирролидин-3-ил, пиперидин-3-ил и пиперидин-4-ил необязательно замещены на атоме азота метилом, фенилметилом, фенэтилом или метилкарбонилом;
и их энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Настоящее изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение формулы (I) или его фармацевтически приемлемую соль.
Также в настоящем изобретении предложены способы получения фармацевтической композиции, включающие смешивание соединения формулы (I) и фармацевтически приемлемого носителя.
Настоящее изобретение дополнительно относится к способам лечения или облегчения симптомов расстройства, модулируемого опиоидными рецепторами. В частности, способы настоящего изобретения направлены на лечение или облегчение симптомов расстройств, модулируемых опиоидными рецепторами, включая без ограничений воспалительную боль; боль, опосредуемую центральной нервной системой; боль, опосредуемую периферической системой; висцеральную боль; боль, вызванную структурными нарушениями; онкологическую боль; боль, связанную с травмой мягких тканей; боль, связанную с прогрессирующим заболеванием; невропатическую боль и острую боль, связанную с острым поражением; острую боль, связанную с травмой; острую боль, связанную с хирургическим вмешательством; хроническую головную боль, хроническую боль при невропатических заболеваниях, хроническую боль при пост-инсультных состояниях и хроническую боль при мигрени.
В настоящем изобретении также предложены способы получения указанных соединений и фармацевтических композиций, а также лекарственных препаратов, изготовленных на их основе.
Для целей настоящего документа следующие термины имеют следующие определения:
“Ca-b” (где a и b представляют собой целые числа) относится к радикалу, содержащему от a до b атомов углерода, включительно. Например, C1-3 обозначает радикал, содержащий 1, 2 или 3 атома углерода.
По отношению к заместителям термин «независимо» обозначает, что при возможности ввести более одного из таких заместителей вводимые заместители могут быть одинаковыми или разными. Таким образом, указанное число атомов углерода (например, C1-8) независимо обозначает количество атомов углерода в алкильном или циклоалкильном фрагменте или алкильной части более крупного заместителя, в названии которого присутствует корень «алкил» в качестве префикса.
Если не указано иное, термин «алкил», используемый в настоящем документе, самостоятельно или в составе названия заместителя, относится к линейной и разветвленной углеродным цепям, содержащим от 1 до 8 атомов углерода либо любое число атомов углерода в пределах обозначенного диапазона. Термин «алкокси» относится к заместителю типа -O-алкил, где «алкил» применяется в указанном выше смысле. Аналогичным образом термины «алкенил» и «алкинил» относятся к линейной и разветвленной углеродным цепям, содержащим от 2 до 8 атомов углерода или любое число атомов углерода в пределах обозначенного диапазона, при этом алкенильная цепь содержит по меньшей мере одну двойную связь в цепи, а алкинильная цепь содержит по меньшей мере одну тройную связь в цепи. Алкильная и алкоксильная цепи могут быть замещены по атому углерода. В заместителях, содержащих множество алкильных групп, например, (C1-6алкил)-2-амино-, C1-6-алкильные группы диалкиламиногрупп могут быть одинаковыми или разными.
Термин «галогензамещенный алкил» относится к насыщенному алкильному радикалу с разветвленной или линейной цепью, полученному путем отрыва одного атома водорода от материнской молекулы алкана. Материнская алкильная цепь содержит от 1 до 8 атомов углерода, при этом 1 или более атомов водорода замещены атомами галогена, вплоть до замещения всех включительно атомов водорода атомами галогена. Предпочтительные галогензамещенные алкильные группы включают трифторметилзамещенные алкилы, дифторметилзамещенные алкилы и перфторзамещенные алкилы; более предпочтительные фторированные алкилы включают трифторметил и дифторметил.
Термин «галогензамещенный алкокси» относится к радикалу, полученному из галогензамещенного алкильного радикала путем его присоединения к атому кислорода, при этом атом кислорода имеет одну свободную валентность для присоединения к материнской структуре.
Термин «циклоалкил» относится к насыщенному или частично ненасыщенному моноциклическому или полициклическому углеводороду, содержащему от 3 до 20 атомов углерода (предпочтительно от 3 до 14 атомов углерода). Примеры таких групп включают, помимо прочего, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или адамантил. Термин «циклоалкил» включает циклоалкильное кольцо, конденсированное с бензольным кольцом (бензоконденсированный циклоалкил) или 5- или 6-членным гетероароматическим кольцом (содержащим один из O, S или N и необязательно еще один атом азота) с образованием гетероарилконденсированного циклоалкила.
Термин «гетероциклил» относится к 5-10-членному неароматическому моноциклическому кольцу, в котором от 1 до 4 членов представляют собой атомы азота, либо к 5-10-членному неароматическому моноциклическому кольцу, в котором ни один, один или два члена представляют собой атомы азота и до двух членов представляют собой атомы кислорода или серы; при этом кольцо необязательно содержит от нуля до двух ненасыщенных связей. Термин «гетероциклил» включает гетероциклическое кольцо, конденсированное с бензольным кольцом (бензоконденсированный гетероциклил), 5- или 6-членным гетероароматическим кольцом (содержащим один из O, S или N и необязательно еще один атом азота), 5-7-членным циклоалкильным или циклоалкенильным кольцом, 5-7-членным гетероциклильным кольцом (в определенном выше смысле, за исключением дополнительного конденсированного кольца), либо конденсированное по одному атому углерода циклоалкильного, циклоалкенильного или гетероциклильного кольца с образованием спирофрагмента. Для соединений, составляющих предмет настоящего изобретения, кольцевые атомы углерода, образующие гетероциклильное кольцо, являются полностью насыщенными. Другие соединения, составляющие предмет настоящего изобретения, могут иметь частично насыщенное гетероциклильное кольцо. Кроме того, термин «гетероциклил» включает гетероциклическое мостиковое кольцо, образующее бициклические кольца. Предпочтительные частично насыщенные гетероциклильные кольца могут иметь от одной до двух двойных связей. Такие соединения не считаются полностью ароматическими и не входят в понятие гетероарильных соединений. Примеры гетероциклильных групп без ограничений включают пирролинил (включая 2H-пиррол, 2-пирролинил или 3-пирролинил), пирролидинил, 2-имидазолинил, имидазолидинил, 2-пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил и пиперазинил.
Термин «арил» относится к ненасыщенному ароматическому моноциклическому кольцу из 6 атомов углерода или к ненасыщенному ароматическому полициклическому кольцу из 10-14 атомов углерода. Примеры таких арильных колец, помимо прочего, включают фенил, нафталинил или антраценил. Предпочтительными арильными группами для практического осуществления настоящего изобретения являются фенил и нафталинил.
Термин «гетероарил» относится к 5- или 6-членному ароматическому кольцу, причем указанное кольцо состоит из атомов углерода и содержит по меньшей мере один гетероатом. Соответствующие гетероатомы включают азот, кислород или серу. В случае 5-членных колец гетероарильное кольцо содержит один атом азота, кислорода или серы, а также может содержать до трех дополнительных атомов азота. В случае 6-членных колец гетероарильное кольцо может содержать от одного до трех атомов азота. В том случае, когда 6-членное кольцо содержит три атома азота, не более двух атомов азота находятся в соседних положениях.
Термин «гетероарил» включает гетероарильное кольцо, конденсированное с бензольным кольцом (бензоконденсированный гетероарил), 5- или 6-членным гетероарильным кольцом (содержащим один из O, S или N и необязательно еще один атом азота), 5-7-членным циклоалкильным кольцом или 5-7-членным гетероциклильным кольцом (в определенном выше смысле, за исключением дополнительного конденсированного кольца).
Примеры гетероарильных групп включают, помимо прочего, фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил; конденсированные гетероарильные группы включают индолил, изоиндолил, бензофурил, бензотиенил, индазолил, бензимидазолил, бензотиазолил, бензоксазолил, бензизоксазолил, бензотиадиазолил, бензотриазолил, хиноксалинил, хинолинил, изохинолинил или хиназолинил.
Термин «арилалкил» обозначает алкильную группу, замещенную арильной группой (например, бензил, фенэтил). Аналогичным образом термин «арилалкокси» обозначает алкоксильную группу, замещенную арильной группой (например, бензилокси).
Термин «галоген» относится к фтору, хлору, брому и йоду. Заместители, замещенные галогенами по нескольким положениям, замещаются с возможностью получения устойчивых соединений.
Термин «винил» относится к двухуглеродной ненасыщенной мостиковой группе, в которой ненасыщенность представлена двойной связью между указанными двумя атомами углерода. Когда у винильной мостиковой группы появляются два заместителя, подразумевается, что заместители присоединены по соседним атомам углерода таким образом, что заместители находятся в 1,2-положении.
Термин «оксо», используемый самостоятельно или в качестве части названия заместителя, относится к фрагменту O=, связанному с атомом углерода или серы. Например, фталимид и сахарин представляют собой примеры соединений с оксозаместителями.
Если термин «алкил» или «арил», либо любой из образованных от этих корней префиксов, появляется в названии заместителя (например, арилалкил, алкиламино), подразумевается, что все указанные выше ограничения для терминов «алкил» и «арил» относятся и к производным названиям. Указание количества атомов углерода (например, C1-C6) относится независимо к количеству атомов углерода в алкильном фрагменте или к алкильной части более крупного заместителя, в названии которого корень «алкил» используется в качестве префикса. Для алкильных и алкоксильных заместителей указанное количество атомов углерода включает все независимые члены приведенного диапазона по отдельности, а также любые сочетания диапазонов в указанных границах. Например, C1-6 алкил включает по отдельности метил, этил, пропил, бутил, пентил и гексил, а также их подкомбинации (например, C1-2, C1-3, C1-4, C1-5, C2-6, C3-6, C4-6, C5-6, C2-5 и т.д.).
Используемый в настоящем документе термин «пациент» обозначает животное, предпочтительно млекопитающее, наиболее предпочтительно человека, являющееся объектом лечения, наблюдения или эксперимента.
Используемый в настоящем документе термин «терапевтически эффективное количество» обозначает такое количество активного соединения или фармацевтического вещества, которое вызывает ожидаемую исследователем, ветеринаром, врачом или иным клиницистом биологическую или медицинскую реакцию со стороны системы тканей, организма животного или человека, которая включает облегчение симптоматики заболевания или патологического состояния, лечение которого проводится.
Используемый в настоящем документе термин «композиция» относится к любому продукту, содержащему указанные компоненты в указанных количествах, а также к любым продуктам, которые могут быть получены, прямо или косвенно, из комбинаций указанных компонентов в указанных количествах.
Используемый в настоящем документе термин «ацил» относится к алкилкарбонильным заместителям.
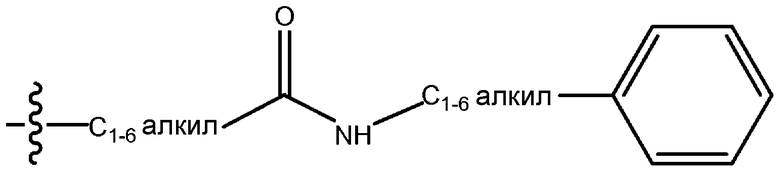
В рамках настоящего документа первой указывают концевую часть описываемой боковой цепи, а затем перечисляют функциональные группы по направлению к точке присоединения заместителя. Например, заместитель «фенил(C1-6)алкиламинокарбонил(C1-6)алкил» обозначает группу формулы
Если не указано иное, предполагается, что определение какого-либо заместителя или переменной на определенной позиции в молекуле не зависит от соответствующих определений на других участках молекулы. Принимается, что заместители и схемы замещения соединений формулы (I) могут выбираться специалистом в данной области для обеспечения химически стабильных соединений, которые легко синтезировать по известным в данной области методикам, а также способами, изложенными в настоящем документе.
Для целей настоящего изобретения термин «модулируемый опиоидным рецептором» используется для обозначения состояния зависимости от модуляции опиоидного рецептора, включая, помимо прочего, опосредование опиоидным рецептором.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Варианты осуществления настоящего изобретения включают соединения формулы (I), в которых
a) R1 выбран из группы, состоящей из фенила, пиридинила и тиазолила; причем R1 необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, атома фтора, атома хлора, атома брома и цианогруппы; кроме этого, R1 необязательно замещен аминокарбонилом, C1-4алкиламинокарбонилом или ди(C1-4алкил)аминокарбонилом;
b) R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, атома фтора и атома брома; кроме того, R1 необязательно замещен ди(C1-4алкил)аминокарбонилом;
c) R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и атома фтора; кроме того, R1 необязательно замещен ди(C1-4алкил)аминокарбонилом;
d) R1 представляет собой фенил, необязательно замещенный одним заместителем, выбранным из группы, состоящей из C1-4алкокси и ди(C1-4алкил)аминокарбонила;
e) Y представляет собой O, NH, винил, этинил или S(O),
f) Y представляет собой O или этинил;
g) Y представляет собой O;
h) R2 представляет собой заместитель, выбранный из группы, состоящей из C1-2алкокси, атома фтора и атома брома;
i) R2 представляет собой C1-2алкокси или атом фтора;
j) Ra представляет собой водород;
k) R3 выбран из группы, состоящей из пирролидин-2-илметила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, пиперидин-3-илэтила, пиперидин-4-илэтила, азетидин-3-илметила, морфолин-2-илметила, пиперидин-3-ила, пиперидин-4-ила, пирролидин-3-ила, 3-аминоциклогексила, 4-аминоциклогексила, 3-гидрокси-2-аминопропила, 4-диэтиламинобут-2-ила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила и 2-(метиламино)этила;
при этом пиперидин-3-ил необязательно замещен на атоме углерода фенилом; и при этом пирролидин-2-ил в пирролидин-2-ил-метиле, пирролидин-3-ил, пиперидин-3-ил и пиперидин-4-ил необязательно замещены на атоме азота метилом, фенилметилом, фенэтилом или метилкарбонилом;
l) R3 выбран из группы, состоящей из пирролидин-2-ил-метила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, азетидин-3-илметила, пиперидин-3-ила, пиперидин-4-ила, 3-аминоциклогексила, 4-аминоциклогексила, 3-гидрокси-2-аминопропила, 4-диэтиламинобут-2-ила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила и 2-(метиламино)этила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом;
m) R3 выбран из группы, состоящей из пирролидин-2-илметила, пиперидин-3-ила и 3-аминоциклогексила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом;
и любые комбинации описанных выше вариантов осуществления а)-m), при условии что предполагается, что те комбинации, в которых присутствуют различные варианты осуществления одного и того же заместителя, должны быть исключены;
и их энантиомеры, диастереомеры, сольваты и фармацевтически приемлемые соли.
Следующий вариант осуществления настоящего изобретения относится к соединению формулы (I)
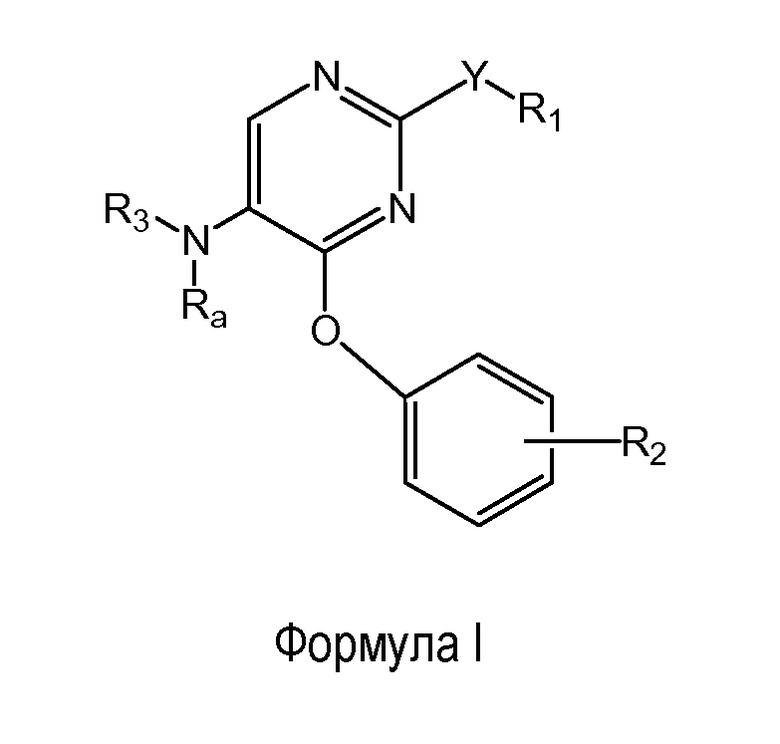
где
R1 выбран из группы, состоящей из фенила, пиридинила и тиазолила; причем R1 необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, атома фтора, атома хлора, атома брома и цианогруппы; кроме этого, R1 необязательно замещен аминокарбонилом, C1-4алкиламинокарбонилом или ди(C1-4алкил)аминокарбонилом;
Y представляет собой O, NH, винил, этинил или S(O);
R2 представляет собой заместитель, выбранный из группы, состоящей из C1-2алкокси, атома фтора и атома брома;
Ra представляет собой водород или метил;
R3 выбран из группы, состоящей из пирролидин-2-илметила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, пиперидин-3-илэтила, пиперидин-4-илэтила, азетидин-3-илметила, морфолин-2-илметила, пиперидин-3-ила, пиперидин-4-ила, пирролидин-3-ила, 3-аминоциклогексила, 4-аминоциклогексила, 3-гидрокси-2-аминопропила, 4-диэтиламинобут-2-ила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила и 2-(метиламино)этила;
при этом пиперидин-3-ил необязательно замещен на атоме углерода фенилом; и при этом пирролидин-2-ил в пирролидин-2-ил-метиле, пирролидин-3-ил, пиперидин-3-ил и пиперидин-4-ил необязательно замещены на атоме азота метилом, фенилметилом, фенэтилом или метилкарбонилом;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Другой вариант осуществления настоящего изобретения относится к соединению формулы (I)
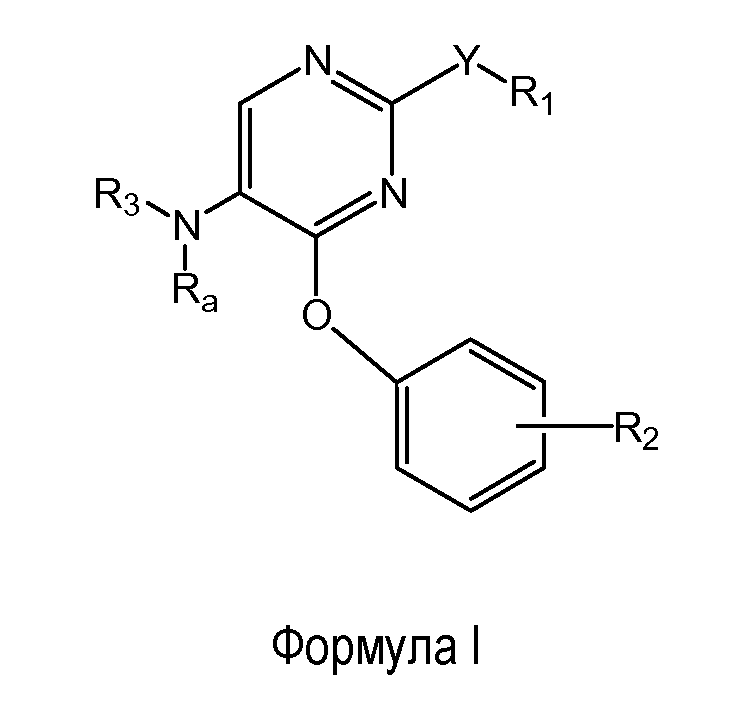
где
R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси, атома фтора и атома брома; кроме того, R1 необязательно замещен ди(C1-4алкил)аминокарбонилом;
Y представляет собой O, NH, винил, этинил или S(O);
R2 выбран из группы, состоящей из C1-2алкокси, атома фтора и атома брома;
Ra представляет собой водород;
R3 выбран из группы, состоящей из пирролидин-2-ил-метила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, азетидин-3-илметила, пиперидин-3-ила, пиперидин-4-ила, 3-аминоциклогексила, 4-аминоциклогексила, 3-гидрокси-2-аминопропила, 4-диэтиламинобут-2-ила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила и 2-(метиламино)этила;
причем пирролидин-2-ил в пирролидин-2-ил-метиле необязательно замещен на атоме азота метилом;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Другой аспект настоящего изобретения относится к соединению формулы (I)
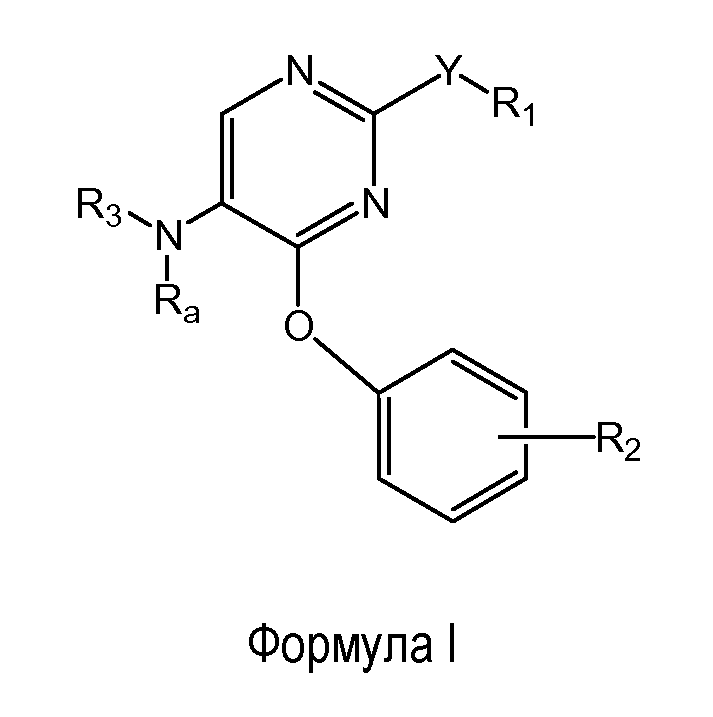
где
R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-4алкокси и атома фтора; кроме того, R1 необязательно замещен ди(C1-4алкил)аминокарбонилом;
Y представляет собой O или этинил;
R2 представляет собой заместитель, выбранный из группы, состоящей из C1-2алкокси, атома фтора и атома брома;
Ra представляет собой водород;
R3 выбран из группы, состоящей из пирролидин-2-илметила, пиперидин-3-ила и 3-аминоциклогексила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Другой вариант осуществления настоящего изобретения относится к соединению формулы (I)

где
R1 представляет собой фенил, необязательно замещенный одним заместителем, независимо выбранным из группы, состоящей из C1-4алкокси и ди(C1-4алкил)аминокарбонила;
Y представляет собой O;
R2 представляет собой C1-2алкокси или атом фтора;
Ra представляет собой водород;
R3 выбран из группы, состоящей из пирролидин-2-илметила, пиперидин-3-ила и 3-аминоциклогексила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом;
и его энантиомерам, диастереомерам, сольватам и фармацевтически приемлемым солям.
Соединения формулы (I) включают соединения формулы (II)
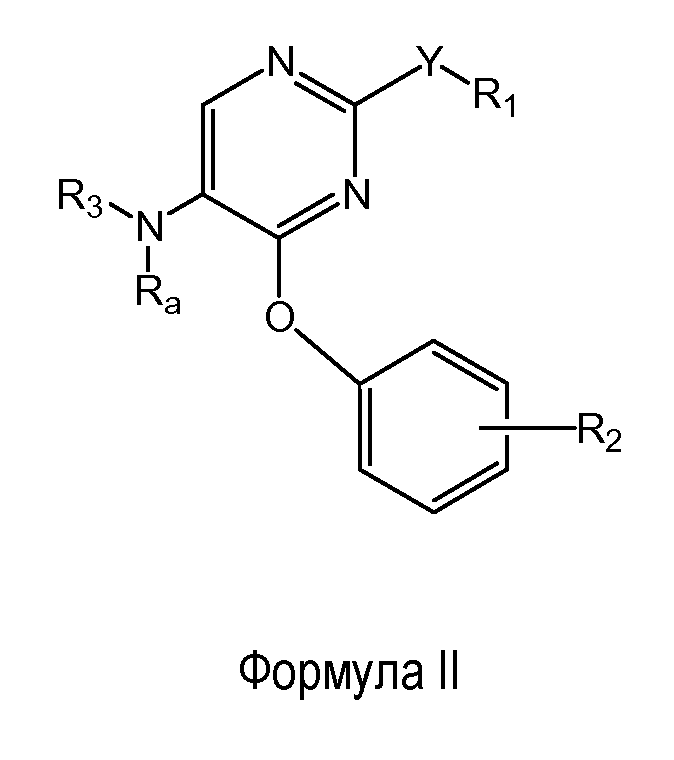
где R1, R2, Ra и R3 соответствуют определениям настоящего документа; и их энантиомеры, диастереомеры, сольваты и фармацевтически приемлемые соли.
Следующий вариант осуществления настоящего изобретения относится к соединению формулы (I)
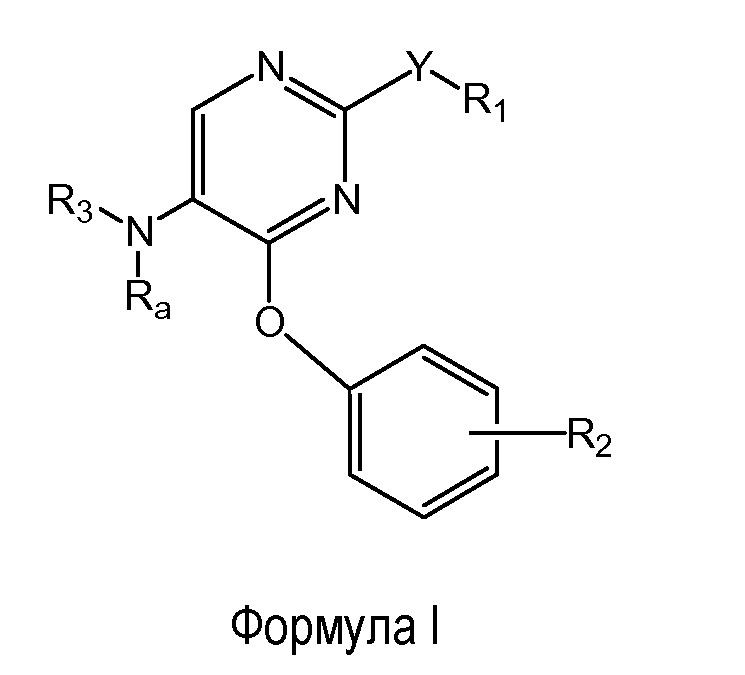
выбранному из группы, состоящей из:
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пиперидин-3-ил; (RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 3-аминоциклогексил; (1RS,3RS)
соединения формулы (I), где R1 представляет собой 2-фенил, Y представляет собой этинил, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-диэтиламинокарбонилфенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2R)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой метил и R3 представляет собой 1-метилпирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-метилпирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 3-гидрокси-2-аминопропил; (2R)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 8-азабицикло[3.2.1]окт-3-ил; (1R, 5S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой азетидин-3-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-азабицикло[2.2.2]окт-3-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пиперидин-3-илметил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 4-аминоциклогексил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пиперидин-4-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 2-метиламиноэтил;
соединения формулы (I), где R1 представляет собой 2-(4-метоксифенил), Y представляет собой винил, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой S(O), R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 3-гидрокси-2-аминопропил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-3-илметил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой NH, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-фторфенил, Y представляет собой O, R2 представляет собой 4-фтор, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2*S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пиперидин-2-илметил; (2RS)
соединения формулы (I), где R1 представляет собой 2-бромфенил, Y представляет собой O, R2 представляет собой 2-бром, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-фенилметилпирролидин-3-ил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-фенилметилпиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-фенэтилпиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-метилпиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой морфолин-2-илметил; (2RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-фенилметилпиперидин-3-ил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 2-(пиперидин-4-ил)этил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 2-(пиперидин-3-ил)этил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 4-фенилпиперидин-3-ил; (3RS, 4RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-3-ил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 4-(имидазол-1-ил)фенилметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 4-диэтиламинобут-2-ил; (2RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пиридин-4-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-(пиридин-4-ил)этил; (1RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1-метилкарбонилпиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 1H-имидазол-2-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой тиазол-2-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой 2-гуанидиноэтил;
соединения формулы (I), где R1 представляет собой пиридин-3-ил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-фторфенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-фторфенил, Y представляет собой S, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой пиридин-3-ил, Y представляет собой NH, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-фторфенил, Y представляет собой NH, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-ил-метил; (2S)
соединения формулы (I), где R представляет собой тиазол-2-ил, Y представляет собой NH, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-хлорфенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-метоксифенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-цианофенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
и
соединения формулы (I), где R1 представляет собой 3,5-дифторфенил, Y представляет собой O, R2 представляет собой 4-метокси, Ra представляет собой H и R3 представляет собой пирролидин-2-илметил; (2S)
и его фармацевтически приемлемым солям.
Для использования в медицинских целях соли соединений формулы (I) относятся к нетоксичным «фармацевтически приемлемым солям». Однако для получения соединений формулы (I) или их фармацевтически приемлемых солей могут использоваться и другие соли. Соответствующие фармацевтически приемлемые соли соединений формулы (I) включают соли присоединения кислоты, которые, например, могут быть получены при смешивании раствора соединения с раствором фармацевтически приемлемой кислоты, например, соляной кислоты, серной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты, уксусной кислоты, бензойной кислоты, лимонной кислоты, винной кислоты, углекислоты или фосфорной кислоты.
Кроме того, когда соединения формулы (I) имеют кислотный фрагмент, их допустимые фармацевтически приемлемые соли могут включать соли щелочных металлов, например, натриевые или калиевые соли; соли щелочноземельных металлов, например, кальциевые или магниевые соли, а также соли с соответствующими органическими лигандами, например, четвертичные аммонийные соли. Таким образом, типичные примеры фармацевтически приемлемых солей включают следующие соли: ацетаты, бензолсульфонаты, бензоаты, бикарбонаты, бисульфаты, битартраты, бораты, бромиды, кальция эдетаты, камсилаты, карбонаты, хлориды, клавуланаты, цитраты, дигидрохлориды, эдетаты, эдисилаты, эстолаты, эсилаты, фумараты, глюцептаты, глюконаты, глутаматы, гликоллиларсанилаты, гексилрезорцинаты, гидрабамины, гидробромиды, гидрохлориды, гидроксинафтоаты, йодиды, изотионаты, лактаты, лактобионаты, лаураты, малаты, малеаты, манделаты, мезилаты, метилбромиды, метилнитраты, метилсульфаты, мукаты, напсилаты, нитраты, N-метилглюкамина аммониевые соли, олеаты, памоаты (эмбонаты), пальмитаты, пантотенаты, фосфаты/дифосфаты, полигалактуронаты, салицилаты, стеараты, сульфаты, субацетаты, сукцинаты, таннаты, тартраты, теоклаты, тозилаты, триэтиодиды и валераты.
Типичные примеры кислот и оснований, которые могут применяться для получения фармацевтически приемлемых солей, включают следующие: кислоты, в том числе уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, (+)-камфорную кислоту, камфорсульфокислоту, (+)-(1S)-камфор-10-сульфокислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, додецилсерную кислоту, этан-1,2-дисульфокислоту, этансульфокислоту, 2-гидроксиэтансульфокислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкороновую кислоту, L-глютаминовую кислоту, α-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромистоводородную кислоту, соляную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфокислоту, нафталин-2-сульфокислоту, нафталин-1,5-дисульфокислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, фосфорную кислоту, L-пироглютаминовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-виннокаменную кислоту, тиоциановую кислоту, п-толуолсульфокислоту и ундециленовую кислоту;
и основания, в том числе аммиак, L-аргинин, бенетамин, бензатин, кальция гидроксид, холин, деанол, диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин, 1H-имидазол, L-лизин, магния гидроксид, 4-(2-гидроксиэтил)морфолин, пиперазин, калия гидроксид, 1-(2-гидроксиэтил)пирролидин, натрия гидроксид, триэтаноламин, трометамин и цинка гидроксид.
Варианты осуществления настоящего изобретения включают пролекарства соединений формулы (I). В целом подобные пролекарства представляют собой функциональные производные соединений, которые in vivo легко превращаются в требуемое соединение. Таким образом, в вариантах осуществления настоящего изобретения, относящихся к способам лечения, термин «введение» охватывает лечение различных заболеваний, упоминаемых в описании соединения, являющегося предметом настоящего изобретения, или соединения, не упоминаемого в настоящем описании, но преобразующегося в указанное соединение in vivo после его введения пациенту. Общепринятые процедуры отбора и получения соответствующих производных пролекарственных форм описаны, например, в работе «Design of Prodrugs», Ed. H. Bundgaard, Elsevier, 1985.
Если соединения в соответствии с вариантами осуществления настоящего изобретения имеют по меньшей мере один хиральный центр, они могут соответственно существовать в форме энантиомеров. В тех случаях, когда соединения обладают двумя или более хиральными центрами, они дополнительно могут существовать в форме диастереомеров. Следует понимать, что все такие изомеры и их смеси попадают в рамки настоящего изобретения. Кроме того, некоторые из кристаллических форм соединений могут существовать в виде полиморфов, и в таком качестве они попадают под действие настоящего изобретения. Кроме того, некоторые из соединений могут образовывать сольваты с водой (то есть гидраты) или широко распространенными органическими растворителями, при этом такие сольваты также попадают в рамки настоящего изобретения. Специалисты в данной области понимают, что используемый в настоящей заявке термин «соединение» считается включающим сольватированные соединения формулы I.
В тех случаях, когда способы получения соединений в соответствии с определенными вариантами осуществления настоящего изобретения приводят к образованию смеси стереоизомеров, при этом эти изомеры могут быть изолированы стандартными способами, такими как препаративная хроматография. Соединения могут быть получены в форме рацематов, либо отдельные энантиомеры могут быть получены в результате энантиоспецифического синтеза или посредством разделения. Соединения могут, например, быть разделены на составляющие энантиомеры стандартными способами, такими как формирование диастереометрических пар путем образования солей с оптически активными кислотами, например, (-)-ди-п-толуоил-D-винная кислота и/или (+)-ди-п-толуоил-L-винная кислота, с последующей фракционной кристаллизацией и восстановлением свободного основания. Соединения могут также быть разделены путем образования диастереомерных эфиров или амидов с последующим хроматографическим разделением и удалением хирального партнера. В альтернативном варианте осуществления соединения могут быть разделены при помощи хиральной колонки для ВЭЖХ.
Один вариант осуществления настоящего изобретения относится к композиции, содержащей (+)-энантиомер соединения формулы (I), при этом указанная композиция по существу не содержит (-)-изомера указанного соединения. В данном контексте фраза «по существу не содержит» обозначает содержание (-)-изомера менее 25%, предпочтительно - менее 10%, более предпочтительно - менее 5%, еще более предпочтительно - менее 2% и еще более предпочтительно - менее 1%, рассчитанное следующим образом:
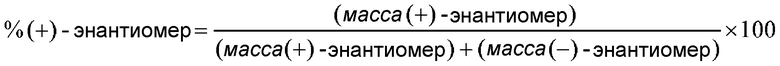
Другой вариант осуществления настоящего изобретения представляет собой композицию, содержащую (-)-энантиомер соединения формулы (I), при этом указанная композиция по существу не содержит (+)-изомера указанного соединения. В данном контексте фраза «по существу не содержит» обозначает содержание (+)-изомера менее 25%, предпочтительно - менее 10%, более предпочтительно - менее 5%, еще более предпочтительно - менее 2% и еще более предпочтительно - менее 1%, рассчитанное следующим образом:
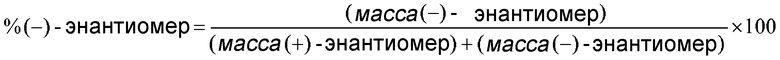 .
.
Во время процессов получения соединений в соответствии с вариантами осуществления настоящего изобретения может возникнуть необходимость в защите чувствительных или реакционных групп на любой из рассматриваемых молекул. Для этих целей могут использоваться соответствующие защитные группы, например, описанные в работах «Protective Groups in Organic Chemistry», ed. J.F.W. McOmie, Plenum Press, 1973; и T.W. Greene & P.G.M. Wuts, «Protective Groups in Organic Synthesis», John Wiley & Sons, 1991. Защитные группы могут быть впоследствии удалены на любой удобной для этого стадии известным специалистам способом.
Хотя соединения в соответствии с вариантами осуществления настоящего изобретения (включая их фармацевтически приемлемые соли и фармацевтически приемлемые сольваты) могут вводиться пациенту отдельно, как правило, они будут вводиться в виде смеси с фармацевтически приемлемым носителем, эксципиентом или разбавителем, выбираемым с учетом предполагаемого способа введения и стандартной фармацевтической практики. Таким образом, конкретные варианты осуществления настоящего изобретения относятся к фармацевтическим композициям, содержащим соединения формулы (I) и один или более фармацевтически приемлемых носителей, эксципиентов или разбавителей.
В качестве примера в фармацевтических и ветеринарных композициях в соответствии с вариантами осуществлениями настоящего изобретения соединения формулы (I) могут присутствовать в виде смеси с любым(-и) соответствующим(-и) связующим(-и) веществом(-ами), смазывающим(-и) веществом(-ами), суспендирующим(-и) веществом(-ами), покрывающим(-и) веществом(-ами) и/или солюбилизирующим(-и) веществом(-ами).
Таблетки или капсулы с соединениями могут вводиться по одной или по две и более за один прием, в зависимости от ситуации. Указанные соединения также можно применять в виде композиций замедленного высвобождения.
В альтернативном варианте осуществления соединения формулы (I) можно вводить путем ингаляций (интратрахеальных или интраназальных) либо в форме суппозиториев или пессариев, или применять местно в форме лосьона, раствора, крема, мази или присыпки. Например, описываемые соединения можно вводить в состав крема, состоящего из водной эмульсии полиэтиленгликолей или жидкого парафина. Их также можно вводить в концентрации от 1 до 10% вес. в состав мази, имеющей в качестве основы белый воск или белый мягкий парафин и содержащей необходимые стабилизаторы и консерванты. Альтернативным способом трансдермального введения является использование пластыря.
Для ряда вариантов применения предпочтительно пероральное введение композиций в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, либо в форме капсул или драже, в чистом виде или в смеси с эксципиентами, либо в форме эликсиров, растворов или суспензий, содержащих ароматизаторы или красители.
Композиции (а также отдельные соединения) также можно вводить парентерально в виде инъекций, например, путем внутрикавернозного, внутривенного, внутримышечного, подкожного, внутрикожного или спинального введения. В этом случае композиции будут содержать соответствующий носитель или разбавитель.
Наилучшей формой композиций для парентерального введения является стерильный водный раствор, в состав которого могут также входить и другие компоненты, например, достаточное количество солей или моносахаридов для получения изотоничного крови раствора.
Для трансбуккального или сублингвального способа введения композицию можно вводить пациенту в виде таблеток или пастилок, изготавливаемых стандартными способами.
В качестве дополнительного примера фармацевтические и ветеринарные композиции, содержащие в качестве активного компонента одно или более соединений формулы (I), могут быть получены путем смешивания соединения или соединений с фармацевтическим носителем в соответствии со стандартными фармацевтическими методиками. Носитель может иметь разные формы, в зависимости от предполагаемого способа введения (например, перорального, парентерального и т.д.). Таким образом, для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы, приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, стабилизаторы, красители и т.п.; для твердых пероральных лекарственных форм, таких как порошки, капсулы и таблетки, приемлемые носители и добавки включают крахмалы, сахара, разбавители, гранулообразующие вещества, смызывающие вещества, связующие вещества, добавки для улучшения распадаемости таблеток и т.п. Твердые пероральные лекарственные формы также могут быть покрыты оболочкой из таких веществ, как сахара, либо могут быть покрыты кишечнорастворимой оболочкой для изменения основного места всасывания и растворения лекарства. Для парентерального введения носитель, как правило, состоит из стерильной воды, при этом для улучшения растворимости или консервации могут быть добавлены другие ингредиенты. Инъекционно вводимые суспензии или растворы также могут быть получены с использованием водных носителей с соответствующими добавками.
Терапевтически эффективное количество соединений формулы (I) или включающей их фармацевтической композиции составляет диапазон дозировок от приблизительно 0,1 мг до приблизительно 3000 мг, более конкретно - от приблизительно 1 мг до приблизительно 1000 мг или более конкретно - от приблизительно 10 мг до приблизительно 500 мг активного компонента при периодичности приема приблизительно от 1 до 4 раз в день для среднего (70 кг) человека. Однако специалисту в данной области будет понятно, что терапевтически эффективное количество для активных соединений, составляющих предмет настоящего изобретения, будет варьироваться в зависимости от соответствующего заболевания.
Для перорального введения фармацевтическая композиция предпочтительно используется в форме таблеток, содержащих 0,01, 10,0, 50,0, 100, 150, 200, 250 и 500 мг активного компонента для симптоматической коррекции дозировки у пациента, получающего лечение.
Соединения формулы (I) преимущественно могут назначаться в виде однократной дневной дозы, или суммарная дневная доза может назначаться многократными дозами дважды, трижды или четыре раза в день. Более того, соединения формулы (I) можно вводить интраназально при помощи местного использования соответствующих интраназальных средств доставки или с помощью трансдермальных кожных пластырей, хорошо известных специалистам в данной области.
Специалисту в данной области также очевидно, что терапевтически эффективная доза активных соединений формулы (I) или содержащей их фармацевтической композиции будет варьироваться в зависимости от желаемого эффекта. Поэтому оптимальные назначаемые дозы могут быть легко определены специалистами и варьироваться в зависимости от конкретно используемого соединения, способа введения, силы препарата и степени выраженности патологического состояния. Кроме того, факторы, связанные с индивидуальным проходящим курс лечения пациентом, такие как возраст, вес, диета, время введения, также должны учитываться при корректировке дозировки для достижения требуемого терапевтического уровня. Поэтому приведенные выше дозировки являются примерными для некоторого среднего случая. Разумеется, в некоторых отдельных случаях требуется использование более высокого или более низкого диапазона доз, и такие случаи входят в сферу действия настоящего изобретения.
Соединения формулы (I) можно вводить пациенту в форме любой из описанных выше композиций и при любом описанном выше режиме приема или с использованием любых общепринятых в данной области композиций и режимов приема в любых случаях, когда нуждающемуся в этом пациенту требуется введение соединений формулы (I).
Примеры болей, входящих в сферу действия настоящего изобретения включают, помимо прочего, воспалительную боль, боль, опосредуемую центральной нервной системой; боль, опосредуемую периферической системой; висцеральную боль; боль, вызванную структурными нарушениями или травмой мягких тканей; боль, связанную с прогрессирующим заболеванием, невропатическую боль и острую боль, такую как боль, связанную с острым поражением, травмой или хирургическим вмешательством, а также хроническую боль, такую как головная боль и боль, вызванная невропатическими состояниями, постинсультными состояниями, раком и мигренью.
Соединения, составляющие предмет настоящего изобретения, также могут применяться в качестве иммунодепрессантов, противовоспалительных средств, средств для лечения и профилактики неврологических и психических расстройств, например, депрессии и болезни Паркинсона; средств для лечения урологических расстройств и расстройств репродуктивной системы, например, недержания мочи и преждевременного семяизвержения; препаратов для лечения алкогольной и наркотической зависимости, средств для лечения гастрита и диареи, средств для лечения сердечно-сосудистой системы, кардиозащитных средств и средств для лечения респираторных заболеваний.
Соединения, составляющие предмет настоящего изобретения, применимы при лечении боли, вызванной следующими причинами: остеоартрит, ревматоидный артрит, фибромиалгия, головная боль, зубная боль, ожог, солнечный ожог, укус змеи (в частности, укус ядовитой змеи), укус паука, укус насекомого, нейрогенный мочевой пузырь, доброкачественная гипертрофия предстательной железы, интерстициальный цистит, ринит, контактный дерматит/гиперчувствительность, зуд, экзема, фарингит, мукозит, энтерит, целлюлит, каузалгия, неврит седалищного нерва, невралгия в височно-нижнечелюстном суставе, периферический неврит, полиневрит, культевая боль, фантомная боль, послеоперационная кишечная непроходимость, холецистит, болевой синдром после мастэктомии, невропатическая боль в ротовой полости, синдром Шарко, рефлекторная симпатическая дистрофия, синдром Гийена-Барре, парестетическая мералгия, синдром жжения в полости рта, постгерпетическая невралгия, тригеминальная невралгия, кластерная головная боль, мигреневая головная боль, периферическая невропатия, двусторонняя периферическая невропатия, диабетическая невропатия, неврит зрительного нерва, постфебрильный неврит, мигрирующий неврит, сегментарный неврит, неврит Гомбо, нейронит, шейно-плечевая невралгия, черепная невралгия, невралгия коленчатого узла, невралгия языкоглоточного нерва, мигренозная невралгия, идиопатическая невралгия, межреберная невралгия, невралгия в области молочных желез, невралгия Мортона, синдром носоресничного нерва, затылочная невралгия, эритромелалгия, невралгия Слудера, невралгия крылонебного узла, невралгия надглазничного нерва, невралгия видиева нерва, воспалительные заболевания кишечника, синдром раздраженного кишечника, синусовая головная боль, тензионная головная боль, схватки, роды, менструальные боли и рак.
В отношении применения настоящих соединений при лечении заболеваний и патологических состояний, подобных указанным выше, терапевтически эффективные дозировки могут быть определены специалистами в данной области путем применения стандартных моделей животных. Такая дозировка наиболее вероятно будет выбрана из диапазона от приблизительно 0,01 мг до приблизительно 15 000 мг активного компонента, вводимого от 1 до 4 раз в день человеку со средним весом (70 кг).
ОБЩИЕ СПОСОБЫ СИНТЕЗА
Типичные примеры соединений, составляющих предмет настоящего изобретения, могут быть синтезированы в соответствии с общими способами синтеза, описанными ниже и показанными на приведенных далее схемах и примерах. Поскольку схемы приведены в качестве иллюстрации, настоящее изобретение не следует интерпретировать как ограниченное химическими реакциями и условиями, описанными на схемах. Различные исходные вещества, указанные на схемах и используемые в примерах, имеются в продаже или могут быть получены способами, хорошо известными специалистам в данной области. Переменные соответствуют описанию, приведенному в настоящем документе.
В настоящем описании, в частности схемах и примерах, используются следующие сокращения:
На схеме A показан путь синтеза соединений формулы (I)-A, где R1 представляет собой необязательно замещенный фенил, Y представляет собой O, S или NH и R3 представляет собой пиперидинил, амино-C3-6циклоалкил или пирролидинил.
Схема A
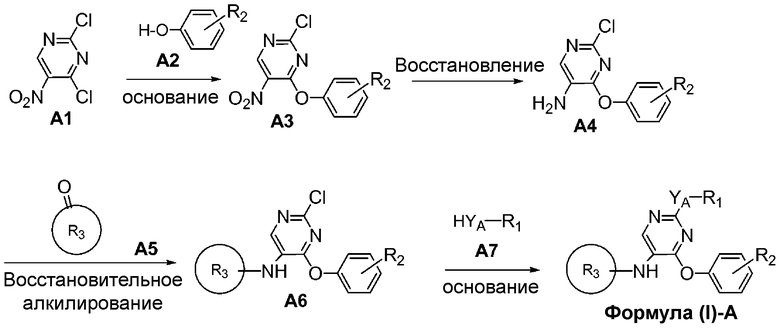
Соединение формулы A1 можно приобрести в готовом виде или получить известными способами, описанными в научной литературе. Соединение формулы A1 можно обработать соединением формулы A2 при основных условиях с образованием соединения формулы A3. Нитрогруппа соединения формулы A3 может быть восстановлена до соответствующей первичной аминогруппы формулы A4 под воздействием восстановителя, такого как цинк, олово или железо, в уксусной кислоте или путем каталитической гидрогенизации. Полученная аминогруппа соединения формулы A4 может быть подвергнута восстановительному алкилированию кетоном формулы A5 (где кольцо R3 представляет собой пиперидинил, аминозамещенный C3-6циклоалкил или пирролидинил) в присутствии источника гидрид-иона, например, триацетоксинатрия боргидрида, с получением соединения формулы A6. В кетонах формулы A5, где кольцо R3 представляет собой гетероцикл, после стадии восстановительного алкилирования может потребоваться обычное удаление защитной аминогруппы. Например, защита с Boc-защищенных аминов может быть снята в кислотных условиях с использованием таких реактивов как HCl, TFA и т.п. Аналогичным образом можно убрать защиту с Cbz-защищенных аминов в кислотных условиях.
Соединение формулы A6 можно обработать R1-замещенным нуклеофильным реагентом формулы A7 (где YA представляет собой O, S или NH) в щелочных условиях с получением соединения формулы (I)-A.
На схеме B представлен путь синтеза соединений формулы (I)-B, где R1 необязательно замещен фенилом, Y представляет собой O, S или NH, а R3 выбран из группы, состоящей из пирролидинилметила, пиперидинилэтила, пиридин-4-ил-C1-2алкила, азетидин-3-илметила, морфолинилметила, имидазолилметила, тиазолилметила, 4-(имидазол-1-ил)фенилметила, 2-(метиламино)этила и 2-диэтиламиноэтила.
Схема B
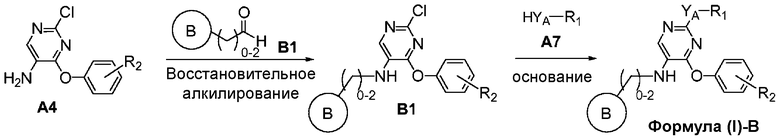
Соединение формулы A4 может быть подвергнуто восстановительному алкилированию с использованием альдегида формулы B1 в присутствии источника гидрид-иона, например, триацетоксинатрия боргидрида, с получением соединений формулы B1, составляющих предмет настоящего изобретения. Кольцо B соединений формулы B1 выбирают из группы, состоящей из пирролидинила, пиперидинила, пиридинила, азетидинила, морфолинила, имидазолила, тиазолила и 4-(имидазол-1-ил)фенила). В альдегидах формулы B1, где кольцо B является азотсодержащим и насыщенным, после стадии восстановительного алкилирования может потребоваться обычное удаление защитной аминогруппы. Соединение формулы B1 может быть обработано R1 -замещенным нуклеофильным реагентом формулы A7 в щелочных условиях с получением соединения формулы (I)-B.
На схеме C представлен путь синтеза соединений формулы (I)-C1, формулы (I)-C2, где Ra представляет собой метил, и формулы (I)-C3; при этом R3 представляет собой пирролидинил- или пиперидинилсодержащий заместитель, причем пирролидинил и пиперидинил необязательно замещены у атома азота метилом, фенилметилом или фенэтилом.
Схема C
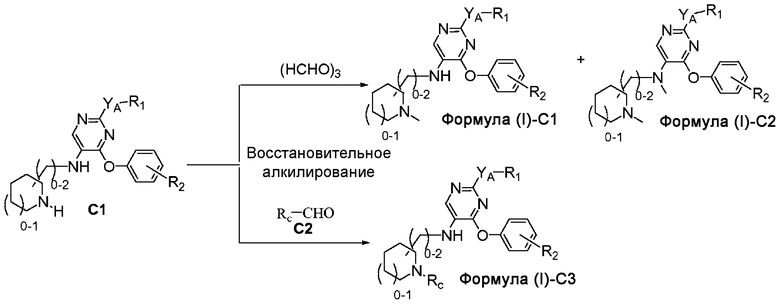
Соединение формулы C1, полученное как описано в общем виде на схеме B, может быть подвергнуто восстановительному алкилированию формалином в кислотных условиях и в присутствии источника гидрид-иона, такого как NaBH3CN, с получением монометилированных соединений формулы (I)-C1 и диметилированных соединений формулы (I)-C2, составляющих предмет настоящего изобретения. Аналогичным образом соединение формулы C1 может быть подвергнуто восстановительному алкилированию с использованием соответствующим образом замещенного альдегида (C2), где Rc представляет собой фенил или бензил, в присутствии источника гидрид-иона, с образованием соединений формулы (I)-C3, где Rc представляет собой фенилметил или фенэтил, соответственно.
На схеме D представлен путь синтеза соединений формулы (I)-D, где Y представляет собой O, S или NH и R3 представляет собой 3-гидрокси-2-аминопропил.
Схема D
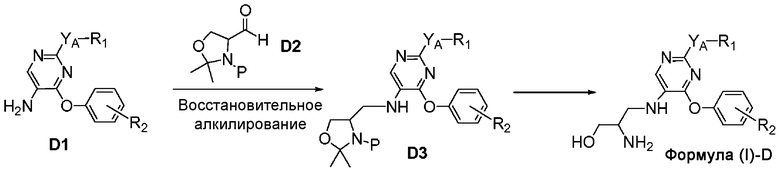
Соединение формулы D1 может быть подвергнуто восстановительному алкилированию альдегидом формулы D2 (где P представляет собой соответствующую защитную аминогруппа) в присутствии источника гидрид-иона, например, триацетоксинатрия боргидрида, с получением соединения формулы D3. С соединения формулы D3 можно снять защиту при помощи сильной кислоты, например, трифторуксусной кислоты, для получения соединения формулы (I)-D.
На схеме E представлен путь синтеза соединений формулы (I)-E, где R3 представляет собой гуанидинилэтил.
Схема E
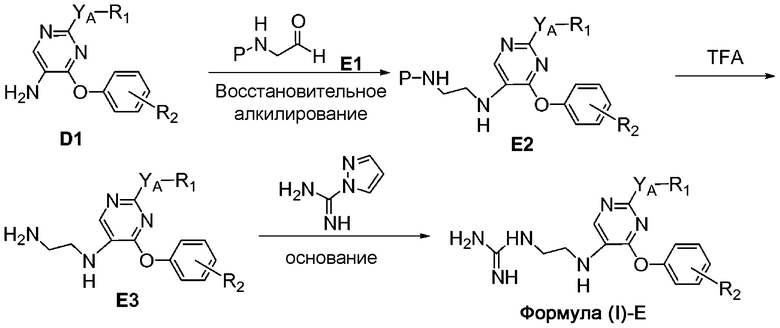
Соединение формулы D1 может быть подвергнуто восстановительному алкилированию альдегидом формулы E1 (где P представляет собой соответствующую защитную аминогруппу) в присутствии источника гидрид-иона, например, триацетоксинатрия боргидрида, с получением соединения формулы E2. С соединения формулы E2 можно снять защиту при помощи сильной кислоты, например, трифторуксусной кислоты, для получения соединения формулы E3, и первичный амин можно обработать гидрохлоридом 1H-пиразол-1-карбоксамидина в присутствии третичного амина для получения гуанидинилзамещенного соединения формулы (I)-E.
На схеме F представлен путь синтеза соединений формулы (I)-F1 и формулы (I)-F2, где Y представляет собой S или S(O), соответственно.
Схема F
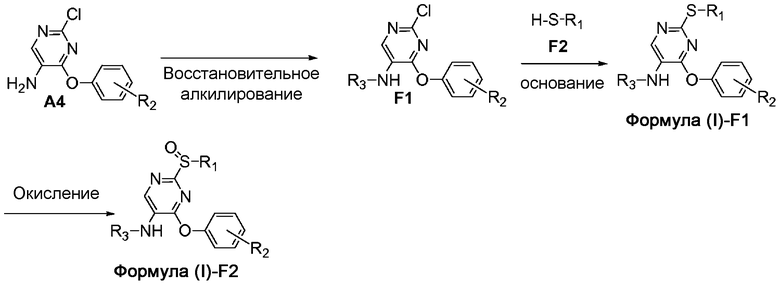
Аминогруппа соединения формулы A4 может быть подвергнута восстановительному алкилированию с использованием соответствующим образом замещенного кетона или альдегида, определенных в настоящем документе, с получением R3-замещенного соединения формулы F1. Соединение формулы F1 может принимать участие в реакции ароматического нуклеофильного замещения соединением формулы F2 для получения соединения формулы (I)-F1, где Y представляет собой S. При последующей обработке воздухом соединение формулы (I)-F1 медленно превращается в соответствующее соединение формулы (I)-F2, где Y представляет собой S(O).
На схеме G представлен путь синтеза соединений формулы (I)-G, где Y представляет собой винил.
Схема G
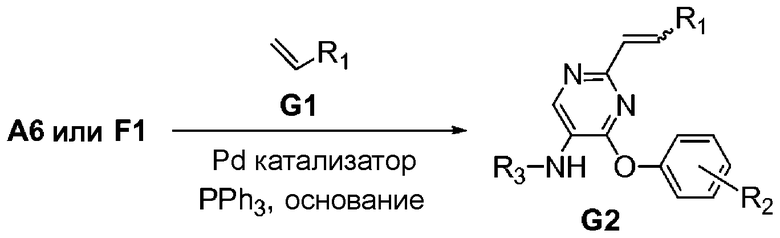
Соединение формулы G1 можно приобрести в готовом виде либо получить известными способами, описанными в литературе. Хлорид формулы A6 или F1 может быть связан перекрестными связями с соединением формулы G1 в присутствии палладиевого катализатора, подходящих лигандов и неорганического основания с получением соединения формулы (I)-G.
На схеме H представлен путь синтеза соединений формулы (I)-H, где Y представляет собой NH.
Схема H
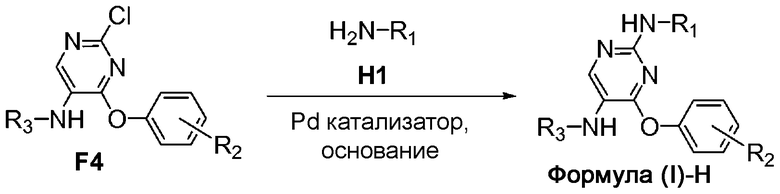
Соединение формулы H1 можно приобрести в готовом виде либо получить известными способами, описанными в литературе. Соединение формулы F4 можно обработать соединением формулы H1 в присутствии палладиевого катализатора, фосфиновых лигандов и неорганического основания с получением соединения формулы (I)-H.
На схеме I представлен путь синтеза соединений формулы (I)-I, где Y представляет собой этинил.
Схема I
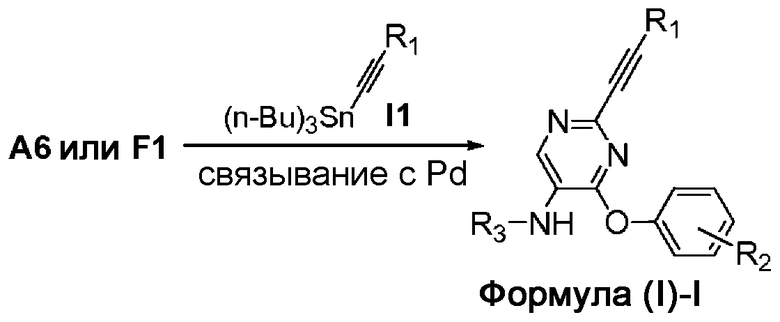
Соединения формулы I1 можно приобрести в готовом виде либо получить путем проведения химических реакций, описанных в литературе. Арилхлорид формулы A6 или F1 может быть связан перекрестными связями с оловосодержащим реагентом формулы I1 в присутствии палладиевого катализатора, например, тетракис(трифенилфосфин)палладия (0), с получением соединения формулы (I)-I.
На схеме J представлен путь синтеза соединений формулы (I)-J, где R3 представляет собой пирролидинил- или пиперидинилсодержащий заместитель, причем пирролидинил и пиперидинил необязательно замещены у атома азота метилкарбонилом.
Схема J
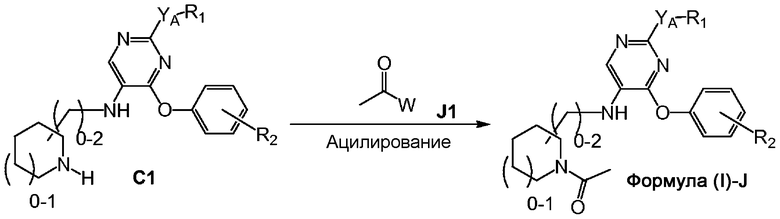
Соединение формулы C1 можно ацилировать при помощи соединения формулы J1, где W представляет собой хлор, ацетокси или активированный алкоксид, с получением соединения формулы (I)-J.
На схеме K представлен путь синтеза соединений формулы (I)-K, где R1 представляет собой необязательно замещенный фенил и имеет заместители, отличные от R2; и YA представляет собой O, S или NH, а R3 представляет собой пиперидинил, амино-C3-6циклоалкил или пирролидинил.
Схема K
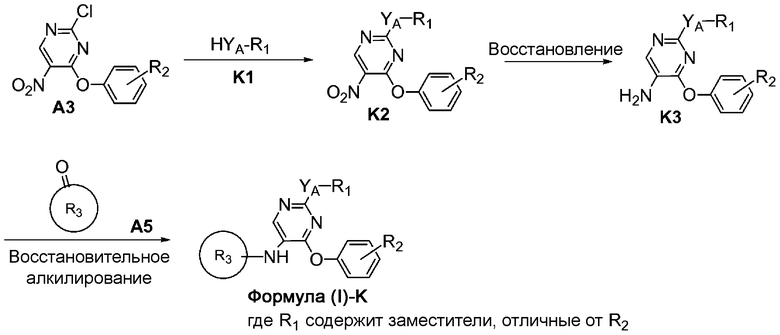
Соединение формулы A3 можно подвергнуть реакции ароматического нуклеофильного замещения с соединением формулы K1, где YA представляет собой O, S или NH, а R1 соответствует определениям настоящего документа. Восстановление нитрогруппы с последующим восстановительным алкилированием при помощи соединения формулы A5 позволяет получить соединение формулы (I)-K.
Конкретные примеры
Все реагенты были приобретены из доступных на рынке источников. Спектры ядерного магнитного резонанса (ЯМР) для атомов водорода были сняты в указанном растворителе с использованием TMS в качестве внутреннего стандарта на спектрометре Bruker Avance или Varian (300 или 400 МГц). Полученные значения приведены в миллионных долях в сторону низкого поля от сигнала TMS. Масс-спектры (МС) были получены на спектрометре Micromass Platform LC или Agilent 1100 LCMS в виде (ЭРИ) m/z (M+H)+ при использовании электрораспылительной ионизации. Ускоряемые СВЧ-нагреванием реакции проводили с использованием микроволновых приборов CEM Discover или Biotage, при этом, если не указано иное, реакционную смесь помещали в герметически закрытый сосуд. Стереоизомерные соединения можно охарактеризовать как рацемические смеси или как их отдельные диастереомеры и энантиомеры с использованием рентгенологической кристаллографии и других известных специалистам способов. Если не указано иное, все использованные в приведенных ниже примерах материалы были получены от стандартных коммерческих поставщиков реагентов или были синтезированы стандартными способами, известными специалистам в области химического синтеза. Если не указано иное, варьируемые в примерах группы заместителей представляют собой водород.
Пример 1
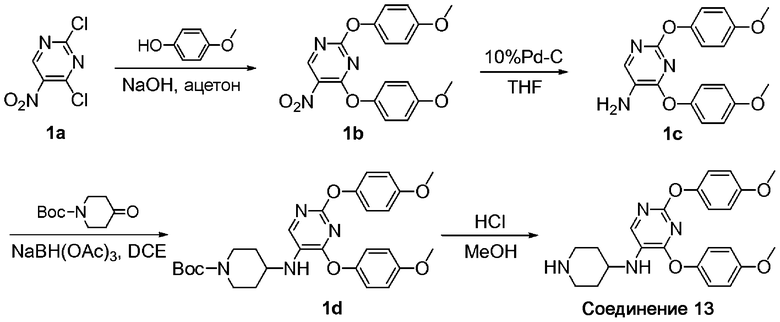
2,4-Бис-(4-метоксифенокси)-5-нитропиримидин (1b). К раствору 2,4-дихлор-5-нитропиримидина (соединение 1a) (0,5 г; 2,6 ммоль) в ацетоне (40 мл) по каплям добавили раствор 4-метоксифенола (0,71 г; 5,7 ммоль) в 1Н водном растворе NaOH (5,7 мл; 5,7 ммоль) и H2O (20 мл). После добавления реакционную смесь медленно нагревали до комнатной температуры, а затем перемешивали при комнатной температуре в течение 20 часов. После удаления растворителей путем выпаривания осадок экстрагировали EtOAc, последовательно промыли 1Н NaOH (водн.) и солевым раствором и высушили над MgSO4. Смесь отфильтровали, сконцентрировали и очистили колоночной хроматографией (элюент, соотношение EtOAc/гексаны: 1/4 к 1/1), получив соединение 1b в виде твердого вещества желтого цвета (1,0; 100%). 1H-ЯМР (300 МГц, CDCl3): δ 9,16 (c, 1H), 7,03-7,07 (д, 2H), 6,95-6,98 (д, 2H), 6,86-6,89 (д, 2H), 6,82-6,85 (д, 2H), 3,82 (c, 1H), 3,80 (c, 1H); МС: m/z 370,2 (M+H)+.
B. 2,4-Бис-(4-метоксифенокси)пиримидин-5-иламин (1c). К раствору соединения 1b (1,25 г; 3,38 ммоль) в тетрагидрофуране (30 мл) добавили 10% Pd-C (0,5 г) и смесь встряхивали в водородной атмосфере 344,7 кПа (50 psi) в гидрогенизаторе Парра в течение 17 ч. После фильтрования и выпаривания до сухого состояния получили соединение 1c в виде твердого вещества коричневого цвета (1,18 г; 100%). 1H-ЯМР (300 МГц, CDCl3): δ 7,82 (c, 1H), 7,09-7,12 (д, 2H), 7,00-7,03 (д, 2H), 6,88-6,91 (д, 2H), 6,82-6,85 (д, 2H), 3,81 (c, 3H), 3,78 (3H, с), 3,63 (c, 2H); МС: m/z 340,2 (M+H)+.
C. трет-Бутиловый эфир 4-[2,4-бис-(4-метоксифенокси)пиримидин-5-иламино]пиперидин-1-карбоновой кислоты (1d). К раствору соединения 1c (1,12 г; 3,3 ммоль) и трет-бутил 4-оксо-1-пиперидинкарбоксилата (0,67 г; 3,3 ммоль) в DCE (17 мл) добавили NaBH(OAc)3 (1,05 г; 4,95 ммоль). Полученную смесь перемешивали в атмосфере азота при комнатной температуре в течение 22 ч. После выделения продукта из воды и очистки колоночной флеш-хроматографией (элюент, соотношение EtOAc/гексаны: 3/7) получили соединение 1d (1,06 г; 61%). 1H-ЯМР (300 МГц, CDCl3): δ 7,66 (c, 1H), 7,08-7,11 (д, 2H), 7,00-7,03 (д, 2H), 6,89-6,92 (д, 2H), 6,83-6,86 (д, 2H), 4,04-4,08 (м, 2H), 3,81 (c, 3H), 3,78 (c, 3H), 3,36-3,38 (м, 1H), 2,90-2,98 (м, 2H), 2,04-2,09 (м, 2H), 1,46 (c, 9H), 1,40-1,47 (м, 2H); МС: m/z 523,3 (M+H)+.
D. 2,4-Бис-(4-метоксифенокси)пиримидин-5-ил]пиперидин-4-иламин (соединение 13). К раствору соединения 1d (0,08 г; 0,15 ммоль) в MeOH (1 мл) добавили 4Н HCl в диоксане (2 мл). Смесь перемешивали при 50°C в течение 1 ч и выпаривали до сухого состояния. Осадок дважды промыли Et2O и высушили, получив соединение 13 в виде соли HCl с количественным выходом. 1H-ЯМР (300 МГц, CD3OD): δ 7,94 (c, 1H), 7,01-7,04 (д, 2H), 6,96-6,99 (д, 2H), 6,83-6,86 (д, 2H), 6,80-6,83 (д, 2H), 3,78 (c, 1H), 3,77 (c, 1H), 3,70-3,73 (м, 1H), 3,48-3,52 (м, 2H), 3,14-3,23 (м, 2H), 2,28-2,32 (м, 2H), 1,81-1,85 (м, 2H); МС: m/z 423,3 (M+H)+.
Следуя процедуре, описанной выше для примера 1, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
Пример 2
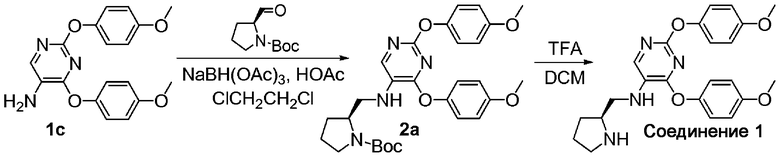
A. трет-Бутиловый эфир 2-(S)-{[2,4-бис-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (2a). К раствору соединения 1c (0,29 г; 0,85 ммоль), N-t-Boc-L-пролиналя (0,17 г; 0,85 ммоль) в DCE (5 мл) добавили уксусную кислоту (0,1 мл) и реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 1 ч. Затем к реакционной смеси добавляли NaBH(OAc)3 (0,27 г; 1,28 ммоль). Смесь непрерывно перемешивали в течение 20 ч. Полученную смесь разделили между дихлорметаном и насыщенным водным раствором NaHCO3. Органический слой промыли солевым раствором, высушили над Na2SO4 и профильтровали. Затем растворитель выпарили in vacuo для получения неочищенного масла. Неочищенное масло очистили колоночной флэш-хроматографией (элюент, градиент EtOAc/гексаны) и получили соединение 2a в виде бесцветного геля (0,5 г; выход 100%). 1H-ЯМР (300 МГц, CDCl3): δ 7,64 (с, 1H), 7,05-7,13 (м, 2H), 6,98-7,03 (м, 2H), 6,82-6,90 (м, 4H), 4,09-4,28 (м, 1H), 3,81 (с, 3H), 3,78 (с, 3H), 3,27-3,68 (м, 4H), 1,74-2,11 (м, 4H), 1,46 (с, 9H); МС: m/z 523,3 (M+H)+.
B. [2,4-Бис-(4-метоксифенокси)пиримидин-5-ил]пирролидин-2-(S)-илметиламин (соединение 1). К раствору соединения 2a (0,16 г; 0,3 ммоль) в DCM (1 мл) добавили TFA (1 мл). Смесь перемешивали в течение 2 часов при комнатной температуре. После концентрирования реакционной смеси и очистки методом ВЭЖХ на обращенной фазе получили соединение 1 в виде трифторуксусной соли. МС: m/z 423,3 (M+H)+.
Следуя процедуре, описанной выше для примера 2, и заменив соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
Соединение 25:
Заявляемое соединение получили с помощью адаптированного варианта процедуры, описанной выше в примере 2, где вместо соединения 1c на стадии A использовали 2,4-бис-(4-фторфенокси)пиримидин-5-иламин (полученный аналогично соединению 1c из примера 1 при использовании 4-фторфенола вместо 4-метоксифенола в стадии A). 1H ЯМР (300 МГц, CDCl3): δ 10,02 (уш. с., 1H), 9,27 (уш. с., 1H), 7,74 (с, 1H), 6,89-7,04 (м, 8H), 3,90 (уш. с., 1H), 3,41-3,60 (м, 2H), 3,12-3,40 (м, 2H), 2,11-2,26 (м, 1H), 1,88-2,11 (м, 2H), 1,68-1,87 (м, 1H).
Соединение 27:
Заявляемое соединение получили с помощью адаптированного варианта процедуры, описанной выше в примере 2, где вместо соединения 1c на стадии A использовали 2,4-бис-(2-бромфенокси)пиримидин-5-иламин (полученный аналогично соединению 1c из примера 1 при использовании 2-бромфенола вместо 4-метоксифенола в процедуре A). 1H ЯМР (300 МГц, MeOH-d4): δ 7,95 (с, 1H), 7,45-7,6 (м, 2H), 6,95-7,35 (м, 6H), 3,95 (м, 1H), 3,5 (м, 2H), 3,3 (м, 2H), 2,3 (м, 1H), 2,1 (м, 2H), 1,85 (м, 1H); МС: m/z 521,1 (M+H)+.
Пример 3
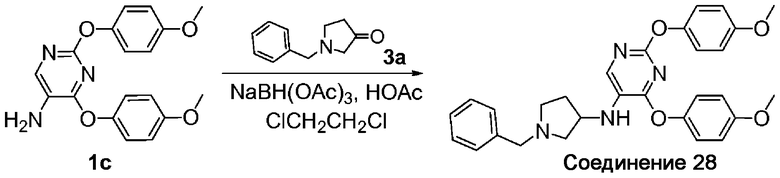
A. (1-Бензилпирролидин-3-ил)-[2,4-бис-(4-метоксифенокси)пиримидин-5-ил]амин (соединение 28). Заявляемое соединение 28 получили с использованием адаптированного варианта процедуры, описанной для стадии А примера 2, с заменой N-t-Boc-L-пролиналя на 1-бензилпирролидин-3-он (соединение 3a). 1H-ЯМР (300 МГц, CDCl3): δ 10,05 (уш. с., 2H), 7,76 (с, 1H), 7,41 (с, 5H), 6,98 (д, 2H), 6,91 (д, 2H), 6,76 (д, 4H), 4,00-4,37 (м, 4H), 3,76 (с, 6H), 3,64-3,68 (м, 1H), 3,29-3,35 (м, 1H), 2,99-3,09 (м, 1H), 2,61-2,69 (м, 1H), 2,15-2,25 (м, 1H); МС: m/z 499,2 (M+H)+.
Следуя процедуре, описанной выше для примера 3, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 4
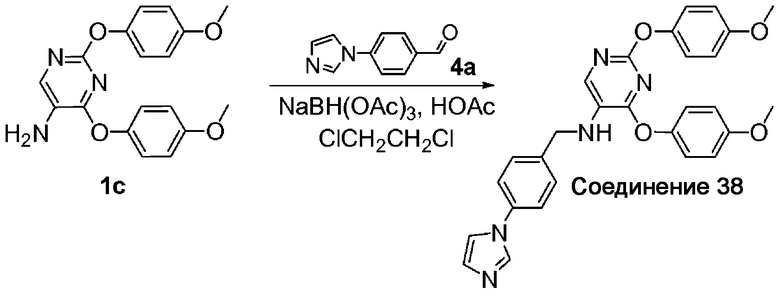
A. [2,4-Бис-(4-метоксифенокси)пиримидин-5-ил]-(4-имидазол-1-ил-бензил)амин (соединение 38). Заявляемое соединение 38 получили с использованием адаптированного варианта процедуры, описанной для стадии А примера 2, с заменой N-t-Boc-L-пролиналя на 4-имидазол-1-ил-бензальдегид (соединение 4a). 1H-ЯМР (300 МГц, CDCl3): δ 12,45 (уш. с., 2H), 9,01 (с, 1H), 7,58-7,68 (м, 2H), 7,44-7,57 (м, 5H), 6,96-7,09 (м, 2H), 6,85-6,96 (м, 2H), 6,78-6,85 (м, 2H), 6,70-6,78 (м, 2H), 4,51 (с, 2H), 3,78 (с, 3H), 3,75 (с, 3H); МС: m/z 496,2 (M+H)+.
Следуя процедуре, описанной выше для примера 4, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 5
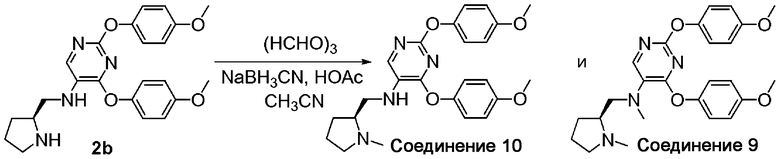
A. [2,4-Бис-(4-метоксифенокси)-пиримидин-5-ил]-(1-метилпирролидин-2-(S)-илметил)амин (соединение 10). К раствору соединения 2b (0,13 г; 0,3 ммоль) в CH3CN (5 мл) и HOAc (0,08 мл) добавили формалин (37%, 0,03 мл) и NaBH3CN (0,08 г; 1,14 ммоль). После перемешивания при комнатной температуре в течение 30 минут смесь концентрировали и осадок разделяли между 1Н водным раствором NaOH и EtOAc. Выделенную органическую фазу концентрировали и очищали методом ВЭЖХ с получением соединения 10. 1H-ЯМР (300 МГц, CDCl3): δ 7,85 (с, 1H), 7,00-7,03 (д, 2H), 6,93-6,96 (д, 2H), 6,78-6,80 (д, 4H), 3,80-3,96 (м, 2H), 3,79 (с, 3H), 3,78 (с, 3H), 3,56-3,68 (м, 2H), 2,96 (с, 3H), 2,91-3,05 (м, 1H), 2,29-2,42 (м, 1H), 2,09-2,23 (м, 2H), 1,93-2,04 (м, 1H); МС: m/z 437,2 (M+H)+.
B. 2,4-Бис-(4-метоксифенокси)пиримидин-5-ил]метил-(1-метилпирролидин-2-(S)-илметил)амин (соединение 9). К раствору соединения 2b (0,16 г; 0,38 ммоль) в CH3CN (5 мл) и HOAc (0,08 мл) добавили формалин (37%, 0,15 мл) и NaBH3CN (0,08 г; 1,14 ммоль). После перемешивания при комнатной температуре в течение 30 минут смесь концентрировали и осадок разделяли между 1Н водным раствором NaOH и EtOAc. Выделенную органическую фазу выпаривали и очищали методом ВЭЖХ с получением соединения 9. 1H-ЯМР (300 МГц, CDCl3): δ 7,93 (с, 1H), 7,02-7,05 (д, 2H), 6,92-6,97 (д, 2H), 6,86-6,89 (д, 2H), 6,80-6,83 (д, 2H), 4,34-4,44 (м, 1H), 3,81 (с, 3H), 3,78 (с, 3H), 3,51-3,93 (м, 4H), 3,41 (с, 3H), 2,95 (с, 3H), 2,56-2,65 (м, 1H), 2,36-2,19 (м, 2H), 1,96-2,09 (м, 1H); МС: m/z 450,2 (M)+.
Пример 6
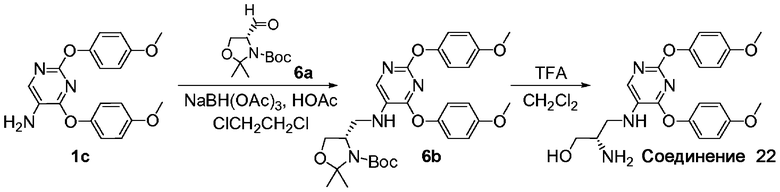
A. трет-Бутиловый эфир 2-(S)-{[4-(4-метоксифенокси)-[2,5']бипиримидинил-5-иламино]метил}пирролидин-1-карбоновой кислоты (6b). Заявляемое соединение 6b получили с использованием адаптированного варианта процедуры, описанной для стадии A примера 2, с заменой N-t-Boc-L-пролиналя на трет-бутиловый эфир 4-формил-2,2-диметилоксазолидин-3-карбоновой кислоты (соединение 6a). МС: m/z 553,3 (M+Н)+.
B. 2-(S)-Амино-3-[2,4-бис-(4-метоксифенокси)пиримидин-5-иламино]пропан-1-ол (соединение 22). Используя адаптированный вариант процедуры, описанной для стадии B примера 2, и заменив соединение 2a на соединение 6b, получили заявляемое соединение 22 в виде трифторуксусной соли. МС: m/z 413,2 (M+Н)+.
Следуя процедуре, описанной выше для примера 6, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 7
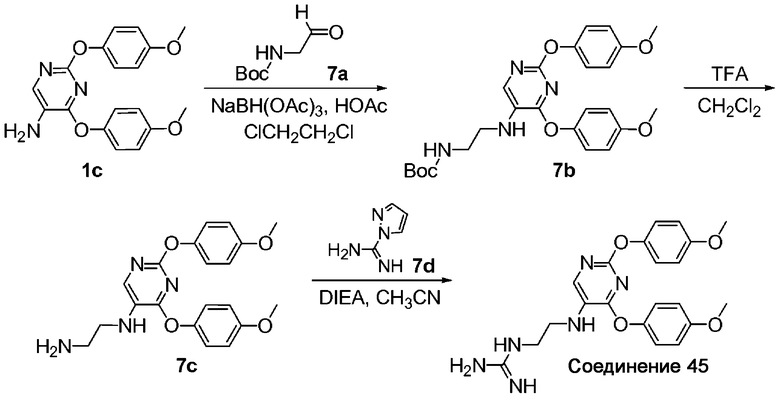
A. трет-Бутиловый эфир {2-[2,4-бис-(4-метоксифенокси)пиримидин-5-иламино]этил}-карбаминовой кислоты (7b). Заявляемое соединение 7b получили с использованием адаптированного варианта процедуры, описанной для стадии A примера 2, с заменой N-t-Boc-L-пролиналя на трет-бутиловый эфир (2-оксоэтил)-карбаминовой кислоты (соединение 7a). МС: m/z 483,2 (M+Н)+.
B. N 1 -[2,4-Бис-(4-метоксифенокси)пиримидин-5-ил]этан-1,2-диамин (7c). К раствору соединения 7b (74 мг; 0,15 ммоль) в CH2Cl2 (3 мл) добавили TFA (0,4 мл) при температуре окружающей среды. Смесь перемешивали при комнатной температуре в течение 20 часов. Полученную смесь сконцентрировали in vacuo. Остаток разделили между CH2Cl2 и насыщенным водным раствором NaHCO3. Водную фазу подвергли экстракции с помощью CH2Cl2. Объединенные органические экстракты высушивали над Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении с получением соединения 7c (42 мг; выход 73%). Неочищенный продукт использовали напрямую на следующей стадии реакции без дополнительной очистки. МС: m/z 383,2 (M+Н)+.
C. N-{2-[2,4-Бис-(4-метоксифенокси)пиримидин-5-иламино]этил}гуанидин (соединение 45). К раствору соединения 7c (42 мг; 0,11 ммоль) в ацетонитриле (10 мл) добавили гидрохлорид 1H-пиразол-1-карбоксамидина (соединение 7d) (16 мг; 0,11 ммоль) и N,N-диизопропилэтиламин (0,22 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Полученную смесь разделили между EtOAc и H2O. Органическую фазу промыли H2O и высушили над Na2SO4. Смесь фильтровали и растворитель выпаривали при пониженном давлении с получением осадка, который очищали методом ВЭЖХ на обращенной фазе (с использованием в качестве элюента градиент CH3CN-H2O, содержание TFA 0,5%), получив соединение 45 (11 мг; выход 15%) в виде трифторуксусной соли. МС: m/z 425,2 (M+Н)+.
Пример 8
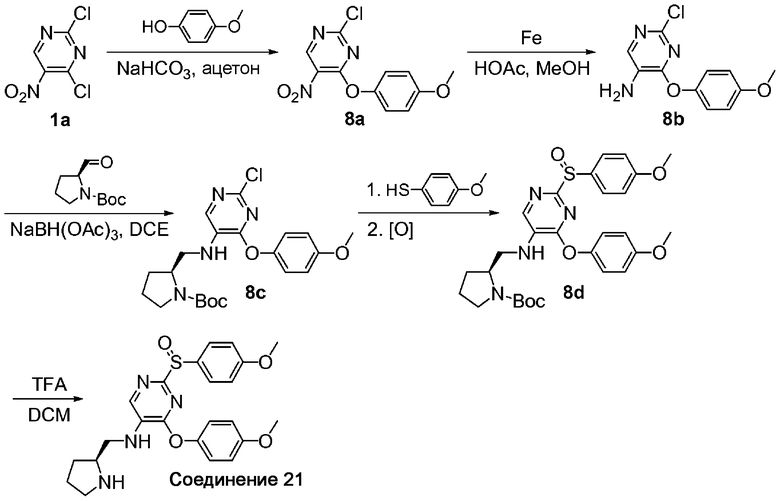
A. 2-Хлор-4-(4-метоксифенокси)-5-нитропиримидин (8a). К раствору соединения 1a (3 г; 15,5 ммоль) в ацетоне (240 мл) при температуре 0°C по каплям добавили раствор 4-метоксифенола (1,94 г; 15,5 ммоль) и 1 Н водного раствора NaHCO3 (15,5 мл; 15,5 ммоль) и H2O (60 мл). После добавления реакционную смесь медленно нагревали до комнатной температуры, а затем перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь концентрировали, осадок извлекали в EtOAc, промывали последовательно 1Н водным раствором NaOH и солевым раствором и высушивали над MgSO4. Смесь фильтровали и концентрировали, получив соединение 8a в виде твердого вещества коричневого цвета. 1H-ЯМР (300 МГц, CDCl3): δ 9,15 (с, 1H), 7,10-7,13 (д, 2H), 6,95-6,99 (д, 2H), 3,85 (с, 3H); МС: m/z 282,0 (M+Н)+.
B. 2-Хлор-4-(4-метоксифенокси)пиримидин-5-иламин (8b). К раствору соединения 8a (0,42 г; 1,5 ммоль) в HOAc (5,5 мл) и MeOH (6 мл) добавляли порциями порошок железа (0,25 г; 4,5 ммоль). Смесь выдерживали при температуре 65°C в течение 2,5 часов. После удаления растворителя методом выпаривания осадок разделяли между 1Н водным раствором NaOH и DCM, фильтровали через подушку с диатомитовой землей, после чего разделяли фазы. Органическую фазу последовательно промыли водой и соляным раствором, а затем высушили над Na2SO4. После концентрирования смеси получили соединение 8b (0,49 г; 100%). 1H-ЯМР (300 МГц, CDCl3): δ 7,92 (с, 1H), 7,09-7,12 (д, 2H), 6,92-6,95 (д, 2H), 3,92 (с, 2H), 3,83 (с, 3H); МС: m/z 252,1 (M+Н)+.
C трет-Бутиловый эфир 2-(S)-{[2-хлор-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (8c). К раствору соединения 8b (1,65 г; 6,6 ммоль) и N-трет-Boc-L-пролиналя (1,6 г; 7,8 ммоль) в DCE (40 мл) добавили NaBH(OAc)3 (1,12 г; 10 ммоль). Полученную смесь перемешивали в атмосфере азота при комнатной температуре в течение 16 ч. После удаления растворителей осадок разделяли между насыщенным водным раствором NaHCO3 и EtOAc, экстракт в EtOAc промывали солевым раствором и высушивали над MgSO4. После выпаривания растворителя и очистки методом препаративной ТСХ (элюент, EtOAc/гексаны: 3/7) получили соединение 8c в виде желтого масла (2,51 г; 87%). 1H-ЯМР (300 МГц, CDCl3): δ 7,64 (с, 1H), 6,99-7,02 (д, 2H), 6,82-6,85 (д, 2H), 4,09-4,22 (м, 1H), 3,78 (с, 3H), 3,27-3,66 (м, 4H), 1,73-2,09 (м, 3H), 1,44-1,55 (м, 1H); МС: m/z 523,3 (M+Н)+.
D. трет-Бутиловый эфир 2-(S)-{[2-(4-метоксибензолсульфонил)-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (8d). Смесь соединения 8c (0,05 г; 0,11 ммоль) и 4-метоксибензолтиола (0,073 мл; 0,57 ммоль) в 2-пропаноле (3,5 мл) нагревали с обратным холодильником в течение 20 ч. После охлаждения до комнатной температуры через смесь пропускали пузырьки воздуха в течение 20 ч. После концентрирования реакционной смеси при пониженном давлении получили соединение 8d, которое использовали на дальнейшем этапе без дополнительной очистки. МС: m/z 555,2 (M+Н)+.
E. 2-(4-Метоксибензолсульфонил)-4-(4-метоксифенокси)пиримидин-5-ил]пирролидин-2-(S)-илметиламин (соединение 21). К раствору соединения 8d (0,13 г; 0,24 ммоль) в DCM (1 мл) добавили TFA (1 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. Смесь сконцентрировали и очистили ВЭЖХ на обращенной фазе для получения соединения 21 в виде трифторацетата. 1H-ЯМР (300 МГц, CDCl3): δ 7,73 (с, 1H), 7,13-7,16 (д, 2H), 7,06-7,10 (д, 2H), 6,67-6,73 (м, 4H), 4,04-4,18 (м, 1H), 3,84 (с, 3H), 3,82 (с, 3H), 3,53-3,75 (м, 2H), 3,27-3,47 (м, 2H), 1,99-2,30 (м, 3H), 1,70-1,86 (м, 1H); МС: m/z 454,9 (M+Н)+.
Пример 9
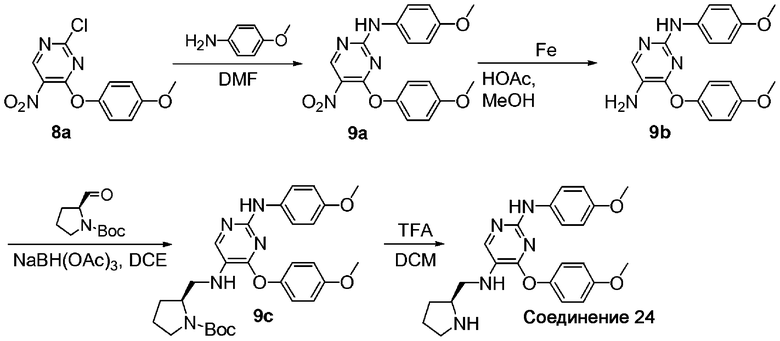
A. 4-(4-Метоксифенокси)-5-нитропиримидин-2-ил]-(4-метоксифенил)амин (9a). Раствор соединения 8a (0,14 г; 0,5 ммоль) и 4-метоксифениламина (0,31 г; 2,5 ммоль) в DMF (1 мл) нагревали при 60°C в течение 25 ч. Реакцию гасили путем добавления насыщенного водного раствора NH4Cl, извлекали в EtOAc и объединенные экстракты высушивали над Na2SO4. Смесь фильтровали, концентрировали и очищали колоночной флеш-хроматографией (элюент, EtOAc/гексаны: 1/1) с получением соединения 9a. 1H-ЯМР (300 МГц, CDCl3): δ 9,12 (с, 1H), 7,34-7,52 (м, 2H), 6,86-6,96 (м, 2H), 6,74-6,83 (м, 4H), 4,54 (с, 1H), 3,85 (с, 3H), 3,81 (с, 3H); МС: m/z 368,1 ((M)+.
B. 4-(4-Метоксифенокси)-N 2 -(4-метоксифенил)пиримидин-2,5-диамин (9b). Заявляемое соединение 9b получили с использованием адаптированного варианта процедуры, описанной для стадии B примера 8, с заменой соединения 8a на соединение 9a. МС: m/z 338,1 (M)+.
C. трет-Бутиловый эфир 2-(S)-{[4-(4-метоксифенокси)-2-(4-метоксифениламино)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (9c). Заявляемое соединение 9c получили с использованием адаптированного варианта процедуры, описанной для стадии C примера 8, с заменой соединения 8b на соединение 9b. МС: m/z 522,0 (M+H)+.
D. 4-(4-Метоксифенокси)-N 2 -(4-метоксифенил)-N 6 -пирролидин-2-(S)-илметилпиримидин-2,5-диамин (соединение 24). К раствору соединения 9c (0,1 г; 0,18 ммоль) в DCM (1 мл) добавили TFA (1 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь сконцентрировали, остаток очистили ВЭЖХ на обращенной фазе для получения соединения 24 в виде соли TFA. 1H-ЯМР (300 МГц, CDCl3): δ 7,40 (с, 1H), 6,97-7,00 (д, 2H), 6,76-6,85 (м, 4H), 6,49-6,52 (д, 2H), 3,86-4,00 (м, 1H), 3,78 (с, 3H), 3,67 (с, 3H), 3,25-3,56 (м, 4H), 2,03-2,36 (м, 3H), 1,72-1,87 (м, 1H); МС: m/z 422,0 (M+H)+.
Пример 10
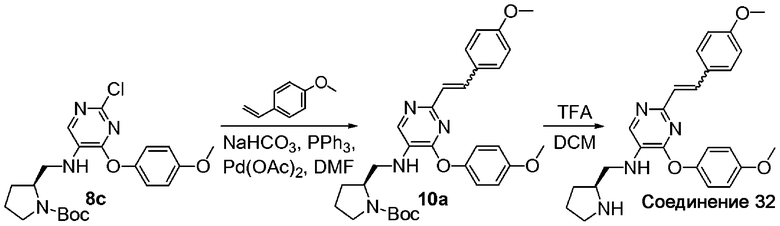
A. трет-Бутиловый эфир 2-(S)-({4-(4-Метоксифенокси)-2-[2-(4-метоксифенил)винил]пиримидин-5-иламино}метил)пирролидин-1-карбоновой кислоты (10a). Смесь 1-метокси-4-винилбензола (0,16 мл; 1,17 ммоль), соединения 8c (0,11 г; 0,25 ммоль), NaHCO3 (0,15 г; 1,84 ммоль), PPh3 (0,12 г; 0,46 ммоль) и Pd(OAc)2 (0,01 г; 0,046 ммоль) в DMF (1 мл) нагревали в герметично закрытой пробирке до 130°C в течение 16 ч. Реакционную смесь разбавляли водой, экстрагировали и очищали колоночной флеш-хроматографией (элюент, EtOAc/гексаны: 1/1) с получением соединения 10a в виде смеси его транс- и цис-стереоизомеров (0,03 г; 23%). МС: m/z 533,5 (M+H)+.
B. {4-(4-Метоксифенокси)-2-[2-(4-метоксифенил)винил]пиримидин-5-ил}пирролидин-2-(S)-илметиламин (10b). К раствору соединения 10a (0,048 г; 0,09 ммоль) в DCM (1 мл) добавили TFA (1 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. Смесь концентрировали и очищали методом ВЭЖХ на обращенной фазе с получением соединения 10b в виде смеси его транс- и цис-стереоизомеров. МС: m/z 432,9 (M+H)+.
Пример 11
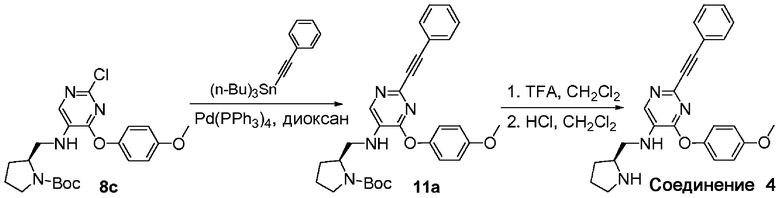
A. трет-Бутиловый эфир 2-(S)-{[4-(4-метоксифенокси)-2-фенилэтинилпиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (11a). В пробирку Шленка, закрытую септой с тефлоновым покрытием, добавили смесь соединения 8c (214 мг, 0,49 ммоль), трибутилфенилэтинилстаннана (289 мг, 0,739 ммоль) и тетракис-(трифенилфосфин)палладия(0) (57 мг, 0,049 ммоль) в диоксане (1,0 мл), затем смесь облучали в микроволновом реакторе при 150°C в течение 30 минут. Полученную смесь разбавили EtOAc, а затем промыли насыщенным водным раствором NH4Cl и водой. Органическую фазу промыли H2O, а затем высушили над Na2SO4.
Смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили неочищенный материал. Неочищенный материал очистили колоночной флеш-хроматографией (SiO2, используя в качестве элюента градиент гептан-EtOAc) и получили соединение 11a (120 мг, выход 49%). 1H-ЯМР (400 МГц, CDCl3): δ 7,84-7,98 (м, 1H), 7,52-7,60 (м, 2H), 7,29-7,34 (м, 3H), 7,08-7,19 (м, 2H), 6,89-6,99 (м, 2H), 5,98 (уш. с., 0,6 H), 4,97 (уш. с., 0,4 H), 4,18-4,38 (м, 1H), 3,85 (с, 3H), 3,13-3,46 (м, 4H), 2,07-2,17 (м, 1H), 1,90-2,03 (м, 2H), 1,76-1,88 (м, 1H), 1,44-1,52 (м, 9H); МС: m/z 501,1 (M+H)+.
B. [4-(4-Метоксифенокси)-2-фенилэтинилпиримидин-5-ил]пирролидин-2-(S)-илметиламин (11b).
К раствору соединения 11a (118 мг; 0,236 ммоль) в CH2Cl2 (3 мл) при температуре окружающей среды добавили трифторуксусную кислоту (0,3 мл). Реакционную смесь перемешивали 20 часов при комнатной температуре. Затем pH среды довели до pH 12, используя 1Н водного раствора NaOH. Смесь разделили между CH2Cl2 и H2O, органическую фазу промыли H2O и высушили над Na2SO4.
После этого смесь отфильтровали, а фильтрат сконцентрировали при пониженном давлении. Остаток растворили в CH2Cl2 (3 мл) и обработали 1,0 М раствор HCl в Et2O (0,24 мл, 0,24 ммоль) при температуре окружающей среды. Реакционную смесь перемешивали 20 часов при комнатной температуре. Полученную смесь концентрировали под вакуумом с получением осадка, который растирали в порошок с Et2O. Твердое вещество отбирали методом фильтрования и высушивали с получением соединения 11b в виде гидрохлорида (97 мг; выход 94 %). Соль HCl 1H-ЯМР (400 МГц, DMSO-d6): δ 8,94 (уш. с., 1H), 8,54 (уш. с., 1H), 8,13 (с, 1H), 7,48-7,55 (м, 2H), 7,37-7,46 (м, 2H), 7,14-7,21 (м, 2H), 6,99-7,06 (м, 2H), 6,45 (т, 1H), 3,80-3,88 (м, 1H), 3,79 (с, 3H), 3,49-3,57 (м, 2H), 3,16-3,28 (м, 2H), 2,07-2,21 (м, 1H), 1,84-2,05 (м, 2H), 1,63-1,78 (м, 1H); МС: m/z 401,1 (M+H)+.
Пример 12
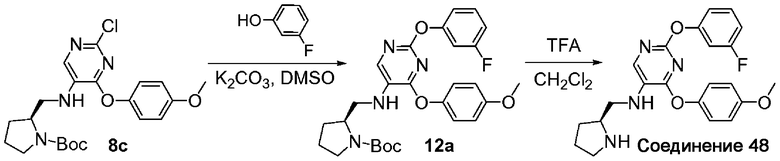
A. трет-Бутиловый эфир 2-(S)-{[2-(3-фторфенокси)-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (12a). В колбу Шленка, закрытую септой с тефлоновым покрытием, поместили раствор соединения 8c (150 мг; 0,345 ммоль), 3-фторфенола (100 мг; 0,89 ммоль) и K2CO3 (95 мг; 0,69 ммоль) в DMSO (1 мл) и облучили ее в микроволновом реакторе при температуре 180°C в течение 10 минут. Полученную разбавленную смесь разбавили Et2O и промыли насыщенным водным раствором NH4Cl и H2O. Органическую фазу отделили и последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4. Смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили неочищенный материал. Неочищенный материал очистили колоночной флеш-хроматографией (SiO2, используя в качестве элюента градиент гептан-EtOAc) и получили соединение 12a (35 мг, выход 20%). 1H-ЯМР (400 МГц, CDCl3): δ 7,67-7,72 (м, 1H), 7,21-7,25 (м, 2H), 7,04-7,11 (м, 2H), 6,80-6,93 (м, 4H), 5,71 (уш. с., 0,2H), 5,21 (уш. с., 0,5H), 4,45 (уш. с., 0,3H), 4,16-4,29 (м, 1H), 3,81 (с, 3H), 3,09-3,55 (м, 4H), 1,77-2,11 (м, 4H), 1,45-1,48 (м, 9H); МС: m/z 511,2 (M+H)+.
B. [2-(3-Фторфенокси)-4-(4-метоксифенокси)пиримидин-5-ил]пирролидин-2-(S)-илметиламин (соединение 48). К раствору соединения 12a (35 мг, 0,069 ммоль) в CH2Cl2 (2 мл) добавили трифторуксусную кислоту (0,25 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, растворитель выпарили in vacuo для получения неочищенного материала. Неочищенный материал очистили ВЭЖХ на обращенной фазе (элюент, градиент CH3CN-H2O) и получили соединение 48 (23 мг, выход 53%) в виде соли TFA. 1H-ЯМР (400 МГц, CDCl3): δ 9,56 (уш. с., 1H), 7,66 (с, 1H), 7,20-7,24 (м, 2H), 7,00-7,03 (м, 2H), 6,79-6,86 (м, 4H), 4,87 (уш. с., 1H), 3,80-3,84 (м, 1H), 3,79 (с, 3H), 3,46 (уш. с., 2H), 3,17-3,26 (м, 2H), 2,10-2,19 (м, 1H), 1,92-2,08 (м, 2H), 1,72-1,82 (м, 1H); МС: m/z 411,2 (M+H)+.
Следуя процедуре, описанной выше для примера 12, и заменив соответствующие реагенты, исходные соединения и способы очистки, известные специалистам в данной области, были получены следующие соединения, составляющие предмет настоящего изобретения:
Пример 13
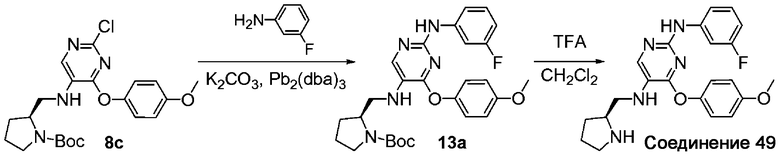
A. трет-Бутиловый эфир 2-(S)-{[2-(3-фторфениламино)-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (13a). В колбу Шленка добавляли смесь соединения 8c (100 мг; 0,23 ммоль), 3-фторфениламина (31 мг; 0,28 ммоль), K2CO3 (44,5 мг; 0,32 ммоль), 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (8 мг; 0,014 ммоль) и трис(дибензилиденацетон)палладий(0) (4,2 мг; 0,0046 ммоль). Колбу закрыли септой с тефлоновым покрытием, откачали и заполнили аргоном. Через шприц добавляли толуол (0,8 мл) и несколько капель воды. Смесь облучали в микроволновом реакторе при температуре 180°C в течение 30 минут. Полученную смесь разбавили EtOAc и последовательно промыли насыщенным водным раствором NH4Cl и H2O. Органическую фазу промыли H2O, а затем высушили над Na2SO4.
Смесь отфильтровали, фильтрат выпарили при пониженном давлении и получили неочищенный материал. Неочищенный материал очистили колоночной флеш-хроматографией (SiO2, элюент, градиент гептан-EtOAc) и получили соединение 13a (30 мг, выход 26%). 1H-ЯМР (400 МГц, CDCl3): δ 7,77 (с, 1H), 7,34 (дт, 1H), 7,10 (д, 2H), 7,02-7,08 (м, 1H), 6,98 (д, 2H), 6,79 (д, 1H), 6,74 (уш. с., 1H), 6,52 (тд, 1H), 4,76-4,80 (м, 0,5H), 4,16-4,26 (м, 1,5H), 3,86 (с, 3H), 3,11-3,52 (м, 4H), 1,87-2,10 (м, 4H), 1,23-1,30 (м, 9H); МС: m/z 510,3 (M+H)+.
B. N 2 -(3-Фторфенил)-4-(4-метоксифенокси)-N 5 -пирролидин-2-(S)-илметилпиримидин-2,5-диамин (соединение 49). К раствору соединения 13a (30 мг, 0,059 ммоль) в CH2Cl2 (2 мл) добавили трифторуксусную кислоту (0,3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, растворитель выпарили in vacuo для получения неочищенного материала. Неочищенный материал очистили ВЭЖХ на обращенной фазе (элюент, градиент CH3CN-H2O) и получили соединение 49 (25 мг, выход 67%) в виде соли TFA. 1H-ЯМР (400 МГц, DMSO-d6): δ 9,25 (с, 1H), 8,91 (уш. с., 1H), 8,41 (уш., 1H), 7,95 (с, 1H), 7,40 (дт, 1H), 7,15-7,19 (м, 2H), 7,02-7,13 (м, 4H), 6,53 (тд, 1H), 5,34 (уш. с., 1H), 3,81-3,86 (м, 1H), 3,79 (с, 3H), 3,20-3,39 (м, 4H), 2,10-2,17 (м, 1H), 1,87-1,99 (м, 2H), 1,66-1,73 (м, 1H); МС: m/z 410,3 (M+H)+.
Пример 14
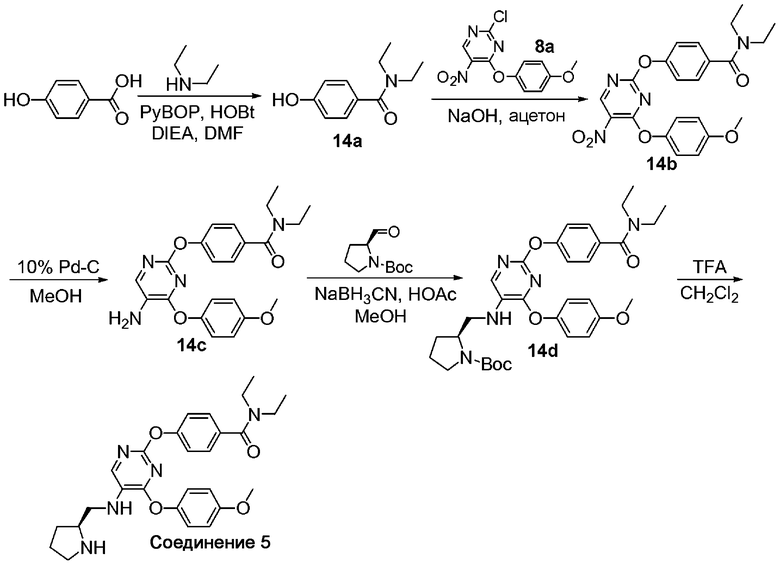
А. N,N-Диэтил-4-гидроксибензамид (14a). Смесь 4-гидроксибензойной кислоты (0,70 г; 5,0 ммоль), Et2NH (1 мл; 10,0 ммоль), гексафторфосфата (бензотриазол-1-ил-окси)трипирролидинофосфония (5,2 г; 10,0 ммоль), N-гидроксибензотриазола (1,0 г; 7,5 ммоль) и N,N-диизопропилэтиламина (1,74 мл; 10,0 ммоль) в DMF (8 мл) перемешивали в азотной атмосфере при комнатной температуре в течение 20 ч. Реакцию погасили водой и затем экстрагировали EtOAc. Органическую фазу последовательно промыли 1Н водным раствором HCl, насыщенным водным раствором NaHCO3 и солевым раствором, после чего высушили над Na2SO4. Смесь фильтровали, фильтрат концентрировали и полученный осадок очищали колоночной флеш-хроматографией (элюент, EtOAc/гексаны: 1/1) с получением соединения 14a в виде твердого вещества белого цвета (0,45 г; выход 47%). 1H-ЯМР (300 МГц, CDCl3): δ 9,22 (с, 1H), 7,17 (д, 2H), 6,72 (д, 2H), 3,33-3,51 (м, 4H), 1,10-1,26 (м, 6H); МС: m/z 194,1 (M+H)+.
B. N,N-Диэтил-4-[4-(4-метоксифенокси)-5-нитропиримидин-2-илокси]бензамид (14b). К раствору соединения 8a (0,14 г; 0,5 ммоль) в ацетоне (4 мл) по каплям добавили раствор соединения 14a (0,11 г; 0,55 ммоль) в 1Н водном растворе NaOH (0,55 мл; 0,55 ммоль) и H2O (2 мл). После добавления реакционную смесь медленно нагревали до комнатной температуры, а затем перемешивали при комнатной температуре в течение 20 часов. После концентрирования реакционной смеси осадок экстрагировали в EtOAc, промывали 1Н водным раствором NaOH и солевым раствором и высушивали над MgSO4. После удаления растворителя и последующей очистки колоночной флеш-хроматографией (элюент, EtOAc/гексаны: 1/1) получили соединение 14b (0,09 г; 41%). МС: m/z 439,2 (M+H)+.
C. 4-[5-Амино-4-(4-метоксифенокси)пиримидин-2-илокси]-N,N-диэтилбензамид (14c). К раствору соединения 14b (0,09 г; 0,2 ммоль) в MeOH (10 мл) добавили 10% Pd-C (0,1 г) и реакционную смесь встряхивали в гидрогенизаторе Парра в атмосфере водорода 220,6 кПа (32 psi) в течение 20 ч. После фильтрации и выпаривания получили соединение 14c (0,08 г; 98%). МС: m/z 409,2 ((M+H)+.
D. трет-Бутиловый эфир 2-(S)-{[2-(4-диэтилкарбамоилфенокси)-4-(4-метоксифенокси)пиримидин-5-иламино]метил}пирролидин-1-карбоновой кислоты (14d). К раствору соединения 14c (0,08 г; 0,196 ммоль) и N-трет-Boc-L-пролиналя (0,043 г; 0,215 ммоль) в MeOH (1 мл) и HOAc (0,1 мл) добавили NaBH3CN (0,025 г; 0,392 ммоль). После перемешивания при комнатной температуре в течение 4 ч реакцию гасили путем добавления солевого раствора, летучие компоненты удаляли выпариванием и осадок экстрагировали в EtOAc. Органическую фазу последовательно промывали 1Н водным раствором HCl, насыщенным водным раствором NaHCO3 и солевым раствором, после чего высушивали над Na2SO4. После концентрирования смеси с последующей очисткой методом препаративной ТСХ (элюент, EtOAc/гексаны: 1/1) получили соединение 14d. МС: m/z 592,3 (M+H)+.
Е. N,N-Диэтил-4-{4-(4-метоксифенокси)-5-[(пирролидин-2-(S)-илметил)амино]пиримидин-2-илокси}бензамид (14e). К раствору соединения 14d (0,1 г; 0,19 ммоль) в DCM (1 мл) добавили TFA (1 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. После концентрирования реакционной смеси и очистки методом ВЭЖХ на обращенной фазе получили соединение 5 в виде трифторуксусной соли. 1H-ЯМР (300 МГц, MeOH-d4): δ 7,86 (д, 1H), 7,18-7,41 (м, 3H), 7,00-7,14 (м, 2H), 6,79-6,97 (м, 3H), 3,93 (уш. с., 1H), 3,77 (д, 3H), 3,43-3,63 (м, 4H), 3,31-3,43 (м, 4H), 2,21-2,39 (м, 1H), 1,98-2,21 (м, 2H), 1,76-1,93 (м, 1H), 1,25 (уш. с., 3H), 1,14 (уш. с., 3H); МС: m/z 492,3 (M+H)+.
Используя описанные выше способы, были синтезированы приведенные ниже в таблице 1 соединения 1-54 формулы (I).
нение
хим.
[3.2.1]
окт-3-ил
3-илметил
[2.2.2]
окт-3-ил
4RS)
Биологические исследования
Исследования in vitro
Пример 1
24-Луночный анализ связывания с дельта-опиоидными рецепторами на клетках линии NG108-15
Способ: клеточные мембраны NG108-15 приобрели в компании Applied Cell Sciences (г. Роквилль, штат Мэриленд). 5 мг/мл мембранных белков суспендировали в 10 мМ ТРИС-HCl pH 7,2, 2 мМ ЭДТК, 10% сахарозы. Содержимое каждого флакона гомогенизировали в 5 мл 50 мМ трис-буферного раствора при pH 7,4 с использованием нескольких коротких импульсов на гомогенизаторе Polytron. Гомогенат разбавили в 50 мМ трис-буферном растворе, содержащем 5 мМ MgCl2 до концентрации 330 мкг/мл в рабочем растворе с получением итоговой концентрации белка 133 мкг/лунку. Полученный препарат использовали для проведения 24-луночного анализа связывания с дельта-опиоидными рецепторами.
После инкубирования с дельта-селективным лигандом пептида, ~0,2 нМ [3H]налтриндола, при температуре 25°C в течение 2,5 часов на 24-луночном планшете с общим объемом 1 мл содержимое планшета профильтровали через фильтр UniFilter24, GF/B. Данный планшет предварительно замочили в 0,3% PEI и профильтровали через 24-луночную систему сбора клеток. Фильтр UniFilter24 трижды промыли 2 мл 10 мМ буферного раствора HEPES (pH 7,4) и высушили в печи при температуре 37°C в течение 1,5 часов. В каждую лунку добавили по 150 мкл Scint0 (компания PerkinElmer, № по каталогу 6013611). Затем планшеты анализировали на сканере TopCount.
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). В качестве отрицательного контроля использовали неспецифическое связывание (н.с. - 1 мМ налоксона), в качестве положительного контроля использовали суммарное связывание (с.с. - только мембрана и лиганд). При анализе одной концентрации процентную степень ингибирования рассчитывали как (количество отсчетов в мин. для суммарного связывания минус количество отсчетов в мин. для тестируемого соединения), разделенное на (количество отсчетов в мин. для суммарного связывания минус количество отсчетов в мин. для неспецифичного связывания). Каждую приведенную процентную степень ингибирования получали усреднением результатов трех измерений. При работе с множеством концентраций полученные значения анализировали с помощью программы нелинейной регрессии для связывания по одному сайту из программного пакета Prism для получения значений Ki. Максимальные и минимальные значения использовали как глобально доступные. Каждое приведенное значение Ki получали путем усреднения по результатам трех измерений.
Полученные данные приведены в таблице 2 ниже.
Пример 2
Анализ связывания с дельта-опиоидными рецепторами на мозге крысы
Процедура: самцов крыс линии Wistar (150-250 г, VAF, компания Charles River, г. Кингстон, шт. Нью-Йорк) умерщвляли CO2, мозг извлекали и немедленно помещали в ледяной трис-HCl буферный раствор (50 мМ, pH 7,4). Передние отделы отделяли от остального мозга с использованием коронального сечения, начиная сверху у холмиков и проводя разрез вниз через соединение среднего мозга с мостом. После вскрытия передний мозг гомогенизировали в трис-буферном растворе в тефлон®-стеклянном гомогенизаторе. Гомогенат разбавляли до концентрации 1 г ткани переднего мозга на 80 мл буферного раствора и центрифугировали на скорости 39000×g в течение 10 минут. Осадок ресуспендировали в таком же объеме буферного раствора с добавлением 5 мМ MgCl2 с помощью нескольких небольших импульсов на гомогенизаторе Polytron. Полученный препарат использовали для проведения анализа связывания с дельта-опиоидными рецепторами. После инкубирования с дельта-селективным пептидным лигандом, ~4 нМ [3H]DPDPE или 0,25 нМ [3H]налтриндола, при температуре 25°C в течение 2,5 часов на 96-луночном планшете с общим объемом 1 мл содержимое планшета профильтровали через плоские фильтры Wallac B на 96-луночной системе сбора клеток Tomtec. Фильтры трижды промыли 2 мл 10 мМ раствора HEPES (pH 7,4) и дважды просушили в микроволновой печи мощностью 650 Вт в течение 1,75 минут. На каждую зону с образцом поместили 2×50 мкл сцинтилляционной жидкости Betaplate Scint (компания LKB) и количественно определили радиоактивность с использованием жидкостного сцинтилляционного счетчика 1205 BetaPlate компании LKB (Wallac).
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). Процентную степень ингибирования рассчитывали как [(количество распадов в минуту для суммарного связывания - количество распадов в минуту для тестируемого соединения)/(количество распадов в минуту для суммарного связывания - количество распадов в минуту для неспецифического связывания)]*100. Значения Kd и Ki рассчитывали с использованием программы анализа данных GraphPad PRISM. Полученные данные приведены в таблице 2 ниже.
Пример 3
Анализ связывания с мю-опиоидными рецепторами на мозге крысы
Процедура: самцов крыс линии Wistar (150-250 г, VAF, компания Charles River, г. Кингстон, шт. Нью-Йорк) умерщвляли CO2, мозг извлекали и немедленно помещали в ледяной трис-HCl буферный раствор (50 мМ, pH 7,4). Передние отделы отделяли от остального мозга с использованием коронального сечения, начиная сверху у холмиков и проводя разрез вниз через соединение среднего мозга с мостом. После вскрытия передний мозг гомогенизировали в трис-буферном растворе в тефлон®-стеклянном гомогенизаторе. Гомогенат разбавляли до концентрации 1 г ткани переднего мозга на 80 мл буферного раствора и центрифугировали на скорости 39000×g в течение 10 минут. Осадок ресуспендировали в таком же объеме буферного раствора с добавлением 5 мМ MgCl2 с помощью нескольких небольших импульсов на гомогенизаторе Polytron. Полученный препарат использовали для проведения анализа связывания с мю-опиоидными рецепторами. После инкубирования с мю-селективным пептидным лигандом, ~0,8 нМ [3H]DAMGO, при температуре 25°C в течение 2,5 часов на 96-луночном планшете с общим объемом 1 мл содержимое планшета профильтровали через плоские фильтры Wallac B на 96-луночной системе сбора клеток Tomtec. Фильтры трижды промыли 2 мл 10 мМ раствора HEPES (pH 7,4) и дважды просушили в микроволновой печи мощностью 650 Вт в течение 1,75 минут. На каждую зону с образцом поместили 2×40 мкл сцинтилляционной жидкости Betaplate Scint (компания LKB) и количественно определили радиоактивность с помощью жидкостного сцинтилляционного счетчика 1205 BetaPlate компании LKB (Wallac).
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). Процентную степень ингибирования рассчитывали как [(количество распадов в минуту для суммарного связывания - количество распадов в минуту для тестируемого соединения)/(количество распадов в минуту для суммарного связывания - количество распадов в минуту для неспецифического связывания)]*100. Значения Kd и Ki рассчитывали с использованием программы анализа данных GraphPad PRISM. Полученные данные приведены в таблице 2 ниже.
Данные по связыванию с дельта- и мю-опиоидными рецепторами
Ki (мкмоль)
(лиганд DPDPE)
Ki (мкмоль)
(лиганд налтриндол)
Ki (мкмоль)
Ki (мкмоль)
Пример 4
Анализ связывания [35S]GTPγS на клеточных мембранах NG108-15 (функциональный тест на дельта-опиоидные рецепторы) - скрининг при концентрации 200 нМ
Способы: клеточные мембраны NG108-15 приобрели в компании Applied Cell Sciences (г. Роквилл, штат Мэриленд). 5 мг/мл мембранных белков суспендировали в 10 мМ ТРИС-HCl pH 7,2, 2 мМ ЭДТК, 10% сахарозы. Мембраны хранили при температуре 4-8°C.
1 мл препарата мембран добавили в 10 мл холодного буферного раствора для проведения теста. Буферный раствор для проведения теста содержал 50 мМ трис-буферного раствора, pH 7,6, 5 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT и 1 мМ EGTA. Суспензию мембран дважды гомогенизировали на гомогенизаторе Polytron и центрифугировали на скорости 3000 об/мин в течение 10 минут. Супернатант затем центрифугировали на скорости 18000 об/мин в течение 20 минут. В пробирку с дебрисом добавили десять мл буферного раствора для проведения теста. Дебрис и буфер перемешали с использованием гомогенизатора Polytron.
Процедура инкубирования: осажденные мембраны (75 мкг/мл) предварительно инкубировали с частицами для сцинтиляционного анализа сближения (SPA) (10 мг/мл) при температуре 25°C в течение 45 минут в буферном растворе для проведения теста. Связавшиеся с мембранами (37,5 мкг/мл) SPA (5 мг/мл) затем инкубировали с 0,1 нМ [35S] GTPγS в том же трис-буферном растворе, содержащем 100 мкМ GDP, в суммарном объеме 200 мкл.
Для стимулирования связывания [35S]-GTPγS добавляли 200 нМ агонистов рецептора. Базовый уровень связывания тестировали в отсутствие агонистов, а уровень неспецифического связывания тестировали в присутствии 10 мкМ немеченого GTPγS. Данные анализировали на счетчике Packard Top Count, результаты приведены в таблице 3 ниже.
ДАННЫЕ
% от базового=(стимулированный-неспецифичный)*100/(базовый-неспецифичный).
Относительная эффективность соединения при концентрации 200 нМ
= (% от базового для тестируемого соединения при 200 нМ)/(рассчитанный максимум кривой зависимости эффекта от дозы для SNC80; кривая в пакете prism).
Пример 5
Анализ связывания [35S]GTPγS на клеточных мембранах CHO-hMOR (функциональный тест на мю-опиоидные рецепторы)
Способы: клеточные мембраны CHO-hMOR можно приобрести в компании Receptor Biology, Inc. (г. Балтимор, штат Мэриленд, США). Мембранный белок можно суспендировать в концентрации приблизительно 10 мг/мл в 10 мМ ТРИС-HCl буферного раствора при pH 7,2 с добавлением 2 мМ ЭДТК, 10% сахарозы. Суспензию хранили на льду. 1 мл препарата мембран можно добавить к 15 мл холодного буферного раствора для проведения теста, который содержит 50 мМ буферного раствора HEPES, pH 7,6, 5 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT и 1 мМ ЭДТК. Суспензию мембран можно гомогенизировать на гомогенизаторе Polytron и центрифугировать при скорости 3000 об/мин в течение 10 минут. Супернатант можно затем центрифугировать при скорости 18000 об/мин в течение 20 минут. Полученный осадок можно повторно растворить в 10 мл буферного раствора для проведения теста на гомогенизаторе Polytron. Мембраны можно предварительно инкубировать с покрытыми агглютинином из проростков пшеницы SPA-частицами (компания Amersham) при температуре 25°C в течение 45 минут в буферном растворе для проведения теста. Затем связавшиеся с мембранами (10 мкг/мл) SPA-частицы (5 мг/мл) можно инкубировать с 0,5 нМ [35S]GTPγS в буферном растворе для проведения теста. Базовое связывание, которое может происходить в отсутствие добавленного тестируемого соединения, принимали за 100%, при этом стимулированное агонистом связывание может достигать уровня, значительно превышающего данное значение. Для стимулирования связывания [35S]GTPγS можно использовать диапазон концентраций агонистов рецептора. Как базовое, так и неспецифическое связывание можно тестировать в отсутствие агониста. Для определения уровня неспецифичного связывания использовали 10 мкМ немеченого GTPγS.
Соединения можно тестировать на активность как антагониста путем оценки их потенциала по ингибированию стимулированного агонистом связывания GTPγS. Радиоактивность можно определять количественно на счетчике Packard TopCount. Можно рассчитать следующие параметры:
% стимуляции = (число отсчетов в мин для тестируемого соединения - число отсчетов в мин для неспецифичного связывания) ×100
(количество отсчетов в минуту для базового связывания - количество отсчетов в минуту для неспецифичного связывания).
% ингибирования = (% стимуляции 1 мкМ DAMGO - % стимуляции тестируемым соединением) ×100
(% стимуляции 1 мкМ DAMGO - 100)
Значения EC50 можно рассчитать в программе GraphPad Prism. Они приведены в таблице 3 ниже.
Функциональные характеристики дельта- и мю-опиоидных рецепторов
δ-отн.
Эффективность при
200 нМ
δ-опиоидный рецептор
EC50 (мкМ)
δ-опиоидный рецептор, % ингиб. при 10 мкМ
δ-опиоидный рецептор, отн.
эффективность
μ-опиоидный рецептор, EC50 (мкМ)
μ-опиоидный рецептор,
% ингиб.
при 10 мкМ
3,653
16,430
19,733
Исследование in vivo
Пример 6
Модель воспалительной боли на основе гиперчувствительности к излучаемому теплу у крыс, вызванной введением CFA
Введение полного адъюванта Фрейнда (CFA) в подошву лапки вызывает у грызуна сильную и продолжительную воспалительную реакцию, которая характеризуется хронической ярко выраженной гипералгезией как к тепловым, так и к механическим воздействиям. Эти эффекты достигают максимальной выраженности в период 24-72 часа после инъекции и могут продолжаться от нескольких дней до нескольких недель. Для оценки способности соединений к обращению тепловой гипералгезии в подошву левой задней лапки самцам крыс линии Sprague-Dawley (200-350 г) может быть введена инъекция CFA (1:1 CFA:солевой раствор, 100 мкл). По истечении 24-часового инкубационного периода можно определить задержки реакции на излучающем тепло стимуляторе лапы (RH), которые можно сравнить с фоновыми задержками до введения CFA. Стимулятор автоматически фиксирует поднятие лапки с поверхности стекла. Анализ продолжали только для крыс, у которых имело место по меньшей мере 25% сокращение латентного периода реакции (то есть имела место гипералгезия). После определения задержки после введения CFA крысам перорально можно ввести (2,5 мл/кг) тестируемое соединение или инертный носитель (гидроксипропилметилцеллюлоза, HPMC). Для каждого животного можно рассчитать процентную степень обращения гипералгезии как (реакция после введения тестируемого соединения - реакция после введения CFA)/(реакция до введения CFA - реакция после введения CFA)×100. Таким образом, возвращение к нормальным порогам чувствительности до введения CFA можно определить как 100% эффективность, тогда как отсутствие отличия от порогов чувствительности после введения CFA можно оценить как 0% эффективность. Затем для каждой группы можно рассчитать среднюю процентную степень обращения гипералгезии (n=6-8 крыс/группа).
Приведенное выше техническое описание содержит сведения о принципах, лежащих в основе настоящего изобретения, и иллюстрирующие его примеры, однако следует понимать, что практическое применение изобретения распространяется на все обычные вариации, адаптации и/или модификации, в соответствии с нижеприведенными пунктами формулы изобретения и их эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-ЗАМЕЩЕННЫЕ-2-ФЕНОКСИФЕНИЛАМИНОВЫЕ МОДУЛЯТОРЫ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2553453C2 |
| ПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2568434C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617424C2 |
| ПИРАЗИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2543484C2 |
| (ГЕТЕРО)АРИЛЦИКЛОПРОПИЛАМИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ LSD1 | 2012 |
|
RU2681211C2 |
| КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КАЛЬПАИНА | 2010 |
|
RU2540856C2 |
| ПРОИЗВОДНЫЕ 5-АМИНОЦИКЛИЛМЕТИЛОКСАЗОЛИДИН-2-ОНА | 2008 |
|
RU2492169C2 |
| ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗ | 2009 |
|
RU2445314C9 |
| ПРОИЗВОДНЫЕ АЗАСПИРОАЛКАНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ МЕТАЛЛОПРОТЕАЗ | 2004 |
|
RU2379303C2 |
| ТРИЦИКЛИЧЕСКИЕ ПИРРОЛО ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2012 |
|
RU2591191C2 |
Изобретение относится к новым соединениям формулы I, обладающим свойствами связывания с дельта опиоидными рецепторами. Соединения могут быть использованы при лечении боли, вызванной заболеваниями или состояниями, такими как остеоартрит, ревматоидный артрит, мигрень, ожог, фибромиалгия, цистит, ренит, невропатическая боль, идиопатическая невралгия, зубная боль и др. В формуле I
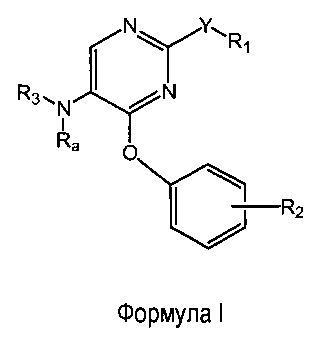
R1 выбран из группы, состоящей из фенила, пиридинила и тиазолила; причем R1 необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси, атома фтора, атома хлора, атом брома и цианогруппы; кроме этого, R1 необязательно замещен ди(С1-4алкил)аминокарбонилом; Υ представляет собой О, S, ΝΗ, винил, этинил или S(О); R2 представляет собой заместитель, выбранный из группы, состоящей из водорода, С1-4алкила, С1-4алкокси, С1-4алкилтио, атома фтора, атома хлора, атома брома и гидрокси; Ra представляет собой водород или метил; R3 выбран из группы, состоящей из пирролидин-2-илметила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, пиперидин-2-илэтила, пиперидин-3-илэтила, пиперидин-4-илэтила, пиридин-4-ил-(С1-2)алкила, азетидин-3-илметила, морфолин-2-илметила, морфолин-3-илметила, имидазолилметила, тиазолилметила, (амино)-С3-6циклоалкила, 3-гидрокси-2-аминопропила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила, гуанидинилэтила, 4-(имидазол-1-ил)фенилметила, 2-(метиламино)этила, 2-диэтиламиноэтила, 4-диэтиламинобут-2-ила, пиперидин-3-ила, пиперидин-4-ила и пирролидин-3-ила; и при этом пиперидин-3-ил необязательно замещен на атоме углерода фенилом; и при этом пирролидин-2-ил в пирролидин-2-ил-метиле, пирролидин-3-ил, пиперидин-3-ил и пиперидин-4-ил необязательно замещены на атоме азота метилом, фенилметилом, фенэтилом или метилкарбонилом. 8 н. и 16 з.п. ф-лы, 3 табл., 19 пр.
1. Соединение формулы (I)

где
R1 выбран из группы, состоящей из фенила, пиридинила и тиазолила; причем R1 необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси, атома фтора, атома хлора, атом брома и цианогруппы; кроме этого, R1 необязательно замещен ди(С1-4алкил)аминокарбонилом;
Υ представляет собой О, S, ΝΗ, винил, этинил или S(О);
R2 представляет собой заместитель, выбранный из группы, состоящей из водорода, С1-4алкила, С1-4алкокси, С1-4алкилтио, атома фтора, атома хлора, атома брома и гидрокси;
Ra представляет собой водород или метил;
R3 выбран из группы, состоящей из пирролидин-2-илметила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, пиперидин-2-илэтила, пиперидин-3-илэтила, пиперидин-4-илэтила, пиридин-4-ил-(С1-2)алкила, азетидин-3-илметила, морфолин-2-илметила, морфолин-3-илметила, имидазолилметила, тиазолилметила, (амино)-С3-6циклоалкила, 3-гидрокси-2-аминопропила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила, гуанидинилэтила, 4-(имидазол-1-ил)фенилметила, 2-(метиламино)этила, 2-диэтиламиноэтила, 4-диэтиламинобут-2-ила, пиперидин-3-ила, пиперидин-4-ила и пирролидин-3-ила;
и при этом пиперидин-3-ил необязательно замещен на атоме углерода фенилом; и при этом пирролидин-2-ил в пирролидин-2-ил-метиле, пирролидин-3-ил, пиперидин-3-ил и пиперидин-4-ил необязательно замещены на атоме азота метилом, фенилметилом, фенэтилом или метилкарбонилом;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
2. Соединение по п. 1, где R1 выбран из группы, состоящей из фенила, пиридинила и тиазолила; причем R1 необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси, атома фтора, атома брома и цианогруппы; кроме того, R1 необязательно замещен ди(С1-4алкил)аминокарбонилом.
3. Соединение по п. 2, где R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси, атома фтора и атома брома; кроме того, R1 необязательно замещен ди(С1-4алкил)аминокарбонилом.
4. Соединение по п. 3, где R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси и атома фтора; кроме того, R1 необязательно замещен ди(С1-4алкил)аминокарбонилом.
5. Соединение по п. 4, где R1 представляет собой фенил, необязательно замещенный одним заместителем, выбранным из группы, состоящей из С1-4алкокси и ди(С1-4алкил)аминокарбонила.
6. Соединение по п. 1, где Υ представляет собой О, ΝΗ, винил, этинил или S(О).
7. Соединение по п. 6, где Υ представляет собой О или этинил.
8. Соединение по п. 7, где Υ представляет собой О.
9. Соединение по п. 1, где R2 представляет собой заместитель, выбранный из группы, состоящей из С1-2алкокси, атома фтора и атома брома.
10. Соединение по п. 9, где R2 представляет собой С1-2алкокси или атом фтора.
11. Соединение по п. 1, где Ra представляет собой водород.
12. Соединение по п. 1, где R3 выбран из группы, состоящей из пирролидин-2-илметила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, пиперидин-3-илэтила, пиперидин-4-илэтила, азетидин-3-илметила, морфолин-2-илметила, пиперидин-3-ила, пиперидин-4-ила, пирролидин-3-ила, 3-аминоциклогексила, 4-аминоциклогексила, 3-гидрокси-2-аминопропила, 4-диэтиламинобут-2-ила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила и 2-(метиламино)этила;
при этом пиперидин-3-ил необязательно замещен на атоме углерода фенилом; и при этом пирролидин-2-ил в пирролидин-2-илметиле, пирролидин-3-ил, пиперидин-3-ил и пиперидин-4-ил необязательно замещены на атоме азота метилом, фенилметилом, фенэтилом или метилкарбонилом.
13. Соединение по п. 12, где R3 выбран из группы, состоящей из пирролидин-2-илметила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, азетидин-3-илметила, пиперидин-3-ила, пиперидин-4-ила, 3-аминоциклогексила, 4-аминоциклогексила, 3-гидрокси-2-аминопропила, 4-диэтиламинобут-2-ила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила и 2-(метиламино)этила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом.
14. Соединение по п. 13, где R3 выбран из группы, состоящей из пирролидин-2-илметила, пиперидин-3-ила и 3-аминоциклогексила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом.
15. Соединение формулы (I)
где R1 выбран из группы, состоящей из фенила, пиридинила и тиазолила; причем R1 необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси, атома фтора, атома хлора, атома брома и цианогруппы; кроме этого, R1 необязательно замещен ди(С1-4алкил)аминокарбонилом;
Υ представляет собой О, ΝΗ, винил, этинил или S(О);
R2 представляет собой заместитель, выбранный из группы, состоящей из С1-2алкокси, атома фтора и атома брома;
Ra представляет собой водород или метил;
R3 выбран из группы, состоящей из пирролидин-2-ил-метила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, пиперидин-3-илэтила, пиперидин-4-илэтила, азетидин-3-илметила, морфолин-2-илметила, пиперидин-3-ила, пиперидин-4-ила, пирролидин-3-ила, 3-аминоциклогексила, 4-аминоциклогексила, 3-гидрокси-2-аминопропила, 4-диэтиламинобут-2-ила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила и 2-(метиламино)этила;
при этом пиперидин-3-ил необязательно замещен на атоме углерода фенилом; и при этом пирролидин-2-ил в пирролидин-2-илметиле, пирролидин-3-ил, пиперидин-3-ил и пиперидин-4-ил необязательно замещены на атоме азота метилом, фенилметилом, фенэтилом или метилкарбонилом;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
16. Соединение формулы (I)
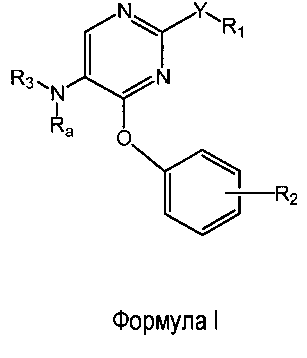
где
R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси, атома фтора и атома брома; кроме того, R1 необязательно замещен ди(С1-4алкил)аминокарбонилом;
Υ представляет собой О, ΝΗ, винил, этинил или S(O);
R2 выбран из группы, состоящей из С1-2алкокси, атома фтора и атома брома;
Ra представляет собой водород;
R3 выбран из группы, состоящей из пирролидин-2-илметила, пирролидин-3-илметила, пиперидин-2-илметила, пиперидин-3-илметила, пиперидин-4-илметила, азетидин-3-илметила, пиперидин-3-ила, пиперидин-4-ила, 3-аминоциклогексила, 4-аминоциклогексила, 3-гидрокси-2-аминопропила, 4-диэтиламинобут-2-ила, 8-азабицикло[3.2.1]октанила, 1-азабицикло[2.2.2]октанила и 2-(метиламино)этила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
17. Соединение формулы (I)
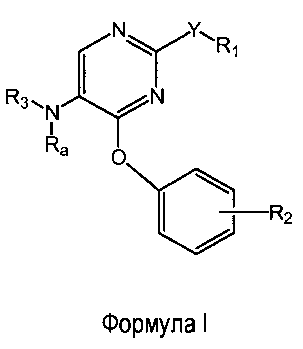
где
R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-4алкокси и атома фтора; кроме того, R1 необязательно замещен ди(С1-4алкил)аминокарбонилом;
Υ представляет собой О или этинил;
R2 представляет собой заместитель, выбранный из группы, состоящей из С1-2алкокси, атома фтора и атома брома;
Ra представляет собой водород;
R3 выбран из группы, состоящей из пирролидин-2-илметила, пиперидин-3-ила и 3-аминоциклогексила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
18. Соединение формулы (I)
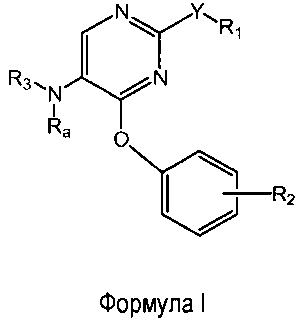
где
R1 представляет собой фенил, необязательно замещенный одним заместителем, независимо выбранным из группы, состоящей из C1-4алкокси и ди(С1-4алкил)аминокарбонила;
Υ представляет собой О;
R2 представляет собой С1-4алкокси или атом фтора;
Ra представляет собой водород;
R3 выбран из группы, состоящей из пирролидин-2-илметила, пиперидин-3-ила и 3-аминоциклогексила;
причем пирролидин-2-ил в пирролидин-2-илметиле необязательно замещен на атоме азота метилом;
и его энантиомеры, диастереомеры и фармацевтически приемлемые соли.
19. Соединение формулы (I)
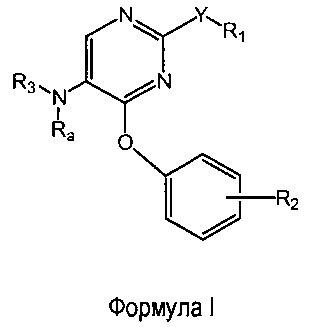
выбранное из группы, состоящей из:
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-ил-метил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пиперидин-3-ил; (RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 3-аминоциклогексил; (1RS,3RS)
соединения формулы (I), где R1 представляет собой 2-фенил, Υ представляет собой этинил, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-диэтиламинокарбонилфенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2R)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой метил и R3 представляет собой 1-метилпирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-метилпирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 3-гидрокси-2-аминопропил; (2R)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 8-азабицикло[3.2.1]окт-3-ил; (1R,5S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой азетидин-3-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-азабицикло[2.2.2]окт-3-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пиперидин-3-илметил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 4-аминоциклогексил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пиперидин-4-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 2-метиламиноэтил;
соединения формулы (I), где R1 представляет собой 2-(4-метоксифенил),Υ представляет собой винил, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой S(О), R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 3-гидрокси-2-аминопропил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-3-илметил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой NH, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-фторфенил, Υ представляет собой О, R2 представляет собой 4-фтор, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2*S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пиперидин-2-илметил; (2RS)
соединения формулы (I), где R1 представляет собой 2-бромфенил, Υ представляет собой О, R2 представляет собой 2-бром, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-фенилметилпирролидин-3-ил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-фенилметилпиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-фенэтилпиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-метилпиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой морфолин-2-илметил; (2RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-фенилметилпиперидин-3-ил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 2-(пиперидин-4-ил)этил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 2-(пиперидин-3-ил)этил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 4-фенилпиперидин-3-ил; (3RS, 4RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-3-ил; (3RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 4-(имидазол-1-ил)фенилметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 4-диэтиламинобут-2-ил; (2RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пиридин-4-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-(пиридин-4-ил)этил; (1RS)
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1-метилкарбонилпиперидин-4-ил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 1Н-имидазол-2-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой тиазол-2-илметил;
соединения формулы (I), где R1 представляет собой 4-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой 2-гуанидиноэтил;
соединения формулы (I), где R1 представляет собой пиридин-3ил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-фторфенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-фторфенил, Υ представляет собой S, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой пиридин-3-ил, Υ представляет собой NH, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-фторфенил, Υ представляет собой NH, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой тиазол-2-ил, Υ представляет собой NH, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-хлорфенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-метоксифенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
соединения формулы (I), где R1 представляет собой 3-цианофенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-ил-метил; (2S) и
соединения формулы (I), где R1 представляет собой 3,5-дифторфенил, Υ представляет собой О, R2 представляет собой 4-метокси, Ra представляет собой Η и R3 представляет собой пирролидин-2-илметил; (2S)
и его фармацевтически приемлемые соли.
20. Фармацевтическая композиция, обладающая свойствами ингибитора дельта опиоидных рецепторов, содержащая терапевтически эффективное количество соединения по любому из пп. 1-19 и по меньшей мере одно из фармацевтически приемлемого носителя, фармацевтически приемлемого эксципиента и фармацевтически приемлемого разбавителя.
21. Фармацевтическая композиция по п. 20, где композиция представляет собой твердую дозированную форму для перорального введения.
22. Фармацевтическая композиция по п. 20, где композиция представляет собой сироп, эликсир или суспензию.
23. Способ лечения боли, включающий введение терапевтически эффективного количества соединения формулы (I) по любому из пп. 1-19, обладающего способностью связывания с дельта опиоидными рецепторами.
24. Способ по п. 23, где боль выбрана из воспалительной боли.
| WO 0242280 A2, 30 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| АППАРАТ ДЛЯ АКТИВНОЙ МЕХАНОТЕРАПИИ | 0 |
|
SU208205A1 |
| RU2008147305 A,10.05.2010 & RU 2491071 | |||
| Устройство для реверсирования направления вращения двигателей постоянного тока | 1926 |
|
SU11009A1 |
Авторы
Даты
2015-06-27—Публикация
2010-10-28—Подача