Настоящее изобретение относится к новым производным 5-аминоциклилметилоксазолидин-2-она, фармацевтической антибактериальной композиции, содержащей их, и к применению этих соединений для приготовления лекарственного средства для лечения инфекций (например, бактериальных инфекций). Эти соединения используются в качестве антимикробных агентов, эффективных по отношению к целому ряду болезнетворных организмов человека и животных, включая, среди прочих, грамположительные и грамотрицательные аэробные и анаэробные бактерии и микобактерии.
Интенсивное применение антибиотиков оказывает селективное эволюционное давление на микроорганизмы, способствуя продуцированию в них генетически сформированных механизмов резистентности. Современное медицинское и социо-экономическое поведение обостряет проблему развития резистентности, создавая условия замедленного роста патогенных микроорганизмов, например, в искусственных суставах, и в условиях долговременной поддержки резервов хозяина, например, у иммунологически «скомпрометированных» пациентов.
В больничных условиях увеличивающееся число штаммов Staphylococcus aureus, Streptococcus pneumonia, Enterococcus spp. и Pseudomonas aeruginosa, главных источников инфекций, делает их резистентными в отношении множества лекарств и вызывает трудности в лечении, вплоть до невозможности лечения вообще:
- S. aureus является резистентным по отношению к β-лактаму, хинолонам и теперь даже к ванкомицину;
- S. pneumoniae становится резистентным по отношению к пенициллиновым или хинолоновым антибиотикам и даже к новым макролидам;
- Enteroccocci являются резистентными по отношению к хинолону и ванкомицину, а β-лактамные антибиотики не оказывают никакого эффективного воздействия на эти штаммы;
- Enterobacteriacea являются резистентными по отношению к цефалоспорину и хинолону;
- Р. Aeruginosa являются резистентными по отношению к Р-лактаму и хинолону.
Кроме того, скорость распространения мультилекарственной резистентности грамотрицательных штаммов таких, как Enterobacteriacea и Pseudomonas aeruginosa, постоянно увеличивается, вследствие чего вновь появляющиеся организмы, подобные таким организмам, как Acinetobacter spp., которые были выделены в процессе терапии с использованием применяемых в настоящее время антибиотиков, становятся реальной проблемой в больничных условиях. Вследствие этого существует необходимость в новых антибактериальных агентах, способных преодолевать мультилекарственную резистентность грамотрицательных бактерий таких, как A. baumannii, ESBL-продуцируемых Е. coli и Klebsiella видов и Pseudomonas aeruginosa (George H. Talbot et al., Clinical Infectious Diseases, (2006), 42, 657-68).
Помимо этого, микроорганизмы, вызывающие устойчивые инфекции, все более признаются в качестве являющихся причиной или сопутствующими факторами некоторых хронических болезней, подобных пептическим язвам или сердечным болезням.
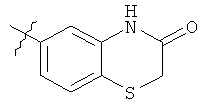
WO 02/50040 описывает некоторые производные пиперазина в качестве антибактериальных агентов, среди которых два соединения, имеющие структуры (А1) и (А2), представленные ниже:
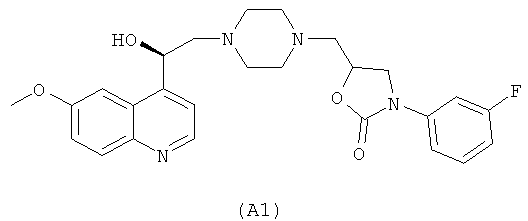
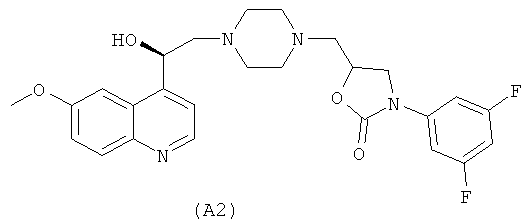
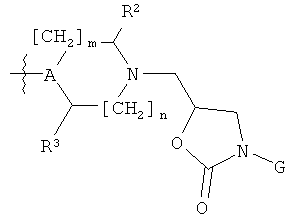
WO 2004/032856 раскрывает ингибиторы рецептора хемокина CCR8 формулы (A3)
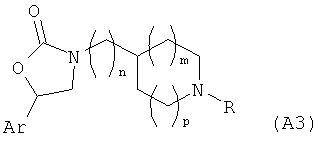
где
n=0 или 1; m=0 или 1; р=1,2 или 3;
Ar обозначает незамещенный хинолинил, [1,5]нафтиридинил или пиридинил; или замещенные хинолинил, [1,5]нафтиридинил или пиридинил одним или более радикалами, выбранными из (предпочтительно) C1-6алкоксигруппы, галогена и цианогруппы; и
R представляет собой (предпочтительно) незамещенный или замещенный фенил-низший алкил, незамещенный или замещенный пиридил-низший алкил, незамещенный или замещенный индолил-низший алкил, незамещенный или замещенный N-(низший алкил)индолил-низший алкил, незамещенный или замещенный хинолинил-низший алкил, незамещенный или замещенный нафтил-низший алкил, незамещенный или замещенный бензофуранил-низший алкил, незамещенный или замещенный бензотиофенил-низший алкил; где, в случае замещения, группа является замещенной одним или более радикалом, выбранным из группы, включающей С1-6алкоксигруппу, С1-6алкил, галоген, цианогруппу и тригалометил.
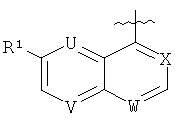
Кроме того, WO 2004/050036 описывает антибактериальные соединения формулы (А4)
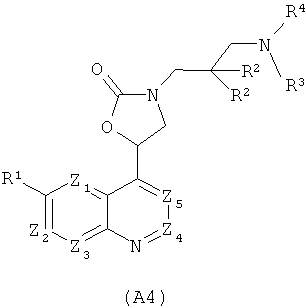
где
один из Z1, Z2, Z3, Z4 и Z5 является N, один является CR1a, а оставшиеся представляют собой CH, или один или два из Z1, Z2, Z3, Z4 и Z5 представляют собой независимо CR1a, а оставшиеся представляют собой СН;
R1 и R1a представляют собой независимо (предпочтительно) водород, галоген, С1-6алкоксигруппу или цианогруппу;
каждый R2 представляет собой независимо (предпочтительно) водород, ОН или NH2;
R3 представляет собой H или незамещенный или замещенный С1-6алкил;
R4 представляет собой группу -U-R5, где U является СН2, С=O или SO2, и R5 является предпочтительно бициклической гетероциклической кольцевой системой такой, как 4Н-бензо[1,4]оксазин-3-он-6-ил, 4Н-бензо[1,4]тиазин-3-он-6-ил, 3-оксо-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-6-ил или 3-оксо-3,4-дигидро-2Н-пиридо[3,2-b][1,4]тиазин-6-ил.
Заявитель неожиданно обнаружил, что соединения формулы (I), описанные далее, применимы в качестве антибактериальных агентов.
Различные варианты осуществления настоящего изобретения представлены далее:
i) Изобретение, в первую очередь, относится к соединениям формулы (I)
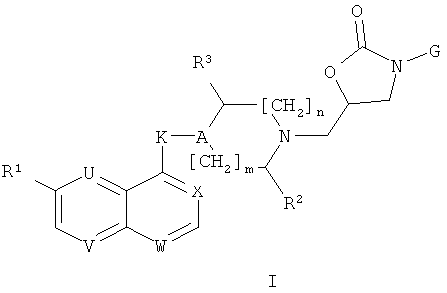
где
один или два (и, предпочтительно, два) из U, V, W и Х представляют собой N, остальные представляют собой CH или, в случае X, могут также представлять собой CRa, где Ra является фтором;
R1 представляет собой алкоксигруппу, галоген или цианогруппу;
R2 представляет собой Н, СН2ОН, CH2N3, CH2NH2, алкилкарбониламинометил или триазол-1-илметил;
R3 представляет собой Н или, когда n=1, R3 может также представлять собой ОН, NH2, NHCOR6 или триазол-1-ил;
А представляет собой CR4;
К представляет собой О, NH, OCH2, NHCO, NHCH2, CH2NH, CH2CH2, СН=СН, СНОНСНОН или CHR5;
R4 представляет собой Н или вместе с R5 образует связь, или R4 может также представлять собой ОН, когда К не является О, NH, OCH2 или NHCO;
R5 представляет собой ОН или вместе с R4 образует связь;
R6 представляет собой алкил;
m=0 или 1 и n=0 или 1; и
G представляет собой группу
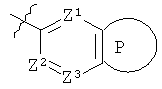
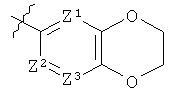
где Z1 представляет собой N, Z2 представляет собой СН и Z3 представляет собой СН; или
Z1 представляет собой СН, Z2 представляет собой N и Z3 представляет собой СН или N; или
Z1 представляет собой СН, Z2 представляет собой СН и Z3 представляет собой СН или N;
и кольцо Р выбрано из следующих групп:
в которых Q представляет собой О или S;
и солям (в частности, фармацевтически приемлемым солям) соединений формулы (I).
Соединения формулы (I) могут содержать один или более стереогенных или асимметрических центров таких, как например, один или более асимметрических атомов углерода. Заместители при двойной связи могут присутствовать в Z- или Е-конфигурации, если не указано иначе. Соединения формулы (I) могут вследствие этого представлять собой смесь стереоизомеров или, предпочтительно, чистые стереоизомеры. Смеси стереоизомеров могут быть разделены способами, известными специалистам в области техники.
Относительная конфигурация (xR*,yR*) стереоизомеров, где х и у являются целыми числами, обозначена, как суммарная у следующего примера: 6-{(R)-5-[(3R*,4R*)-3-(6-метоксихиназолин-4-илокси)-4-[1,2,3]триазол-1-илпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он именуется, как 6-{(R)-5-[(3R,4R)-3-(6-метоксихиназолин-4-илокси)-4-[1,2,3]триазол-1-илпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он, или 6-{(R)-5-[(3S,4S)-3-(6-метоксихиназолин-4-илокси)-4-[1,2,3]триазол-1-илпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он, или смесь этих двух стереоизомеров.
В следующих абзацах представлены определения различных химических остатков для соединений согласно изобретению. Указанные определения предназначены для единообразного применения во всем описании и в формуле изобретения, если не указано иначе, и если определения не подлежат более широкому или, наоборот, более узкому толкованию.
Термин «алкил», используемый самостоятельно или в комбинации, относится к насыщенной линейной или разветвленной алкильной группе, содержащей от одного до четырех атомов углерода. Типичные примеры алкильных групп включают метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Термин «C1-xалкил» (х обозначает целое число) относится к линейной или разветвленной алкильной группе, содержащей от 1 до х атомов углерода.
Термин «алкоксигруппа», используемый самостоятельно или в комбинации, относится к насыщенной линейной или разветвленной алкоксигруппе, содержащей от одного до четырех атомов углерода. Типичные примеры алкоксигрупп включают метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу. Термин «С1-xалкоксигруппа» относится к линейной или разветвленной алкоксигруппе, содержащей от 1 до х атомов углерода.
Термин «галоген» относится к фтору, хлору, брому или йоду, предпочтительно к фтору или хлору.
Термин «алкилкарбониламинометил» относится к метильной группе, где один атом водорода замещен алкилкарбониламиногруппой, при этом алкильная группа представляет собой описанную ранее. Типичные примеры алкилкарбониламинометильных групп включают, не лимитируя, метиламинокарбонилметил и этиламинокарбонилметил (предпочтительно, метиламинокарбонилметил).
Связь, прерванная волнистой линией, в настоящем описании указывает на точку присоединения радикала. Например, радикал, изображенный ниже,
является 3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ильной группой.
Кроме того, в настоящем описании, когда К является ассиметричным радикалом, левая часть радикала, представленного ниже, (например, О в ОСН2) присоединена к ароматическому фрагменту
в то время как правая часть представленного радикала (например, СН2 в OCH2) присоединена к пиперидиновому фрагменту
Кроме того, термин «комнатная температура», используемый в настоящем описании, относится к температуре 25°С.
Когда речь идет не о температурах, термин «приблизительно», расположенный перед численной величиной «X», относится в обычном применении к интервалу, составляющему от Х минус 10% Х до Х плюс 10% X, и предпочтительно, к интервалу, составляющему от Х минус 5% Х до Х плюс 5% X. В особом случае, касающемся температур, термин «приблизительно», расположенный, перед температурой «Y» относится в обычном применении к температурному интервалу, составляющему от Y минус 10 С до Y плюс 10°С, и предпочтительно, к интервалу, составляющему от Y минус 5 С до Y плюс 5 С.
ii) В другом варианте изобретение относится к соединениям формулы (I), имеющим значения, указанные в варианте i) выше, или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными), где G представляет собой следующие группы:
 или
или 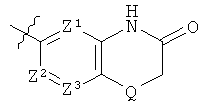
где Z1, Z2, Z3 и Q имеют значения, указанные в варианте i) выше.
iii) В другом варианте изобретение относится к соединениям формулы (I), имеющим значения, указанные в варианте i) или ii) выше, или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными), где
R1 представляет собой алкоксигруппу;
R3 представляет собой Н или, когда n=1, R3 может также представлять собой ОН, NH2 или триазол-1-ил;
К представляет собой О, NH, OCH2, NHCO, NHCH2, СН2СН2, СН=СН, СНОНСНОН или CHR5, где R5 имеет значения, указанные в варианте i) выше; и
G представляет собой группу
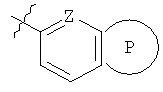
где Z представляет собой N или СН, и кольцо Р выбрано из следующих групп:
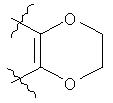
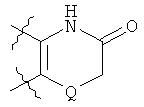
в которых Q представляет собой О или S.
iv) В частности, изобретение относится к соединениям формулы (I), которые также являются соединениями формулы (I)CE
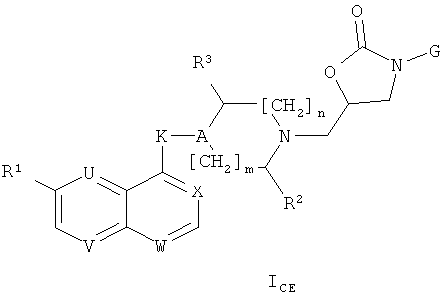
где
U и V каждый представляет собой N, и W и Х каждый представляет собой CH, или U и V каждый представляет собой СН, и W и Х каждый представляет собой N, или также U и W каждый представляет собой N, и V и Х каждый представляет собой CH;
R1 представляет собой алкоксигруппу (и, предпочтительно, метоксигруппу);
R2 представляет собой Н, СН2ОН, CH2N3, CH2NH2, алкилкарбониламинометил или триазол-1-илметил;
R3 представляет собой И, или, когда n=1, R3 может также представлять собой ОН, NH2 или триазол-1-ил;
А представляет собой CR4;
К представляет собой О, NH, NHCO, NHCH2, CH2CH2, СН=СН, СНОНСНОН или CHR5;
R4 представляет собой Н или вместе с R5 образует связь, или R4 может также представлять собой ОН, когда К не является О, NH или NHCO;
R5 представляет собой ОН, или вместе с R4 образует связь;
m=0 или 1 и n=0 или 1; и
G представляет собой одну из групп, представленных ниже
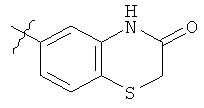
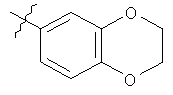
и к солям (в частности, фармацевтически приемлемым солям) соединений формулы (I)CE.
v) Согласно предпочтительному варианту осуществления настоящего изобретения соединения формулы (I), имеющие значения, указанные в вариантах i)-iv) выше, или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными), должны быть такими, в которых R1 являлся С1-3алкоксигруппой (предпочтительно метоксигруппой или этоксигруппой и, в частности, метоксигруппой).
vi) Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы (I), имеющим значения, указанные в вариантах i)-v) выше, или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными), где U и V каждый представляет собой N, и W и Х каждый представляет собой СН, или U и V каждый представляет собой СН, и W и Х каждый представляет собой N, или также U и W каждый представляет собой N, и V и Х каждый представляет собой СН.
vii) Согласно одному из предпочтительных вариантов осуществления настоящего изобретения vi), представленному выше, соединения формулы (I) или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых U и V каждый представлял собой N, и W и Х каждый представлял собой СН.
viii) Согласно другому предпочтительному варианту осуществления настоящего изобретения vi), представленному выше, соединения формулы (I) или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых U и V каждый представляет собой СН, и W и Х каждый представляет собой N.
ix) Согласно другому предпочтительному варианту осуществления настоящего изобретения vi), представленному выше, соединения формулы (I) или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых U и W каждый представляет собой N, и V и Х каждый представляет собой СН.
х) Еще один другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы (I), имеющим значения, указанные в вариантах i)-ix), представленных выше, или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными) где:
К представляет собой NHCO или NHCH2, А представляет собой CH, тип каждый = 0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой CH, тип каждый = 0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, NHCO, СН2СН2 или СН=СН, А представляет собой СН, m=1 и n=0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой СН, m=0 и n=1, R2 представляет собой Н и R3 представляет собой ОН;
К представляет собой О, А представляет собой СН, m и n каждый = 1 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой СН, m=0 и n=1, R2 представляет собой Н и R3 представляет собой NH2 или триазол-1-ил;
К представляет собой О, А представляет собой СН, m=1 и n=0, R2 представляет собой СН2ОН, CH2NH2, ацетиламинометил или триазол-1-илметил и R3 представляет собой Н;
К представляет собой CR5, А представляет собой CR4, R4 и R5 вместе образуют связь (т.е. группа КА представляет собой СН=С), m и n каждый = 1 и R2 и R3 каждый представляет собой Н;
К представляет собой CHR5, R5 представляет собой ОН, А представляет собой CR4, R4 представляет собой ОН, тип каждый = 1 и R2 и R3 каждый представляет собой Н; или
К представляет собой СНОНСНОН, А представляет собой СН, m=1 и n=0 и R2 и R3 каждый представляет собой Н.
xi) Согласно одному из предпочтительных вариантов х), настоящее изобретение относится к соединениям формулы (I) или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными) в которых:
К представляет собой NHCO или NHCH2, А представляет собой СН, m и n каждый = 0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой СН, m и n каждый = 0 и R2 и R3 каждый представляет собой H;
К представляет собой О, NHCO, СН2СН2 или СН=СН, А представляет собой СН, m=1 и n=0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой СН, m=0 и n=1, R2 представляет собой Н и R3 представляет собой ОН;
К представляет собой О, А представляет собой СН, m и n каждый = 1 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой СН, m=0 и n=1, R2 представляет собой Н и R3 представляет собой NH2 или триазол-1-ил;
К представляет собой О, А представляет собой СН, m=1 и n=0, R2 представляет собой СН2ОН, CH2NH2, ацетиламинометил или триазол-1-илметил и R3 представляет собой Н; или
К представляет собой CR5, А представляет собой CR4, R4 и R5 вместе образуют связь (то есть, группу КА представляет собой СН=С), тип каждый = 1 и R2 и R3 каждый представляет собой Н.
xii) Предпочтительно, соединения формулы (I) согласно варианту xi) или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых:
К представляет собой NHCO или NHCH2, А представляет собой СН, m и n каждый = 0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой СН, m и n каждый = 0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, NHCO, СН2СН2 или СН=СН, А представляет собой СН, m=1 и n=0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой СН, m=0 и n=1, R2 представляет собой Н и R3 представляет собой ОН;
К представляет собой О, А представляет собой СН, m и n каждый = 1 и R2 и R3 каждый представляет собой Н;
К представляет собой О, А представляет собой СН, m=0 и n=1, R2 представляет собой Н и R3 представляет собой NH2 или триазол-1-ил;
К представляет собой О, А представляет собой СН, m=1 и n=0, R2 представляет собой СН2ОН или триазол-1-илметил и R3 представляет собой Н; или
К представляет собой CR5, А представляет собой CR4, R4 и R5 вместе образуют связь (то есть, группа КА представляет собой СН=С), тип каждый = 1 и R2 и R3 каждый представляет собой Н.
xiii) Более предпочтительно, соединения формулы (I) согласно варианту xi) или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых А представляет собой СН и:
К представляет собой NHCO или NHCH2, m и n каждый = 0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, m и n каждый = 0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, NHCO, СН2СН2 или СН=СН, m=1 и n=0 и R2 и R3 каждый представляет собой Н;
К представляет собой О, m=0 и n=1, R2 представляет собой Н и R3 представляет собой ОН; или
К представляет собой О, m и n каждый = 1 и R2 и R3 каждый представляет собой Н.
xiv) Согласно другому предпочтительному варианту х), настоящее изобретение относится к соединениям формулы (I) или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными) где:
К представляет собой CHR5, R5 представляет собой ОН, А представляет собой CR4, R4 представляет собой ОН, m и n каждый = 1 и R2 и R3 каждый представляет собой Н;
К представляет собой СНОНСНОН, А представляет собой СН, m=1 и n=0 и R2 и R3 каждый представляет собой Н.
xv) Согласно одному из вариантов осуществления настоящего изобретения, соединения формулы (I) или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными), имеющие значения, приведенные в одном из вариантов i)-xiii), должны быть такими, в которых m и n каждый = 0.
xvi) Согласно следующему одному из вариантов осуществления настоящего изобретения, соединения формулы (I) или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными), имеющие значения, приведенные в одном из вариантов i)-xiii), должны быть такими, в которых m=0 и n=1.
xvii) Согласно другому варианту осуществления настоящего изобретения, соединения формулы (I) или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными), имеющие значения, приведенные в одном из вариантов i)-xiv), должны быть такими, в которых m=1 и n=0.
xviii) Согласно еще одному другому варианту осуществления настоящего изобретения, соединения формулы (I) или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными), имеющие значения, приведенные в одном из вариантов i)-xiv), должны быть такими, в которых m и n каждый = 1.
xix) Согласно еще одному другому варианту осуществления настоящего изобретения, соединения формулы (I), имеющие значения, приведенные в одном из вариантов i)-xviii) выше, или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых кольцо Р группы G представляет собой

где Q представляет собой О или S (и, в частности, S).
хх) Согласно еще одному другому варианту осуществления настоящего изобретения, соединения формулы (I), имеющие значения, приведенные в одном из вариантов i)-xviii) выше, или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых кольцо Р группы G представляет собой
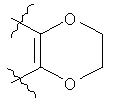
xxi) Предпочтительно, соединения формулы (I), имеющие значения, приведенные выше в вариантах xix) или хх), или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых Z обозначает СН.
xxii) Более предпочтительно, соединения формулы (I), имеющие значения, приведенные выше в вариантах xix) или хх), или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых группа G представляет собой 3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил или 2,3-дигидробензо[1,4]диоксин-6-ил (в частности, 3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил).
xxiii) Особый вариант настоящего изобретения относится к соединениям формулы (I), имеющим значения, приведенные в одном из вариантов i)-xiii) и xv)-xxii) выше, или к их солям (среди которых фармацевтически приемлемые соли являются предпочтительными), где К представляют собой О или ОСН2.
xxiv) Другой предпочтительный вариант настоящего изобретения относится к соединениям формулы (I), имеющим значения, приведенные в одном из вариантов i)-xiii) и xv)-xxii) выше, или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными), где К представляет собой NH, NHCO или NHCH2.
xxv) Согласно подварианту особого варианта xxiv) соединения формулы (I), имеющие значения, приведенные в одном из вариантов xxiv) выше, или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых К представляет собой NH.
xxvi) Согласно другому подварианту особого варианта xxiv), соединения формулы (I), имеющие значения, приведенные в одном из вариантов xxiv) выше, или их соли (среди которых фармацевтически приемлемые соли являются предпочтительными) должны быть такими, в которых К представляет собой NHCO.
xxvii) Согласно еще одному подварианту особого варианта xxiv), соединения, имеющие значения, приведенные в одном из вариантов xxiv) выше, или их соли (среди которых фармацевтически приемлемые солям являются предпочтительными) должны быть такими, в которых К представляет собой NHCH2.
xxviii) Еще один предпочтительный вариант настоящего изобретения относится к соединениям формулы (I), имеющим значения, приведенные выше в одном из вариантов i)-xxii), или их солям (среди которых фармацевтически приемлемые соли являются предпочтительными), где К представляет собой СН2СН2, СН=СН, СНОНСНОН или CHR5.
xxix) Особенно предпочтительными являются соединения формулы (I), имеющие значения, приведенные в одном из вариантов i)-iv):
6-{(R)-5-[3-(6-метокси-[1,5]нафтиридин-4-илокси)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Д-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(S)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-оксазолидин-2-он;
6-{(R)-5-[(2S,4S)-2-гидроксиметил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-2-азидометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
(6-метокси[1,5]нафтиридин-4-ил)амид 1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[1,4]тиазин-6-ил)-оксазолидин-5-илметил]азетидин-3-карбоновой кислоты;
(6-метокси[1,5]нафтиридин-4-ил)амид 1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-3-карбоновой кислоты;
6-((R)-5-{3-[(Е)-2-(6-метокси[1,5]нафтиридин-4-ил)винил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{3-[2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{3-[(1R,2R)-1,2-дигидрокси-2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(3-метоксихиноксалин-5-илметилен)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{4-гидрокси-4-[гидрокси(3-метоксихиноксалин-5-ил)метил]пиперидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{3-[(6-метокси-[1,5]нафтиридин-4-иламино)метил]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-2-аминометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4R*)-3-(6-метоксихиназолин-4-илокси)-4-[1,2,3]триазол-1-илпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
N-{(2S,4S)-4-(6-метоксихиназолин-4-илокси)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-2-илметил}ацетамид;
6-{(R)-5-[(3R*,4R*)-3-амино-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-4-(6-метоксихиназолин-4-илокси)-2-[1,2,3]триазол-1-илметилпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(6-метоксихиназолин-4-илокси)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4R*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4R*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
а также их соли (в частности, фармацевтически приемлемые соли).
ххх) Кроме того, особенно предпочтительны следующие соединения формулы (I), имеющие значения, представленные в одном из вариантов i)-iv):
6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-илокси)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(S)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[(R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-оксазолидин-2-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[(S)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]оксазолидин-2-он;
6-{(R)-5-[(2S,4S)-2-гидроксиметил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-2-азидометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
(6-метокси[1,5]нафтиридин-4-ил)амид 1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]азетидин-3-карбоновой кислоты;
(6-метокси[1,5]нафтиридин-4-ил)амид (R)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-3-карбоновой кислоты;
(6-метокси[1,5]нафтиридин-4-ил)амид (S)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-3-карбоновой кислоты;
6-((R)-5-{(R)-3-[(E)-2-(6-метокси[1,5]нафтиридин-4-ил)винил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{(S)-3-[(E)-2-(6-метокси[1,5]нафтиридин-4-ил)винил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{(R)-3-[2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{(S)-3-[2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{(R)-3-[(1R,2R)-1,2-дигидрокси-2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{(S)-3-[(1R,2R)-l,2-дигидрокси-2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(3-метоксихиноксалин-5-илметилен)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{4-гидрокси-4-[(R)-гидрокси-(3-метоксихиноксалин-5-ил)метил]пиперидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{4-гидрокси-4-[(S)-гидрокси-(3-метоксихиноксалин-5-ил)-метил]пиперидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-((R)-5-{3-[(6-метокси[1,5]нафтиридин-4-иламино)метил]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-2-аминометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4R*)-3-(6-метоксихиназолин-4-илокси)-4-[1,2,3]триазол-1-илпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
N-{(2S,4S)-4-(6-метоксихиназолин-4-илокси)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-2-илметил} ацетамид;
6-{(R)-5-[(3R*,4R*)-3-амино-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-4-(6-метоксихиназолин-4-илокси)-2-[l,2,3]триазол-l-илметилпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(6-метоксихиназолин-4-илокси)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4R*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4R*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
а также их соли (в частности, фармацевтически приемлемые соли).
xxxi) Кроме того, следующие соединения формулы (I), имеющие значения, представленные в одном из вариантов i)-iv), особенно предпочтительны:
6-{(R)-5-[3-(3-фтор-6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]оксазин-3-он;
6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]оксазин-3-он;
6-{(R)-5-[3-(6-метоксихинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]оксазин-3-он;
6-((R)-5-{3-[(3-фтор-6-метокси[1,5]нафтиридин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]оксазин-3-он;
6-((R)-5-{3-[(6-метокси[1,5]нафтиридин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]оксазин-3-он;
6-((R)-5-{3-[(3-фтор-6-метоксихинолин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]оксазин-3-он;
6-((R)-5-{3-[(6-метоксихинолин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]оксазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихиназолин-4-илоксиметил)азетидин-1-илметил]оксазолидин-2-он;
6-{(R)-5-[4-(6-метоксихиназолин-4-илокси)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]оксазин-3-он;
N-{(3R*,4R*)-4-(6-метоксихиназолин-4-илокси)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-3-ил}ацетамид;
(R)-3-(6,7-дигидро[1,4]диоксино[2,3-с]пиридазин-3-ил)-5-[3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]оксазолидин-2-он (особенно такой как (R)-3-(6,7-дигидро[1,4]диоксино[2,3-с]пиридазин-3-ил)-5-[(R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]оксазолидин-2-он или (R)-3-(6,7-дигидро-[1,4]диоксино[2,3-с]пиридазин-3-ил)-5-[(R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-оксазолидин-2-он);
6-((R)-5-{3-[(3-метоксихиноксалин-5-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4H-бензо[1,4]оксазин-3-он;
6-{(R)-5-[4-(6-метокси[1,5]нафтиридин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]оксазин-3-он;
6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[3-(6-метоксихинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
4-{1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2H-бензо[l,4]тиазин-6-ил)оксазолидин-5-илметил]азетидин-3-иламино}хинолине-6-карбонитрил;
6-{(R)-5-[3-(6-фторхинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(6-метокси[1,5]нафтиридин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(6-метоксихинолин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]тиазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]оксазолидин-2-он;
6-{(R)-5-[3-(6-фторхинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4H-бензо[1,4]оксазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихинолин-4-илокси)азетидин-1-илметил]оксазолидин-2-он;
а также их соли (в частности, фармацевтически приемлемые соли).
Соединения формулы (I) согласно изобретению, т.е. согласно одному из вариантов i)-xxxi), являются подходящими для применения в качестве химиотерапевтических активных соединений в медицине и ветеринарии, а также в качестве субстанций для сохранения неорганических и органических материалов, в частности, любых типов органических материалов, например, полимеров, смазок, лакокрасочных материалов, волокон, кожи, бумаги и шерсти.
Соединения согласно настоящему изобретению особенно активны против бактерий и подобных бактериям организмов, и поэтому являются особенно подходящими для человека, а также животных при профилактике и химиотерапии локальных и системных инфекций, вызываемых этими патогенными организмами, а также заболеваний, связанных с бактериальными инфекциями, включая пневмонию, воспаление среднего уха, синусит, бронхит, тонзиллит и мастоидит, связанные с инфекцией, вызываемой Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Enterococcus faecalis, E. faecium, E. casseliflavus, S. epidermidis, S. haemolyticus или Peptostreptococcus spp.; фарингит, ревматическую лихорадку и гломерулонефрит, связанные с инфекцией, вызываемой Streptococcus pyogenes, группами С и G streptococci, Corynebacterium diphtheriae или Actinobacillus haemolyticum; инфекции верхних дыхательных путей, связанные с инфекцией, вызываемой Mycoplasma pneumoniae, Legionella pneumophila, Streptococcus pneumoniae, Haemophilus influenzae или Chlamydia pneumoniae; инфекции крови и тканей, включая эндокардит и остеомиелит, вызываемые S. aureus, S. haemolyticus, E. faecalis, E. faecium, E. durans, включая наследственную резистентность к известным антибактериальным средствам таким, как, не лимитируя, β-лактамы, ванкомицин, аминогликозиды, хинолоны, хлорамфеникол, тетрациклины и макролиды; неосложненные инфекции кожи и мягких тканей, абсцессы и послеродовой сепсис, связанные с инфекцией, вызываемой Staphylococcus aureus, некоагулируемыми staphylococci (т.е., S. epidermidis, S. haemolyticus и тому подобные), Streptococcus pyogenes, Streptococcus agalactiae, Streptococcal групп C-F (мельчайшая колония streptococci), viridans streptococci, Corynebacterium minutissimum, Clostridium spp. или Bartonella henselae; неосложненные острые инфекции мочевого тракта, связанные с инфекцией, вызываемой Staphylococcus aureus, некоагулируемыми видами стафилококков или Enterococcus spp.; уретрит и цервицит; болезни, передаваемые половым путем, связанные с инфекцией, вызываемой Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrhoeae; токсикозы, связанные с инфекцией, вызываемой S. aureus (пищевое отравление и токсический шок), или группами А, В и С streptococci; язвы, связанные с инфекцией, вызываемой Helicobacter pylori; системный лихорадочный синдром, связанный с инфекцией, вызываемой Borrelia recurrentis; болезнь Лайма, связанная с инфекцией, вызываемой Borrelia burgdorferi; конъюнктивит, кератит и дакриоцистит, связанные с инфекцией, вызываемой Chlamydia trachomatis, Neisseria gonorrhoeae, S. aureus, S. pneumonias, S. pyogenes, H. Influenzae или Listeria spp.; диссеминированный Mycobacterium avium комплекс (MAC), связанный с инфекцией, вызываемой Mycobacterium avium или Mycobacterium intracellulare; инфекции, вызываемые Mycobacterium tuberculosis, M. leprae, M. paratuberculosis, M. Kansasii или М. chelonei; гастроэнтерит, связанный с инфекцией, вызываемой Campylobacter jejuni; кишечные протозойные инфекции, связанные с инфекцией, вызываемой Cryptosporidium spp.; стоматологическая инфекция, связанная с инфекцией, вызываемой viridans streptococci; стойкий кашель, связанный с инфекцией, вызываемой Bordetella pertussis; газовая гангрена, связанная с инфекцией, вызываемой Clostridium perfringens или Bacteroides spp.; и атеросклероз или сердечно-сосудистая болезнь, связанные с инфекцией, вызываемой Helicobacter pylori или Chlamydia pneumoniae.
Соединения формулы (I) согласно настоящему изобретению применяются, кроме того, для приготовления лекарственного средства для лечения инфекций, вызываемых такими бактериями, как Е. coli, Klebsiella pneumoniae и другими энтеробактериями, Acinetobacter spp., Stenothrophomonas maltophilia, Neisseria meningitidis. Bacillus cereus. Bacillus anthrauuc, Corynebacterium spp., Propionibacterium acnes и бактероидами spp..
Соединения формулы (I) согласно настоящему изобретению применяются, кроме того, для лечения протозойных инфекций, вызываемых Plasmodium malaria, Plasmodium falciparum, Toxoplasma gondii, Pneumocystis carinii, Trypanosoma brucei и Leishmania spp.
Представленный перечень патогенных микроорганизмов должен рассматриваться только в качестве примеров и никоим образом в качестве лимитирующего перечня.
Один аспект настоящего изобретения относится поэтому к применению соединения формулы (I) по настоящему изобретению или его фармацевтически приемлемой соли для получения лекарственного средства при профилактике или лечении бактериальной инфекции.
Также как в медицине, бактериальные инфекции подлежат лечению с применением соединений формулы (I) (или их фармацевтически приемлемых солей) и в ветеринарии для лечения таких видов животных как, например, свиньи, жвачные, лошади, собаки, кошки и домашняя птица.
Настоящее изобретение относится также к фармакологически приемлемым солям и к композициям и составам на основе соединений формулы (I).
Любая ссылка на соединение формулы (I) подразумевает ссылку на соли (в частности, фармацевтически приемлемые соли) таких соединений, как уместную и целесообразную.
Термин «фармацевтически приемлемые соли» относится к нетоксичным, неорганическим и/или органическим основно-аддитивным солям. Ссылка может быть сделана на публикацию: «Salt selection for basic drugs». Int. J. Pharm. (1986), 33, 201-217.
Фармацевтическая композиция согласно настоящему изобретению содержит, по крайней мере, одно соединение формулы (I) (или его фармацевтически приемлемую соль) в качестве активного агента и необязательно носители и/или разбавители и/или добавки, и может также содержать дополнительно известные антибиотики.
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например, в форме фармацевтических композиций для энтерального и парентерального введения.
Изготовление фармацевтических композиций осуществляется методом, известным любому специалисту в области техники (см., например, Remington, The Science and Practice of Pharmacy, 21st Edition (2005), Part 5, «Pharmaceutical Manufacturing» [published by Lippincott Williams & Wilkins]) путем введения описанных соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими фармацевтически приемлемыми субстанциями, в лекарственную форму вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и, если необходимо, обычными фармацевтическими наполнителями.
Другой аспект по изобретению относится к способу лечения бактериальной инфекции у пациента, заключающему во введении названному пациенту фармацевтически активного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Кроме того, любые предпочтения, указанные для соединения формулы (I) (либо для самого соединения, его солей, композиций, содержащих соединения или его соли, применений соединения или его солей, и т.п.) применимы с соответствующими изменениями к соединениям формулы (ICE).
Более того, соединения формулы (I) могут быть применены для дезинфекции, например, для обработки хирургических инструментов с целью удаления патогенных микробов и бактерий или асептической очистки помещения или поверхностей. Для этих целей соединения формулы (I) могут применяться в виде раствора или спрея.
Согласно изобретению, соединения формулы (I) могут быть получены с помощью методов, описанных ниже.
Получение соединений формулы (I)
Аббревиатуры:
В описании и примерах используются следующие аббревиатуры:
Ас - ацетил, АсОН - уксусная кислота, AD - смесь α-1,4-бис(дигидрохинолин)фталазин, K3Fe(CN)6, K2CO3 и K2OsO4 2Н2О, AD - смесь β-1,4-бис(дигидрохинолин)фталазин, K3Fe(CN)6, K2CO3 и K2OsO4 2H2O, БИНАФ - 2,2'-бис-(дифенилфосфино)-1,1'-бинафталин, Boc - трет-бутоксикарбонил, Cbz - бензилоксикарбонил, КДИ - 1,1'-карбонилдиимидазол, ДЦК - дициклогексилкарбодиимид, ДХМ - дихлорметан, 1,2-ДХЭ - 1,2-дихлорэтан, ДЭАД - диэтилазодикарбоксилат, (DHQ)2PHAL - 1,4-бис(дигидрохинин)фталазин), (DHQD)2PHAL - 1,4-бис(дигидрохинидин)фталазин), ДИАД - диизобутилазодикарбоксилат, ДИБАГ - диизобутилалюминийгидрид, ДИПЭА - N,N-диизопропилэтиламин, ДМАП - 4-диметиламинопиридин, 1,2-ДМЭ - 1,2-диметоксиэтан, ДМФ - N,N-диметилформамид, ДМСО - диметилсульфоксид, DPEphos - бис(2-дифенилфосфинофенил)эфир, ЭА - этилацетат, ЭДС1 - гидрохлорид 1-(3-диэтиламинопропил)-3-этилкарбодиимида, ЭСН - ионизация электрораспылением, экв, - эквивалент, эфир - диэтиловый эфир, Et - этил, ВВ - условия высокого вакуума, КГМДС - гексаметилдисилазид калия, ВЭЖХ - высокоэффективная жидкостная хроматография, ЛДА - литийдиизопропиламид, м-ХПБК - м-хлорпербензойная кислота, Me - метил, MeCN - ацетонитрил, мин -минута, МС - масс-спектроскопия, Мс - метансульфонил (мезил), n-Bu - н-бутил, NMO - N-оксид N-метилморфолина, N-МП - N-метилпирролидон, Pd/C - палладий на угле, Ph - фенил, рац. - рацемический, RT - комнатная температура, ТБАФ - тетрабутиламмонийфторид, ТБДМС - трет-бутилдиметилсилил, TБДMCOTf - трет-бутилдисилилтрифторметансульфонат, tBu - трет-бутпл, ТЭА - триэтиламин, TEMPO - 2,2,6,6-тетраметил-1-пиперидинилокси-, Tf - трифторметансульфонил (трифлил), ТФК - трифторуксусная кислота, ТГФ - тетрагидрофуран, ТМС - триметилсилил, Ts - п-толуолсульфонил, Z (в аминокислотах) - бензилоксикарбонил.
Общие реакционные методы:
Общий реакционный метод 1: защита аминогруппы
Амины обычно защищают такими группами, как Аллок, Cbz, Boc или Фмок. При этом используют реакцию амина с аллил или бензилхлорформиатом, ди-трет-бутилдикарбонатом или Фмок-С1 в присутствии основания такого, как NaOH, ТЭА, ДМАП или имидазол. Они могут быть защищены в виде N-бензильных производных, полученных посредством реакции с бензилбромидом или бензилхлоридом в присутствии основания такого, как Na2CO3 или ТЭА. Альтернативно, N-бензильные производные могут быть получены посредством восстановительного аминирования в присутствии бензальдегида и боргидридного реагента такого, как NaBH4, NaBH3CN или NaBH(ОАс)3 в растворителе таком, как EtOH. Кроме того, методы включают другие защитные аминные группы, описанные в Protecting Groups in Organic Synthesis, 3rd Ed (1999), 494-653; T.W.Greene, P.G.M. Wuts (Publisher: John Wiley and Sons, Inc., New York, N.Y.).
Общий реакционный метод 2: защита гидроксильной группы:
Спирты защищают, превращая их в силильные эфиры (обычно ТБДМС или ТБДФС), используя реакцию спирта с требуемым силилхлоридом (ТБДМС-С1 или ТБДФС-С1) в присутствии основания такого, как имидазол или ТЭА в растворителе таком, как ДХМ или ДМФ, в температурном интервале от +10°С до +40°С. ТБДМС группа может быть также введена путем реакции с ТБДМСОТгв присутствии лутидина. Кроме того, методы включают другие защитные спиртовые группы, описанные в Protecting Groups in Organic Synthesis, 3rd Ed (1999), 23-147; T.W.Greene, P.G.M. Wuts (Publisher: John Wiley and Sons, Inc., New York, N.Y.).
Общий реакционный метод 3: снятие защиты с гидроксильной группы:
Силилэфирные группы удаляют либо с помощью использования источников аниона фтора таких, как ТБАФ в ТГФ, HF в MeCN или пиридин HF в ТГФ в температурном интервале от 0°С до +40°С, или в кислых условиях, используя АсОН в смеси ТГФ/МеОН или HCl в МеОН. Другие методы удаления ТБДМС и ТБДФС групп приведены в публикации: Protecting Groups in Organic Synthesis 3rd Ed; 1999, 133-139 и 142-143 соответственно; T.W.Greene, P.G.M. Wuts; (Publisher: John Wiley and Sons, Inc., New York, N.Y.). Другие общие методы удаления защитных спиртовых групп описаны в публикации: Protecting Groups in Organic Synthesis, 3rd Ed (1999), 23-147; T.W.Greene, P.G.M. Wuts (Publisher: John Wiley and Sons, Inc., New York, N.Y.).
Общий реакционный метод 4: получение оксазолидинона через глицедиловые сложные эфиры:
Соответствующие карбаматы, полученные из анилина или 2-аминопиридина, вводят в реакцию в сухом растворителе таком, как ТГФ или ДМФ, с сильным органическим основанием таким, как н-BuLi в температурном интервале от -100°С до +30°С, или с трет-BuOLi или трет-BuOK или КНМДС при температуре от -100°С до -30°С в ДМФ или ТГФ. Анион реагирует при этих температурах с соответствующим эпоксидом, после чего реакционную смесь оставляют самопроизвольно нагреваться до комнатной температуры.
Общий реакционный метод 5: катализируемые металлом реакции поперечной конденсации для N и О арилирования:
Ароматический галогенид или трифлат вводят в реакции с соответствующим амином в присутствии палладиевого катализатора (как описано в: J. Am. Chem. Soc. (1997), 119, 3395-96 или J. Org. Chem. (2007), 72, 2232-2235) и основания такого, как трет-BuOK или ЛДА при температуре от +20°С до +100°С. В варианте Голдберга реакцию осуществляют, используя ароматический галогенид или трифлат и пактам, карбамат или амин в присутствии CuI, неорганическое основание такое, как K2CO3 или K3PO4 в температурном интервале от +40°С до +110°С, как описано в: Tetrahedron Letters (2006), 47, 1181-86 или J. Am. Chem. Soc. (2001), 123, 7727-29. Для катализируемого металлом N-арилирования 2-оксазолидинонов реакцию осуществляют в присутствии CuI, 1,1,1-трис(гидроксиметил)этана и Cs2CO3 (Org. Lett. (2006), 8, 5609-5612) или Pd(OAc)2 и ДФЭфос в присутствии K3PO4 (J. Org. Chem. (2007), 72, 2232-2235).
Общий реакционный метод 6: реакция Митцунобу:
Конденсация по Митцунобу была предложена О. Mitsunobu in Synthesis (1981), 1. Реакция между фенолом, триолом или сульфонамидом и спиртом осуществляется в присутствии ДЭАД или ДИАД и PPh3. Реакция может быть проведена с использованием ряда растворителей таких, как ДМФ, ТГФ или ДХМ, и в широком интервале температур (от -78°С до 50°С).
Общий реакционный метод 7: алкилирование:
Производное амина вводят в реакцию с соединением формулы алкил-L2, где L2 представляет собой OMs, OTf, OTs, Cl, Br или I, или соответствующим производным, имеющим боковую группу L2, как отмечено ранее, аллильным или гомоаллильным галогенидом в присутствии неорганического основания такого, как K2CO3, или органического основания такого, как ТЭА, в растворителе таком, как ТГФ, в температурном интервале от 0°С до +80°С. Подробные детали могут быть найдены в: Comprehensive Organic Transformations. A guide to Functional Group Preparations; 2nd Edition, R.C.Larock, Wiley-VC; New York, Chichester, Weinheim, Brisbane, Singapore, Toronto, (1999). Section Amines, p.779.
Общий реакционный метод 8: активация спирта:
Спирт вводят в реакцию с MsCl, TfCl или TsCI в присутствии основания такого, как ТЭА, в сухом апротонном растворителе таком, как пиридин, ТГФ или ДХМ, в температурном интервале от -30°С до +50°С. В случае трифторметансульфоната или метансульфоната могут быть также использованы Tf2O или Ms2O. Эти сульфонаты могут быть введены в реакцию с йодидом натрия в ацетоне в температурном интервале от +40°С до +80°С с получением соответствующего йодпроизводного.
Общий реакционный метод 9: амидная конденсация:
Карбоновую кислоту вводят в реакцию с амином в присутствии активирующего агента такого, как ДЦК, ЭДCI, ГОБТ, ангидрид н-пропилфосфоновой кислоты, ГАТУ, КДИ или ди-(N-сукцинимидил)карбонат, в сухом апротонном растворителе таком, как ДХМ, MeCN или ДМФ, в температурном интервале от -20°С до +60°С (см.: G. Benz in Comprehensive Organic Synthesis, B.M. Trost, I. Fleming, Eds; Pergamon Press: New York (1991), vol. 6, p.381). Альтернативно, карбоновая кислота может быть активирована путем превращения ее в соответствующий хлорангидрид посредством реакции с оксалилхлоридом или тионилхлоридом, неразбавленными или разбавленными растворителем типа ДХМ, в температурном интервале от -20°С до +60°С. Другие активирующие агенты могут быть найдены в публикации: Comprehensive Organic Transformations. A guide to Functional Group Preparations; 2 Edition, R.C.Larock, Wiley-VC; New York, Chichester, Weinheim, Brisbane, Singapore, Toronto, 1999. Section nitriles, carboxylic acids and derivatives, p.1941-1949.
Общий реакционный метод 10: цис-дигидроксилирование:
Диол получают дигидроксилированием соответствующего этиленового производного с использованием каталитического количества тетроксида осмия в присутствии сооксиданта такого, как NMO в водном растворителе таком, как смеси ацетона с водой или ДХМ с водой (см.: Cha, J.K. Chem. Rev. (1995), 95, 1761-1795). Хиральные цис-диолы получают с использованием AD-смеси α или AD-смеси β в присутствии метансульфонамида в смеси вода/2-метил-2-пропанол, как описано в Chem. Rev. (1994), 94, 2483. Ориентация индукции зависит от хирального лиганда, содержащегося в AD смеси, либо дигидрохинин-основного лиганда в AD-смеси α, либо дигидрохинидин-основного лиганда в AD-смеси β.
Общий реакционный метод 11: удаление аминозащитных групп:
Бензилкарбаматы освобождаются от защиты посредством гидрогенолиза над катализаторами из благородных металлов (например, Pd/C или Pd(OH)2/C). Вос-группа удаляется в кислых условиях таких, как HCl в органическом растворителе таком, как метиловый спирт или диоксан, или ТФК (неразбавленная или разбавленная), в растворителе таком, как ДХМ. Другие общие методы удаления защитных аминогрупп описаны в: Protecting Groups in Organic Synthesis, 3rd Ed (1999), 494-653; T.W.Greene, P.G.M. Wuts (Publisher: John Wiley and Sons, Inc., New York, N.Y.).
Общий реакционный метод 12: удаление защиты с кетальных групп:
Кеталь превращают в соответствующий кетон в кислых условиях с применением разбавленного водного раствора HCl в МеОН, разбавленного водного раствора АсОН, или с использованием кислотных смол таких, как Amberlite IR120H или DOWEX
50W8, в смеси вода-растворитель такой, как МеОН/вода или ТГФ/вода, в температурном интервале от 20°С до 80°С.
Общий реакционный метод 13: окисление спиртов в кислоты:
Спирты могут быть могут быть непосредственно окислены в соответствующие кислоты с использованием различных методов, описанных в: Comprehensive Organic Transformations. A guide to Functionnal Группа Preparations; 2nd Edition, R.C.Larock, Wiley-VC; New York, Chichester, Weinheim, Brisbane, Singapore, Toronto, 1999. Section nitriles, carboxylic acids and derivatives, p.1646-1648. Среди этих методов часто используются [бис(ацетокси)йод]бензол в присутствии ТЕМПО, реагенты Джонса (CrO3/H2SO4), NaIO4 в присутствии RuCl3, KMnO4 или пиридин/H2Cr2O7.
Общий реакционный метод 14: получение алкена посредством реакции конденсации по Виттигу или Жюлиа:
Реакция Виттига:
Алкен RaCH=CHRb может быть получен с помощью реакции RaCHO с фосфораном Ph3P=CHRb. Для реакции используется широкий выбор растворителей таких, как, например, толуол или ТГФ, в температурном интервале от -10°С до 100°С. Требуемый фосфоран получают из соответствующего галогенида фосфония Ph3P+CH2RbHal- (Hal обозначает атом галогена) в присутствии основания такого, как алкилат калия (например, трет-BuOK), LiHMДC, КНМДС или н-BuLi. Соль фосфония получают из соответствующего галогенида HalCH2Rb и PPh3 при нагревании с обратным холодильником в растворителе таком, как толуол или MeCN.
Конденсация Жюлиа:
Алкен RaCH=CHRb может быть получен при использовании реакции конденсации по Жюлиа сульфона RbCH2SO2Rc и альдегида RaCHO в присутствии основания такого, как LiHMДC или КНМДС, в растворителе таком, как 1,2-ДМЭ, ДМФ или толуол, как описано Blakemore, P.R in J. Chem. Soc., Perkin, Trans. 1 (2002), 2563-2585. Требуемый сульфон получают из соответствующего сульфида RbCH2SRc с помощью окисления. Для осуществления этой реакции может быть использован целый ряд окислительных агентов таких, как м-ХПБК в растворителе таком, как ДХМ, oxone® в растворителе таком, как водный раствор МеОН (см.: Tetrahedron Lett. (1981), 22, 1287), или водный раствор перекиси водорода в присутствии тетрагидрата гептамолибдата аммония в EtOH (см.: J. Org. Chem. (1963), 28, 1140). Сульфид получают из соответствующего спирта RbCH2OH, используя реакцию конденсации Митцунобу. Альтернативный путь получения промежуточного сульфида требует превращения спирта RbCH2OH в активный йодид с последующим применением общего реакционного метода 8. Последний служит в качестве алкилирующего агента 1-фенил-1Н-тетразол-5-тиола. Реакция алкилирования осуществляется в присутствии неорганического основания такого, как КОН или NaOH, в растворителе таком, как EtOH, в температурном интервале от -20°С до 70°С. Алкен RaRa'C=CHRb может быть получен реакцией кетона RaCORa' с фосфораном Ph3P=CHRb, как описано выше.
Общий реакционный метод 15: гидролиз сложного эфира до карбоновой кислоты:
Когда сложноэфирная боковая цепь представляет собой линейный алкил, гидролиз обычно проводится путем обработки гидроксидом щелочного металла такого, как LiOH, КОН или NaOH в смеси вода/диоксан или вода/ТГФ, в температурном интервале от 0°С до +80°С. Когда сложноэфирная боковая цепь представляет собой трет-Bu, гидролиз может быть проведен с использованием концентрированной или разбавленной ТФК, или HCl в органическом растворителе таком, как эфир или ТГФ. Когда сложноэфирная боковая цепь представляет собой аллильную группу, реакция осуществляется в присутствии тетракис(трифенилфосфин)палладия(0) в присутствии акцептора аллильного катиона такого, как морфолин, димедон или гидрид трибутилолова, в температурном интервале от 0°С до +50°С, в растворителе таком, как ТГФ. Когда сложноэфирная боковая цепь представляет собой бензил, реакция осуществляется в атмосфере водорода в присутствии благородного металла в качестве катализатора такого, как Pd/C, в растворителе таком, как МеОН, ТГФ или ЭА. Дальнейшие методики, включающие введение других защитных кислотных групп и общие методы их удаления, описаны в: Protecting Groups in Organic Synthesis, 3rd Ed (1999), 369-441; T.W. Greene, P.G.M. Wuts (Publisher: John Wiley and Sons, Inc., New York, N.Y.).
Общий реакционный метод 16: восстановление кетонов и альдегидов до соответствующих спиртов:
Альдегиды и кетоны могут быть восстановлены до соответствующих спиртов с использованием широкого ряда восстановительных агентов, как описано Larock, R.C. in Comprehensive Organic Transformations A guide to Functional Группа Preparations, 2nd Ed., Wiley, New York, Chichester, Weinheim, Brisbane, Singapore, Toronto (1999), Section Alcohols and phenols; p.1075-1110. Наиболее предпочтительными среди них являются LiAlH4 и NaBH4.
Общий реакционный метод 17: восстановление сложного эфира в соответствующий спирт:
Сложный эфир может быть восстановлен в соответствующий спирт с использованием различных восстанавливающих агентов, как описано by Larock, R.С. in Comprehensive Organic Transformations A guide to Functional Группа Preparations, 2nd Ed., Wiley, New York, Chichester, Weinheim, Brisbane, Singapore, Toronto (1999), Section Alcohols and phenols; p.1114 to 1120. Наиболее предпочтительными среди них являются LiAlH4 или ДИБАН.
Общий реакционный метод 18: восстановительное аминирование:
Реакцию между амином и альдегидом или кетоном проводят в условиях с использованием растворителей, позволяющих удалять образовавшуюся воду с помощью физических или химических методов (например, путем дистилляции азетропной смеси растворитель-вода или с применением осушающих агентов таких, как молекулярные сита, MgSO4 или Na2SO4). Такими растворителями обычно являются толуол, гексан, ТГФ, ДХМ или 1,2-ДХЭ, или смесь растворителей такая, как 1,2-ДХЭ/МеОН. Реакцию можно катализировать, используя следы кислоты (обычно АсОН). Промежуточно образующийся имин восстанавливают с помощью подходящего восстановительного агента (например, NaBH4, NaBHCN3 или NaBH(ОАс)3) или посредством гидрогенизации над катализатором из благородного металла таким, как Pd/C. Реакция протекает в температурном интервале от -10°С до 110°С, предпочтительно в интервале от 0°С до 60°С. Реакция может быть также проведена в одной емкости, в протонных растворителях таких, как МеОН или вода, в присутствии комплекса пиколин-боран (Tetrahedron (2004), 60, 7899-7906).
Общие препаративные методы:
Получение соединений формулы (I):
Соединения формулы (I) могут быть получены с помощью методов, приведенных ниже, методов, приведенных в примерах или аналогичными методами. Оптимальные реакционные условия могут варьироваться в зависимости от особенностей используемых реагентов или растворителей, но такие условия могут быть изменены специалистом в области техники путем оптимизации методик.
В разделах а)-п), представленных далее, описываются общие методы получения соединений формулы (I). Получение сложных промежуточных соединений и основных структурных блоков описаны далее. Общие синтетические методы, неоднократно используемые в схемах, представленных ниже, описаны выше в главе, озаглавленной «Общий реакционный методы». Если не указано иначе, общие группы U, V, W, X, R1, R2, R3, А, K, G, m и n имеют значения, приведенные для формулы (I).
а) Соединения формулы (I) могут быть получены реакцией соединения формулы (II)
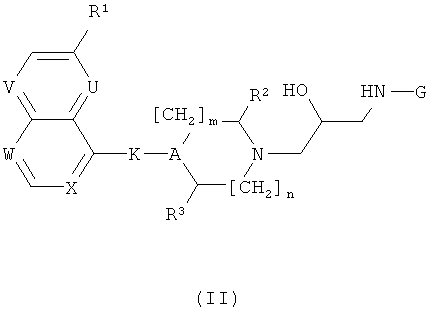
с производными карбоновой кислоты формулы (III)
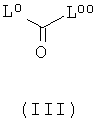
где L0 и L00 оба представляет собой хлор, OCCl3, имидазолил или сукцинимидилоксигруппу, или L0 представляют собой хлор и L00 представляет собой OCCl3. Эта реакция предпочтительно проводится в сухом апротонном растворителе таком, как ДХМ или ТГФ, в присутствии органического основания такого, как ТЭА или пиридин, в температурном интервале от -30°С до +80°С. В случае присутствия одной или более свободных спиртовых или аминогрупп на А, К, R2 или R3, эти функциональные группы защищают (см. общие реакционные методы 1 и 2) перед реакцией и удаляют после проведения реакции (см. общие реакционные методы 3 и 11).
б) Соединения формулы (I) могут быть также получены с помощью реакции соединения формулы (IV)
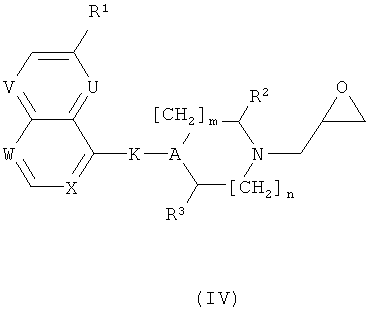
с анионом соединения формулы (V)
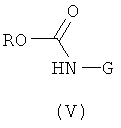
где R представляет собой алкил или бензил. Эту реакцию проводят с помощью общего реакционного метода 4.
в) Соединения формулы (I), где А обозначает CH и К обозначает О или ОСН2 могут быть получены реакцией соединения формулы (VI)
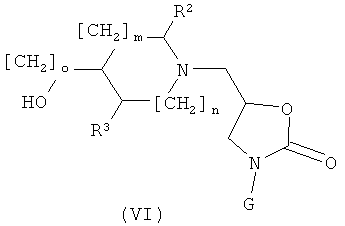
где о представляет собой 0 или 1, с соединением формулы (VII)
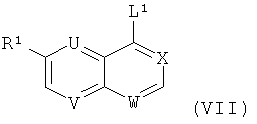
где L1 представляет собой хлор, бром или OTf, в растворителе таком, как диоксан, N-МП или ДМФ, в температурном интервале от около +20°С до около +120°С, необязательно в присутствии катализатора, как описано в общем реакционном методе 5, или, когда L1 представляет собой ОН, в условиях реакции Митцунобу, следуя общему реакционному методу 6.
г) Соединения формулы (I), где А обозначает СН и K обозначает NHCO, могут быть получены реакцией соединения формулы (VIII)
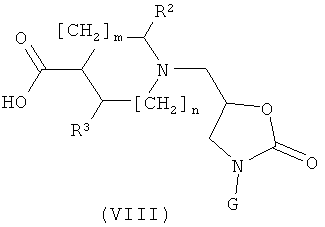
с соединением формулы (VIIa,)
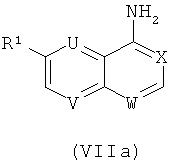
следуя общему реакционному методу 9.
Альтернативно, соединения формулы (I), где А обозначает СН и К обозначает NHCO, могут быть также получены реакцией карбоксамидов, полученных, в свою очередь, из карбоновых кислот формулы (VIII), с соединениями формулы (VII), где L представляет собой OTf, следуя общему реакционному методу 5.
д) Соединения формулы (I) могут быть, кроме того, получены конденсацией соединения формулы (IX)
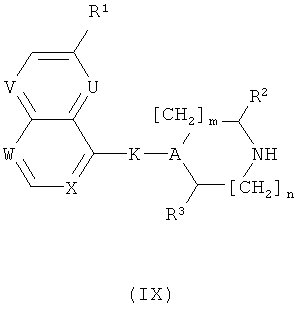
с соединением формулы (X)
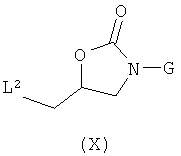
где L2 представляет собой OMs, OTf, OTs, хлор, бром или йод, следуя общему реакционному методу 7.
е) Соединения формулы (I), где А обозначает СН и К обозначает СН=СН, могут быть получены реакцией соединения формулы (XI)
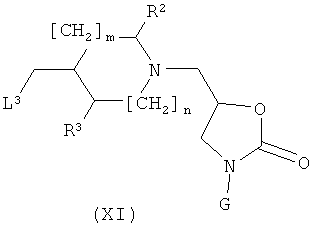
где L3 представляет собой P+Ph3 Hal- или SO2Rd, где Rd обозначает 1-фенил-1Н-тетразол-5-ил или бензотиазол-2-ил и Hal представляет собой галоген, с соединением формулы (XII)
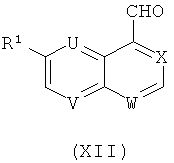
в растворителе таком, как толуол, диоксан или ТГФ, в температурном интервале от около -20°С до около +120°С, в присутствии основания, как описано в общем реакционном методе 14.
ж) Соединения формулы (I), где КА обозначает СН=С, могут быть получены реакцией соединения формулы (XIII)

с соединением формулы (XIV)
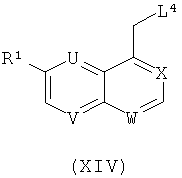
где L4 обозначает Р+Ph3 Hal-, Hal представляет собой галоген, в растворителе таком, как толуол, диоксан или ТГФ, в температурном интервале от около -20°С до около +120°С, в присутствии основания, как описано в общем реакционном методе 14.
з) Соединения формулы (I) могут, кроме того, быть получены реакцией соединения формулы (XV)
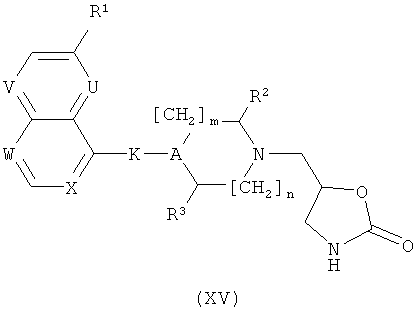
с соединением формулы L5-G, где L5 представляет собой OTf или галоген такой, как бром или йод. Эту реакцию проводят, следуя общему реакционному методу 5. В случае, когда группа G является такой, что Z представляет собой N, реакцию проводят в присутствии NaH.
и) Соединения формулы (I), где А обозначает СН и К обозначает СН2СН2, могут быть получены гидрированием соответствующего соединения формулы (I), где К обозначает СН=СН, над катализатором из благородного металла таким, как Pd/C.
й) Соединения формулы (I), где А обозначает CH и К обозначает СН(ОН)СН(ОН), могут быть получены путем цис-дигидроксилирования соответствующего соединения формулы (I), где К обозначает СН=СН, следуя общему реакционному методу 10.
к) Соединения формулы (I) где А обозначает СНОН и К обозначает СН(ОН), могут быть получены путем цис-дигидроксилирования соответствующего соединения формулы (I), где К представляет собой CHR5, А представляет собой CR4 и R4 вместе с R5 образует связь (то есть К-А представляет собой СН=С), следуя общему реакционному методу 10.
л) Соединения формулы (I), где K обозначает NH или NHCH2, могут быть получены из аминов формулы (XIa)
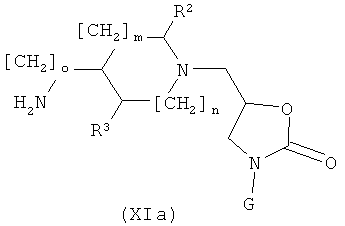
где о=0 или 1, с соединением формулы (VII), где L1 обозначает OTf, следуя общему реакционному методу 7.
м) Соединения формулы (I), где R3 обозначает NH2 или R2 обозначает CH2NH2, могут быть получены из соответствующих производных формулы (I), где R3 обозначает N3 или R2 обозначает CH2N3, реакцией с PPh3 в присутствии воды.
н) Соединения формулы (I), где R3 обозначает NHCOR6, получают из соответствующих соединений формулы (I), где R3 обозначает NH2, после реакции с соединением формулы R6COZ, где Z представляет собой ОН или галоген, следуя общему реакционному методу 9.
о) Соединения формулы (I), где R3 обозначает триазол-1-ил или R2 обозначает триазол-1-илметил, могут быть получены из соответствующих производных формулы (I), где R3 обозначает N3 или R2 обозначает CH2N3, с помощью реакции с ацетиленом или бицикло[2.2.1]гепта-2,5-диеном.
п) Соединения формулы (I), где К обозначает CH2NH и А обозначает СН, могут быть получены путем восстановительного аминирования аминов формулы (XIa), где о=0, с альдегидами формулы (XII), следуя общему реакционному методу 18.
Соединения формулы I, полученные согласно вышеуказанным общим синтетическим методам, затем могут быть, при необходимости, превращены в их соли, предпочтительно в их фармацевтически приемлемые соли.
Кроме того, когда соединения формулы (I) получают в виде смеси энантиомеров, энантиомеры могут быть разделены с использованием методов, известных специалистам в области техники: например, путем образования и разделения диастереомерных солей, или с помощью ВЭЖХ над хиральной стационарной фазой такой, как Regis Whelk-O1(R,R) (10 мкм) колонка, Daicel ChiralCel OD-H (5-10 мкм) колонка, или Daicel ChiralPak IA (10 мкм) или AD-Н (5 мкм) колонка. Типичными условиями проведения хиральной ВЭЖХ являются: изократное применение смеси элюента A (EtOH, в присутствии или отсутствии амина такого, как триэтиламин, диэтиламин) и элюента Б (гексан), при скорости истечения от 0,8 до 150 мл/мин.
Получение соединений формулы (II) и (IV):
Соединения формулы (II) и (IV) могут быть получены, как представлено на нижеприведенной схеме 1.
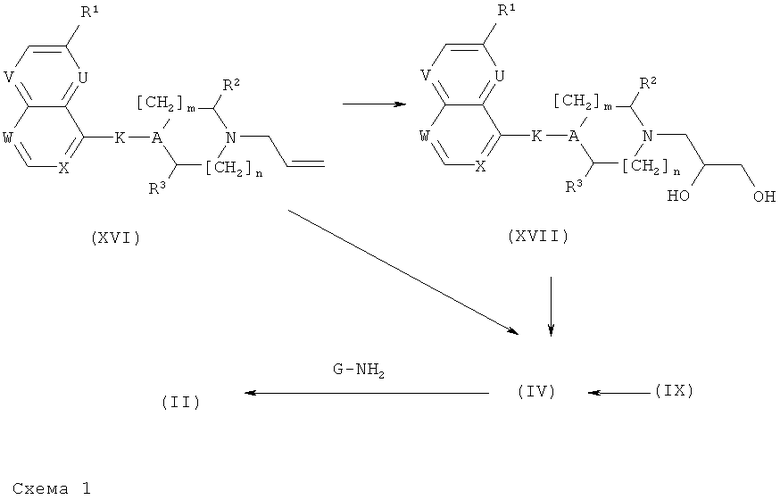
Аллильные производные формулы (XVI) могут быть превращены (схема 1) в соответствующие эпоксиды формулы (IV) либо посредством прямого эпоксидирования концевой двойной связи, или посредством цис-дигидроксилирования с помощью OsO4/NMO (общий реакционный метод 10), или, как описано V. Van Rheenen et al. in Tetrahedron Lett. (1976), 23, 1973-76, с последующей конверсией в соответствующие эпоксиды после мезилирования или тозилирования, и замыкания кольца в основных условиях с применением, например, ТЭА. В случае, когда требуются хиральные эпоксиды, они могут быть получены посредством гидролитического кинетического разделения (ГКР), катализируемого хиральным (salen)-Co(III) комплексом (например, [(R,R)-N,N'-бис-(3,5-ди-трет-бутилсалицилиден)-1,2-циклогександиаминато-(2-)]кобальт(III) рацемической смеси эпоксидов, как описано Jacobsen et al. in J. Am. Chem. Soc. (2002), 124, 1307-1315 и Science (1997), 277, 936-938. Альтернативно, хиральные эпоксиды могут быть получены из аллильных производных формулы (XVI) посредством или Shi хирального эпоксидирования с использованием хирального кетона, как описано в Асе. Chem Res. (2004), 37, 488-496, или посредством хирального цис-дигидроксилирования с использованием AD смесей, следуя общему реакционному методу 10, с последующим образованием мезилата первичного спирта, следуя общему реакционному методу 8, и образования эпоксида в основных условиях.
Эпоксиды формулы (IV) могут быть также получены (схема 1) реакцией аминов формулы (IX) с эпихлоргидрином, или, необязательно, с одним из двух энантиомеров эпихлоргидрина, необязательно в присутствии MgSO4, с последующим образованием эпоксида после обработки основанием таким, как трет-BuOK в ДМФ.
Эпоксиды формулы (IV) могут быть затем введены в реакцию с аминами формулы G-NH2, приводящую к соединениям формулы (II).
В случае ароматического N-оксида или N-оксида третичного амина, образующихся во время окислительной стадии, они могут быть восстановлены до соответствующего нафтиридина, хинолина или хиназолина или до соответствующего третичного амина посредством дезоксигенирования цинковой пылью в кислой среде и ангидридом уксусной и муравьиной кислоты, соответственно, как описано в Bioorg. Med. Chem. Lett. (2007), (17), 3322-3329 и Chemistry Letters (1985), 10, 1517-1520.
Получение соединений формулы (V):
Карбаматы формулы (V) могут быть получены из соответствующих (обычно коммерчески доступных) аминов формулы G-NH;, следуя общему реакционному методу 1.
Получение соединений формулы (VI) и (VIII):
Соединения формулы (VI) и (VIII) могут быть получены, как представлено на нижеприведенной схеме 2.
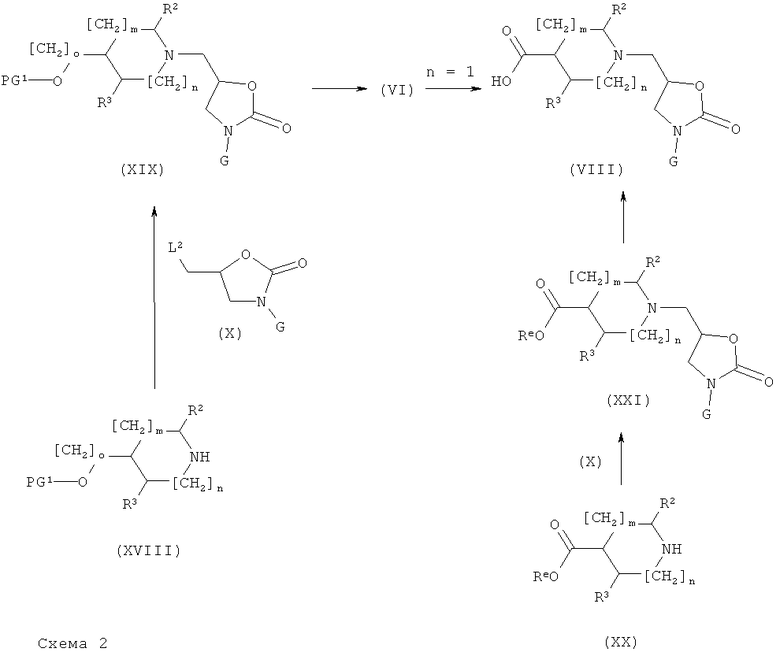
На схеме 2, PG представляет собой силильную защитную группу такую, как ТБДМС или ТБДФС, Re представляет собой алкильную группу такую, как метил или этил, или бензильную группу.
Амины формулы (XVIII) могут быть введены в реакцию (схема 2) с производными формулы X, где L2 представляют собой OMs, OTf, OTs, хлор, бром или йод, следуя общему реакционному методу 7. Соединения формулы (VI) получают путем удаления защитной группы с промежуточного соединения формулы (XIX), следуя общему реакционному методу 3.
Соединения формулы (VIII) могут быть получены путем гидролиза сложноэфирной группы промежуточных соединений формулы (XXI), следуя общему реакционному методу 15. Эти соединения могут быть также получены окислением соединений формулы (VI), где n=1, следуя общему реакционному методу 13. Соединения формулы (XXI) получают из промежуточных соединений формулы (XX) и (X) (где L2 представляет собой OMs, OTf, OTs, хлор, бром или йод), используя общий реакционный метод 7.
Получение соединений формулы (VII):
Требуемые хинолин, [1,5]-нафтиридин, хиназолин и хиноксалин производные формулы (VII), где L1 представляет собой Br, или коммерчески доступны, или могут быть получены согласно литературным методам. Например, соединения, где L1=Br, W=N и X=V=U=CH, получают согласно WO 2003/087098, соединения, где L1=Br, W=V=N и Х=U=CH, получают согласно WO 2006/032466, соединения, где L1=Br, Х=N и U=V=W=CH, или где L1=Cl, W=N и Х=V=U=CH, получают согласно WO 2004/089947, и соединения, где L1=Cl, V=N и X=W=U=CH, получают согласно WO 2005/019215.
Соединения формулы VII, где L1=Br, могут быть получены из соединений формулы (VIIb)
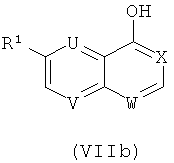
с помощью реакции PBr3 в ДМФ при температуре около 40°С.
Соединения формулы (VII), где L1=OTf, могут быть получены из соединений формулы (VIIb), по определению выше, посредством реакции Tf2O (используя общий реакционный метод 8) или N,N-бис(трифторметансульфонил)анилина в присутствии ТЭА.
Получение соединений формулы (VIIa):
Соединения формулы (VIIa) могут быть получены реакцией соответствующих соединений формулы (VII), где L1 представляет собой OTf, с аммиаком в растворителе, подобном ДХМ или ТГФ, или с гидрохлоридом н-пропиламина в пиридине, в температурном интервале от -20°С до 100°С (R. Radinov, Synthesis (1986), 886). 4-Аминохиназолиновые производные формулы (VIIa) могут быть также получены из соответствующих соединений формулы (VII), где L1 представляет собой хлор, посредством реакции с аммиаком в тех же самых условиях.
Получение соединений формулы (VIIb):
Соединения формулы (VIIb) коммерчески доступны или могут быть получены согласно методам, описанным в WO 2006/32466 (V=N и X=U=W=СН), или в WO 2004/02490 (U=V=N и X=W=CH).
Получение соединений формулы (IX):
Соединения формулы (I)Х могут быть получены, как представлено на нижеприведенной схеме 3.
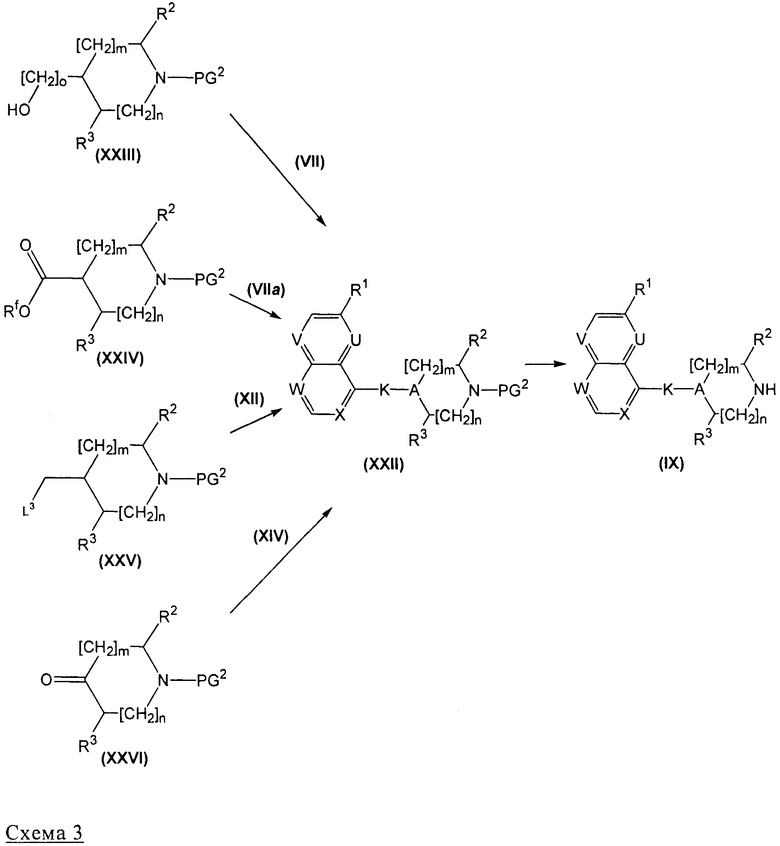
На схеме 3, PG2 представляет собой аминозащитную группу такую, как Cbz или Boc.
Соединения формулы (IX) могут быть получены (схема 3) путем удаления защитной группы с соединения формулы (XXII), следуя общему реакционному методу 11.
Соединения формулы (XXII), где К обозначает О(СН2)n, и n=0 или 1, могут быть получены (схема 3) реакцией производных формулы (VII), где L1 представляет собой бром или OTf, со спиртами формулы (XXIII), где n=0 или 1, как описано в части в) раздела «Получение соединений формулы (I)».
Соединения формулы (XXII), где К обозначает NHCO, могут быть получены (схема 3) реакцией аминопроизводных формулы (VIIa) с кислотами формулы (XXIV), где Rf обозначает Н, как описано в главе «Получение соединений формулы (I)», часть г).
Соединения формулы (XXII), где К обозначает СН=СН, могут быть получены (схема 3) реакцией альдегидов формулы (XII) с соединениями формулы (XXV), где L3 представляет собой Р+Ph3 Hal- или SO2Rd, где Rd обозначает 1-фенил-1Н-тетразол-5-ил или бензотиазол-2-ил, Hal представляет собой атом галогена, как описано в главе «Получение соединений формулы (I)», часть е).
Соединения формулы (XXII), где K-А обозначает СН=С, (то есть, где К представляет собой CHR5, А представляет собой CR4 и R4 вместе с R5 образует связь) могут быть получены (схема 3) реакцией кетоновых производных формулы (XXVI) с соединениями формулы (XIV), где L4 представляет собой Р+Ph3 Hal-, a Hal представляет собой атом галогена, как описано в разделе «Получение соединений формулы (I)», часть ж).
Соединения формулы (XXII), где К обозначает СН2СН2, могут быть получены посредством гидрирования производных формулы (XXII), где К обозначает СН=СН, как описано в главе «Получение соединений формулы (I)», часть и). В особом случае, где PG2 обозначает Cbz, соединение формулы (IX), где К обозначает СН2СН2, получают прямым способом.
Кроме того, соединения формулы (XXII), где КА обозначает СНОНС(ОН), могут быть получены посредством цис-гидроксилирования производных формулы (XXII), где КА обозначает СН=С, как описано в разделе «Получение соединений формулы (I)», часть к).
Получение соединений формулы (X):
Соединения формулы (X) могут быть получены или путем разрыва трет-бутил-диметилсилилэфира с помощью аминов формулы G-NH2, с последующим образованием оксазолидинона, следуя методу, описанному в части а) главы «Получение соединений формулы (I)», и удалением ТБДМС защитной группы, используя общий реакционный метод 3, или из карбаматов формулы (V) и глицидилбутирата, используя общий реакционный метод 4, с последующей конверсией гидроксигруппы в OMs, OTf, OTs, хлор, бром или йодгруппу, с использованием методов, описанных в главе «Общие реакционные методы 8».
Получение соединений формулы (XI):
Соединения формулы (XI), где L3 обозначает PPh3 +Hal- получают из соединений формулы (VI), где о=1, после превращения спиртовой функции в соответствующий мезилат и галогенид, следуя общему реакционному методу 8, и реакцией с PPh3. Соединения формулы (XI), где L3 обозначает SO2Rd, получают из спирта формулы (VI), где о=1, используя общий реакционный метод 14 в разделе, описывающим конденсацию по Жюлиа.
Получение соединений формулы (XIa):
Соединения формулы (XIa) получают посредством превращения соединений формулы (VI) в их соответствующие мезилаты, используя общий реакционный метод 8, с последующей реакцией с азидом натрия и восстановлением азидной группы в соответствующий амин с помощью PPh3 и воды.
Получение соединений формулы (XII):
Требуемые хинолиновые, [1,5]-нафтиридиновые, хиноксалиновые и хиназолиновые производные формулы (XII), где R1 обозначает ОМе, или коммерчески доступны, или могут быть получены с использованием описанных в литературе методов. Например, соединения, где U=W=N и X=V=СН, получают согласно WO 2006/032466, соединения, где V=N и W=X=U=СН, получают согласно WO 2006/032466, соединения, где U=V=N и W=X=СН, получают согласно WO 2006/021448 и соединения, где U=N и V=W=X=CH, получают согласно WO 2006/046552.
Получение соединений формулы (XIII):
Соединения формулы (XIII), где R3 обозначает Н, могут быть получены, как представлено на нижеприведенной схеме 4.
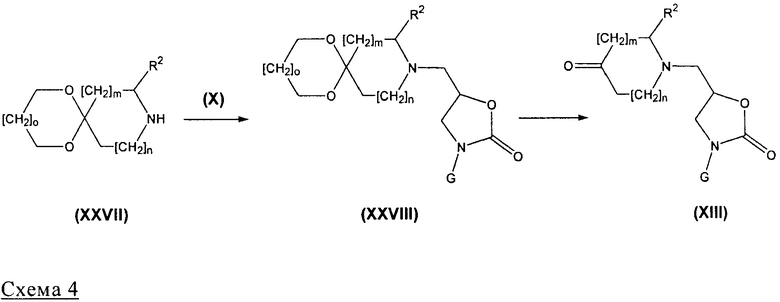
На схеме 4 о=0 или 1.
Соединения формулы (XIII) могут быть получены (схема 4) с помощью кислотного удаления защитной группы с кетальной функции соединения формулы (XXVIII), используя общий реакционный метод 12. Соединения формулы (XXVIII) получают из соединений формулы (XXVII) и (X), следуя общему реакционному методу 7.
Получение соединений формулы (XIV):
Требуемые хинолиновые, [1,5]-нафтиридиновые, хиноксалиновые и хиназолиновые производные формулы (XIV), где R1 обозначает ОМе и L4 обозначает Р+РН3 Hal-, могут быть получены, как представлено на нижеприведенной схеме 5.
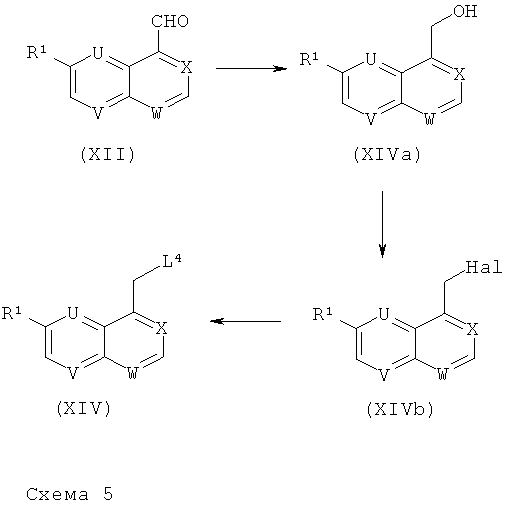
Соединения формулы (XII) могут быть восстановлены (схема 5) в спирты формулы (XIVa) (общий реакционный метод 16), которые могут быть превращены в соответствующие соединения формулы (XIVb), где Hal обозначает галоген (например, когда Hal обозначает бром, реакцией с PBr3). Соединения формулы (XIV) получают с помощью реакции соединения формулы (XIVb) с PPh3.
Получение соединений формулы (XV):
Промежуточные соединения формулы (XV) могут быть получены реакцией эпоксидов формулы (IV) с азидом натрия с последующим гидрированием над катализатором из благородного металла такого, как Pd/C, или реакцией с КДИ, или последующим превращением соответствующего карбамата с CbzCl или Вос2О. Оксазолидиноновое кольцо образуется затем с помощью реакции с NaH. Эти соединения могут быть также получены реакцией соединений формулы (IX) с бензилоксиран-2-илметилкарбаматом или одним из его энантиомеров, с использованием общего реакционного метода 4 перед обработкой NaH.
Получение исходных соединений:
Соединения формулы (XVI) могут быть получены путем алкилирования соединений формулы (IX) аллилбромидом в присутствии основания такого, как ТЭА.
Соединения формулы (XVIII) могут быть получены путем удаления защитной группы у спиртов формулы (XXIII), с использованием общего реакционного метода 2, с последующим удалением аминозащитной группы, используя общий реакционный метод 11.
Соединения формулы (XX) могут быть получены путем удаления защитных групп с соединений формулы (XXIV), используя общий реакционный метод 11. Соединения формулы (XXIV), где Rf обозначает метил, могут быть получены эстерификацией карбоновых кислот формулы (XXIV), где Rf обозначает Н, например, эстерификацией диазометаном или ТМС-диазометаном.
Соединения формулы (XXIII), где о=0, могут быть получены восстановлением кетонной функции производных формулы (XXVI), следуя общему реакционному методу 16. Соединения формулы (XXIII), где о=1, могут быть получены восстановлением сложноэфирной функции соединений формулы с (XXIV), где Rf обозначает метил, используя общий реакционный метод 17.
Соединения формулы (XXIII), где o=0, m=n=1, R3 обозначает Н и R2 обозначает CH2N3, могут быть получены из трет-бутилового эфира 4-[[(1,1-диметилэтил)диметилсилил]окси]-2-(гидроксиметил)-1-пиперидинкарбоновой кислоты, полученного, как описано в WO 2007/122103, после перевода его в соответствующие мезилаты (следуя общему реакционному методу 8 и реакции с азидом натрия) и удаления Вос-защитной группы, как описано в общем реакционном методе 11. Соединения формулы (XXIII), где o=0, m=n=1, R2 обозначает Н и R3 обозначает NH2, могут быть получены восстановлением соответствующих трет-бутил-3-азидо-4-гидрокси-1-пиперидинкарбоксилатов (полученных согласно WO 02/096426) с использованием вышеупомянутого метода с последующим удалением Вос-защитной группы, как описано в общем реакционном методе 11. Соединения формулы (XXIII), где о=1, m=n=1, R2 обозначает Н и R3 обозначает NH2, могут быть получены согласно WO 01/81347.
Карбоновые кислоты формулы (XXIV), где Rf обозначает В, R2 обозначает Н, R3 обозначает Н, PG2 обозначает Cbz и m=n=0, или m=n=1 или m=1 и n=0, являются коммерчески доступными. Другие карбоновые кислоты формулы (XXIV) могут быть получены, как представлено на нижеприведенной схеме 6.
Карбоновые кислоты формулы (XXIV), где Rf обозначает Н, m=n=1 или m=1 и n=0, R2 обозначает СН2ОН и R3 обозначает Н, могут быть получены (схема 6) из соответствующих сложных эфиров формулы (XXIX) или (XXX), описанных в публикациях ЕР 334244 и Tetrahedron (1995), 51 (31), 8545-54, соответственно, с использованием стандартных методов (гидролиз сложного эфира согласно общему реакционному методу 15 и гидролиз сложного эфира с последующим восстановлением, как описано в общем реакционном методе 17).
Предшественники соединений формулы (XXV), то есть соединения формулы (XXV), где L3 может быть OMs, OTs или галогеном таким, как йод, могут быть получены из спиртов формулы (XXIII), где о=1, с использованием общего реакционного метода 8. Соединения формулы (XXV), где L3 обозначает PPh3 +Hal- получают реакцией названных предшественников (L3 является галогеном) с PPh3. Соединения формулы (XXV), где L3 обозначает SO2Rd, могут быть получены из названных предшественников с использованием общего реакционного метода 14, раздел, описывающий конденсацию по Жюлиа.
Кетоны формулы (XXVI), где R2 обозначает Н, PG2 обозначает Cbz и m=n=0, или m=n=1 или m=1 и n=0, являются коммерчески доступными. Кетоны формулы (XXVI), где m=n=1 или m=1 и n=0, и К обозначает CH2OH, могут быть получены из соответствующих коммерчески доступных сложных эфиров (R2 = СООалкил) посредством восстановления согласно общему реакционному методу 17.
Соединения формулы (XXVII) могут быть получены путем защиты кетонной группы соединений формулы (XXVI) с помощью этандиола или 1,3-пропандиола в присутствии п-TsOH, с последующим удалением аминозащитной группы, как описано в общем реакционном методе 11.
Отдельные варианты осуществления настоящего изобретения описаны в следующих примерах, которые более детально иллюстрируют изобретение, ни в коей мере не лимитируя его объема.
Примеры
Общие методы:
Метод А: удаление Вос-защитной группы:
Вос-защищенный амин (1 ммоль) растворяют в ДХМ (2 мл), а затем добавляют Et3SiH (1,05 ммолей) (необязательно) и ТФК (2 мл). Смесь перемешивают при комнатной температуре в течение 1 ч, концентрируют в вакууме и переносят в смесь ДХМ/NH4OH. Органический слой промывают водой, высушивают над MgSO4 и концентрируют при пониженном давлении.
Метод Б: алкилирование аминов йодидами и мезилатами:
Раствор амина (1 ммоль в случае йодидов; 1-2 ммоля в случае мезилатов), мезилат/йодид (1 ммоль) и ДИПЭА (1,1 ммолей) в сухом ДМСО нагревают при температуре 70°С до полного завершения реакции (1-3 дня). После охлаждения до комнатной температуры добавляют воду и ЭА и разделяют фазы. Водный слой экстрагируют более двух раз ЭА и объединенные органические слои промывают водой (трижды) и рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии.
Метод В: нуклеофильное ароматическое замещение 4-хлор-6-метоксихиназолина:
К раствору гидроксисоединения (1 ммоль) и 4-хлор-6-метоксихиназолина (1 ммоль) в N-МП (2 мл) при температуре 0°С прибавляют NaH (1 ммоль, 60%-ный раствор в минеральном масле). Смесь перемешивают при 0°С до завершения реакции (обычно в течение 1-4 ч), гасят водой и экстрагируют ЭА. Объединенные органические слои промывают несколько раз водой и рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии.
Метод Г: амидная конденсация с ГАТУ:
К раствору ДИПЭА (4 ммолей), амина (1 ммоль) и кислоты (1 ммоль), растворенной в ДМФ (2 мл) добавляют ГАТУ (2 ммолей) при комнатной температуре. Полученную смесь перемешивают при комнатной температуре до завершения реакции, после чего добавляют воду и ЭА, фазы разделяют и водную фазу экстрагируют этилацетатом. Объединенные органические слои промывают несколько раз водой и рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии.
Метод Д: нуклеофильное ароматическое замещение:
Смесь арилгалогенида или арилтрифлата (1 ммоль), амина (1 ммоль) и ДИПЭА (1,2 ммолей) в N-МП (4 мл) нагревают при температуре 70-80°С до завершения реакции, после чего добавляют воду и смесь экстрагируют этилацетатом. Объединенные органические слои промывают водой (трижды), рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии.
Метод Е: конденсация Бухвальда:
В высушенную в сушильном шкафу колбу помещают арилбромид или арилхлорид (1 ммоля), палладий(II)ацетат (0,04 ммоля), БИНАФ (0,08 ммоля) или бис-(2-дифенилфосфино)фениловый эфир (0,08 ммолей), K3PO4 (2,5 ммоля) и амин (1 ммоль). Смесь в течение нескольких минут продувают аргоном. Затем через шприц добавляют диоксан (1 мл) и полученную суспензию продувают аргоном в течение 3 мин. Затем смесь нагревают при температуре 85°С до завершения реакции. После этого растворитель удаляют при пониженном давлении, а остаток экстрагируют смесью этилацетата с водой. Органический слой промывают рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии.
Метод Ж: гидрирование Cbz-группы:
Супензию бензилкарбамата (1 ммоль) в МеОН (6 мл) гидрируют над 5 или 10%-ным Pd/C (200 мг) в течение 2 ч. Катализатор отфильтровывают, а осадок на фильтре промывают МеОН и ДХМ. Фильтрат концентрируют при пониженном давлении.
Метод 3: восстановительное аминирование:
Раствор первичного амина (1 ммоль) и альдегида или кетона (1 ммоль) в смеси ДХЭ/МеОН в соотношении 1:1 (10 мл) перемешивают при комнатной температуре в течение ночи. Затем добавляют NaBH4 (2-5 экв.) и реакцию продолжают еще в течение 1 ч, после чего реакционную смесь разбавляют ДХМ и водным раствором NH4OH. Органическую фазу промывают водой, высушивают над MgSO4 и концентрируют.
Препаративные методы:
Препаративный метод А: (S)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметиловый эфир метансульфоновой кислоты:
A.i. 6-[(S)-3-(треди-бутилдиметилсиланилокси)-2-гидроксипропиламино]-4Н-бензо[1,4]тиазин-3-он:
К раствору трет-бутилдиметил-((S)-1-оксиранилметокси)силана (13,0 г, 69 ммолей) в ацетонитриле (220 мл) добавляют LiClO4 (22 г, 207 ммолей), а затем 6-амино-4Н-бензо[1,4]тиазин-3-он (11,4 г, 64 ммолей) и смесь перемешивают при температуре 50°С в течение 6 ч. Затем растворитель удаляют в вакууме, а остаток хроматографируют (ДХМ/МеОН/NH4OH в соотношении от 1000:25:2 до 1000:100:2), получая названное в заголовке соединение в виде бледнокоричневой пены (выход 11,16 г, 44%).
МС (ЭСИ, m/z): 369,3 [М+Н+].
A.ii. 6-[(S)-5-(трет-бутилдиметилсиланилоксиметил)-2-оксооксазолидин-3-ил]-4Н-бензо[1.4]тиазин-3-он:
Раствор промежуточного соединения (A.i) (11,60 г, 30 ммолей) и КДИ (5,57 г, 33 ммоля) в ТГФ (130 мл) нагревают при температуре 50°С в течение 2 ч, после чего смесь концентрируют в вакууме и распределяют между ЭА и водой. Некоторое количество кристаллического продукта отфильтровывают и промывают водой и этилацетатом, получая 5,21 г продукта. Органический слой промывают рассолом, высушивают над MgSO4 и концентрируют. Остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:50:4), получая дополнительно 2,28 г продукта (общий выход 7,49 г грязно-белого твердого вещества, 63%).
МС (ЭСИ, m/z): 395,1 [М+H+].
A.iii. 6-((S)-5-гидроксиметил-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Супензию промежуточного соединения (A.ii) (11,49 г, 29,1 ммолей) в ТГФ (29 мл) обрабатывают ТБАФ (1-молярный раствор в ТГФ, 29,1 мл). Желтый раствор перемешивают при температуре 0°С в течение 3 ч, а затем распределяют в смеси воды и этилацетата. Некоторое количество кристаллического продукта отфильтровывают и промывают водой и этилацетатом, получая 6,49 г продукта. Водный фазу экстрагируют этилацетатом (трижды). Объединенные органические слои промывают рассолом, высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт тритурируют с ЭА, получая дополнительно 1,23 г продукта (общий выход 7,72 г грязно-белого твердого вещества, 95%).
МС (ЭСИ, m/z): 281,3 [М+H+].
A.iv. (S)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)-оксазолидин-5-илметиловый эфир метансульфоновой кислоты:
Раствор промежуточного соединения (A.iii) (2,77 г, 9,88 ммолей) в безводном ДХМ (100 мл) и ДИПЭА (4,7 мл, 28,2 ммолей) охлаждают до температуры 0°С и по каплям добавляют к нему MsCl (1,07 мл, 13,8 ммолей). Полученную смесь перемешивают при температуре 0°С в течение 1 ч, затем добавляют воду, после чего смесь экстрагируют ДХМ и объединенные органические слои промывают водой. Желтый остаток тритурируют смесью ЭА/ДХМ/эфир, получая названное в заголовке соединение в виде бесцветного твердого вещества (выход 2,45 г, 69%).
1Н ЯМР (ДМСО-d6) δ: 10,57 (s, 1Н), 7,31 (m, 2H), 7,10 (dd, J=8,5, 2,3 Гц, 1Н), 4,98 (m, 1Н), 4,48 (m, 2H), 4,13 (t, J=9,4 Гц, 1Н), 3,75 (dd, J=9,4, 6,4 Гц, 1Н), 3,43 (s, 2H), 3,23 (s, 3Н). МС (ЭСИ, m/z): 359,3 [М+Н+].
Препаративный метод Б: 6-((S)-5-йодметил-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Б.i. (S)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметиловый эфир толуол-4-сульфоновой кислоты:
К раствору промежуточного соединения (A.iii) (3,2 г, 11,5 ммолей) и ДМАП (1,40 г, 11,5 ммолей) в ДХМ (80 мл), охлажденному до 0°С, прибавляют ТЭА (4,6 мл, 33,3 ммолей) и раствор TsCl (2,2 г, 11,5 ммолей) в ДХМ (15 мл). Смесь перемешивают при комнатной температуре в течение ночи, после чего добавляют воду. Образовавшееся твердое вещество отфильтровывают, получая названное в заголовке соединение в виде бежевого твердого вещества (выход 4,19 г, 84%).
МС (ЭСИ, m/z): 435,2 [М+Н+].
Б.ii. 6-((S)-5-йодметил-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Супензию промежуточного соединения (Б-i) (4,19 г, 9,64 ммолей) и NaI (5,78 г, 38,57 ммолей) в ацетоне (70 мл) нагревают с обратным холодильником в течение 5 ч. Растворитель затем выпаривают, а остаток экстрагируют смесью вода/ДХМ, осаждая таким образом требуемый продукт в виде твердого вещества бледно-розового цвета (выход 3,39 г, 90%).
1Н ЯМР (ДМСО-d6) δ: 10,54 (s, 1Н), 7,30 (m, 2H), 7,11 (dd, J=8,5, 2,1 Гц, 1Н), 4,69 (m, 1Н), 4,13 (t, J=9,1 Гц, 1Н), 3,57 (m, 3Н), 3,43 (s, 2H).
МС (ЭСИ, m/z): 391,1 [М+Н+].
Препаративный метод В: 6-((R)-5-йодметил-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Исходя из трет-бутилдиметил-((R)-1-оксиранилметокси)силана и используя методику препаративного метода Б, стадия Б.ii, названное в заголовке соединение (энантиомерный антипод соединения, полученного в препаративном методе Б) получают в виде грязно-белого твердого вещества (выход 120 мг, 33%).
МС (ЭСИ, m/z): 391,1 [М+Н+].
Препаративный метод Г: (S)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил)оксазолидин-5-илметиловый эфир метансульфоновой кислоты:
Г.i. 6-[(S)-3-(трет-бутилдиметилсиланилокси)-2-гидроксипропиламино1-4Н-бензо[1,4]оксазин-3-он:
Исходя из 6-амино-4Н-бензо[1,4]оксазин-3-она и используя методику препаративного метода А, стадия A.i., названное в заголовке соединение получают в виде светло-коричневой пены (выход 5,2 г, 66%).
МС (ЭСИ, m/z): 353,3 [М+Н+].
Г.ii. 6-[(S)-5-(трет-бутилдиметилсиланилоксиметил)-2-оксооксазолидин-3-ил]-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (Г.i) и используя методику препаративного метода А, стадия A.ii, названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 5,15 г, 91%).
МС (ЭСИ, m/z): 379,2 [М+Н+].
Г.iii. 6-((S)-5-гидроксиметил-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточное соединение (Г.ii) и используя методику препаративного метода А, стадия A.iii, названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 3,14 г, 87%).
МС (ЭСИ, m/z): 265,5 [М+Н+].
Г.iv. (S)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил)-оксазолидин-5-илметиловый эфир метансульфоновой кислоты:
Исходя из промежуточного соединение (Г.iii) и используя методику препаративного метода А, стадия A.iv, названное в заголовке соединение получают в виде грязно-белого твердого вещества (выход 1,40 г, 44%).
1Н ЯМР (ДМСО-d6) δ: 10,72 (s, 1H), 7,29 (dd, J=2,1, 0,6 Гц, 1Н). 6,94 (m, 2H), 4,95 (m, 1Н), 4,52 (s, 2H), 4,49 (m, 2H), 4,11 (t, J=9,1 Гц, 1Н), 3,73 (m, 2H), 3,23 (s, 3H). МС (ЭСИ, m/z): 343,2 [М+Н+].
Препаративный метод Д: (S)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-йодметилоксазолидин-2-он:
Д.i. (S)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-гидроксиметилоксазолидин-2-он:
Раствор бензилового эфира (2,3-дигидробензо[1,4]диоксин-6-ил)карбаминовой кислоты (3,0 г, 10,5 ммолей) в ТГФ (60 мл) охлаждают до температуры -78°С, после чего по каплям добавляют н-BuLi (5,1 мл 2,5-молярного раствора в гексане, 1,2 экв.). Смесь перемешивают при температуре -78°С в течение 1 ч, а затем нагревают до температуры -15°С и при этой температуре по каплям добавляют (S)-глицидилбутират (1,98 г, 1,2 экв.). Смесь перемешивают при комнатной температуре в течение ночи, затем добавляют Cs2CO3 (шпателем) и смесь нагревают при температуре 40°С до завершения конверсии. После этого смесь разбавляют ЭА и промывают насыщенным раствором NH4Cl и водой. Органический слой высушивают над MgSO4 и концентрируют. Соединение очищают с помощью колоночной хроматографии (гексан/этилацетат в соотношениях 2:1, 1:1), получая требуемое промежуточное соединение в виде бежевого твердого вещества (выход 1,09 г, 41%).
1Н ЯМР (ДМСО d6) δ: 7,13 (d, J=2,5 Гц, 1H), 6,96 (dd, J=2,5, 8,9 Гц, 1Н), 6,86 (d, J=8,9 Гц, 1H), 5,16 (t, J=5,8 Гц, 1H), 4,70-4,50 (m, 1H), 4,30-4,10 (m, 4H), 4,10-3,90 (m, 1H), 4,80-4,70 (m, 1H), 4.70-4,60 (m, 1H), 4,60-4,50 (m, 1H).
Д.ii. (S)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-2-оксооксазолидин-5-илметиловый эфир метансульфоновой кислоты:
Раствор промежуточного соединения (Д.i) (1 г, 4 ммоля) в ДХМ (20 мл) охлаждают до температуры 0°С, добавляют ДИПЭА (0,62 г, 1,2 экв.) и MsCl (0,502 г, 1,1 экв.) и перемешивают смесь в течение 1 ч при 0°С. Смесь затем разбавляют ДХМ и промывают водой. Органический фазу высушивают над MgSO4 и концентрируют, получая названный в заголовке мезилат в виде бесцветного твердого вещества (выход 1,26 г, 97%), который используют на следующей стадии без дальнейшей очистки.
МС (ЭСИ, m/z): 329,8 [М+Н+].
Д.iii. (S)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-йодметилоксазолидин-2-он:
Смесь промежуточного соединения (Д-ii) (509 мг, 1,55 ммолей) и NaI (927 мг, 6,18 ммолей) в ацетоне (10 мл) нагревают с обратным холодильником в течение 3 ч. Растворитель затем выпаривают, а остаток экстрагируют смесью вода/ДХМ. Органический слой промывают рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении, получая названное в заголовке соединение в виде светло-бежевого твердого вещества (выход 393 мг, 70%).
1Н ЯМР (CDCl3) δ: 7,07 (d, J=2,6 Гц, 1Н), 6,98 (dd, J=9,1, 2,6 Гц, 1Н), 6,85 (d, J=8,9 Гц, 1Н), 4,68 (m, 1Н), 4,24 (s, 4Н), 4,10 (t, J=9,1 Гц, 1Н), 3,72 (dd, J=9,1, 5,9 Гц, 1Н), 3,46 (m, 1Н), 3,33 (m, 1Н).
МС (ЭСИ, m/z): 362,1 [М+Н+].
Препаративный метод Е: (S)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-2-оксооксазолидин-5-карбоновая кислота:
К раствору промежуточного соединения (Д-i) (985 мг, 3,92 ммолей) в смеси вода/MeCN (в соотношении 1:1) (20 мл), охлажденного до температуры 0°С, добавляют диацетоксийодбензол (2,83 г, 2,2 экв.) и ТЕМПО (122 мг, 0,2 экв.). Смесь перемешивают при 0°С в течение 30 мин и при комнатной температуре в течение ночи, после чего добавляют ЭА и насыщенный водный раствор Na2CO3, после чего фазы разделяют. Водный слой промывают однократно этилацетатом и затем осторожно подкисляют 1-молярным раствором HCl. Водную фазу дважды экстрагируют этилацетатом. Объединенные органические слои промывают рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении, получая названный в заголовке продукт в виде бесцветного твердого вещества (выход 847 мг, 81%).
МС (ЭСИ. m/z): 266,3 [М+Н+].
Примеры
Пример 1: 6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-илокси)азетидин-1-илметил1-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
1.i. трет-бутиловый эфир 3-(6-метокси[1,5]нафтиридин-4-илокси)азетидин-1-карбоновой кислоты
ДИАД (0,69 мл, 3,45 ммолей) по каплям прибавляют к суспензии 6-метокси-[1,5]нафтиридин-4-ола (507 мг, 2,88 ммолей), трет-бутилового эфира 3-гидроксиазетидин-1-карбоновой кислоты (коммерческий, 500 мг, 2,88 ммолей) и PPh3 (906 мг, 3,45 ммолей) в ТГФ (5 мл). При этом образуется прозрачный раствор, который перемешивают при комнатной температуре в течение ночи. Смесь затем концентрируют при пониженном давлении и очищают с помощью колоночной хроматографии (гексан/этилацетат в соотношении 1:1), получая названное в заголовке промежуточное соединение в виде желтого твердого вещества (выход 590 мг, 62%).
МС (ЭСИ, m/z): 332,4 [М+Н+].
1.ii. 8-(азетидин-3-илокси)-2-метокси[1,5]нафтиридин:
Исходя из промежуточного соединения (1.i) и используя метод А, требуемое промежуточное соединение получают в виде желтого твердого вещества (выход 172 мг, 42%).
МС (ЭСИ, m/z): 232,5 [М+Н+].
1.iii. 6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-илокси)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (1.ii) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт получают в виде бесцветного твердого вещества (выход 5 мг, 3%).
1Н ЯМР (CDCl3) δ: 8,56 (d, J=5,3 Гц, 1Н), 8,42 (s, 1H), 8,15 (d, J=8,8 Гц, 1Н), 7,45 (d, J=2,3 Гц, 1Н), 7,25 (m, 1Н), 7,11 (d,J=9,l Гц, 1H), 6,88 (dd, J=8,8, 2,3 Гц, 1H), 6,66 (d, J=5,3 Гц, 1H), 5,04 (t, J=5,9 Гц, 1H), 4,71 (m, 1H), 4,06 (m, 6H), 3,90 (dd, J=8,8, 6,7 Гц, 1H), 3,59 (m, 2H), 3,39 (s, 2H), 3,03 (m, 1H), 2,90 (m, 1H).
МС (ЭСИ, m/z): 493,8 [М+Н+].
Пример 2: 6-{(R)-5-[(R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
2.i. трет-бутиловый эфир (R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-карбоновой кислоты:
Исходя из трет-бутилового эфира (R)-3-гидроксипирролидин-1-карбоновой кислоты (коммерческий продукт) и 4-хлор-6-метоксихиназолина и используя метод В, требуемый продукт получают в виде желтого масла (выход 1,54 г, 42%).
МС (ЭСИ, m/z): 346,2 [М+Н+].
2.ii. 6-метокси-4-((R)-пирролидин-3-илокси)хиназолин:
Исходя из промежуточного соединения (2.i) и используя метод А, требуемое промежуточное соединение получают в виде грязно-белого твердого вещества (выход 458 мг, 43%).
МС (ЭСИ, m/z): 246,4 [М+Н+].
2.iii. 6-{(R)-5-[(R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (2.ii) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт получают в виде коричневой пены (выход 70 мг, 41%).
МС (ЭСИ, m/z): 508,1 [М+Н+].
Пример 3: 6-{(R)-5-[(S)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил1-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Названное в заголовке соединение получают в виде коричневого твердого вещества выход (выход 83 мг, 49%) исходя из энантиомерного антипода промежуточного соединения (2.ii) и используя методику примера 2, стадия 2.iii.
МС (ЭСИ, m/z): 508,2 [М+Н+].
Пример 4: (R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[(RS)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил1оксазолидин-2-он:
Названное в заголовке соединение получают в виде бледно-желтой пены (выход 33 мг, 32%) исходя из рацемата промежуточного соединения (2.ii) и используя методику примера 2, стадия 2.iii.
МС (ЭСИ, m/z): 479,3 [М+Н+].
Пример 5: 6-{(R)-5-[(2S,4S)-2-гидроксиметил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
5.i. трет-бутиловый эфир (2S,4S)-2-(2,2-диметилпропионилоксиметил)-4-гидроксипирролидин-1-карбоновой кислоты:
К перемешиваемому раствору wpew-бутилового эфира (S)-2-(2,2-диметилпропионилоксиметил)-4-оксопирролидин-1-карбоновой кислоты (50 г, 16,7 ммолей; получен согласно WO 2007/017828) в МеОН (40 мл) добавляют NaBH4 (1,90 г, 3 экв.) порциями с интервалом 30 мин при температуре 0-5°С. Смесь перемешивают при температуре 10°С в течение 2 ч, после чего к ней добавляют воду и смесь экстрагируют ДХМ. Органический слой высушивают над MgSO4 и концентрируют при пониженном давлении, получая названное в заголовке промежуточное соединение в виде бежевого твердого вещества (выход 4,13 г, 82%).
1Н ЯМР (CDCl3) δ: 4,42 (m, 1Н), 4,26 (m, 1H), 4,10-4,00 (m, 1H), 3,60 (m, 1H), 3,36 (m, 1H), 2,19 (m, 2H), 1,95 (m, 1H), 1,46 (s, 9H), 1,21 (s, 9H).
MC (ЭСИ, m/z): 302,2 [M+H+].
5.ii. трет-бутиловый эфир (2S,4S)-2-(2,2-диметилпропионилоксиметил)-4-(6-метоксихиназолин-4-илокси)пирролидин-1-карбоновой кислоты:
Исходя из промежуточное соединение (5.i) и используя метод В, требуемое промежуточное соединение получают в виде бледно-желтой пены (выход 1,56 г, 56%).
MC (ЭСИ, m/z): 460,0 [М+Н+].
5.iii. трет-бутиловый эфир (2S,4S)-2-гидроксиметил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-карбоновой кислоты:
ДИБАГ (1,92 мл, 1,7-молярный раствор в толуоле) медленно добавляют к раствору промежуточного соединения (5.ii) (500 мг, 1,1 ммолей) в толуоле (16 мл) при температуре -78°С. Смесь перемешивают при этой температуре в течение 2 ч и затем гасят путем прикапывания к ней насыщенного раствора соли Рошеля (1,5 мл). После этого смесь оставляют самопроизвольно нагреваться до комнатной температуры и разбавляют этилацетатом. Органический слой высушивают над MgSO4 и концентрируют при пониженном давлении, получая названное в заголовке промежуточное соединение в виде бледно-желтого твердого вещества (выход 440 мг, 100%).
МС (ЭСИ, m/z): 376,5 [М+Н+].
5.iv. [(2S,4S)-4-(6-метоксихиназолин-4-илокси)пирролидин-2-ил]метанол:
Исходя из промежуточного соединения (5-iii) и используя метод А, требуемое промежуточное соединение получают в виде бледно-желтого твердого вещества (выход 162 мг, 50%).
МС (ЭСИ, m/z): 276,2 [М+Н+].
5.v. 6-{(R)-5-[(2S,4S)-2-гидроксиметил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (5.iv) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт получают в виде бесцветной пены (выход 40 мг, 41%).
1Н ЯМР (CDCl3) δ: 8,60 (s, 1H), 8,41 (s, 1H), 7,80 (d, J=9,1 Гц, 1Н), 7,43 (m, 1H), 7,34 (d, J=2,6 Гц, 1H), 7,23 (m, 1H), 7,11 (d, J=8,8 Гц, 1H), 6,82 (m, 1H), 5,71 (m, 1H), 4,74 (m, 1H), 3,97 (m, 1H), 3,91 (s, 3Н), 3,76 (m, 2H), 3,59 (m, 2H), 3,39 (s, 2H), 3,17 (m, 1H), 2,97 (m, 2H), 2,80 (m, 2H), 2,54 (m, 1H), 2,22 (m, 1H).
МС (ЭСИ, m/z): 538,2 [М+Н+].
Пример 6: 6-{(R)-5-[(2S,4S)-2-азидометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
6.i. трет-бутиловый эфир (2S,4S)-2-азидометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-карбоновой кислоты:
Желтоватый раствор промежуточного соединения (5.iii) (603 мг, 1,61 ммолей) в безводном ДХМ (7 мл) и ДИПЭА (0,825 мл, 3 экв.) охлаждают до температуры 0°С и прикалывают MsCl (0,15 мл, 1,2 экв.). Полученную смесь перемешивают при температуре 0°С в течение 1 ч, после чего прибавляют воду и смесь экстрагируют ДХМ. Органический слой высушивают над MgSO4 и концентрируют при пониженном давлении. К раствору сырого мезилата в ДМФ (6 мл) прибавляют NaN3 (165 мг, 1,5 экв.). Полученную смесь перемешивают при температуре 80°С в течение ночи. Растворитель выпаривают без досушивания и остаток растворяют в ДХМ. Органический слой промывают водой, высушивают над MgSO4 и выпаривают при пониженном давлении, получая названное в заголовке промежуточное соединение в виде коричневого масла (выход 621 мг, 92%).
МС (ЭСИ, m/z): 401,4 [M+H+].
6.ii. 4-((3S,5S)-5-азидометилпирролидин-3-илокси)-6-метоксихиназолин:
Исходя из промежуточного соединения (6.i) и используя метод А, требуемое промежуточное соединение получают в виде коричневого масла (выход 465 мг, 100%).
МС (ЭСИ, m/z): 302.3 [M+H+].
6.iii. 6-{(R)-5-[(2S,4S)-2-азидометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (6.ii) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт получают в виде бледно-желтой пены (выход 131 мг, 30%).
МС (ЭСИ, m/z): 563,3 [М+Н+].
Пример 7: (6-метокси[1,5]нафтиридин-4-ил)амид 1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]азетидин-3-карбоновой кислоты:
7.1. трет-бутиловый эфир 3-(6-метокси[1,5]нафтиридин-4-илкарбамоил)азетидин-1-карбоновой кислоты:
Исходя из 6-метокси-[1,5]нафтиридин-4-иламина и моно-трет-бутилового эфира азетидин-1,3-дикарбоновой кислоты и используя метод Г, требуемый продукт получают в виде бежевого твердого вещества (выход 1,60 г, 60%).
МС (ЭСИ, m/z): 359,4 [M+H+].
7.ii. (6-метокси-[1,5]нафтиридин-4-ил)амид азетидин-3-карбоновой кислоты:
Исходя из промежуточного соединения (7.i) и используя метод А, требуемое промежуточное соединение получают в виде коричневого твердого вещества (выход 1,25 г, 100%).
1Н ЯМР (CDCl3) δ: 10,35 (расширенный, s, 1H), 8,71 (d, J=5,3 Гц, 1Н), 8,53 (d, J=5,3 Гц, 1H), 8,21 (d, J=9,1 Гц, 1H), 7,15 (d, J=8,8 Гц, 1H), 4,10 (s, 3Н), 3,97 (m, 4H), 3,55 (m, 1H).
MC (ЭСИ, m/z): 259,3 [M+H+].
7.iii. (6-метокси-[1,5]нафтиридин-4-ил)амид 1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)-оксазолидин-5-илметил]азетидин-3-карбоновой кислоты:
Исходя из промежуточного соединения (7.ii) и соединения, полученного в препаративном методе А, и используя метод Б, требуемый продукт получают в виде бледно-желтой пены (выход 37 мг, 34%).
MC (ЭСИ, m/z): 521,4 [М+Н+].
Пример 8: (6-метокси-[1,5]нафтиридин-4-ил)амид (RS)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-3-карбоновой кислоты:
Названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 25 мг, 22%), используя методики примера 7, исходя, однако при синтезе из 1-трет-бутилового эфира рац-пирролидин-1,3-дикарбоновой кислоты.
MC (ЭСИ, m/z): 535,4 [М+Н+].
Пример 9: 6-((R)-5-{(RS)-3-Г(Е)-2-(6-метокси[1,5]нафтиридин-4-ил)винил1пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
9.i. трет-бутиловый эфир (RS)-3-(1-фенил-1Н-тетразол-5-сульфонилметил)пирролидин-1-карбоновой кислоты:
К раствору 1-фенил-1Н-тетразол-5-тиола (5,92 г, 33 ммоля) в EtOH (80 мл) добавляют КОН (2,1 г, 38 ммолей) и смесь нагревают с обратным холодильником в течение 1 ч, затем добавляют трет-бутиловый эфир (RS)-3-йодметилпирролидин-1-карбоновой кислоты (9,0 г, 29 ммолей) и нагревают с обратным холодильником в течение 3 ч, после чего добавляют воду (70 мл) и большую часть EtOH удаляют при пониженном давлении. Остаток экстрагируют этилацетатом, и органический слой промывают водой и рассолом, высушивают над MgSO4 и концентрируют. Затем к полученному таким образом сырому сульфиду в EtOH (200 мл) добавляют молибдат аммония (7,0 г, 0,2 экв.) и 30%-ную Н2О2 (15 мл), смесь нагревают до температуры 65°С и перемешивают при этой температуре в течение 3 ч. Затем добавляют воду (500 мл) и большую часть EtOH удаляют при пониженном давлении. Остаток экстрагируют этилацетатом. Органический слой промывают 10%-ным водным раствором Na2S2O3, водой и рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении, получая названное в заголовке промежуточное соединение в виде бледно-желтого масла (выход 9,48 г, 85%).
МС (ЭСИ, m/z): 394,3 [М+Н+].
9.ii. wpew-бутиловый эфир (RS)-3-[(Е)-2-(6-метокси[1,5]нафтиридин-4-ил)винил]пирролидин-1-карбоновой кислоты:
К суспензии 6-метокси[1,5]нафтиридин-4-карбальдегида (2,0 г, 10,6 ммолей) и промежуточного соединения (9.i) (4,40 г, 1,05 экв.) в 1,2-ДМЭ (60 мл), охлажденных до температуры -78°С, добавляют по каплям раствор КГМДС (0,5-молярный в толуоле, 34 мл). Смесь перемешивают в течение 1 ч при этой температуре, после чего нагревают до комнатной температуры. После перемешивания в течение 45 мин добавляют воду (150 мл) и этилацетат (150 мл). Два образовавшихся слоя разделяют, и водный слой дважды экстрагируют этилацетатом (200 мл). Объединенные органические слои высушивают над MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (гептан/этилацетат в соотношении 1:1), получая названное в заголовке промежуточное соединение в виде желтого масла (выход 2,1 г, 56%).
МС (ЭСИ, m/z): 356,3 [М+Н+].
9.iii. (RS)-2-метокси-8-((Е)-2-пирролидин-3-илвинил)-[1,5]нафтиридин:
Исходя из промежуточного соединения (9.ii) и используя метод А, требуемое промежуточное соединение получают в виде желтого масла (выход 187 мг, 100%).
МС (ЭСИ, m/z): 256,5 [М+Н+].
9.iv. 6-((R)-5-{(RS)-3-[(Е)-2-(6-метокси[1,5]нафтиридин-4-ил)винил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (9.iii) и соединения, полученного в препаративном методе А, и используя метод Б, требуемый продукт получают в виде бледно-желтого твердого вещества (выход 28 мг, 22%).
1Н ЯМР (CDCl3) δ: 8,67 (dd, J=4,4, 2,3 Гц, 1Н), 8,38 (m, 1H), 8,18 (d, J=9,1 Гц, 1H), 7,56 (dd, J=4,7, 2,9 Гц, 1H), 7,45 (m, 2H), 7,26 (m, 1H), 7,11 (d, J=9,1 Гц, 1H), 6,96 (dd, J=8,8, 2,3 Гц, 1H), 6,71 (m, 1H), 4,78 (m, 1H), 4,07 (m, 4H), 3,87 (ddd, J=8,8, 6,7, 4,7 Гц, 1H), 3,41 (s, 2H), 3,20-2,80 (m, 6H), 2,62 (m, 1H), 2,22 (m, 1H), 1,81 (m, 1H).
МС (ЭСИ, m/z): 518,3 [M+H+].
Пример 10: 6-((R)-5-{(RS)-3-Г2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
10.i. трет-бутиловый эфир (RS)-3-[2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-карбоновой кислоты:
Раствор промежуточного соединения (9.ii) (287 мг, 0,78 ммолей) в этилацетате (10 мл) гидрируют над Pd/C (10%-ный; 100 мг) в течение 1 ч. Катализатор затем отфильтровывают и оставшийся на фильтре слой промывают этилацетатом. Фильтрат концентрируют при пониженном давлении, получая названное в заголовке промежуточное соединение в виде серого масла (выход 267 мг, 96%).
МС (ЭСИ, m/z): 358,3 [М+Н+].
10.ii. (RS)-2-метокси-8-(2-пирролидин-3-илэтил)-[1,5]нафтиридин:
Исходя из промежуточного соединения (10.i) и используя метод А, требуемое промежуточное соединение получают в виде желтого масла (выход 165 мг, 86%).
МС (ЭСИ, m/z): 258,2 [М+Н+].
10.iii. 6-((R)-5-{(RS)-3-[2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (10.ii) и промежуточного соединения, полученного в препаративном методе А, и используя метод Б, требуемый продукт получают в виде бесцветного твердого вещества (выход 25 мг,20%).
МС (ЭСИ, m/z): 520,5 [М+Н+].
Пример 11: 6-((R)-5-{(RS)-3-[(1R,2R)-1,2-дигидрокси-2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
11.i. трет-бутиловый эфир (RS)-3-[(1R,2R)-1,2-дигидрокси-2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-карбоновой кислоты:
К суспензии промежуточного соединения (9.ii) (662 мг, 1,86 ммолей) в трет-BuOH (10 мл) и воде (10 мл) добавляют метансульфонамид (213 мг, 1,2 экв.) и AD-смесь [3 (2,7 г). Реакционную смесь энергично перемешивают при комнатной температуре в течение ночи. Затем реакционную смесь разбавляют водой и ЭА. Два слоя разделяют и водный слой дважды экстрагируют этилацетатом. Объединенные органический слои промывают 10%-ным водным раствором NaHSO3, водой (50 мл) и рассолом, высушивают над MgSO4, фильтруют и концентрируют без досушивания при пониженном давлении, получая названное в заголовке промежуточное соединение в виде бесцветной пены (выход 660 мг, 91%).
МС (ЭСИ, m/z): 390.4 [М+Н+].
11.ii. трет-бутиловый эфир (RS)-3-[(4R,5R)-5-(6-метокси[1,5]нафтиридин-4-ил)-2,2-диметил[1,3]диоксолан-4-ил]пирролидин-1-карбоновой кислоты:
К раствору промежуточного соединения (11.i) (371 мг, 0,95 ммолей) в ТГФ (10 мл) добавляют TsOH (199 мг, 1,1 экв.) и 2,2-диметоксипропан (0,35 мл, 3 экв.). Смесь перемешивают при комнатной температуре в течение 36 ч, после чего добавляют насыщенный раствор бикарбоната натрия и этилацетат. Два слоя разделяют и водный слой экстрагируют ЭА. Объединенные органические слои промывают рассолом, высушивают над MgSO4, фильтруют и концентрируют без досушивания. Остаток хроматографируют (ДХМ/МеОН/NH4OH в соотношении 1000:50:4), получая названное в заголовке промежуточное соединение в виде бесцветной пены (выход 265 мг, 65%).
МС (ЭСИ, m/z): 430,3 [М+Н+].
11.iii. 6-((R)-5-{(RS)-3-[(4R,5R)-5-(6-метокси[1,5]нафтиридин-4-ил)-2,2-диметил[1,3]диоксолан-4-ил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
К охлажденному льдом раствору промежуточного соединения (11.ii.) (220 мг, 0,51 ммолей) в ДХМ (3 мл) прикапывают в атмосфере азота 2,6-лутидин (0,24 мл, 4 экв.) и ТБДМСOTf (0,24 мл, 2 экв.). Через 1 ч при температуре 0°С реакционную смесь гасят, добавляя ДХМ. Два слоя разделяют, органический слой высушивают над MgSO4, фильтруют и концентрируют без досушивания при пониженном давлении. К раствору полученного таким образом сырого силилкарбамата в ТГФ (3 мл) добавляют ТБАФ (1-молярный раствор в ТГФ, 1,05 мл, 2 экв.), после чего реакция продолжается в течение 30 мин. Растворитель выпаривают и остаток хроматографируют (ДХМ/МеОН/NH4OH в соотношении 1000:100:8), получая желтое масло (выход 140 мг, 83%).
МС (ЭСИ, m/z): 330,3 [М+Н+].
Образовавшийся свободный амин (81 мг, 0,25 ммолей) вводят в реакцию с соединением, полученным в препаративном методе А, используя метод Б и получая требуемый продукт в виде коричневого масла (выход 78 мг, 54%).
МС (ЭСИ, m/z): 592,4 [М+Н+].
11.iv. 6-((R)-5-{(RS)-3-[(1R,2R)-1,2-дигидрокси-2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Раствор промежуточного соединения (11.iii) (70 мг, 0,12 ммоля) в водном растворе ТФК (80%-ный, 2 мл) перемешивают при температуре 40°С в течение 1 ч. Летучие фракции удаляют в вакууме, а остаток переносят в насыщенный водный раствор бикарбоната натрия. Твердое вещество отфильтровывают, промывают водой и лиофилизируют. Остаток хроматографируют (ДХМ/МеОН/NH4OH в соотношении 1000:100:8), получая названное в заголовке соединение в виде бежевого твердого вещества (выход 34 мг, 52%).
1Н ЯМР (ДМСО-d6) δ: 10,52 (m, 1H), 8,74 (d, J=4,7 Гц, 1Н), 8,24 (dd, J=9,1, 0,6 Гц, 1H), 7,72 (d, J=4,4 Гц, 1H), 7,27 (m, 3Н), 7,09 (m, 1H), 5,53 (m, 1H), 5,30 (m, 1H), 4,76 (m, 1H), 4,32 (m, 1H), 4,02 (m, 5H), 3,68 (m, 2H), 3,42 (s, 2H), 2,65 (m,6H), 1,81 (m, 2H).
MC (ЭСИ, m/z): 552,5 [М+Н+].
Пример 12: 6-{(R)-5-[4-(3-метоксихиноксалин-5-илметилен)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
12.i. (3-метоксихиноксалин-5-ил)метанол:
К перемешиваемой суспензии 3-метоксихиноксалин-5-карбальдегида (5,0 г, 26,6 ммолей, полученному согласно WO 2007/107965) в EtOH (200 мл), охлажденной до температуры 0°С, одной порцией добавляют NaBH4 (1,1 г, 1,1 экв.). Реакционную смесь нагревают затем до комнатной температуры и добавляют ТГФ (50 мл), при этом образуется прозрачный раствор. Смесь затем перемешивают при комнатной температуре в течение 30 мин, добавляют воду (200 мл), после чего летучие компоненты удаляют в вакууме. Остаток отфильтровывают и промывают водой. Твердое вещество высушивают в высоком вакууме, получая названный в заголовке спирт в виде коричневого твердого вещества (выход 4,8 г, 95%).
MC (ЭСИ, m/z): 191,3 [М+Н+].
12.ii. 8-бромметил-2-метоксихиноксалин:
К перемешиваемому раствору промежуточного соединения (12.i) (4,8 г, 25 ммолей) в ДМФ (45 мл), прикалывают PBr3 (2,6 мл, 1,1 экв.) при комнатной температуре, при этом образуется твердое вещество. Реакционную смесь перемешивают затем в течение 30 мин, после чего добавляют бикарбонат натрия. Образовавшееся твердое вещество отфильтровывают, тщательно промывают водой и затем лиофилизируют, получая названное в заголовке промежуточное соединение в виде бежевого твердого вещества (выход 5,45 г, 85%).
1Н ЯМР (CDCl3) δ: 8,51 (s, 1H), 7,99 (dd, J=8,2, 1,5 Гц, 1H), 7,78 (dd, J=7,3, 1,5 Гц, 1H), 7,52 (dd, J=8,2, 7,3 Гц, 1H), 5,08 (s, 2H), 4,15 (s, 3Н).
12.iii. (3-метоксихиноксалин-5-илметил)трифенилфосфонийбромид:
Раствор промежуточного соединения (12.ii) (4,54 г, 17,9 ммолей) и PPh3 (5,65 г, 1,2 экв.) в толуоле (100 мл) нагревают с обратным холодильником в течение 6 ч. После охлаждения до комнатной температуры образовавшийся осадок отфильтровывают и промывают этилацетатом, получая названное в заголовке промежуточное соединение в виде бежевого твердого вещества (выход 8,59 г, 93%).
1Н ЯМР (ДМСО-d6) δ: 8,43 (s, 1H), 7,96 (dt, J=7,6, 2,1 Гц, 1Н), 7,83 (m, 3Н), 7,57 (m, 12H), 5,56 (d, J=14,9 Гц, 2Н), 3,74 (s, 3Н).
12.iv. трет-бутиловый эфир 4-(3-метоксихиноксалин-5-илметилен)пиперидин-1-карбоновой кислоты:
Раствор н-BuLi (2 мл, 2,4-молярный в смеси гексанов) прикалывают в атмосфере азота при температуре -78°С к суспензии промежуточного соединения (12-iii) (2,50 г, 4,85 ммолей) в сухом ТГФ (20 мл). Через15 мин добавляют раствор трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты (0,97 г, 1 экв.) в сухом ТГФ (15 мл) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение ночи, после чего ее охлаждают до температуры 0°С и гасят, добавляя насыщенный водный раствор NH4Cl и разбавляя этилацетатом. Органический слой промывают насыщенным водным раствором NaHCO3 и рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (гептан/ЭА в соотношении 2:1), получая названное в заголовке промежуточное соединение в виде бледно-желтого масла (выход 552 мг, 32%).
МС (ЭСИ, m/z): 356,2 [М+Н+].
12.v. 2-метокси-8-пиперидин-4-илиденметилхиноксалин:
Исходя из промежуточного соединения (12.iv) и используя метод А, требуемое промежуточное соединение получают в виде темно-желтого масла (выход 41 мг, 57%).
МС (ЭСИ, m/z): 256,3 [M+H+].
12.vi. 6-{(R)-5-[4-(3-метоксихиноксалин-5-илметилен)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (12.v) и промежуточного соединения А и используя метод Б, требуемый продукт получают в виде бежевого твердого вещества (выход 24 мг, 34%).
МС (ЭСИ, m/z): 518,4 [М+Н+].
Пример 13: 6-((R)-5-{4-гидрокси-4-[(RS)-гидрокси-(3-метоксихиноксалин-5-ил)метил1пиперидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
13.i. трет-бутиловый эфир (RS)-4-гидрокси-4-[гидрокси-(3-метоксихиноксалин-5-ил)метил] пиперидин-1-карбоновой кислоты:
К раствору промежуточного соединения (12. iv) (485 мг, 1,4 ммолей) в ДХМ (3 мл) прибавляют воду (1 мл), NMO (192 мг, 1,2 экв.) и дигидрат осмата калия (20 мг). Полученную смесь энергично перемешивают при комнатной температуре в течение ночи. Смесь затем переносят в воду, и органический слой промывают насыщенным водным раствором Na2S2O3. Водные слои экстрагируют ДХМ и объединенные органические слои высушивают над MgSO4 и концентрируют. Остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:100:8), получая названное в заголовке промежуточное соединение в виде бесцветной пены (выход 318 мг, 60%).
МС (ЭСИ, m/z): 390,3 [М+Н+].
13.ii. трет-бутиловый эфир (RS)-4-(3-метоксихиноксалин-5-ил)-2,2-диметил-1,3-диокса-8-аза-спиро[4,5]декан-8-карбоновой кислоты:
Исходя из промежуточного соединения (13.i) и используя методику примера 11, стадия 11.ii, названное в заголовке промежуточное соединение получают в виде желтой пены (выход 187 мг, 55%).
МС (ЭСИ, m/z): 430,3 [М+Н+].
13.iii. 6-{(R)-5-[(RS)-4-(3-метоксихиноксалин-5-ил)-2,2-диметил-1,3-диокса-8-аза-спиро[4.5]дец-8-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (13.ii) и используя методику примера 11, стадия 11.iii, названное в заголовке промежуточное соединение получают в виде бесцветного твердого вещества (выход 130 мг, 81%).
МС (ЭСИ, m/z): 592,4 [М+Н+].
13.iv. 6-((R)-5-{4-гидрокси-4-[(RS)-гидрокси-(3-метоксихиноксалин-5-ил)метил]пиперидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (13.iii) и используя методику примера 11, стадия 11.iv, названное в заголовке соединение получают в виде бежевого твердого вещества (выход 56 мг, 48%).
1Н ЯМР (CDCl3) δ: 8,49 (m, 1Н), 7,97 (m, 2H), 7,58 (m, 2H), 7,36 (s, 1H), 7,23 (m, 1H), 6,88 (dd, J=8,8, 2,3 Гц, 1H), 5,13 (s, 1H), 4,70 (m, 1H), 4,06 (s, 3Н), 3,95 (t, J=8,5 Гц, 1H), 3,67 (m, 1H), 3,46 (s, 2H), 3,37 (s, 2H), 3,23 (m, 1H), 2,62 (m, 5H), 1,86 (m, 1H), 1,63 (m, 2H), 1,31 (m, 1H).
МС (ЭСИ, m/z): 552,5 [M+H+].
Пример 14: 6-((R)-5-{3-[(6-метокси[1,5]нафтиридин-4-иламино)метил]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
14.i. (1-бензгидрилазетидин-3-илметил)-(6-метокси[1,5]нафтиридин-4-ил)амин:
Исходя из 6-метоксихинолин-4-илового эфира трифторметансульфоновой кислоты (получен согласно WO 00/40554) и 3-аминометил-1-дифенилметилазетидина (коммерческий продукт) и используя метод Д, требуемое промежуточное соединение выделяют с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 100:50:4) в виде бесцветного масла (выход 1,25 г, 35%).
МС (ЭСИ, m/z): 411,1 [М+Н+].
14.ii. азетидин-3-илметил-(6-метокси[1,5]нафтиридин-4-ил)амин:
Раствор промежуточного соединения (14.i) (50 мг, 0,085 ммолей) в ДХМ (0,5 мл), охлажденный до температуры 0°С, обрабатывают 1-хлорэтилхлорформиатом (35 мг, 2,5 экв.) и оставляют самопроизвольно нагреваться до комнатной температуры. Затем реакционную смесь перемешивают в течение ночи, после чего концентрируют при пониженном давлении. Остаток растворяют в МеОН и перемешивают при комнатной температуре в течение 3,5 ч. Раствор концентрируют и остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:200:16), получая названное в заголовке промежуточное соединение в виде бесцветного твердого вещества (выход 5 мг, 24%).
МС (ЭСИ, m/z): 245,1 [М+Н+].
14.iii. 6-((R)-5-{3-[(6-метокси[1,5]нафтиридин-4-иламино)метил]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (14.ii) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт получают в виде бесцветного твердого вещества (выход 2 мг, 19%).
МС (ЭСИ, m/z): 507,1 [М+Н+].
Пример 15: 6-{(R)-5-[(2S,4S)-2-аминометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
К раствору соединения (6.iii) (35 мг, 0,065 ммолей) в ТГФ (1,5 мл) прибавляют PPh3 (33 мг, 2 экв.) и воду (0,01 мл). Смесь нагревают при температуре 50°С в течение 3 ч. Реакционную смесь затем концентрируют без досушивания и остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:200:16), получая названное в заголовке соединение в виде бесцветного твердого вещества (выход 5 мг, 24%).
МС (ЭСИ, m/z): 537,3 [М+Н+].
Пример 16: 6-{(R)-5-[(3R*,4R*)-3-(6-метоксихиназолин-4-илокси)-4-[1,2,3]триазол-1-илпирролидин-1-илметил1-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
16.i. wpew-бутиловый эфир (3R*,4R*)-3-азидо-4-(6-метоксихиназолин-4-илокси)пирролидин-1-карбоновой кислоты:
Исходя из трет-бутилового эфира (3R*,4R*)-3-азидо-4-гидроксипирролидин-1-карбоновой кислоты (полученного согласно Tetrahedron Asymmetry (2001), 12, 2989) и используя метод В, требуемое промежуточное соединение получают в виде желтого масла (выход 2,18 г, 69%).
МС (ЭСИ, m/z): 387,3 [М+Н+].
16.ii. 4-((3R*,4R*)-4-азидопирролидин-3-илокси)-6-метоксихиназолин:
Исходя из промежуточного соединения (16.i) и используя метод А, требуемое промежуточное соединение получают в виде желтоватого твердого вещества (выход 984 мг, 61%).
МС (ЭСИ, m/z): 287,3 [М+Н+].
16.iii. 6-{(R)-5-[(3R*,4R*)-3-азидо-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (16.ii) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт выделяют в виде бесцветного твердого вещества (выход 61 мг, 20%).
МС (ЭСИ, m/z): 549,3 [М+Н+].
16.iv. 6-{(R)-5-[(3R*,4R*)-3-(6-метоксихиназолин-4-илокси)-4-[1,2,3]триазол-1-илпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Раствор промежуточного соединения (16.iii) (30 мг, 0,055 ммолей) и бицикло[2.2.1]гепта-2,5-диена (20 мг, 4 экв.) в диоксане (0,5 мл) нагревают с обратным холодильником в течение ночи. Смесь затем концентрируют и очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:50:4), получая названное в заголовке соединение в виде желтого твердого вещества (выход 9 мг, 29%).
МС (ЭСИ, m/z): 575,2 [М+Н+].
Пример 17: N-{(2S,4S)-4-(6-метоксихиназолин-4-илокси)-1-[(R)-2-оксо-3-(3-оксо-3.4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-2-илметил}ацетамид:
К раствору соединения примера 15 (13 мг, 0,024 ммолей) в ДМФ (0,5 мл) прибавляют АсОН (1 мкл, 1 экв.), ДИПЭА (9 мкл, 3 экв.), ГОБТ (3 мг, 1 экв.) и ЭДК (6 мг, 1,2 экв.) при комнатной температуре. После перемешивания в течение 8 ч при комнатной температуре добавляют воду, а затем смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом, высушивают над MgSO4 и концентрируют. Остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:50:4), получая названное в заголовке соединение в виде желтой пены (выход 6 мг, 43%).
МС (ЭСИ, m/z): 579,2 [М+Н+].
Пример 18: 6-{(R)-5-[(3R*,4R*)-3-амино-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
К раствору соединения (16.iii) (20 мг, 0,36 ммолей) в ТГФ (1,5 мл) прибавляют PPh3 (19 мг, 2 экв.) и воду (0,007 мл). Смесь нагревают при температуре 50°С в течение 3 ч. Реакционную смесь затем концентрируют без досушивания и остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:100:8), получая названное в заголовке соединение в виде желтой пены (выход 15 мг, 79%).
МС (ЭСИ, m/z): 523,0 [М+Н+].
Пример 19: 6-{(R)-5-[(2S,4S)-4-(6-метоксихиназолин-4-илокси)-2-[1,2,3]триазол-1-илметилпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Раствор соединения примера 6 (30 мг, 0,053 ммолей) и бицикло[2.2.1]гепта-2,5-диена (20 мг, 4 экв.) в диоксане (0,5 мл) нагревают с обратным холодильником в течение ночи. Смесь затем концентрируют и очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:50:4), получая названное в заголовке соединение в виде желтой пены (выход 17 мг, 54%).
1Н ЯМР (CDCl3) δ: 8,64 (s, 1H), 8,21 (d, J=0,6 Гц, 1Н), 7,86 (d, J=9,1 Гц, 1H), 7,66 (m, 2H), 7,49 (m, 1H), 7,33 (m, 2H), 7,23 (m, 1H), 6,99 (m, 1H), 5,77 (m, 1H), 4,63 (m, 2H), 4,00-3,60 (m, 6H), 3,58-3,36 (m, 4H), 3,06 (m, 1H), 2,90 (m, 2H), 2,58(m, 1H), 2,05 (m, 1H).
MC (ЭСИ, m/z): 589,1 [M+H+].
Пример 20: 6-{(R)-5-[4-(6-метоксихиназолин-4-илокси)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
20.i. трет-бутиловый эфир 4-(6-метоксихиназолин-4-илокси)пиперидин-1-карбоновой кислоты:
Исходя из трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты (коммерческий продукт) и 4-хлор-6-метоксихиназолина и используя метод В, требуемый продукт получают в виде желтого твердого вещества (выход 649 мг, 50%).
MC (ЭСИ, m/z): 360,5 [М+Н+].
20.ii. 6-метокси-4-(пиперидин-4-илокси)хиназолин:
Исходя из промежуточного соединения (20.i) и используя метод А, требуемое промежуточное соединение получают в виде желтого твердого вещества (выход 469 мг, 100%).
MC (ЭСИ, m/z): 260,2 [М+Н+].
20.iii. 6-{(R)-5-[4-(6-метоксихиназолин-4-илокси)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (20.ii) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт получают в виде грязно-белого твердого вещества (выход 66 мг, 49%).
1Н ЯМР (ДМСО-d6) δ: 10,53 (s, 1H), 8,64 (s, 1H), 7,83 (d, J=9,1 Гц, 1H), 7,56 (dd, J=9,1, 2,9 Гц, 1H), 7,34 (m, 3H), 7,12 (dd, J=8,8, 2,3 Гц, 1H), 5,36 (m, 1H), 4,84 (m, 1H), 4,08 (m, 1H), 3,89 (s, 3H), 3,73 (m, 1H), 3,42 (s, 2H), 2,85 (m, 2H), 2,76 (m, 2H), 2,49 (m, 2H), 2,05 (m, 2H), 1,84 (m, 2H).
MC (ЭСИ, m/z): 522.2 [M+H+].
Пример 21: 6-{(R)-5-[(3R*,4S*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
21.i. трет-бутиловый эфир (3R*,4S*)-3,4-дигидроксипирролидин-1-карбоновой кислоты:
К раствору трет-бутилового эфира 2,5-дигидропиррол-1-карбоновой кислоты (коммерческий продукт, 1,0 г, 5,91 ммолей) в трет-BuOH (25 мл) и воде (25 мл) добавляют AD-смесь α (0,75 г) и AD-смесь β (0,75 г). Полученную смесь перемешивают при комнатной температуре в течение ночи, после чего дополнительно добавляют AD-смесь α (0,5 г) и AD-смесь β (0,5 г) и перемешивание продолжают при комнатной температуре в течение ночи. Затем добавляют бисульфит натрия (10 г) и смесь перемешивают в течение 30 мин. Фазы разделяют и водный слой экстрагируют смесью ДХМ/МеОН в соотношении 9:1 (дважды по 40 мл). Органический слой высушивают над MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:100:8), получая названное в заголовке промежуточное соединение в виде бесцветного масла (выход 390 мг, 32%).
1Н ЯМР (CDCl3) δ: 4,21 (расширенный t, J=3,8 Гц, 2Н), 3,55 (m, 2H), 3,31 (m, 2H), 1,44 (s, 9H).
21.ii. трет-бутиловый эфир (3R*,4S*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-карбоновой кислоты:
Исходя из промежуточного соединения (21.i) (386 мг, 3,90 ммолей) и 4-хлор-6-метоксихиназолина (370 мг, 3,90 ммолей) и используя метод В, требуемый продукт выделяют в виде желтого масла (выход 346 мг, 50%).
МС (ЭСИ, m/z): 362,2 [M+H+].
21.iii. (3R*,4S*)-4-(6-метоксихиназолин-4-илокси)пирролидин-3-ол:
Исходя из промежуточного соединения (21.ii) и используя метод А, требуемое промежуточное соединение получают в виде желтого твердого вещества (выход 101 мг, 40%).
МС (ЭСИ, m/z): 262,3 [М+Н+].
21.iv. 6-{(R)-5-[(3R*,4S*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (21.iii) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт получают в виде светло-желтой пены (выход 66 мг, 66%).
МС (ЭСИ, m/z): 524,0 [М+Н+].
Пример 22: 6-{(R)-5-[(3R*,4R*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
22.i. трет-бутиловый эфир (3R*,4R*)-3,4-дигидроксипирролидин-1-карбоновой кислоты:
К раствору трет-бутилового эфира (1R*,5S*)-6-окса-3-аза-бицикло[3.1.0]гексан-3-карбоновой кислоты (коммерческий продукт, 1,63 г, 8,80 ммолей) в диоксане (8 мл) добавляют 2-молярный водный раствор NaOH (30 мл) и смесь перемешивают при температуре 95°С в течение 2 ч. Смесь затем выпаривают и трижды экстрагируют этилацетатом. Объединенные органические слои промывают рассолом, высушивают над MgSO4 и концентрируют при пониженном давлении. Сырой продукт растирают с ЭА, фильтруют, и промывают ЭА, получая названное в заголовке промежуточное соединение в виде желтого твердого вещества (выход 243 мг, 14%).
1Н ЯМР (ДМСО-d6) δ: 5,09 (s, 2Н), 3,84 (s, 2Н), 3,31 (m, 2H), 3,09 (m, 2H), 1,37 (s, 9H).
22.ii. трет-бутиловый эфир (3R*,4R*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-карбоновой кислоты:
Исходя из промежуточного соединения (22.i) (240 мг, 1,18 ммолей) и 4-хлор-6-метоксихиназолина (230 мг, 1,18 ммолей) и используя метод В, требуемый продукт получают в виде желтого масла (выход 189 мг, 44%).
МС (ЭСИ, m/z): 362,2 [М+Н+].
22.iii. (3R*,4R*)-4-(6-метоксихиназолин-4-илокси)пирролидин-3-ол:
Исходя из промежуточного соединения (22.i) и используя метод А, требуемое промежуточное соединение получают в виде желтой пены (выход 74 мг, 54%).
МС (ЭСИ, m/z): 262,4 [M+H+].
22.iv. 6-{(R)-5-[(3R*,4R*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (22.iii) и соединения, полученного в препаративном методе Б, и используя метод Б, требуемый продукт получают в виде светло-желтой пены (выход 14 мг, 19%).
МС (ЭСИ, m/z): 524,2 [М+Н+].
Пример 23: 6-{(R)-5-[3-(3-фтор-6-метокси-[1,5]нафтиридин-4-иламино)азетидин-1-илметил1-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
23.i. бензиловый эфир {1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил)оксазолидин-5-илметил]азетидин-3-ил}карбаминовой кислоты:
Исходя из соединения, полученного в препаративном методе Г, и фенилметилового эфира (3-азетидинилметил)карбаминовой кислоты (коммерческий продукт, CAS 914348-04-2) и используя метод Б, названное в заголовке промежуточное соединение получают в виде бесцветной пены (выход 272 мг, 46%).
МС (ЭСИ, m/z): 453,1 [М+Н+].
23.ii. 6-[(R)-5-(3-аминоазетидин-1-илметил)-2-оксооксазолидин-3-ил]-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (23.i) и используя метод Ж, названное в заголовке промежуточное соединение получают в виде бесцветной пены (выход 43 мг, 76%).
МС (ЭСИ, m/z): 319,1 [М+Н+].
23.iii. 6-{(R)-5-[3-(3-фтор-6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (23.ii) и 8-бром-7-фтор-2-метокси-[1,5]нафтиридина (коммерческий продукт, CAS 724788-70-9) и используя метод Е, названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 24 мг, 48%).
1Н ЯМР (CDCl3) δ: 9,22 (s, 1H), 8,37 (d, J=4,4 Гц, 1Н), 8,06 (d, J=9,1 Гц, 1Н), 7,45 (d, J=2,3 Гц, 1H), 7,00 (d, J=9,1 Гц, 1H), 6,88 (m, 1H), 6,74 (dd, J=8,8, 2,6 Гц, 1H), 6,03 (dd, J=7,0, 2,1 Гц, 1H), 4,68 (m, 2H), 4,55 (s, 2H), 3,91 (m, 7H), 3,28 (t, J=6,7 Гц, 2H), 2,89 (m, 2H).
MC (ЭСИ, m/z): 495,1 [M+H+].
Пример 24: 6-{(R)-5-[3-(6-метокси-[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
Аналогично примеру 23, стадия 23.iii, исходя из 8-бром-2-метокси-1,5-нафтиридина (коммерческий продукт; CAS 881658-92-0) и промежуточного соединения (23. ii), названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 14 мг, 26%).
1Н ЯМР (CDCl3) δ: 9,36 (s, 1H), 8,38 (d, J=5,3 Гц, 1H), 8,12 (d, J=9,1 Гц, 1H), 7,50 (d, J=2,6 Гц, 1H), 7,05 (d, J=9,1 Гц, 1H), 6,88 (m, 1H), 6,71 (dd, J=8,8, 2,6 Гц, 1H), 6,36 (m, 2H), 4,69 (m, 1H), 4,54 (s, 2H), 4,30 (m, 1H), 4,00 (m, 6H), 3,85 (dd, J=8,5, 6,4 Гц, 1H), 3,29 (t, J=6,7 Гц, 2H), 2,97 (m, 1H), 2,85 (m, 1H).
MC (ЭСИ, m/z): 477,0 [М+Н+].
Пример 25: 6-{(R)-5-[3-(6-метоксихинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
Аналогично примеру 23, стадия 23.iii, исходя из 4-бром-6-метоксихинолина (коммерческий продукт; CAS 42881-66-3) и промежуточного соединения (23.ii), названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 16 мг, 30%).
MC (ЭСИ, m/z): 476,0 [М+Н+].
Пример 26: 6-((R)-5-{3-[(3-фтор-6-метокси-[1,5]нафтиридин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (23.ii) и 3-фтор-6-метокси-[1,5]нафтиридин-4-карбальдегида (получен согласно WO 2006/032466) и используя метод 3, названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 14 мг, 77%).
MC (ЭСИ, m/z): 509,0 [М+Н+].
Пример 27: 6-((R)-5-{3-[(6-метокси-[1,5]нафтиридин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (23. ii) и 6-метокси-[1,5]нафтиридин-4-карбальдегида (получен согласно WO 2006/032466) и используя метод 3, названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 12 мг, 29%).
МС (ЭСИ, m/z): 490,9 [М+Н+].
Пример 28: 6-((R)-5-{3-[(3-фтор-6-метоксихинолин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (23.ii) и 3-фтор-6-метоксихинолин-4-карбальдегида (получен согласно WO 2007/105154) и используя метод 3, названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 7 мг, 14%).
МС (ЭСИ, m/z): 508,1 [М+Н+].
Пример 29: 6-((R)-5-{3-[(6-метоксихинолин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (23.ii) и 6-метоксихинолин-4-карбальдегида (коммерческий продукт, CAS 4363-94-4) и используя метод 3, названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 8 мг, 31%).
МС (ЭСИ, m/z): 490,1 [М+Н+].
Пример 30: (R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихиназолин-4-илоксиметил)азетидин-1-илметил]оксазолидин-2-он:
30.i. трет-бутиловый эфир 3-(6-метоксихиназолин-4-илоксиметил)азетидин-1-карбоновой кислоты:
Исходя из 1-трет-бутоксикарбонил-3-гидроксиметилазетидина (коммерческий продукт; CAS 142253-56-3) и 4-хлор-6-метоксихиназолина (коммерческий продукт; CAS 50424-28-7) и используя метод В, названное в заголовке промежуточное соединение получают в виде желтого масла (выход 390 мг, 89%).
МС (ЭСИ, m/z): 346,2 [М+Н+].
30.ii. 4-(азетидин-3-илметокси)-6-метоксихиназолин:
Исходя из промежуточного соединения (30.i) и используя метод А, названное в заголовке промежуточное соединение получают в виде бесцветного масла (выход 148 мг, 48%).
МС (ЭСИ, m/z): 246,4 [М+Н+].
30.iii. (R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихиназолин-4-илоксиметил)азетидин-1-илметил]оксазолидин-2-он:
Исходя из промежуточного соединения (30.ii) и соединения, полученного в препаративном методе Д, и используя метод Б, названное в заголовке соединение получают в виде бесцветного масла (выход 10 мг, 2%).
МС (ЭСИ, m/z): 479,3 [М+Н+].
Пример 31: 6-{(R)-5-[4-(6-метоксихиназолин-4-илокси)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (20.ii) и соединения, полученного в препаративном методе Г, и используя метод Б, названное в заголовке соединение получают в виде бесцветного масла (выход 19 мг, 16%).
МС (ЭСИ, m/z): 506,2 [М+Н+].
Пример 32: N-{(3R*,4R)-4-(6-метоксихиназолин-4-илокси)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-3-ил}ацетамид:
К раствору соединения примера 18 (4 мг, 0,008 ммолей) в ДХМ (1 мл) прибавляют 1-ацетилимидазол (1,1 экв.) и ДИПЭА (1,2 экв.). После перемешивания при комнатной температуре в течение одного дня добавляют 1-ацетилимидазол (1,1 экв.) и ДИПЭА (1,2 экв.) и продолжают перемешивание при комнатной температуре в течение 4 дней. Затем бесцветный раствор концентрируют при пониженном давлении и очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:50:4), получая названное в заголовке соединение в виде бесцветного твердого вещества (выход 4 мг, 93%).
МС (ЭСИ, m/z): 565,3 [М+Н+].
Пример 33: (R)-3-(6,7-дигидро-[1,4]диоксино[2,3-с]пиридазин-3-ил)-5-[(RS)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]оксазолидин-2-он:
33.i. трет-бутиловый эфир (RS)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-карбоновой кислоты:
Названное в заголовке промежуточное соединение получают аналогично примеру 2, стадия 1 л, исходя из трет-бутилового эфира (RS)-3-гидроксипирролидин-1-карбоновой кислоты (коммерческий продукт, CAS 103057-44-9) в виде бледно-желтого масла (выход 764 мг, 43%).
МС (ЭСИ, m/z): 346,3 [М+Н+].
33.ii. 6-метокси-4-((RS)пирролидин-3-илокси)хиназолин:
Исходя из промежуточного соединения (33.i) и используя метод А, названное в заголовке промежуточное соединение получают в виде бледно-желтого твердого вещества (выход 560 мг, 100%).
МС (ЭСИ, m/z): 246,5 [М+Н+].
33.hi. бензиловый эфир {(S)-2-гидрокси-3-[(RS)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-ил]пропил}карбаминовой кислоты:
Раствор промежуточного соединения (33.ii) (133 мг, 0,544 ммолей) и фенилметилового эфира [(2S)-оксиранилметил]карбаминовой кислоты (коммерческий продукт; CAS 247050-11-9, 1 экв.) в смеси EtOH/Н2О (в соотношении 9:1) перемешивают при температуре 80°С в течение ночи, после чего смесь концентрируют при пониженном давлении и очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:50:4), получая названное в заголовке промежуточное соединение в виде желтого масла (выход 89 мг, 36%).
МС (ЭСИ, m/z): 453,1 [М+Н+].
33.iv. (S)-5-[(RS)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]оксазолидин-2-он:
К раствору промежуточного соединения (33.iii) (89 мг, 0,20 ммолей) в ДМФ (1 мл) прибавляют NaH (55%-ный раствор в минеральном масле, 9 мг, 1 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Затем добавляют воду и смесь трижды экстрагируют этилацетатом. Объединенные органический фазы промывают водой и рассолом, высушивают над MgSO4 и концентрируют. Остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН/NH4OH в соотношении 1000:50:4), получая названное в заголовке промежуточное соединение в виде желтого масла (выход 12 мг, 18%).
МС (ЭСИ, m/z): 345,2 [М+Н+].
33.v. (R)-3-(6,7-дигидро-[1,4]диоксино[2,3-с]пиридазин-3-ил)-5-[(RS)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]оксазолидин-2-он:
Исходя из промежуточного соединения (33.iv) и 3-хлор-6,7-дигидро-[1,4]диоксино[2,3-с]пиридазина (коммерческий продукт; CAS 943026-40-2) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 3 мг, 21%).
МС (ЭСИ, m/z): 481,1 [М+Н+].
Пример 34: 6-((R)-5-{3-[(3-метоксихиноксалин-5-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (23.ii) и 3-метоксихиноксалин-5-карбальдегида (получен согласно WO 2007/107965) и используя метод 3, названное в заголовке соединение получают в виде бесцветного твердого вещества (выход 8 мг, 17%).
МС (ЭСИ, m/z): 490,9 [М+Н+].
Пример 35: 6-{(R)-5-[4-(6-метокси-[1,5]нафтиридин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
35.i. трет-бутиловый эфир {1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил)оксазолидин-5-илметил]пиперидин-4-ил}карбаминовой кислоты:
Исходя из соединения, полученного в препаративном методе Г, и трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (коммерческий продукт, CAS 73874-95-0) и используя метод Б, названное в заголовке промежуточное соединение получают в виде бледно-желтого твердого вещества (выход 721 мг, 69%).
МС (ЭСИ, m/z): 447,2 [М+Н+].
35.ii. 6-[(R)-5-(4-аминопиперидин-1-илметил)-2-оксооксазолидин-3-ил]-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (35.i) и используя метод А, названное в заголовке промежуточное соединение получают в виде бесцветного твердого вещества (выход 362 мг, 65%).
МС (ЭСИ, m/z): 347,1 [М+Н+].
35.iii. 6-{(R)-5-[4-(6-метокси[1,5]нафтиридин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (35.ii) и 8-бром-2-метокси-1,5-нафтиридина (коммерческий продукт) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 36 мг, 7%).
МС (ЭСИ, m/z): 505,4 [М+Н+].
Пример 36: 6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
36.i. трет-бутиловый эфир {1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]азетидин-3-ил}карбаминовой кислоты:
Исходя из соединения, полученного в препаративном методе Б, и трет-бутилового эфира азетидин-3-илкарбаминовой кислоты (коммерческий продукт, CAS 91188-13-5) и используя метод Б, названное в заголовке промежуточное соединение получают в виде желтого твердого вещества (выход 2,04 г, 58%).
МС (ЭСИ, m/z): 435.2 [М+Н+].
36.ii. 6-[(R)-5-(3-аминоазетидин-1-илметил)-2-оксооксазолидин-3-ил]-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (36.i) и используя метод А, названное в заголовке промежуточное соединение получают в виде бледно-желтого твердого вещества (выход 1,22 г, 76%).
МС (ЭСИ, m/z): 335,2 [М+Н+].
36.iii. 6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (36.ii) и 8-бром-2-метокси[1,5]нафтиридина (коммерческий продукт) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 612 мг, 85%),
1Н ЯМР (CDCl3) δ: 8,74 (s, 1H), 8,39 (d, J=5,3 Гц, 1Н), 8,10 (d, J=9,1 Гц, 1H), 7,47 (d, J=2,3 Гц, 1H), 7,25 (m, 1H), 7,06 (d, J=9,1 Гц, 1H), 6,89 (dd, J=8,8, 2,3 Гц, 1H), 6,38 (d, J=5,3 Гц, 1H), 6,31 (d, J=6,2 Гц, 1H), 4,71 (m, 1H), 4,31 (m, 1H), 4,02 (m, 6H), 3,89 (dd, J=8,5, 6,4 Гц, 1H), 3,40 (s, 2H), 3,28 (td, J=6,7, 3,2 Гц, 2H), 2,87 (m, 1H), 2,98 (m, 1H).
MC (ЭСИ, m/z): 493,0 [M+H+].
Пример 37: 6-{(R)-5-[3-(6-метоксихинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (36.ii) и 4-бром-6-метоксихинолина (коммерческий продукт) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 504 мг, 70%).
1Н ЯМР (CDCl3) δ: 8,30 (d, J=5,3 Гц, 1H), 7,82 (d, J=9,4 Гц, 1H), 7,40 (d, J=2,3 Гц, 1H), 7,23 (m, 3H), 7,12 (d, J=2,6 Гц, 1H), 6,83 (dd, J=8,5, 2,3 Гц, 1H), 6,14 (d, J=5,3 Гц, 1H), 4,65 (m, 1H), 4,26 (m, 1H), 3,93 (m, 6Н), 3,78 (dd, J=8,5, 6,4 Гц, 1H), 3,34 (m, 4H), 2,92 (m, 1H), 2,81 (m, 1H).
MC (ЭСИ, m/z): 492,1 [М+Н+].
Пример 38: 4-{1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]азетидин-3-иламино)хинолин-6-карбонитрил:
Исходя из промежуточного соединения (36.ii) и 4-бромхинолин-6-карбонитрила (коммерческий продукт, CAS 642477-82-5) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 225 мг, 77%).
MC (ЭСИ, m/z): 487,5 [М+Н+].
Пример 39: 6-{(R)-5-[3-(6-фторхинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (36.ii) и 4-бром-6-фторхинолина (коммерческий продукт, CAS 661463-17-8) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 93 мг, 32%).
MC (ЭСИ, m/z): 480,3 [М+Н+].
Пример 40: 6-{(R)-5-[4-(6-метокси[1,5]нафтиридин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
40.i. трет-бутиловый эфир {1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пиперидин-4-ил}карбаминовой кислоты:
Исходя из соединения, полученного в препаративном методе Б, и трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (коммерческий продукт, CAS 73874-95-0) и используя метод Б, названное в заголовке промежуточное соединение получают в виде бежевого твердого вещества (выход 2,88 г, 49%).
МС (ЭСИ, m/z): 463,2 [М+Н+].
40.ii. 6-[(R)-5-(4-аминопиперидин-1-илметил)-2-оксооксазолидин-3-ил]-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (40.i) и используя метод А, названное в заголовке промежуточное соединение получают в виде бледно-желтой пены (выход 2,27 г, 100%).
МС (ЭСИ, m/z): 363,1 [М+Н+].
40.iii. 6-{(R)-5-[4-(6-метокси[1,5]нафтиридин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (40.ii) и 8-бром-2-метокси-1,5-нафтиридина (коммерческий продукт) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 355 мг, 41%).
МС (ЭСИ, m/z): 521,4 [М+Н+].
Пример 41: 6-{(R)-5-[4-(6-метоксихинолин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он:
Исходя из промежуточного соединения (40.ii) и 4-бром-6-метоксихинолина (коммерческий продукт) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 102 мг, 12%).
МС (ЭСИ, m/z): 520,5 [М+Н+].
Пример 42: (R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]оксазолидин-2-он:
42.i. трет-бутиловый эфир {1-[(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-2-оксооксазолидин-5-илметил]азетидин-3-ил}карбаминовой кислоты:
Раствор соединения, полученного в препаративном методе Д, (3,16 г, 8,7 ммолей) и трет-бутилового эфира азетидин-3-илкарбаминовой кислоты (1,5 г, 1 экв.) в сухом ДМСО (30 мл) обрабатывают ДИПЭА (1,8 мл) и нагревают при температуре 80°С в течение 72 ч. Смесь распределяют между этилацетатом и водой, органическую фазу промывают водой и рассолом, высушивают над MgSO4 и концентрируют. Остаток очищают с помощью ускоренной хроматографии (ЭА, ЭА/МеОН в соотношении 9:1+1% NH4OH), получая требуемое промежуточное соединение в виде бежевого твердого вещества (выход 2,5 г, 71%).
1Н ЯМР (ДМСО d6) δ: 7,27 (dd, J=7,0, 0,9 Гц, 1Н), 7,09 (d, J=2,6 Гц, 1Н), 6,94 (m, 1Н), 6,83 (m, 1Н), 4,57 (m, 1Н), 4,21 (m, 1Н), 4,00 (m, 4H), 3,66 (dd, J=8,8, 6,4 Гц, 1Н), 3,50 (q, J=7,0 Гц, 2Н), 2,91 (m. 2Н), 2,65 (m, 2H), 1,35 (s, 9H).
42.ii. (R)-5-(3-аминоазетидин-1-илметил)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)оксазолидин-2-он:
Исходя из промежуточного соединения (42.i) и используя метод А, названное в заголовке промежуточное соединение получают в виде бесцветной смолы (выход 1,33 г, 70%).
1Н ЯМР (ДМСО-d6) δ: 7,09 (d, J=2,6 Гц, 1Н), 6,94 (m, 1Н), 6,83 (m, 1Н), 4,56 (m, 1Н), 4,21 (m, 4H), 3,98 (t, J=8,8 Гц, 1Н), 3,66 (dd, J=8,8, 6,7 Гц, 1Н), 3,50 (m, 3H), 3,38 (d, J=6,7 Гц, 2Н), 2,65 (m, 4H).
42.iii. (R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метокси-[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-оксазолидин-2-он:
Исходя из промежуточного соединения (42.ii) (61 мг, 0,2 ммоля) и 8-бром-2-метокси-1,5-нафтиридина (коммерческий продукт) и используя метод Е, названное в заголовке соединение получают в виде бледно-желтого твердого вещества (выход 71 мг, 77%).
1Н ЯМР (CDCl3) δ: 8,40 (d, J=5,3 Гц, 1Н), 8,09 (d, J=9,1 Гц, 1Н), 7,04 (m. 3H), 6,85 (d, J=8,8 Гц, 1Н), 6,37 (d, J=5,3 Гц, 1Н), 6,31 (d, J=6,4 Гц, 1Н), 4,65 (m, 1H), 4,30 (m, 1H), 4,25 (s, 4H), 4,05 (s, 3H), 3.98 (m, 4H), 3,84 (dd, J=8,5, 6,7 Гц, 1H), 3,25 (t, J=6,7 Гц, 2Н), 2,93 (m, 1H), 2,81 (m, 1H).
МС (ЭСИ, m/z): 464,3 [М+Н+].
Пример 43: 6-{(R)-5-[3-(6-фторхинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
43. i. 6-йод-4-(4-метоксибензил)-4Н-бензо[1,4]оксазин-3-он:
Раствор 6-йод-4Н-бензо[1,4]оксазин-3-она (6,88 г, 25 ммолей) в ДМФ (50 мл) обрабатывают 4-метоксибензилхлоридом (3,8 мл, 28 ммолей, 1,1 экв.) и Cs2CO3 (9,78 г, 30 ммолей, 1,2 экв.). Смесь перемешивают при комнатной температуре в течение 4 ч и распределяют между этилацетатом (300 мл) и водой (300 мл). Органическую фазу промывают водой (250 мл) и рассолом (200 мл), высушивают над MgSO4 и концентрируют. Остаток растирают со смесью MeOH/Et2O, твердое вещество отфильтровывают, промывают смесью MeOH/Et2O и высушивают в высоком вакууме, получая названное в заголовке промежуточное соединение в виде бежевого твердого вещества (выход 7,8 г, 79%).
МС (ЭСИ, m/z): 395,7 [М+Н+].
43.ii. трет-бутиловый эфир [1-(3-бензилоксикарбониламино-2-гидроксипропил)азетидин-3-ил]карбаминовой кислоты:
Раствор бензилового эфира (S)-оксиранилметилкарбаминовой кислоты (9,3 г, 45 ммолей, 1,5 экв.) и трет-бутилового эфира азетидин-3-илкарбаминовой кислоты (5,2 г, 30 ммолей) в МеОН (60 мл) обрабатывают MgSO4 (7,9 г) и нагревают при температуре 40°С в течение 3 ч. Смесь распределяют между ЭА и МеОН (в соотношении 19:1) (150 мл) и водой (200 мл). Водный слой промывают смесью ЭА/МеОН в соотношении 19:1 (150 мл), а объединенные органический фазы промывают рассолом (150 мл), высушивают над MgSO4 и концентрируют. Остаток растирают с этилацетатом и фильтруют, получая названное в заголовке промежуточное соединение в виде бесцветного твердого вещества (выход 3,4 г, 30%).
МС (ЭСИ, m/z): 380,2 [М+Н+].
43.iii. трет-бутиловый эфир [1-((S)-2-оксооксазолидин-5-илметил)азетидин-3-ил]карбаминовой кислоты:
Раствор промежуточного соединения (43. ii) (3,42 г, 9 ммолей) в МеОН (100 мл) обрабатывают K2CO3 (1,35 г, 9,8 ммолей, 1,09 экв.) и нагревают при температуре 60°С в течение 4 ч. Смесь затем концентрируют в вакууме и очищают с помощью ускоренной хроматографии (ЭА/МеОН в соотношениях 19:1, 9:1+1% NH4OH), получая названное в заголовке промежуточное соединение в виде бесцветного твердого вещества (выход 2,3 г, 95%).
МС (ЭСИ, m/z): 273,3 [М+Н+].
43.iv. трет-бутиловый эфир (1-{(R)-3-[4-(4-метоксибензил)-3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил]-2-оксооксазолидин-5-илметил}азетидин-3-ил)карбаминовой кислоты:
Промежуточное соединение (43.hi) (1 г, 3,7 ммолей), промежуточное соединение (43.i) (1,46 г, 3,7 ммолей, 1 экв.), CuI (141 мг, 0,74 ммолей, 0,2 экв.) и K2CO3 (1,02 г, 7,4 ммолей, 2 экв.) помещают в продутый аргоном сосуд и прибавляют к этой смеси твердых веществ 1,2-диаминоциклогексан (0,091 мл, 0,74 ммолей, 0,2 экв.) и диоксан (22 мл). Полученную смесь продувают аргоном и нагревают при температуре 100°С в течение 2 дней. Смесь затем распределяют между этилацетатом и водой, органическую фазу промывают водой и рассолом, высушивают над MgSO4 и концентрируют. Остаток очищают с помощью ускоренной хроматографии (ЭА, ЭА/МеОН в соотношении 9:1+1% NH4OH), получая названное в заголовке промежуточное соединение в виде коричневой пены (выход 1,14 г, 58%).
МС (ЭСИ, m/z): 539,2 [М+Н+].
43.v. 6-[(R)-5-(3-аминоазетидин-1-илметил)-2-оксооксазолидин-3-ил]-4-(4-метоксибензил)-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (43.iv) (1,13 г) и используя метод А, названное в заголовке промежуточное соединение получают в виде бесцветной смолы (выход 0,85 г, 92%).
МС (ЭСИ, m/z): 439,5 [М+Н+].
43.vi. 6-{(R)-5-[3-(6-фторхинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4-(4-метоксибензил)-4Н-бензо[1,4]оксазин-3-он:
Исходя из промежуточного соединения (43. v) (429 мг, 1,9 ммолей) и 4-бром-6-фторхинолина (коммерческий продукт) и используя метод Е, названное в заголовке промежуточное соединение получают в виде бледно-желтого твердого вещества (выход 929 мг, 84%).
МС (ЭСИ, m/z): 584,4 [M+H+].
43.vii. 6-{(R)-5-[3-(6-фторхинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он:
Раствор промежуточного соединения (43.vi) (905 мг, 1,55 ммолей) в ТФК (15 мл) в запаянной емкости нагревают при температуре 80°С в течение ночи. Летучие компоненты удаляют при пониженном давлении, а остаток распределяют в смеси ДХМ/МеОН в соотношении 9:1 (130 мл) и NH4OH (80 мл). Органическую фазу промывают водой (100 мл), высушивают над MgSO4 и концентрируют. Остаток кристаллизуют из смеси ДХМ/МеОН, получая названное в заголовке соединение в виде бесцветного твердого вещества (выход 0,5 г,70%).
1Н ЯМР (CDCl3) δ: 8,40 (d, J=5,3 Гц, 1Н), 8,09 (d, J=9,1 Гц, 1Н), 7,04 (m, 3Н), 6,85 (d, J=8,8 Гц, 1Н), 6,37 (d, J=5,3 Гц, 1Н), 6,31 (d, J=6,4 Гц, 1Н), 4,66 (m, 1Н), 4,30 (m, 1Н), 4,25 (s, 4H), 4,05 (s, 3Н), 3,98 (m, 3Н), 3,84 (dd, J=8,5, 6,7 Гц, 1Н), 3,25 (t, J=6,7 Гц, 2Н), 2,93 (m, 1Н), 2,81 (m, 1Н).
МС (ЭСИ, m/z): 464,3 [М+Н+].
Пример 44: (R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихинолин-4-илокси)азетидин-1-илметил]оксазолидин-2-он:
44.i. 3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-(3-гидроксиазетидин-1-илметил)оксазолидин-2-он:
Соединение, полученное в препаративном методе Д, (9 г, 25 ммолей) и гидрохлорид 3-гидроксиазетидина (4,1 г, 1,5 экв.) конденсируют, используя метод Б и получая названное в заголовке промежуточное соединение в виде бежевого твердого вещества (выход 1,3 г, 17%).
МС (ЭСИ, m/z): 307,3 [М+Н+].
44.ii. (R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихинолин-4-илокси)азетидин-1-илметил]оксазолидин-2-он:
ДИАД (0,116 мл) прикалывают к раствору промежуточного соединения (44.i) (0,15 г, 0,49 ммолей), PPh3 (0,141 г) и 6-метоксихинолин-4-ола (0,086 г) в ТГФ (1 мл). Смесь перемешивают при комнатной температуре в течение 1,5 ч, концентрируют в вакууме и очищают с помощью ускоренной хроматографии (ЭА, ЭА/МеОН в соотношении 9:1+1% NH4OH), получая названное в заголовке соединение в виде желтого масла (12 мг).
МС (ЭСИ, m/z): 464,5 [М+H+].
Фармакологические свойства соединений по изобретению
Анализы методом in vitro
Экспериментальные методы:
Эти анализы осуществляются в соответствие с описанием, приведенным в: «Methods for dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically, 4th ed.; Approved standard: NCCLS Document M7-A4; National Committee for Clinical Laboratory Standards: Villanova, PA, USA, 1997». Минимальные концентрации ингибирования (MICs; мг/л) определялись в катион-регулируемой питательной среде Mueller-Hinton Broth (BBL) с использованием метода микроразбавления согласно указаниям NCCLS (National Committee for Clinical Laboratory Standards. Methods for Dilution Antimicrobial Susceptibility). Величина рН тестируемой среды составляет 7,2-7,3.
Результаты:
Соединения всех вышеприведенных примеров протестированы относительно воздействия на граммположительные и граммотрицательные бактерии.
Типичные результаты антибактериальных тестов представлены в нижеприведенной таблице (MIC в мг/л).
| название | год | авторы | номер документа |
|---|---|---|---|
| ОКСАЗОЛИДИНОВЫЕ АНТИБИОТИКИ | 2008 |
|
RU2470022C2 |
| ОКСАЗОЛИДИНИЛОВЫЕ АНТИБИОТИКИ | 2009 |
|
RU2516701C2 |
| ТРИЦИКЛИЧЕСКИЕ ОКСАЗОЛИДИНОНОВЫЕ АНТИБИОТИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2530884C2 |
| АНТИБИОТИЧЕСКИЕ ПРОИЗВОДНЫЕ 2-ОКСО-ОКСАЗОЛИДИН-3, 5-ДИИЛА | 2012 |
|
RU2616609C2 |
| ПОИЗВОДНЫЕ ОКСАЗОЛИДИНОНА | 2009 |
|
RU2501799C2 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛИДИНОВЫХ АНТИБИОТИКОВ | 2008 |
|
RU2506263C2 |
| ПРОИЗВОДНЫЕ 5-ГИДРОКСИМЕТИЛОКСАЗОЛИДИН-2-ОНА | 2007 |
|
RU2453546C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2267489C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ АНГИОГЕНЕЗА | 2000 |
|
RU2262935C2 |
| ПРОИЗВОДНЫЕ 2-ГИДРОКСИЭТИЛ-1Н-ХИНОЛИН-2-ОНА И ИХ АЗАИЗОСТЕРИЧЕСКИЕ АНАЛОГИ С АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2540862C2 |
Изобретение относится к антибактериальным соединениям формулы (I)

где один или два из U, V, W и Х представляет собой N, остальные представляют собой СН или, в случае X, могут также представлять собой CRa, где Ra представляет собой фтор; R1 представляет собой алкоксигруппу, галоген или цианогруппу; R2 представляет собой Н, СН2ОН, CH2N3, CH2NH2, алкилкарбониламинометил или триазол-1-илметил; R3 представляет собой Н или, когда n=1, R3 может также представлять собой ОН, NH2, NHCOR6 или триазол-1-ил; А представляет собой CR4; К представляет собой О, NH, ОСН2, NHCO, NHCH2, CH2NH, CH2CH2, СН=СН, СНОНСНОН или CHR5; R4 представляет собой Н или вместе с R5 образует связь, или R4 может также представлять собой ОН, когда K не является О, NH, ОСН2 или NHCO; R5 представляет собой ОН или вместе с R4 образует связь; R6 представляет собой алкил; m=0 или 1 и n=0 или 1; и G определено в п.1 формулы; и к солям такого соединения. 3 н. и 16 з.п. ф-лы, 1 табл., 44 пр.
1. Соединение формулы (I)
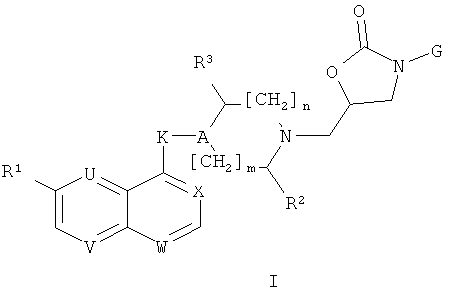 ,
,
где один или два из U, V, W и Х представляют собой N, остальные представляют собой СН или, в случае X, могут также представлять собой CRa, где Ra обозначает фтор;
R1 представляет собой алкоксигруппу, галоген или цианогруппу;
R2 представляет собой Н, CH2OH, CH2N3, CH2NH2, алкилкарбониламинометил или триазол-1-илметил;
R3 представляет собой Н или, когда n=1, R3 может также представлять собой ОН, NH2, NHCOR6 или триазол-1-ил;
А представляет собой CR4;
K представляет собой О, NH, ОСН2, NHCO, NHCH2, CH2NH, CH2CH2, СН=СН, СНОНСНОН или CHR5;
R4 представляет собой Н или вместе с R5 образует связь или R4 может также представлять собой ОН, когда K не является О, NH, ОСН2 или NHCO;
R5 представляет собой ОН или вместе с R4 образует связь;
R6 представляет собой алкил;
m=0 или 1 и n=0 или 1 и
G представляет собой группу

где Z1 представляет собой N, Z2 представляет собой СН и Z3 представляет собой СН; или
Z1 представляет собой СН, Z2 представляет собой N и Z3 представляет собой СН или N; или
Z1 представляет собой СН, Z2 представляет собой СН и Z3 представляет собой СН или N;
и кольцо Р выбрано из следующих групп:


в которых Q представляет собой О или S;
или соль такого соединения.
2. Соединение формулы (I) по п.1, где R1 представляет собой метоксигруппу; или соль такого соединения.
3. Соединение формулы (I) по п.1, где
R1 представляет собой алкоксигруппу;
R3 представляет собой Н или, когда n=1, R3 может также представлять собой ОН, NH2 или триазол-1-ил;
K представляет собой О, NH, ОСН2, NHCO, NHCH2, CH2CH2, CH=CH, СНОНСНОН или CHR5, где значения R5 определены в п.1; и
G представляет собой группу

где Z представляет собой N или СН и кольцо Р определено в п.1;
или соль такого соединения.
4. Соединение формулы (I) по п.3, где R1 представляет собой метоксигруппу; или соль такого соединения.
5. Соединение формулы (I) по п.1, где U и V каждый представляет собой N и W и Х каждый представляет собой СН, или U и V каждый представляет собой СН и W и Х каждый представляет собой N, или также U и W каждый представляет собой N и V и Х каждый представляет собой СН; или соль такого соединения.
6. Соединение формулы (I) по п.5, где R1 представляет собой метоксигруппу; или соль такого соединения.
7. Соединение формулы (I) по п.1, где m и n каждый = 0; или соль такого соединения.
8. Соединение формулы (I) по п.7, где R1 представляет собой метоксигруппу; или соль такого соединения.
9. Соединение формулы (I) по п.1, где m=1 и n=0; или соль такого соединения.
10. Соединение формулы (I) по п.9, где R1 представляет собой метоксигруппу; или соль такого соединения.
11. Соединение формулы (I) по п.1, где G представляет собой 3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил; или соль такого соединения.
12. Соединение формулы (I) по п.11, где R1 представляет собой метоксигруппу; или соль такого соединения.
13. Соединение формулы (I) по п.12, где m и n каждый = 0; или соль такого соединения.
14. Соединение формулы (I) по п.12, где m=1 и n=0; или соль такого соединения.
15. Соединение формулы (I) по п.1, которое выбрано из следующих соединений:
6-{(R)-5-[3-(6-метокси-[1,5]нафтиридин-4-илокси)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(R)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(S)-3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]оксазолидин-2-он;
6-{(R)-5-[(2S,4S)-2-гидроксиметил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-2-азидометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
(6-метокси[1,5]нафтиридин-4-ил)амид 1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]азетидин-3-карбоновой кислоты;
(6-метокси[1,5]нафтиридин-4-ил)амид 1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-3-карбоновой кислоты;
6-((R)-5-{3-[(Е)-2-(6-метокси[1,5]нафтиридин-4-ил)винил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он;
6-((R)-5-{3-[2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он;
6-((R)-5-{3-[(1R,2R)-1,2-дигидрокси-2-(6-метокси[1,5]нафтиридин-4-ил)этил]пирролидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(3-метоксихиноксалин-5-илметилен)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-((R)-5-{4-гидрокси-4-[гидрокси(3-метоксихиноксалин-5-ил)метил]пиперидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он;
6-((R)-5-{3-[(6-метокси[1,5]нафтиридин-4-иламино)метил]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-2-аминометил-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4R*)-3-(6-метоксихиназолин-4-илокси)-4-[1,2,3]триазол-1-илпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
N-{(2S,4S)-4-(6-метоксихиназолин-4-илокси)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-2-илметил} ацетамид;
6-{(R)-5-[(3R*,4R*)-3-амино-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(2S,4S)-4-(6-метоксихиназолин-4-илокси)-2-[1,2,3]триазол-1-илметилпирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(6-метоксихиназолин-4-илокси)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4S*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[(3R*,4R*)-3-гидрокси-4-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
или соль такого соединения.
16. Соединение формулы (I) по п.1, которое выбрано из следующих соединений:
6-{(R)-5-[3-(3-фтор-6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он;
6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он;
6-{(R)-5-[3-(6-метоксихинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он;
6-((R)-5-{3-[(3-фтор-6-метокси[1,5]нафтиридин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он;
6-((R)-5-{3-[(6-метокси[1,5]нафтиридин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он;
6-((R)-5-{3-[(3-фтор-6-метоксихинолин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он;
6-((R)-5-{3-[(6-метоксихинолин-4-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихиназолин-4-илоксиметил)азетидин-1-илметил]оксазолидин-2-он;
6-{(R)-5-[4-(6-метоксихиназолин-4-илокси)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он;
N-{(3R*,4R*)-4-(6-метоксихиназолин-4-илокси)-1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]пирролидин-3-ил}ацетамид;
(R)-3-(6,7-дигидро[1,4]диоксино[2,3-с]пиридазин-3-ил)-5-[3-(6-метоксихиназолин-4-илокси)пирролидин-1-илметил]оксазолидин-2-он;
6-((R)-5-{3-[(3-метоксихиноксалин-5-илметил)амино]азетидин-1-илметил}-2-оксооксазолидин-3-ил)-4Н-бензо[1,4]оксазин-3-он;
6-{(R)-5-[4-(6-метокси[1,5]нафтиридин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он;
6-{(R)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[3-(6-метоксихинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
4-{1-[(R)-2-оксо-3-(3-оксо-3,4-дигидро-2Н-бензо[1,4]тиазин-6-ил)оксазолидин-5-илметил]азетидин-3-иламино}хинолин-6-карбонитрил;
6-{(R)-5-[3-(6-фторхинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(6-метокси[1,5]нафтиридин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
6-{(R)-5-[4-(6-метоксихинолин-4-иламино)пиперидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]тиазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метокси[1,5]нафтиридин-4-иламино)азетидин-1-илметил]оксазолидин-2-он;
6-{(R)-5-[3-(6-фторхинолин-4-иламино)азетидин-1-илметил]-2-оксооксазолидин-3-ил}-4Н-бензо[1,4]оксазин-3-он;
(R)-3-(2,3-дигидробензо[1,4]диоксин-6-ил)-5-[3-(6-метоксихинолин-4-илокси)азетидин-1-илметил]-оксазолидин-2-он;
или соль такого соединения.
17. Соединение формулы (I) по одному из пп.1-16 или его фармацевтически приемлемая соль в качестве лекарственного средства для профилактики или лечения бактериальной инфекции.
18. Фармацевтическая композиция для профилактики или лечения бактериальной инфекции, содержащая в качестве активной составляющей соединение формулы I по одному из пп.1-16 или его фармацевтически приемлемую соль и по крайней мере одно терапевтически инертное вспомогательное вещество.
19. Применение соединения формулы I по одному из пп.1-16 или его фармацевтически приемлемой соли для приготовления лекарственного средства, предназначенного для профилактики или лечения бактериальной инфекции.
| DE 10316081 A1, 21.10.2004 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛИДИНОНОВ В КАЧЕСТВЕ АНТАГОНИСТОВ 5-HT, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2196140C2 |
Авторы
Даты
2013-09-10—Публикация
2008-12-17—Подача