Область техники
Эта заявка претендует на приоритет по патентной заявке Японии номер 2009-140363, поданной 11 июня 2009 года, полное содержание которой включено в настоящий документ путем ссылки.
Настоящее изобретение относится к фармацевтическим композициям и вакцинам для лечения и/или предупреждения заболеваний, вызванных неоваскуляризацией сосудистой оболочки (неоваскулярной макулопатией). Настоящее изобретение также относится к фармацевтическим композициям и вакцинам для ингибирования неоваскуляризации сосудистой оболочки глаза.
Уровень техники
Экссудативная форма возрастной макулярной дегенерации (АМД), вызванная неоваскуляризацией (CNV), является одной из основных причин тяжелых нарушений зрения в развитых странах. Данные на сегодняшний день свидетельствуют о том, что фактор роста эндотелия сосудов (VEGF) играет центральную роль в развитии CNV. Например, было опубликовано, что CNV подавляют соединения, ингибирующие сигнальный путь VEGF. Кроме того, также было опубликовано, что антитела к VEGF обладают высокой терапевтической эффективностью по сравнению с обычными способами лечения, включая фотодинамическую терапию. Поэтому в последние годы анти-VEGF агенты стали основным выбором лекарственных средств при лечении CNV.
Сигнальный путь VEGF опосредован двумя типами рецепторных тирозиновых киназ, а именно, VEGF-рецептором 1 (VEGFR-1) и VEGF-рецептором 2 (VEGFR-2). Эти два рецептора экспрессируются на CNV-мембране человека и CNV-мембране лабораторных мышей. Однако роль сигнального пути VEGFR-1 в CNV все еще противоречива. Например, в одном исследовании было опубликовано, что ингибирование сигнала от VEGFR-1 в результате перорального введения антитела, нокдауна гена или киРНК ингибировало CNV. В другом исследовании было опубликовано, что в глазах активация VEGFR-1 с помощью VEGF или плацентарного фактора роста 1 (PIGF1), который является лигандом VEGFR-2, приводит к активации CNV в результате активации VEGFR-2 с помощью SPARC. С другой стороны, в отношении VEGFR-2 в общем принято, что активация сигнала от VEGFR-2 усиливает рост CNV. Поэтому ожидается, что антиангиогенные подходы, направленные на VEGFR-2, такие как системное или местное введение анти-VEGFR-2 агентов или антител к VEGFR-2, и интравитреальное введение киРНК будут ингибировать сигнальный путь VEGFR-2 и рост CNV.
Однако проблема с доступными на сегодняшний день анти-VEGF агентами состоит в том, что их необходимо постоянно вводить с помощью инъекций с 4-6-недельными интервалами. Кроме того, существует высокий риск тяжелых осложнений, таких как эндофтальмит и отслоение сетчатки. Поэтому необходимо разработать новый способ лечения, который может заменить используемые на сегодняшний день анти-VEGF агенты.
Известно, что вакцина, в которой используется пептид, полученный из VEGF-рецептора 2 человека, индуцирует цитотоксические Т-лимфоциты (CTL) в опухолевых тканях, которые проявляют сильную цитотоксичность в отношении экспрессирующих VEGFR-2 эндотелиальных клеток (патентный документ 1). Также известно, что вакцина, в которой используется пептид, полученный из VEGF-рецептора 1 человека, индуцирует CTL, проявляющие сильную цитотоксичность в отношении экспрессирующего VEGFR-1 эндотелия (патентный документ 2). Кроме того, было подтверждено, что вакцина, в которой используется пептид, полученный из VEGF-рецептора 2, ингибирует CNV у мышей (патентный документ 3). Однако, как и для других тканей, в механизме неоваскуляризации хориоидеи остается много неясных моментов, и не существует вакцина, эффективно ингибирующая CNV в хориоидее человека.
Список цитируемой литературы
Патентная литература
[Патентная литература 1] WO 2004/024766
[Патентная литература 2] WO 2006/093030
[Патентная литература 3] WO 2008/099908
Краткое описание сущности изобретения
Техническая проблема
Настоящее изобретение было выполнено с учетом вышеуказанных обстоятельств. Задача настоящего изобретения относится к новым фармацевтическим агентам и способам лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией).
Решение проблемы
Авторы изобретения вводили фармацевтическую композицию/вакцину, содержащую пептид из VEGFR-1, пациентам с неоваскулярной макулопатией и в результате обнаружили, что это может эффективно ингибировать CNV у человека, не вызывая проблем, связанных с безопасностью, таким образом выполнив настоящее изобретение.
Более конкретно, настоящее изобретение относится к фармацевтической композиции для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, содержащей в качестве активного ингредиента по меньшей мере пептид, содержащий аминокислотную последовательность, полученную из белка VEGFR-1, и способный индуцировать цитотоксические Т-клетки, и/или кодирующий его полинуклеотид.
Настоящее изобретение также относится к вакцине для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), содержащей в качестве активного ингредиента по меньшей мере пептид, содержащий аминокислотную последовательность, полученную из белка VEGFR-1, и способный индуцировать цитотоксические Т-клетки, и/или кодирующий его полинуклеотид.
Настоящее изобретение также относится к фармацевтической композиции для ингибирования неоваскуляризации хориоидеи человека, содержащей в качестве активного ингредиента по меньшей мере пептид, содержащий аминокислотную последовательность, полученную из белка VEGFR-1, и способный индуцировать цитотоксические Т-клетки, и/или кодирующий его полинуклеотид.
Кроме того, настоящее изобретение относится к вакцине для ингибирования неоваскуляризации хориоидеи человека, содержащей в качестве активного ингредиента по меньшей мере пептид, содержащий аминокислотную последовательность, полученную из белка VEGFR-1, и способный индуцировать цитотоксические Т-клетки, и/или кодирующий его полинуклеотид.
Настоящее изобретение относится к способу лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, включающему стадию введения субъекту по меньшей мере пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Настоящее изобретение также относится к способу ингибирования неоваскуляризации хориоидеи человека, включающему стадию введения субъекту по меньшей мере пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Настоящее изобретение дополнительно относится к применению пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида в изготовлении фармацевтической композиции для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека.
Кроме того, настоящее изобретение относится к применению пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида в изготовлении вакцины для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека.
Настоящее изобретение также относится к применению пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида в изготовлении фармацевтической композиции для ингибирования неоваскуляризации хориоидеи человека.
В дополнение, настоящее изобретение относится к применению пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида в изготовлении вакцины для ингибирования неоваскуляризации хориоидеи человека.
Настоящее изобретение дополнительно относится к пептиду, содержащему аминокислотную последовательность, полученную из белка VEGFR-1, и способному индуцировать цитотоксические Т-клетки, для применения при лечении и/или предупреждении заболевания, вызванного неоваскуляризацией хориоидеи человека.
В качестве альтернативы, настоящее изобретение дополнительно относится к способу или процессу изготовления фармацевтической композиции для лечения или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, причем способ или процесс включают стадию введения в состав фармацевтически или физиологически приемлемого носителя с активным ингредиентом - пептидом, содержащим аминокислотную последовательность, полученную из белка VEGFR-1, и способным индуцировать цитотоксические Т-клетки, и/или кодирующим его полинуклеотидом.
В другом варианте осуществления настоящее изобретение также относится к способу или процессу изготовления фармацевтической композиции для лечения или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, причем способ или процесс включают стадию смешивания активного ингредиента с фармацевтически или физиологически приемлемым носителем, где активным ингредиентом является пептид, содержащий аминокислотную последовательность, полученную из белка VEGFR-1, и способный индуцировать цитотоксические Т-клетки, и/или кодирующий его полинуклеотид.
В качестве альтернативы, в одном варианте осуществления настоящего изобретения для лечения или ингибирования CNV человека пептид, полученный из VEGFR-1, можно также вводить в комбинации с пептидом, полученным из VEGFR-2. Соответственно, настоящее изобретение относится к фармацевтической композиции для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), содержащей в качестве активного ингредиента по меньшей мере один тип каждого из пептидов, выбранных из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Настоящее изобретение также относится к вакцине для лечения или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, содержащей в качестве активного ингредиента по меньшей мере один тип каждого из пептидов, выбранных из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Настоящее изобретение также относится к фармацевтической композиции для ингибирования неоваскуляризации хориоидеи человека, содержащей в качестве активного ингредиента по меньшей мере один тип каждого из пептидов, выбранных из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Кроме того, настоящее изобретение относится к вакцине для ингибирования неоваскуляризации хориоидеи человека, содержащей в качестве активного ингредиента по меньшей мере один тип каждого из пептидов, выбранных из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Настоящее изобретение также относится к способу лечения или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, включающему стадию введения субъекту по меньшей мере одного типа каждого из пептидов, выбранных из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Настоящее изобретение также относится к способу ингибирования неоваскуляризации хориоидеи человека, включающему стадию введения субъекту по меньшей мере одного типа каждого из пептидов, выбранных из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Настоящее изобретение дополнительно относится к применению пептида, выбранного из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки,
в изготовлении фармацевтической композиции для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека.
Кроме того, настоящее изобретение относится к применению пептида, выбранного из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки,
в изготовлении вакцины, и/или кодирующего его полинуклеотида, для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека.
Настоящее изобретение дополнительно относится к применению пептида, выбранного из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида,
в изготовлении фармацевтической композиции для ингибирования неоваскуляризации хориоидеи человека.
В дополнение, настоящее изобретение относится к применению пептида, выбранного из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида,
в изготовлении вакцины для ингибирования неоваскуляризации хориоидеи человека.
В дополнение, настоящее изобретение относится к пептиду, выбранному из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида,
для применения при лечении или предупреждении заболевания, вызванного неоваскуляризацией хориоидеи человека.
В дополнение, настоящее изобретение относится к пептиду, выбранному из группы, состоящей из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида,
для применения при ингибировании неоваскуляризации хориоидеи человека.
В качестве альтернативы, настоящее изобретение дополнительно относится к способу или процессу изготовления фармацевтической композиции для лечения или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, причем способ или процесс включают стадию введения в состав фармацевтически или физиологически приемлемого носителя с активным ингредиентом, выбранным из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида,
в качестве активных ингредиентов.
В качестве альтернативы, настоящее изобретение дополнительно относится к способу или процессу изготовления вакцины для ингибирования неоваскуляризации хориоидеи человека, причем способ или процесс включают стадию введения в состав фармацевтически или физиологически приемлемого носителя с активным ингредиентом, выбранным из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида,
в качестве активных ингредиентов.
В другом варианте осуществления настоящее изобретение также относится к способу или процессу изготовления фармацевтической композиции для лечения или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, причем способ или процесс включают стадию смешивания активного ингредиента с фармацевтически или физиологически приемлемым носителем, где активный ингредиент выбран из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
В другом варианте осуществления настоящее изобретение также относится к способу или процессу изготовления вакцины для ингибирования неоваскуляризации хориоидеи человека, причем способ или процесс включают стадию смешивания активного ингредиента с фармацевтически или физиологически приемлемым носителем, в котором активный ингредиент выбран из:
(а) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-1, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида, и
(b) пептида, содержащего аминокислотную последовательность, полученную из белка VEGFR-2, и способного индуцировать цитотоксические Т-клетки, и/или кодирующего его полинуклеотида.
Более конкретно, настоящее изобретение относится к следующим пп. [1]-[30]:
[1] Фармацевтической композиции для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), содержащей в качестве активного ингредиента по меньшей мере один тип пептидов из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки, или кодирующий его полинуклеотид,
[2] Фармацевтической композиции по п. [1], в которой вышеуказанные пептиды по (а) включают пептид (i) и (ii), описанный ниже:
(i) по меньшей мере один пептид, содержащий любую одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4;
(ii) по меньшей мере один пептид, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в любой одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4,
[3] Фармацевтической композиции по п. [2], в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является лейцином или метионином;
(2) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является лейцином или метионином, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, тирозином, метионином или триптофаном;
(5) пептидом, в котором С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, лейцином, изолейцином, триптофаном или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, тирозином, метионином или триптофаном, и С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, лейцином, изолейцином, триптофаном или метионином,
[4] Фармацевтической композиции по любому одному из пп. [1]-[3], в котором композиция дополнительно содержит по меньшей мере один тип пептидов из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки,
[5] Фармацевтической композиции по п. [4], в которой вышеуказанные пептиды по (b) включают (i) и (ii), описанные ниже:
(i) по меньшей мере один пептид, содержащий любую одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5-17; и
(ii) по меньшей мере один пептид, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в любой одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17,
[6] Фармацевтической композиции по п. [5], в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является лейцином или метионином;
(2) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является лейцином или метионином, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, тирозином, метионином или триптофаном;
(5) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, лейцином, изолейцином, триптофаном или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, тирозином, метионином или триптофаном, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, лейцином, изолейцином, триптофаном или метионином,
[7] Фармацевтической композиции по любому одному из пп. [1]-[6], в котором заболевание, вызванное неоваскуляризацией хориоидеи (неоваскулярной макулопатией), выбрано из экссудативной возрастной макулярной дегенерации, миопической макулярной дегенерации, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных видов пигментной эпителиопатии сетчатки, хориоидальной атрофии, хориодеремии и хориоидальной остеомы,
[8] Фармацевтической композиции по любому одному из пп. [1]-[7], которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24,
[9] Вакцине для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), содержащей в качестве активного ингредиента по меньшей мере один тип пептидов из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки, или кодирующий его полинуклеотид,
[10] Вакцине по п. [9], в которой вышеуказанные пептиды по (а) включают пептид (i) и (ii), описанный ниже:
(i) по меньшей мере один пептид, содержащий любую одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4; и
(ii) по меньшей мере один пептид, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в любой одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4,
[11] Вакцине по п. [10], в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является лейцином или метионином;
(2) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является лейцином или метионином, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, тирозином, метионином или триптофаном;
(5) пептидом, в котором С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, лейцином, изолейцином, триптофаном или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, тирозином, метионином или триптофаном, и С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, лейцином, изолейцином, триптофаном или метионином,
[12] Вакцине по любому одному из пп. [9]-[11], в котором вакцина дополнительно содержит по меньшей мере один тип пептидов из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки,
[13] Вакцине по п. [12], в которой вышеуказанные пептиды по (b) включают (i) и (ii), описанные ниже:
(i) по меньшей мере один пептид, содержащий аминокислотную последовательность любой одной из SEQ ID NO: 5-17; и
(ii) по меньшей мере один пептид, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в любой одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17,
[14] Вакцине по п. [13], в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является лейцином или метионином;
(2) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является лейцином или метионином, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, тирозином, метионином или триптофаном;
(5) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, лейцином, изолейцином, триптофаном или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, тирозином, метионином или триптофаном, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, лейцином, изолейцином, триптофаном или метионином,
[15] Вакцине по любому одному из пп. [9]-[14], в котором заболевание, вызванное неоваскуляризацией хориоидеи (неоваскулярной макулопатией), выбрано из экссудативной возрастной макулярной дегенерации, миопической макулярной дегенерации, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных видов пигментной эпителиопатии сетчатки, хориоидальной атрофии, хориодеремии и хориоидальной остеомы,
[16] Вакцине по любому одному из пп. [9]-[15], которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24,
[17] Фармацевтической композиции для ингибирования неоваскуляризации хориоидеи человека, содержащей в качестве активного ингредиента по меньшей мере один тип пептидов из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки, или кодирующий его полинуклеотид,
[18] Фармацевтической композиции по п. [17], в которой вышеуказанные пептиды по (а) включают пептид (i) и (ii), описанный ниже:
(i) по меньшей мере один пептид, содержащий любую одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4; и
(ii) по меньшей мере один пептид, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в любой одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4,
[19] Фармацевтической композиции по п. [18], в которой вышеуказанный пептид (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является лейцином или метионином;
(2) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является лейцином или метионином, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, тирозином, метионином или триптофаном;
(5) пептидом, в котором С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, лейцином, изолейцином, триптофаном или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, тирозином, метионином или триптофаном, и С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, лейцином, изолейцином, триптофаном или метионином,
[20] Фармацевтической композиции по любому одному из пп. [17]-[19], в котором композиция дополнительно содержит по меньшей мере один тип пептидов из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки,
[21] Фармацевтической композиции по п. [20], в которой вышеуказанные пептиды по (b) включают (i) и (ii), описанные ниже:
(i) по меньшей мере один пептид, содержащий аминокислотную последовательность любой одной из SEQ ID NO: 5-17; и
(ii) по меньшей мере один пептид, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в любой одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17,
[22] Фармацевтической композиции по п. [21], в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является лейцином или метионином;
(2) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является лейцином или метионином, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, тирозином, метионином или триптофаном;
(5) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, лейцином, изолейцином, триптофаном или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, тирозином, метионином или триптофаном, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, лейцином, изолейцином, триптофаном или метионином,
[23] Фармацевтической композиции по любому одному из пп. [15]-[19], которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24,
[24] Вакцине для ингибирования неоваскуляризации хориоидеи человека, содержащей в качестве активного ингредиента по меньшей мере один тип пептидов из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки, или кодирующий его полинуклеотид,
[25] Вакцине по п. [24], в которой вышеуказанные пептиды по (а) включают пептид (i) и (ii), описанный ниже:
(i) по меньшей мере один пептид, содержащий любую одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4; и
(ii) по меньшей мере один пептид, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в любой одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4,
[26] Вакцине по п. [25], в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является лейцином или метионином;
(2) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является лейцином или метионином, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 1-3 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, тирозином, метионином или триптофаном;
(5) пептидом, в котором С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, лейцином, изолейцином, триптофаном или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, тирозином, метионином или триптофаном, и С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 является фенилаланином, лейцином, изолейцином, триптофаном или метионином,
[27] Вакцине по любому одному из пп. [24]-[26], которая дополнительно содержит по меньшей мере один тип пептидов из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки,
[28] Вакцине по п. [27], в которой вышеуказанные пептиды по (b) включают (i) и (ii), описанные ниже:
(i) по меньшей мере один пептид, содержащий аминокислотную последовательность любой одной из SEQ ID NO: 5-17; и
(ii) по меньшей мере один пептид, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в любой одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17,
[29] Вакцине по п. [28], в которой вышеуказанный пептид по (ii) является любым одним из пептидов по (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является лейцином или метионином;
(2) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является лейцином или метионином, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, тирозином, метионином или триптофаном;
(5) пептидом, в котором С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, лейцином, изолейцином, триптофаном или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, тирозином, метионином или триптофаном, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 5-10 является фенилаланином, лейцином, изолейцином, триптофаном или метионином, и
[30] Вакцине по любому одному из пп. [24]-[29], которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24.
Предпочтительные эффекты изобретения
Настоящее изобретение может относиться к фармацевтическим композициям и вакцинам, эффективным для лечения и предупреждения заболеваний, вызванных неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией). Кроме того, настоящее изобретение может относится к фармацевтическим композициям и вакцинам, эффективным для ингибирования неоваскуляризации хориоидеи человека.
Краткое описание чертежей
[Фиг. 1-1] На фиг. 1 показано ослабление симптомов возрастной макулярной дегенерации у пациента с HLA-A0201 (случай 1), который получал пептид из VEGFR-1 и пептид из VEGFR-2. На (A) показаны томографические изображения перед началом введения, на (В) показаны фотографии глазного дна перед началом введения, на (С) показаны фотографии глазного дна методом флюоресцентной ангиографии перед началом введения. Стрелки на (A) и (D) указывают линию пигментного эпителия, а на (B) и (E) указывают отслоение пигментного эпителия.
[Фиг. 1-2] На фиг. 1 показано ослабление симптомов возрастной макулярной дегенерации у пациента с HLA-A0201 (случай 1), который получал пептид из VEGFR-1 и пептид из VEGFR-2. На (D) показаны томографические изображения через пять месяцев после начала введения, на (E) показана фотография глазного дна через пять месяцев после начала введения, на (F) показана фотография глазного дна методом флюоресцентной ангиографии через пять месяцев после начала введения. Стрелки на (A) и (D) указывают линию пигментного эпителия, а на (B) и (E) указывают отслоение пигментного эпителия.
[Фиг. 2] На фиг. 2 показаны томографические изображения сетчатки, полученные с помощью оптической когерентной томографии, проведенной в одном случае возрастной макулярной дегенерации у пациента с HLA-A0201 (случай 3), который получал пептид из VEGFR-1 и пептид из VEGFR-2. На (А) показаны томографические изображения перед началом введения, и на (В) показаны томографические изображения через один месяц после начала введения. Стрелки указывают эдему, а пунктирная стрелка указывают явно фиброзную и гипоактивную неоваскулярную мембрану.
[Фиг. 3] На фиг. 3 показано ослабление симптомов и восстановление зрения у пациента с возрастной макулярной дегенерацией HLA-A2402 (случай 1), который получал пептид из VEGFR-1 и пептид из VEGFR-2. Верхние фотографии являются фотографиями глазного дна, а нижние фотографии являются томографическими изображениями сетчатки. После начала лечения исчезли субретинальные кровоизлияния (стрелки) и улучшилось зрение (значение в скобках). Кроме того, сохранилась анатомия желтого пятна.
[Фиг. 4-1] На фиг. 4 показан VEGFR1-специфичный ответ у пациента с HLA-A0201 (случай 1). Исследовали PBMC перед лечением (а) и после 1-го курса (b). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR1-A2-770 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (нижняя левая панель) и специфичных к VEGFR1-пептиду точек (нижняя правая панель). Статистический анализ проводили, используя непарный Т-тест Стьюдента (отмечено звездочкой, P<0,05). Кружком отмечено, что число точек является насыщенным.
[Фиг. 4-2] На фиг. 4 показан VEGFR1-специфичный ответ у пациента с HLA-A0201 (случай 1). Исследовали PBMC после 2 курсов (с) и после 3 курсов (d). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR1-A2-770 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (нижняя левая панель) и специфичных к VEGFR1-пептиду точек (нижняя правая панель). Статистический анализ проводили, используя непарный Т-тест Стьюдента (отмечено звездочкой, P<0,05). Кружком отмечено, что число точек является насыщенным.
[Фиг. 4-3] На фиг. 4 показан VEGFR1-специфичный ответ у пациента с HLA-A0201 (случай 1). Исследовали PBMC после 4 курсов (е). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR1-A2-770 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (нижняя левая панель) и специфичных к VEGFR1-пептиду точек (нижняя правая панель). Статистический анализ проводили, используя непарный Т-тест Стьюдента (отмечено звездочкой, P<0,05). Кружком отмечено, что число точек является насыщенным.
[Фиг. 5-1] На фиг. 5 показан VEGFR2-специфичный ответ у пациента с HLA-A0201 (случай 1). Исследовали PBMC перед лечением (а) и после 1-го курса (b). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR2-A2-773 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (нижняя левая панель) и специфичных к VEGFR2-пептиду точек (нижняя правая панель).
[Фиг. 5-2] На фиг. 5 показан VEGFR2-специфичный ответ у пациента с HLA-A0201 (случай 1). Исследовали PBMC после 2 курсов (с) и после 3 курсов (d). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR2-A2-773 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (нижняя левая панель) и специфичных к VEGFR2-пептиду точек (нижняя правая панель).
[Фиг. 5-3] На фиг. 5 показан VEGFR2-специфичный ответ у пациента с HLA-A0201 (случай 1). Исследовали PBMC после 4 курсов (е). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR2-A2-773 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (нижняя левая панель) и специфичных к VEGFR2-пептиду точек (нижняя правая панель).
[Фиг. 6-1] На фиг. 6 показан VEGFR1-специфичный ответ у пациента с HLA-A0201 (случай 3). В качестве репрезентативных результатов показаны ответы PBMC после 1-го курса (а). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR1-A2-770 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (средняя левая панель) и специфичных к VEGFR1-пептиду точек (средняя правая панель). Статистический анализ проводили, используя непарный Т-тест Стьюдента (отмечено звездочкой, P<0,05). Специфичный к VEGFR1-пептиду Т-клеточный рецептор детектировали с помощью HLA-A*0201/VEGFR1-декстрамера (нижняя панель).
[Фиг. 6-2] На фиг. 6 показан VEGFR1-специфичный ответ у пациента с HLA-A0201 (случай 3). В качестве репрезентативных результатов показаны ответы PBMC после 3 курсов (b). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR1-A2-770 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (средняя левая панель) и специфичных к VEGFR1-пептиду точек (средняя правая панель). Статистический анализ проводили, используя непарный Т-тест Стьюдента (отмечено звездочкой, P<0,05). Специфичный к VEGFR1-пептиду Т-клеточный рецептор детектировали с помощью HLA-A*0201/VEGFR1-декстрамера (нижняя панель).
[Фиг. 6-3] На фиг. 6 показан VEGFR1-специфичный ответ у пациента с HLA-A0201 (случай 3). В качестве репрезентативных результатов показаны ответы PBMC после 4 курсов (с). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR1-A2-770 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (средняя левая панель) и специфичных к VEGFR1-пептиду точек (средняя правая панель). Статистический анализ проводили, используя непарный Т-тест Стьюдента (отмечено звездочкой, P<0,05). Специфичный к VEGFR1-пептиду Т-клеточный рецептор детектировали с помощью HLA-A*0201/VEGFR1-декстрамера (нижняя панель).
[Фиг. 6-4] На фиг. 6 показан VEGFR1-специфичный ответ у пациента с HLA-A0201 (случай 3). В качестве репрезентативных результатов показаны ответы PBMC после 5 курсов (d). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR1-A2-770 (верхняя левая панель) или пептидом HIV-Env (верхняя правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число точек (средняя левая панель) и специфичных к VEGFR1-пептиду точек (средняя правая панель). Статистический анализ проводили, используя непарный Т-тест Стьюдента (отмечено звездочкой, P<0,05). Специфичный к VEGFR1-пептиду Т-клеточный рецептор детектировали с помощью HLA-A*0201/VEGFR1-декстрамера (нижняя панель).
[Фиг. 7-1] На фиг. 7 показан VEGFR2-специфичный ответ у пациента с HLA-A0201 (случай 3). Исследовали PBMC перед началом лечения (а), после одного курса (b) и после 3 курсов (с). На каждой фигуре число точек против импульсно меченных пептидом VEGFR2-A2-773 клеток TISI или импульсно меченных пептидом HIV-Env клеток TISI (левая панель) и специфичных к пептиду VEGFR2 точек (правая панель) указано на диаграммах.
[Фиг. 7-2] На фиг. 7 показан VEGFR2-специфичный ответ у пациента с HLA-A0201 (случай 3). Исследовали PBMC после 4 курсов (d) и после 5 курсов (е). На каждой фигуре число точек против импульсно меченных пептидом VEGFR2-A2-773 клеток TISI или импульсно меченных пептидом HIV-Env клеток TISI (левая панель) и специфичных к пептиду VEGFR2 точек (правая панель) указано на диаграммах.
[Фиг. 8] На фиг. 8 показан VEGFR1-специфичный ответ у пациента с HLA-A2402 (случай 1). В качестве репрезентативных результатов показаны ответы PBMC после 2 курсов (а) и после 6 курсов (b). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR1-A24-1084 (левая панель) или пептидом HIV-Env (правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число специфичных к VEGFR1-пептиду точек. Статистический анализ проводили, используя непарный Т-тест Стьюдента (отмечено звездочкой, P<0,05). Кружок указывает на то, что число точек является насыщенным.
[Фиг. 9] На фиг. 9 показан VEGFR2-специфичный ответ у пациента с HLA-A2402 (случай 1). В качестве репрезентативных результатов показаны ответы PBMC после 2 курсов (а) и после 6 курсов (b). На каждой фигуре показана фотография ELISPOT-планшета, в котором PBMC стимулировали пептидом VEGFR2-A24-169 (левая панель) или пептидом HIV-Env (правая панель). R/S: соотношение ответ/стимул. На диаграммах указано число специфичных к VEGFR1-пептиду точек.
[Фиг. 10] На фиг. 10 показано изменение зрения субъектов после лечения. Зрение у групп, получавших лечение, улучшилось по сравнению с группой, не получавшей лечение, с достоверной разницей (р=0,015).
Описание вариантов осуществления изобретения
Определения
Используемое в настоящем документе единственное число означает «по меньшей мере один», если конкретно не указано иное.
Термины «полипептид», «пептид» и «белок» используются в настоящем документе взаимозаменяемо для обозначения полимера из аминокислотных остатков. Термины применяются к аминокислотным полимерам, в которых один или несколько аминокислотных остатков могут быть модифицированными остатками или неприродными остатками, как, например, искусственные химические миметики соответствующих природных аминокислот, а также к природным аминокислотным полимерам.
Используемый в настоящем документе термин «аминокислота» относится к природным или синтетическим аминокислотам, а также к аминокислотным аналогам и аминокислотным миметикам с функциями, аналогичными природным аминокислотам. Аминокислота может быть либо L-аминокислотой, либо D-аминокислотой. Природными аминокислотами являются те, которые закодированы генетическим кодом, а также модифицированные после трансляции в клетках (например, гидроксипролин, гамма-карбоксиглутамат и О-фосфосерин). Фраза «аминокислотный аналог» относится к соединениям, которые имеют одинаковую базовую химическую структуру (альфа-углерод, связанный с водородом, карбоксильная группа, аминогруппа и R-группа) в качестве природной аминокислоты, но имеют одну или несколько модифицированных R-групп или модифицированных каркасов (например, гомосерин, норлейцин, метионин сульфоксид, метионинметилсульфоний). Фраза «аминокислотный миметик» относится к химическим соединениям, которые имеют аналогичные функции с обычными аминокислотами, но отличаются по структуре.
В настоящем документе аминокислоты могут быть указаны с помощью общеизвестных трехбуквенных символов или однобуквенных символов, рекомендованных Комиссией IUPAC-IUB по биохимической номенклатуре.
Термины «ген», «полинуклеотиды», «нуклеотиды» и «нуклеиновые кислоты» используются в настоящем документе взаимозаменяемо, и, если конкретно не указано иное, указаны с помощью их общепринятых однобуквенных кодов.
Предполагается, что используемый в настоящем документе термин «композиция» охватывает продукт, включающий указанные ингредиенты в указанных количествах, а также любой продукт, который образуется (прямо или непрямо) в результате объединения определенных ингредиентов в определенных количествах. Предполагается, что такой термин в отношении «фармацевтической композиции» охватывает продукт, включающий активный(ые) ингредиент(ы) и любой(ые) инертный(ые) ингредиент(ы), которые составляют носитель, а также любой продукт, который образуется (прямо или непрямо) в результате объединения, комплексообразования или агрегации любых двух или нескольких ингредиентов или диссоциации одного или нескольких ингредиентов, или любых других типов реакций или взаимодействий одного или нескольких ингредиентов. Соответственно, в контексте настоящего изобретения фраза «фармацевтическая композиция» охватывает любую композицию, изготовленную смешиванием соединения по настоящему изобретению и фармацевтически или физиологически приемлемого носителя. Используемые в настоящем документе фразы «фармацевтически приемлемый носитель» или «физиологически приемлемый носитель» означают фармацевтически или физиологически приемлемый материал, композицию, вещество или носитель, в том числе, но не ограниченные эти, жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или материал оболочки, используемые в переносе или транспорте активного ингредиента (активных ингредиентов) из одного органа или части тела в другой орган или часть тела.
Если не указано иное, то термины «цитотоксический Т-лимфоцит», «цитотоксическая Т-клетка» и «CTL» используются в настоящем документе взаимозаменяемо и, если конкретно не указано иное, относятся к подгруппе Т-лимфоцитов, способных узнавать чужеродные клетки (например, инфицированные вирусом клетки) и вызывать смерть таких клеток.
Если не дано другое определение, то термин «HLA-A24» относится к HLA-A24-типу, содержащему подтипы, такие как HLA-A*2402.
Если не дано другое определение, то используемый в настоящем документе термин «HLA-A02», соответственно, относится к подтипам, таким как HLA-A*0201.
Если не дано другое определение, то используемый в настоящем документе термин «набор» относится к комбинации реагентов и других материалов. Не предполагается, что термин «набор» ограничен конкретной комбинацией агентов и/или материалов.
В отношении применения способов и композиций по настоящему изобретению в контексте «лечения» заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), лечение считается «эффективным», если оно приводит к клиническому эффекту, например, снижению отслоения пигментного эпителия, замедлению отслоения пигментного эпителия, снижению просачивания жидкости или уменьшению искажения зрения у субъекта. Эффективность определяют в связи с любым известным способом лечения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией).
Если не указано иное, то все технические и научные термины, используемые в настоящем документе, имеют такое же значение, какое под ними понимает средний специалист в данной области, к которой принадлежит изобретение.
Настоящее изобретение относится к фармацевтической композиции для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией) и фармацевтической композиции для ингибирования неоваскуляризации хориоидеи, которая содержит в качестве активного ингредиента пептид, содержащий аминокислотную последовательность, полученную из белка VEGFR-1, и способный индуцировать цитотоксические Т-клетки (именуемый в настоящем документе «пептид VEGFR-1») (далее композиция может в совокупности именоваться как «фармацевтическая композиция по настоящему изобретению»), и/или кодирующий его полинуклеотид. Кроме того, настоящее изобретение относится к вакцинам для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), и вакцинам для ингибирования неоваскуляризации хориоидеи, которые содержат VEGFR-1 (далее композиция может в совокупности именоваться как «вакцина по настоящему изобретению») и/или кодирующий его полинуклеотид. Вышеуказанные фармацевтическая композиция и вакцина могут содержать любые другие вещества, например, иммуностимуляторы. Предпочтительно, чтобы содержался пептид, включающий аминокислотную последовательность, полученную из другого белка, и способный индуцировать цитотоксические Т-клетки. Более предпочтительно - пептид, содержащий аминокислотную последовательность, полученную из белка VEGFR-2, и способный индуцировать цитотоксические Т-клетки (далее именуемый «пептид VEGFR-2»). Настоящее изобретение основано на открытии авторов изобретения, что фармацевтические композиции/вакцины, содержащие пептид VEGFR-1, эффективны в отношении ингибирования неоваскуляризации хориоидеи.
Пептид VEGFR-1
Пептид VEGFR-1, содержащийся в фармацевтических композициях и вакцинах по настоящему изобретению (далее в настоящем документе «пептид VEGFR-1» может именоваться «пептидом по настоящему изобретению»), можно получить, синтезируя пептиды, начиная с любой позиции в аминокислотной последовательности известного белка VEGFR-1. Настоящее изобретение может включать пептид VEGFR-2, который также можно получить синтезом пептидов с любой позиции в аминокислотной последовательности известного VEGFR-2. Аминокислотные последовательности VEGFR-1 человека и VEGFR-2 человека известны, и опытные специалисты в данной области могут легко получить их из баз данных белковых последовательностей, доступных в Интернете. Примером аминокислотной последовательности белка VEGFR-1 человека является аминокислотная последовательность SEQ ID NO: 19 (аминокислотная последовательность, кодируемая нуклеотидной последовательностью с номером доступа в базе данных GenBank - NM_002019). Примером аминокислотной последовательности белка VEGFR-2 человека является аминокислотная последовательность SEQ ID NO: 21 (аминокислотная последовательность, кодируемая нуклеотидной последовательностью с номером доступа в базе данных GenBank - NM_002253).
Синтез пептидов можно провести в соответствии со способами, обычно используемыми в пептидной химии. Стандартные способы синтеза описаны в документах, таких как «Peptide Synthesis», Interscience, New York, 1966; «The Proteins», Vol. 2, Academic Press Inc., New York, 1976; «Peptide Synthesis (Peptide Gosei)», Maruzen, 1975; «Fundamentals and Experiments of Peptide Synthesis (Peptide Gosei no Kiso to Jikken)», Maruzen, 1985; и «The sequel of Development of Pharmaceuticals (Zoku Iyakuhin no Kaihatsu)", Vol. 14, Peptide Synthesis (Peptide Gosei), Hirokawa Shoten, 1991, и в публикациях, таких как международная публикация № WO 99/67288. Пептиды по настоящему изобретению можно также синтезировать известными способами генной инженерии. Далее следует пример генно-инженерного способа синтеза. Вектор, в который встроена ДНК, кодирующая пептид по настоящему изобретению, вводят в подходящие клетки-хозяева для получения трансформированных клеток. Пептиды по настоящему изобретению можно получить, собирая пептиды, полученные в этих трансформированных клетках. Пептиды по настоящему изобретению можно сначала получить в виде слитого белка, который для получения пептидов затем расщепляют, используя соответствующую протеазу.
В способе получения слитого белка полинуклеотид, кодирующий пептид по настоящему изобретению, можно лигировать, сохраняя рамку считывания, с полинуклеотидом, кодирующим другой пептид, и эту конструкцию можно вставить в экспрессионный вектор для экспрессии в хозяине. Для этих целей можно использовать методики, известные опытным специалистам в данной области. В качестве пептидов, слитых с пептидами по настоящему изобретению, специалист может использовать известные пептиды, такие как FLAG (Hopp, T. P. et al., BioTechnology (1988) 6, 1204-1210), 6×His, состоящий из шести остатков гистидина (His), 10×His, гемагглютинин вируса гриппа (HA), фрагменты белка c-myc человека, фрагменты VSV-GP, фрагменты p18HIV, T7-tag, HSV-tag, E-tag, фрагменты SV40T-антигена, lck-tag, фрагменты альфа-тубулина, B-tag и фрагменты белка C. Также, для получения слитых белков можно лигировать пептиды по настоящему изобретению с глутатион-S-трансферазой (GST), гемагглютинином вируса гриппа (НА), константными областями иммуноглобулинов, бета-галактозидазой, мальтозосвязывающим белком (МВР) или аналогичными полипептидами. Пептиды по настоящему изобретению можно получить, обрабатывая полученные таким образом слитые пептиды подходящей протеазой и затем собирая интересующие пептиды. Пептиды можно собрать способами, известными опытным специалистам в данной области, например, с помощью аффинной хроматографии.
В качестве аминокислотной последовательности пептида по настоящему изобретению, например, можно выбрать любую последовательность из полноразмерной аминокислотной последовательности белка VEGFR-1 или полноразмерной аминокислотной последовательности белка VEGFR-2, используя в качестве индикатора аффинность связывания с HLA-антигенами. Аффинность связывания с HLA-антигенами можно измерить, выделяя клетки, имеющие HLA-антигены на клеточной поверхности, такие как дендритные клетки, и измеряя связывание пептидов с клетками, используя стандартные способы. В качестве альтернативы, аффинность связывания можно вычислить in silico с помощью программного обеспечения, недавно доступного через Интернет, такого как описанное в Parker K. C., J. Immunol. 152, 1994. В отношении японцев для получения эффективных результатов предпочтительно в качестве HLA-антигена использовать, например, тип А-24, тип А-02 или аналогичные типы, которые, как известно, часто экспрессируются в японской популяции. HLA-антигены, такие как типы А-02 и А-24, все включают подтипы, такие как A-0201 или A-2402. Примеры пептидов VEGFR-1 с высокой аффинностью связывания с HLA-A*0201 включают пептиды, содержащие аминокислотные последовательности SEQ ID NO: 1-3, а примеры пептидов VEGFR-1 с высокой аффинностью связывания с HLA-A*2402 включают пептиды, содержащие аминокислотную последовательность SEQ ID NO: 4 (WO 2006/093030). Примеры пептидов VEGFR-2 с высокой аффинностью связывания с HLA-A*0201 включают пептиды, содержащие аминокислотные последовательности SEQ ID NO: 11-17, а примеры пептидов VEGFR-2 с высокой аффинностью связывания с HLA-A*2402 включают пептиды, содержащие аминокислотные последовательности SEQ ID NO: 5-10 (WO 2004/024766). В клинической практике пептиды, имеющие высокую аффинность связывания с HLA-антигеном пациента, который нуждается в лечении, можно соответственно выбрать, заранее проведя исследование типа HLA-антигена.
Пептиды, имеющие высокую аффинность связывания с HLA-антигенами, с высокой вероятностью будут эффективны в качестве пептидов, способных индуцировать цитотоксические Т-клетки (CTL). Тем не менее, желательно исследовать, способен или нет пептид-кандидат, выбранный с использованием наличия высокой аффинности связывания в качестве индикатора, индуцировать CTL. CTL-индуцирующую активность можно подтвердить, стимулируя антиген-представляющие клетки, содержащие МНС-антигены человека (такие как В-лимфоциты, макрофаги и дендритные клетки), предпочтительно, дендритные клетки, полученные из мононуклеарных клеток периферической крови, с пептидом-кандидатом; смешивая клетки с CD8-положительными клетками; и затем измеряя цитотоксичность к целевым клеткам. В качестве реакционной системы можно использовать трансгенных животных, полученных для экспрессии HLA-антигена человека (например, описанных в Hum. Immunol. 2000 Aug; 61(8):764-79 Related Articles, Books, Linkout Induction of CTL response by a minimal epitope vaccine in HLA A*0201/DR1 transgenic mice: dependence on HLA class II restricted T(H) response., Ben Mohamed L., Krishnan R., Longmate J., Auge C., Low L., Primus J., Diamond D.J.). Цитотоксичность можно вычислить по высвобождению радиоактивности из клеток-мишеней, радиоактивно меченных, например, 51Cr или аналогичным изотопом. В качестве альтернативы, активность можно исследовать, измеряя IFN-гамма, продуцируемый и высвобождаемый CTL в присутствии антиген-представляющих клеток, которые несут пептиды, и визуализируя зону ингибирования на среде с использованием анти-IFN-гамма моноклональных антител.
Длина пептидов по настоящему изобретению конкретно не ограничена, при условии, что они имеют CTL-индуцирующую активность, но предпочтительно составляет 50 аминокислот или меньше, более предпочтительно 30 аминокислот или меньше и еще более предпочтительно 15 аминокислот или меньше. Например, при представлении на антиген-представляющих клетках in vivo различные белки расщепляются до 9-членных пептидов (нонапептидов) и затем представляются. Поэтому пептиды по настоящему изобретению, желательно, являются 9-членными (нонапептидами) или 10-членными (декапептидами). Предпочтительные пептиды VEGFR-1 включают пептиды, содержащие аминокислотные последовательности SEQ ID NO: 1-4 (WO 2006/093030). Предпочтительные пептиды VEGFR-2 включают пептиды, содержащие аминокислотные последовательности SEQ ID NO: 5-17 (WO 2004/024766).
Кроме того, одна, две или несколько аминокислот могут быть замещены, удалены, добавлены и/или вставлены в аминокислотные последовательности частичных пептидов из природных VEGFR-1 или VEGFR-2. В настоящем документе «несколько» означает пять или меньше, и, предпочтительно, три или меньше. При модификации аминокислотных остатков желательно замещать их аминокислотами, у которых сохраняются свойства боковых цепей аминокислот. Примерами свойств боковых цепей аминокислот являются: гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V); гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S и T); аминокислоты, содержащие алифатические боковые цепи (G, A, V, L, I и P); аминокислоты, содержащие боковые цепи с гидроксильной группой (S, T и Y); аминокислоты, содержащие боковые цепи с атомом серы (С и М); аминокислоты, содержащие боковые цепи с карбоксильной группой и амидной группой (D, N, E и Q); аминокислоты, содержащие основные боковые цепи (R, K и H); и аминокислоты, содержащие боковые цепи с ароматической группой (H, F, Y и W) (все аминокислоты представлены однобуквенным кодом в круглых скобках). Аминокислотная замена в пределах каждой из этих группы в общем называется консервативной заменой. Известно, что пептид, содержащий модифицированную аминокислотную последовательность, в которой одна или несколько аминокислот замещены, удалены, добавлены и/или вставлены до некоторой аминокислотной последовательности, сохраняет биологическую активность своего исходного пептида (Mark, D. F. et al., Proc. Natl. Acad. Sci. USA (1984) 81, 5662-6; Zoller, M. J. and Smith, M., Nucleic Acids Res. (1982) 10, 6487-500; Wang, A. et al., Science (1984) 224:1431-3; Dalbadie-McFarland, G. et al., Proc. Natl. Acad. Sci. USA (1982) 79:6409-13). Предпочтительные примеры таких модифицированных пептидов VEGFR-1 включают пептиды, содержащие аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности любой одной из SEQ ID NO: 1-4. Предпочтительные примеры модифицированных пептидов VEGFR-2 включают пептиды, содержащие аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности любой одной из SEQ ID NO: 5-17.
Кроме того, поскольку уже известна закономерность в последовательностях пептидов, представленных в результате связывания с HLA-антигенами (J. Immunol., 152:3913, 1994; Immunogenetics, 41:178, 1995; J. Immunol., 155:4307, 1994), то можно выбрать последовательности с такой закономерностью, или, исходя из этой закономерности, можно провести модификации пептидов, полученных, как описано выше. Например, известно, что высокой аффинностью связывания с HLA-24 обладают пептиды, в которых вторая аминокислота с N-конца пептида является фенилаланином, тирозином, метионином или триптофаном, а С-концевая аминокислота является фенилаланином, лейцином, изолейцином, триптофаном или метионином. Поэтому в качестве пептидов, которые будут содержаться в фармацевтических композициях или вакцинах для введения субъектам, несущим HLA-24-тип HLA-антигена, можно выбрать пептиды, в которых второй аминокислотой с N-конца является фенилаланин, тирозин, метионин или триптофан, и/или С-концевой аминокислотой является фенилаланин, лейцин, изолейцин, триптофан или метионин. В качестве альтернативы, вторая аминокислота с N-конца полученного пептида может быть модифицирована до фенилаланина, тирозина, метионина или триптофана, или С-концевая аминокислота может быть модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина. Предпочтительные примеры таких пептидов VEGFR-1 включают пептиды, в которых вторая аминокислота с N-конца полученного пептида модифицирована до фенилаланина, тирозина, метионина или триптофана, и/или С-концевая аминокислота модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина в аминокислотной последовательности SEQ ID NO: 4.
Кроме того, предпочтительные примеры таких пептидов VEGFR-2 включают пептиды, в которых вторая аминокислота с N-конца полученного пептида модифицирована до фенилаланина, тирозина, метионина или триптофана, и/или С-концевая аминокислота модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина в аминокислотной последовательности любой одной из SEQ ID NO: 5-10. При этом известно, что высокой аффинностью связывания с HLA-02 обладают пептиды, в которых вторая аминокислота с N-конца пептида является лейцином или метионином, а С-концевая аминокислота является валином или лейцином. Поэтому в качестве пептидов, которые будут содержаться в фармацевтических композициях или вакцинах для введения субъектам, несущим HLA-02-тип HLA-антигена, можно выбрать пептиды, в которых второй аминокислотой с N-конца является лейцин или метионин, и/или С-концевой аминокислотой является валин или лейцин. В качестве альтернативы, вторая аминокислота с N-конца полученного пептида может быть модифицирована до лейцина или метионина, и С-концевая аминокислота может быть модифицирована до валина или лейцина. Предпочтительные примеры таких пептидов VEGFR-1 включают пептиды, в которых вторая аминокислота с N-конца полученного пептида модифицирована до лейцина или метионина, и/или С-концевая аминокислота модифицирована до валина или лейцина в аминокислотной последовательности любой одной из SEQ ID NO:1-3. Примером модифицированных пептидов VEGFR-2 для HLA-02-типа является пептид, содержащий аминокислотную последовательность SEQ ID NO:11-17.
Пептиды по настоящему изобретению можно получить, как описано выше, но когда последовательность пептида идентична участку аминокислотной последовательности эндогенного или экзогенного белка с другой функцией, это может вызывать побочные эффекты, такие как аутоиммунные заболевания или аллергические симптомы против определенных веществ. Поэтому предпочтительно использовать доступные базы данных для проведения поиска
гомологии, и проверить совпадает ли последовательность полученного пептида с аминокислотными последовательностями других белков. Если последовательность пептида совпадает с аминокислотной последовательностью другого белка, не следует выбирать эту пептидную последовательность. Если поиск гомологии показывает, что не существует пептидов, отличающихся по одной или двум аминокислотам, то вышеуказанные модификации аминокислотной последовательности для увеличения аффинности связывания с HLA-антигенами и/или CTL-индуцирующей активности не будут вызывать эти проблемы.
Полинуклеотиды
Настоящее изобретение также относится к полинуклеотидам, которые кодируют любой из вышеуказанных пептидов по настоящему изобретению. Они включат полинуклеотиды, полученные из природного гена VEGFR-1 (номер доступа в базе данных GenBank - NM_002019 (например, SEQ ID NO: 18)) или гена VEGFR-2 (номер доступа в базе данных GenBank - NM_002253 (например, SEQ ID NO: 20)), а также полинуклеотиды, имеющие их консервативно модифицированные нуклеотидные последовательности. В настоящем документе фраза «консервативно модифицированная нуклеотидная последовательность» относится к последовательностям, которые кодируют идентичные или по существу идентичные аминокислотные последовательности. Вследствие вырожденности генетического кода любой указанный белок кодируется большим числом функционально идентичных нуклеиновых кислот. Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Поэтому в каждой позиции кодона, определяющего аланин, кодон можно изменить на любой из соответствующих описанных кодонов, не изменяя кодируемый полипептид. Такие изменения нуклеиновой кислоты называются «молчащими изменениями», которые являются одним из видов консервативных модификаций. Каждая нуклеотидная последовательность в настоящем документе, которая кодирует пептид, также описывает каждое возможное молчащее изменение нуклеиновой кислоты. Для специалиста в данной области будет ясно, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который обычно является единственным кодоном метионина, и TGG, который обычно является единственным кодоном триптофана) можно модифицировать, получая функционально идентичную молекулу. Соответственно, каждое молчащее изменение нуклеиновой кислоты, кодирующей пептид, по умолчанию описано в каждой раскрытой последовательности.
Полинуклеотид по настоящему изобретению может состоять из ДНК, РНК или их производных. Как известно, молекула ДНК состоит из оснований, таких как природные основания А, Т, С и G, а в РНК Т заменено на U. Специалисту в данной области будет ясно, что в полинуклеотиды также могут быть включены неприродные основания.
Полинуклеотид по настоящему изобретению может кодировать множественные пептиды по настоящему изобретению с промежуточными аминокислотными последовательностями или без них. Например, промежуточная аминокислотная последовательность может обеспечивать сайт расщепления (например, последовательность, распознаваемую ферментом) полинуклеотида или транслированных пептидов. Кроме того, полинуклеотиды могут включать любые последовательности, дополнительные к последовательности, кодирующей пептид по настоящему изобретению. Например, полинуклеотид может быть рекомбинантным полинуклеотидом, который включает регуляторные последовательности, необходимые для экспрессии пептида, или может представлять собой экспрессионный вектор (плазмиду) с маркерными генами и т.п. В общем, такие рекомбинантные полинуклеотиды можно получить манипуляциями с полинуклеотидами с помощью стандартных рекомбинантных методик, используя, например, полимеразы и эндонуклеазы.
Для получения полинуклеотида по настоящему изобретению можно использовать как рекомбинантные методики, так и методики химического синтеза. Например, полинуклеотид можно получить встраиванием в соответствующий вектор, который можно экспрессировать после его трансфекции в компетентные клетки. В качестве альтернативы, полинуклеотид можно амплифицировать с использованием ПЦР-методик или с помощью экспрессии в подходящих хозяевах (смотри, например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York, 1989). В качестве альтернативы, полинуклеотид можно синтезировать с использованием методик твердофазного синтеза, описанных в Beaucage SL & Iyer RP, Tetrahedron 1992, 48:2223-311; Matthes et al., EMBO J 1984, 3:801-5.
Фармацевтические композиции и вакцины, содержащие пептид VEGFR-1 и/или кодирующий его полинуклеотид
Настоящее изобретение относится к фармацевтическим композициям для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи человека, содержащим в качестве активного ингредиента по меньшей мере пептид VEGFR-1 и/или кодирующий его полинуклеотид.
Лечение по настоящему изобретению относится к уменьшению симптомов, характерных для заболеваний, вызванных неоваскуляризацией хориоидеи пациентов, у которых на данный момент обнаружили симптомы. В настоящем изобретении степень уменьшения конкретно не ограничена, и до тех пор пока симптомы можно уменьшить даже в незначительной степени, оно включено в смысл лечения по настоящему изобретению. В настоящем изобретении предупреждение означает подавление развития симптомов, характерных для заболеваний, вызванных неоваскуляризацией хориоидеи, до их возникновения. В настоящем изобретении степень подавления развития симптомов никак не ограничена, и пока развитие можно подавить, даже в очень небольшой степени, это включено в значение предупреждения по настоящему изобретению. Симптомы заболевания, вызванного неоваскуляризацией хориоидеи, включают снижение зрения. Оценку уменьшения выраженности этого симптома можно определить при проверке зрения. Кроме того, подавляется или нет развитие симптомов, можно определить, оценивая активность хориоидальных неососудов в результате исследования с использованием флюоресцентной ангиографии глазного дна или оптической когерентной томографии.
Кроме того, настоящее изобретение относится к вакцинам для лечения и/или предупреждения заболевания, вызванного неоваскуляризацией хориоидеи, содержащим по меньшей мере пептид VEGFR-1 и/или кодирующий его полинуклеотид в качестве активного ингредиента. В настоящем изобретении вакцина относится к композиции, которая при введении в организм может вызывать иммунные ответы in vivo в этом организме. В настоящем изобретении иммунные ответы, индуцированные in vivo, относятся, в частности, к индукции CTL, мишенью которых являются клетки, экспрессирующие VEGFR-1. Поскольку клетки сосудистого эндотелия, вовлеченные в неоваскуляризацию хориоидеи, экспрессируют VEGFR-1 на поверхности клеток, они могут стать мишенями CTL, индуцированных в результате введения этой вакцины. То есть, введение вакцины по настоящему изобретению обеспечивает презентацию пептидов по настоящему изобретению с высокой плотностью на HLA-антигенах по настоящему изобретению, что активирует CTL, реагирующие специфично с комплексом, образуемым между представленным пептидом и HLA-антигеном, и в результате усиливается способность атаковать клетки сосудистого эндотелия хориоидеи. В качестве альтернативы, антиген-представляющие клетки, имеющие пептиды по настоящему изобретению на своей клеточной поверхности, получают, выделяя дендритные клетки у пациента и стимулируя их пептидами по настоящему изобретению. Введение клеток обратно пациенту вызывает активацию CTL у пациента, и в результате усиливается способность атаковать клетки сосудистого эндотелия хориоидеи.
Фармацевтические композиции и вакцины по настоящему изобретению эффективны против заболеваний, вызванных неоваскуляризацией хориоидеи. Не существует ограничений по болезням, против которых направлены фармацевтические композиции и вакцины по настоящему изобретению, если заболевания вызваны неоваскуляризацией хориоидеи. Предпочтительно, заболевания включают неоваскулярную макулопатию, которая ассоциирована с заболеваниями, такими как экссудативная возрастная макулярная дегенерация, миопическая макулярная дегенерация, ангиоидные полосы сетчатки, центральная экссудативная хориоретинопатия, различные виды пигментной эпителиопатии сетчатки, хориоидальная атрофия, хориодеремия и хориоидальная остеома. Особенно предпочтительным примером является экссудативная возрастная макулярная дегенерация. Фармацевтические композиции и вакцины по настоящему изобретению избирательно атакуют клетки сосудистого эндотелия и поэтому имеют низкий риск быстрого снижения зрения и развития тяжелых осложнений после лечения, которые представляют проблемы при стандартных способах лечения. Поэтому фармацевтические композиции по настоящему изобретению можно применять не только у пациентов с сильно выраженными симптомами, но также у пациентов на ранних стадиях заболеваний с относительно хорошим зрением. Поскольку на ранних стадиях заболевания сетчатка повреждена незначительно при относительно хорошем зрении, ожидается, что прогноз в отношении зрения после лечения запущенных стадий будет гораздо более благоприятным по сравнению со стандартными способами лечения. Кроме того, было подтверждено, что фармацевтические композиции и вакцины по настоящему изобретению показывают эффективность в случаях, которые не отвечают на обычные способы лечения и могут применяться в таких случаях.
Настоящее изобретение основано на открытии, что неоваскуляризация хориоидеи ингибируется введением пептидов VEGFR-1. Поэтому настоящее изобретение относится к фармацевтическим композициям для ингибирования неоваскуляризации хориоидеи, содержащим по меньшей мере один тип каждого пептида VEGFR-1 и/или кодирующего его полинуклеотида. Кроме того, фармацевтические композиции, содержащие пептиды VEGFR-1 и/или кодирующий их полинуклеотид, могут использоваться в качестве вакцин. Поэтому настоящее изобретение также относится к вакцинам для ингибирования неоваскуляризации хориоидеи, содержащим по меньшей мере пептид VEGFR-1 и/или кодирующий его полинуклеотид. Степень ингибирования конкретно не ограничена, и до тех пор пока неоваскуляризацию можно ингибировать даже в незначительной степени, оно включено в смысл ингибирования.
Фармацевтические композиции и вакцины по настоящему изобретению конкретно не ограничены, пока они содержат по меньшей мере пептид VEGFR-1 и/или кодирующий его полинуклеотид, и, например, они могут содержать множество типов пептидов VEGFR-1 и/или другие вещества, например, иммуностимуляторы. Предпочтительно, чтобы содержался пептид, включающий аминокислотную последовательность, полученную из другого белка, и способный активировать цитотоксические Т-клетки. Более предпочтительно, чтобы содержался пептид, включающий аминокислотную последовательность, полученную из белка VEGFR-2, и способный активировать цитотоксические Т-клетки (далее именуемый «пептид VEGFR-2»). Фармацевтические композиции и вакцины по настоящему изобретению могут содержать (дополнительно к пептидам) носители, эксципиенты и т.п., обычно используемые в фармацевтических препаратах при необходимости. Например, их можно использовать парентерально в инъекционной лекарственной форме - стерильных растворах или суспензиях, приготовленных на воде или других фармацевтически приемлемых жидкостях. Их можно составить, соответственно объединяя их с фармацевтически приемлемыми носителями или наполнителями, более конкретно, со стерильными водными или физиологическим растворами, растительными маслами, эмульгаторами, суспендирующими агентами, поверхностно-активными веществами, стабилизаторами, вкусо-ароматическими агентами, эксципиентами, наполнителями, консервантами, связывающими агентами и т.п., и смешивая их в лекарственную форму, требуемую в общепринятой фармацевтической практике. В эти составы включают такое количество активного ингредиента, чтобы получить соответствующие дозировки в указанном пределе.
Если настоящее изобретение представляет собой вакцину, то она может включать адъювант для эффективной индукции клеточного иммунитета, и вакцины также могут включать другие активные ингредиенты против неоваскулярной макулопатии и т.п. Их также можно изготавливать в форме аэрозольных составов. В качестве адъювантов доступны описанные в документе (Johnson AG., Clin. Microbiol. Rev., 7:277-289, 1994) или аналогичные соединения. Другие составы могут представлять собой липосомные препараты, гранулярные препараты, полученные связыванием с микрошариками, или препараты, связанные с липидами.
Количество пептида VEGFR-1, содержащегося в фармацевтических композициях и вакцинах по настоящему изобретению, конкретно не ограничено, если оно составляет фармацевтически эффективное количество. Например, эффективное количество каждого пептида может составлять от 0,001 мг до 1000 мг, предпочтительно, от 0,001 мг до 1000 мг и, более предпочтительно, от 0,1 мг до 10 мг. Кроме того, если фармацевтические композиции и вакцины содержат пептид VEGFR-2, то соотношение между пептидами VEGFR-1 и VEGFR-2 конкретно не ограничено, при условии содержания фармацевтически эффективного количества двух пептидов. Количество объединенных пептидов VEGFR-1 и VEGFR-2 может быть одинаковым, или любой один из объединенных пептидов может превышать по количеству другой пептид. В то время как VEGFR-2 экспрессируется на поверхности практически всех клеток сосудистого эпителия, VEGFR-1 экспрессируется только на поверхности определенной части клеток сосудистого эпителия; поэтому количество пептида VEGFR-2 в смеси может превышать количество пептида VEGFR-1.
В другом варианте осуществления настоящего изобретения пептиды по настоящему изобретению можно также вводить в форме фармацевтически приемлемой соли. Предпочтительные примеры солей включают соли с щелочным металлом, соли с металлом, соли с органическим основанием, соли с органической кислотой и соли с неорганической кислотой.
Настоящее изобретение также включает применение пептида VEGFR-1 или кодирующего его полинуклеотида в изготовлении фармацевтических композиций или вакцин для лечения и/или предупреждения заболеваний, вызванных неоваскуляризацией хориоидеи человека. Кроме того, настоящее изобретение включает применение пептида VEGFR-1 и/или кодирующего его полинуклеотида в изготовлении фармацевтических композиций или вакцин для ингибирования неоваскуляризации хориоидеи человека.
Настоящее изобретение включает пептиды VEGFR-1 и/или кодирующий их полинуклеотид, которые вводятся субъектам для лечения и/или предупреждения заболеваний, вызванных неоваскуляризацией хориоидеи человека. Дополнительно, настоящее изобретение включает пептиды VEGFR-2 и/или кодирующий их полинуклеотид, которые вводятся субъектам совместно с пептидом VEGFR-1 или кодирующим его полинуклеотидом для лечения и/или предупреждения заболеваний, вызванных неоваскуляризацией хориоидеи человека. Кроме того, настоящее изобретение включает пептиды VEGFR-2 и/или кодирующий их полинуклеотид, которые вводятся субъектам совместно с пептидом VEGFR-1 и/или кодирующим его полинуклеотидом для ингибирования неоваскуляризации хориоидеи человека. Дополнительно, настоящее изобретение включает пептиды VEGFR-1 и/или кодирующий их полинуклеотид, которые вводятся субъектам совместно с пептидом VEGFR-2 и/или кодирующим его полинуклеотидом для ингибирования неоваскуляризации хориоидеи человека.
Наборы для лечения или предупреждения неоваскулярной макулопатии и наборы для ингибирования неоваскуляризации хориоидеи
Настоящее изобретение относится к наборам для лечения и/или предупреждения заболеваний, вызванных неоваскуляризацией хориоидеи, содержащим по меньшей мере пептид VEGFR-1 и/или кодирующий его полинуклеотид. Настоящее изобретение также относится к наборам для ингибирования неоваскуляризации хориоидеи, содержащим по меньшей мере пептид VEGFR-1 и/или кодирующий его полинуклеотид.
Пептид VEGFR-1, который включают в наборы по настоящему изобретению, может присутствовать индивидуально сам по себе, или пептиды могут существовать в форме составов или вакцин после соответствующего объединения с фармацевтически приемлемыми носителями или наполнителями, или, более конкретно, стерильными водными или физиологическим растворами, растительными маслами, эмульгаторами, суспендирующими агентами, поверхностно-активными веществами, стабилизаторами, вкусо-ароматическими агентами, эксципиентами, наполнителями, консервантами, связывающими агентами и т.п. Если пептиды получают в форме вакцин, то для эффективной индукции клеточного иммунитета может быть включен адъювант, а также могут быть включены другие активные ингредиенты против неоваскулярной макулопатии и т.п. Предпочтительно, чтобы был включен пептид VEGFR-2. Вакцины также могут быть изготовлены в виде гранулярных составов. В качестве адъювантов доступны описанные в документе (Johnson AG., Clin. Microbiol. Rev., 7:277-289, 1994) или аналогичные соединения. Другие составы могут представлять собой липосомные препараты, гранулярные препараты, полученные связыванием с микрошариками, или препараты, связанные с липидами.
Наборы по настоящему изобретению могут дополнительно включать фармацевтически приемлемые носители или наполнители, такие как описанные выше, для того чтобы при получении фармацевтических препаратов можно было ввести соответствующие коррективы.
Способы лечения и предупреждения неоваскулярной макулопатии и способы ингибирования неоваскуляризации хориоидеи
Настоящее изобретение дополнительно относится к способам лечения и/или предупреждения заболеваний, вызванных неоваскуляризацией хориоидеи, включающим стадию введения субъекту по меньшей мере пептида VEGFR-1 и/или кодирующего его полинуклеотида. Кроме того, настоящее изобретение относится к способам ингибирования неоваскуляризации хориоидеи человека, включающим стадию введения субъекту по меньшей мере пептида VEGFR-1 и/или кодирующего его полинуклеотида.
Пептид VEGFR-1 можно вводить субъектам парентерально в форме стерильных растворов или суспензий для инъекций, приготовленных на воде или других фармацевтически приемлемых жидкостях. Их можно также вводить субъектам в форме состава, соответственно объединяя их с фармацевтически приемлемыми носителями или наполнителями, более конкретно, со стерильными водными или физиологическим растворами, растительными маслами, эмульгаторами, суспендирующими агентами, поверхностно-активными веществами, стабилизаторами, вкусо-ароматическими агентами, эксципиентами, наполнителями, консервантами, связывающими агентами и т.п., и смешивая их в лекарственную форму, требуемую в общепринятой фармацевтической практике. При введении пептида VEGFR-1 в качестве вакцин, их можно вводить совместно с адъювантом для эффективной индукции клеточного иммунитета, и их также можно вводить совместно с другими активными ингредиентами против неоваскулярной макулопатии и т.п. В качестве адъювантов доступны описанные в документе (Johnson AG., Clin. Microbiol. Rev., 7:277-289, 1994) или аналогичные соединения. Также совместно можно вводить пептид VEGFR-2.
Опытные специалисты в данной области могут соответственно планировать способ введения, дозировку и длительность введения VEGFR-1 в зависимости от симптомов у пациентов (субъектов), нуждающихся в введении пептидов по настоящему изобретению. Пептид VEGFR-1 можно вводить субъектам в виде фармацевтических композиций или вакцин по настоящему изобретению, или пептиды можно вводить субъектам в виде фармацевтических композиций или вакцин, содержащих каждый из пептидов индивидуально. Пептид VEGFR-1 можно вводить или системно, или местно. Примеры системного введения включают пероральное введение, интрадермальное введение, подкожное введение или внутривенное введение. Примеры местного введения включают введение близко к хориоидее.
Доза пептида VEGFR-1 может составлять, например, от 0,001 мг до 1000 мг, предпочтительно, от 0,001 мг до 1000 мг и, более предпочтительно, от 0,1 мг до 10 мг, но не ограничена этими пределами. Кроме того (без ограничений) вакцины предпочтительно вводить один раз в несколько дней или несколько месяцев и более предпочтительно один раз в неделю.
Примеры
Ниже настоящее изобретение более конкретно описано на примерах, но эти примеры не следует истолковывать, как ограничивающие изобретение.
Пример 1
Субъекты
HLA-A0201 (случай 1)
В качестве субъекта был выбран 67-летний пожилой мужчина с возрастной макулярной дегенерацией, который получал фотодинамическую терапию и авастин. В данном случае в результате стандартных способов лечения ремиссия не наступила. Исследование HLA-A-локуса подтвердило, что субъект несет маркер HLA-A*0201.
HLA-A0201 (случай 3)
В качестве субъекта был выбран 76-летний пожилой мужчина с возрастной макулярной дегенерацией, который получал лечение инъекциями стероидов (триамцинолона) ниже теноновой капсулы, фотодинамической терапией и введением авастина. В данном случае в результате стандартных способов лечения ремиссия не наступила. Исследование HLA-A-локуса подтвердило, что субъект несет маркер HLA-A*0201.
HLA-A2402 (случай 1)
В качестве субъекта был выбран 67-летний пожилой мужчина с возрастной макулярной дегенерацией. В данном случае в результате стандартных способов лечения ремиссия не наступила. Исследование HLA-A-локуса подтвердило, что субъект несет маркер HLA-A*2402.
Пептиды
Синтез и анализ качества специфичного к HLA-A*2402 пептида VEGFR1 (VEGFR1-A24-1084; SYGVLLWEI; SEQ ID NO: 4), специфичного к HLA-A*2402 пептида VEGFR2 (VEGFR2-A24-169; RFVPDGNRI; SEQ ID NO: 8), специфичного к HLA-A*0201 пептида VEGFR1 (VEGFR1-A2-770; TLFWLLLTL; SEQ ID NO: 2) и специфичного к HLA-A*0201 пептида VEGFR2 (VEGFR2-A2-773; VIAMFFWLL; SEQ ID NO: 12) с чистотой, соответствующей Надлежащей производственной практике (GMP), специфичного к HLA-A*2402 пептида из белка HIV-Env (HIV-A24; RYLRDQQLL; SEQ ID NO: 22) и специфичного к HLA-A*0201 пептида из белка HIV-Env (HIV-A2; SLYNTYATL; SEQ ID NO: 23) был проведен компанией American Peptide Company Inc. (Sunnyvale, CA).
Способ введения
Синтетические пептиды GMP-чистоты - пептид VEGFR-1 (TLFWLLLTL; SEQ ID NO: 2) и пептид VEGFR-2 (VIAMFFWLL; SEQ ID NO: 12) - были получены из Центра Генома Человека, Института Медицинских Наук Университета Токио. Один миллиграмм каждого из пептидов VEGFR-1 и VEGFR-2 смешивали с 1 мл неполного адъюванта Фрейнда (MONTANIDE*ISA51VG, SEPPIC, France), и их вводили подкожно в подмышечную ямку пациента. Введение проводили один раз в неделю.
РВМС
Мононуклеарные клетки периферической крови (РВМС) выделяли из крови пациентов (HLA-A*2402- или HLA-A*0201-положительных) с использованием раствора Ficoll-Plaque (Pharmacia).
ELISPOT-анализ на IFN-гамма
Перед началом лечения и в конце каждого курса лечения выделяли РВМС и немедленно замораживали. Для контроля иммунного ответа все замороженные РВМС, полученные от каждого пациента, размораживали одновременно и стимулировали 10 мкг/мл когнатного пептида и 20 МЕ/мл интерлейкина-2 (Chiron, Emeryville, CA) при 37°С в 5% СО2 в течение 2 недель. После истощения РВМС по CD4+ клеткам с помощью набора для выделения CD4-положительных клеток Dynal CD4 positive isolation kit (Invitrogen, Carlsbad, CA), клетки использовали в иммуноферментом анализе клеток (ELISPOT) на интерферон-гамма (IFN-гамма). ELISPOT-анализ на IFN-гамма проводили в соответствии с инструкцией изготовителя (BD Biosciences, San Jose, CA). Кратко, HLA-A*2402-положительные B-лимфобластные клетки TISI (IHWG Cell and Gene Bank, Seattle, WA) или HLA-A*0201-положительные B-лимфобластные клетки T2 (ATCC, Tokyo, Japan) инкубировали с 20 мкг/мл когнатного пептида или пептида HIV-Env в течение ночи. После отмывки оставшегося пептида, который не связался с HLA на поверхности клеток, импульсно меченные соответствующим пептидом клетки (2×104 клеток на лунку) использовали для стимуляции полученных CD4- клеток (1×104 клеток на лунку) на 96-луночном планшете (Millipore, Bedford, MA) при 37°С в 5% СО2 в течение ночи. Планшеты сканировали и анализировали с помощью устройства ImmunoSpot S4 Analyzer и программного обеспечения ImmunoSpot image analyzer software version 5.0 (Cellular Technology Ltd., Cleveland, OH). Число точек, специфичных к когнатному пептиду, вычисляли, вычитая число точек при стимуляции пептидом HIV-Env из числа точек при стимуляции когнатным пептидом. Все ELISPOT-анализы проводили в трипликатах. При детекции избыточного количества точек точное количество точек невозможно вычислить из-за их слияния, и считалось, что в этих лунках достигнуто насыщение.
Анализ методом проточной цитометрии
Для детекции пептид-специфичного Т-клеточного рецептора, 5×105 CD4- клеток, приготовленных для ELISPOT-анализа, окрашивали конъюгированным с фикоэритрином (PE) HLA-A*2402/VEGFR1-декстрамером или HLA-A*0201/VEGFR1-декстрамером (DAKO Japan, Tokyo, Japan), конъюгированными с изотиоцианатом флуоресцеина (FITC) мышиными антителами (mAb) к CD8 человека (RPA-T8, BD Biosciences, San Jose, CA) и конъюгированными с аллофикоцианином (АРС) мышиными антителами (mAb) к CD3 человека (UCHT1, BD Biosciences, San Jose, CA), и затем анализировали с использованием проточного цитометра FACSCanto II (BD Biosciences, San Jose, CA). В качестве отрицательных контролей использовали HLA-A*2402/HIV-Env-декстрамер или HLA-A*0201/HIV-Env-декстрамер (DAKO Japan, Tokyo, Japan). Мертвые клетки исключали из анализа, исходя из окрашивания 7-ADD (Sigma-Aldrich Japan, Tokyo, Japan).
Результаты
HLA-A0201 (Случай 1)
Стадию развития возрастной макулярной дегенерации анализировали с помощью оптической когерентной томографии, флюоресцентной ангиографии глазного дна и фотографии глазного дна. До начала введения пептида VEGFR-1 и пептида VEGFR-2 на изображениях, полученных с помощью оптической когерентной томографии, наблюдалось обширное отслоение пигментного эпителия (фиг. 1А). Отслоение пигментного эпителия также ясно наблюдалось на фотографии глазного дна (фиг. 1В). Кроме того, на фотографии, полученной с помощью флуоресцентной ангиографии, наблюдалось интенсивное просачивание жидкости из сосудов (фиг. 1D).
Через пять месяцев после начала введения пептида VEGFR-1 и пептида VEGFR-2 на изображениях, полученных с помощью оптической когерентной томографии, наблюдалось значительное снижение отслоения пигментного эпителия (фиг. 1D). Уменьшение отслоения пигментного эпителия также наблюдалось на фотографиях глазного дна (фиг. 1E). Кроме того, снижение просачивания жидкости было подтверждено с помощью флуоресцентной ангиографии глазного дна (фиг. 1F). Также было отмечено ослабление субъективных симптомов, таких как искажение изображения. Зрение правого глаза немного улучшилось (Rv=(0,9)→Rv=(1,2)). Эти результаты подтвердили, что введение пептида VEGFR-1 и пептида VEGFR-2 давало эффект ослабления возрастной макулярной дегенерации. Проблем, связанных с вопросами безопасности, не возникало.
HLA-A0201 (Случай 3)
Перед началом введения пептидов VEGFR-1 и VEGFR-2 на изображениях, полученных с помощью оптической когерентной томографии, наблюдались разрыв сетчатки вследствие просачивания жидкости из новообразованных сосудов и отек сетчатки (фиг. 2А). Через один месяц после начала введения пептидов VEGFR-1 и VEGFR-2 наблюдалось явное уменьшение отека сетчатки по сравнению с началом введения (фиг. 2В). Кроме того, наблюдалась очевидно фиброзная и гипоактивная неоваскулярная мембрана (фиг. 2В). Кроме того, было зафиксировано значительное ослабление субъективных симптомов, таких как искажение изображения. Эти результаты подтвердили, что и в данном случае введение пептидов VEGFR-1 и VEGFR-2 ослабляет симптомы возрастной макулярной дегенерации. Проблем, связанных с вопросами безопасности, не возникало.
HLA-A2402 (Случай 1)
Перед началом введения пептидов VEGFR-1 и VEGFR-2 на фотографиях глазного дна ясно наблюдались субретинальные кровоизлияния (фиг. 3, верхняя левая панель). Через три месяца после введения субретинальные кровоизлияния значительно уменьшились по сравнению с их размерами до введения (фиг. 3 верхние центральная и правая панели). Кроме того, не изменилась анатомия желтого пятна (фиг. 3, нижняя панель), и улучшилось зрение.
Анализ мониторинга пациентов
Для мониторинга пациентов, получающих лечение, проводили ELISPOT-анализ на IFN-гамма и/или анализ с помощью проточной цитометрии.
Итоговые результаты анализа мониторинга
HLA-A0201 (Случай 1)
В ELISPOT-анализе на IFN-гамма наблюдалось значительное большее число точек при стимуляции импульсно меченными пептидом VEGFR1-A2-770 клетками Т2 по сравнению числом точек, полученных при стимуляции импульсно меченными пептидом HIV-Env клетками T2, особенно после курсов лечения (таблица 1 и фигура 4). Напротив, не наблюдалось специфичной продукции IFN-гамма при стимуляции пептидом VEGFR2-A2-773 (таблица 1 и фигура 5), несмотря на то, что введение двух пептидов VEGFR1-A2-770 и VEGFR2-A2-773 показывало явную эффективность у пациента. В результате, это указывало, что улучшение в данном случае обеспечивало действие только пептида VEGFR1-A2-770.
HLA-A0201 (Случай 3)
В ELISPOT-анализе на IFN-гамма наблюдалось значительное большее число точек при стимуляции импульсно меченными пептидом VEGFR1-A2-770 клетками Т2 по сравнению числом точек, полученных при стимуляции импульсно меченными пептидом HIV-Env клетками T2 (таблица 1 и фигура 6). Соответственно, с помощью проточного цитометрического анализа была детектирована значительная популяция клеток HLA-A*0201/VEGFR1-A2-770-декстрамер+ CD8+ (фигура 6, нижние панели). Напротив, не наблюдалось специфичной продукции IFN-гамма при стимуляции пептидом VEGFR2-A2-773 (таблица 1 и фигура 7), несмотря на то, что введение двух пептидов VEGFR1-A2-770 и VEGFR2-A2-773 показывало явную эффективность у пациента. В результате, это указывало, что улучшение в данном случае обеспечивало действие только пептида VEGFR1-A2-770.
HLA-A2402 (Случай 1)
В ELISPOT-анализе на IFN-гамма наблюдалось значительное большее число точек при стимуляции импульсно меченным пептидом VEGFR1-A24-1084 клетками TISI по сравнению числом точек, полученных при стимуляции импульсно меченными пептидом HIV-Env клетками TISI, особенно после курсов лечения (таблица 1 и фигура 8). Напротив, не наблюдалось специфичной продукции IFN-гамма при стимуляции пептидом VEGFR2-A24-169 (таблица 1 и фигура 9), несмотря на то, что введение двух пептидов VEGFR1-A24-1084 и VEGFR2-A24-169 показывало явную эффективность у пациента. В результате, это указывало, что улучшение в данном случае обеспечивало действие только пептида VEGFR1-A24-1084.
Изменение зрения после лечения
Зрение у пациентов из групп, получавших лечение, улучшилось с достоверной разницей (p=0,015) (фиг. 10).
Промышленная применимость
Настоящее изобретение относится к фармацевтическим композициям/вакцинам для лечения и/или предупреждения заболеваний, вызванных неоваскуляризацией хориоидеи (неоваскулярной макулопатией). Обычно в качестве способов лечения неоваскулярной макулопатии применяли лазерную терапию, фотодинамическую терапию, оперативное вмешательство, лекарственную терапию и т.п. Однако лазерная терапия может уменьшить центральное зрение. Есть примеры быстрого снижения зрения после фотодинамической терапии в случае хорошего зрения. При оперативном лечении существует риск послеоперационных осложнений, ассоциированных с хирургическим вмешательством. При лекарственной терапии существует риск серьезных осложнений, таких как эндофтальмит и отслоение сетчатки вследствие внутриглазных инъекций. То есть, при обычных способах лечения существует высокий риск снижения зрения в результате ассоциированных с лечением побочных эффектов и осложнений. Поэтому сложно осуществлять лечение ранних стадий заболевания с относительно хорошим зрением. Поскольку в случаях, в которых вводили композиции/вакцины по изобретению, проблем с безопасностью не возникало, можно ожидать, что фармацевтические композиции/вакцины по настоящему изобретению относятся к имеющим низкую степень риска и высокобезопасным терапевтическим агентам и способам лечения неоваскулярной макулопатии. Кроме того, поскольку было показано, что они эффективны для случаев, которые не отвечают на обычные способы лечения, можно ожидать, что они будут относиться к терапевтическим агентам и способам лечения, используемым в случае неэффективности обычных способов лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНОТЕРАПИЯ НЕОВАСКУЛЯРИЗАЦИИ СОСУДИСТОЙ ОБОЛОЧКИ ГЛАЗА | 2008 |
|
RU2481118C2 |
| ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ URLC10, И СОДЕРЖАЩАЯ ЕГО ВАКЦИНА | 2015 |
|
RU2700881C2 |
| ВАКЦИНЫ НА ОСНОВЕ ПЕПТИДА FOXP3 | 2007 |
|
RU2473557C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С ИСПОЛЬЗОВАНИЕМ АНТИГЕННОГО ПЕПТИДА И ХИМИОТЕРАПЕВТИЧЕСКОГО СРЕДСТВА | 2008 |
|
RU2472522C2 |
| ПЕПТИДЫ ТЕМ8 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2008 |
|
RU2498993C2 |
| ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ CDCA1, И СОДЕРЖАЩАЯ ЕГО ВАКЦИНА | 2015 |
|
RU2699543C2 |
| ПЕПТИДЫ ЭПИТОПОВ MYBL2 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2496787C2 |
| ПЕПТИДЫ UBE2T И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2013 |
|
RU2663350C2 |
| CDCA1 ЭПИТОП-ПЕПТИДЫ И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2502740C2 |
| ПЕПТИДЫ ТОРК И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2012 |
|
RU2633503C2 |























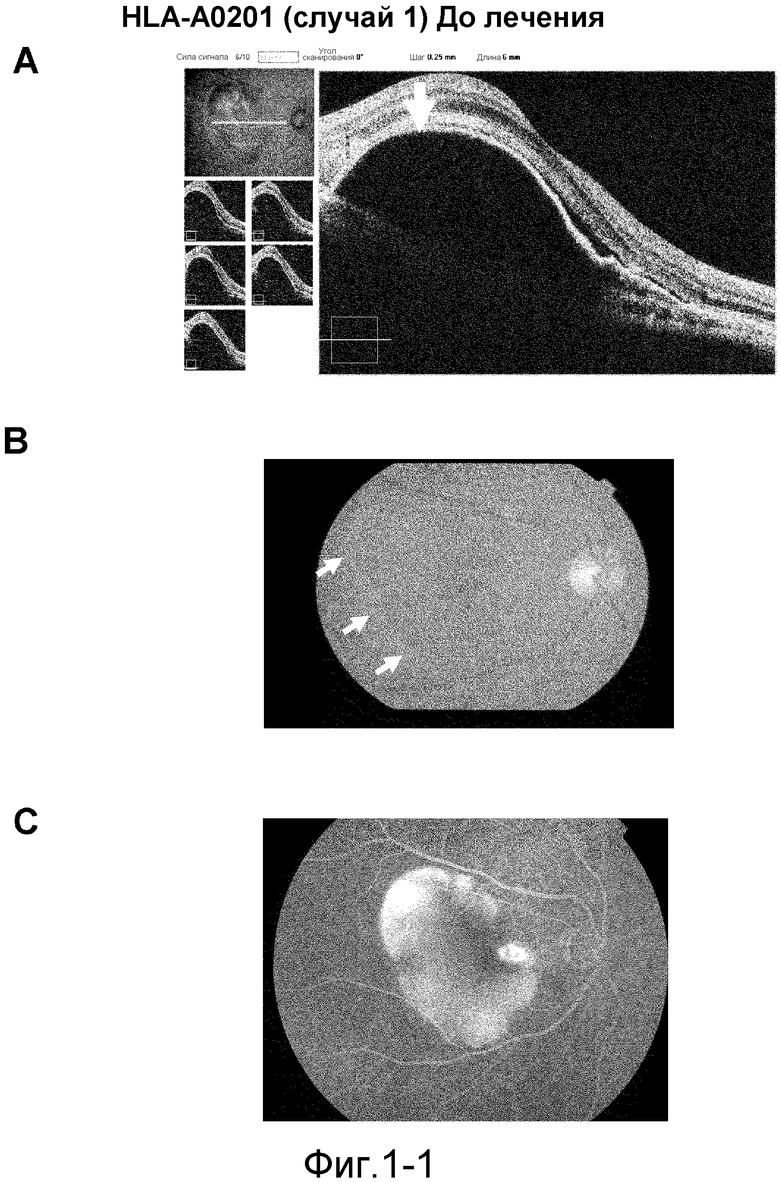
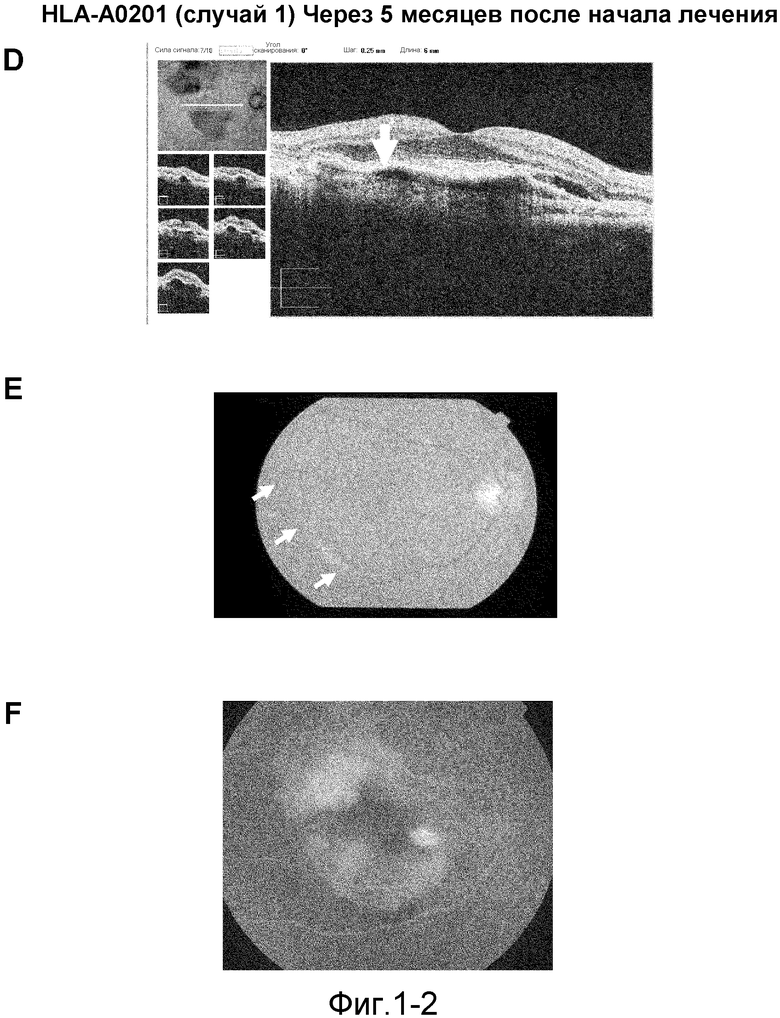
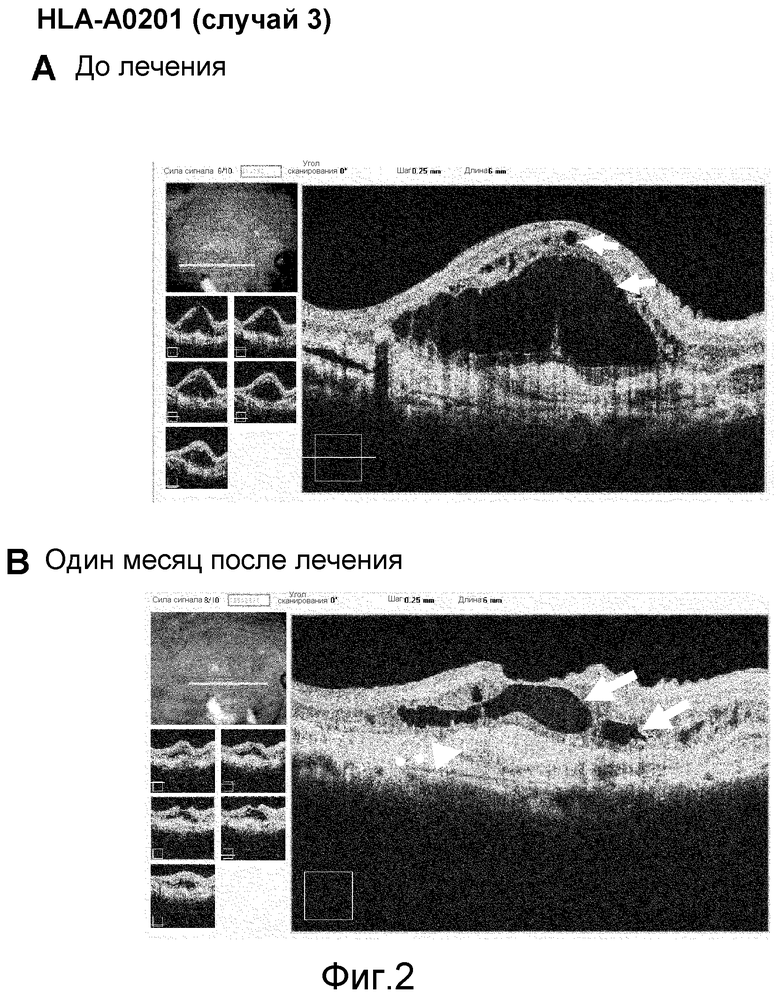
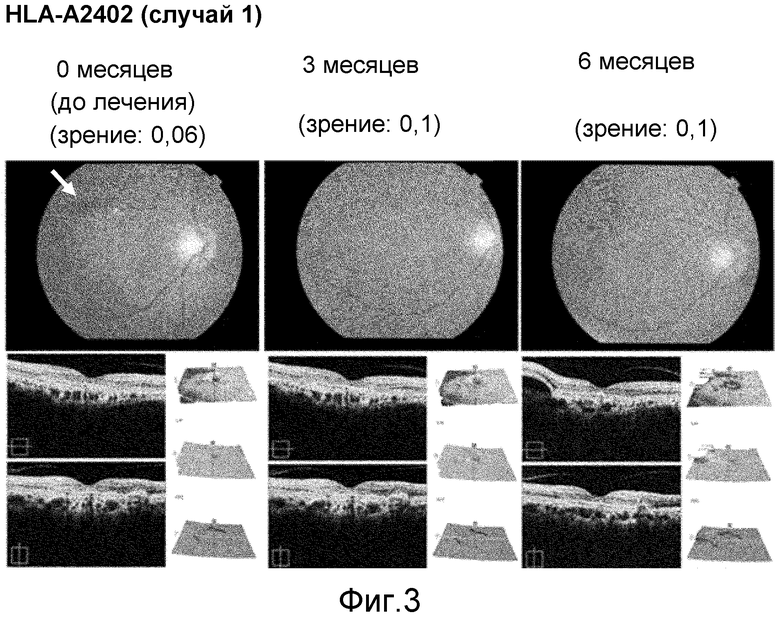
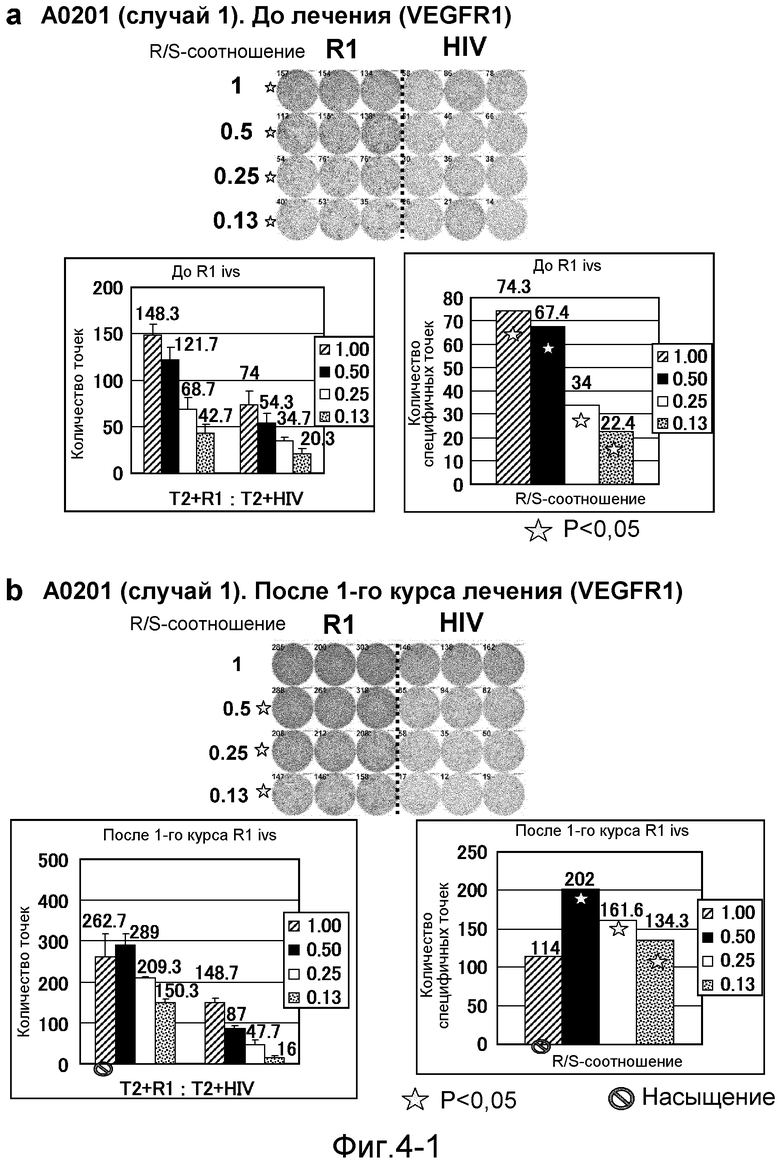
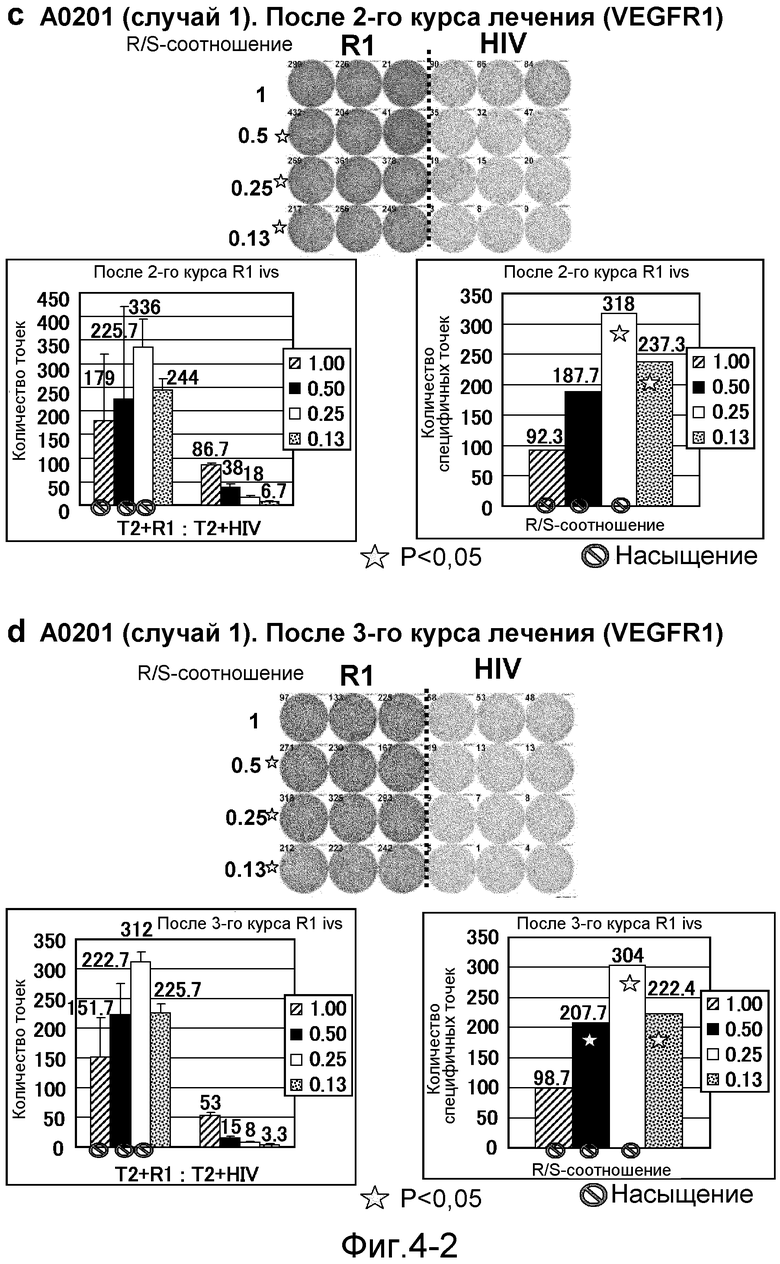
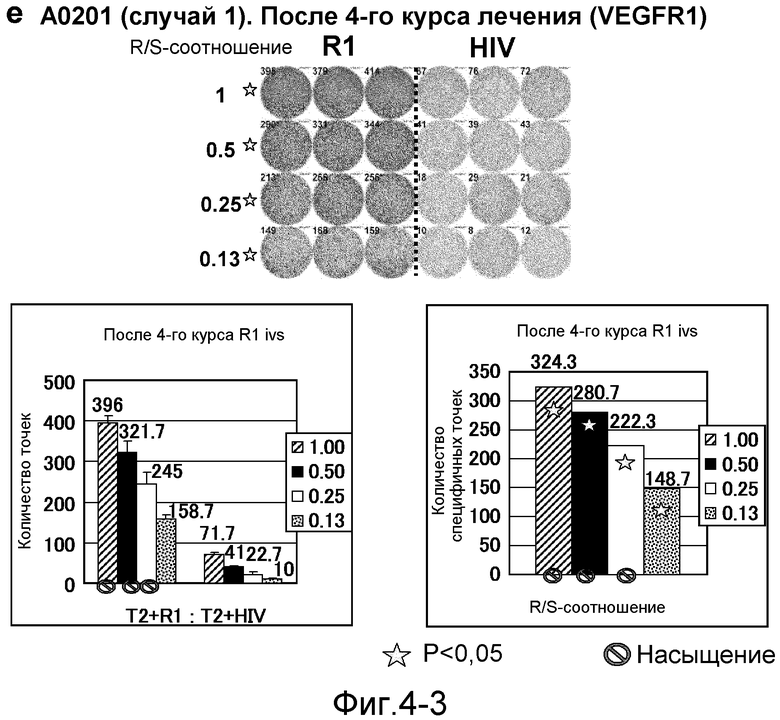
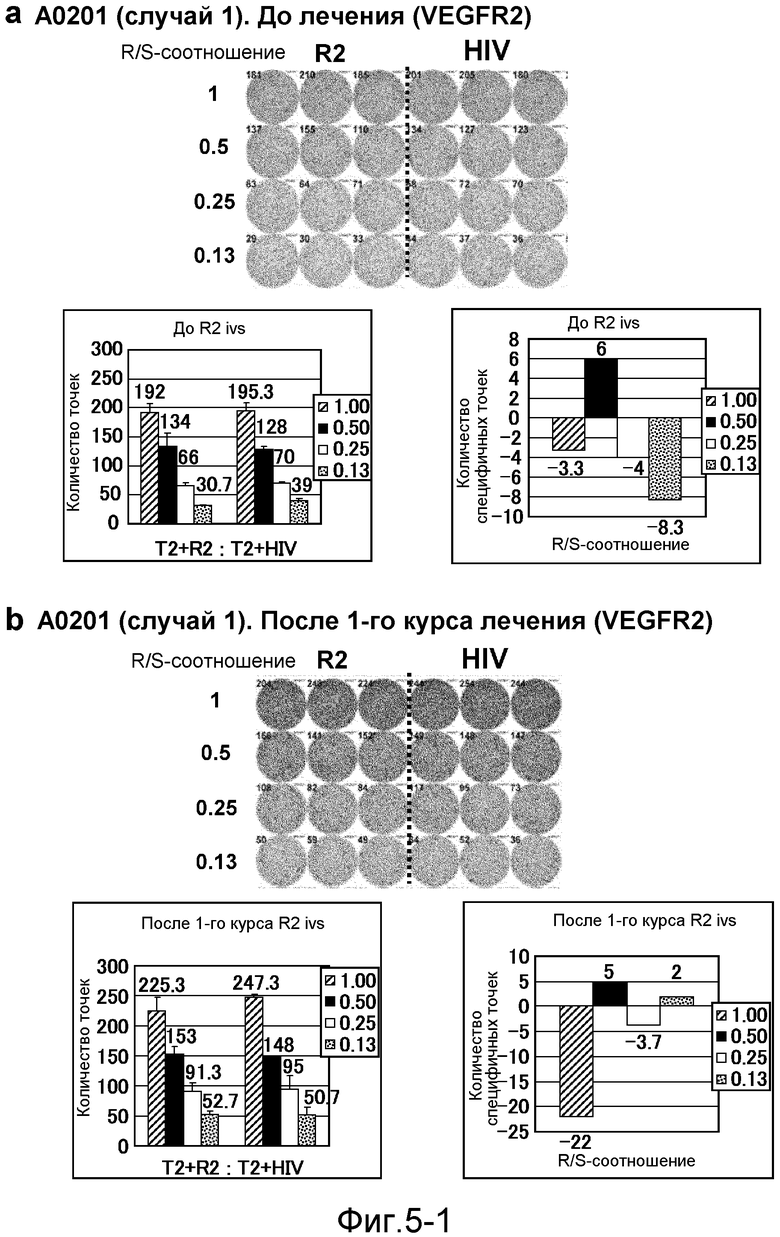
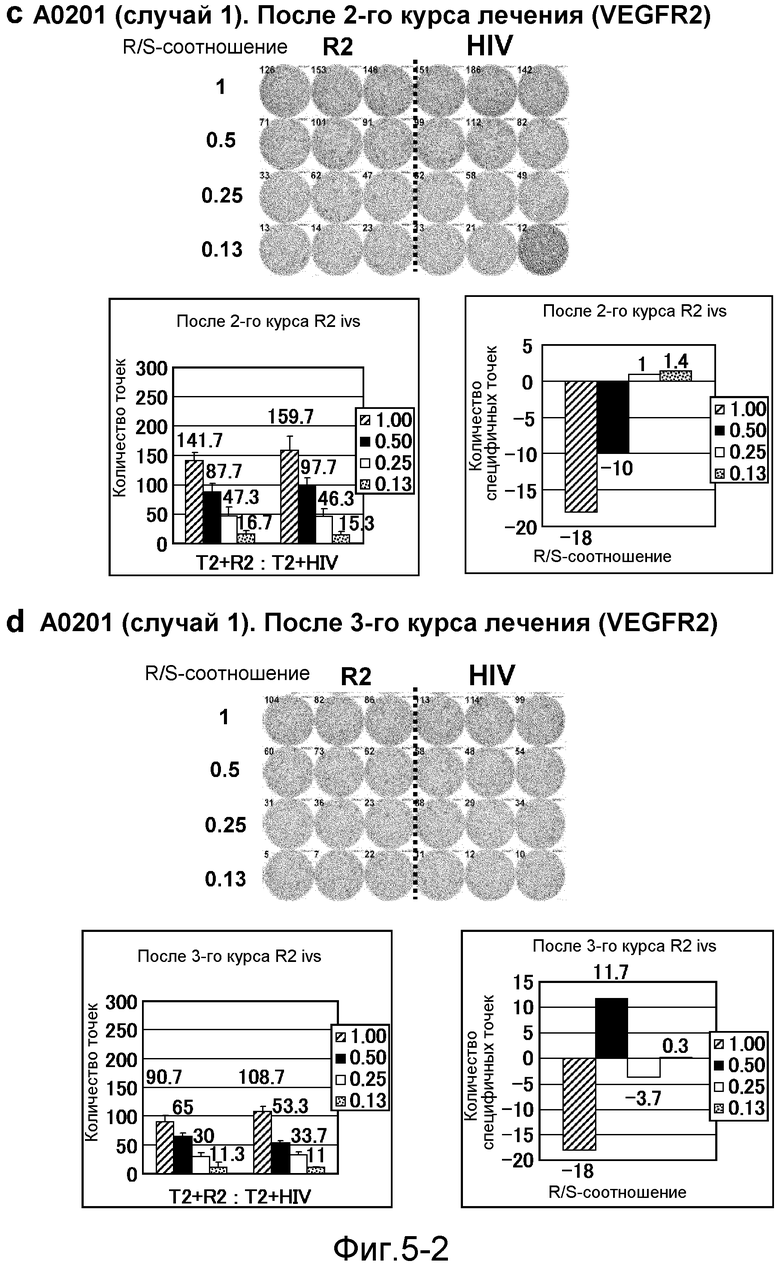
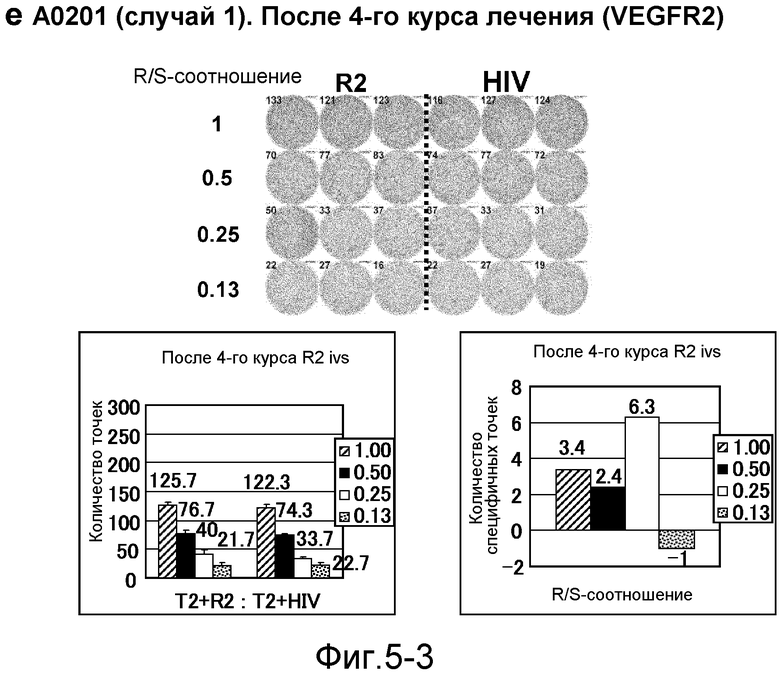
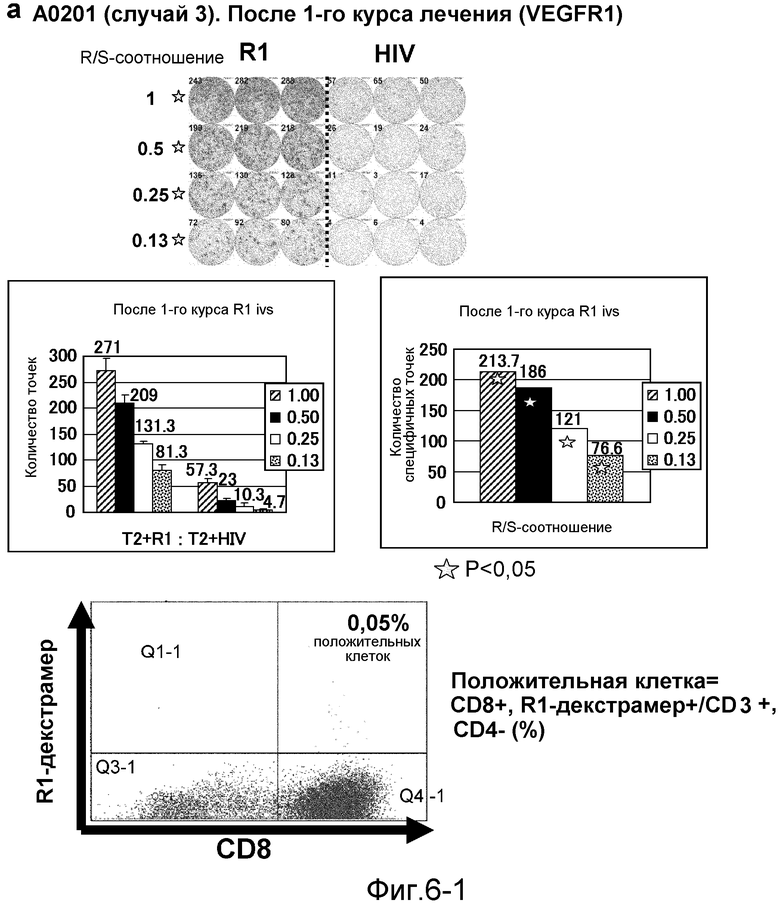
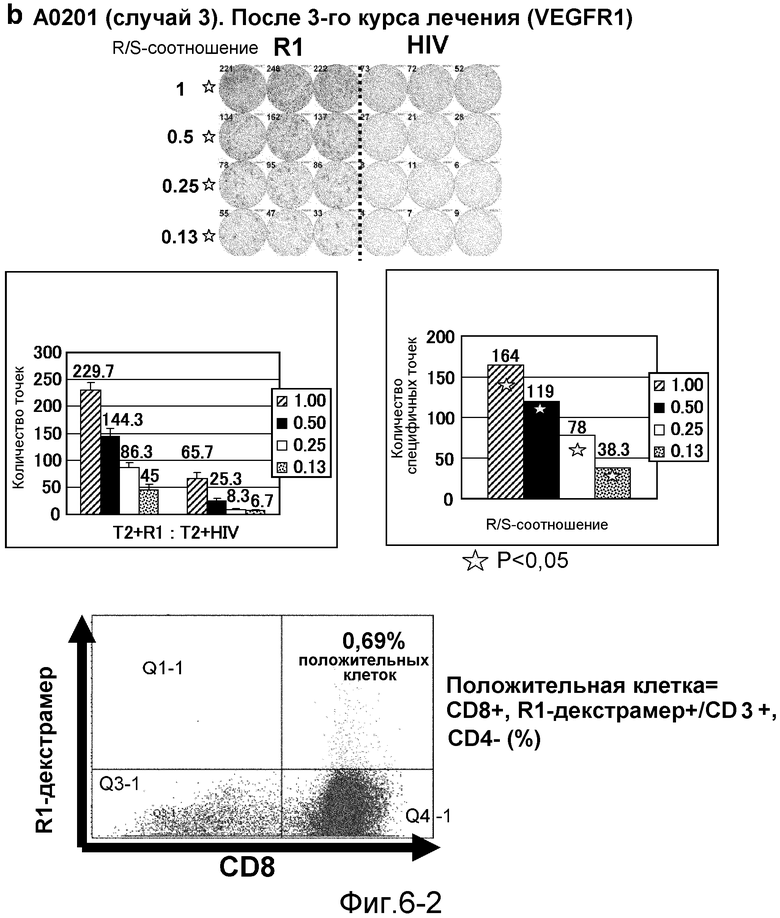
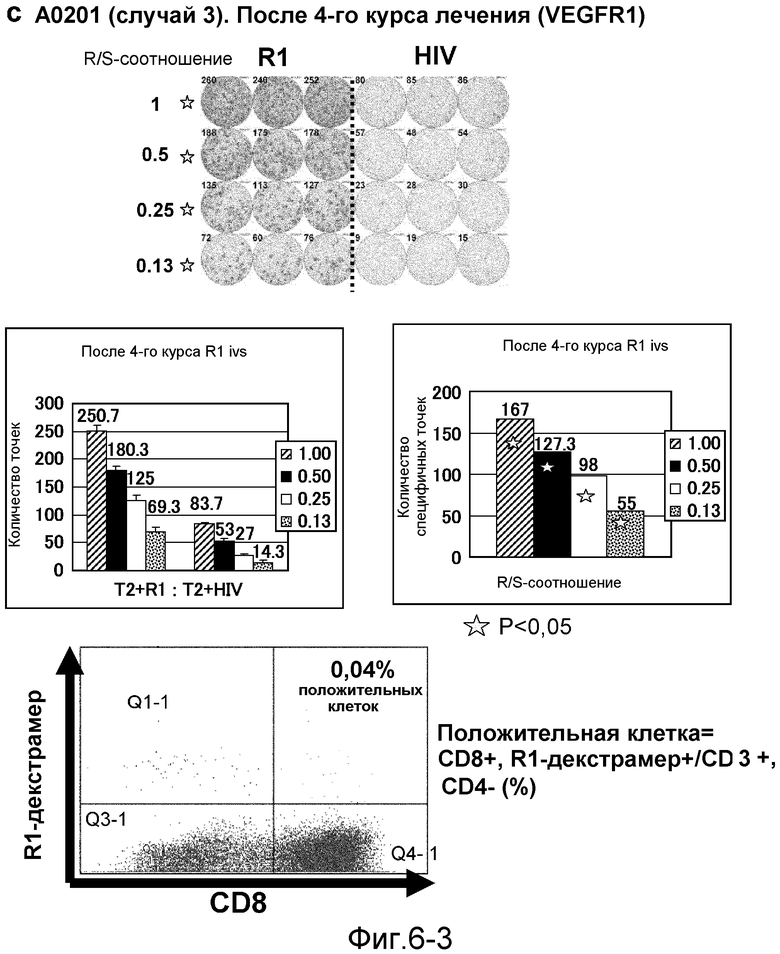
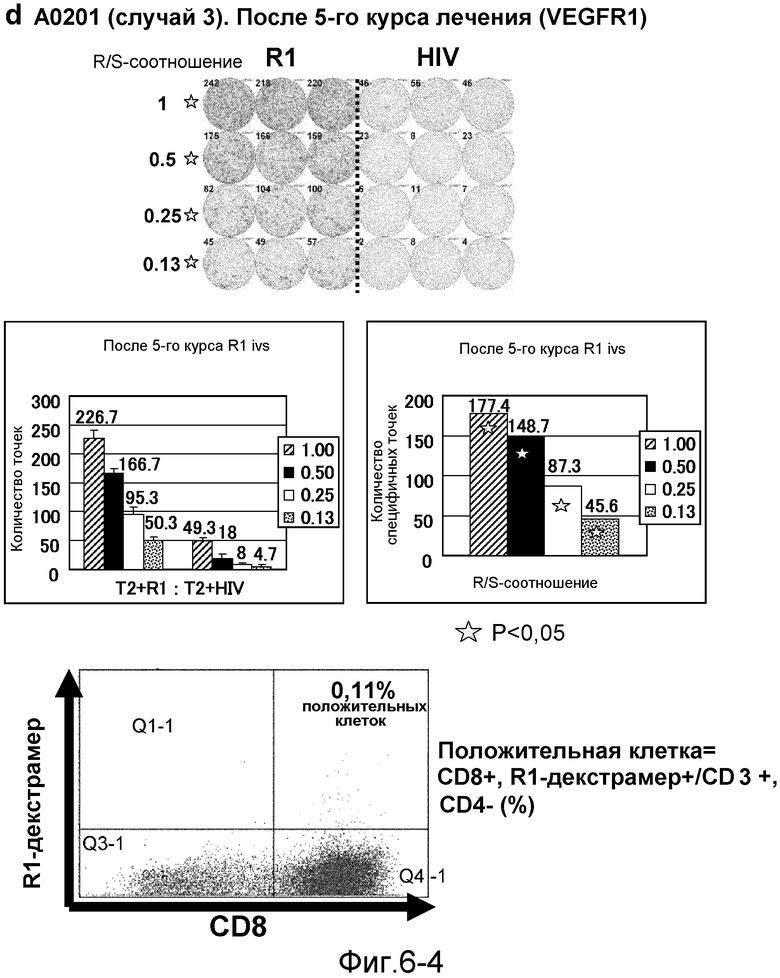
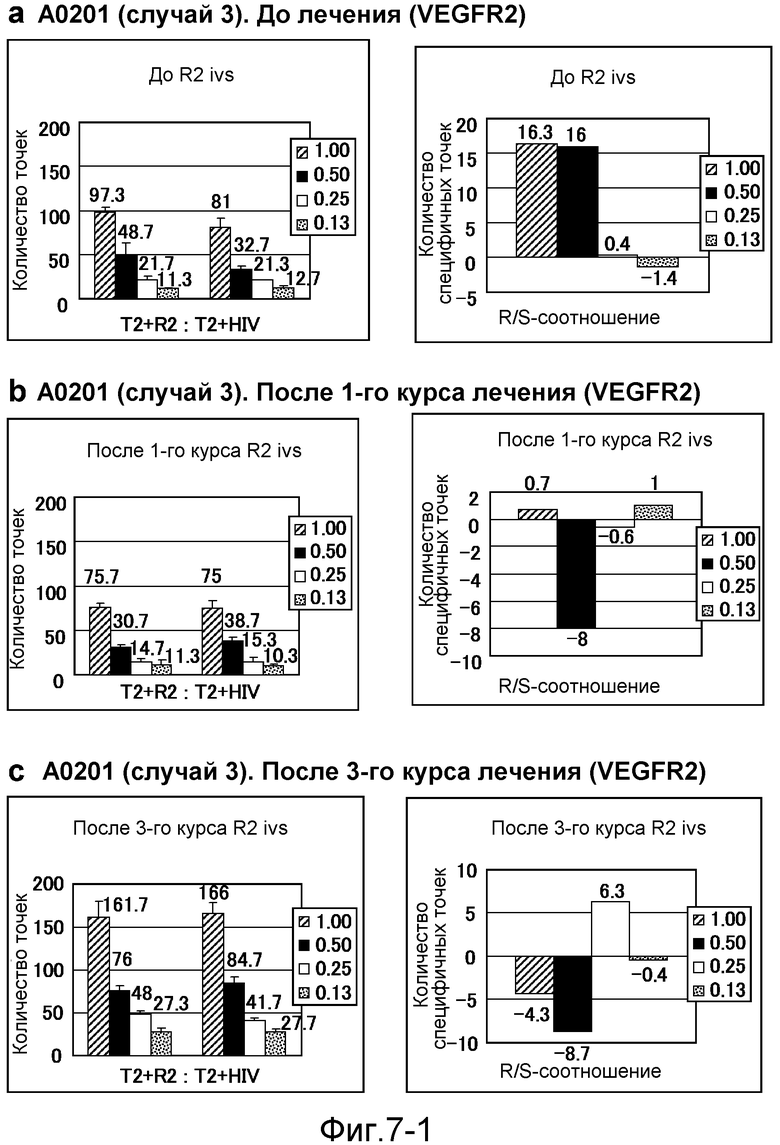
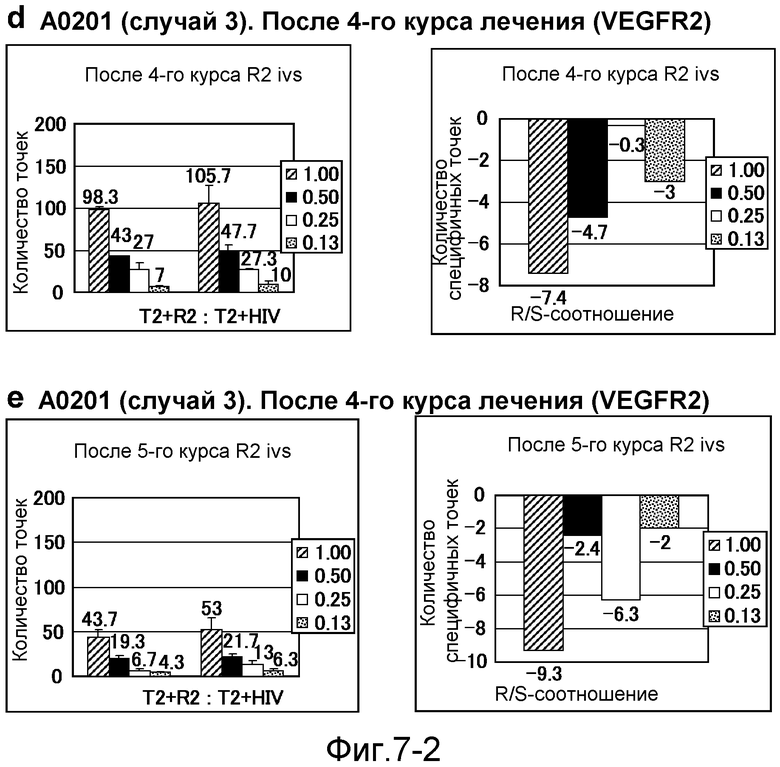
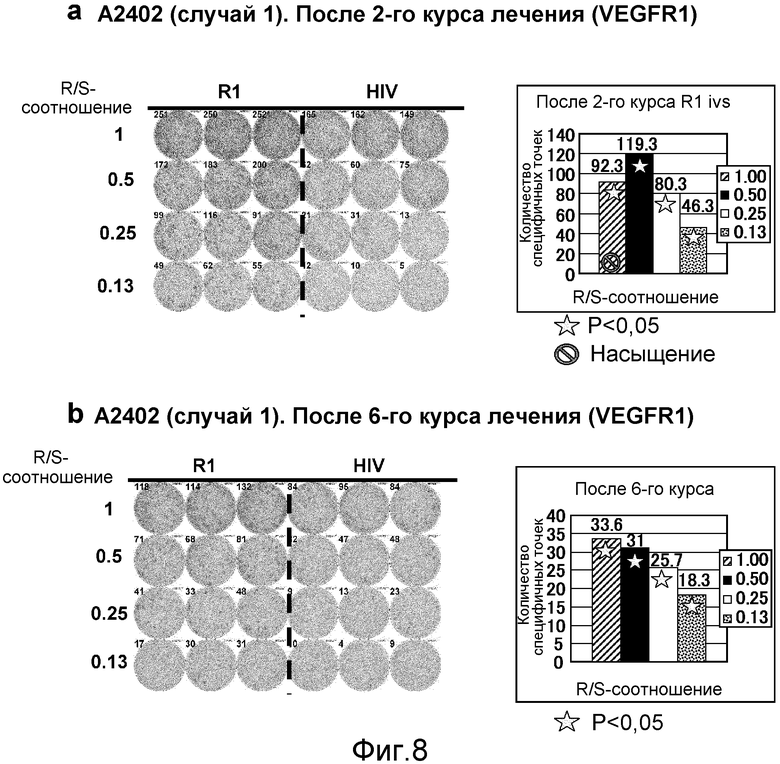

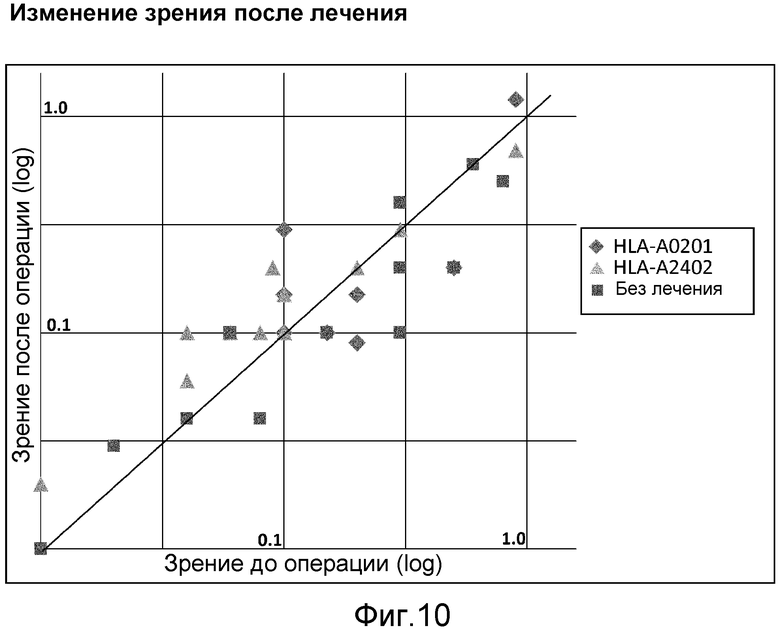
Группа изобретений относится к способам для лечения или предупреждения заболеваний, вызванных неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), а также к фармацевтическим композициям, содержащим в качестве активного ингредиента по меньшей мере один пептид из пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и обладающих активностью индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток и по меньшей мере один пептид из пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2 и обладающих активностью индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток или кодирующие их полинуклеотиды, где клетки сосудистого эндотелия, вовлеченные в неоваскуляризацию хориоидеи у человека, экспрессируют VEGFR-1 рецепторный белок на поверхности клеток. Группа изобретений эффективна в лечении или предупреждении заболеваний, вызванных неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией). 6 н. и 30 з.п. ф-лы, 19 ил., 1 табл., 1 пр.
1. Фармацевтическая композиция для лечения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), содержащая в качестве активного ингредиента по меньшей мере один пептид из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток или кодирующий его полинуклеотид, в которой вышеуказанный пептид по (а) представляет любой один из пептидов (i) и (ii), описанный ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4;
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4 и,
где клетки сосудистого эндотелия, вовлеченные в неоваскуляризацию хориоидеи у человека, экспрессируют VEGFR-1 рецепторный белок на поверхности клеток.
2. Фармацевтическая композиция по п. 1, в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина;
(2) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана;
(5) пептидом, в котором C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана, и C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина.
3. Фармацевтическая композиция по п. 1, в котором композиция дополнительно содержит по меньшей мере один пептид из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, в которой вышеуказанный пептид по (b) является любым из пептидов (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5-17; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17.
4. Фармацевтическая композиция по п. 3, в которой вышеуказанный пептид (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина;
(2) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана;
(5) пептидом, в котором С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана, и С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина.
5. Фармацевтическая композиция по любому одному из пп. 1-4, в котором заболевание, вызванное неоваскуляризацией хориоидеи (неоваскулярной макулопатией), выбрано из экссудативной возрастной макулярной дегенерации, миопической макулярной дегенерации, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных видов пигментной эпителиопатии сетчатки, хориоидальной атрофии, хориодеремии и хориоидальной остеомы.
6. Фармацевтическая композиция по любому одному из пп. 1-4, которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24.
7. Фармацевтическая композиция по п. 5, которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24.
8. Вакцина для лечения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), содержащая в качестве активного ингредиента по меньшей мере один пептид из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, или кодирующий его полинуклеотид, в которой вышеуказанные пептиды по (а) являются любым пептидом из (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4 и,
где клетки сосудистого эндотелия, вовлеченные в неоваскуляризацию хориоидеи у человека, экспрессируют VEGFR-1 рецепторный белок на поверхности клеток.
9. Вакцина по п. 8, в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина;
(2) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана;
(5) пептидом, в котором С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана, и C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина.
10. Вакцина по п. 8, в котором вакцина дополнительно содержит по меньшей мере один пептид из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, в которой вышеуказанный пептид по (b) является любым пептидом из (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из любой одной из SEQ ID NO: 5-17; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17.
11. Вакцина по п. 10, в которой вышеуказанный пептид (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина;
(2) пептидом, в котором С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана;
(5) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана, и С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина.
12. Вакцина по любому одному из пп. 8-11, в котором заболевание, вызванное неоваскуляризацией хориоидеи (неоваскулярной макулопатией), выбрано из экссудативной возрастной макулярной дегенерации, миопической макулярной дегенерации, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных видов пигментной эпителиопатии сетчатки, хориоидальной атрофии, хориодеремии и хориоидальной остеомы.
13. Вакцина по любому одному из пп. 8-11, которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24.
14. Вакцина по п. 12, которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24.
15. Фармацевтическая композиция для ингибирования неоваскуляризации хориоидеи человека, содержащая в качестве активного ингредиента по меньшей мере один пептид из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, или кодирующий его полинуклеотид, в которой вышеуказанный пептид по (а) является любым одним пептидом из (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4 и,
где клетки сосудистого эндотелия, вовлеченные в неоваскуляризацию хориоидеи у человека, экспрессируют VEGFR-1 рецепторный белок на поверхности клеток.
16. Фармацевтическая композиция по п. 15, в которой вышеуказанный пептид (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина;
(2) пептидом, в котором С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина, и С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана;
(5) пептидом, в котором С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана, и C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина.
17. Фармацевтическая композиция по п. 15, которая дополнительно содержит по меньшей мере один пептид из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, в которой вышеуказанный пептид по (b) является пептидом (i) и (ii), описанным ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5-17; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17.
18. Фармацевтическая композиция по п. 17, в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина;
(2) пептидом, в котором С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 является валином или лейцином;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина, и С-концевая аминокислота любой одной аминокислотной последовательности из SEQ ID NO: 11-17 является валином или лейцином;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана;
(5) пептидом, в котором С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионином; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана, и С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина.
19. Фармацевтическая композиция по любому одному из пп. 15-18, которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24.
20. Вакцина для ингибирования неоваскуляризации хориоидеи человека, содержащая в качестве активного ингредиента по меньшей мере один пептид из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, или кодирующий его полинуклеотид, в которой вышеуказанный пептид по (а) является любым одним из пептидов (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4 и,
где клетки сосудистого эндотелия, вовлеченные в неоваскуляризацию хориоидеи у человека, экспрессируют VEGFR-1 рецепторный белок на поверхности клеток.
21. Вакцина по п. 20, в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 1-3 модифицирована до метионина;
(2) пептидом, в котором С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана;
(5) пептидом, в котором C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана, и C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина.
22. Вакцина по п. 20, которая дополнительно содержит по меньшей мере один пептид из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, в которой вышеуказанный пептид по (b) является любым одним из пептидов (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность выбранную из группы, состоящей из SEQ ID NO: 5-17; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17.
23. Вакцина по п. 22, в которой вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 11-17 модифицирована до лейцина или метионина;
(2) пептидом, в котором С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина, и С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной аминокислотной последовательности из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана;
(5) пептидом, в котором С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана, и С-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина.
24. Вакцина по любому одному из пп. 20-23, которую вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24.
25. Способ лечения заболевания, вызванного неоваскуляризацией хориоидеи человека (неоваскулярной макулопатией), включающий введение субъекту фармацевтической композиции, содержащей по меньшей мере один пептид из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток или кодирующий его полинуклеотид, в которой вышеуказанный пептид по (а) представляет любой из пептидов (i) и (ii), описанных ниже:
(i) пептид, из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4;
(ii) пептид, из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4 и,
где клетки сосудистого эндотелия, вовлеченные в неоваскуляризацию хориоидеи у человека, экспрессируют VEGFR-1 рецепторный белок на поверхности клеток.
26. Способ по п. 25, в котором вышеуказанный пептид по (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина;
(2) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана;
(5) пептидом, в котором С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана, и C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина.
27. Способ по п. 25, в котором композиция дополнительно содержит по меньшей мере один пептид из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, в которой вышеуказанный пептид по (b) является любым из (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5-17; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17.
28. Способ по п. 27, в котором вышеуказанный пептид (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина;
(2) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана;
(5) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина.
29. Способ по любому из пунктов 25-28, в котором заболевание, вызванное неоваскуляризацией хориоидеи (неоваскулярной макулопатией), выбрано из экссудативной возрастной макулярной дегенерации, миопической макулярной дегенерации, ангиоидных полос сетчатки, центральной экссудативной хориоретинопатии, различных видов пигментной эпителиопатии сетчатки, хориоидальной атрофии, хориодеремии и хориоидальной остеомы.
30. Способ по любому одному из пп. 25-28, в котором фармацевтическую композицию вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-A24.
31. Способ по п. 29, в котором фармацевтическую композицию вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-А24.
32. Способ ингибирования неоваскуляризации хориоидеи человека (неоваскулярной макулопатией), включающий введение субъекту фармацевтической композиции, содержащей по меньшей мере один пептид из (а) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 1, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток или кодирующий его полинуклеотид, в которой вышеуказанный пептид по (а) представляет любой из пептидов (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4;
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-4 и,
где клетки сосудистого эндотелия, вовлеченные в неоваскуляризацию хориоидеи у человека, экспрессируют VEGFR-1 рецепторный белок на поверхности клеток.
33. Способ по п. 32, в котором вышеуказанный пептид (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина;
(2) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 1-3 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана;
(5) пептидом, в котором C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, метионина или триптофана, и C-концевая аминокислота аминокислотной последовательности SEQ ID NO: 4 модифицирована до фенилаланина, лейцина, триптофана или метионина.
34. Способ по п. 32, в котором композиция дополнительно содержит по меньшей мере один пептид из (b) пептидов, содержащих аминокислотную последовательность, полученную из белка VEGF-рецептора 2, и способных индуцировать цитотоксические Т-клетки в присутствии антиген-представляющих клеток, в которой вышеуказанный пептид по (b) является любым из (i) и (ii), описанных ниже:
(i) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5-17; и
(ii) пептид из менее чем 15 аминокислот, содержащий аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, добавлениями и/или вставками в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5-17.
35. Способ по п. 34, в котором вышеуказанный пептид (ii) является любым одним из пептидов (1)-(6), описанных ниже:
(1) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина;
(2) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(3) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до лейцина или метионина, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 11-17 модифицирована до валина или лейцина;
(4) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана;
(5) пептидом, в котором C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина; и
(6) пептидом, в котором вторая аминокислота с N-конца любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, тирозина, метионина или триптофана, и C-концевая аминокислота любой одной из аминокислотных последовательностей из SEQ ID NO: 5-10 модифицирована до фенилаланина, лейцина, изолейцина, триптофана или метионина.
36. Способ по любому из пунктов 32-35, в котором композицию вводят субъекту, чьим HLA-антигеном является HLA-A02 или HLA-А24.
| WO2008099908 A1 21.08.2008 WO2006093030 A1 08.09.2006 WO2004024766 A1 25.03.2004 GEHLBACH,P | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ применения резонанс конденсатора, подключенного известным уже образом параллельно к обмотке трансформатора, дающего напряжение на анод генераторных ламп | 1922 |
|
SU129A1 |
Авторы
Даты
2015-07-10—Публикация
2010-06-10—Подача