ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к выявлению и определению функциональных характеристик пептидов человека, проникающих в клетки (CPP), и их применению, в частности, в качестве носителей при трансфекции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Плазматическая мембрана клетки представляет собой эффективный барьер, предотвращающий поступление в клетку большинства молекул, которые не подвергаются активному транспорту, но тем самым также затрудняется целевая доставка терапевтических субстанций. Лишь небольшой набор молекул, обладающих определенной молекулярной массой, полярностью и/или суммарным зарядом, способны (пассивно) диффундировать сквозь клеточные мембраны. Все остальные молекулы должны активно транспортироваться, например, посредством рецептор-опосредованного эндоцитоза или с помощью АТФ-связывающих транспортных молекул. Кроме того, можно также искусственно создать условия, заставляющие молекулы проходить через клеточную мембрану, например, с помощью электропорации, катионных липидов/липосом, микроинъекции, вирусной доставки или инкапсуляции в полимерах. Однако эти способы в основном применяют для доставки гидрофобных молекул. Дополнительно, существенные побочные эффекты, связанные с этими способами, и тот факт, что их применение в основном ограничено системами in vitro, не позволяют этим способам стать эффективным инструментом доставки лекарственных препаратов или других терапевтически активных агентов в клетки с целью профилактики или лечения медицинских состояний.
В частности, необходимость целевой доставки также оказалось существенной проблемой при разработке лекарственных препаратов на основе РНКi (РНК-интерференции). Такие агенты включают малые молекулы РНК (например, siРНК, miРНК или shРНК), которые препятствуют экспрессии генов, вызывающих заболевание или способствующих развитию заболевания. После того, как в 2001 г. наличие РНКi было продемонстрировано в клетках млекопитающих (Elbashir, S.M. et al. (2001) Nature 411, 494-498), быстро стало понятно, что этот сиквенс-специфичный механизм посттранскрипционного сайленсинга генов можно применять для разработки нового класса лекарственных препаратов, который также может стать многообещающим средством лечения заболеваний, которые до сих пор были недоступны для терапевтического вмешательства (De Fougerolles, A. et al. (2007) Nat. Rev. Drug Discov. 6, 443-453).
Однако, так как РНКi происходит в цитозоле, то для проявления своего терапевтического действия любые лекарственные препараты на основе РНК должны проходить через клеточную мембрану. К настоящему моменту описано несколько способов достижения этой цели, например, применение липидов (Schroeder; А. et al. (2010) J. Intern. Med. 267, 9-21), вирусных носителей (Liu, Y.P: and Berkhout, B. (2009) Curr. Top.Med. Chem. 9, 1130-1143) и поликатионных наночастиц (Howard, K.A. (2009) Adv. Drug Deliv. Rev. 61, 710-720).
Еще одним способом перемещения молекул через клеточную мембрану является применение пептидов, проникающих в клетки (CPP) (называемых также доменами белковой трансдукции (PTD) или последовательностями транслокации через мембрану (MTS); см. обзор, например, в публикации: Fonseca, S.B et al. (2009) Adv. Drug Deliv. Rev. 61, 953-964; Heitz, F. et al. (2009) Br. J. Pharmacol. 157, 195-206).
CPP представляют собой гетерогенную группу пептидных молекул - с точки зрения как их первичных аминокислотных последовательностей, так и их структур. Известные примеры CPP включают домен транслокации HIV-1 TAT (Green; M. and Loewenstein, P.M. (1988) Cell 55, 1179-1188) и гомеодомен белка Antennapedia из Drosophila (Joliot; A. et al. (1991) Proc. Natl. Acad. Sci. USA 88, 1864-1868). Точный механизм транслокации до сих пор остается спорным вопросом. Исследования мутаций белка Antennapedia выявили, что последовательность из 16 аминокислот, называемая пенетратином или pAntp (Derossi, D. et al. (1994) J. Biol. Chem. 269, 10444-10450), является необходимым и достаточным фактором для транслокации через мембрану. В дальнейшем были разработаны другие полученные из белков пептиды CPP, такие как основная последовательность белка HIV-1 Tat (Vives, E. et al. (1997) J. Biol. Chem. 272, 16010-16017). Разработан синтетический пептид - амфипатический модельный пептид MAP (Oehlke, J. et al. (1998) Biochim. Biophys. Acta 1414, 127-139).
Показано, что соединение антисмысловой ДНК или пептидо-нуклеиновых кислот (PNA) с пептидами CPP дает требуемый эффект in vivo. Однако до сих пор обсуждается, какие свойства необходимы пептиду CPP для проявления транслокационной функции. В общем случае между различными пептидами CPP было обнаружено мало сходства с точки зрения последовательности и/или структуры. На настоящий момент известно только одно общее свойство - это достаточно высокое содержание основных (положительно заряженных) аминокислот, которое обусловливает положительный суммарный заряд. Таким образом, высказано предположение, что пептиды CPP сначала связываются с отрицательно заряженными группами головки липидов или белками (протеогликанами) на клеточной мембране. Однако после связывания пептиды остаются внутри мембрано-связанных компартментов. Механизм поглощения на дальнейших этапах до сих пор активно обсуждается. Предполагают, что пептиды CPP либо «ретроградно» транспортируются в ЭПР, где они попадают под действие существующего в клетке механизма транслокации (Fischer, R. et al. (2004) J. Biol. Chem. 279, 12625-12635), либо они напрямую транслоцируются через мембрану (Rothbard, J.B. et al. (2005) Adv. Drug Deliv. Rev. 57, 495-504). В зависимости от механизма интернализации известные пептиды CPP в основном располагаются в ядре или, в случае, если они интернализируются внутри везикул, в основном остаются внутри этих везикул, и только незначительная часть высвобождается в цитоплазму.
Многие пептиды CPP оказывают серьезные побочные эффекты на клетки, на которые они действуют, и это неудивительно с учетом того факта, что большинство пептидов, от которых происходят CPP, функционируют в качестве, например, противомикробных субстанций или токсинов. Например, пептиды CPP могут вызывать вытекание цитоплазмы из-за повреждения мембраны, а также оказывать мешающее воздействие на нормальное функционирование мембранных белков. Пептиды CPP могут также демонстрировать цитотоксические эффекты, примером может служить, транспортан, который влияет на ГТФазную активность (Soomets, U. et al. (2000) Biochim. Biophys. Acta 1467, 165-176). Кроме того, накапливается все больше доказательств того, что многие пептиды CPP выполняют свою функцию только в определенных, очень специфических условиях, которые невозможно обеспечить в системе in vivo. Еще один недостаток заключается в том, что, в зависимости от клетки-мишени, пептиды CPP могут подвергаться быстрой деградации в клетках. Наконец, так как многие известные пептиды CPP происходят от белков, не являющихся белками человека, регулярно отмечались токсические и/или иммуногенные эффекты, которые могут препятствовать применению этих пептидов, например, с терапевтическими целями у человека.
Таким образом, сохраняется потребность в улучшенных пептидах, проникающих в клетки, которые позволят преодолеть все указанные выше ограничения. В частности, имеется потребность в пептидах, проникающих в клетки, которые представляют собой пригодные везикулы или носители для трансфекции, позволяющие осуществлять доставку соединений, таких как терапевтические агенты, в клетки-мишени с высокой эффективностью, но без проявления существенных цитотоксических и/или иммуногенных эффектов.
Кроме того, сохраняется потребность в композициях, содержащих такие пептиды CPP, а также в способах, в которых такие пептиды CPP применяются в качестве молекулярного инструмента для диагностических и терапевтических применений.
Соответственно, цель настоящего изобретения - предложить такие пептиды CPP и соответствующие композиции и способы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одной из особенностей настоящего изобретения является то, что оно относится к пептидной молекуле, которая может быть интернализирована внутрь клетки, при этом пептидная молекула (a) имеет длину по меньшей мере 10, предпочтительно - по меньшей мере 15 аминокислотных остатков; (b) содержит в своей первичной аминокислотной последовательности по меньшей мере 25%, предпочтительно - по меньшей мере 30% положительно заряженных аминокислотных остатков; и (c) интернализируется внутрь клетки с эффективностью, составляющей по меньшей мере 80%, предпочтительно - по меньшей мере 90% от эффективности интернализации пептида TAT, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1).
В конкретных примерах воплощения по меньшей мере часть пептида образует альфа-спиральную вторичную структуру.
Предпочтительно, пептид является пептидом млекопитающих, в частности, предпочтительно, происходит от молекулы человека.
В дополнительных предпочтительных вариантах воплощения пептид имеет аминокислотную последовательность, выбранную из группы, состоящей из:
 (SEQ ID NO: 2);
(SEQ ID NO: 2);
 (SEQ ID NO: 3);
(SEQ ID NO: 3);
 (SEQ ID NO: 4);
(SEQ ID NO: 4);
 (SEQ ID NO: 5);
(SEQ ID NO: 5);
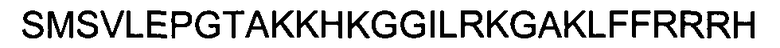 (SEQ ID NO: 6);
(SEQ ID NO: 6);
 (SEQ ID NO: 7);
(SEQ ID NO: 7);
 (SEQ ID NO: 8);
(SEQ ID NO: 8);
 (SEQ ID NO: 9);
(SEQ ID NO: 9);
 (SEQ ID NO: 10); и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 10.
(SEQ ID NO: 10); и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 10.
В конкретных предпочтительных вариантах воплощения пептид имеет аминокислотную последовательность, выбранную из группы, состоящей из:
 (SEQ ID NO: 2);
(SEQ ID NO: 2);
 (SEQ ID NO: 3);
(SEQ ID NO: 3);
 (SEQ ID NO: 4); и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 4.
(SEQ ID NO: 4); и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 4.
Еще одной особенностью настоящего изобретения является то, что оно относится к молекуле нуклеиновой кислоты, кодирующей пептид, указанный в этом документе выше.
Еще одной особенностью настоящего изобретения является то, что оно относится к вектору, содержащему молекулу нуклеиновой кислоты, описанную в этом документе выше.
Еще одной особенностью настоящего изобретения является то, что оно относится к клетке-хозяину, содержащей вектор, описанный в этом документе выше.
Дополнительной особенностью настоящего изобретения является то, что оно относится к способу получения пептида, указанного в этом документе выше, включающему: (a) культивирование клетки-хозяина, указанной в этом документе выше, в пригодных условиях; и (b) выделение полученного пептида.
Еще одной особенностью настоящего изобретения является то, что оно относится к композиции, содержащей по меньшей мере один пептид, указанный в этом документе выше, присоединенный к любой молекуле, выбранной из группы, состоящей из одной или нескольких молекул нуклеиновых кислот, одного или нескольких пептидов или белков, одной или нескольких малых молекул и одной или нескольких наночастиц, при этом присоединение осуществляют посредством связывания, выбранного из группы, состоящей из ковалентного связывания и нековалентного связывания.
В конкретных примерах воплощения по меньшей мере один пептид в составе композиции присоединен к одному или нескольким другим пептидам. Предпочтительно, один или несколько других пептидов образуют, по меньшей мере частично, альфа-спиральную вторичную структуру. В некоторых вариантах воплощения один или несколько других пептидов являются про-апоптотическими пептидами.
Дополнительной особенностью настоящего изобретения является то, что оно относится к способу получения композиции, указанной в этом документе выше, включающему: (a) создание по меньшей мере одного пептида, указанного в этом документе выше; и (b) осуществление контакта этого по меньшей мере одного пептида с любой молекулой, выбранной из группы, состоящей из одной или нескольких молекул нуклеиновых кислот, одного или нескольких пептидов или белков, одной или нескольких малых молекул и одной или нескольких наночастиц, для того, чтобы обеспечить осуществление присоединения.
Еще одной особенностью настоящего изобретения является то, что оно относится к способу выявления способности к интернализации у пептида, указанного в этом документе выше, или у композиции, указанной в этом документе выше, включающему: (a) введение пептида или композиции в одну или несколько клеток; и (b) выявление интернализации пептида или композиции.
Дополнительной особенностью настоящего изобретения является то, что оно относится к фармацевтической композиции, содержащей по меньшей мере один пептид, указанный в этом документе выше, или композицию, указанную в этом документе выше, и, возможно, дополнительно содержащей одно или несколько фармацевтически приемлемых вспомогательных веществ и/или добавок.
Еще одной особенностью настоящего изобретения является то, что оно относится к применению пептида, указанного в этом документе выше, или композиции, указанной в этом документе выше, для трансформации или трансфекции одной или нескольких клеток.
Еще одной особенностью настоящего изобретения является то, что оно относится к пептиду, указанному в этом документе выше, или к композиции, указанной в этом документе выше, для применения с целью профилактики и/или лечения состояния, выбранного из группы, состоящей из онкологического заболевания, иммунных заболеваний, сердечно-сосудистых заболеваний, неврологических заболеваний, инфекций и воспалительных заболеваний.
Еще одной особенностью настоящего изобретения является то, что оно относится к способу профилактики и/или лечения состояния, выбранного из группы, состоящей из онкологического заболевания, иммунных заболеваний, сердечно-сосудистых заболеваний, неврологических заболеваний, инфекций и воспалительных заболеваний, включающему: введение субъекту по меньшей мере одного пептида, указанного в этом документе выше, или композиции, указанной в этом документе выше.
Дополнительной особенностью настоящего изобретения является то, что оно относится к составному набору, содержащему по меньшей мере одно из следующего: (a) пептид, указанный в этом документе выше; (b) молекулу нуклеиновой кислоты, указанную в этом документе выше; (c) вектор, указанный в этом документе выше; (d) клетку-хозяина, указанную в этом документе выше; и (e) композицию, указанную в этом документе выше.
Другие варианты воплощения настоящего изобретения будут очевидны из детального описания, приведенного далее.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГУРА 1. Биоинформационный способ выявления пептидов, проникающих в клетки человека.
Представлено схематическое изображение применяемой процедуры скрининга. Были отобраны все элементы базы данных SwissProt, относящиеся к белкам человека, вместе с их описанием и аннотацией из Генной онтологии (GO) (A), и проведен их анализ с применением скользящего окна размером 30 аминокислотных остатков (B). Для выявления предполагаемых пептидов, проникающих в клетки (CPP) применяли биоинформационные фильтры (C): во-первых, отбирали только пептиды, содержащие 10 или более положительных зарядов; во-вторых, отбирали только внеклеточные белки с низкой вероятностью проявления иммуногенности («этапы 2 и 3»). Для уменьшения количества пептидов выбрали несколько подходов: сочетание наибольшего значения изоэлектрической точки (ИЭТ) и наивысшей степени гидрофобности, сходство последовательности с последовательностью полученного из ВИЧ пептида TAT, а также тщательное изучение литературных источников и результатов BLAST-анализа.
ФИГУРА 2. Диаграмма, демонстрирующая гидрофобность и ИЭТ для 500 произвольно выбранных пептидов.
На диаграмме отобразили гидрофобность и ИЭТ для 500 пептидов, произвольно выбранных из совокупности, состоящей из 10,5×106 30-мерных пептидов, принадлежащих человеку. В качестве контролей добавили пептиды TAT, поли-Arg, REV, протамин и INF7 (незакрашенные квадраты). Нетоксические и неспособные к трансфекции пептиды указаны в виде закрашенных черным кругов, трансфецирующие токсические пептиды обозначены перечеркнутым незакрашенным кругом, токсические пептиды - незакрашенным кругом с вписанным крестом и нетоксические трансфецирующие пептиды - незакрашенным кругом.
ФИГУРА 3. Диаграмма, демонстрирующая токсичность и способность к трансфекции для всех проанализированных пептидов.
Все пептиды были проанализированы на способность осуществлять трансфекцию siРНК, и их токсичность была нанесена на диаграмму как среднее значение уровней GAPDH мРНК при концентрации 20 мкМ каждой из Aha1 siРНК и siPHK люциферазы (ось y, «Токсичность»), а также были указаны относительные различия показателей Aha1/GAPDH при трансфекции siPHK люциферазы и Aha1/GAPDH при трансфекции Aha1 siРНК в концентрации 20 мкМ каждой (ось x, «Трансфекция»). Пороговые значения для токсичности (среднее содержание GAPDH мРНК на уровне 70%) и трансфекции (>TAT, 18%) указаны красными пунктирными линиями. Пунктирные линии делят диаграмму на 4 квадранта: верхний левый - нетрансфецирующий нетоксические пептиды; верхний правый - трансфецирующие нетоксические пептиды; нижний левый - токсические пептиды; нижний правый - трансфецирующие токсические пептиды. На вставке показаны токсические пептиды, попавшие в диапазон, выходящий за рамки диаграммы.
ФИГУРА 4. Анализ пептида WNT16.
WNT16 представляет собой пример нетоксического, неспособного к трансфекции (т.е., нетрансфецирующего) пептида. Применяли тот же экспериментальный подход, что и в случае фиг.3. Для демонстрации дозо-зависимых эффектов значения содержания мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Жизнеспособность выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы (Luc) показаны в виде незакрашенных кружков.
ФИГУРА 5. Анализ пептидов BPIL3 и FALL.
BPIL3 представляет собой пример токсического, неспособного к трансфекции пептида. Применяли тот же экспериментальный подход, что и в случае фиг.3. (A). Обратите внимание, что уровни Aha1 и GAPDH демонстрируют схожее поведение, при этом GAPDH показывает более высокую чувствительность. Это служит объяснением повышения значений Aha1/GAPDH. Для демонстрации потенциального терапевтического окна для токсического пептида, обладающего способностью к трансфекции, которая маскируется его токсичностью, тот же анализ провели для пептида FALL (В). Для выявления дозо-зависимых эффектов значения уровней мРНК для обоих пептидов (A, B), полученные при концентрации 1 мкМ, приняли за 100%. Жизнеспособность для обоих пептидов (A, B) выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 6. Анализ пептида CU025.
CU025 представляет собой пример токсического, способного к трансфекции пептида. Применяли тот же экспериментальный подход, что и в случае фиг.3. Для демонстрации дозо-зависимых эффектов значения содержания мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Жизнеспособность выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 7. Анализ нетоксических, способных к трансфекции пептидов.
CPXM2, ASM3B и NRTN представляют собой примеры нетоксических, способных к трансфекции пептидов. Применяли тот же экспериментальный подход, что и в случае фиг.3. В качестве контроля определяли соотношения Aha1/GAPDH для пептидов TAT и поли-Arg (A). Как CPXM2 (B), так и ASM3B (C) демонстрируют зависящее от концентрации снижение уровня Aha1 мРНК относительно GAPDH мРНК, не влияя существенно на жизнеспособность клеток. Подробный анализ NRTN (D) выявил существенное снижение уровня Aha1 мРНК относительно уровня GAPDH мРНК без существенных дозо-зависимых эффектов на жизнеспособность клеток. (A, B, C, D) Во всех случаях для демонстрации дозо-зависимых эффектов значения уровней мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Жизнеспособность выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 8. Анализ сдвига электрофоретической подвижности выбранных пептидов в геле.
С целью демонстрации образования соответствующих комплексов пептидов TAT (A), NRTN (B) и WNT16 (D) инкубировали 500 мкг дуплексной siРНК с пептидом, взятым в указанном молярном соотношении, в течение одного часа и проводили анализ с применением электрофореза в агарозном геле и окрашивания бромидом этидия. Данный анализ демонстрирует образование комплексов между siРНК и пептидами TAT, NRTN и WNT16, соответственно. Для демонстрации влияния пептида NRTN на доступность siРНК для бромида этидия комплекс инкубировали в присутствии или в отсутствие протеиназы K (C).
ФИГУРА 9. Опосредованной пептидом NRTN трансфекции достаточно для воздействия на клеточный фенотип.
Специфичность пептида NRTN к последовательности siРНК исследовали с применением анализа способности пептида трансфецировать дуплекс siРНК, мишенью которой служит Eg5 мРНК человека. Индукцию апоптоза, вызванного нокдауном Eg5, определяли с помощью анализа цитотоксичности Cyto Tox-Glo (Promega Inc.) Для демонстрации дозо-зависимых эффектов значения содержания мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Индукция апоптоза выражена как процентная доля относительно контроля (среда без добавок). Данные для Aha1 siPHK обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 10. Выравнивание последовательностей GDNF и NRTN.
Выравнивание аминокислотных последовательностей GDNF крысы и NRTN человека продемонстрировало, что они являются родственными белками. Идентичные аминокислоты показаны светло-серым цветом на белом фоне, схожие аминокислоты - черным цветом на светло-сером фоне и различающиеся аминокислоты - черным цветом на белом фоне. В GDNF крысы обозначен отрезок, соответствующий альфа-спиральной структуре. Прямоугольной рамкой в составе NRTN выделен пептид, который применяли в экспериментах.
ФИГУРА 11. NTRN содержит альфа-спиральный структурный элемент.
Анализ пептидов FALL (A), NRTN (B) и TAT (C) с применением спектроскопии кругового дихроизма в УФ диапазоне. Спектры получали в диапазоне от 195 нм до 260 нм с шагом 0,1 нм и шириной полосы пропускания 1 нм, применяя раствор пептида 0,1 мг/мл в отсутствие («H2O») или в присутствии 10%, 25% и 50% трифторэтанола (TFE), соответственно.
ФИГУРА 12. NRTN, TAT и FALL действуют в качестве пептидов, проникающих в клетки.
Применение флуоресцентно-активированного клеточного сортинга (FACS) для анализа пептидов TAT (A), WNT16 (B), FALL (C) и NRTN (D), содержащих N-концевую FITC-метку. Клетки инкубировали в течение 3 ч в присутствии пептида, обрабатывали протеиназой К в течение 30 мин. и проводили анализ с применением FACS для выявления интернализированных пептидов в канале, соответствующем FITC. Черными линиями показаны сигналы при концентрации 1 мкМ, светло-серыми линиями показаны сигналы при концентрации 5 мкМ и темно-серыми линиями показаны сигналы при концентрации 10 мкМ.
ФИГУРА 13. NRTN демонстрирует активность в условиях присутствия сыворотки.
Провели анализ способности NRTN осуществлять трансфекцию дуплексов siРНК в отсутствие (A) и в присутствии (B) сыворотки в среде для трансфекции. Применяли тот же экспериментальный подход, что и в случае фиг.3. Анализ проводили либо в нормальной питательной среде RPMI 1640, содержащей 10% FCS (сыворотки плодов крупного рогатого скота) (B), либо с инкубацией в течение трех часов в среде OptiMEM для выращивания с пониженным содержанием сыворотки с последующей заменой среды на нормальную питательную среду (A). Для демонстрации дозо-зависимых эффектов значения содержания мРНК, полученные при концентрации 1 мкМ, были приняты за 100%. Данные для Aha1 siРНК обозначены в виде черных закрашенных квадратов; данные для siРНК люциферазы показаны в виде незакрашенных кружков.
ФИГУРА 14. Поглощение NRTN эндотелиальными клетками головного мозга человека.
Конъюгированные с флуоресцеинизотиоцианатом (FITC) пептиды NRTN (с N-концевой и C-концевой конъюгацией, соответственно) инкубировали с эндотелиальными клетками головного мозга hCMEC/D3 при концентрации 5 мкМ в течение 1 ч при 37°C. После этого клетки промывали и фиксировали. Изображения получали с применением флуоресцентной микроскопии. В обоих случаях пептид располагался во внутриклеточных эндосомальных структурах.
ФИГУРА 15. NRTN-опосредованное поглощение клетками про-апоптотического пептида Nur77.
Клетки рака груди человека MCF-7 инкубировали в течение 24 ч в присутствии различных концентраций пептидов NRTN (квадраты), Nur (кружки) и NurNRTN (треугольники). Соответствующие аминокислотные последовательности приведены в нижней части фигуры. Для оценки жизнеспособности клеток (и, таким образом, индукции апоптоза) применяли тот же экспериментальный подход, что и в случае фиг.3.
ФИГУРА 16. NRTN-опосредованное поглощение клетками про-апоптотического пептида 4E-BP1.
Клетки рака груди человека MCF-7 инкубировали в течение 24 ч в присутствии различных концентраций пептидов 4E-BP1 (кружки), TAT4E-BP1 (квадраты) и NRTN4E-BP1 (треугольники) (верхняя часть фигуры). Дополнительно проводили сравнение соответствующих эффектов двух химерных пептидов (сплошные линии) с их неактивными вариантами (TATinact4E-BP1 и NRTNinact4E-BP1; пунктирные линии), соответственно (средняя часть фигуры). Соответствующие аминокислотные последовательности приведены в нижней части фигуры. Для оценки жизнеспособности клеток (и, таким образом, индукции апоптоза) применяли тот же экспериментальный подход, что и в случае фиг.3.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В основе настоящего изобретения лежит неожиданно обнаруженный факт, что с помощью сочетания биоинформационного скрининга и последующей экспериментальной оценки кандидатных пептидов можно выявить несколько пептидов CPP, которые демонстрируют улучшенный функциональный профиль, по сравнению с предшествующим «золотым стандартом» - эталонным пептидом TAT, в частности, более высокую общую эффективность трансфекции, более высокую трансфекционную активность в присутствии сыворотки, а также более низкую степень цитотоксичности. Примечательно, что эти пептиды CPP не демонстрируют существенного сходства их первичных аминокислотных последовательностей. Таким образом, эти пептиды могут служить в качестве модулей при разработке новых эффективных агентов для доставки с целью применения при терапевтическом вмешательстве.
Настоящее изобретение, наглядное описание которого приведено далее, может применяться на практике в отсутствие любого элемента или элементов, ограничения или ограничений, не раскрытых специально в этом документе.
В случаях, когда в настоящем описании и формуле изобретения используется термин «содержащий», не исключается наличие других элементов или этапов. Для целей настоящего изобретения предполагается, что термин «состоящий из» является предпочтительным вариантом воплощения термина «содержащий». Если далее в этом документе указано, что группа содержит по меньшей мере определенное количество вариантов воплощения, это также следует понимать как раскрытие группы, которая предпочтительно состоит только из этих вариантов воплощения.
В случае если используется существительное в единственном числе, оно включает в себя и форму множественного числа этого существительного, если особо не указано иначе.
В случае указания в контексте настоящего изобретения числовых значений специалисту в данной области будет понятно, что техническое действие рассматриваемой особенности гарантированно находится в интервале, определяемом с определенной точностью, который в типичном случае включает отклонение от данного числового значения на ±10% и предпочтительно - на ±5%.
Дополнительно, термины «первый», «второй», «третий», «(a)», «(b)», «(c)» и т.п. в описании и в формуле изобретения используются для отделения друг от друга схожих элементов и не обязательно для описания последовательности или хронологического порядка. При этом понимается, что используемые таким образом термины являются взаимозаменяемыми при соответствующих условиях, и что варианты воплощения изобретения, описанные в этом документе, могут быть осуществлены в последовательности, отличной от описанной или проиллюстрированной в этом документе.
Дополнительные определения терминов будут даны далее, в контексте, в котором эти термины используются. Приведенные далее термины или определения представлены исключительно для облегчения понимания изобретения. Эти определения не следует толковать как имеющие меньший объем, чем объем, понимаемый специалистом в данной области.
Первой особенностью настоящего изобретения является то, что оно относится к пептидной молекуле, которая может быть интернализирована внутрь клетки, при этом пептидная молекула:
(a) имеет длину по меньшей мере 10, предпочтительно - по меньшей мере 15 аминокислотных остатков;
(b) содержит в своей первичной аминокислотной последовательности по меньшей мере 25%, предпочтительно - по меньшей мере 30% положительно заряженных аминокислотных остатков; и
(c) интернализируется внутрь клетки с эффективностью, составляющей по меньшей мере 80%, предпочтительно - по меньшей мере 90% от эффективности интернализации пептида TAT, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1).
Термин «пептидная молекула» (также называемая в этом документе «пептидом») при использовании в этом документе означает любые имеющие природное происхождение или синтетические (например, полученные с применением химического синтеза или технологии рекомбинантных ДНК) линейные макромолекулы, содержащие множество природных или модифицированных аминокислотных остатков, соединенных пептидными связями. Такие пептиды могут образовывать олигомеры, состоящие по меньшей мере из двух идентичных или различных пептидных молекул.
Пептиды по изобретению имеют длину по меньшей мере 10 аминокислотных остатков (например, 10, 11, 12, 13 или 14 аминокислотных остатков) и предпочтительно имеют длину по меньшей мере 15 аминокислотных остатков, по меньшей мере 20 аминокислотных остатков, по меньшей мере 25 аминокислотных остатков, по меньшей мере 30 аминокислотных остатков, по меньшей мере 35 аминокислотных остатков, по меньшей мере 40 аминокислотных остатков или по меньшей мере 45 аминокислотных остатков. В конкретных примерах воплощения пептиды по изобретению имеют длину 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 39, 40, 41, 42, 43, 44 или 45 аминокислотных остатков.
Термин «природные аминокислотные остатки» при использовании в этом документе обозначает любую из 22 «канонических» аминокислот, которые в природе встраиваются в пептиды. Из этих двадцати двух аминокислот двадцать непосредственно кодируются при помощи универсального генетического кода. Две оставшиеся, селеноцистеин и пирролизин, встраиваются в белки с помощью уникальных механизмов синтеза. В типичном случае аминокислотные остатки пептида по изобретению представлены в форме L-изомеров. В некоторых вариантах воплощения один или несколько аминокислотных остатков пептида по изобретению представлены в форме D-изомеров. Термин «модифицированный аминокислотный остаток» при использовании в этом документе обозначает неканонические аминокислоты, такие как посттрансляционно модифицированные аминокислоты. Примеры посттрансляционных модификаций включают, среди прочего, фосфорилирование, гликозилирование, ацилирование (например, ацетилирование, миристоилирование, пальмитоилирование), алкилирование, карбоксилирование, гидроксилирование, гликирование, биотинилирование, убиквитилирование, изменения химической природы (например, деимидирование, деамидирование по механизму β-элиминирования) и структурные изменения (например, образование дисульфидных мостиков).
Аминокислотные последовательности пептидов, указанные в этом документе, представлены, в соответствии с общепринятым правилом, от амино (M)-конца до карбокси (C)-конца. Однако соответствующие «обратные» пептиды также включены в объем настоящего изобретения. Термин «обратные пептиды» при использовании в этом документе обозначает пептиды, обладающие такой же последовательностью, что и их «нормальные» аналоги, но представленные в обратной ориентации, т.е., от C-конца к N-концу. Например, «нормальный» пептид TAT имеет аминокислотную последовательность GRKKRRQRRRPPQ. Соответствующий «обратный» пептид TAT имеет аминокислотную последовательность QPPRRRQRRKKRG.
Пептиды по настоящему изобретению содержат в своих соответствующих первичных аминокислотных последовательностях (т.е. по всей своей длине) по меньшей мере 25%, предпочтительно - по меньшей мере 30% положительно заряженных аминокислотных остатков. Термин «положительно заряженные аминокислоты» (в этом документе называемые также «основными аминокислотами») при использовании в этом документе обозначает совокупность остатков лизина (K), гистидина (H) и аргинина (R), присутствующих в конкретном пептиде. В конкретных примерах воплощения пептид по настоящему изобретению содержит в своей первичной аминокислотной последовательности 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34% или 35% положительно заряженных аминокислотных остатков. В других вариантах воплощения пептиды по изобретению содержат в своих соответствующих первичных аминокислотных последовательностях по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55% или по меньшей мере 60% положительно заряженных аминокислотных остатков.
Термин «может быть интернализирован внутрь клетки» при использовании в этом документе означает способность пептидов проходить сквозь клеточные мембраны (включая, среди прочего, наружную «ограничивающую» клеточную мембрану (также обычно называемую «плазматической мембраной»), эндосомальные мембраны и мембраны эндоплазматического ретикулума) и/или управлять прохождением данного агента или нагрузки сквозь эти клеточные мембраны. Такое прохождение сквозь клеточные мембраны называется в этом документе «проникновением в клетку». Соответственно, пептиды, обладающие указанной способностью проходить сквозь клеточные мембраны, называются в этом документе «пептидами, проникающими в клетки». В контексте настоящего изобретения подразумевается любой возможный механизм интернализации, включая как механизмы энергозависимого (т.е., активного) транспорта (например, эндоцтоз), так и механизм энергонезависимого (т.е., пассивного) транспорта (например, диффузию). При использовании в этом документе термин «интернализация» следует понимать как включающий локализацию по меньшей мере части пептидов, которые прошли сквозь плазматическую клеточную мембрану, в цитоплазме (в противоположность локализации в других клеточных компартментах, таких как везикулы, эндосомы или ядро). В конкретных примерах воплощения данный задействованный механизм транспорта обеспечивает, чтобы по меньшей мере 0,01%, по меньшей мере 0,05%, по меньшей мере 0,1%, по меньшей мере 0,5%, по меньшей мере 1%, по меньшей мере 2%, по меньшей мере 5% или по меньшей мере 10% интернализированных пептидов или композиций были локализированы в цитоплазме.
Пептиды по настоящему изобретению интернализируются внутрь клетки с эффективностью, составляющей по меньшей мере 80%, предпочтительно - по меньшей мере 90% от эффективности интернализации пептида ТАТ, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1; см. также публикацию: Vives; E. et al. (1997), см. выше). Иначе говоря, характеристика функциональной активности пептидов дается в сравнении с эталонным пептидом (пептид TAT представляет собой «золотой стандарт» для пептидов, проникающих в клетки). В конкретных примерах воплощения пептиды по изобретению интернализируются с эффективностью, составляющей 80%, 85%, 90% или 95% от эффективности интернализации пептида TAT. В конкретных предпочтительных примерах воплощения пептиды по изобретению интернализируются по меньшей мере с такой же эффективностью (т.е., 100%), что и пептид TAT. В частности, предпочтительно, пептиды по изобретению интернализируются с более высокой эффективностью (т.е., более чем 100% или по меньшей мере 101%), чем пептид TAT, например, с эффективностью, составляющей 105%, 110%, 115%, 120%, 125%, 130%, 140%, 150%, 160%, 170%, 180%, 190% или 200% от эффективности интернализации пептида TAT.
Термин «эффективность интернализации» при использовании в этом документе следует понимать в широком смысле. Этот термин относится не только к степени, в которой пептид по изобретению проходит сквозь плазматическую мембрану клеток (т.е., к свойствам собственно интернализации), но также к эффективности, с которой пептид управляет прохождением данного агента или нагрузки сквозь клеточную плазматическую мембрану (т.е., к его способности осуществлять трансфекцию; в этом документе ее также называют «эффективностью трансфекции»). В данной области разработан ряд способов определения свойств интернализации и/или способности к трансфекции данного пептида, например, путем присоединения детектируемой метки (такой как флуоресцентный краситель) к пептиду (и/или к нагрузке, которая будет трансфецироваться) или с помощью соединения пептида с репортерной молекулой, что позволяет проводить детекцию после того, как происходит поглощение пептида клетками, например, с применением анализа FACS или с помощью специфических антител (см., например Ausubel, F.M. et al. (2001) Current Protocols in Molecular Biology, Wiley & Sons, Hoboken, NJ, USA). Специалисту в данной области также хорошо известно, как выбрать соответствующие диапазоны концентраций пептида и, если применимо, нагрузки, которые будут применяться в таких способах; этот выбор может зависеть от природы пептида, размера нагрузки, типа применяемых клеток и т.п.
В дополнительных вариантах воплощения пептиды по настоящему изобретению не проявляют существенного цитотоксического и/или иммуногенного действия в отношении своих соответствующих клеток-мишеней после интернализации, то есть, они не оказывают мешающего воздействия на жизнеспособность клеток (по меньшей мере в концентрациях, которые достаточны для опосредования клеточной трансфекции и/или проникновения). Термин «несущественный» при использовании в этом документе следует понимать в том смысле, что менее чем 50%, предпочтительно - менее чем 40% или 30% и, в частности, менее чем 20% или 10% клеток-мишеней погибают после интернализации пептида по изобретению. В других вариантах воплощения цитотоксическое (и/или иммуногенное) действие, оказываемое пептидами после интернализации в клетку, такое же или менее выражено, чем соответствующее действие, оказываемое пептидом TAT, имеющим аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1). В конкретных примерах воплощения цитотоксическое (и/или иммуногенное) действие, оказываемое пептидами после интернализации в клетку, такое же или составляет менее чем 95%, менее чем 90%, менее чем 85%, менее чем 80%, менее чем 75%, менее чем 70%, менее чем 60%, менее чем 50%, менее чем 40%, менее чем 30%, менее чем 20% или менее чем 10% от действия, оказываемого пептидом ТАТ. Специалисту в данной области хорошо известны способы определения цитотоксичности данного соединения и/или жизнеспособности данной клетки-мишени, к которой применяется соединение (см., например Ausubel, F.M. et al. (2001), см. выше). Соответствующие аналитические наборы доступны для приобретения у различных поставщиков.
В конкретных примерах воплощения потенциальное цитотоксическое и/или иммуногенное действие, присущее пептиду по изобретению, может «маскироваться» с помощью внесения в пептид одной или нескольких модификаций, например, посредством химического синтеза или технологии рекомбинантных ДНК. Такие модификации могут быть связаны, например, с добавлением, удалением или заменой функциональных групп или с изменением положений таких функциональных групп. Специалисту в данной области хорошо известно, каким образом такое «маскирование» может быть достигнуто в случае данного пептида.
В дополнительных вариантах воплощения пептидные молекулы по изобретению содержат по меньшей мере один структурированный домен, т.е., элемент, который образует (т.е., укладывается определенным образом) стабильную вторичную структуру, а именно, определенное пространственное расположение аминокислотных остатков, которые локализованы рядом друг с другом в линейной последовательности. Часто стерические взаимодействия между аминокислотными остатками носят регулярный характер, что приводит к образованию периодических структур, хорошо известных специалистам в данной области, таких как α-спирали (похожая на стержень плотно свернутая спиральная структура) и β-структуры (вытянутый участок, при этом множество таких участков, возможно, образуют параллельные или антипараллельные β-складчатые листы). В рамках настоящего изобретения пептидная молекула может содержать один такой структурированный домен, окруженный неструктурированными областями, или может содержать два или несколько таких структурированных доменов (одного типа или различных типов, например, две α-спирали или одну α-спираль и одну β-структуру), отделенные друг от друга. В некоторых вариантах воплощения пептидная молекула образует вторичную структуру по всей своей длине (т.е., не содержит неструктурированных областей).
В предпочтительных примерах воплощения по меньшей мере часть пептидной молекулы, описанной в этом документе, образует альфа-спиральную вторичную структуру. α-Спиральный элемент может содержать по меньшей мере 4 или 6 аминокислотных остатков и, предпочтительно, по меньшей мере 8 или 10 аминокислотных остатков. В конкретных примерах воплощения пептидная молекула по изобретению содержит одиночный α-спиральный элемент в качестве единственной вторичной структуры.
В предпочтительных воплощениях пептидные молекулы по настоящему изобретению происходят от молекул млекопитающих, т.е., они происходят из таких организмов, как мышь, крыса, хомяк, кролик, кошка, собака, свинья, корова, лошадь или обезьяна. В частности, предпочтительно, пептидные молекулы происходят от молекул человека, т.е., они являются производными от последовательностей человека или представляют собой последовательности человека. Термин «является производным от последовательностей человека» при использовании в этом документе обозначает последовательности, происходящие от молекул человека, несущие незначительные модификации (например, одну или несколько аминокислотных замен) по сравнению с последовательностями человека природного происхождения. Термин «представляет собой последовательность человека» при использовании в этом документе обозначает последовательность, идентичную последовательности человека природного происхождения (т.е., не содержащую вариантов или модификаций последовательности).
В дополнительных предпочтительных вариантах воплощения пептидная молекула по изобретению имеет аминокислотную последовательность, выбранную из группы, состоящей из:
 (пептид NRTN; SEQ ID NO: 2);
(пептид NRTN; SEQ ID NO: 2);
 (пептид СРХМ2; SEQ ID NO: 3);
(пептид СРХМ2; SEQ ID NO: 3);
 (пептид ASM3B; SEQ ID NO: 4);
(пептид ASM3B; SEQ ID NO: 4);
 (пептид FGF 12; SEQ ID NO: 5);
(пептид FGF 12; SEQ ID NO: 5);
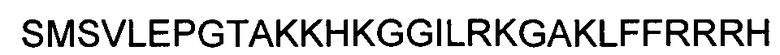 (пептид CU025; SEQ ID NO: 6);
(пептид CU025; SEQ ID NO: 6);
 (пептид IGS10; SEQ ID NO: 7);
(пептид IGS10; SEQ ID NO: 7);
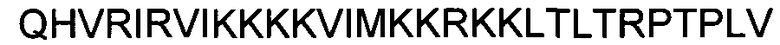 (пептид СРХМ; SEQ ID NO: 8);
(пептид СРХМ; SEQ ID NO: 8);
 (пептид CD026; SEQ ID NO: 9);
(пептид CD026; SEQ ID NO: 9);
 (пептид FALL39, вар.1 (также называемый пептидом FALL; SEQ ID NO: 10);
(пептид FALL39, вар.1 (также называемый пептидом FALL; SEQ ID NO: 10);
И при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 10.
В конкретных предпочтительных вариантах воплощения пептид имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4; и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 4.
Термин «процент (%) идентичности последовательности» при использовании в этом документе описывает количество совпадений идентичных аминокислот в двух или нескольких выровненных аминокислотных последовательностях по сравнению с количеством аминокислотных остатков, составляющих полную длину аминокислотных последовательностей, служащих образцом для сравнения. Иначе говоря, при применении выравнивания двух или нескольких последовательностей или под-последовательностей (т.е., полученных из них фрагментов или укороченных вариантов) можно определить процентную долю аминокислотных остатков, которые являются одинаковыми, когда (под-)последовательности сравнивают и выравнивают до достижения максимальной степени соответствия на протяжении окна сравнения или на протяжении заданной области согласно оценке с применением известного специалистам в данной области алгоритма сравнения последовательностей, или при выравнивании вручную и визуальной оценке. Следовательно, приведенное выше определение применимо не только к полноразмерным последовательностям с SEQ ID NO: 2 по SEQ ID NO: 10, но также к любому укороченному варианту аминокислотных последовательностей длиной по меньшей мере 10, предпочтительно - по меньшей мере 15 остатков, содержащихся в любой последовательности с SEQ ID NO: 2 по SEQ ID NO: 10.
Для оценки уровня идентичности между двумя белковыми последовательностями их можно выравнивать в электронном виде, применяя пригодные компьютерные программы, известные специалистам в данной области. Такие программы включают, среди прочего, BLAST (Altschul, S.F. et al. (1990) J. Mol. Biol. 215, 403-410), FASTA (Lipman, D.J. and Pearson, W.R. (1985) Science 227, 1435-1441) или программы, применяющие алгоритм Смита-Уотермана (Smith, T.F. and Waterman, M.S. (1981) J. Mol. Biol. 147, 195-197). Эти программы, помимо обеспечения попарного выравнивания последовательностей, также определяют уровень идентичности последовательностей (обычно в виде процента идентичности) и вероятность того, что выравнивание было случайным явлением (значение фактора p). В случае аминокислотных последовательностей программа BLASTP применяет в качестве настроек по умолчанию длину слова (W), равную 3, и ожидание (E), равное 10. В матрице замен BLOSUM62 (Henikoff, S. and Henikoff, J.G. (1992) Proc. Natl. Acad. Sci. USA 89, 10915-10919) применяется значение выравнивания (В), равное 50, ожидание (E), равное 10, M=5, N=4 и сравнение обеих нитей. Такие компьютерные программы, как CLUSTALW (Higgins, D. et al. (1994) Nucl. Acids Res. 2, 4673-4680) можно применять для выравнивания более чем двух последовательностей. Кроме того, программа CLUSTALW при вычислении степени идентичности учитывает пропуски в последовательностях.
Если аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 10, она является вариантом воплощения настоящего изобретения. Тип присутствующих аминокислотных изменений (например, добавление на концах, вставка, делеция и замена одного или нескольких аминокислотных остатков или сочетание этих изменений) не имеет значения. В конкретных примерах воплощения «производные аминокислотных последовательностей» обладают по меньшей мере 70%, по меньшей мере 72%, по меньшей мере 74%, по меньшей мере 76% или по меньшей мере 78% общей идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 10. Предпочтительно, «производные аминокислотных последовательностей» обладают по меньшей мере 80%, по меньшей мере 82%, по меньшей мере 84%, по меньшей мере 86%, по меньшей мере 88%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% общей идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 10.
Второй особенностью настоящего изобретения является то, что оно относится к молекуле нуклеиновой кислоты, кодирующей пептидную молекулу, указанную в этом документе выше.
Термин «молекула нуклеиновой кислоты» при использовании в этом документе обозначает любую нуклеиновую кислоту, кодирующую пептид по изобретению. Примеры таких молекул нуклеиновой кислоты включают нуклеиновые кислоты природного происхождения, такие как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК), а также искусственно созданные нуклеиновые кислоты, которые были синтезированы химически или получены с применением технологии рекомбинантных генов, включая, например, аналоги нуклеиновых кислот, такие как, среди прочего, пептидо-нуклеиновые кислоты (PNA) или «запертые» нуклеиновые кислоты (LNA) (см., например, Sambrook, J., and Russel, D.W. (2001), Molecular cloning: A laboratory manual (3rd Ed.) Cold Spring Harbor, NY, Cold Spring Harbor Laboratory Press). Конкретные примеры нуклеиновых кислот природного происхождения включают последовательности ДНК, такие как геномная ДНК или молекулы кДНК, а также последовательности РНК, такие как молекулы гяРНК, мРНК или рРНК, или обратно-комплементарные последовательности нуклеиновых кислот. Такие нуклеиновые кислоты могут иметь любую длину и могут являться как одноцепочечными, так и двуцепочечными молекулами. В типичном случае целевые нуклеиновые кислоты по изобретению имеют длину от 30 до 5000 нуклеотидов, например, от 30 до 3000 нуклеотидов, от 45 до 2000 нуклеотидов, от 60 до 1000 нуклеотидов или от 75 до 500 нуклеотидов. При использовании в этом документе термин «нуклеотид» следует понимать как относящийся как к рибонуклеотидам, так и к дезоксирибонуклеотидам (т.е., к молекулам РНК и ДНК).
Предпочтительно, молекула нуклеиновой кислоты по настоящему изобретению представляет собой составную часть генетической конструкции (также часто обозначаемой как «экспрессионная кассета»), которая обеспечивает ее экспрессию. Генетическую конструкцию называют «способной экспрессировать молекулу нуклеиновой кислоты» или способной «обеспечивать экспрессию последовательности нуклеиновой кислоты (т.е., нуклеотидной последовательности)», если она содержит элементы последовательности, которые включают информацию, касающуюся регуляции транскрипции и/или трансляции, и если такие последовательности «функционально присоединены» к нуклеотидной последовательности, кодирующей пептид. Функциональное присоединение - это присоединение, при котором регуляторные элементы последовательности и последовательность, которую будут экспрессировать (и/или последовательности, которые будут экспрессировать совместно друг с другом), соединены таким способом, при котором возможна экспрессия гена.
Конкретная природа регуляторных областей, необходимых для экспрессии гена, может варьировать в зависимости от биологического вида, но в общем случае эти области содержат промотор, который у прокариот включает как собственно промотор, т.е., элементы ДНК, управляющие инициацией транскрипции, так и элементы ДНК, которые после транскрипции в РНК будут служить сигналом инициации трансляции. Такие промоторные области обычно включают 5'-некодирующие последовательности, участвующие в инициации транскрипции и трансляции, такие как -35/-10-боксы и элемент Шайна-Далгарно у прокариот или ТАТА-бокс, последовательности CAAT и 5'-кэпирующие элементы у эукариот. Эти области также могут включать энхансерные или репрессорные элементы, а также транслируемые сигналы и лидерные последовательности для нацеливания нативного полипептида на специфический компартмент клетки-хозяина. Пригодные прокариотические промоторы включают, среди прочего, промоторы lacUV5, trp, tet и tac из E. coli и промотор фага T7. Пригодные эукариотические промоторы включают, среди прочего, ранний и поздний промоторы SV40, промоторы RSV и CMV и промоторы дрожжей A0X1 и GAL1. Кроме того, 3'-некодирующие последовательности могут содержать регуляторные элементы, участвующие в терминации транскрипции, полиаденилировании или т.п. Однако, если эти последовательности терминации не обеспечивают удовлетворительное функционирование в клетке-хозяине, то они могут быть заменены на сигнальные последовательности, функционально активные в этой клетке. Специалисту хорошо известны все эти регуляторные элементы, и он способен выбрать такие элементы, пригодные для экспрессии молекулы нуклеиновой кислоты в заданных условиях.
Молекулы нуклеиновой кислоты по изобретению, возможно, являясь частью экспрессионной кассеты, также могут находиться в составе вектора или другого носителя для клонирования. Соответственно, дополнительной особенностью настоящего изобретения является то, что оно относится к вектору, содержащему молекулу нуклеиновой кислоты по настоящему изобретению.
Вектор по изобретению может являться, например, плазмидой, космидой, фагмидой, вирусом, бактериофагом, искусственной хромосомой или другим носителем, обычно применяемым в генетической инженерии. Предпочтительно, вектор представляет собой экспрессионный вектор, который способен обеспечивать экспрессию молекулы нуклеиновой кислоты по изобретению. Такой экспрессионный вектор может включать, помимо регуляторных последовательностей, описанных выше, и последовательности нуклеиновой кислоты, которая будет экспрессироваться, по меньшей мере один ориджин репликации, а также регуляторные последовательности, происходящие из биологического вида, схожего с организмом-хозяином, чьи клетки применяют для экспрессии, а также один или несколько селектируемых маркеров, обеспечивающих селектируемый фенотип трансфецированным клеткам. Специально сконструированные векторы (т.е., челночные векторы), содержащие более одного ориджина репликации, позволяют осуществлять перенос между разными хозяевами, например, между бактериальными клетками и клетками грибов или между бактериальными клетками и клетками животных. Пригодные ориджины репликации для прокариотических клеток включают, например, ColE1 и M13. Примером ориджина репликации в векторах для клеток млекопитающих является SV40. Пригодные прокариотические селектируемые маркеры включают, среди прочего, гены устойчивости к канамицину, ампициллину и тетрациклину. В случае эукариотических клеток примерами селектируемых маркеров, которые можно применять, являются ген дигидрофолатредуктазы и ген глутаминсинтетазы. Способы, которые можно применять для конструирования и/или модификации рекомбинантных векторов, хорошо известны специалистам в данной области (см., например, Sambrook, J., and Russel, D.W. (2001), см. выше).
Большое количество пригодных векторов доступны для приобретения и хорошо известны специалистам в данной области, которые также способны определить, какие векторы пригодны для экспрессии представляющей интерес молекулы нуклеиновой кислоты в заданных условиях. Примеры таких векторов включают, среди прочего, прокариотические векторы, такие как векторы серии pUC, pBluescript, векторы серии pET, pCRTOPO, лямбда-gt11, векторы серии pBBR1-MCS и pBC2, а также векторы, совместимые с экспрессией в клетках млекопитающих, такие как pCEP4, pXT1, pSG5, pRSVneo, pSV2-dhfr, pcDNA3 pSIR и pIRES-EGFP. Примеры плазмидных векторов, пригодных для экспрессии генов в Pichia pastoris, включают, среди прочего, pAO815, pPIC9K и pPIC3.5K.
В соответствии с другим вариантом, молекула нуклеиновой кислоты по настоящему изобретению, описанная в этом документе, также может быть вставлена в векторы таким образом, что происходит соединение с еще одной молекулой нуклеиновой кислоты, и при трансляции образуется химерный продукт. Другая молекула нуклеиновой кислоты может, например, кодировать пептид или белок, который повышает растворимость и/или облегчает очистку пептида по изобретению. Примеры таких векторов включают pET32, pET41 и pET43.
Еще одной особенностью настоящего изобретения является то, что оно относится к клетке-хозяину, содержащей вектор, описанный в этом документе выше.
Внедрение вектора в виде нуклеиновой кислоты в клетку-хозяина может быть осуществлено с применением различных способов трансформации, трансдукции или трансфекции, которые хорошо известны специалистам в данной области (см., например, Sambrook, J., and Russel, D.W. (2001), см. выше).
В рамках настоящего изобретения внедренный вектор может размножаться и сохраняться в клетке-хозяине в виде независимой генетической единицы или же он может стабильно интегрироваться в геном клетки-хозяина посредством генетической рекомбинации. Подобная рекомбинация может происходить либо в случайных положениях в составе генома по механизму негомологичной рекомбинации, либо в специфических положениях в составе генома по механизму гомологичной рекомбинации или с участием сайт-специфичных интеграз.
Клетка-хозяин по настоящему изобретению может являться прокариотической или эукариотической клеткой, при этом предпочтительной является эукариотическая клетка. Пригодные прокариотические клетки-хозяева включают, среди прочего, штаммы Escherichia coli (E. coli) (например, BL21, DH5α, XL-1-Blue, JM105, JM110 и Rosetta®), Bacillus subtilis, Salmonella spec., и Agrobacterium tumefaciens. Пригодные эукариотические клетки-хозяева включают, среди прочего, дрожжи (например, Pichia pastoris и Saccharomyces cerevisiae), клетки насекомых (например, клетки S2 Drosophila melanogaaster и клетки Sf9 Spodoptera frugiperda) и клетки растений. Предпочтительно, применяемые в данном изобретении эукариотические клетки-хозяева являются клетками млекопитающих, в частности, клетками человека.
Пригодные клетки млекопитающих включают, среди прочего, иммортализированные клеточные линии, такие как клетки человека Hela, HEK293, H9, MCF7 и Jurkat, клетки мыши NIH3T3, C127 и L, клетки обезьян COS1 и COS7, клетки перепела QC1-3 и клетки яичника китайского хомячка (CHO). Все эти клетки-хозяева могут быть получены из депозитариев, таких как Американская коллекция типовых культур (Манассас, Вирджиния, США) или Немецкая коллекция микроорганизмов и клеточных культур (Брауншвейг, Германия), а также от различных коммерческих поставщиков. Также в объем настоящего изобретения входят первичные культуры клеток млекопитающих, т.е., культуры клеток, полученных непосредственно из организма (на любой стадии развития, включая, среди прочего, стадию бластоцисты, эмбриональную, личиночную стадии и взрослые организмы). Примеры пригодных первичных клеточных культур включают культуры кардиомиоцитов, гепатоцитов, фибробластов, нейронов, а также стволовых клеток. В объем настоящего изобретения также входят иммортализированные стабильные клеточные линии, полученные из первичных клеточных линий.
В некоторых вариантах воплощения клетка-хозяин по настоящему изобретению является частью многоклеточного организма. Иными словами, изобретение также относится к трансгенным организмам, содержащим по меньшей мере одну клетку-хозяина, описанную в этом документе. Предпочтительно, трансгенный организм является млекопитающим, например, мышью, крысой, хомяком, кроликом, кошкой, собакой, свиньей, коровой, лошадью, обезьяной или человеком.
Дополнительной особенностью настоящего изобретения является то, что оно относится к способу получения пептида, описанного в этом документе выше, включающему:
(a) культивирование клетки-хозяина по изобретению в пригодных условиях; и
(b) выделение полученного пептида.
Доступно большое количество пригодных способов получения пептидов в соответствующих клетках-хозяевах. В случае одиночных клеток, например, прокариотических клеток или клеточных линий млекопитающих, специалист в данной области может применять различные условия культивирования. В одном варианте выработанный пептид собирают из культуральной среды, лизатов или экстрактов культивируемых клеток или из выделенных (биологических) мембран с применением общепринятых способов (см., например, Sambrook, J., and Russel, D.W. (2001), см. выше). В случае если клетка-хозяин является частью многоклеточного организма, фракция этих клеток может служить источником для выделения пептида по изобретению.
Подходящие культуральные среды и условия культивирования для описанных выше клеток-хозяев хорошо известны специалистам в данной области. Например, пригодные условия для культивирования бактерий включают их выращивание в условиях аэрации в среде Луриа-Бертани (LB). С целью повышения выхода и растворимости продукта экспрессии среду можно буферизировать или внести в нее пригодные добавки, известные специалистам в данной области (такие как шапероны, тРНК для редких кодонов, простетические группы, ко-факторы, ионы металлов и т.п.) В типичном случае E. coli можно культивировать при температуре от 4°C до 37°C, при этом конкретное значение температуры или последовательность смены температуры зависит от молекулы, которую будут экспрессировать. В общем случае специалисту в данной области также понятно, что эти условия, возможно, необходимо будет адаптировать к потребностям клетки-хозяина и требованиям, обусловленным экспрессируемым пептидом или белком. В случае, если для регуляции представляющей интерес экспрессии молекулы нуклеиновой кислоты в клетке-хозяине применяют индуцибельную систему экспрессии (например, индуцируемую тетрациклином систему Tet-On/Tet-Off или систему, индуцируемую экдизоном), экспрессию можно индуцировать добавлением соответствующего индуцирующего агента.
В зависимости от конкретного применяемого типа клеток и их специфических требований к условиям роста, культуру клеток млекопитающих можно культивировать, например, в среде RPMI 1640 или DMEM (среде Игла в модификации Дульбекко) с добавлением 10% (об./об.) FCS (сыворотки плодов крупного рогатого скота), 2 мМ L-глутамина и 100 ед./мл пенициллина/стрептомицина. В соответствии с другим вариантом, можно применять питательную среду с пониженной концентрацией сыворотки, такую как OptiMEM. Клетки можно инкубировать при 37°C в водонасыщенной атмосфере с 5% CO2.
Пригодные среды для культуры клеток насекомых включают, среди прочего, среду TNM с добавлением 10% FCS или среду SF900. Клетки насекомых обычно выращивают при 27°C в виде адгезионных или суспензионных культур.
Пригодные протоколы экспрессии как для прокариотических, так и для эукариотических клеток хорошо известны специалистам в данной области (см., например, Sambrook, J., and Russel, D.W. (2001), см. выше). Соответствующие аналитические системы, наборы и реактивы доступны для приобретения у различных поставщиков.
В соответствии с другим способом получения пептидных молекул по изобретению применяют трансляцию мРНК in vitro. Пригодные бесклеточные системы трансляции in vitro включают, среди прочего, лизат ретикулоцитов кролика, экстракт зародышей пшеницы, микросомальные мембраны клеток поджелудочной железы собаки, экстракт S30 из E. coli, а также объединенные системы для транскрипции и трансляции. Соответствующие аналитические системы доступны для приобретения у различных поставщиков.
Способы выделения полученного пептида хорошо известны специалистам в данной области и включают, среди прочего, ионообменную хроматографию, аффинную хроматографию, гель-фильтрацию (эксклюзионную хроматографию), высокоэффективную жидкостную хроматографию (ВЭЖХ), обратнофазовую ВЭЖХ, диск-электрофорез в гелях и иммунопреципитацию (см., например, Sambrook, J., and Russel, D.W. (2001), см. выше).
Еще одной особенностью настоящего изобретения является то, что оно относится к композиции (также называемой в этом документе «комплексом»), содержащей по меньшей мере один пептид, указанный в этом документе выше, присоединенный по меньшей мере к одному другому фрагменту (также называемому в этом документе «носителем»), при этом по меньшей мере один другой фрагмент предпочтительно является фрагментом, выбранным из группы, состоящей из одной или нескольких молекул нуклеиновых кислот, одного или нескольких пептидов или белков, одной или нескольких малых молекул и одной или нескольких наночастиц, при этом присоединение осуществляют посредством связывания, выбранного из группы, состоящей из ковалентного связывания и нековалентного связывания.
Термин «присоединение» при использовании в этом документе следует понимать в самом широком смысле, т.е., он относится к любому типу молекулярного взаимодействия между двумя или несколькими соединениями. Термин «ковалентное связывание» относится к внутримолекулярной форме образования химической связи, характеризующейся обобществлением одной или нескольких пар электронов между двумя компонентами, в результате чего возникает взаимное притяжение, удерживающее образованную в результате молекулу как единое целое. Термин «нековалентное связывание» относится к различным взаимодействиям, не являющимися ковалентными по своей природе, между молекулами или частями молекул, которые обеспечивают удерживание молекул или частей молекул друг с другом, обычно в специфической ориентации или конформации. Такие нековалентные взаимодействия включают, среди прочего, ионные связи, гидрофобные взаимодействия, водородные связи, ван-дер-ваальсовы взаимодействия, и диполь-дипольные связи. В случае ковалентного связывания пептид по изобретению может быть соединен по меньшей мере с одним другим фрагментом напрямую или через линкерную молекулу, которая служит для физического разделения пептида по изобретению и по меньшей мере одного другого фрагмента и тем самым обеспечивает, отсутствие ограничений функционирования обоих компонентов из-за их близкого расположения друг к другу. В зависимости от по меньшей мере одного другого фрагмента линкер может являться, например, пептидной связью, аминокислотой, пептидом соответствующей длины или другой молекулой, обеспечивающей требуемые свойства. В конкретных примерах воплощения линкер является остатком лизина или аргинина, ε-аминогруппы которых пригодны для присоединения пептидов, таких как описаны в этом документе, к различным другим фрагментам. Специалисту в данной области известно, как сконструировать подходящие линкерные молекулы, в частности, линкерные пептиды, исходя из общеизвестных знаний. Например, пептидные линкеры можно выбрать из базы данных LIP (Loops in Proteins («Петли в белках»)) (Michalsky, E. et al. (2003) Prot. Eng. 56, 979-985). Такой линкер может быть присоединен к N- или C-концу или, если это считается предпочтительным, также к не терминальному аминокислотному остатку пептида по настоящему изобретению.
В предпочтительных воплощениях по меньшей мере один пептид, такой как описан в этом документе выше, присоединен к по меньшей мере одному другому фрагменту посредством нековалентного взаимодействия, например, посредством (обратимого) образования комплекса.
В других предпочтительных вариантах воплощения по меньшей мере один пептид, такой как описан в этом документе выше, присоединен к по меньшей мере одному другому фрагменту посредством ковалентного взаимодействия, например, в форме химерной молекулы. Термин «химерная молекула» при использовании в этом документе обозначает по меньшей мере двухчастную молекулу, содержащую пептид по изобретению, соединенный по меньшей мере с одним другим фрагментом с образованием единой молекулы. Пептид и по меньшей мере один другой фрагмент могут быть разделены линкером, как описано выше, или могут быть соединены напрямую. По меньшей мере один другой фрагмент может быть присоединен к пептиду по изобретению на N-конце, C-конце или к любой аминокислоте, отличной от концевых аминокислот, при этом предпочтительным является присоединение к N-концу. К фрагменту, уже содержащемуся в составе химерной молекулы, могут быть присоединены дополнительные фрагменты. Специалисту известны способы анализа для определения оптимального порядка и/или сочетания фрагментов в химерной молекуле по изобретению. В типичном случае, если химерная молекула содержит пептид по изобретению и по меньшей мере один другой пептид, такие химерные молекулы не включены в этот термин, если соединение приводит к образованию пептидов природного происхождения. Такую химерную молекулу можно получить и выделить согласно способам, описанным выше для получения пептидов по изобретению.
Композиция по изобретению может содержать один или несколько пептидов, таких как описанные в этом документе. В случае множества из по меньшей мере двух пептидов, они могут быть одного типа или различных типов. И наоборот, если по меньшей мере один пептид по изобретению присоединен к двум или нескольким фрагментам, эти фрагменты могут быть одного типа или разных типов (например, две молекулы нуклеиновой кислоты или одна молекула нуклеиновой кислоты и одна пептидная молекула). В конкретных примерах воплощения одиночный пептид по изобретению присоединен к множеству из двух или нескольких других фрагментов. В других вариантах воплощения множество из двух или нескольких пептидов по изобретению присоединено к единичному другому фрагменту.
В предпочтительных воплощениях по меньшей мере один другой фрагмент выбран из группы, состоящей из одной или нескольких молекул нуклеиновых кислот, одного или нескольких пептидов или белков, одной или нескольких малых молекул и одной или нескольких наночастиц.
Композиция по настоящему изобретению также может содержать дополнительные компоненты, например, агенты для стабилизации соединения между одним или несколькими пептидами, описанными в этом документе, и по меньшей мере одним другим фрагментом (например, хелатирующие агенты); агенты для защиты композиции (например, от клеточных нуклеаз); или агенты для компенсации суммарного заряда композиции с целью облегчения поглощения клетками.
Термин «малые молекулы» при использовании в этом документе следует понимать в самом широком смысле, и он включает не только низкомолекулярные органические соединения, но также метки и репортерные молекулы (см. ниже), гаптены (т.е., малые молекулы, которые способны вызывать иммунный ответ только при их присоединении к более крупному носителю), такие как гидралазин, урушиол, флуоресцеин, биотин и дигоксигенин, и аптамеры.
Термин «наночастицы» при использовании в этом документе обозначает микроскопические частицы, размер которых по меньшей мере в одном измерении составляет менее 100 нм. В типичном случае наночастицы имеют диаметр в диапазоне от 50 нм до 500 нм (т.е., от 0,05 мкм до 0,5 мкм), сохраняют стабильную структуру в физиологических условиях и способны удерживать внутри более мелкие молекулы, такие как лекарственные вещества или другие биоактивные агенты, которые затем могут доставляться в требуемую область. Многие наночастицы (или наноносители) являются температурочувствительными и/или чувствительными к значению pH, т.е., они высвобождают свою нагрузку при нагревании и/или изменении значения pH. Такие наноносители защищают находящиеся внутри них соединения от деградации и пищеварительных соков до тех пор, пока они не будут высвобождены.
В конкретных примерах воплощения по меньшей мере один пептид по изобретению, который находится в составе композиции, присоединен к одной или нескольким молекулам нуклеиновой кислоты. Предпочтительно, по меньшей мере один пептид по изобретению, к которому присоединена одна или несколько молекул нуклеиновой кислоты, имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 4.
Одна или несколько молекул нуклеиновой кислоты, к которым присоединен по меньшей мере один пептид, такой как описан в этом документе, могут являться молекулами ДНК или молекулами РНК природного или искусственного происхождения, имеющими любую длину (в том числе аптамерами), и могут быть одноцепочечными или двуцепочечными. В вариантах воплощения с более чем одной молекулой нуклеиновой кислоты, присоединенной по меньшей мере к одному пептиду, эти молекулы нуклеиновой кислоты могут быть одного типа (т.е., иметь идентичные нуклеотидные последовательности) или разных типов. В типичном случае один пептид по изобретению присоединен к одной молекуле нуклеиновой кислоты.
В конкретных примерах воплощения одна или несколько молекул нуклеиновой кислоты являются молекулами РНК, в типичном случае - молекулами малых некодирующих РНК (т.е., РНК, которые не транслируются в пептид или белок, таких как мяРНК, мядРНК, stРНК, siРНК, miРНК и shРНК), и предпочтительно молекулы РНК выбраны из группы, состоящей из молекул siРНК, молекул miРНК и молекул shРНК.
Термин «молекула miРНК» (или «miРНК») при использовании в этом документе имеет свой обычный смысл, принятый в данной области (см. обзор, например, в публикациях: Bartel, D.P. (2004) Cell 23, 281-292; He, L. and Hannon, G.J. (2004) Nat. Rev. Genet. 5, 522-531). Соответственно, термин «микроРНК» обозначает эндогенную молекулу РНК, происходящую от геномного локуса, которая была процессирована из транскриптов, которые способны образовывать локальные структуры, характерные для РНК-предшественников miРНК. Зрелая miРНК обычно имеет длину 20, 21, 22, 23, 24 или 25 нуклеотидов, хотя также может присутствовать другое количество нуклеотидов, например, 18, 19, 26 или 27 нуклеотидов.
Последовательность, кодирующая miРНК, обладает способностью спариваться с фланкирующими геномными последовательностями, при этом зрелая miРНК участвует в образовании несовершенного дуплекса (также называемого в этом документе структурой стебель-петля или шпилечной структурой или пре-miРНК), который служит в качестве промежуточного продукта при процессинге miРНК из более длинного транскрипта-предшественника. Такой процессинг в типичном случае происходит путем последовательного действия двух специфических эндонуклеаз, называемых Drosha и Dicer, соответственно. В результате действия Drosha из первичного транскрипта (называемого «при-miРНК») образуется предшественник miРНК (также обозначаемый в общем случае «пре-miРНК»), который в общем случае сворачивается в шпилечную структуру или структуру стебель-петля. Из этого предшественника miРНК под действием Dicer вырезается дуплекс miРНК, который содержит зрелую miРНК в одном плече шпилечной структуры или структуры стебель-петля и имеющий схожий размер сегмент (обычно обозначаемый miРНК*) в другом плече. После этого miРНК направляется к ее целевой мРНК для выполнения своей функции, при этом miРНК* во многих случаях деградируется. В зависимости от степени комплементарности между miРНК и ее целевой мРНК, miРНК может запускать различные регуляторные процессы. Целевые мРНК, которые в высокой степени комплементарны miРНК, специфически расщепляются с участием механизмов, идентичных РНК-интерференции (РНКi), a miРНК выполняют роль малых интерферирующих РНК (siРНК). Целевые мРНК, которые в меньшей степени комплементарны miРНК, либо направляются в метаболические пути деградации в клетке и/либо их трансляция подавляется. Однако механизм, с помощью которого miРНК подавляет трансляцию своих целевых мРНК, до сих пор является спорным вопросом.
В некоторых вариантах воплощения одна или несколько молекул нуклеиновой кислоты, присоединенные по меньшей мере к одному пептиду, такому как описан в этом документе, являются зрелыми молекулами miРНК. В других вариантах воплощения применяют молекулы предшественника miРНК. Термин «предшественник miРНК» (или «miРНК-предшественник» или «пре-miРНК») при использовании в этом документе обозначает часть первичного транскрипта miРНК, из которой в результате процессинга образуется зрелая miРНК. В типичном случае пре-miРНК складывается в стабильную шпилечную структуру (т.е., дуплекс) или структуру стебель-петля. Шпилечная структура имеет длину в диапазоне от 50 до 120 нуклеотидов, в типичном случае - от 55 до 100 нуклеотидов и предпочтительно - от 60 до 90 нуклеотидов (с учетом остатков нуклеотидов, спаривающихся с miРНК (т.е., «стебля») и любых промежуточных сегментов (т.е., «петли»), но без учета расположенных более дистально последовательностей).
Термин «молекула siРНК» (или «siРНК») при использовании в этом документе также имеет свое обычное значение, принятое в данной области (см. обзор, например, в публикациях: Dorsett, Y. and Tuschl, T. (2004) Nat. Rev. Drug Disc. 3, 318-329; Rana, T.M. (2007) Nat. Rev. Mol. Cell Biol. 8, 23-36). Соответственно, термин «siРНК» обозначает двуцепочечную молекулу РНК, в типичном случае имеющую 2 неспаренных нуклеотида на своем 3'-конце и фосфатную группу на своем 5'-конце. Зрелая siРНК обычно имеет длину 20, 21, 22, 23, 24 или 25 нуклеотидов, хотя также может присутствовать другое количество нуклеотидов, например, 18, 19, 26 или 27 нуклеотидов. В рамках настоящего изобретения также могут применяться молекулы предшественника siРНК, имеющие длину до 49 нуклеотидов. Зрелая siРНК образуется из такого предшественника в результате процессинга с участием Dicer.
Традиционно термин «siРНК» применяли для обозначения интерферирующих РНК, которые экзогенно вводят в клетку. Однако в различных организмах были обнаружены эндогенные siРНК, которые относятся по меньшей мере к четырем классам: транс-действующие siРНК (tasiРНК), ассоциированные с повторами siРНК (rasiРНК), сканирующие малые (scn)РНК и взаимодействующие с Piwi (pi)РНК (обзор см., например, в публикации: Rana, T.M. (2007), см. выше).
Одна цепочка siРНК входит в состав рибонуклеопротеинового комплекса, известного как комплекс, осуществляющий индуцируемый РНК сайленсинг (RISC). Комплекс RISC использует данную цепь siРНК для выявления целевых молекул мРНК, которые по меньшей мере частично комплементарны входящей в его состав нити siРНК, а затем расщепляет эти целевые мРНК. Нить siРНК, которая входит в состав комплекса RISC, называют нитью-гидом или антисмысловой нитью. Другая нить siРНК, называемая нитью-пассажиром или смысловой нитью, удаляется из siРНК, и она по меньшей мере частично гомологична целевой мРНК. Специалисту в данной области будет понятно, что, в принципе, любая нить siРНК может входить в состав комплекса RISC и выполнять функцию нити-гида. Однако особенности строения siРНК (например, пониженная стабильность дуплекса siРНК на 5'-конце нити, которая должна служить гидом) могут способствовать включению в комплекс RISC нужной нити-гида. Антисмысловая нить siРНК является активным агентом, выполняющим в siРНК роль гида, в том смысле, что антисмысловая нить включается в состав комплекса RISC, позволяя тем самым комплексу RISC выявлять целевые мРНК, обладающие по меньшей мере частичной комплементарностью с антисмысловой нитью siРНК, с целью расщепления или подавления трансляции. Опосредованное комплексом RISC расщепление мРНК, имеющих последовательность, по меньшей мере частично комплементарную нити-гиду, ведет к снижению равновесного уровня этой мРНК и соответствующего белка.
Термин «молекула shPHK» (т.е., молекула короткой шпилечной РНК) при использовании в этом документе обозначает искусственно созданные одноцепочечные интерферирующие молекулы РНК, содержащие как смысловую, так и антисмысловую нити «дуплекса siРНК» в составе структуры стебель-петля или шпилечной структуры. Стебель этой шпилечной структуры в типичном случае имеет длину в диапазоне от 19 до 29 нуклеотидов, а петля в типичном случае имеет длину в диапазоне от 4 до 15 нуклеотидов (см., например, Siolas, D. et al. (2004) Nat. Biotechnol. 23, 227-231). Обычно молекула shРНК кодируется ДНК в составе экспрессионного вектора под контролем промотора для РНК-полимеразы III (например, промотора U6).
В некоторых вариантах воплощения молекулы РНК, описанные выше, содержат структуру остова, включающую только рибонуклеотидные единицы. В других вариантах воплощения такие молекулы РНК содержат по меньшей мере одну рибонуклеотидную единицу остова и по меньшей мере одну дезоксирибонуклеотидную единицу остова. Дополнительно, молекула РНК может содержать одну или несколько модификаций 2'-OH-группы рибозы в 2'-O-метильную группу или 2'-O-метоксиэтильную группу (также называемых «2'-»«O»«-метилированием»), которые предотвращают деградацию нуклеазами в культуральной среде и, что особенно важно, также предотвращают эндонуклеолитическое расщепление нуклеазой комплекса, осуществляющего индуцируемый РНК сайленсинг, которое ведет к необратимому ингибированию молекулы малой РНК. Еще одна возможная модификация, которая функционально эквивалентна 2'-O-метилированию, включает «запертые» нуклеиновые кислоты (LNA), которые представляют собой аналоги нуклеиновых кислот, содержащие один или несколько нуклеотидных мономеров LNA, в которых бициклическая фуранозная единица находится в «запертом» состоянии, имитирующем конформацию сахара в составе РНК (см., например, Orom, U.A. et al. (2006) Gene 372, 137-141).
В некоторых других вариантах воплощения молекулы нуклеиновой кислоты, предназначенные для присоединения к по меньшей мере одной пептидной молекуле по изобретению, представляют собой агенты, вызывающие сайленсинг экспрессии эндогенных miРНК. Одним из примеров такого агента, вызывающего сайленсинг, являются сконструированные химическими способами олигонуклеотиды, называемые «антагомирами», которые представляют собой одноцепочечные молекулы РНК длиной 23 нуклеотида, конъюгированные с холестеролом (Krutzfeldt, J. et al. (2005) Nature 438, 685-689). В качестве альтернативы таким химически модифицированным олигонуклеотидам были получены ингибиторы микроРНК, которые способны экспрессироваться в клетках в виде РНК, синтезируемых с трансгенов. Эти конкурентные ингибиторы, называемые «губками для микроРНК», являются транскриптами, экспрессируемыми с сильных промоторов и содержащими множественные тандемно расположенные сайты связывания для представляющей интерес микроРНК (Ebert, M.S. et al. (2007) Nat. Methods 4, 721-726).
В особенно предпочтительных примерах воплощения по меньшей мере один пептид в составе композиции присоединен к одному или нескольким другим пептидам. Термин «другие пептиды» при использовании в этом документе означает, что эти пептиды отличаются от пептидов, которые могут быть интернализированы внутрь клетки, таких как описанные в этом документе (т.е., пептидов, указанных в формуле изобретения).
В частности, предпочтительно, по меньшей мере один пептид по изобретению, к которому присоединена одна или несколько молекул других пептидов, имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, и при этом аминокислотная последовательность обладает по всей своей длине по меньшей мере 70%, предпочтительно - по меньшей мере 80% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 4.
Один или несколько других пептидов, к которым присоединен по меньшей мере один пептид, описанный в этом документе, могут быть молекулами природного происхождения или искусственно созданными молекулами любой длины. Например, длина таких пептидов может находиться в диапазоне от 2 до 500 аминокислот или от 5 до 200 аминокислот. В типичном случае такие пептиды имеют длину от 8 до 100 аминокислот или от 10 до 50 аминокислот. Предпочтительно, длина таких пептидов может находиться в диапазоне от 10 до 40 аминокислот, от 12 до 35 аминокислот или от 15 до 30 аминокислот. Искусственно созданные пептидные молекулы могут быть получены с применением химического синтеза, посредством технологии рекомбинантных ДНК или сочетания этих способов. Все эти способы синтеза хорошо известны специалистам в данной области (см., например, Sambrook, J., and Russel, D.W. (2001), см. выше).
В вариантах воплощения с более чем одной молекулой других пептидов, присоединенной по меньшей мере к одному пептиду по изобретению, эти молекулы других пептидов могут быть одного типа (т.е., иметь идентичные аминокислотные последовательности) или разных типов. В типичном случае один пептид по изобретению присоединен к одной молекуле другого пептида.
В дополнительных вариантах воплощения одна или несколько молекул других пептидов содержат по меньшей мере один структурированный домен, т.е., элемент, который образует (т.е., укладывается определенным образом) стабильную вторичную структуру, а именно, определенное пространственное расположение аминокислотных остатков, которые локализованы рядом друг с другом в линейной последовательности. Часто стерические взаимодействия между аминокислотными остатками носят регулярный характер, что приводит к образованию периодических структур, хорошо известных специалистам в данной области, таких как α-спирали (похожая на стержень плотно свернутая спиральная структура) и β-структуры (вытянутый участок, при этом множество таких участков, возможно, образуют параллельные или антипараллельные β-складчатые листы). Пептидные молекулы могут содержать один такой структурированный домен, окруженный неструктурированными областями, или могут содержать два или несколько таких структурированных доменов (одного типа или различных типов, например, две α-спирали или одну α-спираль и одну β-структуру), отделенные друг от друга. Пептидные молекулы могут образовывать такую вторичную структуру по всей своей длине (т.е., не содержать неструктурированных областей). В случае, если в составе композиции, описанной в этом документе, содержится более чем одна молекула других пептидов, возможно также, что часть молекул других пептидов содержит по меньшей мере один структурированный домен, при этом остальная часть является неструктурированной.
В предпочтительных примерах воплощения по меньшей мере часть одной или нескольких молекул других пептидов, описанных в этом документе, образует альфа-спиральную вторичную структуру. α-Спиральный элемент может содержать по меньшей мере 4 или 6 аминокислотных остатков и, предпочтительно, по меньшей мере 8 или 10 аминокислотных остатков. В конкретных примерах воплощения пептидная молекула по изобретению содержит одиночный α-спиральный элемент в качестве единственной вторичной структуры.
В других предпочтительных вариантах воплощения один или несколько других пептидов являются про-апоптотическими пептидами, т.е., пептидами, которые способны индуцировать и/или регулировать апоптоз (т.е., программируемую клеточную гибель). Специалисту в данной области будут известны белковые факторы, которые отвечают за индукцию и/или опосредование апоптоза, а также пригодные способы выбора пептидных последовательностей, которые обладают про-апоптотической функциональной активностью. Например, информацию о таких про-апоптотических факторах можно найти в научных публикациях, а также в различных базах данных, таких как «APOPTOSIS Databas» (Doctor, K.S. et al. (2003) Cell Death Diff. 10, 621-623).
В других вариантах воплощения один или несколько других пептидов имеют функциональные активности, выбранные из группы, состоящей из активации/снятия репрессии супрессоров опухолевых клеток, ингибирования клеточных онкогенов и ингибирования конститутивно активных вариантов белков. В других вариантах воплощения один или несколько пептидов представляют собой лиганды природного происхождения или синтетические лиганды (например, агонисты и антагонисты) клеточных рецепторов, таких как рецепторы цитокинов, рецепторы ангиотензина, рецепторы эндотелина, рецепторы вазопрессина и рецепторы брадикинина. Опять же, множество таких пептидов хорошо известны специалистам в данной области, или информацию о них можно легко найти в различных источниках.
Дополнительной особенностью настоящего изобретения является то, что оно относится к способу получения композиции, указанной в этом документе выше, включающему:
(a) создание по меньшей мере одного пептида по изобретению; и
(b) осуществление контакта этого по меньшей мере одного пептида с любой молекулой, выбранной из группы, состоящей из одной или нескольких молекул нуклеиновых кислот, одного или нескольких пептидов или белков, одной или нескольких малых молекул и одной или нескольких наночастиц, для того, чтобы обеспечить осуществление присоединения.
Специалисту в данной области будут известны пригодные условия проведения реакций с целью осуществления такого способа (см., например, Sambrook, J., and Russel, D.W. (2001), см. выше; Ausubel, F.M. et al. (2001), см. выше).
Дополнительной особенностью настоящего изобретения является то, что оно относится к способу выявления способности к интернализации у пептида по изобретению или композиции (т.е., по меньшей мере одного пептида, присоединенного к нагрузке) по изобретению, включающему:
(a) введение пептида или композиции в одну или несколько клеток; и
(b) выявление интернализации пептида или композиции.
Этот способ может быть особенно предпочтительным для оценки возможности применения пептида или композиции для медицинских (например, диагностических) или научно-исследовательских задач. Если обнаружен достаточный уровень интернализации пептида или композиции и, возможно, их локализация в цитоплазме, это свидетельствует о том, что соответствующее соединение можно применять для определенной задачи.
С этой целью пептид или композицию по изобретению можно присоединить к одной или нескольким детектируемым меткам. Метки, которые можно применять в соответствии с изобретением, включают любое соединение, которое напрямую или опосредованно вызывает образование детектируемого соединения или сигнала в результате химической, физической или ферментативной реакции. Мечение и последующую детекцию можно осуществлять способами, хорошо известными специалистам в данной области (см., например, Sambrook, J., and Russel, D.W. (2001), см. выше; и Lottspeich, F., and Zorbas H. (1998) Bioanalytik, Spektrum Akademischer Verlag, Heidelberg/Berlin, Germany). Метки могут быть выбраны, среди прочего, из флуоресцентных меток, ферментативных меток, хромогенных меток, люминесцентных меток, радиоактивных меток, гаптенов, биотина, комплексов с металлами, металлов и коллоидного золота. Все эти типы меток хорошо известны специалистам в данной области, и их можно приобрести у различных поставщиков. Примером физической реакции, которую опосредуют такие метки, является испускание флуоресценции или фосфоресценции при облучении. Щелочная фосфатаза, пероксидаза хрена, β-галактозидаза и β-лактамаза представляют собой примеры ферментативных меток, которые катализируют образование хромогенных продуктов реакции и которые можно применять в настоящем изобретении.
Еще одной особенностью настоящего изобретения является то, что оно относится к применению пептида, описанного в этом документе, или композиции, описанной в этом документе, для трансформации или трансфекции одной или нескольких клеток, т.е., к применению указанных соединений в качестве носителя для доставки с целью переноса нагрузки в конкретные целевые клетки.
В конкретных примерах воплощения изобретение относится к применению композиции, описанной в этом документе выше, содержащей по меньшей мере один пептид по изобретению, который присоединен к по меньшей мере одному соединению из группы, состоящей из одной или нескольких молекул нуклеиновой кислоты и одного или нескольких пептидов или белков, для трансфекции и/или целевой доставки агентов в конкретные клетки.
Еще одной особенностью настоящего изобретения является то, что оно относится к фармацевтической композиции, содержащей по меньшей мере одну пептидную молекулу, указанную в этом документе, или композицию, указанную в этом документе (т.е., по меньшей мере один пептид, присоединенный к нагрузке), и, возможно, дополнительно содержащей одно или несколько фармацевтически приемлемых вспомогательных веществ и/или добавок.
Термин «фармацевтическая композиция» при использовании в этом документе относится к композиции, предназначенной для введения субъекту, предпочтительно - пациенту, являющемуся человеком. Фармацевтические композиции по настоящему изобретению включают любые фармацевтические лекарственные формы, известные в данной области, такие как, среди прочего, капсулы, микрокапсулы, крахмальные капсулы, драже, таблетки, порошки, пилюли, многокомпонентные готовые лекарственные формы (например, шарики, гранулы или кристаллы), аэрозоли, спреи, пены, растворы, дисперсии, настойки, сиропы, эликсиры, суспензии, эмульсии типа вода-в-масле, например, мази, и эмульсии типа масло-в-воде, например, кремы, лосьоны и бальзамы. Готовые лекарственные формы могут быть упакованы в виде отдельных единиц дозирования или в многодозовых контейнерах.
Фармацевтические композиции по изобретению включают готовые лекарственные формы, пригодные для перорального, ректального, назального, местного (в том числе буккального и подъязычного), перитонеального и парентерального (включая внутримышечное, подкожное и внутривенное) введения или для введения посредством ингаляции или инсуффляции. Введение может быть местным или системным.
Фармацевтические композиции можно приготовить в соответствии с хорошо известными способами (см., например, Gennaro, A.L. and Gennaro, A.R. (2000) Remington: The Science and Practice of Pharmacy, 20th Ed., Lippincott Williams & Wilkins, Philadelphia, PA; Crowder, T.M. et al. (2003J A Guide to Pharmaceutical Particulate Science. Interpharm/CRC, Boca Raton, FL; Niazi, S.K. (2004) Handbook of Pharmaceutical Manufacturing Formulations, CRC Press, Boca Raton, FL).
Для приготовления указанных композиций можно применять одно или несколько фармацевтически приемлемых (т.е., инертных) неорганических или органических вспомогательных веществ (т.е., носителей). Для приготовления, например, драже, таблеток, капсул или гранул, можно применять, например, лактозу, тальк, стеариновую кислоту и ее соли, жиры, воски, твердые или жидкие высокомолекулярные спирты, природные и гидрогенизированные масла. Пригодные вспомогательные вещества для производства растворов, суспензий, эмульсий, аэрозольных смесей или порошков для приготовления восстановленных растворов или аэрозольных смесей перед применением включают, среди прочего, воду, спирты, глицерин, высокомолекулярные спирты и их пригодные смеси, а также растительные масла. Фармацевтическая композиция также может содержать добавки, такие как, например, наполнители, связующие вещества, смачивающие агенты, скользящие вещества, стабилизаторы, консерванты, эмульгирующие агенты и дополнительные растворители или агенты, повышающие растворимость, или агенты, способствующие достижению пролонгированного действия. В последнем случае предполагается, что активные пептиды или композиции по изобретению могут быть внедрены в системы для медленного или отложенного высвобождения или для целевой доставки, такие как липосомы, наночастицы и микрокапсулы.
Фармацевтическая композиция по изобретению будет вводиться субъекту в пригодной дозировке. Конкретный применяемый режим дозирования будет определен лечащим врачом, а также будет зависеть от клинических факторов. Как хорошо известно специалистам в области медицины, соответствующая для данного пациента дозировка зависит от множества факторов, включая массу, пол и возраст пациента, конкретное соединение, которое будет вводиться, время и путь введения, общее состояние здоровья, уже существующие состояния и другие лекарства, которые вводятся параллельно. Терапевтически эффективное количество для данной ситуации будет легко определить с применением стандартных экспериментальных способов, и это может осуществить обычный клиницист или врач. В общем случае дозировка при регулярном введении должна находиться в диапазоне от 1 мкг до 1 г в день. Однако предпочтительная дозировка может находиться в диапазоне от 0,01 мг до 100 мг, более предпочтительная дозировка - в диапазоне от 0,01 мг до 50 мг и наиболее предпочтительная дозировка - в диапазоне от 0,01 мг до 10 мг в день.
Еще одной особенностью настоящего изобретения является то, что оно относится к пептиду, указанному в этом документе, или к композиции, указанной в этом документе, для применения с целью профилактики и/или лечения состояния, при этом состояние предпочтительно выбрано из группы, состоящей из онкологического заболевания, иммунных заболеваний, сердечно-сосудистых заболеваний, неврологических заболеваний, инфекций и воспалительных заболеваний. С этой целью пептид или композиция по изобретению могут быть приготовлены в виде фармацевтической композиции, такой как описанная в этом документе выше, и введены субъекту, предпочтительно - пациенту, являющемуся человеком.
Термин «онкологическое заболевание» при использовании в этом документе обозначает любой тип или форму злокачественного новообразования, характеризующегося неконтролируемым делением целевых клеток в результате генетического ре-программирования и способностью целевых клеток распространяться, как путем непосредственного врастания в соседние ткани посредством инвазии, так и путем имплантации в отдаленные области с образованием метастазов (при этом раковые клетки переносятся по кровеносной или лимфатической системе). Примеры включают, среди прочего, рак груди, колоректальный рак, рак простаты, лейкемию, лимфомы, нейробластому, глиобластому, меланому, рак печени и рак легких.
Термин «иммунное заболевание» при использовании в этом документе относится к любому нарушению, затрагивающему иммунную систему. Примеры таких иммунных заболеваний включают, среди прочего, иммунодефициты (т.е., врожденные или приобретенные состояния, при которых способность иммунной системы бороться с инфекционными заболеваниями подавлена или полностью отсутствует, такие как СПИД или ТКИД), гиперчувствительность (например, аллергии или астма) и аутоиммунные заболевания. Термин «аутоиммунное заболевание» при использовании в этом документе следует понимать как обозначающий любое нарушение, возникающее в результате слишком активного иммунного ответа организма, направленного против эндогенных субстанций и тканей, при этом организм атакует свои собственные клетки. Примеры аутоиммунного заболевания включают, среди прочего, множественный склероз, болезнь Крона, красную волчанку, миастению гравис, ревматоидный артрит и полиартрит.
Термин «сердечно-сосудистое заболевание» при использовании в этом документе относится к любому нарушению, затрагивающему сердце и коронарные кровеносные сосуды. Примеры сердечно-сосудистых заболеваний включают, среди прочего, коронарную болезнь сердца, стенокардию, артериосклероз, кардиомиопатии, инфаркт миокарда, ишемию и миокардит.
Термин «неврологическое заболевание» (или «неврологическое нарушение») при использовании в этом документе обозначает любое нарушение, затрагивающее нервную систему, включая заболевания центральной нервной системы (ЦНС) (т.е., головного и спинного мозга) и заболевания периферической нервной системы. Примеры заболеваний ЦНС включают, среди прочего, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, бодрствующую кому и синдром Туретта. Примеры заболеваний периферической нервной системы включают, например, множественный мононеврит и полиневропатию.
Термин «инфекция» при использовании в этом документе обозначает любое нарушение, вызванное колонизацией организма-хозяина чужеродным патогеном, таким как бактерии, вирусы или грибы. Примеры бактериальных инфекций включают, среди прочего, бактериальный менингит, холеру, дифтерию, листериоз, коклюш, сальмонеллез, столбняк и сыпной тиф. Примеры вирусных инфекций включают, среди прочего, простуду, грипп, лихорадку денге, геморрагическую лихорадку Эбола, гепатит, эпидемический паротит, полиомиелит, бешенство и черную оспу. Примеры грибковых инфекций включают, среди прочего, дермофитию стопы, бластомикоз и кандидоз.
Термин «воспалительное заболевание» при использовании в этом документе обозначает любое нарушение, ассоциированное с воспалением, включая, например, акне, астму, сенную лихорадку, артрит, воспалительное заболевание кишечника, воспалительное заболевание органов таза и отторжение трансплантата.
Дополнительной особенностью настоящего изобретения является то, что оно относится к способу профилактики и/или лечения состояния, выбранного из группы, состоящей из онкологического заболевания, иммунных заболеваний, сердечно-сосудистых заболеваний, неврологических заболеваний, инфекций и воспалительных заболеваний, включающему: введение субъекту по меньшей мере одного пептида по изобретению или композиции по изобретению. Предпочтительно, субъект является человеком.
Заключительной особенностью настоящего изобретения является то, что оно относится к составному набору, содержащему по меньшей мере одно из следующего:
(a) пептидную молекулу, описанную в этом документе выше;
(b) молекулу нуклеиновой кислоты, описанную в этом документе выше;
(c) вектор, описанный в этом документе выше;
(d) клетку-хозяина, описанную в этом документе выше; и
(e) композицию, описанную в этом документе выше.
Различные компоненты (a)-(e) набора могут быть упакованы в один или несколько контейнеров, таких как один или несколько флаконов. Например, каждый компонент, содержащийся в наборе, может быть упакован в отдельный контейнер.
Вышеуказанные компоненты набора могут поставляться в лиофилизированной или сухой форме или растворенными в пригодном буферном растворе, таком как фосфатно-солевой буферный раствор или буферный раствор трис/ЭДТА (TE). Клетка-хозяин по настоящему изобретению может поставляться, например, в виде культуры, нанесенной в виде штрихов на чашку с агаром или в любой другой форме, пригодной для длительного хранения. Такие способы хранения хорошо известны специалистам в данной области.
Набор может также содержать дополнительные реактивы, включая, среди прочего, консерванты, питательную среду и/или буферные растворы для хранения и/или восстановления вышеуказанных компонентов, растворы для промывания и т.п. Эти реактивы могут поставляться в сочетании с одним или несколькими компонентами (a)-(e), т.е., в том же контейнере (например, молекула пептида или нуклеиновой кислоты, растворенная в соответствующем буферном растворе). В соответствии с другим вариантом, по меньшей мере некоторые из этих дополнительных реактивов могут поставляться в отдельных контейнерах.
Изобретение дополнительно описано с помощью фигур и следующих далее примеров, которые служат исключительно для иллюстрации конкретных примеров воплощения настоящего изобретения и не должны толковаться как ограничивающие объем настоящего изобретения каким-либо образом.
ПРИМЕРЫ
Пример 1: Материалы и способы
1.1 Культура клеток млекопитающих
Клетки MCF7 посеяли при плотности 15000 клеток на лунку в 96-луночные планшеты. Клетки инкубировали в течение 24 ч при 37°C, 5% CO2 и влажности 85% в среде RPMI 1640 с добавлением 10% FCS (сыворотки плодов крупного рогатого скота) и L-глутамина. Для проведения анализа функциональной активности клетки промывали в среде OptiMEM и заменяли среду RPMI 1640 на OptiMEM (все реактивы приобретали в компании Invitrogen Corporation, Карлсбад, Калифорния, США). Для образования комплексов siРНК с пептидами проводили инкубацию 100 нМ siРНК с указанными концентрациями пептидов в среде OptiMEM в течение 30 мин. при комнатной температуре. Комплексы добавляли к клеткам и инкубировали в течение 3 ч. Затем среду OptiMEM заменяли на нормальную питательную среду RPMI 1640. Клетки инкубировали еще в течение 21 ч для получения лизатов для анализа с помощью p-ДНК и в течение дополнительных 45 ч для проведения анализа с наборами CellTiter-Glo или CytoTox-Glo (см. ниже).
1.2 Количественное определение уровней мРНК
С целью количественного определения уровней клеточных мРНК проводили анализ по методу p-ДНК (разветвленной ДНК), который позволяет оценивать уровни индивидуальных мРНК. Для этого определенное количество клеток, которые будут подвергнуты анализу, посеяли в 96-луночные планшеты и оставили на ночь для прикрепления. На следующий день провели трансфекцию клеток молекулами siРНК.
Спустя еще 24 ч провели количественное определение индивидуальных мРНК с применением аналитического набора QuantiGene Plex 2.0 согласно рекомендациям производителя (Affymetrix Inc., Санта-Клара, Калифорния, США). Коротко: клеточные лизаты переносили в планшет с захватывающим агентом в присутствии набора ген-специфических зондов и инкубировали при 53°C в течение ночи. После промывки лунки последовательно инкубировали при 53°C с амплифицирующим агентом и с зондом, конъюгированным с щелочной фосфатазой (AP), а между этими этапами проводили промывку. Далее добавляли люминесцентный субстрат для AP - диоксетан - и инкубировали в течение 30 мин. при 53°C. Уровень люминесценции измеряли с применением ридера для определения люминесценции InfiniteF200 (Tecan Austria GmbH, Грединг, Австрия).
1.3 Анализ жизнеспособности клеток
Для определения количества живых клеток применяли аналитический набор CellTiter-Glo Luminescent Cell Viability Assay (Promega Corporation,Мадисон, Висконсин, США) в соответствии с протоколом, предложенным производителем. Клетки инкубировали в течение 48 ч в присутствии пептидов и siРНК. После этого проводили лизис клеток и индуцировали люминесцентный сигнал, который пропорционален количеству присутствующего АТФ, которое, в свою очередь, пропорционально количеству присутствующих живых клеток. Уровень люминесценции анализировали с помощью ридера для определения люминесценции InfiniteF200.
1.4 Анализ цитотоксичности
Для определения цитотоксичности пептидов применяли аналитический набор CytoTox-Glo Cytotocity Assay (Promega Corporation, Мадисон, Висконсин, США) в соответствии с протоколом, предложенным производителем. Клетки инкубировали в течение 48 ч в присутствии пептидов и siРНК. Затем клетки обрабатывали люминогенным пептидным субстратом с целью измерения активности протеаз мертвых клеток, высвобождающихся из клеток, у которых нарушена целостность мембраны. Субстрат не может проходить сквозь интактную мембрану живых клеток и не генерирует существенного сигнала при добавлении к популяции живых клеток. Таким образом, уровень люминесценции при данном анализе соответствует количеству мертвых клеток. Анализ 96-луночных планшетов проводили в ридере для определения люминесценции InfiniteF200.
1.5 Синтез пептидов
Синтез пептидов проводили в соответствии с принятыми протоколами («FastMoc 0.25 mmol») в автоматизированном пептидном синтезаторе Applied Biosystems ABI 433A с применением химической реакции с участием Fmoc. В ходе повторяющихся циклов собирали соответствующие пептидные последовательности путем последовательного присоединения соответствующих Fmoc-аминокислот.
На каждом этапе присоединения N-концевую Fmoc-группу удаляли с помощью обработки смолы 20%-ым раствором пиперидина в N-метилпирролидоне. Присоединение осуществляли с применением Fmoc-защищенных аминокислот (1 ммоль), активированных раствором гексафторфосфат-O-(бензотриазол-1-ил)-1,1,3,3-тетраметилурония / 1-гидроксибензотриазола (HBTU/HOBt, по 1 ммоль каждого) и диизопропилэтиламина (DIPEA, 2 ммоль) в диметилформамиде (DMF). После этапа присоединения проводили присоединение защитных групп к непрореагировавшим аминогруппам с помощью обработки смесью Ac2O (0,5 М), DIPEA (0,125 М) и HOBt (0,015 М) в NMP. Между двумя этапами смолу обильно промывали N-метилпирролидоном в DMF. Введение создающих стерические препятствия аминокислот проводили с применением автоматизированного двойного присоединения. Для этого смолу обрабатывали дважды с помощью 1 ммоля активированного стандартного блока без промежуточного этапа присоединения защитных групп. По завершении синтеза целевой последовательности присоединяли к пептиду Fmoc-12-амино-4,7,10-триоксадодекановую кислоту (TEG-спейсер), применяя стандартные условия проведения реакции. После этого присоединяли Fmoc-Cys(Trt)-OH к аминоконцу всех пептидных последовательностей. После снятия защитных Fmoc-групп несущую пептиды смолу помещали во фриттовый фильтр и обрабатывали смесью трифторацетатной кислоты, воды и триизопропилсилана (в соотношении 19 мл : 0,5 мл : 0,5 мл) в течение 2,5 ч. Раствор с продуктами расщепления профильтровывали и осаждали пептиды с помощью добавления охлажденного (0°C) диизопропилового эфира (300 мл) с получением бесцветного твердого вещества, которое повторно промывали диизопропиловым эфиром. Неочищенный продукт повторно растворяли в смеси уксусной кислоты и воды, лиофилизировали и очищали с применением препаративной обратнофазовой ВЭЖХ, используя градиент ацетонитрил / вода, содержащий 0,1% трифторуксусную кислоту (TFA) (колонка Chromolith prep RP-18e, 100×25 мм; Merck KGaA, Дармштадт, Германия).
1.6 Анализ с применением FACS (флуоресцентно-активированного клеточного сортинга)
Для проведения анализа с применением FACS осуществляли открепление клеток MCF7 (ATCC № HTB-22) путем инкубации в течение 15 мин. с аккутазой (раствором фермента, обладающего протеолитической и коллагенолитической активностями; доступен для приобретения у различных поставщиков). После промывки буферным раствором для FACS (фосфатно-солевым буфером (PBS), содержащим 5% FCS) клетки посеяли в 96-луночный планшет с лунками, имеющими округлое дно (кат. №3799, Corning Inc., Корнинг, Нью-Йорк, США), при конечной плотности 3×105 клеток/мл и сразу же применяли. Клетки инкубировали в присутствии, соответственно, 1 мкМ, 5 мкМ и 10 мкМ FITC-меченных пептидов в среде OptiMEM в течение 3 ч при 37°C. После этого клетки промывали в буферном растворе для FACS и инкубировали в буферном растворе, содержащем протеиназу К (0,02 мг/мл), в течение 30 мин. при 37°C. Клетки дважды промывали и анализировали на приборе FACSCanto II (BD Biosciences; Сан-Хосе, Калифорния, США) с применением канала для FITC.
1.7 Анализ сдвига электрофоретической подвижности в геле
Анализ сдвига электрофоретической подвижности в геле проводили путем смешивания 500 мкг дуплекса siРНК с соответствующими пептидами в указанном молярном соотношении в воде. Комплексы образовывались в течение 1 ч при 37°C, после чего проводили их анализ в 2,5% агарозном геле с бромидом этидия (разделение: 40 мин. при 125 В). Для обработки протеиназой К добавляли 1 мкл протеиназы К в стандартную реакцию, как указано выше.
Пример 2: Выявление потенциальных пептидов CPP человека
2.1 Биоинформационный способ
Одна группа пептидов, проникающих в клетки (CPP), примерами которой являются происходящий из ВИЧ пептид TAT (Frankel, A.D. and Pabo, С.О. (1988) Cell 55, 1189-1193; Vives; E. et al. (1997), см. выше) и модельный пептид полиаргинин (Wender, P.A. et al. (2000) Proc. Natl. Acad. Sci. USA 97, 13003-13008; Futaki, S. et al. (2001) J. Biol. Chem. 276, 5836-5840), характеризуется высоким содержанием положительно заряженных аминокислот. Другие пептиды CPP, так называемые пептиды, имеющие структуру спирали с асимметричным распределением гидрофобных остатков (tilted peptides), состоят как из заряженных гидрофильных участков, так и из незаряженных липофильных участков аминокислот (Lins, L. et al. (2008) Biochim. Biophys. Acta 1778, 1537-1544). Таким образом, можно предположить, что пептиды CPP должны обладать обеими этими характеристиками. С целью выявления таких последовательностей в составе протеома человека применяли биоинформационный способ. На Фиг.1 приведена схема процесса, примененного для получения списков кандидатных пептидов.
Для получения пептидной библиотеки применяли способ скользящего окна. Было выбрано окно размером в 30 аминокислот, которое применили в отношении всех записей, содержащихся в базе данных по белкам SwissProt (Swiss Institute of Bioinformatics; http://www.expasy.org/sprot/). В результате была получена библиотека из 10459557 индивидуальных пептидов, из которых 1024818 были уникальными. 163887 пептидов были обнаружены более одного раза, в среднем 2,7 раз, что отражает наличие в структуре некоторых белков повторяющихся последовательностей. В сгенерированной библиотеке каждая индивидуальная пептидная последовательность связана с соответствующей ей исходной информацией (последовательность пептида, исходный белок и положение в составе этого белка), а также с аннотациями в генной онтологии (GO) (Ashburner, М. et al. (2000) Nat. Genet. 25, 25-39) об исходном белке. Дополнительная информация, связанная с каждым пептидом, включает его аминокислотный состав, например, количество зарядов, изоэлектрическую точку (ИЭТ) и предсказанные гидрофобные свойства. Обоснованием применения скользящего окна размером в 30 аминокислот была необходимость получения более длинных пептидов, чем обычно применяемые в качестве пептидов CPP, так как более длинные пептиды с большей вероятностью образуют вторичную структуру (например, альфа-спирали или бета-слои). Было показано, что пептиды, содержащие такие вторичные структуры, обладают преимуществами для проникновения в клетки, по сравнению с неструктурированными пептидами (Deshayes, S. et al. (2004) Biochemistry 43, 7698-7706). Кроме того, сообщалось, что альфа-спиральные пептиды длиной менее 12 аминокислот имеют пониженную способность взаимодействовать с молекулами нуклеиновых кислот и, таким образом, переносить их (Niidome, T. et al. (1999) Bioconjug. Chem. 10, 773-780).
На следующем этапе были отфильтрованы пептиды, содержащие в своей первичной аминокислотной последовательности более 30% положительно заряженных аминокислотных остатков (т.е., аргинина (R), гистидина (H) и лизина (K)) с целью получения пептидов, обладающих более высокой схожестью с положительно заряженными модельными пептидами TAT и поли-Arg. В результате применения этого фильтра было отобрано 227307 индивидуальных пептидов. Для обогащения полученной выборки пептидами, которые обладают более высоким потенциалом переносимости для иммунной системы (т.е., которые с меньшей вероятностью являются иммуногенными), результаты сопоставили с данными GO из записей для соответствующих белков и ограничили выбор только внеклеточными белками. В конечном итоге применение этого фильтра (т.е., выборки кандидатов, полученных из внеклеточных белков человека, которые, таким образом, являются «видимыми» для иммунной системы человека) существенно снизило количество пептидов до 8630 от 583 индивидуальных белков.
2.2 Выбор кандидатных пептидов для экспериментального определения параметров
Основным фактором для снижения количества кандидатных пептидов был переход от способов in silico (при помощи которых можно анализировать практически неограниченное количество проб) к экспериментальному анализу в условиях лаборатории (при котором возможно тщательное исследование лишь ограниченного количества кандидатных молекул). Кроме того, еще одним практическим соображением в пользу уменьшения списка кандидатных пептидов была легкость применения, применимость в биологических способах анализа и, наконец, возможность разработки фармакологически активного соединения. С другой стороны, из дальнейшей оценки были исключены пептидные последовательности, которые очевидно плохо растворимы или трудны для синтеза.
Для того, чтобы избежать ситуации, когда выбор кандидатных молекул на последнем этапе определяется одним или, возможно, двумя строгими параметрами, финальный список кандидатных пептидов для экспериментальной оценки получили тремя различными способами.
Одна подгруппа кандидатных пептидов характеризуется содержанием не только по меньшей мере 30% положительно заряженных («KHR30»), но также большим количеством гидрофобных остатков. Следовательно, пептиды были ранжированы с точки зрения их ИЭТ, а также их гидрофобности. Пересечение подмножеств обоих списков, каждое из которых состояло из 1000 пептидов, имеющих наивысшую оценку, дало в результате 91 пептид, происходящий из 29 белков. Наконец, были выбраны 20 пептидов, происходящих из 20 белков, с наивысшими значениями в составе пересечения.
Вторую подгруппу кандидатных пептидов получили на основании схожести с последовательностью пептида ТАТ. Все пептиды подвергали сравнению на степень гомологии с применением алгоритма FASTA (Lipman, D.J. and Pearson, W.R. (1985), см. выше). Пептиды ранжировали в соответствии с их относительными значениями Е (чем ниже значение Е, тем выше положение в списке). В результате применения этого способа отобрали 135 пептидов, происходящих из 10 белков. Наконец, для дальнейшего анализа выбрали 5 пептидов, происходящих из 5 белков.
В качестве третьей подгруппы для экспериментальной оценки выбрали 36 кандидатных пептидов, происходящих от 25 индивидуальных белков, основываясь на анализе литературных данных относительно функции (или функций) белков, от которых они происходят. Несоответствие между количеством пептидов и количеством белков объясняется применением множества последовательностей из одного белка (например, CO9_mot1a, CO9_mot1b) или различных вариантов одной последовательности (например, включающих или не содержащих дисульфидные мостики, таких как гранулизин WT (дикого типа), гранулизин G8, гранулизин G9). В общем случае сохраняли длину в 30 аминокислот, но если было выявлено, что такой 30-мер содержит известный мотив, то длину пептида увеличивали до 39 аминокислотных остатков, как в случае пептида FALL (Yang, Y.X. et al. (2004) Acta Pharmacol. Sin. 25, 239-245), или до 48 аминокислотных остатков, как в случае LIP_Cons_C_WT, консенсусной последовательности для множества липаз (Demant, Т. et al. (1988) J. Lipid Res. 29, 1603-1611). Ограничение основывалось на тщательном анализе литературных данных и результатов BLAST-анализа, полученных для этих последовательностей. Предпочтение отдавали: пептидам, происходящим от белков, о которых известно, что они оказывают разрушающее воздействие мембраны, таких как факторы системы комплемента; пептидам, происходящим от белков, которые участвуют в деградации липидов (таких как липазы); пептидам, происходящим от белков, которые являются предшественниками бактерицидных факторов, таких как FALL (Nijink, A. and Hancock, R.E. (2009) Curr. Opin. Hematol. 16, 41-47) или BPIL3 (Mulero, J.J. et al. (2002) Immunogenetics 54, 293-300); и пептидам, схожим с пептидами, о которых сообщалось, что они действуют как CPP (Takeshima, K. et al. (2003) J. Biol. Chem. 278, 1310-1315; Arrighi, R.B. et al. (2008) Antimicrob. Agents Chemother. 52, 3414-3417).
Все пептиды (в том числе контрольные), которые подвергали дальнейшей экспериментальной оценке, перечислены в таблице 1.
Для визуальной демонстрации начального фильтра построили график зависимости ИЭТ пептидов от их гидрофобности. При сравнении с 500 случайным образом выбранными пептидами (из множества размером примерно 10×106) очевидно, что начальный фильтр позволяет выделить область скопления выбранных пептидов (см. фиг.2). Для дополнительного сравнения были также включены пять пептидов в качестве положительного контроля (т.е., TAT, REV, протамин, поли-Arg и INF7). Данный анализ показывает, что положительно заряженные контрольные пептиды TAT, REV, протамин и 10×Arg соответствуют критериям фильтра, тогда как INF7, который является отрицательно заряженным и гидрофобным пептидом, обнаруживается на другом конце шкалы.
В дополнение к выбранным кандидатным пептидам CPP человека в качестве контролей при скрининге были добавлены восемь пептидов, для которых сообщается о том, что они обладают активностью CPP (см. таблицу 1). Эти пептиды способны образовывать нековалентные комплексы с нуклеотидами и обладают способностью к трансфекции: TAT, пептид CPP, происходящий от трансактивирующего белка ВИЧ (Ignatovich, I.A. et al. (2003) J. Biol. Chem. 278, 42625-42636); REV, родственный пептиду TAT пептид ВИЧ (Futaki, S. et al., см. выше); поли-Arg (Kim, W.J. et al. (2006) Mol. Ther. 14, 343-350) в качестве истинного примера положительно заряженного пептида; кротамин (Nascimento, F.D. et al. (2007) J. Biol. Chem. 282, 21349-21360). Кроме того, укороченный протамин (Song, E. et al. (2005) Nat. Biotechnol. 23, 709-717) и N-концевой фрагмент перфорина добавили в качестве примеров пептидов человека. Двумя дополнительными контролями, не относящимися к классу TAT-подобных пептидов CPP, были Inf7, пептид, происходящий от HA вируса гриппа (отрицательно заряженный и гидрофобный пептид; Plank, С.et al. (1994) J. Biol. Chem. 269, 12918-12924) и MTS (в основном гидрофобный пептид; Lin, Y.Z. et al. (1995) J. Biol. Chem. 270, 14255-14258).
Пример 3: Скрининг пептидов, опосредующих трансфекцию siРНК
Для анализа потенциальных пептидов СРР на способность осуществлять трансфекцию siРНК в клетки млекопитающих применяли возрастающие концентрации пептидов (от 1 мкМ до 20 мкМ) при постоянной концентрации siРНК (100 нМ). Этот диапазон концентраций пептидов применяли потому что было показано, что положительно заряженные пептиды, такие как ТАТ, интернализируются внутрь клеток в диапазоне концентраций от 10 мкМ и сохраняются во внутриклеточных ограниченных мембраной компартментах без существенного выхода в цитозоль (Duchardt, F. et al. (2007) Traffic 8, 848-866). Показано, что эти пептиды выходят в цитозоль только при концентрации выше порогового значения, равного примерно 5-10 мкМ. Концентрация 10 нМ siРНК находится в диапазоне насыщающих концентраций, согласно данным контрольных экспериментов с применением реактива для трансфекции DharmaFECT (Dharmacon, Inc., Лафейетт, Колорадо, США; данные не показаны).
Применяемые олигонуклеотиды siРНК были разработаны против Aha1 мРНК человека (Panaretou, В. et al. (2002) Mol. Cell 10, 1307-1318) или против мРНК люциферазы, выступающей в качестве контроля.
Комплексы siPHK и соответствующих пептидов образовывались в среде OptiMEM при инкубации в течение 15 мин. при комнатной температуре. Клетки инкубировали в присутствии комплексов в течение трех часов в среде OptiMEM. После промывки клетки инкубировали дополнительно в течение 21 ч или 45 ч в нормальной питательной среде. После этого с помощью метода разветвленной ДНК определяли уровни Aha1 мРНК и контрольной мРНК (т.е. GAPDH мРНК). Этот анализ проводили для клеток, которые были трансфецированы siAHA1 или контрольной siРНК (siGL3, против люциферазы), соответственно.
Для количественной оценки специфической РНКi снижение уровней Aha1 мРНК относительно уровней GAPDH мРНК сравнивали в клетках, трансфецированных siAHA1, и в клетках, трансфецированных siGL3. Трансфекция, опосредованная специфической siPHK, вызывает снижение значений соотношения уровней Aha1/GAPDH мРНК в клетках, трансфецированных siAhA1, по сравнению с клетками, трансфецированными siGL3. На фиг.3 приведены данные скрининга, полученные в результате таких экспериментов: значения Aha1/GAPDH мРНК для не трансфецированных контрольных клеток были приняты за 100% (для каждого эксперимента) и значения Aha1/GAPDH мРНК для трансфецированных siAha1 или siGL3 клеток выражали относительно этих значений. Для такого нормированного набора данных определяли разности между относительными уровнями Aha1/GAPDH мРНК в клетках, трансфецированных siAha1 и siGL3. Специфические пептиды вызывали существенное снижение при трансфекции siAha1, при этом снижения не наблюдалось при трансфекции siGL3, что приводит к положительным значениям разности. Чем более явно выражены эти значения, тем более специфическим является наблюдаемый процесс РНКi (см. фиг.3).
В выбранных пробах снижение уровней Aha1 мРНК и/или GAPDH мРНК наблюдалось при всех способах трансфекции. Это указывает на склонность к ингибированию роста и оказанию токсического воздействия у применяемых пептидов, независимо от специфичности siРНК. Пептиды, которые нарушают целостность мембран (т.е., пептиды CPP), часто обладают исходно присущей им способностью повреждать клетки, и это подтверждается тем фактом, что некоторые из этих пептидов также действуют в качестве бактерицидных агентов (Arrighi, R.B. et al. (2008), см. выше). Поэтому цитотоксическую активность предполагаемых пептидов CPP человека проанализировали с применением аналитических наборов CytoTox-Glo и CellTiter-Glo (Promega Corporation, Мадисон, Висконсин, США). Опосредованные пептидами ингибирование роста или цитотоксичность, согласно определению с применением аналитического набора CellTiterGlow, хорошо коррелировали с соответствующим снижением уровней GAPDH мРНК. Исходя из этого наблюдения, уровни GAPDH мРНК применяли в качестве общего показателя токсичности: среднее значение показателя, равное 100% GAPDH мРНК относительно контроля с питательной средой, считали свидетельством отсутствия токсичности, значения от 99% до 70% - свидетельством умеренной токсичности и значения менее 70% - свидетельством наличия токсичности (см. фиг.3).
На основании эффективности пептидов в опосредовании трансфекции и/или ингибирования роста/цитотоксичности были выделены различные фенотипические категории: пептиды, которые демонстрировали более низкую Aha1-специфическую трансфекцию siРНК, чем пептид TAT, были отнесены к категории «нетрансфецирующие» пептиды; пептиды, которые демонстрировали равную или более высокую эффективность трансфекции относительно пептида TAT, были названы «трансфецирующими» пептидами. Схожим образом, пептиды, приводящие к значениям GAPDH мРНК>70% классифицировали как «нетоксические», тогда как пептиды, которые вызывали более слабое снижение уровней GAPDH мРНК, были названы «токсическими».
На основании этих категорий все пептиды были отнесены к одному из следующих четырех классов:
(a) нефункциональные пептиды (нетрансфецирующие и нетоксические);
(b) нетрансфецирующие токсические пептиды;
(c) трансфецирующие токсические пептиды;
(d) трансфецирующие нетоксические пептиды.
3.1 Нефункциональные пептиды
В эту категорию попал 41 из 61 прошедшего скрининг пептида, происходящего от белков человека (таблица 1 и фиг.3). Эти пептиды не демонстрируют существенной токсичности в отношении клеток, а также не способны опосредовать трансфекцию siРНК при концентрациях, которые были применены. Таким образом, 67% пептидов, которые были отобраны в качестве предполагаемых пептидов CPP в ходе способа in silico, не продемонстрировали какого-либо фенотипического проявления в экспериментах по исследованию трансфекции и жизнеспособности. В группе, состоящей из 8 контрольных пептидов, для которых ранее сообщалось о наличии у них активности CPP, три пептида (кротамин, MTS и перфорин) попали в эту категорию.
В качестве примера, на фиг.4 изображено фенотипическое проявление действия пептида, происходящего от белка WNT16, который участвует в сигнальном пути WNT (Mazieres, J. et al. (2005) Oncogene 24, 5396-5400). Последовательность пептида WNT16 была включена в качестве кандидатного пептида для экспериментальной оценки, потому что она соответствует параметрам поиска «KHR10 + внеклеточная локализация».
3.2 Нетрансфецирующие токсические пептиды
В эту категорию попали 11 из 61 прошедшего скрининг пептида, происходящего от белков человека, которые продемонстрировали свидетельства наличия токсичности (снижение жизнеспособности и/или >70% снижение уровня GAPDH мРНК), но не были способны опосредовать трансфекцию siРНК в применяемых концентрациях (см. таблицу 1 и фиг.3). Таким образом, их способность осуществлять трансфекцию была ниже, чем у пептида TAT. Ни один из проанализированных пептидов, являющихся (положительными) контролями, не попал в эту категорию, что свидетельствует о том, что контроли действительно обладают способностью к трансфекции. На фиг.5 представлено фенотипическое проявление для двух примеров пептидов, принадлежащих к данному классу.
Один пептид происходит от белка человека BPLI3 (фиг.5A; Bingle, C.D. and Craven, C.J. (2004) Trends Immunol. 25, 53-55). При анализе CellTiter-Glo у клеток, подвергнутых воздействию этим пептидом, наблюдали дозозависимое снижение жизнеспособности. Параллельно с этим наблюдалось дозозависимое снижение уровней GAPDH мРНК, что свидетельствует в пользу применения средних значений уровней GAPDH мРНК в качестве показателя подавления роста и/или токсичности. Интересно отметить, что анализ CytoTox-Glo не показал существенного уровня апоптоза в клетках, подвергнутых воздействию пептида BPIL3 (данные не приведены). Таким образом, этот пептид вызывает ингибирование роста и/или гибель клеток по механизму, отличному от апоптоза. Трансфекционная активность (специфическое снижение уровней Aha1 мРНК относительно уровней GAPDH мРНК) у этого пептида не наблюдалась.
Еще один пептид с цитотоксическими свойствами (фиг.5B) происходит от белка человека кателицидина (Nijink, A. and Hancock, R.E. (2009), с/и. выше). Также сообщалось, что пептид, называемый FALL, обладает противомикробной функциональной активностью. Пептид FALL продемонстрировал существенный уровень токсичности при воздействии на клетки, что выражалось в потере клетками жизнеспособности и снижении уровней GAPDH мРНК. Анализ потенциальной трансфекционной активности позволил выявить лишь не позволяющие сделать окончательный вывод свидетельства специфического снижения уровней Aha1 мРНК (в сравнении с GAPDH мРНК) при концентрациях 10 мкМ или выше, при которых токсические свойства явно выражены. В этих (токсических) условиях наблюдалось лишь некоторое незначительное снижение уровней мРНК. Однако при более низких концентрациях (5 мкМ) можно наблюдать явно выраженное и специфическое снижение уровней Aha1 мРНК. Это свидетельствует о том, что пептид FALL, возможно, способен осуществлять трансфекцию siРНК, хотя и с меньшей эффективностью трансфекции, чем пептид ТАТ, т.е., с эффективностью, находящейся ниже порогового значения, установленного для этого класса трансфецирующих пептидов.
3.3 Трансфицирующие токсические пептиды
Этот класс пептидов не включает ни одного из контрольных пептидов, но содержит 5 кандидатных пептидов человека. Последние показали явные признаки трансфекционной активности (т.е., специфический нокдаун Aha1), а также вызывали ингибирование роста клеток и/или токсичность.
В качестве примера на фиг.6 показан фенотип клеток, подвергнутых воздействию пептида, происходящего от белка CU025. CU025 - это белок, содержащий кальций-связывающий домен, функциональная активность которого не известна (SwissProt, номер доступа: Q9Y426). Эксперименты по трансфекции siРНК продемонстрировали существенное и специфическое снижение уровней Aha1 мРНК по сравнению с уровнями GAPDH мРНК. Однако этот пептид также вызывал ингибирование роста и/или токсичность, как показал анализ жизнеспособности и существенное снижение уровней GAPDH мРНК. Эта пониженная жизнеспособность становилась очевидной уже при концентрациях пептида, которые необходимы для достижения трансфекции и РНКi. Таким образом, применимость этого пептида и других членов данного класса пептидов для трансфекции siРНК существенно ограничена их токсическими фенотипическими проявлениями.
3.4 Трансфицирующие нетоксические пептиды
Этот класс пептидов представляет наибольший интерес с точки зрения применений, включающих трансфекцию siРНК, так как эти пептиды обладают трансфекционной функциональной активностью в концентрациях, которые не оказывают негативного воздействия на жизнеспособность клеток. Большинство контрольных пептидов попало в этот класс. Из 61 кандидатного пептида человека, отобранного для экспериментальной оценки, три пептида продемонстрировали явные свидетельства трансфекционной активности в концентрациях, которые не опосредуют негативного воздействия на жизнеспособность клеток, либо вызывают лишь минимальное такое воздействие. Эти пептиды происходили от CPXM2, ранее не охарактеризованной карбоксипептидазы (номер доступа в SwissProt: Q8N436), от ASM3B (номер доступа в SwissProt: Q92485), кислой сфингомиелиназо-подобной фосфодиэстеразы и от GDNF-подобного нейротрофического фактора человека неуртурина (NRTN; Kotzbauer, P.T. et at. (1996) Nature 384, 467-470).
На фиг.7 приведено сравнение опосредованного трансфекцией специфического нокдауна Aha1 и воздействий на жизнеспособность клеток пептидов CPXM2 (фиг.7B), ASM3B (фиг.7C) и NRTN (фиг.7D) с этими же показателями пептидов TAT и поли-Arg (фиг.7A). Как CPXM2, так и ASM3B вызывали существенное снижение уровней эндогенной Aha1 мРНК при их совместном применении с siРНК, специфической в отношении Aha1, при этом не вызывая существенной токсичности. Это фенотипическое проявление было схожим с таковым, наблюдаемым в случае контрольных пептидов TAT и поли-Arg (данные не показаны).
Пептид NRTN опосредовал даже более существенное снижение уровней Aha1 мРНК относительно уровней GAPDH мРНК, оказывая при этом лишь незначительное воздействие на жизнеспособность клеток. Влияние на рост клеток/жизнеспособность наблюдалось лишь при высоких концентрациях (более 10 мкМ). Интересно отметить, что пептид NRTN демонстрировал значительную трансфекционную активность даже при более низких, нетоксических, концентрациях. При этих концентрациях эффективность трансфекции пептидов, происходящих от NRTN, была выше, чем у всех проанализированных пептидов, служащих (положительными) контролями. Принимая во внимание это фенотипическое проявление, для пептида NRTN провели более подробное определение параметров.
Пример 4: Образование комплексов пептид/siРНК является необходимым, но не достаточным фактором для опосредования трансфекции
Механизмы, которые могут объяснить трансфекционную функциональную активность заряженных пептидов, таких как TAT или протамин, включают образование комплексов между положительно заряженными пептидами и отрицательно заряженными нуклеиновыми кислотами. Такие комплексы делают возможными функциональные активности по пептид-опосредованному взаимодействию с мембранами и/или выходу из эндосом, необходимые для переноса находящихся в комплексе нуклеиновых кислот в цитозоль клеток (Law, М. et al. (2008) Biotechnol. Prog. 24, 957-963). Для выяснения того, является ли описанный выше механизм применимым также и для случая пептида, происходящего от NTRN, провели анализ сдвига электрофоретической подвижности в геле (см. фиг.8). С этой целью siРНК инкубировали совместно с возрастающими концентрациями пептида, после чего проводили анализ их миграции при разделении гель-электрофорезом. Пептид TAT продемонстрировал ожидаемое (от положительного контроля) зависящее от концентрации замедление миграции siРНК (фиг.8A). Таким образом, пептид TAT образует комплексы с молекулами siРНК. В случае пептида TAT сдвиг электрофоретической подвижности в геле наблюдался начиная с соотношения пептид: siРНК, равного 10:1, при этом наиболее выраженный эффект наблюдался при соотношении 25:1 или выше.
Параллельно проведенный анализ с участием siРНК, подвергнутой воздействию пептида, происходящего от NTRN, показан на фиг.8B. Замедление миграции siРНК наблюдалось уже при соотношении пептид : siРНК. равном 1:1 или выше. Кроме того, в отличие от пептида ТАТ (который всегда входил в гель), при соотношении пептид NTRN : siРНК, равном 25:1, наблюдалось удерживание образованных комплексов в кармане геля. При более высоких соотношениях было невозможно проводить детекцию с применением бромида этидия. Эти результаты соответствуют наблюдению, свидетельствующему о том, что комплексы нуклеиновых кислот с поликатионными пептидами имеют меньшую доступность для интеркалирующих агентов (Wolfert, M.A. and Seymour, L.W. (1996) Gene Ther. 3, 269-273). Однако после обработки протеазой K в геле можно наблюдать соответствующий сигнал от siРНК (см. фиг.8C). Таким образом, пептид, происходящий от NRTN, способен образовывать стабильные комплексы с siРНК, которые, по-видимому, обладают высокой степенью компактизации.
Эти результаты показали, что образование комплексов пептид/siРНК связано с трансфекционной функциональной активностью как пептида, происходящего от TAT, так и пептида, происходящего от NTRN. Следовательно, можно предположить, что указанное комплексообразование (т.е. образование комплексов) необходимо для того, чтобы применять функциональные активности пептидов по взаимодействию с мембранами и/или «выходу из эндосом» для трансфекции siРНК. Однако, необходимо выяснить, является ли наблюдаемое комплексообразование также и достаточным для проявления трансфекционной функциональной активности? Соответственно, способность к комплексообразованию с siРНК также проанализировали для пептида, происходящего от WNT16, который не демонстрирует ни цитотоксичности, ни трансфекционной функциональной активности (см. выше). Анализ сдвига электрофоретической подвижности в геле для siРНК, подвергнутой воздействию пептида, происходящего от WNT16, показал явное дозозависимое замедление электрофоретической подвижности siРНК, даже более сильное, чем наблюдалось в случае пептида TAT (см. фиг.8D). Эффективный сдвиг электрофоретической подвижности в геле наблюдался при соотношениях пептид : siРНК, равных 1:1 или выше. Наблюдение эффективного образования комплексов нетрансфецирующим пептидом указывает на то, что комплексообразование между пептидом и siРНК само по себе не является достаточным для обеспечения трансфекционной функциональной активности. Таким образом, комплексообразование с siРНК, по-видимому, является необходимой предпосылкой для проявления функциональной активности, но дополнительные особенности последовательности и/или структуры пептидов также могут играть важную роль в опосредовании трансфекции.
Приведенные выше данные показали, что пептид, происходящий от NTRN, эффективно образует комплексы с молекулами siРНК и опосредует их трансфекцию. Примененной siРНК была siAha1, которая нацелена на мРНК продукта клеточного гена «домашнего хозяйства», активатора гомолога 1 АТФазы белка теплового шока 90 (Panaretou, В. et al. (2002), см. выше). В качестве контроля применяли siРНК, направленную против мРНК люциферазы.
Для подтверждения того, что пептид NTRN в общем случае применим для трансфекции siРНК (и его функциональность не ограничена последовательностью конкретной siРНК), исследовали его способность трансфецировать siРНК, отличную от siAha1. На фиг.9 показаны результаты опосредованной пептидом NTRN трансфекции siРНК, направленной против мРНК митотического кинезина Eg5 (Blangy, A. et al. (1995) Cell 83, 1159-1169). Эффективное снижение уровней клеточной Eg5 мРНК было обнаружено при концентрациях <10 мкМ. При таких дозах пептид NTRN не оказывает негативного влияния на жизнеспособность клеток. Известно, что эффективное снижение уровней Eg5 мРНК вызывает остановку митоза, что в результате приводит к началу апоптоза (Blangy, A. et al. (1995), см. выше). В соответствии с этим при опосредованной пептидом NTRN трансфекции siEg5 наблюдали апоптотический фенотип (фиг.9). Трансфекция контрольной siРНК в таких же условиях не давала цитотоксического эффекта, подтверждая тем самым, что апоптотический фенотип был вызван снижением уровня Eg5 мРНК.
Приведенные выше данные демонстрируют не только то, что пептид, происходящий от NRTN человека, в общем случае применим для опосредования трансфекции siРНК, но также то, что его эффективность трансфекции является достаточной для проявления клеточных фенотипов, обусловленных siРНК.
Пример 5: Способные к трансфекции пептиды интернализируются внутрь клеток
Для определения способности к интернализации у пептидов CPP, выявленных в ходе процедуры скрининга провели анализ FITC-меченных производных указанных пептидов (при концентрациях 1 мкМ, 5 мкМ и 10 мкМ, соответственно) с применением FACS. Применяли следующие пептиды: NRTN в качестве трансфецирующего пептида, WNT16 в качестве нетрансфецирующего пептида, FALL в качестве токсического пептида и TAT в качестве стандарта сравнения (положительного контроля) (см. фиг.12). Клетки MCF7 инкубировали в присутствии флуоресцентно меченных производных пептидов в течение 3 часов при 37°C в среде OptiMEM. После этого клетки обрабатывали протеиназой К в течение 30 мин. при 37°C с целью удаления связанных с поверхностью пептидов для того, чтобы гарантировать исследование только интернализированных пептидов. Затем клетки промыли в PBS и проанализировали с применением FACS.
Результаты показывают, что контрольный пептид TAT интернализируется внутрь клеток MCF (см. фиг.12A). Поглощение пептида TAT внутрь клеток демонстрирует линейную зависимость от концентрации пептида, что также согласуется с наблюдением, свидетельствующим о том, что пептид TAT функционирует в качестве реактива для трансфекции siРНК (см. выше). Нетрансфецирующий нетоксический пептид WNT16 не демонстрировал существенного уровня поглощения внутрь клеток MCF7 (фиг.12B), что согласуется с наблюдаемой неспособностью этого пептида осуществлять трансфекцию siРНК. Это также демонстрирует отсутствие простой корреляции между поглощением пептида и наличием положительно заряженных аминокислот. Токсический пептид FALL интернализировался внутрь клеток MCF, и процесс демонстрировал линейную зависимость от концентрации (фиг.12C).
Способный к трансфекции пептид NRTN также интернализировался внутрь клеток MCF7 (фиг.12D). Однако, в отличие от других пептидов, NRTN не демонстрировал линейной зависимости поглощения от концентрации. Фактически при повышении концентрации с 5 мкМ до 10 мкМ наблюдалось сильное повышение интернализации. Эти данные предполагают, что имеется пороговое значение, ниже которого поглощение является значимым, но слабым. Выше этого порогового значения наблюдается значительное повышение уровня поглощения клетками.
В целом, эти результаты демонстрируют способность обладающих трансфекционной активностью пептидов взаимодействовать с клетками и быть интернализированными в клетки. Кроме того, эти данные показывают, что проанализированные пептиды не только функционируют в качестве реактивов для трансфекции, но также действуют как пептиды, проникающие в клетки.
Пример 6: Сортинг, отфильтровывание и классификация кандидатных пептидов
С помощью объединения способов in silico и экспериментального скрининга в протеоме человека были выявлены пептидные последовательности, потенциально имеющие функциональные активности CPP или трансфекционных агентов. Обнаружено, что среди этих кандидатных молекул три пептида были способны осуществлять трансфекцию и не были токсическими, т.е., они обладали трансфекционной функциональной активностью при дозах, которые не оказывают негативного влияния на жизнеспособность клеток. Эти пептиды могут, среди прочего, служить в качестве модулей для разработки агента для доставки siРНК, являющегося частью лекарств на основе siРНК, которые будут разрабатываться в будущем.
6.1 Биоинформационный способ
Примененные способы in silico были основаны на библиотеке 30-мерных пептидов, которая содержала все перекрывающиеся пептиды, присутствующие в белках человека. Среди этих более чем 10×106 пептидов были выявлены 8630 пептидов, происходящих от 583 внеклеточных белков человека, которые соответствовали начальным условиям поиска (>30% положительно заряженных аминокислотных остатков (т.е., H+K+R) в составе 30-мерного пептида).
С целью получения окончательного списка пептидов, которые подвергали экспериментальным лабораторным исследованиям, количество кандидатных молекул дополнительно ограничили с применением этапов отрицательного и положительного отбора: в случаях, когда из-за наличия длинных основных участков наблюдалось множество пептидов, расположенных в одном и том же белке, такой множественности избегали. В большинстве таких случаев выбирали один представительный пептид, происходящий от данного белка. Пептиды, которые, по-видимому, трудно синтезировать или с которыми трудно работать, например, из-за присутствия множества дисульфидных мостиков или предсказанной плохой растворимости, исключали из дальнейшего рассмотрения. С целью выбора (из оставшегося списка) кандидатных молекул для экспериментальной оценки применили несколько параметров положительного отбора, включая (i) высокое значение ИЭТ и высокую степень гидрофобности; (ii) сходство последовательности с пептидом TAT; и (iii) предполагаемую функциональную активность в отношении взаимодействия с мембранами, присущую белкам, от которых происходят пептиды, таким как белки системы комплемента, бактерицидные факторы и липазы.
6.2 Способ экспериментальной оценки
При экспериментальной оценке кандидатные пептиды (выбранные в результате способа скрининга in-silico) были разделены на четыре класса: (a) нефункциональные пептиды (т.е., нетрансфецирующие и нетоксические), (b) нетрансфецирующие токсические пептиды, (c) трансфецирующие токсические пептиды и (d) трансфецирующие нетоксические пептиды.
Первый способ состоял в том, что кандидатные пептиды были отобраны на основании их нахождения на верхних позициях в списке, ранжированном по признаку значений ИЭТ и профилей гидрофобности, например, способные к трансфекции токсические пептиды CU025 и CPXM, не способные к трансфекции токсические пептиды CD026 и MMP25. Следовательно, этот фильтр позволяет выявить предполагаемые пептиды, проникающие в клетки (CPP), среди множества пептидов, обогащенных положительно заряженными аминокислотами.
Другой примененный фильтр был основан на сходстве последовательностей кандидатных пептидов с пептидом сравнения - TAT. Экспериментальной оценке были подвергнуты пять пептидов, обладающих наиболее выраженным сходством с пептидом TAT. Однако четыре из этих пептидов (включая пептид PROK2, демонстрирующий самую высокую степень сходства с TAT) не показали детектируемой трансфекционной активности в дозах, которые не оказывают негативного воздействия на жизнеспособность клеток. Пептид, происходящий от NRTN, был единственным функционально активным членом группы (т.е., был способен осуществлять трансфекцию). Этот пептид показал самую высокую трансфекционную функциональную активность в ходе проведенных исследований, при этом его эффективность была выше, чем даже у пептида TAT. Это свидетельствует о том, что трансфекционная активность данных пептидов определяется не только первичной аминокислотной последовательностью, но также определенными мотивами последовательности и, в частности, вторичными структурами.
При третьем способе для ограничения списка кандидатных пептидов применяли данные литературных источников и результаты анализа BLAST. Выбранные для экспериментальной оценки пептиды являлись пептидами, происходящими от белков, которым для проявления их активности необходимо взаимодействие с мембранами. Большинство отобранных пептидов не продемонстрировали какого-либо функционального фенотипического проявления (т.е., способности осуществлять трансфекцию). Даже пептиды, происходящие от белков, о которых хорошо известно, что они нарушают целостность мембран (таких как факторы системы комплемента или перфорин), не показали трансфекционной функциональной активности. Эти результаты предполагают, что для придания этим пептидам активности по нарушению целостности мембран могут быть необходимы должным образом структурированные домены (например, домен MACPF (Rosado, C.J. et al. (2008) Cell. Microbiol. 10, 1765-1774)). Очевидно, что эта функциональная активность не может воспроизводиться пептидами, даже если они соответствуют примененной стратегии поиска.
С другой стороны, в эту третью группу включены трансфецирующие нетоксические пептиды, происходящие от CPXM2 и ASM3B, соответственно, и токсические пептиды, происходящие от BPIL3 и FALL39. Интересно отметить, что некоторые из пептидов, классифицированных как токсические, происходили от бактерицидных пептидов. Такие пептиды оказывают негативное влияние на целостность мембран патогенов. В высоких концентрациях эти пептиды токсичны для раковых клеток человека. По крайней мере для пептида FALL было показано, что в определенном диапазоне концентраций он опосредует трансфекцию siРНК. Одним из объяснений этого результата может быть образование перфораций в плазматической мембране, через которые может происходить неспецифическое поглощение siРНК. Другим объяснением может быть опосредованное пептидом поглощение siРНК, которое маскируется токсичностью пептида. Кроме того, недавно предложенный механизм репарации мембран, вовлеченный в поглощение пептидов CPP (Palm-Apergi, C. et al. (2009) FASEB J. 23, 214-223), также может быть привлечен в качестве объяснения частичного проявления функциональной активности этими пептидами.
Однако тот факт, что эти пептиды снижают жизнеспособность клеток уже в концентрациях, которые необходимы для трансфекции, препятствует применению этого класса пептидов для доставки siРНК.
Пример 7: Определение параметров пептида, происходящего от NRTN
7.1 Структурные особенности пептида, происходящего от NRTN
Пептид, происходящий от неуртурина (NRTN) был кандидатной молекулой, выявленной в ходе настоящего скрининга, которая стабильно демонстрировала самый высокий уровень способности осуществлять трансфекцию siРНК в концентрациях, которые не оказывали негативного влияния на жизнеспособность клеток. Этот пептид способен образовывать нековалентные комплексы с siРНК, при этом нуклеиновая кислота сильно компактизируется. Эта особенность согласуется с результатом, показавшим, что siРНК, находящаяся в комплексе с NRTN, недоступна для интеркаляции бромида этидия. Как определено с применением анализа сдвига электрофоретической подвижности в геле, образование комплексов между NRTN и siРНК было максимальным при соотношении 1:50. Это соответствует соотношению 100 нМ siРНК к 5 мкМ пептида в применяемой здесь системе испытания функциональной активности in vitro (т.е., способности осуществлять трансфекцию). Однако, если концентрация NRTN в системе in vitro повышается до соотношений, превышающих соотношение, при котором наблюдается насыщение комплексов, наблюдается дополнительное увеличение трансфекционной активности. Этот результат может быть объяснен способностью свободного положительно заряженного пептида NRTN защищать комплексы siРНК-NRTN от разрушения анионными протеогликанами на поверхности клеток.
Что может служить механизмом, с помощью которого пептид NRTN опосредует трансфекцию siРНК? Образование комплексов с нуклеиновыми кислотами, несомненно, является одним из требований к функциональной активности пептида, так как все способные осуществлять трансфекцию пептиды демонстрируют такую особенность. Однако комплексообразование само по себе не является достаточным для опосредования трансфекции, поскольку также были выявлены пептиды, которые образуют комплексы с siРНК столь же хорошо или даже лучше, чем пептид TAT, но не обладают трансфекционной функциональной активностью. Кроме того, маловероятно, что композиция первичной последовательности, т.е., количество присутствующих заряженных и/или гидрофобных остатков, является единственным фактором, опосредующим функциональную активность. Оказалось, что многие пептиды, обладающие сходством последовательности с пептидом TAT (включая пептиды с очень высокой степенью сходства последовательностей), являются нефункциональными.
Одно из возможных объяснений наличия трансфекционной функциональной активности у пептида, происходящего от NRTN, можно обнаружить в его вторичной структуре. Выбор для проведения скрининга 30-мерного пептида (в противоположность большинству других способов, в которых применяют более короткие пептиды (Futaki, S. et al. (2001), см. выше; Crombez, L. et al. (2007) Biochem. Soc. Trans. 35, 44-46; Jafari, M and Chen, P. (2009) Curr. Top. Med. Chem. 9, 1088-1097)) имеет преимущество, заключающееся в том, что эти пептиды с более высокой вероятностью сворачиваются во вторичную структуру и поддерживают ее. NRTN является членом семейства белков фактора роста TGF и обладает сходством с GDNF и артемином, соответствующие структуры которых уже были определены (Eigenbrot, С. and Gerber, N. (1997) Nat. Struct, Biol. 4, 435-438; Wang, X. et al. (2006) Structure 14, 1083-1092).
Выравнивание последовательности GDNF крысы и последовательности NRTN человека и сравнение предполагаемых вторичных структур позволяет увидеть, что обладающий трансфекционной активностью отрезок пептида NRTN может образовывать вторичную структуру (см. фиг.10). Последовательность, соответствующая функционально активному пептиду NRTN, частично расположена на доступной поверхности белка и содержит положительно заряженный альфа-спиральный отрезок аминокислот. Выявление альфа-спиральных структур в составе NRTN полностью согласуется с существующей гипотезой о том, что альфа-спиральные структуры являются полезными с точки зрения проникновения в мембраны (Deshayes, S. et al. (2004), см. выше). Наблюдение, показавшее, что проанализированный пептид, происходящий от NRTN, включает полную альфа-спиральную структуру, а также окружающие области, свидетельствует в пользу пригодности настоящего способа скрининга более длинных пептидов. Остается неясным, является наличие альфа-спиральной структуры самой по себе (которая занимает 12 аминокислот в составе 30-мерного пептида) достаточным условием для опосредования эффективной трансфекции. Однако кажется вероятным, что по меньшей мере некоторые из дополнительных остатков также необходимы для проявления функциональной активности пептида.
С целью получения экспериментального подтверждения для этих предсказаний вторичной структуры провели дополнительный анализ пептида NRTN на присутствие элементов вторичной структуры с применением спектроскопии кругового дихроизма в УФ-области спектра (УФ-КД) (см. обзор в публикации: Whitmore, L. and Wallace, B.A. (2008) Biopolymers 89, 392-400). Данная методика позволяет осуществлять идентификацию элементов последовательности, сворачивающихся во вторичную структуру, на основании их определенного УФ-спектра в сравнении с неструктурированными отрезками, имеющими форму статистического клубка. Этот анализ проводили с применением спектрополяриметра Jasco J 715 (Jasco, Inc., Истон, Мэриленд, США) в диапазоне от 195 нм до 260 нм с шагом 0,1 нм и шириной полосы пропускания 1 нм. Кювета прибора имела длину 0,1 см. Пептиды применяли в концентрации 0,1 мг/мл (см. фиг.11).
Пептид FALL, для которого ранее было показано, что он сворачивается в альфа-спиральную структуру, применяли в качестве положительного контроля (Agerberth, В. et al. (1995) Proc. Natl. Acad. Sci. USA 92, 195-199). В водном растворе пептид FALL принимал конформацию статистического клубка. В присутствии 10% трифторэтанола (TFE) в качестве сорастворителя на спектре наблюдались характерные впадины при 208 нм и 222 нм, соответственно, которые становились еще более выраженными при повышении концентрации TFE (т.е., 25% TFE и 50% TFE; см. фиг.11A). Известно, что TFE стабилизирует и индуцирует образование вторичных структур в пептидах и белках (Buck, М. (1998) Q. Rev. Blophys. 31, 297-355).
При анализе пептида NRTN в тех же экспериментальных условиях, что применялись для пептида FALL, наблюдался аналогичный спектр, т.е., спектр со впадинами при 208 нм и 222 нм, соответственно. Следовательно, пептид NRTN на самом деле содержит альфа-спиральную область, которая была предсказана на основании данных по гомологии последовательностей (см. фиг.11B).
В противоположность этому, спектр, полученный для пептида ТАТ, не демонстрировал признаков того, что этот пептид сворачивается во вторичную структуру. Даже в присутствии 50% TFE этот пептид принимал конформацию статистического клубка (см. фиг.11C).
Кроме того, изучение способности к интернализации с применением анализа FACS продемонстрировало, что пептид NRTN функционирует не только в качестве реактива для трансфекции, например, в отношении молекул siРНК, но также в качестве пептида, проникающего в клетки, даже в отсутствие молекул нуклеиновой кислоты. Эти результаты свидетельствуют, что пептид NRTN также может представлять собой пригодный носитель для конъюгированной нагрузки, такой как другие пептиды или белки. Примечательно, что интернализация пептида NRTN, по-видимому, не обладает линейной зависимостью от применяемой концентрации. Скорее всего, по-видимому, существует специфическое пороговое значение, при превышении которого происходит поглощение клетками. Такой феномен наличия порогового значения также наблюдали в случае интернализации других пептидов, таких как TAT и поли-Arg (Duchardt, F. et al. (2007), см. выше).
Более того, анализ FACS выявил сильно выраженное накопление пептида FALL в клетках. Этот результат согласуется с наблюдением того факта, что FALL действует в качестве цитотоксического пептида. Для проявления токсичности необходимо прямое физическое взаимодействие пептида с целевой клеткой. Однако, в отличие от пептида NRTN, процесс интернализации FALL характеризуется линейной зависимостью от его концентрации. Следовательно, для токсических свойств пептида FALL не существует порогового значения, что согласуется с полученными данными по жизнеспособности клеток, демонстрирующими наличие зависимости цитотоксичности от концентрации.
С другой стороны, нетрансфецирующий пептид WNT16 не демонстрировал существенной степени интернализации внутрь клеток. Таким, образом, единственный факт наличия положительно заряженных аминокислот в первичной последовательности пептидов не является признаком применимости пептида в качестве пептида СРР. Настоящие результаты служат дополнительными свидетельствами в пользу того, что мотивы последовательности, сворачивающиеся во вторичную структуру (как в пептиде NRTN) могут являться основными детерминантами для поглощения клетками пептидов CPP.
7.2 Пептид, происходящий от NRTN, обладает трансфекционной активностью в присутствии сыворотки
Терапевтическая доставка siРНК представляет собой одно из многообещающих применений выявленных CPP-подобных пептидов человека. Замена не принадлежащих человеку, происходящих от патогенов, молекул на принадлежащие человеку последовательности, демонстрирующие схожую или даже более высокую функциональную активность, является преимуществом для терапевтических способов, так как это позволяет снизить риск того, что применяемые для трансфекции модули могут быть иммуногенными. Терапевтическое применение данного пептида также требует, чтобы указанный пептид обладал существенной (трансфекционной) активностью. Дополнительно, наблюдаемые in vitro активности пептида также должны проявляться в условиях in vivo.
Большинство способов анализа, описанных в этом документе, осуществляли в «стандартных условиях in vitro» для выявления опосредованной пептидами трансфекции, которые хорошо известны специалистам в данной области (см., например, Simeoni, F. et al. (2003) Nucleic Acids Res. 31, 2717-2724; Richard, J.P. et al. (2005) J. Biol. Chem. 280, 15300-15306; Abes, R. et al. (2007) Biochem. Soc. Trans. 35, 775-779; Kumar, P. et al. (2007) Nature 448, 39-43; Mueller, J. et al. (2008) Bioconjug. Chem. 19, 2363-2374; Sugita, Т. et al. (2008) Br. J. Pharmacol. 153, 1143-1152). Соответственно, инкубацию в качестве начального «этапа трансфекции» проводят в основном в условиях отсутствия сыворотки. Добавление сыворотки на этом этапе препятствует способности пептидов CPP осуществлять трансфекцию (см. фиг.13; см. также публикацию: Ignatovich, I.A. et al. (2003), см. выше). Однако возможность терапевтического применения (CPP-подобных) пептидов, очевидно, требует вступления в контакт с сывороткой. Примечательно, что в присутствии среды (хоть и с пониженной концентрацией сыворотки) пептид NRTN сохраняет способность опосредовать трансфекцию (см. фиг.13).
7.3 Пептид, происходящий от NRTN, связывается с эпителиальными клетками и интернализируется внутрь этих клеток в модельной культуре клеток гематоэнцефалического барьера
Ранее сообщалось, что пептиды, проникающие в клетки, не только можно применять в качестве носителей при трансфекции с целью доставки в клетку siРНК, но они также, по-видимому, обладают функциональной активностью в проникновении сквозь такие барьеры, как гематоэнцефалический барьер, например, с целью опосредования процесса РНКi в головном мозге (Mathupala, S.P. (2009) Expert Opin. Ther. Pat. 19, 137-140). Можно предположить, что пептид NRTN также может быть функционально активен в этом отношении, так как NRTN является нейротрофическим фактором, вырабатываемым клетками глии (Sariola, H. and Saarma, M. (2003) J. Cell Sci. 116, 3855-3862), который потенциально обладает высокой способностью доступа в центральную нервную систему.
Для оценки потенциальных взаимодействий пептида, происходящего от NRTN, с эндотелиальными клетками, образующими гематоэнцефалический барьер, клетки hCMEC/D3 или первичную культуру эндотелиальных клеток головного мозга человека подвергали воздействию пептида, происходящего от NRTN, в модели гематоэнцефалический барьера (ГЭБ) (Weksler, В.В. et al. (2005) FASEB J. 19, 1872-1874; Poller, В. et al. (2008) J. Neurochem. 107. 1358-1363). Результаты этого анализа (см. фиг.14) выявили, что пептид, происходящий от NRTN, накапливается (те., интернализируется) в этих экспериментальных условиях в эндосомальных структурах. В эндотелиальных клетках ГЭБ перенос через слой клеток гидрофильных молекул эффективно предотвращается их плотными контактами, и эндосомы являются основными компонентами трансцитозольных механизмов, которые позволяют осуществлять контролируемый перенос макромолекул через гематоэнцефалический барьер. Таким образом, пептид, происходящий от NRTN, располагается в компартменте, который играет важную роль в функционировании ГЭБ (т.е., в опосредовании и контроле транспорта через ГЭБ).
Возможное дополнительное расширение области терапевтического применения пептидов CPP может быть связано с их сочетанием с нацеливающими молекулами, такими как антитела и фрагменты антител.
Пример 8: Применение пептида, происходящего от NRTN, для внутриклеточной доставки про-апоптотических пептидов
Способность к интернализации пептидов, происходящих от NRTN (см. выше), свидетельствует, что эти пептиды функционируют не только в качестве реактивов для трансфекции, например, в отношении молекул siРНК, но также в качестве «классических» пептидов, проникающих в клетки. Эти результаты свидетельствуют, что пептид NRTN также может представлять собой пригодный носитель для конъюгированной нагрузки, такой как другие пептиды или белки.
С целью определения, способна ли последовательность, происходящая от NRTN, опосредовать поглощение клетками пептидов, произвели конъюгацию различных биологически активных пептидов с NRTN. Для примененных в качестве партнеров для конъюгации пептидов была показана способность взаимодействовать с цитоплазматическими целевыми белками, участвующими в опосредовании апоптоза. Иными словами, при экспрессии или активной доставке в цитоплазму раковых клеток эти пептиды вызывают апоптоз (т.е., они являются «про-апоптотическими»). Однако эти про-апоптотические пептиды не могут проникать через биологические мембраны сами по себе. Только их конъюгация или соединение с известными пептидами CPP, такими как пептид TAT, пенетратин и поли-Arg, позволяет добиться поглощения клетками и, таким образом, вызвать апоптоз.
Для оценки функциональной активности в отношении проникновения в клетки, присущей последовательностям, происходящим от NRTN, применяли следующие молекулы-партнеры для конъюгации: (i) пептид, происходящий от ядерного рецептора Nur77, который взаимодействует с белком BCL2 и превращает его в про-апоптотическую молекулу; и (ii) пептид, происходящий от 4E-BP1, который взаимодействует с фактором трансляции eIF4E, связывающимся со структурой 5'-кэпа в составе мРНК и, как было выяснено, модулирует апоптоз в раковых клетках.
8.1 NRTN-опосредованное поглощение внутрь клеток про-апоптотического пептида, происходящего от NUR77
Nur77 - это ядерный рецептор-сирота, способный взаимодействовать с ключевыми посредниками, участвующими в апоптозе, такими как белки BCLB и BCL2. Взаимодействие Nur77 с белком BCL2 вызывает конформационные изменения белка BCL2, которые приводят к экспонированию домена BH3. Это превращает BCL-2 в белок с про-апоптотической функцией (Lin, В. et al. (2004) Cell 116, 527-540; Luciano, F. et al. (2007) Blood 109, 3849-3855). Такого же превращения можно достигнуть также с применением пептидов, происходящих от родственных белков, таких как Nor1 (Kolluri, S.K. et al. (2008) Cancer Cell 14, 285-298).
Соответствующие последовательности, взаимодействующие с BCL2, в составе Nor1 и Nur77 можно выровнять следующим образом:
Nor1  (SEQ ID NO: 70)
(SEQ ID NO: 70)
Nur77  (SEQ ID NO: 71)
(SEQ ID NO: 71)
Еще более короткий пептид, способный взаимодействовать с BCL-2, состоит из 12 C-концевых аминокислот белка Nor1: FSRSLHSLLVDL (SEQ ID NO: 72).
Несмотря на его доказанную способность превращать BCL-2 в про-апоптотическую молекулу, добавление последнего пептида (т.е., «Nor/Nur»; SEQ ID NO: 72) к раковым клеткам, даже в высоких концентрациях, не является достаточным для индукции апоптоза, так как клеточный целевой белок расположен в цитоплазме, но пептид сам по себе не способен эффективно проникать через клеточную мембрану для достижения целевой молекулы. Коротко, клетки рака груди MCF-7 инкубировали в присутствии этого пептида в течение 24 ч. Снижения жизнеспособности клеток или индукции апоптоза не наблюдалось (см. описание анализа цитотоксичности и жизнеспособности в примере 1). Аналогично, воздействие на эти клетки пептида CPP NRTN человека также не влияло на жизнеспособность клеток или не приводило к индукции апоптоза (см. фиг.15).
Для того, чтобы проанализировать, обладает ли на самом деле пептид NRTN функциональной активностью CPP, была получена гибридная последовательность, которая включает отрезок, состоящий из пептида, происходящего от Nur77, на N-конце, присоединенный к части пептида NRTN, расположенной на C-конце. При определении пригодного положения для соединения было обнаружено, что C-концевая часть пептида Nur77 была схожа с отрезком последовательности в составе пептида NRTN, и эту область выбрали в качестве точки соединения. Аминокислотные последовательности полученного в результате химерного пептида NurNRTN, а также двух пептидов-партнеров схематично изображены в нижней части фиг.15. Химерный пептид сохраняет полноразмерную последовательность отрезка из Nur77 (практически в неизменном виде) и укороченный N-концевой отрезок пептида NRTN. Полученный в результате пептид обладает такой же длиной (30 аминокислот), что и исходный пептид NRTN.
NurNRTN имеет следующую аминокислотную последовательность:
 (SEQ ID NO: 73).
(SEQ ID NO: 73).
Для определения, сохраняются ли у химерного пептида NurNRTN свойства связывания с BCL2, присущие пептиду, происходящему от Nur77, соответствующие пептиды NurNRTN и NRTN присоединили к иодоацетильным шарикам (Pierce Biotechnology, Inc., Рокфорд, Иллинойс, США). Шарики инкубировали с рекомбинантным BCL2 (Calbiochem/Merck, Дармштадт, Германия) и промывали с помощью PBS и 0,5 М NaCl, 0,025 NaN3, 0,05% Твин-20 для удаления несвязанного белка. Специфическое связывание BCL2 с иммобилизованным химерным пептидом NurNTRN определяли, элюируя связанный белок с шариков с применением буфера для элюции (pH 2,8), перенося элюированную фракцию на нитроцеллюлозную мембрану (Invitrogen Corporation, Карлсбад, Калифорния, США) и определяя белок с применением набора для обратимого окрашивания белков MemCode Reversible Protein Stain Kit (Pierce Biotechnology, Inc., Рокфорд, Иллинойс, США). Результаты этого анализа показали, что белок BCL2 выявляется в элюате с шариков, которые были покрыты химерным пептидом NurNRTN. В противоположность этому, с шариков, покрытых пептидом NRTN, элюировались очень небольшие количества белка BCL2. Следовательно, химерный пептид NurNRTN сохраняет способность связываться с BCL2.
Далее была проведена оценка того, способен ли химерный пептид NurNRTN проникать через клеточные мембраны и тем самым индуцировать про-апоптотическую активность внутри клеток. В качестве модели применяли клетки рака груди MCF-7. Экспериментальный подход был таким же, как описанный выше (см. пример 1). При концентрациях пептида, которые не вызывали токсических явлений при тестировании пептидов Nur77 и NRTN, соответственно, химерный пептид демонстрировал выраженное токсическое действие, что также выражается в индукции апоптоза (см. фиг.15). Этот эффект был дозозависимым: цитотоксичность возрастала при повышении концентрации пептида.
В качестве контроля произвели присоединение функционально неактивной мутантной формы пептида NUR к пептиду NRTN. Этот пептид не оказывал негативного влияния на жизнеспособность клеток. Дополнительно, присоединение пептида NUR к функционально неактивному пептиду WNT16 также не оказывало негативного влияния на жизнеспособность клеток.
Эти результаты демонстрируют, что молекулы, полученные в результате соединения последовательностей, происходящих от NRTN, с пептидами, которые сами по себе не способны проникать в клетки, могут попадать внутрь клеток и проявлять внутриклеточную активность. Иначе говоря, соответствующая NRTN часть химерного пептида функционирует в качестве носителя, необходимого для проявления пептидом Nur77 (т.е., нагрузкой) про-апоптотических свойств внутри клетки. Дополнительно, эти результаты свидетельствуют в пользу того, что последовательность, происходящая от NRTN, которая несет изменения в своей амино-концевой области, сохраняет функциональную активность пептида CPP.
8.2 NRTN-опосредованное поглощение внутрь клеток про-апоптотического пептида, происходящего от 4E-BP1
eIF4E - это фактор трансляции, который связывается со структурой 5'-кэпа в составе мРНК и играет важную роль в обеспечении жизнеспособности клеток. Негативное воздействие на функциональную активность eIF4E может привести к апоптозу в раковых клетках. Белок 4E-BP1 связывается и таким образом модулирует/препятствует функциональной активности фактора eIF4E. В связи с этим повышение уровней белка 4E-BP1 приводит к ингибированию трансляции и тем самым - к индукции апоптоза в раковых клетках благодаря осуществляемой им модуляции функциональной активности фактора eIF4E (Flynn, A. and Proud, C.G. (1996) Cancer Surv. 27, 293-310; Robert, F. and Pelletier, J. (2009) Expert Opin. Ther. Targets 13, 1279-1293).
Про-апоптотическая функциональная активность полноразмерного 4E-BP1 может быть достигнута также с помощью короткого пептида длиной 20 аминокислот (Tomoo, К. et al. (2006) Biochem. J. 140, 237-246). Этот пептид содержит мотив связывания с eI4FE (YXRXXLB, где X - любая аминокислота и B - гидрофобный остаток; Moerke, N.J. et al. (2007) Cell 128, 257-267). Дополнительный анализ показал, что три оставшихся аминокислотных остатка в составе мотива связывания (т.е., Y, R, L) важны для проявления про-апоптотической функциональной активности (Marcotrigiano, J. et al. (1999) Mol. Cell 3, 707-716). Мутации по этим остаткам (например, замена на остатки глицина) приводит к превращению активных пептидов, происходящих от 4EBP1, в неактивные производные.
Аминокислотные последовательности активных и неактивных пептидов 4EBP1, применяемых в данном изобретении, были следующие (для всех последовательностей см. также фиг.16, верхняя часть):
 (SEQ ID NO: 74)
(SEQ ID NO: 74)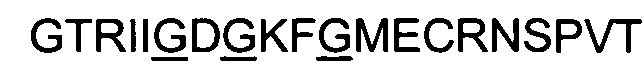 (SEQ ID NO: 75)
(SEQ ID NO: 75)
Несмотря на то, что была доказана способность 4E-BP1 блокировать eIF4E, простое добавление пептидов, происходящих от 4E-BP1, к раковым клеткам, даже в высоких концентрациях, не является достаточным для индукции апоптоза, так как клеточный целевой белок расположен в цитоплазме, но пептид сам по себе не способен эффективно проникать через клеточную мембрану для достижения целевой молекулы. Коротко, клетки рака груди MCF-7 инкубировали в присутствии этого пептида в течение 24 ч. Снижения жизнеспособности клеток или индукции апоптоза не наблюдалось (см. описание анализа цитотоксичности и жизнеспособности в примере 1). Аналогично, воздействие на эти клетки пептида CPP NRTN человека также не влияло на жизнеспособность клеток или не приводило к индукции апоптоза (см. фиг.16, верхняя часть).
Ранее было показано, что присоединение известных пептидов CPP, таких как пептид TAT, к пептидам, происходящим от 4EPB1, приводит к поглощению химерного пептида клетками (Ko, S.Y. et al. (2009) Clin. Cancer Res. 15, 4336-4347). В данном примерен применяли следующие химерные пептиды TAT/eIFE4:
 (SEQ ID NO: 76)
(SEQ ID NO: 76) (SEQ ID NO: 77)
(SEQ ID NO: 77)
Клетки рака груди MCF-7, которые инкубировали в течение 24 ч в присутствии этих химерных пептидов TAT/4E-BP1, демонстрировали явные признаки снижения жизнеспособности клеток и цитотоксичности в результате индукции апоптоза (см. описание анализа цитотоксичности и жизнеспособности в примере 1) при концентрации 20 мкМ. Этот эффект специфически опосредован функционально активной (т.е., обладающей про-апоптотическим действием) последовательностью пептида 4E-BP1, так как соответствующий мутантный вариант был полностью неактивен (см. фиг.16, средняя часть).
Для того, чтобы проанализировать, обладает ли на самом деле пептид NRTN функциональной активностью CPP, была получена гибридная последовательность, которая включает часть пептида NRTN на N-конце, присоединенную к отрезку активного или неактивного пептида, происходящего от 4EBP1, расположенному на C-конце. Аминокислотные последовательности полученных в результате двух химерных пептидов схематично изображены в нижней части фиг.16. Химерные пептиды сохраняют полноразмерный отрезок последовательности из 4E-BP1, а также полноразмерный пептид NRTN, что дает в сумме длину 50 аминокислот. Таким образом, эти молекулы существенно длиннее, чем известные пептиды CPP.
Аминокислотные последовательности активного и неактивного химерных пептидов NRTN/4E-BP1 были следующие:
NRTN4E-BP1 (SEQ ID NO: 78)

NRTNinact4E-BP1 (SEQ ID NO: 79)

Далее была проведена оценка того, способен ли химерный пептид NRTN4E-BP1 проникать через клеточные мембраны и тем самым индуцировать про-апоптотическую активность внутри клеток. В качестве модели применяли клетки рака груди MCF-7. Экспериментальный подход был таким же, как описанный выше (см. пример 1). При концентрациях пептида, которые не вызывали токсических явлений при тестировании пептидов 4E-BP1 и NRTN, соответственно, химерный пептид демонстрировал заметное токсическое действие, что также выражается в индукции апоптоза (см. фиг.16, средняя часть). Этот эффект был дозозависимым: цитотоксичность возрастала при повышении концентрации пептида.
Дополнительно, химерный пептид, содержащий NRTN, демонстрировал существенно более высокую эффективность, по сравнению со своим аналогом, содержащим пептид TAT. Кроме того, наблюдаемое цитотоксическое действие специфически опосредуется функционально активной (т.е., обладающей про-апоптотическим действием) частью последовательности пептида 4E-BP1, так как соответствующий мутантный вариант химерного пептида был неактивен (см. фиг.16, средняя часть). Присоединение пептида 4E-BP1 к пептиду WNT16 не оказывало негативного влияния на жизнеспособность клеток.
Эти результаты демонстрируют, что молекулы, полученные в результате соединения последовательностей, происходящих от NRTN, с пептидами, которые сами по себе не способны проникать в клетки, могут попадать внутрь клеток и проявлять внутриклеточную активность. Прямое сравнение с химерными пептидами, содержащими пептид TAT, выявило, что химерные пептиды, содержащие пептид NRTN, обладают более высокой эффективностью. Эти результаты также свидетельствуют в пользу того, что последовательность, происходящая от NRTN, которая несет изменения в своей карбокси-концевой области, сохраняет функциональную активность пептида CPP. Наконец, применяя последовательности, происходящие от NRTN, можно получать функционально активные пептиды CPP, которые имеют длину по меньшей мере 50 аминокислот.
Настоящее изобретение, наглядное описание которого приведено в этом документе, может применяться на практике в отсутствие любого элемента или элементов, ограничения или ограничений, не раскрытых специально в этом документе. Таким образом, например, термины «содержащий», «включающий» и т.д. следует понимать в расширительном толковании и без ограничений. Дополнительно, применяемые в этом документе термины и выражения были использованы в качестве терминов и описаний, и не накладывают ограничений, а также в использовании таких терминов и выражений не имеется намерения исключить какие-либо особенности, эквивалентные продемонстрированным и описанным особенностям или их части, и признается, что в пределах объема заявленного изобретения возможны различные модификации. Таким образом, следует понимать, что несмотря на то, что настоящее изобретение было специфически раскрыто с помощью воплощений и возможных особенностей, специалист в данной области может прибегнуть к модификациям и вариантам приведенных воплощений изобретения, и подразумевается, что такие модификации и варианты входят в объем настоящего изобретения.
В этом документе изобретение было описано в широком смысле и в общих чертах. Каждый из более узких видов и подгрупп, попадающих в пределы родового раскрытия, также образует часть изобретения. Сюда относится родовое описание изобретения с положительными и отрицательными признаками, отсекающими любой объект от рода объектов, несмотря на то, был ли исключаемый материал специфически перечислен в этом документе или нет.
Другие воплощения указаны в приведенной далее формуле изобретения. Кроме того, в случаях, когда свойства или особенности изобретения описаны в терминах групп Маркуша, специалисту в данной области будет понятно, что изобретение также тем самым описывается в терминах любого отдельного члена или подгруппы членов группы Маркуша.









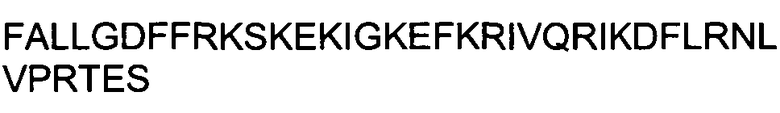







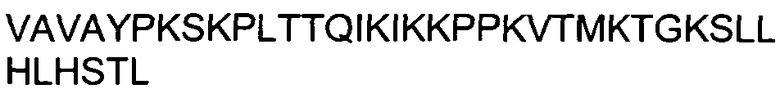










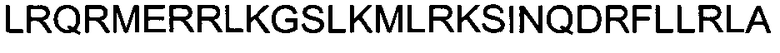
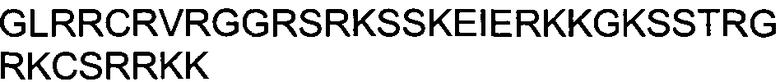










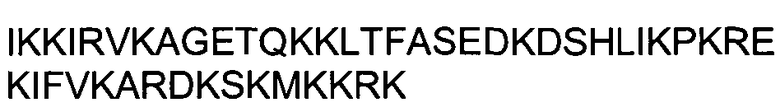









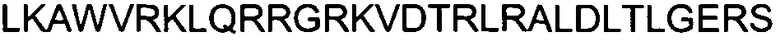








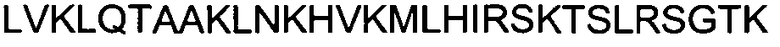



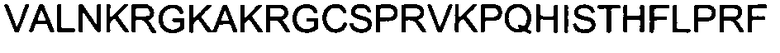




| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛИ | 2011 |
|
RU2636461C2 |
| ОПОСРЕДОВАННОЕ РНКi ИНГИБИРОВАНИЕ Rho-КИНАЗЫ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ НАРУШЕНИЙ | 2006 |
|
RU2432165C2 |
| iPHK-ОПОСРЕДОВАННОЕ ИНГИБИРОВАНИЕ СВЯЗАННЫХ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ АЛЬФА СОСТОЯНИЙ | 2007 |
|
RU2469090C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2011 |
|
RU2595389C2 |
| ЛЕЧЕНИЕ НАРУШЕНИЙ ЦНС | 2007 |
|
RU2426544C2 |
| НОВЫЕ ПРОНИКАЮЩИЕ В КЛЕТКУ ПЕПТИДЫ | 2013 |
|
RU2670488C2 |
| ПОЛИПЕПТИДЫ ТРАНСПОЗАЗЫ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2735700C2 |
| ФОСФОДИЭСТЕРАЗА 4D7 В КАЧЕСТВЕ МАРКЕРА ДЛЯ АГРЕССИВНОГО ГОРМОН-ЧУВСТВИТЕЛЬНОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2010 |
|
RU2575076C2 |
| МНОГОЦЕПОЧЕЧНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР И ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2663725C2 |
| ИНГИБИТОРЫ АПОПТОЗА И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2582247C2 |






















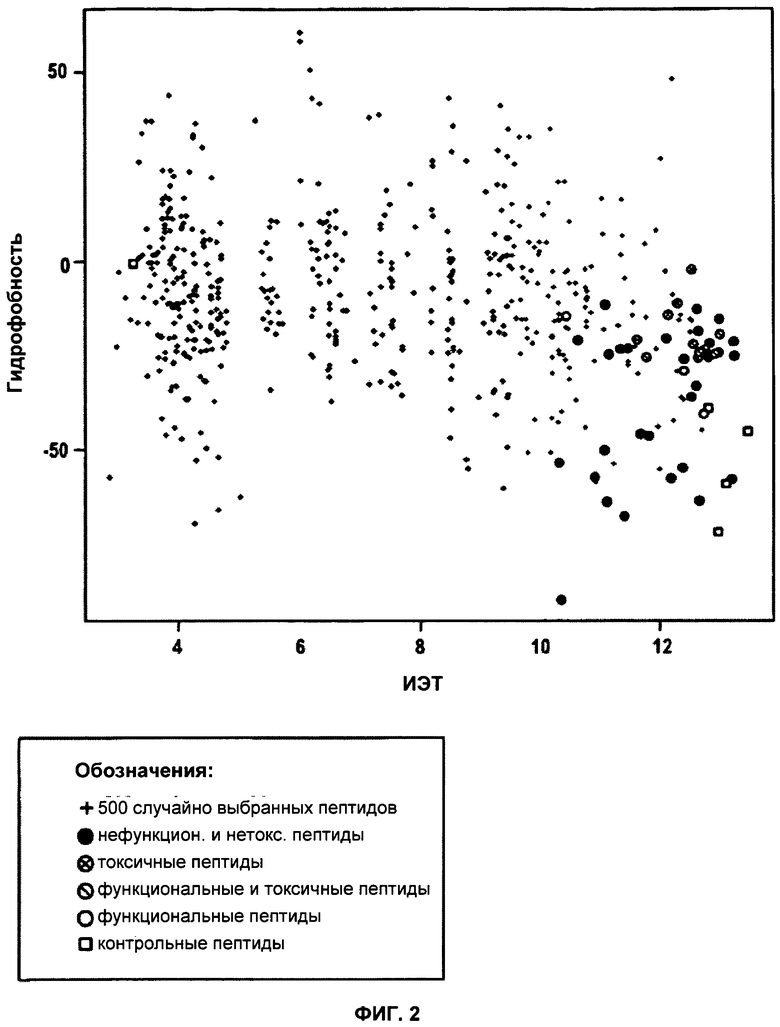
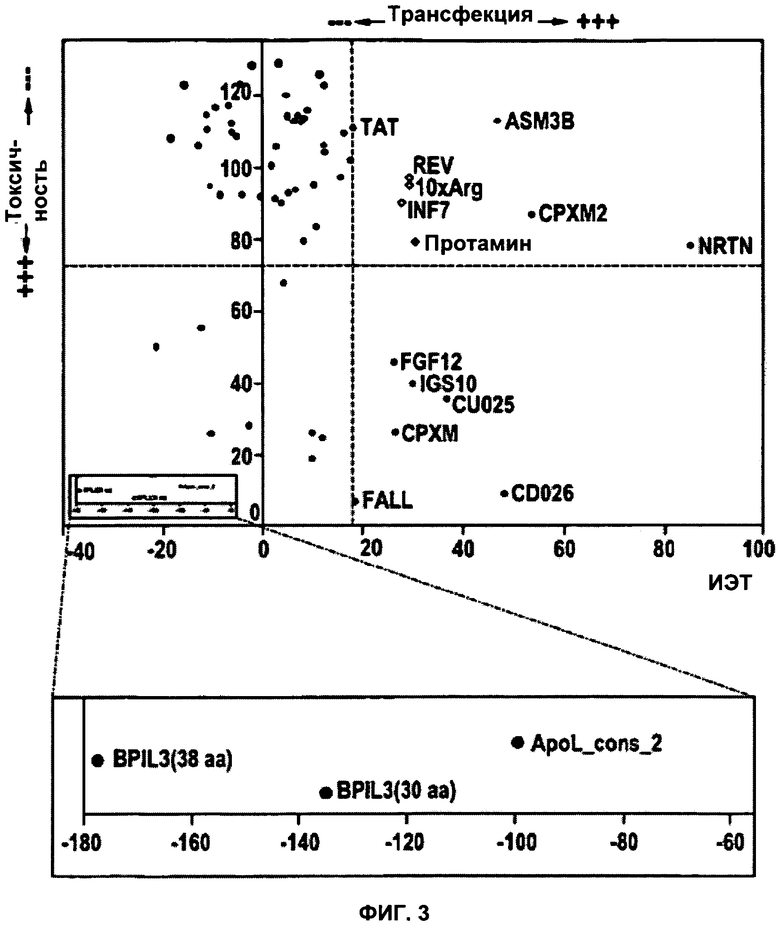
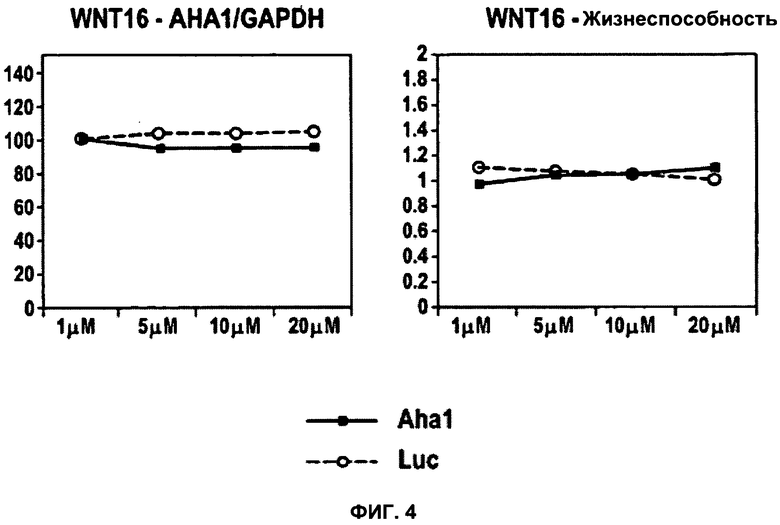
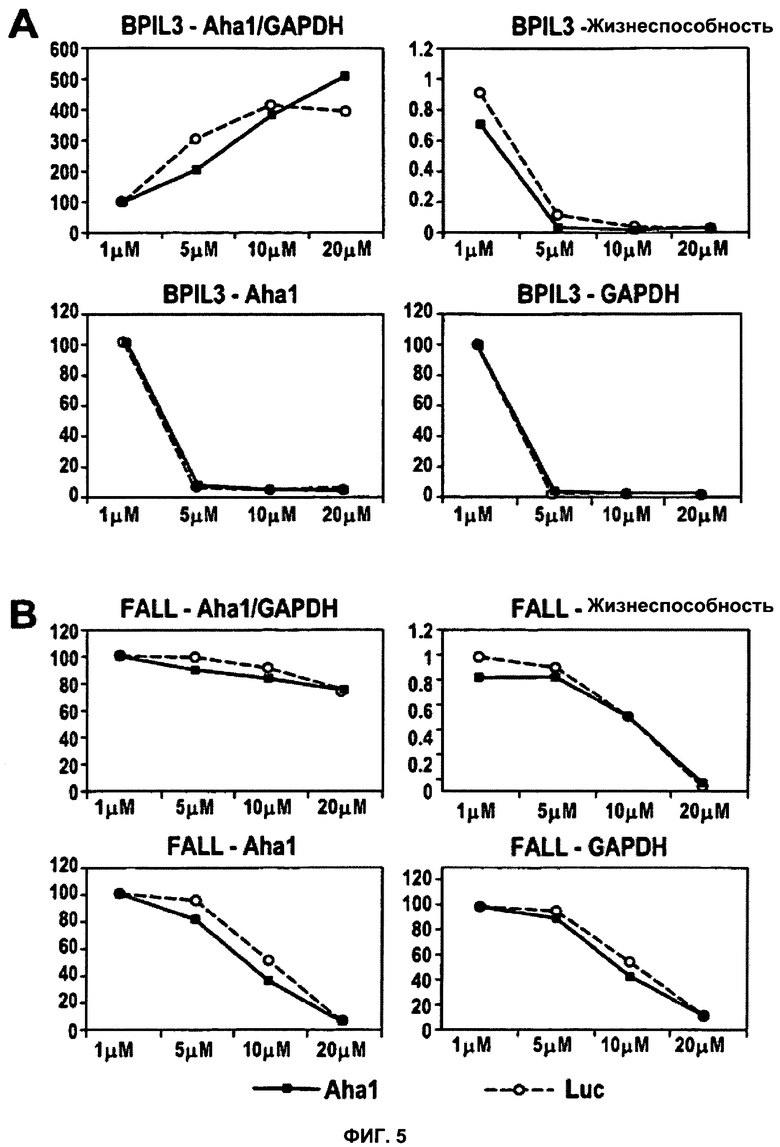
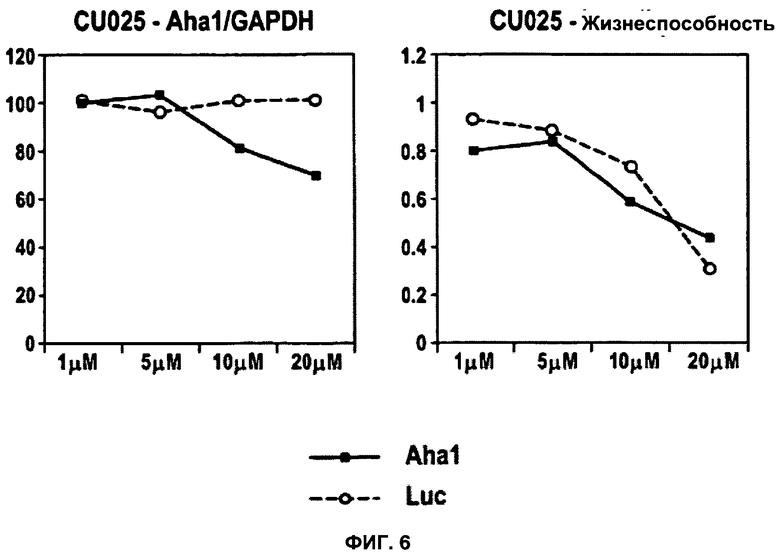
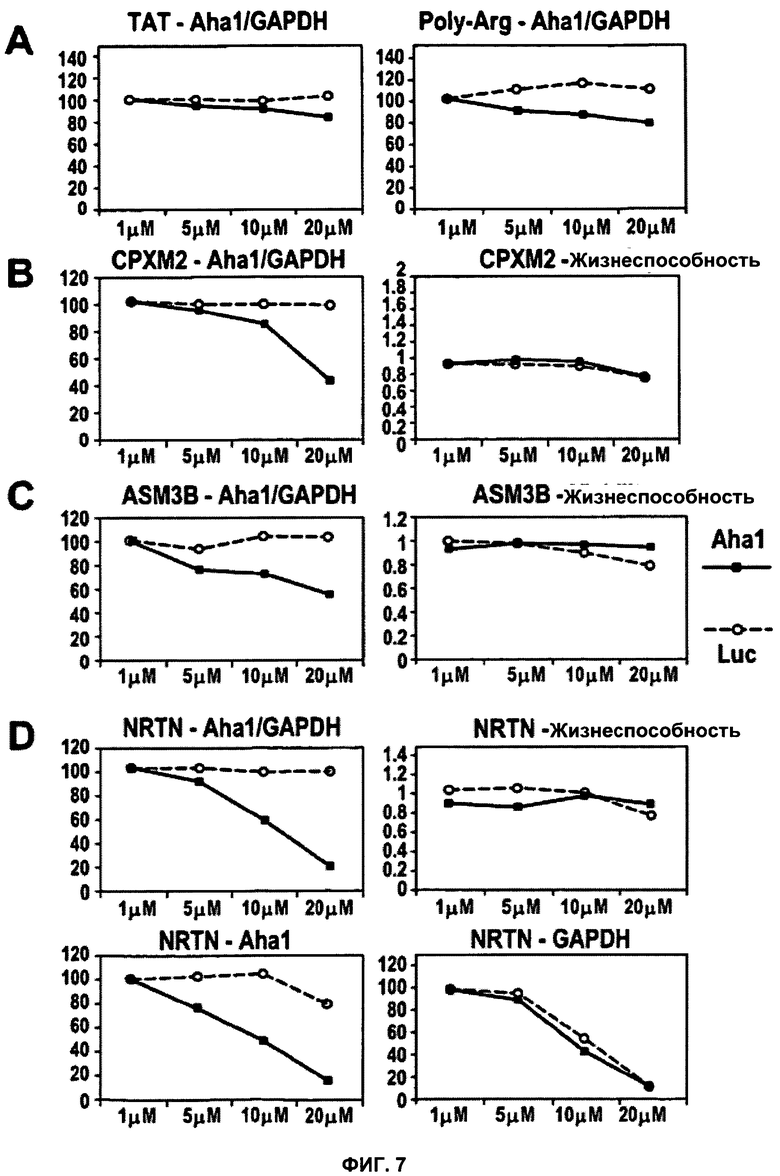
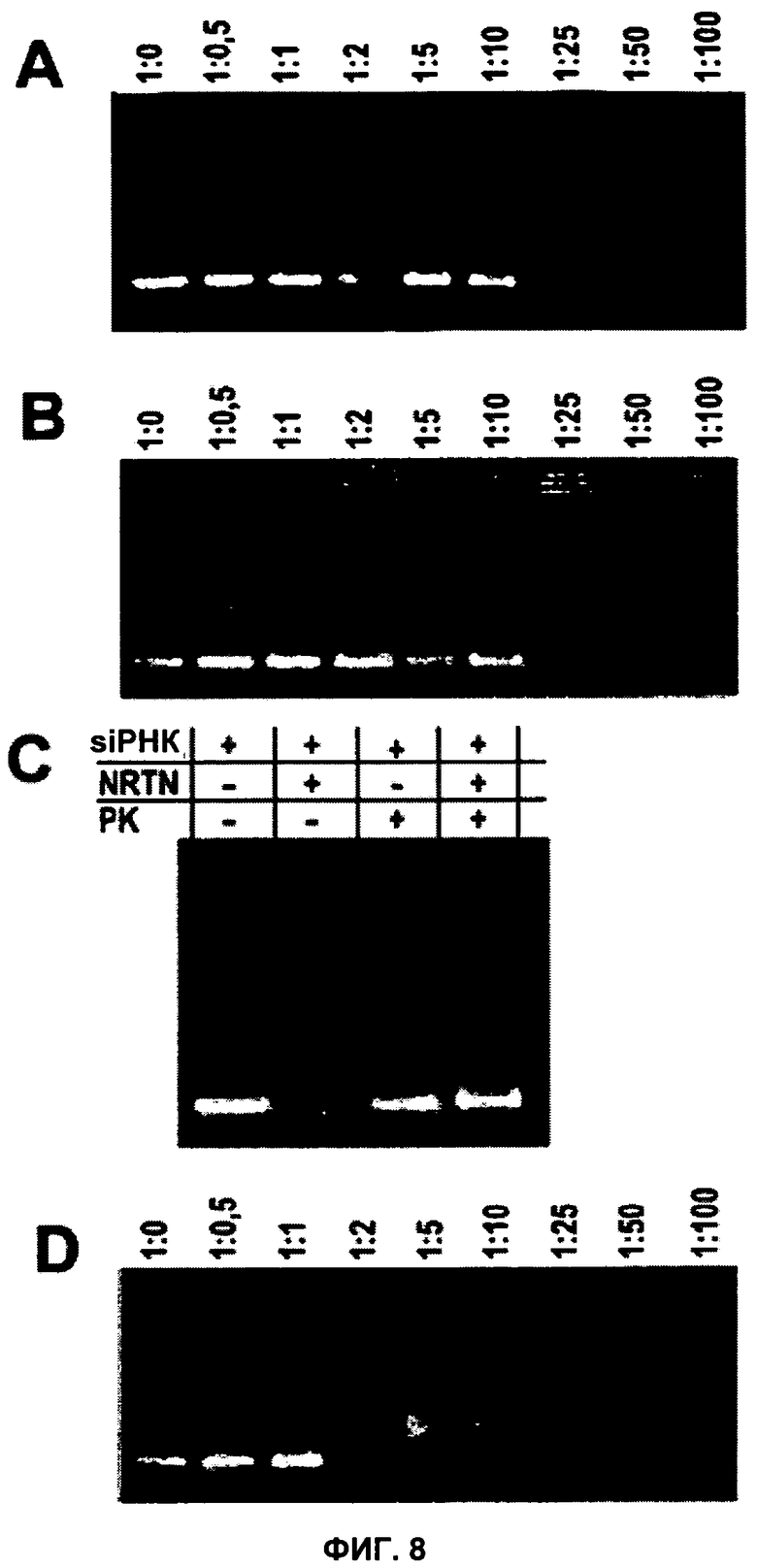
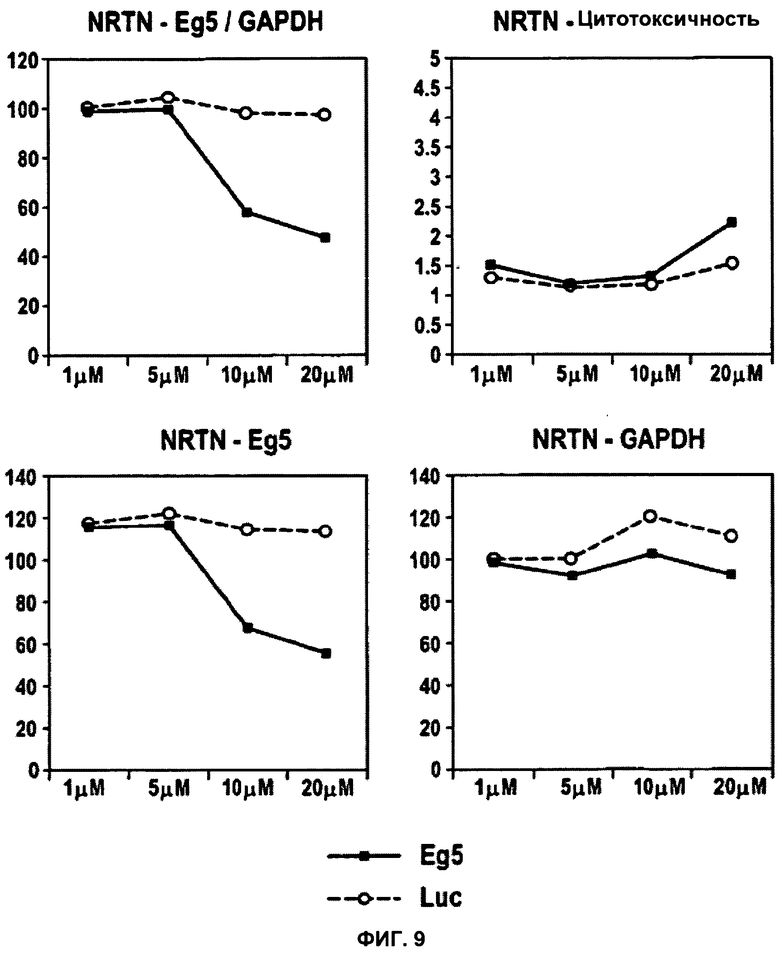

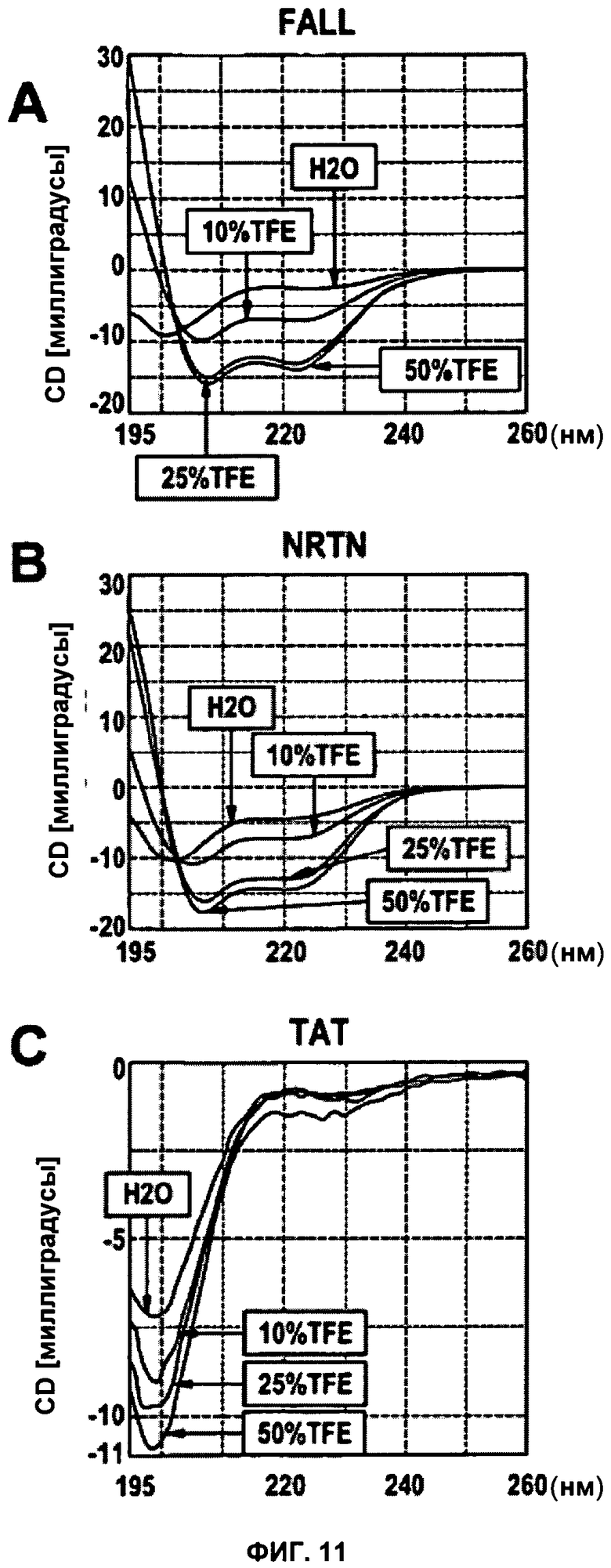
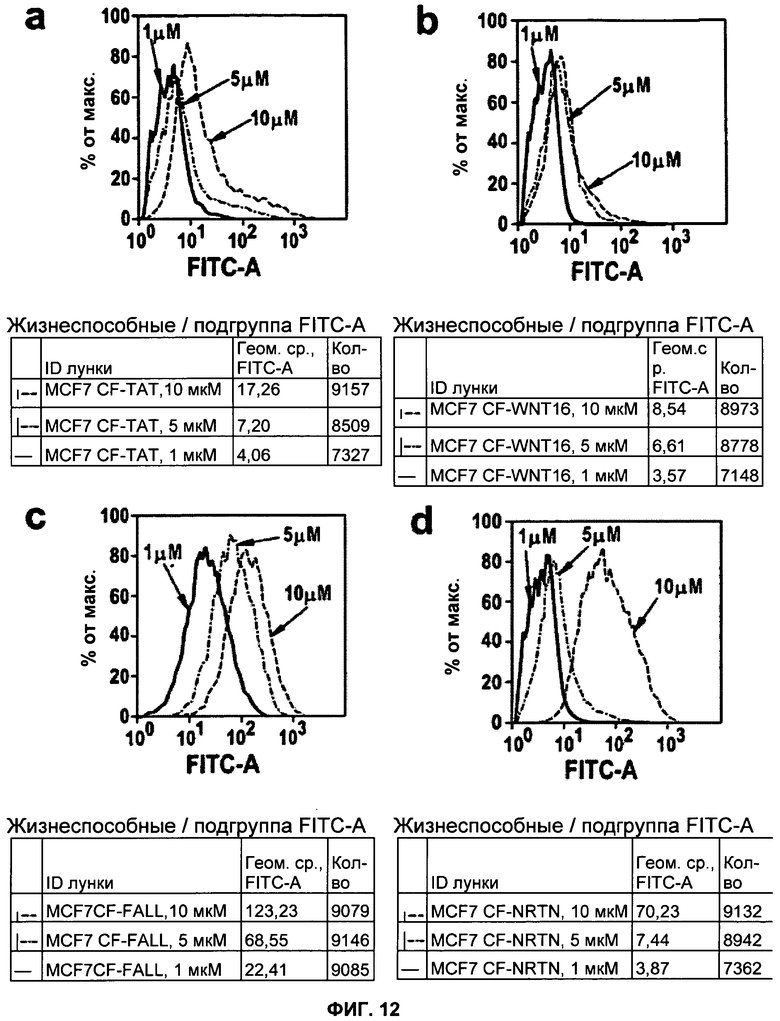
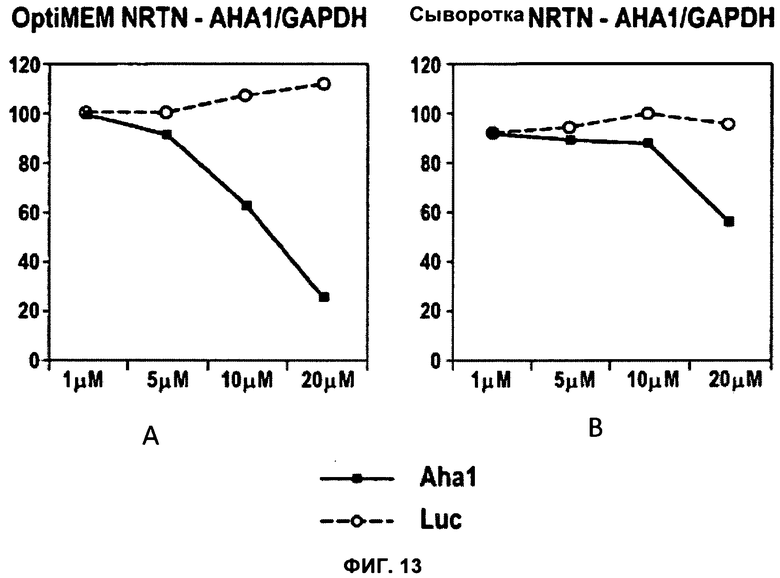
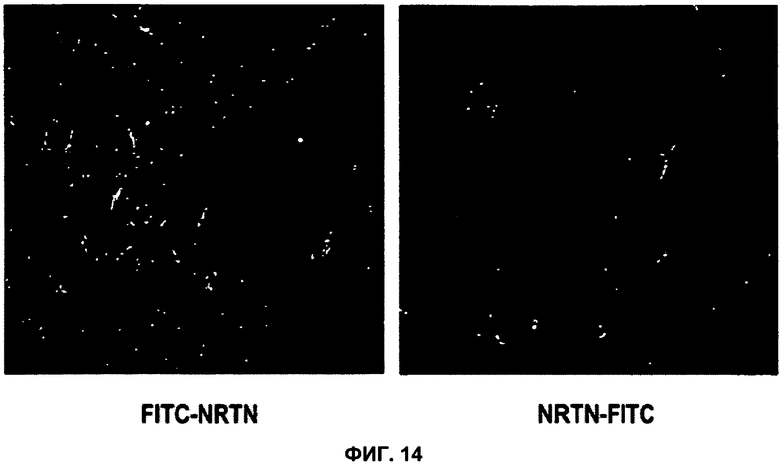
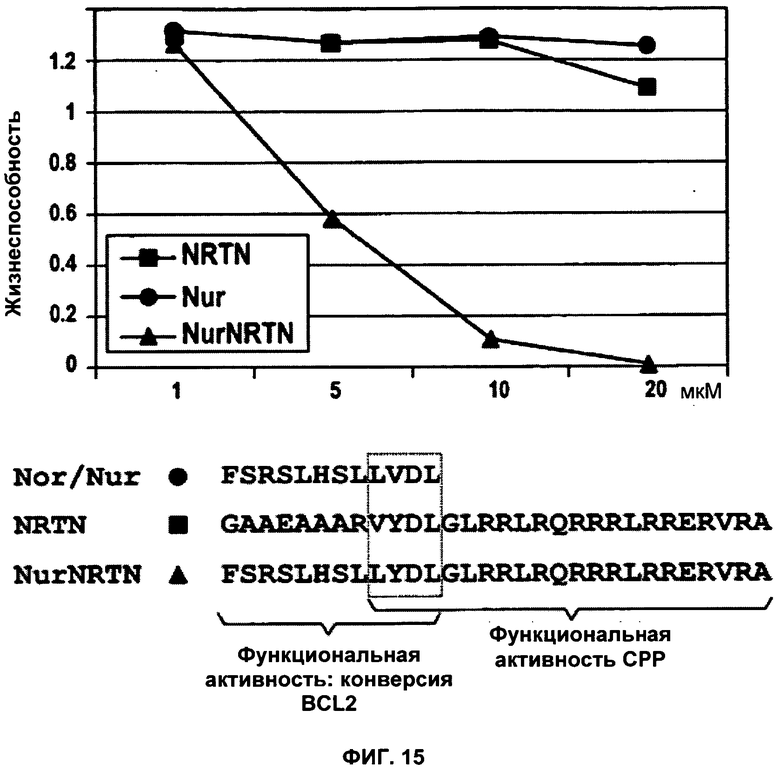
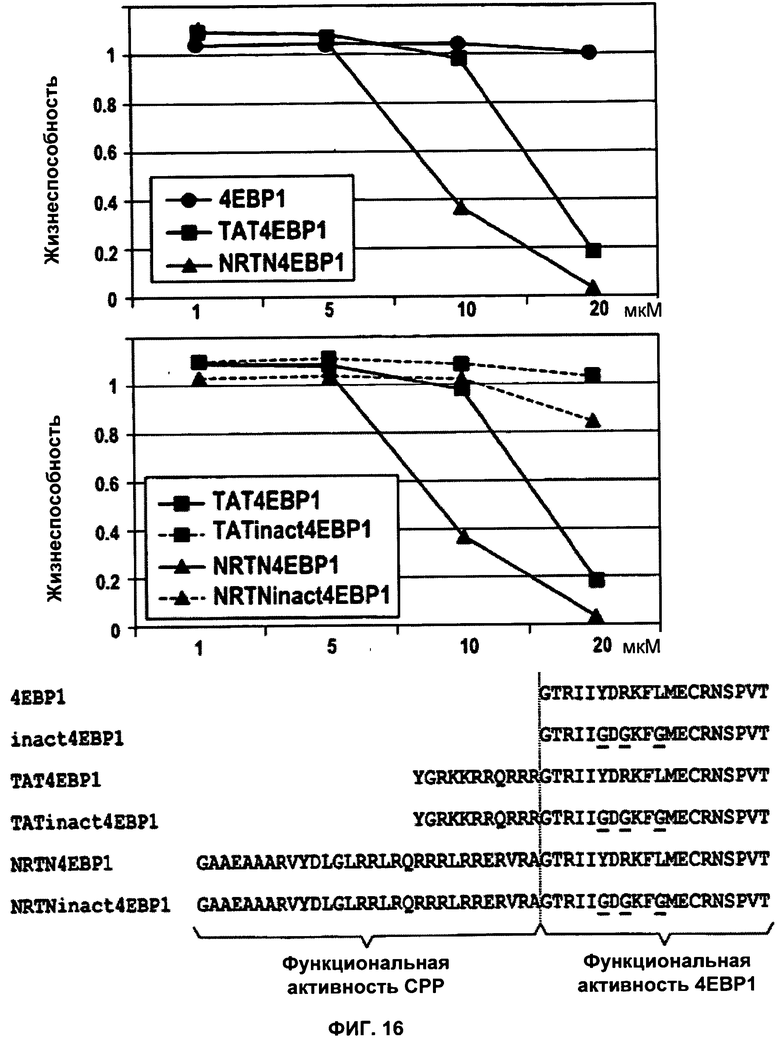
Изобретение относится к области биотехнологии, конкретно к интернализации терапевтических молекул внутрь клетки, и может быть использовано в медицине. Получают композицию для доставки молекул нуклеиновых кислот в клетки, содержащую по меньшей мере один пептид с по меньшей мере 92% идентичностью к GAAEAAARVYDLGLRRLRQRRRLRRERVRA (SEQ ID NO: 2); IREIMEKFGKQPVSLPARRLKLRGRKRRQR (SEQ ID NO: 3); или YLKVVRKHHRVIAGQFFGHHHTDSFRMLYD (SEQ ID NO: 4), присоединенный к одной или нескольким молекулам нуклеиновых кислот. Изобретение позволяет повысить эффективность доставки молекул нуклеиновых кислот внутрь клетки млекопитающего за счет пептида, способного интернализироваться внутрь клетки млекопитающего с эффективностью, составляющей по меньшей мере 200% от эффективности интернализации пептида ТАТ, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1). 5 н. и 3 з.п. ф-лы, 16 ил., 1 табл., 8 пр.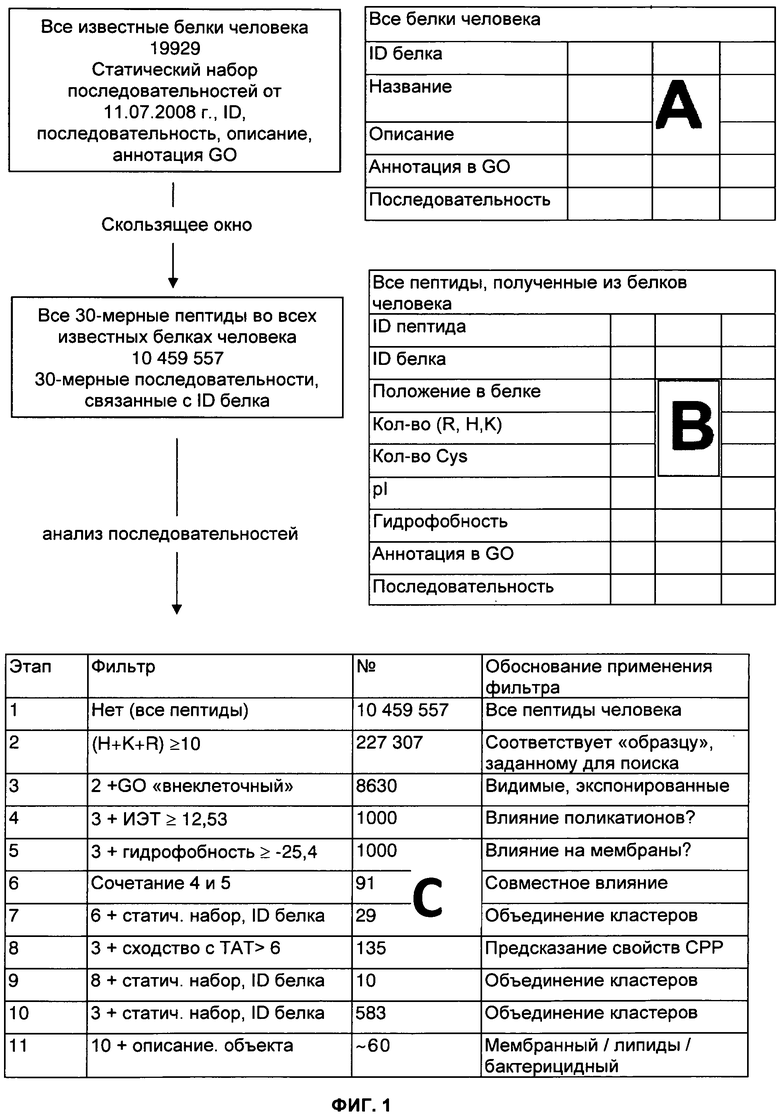
1. Композиция для доставки молекул нуклеиновых кислот в клетки, содержащая по меньшей мере один пептид, присоединенный к одной или нескольким молекулам нуклеиновых кислот, указанный пептид способен интернализироваться внутрь клетки млекопитающего, где пептид:
(а) имеет аминокислотную последовательность, выбранную из группы, состоящей из:
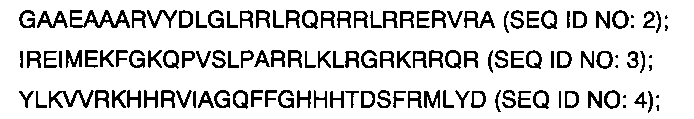 и
и
аминокислотной последовательности, обладающей по всей своей длине по меньшей мере 92% суммарной идентичностью последовательности относительно любой из последовательностей с SEQ ID NO: 2 по SEQ ID NO: 4; и
(б) интернализируется внутрь клетки млекопитающего с эффективностью, составляющей по меньшей мере 200% от эффективности интернализации пептида ТАТ, имеющего аминокислотную последовательность GRKKRRQRRRPPQ (SEQ ID NO: 1); и
при этом присоединение осуществляют посредством связывания, выбранного из группы, состоящей из ковалентного связывания и нековалентного связывания.
2. Композиция по п. 1, где по меньшей мере часть по меньшей мере одного пептида образует альфа-спиральную вторичную структуру.
3. Композиция по п. 1, где по меньшей мере один пептид является пептидом млекопитающих, предпочтительно человеческого происхождения.
4. Способ получения композиции по любому из пп. 1-3, содержащий:
(а) создание по меньшей мере одного пептида, определенного в п. 1, способного интернализироваться внутрь клетки млекопитающего; и
(б) осуществление контакта этого по меньшей мере одного пептида с одной или несколькими молекулами нуклеиновых кислот для того, чтобы обеспечить осуществление присоединения.
5. Способ in vitro выявления способности к интернализации у композиции по любому из пп. 1-3, включающий:
(а) введение композиции по любому из пп. 1-3 в одну или несколько клеток млекопитающего; и
(б) выявление интернализации пептида или композиции.
6. Фармацевтическая композиция для доставки молекул нуклеиновых кислот внутрь одной или более клеток млекопитающего, содержащая композицию по любому из пп. 1-3 в эффективном количестве, и необязательно дополнительно содержащая один или несколько фармацевтически приемлемых эксципиентов и/или добавок.
7. Применение композиции по любому из пп. 1-3 для in vitro трансформации или трансфекции одной или нескольких клеток млекопитающего.
8. Композиция по любому из пп. 1-3 для применения с целью профилактики или лечения состояния, выбранного из группы, состоящей из онкологического заболевания, иммунных заболеваний, сердечно-сосудистых заболеваний, неврологических заболеваний, инфекций и воспалительных заболеваний.
| US 7067473 B1, 27.06.2006 | |||
| HEITZ FREDERIC ET AL., Twenty years of cell-penetrating peptides: from molecular mechanisms to therapeutics, BRITISH JOURNAL OF PHARMACOLOGY, 2009, v.157, n.2, p.195-206 | |||
| ХИМЕРНЫЙ БЕЛОК ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ЛИМФОМ | 2004 |
|
RU2297241C2 |
Авторы
Даты
2015-07-20—Публикация
2011-06-14—Подача