Изобретение относится к области лекарственных препаратов на основе химерных (т.е. содержащих фрагменты полипептидов из разных белков) проникающих белков, предназначенных для лечения опухолевых заболеваний типа злокачественных лимфом.
Одним из направлений лечения опухолевых заболеваний является использование ингибиторов циклиновых киназ, например белков семейства INK4a. При этом желательно, чтобы молекулярные конструкции доставлялись в клетку "адресно" и воздействовали на конкретный внутриклеточный сигнал или функцию.
Исследование транспортных свойств пептидов с разной структурой (последовательностью аминокислот) показало, что в зависимости от структуры, разные пептиды могут по-разному накапливаться в разных компартментах клетки. Это свойство дает теоретическую возможность конструировать последовательности с целевой доставкой в различные органеллы клетки.
Известно использование в качестве транспортного агента вектора Antp (пенетратин) [Robin Fåhraeus, Jesús M. Paramio, Kathryn L. Ball, Sonia Laín, David P. Lane. Inhibition of pRb phosphorylation and cell-cycle progression by a 20-residue peptide from p16CDKN2/INK4A//Current Biology. 1996, 6:84-91].
Также известно использование в данном качестве вирусного вектора и экспрессии полноразмерного белка [Schreiber, M., Muller, W.J., Singh, G., and Graham, F.L. Comparison of the effectiveness of adenovirus vectors expressing cyclin kinase inhibitors p16INK4A, p18INK4C, p19INK4D, p21Waf/Cip1 and p27Kip1 in inducing cell cycle arrest, apoptosis and inhibition of tumorigenicity //Oncogene. 1999, 18:1663-1676].
Однако недостатками при этом являются низкий уровень экспрессии белка и низкая эффективность его проникновения в клетки.
Ни один из известных химерных белков не может быть указан в качестве наиболее близкого аналога изобретения.
Задачей изобретения является создание химерного белка, обладающего повышенным биологическим действием за счет улучшения свойств транспортного агента.
Соответственно его техническим результатом является медико-биологический эффект, объективно проявляющийся при использовании данного химерного белка и заключающийся в решении указанной задачи.
Технический результат достигается тем, что химерный белок для лечения злокачественных лимфом содержит две последовательности аминокислот, первая из которых включает в себя ингибитор циклиновых киназ в виде активного фрагмента p16INK4a (аминокислотные остатки 84-103 или 84-106) в качестве терапевтического агента, а вторая включает в себя пептид VP22 (аминокислотные остатки 140-301) вируса простого герпеса в качестве транспортного агента для переноса ингибитора циклиновых киназ внутрь целевых клеток.
При этом последовательность аминокислот имеет следующий вид (подчеркнута последовательность из р16):
D-A-A-T-A-T-R-G-R-S-A-A-S-R-P-T-E-R-P-R-A-P-A-R-S-A-S-R-P-R-R-P-V-E-D-A-A-R-E-G-F-L-D-T-L-V-V-L-H-R-A-G-A-R
Контроль и синхронизация событий в процессе клеточного деления осуществляется большим комплексом молекул. Одними из ключевых участников этого процесса являются циклины, активирующие так называемые циклинзависимые киназы (CDK). В течение клеточного цикла происходит последовательная активация транскрипции определенного циклина с последующим образованием активного комплекса циклин-CDK. Остановка клеточного деления в контрольных (рестрикционных) точках (G1, S, G2) осуществляется ингибированием соответствуюшего циклинового комплекса через специфические белки. Семейство белков, ингибирующих циклин D (контролирующий переход G1-S). относится к белкам INK4a.
Белок р16INK4a является наиболее изученным из этой группы. Данный белок ингибирует активность CDK4 и CDK6, входящих в комплекс с циклином D, что препятствует фосфорилированию pRb и высвобождению E2F и приводит к остановке клеточного цикла на границе G1-S перехода. Структурно функциональные исследования данного белка выявили активный фрагмент р16INK4a (аминокислоты 84-103 или 84-106), который ответственен за ингибирование CDK4 и CDK6, входящих в комплекс с циклином D.
Белок р16INK4a играет важную роль в процессе дифференцировки и старения клеток, а также он не функционален или отсутствует во многих опухолевых тканях. Для 40% злокачественных лимфом человека характерно нарушение функции белка р16INK4a. Еще около 20% составляют случаи с гиперэкспрессией циклина D. Т.е. более половины всех случаев злокачественных лимфом имеют нарушения контроля рестрикционной точки R1 (G1-S перехода).
Возможность использовать естественные ингибиторы циклиновых киназ для контроля пролиферации возникла после открытия способности некоторых белков к трансактивации. Т.е. белки, синтезированные в одной клетке, могли выходить из нее и, проникая в другую клетку, приводить к активации определенных генов. Исследование структуры этих белков позволило выявить короткие (от 16 до 30 аминокислот) аминокислотные последовательности, ответственные за внутриклеточный транспорт. Было показано, что добавление такой последовательности в структуру произвольного белка наделяет его свойствами внутриклеточной и внутриядерной интернализации. В настоящее время известно около 30 последовательностей таких пептидов.
Согласно изобретению была сконструирована химерная белковая молекула, несущая интернализующий фрагмент белка VP22, и фрагмент белка p16INK4a - ингибитора циклиновых киназ.
Данная последовательность была синтезирована впрямую на пептидном синтезаторе, а также получена генно-инженерными методами. Был клонирован ген и отработана методика получения гибридного белкового продукта микробиологическим методом.
Методика синтеза: пептиды получены твердофазным методом [Stewart, J.M., Young, J.D Solid Phase Peptide Synthesis, 2nd edn., 1984, Pierce Chem.Co., Rockford, IL] с использольванием Boc/Bzl - стратегии и следующих защитных групп для боковых функций аминокислот: Asp(cHex), Glu(cHex), Arg(Tos), Met(O), Ser(Bzl), Thr(Bzl), His(Bom), Lys(2Cl-Z) и Тгр(СНО). В качестве полимерной подложки был использован сополимер стирола с 1% дивинилбензола, содержащий 0,53 ммоль/г Boc-Lys(2Cl-Z)-PAM, производные аминокислот, конденсирующие агенты и катализаторы, растворители и трифторуксусная кислота (ТФУ). Деблокирование Вос-групп осуществляли действием 50% ТФУ в дихлорметане (DCM) с последующей нейтрализацией 5% раствором диизопропилэтиламина в DCM. Синтезы были осуществлены в проточном реакторе с непрерывной регистрацией изменения объема пептидилполимера (свеллографический мониторинг). Конденсации проводились с помощью TBTU в присутствии 1-гидроксибензотриазола (HOBt) и N-метилморфолина [Reid, G.E. and Simpson, R.J. Automated solid-phase peptide synthesis: use of 2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium tetrafluoroborate for coupling of tert-butyloxycarbonyl amino acids, Anal Biochem, 1992, v.200(2), pp.301-9]. Полноту прохождения реакций конденсации на каждой стадии контролировали по качественному нингидриновому тесту [Kaiser, E., Colescott, R.L., Bossinger C.D. Color test for detection of free terminal amino groups in the solid-phase synthesis of peptides, Anal Biochem, 1970, v.34(2), pp.595-8]. Четырехкратные избытки активированных производных применялись в ходе первой и, в случае необходимости, повторных конденсаций. Реакцию проводили в течение 20 часов. Непосредственно перед отщеплением пептида от полимерной подложки проводили удаление Fmoc и/или формильных групп, блокировавших боковые функции остатков триптофана, обработкой смолы 20%-ным раствором пиперидина в ДМФ (0°С, 2 часа). Пептиды отщепляли от полимерной подложки с одновременным удалением постоянных защитных групп жидким фтористым водородом в две стадии по методике «low-high HF» [Tam J.P. and Merrifield R.B. Strong acid deprotection of the synthetic peptides: mechanisms and methods. - In: The Peptides, v.9 (Udenfriend S., Meienhofer J., eds.). New York: Academic Press, 1987, pp.185-248]. После лиофилизации пептиды переводили в ацетат пропусканием через короткую колонку, заполненную ионообменной смолой (3 г, ацетатная форма). Отделяли от побочных продуктов непептидной природы хроматографированием на колонке. Осуществляли элюирование 1N AcOH. Фронтальный пик собирали и лиофилизовали. Для всех пептидов получены адекватные величины молекулярных масс.
Стратегия клонирования химерного гена заключалась в клонировании гена фрагмента белка VP22 (аминокислотные остатки 140-301) из ДНК вируса простого герпеса (HSV 1) в вектор pR731, затем химического синтеза фрагмента гена p16INK4a (аминокислотные остатки 84-103 или 84-106) и получение вектора pR760 с данным фрагментом, затем слияние двух генов и получение клонированного химерного гена.
1) Полимеразная цепная реакция и клонирование ДНК, кодирующей С-конец белка VP22 (аминокислотные остатки 140-301).
Используя в качестве матрицы ДНК вируса HSV1, методом полимеразной цепной реакции с использованием олигонуклеотидных праймеров состава
5'-ccg-gcg-gcg-gga-tcc-ace-cgc-ggc-agg
5'-ctg-ggt-aag-ctt-aag-atc-tct-cga-cgg-gcc-gtc-tgg-ggc-gag,
соответствующих середине и концевой части ДНК, кодирующей белок VP22, амплифицировали последовательность нуклеотидов (подчеркнуты сайты спецефических эндонуклеаз BamHI, BglII и HindIII.
Полимеразную цепную реакцию (ПЦР) проводили при следующих условиях - 4,5 мин - 94°С; в течение 5 циклов: 64°С - 5 мин, 72°С - 1 мин и 94°С; 30 циклов: 64°С - 30 сек, 72°С - 1 мин и 94°С - 30 сек; 64°С - 5 мин; 72°С - 10 мин.
ПЦР проводили в 25-50 мкл реакционной смеси, содержащей 10 пкМ каждого праймера, 67 мМ трис-HCl буфера (рН 8.8 при 25°С) 15 мМ сульфата аммония, 2.5 мМ хлористого магния 0.01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2.5 мМ) и 1 ед. фермента Taq-полимеразы.
Для получения плазмиды, экспрессирующей С-конец белка, полученную ДНК pCRVP22 размером 510 н.п. клонировали в плазмиде pQE 16, используя рестрикционные эндонуклеазы BamHI и HindIII, при этом фрагмент ДНК pCRVP22 размером 499 н.п., соответствующий фрагменту гена VP22, объединяли с фрагментом ДНК плазмиды pQE 16 размером 3396 н.п., содержащим промоторную область фага Т5. Полученную плазмиду назвали pR731. Для этой и последующих стадий для трансформации использовали штамм E.coli M15[REP4] (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) (QUIAGEN). Все молекулярно-биологические процедуры, включая выделение ДНК, рестрикцию, кинирование олигонуклеотидов, лигирование ДНК, трансформацию ДНК в клетки E.coli. Вектор pR731 использовали для наработки контрольного белка VP22.
2) Синтез и клонирование олигонуклеотидного дуплекса, кодирующего пептид белка р16.
Фрагмент гена р16 (для варианта аминокислотного остатка 84-103) получен химико-ферментативным способом из следующих олигонуклеотидов:
1.5'-gatccgacgc tgctcgcgaa ggtttcctg
2.5'-gacaccctgg tagtactgca ccgtgctggt gctagatctt a
3.5'-accagggtgt ccaggaaacc ttcgcgagca gcgtcg
4.5'-agcttaagatctagcaccag cacggtgcag tact.
Последовательность фланкирована полусайтами специфических эндонуклеаз BamHI (онт 1) и HindIII (онт 4) (подчеркнуты), на С-конце перед сайтом HindIII предусмотрен стоп-кодон. Внутри олигонуклеотидного дуплекса предусмотрены сайты рестриктаз Nrul (онт 1, 3), Seal (онт 2, 4), BglII (онт 2, 4) (все подчеркнуты).
Плазмиду получили клонированием предварительно прокинированных и отожженных олигонуклеотидов в плазмиде pQE16, для чего был взят ее фрагмент размером 3396 н.п., полученный рестрикцией эндонуклеазами BamHI и HindIII, и назвали pR760.
3) Клонирование гена гибридного белка p16-VP22.
Плазмиду, экспрессирующую гибридный белок, содержащий фрагмент гена р16 и фрагмент гена белка VP22, конструировали из фрагмента ДНК плазмиды pR731 размером 3197 н.п., полученного рестрикцией эндонуклеазами BamHI и Pvul и включающегофрагмент гена VP22, а также фрагмента ДНК плазмиды pR760 размером 806 н.п., полученного рестрикцией эндонуклеазами BglII и Pvul и включающего фрагмент гена р16.
Возможность осуществления изобретения с реализацией указанного назначения подтверждают следующие примеры.
Пример 1. Анализ клеточной пролиферации.
Часть белка была конъюгирована с флоуресцеин-изотиоцианатом (ФИТЦ). Во время реакции использовалась низкая концентрация ФИТЦ и ограничивалось ее время. Таким образом, достигалось частичное мечение белка.
Методом световой флуоресцентной микроскопии было показано, что белок связывается с клетками и проникает в клеточные линии Raji, Jurkatt, А549, 293 и периферические лимфоциты крови человека. Методом проточной цитофлуорометрии было показано связывание пептида с клетками и отсутствие эффекта тушения флуоресценции трипановым синим. Что свидетельствует о накопление пептида внутри клетки. В сумме полученные данные указывали на накопление пептида внутри клетки
Биологическое действие химерного пептида, содержащего активный фрагмент белка p16INK4a, было исследовано на клеточных линиях (Raji, Jurkatt, A549, 293). Исследование клеточного деления показало наличие цитостатического эффекта данного препарата. Эксперименты проводились на синхронизированных в фазе G0/1 клеточных линиях Raji, Jurkatt и A549. Клеточные линии синхронизировались путем их посева в среду, содержащую 0,2% эмбриональной сыворотки и, следовательно, лишенную в требуемом количестве ростовых факторов. Синхронизированные клеточные линии высеивались в среду, содержащую 10% эмбриональную сыворотку. Туда же вносили исследуемый пептид до концентрации 5 мкМ. Под воздействием ростовых факторов клетки вступали в митоз и через 24, 48 и 72 часа исследовалась концентрация клеток и проводился анализ клеточного цикла с использованием метода проточной цитофлоурометрии. В качестве положительного контроля использовали 5-фтор-урацил и токсол. Было отмечено снижение S, G2 и М фаз клеточного цикла и отставание в росте клеточной линии от контрольной. Кроме того, было отмечено значительное увеличение числа клеток, вошедших в апоптоз.
Наиболее объективные данные о накоплении пептида внутри клетки были получены с использованием метода сканирующей лазерной микроскопии. Белок, меченный флюоресцеин изотиоцианатом, был растворен в 0,9% NaCl. Клеточные линии A549, 293 выращивались на предметных стерильных стеклах и помещались в специальной камере непосредственно под окуляры микроскопа. Среда замещалась на среду с исследуемым белком. Насыщение белком наблюдали во времени. Кроме того, производилось послойное сканирование клеток с целью определения локализации накопления пептида.
Анализ полученных изображений показал, что белок распределяется в компартментах клетки неравномерно. Проникновение белка внутрь клетки происходит достаточно быстро. И уже через 15 минут инкубации большая его часть распределена в цитоплазме.
Скорость его проникновения в периферические лимфоциты крови человека, а также лимфоциты клеточных линий (Raji, Jurkatt) была оценена с использованием метода проточной цитофлуорометрии. Данный метод позволяет исследовать большие концентрации клеток во времени и удобен для оценки скорости проникновения исследуемого пептида. Измерялась флуоресценция лимфоцитов под действием белка р16-VP22-ФИТЦ при рН 7.5 и рН 6.0. Принцип метода основан на меньшем квантовом выходе флуоресценции ФИТЦ в растворах с более кислым рН. Так как скорость измерения происходит достаточно быстро, то значение рН внутри клетки не может измениться. Лимфоциты инкубировались с пептидом в течение 1-15 минут, после этого к ним сразу добавлялся 20-кратный объем фосфатного буфера с рН 6.0 и рН 7.5. При этом оценивалась разность интенсивности флуоресценции. В большинстве измерений интенсивности флуоресценции достоверно не отличались после 15 минут инкубации. Таким образом, можно предположить, что после 15 минут инкубации пептид полностью проникает внутрь клетки. При этом представленные графики подтверждают большую эффективность заявленного химерного белка.
Пример 2. Исследование биологического действия химерного белка p16-VP22. Оценка цитотоксичности и антипролиферативной активности препарата на нормальные и опухолевые линии клеток оценивалась для клеточных линий Raji, Jurkatt, A549, 293.
В экспериментах с клеточными линиями оценивали как скорость пролиферации, так и долю клеток, вступивших в апоптоз. Для анализа использовали программы FloMax 2.0 и ModFit LT 3.0. На всех клеточных линиях был показан цитостатический эффект белка p16-VP22. Эксперименты проводились как на синхронизированных, так и несинхронизированных в фазе G0/1 клеточных линиях Raji, Jurkatt, A549, 293. Максимальный эффект воздействия белка p16-VP22 достигался на синхронизированных клеточных линиях. Так процент субдиплойдного пика на ДНК гистограммах, характеризующий уровень апоптоза, достигал 80% при концентрации белка 10 мкМ. Отношение клеток, находящихся в S, G2 и М фазах клеточного цикла, к клеткам, находящимся в G0/1 фазе, характеризует степень пролиферации клеток. Это соотношение в контроле значительно выше, чем в случае с использованием белка p16-VP22.
Пример 3. Трем группам мышей линии BLRB перевивали в брюшную полость краткосрочную линию рака молочной железы, полученную из спонтанного рака этой же линии. Одна группа не получала никакого лечения, вторая - экспериментальный пептид, а третья - пептид, имеющий аминокислотную замену, и не активный.
Анализ выживаемости показывает увеличение продолжительности жизни в экспериментальной группе на 10-30% и увеличение в ней доли животных с большими сроками жизни.
Таким образом, показан значительный цитостатический и цитотоксический эффект заявленного химерного белка, обусловленный синергетическим эффектом его компонентов.
Изобретение относится к области медицины и касается химерного белка для лечения злокачественных лимфом. Сущность изобретения включает химерный белок, состоящий из двух пептидов - ингибитора циклиновых киназ в виде активного фрагмента p16INK4a с аминокислотной последовательностью 84-103 или 84-106 в качестве терапевтического агента и второго пептида VP22 с последовательностью 140-301 вируса простого герпеса в качестве транспортного агента. Преимущество изобретения заключается в разработке препарата, с высокой эффективностью проникающего в клетки-мишени и обладающего цитостатическим и цитотоксическим действием. 1 ил.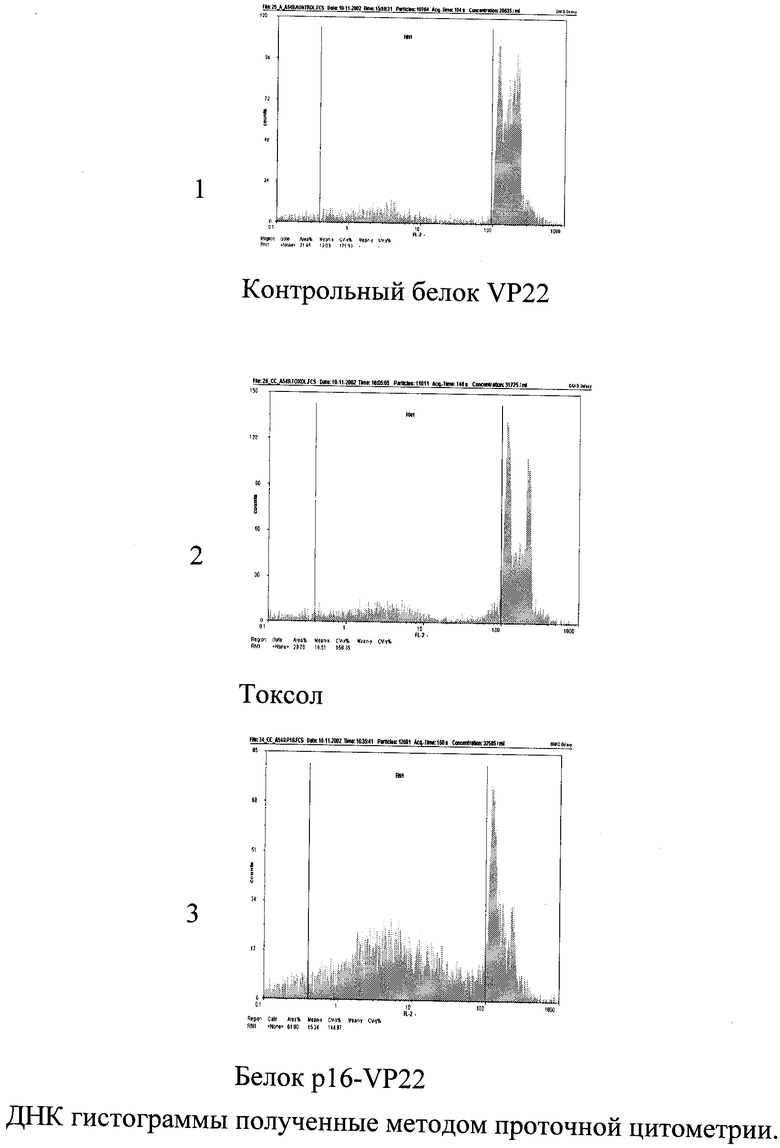
Химерный белок для лечения злокачественных лимфом, содержащий две последовательности аминокислот, первая из которых включает в себя ингибитор циклиновых киназ в виде активного фрагмента p16INK4a (аминокислотные остатки 84-103 или 84-106) в качестве терапевтического агента, а вторая включает в себя пептид VP22 (аминокислотные остатки 140-301) вируса простого герпеса в качестве транспортного агента для переноса ингибитора циклиновых киназ внутрь целевых клеток.
| US 6569833 A, 27.05.2003 | |||
| US 6734167 A, 11.05.2004 | |||
| US 6610489 A, 26.08.2003. |
Авторы
Даты
2007-04-20—Публикация
2004-11-22—Подача