Область техники, к которой относится изобретение
Изобретение относится к области композиций интерферирующих РНК для ингибирования экспрессии мишеней мРНК Rho-киназы при глазных нарушениях, в частности, для снижения внутриглазного давления при лечении глазной гипертензии и глаукомы.
Предпосылки изобретения
Глаукома представляет собой гетерогенную группу оптических нейропатий с некоторыми общими клиническими признаками. Потеря зрения при глаукоме происходит вследствие селективной гибели ганглионарных клеток сетчатки в нейральной сетчатке, которая клинически диагностируется по характерным изменениям зрительного поля, дефектам слоя нервных волокон и прогрессирующей экскавации диска зрительного нерва (ДЗН). Одним из основных факторов риска развития глаукомы является наличие глазной гипертензии (OHT), т.е. повышенного внутриглазного давления (ВГД). Нормальное ВГД необходимо для поддержания формы глаза и для обеспечения градиента давления, обеспечивающего поток водянистой влаги к лишенных сосудов роговице и хрусталику. Уровни ВГД также могут принимать участие в патогенезе глаукомы нормального давления (NTG), что доказано наличием пациентов с улучшением после снижающих ВГД лекарственных средств. После поправок на центральную толщину роговицы показателей ВГД у пациентов с NTG обнаружено, что у многих этих пациентов присутствует глазная гипертензия.
Повышенное ВГД, связанное с глаукомой, возникает в результате повышенного сопротивления оттоку водянистой влаги в трабекулярной сети (ТС), небольшом количестве специализированной ткани, расположенной в радужно-роговичном угле передней камеры глаза. Глаукоматозные изменения в ТС включают потерю клеток в ТС и отложение и накопление экстрацеллюлярного осадка, включая белковый бляшкообразный материал. Кроме того, также существуют изменения, происходящие при глаукоме в ДЗН. В глазах при глаукоме происходят морфологические и непостоянные изменения в глиальных клетках ДЗН. В ответ на повышенное ВГД и/или транзиторные ишемические инсульты, происходят изменение состава внеклеточного матрикса ДЗН и изменения в морфологии глиальных клеток и аксонов ганглионарных клеток сетчатки.
Первичные глаукомы являются следствием нарушений в токе внутриглазной жидкости, которые имеют анатомическое или физиологическое основание. Вторичные глаукомы возникают в результате повреждения или травмы глаз или предшествующего заболевания. Первичная открытоугольная глаукома (ПОУГ), также известная как хроническая или простая глаукома, представляет собой большинство всех первичных глауком. ПОУГ характеризуется дегенерацией трабекулярной сети, приводящей к аномально высокому сопротивлению оттоку жидкости из глаза. Следствием такого сопротивления является увеличение ВГД, которое необходимо для прохождения нормально продуцируемой глазами жидкости при увеличенном сопротивлении.
Связанные с Rho, содержащие двойную спираль протеинкиназы, также известные как Rho-киназы или ROCK, являются эффекторами семейства Rho малых ГТФ-связывающих белков (Rho-ГТФазы). Существуют доказательства, что путь передачи сигнала Rho-ГТФазы играет роль в регуляции оттока водянистой влаги, например, посредством изменения организации цитоскелета трабекулярной сети (ТС) и/или клеток цилиарной мышцы (ЦМ). Низкомолекулярные ингибиторы Rho-киназы вызывают обратимые изменения морфологии и организации цитоскелета клеток ТС, снижают сократительную способность изолированной ткани ЦМ и увеличивают легкость оттока водянистой влаги в органной культуре (Waki M. et al., Curr Eye Res. 22:470-4 (2001); Honjo M. et al, Invest Ophthalmol Vis Sci. 42:137-44 (2001); Rao PV. et al., Mol. Vis. 11:288-97 (2005); Rao PV. et al., Invest Ophthalmol. Vis Sci. 42:1029-37 (2001)). Подобные эффекты происходят при экспрессии доминантно-негативных Rho-связывающих доменов. Однако обработка низкомолекулярными ингибиторами Rho-киназы также вызывает вазодилатацию и гиперемию конъюнктивы. Кроме того, эффективность основанных на низкомолекулярных соединениях лекарственных средств является относительно кратковременной, требуя введения дозы в течение каждых суток, а в некоторых случаях эффективность с течением времени снижается.
Ввиду важности глазной гипертензии в глаукоме и побочных эффектов применяемых ранее способов лечения, было бы желательным иметь улучшенный способ лечения глазной гипертензии.
Сущность изобретения
Настоящее изобретение относится к интерферирующей РНК, подавляющей экспрессию мРНК Rho-киназы, снижая, таким образом, внутриглазное давление у пациентов с глазной гипертензией или глаукомой или с риском развития гипертензии или глаукомы. Мишени Rho-киназы включают ROCK1 (также известную как ROCKI, ROKP или p160ROCK) и ROCK2 (также известную как ROCKII или ROKα). Интерферирующая РНК по изобретению эффективна для лечения пациентов с глазной гипертензией или глаукомой, такой как глаукома нормального давления и открытоугольная глаукома.
Один из вариантов осуществления настоящего изобретения относится к способу снижения экспрессии мРНК Rho-киназы у индивида. Способ включает введение индивиду композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель. В одном из вариантов осуществления введение проводят в глаз индивида для снижения экспрессии мишени при глазной гипертензии у человека.
В одном из вариантов осуществления изобретения интерферирующая РНК содержит цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов и область по меньшей мере почти абсолютной непрерывной комплементарности по меньшей мере из 19 нуклеотидов. Кроме того, антисмысловая цепь в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, которые являются смысловыми последовательностями кДНК, кодирующими ROCK1 и ROCK2, соответственно (инвентарные номера GenBank NM_005406 и NM_004850, соответственно). Антисмысловая цепь содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, соответственно. Введение такой композиции снижает экспрессию Rho-киназы у индивида.
В одном из вариантов осуществления изобретения интерферирующая РНК сконструирована так, чтобы ее целью была мРНК, соответствующая SEQ ID NO:1, содержащей нуклеотид 605, 653, 659, 1248, 1562, 1876, 2266, 2474, 2485, 2740, 2808, 2834, 3007, 3146, 3199, 3245, 3379, 3453, 3511, 3513, 3519, 3781, 3782, 998, 1132, 1200, 1648, 1674, 1708 или 2077. В другом варианте осуществления изобретения, интерферирующая РНК сконструирована так, чтобы ее целью была мРНК, соответствующая SEQ ID NO:2, содержащей нуклеотид 1102, 1865, 2000, 2229, 2514, 2584, 2738, 3305, 4111, 4652, 5184, 5187, 5255, 5315, 5439, 5450, 5578, 5579, 5611, 5625, 5795, 6000, 6228, 6264, 584, 1337, 1678, 2773, 2814, 2941, 3357, 3398, 3481, 3633, 3644, 3645, 3767, 3836, 4023, 4097, 5202 или 5440.
Настоящее изобретение также относится к введению индивиду в дополнение к первой интерферирующей РНК второй интерферирующей РНК. Способ включает введение индивиду второй интерферирующей РНК с длиной от 19 до 49 нуклеотидов и содержащей цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов и область по меньшей мере почти абсолютной комплементарности по меньшей мере из 19 нуклеотидов; где антисмысловая цепь второй интерферирующей РНК в физиологических условиях гибридизуется со второй частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, а антисмысловая цепь содержит область по меньшей мере почти абсолютной непрерывной комплементарности по меньшей мере из 19 нуклеотидов со второй гибридизующейся частью из мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, соответственно. Вторая интерферирующая РНК может иметь мишенью ту же мРНК, что и первая интерферирующая РНК, или может иметь мишенью другую мРНК. Кроме того, подобным образом можно вводить третью, четвертую или пятую и т.д. интерферирующую РНК.
Другой вариант осуществления изобретения представляет собой способ снижения экспрессии Rho-киназы у индивида, включающий введение индивиду композиции, содержащей эффективное количество одноцепочечной интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель.
Для снижения экспрессии ROCK1 одноцепочечная интерферирующая РНК в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1, содержащей нуклеотид 605, 653, 659, 1248, 1562, 1876, 2266, 2474, 2485, 2740, 2808, 2834, 3007, 3146, 3199, 3245, 3379, 3453, 3511, 3513, 3519, 3781, 3782, 998, 1132, 1200, 1648, 1674, 1708 или 2077, и интерферирующая РНК содержит область по меньшей мере почти абсолютной комплементарности по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1. Таким образом снижается экспрессия ROCK1.
Для снижения экспрессии ROCK2 одноцепочечная интерферирующая РНК в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:2, содержащей нуклеотид 1102, 1865, 2000, 2229, 2514, 2584, 2738, 3305, 4111, 4652, 5184, 5187, 5255, 5315, 5439, 5450, 5578, 5579, 5611, 5625, 5795, 6000, 6228, 6264, 584, 1337, 1678, 2773, 2814, 2941, 3357, 3398, 3481, 3633, 3644, 3645, 3767, 3836, 4023, 4097, 5202 или 5440, и интерферирующая РНК содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:2. Таким образом снижается экспрессия ROCK2.
Другой вариант осуществления изобретения представляет собой способ лечения глазной гипертензии или глаукомы у пациента. Способ включает введение в глаз индивида композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов и область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов. Антисмысловая цепь в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, и содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, соответственно. Таким образом проводят лечение глазной гипертензии или глаукомы.
Другой вариант осуществления изобретения представляет собой способ лечения глазной гипертензии или глаукомы у пациента, где способ включает введение в глаз индивида композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК, содержащая область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9 - SEQ ID NO:79, где таким образом проводят лечение глазной гипертензии.
Другой вариант осуществления изобретения представляет собой способ снижения экспрессии мишени мРНК Rho-киназы у индивида, включающий введение индивиду композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9 - SEQ ID NO:79, как указано ниже.
Если мишень мРНК Rho-киназы представляет собой мРНК ROCK1, интерферирующая РНК содержит область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей SEQ ID NO:3, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78 или SEQ ID NO:79.
Если мишень мРНК Rho-киназы представляет собой мРНК ROCK2, то интерферирующая РНК содержит область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:46, SEQ ID NO:47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71 или SEQ ID NO:72.
В дополнительном варианте осуществления настоящего изобретения область последовательных нуклеотидов представляет собой область по меньшей мере из 14 последовательных нуклеотидов, по меньшей мере на 85% комплементарную или по меньшей мере на 85% идентичную с предпоследними 14 нуклеотидами 3'-конца мРНК, соответствующей последовательности с идентификатором последовательности. Еще в одном варианте осуществления изобретения область последовательных нуклеотидов представляет собой область, как правило, из 15, 16, 17 или 18 последовательных нуклеотидов, по меньшей мере на 80% комплементарную или по меньшей мере на 80% идентичную с предпоследними 15, 16, 17 или 18 нуклеотидами, соответственно, 3'-конца мРНК, соответствующей последовательности-мишени, определяемой идентификатором последовательности.
Дополнительный вариант осуществления изобретения представляет собой способ лечения глазной гипертензии у пациента, где способ, включающий введение индивиду композиции, содержащей молекулу двухцепочечной siРНК, снижающей экспрессию гена ROCK1 или ROCK2 вследствие РНК-интерференции, где длина каждой цепи молекулы siРНК независимо составляет приблизительно от 19 до приблизительно 27 нуклеотидов; и одна из цепей молекулы siРНК содержит нуклеотидную последовательность со значительной комплементарностью с мРНК, соответствующей гену ROCK1 или ROCK2, соответственно, так, что молекула siРНК обуславливает расщепление мРНК вследствие РНК-интерференции.
Вариантом осуществления настоящего изобретения являются композиции, содержащие интерферирующую РНК с длиной от 19 до 49 нуклеотидов и с нуклеотидной последовательностью любой из SEQ ID NO:3 и SEQ ID NO:9 - SEQ ID NO:79 или комплементарных им и фармацевтически приемлемый носитель. В одном из вариантов осуществления интерферирующая РНК является выделенной. Термин "выделенная" обозначает, что интерферирующая РНК не содержит ее общего природного окружения.
Другим вариантом осуществления изобретения являются композиции, содержащие молекулу двухцепочечной siРНК, снижающую экспрессию гена ROCK1 или ROCK2 вследствие РНК-интерференции, где длина каждой цепи молекулы siРНК независимо составляет приблизительно от 19 до приблизительно 27 нуклеотидов; и одна из цепей молекулы siРНК содержит нуклеотидную последовательность со значительной комплементарностью с мРНК, соответствующей гену ROCK1 или ROCK2, соответственно, так, что молекула siРНК обуславливает расщепление мРНК вследствие РНК-интерференции.
Настоящее изобретение имеет преимущество по сравнению с низкомолекулярными ингибиторами Rho-киназ, так как нежелательный побочный эффект современных низкомолекулярных лекарственных средств, например, гиперемия, можно отделить от желательного эффекта снижения внутриглазного давления.
Применение любого из вариантов осуществления, как описано в настоящем документе, в получении лекарственного средства для снижения экспрессии мРНК ROCK1 или ROCK2 также представляет собой вариант осуществления настоящего изобретения.
Краткое описание чертежей
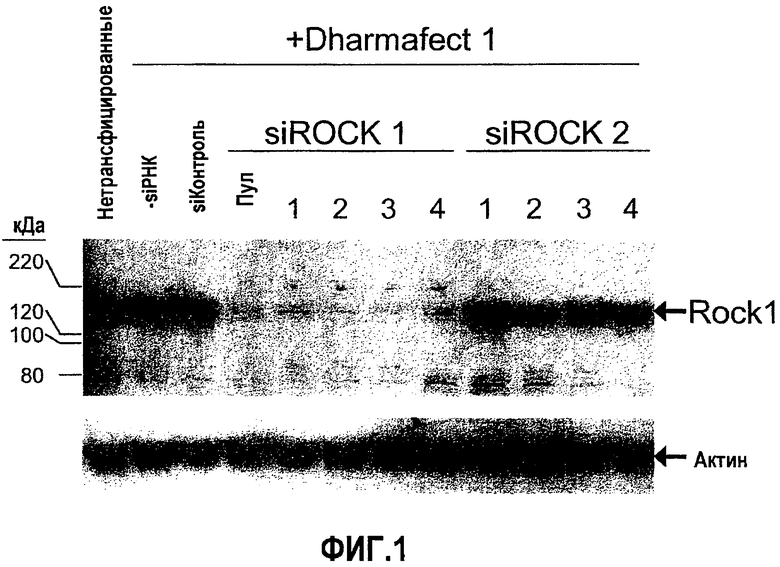
На фиг.1 предоставлен "вестерн"-блот ROCK1 клеток GTM-3, трансфицированных siРНК ROCK1 № 1, № 2, № 3 и № 4; siРНК ROCK2 № 1, № 2, № 3 и № 4; группой siРНК ROCK1; ненаправленной контрольной siРНК; контрольным буфером (без siРНК). Концентрация siРНК составляла 100 нМ. Стрелки указывают положения полос 160 кДа белка ROCK1 и 42 кДа белка актина.
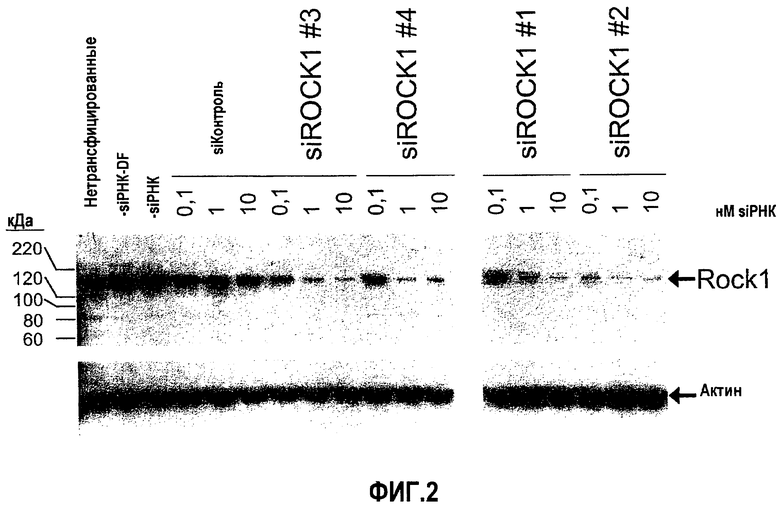
На фиг.2 предоставлен "вестерн"-блот ROCK1 клеток GTM-3, трансфицированных siРНК ROCK1 № 1, № 2, № 3, и № 4, и ненаправленной контрольной siРНК, каждая при 10 нМ, 1 нМ и 0,1 нМ, и контрольным буфером (без siРНК). Стрелки указывают положения полос 160 кДа белка ROCK1 и 42 кДа белка актина.
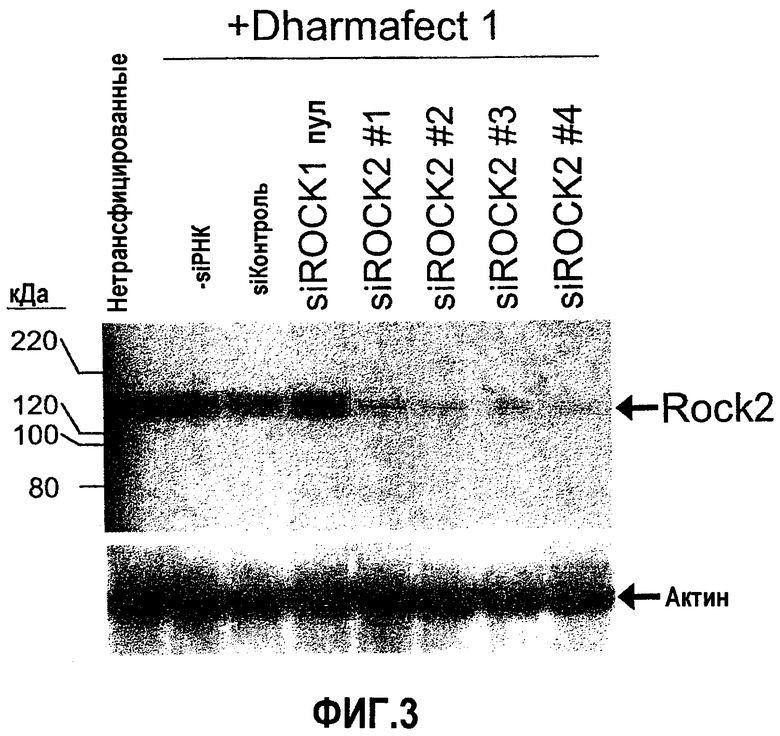
На фиг.3 предоставлен "вестерн"-блот ROCK2 клеток GTM-3, трансфицированных siРНК ROCK2 № 1, № 2, № 3, и № 4, a ROCK1 pool, и ненаправленная контрольная siРНК, каждая при 100 нМ, и контрольным буфером (без siРНК). Стрелки указывают положения полос 160 кДа белка ROCK2 и 42 кДа белка актина.
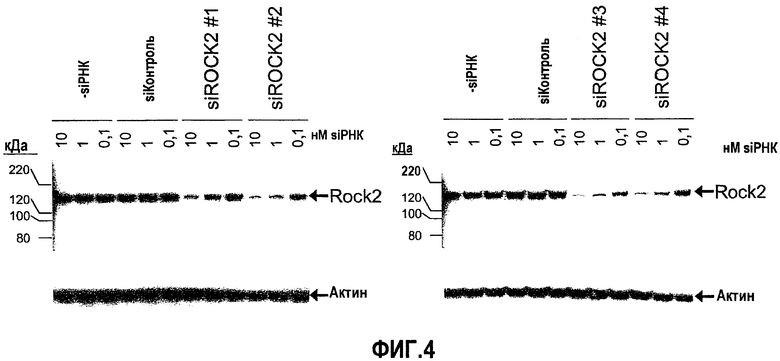
На фиг.4 предоставлен "вестерн"-блот ROCK2 клеток GTM-3, трансфицированных siРНК ROCK2 № 1, № 2, № 3, и № 4, и ненаправленная контрольная siРНК, каждая при 10 нМ, 1 нМ, и 0,1 нМ, и контрольным буфером (без siРНК). Стрелки указывают положения полос 160 кДа белка ROCK2 и 42 кДа белка актина.
Подробное описание изобретения
РНК-интерференция (РНКi) представляет собой процесс, при котором двухцепочечная РНК (dsРНК) используется для подавления экспрессии гена. Хотя необходимости быть связанным с теорией нет, РНКi начинается с расщепления более длинных dsРНК на малые интерферирующие РНК (siРНК) подобным РНКазе III ферментом, дайсером. SiРНК представляют собой dsРНК, длина которых, как правило, составляет приблизительно от 19 до 28 нуклеотидов, или от 20 до 25 нуклеотидов, или от 21 до 22 нуклеотидов и которые часто содержат на "липкие" 3'-концы из 2 нуклеотидов и 5'-фосфатный и 3'-гидроксильный концы. Одна цепь siРНК встроена в рибонуклеопротеиновый комплекс, известный как индуцированный РНК подавляющий комплекс (RISC). RISC использует эту цепь siРНК для идентификации молекул мРНК, которые, по меньшей мере частично комплементарны встроенной цепи siРНК, а затем расщепляет эту мРНК-мишень или ингибирует ее трансляцию. Таким образом, цепь siРНК, которая встроена в RISC, известна как направляющая цепь или антисмысловая цепь. Другая цепь siРНК, известная как цепь-пассажир или смысловая цепь, удаляется из siРНК, и она, по меньшей мере частично гомологична мРНК-мишени. Специалистам в данной области понятно, что, в принципе, встроиться в RISC и функционировать в качестве направляющей цепи может любая из цепей siРНК. Однако конструкция siРНК (например, пониженная стабильность дуплекса siРНК на 5'-конце антисмысловой цепи) может благоприятствовать встраиванию в RISC антисмысловой цепи.
Опосредованное RISC расщепление мРНК с последовательностью по меньшей мере частично комплементарной направляющей цепи, приводит к снижению стационарного уровня этой мРНК и соответствующего белка, кодируемого этой мРНК. Альтернативно, RISC также может снижать экспрессию соответствующего белка вследствие репрессии трансляции без расщепления мРНК-мишени. С RISC также могут взаимодействовать и подавлять экспрессию генов другие молекулы РНК и подобные РНК молекулы. Примеры других молекул РНК, которые взаимодействуют с RISC, включают короткошпилечную РНК (кшРНК), одноцепочечную siРНК, микроРНК (мкРНК) и являющиеся субстратом дайсера 27-членные дуплексы. Как применяют в настоящем документе, если не указано иначе, термин "siРНК" относится к двухцепочечной интерферирующей РНК. Примеры подобных РНК молекул, которые могут взаимодействовать с RISC, включают молекулы РНК, содержащие один или несколько химически модифицированных нуклеотидов, один или несколько дезоксирибонуклеотидов и/или одну или несколько связей, отличающихся от фосфодиэфирных. Для целей настоящего обсуждения все молекулы РНК или подобные РНК молекулы, которые могут взаимодействовать с RISC и принимать участие в опосредованных RISC изменениях экспрессии генов, обозначают "интерферирующая РНК". Таким образом, siРНК, кшРНК, мкРНК и являющиеся субстратом дайсера 27-членные дуплексы являются подгруппами "интерферирующей РНК".
Доказано, что интерферирующая РНК по вариантам осуществления изобретения каталитически действует на расщепление мРНК-мишени, т.е. интерферирующая РНК способна осуществлять ингибирование мРНК-мишени в субстехиометрических количествах. По сравнению со способами лечения с применением антисмысловых структур, для обеспечения терапевтического эффекта в таких условиях расщепления необходимо значительно меньше интерферирующей РНК.
Настоящее изобретение относится к применению интерферирующей РНК для ингибирования экспрессии мРНК Rho-киназы (ROCK), таким образом снижая внутриглазное давление у пациентов с глаукомой. Существует две изоформы Rho-киназы: ROCK1 (также известная как ROCKI, ROKβ или p160ROCK) и ROCK2 (также известная как ROCKII или ROKα). Как указано в настоящем документе, в соответствии с настоящим изобретением интерферирующая РНК, предоставляемая экзогенно или экспрессируемая эндогенно, особенно эффективна для подавления мРНК ROCK.
Низкомолекулярные ингибиторы ROCK вызывают обратимые изменения в морфологии и организации цитоскелета клеток трабекулярной сети, снижают сократительную способность изолированной ткани цилиарной мышцы и увеличивают легкость оттока водянистой влаги в органной культуре. Сходные эффекты происходят при экспрессии доминантно-негативных Rho-связывающих доменов. Обработка низкомолекулярными ингибиторами ROCK снижает ВГД, однако доказано, что такая обработка также вызывает гиперемию. Низкомолекулярные ингибиторы ROCK, проверенные к настоящему времени, в дополнение к ROCK1 и ROCK2 ингибируют несколько киназ. Ожидают, что применение интерферирующей РНК по настоящему изобретению со специфичностью к мРНК ROCK1 или ROCK2 позволит отделить желательный эффект обработки снижения ВГД от нежелательного эффекта обработки гиперемии.
Если не указано иначе, приводимые в настоящем документе последовательности нуклеиновой кислоты записаны в направлении от 5' к 3'. Как применяют в настоящем документе, термин "нуклеиновая кислота" относится или к ДНК, или РНК, или к их модифицированным формам, содержащим пуриновые или пиримидиновые основания, существующие в ДНК (аденин "A", цитозин "C", гуанин "G", тимин "T") или в РНК (аденин "A", цитозин "C", гуанин "G", урацил "U"). Предоставленная по настоящему документу интерферирующая РНК может содержать основания "T", особенно на 3'-концах, несмотря на то, что основания "T" не встречаются в РНК в природе. "Нуклеиновая кислота" включает термины "олигонуклеотид" и "полинуклеотид" и может относиться к одноцепочечной молекуле или к двухцепочечной молекуле. Двухцепочечная молекула формируется посредством спаривания оснований по Уотсону-Крику между основаниями A и T, основаниями C и G и между основаниями A и U. Цепи двухцепочечной молекулы могут быть частично, в значительной степени или полностью комплементарными друг другу и могут формировать гибридный дуплекс, сила связывания которого зависит от характера и степени комплементарности последовательности оснований.
Последовательность мРНК легко вывести из последовательности соответствующей последовательности ДНК. Например, SEQ ID NO:1 представляет смысловую цепь последовательности ДНК, соответствующей мРНК ROCK1. Последовательность мРНК идентична последовательности смысловой цепи ДНК с заменой оснований "T" на основания "U". Таким образом, последовательность мРНК ROCK1 известна из SEQ ID NO:1, а последовательность мРНК ROCK2 известна из SEQ ID NO:2.
мРНК Rho-киназы (ROCK1 и ROCK2): связанные с Rho, содержащие двойную спираль протеинкиназы, также известные как Rho-киназы или ROCK, являются эффекторами семейства Rho малых ГТФ-связывающих белков (Rho-ГТФазы). Существуют доказательства, что путь передачи сигнала Rho-ГТФазы играет роль в регуляции оттока водянистой влаги, например, посредством изменения организации цитоскелета трабекулярной сети (ТС) и/или клеток цилиарной мышцы (ЦМ).
ROCK представляют собой серин/треонин протеинкиназы, которые активируются посредством ГТФ-связанной Rho. Активация ROCK приводит к фосфорилированию нескольких субстратов, вовлеченных в сборку актиновых филаментов и сократимость клеток, включая, например, легкую цепь миозина, фосфатазу легких цепей миозина, LIM-киназу, аддуцин, ERM. Таким образом, ROCK регулируют широкое множество клеточных процессов, включая формирование волокон натяжения, сокращение, адгезию, миграцию, фагоцитоз, апоптоз и цитокинез. Двумя изоформами ROCK являются ROCK1 (также известная как ROCKI, ROKβ или p160ROCK) и ROCK2 (также известная как ROCKII или ROKα). Две изоформы являются очень сходными, особенно в их киназных доменах (92% идентичности на уровне аминокислот), однако, они проявляют различия в тканевом распределении и внутриклеточной локализации, что указывает на то, что они могут иметь особые, не дублирующиеся функции. И ROCK1, и ROCK2 экспрессируются в передней части глаза человека.
В базе данных GenBank из National Center for Biotechnology Information на ncbi.nlm.nih.gov предоставлена последовательность ДНК для ROCK1 в виде инвентарного номера NM_005406, приведенная в "Списке последовательностей" как SEQ ID NO:1. SEQ ID NO:1 представляет последовательность смысловой цепи ДНК, соответствующую мРНК, кодирующей ROCK1 (за исключением замены оснований "T" на основания "U"). Кодирующую последовательность ROCK1 составляют нуклеотиды 1-4065.
Эквивалентами приведенной выше последовательности мРНК ROCK1 являются формы альтернативного сплайсинга, аллельные формы, изозимы или родственные формы. Родственной является мРНК ROCK1 других видов млекопитающих, которая гомологична SEQ ID NO:1 (ортолог).
В базе данных GenBank представлена последовательность ДНК для ROCK2 в виде инвентарного номера NM_ 004850, приведенная в "Списке последовательностей" как SEQ ID NO:2. SEQ ID NO:2 представляет последовательность смысловой цепи ДНК, соответствующую мРНК, кодирующей ROCK2 (за исключением замены оснований "T" на основания "U"). Кодирующую последовательность ROCK2 составляют нуклеотиды 450-4616.
Эквивалентами приведенной выше последовательности мРНК ROCK2 являются формы альтернативного сплайсинга, аллельные формы, изозимы или родственные формы. Родственной является мРНК ROCK2 других видов млекопитающих, которая гомологична SEQ ID NO:2 (ортолог).
Снижение экспрессии мРНК: Как используют в настоящем документе, фраза "снижение экспрессии мРНК" означает введение или экспрессию количества интерферирующей РНК (например, siРНК) для снижения трансляции мРНК-мишени в белок или посредством расщепления мРНК, или посредством прямого ингибирования трансляции. Снижение экспрессии мРНК-мишени или соответствующего белка обычно обозначают как "нокдаун" и представляют относительно уровней, существующих после введения или экспрессии ненаправленной контрольной РНК (например, ненаправленная контрольная siРНК). Вариантами осуществления по настоящему документу предусмотрен нокдаун экспрессии в размере от 50% до 100% включительно. Однако в рамках настоящего изобретения не обязательно, чтобы достигались такие уровни нокдауна. В одном из вариантов осуществления для снижения ВГД вводят одну интерферирующую РНК, направленную к одной из мишеней Rho-киназ. В других вариантах осуществления для снижения ВГД вводят две или более интерферирующих РНК, направленных к одной и той же мишени Rho-киназы (например, ROCK1). В других вариантах осуществления для снижения ВГД вводят две или более интерферирующих РНК, направленных к обеим мишеням Rho-киназ (например, ROCK1 и ROCK2).
Как правило, нокдаун оценивают, измеряя уровни мРНК с применением амплификации при количественной полимеразной цепной реакции (кПЦР) или измеряя уровни белка при "вестерн"-блоттинге или в твердофазном иммуноферментном анализе (ELISA). Анализ уровня белка обеспечивает оценку расщепления мРНК, а также ингибирования трансляции. Дополнительные способы для измерения нокдауна включают гибридизацию раствора РНК, защиту от нуклеаз, "нозерн"-гибридизацию, наблюдение за генной экспрессией с применением микрочипов, связывание антител, радиоиммунный анализ и анализ активированных флуоресценцией клеток.
Ингибирование ROCK1 или ROCK2 также можно определить in vitro, оценивая уровни мРНК-мишени или уровни белка-мишени, например, в клетках ТС человека после трансфекции интерферирующей РНК для ROCK1 или ROCK2, как описано ниже.
Указанное в настоящем документе ингибирование мишеней также предполагают у человека и млекопитающего при наблюдении улучшения симптомов глаукомы, таких как, например, улучшение внутриглазного давления, улучшения при потере полей зрения или улучшения при изменениях диска зрительного нерва.
Интерферирующая РНК: В одном из вариантов осуществления изобретения интерферирующая РНК (например, siРНК) содержит смысловую цепь и антисмысловую цепь, а смысловая и антисмысловая цепи содержат область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов. В дополнительном варианте осуществления изобретения интерферирующая РНК (например, siРНК) содержит смысловую цепь и антисмысловую цепь, а антисмысловая цепь содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с последовательностью-мишенью мРНК ROCK1 или ROCK2, а смысловая цепь содержит область по меньшей мере почти абсолютной непрерывной идентичности, по меньшей мере из 19 нуклеотидов с последовательностью-мишенью мРНК ROCK1 или ROCK2, соответственно. В дополнительном варианте осуществления изобретения интерферирующая РНК содержит область по меньшей мере из 13, 14, 15, 16, 17 или 18 последовательных нуклеотидов с определенным процентом комплементарности последовательностей или с определенным процентом идентичности последовательностей с предпоследними 13, 14, 15, 16, 17 или 18 нуклеотидами, соответственно, 3'-конца соответствующей последовательности-мишени в пределах мРНК.
Длина каждой цепи интерферирующей РНК составляет от 19 до 49 нуклеотидов и может составлять 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 нуклеотидов.
Антисмысловая цепь siРНК представляет собой активный направляющий фактор siРНК, в котором антисмысловая цепь встроена в RISC, таким образом позволяя RISC идентифицировать мРНК-мишень по меньшей мере с частичной комплементарностью к антисмысловой цепи siРНК для расщепления или репрессии трансляции.
В вариантах осуществления настоящего изобретения последовательности-мишени интерферирующей РНК (например, последовательности-мишени siРНК) в пределах последовательности-мишени мРНК выбирают с применением доступных средств конструирования. Затем интерферирующие РНК, соответствующие последовательности-мишени ROCK1 или ROCK2, тестируют посредством трансфекции клеток, экспрессирующих мРНК-мишень, с последующей оценкой нокдауна, как описано выше.
Способы выбора последовательностей-мишеней для siРНК предоставлены в Tuschl, T. et al., "The siRNA User Guide", исправленном 6 мая 2004 года, доступном на веб-сайте Rockefeller University; в Technical Bulletin № 506, "siRNA Design Guidelines", Ambion Inc. на веб-сайте Ambion; и в других доступных на веб-сайтах средствах конструирования, например, на веб-сайтах Invitrogen, Dharmacon, Integrated DNA Technologies, Genscript или Proligo. Начальные параметры поиска могут включать содержание G/C от 35% до 55% и длины siРНК от 19 до 27 нуклеотидов. Последовательность-мишень может находиться в кодирующей области или в 5'- или 3'-нетранслируемых областях мРНК.
Вариант осуществления 19-нуклеотидной последовательности-мишени ДНК для мРНК ROCK1 находится в положениях нуклеотидов SEQ ID NO:1 от 605 до 623:
5'-ATAACATGCTGCTGGATAA-3' SEQ ID NO:3.
siРНК по изобретению, направленная на соответствующую последовательность мРНК SEQ ID NO:3 и содержащая 21-нуклеотидые цепи и 2-нуклеотидые "липкие" 3'-концы, представляет собой:
5'-AUAACAUGCUGCUGGAUAANN-3' SEQ ID NO:4
3'-NNUAUUGUACGACGACCUAUU-5' SEQ ID NO:5.
Каждый остаток "N" может представлять собой любой нуклеотид (A, C, G, U, T) или модифицированный нуклеотид. 3'-конец может содержать ряд остатков "N" в промежутке и включая 1, 2, 3, 4, 5 и 6. Остатки "N" на каждой цепи могут быть одним и тем же остатком (например, UU, AA, CC, GG или TT) или они могут быть различными (например, AC, AG, AU, CA, CG, CU, GA, GC, GU, UA, UC или UG). "Липкие" 3'-концы могут быть одинаковыми или они могут быть различными. В одном из вариантов осуществления обе цепи содержат "липкие" 3'-концы UU.
siРНК по изобретению, направленная на соответствующую последовательность мРНК SEQ ID NO:3 и содержащая 21-нуклеотидные цепи и "липкие" 3'-концы UU на каждой цепи, представляет собой:
5'-AUAACAUGCUGCUGGAUAAUU-3' SEQ ID NO:6
3'-UUUAUUGUACGACGACCUAUU-5' SEQ ID NO:7.
Интерферирующая РНК также может содержать "липкий" нуклеотидный 5'-конец или она может содержать тупые концы. siРНК по изобретению, направленная на соответствующую последовательность мРНК SEQ ID NO:3 и содержащая 19-нуклеотидые цепи и тупые концы, представляет собой:
5'-AUAACAUGCUGCUGGAUAA-3' SEQ ID NO:80
3'-UAUUGUACGACGACCUAUU-5' SEQ ID NO:81.
Цепи двухцепочечной интерферирующей РНК (например, siРНК) могут соединяться с формированием шпильки или структуры стебель-петля (например, кшРНК). кшРНК по изобретению, направленная на соответствующую последовательность мРНК SEQ ID NO:2 и содержащая двухцепочечную область стебля из 19 п.н. и "липкий" 3'-конец UU, представляет собой:
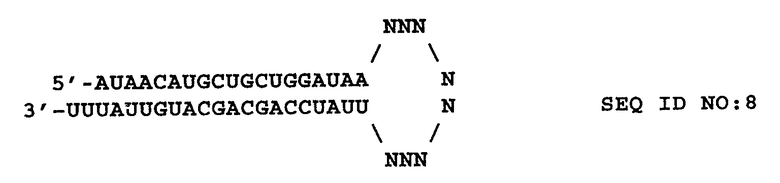
N представляет собой нуклеотид A, T, C, G, U или модифицированную форму, известную специалисту в данной области. Количество нуклеотидов N в петле представляет собой число от 3 до 23, или от 5 до 15, или от 7 до 13, или от 4 до 9, или от 9 до 11, включительно, или число нуклеотидов N составляет 9. Некоторые из нуклеотидов в петле могут участвовать во взаимодействиях с образованием пар нуклеотидов с другими нуклеотидами петли. Примеры олигонуклеотидных последовательностей, которые можно использовать для формирования петли, включают 5'-UUCAAGAGA-3' (Brummelkamp, T.R. et al (2002) Science 296:550) и 5'-UUUGUGUAG-3' (Castanotto, D. et al. (2002) RNA 8:1454). Специалисту в данной области понятно, что полученный в результате одноцепочечный олигонуклеотид формирует структуру стебля-петли или шпильки, содержащую двухцепочечную область, способную к взаимодействию с механизмом РНКi.
Последовательность-мишень siРНК, указанную выше, можно удлинить на 3'-конце для облегчения конструкции являющихся субстратом дайсера 27-членных дуплексов. Удлинение 19-нуклеотидной последовательности-мишени ДНК (SEQ ID NO:3), указанной в последовательности ДНК ROCK1 (SEQ ID NO:1) на 6 нуклеотидов, дает 25-нуклеотидную последовательность-мишень ДНК, находящуюся в положениях нуклеотидов SEQ ID NO:1 от 605 до 629;
5'-ATAACATGCTGCTGGATAAATCTGG-3' SEQ ID NO:82.
Являющийся субстратом дайсера 27-членный дуплекс по изобретению, направленный на соответствующую последовательность мРНК SEQ ID NO:10, представляет собой:
5'-AUAACAUGCUGCUGGAUAAAUCUGG-3' SEQ ID NO:83
3'-UUUAUUGUACGACGACCUAUUUAGACC-5' SEQ ID NO:84.
Два нуклеотида на 3'-конце смысловой цепи (т.е. нуклеотиды GG из SEQ ID NO:83) могут представлять собой дезоксинуклеотиды для улучшенного процессинга. Конструирование являющихся субстратом дайсера 27-членных дуплексов из последовательностей-мишеней длиной 19-21 нуклеотидов, такое как предоставлено в настоящем документе, дополнительно обсуждается на веб-сайте Integrated DNA Technologies (IDT) и в Kim, D.-H. et al., (февраль 2005) Nature Biotechnology 23:2; 222-226.
Когда интерферирующую РНК получают химическим синтезом, фосфорилирование в положении 5' нуклеотида на 5'-конце одной или обеих цепей (когда присутствуют) может увеличить эффективность и специфичность siРНК связанного комплекса RISC, но оно не обязательно, т.к. фосфорилирование может происходить внутриклеточно.
В таблице перечислены примеры последовательности-мишени ДНК ROCK1 и ROCK2 из SEQ ID NO:1 и SEQ ID NO:2, соответственно, из которых конструируют siРНК по настоящему изобретению указанным выше способом. ROCK1 и ROCK2 кодируют две изоформы Rho-киназы, как указано выше.
Последовательности-мишени ROCK1 и ROCK2 для siРНК
Как указано в примерах выше, специалист в данной области может использовать информацию последовательности-мишени, приведенную в таблице, для конструирования интерферирующей РНК с длиной короче или длиннее, чем у последовательностей, представленных в таблице, и исходя из положения последовательности в SEQ ID NO:1 или SEQ ID NO:2 и добавляя или удаляя нуклеотиды, комплементарные или почти комплементарные SEQ ID NO:1 или SEQ ID NO:2, соответственно.
Реакция расщепления РНК-мишени, направляемая siРНК и другими формами интерферирующей РНК, является высокоспецифичной в отношении последовательностей. Для указанного в настоящем документе ингибирования мРНК вариантами осуществления siРНК в основном являются содержащая цепь смысловых нуклеотидов siРНК, идентичная по последовательности части мРНК-мишени, и цепь антисмысловых нуклеотидов, абсолютно комплементарная части мРНК-мишени. Однако 100% комплементарности последовательностей между антисмысловой цепью siРНК и мРНК-мишени или между антисмысловой цепью siРНК и смысловой цепью siРНК в практическом осуществлении настоящего изобретения не требуется. Таким образом, например, изобретение предусматривает вариации последовательности, которые можно ожидать вследствие генетического мутирования, полиморфизма цепи или эволюционной дивергенции.
В одном из вариантов осуществления изобретения антисмысловая цепь siРНК обладает по меньшей мере почти абсолютной непрерывной комплементарностью, по меньшей мере из 19 нуклеотидов с мРНК-мишенью. Как применяют в настоящем документе, "почти абсолютная" означает, что антисмысловая цепь siРНК "в значительной степени комплементарна", а смысловая цепь siРНК "в значительной степени идентична" по меньшей мере части мРНК-мишени. Как известно специалисту в данной области, "идентичность" представляет собой степень родства последовательностей у нуклеотидных последовательностей, как определяется при совпадении порядка и идентичности нуклеотидов у последовательностей. В одном из вариантов осуществления антисмысловую цепь siРНК с 80% и от 80% до 100% комплементарностью, например, с 85%, 90% или 95% комплементарностью с последовательностью-мишенью мРНК считают почти абсолютно комплементарными и их можно использовать в настоящем изобретении. "Абсолютная" непрерывная комплементарность представляет собой стандартное спаривание оснований по Уотсону-Крику соседних пар оснований. Как применяют в настоящем документе, "по меньшей мере почти абсолютная" непрерывная комплементарность включает "абсолютную" комплементарность. Для определения наибольшей степени совпадения нуклеотидных последовательностей разработаны компьютерные способы определения идентичности или комплементарности, например, BLASTN (Altschul, S.F., et al. (1990) J. Mol. Biol. 215:403-410).
Термин "процент идентичности" означает процент последовательных нуклеотидов в первой молекуле нуклеиновой кислоты, которые совпадают с рядом последовательных нуклеотидов такой же длины во второй молекуле нуклеиновой кислоты. Термин "процент комплементарности" означает процент последовательных нуклеотидов в первой молекуле нуклеиновой кислоты, который может образовывать пару оснований по Уотсону-Крику с рядом последовательных нуклеотидов во второй молекуле нуклеиновой кислоты.
Отношение между мРНК-мишенью (смысловой цепью) и одной из цепей siРНК (смысловой цепью) представляет собой отношение идентичности. Смысловую цепь siРНК, если она присутствует, также называют цепь-пассажир. Отношение между мРНК-мишенью (смысловой цепью) и другой цепью siРНК (антисмысловой цепью) представляет собой отношение комплементарности. Антисмысловую цепь siРНК также называют направляющей цепью.
Предпоследнее основание в последовательности нуклеиновой кислоты, которая записана в направлении от 5' к 3', является следующим за последним основанием, т.е. основание, следующее за основанием на 3'-конце. Предпоследние 13 оснований последовательности нуклеиновой кислоты, записанной в направлении от 5' к 3', представляют собой последние 13 оснований последовательности, следующие за последним основанием на 3'-конце и не включающие основание на 3'-конце. Подобным образом, предпоследние 14, 15, 16, 17 или 18 оснований последовательности нуклеиновой кислоты, записанной в направлении от 5' к 3', представляют собой последние 14, 15, 16, 17 или 18 оснований последовательности, соответственно, следующие за основанием на 3'-конце и не включающие основание на 3'-конце.
Фраза "область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарная или по меньшей мере на 90% идентичная с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей любой из (идентификаторов последовательностей)", допускает одну замену нуклеотида. Две замены нуклеотидов (т.е. 11/13=85% идентичность/комплементарность) не включены в такую фразу.
В одном из вариантов осуществления изобретения область последовательных нуклеотидов представляет собой область по меньшей мере из 14 последовательных нуклеотидов, по меньшей мере на 85% комплементарную или по меньшей мере на 85% идентичную с предпоследними 14 нуклеотидами 3'-конца мРНК, соответствующей последовательности, определяемой каждым идентификатором последовательности. Две замены нуклеотидов (т.е. 12/14=86% идентичность/комплементарность) в такую фразу включены.
В дополнительном варианте осуществления изобретения область последовательных нуклеотидов представляет собой область по меньшей мере из 15, 16, 17 или 18 последовательных нуклеотидов, по меньшей мере с 80% комплементарностью последовательности, или по меньшей мере с 80% идентичностью последовательности с предпоследними 14 нуклеотидами 3'-конца мРНК, соответствующей последовательности с идентификатором последовательности. В такую фразу включены замены трех нуклеотидов.
Последовательность-мишень в мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, может находиться в 5'- или 3'-нетранслируемых областях мРНК, а также в кодирующей области мРНК.
Одна или обе цепи двухцепочечной интерферирующей РНК могут содержать "липкие" 3'-концы длиной от 1 до 6 нуклеотидов, которые могут представлять собой рибонуклеотиды или дезоксирибонуклеотиды или их смесь. Нуклеотиды "липких" концов не спарены. В одном из вариантов осуществления изобретения интерферирующая РНК содержит "липкие" 3'-концы из TT или UU. В другом варианте осуществления изобретения, интерферирующая РНК содержит по меньшей мере один тупой конец. Концы, как правило, содержат 5'-фосфатную группу или 3'-гидроксильную группу. В других вариантах осуществления антисмысловая цепь содержит 5'-фосфатную группу, а смысловая цепь содержит 5'-гидроксильную группу. В других вариантах осуществления, концы дополнительно модифицированы посредством ковалентного добавления других молекул или функциональных групп.
Смысловая и антисмысловая цепи двухцепочечной siРНК могут находиться в дуплексной конфигурации из двух одиночных цепей, как описано выше, или могут представлять собой одиночную молекулу, где области комплементарности образуют пары оснований и ковалентно связаны петлей шпильки с образованием одиночной цепи. Полагают, что шпилька внутри клетки расщепляется белком, называемым дайсером, с формированием интерферирующей РНК из двух отдельных молекул РНК со спаренными основаниями.
Интерферирующая РНК может отличаться от встречающейся в природе РНК добавлением, удалением, заменой или модификацией одного или нескольких нуклеотидов. С интерферирующей РНК на 5'-конце, 3'-конце или изнутри может быть связано не являющееся нуклеотидами вещество. Такие модификации в основном предназначены для увеличения устойчивости интерферирующей РНК к нуклеазам, для улучшения клеточного захвата, для улучшения клеточной направленности, для облегчения обнаружения интерферирующей РНК, для дополнительного улучшения стабильности или для уменьшения потенциала активации пути интерферона. Например, интерферирующая РНК может содержать пуриновый нуклеотид на концах "липких" концов. Например, конъюгация холестерина с 3'-концом смысловой цепи молекулы siРНК посредством пирролидинового линкера также обеспечивает стабильность siРНК.
Дополнительные модификации, например, включают 3'-концевую молекулу биотина, пептид, известный, как обладающий свойствами проникновения в клетку, наночастицу, пептидомиметик, флуоресцентный краситель или дендример.
Нуклеотиды можно модифицировать в основной части, в сахарной части или в фосфатной части их молекул, и они могут функционировать в вариантах осуществления настоящего изобретения. Например, модификации включают замены алкильными, алкокси, амино, деаза, галогеновыми, гидроксильными, тиольными группами или их сочетанием. Нуклеотиды можно замещать аналогами с большей стабильностью, например, как замена рибонуклеотида дезоксирибонуклеотидом, или несущими модификации сахаров, например, такими как 2'-OH-группы, замещенные 2'-аминогруппами, 2'-O-метильными группами, 2'-метоксиэтильными группами или метиленовый мостик между 2'-O и 4'-C. Примеры пуриновых или пиримидиновых аналогов нуклеотидов включают ксантин, гипоксантин, азапурин, метилтиоаденин, 7-деазааденозин и O- и N-модифицированные нуклеотиды. Фосфатную группу нуклеотида можно модифицировать заменой одного или нескольких атомов кислорода фосфатной группы азотом или серой (фосфоротиоаты). Модификации полезны, например, для усиления функции, улучшения стабильности или проницаемости, или для указания локализации или направленности.
В цепи антисмысловой интерферирующей РНК могут существовать область или области, которые не комплементарны части SEQ ID NO:1 или SEQ ID NO:2. Некомплементарные области могут находиться на 3', 5' или обоих концах области комплементарности или между двумя комплементарными областями.
Интерферирующую РНК можно получать экзогенно химическим синтезом, транскрипцией in vitro или расщеплением более длинной двухцепочечной РНК дайсера или другой подходящей нуклеазой со сходной активностью. Химически синтезированную интерферирующую РНК, полученную из защищенных рибонуклеозидфосфороамидитов с применением обычного синтезатора ДНК/РНК, можно получить от коммерческих поставщиков, таких как Ambion Inc. (Austin, TX), Invitrogen (Carlsbad, CA) или Dharmacon (Lafayette, CO). Интерферирующую РНК очищают, например, экстракцией растворителем или смолой, преципитацией, электрофорезом, хроматографией или их сочетанием. Альтернативно, интерферирующую РНК можно использовать без особой очистки или совсем без нее во избежание потерь вследствие обработки образца.
Интерферирующую РНК также можно экспрессировать эндогенно с плазмидных или вирусных экспрессирующих векторов или с минимальных экспрессирующих кассет, например, полученные посредством ПЦР фрагменты, содержащие один или несколько промоторов и соответствующую матрицу или матрицы для интерферирующей РНК. Примеры коммерчески доступных основанных на плазмидах экспрессирующих векторов для кшРНК включают представители серии pSilencer (Ambion, Austin, TX) и pCpG-siРНК (InvivoGen, San Diego, CA). Вирусные векторы для экспрессии интерферирующей РНК можно получать из множества вирусов, включая аденовирус, аденоассоциированный вирус, лентивирус (например, HIV, FIV и EIAV) и вирус герпеса. Примеры коммерчески доступных вирусных векторов для экспрессии кшРНК включают pSilencer адено (Ambion, Austin, TX) и pLenti6/BLOCK-iT™-DEST (Invitrogen, Carlsbad, CA). Выбор вирусных векторов, способов экспрессии интерферирующей РНК с вектора и способов доставки вирусных векторов известны специалисту в данной области. Примеры наборов для получения образуемых при ПЦР экспрессирующих кассет кшРНК включают Silencer Express (Ambion, Austin, TX) и siXpress (Mirus, Madison, WI). Первую интерферирующую РНК можно вводить посредством экспрессии in vivo с первого экспрессирующего вектора, способного к экспрессии первой интерферирующей РНК, а вторую интерферирующую РНК можно вводить посредством экспрессии in vivo со второго экспрессирующего вектора, способного к экспрессии второй интерферирующей РНК, или обе интерферирующие РНК можно вводить посредством экспрессии in vivo с одного экспрессирующего вектора, способного к экспрессии обеих интерферирующих РНК.
Интерферирующая РНК может экспрессироваться с множества эукариотических промоторов, известных специалистам в данной области, включая промоторы pol III, такие как промоторы U6 или H1, или промоторы pol II, такие как промоторы цитомегаловирусов. Специалистам в данной области понятно, что эти промоторы также можно адаптировать для обеспечения индуцируемой экспрессии интерферирующей РНК.
Гибридизация в физиологических условиях: В определенных вариантах осуществления настоящего изобретения антисмысловая цепь интерферирующей РНК гибридизуется с мРНК in vivo как часть комплекса RISC.
"Гибридизация" относится к процессу, в котором одноцепочечные нуклеиновые кислоты с комплементарными или почти комплементарными последовательностями оснований взаимодействуют с образованием связанных водородными связями комплексов, называемых гибридами. Реакции гибридизации являются чувствительными и селективными. In vitro специфичность гибридизации (т.е. строгость) контролируют, например, концентрацией солей или формамида в растворах для предгибридизации и гибридизации и температурой гибридизации; такие способы хорошо известны в данной области, в частности строгость увеличивается при снижении концентрации солей, увеличении концентрации формамида или повышении температуры гибридизации.
Например, условия с высокой строгостью могут возникать при приблизительно 50% формамида при температуре от 37°C до 42°C. Условия с пониженной строгостью могут возникать при приблизительно от 35% до 25% формамида при температуре от 30°C до 35°C. Примеры условий строгости для гибридизации предоставлены в Sambrook, J., 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. Дополнительные примеры строгих условий гибридизации включают 400 мМ NaCl, 40 мМ PIPES pH 6,4, 1 мМ EDTA, 50°C или 70°C в течение 12-16 часов с последующей отмывкой, или гибридизацию при 70°C в 1×SSC или 50°C в 1×SSC, 50% формамиде с последующей отмывкой при 70°C в 0,3×SSC, или гибридизацию при 70°C в 4×SSC или 50°C в 4×SSC, 50% формамиде с последующей отмывкой при 67°C в 1×SSC. Температура гибридизации составляет приблизительно на 5-10°C меньше температуры плавления (Tm) гибрида, где Tm определяют для гибридов длиной от 19 до 49 пар оснований с применением следующего расчета: Tm °C=81,5+16,6(log10[Na+])+0,41(% G+C)-(600/N), где N представляет собой количество оснований в гибриде, а [Na+] представляет собой концентрацию ионов натрия в гибридизационном буфере.
Описанный выше анализ гибридизации in vitro предоставляет способ предсказания того, будет ли связывание между кандидатной siРНК и мишенью специфическим. Однако в области комплекса RISC также может происходить специфическое расщепление антисмысловой цепи, у которой не наблюдают высокой строгости гибридизации in vitro.
Одноцепочечная интерферирующая РНК: Как указано выше, интерферирующая РНК, в конечном счете, функционирует как одиночные цепи. Выявлено, что одноцепочечная (о/ц) интерферирующая РНК осуществляет подавление мРНК, хотя и менее эффективно, чем двухцепочечная siРНК. Таким образом, варианты осуществления настоящего изобретения также относятся к введению о/ц интерферирующей РНК, которая в физиологических условиях гибридизуется с частью SEQ ID NO:1 или SEQ ID NO:2 и содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью SEQ ID NO:1 или SEQ ID NO:2, соответственно. О/ц интерферирующая РНК имеет в длину от 19 до 49 нуклеотидов, как и д/ц siРНК, указанная выше. О/ц интерферирующая РНК содержит 5'-фосфат или фосфорилируется in situ или in vivo в положении 5'. "фосфорилированный на 5'-конце" применяют, например, для описания полинуклеотидов или олигонуклеотидов с фосфатной группой, присоединенной посредством сложноэфирной связи к C5-гидроксилу сахара (например, рибозы, дезоксирибозы или их аналога) на 5'-конце полинуклеотида или олигонуклеотида.
О/ц интерферирующая РНК синтезирует химически или посредством транскрипции in vitro или экспрессируют эндогенно с векторов, или экспрессирующих кассет, как и для д/ц интерферирующей РНК. 5'-фосфатные группы можно добавлять с помощью киназы или 5'-фосфат может быть результатом нуклеазного расщепления РНК. Доставку осуществляют как для д/ц интерферирующей РНК. В одном из вариантов осуществления о/ц интерферирующую РНК с защищенными концами и модификациями для устойчивости к нуклеазам вводят для подавления. О/ц интерферирующую РНК можно высушивать для хранения или растворять в водном растворе. Раствор может содержать буферы или соли для ингибирования отжига или для стабилизации.
Шпилечная интерферирующая РНК: Шпилечная интерферирующая РНК представляет собой отдельную молекулу (например, отдельная олигонуклеотидая цепь), содержащую и смысловую и антисмысловую цепи интерферирующей РНК в виде структуры стебля-петли или шпильки (например, кшРНК). Например, кшРНК можно экспрессировать с векторов ДНК, в которых олигонуклеотиды ДНК, кодирующие смысловую интерферирующую цепь РНК, посредством короткого спейсера соединены с олигонуклеотидами ДНК, кодирующие обратно комплементарную цепь антисмысловой интерферирующей РНК. Если необходимо для выбранного экспрессирующего вектора, можно добавлять 3'-концевые T и нуклеотиды, формирующие участки рестрикции. Полученный в результате транскрипт РНК складывается сам с собой с формированием структуры стебля-петли.
Способ введения: интерферирующую РНК можно доставлять, например, аэрозольным, буккальным, дермальным, интрадермальным, ингаляционным, внутримышечным, интраназальным, внутриглазным, внутрилегочным, внутривенным, интраперитонеальным, назальным, окулярным, пероральным, ушным, парентеральным, очаговым, подкожным, сублингвальным, местным или трансдермальным способом введения.
Интерферирующую РНК можно доставлять непосредственно в глаза посредством инъекции в ткани глаза, такой как периокулярная, конъюнктивальная, субтеноновая, внутрикамерная, интравитреальная, внутриглазная, субретинальная, субконъюнктивальная, ретробульбарная или внутриканальцевая инъекции; посредством прямого нанесения на глаз с применением катетера или другого устройства нанесения, такого как ретинальная гранула, внутриглазная вставка, суппозиторий или имплантат, содержащие пористый, непористый или желатинозный материал; посредством топических глазных капель или мазей или посредством устройств с замедленным высвобождением в слепом мешке или имплантированных рядом со склерой (транссклерально) или в глазу. Внутрикамерную инъекцию можно проводить через роговицу в переднюю камеру, чтобы позволить средству достичь трабекулярной сети. Внутриканальцевую инъекцию можно проводить в венозные собирательные канальцы, дренирующие шлеммов канал или в шлеммов канал.
Индивид: Индивид с необходимостью лечения глазной гипертензии или с риском развития глазной гипертензии представляет собой человека или другого млекопитающего с глазной гипертензией или с риском возникновения глазной гипертензии, ассоциированной с нежелательной или неадекватной экспрессией или активностью указанных в данном документе мишеней, т.е. ROCK1 или ROCK2. Структуры глаза, ассоциированные с такими нарушениями, могут включать, например, глаз, сетчатку, сосудистую оболочку глаза, хрусталик, роговицу, трабекулярную сеть, радужку, зрительный нерв, диск зрительного нерва, склеру, передние или задние сегменты или ресничное тело. Мишень также может представлять собой клетку глаза, клеточную культуру глаза, орган или орган или ткань глаза ex vivo.
Составы и дозировки: Фармацевтические составы содержат интерферирующую РНК или ее соли по изобретению до 99% мас., смешанные с физиологически приемлемой несущей средой, такой как вода, буфер, солевой раствор, глицин, гиалуроновая кислота, маннит и т.п.
Интерферирующую РНК по настоящему изобретению вводят в виде растворов, суспензий или эмульсий. Следующее представляет собой примеры возможных составов, применяемых в данном изобретении.
Как правило, эффективное количество интерферирующей РНК по вариантам осуществления изобретения дает в результате внеклеточную концентрацию на поверхности клетки мишени от 100 пМ до 1 мкМ, или от 1 нМ до 100 нМ, или от 5 нМ приблизительно до 50 нМ или приблизительно до 25 нМ. Доза, необходимая для достижения этой локальной концентрации, изменяется в зависимости от ряда факторов, включая способ доставки, участок доставки, количество клеточных слоев между участком доставки и клеткой-мишенью или тканью-мишенью, является ли доставка местной или системной и т.д. Концентрация в участке доставки может быть значительно большей, чем на поверхности клетки-мишени или ткани-мишени. Топические композиции доставляют на поверхность органа-мишени от одного до четырех раз в сутки или по расширенному протоколу доставки, такому как ежедневно, еженедельно, раз в две недели, ежемесячно или дольше, в соответствии с соответствующим выбором квалифицированного клинического врача. pH состава составляет приблизительно от pH 4 до pH 9 или от pH 4,5 до pH 7,4.
Ожидают, что терапевтическое лечение пациентов интерферирующей РНК, направленной против мРНК ROCK1 или ROCK2, будет иметь преимущество над лечением низкомолекулярными соединениями вследствие увеличения длительности действия, таким образом, позволяя менее частое дозирование и большее соблюдение пациентом схемы лечения.
Эффективное количество состава может зависеть от таких факторов, как, например, возраст, раса и пол индивида, тяжести глазной гипертензии, скорости обращения транскрипта/белка гена-мишени, эффективности интерферирующей РНК и стабильности интерферирующей РНК. В одном из вариантов осуществления интерферирующую РНК доставляют в орган-мишень топически и она достигает содержащей мРНК ROCK1 или ROCK2 ткани, такой как трабекулярная сеть, сетчатка или диск зрительного нерва в терапевтической дозе, таким образом, улучшая ассоциированный с глазной гипертензией патологический процесс.
Приемлемые носители: Приемлемый носитель относится к таким носителям, которые самое большое вызывают от небольшого раздражения слизистой оболочки глаз до отсутствия раздражения, если нужно, обеспечивают подходящее сохранение и доставляют одну или несколько интерферирующих РНК по настоящему изобретению в гомогенной дозе. Приемлемый носитель для введения интерферирующей РНК по вариантам осуществления настоящего изобретения включает катионные реагенты для липидной трансфекции TransIT®-TKO (Mirus Corporation, Madison, WI), липофектин (LIPOFECTIN®), липофектамин (Lipofectamine), олигофектамин (OLIGOFECTAMINE™) (Invitrogen, Carlsbad, CA) или дармафект (DHARMAFECT™) (Dharmacon, Lafayette, CO); поликатионы, такие как полиэтиленимин; катионные пептиды, такие как Tat, полиаргинин или пенетратин (пептид Antp); или липосомы. Липосомы формируются из стандартных формирующих везикулы липидов и стерина, такого как холестерин, и могут включать, например, направляющую молекулу, такую как моноклональное антитело с аффинностью связывания к поверхностным антигенам эндотелиальных клеток. Кроме того, липосомы могут представлять собой пегилированные липосомы.
Интерферирующие РНК можно доставлять в растворе, суспензии или в биоэродируемых или в небиоэродируемых носителях. Интерферирующие РНК можно доставлять отдельно или в виде комплексов определенных ковалентных конъюгатов. Интерферирующие РНК также могут образовывать комплексы с катионными липидами, катионными пептидами или катионными полимерами; комплексы с белками, слитными белками или белковыми доменами со свойствами связывания нуклеиновых кислот (например, протамин); или их можно инкапсулировать в наночастицы или липосомы. Можно осуществлять ткане- или клеточно-специфическую доставку посредством включения соответствующих направляющих групп, таких как антитело или фрагмент антитела.
Для доставки в глаза интерферирующую РНК можно комбинировать с офтальмологически приемлемыми консервантами, вспомогательными растворителями, поверхностно-активными веществами, усилителями вязкости, усилителями всасывания, буферами хлорида натрия или водой с формированием водной стерильной офтальмической суспензии или раствора. Композиции растворов можно получать посредством растворения интерферирующей РНК в физиологически приемлемом изотоническом водном буфере. Кроме того, раствор может включать приемлемое поверхностно-активное вещество для содействия растворению ингибитора. Для улучшения удержания соединения к композициям по настоящему изобретению можно добавлять сгущающие средства, такие как гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, метилцеллюлоза, поливинилпирролидон или подобные.
Для получения стерильных офтальмических мазевых композиций интерферирующую РНК комбинируют с консервантом в подходящем носителе, таком как минеральное масло, жидкий ланолин или медицинский вазелин. Стерильные офтальмические гелевые композиции можно получать посредством суспендирования интерферирующей РНК в гидрофильном основании, например, полученном из комбинации, карбопола-940 (CARBOPOL®-940) (BF Goodrich, Charlotte, NC) или т.п., известными в данной области способами. Например, для внутриглазной инъекции можно использовать вискозат (VISCOAT®) (Alcon Laboratories, Inc., Fort Worth, TX). Другие композиции по настоящему изобретению могут содержать усилители всасывания, такие как кремофор и TWEEN® 80 (полиоксиэтилен сорбитан монолаурат, Sigma Aldrich, St. Louis, MO), в случае, когда интерферирующая РНК хуже всасывается в глаз.
Наборы: В вариантах осуществления настоящего изобретения предоставлен набор, включающий реагенты для подавления экспрессии мРНК в клетке, как указано выше. Набор содержит экспрессирующий siРНК или кшРНК вектор. Для экспрессирующих siРНК векторов и экспрессирующих кшРНК невирусных векторов набор также содержит реагент для трансфекции или другой подходящий для доставки носитель. Для экспрессирующих кшРНК вирусных векторов набор может содержать вирусный вектор и/или необходимые для получения вирусного вектора компоненты (например, пакующую клеточную линию, а также вектор, содержащий матрицу вирусного вектора и дополнительные векторы-помощники для упаковки). Набор также может содержать положительный и отрицательный контроль экспрессирующих siРНК или кшРНК векторов (например, ненаправленную контрольную siРНК или siРНК, направленную на постороннюю мРНК). Набор также может содержать реагенты для определения нокдауна заданного гена-мишени (например, праймеры и зонды для количественной ПЦР для детекции мРНК-мишени и/или антитела к соответствующему белку для вестерн-блоттинга). Альтернативно набор может содержать последовательность siРНК или последовательность кшРНК и инструкции и материалы, необходимые для получения siРНК посредством транскрипции in vitro или для конструирования экспрессирующего кшРНК вектора.
Дополнительно в форме набора предоставлена фармацевтическая комбинация, которая в упакованном наборе включает несущие средства, адаптированные для содержания контейнерных средств в закрытой вместе с ними оболочке, и первые контейнерные средства, содержащие композицию интерферирующей РНК и приемлемый носитель. Как легко поймут специалисты в данной области, такие наборы, при желании, могут дополнительно включать одно или несколько различных общепринятых компонентов фармацевтических наборов, например, таких как, контейнеры с одним или несколькими фармацевтически приемлемыми носителями, дополнительные контейнеры и т.д. В наборе также в виде вкладок или этикеток могут содержаться напечатанные инструкции, указывающие количества компонентов для введения; указания для введения и/или указания для смешивания компонентов.
Способность интерферирующей РНК подавлять уровни эндогенной экспрессии гена-мишени, например, в клетках трабекулярной сети (ТС) человека оценивают in vitro, как описано ниже. Трансформированные клетки ТС человека, например, клеточные линии, обозначаемые GTM-3 или HTM-3 (см., Pang, I.H. et at., 1994. Curr. Eye Res. 13:51-63), за 24 часа до трансфекции высевают в стандартную среду для выращивания (например, DMEM, дополненная 10% эмбриональной телячьей сывороткой). Трансфекцию проводят с применением Dharmafect 1 (Dharmacon, Lafayette, CO) по инструкциям производителя при концентрации интерферирующей РНК в диапазоне от 0,1 нМ до 100 нМ. В качестве отрицательного и положительного контролей используют ненаправленную siРНК SiCONTROL™ № 1 и siРНК циклофилина B siCONTROL™ (Dharmacon), соответственно. Уровни МРНК-мишени и уровни циклофилина B мРНК (PPIB, NM_000942) оценивают посредством кПЦР через 24 часа после трансфекции с применением, например, прямого и обратных праймеров TAQMAN® и набора зондов, который предпочтительно захватывает участок-мишень (Applied Biosystems, Foster City, CA). При эффективности трансфекции 100% siРНК положительного контроля приводит по существу к полному нокдауну мРНК циклофилина B мРНК. Таким образом, нокдаун мРНК-мишени корректируют на эффективность трансфекции по отношению к уровню мРНК циклофилина B в клетках ТС, трансфицированных siРНК циклофилина B. Уровни белка-мишени оценивают приблизительно через 72 часа после трансфекции (фактическое время зависит от скорости обращения белка), например, посредством вестерн-блоттинга. Стандартные способы выделения РНК и/или белка из культивируемых клеток хорошо известны специалистам в данной области. Для снижения вероятности неспецифических, не обусловленных мишенью эффектов, используют наименьшую возможную концентрацию интерферирующей РНК, которая дает желательный уровень нокдауна экспрессии гена-мишени.
Способность интерферирующей РНК по настоящему изобретению подавлять уровни экспрессии белка Rho-киназы дополнительно проиллюстрирована в примерах 1 и 2, как изложено ниже.
Пример 1
Интерферирующая РНК для специфического подавления ROCK1 в клетках трабекулярной сети
В настоящем исследовании проверяют способность интерферирующей РНК ROCK1 подавлять уровни эндогенной экспрессии ROCK1 в культивируемых глаукомных клетках трабекулярной сети (ТС) человека.
Трансфекцию клеток GTM-3 (Pang, I.H., et al. 1994 Curr Eye Res. 13:51-63) проводили с применением стандартных концентраций siРНК ROCK1 или ROCK2 или ненаправленной контрольной siРНК in vitro (100 нМ) и реагента для трансфекции DHARMAFECT® № 1 (Dharmacon, Chicago, IL). Все siРНК растворяли в 1× буфере siРНК, водном растворе 20 мМ KCl, 6 мМ HEPES (pH 7,5), 0,2 мМ MgCl2. Экспрессию белка ROCK1 оценивали посредством анализа вестерн-блоттинга через 72 часа после трансфекции. siРНК ROCK1 представляют собой двухцепочечные интерферирующие РНК со специфичностью к следующим мишеням: siROCK1№1, направлена к SEQ ID NO:23; siROCK1№2, направлена к SEQ ID NO:29; siROCK1№3, направлена к SEQ ID NO:10; siROCK1№4, направлена к SEQ ID NO:9. Последовательности siROCK2 приведены в примере 2 ниже. Как показано посредством данных вестерн-блоттинга на фиг.1, при 100 нМ каждая из четырех siРНК ROCK1 снижала экспрессию ROCK1 относительно ненаправленной контрольной siРНК. Направленная к SEQ ID NO:29 siROCK1№2 и направленная к SEQ ID NO:10 siROCK1№3 оказываются особенно эффективными. siРНК ROCK2 оказывали небольшой, если вообще оказывали, эффект на экспрессию ROCK1, подтверждая специфичность siРНК ROCK2 для мишени ROCK2.
Проводили дополнительное исследование с применением siРНК с меньшими концентрациями. Клетки GTM-3 трансфицировали siРНК ROCK1 или ненаправленной контрольной siРНК при 10 нМ, 1 нМ и 0,1 нМ, а экспрессию гена-мишени оценивали посредством анализа вестерн-блоттинга через 72 часа после трансфекции. Контрольные образцы содержали контрольный буфер, в котором объем siРНК замещали равным объемом 1× буфера siРНК (без siРНК). Как показано посредством данных фиг.2, каждая из четырех siРНК ROCK1 значимо снижала экспрессию белка ROCK1 при 10 нМ и 1 нМ, однако, siROCK1№2 также относительно эффективно подавляла экспрессию белка ROCK1 при 0,1 нМ.
Пример 2
Интерферирующая РНК для специфического подавления ROCK2 в клетках трабекулярной сети
В настоящем исследовании проверяют способность интерферирующей РНК ROCK2 подавлять уровни эндогенной экспрессии ROCK2 в культивируемых глаукомных клетках трабекулярной сети (ТС) человека.
Трансфекцию клеток GTM-3 (Pang, I.H., et al., 1994 Curr Eye Res. 13:51-63) проводили с применением стандартных концентраций siРНК ROCK1 или ROCK2 или ненаправленной контрольной siРНК in vitro (100 нМ) и реагента для трансфекции DHARMAFECT® № 1 (Dharmacon, Chicago, IL). Экспрессию белка ROCK2 оценивали посредством анализа вестерн-блоттинга через 72 часа после трансфекции. siРНК ROCK2 представляют собой двухцепочечные интерферирующие РНК со специфичностью к следующим мишеням: siROCK2№1, направлена к SEQ ID NO:33; siROCK2№2, направлена к SEQ ID NO:38; siROCK2№3, направлена к SEQ ID NO:34; siROCK2№4, направлена к SEQ ID NO:39. Как показано посредством данных вестерн-блоттинга на фиг.3, при 100 нМ каждая из четырех siРНК ROCK2 снижала экспрессию ROCK2 относительно ненаправленной контрольной siРНК и относительно пула специфичных для ROCK1 siРНК. Пул siРНК ROCK1 оказывал небольшой, если вообще оказывал, эффект на экспрессию ROCK2, подтверждая специфичность siРНК ROCK1 для мишени ROCK1.
Проводили дополнительное исследование с применением siРНК с меньшими концентрациями. Клетки GTM-3 трансфицировали siРНК ROCK2 или ненаправленной контрольной siРНК при 10 нМ, 1 нМ и 0,1 нМ, а экспрессию гена-мишени оценивали посредством анализа вестерн-блоттинга через 72 часа после трансфекции. Контрольные образцы содержали контрольный буфер, в котором объем siРНК замещали равным объемом 1× буфера siРНК (без siРНК). Как показано посредством данных фиг.4, каждая из четырех siРНК ROCK2 значимо снижала экспрессию белка ROCK2 при 10 нМ и 1 нМ, с siROCK2№3, демонстрирующей большую, чем другие эффективность.
Приведенные в настоящем документе ссылки в тех случаях, когда в них предусмотрены иллюстративные методические или другие подробности, дополняющие те, которые приведены в настоящем документе, конкретно включены в качестве ссылки.
Специалисты в данной области с учетом настоящего описания поймут, что можно проводить очевидные модификации вариантов осуществления, описанных в настоящем документе, без отклонения от сущности и объема изобретения. Все варианты осуществления, описанные в настоящем документе, можно с учетом настоящего описания осуществлять и выполнять без излишнего экспериментирования. Полный объем этого изобретения приведен в описании и является эквивалентным его вариантам осуществления. Описание не следует истолковывать для излишнего сужения полного объема защиты, к которому относится настоящее изобретение.






















Изобретение относится к области медицины и касается опосредованного PHKi ингибирования RHO-киназы для лечения глазных нарушений. Сущность изобретения включает РНК-интерференцию для ингибирования экспрессии мРНК Rho-киназы для лечения пациентов с глазными нарушениями, особенно для лечения внутриглазного давления, глазной гипертензии и глаукомы. Мишени мРНК Rho-киназы включают мРНК гена ROCK1. Преимущество изобретения заключается в создании средства, обладающего улучшенными свойствами. 11 н. и 45 з.п. ф-лы, 4 ил., 1 табл.
1. Способ снижения экспрессии Rho-киназы с помощью интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, для лечения глазных болезней у индивида, включающий:
введение индивиду композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит:
цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов и область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов;
где антисмысловая цепь в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1, и содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1,
где таким образом снижают экспрессию мРНК Rho-киназы.
2. Способ по п.1, где индивид представляет собой человека и у человека присутствует глазная гипертензия.
3. Способ по п.1, где индивид представляет собой человека и у человека существует риск развития глазной гипертензии.
4. Способ по п.1, где композицию вводят посредством местного, интравитреального, транссклерального, периокулярного, конъюнктивального, субтенонового, внутрикамерного, субретинального, субконъюктивального, ретробульбарного или внутриканальцевого способа введения.
5. Способ по п.1, где антисмысловая цепь сконструирована для мРНК-мишени, соответствующей SEQ ID NO:1, содержащей нуклеотид 605, 653, 659, 1248, 1562, 1876, 2266, 2474, 2485, 2740, 2808, 2834, 3007, 3146, 3199, 3245, 3379, 3453, 3511, 3513, 3519, 3781, 3782, 998, 1132, 1200, 1648, 1674, 1708 или 2077.
6. Способ по п.1, дополнительно включающий введение индивиду второй интерферирующей РНК с длиной от 19 до 49 нуклеотидов и содержащей цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов и область по меньшей мере почти абсолютной комплементарности, по меньшей мере из 19 нуклеотидов;
где антисмысловая цепь второй интерферирующей РНК в физиологических условиях гибридизуется со второй частью мРНК, соответствующей SEQ ID NO:1, а антисмысловая цепь содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов со второй гибридизующейся частью из мРНК, соответствующей SEQ ID NO:1.
7. Способ лечения глазной гипертензии у пациента с помощью интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, включающий:
введение в глаза больного композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит:
цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов, и область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов;
где антисмысловая цепь в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1, и содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1,
где таким образом проводят лечение глазной гипертензии.
8. Способ снижения экспрессии мРНК Rho-киназы у индивида с помощью интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, для лечения глазных болезней у индивида, включающий:
введение индивиду композиции, содержащей эффективное количество одноцепочечной интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель,
где одноцепочечная интерферирующая РНК в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1, содержащей нуклеотид 605, 653, 659, 1248, 1562, 1876, 2266, 2474, 2485, 2740, 2808, 2834, 3007, 3146, 3199, 3245, 3379, 3453, 3511, 3513, 3519, 3781, 3782, 998, 1132, 1200, 1648, 1674, 1708 или 2077, и интерферирующая РНК содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1, где таким образом снижают экспрессию мРНК Rho-киназы.
9. Способ снижения экспрессии мРНК-мишени при глазной гипертензии у индивида с помощью интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, где способ включает:
введение индивиду композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит:
область по меньшей мере из 13 последовательных нуклеотидов по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3′-конца мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9-SEQ ID NO:79, где таким образом снижают экспрессию мРНК-мишени при глазной гипертензии.
10. Способ по п.9, где мРНК-мишень при глазной гипертензии представляет собой мРНК ROCK1 и интерферирующая РНК содержит: область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3′-конца мРНК, соответствующей SEQ ID NO:3, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO: 14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO: 18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78 или SEQ ID NO:79.
11. Способ по п.9, где интерферирующая РНК содержит область по меньшей мере из 14 последовательных нуклеотидов, по меньшей мере на 85% комплементарную или по меньшей мере на 85% идентичную с предпоследними 14 нуклеотидами 3′-конца мРНК, соответствующей последовательности, определяемой посредством идентификатора последовательности.
12. Способ по п.9, где интерферирующая РНК содержит область по меньшей мере из 15, 16, 17 или 18 последовательных нуклеотидов, по меньшей мере с 80% комплементарностью последовательности, или по меньшей мере с 80% идентичностью последовательности с предпоследними 15, 16, 17 или 18 нуклеотидами, соответственно, 3′-конца мРНК, соответствующей последовательности, определяемой посредством идентификатора последовательности.
13. Способ по п.9, где композиция дополнительно содержит вторую интерферирующую РНК с длиной от 19 до 49 нуклеотидов и содержащую область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере с 90% комплементарностью, или по меньшей мере 90% идентичностью последовательности с предпоследними 13 нуклеотидами 3′-конца второй мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9-SEQ ID NO:79.
14. Способ лечения глазной гипертензии у пациента с помощью интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, где способ включает:
введение в глаза индивида композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит:
область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3′-конца мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9-SEQ ID NO:79, где таким образом проводят лечение глазной гипертензии.
15. Способ по п.14, где интерферирующая РНК содержит:
область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3′-конца мРНК, соответствующей SEQ ID NO:3, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78 или SEQ ID NO:79.
16. Способ по п.14, где интерферирующая РНК содержит область по меньшей мере из 14 последовательных нуклеотидов, по меньшей мере на 85% комплементарную или по меньшей мере на 85% идентичную с предпоследними 14 нуклеотидами 3′-конца мРНК, соответствующей последовательности, определяемой посредством идентификатора последовательности.
17. Способ по п.14, где интерферирующая РНК содержит область по меньшей мере из 15, 16, 17 или 18 последовательных нуклеотидов, по меньшей мере с 80% комплементарностью последовательности, или по меньшей мере с 80% идентичностью последовательности, с предпоследними 15, 16, 17 или 18 нуклеотидами, соответственно, 3′-конца мРНК, соответствующей последовательности, определяемой посредством идентификатора последовательности.
18. Способ по п.14, где композиция дополнительно содержит вторую интерферирующую РНК с длиной от 19 до 49 нуклеотидов и содержащую область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере с 90% комплементарность, или по меньшей мере с 90% идентичностью последовательности с предпоследними 13 нуклеотидами 3′-конца второй мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9-SEQ ID NO:79.
19. Способ по п.14, где у индивида присутствует глаукома.
20. Способ по п.1, где цепь смысловых нуклеотидов и цепь антисмысловых нуклеотидов связаны посредством петли шпильки.
21. Способ по п.7, где цепь смысловых нуклеотидов и цепь антисмысловых нуклеотидов связаны посредством петли шпильки.
22. Способ по п.9, где интерферирующая РНК представляет собой кшРНК.
23. Способ по п.9, где интерферирующая РНК представляет собой siPHK.
24. Способ по п.9, где интерферирующая РНК представляет собой мкРНК.
25. Способ по п.14, где интерферирующая РНК представляет собой кшРНК.
26. Способ по п.14, где интерферирующая РНК представляет собой siPHK.
27. Способ по п.14, где интерферирующая РНК представляет собой мкРНК.
28. Способ по п.7, где композицию вводят посредством местного, интравитреального, транссклерального, периокулярного, конъюнктивального, субтенонового, внутрикамерного, субретинального, субконъюктивального, ретробульбарного или внутриканальцевого способа введения.
29. Способ по п.7, где композицию вводят посредством экспрессии in vivo с экспрессирующего интерферирующую РНК вектора.
30. Способ по п.14, где композицию вводят посредством местного, интравитреального, транссклерального, периокулярного, конъюнктивального, субтенонового, внутрикамерного, субретинального, субконъюктивального, ретробульбарного или внутриканальцевого способа введения.
31. Способ по п.14, где композицию вводят посредством экспрессии in vivo с экспрессирующего интерферирующую РНК вектора.
32. Способ лечения глазной гипертензии у пациента с помощью интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, включающий:
введение индивиду композиции, содержащей молекулу двухцепочечной siPHK, снижающую экспрессию гена ROCK1 вследствие РНК-интерференции, где:
длина каждой цепи молекулы siPHK независимо составляет приблизительно от 19 до приблизительно 27 нуклеотидов; и одна из цепей молекулы siPHK содержит нуклеотидную последовательность со значительной комплементарностью с мРНК, соответствующей гену ROCK1, так, что молекула siPHK обуславливает расщепление мРНК вследствие РНК-интерференции.
33. Способ по п.32, где композицию вводят аэрозольным, буккальным, дермальным, интрадермальным, ингаляционным, внутримышечным, интраназальным, внутриглазным, внутрилегочным, внутривенным, интраперитонеальным, назальным, окулярным, пероральным, ушным, парентеральным, очаговым, подкожным, сублингвальным, местным или трансдермальным способом введения.
34. Способ по п.32, где интерферирующую РНК вводят посредством экспрессии in vivo с экспрессирующего вектора, способного к экспрессии интерферирующей РНК.
35. Способ по п.32, где интерферирующая РНК представляет собой мкРНК.
36. Способ по п.32, где длина каждой цепи молекулы siPHK независимо составляет приблизительно от 19 нуклеотидов до приблизительно 25 нуклеотидов.
37. Способ по п.32, где длина каждой цепи молекулы siPHK независимо составляет приблизительно от 19 нуклеотидов до приблизительно 21 нуклеотида.
38. Применение для получения композиции для снижения экспрессии мРНК при глазной гипертензии у индивида эффективного количества интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемого носителя, где интерферирующая РНК содержит:
область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3′-конца мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9-SEQ ID NO:79.
39. Применение для получения лекарственного средства для лечения глазной гипертензии у индивида, композиции, содержащей:
эффективное количество интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит: область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3′-конца мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9-SEQ ID NO:79, где таким образом проводят лечение глазной гипертензии.
40. Применение по п.38 или 39, где интерферирующая РНК содержит: область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3′-конца мРНК, соответствующей любой из SEQ ID NO:3, SEQ ID NO:9-SEQ ID NO:30 и SEQ ID NO:73-SEQ ID NO:79.
41. Применение по п.38 или 39, где интерферирующая РНК содержит область по меньшей мере из 14 последовательных нуклеотидов, по меньшей мере на 85% комплементарную или по меньшей мере на 85% идентичную с предпоследними 14 нуклеотидами 3′-конца мРНК, соответствующей последовательности, определяемой посредством идентификатора последовательности.
42. Применение по п.38 или 39, где интерферирующая РНК содержит область по меньшей мере из 15, 16, 17 или 18 последовательных нуклеотидов, по меньшей мере с 80% комплементарностью последовательности или по меньшей мере с 80% идентичностью последовательности, с предпоследними 15, 16, 17 или 18 нуклеотидами, соответственно, 3′-конца мРНК, соответствующей последовательности определяемой посредством идентификатора последовательности.
43. Применение по п.38 или 39, где композиция дополнительно содержит вторую интерферирующую РНК с длиной от 19 до 49 нуклеотидов и содержащую область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере с 90% комплементарностью, или по меньшей мере с 90% идентичностью последовательности с предпоследними 13 нуклеотидами 3′-конца второй мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9-SEQ ID NO:79.
44. Применение для получения лекарственного средства для лечения глазной гипертензии у индивида, композиции, содержащей: эффективное количество интерферирующей РНК, нацеленной на ген ROCK1 Rho-киназы, с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов, и область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов;
где антисмысловая цепь в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1, и содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1.
45. Применение для получения композиции для снижения экспрессии мРНК гена ROCK1 Rho-киназы у индивида эффективного количества одноцепочечной интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемого носителя,
где одноцепочечная интерферирующая РНК в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1, содержащей нуклеотид 605, 653, 659, 1248, 1562, 1876, 2266, 2474, 2485, 2740, 2808, 2834, 3007, 3146, 3199, 3245, 3379, 3453, 3511, 3513, 3519, 3781, 3782, 998, 1132, 1200, 1648, 1674, 1708 или 2077 и интерферирующая РНК содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1.
46. Применение по п.44, где цепь смысловых нуклеотидов и цепь антисмысловых нуклеотидов связана посредством петли шпильки.
47. Применение по пп.38, 39 или 44, где интерферирующая РНК представляет собой кшРНК.
48. Применение по пп.38, 39 или 44, где интерферирующая РНК представляет собой siPHK.
49. Применение по пп.38, 39 или 44, где интерферирующая РНК представляет собой мкРНК.
50. Применение по п.39 или 44, где композицию получают для местного, интравитреального, транссклерального, периокулярного, конъюнктивального, субтенонового, внутрикамерного, субретинального, субконъюктивального, ретробульбарного или внутриканальцевого способа введения.
51. Применение по п.39 или 44, где композиция содержит экспрессирующий вектор, способный к экспрессии интерферирующей РНК.
52. Применение по п.39 или 44, где лекарственное средство предназначено для лечения глазной гипертензии.
53. Применение для получения лекарственного средства для лечения глазной гипертензии у индивида, композиции, содержащей:
молекулу двухцепочечной siPHK, снижающую экспрессию гена ROCK1 вследствие РНК-интерференции, где:
длина каждой цепи молекулы siPHK независимо составляет приблизительно от 19 до приблизительно 27 нуклеотидов; и
одна из цепей молекулы siPHK содержит нуклеотидную последовательность со значительной комплементарностью с мРНК, соответствующей гену ROCK1, так что молекула siPHK обуславливает расщепление мРНК вследствие РНК-интерференции.
54. Применение по п.53, где композицию получают для аэрозольного, буккального, дермального, интрадермального, ингаляционного, внутримышечного, интраназального, внутриглазного, внутрилегочного, внутривенного, интраперитонеального, назального, окулярного, перорального, ушного, парентерального, очагового, подкожного, сублингвального, местного или трансдермального способа введения.
55. Применение по п.53, где композиция содержит экспрессирующий вектор, способный к экспрессии интерферирующей РНК.
56. Применение по п.53, где интерферирующая РНК представляет собой мкРНК.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| US 2005019746 A1, 27.01.2005 | |||
| RAO P.V | |||
| et al., Expression of dominant negative Rho-binding domain of organ cultured human eye anterior segments increases aqueous humor outflow, Molecular Vision, 2005, 27 April, v.11., pp.288-297. | |||
Авторы
Даты
2011-10-27—Публикация
2006-12-19—Подача