Перекрестная ссылка на родственные заявки
Согласно §119 раздела 35 свода законов США по настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/405798, поданной 22 октября 2010, и 61/484749, поданной 11 мая 2011, полное содержания которых приведено в настоящем документе в качестве ссылки.
Область техники
Настоящее изобретение относится к способам уменьшения способности антител к агрегации и к антителам, которые модифицированы так, чтобы уменьшить способность агрегировать. Настоящее изобретение также относится к антителам, которые связываются с фактором альфа некроза опухолей (TNFα). В частности, настоящее изобретение относится к стабильным и растворимым антителам, содержащим модификацию, уменьшающую способность агрегирования, в том числе к антителам в виде scFv и Fab-фрагментов, которые содержат специфические последовательности легкой цепи и тяжелой цепи, которые оптимизированы в отношении стабильности, растворимости и низкой иммуногенности. Кроме того, настоящее изобретение относится к способам диагностики и/или лечения TNF-опосредуемых нарушений.
Предпосылки создания изобретения
Фактор альфа некроза опухолей (TNFα, также известный как кахектин) является природным цитокином млекопитающих, продуцируемым многочисленными типами клеток, в том числе моноцитами и макрофагами в ответ на эндотоксин или другие стимулы. TNFα является основным медиатором воспаления, иммунологических и патофизиологических реакций (Grell, M., et al. (1995) Cell, 83: 793-802).
Растворимый TNFα образуется в результате расщепления трансмембранного белка-предшественника (Kriegler, et al. (1988) Cell 53: 45-53), а секретируемые полипептиды с молекулярной массой 17 кДа собираются в растворимые гомотримерные комплексы (Smith, et al. (1987), J. Biol. Chem. 262: 6951-6954; ради обзоров TNFα см. Butler, et al. (1986), Nature 320: 584; Old (1986), Science 230: 630). Эти комплексы затем связываются с рецепторами, находящимися на множестве клеток. Связывание вызывает большое число провоспалительных эффектов, в том числе (i) выброс других провоспалительных цитокинов, таких как интерлейкин(IL)-6, IL-8 и IL-1, (ii) высвобождение матриксных металлопротеиназ и (iii) повышение экспрессии молекул, вовлекаемых в адгезию к эндотелию, которые дополнительно увеличивают каскад воспалительных и иммунных реакций в результате привлечения лейкоцитов в внесосудистые ткани.
Большое число нарушений связано с повышенными уровнями TNFα, многие из них имеют важное значение в области медицины. Установлено, что экспрессия TNFα повышена при ряде заболеваний человека, включающих хронические заболевания, такие как ревматоидный артрит (RA), воспалительные заболевания кишечника, в том числе болезнь Крона и неспецифический язвенный колит, сепсис, застойную сердечную недостаточность, бронхиальную астму и рассеянный склероз. Трансгенные мыши, несущие ген для TNFα человека, продуцируют высокие уровни TNFα конститутивно, и у них развивается носящий спонтанный характер, деструктивный полиартрит, имеющий сходство с RA (Keffer et al. 1991, EMBO J., 10, 4025-4031). Поэтому TNFα называют провоспалительным цитокином.
В настоящее время общепринято, что TNFα является ключевым фактором в патогенезе RA, который представляет собой хроническое, прогрессирующее и ослабляющее заболевание, характеризующееся воспалением и разрушением множества суставов, при этом системными симптомами являются лихорадка и недомогание и усталость. RA также приводит к хроническому воспалению синовиальной сумки, обычно с прогрессированием до суставного хряща и разрушения кости. Повышенные уровни TNFα обнаружены как в синовиальной жидкости, так и в периферической крови пациентов, страдающих RA. При введении пациентам, страдающим RA, средств, блокирующих TNFα, они уменьшают воспаление, ослабляют симптомы и замедляют разрушение суставов (McKown et al. (1999), Arthritis Rheum. 42: 1204-1208).
Физиологически TNFα также связывают с защитой от конкретных инфекций (Cerami et al. (1988), Immunol. Today 9:28). TNFα высвобождается макрофагами, которые были активированы липополисахаридами грамотрицательных бактерий. Как таковой, TNFα, по-видимому, является имеющим основное значение эндогенным медиатором, вовлеченным в развитие и патогенез эндотоксического шока, связанного с бактериальным сепсисом (Michie, et al. (1989), Br. J. Surg. 76: 670-671; Debets. et al. (1989), Second Vienna Shock Forum, p. 463-466; Simpson, et al. (1989) Crit. Care Clin. 5: 27-47; Waage et al. (1987). Lancet 1: 355-357; Hammerle. et al. (1989) Second Vienna Shock Forum p. 715-718; Debets. et al. (1989), Crit. Care Med. 17: 489-497; Calandra. et al. (1990), J. Infect. Dis. 161: 982-987; Revhaug et al. (1988), Arch. Surg. 123: 162-170).
Установлено, что, как и в случае других систем органов, TNFα также играет ключевую роль в центральной нервной системе, в частности, при воспалительных и аутоиммунных нарушениях нервной системы, включая рассеянный склероз, синдром Гийена-Барра и тяжелой миастении, и при дегенеративных нарушениях нервной системы, включающих болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона. TNFα также вовлечен в нарушения связанных систем сетчатки и мышцы, включающие неврит зрительного нерва, дегенерацию желтого пятна, диабетическую ретинопатию, дерматомиозит, амиотрофический боковой склероз и мышечную дистрофию, а также в повреждения нервной системы, в том числе травматическое повреждение головного мозга, острую травму спинного мозга и удар.
Гепатит является другим, связанным с TNFα воспалительным заболеванием, которое может быть вызвано, среди прочих пусковых механизмов, болезнетворными вирусами, в том числе вирусом Эпштейна-Барра, цитомегаловирусом и вирусами гепатита A-E. Гепатит является причиной острого воспаления печени в области воротной вены и области долек, после чего следует фиброз и развитие опухоли. TNFα может также опосредовать кахексию при раке, которая является самой частой причиной смертности при раке (Tisdale M.J. (2004), Langenbecks Arch Surg. 389: 299-305).
Ключевая роль, которую играет TNFα при воспалении, в клеточных иммунных реакция и патологии многих заболеваний, привела к поиску антагонистов TNFα. Одним из классов антагонистов TNFα, предназначенных для лечения TNFα-опосредуемых заболеваний, являются антитела или фрагменты антител, которые специфически связываются с TNFα и тем самым блокируют их действие. При использовании антител против TNFα было установлено, что блокирование TNFα может устранять эффекты, приписываемые TNFα, в том числе, уменьшает IL-1, GM-CSF, IL-6, IL-8, адгезивные молекулы и разрушение тканей (Feldmann et al. (1997), Adv. Immunol. 1997: 283-350). Среди специфических ингибиторов TNFα, которые недавно появились в продаже, моноклональное, химерное антитело мыши-человека, направленное против TNFα, (инфликсимаб, RemicadeTM; Centocor Corporation/Johnson & Johnson) продемонстрировало клиническую эффективность в лечении RA и болезни Крона. Несмотря на эти достижения, сохраняется необходимость в новых и эффективных формах антител или других антителах для лечения связанных с TNFα нарушений, таких как RA. В частности, существует насущная необходимость в антителах с оптимальными функциональными свойствами для эффективного и длительного лечения артрита и других TNFα-опосредуемых нарушений.
Краткое изложение сущности изобретения
Настоящее изобретение относится к антителам, содержащим по крайней мере одну уменьшающую агрегацию мутацию, и к способам получения таких антител.
В одном из аспектов настоящее изобретение относится к способам уменьшения способности антител к агрегации, включающим введение одной или более уменьшающих агрегацию модификаций в положении остатка, принимающего участие во взаимодействии между вариабельным доменом легкой цепи и вариабельным доменом тяжелой цепи антитела, причем замена уменьшает свободную энергию между вариабельным доменом легкой цепи и вариабельным доменом тяжелой цепи по крайней мере на 0,5 ккал/моль, в связи с чем уменьшается способность к агрегации модифицированного антитела по сравнению с таковой исходного антитела, в котором нет уменьшающей агрегацию модификации(й).
В одном из аспектов способ по настоящему изобретению включает введение одной или более аминокислотных замен в область контакта вариабельного домена легкой цепи (VL) и вариабельного домена тяжелой цепи (VH) антитела, причем одна или более замен находятся в положениях остатков, выбранных для уменьшения свободной энергии между VL и VH по крайней мере на 10%, в связи с чем уменьшается способность к агрегации антитела по сравнению с исходным антителом. В конкретном аспекте последовательность вариабельного домена легкой цепи антитела по крайней мере на 65% идентична последовательности SEQ ID NO:1. В других аспектах последовательность вариабельного домена тяжелой цепи по крайней мере на 85% идентична последовательности SEQ ID NO:3 или последовательности SEQ ID NO:4.
В некоторых аспектах способ по настоящему изобретению включает модифицирование остатка в положении 50 в соответствии с системой нумерации AHo и/или остатка в положении 47 в соответствии с системой нумерации AHo вариабельного домена легкой цепи антитела, в связи с чем уменьшается способность к агрегации антитела по сравнению с исходным антителом. В других аспектах способ по настоящему изобретению, кроме того, включает модифицирование остатков в положениях 12, 103 и 144 в соответствии с системой нумерации AHo вариабельного домена тяжелой цепи.
Настоящее изобретение также относится к антителам с пониженной способностью к агрегации, содержащим одну или несколько уменьшающих агрегацию модификаций. В некоторых аспектах антителом по настоящему изобретению является Fab, Fab', F(ab)'2, одноцепочечный Fv (scFv), Fv-фрагмент или линейное антитело. В других аспектах настоящее изобретение относится к биспецифической или двухвалентной молекуле, содержащей антитело по настоящему изобретению.
В других аспектах уменьшающая агрегацию модификация находится в положении 50 в соответствии с системой нумерации AHo вариабельного домена легкой цепи. В конкретном аспекте уменьшающая агрегацию модификация содержит аргинин (R) в положении 50 в соответствии с системой нумерации AHo вариабельного домена легкой цепи. Тем не менее, в другом аспекте уменьшающая агрегацию модификация содержит замену лизина (K) на аргинин (R) в положении 50 в соответствии с системой нумерации AHo вариабельного домена легкой цепи.
Тем не менее, в других аспектах уменьшающая агрегацию модификация находится в положении 47 в соответствии с системой нумерации AHo вариабельного домена легкой цепи. В конкретном аспекте уменьшающая агрегацию модификация содержит аргинин (R) в положении 47 в соответствии с системой нумерации AHo вариабельного домена легкой цепи. Тем не менее, в другом аспекте уменьшающая агрегацию модификация содержит замену лизина (K) на аргинин (R) в положении 47 в соответствии с системой нумерации AHo вариабельного домена легкой цепи.
Настоящее изобретение также относится к стабильным и растворимым антителам, специфическим для TNFα, которые содержат необычные последовательности легкой цепи и тяжелой цепи, которые оптимизированы в отношении стабильности, растворимости, in vitro и in vivo связывания с TNFα, и низкой иммуногенности. Указанные антитела предназначены для диагностики и/или лечения TNFα-опосредуемых нарушений. Также изобретение относится к нуклеиновым кислотам, векторам и клеткам-хозяевам для экспрессии рекомбинантных антител, вариабельных доменов легких цепей и вариабельных доменов тяжелых цепей по настоящему изобретению, и к способам их выделения и к применению указанных антител в медицине.
Настоящее изобретение также относится к способам лечения TNFα-опосредуемого нарушения, включающим введение индивиду фармацевтической композиции, содержащей антитело против TNFα по настоящему изобретению. В некоторых аспектах TNF-альфа-опосредуемым нарушением является глазная болезнь, выбранная из группы, состоящей из увеита, болезни Бехчета, ретинита, сухости глаз, глаукомы, синдрома Шегрена, диабетической невропатии, склерита, возрастной дегенерации желтого пятна и кератита.
Конкретные предпочтительные варианты осуществления настоящего изобретения станут очевидными из следующего более подробного описания некоторых предпочтительных вариантов осуществления и формулы изобретения.
Краткое описание чертежей
На фиг. 1 представлены титрационные кривые для положений остатков VL47 (сплошные линии) и VL50 (пунктирные линии) в двух различных молекулах scFv, 34rFW1.4 (черный цвет) и 578rFW1.4 (серый цвет).
Фиг. 2A демонстрирует стабильность 34rFW1.4 в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 60 мг/мл.
Фиг. 2B демонстрирует стабильность 34rFW1.4_VLK50R_DHP в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 60 мг/мл.
Фиг. 3A демонстрирует стабильность 34rFW1.4 в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 40 мг/мл.
Фиг. 3B демонстрирует стабильность 34rFW1.4_VLK50R_DHP в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 40 мг/мл.
Фиг. 4A демонстрирует стабильность 34rFW1.4 в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 20 мг/мл.
Фиг. 4B демонстрирует стабильность 34rFW1.4_VLK50R_DHP в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 20 мг/мл.
Фиг. 5A демонстрирует стабильность 34rFW1.4 в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 60 мг/мл.
Фиг. 5B демонстрирует стабильность 34rFW1.4_VL_K50R в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 60 мг/мл.
Фиг. 6A демонстрирует стабильность 34rFW1.4 в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 40 мг/мл.
Фиг. 6B демонстрирует стабильность 34rFW1.4_VLK50R в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 40 мг/мл.
Фиг. 7A демонстрирует стабильность 34rFW1.4 в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 20 мг/мл.
Фиг. 7B демонстрирует стабильность 34rFW1.4_VLK50R в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 20 мг/мл.
Фиг. 8A демонстрирует стабильность 34rFW1.4 в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 60 мг/мл.
Фиг. 8B демонстрирует стабильность 34rFW1.4_K47R в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 60 мг/мл.
Фиг. 9A демонстрирует стабильность 34rFW1.4 в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 20 мг/мл.
Фиг. 9B демонстрирует стабильность 34rFW1.4_K47R в ускоренных условиях, определяемая с помощью анализа с использованием эксклюзионной HPLC после инкубации в течение 2 недель при 40°C и с использованием концентрации, составляющей 20 мг/мл.
Подробное описание настоящего изобретения
Общей целью настоящего изобретения является получение стабильных и растворимых антител, обладающих пониженной способностью к агрегации в растворе. В предпочтительном варианте осуществления указанным антителом является антитело в виде scFv или Fab-фрагмент. Антитела по настоящему изобретению, предпочтительно, включают легкую и тяжелую цепи, раскрытые в настоящем описании.
Представленное в настоящем описании подробное описание служит примером и предназначено лишь для иллюстративного обсуждения предпочтительных вариантов осуществления настоящего изобретения, и приведено ради предоставления того, что, как полагают, является наиболее рациональным и совершенно понятным описанием принципов и концептуальных аспектов различных вариантов осуществления настоящего изобретения. В этой связи не предпринимается попытка показать структурные детали настоящего изобретения более подробно, чем необходимо для понимания принципов настоящего изобретения, при этом на основании описания в сочетании с чертежами и/или примерами специалисту в данной области будет понятно, каким образом могут быть осуществлены на практике некоторые формы настоящего изобретения.
Для понимания настоящего изобретения ниже определены некоторые термины. Дополнительные определения приведены на всем протяжении подробного описания. Следующие определения и объяснения, как подразумевается и предполагается, являются предпочтительными при любом дальнейшем толковании, если только они явно и однозначно не изменены в следующих примерах, или кроме случаев, когда их использование делает какое-либо толкование бессмысленным или по существу бессмысленным. В тех случаях, когда толкование термина будет бессмысленным или по существу бессмысленным, то определение следует брать из словаря Webster, 3-ье издание или словаря, известного специалистам в данной области, такого как Oxford Dictionary of Biochemistry and Molecular Biology (Ed. Anthony Smith, Oxford University Press, Oxford, 2004).
Используемый в настоящем описании термин «антитело» включает полноразмерные антитела и любой антигенсвязывающий фрагмент (т.е. «антигенсвязывающую часть», «антигенсвязывающий полипептид» или «иммунное связующее вещество») или их одиночную цепь. «Антитело» включает гликопротеин, содержащий по крайней мере две тяжелые (H) цепи и две легкие (L) цепи, взаимно соединенные дисульфидными связями, или его антигенсвязывающую часть. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (в настоящем описании сокращенно как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (в настоящем описании сокращенно как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. VH- и VL-области можно далее разделить на участки гипервариабельности, называемые определяющими комплементарность участками (CDR), расположенные вперемежку с областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включающими различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классической системы комплемента.
Термин «антигенсвязывающая часть» антитела (или просто «часть антитела») относится к одному или более фрагментам антитела, которые сохраняют способность к специфическому связыванию с антигеном (например, TNF). Было установлено, что функцию антитела, относящуюся к связыванию антигена, могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, включаемых в термин «антигенсвязывающая часть» антитела, включают (i) Fab-фрагмент, одновалентный фрагмент, состоящий из VL-, VH-, CL- и CH1-доменов; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из VH- и CH1-доменов; (iv) Fv-фрагмент, состоящий из VL- и VH-доменов одного плеча антитела, (v) один домен или dAb-фрагмент (Ward et al., (1989) Nature 341: 544-546), который состоит из VH-домена; и (vi) выделенный определяющий комплементарность участок (CDR) или (vii) комбинацию двух или более выделенных CDR, которые могут быть необязательно соединены с помощью синтетического линкера. Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно соединить, используя способы создания рекомбинантных молекул, с помощью синтетического линкера, который позволяет создать их в виде одной белковой цепи, в которой VL- и VH-области спарены с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Предполагается, что такие одноцепочечные антитела также включены в термин «антигенсвязывающая часть» антитела. Эти фрагменты антител получают, используя обычные способы, известные специалистам в данной области, и фрагменты подвергают скринингу на предмет полезности таким же образом, как и интактные антитела. Антигенсвязывающие части могут быть получены способами рекомбинантных ДНК или с помощью ферментативного или химического расщепления интактных иммуноглобулинов. Антитела могут быть антителами различных изотипов, например, антителом изотипа IgG (например, подтипа IgG1, IgG2, IgG3 или IgG4), IgA1, IgA2, IgD, IgE или IgM.
Термин «каркасные области» относится к принятым в данной области частям вариабельной области антитела, которые находятся между более дивергентными CDR-участками. Такие каркасные области обычно называют каркасными областями с 1 по 4 включительно (FR1, FR2, FR3 и FR4) и обеспечивают остов для удержания, в трехмерном пространстве, трех CDR, обнаруживаемых в вариабельной области тяжелой или легкой цепи антитела, так что CDR могут образовывать антигенсвязывающую поверхность. Такие каркасные области можно также назвать остовами, поскольку они служат опорой для презентации более дивергентных CDR. В качестве антигенсвязывающих молекул могут использоваться другие CDR и каркасные области суперсемейства иммуноглобулинов, такие как анкириновые повторы и фибронектин (см. также, например, патенты США № 6300064 и 6815540 и публикацию заявки на патент США № 20040132028).
Термин «эпитоп» или «антигенная детерминанта» относится к месту на антигене, в котором иммуноглобулин или антитело специфически связывается (например, с TNF). Эпитоп обычно включает по крайней мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот в уникальной пространственной конформации. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, G. E. Morris, Ed. (1996).
Термины «специфическое связывание», «селективное связывание», «селективно связывается» и «специфически связывается» относятся к связыванию антитела с эпитопом заданного антигена. Обычно антитело связывается с аффинностью (KD), составляющей приблизительно менее чем 10-7 M, например, приблизительно менее чем 10-8 M, 10-9 M или 10-10 M или даже меньше, как определено, используя технологию с использованием поверхностного плазмонного резонанса (SPR) в инструментальном средстве BIACORE.
Термин «KD» относится к константе равновесия при диссоциации конкретного взаимодействия антитела с антигеном. В некоторых вариантах осуществления некоторые антитела по настоящему изобретению связываются с TNF с константой равновесия при диссоциации (KD), составляющей менее чем приблизительно 10-7 M, например, менее чем приблизительно 10-8 M, 10-9 M или 10-10 M или даже меньше, например, как определено, используя технологию с использованием поверхностного плазмонного резонанса (SPR) в инструментальном средстве BIACORE.
Как используется в настоящем описании, «идентичность» относится к совпадению последовательностей двух полипептидов, молекул или двух нуклеиновых кислот. Если положение в обеих из двух сравниваемых последовательностей занимает одна и та же мономерная субъединица в виде основания или аминокислоты (например, если положении в каждой из двух молекул ДНК занимает аденин, или положении в каждом из двух полипептидов занимает лизин), то соответствующие молекулы являются идентичными в этом положении. «Процент идентичности» двух последовательностей зависит от числа совпадающих положений, разделяемых двумя последовательностями, разделенного на число сравниваемых положений, x 100. Например, если совпадают 6 из 10 положений в двух последовательностях, то две последовательности являются идентичными на 60%. В качестве примера, последовательности ДНК CTGACT и CAGGTT идентичны на 50% (совпадают 3 из всего 6 положений). Как правило, сравнение осуществляют после выравнивания двух последовательностей для достижения максимальной идентичности. Такое выравнивание можно обеспечить, используя, например, способ Needleman и др. ((1970) J. Mol. Biol. 48: 443-453), просто реализуемый компьютерными программами, такими как программа Align (DNAstar, Inc.). Процент идентичности двух аминокислотных последовательностей можно также определить, используя алгоритм E. Meyers и W. Miller (Comput. Appl. Biosci., 4: 11-17 (1988)), который включен в программу ALIGN (версии 2.0), используя таблицу веса остатков PAM120, штраф за длину пропуска = 12 и штраф за пропуск = 4. Кроме того, процент идентичности двух аминокислотных последовательностей можно определить, используя алгоритм Needleman и Wunsch (J. Mol. Biol. 48: 444-453 (1970)), который включен в программу GAP в пакете программ GCG (доступном на сайте http://www.gcg.com), используя либо матрицу Blossum 62, либо матрицу PAM250, и весовой коэффициент для пропуска, равный 16, 14, 12, 10, 8, 6 или 4, и весовой коэффициент для длины, равный 1, 2, 3, 4, 5 или 6.
«Схожими» последовательностями являются последовательности, которые, при выравнивании, имеют идентичные и схожие аминокислотные остатки, причем схожими остатками являются консервативные замены для соответствующих аминокислотных остатков в выровненной контрольной последовательности. В связи с этим, «консервативной заменой» остатка в контрольной последовательности является замена на остаток, который физически или функционально схож с соответствующим остатком в контрольной последовательности, например, который имеет схожий размер, форму, электрический заряд, химические свойства, включая способность к образованию ковалентных или водородных связей, и т.п. Таким образом, «модифицированной в результате консервативной(ых) замены (замен)» последовательностью является последовательность, которая отличается от контрольной последовательной или последовательности дикого типа тем, что присутствует одна или более консервативных замен. «Процент идентичности» двух последовательностей зависит от числа положений, в которых находятся совпадающие остатки или консервативные замены, разделяемые двумя последовательностями, разделенного на число сравниваемых положений, x 100. Например, если 6 из 10 положений в двух последовательностях совпадают, а в 2 из 10 положений находятся консервативные замены, то две последовательности схожи на 80%.
Используемый в настоящем описании термин «консервативные модификации последовательности», как предполагается, относится к модификациям аминокислот, которые не оказывают отрицательное влияние на характеристики связывания антитела, содержащего эту аминокислотную последовательность, или не изменяют их. Такие консервативные модификации последовательности включают замены, добавления и делеции нуклеотидов и аминокислот. Например, модификации можно ввести с помощью стандартных способов, известных в данной области, таких как сайт-направленный мутагенез и мутагенез с использованием ПЦР. Консервативные аминокислотные замены включают замены, в случае которых аминокислотный остаток заменяют на аминокислотный остаток, имеющий схожую боковую цепь. В данной области были установлены семейства аминокислотных остатков, имеющие схожие боковые цепи. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глютаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глютамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, предсказанный заменимый аминокислотный остаток в конкретном антителе, предпочтительно, заменяют на другой аминокислотный остаток из того же семейства боковых цепей. Способы определения нуклеотидных и аминокислотных консервативных замен, которые не аннулируют связывание с антигеном, хорошо известны в данной области (см., например, Brummell et al, Biochem. 32: 1180-1187 (1993); Kobayashi et al. Protein Eng. 12(10): 879-884 (1999); и Burks et al. Proc. Natl. Acad. Sci. USA 94: 412-417 (1997)).
Как используется в настоящем описании, «аминокислотная консенсусная последовательность» относится к аминокислотной последовательности, которую можно получить, используя матрицу из по крайней мере двух, а, предпочтительно, более, выровненных аминокислотных последовательностей, и предусматривая пропуски при выравнивании, так что можно определить наиболее часто встречающийся аминокислотный остаток в каждом положении. Консенсусная последовательность представляет собой такую последовательность, которая содержит аминокислоты, которые представлены с наибольшей частотой в каждом положении. В том случае, когда две или более аминокислоты представлены в равной степени в одном положении, консенсусная последовательность включает обе или все из этих аминокислот.
Аминокислотную последовательность белка можно исследовать на различных уровнях. Например, сохраняемость или вариабельность может проявляться на уровне одного остатка, уровне множества остатков, множества остатков с пропусками и т.д. Остатки могут проявлять сохраняемость идентичного остатка или могут быть сохраняемыми на уровне класса. Примеры классов аминокислот включают полярные, но незаряженные R-группы (серин, треонин, аспарагин и глютамин); положительно заряженные R-группы (лизин, аргинин и гистидин); отрицательно заряженные R-группы (глютаминовая кислота и аспарагиновая кислота); гидрофобные R-группы (аланин, изолейцин, лейцин, метионин, фенилаланин, триптофан, валин и тирозин) и особые аминокислоты (цистеин, глицин и пролин). Специалисту в данной области известны другие классы, и их можно определить, используя детерминанты структуры или другие данные для определения заменяемости. В некотором смысле заменяемая аминокислота может относиться к любой аминокислоте, которую можно заменить и которая сохраняет функциональный консерватизм в этом положении.
Однако будет понятно, что биофизические свойства аминокислот одного и того же класса могут отличиться степенью. Например, будет понятно, что некоторые гидрофобные R-группы (например, аланин, серин или треонин) являются более гидрофильными (т.е. имеют большую гидрофильность или меньшую гидрофобность), чем другие гидрофобные R-группы (например, валин или лейцин). Относительную гидрофильность или гидрофобность можно определить, используя признанные в данной области способы (см., например, Rose et al., Science, 229: 834-838 (1985) и Cornette et al., J. Mol. Biol, 195: 659-685 (1987)).
Как используется в настоящем описании, в случае выравнивания одной аминокислотной последовательности (например, первой последовательности VH или VL) с одной или более дополнительными аминокислотными последовательностями (например, одной или более последовательностей VH или VL в базе данных) положение аминокислоты в одной последовательности (например, первой последовательности VH или VL) можно сравнить с «соответствующим положением» в одной или более дополнительных аминокислотных последовательностей. Как используется в настоящем описании, «соответствующее положение» представляет собой эквивалентное положение в сравниваемой последовательности(ях) после оптимального выравнивания последовательностей, т.е. после выравнивания последовательностей для достижения наибольшего процента идентичности или процента схожести.
Термин «молекула нуклеиновой кислоты» относится к молекулам ДНК или молекулам РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но, предпочтительно, является двухцепочечной ДНК. Нуклеиновая кислота является «функционально связанной», когда установлена ее функциональная связь с другой последовательностью нуклеиновой кислоты. Например, промотор или энхансер является функционально связанным с кодирующей последовательностью, если он оказывает влияние на транскрипцию этой последовательности. В некоторых вариантах осуществления настоящее изобретение относится к выделенным молекулам нуклеиновых кислот, которые кодируют антитело по настоящему изобретению, вариабельный домен легкой цепи по настоящему изобретению и/или вариабельный домен тяжелой цепи антитела по настоящему изобретению. В некоторых вариантах осуществления молекула нуклеиновой кислоты по настоящему изобретению кодирует полипептид, содержащий вариабельную область легкой цепи, которая по меньшей мере на 97% идентична SEQ ID NO:2 или SEQ ID NO:14; полипептид, содержащий вариабельную область тяжелой цепи, который по меньшей мере на 95% идентична SEQ ID NO:5; или антитело, которое по меньшей мере на 96% идентично SEQ ID NO:10 или SEQ ID NO:17.
Термин «вектор» относится к молекуле нуклеиновой кислоты, способной к переносу другой нуклеиновой кислоты, с которой она соединена. Одним типом вектора является «плазмида», которая относится к петле кольцевой, двухцепочечной ДНК, в которую можно лигировать дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, в случае которого дополнительные сегменты ДНК можно лигировать в геном вируса. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальное начало репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина после введения в клетку-хозяина и в силу этого реплицируются вместе с геном хозяина.
Термин «клетка-хозяин» относится к клетке, в которую был введен вектор экспрессии. Клетки-хозяева могут включать бактериальные, микробные клетки, клетки растений или животных. Бактерии, которые поддаются трансформации, включают члены Enterobacteriaceae, такие как штаммы Escherichia coli или Salmonella; Bacillaceae, такие как Bacillus subtilis; Pneumococcus; Streptococcus и Haemophilus influenzae. Подходящие микробы включают Saccharomyces cerevisiae и Pichia pastoris. Подходящие линии клеток животных-хозяев включают клетки CHO (линии клеток яичника китайского хомячка) и клетки NS0.
Термины «лечить» и «лечение» относятся к терапевтическим или профилактическим мерам, описываемым в настоящем описании. В способах «лечения» используется введение антитела по настоящему изобретению индивиду, при необходимости такого лечения, например, индивиду с TNFα-опосредуемым нарушением, или индивиду у которого в итоге может возникнуть такое нарушение, для профилактики, лечения, отстрочки наступления, уменьшения тяжести или уменьшения интенсивности одного или нескольких симптомов нарушения, или повторного нарушения, или для увеличения продолжительности жизни индивида сверх ожидаемой продолжительности в отсутствие такого лечения.
Термин «TNF-опосредуемое нарушение» в целом относится к болезненным состояниям и/или симптомам, связанным с TNF, включая любое нарушение, для возникновения, прогрессирования или персистирования симптомов которого требуется участие TNF. Примеры TNF-опосредуемых нарушений включают, но ими не ограничиваются, возрастную дегенерацию желтого пятна, неоваскулярную глаукому, диабетическую ретинопатию, ретинопатию недоношенных, ретролентальную фиброплазию, карциномы молочной железы, карциномы легкого, карциномы желудка, карциномы пищевода, колоректальные карциномы, карциномы печени, карциномы яичника, коматозные состояния, арренобластомы, карциномы шейки матки, карциному эндометрия, гиперплазию эндометрия, эндометриоз, фибросаркомы, хориокарциномы, рак головы и шеи, карциному носоглотки, карциномы гортани, гепатобластому, саркому Капоши, меланому, карциномы кожи, гемангиому, пещеристую гемангиому, гемангиобластому, карциномы поджелудочной железы, ретинобластому, астроцитому, глиобластому, шваннному, олигодендроглиому, медуллобластому, нейробластому, рабдомиосаркому, остеогенную саркому, лейомиосаркомы, карциномы мочевых путей, карциномы щитовидной железы, опухоль Вильмса, почечно-клеточную карциному, карциному предстательной железы, анормальную пролиферации клеток сосудистой стенки, связанную с факоматозами, отек (такой как тот, который связан с опухолями головного мозга), синдром Мейгса, ревматоидный артрит, псориаз и атеросклероз. TNF-опосредуемые нарушения также включают сухость глаз и связанные с TNFα воспалительные процессы, такие как воспаление глаза, аллергический конъюнктивит, дерматит, ринит и астму, например, и включают те клеточные изменения, которые являются результатом активности TNFα, которая приводит непосредственно или опосредованно к связанному с TNFα воспалительному процессу. Кроме того, TNF-опосредуемые нарушения также включают ангиогенез в глазу, болезнь Бехчета, ретинит, глаукому, синдром Шегрена, диабетическую невропатию, склерит, кератит и увеит.
Термин «эффективная доза» относится к количеству, достаточному для достижения или по крайней мере отчасти достижения желаемого эффекта. Термин «терапевтически эффективная доза» определяют как количество, достаточное для излечения или по крайней мере частичной остановки заболевания и его осложнений у пациента, уже страдающего этим заболеванием. Количества, эффективные в случае этого применения, будут зависеть от тяжести нарушения, в отношении которого проводят лечение, и общего состояния собственной иммунной системы пациента.
Термин «индивид» относится к любому человеку или не являющемуся человеком животному. Например, способы и композиции по настоящему изобретению могут использоваться для лечения индивида с TNF-опосредуемым нарушением.
Системы нумерации, используемые в настоящем описании для определения положений аминокислотных остатков в вариабельных областях тяжелой и легкой цепей антитела, соответствуют той, которая установлена A. Honegger (J. Mol. Biol. 309 (2001) 657-670) (системе нумерации AHo). Таблицы соотношений между системой нумерации AHo и чаще всего используемой системой, установленной Kabat и др. (Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), приведены в A. Honegger, J. Mol. Biol. 309 (2001) 657-670.
Используемый в настоящем описании термин «агрегация» относится к процессу межмолекулярных взаимодействий/объединений между мономерными молекулами в жидком растворе, приводящему к образованию олигомерного состояния. Агрегацию можно оценить в ухудшенных условиях, используя ускоренные исследования стабильности в концентрированном растворе. Ускоренные исследования стабильности предназначены для увеличения степени деградации, агрегации или химических модификаций соединения в результате использования экстремальных условий хранения. Ускоренные исследования стабильности, также известные исследования в экстремальных условиях, обычно проводят при 40°C и комнатной температуре. Эти исследования стабильности предоставляют ценную информацию, касающуюся эффекта подвергания воздействию условий окружающей среды, находящихся за пределами нормальных условий хранения, указанных на этикетке, также называемых ухудшенными условиями. Растворы с высокими концентрациями белка широко используются в фармацевтической промышленности. Поведение белков в высоких концентрациях в растворе может весьма отличаться от такового, предсказанного на основе анализа разбавленного раствора, вследствие термодинамической неидеальности в этих растворах. Неидеальность, отмечаемая в этих системах, связана с белок-белковыми взаимодействиями (PPI). Различные типы сил играют ключевую роль в определении общей природы и степени этих PPI, и на их относительные вклады оказывают влияния свойства растворенного вещества и растворителя. Роль PPI обусловлена этими межмолекулярными силами с определением характеристик раствора, включая физическую стабильность и самоассоциацию и агрегацию белков. Концентрированными растворами являются такие растворы, в которых PPI оказывает влияние на белки в растворе в результате увеличения степени олигомеризации. Концентрированный раствор может иметь, например, концентрацию белка, составляющую по крайней мере 10 мг/мл.
Растворимые продукты этого процесса можно выявить с помощью аналитических способов, таких как эксклюзионная HPLC. Используемый в настоящем описании термин «уменьшающая агрегацию модификация» относится к модификации, такой как аминокислотная замена, которая уменьшает способность антитела к агрегации в жидком растворе по сравнению с исходным антителом, описываемым в настоящем описании. «Исходным» антителом является антитело, содержащее по существу ту же последовательность, что и соответствующее антитело, которое содержит уменьшающие агрегацию модификации. Например, исходное антитело может иметь те же CDR, что и модифицированное антитело, и может иметь точно такую же последовательность, что и модифицированное антитело, за исключением остатков в положении 47 и/или 50 в соответствии с системой нумерации AHo в последовательности вариабельного домена легкой цепи и может, кроме того, отличаться по положениям 12, 103 и 144 в соответствии с системой нумерации AHo в последовательности вариабельного домена тяжелой цепи. Также могут присутствовать другие отличия при условии, что исходное антитело не содержит уменьшающие агрегацию модификации, присутствующие в антителе, модифицированном в соответствии со способом по настоящему изобретению.
Используемый в настоящем описании термин «взаимодействие» относится к взаимодействию между двумя вариабельными доменами (вариабельными домена легкой и тяжелой цепей) антитела. Область контакта включает аминокислотные остатки, которые участвуют непосредственно или опосредованно во взаимодействии между вариабельными доменами. Такое взаимодействие включает, но ими не ограничиваются, все виды несвязанных взаимодействий, например, силы Ван-дер-Ваальса, водородную связь, электростатические связи и гидрофобные взаимодействия между двумя доменами.
Кроме особо указанных случаев, все технические и научные термины, используемые в настоящем описании, имеют значение, одинаковое с тем, в котором они обычно понимаются средним специалистом в области, к которой относится настоящее изобретение. Хотя способы и материалы, схожие с теми, которые описываются в настоящем описании, или эквивалентные им, могут использоваться при осуществлении на практике или проверке настоящего изобретения, ниже описываются подходящие способы и материалы. В случае противоречия описание настоящего изобретения, включая определения, будет доминировать. Кроме того, материалы, способы и примеры являются лишь иллюстративными и, как предполагается, не являются ограничивающими.
Различные аспекты настоящего изобретения описываются с дополнительными деталями в следующих подразделах. Понятно, что различные варианты осуществления, предпочтения и диапазоны можно произвольно объединить. Кроме того, в зависимости от конкретного варианта осуществления, избранные определения, варианты осуществления или диапазоны могут не быть приемлемыми.
В одном из аспектов настоящее изобретение относится к антителам, которые связываются с TNFα и, таким образом, являются подходящими для блокирования функционирования TNFα in vivo.
В некоторых вариантах осуществления антитела по настоящему изобретению оптимизированы уменьшающей агрегацию модификации(й) относительно исходного антитела, так что антитело по настоящему изобретению имеет уменьшенную способность к агрегации по сравнению с исходным/немодифицированным антителом. Такие модификации(я) включают замены конкретных остатков аминокислот, которые участвуют во взаимодействии вариабельного домена легкой цепи (VL) и вариабельного домена тяжелой цепи (VH). В некоторых вариантах осуществления уменьшающая агрегацию модификация содержит по крайней мере одну аминокислотную замену, которая уменьшает свободную энергию взаимодействия VL-VH по сравнению со свободной энергией взаимодействия VL-VH исходного антитела в способе компьютерного моделирования, описываемом в настоящем описании. Такие модификации включают аминокислотные замены конкретных остатков, которые вносят вклад в свободную энергию взаимодействия VL-VH.
В некоторых вариантах осуществления уменьшающая агрегацию модификация по настоящему изобретению включает замену в положении 50 в соответствии с системой нумерации AHo в VL. В одном из вариантов осуществления заменой является аргинин (R) в положении 50 в соответствии с системой нумерации AHo. В другом варианте осуществления аргинин (R) в положении 50 в соответствии с системой нумерации AHo заменяет лизин (K).
В других вариантах осуществления уменьшающая агрегацию модификация по настоящему изобретению включает замену в положении 47 в соответствии с системой нумерации AHo в VL. В одном из вариантов осуществления заменой является аргинин (R) в положении 47 в соответствии с системой нумерации AHo. В другом варианте осуществления аргинин (R) в положении 47 в соответствии с системой нумерации AHo заменяет лизин (K).
Система нумерации AHo подробно описана в Honegger, A. and Pluckthun, A. (2001) J. Mol. Biol. 309: 657-670. Положение 50 в соответствии с системой нумерации AHo в вариабельном домене легкой цепи соответствует положению 42 в соответствии с системой нумерации Kabat. Положение 47 в соответствии с системой нумерации AHo в вариабельном домене легкой цепи соответствует положению 39 в соответствии с системой нумерации Kabat. Система нумерации Kabat описана, кроме того, в Kabat et al. (Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Таблицы соотношений между системой нумерации AHo и чаще всего используемой системой нумерации, установленной Kabat и др., приведены в A. Honegger, J. Mol. Biol. 309 (2001) 657-670.
Следующие таблицы соотношений приведены для двух различных систем нумерации, используемых для определения положений аминокислотных остатков в вариабельных областях тяжелой и легкой цепей антитела. Система нумерации Kabat описана, кроме того, в Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Система нумерации AHo описана, кроме того, в Honegger, A. and Pluckthun, A. (2001) J Mol. Biol.309: 657-670).
Нумерация в вариабельной области тяжелой цепи
Таблица соотношений для положений остатков в вариабельном домене тяжелой цепи
Нумерация в вариабельной области легкой цепи
Таблица соотношений для положений остатков в вариабельном домене легкой цепи
Антитела по настоящему изобретению могут содержать дополнительные модификации по желанию. Например, антитело по настоящему изобретению может содержать аминокислотные замены для уменьшения его иммуногенности in vivo в соответствии со способами, описанными, например, в заявке на патент СЩА № 12/973968, и/или замены для увеличения растворимости антитела, как описано в WO 09/155725. Таким образом, В одном из вариантов осуществления антитело по настоящему изобретению содержит серин (S) в положении 12 тяжелой цепи (в соответствии с системой нумерации AHo); серин (S) или треонин (T) в положении 103 тяжелой цепи (в соответствии с системой нумерации AHo) и/или серин (S) или треонин (T) в положении 144 тяжелой цепи (в соответствии с системой нумерации AHo). Кроме того, антитело может содержать серин (S) или треонин (T) в положениях 97, 98 и/или 99 тяжелой цепи (в соответствии с системой нумерации AHo). Предпочтительно, антитело содержит серин (S) в положении 12 тяжелой цепи (в соответствии с системой нумерации AHo), треонин (T) в положении 103 тяжелой цепи (в соответствии с системой нумерации AHo) и треонин (T) в положении 144 тяжелой цепи (в соответствии с системой нумерации AHo).
В одном из вариантов осуществления антитело по настоящему изобретению содержит вариабельный домен легкой цепи, содержащий SEQ ID NO:1:
EIVMTQSPSTLSASVGDRVIITC(X)n=1-50 WYQQKPGRAPKLLIY(X)n=1-50 GVPSRFSGSGSGAEFTLTISSLQPDDFATYYC(X)n=1-50 FGQGTKLTVLG
В предпочтительном варианте осуществления антитело по настоящему изобретению содержит вариабельный домен легкой цепи (CDR подчеркнуты), содержащий SEQ ID NO:2:
EIVMTQSPSTLSASVGDRVIITCQSSQSVYGNIWMAWYQQKPGRAPKLLIYQASKLASGVPSRFSGSGSGAEFTLTISSLQPDDFATYYCQGNFNTGDRYAFGQGTKLTVLG
В другом варианте осуществления антитело по настоящему изобретению содержит вариабельный домен тяжелой цепи, содержащий SEQ ID NO:3 (каркасная область вариабельного домена тяжелой цепи):
EVQLVESGGGLVQPGGSLRLSCTAS(X)n=1-50 WVRQAPGKGLEWVG(X)n=1-50 RFTISRDTSKNTVYLQMNSLRAEDTAVYYCAR(X)n=1-50 WGQGTLVTVSS
Тем не менее, в другом варианте осуществления антитело по настоящему изобретению содержит каркасную область вариабельного домена тяжелой цепи:
SEQ ID NO:4: каркасная область вариабельного домена тяжелой цепи
EVQLVESGGGLVQPGGSLRLSCTVS(X)n=1-50 WVRQAPGKGLEWVG(X)n=1-50 RFTISKDTSKNTVYLQMNSLRAEDTAVYYCAR(X)n=1-50 WGQGTLVTVSS
В предпочтительном варианте осуществления антитело по настоящему изобретению содержит вариабельный домен тяжелой цепи (CDR подчеркнуты), содержащий SEQ ID NO:5:
EVQLVESGGGSVQPGGSLRLSCTASGFTISRSYWICWVRQAPGKGLEWVGCIYGDNDITPLYANWAKGRFTISRDTSKNTVYLQMNSLRAEDTATYYCARLGYADYAYDLWGQGTTVTVSS
Как используются в настоящем описании, остатки X являются местами вставки CDR. X может представлять собой любую природную аминокислоту; могут присутствовать по крайней мере три и вплоть до 50 аминокислот.
В одном из вариантов осуществления каркасная область вариабельного домена легкой цепи антитела по настоящему изобретению содержит SEQ ID NO:1, а каркасная область вариабельного домена тяжелой цепи включает SEQ ID NO:3 или SEQ ID NO:4.
В другом варианте осуществления каркасная область вариабельного домена легкой цепи антитела по настоящему изобретению содержит последовательность, которая по меньшей мере на 65%, более предпочтительно, по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:1. Наиболее предпочтительно, когда указанная последовательность содержит аргинин (R) в положении 50 в соответствии с системой нумерации AHo. В другом варианте осуществления указанная последовательность содержит аргинин (R) в положении 47 в соответствии с системой нумерации AHo.
В другом варианте осуществления каркасная область вариабельного домена тяжелой цепи антитела по настоящему изобретению содержит последовательность, которая по меньшей мере на 80%, более предпочтительно, по меньшей мере на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:3. Предпочтительно, когда указанное антитело содержит серин (S) в положении 12 тяжелой цепи (в соответствии с системой нумерации AHo), треонин (T) в положении 103 тяжелой цепи (в соответствии с системой нумерации AHo) и треонин (T) в положении 144 тяжелой цепи (в соответствии с системой нумерации AHo).
В другом варианте осуществления каркасная область вариабельного домена легкой цепи антитела по настоящему изобретению содержит последовательность, которая по меньшей мере на 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:2 или SEQ ID NO:14.
В другом варианте осуществления каркасная область вариабельного домена тяжелой цепи антитела по настоящему изобретению содержит последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:5.
В другом варианте осуществления антитело по настоящему изобретению содержит последовательность, которая по меньшей мере на 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:10 или на SEQ ID NO:17.
В другом варианте осуществления каркасная область вариабельного домена легкой цепи антитела по настоящему изобретению содержит SEQ ID NO:2 или SEQ ID NO:14, а каркасная область вариабельного домена тяжелой цепи содержит SEQ ID NO:5.
В одном из вариантов осуществления антителами или фрагментами антител по настоящему изобретению являются одноцепочечные антитела (scFv) или Fab-фрагменты. В случае scFv антител VL-домен может быть связан с VH-доменом в той или другой ориентации с помощью гибкого линкера. Подходящая структура линкера уровня техники состоит из повторяющихся аминокислотных последовательностей GGGGS (SEQ ID NO:6) или их вариантов. В предпочтительном варианте осуществления настоящего изобретения используется линкер в виде (GGGGS)4 (SEQ ID NO:7) или его производное, но также возможны варианты из 1-3 повторов (Holliger et al. (1993), Proc. Natl. Acad. Sci. USA 90: 6444-6448). Другие линкеры, которые могут использоваться для настоящего изобретения, описаны в Alfthan et al. (1995), Protein Eng. 8: 725-731, Choi et al. (2001), Eur. J. Immunol. 31: 94-106, Hu et al. (1996), Cancer Res. 56: 3055-3061, Kipriyanov et al. (1999), J. Mol. Biol. 293: 41-56 и Roovers et al. (2001), Cancer Immunol. Immunother. 50: 51-59. Расположением может быть или VL-линкер-VH, или VH-линкер-VL, при этом первое расположение является предпочтительным. В случае Fab-фрагментов отобранные вариабельные домены легкой цепи VL слиты с константной областью легкой цепи каппа Ig человека, в то время как подходящие вариабельные домены тяжелой цепи VH слиты с первым (N-концевым) константным доменом CH1 IgG человека. На C-конце межцепочечный дисульфидный мостик образуется между двумя константными доменами.
Таким образом, в одном из вариантов осуществления антитело по настоящему изобретению содержит последовательность:
SEQ ID NO:8
EIVMTQSPSTLSASVGDRVIITC(X)n=1-50WYQQKPGRAPKLLIY(X)n=1-50 GVPSRFSGSGSGTEFTLTISSLQPDDFATYYC(X)n=1-50FGQGTKLTVLG GGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVQPGGSLRLSCTAS(X)n=1-50 WVRQAPGKGLEWVG(X)n=1-50RFTISRDTSKNTVYLQMNS LRAEDTAVYYCAR(X)n=1-50WGQGTLVTVSS
В другом варианте осуществления антитело по настоящему изобретению содержит последовательность:
SEQ ID NO:9
EIVMTQSPSTLSASVGDRVIITC(X)n=1-50WYQQRPGKAPKLLIY(X)n=1-50 GVPSRFSGSGSGTEFTLTISSLQPDDFATYYC(X)n=1-50FGQGTKLTVLG GGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVQPGGSLRLSCTVS(X)n=1-50 WVRQAPGKGLEWVG(X)n=1-50RFTISKDTSKNTVYLQMNSLR AEDTAVYYCAR(X)n=1-50WGQGTLVTVSS
В предпочтительном варианте осуществления антитело по настоящему изобретению содержит последовательность:
SEQ ID NO:10
(34rFW1.4_VL_K50R_DHP):
EIVMTQSPSTLSASVGDRVIITCQSSQSVYGNIWMAWYQQKPGRAPKLLIYQASKLASGVPSRFSGSGSGAEFTLTISSLQPDDFATYYCQGNFNTGDRYAFGQGTKLTVLGGGGGSGGGGSGGGGSGGGGSEVQLVESGGGSVQPGGSLRLSCTASGFTISRSYWICWVRQAPGKGLEWVGCIYGDNDITPLYANWAKGRFTISRDTSKNTVYLQMNSLRAEDTATYYCARLGYADYAYDLWGQGTTVTVSS
В одном из вариантов осуществления антитело по настоящему изобретению содержит вариабельный домен легкой цепи, содержащий SEQ ID NO:11 (каркасная область вариабельного домена легкой цепи FW1.4 (KI27)):
EIVMTQSPSTLSASVGDRVIITC(X)n=1-50 WYQQKPGKAPKLLIY(X)n=1-50 GVPSRFSGSGSGAEFTLTISSLQPDDFATYYC(X)n=1-50 FGQGTKLTVLG
В другом варианте осуществления антитело по настоящему изобретению содержит вариабельный домен легкой цепи, содержащий SEQ ID NO:12 (содержащая замены каркасная область вариабельного домена легкой цепи FW1.4)):
EIVMTQSPSTLSASVGDRVIITC(X)n=1-50 WYQQKPGKAPKLLIY(X)n=1-50 GVPSRFSGSGSGTEFTLTISSLQPDDFATYYC(X)n=1-50 FGQGTKLTVLG
Тем не менее, в другом предпочтительном варианте осуществления антитело по настоящему изобретению содержит последовательность:
SEQ ID NO:13
EIVMTQSPSTLSASVGDRVIITC(X)n=1-50WYQQRPGKAPKLLIY(X)n=1-50 GVPSRFSGSGSGAEFTLTISSLQPDDFATYYC(X)n=1-50 FGQGTKLTVLG
В другом варианте осуществления антитело по настоящему изобретению содержит вариабельный домен легкой цепи (CDR подчеркнуты), содержащий SEQ ID NO:14:
EIVMTQSPSTLSASVGDRVIITCQSSQSVYGNIWMAWYQQRPGKAPKLLIYQASKLASGVPSRFSGSGSGAEFTLTISSLQPDDFATYYCQGNFNTGDRYAFGQGTKLTVL
Таким образом, в одном из вариантов осуществления антитело по настоящему изобретению содержит последовательность:
SEQ ID NO:15:
EIVMTQSPSTLSASVGDRVIITC(X)n=1-50WYQQRPGKAPKLLIY(X)n=1-50 GVPSRFSGSGSGTEFTLTISSLQPDDFATYYC(X)n=1-50FGQGTKLTVLG GGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVQPGGSLRLSCTAS(X)n=1-50 WVRQAPGKGLEWVG(X)n=1-50RFTISRDTSKNTVYLQMNS LRAEDTAVYYCAR(X)n=1-50WGQGTLVTVSS
В другом варианте осуществления антитело по настоящему изобретению содержит последовательность:
SEQ ID NO:16:
EIVMTQSPSTLSASVGDRVIITC(X)n=1-50WYQQRPGKAPKLLIY(X)n=1-50 GVPSRFSGSGSGTEFTLTISSLQPDDFATYYC(X)n=1-50FGQGTKLTVLG GGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVQPGGSLRLSCTVS(X)n=1-50 WVRQAPGKGLEWVG(X)n=1-50RFTISKDTSKNTVYLQMNSLR AEDTAVYYCAR(X)n=1-50WGQGTLVTVSS
В одном из вариантов осуществления антитело по настоящему изобретению содержит последовательность:
SEQ ID NO: 17
(34rFW1.4_VL_K47R_DHP):
EIVMTQSPSTLSASVGDRVIITCQSSQSVYGNIWMAWYQQRPGKAPKLLIYQASKLASGVPSRFSGSGSGAEFTLTISSLQPDDFATYYCQGNFNTGDRYAFGQGTKLTVLGGGGGSGGGGSGGGGSGGGGSEVQLVESGGGSVQPGGSLRLSCTASGFTISRSYWICWVRQAPGKGLEWVGCIYGDNDITPLYANWAKGRFTISRDTSKNTVYLQMNSLRAEDTATYYCARLGYADYAYDLWGQGTTVTVSS
Тем не менее, в другом варианте осуществления антитело по настоящему изобретению содержит последовательность:
SEQ ID NO:18
(34rFW1.4)
EIVMTQSPSTLSASVGDRVIITCQSSQSVYGNIWMAWYQQKPGKAPKLLIYQASKLASGVPSRFSGSGSGAEFTLTISSLQPDDFATYYCQGNFNTGDRYAFGQGTKLTVLGGGGGSGGGGSGGGGSGGGGSEVQLVESGGGSVQPGGSLRLSCTASGFTISRSYWICWVRQAPGKGLEWVGCIYGDNDITPLYANWAKGRFTISRDTSKNTVYLQMNSLRAEDTATYYCARLGYADYAYDLWGQGTTVTVSS
В одном из вариантов осуществления VL исходного антитела представляет собой или содержит SEQ ID NO:11 или SEQ ID NO:12, или последовательность, которая по меньшей мере на 65%, более предпочтительно, на 80%, 85%, 90%, 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:11 или SEQ ID NO:12. В другом предпочтительном варианте осуществления VH исходного антитела представляет собой или содержит SEQ ID NO:3 или SEQ ID NO:4, или последовательность, которая по меньшей мере на 80%, более предпочтительно, на 85%, 90%, 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:3 или SEQ ID NO:4.
Антитело по настоящему изобретению, которое содержит уменьшающую агрегацию модификацию, предпочтительно, включает один или более CDR из антитела кролика. Как известно в данной области, CDR кролика отличаются от CDR человека или грызуна: они могут содержать остатки цистеина, которые становятся связанными дисульфидными мостиками с каркасной областью или образуют меж-CDR S-S-мостики. Более того, кроличьи CDR часто не относятся к какой-либо ранее известной канонической структуре.
Отличительным признаком настоящего изобретения также являются двухвалентные и биспецифические молекулы, содержащие антитело против TNFα, или его фрагмент, настоящего изобретения. Антитело по настоящему изобретению, или его антигенсвязывающие части, может быть подвергнуто дериватизации или связано с другой функциональной молекулой, например, другим пептидом или белком (например, другим антителом или лигандом для рецептора) для создания биспецифической молекулы, которая связывается с по крайней мере двумя различными сайтами связываниями или молекулами-мишенями. Антитело по настоящему изобретению может быть подвергнуто дериватизации или связано с более чем одной другой функциональной молекулой для создания полиспецифических молекул, которые связываются с более чем двумя различными сайтами связывания и/или молекулами-мишенями; такие полиспецифические молекулы, как предполагается, также охватываются термином «биспецифическая молекула», используемым в настоящем описании. Не ограничивающие примеры биспецифических молекул включают диатело, одноцепочечное диатело и тандемное антитело, как известно специалистам в данной области.
Для создания биспецифической молекулы по настоящему изобретению антитело по настоящему изобретению можно функционально связать (например, с помощью химической связи, генетического слияния, нековалетной связи или иначе) с одной или более связывающих молекул, таких как другое антитело, фрагмент антитела, опухолевоспецифические или специфические для патогена антигены, пептидомиметик или миметик связывания, так что результатом является биспецифическая молекула. Соответственно, настоящее изобретение включает биспецифические молекулы, содержащие по крайней мере одну связывающую молекулу, обладающую специфичностью в отношении TNFα, и вторую связывающую молекулу, обладающую специфичностью в отношении одного или более дополнительных эпитопов-мишеней.
В одном из вариантов осуществления биспецифические молекулы по настоящему изобретению обладают специфичностью связывания по крайней мере одного антитела, или фрагмента антитела, включая, например, Fab, Fab', F(ab')2, Fv или одноцепочечный Fv. Антитело также может быть димером легкой цепи или тяжелой цепи, или любым его минимальным фрагментом, таким как Fv или одноцепочечная конструкция, описанная Ladner и др. в патенте США № 4946778, содержание которого в словесной форме включено в качестве ссылки.
Хотя предпочтительными являются моноклональные антитела человека, другими антителами, которые могут использоваться в биспецифических молекулах по настоящему изобретению, являются мышиные, химерные и гуманизированные моноклональные антитела.
Биспецифические молекулы по настоящему изобретению можно получить посредством соединения входящих в состав специфичностей связывания, используя известные в данной области способы. Например, каждую специфичность связывания биспецифической молекулы можно получить отдельно, а затем соединить друг с другом. Когда специфичностями связывания являются белки или пептиды, множество агентов для соединения или сшивания можно использовать для ковалентного соединения. Примеры сшивающих агентов включают белок A, карбодиимид, N-сукцинимидил-S-ацетилтиоацетат (SATA), 5,5'-дитиобис(2-нитробензойную кислоту) (DTNB), орто-фенилендималеимид (oPDM), N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) и сульфосукцинимидил-4-(N-малеимидометил)циклогаксан-1-карбоксилат (сульфо-SMCC) (см., например, Karpovsky et al. (1984) J. Exp. Med. 160: 1686; Liu, MA et al. (1985) Proc. Natl. Acad. Sci. USA 82: 8648). Другие способы включают те, которые описаны в Paulus (1985) Behring Ins. Mitt. No. 78, 118-132; Brennan et al. (1985) Science 229: 81-83) и Glennie et al (1987) J. Immunol. 139: 2367-2375). Предпочтительными агентами для соединения являются SATA и сульфо-SMCC, оба из которых можно приобрести у Pierce Chemical Co. (Rockford, IL).
Когда специфичностями связывания являются антитела, их можно соединить посредством связывания сульфгидрильных остатков, например, через C-концевые шарнирные области двух тяжелых цепей или другие места, или природные, или введенные искусственно. В особо предпочтительном варианте осуществления шарнирную область подвергают модификации с включением нечетного числа сульфгидрильных остатков, предпочтительно, одного, до соединения.
Альтернативно, обе специфичности связывания могут кодироваться в одном и том же векторе, и экспрессироваться и собираться в одной и той же клетке-хозяине. Этот способ особенно применим, когда биспецифической молекулой является слитый белок мАт x мАт, мАт x Fab, Fab x F(ab')2 или лиганд x Fab. Биспецифическая молекула по настоящему изобретению может представлять собой одноцепочечную молекулу, содержащую одно одноцепочечное антитело и детерминанту связывания, или одноцепочечную биспецифическую молекулу, содержащую две детерминанты связывания. Биспецифические молекулы могут содержать по крайней мере две одноцепочечные молекулы. Кроме того, биспецифической молекулой может быть scFv, который специфически связывается с первой мишенью, причем VH и VL указанного scFv связаны с помощью гибкого линкера, содержащего домен, обеспечивающий специфическое связывание со второй мишенью. Подходящие линкеры описаны, например, в международной заявке на патент WO 2010/006454. Способы получения биспецифических молекул описаны, например, в патенте США № 5260203; патенте США № 5455030; патенте США № 4881175; патенте США № 5132405; патенте США № 5091513; патенте США № 5476786; патенте США № 5013653; патенте США № 5258498 и патенте США № 5482858.
Связывание биспецифических молекул со специфическими для них мишенями можно подтвердить с помощью, например, иммуноферментного твердофазного анализа (ELISA), радиоиммуноанализа (RIA), анализа с использованием клеточного сортера с возбуждением флуоресценции (FACS), биоанализа (например, ингибирования роста) или с помощью анализа с использованием иммуноблота. С помощью каждого из этих анализов обычно выявляется присутствие представляющих особый интерес комплексов белок-антитело посредством использования меченого реагента (например, антитела), специфического для представляющего интерес комплекса. Например, комплекс TNF-антитело можно выявить, используя, например, связанное с ферментом антитело или фрагмент антитела, которое распознает и специфически связывается с комплексами антитело-TNF. Альтернативно, комплексы можно выявить, используя любой из множества других иммуноанализов. Например, антитело можно пометить радиоактивным изотопом и использовать в радиоиммуноанализе (RIA) (см., например, Weintraub, B., Principles of Radioimmunoassays, Seventh Training Course on Radioligand Assay Techniques, The Endocrine Society, March, 1986, который включен в нстоящее описание в качестве ссылки). Радиоактивный изотоп можно выявить таким способом, как использование γ-счетчика или сцинтилляционного счетчика, или с помощью авторадиографии.
В другом аспекте настоящее изобретение относится к получению антител, раскрытых в настоящем описании. Способы получения антител, имеющих уменьшенную способность к агрегации в растворе, обеспечиваемые в настоящем описании, основаны на неожиданном результате наблюдений, что благодаря модуляции взаимодействия между доменами легкой цепи и тяжелой цепи антитела можно уменьшить способность антител к агрегации, и что уменьшающие агрегацию мутации можно с большой вероятностью предсказать посредством определения свободной энергии взаимодействия VL/VH, определяемой как разница между энергией антитела (такого как scFv) и энергиями отдельных вариабельных доменов. Как продемонстрировано в настоящем описании, уменьшающие агрегацию замены, которые модулируют взаимодействие доменов антитела в результате уменьшения свободной энергии между вариабельными доменами, можно осуществить без оказания влияния на стабильность или активность связывания антитела.
В одном из вариантов осуществления способ по настоящему изобретению включает стадии:
(i) получения антитела, содержащего вариабельный домен легкой цепи (VL) и вариабельный домен тяжелой цепи (VH);
(ii) определения одного или более положений остатков, участвующих во взаимодействии между вариабельным доменом легкой цепи (VL) и вариабельным доменом тяжелой цепи (VH) антитела; и
(iii) модифицирования антитела посредством введения замены в определенном положении(ях) остатка из условия, чтобы замена(ы) уменьшала свободную энергию между VL- и VH-доменами по крайней мере на 0,5 ккал/моль, предпочтительно, по крайней мере на 1,0 ккал/моль и, наиболее предпочтительно, по крайней мере на 2,0 ккал/моль (т.е. свободная энергия между VL- и VH-доменами с заменой меньше по крайней мере на 0,5 ккал/моль свободной энергии между соответствующими VL- и VH-доменами, которые не содержат аминокислотную замену), уменьшая тем самым способность к агрегации модифицированного антитела по сравнению с таковой исходного антитела.
Как отмечено выше, антителом может быть, например, Fab, Fab', F(ab)'2, одноцепочечный Fv (scFv), Fv-фрагмент, диатело, одноцепочечное диатело, тандемное антитело или линейное антитело; в предпочтительном варианте осуществления антителом является одноцепочечный Fv (scFv).
В предпочтительном варианте осуществления определение одного или более положений остатков, участвующих во взаимодействии между вариабельным доменом легкой цепи и вариабельным доменом тяжелой цепи антитела, (т.е. стадия (ii)) включает определение свободной энергии взаимодействия VL-VH. Это можно выполнить посредством использования общеизвестных биоинформатических программ. Одним из примеров подходящей биоинформатической программы является CHARMM (Chemistry at HARvard Macromolecular Mechanics).
С целью определения свободной энергии взаимодействия VL-VH, обычно обеспечивается полное атомно-молекулярное представление. Свободная энергия взаимодействия представляет собой разницу между энергией всего антитела, содержащего оба вариабельные домены VL и VH, и суммой энергией отдельных доменов в рамках способа с использованием неявно заданного растворителя. Это включает расчеты трех отдельных энергий: (1) G(a) антитела; (2) G(b) VL и (3) G(c) VH. Соответственно, свободная энергия взаимодействия равна
G взаимодействия = G(a)-G(b)-G(c).
В одном из вариантов осуществления способом с использованием неявно заданного растворителя является GBMV или PBSA, известный в данной области.
Определение свободной энергии может, кроме того, включать стадию моделирования распределения зарядов в белке. Моделирование указанного распределения зарядов можно осуществить на основе электростатических сил или сил Ван-дер-Ваальса.
Для определения подходящей модификации можно выбрать для замены один или более аминокислотных остатков, участвующих во взаимодействии. Например, создают молекулярную модель белка, содержащего одну или более замен (например, замену одного или более остатков на аланин) в выбранных положениях, и определяют свободную энергию взаимодействия в представлении молекулы с заменой(ами). Если свободная энергия взаимодействия в модели молекулы с заменой(ами) меньше свободной энергии взаимодействия в исходной молекулярной модели, аминокислотный остаток выбирают для замены. В рамках CHARMm мутации можно сконструировать, например, с использованием протокола Build Mutants. Одна или более замен в молекулярной модели может находиться в положениях, которые, как известно или полагают, вовлечены во взаимодействие VL/VH.
В одном из вариантов осуществления проводят дополнительную стадию минимизации энергии молекулярной модели, содержащей одну или более замен в выбранном положении(ях), в области вокруг мутации(й). Указанную область можно задать в значении, равном 10 ангстрем.
В одном из вариантов осуществления определенное для замены положение остатка занимает заряженная аминокислота.
Антитело, полученное способом по настоящему изобретению, может содержать любой подходящий вариабельный домен легкой цепи или тяжелой цепи, известный в данной области, и, предпочтительно, содержит по крайней мере один CDR из антитела кролика. В настоящем описании описаны некоторые предпочтительные вариабельные домены легкой и тяжелой цепей. Например, антитело по настоящему изобретению может содержать каркасную область VL антитела, которая по меньшей мере на 65%, более предпочтительно, на 80%, 85%, 90%, 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:11 или SEQ ID NO:12, содержащую, кроме того, аргинин (R) в положении 47 в соответствии с системой нумерации AHo и/или в положении 50 в соответствии с системой нумерации AHo вариабельного домена легкой цепи; и каркасную область VH антитела, которая по меньшей мере на 80%, более предпочтительно, на 85%, 90%, 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:3.
Модификацию одного или более положений остатков осуществляют, предпочтительно, в соответствии со способами, изложенными в PCT/CH2008/000285, которая включена в настоящее описание в качестве ссылки в полном объеме. Вкратце, в случае конкретного подтипа антитела определенные аминокислоты присутствуют в конкретных положениях остатков каркасной области антитела. Например,
a) в случае вариабельной области тяжелой цепи семейства VH3 человека предпочтительными аминокислотами являются:
(i) глютамин (Q) в положении 1 аминокислоты, используя систему нумерации AHo или Kabat;
(ii) глютамин (Q) в положении 6 аминокислоты, используя систему нумерации AHo или Kabat;
(iii) треонин (T) или аланин (A) в положении 7 аминокислоты, используя систему нумерации AHo или Kabat;
(iv) аланин (A), валин (V) или фенилаланин (F) в положении 89 аминокислоты, используя систему нумерации AHo (в положении 78 аминокислоты, используя систему нумерации Kabat); и/или
(v) аргинин (R), глютамин (Q), изолейцин (I), лейцин (L), метионин (M) или фенилаланин (F) в положении 103 аминокислоты, используя систему нумерации AHo (в положении 89 аминокислоты, используя систему нумерации Kabat);
b) в случае вариабельной области тяжелой цепи семейства VH1a человека предпочтительными аминокислотами являются:
(i) глютаминовая кислота (E) в положении 1 аминокислоты, используя систему нумерации AHo или Kabat;
(ii) глютаминовая кислота (E) в положении 6 аминокислоты, используя систему нумерации AHo или Kabat;
(iii) лейцин (L) в положении 12 аминокислоты, используя систему нумерации AHo (в положении 11 аминокислоты, используя систему нумерации Kabat);
(iv) метионин (M) в положении 13 аминокислоты, используя систему нумерации AHo (в положении 12 аминокислоты, используя систему нумерации Kabat);
(v) глютаминовая кислота (E) или глютамин (Q) в положении 14 аминокислоты, используя систему нумерации AHo (в положении 13 аминокислоты, используя систему нумерации Kabat);
(vi) лейцин (L) в положении 19 аминокислоты, используя систему нумерации AHo (в положении 18 аминокислоты, используя систему нумерации Kabat);
(vii) изолейцин (I) в положении 21 аминокислоты, используя систему нумерации AHo (в положении 20 аминокислоты, используя систему нумерации Kabat);
(viii) фенилаланин (F), серин (S), гистидин (H) или аспарагиновая кислота (D) в положении 90 аминокислоты, используя систему нумерации AHo (в положении 79 аминокислоты, используя систему нумерации Kabat);
(ix) аспарагиновая кислота (D) или глютамин (Q) в положении 92 аминокислоты, используя систему нумерации AHo (в положении 81 аминокислоты, используя систему нумерации Kabat);
(x) глицин (G), аспарагин (N) или треонин (T) в положении 95 аминокислоты, используя систему нумерации AHo (в положении 82b аминокислоты, используя систему нумерации Kabat); и/или
(xi) треонин (T), аланин (A), пролин (P) или фенилаланин (F) в положении 98 аминокислоты, используя систему нумерации AHo (в положении 84 аминокислоты, используя систему нумерации Kabat);
с) в случае вариабельной области тяжелой цепи семейства VH1b человека предпочтительными аминокислотами являются:
(i) глютаминовая кислота (E) в положении 1 аминокислоты, используя систему нумерации AHo или Kabat;
(ii) треонин (T), пролин (P), валин (V) или аспарагиновая кислота (D) в положении 10 аминокислоты, используя систему нумерации AHo (в положении 9 аминокислоты, используя систему нумерации Kabat);
(iii) лейцин (L) в положении 12 аминокислоты, используя систему нумерации AHo (в положении 11 аминокислоты, используя систему нумерации Kabat);
(iv) валин (V), аргинин (R), глютамин (Q) или метионин (M) в положении 13 аминокислоты, используя систему нумерации AHo (в положении 12 аминокислоты, используя систему нумерации Kabat);
(v) глютаминовая кислота (E), аргинин (R) или метионин (M) в положении 14 аминокислоты, используя систему нумерации AHo (в положении 13 аминокислоты, используя систему нумерации Kabat);
(vi) аргинин (R), треонин (T) или аспарагин (N) в положении 20 аминокислоты, используя систему нумерации AHo (в положении 19 аминокислоты, используя систему нумерации Kabat);
(vii) изолейцин (I), фенилаланин (F) или лейцин (L) в положении 21 аминокислоты, используя систему нумерации AHo (в положении 20 аминокислоты, используя систему нумерации Kabat);
(viii) лизин (K) в положении 45 аминокислоты, используя систему нумерации AHo (в положении 38 аминокислоты, используя систему нумерации Kabat);
(ix) треонин (T), пролин (P), валин (V) или аргинин (R) в положении 47 аминокислоты, используя систему нумерации AHo (в положении 40 аминокислоты, используя систему нумерации Kabat);
(x) лизин (K), гистидин (H) или глютаминовая кислота (E) в положении 50 аминокислоты, используя систему нумерации AHo (в положении 43 аминокислоты, используя систему нумерации Kabat);
(xi) изолейцин (I) в положении 55 аминокислоты, используя систему нумерации AHo (в положении 48 аминокислоты, используя систему нумерации Kabat);
(xii) лизин (K) в положении 77 аминокислоты, используя систему нумерации AHo (в положении 66 аминокислоты, используя систему нумерации Kabat);
(xiii) аланин (A), лейцин (L) или изолейцин (I) в положении 78 аминокислоты, используя систему нумерации AHo (в положении 67 аминокислоты, используя систему нумерации Kabat);
(xiv) глютаминовая кислота (E), треонин (T) или аланин (A) в положении 82 аминокислоты, используя систему нумерации AHo (в положении 71 аминокислоты, используя систему нумерации Kabat);
(xv) треонин (T), серин (S) или лейцин (L) в положении 86 аминокислоты, используя систему нумерации AHo (в положении 75 аминокислоты, используя систему нумерации Kabat);
(xvi) аспарагиновая кислота (D), аспарагин (N) или глицин (G) в положении 87 аминокислоты, используя систему нумерации AHo (в положении 76 аминокислоты, используя систему нумерации Kabat); и/или
(xvii) аспарагин (N) или серин (S) в положении 107 аминокислоты, используя систему нумерации AHo (в положении 93 аминокислоты, используя систему нумерации Kabat);
d) в случае вариабельной области легкой цепи семейства Vкаппа1 человека предпочтительными аминокислотами являются:
(i) глютаминовая кислота (E) или изолейцин (I) в положении 1 аминокислоты, используя систему нумерации AHo или Kabat;
(ii) валин (V) или изолейцин (I) в положении 3 аминокислоты, используя систему нумерации AHo или Kabat;
(iii) валин (V), лейцин (L) или изолейцин (I) в положении 4 аминокислоты, используя систему нумерации AHo или Kabat;
(iv) глютамин (Q) в положении 24 аминокислоты, используя систему нумерации AHo или Kabat;
(v) аргинин (R) или изолейцин (I) в положении 47 аминокислоты, используя систему нумерации AHo (в положении 39 аминокислоты, используя систему нумерации Kabat);
(vi) аргинин (R), глютаминовая кислота (E), треонин (T), метионин (M) или глютамин (Q) в положении 50 аминокислоты, используя систему нумерации AHo (в положении 42 аминокислоты, используя систему нумерации Kabat);
(vii) гистидин (H), серин (S) или фенилаланин (F) в положении 57 аминокислоты, используя систему нумерации AHo (в положении 49 аминокислоты, используя систему нумерации Kabat);
(viii) фенилаланин (F) в положении 91 аминокислоты, используя систему нумерации AHo (в положении 73 аминокислоты, используя систему нумерации Kabat); и/или
(ix) валин (V), серин (S), глицин (G) или изолейцин (I) в положении 103 аминокислоты, используя систему нумерации AHo (в положении 85 аминокислоты, используя систему нумерации Kabat);
e) в случае вариабельной области легкой цепи семейства Vкаппа3 человека предпочтительными аминокислотами являются:
(i) треонин (T) в положении 2 аминокислоты, используя систему нумерации AHo или Kabat;
(ii) треонин (T) в положении 3 аминокислоты, используя систему нумерации AHo или Kabat;
(iii) изолейцин (I) в положении 10 аминокислоты, используя систему нумерации AHo или Kabat;
(iv) тирозин (Y) в положении 12 аминокислоты, используя систему нумерации AHo или Kabat;
(v) серин (S) в положении 18 аминокислоты, используя систему нумерации AHo или Kabat;
(vi) аланин (A) в положении 20 аминокислоты, используя систему нумерации AHo или Kabat;
(vii) метионин (M) в положении 56 аминокислоты, используя систему нумерации AHo (в положении 48 аминокислоты, используя систему нумерации Kabat);
(viii) валин (V) или треонин (T) в положении 74 аминокислоты, используя систему нумерации AHo (в положении 58 аминокислоты, используя систему нумерации Kabat);
(ix) аспарагин (N) в положении 94 аминокислоты, используя систему нумерации AHo (в положении 76 аминокислоты, используя систему нумерации Kabat);
(x) тирозин (Y) или серин (S) в положении 101 аминокислоты, используя систему нумерации AHo (в положении 83 аминокислоты, используя систему нумерации Kabat); и/или
(xi) лейцин (L) или аланин (A) в положении 103 аминокислоты, используя систему нумерации AHo (в положении 85 аминокислоты, используя систему нумерации Kabat);
f) в случае вариабельной области легкой цепи семейства Vлямбда1 человека предпочтительными аминокислотами являются:
(i) лейцин (L), серин (S) или глютаминовая кислота (E) в положении 1 аминокислоты, используя систему нумерации AHo или Kabat;
(ii) аланин (A), пролин (P), изолейцин (I) или тирозин (Y) в положении 2 аминокислоты, используя систему нумерации AHo или Kabat;
(iii) валин (V) или метионин (M) в положении 4 аминокислоты, используя систему нумерации AHo или Kabat;
(iv) глютаминовая кислота (E) в положении 7 аминокислоты, используя систему нумерации AHo или Kabat;
(v) аланин (A) в положении 11 аминокислоты, используя систему нумерации AHo или Kabat;
(vi) треонин (T) или серин (S) в положении 14 аминокислоты, используя систему нумерации AHo или Kabat;
(vii) гистидин (H) в положении 46 аминокислоты, используя систему нумерации AHo (в положении 38 аминокислоты, используя систему нумерации Kabat);
(viii) треонин (T), серин (S), аспарагин (N), глютамин (Q) или пролин (P) в положении 53 аминокислоты, используя систему нумерации AHo (в положении 45 аминокислоты, используя систему нумерации Kabat);
(ix) аргинин (R) или глютамин (Q) в положении 82 аминокислоты, используя систему нумерации AHo (в положении 66 аминокислоты, используя систему нумерации Kabat);
(x) глицин (G), треонин (T) или аспарагиновая кислота (D) в положении 92 аминокислоты, используя систему нумерации AHo (в положении 74 аминокислоты, используя систему нумерации Kabat); и/или
(xi) валин (V), треонин (T), гистидин (H) или глютаминовая кислота (E) в положении 103 аминокислоты, используя систему нумерации AHo (в положении 85 аминокислоты, используя систему нумерации Kabat). Соответственно, замены, введенные в способе по настоящему изобретению, подчиняются идеям, изложенным в PCT/CH2008/000285. Определение подтипа известно специалисту в данной области.
В одном из вариантов осуществления способ по настоящему изобретению включает модифицирование антитела в положении 47 и/или 50 в соответствии с системой нумерации AHo вариабельного домена легкой цепи, в частности, вариабельного домена легкой цепи Vкапппа1. Предпочтительно, антитело подвергают модификации с включением аргинина (R) в положении 47 в соответствии с системой нумерации AHo и/или в положении 50 в соответствии с системой нумерации AHo вариабельного домена легкой цепи. В некоторых вариантах осуществления лизин (К) заменяют на аргинин (R) в положении 47 и/или положении 50 в соответствии с системой нумерации AHo вариабельного домена легкой цепи. Поскольку антитела по настоящему изобретению могут содержать дополнительные модификации при желании, способы по настоящему изобретению могут включать дополнительную стадию модифицирования антитела, например, с включением серина (S) в положении 12 тяжелой цепи (в соответствии с системой нумерации AHo); серина (S) или треонина (T) в положении 103 тяжелой цепи (в соответствии с системой нумерации AHo) и/или серина (S) или треонина (T) в положении 144 тяжелой цепи (в соответствии с системой нумерации AHo). Кроме того, антитело может быть модифицировано с включением серина (S) или треонина (T) в положениях 97, 98 и/или 99 тяжелой цепи (в соответствии с системой нумерации AHo). Предпочтительно, когда способ включает стадию модифицирования антитела с включением серина (S) в положении 12 тяжелой цепи (в соответствии с системой нумерации AHo), треонина (T) в положении 103 тяжелой цепи (в соответствии с системой нумерации AHo) и треонина (T) в положении 144 тяжелой цепи (в соответствии с системой нумерации AHo).
Настоящее изобретение, кроме того, относится к способу создания гуманизированного антитела с низкой способностью к агрегации в растворе, включающему отбор каркасной области вариабельного домена легкой цепи, которая содержит аргинин (R) в положении 47 и/или положении 50 в соответствии с системой нумерации AHo. Способ может, кроме того, включать отбор каркасной области вариабельного домена тяжелой цепи, которая содержит серин (S) в положении 12 тяжелой цепи (в соответствии с системой нумерации AHo); серин (S) или треонин (T) в положении 103 тяжелой цепи (в соответствии с системой нумерации AHo) и/или серин (S) или треонин (T) в положении 144 тяжелой цепи (в соответствии с системой нумерации AHo). В одном из вариантов осуществления каркасная область, идентифицированная на основе выбранного критерия отбора, может быть дополнительно модифицирована с помощью уменьшающей агрегацию модификации настоящего изобретения. Например, в случае идентификации каркасной области вариабельного домена легкой цепи, которая содержит аргинин (R) в положении 50, остаток в положении в соответствии с системой нумерации AHo может быть заменен на отличающуюся аминокислоту, такую как аргинин (R), или в случае идентификации каркасной области вариабельного домена тяжелой цепи, которая содержит серин (S) в положении 12 в соответствии с системой нумерации AHo, остатки в положениях 103 и 144 в соответствии с системой нумерации AHo могут быть замены на треонин.
Как используется в настоящем описании, «гуманизированное» антитело представляет собой антитело, которое содержит CDR, не являющиеся человеческими, и человеческие или происходящие от человека последовательности каркасных областей вариабельного домена тяжелой цепи и/или вариабельного домена легкой цепи. Гуманизация антител хорошо известна в данной области. В одном из вариантов осуществления гуманизированное антитело содержит по крайней мере один, а, предпочтительно, шесть CDR из антитела, продуцируемого у кролика или отобранного из библиотеки CDR.
Каркасные области вариабельного домена антитела можно отобрать, например, из базы данных (такой как база данных Kabat, Genbank (http://www.ncbi.nlm.nih.gov/genbank/), VBASE (http://vbase.mrc-cpe.cam.ac.uk/), VBASE2 (http://www.vbase2.org/), базы данных Kabat, касающихся последовательностей представляющих иммунологических интерес белков (http://www.kabatdatabase.com/index.html), всемирных белковых ресурсов (UniProt; http://pir.georgetown.edu/) и базы данных Abysis (http://www.bioinf.org.uk/abs/), на основе идентичности и/или схожести с последовательностями каркасных областей вариабельного домена антитела, от которого произошли CDR, или на основе предпочтительных в ином отношении последовательностей(и) каркасных областей.
Существуют различные компьютерные программы для поиска подходящих последовательностей каркасных областей человека, которые удовлетворяют выбранному требованию(ям). Например, «KabatMan» является версией, допускающей возможность поиска с помощью компьютера в данных о последовательностях антител Kabat из книги Sequences of Immunological Interest. Программа KabatMan описана в статье: Martin (1996) Accessing the Kabat Antibody Sequence Database by Computer PROTEINS: Structure, Function and Genetics, 25, 130-133, и имеется на сайте http://www.bioinf.org.uk/abs/simkab.html и http://www.bioinf.org.uk/abs/kabatman.html. В базе данных Abysis, на сайте http://www.bioinf.org.uk/abysis/, объединены данные о последовательностях от Kabat, из IMGT и PDB со структурными данными из PDB. Она обеспечивает полный интерфейс «указал и щелкнул», который позволяет перебирать данные о последовательностях согласно различным критериям и выводит на экран результаты в различных форматах. В случае данных из PDB перебор последовательностей может сочетаться со структурными ограничениями.
В другом аспекте настоящее изобретение относится к антителу, полученному с использованием способа, описываемого в настоящем описании. В предпочтительном варианте осуществления указанное антитело содержит каркасную область VL антитела, которая по крайней мере на 80%, более предпочтительно, на 85%, 90%, 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:12 или SEQ ID NO:13; предпочтительно, антитело содержит аргинин (R) в положении 47 и/или в положении 50 в соответствии с системой нумерации AHo вариабельного домена легкой цепи.
Дополнительно или альтернативно, каркасная область VH антитела представляет собой или содержит SEQ ID NO:3, или последовательность, которая по меньшей мере на 80%, более предпочтительно, на 85%, 90%, 95%, 96%, 97%, 98%, более предпочтительно, на 99% идентична SEQ ID NO:3.
В некоторых вариантах осуществления настоящее изобретение, кроме того, относится к:
(1) Способу уменьшения способности к агрегации антитела, представляющего собой гетеродимерный комплекс, которое содержит вариабельные домены тяжелой и легкой цепей, который включает стадии:
(a) получения полного атомно-молекулярного представления антитела;
(b) определения свободной энергии взаимодействия между обоими доменами;
(c) выбора одного или более аминокислотных остатков, участвующих во взаимодействии, для замены посредством предоставления молекулярной модели антитела, содержащего одну или более замен в выбранных положениях, и определения свободной энергии взаимодействия в представлении молекулы с заменой(ами);
(d) выбора аминокислотного остатка для замены, если свободная энергия взаимодействия в модели молекулы с заменой(ами) меньше свободной энергии взаимодействия в исходной молекулярной модели;
(2) Способу по (1), в котором свободную энергию взаимодействия определяют с помощью расчета разницы между энергией комплекса и суммой энергий отдельных доменов в рамках способа с использованием неявно заданного растворителя;
(3) Способу по (2), в котором растворителем является GBMV или PBSA;
(4) Способу по любому из предшествующих (1)-(3), дополнительно включающему стадию
(i) моделирования распределения зарядов в белке, причем эту стадию выполняют в рамках стадии a и b;
(5) Способу по (4), в котором моделирование распределения зарядов осуществляют на основе электростатических сил или сил Ван-дер-Ваальса;
(6) Способу по любому из предшествующих (1)-(5), в котором стадия (c) включает дополнительную стадию минимизации энергии в области вокруг мутации;
(7) Способу по любому из предшествующих (1)-(7), в котором антителом является одноцепочечный Fv-фрагмент (scFv).
Антитела по настоящему изобретению можно получить, используя обычные способы в области рекомбинантной генетики. Зная последовательности полипептидов, можно получить кДНК, кодирующие их, с помощью синтеза генов с использованием известных в данной области способов. Эти кДНК можно клонировать в подходящие векторные плазмиды.
Стандартные способы клонирования и мутагенеза, хорошо известны специалисту в данной области, могут использоваться для присоединения линкеров, перетасовки доменов или создания слияний для получения Fab-фрагментов. Основные методики, описывающие общие способы этого изобретения, описаны в Molecular Cloning, A Laboratory Manual (Sambrook & Russell, 3rd ed. 2001) и в Current Protocols in Molecular Biology (Ausubel et al., 1999).
Последовательность ДНК, содержащую ген, кодирующий полипептид scFv, или в случае Fab-фрагментов, содержащую или два отдельных гена, или бицистронный оперон, содержащий два гена для слияний VL-Cκ и VH-CH1, клонируют в подходящий вектор экспрессии, предпочтительно, вектор с индуцируемым промотором. Необходимо позаботиться, чтобы перед каждым геном присутствовал соответствующий сайт связывания рибосом, который обеспечивает трансляцию. Следует понимать, что антитела по настоящему изобретению содержат описанные последовательности, а не состоят из них. Например, стратегии клонирования могут предписывать создание конструкции, с которой экспрессируется антитело, в котором присутствует один или небольшое число дополнительных остатков на N-конце. В частности, метионин, происходящий от старт-кодона, может присутствовать в конечном белке в случаях, когда он не отщепляется посттрансляционно. Большинство конструкций для антител в виде scFv обусловливает дополнительный аланин на N-конце. В предпочтительном варианте осуществления настоящего изобретения выбирают вектор экспрессии для периплазматической экспрессии в E. coli (Krebber, 1997). Указанный вектор содержит промотор перед расщепляемой сигнальной последовательностью. Последовательность, кодирующую пептид антитела, затем сливают в рамке считывания с расщепляемой сигнальной последовательностью. Это делает возможной направленную доставку экспрессированного полипептида в периплазму бактерии, где сигнальная последовательность отщепляется. Затем антитело сворачивается. В случае Fab-фрагментов оба пептида слияния VL-Cκ и VH-CH1 должны быть связаны с сигналом экспортирования. После достижения пептидами периплазмы образуется ковалентная S-S связь между C-концевыми цистеинами. Если предпочтительной является экспрессия антител в цитоплазме, указанные антитела можно обычно получить с высокими выходами из телец включения, которые можно легко отделить от других клеточных фрагментов и белка. В этом случае тельца включения растворяют в денатурирующем агенте, таком как, например, гуанидин гидрохлорид (GndHC1), и затем подвергают рефолдингу с помощью процедур ренатурации, хорошо известных специалистам в данной области.
Плазмиды, экспрессирующие полипептиды scFv или Fab, вводят в подходящий хозяин, предпочтительно, бактериальную, дрожжевую клетку или клетку млекопитающего, наиболее предпочтительно, в подходящий штамм E. coli, например, JM83 для периплазматической экспрессии или BL21 для экспрессии в виде телец включения. Полипептид можно получить или из периплазмы, или из телец включения и подвергнуть очистке, используя стандартные способы, такие как ионообменная хроматография, хроматография с обращенной фазой, аффинная хроматография и/или гель-фильтрация, которые хорошо известны специалисту в данной области.
Антитела по настоящему изобретению можно охарактеризовать в отношении выхода, растворимости и стабильности in vitro. Например, способности к связыванию с TNF, предпочтительно, TNFα человека, можно исследовать in vitro с помощью ELISA или поверхностного плазмонного резонанса (BIACore), используя рекомбинантный TNF человека, как описано в WO9729131, при этом последний из названных способов также позволяет определить константу скорости koff, которая, предпочтительно, должна составлять менее 10-3 сек-1. Предпочтительными являются значения Kd ≤ 10 нМ.
В одном из вариантов осуществления настоящее изобретение относится к антителам, которые связываются с TNFα и, соответственно, являются подходящими для блокирования функционирования TNFα in vivo. В конкретном варианте осуществления антитело против TNFα содержит последовательность SEQ ID NO:10 или SEQ ID NO:17.
При терапевтическом применении антитела против TNF по настоящему изобретению вводят млекопитающему, предпочтительно, человеку, в фармацевтически приемлемой лекарственной форме, такой как те, которые обсуждались выше, включая те, которые можно вводить человеку внутривенно в виде болюсной инъекции или с помощью непрерывной инфузии в течение периода времени, с использованием внутримышечного, внутрибрюшинного, интрацереброспинального, подкожного, внутрисуставного, интрасиновиального, подоболочечного, перорального, местного, внутриглазного, интраназального, ушного, сублингвального, чрескожного пути или путем ингаляции, например. Антитела также соответственно вводят внутрь опухолей, около опухолей, внутрь поражений или около поражений для проявления местных, а также системных терапевтических эффектов.
Для профилактики или лечения заболевания соответствующая доза антитела будет зависеть от типа заболевания, в отношении которого проводят лечение, определенное выше, тяжести и течения заболевания, того, вводится ли антитело с превентивной или терапевтической целью, предшествующей терапии, истории болезни пациента и ответной реакции на антитело, и усмотрения лечащего врача. Антитела соответственно вводить пациенту один раз или в течение ряда лечений.
Антитела против TNF по настоящему изобретению можно использовать для лечения TNF-опосредуемых заболеваний. В зависимости от типа и тяжести заболевания от приблизительно 1 мкг/кг до приблизительно 50 мг/кг (например, 0,1-20 мг/кг) антитела составляет первоначальная возможная доза для введения пациенту, например, или с использованием одного или более отдельных введений, или с использованием непрерывной инфузии. Типичная суточная или еженедельная доза, вероятно, находится в диапазоне от приблизительно 1 мкг/кг до приблизительно 20 мг/кг или более в зависимости от факторов, отмеченных выше. В случае повторных введений в течение нескольких дней или дольше, в зависимости от состояния, лечение повторяют до возникновения желаемого подавления симптомов заболевания. Однако могут использоваться другие схемы введения доз. За успехами этой терапии легко проследить с помощью обычных способов и анализов, включая, например, рентгенографию опухолей.
В соответствии с другим вариантом осуществления настоящего изобретения эффективность антитела для профилактики или лечения заболевания можно повысить путем введения антитела периодически или в комбинации с другим средством, который является эффективным для этих целей, таким как фактор роста сосудистого эндотелия (VEGF), антитело, способное к ингибированию или нейтрализации ангиогенной активности кислотного и основного фактора роста фибробластов (FGF), или фактора роста гепатоцитов (HGF), антитело, способное к ингибированию или нейтрализации коагулирующей активности тканевого фактора, белка C или белка S (см. Esmon et al., PCT-заявка на патент № WO 91/01753, опубликованная 21 февраля 1991), антитело, способное к связыванию с рецептором HER2 (см. Hudziak et al., PCT-заявка на патент № WO 89/06692, опубликованная 27 июля 1989), или с одним или более традиционных терапевтических средств, таких как, например, алкилирующие агенты, антагонисты фолиевой кислоты, антиметаболиты метаболизма нуклеиновых кислот, антибиотики, аналоги пиримидинов, 5-фторурацил, цисплатин, пуриновые нуклеозиды, амины, аминокислоты, триазолнуклеозид или кортикостероиды. Такие другие агенты могут находиться в вводимой композиции или могут вводиться отдельно. Также антитело соответственно вводить периодически или в комбинации с радиологическими лечениями, включающими или облучение, или введение радиоактивных веществ.
Антитела по настоящему изобретению могут использоваться в качестве средств для аффинной очистки. В этом процессе антитела подвергают иммобилизации на твердой фазе, такой как смола Sephadex или фильтровальная бумага, используя хорошо известные в данной области способы. Подвергнутое иммобилизации антитело приводят в контакт с образцом, содержащим белок-мишень (или его фрагмент), с которым связывается антитело, такой как TNF в случае антител против TNFα, подвергаемый очистке, и впоследствии подложку промывают подходящим растворителем, который будет удалять по существу весь материал в образце за исключением белка-мишени, который связан с иммобилизованным антителом. Наконец, подложку промывают другим подходящим растворителем, таким как глициновый буфер, pH 5,0, который будет освобождать белок-мишень от антитела.
Антитела также могут использоваться в диагностических исследованиях в отношении белка-мишени, например, для выявления его экспрессии в конкретных клетках, тканях или сыворотке. Такие способы диагностики могут использоваться для диагностики рака.
При применении для диагностики антитело обычно метят визуализируемой молекулой. В наличии имеются многочисленные метки, которые можно, как правило, разделить на следующие классы:
(a) Радиоизотопы, такие как 111In, 99Tc, 14C, 131I, 125I, 3H, 32P или 35S. Антитело можно пометить радиоизотопом, используя способы, описанные в Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, N.Y., Pubs. (1991), например, и радиоактивность можно измерить, используя сцинтилляционные измерения.
(b) Флуоресцентные метки, такие как хелаты редкоземельных элементов (хелаты европия) или флуоресцеин и его производные, родамин и его производные, дансил, Лиссамин, фикоэритрин и Техасский красный, имеются в наличии. Флуоресцентные метки можно конъюгировать с антителом, используя способы, описанные в Current Protocols in Immunology, выше, например. Флуоресценцию можно измерить, используя флуориметр.
(c) Различные метки в виде комбинаций фермент-субстрат имеются в наличии, и обзор некоторых из них представлен в патенте США № 4275149. Фермент обычно катализирует химическое изменение хромогенного субстрата, которое можно измерить с использованием различных способов. Например, фермент может катализировать изменение цвета субстрата, которое можно измерить спектрофотометрически. Альтернативно, фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Способы определения изменения флуоресценции описаны выше. Хемилюминесцентный субстрат становится электронно-возбужденным в результате химической реакции и может затем излучать свет, который можно измерить (используя хемилюминометр, например), и передавать энергию флуоресцентному акцептору. Примеры ферментных меток включают люциферазы (например, люциферазу светляков и бактериальную люциферазу; патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRPO), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы (например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфат-дегидрогеназу), оксидазы гетероциклических соединений (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и т.п. Способы коъюгирования ферментов с антителами описаны в O'Sullivan et al., Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay, in Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic press, New York, 73: 147-166 (1981). Примеры комбинаций фермент-субстрат включают, например:
(i) пероксидазу хрена (HRPO) с перекисью водорода в качестве субстрата, причем гидрогенпероксидаза окисляет сухой предшественник (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидина гидрохлорид (TMB));
(ii) щелочную фосфатазу (AP) с пара-нитрофенилфосфатом в качестве хромогенного субстрата и
(iii) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, пара-нитрофенил-β-D-галактозидазу) или 4-метилумбеллиферил-β-D-галактозидазу с хромогенным субстратом.
Другие многочисленные комбинации фермент-субстрат хорошо известны специалистам в данной области. Их общий обзор приведен в патентах США № 4275149 и 4318980. Иногда метку опосредованно конъюгируют с антителом. Специалист в данной области осведомлен о различных способах для достижения этого. Например, антитело можно конъюгировать с биотином, а любую из трех широких классов меток, упомянутых выше, можно конъюгировать с авидином, или наоборот. Биотин селективно связывается с авидином, и поэтому метку можно конъюгировать с антителом таким непрямым способом. Альтернативно, для достижения непрямого конъюгирования метки с антителом антитело конъюгируют с небольшим гаптеном (например, дигоксином), а одну из различных типов меток, упомянутых выше, конъюгируют с антителом против гаптена (например, антителом против дигоксина). Таким образом, может быть достигнуто непрямое конъюгирование метки с антителом.
В некоторых вариантах осуществления не требуется метить антитело, а его присутствие можно выявить, используя меченое антитело, которое связывается с антителом-мишенью.
Антитела по настоящему изобретению можно использовать в любом известном способе исследования, таком как анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и реакции иммунопреципитации. См. Zola, Monoclonal Antibodies: A Manual of Techniques, pp.147-158 (CRC Press, Inc. 1987).
Анализы конкурентного связывания основываются на способности меченого стандарта конкурировать с аналитом в исследуемом образце за связывание с ограниченным количеством антитела. Например, количество белка TNF в исследуемом образце обратно пропорционально количеству стандарта, которое связывается с антителами. Для облегчения определения количества стандарта, которое связывается, антитела обычно переводят в нерастворимую форму до или после конкуренции, так что стандарт и аналит, которые связаны с антителами, можно легко отделить от стандарта и аналита, которые остаются несвязанными.
Сэндвич-анализы включают использование двух антител, каждое из которых способно к связыванию с различными иммуногенными частями, или эпитопами, выявляемого белка. В случае сэндвич-анализа аналит в исследуемом образце связывается с первым антителом, которое иммобилизовано на твердой подложке, и впоследствии второе антитело связывается с аналитом, образуя, таким образом, нерастворимый трехкомпонентный комплекс. См., например, патент США № 4376110. Само второе антитело может быть помечено выявляемой составляющей (прямые сэндвич-анализы), или его можно измерить, используя антитело против иммуноглобулина, которое помечено выявляемой составляющей (непрямые сэндвич-анализы). Например, одним типом сэндвич-анализа является анализ ELISA, в случае которого выявляемой составляющей является фермент.
В случае иммуногистохимического исследования образец ткани, такой как образец опухоли, может быть свежим или замороженным, или может быть помещен в парафин и фиксирован с использованием фиксатора, такого как формалин, например.
Антитела также могут использоваться для in vivo диагностических анализов опухолей. Как правило, антитело метят радионуклидом (таким как 111In, 99Tc, 14C, 131I, 125I, 3H, 32P или 35S), так что местонахождение опухоли можно определить, используя иммуносцинтиграфию.
Антитело по настоящему изобретению может находиться в наборе, упакованном комбинацией реагентов в заданных количествах вместе с инструкцией по выполнению диагностического исследования. В случае, когда антитело помечено ферментом, набор будет содержать субстраты и кофакторы, требуемые ферментом (например, предшественник субстрата, который обеспечивает выявляемый хромофор или флуорофор). Кроме того, могут быть включены другие компоненты, такие как стабилизаторы, буферы (например, буфер для блокирования или буфер для лизиса) и т.п. Относительные количества различных реагентов могут изменяться в широком диапазоне для достижения определенных концентраций реагентов в растворе, которые существенно оптимизируют чувствительность анализа. В частности, реагенты могут находиться в виде сухих порошков, обычно лиофилизированнных, содержащих наполнители, которые при растворении будет создавать раствор реагента с подходящей концентрацией.
Настоящее изобретение также относится к фармацевтическим препаратам, содержащим одно или более антител по настоящему изобретению, для терапевтических целей. В одном из вариантов осуществления настоящее изобретение относится к антителам против TNF для лечения TNF-опосредуемых заболеваний.
Термин «фармацевтический препарат» относится к препаратам, которые находятся в такой форме, что создается возможность для того, чтобы биологическая активность антитела была неуклонно эффективной, и которые не содержат дополнительные компоненты, которые являются токсичными для индивидов, которым препарат будет вводиться. «Фармацевтически приемлемыми наполнителями» (носителями, добавками) являются наполнители, которые можно мотивировано вводить рассматриваемому млекопитающему для достижения эффективной дозы используемого активного ингредиента.
«Стабильным» препаратом является препарат, в котором антитело по существу сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность при хранении. В данной области имеются различные аналитические способы для определения стабильности белка, и их обзоры приведены в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. (1993) Adv. Drug Delivery Rev. 10: 29-90, например. Стабильность можно определить при выбранной температуре в течение выбранного периода времени. Предпочтительно, когда препарат является стабильным при комнатной температуре (приблизительно 30°C) или при 40°C в течение по крайней мере 1 месяца, и/или стабильным при приблизительно 2-8°C в течение по крайней мере 1 года или в течение по крайней мере 2 лет. Кроме того, препарат, предпочтительно, является стабильным после замораживания (например, до -70°C) и оттаивания препарата.
Антитело «сохраняет свою физическую стабильность» в фармацевтическом препарате, если оно не демонстрирует признаки агрегации, преципитации и/или денатурации, определяемые при визуальном исследовании цвета и/или прозрачности, или определяемые с помощью рассеивания УФ света или гель-фильтрации.
Антитело «сохраняет свою химическую стабильность» в фармацевтическом препарате, если химическая стабильность в конкретный момент времени является такой, что белок, как считается, все еще сохраняет свою биологическую активность, определяемую ниже. Химическую стабильность можно определить посредством выявления и количественного определения химически измененных форм антитела. Химическое изменение может включать изменение размера (например, усечение), которое можно оценить, используя гель-фильтрацию, электрофорез в SDS-ПААГ и/или ионизацию лазерной десорбции с использованием матрицы/времяпролетную масс-спектрометрию (MALDI/TOF MS), например. Другие типы химического изменения включают изменение заряда (например, возникающее в результате дезамидирования), оценку которого можно осуществить с помощью ионообменной хроматографии, например.
Антитело «сохраняет свою биологическую активность» в фармацевтическом препарате, если биологическая активность антитела в конкретный момент времени находится в пределах приблизительно 10% (в границах ошибок исследования) биологической активности, продемонстрированной в тот момент времени, когда фармацевтический препарат был получен, как определено в анализе связывания антигена, например. Другие анализы «биологической активности» конкретизированы в настоящем описании ниже.
Под «изотоническим» подразумевается, что представляющий интерес препарат имеет по существу то же осмотическое давление, что и кровь человека. Изотонические препараты будут, как правило, иметь осмотическое давление от приблизительно 250 до 350 мОсм. Изотоничность можно определить, используя паронаполненный или криоскопический осмометр, например.
«Полиол» представляет собой вещество с множеством гидроксильных групп и включает сахара (восстанавливающие и невосстанавливающие сахара), сахароспирты и сахарокислоты. Предпочтительные в настоящем описании полиолы имеют молекулярную массу, которая составляет менее чем приблизительно 600 кДа (например, находится в диапазоне от приблизительно 120 до приблизительно 400 кДа). «Восстанавливающим сахаром» является сахар, который содержит полуацетальную группу ОН, которая может уменьшать количество йонов металлов или реагировать с образованием ковалентной связи с лизином и другими аминогруппами в белках, а «невосстанавливающим сахаром» является сахар, который не обладает этими свойствами восстанавливающего сахара. Примерами восстанавливающих сахаров являются фруктоза, манноза, мальтоза, лактоза, арабиноза, ксилоза, рибоза, рамноза, галактоза и глюкоза. Невосстанавливающие сахара включают сахарозу, трегалозу, сорбозу, мелецитозу и раффинозу. Маннит, ксилит, эритрит, треит, сорбит и глицерин являются примерами сахароспиртов. В качестве сахарокислот они включают соль L-глюконовой кислоты и их соли металлов. В случае, когда желательно, чтобы препарат был устойчивым к замораживанию-оттаиванию, полиолом, предпочтительно, является тот, который не кристаллизуется при температурах замораживания (например, -20°C) с дестабилизацией антитела в препарате. Невосстанавливающие сахара включают, но ими не ограничиваются, сахарозу и трегалозу.
Как используется в настоящем описании, «буфер» относится к забуференному раствору, который является устойчивым к изменениям pH благодаря действию его кислотно-основных соединенных компонентов. Буфер по настоящему изобретению имеет pH в диапазоне от приблизительно 4,5 до приблизительно 7; предпочтительно, от приблизительно 4,8 до приблизительно 6,5. Примеры буферов, которые будут контролировать pH в этом диапазоне, включают ацетатный (например, натрийацетатный), сукцинатный (например, натрийсукцинатный), глюконатный, гистидиновый, цитратный и включающие другие органические кислоты буферы. Если желательным является устойчивый к замораживанию-оттаиванию препарат, буфер предпочтительно не является фосфатным.
В фармакологическом значении, в контексте настоящего изобретения, «терапевтически эффективное количество» антитела относится к количеству, эффективному для профилактики или лечения нарушения, для лечения которого антитело является эффективным. «Заболеванием/нарушением» является любое состояние, лечение антителом которого будет иметь эффект. Оно включает хронические и острые нарушения или заболевания, в том числе те патологические состояния, которые вызывают предрасположенность млекопитающего к нарушению, о котором идет речь.
«Консервантом» является соединение, которое может быть включено в препарат для существенного уменьшения жизнедеятельности бактерий, способствуя тем самым получению препарата для многоразового использования, например. Примеры возможных консервантов включают октадецилдиметилбензиламмония хлорид, гексаметония хлорид, бензалкония хлорид (смесь алкилбензилдиметиламмония хлоридов, в которых алкильными группами являются длинноцепочечные соединения) и бензетония хлорид. Другие типы консервантов включают ароматические спирты, такие как фенол, бутиловый и бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцин, циклогексанол, 3-пенанол и м-крезол. Наиболее предпочтительным консервантом является бензиловый спирт.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим одно или более антител вместе по крайней мере с одним физиологически приемлемым носителем или наполнителем. Фармацевтические композиции могут содержать, например, одно или более из следующего: воду, буферы (например, нейтральный забуференный солевой раствор или забуференный фосфатом солевой раствор), этанол, минеральное масло, растительное масло, диметилсульфоксид, углеводы (например, глюкозу, маннозу, сахарозу или декстраны), маннит, белки, вспомогательные вещества, полипептиды или аминокислоты, такие как глицин, антиоксиданты, комплексообразующие средства, такие как EDTA или глютатион, и/или консерванты. Как отмечено выше, другие активные ингредиенты могут (но необязательно) быть включены в фармацевтические композиции по настоящему изобретению.
Носителем является вещество, которое может быть объединено с антителом до введения пациенту, часто с целью контролирования стабильности или биодоступности соединения. Носители для применения в таких препаратах являются обычно биосовместимыми и также могут быть биодеградируемыми. Носители включают, например, одновалентные или поливалентные молекулы, такие как сывороточный альбумин (например, человеческий или бычий), овальбумин, пептиды, полилизин и полисахариды, такие как аминодекстран и полиамидоамины. Носители также включают материалы твердых подложек, такие как гранулы и микрочастицы, содержащие, например, полилактат, полигликолят, сополимер лактида с гликолидом, полиакрилат, латекс, крахмал, целлюлозу или декстран. Носитель может нести соединения рядом способов, включая ковалентную связь (или непосредственно, или через линкерную группу), нековалентное взаимодействие или смешивание.
Фармацевтические композиции могут быть получены для любого подходящего способа введения, включая, например, глазное, интраназальное, ушное, сублингвальное, чрескожное, местное, пероральное, назальное, ректальное или парентеральное введение. В некоторых вариантах осуществления предпочтительными являются композиции в форме, подходящей для перорального применения. Такие формы включают, например, пилюли, таблетки, пастилки, лепешки, суспензии на водной или масляной основе, дисперсные порошки или гранулы, эмульсию, твердые или мягкие капсулы, или сиропы, или эликсиры. Тем не менее, в других вариантах осуществления композиции по настоящему изобретению можно получить в виде лиофилизата. Используемый в настоящем описании термин «парентеральное(ая)» включает подкожную, внутрикожную, внутрисосудистую (например, внутривенную), внутримышечную, спинномозговую, внутричерепную, подоболочечную и внутрибрюшинную инъекцию, а также любой схожий способ инъекции или инфузии.
В некоторых вариантах осуществления антитело по настоящему изобретению можно вводить непосредственно в глаз путем инъекции в ткани глаза, такой как периокулярная, конъюнктивальная, субтеноновая, интракамеральная инъекция, инъекция в стекловидное тело, внутрь глаза, субретинальная, субконъюнктивальная, ретробульбарная или интраканаликулярная инъекция; с помощью непосредственного введения в глаз, используя катетер или другое устройство для введения, такое как гранула для ретинального применения, вставка внутрь глаза, суппозиторий или имплантат, содержащий пористый, непористый или гелеобразный материал; с помощью глазных капель или мазей для местного применения; или с помощью устройства для медленного высвобождения, расположенного в мешке или имплантированного рядом со склерой (трассклеральное введение) или в склере (интрасклеральное введение), или внутри глаза. Интракамеральная инъекция может осуществляться через роговицу в переднюю камеру, чтобы сделать возможным достижение средством трабекулярной сети. Интраканаликулярная инъекция может осуществляться в венозные коллекторные каналы, начинающиеся у шлеммова канала, или в шлеммов канал.
Для доставки в глаз антитело по настоящему изобретению может быть объединено с офтальмологически приемлемыми консервантами, сорастворителями, поверхностно-активными веществами, увеличивающими вязкость веществами, увеличивающими проникновение веществами, буферами, хлоридом натрия или водой для образования водной, стерильной суспензии или раствора для офтальмологического применения. Продукты для местного офтальмологического применения могут быть упакованы, например, в многодозовой форме. Поэтому могут потребоваться консерванты для предотвращения заражения микробами во время применения. Подходящие консерванты включают хлорбутанол, метилпарабен, пропилпарабен, фенилэтиловый спирт, эдедат динатрия, сорбиновую кислоту, поликватерниум-1 или другие агенты, известные специалистам в данной области. Такие консерванты обычно используются на уровне от 0,001 до 1,0% в отношении веса к объему. Композиции по настоящему изобретению в форме однократной дозы будут стерильными, но обычно без консервантов. Такие композиции, следовательно, не будут, как правило, содержать консерванты.
В некоторых вариантах осуществления композиции, предназначенные для местного введения в глаз, получают в виде глазных капель или глазных мазей, причем общее количество антитела будет составлять приблизительно 0,001-1,0% (в весовом отношении). Предпочтительно, количество антитела против TNFα составляет от приблизительно 0,01 до приблизительно 1,0% (в весовом отношении).
Композиции по настоящему изобретению в некоторых случаях будут вводиться в виде растворов для местного введения. Водные растворы являются, как правило, предпочтительными, на основе легкости получения, а также возможности легкого введения таких композиций пациентом с помощью введения одной-двух капель растворов в пораженные глаза. Однако композиции могут быть также суспензиями, вязкими или полувязкими гелями, или другими типами твердых или полутвердых композиций.
Композиции, предназначенные для перорального применения, можно получить в соответствии с любым способом, известным в данной области для получения фармацевтических композиций, и могут содержать один или более агентов, таких как подсластители, корригенты, красители и консерванты для получения привлекательных и вкусных препаратов. Таблетки содержат активный ингредиент в смеси с физиологически приемлемыми наполнителями, которые подходят для производства таблеток. Такие наполнители включают, например, инертные разбавители (например, карбонат кальция, карбонат натрия, лактозу, фосфат кальция или фосфат натрия), агенты для гранулирования и улучшения распадаемости таблеток (например, кукурузный крахмал или альгиновую кислоту), связующие вещества (например, крахмал, желатин или аравийскую камедь) и лубриканты (например, стеарат магния, стеариновую кислоту или тальк). Таблетки могут быть без покрытия, или они могут быть покрыты известными способами для отсрочки распада и всасывания в желудочно-кишечном тракте и тем самым обеспечивают непрерывное действие в течение более длительного периода времени. Например, материал с задержкой по времени, такой как глицерилмоностеарат или глицерилдистеарат, может использоваться.
Препараты для перорального применения могут быть также вводиться в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем (например, карбонатом кальция, фосфатом кальция или каолином), или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой (например, арахисовым маслом, жидким парафином или оливковым маслом). Водные суспензии содержат антитело в смеси с наполнителями, подходящими для получения суспензий на водной основе. Такие наполнители включают суспендирующие средства (например, натрий карбоксиметилцеллюлозу, метилцеллюлозу, гидропропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и аравийскую камедь); и диспергаторы или смачивающие средства (например, природные фосфатиды, такие как лецитин, продукты конденсации алкиленоксида с жирными кислотами, такие как полиоксиэтиленстеарат, продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, такие как гептадекаэтиленоксицетанол, продукты конденсации этиленоксида с неполными эфирами, получаемыми из жирных кислот и гекситола, такие как полиоксиэтиленсорбитмоноолеат, или продукты конденсации этиленоксида с неполными эфирами, получаемыми из жирных кислот и гекситоловых ангидридов, такие как полиэтиленсорбитанмоноолеат). Водные суспензии также могут содержать один или несколько консервантов, например, этил- или н-пропил-пара-гидроксибензоат, один или более красителей, один или более корригентов, и один или более подсластителей, таких как сахароза или сахарин. Сиропы и эликсиры могут быть получены с подсластителями, такими как глицерин, пропиленгликоль, сорбит или сахароза. Такие препараты также могут содержать одно или более средств, уменьшающих раздражение, консервантов, корригентов и/или красителей.
Суспензии на масляной основе могут быть получены путем суспендирования активных ингредиентов в растительном масле (например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле) или в минеральном масле, таком как жидкий парафин. Суспензии на масляной основе могут содержать загуститель, такой как желтый воск, твердый парафин или цетиловый спирт. Подсластители, такие как те, которые изложены выше, и/или корригенты могут быть добавлены для полученияя пероральных препаратов с привлекательным вкусом. Сохранение такие суспензий можно обеспечить посредством добавления антиоксиданта, такого как аскорбиновая кислота.
Дисперсные порошки и гранулы, подходящие для получения суспензии на водной основе посредством добавления воды, обеспечивают активный ингредиент в смеси с диспергатором или смачивающим агентом, суспендирующим агентом и одним или более консервантов. Примерами подходящих диспергаторов и смачивающих агентов служат те, которые уже отмечены выше. Также могут присутствовать дополнительные наполнители, например, подсластители, коррригенты и красители.
Фармацевтические композиции могут быть также в форме эмульсий типа «масло-в-воде». Масляной фазой может быть растительное масло (например, оливковое масло или арахисовое масло), минеральное масло (например, жидкий парафин) или их смесь. Подходящие эмульгаторы включают природные камеди (например, аравийскую камедь или трагакантовую камедь), природные фосфатиды (например, сою, лецитин и эфиры или неполные эфиры, получаемые из жирных кислот и гекситола), ангидриды (например, сорбитмоноолеат) и продукты конденсации неполных эфиров, получаемых из жирных кислот и гекситола, с этиленоксидом (например, полиоксиэтиленсорбитанмоноолеат). Эмульсия может также содержать один или более подсластителей, и/или корригентов.
Фармацевтическая композиция может быть получена в виде стерильной инъецируемой водной или содержащей масло суспензии, в которой модулятор, в зависимости от используемого носителя и концентрации, или суспендирован, или растворен в носителе. Такую композицию можно получить в соответствии с известным уровнем, используя подходящие диспергаторы, смачивающие агенты и/или суспендирующие агенты, такие как те, которые отмечены выше. Среди подходящих носителей и растворителей, которые могут использоваться, находятся вода, 1,3-бутандиол, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла могут использоваться в качестве растворителя или суспендирующей среды. С этой целью может использоваться любое безвкусное нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, могут использоваться при получении инъецируемых композиций, и вспомогательные средства, такие как местные анестетики, консерванты и/или буферные вещества, могут быть растворены в носителе.
Фармацевтическая композиция может быть получена в виде препаратов с замедленным высвобождением (т.е. препарата, такого как капсула, который имитирует медленное высвобождение модулятора после введения). Такие препараты можно, как правило, получить, используя хорошо известную технологию, и вводить с помощью, например, оральной, ректальной или подкожной имплантации, или имплантации в желаемое целевое место. Носители для применения в таких препаратах являются биосовместимыми и также могут быть биодеградируемыми; предпочтительно, когда препарат обеспечивает относительно постоянный уровень высвобождения модулятора. Количество антитела, содержащегося в препарате с замедленным высвобождением, зависит, например, от места имплантации, скорости и предполагаемой продолжительности высвобождения и природы заболевания/нарушения, которое лечат или предупреждают.
Антитела против TNFα, описанные в настоящем описании, можно вводить в количестве, которое дает концентрацию в жидкости в организме (например, крови, плазме, сыворотке, спинномозговой жидкости, синовиальной жидкости, лимфе, межклеточной интерстициальной жидкости, слезах или моче), которая является достаточной для выявляемого связывания с TNF и профилактики или подавления TNF-опосредуемых заболеваний/нарушений. Считается, что доза является эффективной, если она вызывает положительный эффект у пациента, как описано выше. Предпочтительные дозы для системного введения находятся в диапазоне от приблизительно 0,1 мг до приблизительно 140 мг на килограмм веса тела в день (от приблизительно 0,5 мг до приблизительно 7 г для каждого пациента в день), при этом дозы для перорального введения, как правило, превышают в приблизительно 5-20 раз дозы для внутривенного введения. Количество антитело, которое может быть объединено с материалами носителя для получения формы однократной дозы, будет варьировать в зависимости от хозяина, в отношении которого проводят лечение, и конкретного способа введения. Формы единиц дозирования будут, как правило, содержать от приблизительно 1 мг до приблизительно 500 мг активного ингредиента.
В некоторых вариантах осуществления фармацевтические композиции могут быть упакованными для лечения состояний, реагирующих на антитело, направленное против TNF. Упакованные фармацевтические композиции могут включать контейнер, вмещающий эффективное количество по крайней мере одного антитела, описываемого в настоящем описании, и инструкции (например, этикетку), в которых указывается то, что содержащаяся в нем композиция должна использоваться для лечения заболевания/нарушения, реагирующего на одно антитела после введения пациенту.
Антитела по настоящему изобретению могут быть также химически модифицированными. Предпочтительными модифицирующими группами являются полимеры, например, необязательно замещенный, неразветвленный или разветвленный полиалкен, полиалкенилен и полиоксиалкиленовый полимер, или разветвленный, или неразветвленный полисахарид. Такая эффекторная группа может увеличить полупериод существования антитела in vivo. Конкретные примеры синтетических полимеров включают необязательно замещенный, неразветвленный или разветвленный полиэтиленгликоль (ПЭГ), полипропиленгликоль, поливиниловый спирт или их производные. Конкретные природные полимеры включают лактозу, амилозу, декстран, гликоген или их производные. Размер полимера может варьировать при желании, но будет, как правило, находиться в диапазоне для средней молекулярной массы от 500 Да до 50000 Да. В случае местного применения, когда антитело предназначено для проникновения в ткань, предпочтительная молекулярная масса полимера составляет приблизительно 5000 Да. Молекулу полимера можно присоединить к антителу, например, к C-концу тяжелой цепи Fab-фрагмента через ковалентно связываемый шарнирный пептид, как описано в WO0194585. Что касается присоединения ПЭГ составляющих, приводится ссылка на "Poly(ethyleneglycol) Chemistry, Biotechnological and Biomedical Applications", 1992, J. Milton Harris (ed), Plenum Press, New York и "Bioconjugation Protein Coupling Techniques for the Biomedical Sciences", 1998, M. Aslam and A. Dent, Grove Publishers, New York.
После получения представляющего интерес антитела, описываемого выше, получают содержащую его фармацевтическую композицию. Антитело, вводимое в композицию, не было подвергнуто предшествующей лиофилизации, и представляющим в настоящем описании интерес препаратом является водный препарат. Предпочтительно, антителом в препарате является фрагмент антитела, такой как scFv. Терапевтически эффективное количество антитела, присутствующего в препарате, определяют с учетом желаемых объемов дозы и способа(ов) введения, например. Приводимой в качестве примера концентрацией антитела в препарате является от приблизительно 0,1 мг/мл до приблизительно 50 мг/мл, предпочтительно, от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл и, наиболее предпочтительно, от приблизительно 2 мг/мл до приблизительно 10 мг/мл.
Получают водный препарат, содержащий антитело в pH-буферном растворе, как описано выше. Концентрация буфера может составлять от приблизительно 1 мМ до приблизительно 50 мМ, предпочтительно, от приблизительно 5 мМ до приблизительно 30 мМ, в зависимости, например, от буфера и желаемой изотоничности препарата.
В композицию вводят полиол, который выполняет функцию средства поддерживающего тоничность раствора, и может стабилизировать антитело. В предпочтительных вариантах осуществления препарат не содержит поддерживающее тоничность количество соли, такой как хлорид натрия, поскольку это может быть причиной преципитации антитела и/или может привести к окислению при низком pH. В предпочтительных вариантах осуществления полиолом является невосстанавливающий сахар, такой как сахароза или трегалоза. Полиол добавляют к препарату в количестве, которое может меняться с учетом желаемой изотоничности препарата. Предпочтительно, водный препарат является изотоническим, в случае которого подходящие концентрации полиола в препарате находятся в диапазоне от приблизительно 1% до приблизительно 15% в отношении веса к объему, предпочтительно, в диапазоне от приблизительно 2% до приблизительно 10% в отношении веса к объему, например. Однако гипертонические или гипотонические препараты также могут быть подходящими. Добавляемое количество полиола может также меняться с учетом молекулярной массы полиола. Например, может быть добавлено меньшее количество моносахарида (например, маннита) по сравнению с дисахаридом (таким как трегалоза).
К содержащему антителу препарату может быть добавлено поверхностно-активное вещество. Приводимые в качестве примера поверхностно-активные вещества включают неионные поверхностно-активные вещества, такие как полисорбаты (например, полисорбаты 20, 80 и т.д.) или полоксамеры (например, полоксамер 188). Обычно добавляемое количество поверхностно-активного вещества является таковым, что оно уменьшает агрегацию введенного в препарат антитела/производного антитела и/или сводит к минимуму образование частиц в препарате, и/или уменьшает адсорбцию. Например, поверхностно-активное вещество может присутствовать в препарате в количестве, составляющем от приблизительно 0,001% до приблизительно 0,5%, предпочтительно, от приблизительно 0,005% до приблизительно 0,2% и, наиболее предпочтительно, от приблизительно 0,01% до приблизительно 0,1%.
В одном из вариантов осуществления препарат содержит определенные выше агенты (т.е. антитело, буфер, полиол и поверхностно-активное вещество) и по существу не содержит один или более консервантов, таких как бензиловый спирт, фенол, м-крезол, хлорбутанол и бензетония Cl. В другом варианте осуществления консервант может быть включен в препарат, особенно когда препаратом является мультидозовый препарат. Концентрация консерванта может находиться в диапазоне от приблизительно 0,1% до приблизительно 2%, наиболее предпочтительно, от приблизительно 0,5% до приблизительно 1%. В препарат может быть введен один или более других фармацевтически приемлемых носителей, наполнителей или стабилизаторов, таких как те, которые описаны в Remington's Pharmaceutical Sciences 21st edition, Osol, A. Ed. (2006), при условии, что они не оказывают неблагоприятный эффект на желаемые характеристики препарата. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают дополнительные буферные вещества; сорастворители; антиоксиданты, включающие аскорбиновую кислоту и метионин; комплексообразующие вещества, такие как EDTA; металлокомплексы (например, комплексы Zn-белок); биодеградируемые полимеры, такие как полиэфиры; и/или образующие соли противоионы, такие как натрий.
Используемые для in vivo введения препараты должны быть стерильными. Это легко осуществить с помощью фильтрации через стерильные мембранные фильтры, до или после получения препарата.
Препарат вводят млекопитающему, при необходимости лечения антителом, предпочтительно, человеку, известными способами, такими как внутривенное введение в виде болюсной инъекции или с помощью непрерывной инфузии в течение периода времени, с использованием внутримышечного, внутрибрюшинного, интрацереброспинального, подкожного, внутрисуставного, интрасиновиального, подоболочечного, перорального, местного пути или путем ингаляции, или другими путями, описываемыми в настоящем описании. В некоторых вариантах осуществления препарат вводят млекопитающему с использованием внутривенного введения. С этой целью препарат можно ввести, используя шприц или капельницу, например.
Соответствующая доза («терапевтически эффективное количество») антитела будет зависеть, например, от заболевания, в отношении которого проводят лечение, тяжести и течения заболевания, того, вводится ли антитело с превентивной или терапевтической целью, предшествующей терапии, истории болезни пациента и ответной реакции на антитело, типа используемого антитела и усмотрения лечащего врача. Антитело соответственно вводят пациенту один раз или в течение ряда лечений, и его можно вводить пациенту в любой момент времени, начиная с момента диагностирования. Антитело можно вводить в качестве единственного лечения или вместе с другими лекарственными средствами, или терапией, применимой для лечения заболевания, о котором идет речь.
В качестве общего предположения, вводимое терапевтически эффективное количество антитела будет находиться в диапазоне от приблизительно 0,1 до приблизительно 100 мг/кг веса тела пациента, или при однократном, или при многократном введении, при этом типичный используемый диапазон антитела будет составлять от приблизительно 0,3 до приблизительно 20 мг/кг, более предпочтительно, от приблизительно 0,3 до приблизительно 15 мг/кг, вводимых ежедневно, например. Однако могут использоваться другие схемы введения доз. За эффективностью этой терапии легко проследить с помощью обычных способов.
В некоторых вариантах осуществления фармацевтические композиции, содержащие антитело против TNFα по настоящему изобретению, вводят пациенту с TNF-опосредуемым нарушением.
В другом варианте осуществления настоящее изобретение относится к готовому изделию, содержащему контейнер, который вмещает водный фармацевтический препарат по настоящему изобретению и который снабжен инструкциями в отношении его применения. Подходящие контейнеры включают, например, флаконы, ампулы и шприцы. Контейнер может быть получен из множества материалов, таких как стекло или пластмасса. Приводимым в качестве примера контейнером является 3-20 см3 стеклянная ампула для однократного применения. Альтернативно, в случае многодозового препарата контейнером может быть 3-100 см3 стеклянный пузырек. Контейнер вмещает препарат, и этикетка на контейнере, или соединенная с ним, может указывать на области применения. Готовое изделие может, кроме того, включать другие материалы, желательные с коммерческой точки зрения и точки зрения потребителя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями в отношении применения.
Содержания любых патентов, заявок на патенты и ссылочных документов, которые приводятся на всем протяжении этого описания изобретения, включены при сем посредством ссылки в их полных объемах.
Кроме случаев, когда контекст диктует противное, используемые в настоящем описании термины в единственном числе должны включать множественное число, а термины во множественном числе должны включать единственное число.
ПРИМЕРЫ
Настоящее изобретение, кроме того, поясняется следующими примерами, которые не должны рассматриваться как дополнительное ограничение. Содержания всех фигур и всех ссылочных документов, патентов и опубликованных заявок на патенты, которые приведены на всем протяжении этой заявки, намеренно включены в настоящее описание в качестве ссылки в полном объеме.
Везде в примерах были использованы следующие материалы и способы, кроме особо оговоренных случаев.
Общие материалы и способы
Как правило, при осуществлении на практике настоящего изобретения используются, кроме особо оговоренных случаев, обычные способы химии, молекулярной биологии, технологии рекомбинантных ДНК, иммунологии (особенно, например, технологии создания антител) и стандартные способы получения полипептидов. См., например, Sambrook, Fritsch and Maniatis, Molecular Cloning: Cold Spring Harbor Laboratory Press (1989); Antibody Engineering Protocols (Methods in Molecular Biology), 510, Paul, S., Humana Pr (1996); Antibody Engineering: A Practical Approach (Practical Approach Series, 169), McCafferty, Ed., Irl Pr (1996); Antibodies: A Laboratory Manual, Harlow et al., C.S.H.L. Press, Pub. (1999); и Current Protocols in Molecular Biology, eds. Ausubel et al., John Wiley & Sons (1992).
Определения термоустойчивости
ИК-спектры нарушенного полного внутреннего отражения с Фурье-преобразованием (FTIR-ATR) были получены для различных одиночных цепей и последующих молекул, используя кювету FT-IR Bio-ATR в Tensor Bruker. Молекулы концентрировали вплоть до 3 мг/мл и подвергали диализу в течение ночи при 4°C против PBS, pH 6,5, и проточный буфер собирали в качестве контроля. Профили денатурации получали воздействием на молекулы тепла с использованием широкого диапазона температур с 5°C скачками (25-95°C). Обработки всех спектров осуществляли, используя программное обеспечение OPUS. Фон в виде основного буфера и нестационарный атмосферный фон (CO2 и H2O) вычитали из спектра отражении белка. Затем в результирующий спектр отражения белка вносили поправку на базовую линию, и спектры, соответствующие амиду I белка, определяли, исходя из ширины самого широкого разрешимого пика в предполагаемой области. Вторые производные спектры получали для спектров с полосой, соответствующей амиду I, используя функцию на основе полиномов третьей степени вместе со сглаженной функцией. Изменения структуры белка оценивали с помощью анализа вторых производных спектров, соответствующих амиду I, используя линейную калибровочную кривую для первоначальных расчетов на основе подбора по кривой, считая денатурацию = 0% для измерений при 3 низких температурах, и денатурацию = 100% для измерений при 3 высших температурах. Профили денатурации использовали для аппроксимации средних точек конформационных переходов под действием тепла (TM) для каждого варианта, используя сигмоидальную модель Больцманна.
Определения растворимости
Относительную растворимость различных молекул scFv определяли после увеличения агрегации и преципитации белка в присутствии сульфата аммония. Сульфат аммония добавляли к белку в водных растворах с созданием шагов увеличений насыщения на 5% в конечной смеси соль-белок. Преципитацию в динамическом диапазоне определяли эмпирически, и шаги насыщения уменьшали в этом диапазоне до 2,5% в конечной смеси. После добавления сульфата аммония образцы слегка перемешивали и центрифугировали в течение 30 минут при 6000 оборотов/мин. Белок, остающийся в супернатантах, получали для каждого процента насыщения сульфатом аммония. Кривые растворимости устанавливали посредством определения концентрации белка в супернатанте, используя спектрофотометр NanoDropTM 1000. Измерения остающегося растворимого белка в супернатантах нормализовали и использовали для оценки средних точек относительной растворимости для каждого варианта, используя сигмоидальную модель Больцманна.
Исследование кратковременной стабильности
Белок исследовали после инкубации в течение двух недель при 40°C в отношении растворимых агрегатов и продуктов деградации. Белки с концентрацией, составляющей 10 мг/мл, подвергали диализу в течение ночи при 4°C против PBS с широким диапазоном значений pH (3,5, 4,5, 5,5, 6,5, 7,0, 7,5 и 8,5). Контрольный белок с той же концентрацией в стандартном буфере PBS (pH 6,5) хранили при -80°C в течение 2-недельного периода. Определение полос деградации с помощью электрофореза в SDS-ПААГ выполняли в моменты времени t=0 и t=14 дней, а растворимые агрегаты определяли с помощью эксклюзионной HPLC. Определение остающейся активности спустя 2 недели при 40°C осуществляли, используя Biacore.
Пример 1
Оптимизация антитела против TNFα в виде scFv, 34rFW1.4, с целью уменьшения агрегации
Антитело 34rFW1.4 демонстрирует способность к агрегации в зависимости от pH в растворе. Антитело 578rFW1.4 (см. международную заявку WO2009155724), которое имеет такую же каркасную структуру, что и 34rFW1.4, не демонстрирует способность к агрегации. С целью определения возможных остатков в 34rFW1.4, которые можно модифицировать для уменьшения его способности к агрегации, были созданы гомологичные модели, как указано далее.
Последовательности вариабельных доменов использовали для создания гомологичных моделей антитела 34rFW1.4 и антитела 578rFW1.4. Для создания моделей использовали поиски на основе алгоритма BLAST для идентификации структур-образцов для последовательностей вариабельных доменов легкой цепи (VL) и тяжелой цепи (VH) для каждого антитела отдельно. BLOSUM80 (матрицу для менее дивергентных выравниваний) использовали в качестве матрицы для выравниваний вследствие высокого консерватизма каркасных областей в антителах. Были выбраны образцы для каждой цепи (VL/VH), которые идентичны на более чем 70% последовательностям запроса.
Программу MODELER программного обеспечения Discovery Studio версии 2.5.5 (DS 2.5.5) (Accelrys, Inc., San Diego, CA) использовали для создания 100 моделей scFv на основе идентифицированных образцов вариабельных доменов. Выравнивание контрольных последовательностей, подвергаемых моделированию, со структурами-образцами использовали в качестве входных данных. Было создано 100 моделей, содержащих все не являющиеся водородом атомы. Наилучшие модельные структуры отбирали на основе показателя PDF (вероятностной плотности распределения) физической энергии. Относительная ориентация VH- и VL-домена была задана соответствующей таковой в структуре-образце вариабельных доменов с наибольшей гомологией с обеими последовательностями (VL и VH), подвергаемыми моделированию. Дублирующие конформации при моделировании исключали, добавляли концы, и добавляли недостающие атомы боковых цепей. Силовое поле CHARMM прилагали к моделям scFv и подвергали 2000 циклам минимизации энергии, используя RMS падение = 0,01 и обобщенную Борном модель с использованием молекулярного объема (GBMV) в качестве модели с использованием неявно заданного растворителя.
Для каждого из антител были сделаны расчеты ионизации белка и pK остатков. Расчеты были сделаны, используя выполнение протокола, включенного в Discovery Studio версии 2.5.5 (DS 2.5.5), основанного на теории, разработанной Bashford и Karplus, 1991. Результаты расчетов ионизации белка и pK остатков для двух молекул сравнивали по показателю pK1/2 боковых цепей и кривых титрования каждого титрующегося остатка, включая Asp, Glu, Arg, Lys, His, Tyr, Cys, N-концевые и C-концевые остатки антител.
Силовое поле CHARMM прилагали к моделям scFv, и осуществляли протонирование при pH 7,4, кривые титрования и pK отдельных остатков рассчитывали, исходя из диапазона от pH 2 до pH 14 с использованием скачков рН=0,2. Два консервативных остатка Lys в положениях 47 и 50 в легкой цепи антитела 578rFW1.4 сравнивали с Lys в тех же положениях в 34rFW1.4 (см. фиг. 1).
Введение предпочтительных замен
Программное обеспечение Discovery Studio использовали для выполнения моделирований динамики молекул для предсказания мутаций, которые увеличивают взаимодействие между VL и VH, предотвращая тем самым развал доменов и образование олигомеров и/или агрегатов более высокого порядка. Стабильность взаимодействия VL/VH антитела 34rFW1.4 определяли энергетически как свободную энергию G. Адаптацию протокола CHARMM (также включенную в DS 2.5.5) использовали для расчета разницы между энергий всего гетеродимерного комплекса scFv и суммой энергий каждого из отдельных вариабельных доменов. Расчеты были сделаны в рамках способа с использованием неявно заданного растворителя, используя обобщенную Борном модель с использованием молекулярного объема (GBMV). Были рассчитаны энергии обоих доменов и комплекса, и результат вычислений устанавливали в виде разницы между энергией комплекса и суммой энергией отдельных доменов согласно следующему расчету: G взаимодействия = G(a) - G(b) - G(c), где G(a) представляет собой энергию антитела, G(b) представляет собой энергию VL, а G(c) представляет собой энергию VH.
Аргинин (R) был выбран в качестве возможной замены остатка вместо лизина (K) в положениях 47 и 50, поскольку значение pKa для боковой цепи R (12,5) больше pKa для K (10,5). Мутанты K47R и K50R были созданы посредством замены K на R по отдельности в соответствующих положениях. 2000 циклов минимизации энергии было выполнено для остатков, находящихся на расстоянии 10 ангстрем или ближе к области вокруг мутации, для обеспечения адаптации новых модельных молекул к изменению. Моделью с использованием неявно заданного растворителя для этих циклов минимизации энергии была GBMV. Предсказанная средняя ΔG для мутантов составляла -94 ккал/моль. Следовательно, в соответствии с оценкой вклад мутаций составляет 4 ккал/моль по сравнению с исходным антителом против TNF в виде scFv.
Пример 2
Анализ стабильности оптимизированного антитела 34rFW1.4
Мутант K50R и мутант K47R были созданы в антителе 34rFW1.4 (которое описано в находящейся одновременно на рассмотрении патентного ведомства международной заявке № PCT/CH2009/000219, поданной 25 июня 2009, содержание которой включено в настоящее описание в качестве ссылки в полном объеме). Другой мутант 34rFW1.4, содержащий дополнительные замены для уменьшения его иммуногенности in vivo, был получен в соответствии со способами, описанными в заявке на патент США № 12/973968. В частности, третий мутант, названный 34rFW1.4_VLK50R_DHP, содержал серин (S) в положении 12 тяжелой цепи (в соответствии с системой нумерации AHo), треонин (T) в положении 103 тяжелой цепи (в соответствии с системой нумерации AHo) и треонин (T) в положении 144 тяжелой цепи (в соответствии с системой нумерации AHo). Исследования стабильности исходного и мутантных антител 34rFW1.4 проводили в ускоренных условиях, как описано ниже.
Антитело 34rFW1.4, мутант 34rFW1.4_VL_K50R и 34rFW1.4_VLK50R_DHP концентрировали вплоть до 20, 40 и 60 мг/мл в составе забуференного фосфатом солевого раствора (50 мМ Na2HPO4, 150 мМ NaCl, pH 6,5) и инкубировали в течение 2 недель при 40°C. Антитела 34rFW1.4 и 34rFW1.4_K47R концентрировали вплоть до 20 и 60 мг/мл в составе забуференного фосфатом солевого раствора (50 мМ Na2HPO4, 150 мМ NaCl, pH 6,5) и инкубировали в течение 2 недель при 40°C. Образцы исследовали до и после инкубации в течение 14 дней в отношении деградации, используя электрофорез в 12,5% полиакриламидном геле с натрия додецилсульфатом (SDS-ПААГ) в восстанавливающих и невосстанавливающих условиях. Эксклюзионную жидкостную хроматографию высокого разрешения (эксклюзионную HPLC) использовали для определения содержания мономеров и растворимых агрегатов в образцах до и после инкубационного периода. Мономеры отделяли от немономерных состояний на колонке TSKgel Super SW2000 (TOSOH Bioscience), и рассчитывали процент мономерного белка как площадь соответствующего мономеру пика, разделенную на общую площадь всех полученных пиков. Результаты исследований для 34rFW1.4 и 34rFW1.4_VLK50R_DHP представлены на фиг. 2A-B, 3A-B и 4A-B, соответственно. Результаты для 34rFW1.4_VL_K50R представлены на фиг. 5B, 6B и 7B. Эти эксперименты показали, что 34rFW1.4_VLK50R_DHP имеет уменьшенную способность к агрегации по сравнению с 34rFW1.4. Мутант 34rFW1.4_K47R также продемонстрировал такое уменьшение, как показано на фиг. 8B и 9B.
Кроме того, сравнивали термоустойчивость и аффинности связывания антител 34rFW1.4 и 34rFW1.4_VLK50R_DHP. Результаты показали, что мутации, введенные для создания антитела 34rFW1.4_VLK50R_DHP, не оказывают влияние на стабильность или активность связывания по сравнению с исходным антителом 34rFW1.4.
ЭКВИВАЛЕНТЫ
Многочисленные модификации и альтернативные варианты осуществления настоящего изобретения будут очевидны специалистам в данной области ввиду предшествующего описания. Соответственно, это описание должно рассматриваться лишь как иллюстрация и предназначено для сообщения специалистам в данной области лучшего варианта осуществления настоящего изобретения. Детали структуры могут существенно меняться, не выходя за рамки сущности настоящего изобретения, а исключительное использование всех модификаций, которые входят в объем прилагаемой формулы изобретения, сохраняется. Предполагается, что настоящее изобретение ограничивается лишь в той мере, которую предусматривает прилагаемая формула изобретения и применимые правила закона.
Вся литература и схожие материалы, которые приведены в настоящей заявке, включая патенты, заявки на патенты, статьи, книги, трактаты, диссертации, Web-страницы, фигуры и/или приложения, независимо от формата такой литературы и схожих материалов, включены в словесной форме посредством ссылки в их полном объеме. В том случае, когда один или более из включенных литературных источников и схожих материалов отличается от этой заявки или противоречит ей, включая определенные термины, применение терминов, описанные способы или т.п., доминирует эта заявка.
Используемые в настоящем описании заголовки разделов служат лишь организационным целям и не должны рассматриваться как ограничение описываемого объекта никоим образом.
Хотя настоящие изобретения описаны в связи с различными вариантами осуществления и примерами, не предполагается, что идеи настоящего изобретения ограничиваются такими вариантами осуществления или примерами. Напротив, настоящие изобретения включают различные альтернативы, модификации и эквиваленты, как будет понятно специалистам в данной области.
Формула изобретения не должна считаться ограниченной описанным порядком или элементами, если только не указывается на этот эффект. Следует понимать, что различные изменения формы и детали могут быть осуществлены, не выходя за рамки объема прилагаемой формулы изобретения. Поэтому заявлены права за все варианты осуществления, которые входят в объем и сущность следующей формулы изобретения, и их эквиваленты.



























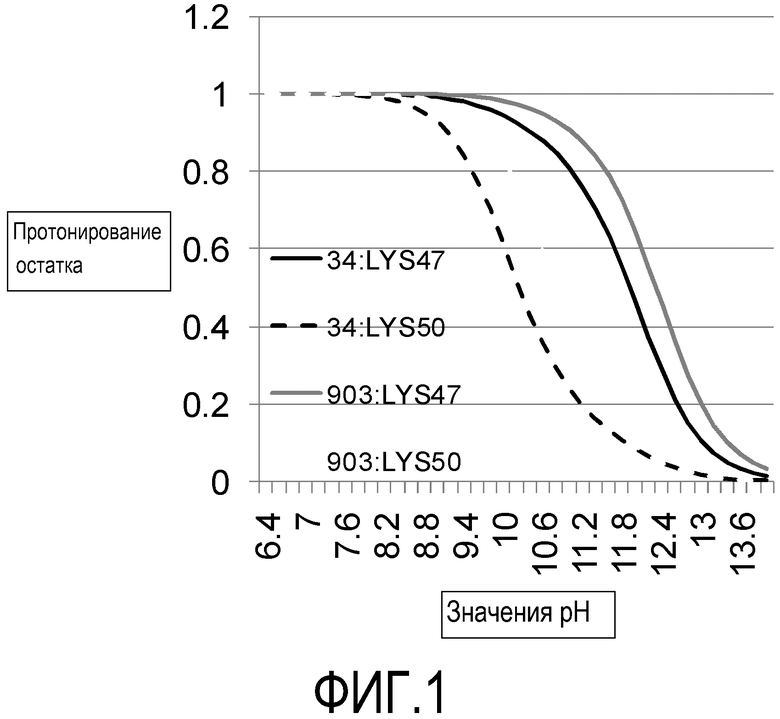
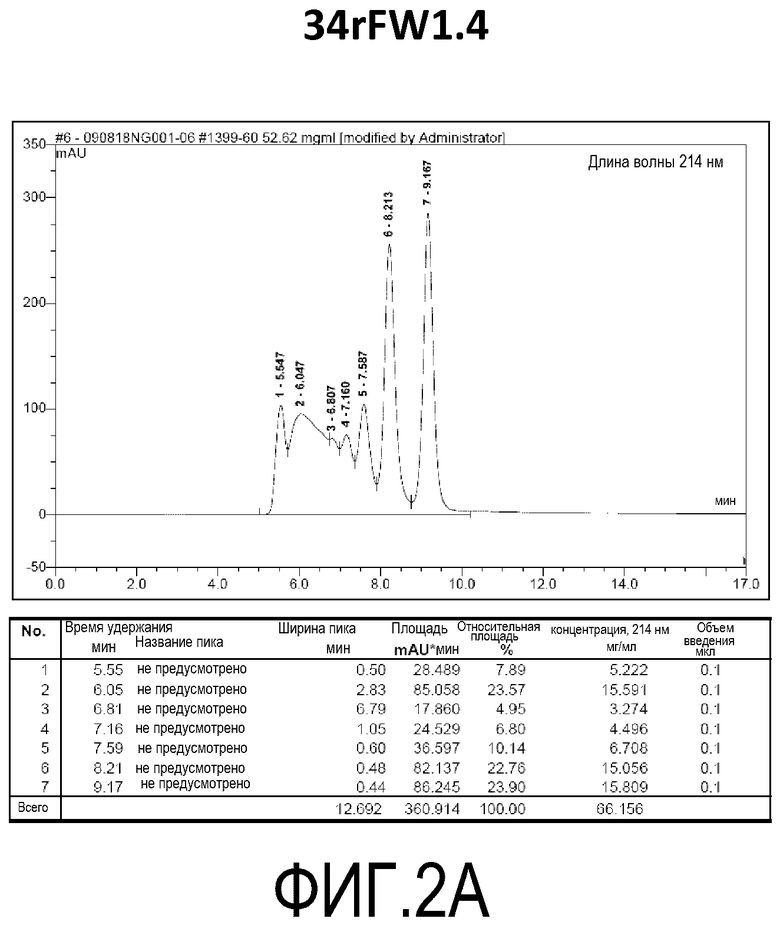
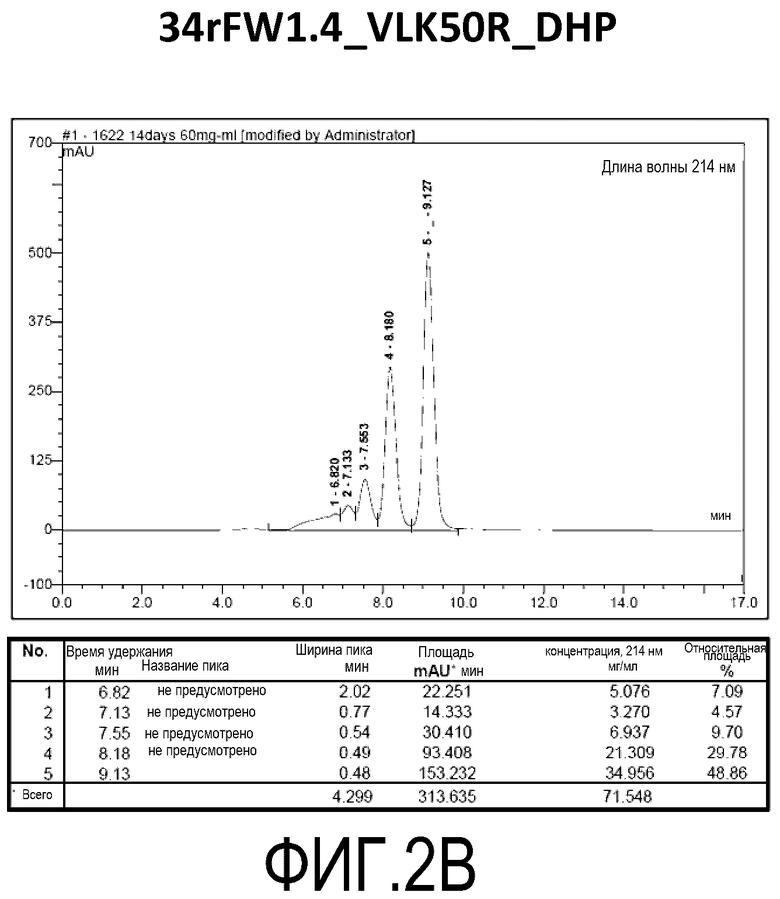
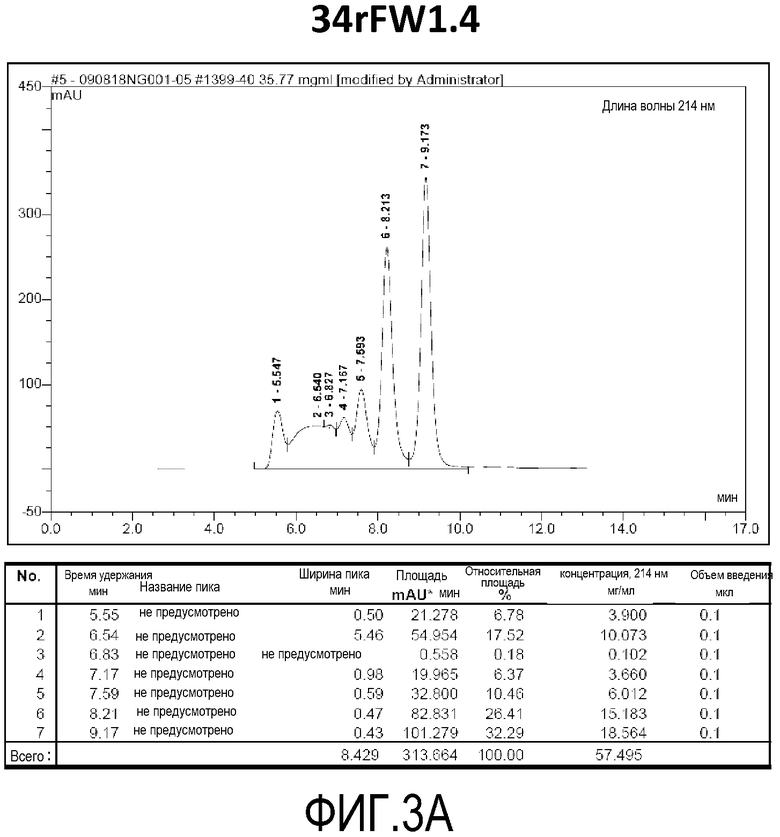
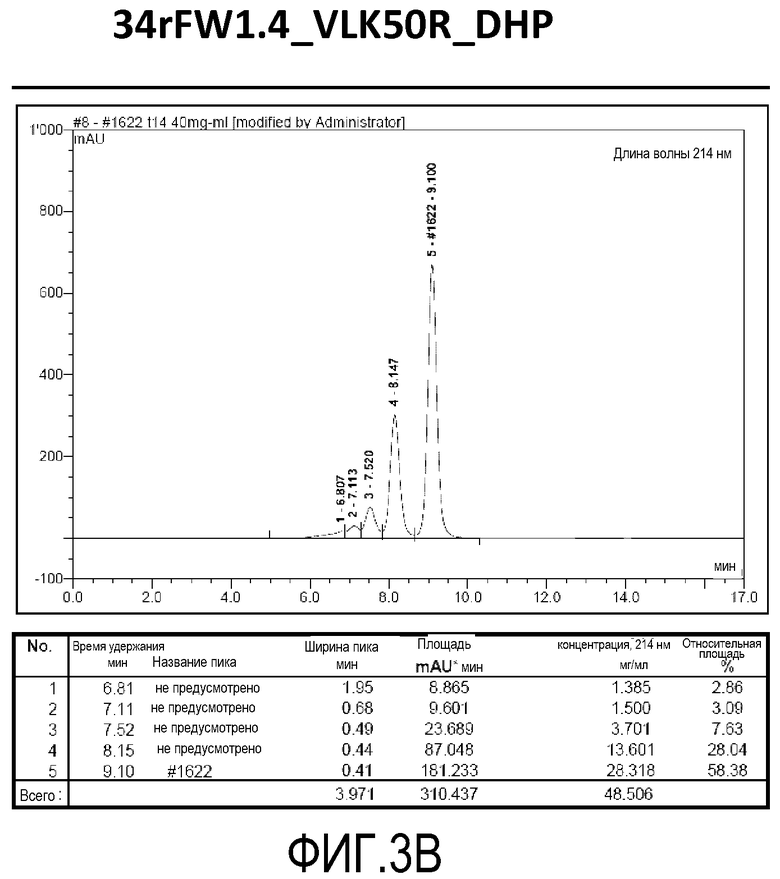
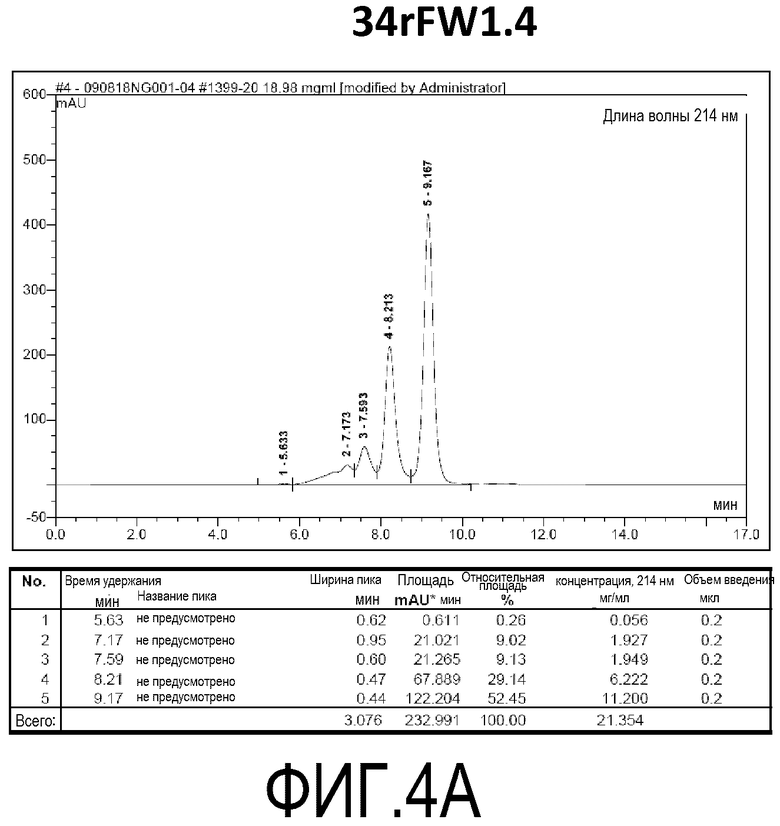
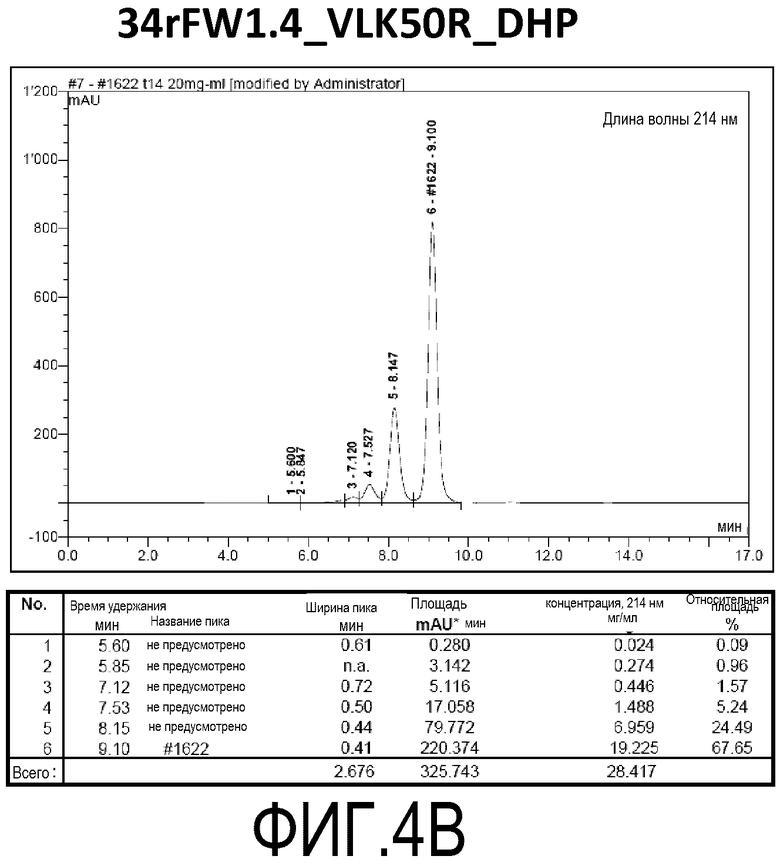
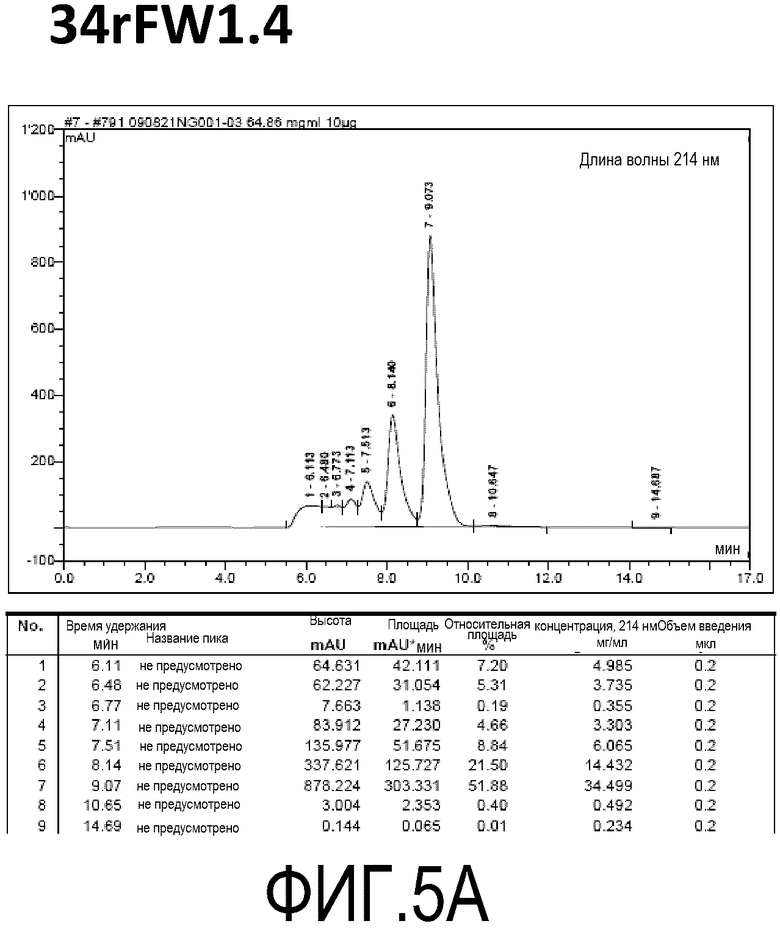
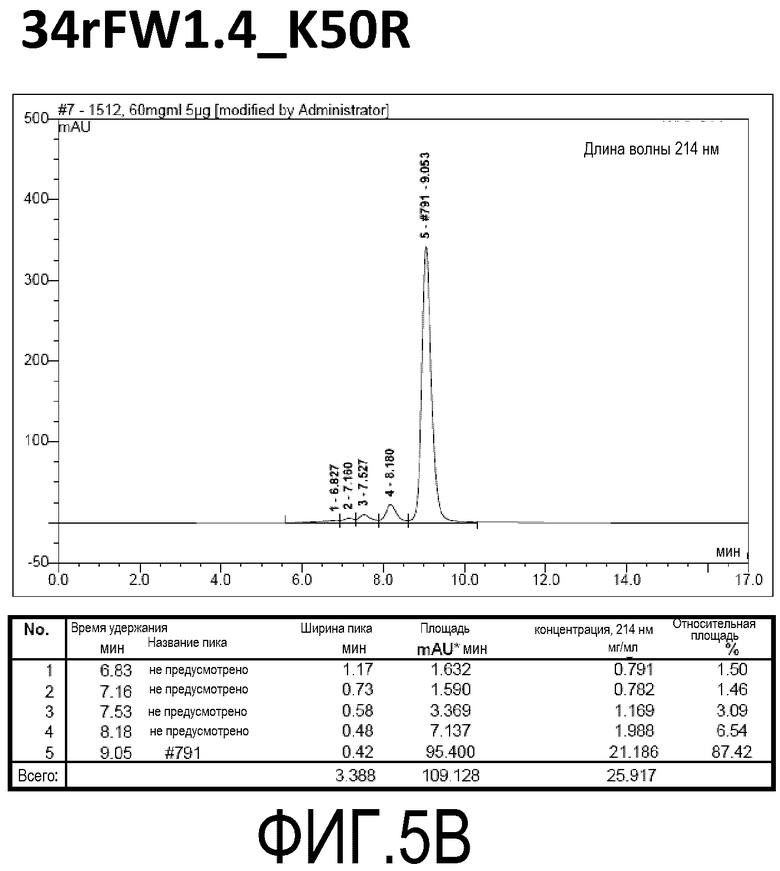
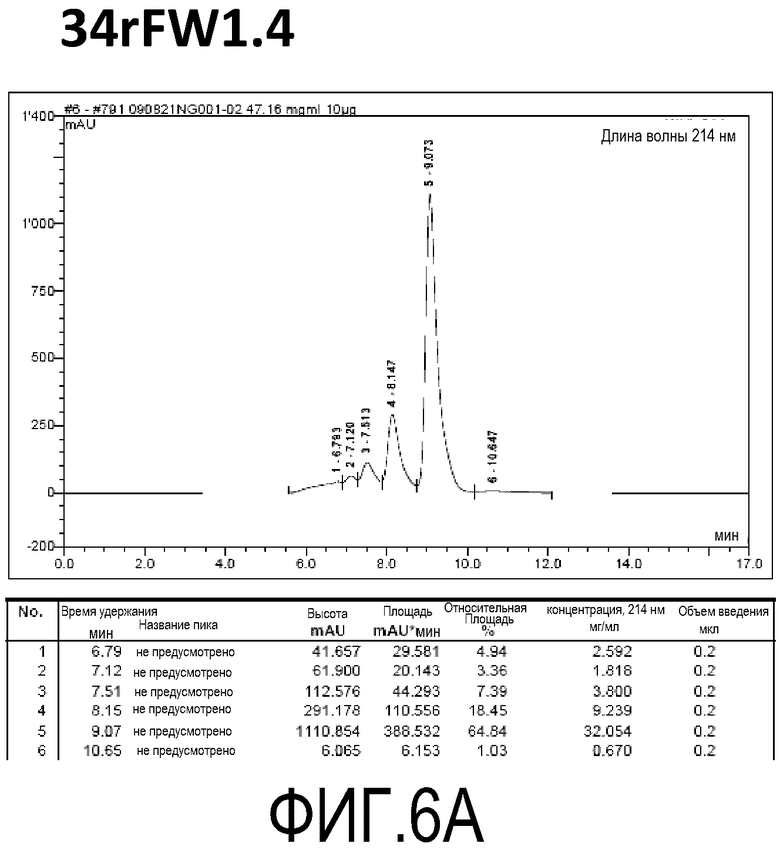
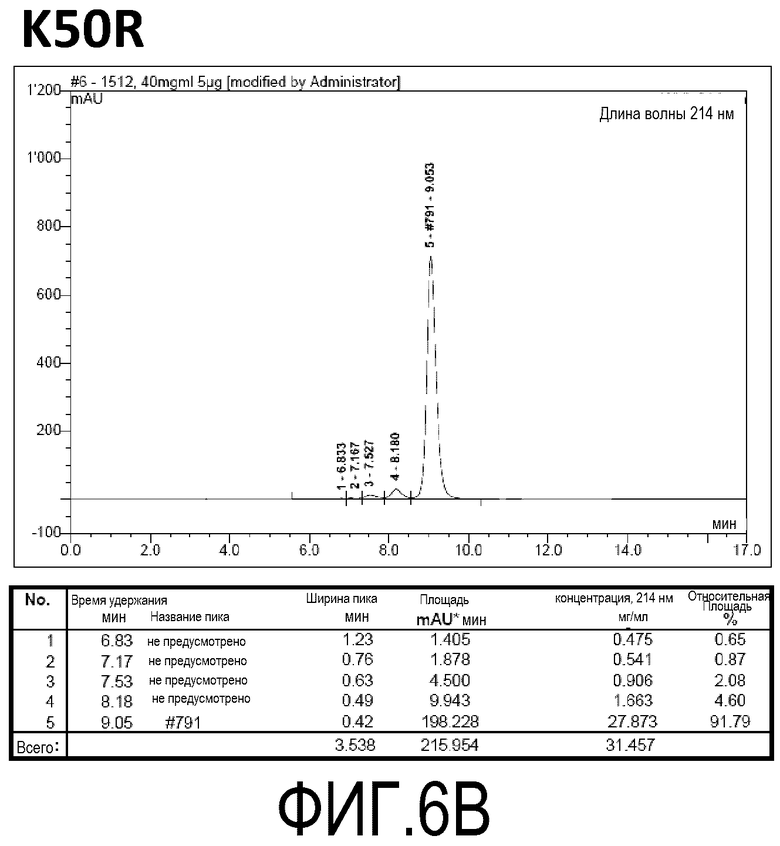
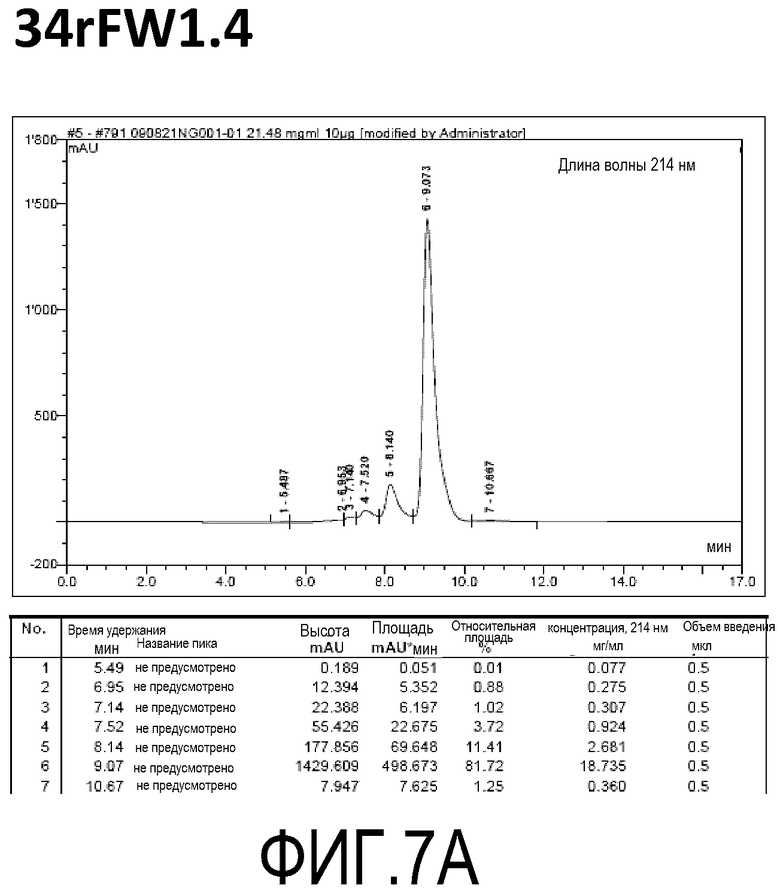
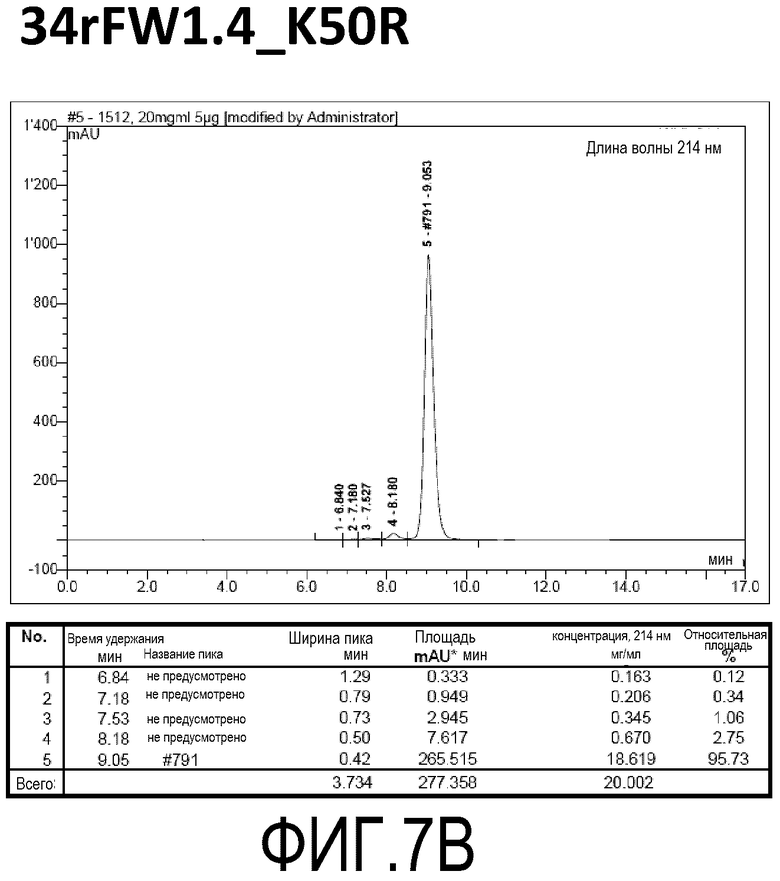
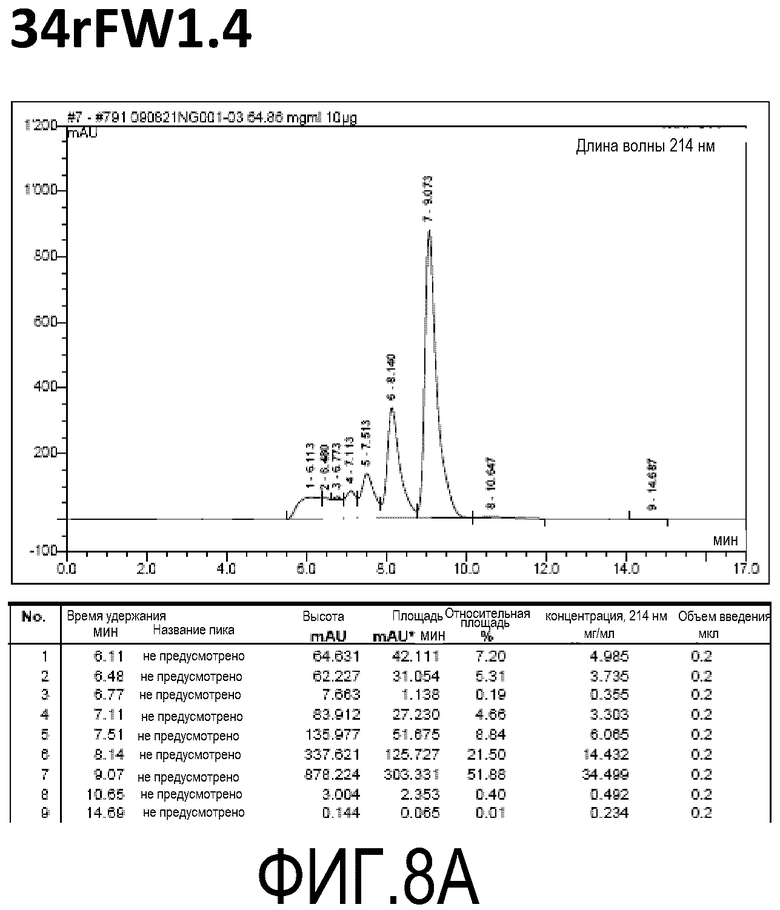
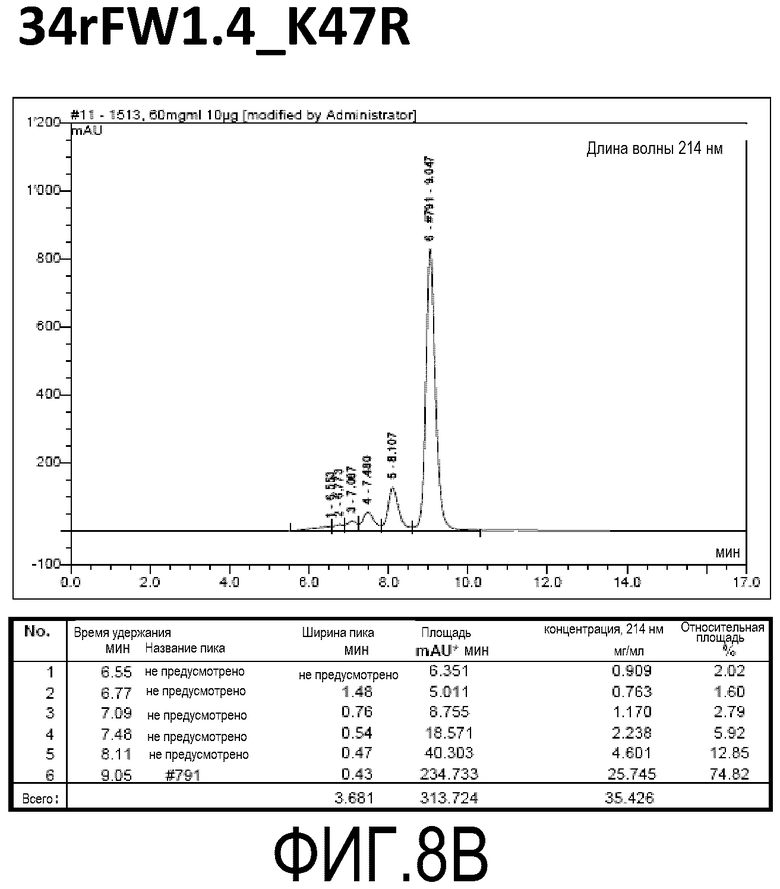
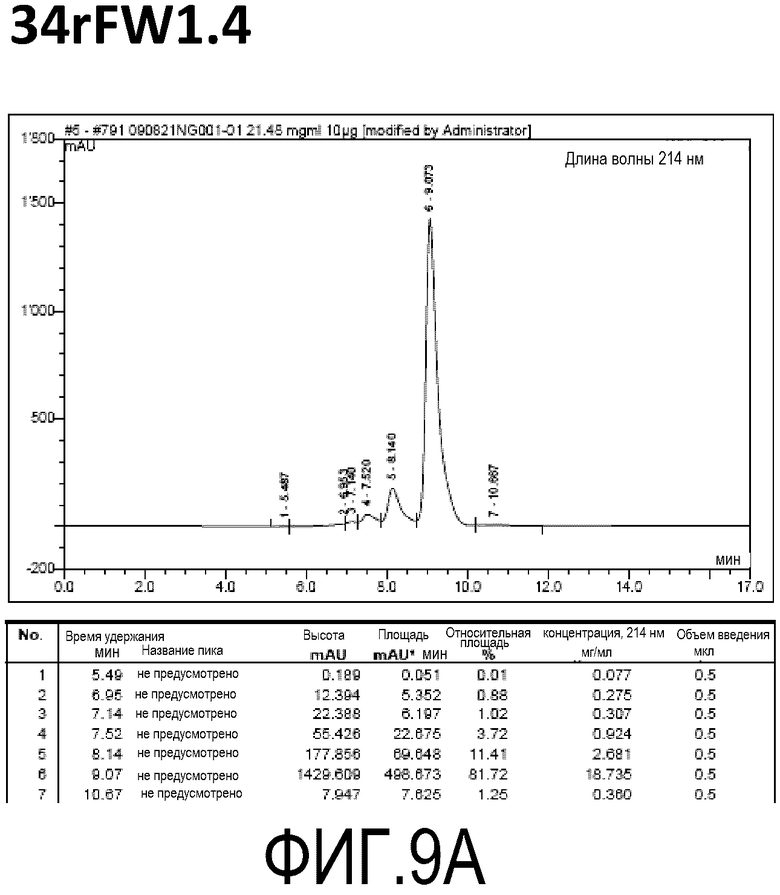
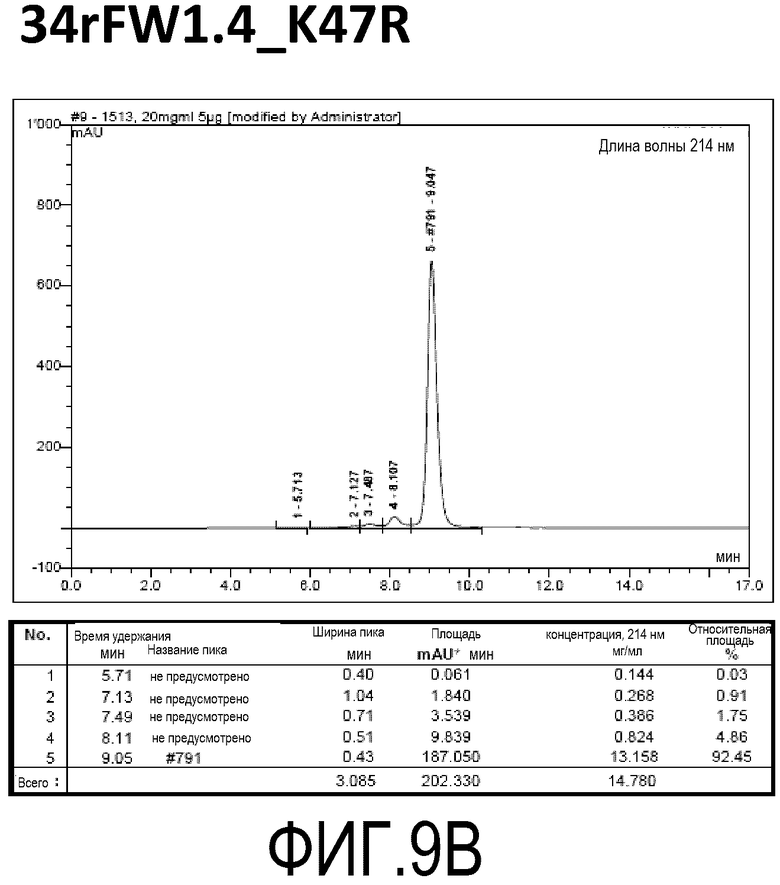
Изобретение относится к области биохимии, в частности к антителу или его антиген-связывающему фрагменту, которые специфически связываются с TNFα человека . Также раскрыты выделенная молекула нуклеиновой кислоты, кодирующая вышеуказанное антитело, вектор экспрессии, содержащий указанную молекулу нуклеиновой кислоты, и клетка-хозяин, содержащая указанный вектор, для экспрессии вышеуказанного антитела. Раскрыты фармацевтическая композиция для лечения TNFα-опосредуемого заболевания, содержащая терапевтически эффективное количество вышеуказанного антитела, и способ лечения TNFα-опосредуемого заболевания с использованием указанной композиции. Изобретение позволяет эффективно лечить TNFα-опосредуемые заболевания. 6 н. и 10 з.п. ф-лы, 9 ил., 2 табл., 2 пр.
1. Антитело, или его антиген-связывающий фрагмент, которое специфически связывается с TNFα человека, содержащее:
a) вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 2 или SEQ ID NO: 14, и
b) вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 5.
2. Антитело по п. 1, в котором вариабельный домен легкой цепи содержит последовательность SEQ ID NO: 2.
3. Антитело по п. 1, в котором вариабельный домен легкой цепи содержит последовательность SEQ ID NO: 14.
4. Антитело по п. 1, дополнительно имеющее линкер, содержащий последовательность SEQ ID NO: 7.
5. Антитело по п. 1, которое содержит последовательность SEQ ID NO: 10.
6. Антитело по п. 1, которое содержит последовательность SEQ ID NO: 17.
7. Фармацевтическая композиция для лечения TNFα-опосредуемого заболевания, содержащая терапевтически эффективное количество антитела по п. 1 и фармацевтически приемлемый носитель.
8. Способ лечения TNFα-опосредуемого заболевания, включающий введение индивиду фармацевтической композиции по п. 7.
9. Способ по п. 8, в котором TNFα-опосредуемым заболеванием является глазная болезнь, выбранная из группы, состоящей из увеита, болезни Бехчета, ретинита, сухости глаз, глаукомы, синдрома Шегрена, диабетической невропатии, склерита, возрастной дегенерации желтого пятна и кератита.
10. Способ по п. 8, в котором фармацевтическую композицию вводят с использованием глазного, интраназального, ушного, сублингвального, чрескожного, местного, перорального, назального, ректального или парентерального введения.
11. Способ по п. 10, в котором фармацевтическую композицию вводят однократно или разделяют на курс лечения в общей дозе, составляющей от 0,1 до 100 мг антитела.
12. Способ по п. 8, в котором TNFα-опосредуемым заболеванием является увеит, а фармацевтическую композицию применяют местно в глаз индивида.
13. Выделенная молекула нуклеиновой кислоты, кодирующая антитело по п. 1.
14. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п. 13.
15. Клетка-хозяин для экспрессии антитела, содержащая вектор по п. 14.
16. Антитело, или антиген-связывающий фрагмент, по п. 1, где антиген-связывающий фрагмент представляет собой Fab, Fab′, F(ab)′2, одноцепочечный Fv (scFv), Fv-фрагмент или линейное антитело.
| WO2009155724 A2, 30.12.2009 | |||
| US20020095000 A1, 18.07.2002 | |||
| KRITHIKA R | |||
| et al., Comparing the Discriminative Validity of Two Generic and One Disease-Specific Health-Related Quality of Life Measures in a Sample of Patients with Dry Eye, Value in health, 2005, Vol | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Приспособление, заменяющее сигнальную веревку | 1921 |
|
SU168A1 |
| СПОСОБ МОДИФИКАЦИИ, СПОСОБ ОБЕСПЕЧЕНИЯ СВЯЗЫВАНИЯ БЕЛКА С АНТИТЕЛОМ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБ ДИАГНОСТИКИ | 1993 |
|
RU2157239C2 |
Авторы
Даты
2015-07-27—Публикация
2011-10-24—Подача