Область техники
Настоящее изобретение относится к терапевтическому средству или профилактическому средству для лечения нарушения(й) накопления мочи.
Уровень техники
Нарушение накопления мочи представляет собой состояние, при котором мочевой пузырь не способен собирать достаточное количество мочи при накоплении мочи, и основными симптомами такого нарушения являются поллакиурия, недержание мочи и сильные позывы на мочеиспускание. Поллакиурия представляет собой состояние, при котором число случаев мочеиспускания является больше нормального; недержание мочи представляет собой состояние, при котором имеет место непроизвольное или бессознательное подтекание мочи, и это становится гигиенической и социальной проблемой; и сильные позывы на мочеиспускание представляют собой состояние, при котором человек чувствует сильный, вынужденный позыв на мочеиспускание, который возникает неожиданно. В настоящее время в качестве терапевтического средства для лечения нарушения(й) накопления мочи, такого(их) как поллакиурия, недержание мочи, сильные позывы на мочеиспускание и/или подобного нарушения, используют, главным образом, антихолинергические средства. Антихолинергические средства представляют собой средства, которые связываются с мускариновыми рецепторами и влияют на рецептор антагонистическое действие (антихолинергическое действие).
Пациенты, проявляющие нарушение(я) накопления мочи, такие как поллакиурия, недержание мочи и/или сильные позывы на мочеиспускание, также могут жаловаться на боль. Например, в случае, где причиной является интерстициальный цистит, известно, что у больных также имеет место боль в животе во время накопления мочи, и/или боль и/или дискомфорт в везикоуретральной части при мочеиспускании помимо нарушения(й) накопления мочи, такого(их) как поллакиурия, недержание мочи и/или сильные позывы на мочеиспускание.
Некоторые фармацевтические средства, которые используют в качестве анальгетика до настоящего времени, как показано, являются эффективными против нарушений накопления мочи, включая поллакиурию и недержание мочи. Например, сообщалось, что локсопрофен, который является нестероидным противовоспалительным лекарственным средством, поправляет никтурию (непатентный документ 1); и что трамадол, который является опиодным ненаркотическим анальгетиком, эффективен против поллакиурии и недержания мочи (патентный документ 1).
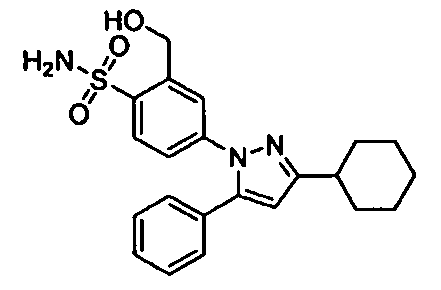
С другой стороны, что касается производных пиразола (патентный документ 2) и производных циклогексана приведенной ниже формулы, которые имеют сульфонильную группу на ароматическом кольце, связанном с пиразольным кольцом (патентный документ 3), то было сообщено об их обезболивающем действии; но нет сообщения, в котором предполагается, что такое производное эффективно в отношении нарушения(й) накопления мочи.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: WO 98/046216.
Патентный документ 2: WO 08/105383.
Патентный документ 3: WO 00/066562.
Непатентные документы
Непатентный документ 1: Saito M. et al., Int. J. Urol., 2005, vol. 12, p. 779.
Описание изобретения
Проблемы, решаемые с помощью изобретения
Однако антихолинергические средства, которые использовали для лечения нарушений накопления мочи, таких как поллакиурия, недержание мочи и/или сильные позывы на мочеиспускание, имеют побочные эффекты вследствие их фармакологического действия, такие как сухость во рту; симптомы желудочно-кишечной системы, такие как запор; сердечно-сосудистые симптомы, такие как ортостатическая гипотензия; и дисфункцию мочеиспускания, такую как задержка мочи и остаточная моча, и, следовательно, применение антихолинергических средств ограничено. Кроме того, локсопрофен проявляет вредные воздействия на желудочно-кишечную систему, а традамол проявляет вредные воздействия на желудочно-кишечную и центральную нервную систему, которыми в особенности обладают опиоидные лекарства, такие как тошнота, рвота, головокружение и ощущение легкого головокружения. Следовательно, использование таких лекарственных средств также ограничено.
Таким образом, цель настоящего изобретения состоит в разработке терапевтического средства или профилактического средства, эффективного для лечения нарушений накопления мочи, и с помощью такого средства достигают исправления побочных эффектов вследствие антихолинергического действия, а также такой агент обладает обезболивающим действием.
Заявители настоящего изобретения провели интенсивное исследование, чтобы установить, что новые циклогексановые производные, обладающие прекрасным обезболивающим действием, проявляют прекрасные терапевтические и профилактические действия против нарушений накопления мочи и, что весьма вероятно, не вызывают побочных эффектов вследствие антихолинергического действия, в результате чего реализовано настоящее изобретение.
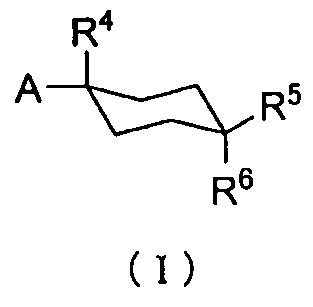
То есть, настоящее изобретение предлагает терапевтическое средство или профилактическое средство для лечения нарушений накопления мочи, и указанное средство содержит в качестве эффективного ингредиента циклогексановое производное, представленное формулой (I):
или его фармацевтически приемлемую соль или его пролекарство;
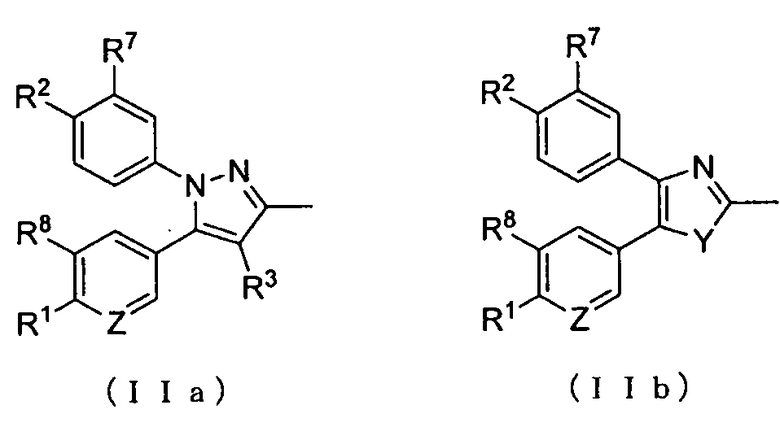
где А представляет собой заместитель, представленный формулой (IIa) или (IIb):
 ;
;
R1 и R2 каждый независимо друг от друга представляет собой атом водорода, атом хлора, C1-C3-галогеналкильную группу, C1-C4-алкильную группу или C1-C4-алкокси-группу; R3 представляет собой атом водорода или атом хлора; R4 представляет собой атом фтора, гидроксиметильную группу или гидроксильную группу; R5 и R6 каждый независимо друг от друга представляет собой атом водорода, атом фтора, C1-C3-галогеналкильную группу, карбоксильную группу, метоксикарбонильную группу, этоксикарбонильную группу, C1-C4-алкокси-группу, гидроксильную группу или C2-C5-алкилкарбонилокси-группу, или необязательно вместе образуют оксо-группу; R7 и R8 каждый независимо друг от друга представляет собой атом водорода или атом фтора; Y представляет собой атом кислорода или атом серы; Z представляет собой атом азота или метиновую группу.
В описанном выше циклогексановом производном предпочтительно, чтобы каждый заместитель R1 и R2 независимо друг от друга представлял собой трифторметильную группу, метильную группу или метокси-группу, и более предпочтительно, чтобы R3 представлял собой атом водорода; R4 представлял собой гидроксиметильную группу или гидроксильную группу; каждый заместитель R5 и R6 независимо друг от друга представлял собой атом водорода, атом фтора, трифторметильную группу, карбоксильную группу, метокси-группу, гидроксильную группу или ацетилокси-группу (или необязательно вместе могут образовывать оксо-группу).
Кроме того, более предпочтительно, чтобы описанное выше терапевтическое средство или профилактическое средство для лечения нарушения(й) накопления мочи представляло собой терапевтическое или профилактическое средство для поллакиурии, недержания мочи и/или сильных позывов на мочеиспускание.
Эффекты изобретения
Терапевтическое средство или профилактическое средство для лечения нарушения(й) накопления мочи в соответствии с настоящим изобретением обладает заметным терапевтическим действием на нарушение(я) накопления мочи, гарантируя при этом безопасность благодаря тому факту, что маловероятно, что агент вызывает побочные эффекты из-за антихолинергического действия. Более того, так как средство также обладает обезболивающим действием, ожидают что, будет подвергаться лечению боль, если нарушение(я) накопления мочи сопровождается болью.
Краткое описание чертежей
ФИГ. 1 показывает результат внутривенного введения циклогексанового производного настоящего изобретения в экспериментальной модели поллакиурии, индуцированной моногидратом циклофосфамида (далее «циклофосфамид») у крыс.
Способ осуществления изобретения
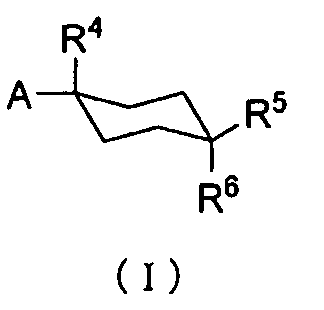
Терапевтическое средство или профилактическое средство для лечения нарушения(й) накопления мочи настоящего изобретения отличается содержанием в качестве эффективного ингредиента циклогексанового производного формулы (I):
 ,
,
где А представляет собой заместитель, представленный приведенными ниже формулами (IIa) или (IIb):
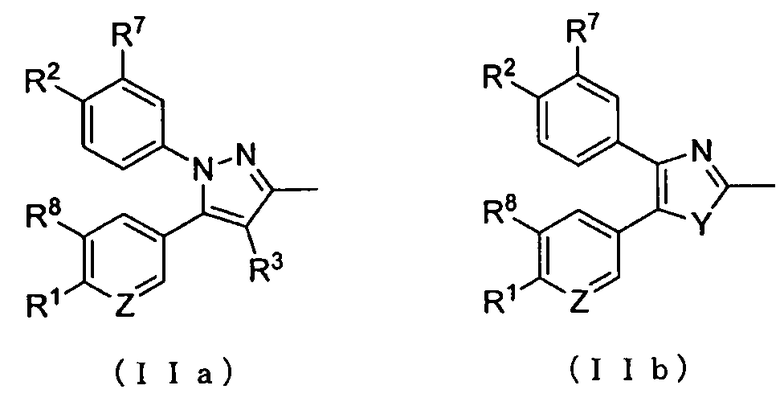 ;
;
R1 и R2 каждый независимо друг от друга представляет собой атом водорода, атом хлора, C1-C3-галогеналкильную группу, C1-C4-алкильную группу или C1-C4-алкокси-группу; R3 представляет собой атом водорода или атом хлора; R4 представляет собой атом фтора, гидроксиметильную группу или гидроксильную группу; R5 и R6 каждый независимо друг от друга представляет собой атом водорода, атом фтора, C1-C3-галогеналкильную группу, карбоксильную группу, метоксикарбонильную группу, этоксикарбонильную группу, C1-C4-алкокси-группу, гидроксильную группу или C2-C5-алкилкарбонилокси-группу; или R5 и R6 необязательно вместе могут образовывать оксо-группу; R7 и R8 каждый независимо друг от друга представляет собой атом водорода или атом фтора; Y представляет собой атом кислорода или атом серы; и Z представляет собой атом азота или метиновую группу,
или его фармацевтически приемлемой соли или пролекарства.
Определение «С1-С4-алкильная группа» означает линейную, разветвленную или циклическую алкильную группу, содержащую от 1 до 4 атомов углерода, и ее примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, циклопропильную группу, циклопропилметильную группу, н-бутильную группу, втор-бутильную группу и трет-бутильную группу.
Определение «С1-С4-алкокси-группа» означает линейную, разветвленную или циклическую алкилокси-группу, содержащую от 1 до 4 атомов углерода, и ее примеры включают метокси-группу, этокси-группу, н-пропилокси-группу, изопропилокси-группу, циклопропилокси-группу, н-бутокси-группу, втор-бутокси-группу и трет-бутокси-группу.
Определение «С1-С3-галогеналкильная группа» означает линейную алкильную группу, содержащую от 1 до 3 атомов углерода, где часть или все атомы водорода группы заменены атомом(ами) галогена (атом галогена означает атом фтора, атом хлора, атом брома или атом йода), и ее примеры включают монохлорметильную группу, монофторметильную группу, дифтор-метильную группу, трифторметильную группу, трихлорметильную группу и пентафторэтильную группу.
Примеры «С2-С5-алкилкарбонилокси-группы» включают ацетилокси-группу, этаноилокси-группу, пропаноилокси-группу, изопропаноилокси-группу, бутаноилокси-группу, изобутаноилокси-группу и пивалоилокси-группу.
В формуле (I) А предпочтительно представляет собой формулу (IIa); Y предпочтительно представляет собой атом кислорода; и Z предпочтительно представляет собой метиновую группу.
Заместитель R1 предпочтительно представляет собой атом водорода, атом хлора, трифторметильную группу, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, метокси-группу, этокси-группу, н-пропилокси-группу или изопропилокси-группу, более предпочтительно трифтометильную группу, метильную группу или метокси-группу, и еще более предпочтительно метильную группу.
Заместитель R2 предпочтительно представляет собой атом водорода, атом хлора, трифторметильную группу, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, метокси-группу, этокси-группу, н-пропилокси-группу или изопропилокси-группу, и более предпочтительно метокси-группу.
Заместитель R3 предпочтительно представляет собой атом водорода; и R4 предпочтительно представляет собой гидроксиметильную группу или гидроксильную группу, и более предпочтительно гидроксильную группу.
Заместитель R5 предпочтительно представляет собой атом водорода, атом фтора, трифторметильную группу, карбоксильную группу, метокси-группу, этокси-группу, н-пропилокси-группу, изопропилокси-группу, гидроксильную группу, ацетилокси-группу, пропаноилокси-группу, бутаноилокси-группу или изобутаноилокси-группу, более предпочтительно атом водорода, гидроксильную группу или карбоксильную группу, и еще более предпочтительно гидроксильную группу.
Заместитель R6 предпочтительно представляет собой атом водорода, атом фтора, трифторметильную группу, карбоксильную группу, метокси-группу, этокси-группу, н-пропилокси-группу, изопропилокси-группу, гидроксильную группу, ацетилокси-группу, пропаноилокси-группу, бутаноилокси-группу или изобутаноилокси-группу, более предпочтительно атом водорода или гидроксильную группу, и еще более предпочтительно атом водорода. Заместители R5 и R6 необязательно вместе могут образовывать оксо-группу.
Заместители R7 и R8 каждый предпочтительно представляет собой атом водорода.
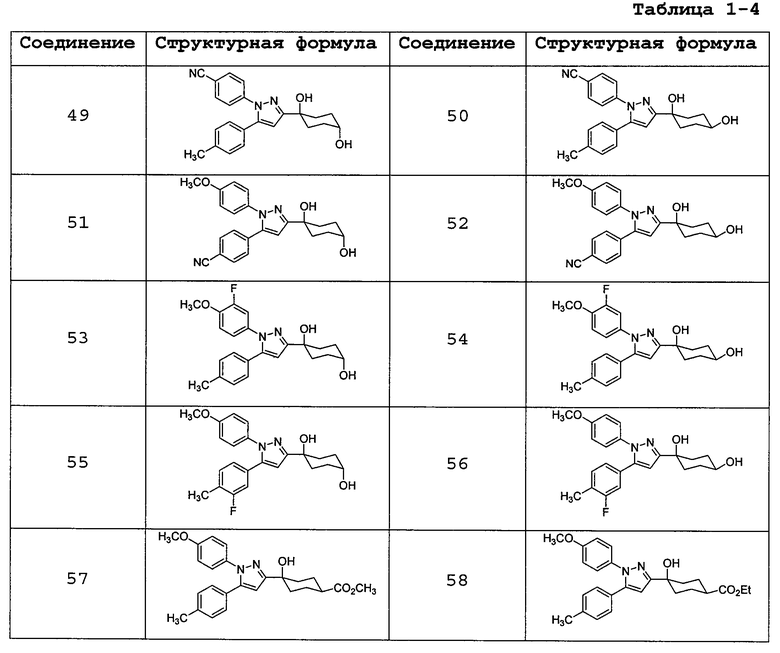
Среди соединений, представленных формулой (I), или их фармацевтически приемлемых солей (далее называемых «соединение (I)»), предпочтительные конкретные примеры представлены в таблице 1, но настоящее изобретение не ограничено ими.
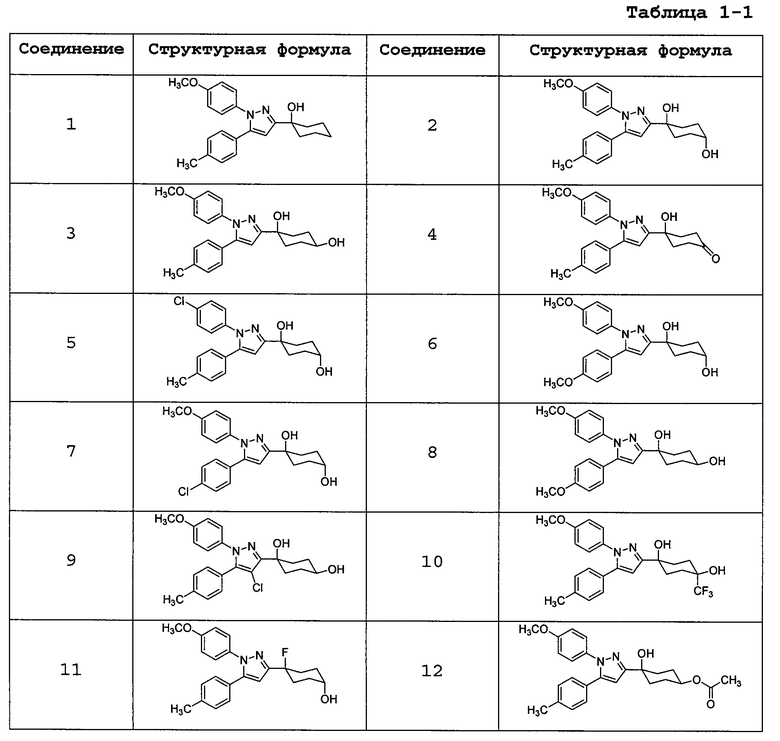
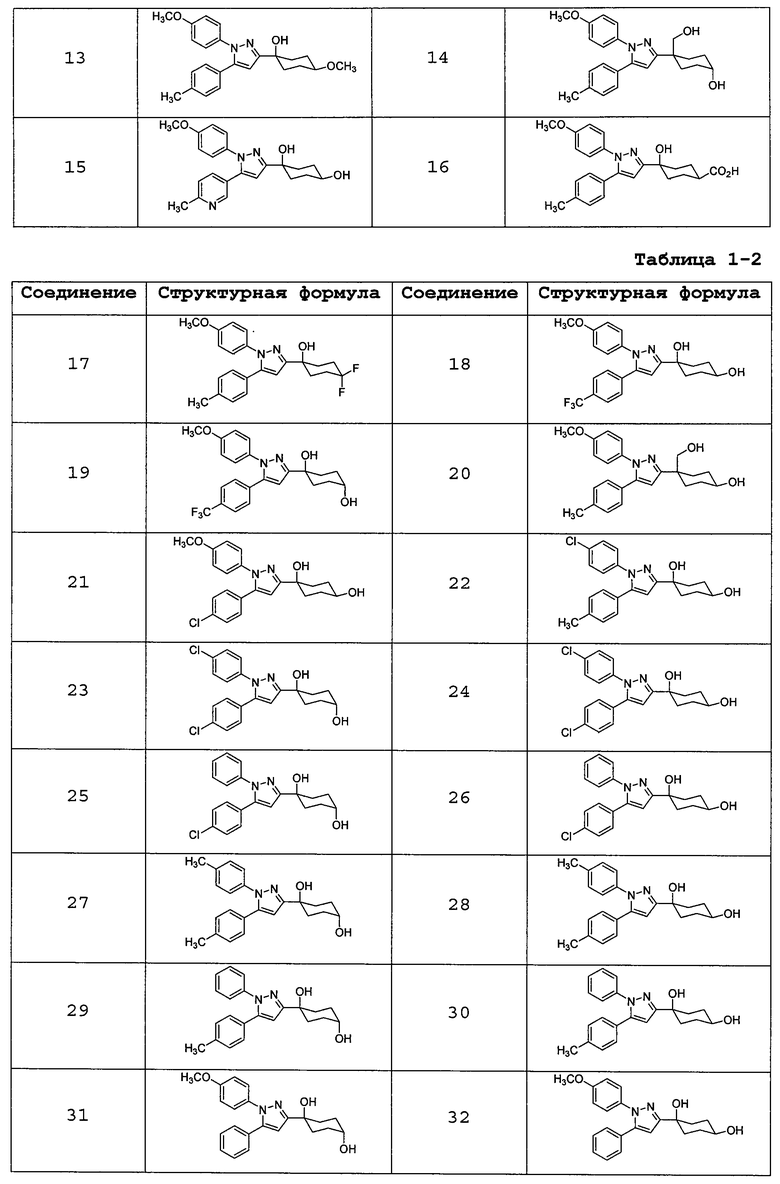
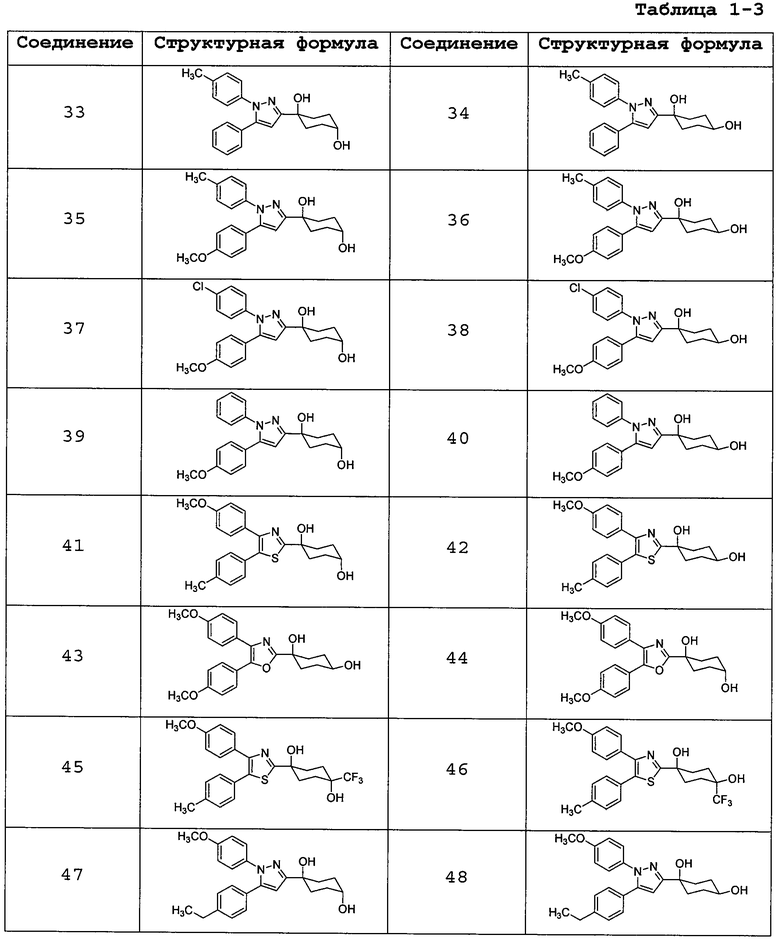
В случаях, где соединение (I) имеет асимметричный(е) атом(ы) углерода, все его энантиомеры и смеси находятся в пределах объема настоящего изобретения.
В случаях, где соединение (I) имеет стереоизомер(ы), все его стереоизомеры и смеси также находятся в пределах объема настоящего изобретения.
Примеры «фармацевтически приемлемой соли» включают соли неорганических кислот, такие как солянокислая соль, сернокислая соль, фосфорнокислая соль и соль бромисто-водородной кислоты; соли органических кислот, такие как щавелевокислая соль, малоновокислая соль, лимоннокислая соль, фумаровокислая соль, молочнокислая соль, яблочнокислая соль, янтарнокислая соль, виннокислая соль, уксуснокислая соль, трифторуксуснокислая соль, малеиновокислая соль, глюконовокислая соль, бензойнокислая соль, аскорбиновокислая соль, соль метансульфоновой кислоты, соль п-толуолсульфоновой кислоты и соль коричной кислоты; соли неорганических оснований, такие как натриевая соль, калиевая соль, кальциевая соль, магниевая соль и аммонийная соль; и соли органических оснований, такие как метиламинная соль, диэтиламинная соль, триметиламинная соль, триэтиламинная соль, пиридиниевая соль, триэтаноламинная соль, этилендиаминная соль и гуанидиновая соль. Кроме того, соединение (I) может образовывать гидрат или сольват, и также в соединение (I) входят кристаллические полиморфы.
Соединение (I) может быть синтезировано, например, в соответствии со способами получения, описанными ниже. Символы в каждой реакционной формуле имеют такие же значения, что и определенные выше, если не указано другое значение.
В случаях, где исходное соединение имеет карбоксильную группу или гидроксильную группу, защитная группа, как это обычно используется, может быть введена в соединение, и защитная группа может быть снята, как это необходимо, после проведения реакции. Примеры защитной группы для гидроксильной группы включают С1-С4-алкильную группу, фенильную группу, тритильную группу, С1-С4-аралкильную группу (например, бензильную группу), ацильную группу (например, формильную группу, ацетильную группу или бензоильную группу), С7-С10-аралкилкарбонильную группу (например, бензилкарбонильную группу) и замещенную силильную группу (например, триметил-силильную группу, триэтилсилильную группу или трет-бутил-диметилсилильную группу). Примеры защитной группы для карбоксильной группы включают С1-С4-алкильную группу.
Способы снятия защитной группы меняются в зависимости от типа защитной группы, и снятие может быть проведено в соответствии со способом, который описан в документе предшествующего уровня техники (Protective groups in organic synthesis, Wiley-Interscience), или способом, аналогичным такому способу.
В описанных ниже способах получения в качестве исходного соединения может быть использована соль. Примеры солей включают те же соли, что и фармацевтически приемлемые соли, описанные выше.
Соединение (I), полученное способами получения, описанными ниже, может быть выделено и очищено в соответствии с известными средствами, и примеры известных средств включают экстракцию растворителем, перекристаллизацию и хроматографию.
В случаях, где соединение (I) имеет оптические изомеры, стереоизомеры, региоизомеры и/или ротамеры, каждый из них может быть получен в виде единственного соединения известным способом синтеза и известным методом разделения.
Способ получения 1: Способ получения соединения (Ic), соединения (Id), соединения (Ie) и соединения (If)
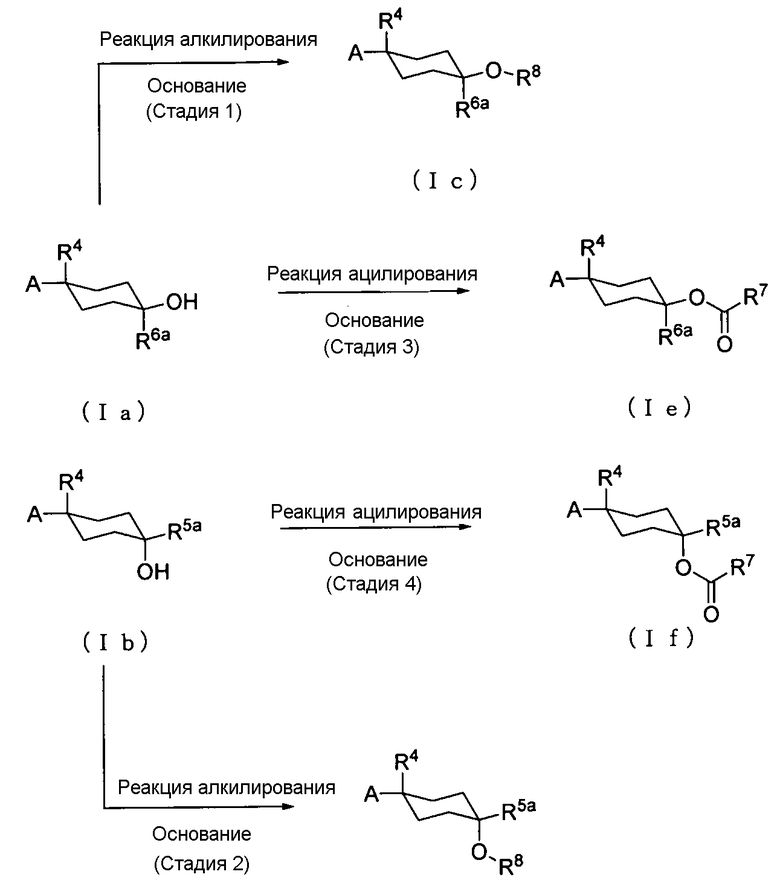
где заместители R5a и R6a каждый независимо друг от друга представляет собой атом водорода, С1-С3-галогеналкильную группу, карбоксильную группу или подобную группу; заместители R7 и R8 каждый независимо друг от друга представляет собой С1-С4-алкильную группу или подобную группу; а другие символы имеют те же значения, что и определенные выше.
Соединение (Ic) может быть получено алкилированием соединения (Ia) и соединение (Id) может быть получено алкилированием соединения (Ib). Соединение (Ie) может быть получено ацилированием соединения (Ia) и соединение (If) может быть получено ацилированием соединения (Ib).
Стадия 1 и стадия 2
Реакцию алкилирования соединения (Ia) или соединения (Ib) обычно проводят путем введения в реакцию соединения (Ia) или соединения (Ib) с алкилгалогенидом в растворителе в присутствии основания. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и диметиловый эфир этиленгликоля; ацетон, ацетонитрил и N,N-диметилформамид. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают гидрокарбонаты щелочного металла, такие как гидрокарбонат натрия и гидрокарбонат калия; карбонаты щелочного металла, такие как карбонат калия и карбонат цезия; амины, такие как триэтиламин, диизопропилэтиламин и пиридин; трет-бутоксид калия; и гидрид натрия.
Количество используемого основания предпочтительно составляет от 0,5 до 6 молей, более предпочтительно от 0,8 до 3 молей из расчета на 1 моль соединения (Ia) или соединения (Ib).
Количество используемого алкилгалогенида предпочтительно составляет от 0,5 до 5 молей, более предпочтительно от 0,8 до 2 молей из расчета на 1 моль соединения (Ia) или соединения (Ib).
Реакционная температура процесса алкилирования предпочтительно составляет от -78 до 200°С, более предпочтительно от -20 до 100°С.
Реакционное время процесса алкилирования меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 78 часов, более предпочтительно от 30 минут до 48 часов.
Стадия 3 и стадия 4
Реакцию ацилирования соединения (Ia) или соединения (Ib) обычно проводят путем введения в реакцию соединения (Ia) или соединения (Ib) с ацилирующим агентом, таким как галогенангидрид или ангидрид кислоты, в растворителе в присутствии основания. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; и простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают пиридин, триэтиламин, диизопропилэтиламин, N,N-диметиламинопиридин и подобные соединения.
Количество используемого галогенангидрида или ангидрида кислоты предпочтительно составляет от 0,5 до 3 молей, более предпочтительно от 0,8 до 1,5 молей из расчета на 1 моль соединения (Ia) или соединения (Ib).
Количество используемого основания предпочтительно составляет от 0,1 до 6 молей, более предпочтительно от 0,8 до 3 молей из расчета на 1 моль соединения (Ia) или соединения (Ib).
Реакционная температура процесса ацилирования предпочтительно составляет от -20 до 150°С, более предпочтительно от 0 до 100°С.
Реакционное время процесса ацилирования меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 2: Способ получения соединения (Ih)

где заместители R5a и R6a каждый независимо друг от друга представляет собой атом водорода, атом фтора, С1-С3-галоген-алкильную группу, С1-С4-алкокси-группу, С2-С5-алкилкарбонилокси-группу или подобную группу; а другие символы имеют те же значения, что и определенные выше.
Соединение (Ih) может быть получено фторированием соединения (Ig).
Стадия 5
Реакцию фторирования соединения (Ig) обычно проводят путем введения в реакцию соединения (Ig) с фторирующим агентом в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры фторирующего агента включают алкиламиносера-трифториды, такие как (диметиламино)сератрифторид (DAST) и бис(2-метоксиэтил)аминосератрифторид.
Количество используемого фторирующего агента предпочтительно составляет от 0,25 до 20 молей, более предпочтительно от 0,5 до 4 молей из расчета на 1 моль соединения (Ig).
Реакционная температура процесса фторирования предпочтительно составляет от -20 до 150°С, более предпочтительно от 0 до 100°С.
Реакционное время процесса фторирования меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 3: Способ получения соединения (Ij)
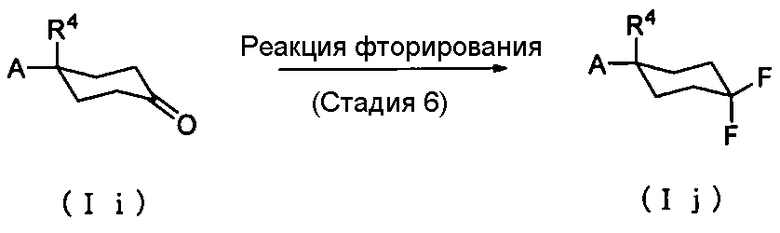
где символы имеют те же значения, что и определенные выше.
Соединение (Ij) может быть получено фторированием соединения (Ii).
Стадия 6
Реакцию фторирования соединения (Ii) обычно проводят путем введения в реакцию соединения (Ii) с фторирующим агентом в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил. С другой стороны, в качестве растворителя может быть использован их смешанный растворитель.
Примеры фторирующего агента включают алкиламиносера-трифториды, такие как (диметиламино)сератрифторид (DAST) и бис(2-метоксиэтил)аминосератрифторид.
Количество используемого фторирующего агента предпочтительно составляет от 0,25 до 20 молей, более предпочтительно от 0,5 до 4 молей из расчета на 1 моль соединения (Ii).
Реакционная температура процесса фторирования предпочтительно составляет от -20 до 150°С, более предпочтительно от 0 до 100°С.
Реакционное время процесса фторирования меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 4: Способ получения соединения (Ik) и соединения (Il)
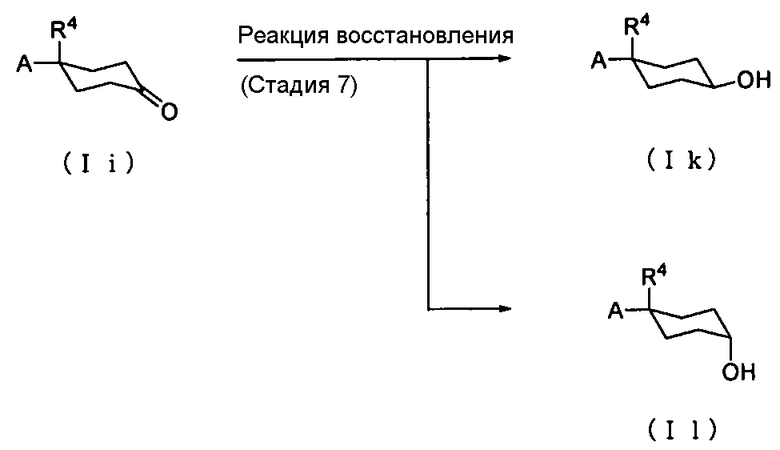 .
.
где символы имеют те же значения, что и определенные выше.
Соединение (Ik) и соединение (Il) могут быть получены восстановлением соединения (Ii).
Стадия 7
Реакцию восстановления соединения (Ii) обычно проводят путем введения в реакцию соединения (Ii) с восстанавливающим агентом в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир; и спирты, такие как метанол, этанол и изопропиловый спирт. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры восстанавливающего агента включают боргидрид натрия, боргидрид лития, гидрид диизобутилалюминия, алюминийгидрид лития, триэтилгидрид лития, бис(2-метоксиэтокси)алюминийгидрид натрия и борановые комплексы.
Количество используемого восстанавливающего агента предпочтительно составляет от 0,25 до 100 молей, более предпочтительно от 0,5 до 20 молей из расчета на 1 моль соединения (Ii).
Реакционная температура процесса восстановления предпочтительно составляет от -78 до 150°С, более предпочтительно от -78 до 100°С.
Реакционное время процесса восстановления меняется в зависимости от реакционных условий, таких как температура реакции, количество восстанавливающего агента и т.д., и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 24 часов.
Способ получения 5: Способ получения соединения (Im) и соединения (In)
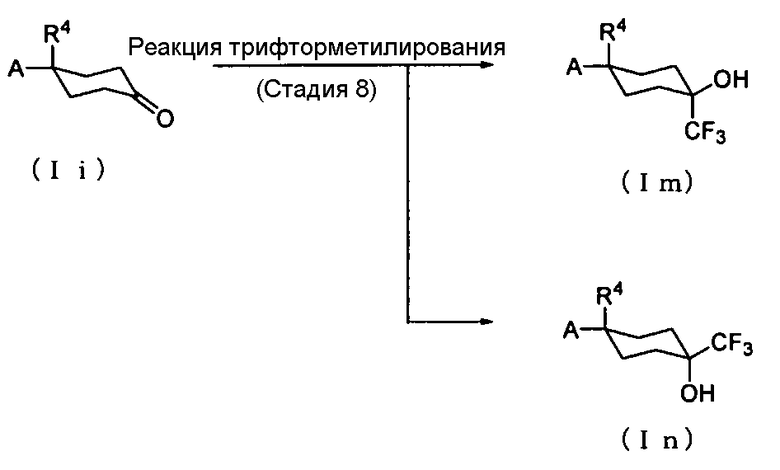
где символы имеют те же значения, что и определенные выше.
Соединение (Im) и соединение (In) могут быть получены трифторметилированием соединения (Ii).
Стадия 8
Примеры трифторметилирующего агента включают кремнийорганические соединения, такие как (трифторметил)-триметилсилан. Реакция трифторметилирования с использованием кремнийорганического соединения может быть проведена в соответствии со способом, описанным в документе предшествующего уровня техники (Journal of the American Chemical Society, 1989, Vol. 39, pp. 393-395), или аналогичным способом.
Способ получения 6: Способ получения соединения (Io)
 .
.
где символы имеют те же значения, что и определенные выше.
Соединение (SI) может быть получено, если дать возможность реагенту Виттига (LI) подействовать на соединение (Ii), а затем гидролизовать полученное соединение. В качестве реагента Виттига можно использовать коммерчески доступные соединения, или реагент может быть синтезирован в соответствии со способом, очевидным для специалиста в данной области техники. Соединение (Io) может быть получено окислением соединения (SI).
Стадия 9
Реакцию Виттига соединения (Ii) обычно проводят путем введения в реакцию соединения (Ii) с реагентом Виттига в растворителе в присутствии основания. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают диизопропиламид лития, трет-бутоксид калия, гидрид натрия, фениллитий и трет-бутиллитий.
Количество используемого основания предпочтительно составляет от 0,5 до 3 молей, более предпочтительно от 0,8 до 2 молей из расчета на 1 моль соединения (Ii).
Количество используемого соединения (LI) предпочтительно составляет от 0,5 до 3 молей, более предпочтительно от 0,8 до 2 молей из расчета на 1 моль соединения (Ii).
Температура реакции Виттига предпочтительно составляет от -78 до 100°С, более предпочтительно от -78 до 50°С.
Время реакции Виттига меняется в зависимости от реакционных условий, таких как температура реакции, и предпочтительно составляет от 5 минут до 48 часов, более предпочтительно от 30 минут до 24 часов.
Реакцию гидролиза для получения соединения (SI) проводят в соответствующим образом выбранном растворителе, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и диметиловый эфир этиленгликоля; спирты, такие как метанол, этанол и трет-бутанол; ацетонитрил; и воду. В качестве растворителя также может быть использован их смешанный растворитель.
Концентрация кислоты, которую используют в реакции гидролиза, предпочтительно составляет от 0,1 до 12 М, и количество используемой кислоты предпочтительно составляет от 1 моля до избыточного количества из расчета на 1 моль соединения (Ii).
Примерами кислоты, которую используют в реакции гидролиза, являются неорганические кислоты, такие как соляная кислота и серная кислота; и органические кислоты, такие как уксусная кислота.
Реакционная температура процесса гидролиза предпочтительно составляет от -20 до 200°С, более предпочтительно от 0 до 100°С.
Реакционное время процесса гидролиза меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 48 часов, более предпочтительно от 30 минут до 24 часов.
Стадия 10
Примеры окисляющего агента, который используют в реакции окисления соединения (SI), включают (оксид хрома(VI))-(уксусная кислота), реагент Джонса, хлорит натрия и подобные агенты. Реакция окисления может быть проведена в соответствии со способом, очевидным для специалиста в данной области техники.
Способ получения 7: Способ получения соединения (Ii)
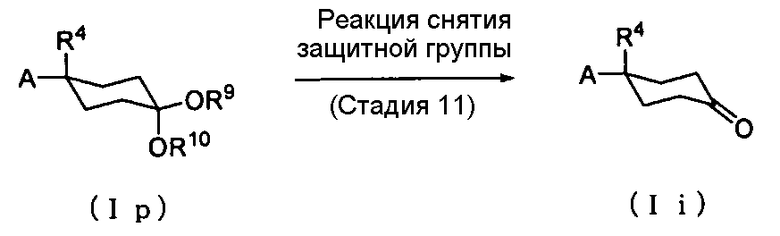
где заместители R9 и R10 каждый независимо друг от друга представляет собой метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу или трет-бутильную группу или подобные группы; или заместители R9 и R10 могут вместе образовывать этиленовую группу (-СН2-СН2-), пропиленовую группу (-СН2-СН2-СН2-) или подобные группы; а другие символы имеют те же значения, что и определенные выше.
Соединение (Ii) может быть получено путем снятия защитной группы соединения (Ip).
Стадия 11
Реакция снятия защитной группы соединения (Ip) может быть проведена в соответствии со способом, который описан в документе предшествующего уровня техники (Protective groups in organic synthesis, Wiley-Interscience), или аналогичным способом.
Способ получения 8: Способ получения соединения (IIIb)
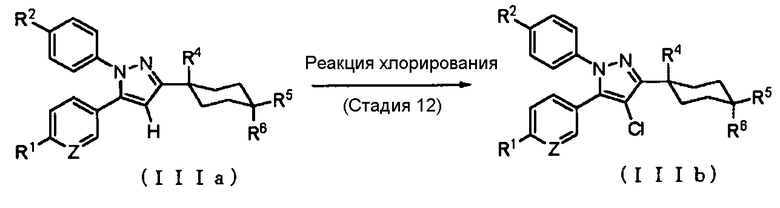
где символы имеют те же значения, что и определенные выше.
Соединение (IIIb) может быть получено путем хлорирования соединения (IIIa).
Стадия 12
Реакцию хлорирования соединения (IIIa) обычно проводят путем введения в реакцию соединения (IIIa) с хлорирующим агентом в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; ацетонитрил; и этилацетат. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры хлорирующего агента включают N-хлорсукцинимид (NCS).
Количество используемого хлорирующего агента предпочтительно составляет от 0,5 до 2 молей, более предпочтительно от 0,8 до 1,2 молей из расчета на 1 моль соединения (IIIa).
Реакционная температура процесса хлорирования предпочтительно составляет от 0 до 200°С, более предпочтительно от 0 до 120°С.
Реакционное время процесса хлорирования меняется в зависимости от реакционных условий, таких как температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 9: Способ получения соединения (IIIa)
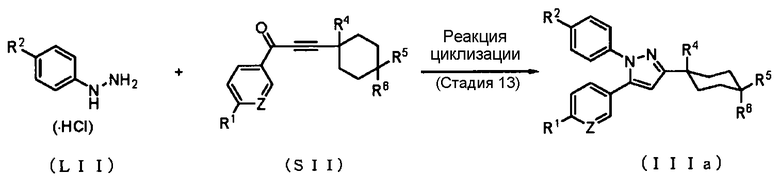
где символы имеют те же значения, что и определенные выше.
Соединение (IIIa) может быть получено циклизацией соединения (LII) с помощью соединения (SII). В качестве соединения (LII) можно использовать коммерчески доступное соединение, или это соединение может быть синтезировано способом, очевидным для специалиста в данной области техники.
Стадия 13
Реакцию циклизации соединения (LII) с помощью соединения (SII) обычно проводят в соответствующим образом выбранном растворителе, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают спирты, такие как метанол, этанол и изопропиловый спирт; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; бензол; толуол; уксусную кислоту и воду. В качестве растворителя также может быть использован их смешанный растворитель.
Количество используемого соединения (LII) предпочтительно составляет от 0,5 до 1,5 молей, более предпочтительно от 0,8 до 1,2 молей из расчета на 1 моль соединения (SII).
В реакции циклизации может быть использован катализатор, и примеры катализатора включают органические основания, такие как триэтиламин и пиридин; неорганические кислоты, такие как соляная кислота и серная кислота; и органические кислоты, такие как уксусная кислота.
Количество используемого катализатора предпочтительно составляет от 0,1 до 3 молей из расчета на 1 моль соединения (SII).
Реакционная температура процесса циклизации предпочтительно составляет от 0 до 200°С, более предпочтительно от 0 до 120°С.
Реакционное время процесса циклизации меняется в зависимости от реакционных условий, таких как температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 10: Способ получения соединения (IV)
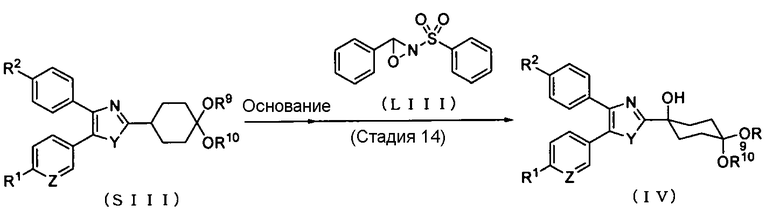
где символы имеют те же значения, что и определенные выше.
Соединение (IV) может быть получено путем снятия защитной группы и окисления соединения (SIII). Реакция окисления может быть проведена в соответствии со способом, описанным в документе предшествующего уровня техники (Tetrahedron, 1989, Vol. 45, pp. 5703-5742), или аналогичным способом.
Стадия 14
Реакцию снятия защитной группы и реакцию окисления соединения (SIII) обычно проводят путем введения в реакцию соединения (SIII) с основанием и окисляющим агентом в безводном растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакции. Примеры растворителя, который не ингибирует реакции, включают углеводороды, такие как октан, гексан и гептан; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают бутиллитии, такие как н-бутил-литий, втор-бутиллитий и трет-бутиллитий.
Количество используемого основания предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (SIII).
Количество используемого соединения (LIII) предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (SIII).
Примеры окисляющего агента, который используют в реакции окисления, включают 3-фенил-2-(фенилсульфонил)-1,2-оксазиридин.
Реакционная температура процесса снятия защитной группы и процесса окисления предпочтительно составляет от -78 до 150°С, более предпочтительно от 0 до 50°С.
Реакционное время процесса снятия защитной группы и процесса окисления меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 11: Способ получения промежуточного соединения (VI)
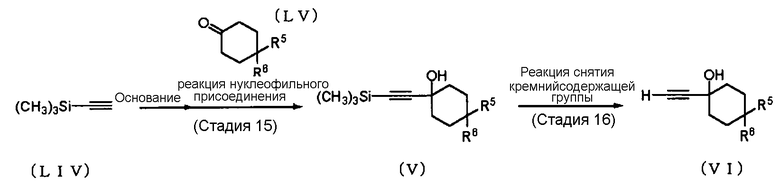
где символы имеют те же значения, что и определенные выше.
Соединение (VI) может быть получено сольволизом соединения (V), которое получено введением в реакцию соединения (LIV) и соединения (LV). В качестве соединения (LIV) и соединения (LV) можно использовать коммерчески доступные соединения, или эти соединения могут быть синтезированы в соответствии со способами, очевидными для специалиста в данной области техники.
Стадия 15
Реакцию между соединением (LIV) и соединением (LV) обычно проводят в безводном растворителе в присутствии основания; и в качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают алкиллитии, такие как метиллитий и н-бутиллитий; и соли диалкиламинов, такие как диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (LIV).
Количество используемого соединения (LV) предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (LIV).
Реакционная температура процесса между соединением (LIV) и соединением (LV) предпочтительно составляет от -78 до 150°С, более предпочтительно от -78 до 100°С.
Реакционное время для процесса между соединением (LIV) и соединением (LV) меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Стадия 16
Реакцию сольволиза обычно проводят в растворителе в присутствии основания; и в качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают спирты, такие как метанол и этанол; и воду. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают карбонат калия, карбонат натрия, гидроксид калия и гидроксид натрия.
Количество используемого основания предпочтительно составляет от 0,5 до 10 молей, более предпочтительно от 0,8 до 3 молей из расчета на 1 моль соединения (V).
Реакционная температура процесса сольволиза предпочтительно составляет от -20 до 150°С, более предпочтительно от 0 до 100°С.
Реакционное время процесса сольволиза меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 12: Способ получения промежуточного соединения (SIIa)
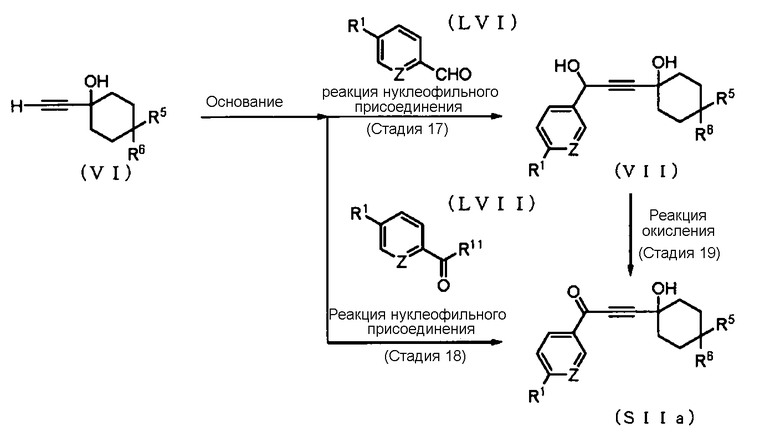
где заместитель R11 представляет собой атом хлора, имидазолильную группу, N-метокси-N-метиламино-группу, алкокси-группу, такую как метокси-группа или этокси-группа или подобные группы; а другие символы имеют те же значения, что и определенные выше.
Соединение (SIIa) может быть получено окислением соединения (VII), которое получено взаимодействием соединения (VI) и соединения (LVI). Соединение (SIIa) также может быть получено взаимодействием соединения (VI) и соединения (LVII). В качестве соединения (LVI) и соединения (LVII) можно использовать коммерчески доступные соединения, или эти соединения могут быть синтезированы в соответствии со способом, очевидным для специалиста в данной области техники.
Стадия 17 или стадия 18
Реакцию между соединением (VI) и соединением (LVI) или соединением (LVII) обычно проводят в безводном растворителе в присутствии основания; и в качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают алкиллитии, такие как метиллитий и н-бутиллитий; и соли диалкиламинов, такие как диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (VI).
Количество соединения (LVI), используемого на стадии 17, или количество соединения (LVII), используемого на стадии 18, предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (VI).
Реакционная температура для процесса между соединением (VI) и соединением (LVI) или соединением (LVII) составляет от -78 до 150°С, более предпочтительно от 0 до 50°С.
Реакционное время для процесса между соединением (VI) и соединением (LVI) или соединением (LVII) меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Стадия 19
Реакцию окисления соединения (VII) обычно проводят путем введения в реакцию соединения (VII) с окисляющим агентом в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил; трифторуксусную кислоту; пиридин; ацетон и подобные растворители. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры окисляющего агента включают коммерчески доступные реагенты, такие как диоксид марганца, (триоксид серы)-пиридин, активированный диметилсульфоксид и реагент Десс-Мартина.
Количество используемого окисляющего агента предпочтительно составляет от 0,5 до 3 молей, более предпочтительно от 0,8 до 2 молей из расчета на 1 моль соединения (VII).
Реакционная температура процесса окисления меняется в зависимости от типа окисляющего агента, и предпочтительно составляет от -78 до 100°С, более предпочтительно от -78 до 40°С.
Реакционное время процесса окисления меняется в зависимости от реакционных условий, таких как тип окисляющего агента, температура реакции и т.д., и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 1 минут до 24 часов.
Способ получения 13: Способ получения промежуточного соединения (IX)
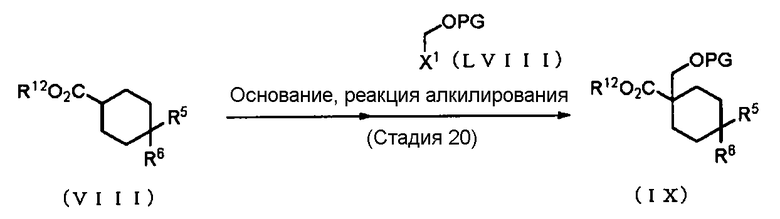
где Х1 представляет собой атом галогена, PG представляет собой защитную группу, такую как метил или бензил; R12 представляет собой алкокси-группу, такую как метокси-группа или этокси-группа, или подобные группы; а другие символы имеют те же значения, что и определенные выше.
Соединение (IX) может быть получено взаимодействием соединения (VIII) и соединения (LVIII). В качестве соединения (VIII) и соединения (LVIII) могут быть использованы коммерчески доступные соединения, или эти соединения могут быть получены в соответствии со способом, очевидным специалисту в данной области.
Стадия 20
Реакцию между соединением (VIII) и соединением (LVIII) обычно проводят в безводном растворителе в присутствии основания; и в качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания предпочтительно составляет от 0,8 до 4 молей, более предпочтительно от 0,9 до 3,5 молей из расчета на 1 моль соединения (VIII).
Количество используемого соединения (LVIII) предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (VIII).
Реакционная температура процесса между соединением (VIII) и соединением (LVIII) предпочтительно составляет от -78 до 150°С, более предпочтительно от 0 до 50°С.
Реакционное время процесса между соединением (VIII) и соединением (LVIII) меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 14: Способ получения промежуточного соединения (XI)
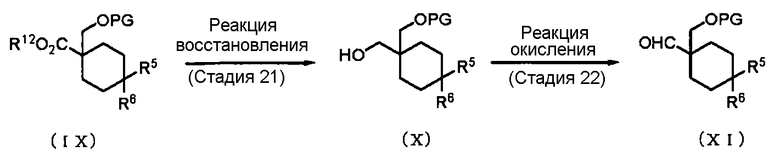
где символы имеют те же значения, что и определенные выше.
Соединение (XI) может быть получено окислением соединения (Х), которое получено восстановлением соединения (IX).
Стадия 21
Реакцию восстановления соединения (IX) обычно проводят путем введения в реакцию соединения (IX) с восстанавливающим агентом в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир; и спирты, такие как метанол, этанол и изопропиловый спирт. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры восстанавливающего агента включают боргидрид лития, гидрид диизобутилалюминия, алюминийгидрид лития, триэтилгидрид лития, бис(2-метоксиэтокси)алюминийгидрид натрия и борановые комплексы.
Количество используемого восстанавливающего агента предпочтительно составляет от 0,25 до 100 молей, более предпочтительно от 0,5 до 20 молей из расчета на 1 моль соединения (IX).
Реакционная температура процесса восстановления предпочтительно составляет от -78 до 150°С, более предпочтительно от -78 до 100°С.
Реакционное время процесса восстановления меняется в зависимости от реакционных условий, таких как температура реакции, количество восстанавливающего агента и т.д., и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 24 часов.
Стадия 22
Реакцию окисления соединения (Х) обычно проводят путем введения в реакцию соединения (Х) с окисляющим агентом в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают трифторуксусную кислоту; пиридин; ацетон; углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры окисляющего агента включают коммерчески доступные реагенты, такие как (триоксид серы)-пиридин, активированный диметилсульфоксид и реагент Десс-Мартина.
Количество используемого окисляющего агента предпочтительно составляет от 0,5 до 3 молей, более предпочтительно от 0,8 до 2 молей из расчета на 1 моль соединения (Х).
Реакционная температура процесса окисления меняется в зависимости от типа окисляющего агента, и предпочтительно составляет от -78 до 100°С, более предпочтительно от -78 до 40°С.
Реакционное время процесса окисления меняется в зависимости от реакционных условий, таких как тип окисляющего агента, температура реакции и т.д., и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 1 минут до 24 часов.
Способ получения 15: Способ получения промежуточного соединения (XII)
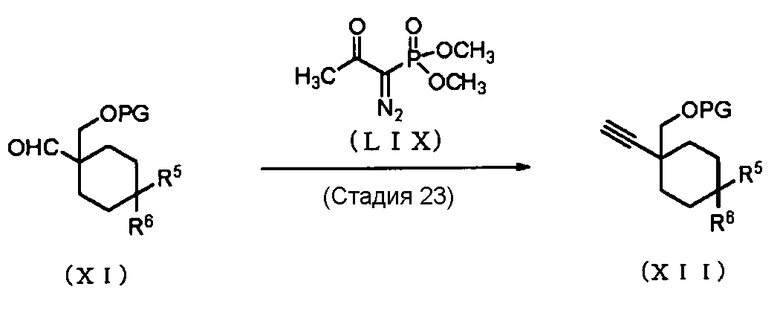
где символы имеют те же значения, что и определенные выше.
Стадия 23
Соединение (XII) может быть получено путем превращением соединения (XI) в алкин. Примеры реагента, который может быть использован в реакции превращения, включают диметил-1-диазо-2-оксопропилфосфонат. Реакция превращения может быть проведена в соответствии со способом, описанным в документе предшествующего уровня техники (Tetrahedron Letters, 2006, Vol. 47, pp. 1729-1731), или аналогичным способом.
Способ получения 16: Способ получения промежуточного соединения (SIIb)
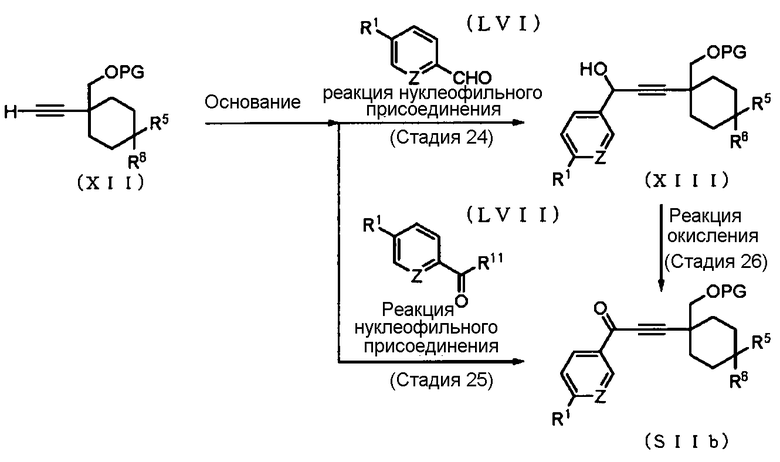
где символы имеют те же значения, что и определенные выше.
Соединение (SIIb) может быть получено окислением соединения (XIII), которое получено взаимодействием соединения (XII) и соединения (LVI). Соединение (SIIb) также может быть получено взаимодействием соединения (XII) и соединения (LVII). В качестве соединения (LVI) и соединения (LVII) можно использовать коммерчески доступные соединения, или эти соединения могут быть синтезированы в соответствии со способом, очевидным для специалиста в данной области техники.
Стадия 24 или стадия 25
Реакцию нуклеофильного присоединения соединения (XII) обычно проводят в безводном растворителе в присутствии основания; и в качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают алкиллитии, такие как метиллитий и н-бутиллитий; и соли диалкиламинов, такие как диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (XII).
Количество соединения (LVI) или соединения (LVII) предпочтительно составляет от 0,8 до 5 молей, более предпочтительно от 0,9 до 3 молей из расчета на 1 моль соединения (XII).
Реакционная температура процесса нуклеофильного присоединения предпочтительно составляет от -78 до 150°С, более предпочтительно от 0 до 50°С.
Реакционное время процесса нуклеофильного присоединения меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Стадия 26
Реакцию окисления соединения (XIII) обычно проводят путем введения в реакцию соединения (XIII) с окисляющим агентом в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают трифторуксусную кислоту; пиридин; ацетон; углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры окисляющего агента включают коммерчески доступные реагенты, такие как диоксид марганца, (триоксид серы)-пиридин, активированный диметилсульфоксид и реагент Десс-Мартина.
Количество используемого окисляющего агента предпочтительно составляет от 0,5 до 3 молей, более предпочтительно от 0,8 до 2 молей из расчета на 1 моль соединения (XIII).
Реакционная температура процесса окисления меняется в зависимости от типа окисляющего агента и предпочтительно составляет от -78 до 100°С, более предпочтительно от -78 до 40°С.
Реакционное время процесса окисления меняется в зависимости от реакционных условий, таких как тип окисляющего агента, температура реакции и т.д., и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 1 до 24 часов.
Способ получения 17: Способ получения промежуточного соединения (SIIIa)
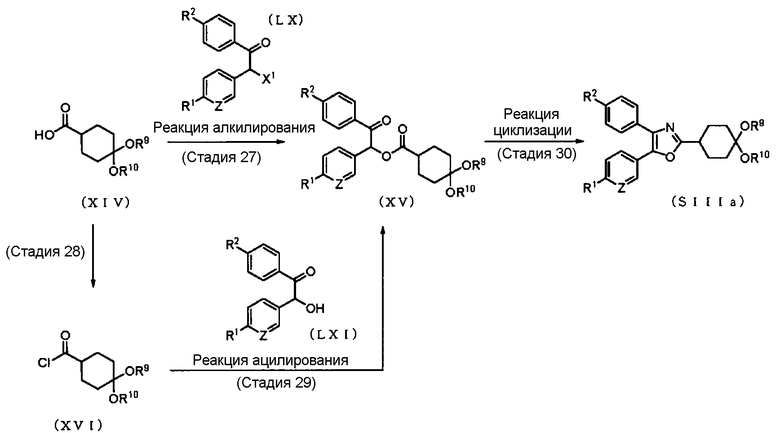
где символы имеют те же значения, что и определенные выше.
Соединение (SIIIa) может быть получено циклизацией соединения (XV), которое получено алкилированием соединения (XIV) с помощью соединения (LX), или ацилированием соединения (XVI), полученного из соединения (XIV), с помощью соединения (LXI). Соединение (XIV) и соединение (LX) могут быть синтезированы способами, которые очевидны для специалиста в данной области техники. В качестве соединения (LXI) можно использовать коммерчески доступное соединение, или это соединение может быть синтезировано способом, очевидным для специалиста в данной области техники.
Стадия 27
Реакцию алкилирования соединения (XIV) обычно проводят путем введения в реакцию соединения (XIV) с алкилгалогенидом в растворителе в присутствии основания; и в качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, диметиловый эфир этиленгликоля и диэтиловый эфир; ацетон; ацетонитрил и N,N-диметилформамид. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры основания включают гидрокарбонаты щелочного металла, такие как гидрокарбонат натрия и гидрокарбонат калия; карбонаты щелочного металла, такие как карбонат калия и карбонат цезия; амины, такие как триэтиламин, диизопропилэтиламин и пиридин; трет-бутоксид калия и гидрид натрия.
Количество используемого основания предпочтительно составляет от 0,5 до 6 молей, более предпочтительно от 0,8 до 3 молей из расчета на 1 моль соединения (XIV).
Количество используемого соединения (LX) предпочтительно составляет от 0,5 до 5 молей, более предпочтительно от 0,8 до 2 молей из расчета на 1 моль соединения (XIV).
Реакционная температура процесса алкилирования предпочтительно составляет от -78 до 200°С, более предпочтительно от -20 до 100°С.
Реакционное время процесса алкилирования меняется в зависимости от реакционных условий и предпочтительно составляет от 5 минут до 78 часов, более предпочтительно от 30 минут до 48 часов.
Стадия 28
Соединение (XVI) может быть синтезировано из соединения (XIV), например, в соответствии со способом, очевидным для специалиста в данной области техники, в котором используют тионилхлорид, оксалилхлорид или подобные соединения.
Стадия 29
Реакцию ацилирования соединения (LXI) соединением (XVI) обычно проводят в растворителе в присутствии основания; и в качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителей, которые не ингибируют реакцию, включают галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; и простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры оснований включают пиридин, триэтиламин, диизопропилэтиламин, N,N-диметиламинопиридин и подобные соединения.
Количество используемого основания предпочтительно составляет от 0,1 до 6 молей, более предпочтительно от 0,8 до 3 молей из расчета на 1 моль соединения (XVI).
Количество используемого соединения (LXI) предпочтительно составляет от 0,5 до 3 молей, более предпочтительно от 0,8 до 1,5 молей из расчета на 1 моль соединения (XVI).
Реакционная температура процесса ацилирования предпочтительно составляет от -20 до 150°С, более предпочтительно от 0 до 100°С.
Реакционное время процесса ацилирования меняется в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Стадия 30
Реакцию циклизации соединения (XV) обычно проводят в растворителе в присутствии аммонийной соли; и в качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают уксусную кислоту и муравьиную кислоту. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры аммонийной соли включают коммерчески доступные реагенты, такие как ацетат аммония, формиат аммония и карбонат аммония.
Количество используемой аммонийной соли предпочтительно составляет от 1 до 20 молей, более предпочтительно от 2 до 15 молей из расчета на 1 моль соединения (XV).
Реакционная температура процесса циклизации предпочтительно составляет от 0 до 200°С, более предпочтительно от 50 до 120°С.
Реакционное время процесса циклизации меняется в зависимости от условий реакции и предпочтительно составляет от 5 минут до 100 часов, более предпочтительно от 30 минут до 48 часов.
Способ получения 18: Способ получения промежуточного соединения (SIIIb)
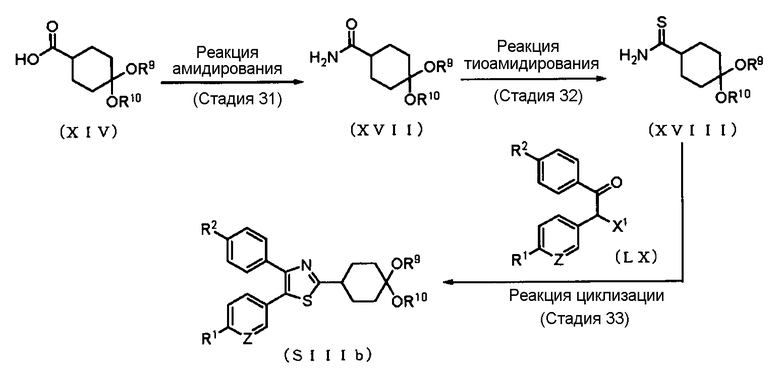
где символы имеют те же значения, что и определенные выше.
Соединение (SIIIb) может быть получено амидированием соединения (XIV) с получением соединения (XVII), затем его тиоамидированием с получением соединения (XVIII), и далее его циклизацией с помощью соединения (LX). Соединение (XIV) может быть синтезировано в соответствии со способом, который очевиден для специалиста в данной области техники. Кроме того, соединение (LX) может быть синтезировано в соответствии со способом, очевидным для специалиста в данной области техники.
Стадия 31
Реакцию амидирования соединения (XIV) обычно проводят путем получения смешанного ангидрида кислоты в растворителе в присутствии основания с использованием хлормуравьиного эфира или подобного соединения, и затем путем обеспечения возможности взаимодействия с ним водного аммиака. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и диметиловый эфир этиленгликоля; галогенированные углеводороды, такие как дихлорметан и хлороформ; и N,N-диметилформамид. В качестве растворителя также может быть использован их смешанный растворитель.
Примеры хлормуравьиного эфира включают метилхлорформиат, этилхлорформиат, изопропилхлорформиат и втор-бутилхлорформиат.
Количество используемого хлормуравьиного эфира предпочтительно составляет от 0,5 до 4 молей, более предпочтительно от 0,9 до 2 молей из расчета на 1 моль соединения (XIV).
Примеры основания включают неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия и карбонат цезия; и органические основания, такие как триэтиламин, диизопропилэтиламин и пиридин.
Количество используемого основания предпочтительно составляет от 0,5 до 5 молей, более предпочтительно от 0,9 до 2,5 молей из расчета на 1 моль соединения (XIV).
Что касается реакционной температуры процесса амидирования, то получение смешанного ангидрида предпочтительно проводят при температуре от -78 до 200°С, более предпочтительно от -20 до 100°С, а реакцию после добавления водного аммиака предпочтительно проводят при температуре от -78 до 200°С, более предпочтительно от -20 до 100°С.
Реакционное время процесса амидирования меняется в зависимости от реакционных условий; и получение смешанного ангидрида кислоты предпочтительно проводят от 5 минут до 48 часов, более предпочтительно от 30 минут до 24 часов; а реакцию после добавления водного аммиака предпочтительно проводят от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Стадия 32
Реакцию тиоамидирования соединения (XVII) обычно проводят путем введения в реакцию соединения (XVII) с коммерчески доступным реагентом, таким как реагент Лоуссона, пентасульфид фосфора или подобные реагенты, в растворителе. В качестве растворителя соответствующим образом выбирают растворитель, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают насыщенные углеводороды, такие как бензол и толуол; галогенированные растворители, такие как дихлорметан и хлороформ; и простые эфиры, такие как тетрагидрофуран и 1,4-диоксан. В качестве растворителя также может быть использован их смешанный растворитель.
Количество используемого реагента Лоуссона, пентасульфида фосфора или подобных реагентов предпочтительно составляет от 0,3 до 4 молей, более предпочтительно от 0,4 до 2 молей из расчета на 1 моль соединения (XVII).
Реакционная температура процесса тиоамидирования предпочтительно составляет от -20 до 200°С, более предпочтительно от 0 до 120°С.
Реакционное время процесса тиоамидирования меняется в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
Стадия 33
Реакцию циклизации соединения (XVIII) обычно проводят в соответствующим образом выбранном растворителе, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают спирты, такие как метанол и этанол; простые эфиры, такие как тетрагидрофуран и 1,4-диоксан; и ацетонитрил. В качестве растворителя также может быть использован их смешанный растворитель.
Количество используемого соединения (LX) предпочтительно составляет от 0,5 до 4 молей, более предпочтительно от 0,9 до 1,5 молей из расчета на 1 моль соединения (XVIII).
Реакционная температура процесса циклизации предпочтительно составляет от -20 до 200°С, более предпочтительно от 0 до 100°С.
Реакционное время процесса циклизации меняется в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно от 30 минут до 48 часов.
В случае, где соединение (I) получают в свободной форме, оно может быть превращено в желаемую соль в соответствии с известным способом или аналогичным ему способом. Напротив, в случае, где соединение (I) получают в виде соли, соль может быть превращена в свободную форму или другую желаемую соль в соответствии с известным способом или аналогичным ему способом.
Соединение (I) может быть использовано в форме пролекарства. Примеры такого пролекарства соединения (I) включают соединения, которые могут быть превращены в соединение (I) по реакции с ферментом, кислотами желудочного сока или подобными веществами при физиологических условиях в живом организме; то есть, соединения, которые будут превращаться в соединение (I) путем ферментативного окисления, восстановления, гидролиза или др., и соединения, имеющие структуру, в которой гидроксильная(ые) группа(ы) соединения (I) подвергнута(ы) ацилированию, алкилированию, фосфорилированию и/или борированию, и эти соединения будут превращаться в соединение (I) настоящего изобретения посредством гидролиза или подобных реакций с помощью кислот желудочного сока или подобных веществ. Предпочтительные конкретные примеры пролекарства соединения (I) представлены в таблице 2, но настоящее изобретение ими не ограничено.
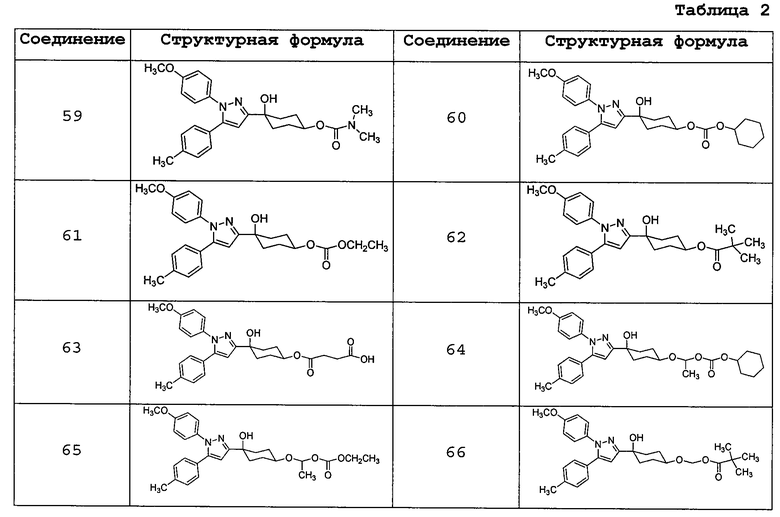
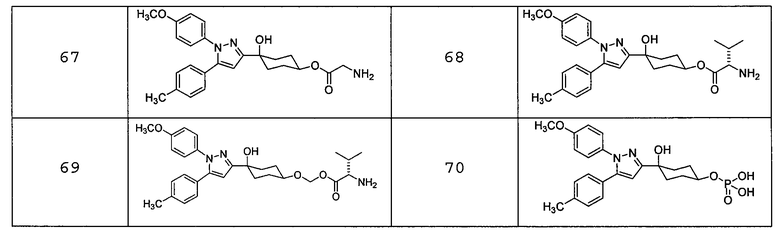
Пролекарство соединения (I) может быть синтезировано из соединения (I) настоящего изобретения в соответствии с известным способом. Пролекарство соединения (I) может представлять собой соединение, которое будет превращаться в соединение (I) при физиологических условиях, описанных в документах предшествующего уровня техники: («Iyakuhin no Kaihatsu (Development of Pharmaceuticals)», Hirokawa Shoten, 1990, Vol. 7, p. 163-198; и Prog. Med. 5, 1985, p. 2157-2161).
Фармацевтическое средство, содержащее соединение (I), проявляет прекрасное терапевтическое действие на нарушения накопления мочи также в случаях, когда его вводят млекопитающему, отличному от человека. Примерами млекопитающего, отличного от человека, являются мышь, крыса, хомяк, кролик, кошка, собака, крупный рогатый скот, овца, обезьяна и т.д.
В качестве способа введения соединения (I) соединение (I) может быть введено перорально или парентерально как оно есть или после смешения его с фармацевтически приемлемым(и) носителем(ями).
В случаях, где препарат, содержащий соединение (I), вводят перорально, примеры дозированных лекарственных форм включают таблетки (в том числе покрытые сахаром таблетки и покрытые пленкой таблетки), пилюли, гранулы, порошки, капсулы (в том числе мягкие капсулы и микрокапсулы), сиропы, эмульсии и суспензии. В случаях, где соединение вводят парентерально, примеры дозированных лекарственных форм включают растворы для инъекций, пропиточные средства, капли и свечи. Также полезно объединять препарат с подходящей основой (например, с полимером масляной кислоты, полимером гликолевой кислоты, сополимером (масляная кислота)-(гликолевая кислота), смесью полимера масляной кислоты и полимера гликолевой кислоты или полиглицериновым эфиром жирной кислоты) с получением препарата с постепенным высвобождением.
Получение препарата, который включает соединение (I) и находится в упомянутой выше дозированной лекарственной форме, может быть осуществлено известным способом получения, обычно используемым в области рецептурирования фармацевтических средств. В этом случае препарат может быть произведен так, чтобы в нем находились наполнитель, связующее вещество, смазывающее вещество, диспергирующий агент, подсластитель, поверхностно-активное вещество, суспендирующий агент, эмульгатор и/или подобные компоненты, которые обычно используют в области рецептурирования фармацевтических средств, если это требуется.
Получение таблетки, содержащей соединение (I), может быть проведено так, чтобы в ней находились наполнитель, связующее вещество, диспергирующий агент, смазывающее вещество и/или подобные компоненты; и получение пилюли или гранулы может быть проведено так, чтобы в них находились наполнитель, связующее вещество, диспергирующий агент и/или подобные компоненты. Получение порошка или капсулы может быть проведено так, чтобы в них находился наполнитель и/или подобный компонент; получение сиропа может быть проведено так, чтобы в нем находился подсластитель и/или подобный компонент; и получение эмульсии или суспензии может быть проведено так, чтобы в них находились поверхностно-активное вещество, суспендирующий агент, эмульгатор и/или подобный компонент.
Примерами наполнителя являются лактоза, глюкоза, крахмал, сахароза, микрокристаллическая целлюлоза, порошкообразная солодка, маннит, гидрокарбонат натрия, фосфат кальция и сульфат кальция.
Примерами связующего вещества являются раствор крахмальной пасты, раствор аравийской камеди, раствор желатина, раствор трагаканта, раствор карбоксиметилцеллюлозы, раствор альгината натрия и глицерин.
Примеры диспергирующего агента включают, например, крахмал и карбонат кальция.
Примеры смазывающего вещества включают стеарат магния, стеариновую кислоту, стеарат кальция и очищенный тальк.
Примеры подсластителя включают глюкозу, фруктозу, инвертный сахар, сорбит, ксилит, глицерин и простой сироп.
Примерами поверхностно-активного вещества являются лаурилсульфат натрия, полисорбат 80, сорбитановый эфир жирной монокислоты и полиоксил-40-стеарат.
Примерами суспендирующего агента являются аравийская камедь, альгинат натрия, натрий-карбоксиметилцеллюлоза, метилцеллюлоза и бентонит.
Примерами эмульгатора являются аравийская камедь, трагакант, желатин и полисорбат 80.
Кроме того, в случаях, где препарат, содержащий соединение (I), готовят в упомянутой выше дозированной лекарственной форме, в него могут быть добавлены краситель, консервант, ароматическое соединение, корригирующее вещество, стабилизатор, загуститель и/или подобный компонент, которые обычно используют в области рецептурирования фармацевтических средств.
Ежедневная доза препарата меняется в зависимости от состояний и веса тела пациента, типа соединения, способа введения и/или подобных факторов. Например, в случае перорального введения предпочтительно, чтобы введение было проведено в количестве от 1 до 1000 мг на взрослого (вес тела: приблизительно 60 кг), за один раз или поделенным на три раза. В случае парентерального введения предпочтительно, чтобы, если препаратом является инъецируемый раствор, введение было проведено в количестве от 0,01 до 100 мг на 1 кг веса тела путем внутривенной инъекции.
Определение «нарушение накопления мочи» относится к состоянию или симптому неспособности накапливать достаточный объем мочи в мочевом пузыре. Конкретные примеры включают поллакиурию, недержание мочи, сильные позывы на мочеиспускание и т.д.
«Поллакиурия» относится к состоянию, при котором растет число случаев мочеиспускания. Примеры поллакиурии включают частое дневное мочеиспускание, никтурию, нейрогенную поллакиурию, психогенную поллакиурию и подобные состояния.
«Недержание мочи» относится к состоянию непроизвольного подтекания мочи. Примеры недержания мочи включают стрессовое недержание мочи, приступообразное недержание мочи, смешанное недержание мочи, энурез (суточный энурез, ночной энурез, смачивание постели), стойкое недержание мочи, недержание мочи при перерастяжении мочевого пузыря, безостановочное недержание мочи, рефлекторное недержание мочи, истинное недержание мочи, функциональное недержание мочи и подобные состояния.
«Сильный позыв на мочеиспускание» относятся к сильной, принудительной потребности в мочеиспускании, которая возникает внезапно. Обычно люди чувствуют потребность в мочеиспускании тогда, когда мочевой пузырь заполнен достаточным объемом мочи; пациенты же с нарушением, таким как гиперактивный мочевой пузырь, чувствуют внезапный, сильный позыв к мочеиспусканию, который трудно подавить, и чувствуют, что они не могут более удерживать мочу, даже когда мочевой пузырь не заполнен достаточным объемом мочи.
Примеры заболевания, которое вызывает нарушение(я) накопления мочи, такое(ие) как поллакиурия, недержание мочи и сильные позывы на мочеиспускание, включают нейрогенный мочевой пузырь, гиперактивный мочевой пузырь, нестабильный мочевой пузырь, цистоспазм, хронический цистит, интерстициальный цистит, синдром болезненного мочевого пузыря (синдром боли в области мочевого пузыря), хронический простатит, доброкачественную простатическую гиперплазию, рак простаты и подобные заболевания.
«Нейрогенный мочевой пузырь» относится к состоянию, при котором функция накопления мочи или мочеиспускания нижнего отдела мочевого тракта находится в ненормальном состоянии из-за некоторого поражения нерва, управляющего нижним отделом мочевого тракта, включающим мочевой пузырь, уретру и наружный сфинктер уретры. Примеры заболевания, которое повреждает нерв, управляющий нижним отделом мочевого тракта, включают церебрально-васкулярное заболевание, опухоль мозга, повреждение мозга, энцефалит, опухоль мозга, гидроцефалию нормального давления, деменцию, болезнь Паркинсона, депрессию, стриато-нигральную дегенерацию, прогрессирующий супра-нуклеарный паралич, оливопонтоцеребеллярную атрофию, синдром Шая-Дрейджера, повреждение спинного мозга, сосудистое заболевание спинного мозга, опухоль спинного мозга, миелит, компрессионное заболевание шейного отдела спинного мозга, сирингомиелию, рассеянный склероз, расщепление позвоночника, грыжу спинного мозга и мозговых оболочек, стеноз позвоночного канала, синдром фиксации спинного мозга, миелопатию, диабет, хирургическое вмешательство в полость таза и подобные заболевания.
Интерстициальный цистит представляет собой заболевание, при котором интерстициальная ткань между уротелием и гладкой мускулатурой мочевого пузыря становится хронически воспаленной вследствие любой причины. Основные симптомы включают нарушения накопления мочи, такие как поллакиурия, недержание мочи и сильные позывы на мочеиспускание; боль и дискомфорт при мочеиспускании, и аналогичные симптомы. Качество жизни (QOL) больных сильно снижается в зависимости от симптомов особенно, таких как боль в нижнем отделе брюшной полости, повышенная частота мочеиспускания и подобные симптомы. Хотя проводили разные лекарственные терапии, ни одна из них не показала достаточный терапевтический эффект.
Терапевтическое средство или профилактическое средство для лечения нарушения(й) накопления мочи в соответствии с настоящим изобретением предпочтительно используют в случае нарушений накопления мочи, сопровождающихся болью, так как оно обладает обезболивающим действием. Среди заболеваний, которые вызывают нарушение(я) накопления мочи, заболевания, сопровождающиеся болью, включают воспалительные заболевания, которые вызывают нарушение(я) накопления мочи, например, хронический цистит, интерстициальный цистит, синдром болезненного мочевого пузыря (синдром боли в области мочевого пузыря) и подобные состояния. Терапевтическое средство или профилактическое средство для лечения нарушения(й) накопления мочи в соответствии с настоящим изобретением еще более предпочтительно используют в случае интерстициального цистита.
Терапевтическое средство или профилактическое средство для лечения нарушения(й) накопления мочи в соответствии с настоящим изобретением может быть использовано в комбинации с другим(и) терапевтическим(и) средством(ами) или профилактическим(и) средством(ами) для лечения нарушения(й) накопления мочи или с терапевтическим(и) средством(ами) или профилактическим(и) средством(ами) для любого(ых) заболевания(й), которое(ые) вызывает(ют) нарушение(я) накопления мочи.
Примеры другого терапевтического средства или профилактического средства для лечения нарушения(й) накопления мочи включают антихолинергические лекарства, такие как пропантелин, оксибутинин, пропиверин, толтеродин, темиверин, троспиум, дарифенацин, солифенацин и KRP-197; гладкомышечные релаксанты, такие как флавоксат; открыватели калиевых каналов, такие как NS-8, ZD-0947, KW-7158, ABT-598 и WAY-151616; антагонисты кальциевых каналов, такие как нифедипин и флунаризин; релаксанты скелетных мышц, такие как баклофен, диазепам и ланперизон; антидепрессанты, такие как имипрамин, дезипрамин, флуоксетин, флувоксамин, милнаципран, пароксетин и дулоксетин; агонисты вазопрессиновых рецепторов, такие как десмопрессин; антагонисты тахикининовых рецепторов, такие как ТАК-637, SR-48968 и талнетант; β-агонисты, такие как кленбутерол, KUC-7483, YM-178 и GW-427353; ваниллоидные агонисты, такие как капсаицин и резинифератоксин; ваниллоидные антагонисты, такие как SB-705498, AMG-0347, BCNC, A-784168, SPM-955 и DD-161515; PGE-антагонисты, такие как ONO-8711 и ONO-8992; ингибиторы СОХ, такие как флурбипрофен; α1 агонисты, такие как R-450; α1 антагонисты, такие как доксазозин, индорамин, теразозин, урапидил, алфузозин, празозин, нафтопидил, тамсулозин, селодозин, фидуксозин и KMD-3213; блокаторы натриевых каналов, такие как винпоцетин, GW-286103, зонизамид, мексилетин, ранолазин, рилузол и подобные средства.
Примеры заболевания, которое вызывает нарушение(я) накопления мочи, включают доброкачественную простатическую гиперплазию, рак простаты, диабет, церебрально-васкулярное заболевание, деменцию, в том числе болезнь Альцгеймера, депрессию, болезнь Паркинсона, рассеянный склероз и подобные заболевания.
Примеры терапевтического средства или профилактического средства для доброкачественной простатической гиперплазии включают ингибиторы 5α-редуктазы, такие как финастерид, дутастерид, изонстерид, CS-891 и MK-434; антагонисты андрогенных рецепторов, такие как флутамид, бикалутамид и нилутамид; антиандрогенные лекарства, такие как аллилэстренол, хлормадинон, гестонорон, ципротерон, озатерон и номегестрол; антагонисты эндотелина, такие как SB-217242 и TA-0201; растительные лекарства, такие как эвипростат и цернилтон; α1 антагонисты, описанные выше, и подобные лекарства.
Примеры терапевтического средства или профилактического средства для рака простаты включают агонисты LH-RH, такие как лейпрорелин, гозерелин, бусерелин, нафарелин и трипторелин; антагонисты LH-RH, такие как цетрореликс, ганиреликс и абареликс; описанные выше ингибиторы 5α-редуктазы; описанные выше антагонисты андрогенных рецепторов; описанные выше антиандрогенные лекарства и подобные лекарства.
Примеры терапевтического средства или профилактического средства для диабета включают лекарства против инсулинорезистентности, такие как пиоглитазон, троглитазон и розиглитазон; усилители выделения инсулина, такие как толбутамид, хлорпропамид, толазамид, ацетогезамид, гликлопирамид, глибенкламид, гликлазид, глимепирид, репаглинид и натеглинид; бигуаниды, такие как метформин и буформин; ингибиторы α-глюкозидазы, такие как инсулин, акарбоза, воглибоза, миглитол и эмиглитат; агонисты β3-адреналинового рецептора, такие как AJ-9677, SR-58611-A, SB-226552 и AZ40140; эрогосет; прамлинтид; лептин; BAY-27-9955 и подобные средства.
Примеры терапевтического средства или профилактического средства для церебрально-васкулярного заболевания включают анирацетам, ибудиласт, тиаприд, кардиокром, цитиколин, γ-аминомасляную кислоту, ифенпродил, ницерголин, винпроцетин, низофенон, бенциклан, цинепазид и подобные средства.
Примеры терапевтического средства или профилактического средства для деменции, в том числе для болезни Альцгеймера, включают донепезил, метантин, галантамин и подобные средства.
Примеры терапевтического средства или профилактического средства для депрессии включают антидепрессанты, описанные выше, и подобные средства.
Примеры терапевтического средства или профилактического средства для болезни Паркинсона включают амантадин, тригексифенидил, бромокриптин, ловадопа, карбидопа, апоморфин и подобные средства.
Примеры терапевтического средства или профилактического средства для рассеянного склероза включают стероидные лекарства, интерферон-β-1b и подобные средства.
ПРИМЕРЫ
Настоящее изобретение далее описано с помощью примеров, но настоящее изобретение не ограничено ими.
Воздействия на экспериментальную модель индуцированной циклофосфамидом поллакиурии у крыс
В опытах 6-7 самок крыс SD возрастом 7-11 недель используют для одной экспериментальной группы. Экспериментальную модель поллакиурии (Lecci A. et al., British journal of pharmacology, 2000, vol. 130, p. 331) готовят путем внутрибрюшинного введения крысам (150 мг/кг) циклофосфамида (SIGMA). Такая модель, как считают, полезна в качестве экспериментальной модели нарушений накопления мочи, сопутствующих воспалительному заболеванию, в частности, в качестве модели поллакиурии интерстициального цистита. Через четыре-пять часов после введения циклофосфамида крыс модели поллакиурии анестезируют путем внутрибрюшинного введения уретана (1 г/кг). Затем в гипогастрии делают небольшой разрез, и оба мочеточника перевязывают, после чего делают небольшой разрез в мочеточниках со стороны почки. Затем самую верхнюю часть мочевого пузыря каждой крысы модели поллакиурии надрезают, и вставляют и оставляют внутри полиэтиленовую трубку, заполненную физиологическим раствором. Другой конец трубки снабжают трехходовым краном. Один проход трехходового крана соединяют с датчиком давления (NIHON KOHDEN) для измерения внутрипузырного давления, а другой проход соединяют с инфузионным насосом, чтобы вливать физиологический раствор.
Через тридцать минут после окончания описанного выше хирургического вмешательства в мочевой пузырь непрерывно вливают физиологический раствор (3,6 мл/час), чтобы получить непрерывные цистометрограммы (далее «ЦМГ», «CMG»). После подтверждения, что ЦМГ становятся стабильными, раствор испытуемого соединения или его растворитель вводят через хвостовую вену. Получают показатель изменения числа случаев мочеиспускания в период от до и после введения испытуемого соединения в группе испытуемого соединения и сравнивают с показателем в группе растворителя.
Раствор испытуемого соединения готовят так, чтобы концентрация испытуемого соединения составляла 10 мг/мл, и вводят внутривенно при объеме введения 0,5 мг на 1 кг веса тела (5 мг/кг). Смесь (диметилсульфоксид (далее «ДМСО»)):Tween 80:(физиологический раствор) (1:1:8) используют в качестве растворителя в растворе испытуемого соединения.
Число случаев мочеиспускания подсчитывают по ЦМГ. Принимая число случаев мочеиспускания, подсчитанных в течение периода времени 20 минут до введения испытуемого соединения как 100%, число случаев мочеиспускания, подсчитанное в течение периода времени 20 минут после введения испытуемого соединения, выражают в %, которые используют как показатель изменения числа случаев мочеиспускания. Статистическую обработку проводят с помощью непарного t-теста.
Результаты представлены на ФИГ. 1. Вертикальная ось дает показатель изменения числа случаев мочеиспускания (среднее ± стандартная ошибка, N=6-7). Звездочки на чертеже означают статистическую значимость (*:р<0,05) от группы растворителя экспериментальной модели поллакиурии у крыс (на чертеже (группа «растворитель»).
Внутривенное введение 5 мг/кг соединения 3 в значительной степени поправляет увеличение числа случаев мочеиспускания, наблюдаемых в экспериментальной модели поллакиурии у крыс, в сравнении с группой растворителя. Такой результат показывает, что соединение (I), имеющее циклогексановую структуру, является эффективным в отношении нарушений накопления мочи.
Связывающая способность к мускариновым рецепторам человека
Используют клетки СНО, экспрессирующие человеческие мускариновые М1, 2, 3, 4 и 5 рецепторы, соответственно (Buckley N.J. et al., Mol. Pharmacol., 1989, vol. 35, № 4, pp. 469-476). Опыты по рецепторному связыванию проводят в соответствии с обычным методом (Luthin G.R. et al., Exp. Ther., 1984, vol. 228, № 3, p. 648-655). В качестве радиомеченного лиганда используют 0,8 нмоль/л [3Н]-N-метил-скополамина; в качестве неспецифического лиганда используют 1 мкмоль/л атропина. Степени ингибирования с помощью соединения 3 специфического связывания радиомеченного лиганда к мускариновым рецепторам, представлены в таблице 3.
(10 мкмоль/л), (%)
Полученные данные подтверждают, что соединение 3 не связывается с каким-либо подтипом мускаринового рецептора, указывая на то, что не существует опасности, что соединение (I), имеющее циклогексановую структуру, будет вызывать побочные эффекты из-за антихолинергического действия.
Воздействия на боль
Для оценки обезболивающего действия соединения (I) используют экспериментальную модель «уксуснокислых корчей» у мышей, с помощью которой может быть оценена боль.
Самцов мышей ddY возрастом 5-6 недель не кормят 16 часов, позволяя им свободно пить воду, и раствор испытуемого соединения или его растворитель вводят мышам перорально (10 мг/кг). В качестве растворителя в растворах испытуемого соединения используют смесь «ДМСО»:Tween 80:(дистиллированная вода) (1:1:8) или 27%-ный гидроксипропил-β-циклодекстрин (далее «НР-β-CD). Через сорок пять минут после введения внутрибрюшинно вводят 0,6%-ный раствор уксусной кислоты (10 мг/кг), чтобы вызвать реакцию «скорчивания» (то есть, поведения с вытягиванием тела и/или сгибанием тела назад). Подсчитывают число реакций «скорчивания», наблюдаемых в течение 10 минут от 10 минут после введения раствора уксусной кислоты, что принимают в качестве показателя боли.
Принимая среднее число реакций «скорчивания» группы растворителя за 100%, дозу испытуемого соединения, с помощью которой реакцию ингибируют на 50%, выражают в виде «ED50». Результаты представлены в таблице 4.
Соединения, перечисленные в таблице 4, все ингибируют реакцию «скорчивания» в модели «уксуснокислых корчей» у мышей, указывая на то, что соединение (I) обладает обезболивающим действием.
Ниже описаны способы синтеза соединения (I) и его исходных материалов и промежуточных соединений. Те соединения, которые используют при синтезе промежуточных соединений, но способы синтеза которых не описаны ниже, являются коммерчески доступными материалами.
Названия растворителей в скобках (), приведенные в данных ЯМР, показывают растворители, использованные для измерений.
Для измерения спектров ЯМР (400 МГц) используют прибор ядерного магнитного резонанса JNM-AL400, производимый фирмой JEOL LTD. Химические сдвиги представлены с помощью δ (м.д.) с использованием тетраметилсилана в качестве стандарта. Сигналы представлены с помощью обозначений с (синглет), д (дублет), т (триплет), кв (квартет), квинт (квинтет), септ (септет), м (мультиплет), уш. (уширенный), дд (дублет дублета), дт (дублет триплета), ддд (дублет дублета дублета), дкв (дублет квартета), тк (триплет дублета), тт (триплет триплета), соответственно. ИК спектр измеряют с использованием прибора FT/IR-41, производимого фирмой Jasco, и спектр ESI-MC (ИЭС-МС) измеряют с использованием прибора Micromass ZQ2K, производимого фирмой Waters, или 1200LC/MSD, производимого фирмой AgilentTechnology. Все используемые растворители являются коммерчески доступными продуктами. Для флэш-хроматографии используют прибор YFLC W-prep2XY, производимый фирмой Yamazen.
Соединение 1
В качестве соединения 1: 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексанол
синтезируют по приведенной ниже методике.
Триэтиламин (258 мкл, 1,88 ммоль) добавляют к суспензии гидрохлорида 4-метоксифенилгидразина (165 мг, 0,944 ммоль) в этаноле (5,0 мл). Полученную смесь перемешивают при комнатной температуре 30 минут и затем добавляют к раствору 3-(1-гидроксициклогексил)-1-(п-толил)-2-пропин-1-она (промежуточное соединение 8) (214 мг, 0,883 ммоль) в этаноле (3,0 мл), после чего перемешивают смесь при комнатной температуре 20 часов. Реакционный раствор концентрируют при пониженном давлении и к остатку добавляют дистиллированную воду, затем экстрагируют полученную смесь этилацетатом. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 1 (141 мг, 0,389 ммоль, 44%) в виде желтого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,31-1,42 (1H, м), 1,54-2,03 (9H, м), 2,33 (3H, с), 2,52 (1H, шир.с), 3,81 (3H, с), 6,40 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09 (4H, с), 7,21 (2H, д, J=8,8 Гц).
Соединение 2 и соединение 3
В качестве соединения 2: 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-транс-1,4-диол
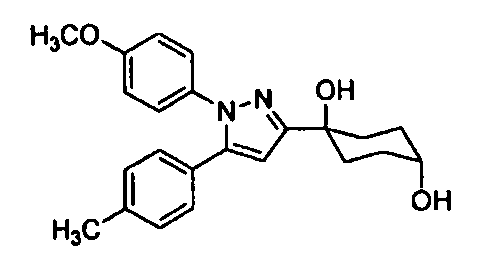
синтезируют по приведенной ниже методике.
В качестве соединения 3 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол
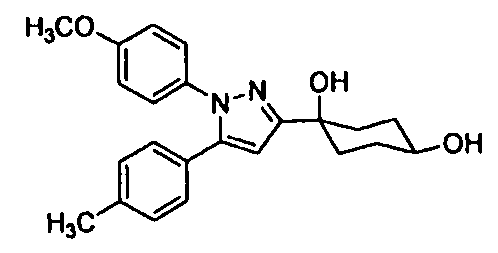
синтезируют по приведенной ниже методике.
Боргидрид натрия (804 мг, 21,3 ммоль) добавляют к раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-циклогексан-1-она (соединение 4) (8,00 г, 21,3 ммоль) в метаноле (200 мл). Полученную смесь перемешивают при комнатной температуре 2 часа и затем выливают в 1 М соляную кислоту. Реакционный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 2 (1,66 г, 4,39 ммоль, 21%) и соединение 3 (4,85 г, 12,8 ммоль, 60%) в виде белого твердого вещества, соответственно.
Соединение 2: 1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (1H, д, J=3,6 Гц), 1,64-1,72 (2H, м), 1,77-1,83 (2H, м), 2,04-2,12 (2H, м), 2,32-2,39 (5H, м), 2,56 (1H, с), 3,81 (3H, с), 4,03-4,06 (1H, м), 6,43 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,21 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3344, 2929, 2875, 1740, 1516, 1443, 1369, 1251, 1032, 1001, 832.
ESI-MC: m/z=379 (M+H)+.
Т.пл: 151-153°C.
Элементный анализ: Вычислено - C23H26N2O3: C 72,99; H 6,92; N 7,40. Найдено: C 72,97; H 6,92; N 7,34.
Соединение 3: 1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (1H, с), 1,81-1,99 (6H, м), 2,04-2,12 (2H, м), 2,33 (3H, с), 2,56 (1H, с), 3,70-3,77 (1H, м), 3,80 (3H, с), 6,37 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,09 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3303, 2918, 1517, 1442, 1366, 1248, 1063, 1026, 837, 807.
ESI-MC: m/z=379 (M+H)+.
Т.пл.: 164-166°C.
Элементный анализ: Вычислено - C23H26N2O3: C 72,99; H 6,92; N 7,40. Найдено: C 72,87; H 6,86; N 7,22.
Соединение 5 и соединение 22
В качестве соединения 5: 1-(1-(4-хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-транс-1,4-диол
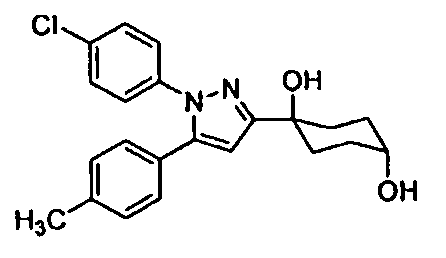
синтезируют по приведенной ниже методике.
В качестве соединения 22: 1-(1-(4-хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол
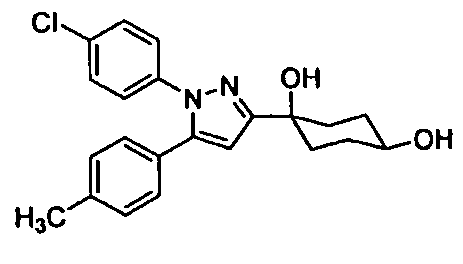
синтезируют по приведенной ниже методике.
Боргидрид натрия (53 мг, 1,40 ммоль) добавляют к раствору 4-гидрокси-4-(1-(4-хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)-циклогесан-1-она (промежуточное соединение 65) (510 мг, 1,34 ммоль) в метаноле (13 мл) и полученную смесь перемешивают при комнатной температуре 2 часа. Реакционный раствор концентрируют при пониженном давлении, затем растворяют в этилацетате и промывают дистиллированной водой и рассолом. Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 5 (114 мг, 0,298 ммоль, 22%) и соединение 22 (360 мг, 0,940 ммоль, 70%) в виде белого твердого вещества, соответственно.
Соединение 5: 1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (1H, шир.), 1,65-1,72 (2H, м), 1,77-1,82 (2H, м), 2,04-2,11 (2H, м), 2,31-2,38 (2H, м), 2,36 (3H, с), 2,51 (1H, с), 4,03-4,08 (1H, м), 6,44 (1H, с), 7,10 (2H, д, J=8,8 Гц), 7,13 (2H, д, J=8,8 Гц), 7,22-7,30 (4H, м).
ИК (KBr, см-1): 3349, 2918, 1497, 1440, 1366, 1240, 1098, 1007, 969, 833, 810.
ESI-MC: m/z=383 (M+H)+.
Соединение 22: 1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (1H, шир.), 1,80-1,99 (6H, м), 2,03-2,07 (2H, м), 2,35 (3H, с), 2,51 (1H, с), 3,70-3,80 (1H, м), 6,39 (1H, с), 7,09 (2H, д, J=8,4 Гц), 7,13 (2H, д, J=8,4 Гц), 7,21-7,24 (2H, м), 7,27-7,31 (2H, м).
ИК (KBr, см-1): 3365, 2946, 1496, 1442, 1368, 1241, 1095, 1059, 1014, 970, 887.
ESI-MC: m/z=365 (M-OH)+.
Соединение 6 и соединение 8
В качестве соединения 6: 1-(1,5-бис(4-метоксифенил)-1Н-пиразол-3-ил)циклогексан-транс-1,4-диол
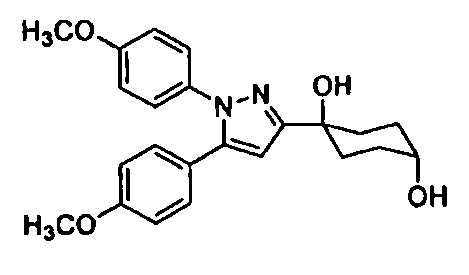
синтезируют по приведенной ниже методике.
В качестве соединения 8: 1-(1,5-бис(4-метоксифенил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол
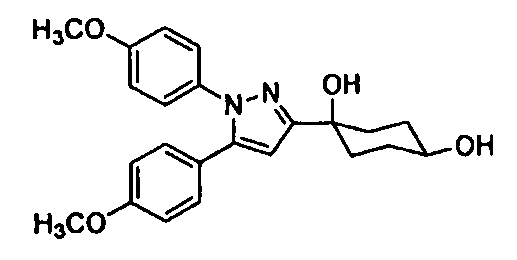
синтезируют по приведенной ниже методике.
Боргидрид натрия (65 мг, 1,7 ммоль) добавляют к раствору 4-(1,5-бис(4-метоксифенил)-1Н-пиразол-3-ил)-4-гидрокси-циклогексан-1-она (промежуточное соединение 63) (523 мг, 1,38 ммоль) в метаноле, полученную смесь перемешивают при комнатной температуре 1,5 часа и концентрируют при пониженном давлении. К остатку добавляют дистиллированную воду, и полученный раствор экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией, чтобы разделить на низкополярные компоненты и высокополярные компоненты. Низкополярные компоненты очищают перекристаллизацией (этилацетат/н-гексан, 2:1), получают соединение 6 (79 мг, 0,20 ммоль, 14%) в виде белых кристаллов. Выскополярные компоненты очищают перекристаллизацией (этилацетат/н-гексан, 2:1), получают соединение 8 (186 мг, 0,471 ммоль, 34%) в виде белых кристаллов.
Соединение 6: 1H-ЯМР (400 МГц, CDCl3) δ: 1,33 (1H, д, J=3,4 Гц), 1,63-1,73 (2H, м), 1,75-1,84 (2H, м), 2,03-2,13 (2H, м), 2,30-2,39 (2H, м), 2,55 (1H, с), 3,80 (3H, с), 3,81 (3H, с), 4,02-4,08 (1H, м), 6,40 (1H, с), 6,82 (2H, д, J=8,8 Гц), 6,85 (2H, д, J=8,8 Гц), 7,14 (2H, д, J=8,8 Гц), 7,21 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3379, 1613, 1517, 1503, 1251, 1180, 1032, 1001, 835.
ESI-MC: m/z=395 (M+H)+.
Соединение 8: 1H-ЯМР (400 МГц, CDCl3) δ: 1,41 (1H, д, J=4,1 Гц), 1,79-2,55 (8H, м), 2,55 (1H, с), 3,69-3,78 (1H, м), 3,80 (3H, с), 3,81 (3H, с), 6,34 (1H, с), 6,81 (2H, д, J=8,8 Гц), 6,85 (2H, д, J=8,8 Гц), 7,13 (2H, д, J=8,8 Гц), 7,20 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3385, 1613, 1517, 1503, 1250, 1064, 1031, 970, 835.
ESI-MC: m/z=395 (M+H)+.
Соединение 7 и соединение 21
В качестве соединения 7: 1-(5-(4-хлорфенил)-1-(4-метокси-фенил)-1Н-пиразол-3-ил)циклогексан-транс-1,4-диол
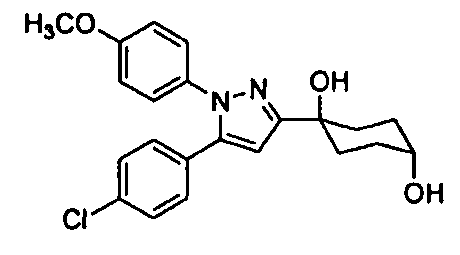
синтезируют по приведенной ниже методике.
В качестве соединения 21: 1-(5-(4-хлорфенил)-1-(4-метокси-фенил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол
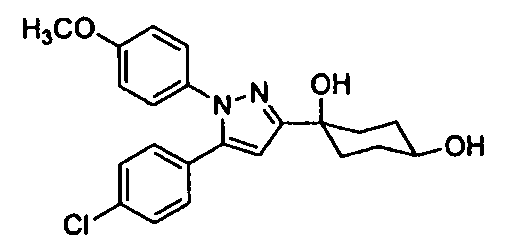
синтезируют по приведенной ниже методике.
Боргидрид натрия (59,0 мг, 1,56 ммоль) добавляют к раствору 4-(5-хлорфенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)-4-гидроксициклогексан-1-она (промежуточное соединение 64) (619 мг, 1,56 ммоль) в метаноле (15,6 мл). Полученную смесь перемешивают при комнатной температуре 1 час и затем выливают в 1 М соляную кислоту. Реакционный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 7 (131 мг, 0,328 ммоль, 21%) и соединение 21 (291 мг, 0,730 ммоль, 47%) в виде белого твердого вещества, соответственно.
Соединение 7: 1H-ЯМР (400 МГц, CDCl3) δ: 1,32 (1H, д, J=3,2 Гц), 1,63-1,73 (2H, м), 1,76-1,84 (2H, м), 2,03-2,12 (2H, м), 2,30-2,39 (2H, м), 2,50 (1H, с), 3,82 (3H, с), 4,02-4,09 (1H, м), 6,46 (1H, с), 6,84-6,87 (2H, м), 7,14 (2H, д, J=8,8 Гц), 7,19 (2H, д, J=8,8 Гц), 7,26-7,28 (2H, м).
ESI-MC: m/z=399 (M+H)+.
Соединение 21: 1H-ЯМР (400 МГц, CDCl3) δ: 1,41 (1H, д, J=5,2 Гц), 1,82-2,09 (8H, м), 2,49 (1H, с), 3,70-3,78 (1H, с), 3,82 (3H, с), 6,41 (1H, с), 6,85-6,87 (2H, м), 7,13 (2H, д, J=8,4 Гц), 7,18 (2H, д, J=8,4 Гц), 7,25-7,27 (2H, м).
ESI-MC: m/z=399 (M+H)+.
Соединение 9
В качестве соединения 9: 1-(4-хлор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол
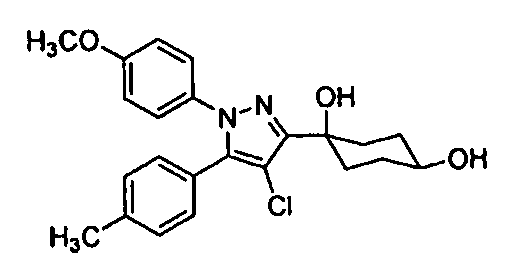
синтезируют по приведенной ниже методике.
Карбонат калия (102 мг, 0,736 ммоль) добавляют к раствору 4-(4-хлор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-с-4-гидроксициклогексан-r-1-илацетата (промежуточное соединение 81) (67 мг, 0,147 ммоль) в метаноле (1,5 мл), и полученную смесь перемешивают при комнатной температуре 2 часа. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 9 (58 мг, 0,140 ммоль, 95%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (1H, с), 1,83-2,05 (6H, м), 2,21-2,23 (2H, м), 2,36 (3H, с), 3,04 (1H, с), 3,76-3,79 (4H, м), 6,79-6,83 (2H, м), 7,11-7,16 (6H, м).
ESI-MC: m/z=395, 397 (M-OH)+.
Соединение 10
В качестве соединения 10: 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-4-(трифторметил)циклогексан-цис-1,4-диол
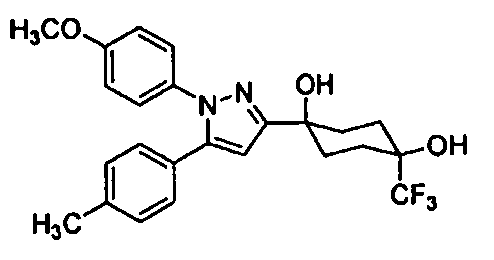
синтезируют по приведенной ниже методике.
К раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-она (соединение 4) (620 мг, 1,65 ммоль) в тетрагидрофуране (6,60 мл) при 0°С добавляют (трифторметил)триметилсилан (535 мкл, 3,62 ммоль). Затем к раствору по каплям добавляют тетра-н-бутиламмонийфторид (TBAF, 1 М раствор в тетрагидрофуране) (362 мкл, 0,36 ммоль), и полученный раствор перемешивают при комнатной температуре 6 часов. К реакционному раствору добавляют тетра-н-бутиламмоний-фторид (TBAF, 1 М раствор в тетрагидрофуране) (3,29 мл, 3,29 ммоль). Полученную смесь перемешивают при комнатной температуре 1 час и затем выливают в 1 М соляную кислоту. Реакционный раствор экстрагируют диэтиловым эфиром. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 10 (410 мг, 0,92 ммоль, 56%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,60 (1H, с), 1,87-2,02 (4H, м), 2,09-2,02 (2H, м), 2,34-2,40 (6H, м), 3,82 (3H, с), 6,47 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,08-7,11 (4H, м), 7,20 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3402, 2954, 1517, 1463, 1305, 1250, 1249, 1179, 1121, 1056, 1024, 834.
ESI-MC: m/z=447 (M+H)+.
Соединение 11
В качестве соединения 11: t-4-фтор-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-ол
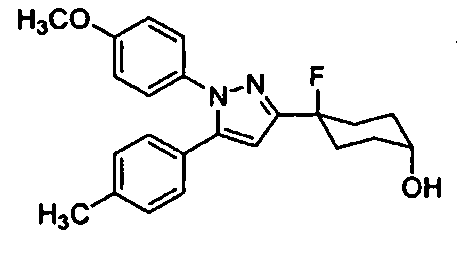
синтезируют по приведенной ниже методике.
DeoxofluorTM (48 мкл, 0,262 ммоль) добавляют к раствору с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-циклогексан-r-1-илацетата (соединение 12) (100 мг, 0,238 ммоль) в дихлорметане (1,19 мл), и полученную смесь перемешивают при комнатной температуре 15 минут. К реакционному раствору добавляют 1 М соляную кислоту, и полученный раствор экстрагируют хлороформом. Органический слой промывают рассолом и затем сушат над безводным сульфатом магния, концентрируют при пониженном давлении с получением остатка.
Карбонат калия (164 мг, 1,18 ммоль) добавляют к раствору полученного остатка в метаноле (2,4 мл), и полученную смесь перемешивают при комнатной температуре 2 часа. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 11 (22,4 мг, 0,058 ммоль, 25%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37 (1H, м), 1,72-1,77 (2H, м), 2,02-2,14 (4H, м), 2,34 (3H, с), 2,38-2,49 (2H, м), 3,81 (3H, с), 4,11 (1H, м), 6,52 (1H, м), 6,84 (2H, д, J=8,8 Гц), 7,22 (2H, д, J=8,8 Гц), 7,26 (4H, с).
ESI-MC: m/z=381 (M+H)+.
Соединение 12
В качестве соединения 12: с-4-гидрокси-4-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-илацетат
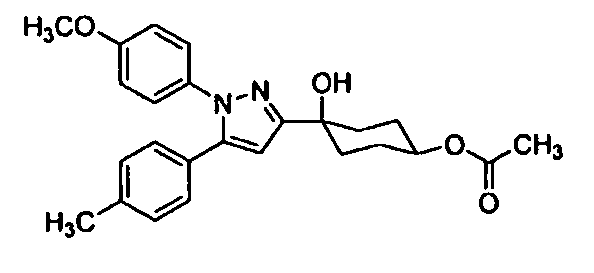
синтезируют по приведенной ниже методике.
Уксусный ангидрид (0,312 мл, 3,30 ммоль), пиридин (0,267 мл, 3,30 ммоль) и 4-диметиламинопиридин (16,1 мг, 0,132 ммоль) добавляют к суспензии 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (500 мг, 1,32 ммоль) в дихлорметане (4,4 мл), и полученную смесь перемешивают при комнатной температуре 45 минут. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 12 (556 мг, 1,32 ммоль, количественный выход) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,89-2,08 (11H, м), 2,34 (3H, с), 2,64 (1H, шир.с), 3,81 (3H, с), 4,80-4,88 (1H, м), 6,36 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,00 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MC: m/z=421 (M+H)+.
Соединение 13
В качестве соединения 13: 4-метокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексанол
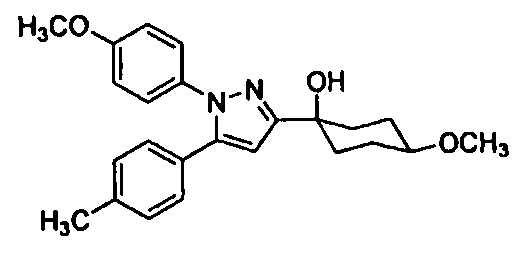
синтезируют по приведенной ниже методике.
Карбонат калия (197 мг, 1,42 ммоль) добавляют к раствору с-4-метокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-илацетата (промежуточное соединение 39) (124 мг, 0,284 ммоль) в метаноле (2,8 мл), и полученную смесь перемешивают при комнатной температуре 18 часов. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 13 (102 мг, 0,260 ммоль, 91%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,78-1,88 (2H, м), 1,90-1,99 (4H, м), 2,03-2,09 (2H, м), 2,33 (3H, с), 2,49 (1H, с), 3,24-3,32 (1H, м), 3,39 (3H, с), 3,81 (3H, с), 6,39 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,09 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3425, 2937, 1516, 1443, 1369, 1300, 1249, 1171, 1099, 1030, 968, 834, 801.
ESI-MC: m/z=393 (M+H)+.
Соединение 14 и соединение 20
В качестве соединения 14: 4-(гидроксиметил)-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-транс-1,4-циклогексанол (Соединение 14)
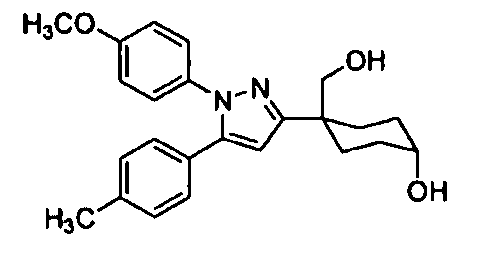
синтезируют по приведенной ниже методике.
В качестве соединения 20: 4-(гидроксиметил)-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-1,4-циклогексанол (Соединение 20)
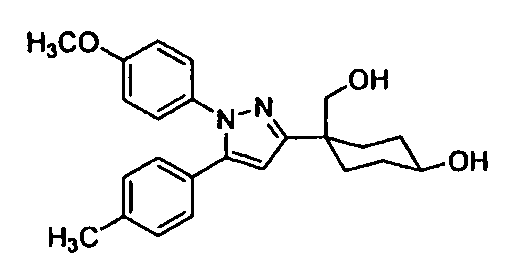
синтезируют по приведенной ниже методике.
Боргидрид натрия (30,4 мг, 0,804 ммоль) добавляют к раствору 4-(бензилоксиметил)-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-она (промежуточное соединение 51) (387 мг, 0,804 ммоль) в метаноле (8,0 мл). Полученную смесь перемешивают при комнатной температуре 1 час, и затем выливают в 1 М соляную кислоту. Реакционный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении с получением остатка.
К раствору полученного остатка в метаноле (8,0 мл) добавляют 10%-ный палладий-на-угле (86,0 мг, 0,080 ммоль) в атмосфере водорода, и полученную смесь перемешивают при комнатной температуре 3 часа. Реакционный раствор фильтруют через целлит, фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (аминосиликагель, н-гексан/этилацетат), получают соединение 14 (51,6 мг, 0,131 ммоль, 16%) в виде белого твердого вещества и соединение 20 (164 мг, 0,418 ммоль, 52%) в виде белого аморфного продукта.
Соединение 14: 1H-ЯМР (400 МГц, CDCl3) δ: 1,43 (1H, шир.с), 1,54-1,67 (2H, м), 1,83-1,91 (4H, м), 2,00-2,08 (2H, м), 2,34 (3H, с), 3,24-3,33 (1H, м), 3,78-3,86 (6H, м), 6,32 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,19 (2H, д, J=8,8 Гц).
ESI-MC: m/z=393 (M+H)+.
Соединение 20: 1H-ЯМР (400 МГц, CDCl3) δ: 1,39 (1H, д, J=4,8 Гц), 1,46-1,60 (4H, м), 1,85-1,95 (2H, м), 2,33-2,40 (5H, м), 2,71 (1H, т, J=6,4 Гц), 3,55 (2H, д, J=6,4 Гц), 3,71-3,83 (4H, м), 6,37 (1H, с), 6,85 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MC: m/z=393 (M+H)+.
Соединение 15
В качестве соединения 15: 1-(1-(4-метоксифенил)-5-(6-метил-пиридин-3-ил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диол
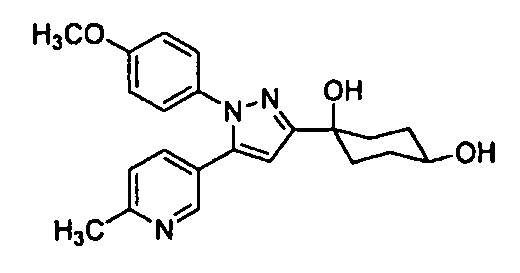
синтезируют по приведенной ниже методике.
Боргидрид натрия (12,1 мг, 0,32 ммоль) добавляют к раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)циклогексан-1-она (промежуточное соединение 62) (109,5 мг, 0,29 ммоль) в метаноле (1,5 мл). Полученную смесь перемешивают при комнатной температуре 40 минут и затем добавляют к ней 1 М соляную кислоту. Реакционный раствор промывают этилацетатом, водный слой подщелачивают 1 М водным раствором гидроксида натрия, затем полученную смесь экстрагируют дважды этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, этилацетат), получают соединение 15 (30,6 мг, 0,81 ммоль, 28%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,59 (1H, шир.с), 1,81-2,00 (6H, м), 2,05-2,08 (2H, м), 2,55 (3H, с), 2,61 (1H, с), 3,71-3,78 (1H, м), 3,81 (3H, с), 6,46 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,06 (1H, д, J=8,0 Гц), 7,18 (2H, д, J=8,8 Гц), 7,32 (1H, дд, J=2,0, 8,0 Гц), 8,40 (1H, д, J=2,0 Гц).
ИК (KBr, см-1): 3444, 2933, 2858, 1516, 1249, 1067, 968, 839.
ESI-MC: m/z=380 (M+H)+.
Соединение 16
В качестве соединения 16: 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексанкарбоновую кислоту
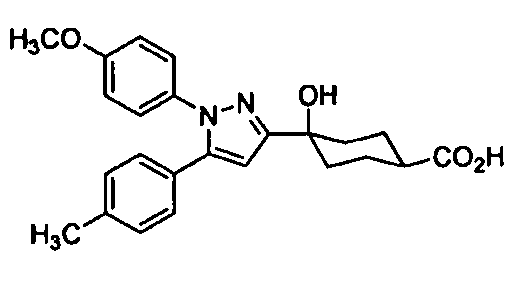
синтезируют по приведенной ниже методике.
Дистиллированную воду (0,8 мл) и 2-метил-2-бутен (101 мкл, 0,96 ммоль) добавляют к раствору с-4-гидрокси-4-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексан-r-1-карбальдегида (промежуточное соединение 42) (124,9 мг, 0,32 ммоль) в трет-бутаноле (2,4 мл), и полученный раствор охлаждают льдом. При 0°С к раствору добавляют дигидрофосфат натрия (42,1 мг, 0,35 ммоль) и хлорит натрия (72,3 мг, 0,80 ммоль), и полученную смесь перемешивают 5 минут. Смеси дают нагреться до комнатной температуры, перемешивают 1 час и затем охлаждают льдом до 0°С. Затем добавляют водный раствор тиосульфата натрия и полученную смесь перемешивают. К смеси добавляют 1 М соляную кислоту и этилацетат, полученный раствор экстрагируют. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 16 (116,6 мг, 0,29 ммоль, 93%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,87-2,11 (9H, м), 2,33 (3H, с), 2,40-2,43 (1H, м), 3,81 (3H, с), 6,38 (1H, с), 6,84 (2H, д, J=9,2 Гц), 7,09-7,09 (4H, м), 7,20 (2H, д, J=9,2 Гц).
ИК (KBr, см-1): 3523, 2928, 1706, 1517, 1252, 831.
ESI-MC: m/z=407 (M+H)+.
Соединение 17
В качестве соединения 17: 4,4-дифтор-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексанол
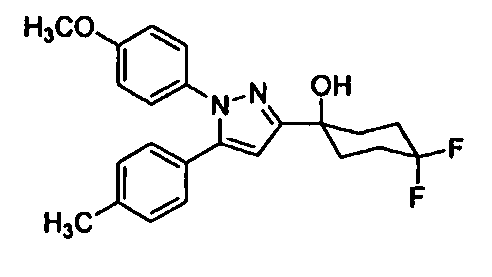
синтезируют по приведенной ниже методике.
К раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-4-оксоциклогексан-1-илацетата (промежуточное соединение 41) (110 мг, 0,263 ммоль) в дихлорметане (2,63 мл) добавляют (диметиламино)сератрифторид (DAST) (104 мкл, 0,578 ммоль), и полученную смесь перемешивают при комнатной температуре 2 часа. К реакционному раствору добавляют 1 М соляную кислоту, и полученный раствор экстрагируют хлороформом. Органический слой промывают рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением остатка.
К раствору полученного остатка в тетрагидрофуране (193 мкл) и метаноле (386 мл) добавляют 4 М водный раствор гидроксида натрия (193 мкл, 0,772 ммоль), и полученную смесь перемешивают при комнатной температуре 6 часов. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 17 (41,0 мг, 0,103 ммоль, 39%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,01-2,31 (8H, м), 2,34 (3H, с), 2,77 (1H, с), 3,81 (3H, с), 6,37 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,21 (2H, д, J=8,8 Гц).
ESI-MC: m/z=399 (M+H)+.
Приведенные ниже соединения синтезируют таким же способом, как и при синтезе описанного выше соединения 2 и соединения 3.
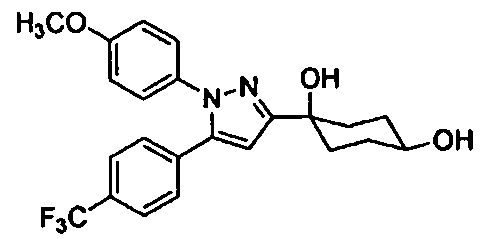
ESI-MC: m/z=433 (M+H)+
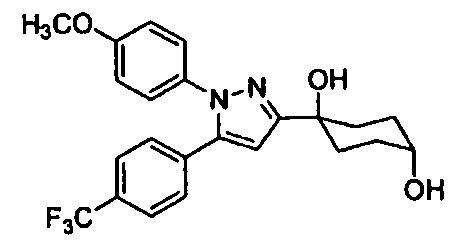
ESI-MC: m/z=433 (M+H)+
ESI-MC: m/z=403 (M+H)+

ESI-MC: m/z=403 (M+H)+
ESI-MC: m/z=369 (M+H)+
ESI-MC: m/z=369 (M+H)+
ИК (KBr, см-1): 3343, 2918, 1518, 1440, 1367, 1266, 1240, 1196, 1159, 1107, 1007, 824, 810.
ESI-MC: m/z=363 (M+H)+
ИК (KBr, см-1): 3375, 2937, 2870, 1519, 1502, 1440, 1362, 1217, 1193, 1112, 1064, 1042, 1017, 973, 886, 821, 804.
ESI-MC: m/z=345 (M-OH)+
ИК (KBr, см-1): 3337, 2920, 1599, 1506, 1437, 1366, 1005, 810, 765, 696.
ESI-MC: m/z=349 (M+H)+
ИК (KBr, см-1): 3374, 2919, 1596, 1505, 1440, 1361, 1217, 1112, 1064, 1044, 1019, 973, 886, 819, 799, 771, 693.
ESI-MC: m/z=331 (M-OH)+
ESI-MC: m/z=365 (M+H)+
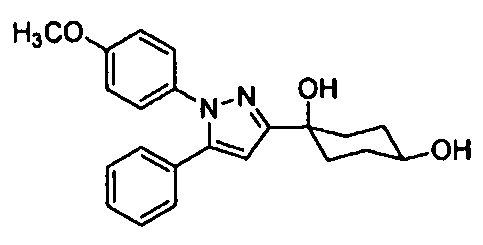
ESI-MC: m/z=365 (M+H)+
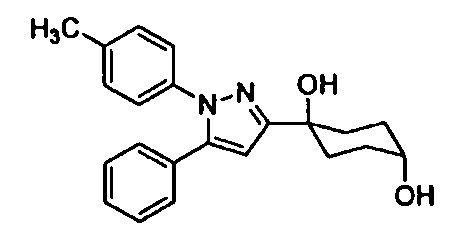
ESI-MC: m/z=349 (M+H)+
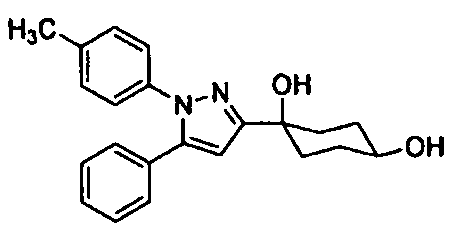
ESI-MC: m/z=349 (M+H)+
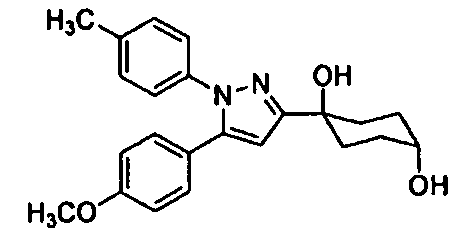
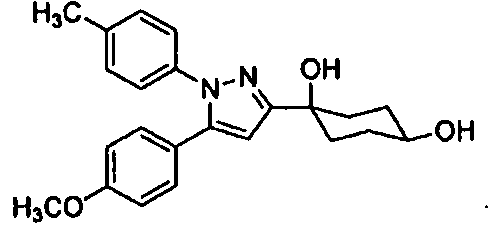
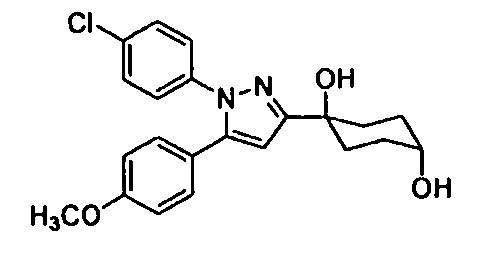
ESI-MC: m/z=399 (M+H)+
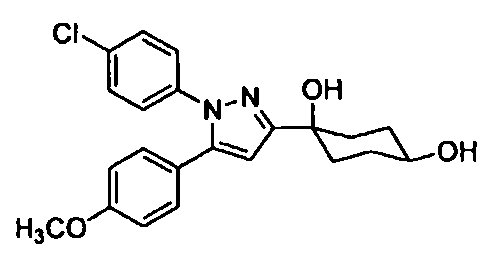
ESI-MC: m/z=399 (M+H)+
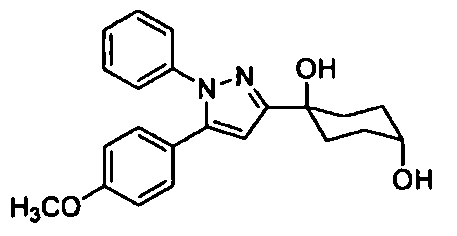
ESI-MC: m/z=365 (M+H)+
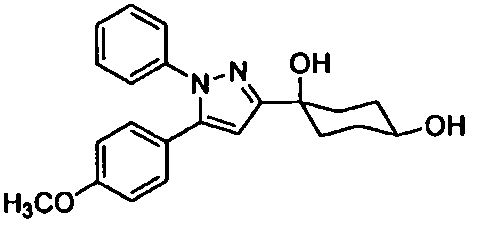
ESI-MC: m/z=365 (M+H)+
Соединение 41 и соединение 42
В качестве соединения 41: 1-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)циклогексан-транс-1,4-диол
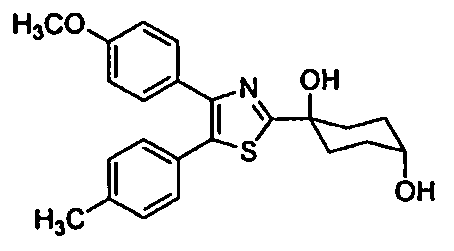
синтезируют по приведенной ниже методике.
В качестве соединения 42: 1-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)циклогексан-цис-1,4-диол
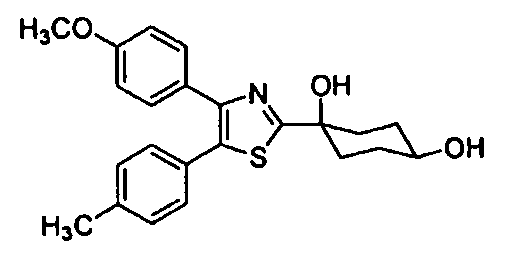
синтезируют по приведенной ниже методике.
Боргидрид натрия (36 мг, 0,943 ммоль) добавляют к раствору 4-гидрокси-4-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)-циклогексан-1-она (промежуточное соединение 83) (186 мг, 0,471 ммоль) в метаноле (4,7 мл), и полученную смесь перемешивают при комнатной температуре 1 час. Реакционный раствор концентрируют при пониженном давлении, затем растворяют в этилацетате и промывают дистиллированной водой и рассолом. Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 41 (42 мг, 0,106 ммоль, 23%) и соединение 42 (136 мг, 0,344 ммоль, 73%) в виде белого твердого вещества, соответственно.
Соединение 41: 1H-ЯМР (400 МГц, CDCl3) δ: 1,53-1,57 (1H, м), 1,76-1,87 (4H, м), 2,05-2,12 (2H, м), 2,35-2,42 (2H, м), 2,36 (3H, с), 3,15 (1H, шир.), 3,80 (3H, с), 4,10-4,14 (1H, м), 6,80-6,84 (2H, м), 7,13 (2H, д, J=8,0 Гц), 7,24 (2H, д, J=8,0 Гц), 7,45-7,49 (2H, м).
ИК (KBr, см-1): 3409, 2923, 1613, 1515, 1252, 1179, 1004, 815.
ESI-MC: m/z=396 (M+H)+.
Соединение 42: 1H-ЯМР (400 МГц, CDCl3) δ: 1,48 (1H, д, J=4,8 Гц), 1,82-1,89 (2H, м), 1,95-2,01 (2H, м), 2,05-2,09 (4H, м), 2,36 (3H, с), 3,01 (1H, с), 3,76-3,82 (1H, м), 3,80 (3H, с), 6,80-6,83 (2H, м), 7,13 (2H, д, J=8,0 Гц), 7,22 (2H, д, J=8,0 Гц), 7,43-7,47 (2H, м).
ИК (KBr, см-1): 3418, 2938, 1611, 1515, 1249, 1177, 1058, 816.
ESI-MC: m/z=396 (M+H)+.
Соединение 43 и соединение 44
В качестве соединения 43: 4-(4,5-бис(4-метоксифенил)-оксазол-2-ил)циклогексан-цис-1,4-диол
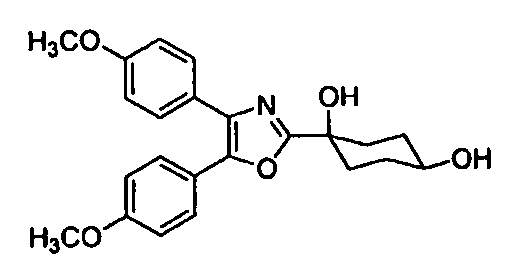
синтезируют по приведенной ниже методике.
В качестве соединения 44: 4-(4,5-бис(4-метоксифенил)-оксазол-2-ил)циклогексан-транс-1,4-диол
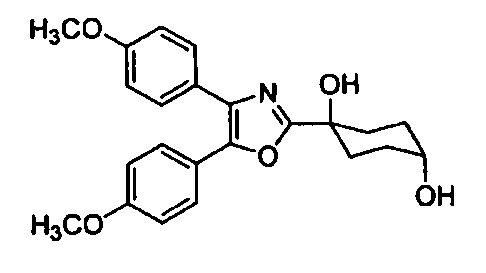
синтезируют по приведенной ниже методике.
Боргидрид натрия (47 мг, 1,24 ммоль) добавляют к раствору 4-(4,5-бис(4-метоксифенил)оксазол-2-ил)-4-гидроксициклогексан-1-она (промежуточное соединение 82) (395 мг, 1,00 ммоль) в метаноле (20 мл), и полученную смесь перемешивают при комнатной температуре 16 часов. Реакционный раствор концентрируют при пониженном давлении, к остатку добавляют дистиллированную воду, после чего полученную смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 43 (207 мг, 0,523 ммоль, 52%) и соединение 44 (73 мг, 0,18 ммоль, 18%) в виде белого твердого вещества, соответственно.
Соединение 43: 1H-ЯМР (400 МГц, CDCl3) δ: 1,49 (1H, шир.с), 1,78-2,13 (8H, м), 2,76 (1H, с), 3,72-3,78 (1H, м), 3,83 (6H, с), 6,89 (2H, д, J=8,8 Гц), 6,90 (2H, д, J=8,8 Гц), 7,49 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3364, 1615, 1599, 1520, 1500, 1302, 1252, 1176, 1069, 1053, 1028, 965, 833.
ESI-MC: m/z=396 (M+H)+.
Соединение 44: 1H-ЯМР (400 МГц, CDCl3) δ: 1,63-1,75 (2H, м), 1,78-1,88 (2H, м), 2,01-2,12 (2H, м), 2,44-2,53 (2H, м), 2,67 (1H, с), 4,00-4,07 (1H, м), 6,89 (2H, д, J=8,8 Гц), 6,90 (2H, д, J=8,8 Гц), 7,51 (2H, д, J=8,8 Гц), 7,57 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3356, 1613, 1600, 1520, 1503, 1254, 1182, 1033, 999, 966, 834.
ESI-MC: m/z=396 (M+H)+.
Соединение 45 и соединение 46
В качестве соединения 45: 1-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)-4-(трифторметил)циклогексан-транс-1,4-диол
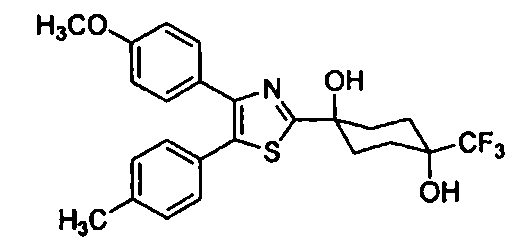
синтезируют по приведенной ниже методике.
В качестве соединения 46: 1-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)-4-(трифторметил)циклогексан-цис-1,4-диол:
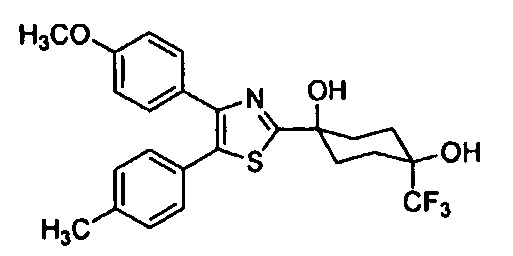
синтезируют по приведенной ниже методике.
К раствору 4-гидрокси-4-(4-(4-метоксифенил)-5-(п-толил)-тиазол-2-ил)циклогексан-1-она (промежуточное соединение 83) (199 мг, 0,506 ммоль) и реагента Рупперта (0,187 мл, 1,26 ммоль) в тетрагидрофуране (2,5 мл) добавляют при комнатной температуре 1,0 М раствор тетрабутиламмонийфторида в тетрагидрофуране (0,051 мл, 0,051 ммоль), и полученную смесь перемешивают 10 минут. Реакционный раствор концентрируют при пониженном давлении и затем растворяют в тетрагидрофуране (3,0 мл). Добавляют дистиллированную воду (0,2 мл) и 1,0 М раствор тетрабутиламмонийфторида в тетрагидрофуране (1,02 мл, 1,02 ммоль), и полученную смесь перемешивают при комнатной температуре 30 минут. К реакционному раствору добавляют дистиллированную воду, и полученный раствор экстрагируют этилацетатом, после чего промывают рассолом. Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 45 (70 мг, 0,151 ммоль, 30%) и соединение 46 (132 мг, 0,285 ммоль, 56%) в виде белого твердого вещества, соответственно.
Соединение 45: 1H-ЯМР (400 МГц, CDCl3) δ: 1,79-1,84 (2H, м), 1,90 (1H, с), 1,96-2,01 (2H, м), 2,21-2,33 (4H, м), 2,37 (3H, с), 3,28 (1H, с), 3,80 (3H, с), 6,80-6,84 (2H, м), 7,13 (2H, д, J=8,0 Гц), 7,23 (2H, д, J=8,0 Гц), 7,44-7,48 (2H, м).
ИК (KBr, см-1): 3460, 2940, 1610, 1515, 1494, 1442, 1310, 1245, 1175, 1035, 1005, 837, 813.
ESI-MC: m/z=464 (M+H)+.
Соединение 46: 1H-ЯМР (400 МГц, CDCl3) δ: 1,90-1,96 (2H, м), 1,97 (1H, шир.), 2,16-2,23 (2H, м), 2,28-2,36 (4H, м), 2,37 (3H, с), 2,81 (1H, шир.), 3,80 (3H, с), 6,80-6,83 (2H, м), 7,14 (2H, д, J=8,0 Гц), 7,26 (2H, д, J=8,0 Гц), 7,44-7,48 (2H, м).
ИК (KBr, см-1): 3419, 2940, 1611, 1515, 1443, 1290, 1250, 1175, 1120, 1066, 993, 837, 814.
ESI-MC: m/z=464 (M+H)+.
Приведенные ниже соединения синтезируют таким же способом, как и при синтезе описанного выше соединения 2 и соединения 3.
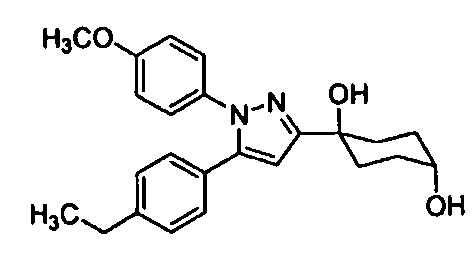
ESI-MC: m/z=393 (M+H)+
ESI-MC: m/z=393 (M+H)+
ESI-MC: m/z=374 (M+H)+
ESI-MC: m/z=374 (M+H)+
ESI-MC: m/z=390 (M+H)+
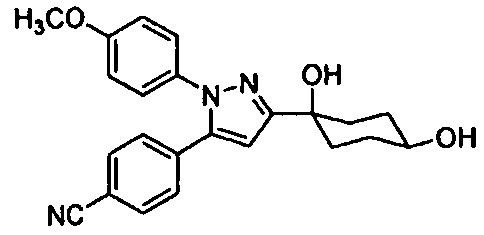
ESI-MC: m/z=390 (M+H)+
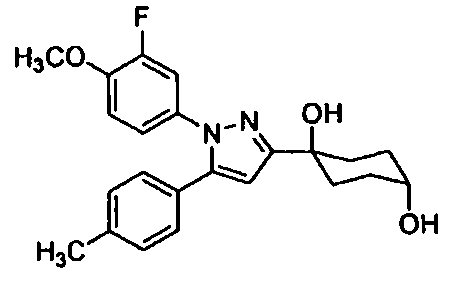
ESI-MC: m/z=397 (M+H)+

ESI-MC: m/z=397 (M+H)+
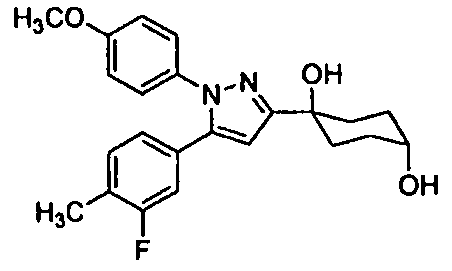
ESI-MC: m/z=397 (M+H)+
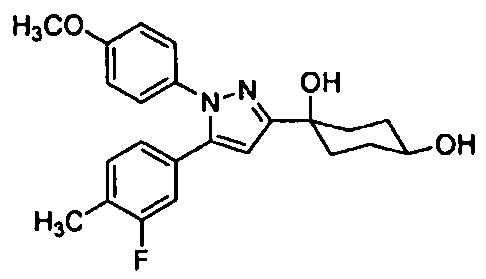
ESI-MC: m/z=397 (M+H)+
Соединение 58
В качестве соединения 58: этил-4-гидрокси-4-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексан-карбоксилат
синтезируют по приведенной ниже методике.
Карбонат калия (41,4 мг, 0,3 ммоль) и этилйодид (24,8 мкл, 0,3 ммоль) добавляют к раствору 4-гидрокси-4-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексанкарбоновой кислоты (соединение 16) (41,6 мг, 0,10 ммоль) в ДМФА (1,0 мл), и полученную смесь перемешивают 2 часа. К реакционному раствору добавляют рассол, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 58 (44,1 мг, 0,10 ммоль, 97%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,27 (3H, т, J=6,8 Гц), 1,85-2,09 (8H, м), 2,33 (3H, с), 2,34-2,41 (1H, м), 2,59 (1H, с), 3,80 (3H, с), 4,15 (2H, кв., J=6,8 Гц), 6,38 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09-7,09 (4H, м), 7,20 (2H, д, J=8,8 Гц).
ESI-MC: m/z=435 (M+H)+.
Синтезированы пролекарства описанного выше соединения 3 (соединения 59-70).
Соединение 59
В качестве соединения 59: 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексилдиметилкарбамат
синтезируют по приведенной ниже методике.
Раствор 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (230 мг, 0,60 ммоль) в тетрагидрофуране (6,0 мл) перемешивают 10 минут при охлаждении льдом. К реакционному раствору добавляют гидрид натрия (26,4 мг, 0,66 ммоль), и полученную смесь перемешивают при той же температуре 20 минут. Добавляют по каплям диметил-карбамоилхлорид (84 мкл, 0,9 ммоль), и полученную смесь перемешивают при комнатной температуре 3 часа. Затем к реакционному раствору добавляют рассол, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат с использованием безводного сульфата натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 59 (95,6 мг, 0,21 ммоль, 35%) в виде светло-желтого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,93-2,04 (8H, м), 2,33 (3H, с), 2,71 (1H, с), 2,92 (6H, с), 3,80 (3H, с), 4,73-4,79 (1H, м), 6,37 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09-7,09 (4H, м), 7,20 (2H, J=8,8 Гц).
ESI-MC: m/z=450 (M+H)+.
Соединение 60
В качестве соединения 60: циклогексил-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-карбонат
синтезируют по приведенной ниже методике.
Раствор 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (250 мг, 0,66 ммоль) в тетрагидрофуране (2,2 мл) охлаждают льдом и добавляют гидрид натрия (63,4 мг, 1,45 ммоль), после чего перемешивают полученную смесь при той же температуре 10 минут. Затем к смеси добавляют циклогексил-1-йодэтилкарбонат (354 мг, 1,18 ммоль), и полученную смесь перемешивают при комнатной температуре 12 часов. К реакционному раствору добавляют рассол, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 60 (161 мг, 0,29 ммоль, 44%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,23-1,28 (4H, м), 1,31-1,40 (2H, м), 1,44-1,56 (4H, м), 1,70-1,79 (4H, м), 1,93-2,08 (4H, м), 2,32 (3H, с), 2,82 (1H, с), 3,79 (3H, с), 4,57-4,64 (1H, м), 4,67-4,71 (1H, м), 6,38 (1H, с), 6,84 (2H, д, J=8,4 Гц), 7,08-7,08 (4H, м), 7,19 (2H, J=8,4 Гц).
ESI-MC: m/z=505 (M+H)+.
Приведенные ниже соединения синтезированы таким же способом, как и при синтезе описанного выше соединения 59 и соединения 60.
ESI-MC: m/z=451 (M+H)+
ESI-MC: m/z=463 (M+H)+
Соединение 63
В качестве соединения 63: моно-4-гидрокси-4-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексиловый эфир янтарной кислоты
синтезируют по приведенной ниже методике.
Гидрид натрия (63,4 мг, 1,45 ммоль) добавляют к раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (250 мг, 0,66 ммоль) в ДМФА (3,3 мл), и полученную смесь перемешивают 30 минут. Добавляют янтарный ангидрид (99 мг, 0,99 ммоль) и полученную смесь перемешивают 12 часов. Затем к реакционному раствору добавляют 1 М соляную кислоту и этилацетат, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 63 (87,0 мг, 0,18 ммоль, 28%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,86-1,88 (2H, м), 1,96-2,02 (4H, м), 2,08-2,11 (3H, м), 2,32 (3H, с), 2,58-2,64 (4H, м), 3,81 (3H, с), 4,82-4,88 (1H, м), 6,38 (1H, с), 6,84 (2H, д, J=8,0 Гц), 7,09-7,09 (4H, м), 7,18 (2H, J=8,0 Гц).
ESI-MC: m/z=479 (M+H)+.
Соединение 64
В качестве соединения 64: циклогексил-(4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-окси)этилкарбонат
синтезируют по приведенной ниже методике.
Циклогексил-1-йодэтилкарбонат (567 мг, 1,90 ммоль), диизопропилэтиламин (460 мкл, 2,64 ммоль) и хлорид серебра (273 мг, 1,90 ммоль) добавляют к раствору 1-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (400 мг, 1,05 ммоль) в дихлорэтане (5,4 мл), и полученную смесь перемешивают при 80°С в течение 12 часов. Смеси дают охладиться до комнатной температуры, и реакционный раствор фильтруют через целлит. К фильтрату добавляют 1 М соляную кислоту и этилацетат, и затем полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают соединение 64 (31,9 мг, 0,058 ммоль, 5,1%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,15-1,34 (9H, м), 1,48-1,65 (4H, м), 1,83-1,98 (8H, м), 2,33 (3H, с), 2,49 (1H, с), 3,52-3,58 (1H, м), 3,64-3,71 (1H, м), 3,81 (3H, с), 4,92 (1H, кв., J=5,2 Гц), 6,39 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09-7,09 (4H, м), 7,19 (2H, J=8,8 Гц).
ESI-MC: m/z=549 (M+H)+.
Приведенные ниже соединения синтезированы таким же способом, как и при синтезе описанного выше соединения 59 и соединения 60.
ESI-MC: m/z=495 (M+H)+
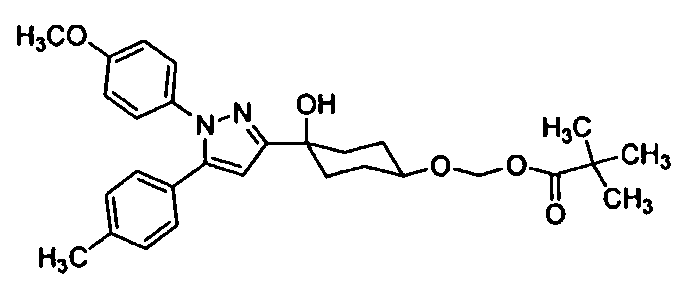
ESI-MC: m/z=493 (M+H)+
Соединение 67
В качестве соединения 67: 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-аминоацетат
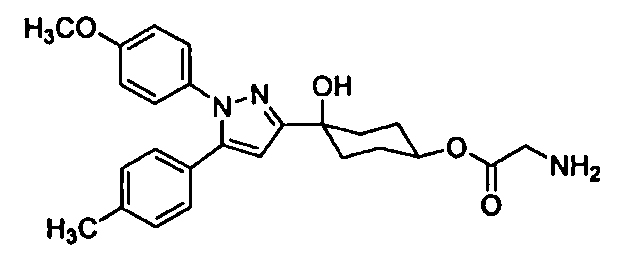
синтезируют по приведенной ниже методике.
К раствору 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-бензилоксикарбониламино-ацетата (промежуточное соединение 57) (33,2 мг, 0,058 ммоль) в метаноле (2,00 мл) при комнатной температуре добавляют 10%-ный палладий-на-угле (6,16 мг, 50% масс.), и полученную смесь перемешивают в атмосфере водорода 14 часов. Реакционный раствор фильтруют через целлит, и фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (NH-силикагель, хлороформ/метанол), получают соединение 67 (18,4 мг, 0,042 ммоль, 73%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,58-1,82 (2H, м), 1,88-2,12 (9H, м), 2,33 (3H, с), 3,43 (2H, с), 3,81 (3H, с), 4,88-4,94 (1H, м), 6,37 (1H, с), 6,83-6,87 (2H, м), 7,09-7,11 (4H, м), 7,18-7,22 (2H, м).
ESI-MC: m/z=436 (M+H)+.
Приведенное ниже соединение синтезировано таким же способом, как и при синтезе описанного выше соединения 67.
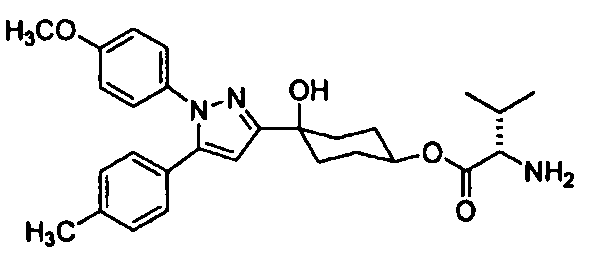
ESI-MC: m/z=460 (M-OH)+
Соединение 69
В качестве соединения 69: (S)-4-гидрокси-4-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-амино-3-метилбутаноат
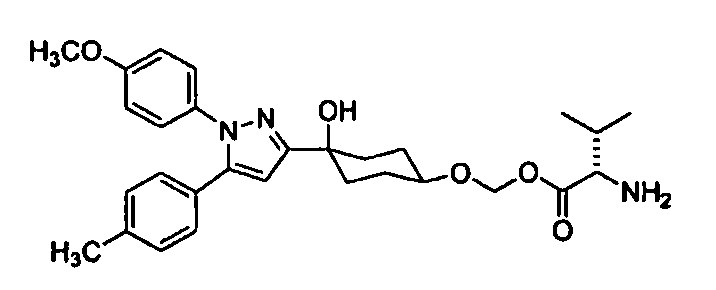
синтезируют по приведенной ниже методике.
К смешанному раствору (S)-4-гидрокси-4-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексилокси)метил-2-(бензилоксикарбониламино)-3-метилбутаноата (промежуточное соединение 59) (122 мг, 0,190 ммоль) в смеси диоксан/этанол (2,00 мл/2,00 мл), добавляют при комнатной температуре 2,2'-бипиридил (15,0 мг, 0,096 ммоль) и 10%-ный палладий-на-угле (49,0 мг, 40% масс.), и полученную смесь перемешивают в атмосфере водорода 14 часов. Реакционный раствор фильтруют через целлит, и фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, хлороформ/метанол), получают соединение 69 (38,6 мг, 0,076 ммоль, 40%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 0,92 (3H, д, J=6,8 Гц), 1,02 (3H, д, J=6,8 Гц), 1,90-2,12 (9H, м), 2,34 (3H, с), 3,32-3,34 (1H, м), 3,67-3,76 (1H, м), 3,81 (3H, с), 5,41 (1H, д, J=6,4 Гц), 5,47 (1H, д, J=6,4 Гц), 6,38 (1H, с), 6,83-6,87 (2H, м), 7,09-7,12 (4H, м), 7,18-7,22 (2H, м).
ESI-MC: m/z=490 (M-OH)+.
Соединение 70
В качестве соединения 70: 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексилдигидрофосфат
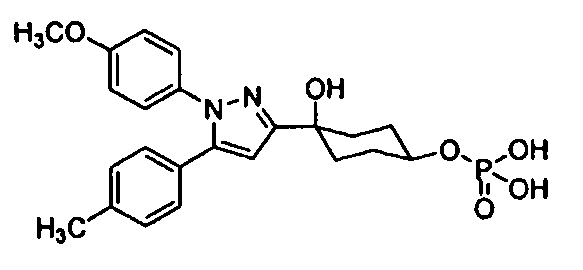
синтезируют по приведенной ниже методике.
К смешанному раствору дибензил-4-гидрокси-4-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексилфосфата (промежуточное соединение 60) (251 мг, 0,393 ммоль), метанола (2,6 мл) и этилацетата (2,6 мл) добавляют 10%-ный палладий-на-угле (41,8 мг, 50% масс.), и полученную смесь перемешивают в атмосфере водорода при комнатной температуре 2,5 часа. Реакционный раствор фильтруют через целлит, и фильтрат концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси дихлорметан/(диэтиловый эфир), получают соединение 70 (97,2 мг, 0,212 ммоль, 54%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, ДМСО-d6) δ: 1,68-1,98 (8H, м), 2,28 (3H, с), 3,76 (3H, с), 4,13 (1H, шир.), 4,92 (1H, шир.), 6,53 (1H, с), 6,91-6,95 (2H, м), 7,08-7,17 (6H, м).
ESI-MC: m/z=459 (M+H)+.
Промежуточное соединение 1
В качестве промежуточного соединения 1: 8-этинил-1,4-диоксаспиро[4.5]декан-8-ол
синтезируют по приведенной ниже методике.
К раствору триметилсилилацетилена (27,1 мл, 0,192 моль) в тетрагидрофуране (300 мл) по каплям при -76°С в течение 30 минут добавляют 2,77 М раствор н-бутиллития (раствор в н-гексане, 69,3 мл, 0,192 ммоль), и полученную смесь перемешивают при той же температуре 30 минут. Затем к смеси при -74°С в течение 30 минут добавляют по каплям раствор 1,4-диоксаспиро[4.5]декан-8-она (25,0 г, 0,160 ммоль) в тетрагидрофуране (100 мл), и полученную смесь перемешивают при той же температуре 1 час и 30 минут. Реакционный раствор выливают в насыщенный водный раствор хлорида аммония, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении.
К остатку добавляют метанол (320 мл), чтобы растворить его, и добавляют карбонат калия (55,3 г, 0,400 моль). Полученную смесь перемешивают при комнатной температуре 2 часа, и реакционный раствор концентрируют при пониженном давлении. К остатку добавляют дистиллированную воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают дистиллированной водой и рассолом. Органический слой сушат над безводным сульфатом натрия и концентрируют в вакууме. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 1 (29,1 мг, 0,160 моль, 100%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,75-2,03 (9H, м), 2,49 (1H, м), 3,95 (4H, с).
ESI-MC: m/z=165 (M-OH)+.
Промежуточное соединение 2
В качестве промежуточного соединения 2: 1-(3-гидрокси-3-(п-толил)пропин-1-ил)циклогексанол
синтезируют по приведенной ниже методике.
К раствору 1-этинилциклогексанола (500 мг, 4,02 ммоль) в тетрагидрофуране (20 мл) по каплям при -78 оС добавляют 2,77 М раствор н-бутиллития (раствор в н-гексане, 3,6 мл, 9,90 ммоль), и полученную смесь перемешивают при той же температуре 1 час. К реакционному раствору при -78°C добавляют п-толуальдегид (0,52 мл, 4,40 ммоль), и полученному раствору дают постепенно нагреться до комнатной температуры при перемешивании. К реакционному раствору добавляют дистиллированную воду и 1 М соляную кислоту, чтобы подкислить раствор, и затем полученный раствор экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 2 (598 мг, 2,44 ммоль, 60%) в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,18-1,30 (1H, м), 1,47-1,74 (7H, м), 1,89-1,98 (2H, м), 2,08 (1H, шир.с), 2,22 (1H, шир.с), 2,36 (3H, с), 5,47 (1H, с), 7,19 (2H, д, J=8,0 Гц), 7,43 (2H, д, J=8,0 Гц).
ESI-MC: m/z=227 (M-OH)+.
Промежуточное соединение 3
В качестве промежуточного соединения 3: 8-(3-гидрокси-3-(п-толил)пропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ол
синтезируют по приведенной ниже методике.
К раствору 8-этинил-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 1) (15,0 г, 82,3 ммоль) в тетрагидрофуране (165 мл) по каплям при -72°С в течение 25 минут добавляют 2,77 М раствор н-бутиллития (раствор в н-гексане, 62,4 мл, 172,9 ммоль), и полученную смесь перемешивают при той же температуре 30 минут. Затем к смеси при -72°C в течение 5 минут по каплям добавляют п-толуальдегид (10,2 мл, 86,4 ммоль), и полученную смесь перемешивают при той же температуре 30 минут. Реакционному раствору дают постепенно нагреться до комнатной температуры и затем выливают в насыщенный водный раствор хлорида аммония. Реакционный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 3 (17,7 мг, 58,5 ммоль, 71%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,72-1,85 (4H, м), 1,90-2,04 (4H, м), 2,35 (3H, с), 2,55 (1H, с), 2,78 (1H, д, J=6,0 Гц), 3,93 (4H, с), 5,44 (1H, д, J=6,0 Гц), 7,17 (2H, д, J=8,0 Гц), 7,40 (2H, д, J=8,0 Гц).
ESI-MC: m/z=285 (M-OH)+.
Промежуточное соединение 4
В качестве промежуточного соединения 4: 8-(3-гидрокси-3-(4-метоксифенил)пропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ол
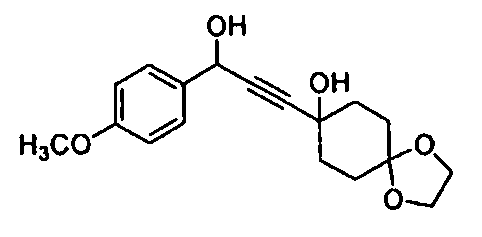
синтезируют по приведенной ниже методике.
К раствору 8-этинил-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 1) (5,02 г, 27,6 ммоль) в тетрагидрофуране (100 мл) по каплям при -72°С в течение 15 минут добавляют 2,63 М раствор н-бутиллития (раствор в н-гексане, 22,0 мл, 57,9 ммоль), и полученную смесь перемешивают при той же температуре 60 минут. Затем к смеси при -72°C в течение 10 минут по каплям добавляют 4-метоксибензальдегид (3,52 мл, 28,9 ммоль), и полученную смесь перемешивают при той же температуре 60 минут. Реакционному раствору дают нагреться до комнатной температуры и затем выливают в насыщенный водный раствор хлорида аммония. Реакционный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 4 (7,46 г, 23,4 ммоль, 85%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,73-1,85 (4H, м), 1,91-2,04 (4H, м), 2,32 (1H, с), 2,52 (1H, д, J=6,1 Гц), 3,81 (3H, с), 3,94 (4H, с), 5,44 (1H, д, J=6,1 Гц), 6,89 (2H, д, J=8,5 Гц), 7,44 (2H, д, J=8,5 Гц).
Промежуточное соединение 5
В качестве промежуточного соединения 5: 8-(3-(4-хлорфенил)-3-гидроксипропин-1-ил)-1,4-диоксаспиро[4.5]декан-8-ол

синтезируют по приведенной ниже методике.
К раствору 8-этинил-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 1) (5,03 г, 27,6 ммоль) в тетрагидрофуране (100 мл) по каплям при -72°С в течение 15 минут добавляют 2,63 М раствор н-бутиллития (раствор в н-гексане, 22,1 мл, 57,9 ммоль), и полученную смесь перемешивают при той же температуре 60 минут. Затем к смеси при -72°C в течение 10 минут порциями добавляют 4-хлорбензальдегид (4,06 г, 28,9 ммоль), и полученную смесь перемешивают при той же температуре 60 минут. Реакционному раствору дают нагреться до комнатной температуры и затем выливают в насыщенный водный раствор хлорида аммония. Реакционный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 5 (8,13 г, 25,2 ммоль, 91%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,68-1,81 (4H, м), 1,86-1,90 (4H, м), 3,55 (1H, с), 3,90 (4H, с), 4,03 (1H, д, J=4,2 Гц), 5,41 (1H, д, J=4,2 Гц), 7,28 (2H, д, J=8,3 Гц), 7,41 (2H, д, J=8,3 Гц).
Приведенные ниже соединения синтезированы таким же способом, как и при синтезе описанных выше промежуточных соединений 1-5.
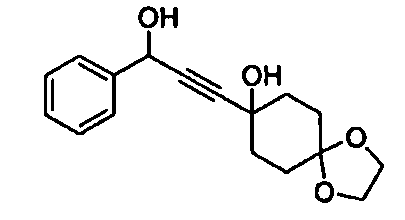
ESI-MC: m/z=271 (M-OH)+
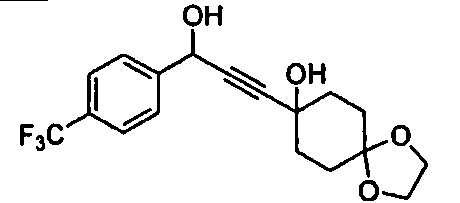
ESI-MC: m/z=339 (M-OH)+
Промежуточное соединение 8
В качестве промежуточного соединения 8: 3-(1-гидрокси-циклогексил)-1-(п-толил)-2-пропин-1-он
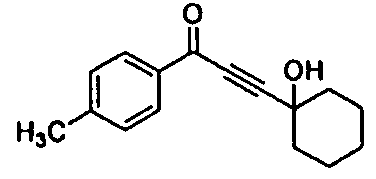
синтезируют по приведенной ниже методике.
Диоксид марганца (1,15 г, 13,2 ммоль) добавляют к раствору 1-(3-гидрокси-3-(п-толил)пропин-1-ил)циклогексанола (промежуточное соединение 2) (593 мг, 2,42 ммоль) в дихлорметане (20 мл), и полученную смесь перемешивают при комнатной температуре 5 часов. Реакционный раствор фильтруют через целит, и фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 8 (534 мг, 2,20 ммоль, 91%) в виде светло-желтого масляного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,28-1,39 (1H, м), 1,55-1,84 (7H, м), 2,02-2,11 (2H, м), 2,23 (1H, шир.с), 2,43 (3H, с), 7,28 (2H, д, J=8,0 Гц), 8,02 (2H, д, J=8,0 Гц).
Промежуточное соединение 9
В качестве промежуточного соединения 9: 3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)-2-пропин-1-он
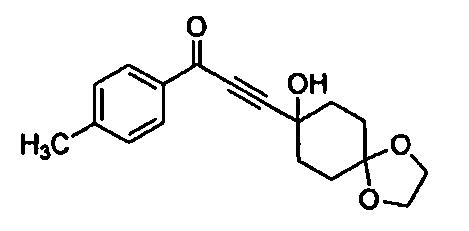
синтезируют по приведенной ниже методике.
Диоксид марганца (29,6 г, 289 ммоль) добавляют к раствору 8-(3-гидрокси-3-(п-толил)пропин-1-ил)-1,4-диоксаспиро[4.5]-декан-8-ола (промежуточное соединение 3) (17,5 г, 57,9 ммоль) в дихлорметане (289 мл), и полученную смесь перемешивают при комнатной температуре 15 часов. Реакционный раствор фильтруют через целит, и фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 9 (14,3 г, 47,6 ммоль, 82%) в виде масляного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,79-1,85 (2H, м), 1,87-1,93 (2H, м), 2,04-2,15 (4H, м), 2,20 (1H, с), 2,43 (3H, с), 3,97 (4H, с), 7,28 (2H, д, J=8,0 Гц), 8,00 (2H, д, J=8,0 Гц).
ESI-MC: m/z=284 (M-OH)+.
Промежуточное соединение 10
В качестве промежуточного соединения 10: 3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(6-метилпиридин-3-ил)-2-пропин-1-он
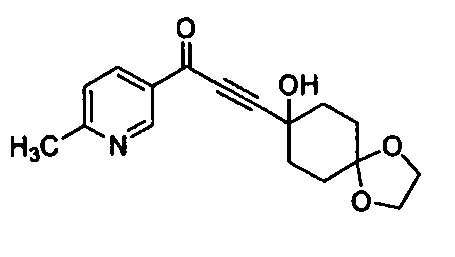
синтезируют по приведенной ниже методике.
К раствору 8-этинил-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 1) (592 мг, 3,25 ммоль) в тетрагидрофуране (6 мл) по каплям при -78°С в течение 5 минут добавляют 2,63 М раствор н-бутиллития (раствор в н-гексане, 2,6 мл, 6,82 ммоль), и полученную смесь перемешивают при той же температуре 30 минут. Затем к смеси при -78°С в течение 20 минут по каплям добавляют раствор N-метокси-N-метил-6-метил-никотинамида (614,5 мг, 3,41 ммоль) в тетрагидрофуране (5 мл), и полученную смесь перемешивают при той же температуре 30 минут. Реакционному раствору дают нагреться до комнатной температуры и затем выливают в насыщенный водный раствор хлорида аммония. Реакционный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 10 (626,3 г, 2,08 ммоль, 65%) в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,76-1,83 (2H, м), 1,87-1,94 (2H, м), 2,04-2,10 (2H, м), 2,12-2,19 (2H, м), 2,30 (1H, с), 2,66 (3H, с), 3,97 (4H, с), 7,29 (1H, д, J=8,0 Гц), 8,22 (1H, дд, J=2,4, 8,0 Гц), 9,21 (1H, д, J=2,4 Гц).
ESI-MC: m/z=284 (M-OH)+.
Промежуточное соединение 11
В качестве промежуточного соединения 11: 3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-1-(4-метоксифенил)-2-пропин-1-он
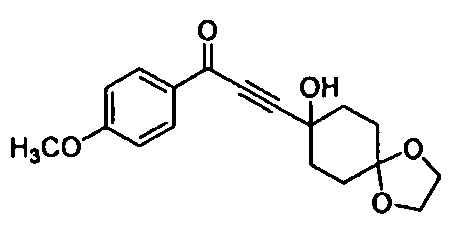
синтезируют по приведенной ниже методике.
Диоксид марганца (9,69 г, 112 ммоль) добавляют к раствору 8-(3-гидрокси-3-(4-метоксифенил)пропин-1-ил)-1,4-диоксаспиро-[4.5]-декан-8-ола (промежуточное соединение 4) (7,10 г, 22,3 ммоль) в дихлорметане (100 мл), и полученную смесь перемешивают при комнатной температуре 18 часов. Реакционный раствор фильтруют через целит, и фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 11 (5,45 г, 17,2 ммоль, 77%) в виде масляного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,78-1,93 (4H, м), 2,03-2,17 (4H, м), 2,27 (1H, с), 3,89 (3H, с), 3,97 (4H, с), 6,95 (2H, д, J=9,0 Гц), 8,08 (2H, д, J=9,0 Гц).
ESI-MC: m/z=299 (M-OH)+.
Промежуточное соединение 12
В качестве промежуточного соединения 12: 1-(4-хлорфенил)-3-(8-гидрокси-1,4-диоксаспиро[4.5]декан-8-ил)-2-пропин-1-он
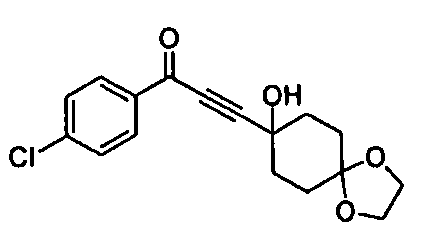
синтезируют по приведенной ниже методике.
Диоксид марганца (10,4 г, 119 ммоль) добавляют к раствору 8-(3-(4-хлорфенил)-3-гидроксипропин-1-ил)-1,4-диоксаспиро-[4.5]декан-8-ола (промежуточное соединение 5) (7,70 г, 23,9 ммоль) в дихлорметане (120 мл), и полученную смесь перемешивают при комнатной температуре 18 часов. Реакционный раствор фильтруют через целит, и фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 12 (5,45 г, 17,0 ммоль, 71%) в виде масляного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,77-1,94 (4H, м), 2,04-2,19 (4H, м), 2,15 (1H, с), 3,98 (4H, с), 7,47 (2H, д, J=8,5 Гц), 8,04 (2H, д, J=8,5 Гц).
ESI-MC: m/z=303 (M-OH)+.
Приведенные ниже соединения синтезированы таким же способом, как и при синтезе описанных выше промежуточных соединений 8-12.
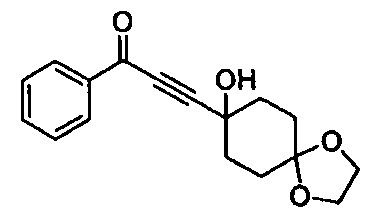
ESI-MC: m/z=269 (M-OH)+
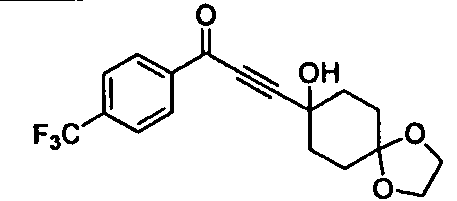
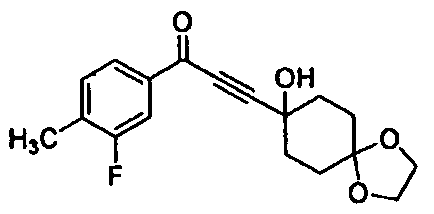
ESI-MC: m/z=319 (M+H)+
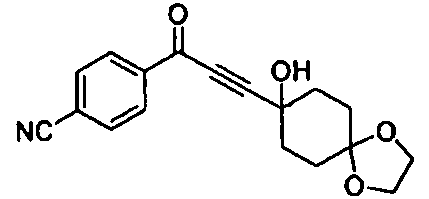
ESI-MC: m/z=312 (M+H)+
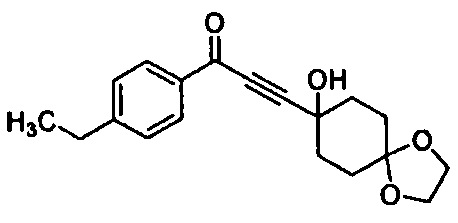
ESI-MC: m/z=315 (M+H)+
Промежуточное соединение 18
В качестве промежуточного соединения 18: 8-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]-декан-8-ол
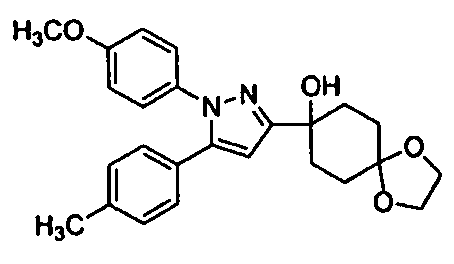
синтезируют по приведенной ниже методике.
Триэтиламин (5,87 мл, 42,1 ммоль) добавляют по каплям к раствору гидрохлорида 4-метоксифенилгидразина (7,35 г, 42,1 ммоль) в этаноле (76,6 мл), и полученную смесь перемешивают при комнатной температуре 30 минут. К реакционному раствору по каплям добавляют раствор 3-(8-гидрокси-1,4-диоксаспиро[4.5]-декан-8-ил)-1-(п-толил)-2-пропин-1-она (промежуточное соединение 9) (11,5 г, 38,5 ммоль) в этаноле (76,6 мл), и полученную смесь перемешивают при комнатной температуре 15 часов. Затем реакционный раствор концентрируют при пониженном давлении. К остатку добавляют воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают 1 М соляной кислотой, дистиллированной водой и рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 18 (14,7 г, 35,0 ммоль, 91%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,71-1,74 (2H, м), 1,99-2,25 (6H, м), 2,33 (3H, с), 2,71 (1H, с), 3,81 (3H, с), 3,96-4,01 (4H, м), 6,39 (1H, с), 6,84 (2H, д, J=8,0 Гц), 7,09 (4H, с), 7,21 (2H, д, J=8,0 Гц).
ESI-MC: m/z=421 (M+H)+.
Промежуточное соединение 19
В качестве промежуточного соединения 19: 8-(1-(4-метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ол
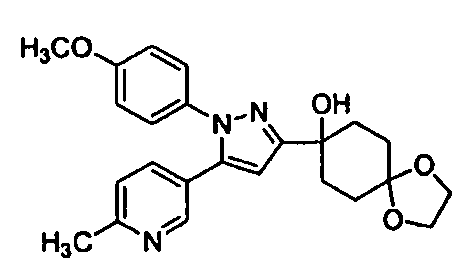
синтезируют по приведенной ниже методике.
Триэтиламин (286 мкл, 2,06 ммоль) добавляют по каплям к раствору гидрохлорида 4-метоксифенилгидразина (359 мг, 2,06 ммоль) в этаноле (4 мл), и полученную смесь перемешивают при комнатной температуре 30 минут. К реакционному раствору по каплям добавляют раствор 3-(8-гидрокси-1,4-диоксаспиро[4.5]-декан-8-ил)-1-(6-метилпиридин-3-ил)-2-пропин-1-она (промежуточное соединение 10) (563,7 мг, 1,87 ммоль) в этаноле (5,4 мл), и полученную смесь перемешивают при комнатной температуре 22 часа. Затем реакционный раствор концентрируют при пониженном давлении. К остатку добавляют воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают дистиллированной водой и рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 19 (177 мг, 0,42 ммоль, 22%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,72-1,75 (2H, м), 2,00-2,03 (2H, м), 2,07-2,14 (2H, м), 2,19-2,26 (2H, м), 2,55 (3H, с), 2,65 (1H, с), 3,81 (3H, с), 3,96-4,03 (4H, м), 6,47 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,06 (1H, д, J=8,0 Гц), 7,20 (2H, д, J=8,8 Гц), 7,33 (1H, дд, J=2,2, 8,0 Гц), 8,40 (1H, д, J=2,2 Гц).
ESI-MC: m/z=422 (M+H)+.
Промежуточное соединение 20
В качестве промежуточного соединения 20: 8-(1,5-бис(4-метоксифенил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ол
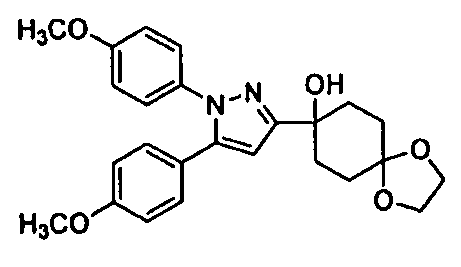
синтезируют по приведенной ниже методике.
К раствору гидрохлорида 4-метоксифенилгидразина (470 мг, 2,69 ммоль) и триэтиламина (0,74 мл, 5,41 ммоль) в этаноле (4,5 мл) добавляют раствор 3-(8-гидрокси-1,4-диоксаспиро[4.5]-декан-8-ил)-1-(4-метоксифенил)-2-пропин-1-она (промежуточное соединение 11) (700 мг, 2,24 ммоль) в этаноле (4,5 мл), и полученную смесь перемешивают при комнатной температуре 20 часов. Реакционный раствор концентрируют при пониженном давлении, и к остатку добавляют дистиллированную воду, после чего полученную смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 20 (864 мг, 1,98 ммоль, 88%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,68-1,77 (2H, м), 1,96-2,26 (6H, м), 2,70 (1H, шир.с), 3,80 (3H, с), 3,81 (3H, с), 3,94-4,04 (4H, м), 6,37 (1H, с), 6,81 (2H, д, J=8,8 Гц), 6,85 (2H, д, J=8,8 Гц), 7,13 (2H, д, J=8,8 Гц), 7,21 (2H, д, J=8,8 Гц).
ESI-MC: m/z=437 (M+H)+.
Промежуточное соединение 21
В качестве промежуточного соединения 21: 8-(5-(4-хлор-фенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)-1,4-диоксаспиро-[4.5]декан-8-ол
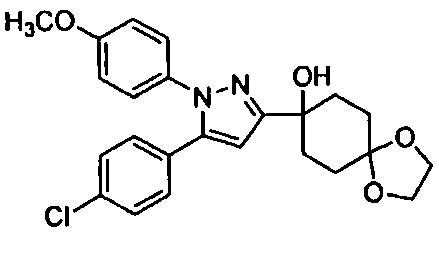
синтезируют по приведенной ниже методике.
Триэтиламин (0,730 мл, 5,24 ммоль) добавляют по каплям к раствору гидрохлорида 4-метоксифенилгидразина (457 мг, 2,62 ммоль) в этаноле (4,4 мл), и полученную смесь перемешивают при комнатной температуре 30 минут. К реакционному раствору по каплям добавляют раствор 1-(4-хлорфенил)-3-(8-гидрокси-1,4-диоксаспиро[4.5]-декан-8-ил)-2-пропин-1-она (промежуточное соединение 12) (700 мг, 2,18 ммоль) в этаноле (4,4 мл), и полученную смесь перемешивают при комнатной температуре 14 часов. Затем реакционный раствор концентрируют при пониженном давлении. К остатку добавляют воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают 1 М соляной кислотой, дистиллированной водой и рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 21 (756 мг, 1,71 ммоль, 79%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,69-1,76 (2H, м), 1,97-2,25 (6H, м), 2,66 (1H, шир.с), 3,82 (3H, с), 3,94-4,03 (4H, м), 6,43 (1H, с), 6,85-6,87 (2H, м), 7,13 (2H, д, J=8,4 Гц), 7,19 (2H, д, J=8,4 Гц), 7,25-7,27 (2H, м).
ESI-MC: m/z=441 (M+H)+.
Промежуточное соединение 22
В качестве промежуточного соединения 22: 8-(1-(4-хлор-фенил)-5-(п-толил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ол
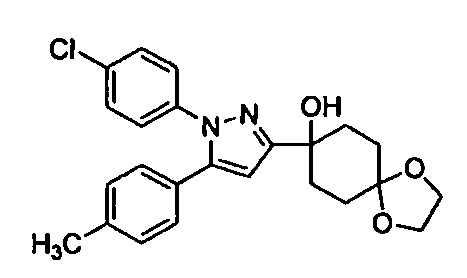
синтезируют по приведенной ниже методике.
Триэтиламин (5,87 мл, 42,1 ммоль) добавляют по каплям к раствору гидрохлорида 4-хлорфенилгидразина (418 мг, 2,33 ммоль) в этаноле (4,8 мл), и полученную смесь перемешивают при комнатной температуре 30 минут. К реакционному раствору по каплям добавляют раствор 3-(8-гидрокси-1,4-диоксаспиро[4.5]-декан-8-ил)-1-(п-толил)-2-пропин-1-она (промежуточное соединение 9) (698 мг, 2,32 ммоль) в этаноле (4,7 мл), и полученную смесь перемешивают при комнатной температуре 14 часов. Затем реакционный раствор концентрируют при пониженном давлении. К остатку добавляют воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают дистиллированной водой и рассолом, затем сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 22 (948 мг, 2,23 ммоль, 96%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,71-1,75 (2H, м), 1,98-2,14 (4H, м), 2,17-2,25 (2H,м), 2,36 (3H, с), 2,62 (1H, с), 3,96-4,03 (4H, м), 6,41 (1H, с), 7,09 (2H, д, J=8,0 Гц), 7,13 (2H, д, J=8,0 Гц), 7,22-7,30 (4H, м).
ESI-MC: m/z=407 (M-OH)+.
Приведенные ниже соединения синтезированы таким же способом, как и при синтезе описанных выше промежуточных соединений 18-22.
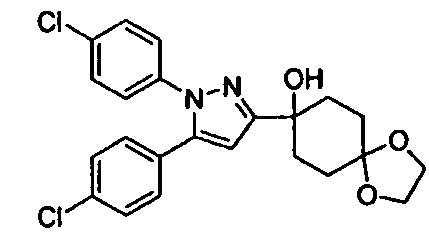
ESI-MC: m/z=445 (M+H)+
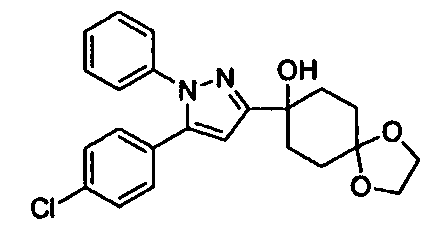
ESI-MC: m/z=411 (M+H)+
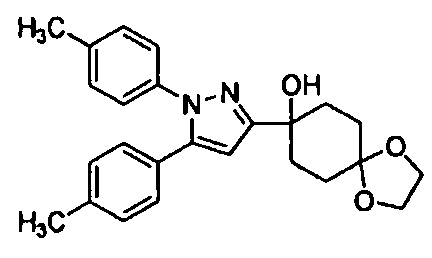
ESI-MC: m/z=387 (M-OH)+
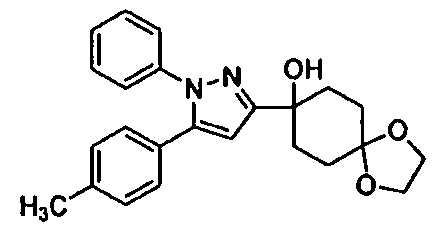
ESI-MC: m/z=373 (M-OH)+
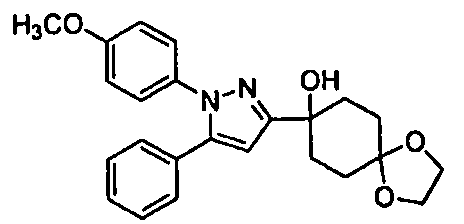

ESI-MC: m/z=391 (M+H)+
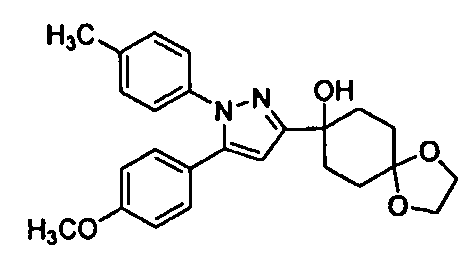
ESI-MC: m/z=421 (M+H)+
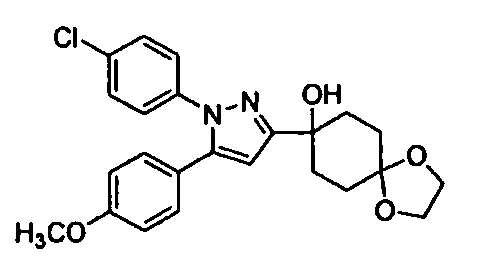
ESI-MC: m/z=441 (M+H)+
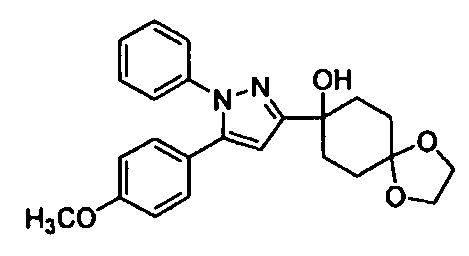
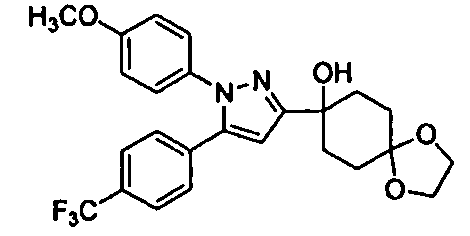
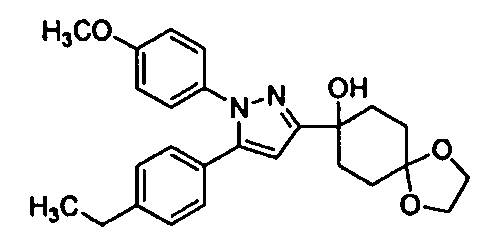
ESI-MC: m/z=425 (M+H)+
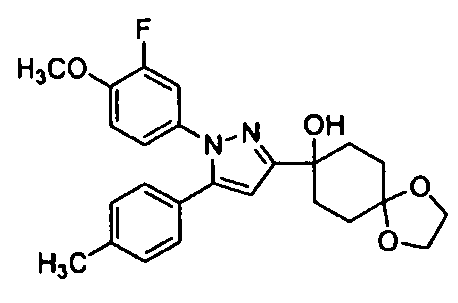
ESI-MC: m/z=425 (M+H)+
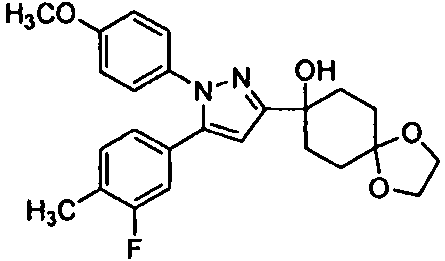
ESI-MC: m/z=439 (M+H)+
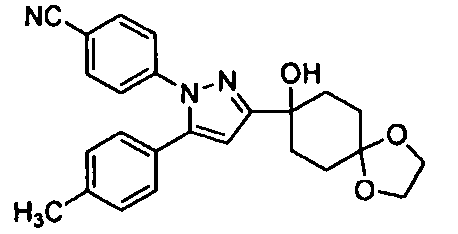
ESI-MC: m/z=416 (M+H)+
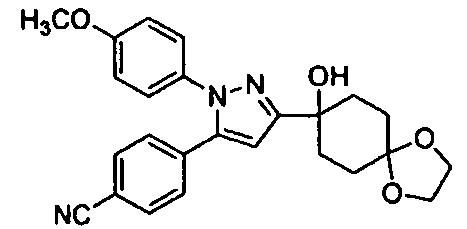
ESI-MC: m/z=432 (M+H)+
Промежуточное соединение 38
В качестве промежуточного соединения 38: 1-(1-(4-метокси-фенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диил-диацетат
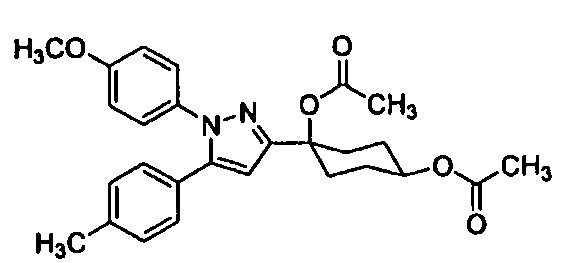
синтезируют по приведенной ниже методике.
Уксусный ангидрид (0,187 мл, 1,98 ммоль), пиридин (0,192 мл, 2,38 ммоль) и 4-диметиламинопиридин (48,4 мг, 0,396 ммоль) добавляют к суспензии 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (300 мг, 0,793 ммоль) в дихлорметане (2,6 мл), и полученную смесь перемешивают при комнатной температуре 60 часов. К смеси снова добавляют 4-диметиламинопиридин (48,4 мг, 0,396 ммоль), и полученную смесь перемешивают при комнатной температуре еще 6 часов. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 38 (297 мг, 0,642 ммоль, 81%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,74-1,82 (2H, м), 1,92-1,98 (2H, м), 2,01-2,08 (5H, м), 2,10 (3H, с), 2,32 (3H, с), 2,70-2,77 (2H, м), 3,80 (3H, с), 4,80-4,89 (1H, м), 6,38 (1H, с), 6,83 (2H, д, J=8,8 Гц), 7,08 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MC: m/z=463 (M+H)+.
Промежуточное соединение 39
В качестве промежуточного соединения 39: с-4-метокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-илацетат
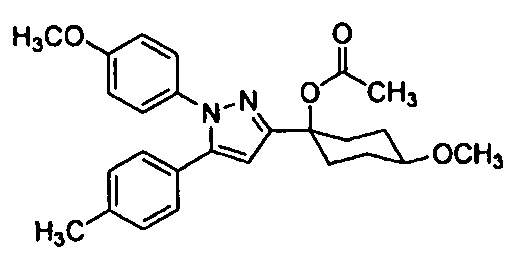
синтезируют по приведенной ниже методике.
К раствору с-4-гидрокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-илацетата (промежуточное соединение 84) (0,150 г, 0,357 ммоль) в N,N-диметилформамиде (1,8 мл) при перемешивании и охлаждении льдом добавляют 55%-ный гидрид натрия (23,4 мг, 0,535 ммоль) и метилйодид (29,0 мкл, 0,464 ммоль), и полученную смесь перемешивают при комнатной температуре 9 часов. К реакционному раствору при перемешивании и охлаждении льдом добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 39 (124 мг, 0,284 ммоль, 80%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,60-1,68 (2H, м), 1,94-2,03 (4H, м), 2,08 (3H, с), 2,32 (3H, с), 2,69-2,76 (2H, м), 3,24-3,33 (1H, м), 3,39 (3H, с), 3,80 (3H, с), 6,37 (1H, с), 6,83 (2H, д, J=8,8 Гц), 7,08 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MC: m/z=435 (M+H)+.
Промежуточное соединение 40
В качестве промежуточного соединения 40: 4-(4-фтор-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-с-4-гидрокси-циклогексан-r-1-илацетат
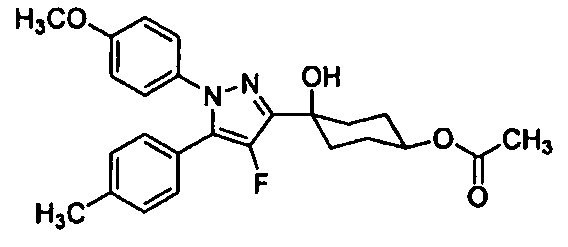
синтезируют по приведенной ниже методике.
SelectflourTM (120 мг, 0,340 ммоль) добавляют к раствору с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-циклогексан-r-1-илацетата (соединение 12) (130 мг, 0,309 ммоль) в ацетонитриле (3,09 мл), и полученную смесь перемешивают при комнатной температуре 3 часа. К реакционному раствору добавляют насыщенный водный раствор тиосульфата натрия, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 40 (61 мг, 0,140 ммоль, 45%) в виде светло-желтого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,89-2,15 (11H, м), 2,35 (3H, м), 2,73 (1H, с), 3,81 (3H, с), 4,82-4,89 (1H, м), 6,84-6,86 (2H, м), 7,10-7,18 (6H, м).
ESI-MC: m/z=439 (M+H)+.
Промежуточное соединение 41
В качестве промежуточного соединения 41: 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-4-оксоциклогексан-1-илацетат
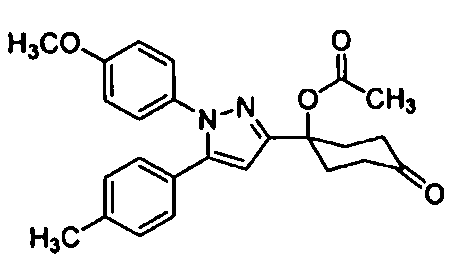
синтезируют по приведенной ниже методике.
Реагент Десс-Мартина (172 мг, 0,405 ммоль) добавляют к раствору с-4-гидрокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-илацетата (промежуточное соединение 84) (142 мг, 0,338 ммоль) в дихлорметане (3,38 мл), и полученную смесь перемешивают при 0°С в течение 2 часов. Реакционный раствор фильтруют через целит, и остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 41 (120 мг, 0,287 ммоль, 85%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,13 (3H, с), 2,33 (3H, с), 2,44-2,52 (4H, м), 2,59-2,65 (2H, м), 2,93-2,96 (2H, м), 3,81 (3H, с), 6,45 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,08 (4H, с), 7,20 (2H, д, J=8,8 Гц).
ESI-MC: m/z=419 (M+H)+.
Промежуточное соединение 42
В качестве промежуточного соединения 42: с-4-гидрокси-(4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-4-циклогексан-r-1-карбальдегид
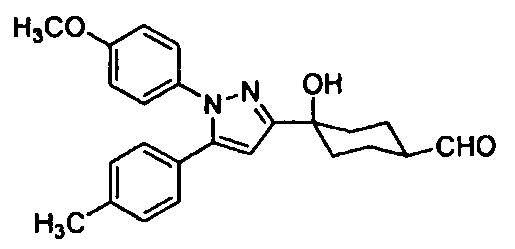
синтезируют по приведенной ниже методике.
К раствору (метоксиметил)трифенилфосфонийхлорида (546,3 мг, 1,59 ммоль) в тетрагидрофуране (1,3 мл) при -40°С добавляют трет-бутоксид калия (178,7 мг, 1,59 ммоль), и полученную смесь перемешивают при той же температуре 60 минут. К реакционному раствору при -40°С по каплям добавляют раствор 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-циклогексан-1-она (соединение 4) (200 мг, 0,53 ммоль) в тетрагидрофуране (1,35 мл), и затем полученную смесь перемешивают при комнатной температуре 1,5 часа. К реакционному раствору при 0°С добавляют 6 М водный раствор соляной кислоты, и полученную смесь перемешивают 12 часов. К реакционному раствору добавляют дистиллированную воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия и рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 42 (87,5 мг, 0,23 ммоль, 42%) в виде бесцветного масляного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,88-1,96 (6H, м), 2,09-2,11 (2H, м), 2,25-2,36 (5H, м), 3,80 (3H, с), 6,39 (1H, с), 6,84 (2H, д, J=8,8 Гц), 7,09-7,14 (4H, м), 7,20 (2H, д, J=8,8 Гц), 9,66 (1H, д, J=2,0 Гц).
ESI-MC: m/z=391 (M+H)+.
Промежуточное соединение 43
В качестве промежуточного соединения 43: этил-1,4-диоксаспиро[4.5]декан-8-карбоксилат
синтезируют по приведенной ниже методике.
Этиленгликоль (3,6 мл, 64,6 ммоль) и моногидрат п-толуол-сульфоновой кислоты (1,12 г, 5,88 ммоль) добавляют к раствору этил-4-оксоциклогексанкарбоксилата (10,0 г, 58,8 ммоль) в толуоле (196 мл), и полученный раствор нагревают при кипении с обратным холодильником при 150°С. Полученный раствор перемешивают 18 часов. К реакционному раствору добавляют насыщенный раствор бикарбоната натрия, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 43 (12,3 г, 57,4 ммоль, 98%) в виде бесцветного масляного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,25 (3H, т, J=7,2 Гц), 1,51-1,61 (2H, м), 1,75-1,86 (4H, м), 1,90-1,98 (2H, м), 2,29-2,38 (1H, с), 3,95 (4H, с), 4,13 (2H, кв., J=7,2 Гц).
ESI-MC: m/z=215 (M+H)+.
Промежуточное соединение 44
В качестве промежуточного соединения 44: этил-8-(бензил-оксиметил)-1,4-диоксаспиро[4.5]декан-8-карбоксилат
синтезируют по приведенной ниже методике.
К раствору этил-1,4-диоксаспиро[4.5]декан-8-карбоксилата (промежуточное соединение 43) (500 мг, 2,33 ммоль) в тетрагидрофуране (7,8 мл) при -78°С добавляют 0,5 М раствор бис(триметилсилил)амида калия (раствор в толуоле, 4,67 мл, 2,33 ммоль), и полученную смесь перемешивают 20 минут. Затем к смеси добавляют бензилхлорметиловый эфир (0,379 мл, 2,45 ммоль), и полученную смесь перемешивают при -78°С в течение 30 минут и при комнатной температуре 1,5 часа. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония, и полученный раствор экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. К остатку добавляют 3 М водный раствор гидроксида натрия (1,0 мл), и полученную смесь перемешивают 4 часа. Реакционный раствор экстрагируют эфиром, и органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 44 (279 мг, 0,834 ммоль, 36%) в виде бесцветного масляного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,24 (3H, т, J=7,2 Гц), 1,52-1,68 (6H, м), 2,16-2,23 (2H, м), 3,46 (2H, с), 3,88-3,96 (4H, м), 4,17 (2H, кв., J=7,2 Гц), 4,49 (2H, с), 7,25-7,39 (5H, м).
ESI-MC: m/z=335 (M+H)+.
Промежуточное соединение 45
В качестве промежуточного соединения 45: (8-(бензил-оксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)метанол
синтезируют по приведенной ниже методике.
К раствору этил-8-(бензилоксиметил)-1,4-диоксаспиро[4.5]-декан-8-карбоксилата (промежуточное соединение 44) (279 мг, 0,834 ммоль) в тетрагидрофуране (4,2 мл) при перемешивании и охлаждении льдом добавляют боргидрид лития (91,0 мг, 4,17 ммоль), и полученную смесь перемешивают при 70°С в течение 4 часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 45 (183 мг, 0,625 ммоль, 75%) в виде бесцветного масляного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,48-1,66 (8H, м), 2,76 (1H, т, J=6,0 Гц), 3,43 (2H, с), 3,60 (2H, д, J=6,0 Гц), 3,91-3,95 (4H, м), 4,52 (2H, с), 7,27-7,38 (5H, м).
ESI-MC: m/z=293 (M+H)+.
Промежуточное соединение 46
В качестве промежуточного соединения 46: (8-(бензилокси-метил)-1,4-диоксаспиро[4.5]декан-8-карбальдегид
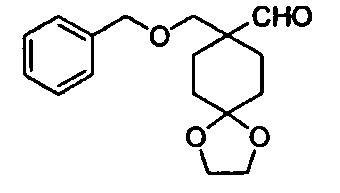
синтезируют по приведенной ниже методике.
К раствору (8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)метанола (промежуточное соединение 45) (183 мг, 0,625 ммоль) в ДМСО (2,1 мл) добавляют 50%-ный комплекс (триоксидсеры)-пиридин (596 мг, 1,87 ммоль) и триэтиламин (0,522 мл, 3,75 ммоль), и полученную смесь перемешивают при комнатной температуре 20 минут. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой последовательно промывают 20%-ным водным раствором лимонной кислоты, насыщенным раствором бикарбоната натрия и рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 46 (172 мг, 0,592 ммоль, 95%) в виде бесцветного масляного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,55-1,67 (6H, м), 2,03-2,11 (2H, м), 3,45 (2H, с), 3,90-3,95 (4H, м), 4,47 (2H, с), 7,25-7,36 (5H, м), 9,60 (1H, с).
ESI-MC: m/z=291 (M+H)+.
Промежуточное соединение 47
В качестве промежуточного соединения 47: 8-(бензилокси-метил)-8-этинил-1,4-диоксаспиро[4.5]декан
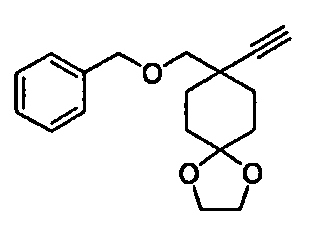
синтезируют по приведенной ниже методике.
К раствору 8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-карбальдегида (промежуточное соединение 46) (100 мг, 0,344 ммоль) в метаноле (5,2 мл) при перемешивании и охлаждении льдом добавляют карбонат калия (143 мг, 1,03 ммоль) и диметил-1-диазо-2-оксопропилфосфонат (165 мг, 0,861 ммоль), и полученную смесь перемешивают при комнатной температуре 1 час. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 47 (88,9 мг, 0,310 ммоль, 90%) в виде бесцветного масляного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,52-1,71 (4H, м), 1,77-1,85 (2H, м), 1,94-2,04 (2H, м), 2,19 (1H, с), 3,38 (2H, с), 3,89-3,99 (4H, с), 4,61 (2H, с), 7,25-7,37 (5H, м).
ESI-MC: m/z=287 (M+H)+.
Промежуточное соединение 48
В качестве промежуточного соединения 48: 3-(8-(бензилокси-метил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)пропин-1-ол
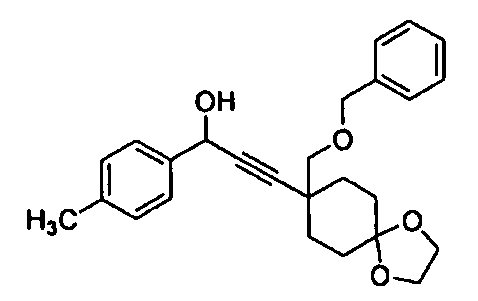
синтезируют по приведенной ниже методике.
К раствору 8-(бензилоксиметил)-8-этинил-1,4-диоксаспиро-[4.5]декана (промежуточное соединение 47) (393 мг, 1,37 ммоль) в тетрагидрофуране (4,6 мл), при -78°С добавляют 2,6 М раствор н-бутиллития (раствор в гексане, 0,555 мл, 1,44 ммоль), и полученную смесь перемешивают 10 минут. Затем к смеси добавляют 4-метилбензальдегид (0,178 мл, 1,51 ммоль), полученной смеси дают постепенно нагреться до комнатной температуры и перемешивают 1 час. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 48 (459 мг, 1,13 ммоль, 82%) в виде бесцветного масляного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,62-1,71 (4H, м), 1,79-1,86 (2H, м), 1,92-2,02 (2H, м), 2,23 (1H, шир.с), 2,34 (3H, с), 3,41 (2H, с), 3,89-3,98 (4H, м), 4,59 (2H, м), 5,44 (1H, д, J=5,2 Гц), 7,15 (2H, д, J=8,0 Гц), 7,25-7,35 (5H, м), 7,43 (2H, д, J=8,0 Гц).
ESI-MC: m/z=407 (M+H)+.
Промежуточное соединение 49
В качестве промежуточного соединения 49: 3-(8-(бензилокси-метил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)пропин-1-он
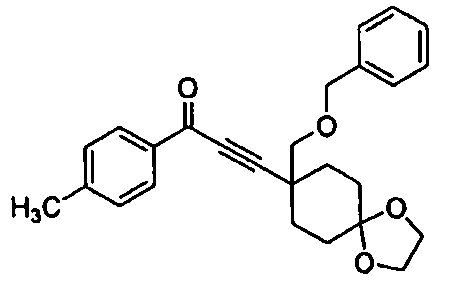
синтезируют по приведенной ниже методике.
Диоксид марганца (625 мг, 7,19 ммоль) добавляют к раствору 3-(8-(бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)пропин-1-ола (промежуточное соединение 48) (585 мг, 1,44 ммоль) в дихлорметане (7,2 мл), и полученную смесь перемешивают при комнатной температуре 13 часов. Реакционный раствор фильтруют через целлит, и затем фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 49 (540 мг, 1,33 ммоль, 93%) в виде бесцветного масляного соединения.
1H-ЯМР (400 МГц, CDCl3) δ: 1,71-1,80 (4H, м), 1,97-2,03 (4H, м), 2,41 (3H, с), 3,52 (2H, с), 3,91-4,00 (4H, м), 4,63 (2H, м), 7,21 (2H, д, J=8,0 Гц), 7,25-7,38 (5H, м), 8,03 (2H, д, J=8,0 Гц).
ESI-MC: m/z=405 (M+H)+.
Промежуточное соединение 50
В качестве промежуточного соединения 50: 3-(8-(бензилокси-метил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол
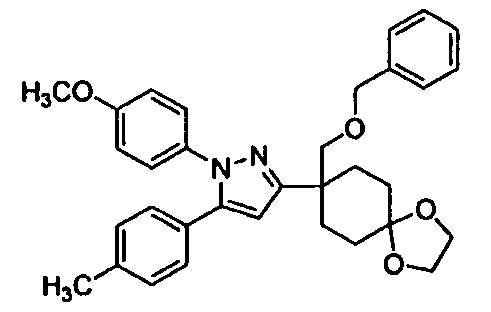
синтезируют по приведенной ниже методике.
Триэтиламин (0,447 мл, 3,20 ммоль) добавляют по каплям к раствору гидрохлорида 4-метоксифенилгидразина (280 мг, 1,60 ммоль) в этаноле (2,7 мл), и полученную смесь перемешивают при комнатной температуре 30 минут. К реакционному раствору по каплям добавляют раствор 3-(8-бензилоксиметил)-1,4-диоксаспиро[4.5]декан-8-ил)-1-(п-толил)пропин-1-она (промежуточное соединение 49) (540 мг, 1,33 ммоль) в этаноле (2,7 мл), и полученную смесь перемешивают при комнатной температуре 14 часов. Затем реакционный раствор концентрируют при пониженном давлении. К остатку добавляют воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают 1 М соляной кислотой, дистиллированной водой и рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 50 (458 мг, 0,872 ммоль, 65%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,64-1,72 (2H, м), 1,76-1,85 (2H, м), 1,89-1,98 (2H, м), 2,27-2,35 (5H, м), 3,50 (2H, с), 3,80 (3H, с), 3,90-3,99 (4H, м), 4,49 (2H, с), 6,38 (1H, с), 6,80-6,85 (2H, м), 7,06-7,31 (11H, м).
ESI-MC: m/z=525 (M+H)+.
Промежуточное соединение 51
В качестве промежуточного соединения 51: 4-(бензилокси-метил)-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-циклогексан-1-он
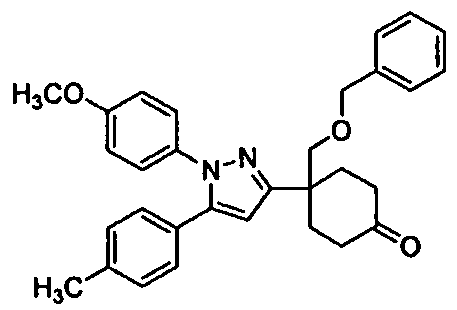
синтезируют по приведенной ниже методике.
К раствору 3-(8-(бензилоксиметил)-1,4-диоксаспиро[4.5]-декан-8-ил)-1-(4-метоксифенил)-5-(п-толил)-1Н-пиразола (промежуточное соединение 50) (458 мг, 0,872 ммоль) в тетрагидрофуране (2,2 мл) добавляют 6 М соляную кислоту (4,4 мл), и полученную смесь перемешивают при комнатной температуре 15 часов. Реакционный раствор охлаждают льдом и по каплям при 0°С добавляют 50%-ный водный раствор гидроксида натрия, пока он не станет основным, после чего полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 51 (387 мг, 0,804 ммоль, 92%) в виде белого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,11-2,21 (2H, м), 2,31-2,39 (5H, м), 2,52-2,68 (4H, м), 3,57 (2H, с), 3,81 (3H, с), 4,51 (2H, с), 6,44 (1H, с), 6,83-6,88 (2H, м), 7,08-7,34 (11H, м).
ESI-MC: m/z=481 (M+H)+.
Промежуточное соединение 52
В качестве промежуточного соединения 52: 8-(4,5-бис(4-метоксифенил)оксазол)-2-ил)-1,4-диоксаспиро[4.5]декан-8-ол
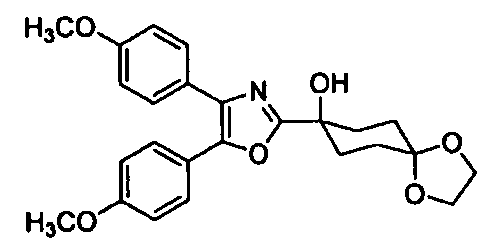
синтезируют по приведенной ниже методике.
К раствору 2-хлор-1,4-бис(4-метоксифенил)оксазола (1,01 г, 3,20 ммоль) в тетрагидрофуране (32 мл), который синтезирован по известной методике получения (WO 07/111323), при 0°С добавляют 1,09 М комплекс боран-тетрагидрофуран (4,0 мл, 4,36 ммоль), и полученную смесь перемешивают при той же температуре 1 час. К реакционному раствору при -78°С добавляют 2,66 М раствор н-бутиллития (1,47 мл, ммоль), и полученную смесь перемешивают при той же температуре 1 час. К реакционному раствору добавляют моноэтиленкеталь 1,4-циклогександиона (524 мг, 3,36 ммоль), и полученному раствору дают постепенно нагреться до комнатной температуры при перемешивании. К реакционному раствору добавляют 1 М соляную кислоту, чтобы подкислить раствор, и полученный раствор экстрагируют этилацетатом. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 52 (844 мг, 1,92 ммоль, 60%) в виде светло-желтого аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,71-1,80 (2H, м), 2,01-2,11 (4H, м), 2,30-2,41 (2H, м), 2,76 (1H, с), 3,83 (3H, с), 3,84 (3H, с), 3,99 (4H, дд, J=Гц), 6,89 (2H, д, J=8,8 Гц), 6,90 (2H, д, J=8,8 Гц), 7,50 (2H, д, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц).
Промежуточное соединение 53
В качестве промежуточного соединения 53: 1,4-диоксаспиро-[4.5]декан-8-карбоксамид
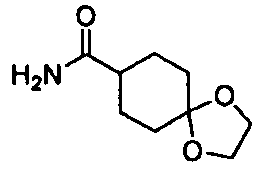
синтезируют по приведенной ниже методике.
Триэтиламин (5,87 мл, 42,1 ммоль) и п-пропилхлорформиат добавляют при 0°С к раствору 1,4-диоксаспиро[4.5]декан-8-карбоновой кислоты (823 мг, 4,42 ммоль) в тетрагидрофуране (22 мл), и полученную смесь перемешивают при той же температуре 1 час. После добавления порциями полученную смесь перемешивают при комнатной температуре 30 минут. К реакционному раствору добавляют 28%-ный водный раствор аммиака (1,5 мл), и полученную смесь перемешивают при комнатной температуре 1 час. Органический слой отделяют от реакционного раствора, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 53 (694 мг, 3,75 ммоль, 85%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,53-1,61 (2H, м), 1,72-1,86 (4H, м), 1,91-1,98 (2H, м), 2,17-2,25 (1H, м), 3,95 (4H, с), 5,29 (1H, шир.с), 5,46 (1H, шир.с).
ESI-MC: m/z=186 (M+H)+.
Промежуточное соединение 54
В качестве промежуточного соединения 54: 1,4-диоксаспиро-[4.5]декан-8-карботиоамид
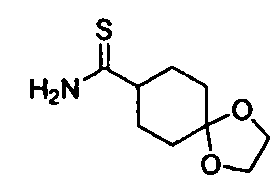
синтезируют по приведенной ниже методике.
Реагент Лоусона (337 мг, 0,834 ммоль) добавляют к раствору 1,4-диоксаспиро[4.5]декан-8-карбоксамида (промежуточное соединение 53) (281 мг, 1,52 ммоль) в толуоле (5 мл), и полученную смесь перемешивают при 100°С 1 час, и затем дают охладиться до комнатной температуры. К реакционному раствору добавляют метанол, и полученный раствор концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 54 (147 мг, 0,730 ммоль, 48%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,57-1,66 (2H, м), 1,79-1,90 (4H, м), 1,97-2,03 (2H, м), 2,64-2,72 (1H, м), 3,96 (4H, с), 6,89 (1H, шир.с), 7,46 (1H, шир.с).
ESI-MC: m/z=202 (M+H)+.
Промежуточное соединение 55
В качестве промежуточного соединения 55: 8-(4-(4-метокси-фенил)-5-(п-толил)тиазол-2-ил)-1,4-диоксаспиро[4.5]декан
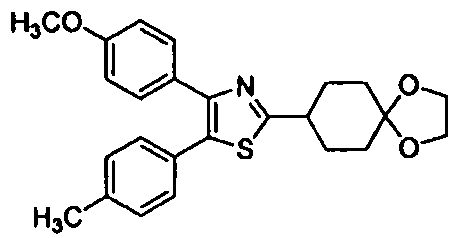
синтезируют по приведенной ниже методике.
Раствор 1,4-диоксаспиро[4.5]декан-8-карботиоамида (промежуточное соединение 54) (389 мг, 1,93 ммоль) и 2-бром-1-(4-метоксифенил)-2-(п-толил)этанона (588 мг, 1,84 ммоль) в ацетонитриле (9,2 мл) перемешивают при комнатной температуре 4 часа. К реакционному раствору добавляют насыщенный водный раствор гидрокарбоната натрия, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 55 (630 мг, 1,49 ммоль, 81%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,68-1,76 (2H, м), 1,88-1,98 (4H, м), 2,18-2,24 (2H, м), 2,35 (3H, с), 3,05-3,13 (1H, м), 3,80 (3H, с), 3,99 (4H, с), 6,79-6,82 (2H, м), 7,11 (2H, д, J=8,0 Гц), 7,22 (2H, д, J=8,0 Гц), 7,43-7,46 (2H, м).
ESI-MC: m/z=422 (M+H)+.
Промежуточное соединение 56
В качестве промежуточного соединения 56: 8-(4-(4-метокси-фенил)-5-(п-толил)тиазол-2-ил)-1,4-диоксаспиро[4.5]декан-8-ол
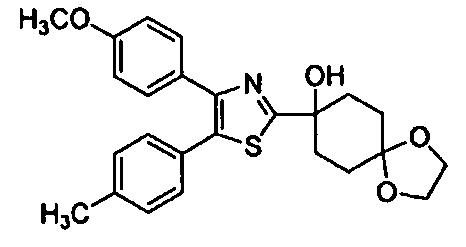
синтезируют по приведенной ниже методике.
К раствору 8-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)-1,4-диоксаспиро[4.5]декана (промежуточное соединение 55) (734 мг, 1,74 ммоль) в тетрагидрофуране (8,7 мл) при -78°С добавляют 1,63 М раствор н-бутиллития в н-гексане (1,17 мл), и полученную смесь перемешивают при той же температуре 1 час. Реакционный раствор при -78°С добавляют к раствору 3-фенил-2-(фенилсульфонил)-1,2-оксазиридина (546 мг, 2,09 ммоль) в тетрагидрофуране (8,7 мл), и полученному раствору дают постепенно нагреться до комнатной температуры при перемешивании. К реакционному раствору добавляют дистиллированную воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, затем сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 56 (417 мг, 0,954 ммоль, 55%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,73-1,79 (2H, м), 2,03-2,10 (4H, м), 2,32-2,39 (2H, м), 2,37 (3H, с), 2,78 (1H, с), 3,84 (3H, с), 3,97-4,02 (4H, м), 6,88-6,92 (2H, м), 7,16 (2H, д, J=8,4 Гц), 7,47 (2H, д, J=8,4 Гц), 7,55-7,58 (2H, м).
ESI-MC: m/z=438 (M+H)+.
Промежуточное соединение 57
В качестве промежуточного соединения 57: 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-бензилоксикарбониламиноацетат
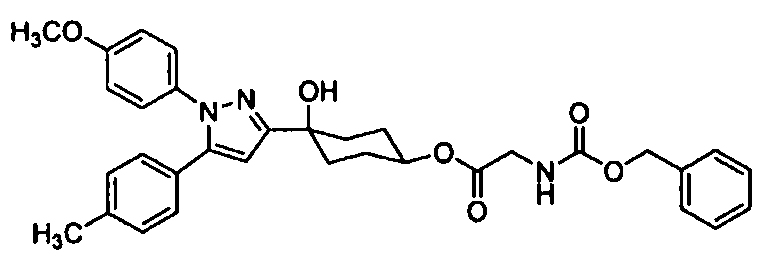
синтезируют по приведенной ниже методике.
Триэтиламин (0,084 мл, 0,60 ммоль), 2-бензилоксикарбонил-аминоуксусную кислоту (46,2 мг, 0,241 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимид (46,2 мг, 0,241 ммоль) и 1-гидроксибензотриазол (15,4 мг, 0,100 ммоль) добавляют при комнатной температуре к раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (76,0 мг, 0,201 ммоль) в дихлорметане (2,00 мл), и полученную смесь перемешивают 20 часов. К реакционному раствору добавляют дистиллированную воду, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 57 (33,2 мг, 0,058 ммоль, 29%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,91-2,07 (8H, м), 2,33 (3H, с), 2,75 (1H, с), 3,80 (3H, с), 3,98-3,99 (2H, м), 4,89-4,94 (1H, м), 5,14 (2H, с), 5,33-5,35 (1H, м), 6,36 (1H, с), 6,82-6,86 (2H, м), 7,08-7,10 (4H, м), 7,17-7,21 (2H, м), 7,29-7,38 (5H, м).
ESI-MC: m/z=552 (M-OH)+.
Промежуточное соединение 58
В качестве промежуточного соединения 58: (S)-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексил-2-(бензилоксикарбониламино)-3-метилбутаноат синтезируют таким же способом, что и промежуточное соединение 57.
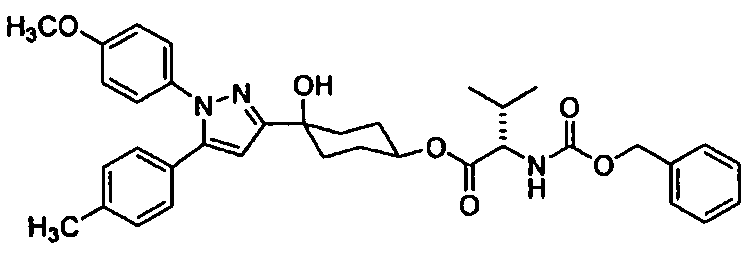
синтезируют по приведенной ниже методике.
1H-ЯМР (400 МГц, CDCl3) δ: 0,92 (3H, д, J=6,4 Гц), 0,99 (3H, д, J=6,4 Гц), 1,89-2,10 (8H, м), 2,16-2,24 (1H, м), 2,34 (3H, с), 2,63 (1H, с), 3,81 (3H, с), 4,30-4,33 (1H, м), 4,88-4,95 (1H, м), 5,12 (2H, с), 5,28-5,30 (1H, м), 6,36 (1H, с), 6,78-6,82 (2H, м), 7,09-7,10 (4H, м), 7,18-7,24 (2H, м), 7,29-7,38 (5H, м).
ESI-MC: m/z=594 (M-OH)+.
Промежуточное соединение 59
В качестве промежуточного соединения 59: (S)-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексил-окси)метил-2-(бензилоксикарбониламино)-3-метилбутаноат
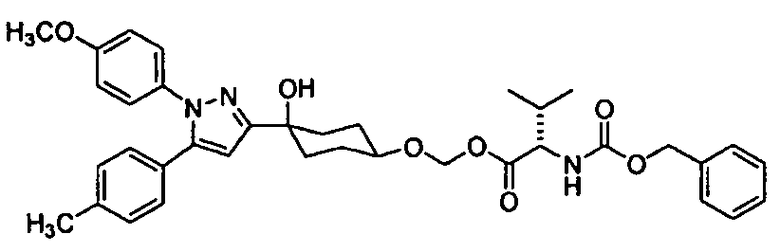
синтезируют по приведенной ниже методике.
Молекулярные сита 4А (300 мг) и диизопропилэтиламин (0,210 мл, 1,21 ммоль) добавляют при комнатной температуре к раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (199 мг, 0,506 ммоль) в дихлорметане (3,00 мл), и полученную смесь охлаждают до -50°. Затем при той же температуре к смеси добавляют (S)-йодметил-2-бензилоксикарбониламино-3-метилбутаноат (0,187 мл, 1,26 ммоль) и трифторметансульфонат серебра (232 мг, 0,904 ммоль), и полученную смесь перемешивают 2 часа, после чего смесь перемешивают 14 часов при -30°С. К реакционному раствору добавляют насыщенный раствор бикарбоната натрия, и полученный раствор фильтруют через целлит. Фильтрат промывают рассолом, органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 59 (123 мг, 0,192 ммоль, 64%) в виде бесцветного аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 0,92 (3H, д, J=6,4 Гц), 1,01 (3H, д, J=6,4 Гц), 1,88-1,99 (6H, м), 2,02-2,09 (2H, м), 2,20-2,26 (1H, м), 2,34 (3H, с), 2,50 (1H, с), 3,66-3,72 (1H, м), 3,81 (3H, с), 4,32-4,36 (1H, м), 5,12 (2H, с), 5,38 (1H, д, J=6,4 Гц), 5,50 (1H, д, J=6,4 Гц), 6,37 (1H, с), 6,83-6,87 (2H, м), 7,08-7,11 (4H, м), 7,18-7,24 (2H, м), 7,29-7,38 (5H, м).
ESI-MC: m/z=624 (M-OH)+.
Промежуточное соединение 60
В качестве промежуточного соединения 60: дибензил-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-цис-циклогексилфосфат
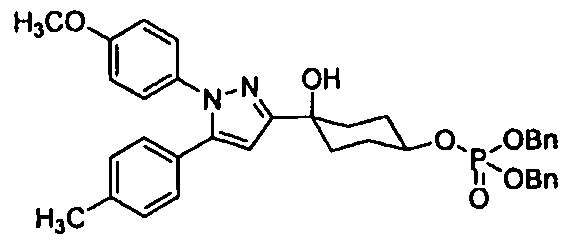
синтезируют по приведенной ниже методике.
К раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диола (соединение 3) (200 мг, 0,528 ммоль) в тетрагидрофуране (2,6 мл) последовательно при перемешивании и при охлаждении льдом добавляют 55%-ный гидрид натрия (55,3 мг, 1,27 ммоль) и тетрабензилпирофосфонат (370 мг, 0,687 ммоль), и полученную смесь перемешивают при комнатной температуре 15 часов. Реакционный раствор охлаждают льдом и добавляют воду. Полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 60 (251 мг, 0,393 ммоль, 74%) в виде бесцветного прозрачного масляного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 1,87-2,11 (8H, м), 2,33 (3H, с), 3,79 (3H, с), 4,42-4,51 (1H, м), 5,00-5,12 (4H, м), 6,34 (1H, с), 6,81-6,87 (2H, м), 7,09 (4H, с), 7,16-7,23 (2H, м), 7,29-7,37 (10H, м).
ESI-MC: m/z=639 (M+H)+.
Соединение 4
В качестве соединения 4: 4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-он
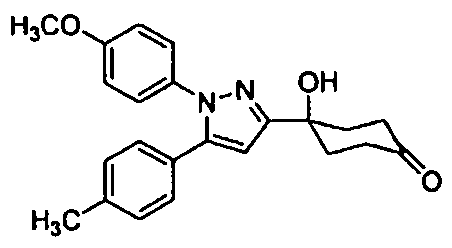
синтезируют по приведенной ниже методике.
К раствору 8-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 18) (14,6 г, 34,7 ммоль) в тетрагидрофуране (69,4 мл), добавляют 6 М соляную кислоту (138,9 мл), и полученную смесь перемешивают при комнатной температуре 15 часов. Реакционный раствор охлаждают льдом и при 0°С добавляют 50%-ный водный раствор гидроксида натрия, пока раствор не станет основным, затем полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают перекристаллизацией (н-гексан/этилацетат, 70°С), получают соединение 4 (10,5 г, 27,9 ммоль, 80%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,33-2,43 (9H, м), 2,87-2,95 (3H, м), 3,82 (3H, с), 6,39 (1H, с), 6,86 (2H, д, J=8,8 Гц), 7,10 (4H, с), 7,22 (2H, д, J=8,8 Гц).
ИК (KBr, см-1): 3321, 2929, 1712, 1518, 1463, 1299, 1249, 1179, 1114, 1027, 961, 821.
ESI-MC: m/z=377 (M+H)+.
Промежуточное соединение 62
В качестве соединения 62: 4-гидрокси-4-(1-(4-метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)-циклогексан-1-он
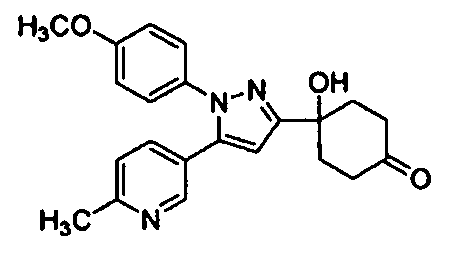
синтезируют по приведенной ниже методике.
К раствору 8-(1-(4-метоксифенил)-5-(6-метилпиридин-3-ил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 19) (128,8 мг, 0,30 ммоль) в тетрагидрофуране (0,6 мл) добавляют 6 М соляную кислоту (1,2 мл), и полученную смесь перемешивают при комнатной температуре 3 часа. Реакционный раствор охлаждают льдом, и при 0°С по каплям добавляют 50%-ный водный раствор гидроксида натрия, пока раствор не станет основным, после чего полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 62 (109,5 мг, 0,29 ммоль, 96%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,34-2,44 (6H, м), 2,55 (3H, с), 2,87-2,95 (2H, м), 3,18 (1H, с), 3,82 (3H, с), 6,49 (1H, с), 6,87 (2H, д, J=8,8 Гц), 7,08 (1H, д, J=8,1 Гц), 7,19 (2H, д, J=8,8 Гц), 7,35 (1H, дд, J=2,2, 8,1 Гц), 8,40 (1H, д, J=2,2 Гц).
ESI-MC: m/z=378 (M+H)+.
Промежуточное соединение 63
В качестве соединения 63: 4-(1,5-бис(4-метоксифенил)-1Н-пиразол-3-ил)-4-гидроксициклогексан-1-он
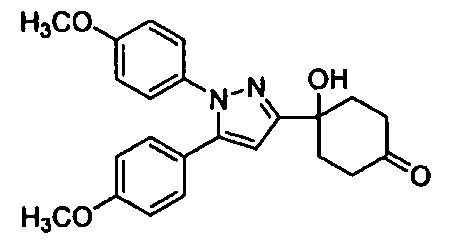
синтезируют по приведенной ниже методике.
К раствору 8-(1,5-бис(4-метоксифенил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 20) (658 мг, 1,50 ммоль) в тетрагидрофуране (3,75 мл) при 0°С добавляют 6 М соляную кислоту (7,5 мл), и полученную смесь перемешивают при комнатной температуре 5 часов. Реакционный раствор нейтрализуют, выливая в охлажденный льдом 10%-ный водный раствор гидроксида натрия. Полученный раствор затем подщелачивают, добавляя в него насыщенный раствор бикарбоната натрия, и экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 63 (523 мг, 1,33 ммоль, 89%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,30-2,45 (6H, м), 2,86-2,96 (2H, м), 2,99 (1H, с), 3,80 (3H, с), 3,82 (3H, с), 6,36 (1H, с), 6,82 (2H, д, J=8,8 Гц), 6,87 (2H, д, J=8,8 Гц), 7,13 (2H, д, J=8,8 Гц), 7,21 (2H, д, J=8,8 Гц).
ESI-MC: m/z=393 (M+H)+.
Промежуточное соединение 64
В качестве соединения 64: 4-(5-(4-хлорфенил)-1-(4-метокси-фенил)-1Н-пиразол-3-ил)-4-гидрокси-циклогексан-1-он
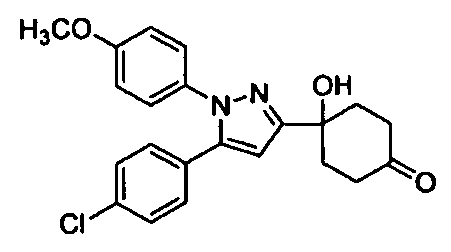
синтезируют по приведенной ниже методике.
К раствору 8-(5-(4-хлорфенил)-1-(4-метоксифенил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 21) (756 мг, 1,71 ммоль) в тетрагидрофуране (4,3 мл) добавляют 6 М соляную кислоту (8,6 мл), и полученную смесь перемешивают при комнатной температуре 15 часов. Реакционный раствор охлаждают льдом, и к раствору по каплям при 0°С добавляют 50%-ный водный раствор гидроксида натрия, пока он не станет основным, затем полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 64 (619 мг, 1,56 ммоль, 91%) в виде аморфного продукта.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31-2,45 (6H, м), 2,85-2,98 (3H, м), 3,82 (3H, с), 6,43 (1H, с), 6,86-6,90 (2H, м), 7,14 (2H, д, J=8,8 Гц), 7,19 (2H, д, J=8,8 Гц), 7,26-7,29 (2H, м).
ESI-MC: m/z=397 (M+H)+.
Промежуточное соединение 65
В качестве соединения 65: 4-гидрокси-4-(1-(4-хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-1-он
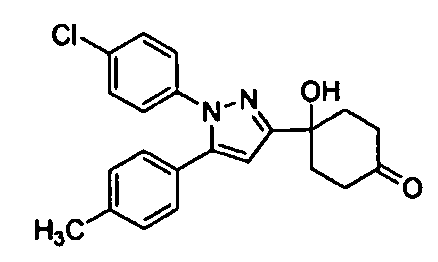
синтезируют по приведенной ниже методике.
К раствору 8-(1-(4-хлорфенил)-5-(п-толил)-1Н-пиразол-3-ил)-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 22) (931 мг, 2,19 ммоль) в тетрагидрофуране (5,5 мл) добавляют 6 М соляную кислоту (11 мл), и полученную смесь перемешивают при комнатной температуре 15 часов. Реакционный раствор подщелачивают, выливая в насыщенный водный раствор гидрокарбоната натрия, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 65 (513 мг, 1,35 ммоль, 61%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,32-2,36 (4H, м), 2,36 (3H, с), 2,38-2,44 (2H, м), 2,87-2,95 (2H, м), 2,90 (1H, с), 6,41 (1H, с), 7,10 (2H, д, J=8,0 Гц), 7,14 (2H, д, J=8,0 Гц), 7,23 (2H, д, J=8,8 Гц), 7,31 (2H, д, J=8,8 Гц).
ESI-MC: m/z=381 (M+H)+.
Приведенные ниже соединения синтезированы тем же способом, как и описанные выше промежуточные соединения.
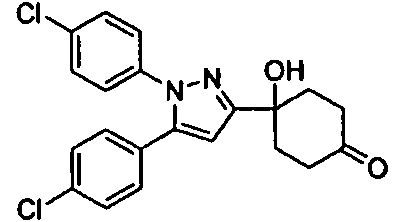
ESI-MC: m/z=401 (M+H)+
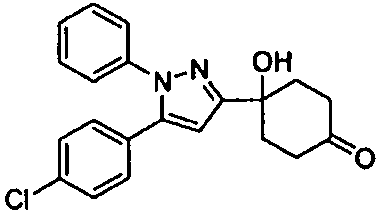
ESI-MC: m/z=367 (M+H)+
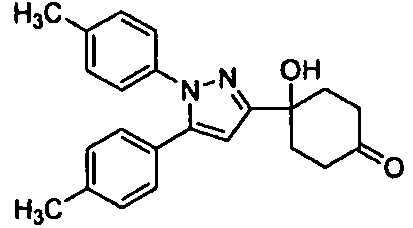
ESI-MC: m/z=361 (M+H)+

ESI-MC: m/z=347 (M+H)+
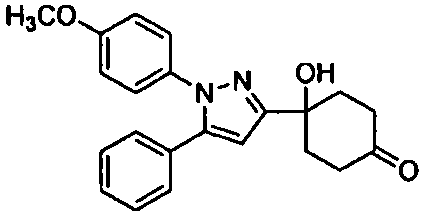
ESI-MC: m/z=363 (M+H)+
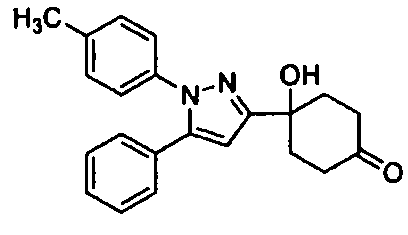
ESI-MC: m/z=347 (M+H)+
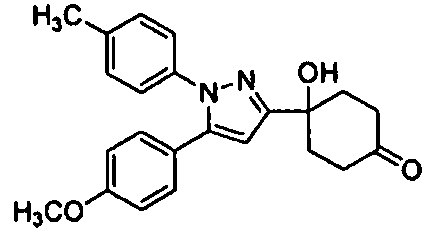
ESI-MC: m/z=377 (M+H)+
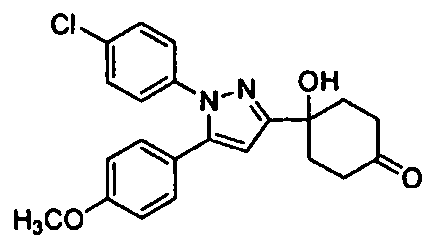
ESI-MC: m/z=397 (M+H)+
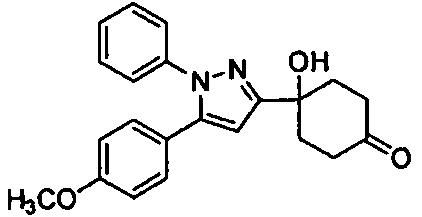
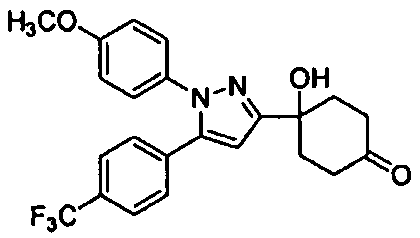
ESI-MC: m/z=431 (M+H)+
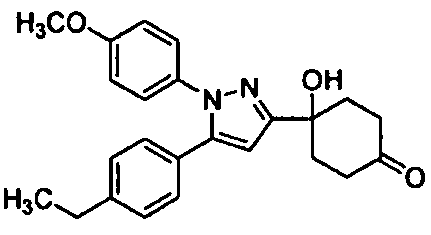
ESI-MC: m/z=391 (M+H)+
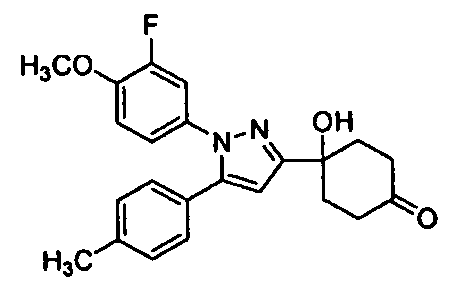
ESI-MC: m/z=395 (M+H)+
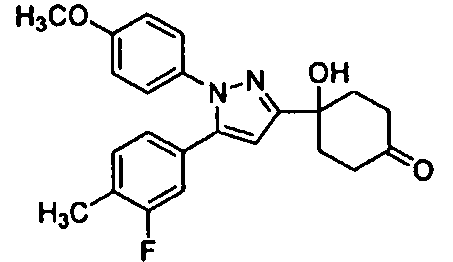
ESI-MC: m/z=395 (M+H)+

ESI-MC: m/z=372 (M+H)+
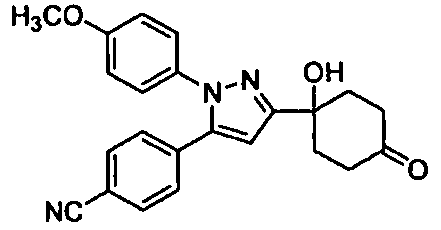
ESI-MC: m/z=425 (M+H)+
Промежуточное соединение 81
В качестве соединения 81: 4-(4-хлор-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)-с-4-гидрокси-циклогексан-r-1-илацетат
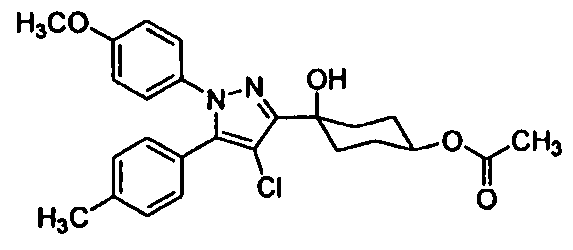
синтезируют по приведенной ниже методике.
К раствору с-4-гидрокси-4-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-илацетата (соединение 12) (140 мг, 0,333 ммоль) в ацетонитриле (1,66 мл) добавляют N-хлор-сукцинимид (49 мг, 0,366 ммоль). Полученную смесь перемешивают при 80°С в течение 15 часов и дают охладиться до комнатной температуры. К реакционному раствору добавляют рассол, и полученный раствор экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 81 (67 мг, 0,147 ммоль, 44%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,92-2,04 (6H, м), 2,28-2,36 (8H, м), 3,10 (1H, с), 3,79 (3H, с), 4,85-4,88 (1H, м), 6,80-6,82 (2H, м), 7,11-7,16 (6H, м).
Промежуточное соединение 82
В качестве соединения 82: 4-(4,5-бис(4-метоксифенил)-оксазол-2-ил)-4-гидроксициклогексан-1-он
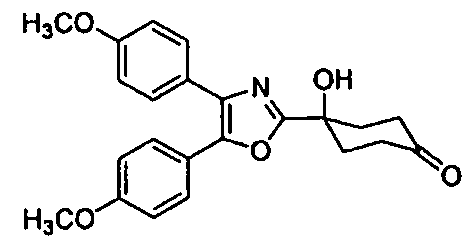
синтезируют по приведенной ниже методике.
К раствору 8-(4,5-бис(4-метоксифенил)оксазол-2-ил)-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 52) (781 мг, 1,78 ммоль) в тетрагидрофуране (4,5 мл) при 0°С добавляют 6 М соляную кислоту (9,0 мл), и полученную смесь перемешивают при комнатной температуре 2 часа. Реакционный раствор охлаждают до 0°С и подщелачивают добавлением 10%-ного водного раствора гидроксида натрия и насыщенного раствора бикарбоната натрия. Полученный раствор экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают перекристаллизацией (этилацетат/н-гексан), получают промежуточное соединение 82 (445 мг, 1,13 ммоль, 63%) в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,32-2,54 (6H, м), 2,81-2,92 (2H, м), 3,17 (1H, м), 3,84 (6H, с), 6,90 (2H, д, J=8,8 Гц), 6,91 (2H, д, J=8,8 Гц), 7,49 (2H, д, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц).
ESI-MC: m/z=394 (M+H)+.
Промежуточное соединение 83
В качестве соединения 83: 4-гидрокси-4-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)циклогексан-1-он
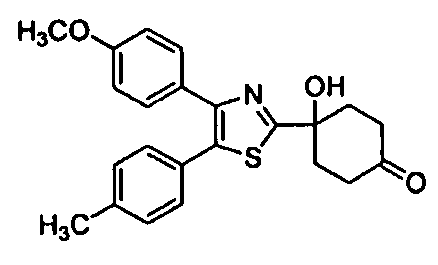
синтезируют по приведенной ниже методике.
К раствору 8-(4-(4-метоксифенил)-5-(п-толил)тиазол-2-ил)-1,4-диоксаспиро[4.5]декан-8-ола (промежуточное соединение 56) (469 мг, 1,07 ммоль) в тетрагидрофуране (5,4 мл) при 0°С добавляют 6 М соляную кислоту (5,4 мл), и полученный раствор перемешивают при комнатной температуре 14 часов. Реакционный раствор подщелачивают, выливая в насыщенный водный раствор гидрокарбоната натрия, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 83 (352 мг, 0,895 ммоль, 83%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,33-2,51 (6H, м), 2,37 (3H, с), 2,86-2,95 (2H, м), 3,50 (1H, с), 3,81 (3H, с), 6,81-6,84 (2H, м), 7,14 (2H, д, J=8,0 Гц), 7,24 (2H, д, J=8,0 Гц), 7,44-7,48 (2H, м).
ESI-MC: m/z=394 (M+H)+.
Промежуточное соединение 84
В качестве соединения 84: с-4-гидрокси-1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-r-1-илацетат
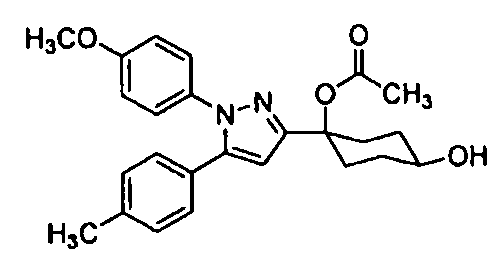
синтезируют по приведенной ниже методике.
Карбонат калия (89,0 мг, 0,624 ммоль) добавляют к раствору 1-(1-(4-метоксифенил)-5-(п-толил)-1Н-пиразол-3-ил)циклогексан-цис-1,4-диилдиацетата (промежуточное соединение 38) (297 мг, 0,642 ммоль) в метаноле (4,3 мл), и полученную смесь перемешивают при комнатной температуре 4 часа. К реакционному раствору добавляют воду, чтобы остановить реакцию, и полученный раствор экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (силикагель, н-гексан/этилацетат), получают промежуточное соединение 84 (213 мг, 0,507 ммоль, 79%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,49 (1H, д, J=4,4 Гц), 1,65-1,74 (2H, м), 1,90-1,98 (4H, м), 2,10 (3H, с), 2,32 (3H, с), 2,71-2,78 (2H, м), 3,74-3,81 (4H, м), 6,37 (1H, с), 6,83 (2H, д, J=9,2 Гц), 7,08 (4H, с), 7,20 (2H, д, J=9,2 Гц).
ESI-MC: m/z=421 (M+H)+.
Промышленное применение
Циклогексановые производные или их фармацевтически приемлемые соли в соответствии с настоящим изобретением могут быть использованы в качестве фармацевтического средства, в особенности терапевтического средства или профилактического средства для лечения нарушения(й) накопления мочи, содержащего их в качестве эффективного ингредиента.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ИЛИ ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОМИАЛГИИ | 2011 |
|
RU2560168C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО И ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2011 |
|
RU2560171C2 |
| ПРОИЗВОДНОЕ ЦИКЛОГЕКСАНА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2009 |
|
RU2478621C2 |
| ПИРАЗОЛО [1, 5-А] ПИРИДИНЫ И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2002 |
|
RU2308457C2 |
| ПРОИЗВОДНЫЕ ЭКТЕИНАСЦИДИНОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ | 2003 |
|
RU2306316C9 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| ИНГИБИТОРЫ ГЛИКОЛАТОКСИДАЗЫ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2805308C2 |
| ИНГИБИТОРЫ КИНАЗ, ПРИМЕНИМЫЕ ДЛЯ ЛЕЧЕНИЯ МИЕЛОПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ И ДРУГИХ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2482112C2 |
| ЗАМЕЩЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ АУТОРЕПАРАЦИИ И РЕГЕНЕРАЦИИ ТКАНИ | 2015 |
|
RU2728782C2 |
| ПРОИЗВОДНЫЕ АРИЛ 5-ТИО-β-D-ГЛЮКОПИРАНОЗИДА И ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА ПРИ ДИАБЕТЕ, СОДЕРЖАЩИЕ ИХ | 2003 |
|
RU2322449C2 |
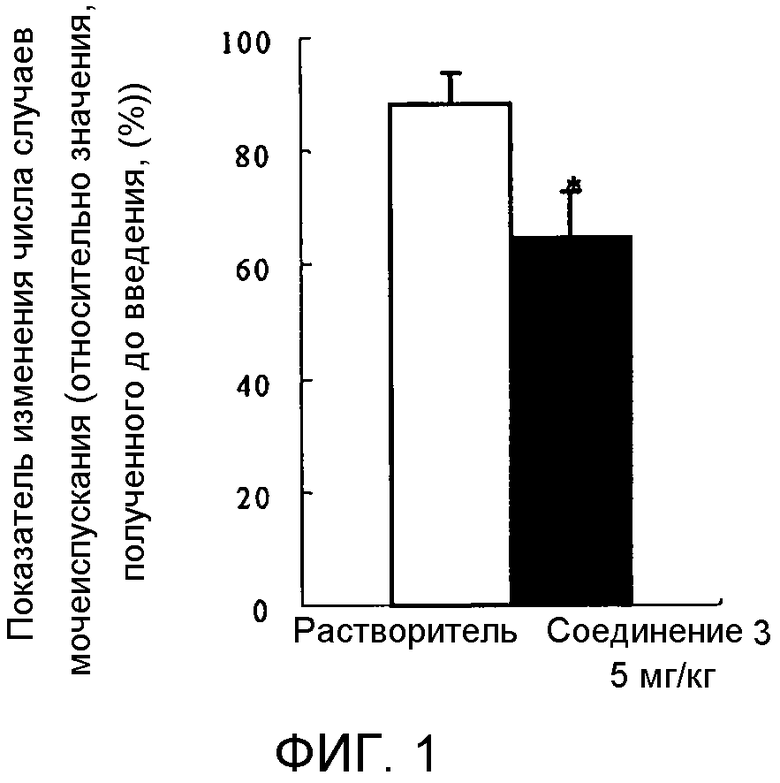
Настоящее изобретение предлагает терапевтическое средство или профилактическое средство для лечения нарушения(й) накопления мочи, причем указанное средство предпочтительно содержит в качестве эффективного ингредиента циклогексановое производное, представленное приведенной ниже формулой, или его фармацевтически приемлемую соль. Технический результат состоит в разработке терапевтического средства или профилактического средства, эффективного для лечения нарушений накопления мочи. С помощью такого средства достигают исправления побочных эффектов из-за антихолинергического действия, а также такое средство обладает обезболивающим действием. 13 з.п. ф-лы, 1 ил., 13 табл.
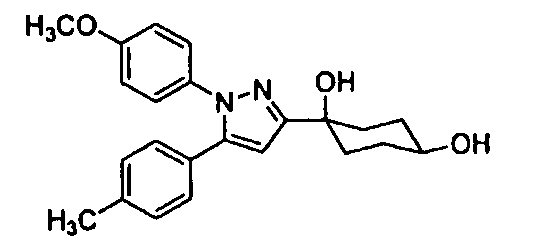
1. Терапевтическое средство или профилактическое средство для лечения нарушения(й) накопления мочи, причем указанное средство содержит в качестве эффективного ингредиента циклогексановое производное, представленное формулой (I):
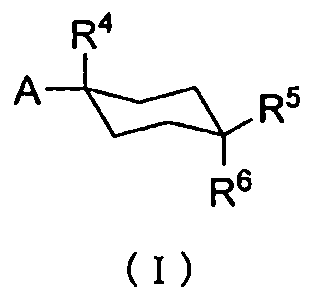
где
А представляет собой заместитель, представленный формулой (IIa) или (IIb):
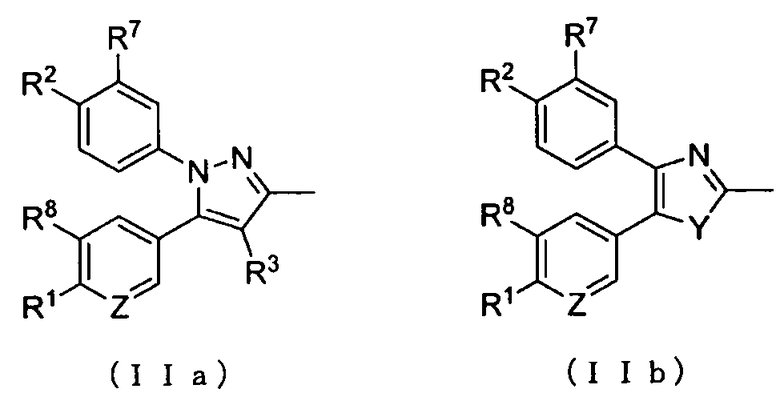
R1 и R2 каждый независимо друг от друга представляет собой атом водорода, атом хлора, C1-C3-галогеналкильную группу, C1-C4-алкильную группу или C1-C4-алкокси-группу;
R3 представляет собой атом водорода или атом хлора; R4 представляет собой атом фтора, гидроксиметильную группу или гидроксильную группу;
R5 и R6 каждый независимо друг от друга представляет собой атом водорода, атом фтора, C1-C3-галогеналкильную группу, карбоксильную группу, метоксикарбонильную группу, этоксикарбонильную группу, C1-C4-алкокси-группу, гидроксильную группу или C2-C5-алкилкарбонилокси-группу, или необязательно вместе образуют оксо-группу;
R7 и R8 каждый независимо друг от друга представляет собой атом водорода или атом фтора;
Y представляет собой атом кислорода или атом серы;
Z представляет собой атом азота или метиновую группу;
или его фармацевтически приемлемую соль.
2. Терапевтическое средство или профилактическое средство по п.1, где R1 и R2 каждый независимо друг от друга представляет собой трифторметильную группу, метильную группу или метокси-группу.
3. Терапевтическое средство или профилактическое средство по п.1 или 2, где R3 представляет собой атом водорода.
4. Терапевтическое средство или профилактическое средство по любому из пп.1 и 2, где R4 представляет собой гидроксиметильную группу или гидроксильную группу.
5. Терапевтическое средство или профилактическое средство по п.3, где R4 представляет собой гидроксиметильную группу или гидроксильную группу.
6. Терапевтическое средство или профилактическое средство по любому из пп.1 и 2, где R5 и R6 каждый независимо друг от друга представляет собой атом водорода, атом фтора, трифторметильную группу, карбоксильную группу, метокси-группу, гидроксильную группу или ацетилокси-группу, или необязательно вместе образуют оксо-группу.
7. Терапевтическое средство или профилактическое средство по п.3, где R5 и R6 каждый независимо друг от друга представляет собой атом водорода, атом фтора, трифторметильную группу, карбоксильную группу, метокси-группу, гидроксильную группу или ацетилокси-группу, или необязательно вместе образуют оксо-группу.
8. Терапевтическое средство или профилактическое средство по п.4, где R5 и R6 каждый независимо друг от друга представляет собой атом водорода, атом фтора, трифторметильную группу, карбоксильную группу, метокси-группу, гидроксильную группу или ацетилокси-группу, или необязательно вместе образуют оксо-группу.
9. Терапевтическое средство или профилактическое средство по п.5, где R5 и R6 каждый независимо друг от друга представляет собой атом водорода, атом фтора, трифторметильную группу, карбоксильную группу, метокси-группу, гидроксильную группу или ацетилокси-группу, или необязательно вместе образуют оксо-группу.
10. Терапевтическое средство или профилактическое средство по любому из пп.1 и 2, где указанное(ые) нарушение(я) накопления мочи представляет(ют) собой поллакиурию, недержание мочи и/или сильные позывы на мочеиспускание.
11. Терапевтическое средство или профилактическое средство по п.3, где указанное(ые) нарушение(я) накопления мочи представляет(ют) собой поллакиурию, недержание мочи и/или сильные позывы на мочеиспускание.
12. Терапевтическое средство или профилактическое средство по п.4, где указанное(ые) нарушение(я) накопления мочи представляет(ют) собой поллакиурию, недержание мочи и/или сильные позывы на мочеиспускание.
13. Терапевтическое средство или профилактическое средство по п.6, где указанное(ые) нарушение(я) накопления мочи представляет(ют) собой поллакиурию, недержание мочи и/или сильные позывы на мочеиспускание.
14. Терапевтическое средство или профилактическое средство по любому одному из пп.5, 7, 8 и 9, где указанное(ые) нарушение(я) накопления мочи представляет(ют) собой поллакиурию, недержание мочи и/или сильные позывы на мочеиспускание.
| WO00/66562 A1, 09.11.2000 | |||
| WO 00/16760 A2, 30.03.2000 | |||
| US 6437146 B1, 20.08.2002 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ПРОИЗВОДНОЕ ЦИКЛОГЕКСАНА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2009 |
|
RU2478621C2 |
Авторы
Даты
2015-08-10—Публикация
2011-03-31—Подача