ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет патентной заявки No. 2010-185406, поданной 20 августа 2010 г. в патентное ведомство Японии, полное содержание которой включено в настоящий документ в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к моноклональному антителу с очень сильной иммуносупрессивной активностью, или к его антигенсвязывающему фрагменту, и к гибридоме, которая их продуцирует.
УРОВЕНЬ ТЕХНИКИ
В рамках терапии при трансплантации органов обычно используются различные иммуносупрессивные средства для того, чтобы подавить отторжение органа после его трансплантации. Эти иммуносупрессивные средства включают, например, такролимус (FK506) и циклоспорин А (Jpn J Pharmacol, 71, 89-100, 1996). Однако у обычных иммуносупрессивных средств имеются отрицательные свойства, в том числе выраженные побочные эффекты, такие как стимуляция роста раковых клеток и миелосупрессия; возникновение при их приеме инфекционных заболеваний, а даже необходимость их пожизненного приема (непатентный документ 1: Transplantation, 58, 170-178, 1994).
Кроме того, определение времени прекращения приема иммуносупрессивных средств в целом является достаточно сложным. Например, приживление трансплантата ткани может произойти без длительного введения иммуносупрессивного средства. В этом случае, длительное и безосновательное введение иммуносупрессивного средства может нанести вред пациенту просто из-за токсичности препарата.
С другой стороны, прекращение введения иммуносупрессивного средства может вызвать отторжение успешно трансплантированной ткани. В этом случае повторное введение иммуносупрессивного средства с целью подавления отторжения часто становится не эффективным.
В тоже время, были проведены различные исследования в области трансплантологии органов. Например, было сообщено об успешном приживлении ткани трансплантата с высоким уровнем приживления ткани при трансплантировании у крыс без введения иммуносупрессивных средств в рамках системы ортотопической трансплантации печени (OLT), когда печень крысы донора DA (с MHC гаплотипа RT1a) была трансплантирована крысе-реципиенту PVG (RT1c) (непатентный документ 2: Transplantation, 35, 304-311-1983).
Кроме того, было описано, что отторжение трансплантата на модели трансплантата было подавлено с использованием комбинирования приемов, в том числе при однократном предоперационном введении крысе, у которой может происходить отторжение, сыворотки крови крысы-реципиента PVG, имеющей пересаженную печень от крысы DA (пост-OLT сыворотка), (непатентный документ 3: J.Surg. Res., 80, 58-61, 1998).
Кроме того, описано, что благодаря послеоперационному введению (in vivo) поликлонального антитела против гистона H1 в систему трансплантата сердца крысы DA (RT1a) в крысу LWIS (RT1L), когда обычно происходит отторжение, при этом отторжение подавляется и реципиент выживает (непатентный документ 4: Transplantation, 77, 1595-1603, 2004).
Кроме того, некоторыми авторами настоящего изобретения было описано ингибирование при смешанной реакции культуры лимфоцитов (MLR) при использовании первичной послеоперационной сыворотки крови крысы PVG, и антитело против гистона H1 проявляет супрессивную активность в отношении MLR (патентный документ 1: выложенная заявка на патент Японии No. 2004-149507).
Кроме того, некоторыми авторами настоящего изобретения было описано получение моноклонального антитела против гистона H1, и моноклонального антитела против гистона H1, продуцируемого гибридомой 16G9 (депозитарный номер FERM - BP-10413), которое связывается с пептидом, состоящим из аминокислотной последовательности SEQ ID NO:1, полученного методом фагового дисплея (патентный документ 2: WO2006/025580).
Кроме того, некоторыми авторами настоящего изобретения было описано получение поликлонального антитела, антигеном которого является пептид, состоящий из аминокислотной последовательности SEQ ID NO:1 (патентный документ 3: US 2009/0081247, A1).
Однако создание моноклонального антитела с очень высокой иммуносупрессивной активностью, которое может использоваться для подавления отторжения трансплантата при трансплантации органов, является по-прежнему необходимым.
СПИСОК ЦИТИРУЕМЫХ ДОКУМЕНТОВ
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
Непатентный документ 1: Transplantation, 58, 170-178, 1994
Непатентный документ 2: Transplantation, 35, 304-311, 1983
Непатентный документ 3: J. Surg. Res., 80, 58-61, 1998
Патентный документ 4: Transplantation, 77, 1595-1603, 2004
ПАТЕНТНЫЕ ДОКУМЕНТЫ
Патентный документ 1: Выложенная заявка на патент Японии No. 2004-149507
Патентный документ 2: WO2006/025580
Патентный документ3: US 2009/0081247, A1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили новое моноклональное антитело с очень высокой иммуносупрессивной активностью, и его антигенсвязывающий фрагмент, а также продуцирующую их гибридому. Настоящее изобретение основано на этих обнаружениях.
В этой связи, объектом настоящего изобретения является новое моноклональное антитело с очень высокой иммуносупрессивной активностью, его антигенсвязывающий фрагмент, а также продуцирующая их гибридома.
Соответственно, моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент связывается с пептидом, содержащим аминокислотную последовательность SSVLYGGPPSAA (SEQ ID NO:1), или с конъюгатом этого пептида и фармацевтически приемлемого носителя, и моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент имеет более высокую аффинность связывания с коровым гистоном, чем с гистоном H1.
Кроме того, гибридома по настоящему изобретению продуцирует вышеуказанное моноклональное антитело или его антигенсвязывающий фрагмент.
Моноклональное антитело по настоящему изобретению имеет значительную иммуносупрессивную активность и может быть успешно использовано для подавления отторжения трансплантата при трансплантации органов.
КРАТКОЕ ОПИСАНИЕ ФИГУР
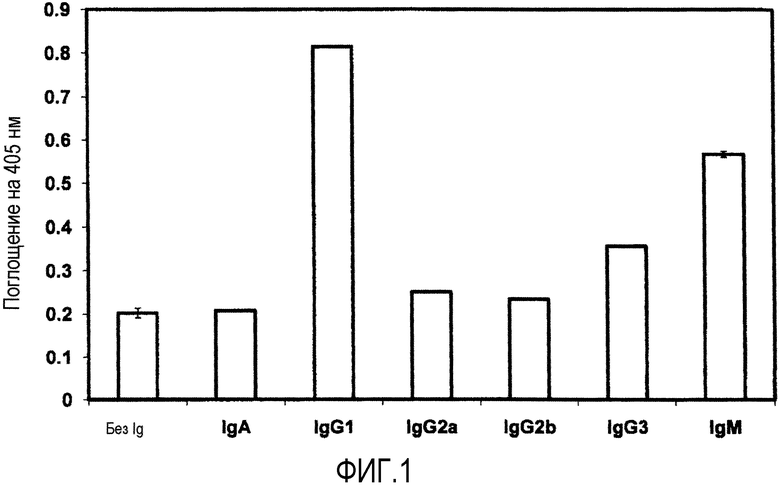
На фиг.1 показаны результаты тестов по идентификации изотипа моноклонального антитела по настоящему изобретению (в дальнейшем также называемого "SSVmAb").
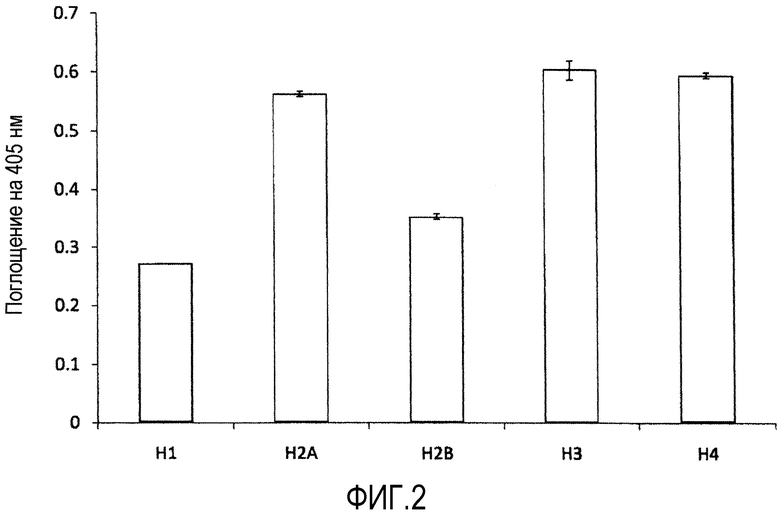
На фиг.2 показаны результаты тестов, где сравнивали аффинности связывания моноклонального антитела по настоящему изобретению (SSVmAb) с гистоном H1 и гистонами H2A, H2B, H3 или H4.
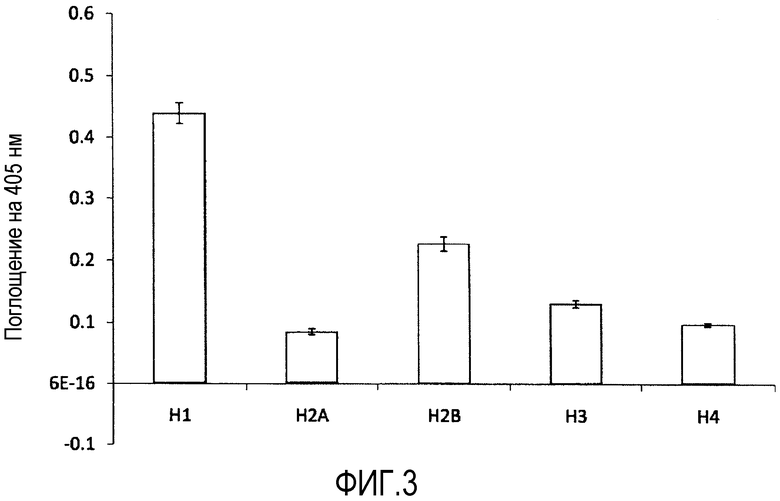
На фиг.3 показаны результаты тестов, где сравнивали аффинности связывания моноклонального антитела, продуцированного гибридомой 16G9 (в дальнейшем также называемой "16G9mAb") с гистоном H1 и с гистонами H2A, H2B, H3 или H4. Гибридома была депонирована под депозитарным номером FERM BP-10413 (Референсная гибридома).
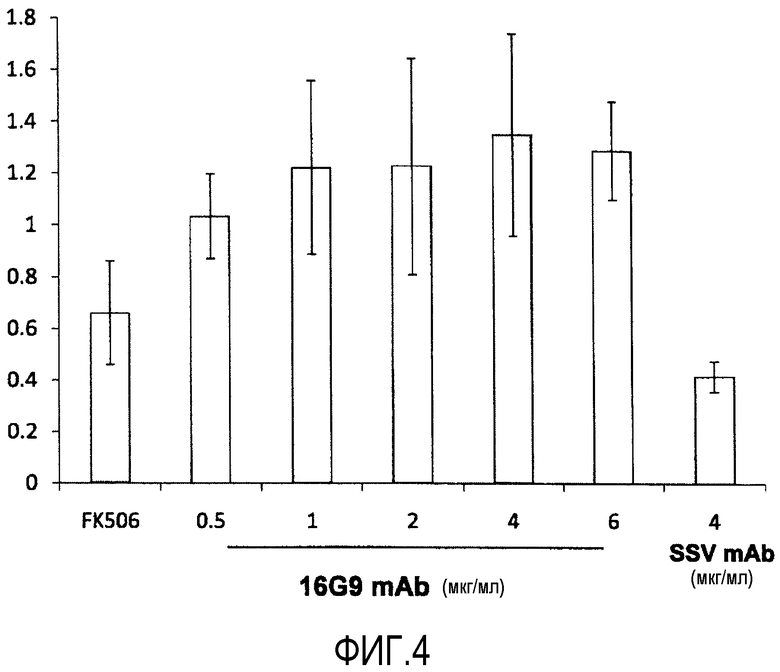
На фиг.4 показаны результаты тестов смешанной реакции лимфоцитов (MLR) с использованием моноклонального антитела по настоящему изобретению (SSV mAb) и антитела 16G9 mAb.
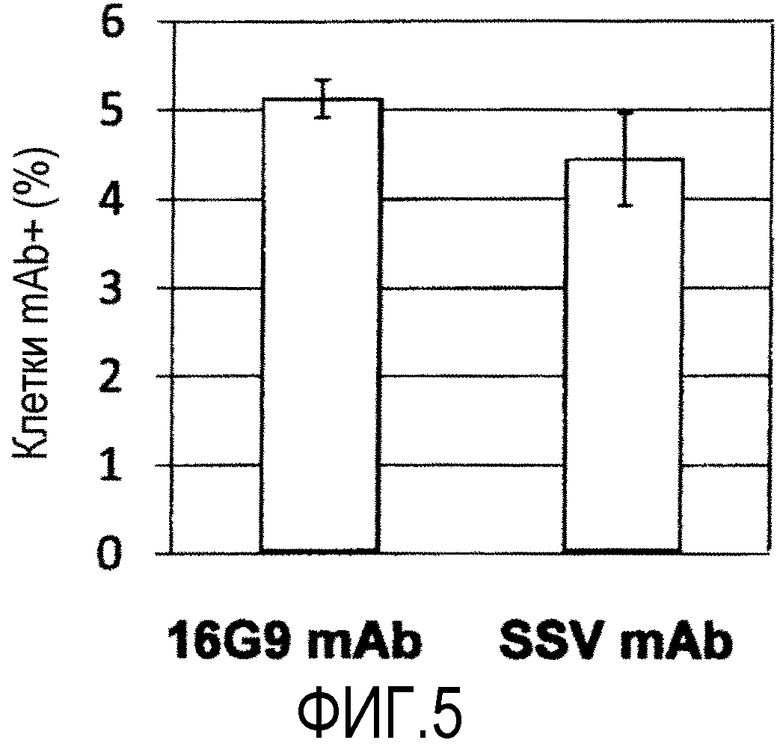
На фиг.5 показаны результаты сравнения, где реакционные способности моноклонального антитела по настоящему изобретению (SSV mAb) и антитела 16G9 mAb по отношению Т-клеток сравнивались при помощи проточной цитометрии.
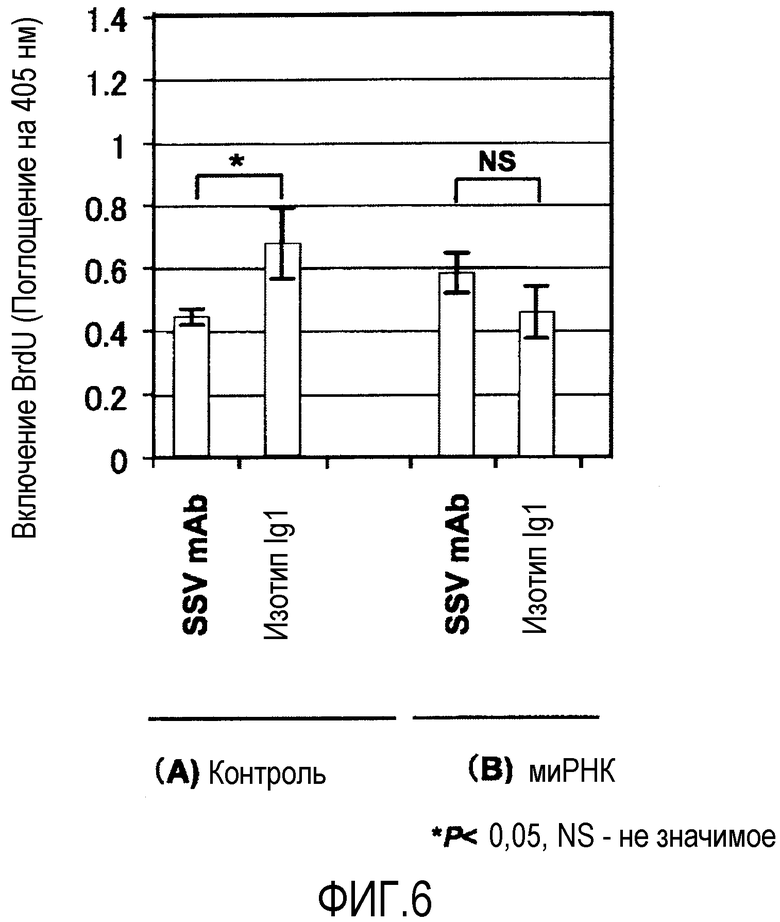
На фиг.6A показаны результаты тестов MLR в отношении моноклонального антитела по настоящему изобретению (SSV mAb) и реактива контроля (изотип IgG1), с использованием клеток селезенки, в которых синтаза ATP не была нокаутирована за счет малых интерферирующих РНК (миРНК).
На фиг.6B показаны результаты тестов MLR в отношении моноклонального антитела по настоящему изобретению (SSV mAb) и реактива контроля (изотип IgG1), с использованием клеток селезенки, в которых синтаза ATP была нокаутирована за счет малых интерферирующих РНК (миРНК).
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
ДЕПОНИРОВАНИЕ
Гибридома по настоящему изобретению представляет собой гибридому "мышь-мышь" SSV-C 93-3, которая была депонирована в патентном депозитарии Национального Института Технологий и Исследований (National Institute of Technology and Evaluation, Patent Microorganisms Depositary (Адрес: Biotechnology Headquarter, 2-5-8 Kazusa Kamatari, Kisarazu-shi, Chiba-ken, Japan)) с первоначальной датой депонирования 17 августа 2010 г., под депозитарным номером BP-972.
МОНОКЛОНАЛЬНОЕ АНТИТЕЛО И ГИБРИДОМА
Одна из особенностей моноклонального антитела по настоящему изобретению или его антигенсвязывающего фрагмента состоит в том, что моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент связывается с пептидом, состоящим из аминокислотной последовательности SSVLYGGPPSAA (SEQ ID NO:1), или с конъюгатом этого пептида и фармацевтически приемлемого носителя, и что моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент имеет более высокую аффинность связывания с коровом гистоном, чем с линкерным гистоном (гистон H1). Авторы настоящего изобретения неожиданно обнаружили, что моноклональное антитело, имеющее такую реакционную способность, или его антигенсвязывающий фрагмент проявляет существенную иммуносупрессивную активность.
Согласно предпочтительному варианту осуществления настоящего изобретения, вышеуказанное антитело или его антигенсвязывающий фрагмент действует против пептида, состоящего из аминокислотной последовательности SSVLYGGPPSAA (SEQ ID NO:1), или против конъюгата пептида с фармацевтически приемлемым носителем.
Согласно другому предпочтительному варианту осуществления настоящего изобретения, коровый гистон представляет собой гистон H2A, H2B, H3 или H4, и, более предпочтительно, представляет собой гистон H2A, H3 или H4.
Антитело по настоящему изобретению или его антигенсвязывающий фрагмент может также содержать тяжелую цепь и/или легкую цепь. В каждой легкой и тяжелой цепях на их N-конце может присутствовать вариабельная область, и каждая вариабельная область может содержать четыре каркасные области (FR) и три области, определяющие комплементарность (CDR), в чередующемся порядке. Остатки в вариабельной области обычно нумеруют согласно системе, разработанной Kabat и др. Эта система описана в работе Kabat et al., 1987, Sequences of Proteins of Immunological Interest, US Departement of Health and Human Services, NIH, USA. Если не указано иначе, эта система нумерации используется в настоящем описании. Нумерация, основанная на способе Kabat и др., может быть легко выполнена, используя, например, вебсайт <http://www.bioinf.org.uk/abysis/tools/analyze.cgi>.
Нумерация остатков по Kabat не обязательно соответствует непосредственной линейной нумерации остатков аминокислот. У фактической линейной аминокислотной последовательности структурного элемента базовой структуры вариабельной области, каркасной области или CDR может быть меньшее количество аминокислот, или она может иметь дополнительные аминокислоты по сравнению со строгой нумерацией по Kabat, в зависимости от укорачиваний (трункаций) или вставок (инсерций). Для предложенного антитела, правильная нумерация остатков по Kabat будет определяться выравниванием гомологичных остатков последовательности, пронумерованной согласно "стандартной" нумерации по Kabat, и последовательности антитела.
Согласно одному из вариантов осуществления изобретения, вариабельная область легкой цепи антитела по настоящему изобретению или его антигенсвязывающего фрагмента содержит CDR1, состоящую из аминокислотной последовательности RASSSVSYMH (SEQ ID NO:2), CDR2, состоящую из аминокислотной последовательности ATSNLAS (SEQ ID NO:3) и CDR3, состоящую из аминокислотной последовательности QQWSSNPWT (SEQ ID NO:4). Согласно более предпочтительному варианту осуществления изобретения, вышеуказанная вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO:6 от положения 23 до положения 128.
Согласно другому варианту осуществления изобретения, вариабельная область тяжелой цепи антитела по настоящему изобретению или его антигенсвязывающего фрагмента содержит CDR1, состоящую из аминокислотной последовательности GYNMN (SEQ ID NO:7), CDR2, состоящую из аминокислотной последовательности NINPYYGSTSYNQKFKG (SEQ ID NO:8) и CDR3, состоящую из аминокислотной последовательности SPYYSNYWRYFDY (SEQ ID NO:9). Согласно более предпочтительному варианту осуществления изобретения, вышеуказанная вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:11 от положения 20 до положения 141.
Кроме того, согласно еще более предпочтительному варианту осуществления изобретения, антитело по настоящему изобретению или его антигенсвязывающий фрагмент содержит вариабельную область легкой цепи, содержащую CDR1, состоящую из аминокислотной последовательности RASSSVSYMH (SEQ ID NO:2), CDR2, состоящую из аминокислотной последовательности ATSNLAS (SEQ ID NO:3), и CDR3, состоящую из аминокислотной последовательности QQWSSNPWT (SEQ ID NO:4), и вариабельную область тяжелой цепи, содержащую CDR1, состоящую из аминокислотной последовательности GYNMN (SEQ ID NO:7), CDR2, состоящую из аминокислотной последовательности NINPYYGSTSYNQKFKG (SEQ ID NO:8), и CDR3, состоящую из аминокислотной последовательности SPYYSNYWRYFDY (SEQ ID NO:9).
Кроме того, согласно еще более предпочтительному варианту осуществления изобретения, антитело по настоящему изобретению или его антигенсвязывающий фрагмент содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:6 от положения 23 до положения 128, и вариабельную область тяжелой цепи, содержащей аминокислотную последовательности SEQ ID NO:11 от положения 20 до положения 141.
Кроме того, согласно предпочтительному варианту осуществления настоящего изобретения, вышеуказанное моноклональное антитело или его антигенсвязывающий фрагмент может ингибировать активность ATP-синтазы. Кроме того, согласно более предпочтительному варианту осуществления настоящего изобретения, вышеуказанная ATP-синтаза представляет собой митохондриальную ATP-синтазу.
Вышеуказанные аффинность связывания и ингибирующая активность в отношении активности ATP-синтазы для моноклонального антитела по настоящему изобретению или его антигенсвязывающего фрагмента определены способами, например такими, как описано в экспериментальных примерах 2 и 4 настоящего описания.
Кроме того, моноклональное антитело по настоящему изобретению, предпочтительно, представляет собой химерное антитело, гуманизированное антитело или полностью человеческое антитело. Специалисты в данной области могут получить такие антитела согласно известным технологиям в данной области, как описано, например, в работах Morrison, S.L., Oi, V. T., "immunoglobulin genes" Academic Press (London), 260-274 (1989); Roguska, M. L. et. al., Humanization of murine monoclonal antibodies through variable domain resurfacing, Proc. Natl. Acad. Sci. USA, 91, 969-973 (1994); Tomizuka, K. et al. Functional expression and germline transmission of a human chromosome fragment in chimeric mice, Nature Genet., 16, 133-143 (1997); Winter, G. et. al., Making antibodies by phage display technology, Ann. Rev. Immunol., 12, 433-455 (1994); Griffiths, A. D. et. al., Isolation of high affinity human antibodies directly from large synthetic repertoires, EMBO. J., 13, 3245-3260 (1994).
Более того, согласно предпочтительному варианту осуществления настоящего изобретения, вышеуказанный антигенсвязывающий фрагмент, предпочтительно, представляет собой Fab, Fab', (Fab')2, Fv или scFv.
Кроме того, согласно другому варианту осуществления, настоящее изобретение относится к гибридоме, которая продуцирует вышеуказанное моноклональное антитело или его антигенсвязывающий фрагмент. Также еще, согласно другому предпочтительному варианту осуществления настоящего изобретения, гибридома представляет собой гибридому "мышь-мышь" SSV-C 93-3.
Моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент и гибридома могут быть получены, например, следующим образом. Так, исходно, гибридома по настоящему изобретению может быть получена с использованием в качестве антигена пептида, содержащего аминокислотную последовательность SSVLYGGPPSAA (SEQ ID NO:1) или конъюгата этого пептида с фармацевтически приемлемым носителем, путем слияния клеток плазмы млекопитающего (иммунные клетки), иммунизированного этим сенсибилизирующим антигеном, с клетками миеломы млекопитающего, клонирования и скрининга полученных гибридом. Затем моноклональное антитело по настоящему изобретению можно получать путем культивирования гибридомы по настоящему изобретению и сбора получаемого антитела, продуцируемого гибридомой.
Для иммунизации млекопитающего могут использоваться любые способы введения, обычные в данной области. В частности, эти способы включают внутрибрюшинную инъекцию, внутриселезеночную инъекцию, внутримышечную инъекцию, подкожную инъекцию, внутрикожную инъекцию, пероральное введение, трансмукозальное введение, трансдермальное введение, но внутрибрюшинная инъекция и внутриселезеночная инъекция являются предпочтительными. Интервал между дозировками сенсибилизирующего антигена определяется соответствующим образом в зависимости от дозы сенсибилизирующего антигена, вида млекопитающего и т.п. Например, интервал между дозировками может представлять введение несколько раз в месяц.
Вид млекопитающих, которые будут иммунизированы, не являются ограниченным, но они, предпочтительно, выбраны, например, после рассмотрения вопроса совместимости клеток миеломы, используемых для слияния клеток. Млекопитающие включают, например, мышь, крысу и хомяка. Предпочтительно, млекопитающее представляет собой мышь.
Кроме того, предпочтительно, когда клетки селезенки используются как иммунные клетки.
Клетки миеломы, используемые для настоящего изобретения, включают, например, P3 (P3X63Ag8.653) (J. Immunol., 123,1548, 1978), p3-U1 (Current Topics in Microbiology and Immunology, 81, 1-7,1978), NS-1 (Eur. J. Immunol., 6, 511-519, 1976), MPC-11 (Cell, 8, 405-415, 1976), Sp2/0-Ag14 (Nature, 276, 269-270, 1978), FO (J. Immunol. Meth., 35, 1-21, 1980), S194 (J. Exp. Med., 148, 313-323, 1978) и R210 (Nature, 277, 131-133, 1979). Клетка миеломы, предпочтительно, представляют собой клетки P3 или p3-U1, более предпочтительно, P3.
Иммунные клетки и клетки миеломы могут быть слиты, например, способом согласно Milstein et. al. (Methods Enzymol., 73, 3-46, 1981). В частности, слияние клеток может быть выполнено, например, путем смешивания иммунных клеток и клеток миеломы в среде культивирования в присутствии промотора слияния. Затем, при слиянии клеток, может быть соответствующим образом повторено дополнение среды культивирования и выполнено центрифугирование, для получения гибридом.
Среда культивирования, используемая для слияния клеток, включает, например, среды культивирования, обычно используемые при слиянии клеток, такие как среда культивирования RPMI-1640 и среда культивирования MEM. Кроме того, дополнения из сыворотки крови, например, эмбриональная телячья сыворотка (FBS), могут также использоваться при необходимости.
Температура слияния клеток, предпочтительно, составляет 25-37°C, и, более предпочтительно, 30-37°C.
Отношение клеток миеломы и иммунных клеток в смеси, предпочтительно, составляет приблизительно от 1:1 до 1:10.
Промоторы слияния могут включать, например, полиэтиленгликоль (PEG) и вирус Сендай (HVJ). Промотор слияния, предпочтительно, представляет собой PEG. Молекулярная масса PEG может быть выбрана подходящим образом, и, в частности, средняя молекулярная масса может находиться в интервале приблизительно 1000-6000. Концентрация PEG в среде для культивирования, предпочтительно, составляет приблизительно 30%-60% (масс./об).
Вспомогательные агенты, например, диметилсульфоксид, могут быть соответствующим образом добавлены по желанию к среде культивирования.
Отбор гибридомы по настоящему изобретению может быть выполнен путем культивирования гибридом, полученных слиянием клеток, например, в обычной среде для отбора, такой как среда культивирования HAT, и использования способа лимитирующих разведений для того, чтобы выполнить скрининг, например, на основе показателя, такого как титр антитела против пептида, состоящего из аминокислотной последовательности SSVLYGGPPSAA (SEQ ID NO:1), или против конъюгата пептида с фармацевтически приемлемым носителем. Период культивирования в среде культивирования HAT является достаточным периодом для того, чтобы клетки (неслитые клетки), кроме целевой гибридомы, погибли, и этот период обычно может составлять от нескольких дней до нескольких недель. Гибридома по настоящему изобретению, полученная таким образом, может подвергаться субкультивированию в обычной среде для культивирования, а также может храниться в жидком азоте в течение длительного времени.
Способы сбора моноклонального антитела по настоящему изобретению или его антигенсвязывающего фрагмента включают, например, способ, где гибридома культивируется обычным способом для получения моноклонального антитела и подобного из супернатанта культуры, или способ, где гибридому вводят восприимчивому млекопитающему для пролиферации, и моноклональное антитело и подобное получают из асцитной жидкости. Первый способ в данном изобретении предпочтителен для получения антитела с очень высокой чистотой, в то время как последний способ предпочтителен для продуцирования больших количеств антитела.
Кроме того, моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут быть очищены до высокой чистоты способами, такими как высаливание, гельфильтрация и аффинная хроматография.
Моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент обладает существенной иммуносупрессивной активностью, как описано выше. Моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент может использоваться самостоятельно или может использоваться в виде фармацевтической композиции вместе с фармакологически приемлемой добавкой. Поэтому, согласно одному варианту осуществления настоящее изобретение относится к фармацевтической композиции, содержащей моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент. Кроме того, согласно предпочтительному варианту осуществления настоящего изобретения, вышеуказанная фармацевтическая композиция используется как иммуносупрессивное средство. Кроме того, согласно другому варианту осуществления, настоящее изобретение относится к применению моноклонального антитела по настоящему изобретению для получения фармацевтической композиции.
Фармацевтическая композиция по настоящему изобретению может быть успешно использована для подавления отторжения пересаженных органов, таких как сердце, почка, печень, костный мозг или кожа, или для снижения риска развития отторжения, и дополнительно может использоваться для лечения аутоиммунных заболеваний и т.п. Фармацевтическая композиция по настоящему изобретению может быть получена, например, путем растворения моноклонального антитела по настоящему изобретению в физиологическом растворе для инъекций, дистиллированной воде для инъекций, буферном растворе для инъекций и т.п. Композиция для иммуносупрессии по настоящему изобретению может дополнительно содержать подходящий растворитель, солюбилизатор, консервант, стабилизатор, эмульгатор, средство для суспендирования, успокаивающее средство, средство для поддержания тоничности, буфер, эксципиент, загуститель, окрашивающий агент, известный носитель (различные липосомы, носители на основе полиаминовой кислоты, синтетические макромолекулы, природные полимеры и т.п.) и т.п.
Кроме того, согласно другому варианту осуществления, настоящее изобретение относится к способу лечения млекопитающего, нуждающегося в иммуносупрессии, где способ включает введение эффективного количества моноклонального антитела по настоящему изобретению или его антигенсвязывающего фрагмента. В этом контексте термин "лечение" подразумевает облегчение состояния при установленной патологии. Кроме того, согласно другому варианту осуществления, настоящее изобретение относится к способу снижения риска развития отторжения трансплантата, где способ включает введение эффективного количества моноклонального антитела по настоящему изобретению или его антигенсвязывающего фрагмента млекопитающему, которому трансплантируется орган.
Кроме того, согласно одному из вариантов осуществления, вышеуказанное млекопитающее уже имеет трансплантированный орган. Вышеупомянутые млекопитающие и доноры для трансплантации органа включают человека, свинью и бабуина. Человек является предпочтительным млекопитающим.
Органы для трансплантации включают, например, печень, сердце, почку или кожу.
Кроме того, моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент, можно одновременно или последовательно вводить млекопитающему в комбинации с другими иммуносупрессивными средствами, используемыми при трансплантации органов. Такие другие иммуносупрессивные средства включают, но без ограничения, например, алкилирующие агенты, в частности, циклофосфамид; антиметаболиты, такие как азатиоприн, метотрексат и мизорибин; ингибиторы активности T-клеток, такие как циклоспорин и такролимус; стероиды, такие как преднизолон, метилпреднизолон, мофетил микофенолата и азатиоприн; ингибиторы функционирования поверхности лимфоцитов, такие как басиликсимаб и муромонаб; и их комбинации.
Кроме того, моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент можно вводить системно или местно. Конкретные способы введения включают инфузию, внутривенную инъекцию, внутримышечную инъекцию, подкожную инъекцию, внутрикожную инъекцию, пероральное введение, трансмукозальное введение и трансдермальное введение.
Кроме того, эффективное количество моноклонального антитела по настоящему изобретению или его антигенсвязывающего фрагмента не является конкретным и ограниченным, и может быть соответствующим образом определено специалистом в данной области в зависимости от вида млекопитающего, его состояния, пола, возраста и т.п. Например, такое эффективное количество включает одну или несколько доз из расчета от 0,05 до 40 мг/кг веса тела в день, предпочтительно, от 0,1 до 1,0 мг/кг веса тела в день.
ПРИМЕРЫ
Далее настоящее изобретение будет детально описано со ссылкой на Примеры, но настоящее изобретение не ограничено этими Примерами.
Пример 1: Получение моноклонального антитела (SSV mAb)
Получение антигенного вещества
В качестве антигенного вещества использовался конъюгат пептида, состоящего из аминокислотной последовательности SEQ ID NO:1, и гемоцианина лимфы фисуреллы (KLH).
При получении антигенного вещества, в первую очередь был синтезирован пептид, состоящий из аминокислотной последовательности SEQ ID NO:1, при помощи способа твердофазного пептидного синтеза Fmoc (используемая аппаратура - ABI 430, Applied Biosystems). Конъюгат вышеуказанного пептида и KLH (SIGMA) был синтезирован путем перемешивания 5 мг вышеуказанного пептида, приблизительно 20 мг KLH и 30 мкг глутаральдегида (Katayama Chemical Industries Co., Ltd.) в фосфатном буфере (pH 8,0) при комнатной температуре в течение приблизительно 6 часов.
Получение гибридомы
Иммунизация
Была получена суспензия (концентрация антигена - 0,25 мг/мл) путем смешивания 0,8 мл раствора, где антигенное вещество было растворено в PBS (концентрация антигенного вещества - 0,5 мг/мл), и 0,8 мл полного адъюванта Фрейнда (Wako Pure Chemical Industries, Ltd.). Затем 0,2 мл этой суспензии было интраперитонеально введено мышам BALB/c. Эта суспензия, в том же самом количестве, дополнительно вводилась мышам каждые две недели. Затем, через 16 недель после начала введения, мышам интраперитонеально вводили заключительную дозу в количестве 0,2 мл раствора, где антиген был растворен в PBS (концентрация антигена составила 600-1000 мг/мл). Кровь после ведения отбирали из вены за глазом, и титр антитела был измерен с помощью ELISA. Спустя четыре дня после последнего введения был выполнен забор всей крови, и полученную кровь центрифугировали (2000 оборотов в минуту, 20 минут) для получения антисыворотки, которая использовалась как контрольная антисыворотка в последующих экспериментах. Кроме того, из грызунов, после забора всей крови, были выделены клетки селезенки и полученные клетки селезенки использовались для слиянии клеток следующим образом.
Слияние клеток
Вышеуказанные клетки селезенки и клетки миеломы (P3X63-Ag.8.653) были смешаны в соотношении клетки селезенки:клетки миеломы равном 1:1-1:10, и подвергнуты центрифугированию (1500 оборотов в минуту, 5 минут). После центрифугирования супернатант был удален с использованием аспиратора, и через 1 минуту к осадку клеток был добавлен 1 мл полиэтиленгликоля 4000 (50% раствор в PBS) при 37°C, с получением смешанной жидкости. После хранения этой смешанной жидкости при 37°C в течение 1 минуты, каждые 30 секунд добавляли 1 мл среды для культивирования IMDM (всего 9 мл), и затем все это центрифугировали (1500 оборотов в минуту, 5 минут). После центрифугирования супернатант был удален путем отсасывания, и было добавлено соответствующее количество 15%-ого раствора FCS (JRH BIOSCIENCES), содержащего среду для культивирования IMDM (GIBCO), при 37°C. Полученная суспензия была помещена в 96-луночные планшеты для культивирования из расчета 100 мл для каждого планшета, и культивировалась в течение одного дня в инкубаторе при 37°C в атмосфере 5% CO2. Кроме того, было добавлено 100 мл среды культивирования HAT (порошок HAT (добавка к среде HAT (x50), SIGMA) был растворен в 10 мл среды для культивирования IMDM без сыворотки, которая затем была разбавлена в 50 раз 10%-ым FCS, содержащим среду культивирования IMDM), и планшеты культивировали в инкубаторе при 37°C в атмосфере 5% CO2. Среда для культивирования HAT заменялась каждые 2-3 дня, и через 10 дней она была заменена на среду для культивирования HT (порошок HT (добавка к среде HT, SIGMA) был растворен в 10 мл среды для культивирования IMDM без сыворотки, которая затем была разбавлена в 50 раз 10%-ым FCS, содержащим среду культивирования IMDM), и планшеты культивировали в течение трех дней в инкубаторе при 37°C в атмосфере 5% CO2. Затем среда для культивирования (среда культивирования HT) заменялась каждые 2-3 дня. После подтверждения роста клеток под микроскопом, был собран супернатант культуры (приблизительно 100 мл). Используя супернатант культуры, и путем измерения титров антител, был выполнен скрининг гибридом.
Скрининг клеток гибридом
Измерение титра антител
Буферный раствор, содержащий вышеуказанное антигенное вещество (5 мг) (бикарбонатный буфер: 100 мМ NaHCO3-NaOH, pH 9,2-9,5; концентрация пептида - 1 мкг/мл), был добавлен в 96-луночный плоскодонный планшет в количестве 50 мкл на лунку, и планшеты хранили при комнатной температуре в течение 2 часов для формирования покрытия. Планшеты были промыты три раза буфером для промывки (PBST), и затем был добавлен блокирующий буфер (3% снятого молока, 1% BSA, PBS) в количестве от 200 до 250 мкл на лунку, для протекания реакции при 4°C в течение одного полного дня, и затем планшеты были промыты три раза. Затем был добавлен супернатант культуры гибридомы в количестве 100 мкл на лунку, для протекания реакции при 37°C в течение 4 часов или при 4°C в течение одного полного дня. После того, как планшеты были промыты три раза, был добавлен анти-IgG мыши, меченный биотином (SIGMA), который был разбавлен в 10000 раз буфером для растворения (10 мМ Трис-HCl (pH 8,0), 0,9% (масс./об) NaCl, 0,05% (масс./об) Tween 20), из расчета 50 мкл на лунку, и планшеты хранили для протекания реакции при комнатной температуре в течение 2 часов. После того, как промывка была выполнена шесть раз, добавляли меченную стрептавидином щелочную фосфатазу, разбавленную в 1000 раз буфером для растворения, из расчета 50 мкл на лунку, и планшеты хранили для протекания реакции при комнатной температуре в течение 1-2 часов. Затем была выполнена шестикратная промывка, и был добавлен флуоресцентный субстратный буфер (субстратный буфер Attophos, Roche Diagnostics) в количестве 50 мкл на лунку, и пластина была помещена в темное место для развития флюоресценции. Интенсивность флюоресценции была измерена при помощи прибора CytoFluorII (PerSeptive Biosystems).
Скрининг гибридом
К лункам 96-луночного планшета для культивирования, которые показали положительный результат в вышеуказанном измерении титра антитела (1×105 клеток/мл), была добавлена среда культивирования IMDM, содержащая 15% FCS, 10% HCF (фактор клонирования гибридом, ORIGIN), в количестве приблизительно 200 клеток на лунку, и планшеты культивировали в инкубаторе при 37°C в атмосфере 5% CO2. Затем были измерены титры антител, как описано выше, и были отобраны гибридомы, которые продемонстрировали высокий выход антител.
Было дополнительно выполнено лимитирующее разбавление так, чтобы выбранная гибридома была растворена из расчета 0,5-1 клетка/лунка в среде культивирования IMDM, содержащей 15% FCS, 10% HCF. После культивирования в инкубаторе при 37°C в атмосфере 5% CO2 в течение приблизительно трех-четырех дней, были измерены титры антитела, как описано выше, чтобы выбрать гибридомы, показывающие высокий выход антител. Дополнительно было повторено лимитирующее разбавление, так чтобы получить гибридомы, которые продуцируют моноклональное антитело против вышеуказанного антигенного вещества. Среди них была выбрана гибридома с самым высоким титром антител, и она была обозначена как гибридома "мышь-мышь" SSV-C 93-3.
Получение моноклонального антитела
Гибридому "мышь-мышь" SSV-C 93-3 культивировали с использованием среды культивирования RPMI (1×106 клеток/мл) с 15% FCS. Затем была собрана среда культуры гибридомы, и отфильтрована через фильтр для того, чтобы удалить дебрис погибших клеток. Затем к супернатанту культуры был добавлен сульфат аммония до конечной концентрации 40%, и смесь перемешивали в течение 1 часа при 40°C. После этого было выполнено центрифугирование (3000 g, 30 минут, 4°C) и супернатант был удален для сбора осадка. Осадок был растворен в PBS, в объеме, эквивалентном 1/10 от количества вышеуказанного супернатанта культуры, и раствор был диализирован против PBS в течение ночи.
Далее, вышеуказанный осадок был дважды разбавлен 20 мМ буфером фосфата натрия (pH 7,0), и загружен в активированную колонку HiTrap NHS вместе с 1M буфером Трис-HCl. Затем антитело было элюировано 0,1 M раствором глицин·HCl (pH 2,7), и его собирали в пробирки для фракционирования.
Экспериментальный пример 1: Идентификация изотипа SSV mAb
Чтобы идентифицировать изотип моноклонального антитела (SSV mAb) Примера 1, были выполнены тесты по идентификации изотипа с использованием набора реактивов для изотипирования Mouse Monoclonal Antibody Isotyping Reagents (SIGMA).
Результаты, показанные на фиг.1, демонстрируют, что IgG1 показал самое высокое значение.
Кроме того, когда IgG1 мыши (eBioscience) и моноклональное антитело (SSV mAb) Примера 1 были восстановлены с помощью 2-меркаптоэтанола и проанализированы с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), полосы, соответствующие тяжелой цепи и легкой цепи, наблюдались в подобных положениях (50 кДа, 25 кДа) для обоих случаев. С другой стороны, подобные группы не наблюдались, когда такой эксперимент проводился с использованием IgM мыши (eBioscience), вместо IgG1 мыши.
Исходя из результатов, представленных на фиг.1, и результатов SDS-PAGE, изотип моноклонального антитела (SSV mAb) Примера 1 был определен как IgG1.
Экспериментальный пример 2: Определение аффинности SSVmAb к коровому гистону
В WO2006/025580 сообщалось о моноклональном антителе (16G9 mAb), продуцируемом гибридомой 16G9 (депозитарный номер FERM BP-10413), как о моноклональном антителе против H1, которое можно использовать для иммуносупрессии, и которое связывается с пептидом, состоящим из аминокислотной последовательности SEQ ID NO:1.
Поэтому, используя антитело (16G9 mAb) описанное в WO2006/025580, как Ссылочный Пример 1, была сравнена аффинность моноклонального антитела (SSV mAb) Примера 1 к антигену.
В качестве антигена были выбраны гистон H1, который является антигеном Ссылочного Примера 1 (16G9 mAb), и коровые гистоны H2A, H2B, H3 и H4, которые являются антигенными аналогами гистона H1.
Аффинитет между SSV mAb и гистоном H1 или коровыми гистонами был определены при помощи ELISA.
96-луночный планшет был покрыт гистоном H1, H2A, H2B, H3 или H4. Каждый используемый гистон был растворен в 100 мМ буфере на основе карбоната натрия (pH 9,3). Планшет был промыт раствором PBS-Tween 20 (0,05%) и заблокирован раствором, содержащим 3% снятого молока и 1% BSA, в течение 1 часа. К каждой лунке было добавлено 5 мкг/мл SSV mAb, и планшет инкубировали в течение 1 часа. Связанный SSV mAb детектировали с использованием конъюгата антитела против IgG1 мыши и пероксидазы (HRP) (SIGMA), и с инкубированием проб в течение 1 часа. Связанный SSV mAb был обнаружен с использованием раствора субстрата ABTS [2,2'-азино-бис(3-этилбензотиазолин-сульфоновая кислота)], и, используя спектрометр Multiskan Ascent (Thermo Fisher Scientific Inc., Waltham, MA), было измерено поглощение на 405 нм.
Результаты показаны на фиг. 2 и 3.
Как показано на фиг.2, аффинность для Примера 1 (SSVmAb) к гистонам H2A, H2B, H3 или H4 была выше, чем аффинность к гистону H1.
С другой стороны, как показано на фиг.3, аффинность для Ссылочного Примера 1 (16G9) к гистону H1 была выше, чем аффинность к гистонам H2A, H2B, H3 и H4.
Экспериментальный пример 3: тесты MLR
Использовались лимфоциты селезенки от нативной крысы DA (чувствительные клетки) и лимфоциты селезенки от крысы LEW, которые были обработаны митомицином-C (Kyowa Hakko Kogyo Co., Ltd.). Чувствительные клетки были доведены до концентрации 5×106 клеток/мл в среде для культивирования RPMI с 10% FCS, и стимулированные клетки были доведены до концентрации 8×106 клеток/мл в среде для культивирования RPMI с 10% FCS. После помещения по 100 мкл суспензии чувствительных клеток и суспензии стимулированных клеток в соответствующие 96-луночные планшеты с полусферическими лунками (Nunc Brand Products), было добавлено моноклональное антитело 16G9 mAb Ссылочного Примера 1 (0,1, 2, 4, или 6 мкг/мл на лунку) или моноклональное антитело SSV mAb Примера 1 (4 мкг/мл на лунку) для старта смешанной культуры, и планшеты культивировали в течение 3,5 дней или дольше при 37°C в атмосфере, содержащей 5% CO2 и 95% воздуха. Кроме того, в качестве положительного контроля было добавлено иммуносупрессивное средство такролимус (FK506: Fujisawa Pharmaceutical Co., Ltd., в количестве 1 нМ/лунка). Также, за 15 часов до конца культивирования, было добавлено 10 мкл бромзамещенного дезоксиуридина (BrdU). Затем была измерена способность к пролиферации клеток, обработанных иммуносупрессивным средством, с использованием набора для мечения и детекции BrdU (BrdU labeling & detection kit III (Roche Diagnostics)), принимая количество BrdU, включенного в клеточную ДНК, в качестве индикатора. Способность к пролифераци использовалась как показатель уровня иммуносупрессии.
Результаты показаны на фиг.4.
Поглощение для Примера 1 (SSV mAb), указывающее на количество включенного BrdU, было ниже, чем поглощение для Ссылочного Примера 1 (16G9 mAb) и такролимуса (FK506). В частности, при одинаковом количестве добавленного антитела (4 мкг/мл на лунку), поглощение для Примера 1 (SSV mAb) составило 0,552±0,114 (среднее±стандартная ошибка (S.E.)), и поглощение для Ссылочного Примера 1 (16G9 mAb) составило 1,351±0,389 (среднее±S.E.), сравнение показывает, что среднее значение для Примера 1 составляет приблизительно 41% от значения для Ссылочного Примера 1.
Экспериментальный пример 4: Определение реактивности моноклонального антитела (SSV mAb) в отношении Т-клеток
Для получения целых клеток селезенки использовали следующее, селезенка была удалена из мыши C57BL/6 (самки в возрасте 5 недель, CHARLES RIVER LABORATORIES JAPAN, INC.).
Прежде всего, в чашках для культивирования на 5 мл (FALCON 351007, BD Bioscience), в которые было помещено 5 мл среды для культивирования RPMI 1640 (R-8758, Sigma-Aldrich), селезенка, при помощи анатомических ножниц и щипцов, была тщательно размельчена для разделения клеток селезенки, которые были перенесены в пробирки для центрифугирования на 15 мл (FALCON 352096, BD Bioscience). Затем чашки на 5 мл были несколько раз промыты физиологическим солевым раствором, забуферированным фосфатом (PBS, Invitrogen, 20012-027), и смывы были также добавлены к полученной суспензии клеток, и оставлены для хранения, после этого супернатант был собран в другие пробирки для центрифугирования на 15 мл. Кроме того, среда для культивирования RPMI 1640, объемом 5 мл, была снова добавлена к не суспендированному остатку ткани селезенки, и взвесь была оставлена для хранения, после чего был собран только супернатант, который был объединен с вышеуказанной суспензией клеток, которую подвергли центрифугированию при 1500 оборотах в минуту в течение 5 минут. К собранным клеткам было добавлено 2 мл буфера для лизирования (150 мМ NH4Cl/15 мМ NaHCO3/0,1 EDTA-Na2; pH 7,3), и был выполнен гемолиз с деструкцией поврежденных клеток, затем добавили 10 мл PBS. После трехкратной промывки путем центрифугирования при 1500 оборотах в минуту в течение 5 минут, были получены целые клетки селезенки.
Затем, согласно принятому подходу, описанному ниже, целые T-клетки были очищены от вышеупомянутых селезеночных клеток магнитной сортировкой (MACS) с использованием набора для выделения клеток Pan T Cell Isolation Kit, mouse (Miltenyl Biotec, 130-090-861).
Прежде всего, клетки селезенки были суспендированы до концентрации 5×107 клеток в 200 мкл буфера MACS (0,5% бычьего сывороточного альбумина (BSA, NACALAI TESQUE, INC, 08777-36) в PBS), к которому было добавлено 50 мкл коктейля биотин-антитело из расчета на 5×107 клеток, и суспензия инкубировалась при 4°C в течении 10 мин. Затем, все это было суспендировано в 150 мкл буфера MACS из расчета на 5×107 клеток, и добавлено 100 мкл суспензии микросфер, из расчета на 5×107 клеток, после чего суспензию инкубировали при 4°C в течении 15 мин. К полученной суспензии был добавлен буфер MACS (10 мл), и суспензия отмывалась центрифугированием при 1500 оборотах в минуту в течение 5 минут, после чего выделенные клетки были суспендированы в 500 мкл буфера MACS. Далее, колонка для MACS (колонка MS, 130-042-201, Miltenyi Biotec) была помещена в магнитное устройство для разделения (MiniMACS separation Unit, 130-090-312, Miltenyi Biotec), колонка была уравновешена 500 мкл буфера MACS, и вышеуказанная суспензия клеток была загружена в колонку. Была собрана фракция, состоящая из 500 мкл суспензии, прошедшей через колонку, и последующей фракции от промывки колонки (1,5 мл) буфером MACS, с получением очищенных нестимулированных T-клеток (приблизительно 97%-ой чистоты).
Реакционная способность вышеуказанных клеток, не подвергшихся стимуляции с помощью моноклональных антител (mAb) 16G9 или SSV, была проанализирована проточной цитометрией (FACS).
Первоначально, после того, как каждая проба T-клеток (1×106 клеток) была суспендирована в 89 мкл буфера FACS (0,5% FBS/PBS/0,02% NaN3), было добавлено антитело мыши против CD16/32, блокирующее связывание Fc (eBioscience, 14-0161-85), в количестве 1 мкг, и пробы инкубировали при 4°C в течение 20 мин. К пробам было добавлено 10 мкл 16G9 mAb или SSV mAb (100 мкг/мл) в качестве первичного антитела, и пробы инкубировали при 4°C в течение 60 мин. После того, как клетки были дважды отмыты центрифугированием с буфером FACS, было добавлено вторичное антитело (mAb против IgM мыши, конъюгированное с биотином, (eBioscience, 13-5780-85) или mAb крысы против IgM мыши, конъюгированное с биотином, (BD Biosciences, 553441), 1 мкг/мл каждого) в объеме 100 мкл, и пробы инкубировали при 4°C в течение 30 мин. После того, как клетки были дважды отмыты центрифугированием с буфером FACS, было добавлено 100 мкл Streptavidin-PE-Cy7 (BD Biosciences, 556463, 1 мкг/мл), к которому было добавлено конъюгированное с FITC mAb крысы против CD3 мыши (BD Biosciences, 553062) до конечной концентрации 1 мкг/мл, и пробы инкубировали при 4°C в течение 30 мин. После того, как клетки были снова дважды отмыты центрифугированием с буфером FACS, и фильтрат был обработан красителем для клеток (556463, BD Biosciences) объемом 40 мкл, каждая проба была подвергнута анализу на проточном цитометре FACSCalibur с программным обеспечением CellQuest (BD Biosciences) для определения количества Т-клеток, позитивных по (16G9 mAb или SSV mAb)/CD3.
Результаты показаны на фиг.5.
При сравнении Ссылочного Примера 1 (16G9 mAb) с Примером 1 (SSV mAb) не наблюдалось никакого существенного различия в отношении реакционной способности T-клеток, положительных по CD3, и эти антитела показали сравнимую реакционную способность (t-тест Стьюдента, p <0,05).
Экспериментальный пример 5: Идентификация мишени для ингибирования SSV mAb
Семь кандидатных белков, которые могут подвергнутся ингибированию со стороны SSV mAb (Пример 1), были идентифицированы с помощью протеомного анализа.
Среди 7 кандидатных белков, ATP синтаза была определена как мишеневый антиген для Примера 1 (SSV mAb), способом, описанным ниже.
Сначала были получены Т-клетки из мышей Balb/c, имеющих нокаутированную митохондриальную ATP синтазу, с использованием набора Acceil siRNA kit от Thermo Fisher Scientific Inc.
Затем, согласно способу экспериментального примера 2, были выполнены тесты MLR, используя Пример 1 (SSV mAb) в качестве испытуемого вещества, с применением полученных Т-клеток.
В тесте, в качестве реактива контроля использовали Isotype IgG1 (eBioscience). Кроме того, был выполнен аналогичный тест с применением T-клеток мыши, не имеющей нокаута ATP синтазы, в качестве тест-контроля.
Результаты показаны на фиг. 6A и 6B.
Как показано на фиг.6A, в случае, когда ATP синтаза не была нокаутирована, Пример 1 (SSV mAb) значительно ингибировал рост клеток по сравнению с Isotype IgG1.
С другой стороны, как показано на фиг.6B, когда ATP синтаза была нокаутирована, не наблюдалось никакого существенного различия между Примером 1 (SSV mAb) и Isotype IgG1 в ингибировании роста клеток.
Результаты, представленные на фиг.6A и фиг.6B предполагает, что при нокаутировании ATP синтазы иммуносупрессивная активность SSV mAb уменьшена, и что SSV mAb обладает ингибирующей активностью в отношении ATP синтазы при иммуносупрессии.
Экспериментальный пример 6: Идентификация последовательностей вариабельных областей легких и тяжелых цепей SSV mAb
Синтез гибридомной кДНК
Полная РНК была получена из 1,6×107 клеток гибридомы, полученной в экспериментальном примере 1 (гибридома "мышь-мышь" SSV-C 93-3), с использованием набора FastPure RNA Kit (TaKaRa). Используя набор для выделения поли(A)+ из общей ДНК (Poly (A)+ Isolation Kit from Total RNA (NIPPON GENE)), было получено 240 мкг общей РНК из мРНК. Для осаждения мРНК было выполнено осаждение этанолом с использованием Etachinmate (NIPPON GENE). После промывки 75%-ым этанолом, мРНК была высушена. К ней было добавлено 10 мкл безводной РНК-азы для растворения мРНК. Полученный раствор мРНК хранили при -80°C. Используя набор для амплификации SMARTer RACE cDNA Amplification Kit (Clontech), для способа 5'-RACE была синтезирована кДНК, в количестве 1 мкг, из мРНК гибридомы SSV. Полученный раствор кДНК хранили при -20°C.
Идентификация определяющих комплементарность областей (CDR) в легких и тяжелых цепях SSV mAb
Основываясь на базовой последовательности константной области тяжелой цепи IgG1 мыши, был получен праймер 5'-CAC CAT GGA GTT AGT TTG GGC AGC AG-3' (SEQ ID NO:12). Основываясь на базовой последовательности константной области легкой цепи κ IgG1 мыши, был получен праймер 5'-CAC GAC TGA GGC ACC TCC AGA TG-3' (SEQ ID NO:13). Используя соответствующий праймер и универсальную смесь праймеров А ((Universal Primer A Mix), включенных в набор SMARTer RACE cDNA Amplification Kit) была выполнена 5'-RACE с использованием кДНА в качестве матрицы. Для реакции RACE использовали набор для ПЦР Advantage 2 PCR Kit (Clontech). Реакционная смесь была подвергнута электрофорезу в агарозе, и тяжелая цепь продукта 5'-RACE, содержащая приблизительно 600 п.о., и легкая цепь продукта 5'-RACE, содержащая приблизительно 550 п.о., были выделены из геля, с использованием набора E.Z.N.A. Gel Extraction Kit (OMEGA bio-tek). Полученные продукты были связаны с вектором pGEM-T Easy Vector (Promega), которым трансформировали высококомпетентные клетки E.coli DH5a (TOYOBO). Из полученного трансформанта, с использованием набора E.Z.N.A. Plasmid Miniprep KitI (OMEGA bio-tek), была получена плазмида. Используя полученную плазмиду в качестве матрицы, были выполнены циклические реакции секвенирования, используя набор BigDye Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems).
Затем были проанализированы основные последовательности вариабельных областей легкой и тяжелой цепей, используя секвенатор для ДНК (Applied Biosystems).
В результате было установлено, что базовая последовательность вариабельной области легкой цепи была представлена последовательностью от положения 67 до положения 384 последовательности SEQ ID NO:5.
Кроме того, было установлено, что базовая последовательность вариабельной области тяжелой цепи была представлена последовательностью от положения 58 до положения 423 последовательности SEQ ID NO:10.
Принимая во внимание положение FR (константная область), а именно, что положение 1 определено кодоном инициации трансляции, и способ нумерации по Kabat, было установлено следующее: положения 1-66 последовательности SEQ ID NO:5, соответствуют базовой последовательности сигнального пептида легкой цепи, и положения 1-57 последовательности SEQ ID NO:10, соответствуют базовой последовательности сигнального пептида тяжелой цепи.
Затем, из полученных базовых последовательностей были определены аминокислотные последовательности вариабельных областей легкой и тяжелой цепей, и области CDR были идентифицированы в соответствии со способом нумерации по Kabat.
В результате было найдено, что аминокислотная последовательность вариабельной области легкой цепи представлена последовательностью от положения 23 до положения 128 последовательности SEQ ID NO:6. При этом последовательность от положения 1 до положения 22 последовательности SEQ ID NO:6 соответствует аминокислотной последовательности сигнального пептида легкой цепи.
Кроме того, в аминокислотной последовательности вариабельной области легкой цепи было определено следующее: CDR1 представлена последовательностью RASSSVSYMH (SEQ ID NO:2), CDR2 представлена последовательностью ATSNLAS (SEQ ID NO:3), и CDR3 представлена последовательностью QQWSSNPWT (SEQ ID NO:4).
Также было найдено, что аминокислотная последовательность вариабельной области тяжелой цепи представлена последовательностью от положения 20 до положения 141 последовательности SEQ ID NO:11. При этом последовательность от положения 1 до положения 19 последовательности SEQ ID NO:11 соответствует аминокислотной последовательности сигнального пептида тяжелой цепи.
Более того, в аминокислотной последовательности вариабельной области тяжелой цепи было определено следующее: CDR1 представлена последовательностью GYNMN (SEQ ID NO:7), CDR2 представлена последовательностью NINPYYGSTSYNQKFKG (SEQ ID NO:8), и CDR3 представлена последовательностью SPYYSNYWRYFDY (SEQ ID NO:9).
| название | год | авторы | номер документа |
|---|---|---|---|
| НАПРАВЛЕННЫЕ НА ОПУХОЛЬ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ FZD10 И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2412203C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА-АЛЬФА И СПОСОБЫ ПРИМЕНЕНИЯ | 2006 |
|
RU2431638C2 |
| Антитело, связывающееся с карбоангидразой, и его применение | 2017 |
|
RU2727682C1 |
| АНТИТЕЛА К PD-1 СОБАК | 2014 |
|
RU2761663C2 |
| МЕТОД ДЕТЕКЦИИ РАКА | 2013 |
|
RU2646466C2 |
| АНТИТЕЛО ПРОТИВ PDL-1, ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2693661C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ (Fab), СВЯЗЫВАЮЩИЕСЯ С ИНТЕРФЕРОНОМ- γ ЧЕЛОВЕКА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КЛЕТКА, ТРАНСФОРМИРОВАННАЯ ФРАГМЕНТОМ ДНК, И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО АНТИТЕЛА И АНТИГЕНСВЯЗЫВАЮЩЕГО ФРАГМЕНТА | 2013 |
|
RU2539752C2 |
| АНТИТЕЛА ПРОТИВ ГЛОБУЛОМЕРА Аβ, ИХ АНТИГЕНСВЯЗЫВАЮЩИЕ ЧАСТИ, СООТВЕТСТВУЮЩИЕ ГИБРИДОМЫ, НУКЛЕИНОВЫЕ КИСЛОТЫ, ВЕКТОРЫ, КЛЕТКИ-ХОЗЯЕВА, СПОСОБЫ ПОЛУЧЕНИЯ УКАЗАННЫХ АНТИТЕЛ, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ АНТИТЕЛА, ПРИМЕНЕНИЯ УКАЗАННЫХ АНТИТЕЛ И СПОСОБЫ ИСПОЛЬЗОВАНИЯ УКАЗАННЫХ АНТИТЕЛ | 2006 |
|
RU2442793C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ (RAGE) И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2518351C2 |
| МЕТОД ДЕТЕКЦИИ РАКА | 2013 |
|
RU2646464C2 |





Изобретение относится к биохимии. Описано моноклональное антитело или его антигенсвязывающий фрагмент с очень высокой иммуносупрессивной активностью, которое связывается с пептидом, содержащим аминокислотную последовательность SSVLYGGPPSAA, или с конъюгатом данного пептида с фармацевтически приемлемым носителем, где моноклональное антитело или его антигенсвязывающий фрагмент имеет более высокую аффинность связывания с коровым гистоном, чем с гистоном H1. Описаны также способы лечения и снижения риска развития отторжения трансплантанта, которые предусматривают введение эффективного количества описанного антитела или его антигенсвязывающего фрагмента. Изобретение расширяет арсенал иммуносупрессивных средств. 3 н. и 9 з.п. ф-лы, 6 ил., 4 пр.
1. Моноклональное антитело или его антигенсвязывающий фрагмент, которое связывается с пептидом, состоящим из аминокислотной последовательности SSVLYGGPPSAA (SEQ ID NO: 1), или с конъюгатом указанного пептида с фармацевтически приемлемым носителем,
где антитело или его антигенсвязывающий фрагмент содержит вариабельную область легкой цепи, содержащую CDR1, состоящую из аминокислотной последовательности RASSSVSYMH (SEQ ID NO: 2), CDR2, состоящую из аминокислотной последовательности ATSNLAS (SEQ ID NO: 3), и CDR3, состоящую из аминокислотной последовательности QQWSSNPWT (SEQ ID NO: 4), и где моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую CDR1, состоящую из аминокислотной последовательности GYNMN (SEQ ID NO: 7), CDR2, состоящую из аминокислотной последовательности NINPYYGSTSYNQKFKG (SEQ ID NO: 8), и CDR3, состоящую из аминокислотной последовательности SPYYSNYWRYFDY (SEQ ID NO: 9).
2. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где моноклональное антитело или его антигенсвязывающий фрагмент действует против пептида, состоящего из аминокислотной последовательности SSVLYGGPPSAA (SEQ ID NO: 1), или против конъюгата пептида с фармацевтически приемлемым носителем.
3. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельная область легкой цепи
моноклонального антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность от положения 23 до положения 128 последовательности SEQ ID NO: 6.
4. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельная область тяжелой цепи моноклонального антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность от положения 20 до положения 141 последовательности SEQ ID NO: 11.
5. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где моноклональное антитело или его антигенсвязывающий фрагмент обладает ингибирующей активностью ATP-синтазы.
6. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где моноклональное антитело представляет собой химерное антитело, гуманизированное антитело или антитело человека.
7. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где коровый гистон представляет собой по меньшей мере один гистон, выбранный из гистонов H2A, H2B, H3 и H4.
8. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где фармацевтически приемлемый носитель представляет собой гемоцианин лимфы фисуреллы, овальбумин или бычий сывороточный альбумин.
9. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где моноклональное антитело или его антигенсвязывающий фрагмент продуцируется гибридомой "мышь-мышь"
SSV-C 93-3, которая депонирована под номером BP-972.
10. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где антигенсвязывающий фрагмент представляет собой фрагмент Fab, Fab′, (Fab′)2, Fv или scFv.
11. Способ лечения млекопитающего, нуждающегося в иммуносупрессии, где способ включает введение млекопитающему эффективного количества моноклонального антитела или его антигенсвязывающего фрагмента по пп. 1-10.
12. Способ снижения риска развития отторжения трансплантата, где способ включает введение млекопитающему, имеющему трансплантированный орган, эффективного количества моноклонального антитела или его антигенсвязывающего фрагмента по пп. 1-10.
| WO2006025580 A1, 09.03.2006 | |||
| РЫБАЛЬСКИЙ Н.Г., СЕРОВА М | |||
| А., ИГНАТЬЕВА Г.А., СТАРЧЕУС А.П | |||
| "Моноклональные антитела и гибридомы", Москва: ВАСХНИЛ, 1989, стр.23-44 |
Авторы
Даты
2015-08-10—Публикация
2011-08-19—Подача