Данное изобретение относится к новым азот-содержащим гетероарильным производным формулы (I),
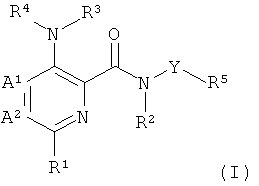
где
А1 и А2 независимо выбраны из группы, состоящей из СН и N, при условии, что А1 и А2 одновременно не представляют собой N;
R1 представляет собой низший алкил, низший алкокси, низший гидроксиалкил, низший галогеноалкил, (низший алкокси)-(низший алкил), ацетил, низший алкил-С(О)-, циано, атом галогена, аминогруппу, возможно замещенную 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил); представляет собой циклоалкил или гетероциклил;
R2 и R3 независимо представляют собой атом водорода или низший алкил;
R4 представляет собой гетероарил, возможно замещенный 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил);
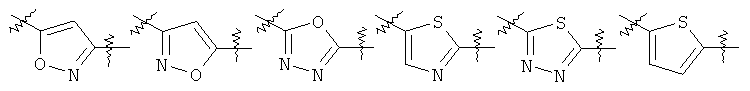
Y представляет собой 5-членный гетероарил, выбранный из группы, состоящей из:
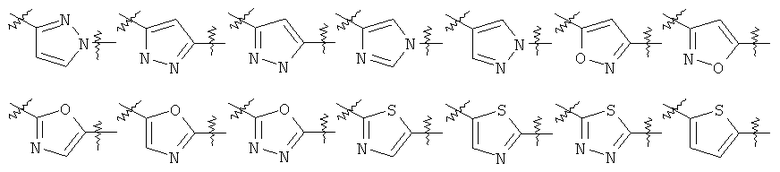 ,
,
где указанный гетероарил возможно замещен одним заместителем, выбранным из группы, состоящей из
низшего алкила, который возможно замещен 1-3 заместителями, выбранными из группы, состоящей из арила, циклоалкила, гетероциклила, низшего алкокси, гидроксила, атома галогена, аминогруппы, возможно замещенной одним или двумя заместителями низший алкил, из СООН, СОО-низшего алкила, оксо, циано и гетероарила, возможно замещенного 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил),
циклоалкила, возможно замещенного 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил), и
гетероциклила, возможно замещенного 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил); и
R5 выбран из группы, состоящей из арила и гетероарила, где указанный арил и указанный гетероарил возможно замещены 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил),
или их фармацевтически приемлемым солям.
Кроме того, изобретение относится к способу получения вышеупомянутых соединений, фармацевтическим композициям, которые содержат такие соединения, а также к применению этих соединений для изготовления фармацевтических композиций.
Шизофрения представляет собой прогрессирующее и изнуряющее неврологическое заболевание, характеризующееся эпизодическими позитивными симптомами, такими как бред, галлюцинации, нарушения мышления и психоз, и стойкими негативными симптомами, такими как притупленный аффект, нарушение внимания и социальная самоизоляция, и когнитивными нарушениями (Lewis D.A. and Lieberman J.A., Neuron, 28: 325-33, 2000). В течение нескольких десятилетий исследование было сконцентрировано на гипотезе "дофаминергической гиперактивности", что привело к терапевтическим вмешательствам, включающим блокаду дофаминергической системы (Vandenberg R.J. and Aubrey K.R., Exp. Opin. Ther. Targets, 5 (4): 507-518, 2001; Nakazato A. and Okuyama S., et al., Exp. Opin. Ther. Patents, 10 (1): 75-98, 2000). Этот фармакологический подход, помимо улучшения позитивных симптомов у пациентов с шизофренией, плохо соответствует лечению негативных и когнитивных симптомов, которые являются лучшими показателями функционального исхода болезни (Sharma Т., Br. J. Psychiatry, 174 (suppl. 28): 44-51, 1999). Кроме того, лечение современными антипсихотическими средствами ассоциировано с неблагоприятными эффектами, такими как увеличение массы (тела), экстрапирамидальные симптомы или влияние на метаболизм глюкозы и липидов, связанными с его неспецифическим фармакологическим действием.
В заключение необходимо отметить, что по-прежнему сохраняется потребность в разработке новых антипсихотических средств с улучшенными эффективностью и профилем безопасности. В середине 1960-х годов была предложена дополнительная модель шизофрении, основанная на психотомиметическом действии, вызываемом блокадой глутаматной системы соединениями, подобными фенциклидину (РСР) и родственным агентам (кетамину), которые являются неконкурентными антагонистами NMDA(N-метил-D-аспартат)-рецепторов. Примечательно, что у здоровых волонтеров РСР-индуцированное психотомиметическое действие включает позитивные и негативные симптомы, а также когнитивную дисфункцию, и, таким образом, сильно напоминает шизофрению у пациентов (Javitt D.C. et al., Biol. Psychiatry, 45: 668-679, 1999).
Циклические нуклеотиды циклоаденозинмонофосфат (цАМФ) и циклогуанозинмонофосфат (цГМФ) являются повсеместно распространенными вторичными мессенджерами, ответственными за опосредование биологического ответа на различные внеклеточные сигналы, включая нейротрансмиттеры, свет и гормоны. цАМФ и цГМФ регулируют различные внутриклеточные процессы, в частности в нейронах центральной нервной системы, посредством активации цАМФ- и цГМФ-зависимых киназ, которые затем фосфорилируют белки, вовлеченные в регуляцию синаптической передачи, дифференцировку и выживаемость нейронов.
Важнейшим механизмом контроля уровней внутриклеточных циклических нуклеотидов и, следовательно, передачи сигнала посредством циклических нуклеотидов является гидролиз 3′,5′-фосфодиэфирной связи под действием фосфодиэстераз. Фосфодиэстеразы (PDE) представляют собой семейство широко экспрессируемых ферментов, кодируемых 21 различными генами у людей, при этом каждый ген кодирует несколько вариантов сплайсинга (Beavo, J., Physiol. Rev. 1995, 75, 725-748; Conti, M., Jin, S.L, Prog. Nucleic Acid Res. Mol. Biol. 1999, 63, 1-38; Soderling, S.H., Beavo, J.A., Curr. Opin. Cell Biol. 2000, 12, 174-179; Manallack, D.T. et al. J. Med. Chem. 2005, 48 (10), 3449-3462).
PDE-семейства различаются по своей субстратной специфичности в отношении циклических нуклеотидов, свойственному им механизму регуляции и по своей чувствительности к ингибиторам. Кроме того, они избирательно локализованы в организме, среди клеток органа и даже внутри клеток. Эти различия приводят к дифференцированному вовлечению PDE-семейств в различные физиологические функции.
PDE10A представляет собой двухсубстратную PDE, которая кодируется одним геном, как сообщалось в 1999 г.тремя различными группами исследователей (Fujishige К., et al., Eur. J. Biochem. (1999) 266 (3): 1118-1127;
Soderling S.H., et al., Proc. Natl. Acad. Sci. USA (1999) 96(12): 7071-7076; Loughney К., et al., Gene (1999) 234 (1); 109-117). Среди других членов мультигенного семейства PDE10A уникальна по аминокислотной (ак) последовательности (779 ак), тканеспецифической картине экспрессии, аффинности в отношении цАМФ и цГМФ и по влиянию на активность PDE специфических и общих ингибиторов.
PDE10A характеризуется одним из наиболее узких распределений среди всего PDE-семейства, экспрессируясь преимущественно в головном мозге, в частности, в прилежащем ядре и в комплексе хвостатого ядра и скорлупы (т.е. дорсальном стриатуме). Кроме этого, умеренные уровни экспрессии PDE10A демонстрируют таламус, обонятельная луковица, гиппокамп и лобный отдел коры. Полагают, что все эти области головного мозга вовлечены в патофизиологию шизофрении и психоза, что является подтверждением центральной роли PDE10A в этом изнуряющем психическом заболевании. За пределами центральной нервной системы экспрессию транскриптов PDE10A также наблюдают в периферических тканях, подобных щитовидной железе, гипофизу, секретирующим инсулин панкреатическим клеткам и семенникам (Fujishige, К. et al., J. Biol. Chem. 1999, 274, 18438-18445, Sweet, L. (2005) WO 2005/012485). С другой стороны, экспрессию белка PDE10A наблюдали только в брюшных ганглиях, семенниках и эпидидимальной сперме (Coskran T.M, et al., J. Histochem. Cytochem. 2006, 54 (11), 1205-1213).
В полосатом теле как мРНК, так и белок экспрессируются только в GABA(y-аминомасляная кислота)-содержащих средних проекционных шипиковых нейронах, делая их привлекательной мишенью для лечения заболеваний центральной нервной системы (Fujishige, К. et al., Eur. J. Biochem. 1999, 266, 1118-1127; Seeger, T.F. et al., Brain Res. 2003, 985, 113-126). Средние шипиковые нейроны полосатого тела являются основным входным сайтом и первым сайтом для интеграции информации в цепи базальных ганглиев головного мозга млекопитающих. Базальные ганглии представляют собой ряд взаимосвязанных подкорковых ядер, которые интегрируют широкий кортикальный вход с дофаминергической передачей сигнала с целью организации и осуществления релевантных моторных и когнитивных паттернов с подавлением при этом нежелательных и нерелевантных паттернов (Graybiel, A.M. Curr. Biol. 2000, 10, R509-R511).
Папаверин, относительно специфичный ингибитор PDE10A, и PDE10A-нокаутные мыши были использованы для изучения физиологии этого фермента и возможного терапевтического применения ингибирования PDE10A. Ингибирование этого фермента фармакологически или посредством повреждения гена приводит к снижению активности и ослабленному ответу на психомоторные стимуляторы. Ингибирование также ослабляет условную реакцию избегания, поведенческую реакцию, которая предсказывает клиническую антипсихотическую активность (Siuciak, J.A. et al., Neuropharmacology, 2006, 51 (2), 386-396; Siuciak, J.A. et al., Neuropharmacology, 2006, 51 (2), 374-385).
Помимо этого, Ингибирование PDE10A дает возможность улучшения негативных и когнитивных симптомов, ассоциированных с шизофренией. Действительно, показано, что папаверин ослабляет нарушения при научении с экстрамерным сдвигом, индуцированные у крыс субхроническим введением РСР, в животной модели гипофункции NMDA-рецепторов (Rodefer, J.S., et al., Eur. J. Neuroscience, 2005, 2, 1070-1076). Помимо этого, у мышей с дефицитом PDE10A2 наблюдали повышенный уровень социального взаимодействия (Sano, H.J. Neurochem. 2008, 105, 546-556).
Заболевания, которые могут быть подвержены лечению ингибиторами PDE10A, включают, но не ограничиваются этим, заболевания, которые, как полагают, частично опосредованы дисфункцией базальных ганглиев, других участков центральной нервной системы и других PDE10A-экспрессирующих тканей. В частности, лечению можно подвергнуть заболевания, при которых Ингибирование PDE10A может оказывать терапевтические эффекты.
Эти заболевания включают, но не ограничиваются этим, некоторые психотические расстройства, такие как шизофрения, позитивные, негативные и/или когнитивные симптомы, ассоциированные с шизофренией, бредовое расстройство или индуцированное веществами психотическое расстройство, тревожные расстройства, такие как паническое расстройство, обсессивно-компульсивное расстройство, острое стрессовое расстройство или генерализованное тревожное расстройство, обсессивно-компульсивные расстройства, лекарственные зависимости, нарушения движений, такие как болезнь Паркинсона или синдром усталых ног, синдром когнитивной недостаточности, такой как болезнь Альцгеймера или мультиинфарктная деменция, расстройства настроения, такие как депрессия или биполярные расстройства, или психоневрологические состояния, такие как психоз, синдром дефицита внимания и гиперактивности (ADHD) или родственные нарушения внимания.
Соединения по настоящему изобретению также подходят для лечения диабета и таких родственных расстройств, как ожирение, посредством регуляции системы передачи сигнала через цАМФ.
Ингибиторы PDE10A также могут быть полезны в предупреждении вступления нейронов в апоптоз посредством повышения уровней цАМФ и цГМФ и, ввиду этого, могут обладать противовоспалительными свойствами. Нейродегенеративные расстройства, поддающиеся лечению ингибиторами PDE10A, включают, но не ограничиваются этим, болезнь Альцгеймера, болезнь Гентингтона, болезнь Паркинсона, множественный склероз, инсульт или повреждение спинного мозга.
Рост раковых клеток ингибируется цАМФ и цГМФ. Таким образом, благодаря повышению уровней цАМФ и цГМФ ингибиторы PDE10A также могут быть использованы для лечения различных солидных опухолей и гематологических злокачественных опухолей, таких как почечноклеточная карцинома или рак молочной железы.
Если не указано иное, следующие далее определения приведены для иллюстрации и устанавливают значение и область применения разных терминов, используемых для изложения изобретения в данном описании.
В этом описании термин "низший" используется для обозначения группы, состоящей из одного-семи, предпочтительно от одного до четырех атомов углерода.
Термин "галоген" относится к фтору, хлору, брому и йоду, причем фтор, хлор и бром являются предпочтительными.
Термин "алкил", один или в комбинации с другими группами, относится к разветвленному или прямому моновалентному насыщенному алифатическому углеводородному радикалу из одного-двадцати атомов углерода, предпочтительно одного-шестнадцати атомов углерода, более предпочтительно одного-десяти атомов углерода. Предпочтительными алкильными группами также являются низшие алкильные группы, которые описаны ниже.
Термин "низший алкил", один или в комбинации с другими группами, относится к разветвленному или прямому моновалентному алкалкильному радикалу из одного-семи атомов углерода, предпочтительно одного-четырех атомов углерода. Другими примерами этого термина являются такие радикалы, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, mpem-бутил и тому подобное.
Термин "циклоалкил" относится к моновалентному карбоциклическому радикалу из 3-10 атомов углерода, предпочтительно 3-6 атомов углерода, такому как циклопропил, циклобутил, циклопентил или циклогексил.
Термин "низший галогеноалкил" относится к низшим алкильным группам, одно- или многократно замещенным атомом галогена. Примерами низших галогеноалкильных групп являются, например CFH2, CF2H, CF3, CF3CH2, CF3(СН2)2, (CF3)2CH и CF2H-CH2.
Термин "алкокси" относится к группе R′-O-, где R′ представляет собой алкил. Термин "низший алкокси" относится к группе R′-O-, где R′ представляет собой низший алкил.
Термин "(низший алкокси)-(низший алкил)" относится к низшим алкильным группам, одно- или многократно замещенным низшим алкокси. Примерами групп (низший алкокси)-(низший алкил) являются, например -СН2-O-СН3, -СН2-СН2-O-СН3 и -СН2-О-CH2-СН3.
Термин "низший гидроксиалкил" относится к низшей алкильной группе, как определено выше, которая замещена 1-3 гидроксигруппами. Примерами низших гидроксиалкильных групп являются, например гидрокси-метил, 2-гидрокси-этил, гидрокси-пропил, 3-гидрокси-пропил, 2-гидрокси-пропил, 3-гидрокси-проп-2-ил, 2,3-дигидрокси-пропил и 1,3-дигидрокси-проп-2-ил.
Термин "амино" относится к моновалентной группе, которая имеет атом азота с двумя атомами водорода (обозначается как -NH2).
Термин "гетероциклил" относится к моновалентному насыщенному 5-6-членному моноциклическому кольцу, содержащему один, два или три кольцевых гетероатома, выбранных из N, О или S, при этом остальными кольцевыми атомами являются атомы углерода, где присоединение может быть осуществлено либо через атом углерода, либо через гетероатом. Примерами гетероциклоалкила являются, например морфолинил, тетрагидропиранил и пиперидинил.
Термин "арил" относится к моновалентному ароматическому углеводородному кольцу. Арильная группа предпочтительно включает С6-10арильные группы. Примерами арильных групп являются, например фенил, 1-нафтил и 2-нафтил.
Термин "гетероарил" относится к ароматическому 5-6-членному моноциклическому кольцу или 9-10-членному бициклическому кольцу, которое содержит 1, 2 или 3 атома, выбранных из азота, кислорода и/или серы, такому как фурил, пиридинил, пиридазинил, пиримидинил, пиразинил, тиенил, изоксазолил, оксазолил, оксадиазолил, имидазолил, пирролил, пиразолил, триазолил, тетразолил, тиазолил, изотиазолил, тиадиазолил, бензоимидазолил, индолил, индазолил, бензотиазолил, бензоизотиазолил, бензоксазолил, бензоизоксазолил, хинолинил и изохинолинил. Предпочтительными гетероарильными группами являются пиридинил, пиримидинил, пиразинил, хинолинил или имидазолил.
Соединения формулы (I) могут образовывать фармацевтически приемлемые соли. Примерами таких фармацевтически приемлемых солей являются соли соединений формулы (I) с физиологически совместимыми минеральными кислотами, такими как соляная кислота, серная кислота, сернистая кислота или фосфорная кислота; или с органическими кислотами, такими как метансульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, молочная кислота, трифторуксусная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота. Термин "фармацевтически приемлемые соли" относится к таким солям. Соединения формулы (I), которые содержат кислотную группу, такую как, например группа СООН, также могут образовывать соли с основаниями. Примерами таких солей являются соли щелочных, щелочноземельных металлов и соли аммония, такие как, например, соли Na, К, Са и триметиламмония. Термин "фармацевтически приемлемые соли" тоже относится к таким солям. Соли, полученные присоединением кислоты, являются предпочтительными.
Термин "фармацевтически приемлемые сложные эфиры" охватывает производные соединений формулы (I), в которых карбоксигруппа превращена в сложноэфирную группу. Сложные (низший алкил)овый, гидрокси-(низший алкил)овый, (низший алкокси)-(низший алкил)овый, амино-(низший алкил)овый, моно- или ди-(низший алкил)-амино-(низший алкил)овый, морфолино-(низший алкил)овый, пирролидино-(низший алкил)овый, пиперидино-(низший алкил)овый, пиперазино-(низший алкил)овый, (низший алкил)-пиперазино-(низший алкил)овый и аралкиловый эфиры представляют собой примеры подходящих сложных эфиров. Сложные метиловые, этиловые, пропиловые, бутиловые и бензиловые эфиры являются примерами предпочтительных сложных эфиров. Термин "фармацевтически приемлемые сложные эфиры" также охватывает соединения формулы (I), в которых гидроксигруппы превращены в соответствующие группы сложных эфиров неорганических или органических кислот, таких как азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и тому подобное, которые не являются токсичными для живых организмов.
Более подробно, настоящее изобретение относится к соединениям формулы (I),
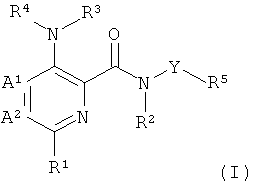
где
А1 и А2 независимо выбраны из группы, состоящей из СН и N, при условии, что А1 и А2 одновременно не представляют собой N;
R1 представляет собой низший алкил, низший алкокси, низший гидроксиалкил, низший галогеноалкил, (низший алкокси)-(низший алкил), ацетил, низший алкил-С(О)-, циано, атом галогена, аминогруппу, возможно замещенную 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил); представляет собой циклоалкил или гетероциклил;
R2 и R3 независимо представляют собой атом водорода или низший алкил;
R4 представляет собой гетероарил, возможно замещенный 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил);
Y представляет собой 5-членный гетероарил, выбранный из группы, состоящей из:
 ,
,
где указанный гетероарил возможно замещен одним заместителем, выбранным из группы, состоящей из
низшего алкила, который возможно замещен 1-3 заместителями, выбранными из группы, состоящей из арила, циклоалкила, гетероциклила, низшего алкокси, гидроксила, атома галогена, аминогруппы, возможно замещенной одним или двумя заместителями низший алкил, из СООН, СОО-низшего алкила, оксо, циано и гетероарила, возможно замещенного 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил),
циклоалкила, возможно замещенного 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил), и
гетероциклила, возможно замещенного 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил); и
R5 выбран из группы, состоящей из арила и гетероарила, где указанный арил и указанный гетероарил возможно замещены 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил), или их фармацевтически приемлемым солям.
Химические структуры Y, описанные выше, соединены с атомом азота амидной группы в формуле (I) своей левой стороной и соединены с R5 своей правой стороной.
Соединения формулы (I) предпочтительны каждый в отдельности, и их физиологически приемлемые соли предпочтительны каждый в отдельности, и их фармацевтически приемлемые сложные эфиры предпочтительны каждый в отдельности, при этом особенно предпочтительны соединения формулы (I).
Соединения формулы (I) могут иметь один или более асимметрических атомов С и поэтому могут существовать в виде энантиомерной смеси, смеси стереоизомеров или в виде оптически чистых соединений.
Предпочтительное воплощение настоящего изобретения относится к соединениям формулы (I), которые описаны выше, где R1 представляет собой низший алкил, циклоалкил или (низший алкокси)-(низший алкил), и более предпочтительно метил, этил, изопропил, изобутил, mpem-бутил, циклопропил, циклогексил или метоксиметил.
Другое предпочтительное воплощение настоящего изобретения относится к соединениям формулы (I), которые описаны выше, где R2 и R3 представляют собой атом водорода.
В другом предпочтительном воплощениинастоящего изобретения R4 представляет собой пиримидинил, возможно замещенный 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил). Соединения, где R4 представляет собой пиримидин-5-ил, являются более предпочтительными.
Другими предпочтительными соединениями по настоящему изобретению являются соединения, где R5 представляет собой фенил или 6- или 10-членный гетероарил, содержащий один или два атома азота, где указанный фенил и указанный гетероарил возможно замещены 1-3 заместителями, выбранными из группы, состоящей из гидроксила, атома галогена, низшего алкила, низшего алкокси, низшего гидроксиалкила, низшего галогеноалкила, группы (низший алкокси)-(низший алкил), ацетила, циано и аминогруппы, возможно замещенной 1 или 2 заместителями низший алкил или (низший алкокси)-(низший алкил). Соединения, где R5 представляет собой фенил, пиридинил, пиразинил или хинолинил, возможно замещенный заместителями, которые определены выше, являются более предпочтительными. Среди заместителей, которые определены выше, более предпочтительными являются атом галогена и низший алкокси. Также более предпочтительно, чтобы R5 представлял собой фенил, 2-фтор-фенил, 4-фтор-фенил, 4-хлор-фенил, 4-бром-фенил, 4-метокси-фенил, пиридин-2-ил, пиридин-4-ил, 5-хлор-пиридин-2-ил, 6-хлор-пиридин-2-ил, пиразин-2-ил или хинолин-2-ил.
Другими предпочтительными соединениями по настоящему изобретению являются соединения, где Y выбран из группы, состоящей из:
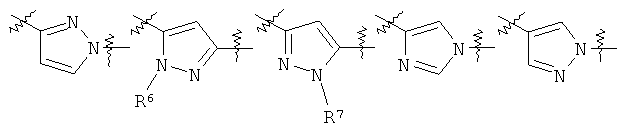 ,
,
где R6 выбран из группы, состоящей из низшего алкила, который возможно замещен 1-3 заместителями, выбранными из группы, состоящей из арила, циклоалкила, гетероциклила, низшего алкокси, гидроксила, атома галогена, аминогруппы, возможно замещенной одним или двумя заместителями низший алкил, из СОО-низшего алкила, циано и гетероарила, возможно замещенного низшим алкилом, циклоалкила и гетероциклила, возможно замещенного 1-3 заместителями, выбранными из группы, состоящей из низшего алкила, и
R7 представляет собой низший алкил или низший алкил, замещенный аминогруппой, возможно замещенной одним или двумя заместителями низший алкил.
Более предпочтительно, R6 представляет собой метил, этил, пропил, изопропил, изобутил, mpem-бутил, 2,2,2-трифтор-этил, 2-гидрокси-этил, 2-метокси-этил, -СН2СООС2Н5, 2-диметиламино-этил, 2-циано-этил, циклопентилметил, циклогексил, циклогексилметил, тетрагидро-пиран-4-ил, 1-метил-пиперидин-4-ил, 2-морфолин-4-ил-этил, бензил, 2-фенилэтил или 3-метил-3Н-имидазол-4-илметил, и R7 представляет собой метил или 2-диметиламино-этил.
Другими предпочтительными соединениями по настоящему изобретению являются соединения, где Y выбран из группы, состоящей из:
 .
.
В частности, предпочтительными соединениями являются соединения формулы (I), описанные в Примерах в качестве индивидуальных соединений, а также фармацевтически приемлемые соли, а также их фармацевтически приемлемые сложные эфиры. Кроме того, заместители, которые можно найти в конкретных описанных ниже примерах, составляют каждый в отдельности предпочтительные воплощения настоящего изобретения.
Предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из:
6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1 -фенил-1 Н-пиразол-3-ил)-амида,
6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1 -(4-фтор-фенил)-1Н-пиразол-3-ил]-амида,
6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1 -(2-фтор-фенил)-1Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1-(4-фтор-фенил)-1 Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-4-ил-1Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-фенил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-диметиламино-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
2-метоксиметил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-циклогексил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
(5-{[6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбонил]-амино}-3-пиридин-2-ил-пиразол-1-ил)-уксусной кислоты этилового эфира,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-морфолин-4-ил-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-фенетил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-трет-бутил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-пиридин-2-ил-2-(тетрагидро-пиран-4-ил)-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-пиридин-2-ил-2-(2,2,2-трифтор-этил)-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-пропил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(6-хлор-пиридин-2-ил)-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-хинолин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(5-хлор-пиридин-2-ил)-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-изопропил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-изобутил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-бензил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-этил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-циклопентилметил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-циклогексилметил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-циано-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(3-метил-3Н-имидазол-4-илметил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-метокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(5-хлор-пиридин-2-ил)-2-метил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-хинолин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(6-хлор-пиридин-2-ил)-2-метил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1-(2-диметиламино-этил)-5-пиридин-2-ил-1Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(1-метил-пиперидин-4-ил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(4-метокси-фенил)-[1,3,4]тиадиазол-2-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(4-фтор-фенил)-[1,3,4]тиадиазол-2-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (3-фенил-изоксазол-5-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-фемил-изоксазол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-фенил-[1,3,4]тиадиазол-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-пиразин-2-ил-[1,3,4]тиадиазол-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-пиридин-2-ил-тиофен-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (3-пиридин-2-ил-изоксазол-5-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-2-ил-1Н-имидазол-4-ил)-амида,
2-изопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
2-циклопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
2-трет-бутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [3-(4-хлор-фенил)-изоксазол-5-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [3-(4-бром-фенил)-изоксазол-5-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [3-(4-фтор-фенил)-изоксазол-5-ил]-амида,
6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
2-циклогексил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
2-изобутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-пиридин-2-ил-тиазол-5-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-метил-5-пиридин-2-ил-1Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-пиридин-2-ил-[1,3,4]оксадиазол-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-2-ил-1Н-пиразол-4-ил)-амидаи
6-циклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты (1-пиридин-2-ил-1Н-имидазол-4-ил)-амида,
или их фармацевтически приемлемых солей.
В частности, предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из:
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1-(4-фтор-фенил)-1 Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-диметиламино-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-морфолин-4-ил-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-пиридин-2-ил-2-(тетрагидро-пиран-4-ил)-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-метокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(5-хлор-пиридин-2-ил)-2-метил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-пиридин-2-ил-тиофен-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (3-пиридин-2-ил-изоксазол-5-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-2-ил-1Н-имидазол-4-ил)-амида,
2-треп7-бутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
2-изобутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида и
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-пиридин-2-ил-тиазол-5-ил)-амида
или их фармацевтически приемлемых солей.
Очевидно, что в данном изобретении могут быть приготовлены производные соединений общей формулы (I) по функциональным группам с получением производных, которые способны к обратному превращению в исходное соединение in vivo.
Данное изобретение также относится к способу получения соединений формулы (I), которые определены выше, включающему:
а) приведение во взаимодействие соединения формулы (IV) или формулы (IVa)
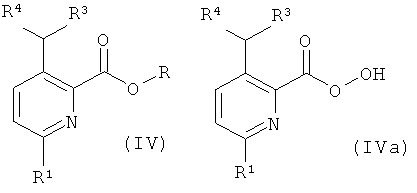
с соединением формулы (XIV),
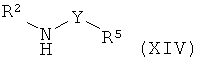
где R представляет собой низший алкил, и R1, R2, R3, R4 и R5 такие, как описано выше, и, при желании, превращение данных соединений в их фармацевтически приемлемые соли;
b) приведение во взаимодействие соединения формулы (VII) или его свободной кислоты
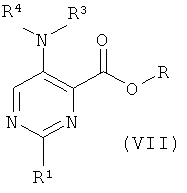
с соединением формулы (XIV),
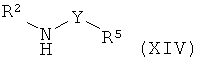
где R представляет собой низший алкил, и R1, R2, R3, R4 и R5 такие, как описано выше, и, при желании, превращение данных соединений в их фармацевтически приемлемые соли;
с) приведение во взаимодействие соединения формулы (VIII)
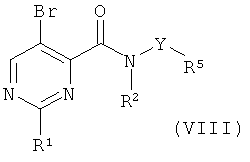
с соединением формулы (XV),
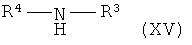
где R1, R2, R3, R4 и R5 такие, как описано выше, и, при желании, превращение данных соединений в их фармацевтически приемлемые соли; или
d) приведение во взаимодействие соединения формулы (XIII) или формулы (XIIIa)
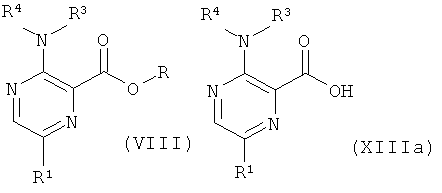
с соединением формулы (XIV),
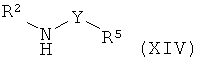
где R представляет собой низший алкил, и R1, R2, R3, R4 и R5 такие, как описано выше, и, при желании, превращение данных соединений в их фармацевтически приемлемые соли.
Описанная выше реакция может быть осуществлена в условиях, изложенных в описании и примерах, или в условиях, хорошо известных специалисту в данной области техники.
Соединения формулы (IV), (IVa), (VII), (VIII), (XIII), (Xllla), (XIV) и (XV) могут быть получены способами, известными в данной области техники, или как описано ниже, или по аналогии с ними. Если не указано иное, R представляет собой низший алкил, a R1, R2, R3, R4, и R5 такие, как описано выше.
Настоящее изобретение также относится к описанным выше соединениям формулы (I), которые получены способом, как описано выше.
Соединения общей формулы (I), где А1 и А2 представляют собой СН, могут быть получены согласно общим способам, описанным в US 2006/0199960, и как приведено на схемах 1 и 2 и в описании общих методик 1, 2а и 2b.
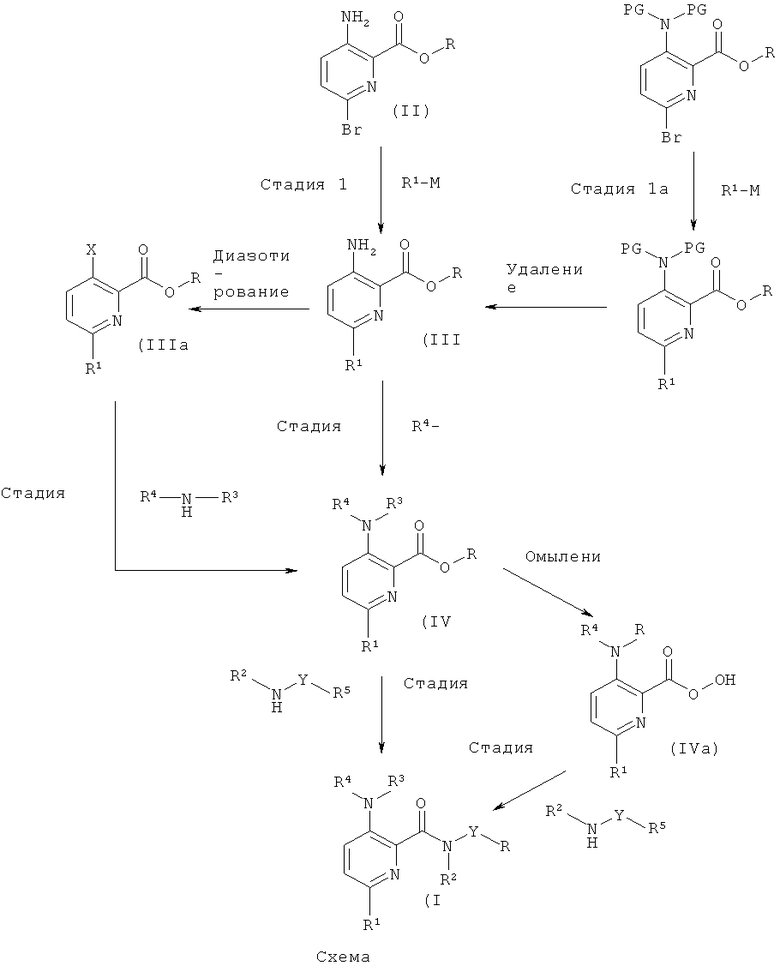
Общая методика 1
Стадия 1
Соединения формулы (II), где R представляет собой низший алкил, имеются в продаже или могут быть получены, исходя из пиридин-2,3-дикарбоновой кислоты, согласно US 2006/0199960. Соединения формулы (II) могут быть превращены в соединение формулы (III) посредством Pd-катализируемой реакции сочетания с металло-органическим реагентом R1-M (например, органобороновой кислотой или сложным эфиром органобороновой кислоты), с использованием Pd-катализатора (например, Pd2(dba)2) и основания (например, фосфата калия) в органическом растворителе (например, диоксане). Соединения формулы (III) можно выделить и очистить традиционными методами.
Соединение формулы (II), где R представляет собой Н, имеется в продаже или может быть получено согласно WO 2008/106692 и может быть преобразовано в соединение формулы (II), где R представляет собой низший алкил, стандартными методами образования сложных эфиров, известными специалистам в данной области.
Стадия 1а
Соединения формулы (II), где R представляет собой низший алкил, также могут быть превращены в соединение формулы (III) согласно способам, описанным в US 2006/0199960, посредством 1) введения защиты на аминогруппу с применением подходящей защитной группы (например, Вое) путем использования, например, ди-mpem-бутил-дикарбоната в присутствии органического или неорганического основания (например, DMAP (4-(диметиламино)пиридин) или триэтиламина) в органическом растворителе, 2) Pd-катализируемой реакции сочетания с металло-органическим реагентом R1-M (например, органоцинковым реагентом или органооловянным реагентом) с использованием Pd-катализатора (например, Pd(PPh3)4) и основания (например, карбоната калия) в органическом растворителе (например, диоксане), и 3) удаления защиты с этой аминогруппы с использованием, например, органической или неорганической кислоты (например, HCI или трифторуксусной кислоты) в органическом растворителе. Соединения формулы (III) можно выделить и очистить традиционными методами.
Стадия 2
Соединение формулы (IV) может быть получено путем, например, Pd-катализируемого арилирования аминогруппы соединений формулы (III) с использованием арилгалогенидов или гетероарилгалогенидов (например, 5-бромпиримидина) R4-X, Pd-катализатора (например, PdOAc2), подходящего лиганда (например, 4,5-бис(дифенил-фосфино)-9,9-диметилксантена) и основания (например, карбоната калия) в органическом растворителе (например, толуоле, о-ксилоле). Соединения формулы (IV) можно выделить и очистить традиционными методами.
Стадия 2а
Соединения формулы (IIIa), где R представляет собой низший алкил, могут быть получены согласно US 2006/0199960. Альтернативно, соединения формулы (III) могут быть превращены в соединение формулы (IIIa), где Х представляет собой атом галогена, посредством диазотирования с использованием, например, нитрита натрия или mpem-бутилнитрита и последующего замещения с использованием подходящего галогенида меди. Соединение формулы (IV) может быть получено путем, например, Pd-катализируемого аминирования соединения (IIIa) с использованием ариламинов или гетероариламинов (например, 5-аминопиримидина) R4-NH-R3, Pd-катализатора (например, PdOAc2), подходящего лиганда (например, 4,5-бис(дифенил-фосфино)-9,9-диметилксантена) и основания (например, карбоната калия) в органическом растворителе (например, толуоле, о-ксилоле). Соединения формулы (IV) можно выделить и очистить традиционными методами.
Стадия 3
Соединение формулы (IV) можно превратить в соединение формулы (I) путем прямого аминолиза сложноэфирной группы, используя гетероариламины R5-Y-NH-R2 и кислоту Льюиса (например, хлорид триметилалюминия или диметилалюминия) в органическом растворителе (например, толуоле или диоксане). Соединения формулы (I) можно выделить и очистить традиционными методами.
Гетероариламины R5-Y-NH-R2 имеются в продаже или могут быть получены стандартными методами, известными специалистам в данной области техники, и как описано в соответствующих примерах.
Стадия 3а
Альтернативно, сложноэфирную группу соединения формулы (IV) можно подвергнуть омылению до его свободной кислоты (IVa), используя неорганическое основание (например, гидроксид лития, гидроксид натрия) в органическом растворителе (например, этаноле, диоксане, THF (тетрагидрофуран) или их смесях). Затем соединение формулы (IVa) может быть превращено в соединение формулы (I) путем образования амидной связи с использованием гетероариламинов R5-Y-NH-R2, реагента сочетания (например, ангидрида пропилфосфоновой кислоты, HATU (2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат), TBTU (тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония)) и органического основания (например, N,N-диизопропилэтиламина, N-метил-морфолина или триэтиламина) в органическом растворителе (например, DMF (диметилформамид), этилацетате, THF). Соединения формулы (I) можно выделить и очистить традиционными методами.
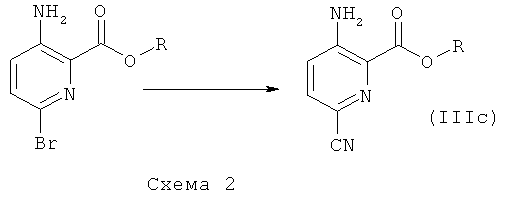
Соединения общей формулы (I), где А1 и А2 представляют собой СН, которые невозможно синтезировать, как приведено на схеме 1 и в описании общей методики 1, могут быть получены из промежуточных соединений общей формулы (IIIb) или (IIIc), как приведено на схеме 2 и в описании общих методик 2а и 2b.
Общая методика 2а:
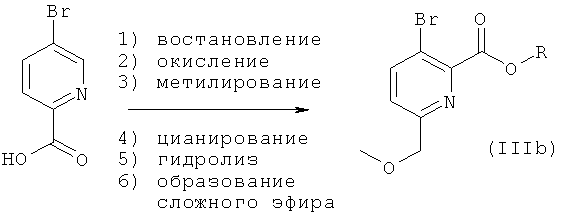
Общая методика 2b:
Общая методика 2а
Исходя из имеющейся в продаже 5-бромпиридин-2-карбоновой кислоты, промежуточное соединение формулы (IIIb) 5-бром-2-метоксиметил-пиридин-2-карбоксилат может быть получено путем:
1) восстановления карбоксилата с использованием восстанавливающего агента (например, боргидрида натрия, боран-диметилсульфида) в органическом растворителе (например, THF);
2) окисления пиридина до пиридин-N-оксида с использованием окисляющего реагента (например, м-хлорбензойной кислоты) в органическом растворителе (например, дихлорметане);
3) алкилирования гидроксильной группы с использованием алкилирующего реагента (например, метилиодида) и подходящего неорганического основания (например, гидрида натрия) в органическом растворителе (например, THF или диоксане);
4) цианирования пиридиний-N-оксида с использованием, например, цианотриметилсилана, подходящего основания (например, триэтиламина) в органическом растворителе (например, ацетонитриле или DMF);
5) гидролиза нитрила с получением свободной кислоты с использованием сильного неорганического основания (например, гидроксида калия) в органическом растворителе (например, метаноле или этаноле);
6) образования сложного эфира кислотной группировки с использованием, например, спирта в присутствии сильной кислоты, алкилгалогенида в присутствии основания или специальных алкилирующих реагентов (например, триметилсилил-диазометана).
Промежуточные соединения формулы (IIIb) далее могут быть превращены в соединения общей формулы (I) общими способами, описанными выше.
Общая методика 2b
Исходя из соединений формулы (II), где R представляет собой низший алкил, можно получить промежуточное соединение формулы (IIIc) 3-амино-6-циано-пиридин-2-карбоксилат путем замещения атома брома нитрильной группой с использованием, например, цианида меди(I) в органическом растворителе, таком как DMF. Это промежуточное соединение также можно преобразовать в соединения общей формулы (I) общими способами, описанными выше. Или нитрильную группу далее можно преобразовать, например, в группу карбоновой кислоты (посредством гидролиза), алкилкарбоксилат (посредством гидролиза и образования сложного эфира), спирт (посредством гидролиза и восстановления), кетон (посредством гидролиза, активации, как например, с образованием амида Вейнреба, и алкилирования с использованием, например, реактива Гриньяра) или аминогруппу (посредством гидролиза и реакции Курциуса), которая далее может быть замещена, например, алкильными группами на стадии получения либо различных промежуточных соединений, либо конечных продуктов. Эти промежуточные соединения далее можно преобразовать в соединения общей формулы (I) общими способами, описанными выше.
Соединения общей формулы (I), где А1 представляет собой СН, и А2 представляет собой N, могут быть получены, как приведено на схемах 3 и 4 и в описании общих методик 3 и 4.
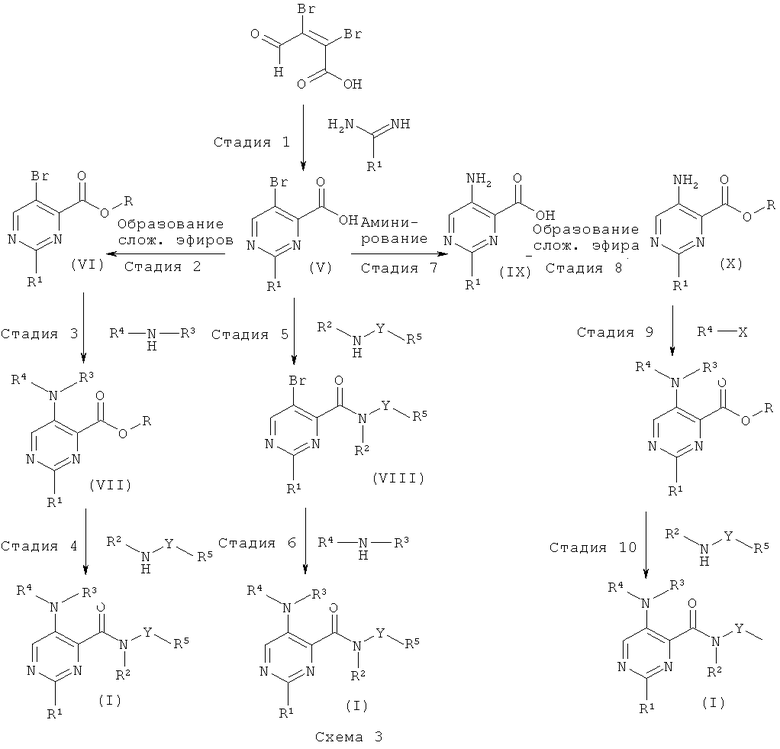
Общая методика 3
Стадия 1
Соединения формулы (V) имеются в продаже или могут быть получены согласно общим способам, описанным, например в WO 2000/066566 или WO 2005/021500, путем конденсации, например мукобромной кислоты с подходящим амидином, содержащим остатком R1, в присутствии органического основания (например, этилата натрия) в органическом растворителе (например, этаноле) при температуре окружающей среды или повышенной температуре.
Стадия 2
Соединение формулы (V) может быть превращено в соединения формулы (VI), где R представляет собой низший алкил, путем образования сложного эфира с использованием, например, спирта в присутствии сильной кислоты, спирта в присутствии реагента, образующего хлорангидрид кислоты, (например, тионилхлорида), алкилгалогенида в присутствии основания или специальных алкилирующих реагентов (например, триметилсилил-диазометана). Соединения формулы (VI) можно выделить и очистить традиционными методами.
Стадия 3
Соединение формулы (VII) может быть получено, например, путем Pd-катализируемого арилирования аминогруппы соединения (VI) с использованием ариламинов или гетероариламинов (например, 5-аминопиримидина) R4-NH-R3, Pd-катализатора (например, PdOAc2), подходящего лиганда (например, 4,5-бис(дифенил-фосфино)-9,9-диметилксантена) и основания (например, карбоната калия) в органическом растворителе (например, толуоле, о-ксилоле). Соединения формулы (VII) можно выделить и очистить традиционными методами.
Стадия 4
Соединение формулы (VII) может быть превращено в соединение формулы (I) путем прямого аминолиза сложноэфирной группы с использованием гетероариламинов R5-Y-NH-R2 и кислоты Льюиса (например, хлорида триметилалюминия или диметилалюминия) в органическом растворителе (например, толуоле или диоксане). Соединения формулы (I) можно выделить и очистить традиционными методами.
Альтернативно, соединение формулы (VII) можно подвергнуть омылению до его свободной кислоты (IVa), используя неорганическое основание (например, гидроксид лития, гидроксид натрия) в органическом растворителе (например, этаноле, диоксане, THF или их смесях). Затем свободная кислота соединения формулы (VII) может быть превращена в соединения формулы (I) путем образования амидной связи с использованием гетероариламинов R5-Y-NH-R2, реагента сочетания (например, ангидрида пропилфосфоновой кислоты, HATU, TBTU) и органического основания (например, N,N-диизопропилэтиламина, N-метил-морфолина или триэтиламина) в органическом растворителе (например, DMF, этилацетате, THF).
Стадия 5
Соединение формулы (V) может быть превращено в соединения формулы (VIII) согласно способу, описанному на стадии 4 для превращения кислот формулы (VII).
Стадия 6
Соединение формулы (VIII) может быть превращено в соединение формулы (I) согласно способу, описанному на стадии 3 для образования соединений формулы (VII).
Стадия 7
Соединение формулы (V) может быть превращено в соединения формулы (IX) путем аминирования бромида с использованием источника аммиака (например, гидроксида аммония) в присутствии переходного металла (например, сульфата меди(И)) в растворителе, подобном воде.
Стадия 8
Соединение формулы (IX) может быть превращено в соединения формулы (X) согласно способу, описанному на стадии 2 для образования соединений формулы (VI).
Стадия 9
Соединение формулы (X) может быть превращено в соединения формулы (VII) согласно способу, описанному на стадии 3 для образования соединений формулы (VII), с использованием арилгалогенидов или гетероарилгалогенидов (например, 5-бромпиримидина) R4-X.
Стадия 10
Соединение формулы (XI) может быть превращено в соединения формулы (I) согласно способу, описанному на стадии 4 для преобразования соединений формулы (VII).
Соединения общей формулы (VI), где А1 представляет собой СН, А2 представляет собой N, и R представляет собой Н или низший алкил, которые невозможно синтезировать, как приведено на схеме 3 и в описании общей методики 3, могут быть получены, например, из имеющихся в продаже промежуточных соединений общей формулы (Vla), как приведено на схеме 4 и в описании общей методики 4.
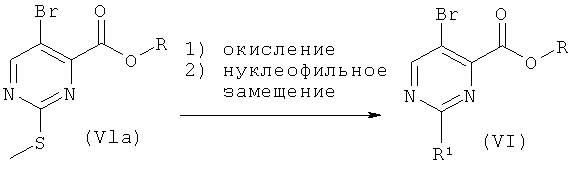
Общая методика 4
Исходя из имеющихся в продаже 5-бром-2-метилтио-пиримидин-4-карбоксилатов общей формулы (Vla), промежуточные соединения формулы VI, где R1 представляет собой алкокси или возможно замещенный амин, могут быть получены путем:
1) окисления группы метилтио с использованием окисляющего реагента (например, 3-хлорпербензойной кислоты) в органическом растворителе (например, метиленхлориде) с образованием метилсульфоновой группы;
2) нуклеофильного замещения метилсульфоновой группы нуклеофилами на основе атома кислорода или азота (например, с использованием алкиламина или алкилсодержащего спирта) в органическом растворителе (например, метиленхлориде) с получением промежуточных соединений (VI). Эти промежуточные соединения далее могут быть превращены в соединения общей формулы (I) общими способами, описанными выше.
Соединения общей формулы (I), где А1 представляет собой N, и А2 представляет собой СН, могут быть получены согласно общим способам, описанным в US 2006/0199828, и как приведено на схеме бив описании общей методики 5.
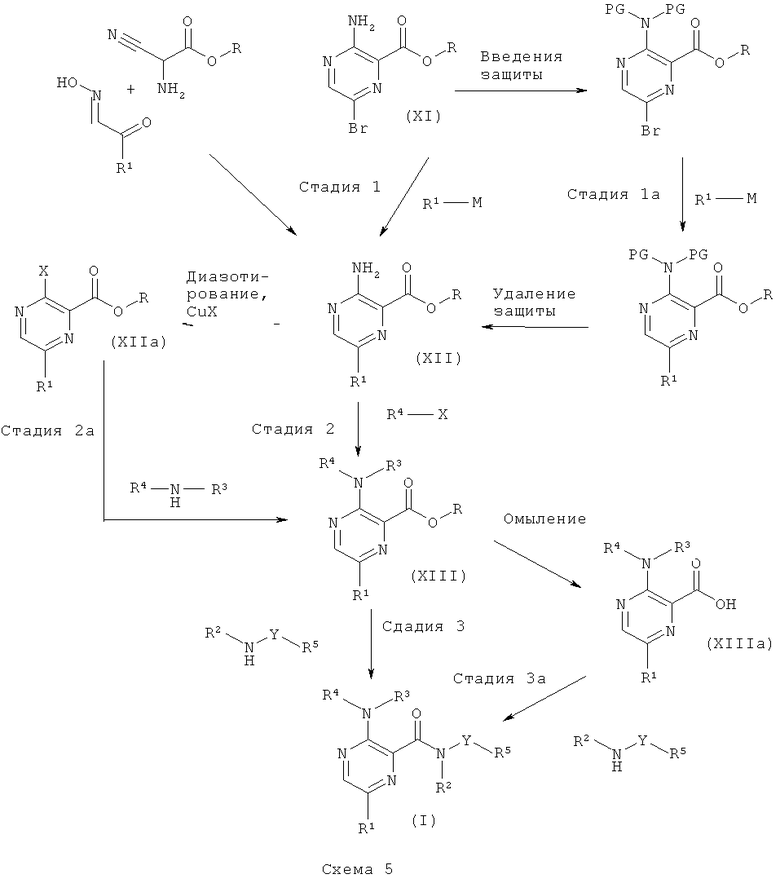
Общая методика 5
Стадия 1
Соединения формулы (XII) имеются в продаже или могут быть получены согласно способу, описанному в US 2006/199828, исходя из сложного эфира аминоцианоуксусной кислоты и соответствующего оксима α-кетоальдегида.
Соединения формулы (XII), где R представляет собой низший алкил, также могут быть получены исходя из соединений формулы (XI), которые имеются в продаже, или могут быть получены исходя из метил-3-аминопиразин-2-карбоксилата или 3-аминопиразин-2-карбоновой кислоты в соответствии, например с J. Am. Chem. Soc. 1949, 71, 2798 или WO 2004/092177. Соединения формулы (XI) могут быть превращены в соединение формулы (XII) путем Pd-катализируемой реакции сочетания с металло-органическим реагентом R1-M (например, органобороновой кислотой или сложным эфиром органобороновой кислоты) с использованием Pd-катализатора (например, Pd2(dba)3) и основания (например, фосфата калия) в органическом растворителе (например, диоксане). Соединения формулы (XII) можно выделить и очистить традиционными методами.
Стадия 1а
Соединения формулы (XI), где R представляет собой низший алкил, также могут быть превращены в соединение формулы (XII) посредством 1) введения защиты на аминогруппу с применением подходящей защитной группы (например, Вое) путем использования, например, ди-трет-бутил-дикарбоната в присутствии органического или неорганического основания (например, DMAP или триэтиламина) в органическом растворителе, 2) Pd-катализируемой реакции сочетания с металло-органическим реагентом R1-M (например, органоцинковым реагентом или органооловянным реагентом) с использованием Pd-катализатора (например, Pd(PPh3)4) и основания (например, карбоната калия) в органическом растворителе (например, диоксане), и 3) удаления защиты с этой аминогруппы с использованием, например, органической или неорганической кислоты (например, HCI или трифторуксусной кислоты) в органическом растворителе. Соединения формулы (XII) можно выделить и очистить традиционными методами.
Стадия 2
Соединение формулы (XIII) может быть получено путем, например, Pd-катализируемого арилирования аминогруппы соединения (XII) с использованием арилгалогенидов или гетероарилгалогенидов (например, 5-бромпиримидина) R4-X, Pd-катализатора (например, PdOAc2), подходящего лиганда (например, 4,5-бис(дифенил-фосфино)-9,9-диметилксантена) и основания (например, карбоната калия) в органическом растворителе (например, толуоле, о-ксилоле). Соединения формулы (XIII) можно выделить и очистить традиционными методами.
Стадия 2а
Альтернативно, соединения формулы (XII) могут быть превращены в соединение формулы (XIIa), где Х представляет собой атом галогена, посредством диазотирования с использованием, например, нитрита натрия или трет-бутилнитрита и последующего замещения с использованием подходящего галогенида меди. Соединение формулы (XIII) может быть получено путем, например, Pd-катализируемого аминирования соединения (XIIa) с использованием ариламинов или гетероариламинов (например, 5-аминопиримидина) R4-NH-R3, Pd-катализатора (например, PdOAc2), подходящего лиганда (например, 4,5-бис(дифенил-фосфино)-9,9-диметилксантена) и основания (например, карбоната калия) в органическом растворителе (например, толуоле, о-ксилоле). Соединения формулы (IV) можно выделить и очистить традиционными методами.
Стадия 3
Соединения формулы (XIII) можно превратить в соединение формулы (I) путем прямого аминолиза сложноэфирной группы, используя гетероариламины R5-Y-NH-R2 и кислоту Льюиса (например, хлорид триметилалюминия или диметилалюминия) в органическом растворителе (например, толуоле или диоксане). Соединения формулы (I) можно выделить и очистить традиционными методами.
Стадия 3а
Альтернативно, сложноэфирную группу соединения формулы (XIII) можно подвергнуть омылению до его свободной кислоты (XIIIa), используя неорганическое основание (например, гидроксид лития, гидроксид натрия) в органическом растворителе (например, этаноле, диоксане, THF). Затем соединения формулы (XIIIa) могут быть превращены в соединение формулы (I) путем образования амидной связи с использованием гетероариламинов R5-Y-NH-R2, реагента сочетания (например, ангидрида пропилфосфоновой кислоты, HATU, TBTU) и органического основания (например, N,N-диизопропилэтиламина, N-метил-морфолина или триэтиламина) в органическом растворителе (например, DMF, этилацетате, THF). Соединения формулы (I) можно выделить и очистить традиционными методами.
Некоторые заместители на группах R1, R2, R3, R4 и R5 могут оказаться не инертными в условиях описанных выше последовательностей синтеза, и может потребоваться введение защиты с использованием стандартных защитных групп, известных в данной области техники. Например, амино- или гидроксильная группа может быть защищена с получением ацетил- или mpem-бутоксикарбонил-производного. Альтернативно, некоторые заместители могут образовываться из других заместителей по окончании последовательности реакций. Например, можно синтезировать соединение формулы I, содержащее в качестве заместителя на группах R1, R2, R3, R4 и R5 группу нитро, этоксикарбонил, группу простого эфира, сульфоновой кислоты, и эти заместители в конце превращаются в заместитель амино- (например, путем восстановления нитрогруппы или отщепления подходящей аминозащитной группы (например, удаления Вос-группы с использованием TFA (трифторуксусная кислота))), алкиламино- (например, путем восстановительного аминирования аминогруппы), диалкиламино- (например, путем алкилирования аминогруппы, восстановления соответствующей ациламиногруппы алюмогидридом лития или с использованием реакции Эшвайлера-Кларка с соответствующей амино- или алкиламиногруппой), ациламино- (путем образования амида из аминогруппы, например с использованием соответствующих ацилгалогенидов или соответствующих карбоновых кислот после их активации CDI (карбонилдиимидазол), EDC (1-этил-3-(3-диметиламинопропил)карбодиимид) и т.д.), алкилсульфониламино- (например, путем взаимодействия аминогруппы с сульфонилхлоридами), арилсульфониламино- (например, путем взаимодействия аминогруппы с сульфонилхлоридами), гидроксильный заместитель (путем отщепления подходящей гидроксизащитной группы (например, удаления группы простого бензилового эфира гидрогенолизом или окислительного отщепления группы простого п-метоксибензилового эфира)), заместитель, представляющий собой группу простого эфира, (например, путем синтеза простых эфиров по Вильямсону по гидроксильной группе) или в карбоксамидный заместитель (например, путем образования амида по группе карбоновой кислоты в результате взаимодействия с соответствующими аминами после активации группы карбоновой кислоты посредством CDI, EDC и т.д. или после превращения в ацилхлорид) или в сульфонамидный заместитель с использованием стандартных методик.
Обычно все реакции проводят в подходящем растворителе и в атмосфере аргона или азота.
Соответствующие соли с кислотами могут быть получены стандартными методами, известными специалисту в данной области, например путем растворения соединение формулы (I) в подходящем растворителе, таком как, например, диоксан или THF, и добавления приемлемого количества соответствующей кислоты. Такие продукты обычно могут быть выделены посредством фильтрации или хроматографии. Превращение соединения формулы (I) в фармацевтически приемлемую соль с основанием можно осуществить путем обработки указанного соединения указанным основанием. Один из возможных способов образования такой соли осуществляют, например, путем добавления 1/n эквивалентов основания, такого как, например М(ОН)n, где М представляет собой катион металла или аммония, a n - число гидроксид-анионов, к раствору соединения в подходящем растворителе (например, этаноле, смеси этанол-вода, смеси тетрагидрофуран-вода) и удаления растворителя выпариванием или лиофилизацией.
Превращение соединений формулы (I) в фармацевтически приемлемые сложные эфиры может быть осуществлено, например путем обработки подходящей присутствующей в молекуле карбоксигруппы подходящим спиртом с использованием, например, конденсирующего реагента, такого какбензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), N,N-дициклогексил-карбодиимид (DCC), N-(3-диметиламинопропил)-N′-этилкарбодиимида гидрохлорид (EDCI) или O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N,N-тетра-метилурония тетрафторборат (TPTU), или путем прямого взаимодействия с подходящим спиртом в кислотных условиях, как например, в присутствии сильной минеральной кислоты, такой как соляная кислота, серная кислота и тому подобное. Соединения, содержащие гидроксильную группу, могут быть превращены в сложные эфиры аналогичными способами с использованием подходящих кислот.
В той части, где их получение не описано в примерах, соединения формулы (I), а также все промежуточные продукты могут быть получены согласно аналогичным способам или в соответствии со способами, изложенными выше. Исходные вещества имеются в продаже, известны в данной области или могут быть получены способами, известными в данной области или по аналогии с ними.
Как описано выше, было обнаружено, что новые соединения по настоящему изобретению ингибируют активность PDE10A. Ввиду этого соединения по настоящему изобретению могут быть использованы как таковые или в комбинации с другими лекарственными средствами для лечения и/или профилактики заболеваний, которые модулируются ингибиторами PDE10A. Эти заболевания включают, но не ограничиваются этим, некоторые психотические расстройства, такие как шизофрения, позитивные, негативные и/или когнитивные симптомы, ассоциированные с шизофренией, бредовое расстройство или индуцированное веществами психотическое расстройство, тревожные расстройства, такие как паническое расстройство, обсессивно-компульсивные расстройства, острое стрессовое расстройство или генерализованное тревожное расстройство, лекарственные зависимости, нарушения движений, такие как болезнь Паркинсона или синдром усталых ног, синдром когнитивной недостаточности, такой как болезнь Альцгеймера или мультиинфарктная деменция, расстройства настроения, такие как депрессия или биполярные расстройства, или психоневрологические состояния, такие как психоз, синдром дефицита внимания и гиперактивности (ADHD) или родственные нарушения внимания. Другими расстройствами являются диабет и связанные с ним расстройства, такие как сахарный диабет 2 типа, нейродегенеративные расстройства, такие как болезнь Альцгеймера, болезнь Гентингтона, болезнь Паркинсона, множественный склероз, инсульт или повреждение спинного мозга, солидные опухоли и гематологические злокачественные опухоли, такие как почечноклеточная карцинома или рак молочной железы.
Следовательно, данное изобретение также относится к фармацевтическим композициям, содержащим соединение, которое определено выше, и фармацевтически приемлемый носитель и/или адъювант.
Изобретение также охватывает соединения, которые описано выше, для применения в качестве терапевтически активных веществ, в особенности в качестве терапевтически активных веществ для лечения и/или профилактики заболеваний, которые модулируются ингибиторами PDE10A, в частности, в качестве терапевтически активных веществ для лечения и/или профилактики психотических расстройств, шизофрении, позитивных, негативных и/или когнитивных симптомов, ассоциированных с шизофренией, бредового расстройства, индуцированного веществами психотического расстройства, тревожных расстройств, панического расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, генерализованного тревожного расстройства, лекарственных зависимостей, нарушений движений, болезни Паркинсона, синдрома усталых ног, синдрома когнитивной недостаточности, болезни Альцгеймера, мультиинфарктной деменции, расстройств настроения, депрессии, биполярных расстройств, психоневрологических состояний, психоза, синдрома дефицита внимания и гиперактивности, нарушений внимания, диабета и связанных с ним расстройств, сахарного диабета 2 типа, нейродегенеративных расстройств, болезни Гемтингтона, множественного склероза, инсульта, повреждения спинного мозга, солидных опухолей, гематологических злокачественных опухолей, почечноклеточной карциномы и рака молочной железы.
В другом предпочтительном воплощении изобретение относится к способу терапевтического и/или профилактического лечения заболеваний, которые модулируются ингибиторами PDE10A, в частности, терапевтического и/или профилактического лечения психотических расстройств, шизофрении, позитивных, негативных и/или когнитивных симптомов, ассоциированных с шизофренией, бредового расстройства, индуцированного веществами психотического расстройства, тревожных расстройств, панического расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, генерализованного тревожного расстройства, лекарственных зависимостей, нарушений движений, болезни Паркинсона, синдрома усталых ног, синдрома когнитивной недостаточности, болезни Альцгеймера, мультиинфарктной деменции, расстройств настроения, депрессии, биполярных расстройств, психоневрологических состояний, психоза, синдрома дефицита внимания и гиперактивности, нарушений внимания, диабета и связанных с ним расстройств, сахарного диабета 2 типа, нейродегенеративных расстройств, болезни Гентингтона, множественного склероза, инсульта, повреждения спинного мозга, солидных опухолей, гематологических злокачественных опухолей, почечноклеточной карциномы и рака молочной железы, включающему введение соединения, которое определено выше, человеку или животному.
Изобретение также охватывает применение соединений, определенных выше, для терапевтического и/или профилактического лечения заболеваний, которые модулируются ингибиторами PDE10A, в частности, терапевтического и/или профилактического лечения психотических расстройств, шизофрении, позитивных, негативных и/или когнитивных симптомов, ассоциированных с шизофренией, бредового расстройства, индуцированного веществами психотического расстройства, тревожных расстройств, панического расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, генерализованного тревожного расстройства, лекарственных зависимостей, нарушений движений, болезни Паркинсона, синдрома усталых ног, синдрома когнитивной недостаточности, болезни Альцгеймера, мультиинфарктной деменции, расстройств настроения, депрессии, биполярных расстройств, психоневрологических состояний, психоза, синдрома дефицита внимания и гиперактивности, нарушений внимания, диабета и связанных с ним расстройств, сахарного диабета 2 типа, нейродегенеративных расстройств, болезни Гентингтона, множественного склероза, инсульта, повреждения спинного мозга солидных опухолей, гематологических злокачественных опухолей, почечноклеточной карциномы и рака молочной железы.
Изобретение также относится к применению соединений, описанных выше, для изготовления лекарственных средств для терапевтического и/или профилактического лечения заболеваний, которые модулируются ингибиторами PDE10A, в частности, терапевтического и/или профилактического лечения психотических расстройств, шизофрении, позитивных, негативных и/или когнитивных симптомов, ассоциированных с шизофренией, бредового расстройства, индуцированного веществами психотического расстройства, тревожных расстройств, панического расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, генерализованного тревожного расстройства, лекарственных зависимостей, нарушений движений, болезни Паркинсона, синдрома усталых ног, синдрома когнитивной недостаточности, болезни Альцгеймера, мультиинфарктной деменции, расстройств настроения, депрессии, биполярных расстройств, психоневрологических состояний, психоза, синдрома дефицита внимания и гиперактивности, нарушений внимания, диабета и связанных с ним расстройств, сахарного диабета 2 типа, нейродегенеративных расстройств, болезни Гентингтона, множественного склероза, инсульта, повреждения спинного мозга, солидных опухолей, гематологических злокачественных опухолей, почечноклеточной карциномы и рака молочной железы. Такие лекарственные средства содержат соединение, которое описано выше.
Изобретение также относится к соединениям или их фармацевтически приемлемым солям, определенным выше, для лечения или профилактики психотических расстройств, шизофрении, позитивных, негативных и/или когнитивных симптомов, ассоциированных с шизофренией, бредового расстройства, индуцированного веществами психотического расстройства, тревожных расстройств, панического расстройства, обсессивно-компульсивных расстройств, острого стрессового расстройства, генерализованного тревожного расстройства, лекарственных зависимостей, нарушений движений, болезни Паркинсона, синдрома усталых ног, синдрома когнитивной недостаточности, болезни Альцгеймера, мультиинфарктной деменции, расстройств настроения, депрессии, биполярных расстройств, психоневрологических состояний, психоза, синдрома дефицита внимания и гиперактивности, нарушений внимания, диабета и связанных с ним расстройств, сахарного диабета 2 типа, нейродегенеративных расстройств, болезни Гентингтона, множественного склероза, инсульта, повреждения спинного мозга, солидных опухолей, гематологических злокачественных опухолей, почечноклеточной карциномы или рака молочной железы.
Предупреждение и/или лечение шизофрении является предпочтительным показанием. Кроме того, предпочтительным является предупреждение и/или лечение позитивных, негативных и/или когнитивных симптомов, ассоциированных с шизофренией.
Следующий далее тест проводили с целью определения активности соединений по настоящему изобретению. Активность соединений по настоящему изобретению в отношении PDE10 определяли, используя основанный на сцинтилляционном анализе сближения (SPA) метод, аналогичный описанному ранее (Fawcett, L. et al., Proc. Natl. Acad. Sci. USA (2000), 97 (7): 3702-3707).
Подробный анализ PDE10A человека проводили в 96-луночных микротитрационных планшетах. Реакционная смесь (50 мкл) содержала 20 мМ HEPES (N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота) рН=7,5/10 мМ MgCl2/BSA (бычий сывороточный альбумин; 0,05 мг/мл) (Sigma, № по каталогу А-7906), 50 нМ цГМФ (Sigma, №по каталогу G6129) и 50 нМ [3H]-цГМФ (13,2 Ки/моль; GE Healthcare S.A, №по каталогу TRK392), фермент PDE10A (3,75 нг/лунка; Enzo Life Science, Lausen, Switzerland, №по каталогу SE-534) с конкретным тестируемым соединением или без него. Для получения данных, необходимых для расчета концентрации ингибитора, вызывающей 50%-ный эффект (например, IC50, концентрации конкурента, ингибирующего активность PDE10A на 50%), использовали диапазон концентраций потенциального ингибитора. Неспецифическую активность тестировали в отсутствие фермента. Реакцию инициировали добавлением раствора субстрата (цГМФ и [3H]-цГМФ) и оставляли протекать в течение 20 минут при комнатной температуре. Реакцию останавливали добавлением 25 мкл сцинтилляционных YSi-SPA-гранул (GE Healthcare, № по каталогу RPNQ0150) в 18 мМ растворе сульфата цинка (стоп-реагент). После встряхивания в течение 1 ч планшет центрифугировали в течение одной минуты при 170д для осаждения гранул. После этого измеряли радиоактивные импульсы на сцинтилляционном планшетном ридере TopCount от Perkin Elmer.
Соединения формулы (I) предпочтительно имеют величину IC50 ниже 10 мкМ, предпочтительно ниже 5 мкМ, более предпочтительно ниже 1 мкМ. Предпочтительно, чтобы величины IC50 были выше 0,01 нМ. В приведенной ниже таблице показаны данные для некоторых примеров.
Соединения формулы 1 и/или их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например в форме фармацевтических композиций для энтерального, парентерального или местного введения. Их можно вводить, например, перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например в форме суппозиториев, парентерально, например в форме растворов или суспензий для инъекций или растворов для инфузий, или местно, например в форме мазей, кремов или масел. Пероральное введение является предпочтительным.
Изготовление фармацевтических композиций может быть осуществлено способом, знакомым каждому специалисту в данной области, путем внесения описываемых соединений формулы 1 и/или их фармацевтически приемлемых солей, возможно в комбинации с другими терапевтически полезными веществами, в форму галенова препарата для введения вместе с подходящими нетоксичными инертными терапевтически совместимыми твердыми или жидкими веществами-носителями и, при желании, общепринятыми фармацевтическими адъювантами.
Подходящими веществами-носителями являются не только неорганические вещества-носители, но также и органические вещества-носители. Так, например, в качестве веществ-носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул, можно использовать лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли. Подходящими веществами-носителями для мягких желатиновых капсул являются, например растительные масла, воски, жиры, полутвердые и жидкие полиолы (в случае мягких желатиновых капсул носители обычно не требуются, однако это зависит от природы активного ингредиента) Подходящими веществами-носителями для изготовления растворов и сиропов являются, например вода, полиолы, сахароза, инвертированный сахар и тому подобное. Подходящими веществами-носителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Подходящими веществами-носителями для суппозиториев являются, например природные или отвержденные жиры, воски, жиры, полужидкие или жидкие полиолы. Подходящими веществами-носителями для препаратов местного применения являются глицериды, полусинтетические и синтетические глицериды, гидрированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стерины, полиэтиленгликоли и производные целлюлозы.
В качестве фармацевтических адъювантов рассматриваются общепринятые стабилизаторы, консерванты, увлажняющие и эмульгирующие агенты, вещества, улучшающие консистенцию, вещества, улучшающие вкус, соли для изменения осмотического давления, буферные вещества, солюбилизаторы, красители, маскирующие агенты и антиоксиданты.
Дозировку соединений формулы (I) можно варьировать в широких пределах в зависимости от подлежащего контролю заболевания, возраста и индивидуального состояния пациента и способа введения, и несомненно, в каждом конкретном случае она должна быть подобрана с учетом индивидуальных потребностей. Для взрослых пациентов рассматривается суточная дозировка примерно 0,1-2000 мг; в особенности примерно 1-500 мг. В зависимости от тяжести заболевания и точного фармакокинетического профиля такое соединение можно вводить в виде одной или нескольких суточных стандартных лекарственных доз, например в виде 1-3 стандартных лекарственных доз.
Удобно, когда фармацевтические композиции содержат примерно 0,1-500 мг; предпочтительно 1-200 мг соединения формулы (I).
Следующие далее примеры служат для более подробной иллюстрации настоящего изобретение. Однако, имеется в виду, что они никоим образом не ограничивают его объем.
Примеры А. Промежуточные соединения
А-1.6-Метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты этиловый эфир
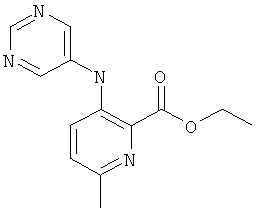
Это соединение получали согласно способу, описанному в US 2006/199960. MS, M=259,3 (М+Н)+.
А-2.6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты этиловый эфир
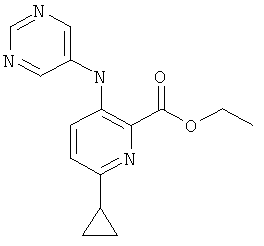
Стадия 1: 3-амино-6-циклопропил-пиридин-2-карбоновой кислоты этиловый эфир
К раствору 3-амино-6-бром-пиридин-2-карбоновой кислоты этилового эфира (полученного согласно US 2006/199960; 1,0 г; 4,08 ммоль), фосфата калия (3,03 г; 14,3 ммоль), трициклогексилфосфина (0,228 г; 0,82 ммоль) и воды (1,25 мл) в толуоле (25 мл) добавляли циклопропилбороновую кислоту (0,91 г; 10,6 ммоль) и ацетат палладия(II) (90 мг; 0,4 ммоль). Полученную суспензию перемешивали при 100°С в течение 24 часов. После выпаривания растворителя указанное в заголовке соединение получали по окончании хроматографии на силикагеле, используя градиент гептан/этилацетат, в виде желтого твердого вещества (0,374 г; 44%).
MS: М=207,0(М+Н)+ .
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты этиловый эфир
Суспензию 3-амино-6-циклопропилпиридин-2-карбоновой кислоты этилового эфира (763 мг; 3,7 ммоль), 5-бромпиримидина (823 мг; 5,2 ммоль), воды (140 мкл; 7,8 ммоль) и карбоната калия (920 мг; 6,7 ммоль) в о-ксилоле (10 мл) вакуумировали и продували аргоном. В атмосфере инертного газа последовательно добавляли ацетат палладия(II) (33 мг; 0,15 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (ксантфос; 107 мг; 0,18 мкмоль), реакционную смесь нагревали до 140°С и перемешивали в течение ночи. После охлаждения до температуры окружающей среды реакционную смесь разбавляли метиленхлоридом (15 мл) и фильтровали. Фильтрат концентрировали в вакууме и продукт очищали хроматографией на силикагеле с использованием градиента гептан/этилацетат, получая указанное в заголовке соединение (796 мг; 75,7%) в виде светло-желтого твердого вещества.
MS: М=285,3(М+Н)+.
А-3.6-Метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты метиловый эфир
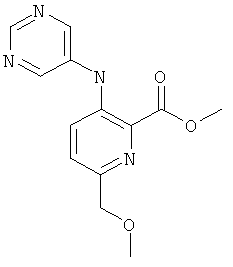
Стадия 1: 5-бром-пиридин-2-ил-метанол
К раствору 5-бромпиридин-2-карбоновой кислоты (8 г; 42,1 ммоль) в THF (100 мл) по каплям при 0°С добавляли боран-диметилсульфид (16 мл; 168,30 ммоль). После нагревания до температуры окружающей среды перемешивание продолжали в течение 24 часов. Раствор вновь охлаждали до 0°С, гасили, используя МеОН, и кипятили с обратным холодильником в течение 1 ч. Растворители удаляли и остаток обрабатывали водой. Водную фазу экстрагировали этилацетатом и объединенные органические слои промывали водой и рассолом, сушили, фильтровали и концентрировали при пониженном давлении, что позволило получить 4,76 г (64%) указанного в заголовке соединения.
MS: M=188,0 и 190,0 (М+Н)+.
Стадия 2: 5-бром-2-гидроксиметил-пиридин-1-оксид
5-Бром-пиридин-2-ил-метанол (6,0 г; 31,9 ммоль) растворяли в метиленхлориде (80 мл) и охлаждали до 0°С. Медленно добавляли раствор 3-хлорпербензойной кислоты (8,26 г; 47,9 ммоль) в метиленхлориде (20 мл), ледяную баню удаляли после завершения добавления и реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Растворитель удаляли и неочищенный продукт очищали хроматографией на силикагеле с использованием этилацетата, получая 3,68 г (56%) указанного в заголовке соединения.
MS: М=204,0 и 206,2 (М+Н)+ .
Стадия 3: 5-бром-2-метоксиметил-пиридин-1-оксид
К раствору 5-бром-2-гидроксиметил-пиридин-1-оксида (6,43 г; 31,5 ммоль) в THF (200 мл) добавляли гидрид натрия (1,51 г; 63,1 ммоль) при 0°С и затем реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. После охлаждения до 0°С добавляли Mel (2,90 мл; 46,6 ммоль). Температура повышалась до температуры окружающей среды, и реакционную смесь нагревали до 70°С в течение 1 ч. После охлаждения до 0°С реакционную смесь гасили МеОН. Растворители удаляли и неочищенный продукт очищали хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/гексан, получая 4,8 г (70%) указанного в заголовке соединения.
MS: М=218,2 и 220,2 (М+Н)+.
Стадия 4: 3-бром-6-метоксиметил-пиридин-2-карбонитрил
Раствор 5-бром-2-метоксиметил-пиридин-1-оксида (5,0 г; 22,7 ммоль), триэтиламина (12,7 мл; 91 ммоль) и триметилсилилцианида (9,1 мл; 68,2 ммоль) в ацетонитриле (10 мл) нагревали до 120°С в течение 18 часов в герметично закрытой пробирке. После завершения реакции к реакционной смеси добавляли воду и ацетонитрил удаляли. Неочищенное вещество экстрагировали этилацетатом, объединенные органические слои промывали водой и рассолом, сушили, фильтровали и упаривали. Неочищенный продукт очищали хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/гексан, получая 3,0 г (58%) указанного в заголовке соединения.
MS: М=229,2 (М+Н)+.
Стадия 5: 3-бром-6-метоксиметил-пиридин-2-карбоновая кислота
К раствору 3-бром-6-метоксиметил-пиридин-2-карбонитрила (300 мг; 1,32 ммоль) в МеОН (6 мл) добавляли раствор гидроксида калия (1,48 г; 26,43 ммоль) в воде (4 мл). Смесь кипятили с обратным холодильником в течение 3 часов. МеОН удаляли в вакууме, водный раствор нейтрализовали конц. HCI при охлаждении и смесь экстрагировали этилацетатом. Объединенные органические слои промывали водой и рассолом, сушили, фильтровали и упаривали. Полученный продукт (276 мг; 85%) использовали на следующей стадии без какой-либо дополнительной очистки.
MS: М=246,2 и 248,2 (М+Н)+ .
Стадия 6: 3-бром-6-метоксиметил-пиридин-2-карбоновой кислоты метиловый эфир
К раствору 3-бром-6-метоксиметил-пиридин-2-карбоновой кислоты (200 мг; 0,81 ммоль) в бензоле (4 мл) и МеОН (1 мл) медленно добавляли триметилсилил-диазометан (0,41 мл; 0,81 ммоль) при температуре окружающей среды и реакционную смесь перемешивали в течение 2 часов. Растворители удаляли и остаток экстрагировали этилацетатом. Объединенные органические слои промывали водой и рассолом, сушили, фильтровали и упаривали. Неочищенный продукт очищали хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/гексан, получая 158 мг (75%) указанного в заголовке соединение в виде светло-желтого масла.
MS: М=260,0 и 262,0 (М+Н)+.
Стадия 7: 6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты метиловый эфир
Согласно способу, описанному на стадии 2 примера А-2, указанное в заголовке соединение получали в виде беловатого твердого вещества с выходом 75%.
MS: М=275,2 (М+Н)+.
А-4.2-Метоксиметил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты метиловый эфир
Стадия 1: 2-метокси-ацетамидин
К раствору метокси-ацетонитрила (6 г; 84,4 ммоль) в МеОН (60 мл) добавляли метилат натрия (0,86 г; 16,0 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение 48 часов. К реакционной смеси добавляли хлорид аммония (4,52 г; 84,5 ммоль) и перемешивание продолжали в течение следующих 12 ч. Растворитель удаляли при пониженном давлении, получая указанное в заголовке соединение, которое использовали на следующей стадии без какой-либо дополнительной очистки. Выход: 6,5 г (88%).
MS: M=89,1 (M+H)+.
Стадия 2: 5-бром-2-метоксиметил-пиримидин-4-карбоновая кислота
К раствору 2-метокси-ацетамидина (7,21 г; 89,19 ммоль) в EtOH (50 мл) добавляли этилат натрия (26 мл; 22%-ный раствор в EtOH) и реакционную смесь нагревали до 50°С в течение 30 мин. Добавляли раствор мукобромной кислоты (6,5 г; 38,77 ммоль) в ЕЮН (50 мл), затем этилат натрия (14 мл; 22%-ный раствор в EtOH) и реакционную смесь продолжали перемешивать при 50°С в течение 1 ч. После фильтрации и выпаривания растворителя добавляли воду (5 мл), реакционную смесь охлаждали до 0°С и подкисляли раствором 2 н. HCI до рН ~6. После выпаривания воды остаток растворяли в МеОН, фильтровали и фильтрат упаривали. Неочищенное вещество очищали хроматографией на силикагеле с использованием в качестве элюента смеси растворителей метанол/метиленхлорид, получая 3,73 г (60%) указанного в заголовке соединения.
MS: М=246,9 и 248,9 (М+Н)+.
Стадия 3: 5-бром-2-метоксиметил-пиримидин-4-карбоновой кислоты метиловый эфир
К раствору 5-бром-2-метоксиметил-пиримидин-4-карбоновой кислоты (2,5 г; 10,1 ммоль) в ацетоне (100 мл) добавляли Cs2CO3 (19,8 г; 60,7 ммоль), затем метилиодид (3,8 мл; 60,7 ммоль). Смесь нагревали до температуры дефлегмации в течение 8 ч. Затем реакционную смесь фильтровали и фильтрат упаривали. Неочищенное вещество очищали хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/гексан, получая 700 мг (27%) указанного в заголовке соединения в виде желтого масла.
MS: М=260,9 и 262,7 (М+Н)+.
Стадия 4: 2-метоксиметил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты метиловый эфир
Согласно способу, описанному на стадии 2 примера А-2, указанное в заголовке соединение получали в виде желтого твердого вещества с выходом 17%.
MS, М=276,2 (М+Н)+.
А-5. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновая кислота
Суспензию 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты этилового эфира (1,85 г; 6,5 ммоль) из примера А-2 в EtOH (15 мл) обрабатывали 1 н. NaOH (13 мл). Реакционную смесь перемешивали при кг в течение ночи. Значение рН плотной суспензии подводили до 6, добавляя 1 н. HCI. Твердое вещество собирали фильтрацией, промывали ЕЮН и сушили, получая продукт (1,29 г; 77%) в виде беловатого твердого вещества.
MS: М=255,0 (М-Н).
А-6.6-Этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты этиловый эфир
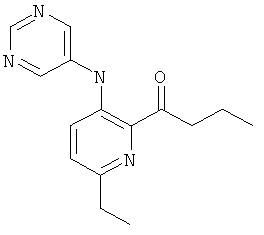
Это соединение получали согласно способу, описанному в US 2006/199960.
MS: M=273,3 (М+Н)+.
А-7.6-11иклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты метиловый эфир
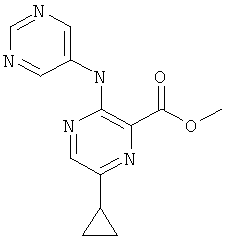
Стадия 1: 3-амино-6-циклопропилпиразин-2-карбоновой кислоты метиловый эфир
К суспензии 3-амино-6-бромпиразин-2-карбоновой кислоты метилового эфира (17,8 г; 76,7 ммоль), циклопропилбороновой кислоты (8,57 г; 99,7 ммоль), фосфата калия (57,0 г; 268 ммоль) и трициклогексилфосфина (2,15 г; 7,67 ммоль) в толуоле (445 мл) и воде (22 мл) добавляли ацетат палладия(II) (0,86 г; 3,84 ммоль). Реакционную смесь нагревали до 100°С и перемешивали в течение 20 ч. Добавляли воду (200 мл), органический слой промывали водой и рассолом и водный слой еще раз экстрагировали этилацетатом. Объединенные органические фазы сушили и растворитель выпаривали. После хроматографии на силикагеле с использованием градиента гептан/этилацетат получали продукт в виде желтого твердого вещества (1,69 г; 11,4%).
MS: М=194,1 (М+Н)+.
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты метиловый эфир
Суспензию 3-амино-6-циклопропилпиразин-2-карбоновой кислоты метилового эфира (2,17 г; 11,2 ммоль), 5-бромпиримидина (2,5 г; 15,7 ммоль), воды (425 мкл; 23,6 ммоль) и карбоната калия (2,79 г; 20,2 ммоль) в о-ксилоле (43,4 мл) продували аргоном и обрабатывали ультразвуком в течение 2 мин. Последовательно в атмосфере инертного газа добавляли ацетат палладия(И) (101 мг; 0,45 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (ксантфос; 325 мг; 0,56 мкмоль), реакционную смесь нагревали до 140°С и перемешивали в течение 2 ч. После охлаждения до температуры окружающей среды реакционную смесь выливали в воду (100 мл) и экстрагировали этилацетатом. Органические слои сушили и концентрировали в вакууме. После хроматографии на силикагеле с использованием градиента гептан/этилацетат получали продукт в виде желтого твердого вещества (2,49 г; 81,7%).
MS: М=272,2 (М+Н)+.
А-8.6-Метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновая кислота
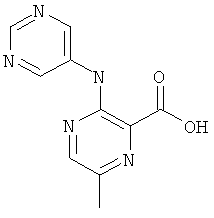
Стадия 1: 3-амино-6-метил-пиразин-2-карбоновой кислоты этиловый эфир
Это соединение получали согласно способу, описанному в US 2006/199828.
MS: M=182,1 (M+H)+.
Стадия 2: 6-метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты этиловый эфир
Суспензию 3-амино-6-метил-пиразин-2-карбоновой кислоты этилового эфира (500 мг; 2,8 ммоль), 5-бромпиримидина (614 мг; 3,9 ммоль), воды (104 мкл; 5,8 ммоль) и карбоната калия (686 мг; 5,0 ммоль) в ксилоле (7 мл) продували аргоном. Последовательно в атмосфере инертного газа добавляли ацетат палладия(II) (25 мг; 0,11 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (ксантфос; 80 мг; 0,14 мкмоль), реакционную смесь нагревали до 140°С и перемешивали в течение 5 ч. После охлаждения до температуры окружающей среды реакционную смесь разбавляли водой (5 мл) и экстрагировали метиленхлоридом. Органические слои промывали водой и рассолом, сушили и концентрировали в вакууме. После хроматографии на силикагеле с использованием градиента гептан/этилацетат получали продукт в виде светло-желтого твердого вещества (585 мг; 81,8%).
MS: M=260.1 (М+Н)+.
Стадия 3: 6-метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновая
кислота
6-Метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты этиловый эфир (300 мг; 1,15 ммоль) растворяли в смеси THF/этанол (5 мл/1 мл), охлаждали до 0°С и обрабатывали гидроксидом лития (4,7 мл; 1 н. водный раствор). Реакционную смесь оставляли нагреваться до температуры окружающей среды и перемешивали при этой температуре в течение 1 часа. После этого рН подводили до соответствующего кислоте значения и полученную суспензию фильтровали. Осадок промывали водой и этилацетатом и сушили, получая продукт в виде светло-желтого твердого вещества (185 мг; 69%).
MS: М=230,2 (М+Н)+.
А-9.2-Изопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты метиловый эфир
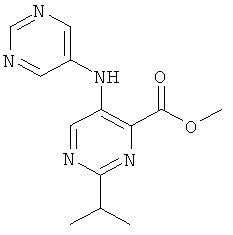
Стадия 1: 5-бром-2-изопропил-пиримидин-4-карбоновая кислота К перемешиваемой суспензии изобутирамида гидрохлорида (6,47 г; 47,5 ммоль) при кг в EtOH (30 мл) в атмосфере аргона добавляли раствор этилата натрия (21 мл; 21%-ного в EtOH) в течение 5 мин. Суспензию нагревали до 50°С и по каплям в течение 5 мин добавляли раствор мукобромной кислоты (5,7 г; 22,1 ммоль) в EtOH (24 мл). По каплям в течение 5 мин добавляли дополнительную порцию раствора этилата натрия (12 мл; 21%-ного в ЕЮН). Затем смесь охлаждали до кг. Твердые вещества отфильтровывали и осадок на фильтре промывали большим количеством этанола. Фильтрат концентрировали, получая неочищенный продукт в виде светло-коричневого твердого вещества. Неочищенное вещество растирали в 2 н. HCI (100 мл). Продукт собирали фильтрацией, промывали большим количеством H2O и большим количеством н-гептана и сушили, получая продукт (2,09 г; 73%) в виде бежевого твердого вещества.
MS: М=244,9 (М-Н)+.
Стадия 2: 5-бром-2-изопропил-пиримидин-4-карбоновой кислоты метиловый эфир
К перемешиваемому охлажденному (0°С) раствору 5-бром-2-изопропил-пиримидин-4-карбоновой кислоты (3 г; 12,2 ммоль) в метаноле (50 мл) в атмосфере аргона по каплям добавляли тионилхлорид (4,37 г; 2,68 мл; 36,7 ммоль). По завершении добавления смесь оставляли нагреваться до кг и перемешивание при кг продолжали в течение 17 ч. Оранжевую смесь концентрировали, получая пастообразное вещество, которое переносили в смесь EtOAc (50 мл)/насыщенный водный раствор Na2CO3 (50 мл). Водную фазу экстрагировали EtOAc. Объединенные органические экстракты промывали H2O и рассолом, сушили над MgSO4, фильтровали и концентрировали, получая продукт (2,98 г; 94%) в виде светло-коричневого масла, которое использовали на следующей стадии реакции без дополнительной очистки.
MS: М=260,9 (М+Н)+.
Стадия 3: 2-изопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты метиловый эфир
Согласно способу, описанному на стадии 2 примера А-2, указанное в заголовке соединение получали в виде желтого твердого вещества с выходом 76%.
MS: M=272,1 (М-Н)-.
А-10.2-Циклопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты метиловый эфир
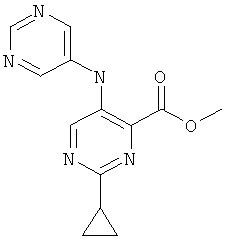
Согласно способам, описанным в примере А-9, указанное в заголовке соединение получали в виде желтого твердого вещества, исходя из циклопропанкарбоксамидина гидрохлорида.
MS: M=270,1 (М-Н)-.
А-11.2-трет-Бутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты метиловый эфир
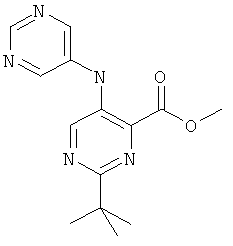
Согласно способам, описанным в примере А-9, указанное в заголовке соединение получали в виде воскообразного твердого соединения, исходя из 2,2-диметил-пропионамидина гидрохлорида.
MS: M=288,1 (М+Н)+.
А-12.2-Циклогексил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты метиловый эфир
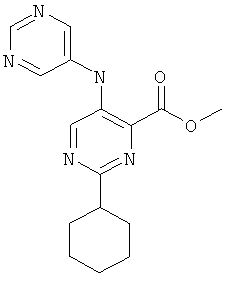
Согласно способам, описанным в примере А-9, указанное в заголовке соединение получали в виде воскообразного твердого соединения, исходя из циклогексанкарбоксамидина.
MS: M=314,1 (М+Н)+.
А-13.2-Изобутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты метиловый эфир
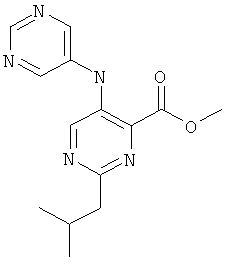
Согласно способам, описанным в примере А-9, указанное в заголовке соединение получали в виде вязкого масла, исходя из 3-метил-бутирамидина гидрохлорида.
MS: М=288,1 (М+Н)+.
А-14.6-Этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновая кислота
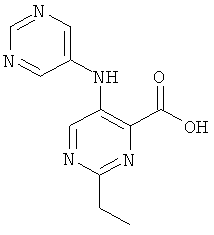
6-Этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты этиловый эфир (полученный согласно US 2006/199960; 200 мг; 0,73 ммоль) растворяли в смеси THF/этанол (12 мл/3 мл), охлаждали до 0°С и обрабатывали гидроксидом лития (2,2 мл; 1 н. водный раствор). Реакционную смесь оставляли нагреваться до температуры окружающей среды и перемешивание продолжали при этой температуре в течение 2 часов. После этого рН подводили до соответствующего кислоте значения и реакционную смесь экстрагировали дихлорметаном (3х40 мл). Объединенные органические фазы сушили и упаривали, получая продукт в виде светло-желтого твердого вещества (175 мг; 97%).
MS: M=243,1 (М+Н)+.
А-15.3-Амино-6-циано-пиридин-2-карбоновой кислоты этиловый эфир
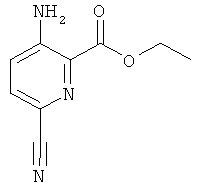
Раствор 3-амино-6-бром-пиридин-2-карбоновой кислоты этилового эфира (40 мг; 163 мкмоль) и цианида меди(I) (29,2 мг; 326 мкмоль) в DMF (800 мкл) нагревали в микроволновой печи при 220°С в течение 8 мин. Реакционную смесь фильтровали через вспомогательный диатомовый порошок для фильтрования и неочищенный продукт очищали препаративной HPLC, что позволило получить указанное в заголовке соединение в виде беловатого твердого вещества (8,3 мг; 26,6%).
MS: M=192.2 (М+Н)+.
А-16.5-Бром-2-(2-метокси-этиламино)-пиримидин-4-карбоновой кислоты этиловый эфир
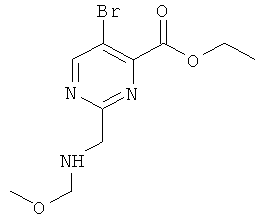
Стадия 1: 5-бром-2-метансульфонил-пиримидин-4-карбоновой кислоты этиловый эфир
Раствор 3-хлорпербензойной кислоты (1,78 г; 7,2 ммоль) в дихлорметане (50 мл) медленно добавляли к раствору 5-бром-2-метилсульфанил-пиримидин-4-карбоновой кислоты этилового эфира (1,0 г; 3,6 ммоль) в дихлорметане (50 мл) при 0-5°С. Через 30 мин охлаждающую баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь экстрагировали насыщенным раствором бикарбоната натрия и водой. Водные фазы вновь экстрагировали дихлорметаном и объединенные органические фазы сушили над MgSO4, фильтровали и упаривали. Неочищенный продукт очищали хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/гептан, получая указанное в заголовке соединение в виде бесцветного воскообразного твердого вещества (0,83 г; 74%).
MS: M=311,1 (М+Н)+.
Стадия 2: 5-бром-2-(2-метокси-этиламино)-пиримидин-4-карбоновой кислоты этиловый эфир
2-Метоксиэтиламин (0,278 мл; 3,2 ммоль) добавляли при комнатной температуре к раствору 5-бром-2-метансульфонил-пиримидин-4-карбоновой кислоты этилового эфира (0,2 г; 0,65 ммоль) в дихлорметане (5 мл). Перемешивание продолжали при 45°С в течение 2 часов. Растворитель выпаривали и неочищенный продукт очищали хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/гептан, получая указанное в заголовке соединение в виде бесцветного масла (0,175 г; 89%). MS, М=304,2 (М+Н)^
В. Конечные продукты
Пример 1. 6-Метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-фенил-1 Н-пиразол-3-ил)-амид
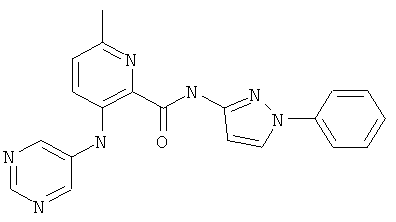
1-Фенил-1H-пиразол-3-иламин (277 мг; 1,74 ммоль) растворяли в атмосфере инертного газа в диоксане (8 мл) и добавляли триметилалюминий (1,02 мл; 2М раствор в гептане). После перемешивания в течение 30 мин при температуре окружающей среды добавляли 6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты этиловый эфир (А-1; 150 мг; 0,58 ммоль) и реакционную смесь нагревали при температуре дефлегмации в течение 1,5 часа. После охлаждения до комнатной температуры добавляли воду (0,7 мл) и в течение 5 мин продолжали интенсивно перемешивать. Добавляли сульфат натрия в количестве, достаточном для поглощения воды, и дихлорметан, продолжая перемешивать. Затем полученный раствор фильтровали через дикалит и промывали дихлорметаном. Растворитель выпаривали и после хроматографии на силикагеле с использованием градиента гептан/этил ацетат получали конечный продукт в виде светло-желтого кристаллического вещества (176 мг; 81%).
MS: M=372,2 (М+Н)+.
Пример 2. 6-Метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1-(4-Фтор-(ренил-1H-пиразол-3-ил]-амид
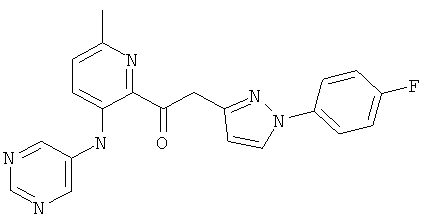
Стадия 1: 1-(4-фтор-фенил)-1Н-пиразол-3-иламин
К горячему раствору mpem-бутилата калия (2,54 г; 23 ммоль) в mpem-бутаноле (30 мл) добавляли 4-фторфенилгидразина гидрохлорид (1,67 г; 10 ммоль). После охлаждения до температуры окружающей среды добавляли раствор 3-этоксиакрилонитрила (1,0 г; 10 ммоль) в mpem-бутаноле (5 мл) и смесь кипятили с обратным холодильником в течение 3 ч. После охлаждения до температуры окружающей среды растворитель выпаривали. Остаток растворяли в этилацетате и экстрагировали водой. Органические фазы объединяли, сушили и упаривали. После хроматографии на силикагеле с использованием градиента гептан/этилацетат получали данный амин в виде оранжевого твердого вещества (0,78 г; 42%).
MS: М=178.3 (М+Н)+.
Стадия 2: 6-метил-3-(пиримидин-5-иламино)-пиридин-2-кар6оновой кислоты [1-(4-фтор-фенил)-1Н-пиразол-3-ил]-амид
1-(4-Фтор-фенил)-1М-пиразол-3-иламин (55 мг; 0,31 ммоль) растворяли в атмосфере инертного газа в диоксане (2 мл) и добавляли триметилалюминий (0,154 мл; 2М раствор в толуоле). После перемешивания в течение 30 мин при температуре окружающей среды добавляли 6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты этиловый эфир (А-1; 20 мг; 0,08 ммоль) и реакционную смесь нагревали при температуре дефлегмации в течение 18 часов. После охлаждения до комнатной температуры добавляли воду (0,5 мл) и в течение 5 мин продолжали интенсивно перемешивать. Добавляли сульфат натрия в количестве, достаточном для поглощения воды, и дихлорметан, продолжая перемешивать. Затем полученный раствор фильтровали через дикалит и промывали дихлорметаном. Растворитель выпаривали и после хроматографии на силикагеле с использованием градиента гептан/этилацетат получали конечный продукт в виде беловатого твердого вещества (5 мг; 16%).
MS: М=390,2 (М+Н)+.
Пример 3. 6-Метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты И -(2-фтор-фенилИ ^-пиразол-3-ил1-амид
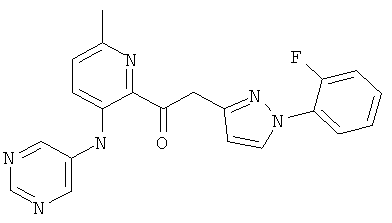
Стадия 1: 1-(2-фтор-фенил)-1Н-пиразол-3-иламин
Согласно способу, описанному на стадии 1 примера 2, данный амин получали, исходя из 2-фторфенилгидразина × HCI, в виде коричневого твердого вещества с выходом 24%.
MS: M=178,3 (М+Н)+.
Стадия 2: 6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1-(2-фтор-фенил)-1 Н-пиразол-3-ил]-амид
Согласно способу, описанному на стадии 2 примера 2, указанное в заголовке соединение получали, исходя из соединения А-1 и 1-(2-фтор-фенил)-1Н-пиразол-3-иламина, в виде беловатого твердого вещества с выходом 16%.
MS: М=390,2 (М+Н)+.
Пример 4. 6-Метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-2-ил-1Н-пиразол-3-ил)-амид
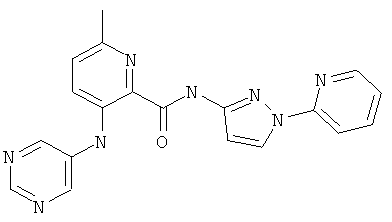
Стадия 1: 1-пиридин-2-ил-1Н-пиразол-3-иламин
Согласно способу, описанному на стадии 1 примера 2, данный амин получали, исходя из пиридин-2-илгидразина, в виде желтого твердого вещества с выходом 34%.
MS: M=161,5 (M+H)+.
Стадия 2: 6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-2-ил-1Н-пиразол-3-ил)-амид
Согласно способу, описанному на стадии 2 примера 2, указанное в заголовке соединение получали, исходя из соединения А-1 и 1-пиридин-2-ил-1Н-пиразол-3-иламина, в виде беловатого твердого вещества с выходом 48%.
MS: M=373,1 (М+Н)+.
Пример 5. 6-Метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-4-ил-1Н-пиразол-3-ил)-амид
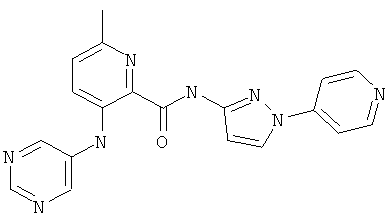
Стадия 1: 1-пиридин-4-ил-1Н-пиразол-3-иламин
К раствору карбоната калия (4,46 г; 32 ммоль) в воде (20 мл) добавляли пиридин-4-ил-гидразин × 2 HCI (1,47 г; 8 ммоль) и смесь охлаждали до 10°С. По каплям при этой же температуре добавляли 2,3-дихлорпропионитрил (1,0 г; 8 ммоль). Далее смесь перемешивали при 45°С в течение 3 ч и при температуре окружающей среды в течение ночи. Реакционную смесь экстрагировали дихлорметаном, органические фазы объединяли, промывали рассолом, сушили и растворитель выпаривали. После хроматографии на силикагеле с использованием градиента гептан/этилацетат получали данный амин в виде желтого твердого вещества (80 мг; 6%).
MS: М=161.3 (М+Н)+.
Стадия 2: 6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-4-ил-1Н-пиразол-3-ил)-амид
Согласно способу, описанному на стадии 2 примера 2, указанное в заголовке соединение получали, исходя из соединения А-1 и 1-пиридин-4-ил-1Н-пиразол-3-иламина, в виде беловатого твердого вещества с выходом 25%.
MS: М=373,2 (М+Н)+.
Пример 6. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1-(4-фтор-фенил)-1Н-пиразол-3-ил]-амид
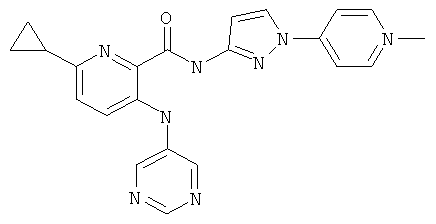
Согласно способу, описанному на стадии 2 примера 2, указанное в заголовке соединение получали, исходя из соединения А-2 и 1-(4-фтор-фенил)-1H-пиразол-3-иламина, в виде светло-желтого твердого вещества с выходом 86%.
MS: M=416.2 (М+Н)+.
Пример 7. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-4-ил-1Н-пиразол-3-ил)-амид
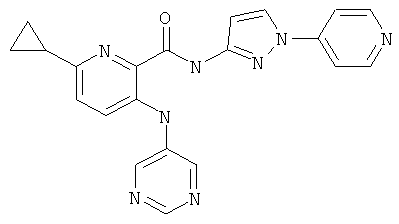
Согласно способу, описанному на стадии 2 примера 2, указанное в заголовке соединение получали, исходя из промежуточного соединения А-2 и 1-пиридин-4-ил-1H-пиразол-3-иламина, в виде желтого твердого вещества с выходом 62%.
MS: М=399,2 (М+Н)+.
Пример 8. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амид
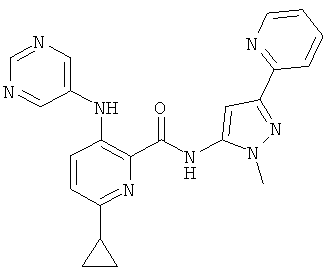
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-2 и 1-метил-3-пиридин-2-ил-1Н-пиразол-5-амина, в виде светло-желтого твердого вещества с выходом 63%.
MS: M=413,2 (М+Н)+
Пример 9. 6-11иклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-фенил-2H-пиразол-3-ил]-амид
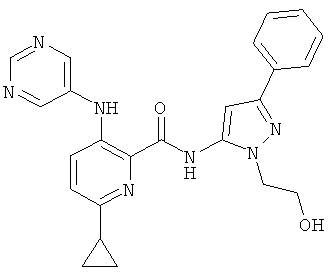
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-2 и 2-(5-амино-3-фенил-пиразол-1-ил)-этанола (CAS 14085-42-8), в виде светло-желтого твердого вещества с выходом 12%.
MS: М=442,2 (М+Н)+.
Пример 10. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амид
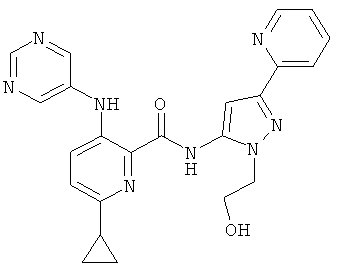
Стадия 1: 2-(5-амино-3-пиридин-2-ил-пиразол-1-ил)-этанол
Раствор 3-оксо-3-пиридин-2-ил-пропионитрила (0,5 г; 3,4 ммоль; CAS 54123-21-6) в ЕЮН (20 мл) обрабатывали 2-гидроксиэтилгидразином (0,7 мл; 10,3 ммоль). Реакционную смесь кипятили с обратным холодильником в течение ночи, затем концентрировали. После хроматографии на силикагеле с использованием градиента CH2Cl2/MeOH получали продукт в виде вязкого желтого масла (0,56 г; 80%).
MS: M=205,1 (М+Н)+.
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амид
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-2 и 2-(5-амино-3- пиридин-2-ил-пиразол-1-ил)-этанола, в виде желтого твердого вещества с выходом 16%.
MS: М=443,2 (М+Н)+.
Пример 11. 6-Метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амид
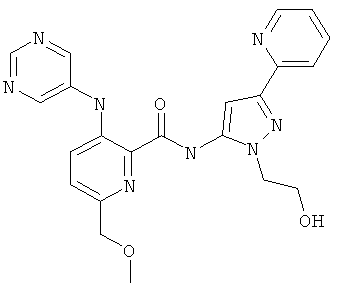
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-3 и 2-(5-амино-3-пиридин-2-ил-пиразол-1-ил)-этанола, в виде желтого твердого вещества с выходом 18%.
MS: M=447,3 (М+Н)+.
Пример 12. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-диметиламино-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амид
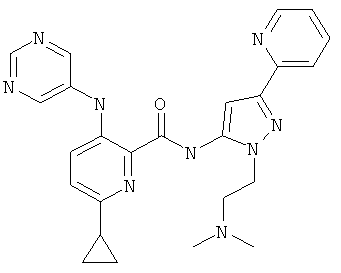
Согласно способу, описанному в примере 10, указанное в заголовке соединение получали в две стадии, исходя из диметиламиноэтилгидразина дигидрохлорида (1ая стадия; выход 25%) и промежуточного соединения А-2 (2ая стадия; выход 29%), в виде желтого твердого вещества.
Пример 13. 2-Метоксиметил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амид
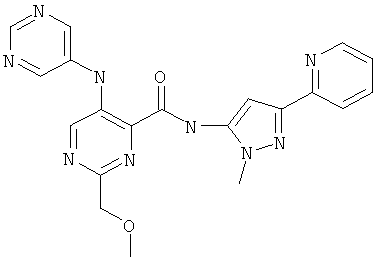
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-4 и 1-метил-3-пиридин-2-ил-1Н-пиразол-5-амина, в виде желтого твердого вещества с выходом 18%.
MS: М=418.4 (М+Н)+.
Пример 14. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-циклогексил-5-пиридин-2-ил-2H-пиразол-3-ил)-амид
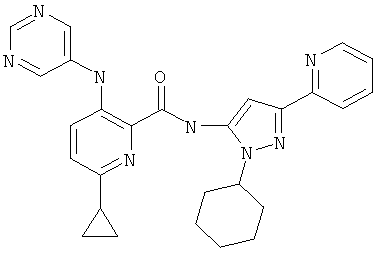
Стадия 1: 2-циклогексил-5-пиридин-2-ил-2Н-пиразол-3-иламин Согласно способу, описанному на стадии 1 примера 10, указанное в заголовке соединение получали из циклогексилгидразина гидрохлорида в виде беловатого твердого вещества с выходом 53%.
MS: М=243,2 (М+Н)+.
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-циклогексил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
К суспензии 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (50 мг; 0,2 ммоль; промежуточное соединение А-5) при кг в атмосфере аргона добавляли 2-циклогексил-5-пиридин-2-ил-2Н-пиразол-3-иламин (47 мг; 0,2 ммоль) и N-этилдиизопропиламин (0,1 мл; 0,6 ммоль). Желтую суспензию охлаждали до 0° и добавляли пропилфосфоновый ангидрид (0,31 мл; 1 ммоль; 50%-ный в AtOEt). Суспензию перемешивали при 0° в течение 30 мин и при кг в течение ночи. Растворитель выпаривали. После хроматографии на силикагеле с использованием градиента CH2Cl2/MeOH получали продукт в виде желтого твердого вещества с выходом 29%.
MS: M=481.3 (M+H)+.
Пример 15. (5-Л6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбонил]-амино}-3-пиридин-2-ил-пиразол-1-ил)-уксусной кислоты этиловый эфир
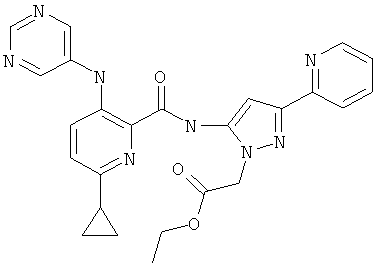
Согласно способу, описанному в примере 14, указанное в заголовке соединение получали в две стадии, исходя из этилгидразиноацетата гидрохлорида (1ая стадия; выход 22%) и промежуточного соединения А-5 (2ая стадия; выход 29%), в виде желтого твердого вещества.
MS: М=485,3 (М+Н)'.
Пример 16. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-морфолин-4-ил-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амид
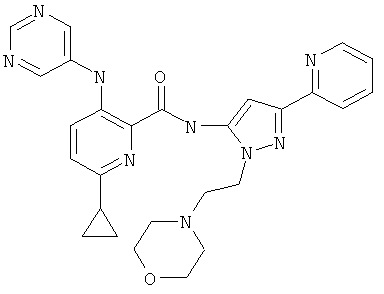
Согласно способу, описанному в примере 14, указанное в заголовке соединение получали в две стадии, исходя из (2-морфолин-4-ил-этил)-гидразина (1ая стадия; выход 23%) и промежуточного соединения А-5 (2ая стадия; выход 14%) в виде бежевого твердого вещества.
MS: М=512,4 (М+Н)+.
Пример 17. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-фенетил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
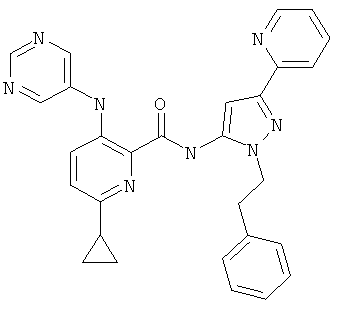
Стадия 1: 2-фенетил-5-пиридин-2-ил-2Н-пиразол-3-иламин К перемешиваемому раствору 3-оксо-3-пиридин-2-ил-пропионитрила (0,46 г; 3,1 ммоль; CAS 54123-21-6) в ЕЮН (10 мл) при кг в атмосфере аргона добавляли триэтиламин (2,6 мл; 18,9 ммоль) и фенелзина сульфат (2,2 г; 9,4 ммоль). Смесь нагревали до температуры дефлегмации и перемешивание продолжали в течение 2 ч. Оранжевый раствор охлаждали до кг. Твердые вещества отфильтровывали. Фильтрат концентрировали, получая оранжевое вязкое масло, которое переносили в EtOAc и промывали водой. Водный слой экстрагировали EtOAc и смесью CH2Cl2/MeOH (9:1). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. После хроматографии на силикагеле с использованием в качестве градиента смеси CH2Cl2/MeOH получали продукт в виде беловатого твердого вещества (0,722 г; 87%).
MS: M=265,1 (М+Н)+.
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-фенетил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
Согласно способу, описанному на стадии 2 примера 14, указанное в заголовке соединение получали из промежуточного соединения А-5 и 2-фенетил-5-пиридин-2-ил-2Н-пиразол-3-иламина в виде светло-желтого твердого вещества с выходом 21%.
MS: М=503,3 (М+Н)+.
Пример 18. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-трет-бутил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
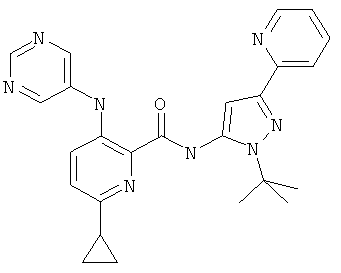
Стадия 1: 2-трет-бутил-5-пиридин-2-ил-2Н-пиразол-3-иламин К перемешиваемому раствору 3-оксо-3-пиридин-2-ил-пропионитрила (0,40 г; 2,7 ммоль; CAS 54123-21-6) при кг в EtOH (10 мл) в атмосфере аргона добавляли триэтиламин (1,1 мл; 8,2 ммоль) и mpem-бутилгидразина гидрохлорид (1,02 г; 8,2 ммоль). Смесь нагревали до температуры дефлегмации и перемешивание продолжали в течение 2 ч. Этот оранжевый раствор охлаждали до кг.Твердые вещества отфильтровывали. Фильтрат концентрировали, получая оранжевое вязкое масло, которое переносили в EtOAc и промывали водой. Водный слой экстрагировали EtOAc и смесью CH2Cl2/MeOH (9:1). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали. После хроматографии на силикагеле с использованием в качестве градиента смеси CH2Cl2/MeOH получали продукт в виде беловатого твердого вещества (0,366 г; 62%).
MS: M=265,1 (М+Н)+.
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-трет-бутил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали из 2-трет-бутил-5-пиридин-2-ил-2Н-пиразол-3-иламина и промежуточного соединения А-2 в виде светло-желтого твердого вещества с выходом 39%.
MS: М=455,3 (М+Н)+.
Пример 19. 6-Этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
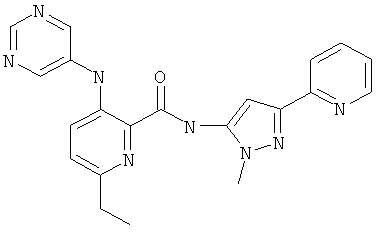
Раствор 2-метил-5-пиридин-2-ил-2H-пиразол-3-иламина (0,1 г; 0,55 ммоль) в диоксане (5 мл) охлаждали в атмосфере инертного газа до 0°С, обрабатывали триметилалюминием (0,275 мл; 2 М раствор в гептане) и перемешивали при температуре окружающей среды в течение 2 ч. Добавляли в виде одной порции промежуточное соединение А-6 (0,05 г; 0,18 ммоль) и полученную реакционную смесь нагревали при температуре дефлегмации в течение 24 часов. После охлаждения до температуры окружающей среды растворитель выпаривали. После очистки препаративной HPLC с использованием градиента вода/ацетонитрил и растирания с этилацетатом получали конечный продукт в виде светло-желтого твердого вещества (7 мг; 10%).
MS: M=401.4 (M+H)+.
Пример 20. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-пиридин-2-ил-2-(тетрагидро-пиран-4-ил)-2H-пиразол-3-ил]-амид
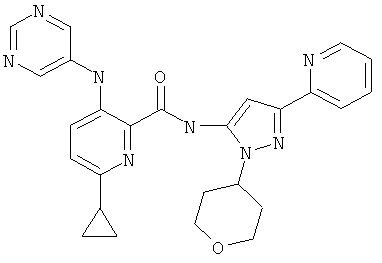
Согласно способу, описанному в примере 14, указанное в заголовке соединение получали в две стадии, исходя из (тетрагидропиран-4-ил)-гидразина гидрохлорида (1ая стадия; выход 10%) и промежуточного соединения А-5 (2ая стадия; выход 11%), в виде желтого твердого вещества.
MS: М=483,2 (М+Н)+.
Пример 21. 6-11иклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
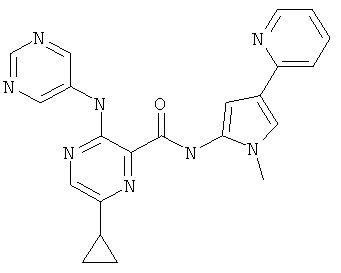
Согласно способу, описанному в примере 19, указанное в заголовке соединение получали, исходя из соединения А-7 и 2-метил-5-пиридин-2-ил-2H-пиразол-3-иламина, после очистки хроматографией на силикагеле и препаративной HPLC в виде желтого твердого вещества с выходом 21%.
MS: M=414.3 (М+Н)+.
Пример 22. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-пиридин-2-ил-2-(2,2,2-трифтор-этил)-2Н-пиразол-3-ил]-амид
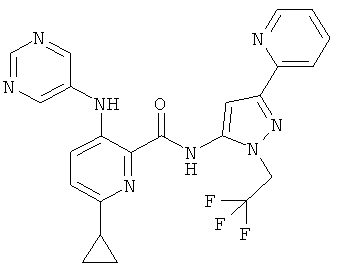
Согласно способу, описанному в примере 10, указанное в заголовке соединение получали в две стадии, исходя из 2,2,2-трифторэтилгидразина (70%-ного водного раствора; 1ая стадия, выход 29%) и промежуточного соединения А-2 (2ая стадия; выход 59%), в виде беловатого твердого вещества.
MS: M=481.2 (M+H)+.
Пример 23. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-пропил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
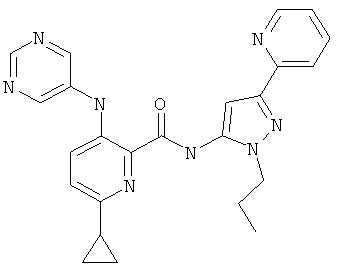
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из оксалата пропилгидразина (1ая стадия; выход 70%) и промежуточного соединения А-5 (2ая стадия; выход 33%), в виде желтого твердого вещества.
MS: М=439,3 (М-Н)-.
Пример 24. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты Г5-(6-хлор-пиридин-2-ил)-2-(2-гидрокси-этил)-2H-пиразол-3-ил]-амид
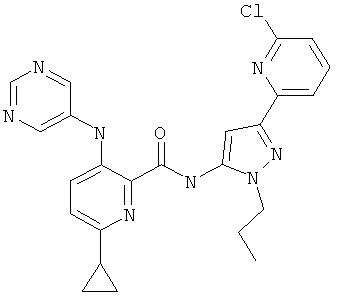
Стадия 1: 3-(6-хлор-пиридин-2-ил)-3-оксо-пропионитрил Суспензию NaH (1,03 г; 26 ммоль; 60%-ую в минеральном масле) в толуоле (30 мл) нагревали до 65°С в атмосфере аргона. Затем по каплям добавляли раствор 6-хлор-пиридин-2-карбоновой кислоты метилового эфира (4,4 г; 26 ммоль) и ацетонитрила (1,33 мл; 26 ммоль) в толуоле (20 мл; нагревание было необходимо для растворения этого сложного эфира) (экзотермический процесс) и смесь перемешивали при 65°С в течение 24 ч (плотная суспензия). После охлаждения до кг добавляли при перемешивании ледяную воду. Водную фазу собирали, промывали Et2O, нейтрализовали HCI, экстрагировали CHsClz, сушили над MgSO4, фильтровали и упаривали. После хроматографии на силикагеле с использованием градиента CH2Cl2/MeOH получали продукт (2,04 г; 40%) в виде коричневого твердого вещества.
MS: M=181,2 (M+H)+.
Стадия 2: 2-[5-амино-3-(6-хлор-пиридин-2-ил)-пиразол-1-ил]-этанол
Согласно способу, описанному на стадии 1 примера 10, указанное в заголовке соединение получали из 3-(6-хлор-пиридин-2-ил)-3-оксо-пропионитрила и 2-гидроксиэтил-гидразина в виде светло-коричневого твердого вещества с выходом 64%.
MS: М=239,0 (М+Н)+
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(6-хлор-пиридин-2-ил)-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-амид
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали из промежуточного соединения А-2 и 2-[5-амино-3-(6-хлор-пиридин-2-ил)-пиразол-1-ил]-этанола в виде желтого твердого вещества с выходом 8%.
MS: M=477.15 (М+Н)+.
Пример 25. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-хинолин-2-ил-2^-пиразол-3-ил1-амид
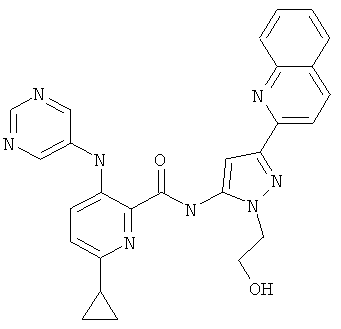
Стадия 1: 2-(5-амино-3-хинолин-2-ил-пиразол-1-ил)-этанол Согласно способам, описанным на стадии 1 и 2 примера 24, указанное в заголовке соединение получали из хинолин-2-карбоновой кислоты метилового эфира (1ая стадия; выход 43%) и 2-гидроксиэтил-гидразина (2ая стадия; выход 42%) в виде беловатого твердого вещества.
MS: М=255,2 (М+Н)+.
Стадия 2: 2-[5-амино-3-(6-хлор-пиридин-2-ил)-пиразол-1-ил]-этанол Согласно способу, описанному на стадии 2 примера 14, указанное в заголовке соединение получали из промежуточного соединения А-5 и 2-(5-амино-3-хинолин-2-ил-пиразол-1-ил)-этанола с выходом 5% в виде желтого твердого вещества.
MS: M=493,2 (М+Н)+.
Пример 26. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(5-хлор-пиридин-2-ил)-2-(2-гидрокси-этил)-2H-пиразол-3-ил]-амид
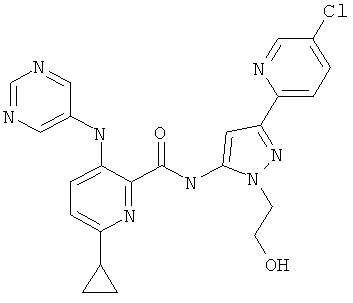
Согласно способам, описанным в примере 24, указанное в заголовке соединение получали из 5-хлор-пиридин-2-карбоновой кислоты метилового эфира (1ая стадия; выход 13%), 2-гидроксиэтил-гидразина (2ая стадия; выход 64%) и промежуточного соединения А-5 (3ая стадия; выход 23%) в виде беловатого твердого вещества.
MS: М=477.15 (М+Н)+.
Пример 27. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-изопропил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
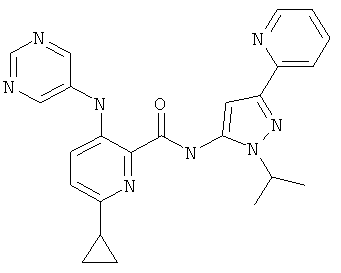
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из изопропилгидразина гидрохлорида (1ая стадия; выход 76%) и промежуточного соединения А-5 (2ая стадия; выход 22%), в виде желтого твердого вещества.
MS: M=441.3 (M+H)+.
Пример 28. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-изобутил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
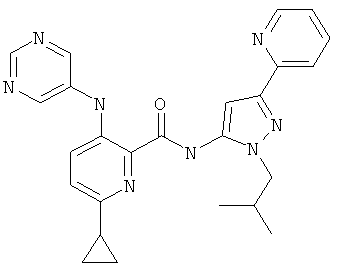
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из 2-метилпропилгидразина гидрохлорида (1ая стадия; выход 61%) и промежуточного соединения А-5 (2ая стадия; выход 26%), в виде желтого твердого вещества.
MS: М=455,3 (М+Н)+.
Пример 29. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-бензил-5-пиридин-2-ил-2^-пиразол-3-ил)-амид
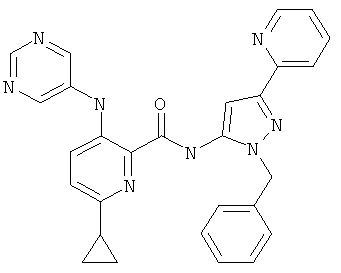
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из бензилгидразина дигидрохлорида (1ая стадия; выход 74%) и промежуточного соединения А-5 (2ая стадия; выход 6%), в виде беловатого твердого вещества.
MS: М=489,4 (М+Н)+.
Пример 30. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-этил-5-пиридин-2-ил-2H-пиразол-3-ил)-амид
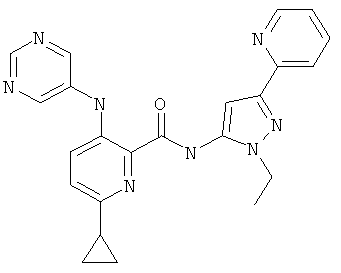
Согласно способу, описанному в примере 18, указанное в заголовке соединение получали в две стадии, исходя из оксалата этилгидразина (1ая стадия) и промежуточного соединения А-2 (2ая стадия), в виде светло-желтого твердого вещества.
MS: М=427,2 (М+Н)+.
Пример 31.6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-циклопентилметил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
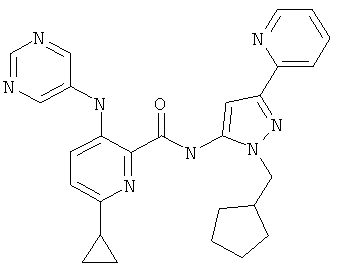
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из 1-(циклопентилметил)гидразина дигидрохлорида (1ая стадия; выход 33%) и промежуточного соединения А-5 (2ая стадия; выход 8%), в виде желтого твердого вещества.
MS: M=481.3 (M+H)+.
Пример 32. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-циклогексилметил-5-пиридин-2-ил-2H-пиразол-3-ил)-амид
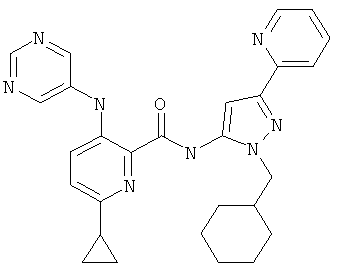
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из 1-(циклогексилметил)гидразина дигидрохлорида (1ая стадия; выход 53%) и промежуточного соединения А-5 (2ая стадия; выход 28%), в виде желтого твердого вещества.
MS: М=495,3 (М+Н)+.
Пример 33. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-циано-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амид
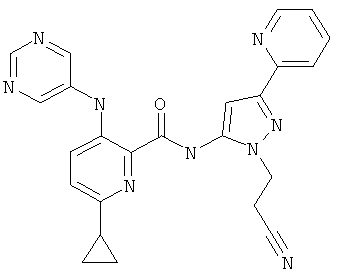
Согласно способу, описанному в примере 14, указанное в заголовке соединение получали в две стадии, исходя из 2-цианоэтилгидразина (1ая стадия; выход 55%) и промежуточного соединения А-5 (2ая стадия; выход 26%), в виде желтого твердого вещества.
MS: М=452,3 (М+Н)+.
Пример 34. 6-Этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амид
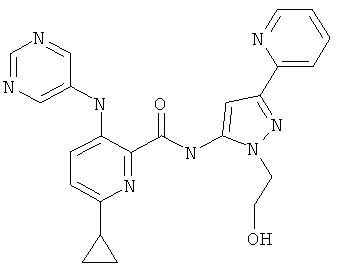
К раствору промежуточного соединения А-14 (50 мг; 0,2 ммоль) в DMF (2 мл) добавляли TBTU (75 мг; 0,23 ммоль), N,N-диизопропилэтиламин (174 мкл; 1,0 ммоль) и 2-(5-амино-3-пиридин-2-ил-пиразол-1-ил)-этанол (46 мг; 0,23 ммоль; см. пример 10, стадия 1). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи, распределяли между этилацетатом и водой и экстрагировали. Объединенные органические фазы промывали водой и рассолом, сушили и упаривали. Полученный остаток растворяли в этилацетате, промывали водным 10%-ным бисульфатом калия, водой и рассолом и объединенные органические фазы сушили и упаривали. После очистки хроматографией на силикагеле с использованием градиента гептан/этилацетат получали конечный продукт в виде светло-желтого твердого вещества (8 мг; 9%).
MS: M=431,3 (M+H)+.
Пример 35. 6-Метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
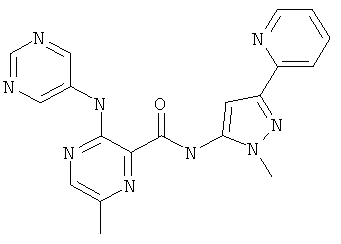
Согласно способу, описанному в примере 34, указанное в заголовке соединение получали, исходя из соединения А-8 и 2-метил-5-пиридин-2-ил-2H-пиразол-3-иламина, после водной обработки в виде выпадающего в осадок желтого вещества без хроматографической очистки с выходом 15%.
MS: М=388,3 (М+Н)+.
Пример 36. 6-Метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты [2-(2-гидрокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амид
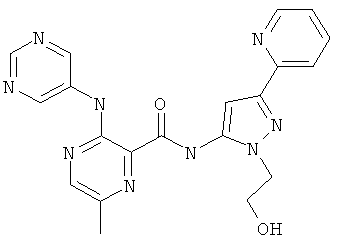
Согласно способу, описанному в примере 34, указанное в заголовке соединение получали, исходя из соединения А-8 и 2-(5-амино-3-пиридин-2-ил-пиразол-1-ил)-этанола (см. пример 10, стадия 1), после очистки препаративной HPLC в виде светло-желтого твердого вещества с выходом 9%.
MS: M=418,4 (М+Н)+.
Пример 37. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(3-метил-3Н-имидазол-4-илметил)-5-пиридин-2-ил-2^-пиразол-3-ил]-амид
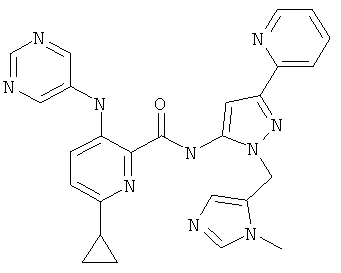
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из (3-метил-3Н-имидазол-4-илметил)-гидразина дигидрохлорида (1ая стадия; выход 67%) и промежуточного соединения А-5 (2ая стадия; выход 15%), в виде светло-желтого твердого вещества.
MS: М=493,4 (М+Н)+.
Пример 38. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-метокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амид
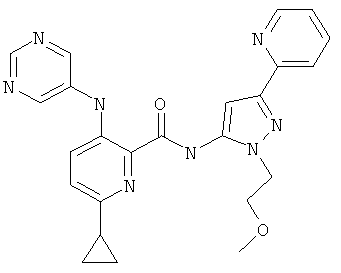
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из 2-(метоксиэтил)гидразина дигидрохлорида (1ая стадия; выход 73%) и промежуточного соединения А-5 (2ая стадия; выход 28%), в виде желтого твердого вещества.
MS: М=457,3 (М+Н)+.
Пример 39. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(5-хлор-пиридин-2-ил)-2-метил-2H-пиразол-3-ил]-амид
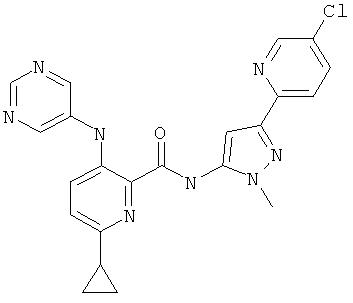
Согласно способам, описанным в примере 24, указанное в заголовке соединение получали из 5-хлор-пиридин-2-карбоновой кислоты метилового эфира (1ая стадия; выход 13%), метилгидразина (2ая стадия; выход 75%) и промежуточного соединения А-2 (3я стадия; выход 15%) в виде желтого твердого вещества.
MS: М=447,3 (М+Н)+.
Пример 40. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-хинолин-2-ил-2Н-пиразол-3-ил)-амид
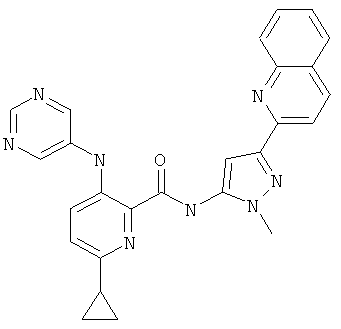
Согласно способам, описанным в примере 25, указанное в заголовке соединение получали из хинолин-2-карбоновой кислоты метилового эфира (1ая стадия; выход 43%), метилгидразина (2ая стадия; выход 83%) и промежуточного соединения А-5 (3я стадия; выход 47%) в виде желтого твердого вещества.
MS: М=463,3 (М+Н)+.
Пример 41. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(6-хлор-пиридин-2-ил)-2-метил-2H-пиразол-3-ил]-амид
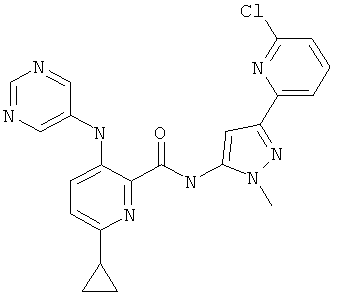
Согласно способам, описанным в примере 24, указанное в заголовке соединение получали из 6-хлор-пиридин-2-карбоновой кислоты метилового эфира (1ая стадия; выход 40%), метилгидразина (2ая стадия; выход 68%) и промежуточного соединения А-2 (3я стадия; выход 25%) в виде желтого твердого вещества.
MS: М=447,3 (М+Н)+.
Пример 42. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [1-(2-диметиламино-этил)-5-пиридин-2-ил-1Н-пиразол-3-ил]-амид
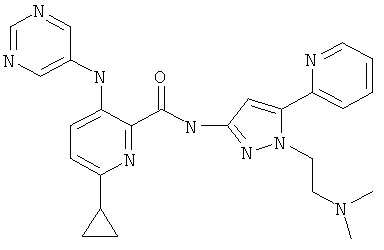
Указанное в заголовке соединение выделяли хроматографией на силикагеле в виде минорного побочного продукта на последней стадии получения 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [2-(2-диметил-амино-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида (пример 12).
MS: М=470,3 (М+Н)+.
Пример 43. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты Г2-(1-метил-пиперидин-4-ил)-5-пиридин-2-ил-2^-пиразол-3-ил1-амид
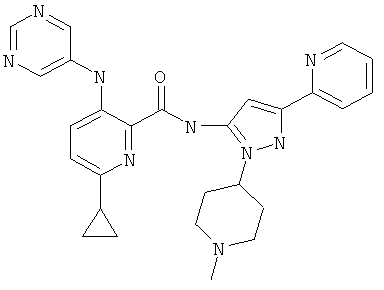
Согласно способу, описанному в примере 17, указанное в заголовке соединение получали в две стадии, исходя из (1-метил-пиперидин-4-ил)-гидразина дигидрохлорида (1ая стадия; выход 68%) и промежуточного соединения А-5 (2ая стадия; выход 6%), в виде желтого твердого вещества.
MS: М=496,3 (М+Н)+.
Пример 44. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(4-метокси-фенил)-[1,3,4] тиадиазол-2-ил]-амид
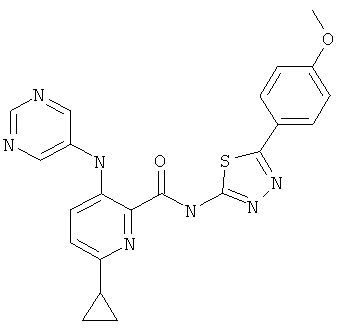
К раствору промежуточного соединения А-2 (50 мг; 0,2 ммоль) и 5-(4-метокси-фенил)-[1,3,4]тиадиазол-2-иламина (73 мг; 0,4 ммоль) в диоксане (1,5 мл) в атмосфере инертного газа добавляли триметилалюминий (0,176 мл; 2 М раствор в гептане). Полученную реакционную смесь нагревали при температуре дефлегмации в течение ночи. После очистки препаративной HPLC с использованием градиента вода/ацетонитрил получали конечный продукт в виде желтого твердого вещества (4 мг; 5%).
MS: M=446,1 (М+Н)+.
Пример 45. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [5-(4-фтор-фенил)-[1,3,4] тиадиазол-2-ил]-амид
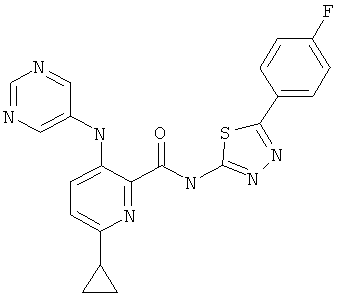
Согласно способу, описанному в примере 44, указанное в заголовке соединение получали, исходя из соединения А-2 и 5-(4-фторфенил)-[1,3,4]тиадиазол-2-иламина, после очистки препаративной HPLC в виде желтого твердого вещества с выходом 17%.
MS: М=434,3 (М+Н)+.
Пример 46. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (3-фенил-изоксазол-5-ил)-амид
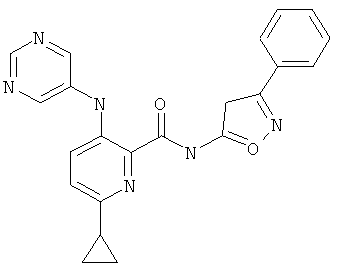
Согласно способу, описанному в примере 44, указанное в заголовке соединение получали, исходя из соединения А-2 и 3-фенил-изоксазол-5-иламина, после очистки препаративной HPLC в виде желтого твердого вещества с выходом 22%.
MS: М=399,2 (М+Н)+.
Пример 47. 6-11иклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-фенил-изоксазол-3-ил)-амид
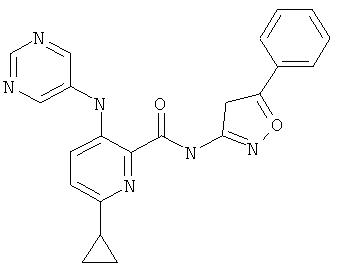
Стадия 1: 5-фенил-изоксазол-3-иламин
Этот амин получали или из бензоилацетонитрила, или из фенилпропиолонитрила, которые являются имеющимися в продаже исходными веществами, в соответствии с известными из литературы методиками (Heterocycles 1991, 32 (6), 1153; J. Chem. Soc., Perkin Trans. 1, 1984 (5), 1079; Chem. Pharm. Bull. 1966, 14 (11), 1277) в виде твердого вещества.
MS: N=163,3 (M+H)+.
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-сренил-изоксазол-3-ил)-амид
Согласно способу, описанному в примере 44, указанное в заголовке соединение получали, исходя из соединения А-2 и 5-фенил-изоксазол-3-иламина, после очистки препаративной HPLC в виде желтого твердого вещества с выходом 9%.
MS: M=399,2 (М+Н)+.
Пример 48. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-фенил-[1,3,4] тиадиазол-2-ил)-амид
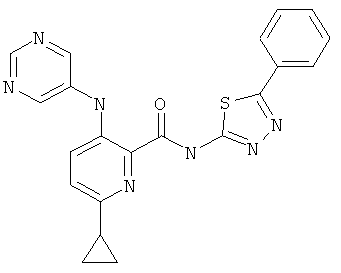
К раствору промежуточного соединения А-5 (42 мг; 0,16 ммоль) в DMF (2 мл) добавляли TBTU (60 мг; 0,18 ммоль), N,N-диизопропилэтиламин (139 мкл; 0,8 ммоль) и 5-фенил-[1,3,4]тиадиазол-2-иламин (32 мг; 0,18 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Конечный продукт получали после очистки препаративной HPLC, используя градиент вода/ацетонитрил, в виде желтого твердого вещества (12 мг; 17%).
MS: М=416,3 (М+Н)+.
Пример 49. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-пиразин-2-ил-[1,3,4]тиадиазол-2-ил)-амид
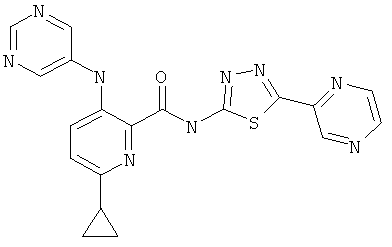
Согласно способу, описанному в примере 48, указанное в заголовке соединение получали, исходя из соединения А-5 и 5-пиразин-2-ил-[1,3,4]тиадиазол-2-иламина, после очистки препаративной HPLC в виде желтого твердого вещества с выходом 18%.
MS: М=418,3 (М+Н)+.
Пример 50. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-пиридин-2-ил-тиофен-2-ил)-амид
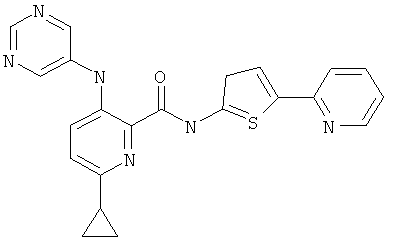
Стадия 1: 5-пиридин-2-ил-тиофен-2-иламин
Этот амин получали, исходя из имеющейся в продаже 5-пиридин-2-ил-тиофен-2-карбоновой кислоты, в соответствии с WO 2007/058942 в виде твердого вещества с выходом 27% для двухстадийной методики.
MS: M=177,2 (M+H)+.
Стадия 2: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-пиридин-2-ил-тиофен-2-ил)-амид
Согласно способу, описанному в примере 44, указанное в заголовке соединение получали, исходя из соединения А-2 и 5-пиридин-2-ил-тиофен-2-иламина, после очистки препаративной HPLC в виде твердого вещества с выходом 38%.
MS: М=415,3 (М+Н)+.
Пример 51. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (3-пиридин-2-ил-изоксазол-5-ил)-амид
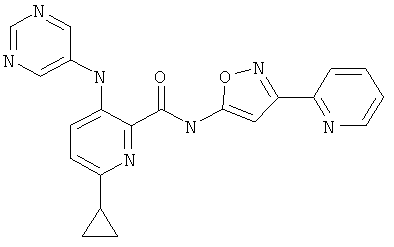
Согласно способу, описанному в примере 44, указанное в заголовке соединение получали, исходя из соединения А-2 и 3-пиридин-2-ил-изоксазол-5-иламина, после очистки препаративной HPLC в виде твердого вещества с выходом 24%.
MS: М=400,2 (М+Н)+.
Пример 52. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-2-ил-1H-имидазол-4-ил)-амид
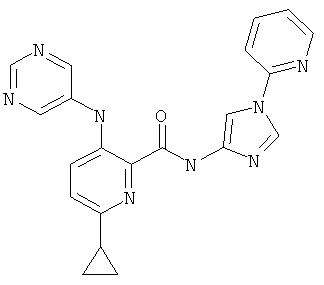
Стадия 1: 2-(4-нитро-имидазол-1-ил)-пиридин
Суспензию 4-нитро-1Н-имидазола (0,5 г; 4,4 ммоль) в DMF (15 мл) охлаждали до 0°С и обрабатывали гидридом натрия (0,23 г; 5,3 ммоль). Перемешивание продолжали при 0°С в течение 1 ч и затем охлаждали до -30°С. В течение 5 мин добавляли раствор трифлата N-фторпиридиния (0,55 г; 2,2 ммоль) в DMF (10 мл). После нагревания до температуры окружающей среды реакционную смесь перемешивали при этой температуре в течение ночи. Неочищенный продукт получали после экстракции этилацетатом (2×100 мл), промывки объединенных органических фаз 10%-ным водным раствором бисульфата калия, водой и рассолом и заключительной сушки и выпаривания растворителя. Это беловатое твердое вещество (0,33 г; 39%) использовали без какой-либо дополнительной очистки на следующей стадии.
MS: M=191,3 (M+H)+.
Стадия 2: 1-пиридин-2-ил-1Н-имидазол-4-иламин
К раствору 2-(4-нитро-имидазол-1-ил)-пиридина (150 мг; 0,79 ммоль) в THF (12 мл) в атмосфере инертного газа добавляли 10%-ный Pd/C (28 мг; 0,026 ммоль). После вакуумирования реакционный сосуд заполняли водородом и реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Катализатор отфильтровывали, объем растворителя уменьшали и данный амин использовали без какой-либо дополнительной очистки в виде ~0,2 М раствора в THF на следующей стадии.
MS: M=161,0 (M+H)+.
Стадия 3: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-2-ил-1Н-имидазол-4-ил)-амид
Согласно способу, описанному в примере 48, указанное в заголовке соединение получали, исходя из соединения А-5 и 1-пиридин-2-ил-1/-/-имидазол-4-иламина (~0,2 М раствора в THF), после очистки препаративной HPLC в виде светло-желтого твердого вещества с выходом 27%.
MSiM=399,1 (М+Н)".
Пример 53. 2-Изопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
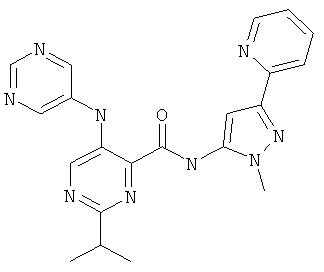
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-9 и 1-метил-3-пиридин-2-ил-1Н-пиразол-5-амина, в виде светло-желтого твердого вещества с выходом 38%.
MS: М=416,2 (М+Н)+.
Пример 54. 2-Циклопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амид
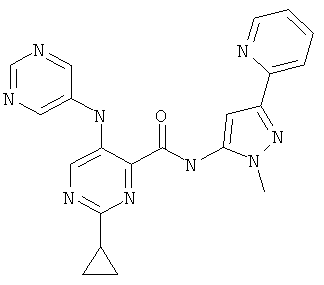
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-10 и 1-метил-3-пиридин-2-ил-1Н-пиразол-5-амина, в виде желтого твердого вещества с выходом 50%.
MS: М=414,2 (М+Н)+.
Пример 55. 2-трепт-Бутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амид
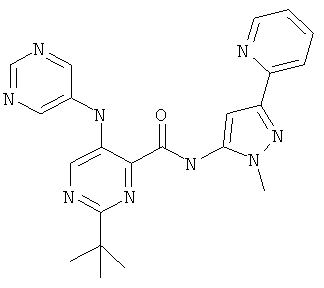
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-11 и 1-метил-3-пиридин-2-ил-1Н-пиразол-5-амина, в виде желтого твердого вещества с выходом 31%.
MS: М=430,3 (М+Н)+.
Пример 56. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [3-(4-хлор-фенил)-изоксазол-5-ил]-амид
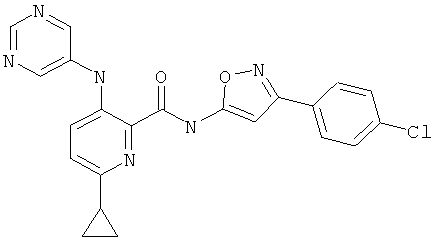
К раствору промежуточного соединения А-5 (30 мг; 0,12 ммоль), HATU (49 мг; 0,13 ммоль) и 3-(4-хлор-фенил)-изоксазол-5-иламина (25 мг; 0,13 ммоль) в THF (1 мл) добавляли N-метилморфолин (65 мкл; 0,6 ммоль). Реакционную смесь перемешивали при температуре дефлегмации в течение ночи. После очистки препаративной HPLC с использованием градиента вода/ацетонитрил получали конечный продукт в виде светло-желтого твердого вещества (11 мг; 23%).
MS: M=433,3 (М+Н)+.
Пример 57. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты [3-(4-бром-фенил)-изоксазол-5-ил]-амид
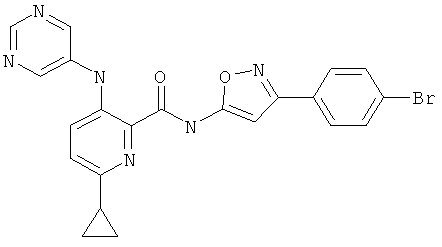
Согласно способу, описанному в примере 56, указанное в заголовке соединение получали, исходя из соединения А-5 и 3-(4-бром-фенил)-изоксазол-5-иламина, после очистки препаративной HPLC в виде светло-желтого твердого вещества с выходом 52%.
MS: M=477,1 (М+Н)+.
Пример 58. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты Г3-(4-сртор-Фенил)-изоксазол-5-ил1-амид
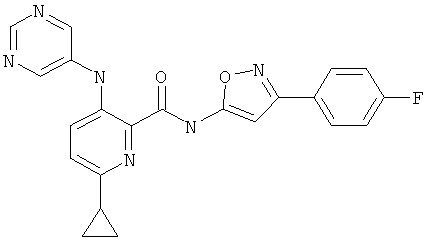
Согласно способу, описанному в примере 56, указанное в заголовке соединение получали, исходя из соединения А-5 и 3-(4-фтор-фенил)-изоксазол-5-иламина, после очистки препаративной HPLC в виде светло-желтого твердого вещества с выходом 14%.
MS: M=417,3 (M+H)+.
Пример 59. 6-Метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
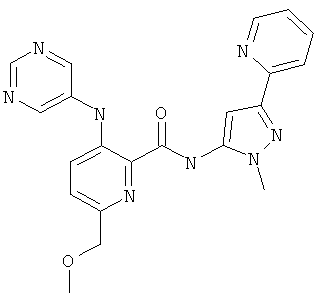
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-3 и 1-метил-3-пиридин-2-ил-1Н-пиразол-5-амина, в виде светло-желтого твердого вещества с выходом 18%.
MS: М=417,2 (М+Н)+.
Пример 60. 2-Циклогексил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амид
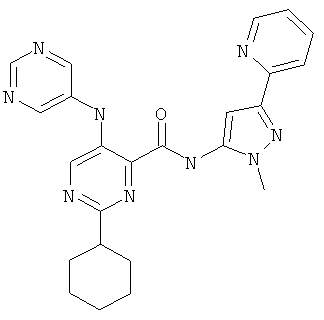
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-12 и 1-метил-3-пиридин-2-ил-1Н-пиразол-5-амина, в виде желтого твердого вещества с выходом 7%.
MS: М=456,3 (М+Н)+.
Пример 61. 2-Изобутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты (2-метил-5-пиридин-2-ил-2^-пиразол-3-ил)-амид
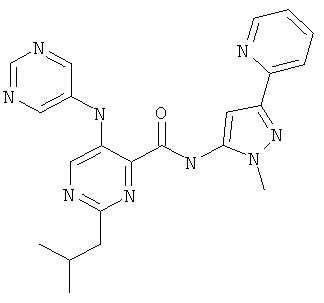
Согласно способу, описанному в примере 1, указанное в заголовке соединение получали, исходя из промежуточного соединения А-13 и 1-метил-3-пиридин-2-ил-1Н-пиразол-5-амина, в виде желтого твердого вещества с выходом 19%.
MS: М=430,3 (М+Н)+.
Пример 62. 6-ииклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-пиридин-2-ил-тиазол-5-ил)-амид
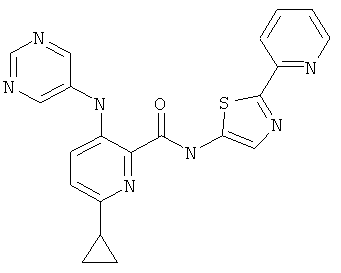
Стадия 1: 2-пиридин-2-ил-тиазол-5-карбоновой кислоты метиловый эфир К суспензии 2-бром-1,3-тиазол-5-карбоновой кислоты метилового эфира (0,5 г; 2,25 ммоль) и Pd(PPh3)4 (0,13 г; 0,11 ммоль) в THF (12,5 мл) в атмосфере инертного газа добавляли бром-(пиридин-2-ил)-цинк (6,75 мл; 0,5 М раствор в THF). Реакционную смесь облучали микроволнами при 120°С в течение 10 мин. Растворитель удаляли и после очистки хроматографией на силикагеле с использованием градиента гептан/этилацетат получали продукт в виде желтых кристаллов (0,34 г; 68%)
MS: M=221,2 (M+H)+.
Стадия 2: 2-пиридин-2-ил-тиазол-5-карбоновая кислота
2-Пиридин-2-ил-тиазол-5-карбоновой кислоты метиловый эфир (0,34 г; 1,55 ммоль) растворяли в смеси THF/метанол (5 мл/1 мл), охлаждали до 0°С и обрабатывали гидроксидом лития (4,7 мл; 1 н. водный раствор). Реакционную смесь оставляли нагреваться до температуры окружающей среды, перемешивали при данной температуре в течение 30 мин и после этого рН подводили до значения ~5. Полученную суспензию обрабатывали дихлорметаном (50 мл) и фильтровали. Осадок промывали водой и дихлорметаном, фильтрат экстрагировали дихлорметаном. Объединенные органические фазы сушили, упаривали и объединяли с осадком, получая продукт в виде светло-коричневого твердого вещества (0,3 г; 92%).
MS: M=161,1 (М-CO2-Н)-.
Стадия 3: (2-пиридин-2-ил-тиазол-5-ил)-карбаминовой кислоты mpem-бутиловый эфир
Раствор 2-пиридин-2-ил-тиазол-5-карбоновой кислоты (250 мг; 1,2 ммоль) в mpem-бутаноле (4,5 мл) обрабатывали дифенилфосфорилазидом (0,4 мл; 1,85 ммоль) и триэтиламином (0,34 мл; 2,4 ммоль) и перемешивали при 90°С в течение 5 ч. Реакционную смесь экстрагировали этилацетатом и объединенные органические фазы промывали насыщенным раствором ацетата аммония, водой и рассолом. После очистки хроматографией на силикагеле с использованием градиента гептан/этилацетат получали конечный продукт в виде желтого масла (180 мг; 54%).
MS: М=278,2 (М+Н)+.
Стадия 4: 2-пиридин-2-ил-тиазол-5-иламин
Раствор (2-пиридин-2-ил-тиазол-5-ил)-карбаминовой кислоты mpem-бутилового эфира (200 мг; 0,72 ммоль) в диоксане (3 мл) обрабатывали 4 М HCl в диоксане (3 мл) и полученную суспензию перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, осадок растворяли в гидроксиде натрия (20 мл; 0,5 М водный раствор) и экстрагировали дихлорметаном. Объединенные органические фазы сушили и растворитель выпаривали, получая продукт в виде оранжевого твердого вещества (78 мг; 60%), которое использовали без какой-либо дополнительной очистки.
MS: M=178,1 (М+Н)+.
Стадия 5: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-пиридин-2-ил-тиазол-5-ил)-амид
К раствору промежуточного соединения А-5 (40 мг; 0,16 ммоль), HATU (66 мг; 0,17 ммоль) и 2-пиридин-2-ил-тиазол-5-иламина (39 мг; 0,22 ммоль) в THF (1,5 мл) добавляли N-метилморфолин (86 мкл; 0,78 ммоль). Реакционную смесь перемешивали при температуре дефлегмации в течение ночи. Полученную суспензию фильтровали и собранное твердое вещество тщательно промывали THF. После сушки осадка получали конечный продукт в виде желтого твердого вещества (40 мг; 61%).
MS: М=416,2 (М+Н)+.
Пример 63. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-метил-5-пиридин-2-ил-1H-пиразол-3-ил)-амид
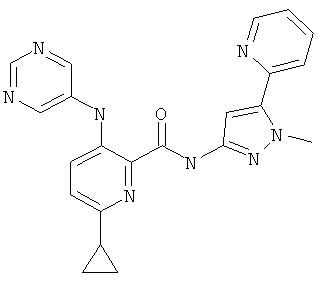
Стадия 1: (7)-4-гидрокси-2-оксо-4-пиридин-2-ил-бут-3-еновой кислоты этиловый эфир
Раствор 2-ацетилпиридина (5,0 г; 40 ммоль) и диэтилоксалата (5,9 г; 40 ммоль) в диэтиловом эфире (75 мл) охлаждали до 0°С и обрабатывали этилатом натрия (16,6 мл; 21%-ный раствор в этаноле). При перемешивании в течение ночи реакционную смесь оставляли медленно нагреваться до температуры окружающей среды. Реакционную смесь подкисляли уксусной кислотой, разбавляли водой и экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали водой и рассолом, сушили и упаривали. Выделенный остаток растирали с гептаном (30 мл) и диэтиловым эфиром (5 мл) в течение 2 ч и полученную суспензию фильтровали для сбора продукта. Этот процесс повторяли для получения продукта в виде светло-коричневого твердого вещества (3,96 г; 44%).
MS: M=220,1 (М-Н)-.
Стадия 2: 1-метил-5-пиридин-2-ил-1Н-пиразол-3-карбоновой кислоты этиловый эфир
К перемешиваемому раствору (Z)-4-гидрокси-2-оксо-4-пиридин-2-ил-бут-3-еновой кислоты этилового эфира (2,32 г; 10 ммоль) при кг в ЕЮН (15 мл) в атмосфере аргона добавляли метилгидразин (0,55 мл; 10 ммоль). Смесь нагревали до температуры дефлегмации и перемешивание продолжали в течение 90 мин. Смесь охлаждали до кг и концентрировали, получая коричневое пастообразное вещество. После хроматографии на силикагеле с использованием градиента CH2Cl2/МеОН получали продукт (1,43 г; 59%) в виде желтого воскообразного твердого вещества.
MS: M=232,1 (М+Н)+.
Стадия 3: 1-метил-5-пиридин-2-ил-1Н-пиразол-3-карбоновая кислота
К перемешиваемому раствору 1-метил-5-пиридин-2-ил-1Н-пиразол-3-карбоновой кислоты сложного этилового эфира (655 мг; 2,8 ммоль) при кг в этаноле (6 мл) в атмосфере аргона добавляли 1 н. NaOH (5,7 мл) в виде одной порции. Смесь перемешивали при кг в течение 5 ч, нейтрализовали, добавляя 1 н. HCl, и концентрировали, получая светло-коричневое твердое вещество. Его растирали в смеси Et2O (10 мл) и EtOH (1 мл). Суспензию перемешивали при кг в течение 2 ч. Твердые вещества собирали фильтрацией, промывали Et2O и сушили, получая указанное в заголовке соединение (0,79 г; выход 100% с чистотой 73%; примесь: NaCl) в виде светло-коричневого твердого вещества.
MS: М=204,2 (М+Н)+.
Стадия 4: (1-метил-5-пиридин-2-ил-1Н-пиразол-3-ил)-карбаминовой кислоты трет-бутиловый эфир
Раствор 1-метил-5-пиридин-2-ил-1Н-пиразол-3-карбоновой кислоты (205 мг; 1,0 ммоль) в mpem-бутаноле (3,8 мл) обрабатывали дифенилфосфорилазидом (225 мкл; 1,0 ммоль) и триэтиламином (280 мкл; 2,0 ммоль) и перемешивали при 90° в течение 24 часов. Поскольку реакция не прошла полностью, добавляли еще один эквивалент дифенилфосфорилазида (225 мкп) и два эквивалента триэтиламина (280 мкл) и перемешивание продолжали при 90С еще в течение 24 часов. Неочищенный продукт очищали хроматографией на силикагеле, используя градиент гептан/этилацетат, и конечный продукт получали в виде беловатого твердого вещества (66 мг; 24%).
MS: M=219,3 (M-C4H8+H)+.
Стадия 5: 1-метил-5-пиридин-2-ил-1Н-пиразол-3-иламин
Раствор (1-метил-5-пиридин-2-ил-1Н-пиразол-3-ил)-карбаминовой кислоты mpem-бутилового эфира (82 мг; 0,30 ммоль) в диоксане (0,85 мл) обрабатывали 4 М HCl в диоксане (0,85 мл) и полученную суспензию перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь экстрагировали этилацетатом, объединенные органические фазы промывали водным раствором бикарбоната натрия и рассолом. Этилацетатную фазу сушили и растворитель выпаривали, получая продукт в виде светло-коричневого вязкого масла (51 мг; 97%), которое использовали без какой-либо дополнительной очистки.
MS: М=175,2 (М+Н)+.
Стадия 6: 6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-метил-5-пиридин-2-ил-1Н-пиразол-3-ил)-амид
Согласно способу, описанному в примере 62, указанное в заголовке соединение получали, исходя из соединения А-5 и 1-метил-5-пиридин-2-ил-1 Н-пиразол-3-иламина, в виде осажденного светло-желтого твердого вещества с выходом 87%.
MS: M=413,3 (M+H)+.
Пример 64. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (5-пиридин-2-ил-[1,3,4]оксадиазол-2-ил)-амид
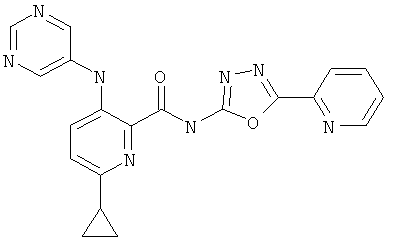
Согласно способу, описанному в примере 62, указанное в заголовке соединение получали, исходя из соединения А-5 и 5-пиридин-2-ил-[1,3,4]оксадиазол-2-иламина, после очистки препаративной HPLC и растирания с этилацетатом в виде светло-коричневого твердого вещества с выходом 17%.
MS: M=401,3 (M+H)+.
Пример 65. 6-Циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (1-пиридин-2-ил-1H-пиразол-4-ил)-амид
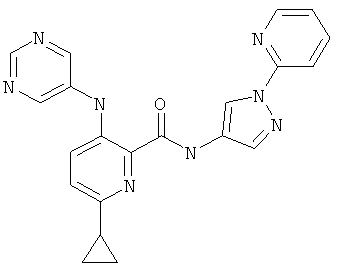
Стадия 1: 1-пиридин-2-ил-1Н-пиразол-4-карбоновой кислоты этиловый эфир
Раствор 1 Н-пиразол-4-карбоновой кислоты сложного этилового эфира (1,25 г; 8,9 ммоль), 2-хлорпиридина (2,02 г; 17,8 ммоль) и карбоната цезия (8,7 г; 26,75 ммоль) в DMF (26,8 мл) облучали микроволнами при 180°С в течение 10 мин. Реакционную смесь экстрагировали диэтиловым эфиром, объединенные органические фазы промывали водой и рассолом. После хроматографии на силикагеле с использованием градиента гептан/этилацетат получали продукт в виде белого твердого вещества (0,81 мг; 42%).
MS: М=218,2 (М+Н)+.
Стадия 2: 1-пиридин-2-ил-1Н-пиразол-4-карбоновая кислота
1-Пиридин-2-ил-1H-пиразол-4-карбоновой кислоты сложный этиловый эфир (0,81 г; 3,73 ммоль) растворяли в смеси THF/этанол (50 мл/10 мл), охлаждали до 0°С и обрабатывали гидроксидом лития (11,2 мл; 1 н. водный раствор). Реакционную смесь оставляли нагреваться до температуры окружающей среды и далее перемешивали при этой температуре в течение 7 ч. Реакционную смесь экстрагировали дихлорметаном (4×100 мл), объединенные органические фазы сушили и упаривали, получая продукт в виде белого твердого вещества (0,68 г; 96%), которое использовали без какой-либо дополнительной очистки.
MS: М=188,2 (М-Н)-.
Стадия 3; (1-пиридин-2-ил-1Н-пиразол-4-ил)-кар6аминовой кислоты сложный mpem-бутиловый эфир
Раствор 1-пиридин-2-ил-1Н-пиразол-4-карбоновой кислоты (200 мг;
1,06 ммоль) в mpem-бутаноле (4,0 мл) обрабатывали дифенилфосфорилазидом (240 мкл; 1,06 ммоль) и триэтиламином (300 мкл; 2,12 ммоль) и перемешивали при 90°С в течение 3 часов. Растворитель удаляли и неочищенный продукт очищали хроматографией на силикагеле с использованием градиента гептан/этилацетат, получая продукт в виде светло-желтого твердого вещества (190 мг; 69%).
MS: M=261,1 (М+Н)+.
Стадия 4: 1-пиридин-2-ил-1Н-пиразол-4-иламин
Раствор (1-пиридин-2-ил-1Н-пиразол-4-ил)-карбаминовой кислоты сложного mpem-бутилового эфира (185 мг; 0,72 ммоль) в диоксане (1,85 мл) обрабатывали 4 М HCl в диоксане (1,85 мл) и полученную суспензию перемешивали при температуре окружающей среды в течение 2 часов. рН реакционной смеси подводили до соответствующих щелочи значений, используя гидроксид натрия (20 мл; 0,5 М водный раствор), и экстрагировали дихлорметаном. Объединенные органические фазы сушили и растворитель выпаривали, получая продукт в виде светло-коричневого твердого вещества (110 мг; 96%), которое использовали без какой-либо дополнительной очистки.
MS: M=161,3 (M+H)+.
Стадия 5: 6-цикпопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты-(1-пиридин-2-ил-1Н-пиразол-4-ил)-амид
Согласно способу, описанному в примере 62, указанное в заголовке соединение получали, исходя из соединения А-5 и 1-пиридин-2-ил-1Н-пиразол-4-иламина в виде осажденного светло-желтого твердого вещества с выходом 24%.
MS: М=399,2 (М+Н)+.
Пример 66. 6-Циклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты (1-пиридин-2-ил-1Я-имидазол-4-ил)-амид
Согласно способу, описанному в примере 62, указанное в заголовке соединение получали, исходя из соединения А-7 и 1-пиридин-2-ил-1Н-имидазол-4-иламина (-0,2 М раствора в THF; пример 52, стадия 2), после очистки препаративной HPLC в виде коричневого твердого вещества с выходом 2%.
MS: M=400,1 (М+Н)+.
Пример А
Таблетки с пленочным покрытием, содержащие приведенные ниже ингредиенты, могут быть изготовлены традиционным способом.
Активный ингредиент просеивают и смешивают с микрокристаллической целлюлозой и смесь гранулируют при добавлении раствора поливинилпирролидона в воде. Гранулят смешивают с натрия крахмала гликолятом и стеаратом магния и прессуют с получением ядер по 120 или 350 мг соответственно. Ядра лакируют водным раствором/водной суспензией указанного выше пленочного покрытия.
Пример В
Капсулы, содержащие приведенные ниже ингредиенты, могут быть изготовлены традиционным способом.
Компоненты просеивают, смешивают и вносят в капсулы размера 2.
Пример С
Растворы для инъекций могут иметь следующий состав. Соединение формулы (I) 3,0 мг Полиэтиленгликоль 400 150,0 мг Уксусная кислота сколько необходимо до рН 5,0 Вода для растворов для инъекций до 1,0 мл
Активный ингредиент растворяют в смеси полиэтиленгликоля 400 и воды для инъекций (в части). Значение рН подводят до 5,0 уксусной кислотой. Объем доводят до 1,0 мл, добавляя оставшееся количество воды. Раствор фильтруют, разливают во флаконы с использованием соответствующего превышения и стерилизуют.
Пример D
Мягкие желатиновые капсулы, содержащие приведенные ниже ингредиенты, могут быть изготовлены традиционным способом.
Содержимое капсулы
Желатиновая капсула
Активный ингредиент растворяют в теплом расплаве других ингредиентов и этой смесью заполняют мягкие желатиновые капсулы соответствующего размера. Заполненные мягкие желатиновые капсулы обрабатывают в соответствии с обычными методиками.
Пример Е
Саше, содержащие приведенные ниже ингредиенты, могут быть изготовлены традиционным способом.
Активный ингредиент смешивают с лактозой, микрокристаллической целлюлозой и натриевой солью карбоксиметилцеллюлозы и гранулируют при добавлении смеси поливинилпирролидона в воде. Гранулят смешивают со стеаратом магния и вкусовыми добавками и вносят в саше.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ N-(ИМИДАЗОПИРИМИДИН-7-ИЛ)-ГЕТЕРОАРИЛАМИДОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE10A | 2011 |
|
RU2562066C2 |
| ПРОИЗВОДНЫЕ ПИРИДИН-2-КАРБОКСАМИДА В КАЧЕСТВЕ АНТАГОНИСТОВ mGluR5 | 2006 |
|
RU2411237C2 |
| АГОНИСТЫ РЕЦЕПТОРА ОКСИТОЦИНА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2014 |
|
RU2664705C2 |
| ПРОИЗВОДНЫЕ ПИРАЗИН-2-КАРБОКСАМИДА В КАЧЕСТВЕ АНТАГОНИСТОВ mGluR5 | 2006 |
|
RU2407739C2 |
| 2-ОКСА-5-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2015 |
|
RU2697651C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛПИРИМИДИНА | 2005 |
|
RU2378277C2 |
| ПРОИЗВОДНЫЕ ЭТИНИЛА | 2010 |
|
RU2553461C2 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛИНОВ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2010 |
|
RU2569887C2 |
| 2-АМИНО-5,5-ДИФТОР-5,6-ДИГИДРО-4Н-ОКСАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ВАСЕ 1 И(ИЛИ) ВАСЕ 2 | 2010 |
|
RU2515221C2 |
| N-ПИРИДИН-3-ИЛ ИЛИ N-ПИРАЗИН-2-ИЛ КАРБОКСАМИДЫ В КАЧЕСТВЕ АГЕНТОВ, ПОВЫШАЮЩИХ УРОВЕНЬ ХОЛЕСТЕРИНА ЛПВП | 2011 |
|
RU2540069C2 |
Изобретение относится к новым азотсодержащим гетероарильным производным формулы (I),
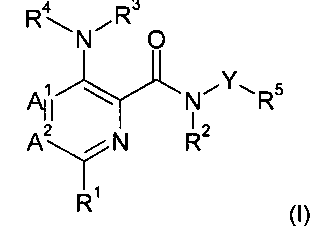
где
А1 и А2 независимо выбраны из группы, состоящей из СН и N, при условии, что А1 и А2 одновременно не представляют собой N; R1 представляет собой C1-С7-алкил, C1-С7-алкокси, C1-С7-алкокси-C1-С7-алкил или циклоалкил; R2 и R3 независимо представляют собой атом водорода или C1-С7-алкил; R4 представляет собой 6-членный гетероарил, содержащий 2 гетероатома, выбранные из N; Y представляет собой 5-членный гетероарил, выбранный из группы, состоящей из:
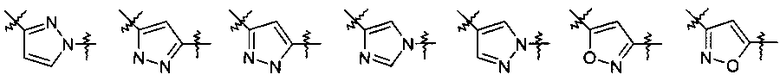
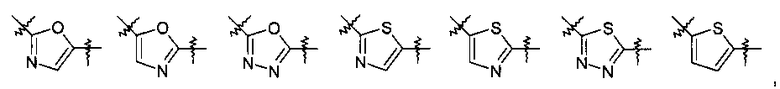
где указанный гетероарил возможно замещен одним заместителем, выбранным из группы, состоящей из C1-С7-алкила, который возможно замещен 1-3 заместителями, выбранными из группы, состоящей из арила, циклоалкила, 6-членного гетероциклила, содержащего 2 гетероатома, выбранные из О и N, C1-С7-алкокси, гидроксила, атома галогена, аминогруппы, возможно замещенной одним или двумя заместителями C1-С7-алкил, из циано и 5-членного гетероарила, содержащего 2 гетероатома, выбранные из N, возможно замещенного 1-3 заместителями, выбранными из C1-С7-алкила, COO-C1-С7-алкила, циклоалкила и 6-членного гетероциклила, содержащего 1 гетероатом, выбранный из O, N, возможно замещенного 1-3 заместителями, выбранными из C1-С7-алкила; и R5 представляет собой фенил или 6- или 10-членный гетероарил, содержащий один или два атома азота, где указанный фенил и указанный гетероарил возможно замещены 1-3 заместителями, выбранными из группы, состоящей из атома галогена, C1-С7-алкокси, или их фармацевтически приемлемые соли. Соединения ингибируют PDE10A (фосфодиэстеразу 10А) и могут быть применены в качестве лекарственных средств. 4 н. и 10 з.п. ф-лы,66 пр., 1 табл.
1. Соединения формулы (I),

где
А1 и А2 независимо выбраны из группы, состоящей из СН и N, при условии, что А1 и А2 одновременно не представляют собой N;
R1 представляет собой C1-С7-алкил, C1-С7-алкокси, C1-С7-алкокси-C1-С7-алкил или циклоалкил;
R2 и R3 независимо представляют собой атом водорода или C1-С7-алкил;
R4 представляет собой 6-членный гетероарил, содержащий 2 гетероатома, выбранные из N;
Y представляет собой 5-членный гетероарил, выбранный из группы, состоящей из:


где указанный гетероарил возможно замещен одним заместителем, выбранным из группы, состоящей из
C1-С7-алкила, который возможно замещен 1-3 заместителями, выбранными из группы, состоящей из арила, циклоалкила, 6-членного гетероциклила, содержащего 2 гетероатома, выбранные из О и N, C1-С7-алкокси, гидроксила, атома галогена, аминогруппы, возможно замещенной одним или двумя заместителями C1-С7-алкил, из циано и 5-членного гетероарила, содержащего 2 гетероатома, выбранные из N, возможно замещенного 1-3 заместителями, выбранными из C1-С7-алкила,
COO-C1-С7-алкила,
циклоалкила и
6-членного гетероциклила, содержащего 1 гетероатом, выбранный из O, N, возможно замещенного 1-3 заместителями, выбранными из C1-С7-алкила; и
R5 представляет собой фенил или 6- или 10-членный гетероарил, содержащий один или два атома азота, где указанный фенил и указанный гетероарил возможно замещены 1-3 заместителями, выбранными из группы, состоящей из атома галогена, C1-С7-алкокси,
или их фармацевтически приемлемые соли.
2. Соединения или их фармацевтически приемлемые соли по п. 1, где R1 представляет собой C1-С7-алкил, циклоалкил или C1-С7-алкокси-C1-С7-алкил.
3. Соединения или их фармацевтически приемлемые соли по п. 1, где R2 и R3 представляют собой атом водорода.
4. Соединения или их фармацевтически приемлемые соли по п. 1, где R4 представляет собой пиримидинил.
5. Соединения или их фармацевтически приемлемые соли по п. 1, где 6- или 10-членный гетероарил представляет собой пиридинил, пиразинил или хинолинил.
6. Соединения или их фармацевтически приемлемые соли по п. 1, где Y выбран из группы, состоящей из:
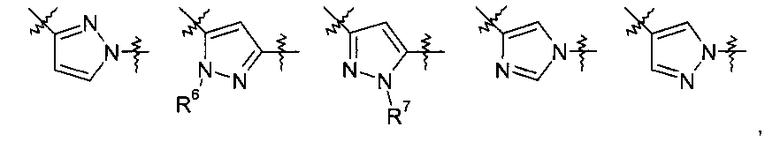
где R6 выбран из группы, состоящей из C1-С7-алкила, который возможно замещен 1-3 заместителями, выбранными из группы, состоящей из арила, циклоалкила, 6-членного гетероциклила, содержащего 2 гетероатома, выбранные из О, N, C1-С7-алкокси, гидроксила, атома галогена, аминогруппы, возможно замещенной одним или двумя заместителями C1-С7-алкил, циано и 5-членного гетероарила, содержащего 2 гетероатома, выбранные из N, возможно замещенного C1-С7-алкилом,
COO-C1-С7-алкила,
циклоалкила и
6-членного гетероциклила, содержащего 1 гетероатом, выбранный из O, N, возможно замещенного 1-3 заместителями, выбранными из группы, состоящей из C1-С7-алкила, и
R7 представляет собой C1-С7-алкил или C1-С7-алкил, замещенный аминогруппой, возможно замещенной одним или двумя заместителями C1-С7-алкил.
7. Соединения или их фармацевтически приемлемые соли по п. 1, где Y выбран из группы, состоящей из:
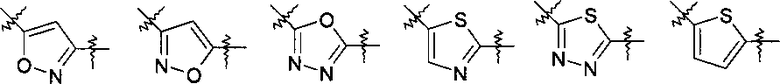
8. Соединения по п. 1, выбранные из группы, состоящей из:
6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(1-фенил-1H-пиразол-3-ил)-амида,
6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[1-(4-фтор-фенил)-1H-пиразол-3-ил]-амида,
6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[1-(2-фтор-фенил)-1H-пиразол-3-ил]-амида,
6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(1-пиридин-2-ил-1H-пиразол-3-ил)-амида,
6-метил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(1-пиридин-4-ил-1H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[1-(4-фтор-фенил)-1H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(1-пиридин-4-ил-1H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-фенил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-диметиламино-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
2-метоксиметил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-циклогексил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
(5-{[6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбонил]-амино}-3-пиридин-2-ил-пиразол-1-ил)-уксусной кислоты этилового эфира,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-морфолин-4-ил-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-фенетил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-трет-бутил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-пиридин-2-ил-2-(тетрагидро-пиран-4-ил)-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-пиридин-2-ил-2-(2,2,2-трифтор-этил)-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-пропил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-(6-хлор-пиридин-2-ил)-2-(2-гидрокси-этил)-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-хинолин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-(5-хлор-пиридин-2-ил)-2-(2-гидрокси-этил)-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-изопропил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-изобутил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-бензил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-этил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-циклопентилметил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-циклогексилметил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-циано-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(3-метил-3H-имидазол-4-илметил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-метокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-(5-хлор-пиридин-2-ил)-2-метил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-метил-5-хинолин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-(6-хлор-пиридин-2-ил)-2-метил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[1-(2-диметиламино-этил)-5-пиридин-2-ил-1H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(1-метил-пиперидин-4-ил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-(4-метокси-фенил)-[1,3,4]тиадиазол-2-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-(4-фтор-фенил)-[1,3,4]тиадиазол-2-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(3-фенил-изоксазол-5-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(5-фенил-изоксазол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(5-фенил-[1,3,4]тиадиазол-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(5-пиразин-2-ил-[1,3,4]тиадиазол-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(5-пиридин-2-ил-тиофен-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(3-пиридин-2-ил-изоксазол-5-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(1-пиридин-2-ил-1H-имидазол-4-ил)-амида,
2-изопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
2-циклопропил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
2-трет-бутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[3-(4-хлор-фенил)-изоксазол-5-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[3-(4-бром-фенил)-изоксазол-5-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[3-(4-фтор-фенил)-изоксазол-5-ил]-амида,
6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
2-циклогексил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
2-изобутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-пиридин-2-ил-тиазол-5-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(1-метил-5-пиридин-2-ил-1H-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(5-пиридин-2-ил-[1,3,4]оксадиазол-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(1-пиридин-2-ил-1H-пиразол-4-ил)-амида и
6-циклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты(1-пиридин-2-ил-1H-имидазол-4-ил)-амида,
или их фармацевтически приемлемых солей.
9. Соединения по п. 1, выбранные из группы, состоящей из:
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[1-(4-фтор-фенил)-1H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-диметиламино-этил)-5-пиридин-2-ил-2Н-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-морфолин-4-ил-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-пиридин-2-ил-2-(тетрагидро-пиран-4-ил)-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты(2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-этил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-метил-3-(пиримидин-5-иламино)-пиразин-2-карбоновой кислоты[2-(2-гидрокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[2-(2-метокси-этил)-5-пиридин-2-ил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты[5-(5-хлор-пиридин-2-ил)-2-метил-2H-пиразол-3-ил]-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(5-пиридин-2-ил-тиофен-2-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(3-пиридин-2-ил-изоксазол-5-ил)-амида,
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(1-пиридин-2-ил-1Н-имидазол-4-ил)-амида,
2-трет-бутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты(2-метил-5-пиридин-2-ил-2Н-пиразол-3-ил)-амида,
6-метоксиметил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида,
2-изобутил-5-(пиримидин-5-иламино)-пиримидин-4-карбоновой кислоты(2-метил-5-пиридин-2-ил-2H-пиразол-3-ил)-амида и
6-циклопропил-3-(пиримидин-5-иламино)-пиридин-2-карбоновой кислоты (2-пиридин-2-ил-тиазол-5-ил)-амида,
или их фармацевтически приемлемых солей.
10. Соединения или их фармацевтически приемлемые соли по любому из пп. 1-9 для применения в качестве терапевтически активных веществ, ингибирующих PDE10A.
11. Соединения или их фармацевтически приемлемые соли по любому из пп. 1-9 для применения в качестве терапевтически активных веществ для лечения и/или профилактики заболеваний, которые модулируются ингибиторами PDE10A (фосфодиэстеразы 10А).
12. Фармацевтические композиции для ингибирования PDE10A, содержащие соединение или его фармацевтически приемлемые соли по любому из пп. 1-9 и фармацевтически приемлемый носитель и/или адъювант.
13. Применение соединений или их фармацевтически приемлемых солей по любому из пп. 1-9 для терапевтического и/или профилактического лечения заболеваний, которые модулируются ингибиторами PDE10A.
14. Применение соединений или их фармацевтически приемлемых солей по любому из пп. 1-9 для изготовления лекарственных средств для терапевтического и/или профилактического лечения заболеваний, которые модулируются ингибиторами PDE10A.
| US2006199960, A1,07.09.2006 | |||
| ПРОИЗВОДНЫЕ БЕНЗОЛА ИЛИ ПИРИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2238264C2 |
Авторы
Даты
2015-08-20—Публикация
2011-01-19—Подача