Изобретение относится к области молекулярной биологии, молекулярной генетики и клеточной биологии и может быть использовано в медицине для разработки новых подходов к терапии различных заболеваний стволовыми клетками.
Стволовые клетки (СК) применяются в клеточной терапии для лечения ряда заболеваний. Известно, что клетки, вводимые в организм с целью терапии, часто массово гибнут под влиянием агрессивной среды больного организма [1-3]. С целью повышения выживаемости МСК предложен метод, получивший название «процедура прекондиционирования СК» [4,5]. Метод предполагает обработку СК стимулирующими факторами, например TNFα [5], LPS [6,7] и лекарственными препаратами [8]. В ряде работ показано, что эффект прекондиционирования основан на стимулировании сигнальных путей, приводящих к активации известного транскрипционного фактора NF-кВ [5-9]. Активация NF-kB приводит к синтезу цитокинов (прежде всего, TNFα [8]), которые увеличивают устойчивость СК к действию различных агрессивных факторов, вызывающих массовую гибель СК. Стволовые клетки, в которых NF-kB предварительно активирован, имеют большие шансы на выживание в организме больного.
Кроме того, в ряде работ показано, что ингибирование р53-сигнального пути в СК способствует повышению жизнеспособности клеток и предотвращает апоптоз стволовых клеток после их трансплантации [14, 15]. Данные литературы позволяют предположить, что активация NF-kB-сигнального пути и ингибирование р53-сигнального пути будет являться безопасным методом повышения эффективности трансплантации СК при терапии в клинике [14].
Один из способов активации NF-kB заключается в использовании лигандов белков семейства TLR. Наиболее часто прибегают к стимуляции в СК рецептора TLR4 (взаимодействует с липополисахаридами, LPS [6, 7]). Таким образом, наиболее близким прототипом изобретения является метод использования в процедуре прекондиционирования LPS - лигандов TLR4 [6, 7]. Недостатком метода является высокая токсичность LPS и способность вызывать воспалительные реакции, в том случае, если вводимый в организм клеточный препарат недостаточно очищен от LPS.
Известно, что NF-kB может быть активирован лигандами рецептора TLR9 (взаимодействует с олигодезоксирибонуклеотидами, которые содержат CpG-последовательность [10]). В литературе не известны примеры использования олигодезоксирибонуклеотидов в процедуре прекондиционирования СК, но содержатся примеры использования олигодезоксирибонуклеотидов (CpG-ODN) в других областях медицины и клеточной биологии [10]. Основным недостатком использования CpG-ODN в терапии является их очень низкая устойчивость к действию экзо- и эндонуклеаз клеток, поэтому синтетические CpG-ODN применяют в очень высоких концентрациях (порядка нескольких тысяч нг/мл [10]), что значительно повышает стоимость лечения.
В основе изобретения лежит использование длинного, двунитевого, CpG-богатого фрагмента ДНК в малых концентрациях (10-50 нг/мл) для проведения процедуры прекондиционирования мезенхимных стволовых клеток с целью повышения их выживаемости при действии агрессивных факторов среды. Фрагмент используемой генетической конструкции длиной ~11 т.п.н. включает CpG- и GC-богатую вставку транскрибируемой области рибосомного повтора человека (область -515 to 5321 (HSU 13369, GeneBank)) и вектор pBR322 (далее «генетическая конструкция»). Нуклеотидная последовательность вставки и вектора указана в приложении 1. Высокое содержание GC-nap в структуре обеспечивает повышенную устойчивость фрагмента к двунитевой фрагментации при действии эндонуклеаз, а 7 CpG-участков в структуре данного фрагмента являются наиболее оптимальными лигандами рецепторов TLR9 человека.
Пример 1. pHRGEE-B стимулирует в жтМСК устойчивость к повреждающему действию этанола.
Мезенхимные стволовые клетки жировой ткани (жтМСК) были получены из коллекции клеток ФГБУ МГНЦ РАМН. От регионального этического комитета получено разрешение на работу с МСК. Использовали культуры клеток 2-4-го пассажа. Клетки культивировали в среде «AmnioMax С_100 (Gibco), AmnioMax Supplement С 100» в СО2 инкубаторе при 37°C. Методом проточной цитометрии показано, что культивируемые МСК содержат маркеры МСК: белки МНС, HLA-ABC+, CD44+, CD54 (low), CD90+, CD106+, CD29+, CD49b (low), CD105+и не содержат маркеров CD34-, CD45-, HLA-DR-, CD117.
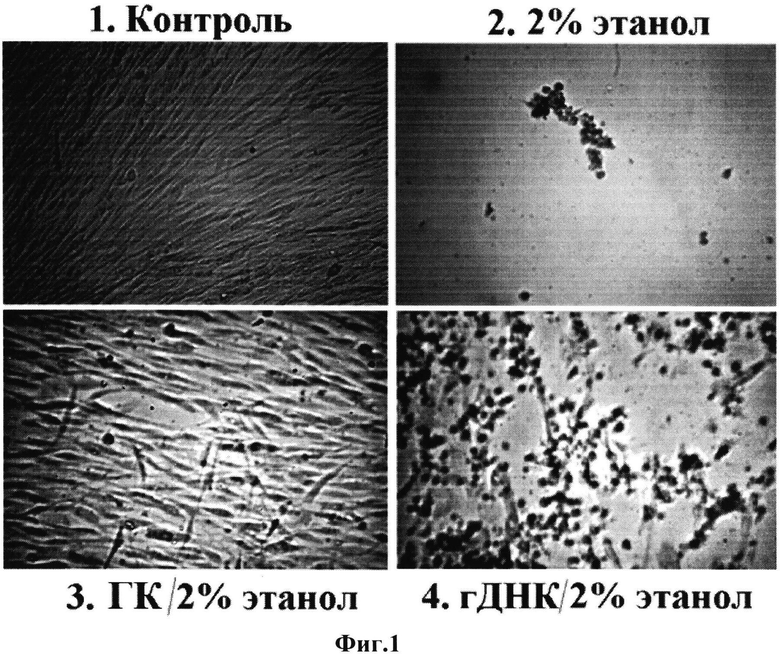
Стволовые клетки обладают чувствительностью к действию этилового спирта в концентрации 1% и выше. Спустя трое суток после культивирования жтМСК в присутствии 2% этанола клетки открепляются от носителя, их количество уменьшается и клетки обладают морфологическими признаками апоптотических клеток (фиг. 1). На рисунке изображено влияние генетической конструкции (ГК) на выживаемость МСК в присутствии 2% этилового спирта в среде культивирования. Варианты опыта указаны на рисунке. Пробы ДНК (50 нг/мл) добавляли за 1 час до добавления этанола. Время культивирования клеток в присутствии этанола - 72 часа. Далее клетки фотографировали, используя микроскоп с фазовым контрастом (увеличение 20). При пересеве такой культуры в среде, не содержащей этанол, не наблюдалось роста клеток. Если в среду культивирования одновременно с 2% этанолом вводили генетическую конструкцию в концентрации 50 нг/мл, то уровень гибели клеток значительно уменьшался, значительная часть клеток продолжала деление. При пересеве такой культуры, уровень пролиферации клеток не отличался от уровня контрольных. Геномная ДНК, в отличие от генетической конструкции, обладала очень слабым цитопротекторным действием.
Пример 2. Генетическая конструкция стимулирует в жтМСК устойчивость к повреждающему действию ионизирующего излучения (адаптивный ответ).
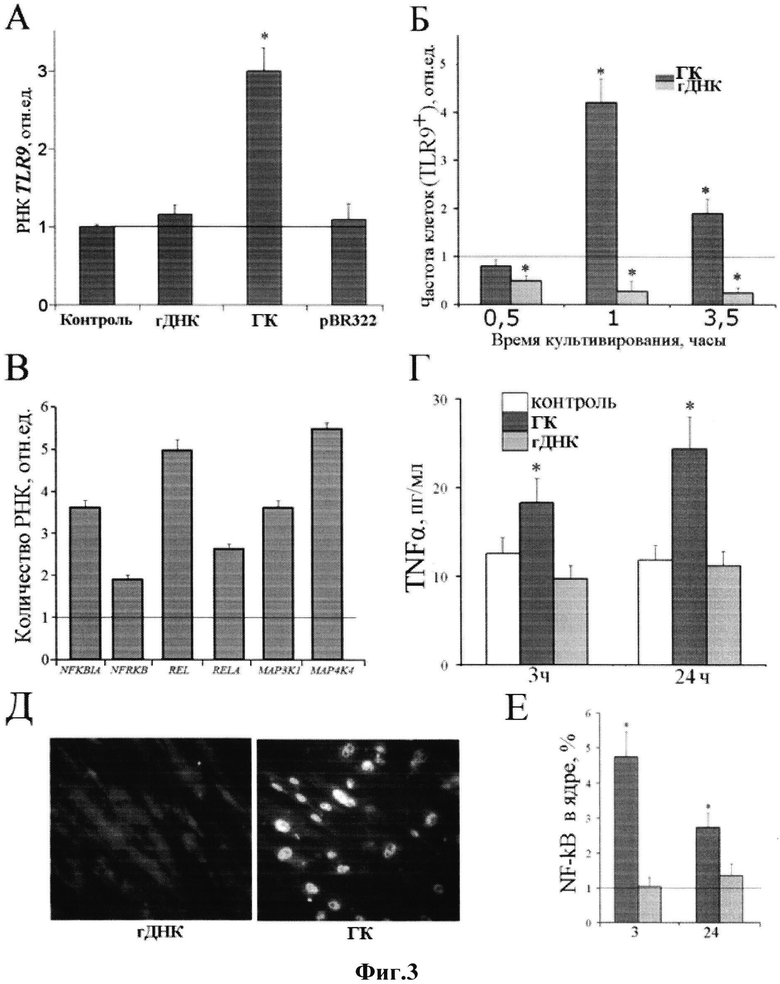
Данное утверждение проиллюстрировано на фиг. 2.
А, Б - Определение двунитевых разрывов хроматина с использованием антител к фосфорилированной форме гистона Н2АХ методом микроскопии (А) и проточной цитофлуориметрии (Б, обозначена область, содержащая клетки с двунитевыми разрывами хроматина).
В - Количественный анализ содержания клеток фракции R в популяции облученных МСК, которые культивировали 2 часа после облучения. Перед облучением клетки культивировали в присутствии проб ДНК (3 часа, 50 нг/мл среды). ГК - генетическая конструкция. (*) р<0,05.
Г - Влияние гДНК или генетической конструкции (ГК) на выживаемость МСК после облучения в дозе 2 Гр. Клетки сначала культивировали 24 часа в присутствии проб ДНК (50 нг/мл), далее облучали, меняли среду на свежую и культивировали 48 часов. Использовали стандартный МТТ-тест.A(0)i, A(2Гр)i - поглощение производного МТТ в контрольных и облученных клетках. (*) р<0,01.
На жтМСК воздействовали ионизирующим излучением в дозе 2 Гр. Для этого использовали прибор Арина-2 (РФ) - источник гамма излучения, амплитуда напряжения 160 кВ, максимум 60 кВ мощность дозы 0,16 Гр/мин. После этого клетки культивировали в течение суток. Уровень повреждений оценивали по количеству двунитевых разрывов хроматина ядер (фиг. 2А). Двойные разрывы ДНК анализировали с использованием антител к фосфорилированной форме гистона Н2АХ методом проточной цитофлуориметрии (фиг. 2Б и В)
На фиг. 2Б приводится зависимость флуоресценции клеток, меченых флуорохромированными антителами к Н2АХ, от содержания ДНК в клетках, окрашенных дополнительно пропидий йодидом. Обозначена зона R, которая содержит клетки с двунитевыми разрывами. Пред облучением клетки культивировали три часа в отсутствие экзогенной ДНК (контроль), в присутствии 50 нг/мл гДНК или. Далее клетки облучали и культивировали еще 2 часа, после чего анализировали уровень двунитевых разрывов, который пропорционален количеству гистона Н2АХ в клетках [11]. После облучения количество контрольных клеток, содержащих двунитевые разрывы, увеличивается в 2 раза. Обработка МСК генетической конструкцией достоверно снижает количества клеток с двунитевыми разрывами, причем размер фракции R уменьшается, даже по сравнению с необлученным контролем.
Был проведен стандартный МТТ-тест на жизнеспособность облученных клеток спустя 48 часов после облучения [12]. Тест проводили в 96-луночном планшете. МТТ окрашивает жизнеспособные клетки с активно функционирующими митохондриями. После облучения уровень окраски снижается на 17%, что соответствует уменьшению количества жизнеспособных клеток на 33%. Геномная ДНК практически не влияла на жизнеспособность облученных клеток. Предварительная обработка клеток генетической конструкцией в концентрации 10-50 нг/мл в течение 24 часов значительно уменьшала токсический эффект от действия ионизирующего излучения в дозе 2 Гр - уровень окраски клеток снижался только на 6% (фиг. 2Г).
Пример 3. Генетическая конструкция в низких концентрациях стимулирует экспрессию генов NF-kB-сигнального пути, обеспечивая устойчивость к повреждающему действию этанола.
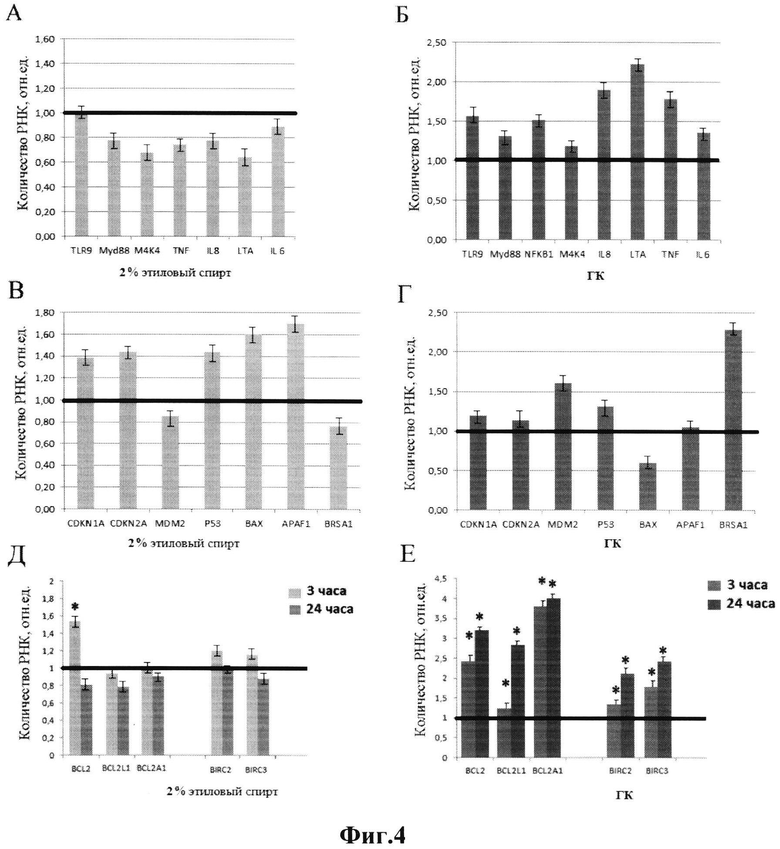
Данное утверждение проиллюстрировано на фиг. 3.
А - генетическая конструкция (ГК) стимулирует экспрессию на уровне РНК гена TLR9 (метод количественной ПЦР). Б - генетическая конструкция (ГК) стимулирует экспрессию белка TLR9 (метод проточной цитофлуориметрии).
В - генетическая конструкция (ГК) стимулирует экспрессию на уровне РНК ряда генов, ассоциированных с активацией транскрипционного фактора NF-kB (метод количественной ПНР). ТВР - ген внутреннего стандарта.

Г - генетическая конструкция (ГК) индуцирует увеличение концентрации TNFα в среде культивирования жтМСК, время культивирования указано по оси X (метод ELISA, использовали наборы «Cytokine» (Санкт-Петербург, РФ).
Д, Е - генетическая конструкция (ГК) стимулирует транслокацию фактора NF-kB в ядро клеток (метод флуоресцентной микроскопии, окраска антителами к р65 компоненте фактора, фирма US Biological, США). Число клеток, содержащих ядерный NF-kB подсчитывали визуально, анализируя 30 видеоизображении (увеличение 20).
Условия: концентрация добавленных проб ДНК (гДНК или генетической конструкции) составляла 10-50 нг/мл среды. Время культивирования - 3 часа (А); 0,5-3,5 часа (Б, Д); 24 часа (В).
(*) р<0,05, сравнение с контролем (статистика Манна-Уитни).
Ранее авторами заявки было показано, что генетическая конструкция в концентрации 50 нг/мл обладает свойством стимулировать транскрипционную активность генов TLR-зависимого сигнального пути и ингибировать апоптоз [13]. В среду культивирования жтМСК добавляли 10-50 нг/мл геномной ДНК человека (гДНК), ДНК вектора pBR322 или генетическую конструкцию. Клетки инкубировали 3 часа, далее из клеток выделяли РНК с использованием набора «Yellow Solve» (Clonogen, Санкт-Петербург). ПЦР в реальном времени проводили на приборе «StepOnePlus instrument (Applied Biosystems)». Использовали праймеры: TLR9 (F:CCCACCTGTCACTCAAGTACA, R:GTGGCTGAAGGTATCGGGATG); TBP (reference gene) (F:GCCCGAAACGCCGAATAT, R: CCGTGGTTCGTGGCTCTCT). Из трех образцов ДНК при низких концентрациях только генетическая конструкция, содержащая фрагмент рибосомного повтора человека, стимулирует 3-кратное увеличение количества PHKTLR9 (фиг. 3А). Экспрессия TLR9 на уровне белка в присутствии гентической конструкции возрастает в 4 раза (фиг. 3Б, метод проточной цитометрии). Геномная тотальная ДНК, напротив, вызывает уменьшение экспрессии белка TLR9.
Стимуляция экспрессии рецептора TLR9 в присутствии генетической конструкции приводит к увеличению экспрессии ряда генов сигнального пути, приводящего к активации транскрипционного фактора NF-kB (фиг. 3В). Активация фактора подтверждается его транслокацией из цитоплазмы в ядра клеток (фиг. 3Д, Е). В результате в среде культивирования умеренно возрастает концентрация цитокина TNFa (фиг. 3Г), который является одним из медиаторов, повышающих устойчивость СК к стрессу [8]. Геномная ДНК и вектор pBR322 в низкой концентрации практически не влияют на уровень TNFα в среде культивирования.
На фиг. 4 показано следующее.
Генетическая конструкция (ГК) на фоне 2% этилового спирта стимулирует экспрессию на уровне РНК ряда генов, ассоциированных с активацией транскрипционного фактора NF-kB (Б), генов р-53- сигнального пути, гена репарации BRCA1 (Г), антиапоптотических генов (Е). Уровень экспрессии генов в МСК при действии 2% этилового спирта (А, В, Д). Метод количественной ПЦР. ТВР - ген внутреннего стандарта. Используемые праймеры:


Условия: концентрация генетической конструкции составляла 50 нг/мл среды. Время культивирования - 24 часа (Б, Г); Д, Е - указано на рисунке.
(*) р<0,05, сравнение с контролем (статистика Манна-Уитни).
При действии 2% этилового спирта большинство генов NF-kB-сигнального пути не повышает или снижает транскрипционную активность по сравнению с контролем (фиг. 4А). При одновременном добавлении генетической конструкции и 2%-ного этилового спирта происходит активация транскрипции многих генов NF-kB-сигнального пути (фиг. 4Б).
2% этиловый спирт активирует транскрипционную активность генов р53-сигнального пути по пути индукции процесса апоптоза в МСК: через 24 часа после добавления к стволовым клеткам 2%-ного этилового спирта увеличивается уровень экспрессии генов CDKN2 и CDKN1A - ингибиторов клеточного цикла, снижается экспрессия гена BRCA1, участвующего в процессах репарации ДНК, на 60-70% повышена экспрессия проапоптотических генов В АХ и APAF1, на 40% повышен уровень экспрессии супрессора опухолевого роста р53, но снижена экспрессия гена MDM2, ингибитора р53 (фиг. 4В). Уровень экспрессии антиапоптотических генов несколько возрастает при действии спирта в течение 3 часов - клетки активируют защитные механизмы, повышая экспрессию антиапоптотических генов, но уже через 24 часа уровень экспрессии генов BCL2, BCL2A1, BCL2L1, BIRC2(c-IAP1) и BIRC3 (с-1АР2) падает ниже контрольного уровня - уровня экспрессии генов в культуре клеток без добавления спирта (фиг. 4Д).
При активации р53-сигнального пути запускаются процессы, задерживающие деление клеток, в результате чего-либо репарируются повреждения ДНК, либо клетка подвергается апоптозу [14]. В присутствии генетической конструкции при культивировании МСК в присутствии спирта, повышается уровень экспрессии гена р53 на 30%, но при этом уровень экспрессии гена MDM2, ингибитора р53, повышается в большей степени - на 60%; незначительно повышен уровень экспрессии генов CDKN2 и CDKN1A, не изменяется уровень экспрессии проапоптотического гена APAF1 и снижен уровень экспрессии гена ВАХ; в 2,3 раза, повышен уровень экспрессии гена BRCA1 (фиг. 4Г).
Генетическая конструкция, добавленная к МСК на фоне спирта и одновременно со спиртом, активирует антиапоптотические процессы в клетках, вызывая повышение экспрессии антиапоптотических генов BCL2, BCL2A1, BCL2L1, BIRC2(c-IAP1) и BIRC3 (с-1АР2) в СК (фиг. 4Д).
Таким образом, р53-сигнальный путь при действии ГЦ-богатой плазмиды активирован в направлении, противоположном, чем при действии спирта - происходит временная остановка клеточного цикла с активацией процессов репарации, при этом не активируются процессы апоптоза.
Список цитируемой литературы
1. Pouzet В, Vilquin JT, Hagege AA et al. Factors affecting functional outcome after autologous skeletal myoblast transplantation. Ann Thorac Surg. 2001; 71: 844-850.
2. Niagara MI, Haider HKh, Jiang S et al. Pharmacologically preconditioned skeletal myoblasts are resistant to oxidative stress and promote angiomyogenesis via release of paracrine factors in the infarcted heart. Circ Res. 2007; 2; 100(4): 545-55.
3. Toma C. Pittenger MF. Cahill KS. et al. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart. Circulation. 2002; 1: 93-98.
4. Haider HKh, Ashraf M. Strategies to promote donor cell survival: combining preconditioning approach with stem cell transplantation. J Mol Cell Cardiol. 2008; 45(4): 554-66.
5. Kim YS, Park HJ, Hong MH et al. TNF-alpha enhances engraftment of mesenchymal stem cells into infarcted myocardium. Front Biosci. 20091; 14: 2845-56.
6. Yao Y, Zhang F, Wang L et al. Lipopolysaccharide preconditioning enhances the efficacy of mesenchymal stem cells transplantation in a rat model of acute myocardial infarction. J Biomed Sci. 2009 Aug 20; 16:74.
7. Wang ZJ, Zhang FM, Wang LS et al. Lipopolysaccharides can protect mesenchymal stem cells (MSCs) from oxidative stress-induced apoptosis and enhance proliferation of MSCs via Toll-like receptor(TLR)-4 and PI3K/Akt. Cell Biol Int. 2009; 33(6): 665-74.
8. Afzal MR, Haider HKh, Idris NM et al. Preconditioning promotes survival and angiomyogenic potential of mesenchymal stem cells in the infarcted heart via NF-kappaB signaling. Antioxid Redox Signal. 2010; 12(6): 693-702.
9. Sarkar FH, Li Y, Wang Z, Kong D. NF-kappaB signaling pathway and its therapeutic implications in human diseases. Int Rev Immunol. 2008; 27(5): 293-319.
10. Akira S, Sato S. Toll-like receptors and their signaling mechanisms. Scand J Infect Dis 2003; 35(9): 555-62.
11. M. Lobrich, A. Shibata, A. Beucher et al. yH2AX foci analysis for monitoring DNA double-strand break repair. Strengths, limitations and optimization. Cell Cycle 2010; 9: 662-669.
12. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983; 65(1-2): 55-63.
13. C.B. Костюк, E.M. Малиновская, A.B. Ермаков и др. Фрагменты внеклеточной ДНК усиливают транскрипционную активность генома мезенхимальных стволовых клеток человека, активируют TLR-зависимый сигнальный путь и ингибируют апоптоз. Биомедицинская химия. 2012; 58(6): 673-683.
14. A. Insinga, A. Cicalese, М. Faretta et al. DNA damage in stem cells activates p.21, inhibits p.53, and induces symmetric self-renewing divisions. Proc Natl Acad Sci USA. 2013; 110(10): 3931-3936.
15. M. Khan, S. Akhtar, S. Mohsin et al. Growth factor preconditioning increases the function of diabetes-impaired mesenchymal stem cells. Stem Cells Dev. 2011; 20(1): 67-75.





| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА рСрG-СytDA/upp ДЛЯ ЭКСПРЕССИ ГИБРИДНОГО БЕЛКА ЦИТОЗИНДЕЗАМИНАЗА-УРАЦИЛФОСФОРИБОЗИЛ ТРАНСФЕРАЗА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА рСрG-СytDA/upp/VP22 ДЛЯ ЭКСПРЕССИИ ГИБРИДНОГО БЕЛКА ЦИТОЗИНДЕЗАМИНАЗА-УРАЦИЛФОСФОРИБОЗИЛ ТРАНСФЕРЕЗА-VP22, ЛЕЧЕБНАЯ КОМПОЗИЦИЯ ДЛЯ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕЕ ПРИМЕНЕНИЯ | 2012 |
|
RU2580220C2 |
| ПРЕПАРАТ СТВОЛОВЫХ КЛЕТОК С РЕПРОГРАММИРОВАННЫМ КЛЕТОЧНЫМ СИГНАЛИНГОМ, СПОСОБ ПОЛУЧЕНИЯ ЭТОГО ПРЕПАРАТА И ЕГО ПРИМЕНЕНИЕ | 2008 |
|
RU2428475C2 |
| Способ увеличения пролиферативного потенциала трехмерных опухолевых клеточных культур | 2021 |
|
RU2782600C1 |
| СПОСОБ ОЦЕНКИ АНГИОГЕННОГО ПОТЕНЦИАЛА ПРОГЕНИТОРНЫХ КЛЕТОК У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ | 2011 |
|
RU2548801C2 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией BDNF для терапии ишемического инсульта | 2023 |
|
RU2829361C1 |
| ПРИМЕНЕНИЕ СТВОЛОВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ МЕЗЕНХИМАЛЬНЫЕ И НЕЙРОНАЛЬНЫЕ МАРКЕРЫ, И ИХ КОМПОЗИЦИЙ ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ (ВАРИАНТЫ) | 2017 |
|
RU2742828C2 |
| СТВОЛОВЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ МЕЗЕНХИМАЛЬНЫЕ И НЕЙРОНАЛЬНЫЕ МАРКЕРЫ, ИХ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2741839C2 |
| КОМПОЗИЦИЯ ДЛЯ УСИЛЕНИЯ ЭКСПРЕССИИ ТРАНСГЕНА В ЭУКАРИОТИЧЕСКИХ КЛЕТКАХ И СПОСОБ УВЕЛИЧЕНИЯ ПРОДУКЦИИ ЦЕЛЕВОГО БЕЛКА, КОДИРУЕМОГО ТРАНСГЕНОМ | 2013 |
|
RU2546249C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КАРДИО-ГЕНЕРАТИВНОГО ПОТЕНЦИАЛА КЛЕТОК МЛЕКОПИТАЮЩИХ | 2010 |
|
RU2624498C2 |
| Генетическая кассета, содержащая кодон-оптимизированные нуклеотидные последовательности генов TRAIL, PTEN и IFNβ-1, и фармацевтическая композиция для лечения онкологических заболеваний | 2020 |
|
RU2757502C1 |
Изобретение относится к области молекулярной биологии, молекулярной генетики и клеточной биологии, в частности к применению ДНК-конструкции для индуцирования в мезенхимных стволовых клетках выраженного адаптивного ответа. Указанная генетическая конструкция включает CpG- и GC-богатую вставку транскрибируемой области рибосомного повтора человека (область от -515 до 5321 (HSU13369, GeneBank)) и вектор pBR322 в низких концентрациях (10-50 нг/мл). Изобретение позволяет повысить устойчивость МСК к действию агрессивных факторов среды. 4 ил., 3 пр.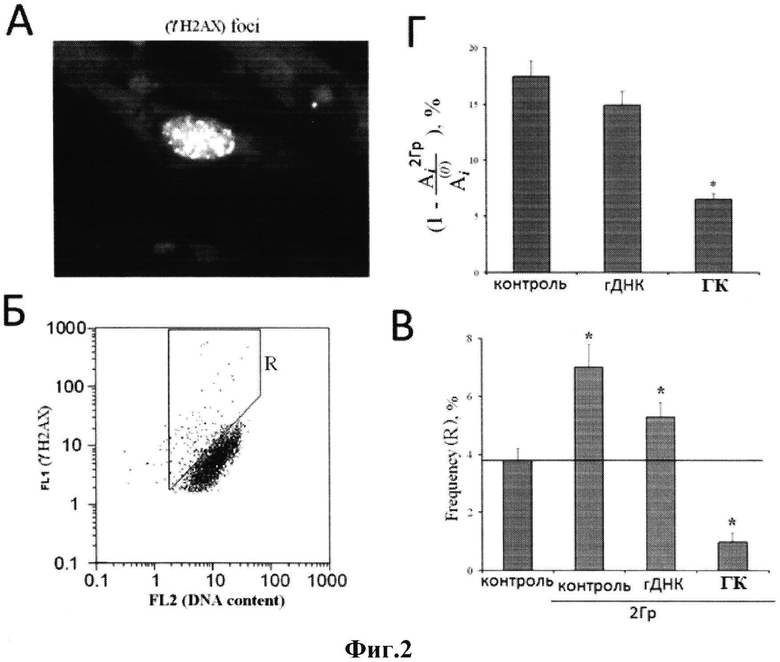
Применение генетической конструкции, включающей CpG- и GC-богатую вставку транскрибируемой области рибосомного повтора человека (область от -515 до 5321 (HSU13369, GeneBank)) и вектор pBR322, в низких концентрациях (10-50 нг/мл) для индуцирования в мезенхимных стволовых клетках выраженного адаптивного ответа, который повышает устойчивость МСК к последующему действию агрессивных факторов среды.
| КОСТЮК С.В | |||
| и др., Фрагменты внеклеточной ДНК усиливают транскрипционную активность генома мезенхимальных стволовых клеток человека, активируют TLR-зависимый сигнальный путь и ингибируют апоптоз, Биомедицинская химия, 2012, т.58, вып.6, стр.673-683 | |||
| ГЛИК Б., ПАСТЕРНАК ДЖ., Молекулярная биотехнология, Принципы и применение, изд | |||
| "Мир", 2002, стр.60. |
Авторы
Даты
2015-08-20—Публикация
2013-10-29—Подача