Область изобретения
Настоящее изобретение связано, по сути, с фармацевтической промышленностью и, в частности, с идентификацией пептидов, полученных из яда скорпиона Rhopalurus junceus, семейства Buthidae, рода Rhopalurus, вида R. junceus, обычное название «красный» скорпион, в котором содержится смесь пептидов, белков, аминокислот и свободных аминов.
Известный уровень техники.
Скорпионы являются сухопутными членистоногими и относятся к ядовитым животным, представляющим старейшую группу, которая первой эволюционировала на Земле. Существует приблизительно более 1500 видов скорпионов, таксономическая классификация которых относит их к Phylum Arthropoda, класс Паукообразные. В естественной среде обитания скорпионов их яд представляет непрозрачную белесоватую жидкость с рН 7,12 и содержит слизь, липиды, углеводы, аминокислоты, неорганические соли, органические молекулы с низкой молекулярной массой и широкий спектр белков с молекулярной массой, колеблющейся от 3 до 90 кДа, представляющих основной компонент. В последнее время исследованиям ядов скорпионов было уделено повышенное внимание в связи с повышенным содержанием в них пептидов, которые продемонстрировали широкий спектр фармакологической активности, в связи с чем они представляют бесценный инструментарий для биомедицинских исследований (Мартин-Оклер М.-Ф., Сегоард М., Рамос К., Цестеле С., Бугис П.Э. и Свенсон Б., «Производство активных специфичных для насекомых нейротоксинов скорпионов в дрожжах.» Евр. Ж. Биохим. 1994; 223; 637-45; Беднарек М.А., Бугианези Р.М., Леонард Р. Дж., Феликс Дж. П. «Химические исследования и исследования структурных функций маргатоксина, мощного ингибитора потенциалозависимого калиевого канала в Т-лимфоцитах человека.» Сообщ. биохим. биофиз. иссл. 28.01.1994; 198(2):619-25.) В связи с этим за последние годы активности этих токсинов и их производных в противовоспалительных компонентах было посвящено значительное количество патентных и беспатентных публикаций (Раджендра В., Армуган А. и Джейясилан К. «Токсины в антиноцицепции и противовоспалении.» Toxicon, июль 2004; 44(1):1-17); болеутоляющие средства (Гуан Р. Дж., Вонг К. Дж., Вонг М. и ВонгД. К. «Депрессантный токсин насекомых с новым болеутоляющим действием из скорпиона Buthus martensii Karsch.» Биохим. биофиз. фонд 2001; 1549(1):9-18), в противоопухолевой терапии (Лю И.Ф., Ма Р.Л., Вонг С.Л., Дуан Ж.И., Жанг Дж.Х., Ву Л.Дж. и Ву К.Ф. Экспрессия противоопухолевого-болеутоляющего пептида из яда китайского скорпиона Buthus martensi Karsch в Escherichia coli. Экспр. очищ. белка 2003; 27(2):253-8; Вонг В. Цз., Цзи И.X. Яд скорпиона индуцирует апоптоз клеток глиомы in vivo и ингибирует опухолевый рост глиомы in vitro. Ж. Нейроонкол. май 2005; 73(1):1-7) и нейродегенеративных заболеваниях (Раджендра В., Армуган А. и Джейясилан К. «Токсины в антиноцицепции и противовоспалении.» Toxicon, июль 2004; 44(1):1-17.) Изобретения, в композиции которых входит тело скорпиона и/или его яд, включают широкий диапазон лекарственных форм, предназначенных для терапии рака. Авторы патентных документов 1993 CN 1073480 и CN 1076858 указывают на то, что ими было получено вино, обеспечивающее противоопухолевую терапию и профилактику, включающее в обоих случаях смесь материалов скорпиона и других растительных и животных материалов.
Скорпионы представляют один из компонентов лекарственных форм в виде таблеток для лечения первичного рака печени (CN 1265901, 2000 и CN 1279088, 2001) и капсул, которые ингибируют рост опухолевых клеток, и могут обеспечивать лечение рака у пациентов (CN 1391941, 2003). В других патентах приводится описание различных лекарственных форм для противоопухолевой терапии (CN 1252321; 2000 CN 1316249, 2001; CN 1399979, 2003).
Также присутствуют патенты по исключительному применению токсинов, полученных из яда скорпиона, которые воздействуют на специфичные типы опухолевых клеток. Ранние работы по токсинам яда скорпиона были посвящены пептиду, полученному из яда желтого скорпиона Leiurus quinquestriatus. Этот токсин, представляющий 4 кДа пептид, получивший наименование хлоротоксин, обладает способностью к связыванию хлоридных каналов, экспрессирующихся в глиомах (первичные опухоли головного мозга из нейроглии (де Бин Дж. А., Маджио Дж. Э., Стрихарц Г.Р. «Очищение и характеризация хлоротоксина, лиганда хлоридного канала из яда скорпиона. Ам. ж. физиол. 1993; 264:361-369.) На основе этих прорывов в 1999 г. Ульрих и соавт. описали в патенте США 5905027 метод диагностики для лечения глиом. Другие работы, в которых за основу было взято специфичное воздействие на определенные клеточные рецепторы в глиомах, показали, что этот токсин является высокоспецифичным маркером для других типов опухолей, клетки которых имеют общее эмбриональное происхождение с клетками центральной нервной системы (ЦНС) (Лайонс С.А., О'Нил Дж., Сонтхаймер X.: «Хлоротоксин, производный из скорпиона пептид, специфично связывается с глиомами и опухолями нейроэктодермального происхождения. GLIA 2002; 39:162-73.) Кроме того, последние работы продемонстрировали, что хлоротоксин не только ингибирует рост глиом «in vitro», но и обладает также способностью предотвращать прорастание и распространение опухолей данного типа в участках мозга, которые не были повреждены, в связи с его специфичным и выборочным взаимодействием с металлопротеиназами, которые представляют собой ферменты, определяющие повышенную инвазивную скорость рака данного типа (Дешейн Дж., Гарнер К.К. и Сонтхаймер X.: «Хлоротоксин ингибирует инвазию глиомных клеток посредством матричной металлопротеиназы-2.» Ж. биол. хим. 2003; 278:4135-44.) В 2004 г. был опубликован другой патент по противоопухолевому воздействию токсина, изолированного из скорпиона Buthus martensis karsh, на привитые животным опухоли (ЕР20020774251).
В некоторых случаях присутствует широкий диапазон лекарственных форм со способностью к лечению или терапии рака у описанных пациентов. Однако эти случаи не доказывают, что данное качество является уникальным для некоторых типов скорпионов и токсинов, используемых при их производстве. С другой стороны, описываемые токсины, полученные от скорпионов Leiurus quinquestriatus, не проявляют противоопухолевой активности в чистом виде, как в случае хлоротоксина и Buthus martensis karsh, в связи с чем они могут быть использованы только для лечения определенных типов опухолей в качестве изолированных токсинов, а не в виде смеси токсинов в цельном яде.
На Кубе присутствует скорпион Rhopalurus junceus, для которого опытным путем в исследованиях было доказано, что разбавленный раствор его яда обладает противоопухолевой активностью. В ходе данной работы раствор вводился домашним животным со спонтанными опухолями и наблюдалось уменьшение размеров и уничтожение опухоли при хорошем показателе выживания (CU 22413 А1). Настоящее изобретение обладает отличительными признаками в том отношении, что на текущий момент отсутствуют знания о фармацевтическом составе для терапии и повышения качества жизни, которые заявлены в настоящем изобретении.
Подробное описание изобретения
Состав и фармакологические свойства яда скорпиона Rhopalurus junceus и/или его производных делают его исключительно ценным лекарственным средством природного происхождения, а его противовоспалительные, болеутоляющие и антиканцерогенные свойства существенно отличают его от других аналогичных продуктов, присутствующих на рынке. Он представляет лекарственное средство полностью природного происхождения, сочетающее высокоэффективные компоненты по борьбе с опухолевыми клетками (пептиды) с другими, которые обеспечивают болеутоляющее и противовоспалительное действие. Кроме того, он оказывает благотворное воздействие посредством индукции апоптоза опухолевых клеток и вследствие его болеутоляющих и противовоспалительных свойств. Данные свойства делают его очень ценным для повышения качества жизни пациентов, страдающих от раковых заболеваний и связанных с ними воспалительных процессов. Было установлено, что состав натурального продукта, полученного в результате настоящего изобретения, включает ряд белков с низкой молекулярной массой, проявляющих антиканцерогенную активность in vitro, активность которых подтверждает потенциальную противоопухолевую активность in vivo.
Одна из целей настоящего изобретения заключается в определении состава и описании присутствующих в яде пептидов, которые представляют активные компоненты, проявляющие противоопухолевую активность. Сводные данные по количественному составу, анализу химического состава, химико-физическим свойствам и фармакологической активности яда скорпиона приведены в таблицах I, II, III, IV, V, VI и VII соответственно.
дозы, 28 суток)
Для определения состава смеси в настоящем изобретении были выполнены следующие процедуры.
- Определение цельных белков с применением модифицированного метода Лоури.
- Анализ химического состава.
- Разделение пептидов на группы с определенной молекулярной массой посредством сепарации жидкостной хроматографией низкого давления с применением колонки с суперозой-12 HR-10/30.
- Электрофорез белков в полиакриламидном геле (ДСН-ПААГ).
- Разделение цельного яда и пептидов посредством жидкостной хроматографии высокого разрешения с применением колонки с обращенной фазой С18.
- Определение УФ-спектров с длинами волн 220 нм и 280 нм.
- Жизнеспособность клеток в нормальных и опухолевых клетках.
- Анализ каждого представляющего интерес пептида с применением масс-спектрометрии.
Согласно результатам испытаний острой и подострой токсичности, выполненным на мышах, продукт настоящего изобретения является нетоксичным.
Исследования, подробно описанные ниже в качестве примеров продукта изобретения, никоим образом не ограничивают область его применения.
Для выполнения экспериментов, приведенных в качестве примеров работы, были отобраны несколько скорпионов, их яд был экстрагирован посредством электрической стимуляции и растворен в надлежащим образом дистиллированной воде. Далее он был подвергнут осветлению путем центрифугирования при 10000 об/мин в течение 15 минут для устранения таких компонентов, как слизь и клеточный детрит. Определение содержания белков в яде выполнялось по методу Лоури, который показал концентрацию 5-15 мг/мл.
Внутрибрюшинный (ВБ) путь введения
Сначала было введено вещество пробы и положительная контрольная проба. Через 30 минут в каждую поверхность внутри и снаружи правого уха животного было введено 10-15 мкл раствора кретонового масла, а левое ухо использовалось в качестве контроля. Через три часа животные были умерщвлены в соответствии с общепринятыми стандартами для данного вида (согласно FELASA), оба уха были рассечены, после чего были взяты круглые пробы диаметром 8 мм путем пробивки и выполнено их взвешивание на аналитических весах.
Местный путь введения
Сначала на внутреннюю и наружную поверхности правого уха животного было нанесено 25-30 мкл раствора кротонового масла, а левое ухо использовалось в качестве контроля. Немедленно после этого было введено вещество пробы. Через три часа животные были умерщвлены в соответствии с общепринятыми стандартами для данного вида (согласно FELASA), оба уха были рассечены, после чего были взяты круглые пробы диаметром 8 мм путем пробивки и выполнено их взвешивание на аналитических весах.
Оральный путь введения
На внутреннюю и наружную поверхности правого уха животного было нанесено 25-30 мкл раствора кротонового масла, а левое ухо использовалось в качестве контроля. Немедленно после этого оральным путем было введено вещество пробы. Через три часа животные были умерщвлены в соответствии с общепринятыми стандартами для данного вида (согласно FELASA), оба уха были рассечены, после чего были взяты круглые пробы диаметром 8 мм путем пробивки и выполнено их взвешивание на аналитических весах.
Местное введение кротонового масла обеспечивает надлежащую модель кожного воспаления для оценки противовоспалительных средств. Активным компонентом кротонового масла является форбол-12-миристат-13-ацетат (ФМА), который представляет собой мощное провоспалительное вещество, накожное применение которого приводит к гистологическим и биохимическим изменениям, включая повышенную сосудистую проницаемость и разрывы сосудов, лейкоцитарную инфильтрацию, активацию протеина С и повышенное высвобождение арахидоновой кислоты и ее метаболитов. Также известно, что ФМА является мощным активатором нейтрофилов, и вызывает обширный и сильный прилив крови в ухо.
ВБ путь введения
ВБ введение доз 1-5 мг/кг массы тела ингибировало опухание, вызванное кротоновым маслом в ушах мышей (таблица VIII), а доза 3 мг/кг была более эффективной, чем ВБ введение подопытным животным 15 мг/кг дексаметазона, поскольку она оказывала повышенное воздействие, ингибирующее воспаление (97% против 60,86%). Доза 5 мг/кг статистически не отличалась (p>0,05) от положительной контрольной пробы (дексаметазон).
Оральный путь введения
Введение 5, 10 и 20 мг яда R. junceus приводит к значительной потере массы уха, связанной с группой отрицательного контроля (таблица IX), однако она не подлежит статистическому сравнению с ингибированием опухоли, индуцированным дексаметазоном, который представляет хорошее стероидное противовоспалительное лекарственное средство, ингибирующее фосфолипазу А2 (фермент, определяющий путь арахидоновой кислоты).
Местный путь введения
Местное введение яда R. junceus привело к снижению размеров ушного отека по сравнению с контрольной группой, как показано в таблице X.
В таблице XI показаны результаты осуществленного исследования. Оральное введение яда R. junceus вызвало слабое ингибирование гранулематозной ткани, которое было определено по сравнению с группой отрицательного контроля, что указывает на активность в пролиферативной фазе воспаления. Две исследованных дозы продукта оказали аналогичное воздействие.
В таблице XII приведены значения массы гранулемы и содержания кармина для различных экспериментальных групп. Токсин снизил массу гранулемы в 1,32 и 2,05 раза по сравнению с контрольной группой (p<0,05) при дозировках 3 и 5 мг/кг соответственно.
Ангиогенез представляет ключевой процесс для роста опухоли и метастазов, так что наличие продуктов, способных к ингибированию данного комплексного процесса, представляет альтернативу для терапии опухолевых заболеваний.
Содержание кармина является индикатором образования новых кровеносных сосудов в гранулеме воздушного мешка. Введение токсина приводило к снижению образования новых кровеносных сосудов в гранулематозной ткани на 39,22% и 69.24% при дозах 3-5 мг/кг (ВБ) соответственно со значительным статистическим расхождением между всеми экспериментальными группами (p<0,001).
В таблице XIII показаны результаты болеутоляющего действия яда R. junceus, введенного внутрибрюшинно в модели судорог, индуцированных 3% уксусной кислотой, у мышей.
Все группы, обработанные различными дозами яда, продемонстрировали значительно сниженные (p<0,05) брюшные сокращения по сравнению с группой отрицательного контроля. Дозы яда 2,5 и 7,5 мг/кг оказали воздействие, аналогичное группе, получавшей аспирин, известное болеутоляющее лекарственное средство. С другой стороны, доза яда R. Junceus 5,0 мг/кг показала повышенное ингибирование (87,74%) по сравнению с показателем, полученным при введении 100 мг/кг аспирина (49,28%).
Введение оральным путем
Как следует из таблицы XIV, все группы, которым вводились различные дозы яда, продемонстрировали заметно более сниженное количество (p<0,05) брюшных сокращений по сравнению с группой отрицательного контроля. Сравнение дозировок яда, использованных в группе положительного контроля (аспирин), продемонстрировало заметный болеутоляющий эффект. Дозы 10, 15 и 20 мг/кг яда R. junceus ингибировали брюшные сокращения аналогично аспирину. В то время как доза 50 мг/кг не обусловливала статистически значимое отличие от положительной контрольной пробы, она обеспечивала 54,78% ингибирования брюшных сокращений у подопытных животных.
- Модель тепловой анальгезии у мышей.
Был использован метод, описанный в журнале Drug Discover.
Использовались мыши OF1 мужского пола массой 20-25 г из Национального центра по подготовке лабораторных животных (CENPALAB).
Животные были помещены на горячую пластину (UGO-Basile), нагреваемую с постоянной температурой 55°С до и после введения вещества пробы. Было измерено время задержки ноцицептивной реакции в форме вылизывания задней лапы или подпрыгивания. Для испытаний были отобраны только те животные, которые показали ноцицептивную реакцию в течение 20 секунд. Отбор завершался по истечении 40 секунд.
После введения физиологического раствора в отрицательную контрольную пробу, 4% кодеина в положительную контрольную пробу и различных дозировок яда R. junceus, через 2-3 часа было измерено время задержки реакции у каждого животного.
В ходе выполнения данной работы была измерена ноцицептивная реакция на тепловой раздражитель у мышей с применением метода горячей пластины, который представляет собой испытание острой болевой чувствительности для определения опиоидной анальгезии, а также некоторых типов значимых гиперболеутоляющих реакций позвоночника. Вещество считается обладающим значительными болеутоляющими свойствами, когда время нормальной реакции животного удваивается при его введении.
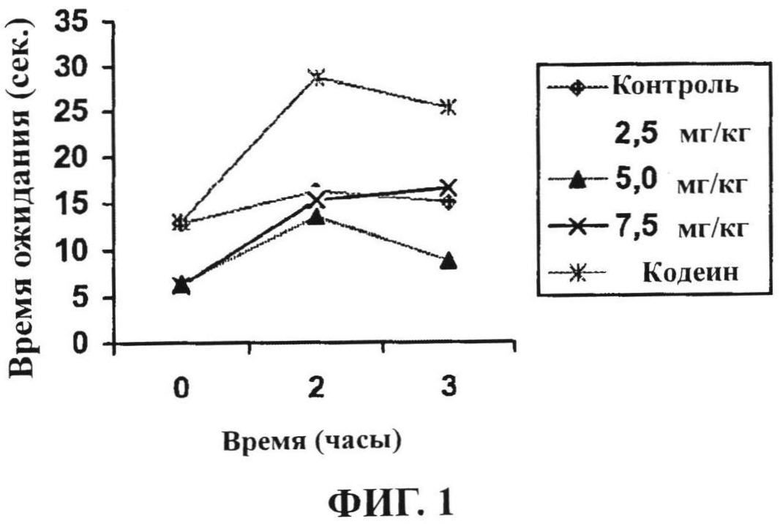
Болеутоляющее воздействие яда R. junceus представлено на фигуре 1 и в таблице XV. Результаты показали, что ВБ введение трех доз продукта существенно снизили термостимулирование на горячей пластине. На фигуре 1 показано, что три дозы яда R. junceus существенно увеличивают периоды задержки ноцицептивной реакции при анализе по методу горячей пластины для мышей.
Ингибирование боли в различных экспериментальных группах показано в таблице XV. Наблюдалось повышенное индуцированное нагревом ингибирование альгезии с максимальным ингибированием через 2 часа после введения. Сильный эффект сохраняется через три часа, и хотя дозы 2,5 и 7,5 мг/кг оказывают аналогичное воздействие на положительную контрольную пробу, повышенная доза определяет более продолжительный эффект, который сильнее, чем для кодеина.
Группы, имеющие, по крайней мере, одну общую букву, статистически не отличаются (p>0,05).
Результаты испытания горячей пластины свидетельствуют о том, что яд R. Junceus оказывает антиноцицептивный эффект на центральную нервную систему, который сильнее, чем на костный мозг, поскольку для реакций вылизывания и подпрыгивания требуется более сильная и комплексная интеграция нейронов.
Различные буквы означают статистическое различие (p<0,05) по сравнению с контрольной пробой.
Различные буквы означают статистическое различие (p<0,05) по сравнению с контрольной пробой.
Однослойные растущие клеточные культуры (раковой опухоли) продемонстрировали значительное ингибирование клеточного роста (p<0,05) и повышенную чувствительность по сравнению с нормальными клетками и опухолевыми клетками, выращенными в суспензии.
Сравнение между CC50 нормальной клеточной линии человека MRC-5 и опухолевыми клетками человека показало, что яд скорпиона R. junceus проявляет различную и существенную цитотоксичность (p<0,05) в опухолевых клетках по сравнению с нормальными клетками (таблица XVIII).
Воздействие яда вызвало значительное ингибирование роста (p<0,05) в опухолевых клеточных линиях человека и мыши в условиях однослойного роста. Опухолевые клеточные линии U937 и S-180 (выращенные в суспензии) продемонстрировали меньшую чувствительность к введению яда; единственный эффект заключался в незначительно сниженном росте (таблица XVIII).
Нормальные клетки, лимфоциты и перитонеальные макрофаги продемонстрировали меньшую чувствительность, чем опухолевые клетки. Значительные токсические эффекты не наблюдались (p>0,05) для полного спектра использованных концентраций (таблица XVIII).
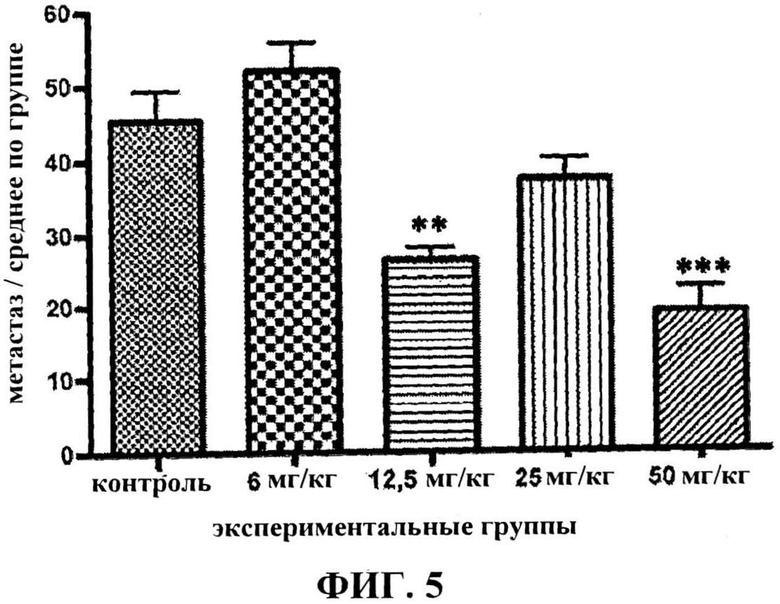
Оценка частоты возникновения легочных метастазов через 50 суток продемонстрировала, что введение яда скорпиона существенно снизило (0,8 мг/кг; 3,2 мг/кг) возникновение спонтанных легочных метастазов (таблица XIX).
Оральный путь введения
Была выполнена оценка воздействия яда скорпиона на модель аденокарциномы молочной железы, привитой мышам Balb/c. Для экспериментальных групп были использованы четыре дозы (6 мг/кг, 12,5 мг/кг, 25 мг/кг и 50 мг/кг). Контрольным подопытным вводился физиологический раствор, и все введения осуществлялись оральным путем в течение 35 суток. Рост опухолей контролировался на протяжении 35 суток.
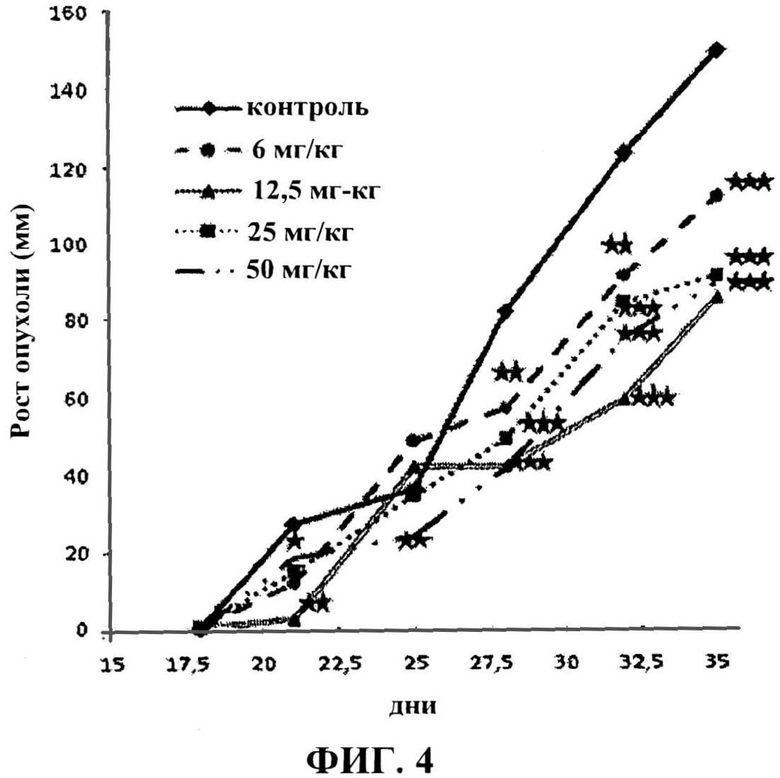
Экспериментальные группы, которым вводился яд скорпиона, продемонстрировали значительное ингибирование роста опухолей (p<0,05) по сравнению с контрольной группой (фигура 4). Экспериментальные группы показали зависимость реакции от дозы на протяжении 35 суток оценки замедления развития опухоли.
Доза 12,5 мг/кг обеспечила наиболее продолжительное среднее время выживания (24 суток), далее доза 25 мг/кг (22,5 суток) и доза 6 мг/кг (20,5 суток), в то время как среднее время выживания контрольных подопытных составляло 20 суток (таблица XXI). Аналогичным образом доза 12,5 мг/кг обеспечила наибольший процент выживания на момент гибели 100% мышей в контрольной группе (таблица XXI), в то время как дозы 6 мг/кг и 25 мг/кг показали 26% и 22% соответственно. Несмотря на данные результаты, более продолжительное время выживания и проценты выживания среди трех экспериментальных групп (6 мг/кг, 12,5 мг/кг и 25 мг/кг) не были статистически значимыми. Доза 50 мг/кг обеспечила значения, аналогичные значениям контрольных подопытных во всех случаях.
Проба антипролиферативной активности фракций, полученная молекулярно-ситовой хроматографией
Воздействие белковых фракций на рост клеток был определен аналогичным образом, как в примере 6. В исследовании были использованы 2 опухолевых клеточных линии: HeLa (рак шейки матки человека) и А549 (рак легких человека) и нормальная клеточная линия MRC-5 (фибробласты легких человека). Окончательная концентрация фракций в лунках составила 9-600 м кг/мл.
Оценка цитотоксичности фракций клеточных линий продемонстрировала замедленный рост опухолевых клеток и низкую токсичность в нормальных клетках фракций LB-03 и LB-04. В таблице XXII приведены CC50 для каждой из фракций очистки.
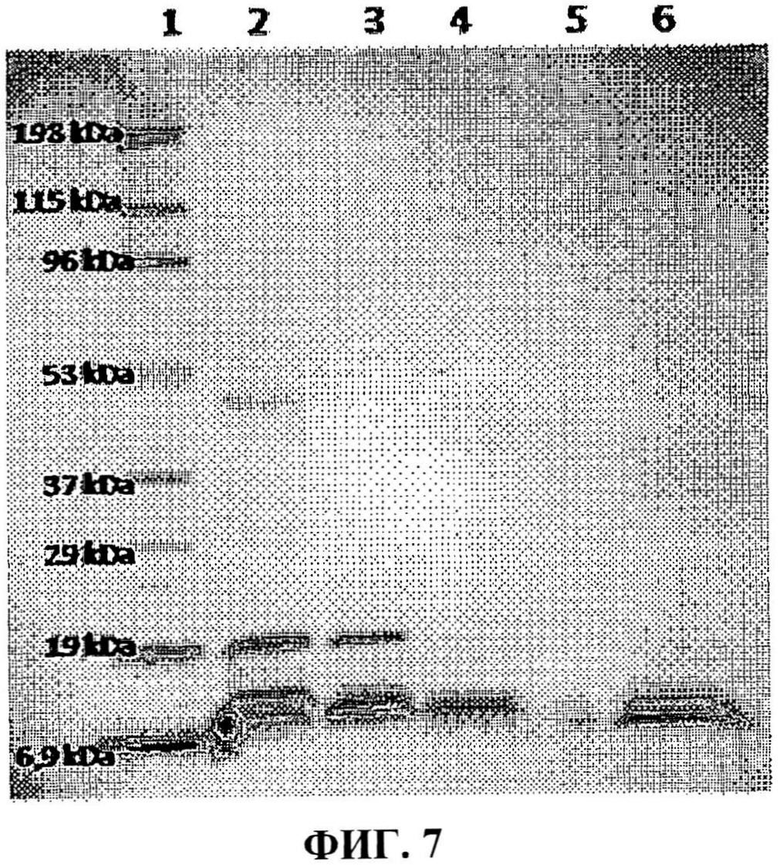
Фракции, полученные молекулярно-ситовой хроматографией ЖЭХБ, были подвергнуты электрофорезу в полиакриламидном геле с градиентом 4-20% для проверки их белкового состава, как показано на фиг.7.
Фракции LB-03 и LB-04 содержат в составе низкомолекулярные белки и, кроме того, эти фракции продемонстрировали повышенную цитотоксичность к опухолевым клеткам (Hela и A549) и низкую токсичность к нормальным клеткам (MRC-5.)
Эти фракции были подвергнуты повторной очистке жидкостной хроматографией высокого разрешения с применением аналитической кривой с обращенной фазой С18. В качестве подвижной фазы были использованы два раствора: Раствор А (0,12% трифторуксусной кислоты (ТФК) в воде) и раствор Б (0,10: ТФК в ацетонитриле). Элюирование компонента фракции выполнялось со ступенчатыми градиентами от 0 до 70% раствора Б в течение 70 минут и расходом 0,5 мл/мин при длине волны обнаружения фракции 220 нм. Полученные чистые пептиды в опухолевых (Hela) и нормальных (СНО) клетках были подвергнуты оценке аналогичным образом, как описано в примере 6, и их молекулярная масса и белковая последовательность была определена посредством масс-спектрометра, встроенного в установку для жидкостной хроматографии высокого разрешения.
Были получены восемь пептидов (RjLB-01, RjLB-03, RjLB-04, RjLB-05, RjLB-07, RjLB-08, RjLB-09 и RjLB-14) с цитотоксической активностью к опухолевым клеткам и низкой токсичностью к нормальным клеткам. Эти результаты согласуются с наблюдаемыми для цельного яда и подтверждают предпочтительную токсичность компонентов яда по отношению к опухолевым клеткам.
На основе очистки активных компонентов было определено их пропорциональное присутствие в яде (таблица XXIII).
Молекулярные массы, полученные для пептидов RjLB-01, RjLB-03 и RjLB-04, составляли 908 Да, 1964 Да и 4748,14 Да соответственно. Полученные последовательности были подвергнуты сравнению с базами данных пептидов яда скорпиона, и гомология с ранее описанными пептидами не была установлена, что является дополнительным доказательством новизны результатов.
Другим результатом настоящего изобретения является лекарственная форма, полученная следующим образом: были отобраны от пятидесяти до ста скорпионов вида Rhopalurus junceus, и их яд был экстрагирован посредством электрической стимуляции и разбавлен в 10-20 мл дистиллированной воды. Далее он был подвергнут осветлению путем центрифугирования при 10000 об/мин в течение 15 минут для устранения таких компонентов, как слизь и клеточный детрит. Одновременно было выполнено определение в нем белков с применением метода Лоури, и в результате была получена концентрация 5-15 мг/мл. Далее яд скорпиона был разбавлен соответствующим количеством дистиллированной воды в качестве единственного наполнителя для получения лекарственной формы с концентрацией в диапазоне 0,05-0,1 мг/мл.
Краткое описание фигур
Фигура 1 представляет поведение кодеина (положительная контрольная проба), центрального болеутоляющего лекарственного средства, среднее время полужизни которого колеблется от 2 до 3 часов, что соответствует нашим результатам.
Фигура 2 представляет электрофорез в 1,5% агарозном геле ДНК, экстрагированной из опухолевых клеточных линий А549 и Hela. Яд был помещен в лунки с конечной концентрацией 0,5 мг/мл. ДНК из каждой клеточной линии была экстрагирована через 24 и 48 часов.
Дорожка М: маркер молекулярной массы Лямбда-ДНК/Hind III.
Дорожка 1-3: клеточная линия А549; 1: контрольная ДНК без яда; 2: ДНК, экстрагированная через 24 часа; 3: ДНК, экстрагированная через 48 часов.
Дорожка 4-6: клеточная линия Hela; 4: контрольная ДНК без яда; 5: ДНК, экстрагированная через 24 часа; 6: ДНК, экстрагированная через 48 часов.
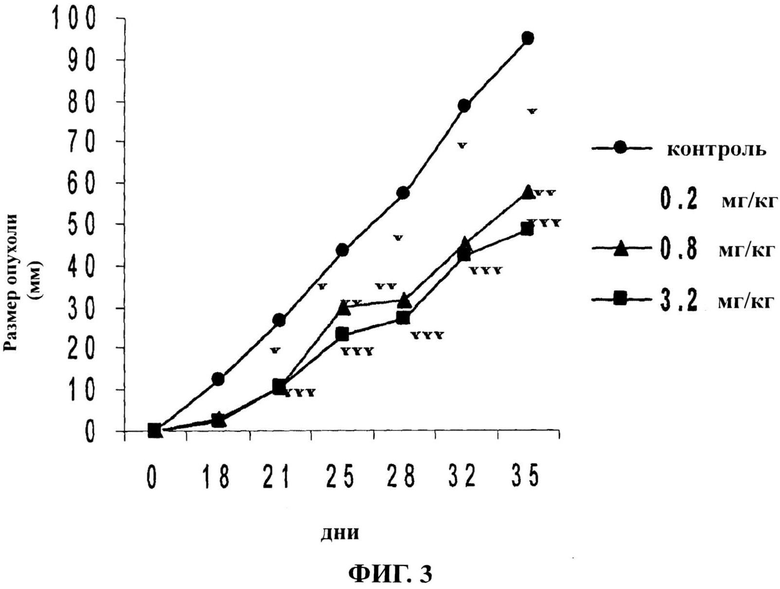
Фигура 3 представляет кинетику роста опухолей в экспериментальных группах. Рост опухолей контролировался на протяжении 35 суток. Ингибирование роста опухолей зависело от введенных доз яда. Статистическая значимость в соответствии с контрольной пробой составляла *p<0,05; **p<0,01, ***p<0,001.
Фигура 4 представляет кинетику роста опухолей в экспериментальных группах. Рост опухолей контролировался на протяжении 35 суток. Ингибирование роста опухолей зависело от введенных доз яда. Статистическая значимость в соответствии с контрольной пробой составляла *p<0,05; **p<0,01, ***p<0,001.
Фигура 5 представляет воздействие орального введения яда скорпиона на частоту возникновения экспериментальных легочных метастазов. Статистически значимое различие: **p<0,01, ***p<0,001.
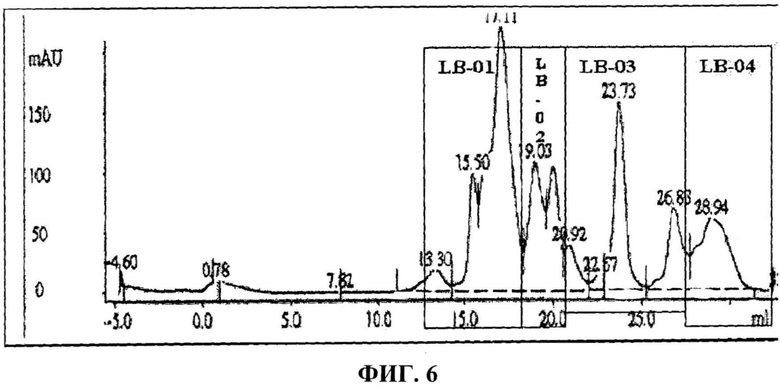
Фигура 6 представляет хроматографический профиль яда скорпиона R. junceus в жидкостной хроматографии низкого давления с применением молекулярно-ситовой колонки с суперозой-12 HR-10/30.
Фигура 7 представляет электрофорез в полиакриламидном геле в восстановительных условиях. Фракции, полученные после очистки, были подвергнуты обработке с применением жидкостной хроматографии низкого давления. Дорожка 1: маркер молекулярной массы; дорожка 2: цельный яд; дорожка 3: фракция LB-01; дорожка 4: фракция LB-02; дорожка 5: фракция LB-03; дорожка 6: фракция LB-04.
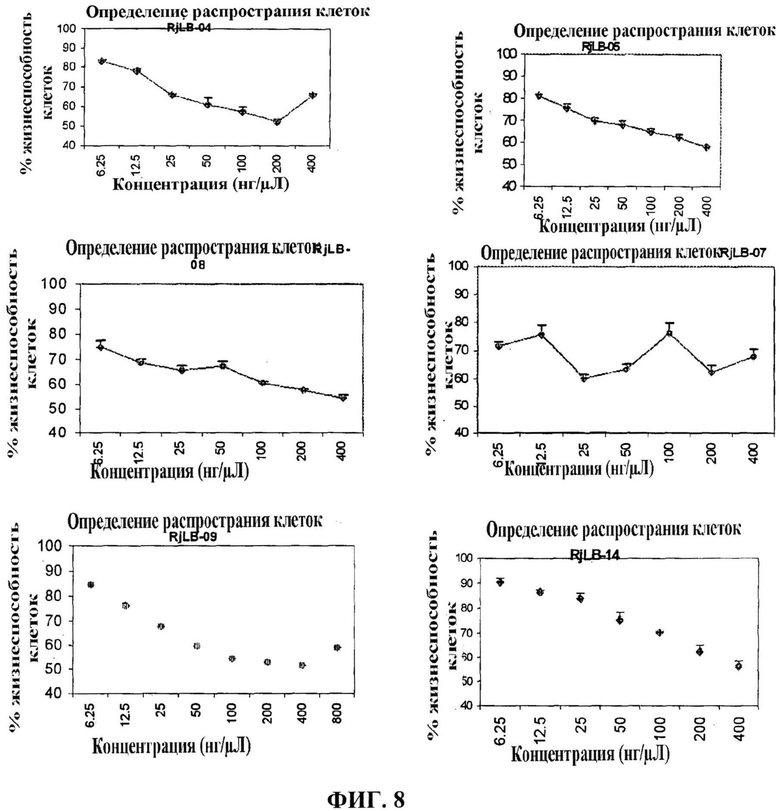
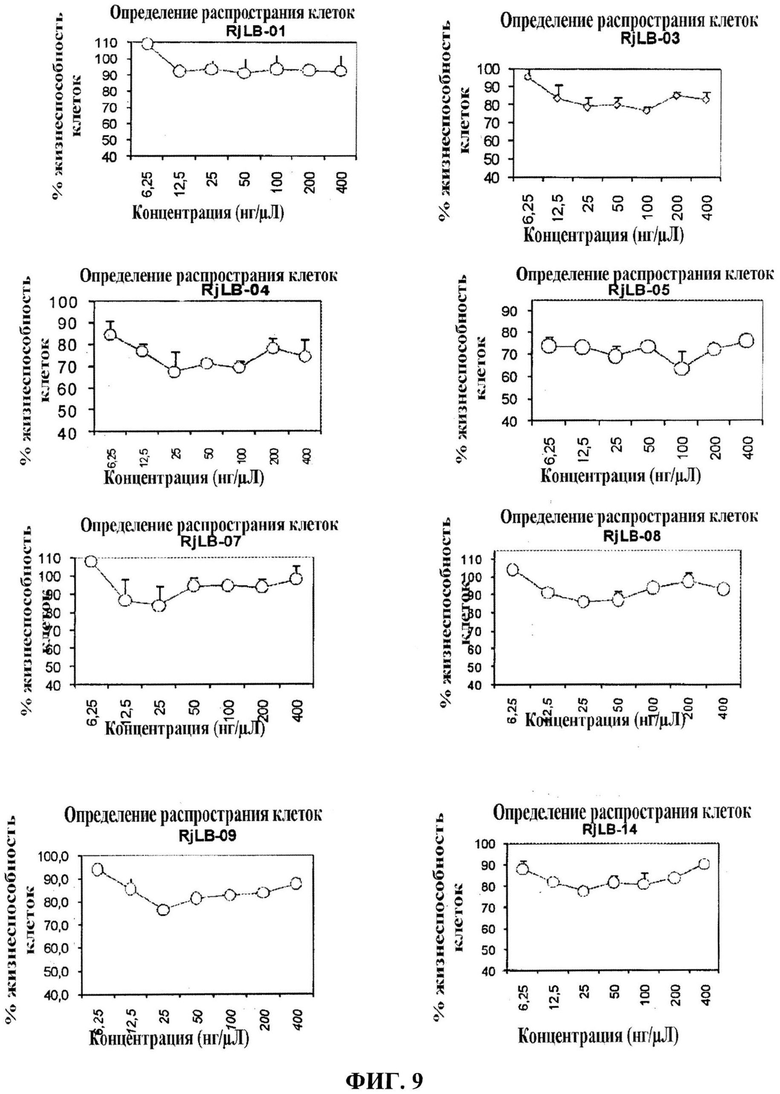
Фигура 8 представляет кривую концентрация-эффект для чистых пептидов, которые были получены при повторной очистке оцениваемых фракций. Оценка была выполнена по отношению к опухолевым клеткам Hela (рак шейки матки человека). Были использованы концентрации 6,25-400 мкг/мл.
Фигура 9 представляет кривую концентрация-эффект для чистых пептидов, которые были получены при повторной очистке оцениваемых фракций. Оценка была выполнена по отношению к неопухолевым клеткам СНО (яичник китайского хомячка). Были использованы концентрации 6,25-800 мкг/мл.
Пример 1. Модель острого воспаления индуцированного кротоновым маслом ушного отека у мышей
Использовались мыши OF-1 мужского пола массой 18-22 г из Национального центра по подготовке лабораторных животных (CENPALAB). Был использован метод, описанный в CYTED (Иберо-американская программа развития науки и технологий, Лима, ноябрь 1996 г.). Использовался 0,5% раствор кретонового масла в ацетоне. Дексаметазон был растворен в 0,5% КМЦ.
Пример 2. Модель имплантации ватных шариков у крыс
Использовались крысы Спрага-Доули с массой тела 180 г из Национального центра по подготовке лабораторных животных (CENPALAB).
Был использован метод имплантации ватных шариков из CYTED (Иберо-американская программа развития науки и технологий, Лима, ноябрь 1996 г.). Воспаление представляет реакцию ткани на повреждения. В их число входит участие и активация ферментов, высвобождение медиаторов, излияние жидкостей, миграция клеток и разрыв и восстановление тканей (Вейн, 1995). Хорошо известно, что противовоспалительный эффект может являться следствием воздействия ряда различных химических факторов и что существует слабая корреляция между их фармакологической активностью и химической структурой (Серти, 1990). Это в сочетании с комплексностью воспалительного процесса требует применения различных экспериментальных моделей для осуществления фармакологического анализа. Модель гранулемы ватных шариков у крыс представляет часто используемый метод анализа для исследования эффекта по отношению к хроническим воспалительным процессам (Элитер, 1999). Были продемонстрированы три фазы воспаления после имплантации шариков. Последняя фаза представляет пролиферацию клеток с третьего по шестой дни. Эта фаза может ингибироваться противовоспалительными стероидами, такими как дексаметазон и нестероидными противовоспалительными препаратами (Су, 1972).
Животные были умерщвлены через 7 дней после имплантации ватных шариков с помощью установленного метода умерщвления, после чего шарики были экстрагированы и исследованы. Разница между конечной и первоначальной массой шариков была рассмотрена как образованная гранулематозная ткань.
Пример 3. Модель воспалительного ангиогенеза
Использовались крысы Спрага-Доули мужского пола из CENPALAB с массой тела 180-240 г.
Воспалительный ангиогенез представляет комплексный процесс, включающий серию различных, но сходных по сути молекулярных механизмов, которые развиваются в ангиогенном каскаде. Через шесть дней после индуцированного образования гранулема была хорошо различимой и прощупываемой в контрольной группе, что согласуется с результатами, опубликованными Примелем в 2001 г. В случае животных с введенными дозами яда гранулемы были меньше наощупь, и их макроскопическое наблюдение показало менее определенные концы, которые не были настолько сильно прикреплены к эпидермису.
Пример 4. Болеутоляющая активность
- Модель индуцированных уксусной кислотой сокращений у мышей
Был использован метод, описанный в CYTED.
Использовались мыши OF1 мужского пола массой 20-25 г из Национального центра по подготовке лабораторных животных (CENPALAB).
Введение внутрибрюшинным путем
Дозы 1, 2,5 и 7,5 мг/кг яда R. junceus были введены внутрибрюшинно. Через тридцать минут подопытным животным был внутрибрюшинно введен 0,1 мл 3-процентного раствора уксусной кислоты, и была выполнена регистрация количества судорог/животное за 10 минут, начиная с первой наблюдаемой судороги.
Введение оральным путем
Дозы 1, 5, 10, 15, 20 и 50 мг/кг яда R. junceus были введены орально. Через час подопытным животным был внутрибрюшинно введен 0,1 мл 3-процентного раствора уксусной кислоты, и была выполнена регистрация количества судорог/животное за 10 минут, начиная с первой наблюдаемой судороги.
Пример 5. Оценка антиоксидантной активности
Оценка антиоксидантной активности in vitro яда Rhopalurus junceus была выполнена на основе защитного эффекта ДНК в окислительных процессах систем медь-фенантролин и блеомицин-железо. Яд продемонстрировал антиоксидантную активность, поскольку защищал ДНК от процессов перекисного окисления.
Системы медь-фенантролин и биомицин-железо продемонстрировали, что производная Rhopalurus junceus в вышеуказанных лекарственных формах не оказывает прооксидантный эффект на ДНК. Значения показателя поглощения, полученные с различными концентрациями производной Rhopalurus junceus, ниже полученных для положительной контрольной пробы. В таблицах XVI и XVII представлены результаты данной оценки.
Пример 6. Цитотоксичность in vitro на панели опухолевых и нормальных клеток
Воздействие яда на рост клеток наблюдалось в анализе МТТ, в котором осуществляется измерение пролиферации клеток вследствие метаболического снижения содержания этой (желтой) соли тетразолия под воздействием митохондриальных дегидрированных ферментов. Итоговое соединение (синий формазан) становится растворимым и может быть количественно определено спектрофотометрически.
В исследовании использовались девять опухолевых клеточных линий: HeLa (рак шейки матки человека), НЕр-2 (плоскоклеточный рак гортани человека), NCI-H292 (слизеобразующий плоскоклеточный рак легких человека), А549 (рак легких человека), U937 (гистиоцитарная лимфома человека), L929 (фибросаркома мыши), S-180 (саркома мыши) и F311 (саркома молочной железы мыши). Одновременно были использованы 3 нормальные клеточные линии: MRC-5 (фибробласты легких человека), Vero (нормальные клетки почек африканской зеленой мартышки) и MDCK (нормальные клетки почек собаки). Также была выполнена оценка перитонеальных макрофагов (экстрагированных из брюшины мышей Balb/c) и лимфоцитов (экстрагированных из селезенки мышей Balc/c). Клетки выращивались в колбах для культур в минимальной поддерживающей среде (МПС) или среде RPMI-1640 в зависимости от характеристик клеточной культуры с добавлением 2 мМ глутамина, неосновных аминокислот, 10% фетальной бычьей сыворотки (ФБС) и 100 МЕ-100 мкг/мл пенициллина-стрептомицина. Каждая культура инкубировалась во влажной атмосфере при 37°С и 5 процентах CO2 до образования одного слоя. Каждая клеточная линия была разделена с применением 0,25% раствора трипсин-ЭДТК и подготовлена до концентрации 2×105 клеток/мл согласно подсчету в камере Нойбауэра.
Анализ выполнялся в 96-луночных полистироловых планшетах с плоским дном для культивирования клеток (Coming Inc. costarR). В каждую лунку было налито по 50 мкл каждой клеточной линии и выполнено инкубирование в атмосфере с 5-процентным содержанием CO2 и при 37°С в течение 24 часов. По прошествии этого времени было добавлено 50 мкл среды, содержащей заранее растворенный яд. Конечные концентрации яда в лунках составили 0,1 мг/мл, 0,25 мг/мл, 0.5 мг/мл, 0,75 мг/мл и 1 мг/мл. Все конечные концентрации клеточных линий составили 104 клеток/лунка. В среде была использована фетальная бычья сыворотка (ФБС) с концентрацией 10%.
Планшеты повторно инкубировались в атмосфере с 5-процентным содержанием CO2 и при 37°С в течение трех суток. По прошествии этого времени в каждую лунку было добавлено 10 мкл стерильного раствора МТТ (5 мг/мл солей тетразолия в стерильном ФБСР) и выполнено инкубирование при тех же условиях в течение 4 часов. Наконец среда была вылита, добавлено 200 мкл/лунка раствора диметилсульфоксида (ДМСО) и выполнено инкубирование при 37°С в течение 30 минут во влажной атмосфере. Оптическая плотность (ОП) была считана на считывателе микропланшетов ELISA MRX производства Revelation Dynex Technologies при 560 нм с 630 нм в качестве эталона. Концентрация каждой фракции была обработана три раза, а анализ был выполнен четыре раза.
Для анализа кривых концентрация-эффект процент пролиферации клеток был получен графически согласно формуле (1-ОП (проба)/ОП (контроль)) Х100 по отношению к различным концентрациям яда. Средняя цитотоксическая концентрация была выражена в виде CC50, которая представляет концентрацию яда, обусловливающую 50 процентное снижение количества жизнеспособных клеток (поглощение МТТ) по сравнению с необработанными контрольными пробами, и приведена в таблице XV для всех оцениваемых клеток.
Пример 7. Исследование апоптоза
Исследование по определению апоптоза было выполнено посредством фрагментации ДНК. Были использованы клеточные линии Hela и А549. Результаты показаны на фигуре 2. Характерная для апоптоза фрагментация ДНК наблюдалась на соответствующих дорожках клеток Hela, обработанных ядом, в то время как в контрольных лунках и в клеточной линии А549 наблюдались одиночные неповрежденные полосы хромосомной ДНК. Эти результаты показывают, что яд скорпиона может индуцировать гибель клеток в соответствии с двумя механизмами одновременно - апоптозом и некрозом.
Пример 8. Противоопухолевая активность в солидных опухолях экспериментальной модели аденокарциномы молочной железы F311. Внутрибрюшинный путь введения.
Была выполнена оценка воздействия яда скорпиона на модель аденокарциномы молочной железы, привитой мышам Balc/c. Для экспериментальных групп были использованы три дозы (0,2 мг/кг, 0,8 мг/кг и 3,2 мг/кг). Контрольным подопытным был внутрибрюшинно введен физиологический раствор. Рост опухолей контролировался на протяжении 35 суток. Через пятьдесят суток после прививания опухоли животные были умерщвлены, их легкие извлечены и выполнен поиск легочных метастазов. Экспериментальные группы, которым вводился яд скорпиона, продемонстрировали значительное ингибирование роста опухолей (p<0,05) по сравнению с контрольной группой (фигура 3). Экспериментальные группы показали зависимость реакции от дозы на протяжении 35 суток оценки замедления развития опухоли. Значительное снижение роста опухолей в группах с введенным препаратом показывает, что яд скорпиона R. junceus оказывает противоопухолевое воздействие, поскольку он влияет на рост опухолей, по крайней мере, на протяжении периода оценки.
Пример 9. Аденокарцинома молочной железы F311. Экспериментальная модель. Оральный путь введения
Была выполнена оценка воздействия яда скорпиона в модели аденокарциномы молочной железы, привитой мышам Balb/c. Для экспериментальных групп были использованы четыре дозы (6 мг/кг, 12,5 мг/кг, 25 мг/кг и 50 мг/кг), контрольной группе был орально введен физиологический раствор. Рост опухолей контролировался на протяжении 35 суток.
Экспериментальные группы, которым вводился яд скорпиона (12,5 мг/кг, 25 мг/кг и 50 мг/кг) продемонстрировали значительное ингибирование роста опухолей (p<0,05) по сравнению с контрольной группой (фигура 4). Значительное снижение развития опухолей в группах с введенным препаратом демонстрирует противоопухолевое воздействие яда скорпиона R. junceus, поскольку он влияет на рост опухолей, по крайней мере, на протяжении периода оценки.
Пример 10. Противоопухолевая активность в асцитных опухолях. Экспериментальная модель саркомы (S-180)
Была выполнена оценка воздействия яда скорпиона в модели саркомы мышей, привитой в брюшину мышей NMRI. Для экспериментальных групп были использованы четыре дозы (6 мг/кг, 12,5 мг/кг, 25 мг/кг и 50 мг/кг). Контрольной группе был введен физиологический раствор. Яд вводился ежедневно на протяжении 24 часов после прививки опухоли до гибели всех экспериментальных групп. В таблице XX приведены результаты по времени выживания животных с введением препарата и контрольных подопытных. В таблице XXI приведены процентные показатели выживания для экспериментальных групп.
Пример 11. Очищение и идентификация белков яда как активных компонентов
Для разделения неочищенных белков цельный яд был растворен в 0,1 М ацетата аммония (NH4Ac) и центрифугирован при 10000 об/мин в течение 15 минут. Надосадочная жидкость была помещена в систему жидкостной хроматографии низкого давления ЖХБР AKTA (Amersham Pharmacia Biotech) с колонкой гель-фильтрации на суперозе 12 HR 10/30 размерами 10×300 мм. Колонка была уравновешена 0,1 М NH4Ac, и материал смешан с тем же растворителем с расходом 0,5 мл/мин. Поглощение контролировалось по оптической плотности (ОП) 280 нм на протяжении 72 минут. Молекулярно-ситовая колонка на суперозе 75 HR 10/20 была откалибрована с применением набора эталонных белков, включающих рибонуклеазу А (13,7 кДа), хемотрипсиноген (25 кДа), овоальбумин (43 кДа), альбумин (67 кДа) и синий декстран 2000. Была построена эталонная кривая для определения относительных молекулярных масс различных белковых фракций, полученных с помощью хроматографии. Результаты хроматографических опытов представлены на фигуре 6.
Пример 12. Клинические исследования лекарственной формы для введения пациентам-людям, больным раком
Цель этого исследования заключалась в оценке качества жизни пациентов, больных раком. Испытуемые, включенные в данное исследование, представляли собой пациентов обоих полов с гистологически подтвержденным раком на любой стадии. Был составлен документ, в котором было определено информированное согласие пациентов и приведена выписка из истории болезни, составленная лечащим онкологом. Данный документ включал оценку клинического состояния пациентов согласно заключениям их терапевтов в больнице в процессе их клинического наблюдения. Периодичность последующих наблюдений составляла не менее двух месяцев. Последующее наблюдение осуществлялось в течение года. Лекарственная форма была приготовлена в 40-мл колбах с концентрациями 0,05-0,1 мг/мл. Содержимое колбы было разведено в дистиллированной воде, используемой как наполнитель, до 1 литра. Продукт вводился ежедневно оральным путем, а рекомендуемые дозы зависели от состояния и гистологического диагноза пациента.
Всего в исследовании приняли участие 100 пациентов, и основными исследованными участками рака являлись молочная железа, предстательная железа, толстая кишка, легкие, головной мозг и поджелудочная железа. Введение продукта не вызывало нежелательных явлений на любой момент лечения, что согласовалось с наблюдениями доклинических исследований. Во всех случаях было достигнуто повышение качества жизни, о чем свидетельствовали основные клинические показатели, такие как снижение или устранение одышки и кашля у всех пациентов, больных раком легких. Многие пациенты продемонстрировали улучшение результатов рентгенологических исследований в виде стабилизации очага в одних случаях и его исчезновения в других. Кроме того, были стабилизированы гематологические показатели и снижены боль и воспаление. Более 50% пациентов, которым лекарственная форма изобретения вводилась на протяжении года, показали более долгое время выживания по сравнению с оценочным для некоторых из исследованных состояний.
Пример 13. Клинические исследования лекарственной формы для введения пациентам-людям, больных раком
Цель этого исследования заключалась в оценке качества жизни пациентов, больных раком. В качестве испытуемых в исследование были включены пациенты обоих полов с гистологическим подтверждением рака на любой стадии. Был составлен документ, в котором содержалось информированное согласие пациентов и приведена выписка из истории болезни, составленная онкологом первичного звена.
В документ была включена оценка клинического поведения пациентов, и данная оценка контролировалась на протяжении клинического течения заболевания и выполнялась специалистами из больниц по месту проживания пациента. Периодичность последующих наблюдений составляла не менее двух месяцев. Последующее наблюдение осуществлялось в течение года. Лекарственная форма была приготовлена в колбах объемом 40 мл с концентрациями 0,05-0,1 мг/мл. Содержимое колбы было разведено в дистиллированной воде, используемой как наполнитель, до 1 литра. Продукт вводился ежедневно оральным путем, а рекомендуемые дозы зависели от стадии и гистологического диагноза пациента.
Всего в исследовании приняли участие 100 пациентов, и основными исследованными участками рака являлись молочная железа, предстательная железа, толстая кишка, легкие, головной мозг и поджелудочная железа. Ни в одном из случаев введение продукта не вызвало нежелательных явлений в ходе лечения, что согласовалось с наблюдениями доклинических исследований. Во всех случаях наблюдалось повышение качества жизни, включая улучшение основных клинических показателей, таких как снижение или устранение одышки и кашля во всех случаях для пациентов, больных раком легких. Многие пациенты продемонстрировали улучшение результатов рентгенологических исследований, поскольку их очаги стали стабильными в одних случаях и полностью исчезли в других. Кроме того, была достигнута стабилизация гематологических показателей и снижение боли и воспаления. Для более чем 50% пациентов, которым лекарственная форма изобретения вводилась на протяжении 1 года, было повышено время выживания по сравнению с оценочным для некоторых из исследованных патологий.
Пример 14. Клинические исследования Vidatox ® 30 СН
VIDATOX ® 30 СН представляет гомеопатический биотерапевтический препарат, разработанный в гомеопатической лаборатории LABIOFAM. Его действующим веществом является яд скорпиона Rhopalurus junceus в 30-сотенном разведении. Он выпускается в форме капель в 33% этиловом спирте в качестве наполнителя.
Исследования, выполненные для 174 пациентов обоих полов со специфичной противоопухолевой терапией, продемонстрировали адъювантный эффект VIDATOX ® 30 СН для лечения рака в различных участках тела (легкие, предстательная железа, молочная железа, толстая кишка, поджелудочная железа, Т-лимфоидные клетки, головной мозг, прямая кишка и т.д.) Их результаты показывают, что 96% пациентов, которым вводился продукт, продемонстрировали выживание более 12 месяцев, для 90% терапевты наблюдали улучшение клинических симптомов, и для этих 63 пациентов боли (как преобладающий симптом) у 62% перешли в смягченную форму, для которой не требовалась обезболивающая терапия, у 27% наблюдалось исчезновение болей, и во всех случаях отсутствовали нежелательные явления, связанные с лечением.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ СЕСКВИТЕРПЕНОВОГО ЛАКТОННОГО СОЕДИНЕНИЯ ПРИ ПОЛУЧЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ОБЛЕГЧЕНИЯ ВЫЗВАННЫХ ЛУЧЕВОЙ ТЕРАПИЕЙ ПОВРЕЖДЕНИЙ | 2021 |
|
RU2822760C1 |
| ИНГИБИТОРЫ 1 КИНАЗЫ КОНТРОЛЬНОЙ ТОЧКИ КЛЕТОЧНОГО ЦИКЛА ДЛЯ УСИЛЕНИЯ ДНК-ПОВРЕЖДАЮЩИХ АГЕНТОВ | 2010 |
|
RU2567044C2 |
| ПРОТИВООПУХОЛЕВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) И ЕЕ ПРИМЕНЕНИЕ | 2005 |
|
RU2396274C2 |
| РЕКОМБИНАНТНЫЙ ИММУНОТОКСИН, НАЦЕЛЕННЫЙ НА МЕЗОТЕЛИН | 2012 |
|
RU2600067C2 |
| НОНАПЕПТИД С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2503685C2 |
| ФАРМАКОЛОГИЧЕСКАЯ КОМБИНАЦИЯ ПОЛИКАТИОННОГО НОСИТЕЛЯ ПЭГ-ПЭИ-ТАТ С ЗАКЛЮЧЕННОЙ В НЕМ ПЛАЗМИДОЙ, НЕСУЩЕЙ ТЕРАПЕВТИЧЕСКИЕ ГЕНЫ HSVtk И GM-CSF ДЛЯ ЦЕЛЕЙ ГЕНОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2575077C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2018 |
|
RU2767664C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2011 |
|
RU2743643C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2018 |
|
RU2757373C2 |
| ИММУНОСТИМУЛИРУЮЩИЕ ПОЛИПЕПТИДНЫЕ ПРОИЗВОДНЫЕ ТАТ ВИЧ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ РАКА | 2014 |
|
RU2695653C2 |






Изобретение относится к области биотехнологии, конкретно к новым пептидам, полученным из яда скорпиона Rhopalurus junceus, и может быть использовано в медицине. Пептид RjLB-014 характеризуется молекулярной массой 5930,45 Да и аминокислотной последовательностью SEQ ID NO: 8. Полученный пептид может быть использован в составе фармацевтической композиции, смешанный с дистиллированной водой в качестве наполнителя, при этом указанные компоненты представлены в следующей концентрации: RjLB-014 0,4-0,8%, дистиллированная вода 10-20 мл. Изобретение позволяет получить пептид из яда скорпиона, обладающий повышенной цитотоксической активностью в отношении опухолевых клеток. 2 н. и 2 з.п. ф-лы, 9 ил., 23 табл., 14 пр.
1. Пептид RjLB-014, полученный из яда скорпиона и характеризующийся молекулярной массой 5930,45 Да и аминокислотной последовательностью SEQ ID NO: 8, обладающий повышенной цитотоксической активностью в отношении опухолевых клеток.
2. Фармацевтическая композиция, обладающая повышенной цитотоксической активностью в отношении опухолевых клеток, содержащая в качестве действующего вещества пептид RjLB-014, полученный из яда скорпиона Rhopalurus junceus, характеризующийся молекулярной массой 5930,45 Да и аминокислотной последовательностью SEQ ID NO: 8, смешанный с дистиллированной водой в качестве наполнителя, при этом указанные компоненты представлены в следующей концентрации: RjLB-014 0,4-0,8%, дистиллированная вода 10-20 мл.
3. Фармацевтическая композиция по п. 2 для гомеопатического применения.
4. Фармацевтическая композиция по п. 2 или 3, используемая для орального, местного, парентерального, ректального, вагинального или аэрозольного введения.
| US2009123558 A1, 14.05.2009 | |||
| Короткодуговая металлогалогенная лампа | 1987 |
|
SU1443053A1 |
| Дверной электрический сигнальный контакт | 1924 |
|
SU843A1 |
Авторы
Даты
2015-09-20—Публикация
2011-09-27—Подача