Область техники, к которой относится изобретение
Настоящее изобретение относится к медицине, фармакологии, биотехнологии, в частности генной инженерии, и касается фармкомпозиции комбинированной природы, состоящей из плазмидной ДНК, несущей генетическую информацию, заключенной в полимерный носитель. Активность фармкопозиции ограничена раковыми клетками.
Фармкомпозиция может быть использована для генной терапии новообразований различной природы.
Уровень техники
Рак представляет собой одну из наиболее серьезных проблем медицины: он занимает второе место по смертности в мире и, по прогнозам, имеет перспективу перейти на первое. Онкологическая заболеваемость имеет тенденцию к росту. Разрабатываются и внедряются новейшие подходы к терапии рака, и немаловажное место занимает современная молекулярная таргетная терапия (МТТ), которая использует концепцию молекулярного нацеливания (таргетинга) противораковых препаратов на предположительные ключевые молекулы раковой клетки, которые вовлечены в развитие опухоли. Однако после первого успеха подобных препаратов новые исследования показали ограниченность данного подхода, и становится более очевидным, что данный подход находится в кризисном состоянии (Salk J J, Fox EJ et al. (2010) Annu Rev Pathol 5:51-75). Большая часть препаратов, использующих таргетный подход, оказалась малоэффективной при проведении клинических и доклинических испытаний (Hambley TW and Hait WN (2009) Cancer Res 69:1259-62), в основном по причине того, что при их применении происходит быстрое возникновение устойчивости раковых клеток к воздействию (Hellerstein МК (2008) Metab Eng 10:1-9), (Bria Ε, Di Maio Μ et al. (2009) J Exp Clin Cancer Res 28:66), (Duenas-Gonzalez A, Garcia-Lopez Ρ et al. (2008) Mol Cancer 7:82), (Hambley TW and Hait WN (2009) Cancer Res 69:1259-62).
Подобный результат вполне закономерен, поскольку онкозаболевания сочетают в себе как сложность клеточной организации, так и свойства сложной растущей системы, способной приспосабливаться к внешним воздействиям, в т.ч. и лекарственным, благодаря микрогетерогенности внутри опухолей (Merlo LM, Pepper JW et al. (2006) Nat Rev Cancer 6:924-35). Гетерогенность раковых опухолей заключается в том, что каждая раковая клетка отличается от всех других клеток этой же опухоли, а опухоль одного пациента отличается от опухоли того же типа у другого пациента (Glazier А (2007))/ (http.//www.curecancerproject.org/beta/pdf/An%20Inconvenient%20Truth,%20Cancer%20is%20a%20hugely%20diverse%20complex%20stochastic%20evolutionary%20process.pdf). Поэтому среди множества клеток в опухоли всегда существуют клетки, устойчивые к воздействию и способные дать рост нового, устойчивого к данному воздействию, клона опухоли. В результате этого становится очевидным, что достаточно сложно однозначно идентифицировать какие- либо ключевые гены, которые могут быть использованы в качестве мишеней для противоопухолевой терапии (Salk JJ, Fox Ε J et al. (2010) Annu Rev Pathol 5:51-75). Таким образом, в области терапии онкозаболеваний сложилась парадоксальная ситуация - с одной стороны, есть набор очень эффективных, но и одновременно высокотоксичных химиотерапевтических препаратов, а с другой, есть малотоксичные, но в то же время низкоэффективные препараты молекулярной таргетной терапии.
Определенные надежды в настоящее время возлагают на генную терапию (ГТ), активно развивающуюся в последнее десятилетие. Генная терапия предполагает доставку регулируемого генетического материала в раковые клетки, где в результате производятся продукты, индуцирующие их гибель. Подходы генной терапии могут быть разделены на две категории: таргентная генная терапия и ген-направленная энзиматическая пролекарственная терапия (Sverdlov ED (2009) Molecular genetics, microbiology and virology 24:93-113) / (http://link.springer.com/article/10.3103%2FS089141680903001X). Таргетным агентом при таргетной ГТ выступает продукт трансгена, являющийся ингибитором какого-либо продукта с повышенной концентрацией в раковой клетке, что является одной из причин ракового процесса, или продукт трансгена, который компенсирует недостаток определенного белка в раковых клетках. В обоих вариантах мишенью воздействия является определенное звено в сигнальных системах клетки, которое меняется при раковом перерождении и способствует ему. Таргетная генная терапия имеет те же недостатки, что и МТТ.
Наиболее изученным и используемым в генной терапии геном-онкосуппрессором является ген р53. Так, первый одобренный для клинического применения генно-терапевтический препарат Гендицин (Gendicine) представляет собой аденовирус, несущий ген р53 (Peng Ζ (2005) Hum Gene Ther 16:1016-27), (Wilson JM (2005) Hum Gene Ther 16:1014-5). Показано, что в сочетании с радиотерапией Гендицин вызывает полную регрессию опухоли у 64% пациентов с раком головы и шеи и частичную - у 29%, тогда как монорадиотерапия приводит к полной регрессии у 19% и частичной у 60% пациентов (Peng Ζ (2005) Hum Gene Ther 16:1016-27). Однако есть основания ожидать появления вторичного роста опухоли, поскольку было показано, что введение р53 в опухоли в которых он исходно поврежден вызывает появление устойчивых к р53 вариантов (Martins CP, Brown-Swigart L et al. (2006) Cell 127:1323-34). Таким образом, ГТ использующая подход МТТ, обладает в полной мере недостатками присущими классической молекулярной таргетной терапии, что не позволяет считать данный подход эффективным.
Вторая стратегия генной терапии использует свойства, характерные для раковых клеток в целом - как бы гетерогенны ни были клетки опухоли, они имеют одно общее фундаментальное свойство - они все непрерывно делятся, то есть процесс деления и репликации является универсальной мишенью для противоопухолевого воздействия (Sverdlov ED (2011) Curr Gene Ther 11:501-31). Данная стратегия имеет сходство с химиотерипией, однако, в отличие от нее, в случае ГТ токсин образуется внутри раковой клетки, поэтому токсической воздействие на нормальные клетки организма сводится к минимуму. Данный подход получил название суицидальной генной терапии, или генной хирургии, и известен как ген-направленная энзиматическая пролекарственная терапия, ГНЭПТ (Gene-directed enzyme prodrug therapy, GDEPT) (Altaner С (2008) Cancer Lett 270:191-201), (Fillat C, Carrio Μ et al. (2003) Curr Gene Ther 3:13-26), (Portsmouth D, Hlavaty J et al. (2007) Mol Aspects Med 28:4-41). Подход генной хирургии заключается в доставке в раковые клетки-мишени генов, кодирующих фермент, который в клетках, где он экспрессируется, способен превращать свой субстрат, вводимый системно, в высокотоксичный агент. Данный подход не является молекулярно таргетированным и потому избегает всех недостатков МТТ.
Основное преимущество генной хирургии заключается в том, что даже небольшого количества экспрессирующих трансген клеток достаточно для того, чтобы вызвать гибель большого числа опухолевых клеток. Токсин, образовавшийся в клетках, экспрессирующих трансген, может высвобождаться из них и проникать в соседние клетки, не получившие трансген, вызывая их гибель. Данное явление получило название «эффекта свидетеля» (bystander effect).
Поскольку известно, что часть клеток опухоли (или опухоли в целом) может быть устойчива к воздействию некоторых токсических агентов ГНЭПТ систем, ряд исследователей предлагает использовать комбинированную генную хирургию, включающую применение двух или более терапевтических генов.
Одним из способов повышения эффективности генной хирургии является ее комбинирование с иммунотерапией. Многие представители семейства цитокинов способны мобилизировать иммунную систему пациентов, способствуя развитию специфического противоопухолевого ответа. В настоящее время три цитокина (IFN-α2a, IFN-α2b и IL-2) наиболее часто применяются для лечения онкологических заболеваний в качестве иммуностимуляторов (Dranoff G (2004) Nat Rev Cancer 4:11-22), (Seruga В, Zhang Η et al. (2008) Nat Rev Cancer 8:887-99). Кроме того, такие цитокины, как G-CSF и GM-CSF, широко применяются в клинической практике в качестве стимуляторов гемопоэза для лечения нейтропении, вызванной применением цитостатических лекарственных средств у онкологических больных, или при состояниях после пересадки костного мозга (Metcalf D (2008) Blood 111:485-91), (Mughal ΤΙ (2004) Hematol Oncol 22:121-34).
Противоопухолевая активность таких цитокинов, как интерлейкины (IL) 2, 4, 7, 12 и 18, фактор некроза опухоли α (ΦΗΟ-α) и GM-CSF, показана в различных исследованиях (Slavcev R, Wettig S et al. (2011)), (Cerullo V, Pesonen S et al. (2010) Cancer Res 70:4297-309), (Niculescu-Duvaz I and Springer С (2004) Methods in Molecular Medicine, Suicide gene therapy; methods and reviews. 90). Ряд цитокинов входит в состав клеточных противоопухолевых вакцин и онколитических вирусов, находящихся на разных стадиях клинических испытаний (Wei LZ, Xu Y et al. (2013) J Cell Mol Med), (Cui Y, Yang X et al. (2013) Oncol Lett 6:537-541), (Miguel A, Herrero MJ et al. (2013) Cancer Gene Ther 20:576-81), (Atherton MJ and Lichty BD (2013) Immunotherapy 5:1191-206).
Например, препарат Онковекс (Oncovex), предназначенный для лечения меланомы, а также рака головы и шеи, полученный на основе модифицированного вируса герпеса человека, несущего ген GM-CSF, в настоящее время проходит III фазу клинических испытаний (Kaufman HL and Bines SD (2010) Future Oncol 6:941-9).
В исследованиях показано, что клеточные вакцины, содержащие GM-CSF, обеспечивают развитие у животных более сильного противоопухолевого ответа, чем вакцины, включающие другие цитокины (Dranoff G, Jaffee Ε et al. (1993) Proc Natl Acad Sci USA 90:3539-43). Полагают, что развитие иммунного ответа обеспечивается за счет активации макрофагов, гранулоцитов и натуральных киллеров (Mach Ν, Gillessen S et al. (2000) Cancer Res 60:3239-46), а также локального увеличения пула дендритных клеток и стимуляции их созревания, что в результате приводит к более эффективной презентации опухолевых антигенов Т-клеткам иммунной системы (Mach Ν, Gillessen S et al. (2000) Cancer Res 60:3239-46), (Qin Z, Noffz G et al. (1997) J Immunol 159:770-6), (Gillessen S, Naumov YN et al. (2003) Proc Natl Acad Sci U S A 100:8874-9).
Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), вместе с G-CSF, M-CSF, IL-3 и IL-5, принадлежит к семейству гемопоэтических цитокинов. GM-CSF секретируется в виде небольшого гликопротеина весом 23кДа. Зрелый GM-CSF человека содержит 127 а.о., мыши - 124 а.о. Оба полипептида образуются из предшественника, содержащего сигнальный пептид (Shi Y, Liu СН et al. (2006) Cell Res 16:126-33). Гомология аминокислотной последовательности между GM-CSF мыши и человека составляет 56%, однако межвидового связывания рецептора или межвидовой биологической активности не наблюдается. GM-CSF представлен в сыворотке крови и большинстве тканей организма человека (Farrar WL, Brini AT et al. (1990) Immunol Ser 49:379-410). Он может быть локализован во внеклеточном матриксе или интегрирован в мембрану (Farrar WL, Brini AT et al. (1990) Immunol Ser 49:379-410). Синтез GM-CSF осуществляется В и Т-лимфоцитами фибробластами, тучными, мезотелиальными и эндотелиальными клетками, макрофагами, а также клетками многих злокачественных опухолей (Cousins DJ, Staynov DZ et al. (1994) Am J Respir Crit Care Med 150:S50-3), (Nimer SD and Uchida Η (1995) Stem Cells 13:324-35).
Биологическая активность GM-CSF опосредуется связыванием GM-CSF с рецептором-гетеромером, который экспрессируется на моноцитах, макрофагах, гранулоцитах, лимфоцитах, эндотелиальных клетках и клетках альвеолярного эпителия (Griffin JD, Spertini О et al. (1990) J Immunol 145:576-84). Рецептор состоит из двух субъединиц: GM-CSF специфичной α-субъединицы и общей для рецепторов GM-CSF, IL-3, IL-5 β-субъединицы (Miyajima А (1992) Int J Cell Cloning 10:126-34). После специфического связывания GM-CSF с α-субъединицей происходит связывание β-субъединицы с комплексом α-субъединица/GM-CSF и передача сигнала по JAK2 пути, в результате чего развивается функциональный ответ (Jenkins BJ, Blake TJ et al. (1998) Blood 92:1989-2002), (Dijkers PF, van Dijk ТВ et al. (1999) Oncogene 18:3334-42), (Erbs P, Regulier Ε et al. (2000) Cancer Res 60:3813-22). GM-CSF стимулирует пролиферацию и дифференцировку гранулоцитов и моноцитов, усиливает фагоцитарную и цитотоксическую активность гранулоцитов и эозинофилов, стимулирует пролиферацию, созревание и дифференцировку дендритных клеток (Shi Y, Liu СН et al. (2006) Cell Res 16:126-33), играет важную роль в рекрутинге и активации антиген-представляющих клеток (Krakowski Μ, Abdelmalik R et al. (2002) J Pathol 196:103-12).
В норме GM-CSF экспрессируется в организме на низком уровне, однако его экспрессия резко возрастает при стимулировании иммунной системы. Значительное увеличение экспрессии GM-CSF показано для кожи пациентов с аллергическими заболеваниями, а также для легочной ткани больных астмой. Высокий уровень GM-CSF наблюдают при таких заболеваниях, как хроническая и острая миелоидная лейкимия, СПИД (Oster W, Mertelsmann R et al. (1989) Int J Cell Cloning 7:13-29), (Drexler HG, Meyer С et al. (1999) Leuk Lymphoma 33:83-91), (Shannon MF, Himes SR et al. (1995) J Leukoc Biol 57:767-73), (Bailer RT, Lazo A et al. (1995) J Interferon Cytokine Res 15:473-83).
Интересно, что сверхэкспрессия GM-CSF может приводить к патологическим изменениям в организме. В экспериментах на GM-CSF-трансгенных мышах было показано, что сверхэкспрессия GM-CSF приводит к слепоте животных и патологическим изменениям в различных тканях организма (Lang RA, Metcalf D et al. (1987) Cell 51:675-86). Также было показано, что у GM-CSF-трансгенных мышей происходит увеличение экспрессии большого количества цитокинов и медиаторов воспаления. Мыши, дефектные по гену GM-CSF, развиваются нормально и не имеют существенных изменений в процессе гемопоэза до двенадцатой недели постэмбрионального развития, однако у некоторых мышей может наблюдаться развитие различных аномалий легкого (Stanley Ε, Lieschke GJ et al. (1994) Proc Natl Acad Sci U S A 91:5592-6). Показано, что у животных, дефектных по гену GM-CSF, ослаблены Тh1 и Th2 иммунные ответы (Wada Η, Noguchi Υ et al. (1997) Proc Natl Acad Sci U S A 94:12557-61). Известно, что GM-CSF в зависимости от условий может стимулировать как Тh1, так и Th2 иммунные ответы (Shi Y, Liu СН et al. (2006) Cell Res 16:126-33).
Известно, что экспрессия GM-CSF в клетках опухоли повышает ее иммуногенность, тем самым способствуя ее элиминации и обеспечивая развитие противоопухолевого ответа (Jones RK, Pope IM et al. (2000) Cancer Gene Ther 7:1519-28), (Finocchiaro LM, Fiszman GL et al. (2008) Cancer Gene Ther 15:165-72). В работах in vivo продемонстрировано, что эффективность системы HSVtk/GCV резко возрастает, если в клетки опухоли вводить ген HSVtk совместно с геном GM-CSF (Jones RK, Pope IM et al. (2000) Cancer Gene Ther 7:1519-28), (Finocchiaro LM, Fiszman GL et al. (2008) Cancer Gene Ther 15:165-72), (Lechanteur C, Delvenne Ρ et al. (2000) Gut 47:343-8), (Majumdar AS, Zolotorev A et al. (2000) Cancer Gene Ther 7:1086-99).
Так, в исследовании группы Brockstedt, были созданы два аденовирусных вектора, один из которых (AV-TK) содержал ген HSVtk, а второй (AV-GM/IL2) гены цитокинов GM-CSF и IL-2 (интерлейкин-2) (Brockstedt DG, Diagana Μ et al. (2002) Mol Ther 6:627-36). На мышах с привитой высокометастазирующей опухолью 4Т1 был оценен противоопухолевый эффект полученных векторов при внутриопухолевом введении. Показано, что только при одновременном введении векторов AV-TK и AV-GM/IL2 достигается полный ответ на лечение. В группе, получившей одновременно два вектора на фоне введения ганцикловира, около 30% животных жили более 75 дней, тогда как все животные в других группах погибли к 40 дню эксперимента. Также изучено влияние интратуморального введения векторов на уровень метастазирования опухоли. Показано, что в группе животных, получивших комбинацию AV-TK+AV-GM/IL2 на фоне введения GCV, только 11% мышей имели метастатические очаги в легких, тогда как в группе животных, получивших комбинацию AV-TK+GCV, у 77% животных были верифицированы легочные метастазы. В группе, получившей AV-TK+AV-GM/IL2 в сочетании с фосфатным буфером, метастазы имелись у 63% животных, в группе AV-TK+PBS - у 93% мышей.
Также в данном исследовании было продемонстрировано развитие специфического иммунного противоопухолевого ответа только у животных, получивших одновременно два вектора. В другой работе, в которой исследовали терапевтический эффект совместного администрирования аденовирусного вектора, несущего ген HSVtk и векторов, содержащих ген IL-2 или GM-CSF, также было показано, что комбинированная терапия увеличивает выживаемость животных и способствует развитию противоопухолевого иммунитета (Majumdar AS, Zolotorev A et al. (2000) Cancer Gene Ther 7:1086-99).
В исследованиях ex vivo и in vivo продемонстрировано превосходство комбинированной терапии, сочетающей введение GM-CSF и системы HSVtk/GCV над генной хирургией, включающей только введение системы HSVtk/GCV. В исследованиях также было показано возникновение противоопухолевого иммунного ответа при использовании GM-CSF (Jones RK, Pope IM et al. (2000) Cancer Gene Ther 7:1519-28), (Lee KH, Piao Η et al. (2004) Cancer Gene Ther 11:570-6), (Castleden SA, Chong Η et al. (1997) Hum Gene Ther 8:2087-102).
Как видно из приведенных выше данных, введение GM-CSF в опухоль индуцирует развитие противоопухолевого иммунитета и улучшает результаты генной хирургии. Однако клетки некоторых опухолей синтезируют как сам GM-CSF, так и его рецепторы (Braun В, Lange Μ et al. (2004) J Neurooncol 68:131-40), (Mueller MM, Peter W et al. (2001) Am J Pathol 159:1567-79). Более того, продукция клетками опухоли GM-CSF привлекает к опухолевому узлу миелоидные супрессорные клетки, которые высвобождают фактор TGF-β, который, в свою очередь, ингибирует функцию Т-клеток (Young MR, Wright MA et al. (1997) J Immunol 159:990-6). При раке головы и шеи продукция опухолью GM-CSF характеризуется крайне неблагоприятным прогнозом (Ninck S, Reisser С et al. (2003) Int J Cancer 106:34-44). Также показано, что GM-CSF может стимулировать рост опухоли и миграцию опухолевых клеток (Mueller MM and Fusenig NE (1999) Int J Cancer 83:780-9), (Mueller MM, Herold-Mende CC et al. (1999) Am J Pathol 155:1557-67), (Obermueller E, Vosseler S et al. (2004) Cancer Res 64:7801-12), (Gutschalk CM, Herold-Mende CC et al. (2006) Cancer Res 66:8026-36), (Pei XH, Nakanishi Y et al. (1999) Br J Cancer 79:40-6).
Существуют предположения, что эффект GM-CSF при опухолевых поражениях может зависеть от того, как происходит продукция GM-CSF в организме: локально или системно (Reali Ε, Canter D et al. (2005) Vaccine 23:2909-21), и от концентрации GM-CSF в опухоли (Dranoff G, Jaffee Ε et al. (1993) Proc Natl Acad Sci U S A 90:3539-43), (Serafini P, Carbley R et al. (2004) Cancer Res 64:6337-43), (Parmiani G, Castelli С et al. (2007) Ann Oncol 18:226-32).
Полагают, что противоопухолевый эффект GM-CSF в сочетании с системой HSVtk/GCV обусловлен следующим механизмом: при одновременном попадании в раковые клетки генов HSVtk и GM-CSF будет происходить гибель раковых клеток за счет работы системы HSVtk/GCV и высвобождение из них опухолевых антигенов. Опухолевые антигены (АГ) будут эффективно представляться GM-CSF-активированными антиген-представляющими клетками Т-клеткам иммунной системы, обеспечивая активацию специфического противоопухолевого иммунитета, в результате чего возрастет гибель опухолевых клеток и снизится вероятность возникновения метастазов. Привлечение к опухоли антиген-представляющих клеток (АПК) и их активация происходит посредством синтезированного GM-CSF. В результате происходит эффективное представление опухолевых антигенов GM-CSF-активированными АПК клетками Т-клеткам иммунной системы и, как следствие, активация специфического противоопухолевого иммунитета (Jones RK, Pope IM et al. (2000) Cancer Gene Ther 7:1519-28), (Lechanteur C, Delvenne Ρ et al. (2000) Gut 47:343-8), (Lee KH, Piao Η et al. (2004) Cancer Gene Ther 11:570-6), (Castleden SA, Chong Η et al. (1997) Hum Gene Ther 8:2087-102), (Serafini P, Carbley R et al. (2004) Cancer Res 64:6337-43), (Parmiani G, Castelli С et al. (2007) Ann Oncol 18:226-32).
Одним из важных элементов успеха генной терапии рака является адекватная система доставки и экспрессии терапевтических генов, поскольку данные гены должны работать в раковых клетках и не работать в нормальных клетках организма. Для доставки терапевтических конструкций в клетки опухоли пациента используют вирусные и невирусные системы. Основным недостатком невирусных систем доставки, по сравнению с вирусными, является их более низкая трансфекционная эффективность. При этом невирусные системы доставки обладают рядом преимуществ: высокая пакующая емкость, низкая иммуногенность, высокая безопасность, возможность экономичного производства (Yue Y and Wu С (2013) Biomaterials Science 1:152-170). Использование специального носителя должно обеспечивать преимущественное накопление фармкомпозиции именно в опухолевых клетках (Seymour LW (1992) Crit Rev Ther Drug Carrier Syst 9:135-87), (Prabhakar U, Maeda Η et al. (2013) Cancer Res 73:2412-7).
В настоящее время, все более очевидным становится тот факт, что лимитирующим препятствием на пути внедрения современных генотерапевтических подходов является отсутствие оптимальных методов доставки рекомбинантного генетического материала в клетки-мишени реципиента. Именно эта проблема является сейчас краеугольным камнем для внедрения новых терапевтических подходов использующих ГТ. Существующие сейчас методы доставки можно условно разделить по типу носителя - на вирусные, и т.н. невирусные методы, включающие обычно искусственные/синтетические конструкции. Поскольку вирусные векторы являлись наиболее очевидным способом доставки генетического материала, в силу своей природной специфики, то на сегодняшний день около 3/4 клинических испытаний (КИ) проведено на их основе [Gene Therapy Clinical Trials (on-line) www.wiley.co.uk/genetherapy/clinical]. Однако трудности и побочные эффекты, встреченные при использовании вирусных носителей, привели к развитию альтернативных технологий доставки, были разработаны и внедрены невирусные системы доставки - в настоящее время растет доля КИ с использованием невирусных систем доставки и уменьшается доля КИ с вирусными носителями (Li SD and Huang L (2007) J Control Release 123:181-3). Основными препятствиями на пути внедрения систем доставки на основе вирусных векторов являются их небезопасноть с возможностью контаминации и/или реверсии к патогенному вирусу дикого типа и иммуногенность, что делает невозможным повторное введение препаратов на основе вирусных векторов, которые ранее вызвали сильный иммунный ответ. Также не стоит забывать, что пакующая способность вирусных векторов весьма ограничена и сильно зависит от типа используемого вектора. Кроме того, вирусы часто проявляют сродство к определенному типу клеток и весьма сложны и дорогостоящи в производстве (Pack DW, Hoffman AS et al. (2005) Nat Rev Drug Discov 4:581-93). Осознание проблематичности данного подхода требовало решений, и в 1987 году появились первые работы, использующие поликатионы и липосомы из катионных липидов в качестве векторов (Wu GY and Wu СН (1987) J Biol Chem 262:4429-32), (Felgner PL, Gadek TR et al. (1987) Proc Natl Acad Sci U S A 84:7413-7). Данные вектора не патогенны, не имеют ограничений по размеру переносимого генетического материала и не очень затратные в производстве по сравнению с вирусными векторами. Дальнейшие работы выявили определенные трудности при работе с препаратами на основе липосом, такие как - сложность стандартизации, стабильность и воспроизводимость комплексов с ДНК, токсичность для ряда клеток, вызывание воспалительных процессов (Filion МС and Phillips NC (1998) International Journal of Pharmaceutics 162:159-170), (Norman J, Denham W et al. (2000) Gene Ther 7:1425-30). Эти и некоторые другие факторы предопределили приоритетность использования поликатионов для доставки ДНК.
Комплексы ДНК с поликатионами, или полиплексы, способны компактизовать ДНК и защищать ее от воздействия внешних факторов. В силу своей специфики, полиплексы обладают возможностью модификации - ковалентного присоединения молекул, обеспечивающих направленное (таргетное) взаимодействие с мишенью. Полиплексы способны преодолевать эндосомные мембраны и выходить в цитозоль, они непатогенны и практически не иммуногенны и нетоксичны. Относительно недорогая стоимость производства делает их весьма привлекательными для фармакологических компаний, а воспроизводимость производства лигандированных полиплексов достаточно высока (Kang НС, Lee Μ et al. (2005) Crit Rev Eukaryot Gene Expr 15:317-42).
Полиплексы можно использовать как для системного введения, так и для локального - в легкие, различные опухоли, мозг (Lungwitz U, Breunig Μ et al. (2005) Eur J Pharm Biopharm 60:247-66), молочные железы и яйцеводы (Sobolev AS, Rosenkranz AA et al. (1998) J Biol Chem 273:7928-33), (Ivanova MM, Rosenkranz AA et al. (1999) Mol Reprod Dev 54:112-20). Ранние работы с использованием полиплексов были ограничены довольно низким уровнем трансформации и такими свойствами полиплексов, влияющих на экспрессию компактизованной в них генетической информации, как стабильность полиплекса в крови и жидкостях тела, способность оболочки защитить заключенную в нее ДНК от ферментативной деградации, возможность быстрого высвобождения ДНК после доставки полиплекса в ядро и свойства распакованной ДНК (чистота, сверхспирализация) и т.д. Работы по оптимизации этих и других свойств полиплексов привели к достижению 60%-ной эффективности трансформации некоторых клеток, что превосходит эффективность липоплексов (Akinc A and Langer R (2002) Biotechnol Bioeng 78:503-8). Успех работ данного направления привлек большой интерес к полиплексам в последнее время, и в последние годы они были использованя для целей ГТ некотрых опухолевых заболеваний. Полиплексы оказались эффективными для генотерапии гепатоцеллюлярной карциномы (Iwai Μ, Harada Y et al. (2002) Biochem Biophys Res Commun 291:48-54) и диссеминированного рака поджелудочной железы (Aoki К, Furuhata S et al. (2001) Gene Ther 8:508-14).
В данном изобретении предлагается создание фармкомпозиции, состоящей из оболочки в виде модифицированного полиплекса (полимерного носителя), в которую будет заключен генетический материал, содержащий компоненты, используемые в ГНЭПТ системах для целей генотерапии рака - суицидный ген в сочетании с иммуностимулирующим компонентом в виде GM-CSF.
Раскрытие изобретения
Настоящее изобретение направлено на создание фармкомпозиции, объединяющей в себе подход ГНЭПТ и доставки при помощи модифицированного искусственного поликатионного носителя (полиплекса). Данный подход призван устранить недостатки, присущие генотерапевтическим системам с ограниченным способом доставки из уровня техники, а также использует ГНЭПТ подход позволяющий убивать раковые клетки независимо от их генезиза и свойств. Фармкопозиция вводится интратуморально, что обеспечивает специфичность ее действия на опухолевые клетки, ГНЭПТ подход позволяет этой композиции быть универсальным средством терапии солидных/консолидированных опухолей. Дополнительное использование иммуностимулирующего компонента в составе генетического вектора, содержащего ГНЭПТ систему, позволяет, в некоторых случаях, активировать противоопухолевый эффект иммунной системы, что может приводить к генерализированному противоопухолевому иммунному ответу организма, в результате которого происходит атака отдаленных опухолевых метастазов, что является критичным при некоторых типах рака.
Для достижения результата, предлагается фармакологическая композиция для противоопухолевой терапии солидных/консолидированных опухолей. Фармакологическая композиция включает следующие активные вещества: 1) нуклеиновую кислоту, кодирующую один или два терапевтических гена (ген-убийца и иммуномодулирующий ген) и регуляторные элементы, необходимые для их экспрессии; 2) полимерную оболочку, которая состоит из трех компонентов - ПЭГ, ПЭИ и ТАТ. Фармакологическая композиция включает следующие вспомогательные вещества - N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислоту (HEPES) с водородным показателем рН7,4 в молярной концентрации 5 мМ; буфер боратный с водородным показателем рН7,5 в молярной концентрации 12,5 мМ, а также содержит 5% глюкозы.
Нуклеиновая кислота представляет собой высокоочищенную сверхскрученную форму плазмиды общей формулы CMV-HSVtk-GM-CSF-pGL3 и кодирует тимидинкиназу вируса простого герпеса (Herpes Simplex Virus thymidine kinase - HSVtk) и гранулоцитарно-макрофагальный колониестимулирующий фактор (Granulocyte macrophage colony-stimulating factor - GM-CSF) под контролем промотора (управляющего участка ДНК) цитомегаловируса (CMV). Поскольку белок гранулоцитарно-макрофагального колониестимулирующего фактора видоспецифичен (Shi Y, Liu СН et al. (2006) Cell Res 16:126-33), а эффективность генно-терапевтических конструкций необходимо тестировать на животных с привитыми опухолями, созданы два варианта конструкции, один из которых содержит ген GM-CSF мыши и предназначен для модельных экспериментов на мышах, другой содержит ген GM-CSF человека и предназначен для клинических испытаний. Таким образом, в качестве GM-CSF может быть использован как человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор - hGM-CSF, так и мышиный гранулоцитарно-макрофагальный колониестимулирующий фактор - mGM-CSF. Рекомбинантная плазмидная ДНК состоит из следующих компонентов: фрагмента промоторного участка (581 нуклеотидная пара), который определяет транскрипцию генов, гена HSVtk, при экспрессии которого синтезируется форма HSVtk, состоящая из 374 аминокислотных остатков, участка внутренней посадки рибосомы (IRES), обеспечивающего экспрессию обоих терапевтических генов с одного вектора (Mizuguchi Η, Xu Ζ et al. (2000) Mol Ther 1:376-82), гена hGM-CSF или mGM-CSF, при экспрессии которого синтезируется форма hGM-CSF или mGM-CSF; сигнала полиаденилирования и терминатора транскрипции SV40, обеспечивающих синтез зрелой РНК генов и вспомогательных областей, необходимых для эффективного биосинтеза плазмидной ДНК в клетках штамма-продуцента E.coli.
Нуклеиновая кислота заключена в полимерный носитель - ПЭГ-ПЭИ-ТАТ, который представляет собой блок-сополимер полиэтиленимина (ПЭИ) и полиэтиленгликоля (ПЭГ) с коньюгированным ТАТ-пептидом, который обеспечивает доставку и проникновение в клетки опухоли плазмиды pCMV-HSVtk-GM-CSF. Используемые блок-сополимеры - неиммуногенны, низкотоксичны и легко модифицируемы для направленной доставки. Для облегчения проникновения в клетки к блок-сополимеру ПЭИ-ПЭГ дополнительно присоединяли ТАТ-пептид GRKKKRRQRC, фрагмент ТАТ-белка, повышающий способность блок-сополимера, в состав которого он входит, проникать в клетки (Ulasov AV, Khramtsov YV et al. (2011) Mol Ther 19:103-12), (Rudolph C, Plank С et al. (2003) J Biol Chem 278:11411-8).
При проникновении молекул плазмиды pCMV-HSVtk-GM-CSF внутрь опухолевых клеток, происходит синтез фермента HSVtk, способного конвертировать фосфорилировать нуклеозидный аналог ганцикловир до ганцикловиртрифосфата, затем последний фосфорилируется клеточными киназами до токсичной формы - ганцикловиртрифосфата. Ганцикловиртрифосфат при клеточном делении включается во вновь синтезированную цепь ДНК и обрывает ее дальнейший синтез, вызывая гибель клетки. Также при проникновении молекул плазмиды внутрь опухолевых клеток происходит синтез белка GM-CSF, вызывающего рост, развитие и дифференцировку гранулоцитов и антиген-представляющих клеток.
Для достижения поставленного результата была создана фармакологическая композиция, представляющая собой комплекс плазмиды pCMV-HSVtk-GM-CSF и носителя ПЭГ-ПЭИ-ТАТ в HEPES-глюкозно-боратном буфере, обозначеная далее как ЛСм при использовании mGM-CSF или ЛСч в случае hGM-CSF. Для достижения поставленного результата ЛСм вводили интратуморально (и/т), с последующим введением пролекарства - ганицикловира (Гц, использован препарат «Цимевен»). Клетки опухоли, содержащие ЛС, превращали пролекартсво в токсический агент за счет HSVtk, который представляет собой фермент, катализирующий присоединение фосфатного остатка к Гц. Фосфорилированный Гц под действием клеточных киназ фософорилируется до трифосфата, который, включаясь в растущую цепь ДНК, приводит к гибели раковые клеток. Гибель раковых клеток сопровождается активацией иммунной системы за счет GM-CSF, кодируемого плазмидой ЛС. Так достигается дополнительный эффект «противоопухолевой вакцинации» организма, и, как следствие, становится возможным удаление отдаленных метастазов.
Настоящее изобретение относится к фармкомпозиции, состоящей из оболочки в виде модифицированного полиплекса (полимерного носителя), в которую будет заключен генетический материал, содержащий компоненты, используемые в ГНЭПТ системах для целей генотерапии рака.
В еще одном аспекте настоящее изобретение относится к экспрессионному вектору, содержащему экспрессионную кассету настоящего изобретения. При этом экспрессионный вектор настоящего изобретения представляет собой невирусный вектор, представленный сверхспирализованной плазмидой.
В следующем аспекте настоящее изобретение относится к фармакологической композиции, содержащей терапевтически эффективное количество экспрессионной кассеты или вектора настоящего изобретения и фармацетвически приемлемое вспомогательное вещество, которое без ограничения может быть представлено носителем, растворителем, эксципиентом, наполнителем, буферным агентом, стабилизатором, консервантом и т.д.
Фармакологическая композиция настоящего изобретения может быть использована для лечения широкого спектра онкологических заболеваний, причем заболевание без ограничения может быть выбрано из группы, включающей: рак легкого, рак поджелудочной железы, меланому, фибросаркому, саркому, рак головы и шеи.
В еще одном аспекте настоящее изобретение относится к способу лечения онкологического заболевания, включающему введение пациенту фармакологической композиции настоящего изобретения.
Способ лечения настоящего изобретения предусматривает внутриопухолевое введение фармакологической композиции настоящего изобретения. Способ лечения может быть использован для лечения онкологического заболевания, без ограничения, выбранного из группы, включающей: рак легкого, рак поджелудочной железы, меланому, фибросаркому, саркому, рак головы и шеи.
Наконец, еще в одном своем аспекте настоящее изобретение относится к применению экспрессионной кассеты или вектора настоящего изобретения для изготовления лекарственного средства для лечения онкологического заболевания. Онкологическое заболевание без ограничения может быть выбрано из группы, включающей: рак легкого, рак поджелудочной железы, меланому, фибросаркому, саркому, рак головы и шеи.
Краткое описание чертежей
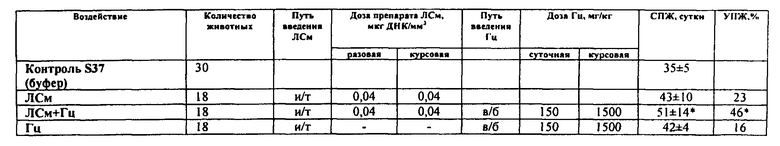
Рис.1. Динамика роста опухоли саркомы S37. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 8-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили неоднократно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг).
Рис.2. Динамика роста опухоли саркомы S37. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 8-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т однократно в разовых дозах 0,01; 0,04; 0,08 и 0,1 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг).
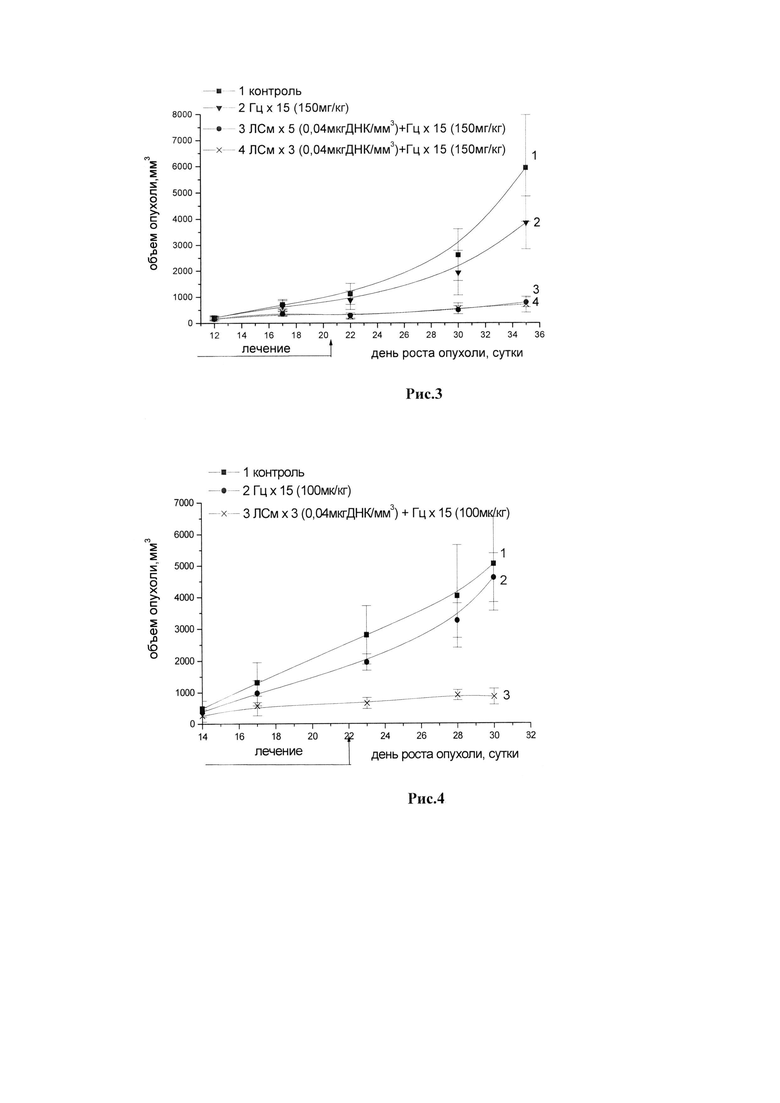
Рис.3. Динамика роста опухоли саркомы S37. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т трехкратно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг).
Рис.4. Динамика роста опухоли аденокарциномы С26. Мыши BALB/c, самки с опухолью С 26 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т трехкратно или пятикратно в дозе 0,04 мкг ДНК/мм3. Интервал между введением ЛСм - 3 или 5 дней. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг).
Рис.5. Динамика роста опухоли плоскоклеточного рака шейки матки РШМ5. Мыши BDF1, самки с опухолью РШМ5 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 10-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т трехкратно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг).
Рис.6. Динамика роста опухоли саркомы S37. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм-ПП - предлагаемое лекарственное средство, в котором в качестве полимерного носителя использован блок-сополимер: полиэтиленгликоль - полиэтиленимин - ТАТ пептид. ЛСм-ЛФ - контрольное лекарственное средство, в котором в качестве полимерного носителя использован липофектамин. ЛСм-ПП/ЛСм-ЛФ вводили и/т трехкратно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг).
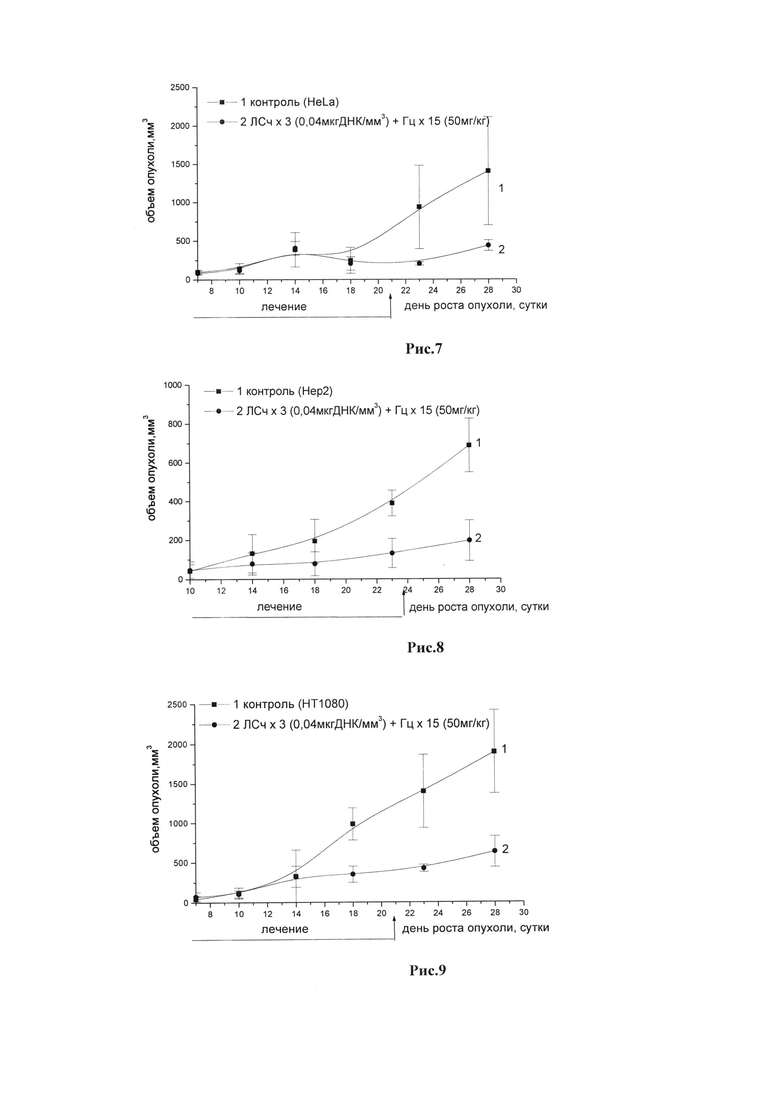
Рис.7. Динамика роста опухоли HeLa у иммунодефицитных мышей под воздействием ЛСч. Мыши nude/c, самки (n=5) с опухолью HeLa, которую перевивали подкожно по 2,6×106 клеток/мышь. Лечение мышей начинали на 7-е сутки роста опухоли. ЛСч вводили и/т 3 раза за курс в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б в разовой дозе 25 мг/кг дважды в день в течение 15 дней (курсовая доза 750 мг/кг).
Рис.8. Динамика роста опухоли Нер2 у иммунодефицитных мышей под воздействием ЛСч. Мыши nude/c, самки (n=5) с опухолью Нер2, которую перевивали подкожно по 2,0×106 клеток/мышь. Лечение мышей начинали на 10-е сутки роста опухоли. ЛСч вводили и/т 3 раза за курс в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б в разовой дозе 25 мг/кг дважды в день в течение 15 дней (курсовая доза 750 мг/кг).
Рис.9. Динамика роста опухоли НТ1080 у иммунодефицитных мышей под воздействием ЛСч. Мыши nude/c, самки (n=5) с опухолью НТ1080, которую перевивали подкожно по 3,0×106 клеток/мышь. Лечение мышей начинали на 7-е сутки роста опухоли. ЛСч вводили и/т 3 раза за курс в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б в разовой дозе 25 мг/кг дважды в день в течение 15 дней (курсовая доза 750 мг/кг).
Осуществление изобретения
Созданная фармкомпозиция является комбинированным препаратом, состоящим из 1) плазмиды, несущей экспрессионную кассету (ЭК), включающую промотор CMV который обеспечивает экспрессию нижерасположенных генов HSVtk и GM-CSF, а также генетические элементы, необходимые для экспрессии внедренной в ЭК генетической информации и наработке плазмиды в E.Coli; 2) специально подобранный полимерный носитель ПЭГ-ПЭИ-ТАТ, необходимый для компактизации плазмиды, служащий для доставки и проникновения в раковые клетки генетического материала.
Полученная фармкомпозиция может быть использована для экспрессии терапевтических генов в раковых клетках в составе экспрессионной кассеты. Избирательность воздействия на раковые клетки осуществляется как за счет интратуморального введения препарата, так и за счет сродства полимерного носителя к опухолевым клетках. Элиминация опухолевых клеток осуществляется за счет заключенной в полимерный носитель генетической информации в составе экспрессионной кассеты.
В качестве генов, подконтрольных промотору CMV в составе экспрессионных кассет, используют гены терапевтического вмешательства следующих групп:
1. Гены-убийцы.
2. Гены-иммуностимуляторы.
1. Гены-убийцы условно разделяют на две подгруппы в зависимости от типа действующего агента: токсичный сам по себе либо при определенных условиях. К генам-убийцам I типа относятся гены токсинов, а ко II типу - ферменты, способные катализировать превращение нетоксичного агента (пролекарство) в токсин, убивающий раковые клетки. Одним из наиболее эффективных генов II типа является ген тимидинкиназы вируса простого герпеса {HSVtk). Тимидинкиназа вируса простого герпеса (HSVtk) - фермент (376 а.о.), катализирующий реакцию фосфорилирования нуклеозидов с образованием нуклеозидмонофосфатов. HSVtk обладает способностью фосфорилировать низкотоксичный аналог гуанозина - ганцикловир до ганцикловирмонофосфата, при этом ее сродство к Гц примерно в 1000 раз выше, чем у киназ млекопитающих (Portsmouth D, Hlavaty J et al. (2007) Mol Aspects Med 28:4-41). Когда в опухолевые клетки доставляется извне Гц, клетки, трансформированные HSVtk, погибают, поскольку HSVtk превращает его в Гц-монофосфат, который затем клеточные киназы фосфорилируют до Гц-трифосфата, который, встраиваясь в растущую цепь ДНК раковых клеток во время деления, ингибирует ее синтез, тем самым обеспечивая гибель раковой клетки.
В настоящее время опубликованы результаты ряда клинических испытаний (КИ) системы HSVtk/GCV. Данная система является единственной ГНЭПТ системой, достигшей III фазы клинических испытаний (Westphal Μ, Yla-Herttuala S et al. (2013) Lancet Oncol 14:823-33), (Immonen A, Vapalahti Μ et al. (2004) Mol Ther 10:967-72), (Rainov NG (2000) Hum Gene Ther 11:2389-401). В ходе клинических испытаний пациенты с мультиформенной глиобластомой получали HSVtk/GCV терапию в комбинации с радиотерапией (Rainov NG (2000) Hum Gene Ther 11:2389-401). Такая схема лечения не привела к улучшению результатов, получаемых при использовании хирургического и последующего химиотерапевтического способов лечения. Однако впоследствии при использовании такой ГНЭПТ-терапии клинические и статистические показатели улучшились с 38 до 62 недель относительно результатов стандартной терапии (Klatzmann D, Valery С A et al. (1998) Hum Gene Ther 9:2595-604).
В начале 2009 года Управление по санитарному контролю за лекарственными средствами Франции одобрило генный препарат Cerepro®, представляющий собой аденовирусный вектор, несущий ген HSVtk, для лечения пациентов со злокачественной глиомой. Позднее, в ходе мультицентрового исследования III фазы было показано, что применение препарата Cerepro® у пациентов с мультиформной глиобластомой после оперативного вмешательства увеличивает время до возникновения рецидива, хотя не увеличивает общую выживаемость (Westphal Μ, Yla-Herttuala S et al. (2013) Lancet Oncol 14:823-33). Однако в другом исследовании было показано, что введение AdvHSVtk в сочетании с GCV пациентам с глиомой приводит к статистически достоверному увеличению продолжительности жизни пациентов (Immonen A, Vapalahti Μ et al. (2004) Mol Ther 10:967-72).
2. Гены-иммуностимуляторы способны мобилизировать иммунную систему пациентов, способствуя развитию специфического противоопухолевого ответа. В настоящее время три цитокина (IFN-α2a, IFN-α2b и IL-2) наиболее часто применяются для лечения онкологических заболеваний в качестве иммуностимуляторов (Dranoff G (2004) Nat Rev Cancer 4:11-22), (Seruga В, Zhang Η et al. (2008) Nat Rev Cancer 8:887-99). Противоопухолевая активность таких цитокинов, как интерлейкины (IL) 2, 4, 7, 12 и 18, фактор некроза опухоли α (ΦΗΟ-α) и GM-CSF, показана в различных исследованиях (Slavcev R, Wettig S et al. (2011)), (Cerullo V, Pesonen S et al. (2010) Cancer Res 70:4297-309), (Niculescu-Duvaz I and Springer С (2004) Methods in Molecular Medicine, Suicide gene therapy; methods and reviews. 90). Например, препарат Онковекс (Oncovex), предназначенный для лечения меланомы, а также рака головы и шеи, полученный на основе модифицированного вируса герпеса человека, несущего ген GM-CSF, в настоящее время проходит III фазу клинических испытаний (Kaufman HL and Bines SD (2010) Future Oncol 6:941-9).
Использование GM-CSF в комплексе с суицидальными генами приводит к увеличению эффективности терапии онкологических заболеваний. Показано, что регрессия опухоли значительно возрастает при совместном использовании гена-убийцы и GM-CSF (Hamilton JA (2002) Trends Immunol 23:403-8), (Hamilton JA and Anderson GP (2004) Growth Factors 22:225-31). В некоторых исследованиях продемонстрировано развитие специфического противоопухолевого иммунитета после совместной экспрессии HSVtk и GM-CSF в клетках опухоли (Guo SY, Gu QL et al. (2003) World J Gastroenterol 9:233-7).
Для транспортировки терапевтических генов в составе экспрессионной кассеты внутрь раковой клетки используют экспрессионные векторы.
Экспрессионный вектор представляет собой молекулу нуклеиновой кислоты, способную транспортировать экспрессионную кассету внутрь клетки. В предлагаемом изобретении экспрессионный вектор - это плазмида, обладающая способностью к автономной репликации в определенных клетках. Векторная молекула обладает следующими свойствами: 1) вектор может длительное время существовать в популяции клеток-хозяев, т.е. реплицироваться автономно; 2) вектор содержит биохимические и/или генетические маркеры, которые позволяют обнаруживать его присутствие в клетках; 3) структура векторной молекулы допускает встраивание в нее чужеродной последовательности нуклеотидов без нарушения ее функциональной целостности.
В целях генной терапии обычно используют несколько типов векторов, отличаемых по способу доставки генетического материала. Так, векторы бывают вирусными и невирусными. В настоящее время способ доставки ДНК в раковые клетки с помощью вирусов является наиболее распространенным. Достоинство вирусных систем - высокая эффективность, недостаток - иммуногенность, а также сложность и высокая себестоимость производства (Prestwich RJ, Errington F et al. (2008) Clin Med Oncol 2:83-96).
В качестве вектора для невирусной доставки обычно используются плазмиды, которые можно нарабатывать в больших количествах в бактериальных культурах.
Плазмида содержит специальные последовательности, необходимые для ее наработки вне организма - точку начала репликации (ori), ген устойчивости к антибиотику, сайт множественного клонирования (MCS). В отличие от вирусных векторов плазмиды довольно просто конструировать и нарабатывать в больших количествах. Плазмиды обеспечивают довольно высокий уровень безопасности при использовании по сравнению с вирусными векторами (Williams PD and Kingston PA (2011) Cardiovasc Res 91:565-76).
Для доставки плазмидных векторов в клетки опухоли используется два подхода. Первый подход использует в качестве вектора доставки искусственные липидные везикулы - липосомы, способные проникать через плазматическую мембрану. Второй способ предполагает использование поликатионных носителей для создания комплекса с ДНК. В качестве поликатионного носителя может выступать полиэтиленимин или поликатионные липосомы, однако при этом образуются большие по размеру комплексы, которые достаточно сложно доставить внутрь клетки (Wagstaff KM and Jans DA (2007) Biochem J 406:185-202).
Для эффективной невирусной доставки вектор должен обладать комбинацией таких свойств, как способность образовывать комплекс с ДНК, конденсировать ДНК в более компактное состояние, защищать ее от действия нуклеаз, обеспечивать эффективное прохождение через клеточные и ядерные мембраны, и при этом не ингибировать транскрипцию ДНК. В зависимости от типа препарата, противораковые препараты ГТ могут вводиться пациенту внутривенно, внутрибрюшинно, внутриопухолево, подкожно или внутримышечно в зависимости от локализации опухоли и распространенности заболевания. Так, эффективность внутриопухолевого введения была показана на основе препарата аденовируса, содержащего гены бактериальной цитозиндезаминазы и тимидинкиназы вируса простого герпеса - Ad5-CD/TKrep. Препарат вводили в простату, с последующим администрированием 5-фторцитозина и ганцикловира (Freytag SO, Khil Μ et al. (2002) Cancer Res 62:4968-76).
В некоторых случаях, препарат представляет собой лиофилизованную ДНК, что является наиболее удобной формой для хранения и использования в качестве инъекций. Для предотвращения потери трансфекционной активности ДНК, перед процессом лиофилизации к ДНК добавляются моно и дисахариды, такие как лактоза, глюкоза и сахароза. Сахара также используют при лиофилизации комплексов ДНК и поликатионов.
Таким образом, генно-терапевтическая фармакологическая композиция должна содержать: 1) экспрессионную кассету в составе экспрессионного вектора, несущую терапевтические гены под контролем промотора; 2) носитель для обеспечения проникновения экспрессионного вектора, содержащего экспрессионную кассету, через мембрану клетки. При использовании невирусного типа доставки носитель должен быть положительно заряженным для образования комплекса с ДНК (полиэтиленимин и другие поликатионы). Вспомогательными компонентами в генно-терапевтической фармакологической композиции могут быть сахара (моно и дисахариды), буферные растворы, антибактериальные агенты и другие.
Данные, полученные на животных, могут быть экстраполированы на человека с солидными опухолями. Так при регрессии первичной опухоли более 80% пациентам может быть рекомендовано двукратное введение препарата, при регрессии более 60 но менее 80% - трехкратное введение препарата, при регрессии опухоли более 40, но менее 60% - четырехкратное введение препарата, при регрессии менее 40% - пятикратное введение препарата. Промежуток времени между введениями препарата зависит от степени агрессивности опухоли, а также от компонентов, используемых в составе комбинированной противоопухолевой терапии.
Примеры
Приведенные ниже примеры предназначены исключительно для иллюстрации отдельных предпочтительных воплощений, но не должны рассматриваться в качестве ограничивающих объем настоящего изобретения.
Пример 1. Оценка на экспериментальной модели опухоли - саркоме S37 противоопухолевой эффективности системы ЛСм+Гц при однократном введении ЛСм
Оценка противоопухолевой эффективности системы ЛСм+Гц, где ДНК лекарственного средства (ЛСм) включает ген гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) мыши, проведена на мышах BDF1 с саркомой S37, привитой подкожно. Лечение начинали на 8-е сутки роста опухоли, когда объем опухоли в среднем составлял ~100 мм3. Лекарственное средство вводили и/т однократно, дозу ЛСм рассчитывали с учетом объема опухоли, используя 0,04 мкг ДНК/мм3. Через 12 часов после введения ЛСм проводили первое внутрибрюшинное (в/б) введение Гц. Далее введение Гц осуществляли в/б дважды в день с интервалом 12 ч в разовой дозе 75 мг/кг (в суточной дозе 150 мг/кг) в течение 10 дней (курсовая доза 1500 мг/кг).
Эффективность лечения экспериментальной саркомы S37 проявлялась в биологически значимом торможении роста опухоли - от 54% до 62% в течение 14 суток, ингибировании метастазирования на 62% (на 30 сутки роста опухоли) и увеличении продолжительности жизни животных на 46% (рис. 1, табл. 1-3).
Таблица 1. Влияние системы ЛСм+Гц на рост саркомы S-37 (однократное введение ЛСм). Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 8-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т однократно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Таблица 2. Влияние системы ЛСм+Гц на метастазирование саркомы S-37 (однократное введение ЛСм). Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 8-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т однократно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).
 Таблица 3. Влияние системы ЛСм+Гц на продолжительность жизни мышей с саркомой S37 (однократное введение ЛСм). Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 8-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т однократно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).
Таблица 3. Влияние системы ЛСм+Гц на продолжительность жизни мышей с саркомой S37 (однократное введение ЛСм). Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 8-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т однократно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).
Пример 2. Оценка на экспериментальной модели опухоли - саркоме S37 противоопухолевой эффективности системы ЛСм+Гц при однократном введении ЛСм в различных дозах.
Оценка противоопухолевой эффективности системы ЛСм+Гц при ее однократном введении в разовых дозах 0,01; 0,04; 0,08 и 0,1 мкг ДНК/мм3 проведена на мышах BDF1 с саркомой S37, привитой подкожно. Лечение начинали на 8-е сутки роста опухоли, когда объем опухоли в среднем составлял ~100 мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг).
Эффективность лечения экспериментальной саркомы S37 зависела от дозы ЛСм и проявлялась в биологически значимом торможении роста опухоли в течение 14 суток, возрастая в пределах 54%-74% при повышении дозы ЛСм. Продолжительность жизни животных увеличивалась в пределах 42-69% (рис. 2, табл. 4-5) в зависимости от разовой дозы ЛСм.
При введении животным ЛС в однократной дозе 0,02 и 0,03 ДНК/мм3 показатель ТРО не отличался от такового, полученного при использовании однократной дозы 0,01 ДНК/ мм3. При введении животным ЛС в однократной дозе 0,05; 0,06 и 0,07 ДНК/мм3 не происходило увеличение ТРО, достигнутого при использовании ЛС в однократной дозе 0,04 ДНК/мм3. Введение животным ЛС в однократной дозе 0,09 ДНК/мм3 не приводило к значимому увеличению ТРО по сравнению с однократной дозой 0,1 ДНК/мм3
Таблица 4. Влияние системы ЛСм+Гц на рост саркомы S37 при однократном введении ЛСм в различных дозах. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 8-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т однократно в разовых дозах 0,01; 0,04; 0,08 и 0,1 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).
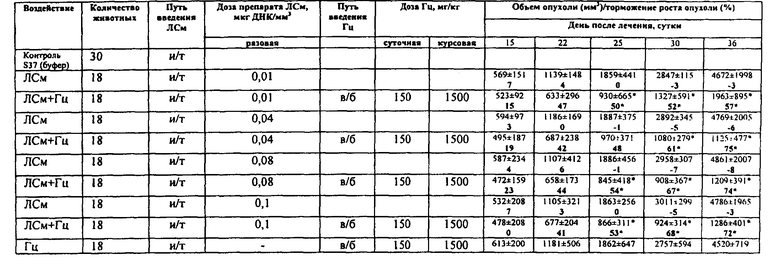
Таблица 5. Влияние системы ЛСм+Гц на продолжительность жизни мышей с саркомой S37 при однократном введении ЛСм в различных дозах. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 8-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т однократно в разовых дозах 0,01; 0,04; 0,08 и 0,1 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 10 дней (курсовая доза 1500 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Двукратное введение животным ЛС в разовой дозе 4 мкг ДНК/мышь (курсовая доза 8 мкг ДНК/мышь), не приводило к увеличению показателя ТРО по сравнению с группой животных, леченных с использованием схемы, подразумевающей однократное введение ЛС. Торможение роста опухоли при двукратном введении комбинации составляло 52% (р<0,05) через 14 дней после окончания лечения (36-й день роста опухоли).
Пример 3. Оценка на экспериментальной модели опухоли - саркоме S37 противоопухолевой эффективности системы ЛСм+Гц при трехкратном или пятикратном введении ЛСм.
Оценка противоопухолевой эффективности системы ЛСм+Гц при трехкратном/пятикратном введении ЛСм проведена на мышах BDF1 с саркомой S37, привитой подкожно. Лечение начинали на 7-е сутки роста опухоли, когда объем опухоли в среднем составлял ~100 мм3. Лекарственное средство вводили и/т трехкратно или пятикратно в дозе 0,04 мкг ДНК/мм3. Интервал между введением ЛСм - 5 дней (трехкратное введение ЛСм) или 3 дня (пятикратное веление ЛСм). Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг). Способ введения ЛСм: по мере увеличения объема опухоли возникала необходимость изменять топологию введения ЛСм. При начале терапия (~100 мм3) для равномерного распределения ЛСм в ткани опухоли достаточно вводить конструкцию в центр опухоли. По мере роста опухолевого узла для равномерности распределения генетического материала его введение проводили в несколько точек: от 3-х до 10-ти по периферии и в центре опухоли. Количество «обкалываний» опухоли проводили по следующей схеме: для опухоли ~100 мм3 делали 1 укол ЛСм, для опухоли ~300 мм3 делали 2 укола ЛСм, для опухоли ~500 мм3 делали 3 укола, для опухоли ~700 мм3 делали 4 укола ЛСм, для опухоли ~800 мм3 делали 5 уколов ЛСм, для опухоли ~1000 мм3 делали 6 уколов ЛСм, для опухоли ~1200 мм3 делали 7 уколов ЛСм, для опухоли ~1500 мм3 делали 8 уколов ЛСм, для опухоли ~1800 мм3 делали 9 уколов ЛСм, для опухоли ~2000 мм3 делали 10 уколов ЛСм.
Эффективность лечения экспериментальной саркомы S37 проявлялась:
1. При трехкратном введении ЛСм в биологически значимом торможении роста опухоли 78% - 88% в течение 14 суток; ингибировании метастазирования 74% (на 30 сутки роста опухоли) и увеличении продолжительности жизни животных на 81% (рис. 3, табл. 6-8).
2. При четырехкратном введении ЛСм в биологически значимом торможении роста опухоли 80%-85% в течение 14 суток; ингибировании метастазирования 75% (на 30 сутки роста опухоли) и увеличении продолжительности жизни животных на 77%.
3. При пятикратном введении ЛСм в биологически значимом торможении роста опухоли 74%-86% в течение 14 суток, ингибировании метастазирования 79% (на 30 сутки роста опухоли) и увеличении продолжительности жизни животных на 83% (рис. 3, табл. 6-8).
Таблица 6. Влияние системы ЛСм+Гц на рост саркомы S37 (трехкратное введение ЛСм). Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). Лекарственное средство вводили и/т трехкратно или пятикратно в дозе 0,04 мкг ДНК/мм3. Интервал между введением ЛСм - 3 или 5 дней. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг).
∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Таблица 7. Влияние системы ЛСм+Гц на метастазирование саркомы S37 (трехкратное введение ЛСм). Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). Лекарственное средство вводили и/т трехкратно или пятикратно в дозе 0,04 мкг ДНК/мм3 (курсовые дозы - 0,12 и 0,20 мкг ДНК/мм3). Интервал между введением ЛСм - 3 или 5 дней. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).
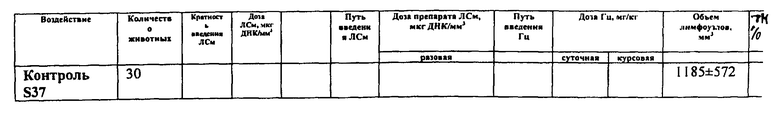

Таблица 8. Влияние системы ЛСм+Гц на продолжительность жизни мышей с саркомой S37 (трехкратное введение ЛСм). Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). Лекарственное средство вводили и/т трехкратно или пятикратно в дозе 0,04 мкг ДНК/мм3. Интервал между введением ЛСм - 3 или 5 дней. Гц вводили в/б в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг).
∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Пример 4. Оценка на экспериментальной модели опухоли - аденокарциноме толстой кишки С26, противоопухолевой эффективности системы ЛСм+Гц при трехкратном введении ЛСм.
Исследования противоопухолевой эффективности системы ЛСм+Гц проведены на мышах BALB/c с аденокарциномой толстой кишки С26, привитой подкожно. Лечение начинали на 7-ой день роста опухоли, когда средний объем опухолей был ~100 мм3. ЛСм вводили интратуморально в разовой дозе 0,04 мкг ДНК/мм3 опухоли трехкратно за курс. Интервал между введением - 5 дней. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 100 мг/кг в течение 15 дней (курсовая доза 1500 мг/кг).
Эффективность лечения экспериментальной аденокарциномы толстой кишки С26 проявлялась в биологически значимом торможении роста опухоли - от 54% до 83% в течение 14 суток и увеличении продолжительности жизни животных на 50% (рис. 4, табл. 9-10).
Таблица 9. Влияние системы ЛСм+Гц на рост аденокарциномы С26. Мыши BALB/c, самки с опухолью С 26 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т трехкратно в разовой дозе 0,04 мкг/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 100 мг/кг в течение 15 дней (курсовая доза 1500 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Таблица 10. Влияние системы ЛСм+Гц на продолжительность жизни мышей с аденокарциномой С26. Мыши BALB/c, самки с опухолью С 26 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т трехкратно в разовой дозе 0,04 мкг/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 100 мг/кг в течение 15 дней (курсовая доза 1500 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Пример 5. Оценка на экспериментальной модели опухоли - раке шейки матки (РШМ5) противоопухолевой эффективности системы ЛСм+Гц при трехкратном введении ЛСм.
Исследования противоопухолевой эффективности системы ЛСм+Гц проведены на модели перевиваемой опухоли - плоскоклеточного рака шейки матки (РШМ5). Опухоль РШМ5 прививали мышам BDF1, самкам, подкожно. Лечение начинали на 10-й день роста опухоли, когда средний объем опухолей был ~100 мм3. ЛСм вводили интратуморально в разовой дозе 0,04 мкг ДНК/мм3 опухоли трехкратно за курс. Интервал между введением - 5 дней. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг). Эффективность лечения экспериментальной опухоли - РШМ5 проявлялась в биологически значимом торможении роста опухоли - от 58% до 61% в течение 7-ми суток и увеличении продолжительности жизни животных на 23% (рис. 5, табл. 11-12).
Таблица 11. Влияние системы ЛСм+Гц на рост опухоли РШМ5. Мыши BDF1, самки с опухолью РШМ5 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 10-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т трехкратно в разовой дозе 0,04 мкг/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Таблица 12. Влияние системы ЛСм+Гц на продолжительность жизни мышей с раком шейки матки РШМ5. Мыши BDF1, самки с опухолью РШМ5 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 10-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм вводили и/т трехкратно в разовой дозе 0,04 мкг/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).
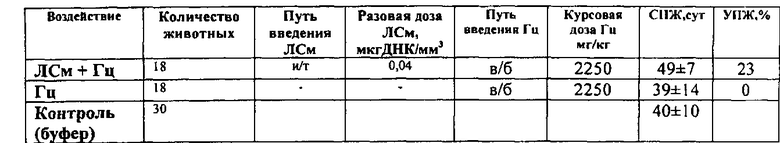
Пример 6. Сравнение противоопухолевого действия системы ЛСм+Гц, в котором в качестве полимерного носителя использован липофектамин (ЛСм-ЛФ) или блок-сополимер: полиэтиленгликоль-полиэтиленимин-ТАТ пептид (ЛСм-ПП) на экспериментальной модели опухоли - саркоме S37.
Сравнение противоопухолевой эффективности систем ЛСм-ПП+Гц и ЛСм-ЛФ+Гц, где ЛСм-ПП - лекарственное средство с полиплексом в качестве носителя, ЛСм-ЛФ -лекарственное средство с липофектамином в качестве носителя, проведено на мышах BDF1 с саркомой S37, привитой подкожно. Лечение начинали на 7-е сутки роста опухоли, когда объем опухоли в среднем составлял ~100 мм3. Лекарственные средства вводили и/т трехкратно в дозах 0,04 мкг ДНК/мм3. Интервал между введением - 5 дней. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг).
Эффективность лечения экспериментальной саркомы S37 проявлялась в биологически значимом торможении роста опухоли в течение 11 суток - от 60% до 76% и от 71% до 75% при введении ЛСм-ПП и ЛСм-ЛФ соответственно, ингибировании метастазирования на 70% и 71% соответственно (на 30 сутки роста опухоли) и увеличении продолжительности жизни животных на 62% и 70% соответственно (рис. 6, табл. 13-15).
Таблица 13. Влияние систем ЛСм-ЛФ+Гц и ЛСм-ПП+Гц на рост саркомы S37. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм-ПП и ЛСм-ЛФ- лекарственные средства, в которых в качестве полимерного носителя использован липофектамин и блок-сополимер: полиэтиленгликоль-полиэтиленимин-ТАТ пептид соответственно. ЛСм-ПП/ЛСм-ЛФ вводили и/т трехкратно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Таблица 14. Влияние систем ЛСм-ЛФ+Гц и ЛСм-ПП+Гц на метастазирование саркомы S37. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли ~100 мм3). ЛСм-ПП и ЛСм-ЛФ - лекарственные средства, в которых в качестве полимерного носителя использован липофектамин и блок-сополимер: полиэтиленгликоль-полиэтиленимин-ТАТ пептид соответственно. ЛСм-ПП/ЛСм-ЛФ вводили и/т трехкратно в разовой дозе 0,04 мкг/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Таблица 15. Влияние систем ЛСм-ЛФ+Гц и ЛСм-ПП+Гц на продолжительность жизни мышей с саркомой S37. Мыши BDF1, самки с опухолью S37 (п/к) (в опытных группах - по 18 животных, в контрольных группах - по 30 животных). Лечение начинали на 7-е сутки роста опухоли (объем опухоли - 100 мм3). ЛСм-ПП и ЛСм-ЛФ - лекарственные средства, в которых в качестве полимерного носителя использован липофектамин и блок-сополимер: полиэтиленгликоль-полиэтиленимин-ТАТ пептид соответственно. ЛСм-ПП/ЛСм-ЛФ вводили и/т трехкратно в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили в/б дважды в день (интервал - 12 ч) в суточной дозе 150 мг/кг в течение 15 дней (курсовая доза 2250 мг/кг). ∗ - отличие от группы животных, которым вводили буферный раствор, статистически значимо (р<0,05).

Полученные результаты свидетельствуют о высокой эффективности обеих генно-терапевтических систем и отсутствии достоверных различий в их эффективности.
Пример 7. Оценка противоопухолевой эффективности системы ЛСч+Гц у иммунодефицитных мышей на ксенографтах: Нер2, HeLa, НТ1080.
Оценка противоопухолевой эффективности системы ЛСч+Гц, где ДНК лекарственного средства (ЛСч) включает ген гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) человека, проведена на мышах nude/c с гетеротрансплантатами опухолей человека. Использовали: мышей nude/c, самок (n=5) с опухолью HeLa, которую перевивали подкожно по 2,6×106 клеток/мышь; мышей nude/c, самок (n=5) с опухолью НТ1080, которую перевивали подкожно по 3,0×106 клеток/мышь; мышей nude/c, самок (n=5) с опухолью Нер2, которую перевивали подкожно по 2,0×106 клеток/мышь. Лечение мышей с HeLa/HT1080 начинали на 7-е сутки роста опухоли, с Нер2 - на 10-е сутки. ЛСч вводили и/т 3 раза за курс в разовой дозе 0,04 мкг ДНК/мм3. Ганцикловир в составе препарата «Цимевен» вводили в/б в разовой дозе 25 мг/кг дважды в день (суточная доза 50 мг/кг) в течение 15 дней (курсовая доза 750 мг/кг).
Эффективность лечения мышей проявлялась в биологически значимом торможении роста опухоли:
- мышей с опухолью HeLa - от 69% до 78% в течение 6 суток,
- мышей с опухолью НТ1080 - от 65% до 70% в течение 11 суток;
- мышей с опухолью Нер2 - от 60% до 71% в течение 11 суток.
(рис. 7-9, табл. 16).
Таблица 16. Противоопухолевое действие ЛСч на бестимусных мышах nude/c с опухолью Мыши nude/c, самки с опухолью HeLa, которую перевивали подкожно по 2,6×106 клеток/мышь. Мыши nude/c, самки с опухолью НТ1080, которую перевивали подкожно по 3,0×106 клеток/мышь. Мыши nude/c, самки с опухолью Нер2, которую перевивали подкожно по 2,0×106 клеток/мышь. Лечение мышей с HeLa/HT1080 начинали на 7-е сутки роста опухоли, с Нер2 - на 10-е сутки. ЛСч вводили и/т 3 раза за курс в разовой дозе 0,04 мкг ДНК/мм3. Гц вводили внутрибрюшинно в разовой дозе 25 мг/кг дважды в день (суточная доза 50 мг/кг) в течение 15 дней (курсовая доза 750 мг/кг).

| название | год | авторы | номер документа |
|---|---|---|---|
| УНИВЕРСАЛЬНЫЙ ПРОМОТОР ДЛЯ ЭКСПРЕССИИ ТЕРАПЕВТИЧЕСКИХ ГЕНОВ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ | 2013 |
|
RU2551784C1 |
| УНИВЕРСАЛЬНЫЕ РАКОВОСПЕЦИФИЧНЫЕ ПРОМОТОРЫ И ИХ ИСПОЛЬЗОВАНИЕ В ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ | 2013 |
|
RU2539764C2 |
| Генотерапевтический препарат FCU1-BsFm/PP для лечения солидных опухолей | 2023 |
|
RU2824977C1 |
| Лекарственная комбинация для ген-иммунной терапии | 2022 |
|
RU2792683C1 |
| МНОГОПРОФИЛЬНЫЙ ПРОМОТОР, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР И СПОСОБ ИЗБИРАТЕЛЬНОГО УБИЙСТВА РАКОВЫХ КЛЕТОК С ИХ ИСПОЛЬЗОВАНИЕМ | 2012 |
|
RU2476596C1 |
| Пептид, обладающий противоопухолевой и антиметастатической активностью, и готовая лекарственная форма на его основе | 2018 |
|
RU2682039C1 |
| Способ повышения эффективности ингибиторов иммунных контрольных точек при помощи терапевтической композиции на основе производных индола и пробиотика | 2023 |
|
RU2826495C1 |
| РЕКОМБИНАНТНЫЙ АДЕНОВИРУС, КОТОРЫЙ СОДЕРЖИТ РИБОЗИМ, ОПОСРЕДУЮЩИЙ ТРАНС-СПЛАЙСИНГ, И ПРОТИВОРАКОВЫЙ ТЕРАПЕВТИЧЕСКИЙ ГЕН, И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2575620C2 |
| СПОСОБ МОДИФИКАЦИИ ФОТОДИНАМИЧЕСКОГО ЛЕЧЕНИЯ | 2010 |
|
RU2449821C1 |
| СПЕЦИФИЧЕСКАЯ СОЧЕТАННАЯ ТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЦИТОСТАТИКОМ И ЕГО МОДИФИКАТОРОМ | 2015 |
|
RU2571551C1 |


Изобретение относится к биотехнологии, в частности к получению противоопухолевых лекарственных средств для генной терапии, и может быть использовано в медицине. Получают лекарственное противоопухолевое средство, содержащее генную конструкцию в форме плазмидной ДНК, включающей гены тимидинкиназы вируса простого герпеса (HSVtk) и гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), заключенную в полимерный носитель - сополимер полиэтиленгликоль-полиэтиленимин-тat пептид (ПЭГ-ПЭИ-ТАТ). При этом генная конструкция обеспечивает экспрессию обоих терапевтических генов HSVtk и GM-CSF с одного вектора. Генная конструкция предназначена для интратуморального введения в режиме прогрессивно увеличивающейся разовой дозы, рассчитываемой в зависимости от объема опухоли, с последующим введением пролекарства - ганцикловира. Изобретение обеспечивает эффективную доставку и проникновение в клетки опухоли плазмиды pCMV-HSVtk-GM-CSF и позволяет с большой эффективностью избирательно уничтожать раковые клетки с предотвращением дальнейшего метастазирования. 2 н. и 6 з.п. ф-лы, 9 ил., 16 табл., 7 пр.
1. Лекарственное противоопухолевое средство, содержащее генную конструкцию в форме плазмидной ДНК, включающей гены тимидинкиназы вируса простого герпеса (HSVtk) и гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), где генная конструкция обеспечивает экспрессию обоих терапевтических генов HSVtk и GM-CSF с одного вектора и заключена в полимерный носитель, представляющий собой сополимер: полиэтиленгликоль-полиэтиленимин-тat пептид (ПЭГ-ПЭИ-ТАТ), где указанная генная конструкция предназначена для интратуморального введения в режиме прогрессивно увеличивающейся разовой дозы, рассчитываемой в зависимости от объема опухоли, перед введением пролекарства - ганцикловира.
2. Лекарственное средство в соответствии с п. 1, в котором использован цитомегаловирусный (CMV) промотор.
3. Лекарственное средство в соответствии с п. 1, в состав плазмидной ДНК которого включен ген гранулоцитарно-макрофагального колониестимулирующего фактора мыши.
4. Лекарственное средство в соответствии с п. 1, в состав плазмидной ДНК которого включен ген гранулоцитарно-макрофагального колониестимулирующего фактора человека.
5. Способ избирательного уничтожения опухолевых клеток путем введения двухкомпонентной системы: генетической конструкции в форме плазмидной ДНК, включающей гены HSVtk и GM-CSF и заключенной в полимерный носитель, представляющий собой сополимер ПЭГ-ПЭИ-ТАТ, которую вводят интратуморально в режиме прогрессивно увеличивающейся разовой дозы, рассчитываемой в зависимости от объема опухоли, с последующим введением пролекарства - ганцикловира.
6. Способ избирательного уничтожения опухолевых клеток в соответствии с п. 5, при котором вводят лекарственное средство по п. 1.
7. Способ избирательного уничтожения опухолевых клеток в соответствии с п. 5, при котором лекарственное средство по п. 1 вводят в несколько точек опухоли в зависимости от размера опухоли, распределяя точки введения равномерно по площади поражения.
8. Способ избирательного уничтожения опухолевых клеток в соответствии с п. 5, при котором после каждого введения лекарственного средства по п. 1 ганцикловир вводят дважды в сутки.
Авторы
Даты
2016-02-10—Публикация
2013-12-19—Подача