Перекрестная ссылка на родственные заявки
[0001] По настоящей заявке испрашивает приоритет, согласно 35 USC §119(e), временной заявки на патент США 61/887166, поданной 4 октября 2013 г., содержание которой полностью включено в настоящую заявку посредством ссылки.
Область техники, к которой относится изобретение
[0002] Настоящее изобретение относится к области иммунотерапевтических противоопухолевых агентов.
Уровень техники
[0003] Иммунные контрольные точки представляют собой ингибиторные молекулы, обеспечивающие ингибирование эффективного иммунного ответа против рака, которое может привести к ускользанию опухоли от иммунных механизмов. Считают, что молекулы иммунологических контрольных точек, такие как антиген цитотоксических Т-лимфоцитов 4 (CTLA-4, cytotoxic T-lymphocyte antigen 4) и белок запрограммированной клеточной смерти 1 (PD-1, programmed cell death 1) наряду с лигандом запрограммированной клеточной смерти 1 (PD-L1, programmed cell death ligand 1), участвуют в иммунной дисфункции, сопровождающей опухолевую прогрессию, и было показано, что их терапевтическая блокада дает клинические результаты. В частности, появление опухолевого PD-L1 с PD-1 на проникающих в опухоль цитотоксических Т-лимфоцитах считают важным механизмом, лежащим в основе ускользания опухоли от иммунных механизмов и устойчивости к иммунному ответу посредством индукции толерантности Т-клеток, их истощения и запрограммированной клеточной гибели. Понимание механизмов работы с молекулами иммунных контрольных точек во время иммунного ответа является важной стратегией создания эффективной иммунотерапии рака человека.
[0004] Трансактиватор транскрипции (Tat, trans-activator of transcription) вируса иммунодефицита человека (ВИЧ) является вариабельным РНК-связывающим пептидом, который повышает транскрипцию вирусной РНК, может запустить апоптоз в Т4 клетках и макрофагах и может стимулировать повышенное образование интерферона альфа. Однако белок Tat, выделенный из пациентов, долгое время инфицированных ВИЧ без прогрессии заболевания, отличается от Tat, обнаруживаемого у пациентов с прогрессией до синдрома приобретенного иммунодефицита (СПИД) в результате инфекции. Белок Tat, обнаруженный у пациентов, долгое время инфицированных ВИЧ без прогрессии заболевания, способен транс-активировать вирусную РНК, однако данный иммуностимулирующий Tat не индуцирует апоптоз в Т4 клетках или макрофагах и не является иммуносупрессорным. Однако варианты иммуностимулирующего Tat, обнаруженного у лентивирусов, инфицирующих различные виды обезьян, не вызывает развитие иммунодефицита и эпидемической инфекции в отношении дифференцировки моноцитов в дендритные клетки, которые стимулируют ответ цитотоксических Т-лимфоцитов. Таким образом, иммуностимулирующий Tat может выполнять функцию стимуляции иммунного ответа в отношении рака человека.
[0005] Рак и хронические инфекции являются наиболее выразительными примерами обычных заболеваний человека, отвечающих на иммунотерапию. Хотя инфекции были первыми заболеваниями, контролируемыми иммунизацией, данные клинических исследований, проведенных на людях, показали, что иммунный ответ, в частности ответ звена иммунной системы, связанного с цитотоксическими Т-лимфоцитами, мог вызывать регресс некоторых видов меланомы человека и рака почки. Эти наблюдения дополнило открытие того факта, что дендритные клетки, особый класс антигенпрезентирующих клеток, являются особенно эффективными в стимуляции активности цитотоксических Т-лимфоцитов в отношении рака и других заболеваний. Технологии, действующие и активирующие дендритные клетки, достигли некоторого успеха в отношении предраковых состояний шейки матки человека, вызванных инфекцией папилломавирусом человека, и рака легких человека. В отличие от химиотерапевтических лекарственных средств, которые применяют в настоящее время против рака, агенты, вызывающие противораковый ответ цитотоксических Т-лимфоцитов, потенциально вызывают несколько побочных эффектов, связанных с высокой специфичностью иммунного ответа.
[0006] Попытки разработать иммунотерапевтические лекарственные средства были затруднены техническими сложностями, связанными с целевым действием и активацией дендритных клеток для доставки и поддержания необходимых сигналов активации цитотоксических Т-лимфоцитов. Целенаправленное действие на антиген для индукции ответа цитотоксических Т-лимфоцитов представляет собой проблему, поскольку естественный процессинг требует поступления антигена в цитоплазму клетки для связывания антигена главного комплекса гистосовместимости (MHC, major histocompatibility complex) класса I иммунной системы, что является обязательным условием активации цитотоксических Т-лимфоцитов, поскольку лигандом для активации Т-клеточного рецептора цитотоксических Т-лимфоцитов является комплекс антигена и MHC класса I. Практически во всех случаях белковые антигены, даже будучи связанными с коактиватором дендритных клеток, проходят исключительно по пути презентации антигена через MHC класса II, исключающему стимуляцию цитотоксических Т-лимфоцитов. Это можно преодолеть частично с помощью пептидных технологий, поскольку пептиды связываются MHC класса I, который уже находятся на поверхности дендритных клеток. Однако данная технология является неспецифичной, а большинство пептидов плохо активируют дендритные клетки, что ограничивает их эффективность как лекарственных средств от рака человека.
[0007] Известно, что ограниченная группа биологических белков стимулирует ответ цитотоксических Т-лимфоцитов. Варианты и производные трансактиватора транскрипции (Tat, trans-activator of transcription) вируса иммунодефицита человека 1 (ВИЧ-1) могут стимулировать данный ответ цитотоксических Т-лимфоцитов. На сегодняшний день известно, что дополнительные биопрепараты на основе белков теплового шока или белков наружной оболочки определенных бактерий напрямую стимулируют ответ цитотоксических Т-лимфоцитов. Было показано, что белки теплового шока обладают ограниченной эффективностью в лечении определенных новообразований половых органов, связанных с инфекцией папилломавирусом человека.
Сущность изобретения
[0008] В настоящей заявке раскрыты производные трансактиватора транскрипции (Tat, trans-activator of transcription) вируса иммунодефицита человека (ВИЧ) для применения в качестве противораковых терапевтических агентов. Искусственные иммуностимулирующие производные Tat обладают способностью лечить рак.
[0009] В одном варианте осуществления настоящее изобретение относится к полипептидному производному трансактиватора транскрипции (Tat), имеющему аминокислотную последовательность, содержащую в следующем порядке: (i) последовательность домена транскрипционного фактора белка Tat вируса иммунодефицита человека (ВИЧ) или вируса иммунодефицита обезьян, (ii) последовательность цистеин-богатого домена из вируса иммунодефицита обезьян, ВИЧ или из дефензина и (iii) последовательность C-концевого домена белка Tat ВИЧ или вируса иммунодефицита обезьян.
[0010] Также в настоящей заявке раскрыта фармацевтическая композиция, содержащая полипептидное производное Tat, раскрытое в настоящей заявке.
[0011] В одном варианте применения полипептидного производного Tat ВИЧ является ВИЧ-1 или ВИЧ-2. В другом варианте осуществления настоящего изобретения Tat ВИЧ-1 происходит из пациента с долгим отсутствием прогрессии. В другом варианте осуществления настоящего изобретения вирус иммунодефицита обезьян происходит из хозяина, выбираемого из Таблицы 2. В другом варианте осуществления настоящего изобретения дефензин является α-дефензином или β-дефензином. В другом варианте осуществления настоящего изобретения полипептидное производное Tat также содержит аргинин-богатый домен из Tat ВИЧ-1 или ВИЧ-2.
[0012] В другом варианте применения полипептидного производного Tat по меньшей мере одна из аминокислот в домене транскрипционного фактора удалена или заменена аланином, аспарагиновой кислотой, глутаминовой кислотой, глицином, лизином, глутамином, аргинином, серином или треонином. В другом варианте осуществления настоящего изобретения по меньшей мере одна замененная аминокислота является пролином.
[0013] В некоторых вариантах осуществления настоящего изобретения домен транскрипционного фактора содержит аминокислотную последовательность одной из SEQ ID NO:96-123. В других вариантах осуществления настоящего изобретения цистеин-богатый домен содержит аминокислотную последовательность одного из SEQ ID NO:124-132. В других вариантах осуществления настоящего изобретения С-концевой домен содержит аминокислотную последовательность одного из SEQ ID NO:133-150.
[0014] В другом варианте осуществления настоящего изобретения полипептидное производное Tat обладает более чем 85% идентичностью последовательности с одной из SEQ ID NO 5-95. В другом варианте осуществления настоящего изобретения полипептидное производное Tat не является одной из SEQ ID NO:2, 3 или 4.
[0015] Также в настоящей заявке раскрыт способ лечения рака, включающий введение терапевтически эффективного количества полипептидного производного Tat или фармацевтической композиции, раскрытой в настоящей заявке, пациенту; и индукцию остановки роста опухоли или регрессии рака у пациента.
[0016] Также в настоящей заявке раскрыто применение терапевтически эффективного количества полипептидного производного Tat или фармацевтической композиции для лечения рака у пациента, вызывающее таким образом остановку роста опухоли или регрессию рака у пациента.
[0017] Также в настоящей заявке раскрыт способ уменьшения опухолевой массы у пациента с раком, при этом способ включает введение терапевтически эффективного количества полипептидного производного Tat или фармацевтической композиции, раскрытой в настоящей заявке, пациенту; и вызывает регрессию рака у пациента.
[0018] Также в настоящей заявке раскрыто применение терапевтически эффективного количества полипептидного производного Tat или фармацевтической композиции для уменьшения опухолевой массы у пациента с раком, вызывающее таким образом регрессию рака у пациента.
[0019] Также в настоящей заявке раскрыт способ ингибирования подавления противоопухолевого иммунного ответа у пациента с раком, при этом способ включает введение терапевтически эффективного количества полипептидного производного Tat или фармацевтической композиции, раскрытой в настоящей заявке, пациенту; при этом такое введение приводит к уменьшению или ингибированию роста опухоли или к регрессии рака у пациента.
[0020] Также в настоящей заявке раскрыто применение терапевтически эффективного количества полипептидного производного Tat или фармацевтической композиции для ингибирования подавления противоопухолевого иммунного ответа у пациента с раком, где введение полипептидного производного Tat приводит к уменьшению или ингибированию роста опухоли или к регрессии рака у пациента.
[0021] Также в настоящей заявке раскрыт способ лечения экспрессирующего PD-L1 рака у пациента с раком, при этом способ включает введение терапевтически эффективного количества полипептидного производного Tat или фармацевтической композиции, раскрытой в настоящей заявке; где введение полипептидного производного Tat приводит к уменьшению или ингибированию роста опухоли или к регрессии рака у пациента.
[0022] Также в настоящей заявке раскрыто применение терапевтически эффективного количества полипептидного производного Tat или фармацевтической композиции для лечения экспрессирующего PD-L1 рака у пациента с раком, где введение полипептидного производного Tat приводит к уменьшению или ингибированию роста опухоли или к регрессии рака у пациента.
[0023] В одном варианте осуществления способов или применений полипептидное производное Tat обладает более чем 85% идентичностью последовательности с одной из SEQ ID NO 5-95.
[0024] В одном варианте осуществления способов или применений полипептидное производное Tat вводят в виде множества доз. В другом варианте осуществления способов или применений введение включает повторяющиеся циклы введения, где каждый цикл включает введение множества доз полипептидного производного Tat в течение определенного промежутка времени, за которым следует период без введения, и где цикл повторяют много раз. В другом варианте осуществления способов или применений введение включает повторяющиеся циклы введения, где каждый цикл включает введение множества доз полипептидного производного Tat в течение определенного промежутка времени, за которым следует введение одной или множества доз терапевтического агента в течение определенного периода времени, и где цикл повторяют много раз. В другом варианте осуществления способов или применений терапевтический агент является циклофосфамидом.
[0025] В другом варианте осуществления способов или применений рак является аденокортикальной карциномой, раком анального канала, раком аппендикса, астроцитомой, базальноклеточной карциномой, раком желчного протока, раком мочевого пузыря, раком кости, раком мозга, раком груди, бронхиальной аденомой/бронхиальным карциноидом, карциноидной опухолью, раком шейки матки, хроническими миелопролиферативными нарушениями, раком толстого кишечника, десмопластической мелкокруглоклеточной опухолью, раком эндометрия, эпендимомой, раком пищевода, саркомой Юинга, герминогенными опухолями, раком глаза, раком желчного пузыря, раком желудка, желудочно-кишечной карциноидной опухолью, желудочно-кишечной стромальной опухолью, гестационной трофобластической опухолью, глиомой, карциноидом желудка, раком головы и шеи, раком сердца, гепатоцеллюлярным раком, лимфомой Ходжкина, гипофарингеальным раком, карциномой островковых клеток, саркомой Капоши, раком почек, лейкемиями, раком губ и ротовой полости, липосаркомой, раком печени, раком легких, лимфомами, макроглобулинемией, медуллобластомой, меланомой, карциномой из клеток Меркеля, мезотелиомой, раком ротовой полости, множественной миеломой/плазмаклеточной миеломой, фунгоидной гранулемой, раком носовой полости и придаточных пазух носа, раком носоглотки, нейробластомой, раком ротовой полости, раком ротоглотки, раком яичников, эпителиальным раком яичников, раком поджелудочной железы, раком паращитовидной железы, раком полового члена, раком глотки, феохромоцитомой, астроцитомой эпифиза, герминомой эпифиза, пинеобластомой, аденомой гипофиза, плевропульмонарной бластомой, раком простаты, раком прямой кишки, почечно-клеточным раком, ретинобластомой, рабдомиосаркомой, раком слюнных желез, саркомой, синдромом Сезари, раком кожи, плоскоклеточной карциномой, раком желудка, раком семенников, раком горла, тимомой, раком щитовидной железы, раком уретры, раком матки, саркомой матки, раком влагалища, раком вульвы, макроглобулинемией Вальденстрема или опухолью Вильмса.
[0026] В другом варианте осуществления способов или применений у пациента по меньшей мере одна опухоль перед лечением содержит по меньшей мере 5% экспрессирующих PD-L1 клеток, от 5% до 20% экспрессирующих PD-L1 клеток, от 5% до 15% экспрессирующих PD-L1 клеток или от 5% до 10% экспрессирующих PD-L1 клеток.
Краткое описание чертежей
[0027] Фиг. 1 показывает стимуляцию человеческих моноцитов производными Tat.
[0028] Фиг. 2 показывает кривую дозозависимости при стимуляции человеческих моноцитов производными Tat.
[0029] Фиг. 3A и 3B показывают эффект терапии производными Tat на рост опухоли 4T1 in vitro. Мышей BALB/c, инъецированных 1×104 опухолевыми клетками 4T1, обрабатывали Nani-P1 или Nani-P2 (400 нг, подкожно [п/к]) (Фиг. 3A) или Nani-P3 (400 нг или 2 мкг, п/к) (Фиг. 3B) в дни 0, 7, 14 и 21 после инъекции опухолевых клеток. Контрольную группу обрабатывали фосфатно-солевым буфером. Данные представляют собой средний объем опухоли; столбцы ± стандартная ошибка. В каждой группе было 10 мышей. Начиная с дня 15, различия между контрольной группой и группами, обработанными Nani-P1 или Nani-P2, были значительными (p<0,05**). Различия между контрольной группой и Nani-P2 или Nani-P2 были высокозначимыми, начиная с дня 22 (p<0,01**). Различий между Nani-P3 (в любой дозе) и контролями не было.
[0030] Фиг. 4 показывает кривую зависимости эффекта от дозы для эффектов очищенного Nani-P2 на рост опухоли молочной железы 4T1 in vivo. Четырем группам по десять мышей BALB/c в каждой имплантировали 1×104 клеток 4T1. Трем группам вводили возрастающие дозы 0,4 нг, 4 нг и 40 нг на мышь, соответственно, в левый бок четыре раза на протяжении 21 дня. Четвертой, контрольной, группе инъецировали в левый бок фосфатно-солевой буфер. Данные представляют собой средний объем опухоли. Различия между контрольной группой и группой получавших дозу 0,4 нг были значительными (p<0,5*), а различия между контролем и группами, обработанными 4 нг или 40 нг Nani-P2, были высокозначимыми (p<0,1**, p<0,01**).
[0031] Фиг. 5A и 5B показывают кривую выживаемости Каплана-Мейера при обработке Nani-P2 мышей, имеющих опухоли молочной железы 4T1. Мышам инъецировали п/к 1×104 клеток 4T1 в область молочной железы в день 0. В день 0 начинали обработку четырьмя дозами Nani-P2 (40 нг), которые вводили п/к. В день 42 выживаемость в группе обработанных мышей была статистически достоверно выше, чем в контроле (**) (Фиг. 5A). В одной группе терапию задерживали до дня 13, когда вводили серию из трех доз Nani-P2 (40 нг) еженедельно либо внутривенно (в/в), п/к в дренирующие лимфатические узлы, либо внутриопухолево (в/о) (Фиг. 5B). Преимущество в выживаемости в/в Nani-P2 было статистически высокозначимым в день 47 (**), в то время как преимущество в выживаемости п/к Nani-P2 было также статистически значимым (*).
[0032] Фиг. 6A и 6B показывают противоопухолевую активность Nani-P2 в моделях карциномы молочной железы TS/A и SM1. Мышам подкожно имплантировали 1×105 клеток рака молочной железы TS/A (Фиг. 6A) и подкожно обрабатывали их возрастающими дозами Nani-P2 (0,4, 4 и 40 нг). Даже при наименьшей дозе различие первичного противоракового эффекта было высокозначимым (p<0,01**), в то время как для дозы 40 нг различие также было высокозначимым (p<0,01***). Фиг. 6B показывает мышей, которым подкожно имплантировали 2×105 клеток рака молочной железы SM1 и которых обрабатывали Nani-P2 (40 нг) в дни 0, 7, 14 и 21. Различие роста первичной опухоли между контролем и обработанными Nani-P2 животными SM1 было статистически высокозначимым (p<0,01***).
[0033] Фиг. 7 показывает образование интерферона гамма IFN-γ (interferon γ) клетками селезенки мышей с опухолями молочной железы 4T1. Мышам Balb/c инъецировали подкожно 1x104 клеток 4T1. Контрольным животным еженедельно инъецировали фосфатно-солевой буфер, в то время как обработка Nani-P2 включала подкожные инъекции (40 нг) один раз в неделю, начиная с дня 0 и на протяжении 4 недель. В день 33, когда контрольные мыши находились на конечной стадии, мышей умерщвляли, собирали селезенки и замораживали в виде суспензии отдельных клеток до проведения исследования. Клетки селезенки (2×105) и 1×104 обработанных митомицином C (50 мкг/мл в течение 30 мин) стимулирующих клеток 4T1 (S, stimulator cells) рассевали в 96-луночные планшеты. Через 72 ч стимуляции собирали супернатанты и определяли концентрацию IFN-γ с помощью коммерческого набора для определения IFN-γ с помощью твердофазного иммуноферментного анализа (ELISA, enzyme-linked immunosorbent assay) (IFN-γ ELISA kit). Образование IFN-γ было значительно выше (p<0,05*) в культурах клеток селезенки из обработанных Nani-P2 мышей при всех условиях культуры in vitro. 1: отсутствие рестимуляции; 2: интерлейкин 4 (IL-4, interleukin-4) (50 нг/мл/GM-CSF (100 мг/мл); 3: стимулирующие клетки/IL-4/GM-CSF; 4: только стимулирующие клетки. Добавление in vitro агонистов IL-4 и GM-CSF (2 и 3) индуцировало высокозначимое увеличение образования IFN-γ (p<0,01**).
[0034] Фиг. 8A и 8B показывают регрессию сформированных опухолей молочной железы 4T1 и ингибирование метастазирование в легкие при обработке Nani-P2. На Фиг. 8A двум группам по 10 мышей BALB/c инъецировали 1×104 клеток 4T1 в область молочной железы в день 0. Одной группе вводили Nani-P2 (40 нг) еженедельно на протяжении трех недель, начиная с дня 14. Вторую группу обрабатывали фосфатно-солевым буфером и применяли в качестве контроля. Опухолевая масса была высокозначимой в день 22 и оставалась таковой на протяжении всего исследования (p<0,01**). Мышей умерщвляли, когда диаметр опухоли достигал 15 мм; в это время считали метастазы в легких (Фиг. 8B). Данные представляют общее количество метастаз в легких, подсчитанных двумя наблюдателями, которые не знали коды лечения согласно протоколу (p<0.01**).
[0035] Фиг. 9 показывает рост опухоли 4T1 и метастазы в легких у мышей BALB/c. Двум группам по 10 мышей BALB/c подкожно имплантировали 1×104 клеток 4T1 и внутривенно инъецировали мышам либо 40 нг Nani-P2, либо фосфатно-солевой буфер. В день лечения 28 мышей умерщвляли и удаляли легкие и опухоли, опухолевые узлы считали на глаз. Показаны фотографии опухолей и легких, репрезентативные для 10 мышей. На поверхности легких можно увидеть белесые опухолевые очаги. Три эксперимента дали схожие результаты.
[0036] Фиг. 10 показывает индуцированную обработкой Nani-P2 регрессию сформированных опухолей молочной железы 4T1. У одной из 10 мышей произошла полная ремиссия, и мышь оставалась здоровой на протяжении более 50 дней, когда исследование завершили. Двум группам по 10 мышей BALB/c инъецировали 1×104 клеток 4T1 в область молочной железы в день 0. Одной группе вводили Nani-P2 (40 нг) на мышь внутривенно еженедельно на протяжении трех недель, начиная с дня 14, а другую группу обрабатывали фосфатно-солевым буфером и применяли в качестве контроля. Различие роста первичной опухоли между контролем и обработанными Nani-P2 группами было высокозначимым (p<0,01***).
[0037] Фиг. 11 показывает рост опухоли после терапии повторяющимися дозами Nani-P2 и циклофосфамидом.
[0038] Фиг. 12 показывает преимущество в выживаемости при введении повторяющихся доз Nani-P2 и циклофосфамида по сравнению с еженедельным введением циклофосфамида.
[0039] Фиг. 13A-B показывает иммуногистохимическое окрашивание клеток CD8+ в ткани селезенки из мыши с карциномой молочной железы 4T1, обработанной фосфатно-солевым буфером (контроль, Фиг. 13A) или Nani-P2 (Фиг. 13B).
[0040] Фиг. 14A-14D показывает иммуногистохимическое окрашивание первичных опухолей молочной железы 4T1 на PD-L1 и CD8. Фиг. 14A показывает иммуногистохимическое окрашивание антителами к PD-L1 в контрольном обработанном фосфатно-солевым буфером животном. Окрашивание PD-L1 наблюдали в клетках, морфологически напоминающих миелоидные супрессорные клетки, ассоциированный с опухолью макрофаг, а также ассоциированные с опухолью дендритные клетки и фибробласт. Фиг. 14B показывает иммуногистохимическое окрашивание в обработанной Nani-P2 мыши. Фиг. 14C показывает иммуногистохимическое окрашивание инфильтрующих CD8+ цитотоксических Т-лимфоцитов в контрольном обработанном фосфатно-солевым буфером животном. Фиг. 14D показывает иммуногистохимическое окрашивание CD8+ цитотоксических Т- лимфоцитов в обработанной Nani-P2 мыши.
Подробное описание изобретения
[0041] Создали серию искусственных производных белка трансактиватора транскрипции (Tat, trans-activator of transcription) вируса иммунодефицита человека (ВИЧ), активных при раке. В настоящей заявке эти молекулы обозначают как «полипептидные производные Tat», «производные Tat» или «точные иммуностимуляторы», и они содержат молекулы Tat, несущие модификации, которые делают иммуносупрессорный Tat иммуностимулирующим.
[0042] Несмотря на относительную распространенность опухолеассоциированных антигенов было доказано, что рак является сложной мишенью для иммунотерапевтических средств. Были накоплены доказательства того, что рефракторное состояние рака по отношению к иммунотерапевтическим средствам может быть обусловлено иммунной супрессией, сопровождающей сформированные опухоли. Эпидемиологические исследования показали, что женщины с инфекцией ВИЧ и даже с синдромом приобретенного иммунодефицита (СПИД) парадоксальным образом были защищены от развития рака молочной железы, даже на поздней стадии заболевания с выраженным иммунодефицитом.
[0043] Белок Tat ВИЧ может повторно индуцировать превращение предшественников линии клеток врожденного иммунитета в активированные антигенпрезентирующие клетки. Эти наблюдения подтвердили специально со ссылкой на дендритные антигенпрезентирующие клетки, активация которых индуцирует циклы репликации ВИЧ, даже при СПИДе. Взятые в совокупности эти данные поддерживали вывод о том, что Tat обладает антисупрессивной активностью. Предполагают, что эти наблюдения, касающиеся Tat, можно связать с эпидемиологическими данными по раку молочной железы через теорию о том, что Tat у ВИЧ-инфицированных индивидов хронически стимулировал врожденный иммунитет, ограничивая таким образом развитие рака молочной железы.
[0044] Полипептидные производные Tat
[0045] Белок Tat ВИЧ является вариабельным РНК-связывающим белком, длиной от 86 до 110 аминокислот, которые кодируются двумя отдельными экзонами в геноме ВИЧ. Tat является высококонсервативным среди всех лентивирусов человека и необходим для репликации вируса. При связывании лентивирусного Tat с TAR (trans-activation responsive, чувствительный к трансактивации) областью РНК уровни транскрипции (превращения вирусной РНК в ДНК, а затем в матричную РНК) значительно повышаются. Показали, что Tat усиливает транскрипцию вирусной РНК, и предположили, что Tat может инициировать апоптоз (запрограммированную клеточную гибель) в T4 клетках и макрофагах (ключевой части системы иммунологического надзора организма для инфекции ВИЧ) и может стимулировать образование α-интерферона (α-интерферон является хорошо известным иммуносупрессорным цитокином) на повышенном уровне.
[0046] Присутствие внеклеточного Tat на ранних этапах ВИЧ-инфекции могло бы снизить иммунный ответ пациента, предоставляя вирусу преимущество над хозяином. Более того, прямое разрушение T4 клеток и индукция образования α-интерферона может объяснить отсутствие сильного иммунного ответа, наблюдаемое у пациентов со СПИДом, а также может вносить вклад в исходную выраженную иммуносупрессию.
[0047] На основании молекулярного анализа белок Tat (SEQ ID NO:1) содержит четыре разных домена: (1) трансдукционный домен (SH3) (3-19 аминокислоты); (2) цистеин-богатый лигандсвязывающий домен (22-37 аминокислоты); (3) направляющую на мембрану последовательность (47-57 аминокислоты) и (4) хвостовую часть, кодируемую вторым экзоном (73-101 аминокислоты).
[0048] Аминоконцевая часть Tat содержит короткую пептидную область ядерного транскрипционного фактора, как правило, фланкируемую остатками пролина. Данная область определяет, по крайней мере частично, насколько стимулирующим или супрессорным является полипептид Tat по отношению к клеткам иммунной системы, в частности в клеткам врожденной иммунной системы, таким как дендритные клетки и макрофаги (антигенпрезентирующий клетки). Следовательно, предсказывают, что модификации области транскрипционного фактора могут сделать полипептиды более активными в терапии рака и других хронических заболеваний.
[0049] SH3 домен связывания Tat ВИЧ-1 идентичен последовательности, обнаруживаемой в другом транскрипционном факторе, hairless (hr), который, как показали ранее, обладает иммуносупрессорными свойствами в мышах. У мышей, несущих мутацию hr, возникает иммунное нарушение, в настоящее время чаще всего называемое «переключение с TH1 на TH2», которое является неотъемлемой частью ВИЧ-инфицированных индивидов, прогрессирующих до СПИДа. Последующий анализ установил, что SH3 связывающая последовательность, полученная из гена hr, является практически инвариантным признаком Tat, выделенного из ВИЧ-1, и очень устойчивым признаком ВИЧ-2.
[0050] Напротив, приматы, инфицированные определенными штаммами вируса иммунодефицита обезьян, лентивируса, тесно связанного с ВИЧ, редко прогрессируют до СПИДа или делают это непредсказуемо. Это наблюдение вместе с открытием потенциально иммуносупрессорного фрагмента транскрипционного фактора hr в иммуносупрессорном Tat ВИЧ-1 позволяет предположить, что некоторые приматы могут иметь другой фрагмент транскрипционного фактора на аминоконце Tat вируса иммунодефицита обезьян (или не иметь такового). Tat из определенных инфицированных вирусом иммунодефицита обезьян дымчатых мангобеев с ослабленным иммунодефицитом содержит на аминоконце фрагмент транскрипционного фактора TARA вместо транскрипционного фактора hr.
[0051] Как правило, иммуностимулирующее полипептидное производное Tat для лечения рака содержит по меньшей мере три области (домена). Первый домен происходит из области ядерного транскрипционного фактора Tat, второй домен представляет собой цистеин-богатую область, а третий домен является C-концевым доменом белка Tat. Каждый из этих доменов содержит последовательность белка Tat из источника, включающего, но не ограничивающегося зараженными ВИЧ-1 или ВИЧ-2 с прогрессией заболевания, зараженными в течение долгого времени без прогрессии, выжившими в течение длительного времени, высококлассными контролями и/или зараженными вирусом иммунодефицита обезьян видами приматов, не относящимися к человеку. Альтернативно цистеин-богатые молекулы дефензина можно заменить цистеин-богатым доменом, происходящим из Tat. В определенных вариантах осуществления настоящего изобретения цистеин-богатый домен из ретровируса комбинируют с доменом транскрипционного фактора и С-концевым доменом последовательности Tat приматов, не являющихся человеком. В другом варианте осуществления настоящего изобретения цистеин-богатый домен приматов, не являющихся человеком, комбинируют с доменом транскрипционного фактора и С-концевым доменом ретровируса. В другом варианте осуществления настоящего изобретения последовательность содержит фрагмент области, которая поддерживает иммуностимулирующую активность полноразмерного домена. Примерами ретровирусов являются вирус иммунодефицита обезьян, ВИЧ, вирус иммунодефицита кошек, вирус иммунодефицита коров, вирус простого герпеса 1, вирус простого герпеса 2 или вирус инфекционной анемии лошадей. В одном варианте осуществления настоящего изобретения ретровирус является лентивирусом, таким как ВИЧ или вирус иммунодефицита обезьян. В другом варианте осуществления настоящего изобретения ВИЧ является ВИЧ-1 или ВИЧ-2.
[0052] Таким образом, в настоящей заявке раскрыты полипептидные производные Tat, содержащие аминокислотную последовательность, содержащую домен транскрипционного фактора, цистеин-богатый домен и С-концевой домен в указанном порядке, при котором и домен транскрипционного фактора, и С-концевой домен происходят из ретровирусного белка Tat, а цистеин-богатый домен происходит из ретровируса или дефензина, такого как α-дефензин или β-дефензин. Не ограничивающие примеры полипептидных производных Tat представлены в Таблице 1. Область транскрипционного фактора содержит С-концевой остаток пролина, а цистеин-богатая область содержит С-концевой фенилаланин. Если в нативной последовательности транскрипционного фактора нет остатка пролина на С-конце, можно вставить пролин на С-конце. Примеры зараженных вирусом иммунодефицита обезьян видов приматов, не являющихся человеком, перечислены в Таблице 2.
[0053] В другом варианте осуществления настоящего изобретения модифицированный полипептид Tat также содержит аргинин-богатый домен из лентивирусного белка Tat. Аргинин-богатый домен находится внутри С-концевой области.
[0054] Последовательности домена транскрипционного фактора, цистеин-богатого домена и С-концевого домена организованы в полипептидном производном Tat в указанном порядке.
[0055] В дополнительных вариантах осуществления настоящего изобретения одна или несколько аминокислот, включая, но не ограничиваясь пролином, в домене транскрипционного фактора удалены или заменены посредством консервативной аминокислотной замены, такой как замена аланином, аспарагиновой кислотой, глутаминовой кислотой, глицином, лизином, глутамином, аргинином, серином или треонином.
[0056] В одном варианте осуществления настоящего изобретения домен транскрипционного фактора содержит, в основном состоит из или состоит из аминокислотной последовательности одной из SEQ ID NO:96-123. В другом варианте осуществления настоящего изобретения цистеин-богатый домен содержит, в основном состоит из или состоит из аминокислотной последовательности одной из SEQ ID NO:124-132. В другом варианте осуществления настоящего изобретения цистеин-богатый домен содержит, в основном состоит из или состоит из аминокислотной последовательности одной из SEQ ID NO:133-150.
Примеры полипептидных производных Tat
β-дефензин
α-дефензин
β-дефензин
‡ Цистеин-богатая область подчеркнута
Сокращенные названия штаммов вируса иммунодефицита обезьян, применимых для пептидных производных Tat
[0057] В дополнительных вариантах осуществления настоящего изобретения в настоящей заявке раскрыто применение консервативно модифицированных вариантов полипептидных производных Tat. Варианты, описанные в настоящей заявке, сохраняют иммуностимулирующую активность исходного или первичного полипептидного производного Tat.
[0058] Как применяют в настоящей заявке, термин «консервативно модифицированные варианты» обозначает варианты пептидов, которые обладают такой же или схожей биологической активностью исходных пептидов. Например, можно сделать консервативные аминокислотные замены, которые хотя и меняют первичную последовательность белка или пептида, не меняют его функцию. Консервативный вариант содержит по меньшей мере одну аминокислоту, замененную другой аминокислотой или аминокислотным аналогом, который обладает по меньшей мере одним признаком, схожим с таковым у исходной аминокислоты из типичного пептида сравнения. Примеры признаков включают, но не ограничиваются, схожим размером, топографией, зарядом, гидрофобностью, гидрофильностью, липофильностью, способностью к ковалентному связыванию, способностью образовывать водородные связи, физико-химическим свойством или подобным или любой их комбинацией. Консервативную замену можно оценить с помощью ряда факторов, таких как, например, физические свойства заменяемой аминокислоты (Таблица 3), или то, как исходная аминокислота перенесет замену (Таблица 4). Наборы аминокислот, которые можно заменить другой аминокислотой в пептиде, раскрытом в настоящей заявке, известны специалистам в данной области техники. Консервативный вариант может функционировать практически таким же образом, как типичный пептид сравнения, и его можно заменить типичным пептидом сравнения в любом аспекте настоящего описания изобретения.
Свойства аминокислот
Аминокислотные замены
[0059] В одном варианте осуществления настоящего изобретения полипептидное производное Tat является пептидом, раскрытым в Таблице 1. В определенных вариантах осуществления настоящего изобретения производное Tat не является одной из SEQ ID NO. 2, 3 или 4. Полипептидное производное Tat также может содержать консервативные варианты полипептидного производного Tat. В одном варианте осуществления настоящего изобретения консервативный вариант полипептидного производного Tat является консервативным вариантом полипептидного производного Tat, раскрытого в настоящей заявке. В аспектах данного варианта осуществления настоящего изобретения консервативный вариант полипептидного производного Tat может быть, например, аминокислотной последовательностью, имеющей по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с полипептидным производным Tat. В других аспектах данного варианта осуществления настоящего изобретения консервативный вариант полипептидного производного Tat может быть, например, аминокислотной последовательностью, имеющей не более 50%, 55%, 60%, 65%, 70%, 75%, не более 80%, не более 85%, не более 90%, не более 95%, не более 97%, не более 98% или не более 99% идентичности аминокислотной последовательности с полипептидным производным Tat.
[0060] Таким образом в настоящей заявке раскрыты аминокислотные последовательности на 85%, 90%, 95%, 98%, 99% или 100% идентичные производным Tat, раскрытым в SEQ ID NO. 5-95.
[0061] В других аспектах данного варианта осуществления настоящего изобретения консервативный вариант полипептидного производного Tat может быть, например, полипептидным производным Tat, имеющим 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30 или более консервативных замен в аминокислотной последовательности полипептидного производного Tat. В других аспектах данного варианта осуществления настоящего изобретения консервативный вариант полипептидного производного Tat может быть, например, аминокислотной последовательностью, имеющей по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 20 или по меньшей мере 25 консервативных замен в аминокислотной последовательности полипептидного производного Tat. В других аспектах данного варианта осуществления настоящего изобретения консервативный вариант полипептидного производного Tat может быть, например, аминокислотной последовательностью, имеющей не более 1, не более 2, не более 3, не более 4, не более 5, не более 6, не более 7, не более 8, не более 9, не более 10, не более 11, не более 12, не более 13, не более 14, не более 15, не более 20, не более 25 или не более 30 консервативных замен в аминокислотной последовательности полипептидного производного Tat.
[0062] Модификации (которые, как правило, не меняют первичную последовательность) включают получение in vivo или in vitro химических производных полипептидов, напр., ацетилирование или карбоксилирование. Также включены модификации гликозилированием, напр., сделанные посредством модификации профилей гликозилирования полипептида во время синтеза и процессинга или последующих стадий процессинга, напр., посредством обработки полипептида ферментами, влияющими на гликозилирование, напр., гликозилирующими или дегликозилирующими ферментами млекопитающих. Также в объем изобретения включены последовательности, имеющие фосфорилированные аминокислотные остатки, напр., фосфотирозин, фосфосерин или фосфотреонин.
[0063] Также включены полипептиды, модифицированные с помощью стандартных молекулярно-биологических техник для улучшения сопротивляемости протеолитической деградации или для оптимизации свойств растворимости. Аналоги таких полипептидов включают остатки, отличные от встречающихся в природе L-аминокислот, напр., D-аминокислот или не встречающихся в природе синтетических аминокислот. Пептиды, раскрытые в настоящей заявке, не ограничивают продуктами любого из конкретных примеров процессов, перечисленных в настоящей заявке.
[0064] Как применяют в настоящей заявке, аминокислотные последовательности, являющиеся в основном одинаковыми, как правило, обладают более чем 95% аминокислотной идентичностью. Однако общепризнанно, что белки (и ДНК или мРНК, кодирующие такие белки), имеющие уровень идентичности ниже вышеописанного, появившиеся как сплайс-варианты или модифицированные консервативными аминокислотными заменами (или заменой вырожденных кодонов), включены в объем настоящего раскрытия. Как известно специалистам в данной области техники, были придуманы разные способы выравнивания последовательностей для сравнения, напр., матрица замен Blosum 62, как описано Henikoff и Henikoff в Proc. Natl. Acad Sci. USA 89:10915 (1992). Алгоритмы, обычно применяемые для этой цели, широко известны (см., например, Needleman and Wunsch in J. Mol. Bio. 48:443 (1970).
[0065] В дополнение к в основном полноразмерным полипептидам настоящие раскрытие также представляет биологически активные фрагменты полипептидных производных Tat. Термин «биологически активный фрагмент» обозначает фрагменты полипептидных производных Tat, обладающие иммуностимулирующей активностью.
[0066] Более того, пептиды, раскрытые в настоящей заявке, могут самоассоциировать в мультимеры, включая, но не ограничиваясь димерами, тримерами и тетрамерами в дополнение к существующей мономерной форме. Мультимеризация пептидов может происходить спонтанно или может быть стимулирована помещением пептидов в условия, способствующие мультимеризации. Такие условия известны специалистам в области пептидной химии. Композиции, раскрытые в настоящей заявке, могут включать мономеры или мультимеры пептидов или смесь мономеров и мультимеров.
[0067] Следующие системы экспрессии подходят для применения для экспрессии раскрытых производных Tat: системы экспрессии в клетках млекопитающих, таких как, но не ограничивающихся клетками яичника китайского хомяка (CHO, Chinese Hamster Ovary), клетками COS (фибробластоподобными клетками ткани почки африканской зеленой мартышки), клетками крупного рогатого скота, мышиными клетками, клетками эмбриональной почки человека или клетки почки новорожденного хомяка; системы экспрессии в клетках насекомых, такие как, но не ограничивающиеся системой экспрессии Bac-to-Bac, бакуловирусной системой экспрессии и системами экспрессии в клетках дрозофилы; системы экспрессии в дрожжах и системы экспрессии в E. coli, включая, но не ограничиваясь системами экспрессии pET, pSUMO и GST. В другом варианте осуществления настоящего изобретения производные Tat экспрессируют с гистидиновым (полигистидиновым) маркером, применимым для выделения полипептида. Системы очистки гистидинового маркера известны специалистам в данной области техники.
[0068] «Терапевтически эффективное количество» предназначено для обозначения количества, необходимого для достижения терапевтического эффекта. Как применяют в настоящей заявке, термин «терапевтически эффективное количество» синонимичен «терапевтически эффективной дозе» и при применении в отношении лечения рака обозначает наиболее эффективную дозу композиции, раскрытой в настоящей заявке, необходимую для достижения желаемого терапевтического эффекта, и включает дозу, достаточную для уменьшения размера опухоли, ингибирования роста опухоли или индукции регрессии опухоли.
[0069] Преодоление иммунологических контрольных точек
[0070] Иммунологические контрольные точки, такие как антиген цитотоксических Т-лимфоцитов 4 (CTLA-4, cytotoxic T-lymphocyte antigen 4) и белок запрограммированной клеточной смерти 1 (PD-1, programmed cell death 1), экспрессирующиеся на опухолеспецифичных Т-клетках, приводят к нарушению активации и подавлению эффекторных функций, таких как пролиферация, секреция цитокинов и лизис опухолевых клеток. Специфичное модулирование этих рецепторов ингибиторами иммунологических контрольных точек представляет собой новый подход в иммунотерапии рака.
[0071] Важный отрицательный костимулирующий сигнал, регулирующий активацию Т-клеток, посылает PD-1 (также известный как CD279) и его лигандсвязывающие партнеры PD-L1 (также известные как B7-H1 и CD274) и PD-L2 (также известные как B7-DC и CD273). PD-1 является родственным CD28 и CTLA-4, но не содержит ближайший к мембране цистеин, который обеспечивает гомодимеризацию. Цитоплазматический домен PD-1 содержит тирозинсодержащий ингибиторный мотив иммунорецепторов (ITIM, immunoreceptor tyrosine-based inhibition motif, V/IxYxxL/V). На сегодня идентифицированными лигандами PD-1 являются только PD-L1 и PD-L2.
[0072] Иммуносупрессорная природа опухолевого микроокружения помогает объяснить иммунологическую дисфункцию, сопровождающую прогрессию рака. Сигнальный путь PD-1/PD-L1 представляет собой одну новую модель ускользания от механизмов иммунологического надзора в очаге опухоли и является важной контрольной точкой и барьером для эффективного иммунного ответа.
[0073] Считают, что присутствие PD-L1 в очаге опухоли способствует ускользанию от механизмов иммунологического надзора в результате активного опухолеопосредованного процесса перепрограммирования клеток-хозяев, присутствующих в опухолевом микроокружении. Взаимодействие PD-L1 с его рецептором PD-1 на поверхности проникающих в опухоль Т-клеток может индуцировать их запрограммированную клеточную гибель, иммунологическую толерантность и истощение. Индукция PD-L1 в опухолевом микроокружении может служить «молекулярным экраном» для защиты опухоли от клеточного иммунного ответа.
[0074] Рефракторное состояние рака по отношению к иммунотерапевтическим средствам может быть последствием иммуносупрессии, сопровождающей прогрессию заболевания при развившемся раке. Полипептидные производные Tat, раскрытые в настоящей заявке, вызывают противоопухолевый иммунный ответ, индуцируя дендритные клетки моноцитарного происхождения к стимуляции CD8+ цитотоксических Т-лимфоцитов преодолевать PD-L1 иммуносупрессию. Таким образом, иммуносупрессорный сигнальный путь PD-1/PD-L1 может представлять возможный механизм, с помощью которого рак молочной железы ускользает от противоопухолевого иммунного ответа хозяина, и, таким образом, полипептидные производные Tat могут влиять на прогрессию солидной опухоли посредством индукции инфильтрации опухоли CD8+ цитотоксическими Т-лимфоцитами на фоне иммуносупрессии PD-L1.
[0075] Модулирование передачи сигнала через PD-L1 и, таким образом, предотвращение передачи отрицательного костимулирующего сигнала от PD-L1 к Т-клеткам, вероятно, усиливает иммунную реакцию в ответ на инфекцию (напр., острую или хроническую) и противоопухолевую иммунную реакцию. Дополнительно полипептидные производные Tat, раскрытые в настоящей заявке, можно комбинировать с антагонистами других компонентов пути передачи сигнала PD-1:PD-L1, например, анти-PD-1 антагонистом и антителами к PD-L2.
[0076] Дополнительно, агенты, модулирующие иммунологические контрольные точки, которые можно применять в курсах лечения рака иммунотерапевтическими средствами в комбинации с раскрытыми полипептидными производными Tat, включают, но не ограничиваются CTLA-4, PD-1, PD-L1, PD-L2, B7-H3, B7-H4, LAG-3, TIM-3 и GITR, и их соответствующими лигандами.
[0077] Применение полипептидных производных Tat
[0078] Раскрытые производные Tat являются иммуностимулирующими полипептидами, применимыми при многих типах рака. В одном варианте осуществления настоящего изобретения производные Tat применимы для лечения типов рака, включающих, но не ограничивающихся аденокортикальной карциномой, раком анального канала, раком аппендикса, астроцитомой, базальноклеточной карциномой, раком желчного протока, раком мочевого пузыря, раком кости, раком мозга, раком груди, бронхиальной аденомой/бронхиальным карциноидом, карциноидной опухолью, раком шейки матки, хроническими миелопролиферативными нарушениями, раком толстого кишечника, десмопластической мелкокруглоклеточной опухолью, раком эндометрия, эпендимомой, раком пищевода, саркомой Юинга, герминогенными опухолями, раком глаза, раком желчного пузыря, раком желудка, желудочно-кишечной карциноидной опухолью, желудочно-кишечной стромальной опухолью, гестационной трофобластической опухолью, глиомой, карциноидом желудка, раком головы и шеи, раком сердца, гепатоцеллюлярным раком, лимфомой Ходжкина, гипофарингеальным раком, карциномой островковых клеток, саркомой Капоши, раком почек, лейкемиями, раком губ и ротовой полости, липосаркомой, раком печени, раком легких, лимфомами, макроглобулинемией, медуллобластомой, меланомой, карциномой из клеток Меркеля, мезотелиомой, раком ротовой полости, множественной миеломой/плазмаклеточной миеломой, фунгоидной гранулемой, раком носовой полости и придаточных пазух носа, раком носоглотки, нейробластомой, раком ротовой полости, раком ротоглотки, раком яичников, эпителиальным раком яичников, раком поджелудочной железы, раком паращитовидной железы, раком полового члена, раком глотки, феохромоцитомой, астроцитомой эпифиза, герминомой эпифиза, пинеобластомой, аденомой гипофиза, плевропульмонарной бластомой, раком простаты, раком прямой кишки, почечно-клеточным раком, ретинобластомой, рабдомиосаркомой, раком слюнных желез, саркомой, синдромом Сезари, раком кожи, плоскоклеточной карциномой, раком желудка, раком семенников, раком горла, тимомой, раком щитовидной железы, раком уретры, раком матки, саркомой матки, раком влагалища, раком вульвы, макроглобулинемией Вальденстрема или опухолью Вильмса.
[0079] В другом варианте осуществления настоящего изобретения рак является раком груди. В другом варианте осуществления настоящего изобретения рак является раком яичников. В другом варианте осуществления настоящего изобретения рак является раком простаты. В другом варианте осуществления настоящего изобретения рак является раком легких. В другом варианте осуществления настоящего изобретения рак является злокачественной меланомой.
[0080] В то время как раскрытые производные Tat являются антисупрессорными агентами с «не имеющей равных» эффективностью при раке, эти наблюдения дополнительно поддерживают возможность синергичного действия производных Tat и других антисупрессорных противораковых терапевтических средств, в настоящее время находящихся на стадии клинической разработки, которые могут оказывать ограниченный эффект на фоне высокой опухолевой нагрузки и сопутствующей тяжелой иммуносупрессии.
[0081] Экспрессию и присутствие PD-L1 в опухоли и внедряющихся иммунных клеток можно применять для предсказания ответа на терапию и/или для прогнозирования заболевания. Таким образом, в одном варианте осуществления настоящего изобретения, раскрытом в настоящей заявке, пациента выбирают для лечения полипептидным производным Tat на основании экспрессии PD-L1 в его опухолевой ткани. В определенных вариантах осуществления настоящего изобретения опухолевую ткань оценивают на предмет экспрессии PD-L1 перед получением субъектом какой-либо противораковой терапии. В другом варианте осуществления настоящего изобретения опухолевую ткань оценивают на предмет экспрессии PD-L1 перед получением субъектом полипептидного производного Tat, раскрытого в настоящей заявке.
[0082] Экспрессию PD-L1 можно определить в помощью иммунологического анализа опухолевой ткани, такого как, но не ограничиваясь иммуногистохимией, иммунологическими исследованиями (твердофазным иммуноферментным анализом (ELISA, enzyme-linked immunosorbent assay, способом иммуноферментных пятен (ELISPOT, enzyme-linked immunospot), радиоиммунологическим анализом), белковыми микрочипами, проточной цитометрией, количественной иммунофлуоресценцией и поверхностным плазмонным резонансом. Также можно применять неиммунологические исследования, такие как количественная полимеразная цепная реакция (qPCR, quantitative polymerase chain reaction) и определение матричной РНК.
[0083] Таким образом, в некоторых вариантах осуществления настоящего изобретения пациента выбирают для лечения полипептидным производным Tat, если перед началом лечения опухоль содержит более 5% экспрессирующих PD-L1 клеток, более 6% экспрессирующих PD-L1 клеток, более 7% экспрессирующих PD-L1 клеток, более 8% экспрессирующих PD-L1 клеток, более 9% экспрессирующих PD-L1 клеток, более 10% экспрессирующих PD-L1 клеток, более 11% экспрессирующих PD-L1 клеток, более 12% экспрессирующих PD-L1 клеток, более 13% экспрессирующих PD-L1 клеток, более 14% экспрессирующих PD-L1 клеток, более 16% экспрессирующих PD-L1 клеток, более 18% экспрессирующих PD-L1 клеток или более 20% экспрессирующих PD-L1 клеток.
[0084] Фармацевтические композиции
[0085] Настоящее раскрытие также направлено на фармацевтические композиции, содержащие описанные выше полипептидные производные Tat. Дозировки и желаемые концентрации лекарственного средства раскрытых фармацевтических композиций могут варьировать в зависимости от конкретного предусмотренного применения. Определение подходящей дозировки или способа введения входит в компетенцию обычных терапевтов. Эксперименты на животных предоставляют надежное руководство по определению эффективных доз для терапии человека. Межвидовое приведение эффективных доз можно проводить согласно принципам, изложенным Mardenti, J. and Chappell, W. “The use of interspecies scaling in toxicokinetics” In Toxicokinetics and New Drug Development, Yacobi et al, Eds., Pergamon Press, New York 1989, pp. 42-96. В одном варианте осуществления настоящего изобретения заболевание присутствует. В другом варианте осуществления настоящего изобретения жизнь клетки или индивидуума продлевают благодаря способам, описанным в настоящей заявке.
[0086] Описанные выше полипептидные производные Tat можно выпускать в составе лекарственной формы без проведения лишних экспериментов для введения млекопитающим, включая человека, в соответствии с конкретным применением. Дополнительно подходящие дозировки композиций можно определить без проведения лишних экспериментов с помощью стандартных протоколов определения дозозависимого эффекта.
[0087] Соответственно, композиции, созданные для перорального, назального, лингвального, сублингвального, буккального, интрабуккального, внутривенного, подкожного, внутримышечного и легочного введения, можно получить без проведения лишних экспериментов с помощью средств, хорошо известных в данной области техники, например, с помощью инертного растворителя или с помощью фармацевтически приемлемого носителя. В целях терапевтического введения фармацевтические композиции можно объединять с эксципиентами и применять в форме таблеток, пастилок, капсул, эликсиров, суспензий, растворов, сиропов и подобного. «Фармацевтически приемлемый носитель» обозначает любой из стандартных фармацевтических носителей. Примеры подходящих носителей хорошо известны в данной области техники и могут включать, но не ограничиваются любыми стандартными фармацевтическими носителями, такими как фосфатно-солевые буферы, фосфатно-солевой буфер, содержащий полисорбат 80, водой, эмульсиями, такими как водно-масляная эмульсия и разными типами увлажняющих агентов. Другие носители могут также содержать стерильные растворы, таблетки, покрытые оболочкой таблетки и капсулы. Как правило, такие носители содержат эксципиенты, такие как крахмал, молоко, сахар, определенные типы глины, желатин, стеариновую кислоту и ее соли, стеарат магния или кальция, тальк, растительные жиры или масла, смолы, гликоли или другие известные эксципиенты. Композиции, содержащие такие носители, выпускают с помощью хорошо известных стандартных способов.
[0088] Композиции полипептидных производных Tat можно легко вводить парентерально, например, посредством внутривенной, внутримышечной, интратекальной или подкожной инъекции. Парентеральное введение можно проводить, включая соединения в раствор или суспензию. Такие растворы или суспензии также могут включать стерильные растворители, такие как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители. Парентеральные составы также могут включать антибактериальные агенты, такие как, например, бензиловый спирт или метилпарабены, антиоксиданты, такие как, например, аскорбиновая кислота или бисульфит натрия, и хелатирующие агенты, такие как ЭДТА. Также можно добавлять буферы, такие как ацетаты, цитраты или фосфаты, и агенты, регулирующие тоничность, такие как хлорид натрия или декстроза. Парентеральные препараты можно заключать в ампулы, одноразовые шприцы или многодозовые флаконы из стекла или пластика.
[0089] Трансдермальное введение включает впитывание композиции через кожу. Трансдермальные формы включают пластыри, приспособления для ионофореза, мази, крема, гели, бальзамы и подобное.
[0090] Композиция может включать разные материалы, модифицирующие физическую форму твердой или жидкой дозированной формы. Например, композиция может включать материалы, образующие защитную оболочку вокруг активных ингредиентов. Материалы, образующие защитную оболочку, являются, как правило, инертными, и их можно выбирать, например, из сахара, шеллака и других кишечнорастворимых покрывающих агентов. Альтернативно, активные ингредиенты можно инкапсулировать в желатиновую капсулу или крахмальную капсулу.
[0091] Композиции полипептидных производных Tat настоящего раскрытия можно вводить в терапевтически эффективном количестве в соответствии с подходящим режимом дозирования. Специалисты в данной области техники считают, что необходимое точное количество может варьировать от пациента к пациенту в зависимости от видовой принадлежности пациента, его возраста и общего состояния, тяжести инфекции, конкретных агентов и способа введения. В некоторых вариантах осуществления настоящего изобретения вводят от приблизительно 0,001 мг/кг до приблизительно 50 мг/кг композиции на основании веса тела пациента, один или два раза в день, для получения желаемого терапевтического эффекта. В других вариантах осуществления настоящего изобретения вводят от приблизительно 1 мг/кг до приблизительно 25 мг/кг композиции на основании веса тела пациента, один или два раза в день, для получения желаемого терапевтического эффекта.
[0092] Общую суточную дозу композиций определит терапевт по результатам медицинской оценки. Конкретный уровень терапевтически эффективной дозы для любого конкретного пациента или пациента будет зависеть от ряда факторов, включая подлежащее лечению нарушение и тяжесть нарушения, активность конкретного применяемого соединения, конкретного применяемого соединения, возраста, веса тела, общего состояния здоровья, пола и диеты пациента или пациента, времени введения, способа введения, скорости выведения конкретного применяемого соединения, продолжительности лечения, лекарственных средств, применяемых в комбинации или совместно с конкретным применяемым соединением, и от других факторов, хорошо известных в медицинской области техники.
[0093] Раскрытые композиции также можно применять в комбинационной терапии. Иными словами, композиции, раскрытые в настоящей заявке, можно вводить одновременно с, перед или после одной или нескольких других желаемых композиций, терапевтических средств или медицинских процедур. Конкретную комбинацию вводимых терапий определит лечащий врач, принимая во внимание совместимость лечения и желаемый терапевтический эффект, который нужно достичь. Предпочтительно, чтобы терапевтически активные агенты, применяемые в комбинации, можно было вводить вместе в виде единой композиции, лечения или процедуры или, альтернативно, а можно было вводить по отдельности.
[0094] В другом варианте осуществления настоящего изобретения предусмотрено повторное или частое введение доз раскрытых производных Tat, которое может опережать развитие тахифилаксии, а также обращать периодическую иммуносупрессию, развивающуюся при прогрессии рака. Частое дозирование является одной из процедур, применяющихся, например, при лечении аллергии, которые могут поддерживать иммунологическую толерантность по отношению к агенту. Поскольку производное Tat можно применять для восстановления иммунореактивности в отношении опухоли, потенциально можно восстановить эффективность других иммунотерапевтических средств, потерявших эффективность из-за распространения заболевания. Во втором протоколе применяют курсы химиотерапии, которые могут вызвать высвобождение множества опухолевых антигенов, чередуя их с иммунотерапией производным Tat. Поскольку у человека рак на поздней стадии часто является устойчивым ко множеству лекарственных средств, лучевая терапия может представлять собой практичную альтернативу для клинических исследований, проводимых на людях.
[0095] Количество повторных доз полипептидных производных Tat может определить медицинский работник на основании ответа пациента на дозы. В одном варианте осуществления настоящего изобретения полипептидные производные Tat вводят один раз каждые три дня, т.е. 3 дозы в течение десятидневного периода. Такую схему введения затем повторяют в течение многих циклов. Настоящее раскрытие предусматривает ряд различных схем введения, где полипептидные производные Tat вводят многократно в течение выбранного интервала времени, а затем повторяют схему введения в течение многих циклов. В другом варианте осуществления настоящего изобретения введение полипептидных производных Tat можно чередовать с введением одного или нескольких противораковых, иммуномодулирующих или иммуносупрессорных агентов. В одном варианте осуществления настоящего изобретения иммуносупрессорный агент является циклофосфамидом.
[0096] Более того, лечение полипептидными производными Tat можно комбинировать с другой противораковой терапией, такой как хирургическое вмешательство, лучевая терапия или химиотерапия. Химиотерапевтические агенты включают алкилирующие агенты, такие как азотистые иприты, нитрозомочевины, тетразины, азиридины, цисплатины и производные; антиметаболиты, такие как антифолаты, фторпиримидины, аналоги дезоксинуклеозидов и тиопурины; агенты, действующие на микротрубочки, такие как алкалоиды барвинка и таксаны; ингибиторы топоизомеразы, такие как кампотецин, иринотекан, топотекан, новобиоцин, мербарон и акларубицин; цитотоксические антибиотики, такие как антрациклины, актиномицин, блеомицин, пликамицин и митомицин.
[0097] Действие полипептидных производных Tat на рак молочной железы
[0098] Проведенные на животных исследования рекомбинантных производных белка Tat на трех различных общепризнанных мышиных моделях рака молочной железы, 4T1, SM1 и TS/A, подтверждают, что производные Tat активны в отношении подавления роста первичной опухоли молочной железы у мышей. Более того, одно производное, Nani-P2, значительно ингибировало развитие спонтанных метастаз в легкие 4T1 и повышало выживаемость по сравнению с контрольными мышами. Следует отметить, что повышение уровня образования IFN-γ сопровождало лечение рака молочной железы у мышей производными Tat. В исследованиях, в которых опухоль молочной железы 4T1 подсаживали за четырнадцать дней до начала лечения, производные Tat были столь же эффективны, как и при введении в момент имплантации опухоли, по данным оценки роста первичной опухоли, выживаемости и уменьшения массы метастаз в легких при сравнении с обработанным фосфатно-солевым буфером контролем.
[0099] Синтетические производные Tat являются иммуностимулирующими в отношении антигенпрезентирующих клеток, обладают выраженной активностью в отношении первичных, а также развившихся опухолей в трех общепризнанных мышиных моделях рака молочной железы. В частности, одно из производных, Nani-P2, оказывало зависящий от дозы и способа введения эффект на рост первичной опухоли, образование метастаз в легких и выживаемость в агрессивной модели рака молочной железы Her2(-) 4T1. Уменьшения метастаз в легких коррелирует с улучшенной выживаемостью, поскольку метастазы в легких являются основной причиной смертности при распространенном раке молочной железы. Важно отметить, что у мышей со сформировавшимся раком молочной железы 4T1, обработанных введенным внутривенно белком Nani-P2, происходило значительное ингибирование роста опухоли и увеличение выживаемости, которая продолжалась по меньшей мере 36 дней после введения последней дозы. В отдельных случаях наблюдали полную ремиссию, которая чаще происходила в случае менее агрессивных (SM1) и/или в некоторой степени более иммуногенных (TS/A) опухолей молочной железы. Задержка введения Nani-P2 после имплантации опухоли оказывала небольшой отрицательный эффект на подавление роста опухоли 4T1, в такой степени, что терапия (п/к), начатая в день 0 после инъекции опухолевых клеток, вызывала уменьшение массы опухоли в среднем на 53%, в то время как п/к терапия, начатая в день 13, когда опухоль достигала размера в среднем 5 мм в диаметре, вызывала уменьшение массы опухоли в среднем на 52% при максимальном эффекте. В совокупности эти наблюдения указывают на то, что производные Tat могут оказывать положительное действие на распространенный и Her2(-) рак молочной железы у человека.
[0100] В исследованиях, приведенных в настоящей заявке, применяли протокол введения приблизительно трех или четырех доз производного Tat в неделю, либо внутривенного, либо подкожного, при этом доказали, что внутривенное введение было наиболее эффективным в отношение увеличения выживаемости и уменьшения метастазирования. Отсутствие токсичности наблюдали у более чем 250 мышей, получавших данные композиции. Чувствительность рака молочной железы к производным Tat выгодно отличается при сравнении с кривой зависимости эффекта от дозы Herceptin® (Genentech), где 4-8 мг/кг применяют в качестве стандартной терапии. По оценкам, производные Tat у человека будут вплоть до в 100 раз более биоактивны, чем у мыши, что означает, что даже меньшие дозы, ассоциированные с меньшим риском развития токсичности, могут оказаться эффективными.
[0101] В настоящей заявке установлено, что производные Tat активируют Т-клеточное звено иммунного ответа, связанное с образованием IFN-γ (Фиг. 5). Исходные уровни IFN-γ, секретируемого спленоцитами мышей, обработанных Nani-P2, в 8 раз превышают уровни контрольных мышей, обработанных фосфатно-солевым буфером. Секрецию IFN-γ в ответ на обработку производным Tat in vivo можно дополнительно усилить (вплоть до 53×) in vitro с помощью агонистов врожденного иммунитета GM-CSF (granulocyte-macrophage colony-stimulating factor, гранулоцитарно-макрофагальный колониестимулирующий фактор) и IL-4, в то время как спленоциты контрольных мышей остаются подавленными даже после попыток костимулировать их высокими дозами GM-CSF и/или IL4.
[0102] Модели более иммуногенного рака молочной железы (SM1) и/или рака молочной железы с иммунодоминантным эпитопом (TS/A) имеют относительно высокую скорость регрессии после терапии производными Tat, в то время как «неиммуногенная» модель 4T1 является более рефракторной. Это согласуется с моделью доминирующей роли подавления иммунитета в прогрессии рака молочной железы и фактического влияния на инвазивность рака молочной железы. Эту модель подтверждает наблюдение высокого уровня экспрессии в 4T1 нескольких общих антигенов рака молочной железы, включая лактадгерин и андрогенсвязывающий белок, иммунный ответ в отношении которых почти полностью подавлен в отсутствие индуцированного производным Tat подавления иммуносупрессии.
Пример 1
In vitro активность производных Tat
[0103] Человеческие моноциты культивировали в течение 24-48 часов с производным Tat (Nani-P2), иммуностимулирующей последовательностью Toll-подобного рецептора (TLR, Toll-like receptor) (Фиг. 1) или липополисахаридом (Фиг. 2), затем клетки промывали и окрашивали флуоресцентно меченым CD86. Производное Tat стимулировало более сильную экспрессию CD86, чем иммуностимулирующая последовательность (TLR) или липополисахарид.
Пример 2
Оценка производных Tat в мышиных моделях рака молочной железы
[0104] Материалы и способы
[0105] Животные. Самок мышей BALB/c в возрасте от 6 до 8 недель приобретали в Jackson Laboratory (Bar Harbor, NE). Мышей адаптировали на протяжении по меньшей мере 1 недели перед применением. Мышей держали в беспатогенных условиях в виварии Колумбийского университета Медицинского центра (Columbia University of Medical Center) и проводили все эксперименты с одобрения Институционального комитета по содержанию и применению Колумбийского университета Медицинского центра (Institutional Animal Care and Use Committee (IACUC) of Columbia University of Medical Center).
[0106] Клеточные линии. Клетки 4T1, устойчивую к тиогуанину клеточную линию, полученную из спонтанно возникшей карциномы молочной железы BALB/c, получали в ATCC (American Type Culture Collection, Американская коллекция типовых культур); TS/A, линию клеток аденокарциномы мыши, предоставила Dr. Sandra Demaria (Demaria S. et al. Clin Cancer Res. 11:728-34, 2005); и SM1, полученную из BALB/с карциному молочной железы любезно предоставил Dr. James Allison, Калифорнийский университет, Беркли (University of California, Berkeley). Все линии раковых клеток культивировали в DMEM (Dulbecco modified Eagle's medium, среда Игла, модифицированная по способу Дульбекко) с добавлением 2 мМ L-глутамина, 10 мМ HEPES (N-2-hydroxyethyl-piperazine-N-2-ethanesulfonic acid, N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота), 150 единиц/мл пенициллина/стрептомицина, 10% инактивированной нагреванием фетальной бычьей сыворотки (Invitrogen), 50 мкМ 2-меркаптоэтанола (Sigma) и 50 мг/л гентамицина (Lanza).
[0107] Индукция опухоли и лечение. Мышам BALB/c инъецировали (п/к) 1×104 клеток 4T1, 1×105 клеток TS/A или 2×105 клеток SM1, соответственно, в левую молочную железу в день 0. Иммунотерапию проводили посредством прямой инъекции производного Tat в правый бок через 0, 7, 12 и 17 дней после введения опухоли. Контрольной группе инъецировали фосфатно-солевой буфер. В некоторых экспериментах, когда у всех мышей сформировалась опухоль измеряемого размера (3-5 мм в диаметре через 14 дней после инъекции опухоли), животных случайным образом распределяли в разные группы терапии, как указано. Опухолевую массу (объем опухоли) измеряли и регистрировали три раза в неделю. Животных умерщвляли, когда опухоль достигала размера 15 мм в диаметре, собирали и взвешивали опухоли.
[0108] Определение метастаз в легких. Легкие исследовали на предмет обнаружения метастаз 4T1, как описано ранее (Pulaski B. et al. Cancer Res. 60:2710-2715, 2000). Первичные опухоли 4T1, формировавшиеся в течение 2-3 недель в мышах BALB/c, метастазировали в легкие в большинстве животных. Вкратце, мышей умерщвляли в соответствии с руководством IACUC, принятым в начале исследований, удаляли легкие, и два наблюдателя, которые не знали коды лечения согласно протоколу, невооруженным глазом подсчитывали опухолевые узлы на поверхности легких.
[0109] Исследование образования IFN-γ иммунными клетками селезенки с помощью твердофазного иммуноферментного анализа (ELISA). Секрецию IFN-γ спленоцитами оценивали с помощью набора OptEIA™ ELISA kit (BD Biosciences). Вкратце, клетки селезенки (1×105/лунка) из мышей с опухолью 4T1 культивировали в присутствии или в отсутствие обработанных 5×103/лунка митомицином C (50 мкг/мл) клеток 4T1 (применяемых в качестве источника опухолевых антигенов) в DMEM в соотношении 20:1 E:T (effector:tumor, эффекторные клетки:опухолевые клетки) с IL-2 (50 нг/мл) и GM-CSF (100 нг/мл) в 96-луночных планшетах. Через 72 часа собирали супернатанты и хранили в замороженном виде при -80°C до проведения анализа без потери активности. IFN-γ измеряли в бесклеточных супернатантах в дублирующих лунках с помощью ELISA в соответствии с инструкциями производителя. Опухолеспецифичное образование IFN-γ рассчитывали, вычитая фоновые значения, измеренные в суперантантах клеток селезенки, культивируемых только в среде, и переводили значения оптической плотности в количество IFN-γ (пг/мл) с помощью стандартной кривой рекомбинантного IFN-γ. Индекс стимуляции вычисляли как отношение IFN-γ в стимулированных культурах к IFN-γ в контрольных культурах.
[0110] Статистический анализ. Проводили статистический анализ данных с помощью критерия Стьюдента (Graph Pad Prism версия 5; GraphPad). Статистический анализ данных экспериментов по оценке выживаемости животных проводили с помощью логрангового критерия (Graph Pad Prism версия 5).
[0111] Результаты
[0112] Исследовали терапевтический эффект системного введения синтетических Tat-производных композиций на мышиных моделях рака молочной железы. Для сравнения относительного защитного действия небольшой панели различных производных в отношении роста первичной опухоли самкам мышей BALB/c инъецировали подкожно 1×104 клеток рака молочной железы 4T1 в молочную железу, а затем обрабатывали 400 нг частично очищенных производных Tat в дни 0, 7, 14 и 21 (п/к инъекция в фосфатно-солевом буфере) в дренирующие подмышечные лимфоузлы.
[0113] Два из производных, Nani-P1 и Nani-P2, значительно уменьшали опухолевую массу по сравнению с контрольными мышами, получающими инъекции только фосфатно-солевым буфером, при этом различие впервые становилось заметным через 15 дней после имплантации опухоли (Фиг. 3A, день 15 p<0,05). В отличие от этого третье производное, Nani-P3, полученное и частично очищенное в соответствии с таким же протоколом, как и другие, было менее эффективным в отношении подавления роста первичной опухоли 4T1, даже в пятикратно более высоких дозах (2 мкг, Фиг. 3B), или в отношении увеличения выживаемости (не показано). Эти результаты эффективно исключают участие загрязнений в препаратах в обеспечении противоопухолевой эффективности, в частности, поскольку последующие исследования проводили с высокоочищенными (>95% чистоты) материалами в гораздо меньших дозах. Эффективность Nani-P2 была значительно более продолжительной, чем Nani-P1, так что в день 21 (введение последней дозы) различие первичной опухолевой массы опухолей, обработанных Nani-P2 и Nani-P1, достигало 18 мм3 и было статистически высокозначимым (p<0,01). Этот эффект сохранялся на протяжении оставшегося времени данного исследования, несмотря на отсутствие дальнейшей терапии.
[0114] Эффект ингибирования роста опухоли молочной железы высокоочищенных Nani-P2 на опухоли 4T1 был дозозависимым, при этом значительный эффект наблюдали после подкожного введения всего лишь 0,4 нг соединения (Фиг. 4). Повышение дозы Nani-P2, вводимого подкожно в бок, дренированный по подмышечной линии, с логарифмическим инкрементом от 0,4 нг до 40 нг в дозе все сильнее ингибировало рост 4T1 опухоли молочной железы. Наиболее выраженное ингибирование роста 4T1 при повышенных дозах Nani-P2 от 0,4 нг до 40 нг было статистически значимым (p<0,01), в то время как повышение дозы до 400 нг и даже до 2 мкг не приводило к дальнейшему повышению противоопухолевой эффективности (данные не показаны). Важно отметить, что после подкожного или внутривенного введения 40 нг Nani-P2 в рамках многих исследований с применением схем многократного дозирования токсичность не наблюдали. Дозу Nani-P2 40 нг выбрали для дальнейшего исследования.
[0115] Чтобы определить, может ли обработка Nani-P2 продлить период выживания в дополнение к уменьшению первичных опухолей у мышей, применяли протоколы лечения с помощью разных схем дозирования и способов (п/к, в/в или внутриопухолевое) введения 40 нг Nani-P2. Продолжительность выживания отслеживали в когортах по 10 мышей в группе, оценивая с помощью множительного способа Каплана-Мейера. В соответствии с требованиями Вивария Медицинского центра Колумбийского университета (Columbia University Medical Center Animal Facility), каждую мышь подвергали эвтаназии при среднем диаметре опухоли равным приблизительно 15 мм или раньше, если мышь начинала умирать, что делало один из этих двух исходов определяющим критерием летальности.
[0116] В первом исследовании, оценивающем Nani-P2, подкожное введение начинали одновременно с имплантацией опухоли. Медианное время выживания контрольных (обработанных фосфатно-солевым буфером) мышей составляло 30 дней, и 100% летальность была ко дню 36. При введении Nani-P2(4 дозы за 21 день), 35% обработанных мышей оставались живы в день 48 (p<0,001, Фиг. 5A), когда всех мышей умерщвляли из-за массы первичной опухоли.
[0117] Во втором исследовании выживаемости давали сформироваться опухоли в течение четырнадцати дней для лучшей оценки эффективности в отношении метастазирующего заболевания, после чего проводили три цикла терапии Nani-P2 еженедельно одним из нескольких способов введения (п/к, в/в или внутриопухолевое) для сравнения относительной эффективности каждого способа дозирования (Фиг. 5B). Также как в предыдущем исследовании медианное время выживания контрольных (подкожно обработанных фосфатно-солевым буфером) мышей составляло 32 дня, и 100% летальность была ко дню 36. Время выживаемости продлевало внутривенное введение Nani-P2 (p<0,005, Фиг. 5B), с 60% выживаемостью в день 47 по сравнению с 20% выживаемостью подкожно обработанных мышей в день 47 (p<0,05). Внутриопухолевое введение соединения немного уступало подкожному введению.
[0118] Для исследования выбрали мышиную модель рака молочной железы 4T1, поскольку она представляет собой быстрорастущую и высокоинвазивную опухоль; обычно она метастазирует на четырнадцатый день после имплантации, и к этому времени она с трудом поддается лечению. Чтобы выяснить, может ли эффективность Nani-P2 распространяться на другие мышиные модели рака молочной железы, исследовали две дополнительные опухоли молочной железы, TS/A и SM1 (Фиг. 6). Первичные опухоли молочной железы TS/A были приблизительно столь же быстрорастущими, как и 4T1, достигая размера опухоли равного 15 мм за 30 дней (Фиг. 6A). Однако опухоли TS/A были значительно более чувствительными к обработке Nani-P2, с приблизительно 50% подавлением роста после обработки 0,4 нг Nani-P2 и 40% общим уровнем ремиссии через 30 дней.
[0119] Модель карциномы молочной железы SM1 (Фиг. 6B) как первичная опухоль исходно является менее быстрорастущей, и смерть, вероятно, наступает из-за других механизмов, чем при метастазирующем заболевании. К 30 дню обработки опухоли SM1 достигали среднего объема приблизительно на 33% меньше, чем TS/A или 4T1. Это указывало на повышенную чувствительность опухоли SM1 к иммунотерапии Nani-P2 по сравнению с 4T1, такую, что рост опухоли был подавлен у 100% животных на протяжении 16 дней, а у 40% животных сохранялась ремиссия даже через 28 дней после имплантации и одну неделю после завершения схемы лечения.
[0120] Чтобы определить, участвуют ли цитотоксические Т-лимфоциты в отторжении опухоли, вызванном терапией Nani-P2, проводили анализ IFN-γ с помощью ELISA (Фиг. 7) для сравнения клетки селезенки мышей с опухолью 4T1, не обработанных (контроль) или обработанных Nani-P2 (Фиг. 7). Селезенку удаляли в стерильных условиях и обрабатывали, как описано в других источниках (duPre' S. et al. Exp. Mol. Path. 85:174-188, 2008). Вкратце, селезенку гомогенизировали, а спленоциты как богатый источник системных цитолитических Т-клеток и антигенпрезентирующих клеток сокультивировали с обработанными митомицином C стимулирующими клетками 4T1, чтобы индуцировать вторичный иммунный ответ. Контрольные лунки культивировали только со средой.
[0121] Количественное определение концентрации IFN-γ, стандартного показателя активации цитотоксических Т-лимфоцитов, проводили с помощью коммерческого ELISA (BD Biosciences). Образование IFN-γ было существенно выше (p<0,01**) в культурах клеток селезенки, отобранных из обработанных Nani-P2 мышей BALB/c во всех условиях исследования. Активность IFN-γ в обработанных Nani-P2, но не в контрольных животных, можно было усилить добавлением IL-4 и GM-CSF (p<0,05) в условиях, которые, как показано, способствуют дифференцировке дендритных клеток, и можно еще больше усилить, добавляя стимуляторы еще в начале культивирования (индекс стимуляции=53 против контроля, 3S+IL4+GM-CSF), указывая на активность Nani-P2, взаимоусиливающую другие агонисты цитотоксических Т-лимфоцитов.
[0122] Для дальнейшего исследования эффективности Nani-P2 в отношении сформированного и метастазирующего рака молочной железы клетки 4T1 инъецировали подкожно в абдоминальную молочную железу мышей и откладывали лечение до того времени, когда опухоль метастазировала в легкие и достигла размера в среднем 3,5 мм (Фиг. 8A, день 13), что соответствует размеру 2,4 см или стадии T2 рака молочной железы человека. Наблюдали за ростом опухоли (Фиг. 8A) и метастазами в легких (Фиг. 8B) у мышей. При вскрытии животные, получавшие лечение Nani-P2, демонстрировали значительное снижение видимого количества метастаз в легких по сравнению с контролем (Фиг. 9). Среднее число видимых невооруженным глазом опухолевых узлов в легких мышей, обработанных внутривенно Nani-P2, равно семи по сравнению с 35,3 в контрольной обработанной фосфатно-солевым буфером группе (p<0,01**). Это соответствовало менее агрессивному фенотипу первичной опухоли, а также метастазам в легкие, размер которых был в среднем гораздо меньше (Фиг. 8B).
[0123] Эффективность Nani-P2 в отношении заранее сформированной быстрорастущей опухоли молочной железы 4T1 явно и достоверно доказывает сравнение массы первичной опухоли у внутривенно обработанных животных (40 нг в/в Nani-P2) и контрольных (обработанных фосфатно-солевым буфером) животных (в день 18 p<0,01**, Фиг. 10). Этот статистически значимый эффект подавления первичной опухоли (Фиг. 10) сохранялся на протяжении всего исследования, продолжающегося 50 дней (p<0,01**), хотя между днями 14 и 28 вводили всего три еженедельные дозы полипептидного производного Tat. Более того, 7 из 10 мышей демонстрировали регрессию опухоли при исходной обработке опухоли в день 14. Это обусловило статистически высокозначимый эффект на выживаемость (p<0,005**, см. Фиг. 5B). Следует отметить, что у одного животного произошла полная ремиссия, и оно оставалось здоровым на протяжении более 50 дней, когда исследование завершили, что подтверждает вывод о том, что данное животное стало практически свободным от опухолей.
Пример 3
Терапия повторными дозами производных Tat и циклофосфамида
[0124] Четырем группам по 10 мышей BALB/c имплантировали 1×104 клеток 4T1 подкожно в жировое тело молочной железы. Лечение начинали, когда диаметр опухоли достигал 4-5 мм, в день 10. Контрольным мышам инъецировали внутривенно фосфатно-солевой буфер с интервалом 3 дня, в то время как парные мыши из группы терапии получали 3 дозы лекарственного средства каждые 3 дня в рамках повторяющихся 10-дневных циклов. Опухолевую массу (размер опухоли в мм3) вычисляли с помощью стандартной формулы. Мышам, обработанным только CY (cyclophosphamide, циклофосфамид), делали еженедельные внутрибрюшинные инъекции 80 мг/кг на мышь, начиная с дня 10. Мышам Nani-P2 (сначала обработанным циклофосфамидом, затем Nani-P2) сначала внутрибрюшинно инъецировали 3 дозы циклофосфамида (80 мг/кг) с 3-дневным интервалом, начиная с дня 10, а затем внутривенно инъецировали Nani-P2 (40 нг) с 3-дневным интервалом, последовательно вводя три дозы. Цикл введения 3 доз CY, а затем 3 доз Nani-P2 повторяли до дня 50. Мышам Nani-P2/CY (сначала Nani-P2, затем циклофосфамид) сначала инъецировали внутривенно 3 дозы Nani-P2 (40 нг) с 3-дневным интервалом, начиная с дня 10, а затем последовательно внутрибрюшинно инъецировали циклофосфамид с 3-дневным интервалом. Цикл введения 3 доз Nani-P2, а затем 3 доз CY повторяли до дня 50.
[0125] Уменьшение опухолевой массы в группе Nani-P2/CY по сравнению с группой CY является статистически высокозначимым (Фиг. 11, p=0,003077).
[0126] Улучшение выживаемости при болюсном введении Nani-P2, чередующимся с циклофосфамидом, по сравнению с еженедельным введением циклофосфамида является статистически высокозначимым (Фиг. 12, p=0,0001). В когорте Nani-P2 у 3 из 10 мышей наступала полная ремиссия, а у 9 из 10 мышей - частичная ремиссия в день 50 (не показано), в то время как 10 из 10 мышей, обработанных циклофосфамидом, умирали к дню 42.
Пример 4
Присутствие CD8+ цитотоксических Т-лимфоцитов селезенки в мышах, получающих Nani-P2
[0127] Селезенка представляет собой основной лимфоидный орган и место, где антигенпрезентирующие клетки презентируют захваченные опухолеассоциированные антигены для стимуляции ответов цитотоксических Т-клеток. Опухолеспецифичные цитотоксические Т-лимфоциты мигрируют к месту инфекции и лизируют клетку-мишень.
[0128] Самкам мышей BALB/c инокулировали в жировое тело молочной железы клетки сингенной и активно метастазирующей опухоли молочной железы 4T1, чтобы смоделировать опухоль молочной железы человека IV стадии. Иммунотерапию Nani-P2 начинали через 7 дней после инокуляции опухолевых клеток. Размер опухоли определяли с помощью циркуля на протяжении всего исследования, и вырезали опухоль в день 29/30. Проводили иммуногистохимическое окрашивание на CD8 фиксированных формалином, заключенных в парафин образцов резецированной ткани селезенки.
[0129] Как показано на Фиг. 13, иммуногистохимическое окрашивание выявляет увеличенные популяции CD8+ клеток селезенки мыши после обработки производными Tat (Фиг. 13B) по сравнению с отсутствием лечения (фосфатно-солевой буфер, Фиг. 13A)).
Пример 5
Индукция проникающих в опухоль молочной железы 4T1 CD8+ цитотоксических T-лимфоцитов с помощью Nani-P2 в присутствии PD-L1
[0130] Рефракторное состояние опухолей по отношению к иммунотерапевтическим средствам может представлять собой последствие иммуносупрессии, сопровождающей прогрессию заболевания при развившейся опухоли. В опухолевом микроокружении экспрессия лиганда рецептора запрограммированной клеточной смерти 1 (PD-L1, programmed cell death ligand 1) является маркером прогрессии заболевания, плохого прогноза и нарушения противоопухолевого иммунитета хозяина за счет подавления функции проникающих в опухоль CD8+ цитотоксических T-лимфоцитов. Таким образом, присутствие PD-L1 в различных типах опухолей представляет собой основное препятствие при разработке эффективных иммунотерапевтических средств.
[0131] Полипептидные производные Tat, раскрытые в настоящей заявке, вызывают противоопухолевый иммунный ответ, индуцируя дендритные клетки моноцитарного происхождения к стимуляции CD8+ цитотоксических Т-лимфоцитов и преодолению PD-L1 иммуносупрессии. Таким образом, иммуносупрессорный сигнальный путь PD-1/PD-L1 может представлять возможный механизм, с помощью которого опухоли 4T1 ускользают от противоопухолевого иммунного ответа хозяина, и, таким образом, полипептидные производные Tat могут влиять на прогрессию солидной опухоли посредством индукции проникающих в опухоль CD8+ цитотоксических Т-лимфоцитов на фоне иммуносупрессии PD-L1.
[0132] Самкам мышей BALB/c инокулировали в жировое тело молочной железы клетки сингенной и активно метастазирующей опухоли молочной железы 4T1, чтобы смоделировать опухоль молочной железы человека IV стадии. Иммунотерапию Nani-P2 начинали через 7 дней после инокуляции опухолевых клеток. Размер опухоли определяли с помощью циркуля на протяжении всего исследования, и вырезали опухоль в день 29/30. Проводили иммуногистохимическое окрашивание PD-L1 и CD8 фиксированных формалином, заключенных в парафин образцов первичных опухолей 4T.
[0133] Как показано на Фиг. 14, экспрессия PD-L1 понижена в животных, получающих лечение Nani-P2 (Фиг. 14B) по сравнению с контролем (Фиг. 14A). Окрашивание PD-L1 наблюдали в клетках, морфологически напоминающих миелоидные супрессорные клетки, ассоциированный с опухолью макрофаг, а также ассоциированные с опухолью дендритные клетки и фибробласт. Снижение PD-L1 основано на in vivo данных измерения опухоли при обработке Nani-P2 по сравнению с контролем, в сочетании с менее интенсивным окрашиванием PD-L1. Наиболее выраженное окрашивание PD-L1 по краю опухоли, по большей части отсутствует при обработке Nani-P2 по сравнению с контролем. Лишь немногие клетки окрашивались положительно на CD8+ цитотоксические Т-лимфоциты в обработанном фосфатно-солевым буфером контроле (Фиг. 14C), в то время как в обработанных PIN-2 мышах инфильтрующие CD8+ цитотоксические Т-лимфоциты проникали по краю опухоли (ФИГ. 14D).
[0134] Иммуноокрашивание сформированных первичных опухолей молочной железы 4T1 в мышах, обработанных PIN-2, по сравнению с контрольными мышами, обработанным фосфатно-солевым буфером, выявило значительное увеличение популяции проникающих в опухоль CD8+ цитотоксических Т-лимфоцитов. Присутствие PD-L1 на краю опухоли может вносить вклад в малигнизацию опухоли и ускользание от механизмов иммунологического надзора, действуя как «молекулярный экран» для ингибирования активности цитотоксических Т-лимфоцитов через PD-1/PD-L1 путь передачи сигнала. Проникающие в опухоль CD8+ цитотоксические Т-лимфоциты, по всей видимости, локализуются на краю опухоли в обработанных Nani-P2 мышах, в то время как в обработанном фосфатно-солевым буфером контроле эти цитотоксические Т-лимфоциты в основном отсутствуют на краю опухоли. Поскольку PD-L1 является маркером, ассоциированным с прогрессией заболевания, злокачественностью и плохим прогнозом, обратную корреляцию опухолевого PD-L1 и CD8+ цитотоксических Т-лимфоцитов можно объяснить на основании противоопухолевого ответа цитотоксических Т-лимфоцитов, наблюдаемого при обработке PIN-2.
[0135] В заключение следует отметить, что (i) при обработке PIN-2 наблюдали уменьшения присутствия PD-L1 на краю опухоли; (ii) CD8+ цитотоксические Т-лимфоциты способствуют противоопухолевому иммунному ответу, наблюдаемому в обработанных PIN-2 мышах; (iii) проникновение CD8+ цитотоксических Т-лимфоцитов в PD-L1+ первичные опухоли молочной железы позволяет предположить, что PINS преодолевает иммуносупрессорные механизмы, которые опухоль применяет в качестве барьеров (иммунологические контрольные точки) для эффективного противоопухолевого иммунного ответа; (iv) детектирование присутствия PD-L1 с помощью иммуногистохимии в сформированных первичных опухолях молочной железы 4T1 указывает на роль иммуносупрессорной линии PD-1/PD-L1 как важного механизма ухода опухоли от иммунных механизмов; (v) полипептидные производные Tat, раскрытые в настоящей заявке, обладают способностью преодолевать PD-1/PD-L1 путь передачи сигнала при раке молочной железы, экспрессирующем PD-L1; и (vi) введение полипептидных производных, раскрытых в настоящей заявке, обращает иммуносупрессию, периодически возникающую во время прогрессии рака, и восстанавливает иммунореактивность.
[0136] Если иное не указано, все числа, выражающие количество ингредиентов, свойства, такие как молекулярный вес, условия реакции и т. п., применяемые в настоящем описании изобретения и в формуле изобретения, следует понимать как определенные во всех случаях термином «приблизительно». Соответственно, если противоположное не указано, числовые параметры, заданные в настоящем описании изобретения и в прикрепленной формуле изобретения, являются приближениями, которые могут варьировать в зависимости от желаемых свойств, которые необходимо определить в настоящем изобретении. По крайней мере, но не желая ограничить применение доктрины эквивалентов объемом формулы изобретения, каждый числовой параметр необходимо интерпретировать с учетом числа из заявленных значащих цифр с применением стандартных техник округления. Даже при условии, что числовые интервалы и параметры, задающие широкий объем изобретения, являются приближениями, числовые значения, указанные в конкретных примерах, приведены с максимально возможной точностью. Однако любое числовое значение по существу содержит определенные ошибки, возникающие как результат стандартного отклонения, выявляемого при соответствующих опытных измерениях.
[0137] Термины «какой-либо», «этот» и подобные обозначения, применяемые в контексте описания настоящего изобретения (особенно в контексте следующей формулы изобретения) предназначены для охвата как единственного, так и множественного числа, если иное не указано в настоящей заявке или четко не противоречит контексту. Перечисление интервалов значений в настоящей заявке подразумевает лишь сокращенный способ дать индивидуальную ссылку на каждое отдельное значение внутри интервала. Если иное не указано в настоящей заявке, каждое индивидуальное значение включено в настоящее описание изобретения так, как если бы на него была представлена индивидуальная ссылка в настоящей заявке. Все способы, описанные в настоящей заявке, можно применять в любой подходящей последовательности, если иное не указано в настоящей заявке или четко не противоречит контексту. Применение любого из примеров и всех примеров или приводимых в качестве примера выражений (напр., «такой как»), представленных в настоящей заявке, предназначено лишь для лучшей иллюстрации изобретения и не накладывает ограничений на объем настоящего изобретения, если иное не заявлено. Никакие выражения в настоящем описании изобретения не следует интерпретировать как указывающие на какой-либо незаявленный элемент, необходимый для практического применения настоящего изобретения.
[0138] Объединение в группы альтернативных элементов или вариантов осуществления настоящего изобретения, раскрытых в настоящей заявке, не следует интерпретировать как ограничение. На каждого члена группы можно дать ссылку или указание отдельно или в комбинации с другими членами группы или другими элементами, обнаруживаемыми в настоящей заявке. Предполагают, что можно включить или исключить одного или нескольких членов группы по причинам удобства и/или патентоспособности. При таком включении или исключении описание изобретения считается содержащим группу с изменениями, удовлетворяя письменному описанию всех групп Маркуша, применяемых в прилагаемой формуле изобретения.
[0139] Определенные варианты осуществления настоящего изобретения описаны в настоящей заявке, включая наилучший способ осуществления изобретения, известный изобретателям. Конечно, вариации этих описанных вариантов применения настоящего изобретения будут очевидны для специалистов в данной области техники при чтении вышеизложенного описания. Изобретатель ожидает, что специалисты в данной области техники будут применять такие вариации соответствующим образом, и изобретатели считают, что настоящее изобретение предназначено для осуществления иначе, чем конкретно описано в настоящей заявке. Соответственно, настоящее изобретение включает все модификации и эквиваленты объекта изобретения, перечисленные в прилагаемой к настоящей заявке формуле изобретения, согласно требованиям применяемых правовых норм. Более того, любая комбинация описанных выше элементов во всех возможных их вариантах включена в объем настоящего изобретения, если иное не указано в настоящей заявке или четко не противоречит контексту.
[0140] Конкретные варианты осуществления настоящего изобретения, раскрытые в настоящей заявке, можно также ограничить пунктами формулы изобретения, применяя выражения «состоящий из» или «состоящий в основном из». При применении в пунктах формулы изобретения, заявленных или добавленных при изменении, переходный термин «состоящий из» исключает любые элементы, стадии или ингредиенты, не определенные в формуле изобретения. Переходный термин «состоящий в основном из» ограничивает объем формулы изобретения конкретными материалами или стадиями и тем, что не оказывает существенного влияния на основные и новые характеристики (характеристику). Варианты осуществления настоящего изобретения, заявленные таким образом, безоговорочно или полностью описаны и представлены в настоящей заявке.
[0141] Более того, на протяжении настоящего описания изобретения были сделаны многочисленные ссылки на патенты и печатные материалы. Каждая из приведенных выше ссылок и печатных материалов в полном объеме индивидуально включена в настоящую заявку посредством ссылки.
[0142] В заключение, следует понимать, что варианты осуществления настоящего изобретения, раскрытые в настоящей заявке, иллюстрируют принципы настоящего изобретения. В объеме изобретения можно применять другие модификации. Таким образом, в качестве примера, но не ограничения, альтернативные конфигурации настоящего изобретения можно применять в соответствии с основными принципами настоящей заявки. Соответственно, настоящее изобретение не ограничивается именно показанным и описанным.



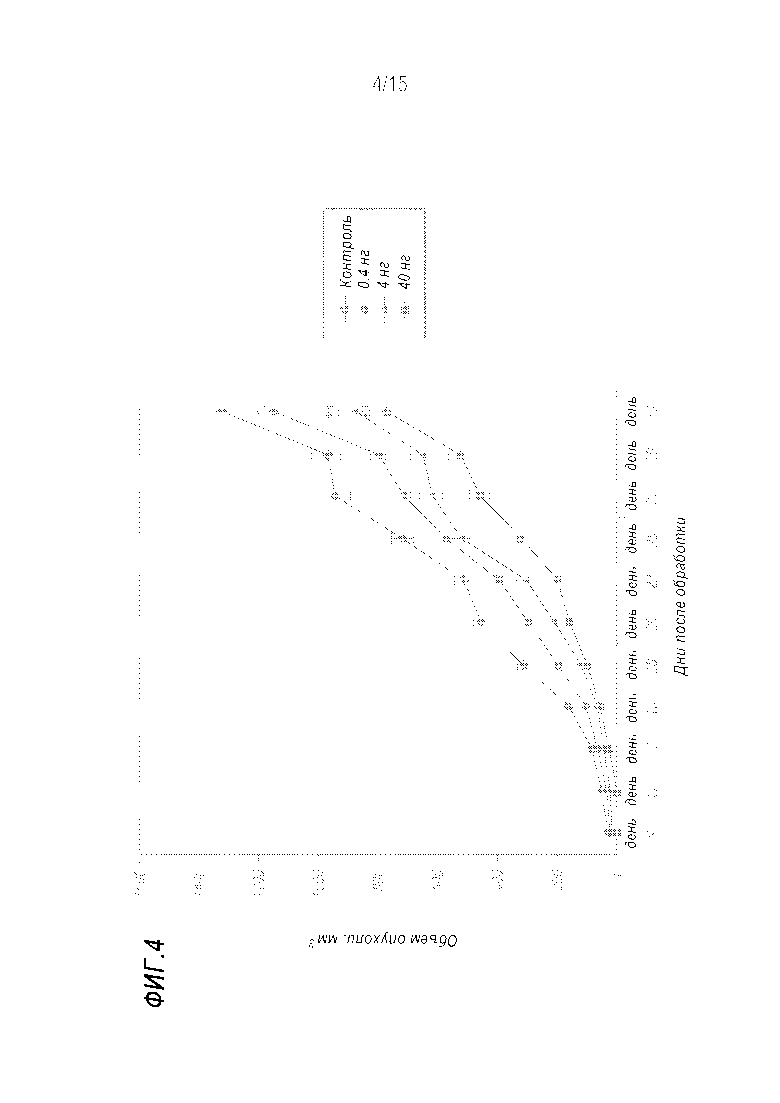
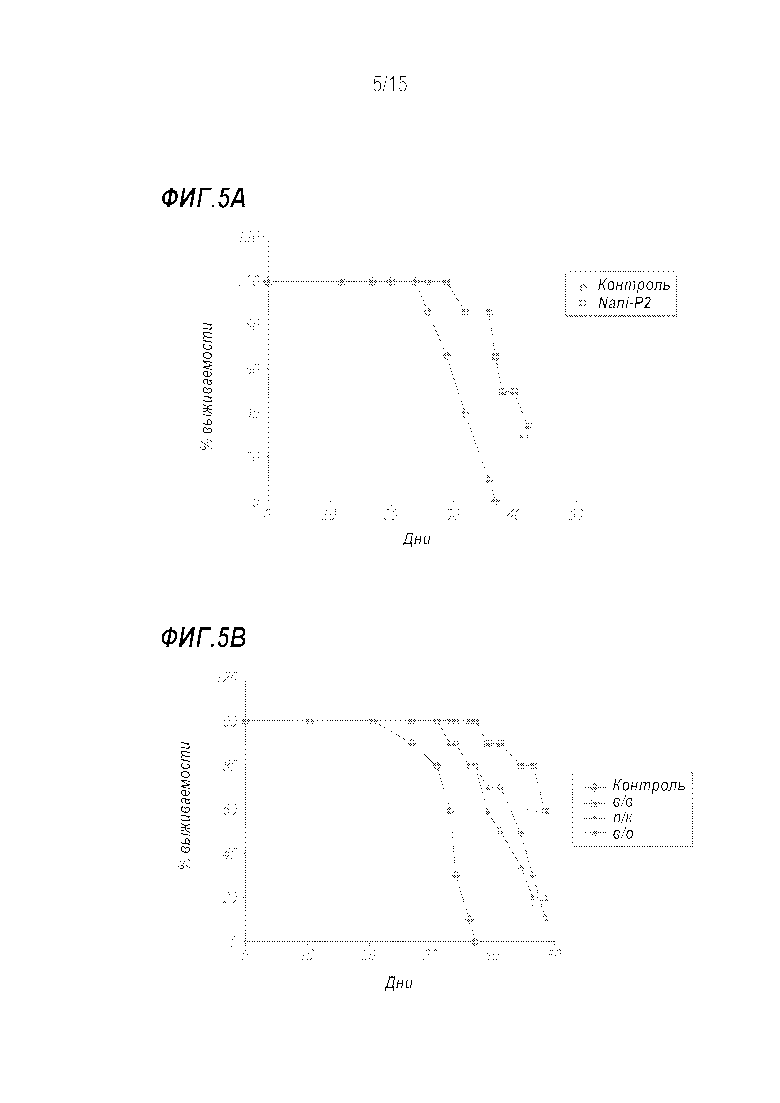

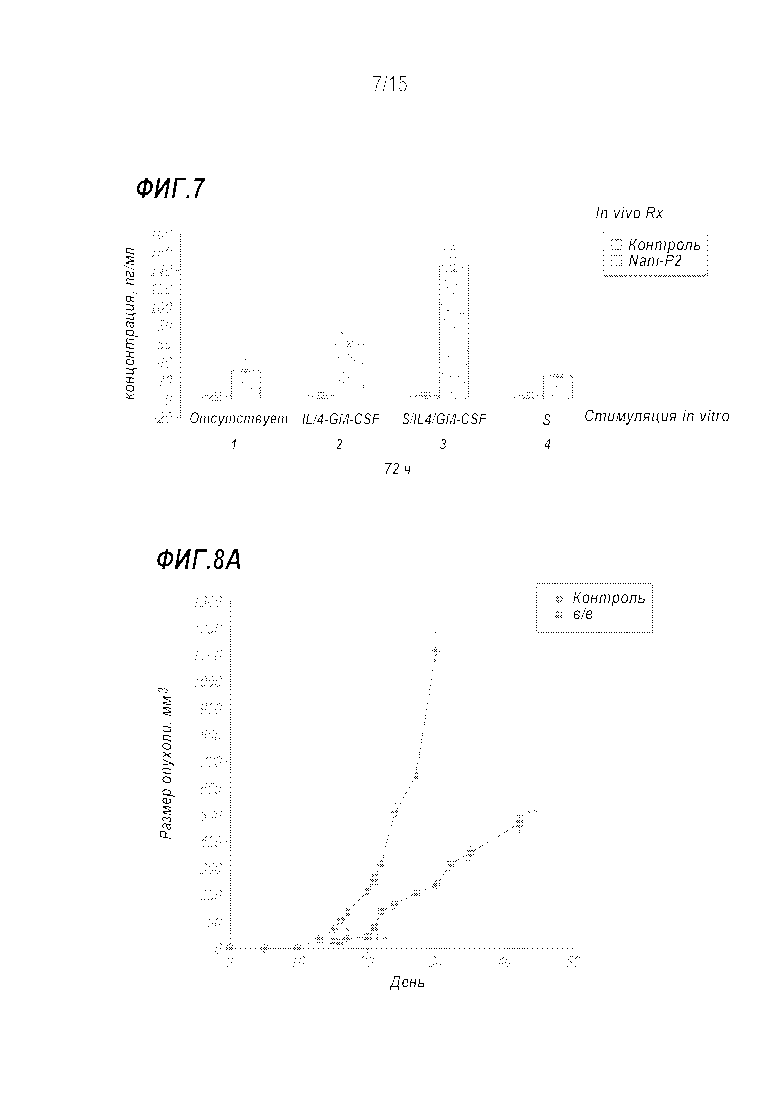



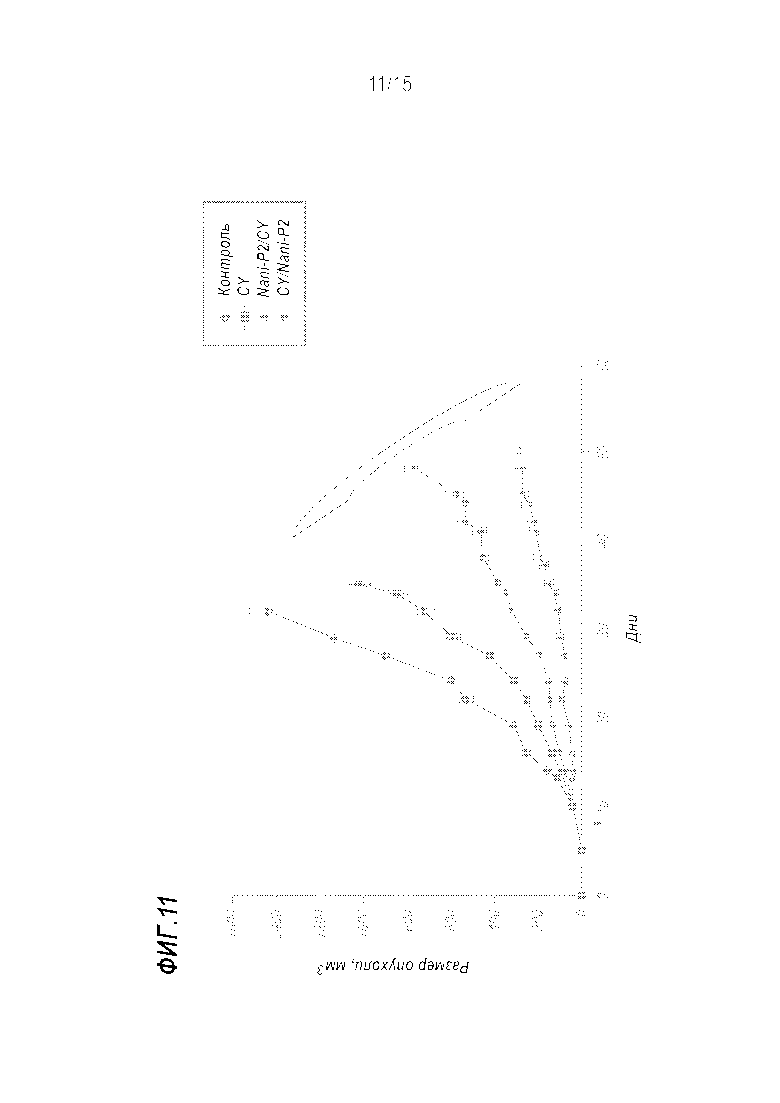

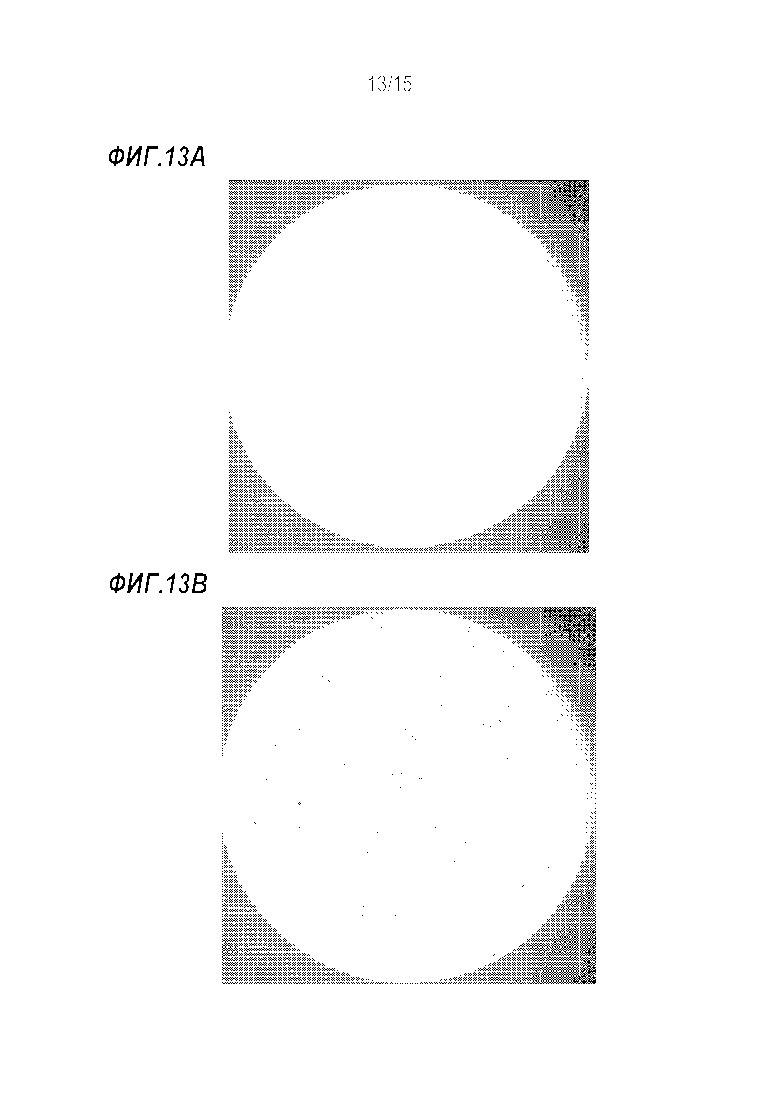


Группа изобретений относится к медицине, а именно к иммунологии, и можжет быть использована для получения иммуностимулирующего полипептидного производного трансактиватора транскрипции (Tat). Иммуностимулирующее полипептидное производное трансактиватора транскрипции имеет аминокислотную последовательность, содержащую в следующем порядке: (i) последовательность домена транскрипционного фактора из белка Tat вируса иммунодефицита человека (ВИЧ) или вируса иммунодефицита обезьян, имеющую аминокислотную последовательность SEQ ID NO:96, 97 или 98, (ii) последовательность цистеин-богатого домена из вируса иммунодефицита обезьян, ВИЧ или дефензина, имеющую более чем 85% идентичность последовательности с аминокислотной последовательностью одной из SEQ ID NO:124-132, и (iii) последовательность С-концевого домена из белка Tat ВИЧ или вируса иммунодефицита обезьян, имеющую более чем 85% идентичность последовательности с аминокислотной последовательностью одной из SEQ ID NO:133-150, причем полипептидное производное Tat не является одним из SEQ ID NO:2, 3 или 4. Группа изобретений включает также применение Tat для ингибирования подавления противоопухолевого иммунного ответа у пациента с раком, для лечения экспрессирующей PD-L1 опухоли. Использование данной группы изобретений позволяет путем ведения полипептидного производного Tat преодолевать PD-1/PD-L1 путь передачи сигнала при раке молочной железы, экспрессирующем PD-L1 путем, а также обращает иммуносупрессию, периодически возникающую во время прогрессии рака, и восстанавливает иммунореактивность. 10 н. и 9 з.п. ф-лы, 5 пр., 4 табл., 14 ил.
1. Иммуностимулирующее полипептидное производное трансактиватора транскрипции (Tat), имеющее аминокислотную последовательность, содержащую в следующем порядке:
(i) последовательность домена транскрипционного фактора из белка Tat вируса иммунодефицита человека (ВИЧ) или вируса иммунодефицита обезьян, имеющую аминокислотную последовательность SEQ ID NO:96, 97 или 98,
(ii) последовательность цистеин-богатого домена из вируса иммунодефицита обезьян, ВИЧ или дефензина, имеющую более чем 85% идентичность последовательности с аминокислотной последовательностью одной из SEQ ID NO:124-132, и
(iii) последовательность С-концевого домена из белка Tat ВИЧ или вируса иммунодефицита обезьян, имеющую более чем 85% идентичность последовательности с аминокислотной последовательностью одной из SEQ ID NO:133-150,
причем полипептидное производное Tat не является одним из SEQ ID NO:2, 3 или 4.
2. Полипептидное производное Tat по п.1, дополнительно содержащее аргинин-богатый домен из Tat ВИЧ-1 или ВИЧ-2.
3. Полипептидное производное Tat по п.1, где по меньшей мере одна из аминокислот в домене транскрипционного фактора удалена или заменена аланином, аспарагиновой кислотой, глутаминовой кислотой, глицином, лизином, глутамином, аргинином, серином или треонином.
4. Полипептидное производное Tat по п.3, где по меньшей мере одна замененная аминокислота является пролином.
5. Полипептидное производное Tat по п.1, где полипептидное производное Tat обладает более чем 85% идентичностью последовательности с одной из SEQ ID NO:5-95.
6. Иммуностимулирующая фармацевтическая композиция, содержащая полипептидное производное Tat по п.1.
7. Применение терапевтически эффективного количества полипептидного производного Tat по любому из пп. 1-5 для лечения рака у пациента, вызывающее таким образом прекращение роста опухоли или регрессию опухоли у пациента.
8. Применение терапевтически эффективного количества полипептидного производного Tat по любому из пп. 1-5 для уменьшения опухолевой массы у пациента с раком, вызывающее таким образом регрессию опухоли у пациента.
9. Применение терапевтически эффективного количества полипептидного производного Tat по любому из пп. 1-5 для ингибирования подавления противоопухолевого иммунного ответа у пациента с раком, где введение полипептидного производного Tat приводит к уменьшению или ингибированию роста опухоли или к регрессии опухоли у пациента.
10. Применение терапевтически эффективного количества полипептидного производного Tat по любому из пп. 1-5 для лечения экспрессирующей PD-L1 опухоли у пациента с раком, где введение полипептидного производного Tat приводит к уменьшению или ингибированию роста опухоли или к регрессии опухоли у пациента.
11. Применение терапевтически эффективного количества фармацевтической композиции по п.6 для лечения рака у пациента, вызывающее таким образом прекращение роста опухоли или регрессию опухоли у пациента.
12. Применение терапевтически эффективного количества фармацевтической композиции по п.6 для уменьшения опухолевой массы у пациента с раком, вызывающее таким образом регрессию опухоли у пациента.
13. Применение терапевтически эффективного количества фармацевтической композиции по п.6 для ингибирования подавления противоопухолевого иммунного ответа у пациента с раком, где введение полипептидного производного Tat приводит к уменьшению или ингибированию роста опухоли или к регрессии опухоли у пациента.
14. Применение терапевтически эффективного количества фармацевтической композиции по п.6 для лечения экспрессирующей PD-L1 опухоли у пациента с раком, где введение полипептидного производного Tat приводит к уменьшению или ингибированию роста опухоли или к регрессии опухоли у пациента.
15. Применение по пп. 9, 10, 13 или 14, где у пациента по меньшей мере одна опухоль перед лечением содержит по меньшей мере 5% экспрессирующих PD-L1 клеток.
16. Применение по п.15, где у пациента по меньшей мере одна опухоль перед лечением содержит от 5% до 20% экспрессирующих PD-L1 клеток.
17. Применение по п.15, где у пациента по меньшей мере одна опухоль перед лечением содержит от 5% до 15% экспрессирующих PD-L1 клеток.
18. Применение по п.15, где у пациента по меньшей мере одна опухоль перед лечением содержит от 5% до 10% экспрессирующих PD-L1 клеток.
19. Применение по любому из пп. 7-14, где рак является аденокортикальной карциномой, раком анального канала, раком аппендикса, астроцитомой, базальноклеточной карциномой, раком желчного протока, раком мочевого пузыря, раком кости, раком мозга, раком груди, бронхиальной аденомой/бронхиальным карциноидом, карциноидной опухолью, раком шейки матки, хроническими миелопролиферативными нарушениями, раком толстого кишечника, десмопластической мелкокруглоклеточной опухолью, раком эндометрия, эпендимомой, раком пищевода, саркомой Юинга, герминогенными опухолями, раком глаза, раком желчного пузыря, раком желудка, желудочно-кишечной карциноидной опухолью, желудочно-кишечной стромальной опухолью, гестационной трофобластической опухолью, глиомой, карциноидом желудка, раком головы и шеи, раком сердца, гепатоцеллюлярным раком, лимфомой Ходжкина, гипофарингеальным раком, карциномой островковых клеток, саркомой Капоши, раком почек, лейкемиями, раком губ и ротовой полости, липосаркомой, раком печени, раком легких, лимфомами, макроглобулинемией, медуллобластомой, меланомой, карциномой из клеток Меркеля, мезотелиомой, раком ротовой полости, множественной миеломой/плазмаклеточной миеломой, фунгоидной гранулемой, раком носовой полости и придаточных пазух носа, раком носоглотки, нейробластомой, раком ротовой полости, раком ротоглотки, раком яичников, эпителиальным раком яичников, раком поджелудочной железы, раком паращитовидной железы, раком полового члена, раком глотки, феохромоцитомой, астроцитомой эпифиза, герминомой эпифиза, пинеобластомой, аденомой гипофиза, плевропульмонарной бластомой, раком простаты, раком прямой кишки, почечно-клеточным раком, ретинобластомой, рабдомиосаркомой, раком слюнных желез, саркомой, синдромом Сезари, раком кожи, плоскоклеточной карциномой, раком желудка, раком семенников, раком горла, тимомой, раком щитовидной железы, раком уретры, раком матки, саркомой матки, раком влагалища, раком вульвы, макроглобулинемией Вальденстрема или опухолью Вильмса.
| WO 2010111292 A1, 09.2010 | |||
| WO 2006033665 A1, 30.03.2006 | |||
| WO 2011128720 A1, 20.10.2011 | |||
| WO 2013173223 A1, 21.11.2013. |
Авторы
Даты
2019-07-25—Публикация
2014-10-03—Подача