ПОПЕРЕЧНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По настоящей заявке PCT испрашивается приоритет в соответствии с заявкой US № 61/286765, поданной 15 декабря 2009. Полное содержание вышеуказанной заявки включено сюда в виде ссылки во всей ее полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается новой соли тиазолидиндионов, которая может использоваться для лечения и/или профилактики состояний нарушения обмена веществ (например, диабета, ожирения и нейродегенеративных заболеваний (например, болезни Альцгеймера)).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В течение последних нескольких десятилетий ученые пришли к обоснованному заключению, что PPARγ является мишенью действия сенсибилизирующих инсулин тиазолидиндионовых соединений.
Рецепторами, активирующими пролиферацию пероксисом (PPAR), являются представители суперсемейства ядерных гормональных рецепторов, которые являются лиганд-активируемыми транскрипционными факторами, регулирующими экспрессию генов. PPAR вовлечены в аутоиммунные и другие заболевания, например, сахарный диабет, сердечно-сосудистые и желудочно-кишечные заболевания и болезнь Альцгеймера.
PPARγ является ключевым регулятором дифференциации жировых клеток и липидного метаболизма. PPARγ также был обнаружен в других типах клеток, в том числе, в фибробластах, миоцитах, клетках молочной железы, клетках-предшественниках костного мозга человека и макрофагах/моноцитах. Кроме того, PPARγ был обнаружен в пенистых клетках макрофагов в атеросклеротических бляшках.
Тиазолидиндионы, разработанные сначала для лечения диабета типа 2, обычно проявляют высокую аффинность в качестве лигандов PPARγ. После того, как было обнаружено, что тиазолидиндионы могут проявлять свои терапевтические эффекты посредством прямых взаимодействий с PPARγ, возникла идея о том, что PPARγ является ключевым регулятором глюкозного и липидного гомеостаза. Однако соединения, которые вовлечены в активацию PPARγ, вызывают также обратный захват натрия и другие неприятные побочные эффекты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
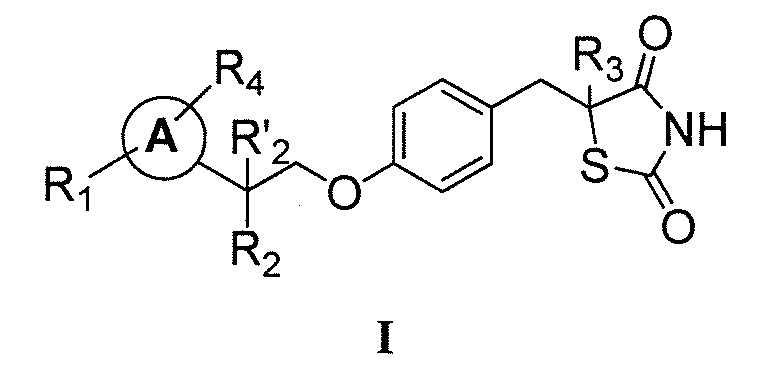
Настоящее изобретение относится к соли тиазолидиндиона. Соединения формулы I, а также их соли, демонстрируют уменьшенное связывание и активацию ядерного фактора транскрипции PPARγ. Соли соединений по настоящему изобретению в меньшей степени связываются с ядерным фактором транскрипции PPARγ и активируют его, не увеличивают обратный захват натрия, и могут использоваться для лечения или профилактики ожирения, диабета, нейродегенеративных заболеваний и других нарушений обмена веществ. Преимущество соединений заключается в их низкой активности в отношении PPARγ, что дает меньше побочных эффектов, чем соединения, обладающие более высокими уровнями активности в отношении PPARγ. Более конкретно, в виду пониженной способности связывать и активировать PPARγ, указанные соли соединений являются особенно эффективными для лечения и/или профилактики ожирения или диабета, как в виде самостоятельного терапевтического средства, так и в сочетании с другими средствами, которые влияют на уровни клеточных циклических нуклеотидов, включая ингибиторы фосфодиэстеразы, адренергические агонисты или различные гормоны. Кроме того, соли по настоящему изобретению могут быть подвергнуты дальнейшей обработке с получением со-кристаллов солей соединений, имеющих формулу I.
Более того, в некоторых случаях, соли соединений обладают улучшенными биологическими и физическими свойствами по сравнению с их формами свободных кислот. Например, некоторые соли соединений демонстрируют улучшенную биодоступность по сравнению с их формами свободных кислот. Другие соли обладают одной полиморфной модификаций, тогда как соединение в форме свободной кислоты обладает несколькими полиформами.
В одном аспекте, настоящее изобретение касается гидрохлоридной (HCl) соли соединения формулы I:
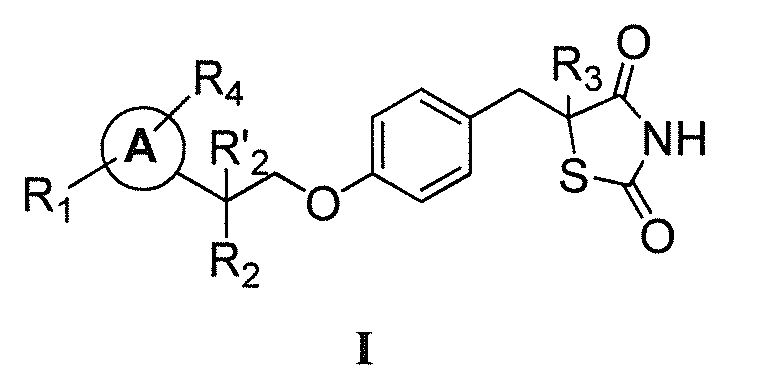
где каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена; R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 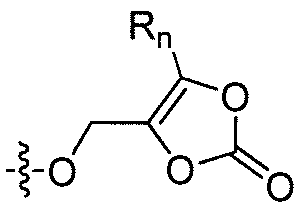 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; R3 представляет собой H или C1-3 алкил; и кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; R3 представляет собой H или C1-3 алкил; и кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
Другой аспект настоящего изобретения касается дигидросульфатной (H2SO4) соли соединения формулы I:
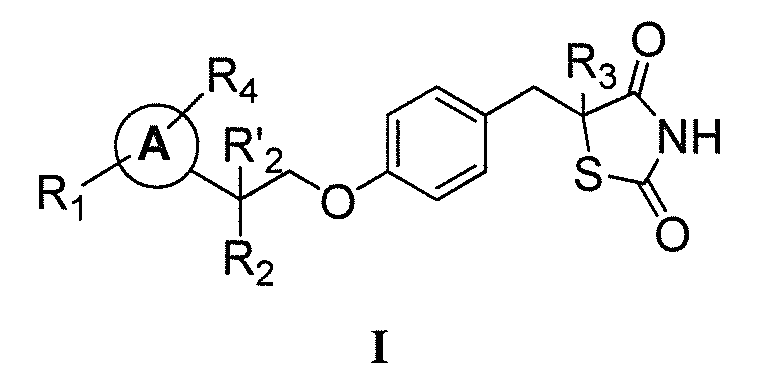
где каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена; R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 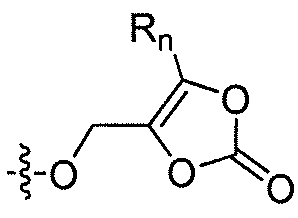 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; R3 представляет собой H или C1-3 алкил; и кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; R3 представляет собой H или C1-3 алкил; и кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
В некоторых вариантах осуществления изобретения, R3 представляет собой H.
В некоторых вариантах осуществления изобретения, R3 представляет собой CH3.
В некоторых вариантах осуществления изобретения, R4 представляет собой H, метил, метокси, этокси, -O-изопропил, -CF3, -OCHF2 или -OCF3.
В некоторых вариантах осуществления изобретения, R4 представляет собой H.
В некоторых вариантах осуществления изобретения, R1 представляет собой H, алкил, галоген или алкокси.
В некоторых вариантах осуществления изобретения, R1 представляет собой H.
В некоторых вариантах осуществления изобретения, R1 представляет собой галоген.
В некоторых вариантах осуществления изобретения, R1 представляет собой C1-3 алкил.
В некоторых вариантах осуществления изобретения, кольцо A представляет собой фенил, который замещен группами R1 и R4 в любом химически приемлемом положении кольца A. В некоторых примерах, кольцо A представляет собой фенил, и один из R1 или R4 присоединен в пара или мета положение кольца A. В других примерах, кольцо A представляет собой фенил, и один из R1 или R4 присоединен в мета положение кольца A. В некоторых примерах, R1 присоединен в пара или мета положение кольца A. И, в некоторых примерах, R1 представляет собой F или Cl, каждый из которых присоединен в пара или мета положение кольца A. В других примерах, R1 представляет собой алкокси (например, метокси, этокси, пропокси, -O-изопропил, бутокси или -O-трет-бутил), который присоединен в пара или мета положение кольца A. В других примерах, кольцо A представляет собой фенил, и R1 присоединен в мета или орто положение фенильного кольца. Так, например, кольцо A представляет собой фенил, и R1 присоединен в орто положение фенильного кольца. В некоторых случаях, кольцо A представляет собой фенил, и R1 представляет собой метокси, этокси или -O-изопропил, любой из которых присоединен в орто положение кольца A. В других случаях, R1 представляет собой -CF3, -OCHF2 или -OCF3.
В некоторых вариантах осуществления изобретения, кольцо A представляет собой необязательно замещенный пиридин-2-ил или необязательно замещенный пиридин-3-ил, любой из которых замещен группами R1 и R4 в любом химически приемлемом положении кольца A. В некоторых примерах, кольцо A представляет собой пиридин-2-ил, и один из R1 или R4 присоединен в 5-ое положение кольца. В других примерах, кольцо A представляет собой пиридин-3-ил, и один из R1 или R4 присоединен в 6-ое положение кольца. В некоторых примерах, кольцо A представляет собой пиридин-2-ил, и R1 присоединен в 5-ое положение кольца. Так, например, кольцо A представляет собой пиридин-2-ил, и R1 представляет собой алкил или алкокси, любой из которых присоединен в 5-ое положение кольца A. В других случаях, кольцо A представляет собой пиридин-2-ил, и R1 представляет собой метил, этил, пропил, изопропил, бутил или трет-бутил, любой из которых присоединены в 5-ое положение кольца A.
В некоторых вариантах осуществления изобретения, R'2 представляет собой H.
В некоторых вариантах осуществления изобретения, R2 представляет собой гидрокси.
В некоторых вариантах осуществления изобретения, R2 представляет собой -O-ацил, -O-ароил или -O-гетероароил.
В некоторых вариантах осуществления изобретения, R2 и R'2 вместе образуют оксо.
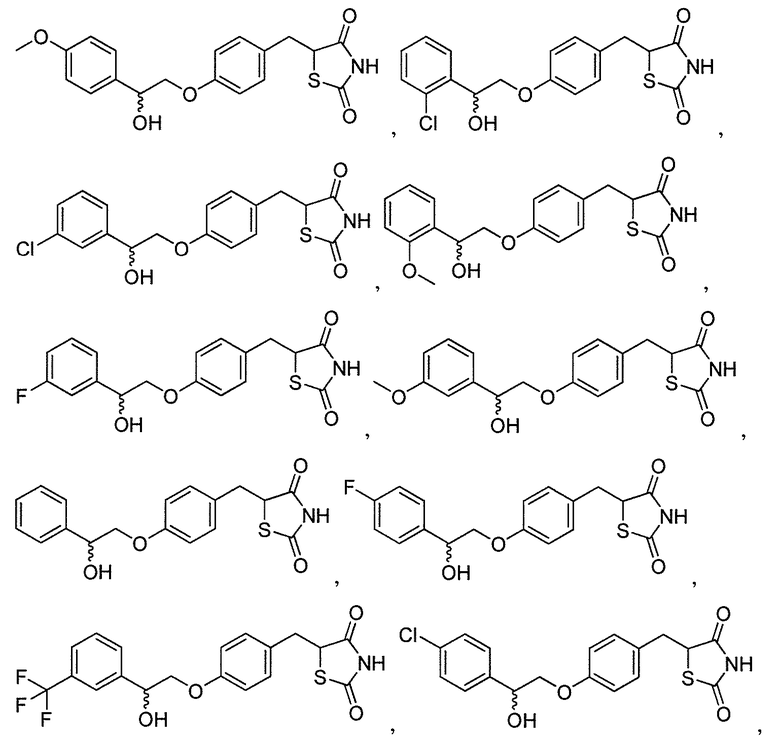
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
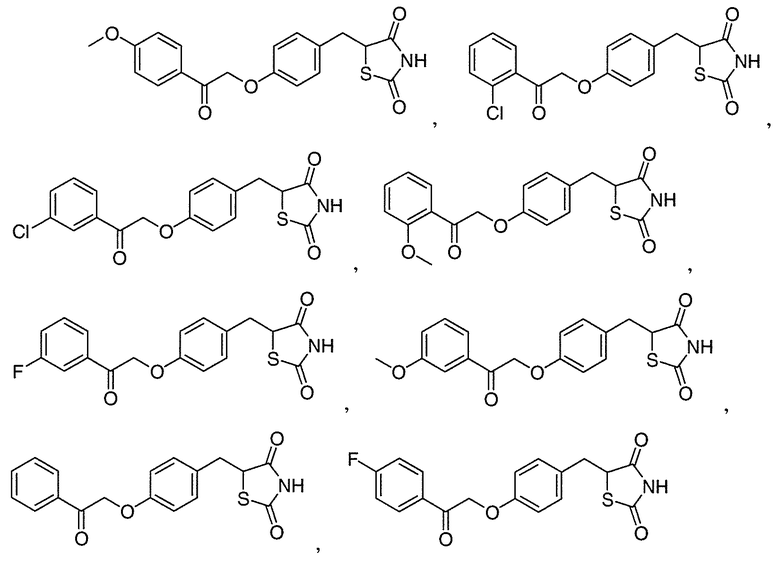
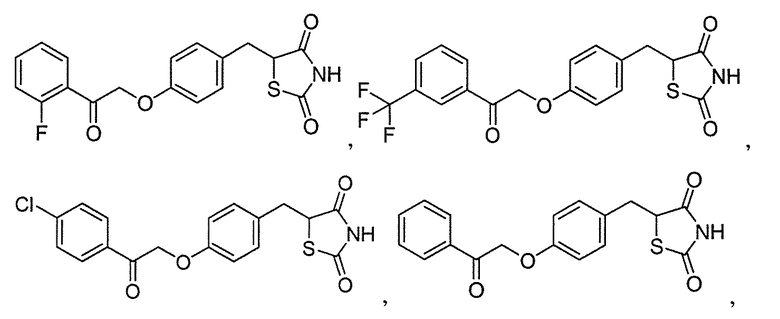
 или
или 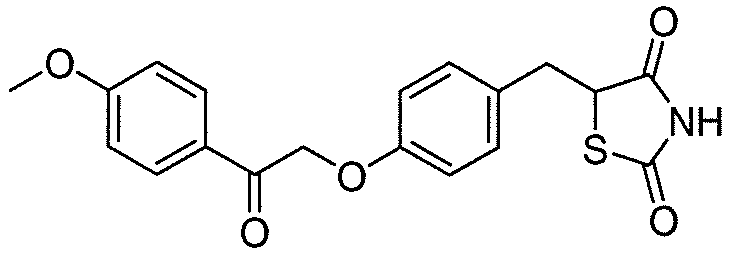 .
.
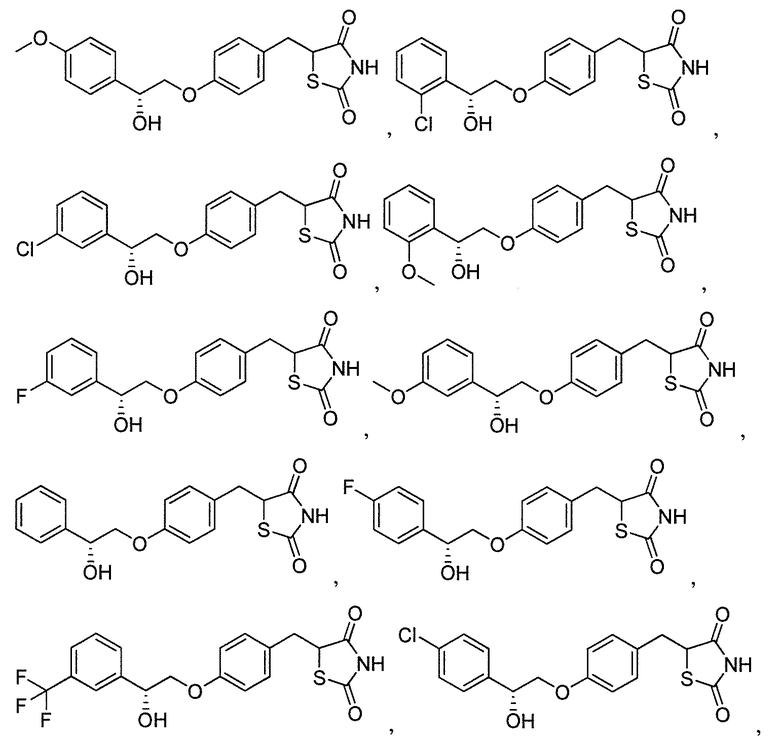
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
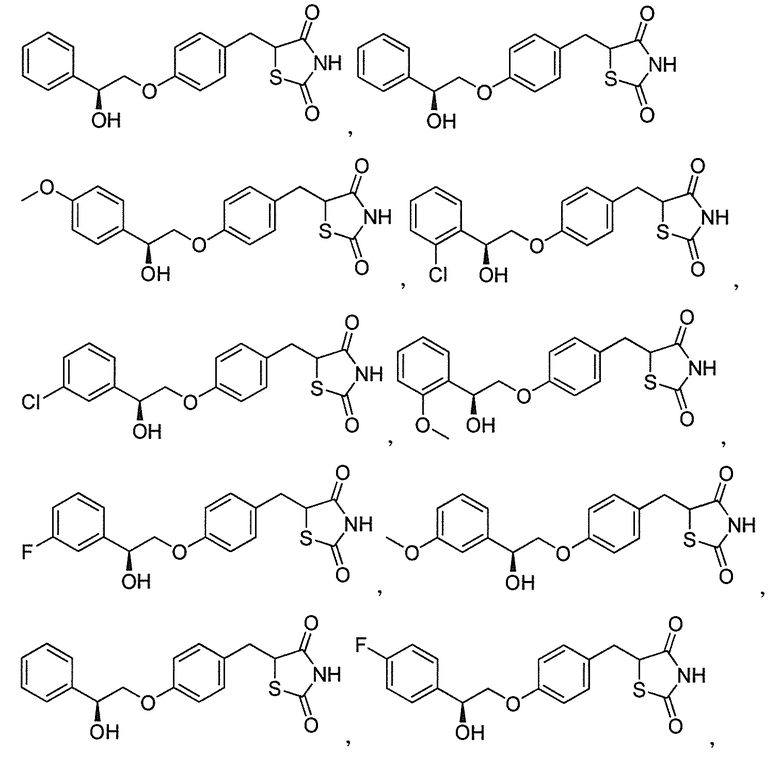
или 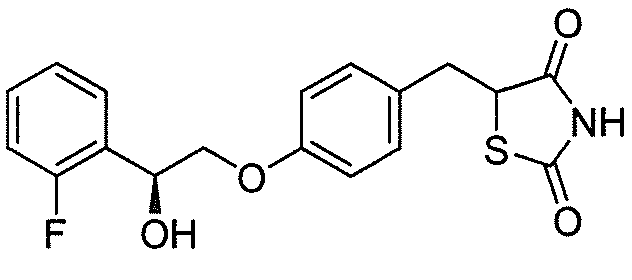 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
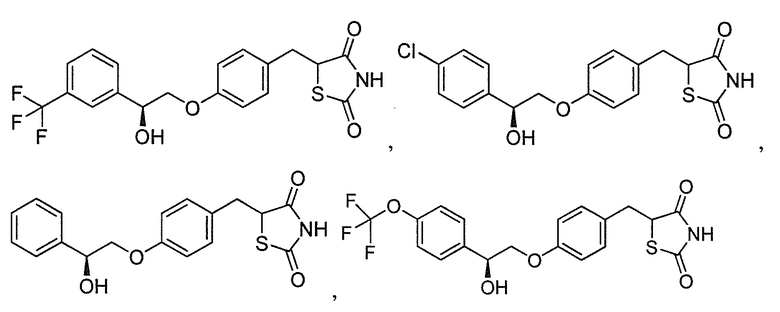
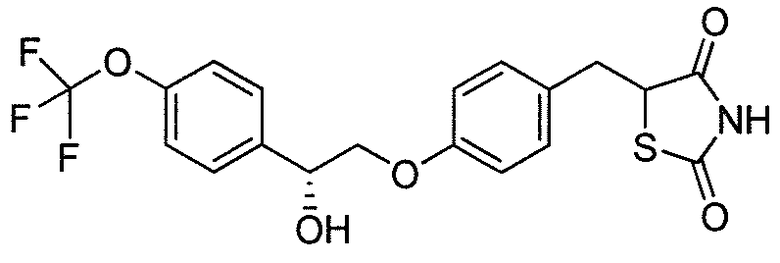 или
или 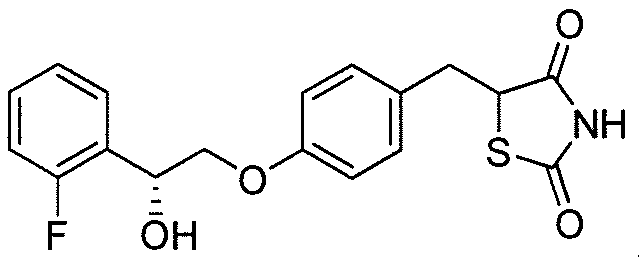 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
 или
или 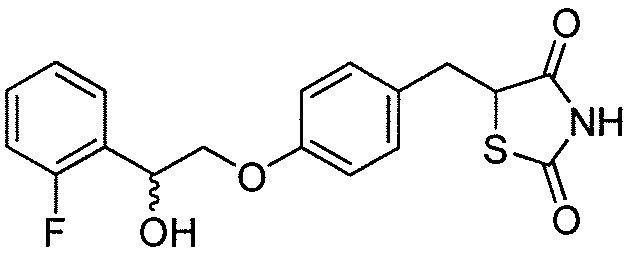 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
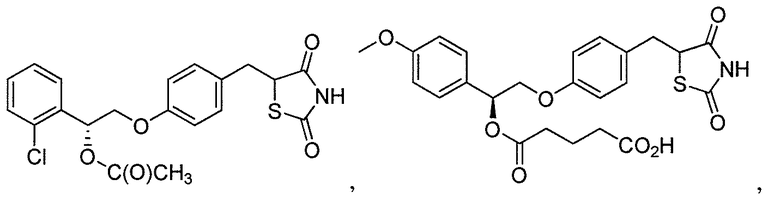
 или
или 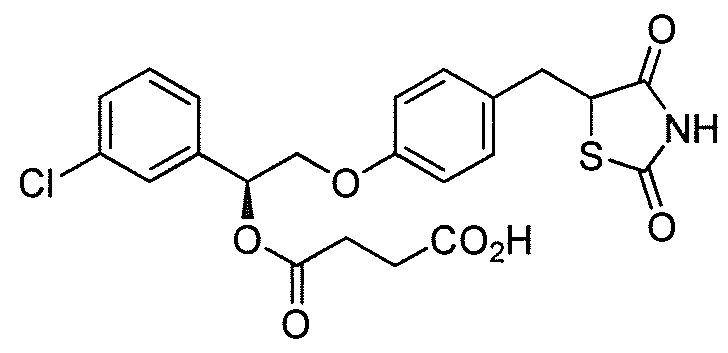 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
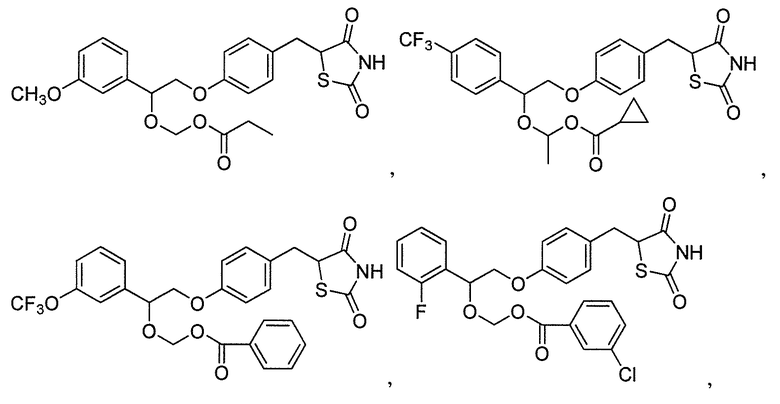
 или
или  .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
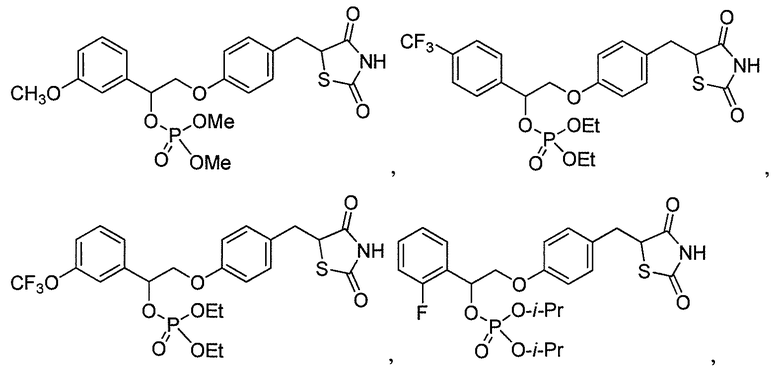
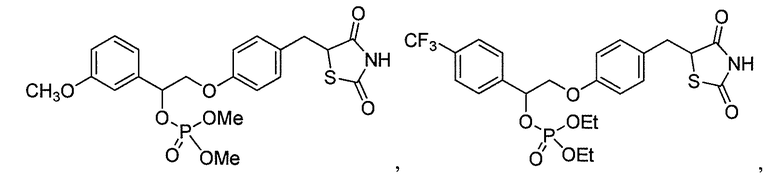
 или
или  .
.
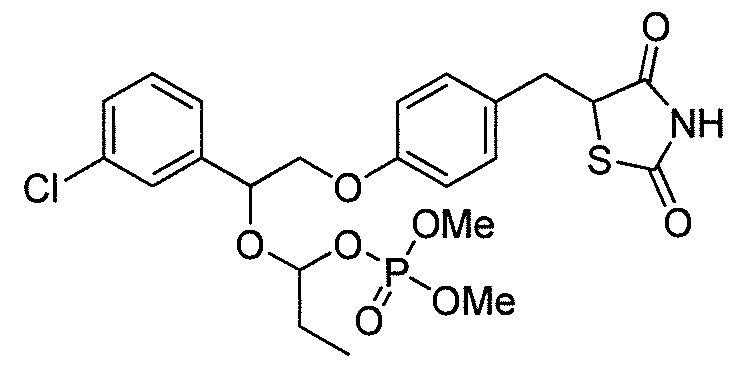
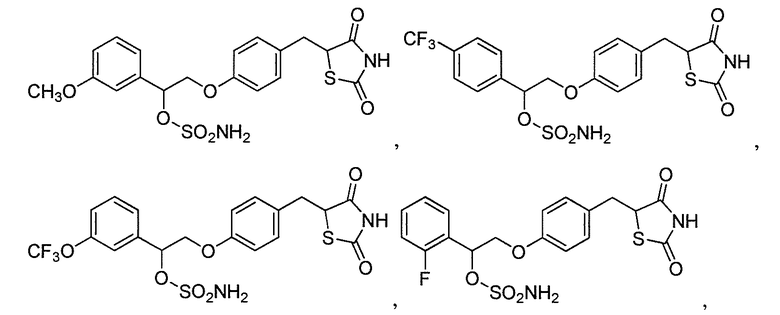
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
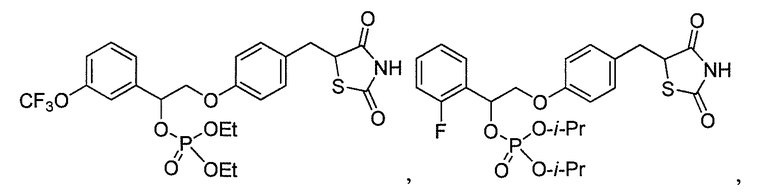
 или
или  .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
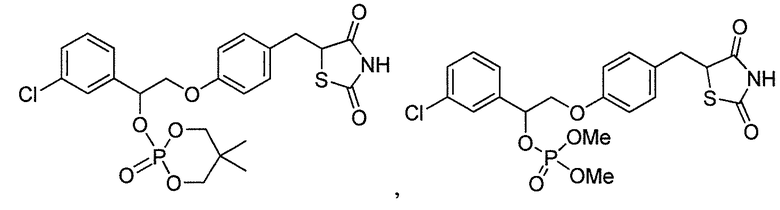
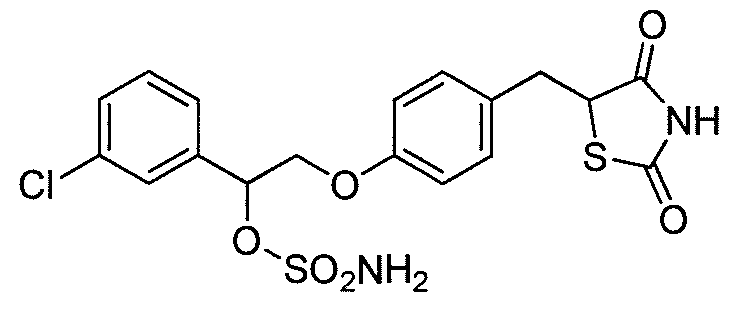 или
или 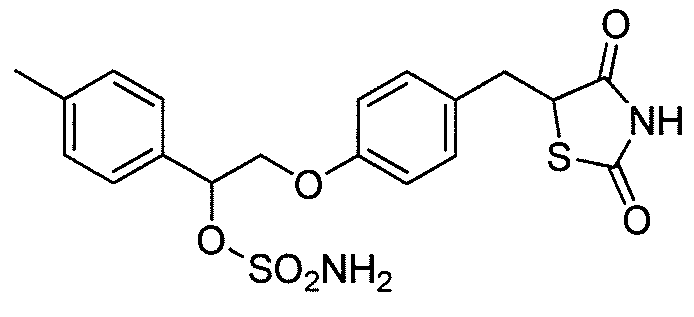 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
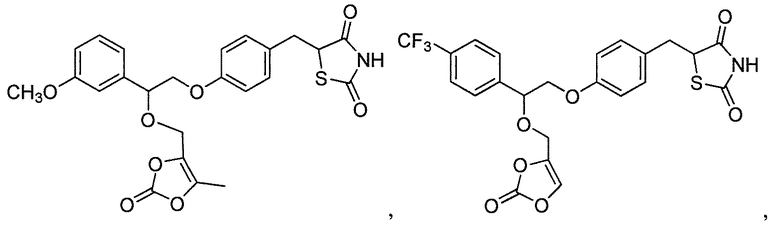
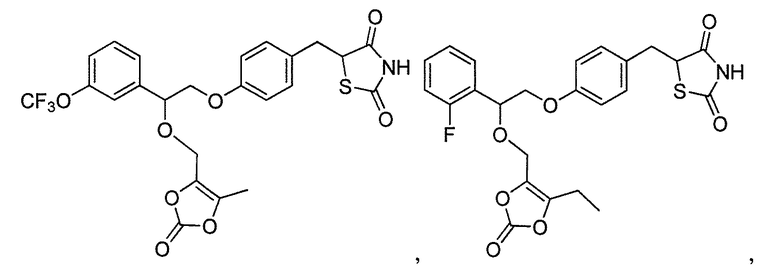
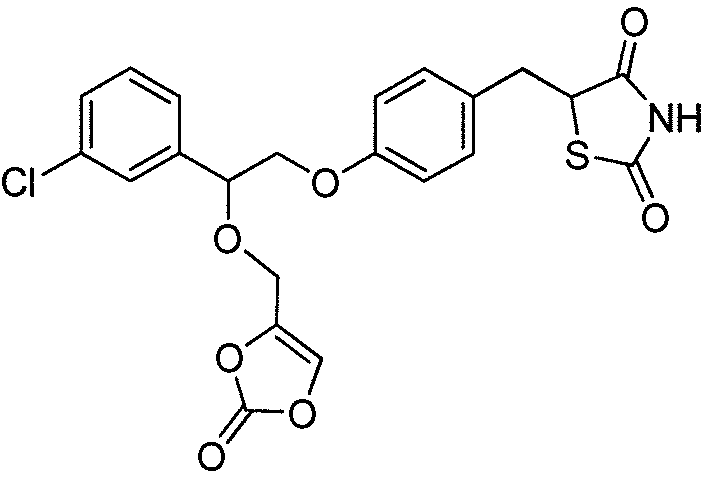 или
или 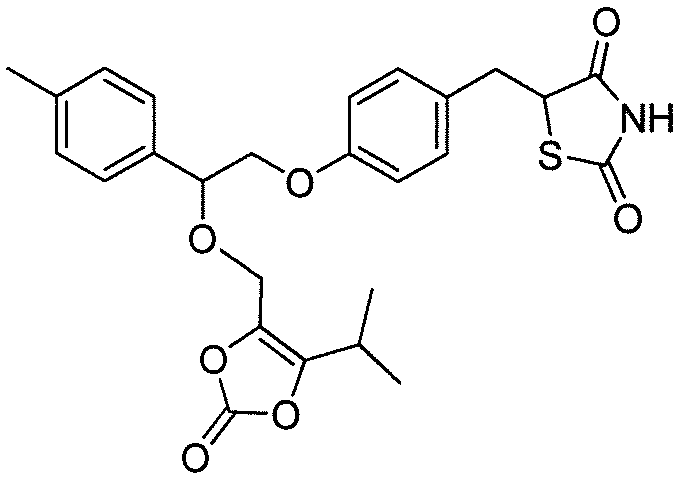 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
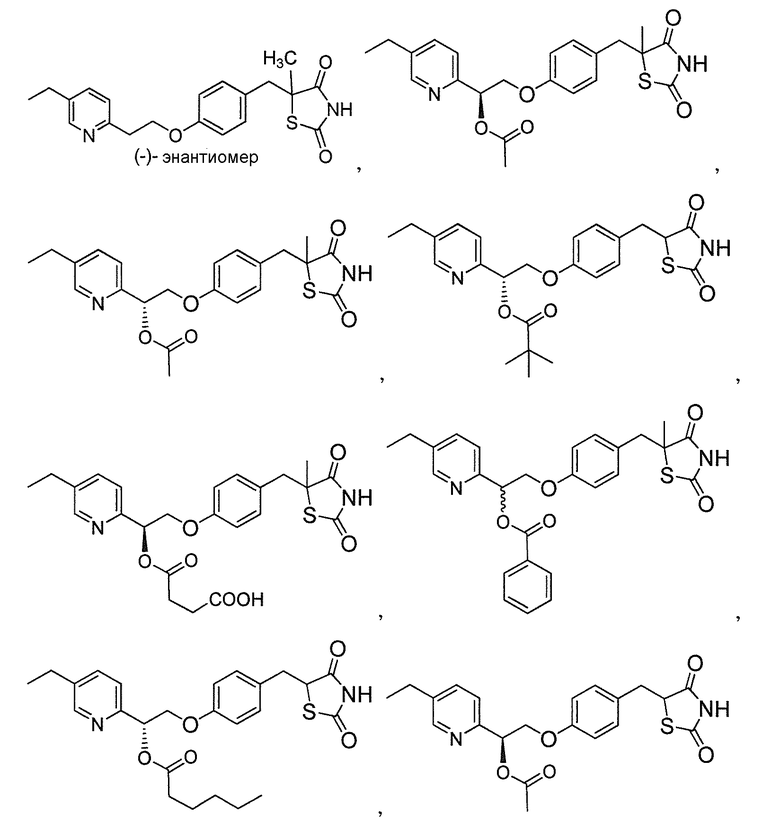
или 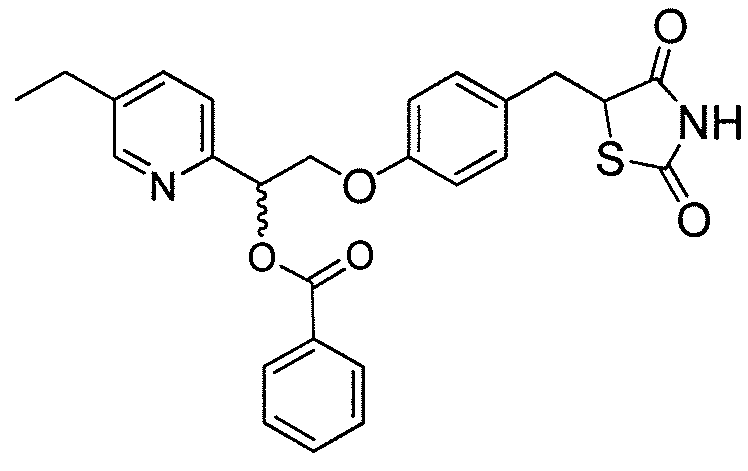 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
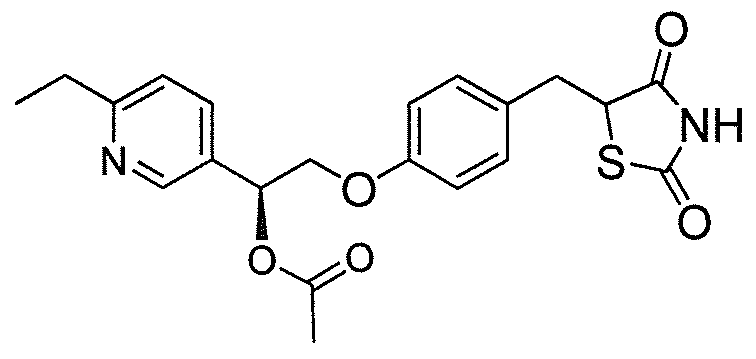 или
или 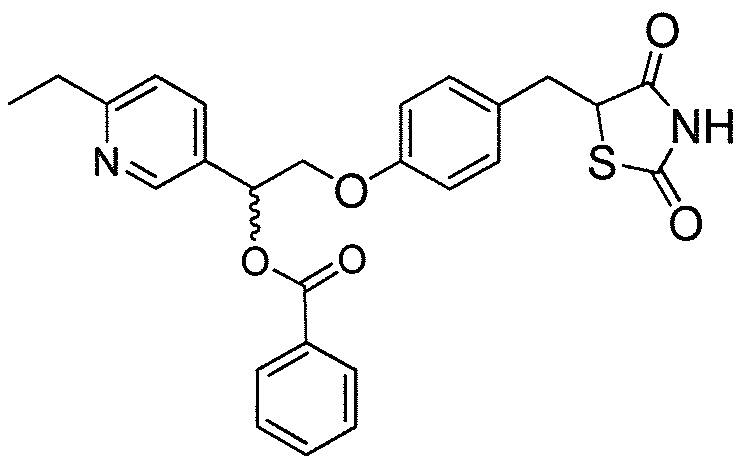 .
.
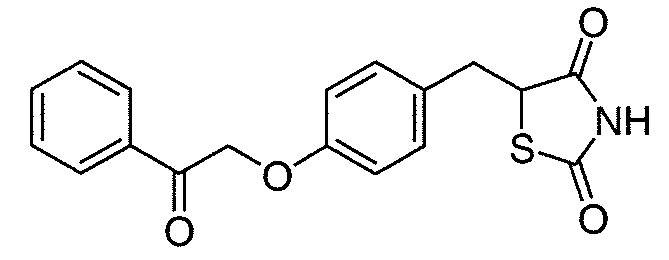
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
или 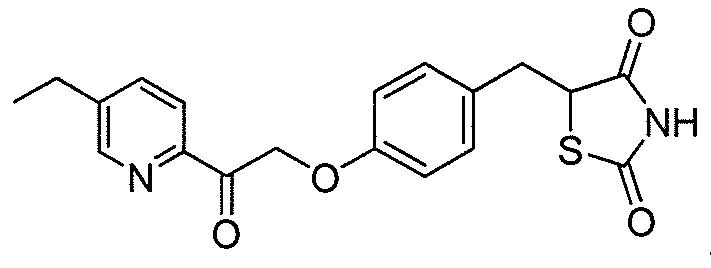 .
.
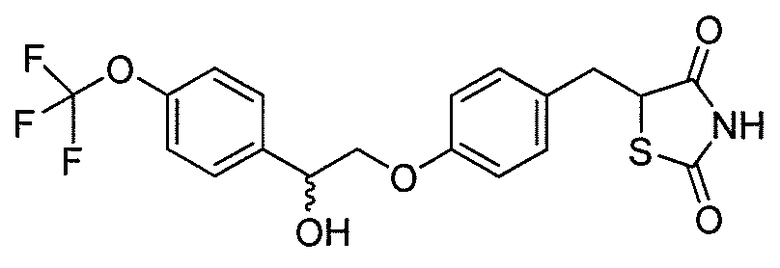
Другой аспект настоящего изобретения касается гидрохлоридной соли соединения, выбранного из:
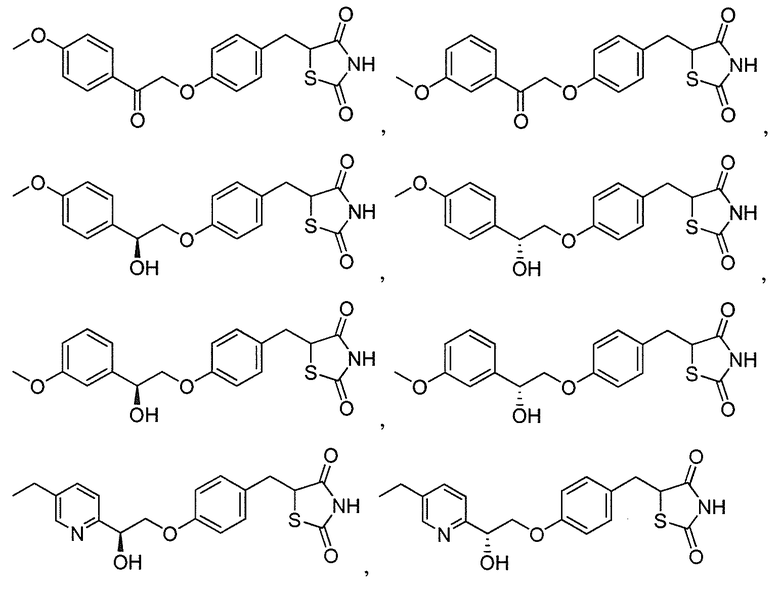
или 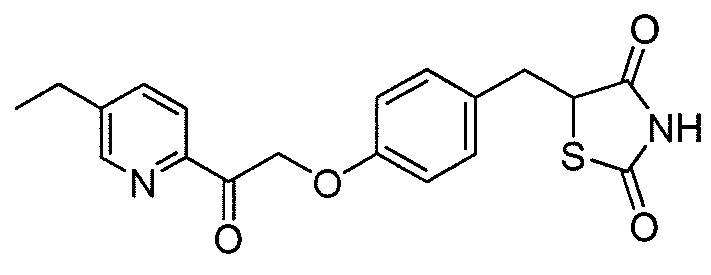 .
.
Другой аспект настоящего изобретения касается дигидросульфатной соли соединения, выбранного из:
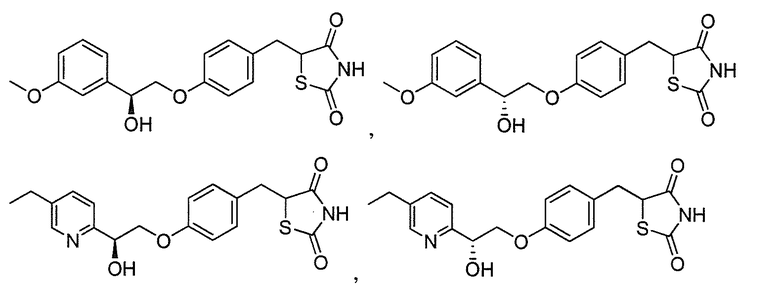
или 
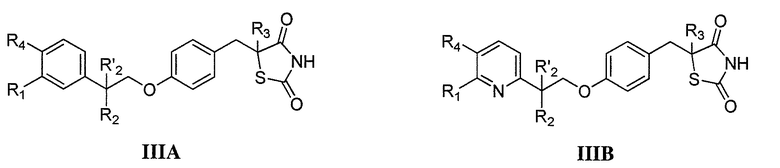
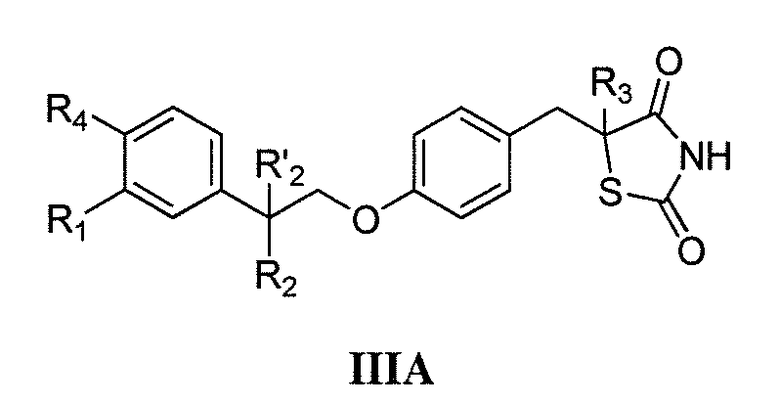
Другой аспект настоящего изобретения касается гидрохлоридной соли соединения формулы IIIA или IIIB:
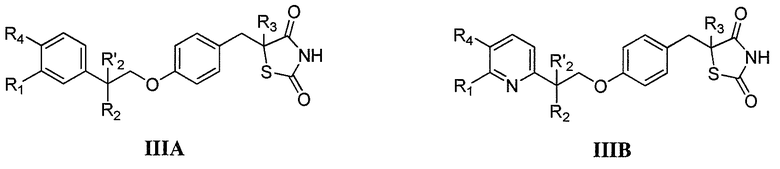
где каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена; R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 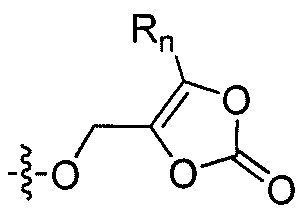 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; и
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; и
R3 представляет собой H или C1-3 алкил.
Другой аспект настоящего изобретения касается дигидросульфатной соли соединения формулы IIIA или IIIB:
где каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена; R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 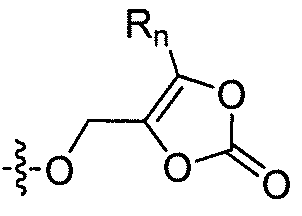 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; и R3 представляет собой H или C1-3 алкил.
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; и R3 представляет собой H или C1-3 алкил.
Другой аспект настоящего изобретения касается соли щелочноземельного металла соединения формулы I:
где каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена; R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 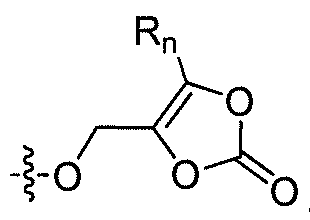 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; R3 представляет собой H или C1-3 алкил; и кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; R3 представляет собой H или C1-3 алкил; и кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
В некоторых вариантах осуществления изобретения, щелочноземельным металлом является калий.
В некоторых вариантах осуществления изобретения, щелочноземельным металлом является натрий.
В некоторых вариантах осуществления изобретения, R3 представляет собой H.
В некоторых вариантах осуществления изобретения, R3 представляет собой CH3.
В некоторых вариантах осуществления изобретения, R4 представляет собой H, метил, метокси, этокси, -O-изопропил, -CF3, -OCHF2 или -OCF3.
В некоторых вариантах осуществления изобретения, R4 представляет собой H.
В некоторых вариантах осуществления изобретения, R1 представляет собой H, алкил, галоген или алкокси.
В некоторых вариантах осуществления изобретения, R1 представляет собой H.
В некоторых вариантах осуществления изобретения, R1 представляет собой галоген.
В некоторых вариантах осуществления изобретения, R1 представляет собой C1-3 алкил.
В некоторых вариантах осуществления изобретения, кольцо A представляет собой фенил, который замещен группами R1 и R4 в любом химически приемлемом положении кольца A. В некоторых примерах, кольцо A представляет собой фенил, и один из R1 или R4 присоединен в пара или мета положение кольца A. В других примерах, кольцо A представляет собой фенил, и один из R1 или R4 присоединен в мета положение кольца A. В некоторых примерах, R1 присоединен в пара или мета положение кольца A. И, в некоторых примерах, R1 представляет собой F или Cl, каждый из которых присоединен в пара или мета положение кольца A. В других примерах, R1 представляет собой алкокси (например, метокси, этокси, пропокси, -O-изопропил, бутокси или -O-трет-бутил), который присоединен в пара или мета положение кольца A. В других примерах, кольцо A представляет собой фенил, и R1 присоединен в мета или орто положение фенильного кольца. Так, например, кольцо A представляет собой фенил, и R1 присоединен в орто положение фенильного кольца. В некоторых случаях, кольцо A представляет собой фенил, и R1 представляет собой метокси, этокси или -O-изопропил, любой из которых присоединен в орто положение кольца A. В других случаях, R1 представляет собой -CF3, -OCHF2 или -OCF3.
В некоторых вариантах осуществления изобретения, кольцо A представляет собой необязательно замещенный пиридин-2-ил или необязательно замещенный пиридин-3-ил, любой из которых замещен группами R1 и R4 в любом химически приемлемом положении кольца A. В некоторых примерах, кольцо A представляет собой пиридин-2-ил, и один из R1 или R4 присоединен в 5-ое положение кольца. В других примерах, кольцо A представляет собой пиридин-3-ил, и один из R1 или R4 присоединен в 6-ое положение кольца. В некоторых примерах, кольцо A представляет собой пиридин-2-ил, и R1 присоединен в 5-ое положение кольца. Так, например, кольцо A представляет собой пиридин-2-ил, и R1 представляет собой алкил или алкокси, любой из которых присоединен в 5-ое положение кольца A. В других случаях, кольцо A представляет собой пиридин-2-ил, и R1 представляет собой метил, этил, пропил, изопропил, бутил или трет-бутил, любой из которых присоединен в 5-ое положение кольца A.
В некоторых вариантах осуществления изобретения, R'2 представляет собой H.
В некоторых вариантах осуществления изобретения, R2 представляет собой гидрокси.
В некоторых вариантах осуществления изобретения, R2 представляет собой -O-ацил, -O-ароил или -O-гетероароил.
В некоторых вариантах осуществления изобретения, R2 и R'2 вместе образуют оксо.
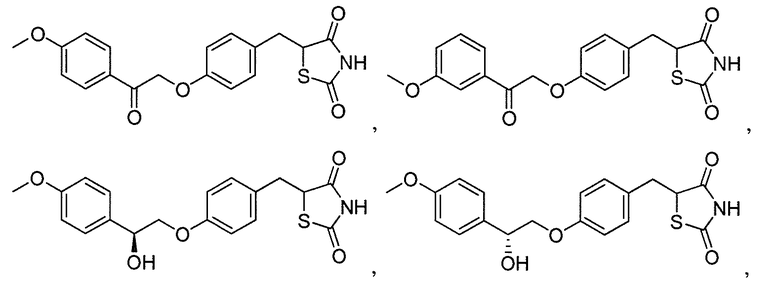
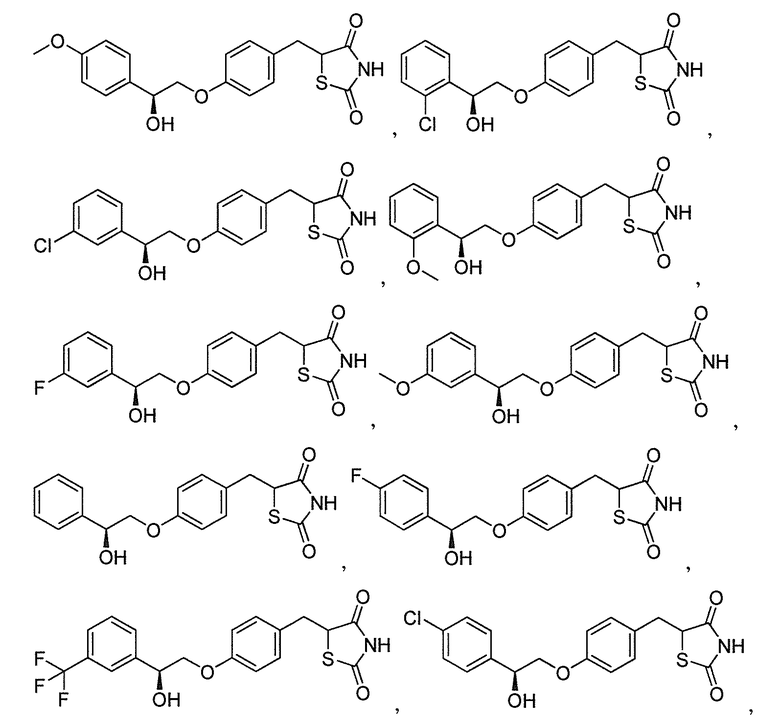
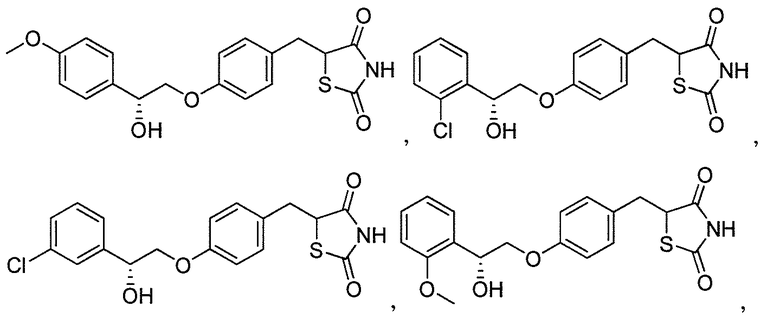
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
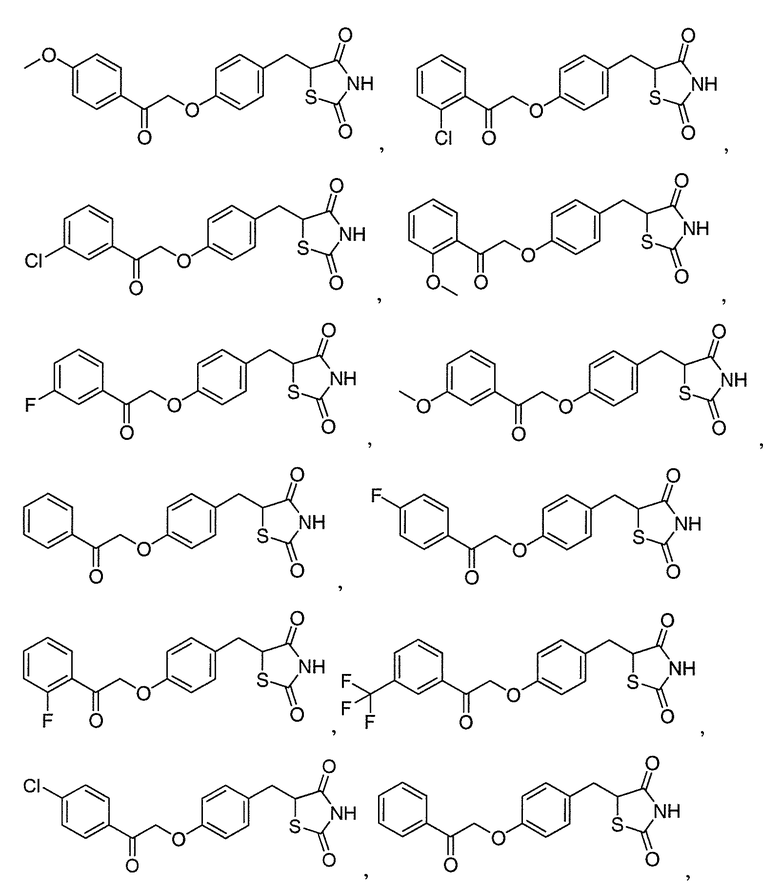
 или
или 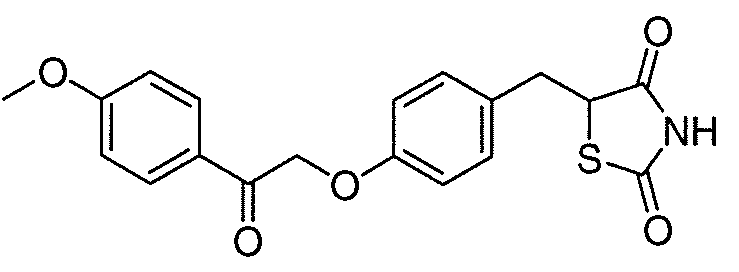 .
.
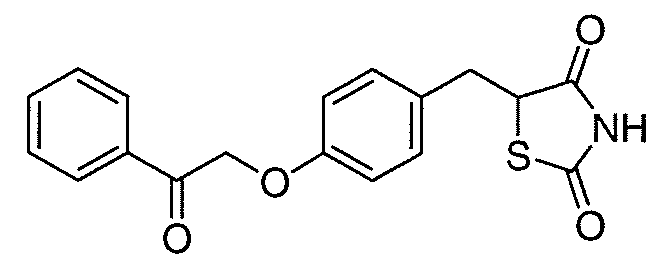
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
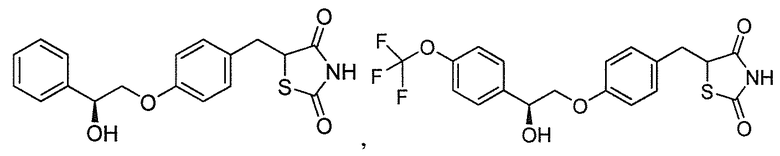
или 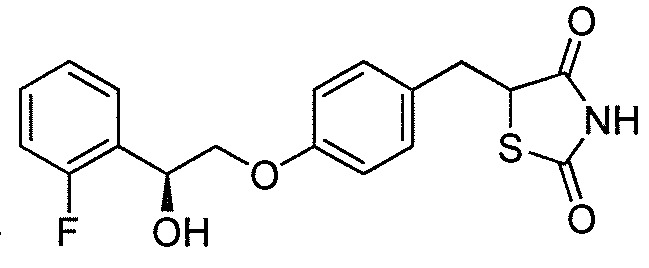 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
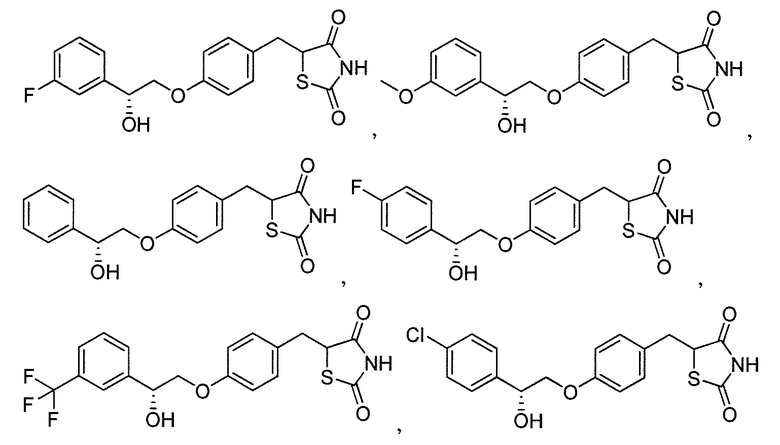
 или
или 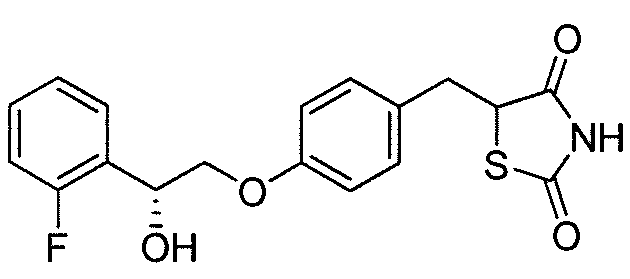 .
.
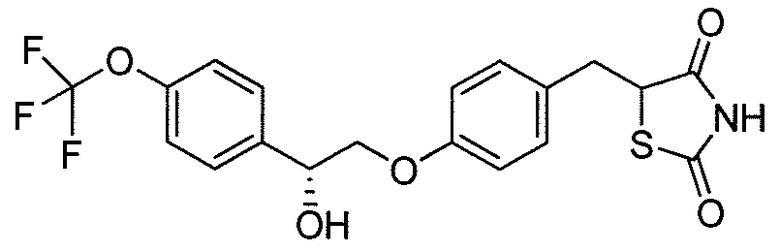
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
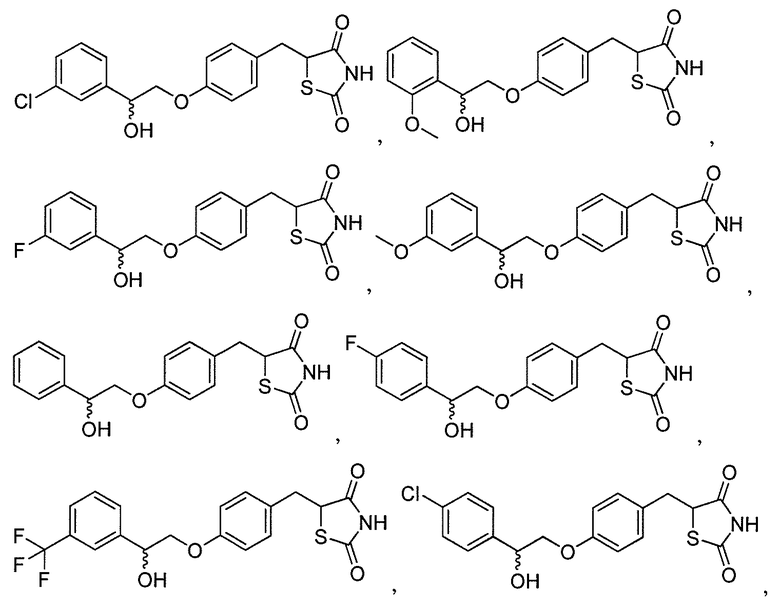
 или
или  .
.
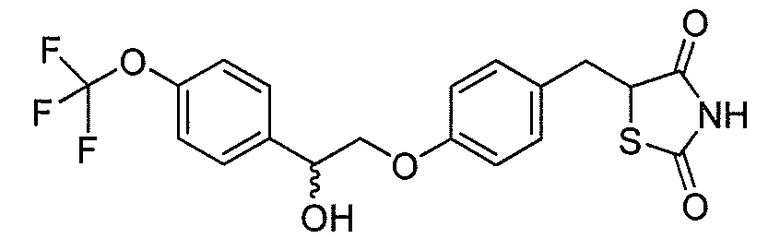
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
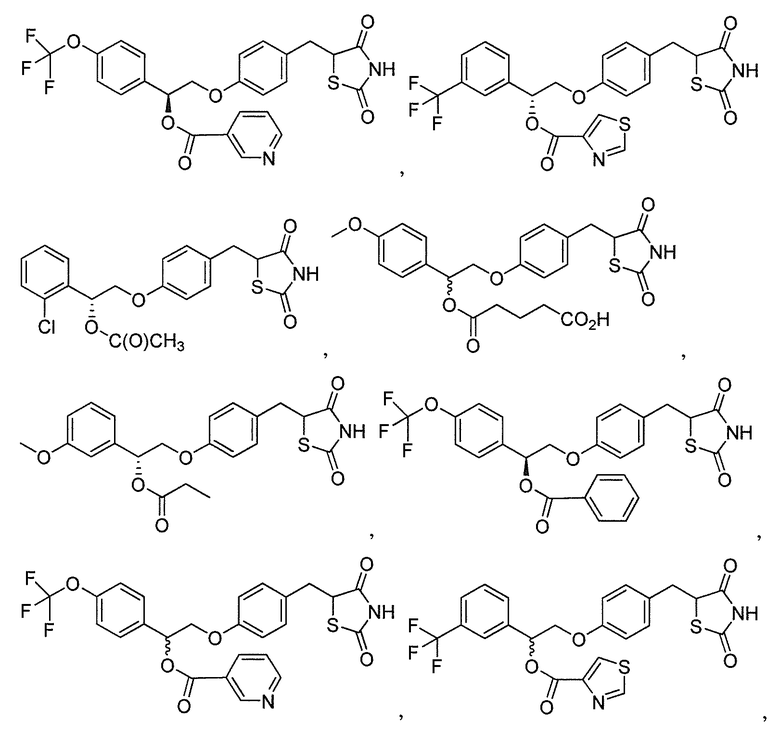
или 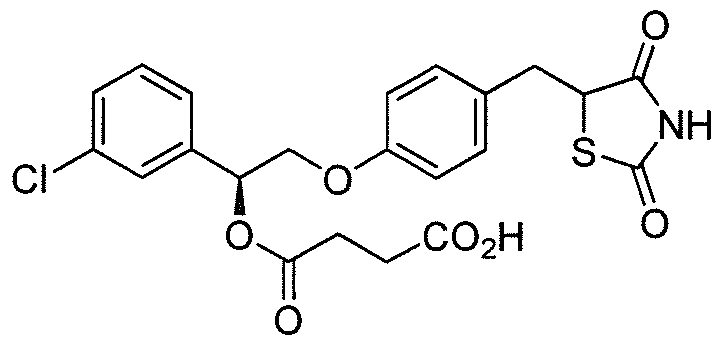 .
.
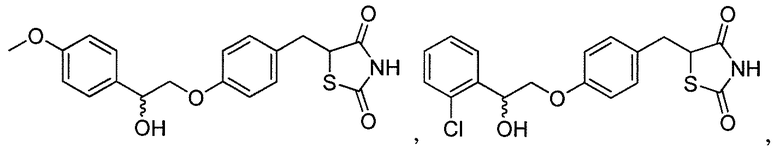
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
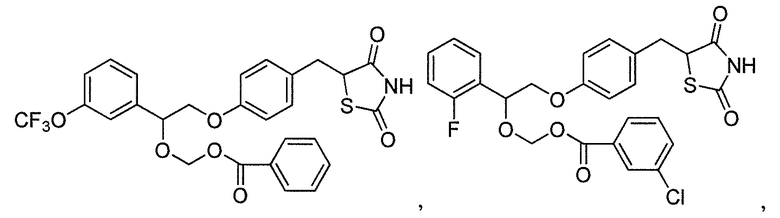
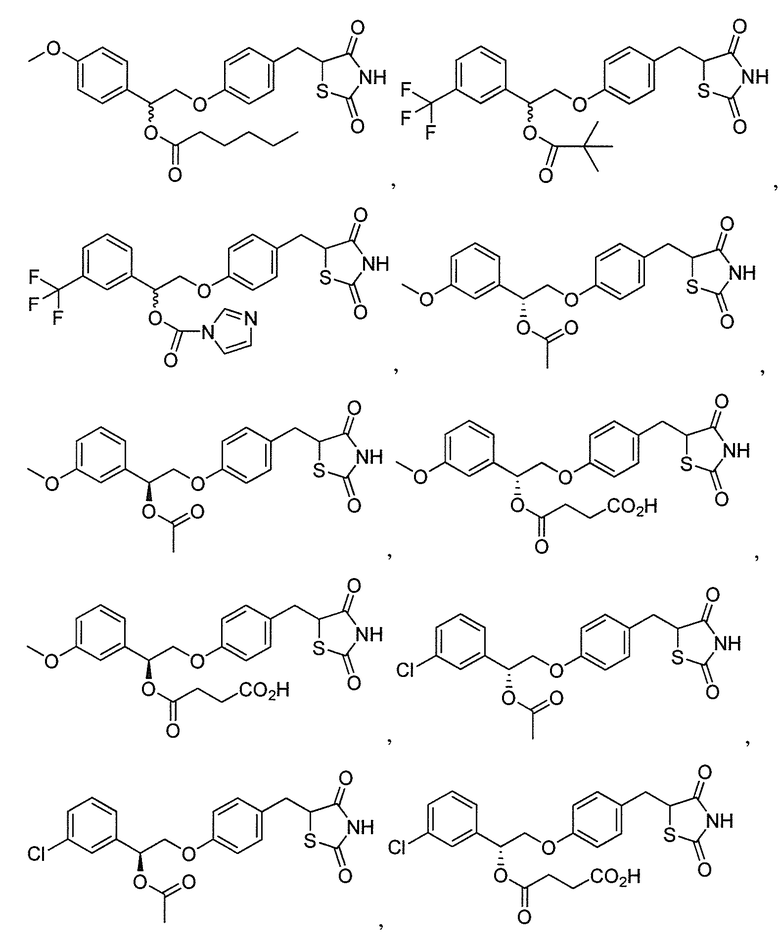
 или
или 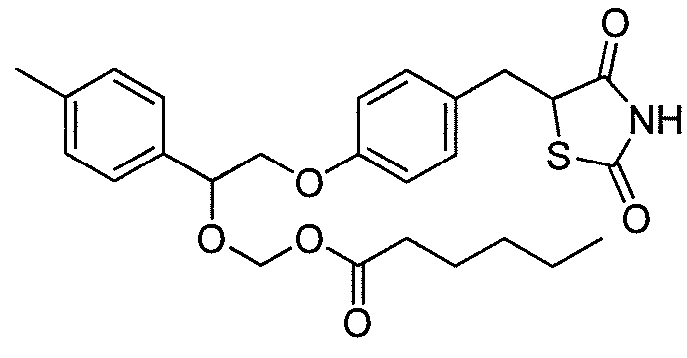 .
.
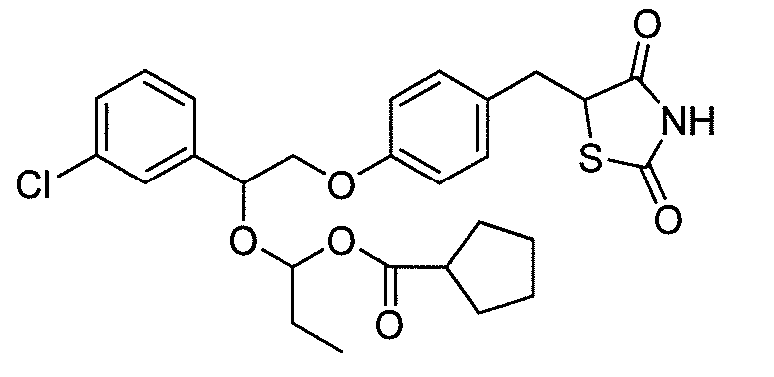
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
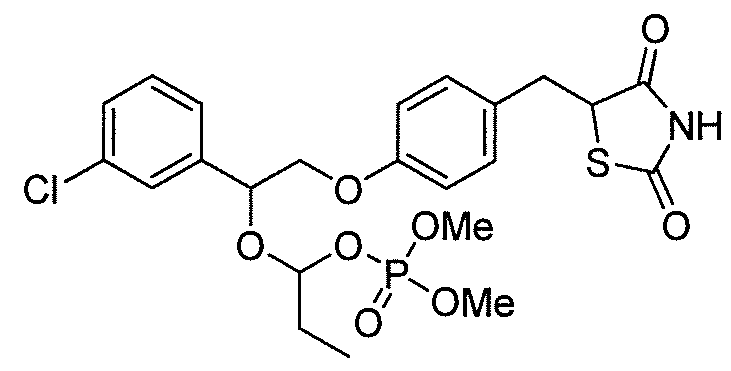 или
или 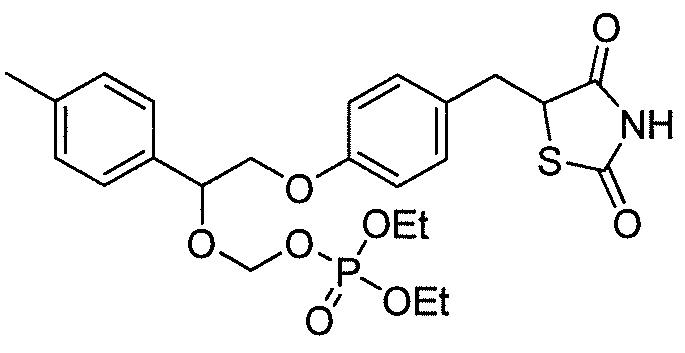 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
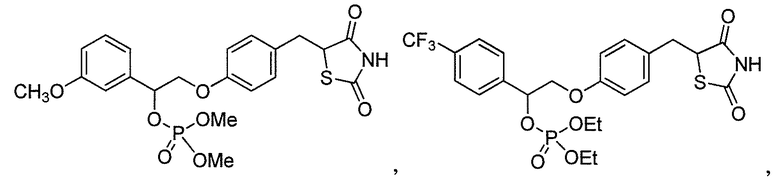
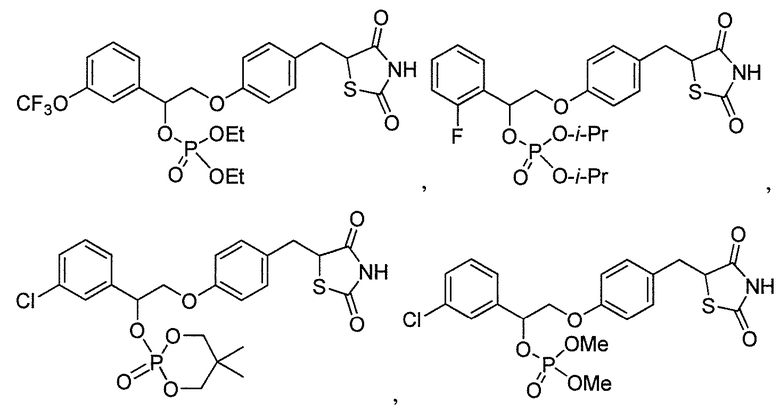
или 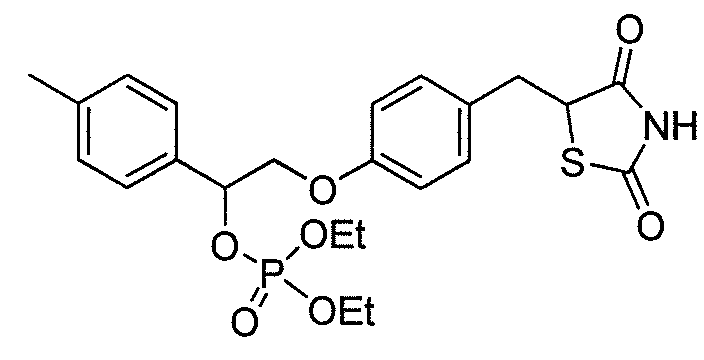 .
.
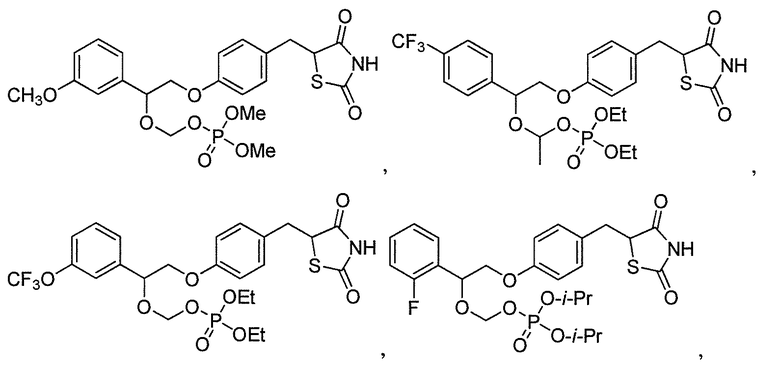
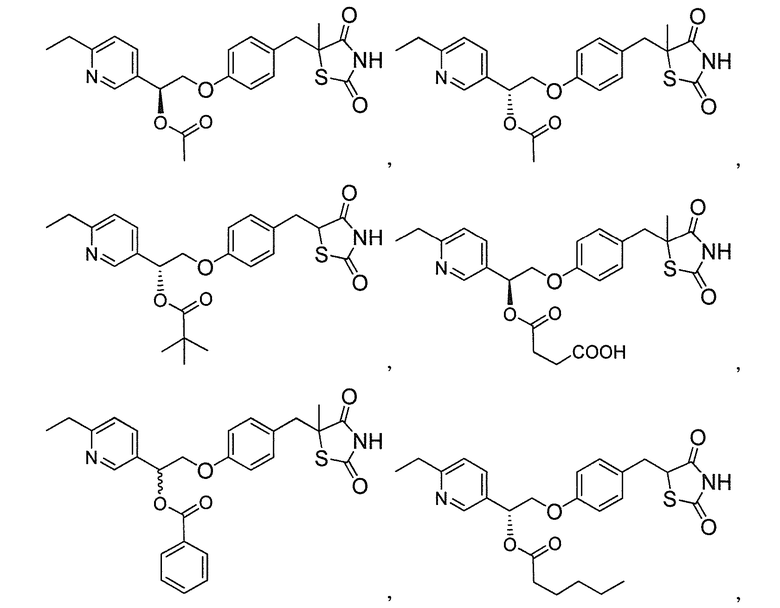
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
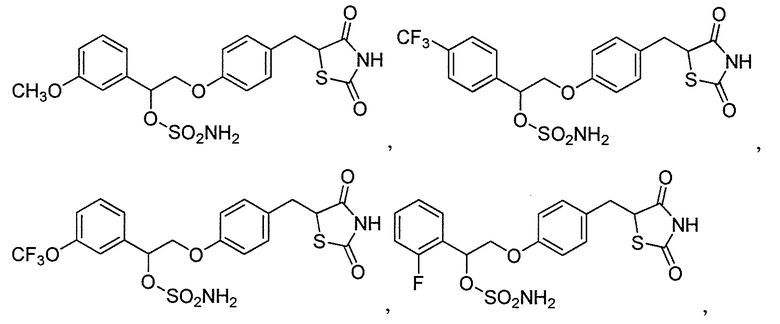
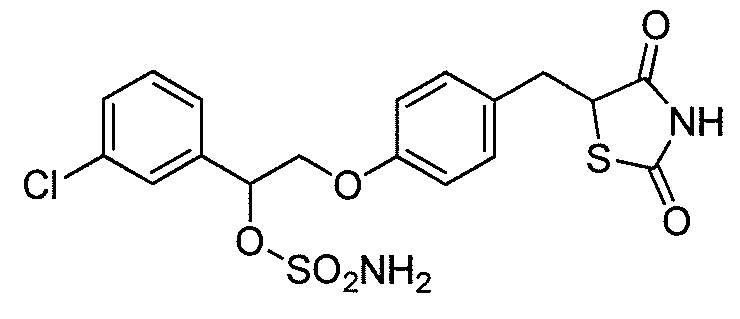 или
или 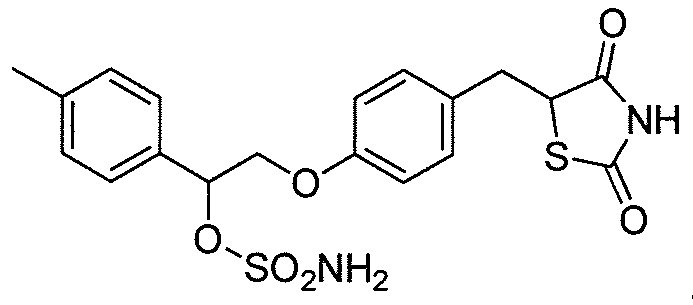 .
.
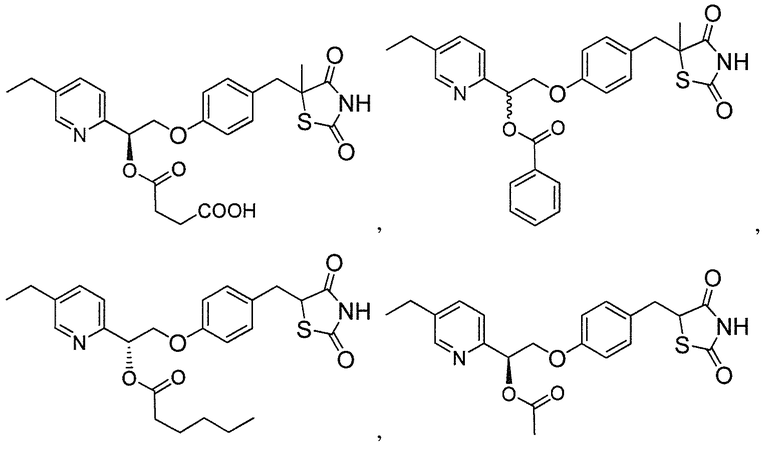
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
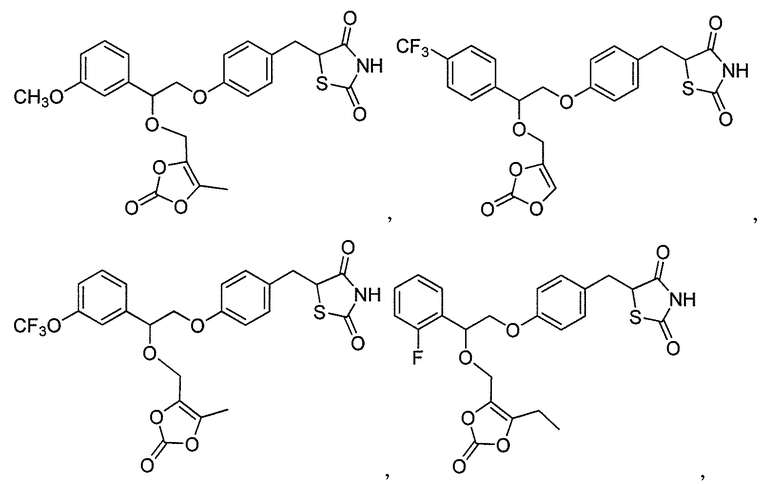
 или
или  .
.
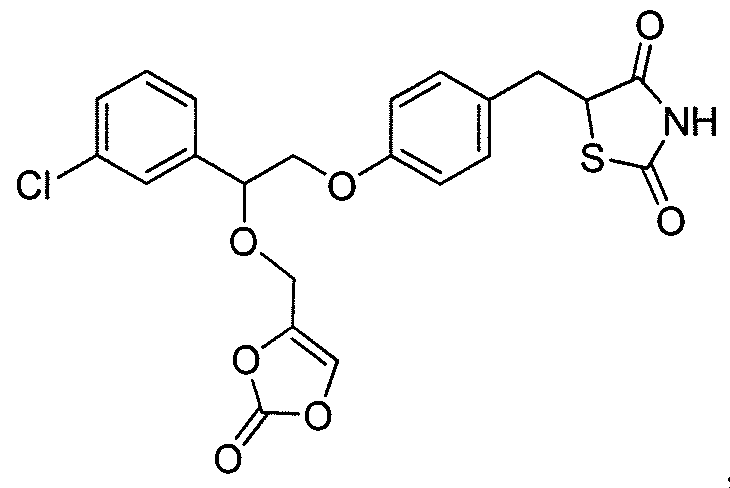
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
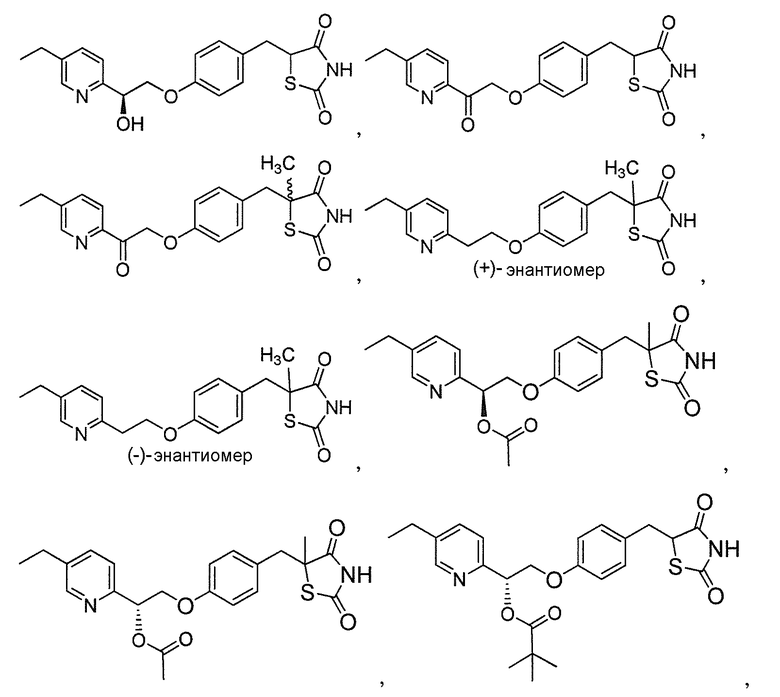
или 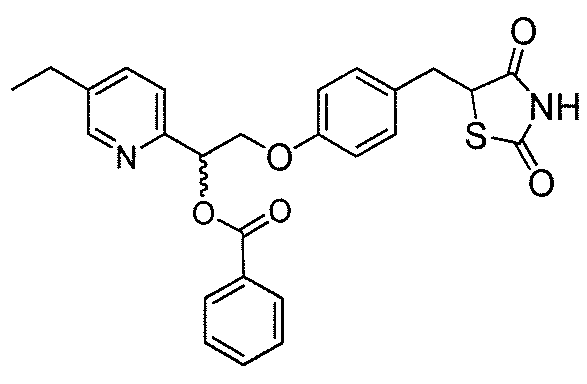 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
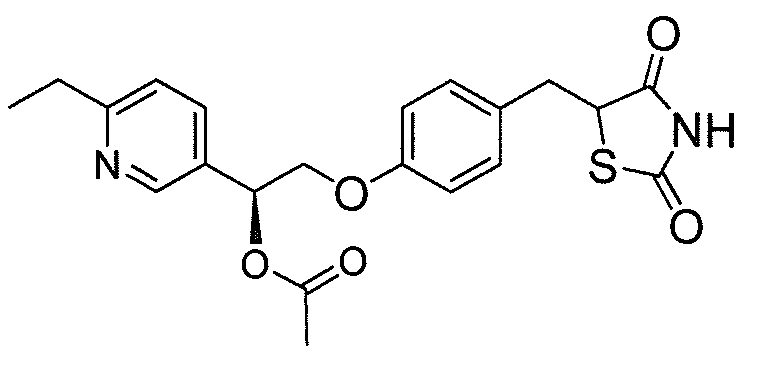 или
или 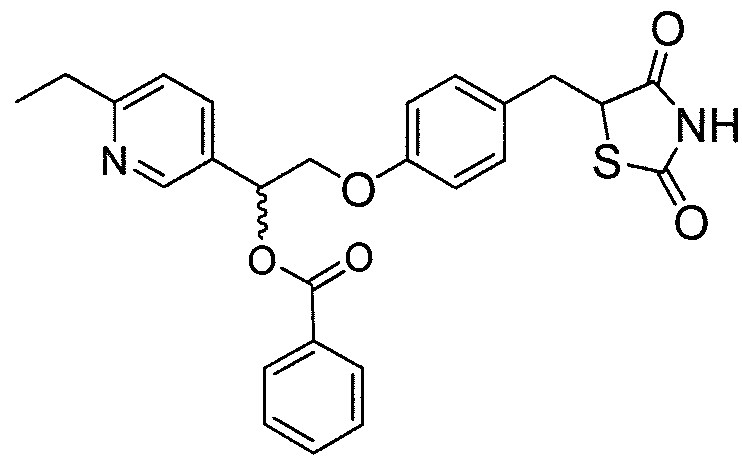 .
.
В некоторых вариантах осуществления изобретения, соединение формулы I представляет собой соединение, выбранное из следующих соединений:
или  .
.
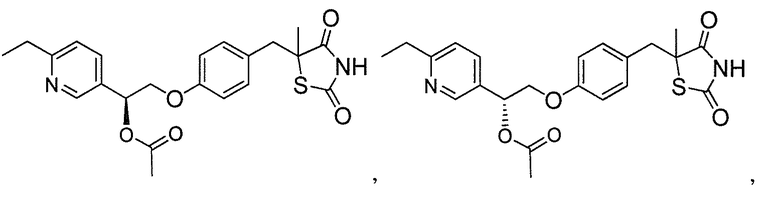
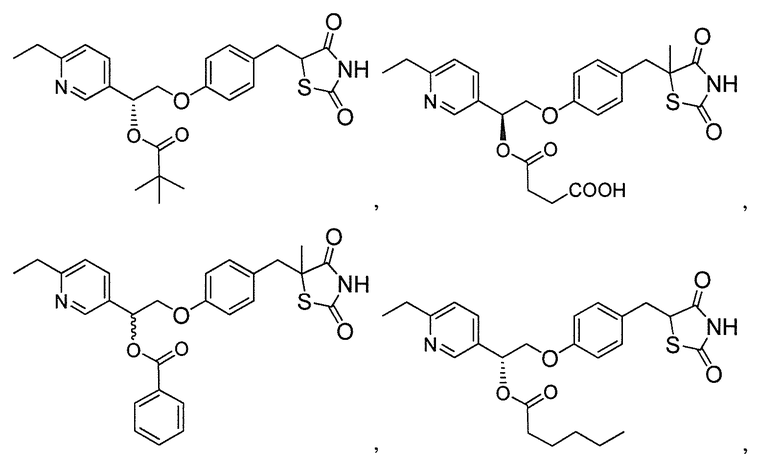
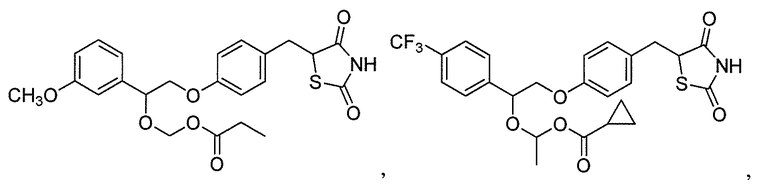
Другой аспект настоящего изобретения касается соли щелочноземельного металла соединения, выбранного из:
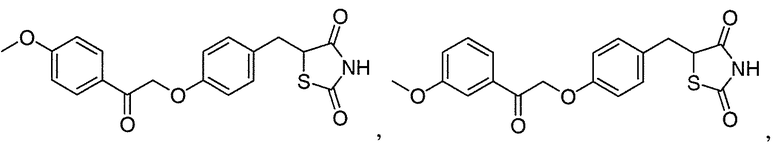
или 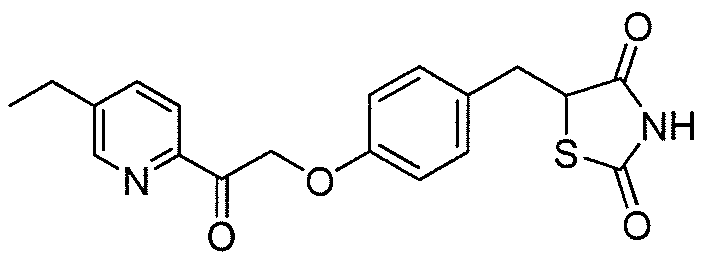 .
.
Другой аспект настоящего изобретения касается соли щелочноземельного металла соединения формулы IIIA или IIIB:
 или
или 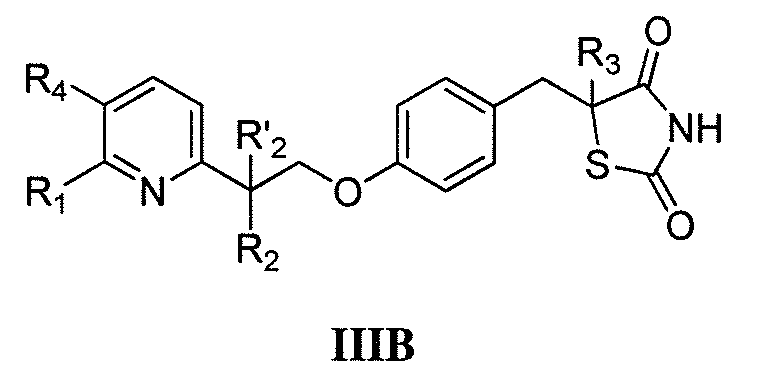
где каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена; R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 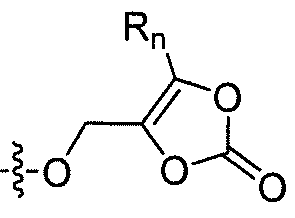 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; и R3 представляет собой H или C1-3 алкил.
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо; и R3 представляет собой H или C1-3 алкил.
В некоторых вариантах осуществления изобретения, щелочноземельным металлом является натрий.
В других вариантах осуществления, щелочноземельным металлом является калий.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Изобретение далее будет описано в виде примеров, с отсылкой к сопроводительным чертежам, в которых:
На фигуре 1 представлены данные XRPD (рентгеновская порошковая дифрактометрия) для натриевой соли соединения формулы I;
На фигуре 2 представлена кривая зависимости массы (%) от температуры для натриевой соли соединения формулы I согласно данным термогравиметрического анализа;
На фигуре 3 представлена кривая зависимости теплопередачи от температуры для натриевой соли соединения формулы I согласно данным DSC (дифференциальная сканирующая калориметрия) анализа;
На фигуре 4 представлена кривая зависимости изменения массы (%) от процента относительной влажности для натриевой соли соединения формулы I согласно данным анализа поглощения влаги;
На фигуре 5 представлены данные XRPD (рентгеновская порошковая дифрактометрия) для калиевой соли соединения формулы I;
На фигуре 6 представлена кривая зависимости массы (%) от температуры для калиевой соли соединения формулы I согласно данным термогравиметрического анализа;
На фигуре 7 представлена кривая зависимости теплопередачи от температуры для калиевой соли соединения формулы I согласно данным DSC (дифференциальная сканирующая калориметрия) анализа;
На фигуре 8 представлена кривая зависимости изменения массы (%) от процента относительной влажности для калиевой соли соединения формулы I согласно данным анализа поглощения влаги;
На фигуре 9 представлена кривая сравнительной биодоступности соединения A и его метаболитов и его натриевой соли;
На фигуре 10 представлен график площадей под кривыми (AUC) соединения B и его соли с металлом;
На фигуре 11 представлена кривая концентрации глюкозы в зависимости от дозы соединения A или его натриевой соли на мышиной модели;
На фигуре 12 представлен 1H ЯМР спектр 5-(4-(2-(5-этилпиридин-2-ил)-2-оксоэтокси)бензил)-1,3-тиазолидин-2,4-диона (соединение A);
На фигуре 13 представлен 1H ЯМР спектр кофеина; и
На фигуре 14 представлен 1H ЯМР спектр примера со-кристалла 5-(4-(2-(5-этилпиридин-2-ил)-2-оксоэтокси)бензил)-1,3-тиазолидин-2,4-диона и кофеина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается соли PPARγ-протективного соединения, такого как соединение формулы I. Такие соли могут быть использованы для лечения нарушения обмена веществ, такого как ожирение, диабет и нейродегенеративные заболевания.
I. ОПРЕДЕЛЕНИЯ
Как здесь используется, если не указано иного, используются следующие определения.
В целях настоящего изобретения, химические элементы определены в соответствии с Периодической таблицей элементов, CAS версия, Handbook of Chemistry and Physics, 75th Ed. Кроме того, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. и March, J., John Wiley & Sons, New York: 2001, все содержание которых включено здесь в качестве ссылок.
Как здесь описано, соединения по изобретению необязательно могут быть замещены одним или несколькими заместителями, такими как показаны в основном выше, или на примере конкретных классов, подклассов и видов по изобретению.
Как здесь используется термин "алифатическая группа" охватывает термины алкил, алкенил, алкинил, каждый из которых необязательно замещен, как указано далее.
Как здесь используется, термин "алкильная" группа относится к насыщенной алифатической углеводородной группе, содержащей 1-12 (например, 1-8, 1-6 или 1-4) атомов углерода. Алкильная группа может быть прямой или разветвленной. Примеры алкильной группы включают, но этим не ограничиваются, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гептил или 2-этилгексил. Алкильная группа может быть замещенной (то есть, необязательно замещенной) одним или несколькими заместителями, такими как галоген, фосфо, циклоалифатическая группа [например, циклоалкил или циклоалкенил], гетероциклоалифатическая группа [например, гетероциклоалкил или гетероциклоалкенил], арил, гетероарил, алкокси, ароил, гетероароил, ацил [например, (алифатическая группа)карбонил, (циклоалифатическая группа)карбонил или (гетероциклоалифатическая группа)карбонил], нитро, циано, амидо [например, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино алкиламинокарбонил, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, ариламинокарбонил или гетероариламинокарбонил], амино [например, алифатический амин, циклоалифатический амин или гетероциклоалифатический амин], сульфонил [например, алифатическая группа-SO2-], сульфинил, сульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбокси, карбамоил, (циклоалифатическая группа)окси, (гетероциклоалифатическая группа)окси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, алкоксикарбонил, алкилкарбонилокси или гидрокси. Без ограничений, некоторые примеры замещенных алкилов включают карбоксиалкил (такой как HOOC-алкил, алкоксикарбонилалкил и алкилкарбонилоксиалкил), цианоалкил, гидроксиалкил, алкоксиалкил, ацилалкил, аралкил, (алкоксиарил)алкил, (сульфониламино)алкил (такой как (алкил-SO2-амино)алкил), аминоалкил, амидоалкил, (циклоалифатическая группа)алкил или галогеналкил.
Как здесь используется, термин "алкенильная" группа относится к алифатической углеродной группе, которая содержит 2-8 (например, 2-12, 2-6 или 2-4) атомов углерода и, по меньшей мере, одну двойную связь. Подобно алкильной группе, алкенильная группа может быть прямой или разветвленной. Примеры алкенильной группы включают, но этим не ограничиваются, аллил, изопренил, 2-бутенил и 2-гексенил. Алкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как галоген, фосфо, циклоалифатическая группа [например, циклоалкил или циклоалкенил], гетероциклоалифатическая группа [например, гетероциклоалкил или гетероциклоалкенил], арил, гетероарил, алкокси, ароил, гетероароил, ацил [например, (алифатическая группа)карбонил, (циклоалифатическая группа)карбонил или (гетероциклоалифатическая группа)карбонил], нитро, циано, амидо [например, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино алкиламинокарбонил, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, ариламинокарбонил или гетероариламинокарбонил], амино [например, алифатический амин, циклоалифатический амин, гетероциклоалифатический амин или алифатический сульфониламино], сульфонил [например, алкил-SO2-, циклоалифатическая группа-SO2- или арил-SO2-], сульфинил, сульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбокси, карбамоил, (циклоалифатическая группа)окси, (гетероциклоалифатическая группа)окси, арилокси, гетероарилокси, аралкилокси, гетероаралкокси, алкоксикарбонил, алкилкарбонилокси или гидрокси. Без ограничений, некоторые примеры замещенных алкенилов включают цианоалкенил, алкоксиалкенил, ацилалкенил, гидроксиалкенил, аралкенил, (алкоксиарил)алкенил, (сульфониламино)алкенил (такой как (алкил-SO2-амино)алкенил), аминоалкенил, амидоалкенил, (циклоалифатическая группа)алкенил или галогеналкенил.
Как здесь используется, термин "алкинильная" группа относится к алифатической углеродной группе, которая содержит 2-8 (например, 2-12, 2-6 или 2-4) атомов углерода и содержит, по меньшей мере, одну тройную связь. Алкинильная группа может быть прямой или разветвленной. Примеры алкинильной группы включают, но этим не ограничиваются, пропаргил и бутинил. Алкинильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как ароил, гетероароил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, нитро, карбокси, циано, галоген, гидрокси, сульфо, меркапто, сульфанил [например, алифатический сульфанил или циклоалифатический сульфанил], сульфинил [например, алифатический сульфинил или циклоалифатический сульфинил], сульфонил [например, алифатическая группа-SO2-, алифатический амин-SO2- или циклоалифатическая группа-SO2-], амидо [например, аминокарбонил, алкиламинокарбонил, алкилкарбониламино, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, циклоалкилкарбониламино, ариламинокарбонил, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (циклоалкилалкил)карбониламино, гетероаралкилкарбониламино, гетероарилкарбониламино или гетероариламинокарбонил], мочевина, тиомочевина, сульфамоил, сульфамид, алкоксикарбонил, алкилкарбонилокси, циклоалифатическая группа, гетероциклоалифатическая группа, арил, гетероарил, ацил [например, (циклоалифатическая группа)карбонил или (гетероциклоалифатическая группа)карбонил], амино [например, алифатический амин], сульфокси, оксо, карбокси, карбамоил, (циклоалифатическая группа)окси, (гетероциклоалифатическая группа)окси или (гетероарил)алкокси.
Как здесь используется, термин "амидо" охватывает как "аминокарбонил", так и "карбониламино". Указанные термины, когда они используются самостоятельно или в сочетании с другой группой, относятся к амидо группе, такой как -N(RX)-C(O)-RY или -C(O)-N(RX)2, когда она находится на конце, и -C(O)-N(RX)- или -N(RX)-C(O)-, когда она находится внутри, где RX и RY могут быть алифатической группой, циклоалифатической группой, арилом, аралифатической группой, гетероциклоалифатической группой, гетероарилом или гетероаралифатической группой. Примеры амидо группы включают алкиламидо (такой как алкилкарбониламино или алкиламинокарбонил), (гетероциклоалифатическая группа)амидо, (гетероаралкил)амидо, (гетероарил)амидо, (гетероциклоалкил)алкиламидо, ариламидо, аралкиламидо, (циклоалкил)алкиламидо или циклоалкиламидо.
Как здесь используется, термин "амино" группа относится к -NRXRY, где каждый из RX и RY независимо представляет собой водород, алифатическую группу, циклоалифатическую группу, (циклоалифатическая группа)алифатическую группу, арил, аралифатическую группу, гетероциклоалифатическую группу, (гетероциклоалифатическая группа)алифатическую группу, гетероарил, карбокси, сульфанил, сульфинил, сульфонил, (алифатическая группа)карбонил, (циклоалифатическая группа)карбонил, ((циклоалифатическая группа)алифатическая группа)карбонил, арилкарбонил, (аралифатическая группа)карбонил, (гетероциклоалифатическая группа)карбонил, ((гетероциклоалифатическая группа)алифатическая группа)карбонил, (гетероарил)карбонил или (гетероаралифатическая группа)карбонил, каждый из которых определен здесь и является необязательно замещенным. Примеры аминогрупп включают алкиламино, диалкиламино или ариламино. Когда термин "амино" не обозначает концевую группу (например, алкилкарбониламино), он представлен -NRX-. RX имеет те же значения, что определены выше.
Как здесь используется, термин "арильная" группа, применяемый самостоятельно или как часть большей группы, как в случае "аралкил", "аралкокси" или "арилоксиалкил", относится к моноциклической (например, фенил); бициклической (например, инденил, нафталенил, тетрагидронафтил, тетрагидроинденил); и трициклической (например, флуоренил, тетрагидрофлуоренил или тетрагидроантраценил, антраценил) кольцевым системам, в которых моноциклическая кольцевая система является ароматической, или, по меньшей мере, одно из колец в бициклической или трициклической кольцевой системе является ароматическим. Бициклические и трициклические группы включают бензоконденсированное 2-3 членные карбоциклические кольца. Например, бензоконденсированная группа включает фенил, конденсированный с двумя или более C4-8 карбоциклическими группами. Арил необязательно замещен одним или несколькими заместителями, включая алифатическую группу [например, алкил, алкенил или алкинил]; циклоалифатическую группу; (циклоалифатическая группа)алифатическую группу; гетероциклоалифатическую группу; (гетероциклоалифатическая группа)алифатическую группу; арил; гетероарил; алкокси; (циклоалифатическая группа)окси; (гетероциклоалифатическая группа)окси; арилокси; гетероарилокси; (аралифатическая группа)окси; (гетероаралифатическая группа)окси; ароил; гетероароил; амино; оксо (на неароматическом карбоциклическом кольце бензоконденсированного бициклического или трициклического арила); нитро; карбокси; амидо; ацил [например, (алифатическая группа)карбонил; (циклоалифатическая группа)карбонил; ((циклоалифатическая группа)алифатическая группа)карбонил; (аралифатическая группа)карбонил; (гетероциклоалифатическая группа)карбонил; ((гетероциклоалифатическая группа)алифатическая группа)карбонил; или (гетероаралифатическая группа)карбонил]; сульфонил [например, алифатическая группа-SO2- или амино-SO2-]; сульфинил [например, алифатическая группа-S(O)- или циклоалифатическая группа-S(O)-]; сульфанил [например, алифатическая группа-S-]; циано; галоген; гидрокси; меркапто; сульфокси; мочевину; тиомочевину; сульфамоил; сульфамид; или карбамоил. Альтернативно, арил может быть незамещенным.
Неограничивающие примеры замещенных арилов включают галогенарил [например, моно-, ди- (такой как п,м-дигалогенарил) и (тригалоген)арил]; (карбокси)арил [например, (алкоксикарбонил)арил, ((аралкил)карбонилокси)арил и (алкоксикарбонил)арил]; (амидо)арил [например, (аминокарбонил)арил, (((алкиламино)алкил)аминокарбонил)арил, (алкилкарбонил)аминоарил, (ариламинокарбонил)арил и (((гетероарил)амино)карбонил)арил]; аминоарил [например, ((алкилсульфонил)амино)арил или ((диалкил)амино)арил]; (цианоалкил)арил; (алкокси)арил; (сульфамоил)арил [например, (аминосульфонил)арил]; (алкилсульфонил)арил; (циано)арил; (гидроксиалкил)арил; ((алкокси)алкил)арил; (гидрокси)арил, ((карбокси)алкил)арил; (((диалкил)амино)алкил)арил; (нитроалкил)арил; (((алкилсульфонил)амино)алкил)арил; ((гетероциклоалифатическая группа)карбонил)арил; ((алкилсульфонил)алкил)арил; (цианоалкил)арил; (гидроксиалкил)арил; (алкилкарбонил)арил; алкиларил; (тригалогеналкил)арил; п-амино-м-алкоксикарбониларил; п-амино-м-цианоарил; п-галоген-м-аминоарил; или (м-(гетероциклоалифатическая группа)-о-(алкил))арил.
Как здесь используется, термин "аралифатическая группа", такая как "аралкильная" группа, относится к алифатической группе (например, C1-4 алкильная группа), которая замещена арильной группой. "Алифатическая группа", "алкил" и "арил" определены здесь. Примером аралифатической группы, такой как аралкильная группа, является бензил.
Как здесь используется, термин "аралкильная" группа относится к алькильной группе (например, C1-4 алкильная группа), которая замещена арильной группой. Как "алкил", так и "арил" определены выше. Примером аралкильной группы является бензил. Аралкил необязательно замещен одним или несколькими заместителями, такими как алифатическая группа [например, алкил, алкенил или алкинил, включая карбоксиалкил, гидроксиалкил или галогеналкил, такой как трифторметил], циклоалифатическая группа [например, циклоалкил или циклоалкенил], (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, амидо [например, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, или гетероаралкилкарбониламино], циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как здесь используется, термин "бициклическая кольцевая система" включает 8-12 (например, 9, 10 или 11) членные структуры, которые образуют два кольца, где два кольца имеют, по меньшей мере, один общий атом (например, 2 общих атома). Бициклические кольцевые системы включают бициклоалифатические группы (например, бициклоалкил или бициклоалкенил), бициклогетероалифатические группы, бициклические арилы и бициклические гетероарилы.
Как здесь используется, термин "циклоалифатическая группа" охватывает "циклоалкильную" группу и "циклоалкенильную" группу, каждая из которых необязательно замещена, как указано далее.
Как здесь используется, термин "циклоалкильная" группа относится к насыщенному карбоциклическому моно- или бициклическому (конденсированному или мостиковому) кольцу, состоящему из 3-10 (например, 5-10) атомов углерода. Примеры циклоалкильной группы включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, норборнил, кубил, октагидроинденил, декагидронафтил, бицикло[3.2.1]октил, бицикло[2.2.2]октил, бицикло[3.3.1]нонил, бицикло[3.3.2]децил, бицикло[2.2.2]октил, адамантил или ((аминокарбонил)циклоалкил)циклоалкил.
Термин "циклоалкенильная" группа, как здесь используется, относится к неароматическому карбоциклическому кольцу, состоящему из 3-10 (например, 4-8) атомов углерода, содержащему одну или несколько двойных связей. Примеры циклоалкенильной группы включают циклопентенил, 1,4-циклогексадиенил, циклогептенил, циклооктенил, гексагидроинденил, октагидронафтил, циклогексенил, циклопентенил, бицикло[2.2.2]октенил или бицикло[3.3.1]ноненил.
Циклоалкильная или циклоалкенильная группа может быть необязательно замещена одним или несколькими заместителями, такими как фосфо, алифатическая группа [например, алкил, алкенил или алкинил], циклоалифатическая группа, (циклоалифатическая группа)алифатическая группа, гетероциклоалифатическая группа, (гетероциклоалифатическая группа)алифатическая группа, арил, гетероарил, алкокси, (циклоалифатическая группа)окси, (гетероциклоалифатическая группа)окси, арилокси, гетероарилокси, (аралифатическая группа)окси, (гетероаралифатическая группа)окси, ароил, гетероароил, амино, амидо [например, (алифатическая группа)карбониламино, (циклоалифатическая группа)карбониламино, ((циклоалифатическая группа)алифатическая группа)карбониламино, (арил)карбониламино, (аралифатическая группа)карбониламино, (гетероциклоалифатическая группа)карбониламино, ((гетероциклоалифатическая группа)алифатическая группа)карбониламино, (гетероарил)карбониламино или (гетероаралифатическая группа)карбониламино], нитро, карбокси [например, HOOC-, алкоксикарбонил или алкилкарбонилокси], ацил [например, (циклоалифатическая группа)карбонил, ((циклоалифатическая группа)алифатическая группа)карбонил, (аралифатическая группа)карбонил, (гетероциклоалифатическая группа)карбонил, ((гетероциклоалифатическая группа)алифатическая группа)карбонил или (гетероаралифатическая группа)карбонил], циано, галоген, гидрокси, меркапто, сульфонил [например, алкил-SO2- и арил-SO2-], сульфинил [например, алкил-S(O)-], сульфанил [например, алкил-S-], сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как здесь используется, термин "гетероциклоалифатическая группа" охватывает гетероциклоалкильную группу и гетероциклоалкенильную группу, каждая из которых необязательно замещена, как указано далее.
Как здесь используется, термин "гетероциклоалкильная" группа относится к 3-10 членной моно- или бициклической (конденсированной или мостиковой) (например, 5-10-членной моно- или бициклической) насыщенной кольцевой структуре, в которой одно или несколько кольцевых атомов являются гетероатомом (например, N, O, S или их сочетания). Примеры гетероциклоалкильной группы включают пиперидил, пиперазил, тетрагидропиранил, тетрагидрофурил, 1,4-диоксоланил, 1,4-дитианил, 1,3-диоксоланил, оксазолидил, изоксазолидил, морфолинил, тиоморфолил, октагидробензофурил, октагидрохроменил, октагидротиохроменил, октагидроиндолил, октагидропиридинил, декагидрохинолинил, октагидробензо[b]тиофенил, 2-окса-бицикло[2.2.2]октил, 1-аза-бицикло[2.2.2]октил, 3-аза-бицикло[3.2.1]октил и 2,6-диоксатрицикло[3.3.1.03,7]нонил. Моноциклическая гетероциклоалкильная группа может быть конденсированной с фенильной группой с образованием структуры, такой как тетрагидроизохинолиновая, которую можно отнести к категории гетероарилы.
Термин "гетероциклоалкенильная" группа, как здесь используется, относится к моно- или бициклической (например, 5-10-членной моно- или бициклической) неароматической кольцевой структуре, содержащей одну или несколько двойной связей, и где одно или несколько кольцевых атомов являются гетероатомом (например, N, O или S). Нумерация моноциклических и бициклических гетероциклоалифатических групп соответствует стандартной химической номенклатуре.
Гетероциклоалкильная или гетероциклоалкенильная группа могут быть необязательно замещенной одним или несколькими заместителями, такими как фосфо, алифатическая группа [например, алкил, алкенил или алкинил], циклоалифатическая группа, (циклоалифатическая группа)алифатическая группа, гетероциклоалифатическая группа, (гетероциклоалифатическая группа)алифатическая группа, арил, гетероарил, алкокси, (циклоалифатическая группа)окси, (гетероциклоалифатическая группа)окси, арилокси, гетероарилокси, (аралифатическая группа)окси, (гетероаралифатическая группа)окси, ароил, гетероароил, амино, амидо [например, (алифатическая группа)карбониламино, (циклоалифатическая группа)карбониламино, ((циклоалифатическая группа) алифатическая группа)карбониламино, (арил)карбониламино, (аралифатическая группа)карбониламино, (гетероциклоалифатическая группа)карбониламино, ((гетероциклоалифатическая группа) алифатическая группа)карбониламино, (гетероарил)карбониламино или (гетероаралифатическая группа)карбониламино], нитро, карбокси [например, HOOC-, алкоксикарбонил или алкилкарбонилокси], ацил [например, (циклоалифатическая группа)карбонил, ((циклоалифатическая группа) алифатическая группа)карбонил, (аралифатическая группа)карбонил, (гетероциклоалифатическая группа)карбонил, ((гетероциклоалифатическая группа)алифатическая группа)карбонил или (гетероаралифатическая группа)карбонил], нитро, циано, галоген, гидрокси, меркапто, сульфонил [например, алкилсульфонил или арилсульфонил], сульфинил [например, алкилсульфинил], сульфанил [например, алкилсульфанил], сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Термин "гетероарильная" группа, как здесь используется, относится к моноциклической, бициклической или трициклической кольцевой системе, имеющей от 4 до 15 кольцевых атомов, где одно или несколько кольцевых атомов являются гетероатомом (например, N, O, S или их сочетания), и где моноциклическая кольцевая система является ароматической или, по меньшей мере, одно из колец в бициклической или трициклической кольцевой системе является ароматическим. Гетероарильная группа включает бензоконденсированную кольцевую систему, имеющую от 2 до 3 колец. Например, бензоконденсированная группа включает бензо, конденсированный с одним или двумя 4-8-членными гетероциклоалифатическими группами (например, индолизил, индолил, изоиндолил, 3H-индолил, индолинил, бензо[b]фурил, бензо[b]тиофенил, хинолинил или изохинолинил). Некоторыми примерами гетероарила являются азетидинил, пиридил, 1H-индазолил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, тетразолил, бензофурил, изохинолинил, бензтиазолил, ксантен, тиоксантен, фенотиазин, дигидроиндол, бензо[1.3]диоксол, бензо[b]фурил, бензо[b]тиофенил, индазолил, бензимидазолил, бензтиазолил, пурил, циннолил, хинолил, хиназолил, циннолил, фталазил, хиназолил, хиноксалил, изохинолил, 4H-хинолизил, бензо-1,2,5-тиадиазолил или 1,8-нафтиридил.
Без ограничений, моноциклические гетероарилы включают фурил, тиофенил, 2H-пирролил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, 1,3,4-тиадиазолил, 2H-пиранил, 4H-пиранил, пиридил, придазил, пиримидил, пиразолил, пиразил или 1,3,5-триазил. Нумерация моноциклических гетероарилов соответствует стандартной химической номенклатуре.
Без ограничений, бициклические гетероарилы включают индолизил, индолил, изоиндолил, 3H-индолил, индолинил, бензо[b]фурил, бензо[b]тиофенил, хинолинил, изохинолинил, индолизил, изоиндолил, индолил, бензо[b]фурил, bexo[b]тиофенил, индазолил, бензимидазил, бензтиазолил, пуринил, 4H-хинолизил, хинолил, изохинолил, циннолил, фталазил, хиназолил, хиноксалил, 1,8-нафтиридил или птеридил. Нумерация биоциклических гетероарилов соответствует стандартной химической номенклатуре.
Гетероарил необязательно замещен одним или несколькими заместителями, такими как алифатическая группа [например, алкил, алкенил или алкинил]; циклоалифатическая группа; (циклоалифатическая группа)алифатическая группа; гетероциклоалифатическая группа; (гетероциклоалифатическая группа)алифатическая группа; арил; гетероарил; алкокси; (циклоалифатическая группа)окси; (гетероциклоалифатическая группа)окси; арилокси; гетероарилокси; (аралифатическая группа)окси; (гетероаралифатическая группа)окси; ароил; гетероароил; амино; оксо (на неароматическом карбоциклическом или гетероциклическом кольце бициклического или трициклического гетероарила); карбокси; амидо; ацил [например, алифатический карбонил; (циклоалифатическая группа)карбонил; ((циклоалифатическая группа)алифатическая группа)карбонил; (аралифатическая группа)карбонил; (гетероциклоалифатическая группа)карбонил; ((гетероциклоалифатическая группа)алифатическая группа)карбонил; или (гетероаралифатическая группа)карбонил]; сульфонил [например, алифатический сульфонил или аминосульфонил]; сульфинил [например, алифатический сульфинил]; сульфанил [например, алифатический сульфанил]; нитро; циано; галоген; гидрокси; меркапто; сульфокси; мочевина; тиомочевина; сульфамоил; сульфамид; или карбамоил. Альтернативно, гетероарил может быть незамещенным.
Неограничивающие примеры замещенных гетероарилов включают (галоген)гетероарил [например, моно- и ди-(галоген)гетероарил]; (карбокси)гетероарил [например, (алкоксикарбонил)гетероарил]; цианогетероарил; аминогетероарил [например, ((алкилсульфонил)амино)гетероарил и ((диалкил)амино)гетероарил]; (амидо)гетероарил [например, аминокарбонилгетероарил, ((алкилкарбонил)амино)гетероарил, ((((алкил)амино)алкил)аминокарбонил)гетероарил, (((гетероарил)амино)карбонил)гетероарил, ((гетероциклоалифатическая группа)карбонил)гетероарил и ((алкилкарбонил)амино)гетероарил]; (цианоалкил)гетероарил; (алкокси)гетероарил; (сульфамоил)гетероарил [например, (аминосульфонил)гетероарил]; (сульфонил)гетероарил [например, (алкилсульфонил)гетероарил]; (гидроксиалкил)гетероарил; (алкоксиалкил)гетероарил; (гидрокси)гетероарил; ((карбокси)алкил)гетероарил; (((диалкил)амино)алкил]гетероарил; (гетероциклоалифатическая группа)гетероарил; (циклоалифатическая группа)гетероарил; (нитроалкил)гетероарил; (((алкилсульфонил)амино)алкил)гетероарил; ((алкилсульфонил)алкил)гетероарил; (цианоалкил)гетероарил; (ацил)гетероарил [например, (алкилкарбонил)гетероарил]; (алкил)гетероарил и (галогеналкил)гетероарил [например, тригалогеналкилгетероарил].
Термин "гетероаралифатическая" (такая как гетероаралкильная группа) как здесь используется, относится к алифатической группе (например, C1-4 алкильной группе), которая замещена гетероарильной группой. Термины "алифатическая группа", "алкил" и "гетероарил" определены выше.
Термин "гетероаралкильная" группа, как здесь используется, относится к алкильной группе (например, C1-4 алкильная группа), которая замещена гетероарильной группой. Оба термина, "алкил" и "гетероарил", определены выше. Гетероаралкил необязательно замещен одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как здесь используется, термин "циклический фрагмент" и "циклическая группа" относится к моно-, би- и три-циклическим кольцевым системам, включая циклоалифатическую группу, гетероциклоалифатическую группу, арил или гетероарил, каждый из которых был определен выше.
Как здесь используется, термин "мостиковая бициклическая кольцевая система" относится к бициклической гетероциклоалифатической кольцевой системе или бициклической циклоалифатической кольцевой системе, в которых кольца являются мостиковыми. Примеры мостиковой бициклической кольцевой системы включают, но этим не ограничиваются, адамантанил, норборнанил, бицикло[3.2.1]октил, бицикло[2.2.2]октил, бицикло[3.3.1]нонил, бицикло[3.3.2]децил, 2-оксабицикло[2.2.2]октил, 1-азабицикло[2.2.2]октил, 3-азабицикло[3.2.1]октил и 2,6-диокса-трицикло[3.3.1.03,7]нонил. Мостиковая бициклическая кольцевая система может быть необязательно замещенной одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как здесь используется, термин "ацильная" группа относится к формильной группе или RX-C(O)- (такой как алкил-C(O)-, также указываемой как "алкилкарбонил"), где RX и "алкил" определены выше. Ацетил и пивалоил являются примерами ацильной группы.
Как здесь используется, термин "ароил" или "гетероароил" относится к арил-C(O)- или гетероарил-C(O)-, соответственно. Арильная и гетероарильная часть ароила или гетероароила являются необязательно замещенными, как определено выше.
Как здесь используется, термин "алкокси" группа относится к алкил-O- группе, где "алкил" определен выше.
Как здесь используется, термин "карбамоильная" группа относится к группе, имеющей структуру -O-СО-NRXRY или -NRX-СО-O-RZ, где RX и RY определены выше, и RZ может быть алифатической группой, арилом, аралифатической группой, гетероциклоалифатической группой, гетероарилом или гетероаралифатической группой.
Как здесь используется, термин "карбокси" группа относится к -COOH, -COORX, -OC(O)H, -OC(O)RX, когда используется как концевая группа; или -OC(O)- или -C(O)O-, когда используется как внутренняя группа.
Как здесь используется, термин "галогеналифатическая группа" относится к алифатической группе, замещенной 1-3 галогенами. Так, например, термин галогеналкил включает группу -CF3.
Как здесь используется, термин "меркапто" группа относится к -SH.
Как здесь используется, термин "сульфо" группа относится к -SO3H или -SO3RX, когда используется как концевая группа или -S(O)3-, когда используется как внутренняя группа.
Как здесь используется, термин "сульфамидная" группа относится к структуре -NRX-S(O)2-NRYRZ, когда используется как концевая группа, и -NRX-S(O)2-NRY-, когда используется как внутренняя группа, где RX, RY и RZ определены выше.
Как здесь используется, термин "сульфамоильная" группа относится к структуре -O-S(O)2-NRYRZ, где RY и RZ определены выше.
Как здесь используется, термин "сульфонамидная" группа относится к структуре -S(O)2-NRXRY или -NRX-S(O)2-RZ , когда используется как концевая группа; или -S(O)2-NRX- или -NRX-S(O)2-, когда используется как внутренняя группа, где RX, RY и RZ определены выше.
Как здесь используется, термин "сульфанильная" группа относится к -S-RX, когда используется как концевая группа, и -S-, когда используется как внутренняя группа, где RX определен выше. Примеры сульфанилов включают алифатическую группу-S-, циклоалифатическую группу-S-, арил-S- или тому подобное.
Как здесь используется, термин "сульфинильная" группа относится к -S(O)-RX, когда используется как концевая группа, и -S(O)-, когда используется как внутренняя группа, где RX определен выше. Примеры сульфинильной группы включают алифатическую группу-S(O)-, арил-S(O)-, (циклоалифатическую группу(алифатическую группу))-S(O)-, циклоалкил-S(O)-, гетероциклоалифатическую группу-S(O)-, гетероарил-S(O)- или тому подобное.
Как здесь используется, термин "сульфонильная" группа относится к -S(O)2-RX, когда используется как концевая группа, и -S(O)2-, когда используется как внутренняя группа, где RX определен выше. Примеры сульфонильной группы включают алифатическую группу-S(O)2-, арил-S(O)2-, (циклоалифатическую группу(алифатическую группу))-S(O)2-, циклоалифатическую группу-S(O)2-, гетероциклоалифатическую группу-S(O)2-, гетероарил-S(O)2-, (циклоалифатическую группу(амидо(алифатическую группу)))-S(O)2-или тому подобное.
Как здесь используется, термин "сульфокси" группа относится к -O-SO-RX или -SO-O-RX, когда используется как концевая группа, и -O-S(O)- или -S(O)-O-, когда используется как внутренняя группа, где RX определен выше.
Как здесь используется, термин "галоген" относится к фтору, хлору, брому или йоду.
Как здесь используется, термин "алкоксикарбонил", который охватывается термином карбокси, используемый самостоятельно или в соединении с другой группой, относится к группе, такой как алкил-O-C(O)-.
Как здесь используется, термин "алкоксиалкил" относится к алькильной группе, такой как алкил-O-алкил-, где алкил определен выше.
Как здесь используется, термин "карбонил" относится к -C(O)-.
Как здесь используется, термин "оксо" относится к =O.
Как здесь используется, термин "фосфо" относится к фосфинатам и фосфонатам. Примеры фосфинатов и фосфонатов включают -P(O)(RP)2, где RP представляет собой алифатическую группу, алкокси, арилокси, гетероарилокси, (циклоалифатическая группа)окси, (гетероциклоалифатическая группа)окси арил, гетероарил, циклоалифатическую группу или амино.
Как здесь используется, термин "аминоалкил" относится к структуре (RX)2N-алкил-.
Как здесь используется, термин "цианоалкил" относится к структуре (NC)-алкил-.
Как здесь используется, термин "мочевина" относится к структуре -NRX-СО-NRYRZ, и термин "тиомочевина" относится к структуре -NRX-CS-NRYRZ, когда используется как концевая группа, и -NRX-СО-NRY- или -NRX-CS-NRY-, когда используется как внутренняя группа, где RX, RY и RZ определены выше.
Как здесь используется, термин "гуанидин" относится к структуре -N=C(N(RXRY))N(RXRY) или -NRX-C(=NRX)NRXRY, где RX и RY определены выше.
Как здесь используется, термин "амидино" относится к структуре -C=(NRX)N(RXRY), где RX и RY определены выше.
Обычно, термин "вицинальный" относится к расположению заместителей на группе, которое включает два или более атомов углерода, где заместители присоединены к соседним атомам углерода.
Обычно, термин "геминальный" относится к расположению заместителей на группе, которое включает два или более атомов углерода, где заместители присоединены к одному и тому же атому углерода.
Термины "концевой" и "внутренний" относятся к положению группы в заместителе. Группа является концевой, когда указанная группа представлена на конце заместителя, не связанная далее в остатком химической структуры. Карбоксиалкил, то есть, RXO(O)C-алкил является примером карбокси группы, указываемой как концевая группа. Группа является внутренней, когда указанная группа представлена в середине заместителя химической структуры. Алкилкарбокси (например, алкил-C(O)O- или алкил-OC(O)-) и алкилкарбоксиарил (например, алкил-C(O)O-арил- или алкил-O(CO)-арил-) являются примерами карбокси группы, указываемой как внутренняя группа.
Как здесь используется, термин "алифатическая цепь" относится к разветвленной или прямой алифатической группе (например, алкильные группы, алкенильные группы или алкинильные группы). Прямая алифатическая цепь имеет структуру -[CH2]v-, где v равен 1-12. Разветвленная алифатическая цепь представляет собой прямую алифатическую цепь, которая замещена одной или несколькими алифатическими группами. Разветвленная алифатическая цепь имеет структуру -[CQQ]v-, где Q независимо представляет собой водород или алифатическую группу; однако, Q будет алифатической группой, по меньшей мере, в одном случае. Термин алифатическая цепь включает алкильные цепи, алкенильные цепи и алкинильные цепи, где алкил, алкенил и алкинил определены выше.
Фраза "необязательно замещенный" используется взаимозаменяемо с фразой "замещенный или незамещенный." Как здесь описано, соединения по изобретению необязательно могут быть замещены одним или несколькими заместителями, такими как в основном показаны выше, или как показано в примерах конкретных классов, подклассов и видов по изобретению. Как здесь описано, варианты значений R1, R2, R'2, R3 и R4 и других символов, содержащихся в формуле I, описанные здесь, охватывают конкретные группы, такие как алкил и арил. Если не указано иного, каждая из конкретных групп для вариантов значений R1, R2, R'2, R3 и R4 и других символов, содержащихся в ней, может быть необязательно замещенной одним или несколькими описанными здесь заместителями. Каждый заместитель конкретной группы необязательно замещен далее от одного до трех заместителями галогеном, циано, оксо, алкокси, гидрокси, амино, нитро, арилом, циклоалифатической группой, гетероциклоалифатической группой, гетероарилом, галогеналкилом и алкилом. Так, например, алкильная группа может быть замещенной алкилсульфанилом, и алкилсульфанил может быть необязательно замещен от одного до трех заместителями галогеном, циано, оксо, алкокси, гидрокси, амино, нитро, арилом, галогеналкилом и алкилом. В качестве дополнительного примера, циклоалкильная часть (циклоалкил)карбониламино может быть необязательно замещенной от одного до трех заместителями галогеном, циано, алкокси, гидрокси, нитро, галогеналкилом и алкилом. Когда две алкокси группы присоединены к одному и тому же атому или к соседним атомам, две алкокси группы могут образовывать кольцо вместе с атомом(ами), к которому(ым) они присоединены.
Обычно, термин "замещенный", либо предворяемый термином "необязательно", либо нет, относится к замене водородных радикалов в данной структуре на радикал конкретного заместителя. Конкретные заместители описаны выше в определениях и ниже в описании соединений и их примеров. Если не указано иного, необязательно замещенная группа может иметь заместитель на каждом подходящем положении группы, и когда более чем одно положение в любой данной структуре может быть замещено более чем одним заместителем, выбранным из конкретной группы, заместитель может быть либо одним и тем же, либо различным в каждом положении. Заместитель в кольце, таком как гетероциклоалкил, может быть связан с другим кольцом, таким как циклоалкил, с образованием спиро-бициклической кольцевой системы, например, оба кольца обладают одним общим атомом. Как понятно специалисту в данной области, комбинации заместителей, предусматриваемые настоящим изобретением, являются такими комбинациями, которые приводят к образованию стабильных или химически возможных соединений.
Фраза "стабильный или химически возможный", как здесь используется, относится к соединениям, которые не изменяются по существу, когда подвергаются воздействию условий, позволяющих их получить, определить и успешно их выделить, и которые используются с одной или несколькими целями, раскрытими в данном описании. В некоторых вариантах осуществления изобретения, стабильным соединением или химически возможным соединением является соединение, которое по существу не изменяется при хранении, по меньшей мере, в течение недели при температуре 40°C или менее, в отсутствие влаги или других химически реакционноактивных условий.
Как здесь используется, термин "эффективное количество" определяет количество, необходимое для достижения терапевтического эффекта у подвергаемого лечению пациента, и оно обычно определяется с учетом возраста, площади поверхности тела, массы и состояния пациента. Взаимозависимость доз для животных и людей (основываясь на миллиграмм на метр площади поверхности тела) описана Freireich et al., Cancer Chemother. Rep., 50: 219 (1966). Площадь поверхности тела может быть приблизительно определена исходя из роста и массы пациента. Смотри, например, Scientific Tables, Geigy Pharmaceuticals, Ardsley, New York, 537 (1970). Как здесь используется, термин "пациент" относится к млекопитающему, включая человека.
Если не утверждается иное, представленные здесь структуры также предназначены для включения всех изомерных (например, энантиомерных, диастереомерных и геометрических (или конформационных)) форм структуры; например, R и S конфигурации для каждого асимметрического центра, (Z) и (E) изомеры двойной связи и (Z) и (E) конформационные изомеры. Таким образом, отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси настоящих соединений входят в объем настоящего изобретения. Если не утверждается иное, все таутомерные формы соединений по изобретению входят в объем настоящего изобретения. Кроме того, если не утверждается иное, представленные здесь структуры также предназначены для включения соединений, которые отличаются только наличием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением того, что водород заменен на дейтерий или тритий, или углерод заменен на 13C- или 14C-обогащенный углерод, входят в объем настоящего изобретения. Такие соединения могут быть использованы, например, в качестве аналитических инструментов или зондов в биологических анализах или в качестве терапевтических средств.
Как здесь используется, термин "адренергический агонист" относится к соединению, обладающему агонистической активностью по отношению к адренергическому рецептору (например, β1, β2, β3). Следует учесть, что термины "бета-адренергический" и "β-адренергический" могут использоваться взаимозаменяемо. Это словосочетание также применимо к подтипам бета агонистов, (например, 'бета-1-адренергический агонист' используется взаимозаменяемо с 'β1-адренергический агонист' и/или 'β1-адренергический агонист').
Как здесь используется, термин "со-кристалл" относится к по существу кристаллическому продукту, имеющему в кристаллической решетке два или более компонента с отличающимися молекулами (например, соединение формулы I или его соль и ингибитор фосфодиэстеразы).
Химические структуры и номенкладура представлены в соответствии с ChemDraw, version 11.0.1, Cambridge, MA.
II. СОЛИ
Соли по настоящему изобретению, содержащие производные тиазолидиндиона (например, соединение формулы I), являются безусловно эффективными при лечении или профилактики нарушения обмена веществ, такого как ожирение (например, абдоминальное ожирение), диабет и/или нейродегенеративные заболевания (например, болезнь Альцгеймера, деменция или тому подобное), у пациента, и указанные соли обладают пониженной способностью к взаимодействию с PPARγ. Соответственно, указанные соли соединений демонстрируют уменьшение побочных эффектов, связанных с взаимодействием с PPARγ, по сравнению с активирующими PPARγ соединениями.
A. Соединения формулы I
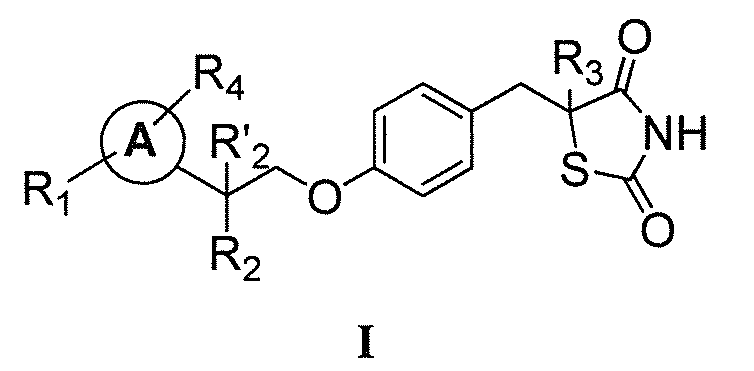
Настоящее изобретение относится к соли соединения формулы I:
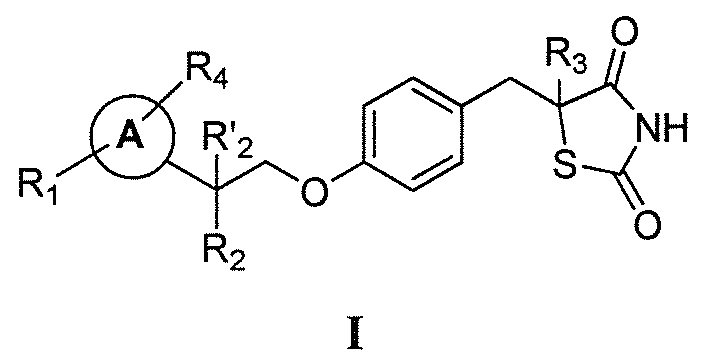
или его фармацевтически приемлемой соли, где:
каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена;
R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 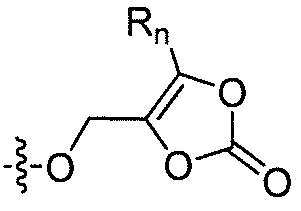 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо;
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо;
R3 представляет собой H или C1-3 алкил; и
кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
В одном аспекте, настоящее изобретение касается гидрохлоридной соли соединения формулы I:
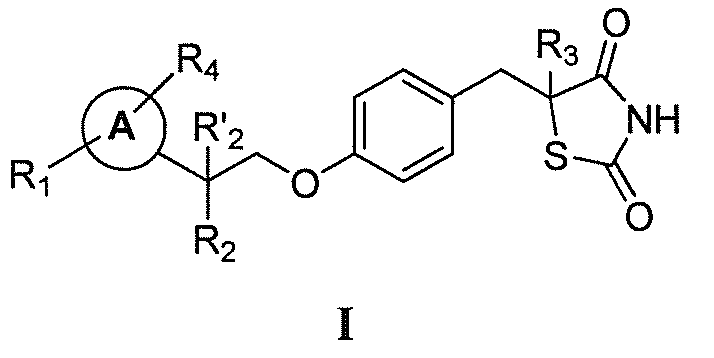
где:
каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена;
R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 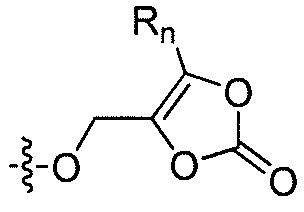 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо;
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо;
R3 представляет собой H или C1-3 алкил; и
кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
Другой аспект настоящего изобретения касается дигидросульфатной соли соединения формулы I:
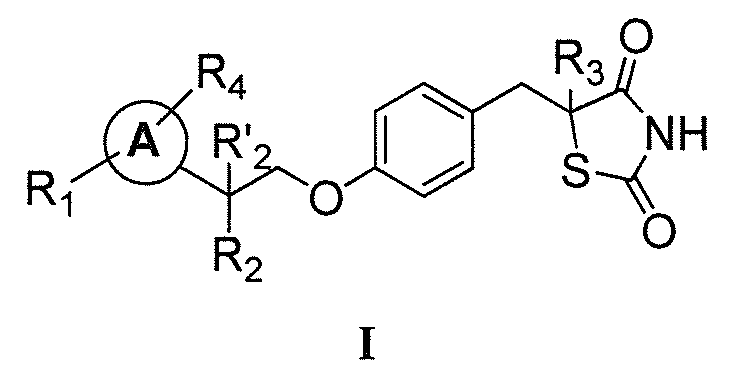
где:
каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена;
R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 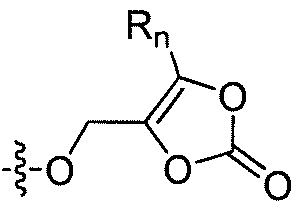 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо;
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо;
R3 представляет собой H или C1-3 алкил; и
кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
Другой аспект настоящего изобретения касается соли щелочноземельного металла соединения формулы I:
где:
каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа или алкокси необязательно замещены 1-3 атомами галогена;
R'2 представляет собой H, и R2 представляет собой H, галоген, гидрокси или необязательно замещенную алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn, -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 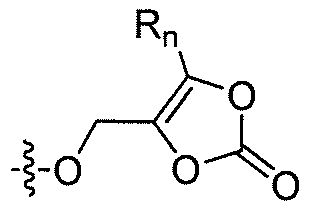 , где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо;
, где каждый Rm независимо представляет собой C1-6 алкил, каждый Rn независимо представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, каждый из которых необязательно замещен; или R2 и R'2 вместе могут образовывать оксо;
R3 представляет собой H или C1-3 алкил; и
кольцо A представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых замещен группой R1 и группой R4 в любом химически приемлемом положении кольца A.
В некоторых вариантах осуществления, щелочноземельным металлом является калий; и в других вариантах осуществления, щелочноземельным металлом является натрий.
В некоторых вариантах осуществления, R1 представляет собой H. В некоторых вариантах осуществления изобретения, R1 представляет собой галоген, такой как F или Cl. В некоторых вариантах осуществления изобретения, R1 представляет собой алифатическую группу, необязательно замещенную 1-3 галогенами. Так, например, R1 представляет собой трифторметил. В некоторых вариантах осуществления изобретения, R1 представляет собой алкокси. Так, например, R1 представляет собой метокси, этокси или -O-изопропил. В еще других вариантах осуществления изобретения, R1 представляет собой алкокси, замещенный 1-3 галогенами. Так, например, R1 представляет собой -OCHF2 или -OCF3. В каждом из следующих далее вариантов осуществления изобретения, R1 может быть замещенным в орто, мета или пара положении кольца A. В некоторых вариантах осуществления изобретения, R1 замещен в пара или мета положении кольца A.
В некоторых вариантах осуществления, R4 представляет собой H. В некоторых вариантах осуществления изобретения, R4 представляет собой галоген, такой как F или Cl. В некоторых вариантах осуществления изобретения, R4 представляет собой алифатическую группу, необязательно замещенную 1-3 галогенами. Так, например, R4 представляет собой трифторметил. В некоторых вариантах осуществления изобретения R4 представляет собой алкокси. Так, например, R4 представляет собой метокси, этокси или -O-изопропил. В еще других вариантах осуществления изобретения, R4 представляет собой алкокси, замещенный 1-3 галогенам. Так, например, R4 представляет собой -OCHF2 или -OCF3. В каждом из следующих далее вариантов осуществления изобретения, R4 может быть замещенным в орто, мета или пара положении кольца A. В некоторых вариантах осуществления изобретения, R4 замещен в пара или мета положении кольца A. В некоторых вариантах осуществления изобретения, R1 и R4 являются различными заместителями. В еще других вариантах осуществления изобретения, R1 и R4 являются одинаковыми заместителями. В некоторых вариантах осуществления изобретения, когда R1 представляет собой алифатическую группу, R4 отличен от H.
В некоторых вариантах осуществления, каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа и алкокси необязательно замещены 1-3 атомами галогена.
В некоторых вариантах осуществления, каждый из R1 и R4 независимо выбран из H, галогена, алифатической группы и алкокси, где алифатическая группа и алкокси необязательно замещены 1-3 атомами галогена.
В некоторых вариантах осуществления, R2 представляет собой галоген, гидрокси, алифатическую группу, -O-ацил, -O-ароил, -O-гетероароил, -O(SO2)NH2, -O-CH(Rm)OC(O)Rn -O-CH(Rm)OP(O)(ORn)2, -O-P(O)(ORn)2 или 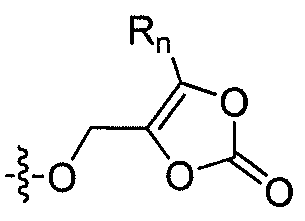 , где каждый Rm представляет собой C1-6 алкил, Rn представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, и каждый заместитель Rm или Rn необязательно замещен.
, где каждый Rm представляет собой C1-6 алкил, Rn представляет собой C1-12 алкил, C3-8 циклоалкил или фенил, и каждый заместитель Rm или Rn необязательно замещен.
В некоторых вариантах осуществления изобретения, R2 представляет собой H.
В некоторых вариантах осуществления изобретения, R2 представляет собой гидрокси.
В некоторых вариантах осуществления изобретения, R2 представляет собой необязательно замещенный прямой или разветвленный C1-6 алкил, необязательно замещенный прямой или разветвленный C2-6 алкенил или необязательно замещенный прямой или разветвленный C2-6 алкинил. В других вариантах осуществления изобретения, R2 представляет собой C1-6 алифатическую группу, необязательно замещенную 1-2 гидрокси, карбокси или галогеном. В других вариантах осуществления изобретения, R2 представляет собой C1-6 алкил, необязательно замещенный гидрокси. В дальнейших вариантах осуществления, R2 представляет собой C1-6 алкил, необязательно замещенный -O-ацилом, -O-ароилом, -O-гетероароилом. В ряде других вариантов осуществления изобретения, R2 представляет собой метил, этил, пропил, изопропил, бутил, трет-бутил, пентил или гексил, каждый из которых необязательно замещен гидрокси. В ряде дополнительных вариантов осуществления изобретения, R2 представляет собой метил или этил, каждый из которых замещен гидрокси.
В ряде вариантов осуществления изобретения, R2 представляет собой -O-ацил, -O-ароил или -O-гетероароил.
В других вариантах осуществления, R2 представляет собой -O-ацетил, -O-гексаноил, -O-бензоил, -O-пивалоил, -O-имидазолил, -O-сукциноил, -O-тиазолил или -O-пиридиноил, каждый необязательно замещенный.
В некоторых вариантах осуществления изобретения, R2 представляет собой -O-C(O)-имидазол-1-ил.
В некоторых вариантах осуществления изобретения, R2 представляет собой -O-CH(Rm)-O-C(O)-Rn.
В некоторых вариантах осуществления изобретения, R2 представляет собой -O-CH(Rm)OP(O)(ORn)2.
В некоторых вариантах осуществления изобретения, R2 представляет собой -O-P(O)(ORn)2.
В других вариантах осуществления, R2 представляет собой -O-S(O2)NH2.
В некоторых еще вариантах осуществления изобертения, R2 представляет собой 1,3-диоксолан-2-он формулы 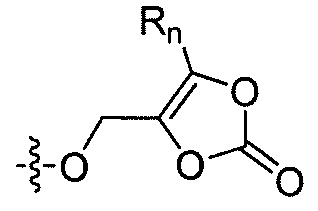 , где Rm и Rn имеют значения, описанные выше.
, где Rm и Rn имеют значения, описанные выше.
В некоторых вариантах осуществления, R'2 представляет собой H.
В некоторых вариантах осуществления изобретения, R2 и R'2 вместе образуют оксо.
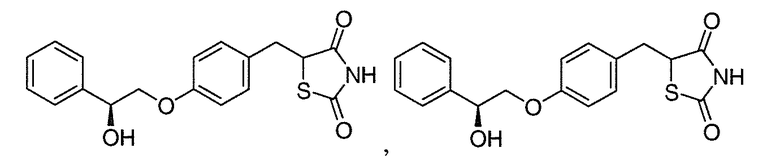
В некоторых вариантах осуществления изобретения, R'2 представляет собой H и R2 имеет R конфигурацию.
В некоторых вариантах осуществления изобретения, R'2 представляет собой H и R2 имеет S конфигурацию.
В некоторых вариантах осуществления изобретения, R'2 представляет собой H и R2 является рацемическим.
В дальнейших вариантах осуществления, кольцо A представляет собой фенил или пиридинил.
В некоторых вариантах осуществления изобретения, кольцо A представляет собой пиридин-2-ил.
В некоторых вариантах осуществления изобретения, кольцо A представляет собой пиридин-3-ил.
В некоторых вариантах осуществления изобретения, кольцо A представляет собой пиридин-4-ил.
В других вариантах осуществления, R3 представляет собой H или необязательно замещенной C1-3 алкил.
В некоторых вариантах осуществления изобретения, R3 представляет собой H.
В некоторых вариантах осуществления изобретения, R3 представляет собой CH3.
Другой аспект настоящего изобретения касается соли (например, гидрохлоридная соль, дигидросульфатная соль или соль щелочноземельного металла) соединения формулы II, IIA или IIB:
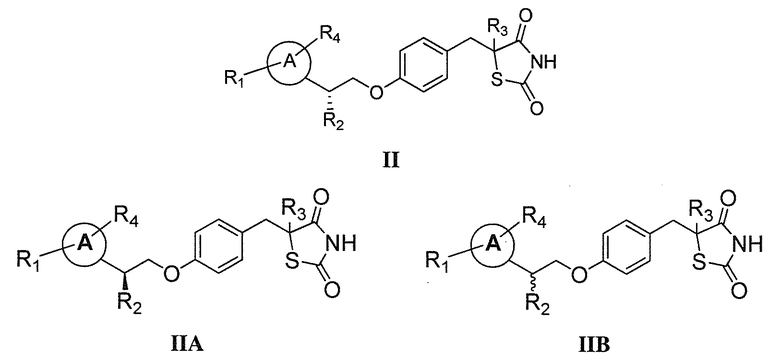
В другом аспекте, изобретение относится к соли (например, гидрохлоридная соль, дигидросульфатная соль или соль щелочноземельного металла) соединения формулы III:
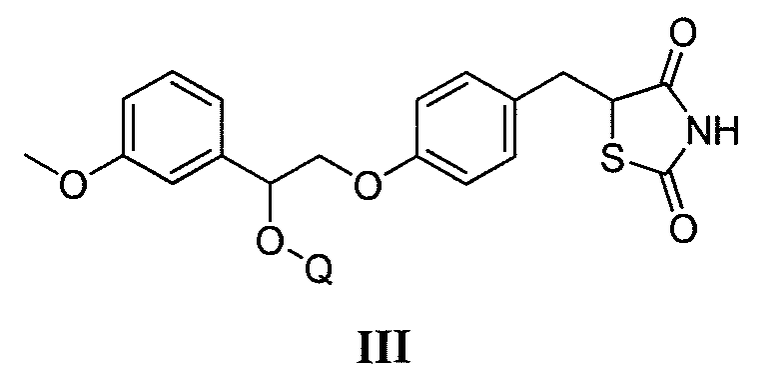
где Q представляет собой ацил, ароил, гетероароил, -SO2NH2, -CH(Rm)OC(O)Rn, -CH(Rm)OP(O)(ORn)2, -P(O)(ORn)2 или 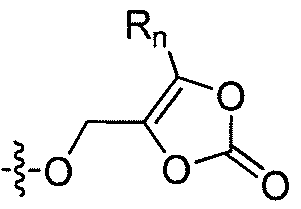 , где каждый Rm представляет собой C1-6 алкил, Rn представляет собой C1-12 алкил, C3-8 циклоалкил, или фенил, где каждый заместитель необязательно замещен.
, где каждый Rm представляет собой C1-6 алкил, Rn представляет собой C1-12 алкил, C3-8 циклоалкил, или фенил, где каждый заместитель необязательно замещен.
В некоторых вариантах осуществления изобретения, Q в формуле III представляет собой ацил.
В некоторых вариантах осуществления изобретения, Q в формуле III представляет собой -ацетил, -гексаноил, -бензоил, -пивалоил, -сукциноил, каждый необязательно замещенный.
В некоторых вариантах осуществления изобретения, Q в формуле III представляет собой ацетил.
В некоторых вариантах осуществления изобретения, Q в формуле III представляет собой гексаноил.
В некоторых вариантах осуществления изобретения, Q в формуле III представляет собой бензоил.
В некоторых вариантах осуществления изобретения, Q в формуле III представляет собой пивалоил.
В некоторых вариантах осуществления изобретения, Q в формуле III представляет собой сукциноил.
В другом аспекте, изобретение относится к соли (например, гидрохлоридная соль, дигидросульфатная соль или соль щелочноземельного металла) соединения формулы IIIA или IIIB:
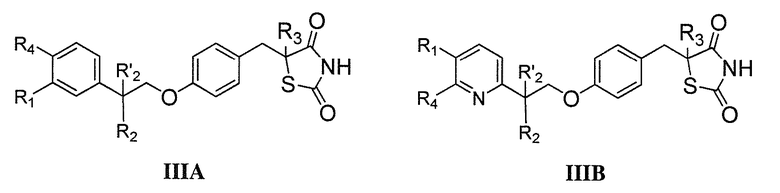
где R1, R2, R'2 и R4 определены выше для формулы I, и R3 представляет собой водород.
В некоторых вариантах осуществления изобретения данного аспекта, R2 и R'2 вместе образуют оксо.
В некоторых вариантах осуществления изобретения, соль представляет собой натриевую соль соединения формулы IIIA или IIIB. В некоторых вариантах осуществления изобретения, соль представляет собой калиевую соль соединения формулы IIIA или IIIB.
В другом аспекте, изобретение относится к соли (например, гидрохлоридная соль, дигидросульфатная соль или соль щелочноземельного металла) соединения формулы IVA или IVB:
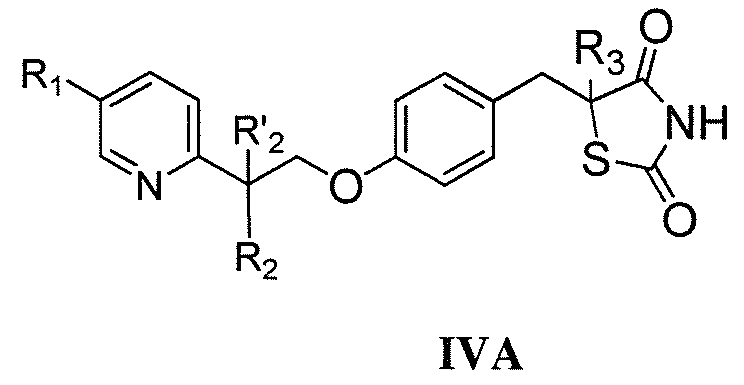 или
или 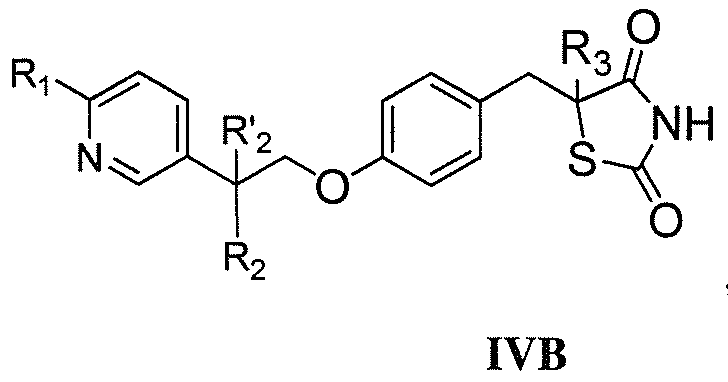 ,
,
где R'2 представляет собой H, R2 представляет собой H, -OH, -O-ацил, -O-ароил или -O-гетероароил; или R2 и R'2 вместе образуют оксо; R1 имеет значения, определенные выше для формулы I; и R3 представляет собой водород.
В дальнейших вариантах осуществления изобретения, Q в формуле IVA или IVB представляет собой H, -O-ацетил, -O-гексаноил, -O-бензоил, -O-пивалоил, -O-сукциноил, каждый необязательно замещенный.
В некоторых вариантах осуществления изобретения, Q в формуле IVA или IVB представляет собой H.
В некоторых вариантах осуществления изобретения, Q в формуле IVA или IVB представляет собой -O-ацетил.
В некоторых вариантах осуществления изобретения, Q в формуле IVA или IVB представляет собой -O-гексаноил.
В некоторых вариантах осуществления изобретения, Q в формуле IVA или IVB представляет собой -O-бензоил.
В некоторых вариантах осуществления изобретения, Q в формуле IVA или IVB представляет собой -O-пивалоил.
В некоторых вариантах осуществления изобретения, Q в формуле IVA или IVB представляет собой -O-сукциноил.
Несколько примеров соединений формулы I представлены ниже в таблицах A-L.
Таблица A: Примеры соединений, где R 2 и R' 2 образуют оксо
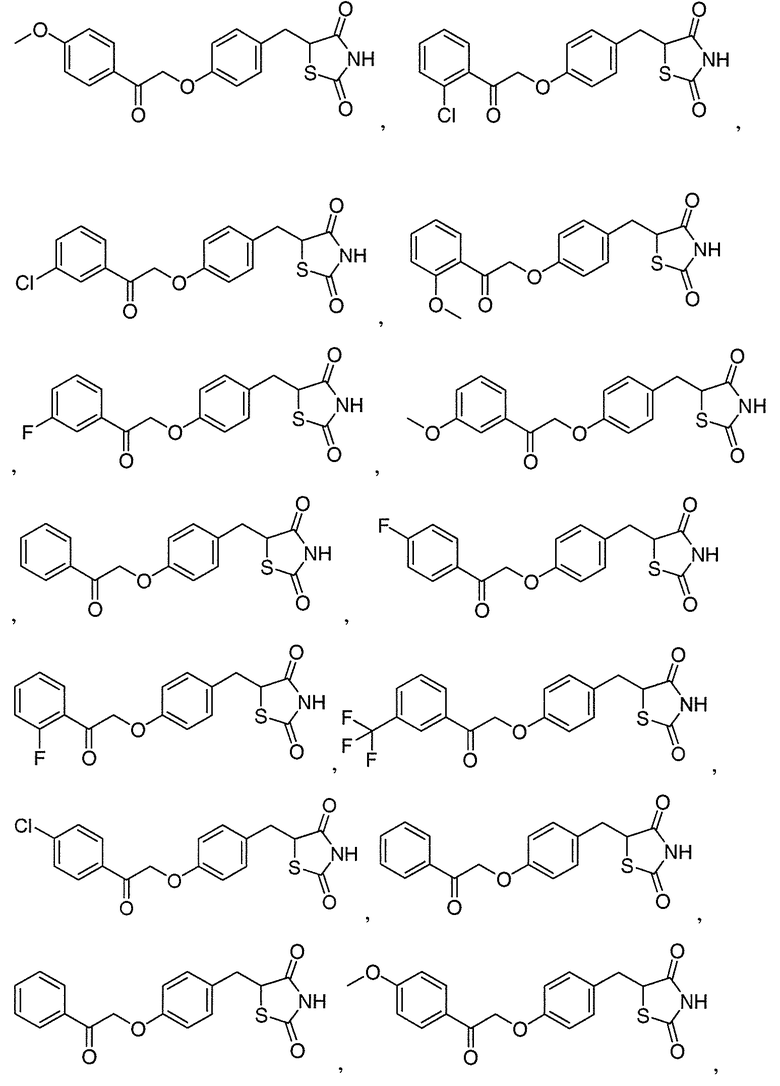
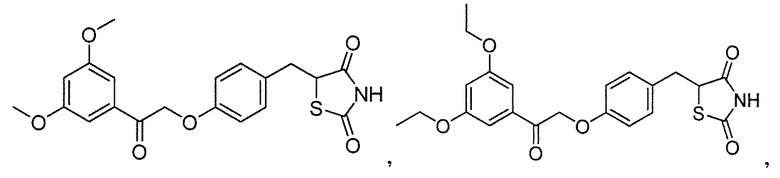
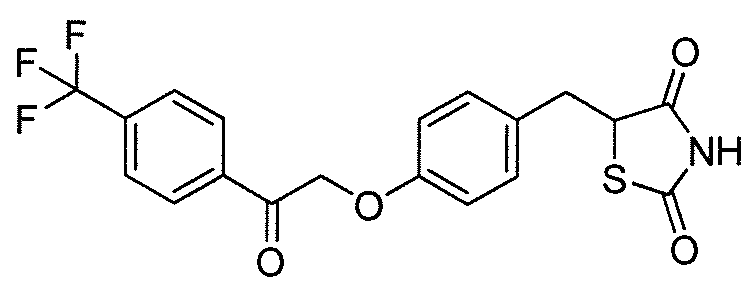 или
или 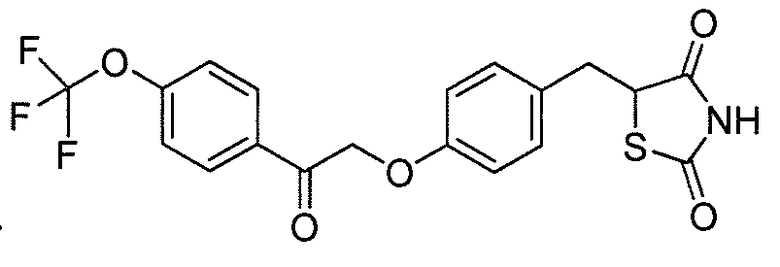 .
.
Таблица B: Примеры соединений, где кольцо A представляет собой фенил, R 2 представляет собой -OH и имеет (R) конфигурацию, и R' 2 представляет собой H
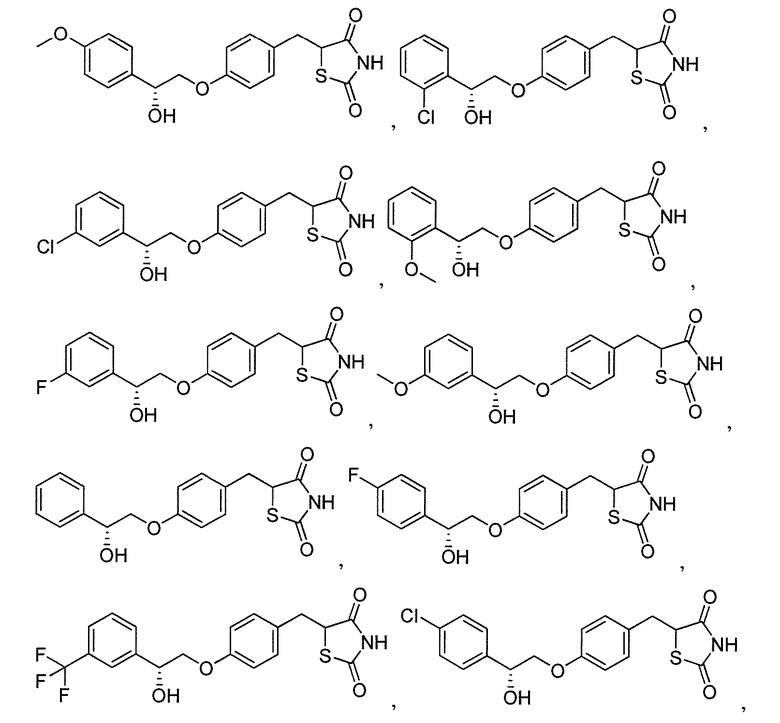
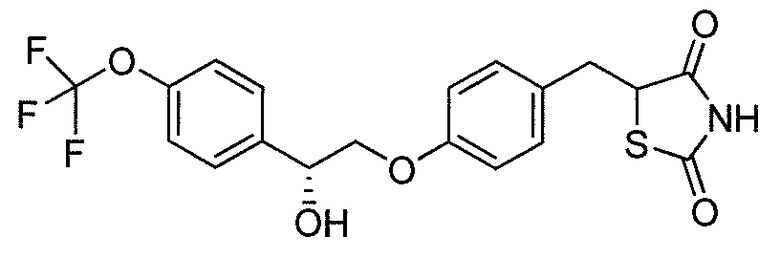 или
или 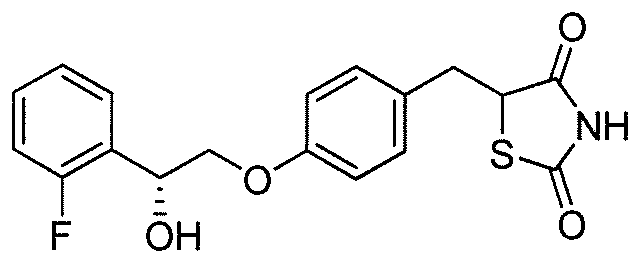 .
.
Таблица C: Примеры соединений, где R 2 представляет собой OH и имеет (S) конфигурацию, и R' 2 представляет собой H
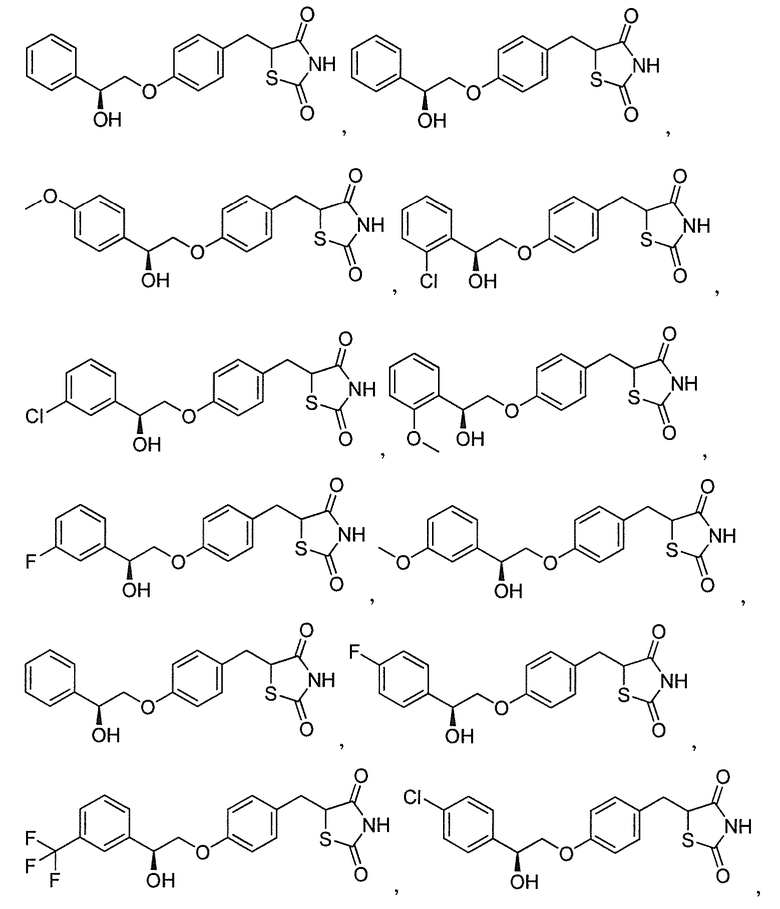
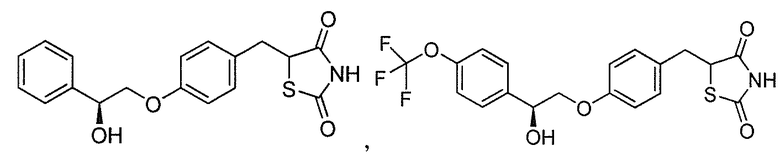
или 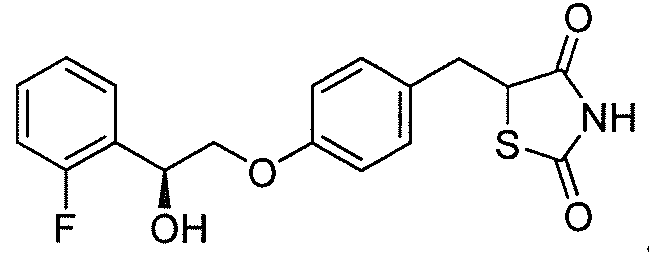 .
.
Таблица D: Примеры соединений, где R 2 является рацемическим -OH и R' 2 представляет собой H
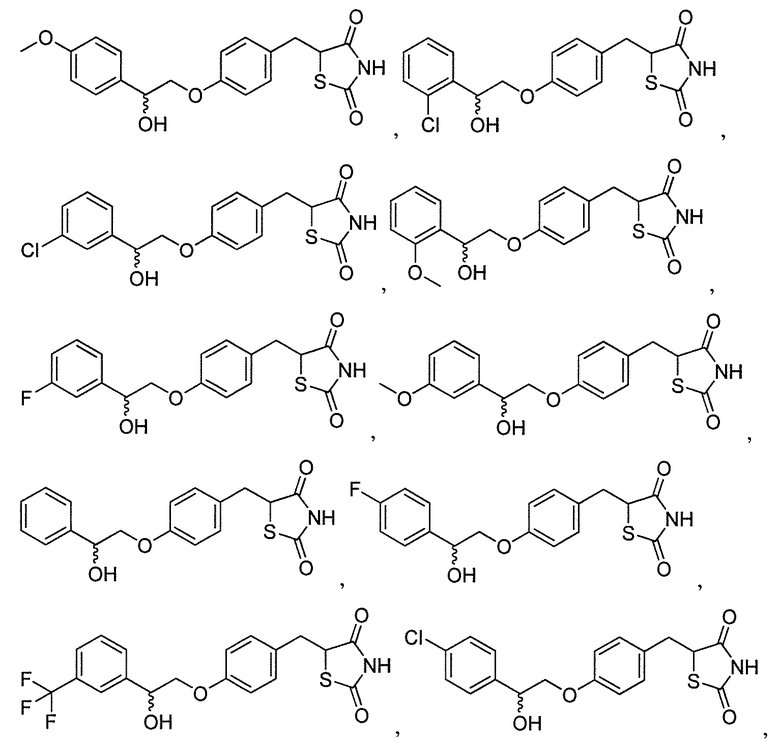
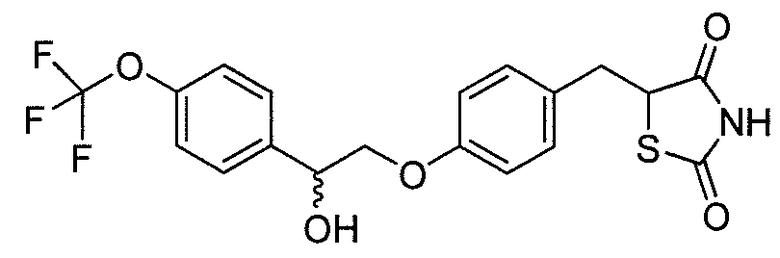 или
или 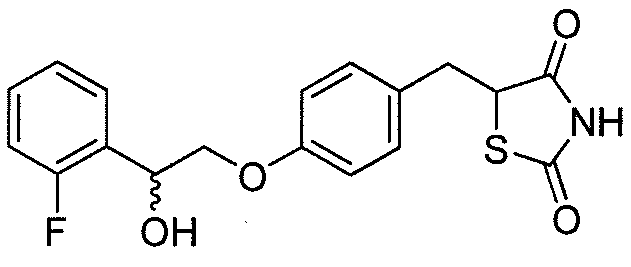 .
.
Таблица E: Примеры соединений, где R 2 представляет собой -O-ацил, -O-ароил или -O-гетероил и R' 2 представляет собой H
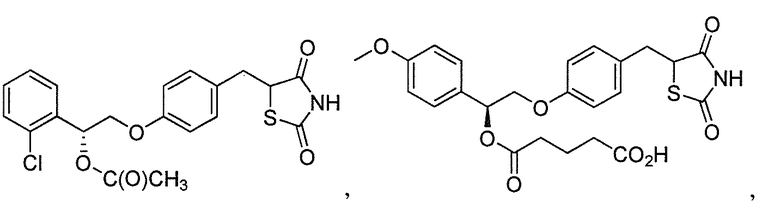
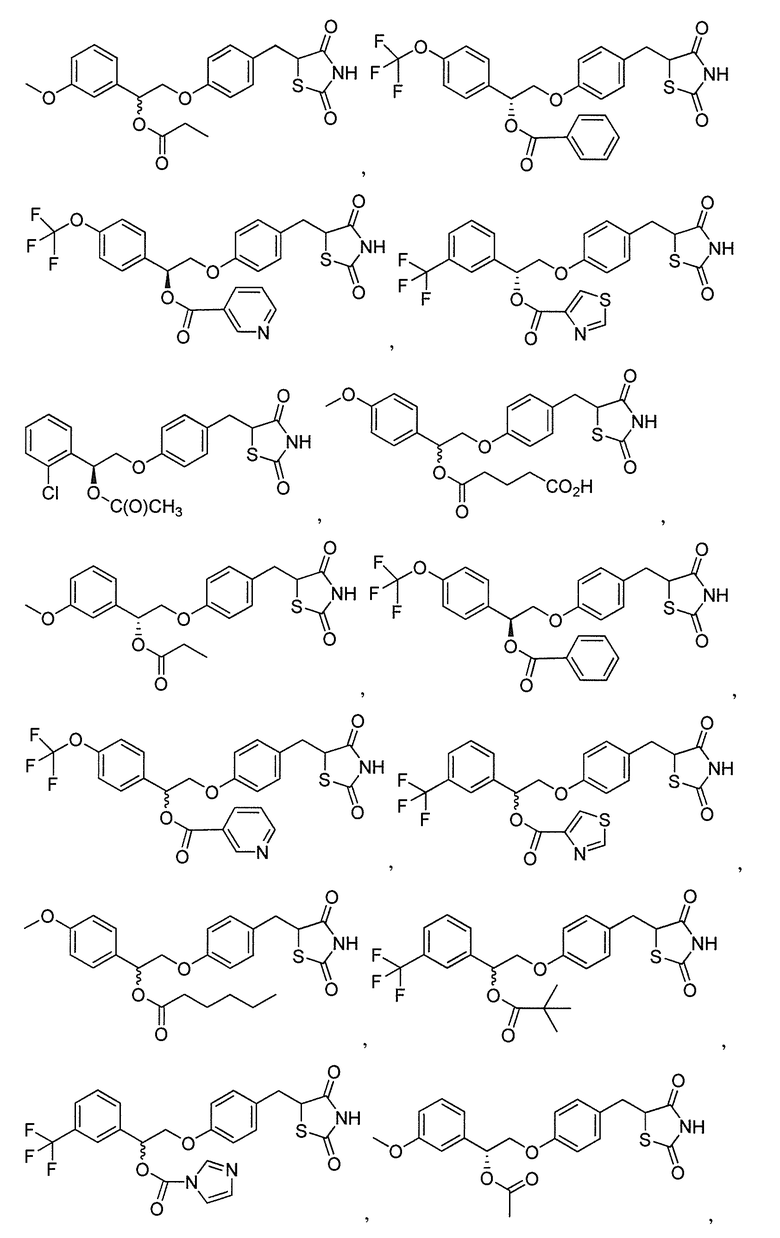
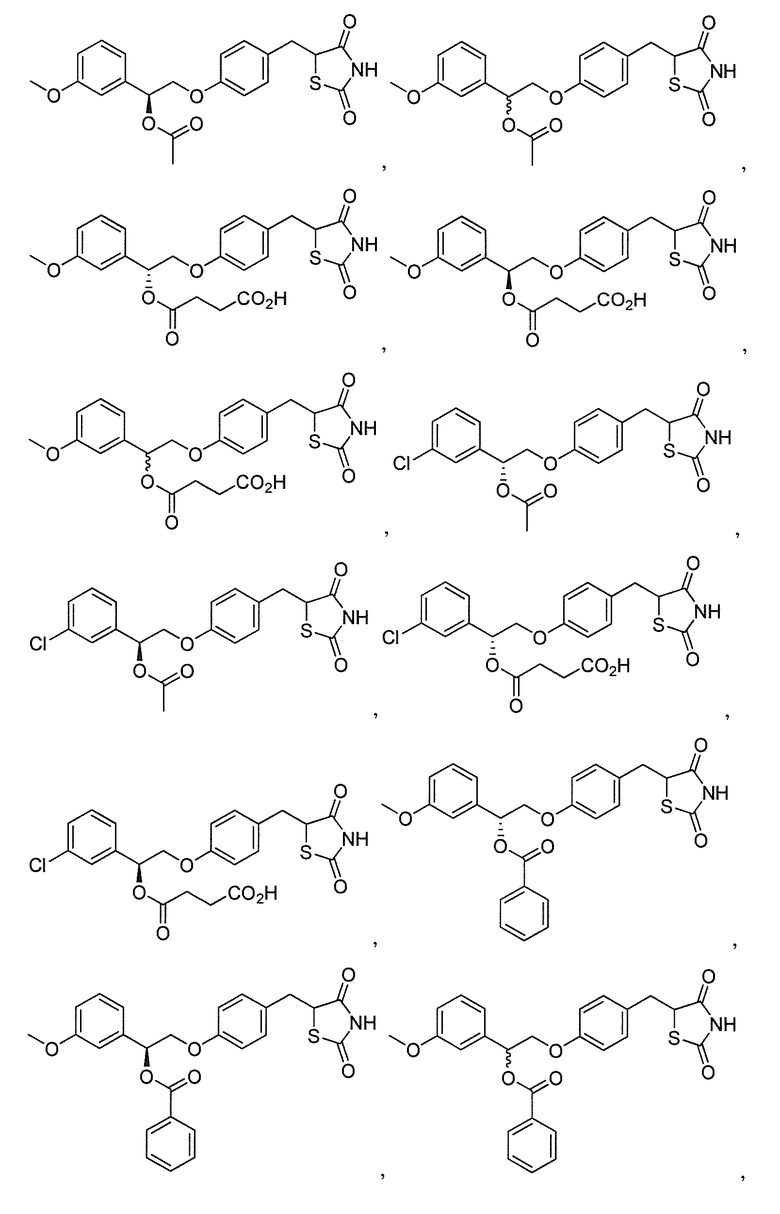
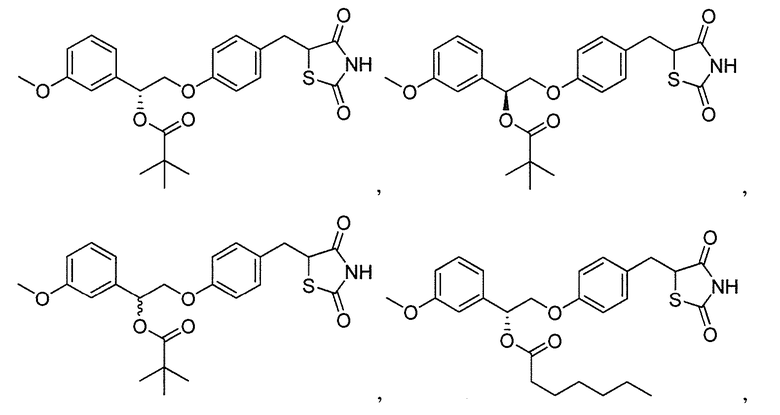
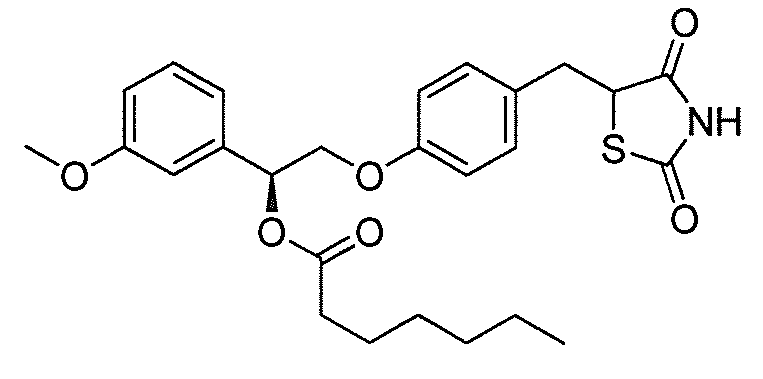 или
или 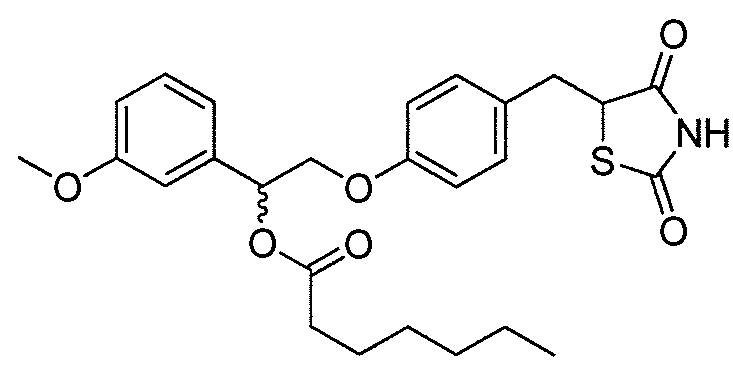 .
.
Таблица F: Примеры соединений, где R 2 представляет собой -O-CH(R m )-O-C(O)R n и R' 2 представляет собой H
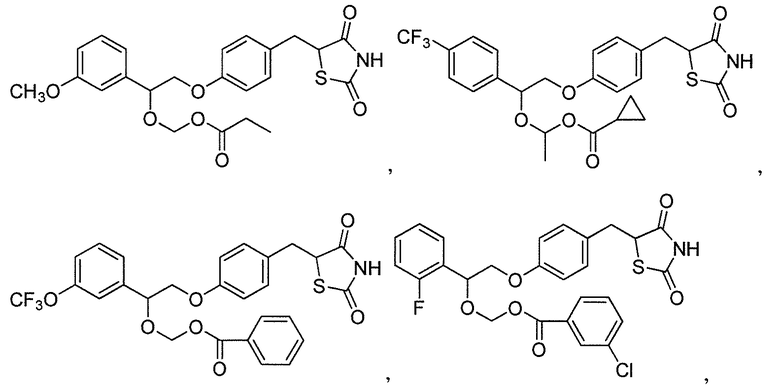
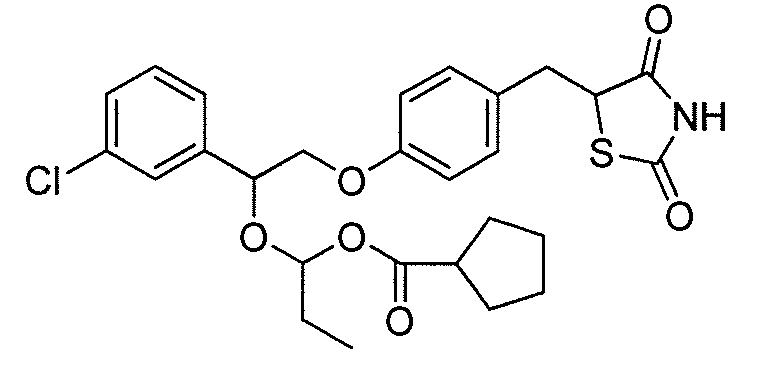 или
или 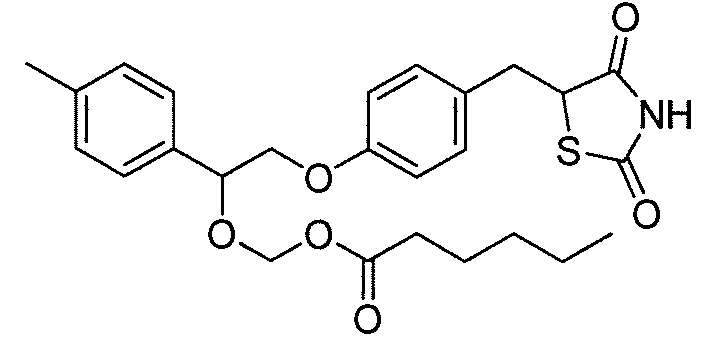 .
.
Таблица G: Примеры соединений, где R2 представляет собой -O-CH(Rm)OP(O)(ORn)2 и R'2 представляет собой H
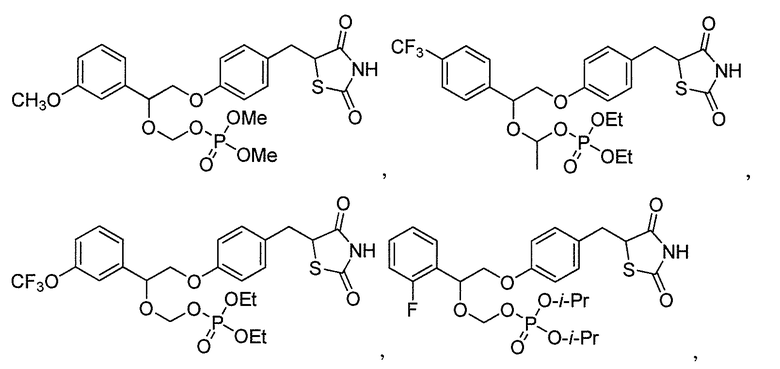
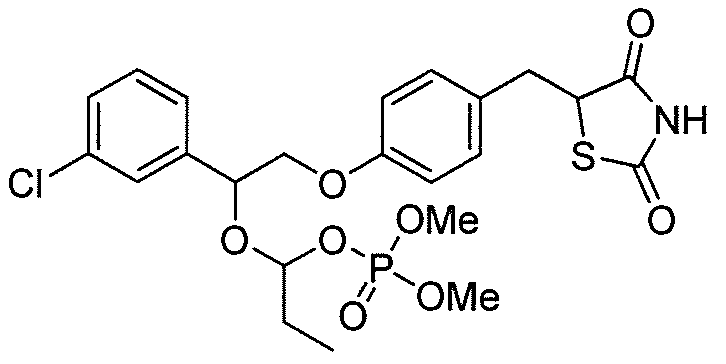 или
или 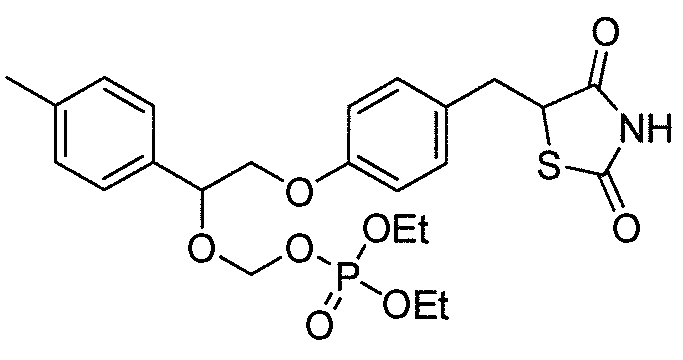 .
.
Таблица H: Примеры соединений, где R 2 представляет собой - O-P(O)(OR n ) 2 и R' 2 представляет собой H
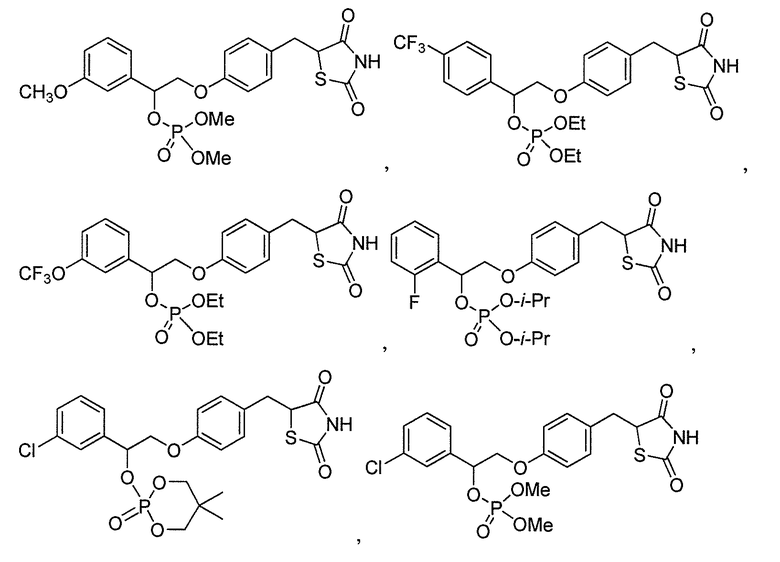
или
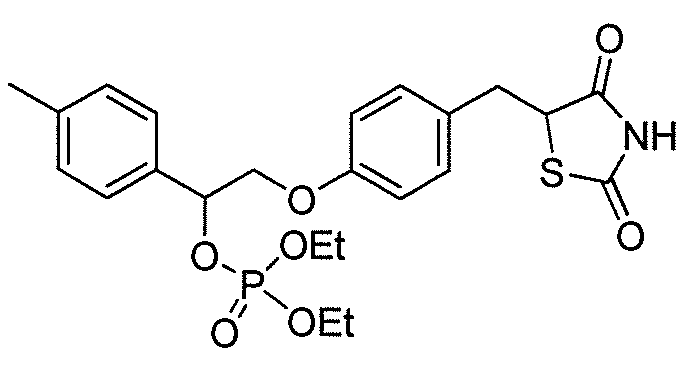 .
.
Таблица I: Примеры соединений, где R 2 представляет собой -O-SO 2 NH 2 и R' 2 представляет собой H
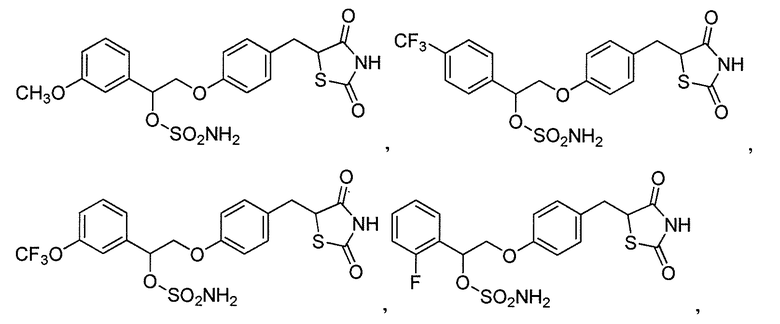
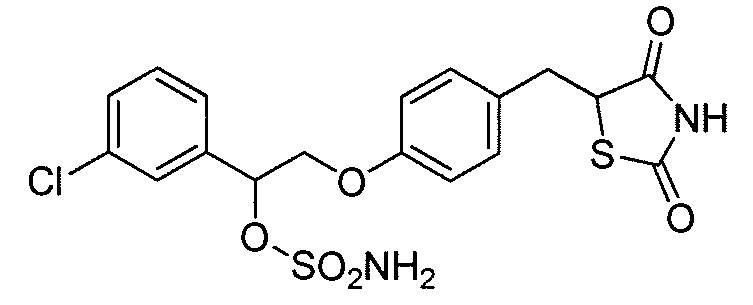 или
или 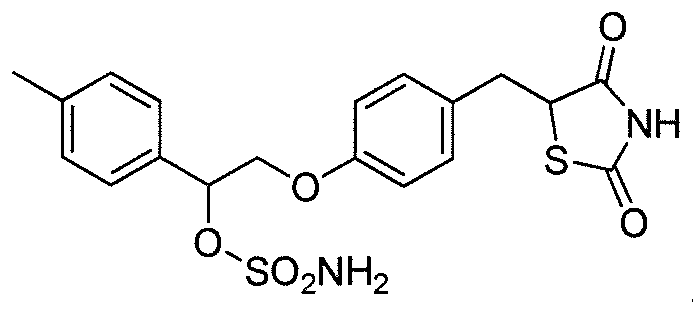 .
.
Таблица J: Примеры соединений, где R
2
представляет собой
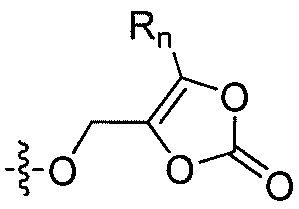 и R'
2
представляет собой H
и R'
2
представляет собой H
 или
или 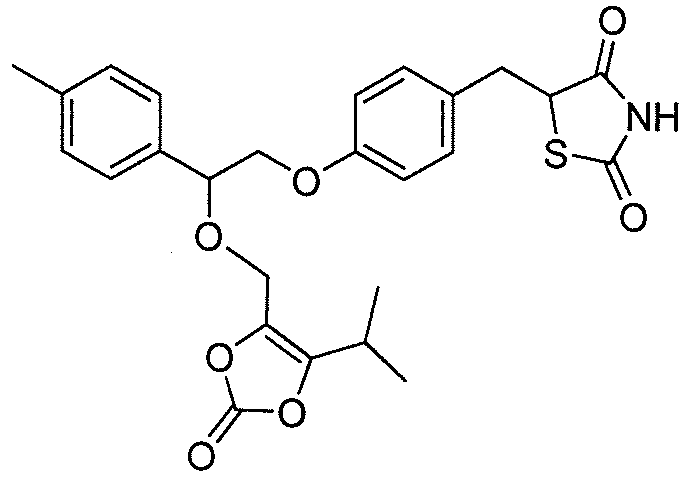 .
.
Таблица K: Пиридин-2-ил производные
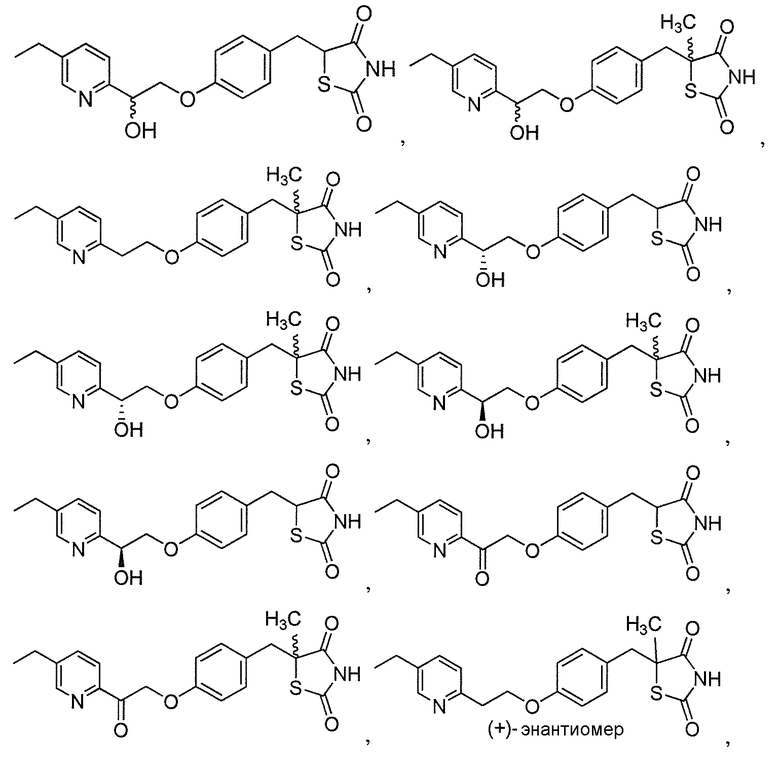
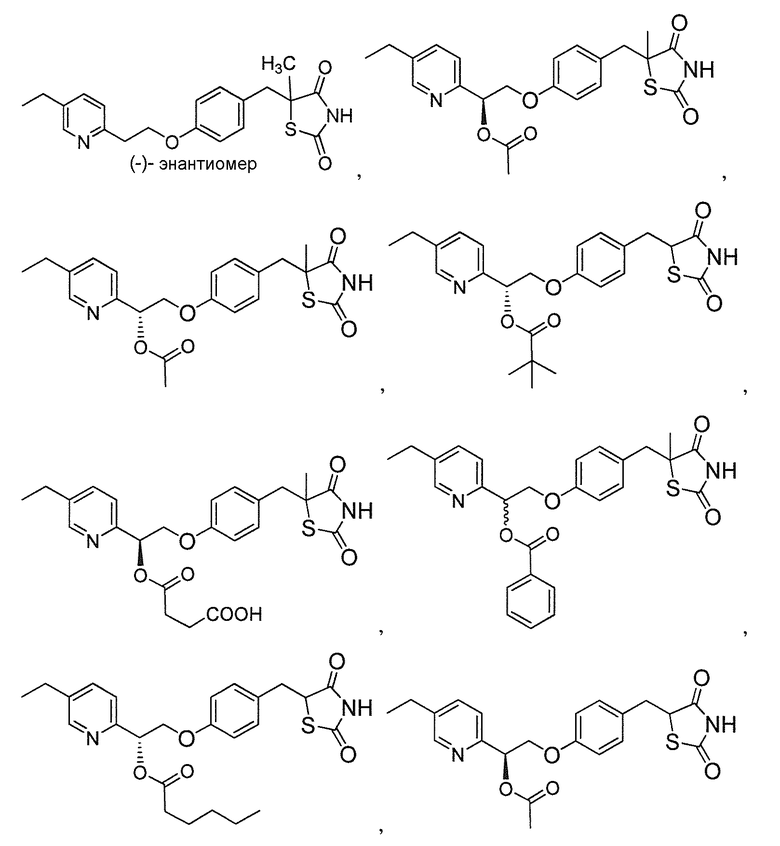
или 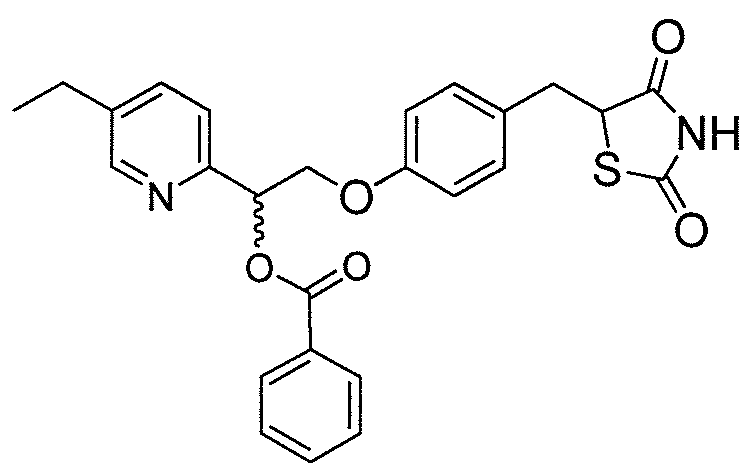 .
.
Таблица L: Пиридин-3-ил производные
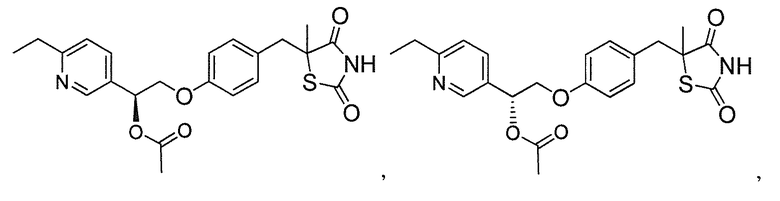
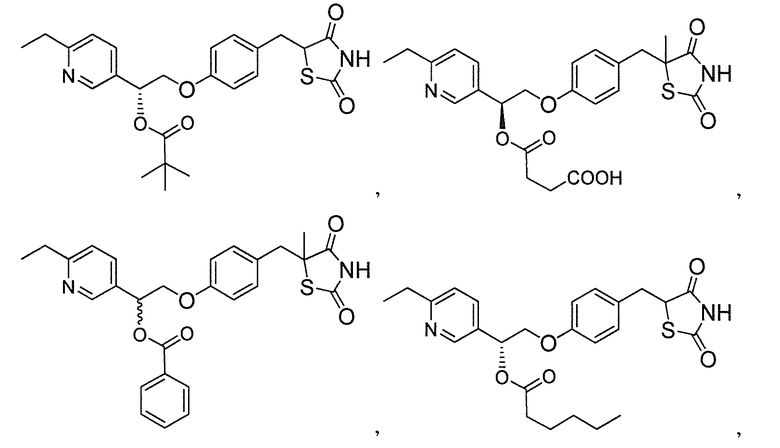
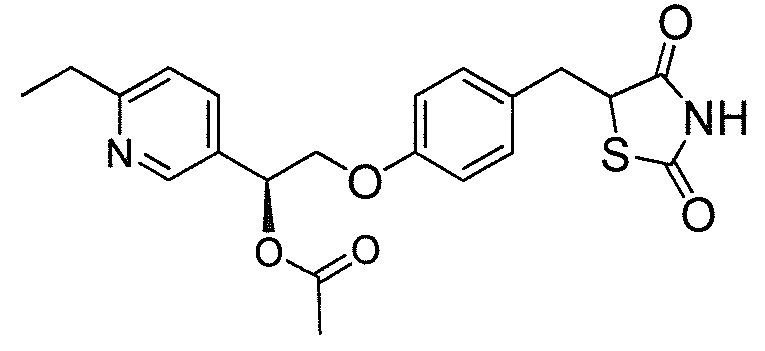 или
или 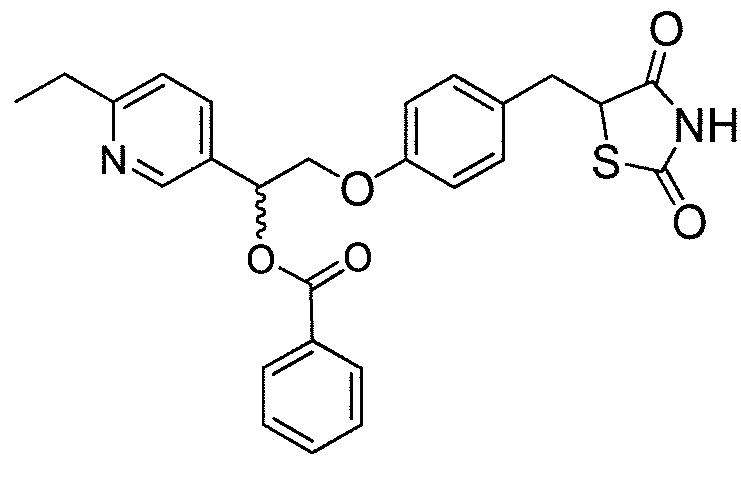 .
.
Другой аспект настоящего изобретения касается фармацевтической композиции, содержащей соль соединения формулы I, II, IIA, IIB, IIIA, IIIB, IVA или IVB с кислотой и ингибитор фосфодиэстеразы (например, кофеин). Например, со-кристалл содержит HCl соль соединения формулы I, II, IIA, IIB, IIIA, IIIB, IVA или IVB и ингибитор фосфодиэстеразы. В другом примере, со-кристалл содержит H2SO4 соль соединения формулы I, II, IIA, IIB, IIIA, IIIB, IVA или IVB и ингибитор фосфодиэстеразы (например, кофеин).
Другой аспект настоящего изобретения касается соли соединения формулы I, II, IIA, IIB, IIIA, IIIB, IVA или IVB и ингибитора фосфодиэстеразы, где соединение обладает 50%-ной активностью PPARγ или меньше по сравнению с активностью росиглитазона, когда дается определенными дозами для достижения периодических уровней более чем 3 мкМ, или обладающее активностью PPARγ в 10 раз меньше, чем активность пиоглитазона в той же дозе.
Другой аспект настоящего изобретения касается фармацевтической композиции, содержащей соль соединения формулы I, ингибитор фосфодиэстеразы и фармацевтически приемлемый носитель.
B. Ингибитор фосфодиэстеразы
В некоторых вариантах осуществления, ингибитор фосфодиэстеразы представляет собой селективный ингибитор или неселективный ингибитор.
Например, ингибитор фосфодиэстеразы представляет собой неселективный ингибитор. В некоторых случаях, неселективный ингибитор фосфодиэстеразы включает кофеин (1,3,7-триметилксантин), теобромин (3,7-диметил-2,3,6,7-тетрагидро-1H-пурин-2,6-дион), теофиллин (1,3-диметил-7H-пурин-2,6-дион) их сочетания или тому подобное.
В другом примере, ингибитор фосфодиэстеразы представляет собой селективный ингибитор. Так, например, селективный ингибитор фосфодиэстеразы включает милдринон (2-метил-6-оксо-1,6-дигидро-3,4'-бипиридин-5-карбонитрил), цилостазол (6-[4-(1-циклогексил-1H-тетразол-5-ил)бутокси]-3,4-дигидро-2(1H)-хинолинон), циломиласт (4-циано-4-(3-циклопентилокси-4-метоксифенил)циклогексан-1-карбоновая кислота), ролипрам (4-(3-циклопентилокси-4-метокси-фенил)пирролидин-2-он), рофлумиласт (3-(циклопропилметокси)-N-(3,5-дихлорпиридин-4-ил)-4-(дифторметокси)бензамид), их сочетания или тому подобное.
В некоторых вариантах осуществления, ингибитор фосфодиэстеразы представлен в со-кристалле, согласно соотношению от около 1:1 до около 1:5 (например, 1:1, 1:2, 1:3 или 1:4), где соотношение представляет собой количество ингибитора фосфодиэстеразы относительно количества соединения формулы I, то есть, количество ингибитора фосфодиэстеразы (в граммах):количество соединения формулы I (в граммах). Следует учесть, что в некоторых вариантах осуществления изобретения, со-кристалл содержит также примеси, образованные при получении, такие как слабые кислоты, которые используются для облегчения образования кристаллов.
В одном варианте осуществления изобретения, со-кристалл содержит кофеин и соединение формулы I, где кофеин представлен согласно соотношению от около 1:1 до около 1:2,5 (например, от около 1:1,25 до около 1:2), где соотношение представляет собой количество (в граммах) ингибитора фосфодиэстеразы относительно количества соединения формулы I. В одном примере, со-кристалл содержит кофеин и соединение формулы I, где кофеин представлен согласно соотношению 1:1,5, то есть, около 40 масс%, относительно соединения формулы I. В другом примере, со-кристалл содержит 5-(4-(2-(5-этилпиридин-2-ил)-2-оксоэтокси)бензил)-1,3-тиазолидин-2,4-дион и кофеин, где кофеин представлен согласно соотношению от около 1:1,25 до около 1:1,75 (например, около 1:1,5) относительно 5-(4-(2-(5-этилпиридин-2-ил)-2-оксоэтокси)бензил)-1,3-тиазолидин-2,4-диона.
В других вариантах осуществления, настоящее изобретение касается со-кристалла, содержащего соединение формулы I, II, IIA, IIB, IIIA, IIIB, IVA или IVB или его фармацевтически приемлемую соль и ингибитор фосфодиэстеразы.
C. Другие фармацевтические композиции
Другой аспект настоящего изобретения касается фармацевтической композиции, содержащей соль соединения формулы I и средство, которое воздействует (например, понижает) уровень циклических нуклеотидов в клетке (например, понижает cAMP) у пациента. Средства, которые понижают cAMP у пациента включают, без ограничений, β-адренергические агонисты, гормоны (например, GLP1), любые их сочетания или тому подобное.
В одном конкретном примере, фармацевтическая композиция содержит соль соединения формулы I и β-адренергический агонист, где соль представляет собой хлористоводородную соль, соль серной кислоты или соль щелочноземельного металла соединения 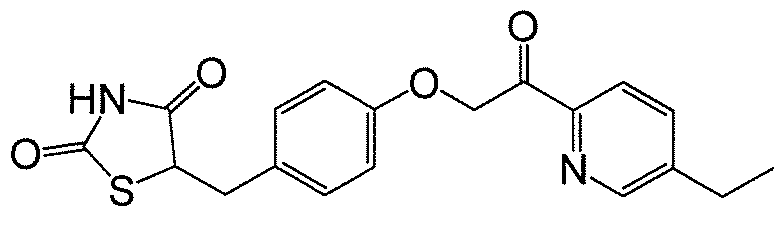 .
.
Другой аспект настоящего изобретения касается фармацевтической композиции, содержащей со-кристалл, бета-адренергический агонист, и, по меньшей мере, одно дополнительное лекарственное средство для снижения веса, где со-кристалл содержит соль соединения формулы I, II, IIA, IIB, IIIA, IIIB, IVA или IVB и ингибитор фосфодиэстеразы. Неограничивающие примеры других лекарственных средств для снижения веса включают подавители аппетита (например, меридиа или тому подобное), ингибиторы усвоения жиров (например, ксеникал или тому подобное) или соединения, которые усиливают симпатомиметическую активность, такие как эфедрин или его различные соли.
III. ОБЩИЕ СХЕМЫ СИНТЕЗА
Соединения формулы I и II могут быть легко синтезированы из коммерчески доступных исходных продуктов известными способами. Примеры путей синтеза для получения соединений формулы I, II, IIA, IIB, IIIA, IIIB, IVA или IVB представлены на схеме 1 ниже.
Схема 1
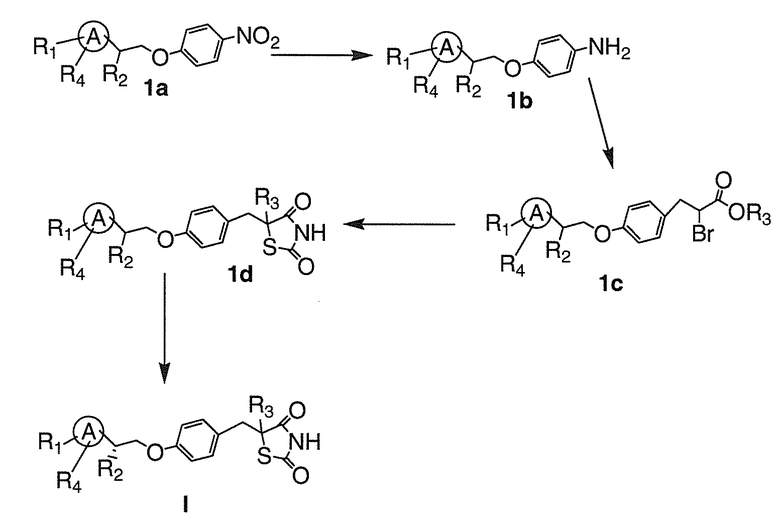
На схеме 1, исходный продукт 1a восстанавливают с образованием анилина 1b. Анилин 1b диазотируют в присутствии бромистоводородной кислоты, эфира акриловой кислоты и катализатора, такого как оксид меди, с получением сложного эфира альфа-бром кислоты 1c. Эфир альфа-бромкислоты 1c циклизуют с тиомочевиной с получением рацемического тиазолидиндиона 1d. Соединения формулы II могут быть выделены из рацемической смеси, используя любой подходящий способ, такой как ВЭЖХ.
На схеме 2 ниже, R2 и R'2 образуют оксо группу или -O-Q, и R3 представляет собой водород.
Схема 2
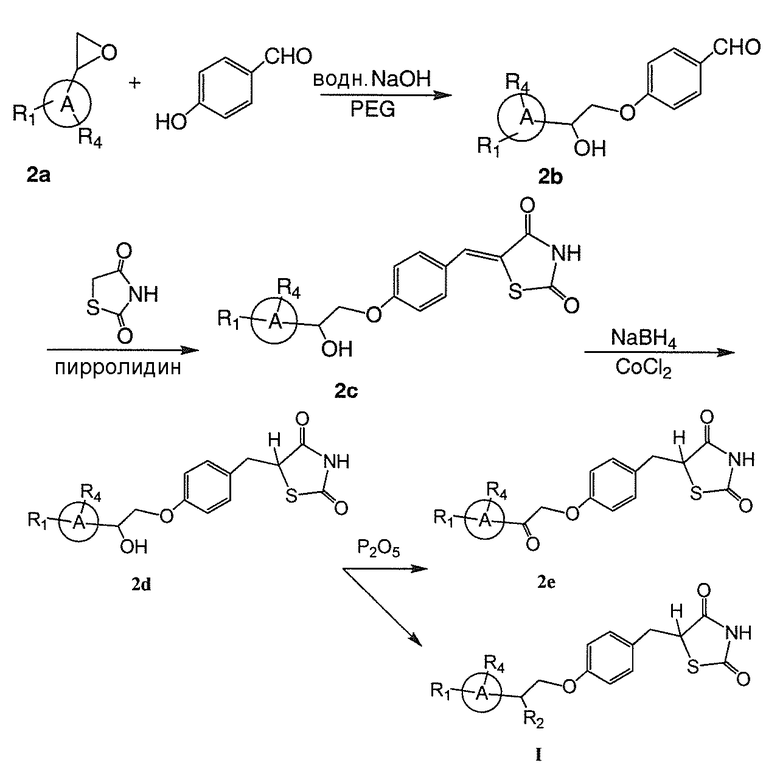
На схеме 2, исходный продукт 2a подвергают взаимодействию с 4-гидроксибензальдегидом в щелочных условиях (например, водн. NaOH) с получением смеси пространственно изомерных спиртов 2b, которые разделяют с помощью хроматографии. Пространственно изомерные спирты 2b подвергают взаимодействию с 2,4-тиазолидиндионом, используя пирролидин в качестве основания, с получением соединение 2c. Катализируемое кобальтом восстановление натрий боргидридом дает соединение 2d, которое окисляют, например, пентоксидом фосфора в присутствии диметилсульфоксида, с получением кетона 2e. Альтернативно, соединения формулы I, где R2 представляет собой -O-Q, могут быть получены исходя из гидрокси соединения 2d, используя известные способы алкилирования, ацилирования, сульфонилирования или фосфорилирования.
IV. ПРИМЕНЕНИЕ, ПРЕПАРАТЫ И ВВЕДЕНИЕ
Как обсуждалось выше, настоящее изобретение относится к со-кристаллам, которые могут быть использованы в качестве терапии или предупредительных мер при нарушениях обмена веществ, таких как ожирение, диабет и/или нейродегенеративные заболевания.
Соответственно, в другом аспекте настоящего изобретения, предложены фармацевтически приемлемые композиции, где указанные композиции содержат со-кристаллы, описанные здесь, и, необязательно, содержат фармацевтически приемлемый носитель, адьювант или наполнитель. В некоторых вариантах осуществления изобретения, указанные композиции необязательно, кроме того, содержат одно или несколько дополнительных терапевтических средств.
Понятно также, что некоторые соединения по настоящему изобретению могут существовать в свободной форме для использования при лечении, или, где приемлемо, в виде фармацевтически приемлемого производного или его пролекарства. В соответствии с настоящим изобретением, фармацевтически приемлемое производное или его пролекарство включают, но этим не ограничивается, фармацевтически приемлемые соли, сложные эфиры, соли таких сложных эфиров или любой другой аддукт или производное, которые при введении пациенту, при необходимости, способны ввести, прямо или опосредованно, соединение, как с другой стороны здесь описано, или его метаболит или остаток.
Как здесь используется, термин "фармацевтически приемлемая соль" относится к таким солям, которые, в объеме обоснованного медицинского заключения, подходят для применения при контакте с тканью человека и низших животных без проявления чрезмерной токсичности, болезненной чувствительности, аллергической реакции и тому подобное, и соответствуют разумному соотношению польза/риск. Термин "фармацевтически приемлемая соль" подразумевает нетоксичную соль или соль сложного эфира соединения по настоящему изобретению, которые, при введении реципиенту, способны обеспечить, либо прямо, либо косвенно, соединение по настоящему изобретению или его ингибиторно активный метаболит или остаток.
Фармацевтически приемлемые соли хорошо известны в данной области. Например, S. M. Berge, et al. подробно описывают фармацевтически приемлемые соли в работе J. Pharmaceutical Sciences, 1977, 66, 1-19, включенной здесь в качестве ссылки. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соли, производные подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых нетоксичных солей добавления кислот являются соли, образованные аминогруппой с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, щавелевая кислота или малоновая кислота, или путем использования других способов, используемых в данной области, таких как обмен ионов. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептаноат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и тому подобное. Соли, полученные с соответствующими основаниями, включают соли щелочных металлов, щелочноземельных металлов, аммиака и N+(C1-4алкил)4. Настоящим изобретением предусматривается возможность кватернизации основной азот-содержащей группы описанных здесь соединений. С помощью такой кватернизации могут быть получены водо- или масло-растворимые или диспергируемые продукты. Представительные примеры солей щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и тому подобное. Кроме того, фармацевтически приемлемые соли включают, когда приемлемо, нетоксичные соли с катионами аммония, четвертичного аммония и амина, образованные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
Как описано выше, фармацевтически приемлемые композиции по настоящему изобретению, кроме того, содержат фармацевтически приемлемые носитель, адьювант или наполнитель, которые, как здесь используется, включают любые и все растворители, разбавители или другие жидкие наполнители, диспергаторы или суспенгаторы, поверхностно-активные агенты, изотонические агенты, загустители или эмульсификаторы, консерванты, твердые связующие, смазывающие агенты и тому подобное, как подходит для конкретной желаемой формы. В обзоре Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) описаны различные носители, используемые при изготовлении фармацевтически приемлемых композиций и известные методики для их получения. За исключением случаев, когда общеизвестная среда носителя несовместима с соединениями по изобретению, такая как вызывающая нежелательный биологический эффект, или, с другой стороны, взаимодействующая вредным образом с любым(и) другим(и) компонентом(ами) фармацевтически приемлемой композици, ее применение подразумевается входящим в объем настоящего изобретения. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но этим не ограничиваются, ионобменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту или сорбат калия, неполные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, динатрий гидрофосфат, калий гидрофосфат, хлорид натрия, соли цинка, коллоидный оксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, полиэтилен-полиоксипропилен-блок полимеры, волосяной жир, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлозу, этилцеллюлозу и ацетат целлюлозы; порошок трагаканта; солод; желатин; тальк; инертные наполнители, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло; подсолнечное масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буфферирующие агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и растворы фосфатных буферов, а также другие нетоксичные совместимые смазывающие агенты, такие как натрий лаурилсульфат и стеарат магния, а также в композиции могут присутствовать красители, разделительные средства, агенты для покрытия, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты, в сооветствии с суждениями фармацевта.
Согласно изобретению, "эффективным количеством" соединения или фармацевтически приемлемой композиции является такое количество, которое эффективно для лечения или уменьшения тяжести онкологических заболеваний.
Фармацевтические композиции, в соответствии со способом по настоящему изобретению, могут быть введены, используя такое количество и такой путь введения, которые эффективны для лечения или ослабления тяжести ожирения и/или связанных с ожирением заболеваний.
Точное требуемое количество будет меняться от субъекта к субъекту, в зависимости от индивидуума, возраста и общего состояния субъекта, тяжести инфекции, конкретного средства, способа его введения и тому подобное. Для легкости введения и равномерности дозировки соединения по изобретению, предпочтительно, включают в состав стандарной лекарственной формы. Выражение "стандарная лекарственная форма", как здесь используется, относится к физически дробной единице средства, подходящего для пациента, подвергаемого лечению. Будет понятно, однако, что общее ежедневное применение соединений и композиций по настоящему изобретению будет решаться лечащим врачом в объеме обоснованного медицинского заключения. Уровень конкретной эффективной дозы конкретного пациента или организма будет зависеть от различных факторов, включая подвергаемое лечению нарушение и тяжесть заболевания; активность конкретного используемого соединения; конкретной используемой композиции; возраста, массы тела, общего состояния здоровья, пола и питания пациента; времени введения, пути введения и скорости выведения используемого соединения; продолжительности лечения; лекарственных средств, используемых в сочетании или совместно с конкретным используемым соединенем и подобными факторами, известными в области медицины. Термин "пациент", как здесь используется, подразумевает животное, например, млекопитающее, и, более конкретно, человека.
Фармацевтически приемлемые композиции по настоящему изобретению могут быть введены людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей или капель), буккально, в виде перорального или назального спрея или тому подобное, в зависимости от тяжести инфекции, подвергаемой лечению. В некоторых вариантах осуществления изобретения, соединения по изобретению могут быть введены перорально или парентерально при уровнях доз от около 0,01 мг/кг до около 50 мг/кг и, предпочтительно, от около 1 мг/кг до около 25 мг/кг массы тела субъекта в сутки, один или несколько раз в день, для получения желаемого терапевтического эффекта. Альтернативно, соединения по изобретению могут быть введены перорально или парентерально при уровнях доз в интервале между 10 мг/кг и около 120 мг/кг.
Жидкие дозированные формы для перорального введения включают, но этим не ограничиваются, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активного соединения, жидкие дозированные формы могут содержать инертные разбавители, широко используемые на практике, такие как, например, воду или другие растворители, солюбилизаторы и эмульсификаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензил бензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси. Помимо инертных разбавителей, пероральные композиции также могут включать адьюванты, такие как увлажнители, эмульгаторы и суспенгаторы, подсластители, ароматизаторы и отдушки.
Препараты для инъекций, например, стерильная вода или масляные суспензии для инъекций, могут быть приготовлены согласно известным в данной области способам, используя подходящие диспергаторы или увлажнители и суспенгаторы. Стерильный препарат для инъекций может представлять собой также стерильный раствор, суспензию или эмульсию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые могут использоваться, имеются вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или среды для суспензий обычно используются стерильные нелетучие масла. Для этой цели может быть использовано любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, при приготовлении инъекций могут быть использованы жирные кислоты, такие как олеиновая кислота.
Препараты для инъекций могут быть стерилизованы, например, путем фильтрования через удерживающий бактерии фильтр или путем включения стерилизующих агентов в форму стерильной твердой композиции, которая может быть растворена или диспергирована перед использованием в стерильной воде или другой стерильной среде для инъекций.
Для того чтобы продлить действие соединения по настоящему изобретению, часто желательно замедлить поглощение соединения при подкожной или внутримышечной инъекции. Это может быть осуществлено путем использования жидкой суспензии кристаллического или аморфного продукта со слабой растворимостью в воде. Скорость поглощения соединения зависит от скорости его растворения, что, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, отсроченное поглощение парентерально вводимой формы соединения осуществляют путем растворения или суспендирования соединения в масляном наполнителе. Депо-формы для инъекций готовят путем образования микроинкапсулированных матриц соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения и полимера и природы конкретного используемого полимера, скорость высвобождения соединения можно контролировать. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депо-препараты для инъекций также получают путем включения соединения в липосомы или микроэмульсии, которые совместимы с тканями организма.
Композициями для ректального или вагинального введения предпочтительно являются суппозитории, которые могут быть получены путем смешивания соединения по настоящему изобретению с подходящими нераздражающими инертными наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при комнатной температуре, но жидкими при температуре организма, и, таким образом, плавятся в прямой кишке или в вагинальной полости и высвобождают активное соединение.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах, активное соединение смешано, по меньшей мере, с одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или фосфат дикальция и/или a) наполнители или разбавители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующие, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и камедь, c) увлажнители, такие как глицерин, d) разрыхлители, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновую кислоту, некоторые силикаты и карбонат натрия, e) раствор замедляющей процесс добавки, такой как парафин, f) ускорители поглощения, такие как четвертичные аммониевые соединения, г) увлажнители, такие как, например, цетиловый спирт и глицерин моностеарат, h) поглощающие вещества, такие как каолиновая и бентонитовая глина, и i) придающие скольжение агенты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, натрий лаурилсульфат и их смеси. В случае капсул, таблеток и пилюль, дозированная форма также может содержать буферирующие агенты.
Твердые композиции подобного вида также могут быть использованы в качестве наполнителей в мягких и твердых-наполненных желатиновых капсулах, используя такие инертные наполнители, как лактоза или молочный сахар, а также полиэтиленгликоли высокой молекулярной массы и тому подобное. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как желудочные покрытия и другие покрытия, хорошо известные в фармацевтике. Они необязательно могут содержать рентгеноконтрастные агенты, и также могут быть в составе композиций, которые высвобождают только активный(ые) ингредиент(ы), или, предпочтительно, в определенной области желудочно-кишечного тракта, необязательно, отсроченным образом. Примеры покрывающих композиций, которые могут быть использованы, включают полимерные вещества и воски. Твердые композиции подобного типа также могут быть использованы в качестве наполнителей для мягких и твердых наполненных желатиновых капсул, используя такие инертные наполнители, как лактоза или молочный сахар, а также полиэтиленгликоли высокой молекулярной массы и тому подобное.
Активные соединения также могут быть представлены в микроинкапсулированных формах с одним или более инертными наполнителями, как указано выше. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как желудочные покрытия, освобождающие контролирующие покрытия и другие покрытия, хорошо известные в фармацевтии. В таких твердых дозированных формах активное соединение может быть смешано, по меньшей мере, с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы также могут содержать, как в нормальной практике, дополнительные вещества, иные, чем инертные разбавители, например, придающие скольжение при изготовлении таблеток агенты и другие вспомогательные средства для изготовления таблеток, такие как стеарат магния и микрокристалллическая целлюлоза. В случае капсул, таблеток и пилюль, дозированные формы также могут содержать буферирующие агенты. Они необязательно могут содержать рентгеноконтрастные агенты, и также могут быть в составе композиций, которые высвобождают только активный(ые) ингредиент(ы), или, предпочтительно, в определенной области желудочно-кишечного тракта, необязательно, отсроченным образом. Примеры покрывающих композиций, которые могут быть использованы, включают полимерные вещества и воски.
Дозированные формы для местного или трансдермального введения соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингалянты или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, какие могут потребоваться. Офтальмический препарат, ушные капли и глазные капли также рассматриваются в объеме настоящего изобретения. Кроме того, настоящее изобретение предусматривает применение трансдермальных пластырей, которые имеют дополнительные преимущества по обеспечению контролируемой доставки соединений в организм. Такие дозированные формы получают путем растворения или диспергирования соединения в соответствующей среде. Также могут быть использованы усилители абсорбции для понижения проницания соединений через кожу. Скорость можно контролировать либо с помощью контролируемой скорость мембраны, либо диспергированием соединения в полимерной матрице или геле.
Как в основном описано выше, соединения по изобретению могут использоваться для лечения онкологических заболеваний.
Активность, или, что еще более важно, пониженная PPARγ активность соединения, используемая в соответствии с настоящим изобретением для лечения ожирения и/или снижения веса, может быть проанализирована в соответствии с методами, описанными в целом в данной области техники и в представленных здесь примерах.
Понятно также, что соединения и фармацевтически приемлемые композиции по настоящему изобретению могут быть использованы в комбинационной терапии, то есть, соединения и фармацевтически приемлемые композиции могут быть введены одновременно, до или после одного или нескольких методов лечения или медицинских процедур. При конкретной комбинационной терапии (методы лечения или процедуры) для использования в комбинационном режиме следует принимать во внимание сопоставимость желаемых методов лечения и/или процедур и желаемого терапевтического эффекта, который должен быть достигнут. Понятно также, что используемые методы лечения позволяют достичь желаемого эффекта для того же самого заболевания (например, соединение по изобретению может быть введено одновременно с другим средством, используемым для лечения того же самого заболевания), или они позволяют достичь различных эффектов (например, подавление каких-либо нежелательных эффектов). Как здесь используется, дополнительные терапевтические средства, которые обычно вводят для лечения или профилактики конкретного заболевания или состояния, известны как "соответствующие подвергаемому лечению заболеванию или состоянию".
Количество дополнительного терапевтического средства, присутствующего в композиции по настоящему изобретению, будет не больше чем количество, которое обычно могло бы быть введено в композиции, содержащей в качестве терапевтического агента только активный агент. Предпочтительно, количество дополнительного терапевтического средства в описанной настоящей композиции будет находиться в области от около 50% до 100% от количества, обычно присутствующего в композиции, содержащей в качестве агента только терапевтически активный агент.
Соединения по настоящему изобретению или его фармацевтически приемлемые композиции также могут быть включены в состав композиции для покрытия имплантируемого медицинского устройства, такого как протез, искусственные клапаны, сосудисттые трансплантаты, стенты и катетеры. Соответственно, настоящее изобретение, в другом аспекте, включает композицию для покрытия имплантируемого устройства, содержащую соединение по настоящему изобретению, как в целом описано выше, и в классах и подклассах здесь, и носитель, подходящий для покрытия указанного имплантируемого устройства. В еще другом аспекте, настоящее изобретение включает имплантируемое устройство, покрытое композицией, содержащей соединение по настоящему изобретению как в целом описано выше, и в классах и подклассах здесь, и носитель, подходящий для покрытия указанного имплантируемого устройства. Подходящие покрытия и общее получение покрытого имплантируемого устройства описаны в патентах США 6099562; 5886026; и 5304121, каждый из которых включен в виде ссылки. Покрытия обычно представляют собой биологически совместимые полимерные иатериалы, такие как полимерный гидрогель, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. Покрытия необязательно могут быть далее покрыты подходящим верхним слоем фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их сочетаний для придания композиции свойств контролируемого высвобождения.
Для того чтобы описанное здесь изобретение было более понятно, представлены следующие примеры. Следует учесть, что эти примеры даны только в иллюстративных целях и не предназначены для ограничения настоящего изобретения каким-либо образом.
V. ПРИМЕРЫ
Некоторые из следующих аббревиатур, используемые далее, определены в таблице M.
Пример 1: 5-[4-(2-оксо-2-фенилэтокси)бензил]-1,3-тиазолидин-2,4-дион
Стадия 1. Получение 4-(2-гидрокси-2-фенилэтокси)бензальдегида
К 2-(4-фторфенил)оксирану (6,50 г, 54,0 ммоль) добавляли толуол (85 мл), 4-гидроксибензальдегид (9,89 г, 81,0 ммоль), ПЭГ4000 (полиэтиленгликоль, 1,15 г) и 1M NaOH (85 мл), и перемешиваемую смесь нагревали при температуре 78°C в течение ночи. После охлаждения до комнатной температуры реакционную смесь экстрагировали EtOAc, и органическую фазу промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло желтого цвета подвергали хроматографии на средней колонке с силикагелем, элюируя с помощью смеси 0-10% EtOAc/DCM. Фракции, содержащие преимущественно пятно с более высоким Rf, объединяли и упаривали в вакууме с получением 1,85 г (14%) указанного в заголовке соединения в виде масла желтого цвета. Фракции, содержащие преимущественно пятно с более низким Rf, объединяли и упаривали в вакууме с получением 0,64 г изомера положения в виде бесцветного вязкого масла. Смешанные фракции объединяли и вновь подвергали хроматографии, элюируя с помощью смеси 30% EtOAc/гексан. Фракции, содержащие продукт с более высоким Rf, объединяли и упаривали в вакууме с получением дополнительных 2,64 г (20%) указанного в заголовке соединения в виде бесцветного масла. Фракции, содержащие продукт с более низким Rf, объединяли и упаривали в вакууме с получением дополнительных 1,82 г изомера положения в виде бесцветного вязкого масла.
Стадия 2: Получение 5-[4-(2-гидрокси-2-фенилэтокси)бензилиден]-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 4-[(2S)-2-гидрокси-2-фенилэтокси]бензальдегида (2,63 г, 10,8 ммоль) в абсолютном EtOH (75 мл) добавляли 2,4-тиазолидиндион (1,27 г, 10,8 ммоль) и пиперидин (0,54 мл, 5,4 ммоль), и полученный раствор нагревали до кипения. Реакционную смесь кипятили с обратным холодильником в течение ночи. Реакционной смеси давали остыть до комнатной температуры. Никакого осадка не образовывалось. pH реакционной смеси был равен приблизительно 5. Добавляли уксусную кислоту (20 капель), и реакционную смесь упаривали в вакууме. Продукт адсорбировали на силикагеле и подвергали хроматографии, элюируя с помощью смеси 30-40% EtOAc/гексан. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 3,18 г (86%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета. MS (ESI-) для C18H15NO4S m/z 340,1 (M-H)-.
Стадия 3: Получение 5-[4-(2-гидрокси-2-фенилэтокси)бензил]-1,3-тиазолидин-2,4-дион
К смеси 5-[4-(2-гидрокси-2-фенилэтокси)бензилиден]-1,3-тиазолидин-2,4-диона (1,50 г, 4,39 ммоль) в ТГФ (20 мл) добавляли H2O (20 мл), 1M NaOH (3 мл), гексагидрат хлорида кобальта(II) (0,60 мг, 0,003 ммоль) и диметилглиоксим (15 мг, 0,13 ммоль). Добавляли раствор тетрагидробората натрия (240 мг, 6,33 ммоль) в 0,2M NaOH (3,6 мл). Реакционная смесь сразу чернела, но очень скоро приобретала вид прозрачного раствора желтого цвета. Добавляли по каплям уксусную кислоту до тех пор, пока раствор вновь не становился темным (3 капли). Спустя приблизительно один час реакционная смесь светлела. Добавляли дополнительное количество NaBH4, CoCl2 и HOAc для достижения темно-сине-лилового цвета. Когда этот цвет тускнел, добавляли еще NaBH4. Когда анализ ВЭЖХ показывал, что реакция завершилась, реакционную смесь распределяли между H2O и EtOAc, и органическую фазу промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученный пенный твердый продукт подвергали хроматографии, элюируя с помощью смеси 50% EtOAc/гексан. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 1,15 г (76%) указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI-) для C18H17NO4S m/z 342,1 (M-H)-.
Стадия 4: Получение 5-[4-(2-оксо-2-фенилэтокси)бензил]-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-[4-(2-гидрокси-2-фенилэтокси)бензил]-1,3-тиазолидин-2,4-диона (1,00 г, 2,91 ммоль) в DCM (35 мл) добавляли ДМСО (2 мл), и раствор охлаждали до температуры 0°C. Добавляли пентоксид фосфора (0,83 г, 2,91 ммоль), затем триэтиламин (1,8 мл, 13,1 ммоль). Реакционной смеси давали медленно нагреться до комнатной температуры. Спустя 2 часа реакционную смесь распределяли между DCM и водой, и органическую фазу промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло желтого цвета подвергали хроматографии на силикагеле, элюируя с помощью смеси 25-35% EtOAc/гексан. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,40 г (40%) указанного в заголовке соединения в виде твердого вещества белого цвета. Растирание в эфире давало 245 мг чистого продукта. MS (ESI-) для C18H15NO4S m/z 340,1 (M-H)-.
Пример 2: Получение 5-{4-[2-(4-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
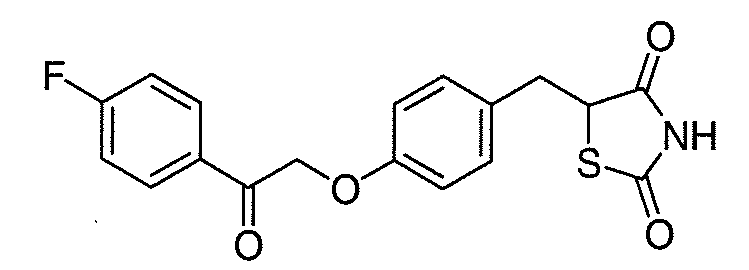
Стадия 1: Получение 4-[2-(фторфенил)-2-гидроксиэтокси]бензальдегида
К перемешиваемому раствору 2-(4-фторфенил)оксирана (5,60 г, 40,0 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (7,40 г, 61,0 ммоль), 1M NaOH (65 мл) и ПЭГ4000 (полиэтиленгликоль, 0,85 г), и реакционную смесь нагревали при температуре 78°C в течение ночи. После охлаждения до комнатной температуры реакционную смесь экстрагировали EtOAc (2×150 мл), и объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло светло-коричневого цвета подвергали хроматографии на силикагеле, элюируя с помощью смеси 30-40% EtOAc/гексан. Фракции, содержащие пятно с более высоким Rf, объединяли и упаривали в вакууме с получением 2,38 г геометрического изомера продукта в виде твердого вещества белого цвета. Фракции, содержащие пятно с более низким Rf, объединяли и упаривали в вакууме с получением 1,54 г (22%) указанного в заголовке соединения в виде бесцветного вязкого масла.
Стадия 2: Получение 5-{4-[2-(4-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору альдегида (2,36 г, 10,8 ммоль) в абсолютном EtOH (75 мл) добавляли 2,4-тиазолидиндион (1,06 г, 9,07 ммоль) и пиперидин (0,45 мл, 4,50 ммоль), и полученный раствор нагревали до кипения. После кипячения с обратным холодильником в течение ночи реакционной смеси давали охладиться до комнатной температуры, и затем упаривали в вакууме. Остаток адсорбировали на силикагеле и подвергали хроматографии, элюируя с помощью смеси 30-40% EtOAc/гексан. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,88 г (27%) указанного в заголовке соединения в виде твердого продукта желтого цвета. MS (ESI-) для C18H14FNO4S m/z 358,1 (M-H)-.
Стадия 3: Получение 5-{4-[2-(4-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона
В перемешиваемую смесь 5-{4-[2-(4-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона (0,87 г, 2,40 ммоль) в ТГФ/H2O (1:1, 20 мл) добавляли 1M NaOH (2 мл), гексагидрат хлорида кобальта(II) (0,30 г, 0,001 ммоль), диметилглиоксим (8,4 мг, 0,073 ммоль) и, наконец, тетрагидроборат натрия (0,13 г, 3,53 ммоль). Реакционная смесь приобретала темно-сине-лиловый цвет. Спустя короткое время темный цвет начинал бледнеть, и добавляли по каплям HOAc для восстановления более темного цвета. Когда цвет бледнел, а добавление HOAc не помогало его восстановить, для восстановления более темного цвета добавляли NaBH4. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь распределяли между водой и EtOAc. Органическую фазу промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло светло-коричневого цвета подвергали хроматографии, элюируя с помощью смеси 35% EtOAc/гексан. Фракции, содержащие соединение, объединяли и упаривали в вакууме с получением 0,77 г (88%) твердого вещества светло-желтого цвета. Твердое вещество желтого цвета растворяли в ТГФ (8 мл) и H2O (8 мл), и полученный раствор обрабатывали CoCl2 (небольшой кристалл) и 2,2'-дипиридилом (5 мг). Наконец, небольшими порциями добавляли NaBH4 до сохранения темно-синего цвета. Реакционную смесь распределяли между EtOAc и H2O, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное слегка слабоокрашенное масло подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 25-35% EtOAc/гексан. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 527 мг (60%) указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI-) для C18H16FNO4S m/z 360,1 (M-H)-.
Стадия 4: Получение 5-{4-[2-(4-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-{4-[2-(4-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона (0,52 г, 1,40 ммоль) в DCM (15 мл) добавляли ДМСО (0,5 мл), и раствор охлаждали до температуры 0°C. Добавляли пентоксид фосфора (0,41 г, 1,44 ммоль), затем триэтиламин (0,90 мл, 6,48 ммоль). Реакционной смеси давали медленно нагреться до комнатной температуры и затем перемешивали в течение 5 часов. Реакционную смесь распределяли между DCM и H2O, и водную фазу экстрагировали DCM. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное твердое вещество белого цвета подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,25 г (48%) указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI+) для C18H14FNO4S m/z 359,9 (M+H)+. MS (ESI-) для C18H14FNO4S m/z 358,0 (M-H)-.
Пример 3: Получение 5-{4-[2-(2-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
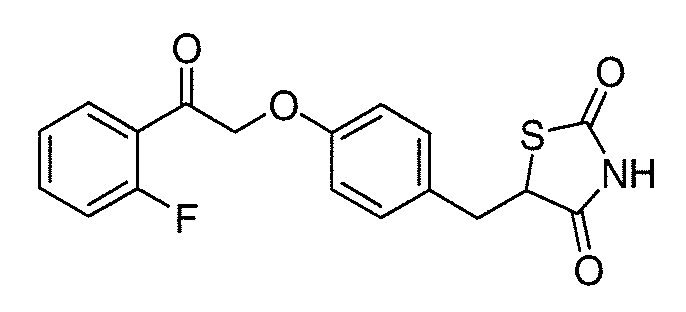
Стадия 1: Получение 2-(2-фторфенил)оксирана
К раствору o-фторстирола (5,0 г, 41,0 ммоль) и уксусной кислоты (2,33 мл, 40,9 ммоль) в диоксане (33 мл) и H2O (78 мл) при температуре 0°C тремя порциями добавляли N-бромсукцинимид (8,02 г, 45,0 моль). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. По частям добавляли карбонат натрия (8,68 г, 81,9 ммоль) и затем добавляли 1M NaOH (прибл. 10 мл), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь распределяли между водой и EtOAc, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме с получением 5,31 г (94%) указанного в заголовке соединения в виде слегка слабоокрашенного масла, которое использовали без дополнительной очистки. MS (ESI+) для C8H7FO m/z 138,1 (M+H)+.
Стадия 2: Получение 4-[2-(2-фторфенил)-2-гидроксиэтокси]бензальдегида
К перемешиваемому раствору 2-(2-фторфенил)оксирана (5,30 г, 38,4 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (7,0 г, 58,0 ммоль), 1M NaOH (65 мл) и ПЭГ4000 (полиэтиленгликоль, 0,85 г) и перемешиваемую смесь нагревали при температуре 78°C в течение ночи. Реакционной смеси давали охладиться до комнатной температуры и затем экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло светло-коричневого цвета адсорбировали на силикагеле и подвергали хроматографии, элюируя с помощью смеси 30-40% EtOAc/гексан с получением 2-х главных пятен. Фракции, содержащие пятно с более высоким Rf, объединяли и упаривали в вакууме с получением 1,10 г (11%) указанного в заголовке соединения в виде бесцветного масла. Фракции, содержащие пятно с более низким Rf, объединяли и упаривали в вакууме с получением 0,67 г (7%) геометрического изомера в виде бесцветного масла.
Стадия 3: Получение 5-{4-[2-(2-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона.
К перемешиваемому раствору альдегида (2,36 г, 10,8 ммоль) в абсолютном EtOH (40 мл) добавляли 2,4-тиазолидиндион (0,495 г, 4,23 ммоль) и пиперидин (0,21 мл, 2,10 ммоль), и полученный раствор нагревали до кипения. После кипячения с обратным холодильником в течение ночи реакционную смесь охлаждали до комнатной температуры и затем упаривали в вакууме. Остаток растворяли в EtOAc, и этот раствор промывали разбаленным водным раствором HOAc, насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное вещество желтого цвета промывали DCM и ацетоном, и фильтрат упаривали в вакууме. Этот продукт адсорбировали на силикагеле и подвергали хроматографии, используя 10-25% EtOAc/DCM. Фракции, содержащие соединение, объединяли и упаривали в вакууме с получением 0,51 г указанного в заголовке соединения в виде твердого продукта желтого цвета. MS (ESI-) для C18H14FNO4S m/z 358,0 (M-H)-.
Стадия 4: Получение 5-{4-[2-(2-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона
В перемешиваемую смесь 5-{4-[2-(2-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона (0,52 г, 1,40 ммоль) в ТГФ/H2O (1:1, 16 мл) добавляли 1M NaOH (2 мл), гексагидрат хлорида кобальта(II) (0,2 мг, 0,0009 ммоль), 2,2'-бипиридин (50,8 мг, 0,33 ммоль) и, наконец, тетрагидроборат натрия (0,11 г, 2,90 ммоль). Реакционная смесь приобретала темно-синий/лиловый цвет. Спустя короткое время, темный цвет становился бледнее, и по каплям добавляли HOAc для восстановления более темного цвета. Когда цвет бледнел, и добавление HOAc не помогало его восстановить, для восстановления более темного цвета добавляли NaBH4. Добавляли по каплям небольшие порции NaBH4 и HOAc до сохранения темно-синего цвета. После повторения этой операции несколько раз ВЭЖХ показывала, что реакция завершалась, несмотря на то, что синий цвет раствора сменился на светло-коричневый. Реакционную смесь распределяли между водой и EtOAc. Органическую фазу промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло светло-коричневого цвета подвергали хроматографии, элюируя с помощью смеси 35% EtOAc/гексан. Фракции, содержащие соединение, объединяли и упаривали в вакууме с получением 0,32 г указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI-) для C18H16FNO4S m/z 360,1 (M-H)-.
Стадия 5: Получение 5-{4-[2-(2-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-{4-[2-(2-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона (0,29 г, 0,80 ммоль) в DCM (15 мл) добавляли ДМСО (0,5 мл) и раствор охлаждали до температуры 0°C. Добавляли пентоксид фосфора (0,23 г, 0,80 ммоль), затем триэтиламин (0,50 мл, 3,6 ммоль). Реакционной смеси давали медленно нагреться до комнатной температуры. Спустя 3 часа добавляли воду и фазы разделяли. pH водной фазы устанавливали равным приблизительно 7, и водную фазу экстрагировали DCM. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное твердое вещество белого цвета подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,19 г (66%) указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI-) для C18H14FNO4S m/z 358,0 (M-H)-.
Пример 4: Получение 5-{4-[2-(3-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
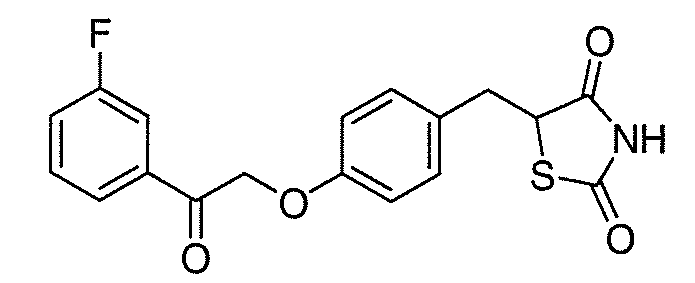
Стадия 1: Получение 2-(3-фторфенил)оксирана
К раствору м-фторстирола (5,00 г, 41,0 ммоль) и уксусной кислоты (2,33 мл, 40,9 ммоль) в диоксане (33 мл) и H2O (78 мл) при температуре 0°C тремя порциями добавляли N-бромсукцинимид (8,02 г, 45,0 ммоль). Реакционной смеси давали нагреться до комнатной температуры. Спустя 4 часа добавляли 2н NaOH (60 мл), и реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь распределяли между водой и EtOAc, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме с получением 6,30 г указанного в заголовке соединения в виде слегка слабоокрашенного масла, которое использовали без дополнительной очистки.
Стадия 2: Получение 4-[2-(3-фторфенил)-2-гидроксиэтокси]бензальдегида
К перемешиваемому раствору 2-(3-фторфенил)оксирана (5,60 г, 40,5 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (7,40 г, 61,0 ммоль), 1M NaOH (65 мл) и ПЭГ4000 (полиэтиленгликоль, 0,85 г), и перемешиваемую смесь нагревали при температуре 78°C в течение ночи. Реакционной смеси давали остыть до комнатной температуры и затем экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло светло-коричневого цвета подвергали хроматографии, элюируя с помощью смеси 30-40% EtOAc/гексан с получением 2-х главных пятен. Фракции, содержащие пятно с более высоким Rf, объединяли и упаривали в вакууме с получением 1,78 г (17%) указанного в заголовке соединения в виде твердого вещества белого цвета. Фракции, содержащие пятно с более низким Rf, объединяли и упаривали в вакууме с получением 0,90 г (9%) геометрического изомера в виде почти бесцветного масла.
Стадия 3: Получение 5-{4-[2-(3-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору альдегида (2,36 г, 10,8 ммоль) в абсолютном EtOH (40 мл) добавляли 2,4-тиазолидиндион (0,90 г, 7,69 ммоль) и пиперидин (0,76 мл, 7,7 ммоль), и полученный раствор нагревали до кипения. Спустя 6 часов реакционной смеси давали остыть до комнатной температуры. Смесь упаривали в вакууме, и остаток растворяли в EtOAc. Этот раствор промывали разбавленным водным раствором HOAc, насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное вещество желтого цвета растворяли в MeOH/DCM, абсорбировали на силикагеле и подвергали хроматографии, элюируя с помощью смеси 30% EtOAc/DCM. Фракции, содержащие соединение, объединяли и упаривали в вакууме с получением 2,17 г (86%) указанного в заголовке соединения в виде твердого продукта желтого цвета. MS (ESI-) для C18H14FNO4S m/z 358,1 (M-H)-.
Стадия 4: Получение 5-{4-[2-(3-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона
5-{4-[2-(3-Фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-дион (1,00 г, 2,78 ммоль) суспендировали в ТГФ (15 мл) и H2O (10 мл). К этому раствору добавляли небольшой кристалл хлорида кобальта, затем 2,2'-бипиридин (98 мг, 0,63 ммоль). По частям добавляли NaBH4 до сохранения синего цвета. Цвет постепенно исчезал, и его несколько раз восстанавливали путем добавления небольших порций боргидрида и HOAc. Когда ВЭЖХ анализ показывал, что реакция завершилась, реакционную смесь распределяли между EtOAc и H2O. Добавляли HOAc до pH водной фазы приблизительно 6. Водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 20% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,72 г (72%) указанного в заголовке соединения в виде твердого вещества белого цвета. Этот продукт вновь подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 10-20% EtOAc/DCM. MS (ESI-) для C18H16FNO4S m/z 360,1 (M-H)-.
Стадия 5: Получение 5-{4-[2-(3-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-{4-[2-(3-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона (0,62 г, 1,70 ммоль) в DCM (15 мл) добавляли ДМСО (0,5 мл), и раствор охлаждали до температуры 0°C. Добавляли пентоксид фосфора (0,49 г, 1,72 ммоль), затем триэтиламин (1,1 мл, 7,72 ммоль). Реакционной смеси давали медленно нагреться до комнатной температуры. Спустя 2 часа ВЭЖХ показывал, что реакция завершилась. Добавляли воду и фазы разделяли. pH водной фазы устанавливали равным приблизительно 7 с помощью 2M NaOH, и водную фазу затем экстрагировали EtOAc. Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное твердое вещество белого цвета подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,25 г (40%) указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI-) для C18H14FNO4S m/z 358,0 (M-H)-.
Пример 5: Получение 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона (соединение B)
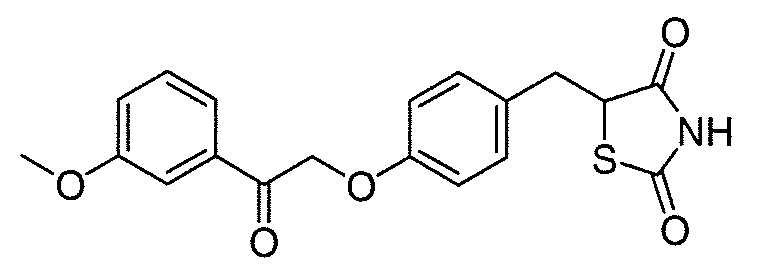
Стадия 1: 2-(3-метоксифенил)оксиран
К раствору 3-виниланизола (5,0 г, 37,0 ммоль) и уксусной кислоты (2,1 мл, 37,0 ммоль) в диоксане (33 мл) и H2O (78 мл) при температуре 0°C тремя порциями добавляли N-бромсукцинимид (7,30 г, 41,0 ммоль). Реакционной смеси давали нагреться до комнатной температуры и затем добавляли 2M NaOH (50 мл). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь затем распределяли между водой и EtOAc, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме с получением 5,60 г (100%) указанного в заголовке соединения в виде слегка слабоокрашенного масла.
Стадия 2: 4-[2-гидрокси-2-(3-метоксифенил)этокси]бензальдегид
К перемешиваемому раствору 2-(3-метоксифенил)оксирана (5,60 г, 37,0 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (6,80 г, 5,60 ммоль), 1M NaOH (65 мл) и ПЭГ4000 (полиэтиленгликоль, 0,85 г), и перемешиваемую смесь нагревали при температуре 78°C в течение ночи. Реакционной смеси давали остыть до комнатной температуры и экстрагировали EtOAc (2 × 150 мл). Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло светло-коричневого цвета подвергали хроматографии, элюируя с помощью смеси 30-40% EtOAc/гексан. Фракции, содержащие пятно с более высоким Rf, объединяли и упаривали в вакууме с получением 1,86 г (18%) указанного в заголовке соединения в виде прозрачного бесцветного масла. Фракции, содержащие пятно с более низким Rf, объединяли и упаривали в вакууме с получением 0,90 г (9%) геометрического изомера в виде почти бесцветного масла.
Стадия 3: 5-{4-[2-гидрокси-2-(3-метоксифенил)этокси]бензилиден}-1,3-тиазолидин-2,4-дион
К перемешиваемому раствору 4-[2-гидрокси-2-(3-метоксифенил)этокси]бензальдегида (1,76 г, 6,46 ммоль) в абсолютном EtOH (50 мл) добавляли 2,4-тиазолидиндион (0,83 г, 7,11 ммоль) и пиперидин (0,70 мл, 7,11 ммоль), и полученный раствор нагревали до кипения. Реакционную смесь кипятили с обратным холодильником в течение ночи и затем упаривали в вакууме. Остаток растворяли в EtOAc, и этот раствор промывали водой (pH устанавливали равным приблизительно 5-6 с помощью HOAc), насыщенным солевым раствором, сушили (Na2SO4), фильтровали и абсорбировали на силикагеле. После хроматографии с помощью 20-30% EtOAc/DCM, фракции, содержащие соединение, объединяли и упаривали в вакууме с получением 1,38 г (58%) указанного в заголовке соединения в виде твердого продукта желтого цвета. MS (ESI-) для C19H17NO5S m/z 370,1 (M-H)-.
Стадия 4: 5-{4-[2-гидрокси-2-(3-метоксифенил)этокси]бензил}-1,3-тиазолидин-2,4-дион
5-{4-[2-Гидрокси-2-(3-метоксифенил)этокси]бензилиден}-1,3-тиазолидин-2,4-дион (1,15 г, 3,10 ммоль) растворяли в ТГФ (15 мл). Добавляли H2O (15 мл) и достаточное количество ТГФ с получением прозрачного раствора. Добавляли небольшой кристалл хлорида кобальта, затем 2,2'-бипиридин (109 мг, 0,70 ммоль). По частям добавляли NaBH4 до сохранения синего цвета. Цвет постепенно исчезал, но его несколько раз восстанавливали путем добавления небольших порций боргидрида и HOAc. Когда ВЭЖХ анализ показывал, что реакция завершилась, реакционную смесь распределяли между EtOAc и H2O. Добавляли HOAc до установления pH водной фазы равным приблизительно 6, и затем водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 20% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,82 г (74%) указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI-) для C19H19NO5S m/z 372,0 (M-H)-.
Стадия 5: Получение 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-{4-[2-гидрокси-2-(3-метоксифенил)этокси]бензил}-1,3-тиазолидин-2,4-диона (0,62 г, 1,7 ммоль) в DCM (15 мл) добавляли ДМСО (0,5 мл), и раствор охлаждали до температуры 0°C. Добавляли пентоксид фосфора (0,52 г, 1,8 ммоль), затем триэтиламин (1,2 мл, 8,3 ммоль). Реакционной смеси давали медленно нагреться до комнатной температуры. Спустя 2 часа добавляли воду и фазы разделяли. pH водной фазы устанавливали равным приблизительно 7 с помощью 2M NaOH. Водную фазу экстрагировали EtOAc. Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное твердое вещество белого цвета подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,33 г (54%) указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI+) для C19H17NO5S m/z 372,0 (M+H)+. MS (ESI-) для C19H17NO5S m/z 370,1 (M-H)-.
Пример 6: Получение 5-{4-[2-(2-метоксифенил) -2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
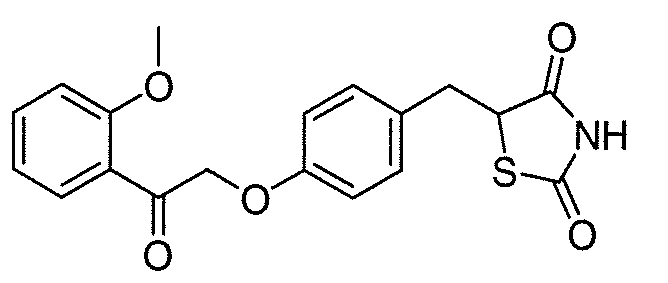
Стадия 1: Получение 2-(2-метоксифенил)оксирана
К раствору 2-виниланизола (5,0 г, 0,037 моль) и уксусной кислоты (2,1 мл, 37 ммоль) в диоксане (33 мл) и H2O (78 мл) при температуре 0°C тремя порциями добавляли N-бромсукцинимид (7,30 г, 40,1 ммоль). Реакционной смеси давали нагреться до комнатной температуры и спустя 1 час добавляли 2M NaOH (50 мл). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь распределяли между водой и EtOAc, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме с получением 7,56 г слегка окрашенного масла. Масло растворяли в диоксане, добавляли 2н NaOH, и реакционную смесь перемешивали при комнатной температуре в течение ночи. Повторная обработка водой давала 5,60 г указанного в заголовке соединения в виде почти бесцветного масла.
Стадия 2: Получение 4-[2-гидрокси-2-(2-метоксифенил)этокси]бензальдегида
К перемешиваемому раствору 2-(2-метоксифенил)оксирана (5,60 г, 37,3 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (6,80 г, 56,0 ммоль), 1M NaOH (65 мл) и ПЭГ4000 (полиэтиленгликоль, 0,85 г), и перемешиваемую смесь нагревали при температуре 78°C в течение ночи. Реакционной смеси давали охладиться до комнатной температуры и затем экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное светлое масло адсорбировали на силикагеле и подвергали хроматографии, элюируя с помощью смеси 30-40% EtOAc/гексан с получением 2 основных пятен. Фракции, содержащие пятно с более высоким Rf, объединяли и упаривали в вакууме с получением 1,71 г (17%) геометрического изомера в виде масла коричневого цвета. Фракции, содержащие пятно с более низким Rf, объединяли и упаривали в вакууме с получением 2,05 г (20%) указанного в заголовке соединения в виде твердого продукта желтого цвета.
Стадия 3: Получение (5Z)-5-{4-[2-гидрокси-2-(2-метоксифенил)этокси]бензилиден}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 4-[2-гидрокси-2-(2-метоксифенил)этокси]бензальдегида (1,71 г, 6,28 ммоль) в абсолютном EtOH (50 мл) добавляли 2,4-тиазолидиндион (0,81 г, 6,91 ммоль) и пиперидин (0,68 мл, 6,9 ммоль), и полученный раствор нагревали до кипения. Реакционную смесь кипятили с обратным холодильником в течение ночи и затем упаривали в вакууме. Остаток растворяли в EtOAc, и этот раствор промывали водной HOAc (pH 5-6), насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток адсорбировали на силикагеле и подвергали хроматографии на силикагеле, элюируя с помощью смеси 20-40% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 1,87 г (80%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета. MS (ESI-) для C19H17NO5S m/z 370,1 (M-H)-.
Стадия 4: 5-{4-[2-Гидрокси-2-(2-метоксифенил)этокси]бензил} -1,3-тиазолидин-2,4-дион
(5Z)-5-{4-[2-Гидрокси-2-(2-метоксифенил)этокси]бензилиден}-1,3-тиазолидин-2,4-дион (1,00 г, 2,69 ммоль) растворяли в ТГФ (20 мл). Добавляли воду (20 мл) и затем дополнительно добавляли достаточное количество ТГФ с получением прозрачного раствора. Добавляли небольшой кристалл хлорида кобальта, затем 2,2'-бипиридин (95 мг, 0,61 ммоль). Реакционную смесь охлаждали до температуры 0°C. По частям добавляли NaBH4 до сохранения синего цвета. Цвет постепенно исчезал, и его несколько раз восстанавливали путем добавления небольших порций боргидрида и HOAc. Когда ВЭЖХ анализ показывал, что реакция завершилась, реакционную смесь распределяли между EtOAc и H2O. Добавляли HOAc до установления pH водной фазы равным приблизительно 6, и затем водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 20% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,63 г (63%) указанного в заголовке соединения в виде твердого вещества белого цвета. MS (ESI-) для C19H19NO5S m/z 372,1 (M-H)-.
Стадия 5: Получение 5-{4-[2-(2-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору пентоксида фосфора (0,30 г, 1,10 ммоль) в DCM (8 мл) при температуре 0°C добавляли раствор 5-{4-[2-гидрокси-2-(2-метоксифенил)этокси]бензил}-1,3-тиазолидин-2,4-диона (0,20 г, 0,54 ммоль) в DCM (8 мл), затем диметилсульфоксид (0,20 мл, 2,80 ммоль). После перемешивания в течение 15 минут добавляли N,N-диизопропилэтиламин (0,28 мл, 1,60 ммоль). Спустя 45 минут реакционную смесь выливали в холодный насыщенный раствор NaHCO3 и экстрагировали EtOAc (×2). Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 0-10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 175 мг (88%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета. MS (ESI-) для C19H17NO5S m/z 370,1 (M-H)-.
Пример 7: Получение 5-{4-[2-(3-хлорфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
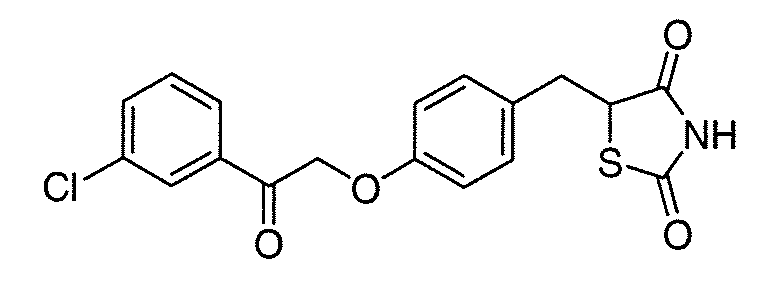
Стадия 1: 2-(3-хлорфенил)оксиран
К раствору м-хлорстирола (5,70 г, 41,0 ммоль) и уксусной кислоты (2,33 мл, 40,9 ммоль) в диоксане (33 мл) и H2O (78 мл) при температуре 0°C тремя порциями добавляли N-бромсукцинимид (8,02 г, 45,0 ммоль). Реакционной смеси давали нагреться до комнатной температуры. Спустя 4 часа добавляли 2н NaOH (60 мл), и реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь распределяли между водой и EtOAc, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме с получением 6,20 г слегка окрашенного масла, которое использовали без дополнительной очистки.
Стадия 2: 4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензальдегид
К перемешиваемому раствору 2-(3-хлорфенил)оксирана (6,20 г, 40,0 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (7,30 г, 60,0 ммоль), 1M NaOH (65 мл) и ПЭГ4000 (полиэтиленгликоль, 0,85 г) и перемешиваемую смесь нагревали при температуре 78°C в течение трех часов. Реакционной смеси давали охладиться до комнатной температуры и затем экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное масло светло-коричневого цвета адсорбировали на силикагеле и подвергали хроматографии, элюируя с помощью смеси 25-40% EtOAc/гексан. Было 2 основных пятна. Фракции, содержащие пятно с более высоким Rf, объединяли и упаривали в вакууме с получением 1,08 г (10%) желаемого продукта в виде бесцветного масла. Фракции, содержащие пятно с более низким Rf, объединяли и упаривали в вакууме с получением 0,95 г (8%) геометрического изомера в виде бесцветного масла, 44B. Также выделяли немного исходного эпоксида (2,85 г).
Стадия 3: 5-{4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-дион
К перемешиваемому раствору 4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензальдегида (1,08 г, 3,90 ммоль) в абсолютном EtOH (50 мл) добавляли 2,4-тиазолидиндион (0,50 г, 4,29 ммоль) и пиперидин (0,42 мл, 4,3 ммоль), и полученный раствор нагревали до кипения и затем перемешивали в течение ночи при комнатной температуре. Реакционную смесь упаривали в вакууме, и остаток растворяли в EtOAc. Этот раствор промывали водной HOAc (pH 5-6), насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток адсорбировали на силикагеле и подвергали хроматографии, элюируя с помощью смеси 10-20% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 1,31 г (89%) продукта в виде твердого вещества светло-желтого цвета. MS (ESI+) для C18H14ClNO4S m/z 375,0 (M+H)+. MS (ESI-) для C18H14ClNO4S m/z 374,1 (M-H)-.
Стадия 4: 5-{4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-дион
5-{4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-дион (0,74 г, 2,00 ммоль) растворяли в ТГФ (20 мл). Добавляли воду (20 мл) и затем добавляли еще ТГФ до полного растворения твердых продуктов. Добавляли небольшой кристалл хлорида кобальта, затем 2,2'-бипиридин (69 мг, 0,44 ммоль). Реакционную смесь охлаждали до температуры 0°C. По частям добавляли NaBH4 до сохранения синего цвета. Цвет постепенно исчезал, и его несколько раз восстанавливали путем добавления небольших порций боргидрида и HOAc. Когда ВЭЖХ анализ показывал, что реакция завершалась, реакционную смесь распределяли между EtOAc и H2O. Добавляли HOAc до установления pH водной фазы равным приблизительно 6, и затем водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 0-10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 0,44 г (59%) липкого вещества желтого цвета. MS (ESI-) для C18H16ClNO4S m/z 376,1 (M-H)-.
Стадия 5: Получение 5-{4-[2-(3-хлорфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона.
К перемешиваемому раствору пентоксида фосфора (0,38 г, 1,30 ммоль) в DCM (8 мл) при температуре 0°C добавляли раствор 5-{4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона (0,25 г, 0,66 ммоль) в DCM (8 мл), затем диметилсульфоксид (0,23 мл, 3,30 мл). После перемешивания в течение 15 минут добавляли N,N-диизопропилэтиламин (0,34 мл, 2,00 ммоль). Спустя 45 минут реакционную смесь выливали в холодный насыщенный раствор NaHCO3 и смесь экстрагировали EtOAc (×2). Объединенные экстракты промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток подвергали хроматографии на небольшой колонке с силикагелем, элюируя с помощью смеси 0-15% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме с получением 117 мг (47%) твердого вещества белого цвета. MS (ESI-) для C18H14ClNO4S m/z 374,1 (M-H)-.
Пример 8: Получение 5-{4-[2-(2-хлорфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
Указанное в заголовке соединение может быть получено, как описано в примере 7, используя подходящие исходные продукты, такие как 2-(2-хлорфенил)оксиран.
Пример 9: Получение 5-{4-[2-(4-метоксифенил) -2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
Указанное в заголовке соединение получали, как описано в примерах 5 и 6, используя подходящие исходные продукты, такие как 2-(4-метоксифенил)оксиран. MS (ESI-) для C19H17NO5S 370,2 m/z (M-1).
Пример 10: Физические данные представительных соединений
1H-ЯМР данные (400 МГц)
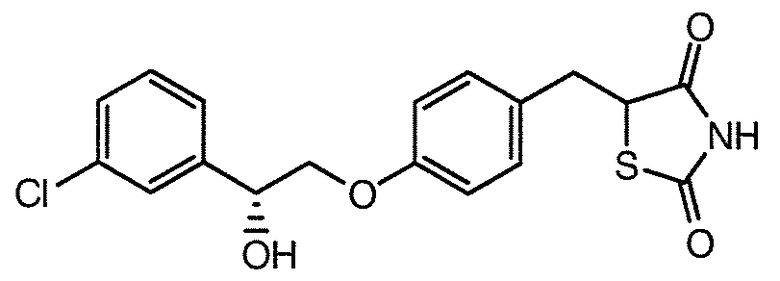
1H-ЯМР (ДМСО-d 6) δ: 12,00 (с, 1H), 7,50 (с, 1H), 7,42-7,32 (м, 3H), 7,13 (д, J=8,5 Гц, 2H), 6,87 (д, J=8,5 Гц, 2H), 5,77 (д, J=5,0 Гц, 1H), 4,92 (д, J=6,2 Гц, 1H), 4,86 (дд, J=8,9, 4,3 Гц, 1H), 4,00 (м, 2H), 3,29 (дд, J=14,3, 4,3 Гц, 1H), 3,05 (дд, J=14,2, 9,0 Гц, 1H).
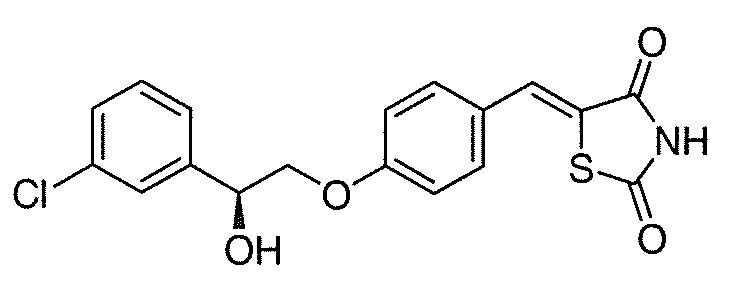
1H-ЯМР (ДМСО-d 6) δ: 12,52 (с, 1H), 7,75 (с, 1H), 7,54 (м, 3H), 7,44-7,33 (м, 3H), 7,11 (д, J=8,91 Гц, 2H), 5,84 (д, J=4,77 Гц, 1H), 4,97 (м, 1H), 4,12 (м, 2H).
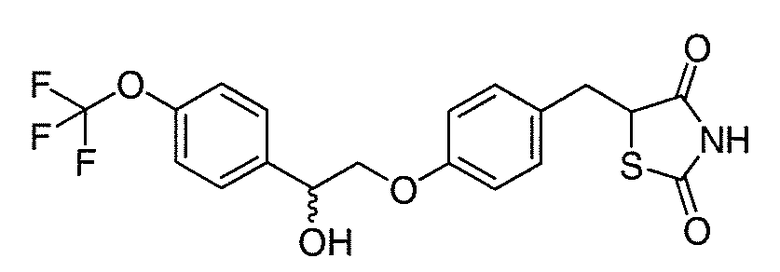
1H-ЯМР (CDCl3) δ: 8,32 (ушир.с, 1H), 7,50 (д, J=8,50 Гц, 2H), 7,26 (м, 2H), 7,17 (м, 2H), 6,88 (м, 2H), 5,15 (дд, J=8,71, 3,11 Гц, 1H), 4,51 (дд, J=9,23, 4,04 Гц, 1H), 4,09 (дд, J=9,64, 3,21 Гц, 1H), 3,45 (дд, J=14,1, 3,94 Гц, 1H), 3,13 (дд, J=14,2, 9,23 Гц, 1H), 2,87 (ушир.с, 1H).
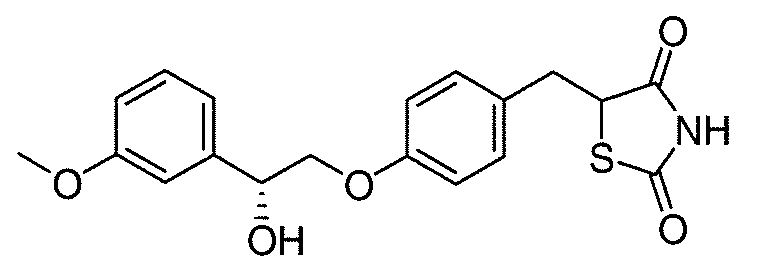
1H-ЯМР (CDCl3) δ: 8,35 (ушир.с, 1H), 7,23 (т, J=8,09, 1H), 7,07 (д, J=8,71 Гц, 2H), 6,94 (м, 2H), 6,81 (м, 3H), 5,03 (дд, J=8,60, 2,80 Гц, 1H), 4,42 (дд, J=9,33, 3,94 Гц, 1H), 4,02 (м, 1H), 3,93 (т, J=9,23 Гц, 1H), 3,76 (с, 3H), 3,36 (дд, J=14,20, 3,84 Гц, 1H), 3,04 (дд, J=14,10, 9,33 Гц, 1H), 2,75 (ушир.с, 1H).
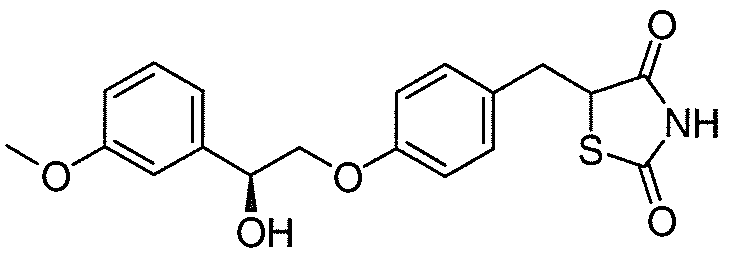
1H-ЯМР (CDCl3) δ: 8,42 (ушир.с, 1H), 7,23 (т, J=7,98 Гц, 1H), 7,07 (д, J=8,71 Гц, 2H), 6,94 (м, 2H), 6,82-6,78 (м, 3H), 5,03 (дд, J=8,71, 2,90 Гц, 1H), 4,41 (дд, J=9,33, 3,94 Гц, 1H), 4,02 (м, 1H), 3,93 (т, J=9,12 Гц, 1H), 3,76 (с, 3H), 3,36 (дд, J=14,10, 3,94 Гц, 1H), 3,03 (дд, J=14,31, 9,33 Гц, 1H), 2,77 (ушир.с, 1H).
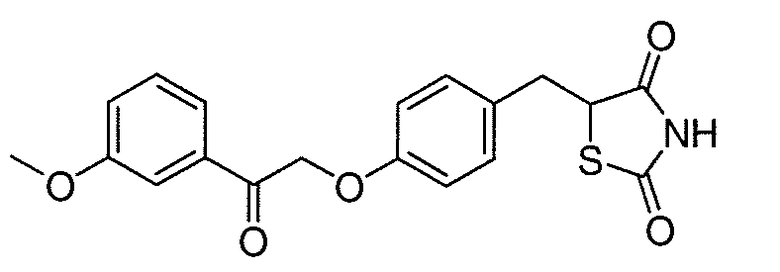
1H-ЯМР (ДМСО-d 6) δ: 12,03 (ушир.с, 1H), 7,62 (д, J=7,67 Гц, 1H), 7,49 (м, 2H), 7,27 (дд, J=8,19, 2,38 Гц, 1H), 7,16 (д, J=8,50 Гц, 2H), 6,91 (д, J=8,50 Гц, 2H), 5,55 (с, 2H), 4,88 (дд, J=9,12, 4,35 Гц, 1H), 3,84 (с, 3H), 3,33-3,29 (м, 1H), 3,05 (дд, J=14,31, 9,12 Гц, 1H).
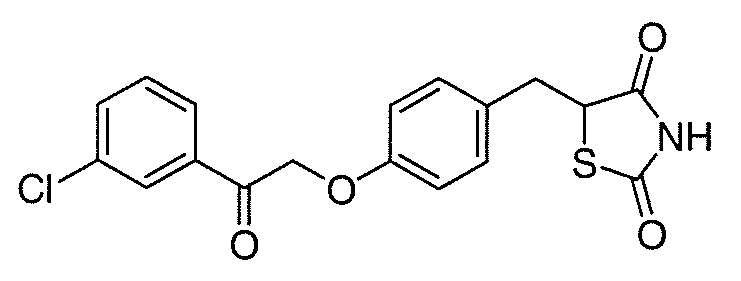
1H-ЯМР (ДМСО-d 6) δ: 12,02 (ушир.с, 1H), 8,05 (т, J=1,66 Гц, 1H), 7,96 (д, J=7,88 Гц, 1H), 7,77 (м, 1H), 7,61 (т, J=7,88 Гц, 1H), 7,16 (д, J=8,71 Гц, 2H), 6,93 (д, J=8,71 Гц, 2H), 5,57 (с, 2H), 4,88 (дд, J=9,12, 4,35 Гц, 1H), 3,31 (м, 1H), 3,06 (дд, J=14,20, 9,23 Гц, 1H).
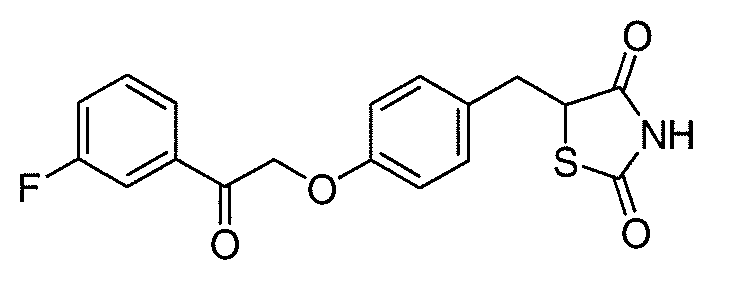
1H-ЯМР (ДМСО-d 6) δ: 12,02 (ушир.с, 1H), 7,83 (м, 2H), 7,59 (м, 2H), 7,16 (д, J=8,71 Гц, 2H), 6,93 (д, J=8,71, 2H), 5,56 (с, 2H), 4,88 (дд, J=9,12, 4,35 Гц, 1H), 3,33-3,29 (м, 1H), 3,06 (дд, J=14,10, 9,12 Гц, 1H).
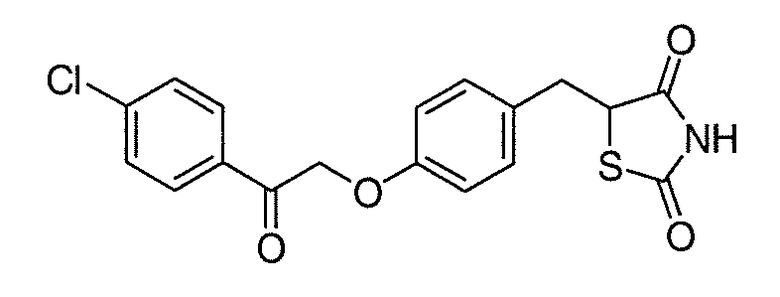
1H-ЯМР (ДМСО-d 6) δ: 12,02 (с, 1H), 8,03 (д, J=8,71 Гц, 2H), 7,65 (д, J=8,50 Гц, 2H), 7,15 (д, J=8,50 Гц, 2H), 6,92 (д, J=8,71 Гц, 2H), 5,54 (с, 2H), 4,88 (дд, J=9,12, 4,35 Гц, 1H), 3,33-3,29 (м, 1H), 3,05 (дд, J=14,10, 9,12 Гц, 1H).
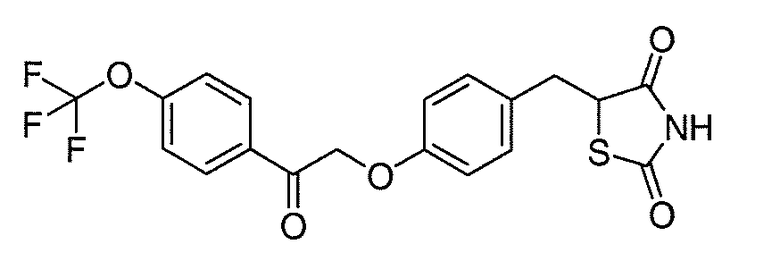
1H-ЯМР (CDCl3) δ: 8,08 (м, 3H), 7,34 (д, J=8,09 Гц, 2H), 7,17 (д, J=8,71 Гц, 2H), 6,90 (д, J=8,71 Гц, 2H), 5,23 (с, 2H), 4,51 (дд, J=9,43, 3,84 Гц, 1H), 3,46 (дд, J=14,10, 3,94 Гц, 1H), 3,13 (дд, 14,20, 9,43 Гц, 1H), 1,60 (ушир.с, 1H).
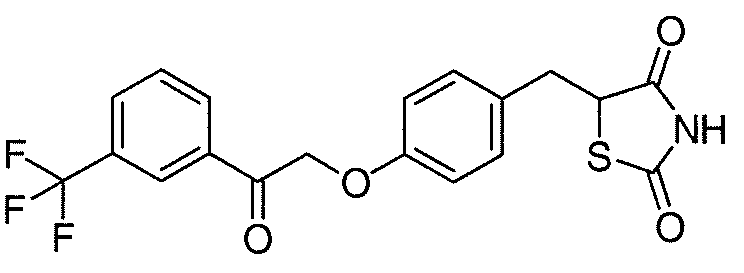
1H-ЯМР (ДМСО-d 6) δ: 12,20 (с, 1H), 8,30 (м, 2H), 8,07 (д, J=7,88 Гц, 1H), 7,82 (т, J=7,88 Гц, 1H), 7,16 (д, J=8,71 Гц, 2H), 6,95 (д, J=8,71 Гц, 2H), 5,64 (с, 2H), 4,88 (дд, J=9,33, 4,35 Гц, 1H), 3,34-3,29 (м, 1H), 3,06 (дд, J=14,10, 9,12 Гц, 1H).
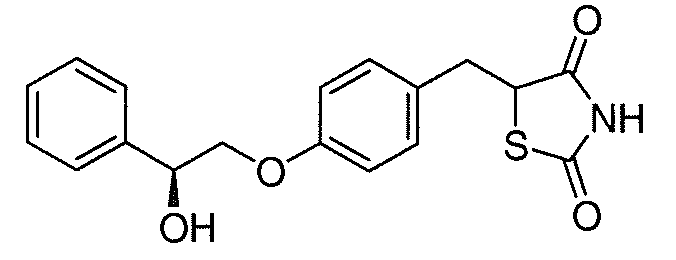
1H-ЯМР (CDCl3) δ: 8,42 (ушир.с, 1H), 7,38 (м, 5H), 7,15 (д, J=8,50 Гц, 2H), 6,88 (д, J=8,50 Гц, 2H), 5,14 (дд, J=8,81, 3,01 Гц, 1H), 4,50 (дд, J=9,33, 3,94 Гц, 1H), 4,11 (м, 1H), 4,01 (т, J=9,23 Гц, 1H), 3,45 (дд, J=14,20, 3,84 Гц, 1H), 3,12 (дд, J=14,20, 9,43 Гц, 1H), 2,84 (ушир.с, 1H).
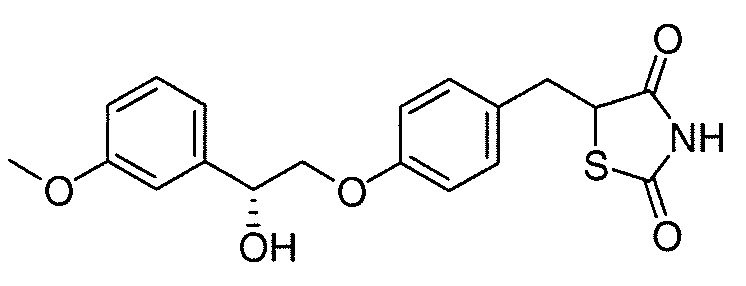
1H-ЯМР (CDCl3) δ: 8,35 (ушир.с, 1H), 7,23 (т, J=8,09, 1H), 7,07 (д, J=8,71 Гц, 2H), 6,94 (м, 2H), 6,81 (м, 3H), 5,03 (дд, J=8,60, 2,80 Гц, 1H), 4,42 (дд, J=9,33, 3,94 Гц, 1H), 4,02 (м, 1H), 3,93 (т, J=9,23 Гц, 1H), 3,76 (с, 3H), 3,36 (дд, J=14,20, 3,84 Гц, 1H), 3,04 (дд, J=14,10, 9,33 Гц, 1H), 2,75 (ушир.с, 1H).
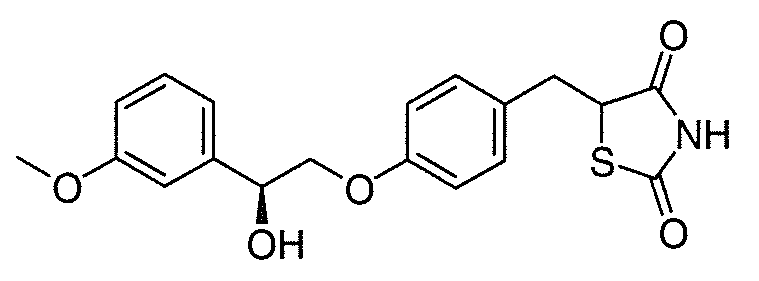
1H-ЯМР (CDCl3) δ: 8,42 (ушир.с, 1H), 7,23 (т, J=7,98 Гц, 1H), 7,07 (д, J=8,71 Гц, 2H), 6,94 (м, 2H), 6,82-6,78 (м, 3H), 5,03 (дд, J=8,71, 2,90 Гц, 1H), 4,41 (дд, J=9,33, 3,94 Гц, 1H), 4,02 (м, 1H), 3,93 (т, J=9,12 Гц, 1H), 3,76 (с, 3H), 3,36 (дд, J=14,10, 3,94 Гц, 1H), 3,03 (дд, J=14,31, 9,33 Гц, 1H), 2,77 (ушир.с, 1H).
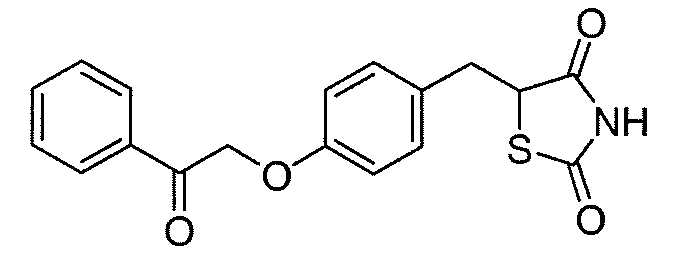
1H-ЯМР (ДМСО-d 6) δ: 12,03 (ушир.с, 1H), 8,02 (м, 2H), 7,69 (т, J=7,36 Гц, 1H), 7,57 (т, J=7,67 Гц, 2H), 7,15 (д, J=8,50 Гц, 2H), 6,91 (д, J=8,50 Гц, 2H), 5,56 (с, 2H), 4,88 (дд, J=9,23, 4,25 Гц, 1H), 3,31 (м, 2H), 3,05 (дд, J=14,02, 9,23 Гц, 1H).
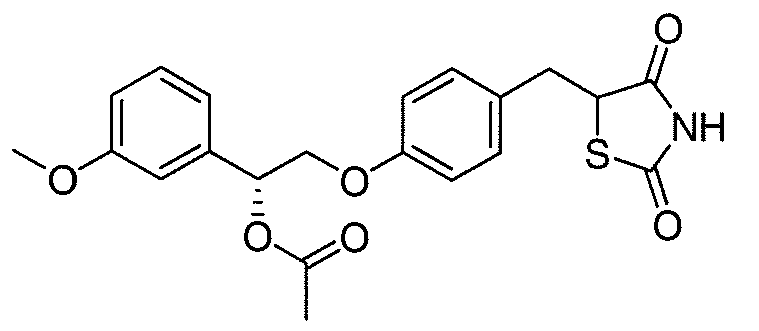
1H-ЯМР (CDCl3): δ=8,57 (ушир.с, 1H), 7,28 (м, 1H), 7,16 (м, 1H), 6,99 (м, 2H), 6,87 (м, 3H), 6,12 (дд, J=7,8, 3,6 Гц, 1H), 4,49 (дд, J=9,3, 3,9 Гц, 1H), 4,25 (м, 1H), 4,13 (дд, J=10,5, 3,6 Гц, 1H), 3,83 (с, 3H), 3,45 (дд, J=14,2, 3,8 Гц, 1H), 3,10 (дд, J=14,0, 9,6 Гц, 1H), 2,14 (с, 3H).
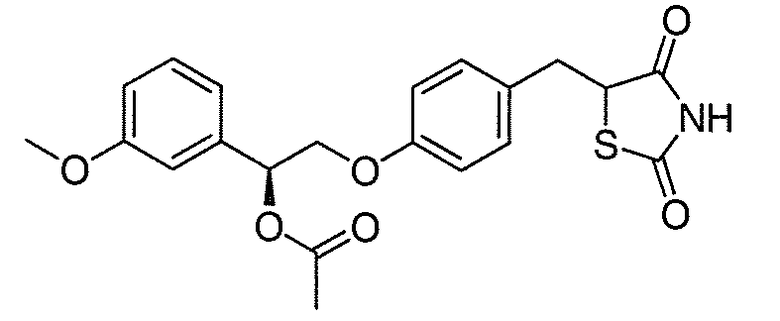
1H-ЯМР (CDCl3): δ=8,31 (ушир.с, 1H), 7,29 (м, 1H), 7,17 (м, 1H), 6,99 (м, 2H), 6,88 (м, 3H), 6,12 (дд, J=7,8, 3,4 Гц, 1H), 4,50 (дд, J=9,4, 3,8 Гц, 1H), 4,25 (м, 1H), 4,13 (дд, J=10,4, 3,7 Гц, 1H), 3,83 (с, 3H), 3,45 (дд, J=14,2, 3,8 Гц, 1H), 3,11 (дд, J=14,1, 9,3 Гц, 1H), 2,14 (с, 3H).
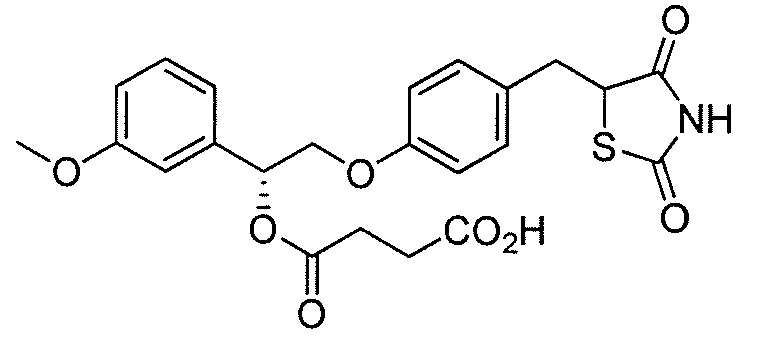
1H-ЯМР (CDCl3): δ=8,65 (м, 1H), 7,29 (м, 1H), 7,13 (м, 1H), 6,97 (м, 2H), 6,86 (м, 3H), 6,13 (м, 1H), 4,49 (дд, J=9,1, 3,9 Гц, 1H), 4,24 (м, 1H), 4,14 (м, 1H), 3,82 (с, 3H), 3,40 (м, 1H), 3,12 (дд, J=14,2, 9,0 Гц, 1H), 2,69 (м, 4H).
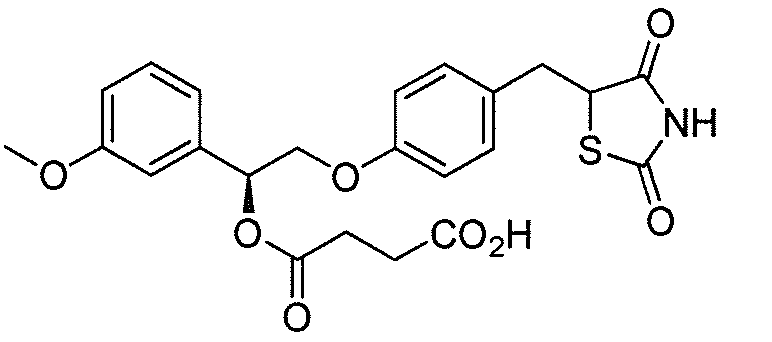
1H-ЯМР (CDCl3): δ=8,78 (ушир.с, 1H), 7,29 (м, 1H), 7,13 (м, 1H), 6,97 (м, 2H), 6,85 (м, 3H), 6,12 (м, 1H), 4,47 (дд, J=8,8, 3,8 Гц, 1H), 4,20 (м, 2H), 3,81 (с, 3H), 3,36 (м, 1H), 3,13 (м, 1H), 2,68 (м, 4H).
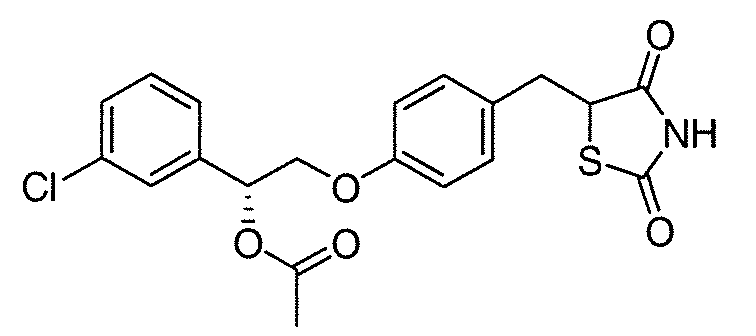
1H-ЯМР (CDCl3): δ=8,74 (ушир.с, 1H), 7,42 (с, 1H), 7,31 (м, 2H), 7,15 (д, J-8,7 Гц, 2H), 6,85 (д, J=8,7 Гц, 2H), 6,10( (дд, J=7,4, 4,0 Гц, 1H), 4,50 (дд, J=9,3, 3,9 Гц, 1H), 4,24 (м, 1H), 4,13 (дд, J=10,4, 4,2 Гц, 1H), 3,45 (дд, J=14,1, 3,7 Гц, 1H), 3,10 (дд, J=14,0, 9,4 Гц, 1H), 2,15 (с, 3H).
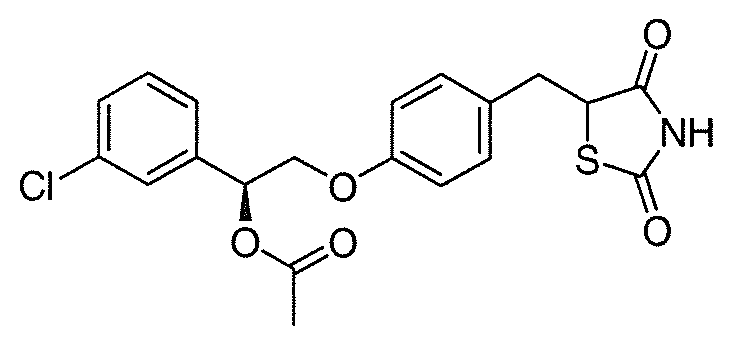
1H-ЯМР (CDCl3): δ=8,67 (ушир.с, 1H), 7,42 (с, 1H), 7,30 (м, 2H), 7,15 (д, J=7,2 Гц, 2H), 6,85 (д, J=8,5 Гц, 2H), 6,10 (дд, J=7,4, 4,0 Гц, 1H), 4,50 (дд, J=9,3, 3,9 Гц, 1H), 4,24 (м, 1H), 4,13 (дд, J=10,4, 4,2 Гц, 1H), 3,45 (дд, J=14,2, 3,8 Гц, 1H), 3,11 (дд, J=14,2, 9,4 Гц, 1H), 2,15 (с, 3H).
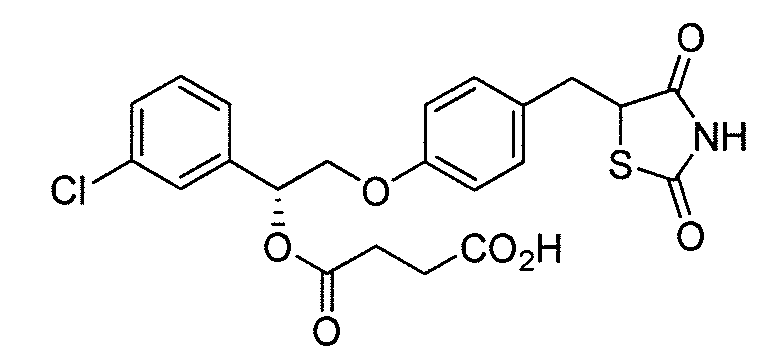
1H-ЯМР (CDCl3): δ=8,94, (д, J=4,8 Гц, 1H), 7,40 (с, 1H), 7,30 (м, 3H), 7,14 (д, J=8,5 Гц, 2H), 6,84 (д, J=8,5 Гц, 2H), 6,11 (м, 1H), 4,49 (дд, J=9,0, 3,8 Гц, 1H), 4,23 (м, 1H), 4,13 (м, 1H), 3,40 (дд, J=14,1, 3,5 Гц, 1H), 3,13 (дд, J=14,1, 9,1 Гц, 1H), 2,71 (м, 4H).
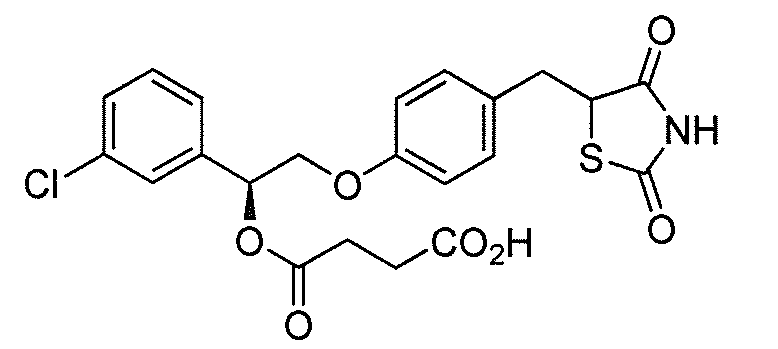
1H-ЯМР (CDCl3): δ=8,88 (д, J=6,4 Гц, 1H), 7,40 (с, 1H), 7,30 (м, 3H), 7,14 (д, J=8,5 Гц, 2H), 6,84 (д, J=7,7 Гц, 2H), 6,11 (м, 1H), 4,49 (дд, J=9,1, 3,9 Гц, 1H), 4,24 (м, 1H), 4,14 (м, 1H), 3,40 (дд, J=14,3, 3,7 Гц, 1H), 3,13 (дд, J=14,2, 9,0 Гц, 1H), 2,70 (м, 4H).
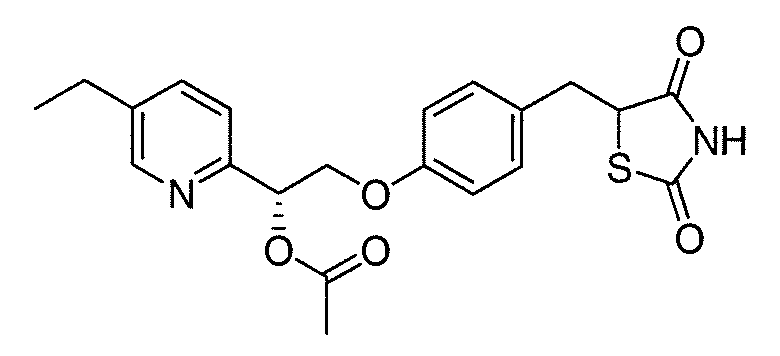
1H-ЯМР (CDCl3): δ=9,34 (ушир.с, 1H), 8,46 (с, 1H), 7,56 (дд, J=8,0, 2,0 Гц, 1H), 7,36 (д, J=8,0, 1H), 7,13 (д, J=7,1 Гц, 2H), 6,86 (дд, J=8,6, 1,8 Гц, 2H), 6,18 (дд, J=6,4, 4,1 Гц, 1H), 4,48 (м, 1H), 4,41 (м, 1H), 3,44 (м, 1H), 3,09 (м, 1H), 2,67(кв., J=7,6 Гц, 2H), 2,15 (с, 3H), 1,26 (т, J=7,6 Гц, 3H).
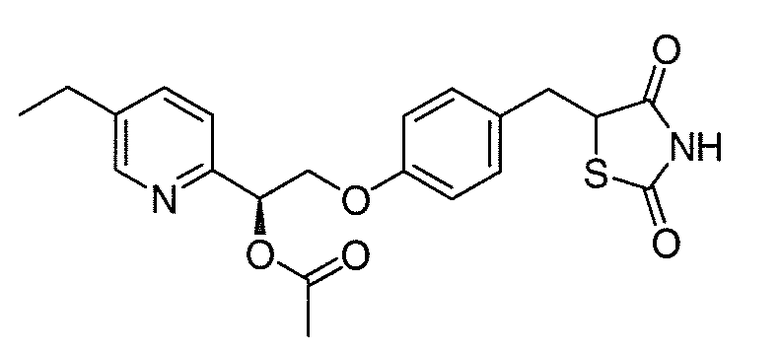
1H-ЯМР (CDCl3): δ=8,85 (ушир.с, 1H), 8,46 (д, J=1,7 Гц, 1H), 7,56 (дд, J=8,0, 2,0 Гц, 1H), 7,37 (д, J=8,1 Гц, 1H), 7,13 (д, J=8,7 Гц, 2H), 6,86 (д, J=7,1 Гц, 2H), 6,19 (дд, J=6,4, 4,2 Гц, 1H), 4,49 (дд, J=9,1, 3,5 Гц, 1H), 4,41 (м, 2H), 3,44 (м, 1H), 3,10 (м, 1H), 2,67 (кв., J=7,5 Гц, 2H), 2,16 (с, 3H), 1,26 (т, 3H).
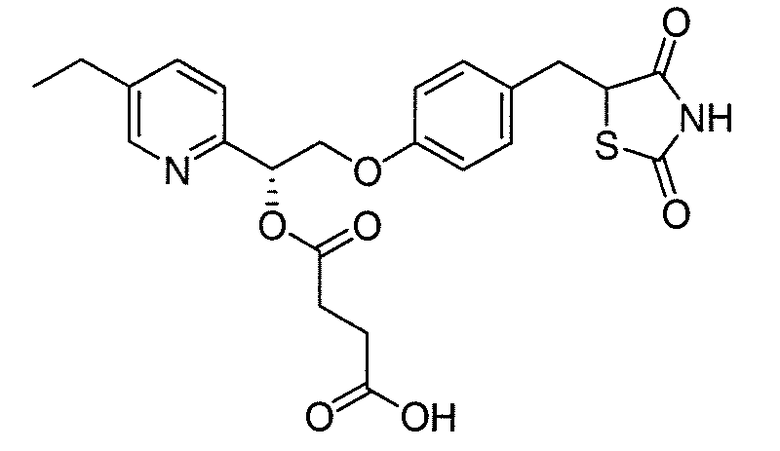
1H-ЯМР (CDCl3): δ=8,63 (ушир.с, 1H), 8,45 (с, 1H), 7,77 (т, J=7,6 Гц, 1H), 7,56 (дд, J=7,9, 1,9 Гц, 1H), 7,10 (д, J=8,3 Гц, 2H), 6,83 (д, J=8,5 Гц, 2H), 6,19 (т, J=5,1 Гц, 1H), 4,46 (дд, J=9,0, 3,8 Гц, 1H), 4,39 (м, 2H), 3,38 (дд, J=14,2, 3,8 Гц, 1H), 3,10 (дд, J=14,2, 9,2 Гц, 1H), 2,68 (м, 6H), 1,24 (т, J=7,6 Гц, 3H).
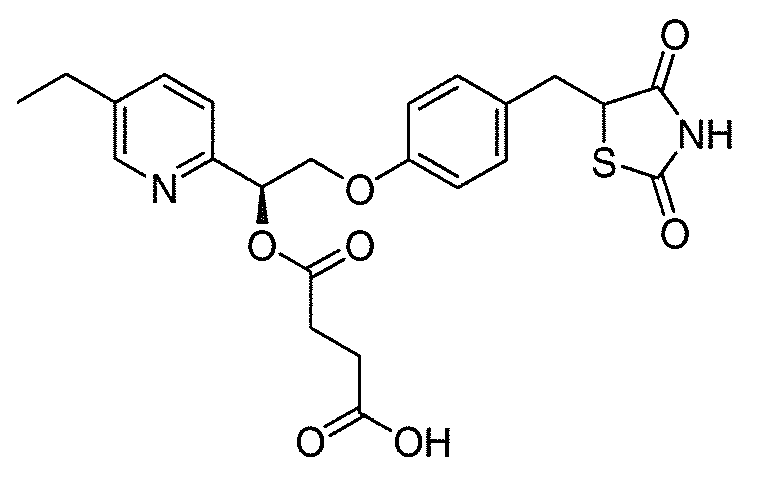
1H-ЯМР (CDCl3): δ=9,20 (ушир.с, 1H), 8,48 (с, 1H), 7,60 (д, J=1,7 Гц, 1H), 7,40 (д, J=8,1 Гц, 1H), 7,12 (дд, J=8,5, 1,7 Гц, 2H), 6,84 (дд, J=8,7, 2,7 Гц, 2H), 6,20 (м, 1H), 4,49 (дд, J=8,3, 4,2 Гц, 1H), 4,40 (м, 2H), 3,33 (м, 1H), 3,18 (м, 1H), 2,71 (м, 6H), 1,25 (т, J=7,6 Гц, 3H).
ES- 342,1 (M-1)
ES- 340,0 (M-1)
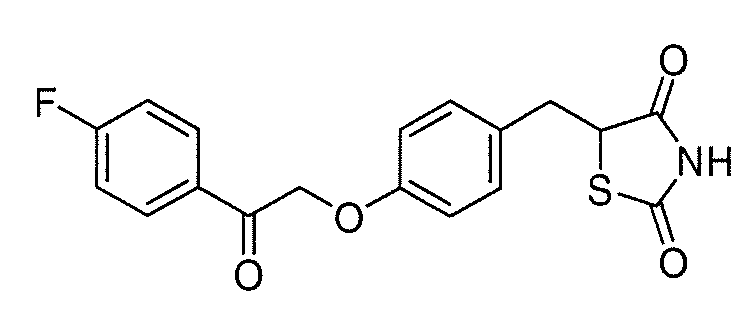
ES- 358,2 (M-1)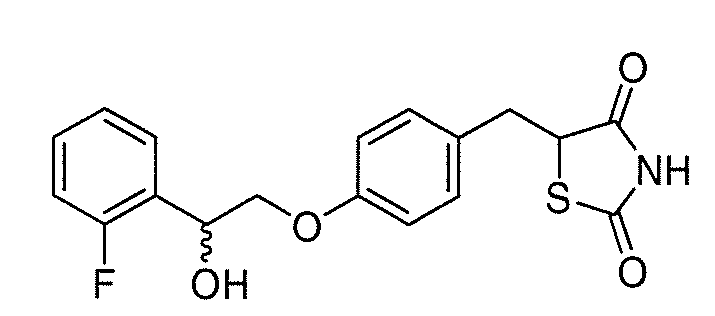
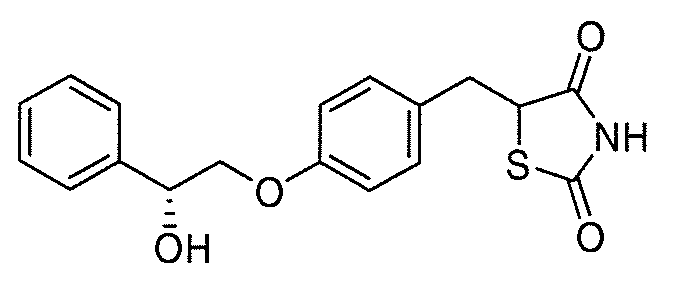
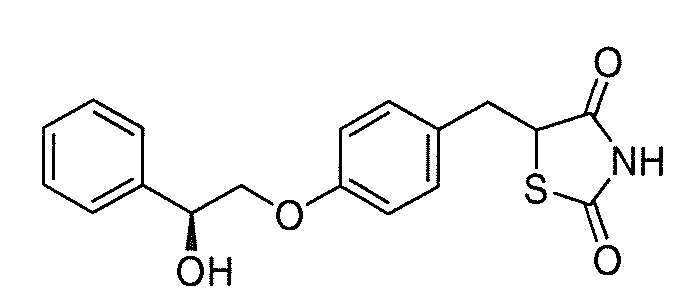
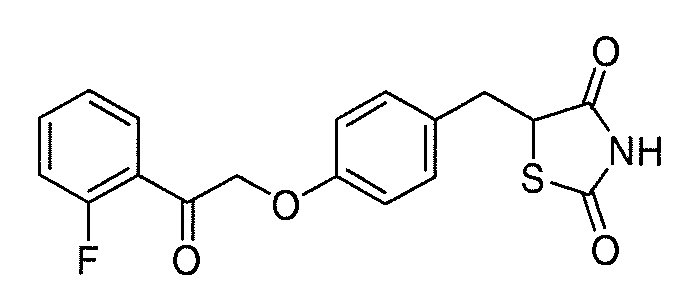
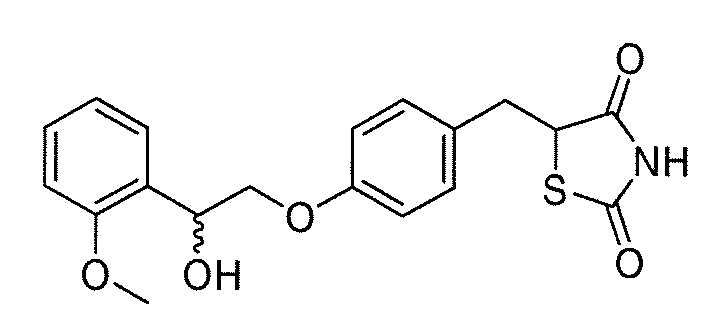
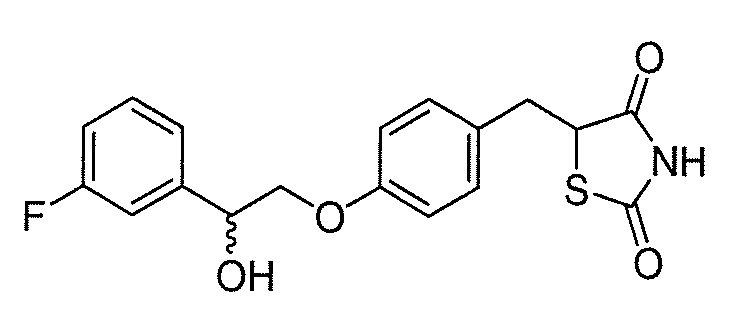
ES- 360,1 (M-1)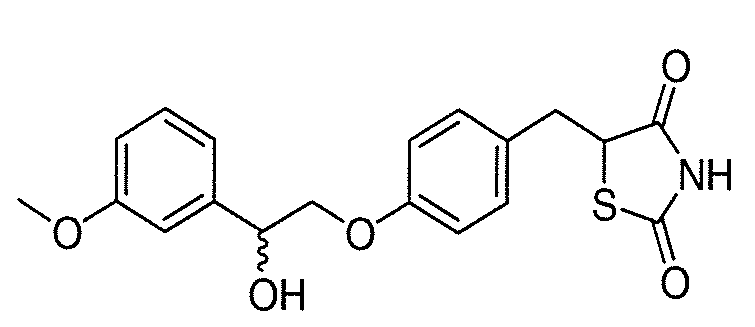
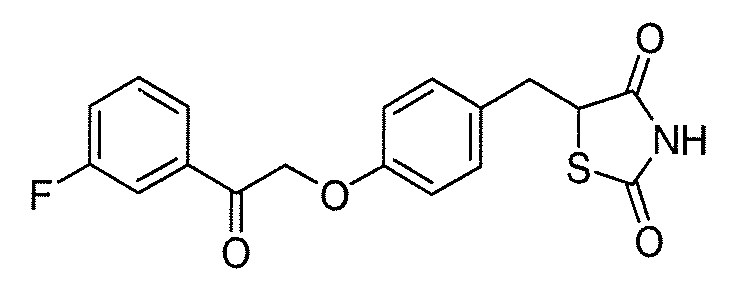
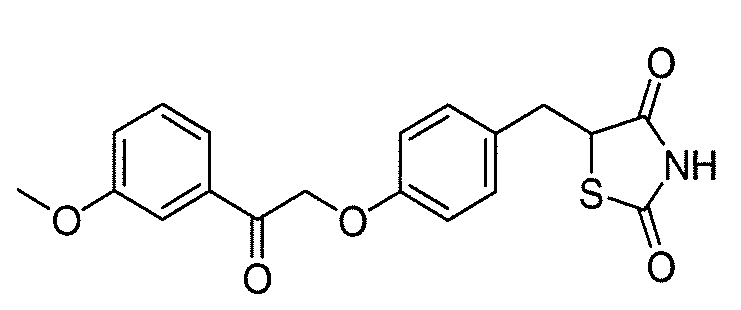
ES- 370,1 (M-1)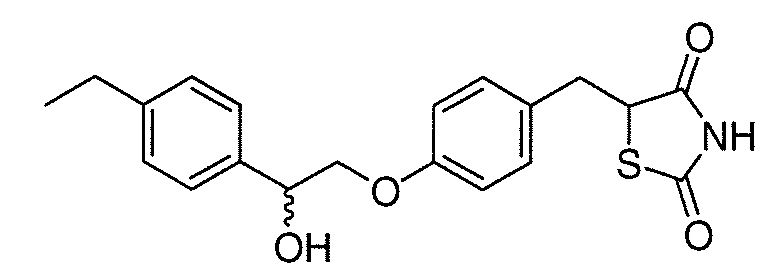
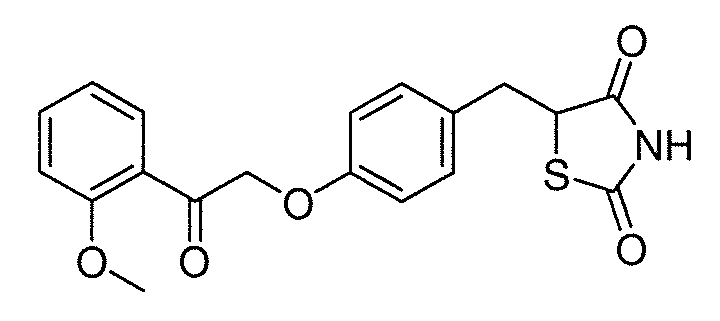
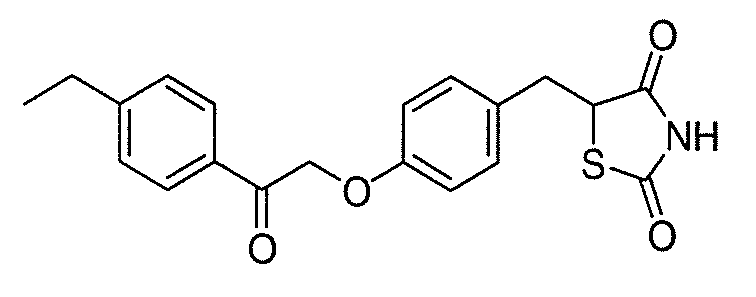
ES- 368,1 (M-1)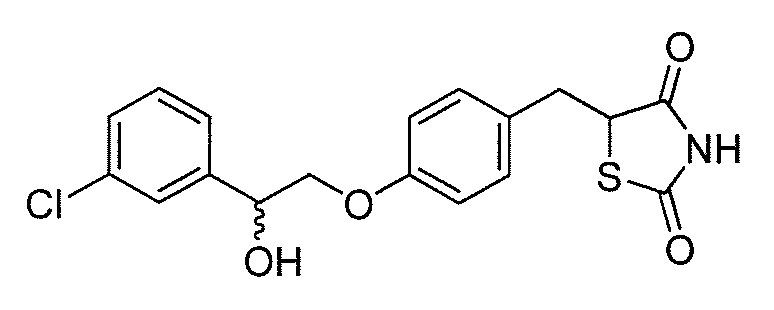
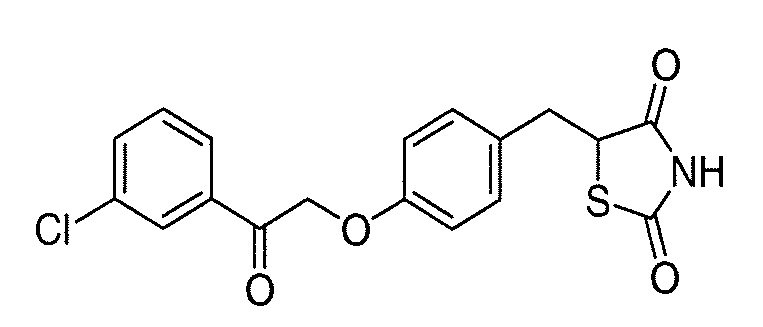
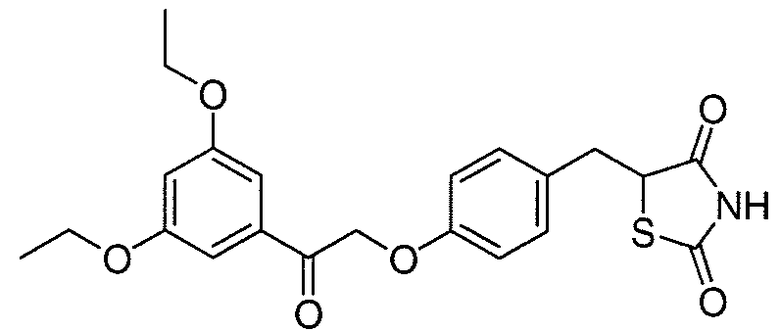
ES- 428,2 (M-1)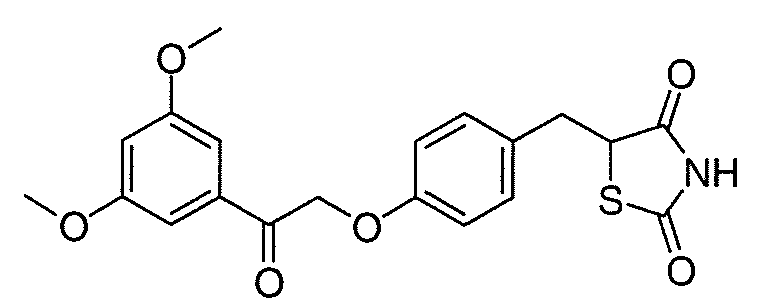
ES- 400,2 (M-1)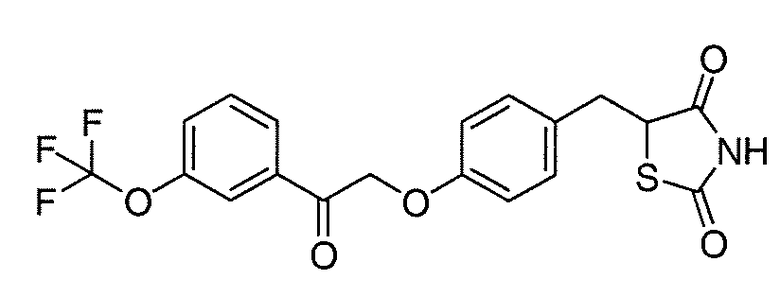
ES- 424,1 (M-1)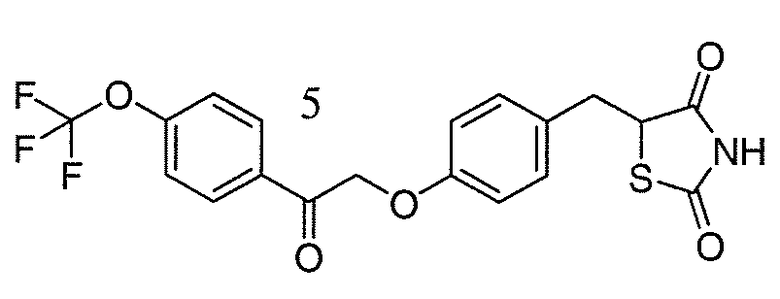
ES- 424,2 (M-1)
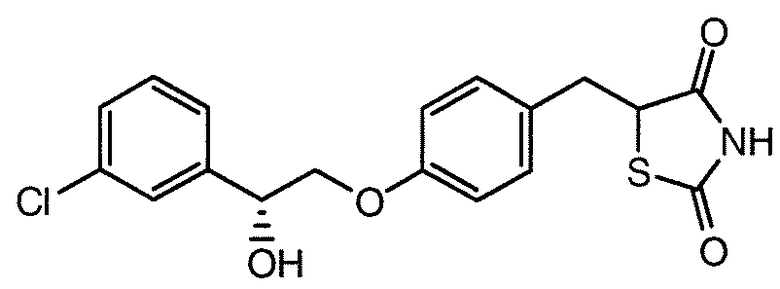
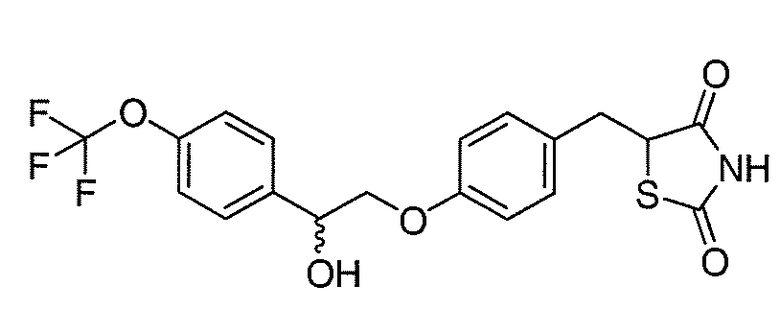
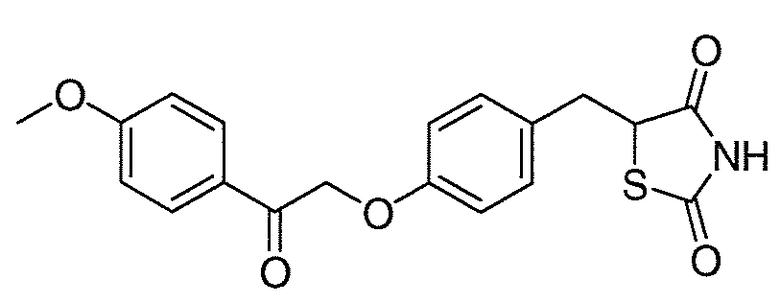
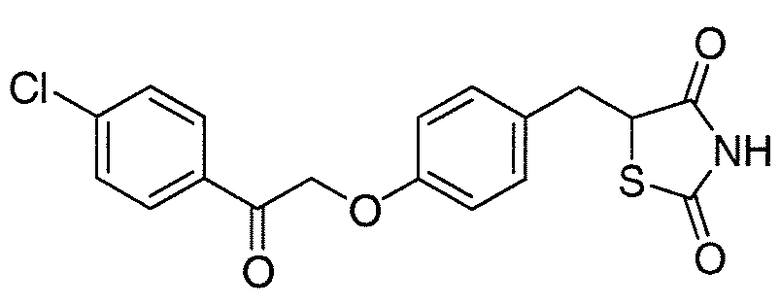
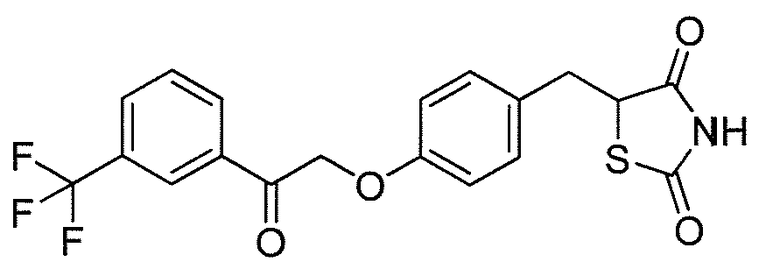
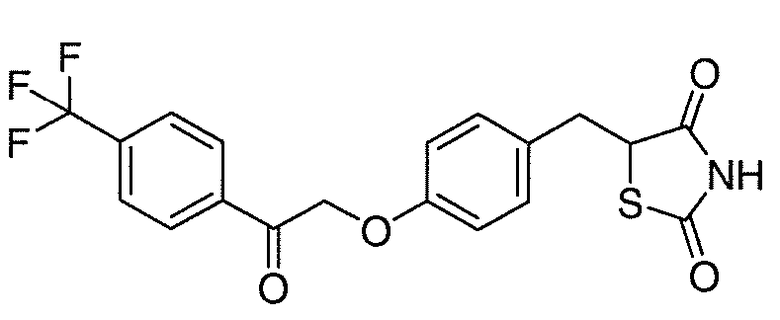
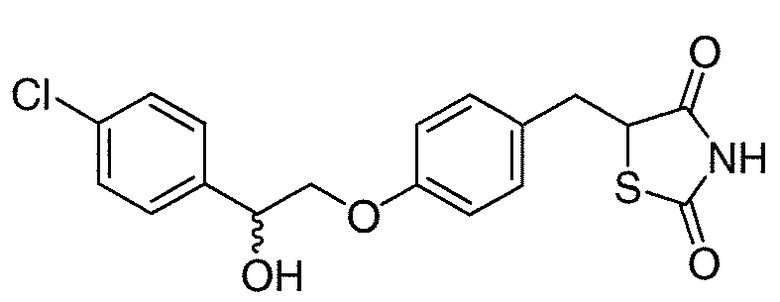
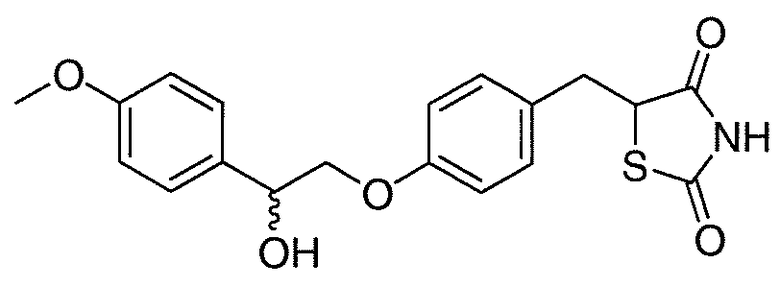
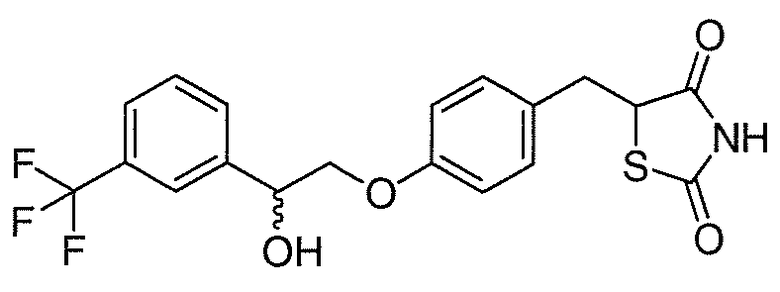
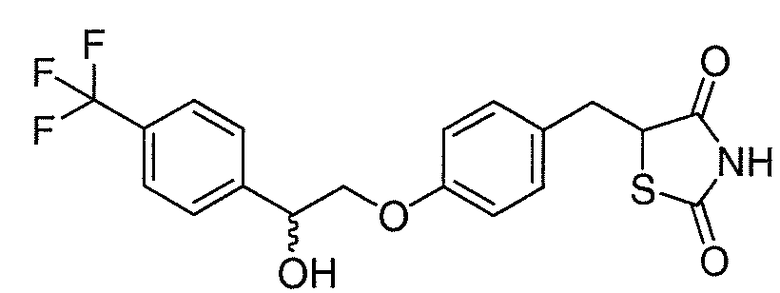
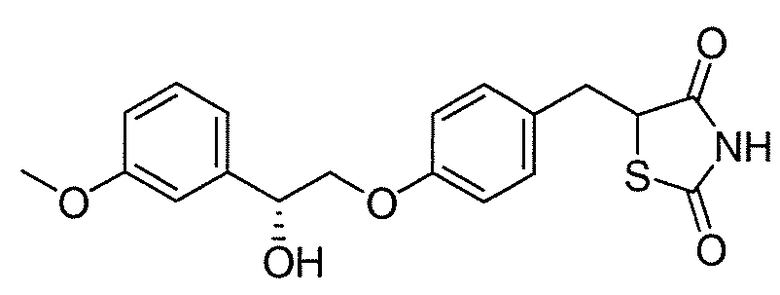
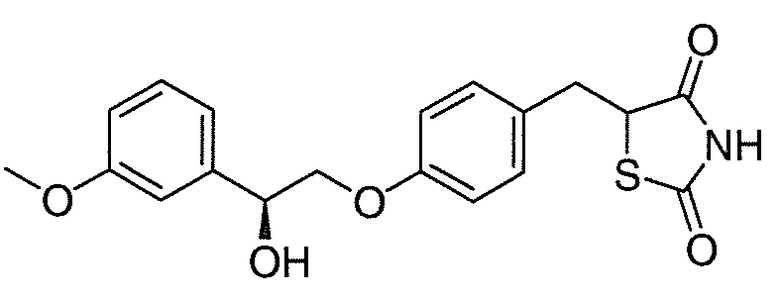
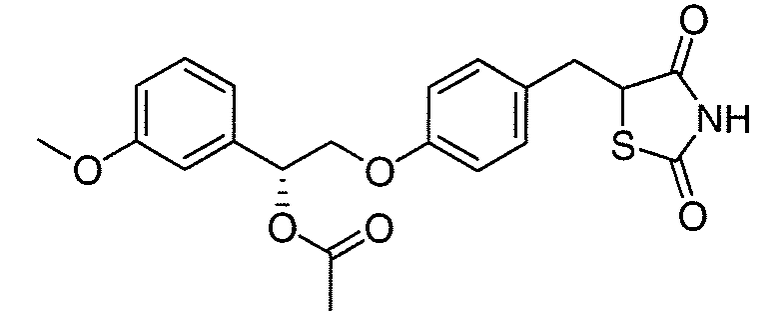
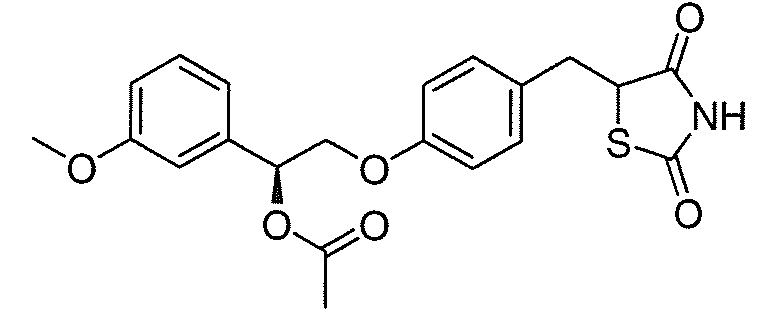
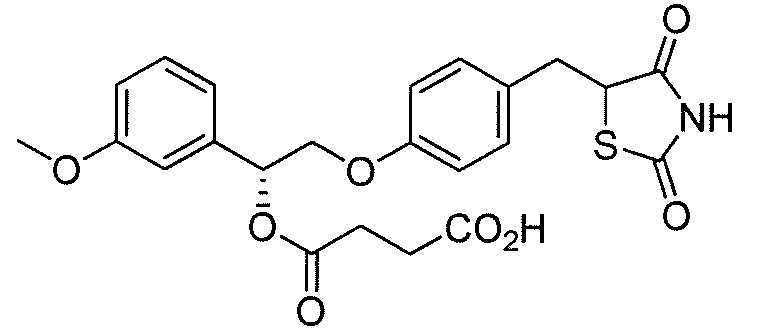
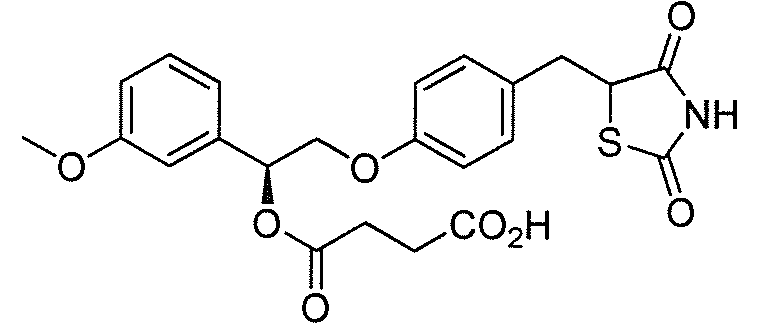
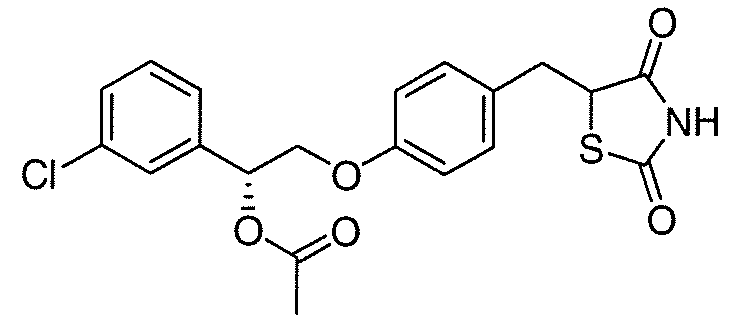
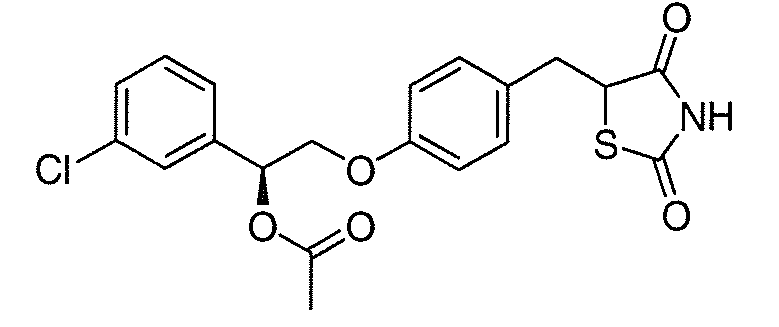
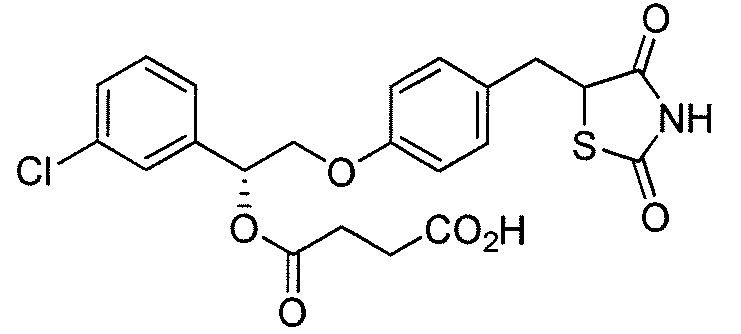
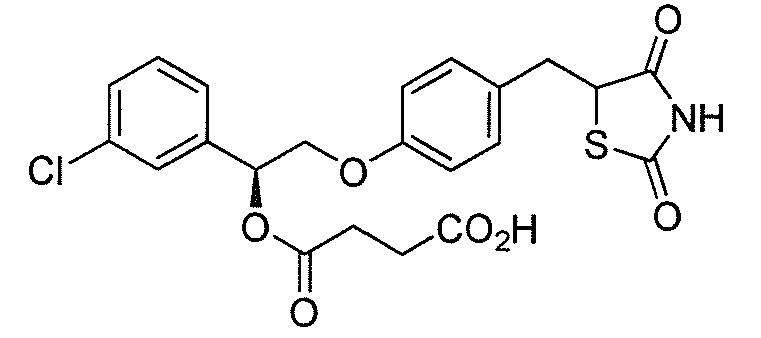
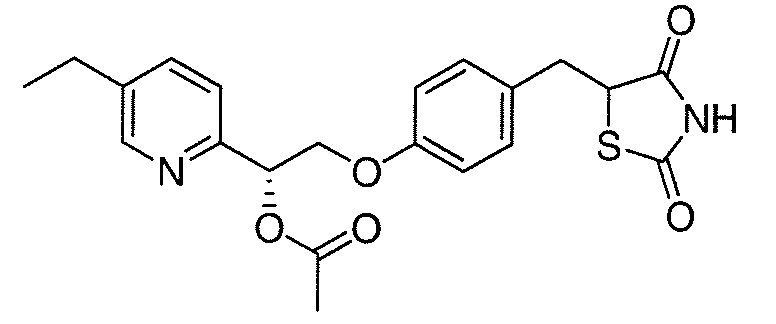
ES- 413,0 m/z (M-1)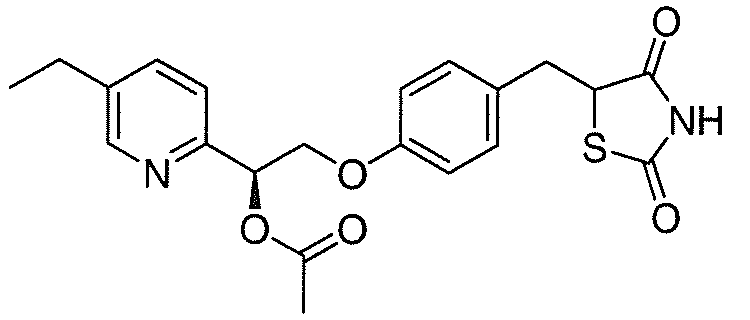
ES- 413,0 m/z (M-1)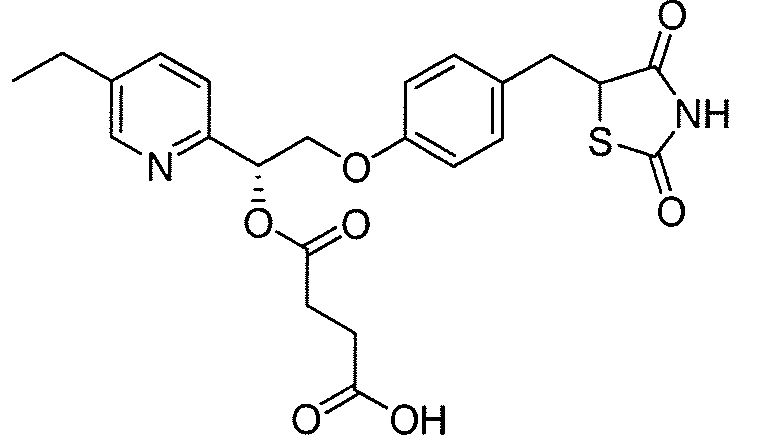
ES- 471,0 m/z (M-1)
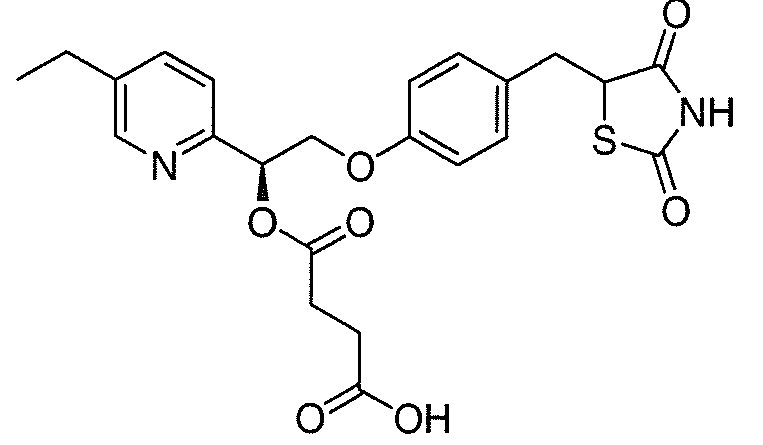
ES- 471,0 m/z (M-1)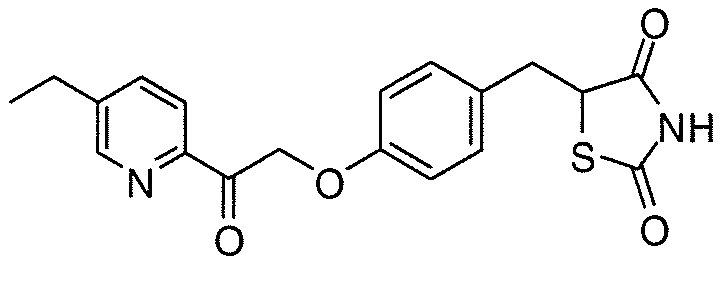
ES- 369,1 (M-1)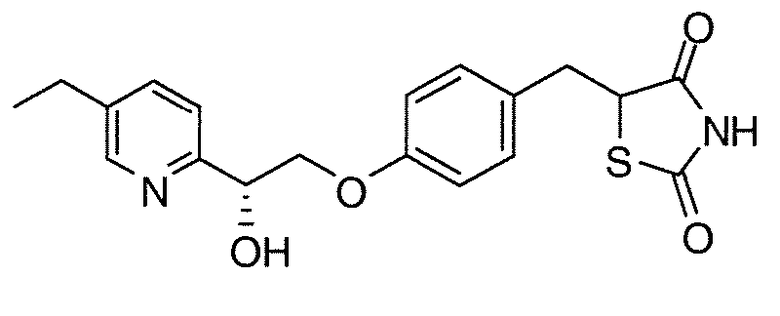
ES- 371,1 (M-1)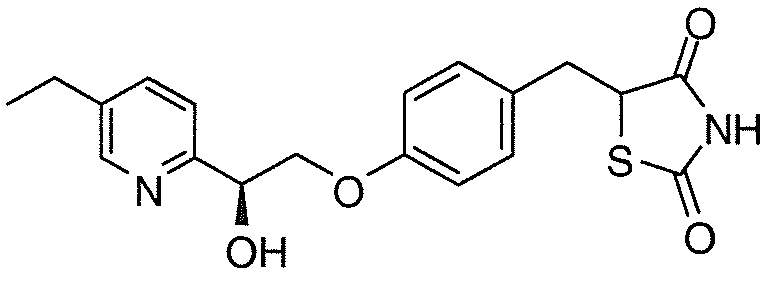
ES- 371,1 (M-1)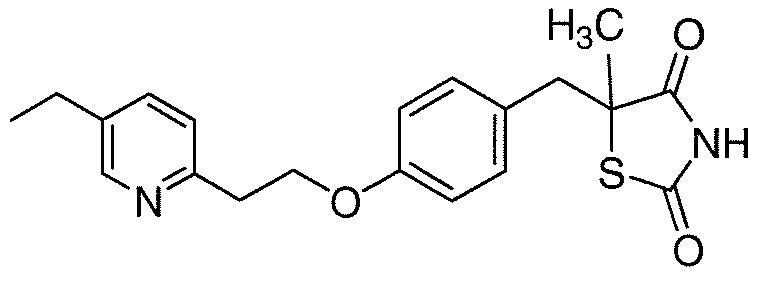
ES- 369,2 (M-1)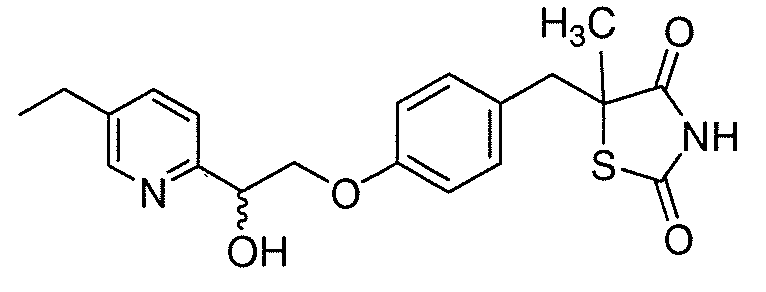
ES- 385,3 (M-1)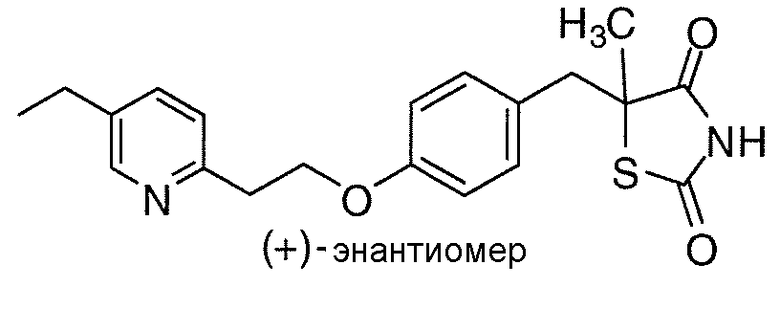
ES- 369,2 (M-1)
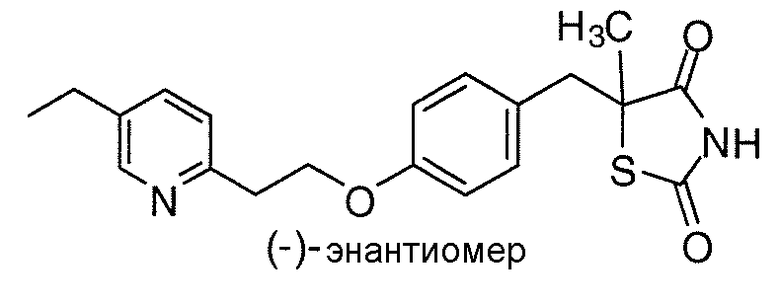
ES- 369,2 (M-1)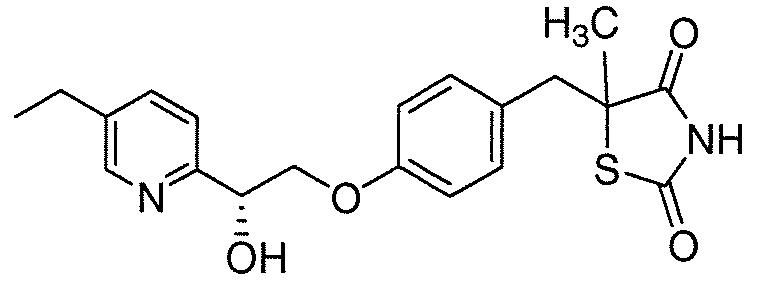
ES- 385,3 (M-1)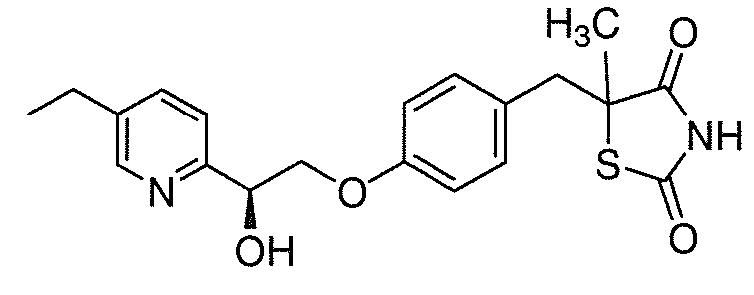
ES- 385,2 (M-1)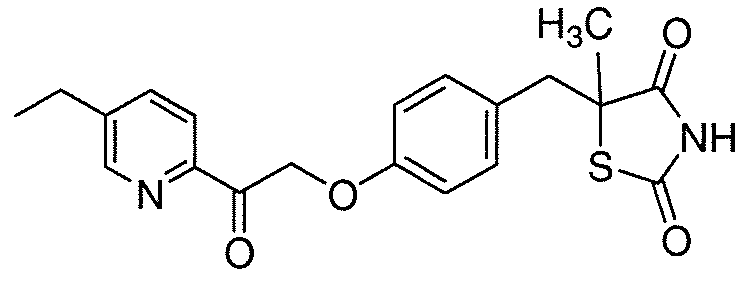
ES- 383,1 (M-1)
ES- 371,2 (M-1)
Пример 10A: Получение соли с кислотой соединения формулы I
Соединение формулы I может быть преобразовано в соль путем растворения соединения в растворителе, в котором соль с кислотой органического соединения является нерастворимой или только труднорастворимой; добавлением одного или нескольких мольных эквивалентов кислоты, такой как HCl, HBr, уксусная кислота, трифторуксусная кислота или H2SO4, метансульфоновая кислота, п-толуолсульфоновая кислота, трифторметансульфоновая кислота или тому подобное, к растворителю, содержащему растворенное соединение формулы I, с образованием осадка соли органического соединения; и отделения осадка, используя фильтрацию, декантацию или иные подобные методы с получением соли органического соединения формулы I в чистом виде.
Пример 10A1: гидрохлорид 5-{4-[2-(5-этилпиридин-2-ил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
1M раствор HCl в EtOH получали путем разбавления 0,70 мл ацетилхлорида (10 ммоль) до 10 мл с помощью безводного EtOH. Суспендировали 5-((4-(2-(5-этил-2-пиридил)-1-оксоэтокси)фенил)метил)-2,4-тиазолидиндион (соединение A) (100 мг, 0,27 ммоль) в безводном EtOH (5мл), и смесь нагревали с помощью тепловой пушки до растворения всех твердых продуктов. Добавляли 0,27 мл 1M раствора HCl в EtOH. Перемешивали в течение 2 часов при комнатной температуре. Упаривали в вакууме (прибл. 50°C) в течение 2 часов с получением вещества желтого цвета, (110 мг).
Анализ, вычисл. для C19H19ClN2O4S плюс 5,25% H2O: C, 53,14; H, 5,05; N, 6,52; Cl, 8,26. Найдено: C, 53,48; H, 4,98; N, 6,26; Cl, 8,62.
Пример 10A2: сульфат 5-{4-[2-(5-этилпиридин-2-ил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
5-{4-[2-(5-Этилпиридин-2-ил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-дион (соединение A) (100 мг, 0,27 ммоль) суспендировали в безводном абс. EtOH (3 мл), и смесь нагревали с помощью тепловой пушки до растворения всех твердых продуктов. Добавляли 1M водн. H2SO4 (0,27 мл, коммерчески доступный раствор). Перемешивали в течение 1 часа при комнатной температуре. Упаривали в вакууме и сушили в высоком вакууме (прибл. 50°C) в течение 2 часов с получением масла желтого цвета (130 мг).
Анализ, вычисл. для C19H18N2O4S плюс 5,12% H2O и 25,07% H2O4S: C, 43,21; H, 4,49; N, 5,30; S, 14,27. Найдено: C, 43,30; H, 4,46; N, 4,96; S, 14,16.
Пример 10B: Получение солей щелочноземельного металла соединений формулы I
Соединение формулы I может быть преобразовано в соль путем растворения соединения в растворителе, в котором соль щелочноземельного металла органического соединения является нерастворимой или только слабо растворимой; добавления одного или нескольких мольных эквивалентов основания, такого как NaOH, KOH или тому подобное, к растворителю, содержащему растворенное соединение формулы I, с образованием осадка соли органического соединения; и отделения осадка, используя фильтрацию, декантацию или иные подобные методы с получением соли органического соединения формулы I в чистом виде.
Альтернативно, соединение формулы I может быть преобразовано в соль путем растворения соединения в растворителе, в котором соль органического соединения также растворима; добавления одного или более мольных эквивалентов основания с относительно низкой температурой кипения, такого как NaOH, KOH или тому подобное, к растворителю, содержащему растворенное соединение формулы I; и затем упаривания растворителя и избытка основания, содержащегося в раствор с получением соли органического соединения в чистом виде.
Пример 10B1: 5-{4-[2-(5-Этилпиридин-2-ил)-2-оксоэтокси]бензил}-2,4-диоксо-1,3-тиазолидин-3-ид натрия
5-{4-[2-(5-Этилпиридин-2-ил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-дион (100 мг, 0,27 ммоль) суспендировали в безводном абс. EtOH (3 мл), и смесь нагревали с помощью тепловой пушки до растворения всех твердых продуктов. Добавляли этоксид натрия (18 мг, 0,27 ммоль). Перемешивали в течение 1 часа. Упаривали в вакууме и сушили в высоком вакууме (прибл. 50°C) в течение 2 часов с получением твердого вещества белого цвета (110 мг, 100%).
Анализ, вычисл. для C19H17N2NaO4S плюс 2,38% H2O: C, 56,77; H, 4,53; N, 6,97. Найдено: C, 57,08; H, 4,33; N, 6,85.
Пример 10B2: 5-{4-[2-(5-Этилпиридин-2-ил)-2-оксоэтокси]бензил}-2,4-диоксо-1,3-тиазолидин-3-ид калия
5-{4-[2-(5-Этилпиридин-2-ил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-дион (100 мг, 0,27 ммоль) в ТГФ (3 мл) добавляли в 1M раствор трет-бутоксида калия в ТГФ (0,27 мл, 0,27 ммоль). Перемешивали при комнатной температуре в течение 2 часов. Упаривали в вакууме. Сушили в высоком вакууме (прибл. 50°C) в течение 2 часов с получением твердого продукта оранжево-розового цвета (110 мг, 100%).
Анализ, вычисл. для C19H17KN2O4S плюс 2,88% H2O и 7,95% KOH: C, 49,74; H, 4,21; N, 6,11. Найдено: C, 49,98; H, 3,79; N, 5,90.
Пример 10B3: 5-{4-[2-(3-Метоксифенил)-2-оксоэтокси]бензил}-2,4-диоксо-1,3-тиазолидин-3-ид натрия
5-{4-[2-(3-Метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-дион (100 мг, 0,27 ммоль) суспендировали в ТГФ (3 мл), и смесь нагревали с помощью тепловой пушки до растворения всех твердых продуктов. Добавляли трет-бутоксид натрия (26 мг, 0,27 ммоль). Перемешивали при комнатной температуре в течение 2 часов. Упаривали в вакууме. Сушили в высоком вакууме (прибл. 50°C) в течение 2 часов с получением твердого вещества не совсем белого цвета (110 мг, 100%).
Анализ, вычисл. для C19H16NNaO5S плюс 1,60% H2O: C, 57,08; H, 4,21; N, 3,50. Найдено: C, 56,91; H, 4,01; N, 3,30.
Пример 10B4: 5-{4-[2-(3-Метоксифенил)-2-оксоэтокси]бензил}-2,4-диоксо-1,3-тиазолидин-3-ид калия
Перемешиваемую суспензию 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона в ТГФ (3 мл) нагревали с помощью тепловой пушки до растворения всех твердых продуктов. Добавляли 1M раствор трет-бутоксида калия в ТГФ (0,27 мл, 0,27 ммоль). Перемешивали в течение 2 часов при комнатной температуре. Упаривали в вакууме. Сушили в высоком вакууме (прибл. 50°C) в течение 2 часов с получением твердого продукта оранжево-розового цвета (110 мг, 100%).
Анализ вычисл. для C19H16K1N1O5S плюс 2,50% H2O и 7,96% KOH: C, 49,84; H, 3,96; N, 3,06. Найдено: C, 49,65; H, 3,58; N, 3,07.
Пример 10B5: 5-{4-[2-(3-Метоксифенил)-2-оксоэтокси]бензил}-2,4-диоксо-1,3-тиазолидин-3-ид калия
Смесь метанола (1,0 литр) и чешуйки гидроксида калия (85% масс/масс) (35,5 г, 0,539 моль) перемешивали с получением прозрачного раствора при 25-30°C. К этому раствору одной партией добавляли 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-дион (200 г, 0,539 моль) при перемешивании с метанолом (200 мл). Образовывался прозрачный раствор, и через 10-15 мин начинал образовываться осадок. Перемешивали реакционную смесь в течение 6 час. Фильтровали полученный твердый продукт и промывали метанолом (200 мл) и сушили в печи при температуре 50-55°C с получением калиевой соли 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона (185 г).
Пример 10C: Получение характеристик металлических солей соединений формулы I
Металлические соли соединений формулы I были охарактеризрваны, используя XRPD, DSC, термогравиметрию и анализ поглощения влаги. Следует учесть, что рентгенограммы XRPD, описанные ниже, и представленные на фигурах 1 и 5, были получены, используя дифрактометр Bruker Model D8 X-Ray Diffractometer. Термогравиметрический анализ, DSC анализ и анализ поглощения влаги осуществляли, используя прибор TA Instruments Universal V4.4A (пер. - Универсальные приборы V4.4A TA).
Пример 10C1: Получение характеристик натриевой соли 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
На фигуре 1 представлена рентгенограмма XRPD образца натриевой соли соединения B, ссылаясь на фигуры 2-4, термогравиметрический, DSC анализ и анализ влагопоглощения осуществляли на натриевой соли соединения B. Термогравиметрический анализ проводили, используя 7,5450 мг натриевой соли, и настройку приборов на 10°C/мин. DSC анализ проводили, используя 2,00 мг образца натриевой соли и настройку приборов на 10°C/мин. Анализ влагопоглощения осуществляли на 14,07 мг натриевой соли при относительной влажности от 5% до 95% при температуре 25°C и максимальном времени установления равновесия 180 мин и выборке данных каждые 2 минуты.
Следует учесть, что натриевая соль была получена в виде единственного полиморфа.
Пример 10B6a: Получение характеристик калиевой соли 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
На фигуре 5 представлена рентгенограмма XRPD образца калиевой соли соединения B, ссылаясь нв фигуры 6-8, термогравиметрический, DSC анализ и анализ влагопоглощения осуществляли на калиевой соли соединения B. Термогравиметрический анализ проводили, используя 15,9290 мг калиевой соли и настройку приборов на 10°C/мин. DSC анализ осуществляли, используя 4,66 мг образца натриевой соли и настройку приборов на 10°C/мин. Анализ поглощения влаги осуществляли на 12,934 мг натриевой соли при относительной влажности от 5% до 95% при температуре 25°C и максимальном времени установления равновесия 180 мин и выборке данных каждые 2 минуты.
Данные для натриевой и калиевой солей соединения B согласуются с кристаллическими веществами, показывающими значительную гигроскопичность. Натриевая соль проявляла ~10,0 масс%-ное увеличение поглощения влаги в интервале между ~6% и ~95% RH. Для калиевой соли наблюдалось ~21,1 масс%-ное поглощение воды при увеличении влажности от ~5% до ~95% RH.
Пример 11: Биологические свойства солей соединения
Пример 11A: Биодоступность натриевой соли соединения A
Что касается фигуры 9, то биодоступность натриевой соли соединения A оценивалась путем перекрестного исследования на 4 самцах человекообразных обезьян весом в области от 4,52 до 5,12 кг. Обезьян застявляли в течение ночи голодать, и дозу вводили через зонд, промытый 10 мл воды из крана. Образцы крови отбирали через 0,25, 0,5, 1, 2, 3, 4, 6, 9, 12, 24 и 48 часов после введения одной дозы и анализировали на продукты, относящиеся к лекарственным средствам, с помощью анализа LCMS, используя внутренний стандарт. 90 мг лекарственного средства помещали в 00 желатиновые капсулы, содержащие 90 мг эквивалента свободного основания. Сравнивали с внутривенной инъекцией 2 мг/кг и 45 мг раствора свободного основания в 50% гидроксипропил b-циклодекстрана. Абсолютную доступность по сравнению с внутривенной инъекцией определяли как для исходного соединения, так и для основного метаболита. Следует отметить, что натриевая соль соединения A, как для метаболита, так и исходного соединения, была значительно выше по биодоступности, чем их свободноосновные эквиваленты.
Пример 11B: Биодоступность калиевых и натриевых солей соединения B
Что касается фигуры 10, то площадь под кривой (AUC) соединения, относящуюся к продуктам, сравнивали со следующими дозировками 250 мг соединения B в виде порошка в капсулах свободной кислоты (PIC), изготовленных таблеток тонкодисперсной свободной кислоты или изготовленных таблеток Na или K солей соединения B, данных в эквивалентах к одной и той же свободной кислоте. (человекообразные обезьяны, N=4). Изготовленная прессованная таблетка также содержит в каждом случае приблизительно 40,5% лактозы, 16,8% микрокристаллической целлюлозы, 1,9% натрий кроскармелозы, 0,5% коллоидного диоксида кремния и 0,9% стеарата магния. Следует отметить, что как натриевая, так и калиевая соли соединения B имеют значительно более высокую биодоступность, чем их свободнокислотные аналоги. Также, соли с объемной кислотой показывали преимущество по сравнению с прессованной таблеткой с тонкодисперсной свободной кислотой.
Пример 11C: Фармакологическая активность натриевой соли соединения A
Что касается фигуры 11, Na соль соединения A демонстрировала прекрасную реакцию на дозирование по снижению глюкозы в крови у диабетических мышей KKAy. В этих экспериментах свободное основание или натриевую соль давали диабетическим мышам KKAy (N=6), и измеряли уровень глюкозы в крови через 4 дня после суточного введения указанной дозы. Мышам KKAy, 8-12 недельного возраста, давали дозы соединений в соответствии с дозами, указанными на оси X фигуры 11. Соединения давали с помощью зонда один раз в сутки в дозе 10 мг/кг. На пятый день (после 4 суточных доз на показанных уровнях) отбирали образец крови для измерения глюкозы в плазме.
Пример 12A: Примеры биологических свойств со-кристалла
Эффективность со-кристаллов солей соединений демонстрировали в клеточных системах, предназначенных для оценки их эффективности в дифференциации коричневой жировой ткани (BAT) в культуре клеток. Со-кристаллы, включающие соли соединений, которые показывают эффективность в клеточных системах, также будут эффективными и предохраняющими от прибавления веса in vivo и сохраняющими b-клетки поджелудочной железы, потеря которых приводит к развитию диабета.
Пример 12B: Получение со-кристаллов
Со-кристалл A:
К кофеину (0,194 г, 1 ммоль) и 5-(4-(2-(5-этилпиридин-2-ил)-2-оксоэтокси)бензил)-1,3-тиазолидин-2,4-диону (0,370 г, 1 ммоль) добавляли ацетонитрил (20 мл). Смесь нагревали на масляной бане при температуре 75°C до растворения твердых продуктов. Нагревание продолжали в течение около 109 минут, затем раствор отфильтровывали и оставляли охлаждаться до комнатной температуры. Растворителю давали выпариваться до завершения кристаллизации. Со-кристаллический твердый продукт выделяли фильтрацией и сушили в вакууме. Точка плавления полученного кристаллического вещества была определена равной от около 123°C до около 131°C. Сдедует учесть, что, как сообщается, точка плавления чистого кофеина составляет от около 234°C до около 236°C, и точка плавления чистого 5-(4-(2-(5-этилпиридин-2-ил)-2-оксоэтокси)бензил)-1,3-тиазолидин-2,4-диона была определена равной от около 140°C до около 142°C.
1H ЯМР спектр 5-(4-(2-(5-этилпиридин-2-ил)-2-оксоэтокси)бензил)-1,3-тиазолидин-2,4-диона, кофеина и со-кристалла представлены на фигурах 15-17. Указанные спектры были получены, используя ЯМР спектрометр Bruker 400 мГц, где анализируемое вещество растворяли в D6-ДМСО.
Со-кристалл B:
К кофеину (0,194 г, 1 ммоль) и 5-(4-(2-(3-метоксифенил)-2-оксоэтокси)бензил)тиазолидин-2,4-диону, имеющему структуру:
(0,371 г, 1 ммоль) добавляли ацетонитрил (20 мл). Смесь нагревали на масляной бане при температуре 75°C до растворения твердых продуктов. Нагревание продолжали в течение около 109 минут, затем раствор отфильтровывали и оставляли охлаждаться до комнатной температуры. Растворителю давали выпариваться до завершения кристаллизации. Со-кристаллический твердый продукт выделяли фильтрацией и сушили в вакууме.
Пример 13: Исследования
Исследования по измерению снижения активации рецепторов PPARγ
Несмотря на то, что активация рецепторов PPARγ, как правило, рассматривается в качестве критерия отбора для выбора молекул, которые могут иметь анти-диабетическую фармакологическую активность и могут быть чувствительны к инсулину, согласно настоящему изобретению было обнаружено, что активация этого рецептора должна быть отрицательным критерием отбора. Молекулы выбирают из этого объема химических соединений потому, что они снижают, не только селективно, активацию PPARγ. Оптимальные соединения обладают по меньшей мере способностью 10-кратно снижать активацию по сравнению с пиоглитазоном, и менее чем на 50% от полной активации, вызываемой росиглитазоном, в исследованиях, проводимых in vitro по трансактивации рецептора PPARγ. Исследования проводят с помощью первичной оценки прямого взаимодействия молекул с лигандом, связывающим домен PPARγ. Это может быть осуществлено с помощью коммерческого набора для взаимодействия, который измеряет прямое взаимодействие с помощью флуоресценции, используя росиглитазон в качестве положительного контроля.
PPARγ связывание измеряют с помощью конкурентного анализа связывания TR-FRET, используя Invitrogen LanthaScreenTM TR-FRET PPARγ competitive Binding Assay (Invitrogen #4894). В этом анализе используют меченое тербием антитело против GST для мечения GST-связанный лиганд-связывающего домена PPARγ (LBD) человека. Флуоресцентная низкомолекулярная лигандная метка pan-PPAR связывается с LBD, вызывая передачу энергии от антитела к лиганду, что приводит к высокому соотношению TR-FRET. Благодаря конкурентному связыванию лиганд PPARγ вытесняет метку с LBD, вызывая низкий сигнал FRET между антителом и меткой. Соотношение TR-FRET определяют путем считывания флуоресцентной эмиссии при 490 и 520 нм, используя планшет-ридер Synergy2 (BioTek). Способность некоторых характерных соединений по настоящему изобретению связываться с PPARγ также измеряли, используя коммерческий анализ связывания (Invitrogen Corporation, Carlsbad, CA), который измеряет способность тестируемых соединений связываться с комплексом PPAR-LBD/Fluormone PPAR Green. Этот анализ осуществляли три раза в каждом анализе, используя четыре отдельные лунки (квадруплет) для каждой концентрации исследуемого соединения. Данные усредняли, и SEM значений получали из трех экспериментов. Росиглитазон использовали в качестве положительного контроля в каждом эксперименте. Соединения добавляли в представленных концентрациях, которые находились в интервале от 0,1-100 микромолей.
Активация PPARγ в интактных клетках может быть измерена с помощью клеточного репортерного анализа, используя Invitrogen GeneBLAzer PPARγ Assay (Invitrogen #1419). В этом репортерном анализе используется лиганд-связывающий домен PPARγ человека (LBD), слитый с ДНК-связывающим доменом (DBD) GAL4), стабильно трансфицированным в клетки HEK 293H, содержащие стабильно экспрессированный репортерный ген бета-лактамазы под контролем активаторной последовательности, расположенной в направлении 3'-5'. Если агонист PPARγ связывается с LBD слитого белка GAL4/PPAR, то белок связывается с активаторной последовательностью, расположенной в направлении 3'-5', активирующей экспрессию бета-лактамазы. Через 16 часов инкубирования с агонистами клетки приводили в контакт с субстратом FRET в течение 2 часов и соотношение флуоресцентной эмиссии FRET получали при 460 и 530 нм с помощью планшет-ридера Synergy2 (BioTek).
Кроме того, что соединения демонстрировали снижение активации рецептора PPARγ in vitro, они не давали значительной активации рецептора у животных. Соединения в дозе, достаточной для достижения полного эффекта в отношении сенсибилизации инсулина in vivo (смотри ниже) не понижают активацию PPARγ в печени, что определено по экспрессии P2, биомаркера эктопического адипогенеза в печени [Matsusue K, Haluzik M, LambertG, Yim S-H, Oksana Gavrilova O, Ward JM, Brewer B,Reitman МЛ, Gonzalez FJ. (2003) Liver-specific disruption of PPAR in leptin-deficient mice improves fatty liver but aggravates diabetic phenotypes. J. Clin. Invest.; 111: 737], что полностью отличается от действия пиоглитазона и росиглитазона, которое снижает экспрессию P2 при тех же условиях.
Анализ конкурентного перекрестного связывания митохондриальной мембраны
Фотоаффинный линкер, образующий поперечные связи, синтезировали конденсацией карбоксильного аналога пиоглитазона с содержащим п-азидо-бензильную группу этиламином, как описано в Amer. J. Physiol 256:E252-E260. Линкер, образующий поперечные связи, йодировали свободным от носителя, используя модификацию способа Iodogen (Pierce), и очищали, используя сквозную колоночную хроматографию (PerkinElmer). Специфическое перекрестное связывание определяли как мечение, которое не возможно в присутствии конкурентного лекарственного средства. Анализ конкурентного связывания проводили в 50 мМ Tris, pH 8,0. Все реакции перекрестного связывания трехкратно повторяли, используя 8 концентраций конкурентного вещества в области 0-25 мкМ. Каждая реакционная пробирка для проведения реакции перекрестного связывания содержит 20 мкг неочищенных митохондриальных мембран клеток печени крыс, 0,1 мкКю 125I-MSDC-1101, и -/+ конкурентного лекарственного средства с конечной концентрацией 1% ДМСО. Реакционную пробирку анализа связывания покачивали при комнатной температуре в темноте в течение 20 минут и реакцию останавливали воздействием 180000 мкДж. После перекрестного связывания мембраны осаждали центрифугированием при 20000×g в течение 5 минут, осадок после центрифугирования ресуспендировали в буфере для образца Laemmli, содержащем 1% BME, и прогоняли на 10-20% гелях Tricine. После электрофореза гели сушили в вакууме и приводили в контакт с пленкой Kodak BioMax MS при температуре -80°C. Плотность полученных специфически меченых ауторадиографических полос оценивали количественно, используя программное обеспечение ImageJ (NIH), и значения IC50 определяли с помощью нелинейного анализа, используя GraphPad PrismTM. Выбранные соединения в этом анализе демонстрировали значение IC50 менее чем 20 мкМ, менее чем 5 мкМ или менее чем 1 мкМ. Образование поперечных связей с этой белковой полосой указывает на способность PPAR-протективных соединений связываться с митохондрией, ключевой органеллой, ответственной за эффективность этих соединений для данного применения.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Следует учесть, что, хотя изобретение было описано в сочетании с подробным его описанием, предшествующее описание предназначено для иллюстрации и не ограничивает объем изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и изменения входят в объем следующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАПП-ПОДДЕРЖИВАЮЩИЕ ТИАЗОЛИДИНДИОНЫ И ИХ КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2570424C2 |
| СИНТЕЗ СОЕДИНЕНИЙ ТИАЗОЛИДИНДИОНА | 2011 |
|
RU2594725C2 |
| НОВЫЙ СПОСОБ СИНТЕЗА СОЕДИНЕНИЙ ТИАЗОЛИДИНДИОНА | 2011 |
|
RU2593370C2 |
| АНАЛОГИ ТИАЗОЛИДИНДИОНА ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА И ДИСЛИПИДЕМИИ | 2008 |
|
RU2486179C2 |
| МАКРОГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2001 |
|
RU2275373C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2010 |
|
RU2531588C2 |
| МОДУЛЯТОРЫ КИНАЗЫ, АССОЦИИРОВАННОЙ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА-1 | 2007 |
|
RU2459821C2 |
| PPAR-ПОДДЕРЖИВАЮЩИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2687490C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2006 |
|
RU2446171C2 |
| ДЕЙТЕРИРОВАННЫЕ ИНГИБИТОРЫ ПРОТЕАЗЫ ГЕПАТИТА С | 2007 |
|
RU2465264C2 |
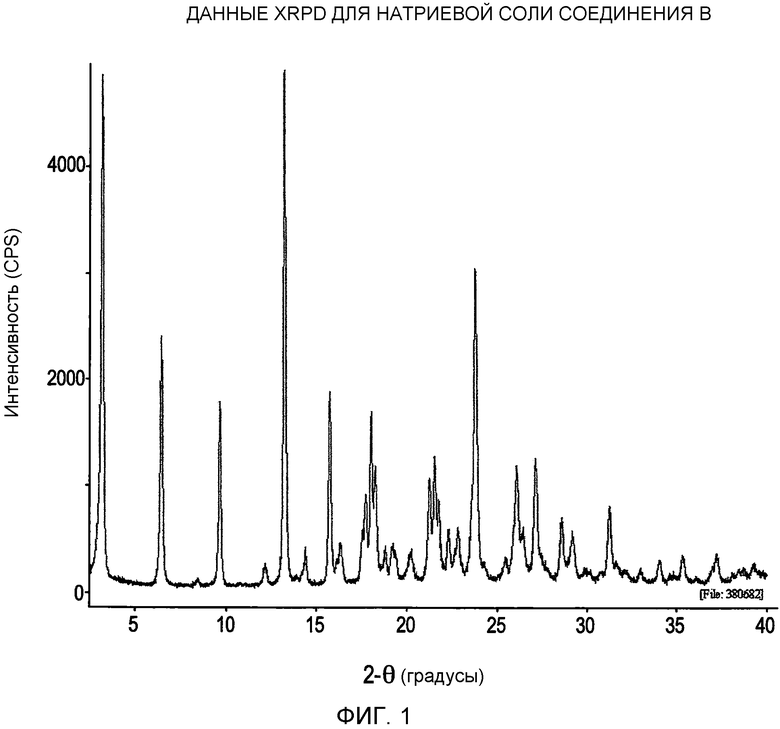
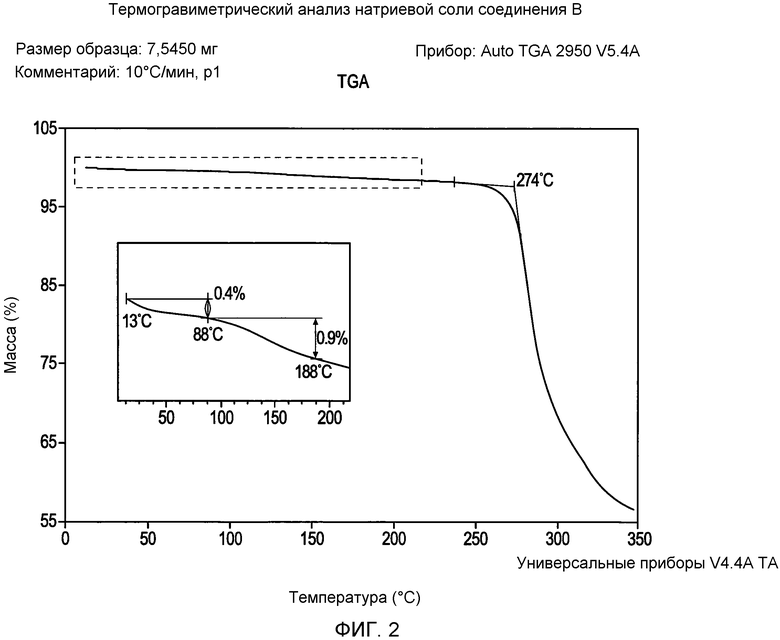
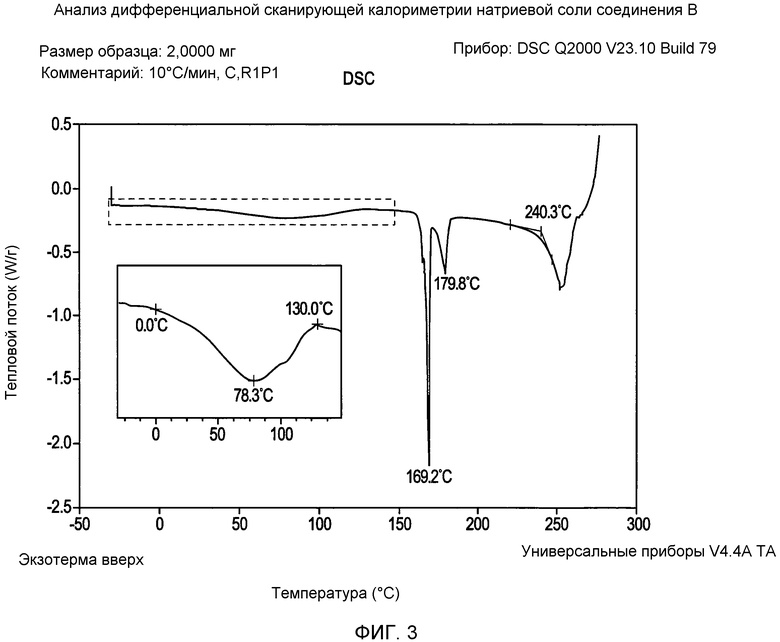
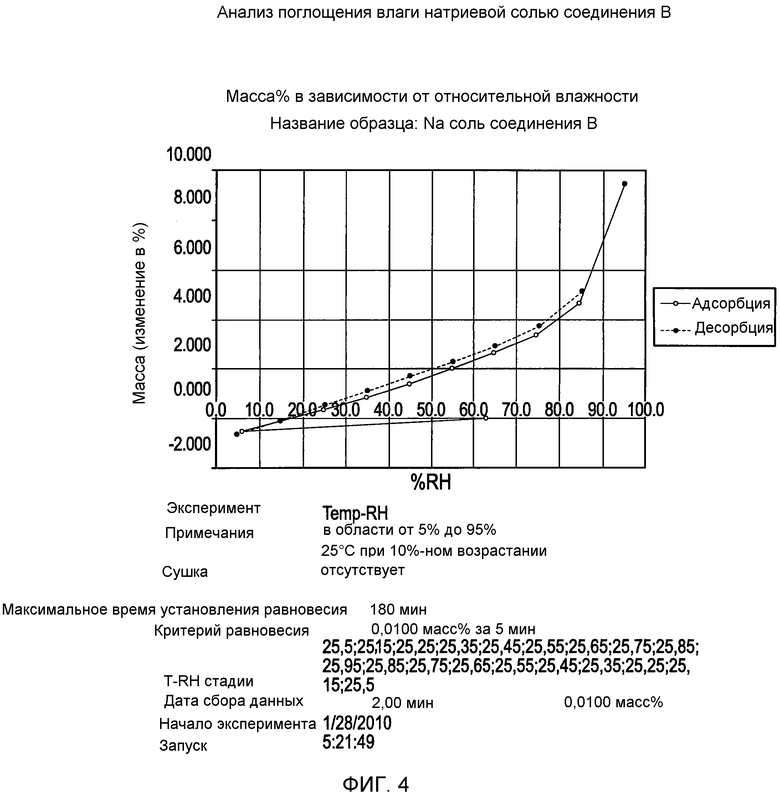
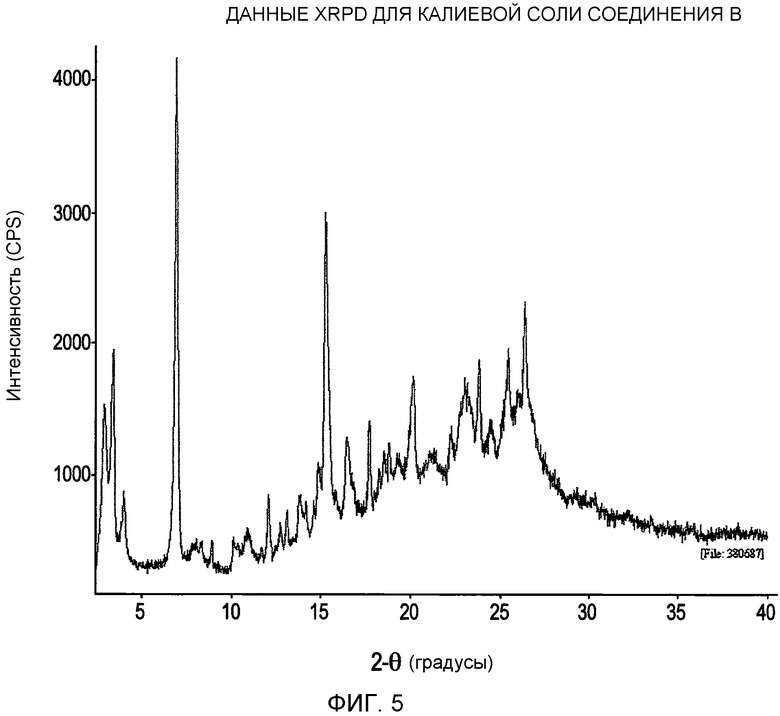
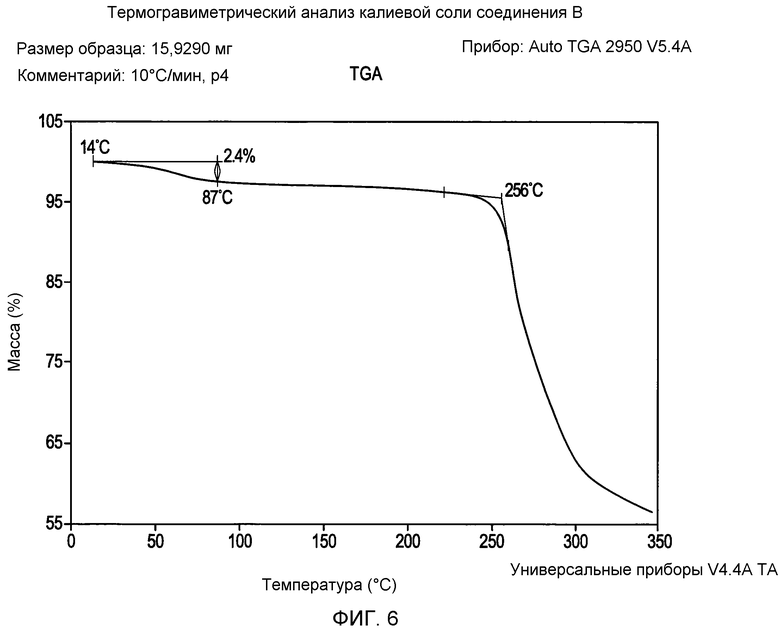
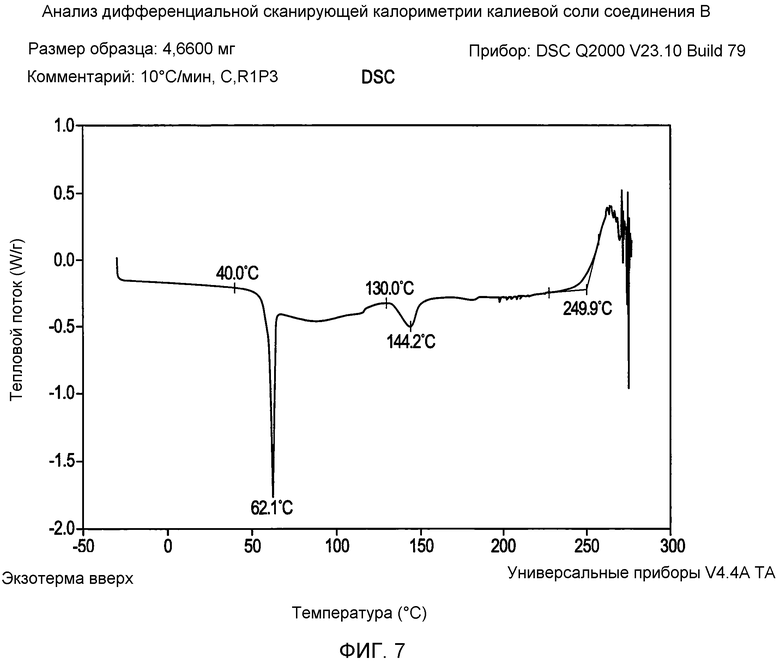
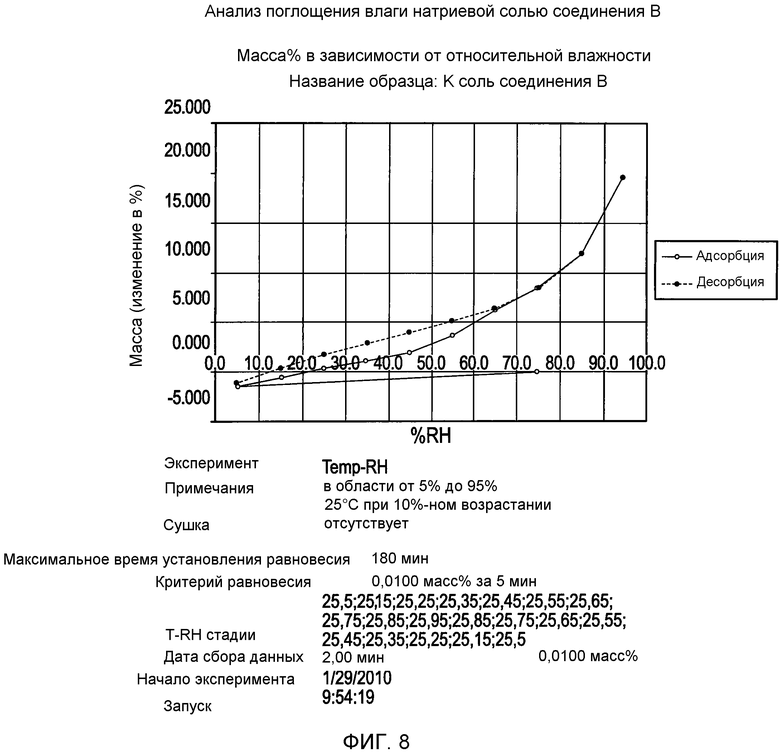
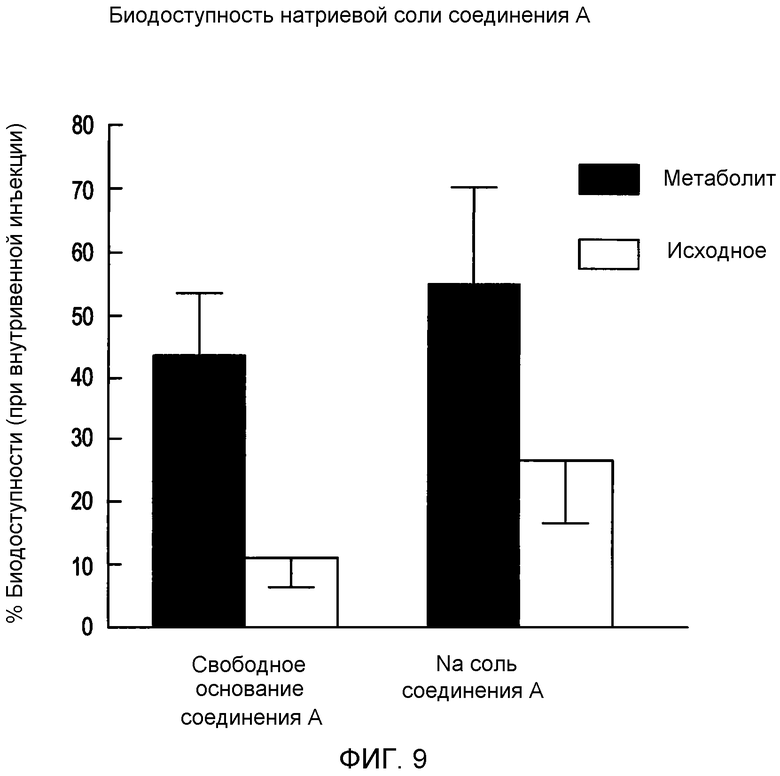
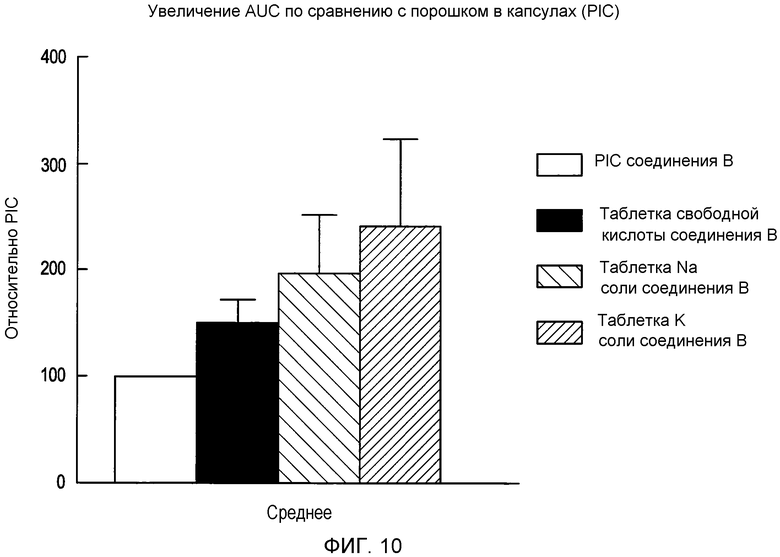
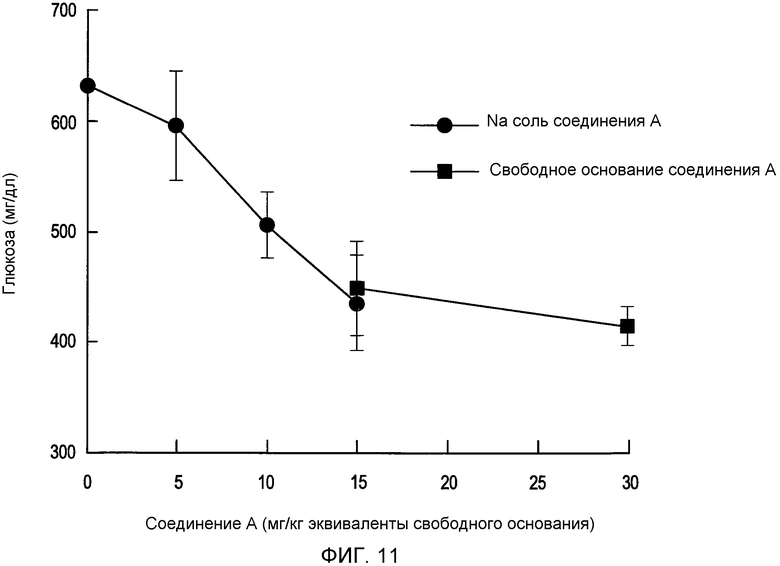
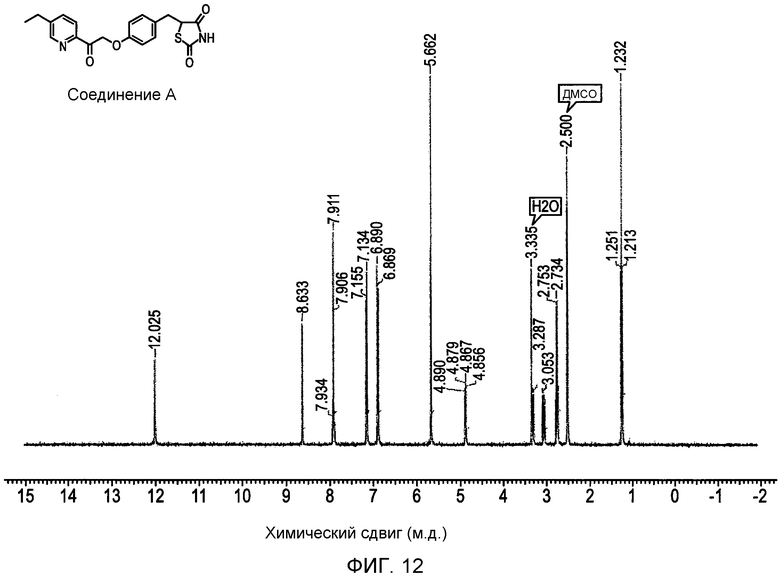
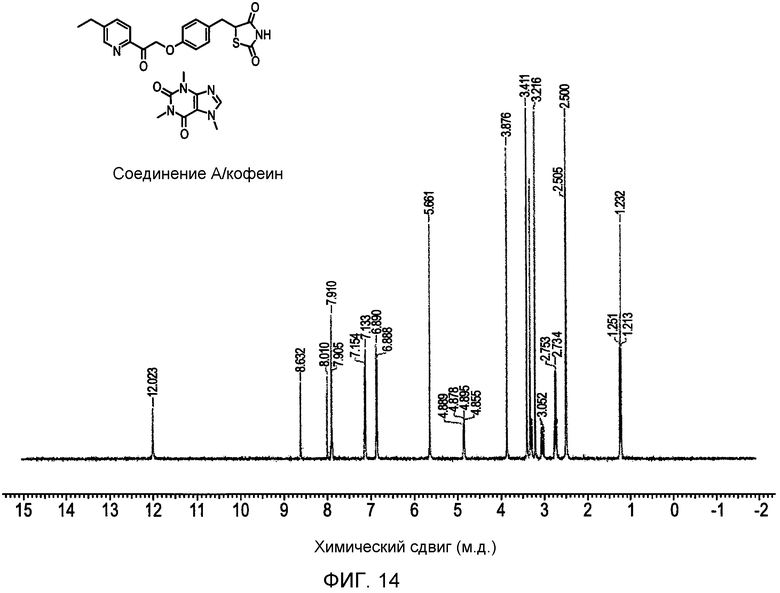
Настоящее изобретение относится к солям тиазолидиндиона, а именно натриевой соли соединения А или калиевой соли соединения B. Технический результат - соли тиазолидинона, которые могут использоваться для лечения и/или профилактики нарушения обмена веществ (например, диабета, ожирения или нейродегенеративных заболеваний (например, болезни Альцгеймера)). 14 ил., 13 табл., 28 пр.
 ,
, 
Натриевая соль соединения А или калиевая соль соединения B:
 ,
, 
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| STEPHEN M.BERGE et al.: "Pharmaceuticals salts", JOURNAL OF PHARMACEUTICAL SCIENCES, 1977, vol.66, no.1, p.1-16, | |||
| RICHARD J.BASTIN et al.: "Salt selection and optimization procedures for pharmaceutical new chemical entities", ORGANIC PROCESS RESEARCH & DEVELOPMENT, 2000, vol.4, no.5, p.427-435, | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2015-10-10—Публикация
2010-12-15—Подача