Притязание на приоритет
Эта заявка заявляет приоритет предварительной заявки U.S. No. 60/972639, зарегистрированной 14 сентября 2007 года, полное содержание которой включено в этот документ.
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции, которая включает селективные аналоги тиазолидиндиона для применения при лечении и предотвращении диабета и дислипидемии.
Уровень техники изобретения
За последние несколько десятилетий ученые постулировали, что PPARy представляет собой, как правило, общепризнанное место действия инсулин-сенсибилизирующих тиазолидиндионовых соединений.
Рецепторы, активируемые пролифератором пероксисом (PPAR), являются представителями суперсемейства ядерных гормональных рецепторов, которые представляют собой лиганд-активирующие транскрипционные факторы, регулирующие генную экспрессию. PPAR вовлечены в аутоиммунные заболевания и другие болезни, а именно, сахарный диабет, сердечно-сосудистое и желудочно-кишечное заболевание, и болезнь Альцгеймера.
PPARy представляет собой ключевой регулятор адипоцитной дифференциации и липидного метаболизма. PPARy также обнаружен в клетках других типов, включая фибробласты, миоциты, клетки молочной железы, человеческие предшественники клеток костного мозга и макрофаги/моноциты. Кроме того, было показано наличие PPARγ в макрофаговых пенистых клетках, в атеросклеротических бляшках.
Тиазолидиндионы, разработанные первоначально для лечения диабета типа 2, в большинстве случаев проявляют высокое сродство в качестве PPARγ лигандов. Обнаружение того, что тиазолидиндионы могут проявлять свои терапевтические эффекты посредством направленных взаимодействий с PPARγ, помогло обосновать концепцию, заключающуюся в том, что PPARγ представляет собой ключевой регулятор глюкозного и липидного гомеостаза. Вместе с тем, соединения, которые задействованы в активации PPARγ, также вызывают реабсорбцию натрия и другие нежелательные побочные эффекты.
Сущность изобретения
В целом, изобретение относится к соединениям, которые снижают связывание и активацию ядерного транскрипционного фактора PPARγ. Соединения, проявляющие активность PPARγ, стимулируют транскрипцию генов, что способствует реабсорбции натрия. Соединения этого изобретения снижают связывание или активацию ядерного транскрипционного фактора PPARγ, не увеличивают повторную адсорбцию натрия и поэтому являются более подходящими для лечения гипертензии, диабета и воспалительных заболеваний. Предпочтительно, соединения, имеющие более низкую PPARγ активность, проявляют меньше побочных эффектов, чем соединения, имеющие более высокие уровни PPARγ активности. Точнее говоря, за счет недостаточного PPARγ связывания и усиления активности эти соединения пригодны, в частности, для лечения гипертензии, диабета и воспалительных заболеваний как в виде индивидуальных веществ, так и в виде комбинации с другими классами антигипертензивных веществ. Поскольку гипертензия, диабет и воспалительные заболевания представляют собой существенный фактор риска при диабете и преддиабете, эти соединения также пригодны для лечения и профилактики диабета и других воспалительных заболеваний.
В одном аспекте, настоящее изобретение предоставляет фармацевтическую композицию, пригодную для лечения гипертензии, диабета и воспалительных заболеваний, включающую соединение формулы I:
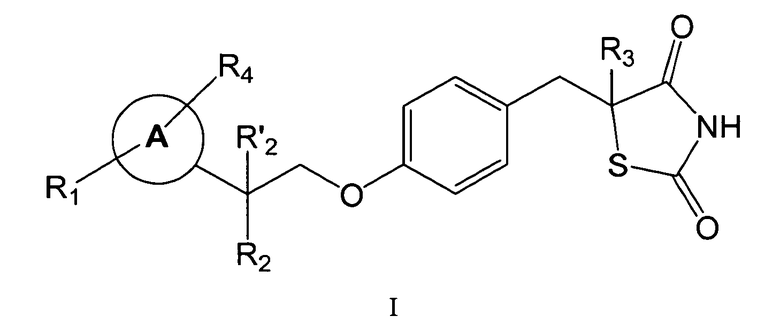
или его фармацевтически приемлемую соль, в которой
каждый из R1 и R4, независимо друг от друга, представляет собой выбранный из H, галогена, алифатической группы и алкоксигруппы, в котором алифатическая группа и алкоксигруппа необязательно замещены 1-3 галогенами;
R2 представляет собой галоген, гидроксигруппу или необязательно замещенную алифатическую группу, и R'2 представляет собой H, или R2 и R'2 вместе образуют оксогруппу;
R3 представляет собой H; и
кольцо A представляет собой фенил.
Другой аспект настоящего изобретения относится к способам лечения гипертензии, диабета и воспалительных заболеваний с помощью фармацевтической композиции, включающей соединение формулы I и фармацевтически приемлемый носитель.
Другой аспект этого изобретения относится к фармацевтическим композициям, включающим соединение формулы I и, по меньшей мере, один диуретик, такой как гидрохлоротиазид. Другие аспекты относятся к фармацевтическим композициям, пригодным для лечения гипертензии, диабета и воспалительных заболеваний, включающим соединение формулы I и одно или несколько веществ, ограничивающих активность ренин-ангиотензиновой системы, таких как ингибиторы ангиотензинпревращающего фермента, т.e. ACE ингибиторы, например, рамиприл, каптоприл, эналаприл или им подобные, и/или блокаторы рецепторов к ангиотензину II, т.e. ARBs, например, кандесартан, лозартан, олмесартан или им подобные; и/или ингибиторы ренина. Еще другие аспекты относятся к фармацевтической композиции, пригодной для лечения гипертензии, диабета и воспалительных заболеваний, включающей соединение формулы I и соединения, ограничивающие гипертензию альтернативными способами, включая блокаторы β-адренергического рецептора и блокаторы кальциевого канала, например, амлодипин.
Это изобретение также относится к фармацевтическим комбинациям, содержащим соединение формулы I и гиполипидемическое вещество. Соединения формулы I, благодаря их PPARγ-щадящим свойствам и полезным воздействиям на липиды, понижающим уровень триглицеридов и повышающим уровень холестерина липопротеинов высокой плотности (HDL), являются, в частности, пригодными к применению в комбинации с одним или несколькими статинами, т.e. ингибитором гидроксиметилглутарил-коэнзим А (HMG-CoA) редуктазы, например, аторвастатином, церивастатином, флувастатином, ловастатином, мевастатином, симвастатином, росувастатином, правастатином или какой-либо их фармацевтически приемлемой комбинацией.
В другом аспекте изобретение относится к сенсибилизаторам инсулина, которые снижают связывание и активацию ядерного транскрипционного фактора PPARγ и вследствие этого вызывают снижение повторной адсорбции натрия и меньшие дозолимитирующие побочные эффекты. Таким образом, соединения формулы I являются существенно более эффективными при лечении и предотвращении диабета и других метаболических заболеваний, связанных с воспалением, включая все аспекты резистентности к инсулину, связанные с метаболическим синдромом, включая дислипидемию и центральное ожирение. Соединения формулы I также пригодны для лечения других воспалительных заболеваний, таких как ревматоидный артрит, волчанка, миастения гравис, васкулит, хроническое обструктивное заболевание легких (COPD) и воспалительное заболевание кишечника, а также и нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, множественный склероз, острые аллергические реакции, отторжение трансплантата, центральное ожирение, дислипидемия, преддиабет и диабет.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, включающим соединение формулы I и метформин.
И еще в другом аспекте изобретение относится к фармацевтическим композициям, включающим соединение формулы I, второе вещество, фармацевтически приемлемый носитель, в которых второе вещество выбирают из ингибиторов дипептидилпептидазы IV, т.e. ингибиторов DPP-4, например, ситаглиптин, вилдаглиптин или им подобные; из станинов, т.e. ингибитор HMG-CoA редуктазы, например, аторвастатин, церивастатин, флувастатин, ловастатин, мевастатин, симвастатин, росувастатин, правастатин или какая-либо их фармацевтически приемлемая комбинация; из агонистов GLP-1 и -2; или их комбинации.
Еще в другом аспекте изобретение относится к комбинации соединения формулы I и глюкокортикоидного агониста, которая пригодна для лечения ряда воспалительных заболеваний и патологических состояний, включая методы лечения подавление иммунного ответа, предотвращение отторжения трансплантата и лечение аутоиммунных болезней. Типичные заболевания и патологические состояния включают ревматоидный артрит, волчанку, миастению гравис, мышечную дистрофию, васкулит, множественный склероз, хроническое обструктивное заболевание легких (COPD), воспалительное заболевание кишечника, лечение острых аллергических реакций и отторжение трансплантата.
Подробное описание изобретения
В описании нижеприведенные определения следует применять, если не оговорено нечто особое.
I. Определения
Для целей этого изобретения химические элементы идентифицируют в соответствии с Периодической системой элементов, издания Periodic Table of the Elements, CAS version, Handbook of Chemistry and Physics, 75th Ed. Кроме того, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001, их содержание в целом включено в настоящий документ в качестве ссылки.
Как описано в этом документе, соединения изобретения могут быть, но необязательно, замещены одним или несколькими заместителями, такими, как проиллюстрированные в общем виде выше, или как представленные определенными классами, подклассами и типами в изобретении.
В описании термин "глюкокортикоидный агонист" относится к стероидным гормонам, для которых характерна способность связываться с рецептором кортизола. Примеры глюкокортикоидных агонистов включают, но не ограничиваются только ими, гидрокортизон, кортизона ацетат, преднизон, преднизолон, метилпреднизолон, дексаметазон, бетаметазон, триамцинолон, беклометазон, флудрокортизона ацетат, дезоксикортикостерона ацетат (DOCA) и альдостерон.
В описании термин "алифатическая группа" охватывает термины "алкил", "алкенил", "алкинил", каждый из которых, но необязательно, замещен, как указано ниже.
В описании группа "алкил" относится к насыщенной алифатической углеводородной группе, содержащей 1-12 (например, 1-8, 1-6 или 1-4) атомов углерода. Алкильная группа может быть прямой или разветвленной. Примеры алкильных групп включают, но не ограничиваются только ими, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гептил или 2-этилгексил. Алкильная группа может быть замещенной (т.e., необязательно замещенной) одним или несколькими заместителями, такими как галоген, фосфогруппа, циклоалифатическая группа [например, циклоалкил или циклоалкенил], гетероциклоалифатическая группа [например, гетероциклоалкил или гетероциклоалкенил], арил, гетероарил, алкоксигруппа, ароил, гетероароил, ацил [например, алифатический карбонил, циклоалифатический карбонил, или гетероциклоалифатический карбонил], нитро, циано, амидо [например, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, алкиламинокарбонил, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, ариламинокарбонил или гетероариламинокарбонил], амино [например, алифатическая аминогруппа, циклоалифатическая аминогруппа или гетероциклоалифатическая аминогруппа], сульфонил [например, алифатическая группа-SO2-], сульфинил, сульфанил, сульфокси, карбамид, тиокарбамид, сульфамоил, сульфамид, оксо, карбокси, карбамоил, циклоалифатическая оксигруппа, гетероциклоалифатическая оксигруппа, арилокси, гетероарилокси, аралкилокси, гетероарилалкоксигруппа, алкоксикарбонил, алкилкарбонилокси или гидроксигруппа. Без ограничения только приведенными некоторые примеры замещенных алкилов включают карбоксиалкил (такой как HOOC-алкил, алкоксикарбонилалкил и алкилкарбонилоксиалкил), цианоалкил, гидроксиалкил, алкоксиалкил, ацилалкил, аралкил, (алкоксиарил)алкил, (сульфониламино)алкил (такой как (алкил-SO2-амино)алкил), аминоалкил, амидоалкил, циклоалифатический алкил или галогеналкил.
В описании к группе "алкенил" относится алифатическая углеродная группа, которая содержит 2-8 (например, 2-12, 2-6 или 2-4) атомов углерода и, по меньшей мере, одну двойную связь. Как и алкильная группа, алкенильная группа может быть прямой или разветвленной. Примеры алкенильной группы включают, но не ограничиваются только ими, аллил, изопренил, 2-бутенил и 2-гексенил. Алкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как галоген, фосфо, циклоалифатическая группа [например, циклоалкил или циклоалкенил], гетероциклоалифатическая группа [например, гетероциклоалкил или гетероциклоалкенил], арил, гетероарил, алкоксигруппа, ароил, гетероароил, ацил [например, алифатический карбонил, циклоалифатический карбонил или гетероциклоалифатический карбонил], нитро, циано, амидо [например, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, алкиламинокарбонил, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, ариламинокарбонил или гетероариламинокарбонил], амино [например, алифатическая аминогруппа, циклоалифатическая аминогруппа, гетероциклоалифатическая аминогруппа или алифатическая сульфониламиногруппа], сульфонил [например, алкил-SO2-, циклоалифатическая-SO2-группа или арил-SO2-], сульфинил, сульфанил, сульфокси, карбамид, тиокарбамид, сульфамоил, сульфамид, оксо, карбокси, карбамоил, циклоалифатическая оксигруппа, гетероциклоалифатическая оксигруппа, арилокси, гетероарилокси, аралкилокси, гетероаралкоксигруппа, алкоксикарбонил, алкилкарбонилокси или гидроксигруппа. Без ограничения только приведенными некоторые примеры замещенных алкенилов включают цианоалкенил, алкоксиалкенил, ацилалкенил, гидроксиалкенил, аралкенил, (алкоксиарил)алкенил, (сульфониламино)алкенил (такой как (алкил-SO2-амино)алкенил), аминоалкенил, амидоалкенил, циклоалифатический алкенил или галогеналкенил.
В описании к группе "алкинил" относится алифатическая углеродная группа, которая содержит 2-8 (например, 2-12, 2-6 или 2-4) атомов углерода и имеет, по меньшей мере, одну тройную связь. Алкинильная группа может быть прямой или разветвленной. Примеры алкинильной группы включают, но не ограничиваются только ими, пропаргил и бутинил. Алкинильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как ароил, гетероароил, алкоксигруппа, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, нитро, карбокси, циано, галоген, гидроксигруппа, сульфо, меркапто, сульфанил [например, алифатический сульфанил или циклоалифатический сульфанил], сульфинил [например, алифатический сульфинил или циклоалифатический сульфинил], сульфонил [например, алифатическая группа-SO2-, алифатическая группа-амино-SO2- или циклоалифатическая группа-SO2-], амидо [например, аминокарбонил, алкиламинокарбонил, алкилкарбониламино, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, циклоалкилкарбониламино, ариламинокарбонил, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (циклоалкилалкил)карбониламино, гетероаралкилкарбониламино, гетероарилкарбониламино или гетероариламинокарбонил], карбамид, тиокарбамид, сульфамоил, сульфамид, алкоксикарбонил, алкилкарбонилокси, циклоалифатическая группа, гетероциклоалифатическая группа, арил, гетероарил, ацил [например, циклоалифатический карбонил или гетероциклоалифатический карбонил], амино [например, алифатическая аминогруппа], сульфокси, оксо, карбокси, карбамоил, циклоалифатическая оксигруппа, гетероциклоалифатическая оксигруппа или (гетероарил)алкоксигруппа.
В описании "амидо" группа охватывает как "аминокарбонил", так и "карбониламино". Эти термины, когда применяются сами по себе или в составе другой группы, относятся к амидогруппе, такой как -N(RX)-C(O)-RY или -C(O)-N(RX)2, когда применяются в конце, и -C(O)-N(RX)- или -N(RX)-C(O)-, когда применяются внутри цепи, в которой Rx и RY представляют собой такие, как определено ниже. Примеры амидогрупп включают алкиламидо (такие как алкилкарбониламино или алкиламинокарбонил), гетероциклоалифатическая амидогруппа, (гетероаралкил)амидо, (гетероарил)амидо, (гетероциклоалкил)алкиламидо, ариламидо, аралкиламидо, (циклоалкил)алкиламидо или циклоалкиламидо.
В описании к группе "амино" относится -NRXRY, в которой каждый из Rx и RY представляет собой, независимо друг от друга, водород, алифатическую группу, циклоалифатическую группу, (циклоалифатическую)алифатическую группу, арил, аралифатическую группу, гетероциклоалифатическую группу, (гетероциклоалифатическую)алифатическую группу, гетероарил, карбокси, сульфанил, сульфинил, сульфонил, алифатический карбонил, циклоалифатический карбонил, (циклоалифатический)алифатический карбонил, арилкарбонил, аралифатический карбонил, гетероциклоалифатический карбонил, (гетероциклоалифатический)алифатический карбонил, (гетероарил)карбонил или гетероаралифатический карбонил, каждый из которых определен в этом документе и является необязательно замещенным. Примеры аминогрупп включают алкиламино, диалкиламино или ариламино. Когда термин "амино" не представляет собой концевую группу (например, алкилкарбониламино), он представлен в виде -NRx-. Rx имеет те же значения, как определено выше.
В описании группа "арил" применяется сама по себе или как составная часть более крупного фрагмента, как в "аралкил", "аралкокси" или "арилоксиалкил", относится к моноциклическим (например, фенил); бициклическим (например, инденил, нафталенил, тетрагидронафтил, тетрагидроинденил); и трициклическим (например, флуоренил, тетрагидрофлуоренил или тетрагидроантраценил, антраценил) кольцевым системам, в которых моноциклическая кольцевая система является ароматической или, по меньшей мере, одно из колец в бициклической или трициклической кольцевой системе является ароматическим. Бициклические и трициклические группы включают бензоконденсированные 2-3-членные карбоциклические кольцевые структуры. Например, бензоконденсированная группа включает фенил, конденсированный с двумя или более C4-8 карбоциклическими фрагментами. Арил представляет собой необязательно замещенный одним или несколькими заместителями, включающими алифатическую группу [например, алкил, алкенил или алкинил]; циклоалифатическую группу; (циклоалифатическую)алифатическую группу; гетероциклоалифатическую группу; (гетероциклоалифатическую)алифатическую группу; арил; гетероарил; алкоксигруппу; циклоалифатическую оксигруппу; гетероциклоалифатическую оксигруппу; арилокси; гетероарилокси; аралифатическую оксигруппу; гетероаралифатическую оксигруппу; ароил; гетероароил; амино; оксо (при неароматическом карбоциклическом кольце бензоконденсированного бициклического или трициклического арила); нитро; карбокси; амидо; ацил [например, алифатический карбонил; циклоалифатический карбонил; (циклоалифатический)алифатический карбонил; аралифатический карбонил; гетероциклоалифатический карбонил; (гетероциклоалифатический)алифатический карбонил; или гетероаралифатический карбонил]; сульфонил [например, алифатическая группа-SO2- или амино-SO2-]; сульфинил [например, алифатическая группа-S(O)- или циклоалифатическая группа-S(O)-]; сульфанил [например, алифатическая группа-S-]; циано; галоген; гидроксигруппа; меркапто; сульфокси; карбамид; тиокарбамид; сульфамоил; сульфамид; или карбамоил. Альтернативно, арил может быть незамещенным.
Неограничивающие выбор примеры замещенных арилов включают галогенарил [например, моно-, ди- (такой как п,м-дигалогенарил) и (тригалоген)арил]; (карбокси)арил [например, (алкоксикарбонил)арил, ((аралкил)карбонилокси)арил и (алкоксикарбонил)арил]; (амидо)арил [например, (аминокарбонил)арил, (((алкиламино)алкил)аминокарбонил)арил, (алкилкарбонил)аминоарил, (ариламинокарбонил)арил и (((гетероарил)амино)карбонил)арил]; аминоарил [например, ((алкилсульфонил)амино)арил или ((диалкил)амино)арил]; (цианоалкил)арил; (алкокси)арил; (сульфамоил)арил [например, (аминосульфонил)арил]; (алкилсульфонил)арил; (циано)арил; (гидроксиалкил)арил; ((алкокси)алкил)арил; (гидрокси)арил, ((карбокси)алкил)арил; (((диалкил)амино)алкил)арил; (нитроалкил)арил; (((алкилсульфонил)амино)алкил)арил; ((гетероциклоалифатическая группа)карбонил)арил; ((алкилсульфонил)алкил)арил; (цианоалкил)арил; (гидроксиалкил)арил; (алкилкарбонил)арил; алкиларил; (тригалогеналкил)арил; п-амино-м-алкоксикарбониларил; п-амино-м-цианоарил; п-галоген-м-аминоарил; или (м-(гетероциклоалифатическая группа)-o-(алкил))арил.
В описании к группе "аралифатическая", такая как "аралкил", относится алифатическая группа (например, C1-4 алкильная группа), которая замещена арильной группой. "Алифатическая группа", "алкил" и "арил" определены в настоящем описании. Пример аралифатической группы, такой как аралкильная группа, представляет собой бензил.
В описании к группе "аралкил" относится алкильная группа (например, C1-4 алкильная группа), которая замещена арильной группой. Как "алкил", так и "арил" были определены выше. Пример аралкильной группы представляет собой бензил. Аралкил является необязательно замещенным одним или несколькими заместителями, такими как алифатическая группа [например, алкил, алкенил или алкинил, включая карбоксиалкил, гидроксиалкил или галогеналкил, такие как трифторметил], циклоалифатическая группа [например, циклоалкил или циклоалкенил], (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкоксигруппа, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, амидо [например, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, или гетероаралкилкарбониламино], циано, галоген, гидроксигруппа, ацил, меркапто, алкилсульфанил, сульфокси, карбамид, тиокарбамид, сульфамоил, сульфамид, оксо или карбамоил.
В описании "бициклическая кольцевая система" включает 8-12 (например, 9, 10 или 11)-членные структуры, которые образуют два кольца, в которых два кольца имеют, по меньшей мере, один общий атом (например, 2 общих атома). Бициклические кольцевые системы включают бициклоалифатические группы (например, бициклоалкил или бициклоалкенил), бициклогетероалифатические группы, бициклические арилы и бициклические гетероарилы.
В описании "циклоалифатическая" группа охватывает "циклоалкильную" группу и "циклоалкенильную" группу, каждая из которых необязательно замещена, как указано ниже.
В описании к "циклоалкильной" группе относится насыщенное карбоциклическое моно- или бициклическое (конденсированное или соединенное «мостиковой» связью) кольцо из 3-10 (например, 5-10) атомов углерода. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, норборнил, кубил, октагидроинденил, декагидронафтил, бицикло[3,2,1]октил, бицикло[2,2,2]октил, бицикло[3,3,1]нонил, бицикло[3,3,2]децил, бицикло[2,2,2]октил, адамантил, или ((аминокарбонил)циклоалкил)циклоалкил.
К "циклоалкенильной" группе в описании относится неароматическое карбоциклическое кольцо из 3-10 (например, 4-8) атомов углерода, имеющее одну или несколько двойных связей. Примеры циклоалкенильных групп включают циклопентенил, 1,4-циклогексадиенил, циклогептенил, циклооктенил, гексагидроинденил, октагидронафтил, циклогексенил, циклопентенил, бицикло[2,2,2]октенил или бицикло[3,3,1]ноненил.
Циклоалкильная или циклоалкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как фосфор, алифатическая группа [например, алкил, алкенил, или алкинил], циклоалифатическая группа, (циклоалифатическая)алифатическая группа, гетероциклоалифатическая группа, (гетероциклоалифатическая)алифатическая группа, арил, гетероарил, алкоксигруппа, циклоалифатическая оксигруппа, гетероциклоалифатическая оксигруппа, арилокси, гетероарилокси, аралифатическая оксигруппа, гетероаралифатическая окси-группа, ароил, гетероароил, амино, амидо [например, алифатическая карбониламиногруппа, циклоалифатическая карбониламиногруппа, (циклоалифатическая)алифатическая карбониламиногруппа, (арил)карбониламино, аралифатическая карбониламиногруппа, гетероциклоалифатическая карбониламиногруппа, (гетероциклоалифатическая)алифатическая карбониламиногруппа, (гетероарил)карбониламино или гетероаралифатическая карбониламиногруппа)], нитро, карбокси [например, HOOC-, алкоксикарбонил или алкилкарбонилокси], ацил [например, циклоалифатическая карбонильная группа, (циклоалифатическая) алифатическая карбонильная группа, аралифатическая карбонильная группа, гетероциклоалифатическая карбонильная группа, (гетероциклоалифатическая)алифатическая карбонильная группа или гетероаралифатическая карбонильная группа], циано, галоген, гидрокси-группа, меркапто, сульфонил [например, алкил-SO2- и арил-SO2-], сульфинил [например, алкил-S(O)-], сульфанил [например, алкил-S-], сульфокси, карбамид, тиокарбамид, сульфамоил, сульфамид, оксогруппа или карбамоил.
В описании термин "гетероциклоалифатическая группа" охватывает гетероциклоалкильную группу и гетероциклоалкенильную группу, каждая из которых необязательно замещена, как указано ниже.
В описании к группе "гетероциклоалкил" относится 3-10-членная моно- или бициклическая (конденсированная или соединенная «мостиковой» связью) (например, 5-10-членная моно- или бициклическая) насыщенная кольцевая структура, в которой один или несколько кольцевых атомов являются гетероатомом (например, N, O, S или их комбинации). Примеры гетероциклоалкильной группы включают пиперидил, пиперазил, тетрагидропиранил, тетрагидрофурил, 1,4-диоксоланил, 1,4-дитианил, 1,3-диоксоланил, оксазолидил, изоксазолидил, морфолинил, тиоморфолил, октагидробензофурил, октагидрохроменил, октагидротиохроменил, октагидроиндолил, октагидропириндинил, декагидрохинолинил, октагидробензо[b]тиофенеил, 2-окса-бицикло[2,2,2]октил, 1-аза-бицикло[2,2,2]октил, 3-аза-бицикло[3,2,1]октил и 2,6-диокса-трицикло[3,3,1,03,7]нонил. Моноциклическая гетероциклоалкильная группа может быть конденсированной с фенильным фрагментом с образованием таких структур, как тетрагидроизохинолин, который можно отнести к категории гетероарилов.
К "гетероциклоалкенильной" группе в описании относится моно- или бициклическая (например, 5-10-членная моно- или бициклическая) неароматическая кольцевая структура, имеющая одну или несколько двойных связей, и в которой один или несколько кольцевых атомов являются гетероатомом (например, N, O или S). Моноциклические и бициклические гетероциклоалифатические группы имеют нумерацию в соответствии со стандартной химической номенклатурой.
Гетероциклоалкильная или гетероциклоалкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как фосфор, алифатическая группа [например, алкил, алкенил или алкинил], циклоалифатическая группа, (циклоалифатическая)алифатическая группа, гетероциклоалифатическая группа, (гетероциклоалифатическая)алифатическая группа, арил, гетероарил, алкоксигруппа, циклоалифатическая оксигруппа, гетероциклоалифатическая оксигруппа, арилокси, гетероарилокси, аралифатическая оксигруппа, гетероаралифатическая оксигруппа, ароил, гетероароил, амино, амидо [например, алифатическая карбониламиногруппа, циклоалифатическая карбониламиногруппа, (циклоалифатическая)алифатическая карбониламиногруппа, (арил)карбониламино, аралифатическая карбониламиногруппа, гетероциклоалифатическая карбониламиногруппа, (гетероциклоалифатическая)алифатическая карбониламиногруппа, (гетероарил)карбониламино или гетероаралифатическая карбониламиногруппа], нитро, карбокси [например, HOOC-, алкоксикарбонил или алкилкарбонилокси], ацил [например, циклоалифатический карбонил, (циклоалифатический)алифатический карбонил, аралифатический карбонил, гетероциклоалифатический карбонил, (гетероциклоалифатический)алифатический карбонил или гетероаралифатический карбонил], нитро, циано, галоген, гидроксигруппа, меркапто, сульфонил [например, алкилсульфонил или арилсульфонил], сульфинил [например, алкилсульфинил], сульфанил [например, алкилсульфанил], сульфокси, карбамид, тиокарбамид, сульфамоил, сульфамид, оксо-группа или карбамоил.
К "гетероарильной" группе в описании относится моноциклическая, бициклическая или трициклическая кольцевая система, имеющая от 4 до 15 кольцевых атомов, в которой один или несколько кольцевых атомов являются гетероатомом (например, N, O, S или их комбинации) в которой моноциклическая кольцевая система является ароматической или, по меньшей мере, одно из колец в бициклической или трициклической кольцевых системах является ароматическим. Гетероарильная группа включает бензоконденсированную кольцевую систему, имеющую от 2 до 3 колец. Например, бензоконденсированная группа включает бензогруппу, конденсированную с одним или двумя от 4 до 8-членными гетероциклоалифатическими фрагментами (например, индолизил, индолил, изоиндолил, 3H-индолил, индолинил, бензо[b]фурил, бензо[b]тиофенил, хинолинил или изохинолинил). Некоторые примеры гетероарилов представляют собой азетидинил, пиридил, 1H-индазолил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, тетразолил, бензофурил, изохинолинил, бензтиазолил, ксантен, тиоксантен, фенотиазин, дигидроиндол, бензо[1,3]диоксол, бензо[b]фурил, бензо[b]тиофенил, индазолил, бензимидазолил, бензтиазолил, пурил, циннолил, хинолил, хиназолил, циннолил, фталазил, хиназолил, хиноксалил, изохинолил, 4H-хинолизил, бензо-l,2,5-тиадиазолил или 1,8-нафтиридил.
Не ограничиваясь только указанными, моноциклические гетероарилы включают фурил, тиофенил, 2H-пирролил, пирролил, оксазолил, тазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, 1,3,4-тиадиазолил, 2H-пиранил, 4H-пиранил, пиридил, пиридазил, пиримидил, пиразолил, пиразил или 1,3,5-триазил. Моноциклические гетероарилы имеют нумерацию в соответствии со стандартной химической номенклатурой.
Не ограничиваясь только указанными, бициклические гетероарилы включают индолизил, индолил, изоиндолил, 3H- индолил, индолинил, бензо[b]фурил, бензо[b]тиофенил, хинолинил, изохинолинил, индолизил, изоиндолил, индолил, бензо[b]фурил, бензо[b]тиофенил, индазолил, бензимидазил, бензтиазолил, пуринил, 4H-хинолизил, хинолил, изохинолил, циннолил, фталазил, хиназолил, хиноксалил, 1,8-нафтиридил или птеридил. Бициклические гетероарилы имеют нумерацию в соответствии со стандартной химической номенклатурой.
Гетероарил является необязательно замещенным одним или несколькими заместителями, такими как алифатическая группа [например, алкил, алкенил или алкинил]; циклоалифатическая группа; (циклоалифатическая)алифатическая группа; гетероциклоалифатическая группа; (гетероциклоалифатическая)алифатическая группа; арил; гетероарил; алкоксигруппа; циклоалифатическая окси-группа; гетероциклоалифатическая оксигруппа; арилокси; гетероарилокси; аралифатическая оксигруппа; гетероаралифатическая оксигруппа; ароил; гетероароил; амино; оксогруппа (на неароматическом карбоциклическом или гетероциклическом кольце бициклического или трициклического гетероарила); карбокси; амидо; ацил [например, алифатический карбонил; циклоалифатический карбонил; (циклоалифатический)алифатический карбонил; аралифатический карбонил; гетероциклоалифатический карбонил; (гетероциклоалифатический)алифатический карбонил; или гетероаралифатический карбонил]; сульфонил [например, алифатический сульфонил или аминосульфонил]; сульфинил [например, алифатический сульфинил]; сульфанил [например, алифатический сульфанил]; нитро; циано; галоген; гидроксигруппа; меркапто; сульфокси; карбамид; тиокарбамид; сульфамоил; сульфамид; или карбамоил. Альтернативно, гетероарил может быть незамещенным.
Не ограничиваясь приведенными примерами, замещенные гетероарилы включают (галоген)гетероарил [например, моно- и ди-(галоген)гетероарил]; (карбокси)гетероарил [например, (алкоксикарбонил)гетероарил]; цианогетероарил; аминогетероарил [например, ((алкилсульфонил)амино)гетероарил и ((диалкил)амино)гетероарил]; (амидо)гетероарил [например, аминокарбонилгетероарил, ((алкилкарбонил)амино)гетероарил, ((((алкил)амино)алкил)аминокарбонил)гетероарил, (((гетероарил)амино)карбонил)гетероарил, ((гетероциклоалифатический)карбонил)гетероарил и ((алкилкарбонил)амино)гетероарил]; (цианоалкил)гетероарил; (алкокси)гетероарил; (сульфамоил)гетероарил [например, (аминосульфонил)гетероарил]; (сульфонил)гетероарил [например, (алкилсульфонил)гетероарил]; (гидроксиалкил)гетероарил; (алкоксиалкил)гетероарил; (гидрокси)гетероарил; ((карбокси)алкил)гетероарил; (((диалкил)амино)алкил]гетероарил; (гетероциклоалифатический)гетероарил; (циклоалифатический)гетероарил; (нитроалкил)гетероарил; (((алкилсульфонил)амино)алкил)гетероарил; ((алкилсульфонил)алкил)гетероарил; (цианоалкил)гетероарил; (ацил)гетероарил [например, (алкилкарбонил)гетероарил]; (алкил)гетероарил и (галогеналкил)гетероарил [например, тригалогеналкилгетероарил].
"Гетероаралифатическая группа" (такая как гетероаралкильная группа) в описании относится к алифатической группе (например, C1-4 алкильной группе), которая замещена гетероарильной группой. "Алифатическая группа", "алкил" и "гетероарил" были определены выше.
"Гетероаралкильная" группа в описании относится к алкильной группе (например, C1-4 алкильной группе), которая замещена гетероарильной группой. Как "алкил", так и "гетероарил" были определены выше. Гетероаралкил является необязательно замещенным одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкоксигруппа, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидроксигруппа, ацил, меркапто, алкилсульфанил, сульфокси, карбамид, тиокарбамид, сульфамоил, сульфамид, оксогруппа или карбамоил.
В описании "циклический фрагмент" и "циклическая группа" относятся к моно-, би- и трициклическим кольцевым системам, включая циклоалифатическую, гетероциклоалифатическую, арильную или гетероарильную, каждая из которых ранее была определена.
В описании "бициклическая кольцевая система с «мостиковой» связью" относится к бициклической гетероциклической алифатической кольцевой системе или бициклической циклоалифатической кольцевой системе, в которой кольца связаны «мостиковой» связью. Примеры бициклических кольцевых систем с «мостиковой» связью включают, но не ограничиваются только ими, адамантанил, норборнанил, бицикло[3,2,1]октил, бицикло[2,2,2]октил, бицикло[3,3,1]нонил, бицикло[3,2,3]нонил, 2-оксабицикло[2,2,2]октил, l-азабицикло[2,2,2]октил, 3-азабицикло[3,2,1]октил и 2,6-диокса-трицикло[3,3,1,03,7]нонил. Бициклическая кольцевая система с мостиковой связью может быть необязательно замещенной одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкоксигруппа, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксиакарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидроксигруппа, ацил, меркапто, алкилсульфанил, сульфокси, карбамид, тиокарбамид, сульфамоил, сульфамид, оксогруппа или карбамоил.
В описании "ацильная" группа относится к формильной группе или Rx-C(O)- (такой как алкил-C(O)-, также обознчаемой как "алкилкарбонил"), в которой Rx и "алкил" были определены ранее. Ацетил и пивалоил представляют собой примеры ацильных групп.
В описании "ароил" или "гетероароил" относится к арил-C(O)- или гетероарил-C(O)-. Арильная или гетероарильная часть ароила или гетероароила является необязательно замещенной, как определено ранее.
В описании "алкоксильная" группа относится к алкил-O-группе, в которой "алкил" был определен ранее.
В описании "карбамоильная" группа относится к группе, имеющей структуру -O-CO-NRxRY или -NRx-CO-O-RZ, в которой Rx и RY были определены выше и RZ может быть алифатической группой, арилом, аралифатической группой, гетероциклоалифатической группой, гетероарилом или гетероаралифатической группой.
В описании "карбоксильная" группа относится к -COOH, -COORx, -OC(O)H, -OC(O)Rx, когда подразумевается как концевая группа; или -OC(O)- или -C(O)O-, когда подразумевается как промежуточная группа.
В описании "галогеналифатическая" группа относится к алифатической группе, замещенной 1-3 галогенами. Например, термин "галогеналкил" включает группу -CF3.
В описании "меркапто" группа относится к -SH.
В описании "сульфо" группа относится к -SO3H или -SO3RX, когда подразумевается как концевая группа, или -S(O)3-, когда подразумевается как промежуточная группа.
В описании "сульфамидная" группа относится к структуре -NRx-S(O)2-NRYRZ, когда подразумевается в качестве концевой, и -NRx-S(O)2-NRY-, когда подразумевается в качестве промежуточной, в которой Rx, RY и RZ были определены выше.
В описании "сульфонамидная" группа относится к структуре -S(O)2-NRxRY или -NRx-S(O)2-RZ, когда подразумевается в качестве концевой; или -S(O)2-NRx- или -NRx -S(O)2-, когда подразумевается в качестве промежуточной, в которой Rx, RY и RZ определены выше.
В описании "сульфанильная" группа относится к -S-Rx, когда подразумевается в качестве концевой, и -S-, когда подразумевается в качестве промежуточной, в которой Rx был определен выше. Примеры сульфанилов включают алифатическая группа-S-, циклоалифатическая группа-S-, арил-S- или им подобные.
В описании "сульфинильная" группа относится к -S(O)-Rx, когда подразумевается в качестве концевой, и -S(O)-, когда подразумевается в качестве промежуточной, в которой Rx был определен выше. Типичные сульфинильные группы включают алифатическая группа-S(O)-, арил-S(O)-, (циклоалифатическая группа(алифатическая группа))-S(O)-, циклоалкил-S(O)-, гетероциклоалифатическая группа-S(O)-, гетероарил-S(O)- или им подобные.
В описании "сульфонильная" группа относится к -S(O)2-Rx, когда подразумевается в качестве концевой, и -S(O)2-, когда подразумевается в качестве промежуточной, в которой Rx был определен выше. Типичные сульфонильные группы включают алифатическая группа-S(O)2-, арил-S(O)2-, (циклоалифатическая группа(алифатическая группа))-S(O)2-, циклоалифатическая группа-S(O)2-, гетероциклоалифатическая группа-S(O)2-, гетероарил-S(O)2-, (циклоалифатическая группа(амидо(алифатическая группа)))-S(O)2- или им подобные.
В описании "сульфоксильная" группа относится к -O-SO-Rx или -SO-O-Rx, когда подразумевается в качестве концевой, и -0-S(O)- или -S(O)-O-, когда подразумевается в качестве промежуточной, где Rx был определен выше.
В описании "галоген" или "галогенная" группа относится к фтору, хлору, брому или йоду.
В описании "алкоксикарбонил", который охватывается термином "карбокси", используется сам по себе или в связи с другой группой, относится к такой группе, как алкил-O-C(O)-.
В описании "алкоксиалкил" относится к алкильной группе, такой как алкил-O-алкил-, в которой алкил был определен выше.
В описании "карбонил" относится к -C(O)-.
В описании "оксо" относится к =О.
В описании термин "фосфо" относится к фосфинатам и фосфонатам. Примеры фосфинатов и фосфонатов включают -P(O)(RP)2, где RP представляет собой алифатическую группу, алкоксигруппу, арилокси, гетероарилокси, циклоалифатическая оксигруппа, гетероциклоалифатический оксиарил, гетероарил, циклоалифатическую группу или аминогруппу.
В описании "аминоалкил" относится к структуре (Rx)2N-алкил-.
В описании "цианоалкил" относится к структуре (NC)-алкил-.
В описании "карбамидная" группа относится к структуре -NRx-CO-NRYRZ и "тиокарбамидная" группа относится к структуре -NRx-CS-NRYRZ, когда подразумевается в качестве концевой, и -NRx-CO-NRY- или -NRx-CS-NRY-, когда подразумевается в качестве промежуточной, в которой Rx, RY и RZ были определены выше.
В описании "гуанидиновая" группа относится к структуре -N=C(N(RxRY))N(RxRY) или -NRx-C(=NRx)NRxRY, в которой Rx и RY были определены выше.
В описании термин "амидиновая" группа относится к структуре -C=(NRx)N(RxRY), в которой Rx и RY были определены выше.
Как правило, термин "вицинальный" относится к расположению заместителей у группы, которая включает два или несколько атомов углерода, в которой заместители присоединены к соседним углеродным атомам.
Как правило, термин "геминальный" относится к расположению заместителей у группы, которая включает два или несколько атомов углерода, в которой заместители присоединены к одному и тому же углеродному атому.
Термины "концевой" и "промежуточный" относятся к расположению группы внутри заместителя. Группа представляет собой концевую, когда группа присутствует на конце заместителя, дополнительно не связанного с остальной химической структурой. Карбоксиалкил, т.e., RxO(O)C-алкил представляет собой пример карбоксильной группы, расположенной как концевая. Группа представляет собой промежуточную, когда группа присутствует в середине химической структуры заместителя. Алкилкарбокси (например, алкил-C(O)O- или алкил-OC(O)-) и алкилкарбоксиарил (например, алкил-C(O)O-арил- или алкил-O(CO)-арил-) представляют собой примеры карбоксильных групп, расположенных как промежуточные.
В описании "алифатическая цепь" относится к разветвленной или прямой алифатической группе (например, алкильные группы, алкенильные группы или алкинильные группы). Прямая алифатическая цепь имеет структуру -[CH2]V-, в которой v представляет собой 1-12. Разветвленная алифатическая цепь представляет собой прямую алифатическую цепь, которая замещена одной или несколькими алифатическими группами. Разветвленная алифатическая цепь имеет структуру [CQQ]v-, в которой Q представляют собой, независимо друг от друга, водород или алифатическую группу; при этом Q должна быть алифатической группой в по меньшей мере одном случае. Термин "алифатическая цепь" включает алкильные цепи, алкенильные цепи и алкинильные цепи, в которых алкил, алкенил и алкинил определены выше.
Выражение "необязательно замещенный" используется на равных правах с выражением "замещенный или незамещенный". Как описано в настоящем описании, соединения изобретения могут быть необязательно замещенными одним или несколькими заместителями, такими как проиллюстрировано в общем виде выше, или как представлены определенными классами, подклассами и типами в изобретении. Как описано в настоящем описании, переменные значения R1, R2 и R3, и другие переменные значения, содержащиеся в формуле, описанной в настоящем описании, охватывают специфические группы, такие как алкил и арил. За исключеним указанного иначе, каждая из специфических групп для переменных значений R1, R2 и R3, и других переменных значений, содержащихся в них, может быть необязательно замещена одним или несколькими заместителями, описанными в настоящем описании. Каждый заместитель специфической группы дополнительно необязательно замещен одним и вплоть до трех галогеном, цианогруппой, оксогруппой, алкоксигруппой, гидроксигруппой, аминогруппой, нитрогруппой, арилом, циклоалифатической группой, гетероциклоалифатической группой, гетероарилом, галогеналкилом и алкилом. Например, алкильная группа может быть замещена алкилсульфанилом, и алкилсульфанил может быть необязательно замещенным одним и вплоть до трех галогеном, цианогруппой, оксогруппой, алкоксигруппой, гидроксигруппой, аминогруппой, нитрогруппой, арилом, галогеналкилом и алкилом. В качестве дополнительного примера, циклоалкильная часть (циклоалкил)карбониламиногруппы может быть необязательно замещенной одним и вплоть до трех галогеном, цианогруппой, алкоксигруппой, гидроксигруппой, нитрогруппой, галогеналкилом и алкилом. Когда две алкоксигруппы связаны с одним и тем же атомом или с соседними атомами, две алкоксигруппы могут сформировать кольцо вместе с атомом(атомами), с которыми они связаны.
Как правило, термин "замещенный", вне зависимости от того, предшествует ли ему термин "необязательно" или нет, относится к замещению водородных радикалов в данной структуре радикалом определенного заместителя. Конкретные заместители описаны выше в определениях и ниже в описании соединений и их примерах. За исключением особо оговоренных случаев, необязательно замещенная группа может иметь заместитель в любом замещаемом положении группы, и в случае, когда более чем одно положение в какой-либо данной структуре может быть замещено более чем одним заместителем, выбранным из определенной группы, заместитель может быть либо тем же самым, либо различным в каждом положении. Заместитель кольцевой структуры, такой как гетероциклоалкил, может быть связан с другим кольцом, таким как циклоалкил, формируя спиробициклическую кольцевую систему, например, с участием одного общего атома обоих колец. Как известно любому среднему специалисту в данной области техники, комбинации заместителей, предусмотренные этим изобретением, представляют собой такие комбинации, которые в результате приводят к образованию стабильных или химически допустимых соединений.
Выражение "стабильные или химически допустимые" в описании относится к соединениям, которые существенно не изменяются в случае, когда подвергаются воздействию условий, обеспечивающих их получение, определение и, предпочтительно, их выделение, очистку и применение для одной или нескольких целей, раскрытых в настоящем описании. В некоторых примерах осуществления изобретения стабильное соединение или химически допустимое соединение представляет собой такое соединение, которое существенно не изменяется в процессе хранения при температуре 40°C или ниже, в отсутствие влаги или других химически активных условий, в течение, по меньшей мере, недели.
В описании "эффективное количество" определяется как количество, необходимое для предоставления терапевтического эффекта пациенту, подвергаемому лечению, и обычно определяется, основываясь на возрасте, площади поверхности, массе и состоянии пациента. Взаимосвязь дозировок для животных и людей (основываясь на миллиграммах на квадратный метр площади поверхности тела) описана в Freireich et al., Cancer Chemother. Rep., 50: 219 (1966). Площадь поверхности тела может быть приблизительно определена по росту и массе пациента. См., например, Scientific Tables, Geigy Pharmaceuticals, Ardsley, New York, 537 (1970). В описании "пациент" относится к млекопитающим, включая человека.
За исключением особо установленных случаев, структуры, представленные в этом документе, также подразумевают включение всех изомерных (например., энантиомерных, диастереомерных и геометрических (или конформационных)) форм структуры; например, R- и S-конфигураций для каждого асимметрического центра, (Z)- и (E)-изомеров по двойной связи, и (Z)- и (E)-конформационных изомеров. Таким образом, одиночные стереохимические изомеры, а также и энантиомерные, диастереомерные и геометрические (или конформационные) смеси представленных соединений находятся в рамках объема изобретения. За исключением особо установленных случаев, все таутомерные формы соединений изобретения находятся в рамках объема изобретения. Кроме того, за исключением особо установленных случаев, структуры, представленные в этом документе также подразумевают включение соединений, которые различаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие представленные структуры, за исключением того, что существует замещение водорода на дейтерий или тритий или замещение углерода на 13C- или 14C-обогащенный углерод, находятся в рамках объема этого изобретения. Такие соединения пригодны к применению, например, в качестве аналитических инструментов или проб в биологических испытаниях, или в качестве терапевтических средств.
II. Фармацевтические композиции
Обычно считают, что эффективные инсулин-сенсибилизирующие соединения должны иметь высокую PPARγ активность, и наоборот, что соединения, имеющие пониженную PPARγ активность, проявят пониженную инсулин-сенсибилизирующую активность. Противоположно этому убеждению, тиазолидиндионовые соединения настоящего изобретения представляют собой уникально эффективные для лечения гипертензии, диабета и воспалительных заболеваний и имеют пониженное взаимодействие с PPARγ.
Не углубляясь в теоретические основы, считают, что метаболическое воспаление является главной причиной многочисленных основных заболеваний, включая гипертензию, диабет и воспалительные заболевания. Кроме того, считают, что тиазолидиндионы настоящего изобретения действуют для предотвращения гипертензии, диабета и воспалительных заболеваний через посредство митохондриального механизма. Более того, поскольку дозолимитирующие побочные эффекты, обусловленные взаимодействием с PPARγ, снижены у соединений настоящего изобретения; особенно у стереоселективных изомеров, соединения формулы I представляют собой очень подходящие для применения при лечении гипертензии, диабета и воспалительных заболеваний.
Кроме того, поскольку аналоги тиазолидиндиона настоящего изобретения действуют через посредство митохондриального механизма, соединения формулы I представляют собой пригодные для применения при лечении или предотвращении всех болезненных состояний, в которых метаболическое воспаление представляет собой предпосылку патологии.
Более того, поскольку дозолимитирующие побочные эффекты, обусловленные взаимодействием с PPARγ, снижены у соединений настоящего изобретения; особенно у стереоселективных изомеров, соединения формулы I, в случае их применения в комбинации с глюкокортикоидным агонистом, могут применяться для лечения воспалительных заболеваний.
Общие композиции
Настоящее изобретение относится к фармацевтическим композициям, которые пригодны для применения при лечении гипертензии, диабета и воспалительных заболеваний, включающие соединение формулы I:
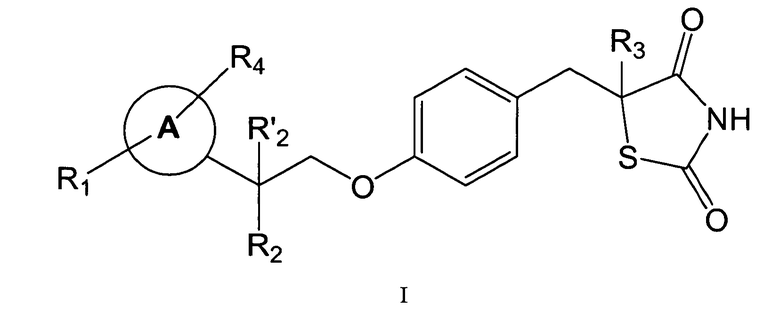
или их фармацевтически приемлемую соль.
Каждый из R1 и R4, независимо друг от друга, выбирают из H, галогена, алифатической группы и алкоксигруппы, в которых алифатическая группа и алкоксигруппа представляют собой необязательно замещенные 1-3 галогенами.
R2 представляет собой галоген, гидроксигруппу или необязательно замещенную алифатическую группу, и R'2 представляет собой H, или R2 и R'2 вместе образуют оксогруппу.
R3 представляет собой H.
Кольцо A представляет собой фенил.
В некоторых примерах осуществления изобретения R1 представляет собой H. В некоторых примерах осуществления изобретения R1 представляет собой галоген, такой как F или Cl.
В некоторых примерах осуществления изобретения R1 представляет собой алифатическую группу, необязательно замещенную 1-3 галогенами. Например, R1 конкретных примеров осуществления изобретения R1 представляет собой, R1 представляет собой алкоксигруппу. Например, R1 представляет собой метоксигруппу, этоксигруппу или -O-изопропил. И еще в других примерах осуществления изобретения R1 представляет собой алкоксигруппу, замещенную 1-3 галогенами. Например, R1 представляет собой -OCHF2 или -OCF3. В каждом из нижеприведенных примеров осуществления изобретения R1 может быть замещен в орто-, мета- или пара-положении фенильного кольца. В определенных примерах осуществления изобретения R1 замещен в пара- или мета-положении фенильного кольца.
В некоторых примерах осуществления изобретения R4 представляет собой H. В некоторых примерах осуществления изобретения R4 представляет собой галоген, такой как F или Cl.
В некоторых примерах осуществления изобретения R4 представляет собой алифатическую группу, необязательно замещенную 1-3 галогенами. Например, R4 конкретных примеров осуществления изобретения, R4 представляет собой алкоксигруппу. Например, R4 предствляет собой метоксигруппу, этоксигруппу или -O-изопропил. И еще в других примерах осуществления изобретения, R4 представляет собой алкоксигруппу, замещенную 1-3 галогенами. Например, R4 представляет собой -OCHF2 или -OCF3. В каждом из нижеприведенных примеров осуществления изобретения R4 может быть замещен в орто-, мета- или пара-положении фенильного кольца. В определенных примерах осуществления изобретения R4 представляет собой замещенный в пара- или мета-положении фенильного кольца. В некоторых примерах осуществления изобретения R1 и R4 представляют собой различные заместители. В еще других примерах осуществления изобретения R1 и R4 представляют собой одни и те же заместители. В некоторых примерах осуществления изобретения, в случае, когда R1 представляет собой алифатическую группу, R4 представляет собой отличный от H.
В некоторых примерах осуществления изобретения каждый из R1 и R4, независимо друг от друга, выбирают из H, галогена, алифатической группы и алкоксигруппы, в которых алифатическая группа и алкоксигруппа представляют собой необязательно замещенные 1-3 галогенами, при условии, что когда один из R1 и R4 представляет собой H, то другой не представляет собой этил.
В некоторых примерах осуществления изобретения каждый из R1 и R4, независимо друг от друга, выбирают из H, галогена, алифатической группы и алкоксигруппы, в которых алифатическая группа и алкоксигруппа представляют собой необязательно замещенные 1-3 галогенами, при условии, что когда один из R1 и R4 представляет собой H, то другой не представляет собой этил, как заместитель в 4 положении фенила.
В некоторых примерах осуществления изобретения R2 представляет собой водород, галоген, гидроксигруппу или необязательно замещенную C1-6 алифатическую группу. Например, R2 представляет собой необязательно замещенный прямой или разветвленный C1-6 алкил, необязательно замещенный прямой или разветвленный C2-6 алкенил, или необязательно замещенный прямой или разветвленный C2-6 алкинил. В других примерах R2 представляет собой C1-6 алифатическую группу необязательно замещенную 1-2 гидроксигруппами или галогенами. В других примерах, R2 представляет собой C1-6 алкил необязательно замещенный гидроксигруппой. В нескольких других примерах R2 представляет собой метил, этил, пропил, изопропил, бутил, трет-бутил, пентил или гексил, каждый их которых необязательно замещен гидроксигруппой. В нескольких дополнительных примерах R2 представляет собой метил или этил, каждый из которых замещен гидроксигруппой.
В некоторых примерах осуществления изобретения R'2 представляет собой H. В некоторых примерах осуществления изобретения R2 и R'2 вместе образуют оксогруппу.
В некоторых примерах осуществления изобретения в случае, когда один из R1 или R4 представляет собой H, другой не представляет собой этил.
В некоторых примерах осуществления изобретения композиция дополнительно включает фармацевтически приемлемый носитель.
Другой аспект настоящего изобретения относится к фармацевтической композиции, включающей соединение формулы II:
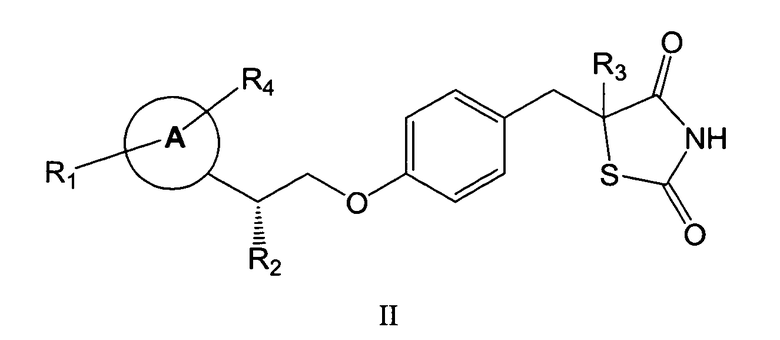
или его фармацевтически приемлемой соли, в которых R'2 представляет собой H, и R1, R3, R4 и кольцо A определены выше в формуле I.
Типичные композиции, в соответствии с настоящим изобретением, включают дозированную лекарственную форму для однократного введения, содержащую от приблизительно 1 мг до приблизительно 200 мг соединения формулы I или II, например, в интервале от приблизительно 10 мг до приблизительно 120 мг, в интервале от приблизительно 10 мг до приблизительно 100 мг, или от приблизительно 15 мг до приблизительно 60 мг.
Некоторые типичные соединения формулы I или II представлены в таблице A, приведенной ниже.
Типичные соединения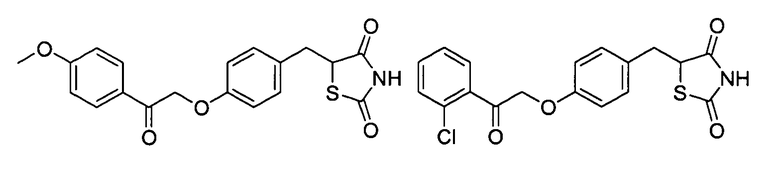
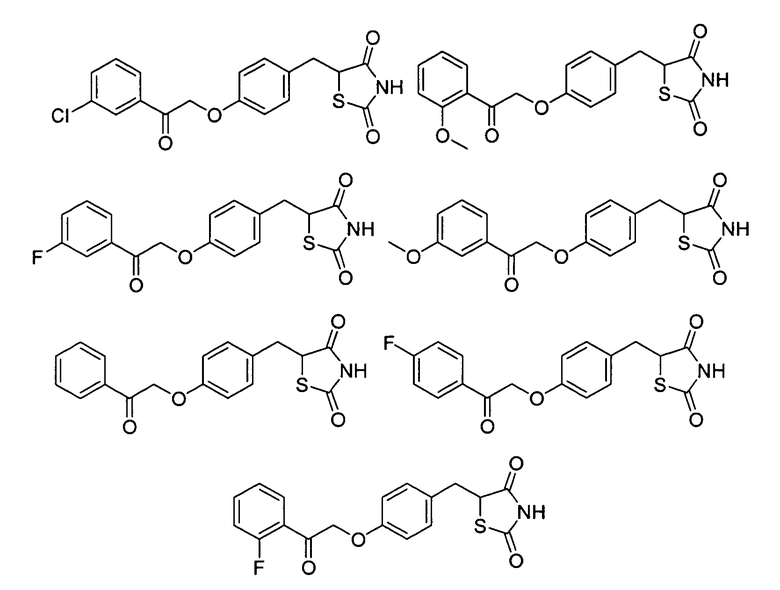
Другой аспект настоящего изобретения относится к фармацевтической композиции, включающей соединение формулы I или II, в которой соединение имеет PPARγ активность, составляющую 50% или менее относительно активности розиглитазона при его дозировке, обеспечивающей уровни циркуляции более чем 3 мкМ, или имеющую PPARγ активность, в 10 раз меньшую, чем у пиоглитазона при такой же дозировке.
Другой аспект настоящего изобретения относится к способу лечения гипертензии, диабета и воспалительных заболеваний, включающему введение фармацевтической композиции, включающей соединение формулы I или II. Композиции нескольких альтернативных способов дополнительно включают фармацевтически приемлемый носитель.
Другой аспект настоящего изобретения относится к способу лечения гипертензии, диабета и воспалительных заболеваний, включающему введение фармацевтической композиции, включающей соединение формулы II, в которой указанное соединение имеет чистоту, приблизительно 70% e.и. или более. Например, способ лечения гипертензии, диабета и воспалительных заболеваний, включающий введение фармацевтической композиции, включающей соединение формулы I, в которой соединение имеет чистоту приблизительно 80% e.и. или более (например, 90% e.и. или более, 95% e.и. или более, 97% e.и. или более, или 99% e.и. или более).
Фармацевтические композиции настоящего изобретения могут также включать одно или несколько дополнительных антигипертензивных веществ или других лекарственных средств. Один аспект настоящего изобретения относится к фармацевтической композиции, включающей соединение формулы I или II и, по меньшей мере, один диуретик, такой как гидрохлоротиазид, хлороталадон, хлоротиазид или их комбинации. Другие аспекты относятся к фармацевтическим композициям, пригодным для лечения гипертензии, диабета и воспалительных заболеваний, включающим соединение формулы I или II и одно или несколько веществ, которые ограничивают активность ренин-ангиотензиновой системы, таких как ингибиторы ангиотензинпревращающего фермента, т.e. ACE ингибиторы, например, рамиприл, каптоприл, эналаприл или им подобные, и/или блокаторы рецепторов к ангиотензину II, т.e. ARB, например, кандесартан, лозартан, олмесартан или им подобные; и/или ингибиторы ренина. Кроме того, другие аспекты относятся к пригодной для применения фармацевтической композиции для лечения гипертензии, диабета и воспалительных заболеваний, включающей соединение формулы I или II и соединения, которые ограничивают гипертензию, диабет и воспалительные заболевания альтернативными способами, включая блокаторы β-адренергического рецептора и блокаторы кальциевого канала, например, амлодипин.
Это изобретение также относится к фармацевтической композиции, которая пригодна к применению для снижения уровня липидов, включающей соединения формулы I или II и один или несколько статинов, т.e. ингибиторов гидроксиметилглутарил-коэнзим А (HMG-CoA) редуктазы, например, аторвастатин, церивастатин, флувастатин, ловастатин, мевастатин, симвастатин, росувастатин, правастатином или какую-либо их фармацевтически приемлемую комбинацию.
Другой аспект настоящего изобретения относится к комбинации соединения формулы I или II с одним или несколькими антигипертензивными веществами, включая диуретик (например, гидрохлоротиазид, хлороталадон, хлоротиазид), ингибиторы ангиотензинпревращающего фермента, например, ACE ингибиторы, например, рамиприл, каптоприл, эналаприл, их комбинации или им подобные; блокаторы рецепторов к ангиотензину II, т.e. ARB, например, лозартан, олмесартан, телмисартан, их комбинации или им подобные; ингибиторы ренина; блокаторы β-адренергического рецептора, статины или их комбинации.
III. Общие схемы синтеза
Соединения формулы I и II легко могут быть синтезированы из коммерчески доступных или известных исходных веществ известными способами. Типичные способы синтеза для получения соединений формулы I или II приведены на нижерасположенной схеме 1.
Схема 1:
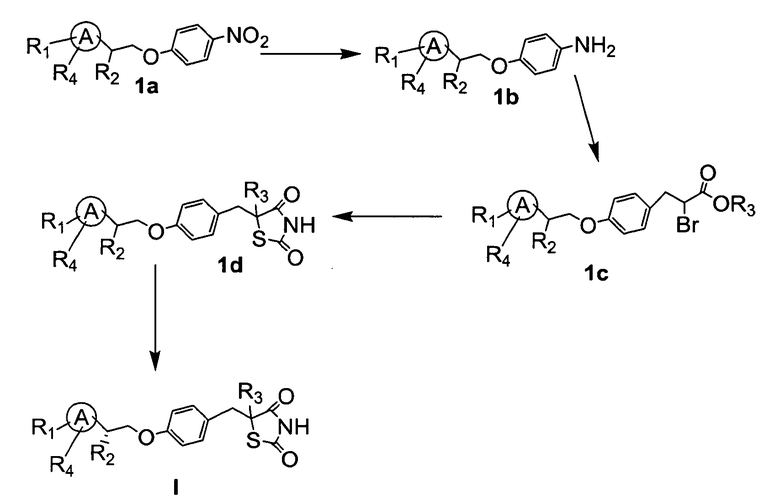
Согласно схеме 1, исходное вещество 1a восстанавливали до образования анилина 1b. Анилин 1b диазотировали в присутствии бромистоводородной кислоты, эфира акриловой кислоты и катализатора, такого как оксид меди, получая сложный эфир альфа-бром-кислоты 1c. Эфир альфа-бром-кислоты 1c циклизовали с помощью тиокарбамида, получая рацемический тиазолидиндион 1d. Соединения формулы II могут быть выделены из рацемической смеси путем использования какого-либо подходящего способа, такого как ВЭЖХ.
На нижеприведенной схеме 2 R2 представляет собой оксогруппу, R3 представляет собой водород.
Схема 2:
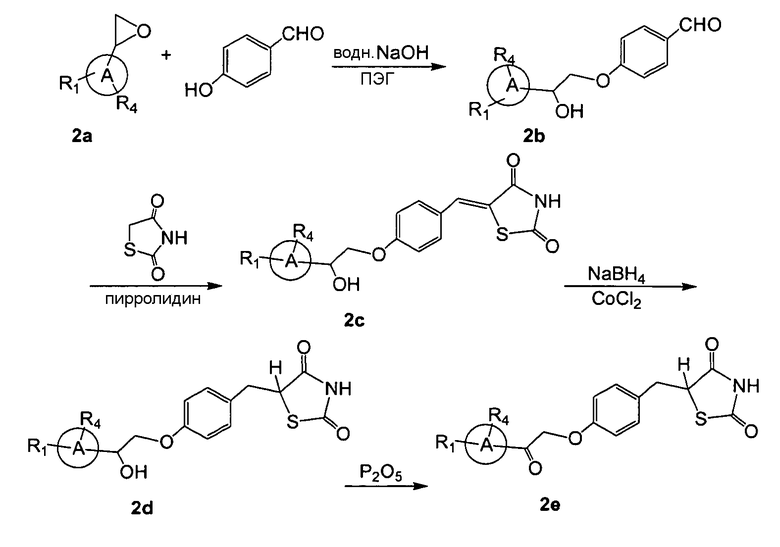
Согласно схеме 2, исходное вещество 2a вводили в реакцию с 4-гидроксибензальдегидом при щелочных условиях (например, водный NaOH), что приводило к получению смеси региоизомерных спиртов 2b, которую выделяли с помощью хроматографии. Региоизомерные спирты 2b вводили в реакцию с 2,4-тиазолидиндионом, используя пирролидин в качестве основания, что приводило к получению соединения 2c. Катализируемое кобальтом восстановление под действием натрий-боргидрида давало соединение 2d, которое окисляли, например, пентоксидом фосфора в присутствии диметилсульфоксида, что приводило к получению кетона 2e.
IV. Применения, технологии приготовления лекарственных форм и введение
Как обсуждалось выше, настоящее изобретение относится к соединениям, которые пригодны для применения в качестве терапевтических средств при гипертензии, диабете и воспалительных заболеваниях.
Таким образом, в другом аспекте настоящего изобретения, предоставлены фармацевтически приемлемые композиции, которые включают какое-либо из соединений, как описано в этом документе, и необязательно включают фармацевтически приемлемый носитель, адъювант или наполнитель. В определенных примерах осуществления изобретения эти композиции необязательно дополнительно включают одно или несколько дополнительных терапевтических средств.
Также следует принять во внимание, что определенные соединения настоящего изобретения могут присутствовать в свободной форме для лечения, или, будучи оптимально модифицированными, - в качестве фармацевтически приемлемого производного или их пролекарства. В соответствии с настоящим изобретением фармацевтически приемлемое производное или пролекарство включает, но не ограничивается только этими, фармацевтически приемлемые соли, эфиры, соли таких эфиров, или какие-либо другие аддукт или производное, которые посредством введения нуждающемуся в этом пациенту способны обеспечить наличие, прямо или косвенно, соединения, как иным образом описано в настоящем описании, или метаболита, или остатка его.
В описании термин "фармацевтически приемлемая соль" относится к таким солям, которые представляют собой, в рамках обоснованного медицинского заключения, пригодные для применения в контакте с тканями человека и более низших животных в отсутствие неспецифической токсичности, раздражения, аллергической реакции и им подобных, и соответствуют приемлемому соотношению польза/риск. "Фармацевтически приемлемая соль" обозначает какую-либо нетоксичную соль или соль эфира соединения этого изобретения, которая посредством введения реципиенту способна обеспечить наличие, либо прямо, либо косвенно, соединения этого изобретения или ингибиторно активного метаболита, или его остатка.
Фармацевтически приемлемые соли хорошо известны из уровня техники. Например, S. M. Berge, et al. описывает фармацевтически приемлемые соли подробно в J. Pharmaceutical Sciences, 1977, 66, 1-19, что включено в настоящее описание в качестве ссылки. Фармацевтически приемлемые соли соединения этого изобретения включают такие, которые получают из приемлемых неорганических и органических кислот и оснований. Примеры фармацевтически приемлемых, нетоксичных солей, полученных посредством прибавления кислоты, представляют собой соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, виноградная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или полученные посредством других методов, применяемых в данной области техники, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и подобные соли. Соли, полученные из приемлемых оснований, включают соли щелочного металла, щелочноземельного металла, аммония и N+(C1-4алкил)4 соли. Это изобретение также предусматривает кватернизацию каких-либо основных азотсодержащих групп соединений, раскрытых в настоящем описании. Водо- или маслорастворимые, или диспергируемые продукты могут быть получены путем такой кватернизации. Типичные представители солей щелочного или щелочноземельного металла включают соли натрия, лития, калия, кальция, магния и им подобные. Кроме того, фармацевтически приемлемые соли включают, когда это приемлемо, нетоксичные аммонийный, четвертичный аммонийный и аминовый катионы, связанные с противоионами, такими как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
Как описано выше, фармацевтически приемлемые композиции настоящего изобретения дополнительно включают фармацевтически приемлемый носитель, адъювант или наполнитель, который в описании включает всевозможные растворители, разбавители или другой жидкий наполнитель, дисперсионные или суспензионные добавки, поверхностно-активные вещества, изотонические вещества, сгущающие или эмульгирующие вещества, консерванты, твердые связующие материалы, скользящие вещества и им подобные, что соответствует желаемой конкретной лекарственной форме. В издании Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) раскрыты всевозможные носители, применяемые при составлении рецептуры фармацевтически приемлемых композиций, и методики их приготовления. Кроме случаев, когда какая-либо обычная среда носителя является несовместимой с соединениями изобретения, таким образом, что получается какой-либо нежелательный биологический эффект или иное взаимодействие нежелательным образом с каким-либо другим компонентом (компонентами) фармацевтически приемлемой композиции, ее применение предполагают в объеме этого изобретения. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются только ими, ионообменные материалы, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту или сорбат калия, отдельные смеси глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамин сульфат, гидрофосфат натрия, дигидрофосфат калия, хлорид натрия, соли цинка, коллоидный оксид кремния, магния трисиликат, поливинилпирролидон, полиакрилаты, воски, полиэтилен-полиоксипропилен-блок-полимеры, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как, натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразную трагакантовую камедь; солод; желатин; тальк; эксципиенты, такие как какао-масло и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также и другие нетоксичные совместимые скользящие вещества, такие как лаурилсульфат натрия и стеарат магния, а также и окрашивающие вещества, разделяющие вещества, покрывающие оболочкой вещества, подслащивающие, коррегирующие вкус и ароматизирующие вещества, консерванты и антиоксиданты также могут присутствовать в композиции, в соответствии с постановлением разработчика рецептуры.
И еще в другом аспекте, настоящее изобретение относится к способу лечения гипертензии, диабета и воспалительных заболеваний, включающему введение фармацевтической композиции, включающей соединение формулы I или II, предпочтительно, млекопитающему, нуждающемуся в лечении.
В соответствии с изобретением, "эффективное количество" соединения или фармацевтически приемлемой композиции представляет собой такое количество, которое эффективно для лечения или умешьшения тяжести гипертензии, диабета и воспалительных заболеваний.
Фармацевтические композиции, в соответствии со способом настоящего изобретения, могут быть введены с применением любого количества и любого способа введения, эффективных для лечения или уменьшения тяжести гипертензии, диабета и воспалительных заболеваний.
Точное необходимое количество будет изменяться от субъекта к субъекту в зависимости от биологического вида, возраста и общего состояния субъекта, тяжести инфекционного заболевания, конкретного вещества, его способа введения и тому подобных факторов. Соединения изобретения предпочтительно готовят в виде дозированной лекарственной формы для удобства введения и обеспечения равномерности дозировки. Выражение "дозированная лекарственная форма" в описании относится к дискретной в физическом смысле единице вещества, предназначенной для пациента, которого лечат. Вместе с тем следует понимать, что суммарное дневное потребление веществ и композиций настоящего изобретения будет определено лечащим врачом в рамках обоснованного медицинского заключения. Конкретный эффективный уровень дозы для определенного пациента или организма будет зависеть от множества факторов, включая заболевание, которое лечат, и тяжесть заболевания; активность конкретного применяемого соединения; конкретную применяемую композицию; возраст, массу тела, общее состояние здоровья, пол и пищевой рацион пациента; время введения, способ введения и скорость выведения из организма конкретного применяемого соединения; продолжительность лечения; лекарственные средства, применяемые в комбинации или совместно с конкретным применяемым соединением, и подобные им факторы, известные из уровня техники в области медицины. Термин "пациент" в описании обозначает животное, например, млекопитающее, и более конкретно, человек.
Фармацевтически приемлемые композиции этого изобретения могут быть введены людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местно (в виде порошков, мазей или капель), буккально, в виде перорального или назального аэрозоля, или другими подобными способами, в зависимости от тяжести инфекции, которую лечат. В определенных примерах осуществления изобретения соединения изобретения могут быть введены перорально или парентерально при уровнях дозировки приблизительно от 0,01 мг/кг до приблизительно 50 мг/кг, и предпочтительно, от приблизительно 1 мг/кг до приблизительно 25 мг/кг массы тела субъекта в день, один или несколько раз в день, для получения желаемого терапевтического эффекта. Альтернативно, соединения изобретения могут быть введены перорально или парентерально при уровнях дозировки в диапазоне от 10 мг/кг и до приблизительно 120 мг/кг.
Жидкие лекарственные формы для перорального введения включают, но не ограничиваются только ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкие лекарственные формы могут содержать инертные разбавитель, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (а именно, хлопковое, арахисовое, кукурузное, зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирной кислоты и сорбитана, и их смеси. Помимо инертных разбавителей, пероральные композиции также могут включать адъюванты, такие как увлажняющие вещества, эмульгирующие и суспендирующие вещества, подслащивающие, коррегирующие вкус и ароматизирующие вещества.
Инъецируемые лекарственные препараты, например, стерильные инъецируемые водные или масляные суспензии могут быть разработаны в соответствии с известным уровнем техники, с использованием подходящих диспергирующих или увлажняющих веществ и суспендирующих веществ. Стерильный инъецируемый лекарственный препарат также может быть стерильным инъекцируемым раствором, суспензией или эмульсией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. В число приемлемых наполнителей и растворителей, которые могут применяться, входят вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды. Для этих целей любое асептическое нелетучее масло может использоваться, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, применяют в получении инъекцируемых форм.
Инъекцируемые лекарственные формы можно подвергнуть стерилизации, например, фильтрованием через задерживающий бактерии фильтр или посредством включения стерилизующих веществ в форму стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной инъекцируемой среде перед применением.
С целью пролонгирования воздействия соединения настоящего изобретения часто желательно замедление абсорбции соединения после подкожной или внутримышечной инъекции. Этого можно достичь путем применения жидкой суспензии кристаллического или аморфного вещества с низкой растворимостью в воде. Скорость абсорбции соединения таким образом зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, отсроченная абсорбция парентерально введенной лекарственной формы соединения достигается растворением или суспендированием соединения в масляном наполнителе. Инъекцируемые формы пролонгированного действия изготавливают путем формирования микроинкапсулированных матриц соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения содержания вещества и полимера и от природы конкретного используемого полимера скорость высвобождения соединения можно контролировать. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъекцируемые лекарственные формы пролонгированного действия также изготавливают путем включения соединения в липосомы или в микроэмульсии, которые совместимы с тканями организма.
Композиции для ректального или вагинального введения представляют собой, предпочтительно, суппозитории, которые могут быть приготовлены путем смешивания соединения этого изобретения с подходящими, не вызывающими раздражение эксципиентами или носителями, такими как какао-масло, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при комнатной температуре, но представляет собой жидкость при температуре тела и поэтому плавятся в ректальной или вагинальной полости и высвобождают активное соединение.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают с по меньшей мере одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальций фосфат и/или a) наполнителями или сухими разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и акациевая камедь, c) увлажняющими веществами, такими как глицерин, d) распадающимися веществами, такими как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедляющими растворение веществами, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими веществами, такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолин и бентонитовая глина, и i) скользящими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смесями. В случае капсул, таблеток и пилюль лекарственная форма может также включать буферные вещества.
Твердые композиции подобного типа могут также применяться в виде наполнителей в мягких и твердых наполняемых желатиновых капсулах, с использованием таких эксципиентов, как лактоза или молочный сахар, а также и полиэтиленгликолей высокой молекулярной массы и им подобных. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрывающими оболочками и защитными покрытиями, такими как кишечнорастворимые оболочки и другие покрытия, хорошо известные их уровня техники в области фармацевтической технологии получения лекарственных форм. Они могут, необязательно, содержать опалесцирующие вещества и могут также быть композицией, из которой высвобождается только активный ингредиент (ингредиенты), или, преимущественно, в определенной части кишечника, необязательно пролонгированным способом. Примеры обволакивающе-заливающих композиций, которые могут применяться, включают полимерные вещества и воски. Твердые композиции подобного типа могут также применяться в качестве наполнителей в мягких и твердых наполняемых желатиновых капсулах, с использованием таких эксципиентов, как лактоза или молочный сахар, а также и полиэтиленгликолей высокой молекулярной массы и им подобные.
Активные соединения могут также быть в микроинкапсулированной форме с одним или несколькими эксципиентами, как указано выше. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрывающими оболочками и защитными покрытиями, такими как кишечнорастворимые оболочки, оболочки с контролируемым высвобождением и другие покрытия, хорошо известные их уровня техники в области фармацевтической технологии получения лекарственных форм. В таких твердых лекарственных формах активное соединение может быть смешано с по меньшей мере одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут также включать, что обычно встречается на практике, дополнительные вещества, отличные от инертных разбавителей, например, скользящие вещества для таблетирования и другие добавки для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы могут также включать буферные вещества. Они могут, необязательно, содержать опалесцирующие вещества и могут также быть композицией, из которой высвобождается только активный ингредиент (ингредиенты), или, преимущественно, в определенной части кишечника, необязательно пролонгированным способом. Примеры обволакивающе-заливающих композиций, которые могут применяться, включают полимерные вещества и воски.
Лекарственные формы для местного или трансдермального введения соединения этого изобретения включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, аэрозоли, средства для ингаляции или пластыри. Активный компонент смешивается при стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, как это может быть необходимо. Офтальмологическая лекарственная форма, ушные капли и глазные капли, также рассматриваются в качестве попадающих в рамки объема этого изобретения. Кроме того, настоящее изобретение предусматривает применение трансдермальных пластырей, которые имеют дополнительное преимущество в обеспечении контролируемой доставки соединения организму. Такие лекарственные формы получают путем растворения или диспергирования соединения в подходящей среде. Усилители абсорбции также могут применяться для увеличения поступления соединения через кожу. Скорость может контролироваться либо предоставлением контролирующей скорость мембраны, либо диспергированием соединения в полимерную матрицу или в гель.
Как описано выше в общих чертах, соединения изобретения пригодны для применения в качестве лечебных средств при гипертензии, диабете и воспалительных заболеваниях.
Активность или, что более важно, понижение PPARγ активности соединением, используемым в этом изобретении в качестве лечебного средства при гипертензии, диабете и воспалительных заболеваниях, могут быть испытаны в соответствии со способами, описанными в общих чертах в данной области техники и в примерах этого описания.
Также следует принять во внимание, что соединения и фармацевтически приемлемые композиции настоящего изобретения могут применяться в комбинации с методами лечения, при которых соединение и фармацевтически приемлемые композиции могут вводиться параллельно, до или после одного или нескольких других необходимых терапевтических средств или медицинских процедур. Определенная комбинация методов лечения (терапевтических средств или процедур) для применения в комбинированной схеме лечения будет принята во внимание с точки зрения совместимости необходимых терапевтических средств и/или процедур и достижения желаемого терапевтического эффекта. Также следует принять во внимание, что применяемые методы лечения могут достигать желаемого эффекта в случае такого же заболевания (например, соединение изобретения может быть введено параллельно с другим веществом, применяемым для лечения такого же заболевания), или они могут достигать разных эффектов (например, контроль любых противоположных эффектов). В описании дополнительные терапевтические средства, которые обычно вводят для лечения или профилактики определенного заболевания или патологического состояния, представляют собой известные как "подходящие для того заболевания или патологического состояния, которые лечат".
Количество дополнительного терапевтического средства, присутствующего в композициях этого изобретения, будет не более, чем то количество, которое обычно следует вводить в композиции, включающей это терапевтическое средство в качестве единственного активного вещества. Предпочтительно, количество дополнительного терапевтического средства в раскрываемых настоящий момент композициях будет варьировать в диапазоне от приблизительно 50% до приблизительно 100% от количества, обычно присутствующего в композиции, включающей это средство в качестве единственного терапевтически активного вещества.
Соединения этого изобретения или их фармацевтически приемлемые композиции также могут быть введены в состав композиций для покрытия оболочкой имплантируемого медицинского изделия, такого как протез, искусственный клапан, сосудистый трансплантат, стенты и катетеры. Таким образом, настоящее изобретение, в другом аспекте, включает композицию для покрытия оболочкой имплантируемого изделия, включающую соединение настоящего изобретения, как в общих чертах описано выше, и в классах и подклассах этого описания, и носитель, подходящий для покрытия оболочкой указанного имплантируемого изделия. И еще в другом аспекте, настоящее изобретение включает имплантируемое изделие, покрытое оболочкой с композицией, включающей соединение настоящего изобретения, как описано в общих чертах выше, и в классах и подклассах этого описания, и носитель, подходящий для покрытия оболочкой указанного имплантируемого изделия. Подходящие покрывающие оболочки и обычные препараты покрытых оболочкой имплантируемых изделий описаны в патентах US 6099562; 5886026; и 5304121, каждый из которых включен в качестве ссылки. Покрывающие оболочки обычно представляют собой биологически совместимые полимерные вещества, такие как гидрогелевый полимер, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимер молочной кислоты, этиленвинилацетат и их смеси. Покрывающие оболочки могут, необязательно, быть дополнительно покрыты подходящим вторым внешним слоем фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их комбинациями для обеспечения контролируемых характеристик высвобождения для композиции.
В соответствии с еще одним примером осуществления изобретения настоящее изобретение относится к способу лечения или уменьшения тяжести гипертензии, диабета и воспалительных заболеваний.
Другой аспект изобретения связан с лечением гипертензии, диабета и воспалительных заболеваний в биологическом образце или у пациента (например, in vitro или in vivo), методом, который включает введение пациенту или контактирование с указанным биологическим образцом фармацевтической композиции, включающей соединение формулы I или II. Термин "биологический образец", используемый в описании, включает, не ограничиваясь только указанными, клеточные культуры или их экстракты; материал биопсии, полученный от млекопитающих, или его экстракты; и кровь, слюну, мочу, кал, сперму, слезы или другие биологические жидкости или их экстракты.
С целью обеспечения возможности более полного понимания изобретения, описанного в настоящем описании, предложены нижеприведенные примеры. Следует понимать, что эти примеры служат только для иллюстративных целей и не должны истолковываться в качестве ограничивающих каким-либо образом это изобретение.
V. Примеры
Пример 1: 5-[4-(2-оксо-2-фенилэтокси)бензил]-1,3-тиазолидин-2,4-дион.
Стадия 1. Получение 4-(2-гидрокси-2-фенилэтокси)бензальдегида.
К 2-(4-фторфенил)этиленоксиду (6,50 г, 54,0 ммоль) добавляли толуол (85 мл), 4-гидроксибензальдегид (9,89 г, 81,0 ммоль), PEG4000 (полиэтиленгликоль, 1,15 г) и 1M NaOH (85 мл), и перемешиваемую смесь нагревали при 78°C в течение ночи. После охлаждения до комнатной температуры реакционную смесь экстрагировали EtOAc, и органическую фазу промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате желтое маслообразное вещество хроматографировали на колонке среднего размера с силикагелем, элюируя 0-10% EtOAc/DCM. Фракции, содержащие преимущественно пятно вещества с наибольшим значением Rf, объединяли и упаривали в вакууме, получая 1,85 г (14%) указанного в заголовке соединения в виде желтого масла. Фракции, содержащие преимущественно пятно вещества с наименьшим значением Rf, объединяли и упаривали в вакууме, получая 0,64 г региоизомера в виде бесцветного, вязкого масла. Смешанные фракции объединяли и повторно хроматографировали, элюируя 30% EtOAc/гексаны. Фракции, содержащие вещество с наибольшим значением Rf, объединяли и упаривали в вакууме, получая дополнительтно 2,64 г (20%) указанного в заголовке соединения в виде бесцветного масла. Фракции, содержащие вещество с наименьшим значением Rf, объединяли и упаривали в вакууме, получая дополнительно 1,82 г региоизомера в виде бесцветного вязкого масла.
Стадия 2: Получение 5-[4-(2-гидрокси-2-фенилэтокси)бензилиден]-1,3-тиазолидин-2,4-диона.
К перемешиваемому раствору 4-[(2S)-2-гидрокси-2-фенилэтокси]бензальдегида (2,63 г, 10,8 ммоль) в абсолютном EtOH (75 мл) добавляли 2,4-тиазолидиндион (1,27 г, 10,8 ммоль) и пиперидин (0,54 мл, 5,4 ммоль), и полученный в результате раствор нагревали до кипения с обратным холодильником. Реакцию выдерживали при кипении с обратным холодильником в течение ночи. Реакционную смесь оставляли охлаждаться до комнатной температуры. Никакого осадка не образовалось. Значение pH реакционной смеси было приблизительно 5. Уксусную кислоту (20 капель) добавляли. Реакционную смесь упаривали в вакууме. Вещество адсорбировали на силикагеле и хроматографировали, элюируя 30-40% EtOAc/гексан. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 3,18 г (86%) указанного в заголовке соединения в виде светло-желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H15NO4S m/z 340,1 (M-H)-.
Стадия 3: Получение 5-[4-(2-гидрокси-2-фенилэтокси)бензил]-1,3-тиазолидин-2,4-диона
К смеси 5-[4-(2-гидрокси-2-фенилэтокси)бензилидена]-1,3-тиазолидин-2,4-диона (1,50 г, 4,39 ммоль) в THF (20 мл) добавляли H2O (20 мл), 1M NaOH (3 мл), гексагидрат хлорида кобальта (II) (0,60 мг, 0,003 ммоль) и диметилглиоксим (15 мг, 0,13 ммоль). Добавляли раствор тетрагидробората натрия (240 мг, 6,33 ммоль) в 0,2M NaOH (3,6 мл). Реакционная смесь моментально потемнела, но очень скоро появился предполагаемый светло-желтый цвет. Уксусную кислоту добавляли по каплям до тех пор, пока раствор потемнеет (3 капли). Спустя приблизительно один час реакционная смесь посветлела. Дополнительно NaBH4, CoCl2 и HOAc добавляли до получения темно-фиолетового цвета. Когда этот цвет поблек, добавляли еще NaBH4. Затем данные ВЭЖХ анализа указали на то, что реакция завершилась, ее разделяли между фазами H2O и EtOAc, и органическую фазу промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате пузырчатое твердое вещество хроматографировали, элюируя 50% EtOAc/гексаны. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 1,15 г (76%) указанного в заголовке соединения, в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H17NO4S m/z 342,1 (M-H)-.
Стадия 4: Получение 5-[4-(2-оксо-2-фенилэтокси)бензил]-1,3-тиазолидин-2,4-диона.
К перемешиваемому раствору 5-[4-(2-гидрокси-2-фенилэтокси)бензил]-1,3-тиазолидин-2,4-диона (1,00 г, 2,91 ммоль) в DCM (35 мл) добавляли DMSO (2 мл) и раствор охлаждали до 0°C. Пентоксид фосфора (0,83 г, 2,91 ммоль) добавляли, затем добавляли триэтиламин (1,8 мл, 13,1 ммоль). Реакцию оставляли для медленного нагревания до комнатной температуры. Спустя 2 часа, реакционную смесь разделяли между фазами DCM и воды, и органическую фазу промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате желтое масло хроматографировали на силикагеле, элюируя 25-35% EtOAc/гексаны. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,40 г (40%) указанного в заголовке соединения в виде белого твердого вещества. Ресуспендирование в диэтиловом эфире позволяло получить 245 мг чистого продукта. Масс-спектр (ионизация электроспреем, ESI-) для C18H15NO4S m/z 340,1 (M-H)-.
Пример 2: Получение 5-{4-[2-(4-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
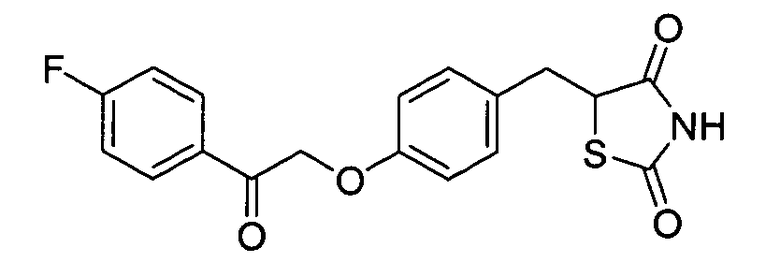
Стадия 1: Получение 4-[2-(фторфенил)-2-гидроксиэтокси]бензальдегида
К перемешиваемому раствору 2-(4-фторфенил)этиленоксида (5,60 г, 40,0 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (7,40 г, 61,0 ммоль), 1M NaOH (65 мл) и PEG4000 (полиэтиленгликоль, 0,85 г), и реакционную массу нагревали до 78°C в течение ночи. После охлаждения до комнатной температуры реакционную массу экстрагировали EtOAc (2×150 мл) и объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате светло-коричневое масло хроматографировали на силикагеле, элюируя 30-40% EtOAc/гексаны.
Фракции, содержащие пятно вещества с наибольшим значением Rf, объединяли и упаривали в вакууме, получая 2,38 г региоизомера продукта в виде белого твердого вещества. Фракции, содержащие пятно вещества с наименьшим значением Rf, объединяли и упаривали в вакууме, получая 1,54 г (22%) указанного в заголовке соединения в виде бесцветного вязкого масла.
Стадия 2: Получение 5-{4-[2-(4-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору альдегида (2,36 г, 10,8 ммоль) в абсолютном EtOH (75 мл) добавляли 2,4-тиазолидиндион (1,06 г, 9,07 ммоль) и пиперидин (0,45 мл, 4,50 ммоль), и полученный в результате раствор нагревали до кипения с обратным холодильником. После кипячения с обратным холодильником в течение ночи реакционную массу оставляли охлаждаться до комнатной температуры и затем упаривали в вакууме. Остаток адсорбировали на силикагеле и хроматографировали, элюируя 30-40% EtOAc/гексаны. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,88 г (27%) указанного в заголовке соединения в виде желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H14FNO4S m/z 358,1 (M-H)-.
Стадия 3: Получение 5-{4-[2-(4-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемой смеси 5-{4-[2-(4-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона (0,87 г, 2,40 ммоль) в THF/H2O (1:1, 20 мл) добавляли 1M NaOH (2 мл), гексагидрат хлорида кобальта (II) (0,30 г, 0,001 ммоль), диметилглиоксим (8,4 мг, 0,073 ммоль), и под конец добавляли тетрагидроборат натрия (0,13 г, 3,53 ммоль). Реакционная масса приобрела темно-фиолетовый цвет. Спустя короткое время темный цвет стал светлеть, и HOAc добавляли по каплям до регенерации темного цвета. Когда цвет поблек и добавления HOAc не хватало для его регенерации, NaBH4 добавляли, чтобы регенерировать темный цвет. Реакцию оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную массу разделяли между фазами воды и EtOAc. Органическую фазу промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате светло-коричневое масло хроматографировали, элюируя 35% EtOAc/гексан. Фракции, содержащие соединение, объединяли и упаривали в вакууме, получая 0,77 г (88%) светло-желтого твердого вещества. Желтое твердое вещество растворяли в THF (8 мл) и H2O (8 мл), и полученный в результате раствор обрабатывали CoCl2 (маленький кристаллик) и 2,2'-дипиридилом (5 мг). И в завершение NaBH4 добавляли маленькими порциями до появления стойкого темно-синего цвета. Реакционную смесь разделяли между фазами EtOAc и H2O, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате слегка окрашенное масло хроматографировали на маленькой колонке с силикагелем, элюируя 25-35% EtOAc/гексаны. Фракции, содержащие продукт, объединяли и упаривали в вакууме, что позволяло получить 527 мг (60%) указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H16FNO4S m/z 360,1 (M-H)-.
Стадия 4: Получение 5-{4-[2-(4-фторфенил)-2-охоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-{4-[2-(4-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона (0,52 г, 1,40 ммоль) в DCM (15 мл) добавляли DMSO (0,5 мл) и раствор охлаждали до 0°C. Пентоксид фосфора (0,41 г, 1,44 ммоль) добавляли, затем добавляли триэтиламин (0,90 мл, 6,48 ммоль). Реакционную массу оставляли медленно нагреваться до комнатной температуры и затем перемешивали в течение 5 часов. Реакционную смесь разделяли между фазами DCM и H2O, и водную фазу экстрагировали DCM. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате белое твердое вещество хроматографировали на маленькой колонке с силикагелем, элюируя 10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,25 г (48%) указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI+) для C18H14FNO4S m/z 359,9 (M+H)+. Масс-спектр (ионизация электроспреем, ESI-) для C18H14FNO4S m/z 358,0 (M-H)-.
Пример 3: Получение 5-{4-[2-(2-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
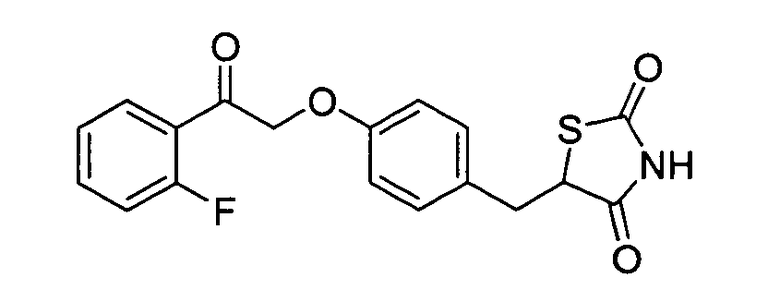
Стадия 1: Получение 2-(2-фторфенил)этиленоксида
К раствору o-фторстирола (5,0 г, 41,0 ммоль) и уксусной кислоты (2,33 мл, 40,9 ммоль) в диоксане (33 мл) и H2O (78 мл) при 0°C добавляли N-бромсукцинимид (8,02 г, 45,0 моль) тремя порциями. Реакцию оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Карбонат натрия (8,68 г, 81,9 ммоль) добавляли порциями и затем 1M NaOH (приблизительно 10 мл) добавляли, и реакционную массу перемешивали при комнатной температуре в течение ночи. Реакционную смесь разделяли между фазами воды и EtOAc, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме, получая 5,31 г (94%) указанного в заголовке соединения в виде слегка окрашенного масла, которое использовали без дополнительной очистки. Масс-спектр (ионизация электроспреем, ESI+) для C8H7FO m/z 138,1 (M+H)+.
Стадия 2: Получение 4-[2-(2-фторфенил)-2-гидроксиэтокси]бензальдегида
К перемешиваемому раствору 2-(2-фторфенил)этиленоксида (5,30 г, 38,4 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (7,0 г, 58,0 ммоль), 1M NaOH (65 мл) и PEG4000 (полиэтиленгликоль, 0,85 г) и перемешиваемую смесь нагревали до 78°C в течение ночи. Реакционную массу оставляли охлаждаться до комнатной температуры и затем экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате светло-коричневое масло адсорбировали на силикагеле и хроматографировали, элюируя 30-40% EtOAc/гексаны. Наблюдали 2 преобладающих пятна веществ. Фракции, содержащие пятно вещества с наибольшим значением Rf, объединяли и упаривали в вакууме, получая 1,10 г (11%) указанного в заголовке соединения в виде бесцветного масла. Фракции, содержащие пятно вещества с наименьшим значением Rf, объединяли и упаривали в вакууме, получая 0,67 г (7%) региоизомера в виде бесцветного масла.
Стадия 3: Получение 5-{4-[2-(2-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору альдегида (2,36 г, 10,8 ммоль) в абсолютном EtOH (40 мл) добавляли 2,4-тиазолидиндион (0,495 г, 4,23 ммоль) и пиперидин (0,21 мл, 2,10 ммоль), и полученный в результате раствор нагревали до кипения с обратным холодильником. После кипячения с обратным холодильником в течение ночи реакционную смесь охлаждали до комнатной температуры и затем упаривали в вакууме. Остаток растворяли в EtOAc и этот раствор промывали разбавленной водной HOAc, солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате желтое твердое вещество промывали DCM и ацетоном и фильтрат упаривали в вакууме. Это вещество адсорбировали на силикагеле и хроматографировали, используя 10-25% EtOAc/DCM. Фракции, содержащие соединение, объединяли и упаривали в вакууме, получая 0,51 г указанного в заголовке соединения в виде желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H14FNO4S m/z 358,0 (M-H)-.
Стадия 4: Получение 5-{4-[2-(2-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемой смеси 5-{4-[2-(2-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона (0,52 г, 1,40 ммоль) в THF/H2O (1:1, 16 мл) добавляли 1M NaOH (2 мл), гексагидрат хлорида кобальта (II) (0,2 мг, 0,0009 ммоль), 2,2'-бипиридин (50,8 мг, 0,33 ммоль), и под конец добавляли тетрагидроборат натрия (0,11 г, 2,90 ммоль). Реакционная масса приобретала темно-фиолетовый цвет. Спустя короткое время, темный цвет начинал блекнуть и HOAc добавляли по каплям до регенерации темного цвета. Затем цвет поблек и добавление HOAc не приводило к его регенерации, NaBH4 добавляли для регенерации темного цвета. Добавляли небольшие порции NaBH4 и HOAc по каплям до достижения устойчивого темно-синего цвета. После повторения этого несколько раз данные ВЭЖХ показали, что реакция завершилась, несмотря на тот факт, что темно-синий цвет менялся с получением светло-коричневого раствора. Реакционную массу разделяли между фазами воды и EtOAc. Органическую фазу промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате светло-коричневое масло хроматографировали, элюируя 35% EtOAc/гексан. Фракции, содержащие соединение, объединяли и упаривали в вакууме, получая 0,32 г указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H16FNO4S m/z 360,1 (M-H)-.
Стадия 5: Получение 5-{4-[2-(2-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-{4-[2-(2-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона (0,29 г, 0,80 ммоль) в DCM (15 мл) добавляли DMSO (0,5 мл) и раствор охлаждали до 0°C. Пентоксид фосфора (0,23 г, 0,80 ммоль) добавляли, затем добавляли триэтиламин (0,50 мл, 3,6 ммоль). Реакционную массу оставляли медленно нагреваться до комнатной температуры. Спустя 3 часа, добавляли воду и фазы разделяли. Значение pH водной фазы доводили приблизительно до 7 и водную фазу экстрагировали DCM. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате белое твердое вещество хроматографировали на маленькой колонке с силикагелем, элюируя 10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,19 г (66%) указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H14FNO4S m/z 358,0 (M-H)-.
Пример 4: Получение 5-{4-[2-(3-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
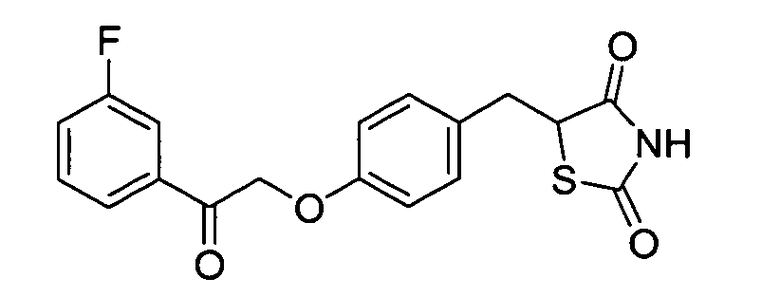
Стадия 1: Получение 2-(3-фторфенил)этиленоксида
К раствору м-фторстирола (5,00 г, 41,0 ммоль) и уксусной кислоты (2,33 мл, 40,9 ммоль) в диоксане (33 мл) и H2O (78 мл) при 0°C добавляли N-бромсукцинимид (8,02 г, 45,0 ммоль) тремя порциями. Реакцию оставляли нагреваться до комнатной температуры. Спустя 4 часа 2N NaOH (60 мл) добавляли и реакцию оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь разделяли между фазами воды и EtOAc, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме, получая 6,30 г указанного в заголовке соединения в виде слегка окрашенного масла, которое использовали без дополнительной очистки.
Стадия 2: Получение 4-[2-(3-фторфенил)-2-гидроксиэтокси]бензальдегида
К перемешиваемому раствору 2-(3-фторфенил)этиленоксида (5,60 г, 40,5 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (7,40 г, 61,0 ммоль), 1M NaOH (65 мл) и PEG4000 (полиэтиленгликоль, 0,85 г) и перемешиваемую смесь нагревали до 78°C в течение ночи. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате светло-коричневое масло хроматографировали, элюируя 30-40% EtOAc/гексан. Наблюдали 2 преобладающих пятна веществ. Фракции, содержащие пятно вещества с наибольшим значением Rf, объединяли и упаривали в вакууме, получая 1,78 г (17%) указанного в заголовке соединения в виде белого твердого вещества. Фракции, содержащие пятно вещества с наименьшим значением Rf, объединяли и упаривали в вакууме, получая 0,90 г (9%) региоизомера в виде почти бесцветного масла.
Стадия 3: Получение 5-{4-[2-(3-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору альдегида (2,36 г, 10,8 ммоль) в абсолютном EtOH (40 мл) добавляли 2,4-тиазолидиндион (0,90 г, 7,69 ммоль) и пиперидин (0,76 мл, 7,7 ммоль), и полученный в результате раствор нагревали до кипения с обратным холодильником. Спустя 6 часов реакционную смесь оставляли охлаждаться до комнатной температуры. Смесь упаривали в вакууме и остаток растворяли в EtOAc. Этот раствор промывали разбавленной водной HOAc, солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате желтое твердое вещество растворяли в MeOH/DCM, адсорбировали на силикагеле и хроматографировали, элюируя 30% EtOAc/DCM. Фракции, содержащие соединение, объединяли и упаривали в вакууме, что приводило к получению 2,17 г (86%) указанного в заголовке соединения в виде желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H14FNO4S m/z 358,1 (M-H)-.
Стадия 4: Получение 5-{4-[2-(3-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона
5-{4-[2-(3-фторфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-дион (1,00 г, 2,78 ммоль) суспендировали в THF (15 мл) и H2O (10 мл). К этому раствору добавляли маленький кристаллик хлорида кобальта, затем добавляли 2,2'-бипиридин (98 мг, 0,63 ммоль). NaBH4 добавляли порциями до установления устойчивого синего цвета. Цвет постепенно поблек, и его повторно регенерировали путем добавления небольшого количества борогидрида и HOAc. Когда данные ВЭЖХ анализа указали на то, что реакция завершена, реакционную смесь разделяли между фазами EtOAc и H2O. HOAc добавляли до тех пор, пока значение pH водной фазы стало приблизительно 6. Водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток хроматографировали на маленькой колонке с силикагелем, элюируя 20% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,72 г (72%) указанного в заголовке соединения в виде белого твердого вещества. Это вещество повторно хроматографировали на маленькой колонке с силикагелем, элюируя 10-20% EtOAc/DCM. Масс-спектр (ионизация электроспреем, ESI-) для C18H16FNO4S m/z 360,1 (M-H)-.
Стадия 5: Получение 5-{4-[2-(3-фторфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-{4-[2-(3-фторфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона (0,62 г, 1,70 ммоль) в DCM (15 мл) добавляли DMSO (0,5 мл) и раствор охлаждали до 0°C. За добавлением пентоксида фосфора (0,49 г, 1,72 ммоль) следовало добавление триэтиламина (1,1 мл, 7,72 ммоль). Реакционную смесь оставляли медленно нагреваться до комнатной температуры. Спустя 2 часа данные ВЭЖХ показали, что реакция завершена. Добавляли воду и разделяли фазы. Значение pH водной фазы доводили до приблизительно 7 с помощью 2M NaOH и водную фазу затем экстрагировали EtOAc. Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате белое твердое вещество хроматографировали на маленькой колонке с силикагелем, элюируя 10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,25 г (40%) указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H14FNO4S m/z 358,0 (M-H)-.
Пример 5: Получение 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
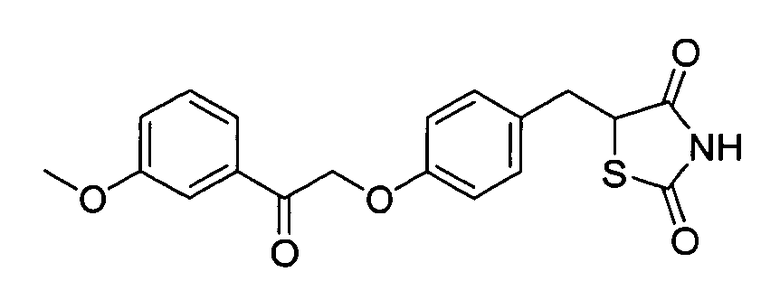
Стадия 1: 2-(3-метоксифенил)этиленоксид
К раствору 3-виниланизола (5,0 г, 37,0 ммоль) и уксусной кислоты (2,1 мл, 37,0 ммоль) в диоксане (33 мл) и H2O (78 мл) при 0°C добавляли N-бромсукцинимид (7,30 г, 41,0 ммоль) тремя порциями. Реакцию оставляли нагреваться до комнатной температуры и затем 2M NaOH (50 мл) добавляли. Реакцию оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь затем разделяли между водой и EtOAc и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме, получая 5,60 г (100%) указанного в заголовке соединения в виде слегка окрашенного масла.
Стадия 2: 4-[2-гидрокси-2-(3-метоксифенил)этокси]бензальдегид
К перемешиваемому раствору 2-(3-метоксифенил)этиленоксида (5,60 г, 37,0 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (6,80 г, 5,60 ммоль), 1M NaOH (65 мл) и PEG4000 (полиэтиленгликоль, 0,85 г), и перемешиваемую смесь нагревали до 78°C в течение ночи. Реакционную смесь оставляли охлаждаться до комнатной температуры и экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате светло-коричневое масло хроматографировали, элюируя 30-40% EtOAc/гексаны. Фракции, содержащие пятно вещества с наибольшим значением Rf, объединяли и упаривали в вакууме, получая 1,86 г (18%) указанного в заголовке соединения в виде прозрачного бесцветного масла. Фракции, содержащие пятно вещества с наименьшим значением Rf, объединяли и упаривали в вакууме, получая 0,90 г (9%) региоизомера в виде почти бесцветного масла.
Стадия 3: 5-{4-[2-гидрокси-2-(3-метоксифенил)этокси]бензилиден}-1,3-тиазолидин-2,4-дион
К перемешиваемому раствору 4-[2-гидрокси-2-(3-метоксифенил)этокси]бензальдегида (1,76 г, 6,46 ммоль) в абсолютном EtOH (50 мл) добавляли 2,4-тиазолидиндион (0,83 г, 7,11 ммоль) и пиперидин (0,70 мл, 7,11 ммоль), и полученный в результате раствор нагревали до кипения с обратным холодильником. Реакцию выдерживали при кипении с обратным холодильником в течение ночи и затем упаривали в вакууме. Остаток растворяли в EtOAc и этот раствор промывали водой (pH доводили до приблизительно 5-6 с помощью HOAc), солевым раствором, сушили (Na2SO4), фильтровали и адсорбировали на силикагеле. После проведения хроматографии с 20-30% EtOAc/DCM фракции, содержащие соединение, объединяли и упаривали в вакууме, получая 1,38 г (58%) указанного в заголовке соединения в виде желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C19H17NO5S m/z 370,1 (M-H)-.
Стадия 4: 5-{4-[2-гидрокси-2-(3-метоксифенил)этокси]бензил} -1,3-тиазолидин-2,4-дион
5-{4-[2-гидрокси-2-(3-метоксифенил)этокси]бензилиден}-1,3-тиазолидин-2,4-дион (1,15 г, 3,10 ммоль) растворяли в THF (15 мл). Добавляли H2O (15 мл) и достаточное количество THF, чтобы получить прозрачный раствор. Маленький кристаллик хлорида кобальта добавляли, затем добавляли 2,2'-бипиридин (109 мг, 0,70 ммоль). NaBH4 добавляли порциями до получения устойчивого синего цвета. Цвет постепенно поблек, но был повторно регенерирован небольшими добавками боргидрида и HOAc. Когда данные ВЭЖХ показали, что реакция завершилась, реакционную смесь разделяли между фазами EtOAc и H2O. HOAc добавляли до достижения значения pH водной фазы приблизительно 6, и затем водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток хроматографировали на маленькой колонке с силикагелем, элюируя 20% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,82 г (74%) указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C19H19NO5S m/z 372,0 (M-H)-.
Стадия 5: Получение 5-{4-[2-(3-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 5-{4-[2-гидрокси-2-(3-метоксифенил)этокси]бензил}-1,3-тиазолидин-2,4-диона (0,62 г, 1,7 ммоль) в DCM (15 мл) добавляли DMSO (0,5 мл) и раствор охлаждали до 0°C. Добавляли пентоксид фосфора (0,52 г, 1,8 ммоль), затем добавляли триэтиламин (1,2 мл, 8,3 ммоль). Реакционную массу оставляли медленно нагреваться до комнатной температуры. Спустя 2 часа добавляли воду и фазы разделяли. Значение pH водной фазы доводили до приблизительно 7 с помощью 2M NaOH. Водную фазу экстрагировали EtOAc. Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате белое твердое вещество хроматографировали на маленькой колонке с силикагелем, элюируя 10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,33 г (54%) указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI+) для C19H17NO5S m/z 372,0 (M+H)+. Масс-спектр (ионизация электроспреем, ESI-) для C19H17NO5S m/z 370,1 (M-H)-.
Пример 6: Получение 5-{4-[2-(2-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
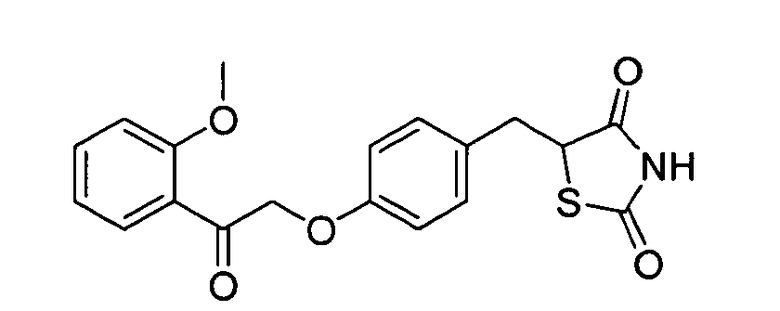
Стадия 1: Получение 2-(2-метоксифенил)этиленоксида
К раствору 2-виниланизола (5,0 г, 0,037 моль) и уксусной кислоты (2,1 мл, 37 ммоль) в диоксане (33 мл) и H2O (78 мл) при 0°C добавляли N-бромсукцинимид (7,30 г, 40,1 ммоль) тремя порциями. Реакцию оставляли нагреваться до комнатной температуры и спустя 1 час добавляли 2M NaOH (50 мл). Реакцию оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь разделяли между фазами воды и EtOAc, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме, получая 7,56 г слегка окрашенного масла. Его растворяли в диоксане, 2N NaOH добавляли и реакционную массу перемешивали при комнатной температуре в течение ночи. Повторная водная обработка привела к получению 5,60 г указанного в заголовке соединения в виде почти бесцветного масла.
Стадия 2: Получение 4-[2-гидрокси-2-(2-метоксифенил)этокси]бензальдегида
К перемешиваемому раствору 2-(2-метоксифенил)этиленоксида (5,60 г, 37,3 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (6,80 г, 56,0 ммоль), 1M NaOH (65 мл) и PEG4000 (полиэтиленгликоль, 0,85 г) и перемешиваемую смесь нагревали до 78°C в течение ночи. Реакционную массу оставляли охлаждаться до комнатной температуры и ее затем экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате светлое масло адсорбировали на силикагеле и хроматографировали, элюируя 30-40% EtOAc/гексаны. Наблюдали 2 преобладающих пятна веществ. Фракции, содержащие пятно вещества с наибольшим значением Rf, объединяли и упаривали в вакууме, получая 1.71 г (17%) региоизомера в виде коричневого масла. Фракции, содержащие пятно вещества с наименьшим значением Rf, объединяли и упаривали в вакууме, получая 2,05 г (20%) указанного в заголовке соединения в виде желтого твердого вещества.
Стадия 3: Получение (5Z)-5-{4-[2-гидрокси-2-(2-метоксифенил)этокси]бензилиден}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору 4-[2-гидрокси-2-(2-метоксифенил)этокси]бензальдегида (1,71 г, 6,28 ммоль) в абсолютном EtOH (50 мл) добавляли 2,4-тиазолидиндион (0,81 г, 6,91 ммоль) и пиперидин (0,68 мл, 6,9 ммоль), и полученный в результате раствор нагревали до кипения с обратным холодильником. Реакционную массу выдерживали при кипении с обратным холодильником в течение ночи и затем упаривали в вакууме. Остаток растворяли в EtOAc и этот раствор промывали водной HOAc (pH 5-6), солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток адсорбировали на силикагеле и хроматографировали на силикагеле, элюируя 20-40% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 1,87 г (80%) указанного в заголовке соединения в виде светло-желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C19H17NO5S m/z 370,1 (M-H)-.
Стадия 4: 5-{4-[2-гидрокси-2-(2-метоксифенил)этокси]бензил} -1,3-тиазолидин-2,4-дион
(5Z)-5-{4-[2-гидрокси-2-(2-метоксифенил)этокси]бензилиден}-1,3-тиазолидин-2,4-дион (1,00 г, 2,69 ммоль) растворяли в THF (20 мл). Воду (20 мл) добавляли и затем добавляли достаточное дополнительное количество THF, чтобы получить прозрачный раствор. Маленький кристаллик хлорида кобальта добавляли, затем добавляли 2,2'-бипиридин (95 мг, 0,61 ммоль). Реакционную смесь охлаждали до 0°C. NaBH4 добавляли порциями до появления устойчивой синей окраски. Цвет постепенно поблек и был повторно регенерирован небольшими добавками боргидрида и HOAc. Когда данные ВЭЖХ указали на то, что реакция завершена, реакционную смесь разделяли между фазами EtOAc и H2O. HOAc добавляли до тех пор, пока значение pH водной фазы стало приблизительно 6, и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток хроматографировали на маленькой колонке с силикагелем, элюируя 20% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,63 г (63%) указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C19H19NO5S m/z 372,1 (M-H)-.
Стадия 5: Получение 5-{4-[2-(2-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору пентоксида фосфора (0,30 г, 1,10 ммоль) в DCM (8 мл) при 0°C добавляли раствор 5-{4-[2-гидрокси-2-(2-метоксифенил)этокси]бензил}-1,3-тиазолидин-2,4-диона (0,20 г, 0,54 ммоль) в DCM (8 мл), затем добавляли диметилсульфоксид (0,20 мл, 2,80 ммоль). После перемешивания в течение 15 минут N,N-диизопропилэтиламин (0,28 мл, 1,60 ммоль) добавляли. Спустя 45 минут реакционную смесь выливали в холодный насыщенный раствор NaHCO3 и экстрагировали EtOAc (×2). Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток хроматографировали на маленькой колонке с силикагелем, элюируя 0-10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 175 мг (88%) указанного в заголовке соединения в виде светло-желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C19H17NO5S m/z 370,1 (M-H)-.
Пример 7: Получение 5-{4-[2-(3-хлорфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
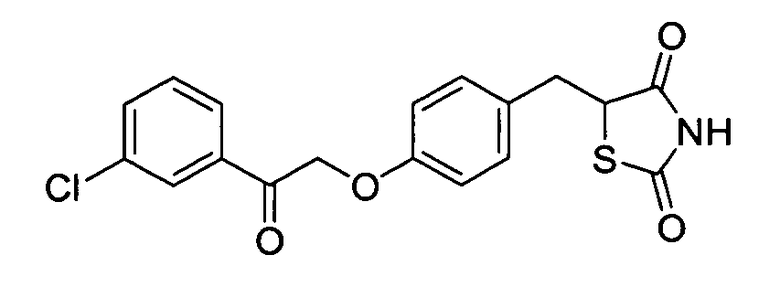
Стадия 1: 2-(3-хлорфенил)этиленоксид
К раствору м-хлорстирола (5,70 г, 41,0 ммоль) и уксусной кислоты (2,33 мл, 40,9 ммоль) в диоксане (33 мл) и H2O (78 мл) при 0°C добавляли N-бромсукцинимид (8,02 г, 45,0 ммоль) тремя порциями. Реакцию оставляли нагреваться до комнатной температуры. Спустя 4 часа добавляли 2N NaOH (60 мл) и реакционную массу оставляли перемешиваться при комнатной температуре в течение ночи.
Реакционную смесь разделяли между фазами воды и EtOAc и водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме, получая 6,20 г слегка окрашенного масла, которое использовали без дополнительной очистки.
Стадия 2: 4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензальдегид
К перемешиваемому раствору 2-(3-хлорфенил)этиленоксида (6,20 г, 40,0 ммоль) в толуоле (65 мл) добавляли 4-гидроксибензальдегид (7,30 г, 60,0 ммоль), 1M NaOH (65 мл) и PEG4000 (полиэтиленгликоль, 0,85 г) и перемешиваемую смесь нагревали до 78°C в течение трех часов. Реакционную массу оставляли охлаждаться до комнатной температуры и затем экстрагировали EtOAc (2×150 мл). Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Полученное в результате светло-коричневое масло адсорбировали на силикагеле и хроматографировали, элюируя 25-40% EtOAc/гексаны. Наблюдали 2 преобладающих пятна веществ. Фракции, содержащие пятно вещества с наибольшим значением Rf, объединяли и упаривали в вакууме, получая 1,08 г (10%) целевого продукта в виде бесцветного масла. Фракции, содержащие пятно вещества с наименьшим значением Rf, объединяли и упаривали в вакууме, получая 0,95 г (8%) региоизомера в виде бесцветного масла, 44B. Некоторое количество стартового эпоксида (2,85 г) также было извлечено.
Стадия 3: 5-{4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-дион
К перемешиваемому раствору 4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензальдегида (1,08 г, 3,90 ммоль) в абсолютном EtOH (50 мл) добавляли 2,4-тиазолидиндион (0,50 г, 4,29 ммоль) и пиперидин (0,42 мл, 4,3 ммоль), и полученный в результате раствор нагревали до кипения с обратным холодильником и затем перемешивали в течение ночи при комнатной температуре. Реакционную смесь упаривали в вакууме и остаток растворяли в EtOAc. Этот раствор промывали водной HOAc (pH 5-6), солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток адсорбировали на силикагеле и хроматографировали, элюируя 10-20% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 1,31 г (89%) продукта в виде светло-желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI+) для C18H14ClNO4S m/z 375,0 (M+H)+. Масс-спектр (ионизация электроспреем, ESI-) для C18H14ClNO4S m/z 374,1 (M-H)-.
Стадия 4: 5-{4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-дион
5-{4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензилиден}-1,3-тиазолидин-2,4-дион (0,74 г, 2,00 ммоль) растворяли в THF (20 мл). Воду (20 мл) добавляли и затем еще больше THF добавляли до растворения всего твердого вещества. Маленький кристаллик хлорида кобальта добавляли, затем добавляли 2,2'-бипиридин (69 мг, 0,44 ммоль). Реакционную смесь охлаждали до 0°C. NaBH4 добавляли порциями до появления устойчивого синего цвета. Цвет постепенно поблек и был повторно регенерирован путем небольших добавок боргидрида и HOAc. Когда данные ВЭЖХ указали на завершение реакции, реакционную смесь разделяли между фазами EtOAc и H2O. HOAc добавляли до тех пор, пока значение pH водной фазы достигло приблизительно 6, и затем водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток хроматографировали на маленькой колонке с силикагелем, элюируя 0-10% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 0,44 г (59%) липкого желтого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H16ClNO4S m/z 376,1 (M-H)-.
Стадия 5: Получение 5-{4-[2-(3-хлорфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
К перемешиваемому раствору пентоксида фосфора (0,38 г, 1,30 ммоль) в DCM (8 мл) при 0°C добавляли раствор 5-{4-[2-(3-хлорфенил)-2-гидроксиэтокси]бензил}-1,3-тиазолидин-2,4-диона (0,25 г, 0,66 ммоль) в DCM (8 мл), затем добавляли диметилсульфоксид (0,23 мл, 3,30 ммоль). После перемешивания в течение 15 минут добавляли N,N-диизопропилэтиламин (0,34 мл, 2,00 ммоль). Спустя 45 минут реакционную массу выливали в холодный насыщенный раствор NaHCO3 и смесь экстрагировали EtOAc (×2). Объединенные экстракты промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали в вакууме. Остаток хроматографировали на маленькой колонке с силикагелем, элюируя 0-15% EtOAc/DCM. Фракции, содержащие продукт, объединяли и упаривали в вакууме, получая 117 мг (47%) белого твердого вещества. Масс-спектр (ионизация электроспреем, ESI-) для C18H14ClNO4S m/z 374,1 (M-H)-.
Пример 8: Получение 5-{4-[2-(2-хлорфенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
Указанное в заголовке соединение может быть получено, как описано в примере 7, при использовании подходящих исходных веществ, таких как 2-(2-хлорфенил)этиленоксид.
Пример 9: Получение 5-{4-[2-(4-метоксифенил)-2-оксоэтокси]бензил}-1,3-тиазолидин-2,4-диона
Указанное в заголовке соединение получали, как описано в примерах 5 и 6, используя подходящие исходные вещества, такие как 2-(4-метоксифенил)этиленоксид. Масс-спектр (ионизация электроспреем, ESI-) для C19H17NO5S 370,2 m/z (M-1).
Пример 10: Испытания
Испытания по определению снижения активации PPARγ рецептора
Принимая во внимание то, что активация PPARγ рецептора обычно считается отборочным критерием при выборе молекул, которые могут проявлять антидиабетические и инсулин-сенсибилизирующие фармакологические свойства, в рамках этого изобретения найдено, что активацию этого рецептора следует рассматривать как отрицательный критерий отбора. Молекулы будут выбраны из этой химической области, потому что они снижают, но не только селективно, активацию PPARγ. Оптимальные соединения обладают, по меньшей мере, 10-кратной понижающей активностью по сравнению с пиоглитазоном и менее чем 50% от всей активности, обеспечиваемой розиглитазоном, в испытаниях, проведенных in vitro, по трансактивации PPARγ рецептора. Испытания проводили путем первичной оценки направленных взаимодействий молекул с лиганд-связывающим доменом PPARγ. Это можно осуществить с помощью коммерческого прибора взаимодействия, который измеряет направленное взаимодействие по флуоресценции с использованием розиглитазона в качестве положительного контроля. Дополнительные испытания могут быть проведены методом, аналогичным тому, который описал Lehmann et al. [Lehmann JM, Moore LB, Smith-Oliver TA: An Antidiabetic Thiazolidinedione is a High Affinity Ligand for Peroxisome Proliferator - activated Receptor (PPAR) J. Biol. Chem. (1995) 270: 12953], но будет использована люцифераза в качестве репортера, как у Vosper et al. [Vosper, H., Khoudoli, GA, Palmer, CN (2003) The peroxisome proliferators activated receptor d is required for the differentiation of THP-1 moncytic cells by phorbol ester. Nuclear Receptor 1:9]. Навески соединений растворяют в DMSO и добавляют к клеточным культурам в конечной концентрации от 0,1 до 100 мкМ, и относительную активацию считают по индукции репортерного гена (люциферазы), скорректированной с учетом экспрессии контрольной плазмиды (кодирующей галактозидазу). Пиоглитазон и розиглитазон применяют в качестве эталонных контрольных соединений, как описано выше.
В добавление к показателям сниженной активации PPARγ рецептора in vitro, соединения не вызывают существенную активацию рецептора у животных. Соединения, взятые в дозах, обеспечивающих в высшей степени эффект инсулин-сенсибилизирующих воздействий in vivo (см. ниже), не будут увеличивать активацию PPARγ в печени, как измерено с помощью экспрессии P2, биомаркера эктопического липогенеза в печени [Matsusue K, Haluzik M, Lambert G, Yim S-H, Oksana Gavrilova O, Ward JM, Brewer B. Reitman ML, Gonzalez FJ. (2003) Liver-specific disruption of PPAR in leptin-deficient mice improves fatty liver but aggravates diabetic phenotypes. J. Clin. Invest.; 111: 737], в отличие от пиоглитазона и розиглитазона, которые приводят к увеличению P2 экспрессии при этих условиях.
Инсулин-сенсибилизирующие и антидиабетические фармакологические свойства измеряли для KKAY мышей, как ранее сообщалось [Hofmann, C., Lornez, K., and Colca, J.R. (1991). Glucose transport deficiency corrected by treatment with the oral anti-hyperglycemic agent Pioglitazone. Endocrinology, 129:1915-1925.] Соединения представляли в виде лекарственной формы с 1% натриевой солью карбоксиметилцеллюлозы и 0,01% твин 20, и с суточной дозировкой для перорального зондового введения. Спустя 4 дня одноразового суточного введения обработанные образцы крови отбирали из ретро-глазничной пазухи и анализировали на глюкозу, триглицериды и инсулин, как описано у Hofmann et al. Дозы соединений, которые обеспечивают, по меньшей мере, 80% от максимального понижения глюкозы, триглицеридов и инсулина, не будут существенно повышать экспрессию P2 в печени этих мышей.
Измерение активации PPARγ рецептора
Способность нескольких типичных соединений настоящего изобретения связываться с PPARγ определяли, используя коммерческий связывающий тест (Invitrogen Corporation, Carlsbad, CA), который определяет способность тестируемых соединений связываться с PPAR-LBD/Fluormone PPAR Green complex. Эти испытания проводили для трех отборов проб, при каждом тесте используя четыре отдельные лунки (четырехкратная повторность) для каждой концентрации тестируемого соединения. Данные усредняли и стандартные средние ошибки (SEM) величин получали из трех экспериментов. Розиглитазон применяли в качестве положительного контроля в каждом эксперименте. Соединения добавляли в представленных концентрациях, которые изменялись в диапазоне 0,1-100 микромолей.
Глюкоза, инсулин и триглицериды у диабетических KKAy мышей, подвергнутых воздействию типичными соединениями настоящего изобретения
Инсулин-сенсибилизирующие и антидиабетические фармакологические свойства определяли на KKAY мышах, как ранее описано [Hofmann, C., Lornez, K., and Colca, J.R. (1991). Glucose transport deficiency corrected by treatment with the oral anti-hyperglycemic agent Pioglitazone. Endocrinology, 129:1915-1925.]. Соединения представляли в виде лекарственной формы с 1% натриевой солью карбоксиметилцеллюлозы и 0,01% твин 20, и с суточной дозировкой для перорального зондового введения. Спустя 4 дня одноразового суточного введения обработанные образцы крови отбирали из ретро-глазничной пазухи и анализировали на глюкозу, триглицериды и инсулин, как описано у Hofmann et al. Дозы соединений, которые обеспечивают, по меньшей мере, 80% от максимального понижения глюкозы, триглицеридов и инсулина, не будут существенно повышать экспрессию P2 в печени этих мышей.
Соединения представляли в виде лекарственной формы суспензии и перорально вводили KKAy мышам в дозе 93 мг/кг в течение 4 дней. Соединения сначала растворяли в DMSO и затем помещали в водную суспензию, содержащую 7-10% DMSO, 1% натриевой соли метилкарбоксицеллюлозы и 0,01% Твин 20. На пятый день мышей не кормили и отбирали образцы крови приблизительно через 18 часов после введения последней дозы. Параметры определяли путем стандартных тестовых методов. Данные усредняли и вычисляли SEM N=6-12 мышей.
Результаты испытаний
тичное отклонение)
тичное отклонение)
тичное отклонение)
тичное отклонение)
Соединения из примеров 1, 2, 3, 4 и 5 показали уровень инсулина в плазме менее чем приблизительно 5 нг/мл и из примера 6 показали уровень инсулина в плазме в интервале между приблизительно 15 и 20 нг/мл; из примеров 1, 2, 3, 4 и 5 показали уровень триглицеридов в плазме в интервале между приблизительно 100 и 200 мг/дл и из примера 6 показали уровень триглицеридов в плазме в интервале между приблизительно 300 и 400 мг/дл; из примеров 1, 2, 3, 4 и 5 показали уровень глюкозы в плазме в интервале между приблизительно 350 и 425 мг/дл и из примера 6 показали уровень глюкозы в плазме в интервале между приблизительно 450 и 525 мг/дл.
PPARγ-защищающие соединения этого изобретения будут более эффективными для лечения заболеваний, обусловленных метаболическим воспалением, таких как диабет и метаболический синдром, за счет ограничения побочных эффектов, свойственных направленной и селективной активации ядерных транскрипционных факторов.
Поскольку соединения настоящего изобретения проявляют пониженную PPARγ активацию, можно предположить, что эти соединения представляют собой соединения, пригодные для применения в комбинации с другими соединениями, имеющими антидиабетическую активность, такими как метформин, ингибиторы DDP-4 или с другими антидиабетическими средствами, которые функционируют по отличающимся механизмам по усилению действий или секреций GLP1 или инсулина. А именно, из-за сниженных PPARγ взаимодействий эти соединения будут также полезны при лечении дислипидемии, связанной с метаболическими воспалительными заболеваниями, сочетаясь очень хорошо с гиполипидемическими статинами, такими как аторвастатин или ему подобными. Также предполагается, что комбинация соединения формулы I и других антидиабетических соединений будет более эффективной при лечении диабета, чем комбинации с PPAR-активирующими соединениями, поскольку они будут устранять побочные эффекты, связанные с активацией PPARγ, которые могут включать увеличение объема, отечность и потерю костной массы.
Другие примеры осуществления изобретения
Следует понимать, что наряду с тем, что изобретение изложено в сочетании с подробным его описанием, предшествующее описание предназначено проиллюстрировать и не ограничить объем изобретения, который определен объемом прилагаемой формулы изобретения. Другие аспекты, достижения и модификации находятся в пределах объема нижеприведенной формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛИ ТИАЗОЛИДИНДИОНА СО СНИЖЕННЫМ СРОДСТВОМ К PPAR ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ ОБМЕНА ВЕЩЕСТВ | 2010 |
|
RU2564661C2 |
| НОВЫЙ СПОСОБ СИНТЕЗА СОЕДИНЕНИЙ ТИАЗОЛИДИНДИОНА | 2011 |
|
RU2593370C2 |
| СИНТЕЗ СОЕДИНЕНИЙ ТИАЗОЛИДИНДИОНА | 2011 |
|
RU2594725C2 |
| РАПП-ПОДДЕРЖИВАЮЩИЕ ТИАЗОЛИДИНДИОНЫ И ИХ КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2570424C2 |
| PPAR-ПОДДЕРЖИВАЮЩИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2687490C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2010 |
|
RU2531588C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2006 |
|
RU2446171C2 |
| АНАЛОГИ ТИАЗОЛИДИНДИОНА | 2007 |
|
RU2445957C2 |
| МОДУЛЯТОРЫ КИНАЗЫ, АССОЦИИРОВАННОЙ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА-1 | 2007 |
|
RU2459821C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2006 |
|
RU2463303C2 |
Изобретение относится к селективному аналогу тиазолидиндиона для применения при лечении и предотвращении диабета и дислипидемии, представляющему собой 5-(4-(2-(3-метоксифенил)-2-оксоэтокси)бензил)тиазолидин-2,4-дион или его фармацевтически приемлемую соль. Также изобретение относится к фармацевтической композиции для лечения диабета и дислипидемии, включающей эффективное количество 5-(4-(2-(3-метоксифенил)-2-оксоэтокси)бензил)тиазолидин-2,4-диона или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Технический результат - селективный аналог тиазолидиндиона, снижающий связывание и активацию ядерного транскрипционного фактора PPARγ. 4 н.п. ф-лы, 2 табл., 10 пр.
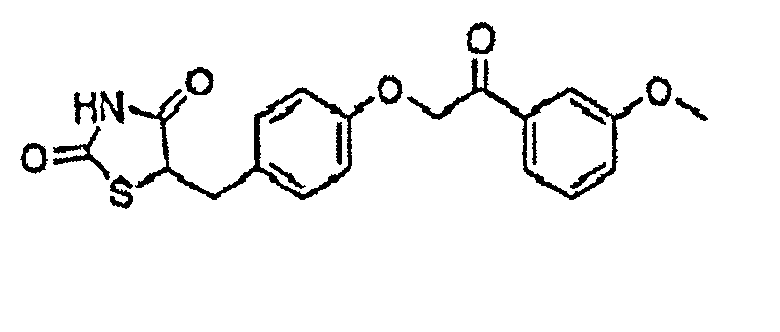
1. Фармацевтическая композиция для лечения диабета и дислипидемии, включающая эффективное количество соединения
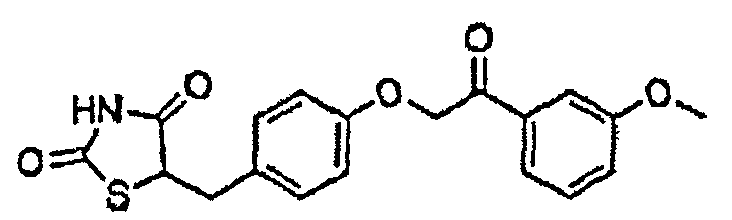
или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
2. Способ лечения диабета, включающий введение пациенту, нуждающемуся в этом, соединения, выбранного из
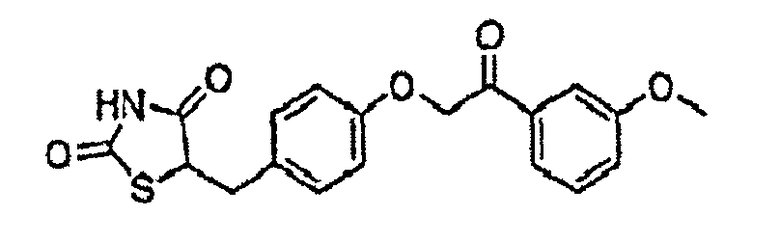
или его фармацевтически приемлемой соли, или фармацевтической композиции по п.1.
3. Способ лечения дислипидемии, включающий введение пациенту, нуждающемуся в этом, соединения, выбранного из
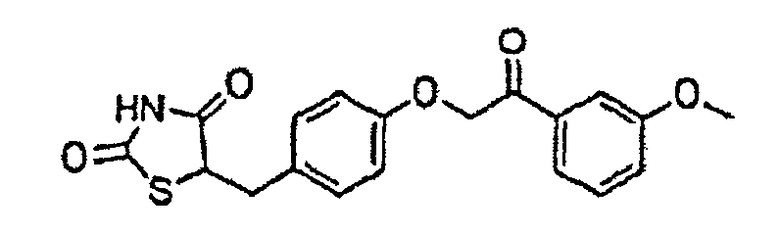
или его фармацевтически приемлемой соли, или фармацевтической композиции по п.1.
4. Соединение, выбранное из 5-(4-(2-(3-метоксифенил)-2-оксоэтокси)бензил)тиазолидин-2,4-диона.
| TAKASHI SOHDA et al.: "Studies on antidiabetic agents | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ФРИКЦИОННАЯ СЦЕПНАЯ МУФТА | 1928 |
|
SU8203A1 |
| Укрытие места загрузки конвейера | 1978 |
|
SU749751A1 |
| Устройство для дистанционного управления шахтным электровозом | 1974 |
|
SU549365A1 |
| GERBER P | |||
| et al.: "Effects | |||
Авторы
Даты
2013-06-27—Публикация
2008-09-15—Подача