ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к некоторым новым макрогетероциклическим соединениям, способам получения таких соединений и способам лечения или облегчения нарушения, опосредованного киназой или двойной киназой. Более конкретно, данное соединение относится к макрогетероциклическим соединениям 1Н-индола, 1Н-пирроло[2,3-b]пиридина, 1Н-пиразоло[3,4-b]пиридина и 1Н-индазола, полезным в качестве селективных ингибиторов киназы или двойной киназы, к способам получения таких соединений и к способам лечения или облегчения нарушения, опосредованного киназой или двойной киназой.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В патенте Соединенных Штатов 5624949 (Hearth Jr. et al.) описываются производные бис-индолмалеимида формулы:

где W представляет собой -О-, -S-, -SO-, -SO2-, -CO-, C2-C6 алкилен, замещенный алкилен, C2-C6 алкенилен, -арил-, -арил(СН2)mO-, -гетероцикл-, гетероцикл-(СН2)mO-, -конденсированный бицикл-, -конденсированный бицикл-(СН2)mO-, -NR3-, -NOR3-, -CONH- или -NHCO-; X и Y независимо представляют собой С1-С4 алкилен, замещенный алкилен или, вместе, Х, Y и W объединены с образованием (CH2)n-AA-; R1 независимо представляет собой водород, галоген, С1-С4 алкил, гидрокси, С1-С4 алкокси, галогеналкил, нитро, NR4R5 или -NHCO(C1-C4)алкил; R2 представляет собой водород, СН3СО-, NH2 или гидрокси; R3 представляет собой водород, (СН2)mарил, С1-С4 алкил, -СОО(С1-С4 алкил), -CONR4R5, -C(C=NH)NH2, -SO(C1-C4 алкил), -SO2(NR4R5) или -SO2(С1-С4 алкил); R4 и R5 независимо представляют собой водород, С1-С4 алкил, фенил, бензил или объединены с азотом, к которому они присоединены, с образованием насыщенного или ненасыщенного 5- или 6-членного кольца; АА представляет собой остаток аминокислоты; m независимо равен 0, 1, 2 или 3; и n независимо равен 2, 3, 4 или 5; в качестве РКС ингибиторов и в качестве селективных ингибиторов РКСβ-I и РКСβ-II.
Предметом настоящего изобретения является разработка макрогетероциклических соединений 1Н-индола, 1Н-пирроло[2,3-b]пиридина, 1Н-пиразоло[3,4-b]пиридина и 1Н-индазола, полезных в качестве ингибиторов киназы или двойной киназы (то есть соединения, способного ингибировать две или более киназ, как, например, киназы, выбранной из протеинкиназы С или гликогенсинтазакиназы-3; и более конкретно киназы, выбранной из протеинкиназы Сα, протеинкиназы Сβ-II, протеинкиназы Cγ и гликогенсинтазакиназы-3β), способов получения таких соединений и способов лечения или облегчения нарушения, опосредованного киназой или двойной киназой.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к макрогетероциклическому соединению формулы (I)
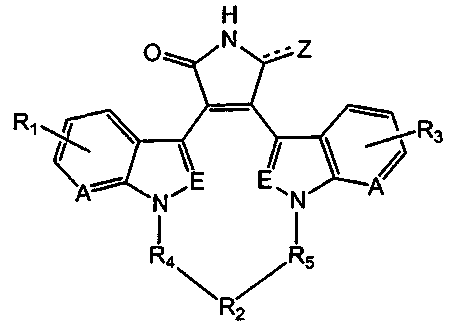
Формула (I)
где
А и Е независимо выбирают из группы, состоящей из замещенного водородом атома углерода и атома азота; где 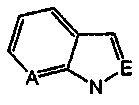
независимо выбирают из группы, состоящей из 1Н-индола, 1H-пирроло[2,3-b]пиридина, 1Н-пиразоло[3,4-b]пиридина и 1Н-индазола;
Z выбирают из О; альтернативно Z выбирают из дигидро; где каждый атом водорода присоединен через одинарную связь;
R4 и R5 независимо выбирают из С1-8алкила, С2-8 алкенила и С2-8алкинила, необязательно замещенных оксо;
R2 выбирают из -С1-8алкила-, -С2-8алкенила-, -С2-8алкинила-, -О-(С1-8)алкил-О-, -О-(С2-8)алкенил-О-, -О-(С2-8)алкинил-О-, -С(О)-(С1-8)алкил-С(О)- (где любая из вышеуказанных алкильных, алкенильных и алкинильных связывающих групп представляет собой линейные углеродные цепи, необязательно замещенные одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, -С(О)О-(С1-8)алкила, -С1-8алкил-С(О)О-(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси, гидрокси(С1-8)алкила и оксо; и где любая из вышеуказанных алкильных, алкенильных и алкинильных связывающих групп необязательно замещена одним-двумя заместителями, независимо выбранными из группы, состоящей из гетероциклила, арила, гетероарила, гетероциклил(С1-8)алкила, арил(С1-8)алкила, гетероарил(С1-8)алкила, спироциклоалкила и спирогетероциклила (где любой из вышеуказанных циклоалкильного, гетероциклического, арильного и гетероарильного заместителей необязательно замещен одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси и гидрокси(С1-8)алкила; и где любой из вышеуказанных гетероциклических заместителей необязательно замещен оксо), циклоалкила, гетероциклила, арила, гетероарила (где циклоалкил, гетероциклил, арил и гетероарил необязательно замещены одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси и гидрокси(С1-8)алкила; и где гетероциклил необязательно замещен оксо), -(O-(CH2)1-6)0-5-O-, -O-(CH2)1-6-O-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-O-(CH2)1-6-O-, -(O-(CH2)1-6)0-5-NR6-, -O-(CH2)1-6-NR6-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6--NR6-, -(O-(CH2)1-6)0-5-S-, -O-(CH2)1-6-S-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-S-, -NR6-, -NR6-NR7-, -NR6-(CH2)1-6-NR7-, -NR6-(CH2)1-6-NR7-(CH2)1-6-NR8-, -NR6=C(O)-, -C(O)-NR6-, -C(O)-(CH2)0-6-NR6-(CH2)0-6-C(O)-, -NR6-(CH2)0-6-C(O)-(CH2)1-6-C(O)-(CH2)0-6-NR7-, -NR6-C(O)-NR7-, -NR6-C(NR7)-NR8-, -O-(CH2)1-6-NR6-(CH2)1-6-S-, -S-(CH2)1-6-NR6-(CH2)1-6-O-, -S-(CH2)1-6-NR6-(CH2)1-6-S-, -NR6-(CH2)1-6-S--(CH2)1-6--NR7-- и -SO2- (где R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, С1-8алкила, С1-8алкокси(С1-8)алкила, карбоксил(С1-8)алкила, амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), гидрокси(С1-8)алкила, гетероциклил(С1-8)алкила, арил(С1-8)алкила и гетероарил(С1-8)алкила (где вышеуказанные гетероциклильный, арильный и гетероарильный заместители необязательно замещены одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси и гидрокси(С1-8)алкила; где гетероциклил необязательно замещен оксо)),
при условии, что если А и Е выбирают из замещенного водородом атома углерода, то R2 выбирают из группы, состоящей из -С2-8алкинила-, -О-(С1-8)алкил-О-, -О-(С2-8)алкенил-О-, -О-(С2-8)алкинил-О-, -С(О)-(С1-8)алкил-С(О)- (где любая из вышеуказанных алкильных, алкенильных и алкинильных связывающих групп представляет собой линейные углеродные цепи, необязательно замещенные одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, -С(О)О-(С1-8)алкила, -С1-8алкил-С(О)О-(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси, гидрокси(С1-8)алкила и оксо; и где любая из вышеуказанных алкильных, алкенильных и алкинильных связывающих групп необязательно замещена одним-двумя заместителями, независимо выбранными из группы, состоящей из гетероциклила, арила, гетероарила, гетероциклил(С1-8)алкила, арил(С1-8)алкила, гетероарил(С1-8)алкила, спироциклоалкила и спирогетероциклила (где любой из вышеуказанных циклоалкильного, гетероциклического, арильного и гетероарильного заместителей необязательно замещен одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси и гидрокси(С1-8)алкила, и где любой из вышеуказанных гетероциклических заместителей необязательно замещен оксо)), циклоалкила (где циклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси и гидрокси(С1-8)алкила, -(O-(CH2)1-6)1-5-O-, -O-(CH2)1-6-O-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-O-(CH2)1-6-O-, -(O-(CH2)1-6)1-5-NR6-, -O-(CH2)1-6-NR6-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-NR6-, -(O-(CH2)1-6)0-5-S-, -O-(CH2)1-6-S-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-S-, -NR6-NR7-, -NR6-(CH2)1-6-NR7-, -NR6-(CH2)1-6-NR7-(CH2)1-6-NR8-, -NR9=C(O)-, -C(O)-NR9-, -C(O)-(CH2)0-6--NR6--(CH2)0-6-C(O)-, -NR6-(CH2)0-6-C(O)-(CH2)1-6-C(O)-(CH2)0-6--NR7-, -NR6-C(O)-NR7-, -NR6-C(NR7)-NR8-, -O-(CH2)1-6-NR6-(CH2)1-6-S-, -S-(CH2)1-6-NR6-(CH2)1-6-O-, -S-(CH2)1-6-NR6-(CH2)1-6-S- и -NR6-(CH2)1-6-S-(CH2)1-6--NR7-- (где R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, С1-8алкила, С1-8алкокси(С1-8)алкила, карбоксил(С1-8)алкила, амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), гидрокси(С1-8)алкила, гетероциклил(С1-8)алкила, арил(С1-8)алкила и гетероарил(С1-8)алкила (где вышеуказанные гетероциклильный, арильный и гетероарильный заместители необязательно замещены одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси и гидрокси(С1-8)алкила; и где гетероциклил необязательно замещен оксо)); и где R9 выбирают из группы, состоящей из С1-8алкила, С1-8алкокси(С1-8)алкила, карбоксил(С1-8)алкила, амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), гидрокси(С1-8)алкила, гетероциклил(С1-8)алкила, арил(С1-8)алкила и гетероарил(С1-8)алкила (где вышеуказанные гетероциклильный, арильный и гетероарильный заместители необязательно замещены одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-8алкила, С1-8алкокси, С1-8алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси и гидрокси(С1-8)алкила; и где гетероциклил необязательно замещен оксо)), и
R1 и R3 независимо выбирают из группы, состоящей из водорода, С1-8алкила, С2-8алкенила, С2-8алкинила (где алкил, алкенил и алкинил необязательно замещены заместителем, выбранным из группы, состоящей из С1-8алкокси, алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), (галогена)1-3, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси, гидрокси(С1-8)алкила и оксо), С1-8алкокси, С1-8алкоксикарбонила, (галоген)1-3(С1-8)алкокси, С1-8алкилтио, арила, гетероарила (где арил и гетероарил необязательно замещены заместителем, выбранным из группы, состоящей из С1-8алкила, С1-8алкокси, алкокси(С1-8)алкила, карбоксила, карбоксил(С1-8)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-8)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-8)алкила, (галоген)1-3(С1-8)алкокси, гидрокси и гидрокси(С1-8)алкила), амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), циано, галогена, гидрокси и нитро;
и его фармацевтически приемлемым солям.
Настоящее изобретение относится к макрогетероциклическим соединениям, полезным в качестве селективного ингибитора киназы или двойной киназы; предпочтительно в качестве ингибиторов киназы, выбранной из протеинкиназы С и гликогенсинтазакиназы-3; и, более конкретно, киназы, выбранной из протеинкиназы Сα, протеинкиназы Сβ-II, протеинкиназы Cγ и гликогенсинтазакиназы-3β.
Настоящее изобретение также относится к способам получения настоящих макрогетероциклических соединений и их фармацевтических композиций и лекарственных средств.
Настоящее изобретение дополнительно относится к способам лечения или облегчения опосредованного киназой или двойной киназой нарушения. В частности, способ по настоящему изобретению относится к лечению или облегчению опосредованного киназой нарушения, такого как, но не ограничиваясь этим, сердечно-сосудистые заболевания, диабет, связанные с диабетом нарушения, воспалительные заболевания, иммунологические нарушения, дерматологические нарушения, онкологические заболевания и расстройства центральной нервной системы (ЦНС).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (Iaa):
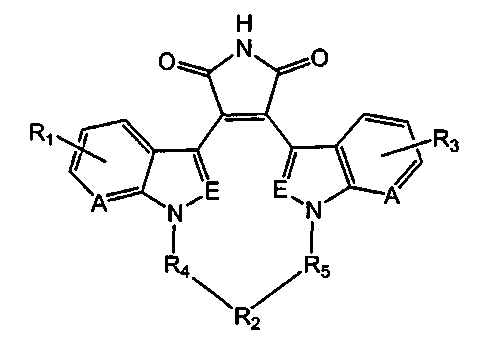
Формула (Iaa)
где
А и Е независимо выбирают из группы, состоящей из замещенного водородом атома углерода и атома азота; где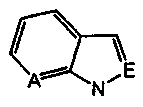 независимо выбирают из группы, состоящей из 1Н-индола, 1H-пирроло[2,3-b]пиридина и 1Н-индазола;
независимо выбирают из группы, состоящей из 1Н-индола, 1H-пирроло[2,3-b]пиридина и 1Н-индазола;
и все другие переменные являются такими, как определено ранее,
и его фармацевтически приемлемые соли.
Более предпочтительно, соединение формулы (I), как упоминается в разделе «Краткое изложение сущности изобретения», представляет собой соединение, выбранное из группы, состоящей из:

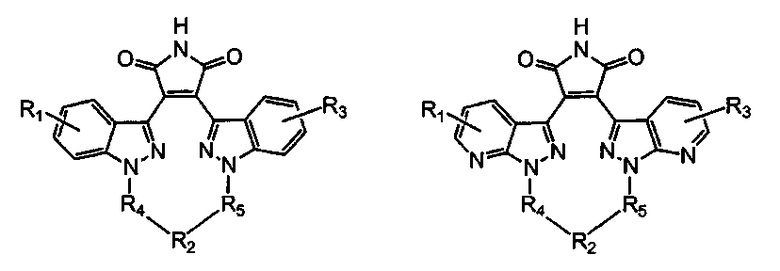
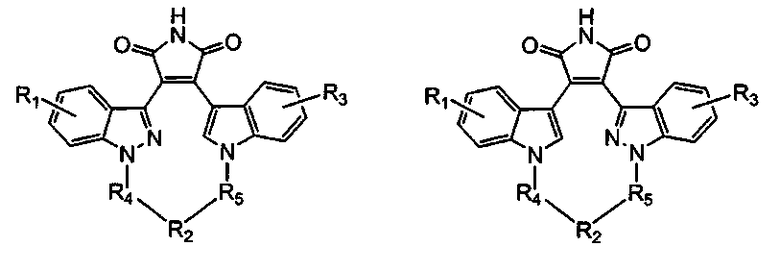
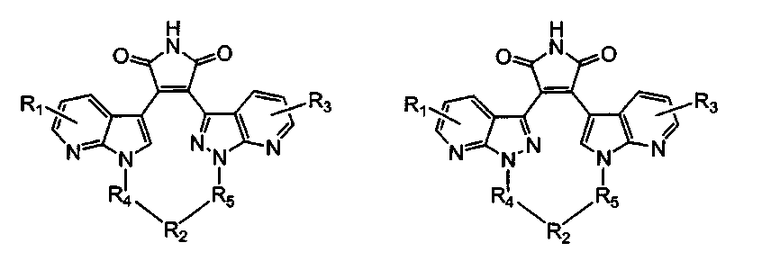
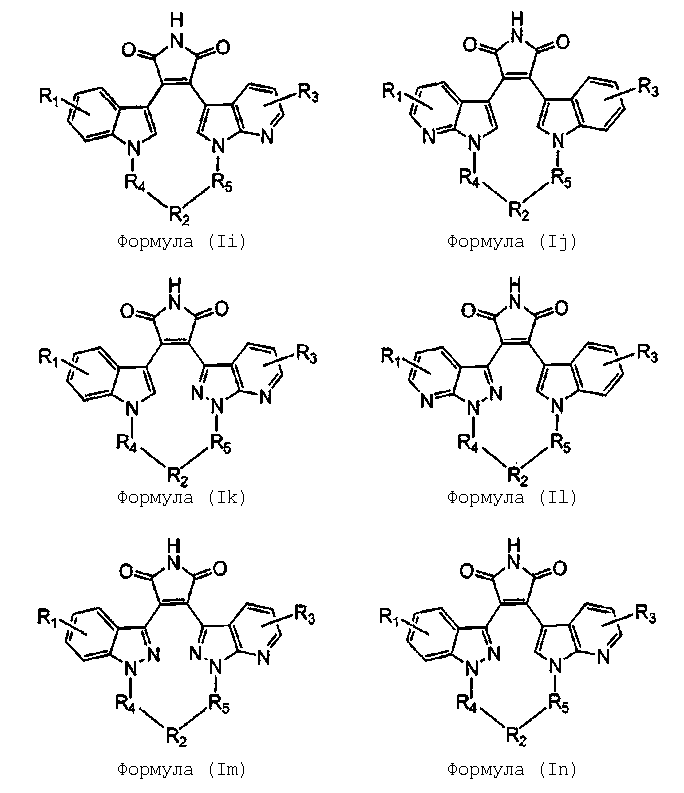
где все другие переменные являются такими, как определено ранее; и его фармацевтически приемлемые соли.
Наиболее предпочтительно соединение формулы (I) представляет собой соединение, выбранное из группы, состоящей из:
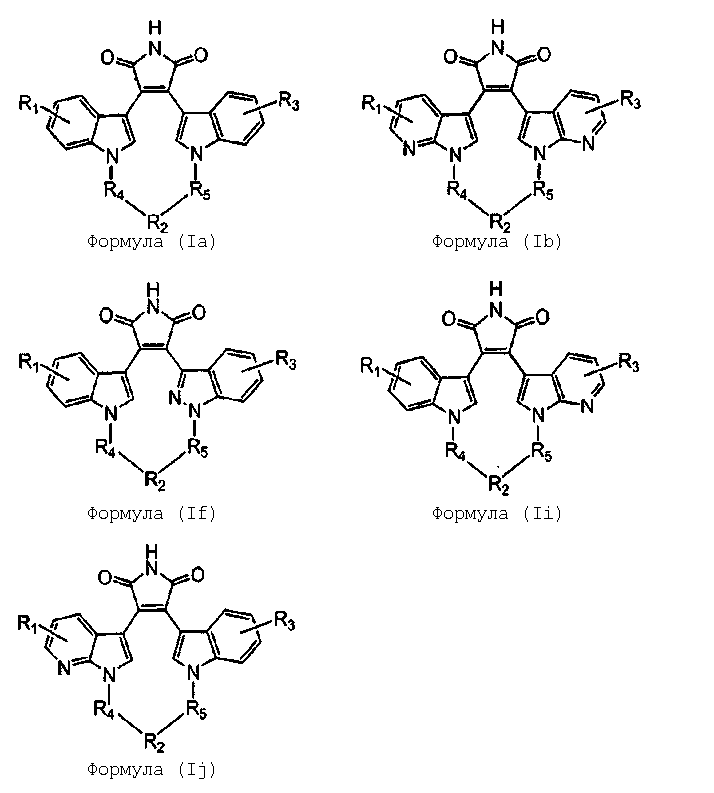
где все другие переменные являются такими, как определено ранее; и их фармацевтически приемлемые соли.
В предпочтительном варианте осуществления настоящего изобретения R4 и R5 независимо выбирают из С1-6алкила, С2-6 алкенила и С2-6алкинила, необязательно замещенного оксо.
Более предпочтительно R4 и R5 независимо выбирают из С1-6алкила, С2-6 алкенила и С2-6алкинила.
Наиболее предпочтительно R4 и R5 независимо выбирают из С1-6алкила. В предпочтительном варианте осуществления настоящего изобретения R2 выбирают из группы, состоящей из -С1-8алкила, -С2-4алкенила, -С2-4алкинила, -О-(С1-4)алкил-О-, -О-(С2-4)алкенил-О-, -О-(С2-4)алкинил-О-, -С(О)-(С1-4)алкил-С(О)- (где любая из вышеуказанных алкильных, алкенильных и алкинильных связывающих групп представляет собой линейные углеродные цепи, необязательно замещенные одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, -С(О)О-(С1-4)алкила, -С1-4алкил-С(О)О-(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси, гидрокси(С1-4)алкила и оксо; и где любая из вышеуказанных алкильных, алкенильных и алкинильных связывающих групп необязательно замещена одним-двумя заместителями, независимо выбранными из группы, состоящей из гетероциклила, арила, гетероарила, гетероциклил(С1-4)алкила, арил(С1-4)алкила, гетероарил(С1-4)алкила, спироциклоалкила и спирогетероциклила (где любой из вышеуказанных циклоалкильного, гетероциклического, арильного и гетероарильного заместителей необязательно замещен одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси и гидрокси(С1-4)алкила; и где любой из вышеуказанных гетероциклических заместителей необязательно замещен оксо)), циклоалкила, гетероциклила, арила, гетероарила (где циклоалкил, гетероциклил, арил и гетероарил необязательно замещены одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси и гидрокси(С1-4)алкила; и где гетероциклил необязательно замещен оксо), -(O-(CH2)1-6)0-5-O-, -O-(CH2)1-6-O-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-O-(CH2)1-6-O-, -(O-(CH2)1-6)0-5-NR6-, -O-(CH2)1-6-NR6-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6--NR6-, -(O-(CH2)1-6)0-5-S-, -O-(CH2)1-6-S-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-S-, -NR6-, -NR6-NR7-, -NR6-(CH2)1-6-NR7-, -NR6-(CH2)1-6-NR7-(CH2)1-6-NR8-, -NR6=C(O)-, -C(O)-NR6-, -C(O)-(CH2)0-6-NR6-(CH2)0-6-C(O)-, -NR6-(CH2)0-6-C(O)-(CH2)1-6-C(O)-(CH2)0-6-NR7-, -NR6-C(O)-NR7-, -NR6-C(NR7)-NR8-, -O-(CH2)1-6-NR6-(CH2)1-6-S-, -S-(CH2)1-6-NR6-(CH2)1-6-O-, -S-(CH2)1-6-NR6-(CH2)1-6-S-, -NR6-(CH2)1-6-S--(CH2)1-6--NR7-- и -SO2- (где R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, С1-4алкила, С1-4алкокси(С1-4)алкила, карбоксил(С1-4)алкила, амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), гидрокси(С1-4)алкила, гетероциклил(С1-4)алкила, арил(С1-4)алкила и гетероарил(С1-4)алкила (где вышеуказанные гетероциклильный, арильный и гетероарильный заместители необязательно замещены одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси и гидрокси(С1-4)алкила; и где гетероциклил необязательно замещен оксо)),
при условии, что если А и Е выбирают из замещенного водородом атома углерода, то R2 выбирают из группы, состоящей из -С2-4алкинила-, -О-(С1-4)алкил-О-, -О-(С2-4)алкенил-О-, -О-(С2-4)алкинил-О-, -С(О)-(С1-4)алкил-С(О)- (где любая из вышеуказанных алкильных, алкенильных и алкинильных связывающих групп представляет собой линейные углеродные цепи, необязательно замещенные одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, -С(О)О-(С1-4)алкила, -С1-4алкил-С(О)О-(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси, гидрокси(С1-4)алкила и оксо; и где любая из вышеуказанных алкильных, алкенильных и алкинильных связывающих групп необязательно замещена одним-двумя заместителями, независимо выбранными из группы, состоящей из гетероциклила, арила, гетероарила, гетероциклил(С1-4)алкила, арил(С1-4)алкила, гетероарил(С1-4)алкила, спироциклоалкила и спирогетероциклила (где любой из вышеуказанных циклоалкильного, гетероциклического, арильного и гетероарильного заместителей необязательно замещен одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси и гидрокси(С1-4)алкила, и где любой из вышеуказанных гетероциклических заместителей необязательно замещен оксо)), циклоалкила (где циклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси и гидрокси(С1-4)алкила, -(O-(CH2)1-6)1-5-O-, -O-(CH2)1-6-O-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-O-(CH2)1-6-O-, -(O-(CH2)1-6)1-5-NR6-, -O-(CH2)1-6-NR6-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-NR6-, -(O-(CH2)1-6)0-5-S-, -O-(CH2)1-6-S-(CH2)1-6-O-, -O-(CH2)1-6-O-(CH2)1-6-S-, -NR6-NR7-, -NR6-(CH2)1-6-NR7-, -NR6-(CH2)1-6-NR7-(CH2)1-6-NR8-, -NR9=C(O)-, -C(O)-NR9-, -C(O)-(CH2)0-6--NR6--(CH2)0-6-C(O)-, -NR6-(CH2)0-6-C(O)-(CH2)1-6-C(O)-(CH2)0-6--NR7-, -NR6-C(O)-NR7-, -NR6-C(NR7)-NR8-, -O-(CH2)1-6-NR6-(CH2)1-6-S-, -S-(CH2)1-6-NR6-(CH2)1-6-O-, -S-(CH2)1-6-NR6-(CH2)1-6-S- и -NR6-(CH2)1-6-S-(CH2)1-6--NR7-- (где R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, С1-4алкила, С1-4алкокси(С1-4)алкила, карбоксил(С1-4)алкила, амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), гидрокси(С1-4)алкила, гетероциклил(С1-4)алкила, арил(С1-4)алкила и гетероарил(С1-4)алкила (где вышеуказанные гетероциклильный, арильный и гетероарильный заместители необязательно замещены одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси и гидрокси(С1-4)алкила; и где гетероциклил необязательно замещен оксо)); и где R9 выбирают из группы, состоящей из С1-4алкила, С1-4алкокси(С1-4)алкила, карбоксил(С1-4)алкила, амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), гидрокси(С1-4)алкила, гетероциклил(С1-4)алкила, арил(С1-4)алкила и гетероарил(С1-4)алкила (где вышеуказанные гетероциклильный, арильный и гетероарильный заместители необязательно замещены одним-четырьмя заместителями, независимо выбранными из группы, состоящей из С1-4алкила, С1-4алкокси, С1-4алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси и гидрокси(С1-4)алкила; и где гетероциклил необязательно замещен оксо)).
Более предпочтительно, R2 выбирают из -С1-8алкила (необязательно замещенного одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, гидрокси и оксо); арила, гетероарила, -(O-(CH2)1-6)0-5-O-, -O-(CH2)1-6-NR6-(CH2)1-6-O-, -O-(CH2)1-6-S-(CH2)1-6-O- и -NR6- (где R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, С1-4алкила и С1-4алкокси(С1-4)алкила);
при условии, что если А и Е выбирают из замещенного водородом атома углерода, то R2 выбирают из группы, состоящей из -(O-(CH2)1-6)1-5-O-, -(O-(CH2)1-6)1-5-NR6-, O-(CH2)1-6-NR6-(CH2)1-6-O-, и -NR6-(CH2)1-6-NR7-(CH2)1-6-NR8- (где R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, С1-4алкила и гидрокси(С1-4)алкила).
Наиболее предпочтительно, R2 выбирают из -С1-8алкила (необязательно замещенного одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, гидрокси и оксо); фенила, пиридинила, -(O-(CH2)2)1-4-O-, -O-(CH2)2-NR6-(CH2)2-O-, -O-(CH2)2-S-(CH2)2-O- и -NR6- (где R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, С1-3алкила и С1-2алкокси(С1-2)алкила);
при условии, что если А и Е выбирают из замещенного водородом атома углерода, то R2 выбирают из группы, состоящей из -(O-(CH2)2)1-4-O-, -(O-(CH2)2)2-NR6-, -O-(CH2)2-NR6-(CH2)2-O-, и -NR6-(CH2)2-NR7-(CH2)2-NR8- (где R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, С1-3алкила и гидрокси(С1-3)алкила).
В предпочтительном варианте осуществления настоящего изобретения R1 и R3 независимо выбирают из группы, состоящей из водорода, С1-4алкила, С2-4алкенила, С2-4алкинила (где алкил, алкенил и алкинил необязательно замещены заместителем, выбранным из группы, состоящей из С1-4алкокси, алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), (галогена)1-3, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси, гидрокси(С1-4)алкила и оксо), С1-4алкокси, С1-4алкоксикарбонила, (галоген)1-3(С1-4)алкокси, С1-4алкилтио, арила, гетероарила (где арил и гетероарил необязательно замещены заместителем, выбранным из группы, состоящей из С1-4алкила, С1-4алкокси, алкокси(С1-4)алкила, карбоксила, карбоксил(С1-4)алкила, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), амино(С1-4)алкила (где амино замещен заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, (галоген)1-3(С1-4)алкила, (галоген)1-3(С1-4)алкокси, гидрокси и гидрокси(С1-4)алкила), амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), циано, галогена, гидрокси и нитро.
Более предпочтительно, R1 и R3 независимо выбирают из группы, состоящей из водорода, С1-4алкила, (необязательно замещенного заместителем, выбранным из группы, состоящей из С1-4алкокси, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), (галогена)1-3, гидрокси и оксо), С1-4алкокси, С1-4алкоксикарбонила, (галоген)1-3(С1-4)алкокси, амино (замещенного заместителем, независимо выбранным из группы, состоящей из водорода и С1-4алкила), галогена, гидрокси и нитро.
Наиболее предпочтительно, R1 и R3 представляют водород.
Иллюстративные соединения настоящего изобретения включают соединение формулы (Ia), выбранное из соединений формулы (Ia1):
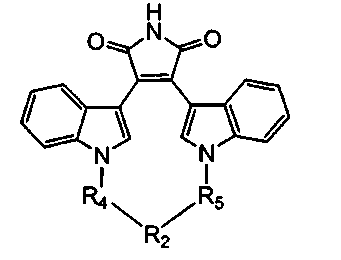
Формула (Ia1)
где R4, R2 и R5 зависимым образом выбирают из:
Иллюстративные соединения настоящего изобретения включают соединение формулы (Ib), выбранное из соединений формулы (Ib1)

Формула (Ib1)
где R4, R2 и R5 зависимым образом выбирают из:
Иллюстративные соединения настоящего изобретения включают соединение формулы (If), выбранное из соединений формулы (If1)
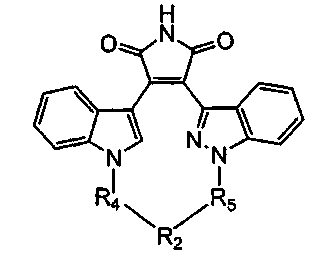
Формула (If1)
где R4, R2 и R5 зависимым образом выбирают из:
Иллюстративные соединения настоящего изобретения включают соединение формулы (Ii), выбранное из соединений формулы (Ii1)
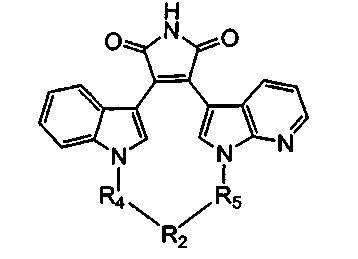
Формула (Ii1)
где R4, R2 и R5 зависимым образом выбирают из:
Иллюстративные соединения настоящего изобретения включают соединение формулы (Ij), выбранное из соединений формулы (Ij1)
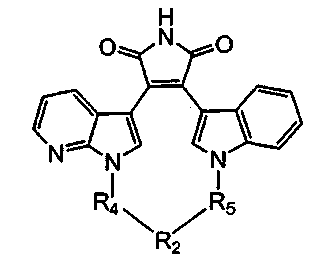
Формула (If1)
где R4, R2 и R5 зависимым образом выбирают из:
Соединения по настоящему изобретению также могут быть представлены в виде их фармацевтически приемлемых солей. Для применения в медицине соли соединений данного изобретения рассматриваются как нетоксичные «фармацевтически приемлемые соли» (см. International J.Pharm., 1986, 33, 201-217; J.Pharm.Sci., 1997 (Jan), 66, 1,1). Однако, другие соли могут оказаться полезными при получении соединений согласно настоящему изобретению или их фармацевтически приемлемых солей. Иллюстративные органические или неорганические кислоты включают, но не ограничиваются этим, хлористоводородную, бромистоводородную, иодистоводородную, перхлорную, серную, азотную, фосфорную, уксусную, пропионовую, гликолевую, молочную, янтарную, малеиновую, фумаровую, яблочную, винную, лимонную, бензойную, миндальную, метансульфоновую, гидроксиэтансульфоновую, бензолсульфоновую, щавелевую, памовую, 2-нафталинсульфоновую, п-толуолсульфоновую, циклогексансульфаминовую, салициловую, сахариновую или трифторуксусную кислоту. Иллюстративные органические или неорганические основания включают, но не ограничиваются этим, соли оснований или катионов, таких как бензатин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин, прокаин, алюминий, кальций, литий, магний, калий, натрий и цинк.
В объем настоящего изобретения включены пролекарства соединений данного изобретения. Обычно, такие пролекарства представляют собой функциональные производные соединений, которые легко превращаются in vivo в требуемое соединение. Таким образом, в способах лечения по настоящему изобретению термин «введение» будет охватывать лечение различных описанных нарушений с использованием конкретного описанного соединения или с использованием соединения, которое может быть не описано конкретно, но которое превращается в конкретное соединение in vivo после введения субъекту. Общепринятые методики выбора и получения подходящих пролекарственных производных описаны, например, в "Design of Prodrugs", ed. H.Bundgaard, Elsevier, 1985.
Когда соединения настоящего изобретения имеют по крайней мере один хиральный центр, они, соответственно, могут существовать в виде энантиомеров. Когда соединения имеют два или более хиральных центров, они дополнительно могут существовать в виде диастереомеров. Когда при использовании способов получения соединений согласно настоящему изобретению возникают смеси стереоизомеров, такие изомеры могут быть разделены обычными способами, такими как препаративная хроматография. Соединения могут быть получены в форме рацемата или могут быть получены индивидуальные энантиомеры с помощью стандартных способов, известных специалистам в данной области, например, энантиоселективным синтезом или оптическим разделением, образованием диастереомерных пар при образовании соли с оптически активной кислотой с последующей дробной кристаллизацией и регенерированием свободного основания. Соединения также могут быть разделены путем образования диастереомерных сложных эфиров или амидов с последующим хроматографическим разделением и удалением вспомогательного хирального вещества. Альтернативно, соединения могут быть разделены с использованием хиральной колонки ВЭЖХ. Следует понимать, что все такие изомеры и их смеси входят в объем настоящего изобретения.
Если не указано другого, термин «алкил» относится к насыщенной линейной или разветвленной цепи, состоящей исключительно из 1-8 замещенных водородом атомов углерода; предпочтительно из 1-6 замещенных водородом атомов углерода; и наиболее предпочтительно из 1-4 замещенных водородом атомов углерода. Термин «алкенил» относится к частично ненасыщенной линейной или разветвленной алкильной цепи, которая содержит по крайней мере одну двойную связь. Термин «алкинил» относится к частично ненасыщенной линейной или разветвленной алкильной цепи, которая содержит по крайней мере одну тройную связь. Термин «алкокси» относится к -О-алкилу, где алкил является таким, как определено выше. Термин «алкилтио» относится к -S-алкилу, где алкил является таким, как определено выше. Карбоксильная группа представляет собой карбонил с терминальной (концевой) ОН группой.
Когда линейная или разветвленная алкильная цепь выполняет функцию связывающей группы и необязательно является замещенной такими заместителями, как амино, галоген, гидрокси или оксо, разветвленная алкильная цепь может быть замещена в связывающей алкильной цепи, в разветвлении связывающей алкильной цепи или в обоих.
Термин «циклоалкил» относится к насыщенному или частично ненасыщенному циклическому алкильному кольцу, состоящему из 3-8 замещенных водородом атомов углерода. Примеры включают, но не ограничиваются этим, циклопропил, циклопентил, циклогексил или циклогептил. Термин «спироциклоалкил» относится к циклоалкильному кольцу, имеющему один совместный кольцевой углерод с другим присоединенным кольцом.
Термин «гетероциклил» относится к насыщенному или частично ненасыщенному кольцу, содержащему пять членов, среди которых по крайней мере один член представляет собой атом N, O или S, и которое необязательно содержит один дополнительный атом О или один, два или три дополнительных атома N; насыщенному или частично ненасыщенному кольцу, содержащему шесть членов, среди которых один, два или три члена представляют собой атом N; к насыщенному или частично ненасыщенному бициклическому кольцу, содержащему девять членов, среди которых по крайней мере один член представляет собой атом N, O или S, и которое необязательно содержит один дополнительный атом О или один, два или три дополнительных атома N, и к насыщенному или частично ненасыщенному бициклическому кольцу, содержащему десять членов, среди которых один, два или три члена представляют собой атом N. Примеры включают, но не ограничиваются этим, пирролинил, пирролидинил, диоксоланил, имидазолинил, имидазолидинил, пиразолинил, пиразолидинил, пиперидинил, морфолинил или пиперазинил. Термин «спирогетероциклил» относится к гетероциклическому кольцу, имеющему один совместный кольцевой углерод с другим присоединенным кольцом.
Термин «арил» относится к ароматической моноциклической кольцевой системе, содержащей 5-6 замещенных водородом атомов углерода, или к ароматической бициклической системе, содержащей 9-14 замещенных водородом атомов углерода. Примеры включают, но не ограничиваются этим, фенил, нафталенил или антраценил.
Термин «гетероарил» относится к ароматической моноциклической кольцевой системе, содержащей пять членов, среди которых по крайней мере один член представляет собой атом N, O или S, и которая необязательно содержит один, два или три дополнительных атома N; к ароматической моноциклической кольцевой системе, содержащей шесть членов, среди которых один, два или три члена представляют собой атом N; к ароматической бициклической кольцевой системе, содержащей девять членов, среди которых по крайней мере один член представляет собой атом N, O или S, и которая необязательно содержит один, два или три дополнительных атома N; и к ароматической бициклической кольцевой системе, содержащей десять членов, среди которых один, два или три члена представляют собой атом N. Примеры включают, но не ограничиваются этим, фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, хинолинил или изохинолинил.
Термин «гало» или «галоген» относится к атому фтора, хлора, брома или иода.
«Независимо» означает, что когда группа замещена более чем одним заместителем, такие заместители могут быть одинаковыми или различными. «Зависимым образом» означает, что заместители определены в указанном сочетании переменных структуры.
Вариантом осуществления изобретения является фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и любое из описанных выше соединений. Иллюстрацией изобретения является фармацевтическая композиция, полученная смешиванием любого из описанных выше соединений и фармацевтически приемлемого носителя. Другой иллюстрацией изобретения является способ получения фармацевтической композиции, включающий смешивание любого из описанных выше соединений и фармацевтически приемлемого носителя. Дополнительной иллюстрацией настоящего изобретения являются фармацевтические композиции, содержащие одно или несколько соединений данного изобретения в сочетании с фармацевтически приемлемым носителем.
Как использовано в данном описании, подразумевается, что термин «композиция» охватывает продукт, включающий определенные ингредиенты в определенных количествах, а также любой продукт, который возникает, непосредственно или косвенно, при комбинации определенных ингредиентов в определенных количествах.
Соединения настоящего изобретения являются селективными ингибиторами киназы или двойной киназы, полезными в способе лечения или облегчения нарушения, опосредованного киназой или двойной киназой. В предпочтительном варианте осуществления киназу выбирают из протеинкиназы С или гликогенсинтазакиназы-3 и, более предпочтительно, киназу выбирают из протеинкиназы Сα, протеинкиназы Сβ-II, протеинкиназы Cγ и гликогенсинтазакиназы-3β. Однако, как продемонстрировано в примерах, включенных в данное описание, соединения данного изобретения также проявляют ингибирующую активность для ряда других киназ.
Изоформы протеинкиназы С
Известно, что протеинкиназа С (РКС) играет ключевую роль во внутриклеточной сигнальной трансдукции (передача сигнала клетка-клетка), генной экспрессии и в контроле дифференциации и роста клеток. Семейство РКС состоит из двенадцати изоформ, которые дополнительно классифицированы в виде 3 подсемейств: кальций-зависимые классические изоформы РКС альфа (α), бета-I (β-I), бета-II (β-II) и гамма (γ); кальций-независимые изоформы РКС дельта (δ), эпсилон (ε), эта (η), тета (θ) и мю (μ); и атипичные изоформы РКС зета (ξ), лямбда (λ) и йота (ι).
Тенденцией некоторых болезненных состояний является связь с повышением конкретных РКС изоформ. Изоформы РКС обладают определенным тканевым распределением, субклеточной локализацией и активационно-зависимыми кофакторами. Например, α и β изоформы РКС селективно индуцируются в клетках сосудов, стимулированных агонистами, такими как сосудистый эндотелиальный фактор роста (VEGF) (P.Xia et al., J.Clin.Invest., 1996, 98, 2018) и вовлекаются в клеточный рост, дифференциацию и проницаемость сосудов (H.Ishii et al., J.Mol.Med., 1998, 76, 21). Повышенные уровни глюкозы в крови, выявленные при диабете, ведут к изоформа-специфическому повышению β-II изоформы в сосудистых тканях (Inoguchi et al., Proc.Natl.Acad.Sci.USA, 1992, 89, 11059-11065). Связанное с диабетом повышение β изоформы в тромбоцитах человека коррелирует с измененной ответной реакцией тромбоцитов на агонисты (Bastyr III, E.J. and Lu J., Diabetes, 1993, 42, (Suppl.1) 97A). Показано, что рецептор витамина D человека селективно фосфорилируется РКСβ. Такое фосфорилирование связано с изменениями в функционировании рецептора (Hsier et al., Proc.Natl.Acad.Sci.USA, 1991, 88, 9315-9319; Hsier et al J.Biol.Chem., 1993, 268, 15118-15126). Дополнительно, исследование показало, что β-II изоформа отвечает за эритролейкемическую клеточную пролиферацию, тогда как α изоформа включена в мегакариоцитную дифференциацию в тех же самых клетках (Murray et al., J.Biol.Chem., 1993, 268, 15847-15853).
Сердечно-сосудистые заболевания.
РКС активность играет важную роль в сердечно-сосудистых заболеваниях. Показано, что повышенная активность РКС в сосудистой системе вызывает повышенное сужение кровеносных сосудов и гипертензию (Bilder G.E.et al., J.Pharmacol.Exp.Ther., 1990, 252, 526-530). РКС ингибиторы блокируют индуцированную агонистом пролиферацию клеток гладких миоцитов (Matsumoto H. And Sasaki Y. Biochem.Biophys.Res.Commun., 1989, 158, 105-109). РКСβ пусковые механизмы приводят к индукции Egr-1 (фактор раннего роста-1) и тканевого фактора при гипоксических состояниях (как часть лишенного кислорода-опосредованного пути для триггерных прокоагулянтных случаев) (Yan S-F. Et al., J.Bio.Chem., 2000, 275, 16, 11921-11928). РКСβ предложена в качестве медиатора продуцирования PAI-1 (ингибитор активатора плазминогена-1) и вовлечена в развитие тромбоза и атеросклероза (Ren S. et al., Am.J.Physiol., 2000, 278 (4, Pt.1), E656-E662). Ингибиторы РКС могут использоваться при лечении сердечно-сосудистой ишемии и для улучшения функции сердца после ишемии (Muid R.E. et al., FEBS Lett., 1990, 293, 169-172; Sonoki H. Et al., Kokyu-To Junkan, 1989, 37, 669-674). Повышенные уровни РКС коррелируют с увеличением функции тромбоцитов как ответной реакции на агонисты (Bastyr III, E.J. and Lu J., Diabetes, 1993, 42 (Suppl.1) 97A). РКС вовлекается в биохимический путь при модулировании тромбоцит-активирующим фактором (PAF) проницаемости микрососудов (Kobayashi et al., Amer.Phys.Soc., 1994, H1214-H1220). Ингибиторы РКС оказывают влияние на агонист-индуцируемую агрегацию тромбоцитов (Toullec D. et al., J.Biol.Chem., 1991, 266, 15771-15781). Соответственно, применение ингибиторов РКС может потребоваться при лечении сердечно-сосудистого заболевания, ишемии, тромботических состояний, атеросклероза и рестеноза.
Диабет
Избыточная активность РКС связана с дефектами инсулиновой передачи сигналов и, следовательно, с инсулиновой резистентностью, наблюдаемой при диабете типа II (Karasik A. Et al., J.Biol.Chem., 1990, 265, 10226-10231; Chen K.S. et al., Trans.Assoc.Am.Physicians, 1991, 104, 206-212; Chin et al., J.Biol.Chem., 1993, 268, 6338-6347).
Связанные с диабетом нарушения
Исследования продемонстрировали повышение РКС активности в тканях, подверженных диабетическим осложнениям при действии гипергликемических состояний (Lee T-S. et al., J.Clin.Invest., 1989, 83, 90-94; Lee T-S. et al., Proc.Natl.Axad.Sci. USA, 1989, 86, 5141-5145; Craven P.A. and DeRubertis F.R., J.Clin.Invest., 1989, 87, 1667-1675; Wolf B.A. et al., J.Clin.Invest., 1991, 87,31-38; Tesfamariam B., et al., J.Clin.Invest., 1991, 87, 1643-1648). Например, активация РКС-β-II изоформы играет важную роль в диабетических сосудистых осложнениях, таких как ретинопатия (Ishii H., et al., Science, 1996, 272, 728-731), и РКСβ вовлечена в развитие сердечной гипертрофии, связанной с сердечной недостаточностью (X.Gu et al., Circ.Res., 1994, 75, 926; R.H.Strasser et al., Circulation, 1996, 94, 1551). Сверхэкспрессия сердечной РКС-β-II у трансгенных мышей вызывает кардиомиопатию, включая гипертрофию, фиброз и пониженную функцию левого желудочка (H.Wakasaki et al., Proc.Natl.Acad.Sci.USA, 1997, 94, 9320).
Воспалительные заболевания
Ингибиторы РКС блокируют воспалительные ответные реакции, такие как окислительный разрыв нейтрофилов, CD3 понижающая регуляция в Т-лимфоцитах и форбол-индуцированный отек конечностей (Twoemy B., et al. Biochem.Biophys.Res. Commun., 1990, 171, 1087-1092; Mulqueen M.J. et al., Agents Actions, 1992, 37, 85-89). РКСβ имеет важную роль при дегрануляции тучных клеток (мастоцитов) - производных костного мозга, воздействуя таким образом на способность клетки продуцировать IL-6 (Интерлейкин-6) (Nechushtan H. Et al., Blood, 2000 (март), 95, 5, 1752-1757). РКС играет роль при повышенном росте клеток ASM (гладкая мускулатура дыхательных путей) на крысиных моделях двух потенциальных угроз астмы: гиперспособности к реагированию на агонисты сокращения и стимулы роста (Ren S., et al., Am.J.Physiol., 2000, 278, (4, Pt.1), E656-E662). Сверхэкспрессия РКСβ-1 усиливает повышение проницаемости эндотелия, наводя на мысль о важной функции в регулировании эндотелиального барьера (Nagpala P.G. et al., J.Cell.Physiol., 1996, 2, 249-55). РКСβ опосредует активацию нейтрофильной NADPH (никотинамид-динуклеотидфосфат, восстановленный) оксидазы с помощью РМА и стимуляции FCγ рецепторов в нейтрофилах (Dekker L.V., et al., Biochem. J., 2000, 347, 285-289). Таким образом, применение ингибиторов РКС может быть показано для использования при лечении воспаления и астмы.
Иммунологические нарушения
РКС может оказаться полезной при лечении или облегчении некоторых иммунологических нарушений. Хотя одно исследование наводит на мысль, что ингибирование HCMV (цитомегаловирус человека) не коррелирует с РКС ингибированием (Slater M.J., et al., Biorg.&Med.Chem., 1999, 7, 1067-1074), в другом исследовании показано, что РКС сигнальный путь трансдукции синергетически взаимодействует с цАМФ-зависимым РКА путем активации или увеличения ВИЧ-1 транскрипции и репликации вируса и аннулируется с помощью РКС ингибитора (Rabbi M.F., et al., Virology, 1998 (June 5), 245, 2, 257-69). Следовательно, иммунологическое нарушение можно лечить или улучшать состояние как функцию затронутой болезнью основной ответной реакции на повышающую или понижающую регуляцию РКС.
Дефицит РКСβ также приводит к иммунодефициту, характеризуемому ослабленными гуморальными иммунными ответными реакциями и пониженной реакцией В-клеток, аналогичной Х-связанному иммунодефициту у мышей, и играет важную роль в опосредованной антигенным рецептором сигнальной трансдукции (Leitges M. Et al., Science (Wash D.C.), 1996, 273, 5276, 788-789). Соответственно, отторжение трансплантата тканей может облегчаться или предотвращаться за счет подавления иммунной ответной реакции с использованием РКСβ ингибитора.
Дерматологические нарушения
Аномальная активность РКС связана с дерматологическими нарушениями, характеризующимися аномальной пролиферацией кератиноцитов, такими как псориаз (Horn F. Etal., J.Invest.Dermatol., 1987, 88, 220-222; Raynaud F. And Evain-brion D., Br.J.Dermatol, 1991, 124, 542-546). Показано, что ингибиторы РКС ингибируют кератиноцитную пролиферацию доза-зависимым образом (Hegemann L., et al., Arch.Dermatol.Res, 1991, 283, 456-460; Bollag W.B. et a., J.Invest. Dermatol., 1993, 100, 240-246).
Онкологические заболевания
РКС активность связана с ростом клеток, промотированием опухоли, неконтролируемым ростом клеток и раком (Rotenberg S.A. and Weinstein I.B., Biochem. Mol.Aspects.Sel.Cancer, 1991, 1, 25-73; Ahmad et al., Molecular Pharmacology, 1993, 43, 858-862); известно, что РКС ингибиторы эффективны для предотвращения роста опухолей на животных (Mever T. Et al., Int.J.Cancer, 1989, 43, 851-856; Akinagaka S. et al., Cancer Res., 1991, 51, 4888-4892). Экспрессия РКСβ-1 и β-2 в дифференцированных клетках HD3 карциномы прямой кишки блокировала их дифференциацию, запускала их пролиферацию в ответ на основной FGF (фактор роста фибробласта) как и недифференцированных клеток, повышая скорость их роста и активируя несколько МВР (миелин-основных протеин) киназ, включая р57 МАР (митоген-активированную протеин) киназу (Sauma S. et al., Cell Growth Differ., 1996, 7, 5, 587-94). Ингибиторы РКСα, обладающие дополнительным терапевтическим действием в сочетании с другими противораковыми агентами, ингибировали рост лейкемических клеток лимфоцитов (Konig A. Et al., Blood, 1997, 90, 10, Suppl. 1, Pt2). РКС ингибиторы усиливали ММС (митомицин-С) индуцированный апоптоз время-зависимым образом в клеточной линии рака желудка, потенциально указывая на применение в качестве агентов при индуцированном химиотерапией апоптозе (Danso D. Et al., proc.Am.Assoc.Cancer Res., 1997, 38, 88 Meet., 92). Следовательно, РКС ингибиторы могут быть показаны для применения с целью снижения роста клеток и опухоли, для лечения или облегчения рака (такого как лейкемия или рак прямой кишки) и в качестве вспомогательных средств для химиотерапии.
РКС α (за счет усиления миграции клеток) может опосредовать некоторые проангиогенные эффекты РКС активации, тогда как РКС δ может направлять антиангиогенные эффекты полной РКС активации (посредством ингибирования роста и пролиферации клеток) в капиллярных эндотелиальных клетках, регулируя таким образом эндотелиальную пролиферацию и ангиогенез (Harrington E.O. et al., J.Biol.Chem., 1997, 272, 11, 7390-7397). Ингибиторы РКС ингибируют рост клеток и индуцируют апоптоз в глиобластомных клеточных линиях человека, ингибируют рост ксенотрансплантатов астроцитомы человека и действуют как сенсибилизаторы радиации в глиобластомных клеточных линиях (Begemann M. Et al., Anticancer Res. (Greece), 1998 (Jul-Aug), 18, 4A, 2275-82). Ингибиторы РКС в сочетании с другими противораковыми агентами являются радио- и химиосенсибилизаторами, полезными при терапии рака (Teicher B.A. et al., Proc. Am.Assoc. Cancer Res., 1998, 39, 89 Meet, 384). Ингибиторы РКС β (посредством блокирования путей МАР киназной сигнальной трансдукции для VEGF (сосудистый эндотелиальный фактор роста) и bFGF (основного фибриногенного фактора роста) в эндотелиальных клетках) в комбинированных режимах с другими противораковыми агентами обладают противоангиогенным и противоопухолевым действием на Т98G глиобастомной многоформенной модели ксенотрасплантата человека (Teicher B.A., Clinical cancer Research, 2001 (March), 7, 634-640). Соответственно, применение ингибиторов РКС может быть показано для использования для облегчения ангиогенеза и для лечения или облегчения состояния при раке (таком как рак молочной железы, мозга, почки, мочевого пузыря, яичников или прямой кишки) и в качестве вспомогательного средства при химиотерапии и лучевой терапии.
Расстройства центральной нервной системы
Активность РКС играет центральную роль в функционировании ЦНС (Huang K.P. Trends Neurosci, 1989, 12, 425-432) и РКС вовлечена в болезнь Альцгеймера (Shimohama S. et al., Neurology, 1993, 43, 1407-1413) и было показано, что ингибиторы предотвращают повреждение, наблюдаемое при очаговом и центральном ишемическом повреждении мозга, и отек мозга (Hara H et al., J.Cereb. Blood Flow Metab., 10990, 10, 646-653; Shibata S. et al., Brain Res., 1992, 594, 290-294). Соответственно, применение ингибиторов РКС может быть показано для использования при лечении болезни Альцгеймера и при лечении нейротравматических и связанных с ишемией заболеваний.
Продолжительное увеличение содержания РКС γ (как компонента фосфоинозитидной 2-й мессенджерной системы) и экспрессии мускаринового ацетилхолинового рецептора на крысиной модели воспаления миндалевидной железы связано с эпилепсией, служащей основой для постоянного состояния гипервозбуждения у крыс (Beldhuis H.J.A., et al., Neuroscience, 1993, 55, 4, 965-73). Таким образом, ингибиторы РКС могут быть показаны для применения при лечении эпилепсии.
Внутриклеточные изменения содержания РКС γ и РКС β-II изоферментов для животных на in vivo модели термической гипералгезии означает, что повреждение периферического нерва вносит вклад в развитие постоянной боли (Miletic V et al., Neurosci. Lett., 2000, 288, 3, 199-202). Мыши с недостатком РКС γ показывают нормальную ответную реакцию на стимул острой боли, но у них почти полностью не развивается синдром невропатической боли после частичного иссечения седалищного нерва (Chen C. Et al., Science (Wash. D.C.), 1997, 278, 5336, 279-283). Таким образом РКС модулирование может быть показано для применения при лечении хронической боли и невропатической боли.
РКС продемонстрировала свою роль в патологии таких состояний, как, но не ограничиваясь этим, сердечно-сосудистые заболевания, диабет, связанные с диабетом нарушения, воспалительные заболевания, иммунологические нарушения, дерматологические нарушения, онкологические нарушения и расстройства центральной нервной системы.
Гликогенсинтазакиназа 3
Гликогенсинтазакиназа 3 (GSK-3) представляет собой серин/треонинпротеинкиназу, состоящую из двух изоформ (α и β), которые кодируются определенными генами. GSK-3 представляет собой одну из нескольких протеинкиназ, которые фосфорилируют гликогенсинтазу (GS) (Embi et al., Eur. J.Biochim., 1980, 107, 519-527). α и β изоформы имеют мономерную структуру из 49 и 47 кДа, соответственно, и обе из них найдены в клетках млекопитающих. Обе изоформы фосфорилируют мышечную гликогенсинтазу (Cross et al., Biochemical Journal, 1994, 303, 21-26), и эти две изоформы демонстрируют хорошую гомологию между видами (GSK-3α человека и кролика идентичны на 96%).
Диабет
Диабет типа II (или инсулинонезависимый сахарный диабет, NIDDM) представляет собой многофакторное заболевание. Гипергликемия возникает вследствие устойчивости инсулина в печени, мышцах и других тканях, связанной с неадекватной или нарушенной секрецией инсулина из островков поджелудочной железы. Скелетные мышцы являются основным местом для инсулин-стимулированного поглощения глюкозы. В этой ткани глюкоза, удаляемая из циркуляторной системы, или метаболизирует посредством гликолиза и ТСА (цикл трикарбоновых кислот) цикла, или запасается в виде гликогена. Запасы мышечного гликогена играют наиболее важную роль в гомеостазисе глюкозы и у субъектов с диабетом типа II нарушено хранение мышечного гликогена. Стимуляция синтеза гликогена с помощью инсулина в скелетных мышцах возникает за счет дефосфорилирования и активации гликогенсинтазы (Villar-Palasi C. and Larber J., Biochim.Biophys,Acta, 1960, 39, 171-173, Parker P.J. et al., Eur.J.Biochem., 1983, 130, 227-234 и Cohen P., Biochem.Soc.Trans., 1993, 21, 555-567). Фосфорилирование и дефосфорилирование GS опосредовано специфическими киназами и фосфатазами. GSK-3 ответственна за фосфорилирование и деактивацию GS, тогда как гликогенсвязанная протеинфосфатаза I (PP1G) дефосфорилирует и активирует GS. Инсулин как деактивирует GSK-3, так и активирует PP1G (Srivastava A.K. and Pandey S.K., Mol. and Cellular Biochem., 1998, 182, 135-141).
Исследования наводят на мысль, что увеличение активности GSK-3 может оказаться важным для мышц при диабете типа II (Chen et al., Diabetes, 1994, 43, 1234-1241). Сверхэкспрессия GSK-3β и неотъемлемо активные мутанты GSK-3β (S9A, S9e) в клетках HEK-293 приводят к подавлению активности гликогенсинтазы (Eldar-Finkelman et al., PNAS, 1996, 93, 10228-10233), а сверхэкспрессия GSK-3β в СНО клетках (клетки яичника китайского хомячка), экспрессирующих как инсулиновый рецептор, так и субстрат инсулинового рецептора 1 (IRS-1), приводит к ухудшению действия инсулина (Eldar-Finkelman and Krebs, PNAS, 1997, 94, 9660-9664). Новое подтверждение вовлеченности повышенной GSK-3 активности и развития инсулиновой резистентности и диабета типа II в жировой ткани возникло при исследованиях, предпринятых на мышах C57BL/6J, подверженных диабету и ожирению (Eldar-Finkelman et al., Diabetes, a999, 48, 1662-1666).
Воспалительные заболевания
Исследования на фибробластах, полученных из GSK-3β нокаутных мышей, показывают, что ингибирование GSK-3 может оказаться полезным при лечении воспалительных нарушений или заболеваний за счет отрицательного регулирования NFkB активности (Hoeflich K.P. et al., nature, 2000, 406, 86-90).
Дерматологические нарушения
Открытие того факта, что временная стабилизация β-катенина может играть роль в развитии волос (Gat et al., Cell, 1998, 95, 605-614), приводит к предположению, что ингибиторы GSK-3 также могут быть полезными при лечении плешивости.
Расстройства центральной нервной системы
В дополнение к модулированию активности гликогенсинтазы, GSK-3 также играет важную роль при расстройствах ЦНС. Ингибиторы GSK-3 могут иметь ценность как нейропротективные агенты при лечении острого удара и других нейротравматических повреждений (Pap and Cooper, J.Bio;.Chem., 1998, 273, 19929-19932). Было показано, что литий, слабый мМ ингибитор GSK-3, защищает мозжечковые гранульные нейроны от смерти (D'Mello et al., Exp.Cell Res., 1994, 211, 332-338), и хроническое лечение литием имеет явную эффективность на модели окклюзии средней церебральной артерии при ударе у грызунов (Nonaka and Chuang, Neuroreport, 1998, 9(9), 2081-2084).
Тау- и β-катенин, два известных in vivo субстрата GSK-3, имеют прямое отношение к рассмотрению дополнительных аспектов ценности ингибиторов GSK-3, касающихся лечения хронических нейродегенеративных состояний. Тау-гиперфосфорилирование представляет собой ранний этап нейродегенеративного состояния, такого как болезнь Альцгеймера, и постулируется, что оно промотирует разборку микротрубочек. Сообщалось, что литий снижает фосфорилирование тау, усиливает связывание тау с микротрубочками и промотирует сборку микротрубочек путем прямого и обратимого ингибирования GSK-3 (Hong M et al., J.Biol.Chem., 1997, 272(40), 25326-32). β-Катенин фосфорилируется GSK-3 как часть трехчастного аксин-протеинового комплекса, приводя к разложению β-катенина (Ikeda et al., EMBO J., 1998, 17, 1371-1384). Ингибирование активности GSK-3 вовлечено в стабилизацию катенина и промотирует β-катенин-LEF-1/TCF транскрипционную активность (активность считывания генетической информации) (Eastman, Grosschedl, Curr, Opin.Cell Biol., 1999,11, 233). Исследования также привели к предположению, что ингибиторы GSK-3 также могут иметь ценность при лечении шизофрении (Cotter D. Et al., Neuroreport, 1998, 9, 1379-1383; Lijam N., et al., Cell, 1997, 90, 895-905) и маниакальной депрессии (Manji et al., J.Clin.Psychiatry, 1999, 60, (Suppl 2), 27-39 для обзора).
Соответственно, соединения, оказавшиеся полезными в качестве ингибиторов GSK-3, могут найти дополнительное терапевтическое применение при лечении диабета, воспалительных заболеваний, дерматологических нарушений и расстройств центральной нервной системы.
Предпочтительным способом настоящего изобретения является способ лечения или облегчения нарушения, опосредованного киназой или двойной киназой, у нуждающегося в этом субъекта, включающий введение субъекту терапевтически эффективного количества настоящего соединения или его фармацевтической композиции. Терапевтически эффективное количество соединений формулы (I), проиллюстрированное в таком способе, составляет от примерно 0,001 мг/кг/день до примерно 300 мг/кг/день.
Варианты осуществления настоящего изобретения включают применение соединения формулы (I) для получения лекарственного средства для лечения или облегчения нарушения, опосредованного киназой или двойной киназой, у нуждающегося в этом субъекта, где предпочтительная стадия способа включает введение ингибитора киназы или двойной киназы пациенту.
В соответствии со способами настоящего изобретения отдельное соединение настоящего изобретения или его фармацевтическую композицию можно вводить по отдельности в различное время в течение курса лечения или одновременно в виде разделенных форм или одной комбинированной формы. Следовательно, настоящее изобретение следует понимать, как охватывающее все такие режимы одновременного или перемежающегося лечения, и термин «введение» следует интерпретировать соответственно.
Варианты осуществления данного способа включают соединение или его фармацевтическую композицию, преимущественно вводимую совместно в сочетании с другими агентами для лечения, уменьшения или облегчения симптомов нарушения, опосредованного киназой или двойной киназой. Например, при лечении диабета, в особенности диабета типа II, соединение формулы (I) или его фармацевтическую композицию можно использовать в сочетании с другими агентами, особенно с инсулином или антидиабетическими агентами, включая, но не ограничиваясь этим, средства, усиливающие секрецию инсулина (такие как сульфонилмочевины), инсулиновые сенсибилизаторы, включая, но не ограничиваясь этим, глитазоновые инсулиновые сенсибилизаторы (такие как тиазолидиндионы) или бигуаниды, или ингибиторы α-глюкозидазы.
Комбинированный продукт представляет собой продукт, который включает совместное введение соединения формулы (I) или его фармацевтической композиции и дополнительного агента для лечения или облегчения симптомов нарушения, опосредованного киназой или двойной киназой, и термин комбинированный продукт дополнительно включает продукт, который последовательно вводят, где продукт включает соединение формулы (I) или его фармацевтическую композицию и дополнительный агент для лечения или облегчения симптомов нарушения, опосредованного киназой или двойной киназой, введение фармацевтической композиции, содержащей соединение формулы (I), или его фармацевтической композиции и дополнительного агента для лечения или облегчения симптомов нарушения, опосредованного киназой или двойной киназой или по существу одновременное введение отдельной фармацевтической композиции, содержащей соединение формулы (I), или его фармацевтической композиции, и отдельной фармацевтической композиции, содержащей дополнительный агент для лечения или облегчения симптомов нарушения, опосредованного киназой или двойной киназой.
Термин «субъект», как он использован в данном описании, относится к животному, предпочтительно к млекопитающему, наиболее предпочтительно к человеку, который является объектом лечения, наблюдения или эксперимента.
Термин «терапевтически эффективное количество», как он использован в данном описании, означает такое количество активного соединения или фармацевтического агента, которое вызывает ответную биологическую или целебную реакцию в системе тканей, у животного или человека, искомую исследователем, ветеринаром, лечащим врачом или другими клиницистом, которая включает облегчение симптомов заболевания или нарушения, подвергаемого лечению.
Повсеместная природа изоформ РКС и GSK и их важные роли в физиологии обеспечивают стимул к получению селективных ингибиторов РКС и GSK. Предоставив доказательство, демонстрирующее связь некоторых изоформ с болезненными состояниями, логично полагать, что ингибирующие соединения, которые являются селективными для одной или двух РКС изоформ или для GSK изоформы относительно других изоформ РКС и GSK, представляют собой превосходные терапевтические агенты. Такие соединения должны продемонстрировать большую эффективность и более низкую токсичность на основании их специфичности. Соответственно, специалисту в данной области будет очевидно, что выбирают конкретное соединение формулы (I), которое является терапевтически эффективным для конкретного нарушения, опосредованного киназой или двойной киназой, на основании модулирования заболевания путем демонстрации селективного ингибирования киназы или двойной киназы в ответ на такое соединение. Эксперименты, иллюстрирующие селективное ингибирование киназы или двойной киназы, приведены в примерах. Полезность соединений формулы (I) в качестве селективного ингибитора киназы или двойной киназы может быть определена в соответствии с описанными здесь способами и основана на данных, полученных к настоящему моменту; предполагается, что конкретное соединение будет полезно для ингибирования одной или нескольких киназ или двойных киназ, опосредующих нарушения, и, следовательно, может использоваться при одном или нескольких нарушениях, опосредованных киназой или двойной киназой.
Таким образом, термин «нарушения, опосредованные киназой или двойной киназой», как он использован в настоящем описании, включает и не ограничивается этим, сердечно-сосудистые заболевания, диабет, связанные с диабетом нарушения, воспалительные заболевания, иммунологические нарушения, дерматологические нарушения, онкологические заболевания и расстройства ЦНС.
Сердечно-сосудистые заболевания включают, но не ограничиваются этим, острый удар, сердечную недостаточность, сердечно-сосудистую ишемию, тромбоз, атеросклероз, гипертензию, рестеноз, ретинопатию при преждевременных родах и возрастную дегенерацию желтого пятна. Диабет включает инсулинозависимый диабет и инсулинонезависимый сахарный диабет типа II. Связанные с диабетом нарушения включают, но не ограничиваются этим, ухудшенную толерантность к глюкозе, диабетическую ретинопатию, пролиферативную ретинопатию, окклюзию вены сетчатки, отек желтого пятна, кардиомиопатию, нефропатию и невропатию. Воспалительные заболевания включают, но не ограничиваются этим, проницаемость сосудов, воспаление, астму, ревматоидный артрит и остеоартрит. Иммунологические нарушения включают и не ограничиваются этим отторжение трансплантата ткани, ВИЧ-1 и иммунологические нарушения, которые лечатся или улучшаются РКС модулированием. Дерматологические нарушения включают и не ограничиваются этим псориаз, облысение и плешивость. Онкологические заболевания включают, но не ограничиваются этим, рак или рост опухоли (такой как рак молочной железы, мозга, почки, мочевого пузыря, яичника или прямой кишки или лейкемия) и другие заболевания, связанные с неконтролируемой пролиферацией клеток, такие как рецидивные доброкачественные опухоли, а также включая пролиферативную ангиопатию и ангиогенез; и включает применение соединения формулы (I) в качестве вспомогательного агента при химиотерапии и лучевой терапии. Расстройства центральной нервной системы включают и не ограничиваются этим хроническую боль, невропатическую боль, эпилепсию, хронические нейродегенеративные состояния (такие как слабоумие или болезнь Альцгеймера), нарушения настроения (такие как шизофрения), маниакальную депрессию и нейротравматические заболевания, угасание познавательной способности и связанные с ишемией заболевания (как в результате травмы головы (при остром ишемическом ударе, повреждении или при хирургическом вмешательстве) или преходящий ишемический удар (в результате коронарного шунтирования или других преходящих ишемических состояний)).
Фармацевтические композиции, предусматриваемые данным изобретением, могут быть получены в соответствии с общепринятыми фармацевтическими методами. В композиции по изобретению можно использовать фармацевтически приемлемый носитель. Композиция может иметь большое число форм, в зависимости от формы препарата, требуемого для введения, включая, но не ограничиваясь, внутривенное (как болюсное, так и инфузионное), пероральное, назальное, чрескожное, местное с окклюзией и без нее, внутрибрюшинное, подкожное, внутримышечное или парентеральное, все используемые формы хорошо известны специалистам в области фармацевтики. При получении композиций в виде пероральных дозированных форм можно использовать один или несколько обычных фармацевтических носителей, таких как вода, гликоли, масла, спирты, вкусовые агенты, консерванты, красители, сироп и тому подобные в случае пероральных жидких препаратов (например, суспензии, эликсиры и растворы), или таких носителей, как крахмалы, сахара, разбавители, гранулирующие агенты, лубриканты, связующие агенты, дезинтегрирующие агенты и тому подобные в случае пероральных твердых препаратов (например, порошки, капсулы и таблетки).
Как также известно в данной области, соединения альтернативно можно вводить парентерально посредством инъекции композиции, состоящей из активного ингредиента, растворенного в инертном жидком носителе. Инъецируемая композиция может включать активный ингредиент, смешанный с подходящим инертным жидким носителем. Приемлемые жидкие носители включают растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло и тому подобные, а также органические растворители, такие как золькеталь, глицерин, формаль и тому подобные. В качестве альтернативы также могут использоваться водные парентеральные композиции. Например, приемлемые водные растворители включают воду, раствор Рингера и изотонический водный физиологический раствор. Кроме того, в качестве растворителя или суспендирующего агента в водной композиции обычно можно использовать стерилизованное нелетучее масло. Композиции получают растворением или суспендированием активного ингредиента в жидком носителе, так что конечная композиция содержит от 0,005 до 10% по весу активного ингредиента. Соответственно, могут использоваться другие вспомогательные вещества, включая консервант, придающий изотонические свойства агент, солюбилизатор, стабилизатор и болеутоляющий агент.
Кроме того, соединения настоящего изобретения можно вводить во внутриназальной форме посредством местного применения подходящих внутриназальных носителей, или с помощью чрескожных путей с использованием чрескожных пластырей для кожи, хорошо известных обычным специалистам в данной области. При введении в форме чрескожной системы доставки введение дозировки, конечно, будет скорее непрерывным, чем периодическим во время режима дозировки.
Благодаря легкости введения, таблетки и капсулы представляют преимущественную пероральную дозированную единичную форму, в которой используются твердые фармацевтические носители. При желании таблетки могут быть покрыты сахаром или покрытием, растворимым в кишечнике, с использованием стандартных методик.
Для жидких форм активный компонент лекарства может быть объединен с ароматизированными подходящим образом суспендирующими или диспергирующими агентами, такими как синтетические и природные камеди, включая, например, трагакант, гуммиарабик, метилцеллюлозу и тому подобные. Другие диспергирующие агенты, которые можно использовать, включают глицерин и тому подобные.
Соединения настоящего изобретения также можно вводить в виде липосомных систем доставки, таких как маленькие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Как хорошо известно в данной области, содержащие липосомы системы доставки образуются из множества фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины.
Настоящая фармацевтическая композиция обычно будет содержать на дозированную единицу (например, таблетку, капсулу, порошок, инъекцию, чайную ложку и тому подобное) от примерно 0,001 до примерно 100 мг/кг. В одном варианте осуществления настоящая фармацевтическая композиция содержит на дозированную единицу от примерно 0,01 до примерно 50 мг/кг соединения, и, предпочтительно, от примерно 0,05 до примерно 20 мг/кг. В данной области известны способы определения терапевтически эффективных доз для настоящих фармацевтических композиций. Терапевтически эффективное количество для введения фармацевтической композиции человеку, например, может быть определено математически из результатов исследований на животных.
Сокращения
Волнистая линия указывает на связь, присоединенную к большей структуре, которая не показана, но во всем остальном идентична большему соединению, для которого изображен фрагмент соединения.
Номенклатура
Соединения называются в соответствии с номенклатурой, хорошо известной в данной области, и такая номенклатура проиллюстрирована с использованием нумерации кольца следующим образом:
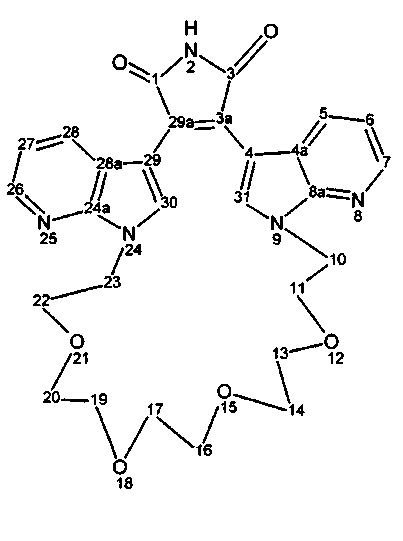
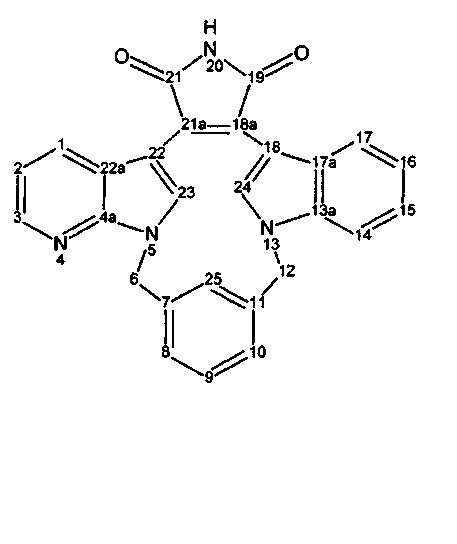
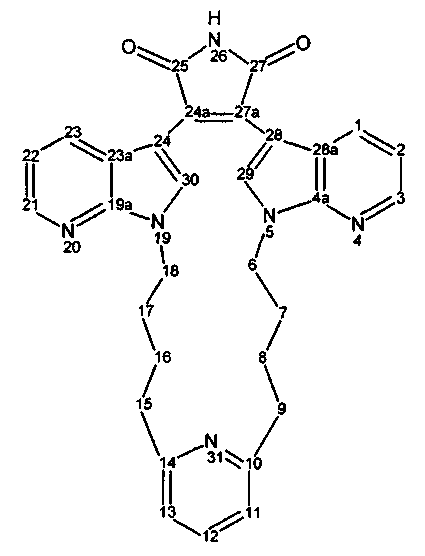
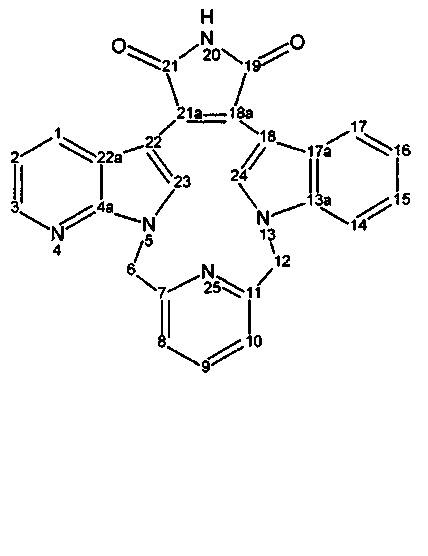
Названия могут быть даны с использованием системы номенклатуры на основании данных примеров, или они могут быть получены с использованием коммерчески доступного программного обеспечения химических названий, такого как ACD/Index Name (Advanced Chemistry Development, Inc., Toronto, Ontario).
ПРИМЕРЫ
Данное изобретение будет лучше понятно со ссылкой на следующие далее экспериментальные подробности, но специалистам в данной области будет очевидно, что они являются только иллюстрацией данного изобретения, описанного более подробно в приведенной ниже формуле изобретения.
Общие способы синтеза
Иллюстративные соединения настоящего изобретения могут быть синтезированы в соответствии с общими способами синтеза, которые описаны ниже и проиллюстрированы более подробно на следующих схемах. Поскольку схемы являются иллюстрацией, подразумевается, что изобретение не ограничено точными химическими реакциями и условиями. Получение различных исходных веществ, использованных в схемах, хорошо известно специалисту в данной области.
Схема А
Получение соединений бис(1Н-пиразоло[3,4-B]пиридин)малеимида формулы (Ic) и соединений бис(1Н-пирроло[2,3-B]пиридин)малеимида формулы (Ia)
Соединение А1 (где А выбирают из азота, и Е выбирают из углерода для соединений формулы (Ia), и А и Е выбирают из азота для соединений формулы (Ic)) растворяли в подходящем растворителе и затем охлаждали. В инертной атмосфере добавляли хлорид триметилолова для взаимодействия с соединением А1 (ниже), а затем добавляли BuLi. Реакционную смесь промывали водным растворителем и очищали продукт - соединение А2. Соединение А2 подвергали взаимодействию с соединением 2,3-дихлормалеимида А3 в присутствии PdCl2(PPh3)2 и LiCl в подходящем растворителе, затем продукт - соединение А4, может быть очищен колоночной хроматографией.
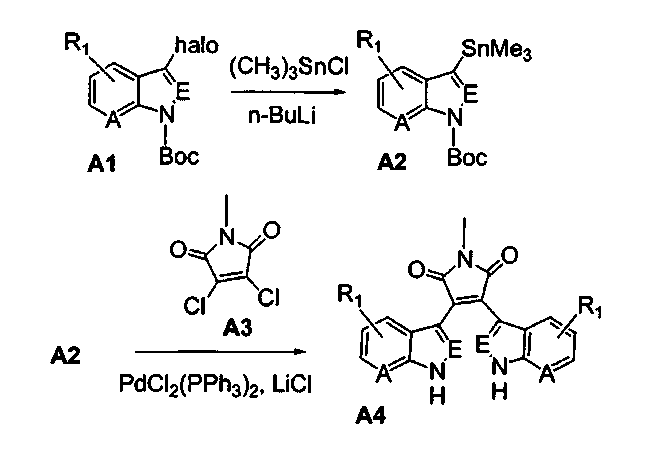
Схема В
Получение соединений индолил(пирроло[2,3-B]пиридин)малеимида формулы (Ig) и соединений индолил(1Н-пиразоло[3,4-B]пиридин)малеимида формулы (Ih)
Соединение хлор-индоилмалеимида А2 (где А выбирают из азота, и Е выбирают из углерода для соединений формулы (Ig), и А и Е выбирают из азота для соединений формулы (Ih)) и соединение В1 растворяли в подходящем растворителе и подвергали взаимодействию в присутствии LiCl и дихлорбис(трифенилфосфин)палладия(II) в инертной атмосфере. Защитную группу соединения А2 удаляли из его промежуточного продукта с соединением В1 реакцией с ТФУК в подходящем растворителе, получая продукт - соединение В2.
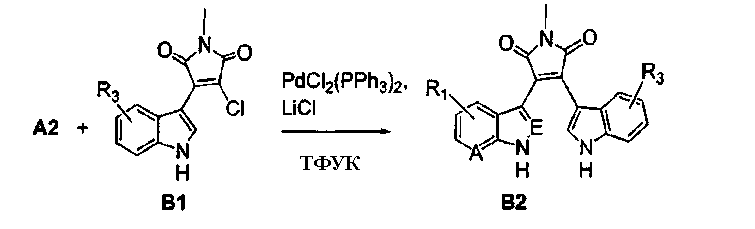
Схема С
Получение полиалкоксильных макроциклов
Гидроксиполиалкоксильная цепь соединения С1 может взаимодействовать с TsCl или MsCl, давая полиалкоксильную цепь соединения С2 или соединения С3, соответственно (получены как описано Bender S.L. and Gauthier D.R., Tetrahedron Lett, 1996, 37(1) 13-16).
Соединение А4 (где А и Е независимо выбирают из группы, состоящей из атома углерода и атома азота) растворяли в подходящем растворителе с Cs2CO3 при повышенной температуре. Соединение С2 или соединение С3 с полиалкоксильной цепью растворяли в подходящем растворителе и медленно добавляли к реакционной смеси. Реакционную смесь затем экстрагировали и очищали, получая продукт - соединение С4.
С использованием эквивалентных способов TfO(CF3SO3) или TsO (толуолSO3) могут быть связаны с кольцевыми атомами азота соединения С4. Соединение С4 растворяли в спирте, затем добавляли основание и нагревали до кипения с обратным холодильником. Реакционную смесь подкисляли для получения осадка соединения С5. Соединение С5 растворяли в подходящем растворителе, содержащем HMDS и нагревали в течение такого промежутка времени и при такой температуре, которые были достаточны для получения соединения С6. Продукт - соединение С6, затем может быть очищен колоночной хроматографией.
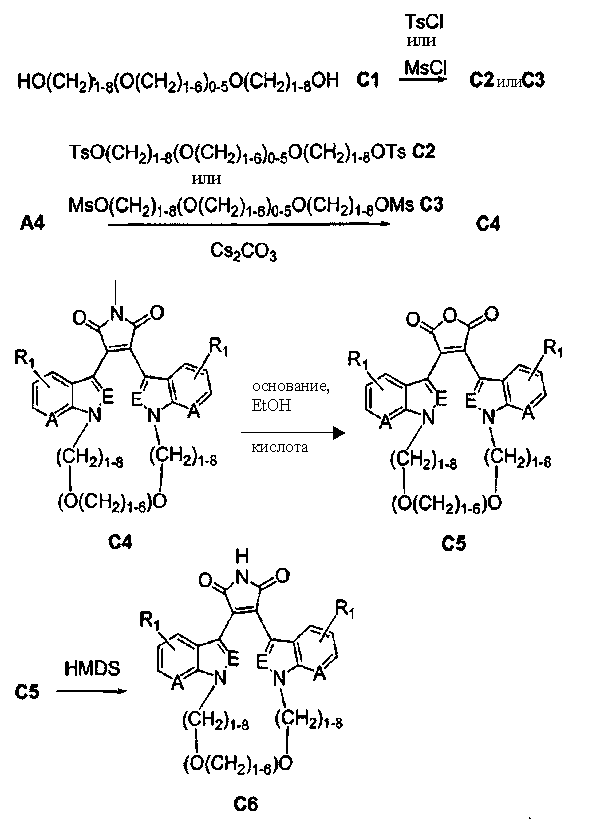
Схема D
Получение алкил(гетероарил/арил)алкильных макроциклов
Соединение А4 (где А и Е независимо выбирают из группы, состоящей из атома углерода и атома азота) растворяли в подходящем растворителе, содержащем Cs2CO3, и подвергали взаимодействию при повышенной температуре с соединением D1 (дибром(СН2)1-4алкил; где Х представляет собой атом углерода или атом азота). Специалистам в области органического синтеза будет очевидно, что термин «повышенная температура» используется для обозначения температур, которые предпочтительно превышают 22 °С и предпочтительно ниже температуры кипения с обратным холодильником. Следует понимать, что специалист в данной области способен варьировать время и температуру данных реакций для оптимизации получения продукта. Продукт экстрагировали и очищали, получая соединение D2. Продукт - соединение D2, растворяли в спирте и основании и нагревали до кипения с обратным холодильником. Затем реакционную смесь подкисляли для образования осадка промежуточного соединения, который растворяли в подходящем растворителе, содержащем HMDS, и нагревали. Продукт - соединение D3, очищали колоночной хроматографией.
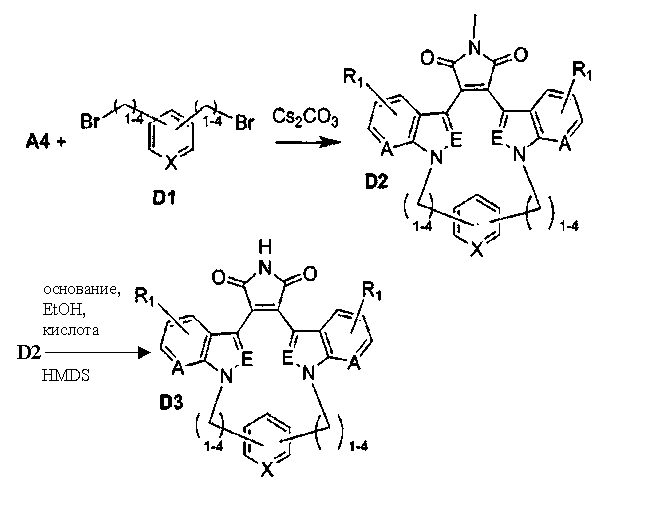
Схема Е
Полигетероатомные симметричные макроциклы
Соединение А4 (где А и Е независимо выбирают из группы, состоящей из атома углерода и атома азота) растворяли в подходящем растворителе, содержащем Cs2CO3, и подвергали взаимодействию при повышенной температуре с соединением Е1 (где а представляет (СН2)1-6алкил). Продукт экстрагировали и очищали, получая соединение Е2. Соединение Е2 подвергали взаимодействию с R6NH2 в присутствии DIEA (N,N-диизопропилэтиламин) в ТГФ при повышенной температуре, затем охлаждали и упаривали, получая соединение Е3. Соединение Е3 растворяли в спирте и основании и нагревали до кипения с обратным холодильником. Затем реакционную смесь подкисляли и упаривали. Полученное твердое вещество обрабатывали ацетатом аммония при повышенной температуре, охлаждали и экстрагировали, получая соединение Е4.
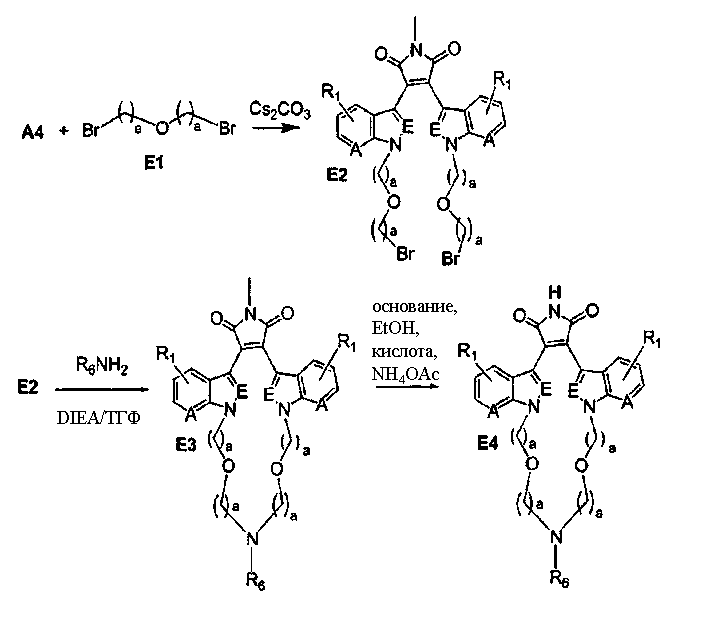
Схема F
Симметричные полиалкиламинные макроциклы.
Соединение А4 (где А и Е независимо выбирают из группы, состоящей из атома углерода и атома азота) растворяли в подходящем растворителе, содержащем Cs2CO3, и подвергали взаимодействию при повышенной температуре с соединением F1 (дигалоген(СН2)1-6алкил). Продукт экстрагировали и очищали, получая соединение F2. Соединение F2 подвергали взаимодействию с соединением F3 NHR6(CH2)1-6NR7(CH2)1-6NHR8 в присутствии DIEA (N,N-диизопропилэтиламин) и KI в ТГФ при повышенной температуре. Продукт охлаждали и упаривали, получая соединение F4. Соединение F3 растворяли в спирте и основании и нагревали до кипения с обратным холодильником. Затем реакционную смесь подкисляли и упаривали. Полученное твердое вещество обрабатывали ацетатом аммония при повышенной температуре, охлаждали и экстрагировали, получая соединение F5.
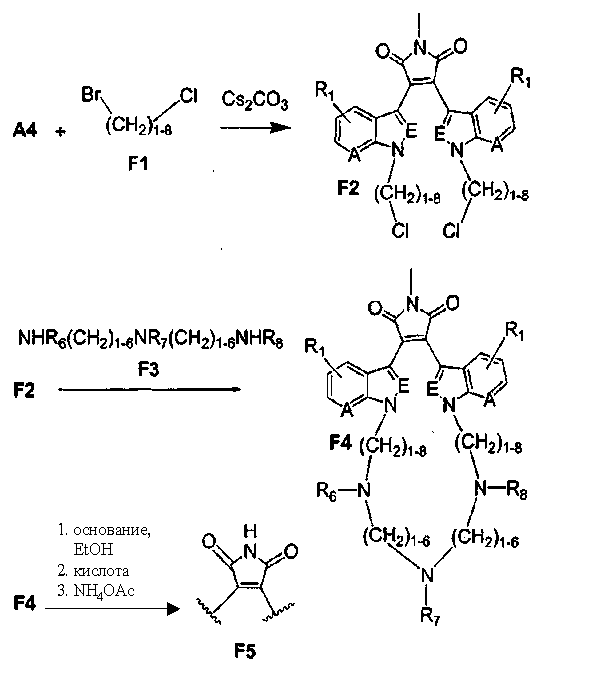
Альтернативно, соединение F2 подвергали взаимодействию с соединением F6 NHR6(CH2)1-6NR7 или соединением F8 NHR6, получая соединение F7, содержащее два атома азота в макроциклическом кольце, или продукт - соединение F9, имеющее 1 атом азота в макроциклическом кольце. По описанным ранее методикам из соединения F7 и соединения F9, соответственно, может быть получен незамещенный имид - соединение F10, и соединение F11.
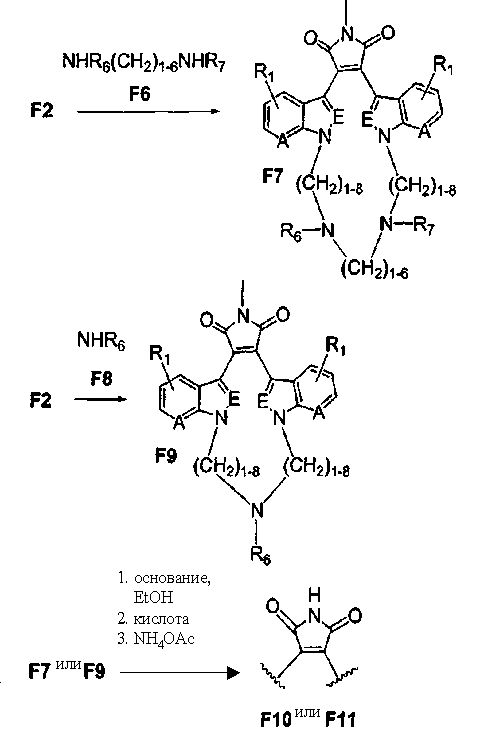
Схема G
Асимметричные макроциклы
Смесь соединения G1 (где А и Е независимо выбирают из группы, состоящей из атома углерода и атома азота) и соединения G2 (где b и с независимо выбирают из (СН2)0-5алкила) растворяли в подходящем растворителе и подвергали взаимодействию при повышенной температуре в присутствии карбоната цезия. Реакционную смесь фильтровали, упаривали и остаток очищали, получая соединение G3. Соединение G4 растворяли в подходящем растворителе в инертной атмосфере и добавляли НОВТ и DCC. Реакционную смесь перемешивали. Медленно добавляли гидроксид аммония и опять перемешивали реакционную смесь. Реакционную смесь фильтровали, фильтрат собирали и экстрагировали водным растворителем. К водному раствору добавляли хлорид натрия и водный раствор экстрагировали этилацетатом. Этилацетатный экстракт сушили и упаривали, получая твердое вещество. Твердый продукт растирали с диэтиловым эфиром и фильтровали, получая соединение G5. К соединению G5 с карбонатом цезия добавляли соединение G6, смесь растворяли в подходящем растворителе и перемешивали при повышенной температуре. Реакционную смесь фильтровали, фильтрат упаривали и остаток очищали, получая соединение G7.
Сложноэфирное соединение G3 и амид - соединение G7, растворяли в подходящем растворителе в инертной атмосфере и охлаждали. Затем медленно добавляли к реакционной смеси 1,0М трет-бутоксид калия в ТГФ. Полученную смесь перемешивали на холоду, оставляли нагреваться и опять перемешивали. Затем добавляли концентрированную HCl и опять перемешивали реакционную смесь. Смесь распределяли между EtOAc и Н2О. Два слоя разделяли и водный слой экстрагировали EtOAc. Объединенные экстракты промывали водой, насыщенным водным раствором NaHCO3 и насыщенным раствором соли, затем сушили и упаривали, получая соединение G8. Соединение G8 растворяли в растворителе, содержащем пиридин, и затем добавляли Ms2O. Реакционную смесь перемешивали при повышенной температуре, а затем реакционную смесь охлаждали до температуры окружающей среды. Добавляли растворитель и кислоту, смесь перемешивали и затем экстрагировали. Органическую фазу промывали кислотой, водой и насыщенным раствором соли, а затем сушили и упаривали, получая соединение G9. Раствор соединения G9, DIEA (N,N-диизопропилэтиламин) и соединения G10 R6NH2 перемешивали при повышенной температуре. Летучие компоненты удаляли в вакууме и остаток очищали, получая целевой продукт - соединение G11.
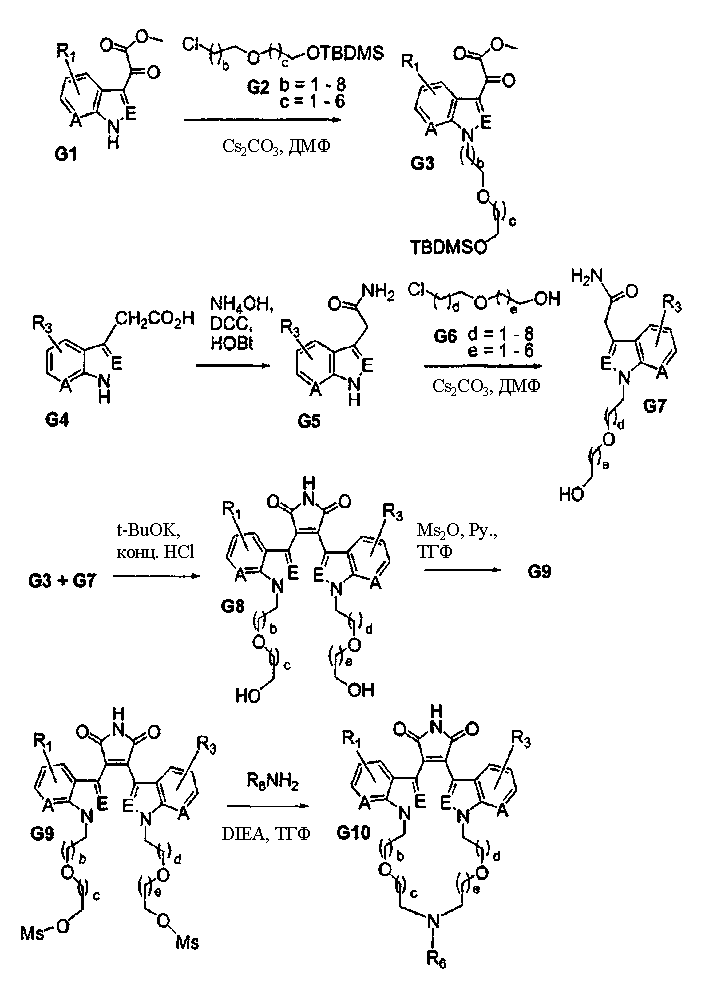
Конкретные примеры синтеза
Конкретные соединения, которые являются иллюстрацией данного изобретения, получали согласно следующим примерам и последовательностям реакций; примеры и схемы, представляющие последовательности реакций, предлагаются в качестве способа иллюстрации, для того, чтобы облегчить понимание изобретения и их не следует рассматривать, как ограничивающие изобретение, сформулированное в следующей далее формуле изобретения. Представленные промежуточные соединения также могут использоваться в последующих примерах для получения дополнительных соединений настоящего изобретения. Не предпринимались попытки оптимизировать выходы соединений, получаемых в любой реакции. Специалисту в данной области известно, каким образом увеличить такие выходы путем обычных изменений времени реакции, температуры, растворителей и/или реагентов.
1Н ЯМР спектры записывали на спектрометре Bruker AC-300 (300 МГц) с использованием тетраметилсилана в качестве внутреннего стандарта. Данные элементного анализа получены согласно Quantitative Technologies Inc. (Whitehouse, New Jersey) и результаты имели отклонения в пределах 0,4% от рассчитанных значений, если не указано другого. Температуры плавления определяли в открытых капиллярах с использованием устройства Томаса-Гувера (Toomas-Hoover), и их не корректировали. Оптическое вращение измеряли при 25°С на поляриметре Autopol III. Масс-спектры электрораспыления (MS-ES) регистрировали на спектрометре Hewlett Packard 59987A. Масс-спектры высокого разрешения (HRMS) получали на спектрометре Micromass Autospec. E.
Пример 1
 6,7,9,10,12,13,15,16-октагидро-23Н-5,26:17,22-диметено-5Н-дипиридо[2,3-k:3',2'-q]пирроло[3,4-n][1,4,7,10,19]триоксадиазациклогеникозин-23,25(24Н)-дион (Соединение 1)
6,7,9,10,12,13,15,16-октагидро-23Н-5,26:17,22-диметено-5Н-дипиридо[2,3-k:3',2'-q]пирроло[3,4-n][1,4,7,10,19]триоксадиазациклогеникозин-23,25(24Н)-дион (Соединение 1)
10,11,13,14,16,17,19,20,22,23-декагидро-9,4:24,29-диметено-1Н-дипиридо[2,3-n:3',2'-t]пирроло[3,4-q][1,4,7,10,13,22]тетраоксадиазациклотетракозин-1,3(2Н)-дион (Соединение 2)
10,11,13,14,16,17,19,20,22,23,25,26-додекагидро-9,4:27,32-диметено-1Н-дипиридо[2,3-q:3',2'-w]пирроло[3,4-t] [1,4,7,10,13,16,25]пентаоксадиазациклогептакозин-1,3(2Н)-дион (Соединение 3)
6,7,9,10,12,13-гексагидро-20Н-5,23:14,19-диметено-5Н-дипиридо[2,3-h:3',2'-n]пирроло[3,4-k][1,4,7,16]диоксадиазациклооктадецин-20,22(21Н)-дион (Соединение 28)
Хлорид триметилолова (26,5 мл, 1 M в ТГФ, 26,5 ммоль) добавляли к раствору в ТГФ (15 мл) соединения 7-аза-1-(трет-бутилоксикарбонил)-3-иодиндола la (1,82 г, 5,3 ммоль, Kelly T. A., J.Med.Chem. 1997, 40, 2430) при -78°C в атмосфере азота. Через 10 минут n-BuLi добавляли по каплям при -78°C (10 мл, 1,6 M в гексане, 16 ммоль) и реакционную смесь оставляли нагреваться до 20° C в течение ночи. Добавляли воду (4 мл) и растворитель удаляли в вакууме. Остаток разбавляли гексаном (250 мл) и органический слой промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (SiO2), получая 1,198 г (60%) оловоорганического соединения lb в виде масла. 1H ЯМР (300 МГц, CDCl3) δ 8,45 (д, J=4,9 Гц, 1H), 7,77 (д, J=7,6 Гц, 1H), 7,48 (с, 1H), 7,13 (дд, J=7,7, 4,8 Гц, 1H), 1,65 (с, 9H), 0,36 (м, 9H); MS (ES) m/z 405 (M+Na).
Смесь соединения lb (185 мг, 0,486 ммоль), 2,3-дихлормалеимида - соединения lc (29 мг, 0,162 ммоль, полученного, как описано в J. Org. Chem, 1998, 63, 1961), PdCl2(PPh3)2 (5,4 мг, 0,0077 ммоль) и LiCl (32 мг, 0,77 ммоль) в безводном толуоле (2 мл) перемешивали при 95°C в течение ночи. Растворитель удаляли в вакууме. Продукт очищали колоночной хроматографией (SiO2), получая 23 мг соединения ld в виде оранжево-красного твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 12,35 (с, 2H), 8,12 (ушир.д, J=3,9 Гц, 2H), 7,92 (с, 2H), 7,08 (д, J=7,7 Гц, 2H), 6,73 (м, 2H), 3,06 (с, 3H); MS (ES) m/z 344 (M+H+).
Получение соединения 1
Тетраэтиленбисмезилат - соединение If (0,252 г, 0,72 ммоль) в ДМФ (5,4 мл) добавляли с помощью шприцевого насоса в течение 3 часов к суспензии Cs2CO3 (0,51 г 1,56 ммоль) и исходного соединения 1d (0,162 г, 0,48 ммоль) в ДМФ (24 мл) при 100°C. По окончании прибавления реакционную смесь охлаждали до 20°C и перемешивали в течение 3 часов. Реакционную смесь разбавляли NH4Cl (водн.) и продукт экстрагировали CH2Cl2. Органический слой промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,075 г (31%) соединения li в виде красновато-оранжевого твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 8,32 (м, 2H), 7,80 (с, 2H), 7,61 (д, J=7,1 Гц, 2H), 6,99 (м, 2H), 4,50 (т, J=4,5 Гц, 4H), 3,71 (т, J=4,5 Гц, 4H), 3,22 (м, 11H); MS (ES) m/z 502 (M+H+).
Смесь соединения li (0,083 г, 0,16 ммоль) в EtOH (1 мл) и 10 н KOH (1,6 ммоль) нагревали при осторожном кипении с обратным холодильником при 78° C в течение ночи. Реакционную смесь охлаждали до 0°C и подкисляли 1н HCl. Добавляли CH2Cl2 и органический слой отделяли, промывали водой, сушили (Na2SO4) и концентрировали, получая продукт - соединение Im (0,074 г, 81%), в виде красного твердого вещества, которое использовали непосредственно. Раствор MeOH (0,05 мл), содержащий HMDS (0,24 г, 1,5 ммоль), добавляли к раствору соединения lm (0,074 г, 0,15 ммоль) в ДМФ (1,0 мл). Реакционную смесь нагревали при 80°C в течение 6 часов. По окончании реакционную смесь охлаждали и растворитель упаривали в вакууме. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,067 г (91%) соединения 1 в виде оранжевого твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 8,32 (д, J=4,3 Гц, 2H), 7,81 (с, 2H), 7,60 (д, J=7,8 Гц, 2H), 7,49 (с, 1H), 7,00 (м, 2H), 4,50 (т, J=4,5 Гц, 4H), 3,71 (т, J=4,5 Гц, 4H), 3,23 (м, 8H); MS (ES) m/z 488 (M+H+).
Получение соединения 2
Пентаэтиленбисмезилат - соединение lg (0,3 г, 0,76 ммоль) в ДМФ (6 мл) добавляли с помощью шприцевого насоса в течение 4 часов к суспензии Cs2CO3 (0,41 г, 1,27 ммоль) и исходного соединения ld (0,2 г, 0,58 ммоль) в ДМФ (18 мл) при 100°C. По окончании прибавления, реакционную смесь охлаждали до 20°C и перемешивали в течение 3 часов. Реакционную смесь после охлаждения до 0°C на ледяной бане разбавляли NH4Cl (водн.). Продукт экстрагировали CH2Cl2. Органический слой промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,126 г (39%) соединения Ij в виде оранжевого твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 8,32 (м, 2H), 7,80 (с, 2H), 7,57 (дд, J=8,0, 1,5 Гц, 2H), 7,00 (м, 2H), 4,44 (т, J=4,6 Гц, 4H), 3,77 (т, J=4,6 Гц, 4H), 3,43 (м, 12H), 3,20 (с, 3H); MS (ES) m/z 546 (M+H+).
Смесь соединения lj (0,094 г, 0,17 ммоль) в EtOH (1 мл) и 10н KOH (1,7 ммоль) нагревали при осторожном кипении с обратным холодильником при 78°C в течение ночи. Реакционную смесь охлаждали до 0°C и подкисляли 1н HCl. Добавляли CH2Cl2 и органический слой отделяли и промывали водой, сушили (Na2SO4) и концентрировали. Продукт - соединение In (0,075 г, 81%), получали в виде оранжевого твердого вещества и использовали непосредственно. Раствор MeOH (0,05 мл), содержащий HMDS (0,23 г, 1,4 ммоль), добавляли к раствору соединения ln (0,075 г, 0,14 ммоль) в ДМФ (1,0 мл). Реакционную смесь нагревали при 80°C в течение 51/2 часов. По окончании реакционную смесь охлаждали и растворитель упаривали в вакууме. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,038 г (51%) соединения 2 в виде оранжевого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,32 (д, J=4,5 Гц, 2H), 7,83 (с, 2H), 7,66 (с, 1H), 7,57 (д, J=7,9 Гц, 2H), 6,99 (м, 2H), 4,45 (т, J=4,7 Гц, 4H), 3,77 (т, J=4,7 Гц, 4H), 3,45 (м, 12H); MS (ES) m/z 532 (M+H+).
Получение соединения 3
Гексаэтиленбисмезилат - соединение lh (0,33 г, 0,76 ммоль) в ДМФ (6 мл) добавляли с помощью шприцевого насоса в течение 3 часов к суспензии Cs2CO3 (0,41 г, 1,27 ммоль) и исходного соединения ld (0,2 г, 0,58 ммоль) в ДМФ (18 мл) при 100°C. По окончании прибавления реакционную смесь охлаждали до 20°C и перемешивали в течение 3 часов.
Реакционную смесь после охлаждения до 0°C на ледяной бане разбавляли NH4Cl (водн.). Продукт экстрагировали CH2Cl2. Органический слой промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,81 г (24%) соединения lk в виде оранжевого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,27 (м, 2H), 7,89 (с, 2H), 7,42 (дд, J=9,4, 1,4 Гц, 2H), 6,89 (м, 2H), 4,47 (т, J=4,8 Гц, 4H), 3,80 (т, J=4,8 Гц, 4H), 3,46 (с, 8H), 3,41 (с, 8H), 3,20 (с, 3H); MS (ES) m/z 590 (M+H+).
Смесь соединения lk (0,073 г, 0,12 ммоль) в EtOH (1 мл) и 10н KOH (1,2 ммоль) нагревали при осторожном кипении с обратным холодильником при 78° C в течение ночи. Реакционную смесь охлаждали до 0°C и подкисляли 1н HCl. Добавляли CH2Cl2 и органический слой отделяли и промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая соединение lo (0,05 г, 70%) в виде оранжевого твердого вещества, и использовали непосредственно. Раствор MeOH (0,05 мл), содержащий HMDS (0,14 г, 0,087 ммоль), добавляли к раствору соединения lo (0,05 г, 0,087 ммоль) в ДМФ (1,0 мл). Реакционную смесь нагревали при 80° C в течение 5 часов. По окончании реакционную смесь охлаждали и растворитель упаривали в вакууме. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,044 г (88%) соединения 3 в виде оранжевого твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 8,29 (м, 2H), 7,90 (с, 2H), 7,80 (с, 1H), 7,42 (дд, J=8,0, 1,4 Гц, 2H), 6,90 (м, 2H), 4,48 (т, J=4,9 Гц, 4H), 3,81 (т, J=4,9 Гц, 4H), 3,47 (с, 8H), 3,43 (с, 8H); MS (ES) m/z 576 (M+H+).
Получение соединения 28
Раствор три(этиленгликоля) (4,97 г, 33,1 ммоль) в CH2Cl2 (40 мл) охлаждали до -40° C. Добавляли триэтиламин (13,8 мл, 99,3 ммоль) с последующим добавлением раствора MsCl (6,4 мл, 82,8 ммоль) в CH2Cl2 (15 мл). Реакционную смесь перемешивали при 0°C в течение 1 часа и выливали в ледяную воду (150 мл). Слои разделяли и водную фазу экстрагировали CH2Cl2 (3 × 15 мл). Органические слои объединяли, промывали последовательно 5%-ной HCl (15 мл), водой (15 мл), 5%-ным NaHCO3 (15 мл) и водой (15 мл), сушили (Na2SO4) и концентрировали при пониженном давлении, получая соединение le (согласно способу, описанному в Liebigs Ann. Chem., 1994, 12, 1199-1209) (9,13 г, 90%) в виде желтого масла; 1H ЯМР (300 МГц, CDCl3) δ 4,36-4,39 (м, 4H), 3,76-3,79 (м, 4H), 3,68 (с, 4H), 3,07 (с, 6 H).
Смесь соединения ld (40 мг, 71% чистота, 0,12 ммоль), Cs2CO3 (115 мг, 0,35 ммоль) и ДМФ (6 мл) нагревали до 100°C. Триэтиленбисмезилат - соединение le (54 мг, 0,18 ммоль), в растворе ДМФ (1,5 мл) добавляли с помощью шприцевого насоса в течение 0,5 часа. После окончания прибавления смесь перемешивали при 20°C в течение 15 часов, гасили водным раствором NH4Cl (6 мл) и экстрагировали EtOAc (2 × 25 мл). Слои разделяли и органическую фазу промывали водой (15 м), затем сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией на силикагеле (элюирование смесью CH2Cl2/ацетон) давало соединение 1l (25 мг, 67%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CDCl3) δ 8,35 (дд, J=4,7, 1,4 Гц, 2H), 8,11 (дд, J=8,0, 1,5 Гц, 2H), 7,63 (с, 2H), 7,12-7,16 (дд, J=8,0, 4,7 Гц, 2H), 4,42 (т, J=4,6 Гц, 4H), 3,77 (т, J=4,8 Гц, 4H), 3,45 (с, 4H), 3,20 (с, 3H); MS (ES) m/z 458 (M+H+).
Смесь соединения 1l (47 мг, 0,10 ммоль), этанола (2 мл) и 10н KOH (0,1 мл) нагревали при 80°C в течение 15 часов. После удаления растворителя остаток разбавляли водой (2 мл) и подкисляли 1н HCl до pH 2. Смесь экстрагировали CH2Cl2 (4 × 15 мл) и органические слои объединяли, сушили (Na2SO4) и концентрировали, получая продукт соединение lp. Соединение lp растворяли в ДМФ (1 мл) и добавляли смесь HMDS (1,1,1,3,3,3-гексаметилдисилазан) (0,25 мл, 1,0 ммоль) и метанола (0,06 мл). Смесь нагревали при 80°C в течение 5,5 часов, затем охлаждали до 20°C и концентрировали при пониженном давлении. Очистка колоночной хроматографией на силикагеле (элюирование смесью CH2Cl2/ацетон) давала соединение 28 (27 мг, 60%) в виде красного твердого вещества: 1H ЯМР (300 МГц, CDCl3) δ 8,35 (дд, J=4,7, 1,5 Гц, 2H), 8,10 (дд, J=8,0, 1,5 Гц, 2H), 7,65 (с, 2H), 8,12-8,17 (дд, J=8,0, 4,7 Гц, 2H), 4,41 (т, J=4,9 Гц, 4H), 3,77 (т, J=4,9 Гц, 4H), 3,44 (с, 4H); MS (ES) m/z 444 (M+H+).
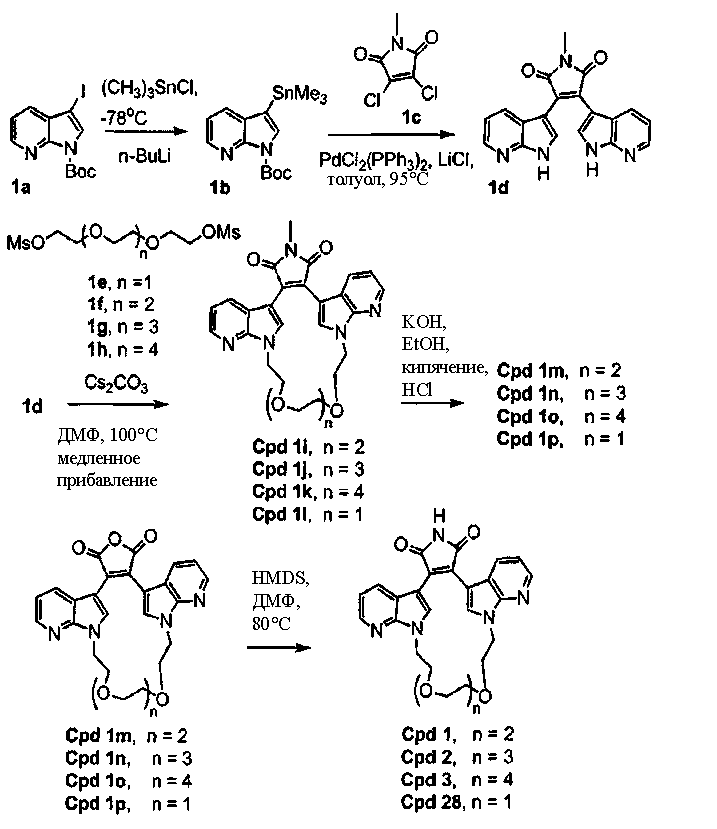
Пример 2
соединение 4 соединение 5 соединение 6 соединение 7
6,7,9,10,12,13-гексагидро-20H-5,23:14,19-диметено-5H-дибензо[h,n]пирроло[3,4-k][1,4,7,16]диоксадиазациклооктадецин-20,22(21H)-дион (соединение 4);
6,7,9,10,12,13,15,16-октагидро-23H-5,26:17,22-диметено-5Hдибензо[k,q]пирроло[3,4-n][1,4,7,10,19]триоксадиазациклогенэйкозин-23,25(24H)-дион (соединение 5);
10,11,13,14,16,17,19,20,22,23-декагидро-9,4:24,29-диметено-1H-дибензо[n,t]пирроло[3,4-q][1,4,7,10,13,22]тетраоксадиазациклотетракозин-1,3(2H)-дион (соединение 6);
10,11,13,14,16,17,19,20,22,23,25,26-додекагидро-9,4:27,32-диметено-1H-дибензо[q,w]пирроло[3,4-t][1,4,7,10,13,16,25]пентаоксадиазациклогептакозин-1,3(2Н)-дион (соединение 7)
Получение соединения 4
Триэтиленбисмезилат - соединение le (0,58 г, 1,9 ммоль), в ДМФ (15 мл) добавляли с помощью шприцевого насоса в течение 3 часов к суспензии Cs2CO3 (1,0 г, 3,2 ммоль) и исходного соединения 2a (0,5 г, 1,5 ммоль, полученного, как описано в Synthesis, 1995, 1511) в ДМФ (40 мл) при 100°C. Затем реакционную смесь охлаждали до 20°C и перемешивали в течение 3 часов. Реакционную смесь разбавляли NH4Cl (водн.) и продукт экстрагировали CH2Cl2. Органический слой промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,29 г (43%) соединения 2c в виде красновато-коричневого твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 7,79 (д, J=8,0 Гц, 2H), 7,41 (с, 2H), 7,23 (м, 6H), 4,20 (т, J=4,5 Гц, 4H), 3,68 (т, J=4,5 Гц, 4H), 3,34 (с, 4H), 3,19 (с, 3H); MS (ES) m/z 456 (M+H+).
Смесь соединения 2b (0,1 г, 0,22 ммоль) в EtOH (1 мл) и 10н KOH (2,2 ммоль) нагревали при осторожном кипении с обратным холодильником при 78°C в течение ночи. Реакционную смесь охлаждали до 0°C и подкисляли 1н HCl. Образовывался темно-красный осадок. Добавляли CH2Cl2 и органический слой отделяли и промывали водой, сушили (Na2SO4) и концентрировали. Продукт - соединение 2f (0,088 г, 91%), получали в виде темно-красного твердого вещества и использовали непосредственно. Раствор MeOH (0,05 мл), содержащий HMDS (0,32 г, 1,97 ммоль), добавляли к раствору соединения 2f (0,088 г, 0,2 ммоль) в ДМФ (1,5 мл). Реакционную смесь нагревали при 80°C в течение 6 часов. По окончании реакционную смесь охлаждали и растворитель упаривали в вакууме. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,32 г (36%) соединения 4 в виде темно-красного твердого вещества после перекристаллизации из смеси (CH2Cl2/гексан); 1H ЯМР (300 МГц CDCl3) δ 7,77 (д, J=8,1 Гц, 2H), 7,43 (с, 2H), 7,26 (м, 6H), 4,20 (м, 4H), 3,69 (м, 4H), 3,34 (с, 4H); MS (ES) m/z 442 (M+H+).
Получение соединения 5
Триэтиленбисмезилат - соединение lf (1,9 ммоль) в ДМФ (15 мл) добавляли с помощью шприцевого насоса в течение 3 часов к суспензии Cs2CO3 (1,0 г, 3,2 ммоль) и исходного соединения 2a (0,5 г, 1,5 ммоль) в ДМФ (40 мл) при 100°C. Реакционную смесь охлаждали до 20°C и перемешивали в течение 2 часов. Реакционную смесь разбавляли NH4Cl (водн.) и продукт экстрагировали CH2Cl2. Органический слой промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,457 г (62%) соединения 2c; 1H ЯМР (300 МГц, CDCl3) δ 7,60 (с, 2H), 7,33 (ушир.т, J=9,3 Гц, 4H), 7,19 (т, J=7,7 Гц, 2H), 6,99 (т, J=7,7 Гц, 2H), 4,25 (т, J=4, 3 Гц, 4H), 3,66 (м, 4H), 3,18 (м, 11H); MS (ES) m/z 500 (M+H+); Элементный анализ. Вычислено для C29H29N3О5·0,45H2O: C, 68,61; H, 5,94; N, 8,28. Найдено: C, 68,86; H, 6,12; N, 7,91.
Смесь соединения 2c (0, 1 г, 0,2 ммоль) в EtOH (1 мл) и 10н KOH (2,0 ммоль) нагревали при осторожном кипении с обратным холодильником при 78°C в течение ночи. Реакционную смесь охлаждали до 0°C и подкисляли 1н HCl. Образовывался темно-красный осадок. Добавляли CH2Cl2 и органический слой отделяли и промывали водой, сушили (Na2SO4) и концентрировали. Продукт - соединение 2g (0,097 г, 100%), получали в виде темно-красного твердого вещества и использовали непосредственно. Раствор MeOH (0,05 мл), содержащий HMDS (0,32 г, 1,97 ммоль), добавляли к раствору соединения 2g (0,097 г, 0,2 ммоль) в ДМФ (1,5 мл). Реакционную смесь нагревали при 80°C в течение 6 часов. По окончании, реакционную смесь охлаждали и растворитель упаривали в вакууме. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,78 г (80%) соединения 5 в виде оранжевого твердого вещества после перекристаллизации из смеси (CH2Cl2/гексан); 1H ЯМР (300 МГц, CDCl3) δ 7,61 (с, 2H), 7,34 (м, 5H), 7,19 (т, J=7,0 Гц, 2H), 6,99 (т, J=7,0 Гц, 2H), 4,25 (т, J=4,5 Гц, 4H), 3,66 (т, J=4,5 Гц, 4H), 3,18 (с, 8H); MS (ES) m/z 486 (M+H+). Элементный анализ. Вычислено для C28H27N3О5: C, 69,26; H, 5,60; N, 8,65. Найдено: C, 69, 49; H, 5,86; N, 8,34.
Получение соединения 6
Пентаэтиленбисмезилат - соединение lg (0,75 г, 1,9 ммоль) в ДМФ (15 мл) добавляли с помощью шприцевого насоса в течение ночи к суспензии Cs2CO3 (1,0 г, 3,2 ммоль) и исходного соединения 2a (0,5 г, 1,5 ммоль) в ДМФ (40 мл) при 100°C. Реакционную смесь охлаждали до 20°C и перемешивали в течение 2 часов. Реакционную смесь разбавляли NH4Cl (водн.) и продукт экстрагировали CH2Cl2. Органический слой промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,44 г (56%) соединения 2d, 1H ЯМР (300 МГц, CDCl3) δ 7,56 (с, 2H), 7,32 (т, J=7,5 Гц, 4H), 7,21 (т, J=7,1 Гц, 2H), 7,01 (т, J=7,7 Гц, 2H), 4,22 (т, J=4,9 Гц, 4H), 3,72 (т, J=4,9 Гц, 4H), 3,47 (с, 4H), 3,42 (м, 4H), 3,34 (м, 4H), 3,20 (с, 3H); MS (ES) m/z 544 (M+H+).
Смесь соединения 2d (0,12 г, 0,22 ммоль) в EtOH (1 мл) и 10н KOH (2,2 ммоль) нагревали при осторожном кипении с обратным холодильником при 78°C в течение ночи. Реакционную смесь охлаждали до 0°C и подкисляли 1н HCl. Образовывался темно-красный осадок. Добавляли CH2Cl2 и органический слой отделяли и промывали водой, сушили (Na2SO4) и концентрировали. Продукт - соединение 2h (0,12 г, 100%), получали в виде темно-красного твердого вещества и использовали непосредственно. Раствор MeOH (0,05 мл), содержащий HMDS (0,36 г, 2,3 ммоль), добавляли к раствору соединения 2h (0,12 г, 0,23 ммоль) в ДМФ (1,5 мл), добавляли MeOH раствор (0,05 мл), содержащий HMDS (0,36 г, 2,3 ммоль). Реакционную смесь нагревали при 80°C в течение 6 часов. По окончании реакционную смесь охлаждали и растворитель упаривали в вакууме. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,066 г (55%) соединения 6 в виде оранжевого твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 7,58 (с, 2H), 7,42 (с, 1H), 7,33 (м, 4H), 7,23 (т, J=6,6 Гц, 2H), 7,02 (т, J=7,0 Гц, 2H), 4,22 (т, J=4,9 Гц, 4H), 3,72 (т, J=4,9 Гц, 4H), 3,48 (с, 4H), 3,43 (м, 4H), 3,35 (м, 4H); MS (ES) m/z 530 (M+H+). Элементный анализ. Вычислено для C30H3lN3О6·0,7H2O: C, 66,46; H, 6,02; N, 7,75. Найдено: C, 66,35; H, 6,17; N, 7,50.
Получение соединения 7
Гексаэтиленбисмезилат - соединение lh (0,84 г, 1,9 ммоль), в ДМФ (15 мл) добавляли с помощью шприцевого насоса в течение ночи к суспензии Cs2CO3 (1,0 г, 3,2 ммоль) и исходного соединения 2a (0,5 г, 1,5 ммоль) в ДМФ (40 мл) при 100°C. Реакционную смесь охлаждали до 20°C и перемешивали в течение 2 часов. Реакционную смесь разбавляли NH4Cl (водн.) и продукт экстрагировали CH2Cl2. Органический слой промывали водой, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,18 г (21%) соединения 2e; 1H ЯМР (300 МГц, CDCl3) δ 7,63 (с, 2H), 7,40 (д, J=8,1 Гц, 2H), 7,17 (м, 4H), 6,92 (т, J=7,5 Гц, 2H), 4,25 (т, J=5,1 Гц, 4H), 3,75 (т, J=5,1 Гц, 4H), 3,40 (м, 16H), 3,20 (с, 3H); MS (ES) m/z 588 (M+H+).
Смесь соединения 2e (0,13 г, 0,22 ммоль) в EtOH (1 мл) и 10н KOH (2,2 ммоль) нагревали при осторожном кипении с обратным холодильником при 78°C в течение ночи. Реакционную смесь охлаждали до 0°C и подкисляли 1н HCl. Образовывался темно-красный осадок. Добавляли CH2Cl2 и органический слой отделяли и промывали водой, сушили (Na2SO4) и концентрировали. Продукт - соединение 2i (0,12 г, 92%), получали в виде темно-красного твердого вещества и использовали непосредственно. Раствор MeOH (0,05 мл), содержащий HMDS (0,34 г, 2,1 ммоль), добавляли к раствору соединения 2i (0,12 г, 0,21 ммоль) в ДМФ (1,5 мл). Реакционную смесь нагревали при 80°C в течение 5 часов. По окончании реакционную смесь охлаждали и растворитель упаривали в вакууме. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон), получая 0,096 г (80%) соединения 7 в виде красного твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 7,64 (с, 2H), 7,36 (с, 3H), 7,17 (м, 4H), 6,93 (т, J=7,8 Гц, 2H), 4,26 (т, J=5,1 Гц, 4H), 3,75 (т, J=5,1 Гц, 4H), 3,43 (м, 16H); MS (ES) m/z 574 (M+H+). Элементный анализ. Вычислено для C32H35N3O7: C, 67,00; H, 6,15; N, 7,33. Найдено:C, 66,63; H, 6,26; N, 7,21.
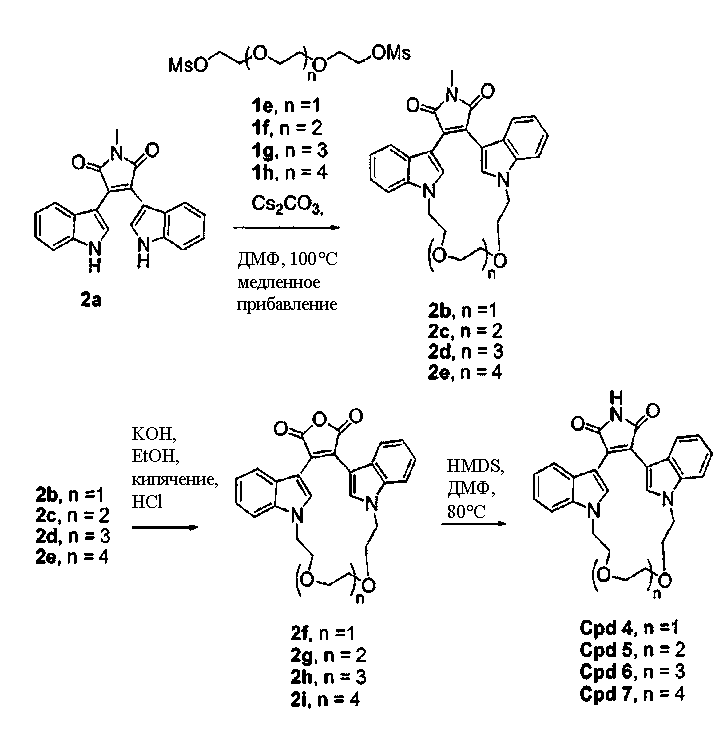
Пример 3
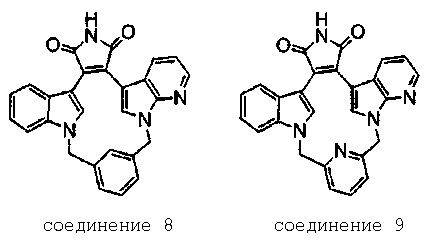
12-гидро-6H,19H-5,22:13,18:7,11-триметенопиридо[2,3-j]пирроло[3,4-m][1,9]бензодиазациклогептадецин-19,21(20H)-дион (соединение 8);
12-гидро-6H,19H-5,22:13,18-диметено-7,11-нитрилопиридо[2,3-j]пирроло[3,4-m][1,9]бензодиазациклогептадецин-19,21(20H)-дион (соединение 9)
Получение соединения 8
Смесь хлор-индолилмалеимида - соединения 3b (0,929 г, 3,57 ммоль, полученного, как описано в Synthesis, 1995,1511), оловоорганического соединения 3a (1,59 г, 3,57 ммоль), хлорида лития (2,06 г, 49 ммоль) и дихлорбис(трифенилфосфин)палладия (II) (0,34 г, 0,49 ммоль) в толуоле (45 мл) нагревали при 95°C в атмосфере азота в течение ночи. Реакционную смесь концентрировали в вакууме и добавляли CH2Cl2 (7,5 мл) и ТФУК (2,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов, затем концентрировали в вакууме. Остаток очищали колоночной хроматографией (CH2Cl2/ацетон), получая смесь оранжевого продукта и 7-азаиндольного промежуточного соединения. Неочищенный продукт растирали в простом эфире для удаления 7-азаиндола и оранжевое твердое вещество - соединение 3c (0,376 г, 31%), собирали фильтрованием; 1H ЯМР (300 МГц, ацетон-d6) δ 8,05 (д, J=4,0 Гц, 1H), 7,88 (с, lH), 7,85 (с, lH), 7,35 (д, J=8,2 Гц, 1H), 7,23 (д, J=8,1 Гц, 1H), 6,97 (т, J=7,8 Гц, 1H), 6,68 (м, 3H), 3,13 (с, 3H); FAB-HRMS (Масс-спектр высокого разрешения - бомбардировка быстрыми атомами) (M+H+). Вычислено для C20H15N4О2 343,1195, найдено 343,1205.
Дигалогензамещенное арил/гетероарильное соединение 3d (такое как α,α'-дибром-м-ксилол; где X представляет собой атом углерода, и галоген представляет атом брома) (200 мг, 0,756 ммоль) в ДМФ (10 мл) добавляли в течение 2 часов с помощью шприцевого насоса к суспензии соединения 3c (246 мг, 0,72 ммоль) и Cs2CO3 (394 мг, 1,2 ммоль) в ДМФ (20 мл) при 100°C, выдерживали при 100°C в течение 20 часов. Реакционную смесь концентрировали в вакууме. Добавляли воду и остаток экстрагировали этилацетатом и затем CH2Cl2. Экстракты объединяли, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон в качестве растворителя), получая 135 мг (42%) соединения 3e в виде кирпично-красного твердого вещества после перекристаллизации из смеси этилацетат/гексаны; 1H ЯМР (300 МГц, CDCl3) δ 8,38 (д, J=4,1 Гц, 1H), 8,21 (д, J=8,2 Гц, 1H), 7,83 (д, J=7,8 Гц, 1H), 7,44 (д, J=8,1 Гц, 1H), 7,25 (м, 6H), 7,09 (с, 1H), 7,03 (с, 1H) 6,69 (с, 1H), 5,42 (с, 2H), 5,16 (с, 2H), 3,23 (с, 3H); FAB-HRMS (M+H+). Вычислено для C27H19N4О2 445,1664, найдено 445,1660.
Смесь соединения 3e (135 мг, 0,304 ммоль) и 10н KOH (0,85 мл) в этаноле (5 мл) нагревали при осторожном кипении с обратным холодильником в течение ночи. Реакционную смесь охлаждали на ледяной бане, 1н HCl (10 мл) добавляли и смесь перемешивали при 0°C в течение 1 часа. Реакционную смесь распределяли между CH2Cl2 (40 мл) и NaHCO3 (водн.) (40 мл). Отделенный водный слой опять экстрагировали CH2Cl2 (2 x 20 мл). Объединенный органический слои сушили (Na2SO4) и концентрировали в вакууме, получая неочищенное соединение ангидрида 3g (48 мг). Раствор MeOH (0,12 мл), содержащий гексаметилдисилазан (HMDS) (0,68 г, 4,2 ммоль) добавляли к раствору соединения 3g в ДМФ (2 мл). Реакционную смесь нагревали в течение ночи при 80°C. Охлажденную реакционную смесь концентрировали в вакууме, продукт очищали колоночной хроматографией (CH2Cl2/ацетон в качестве растворителя), получая 28 мг (21%) соединения 8 в виде кирпично-красного твердого вещества после перекристаллизации из простого эфира; 1H ЯМР (300 МГц, метанол-d4) δ 8,28 (м, 1H), 8,22 (д, J=8,0 Гц, 1H), 7,69 (д, J=7,8 Гц, 1H), 7,54 (д, J=8,2 Гц, 1H), 7,18 (м, 9H), 6,68 (с, lH), 5,35 (с, 2H), 5,19 (с, 2H); FAB-HRMS (M+H+). Вычислено для C27H19N4О2 431,1508, найдено 431,1506.
Получение соединения 9
Дигалогензамещенное арил/гетероарильное соединение 3d (такое как 2,6-бис(хлорметил)пиридин; где X представляет собой атом азота, и галоген представляет собой атом хлора) (133 мг, 0,756 ммоль) в ДМФ (20 мл) добавляли в течение 2 часов с помощью шприцевого насоса к суспензии соединения 3c (246 мг, 0,72 ммоль) и Cs2CO3 (394 мг, 1,2 ммоль) в ДМФ (20 мл) при 100°C и выдерживали при 100°C в течение 20 часов. Реакционную смесь концентрировали в вакууме. Добавляли воду и остаток экстрагировали этилацетатом и затем CH2Cl2. Экстракты объединяли, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон в качестве растворителя), получая 103 мг (32%) соединения 3f в виде кирпично-красного твердого вещества после перекристаллизации из смеси этилацетат/гексаны; 1H ЯМР (300 МГц, CDCl3) δ 8,30 (м, 2H), 7,94 (ушир.д, J=8,3 Гц, 1H), 7,64 (т, J=7,6 Гц, 1H), 7,42 (с, 1H), 7,27 (м, 7H), 5,56 (с, 2H), 5,28 (с, 2H), 3,25 (с, 3H); FAB-HRMS (M+H+). Вычислено для C27H20N5О2 446,1617, найдено 446,1630.
Смесь соединения 3f (87 мг, 0,194 ммоль) и 10н KOH (0,55 мл) в этаноле (3 мл) нагревали при осторожном кипении с обратным холодильником в течение ночи. Реакционную смесь охлаждали на ледяной бане. Добавляли 12н HCl (1 мл) и CH2Cl2 (6 мл) и реакционную смесь перемешивали при 0°C в течение 1 часа. Реакционную смесь распределяли между CH2Cl2 (40 мл) и NaHCO3 (водн.) (40 мл). Отделенный водный слой опять экстрагировали CH2Cl2 (2 × 20 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали в вакууме, получая соединение ангидрида 3h (66 мг). Раствор MeOH (0,12 мл), содержащий HMDS (0,678 г, 2,1 ммоль), добавляли к раствору соединения 3h в ДМФ (4 мл). Реакционную смесь нагревали в течение ночи при 80°C. Охлажденную реакционную смесь концентрировали в вакууме, продукт очищали колоночной хроматографией (CH2Cl2 ацетон в качестве растворителя), получая 50 мг (60%) соединения 9 в виде пурпурного твердого вещества; 1H ЯМР (300 МГц, ацетон-d6) δ 9,82 (ушир.с, 1H), 8,27 (м, 2H), 7,85 (м, 2H), 7,61-7,39 (м, 5H), 7,17 (м, 3H), 5,67 (с, 2H), 5,52 (с, 2H). MS (ES) m/z 432 (M+H+). Элементный анализ. Вычислено для C25H17N5О2·H2О: C, 69,48; H, 4,26; N, 15,58. Найдено: C, 69,20; H, 4,04; N, 15,45.
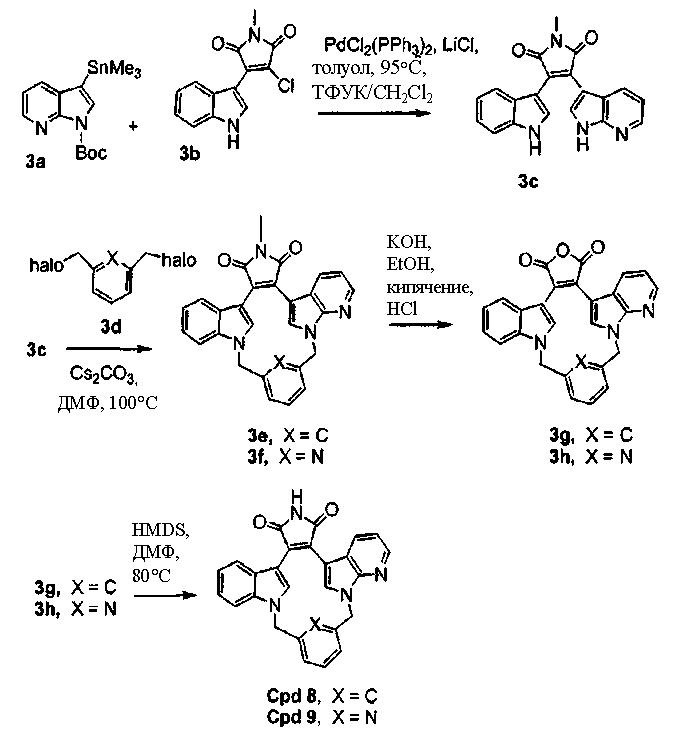 Пример 4
Пример 4
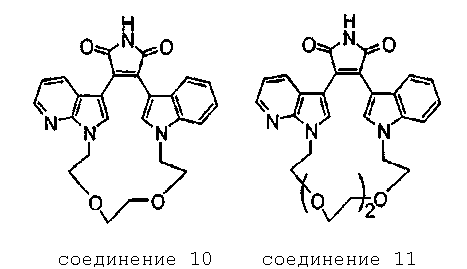
6,7,9,10,12,13-гексагидро-20H-5,23:14,19-диметено-5H-пиридо[2,3-k]пирроло[3,4-n][4,7,1,10]бензодиоксадиазациклооктадецин-20,22(21Н)-дион (соединение 10);
6,7,9,10,12,13,15,16-октагидро-23H-5,26:17,22-диметено-5H-пиридо[2,3-n]пирроло[3,4-q][4,7,10,1,13]бензотриоксадиазациклогенэйкозин-23,25(24H)-дион (соединение 11)
Получение соединения 10
Бисмезилатное соединение le (220 мг, 0,72 ммоль) в ДМФ (10 мл) добавляли в течение 2 часов с помощью шприцевого насоса к суспензии соединения 3c (246 мг, 0,72 ммоль) и Cs2CO3 (394 мг, 1,2 ммоль) в ДМФ (20 мл) при 100°C и выдерживали при 100°C в течение 20 часов. Реакционную смесь концентрировали в вакууме. Добавляли воду и остаток экстрагировали CH2Cl2, затем сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон в качестве растворителя), получая 160 мг (49%) соединения 4a в виде кирпично-красного твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 8,33 (д, J=4,8 Гц, 1H), 8,25 (д, J=7,0 Гц, 1H), 7,65 (д, J=7,8 Гц, 1H), 7,59 (с, 1H), 7,45 (с, 1H), 7,34 (д, J=8,1 Гц, 1H), 7,26 (м, 1H), 7,16 (м, 2H), 4,37 (т, J=4,5 Гц, 2H), 4,27 (т, J=4,7 Гц, 2H), 3,76 (т, J=4,8 Гц, 2H), 3,69 (т, J=4,5 Гц, 2H), 3,38 (м, 4H), 3,20 (с, 3H). MS (ES) m/z 457 (M+H+). Элементный анализ. Вычислено для C26H24N4О4·1,5 H2O: C, 64,59; H, 5,63; N, 11,59. Найдено: C, 64,99; H, 5,27; N, 11,44.
Смесь соединения 4a (124 мг, 0,271 ммоль) и 10н KOH (0,77 мл) в этаноле (4,2 мл) нагревали при осторожном кипении с обратным холодильником в течение ночи. Реакционную смесь охлаждали на ледяной бане, добавляли 12н HCl (2,3 мл) и CH2Cl2 (3 мл) и реакционную смесь перемешивали при 0°C в течение 20 минут. Реакционную смесь распределяли между CH2Cl2 (40 мл) и NaHCO3 (водн.) (40 мл). Отделенный водный слой опять экстрагировали CH2Cl2 (2 × 20 мл). Объединенный органический слои сушили (Na2SO4) и концентрировали в вакууме, получая неочищенное соединение ангидрида 4c (120 мг). Раствор MeOH (0,2 мл), содержащий HMDS (1,19 г, 7,46 ммоль), добавляли к раствору ангидрида в ДМФ (7 мл). Реакционную смесь нагревали в течение ночи при 80°C. Охлажденную реакционную смесь концентрировали в вакууме и продукт очищали колоночной хроматографией (CH2Cl2/ацетон в качестве растворителя), получая 39 мг (33%) соединения 10 в виде оранжевого твердого вещества; 1H ЯМР (300 МГц, ДМСО-d6) δ 11,05 (ушир.с, 1H), 8,29 (д, J=3,3 Гц, 1H), 8,11 (д, J=7,9 Гц, 1H), 7,74 (с, 1H), 7,62 (с, 1H), 7,54 (д, J=8,4 Гц, 2H), 7,18 (м, 2H), 7,05 (т, J=7,8 Гц, 1H), 4,36 (м, 4H), 3,68 (м, 4H), 3,39 (м, 4H). FAB-HRMS (M+H+). Вычислено для C25H23N4О4 443,1719, найдено 443,1713.
Получение соединения 11
Соединение бисмезилата 1f (252 мг, 0,72 ммоль) в ДМФ (10 мл) добавляли в течение 2 часов с помощью шприцевого насоса к суспензии соединения 3c (246 мг, 0,72 ммоль) и Cs2CO3 (394 мг, 1,2 ммоль) в ДМФ (20 мл) при 100°C и выдерживали при 100°C в течение 20 часов. Реакционную смесь концентрировали в вакууме. Добавляли воду и остаток экстрагировали CH2Cl2, сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (CH2Cl2/ацетон в качестве растворителя), получая 100 мг (27%) соединения 4b в виде оранжевого твердого вещества после перекристаллизации из смеси этилацетат/гексаны; 1H ЯМР (300 МГц, CDCl3) δ 8,34 (д, J=3,7 Гц, 1H), 8,05 (д, J=7,1 Гц, 1H), 7,78 (с, 1H), 7,62 (с, lH), 7,40 (д, J=8,2 Гц, 1H), 7,14 (м, 2H), 6,90 (м, 2H), 4,44 (м, 2H), 4,35 (м, 2H), 3,77 (м, 2H), 3,60 (м, 2H), 3,38 (м, 4H), 3,20 (с, 3H), 3,02 (м, 4H). MS (ES) m/z 501 (M+H+). Элементный анализ. Вычислено для C28H28N4O5·0,5 H2О: C, 66,00; H, 5,74; N, 11,00. Найдено: C, 65,88; H, 5,75; N, 10,93.
Смесь соединения 4b (58 мг, 0,116 ммоль) и 10 н KOH (0,33 мл) в этаноле (1,8 мл) нагревали при осторожном кипении с обратным холодильником в течение ночи. Реакционную смесь охлаждали на ледяной бане, добавляли 12н HCl (1 мл) и CH2Cl2 (6 мл) и реакционную смесь перемешивали при 0°C в течение 20 минут. Реакционную смесь распределяли между CH2Cl2 (40 мл) и NaHCO3 (водн.) (40 мл). Отделенный водный слой опять экстрагировали CH2Cl2 (2 × 20 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали в вакууме, получая неочищенное соединение ангидрида 4c (60 мг). Раствор MeOH (0,1 мл), содержащий HMDS (0,51 г, 3,2 ммоль), добавляли к раствору ангидрида в ДМФ (3 мл). Реакционную смесь нагревали в течение ночи при 80°C. Охлажденную реакционную смесь концентрировали в вакууме и затем продукт очищали колоночной хроматографией (CH2Cl2/ацетон в качестве растворителя), получая 47 мг (83%) соединения 11 в виде оранжевого твердого вещества; 1H ЯМР (300 МГц, ацетон-d6) δ 9,66 (ушир.с, 1H), 8,31 (д, J=4,0 Гц, 1H), 7,98 (д, J=8,1 Гц, 1H), 7,83 (с, 1H), 7,64 (с, 1H), 7,56 (д, J=8,4 Гц, 1H), 7,12 (м, 2H), 6,87 (д, J=4,0 Гц, 2H), 4,43 (м, 4H), 3,83 (м, 2H), 3,61 (м, 2H), 3,33 (м, 4H), 3,07 (с, 4H). Элементный анализ. Вычислено для C27H26N4О5·0,7H2O: C, 64,97; H, 5,53; N, 11,22. Найдено: C, 65,40; H, 5,64; N, 10,80; FAB-HRMS (M+H+). Вычислено C27H27N4О5 487,1981, найдено 487,1964.
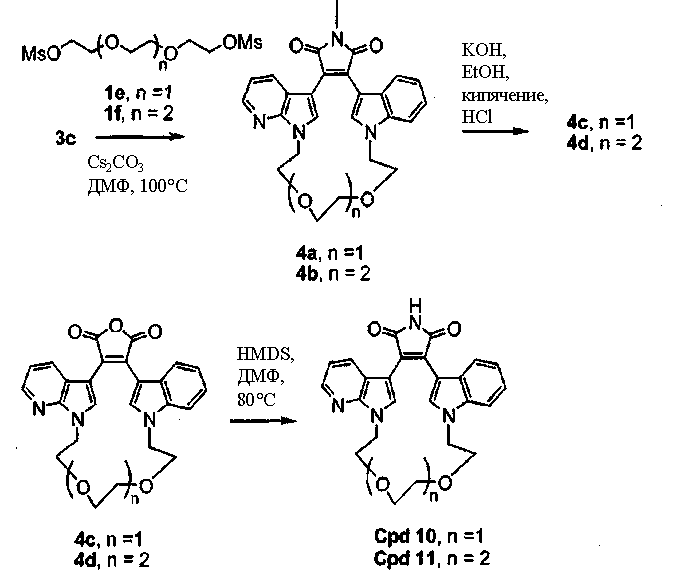
Пример 5
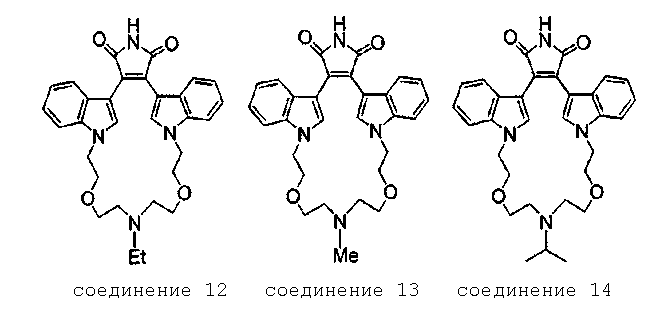
11-этил-6,7,10,11,12,13,15,16-октагидро-23H-5,26:17,22-диметено-5H,9H-дибензо[k,q]пирроло[3,4-n][1,7,4,10,19]диоксатриазациклогенэйкозин-23,25(24H)-дион (соединение 12);
6,7,10,11,12,13,15,16-октагидро-11-метил-23H-5,26:17,22-диметено-5H,9H-дибензо[k,q]пирроло[3,4-n][1,7,4,10,19]диоксатриазациклогенэйкозин-23,25(24H)-дион (соединение 13);
6,7,10,11,12,13,15,16-октагидро-11-(1-метилэтил)-23H-5,26:17,22-диметено-5H,9H-дибензо[k,q]пирроло[3,4-n][1,7,4,10,19]диоксатриазациклогенэйкозин-23,25(24H)-дион (соединение 14)
Получение соединения 12
Суспензию 10,0 г (53 ммоль) соединения 5a в 350 мл смеси дихлорметан:метанол в соотношении 6:1 перемешивали и охлаждали на ледяной бане, добавляя при этом по каплям в течение 1 часа 79 мл 2,0 M раствора TMSCHN2 в гексане. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивание продолжали в течение ночи. Полученное светло-желтое твердое вещество отфильтровывали и промывали простым эфиром, получая 7,5 г (70%) соединения 5b. 1H ЯМР (ДМСО-d6) δ 12,5 (с, 1H), 8,45 (д, 1H), 8,2 (д, 1H), 7,55 (д, 1H), 7,3 (м, 2H), 3,95 (с, 3H). Добавляли по каплям в течение 1 часа 1,0 M трет-бутоксид калия (51,6 мл, 51,6 ммоль) к смеси соединения 5b (3,84 г, 18,9 ммоль) и соединения 3-индолилацетамида 5c (3,00 г, 17,2 ммоль) в сухом ТГФ (30 мл), предварительно охлажденной до 0°C. Далее реакционную смесь перемешивали при 0°C в течение 15 минут, затем при комнатной температуре в течение 3 часов. Реакционную смесь гасили концентрированной хлористоводородной кислотой (24 мл) при интенсивном перемешивании в течение 5 минут. Реакционную смесь разбавляли этилацетатом и промывали водой. Этилацетатный слой промывали водой, затем насыщенным раствором соли, затем сушили (MgSO4) и упаривали в вакууме, получая твердое соединение 5d (6,89 г). Соединение 5d (6,79 г) растворяли в сухом ацетоне (170 мл) с последующим добавлением тонкоизмельченного карбоната калия (3,15 г, 22,8 ммоль) и диметилсульфата (2,16 мл, 22,8 ммоль). Реакционную смесь нагревали при кипении с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и упаривали в вакууме, получая красное твердое вещество. Красное твердое вещество перемешивали в смеси этилацетат/метанол (10: 1,550 мл), сушили и упаривали в вакууме. Неочищенный продукт хроматографировали (силикагель, EtOAc/гексан, от 1:4 до 2:3), получая твердое соединение 5e (1,78 г, 30 % общий выход из расчета на соединение 5c). 1H ЯМР (ДМСО-d6) δ 3,04 (с, 3H), 6,60-6,72 (м, 2H), 6,81 (д, 2H, J=10,45 Гц), 6,95-7,00 (м, 2H), 7,36 (д, 2H, J=7,99 Гц), 7,75 (д, 2H, J=2,59 Гц), 11,67 (с, 2H).ES-MS m/z 341 (MH+).
Соединение 5e (1,50 г, 4,40 ммоль) растворяли в сухом ДМФ (300 мл) с последующим добавлением 2-бромэтилового простого эфира (5,53 мл, 44,0 ммоль) и карбоната цезия (5,73 г, 17,6 ммоль). Реакционную смесь перемешивали при 80°C в течение 8 часов и затем дополнительно добавляли 2-бромэтиловый простой эфир (1,12 мл, 8,80 ммоль) и реакционную смесь перемешивали при 80°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит. Фильтрат разбавляли этилацетатом (20 мл), промывали водой (2×), затем насыщенным раствором соли (l×), затем сушили (Na2SO4) и упаривали в вакууме. Неочищенный продукт хроматографировали (силикагель, EtOAc/гексан, от 1:4 до 1:1), получая соединение 5g (1,06 г, 37%). 1H ЯМР (CDCl3) δ 3,18 (с, 3H), 3,32-3,36 (м, 4H), 3,59-3,66 (м, 4H), 3,81-3,85 (м, 4H), 4,31 (т, 4H, J=5,42 Гц), 6,73 (т, 2H, J=7,22 Гц), 6,98 (д, 2H, J=8,02 Гц), 7,07-7,12 (м, 2H), 7,31 (д, 2H, J=8,25 Гц), 7,72 (с, 2H, H-2). ES-MS m/z 644 (MH+). Раствор соединения 5g (0,40 г, 0,62 ммоль), диизопропилэтиламина (1,29 мл, 7,4 ммоль) и этиламина (2,0 M в ТГФ, 1,85 мл, 3,7 ммоль) в сухом ТГФ (103 мл) перемешивали при 90°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и дополнительно добавляли диизопропилэтиламин (0,64 мл, 3,7 ммоль) и 2,0 M этиламин, соединение 5h в ТГФ (0,92 мл, 1,85 ммоль). Реакционную смесь перемешивали при 90°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и упаривали в вакууме, получая соединение 5k (0,59 г). Неочищенное соединение 5k (0,59 г) суспендировали в EtOH (24 мл) с последующим добавлением гидроксида калия (0,93 г, 16,5 ммоль). Реакционную смесь перемешивали при кипении с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и упаривали в вакууме. Полученный остаток растворяли в воде (55 мл) и подкисляли 10%-ной лимонной кислотой. Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и упаривали в вакууме. Полученное твердое вещество обрабатывали чистым ацетатом аммония (60 г) и перемешивали при 140°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой, подщелачивали 20%-ным гидроксидом натрия до pH=10 и экстрагировали этилацетатом (2 × 80 мл). Органический слой промывали водой (60 мл), затем насыщенным раствором соли (60 мл), затем сушили (Na2SO4) и упаривали в вакууме. Неочищенный продукт хроматографировали (силикагель, ДХМ/MeOH/NH4OH, от 95:3:2 до 93:5:2), получая целевое соединение 12 (38,5 мг). 1H ЯМР (CD3OD) δ 0,95-1,00 (м, 3H), 2,42-2,45 (м, 4H), 2,51-2,58 (кв, 2H), 3,14-3,18 (м, 4H), 3,61-3,64 (м, 4H), 4,25-4,28 (м, 4H), 6,89-6,94 (м, 2H), 7,10-7,19 (м, 4H), 7,44 (д, 2H, J=8,23 Гц), 7,61 (с, 2H). ES-MS m/z 513 (MH+).
Получение соединения 13
Используя методику получения соединения 12 и подходящие реагенты и исходные вещества, известные специалистам в данной области, получали соединение 13: 1H ЯМР (CD3OD) δ 2,16 (с, 3H), 2,29-2,32 (м, 4H), 3,1-3,20 (м, 4H), 3,65-3,67 (м, 4H), 4,30-4,33 (м, 4H), 6,93-6,95 (м, 2H), 7,17-7,21 (м, 4H), 7,47 (д, 2H, J=8,29 Гц), 7,65 (с, 2H). ES-MS m/z 499 (MH+).
Получение соединения 14
Используя методику получения соединения 12 и подходящие реагенты и исходные вещества, известные специалистам в данной области, получали соединение 14:ES-MS m/z 527 (MH+).
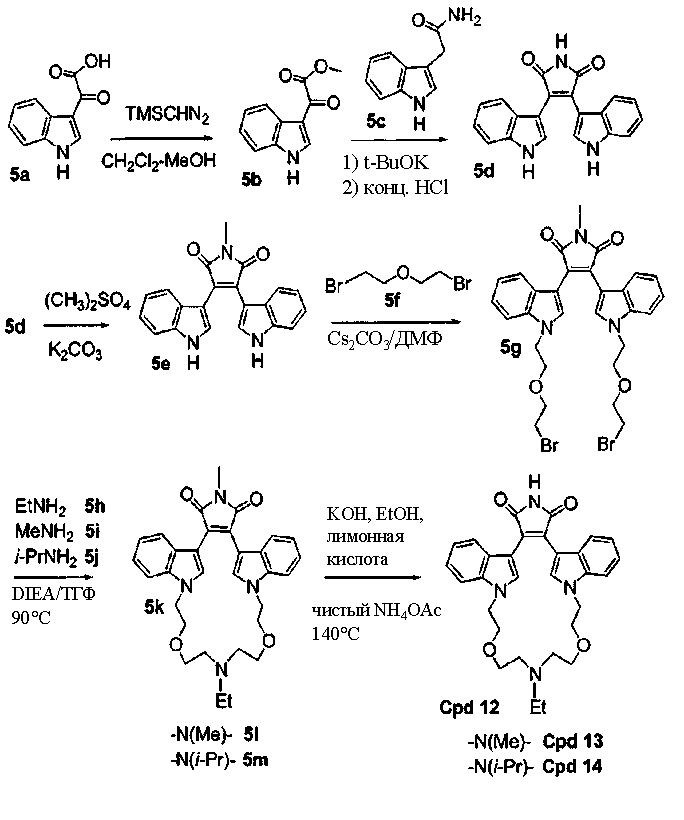
Пример 6
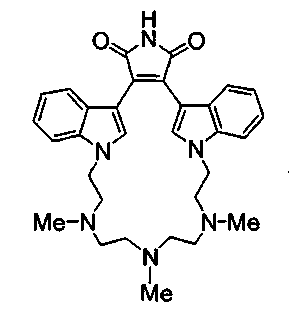
соединение 15
7,8,9,10,11,12,13,14,15,16-декагидро-8,11,14-триметил-6H,23H-5,26:17,22-диметенодибензо[n,t]пирроло[3,4-q][1,4,7,10,13]пентаазациклогенэйкозин-23,25(24Н)-дион (соединение 15)
1-Бром-2-хлорэтан - соединение 6a (430 мг, 3,0 ммоль), добавляли к смеси соединения 5e (51 мг, 0,15 ммоль) и карбоната цезия (122 мг, 0,38 ммоль) в ДМФ (4 мл). Реакционную смесь перемешивали при 45°C в течение 16 часов и затем охлаждали до комнатной температуры. Смесь разбавляли EtOAc (50 мл), промывали водой, затем насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме, получая соединение 6b (69 мг), CI-MS m/z 466 (MH+). Раствор неочищенного соединения 6b (26 мг), 1,4,7-триметилдиэтилентриамина - соединения 6c (10 мг, 0,07 ммоль), KI (28 мг, 0,17 ммоль) и N,N-диизопропилэтиламина (44 мг, 0,34 ммоль) в ТГФ (8 мл) перемешивали при 80°C в течение 8 часов, в этот момент времени ТСХ показала, что реакция прошла только частично. Дополнительно добавляли триметилдиэтилентриамин (20 мг, 0,14 ммоль) и перемешивание продолжали при 120°C в течение 42 часов. Реакционную смесь затем разбавляли EtOAc (50 мл), промывали водой, затем насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме. Полученный остаток - соединение 6d (ES-MS m/z 539 (MH+)) растворяли в EtOH (4 мл) и обрабатывали KOH (63 мг, 1,1 ммоль). Реакционную смесь перемешивали при 80°C в течение 40 часов и затем EtOH удаляли в вакууме. Остаток растворяли в воде (3 мл) и подкисляли 10%-ной лимонной кислотой (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и затем сушили в вакууме. Полученное твердое вещество перемешивали с чистым ацетатом аммония (4,0 г) при 140°C в течение 2,5 часов и смесь охлаждали до комнатной температуры, разбавляли H2O (3 мл), подщелачивали до pH=примерно 10 с использованием 20%-ного водного гидроксида натрия. Раствор экстрагировали EtOAc (40 мл × 2). Органический слой промывали водой, затем насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме, получая неочищенный продукт, который отделяли препаративной ТСХ с использованием смеси CH2Cl2/MeOH/NH4OH (85:13:2), получая соединение 15 в виде красно-оранжевого твердого вещества (12 мг, 41% общий выход из расчета на соединение 5e). 1H ЯМР (CDCl3) δ 7,52 (с, 2H), 7,34-7,30 (м, 4H), 7,20 (т, J=7,1, 7,9 Гц, 2H), 7,00 (т, J=7,0, 7,9 Гц, 2H), 4,08 (м, 4H), 2,67 (м, 4H), 2,32-2,10 (м, 8H), 2,19 (с, 9H); ES-MS m/z 525 (MH+).
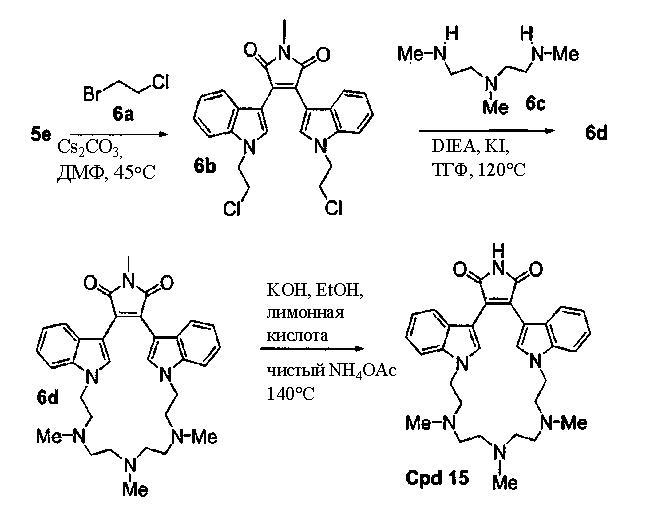
Пример 7
соединение 16 соединение 17 соединение 29
6,7,10,11,12,13,15,16-октагидро-11-метил-23H-5,26-метено-17,22-нитрило-5H,9H-дибензо[k,q]пирроло[3,4-n][1,7,4,10,19]диоксатриазациклогенэйкозин-23,25(24H)-дион (соединение 16);
11-этил-6,7,10,11,12,13,15,16-октагидро-23H-5,26-метено-17,22-нитрило-5H,9H-дибензо[k,q]пирроло[3,4-n][1,7,4,10,19]диоксатриазациклогенэйкозин-23,25(24H)-дион (соединение 17);
6,7,10,11,12,13,15,16-октагидро-11-(2-метоксиэтил)-23H-5,26-метено-17,22-нитрило-5H,9H-дибензо[k,q]пирроло[3,4-n][1,7,4,10,19]диоксатриазациклогенэйкозин-23,25(24H)-дион (соединение 29)
Получение соединения 16
Смесь соединения 5b (2,03 г, 10,0 ммоль), соединения 7a (3,10 г, 13,0 ммоль, полученного из 2-(2-хлорэтокси)этанола и TBDMS-Cl) и карбоната цезия (4,69, 14,4 ммоль) в ДМФ (40 мл) перемешивали при 70°C в течение 8 часов и затем фильтровали. Фильтрат упаривали в вакууме и остаток разделяли колоночной флэш-хроматографией (гексан/EtOAc, 3:1), получая соединение 7b в виде светло-желтого вязкого масла (1,83 г, 45% выход). 1H ЯМР (CDCl3) δ 8,45-8,42 (м, 2H), 7,59-7,30 (м, 3H), 4,34 (т, J=5,3 Гц, 2H), 3,93 (с, 3H), 3,87 (т, J=5,3 Гц, 2H), 3,68 (т, J=5,3, 4,8 Гц, 2H), 3,47 (т, J=5,3, 4,8 Гц, 2H), 0,84 (с, 9H), 0,01 (с, 6H); ES-MS m/z 406 (MH+). Кислоту - соединение 7c (5,28 г, 30 ммоль, получено согласно J.Med.Chem. 1992, 35, 2160), растворяли в ДХМ (120 мл) и ДМФ (30 мл) в атмосфере аргона, добавляли HOBT (4,45 г, 33 ммоль) и DCC (6,51 г, 32 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Добавляли в течение 5 минут гидроксид аммония (28%, 2,7 г, 44 ммоль) и реакционную смесь затем перемешивали при температуре окружающей среды в течение 16 часов. Белое твердое вещество отфильтровывали и фильтрат разбавляли ДХМ (150 мл) и опять фильтровали. Содержащий ДХМ раствор экстрагировали четыре раза 5%-ным NaHCO3 (150 мл); объединенный водный раствор обрабатывали хлоридом натрия (190 г) и экстрагировали этилацетатом (300 мл) шесть раз. Органический экстракт сушили (Na2SO4) и упаривали в вакууме, получая твердое вещество, которое растирали с диэтиловым эфиром (100 мл) и фильтровали, получая соединение 7d (3,52 г, 67%) в виде белого твердого вещества. Смесь соединения 7d (700 мг, 4,0 ммоль), 2-(2-хлорэтокси)этанола - соединения 7e (997 мг, 8,0 ммоль), и карбоната цезия (1,56 г, 4,8 ммоль) в ДМФ (20 мл) перемешивали при 70°C в течение 16 часов и затем фильтровали. Фильтрат упаривали в вакууме и остаток разделяли колоночной флэш-хроматографией (CH2Cl2/MeOH, 9:1), получая соединение 7f в виде светло-желтого твердого вещества (495 мг, 47% выход). 1H ЯМР (CD3OD) δ 7,74 (д, J=8,1 Гц, 1H), 7,58 (д, J=8,6 Гц, 1H), 7,40 (т, J=8,2, 7,1 Гц, 1H), 7,14 (т, J=8,5 Гц, 1H), 4,56 (т, J=5,4 Гц, 2H), 3,92-3,89 (м, 4H), 3,52 (м, 2H), 3,45 (м, 2H); ES-MS m/z 264 (MH+).
К охлажденной до 0°C суспензии сложноэфирного соединения 7b (487 мг, 1,2 ммоль) и амидного соединения 7f (210 мг, 0,8 ммоль) в сухом ТГФ (10 мл) в атмосфере аргона добавляли по каплям 1,0 M трет-бутоксид калия в ТГФ (4 мл, 4,0 ммоль). Полученную смесь перемешивали при 0°C в течение 10 минут и при комнатной температуре в течение 3 часов, а затем добавляли концентрированную HCl (5 мл) и перемешивали при комнатной температуре еще в течение 10 минут. Реакционную смесь распределяли между EtOAc (100 мл) и H2O (40 мл). Два слоя разделяли и водный слой экстрагировали EtOAc (50 мл). Объединенные экстракты промывали водой, затем насыщенным водным раствором NaHCO3, затем насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме, получая соединение 7g в виде темного красно-оранжевого твердого вещества (388 мг). ES-MS m/z 505 (MH+). К раствору неочищенного соединения 7g (255 мг) и пиридина (320 мг, 4,0 ммоль) в ТГФ (14 мл) добавляли Ms2О (440 мг, 2,5 ммоль). Реакционную смесь перемешивали при 50°C в течение 2 часов и затем реакционную смесь охлаждали до комнатной температуры. Затем добавляли ТГФ (10 мл) и 1,0н водн. HCl (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и затем экстрагировали EtOAc (120 мл). Органическую фазу промывали 1,0 н водн. HCl (20 мл), затем водой, затем насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме, получая соединение 7h в виде темного красно-оранжевого твердого вещества (386 мг). ES-MS m/z 661 (MH+). Раствор неочищенного соединения 7h (76 мг), N,N-диизопропилэтиламина (259 мг, 2,0 ммоль) и MeNH2 - соединения 7i (2,0 M в ТГФ, 0,90 мл, 1,8 ммоль), в ТГФ (10 мл) в запаянной трубке перемешивали при 90°C в течение 22 часов. Летучие компоненты удаляли в вакууме и остаток разделяли колоночной флэш-хроматографией (CH2Cl2/MeOH/NH4OH, 88:12:0,5), получая целевой продукт - соединение 16, в виде красно-оранжевого твердого вещества (20 мг, 40% общий выход из расчета на соединение 7f). 1H ЯМР (CD3OD) δ 7,66 (с, 1H), 7,61-7,32 (м, 5H), 7,23-7,20 (м, 1H), 7,07-7,00 (м, 2H), 4,51 (т, J=5,5 Гц, 2H), 4,22 (т, J=4,6 Гц, 2H), 3,64-3,59 (м, 4H), 3,34 (т, J=5,1 Гц, 2H), 3,09 (т, J=5,1 Гц, 2H), 2,43 (т, J=5,1 Гц, 2H), 2,23 (т, J=5,0 Гц, 2H), 2,17 (с, 3H); ES-MS m/z 500 (MH+).
Получение соединения 17
Используя методику получения соединения 16 и подходящие реагенты и исходные вещества, известные специалистам в данной области, получали соединение 17: 1H ЯМР (CD3OD) δ 7,88 (с, 1H), 7,64 (д, J=8,5 Гц, 1H), 7,57 (д, J=8,2 Гц, 1H), 7,47 (м, 2H), 7,20-7,13 (м, 2H), 6,86-6,77 (м, 2H), 4,53 (т, J=4,8 Гц, 2H), 4,36 (т, J=4,7 Гц, 2H), 3,75 (т, J=4,7, 5,0 Гц, 2H), 3,62 (т, J=4,8 Гц, 2H), 3,34 (м, 2H), 3,17 (т, J=5,0 Гц, 2H), 2,77 (м, 4H), 2,63 (т, J=5,0 Гц, 2H), 1,08 (т, J=7,2 Гц, 3H); ES MS m/z 514 (MH+).
Получение соединения 29
Используя методику получения соединения 16 и подходящие реагенты и исходные вещества, известные специалистам в данной области, получали соединение 29: 1H ЯМР (CD3OD) (свободное основание) δ 7,86 (с, 1H), 7,55 (д, J=8,2 Гц, 1H), 7,45-7,37 (м, 3H), 7,19 (т, J=6,8, 8,2 Гц, 1H), 7,11 (т, J=6,6, 7,9 Гц, 1H), 6,97-6,91 (м, 2H), 4,46 (т, J=5,0 Гц, 2H), 4,25 (м, 2H), 3,68-3,31 (м, 10H), 3,27 (с, 3H), 2,95 (м, 2H), 2,77 (м, 2H), 2,68 (м, 2H); ES-MS m/z 544 (MH+).

Пример 8
соединение 18
11-этил-6,7,10,11,12,13,15,16-октагидро-23H-5,26:17,22-диметено-5H,9H-дипиридо[2,3-k:3',2'-q]пирроло[3,4-n][1,7,4,10,19]диоксатриазациклогенэйкозин-23,25(24H)-дион (соединение 18)
2-(2-Хлорэтокси)этанол - соединение 7f (0,35 мл, 3,30 ммоль), добавляли к смеси соединения ld (133 мг, 85% чистота, 0,33 ммоль) и Cs2CO3 (1,07 г, 3,30 ммоль) в ДМФ (1,5 мл). Реакционную смесь перемешивали при 100 °C в течение 2,5 часов, охлаждали до 20° C, разбавляли EtOAc и фильтровали через целит. Растворители удаляли при пониженном давлении и целевой диол - соединение 8a, выделяли (87 мг, 51%) колоночной хроматографией (элюирование смесью смесью MeOH/CH2Cl2) в виде оранжевого твердого вещества:1H ЯМР (300 МГц,CD3OD) δ 8,19 (д, J=4,3 Гц, 2H), 8,01 (с, 2H), 7,18 (д, J=7,7 Гц, 2H), 6,72 (дд, J=8,0, 4,7 Гц, 2H), 4,56 (т, J=4,8 Гц, 4H), 3,83 (т, J=4,8 Гц, 4H), 3,67 (т, J=4,4 Гц, 4H), 3,53 (т, J=3,8 Гц, 4H), 3,18 (с, 3H); MS (ES) m/z 520 (M+H+). К раствору диольного соединения 8a (87 мг, 0,167 ммоль) в CH2Cl2 (1,5 мл) при 0°C добавляли триэтиламин (0,47 мл, 3,35 ммоль) и MsCl (0,13 мл, 1,67 ммоль). После перемешивания при 20°C в течение 15 минут смесь гасили водой (0,5 мл) и затем разбавляли CH2Cl2 (5 мл). После разделения слоев водную фазу экстрагировали CH2Cl2 (3 × 5 мл) и органические слои объединяли, сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование смесью смесью MeOH/CH2Cl2) давала бисмезилатное соединение 8b (113 мг, 100%) в виде оранжевого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (дд, J=4,7, 1,4 Гц, 2H), 7,94 (с, 2H), 7,23 (д, J=7,7 Гц, 2H), 6,76 (м, 2H), 4,55 (т, J=5,0 Гц, 4H), 4,28 (м, 4H), 3,88 (т, J=5,0 Гц, 4H), 3,67 (м, 4H), 3,18 (с, 3H), 2,90 (с, 6H); MS (ES) m/z 698 (M+Na).
I-Pr2NEt - соединение 8d (0,44 мл, 2,51 ммоль), и H2NEt - соединение 8c, в ТГФ (2 M, 0,84 ммоль), добавляли к раствору соединения 8b (113 мг, 0,167 ммоль) в ДМФ (17 мл). Реакционную смесь перемешивали при 80° C в течение 2 часов и добавляли дополнительные порции iPr2NEt соединения 8d (0,2 мл, 1,25 ммоль) и H2NEt соединения 8c (0,42 ммоль). После перемешивания на протяжении 20 часов смесь охлаждали до 20° C и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией (элюирование смесью смесью MeOH/CH2Cl2), получая соединение 8e (59 мг, 67%) в виде оранжевого твердого вещества: 1H ЯМР (400 МГц, CD3OD) δ 8,27 (дд, J=4,7, 1,5 Гц, 2H), 7,82 (с, 2H), 7,58 (дд, J=8,0, 1,5 Гц, 2H), 7,04 (дд, J= 8,0, 4,8 Гц, 2H), 4,47 (т, J=4,8 Гц, 4H), 3,69 (т, J=4,8 Гц, 4H), 3,24 (т, J=5,0 Гц, 4H), 3,14 (с, 3H), 2,51 (д, J=6,1 Гц, 2H), 2,42 (ушир.с, 4H), 0,96 (т, J=7,1 Гц, 3H); MS (ES) m/z 529 (M+H+). Смесь соединения 8e (59 мг, 0,11 ммоль), этанола (4,2 мл) и KOH (196 мг, 3,50 ммоль) нагревали при кипении с обратным холодильником в течение 22 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток растворяли в воде (10 мл) и подкисляли 10%-ной лимонной кислотой (pH 5). Реакционную смесь перемешивали при 20° C в течение 10 минут и затем концентрировали. Полученный остаток смешивали с твердым ацетатом аммония (10,0 г, 0,13 моль) и нагревали при 140°C в течение 3 часов. Реакционную смесь затем охлаждали до 20°C, разбавляли водой, подщелачивали 20%-ной водной NaOH до достижения pH 10 и экстрагировали EtOAc (3 × 30 мл). Объединенные органические экстракты промывали водой и насыщенным раствором соли, затем сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование смесью MeOH/CH2Cl2/NH4OH) давала соединение 18 (6 мг, 11%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD) δ 8,27 (дд, J=4,8, 1,7 Гц, 2H), 7,80 (с, 2H), 7,58 (дд, J=7,9, 1,5 Гц, 2H), 7,03 (дд, J=8,0, 4,8 Гц, 2H), 4,45 (т, J=4,7 Гц, 4H), 3,68 (т, J=4,7 Гц, 4H), 3,23 (т, J=5,0 Гц, 4H), 2,51 (кв, J=7,2 Гц, 2H), 2,40 (т, J=5,1Гц, 4H), 0,96 (т, J=7,2 Гц, 3H); MS (ES) m/z 515 (M+H)+.
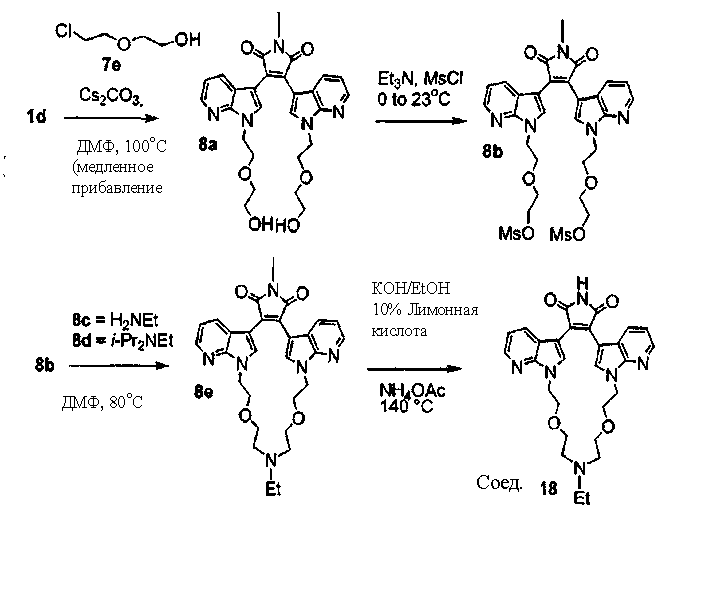
Пример 9
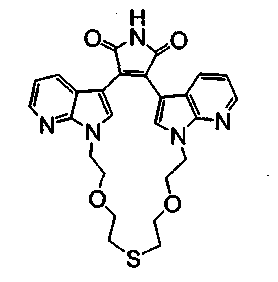
соединение 19
6,7,9,10,12,13,15,16-октагидро-23H-5,26:17,22-диметено-5H-дипиридо[2,3-k:3',2'q]пирроло[3,4-n][1,7,4,10,19]диоксатиадиазациклогенэйкозин-23,25(24H)-дион (соединение 19)
2-Бромэтиловый простой эфир - соединение 5f (0,2 мл, 1,57 ммоль), добавляли к смеси соединения ld (54 мг, 0,16 ммоль), Cs2CO3 (205 мг, 0,63 ммоль) и ДМФ (5, 0 мл). После нагревания при 40° C в течение 1,5 часов смесь перемешивали при 20°C в течение 12 часов, затем фильтровали через целит и разбавляли EtOAc. Органический слой промывали водой (3 x 5 мл), сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование смесью EtOAc/гексан) давала соединение 9a в виде оранжевого твердого вещества (37 мг, 44%): 1H ЯМР (300 МГц, CD3OD) δ 8,13 (дд, J=4,7, 1,4 Гц, 2H), 8,06 (с, 2H), 7,20 (дд, J=8,0, 1,4 Гц, 2H), 6,74 (дд, J=8,0, 4,8 Гц, 2H), 4,53 (т, J=5,0 Гц, 4H), 3,87 (т, J=5,0 Гц, 4H), 3,71 (т, J=5,8 Гц, 4H), 3,42 (т, J=6,0 Гц, 4H), 3,14 (с, 3H); MS (ES) m/z 646 (M+H+). Смесь дибромзамещенного соединения 9a (37 мг, 0,057 ммоль), безводного EtOH (240 мл) и нонагидрата дисульфида натрия (14 мг, 0,057 ммоль) нагревали при кипении с обратным холодильником в течение 66 часов. После удаления растворителя остаток помещали в EtOAc. Органический слой промывали 5%-ным водным NaOH (3 × 5 мл), сушили (Na2SO4) и концентрировали. Остаток очищали колоночной хроматографией (элюирование смесью ацетон/CH2Cl2), получая смесь соединения 9a (12 мг) и соединения 9b (12 мг, 60%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD) δ 8,27 (дд, J=4,8, 1,5 Гц, 2H), 7,84 (с, 2H), 7,53 (дд, J=4,8, 1,5 Гц, 2H), 7,03 (дд, J=8,0, 4,7 Гц, 2H), 4,45 (т, J=4,7 Гц, 4H), 3,70 (т, J=4,7 Гц, 4H), 3,35 (т, J=5,6 Гц, 4H), 3,14 (с, 3H), 2,34 (т, J=5,5 Гц, 4H); MS (ES) m/z 518 (M+H+). Смесь соединения 9b (12 мг, 0,023 ммоль), этанола (2,0 мл) и KOH (188 мг, 3,30 ммоль) нагревали при кипении с обратным холодильником в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток растворяли в воде (3,0 мл) и подкисляли 10%-ной лимонной кислотой (pH 5-6). Реакционную смесь перемешивали при 20°C в течение 10 минут и концентрировали. Полученный остаток смешивали с твердым ацетатом аммония (2,0 г, 26,0 ммоль) и нагревали при 140° C в течение 3 часов. Смесь охлаждали до 20° C, разбавляли водой (3,0 мл), подщелачивали 20%-ным водным NaOH до pH 10 и экстрагировали EtOAc (3 × 15 мл). Объединенные органические слои промывали водой и насыщенным раствором соли, затем сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование смесью ацетон/CH2Cl2) давала соединение 9b (6 мг, 73%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD) δ 8,25 (дд, J=4,8, 1,5 Гц, 2H), 7,82 (с, 2H), 7,52 (дд, J=4,8, 1,5 Гц, 2H), 7,03 (дд, J=8,0, 4,8 Гц, 2H), 4,45 (т, J=4,5 Гц, 4H), 3,70 (т, J=4,5 Гц, 4H), 3,35 (т, J=5,5 Гц, 4H), 2,34 (т, J=5,5 Гц, 4H); MS (ES) m/z 504 (M+H+).
Пример 10
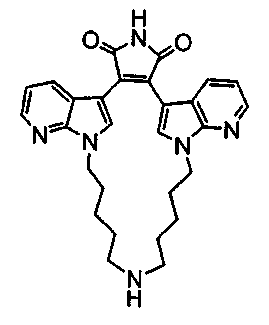
соединение 20
7,8,9,10,11,12,13,14,15,16-декагидро-(6H,23H-5,26:17,22-диметенодипиридо[2,3n:3',2'-t]пирроло[3,4-q][1,7,13]триазациклогенэйкозин-23,25(24Н)-дион (соединение 20)
Пиридин (1,2 мл, 14,6 ммоль) и MsCl (1,1 мл, 14,6 ммоль) добавляли при 0°C к раствору карбаматдиолового соединения 10a (1,06 г, 3,66 ммоль, получено, как описано в MaGee, D.I. и Beck, E.J., Can.J.Chem., 2000, 78, 1060-1066) в CH2Cl2 (13 мл). Реакционную смесь перемешивали при 20° C в течение 1,5 часов, разбавляли диэтиловым эфиром (10 мл) и промывали последовательно холодной водной HCl (5%), NaOH (5%), водой и насыщенным раствором соли. Органический раствор сушили (MgSO4), фильтровали и концентрировали. Очистка колоночной хроматографией на силикагеле (элюирование смесью гексан/EtOAc) давала соединение 10b в виде бесцветного масла (1,20 г, 74%): 1H ЯМР (400 МГц, CDCl3) δ 4,23 (т, J=6,4 Гц, 4H), 3,16 (с, ушир., 4H), 3,01 (с, 6H), 1,78 (м, 4H), 1,55 (м, 4H), 1,45 (с, 9H), 1,40 (м, 4H); MS (ES) m/z 468 (M+Na). Смесь соединения ld (50 мг, 85% чистота, 0,12 ммоль) и Cs2CO3 (190 мг, 0,58 ммоль) в ДМФ (20 мл) нагревали до 100° C. Добавляли с помощью шприцевого насоса в течение 1,5 часов раствор бисмезилатного соединения 10b (77 мг, 0,17 ммоль) в ДМФ (5 мл). После завершения прибавления смесь перемешивали при 20° C в течение 21 часа, гасили водным раствором хлорида аммония (30 мл) и экстрагировали CH2Cl2 (2 × 30 мл). Органические фазы отделяли, объединяли и промывали водой (3 × 20 мл) и насыщенным раствором соли (15 мл). Неочищенный продукт затем сушили (Na2SO4), концентрировали и хроматографировали на колонке с силикагелем (элюирование смесью гексан/EtOAc), получая соединение 10c (36 мг, 50%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD) δ 8,29 (дд, J=4,7, 1,5 Гц, 2H), 7,66 (с, ушир, 2H), 7,58 (с, 2H), 7,05 (дд, J=8,0, 4,7 Гц, 2H), 4,30 (т, J=6,5 Гц, 4H), 3,15 (с, 3H), 2,73 (с, ушир., 4H), 1,75 (т, J=6,6 Гц, 4H), 1,42 (с, 9H), 1,34 (м, 4H), 1,03 (м, 4H); MS (ES) m/z 597 (M+H+).К раствору соединения 10c (13 мг, 0,022 ммоль) в CH2Cl2 (1,0 мл) добавляли ТФУК (0,2 мл). После перемешивания смеси при 20°C в течение 1 часа растворитель и избыток ТФУК удаляли при пониженном давлении. Осторожно добавляли гидроксид аммония и твердое оранжевое вещество разминали, отфильтровывали и промывали водой. Соединение 10d (10 мг, 100%) получали после сушки в вакууме: 1H ЯМР (300 МГц, CD3OD) δ 8,27 (дд, J=4,7, 1,4 Гц, 2H), 7,66 (с, 2H), 7,56 (дд, J=8,0, 1,4 Гц, 2H), 7,02 (дд, J=8,0, 4,8 Гц, 2H), 4,33 (т, J=5,9Гц, 4H), 3,14 (с, 3H), 2,26 (т, J=6,5 Гц, 4H), 1,84 (м, 4H), 1,40 (м, 4H), 0,96 (м, 4H); MS (ES) m/z 497 (M+H+). Смесь соединения 10d (10 мг, 0,020 ммоль), этанола (2,0 мл) и KOH (198 мг, 3,53 ммоль) нагревали при кипении с обратным холодильником в течение 18 часов, затем охлаждали до 20° C и концентрировали при пониженном давлении. Остаток растворяли в воде (3,0 мл) и подкисляли 10%-ной лимонной кислотой (pH 4). Реакционную смесь перемешивали при 20 °C в течение 10 минут и концентрировали. Полученный остаток смешивали с твердым ацетатом аммония (2,4 г, 31,2 ммоль) и нагревали при 140 °C в течение 3 часов. Смесь охлаждали до 20°C, разбавляли водой (3,0 мл), подщелачивали 20%-ным водным NaOH до pH 10 и экстрагировали EtOAc (3 × 25 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование смесью MeOH/CH2Cl2) давала соединение 20 (4 мг, 42%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD) δ 8,27 (дд, J=4,7, 1,5 Гц, 2H), 7,65 (с, 2H), 7,55 (дд, J=8,0, 1,5 Гц, 2H), 7,01 (дд, J=8,0, 4,8 Гц, 2H), 4,32 (т, J=5,9 Гц, 4H), 2,23 (т, J=6,3 Гц, 4H), 1,81 (т, J=5,9 Гц, 4H), 1,40 (м, 4H), 0,94 (т, J=7,5 Гц, 4H); MS (ES) m/z 483 (M+H+).
Пример 11
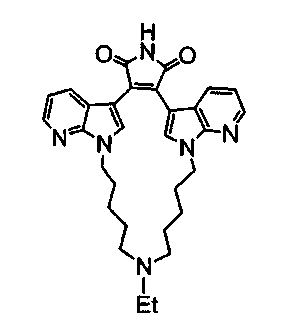
соединение 21
11-этил-7,8,9,10,11,12,13,14,15,16-декагидро-6H,23H-5,26:17,22-диметенодипиридо[2,3-n:3',2'-t]пирроло[3,4-q][1,7,13]триазациклогенэйкозин-23,25(24H)-дион (соединение 21)
Смесь соединения 10d (14 мг, 0,028 ммоль), ТГФ (1,0 мл) и иодэтана (4 мкл, 0,063 ммоль) нагревали при кипении с обратным холодильником в течение двух дней. Продукт концентрировали и хроматографировали (элюирование смесью MeOH/CH2Cl2/NH4OH), получая соединение 11a (12 мг, 75%) в виде оранжевого твердого вещества: 1H ЯМР (400 МГц, CD3OD) δ 8,27 (дд, J=4,7, 1,6 Гц, 2H), 7,64 (с, 2H), 7,62 (дд, J=8,0, 1,6 Гц, 2H), 7,03 (дд, J=8,0, 4,7 Гц, 2H), 4,31 (м, 4H), 3,14 (с, 3H), 2,44 (м, 2H), 2,11 (м, 4H), 1,84 (м, 4H), 1,25 (м, 4H), 0,98 (м, 7H); MS (ES) m/z 525 (M+H+). Соединение 11a (12 мг, 0,023 ммоль) преобразовывали в соединение 21 (6 мг, 50%) с использованием способа, описанного для получения соединения 20. Соединение 21 выделяли в виде оранжевого твердого вещества: 1H ЯМР (400 МГц, CD3OD) δ 8,27 (дд, J=4,7, 1,4 Гц, 2H), 7,62 (с, 2H), 7,60 (дд, J=7,7, 1,5 Гц, 2H), 7,03 (дд, J=8,0, 4,7 Гц, 2H), 4,30 (м, 4H), 2,44 (кв, J=7,1 Гц, 2H), 2,11 (м, 4H), 1,83 (м, 4H), 1,26 (м, 4H), 0,98 (м, 7H); MS (ES) m/z 511 (M+H+).
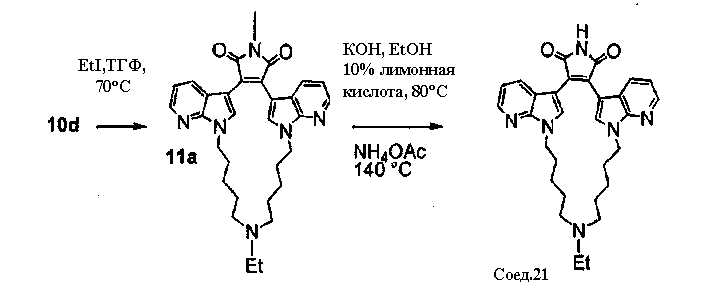
Пример 12
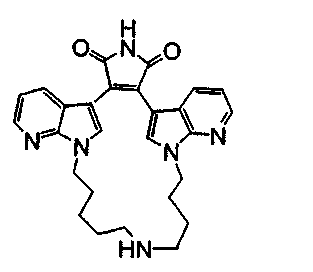
соединение 22
6,7,8,9,10,11,12,13,14,15-декагидро-22H-5,25:16,21-диметено-5H-дипиридо[2,3m:3',2'-с]пирроло[3,4-p][1,6,12]триазациклоэйкозин-22,24(23H)-дион (соединение 22)
Смесь 2,3-дихлормалеинового ангидрида - соединения 12a (1,02 г, 6,10 ммоль), 2,4-диметоксибензиламина - соединения 12b (1,02 г, 6,10 ммоль), в ледяной уксусной кислоте (18 мл) нагревали при 80°C в течение 5 часов. Смесь охлаждали до 20°C, концентрировали при пониженном давлении и разбавляли CH2Cl2 (50 мл). Реакционную смесь последовательно промывали водой (15 мл) и 2 M водным Na2CO3 (15 мл), затем водой (15 мл) и насыщенным раствором соли (15 мл). После концентрирования объединенных органических фаз остаток фильтровали короткий слой SiO2 (элюирование CH2Cl2), получая соединение 12c (1,42 г, 74%) в виде светло-коричневого твердого вещества: 1H ЯМР (300 МГц, CDCl3) δ 7,20 (д, J=8,7 Гц, 1H), 6,44 (д, J=2,3 Гц, 1H), 6,42 (с, 1H), 4,72 (с, 2H), 3,79 (с, 3H), 3,78 (с, 3H). Смесь соединения lb (500 мг, 1,31 ммоль), соединения 12c (180 мг, 0,57 ммоль), PdCl2(PPh3)2 (80 мг, 0,11 ммоль) и LiCl (240 мг, 8,6 ммоль) в толуоле (9,0 мл) нагревали при 100°C в течение 20 часов. После удаления растворителя при пониженном давлении остаток сухим образом загружали на силикагель (элюирование смесью EtOAc/гексан), получая соединение 12d (160 мг, 58%) в виде оранжево-красного твердого вещества: 1H ЯМР (300 МГц, ДМСО-d6) δ 12,30 (с, 2H), 8,12 (д, J=4,6 Гц, 2H), 7,93 (д, J=2,8 Гц, 2H), 7,08 (м, 3H), 6,73 (дд, J=8,0, 4,7 Гц, 2H), 6,58 (д, J=2,1 Гц, 1H), 6,48 (д, J=8,4 Гц, 1H), 4,68 (с, 2H), 3,82 (с, 3H), 3,74 (с, 3H); MS (ES) m/z 480 (M+H+).
Смесь 8-валеролактона - соединения 12e (1,7 мл, 18,3 ммоль), и 4-амино-1-бутанола - соединения 12f (1,7 мл, 18,3 ммоль), в м-ксилоле (50 мл) нагревали при 120 °C в течение 20 часов. Смесь охлаждали до 20° C и нижний слой отделяли от верхнего ксилольного слоя и концентрировали при пониженном давлении, получая неочищенный продукт - соединение 12g (3,50 г, 99%). Раствор неочищенного соединения 12g (1,91 г, 10,1 ммоль) в ТГФ (50 мл) нагревали до кипения с обратным холодильником. Боран-диметилсульфидный комплекс (2 M в ТГФ, 40,0 ммоль) добавляли по каплям с помощью капельной воронки. После завершения прибавления смесь нагревали при кипении с обратным холодильником еще в течение одного часа, затем охлаждали до 20°C и гасили MeOH (4,0 мл). Добавляли хлористый водород (1 M в Et2О, 12,0 ммоль). Реакционную смесь затем перемешивали при 20°C в течение 10 минут и концентрировали при пониженном давлении, получая неочищенную соль диола - соединение 12h. Соединение 12h затем смешивали с MeOH (40 мл), Et3N (5,7 мл, 40,4 ммоль) и Boc2О (2,7 г, 12,1 ммоль).
Реакционную смесь нагревали при кипении с обратным холодильником в течение 3 часов, затем охлаждали до 20°C, концентрировали и помещали в CH2Cl2 (40 мл). Продукт быстро промывали холодной 1н HCl, сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование EtOAc) давала соединение 12i (1,90 г, 70%) в виде бесцветного масла: 1H ЯМР (300 МГц, CDCl3) δ 3,67 (м, 4H), 3,18 (м, 4H), 1,60 (м, 10H), 1,45 (с, 9H); MS (ES) m/z 298 (M+Na). Раствор соединения 12i (1,90 г, 6,91 ммоль) в CH2Cl2 (20 мл) охлаждали на ледяной бане, затем добавляли пиридин (2,2 мл, 27,6 ммоль) c последующим добавлением MsCl (2,1 мл, 27,6 ммоль). Реакционную смесь перемешивали при 20°C в течение 1,5 часов, разбавляли Et2О (15 мл) и промывали холодной 5%-ной HCl и 5%-ным NaOH. Органическую фазу сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией на силикагеле (элюирование смесью гексан/EtOAc) давала бисмезилатное соединение 12j (2,40 г, 82%) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 4,24 (м, 4H), 3,19 (м, 4H), 3,01 (с, 3H), 3,00 (с, 3H), 1,75 (м, 4H), 1,64 (м, 2H), 1,56 (м, 2H), 1,45 (с, 9H), 1,41 (м, 2H); MS (ES) m/z 454 (M+Na). Смесь соединения 12d (38 мг, 0,079 ммоль) и Cs2CO3 (300 мг, 0,92 ммоль) в ДМФ (12 мл) нагревали до 70° C. Раствор бисмезилатного соединения 12j (60 мг, 0,14 ммоль) в ДМФ (2 мл) добавляли с помощью шприцевого насоса в течение 1 часа. После завершения прибавления смесь перемешивали при 70° C в течение 22 часов, охлаждали до 20°C, гасили насыщенным водным раствором хлорида аммония (30 мл) и разбавляли EtOAc (50 мл). Органическую фазу отделяли, промывали водой (3 × 20 мл) и насыщенным раствором соли (15 мл). Неочищенный продукт затем сушили (Na2SO4), концентрировали и хроматографировали на колонке с силикагелем (элюирование смесью гексан/EtOAc), получая соединение 12k (27 мг, 48%) в виде оранжевого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,40 (дд, J=4,8, 1,5 Гц, 2H), 8,29 (м, 2H), 7,78 (с, 1H), 7,18 (дд, J=8,0, 4,7 Гц, 2H), 7,10 (с, 1H), 6,85 (м, 1H), 6,46 (с, 1H), 6,43 (д, J=2,4 Гц, 1H), 4,85 (с, 2H), 4,44 (м, 2H), 4,14 (м, 2H), 3,86 (с, 3H), 3,78 (с, 3H), 3,18 (м, 2H), 2, 90 (м, 2H), 2,56 (м, 2H), 1,90 (м, 2H), 1,64 (м, 2H), 1,39 (с, 9H), 1,13 (м, 2H), 0,74 (м, 2H); MS (ES) m/z 719 (M+H+). К раствору соединения 12k (27 мг, 0,037 ммоль) в CH2Cl2 (2 мл) добавляли ТФУК (1,0 мл). Реакционную смесь перемешивали при 20°C в течение 30 минут. Осторожно добавляли гидроксид аммония для доведения pH смеси до 10. После экстракции EtOAc (3×10 мл), органические слои объединяли, промывали водой (10 мл) и насыщенным раствором соли (5 мл), затем сушили (Na2SO4) и концентрировали, получая соединение 12l (22 мг, 100%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD) δ 8,27 (м, 2H), 7,77 (д, J=8,0 Гц, 1H), 7,68 (д, J=8,0 Гц, 1H), 7,61 (с, 1H), 7,52 (с, 1H), 7,13 (д, J=8,3 Гц, 1H), 7,07 (м, 2H), 6,53 (с, 1H), 6,45 (д, J=8,5 Гц, 1H), 4,77 (с, 2H), 4,26 (м, 4H), 3,84 (с, 3H), 3,83 (с, 3H), 2,44 (т, J=7,1 Гц, 2H), 2,15 (т, J=6,8 Гц, 2H), 1,78 (м, 4H), 1,31 (м, 2H), 1,20 (м, 2H), 1,01 (м, 2H); MS (ES) m/z 619 (M+H+).
К раствору соединения 12l (5 мг, 0,008 ммоль) в CH2Cl2 (1,0 мл) добавляли метансульфоновую кислоту (0,5 мл). Реакционную смесь перемешивали при 20°C в течение 6 часов, затем осторожно добавляли гидроксид аммония, для того чтобы сделать смесь основной. Смесь экстрагировали EtOAc (2 x 10 мл) и органические слои объединяли, промывали водой (5 мл) и насыщенным раствором соли (5 мл), затем сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией на силикагеле (элюирование смесью MeOH/CH2Cl2/NH4OH), получая соединение 22 (5 мг, 100%) в виде оранжевого твердого вещества: lH ЯМР (300 МГц, CDCl3) δ 8,35 (м, 2H), 7,96 (д, J=7,9 Гц, 1H), 7,55 (с, 1H), 7,53 (д, J=8,1 Гц, 1H), 7,42 (с, 1H), 7,09 (дд, J=8,0, 4,7 Гц, 1H), 6,97 (дд, J=8,0, 4,7Гц, 1H), 4,33 (т, J=6,0 Гц, 2H), 4,22 (т, J=6,6 Гц, 2H), 2,45 (т, J=6,4 Гц, 2H), 2,32 (т, J=6,3 Гц, 2H), 1,87 (м, 2H), 1,73 (м, 2H), 1,35 (м, 2H), 1,25 (м, 2H), 1,13 (м, 2H); MS (ES) m/z 469 (M+H+).
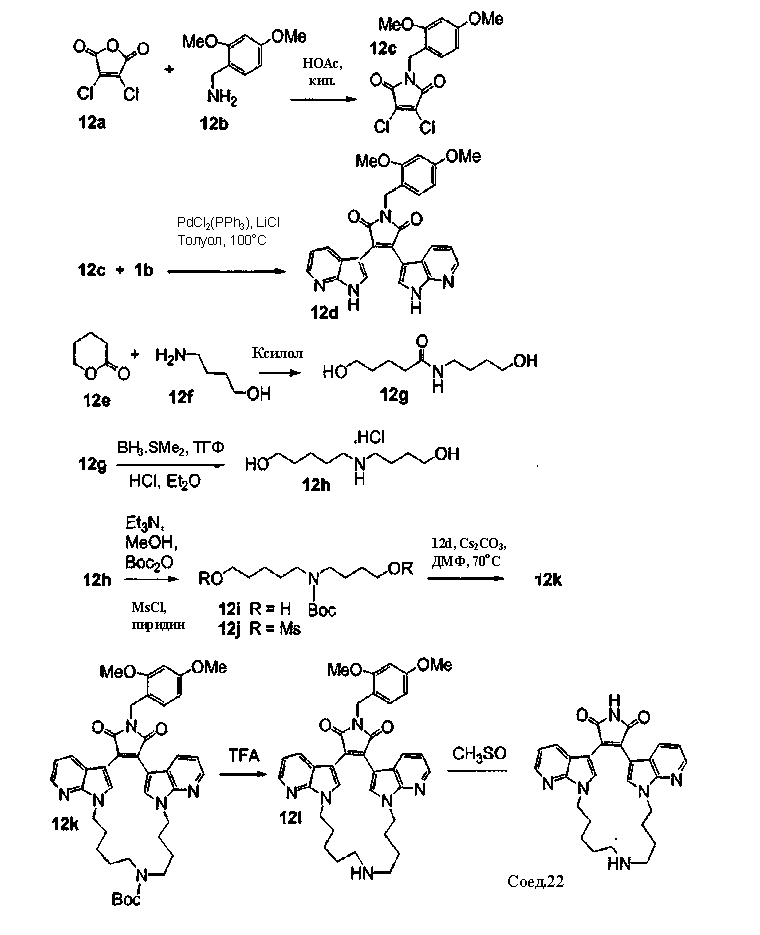
Пример 13
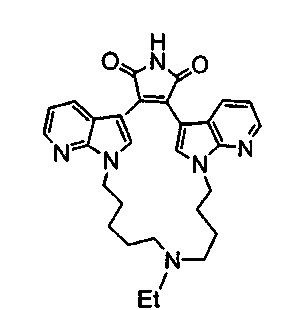
соединение 23
10-этил-6,7,8,9,10,11,12,13,14,15-декагидро-22H-5,25:16,21-диметено-5H-дипиридо[2,3-м:3',2'-с]пирроло[3,4-p][1,6,12]триазациклоэйкозин-22,24(23H)-дион (соединение 23)
Смесь соединения 12l (17 мг, 0,027 ммоль), ТГФ (0,8 мл) и иодэтана (5 мкл, 0,062 ммоль) нагревали при кипении с обратным холодильником в течение двух дней, затем охлаждали и концентрировали при пониженном давлении. Продукт очищали колоночной хроматографией (элюирование смесью MeOH/CH2Cl2), получая соединение 13a (6 мг, 35%) в виде оранжевого твердого вещества: 1H ЯМР (400 МГц, CD3OD) δ 8,32 (дд, J=4,7, 1,5 Гц, 1H), 8,25 (м, 2H), 7,85 (с, 1H), 7,32 (с, 1H), 7,27 (д, J=7,8 Гц, 1H), 7,22 (дд, J=8,0, 4,8 Гц, 1H), 7,14 (д, J=8,4 Гц, 1H), 6,93 (дд, J=8,0, 4,8 Гц, 1H), 6,54 (д, J=2,3 Гц, 1H), 6,46 (дд, J=8,4, 2,3 Гц, 1H), 4,79 (с, 2H), 4,45 (м, 2H), 4,15 (м, 2H), 3,84 (с, 3H), 3,77 (с, 3H), 2,83 (м, 4H), 2,27 (м, 2H), 1,99 (м, 2H), 1,65 (т, J=6,4 Гц, 2H), 1,27 (м, 4H), 1,15 (м, 2H), 0,88 (т, J=7,3 Гц, 3H); MS (ES) m/z 647 (M+H+). К раствору соединения 13a (6 мг, 0,009 ммоль) в CH2Cl2 (1,0 мл) добавляли метансульфоновую кислоту (0,2 мл). После перемешивания смеси при 20°C в течение 2 часов осторожно добавляли гидроксид аммония для того, чтобы сделать смесь основной. Реакционную смесь затем экстрагировали EtOAc (2 × 10 мл) и органические слои объединяли, промывали водой (5 мл) и насыщенным раствором соли (5 мл), затем сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией на силикагеле (элюирование смесью MeOH/CH2Cl2/NH4OH), получая соединение 23 (4 мг, 90%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CDCl3) δ 8,35 (м, 2H), 7,90 (м, 1H), 7,71 (м, 1H), 7,54 (с, 1H), 7,35 (с, 1H), 7,07 (дд, J=7,8, 4,9 Гц, 1H), 7,00 (дд, J=7,3, 4,7 Гц, 1H), 4,24 (м, 4H), 2,37 (м, 2H), 2,30 (м, 2H), 2,04 (м, 2H), 1,73 (т, J=6,2 Гц, 4H), 1,24 (м, 4H), 0,95-1,02 (м, 5H); MS (ES) m/z 497 (M+H+).
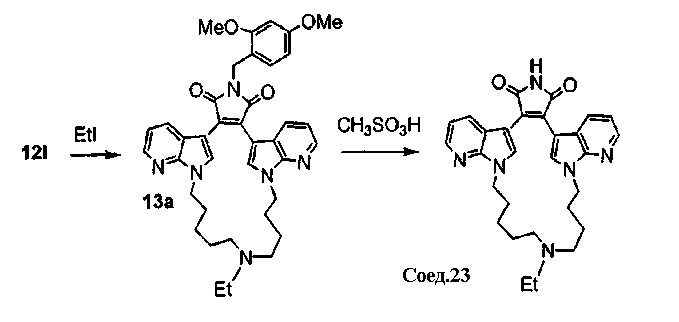
Пример 14
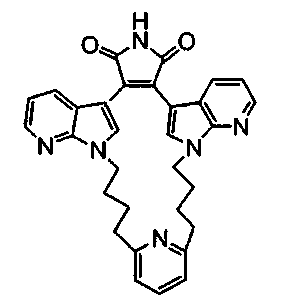
соединение 24
7,8,9,15,16,17,18-гептагидро-6H,25H-5,28:19,24-диметено-10,14-нитрилодипиридо[2,3-b:3',2'-h]пирроло[3,4-e][1,10]диазациклотрикозин-25,27(26H)-дион (соединение 24)
При - 78° C BuLi (1,6 M в гексане, 10,3 ммоль) добавляли к раствору 2,6-лутидина - соединения 14a (0,5 мл, 4,30 ммоль), в ТГФ (15 мл). Раствор, имеющий глубокий красный цвет, перемешивали при -78°C в течение 30 минут, затем добавляли 3-бромпропокси-трет-бутилдиметилсилан - соединение 14b (2,4 мл, 10,3 ммоль). Реакционную смесь нагревали до температуры окружающей среды в течение 18 часов, гасили водой (2 мл) и концентрировали при пониженном давлении. Остаток разбавляли водой (15 мл) и экстрагировали гексаном (3 × 20 мл). Органические экстракты объединяли, сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование смесью гексан/EtOAc) давала соединение 14c (0,55 г, 30 %) в виде бесцветного масла: 1H ЯМР (300 МГц, CDCl3) δ 7,45 (м, 1H), 6,91 (м, 2H), 3,59 (т, J=6,4 Гц, 4H), 2,73 (м, 4H), 1,70 (м, 4H), 1,57 (м, 4H), 0,85 (с, 18H), 0,00 (с, 12H); MS (ES) m/z 452 (M+H+). К смеси соединения 14c (0,55 г, 1,20 ммоль) в ТГФ (3,0 мл) добавляли TBAF (1 M в ТГФ, 2,60 ммоль). Реакционную смесь перемешивали при 20°C в течение 3 часов, затем концентрировали при пониженном давлении. Очистка хроматографией на силикагеле (элюирование EtOAc, содержащим 5% Et3N)) давала соединение 14d (254 мг, 95%) в виде бесцветного масла: 1H ЯМР (300 МГц, CDCl3) δ 7,53 (т, J=7,6 Гц, 1H), 6,98 (д, J=7,6 Гц, 2H), 3,70 (т, J=6,0 Гц, 4H), 2,83 (т, J=7,4 Гц, 4H), 1,85 (м, 4H), 1,64 (м, 4H); MS (ES) m/z 224 (M+H+).
Триэтиламин (0,95 мл, 6,84 ммоль) при 0°C добавляли к раствору диолового соединения 14d (254 мг, 1,14 ммоль) в CH2Cl2 (4 мл) с последующим добавлением MsCl (0,35 мл, 4,56 ммоль). Реакционную смесь перемешивали при 20°C в течение 1,5 часов, разбавляли диэтиловым эфиром (20 мл) и промывали 5%-ной HCl (5 мл). Слои разделяли и органическую фазу отбрасывали. Водную фазу разбавляли CH2Cl2 (10 мл) и подщелачивали 5%-ным NaOH (5 мл). Смесь экстрагировали CH2Cl2 (3 × 20 мл) и органические экстракты объединяли, промывали насыщенным раствором соли (10 мл), затем сушили (Na2SO4) и концентрировали. Очистка хроматографией (элюирование смесью гексан/EtOAc) давала соединение 14e (162 мг, 38%) в виде светло-коричневой жидкости: MS (ES) m/z 380 (M+H+). Смесь соединения ld (74 мг, 0,21 ммоль), Cs2CO3 (290 мг, 0,89 ммоль) и ДМФ (30 мл) нагревали до 100°C. В течение 2 часов добавляли с помощью шприцевого насоса раствор соединения 14e (100 мг, 0,26 ммоль) в ДМФ (7 мл). После завершения добавления смесь перемешивали при 20°C в течение 18 часов, затем гасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом (3 × 50 мл). Органические экстракты объединяли, промывали водой (3 × 30 мл) и насыщенным раствором соли (30 мл), затем сушили (Na2SO4) и концентрировали. Остаток очищали колоночной хроматографией (элюирование смесью ацетон/хлористый метилен) для выделения соединения 14e (21 мг) и получая соединение 14f (14 мг, 22%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD) δ 8,14 (д, J=4,6 Гц, 1H), 7,54-7,73 (м, 8H), 6,97 (м, 2H), 4,30 (т, J=5,6 Гц, 4H), 3,14 (с, 3H), 2,65 (м, 4H), 1,73 (м, 4H), 1,31 (м, 4H); MS (ES) m/z 531 (M+H+). Смесь соединения 14f (14 мг, 0,026 ммоль), KOH (360 мг, 6,43 ммоль) и этанола (3 мл) нагревали при кипении с обратным холодильником в течение двух дней, охлаждали до 20°C и затем растворитель удаляли при пониженном давлении. Остаток растворяли в воде (5 мл), подкисляли 10%-ной лимонной кислотой, перемешивали при 20°C в течение 10 минут и экстрагировали хлористым метиленом (3 × 20 мл). Органические экстракты объединяли, сушили (Na2SO4) и концентрировали. Остаток смешивали с ацетатом аммония (2,5 г), нагревали при 140° C в течение 3 часов и охлаждали до 20°C. Добавляли воду (10 мл), затем раствор подщелачивали 20%-ным водным NaOH и экстрагировали EtOAc (3 × 20 мл). Органические экстракты объединяли, промывали водой (20 мл) и насыщенным раствором соли (10 мл), затем сушили (Na2SO4) и концентрировали. Продукт очищали колоночной хроматографией (элюирование смесью ацетон/CH2Cl2), получая соединение 24 (4 мг, 30%) в виде желтого твердого вещества: 1H ЯМР (300 МГц, CDCl3) δ 8,28 (д, J=4,0 Гц, 2H), 7,68 (м, 2H), 7,43-7,54 (м, 3H), 6,99 (дд, J=7,9, 4,7 Гц, 2H), 6,87 (д, J=7,4 Гц, 2H), 4,28 (т, J=6,2 Гц, 4H), 2,65 (м, 4H), 1,81 (м, 4H), 1,46 (м, 4H); MS (ES) m/z 517 (M+H+).
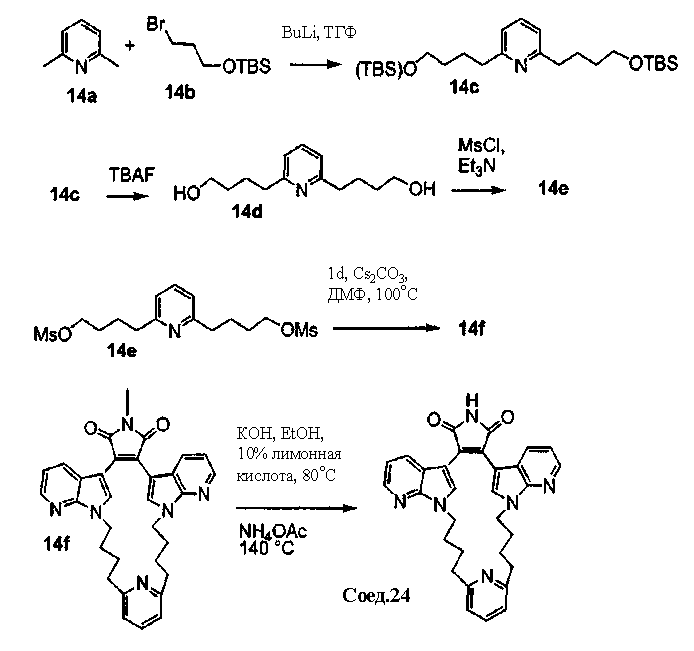
Пример 15
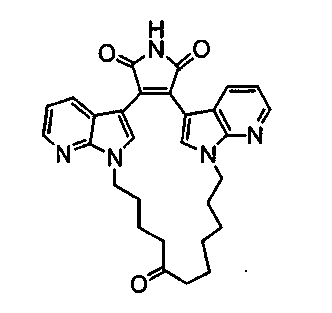
соединение 25
7,8,9,10,11,13,14,15,16-нонагидро-6H,23H-5,26:17,22-диметенодипиридо[2,3-b:3',2'h]пирроло[3,4-e][1,10]диазациклогенэйкозин-12,23,25(24Н)-трион (соединение 25)
Смесь 4-оксо-1,9-нонадикарбоновой кислоты - соединения 15a (240 мг, 1,04 ммоль), абсолютного этанола (3,0 мл) и концентрированной HCl (1,0 мл) нагревали при кипении с обратным холодильником в течение 20 часов. Смесь охлаждали до 20°C, разбавляли EtOAc (25 мл) и нейтрализовали насыщенным водным раствором NaHCO3. Органический слой отделяли, промывали водой (5 мл) и насыщенным раствором соли (5 мл), затем сушили (Na2SO4) и концентрировали, получая соединение 15b (270 мг, 91%) в виде бесцветного масла: 1H ЯМР (300 МГц, CDCl3) δ 4,09-4,16 (м, 4H), 2,10-2,50 (м, 10H), 1,89 (кв, J=7, 0 Гц, 2H), 1,54-1,68 (м, 4H), 1,25 (т, J=7,1 Гц, 6H); MS (ES) m/z 309 (M+Na). Смесь соединения 15b (270 мг, 0,94 ммоль), этиленгликоля (0,24 мл, 4,30 ммоль), триэтилортоформиата (0,48 мл, 2,89 ммоль) и моногидрата TsOH (14 мг, 0,074 ммоль) нагревали при кипении с обратным холодильником в течение 45 минут, охлаждали до 20°C, затем разбавляли насыщенным водным раствором NaHCO3 и экстрагировали диэтиловым эфиром (2 x 20 мл). Органические слои объединяли, промывали опять NaHCO3, сушили (Na2SO4) и концентрировали, получая соединение 15c (310 мг, 100%) в виде бесцветного масла: 1H ЯМР (300 МГц, CDCl3) δ 4,08-4,16 (м, 4H), 3,92 (с, 4H), 2,26-2,33 (м, 4H), 1,58-1,72 (м, 8H), 1,30-1,35 (м, 4H), 1,25 (т, J=7,2 Гц, 6H); MS (ES) m/z 353 (M+Na). Соединение 15c (330 мг, 0,94 ммоль) в ТГФ (5,0 мл) добавляли к раствору LiAlH4 в ТГФ (1,0 M, 1,50 ммоль). После перемешивания смеси при 20°C в течение 2 часов, ее гасили водой и экстрагировали диэтиловым эфиром (3 × 20 мл), органические слои объединяли, сушили (Na2SO4) и концентрировали, получая соединение 15d (210 мг, 91%) в виде бесцветной жидкости: 1H ЯМР (300 МГц, CDCl3) δ 3,93 (с, 4H), 3,62-3,67 (м, 4H), 1,341,67 (м, 16H); MS (ES) m/z 269 (M+Na). Смесь соединения 15d (210 мг, 0,85 ммоль), воды (3,4 мл), H2SO4 (6 M, 0,5 мл) и ацетона (0,3 мл) нагревали при кипении с обратным холодильником в течение 1,5 часов. После концентрирования смеси остаток экстрагировали CH2Cl2 (3 × 15 мл). Органические экстракты объединяли, сушили (Na2SO4) и концентрировали, получая соединение 15e (121 мг, 71%) в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 3,64 (с, 2H), 3,63 (т, J=6,5 Гц, 4H), 2,39-2,46 (м, 4H), 1,25-1,78 (м, 12H); MS (ES) m/z 225 (M+Na). Триэтиламин (0,41 мл, 2,97 ммоль) и MsCl (0,23 мл, 2,97 ммоль) при 0°C добавляли к раствору соединения 15e (120 мг, 0,59 ммоль) в хлористом метилене (2,5 мл). Реакционную смесь перемешивали при 20°C в течение 2 часов и гасили водой. Слои разделяли и водную фазу экстрагировали CH2Cl2 (2 × 20 мл). Органические фазы объединяли, промывали последовательно 5 мл 5%-ной HCl, водой и 5%-ным NaHCO3, затем сушили (Na2SO4) и концентрировали, получая соединение 15f (169 мг, 80%): 1H ЯМР (300 МГц, CDCl3) δ 4,20-4,25 (м, 4H), 3,64 (м, 2H), 3,01 (с, 3H), 3,00 (с, 3H), 2,34-2,49 (м, 4H), 1,32-1,78 (м, 10H); MS (ES) m/z 381 (M+Na).
Смесь соединения 1d (55 мг, 0,13 ммоль), Cs2CO3 (370 мг, 1,13 ммоль) и ДМФ (25 мл) нагревали до 100°C. Добавляли с помощью шприцевого насоса в течение 1,5 часов раствор соединения 15f (84 мг, 0,23 ммоль) в ДМФ (5 мл). После завершения добавления смесь перемешивали при 20°C в течение 2 часов, гасили насыщенным раствором хлорида аммония (30 мл) и экстрагировали хлористым метиленом (2 × 30 мл). Органические фазы объединяли, промывали водой (3 × 20 мл) и насыщенным раствором соли (30 мл), затем сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование смесью EtOAc/гексан) давала соединение 15g (11 мг, 16%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD) δ 8,24-8,30 (ддд, J= 6,0, 4,7, 1,2 Гц, 2H), 7,82-7,85 (дд, J=8,0, 1,3 Гц, 1H), 7,80 (с, 1H), 7,58 (с, 1H), 7,40 (дд, J=8,1, 1,3 Гц, 1H), 7,09 (дд, J=8,0, 4,7 Гц, 1H), 6,96 (дд, J=8,1, 4,8 Гц, 1H), 4,34 (т, J=5,8 Гц, 2H), 4,20 (т, J=6,2 Гц, 2H), 3,14 (с, 3H), 2,32 (т, J=7,1 Гц, 2H), 2,11 (т, J=6,8 Гц, 2H), 1,69-1,84 (м, 4H), 1,37-1,41 (м, 2H), 1,18-1,31 (м, 2H), 1,07-1,16 (м, 2H), 0,90-1,04 (м, 2H); MS (ES) m/z 510 (M+H+). Соединение 15g (12 мг, 0,023 ммоль) превращали в соединение 25 (2 мг, 10%) с использованием способа, описанного для получения соединение 24. 1Н ЯМР (300 МГц, CDCl3) δ 8,37 (д, J=5,0 Гц, 1H), 8,32 (д, J=4,6 Гц, 1H), 7,84 (д, J=8,0 Гц, 1H), 7,70 (с, 1H), 7,49 (с, 1H), 7,42 (м, 1H), 7,08 (дд, J=8,0, 4,6 Гц, 1H), 6,95 (дд, J=8,0, 4,5 Гц, 1H), 4,34 (т, J=6,1 Гц, 2H), 4,20 (т, J=6,2 Гц, 2H), 2,30 (т, J=7,1 Гц, 2H), 2,12 (т, J=6,7 Гц, 2H), 1,73-1,84 (м, 4H), 1,34-1,41 (м, 2H), 1,10-1,22 (м, 4H), 0,85-1,08 (м, 2H); MS (ES) m/z 496 (M+H+).
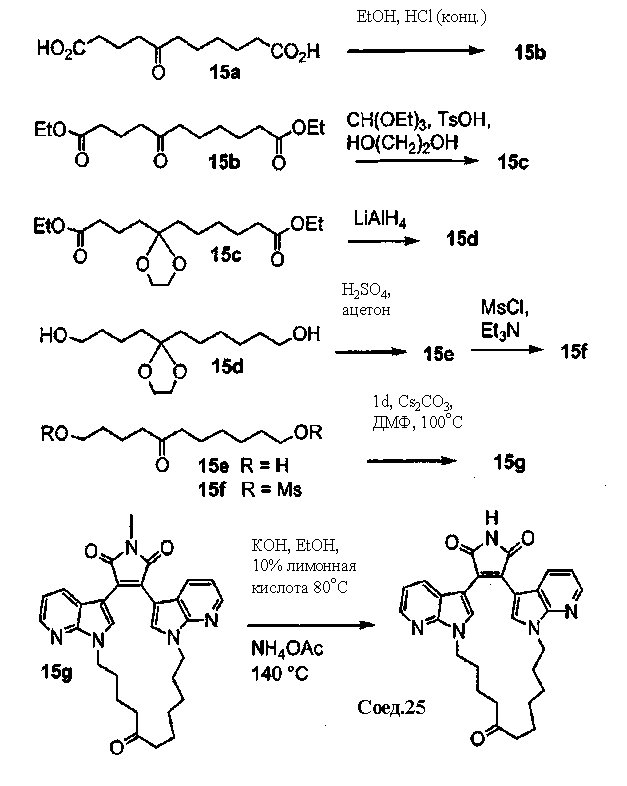
Пример 16
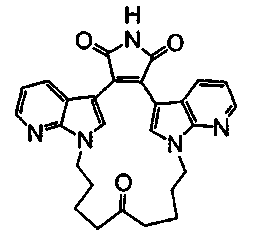
соединение 26
7,8,9,11,12,13,14-гептагидро-6H,21H-5,24:15,20-диметенодипиридо[2,3-b:3',2'h]пирроло[3,4-e][1,10]диазациклононадецин-10,21,23(22H)-трион (соединение 26)
Смесь диэтил 5-оксоазелата - соединения 16a (318 мг, 1,23 ммоль), моногидрата TsOH (19 мг, 0,10 ммоль), этиленгликоля (0,35 мл, 6,20 ммоль) и триэтилортоформиата (0,62 мл, 3,72 ммоль) нагревали при кипении с обратным холодильником в течение 1 часа, охлаждали до 20°C, затем разбавляли насыщенным водным раствором NaHCO3 (5 мл) и экстрагировали диэтиловым эфиром (3 × 15 мл). Органические слои объединяли, промывали насыщенным раствором NaHCO3, сушили (Na2SO4) и концентрировали, получая неочищенный продукт соединения 16b (370 мг, 100%): MS (ES) m/z 325 (M+Na). Раствор неочищенного соединения 16b (370 мг, 1,23 моль) в ТГФ (6 мл) добавляли к LiAlH4 (1 M в ТГФ, 2,90 ммоль). Реакционную смесь перемешивали при 20° C в течение 2 часов и добавляли воду для гашения избытка LiAlH4. Раствор затем экстрагировали диэтиловым эфиром (3 x 20 мл). Органические экстракты сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали колоночной хроматографией (элюирование EtOAc), получая соединение 16c (168 мг, 63%) в виде бесцветного масла: 1H ЯМР (300 МГц, CDCl3) δ 3,94 (с, 4H), 3,65 (т, J=6,3 Гц, 4H), 1,43-1,67 (м, 12H); MS (ES) m/z 241 (M+Na). Триэтиламин (0,48 мл, 3,45 ммоль) и MsCl (0,27 мл, 3,45 ммоль) при 0°C добавляли к раствору соединения 16c (151 мг, 0,69 ммоль) в хлористом метилене (2 мл). Реакционную смесь перемешивали при 20°C в течение 3 часов и гасили водой, получая бисмезилатное соединение 16d. Слои разделяли и органическую фазу промывали последовательно 5%-ной HCl, водой, 5%-ным NaHCO3 и насыщенным раствором соли, затем сушили над Na2SO4 и концентрировали. Очистка колоночной хроматографией (элюирование смесью EtOAc/гексан) давала кетон - соединение 16e (192 мг, 84%) в виде светло-коричневого маслянистого твердого вещества: 1H ЯМР (300 МГц, CDCl3) δ 4,21 (м, 4H), 3,01 (с, 6H), 2,48 (м, 2H), 1,43-1,77 (м, 10H); MS (ES) m/z 353 (M+Na).
Раствор бисмезилатного кетона - соединения 16e (24 мг, 0,072 ммоль), в ДМФ (3 мл) при 70° C добавляли по каплям к смеси соединения 12d (19 мг, 0,040 ммоль), Cs2CO3 (160 мг, 0,50 ммоль) и ДМФ (6 мл). После перемешивания при 70° C в течение 4 часов смесь охлаждали на ледяной бане, гасили водным раствором NH4Cl и экстрагировали EtOAc (2 × 30 мл). Органические экстракты объединяли, промывали водой (3 × 15 мл) и насыщенным раствором соли (15 мл), затем сушили (Na2SO4) и концентрировали, получая неочищенное соединение 16f. Неочищенное соединение 16f смешивали с хлористым метиленом (1 мл), затем добавляли метансульфоновую кислоту (0,3 мл). Реакционную смесь перемешивали при 20° C в течение нескольких часов до тех пор, пока соединение 16f больше не обнаруживалось с использованием масс-спектрометрии. Реакционную смесь охлаждали на ледяной бане, осторожно гасили гидроксидом аммония и экстрагировали EtOAc (3 × 15 мл). Экстракты промывали водой (10 мл) и насыщенным раствором соли (10 мл), затем сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали колоночной хроматографией на силикагеле (элюирование смесью MeOH/CH2Cl2), получая соединение 16f (12 мг, 67% из соединения 16e) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CDCl3) δ 8,34 (д, J=3,9 Гц, 2H), 7,80 (д, J=7,9 Гц, 2H), 7,63 (с, 2H), 7,05 (дд, J=8,0, 4,7 Гц, 2H), 4,26 (т, J=6,0 Гц, 4H), 2,10 (т, J=7,0 Гц, 4H), 1,71-1,80 (м, 4H), 1,32-1,39 (м, 4H); MS (ES) m/z 468 (M+H+).
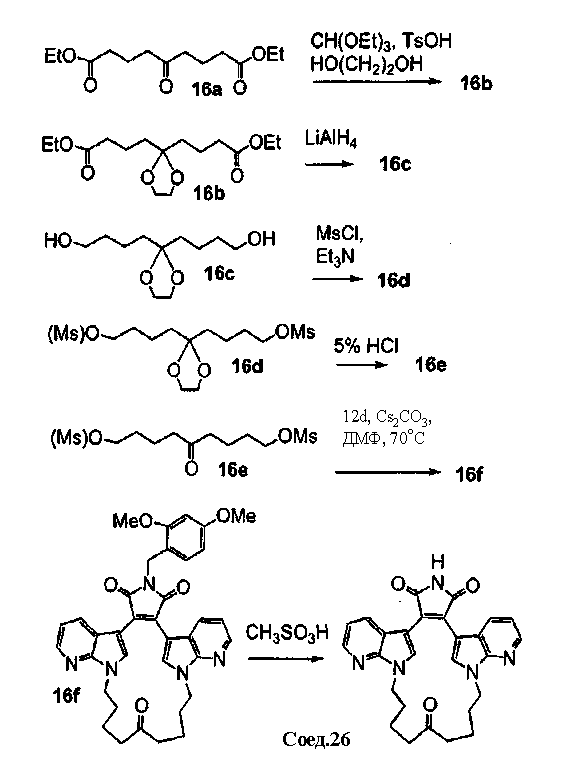
Пример 17
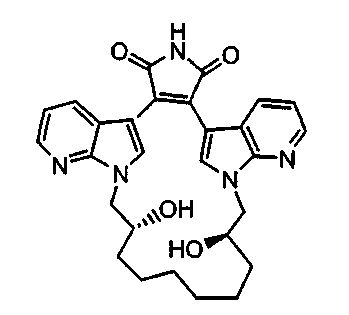
соединение 27
6,7,8,9,10,11,12,13,14,15-декагидро-7,14-дигидрокси-(7R,14R)-22H-5,25:16,21-диметено-5H-дипиридо[2,3-b:3',2'-h]пирроло[3,4-e][1,10]диазациклоэйкозин-22,24(23Н)-дион (соединение 27)
Смесь соединения ld (116 мг, 0,34 ммоль), Cs2CO3 (554 мг, 1,70 ммоль) и ДМФ (68 мл) нагревали до 60° C и добавляли по каплям раствор (R,R)-(+)-1,2,9,10-диэпоксидеканового соединения 17a (0,096 мл, 0,54 ммоль) в ДМФ (2 мл). Реакционную смесь перемешивали при 60° C в течение 5 часов, охлаждали до 20 °C, гасили насыщенным водным раствором NH4Cl (20 мл) и экстрагировали EtOAc (3 × 50 мл). Органические слои объединяли, промывали водой (3 × 15 мл) и насыщенным раствором соли (15 мл), затем сушили (Na2SO4) и концентрировали. Остаток хроматографировали на силикагеле (элюирование смесью ацетон/хлористый метилен), получая соединение 17b (50 мг, 34%) в виде оранжевого твердого вещества: MS (ES) m/z 514 (M+H+). К смеси соединения 17b (47 мг, 0,092 ммоль) в ДМФ (18 мл) добавляли NaH (60% в минеральном масле, 21 мг, 0,52 ммоль) в ДМФ (10 мл). Реакционную смесь перемешивали при 100°C в течение 20 часов, охлаждали до 20°C, гасили насыщенным водным раствором NH4Cl и разбавляли EtOAc. После отделения слоев, органическую фазу промывали водой (3 × 10 мл) и насыщенным раствором соли (10 мл), затем сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали колоночной хроматографией (элюирование смесью ацетон/хлористый метилен), получая соединение 17c (11 мг, 23%) в виде оранжевого твердого вещества: 1H ЯМР (300 МГц, CD3OD): δ 8,28 (дд, J=4,7, 1,5 Гц, 2H), 7,73 (дд, J=8,0, 1,5 Гц, 2H), 7,53 (с, 2H), 7,06 (дд, J=8,0, 4,7 Гц, 2H), 4,44 (м, 2H), 4,09 (м, 2H), 3,93 (т, J=4,8 Гц, 2H), 3,13 (с, 3H), 1,15-1,28 (м, 8H), 0,87-0,89 (м, 4H); MS (ES) m/z 514 (M+H+). Смесь соединения 17c (11 мг, 0,021 ммоль), этанола (2 мл) и 10н KOH (0,1 мл) нагревали при 80°C в течение 18 часов. Реакционную смесь затем концентрировали, разбавляли водой (5 мл), подкисляли 1н HCl до pH 3 и экстрагировали CH2Cl2 (3 × 10 мл). Органические экстракты объединяли, сушили (Na2SO4) и концентрировали. Полученный остаток смешивали с чистым NH4OAc (2 г) и нагревали при 140°C в течение 3 часов. Реакционную смесь охлаждали и разбавляли водой (5 мл), подщелачивали 20%-ным водным NaOH и экстрагировали EtOAc (2 × 15 мл). Органические экстракты промывали водой (15 мл), затем сушили (Na2SO4) и концентрировали. Очистка колоночной хроматографией (элюирование смесью ацетон/хлористый метилен) давала соединение 27 (4 мг, 36%) в виде оранжевого твердого вещества: 1H ЯМР (400 МГц, CDCl3): δ 8,32 (дд, J=4,7, 1,4 Гц, 2H), 7,80 (д, J=7,7 Гц, 2H), 7,39 (с, 2H), 7,08 (дд, J=8,0, 4,8 Гц, 2H), 4,14-4,27 (м, 4H), 3,94 (с, ушир., 2H), 1,17-1,20 (т, J=6,6 Гц, 4H), 0,99 (м, 4H), 0,83-0,89 (м, 4H); MS (ES) m/z 500 (M+H+).
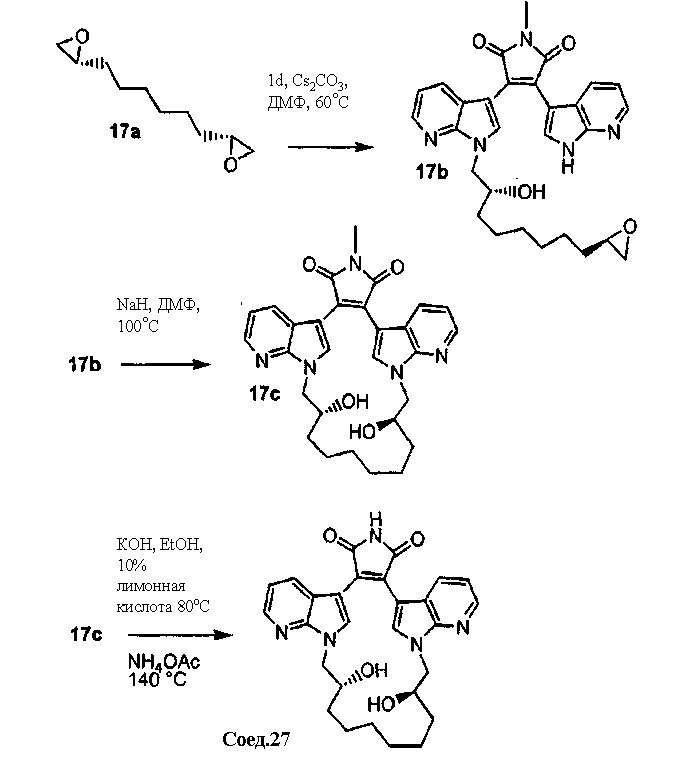
Пример 18
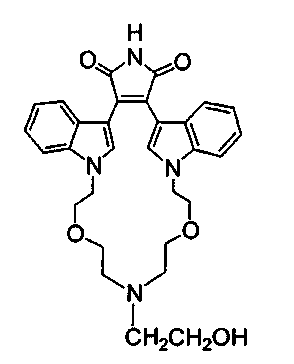
соединение 30
6,7,10,11,12,13,15,16-октагидро-11-(2-гидроксиэтил)-23H-5,26:17,22-диметено-5H,9H-дибензо[k,q]пирроло[3,4-n][1,7,4,10,19]диоксатриазациклогенэйкозин-23,25(24H)-дион (соединение 30)
Смесь соединения 5c (3,00 г, 17,2 ммоль), соединения 7a (5,35 г, 22,4 ммоль) и карбоната цезия (8,41 г, 25,8 ммоль) в ДМФ (70 мл) перемешивали при 70° C в течение 24 часов и затем фильтровали. Фильтрат упаривали в вакууме и остаток разделяли колоночной флэш-хроматографией (CH2Cl2/MeOH, 97:3), получая соединение 18a в виде вязкого масла (1,72 г, 26% выход). 1H ЯМР (CDCl3) δ 7,97 (с, 1H), 7,54 (д, J=7,85 Гц, 1H), 7,32 (д, J=8,16 Гц, 1H), 7,21 (м, 2H), 4,24 (т, J=5,48, 5,50 Гц, 2H), 3,78 (т, J=5,52, 5,40 Гц, 2H), 3,74-3,64 (м, 4H), 3,43 (т, J=5,29, 4,82 Гц, 2H), 0,97 (с, 9H), 0,1 (с, 6H). ES-MS m/z 377 (MH+). К суспензии сложноэфирного соединения 7b (771 мг, 1,9 ммоль) и амидного соединения 18a (500 мг, 1,3 ммоль) в сухом ТГФ (5 мл) в атмосфере азота, предварительно охлажденной до 0°C, добавляли по каплям 1,0 M трет-бутоксид калия в ТГФ (5,2 мл, 5,2 ммоль). Полученную смесь перемешивали при 0°C в течение 1 часа и при комнатной температуре в течение 3 часов, затем добавляли концентрированную HCl (5 мл) и смесь опять перемешивали при комнатной температуре еще в течение 10 минут. Реакционную смесь распределяли между EtOAc (100 мл) и H2O (40 мл), два слоя разделяли и водный слой экстрагировали EtOAc (50 мл). Объединенные экстракты последовательно промывали водой, насыщенным водным раствором NaHCO3 и насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме, получая соединение 18b в виде темного красно-оранжевого твердого вещества (430 мг). ES-MS m/z 504 (MH+).
К раствору неочищенного соединения 18b (430 мг) и Py (пиридин) (403 мг, 5,1 ммоль) в ТГФ (17 мл) добавляли Ms2О (740 мг, 4,25 ммоль). Реакционную смесь перемешивали при 50°C в течение 3 часов и затем реакционную смесь охлаждали до комнатной температуры. Добавляли ТГФ (17 мл) и 1,0н водн. HCl (39 мл), смесь перемешивали при комнатной температуре в течение 10 минут и затем экстрагировали EtOAc (227 мл). Органическую фазу последовательно промывали 1,0н водн. HCl (39 мл), водой и насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме, получая соединение 18c в виде темного красно-оранжевого твердого вещества (500 мг) ES-MS m/z 660 (MH+). Раствор неочищенного соединения 18c (64 мг), DIEA (N,N-диизопропилэтиламин) (50 мг, 0,39 ммоль) и соединения 18d (12 мг, 0,2 ммоль) в ДМФ (13 мл) в запаянной ампуле перемешивали при 90° C в течение 5 часов. Летучие компоненты удаляли в вакууме и остаток разделяли колоночной флэш-хроматографией (CH2Cl2:MeOH:NH4OH 95:3:2), получая целевой продукт соединения 30 в виде красно-оранжевого твердого вещества (10 мг). 1H ЯМР (CD3OD) δ 7,50 (с, 2H), 7,40 (м, 2H), 7,08 (м, 4H), 6,83 (м, 2H), 4,27 (м, 4H), 3,77 (м, 8H), 3,21 (м, 2H). 2,83 (м, 4H), 2,69 (м, 2H). ES-MS m/z 529 (MH+).
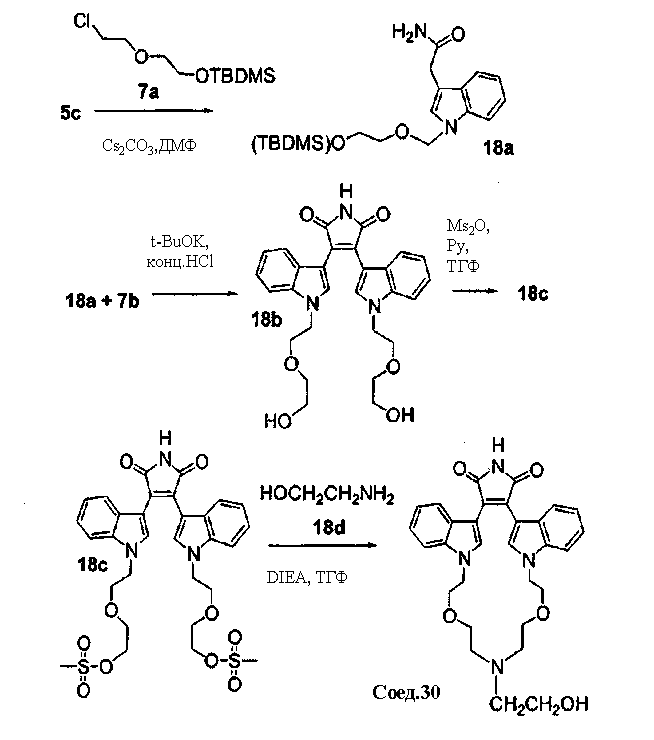
Пример 19
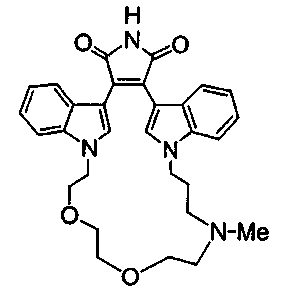
соединение 31
6,7,9,10,12,13,14,15,16,17-декагидро-14-метил-24H-5,27:18,23-диметено-5H-дибензо[l,r]пирроло[3,4-o][1,4,7,11,20]диоксатриазациклодокозин-24,26(25H)-дион (соединение 31)
Смесь соединения 5b (2,50 г, 12,3 ммоль), соединения 19a (6,23 г, 24,6 ммоль) и карбоната цезия (12,02 г, 36,9 ммоль) в ДМФ (50 мл) перемешивали при 75°C в течение 2 часов и затем фильтровали. Фильтрат разбавляли EtOAc (370 мл). Объединенные экстракты последовательно промывали водой и насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме. Остаток разделяли флэш-хроматографией (EtOAc:гексан, 1:9), получая соединение 19b (3,14 г, 68%). 1H ЯМР (CDCl3) δ 8,40-8,36 (м, 1H), 8,31 (с, 1H), 7,38-7,19 (м, 3H), 4,27 (т, J=6,84, 6,82 Гц, 2H), 3,81 (с, 3H), 3,63-3,50 (м, 2H), 2,04-1,96 (м, 2H), 0,87 (с, 9H), 0,01 (с, 6H). ES-MS m/z 376 (MH+). Смесь соединения 5c (2,50 г, 14,3 ммоль), 2-[2-(2-хлорэтокси)этокси]этанола - соединения 19c (4,82 г, 28,6 ммоль), и карбоната цезия (13,98 г, 42,9 ммоль) в ДМФ (58 мл) перемешивали при 78 °C в течение 24 часов. Дополнительно добавляли соединение 19c и реакционную смесь перемешивали в течение 24 часов при 78° C и затем фильтровали. Фильтрат разбавляли EtOAc (430 мл) и объединенные экстракты последовательно промывали водой и насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме. Остаток разделяли флэш-хроматографией (CH2Cl2/MeOH, 93:7), получая соединение 19d (3,60 г, 82%). 1H ЯМР (CDCl3) δ 7,58 (д, J=7,80 Гц, 1H), 7,36-7,30 (м, 1H), 7,26-7,21 (м, 1H), 7,17-7,11 (м, 2H), 4,29 (т, J=5,3, 2H), 3,94-3,79 (м, 2H), 3,69 (с, 2H), 3,59-3,48 (м, 8H). ES-MS m/z 307 (MH+).
К суспензии сложноэфирного соединения 19b (939 мг, 2,5 ммоль) и амидного соединения 19d (520 мг, 1,7 ммоль) в сухом ТГФ (7 мл) в атмосфере азота, предварительно охлажденной до 0°C, добавляли по каплям 1,0 M трет-бутоксид калия в ТГФ (6,8 мл, 6,8 ммоль). Полученную смесь перемешивали при 0° C в течение 1 часа и при комнатной температуре в течение 3 часов и затем добавляли концентрированную HCl (7 мл). Реакционную смесь затем перемешивали при комнатной температуре еще в течение 10 минут и затем распределяли между EtOAc (142 мл) и H2O (57 мл). Два слоя разделяли и водный слой экстрагировали EtOAc (60 мл). Объединенные экстракты последовательно промывали водой, насыщенным водным раствором NaHCO3 и насыщенным раствором соли, затем сушили (Na2SO4) и упаривали в вакууме, получая соединение 19e в виде темного красно-оранжевого твердого вещества (703 мг). ES-MS m/z 518 (MH+). Ms2O (1,13 г, 6,5 ммоль) добавляли к раствору неочищенного соединения 19e (700 мг) и Py (пиридин) (617 мг, 7,8 ммоль) в ТГФ (26 мл). Реакционную смесь перемешивали при 50°C в течение 2,5 часов и затем охлаждали до комнатной температуры. Затем добавляли ТГФ (26 мл) и 1,0 н водн. HCl (43 мл). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и затем экстрагировали EtOAc (347 мл). Органическую фазу промывали 1,0 н водн. HCl (143 мл), затем водой, насыщенным раствором соли и затем сушили (Na2SO4), и упаривали в вакууме, получая соединение 19f в виде темного красно-оранжевого твердого вещества (850 мг). ES-MS m/z 674 (MH+). Раствор неочищенного соединения 19f (81 мг), DIEA (310 мг, 2,4 ммоль) и MeNH2 (2,0 M в ТГФ, 1,1 мл, 2,2 ммоль) в ДМФ (15 мл) в запаянной трубке перемешивали при 90°C в течение 24 часов. Летучие компоненты удаляли в вакууме и остаток разделяли колоночной флэш-хроматографией (CH2Cl2:MeOH:NH4OH, 95:3:2), получая целевой продукт - соединение 31, в виде красно-оранжевого твердого вещества (9 мг), ES-MS m/z 513 (MH+).
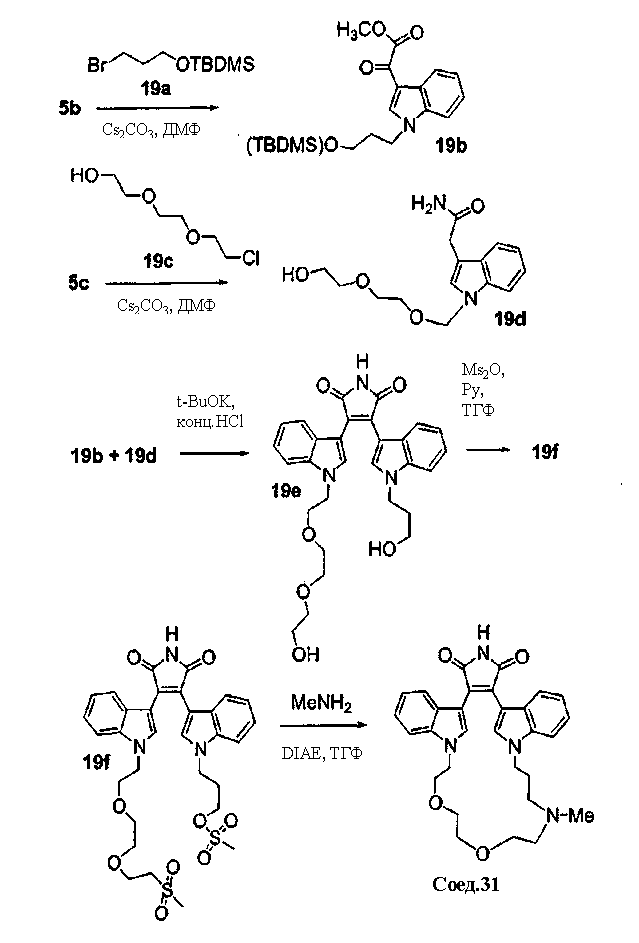
Биологические примеры
Соединения настоящего изобретения были протестированы на биологическую активность в следующих способах in-vitro и in-vivo.
Пример 1
Сцинтилляционный анализ сродства (SPA) к протеинкиназе С
Связывающую активность соединения по отношению к протеинкиназе С (PKC) оценивали с использованием гомогенного сцинтилляционного анализа сродства (SPA) в соответствии с описанной ниже методикой.
Методика
Различные РКС изоферменты человека (получены от PanVera, Madison WI и были приготовлены как рекомбинантные ферменты, продуцируемые при помощи вектора экспрессии бакуловируса) добавляли к реакционной смеси, содержащей исследуемое соединение, 20 мМ HEPES (pH 7,4), 100 мкМ CaCl2, 10 мМ MgCl2, 100 мкг/мл фосфатидилсерина, 20 мкг/мл диацилглицерина, 1 мкМ АТФ, 0,8 мкCi (мкКюри) (33P) АТФ и 5 мк/мл биотинилированного субстратного пептида (Jing Zhao et al., J.Bio.Chem., 1998, 273, 23072). Реакционную смесь инкубировали в течение 15 минут при 30°C. Реакции заканчивали добавлением покрытых стрептавидином SPA бусин (Amersham) в растворе, содержащем 1мМ EGTA, 10 мМ EDTA и 100 мкМ АТФ. Бусинам давали возможность осаждаться в течение ночи и планшеты считывали с помощью сцинтилляционного счетчика Wallac MICROBETA (PerkinElmer Lifesciences, Wellesley, MA).
Анализ гликогенсинтазакиназы 3-β
Ингибирующую активность соединения относительно активности гликогенсинтазакиназы 3-β (GSK 3-β) оценивали с использованием рекомбинантной кроличьей GSK 3-β в соответствии с описанной ниже методикой.
Методика
Исследуемое соединение добавляли к реакционной смеси, содержащей ингибитор-2-протеинфосфотазы (PPI-2) (Calbiochem, San Diego CA) (45 нг), кроличий GSK-3-β (3 (New England Biolabs, Beverly MA) (0,75 единиц) и 33P-АТФ (1 кюри) в 50 мМ Tris-HCl (pH 8,0), 10 мМ MgCl2, 0,1% БСА, 1 мМ DTT и 100 мкМ ванадата натрия. Реакционную смесь подвергали взаимодействию в течение 90 минут при 30° C для фосфорилирования PPI-2 белка и затем белок в реакционной смеси осаждали с использованием 10 %-ной трихлоруксусной кислоты (TCA). Осажденный белок собирали на фильтровальных планшетах (MultiScreen-DV, Millipore, Bedford MA), которые впоследствии промывали. Наконец получали количественные данные для радиоактивности с использованием сцинтилляционного счетчика TopCount (Packard, Meridian CT). Ингибирующие GSK-3 соединения приводили к менее фосфорилированному PPI-2 и таким образом к более низкому сигналу радиоактивности в осажденном белке. В качестве положительного контроля при скрининге использовали стауроспорин или вальпроат (оба доступны из нескольких коммерческих источников).
Значения по ингибированию различных РКС изоферментов и GSK 3-β некоторыми соединениями изобретения, протестированными в РКС SPA и GSK 3-β анализах, приведены в таблице 1.
РКС и GSK 3-β селективность
Пример 2
Анализ биотинилированного пептидного субстрата.
Анализы по исследованию ингибирования соединением других киназ проводили с использованием способов, в которых измеряют количество фосфорилирования биотинилированного пептидного субстрата. Биотинилированные пептидные субстраты выбирали по литературным данным в зависимости от оцениваемого фермента.
Методика
Реакционную смесь киназы получали в 50 мМ Tris-HCl pH=8, 10 мМ MgCl2, 0,1 мМ Na3VO4, 1 мМ DTT, 10 мкМ АТФ, 0,25-1 мкМ биотинилированного пептидного субстрата, 0,2-0,8 мкКюри на лунку 33P-γ-АТФ (2000-3000 Кюри/ммоль). Условия анализа несколько изменяли для каждой протеинкиназы, например, для активности киназы инсулинового рецептора требуется 10 мМ MnCl2, а для кальмодулин-зависимой протеинкиназы требуется кальмодулин и 10 мМ CaCl2. Реакционную смесь распределяли по лункам покрытого стрептавидином флэшпланшета и добавляли 1 мкл исходного раствора лекарственного средства в 100% ДМСО к 100 мкл реакционного объема, что приводило к конечной концентрации ДМСО в реакционной смеси, составляющей 1%. Фермент разбавляли в 50 мМ Tris-HCl pH=8,0, 0,1% БСА и добавляли в каждую лунку. Реакционную смесь инкубировали в течение одного часа при 30°C в присутствии соединения. Через один час реакционную смесь отсасывали из планшета и планшет промывали PBS (забуференным фосфатом физиологическим раствором), содержащим 100 мМ EDTA. Планшет считывали с использованием сцинтилляционного счетчика для определения 33P-γ-АТФ, внедрившегося в иммобилизованный фермент. Исследуемые соединения анализировали в двух повторах при 8 концентрациях (100 мкМ, 10 мкМ, 1 мкМ, 100 нМ, 10 нМ, 1 нМ, 100 пМ, 10 пМ). Максимальный и минимальный сигнал для анализа определяли для каждого планшета.
Значения IC50 рассчитывали из кривой доза-ответная реакция процентного ингибирования максимального сигнала в анализе согласно формуле:
% Ингибирования = ((MS-BS)/ (TCS-BS)) X 100%
где MS = максимальный сигнал, BS = фоновый сигнал, TCS = сигнал тестируемого соединения. Процентное ингибирование изображали графически относительно логарифмической концентрации тестируемого соединения. Для каждого планшета для анализируемой киназы также включали известные ингибирующие сединения в качестве подходящих ссылочных соединений.
Определение и источник киназных ферментов.
VEGF-R (рецептор-2- сосудистого эндотелиального фактора роста) представляет собой слитый белок, содержащий полигистидиновый свободный конец на N-конце с последующими аминокислотами 786-1343 крысиного VEGF-R2 киназного домена (GenBank инвентарный номер U93306). Протеинкиназа A представляет собой каталитическую субъединицу цАМФ зависимой протеинкиназы А, выделенной очисткой из бычьего сердца (Upatste Biotech, Lake Placid, NY, каталожный номер 14-114). CDK1 (циклинзависимая киназа 1) выделяют из клеток насекомых, экспрессирующих как каталитическую субъединицу CDK1 человека, так и его положительную регулирующую субъединицу циклин В (New England Biolabs, Beverly, MA, каталожный номер 6020). Казеинкиназа-1 представляет собой белок, усеченный по аминокислоте 318 по С-концевой части крысиной СК1 дельта изоформы, продуцируемой E. coli (New England Biolabs, Beverly, MA, каталожный номер 6030). Киназа инсулинового рецептора состоит из остатков 941-1313 цитоплазматического домена бета-субъединицы инсулинового рецептора человека (BIOMOL, Plymouth Meeting, PA, каталожный номер SE-195). Кальмодулинкиназа (кальмодулин-зависимая протеинкиназа 2) представляет собой усеченную версию альфа-субъединицы крысинового белка, продуцируемого в клетках насекомых (New England Biolabs, Beverly, MA, каталожный номер 6060). MAP киназа представляет собой крысиную ERK-2 изоформу, содержащую полигистидиновый свободный конец на N-конце, продуцируемую E.coli и активированную с помощью фосфорилирования MEK1 перед очисткой (BIOMOL, Plymouth Meeting, PA, каталожный номер SE-137). EGFR (рецептор эпидермального фактора роста) очищают из мембран клеток А431 человека (Sigma, St. Louis, MO, каталожный номер E3641).
Пептидные субстраты
Данные IC50 для некоторых соединений изобретения, протестированных относительно различных киназ, представлены в таблице 2. Для соединений, где значение для киназы IC50 > 10, не наблюдалось 50%-ного ингибирования при наиболее высокой дозе, протестированной для данной киназы и не наблюдался максимум ингибирования.
Селективные анализы относительно других киназ
Пример 3
Анализ GSK 3-β на основе клеток
Измеряли содержание гликогена в L6 мышечных клетках в соответсвии со способом, описанным в Berger и Hayes, Anal. Biochem., 1998, 261, 159-163.
Методика.
Кратко, из L6 клеток удаляли сыворотку в течение ночи в среде альфа-МЕМ, содержащей 0,1 %.
На следующий день клетки три раза промывали 300 мкл KRPH буфера (150 мМ NaCl, 5 мМ KCl, 2,9 мМ Na2HPO4, 1,25 мМ MgSO4, 1,2 мМ CaCl2, 10 мМ HEPES, pH 7,4) и метили 200 мкл альфа-МЕМ, содержащей 5,5 мМ 14C-глюкозы (0,1 мкКюри) в присутствии носителя (ДМСО) или соединений. Через 2 часа клетки промывали три раза охлажденным на льду PBS и гликоген осаждали в течение 2 часов с использованием охлажденного на льду 66% EtOH. Осажденный гликоген затем промывали три раза охлажденным на льду 66% EtOH и оценивали количество 14C-гликогена с использованием TopCount (Packard). Как показано в таблице 3, L6 клетки скелетных мышц продемонстрировали увеличение синтеза гликогена при действии соединений 1, 2 и 5. Соединения тестировали в отдельных экспериментах при показанных уровнях дозировки. Там, где это показано, 0,0 мкМ дозу использовали в качестве контроля.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ ПИПЕРИДИНИЛА, СЕЛЕКТИВНО СВЯЗЫВАЮЩИЕ ИНТЕГРИНЫ | 2003 |
|
RU2333210C2 |
| СИММЕТРИЧНЫЕ И НЕСИММЕТРИЧНЫЕ ПРОИЗВОДНЫЕ ДИФЕНИЛМОЧЕВИНЫ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК, ОПОСРЕДОВАННОГО КИНАЗОЙ RAF | 1998 |
|
RU2247109C9 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПУРИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1997 |
|
RU2228335C2 |
| ИЗОИНДОЛИНОНОВЫЕ ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ MDM2-P53, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2794333C1 |
| ИНДОЛИЛМАЛЕИМИДНЫЕ ПРОИЗВОДНЫЕ | 2005 |
|
RU2373201C2 |
| НОВЫЕ ЛИГАНДЫ ЭСТРОГЕНОВЫХ РЕЦЕПТОРОВ | 2009 |
|
RU2492164C2 |
| СТИМУЛЯТОРЫ СЕКРЕЦИИ ГОРМОНА РОСТА | 1996 |
|
RU2172742C2 |
| ИНГИБИТОРЫ ТРОМБИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ЗАЩИЩЕННОЕ ПРОИЗВОДНОЕ | 1996 |
|
RU2176645C2 |
| ИМИДАЗОПИРАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗ | 2004 |
|
RU2405784C2 |
| НОВЫЕ (ПОЛИ)АМИНОАЛКИЛАМИНОАЛКИЛАМИДНЫЕ, АЛКИЛ-МОЧЕВИННЫЕ ИЛИ АЛКИЛ-СУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ ЭПИПОДОФИЛЛОТОКСИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ СРЕДСТВ | 2009 |
|
RU2529676C2 |
Изобретение относится к некоторым новым макрогетероциклическим соединениям, которые могут выступать как селективные ингибиторы киназы или двойной киназы. Описываются соединения формул:
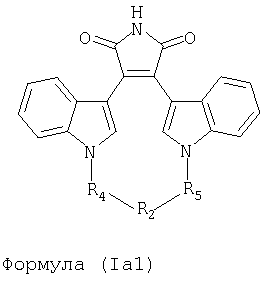
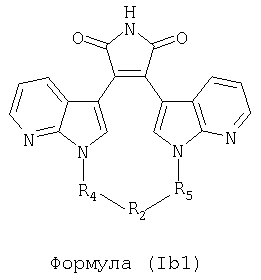
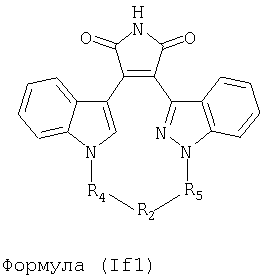
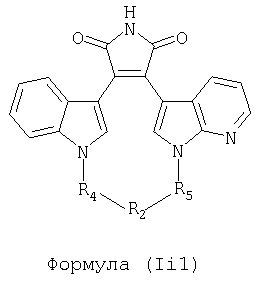
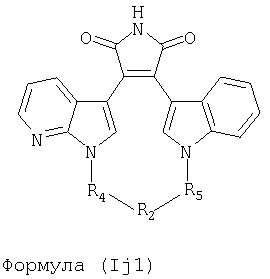
в которых R2, R4 и R5 выбираются зависимым образом, так как это указано в формуле изобретения. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 5 н.п. ф-лы, 3 табл.
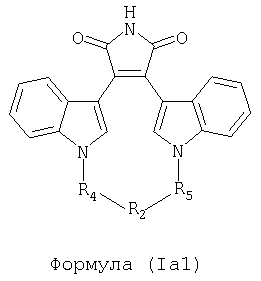
где R4, R2 и R5 зависимым образом выбирают из:
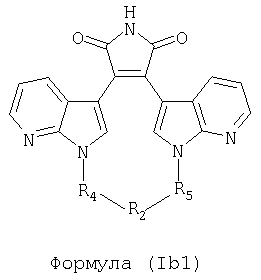
где R4, R2 и R5 зависимым образом выбирают из:
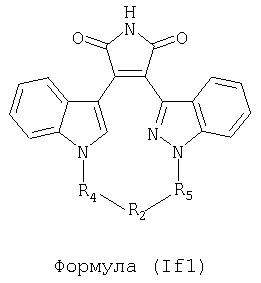
где R4, R2 и R5 зависимым образом выбирают из:
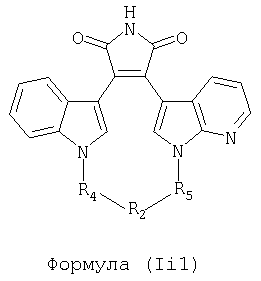
где R4, R2 и R5 зависимым образом выбирают из:
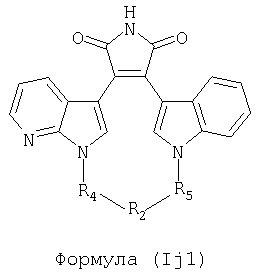
где R4, R2 и R5 зависимым образом выбирают из:
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| БИС-ИНДОЛМАЛЕИМИДНЫЕ МАКРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2147304C1 |
| Способ изготовления магнитопроводов ферритовых магнитных головок | 1976 |
|
SU657458A1 |
| US 6093713 А1, 25.07.2000. | |||
Авторы
Даты
2006-04-27—Публикация
2001-12-06—Подача