Изобретение относится к органической химии и касается новой кристаллической безводной модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида (дазатиниб - международное не патентованное название), названной нами δ-модификацией, способа ее получения и фармацевтической композиции на ее основе, которая может быть использована в фармацевтической промышленности и медицине в качестве ингибитора тирозинкиназ для лечения иммунологических и онкологических заболеваний.
Известны замещенные циклические соединения и их фармацевтические приемлемые соли в качестве ингибиторов протеинтирозинкиназ, способы их получения и содержащие их композиции для лечения иммунологических расстройств и опухолевых заболеваний. (RU 2260592 C2 от 12.04.2000 г.; RU 2312860 C2 от 12.04.2000 г.; RU 2009121653 A от 20.12.2010 г.; RU 2006103858 A от 27.06.2006 г.; ЕПВ 200702238 A1 от 28.04.2008 г.; WO 2011/095588 A1 от 11.08.2011 г.).
Однако в данных патентах не описаны конкретные соли, или гидраты солей, или их сольваты. Кроме того, синтезируемые вещества не охарактеризованы на предмет их принадлежности к той или иной полиморфной модификации и не определены параметры получаемых порошков. Эти свойства, в конечном итоге, определяют биологическую активность получаемых субстанций.
Известны кристаллические модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида-сольваты, такие как моногидрат - (H1-7 и полиформ 1-формы), этанол сольваты (T1E2-1 и E2-1 формы); бутанол сольват (BU-форма) н-пропанол-диметилсульфоксид (DMSO) сольват (K2-форма); DMSO сольват (C-форма); тетрагидрофуран (THF) сольват (D-форма); 2-метил-THF сольват (E-форма); 1,4-диоксин сольват (F форма); пиридин сольват (G-форма); толуол сольват (H-форма); метил изобутил кетон (MIBK) сольват (I-форма); моноацетон сольват (J-форма); изо-пропанол (IPA)-DMSO сольват (A2-форма); 2-бутанол-(DMSO) сольват (L2-форма); IPA-DMF сольват (A1 форма); IPA сольват (A3 форма); н-пропанол-DMF сольват (K1-форма); н-пропанол сольват (K3-форма); 2-бутанол-DMF сольват (L1-форма); 2-бутанол сольват (L3-форма); н-бутанол-DMSO сольват (N2-форма); DMF-H2O сольват (P-форма); DMF-сольват (Q-форма); метил-изопропил кетон (MIPK) сольват (AA-форма); диметоксиэтан сольват (AB-форма); целлозольв сольват (AC-форма); метилацетат сольват (AD-форма); метанол сольват (AE-форма); этилацетат сольват (AF-форма); 2-пентанол сольват (AG форма); диметилкарбонат сольват (AI-форма); изопропилацетат сольват (AJ-форма); этиленгликоль сольват (AW-формат); дихлорметан сольват (AL-форма); метилформиат сольват (AM форма); третбутанол сольват (AN-форма); диметоксиэтан сольват (AP-форма); метилэтил кетон (MEK) сольват (AQ-форма); монохлорбензол сольват (AR-форма); пропиленгликоль моноэтилового эфира (PGME) сольват (AS-форма); циклопентил метилового эфира сольват (AU-форма); метилтретбутилового эфира сольват (AV-форма); амилового спирта сольват (AH форма); метилизопропил кетон (BG-форма); монохлорбензол сольват (BI-форма); глицеролформиат сольват (BL-форма); изосорбид диметилэтил сольват (BN-форма); Ν,Ν′-диметилэтилен мочевина сольват (BR-форма); Ν,Ν′-диметилпропилен мочевина (BS-форма) и другие. (WO 2007/035874 Al от 29.03.2007 г.; WO 2010/067374 A2 от 17.06.2010 г.; WO 2010/062715 A2 от 3.06.2010 г.; US 11/051208 от 4.02.2005 г.; WO 2011/095059 A1 от 11.08.2011 г.; US 2006/0004067 A1 от 5.01.2006 г.; WO 2010/139981 A2 от 28.05.2010 г.; WO 2010/139980 A1 от 9.12.2010 г.; WO 2010/139979 A2 от 9.12.2010 г.; WO 2010/067374 A2 от 17.06.2010 г.; US 2005/0215795 A1 от 28.09.2006 г.; US 2006/0094728 A1 от 4.05.2006 г.; WO 2009/053854 A2 от 30.04.2009 г.).
Однако все эти формы отличаются от заявляемой кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида химическим составом - наличием в химических формулах «сольватных» или «гидратных» молекул.
Наиболее близкими к заявляемой новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида являются кристаллические безводные формы дазатиниба (безводная форма - без названия; форма I; полиморф II; Ν-6; T1H1-7; форма 1 ABT-888 и форма B) (WO 2011/095059 A1 от 11.08.2011 г.; WO 2010/139979 A2 от 28.05.2010 г.; WO 2010/139981 A2 от 9.12.2010 г.; US 2005/0215795 A1 от 28.09.2006 г.; WO 2009/053854 A2 от 30.04.2009 г.; WO 2010/067374 A2 от 17.06.2010 г.; RU 2476434 C2 от 27.02.2013 г.).
Известные кристаллические безводные модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамид представляют собой порошки от желтоватого до белого цвета, без запаха, практически не растворимые в воде, мало растворимые в этаноле и метаноле.
Известные кристаллические безводные модификации дазатиниба характеризуются физико-химическими методами анализа, например ядерным магнитным резонансом (ЯМР), методом рентгенофазового анализа (РФА) - наборами углов 2θ, град - межплоскостных расстояний (d, Å) и их интенсивностью (Iот,=Ii/Imax×100, %) или непосредственно рентгенограммами (получение дифрактограмм авторы вышеприведенных патентов проводили на CuKα-излучении); ИК-спектрометрическими методами анализа, термоаналитическими исследованиями и другими.
Рассмотренные выше модификации дазатиниба получают из исходных компонентов или одну из другой в растворах, варьируя тип растворителей, условия приготовления растворов, а также условия выделения из органических растворителей или их смесей различными методами, например кристаллизацией из растворов (как правило, методом замены растворителей или охлаждением) с последующим фильтрованием, промыванием и далее сушкой на воздухе, вакуумной сушкой или сушкой в роторном испарителе (WO 2011/095125 A1 от 11.08.2011 г.; WO 2011/095059 A1 от 11.08.2011 г.; US 2006/0004067 A1 от 5.01.2006 г.; WO 2010/139979 A2 от 9.12.2010 г.; US 2005/0215795 A1 от 28.09.2006 г.; WO 2010/067374 A2 от 17.06.2010 г.).
В качестве наиболее близкого по технической сущности аналога (прототипа) может быть выбран способ получения кристаллических безводных модификаций дазатиниба, заключающийся в том, что кристаллиты дазатиниба выделяют из реакционной смеси, как правило, методом замены растворителя или охлаждением, фильтруют, промывают и сушат в вакууме при температуре 50-65°C в течение 8-12 часов (WO 2010/139979 A2 от 28.05.2010 г.).
Сходство заявляемой кристаллической безводной δ-модификации Ν-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида с известными кристаллическими безводными модификациями дазатиниба заключается в идентичности их химических составов.
Отличие заявляемой кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида от известных кристаллических модификаций дазатиниба заключается в различии их дифрактограмм рентгенофазового анализа (РФА): определенного набора углов 2θ (град) - межплоскостных расстояний (d, Å), и их интенсивностью (Iот,=Ii/Imax×100, %).
Отличие способа получения заявляемой кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида от способа получения известных кристаллических безводных форм дазатиниба состоит в том, что кристаллиты дазатиниба после выделения из реакционной смеси, фильтрования и промывки замораживают и подвергают сублимационной сушке в течение 22-27 часов при конечной температуре на продукте не менее 25°C.
Отличие заявляемой фармацевтической композиции, обладающей активностью ингибитора тирозинкиназ для лечения иммунологических и онкологических заболеваний, на основе N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида от известной композиции (WO 2011/095588 A1 от 11.08.2011 г.; Регистр Лекарственных Средств России - Инструкция применения препарата Спрайсел/Sprycel®) состоит в том, что в качестве действующего вещества используют терапевтически эффективное количество новой, не известной ранее, кристаллической безводной δ-модификации дазатиниба.
Целью изобретения является получение новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, разработка способа ее получения и применение ее в фармацевтической композиции, обладающей активностью ингибитора тирозинкиназ для лечения иммунологических и онкологических заболеваний.
Поставленная цель достигнута настоящим изобретением, а именно получением новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, характеризующейся следующим набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iот,=Ii/Imax×100, %): 9,637 - 69,1%; 7,928 - 29,2%; 6,415 - 100%; 5,819 - 39,4%; 5,529 - 3,0%; 4,941 - 27,2%; 4,887 - 5,6%; 4,549 - 72,6%; 4,092 - 3,8%; 4,037 - 3,2%; 3,847 - 35,0%; 3,782 - 5,8%; 3,751 - 5,2%; 3,642 - 3,9%; 3,607 - 2,7%; 3,442 - 16,6%; 3,383 - 3,0%; 3,183 - 27,4%; 3,122 - 21,7%; 3,099 - 5,6%; 2,958 - 6,9%; 2,905 - 3,4%; 2,763 - 7,5%; 2,757 - 7,8%; 2,694 - 9,2%; 2,551 - 12,6%; 2,516 - 2,6%; 2,463 - 3,9%; 2,292 - 3,9%; 2,270 - 5,0%; 2,137 - 4,0%; 2,112 - 3,5%; 2,024 - 3,7%; 1,906 - 3,4%; 1,867 - 3,0%; 1,780 - 6,0%.
Поставленная цель достигнута также разработкой способа получения новой, не известной ранее, кристаллической безводной δ-модификации Ν-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, который состоит в том, что кристаллиты субстанции выделяют из реакционной смеси, фильтруют, промывают, замораживают, подвергают сублимационной сушке в течение 22-27 часов при конечной температуре на продукте не менее 25°C.
Кроме того, поставленная цель достигнута применением новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, обладающей ингибирующей активностью в отношении тирозинкиназ, для приготовления фармацевтической композиции для лечения иммунологических и онкологических заболеваний, содержащей терапевтически эффективное количество кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида и, по крайней мере, один фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или наполнитель.
Из патентной и научно-технической литературы не известна кристаллическая безводная δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, способ ее получения и применение ее в качестве ингибитора тирозинкиназ для лечения иммунологических и онкологических заболеваний.
Нами обнаружена новая, не известная ранее, кристаллическая безводная δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, характеризующаяся определенным набором дифракционных максимумов (d, Å) и их интенсивностью (Iотн., %), предложены способ ее получения и применение ее для приготовления фармацевтической композиции в качестве ингибитора тирозинкиназ для лечения иммунологических и онкологических заболеваний.
Заявляемая новая, не известная ранее, кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида представляет собой легкий пушистый порошок от желтоватого до белого цвета, без запаха, практически не растворимый в воде, мало растворимый в этаноле и метаноле.
Для пояснения сущности заявляемого технического решения к описанию приложены следующие таблицы и чертежи:
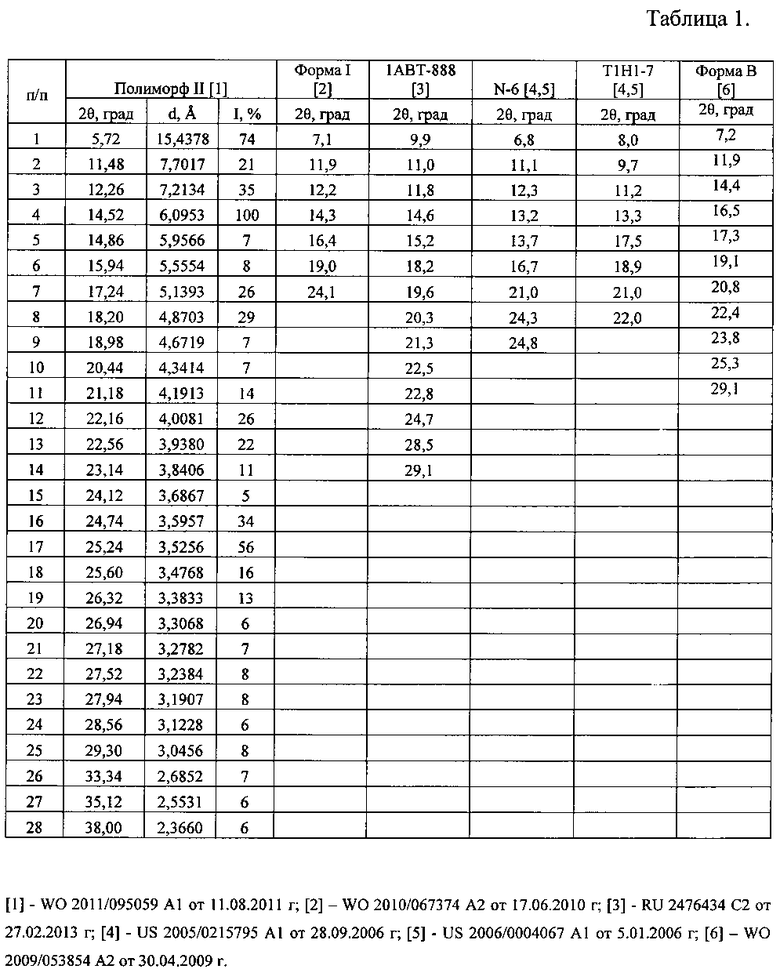
Таблица 1. Углы 2Θ, межплоскостные расстояния (d, Å) и их интенсивности (Iотн., %) известных кристаллических безводных модификаций дазатиниба (форма I; полиморф II; N-6; T1H1-7; 1 ABT-888, форма B).
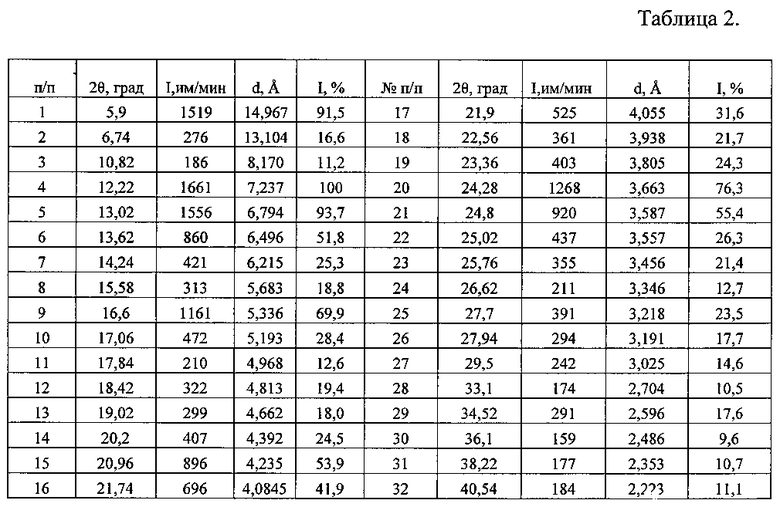
Таблица 2. Углы 2Θ, межплоскостные расстояния (d, Å) и их интенсивности (Iотн., %) известной кристаллической безводной модификации дазатиниба (без названия) - исходной субстанции (производства «AFINE CHEMICALS LTD» Китай).
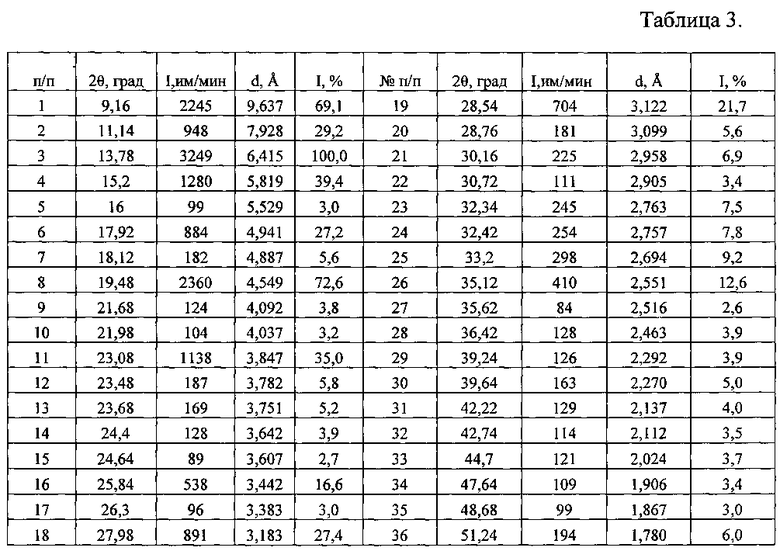
Таблица 3. Углы 2Θ, межплоскостные расстояния (d, Å) и их интенсивности (Iотн., %) новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида.
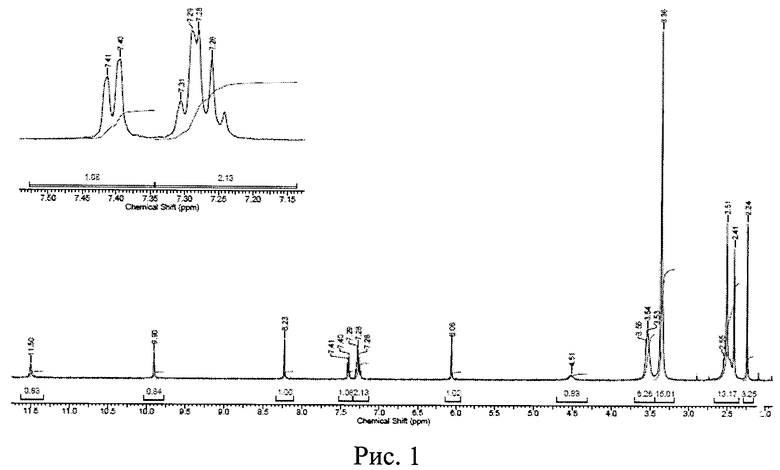
Рис. 1. ЯМР 1H-спектр исходной известной кристаллической безводной модификации дазатиниба (без названия).
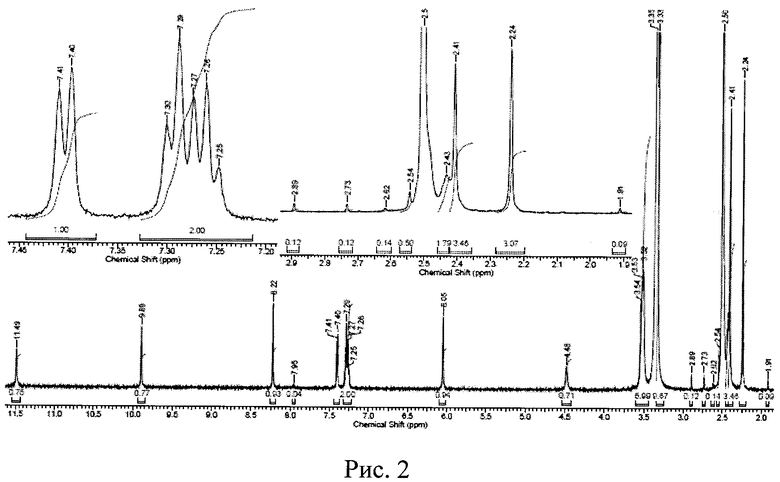
Рис. 2. ЯМР 1H-спектр новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида.
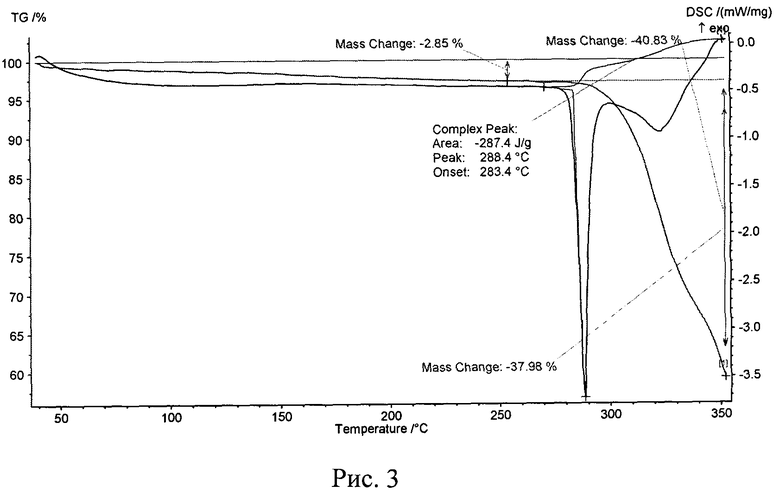
Рис. 3. Термограмма исходной известной кристаллической безводной модификации дазатиниба (без названия).
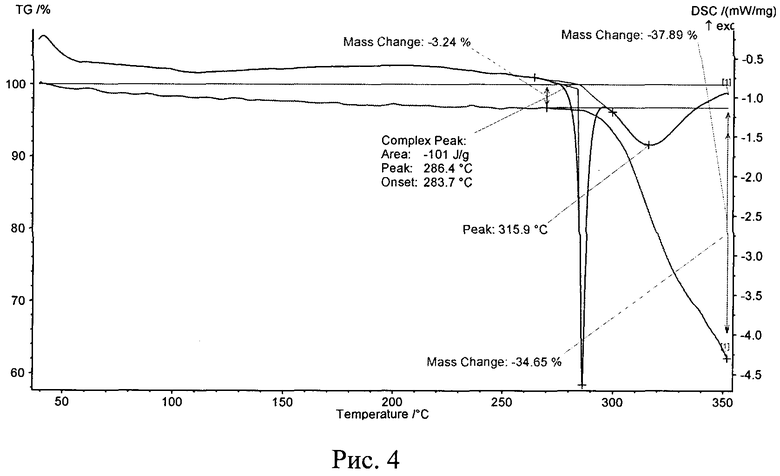
Рис. 4. Типичная термограмма новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида.
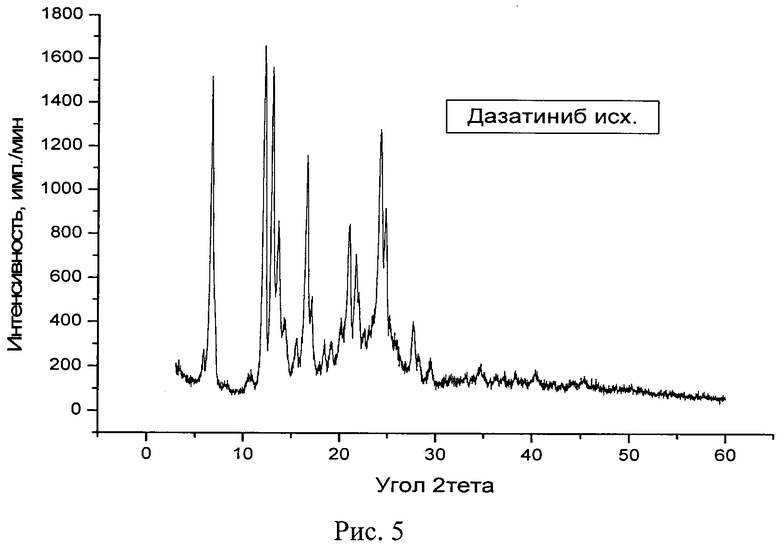
Рис. 5. Дифрактограмма исходной известной кристаллической безводной модификации дазатиниба (без названия).
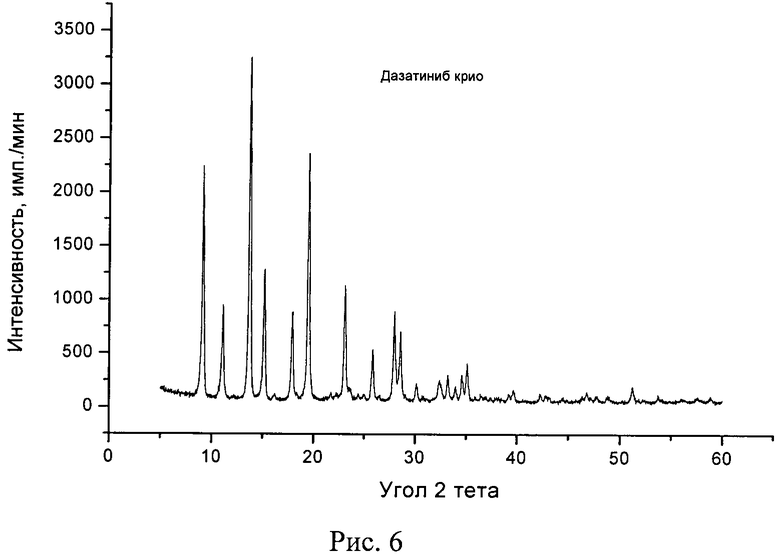
Рис. 6. Типичная дифрактограмма новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида.
Для идентификации полученного вещества был проведен комплекс физико-химических методов анализа.
Первоначально, методом ядерного магнитного резонанса (ЯМР 1H) и термоаналитическими исследованиями была установлена идентичность химических формул исходной известной кристаллической безводной модификации дазатиниба (без названия) и новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида.
Определение химических сдвигов исходного и полученного вещества было проведено в его насыщенном растворе в дейтерированном диметилсульфоксиде (ДМСО-D6) на ЯМР-спектрометре высокого разрешения VXR-400 фирмы "VARIAN" (США). Полученные данные приведены на рис. 1 и 2, соответственно. Сравнение результатов, представленных на рис. 1 (исходная известная кристаллическая безводная модификация дазатиниба (без названия)), с данными, приведенными на рис. 2 (новая, не известная ранее, кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида), показывает, что ЯМР - 1H-спектры исходного и полученного нами вещества идентичны, т.е. полученное вещество является N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамидом.
Термоаналитические исследования проводили на термоанализаторе STA 449 C Jupiter (NETZSCH) в токе аргона при повышении температуры 10 град/мин. В качестве держателей образцов использовали алюминиевые кюветы. Навески проб составляли 1,9-4,4 мг. Полученные данные приведены на рис. 3 и рис. 4. Видно, что кривые ДСК исходной известной кристаллической безводной модификации дазатиниба (без названия) (рис. 3) и полученной из него новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида (рис. 4) практически не различаются. До температуры ~283°C - начало процесса термического разложения на термогравиметрических кривых и кривых дифференциальной сканирующей калориметрии эффектов, связанных с удалением воды или других процессов, не наблюдаются. Кроме того, температуры плавления исходной известной кристаллической безводной модификации дазатиниба (без названия) (рис. 3) и полученной из него новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида (рис. 4) практически не различаются и равны 288,4°C и 286,4°C, соответственно. Однако величины экзотермических эффектов термического разложения различаются: для исходной кристаллической безводной модификации дазатиниба (без названия) величина экзотермического эффекта термического разложения равна 287,4 Дж/г, а для новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида величина экзотермического эффекта термического разложения равна 101 Дж/г, что в 2,8 раза меньше. Это свидетельствует о том, что полученная новая, не известная ранее, кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида более активна к процессам термического разложения и, по всей видимости, будет более активна и в биологических процессах.
Таким образом, проведенные эксперименты свидетельствуют о том, что при получении новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида из исходной кристаллической безводной модификации дазатиниба (без названия) распада вещества не происходит. Не происходит также образования кристаллогидратов или кристаллосольватов.
Экспериментальные результаты ядерного магнитного резонанса (ЯМР - 1H) и термоаналитических исследований однозначно свидетельствуют о том, что полученное из известной, кристаллической безводной модификации дазатиниба (без названия) вещество является N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамидом.
Для подтверждения того, что полученное вещество является новой, не известной ранее, кристаллической безводной δ-модификацией N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, был проведен рентгенофазовый анализ (РФА).
Рентгенофазовый анализ (РФА) исходной известной кристаллической безводной модификации дазатиниба (без названия) и полученного из нее вещества проводили на дифрактометре Rigaku D/MAX-2500 (Rigaku, Япония) на CuKα излучении (λ=1,54056 Å). Полученные результаты для исходной известной кристаллической безводной модификации дазатиниба (без названия) приведены в табл. 2 и на рис. 5, а для полученного из него вещества - в табл. 3 и на рис. 6. Сравнение полученных данных, представленных в табл. 1, 2 и табл. 3, а также на рис. 5 и рис. 6, свидетельствует о том, что полученный порошок дазатиниба является новой, не известной ранее, кристаллической безводной δ-модификацией N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида.
Таким образом, экспериментальные результаты рентгенофазового анализа однозначно свидетельствуют о том, что полученное вещество является новой, не известной ранее, кристаллической безводной δ-модификацией Ν-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида. Она характеризуется отличными от других кристаллических безводных модификаций дазатиниба набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн., %): 9,637 - 69,1%; 7,928 - 29,2%; 6,415 - 100%; 5,819 - 39,4%; 5,529 - 3,0%; 4,941 - 27,2%; 4,887 - 5,6%; 4,549 - 72,6%; 4,092 - 3,8%; 4,037 - 3,2%; 3,847 - 35,0%; 3,782 - 5,8%; 3,751 - 5,2%; 3,642 - 3,9%; 3,607 - 2,7%; 3,442 - 16,6%; 3,383 - 3,0%; 3,183 - 27,4%; 3,122 - 21,7%; 3,099 - 5,6%; 2,958 - 6,9%; 2,905 - 3,4%; 2,763 - 7,5%; 2,757 - 7,8%; 2,694 - 9,2%; 2,551 - 12,6%; 2,516 - 2,6%; 2,463 - 3,9%; 2,292 - 3,9%; 2,270 - 5,0%; 2,137 - 4,0%; 2,112 - 3,5%; 2,024 - 3,7%; 1,906 - 3,4%; 1,867 - 3,0%; 1,780 - 6,0%.
Способ получения новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида заключается в том, что растворяют N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамид в органическом растворителе, выделяют кристаллиты из раствора методом замены растворителя или охлаждением с последующим фильтрованием, промыванием, замораживают кристаллиты и подвергают сублимационной сушке в течение 22-27 часов при конечной температуре на продукте не менее 25°C.
Отличие способа получения заявляемой кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида от способа получения известных кристаллических безводных форм дазатиниба состоит в том, что кристаллиты после выделения из реакционной смеси, фильтрования и промывки замораживают и подвергают сублимационной сушке в течение 22-27 при конечной температуре на продукте не менее 25°C.
Замораживание кристаллитов с остатками промывочной жидкости - воды - можно проводить любым из известных методов и с любой скоростью криокристаллизации. Этот процесс необходим для корректного проведения процесса сублимационной сушки - перевод остатков промывочной жидкости - воды - из твердого, замороженного состояния в газообразное, минуя жидкое.
Уменьшение времени сублимационной сушки меньше 22 ч приводит к получению невысохшего продукта: «порошок дазатиниба - его замороженные кристаллиты с остатками промывочной жидкости - воды». Система при комнатной температуре плавится, частично образуя известную кристаллическую модификацию, содержащую кристаллогидратную воду. Получить новую, не известную ранее, кристаллическую безводную δ-модификацию Ν-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида в чистом виде не удается.
Увеличение времени сублимационной сушки больше 27 ч нецелесообразно, так как не приводит к увеличению выхода целевого продукта - новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида и лишь удорожает процесс.
Уменьшение конечной температуры на продукте в процессе сублимационной сушки меньше комнатной 25°C приводит после выгрузки продукта из сублимационной установки к конденсации паров воды из воздуха на продукт и, как следствие, к образованию на поверхности получаемого порошка дазатиниба известной кристаллической модификации, содержащей кристаллогидратную воду. Получить новую, не известную ранее, кристаллическую безводную δ-модификацию N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида в чистом виде не удается.
Возможность осуществления предлагаемого изобретения иллюстрируется следующими примерами, но не ограничивается ими.
Пример 1. 1,00 г исходной известной кристаллической безводной модификации дазатиниба (без названия) (производства фирмы «AFINE CHEMICALS LTD» (Китай)) чистотой 99,4% (ВЭЖХ) растворяют при 50°C в 100 мл смеси ацетон : вода = 1:1 и полученный истинный раствор выливают в 230 мл дистиллированной воды, при этом из раствора выделяются кристаллиты, которые отфильтровывают от маточного раствора и промывают 60 мл дистиллированной воды. Полученный осадок переносят на поддон из нержавеющей стали и замораживают непосредственно на плите сублимационной камеры, предварительно охлажденной до -30°C в течение 4 часов. Замороженный продукт подвергают сублимационной сушке при температурах: на конденсаторе -50…-55°C; на продукте -30…+25°C и остаточном давлении в камере (8-6)·10-2 Торр в течение 22 ч. Выход продукта составил 0,96 г (96 масс.%). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 6, и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой, не известной ранее, кристаллической безводной δ-модификации Ν-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, представленными в табл. 3. По данным термического анализа полученное вещество характеризуется типичными термограммами, представленными на рис. 4 и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида. Величина экзотермического эффекта разложения равна (100,9±0,4) Дж/г при температуре (286,3±0,5)°C. Кроме того, на термогравиметрической кривой и кривой ДСК полученного вещества до ~283°C тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных молекул используемых растворителей.
Пример 2. 2,55 г исходной известной кристаллической безводной модификации дазатиниба (без названия) (производства фирмы «AFINE CHEMICALS LTD» (Китай)) чистотой 99,4% (ВЭЖХ) растворяют при 70°C в 250 мл смеси ацетон : вода = 1:1 и полученный истинный раствор выливают в 460 мл дистиллированной воды, при этом из раствора выделяются кристаллиты, которые отфильтровывают от маточного раствора и промывают 80 мл дистиллированной воды. Полученный осадок замораживают перенесением в предварительно охлажденный и наполненный жидким азотом (Tкип=-196°C) поддон из нержавеющей стали (скорость замораживания ~3×102 град/мин). Полученный замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -50…-55°C; на продукте -196…+60°C и остаточном давлении в камере (5-6)·10-2 Торр в течение 27 ч. Выход продукта составил 2,47 г (96,9 масс.%). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 6, и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, представленными в табл. 3. По данным термического анализа полученное вещество характеризуется типичными термограммами, представленными на рис. 4 и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида. Величина экзотермического эффекта разложения равна (101±0,4) Дж/г при температуре (286,4±0,5)°C. Кроме того, на термогравиметрической кривой и кривой ДСК полученного вещества до ~283°C тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных молекул растворителей.
Пример 3. Фармацевтическая композиция. Для приготовления 10,00 г известной композиции, включающей в качестве действующего вещества кристаллическую безводную модификацию дазатиниба и вспомогательные вещества в соотношении (масс.%):
2,604 г порошка новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида смешивают в течение 5 минут в керамической ступке с вспомогательными веществами: 3,516 г лактозой моногидратом (по фармакопее США и Европейской фармакопее), 3,516 г микрокристаллической целлюлозы (по фармакопее США и Европейской фармакопее), 0,313 г гипролозы (гидроксипропилцеллюлозы) (по фармакопее США и Европейской фармакопее) и 0,051 г магния стеарата (по ТУ 6-09-16-1533-90). Полученную смесь подвергали физико-химическим и биологическим методам анализа. По данным РФА в полученной смеси присутствует вещество, которое характеризуется набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой, не известной ранее, кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, представленными в табл. 3.
Аналогичным способом и идентичным по составу была приготовлена композиция на основе исходной известной, кристаллической безводной модификации дазатиниба (без названия). По данным РФА в полученной смеси присутствует вещество, которое характеризуется набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для исходной известной, модификации безводной N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, представленными в табл. 2.
Биологические эксперименты проводили на кроликах-самцах массой 2,0-2,5 кг. Для получения надежных результатов в параллельных сериях опытов использовали не менее 5ти кроликов. Определение времени появления дазатиниба в крови проводили методом in vivo при пероральном введении композиции с последующим забором плазмы из ушной раковины. Во всех случаях количество вводимого в животное действующего вещества составляло 10,0 мг смеси (2,6 мг дазатиниба). Оказалось, что для композиции, содержащей новую, не известную ранее, кристаллическую безводную δ-модификацию N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, время появления дазатинаба в крови кроликов равно 16±3 мин, а для известной композиции, содержащей в качестве действующего вещества исходную известную кристаллическую безводную модификацию дазатиниба (без названия), - 27±3 мин.
Таким образом, нами обнаружена новая, не известная ранее, кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, предложены способ ее получения и применение ее для приготовления фармацевтической композиции в качестве ингибитора тирозинкиназ для лечения иммунологических и онкологических заболеваний.
Полученная новая, не известная ранее, кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида характеризуется отличным от исходной кристаллической безводной модификации дазатиниба (без названия) набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн., %): 9,637 - 69,1%; 7,928 - 29,2%; 6,415 - 100%; 5,819 - 39,4%; 5,529 - 3,0%; 4,941 - 27,2%; 4,887 - 5,6%; 4,549 - 72,6%; 4,092 - 3,8%; 4,037 - 3,2%; 3,847 - 35,0%; 3,782 - 5,8%; 3,751 - 5,2%; 3,642 - 3,9%; 3,607 - 2,7%; 3,442 - 16,6%; 3,383 - 3,0%; 3,183 - 27,4%; 3,122 - 21,7%; 3,099 - 5,6%; 2,958 - 6,9%; 2,905 - 3,4%; 2,763 - 7,5%; 2,757 - 7,8%; 2,694 - 9,2%; 2,551 - 12,6%; 2,516 - 2,6%; 2,463 - 3,9%; 2,292 - 3,9%; 2,270 - 5,0%; 2,137 - 4,0%; 2,112 - 3,5%; 2,024 - 3,7%; 1,906 - 3,4%; 1,867 - 3,0%; 1,780-6,0%.
Кроме того, новая, не известная ранее, кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида отличается повышенной биологической активностью в составе фармацевтической композиции по сравнению с действием исходной известной кристаллической безводной модификации дазатиниба (без названия).
Из вышеизложенного можно сделать вывод о том, что заявляемая новая, не известная ранее, кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, способ ее получения и применение ее для приготовления фармацевтической композиции в качестве ингибитора тирозинкиназ для лечения иммунологических и онкологических заболеваний являются новыми и удовлетворяют критериям «изобретательский уровень» и «промышленная применимость».
Изобретение относится к кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, характеризующейся следующим набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн., %): 9,637 - 69,1%; 7,928 - 29,2%; 6,415 - 100%; 5,819 - 39,4%; 5,529 - 3,0%; 4,941 - 27,2%; 4,887 - 5,6%; 4,549 - 72,6%; 4,092 - 3,8%; 4,037 - 3,2%; 3,847 - 35,0%; 3,782 - 5,8%; 3,751 - 5,2%; 3,642 - 3,9%; 3,607 - 2,7%; 3,442 - 16,6%; 3,383 - 3,0%; 3,183 - 27,4%; 3,122 - 21,7%; 3,099 - 5,6%; 2,958 - 6,9%; 2,905 - 3,4%; 2,763 - 7,5%; 2,757 - 7,8%; 2,694 - 9,2%; 2,551 - 12,6%; 2,516 - 2,6%; 2,463 - 3,9%; 2,292 - 3,9%; 2,270 - 5,0%; 2,137 - 4,0%; 2,112 - 3,5%; 2,024 - 3,7%; 1,906 - 3,4%; 1,867 - 3,0%; 1,780 - 6,0%. Кристаллическую безводную δ-модификацию N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида получают путем растворения N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида в органическом растворителе. Выделяют кристаллиты из раствора методом замены растворителя или охлаждением с последующим фильтрованием, промыванием, замораживают кристаллиты и подвергают сублимационной сушке в течение 22-27 часов при конечной температуре на продукте не менее 25°C. Применяют кристаллическую безводную δ-модификацию N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, обладающую ингибирующей активностью в отношении тирозинкиназ, для приготовления фармацевтической композиции для лечения иммунологических и онкологических заболеваний. Технический результат - новая кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, обладающая повышенной биологической активностью. 3 н. и 2 з.п. ф-лы, 6 ил., 3 табл., 2 пр.
1. Кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, характеризующаяся следующим набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн., %): 9,637 - 69,1%; 7,928 - 29,2%; 6,415 - 100%; 5,819 - 39,4%; 5,529 - 3,0%; 4,941 - 27,2%; 4,887 - 5,6%; 4,549 - 72,6%; 4,092 - 3,8%; 4,037 - 3,2%; 3,847 - 35,0%; 3,782 - 5,8%; 3,751 - 5,2%; 3,642 - 3,9%; 3,607 - 2,7%; 3,442 - 16,6%; 3,383 - 3,0%; 3,183 - 27,4%; 3,122 - 21,7%; 3,099 - 5,6%; 2,958 - 6,9%; 2,905 - 3,4%; 2,763 - 7,5%; 2,757 - 7,8%; 2,694 - 9,2%; 2,551 - 12,6%; 2,516 - 2,6%; 2,463 - 3,9%; 2,292 - 3,9%; 2,270 - 5,0%; 2,137 - 4,0%; 2,112 - 3,5%; 2,024 - 3,7%; 1,906 - 3,4%; 1,867 - 3,0%; 1,780 - 6,0%.
2. Способ получения кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида по п. 1, характеризующийся тем, что растворяют N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамид в органическом растворителе, выделяют кристаллиты из раствора методом замены растворителя или охлаждением с последующим фильтрованием, промыванием, замораживают кристаллиты и подвергают сублимационной сушке в течение 22-27 часов при конечной температуре на продукте не менее 25°C.
3. Способ по п. 2, характеризующийся тем, что для промывания используют дистиллированную воду.
4. Способ по п. 2 или 3, характеризующийся тем, что конечная температура при сублимационной сушке на продукте составляет 25°C - 60°C.
5. Применение кристаллической безводной δ-модификации N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида по п. 1, обладающей ингибирующей активностью в отношении тирозинкиназ, для приготовления фармацевтической композиции для лечения иммунологических и онкологических заболеваний.
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНОТИАЗОЛ-5-АРОМАТИЧЕСКИХ КАРБОКСАМИДОВ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2005 |
|
RU2382039C2 |
Авторы
Даты
2015-11-10—Публикация
2014-04-23—Подача