Изобретение относится к органической химии и касается новой слабозакристаллизованной модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата [софосбувир (международное непатентованное название)], названной нами слабозакристаллизованной β-модификацией, способа ее получения и фармацевтической композиции на ее основе, которая может быть использована в фармацевтической промышленности и медицине в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С.
Термин «слабозакристаллизованная» был представлен в названии новой модификации в связи с тем, что на дифрактограмме полученной новой модификации софосбувира присутствуют уширенные дифракционные максимумы в отличие от рентгенограмм известных кристаллических модификаций, где пики хорошо выражены или присутствует рентгеноаморфное гало без максимумов в случае аморфной модификации. Если бы полученный нами порошок был аморфным, то на термоаналитических кривых четких пиков не было бы. Было бы смещение базовой линии ДСК - кривых, связанных со стеклованием [http://www.pslc.ws/russian/dsc.htm].
Известны производные нуклеозидов фосфороамидаты и их фармацевтически приемлемые соли в качестве нуклеотидного ингибитора полимеразы, способы их получения и содержащие их фармацевтические композиции для лечения хронического вирусного гепатита С. (RU 2478104 С2 от 27.03.2013 г; RU 2009139968 А от 10.05.2011 г.; WO 2008/121634 А2 от 9.10.2008 г.; US 7429572 В2 от 25.09.2008 г. и др.).
Однако в этих патентах синтезируемые вещества не охарактеризованы на предмет их принадлежности к той или иной полиморфной модификации.
Известны кристаллические и аморфные модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата в виде сольватов, а также соли софосбувира с фармацевтически приемлемыми кислотами. (ЕА 2011/71417 А1 от 25.05.2012 г; WO 2011/123645 А2 от 6.10.2011 г.; WO 2016/023905 А1 от 18.02.2016 г. и др.)
Однако все эти формы отличаются от заявляемой новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата химическим составом.
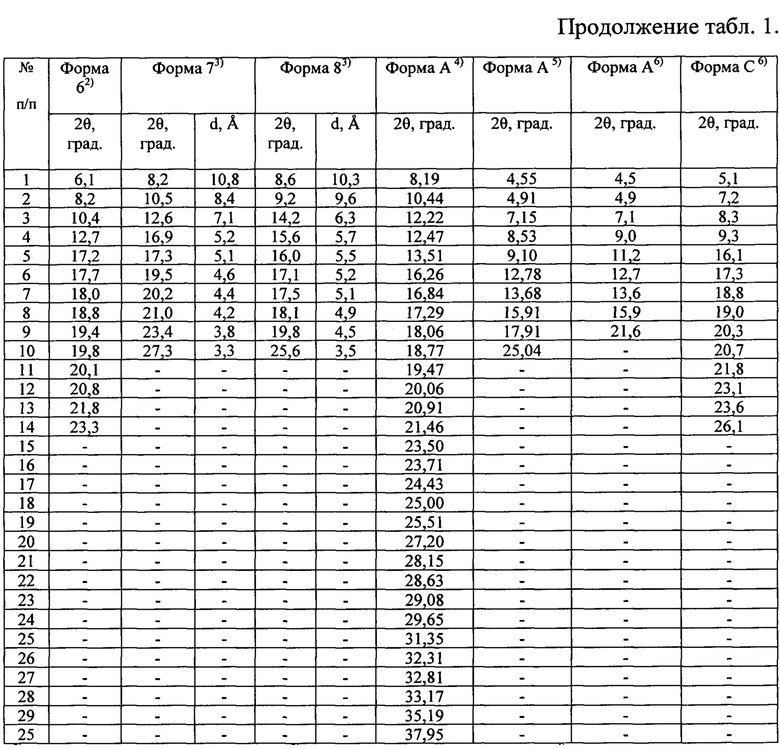
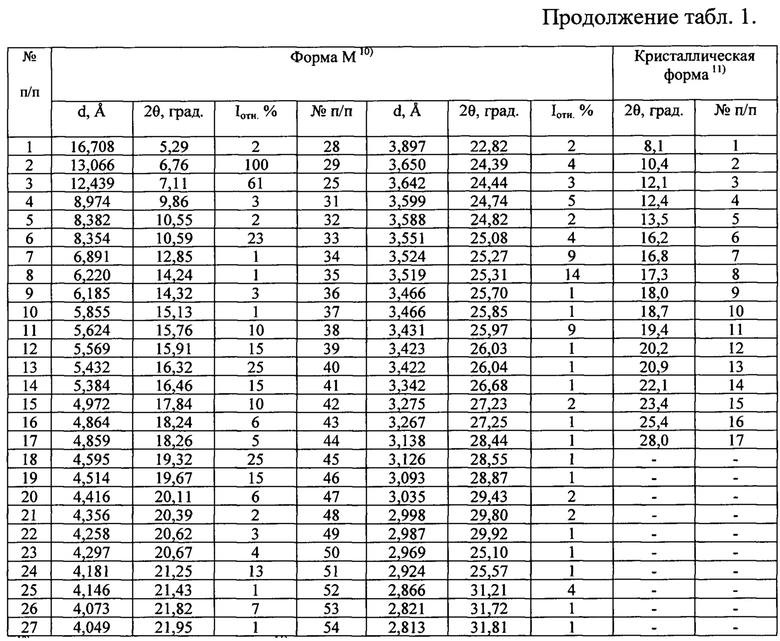
Наиболее близкими к заявляемой новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата являются полиморфные модификации софосбувира: кристаллические формы: Форма 1; Форма 6; Форма 7; Форма 8; Форма А; Форма С; Форма D; Форма Е; Форма М; Форма M1; Форма М; Форма Z-1; кристаллическая форма и аморфная форма (WO 2010/135569 А1 от 25.11.2010 г.; WO 2015/025853 А1 от 5.03.2015 г.; WO 2015/097605 А1 от 2.07.2015 г.; WO 2015/099989 А1 от 2.07.2015 г.; CN 104125252 А от 5.11.2014 г.; WO 2016/035006 А1 от 10.03.2016 г.; WO 2015/126995 А1 от 27.08.2015 г.; WO 2015/191945 А2 от 17.12.2015 г.; WO 2016/038542 А2 от 17.03.2016 г.; WO 2016/008461 А1 от 21.01.2016 г.; CN 104277088 А от 14.01.2015 г.; WO 2016/023906 А1 18.02.2016 г. и др.).
Известные кристаллические модификации софосбувира характеризуются физико-химическими методами анализа такими, как: ядерным магнитным резонансом (ЯМР) - совокупностью химических сдвигов (м.д.), высокоэффективной жидкостной хроматографией (ВЭЖХ) - временами удерживания (мин), рентгенофазовым анализом (РФА) - наборами углов (2θ, град), межплоскостных расстояний (d, Å) и их интенсивностью (I, имп./мин; Iотн,=Ii/Imax×100, %) или непосредственно рентгенограммами (получение дифрактограмм авторы вышеприведенных патентов проводили на Сu Kα - излучении), термоаналитическими исследованиями (температурами тепловых эффектов) и другими.
Сходство заявляемой новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, с известными кристаллическими и аморфной модификациями софосбувира заключается в идентичности их химических составов.
Отличие заявляемой новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, от известных кристаллических и аморфной модификаций софосбувира заключается в различии их дифрактограмм рентгенофазового анализа (РФА): определенного набора углов 2θ (град) - межплоскостных расстояний (d, Å), и их интенсивностью (Iотн,=Ii/Imax×100, %), а также в различии кривых дифференциальной сканирующей калориметрии (ДСК). Кривая ДСК новой слабозакристаллизованной β - модификации софосбувира характеризуется двумя эндотермическими эффектами.
Известные кристаллические модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата представляют собой порошки белого или почти белого цвета, без запаха, легко растворимые в ацетоне и этаноле, растворимые в изопропаноле, мало растворимые в воде.
Рассмотренные выше модификации софосбувира получают из исходных компонентов или одну из другой в растворах, варьируя тип растворителей, условия приготовления растворов, а также условия выделения целевого продукта из органических растворителей или их смесей различными методами, такими, как кристаллизацией из растворов с последующим фильтрованием, промыванием и, далее, сушкой на воздухе, вакуумной сушкой, распылительной сушкой или сублимационной сушкой (WO 2010/135569 А1 от 25.11.2010 г.; WO 2015/025853 А1 от 5.03.2015 г.; WO 2015/099989 А1 от 2.07.2015 г.; CN 104125252 А от 5.11.2014 г.; WO 2016/035006 А1 от 10.03.2016 г.; WO 2015/126995 А1 от 27.08.2015 г.; WO 2015/191945 А2 от 17.12.2015 г.; WO 2016/038542 А2 от 17.03.2016 г.; WO 2016/008461 А1 от 21.01.2016 г.; CN 104277088 А от 14.01.2015 г.; WO 2016/023905 А1 18.02.2016 г.; WO 2016/023906 А1 от 18.02.2016 г. и др.).
Наиболее близким по технической сущности является способ получения аморфной формы (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, заключающийся в том, что софосбувир растворяют в смеси воды и органического растворителя, используя ультразвук для ускорения растворения, гомогенный раствор замораживают в бане с жидким азотом и лиофилизируют (подвергают сублимационной сушке) при -36°С и давлении от 0 до 2 мбар. Скорости замораживания гомогенного раствора и продолжительность лиофилизации авторы патента не указали (WO 2016/023905 А1 от 18.02.2016 г.).
Отличие способа получения заявляемой новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата от способа получения известных кристаллических форм софосбувира состоит в том, что софосбувир растворяют в органическом растворителе при 25°С-70°С, смешивают полученный раствор с дистиллированной водой в соотношении 1:2 - 1:10, замораживают при скорости охлаждения не ниже 60 град/мин, подвергают сублимационной сушке и дополнительно отжигают при температурах (50-85)°С в течение не менее 1 часа с последующим охлаждением до комнатной температуры со скоростью не выше 5 град/час.
Отличие заявляемой фармацевтической композиции в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С на основе (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата от известных композиций (Инструкция применения препарата софосбувира: Совальди®/Sovaldi®, Виропак®/МРI Viropack®, Hepcinat®, Hopetavir® и др.) состоит в том, что в качестве действующего вещества используют терапевтически эффективное количество новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата (софосбувира).
Целью изобретения является получение новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, разработка способа ее получения и применение ее в фармацевтической композиции в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С.
Поставленная цель достигнута настоящим изобретением, а именно получением новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, характеризующейся следующим набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iот.,=Imах×100, %):
25,638 Å - 15,95%; 21,101 Å - 17,80%; 16,458 Å - 21,57%; 13,368 Å - 26,61%; 12,290 Å - 28,21%; 11,343 Å - 31,14%; 11,032 Å - 40,14%; 01,287 Å - 36,18%; 9,083 Å - 39,89%; 8,458 Å - 43,59%; 7,641 Å - 40,40%; 7,148 Å - 46,78%; 7,013 Å - 54,75%; 6,528 Å - 46,01%; 5,975 Å - 55,33%; 5,225 Å - 79,00%; 5,093 Å - 100,00%; 4,892 Å - 86,15%; 4,707 Å - 98,40%; 4,614 Å - 84,56%; 4,535 Å - 94,38%; 4,505 Å - 90,68%; 4,371 Å - 89,60%; 4,259 Å - 75,49%; 4,008 Å - 62,48%; 3,792 Å - 57,69%; 3,741 Å - 54,50%; 3,539 Å - 47,35%; 3,500 Å - 46,01%; 3,263 Å - 46,27%; 3,172 Å - 38,54%; 3,141 Å - 40,71%; 2,999 Å - 25,82%; 2,839 Å - 25,82%; 2,773 Å - 25,06%; 2,722 Å - 27,38%; 2,542 Å - 25,02%; 2,359 Å - 23,68%; 2,192 Å - 22,85%; 2,117 Å - 21,83%,
и наличием двух эндотермических эффектов на кривой ДСК при температурах (39,7-48,1)°С и (120,7-125,9)°С.
Поставленная цель достигнута также разработкой способа получения новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)-фосфориламино)пропаноата, который состоит в том, софосбувир растворяют в органическом растворителе при 25°С-70°С, смешивают полученный раствор с дистиллированной водой в соотношении 1:2 - 1:10, замораживают при скорости охлаждения не ниже 60 град/мин, подвергают сублимационной сушке и дополнительно отжигают при температурах (50-85)°С в течение не менее 1 часа с последующим охлаждением до комнатной температуры со скоростью не выше 5 град/час.
Кроме того, поставленная цель достигнута применением новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата для приготовления фармацевтической композиции в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С. Указанная композиция содержит слабозакристаллизованную β - модификацию софосбувира в терапевтически эффективном количестве и, по крайней мере, один фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или наполнитель.
Из патентной и научно-технической литературы не известна слабозакристаллизованная β - модификация N(S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, способ ее получения и применение ее в фармацевтической композиции в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С.
Нами обнаружена новая, не известная ранее, слабозакристаллизованная β - модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, характеризующаяся определенным набором дифракционных максимумов (d, Å) и их интенсивностью (Iотн, %) и наличием двух эндотермических эффектов на кривой ДСК, предложены способ ее получения и применение ее для приготовления фармацевтической композиции в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С.
Заявляемая новая, не известная ранее, слабозакристаллизованная β - модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата представляют собой порошок белого или почти белого цвета, без запаха, легко растворимый в ацетоне и этаноле, растворимый в изопропаноле, мало растворимый в воде.
Для пояснения сущности заявляемого технического решения к описанию приложены следующие таблицы и рисунки:
Таблица 1. Углы 2θ, град, межплоскостные расстояния (d, Å) и их интенсивности (Iотн, %) известных модификаций софосбувира по литературным данным.
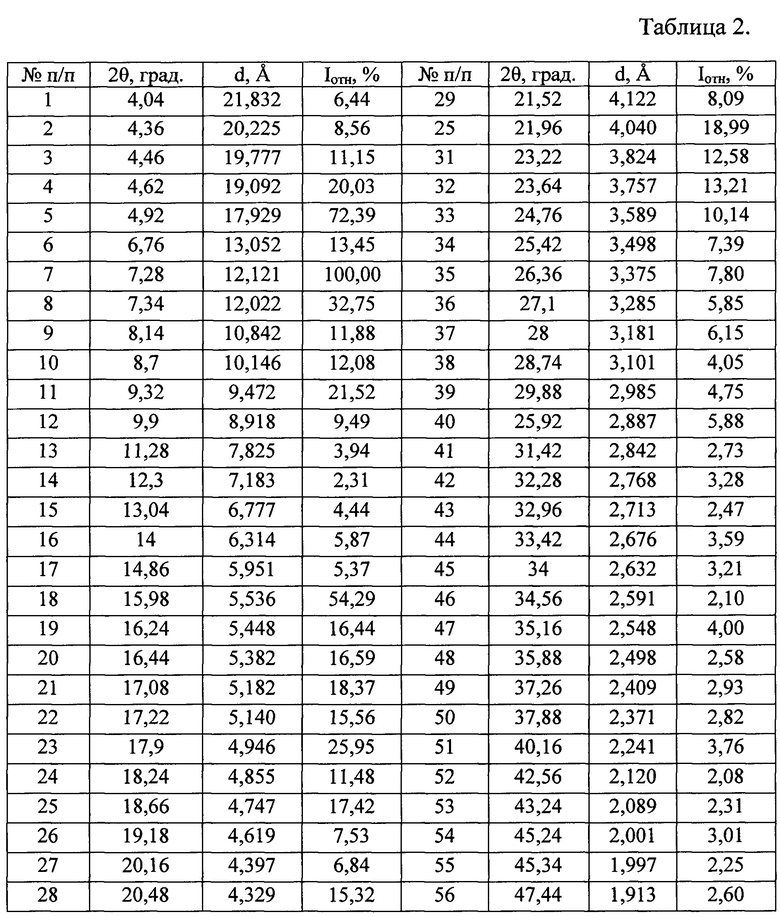
Таблица 2. Углы 2θ, град, межплоскостные расстояния (d, Å) и их интенсивности (Iотн, %) известной кристаллической модификации софосбувира (Форма I), которую использовали в качестве исходного вещества.
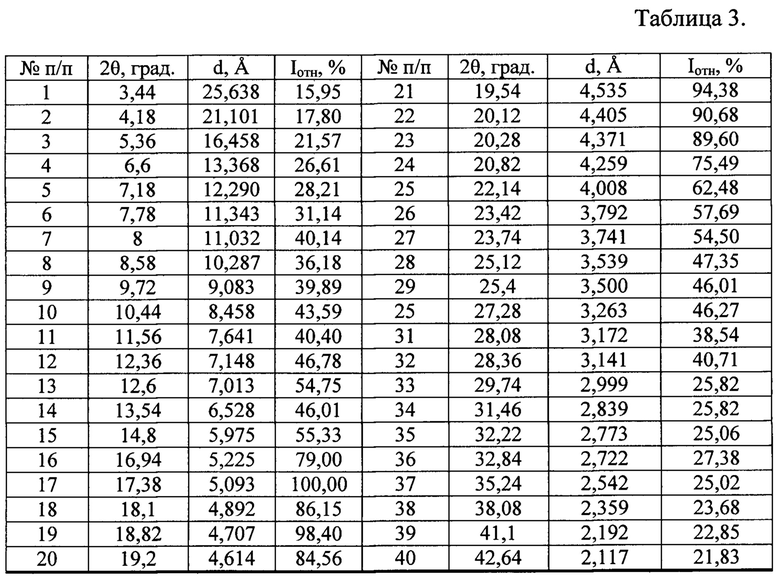
Таблица 3. Углы 2θ, межплоскостные расстояния (d, Å) и их интенсивности (Iотн, %) новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата.
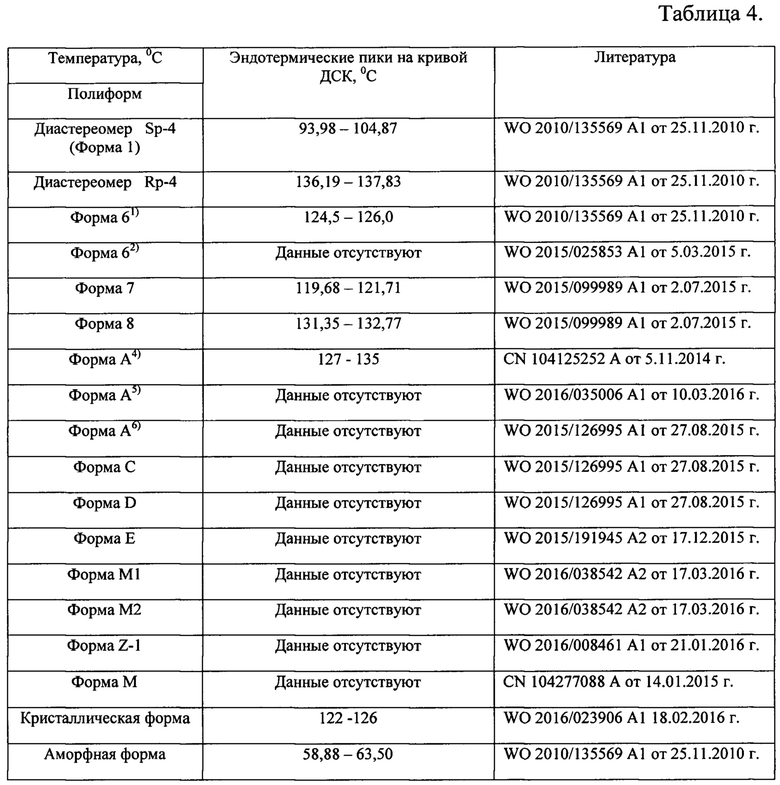
Таблица 4. Результаты термоаналитических исследований известных модификаций софосбувира по литературным данным.
Рис. 1. ЯМР 1Н - спектр известной кристаллической модификации софосбувира (Форма I), которую использовали в качестве исходного вещества.
Рис. 2. ЯМР 1Н - спектр новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата.
Рис. 3. Дифрактограмма известной кристаллической модификации софосбувира (Форма I), которую использовали в качестве исходного вещества.
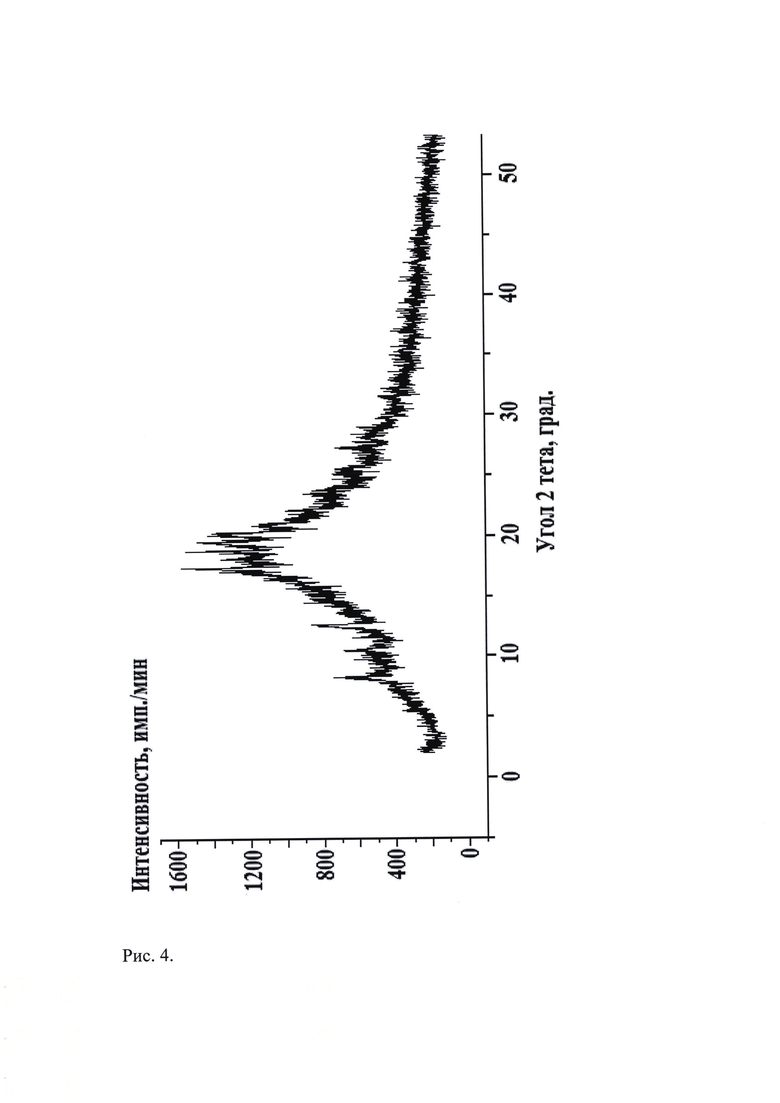
Рис. 4. Типичная дифрактограмма новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата.
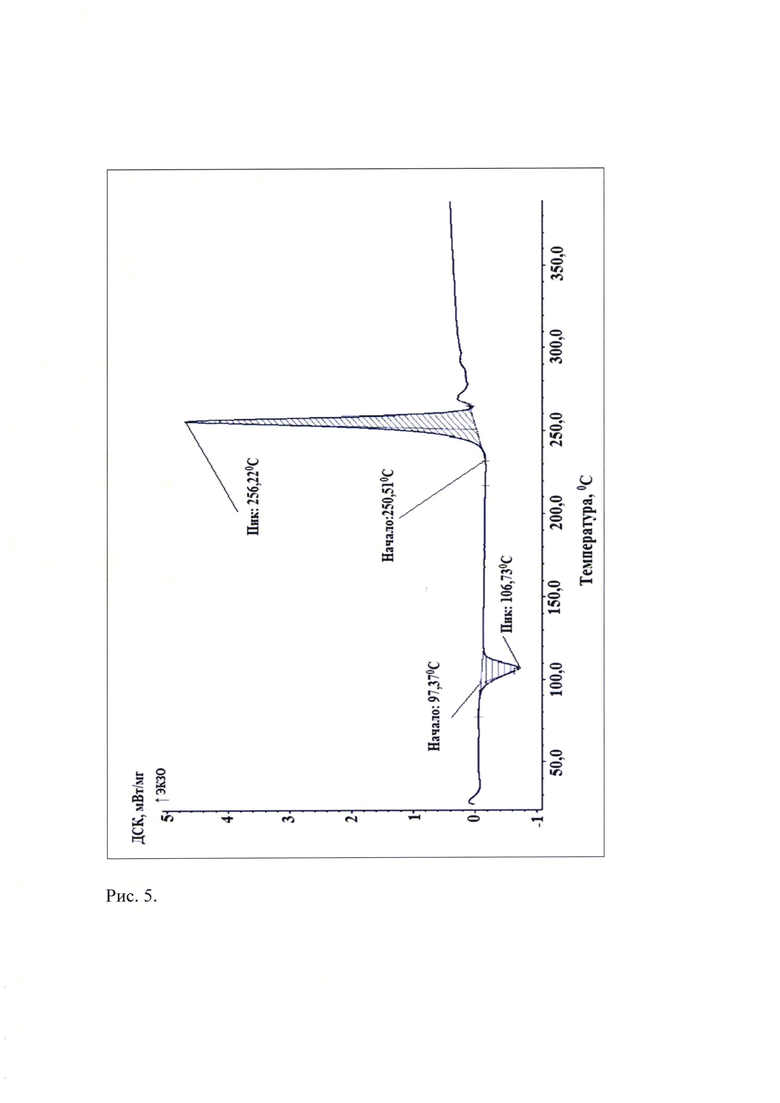
Рис. 5. Термограмма известной кристаллической модификации софосбувира (Форма 1), которую использовали в качестве исходного вещества.
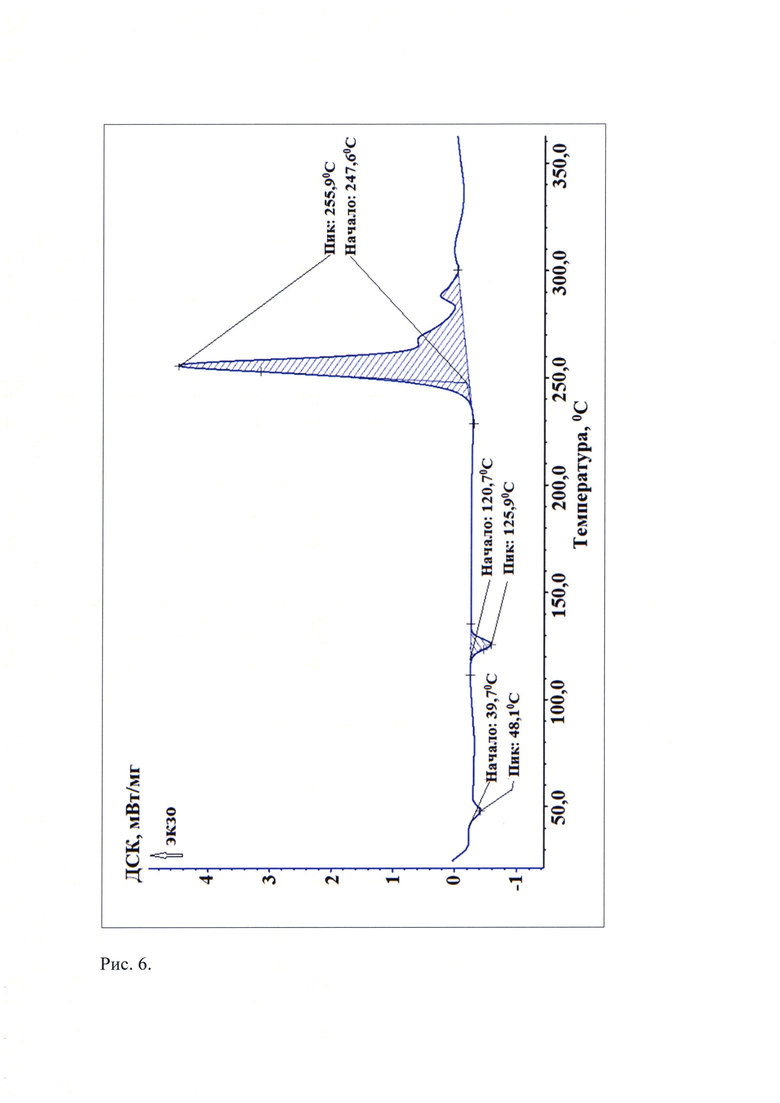
Рис. 6. Типичная термограмма новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата.
Для идентификации полученного вещества был проведен комплекс физико-химических методов анализа.
Первоначально, методами ядерного магнитного резонанса (ЯМР 1Н) и высокоэффективной жидкостной хроматографии (ВЭЖХ) была установлена идентичность химических формул известной кристаллической модификации софосбувира (Форма 1), которую использовали в качестве исходного вещества, и новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)-фосфориламино)пропаноата.
Определение химических сдвигов исходного софосбувира (Форма 1) и полученного из него вещества было проведено в его насыщенном растворе в дейтерированном диметилсульфоксиде (ДМСО-D6) на ЯМР-спектрометре высокого разрешения VXR-400 фирмы "VARIAN" (США). Полученные данные приведены на рис. 1 и 2, соответственно. Сравнение результатов, представленных на рис. 1 [известная кристаллическая модификация софосбувира (Форма 1)], с данными, приведенными на рис. 2 [новая, не известная ранее, слабозакристаллизованная β - модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата показывает, что ЯМР - 1Н - спектры исходного и полученного нами вещества практически идентичны, т.е. полученное вещество является (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноатом.
Хроматографическую подвижность известной кристаллической модификации софосбувира (Форма 1), которую использовали в качестве исходного вещества и, полученной из нее, новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата определяли методом ВЭЖХ на хроматографе Shimadzu LC - 20А с детектором SPD-М20А и с колонкой длиной 150 мм, диаметром 4,6 мм, сорбентом XSelect HSS Т3, 3,5 мкм с детектированием при длине волны 260,8 нм. В качестве подвижной фазы А использовали 0,05% раствор ортофосфорной кислоты в воде, подвижной фазы В - ацетонитрил и в качестве растворителя проб - ацетатный буферный раствор с рН=4 : метанол=60:40 при 25°С и скорости 1,3 мл/мин. Объем испытуемой пробы составил 5 мкл с концентрацией 1,0 мг/мл. Оказалось, что хроматограммы известной кристаллической модификации софосбувира (Форма 1), которую использовали в качестве исходного вещества и новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата содержат по одному пику основного компонента с характерными временами удерживания 16,187 мин и 16,167 мин соответственно. Эти величины времен удерживания, в пределах ошибки определения - 0,06%, одинаковы. Чистота исследованных образцов, определенных методом ВЭЖХ составили 100,00% (исходное вещество) и 99,97% (новая, не известная ранее, слабозакристаллизованная β - модификация софосбувира).
Проведенные методом ВЭЖХ эксперименты, свидетельствуют о том, что при получении новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата из исходного вещества - известной кристаллической модификации софосбувира (Форма 1), разложения исходного вещества не происходит.
Таким образом, экспериментальные результаты ядерного магнитного резонанса (ЯМР-1Н) и высокоэффективной жидкостной хроматографии (ВЭЖХ) однозначно свидетельствуют о том, что полученное вещество является (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноатом.
Для подтверждения того, что полученное вещество является новой, не известной ранее, слабозакристаллизованной β - модификацией (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, были проведены рентгенофазовый анализ (РФА) и термоаналитические исследования.
Рентгенофазовый анализ (РФА) известной кристаллической модификации софосбувира (Форма 1), которую использовали в качестве исходного вещества и полученного из нее соединения проводили на дифрактометре Rigaku D/MAX-2500 (Rigaku, Япония) на СuKα излучении (λ=1,54056 Å).
Полученные данные РФА для софосбувира, который использовали в качестве исходного вещества, приведены в табл. 2 и на рис. 3. Сравнение результатов РФА, представленных в табл. 2 и в табл. 1 (литературные данные), однозначно свидетельствует о том, что в качестве исходного вещества была использована известная кристаллическая модификация софосбувира - Форма 1. Результаты рентгенофазового анализа порошка, полученного из известной кристаллической модификации софосбувира (Форма 1) представлены в табл. 3 и на рис. 4. Сравнение полученных данных, представленных в табл. 3, табл. 2 и табл. 1, а также на рис. 3, рис. 4 и на рисунках, приведенных в литературных источниках (WO 2010/135569 А1 от 25.11.2010 г.; WO 2015/025853 А1 от 5.03.2015 г.; WO 2015/097605 А1 от 2.07.2015 г.; WO 2015/099989 А1 от 2.07.2015 г.; CN 104125252 А от 5.11.2014 г.; WO 2016/035006 А1 от 10.03.2016 г.; WO 2015/126995 А1 от 27.08.2015 г.; WO 2015/191945 А2 от 17.12.2015 г.; WO 2016/038542 А2 от 17.03.2016 г.; WO 2016/008461 А1 от 21.01.2016 г.; CN 104277088 А от 14.01.2015 г.; WO 2016/023906 А1 18.02.2016 г. и др.) свидетельствует о том, что полученный порошок софосбувира является новой, не известной ранее, слабозакристаллизованной β - модификацией (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата.
Таким образом, экспериментальные результаты рентгенофазового анализа однозначно свидетельствуют о том, что полученное вещество является новой, не известной ранее, слабозакристаллизованной β - модификацией (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2H)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата. Она характеризуется отличной от других кристаллических модификаций софосбувира, совокупностью межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн, %):
25,638 Å - 15,95%; 21,101 Å - 17,80%; 16,458 Å - 21,57%; 13,368 Å - 26,61%; 12,290 Å - 28,21%; 11,343 Å - 31,14%; 11,032 Å - 40,14%; 01,287 Å - 36,18%; 9,083 Å - 39,89%; 8,458 Å - 43,59%; 7,641 Å - 40,40%; 7,148 Å - 46,78%; 7,013 Å - 54,75%; 6,528 Å - 46,01%; 5,975 Å - 55,33%; 5,225 Å - 79,00%; 5,093 Å - 100,00%; 4,892 Å - 86,15%; 4,707 Å - 98,40%; 4,614 Å - 84,56%; 4,535 Å - 94,38%; 4,505 Å - 90,68%; 4,371 Å - 89,60%; 4,259 Å - 75,49%; 4,008 Å - 62,48%; 3,792 Å - 57,69%; 3,741 Å - 54,50%; 3,539 Å - 47,35%; 3,500 Å - 46,01%; 3,263 Å - 46,27%; 3,172 Å - 38,54%; 3,141 Å - 40,71%; 2,999 Å - 25,82%; 2,839 Å - 25,82%; 2,773 Å - 25,06%; 2,722 Å - 27,38%; 2,542 Å - 25,02%; 2,359 Å - 23,68%; 2,192 Å - 22,85%; 2,117 Å - 21,83%.
Термоаналитические исследования известной кристаллической модификации софосбувира (Форма 1), которую использовали в качестве исходного вещества и полученного из нее соединения проводили на DSC 204 F1 Рое-nix (NETZSCH, Германия) в токе аргона при повышении температуры со скоростью 10 град/мин. В качестве держателей образцов использовали алюминиевые кюветы. Навеска пробы составляла (5-10) мг. Полученные данные приведены на рис. 5 и рис. 6. Видно, что на кривой дифференциальной сканирующей калориметрии новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата (рис. 6) наблюдаются 2 эндотермических пика при температурах (39,7-48,1)°С и (120,7-125,9)°С, а на кривой ДСК известной кристаллической модификации софосбувира - Формы 1 присутствует только один эндотермический пик при (97,4-106,7)°С (см. рис. 5). Отметим, что согласно литературным источникам, представленным в табл. 4, на термограммах известных кристаллических модификаций присутствуют по одному эндотермическому пику.
Таким образом, проведенные термоаналитические эксперименты показали, что полученная новая, не известная ранее, слабозакристаллизованная β - модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата характеризуется наличием двух эндотермических эффектов на кривой ДСК при температурах (39,7-48,1)°С и (120,7-125,9)°С в отличие от известных модификаций софосбувира.
Приведенные экспериментальные данные рентгенофазового анализа и термоаналитических исследований однозначно свидетельствуют о том, что полученная новая, не известная ранее, слабозакристаллизованная β - модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата характеризуется отличной от других кристаллических модификаций софосбувира совокупностью межплоскостных расстояний и соответствующих им интенсивностей и наличием двух эндотермических эффектов на кривой ДСК.
Способ получения новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, заключается в том, что софосбувир растворяют в органическом растворителе при 25°С-70°С, смешивают полученный раствор с дистиллированной водой в соотношении 1:2 - 1:10, замораживают при скорости охлаждения не ниже 60 град/мин, подвергают сублимационной сушке и дополнительно отжигают при температурах (50-85)°С в течение не менее 1 часа с последующим охлаждением до комнатной температуры со скоростью не выше 5 град/час.
Отличие способа получения заявляемой новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата от способа получения известных кристаллических форм софосбувира состоит в том, что софосбувир растворяют в органическом растворителе при 25°С-70°С, смешивают полученный раствор с дистиллированной водой в соотношении 1:2 - 1:10, замораживают при скорости охлаждения не ниже 60 град/мин, подвергают сублимационной сушке и дополнительно отжигают при температурах (50-85)°С в течение не менее 1 часа с последующим охлаждением до комнатной температуры со скоростью не выше 5 град/час.
Предложенный способ получения, заключающийся в том, что софосбувир растворяют в органическом растворителе при 25°С-70°С, смешивают полученный раствор с дистиллированной водой в соотношении 1:2 - 1:10, замораживают при скорости охлаждения не ниже 60 град/мин, подвергают сублимационной сушке и дополнительно отжигают при температурах (50-85)°С в течение не менее 1 часа с последующим охлаждением до комнатной температуры со скоростью не выше 5 град/час, позволяет получить новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфорил-амино)пропаноата.
В качестве органического растворителя возможно использование низших спиртов, ацетона, ацетонитрила, диметилсульфоксида и других, которые смешиваются с водой.
Приготовление раствора софосбувира при повышенных температурах было использовано для ускорения процесса растворения (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата.
Уменьшение температуры раствора софосбувира в органическом растворителе ниже 25°С (комнатной температуры) не целесообразно поскольку требует дополнительных затрат энергии на охлаждение системы.
Увеличение температуры раствора софосбувира в органическом растворителе выше 70°С также не целесообразно из-за необходимости применения специального оборудования.
Смешивание органического раствора софосбувира в органическом растворителе с водой в соотношении менее 1:2 приводит к тому, что в этих условиях образуется одна из известных модификаций софосбувира. Получить новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата в чистом виде не удается.
Смешивание органического раствора софосбувира в органическом растворителе с водой в соотношении более 1:10 не приводит к увеличению выхода целевого продукта - новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата и лишь удорожает производство.
Уменьшение скорости замораживания ниже 60 град/мин скорость криокристаллизации раствора софосбувира уменьшается и приближается к равновесному процессу. Это приводит к получению уже известных модификаций. Получить новую, не известную ранее, кристаллическую β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата в чистом виде не удается. Отметим, что известный способ замораживания раствора, содержащий софосбувир (WO 2016/023905 А1 18.02.2016 г.) предполагает замораживание в бане с жидким азотом. В этих условиях, как правило, реализуется скорость замораживания не выше 50 град/мин.
Сублимационная сушка замороженного раствора софосбувира необходима для получения сухого порошка, который в дальнейшем позволяет формировать собственно новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата. Предпочтительным режимом сублимационной сушки является процесс, которую проводят при температурах: на конденсаторе -42°С… -56°С; на продукте -196…+50°С и остаточном давлении в камере (9-3)×10-2 Торр в течение 22-26 ч.
Дополнительный отжиг продуктов сублимационной сушки при температурах (50-85)°С в течение не менее 1 часа с последующим охлаждением до комнатной температуры со скоростью не выше 5 град/час, позволяет получить собственно новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата.
Уменьшение температуры дополнительного отжига продуктов сублимационной сушки ниже 50°С приводит к тому, что в этих условиях образуется одна из известных модификаций софосбувира. Получить новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата в чистом виде не удается.
Увеличение температуры дополнительного отжига продуктов сублимационной сушки выше 85°С приводит к тому, что в этих условиях образуется одна из известных модификаций софосбувира. Получить новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата в чистом виде не удается.
Выдержка продуктов сублимационной сушки при температурах (50-85)°С в течение менее 1 часа приводит к тому, что в этих условиях образуется одна из известных модификаций софосбувира. Получить новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата в чистом виде не удается.
Увеличение скорости охлаждения порошка от температуры (50-85)°С до комнатной температуры со скоростью выше 5 град/час приводит к тому, что в этих условиях образуется одна из известных модификаций софосбувира. Получить новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата в чистом виде не удается.
Возможность осуществления предлагаемого изобретения иллюстрируется следующими примерами, но не ограничивается ими.
Пример 1. В 35 мл органического растворителя - метилового спирта марки «ХЧ» ГОСТ 2222-95 фирмы «ООО Вектон-М, РФ» при перемешивании растворяют 0,35 г известной кристаллической модификации софосбувира (Форма 1) при 25°С, смешивают полученный раствор с 70 мл дистиллированной воды (соотношение 1:2) и замораживают со скоростью 60 град/мин вливанием сразу всего объема раствора в предварительно наполненный жидким азотом (Ткип=-196°С), но не охлажденный предварительно, поддон из нержавеющей стали. Замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -52°С…-56°С; на продукте -196°С…+30°С и остаточном давлении в камере (9-5)⋅10-2 Торр в течение 26 ч. Продукт сублимационной сушки - легкий, пушистый порошок белого цвета, помещают в химический термостойкий стакан вместимостью 100 мл, вносят его в предварительно разогретый до 50°С сушильный шкаф, выдерживают при этой температуре в течение 1 часа и охлаждают до комнатной температуры в течение 12,5 часов (скорость охлаждения - 2 град/час). Выход продукта составил 0,34 г (97,1 мас. %). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 4 и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, представленными в табл. 3. По данным термоаналитических исследований полученное вещество характеризуется типичной кривой дифференциальной сканирующей калориметрии, представленной на рис. 6, характеризующей новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата. Температуры эндотермических пиков полученного порошка равны (39,7-48,1)°С и (120,7-125,9)°С. По данным ВЭЖХ чистота полученной новой, не известной ранее, слабозакристаллизованной β - модификации софосбувира составляет 99,98%.
Пример 2. В 60 мл органического растворителя - ацетонитриле, марки «ХЧ» ТУ 6-094326-76 фирмы «ООО Компонент - Реактив, РФ», при перемешивании растворяют 0,90 г известной кристаллической модификации софосбувира (Форма 1) при 70°С, смешивают полученный раствор с 300 мл дистиллированной воды (соотношение 1:5) и замораживают со скоростью (2-3)×102 град/мин вливанием раствора небольшими порциями в предварительно охлажденный и наполненный жидким азотом (Ткип=-196°С) поддон из нержавеющей стали. Замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -45°С…-51°С; на продукте - 196°С…+50°С и остаточном давлении в камере (9-5)⋅10-2 Торр в течение 22 ч. Продукт сублимационной сушки - легкий, пушистый порошок белого цвета, помещают в химический термостойкий стакан вместимостью 250 мл, вносят его в предварительно разогретый до 85°С сушильный шкаф, выдерживают при этой температуре в течение 2 часов и охлаждают до комнатной температуры в течение 12,0 часов (скорость охлаждения - 5 град/час). Выход продукта составил 0,87 г (96,7 мас. %). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 4 и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, представленными в табл. 3. По данным термоаналитических исследований полученное вещество характеризуется типичной кривой дифференциальной сканирующей калориметрии, представленной на рис. 6, характеризующей новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата. Температуры эндотермических пиков полученного порошка равны (37,5-49,3)°С и (118,4-124,2)°С. По данным ВЭЖХ чистота полученной новой, не известной ранее, слабозакристаллизованной β - модификации софосбувира составляет 99,96%.
Пример 3. В 40 мл органического растворителя - диметилсульфоксиде (ДМСО), марки «ХЧ» ТУ 6-09-3818-77 производства «ООО НПП Викинг, РФ», при перемешивании растворяют 0,50 г известной кристаллической модификации софосбувира (Форма 1) при 60°С, смешивают полученный раствор с 400 мл дистиллированной воды (соотношение 1:10) и замораживают со скоростью примерно 103 град/мин распылением раствора пневматической форсункой при избыточном давлении 0,4 кг/см2 в реактор, наполненный жидким азотом (Ткип=-196°С). Замороженный продукт переносят в поддон из нержавеющей стали и подвергают сублимационной сушке при температурах: на конденсаторе -52°С…-56°С; на продукте -196°С…+40°С, и остаточном давлении в камере (6-3)⋅10-2 Торр в течение 24 ч. Продукт сублимационной сушки - легкий, пушистый порошок белого цвета, помещают в химический термостойкий стакан вместимостью 250 мл, вносят его в предварительно разогретый до 70°С сушильный шкаф, выдерживают при этой температуре в течение 3 часов и охлаждают до комнатной температуры в течение 15,0 часов (скорость охлаждения - 3,0 град/час). Выход продукта составил 0,47 г (94,0 мас. %). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 4 и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, представленными в табл. 3. По данным термоаналитических исследований полученное вещество характеризуется типичной кривой дифференциальной сканирующей калориметрии, представленной на рис. 6, характеризующей новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата. Температуры эндотермических пиков полученного порошка равны (40,8-46,9)°С и (121,8-127,1)°С. По данным ВЭЖХ чистота полученной новой, не известной ранее, слабозакристаллизованной β - модификации софосбувира составляет 99,97%.
Пример 4. В 200 мл органического растворителя - этилового спирта 95% ГОСТ 51652 - 2000 фирмы «ООО СпиртТорг, РФ» при перемешивании растворяют 15,00 г известной кристаллической модификации софосбувира (Форма 1) при 40°С, смешивают полученный раствор с 1800 мл дистиллированной воды (соотношение 1:9) и замораживают со скоростью (2-3)×102 град/мин вливанием раствора небольшими порциями в предварительно охлажденные и наполненные жидким азотом (Ткип=-196°С) поддоны из нержавеющей стали. Замороженный продукт на поддонах переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -45°С…-50°С; на продукте -196°С…+30°С и остаточном давлении в камере (9-5)⋅10-2 Торр в течение 25 ч. Продукт сублимационной сушки - легкий, пушистый порошок белого цвета, помещают в химический термостойкий стакан вместимостью 1000 мл, вносят его в предварительно разогретый до 80°С сушильный шкаф, выдерживают при этой температуре в течение 1,5 часов и охлаждают до комнатной температуры в течение 25,0 часов (скорость охлаждения - 2,2 град/час). Выход продукта составил 14,80 г (98,7 мас. %). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на рис. 4 и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, представленными в табл. 3. По данным термоаналитических исследований полученное вещество характеризуется типичной кривой дифференциальной сканирующей калориметрии, представленной на рис. 6, характеризующей новую, не известную ранее, слабозакристаллизованную β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидpoпиpимидин-(2H)-ил)-4-фтop-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата. Температуры эндотермических пиков полученного порошка равны (39,5-48,3)°С и (120,5-125,7)°С. По данным ВЭЖХ чистота полученной новой, не известной ранее, слабозакристаллизованной β - модификации софосбувира составляет 99,97%.
Пример 5. Фармацевтическая композиция. Для приготовления 10,00 г известной композиции, включающей в качестве действующего вещества кристаллическую модификацию софосбувира и вспомогательные вещества в соотношении (мас. %):
3,33 г порошка новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диoкco3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата смешивают в течение 10 минут в керамической ступке с вспомогательными веществами: 3,00 г маннитолом (по фармакопее США и Европейской фармакопее), 2,97 г целлюлозой микрокристаллической (по фармакопее США и Европейской фармакопее), 0,50 г кроскармеллозой натрия (по фармакопее США и Европейской фармакопее), 0,05 г кремния диоксида коллоидного (по фармакопее США и Европейской фармакопее) и 0,15 г магния стеарата (по ТУ 6-09-16-1533-90). Полученную смесь подвергали физико-химическим и биологическим методам анализа. По данным РФА в полученной смеси присутствует вещество, которое характеризуется набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой, не известной ранее, слабозакристаллизованной β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, представленными в табл. 3.
Аналогичным способом и идентичным по составу была приготовлена композиция на основе известной кристаллической модификации софосбувира (Форма 1), которую использовали в качестве исходного вещества. По данным РФА в полученной смеси присутствует вещество, которое характеризуется набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для известной модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата (Форма 1), представленными в табл. 2.
Биологические эксперименты проводили на кроликах-самцах массой 2,0-2,5 кг. Для получения надежных результатов в параллельных сериях опытов использовали не менее 5ти кроликов. Определение времени появления софосбувира в крови проводили методом in vivo при пероральном введении композиции с последующим забором плазмы из ушной раковины. Во всех случаях количество вводимого в животное действующего вещества составляло 37,50 мг смеси (12,38 мг софосбувира). Оказалось, что для композиции, содержащей новую, не известную ранее, кристаллическую β - модификацию (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата в крови кроликов равно (14±4) мин, а для известной композиции, содержащей в качестве действующего вещества известную кристаллическую модификацию софосбувира (Форма 1) - (25±4) мин.
Таким образом, нами обнаружена новая, не известная ранее, слабозакристаллизованная β - модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, предложены способ ее получения и применение ее для приготовления фармацевтической композиции в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С.
Полученная новая, не известная ранее, слабозакристаллизованная β - модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата характеризуется, отличным от известных кристаллических модификаций софосбувира набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн, %):
25,638 Å - 15,95%; 21,101 Å - 17,80%; 16,458 Å - 21,57%; 13,368 Å - 26,61%; 12,290 Å - 28,21%; 11,343 Å - 31,14%; 11,032 Å - 40,14%; 01,287 Å - 36,18%; 9,083 Å - 39,89%; 8,458 Å - 43,59%; 7,641 Å - 40,40%; 7,148 Å - 46,78%; 7,013 Å - 54,75%; 6,528 Å - 46,01%; 5,975 Å - 55,33%; 5,225 Å - 79,00%; 5,093 Å - 100,00%; 4,892 Å - 86,15%; 4,707 Å - 98,40%; 4,614 Å - 84,56%; 4,535 Å - 94,38%; 4,505 Å - 90,68%; 4,371 Å - 89,60%; 4,259 Å - 75,49%; 4,008 Å - 62,48%; 3,792 Å - 57,69%; 3,741 Å - 54,50%; 3,539 Å - 47,35%; 3,500 Å - 46,01%; 3,263 Å - 46,27%; 3,172 Å - 38,54%; 3,141 Å - 40,71%; 2,999 Å - 25,82%; 2,839 Å - 25,82%; 2,773 Å - 25,06%; 2,722 Å - 27,38%; 2,542 Å - 25,02%; 2,359 Å - 23,68%; 2,192 Å - 22,85%; 2,117 Å - 21,83%,
и наличием двух эндотермических эффектов на кривой ДСК при температурах (39,7-48,1)°С и (120,7-125,9)°С.
Кроме того, новая, не известная ранее, слабозакристаллизованная β - модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата отличается повышенной биологической активностью в составе фармацевтической композиции по сравнению с действием известной кристаллической модификации софосбувира (Форма 1), которую использовали в качестве исходного вещества.
Из вышеизложенного можно сделать вывод о том, что заявляемая новая, не известная ранее, слабозакристаллизованная β - модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, способ ее получения и применение ее для приготовления фармацевтической композиции в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С являются новыми и удовлетворяют критериям «изобретательский уровень» и «промышленная применимость».

1) WO 2010/135569 А1 от 25.11.2010 г.
2) WO 2015/025853 A1 от 5.03.2015 г.; 3) US 2015/0175646 от 25.06.2015 г.; 4) CN 104125252 А от 5.11.2014 г.;
5) WO 2016/035006 А1 от 10.03.2016 г.; 6) WO 2015/126995 А1 от 27.08.2015 г.

6) WO 2015/126995 A1 от 27.08.2015 г.; 7) WO 2015/191945 A2 от 17.12.2015 г.; 8) WO 2016/038542 А2 от 17.03.2016 г.; 9) WO 2016/008461 A1 от 21.01.2016 г.
10) CN 104277088 А от 14.01.2015 г.; 11) WO 2016/023906 A1 18.02.2016 г.



Изобретение относится к новой безводной модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата для лечения хронического вирусного гепатита С, способу ее получения и фармацевтической композиции на ее основе, которые могут быть использованы в фармацевтической промышленности. Предложена новая β-модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, характеризующаяся следующим набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн, %): 25,638 Å - 15,95%; 21,101 Å - 17,80%; 16,458 Å - 21,57%; 13,368 Å - 26,61%; 12,290 Å - 28,21%; 11,343 Å - 31,14%; 11,032 Å - 40,14%; 01,287 Å - 36,18%; 9,083 Å - 39,89%; 8,458 Å - 43,59%; 7,641 Å - 40,40%; 7,148 Å - 46,78%; 7,013 Å - 54,75%; 6,528 Å - 46,01%; 5,975 Å - 55,33%; 5,225 Å - 79,00%; 5,093 Å - 100,00%; 4,892 Å - 86,15%; 4,707 Å - 98,40%; 4,614 Å - 84,56%; 4,535 Å - 94,38%; 4,505 Å - 90,68%; 4,371 Å - 89,60%; 4,259 Å - 75,49%; 4,008 Å - 62,48%; 3,792 Å - 57,69%; 3,741 Å - 54,50%; 3,539 Å - 47,35%; 3,500 Å - 46,01%; 3,263 Å - 46,27%; 3,172 Å - 38,54%; 3,141 Å - 40,71%; 2,999 Å - 25,82%; 2,839 Å - 25,82%; 2,773 Å - 25,06%; 2,722 Å - 27,38%; 2,542 Å - 25,02%; 2,359 Å - 23,68%; 2,192 Å - 22,85%; 2,117 Å - 21,83%,
и наличием двух эндотермических эффектов на кривой ДСК при температурах 39,7-48,1°C и 120,7-125,9°C с улучшенной эффективностью. Предложен новый эффективный способ получения указанной формы, характеризующийся тем, что софосбувир растворяют в органическом растворителе при 25-70°C, смешивают полученный раствор с дистиллированной водой в соотношении 1:2-1:10, замораживают при скорости охлаждения не ниже 60 град/мин, подвергают сублимационной сушке и дополнительно отжигают при температурах 50-85°C в течение не менее 1 ч с последующим охлаждением до комнатной температуры со скоростью не выше 5 град/ч. 3 н. и 1 з.п. ф-лы, 6 ил., 4 табл., 5 пр.
1. Слабозакристаллизованная β-модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4- метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, характеризующаяся следующим набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн, %):
25,638 Å - 15,95%; 21,101 Å - 17,80%; 16,458 Å - 21,57%; 13,368 Å - 26,61%; 12,290 Å - 28,21%; 11,343 Å - 31,14%; 11,032 Å - 40,14%; 01,287 Å - 36,18%; 9,083 Å - 39,89%; 8,458 Å - 43,59%; 7,641 Å - 40,40%; 7,148 Å - 46,78%; 7,013 Å - 54,75%; 6,528 Å - 46,01%; 5,975 Å - 55,33%; 5,225 Å - 79,00%; 5,093 Å - 100,00%; 4,892 Å - 86,15%; 4,707 Å - 98,40%; 4,614 Å - 84,56%; 4,535 Å - 94,38%; 4,505 Å - 90,68%; 4,371 Å - 89,60%; 4,259 Å - 75,49%; 4,008 Å - 62,48%; 3,792 Å - 57,69%; 3,741 Å - 54,50%; 3,539 Å - 47,35%; 3,500 Å - 46,01%; 3,263 Å - 46,27%; 3,172 Å - 38,54%; 3,141 Å - 40,71%; 2,999 Å - 25,82%; 2,839 Å - 25,82%; 2,773 Å - 25,06%; 2,722 Å - 27,38%; 2,542 Å - 25,02%; 2,359 Å - 23,68%; 2,192 Å - 22,85%; 2,117 Å - 21,83%,
и наличием двух эндотермических эффектов на кривой ДСК при температурах 39,7-48,1°C и 120,7-125,9°C.
2. Способ получения слабозакристаллизованной β-модификации (S)-изопропил 2-((S)- (((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата по п. 1, характеризующийся тем, что софосбувир растворяют в органическом растворителе при 25-70°C, смешивают полученный раствор с дистиллированной водой в соотношении 1:2-1:10, замораживают при скорости охлаждения не ниже 60 град/мин, подвергают сублимационной сушке и дополнительно отжигают при температурах 50-85°C в течение не менее 1 ч с последующим охлаждением до комнатной температуры со скоростью не выше 5 град/ч.
3. Способ по п. 2, характеризующийся тем, что сублимационную сушку замороженного раствора софосбувира проводят при температурах: на конденсаторе (-43)-(-56)°C; на продукте (-196)-(+50)°C и остаточном давлении в камере (9-3)×10-2 Topp в течение 22-26 ч.
4. Применение слабозакристаллизованной β-модификации (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4- метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата по п. 1 для приготовления фармацевтической композиции в качестве нуклеотидного ингибитора полимеразы для лечения хронического вирусного гепатита С.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| WO 2015025853 А1, 05.03.2015 | |||
| WO 2015097605 А1, 02.07.2015 | |||
| WO 2015099989 А1, 02.07.2015 | |||
| CN 104125252 А, 05.11.2014 | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| CN 104277088 А, 14.01.2015 | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| WO 2016189443 A2, 01.12.16 | |||
| Ming-Hui Qi et al., Crystal Growth & Design (2015), 15(10), 5062-5067 | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ЦИЛИНДРИЧЕСКИХ И КОНИЧЕСКИХ РОЛИКОПОДШИПНИКОВСЕПАРАТОР | 0 |
|
SU235513A1 |
| Sofia Michael J | |||
| et al., Journal of Medicinal Chemistry (2010), 53(19), 7202-7218 | |||
| WO 2016023905 А1, 18.02.2016 | |||
| US 20150175646 A1, 25.06.2015 | |||
| НУКЛЕОЗИДФОСФОРАМИДАТЫ В КАЧЕСТВЕ ПРОТИВОВИРУСНЫХ АГЕНТОВ | 2008 |
|
RU2478104C2 |
Авторы
Даты
2018-06-04—Публикация
2017-06-13—Подача