Область техники, к которой относится изобретение
Настоящее изобретение относится к новому фармацевтическому применению антитела против CAPRIN-1 или его фрагменту в качестве средства для лечения и/или профилактики рака.
Уровень техники
Рак является лидирующей причиной смертности. Проводимая в настоящее время терапия, главным образом, включает хирургическое вмешательство в сочетании с лучевой терапией и химиотерапией. Несмотря на разработку новых хирургических приемов и открытие новых противораковых средств в последние годы, результаты лечения рака ненамного улучшились в последнее время, за исключением некоторых типов рака. Недавние успехи в молекулярной биологии или иммунологии рака привели к идентификации антител, специфично взаимодействующих с раковым заболеванием, раковых антигенов, узнаваемых цитотоксическими T-клетками, генов, кодирующих раковые антигены и тому подобного. Потребность в специфичной терапии рака, нацеленной на раковые антигены, возрастает (непатентная литература 1).
При терапии рака желательно, чтобы пептиды, полипептиды или белки, распознаваемые в качестве антигенов, почти не присутствовали в нормальных клетках, но присутствовали специфично в раковых клетках, чтобы уменьшить побочные эффекты. В 1991 году Boon с соавторами (Ludwig Institute for Cancer Research, Belgium) выделили антиген меланомы человека MAGE1, узнаваемый CD8-позитивными T-клетками, способом клонирования кДНК на основе экспрессии с использованием аутологичных линий раковых клеток и реактивных по отношению к опухоли T-клеток (непатентная литература 2). Впоследствии сообщили о способе SEREX (серологическая идентификация антигенов посредством основанного на экспрессии рекомбинантов клонирования), который включает в себя идентификацию опухолевых антигенов, узнаваемых антителами, которые продуцируются in vivo в ответ на аутологичный рак у пациента с раковым заболеванием, способом клонирования генов на основе экспрессии (непатентная литература 3 и патентная литература 1). С применением такого способа были выделены некоторые раковые антигены, которые практически не экспрессируются в нормальных клетках, но специфично экспрессируются в раковых клетках (непатентная литература 4-9). Кроме того, проводили клинические испытания клеточной терапии, нацеленной на некоторые раковые антигены, с использованием иммуноцитов, специфично отвечающих на раковые антигены, или специфичной по отношению к раковому заболеванию иммунотерапии с использованием вакцин или тому подобного, содержащих раковые антигены.
Тем временем, в последние годы во всем мире появились различные лекарства на основе антител, мишенью которых являются антигенные белки на раковых клетках, для лечения рака. Лекарства на основе антител оказывают некоторое фармакологическое действие в качестве специфичных для рака терапевтических средств, и поэтому привлекают внимание. Однако большинство антигенных белков, которые должны быть мишенями, также экспрессируются в нормальных клетках, так что не только раковые клетки, но и нормальные клетки, экспрессирующие антигены, также повреждаются в результате введения антител. Полученные побочные эффекты являются поводом для беспокойства. Поэтому предполагается, что идентификация раковых антигенов, которые специфично экспрессируются на поверхности раковой клетки, и применение антител, мишенью которых являются раковые антигены, в качестве фармацевтических средств позволит осуществить лечение основанными на антителах лекарственными средствами с более низкими побочными эффектами.
Цитоплазматический и ассоциированный с пролиферацией белок 1 (CAPRIN-1) экспрессируется, когда нормальные клетки в фазе покоя активируются или подвергаются клеточному делению, и он является внутриклеточным белком, который, как известно, образует внутриклеточные стрессовые гранулы с РНК в клетках для участия в транспорте мРНК и регуляции трансляции. При этом существует много других названий указанного CAPRIN-1, таких как GPI-заякоренный мембранный белок 1 или поверхностный маркерный белок 1 мембранного компонента (M11S1), поскольку такие белки были известны как якобы белки клеточной мембраны. Такие названия происходят на основании сообщения о том, что последовательность гена CAPRIN-1 соответствует мембранному белку, имеющему GPI-связывающую область и экспрессируемому в раковых клетках прямой и ободочной кишки (непатентная литература 10). Однако последовательность гена CAPRIN-1, представленная в указанном сообщении, оказалась неправильной, как было выявлено позднее. Недавно появилось следующее сообщение; а именно делеция одного нуклеотида в последовательности гена CAPRIN-1, зарегистрированной в GenBank или тому подобной, вызывает сдвиг рамки, так что происходит утрата 80 аминокислот из C-конца, приводя к образованию артефакта (74 аминокислоты), который соответствует GPI-связывающей части, указанной в предыдущем сообщении, и кроме того, также присутствует другая ошибка с 5'-стороны генной последовательности, так что происходит утрата 53 аминокислот из N-конца (непатентная литература 11). Также недавно появилось сообщение о том, что белок, кодируемый последовательностью гена CAPRIN-1, зарегистрированной в GenBank или тому подобной, не является белком клеточной мембраны (непатентная литература 11).
Кроме того, на основе сообщения в непатентной литературе 10 о том, что CAPRIN-1 является белком клеточной мембраны, в патентной литературе 2 и 3 описано, что CAPRIN-1 (в качестве белка клеточной мембраны) под названием M11S1 может быть использован в качестве мишени для основанного на антителах лекарственного средства при терапии рака, хотя в рабочих примерах не описано лечение с применением антитела против данного белка. Однако, как сообщается в непатентной литературе 11, обычно полагали со времени подачи патентного документа 2 до настоящего времени, что CAPRIN-1 не экспрессируется на поверхности клетки. Содержание патентных документов 2 и 3, основанных только на неверной информации о том, что CAPRIN-1 является белком клеточной мембраны, не следует понимать как обычный уровень техники, известный специалистам в данной области.
Литература известного уровня техники
Патентная литература
Патентная литература 1: патент США № 5698396;
Патентная литература 2: US2008/0075722;
Патентная литература 3: WO2005/100998.
Непатентная литература
Непатентная литература 1: Tsuyoshi Akiyoshi, “Gan To Kagaku-Ryoho (Cancer and Chemotherapy),” 1997, Vol. 24, p.551-519 (Cancer and Chemotherapy Publishers, Inc., Japan)
Непатентная литература 2 Bruggen P. et al., Science, 254: 1643-1647 (1991)
Непатентная литература 3: Proc. Natl. Acad. Sci. U.S.A, 92: 11810-11813 (1995)
Непатентная литература 4: Int. J. Cancer, 72: 965-971 (1997)
Непатентная литература 5: Cancer Res., 58: 1034-1041 (1998)
Непатентная литература 6: Int. J. Cancer, 29: 652-658 (1998)
Непатентная литература 7: Int. J. Oncol., 14: 703-708 (1999)
Непатентная литература 8: Cancer Res., 56: 4766-4772 (1996)
Непатентная литература 9: Hum. Mol. Genet6: 33-39, 1997
Непатентная литература 10: J. Biol. Chem., 270: 20717-20723, 1995
Непатентная литература 11: J. Immunol., 172: 2389-2400, 2004.
Сущность изобретения
Проблема, решаемая изобретением
Целями настоящего изобретения являются: идентификация белка ракового антигена, специфично экспрессируемого на поверхности раковой клетки, и применение антитела, мишенью которого является белок ракового антигена, в качестве средства для лечения и/или профилактики рака.
Способы решения проблемы
В результате интенсивных исследований авторы настоящего изобретения в настоящее время получили кДНК, кодирующую белок, который связывается с антителом, присутствующем в сыворотке собак с раком молочной железы, способом SEREX, используя как библиотеки кДНК, полученные из тканей семенников собак, так и сыворотки собак с раком молочной железы. Кроме того, авторы настоящего изобретения получили в настоящее время белки CAPRIN-1, имеющие аминокислотные последовательности, пронумерованные четными числами среди последовательностей SEQ ID NO: 2-30, и антитела против таких белков CAPRIN-1, на основе полученного гена собак и соответствующих гомологичных генов человека, коровы, лошади, мыши и кур. Таким образом, авторы настоящего изобретения обнаружили в настоящее время, что CAPRIN-1 специфично экспрессируется в клетках рака молочной железы, опухоли головного мозга, лейкоза, лимфомы, рака легкого, рака шейки матки, рака мочевого пузыря, рака пищевода, рака прямой и ободочной кишки, раке желудка и рака почек, и что часть белка CAPRIN-1 специфично экспрессируется на поверхности каждой раковой клетки. Таким образом, авторы изобретения в настоящее время обнаружили, что антитело или антитела против части CAPRIN-1, экспрессируемой на поверхности каждой раковой клетки, является/являются цитотоксичными для CAPRIN-1-экспрессирующих раковых клеток. На основе указанных открытий было осуществлено настоящее изобретение, которое описано ниже.
Настоящее изобретение имеет следующие отличительные признаки.
Настоящее изобретение относится к фармацевтической композиции для лечения и/или профилактики рака, содержащей антитело, которое содержит вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO: 39, 40 и 41, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO: 43, 44 и 45, или его фрагмент в качестве активного ингредиента и обладает иммунологической реактивностью по отношению к белку CAPRIN-1.
В одном варианте указанный выше рак представляет собой рак молочной железы, опухоль головного мозга, лейкоз, лимфому, рак легкого, рак шейки матки, рак мочевого пузыря, рак пищевода, рак прямой и ободочной кишки, рак желудка или рак почек.
В другом варианте указанное выше антитело является человеческим антителом, гуманизированным антителом, химерным антителом, одноцепочечным антителом или биспецифичным антителом.
Настоящее описание включают все или часть содержания, которое раскрыто в описаниях и/или на чертежах в заявках на выдачу патента Японии № 2010-023452, на основании которых настоящая заявка притязает на приоритет.
Результаты изобретения
Антитело против CAPRIN-1, применяемое в настоящем изобретении, является цитотоксичным для раковых клеток. Как таковое антитело против CAPRIN-1 применимо для лечения или профилактики раковых заболеваний.
Краткое описание чертежей
Фиг. 1 показывает картины экспрессии генов, кодирующих белки CAPRIN-1, в нормальных тканях и в линиях опухолевых клеток. Обозначение № 1 указывает на картины экспрессии генов, кодирующих белки CAPRIN-1, и обозначение № 2 указывает на картины экспрессии генов GAPDH.
Фиг. 2 показывает цитотоксичность моноклонального анти-CAPRIN-1-антитела №1 (которое взаимодействует с поверхностями раковых клеток), направленную против линии раковых клеток молочной железы MDA-MB-157, экспрессирующих CAPRIN-1. Обозначение № 3 указывает активность, проявляемую в случае, когда добавляли моноклональное анти-CAPRIN-1-антитело №1. Обозначение №4 указывает на активность, проявляемую в случае добавления PBS вместо антител.
Фиг. 3 показывает противоопухолевое действие моноклонального анти-CAPRIN-1-антитела №1 (которое взаимодействует с поверхностями раковых клеток) у мышей Balb/c, которым трансплантировали линию раковых клеток молочной железы мыши 4T1, экспрессирующих CAPRIN-1. Обозначение №5 указывает размер опухоли у мыши, которой вводили моноклональное анти-CAPRIN-1-антитело №1. Обозначение №6 указывает размер опухоли у мыши, которой вводили PBS вместо антител.
Способ осуществления изобретения
Противоопухолевую активность антитела против полипептида, представленного любой из последовательностей SEQ ID NO: 2-30, пронумерованных четными числами, используемого в настоящем изобретении, можно оценить благодаря определению in vivo подавления опухолевого роста у животных с раковым заболеванием или благодаря исследованию того, проявляет ли антитело или не проявляет цитотоксичность посредством иммуноцитов или комплемента по отношению к опухолевым клеткам, экспрессирующим полипептид, in vitro, как описано далее.
В данном контексте нуклеотидные последовательности полинуклеотидов, кодирующих белки, содержащие аминокислотные последовательности, пронумерованные четными числами (т.е., SEQ ID NO: 2, 4, 6,..., 28, 30) среди последовательностей SEQ ID NO: 2-30, представлены последовательностями, пронумерованными нечетными числами (т.е., SEQ ID NO: 1, 3, 5,..., 27, 29) среди последовательностей SEQ ID NO: 1-29.
Аминокислотные последовательности, которые представлены в виде SEQ ID NO: 6, 8, 10, 12 и 14 в списке последовательностей, приведенном в настоящем описании, представляют собой аминокислотные последовательности CAPRIN-1, выделенные в виде полипептидов, которые связываются с антителами, специфично присутствующими в сыворотке от собаки с раковым заболеванием, способом SEREX с использованием библиотеки кДНК из ткани семенников собаки и сыворотки собаки с раком молочной железы. Аминокислотные последовательности, представленные в виде SEQ ID NO: 2 и 4, представляют собой аминокислотные последовательности CAPRIN-1, выделенные в виде гомологов человека. Аминокислотная последовательность, представленная в SEQ ID NO: 16, является аминокислотной последовательностью CAPRIN-1, выделенной в качестве гомолога, присутствующего у коров. Аминокислотная последовательность, представленная в SEQ ID NO: 18, является аминокислотной последовательностью CAPRIN-1, выделенной в качестве гомолога, присутствующего у лошади. Аминокислотные последовательности, представленные SEQ ID NO: 20-28, являются аминокислотными последовательностями CAPRIN-1, выделенными в качестве мышиных гомологов. Аминокислотная последовательность, представленная в виде SEQ ID NO: 30, является аминокислотной последовательностью CAPRIN-1, выделенного в качестве куриного гомолога (см. пример 1, описанный далее). Известно, что CAPRIN-1 экспрессируется, когда нормальные клетки в фазе покоя подвергаются активации или стимуляции клеточного деления.
Было известно, что CAPRIN-1 не экспрессируется на поверхности клеток. Однако в результате исследования, проведенного авторами настоящего изобретения, в настоящее время выявлено, что часть белка CAPRIN-1 экспрессируется на поверхности различных раковых клеток. Таким образом, было обнаружено, что антитело, обладающее иммунологической реактивностью по отношению к неполной области белка CAPRIN-1, которая экспрессируется на поверхности раковых клеток, или специфично узнающее данную область (то есть, специфично связывающееся с данной областью) и содержащее вариабельную область тяжелой цепи, которая содержит последовательности SEQ ID NO: 39, 40 и 41, и вариабельную область легкой цепи, которая содержит последовательности SEQ ID NO: 43, 44 и 45, проявляет противоопухолевую активность.
Описанное выше анти-CAPRIN-1-антитело, используемое в настоящем изобретении, может быть моноклональным антителом любого типа, при условии, что оно может проявлять противоопухолевую активность. Примеры таких антител включают рекомбинантные антитела, такие как синтетические антитела, полиспецифичные антитела, гуманизированные антитела, химерные антитела и одноцепочечные антитела (scFv), человеческие антитела и их фрагменты, такие как Fab, F(ab')2 и Fv. Такие антитела и их фрагменты могут быть получены способами, известными специалистам в данной области. Также в том случае, когда субъектом является человек, требуются человеческие антитела или гуманизированные антитела, чтобы избежать или подавить отторжение.
Термин «специфично связывающееся с неполной областью белка CAPRIN-1» в используемом в настоящем описании смысле означает, что «антитело специфично связывается с конкретной областью белка CAPRIN-1, но по существу не связывается с другими частями белка, отличными от такой области».
Противоопухолевую активность антитела, которое можно применять в настоящем изобретении, можно оценивать, как описано ниже, путем исследования in vivo подавления роста опухоли у животных с раковым заболеванием или путем исследования того, проявляет ли оно или не проявляет цитотоксическую активность in vitro, которая опосредована иммуноцитами или комплементом, по отношению к опухолевым клеткам, экспрессирующим полипептид.
Кроме того, примерами субъектов для лечения и/или профилактики рака согласно настоящему изобретению являются млекопитающие, такие как человек, комнатные животные, домашние животные и животные для соревнований. Предпочтительным субъектом является человек.
Получение антигенов и антител и фармацевтических композиций, относящихся к настоящему изобретению, описано ниже.
Получение антигенов для получения антител
Белки или их фрагменты, используемые в качестве сенсибилизирующих антигенов для получения анти-CAPRIN-1-антител, применяемых в настоящем изобретении, могут быть получены из любого вида животного без особого ограничения, такого как человек, собаки, крупный рогатый скот, лошади, мыши, крысы и куры. Однако белки или их фрагменты предпочтительно выбраны с учетом совместимости с исходными клетками, используемыми для слияния клеток. В общем, предпочтительными являются полученные от млекопитающих белки и, в частности, предпочтительным является белок, полученный из организма человека. Например, когда CAPRIN-1 является CAPRIN-1 человека, можно использовать белок CAPRIN-1 человека, его неполный пептид или клетки, экспрессирующие CAPRIN-1 человека.
Нуклеотидные последовательности и аминокислотные последовательности CAPRIN-1 человека и его гомологов можно получить, осуществляя доступ в GenBank (NCBI, U.S.A.) и используя такие алгоритмы, как BLAST или FASTA (Karlin and Altschul, Proc. Natl. Acad. Sci. U.S.A., 90: 5873-5877, 1993; Altschul et al., Nucleic Acids Res. 25: 3389-3402, 1997).
В настоящем изобретении на основе нуклеотидной последовательности (SEQ ID NO: 1 или 3) или аминокислотной последовательности (SEQ ID NO: 2 или 4) CAPRIN-1 человека определили, что нуклеиновая кислота-мишень или белок-мишень содержит последовательность, имеющую 70-100%, предпочтительно 80-100%, более предпочтительно 90-100%, еще более предпочтительно 95%-100% (например, 97-100%, 98-100%, 99-100% или 99,5-100%) идентичность последовательности с нуклеотидной последовательностью или аминокислотной последовательностью ORF или зрелой части CAPRIN-1 человека. В используемом в настоящем описании смысле термин «идентичность последовательности в %» относится к процентному содержанию (%) идентичных аминокислот (или нуклеотидов) относительно общего количества аминокислот (или нуклеотидов) при выравнивании двух последовательностей для достижения наибольшего сходства с введением или без введения пробелов.
Длина фрагмента белка CAPRIN-1 варьируется от длины аминокислот эпитопа (антигенной детерминанты), который является минимальной единицей, узнаваемой антителом, до длины, составляющей менее полной длины белка. Термин «эпитоп» относится к полипептидному фрагменту, обладающему антигенностью или иммуногенностью у млекопитающих, предпочтительно у человека, и минимальная единица эпитопа состоит примерно из 7-12 аминокислот (например, 8-11 аминокислот).
Полипептиды, содержащие указанный выше белок CAPRIN-1 человека или неполные пептиды белка, могут быть синтезированы способом химического синтеза, таким как Fmoc-способ (способ с использованием флуоренилметилоксикарбонила) или tBoc-способ (способ с использованием трет-бутилоксикарбонила) (под редакцией The Japanese Biochemical Society, Seikagaku Jikken Koza (Biochemical Experimental Lecture Series) 1, Protein Chemistry IV, Chemical Modification and Peptide Synthesis, TOKYO KAGAKU DOZIN (Japan), 1981). Альтернативно указанные выше полипептиды также могут быть синтезированы обычными способами с использованием различных коммерчески доступных синтезаторов пептидов. Кроме того, с применением известных способов генетической инженерии (например, Sambrook et al., Molecular Cloning, 2nd Edition, Current Protocols in Molecular Biology (1989), Cold Spring Harbor Laboratory Press, Ausubel et al., Short Protocols in Molecular Biology, 3rd Edition, A compendium of Methods from Current Protocols in Molecular Biology (1995), John Wiley & Sons) получают полинуклеотид, кодирующий указанный выше полипептид, и затем включают в экспрессирующий вектор, который затем вводят в клетку-хозяина, чтобы получить представляющий интерес полипептид в клетке-хозяине, и затем извлекают его.
Полинуклеотиды, кодирующие указанные выше полипептиды, можно легко получить известными способами генетической инженерии или обычными способами с использованием коммерчески доступного синтезатора нуклеиновых кислот. Например, ДНК, содержащая нуклеотидную последовательность SEQ ID NO: 1, может быть получена в ПЦР с использованием библиотеки хромосомной ДНК человека или кДНК в качестве матрицы и пары праймеров, сконструированных так, чтобы можно было амплифицировать нуклеотидную последовательность, представленную в SEQ ID NO: 1. Условия ПЦР могут быть соответствующим образом определены. Например, условия ПЦР включают в себя проведение 30 следующих циклов реакции: денатурация при 94°C в течение 30 секунд; отжиг при 55°C в течение периода времени от 30 секунд до 1 минуты; и элонгация при 72°C в течение 2 минут, с использованием термостабильной ДНК-полимеразы (например, Taq-полимеразы или Pfu-полимеразы) и буфера для ПЦР, содержащего Mg2+, с последующим проведением реакции при 72°C в течение 7 минут. Однако условия ПЦР не ограничены приведенным выше примером. Способы ПЦР, условия и тому подобное описаны в публикации Ausubel с соавторами (Short Protocols in Molecular Biology, 3rd Edition, A compendium of Methods from Current Protocols in Molecular Biology (1995), John Wiley and Sons (в частности в главе 15)).
Также на основе информации о нуклеотидной последовательности и аминокислотной последовательности, представленной в виде последовательностей SEQ ID NO: 1-30 в списке последовательностей, приведенном в настоящем описании, получают соответствующие зонды или праймеры и затем, используя их, проводят скрининг библиотеки кДНК человека или тому подобной, с тем, так что можно выделить требуемую ДНК. Библиотеку кДНК предпочтительно конструируют из клеток, органов или тканей, которые экспрессируют белки, имеющие последовательности SEQ ID NO: 2-30, пронумерованные четными числами. Примеры таких клеток или тканей включают клетки или ткани, полученные из семенников, и раковые заболевания или опухоли, такие как лейкоз, рак молочной железы, лимфома, опухоль головного мозга, рак легкого, рак прямой и ободочной кишки и тому подобные. Способы, такие как получение зондов или праймеров, конструирование библиотеки кДНК, скрининг библиотеки кДНК и клонирование генов-мишеней, известны специалисту в данной области и могут быть осуществлены способами, описанными Sambrook с соавторами (Molecular Cloning, 2nd Edition, Current Protocols in Molecular Biology (1989)), Ausbel с соавторами (выше), и тому подобными. Из полученной таким образом ДНК может быть получена ДНК, кодирующая белок CAPRIN-1 человека или его неполный пептид.
Клетками-хозяевами могут быть любые клетки, при условии, что они могут экспрессировать указанный выше полипептид. Примерами прокариотических клеток являются без ограничения клетки Escherichia coli и тому подобные. Примерами эукариотических клеток являются без ограничения клетки млекопитающих, такие как клетки почки обезьяны (COS1) и клетки яичника китайского хомячка (CHO), линия клеток почки плода человека (HEK293), линии клеток кожи плода мыши (NIH3T3), дрожжевые клетки, такие как почкующиеся дрожжи и делящиеся дрожжи, клетки шелкопряда и ооциты Xenopus.
В случае использования прокариотических клеток в качестве клеток-хозяев экспрессирующий вектор, используемый в настоящем изобретении, содержит начало, реплицируемое в прокариотических клетках, промотор, сайт связывания рибосомы, сайт множественного клонирования, терминатор, ген лекарственной резистентности, ген, комплементирующий ауксотрофность, и тому подобное. Примеры экспрессирующего вектора для Escherichia coli включают вектор на основе pUC, pBluescript II, систему экспрессии pET и систему экспрессии pGEX. ДНК, кодирующую указанный выше полипептид, включают в такой экспрессирующий вектор, прокариотические клетки-хозяева трансформируют вектором, полученные таким образом трансформированные клетки культивируют и, таким образом, полипептид, кодируемый ДНК, может быть экспрессирован в прокариотических клетках-хозяевах. В то же время полипептид также может быть экспрессирован в виде белка, слитого с другим белком.
При использовании в качестве клеток-хозяев эукариотических клеток экспрессирующий вектор, используемый в настоящем изобретении, представляет собой экспрессирующий вектор для эукариотических клеток, который содержит промотор, область сплайсинга, сайт добавления поли(A) и тому подобное. Примеры такого экспрессирующего вектора включают pKA1, pCDM8, pSVK3, pMSG, pSVL, pBK-CMV, pBK-RSV, вектор EBV, pRS, pcDNA3 и pYES2. Подобно упоминаемому выше случаю ДНК, кодирующую указанный выше полипептид, включают в такой экспрессирующий вектор, эукариотические клетки-хозяева трансформируют вектором, полученные таким образом трансформированные клетки культивируют и таким образом, полипептид, кодируемый ДНК, может быть экспрессирован в эукариотических клетках-хозяевах. Когда используют векторы pIND/V5-His, pFLAG-CMV-2, pEGFP-N1, pEGFP-C1 или тому подобные в качестве экспрессирующего вектора, указанный выше полипептид может быть экспрессирован в виде слитого белка, к которому может быть добавлена метка из числа различных меток, таких как His-метка (например, (His)6-(His)10), FLAG-метка, myc-метка, HA-метка и GFP.
Для введения экспрессирующего вектора в клетки-хозяева можно применять известный способ, такой как электропорация, способ с использованием фосфата кальция, способ на основе липосом, способ с использованием DEAE-декстрана, микроинъекция, вирусная инфекция, липофекция и связывание с проникающим через клеточную мембрану пептидом.
Представляющий интерес полипептид может быть выделен и очищен из клеток-хозяев с использованием сочетания известных способов разделения. Примеры таких способов включают без ограничения обработку денатурирующим агентом, таким как мочевина или поверхностно-активное вещество, обработку ультразвуком, ферментативное расщепление, высаливание или фракционирование в растворителях и преципитация, диализ, центрифугирование, ультрафильтрация, гель-фильтрация, SDS-ПААГ, изоэлектрическое фокусирование ионообменная хроматография, гидрофобная хроматография, аффинная хроматография и обращено-фазовая хроматография.
Структура антитела
Антитело является гетеромультимерным гликопротеидом, который, в общем, содержит, по меньшей мере, две тяжелых цепи и две легких цепи. Антитела, отличные от IgM, представляют собой гетеротетрамерный гликопротеид с молекулярной массой примерно 150 кДа, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Обычно каждая легкая цепь связана с тяжелой цепью одной дисульфидной ковалентной связью, однако количество дисульфидных связей между тяжелыми цепями различных изотипов иммуноглобулинов варьируют. Каждая тяжелая цепь или каждая легкая цепь также имеет внутрицепочечную дисульфидную связь. Каждая тяжелая цепь имеет вариабельный домен (VH-область) на одном конце, за которой следует несколько константных областей. Каждая легкая цепь имеет вариабельный домен (VL-область) и имеет одну константную область на конце, противоположном другому концу. Константная область легкой цепи совмещена с первой константной областью тяжелой цепи, а вариабельный домен легкой цепи совмещен с вариабельным доменом тяжелой цепи. Специфичная область вариабельного домена антитела имеет специфичную вариабельность, и такую область называют определяющей комплементарность областью (CDR), в силу того, что она придает антителу специфичность связывания. Часть вариабельной области, которая является относительно консервативной, называют каркасной областью (FR). Полные вариабельные домены тяжелой цепи и легкой цепи по отдельности содержат четыре FR, соединенные тремя CDR. Три CDR в тяжелой цепи называют CDRH1, CDRH2 и CDRH3 в порядке, начиная с N- конца. Подобным образом в случае легкой цепи CDRL называют CDRL1, CDRL2 и CDRL3. CDRH3 наиболее важна для специфичности связывания антитела с антигеном. Также CDR каждой цепи удерживаются вместе в состоянии близкого соседства друг с другом благодаря FR-областям, внося вклад в образование антигенсвязывающего участка антитела вместе с CDR из другой цепи. Константная область непосредственно не вносит вклад в связывание антитела с антигеном, но проявляет различные эффекторные функции, такие как участие в зависимой от антител опосредованной клетками цитотоксичности (ADCC), фагоцитоз посредством связывания с рецептором Fcγ, определение показателя времени полужизни/клиренса посредством неонатального Fc-рецептора (FcRn) и зависимая от комплемента цитотоксичность (CDC) посредством компонента C1q каскада комплемента.
Получение антитела
Термин «анти-CAPRIN-1-антитело» в используемом в настоящем описании смысле относится к антителу, обладающему иммунологической реактивностью по отношению к полноразмерному белку CAPRIN-1 белок или его фрагменту.
В используемом в настоящем описании смысле термин «иммунологическая реактивность» относится к свойству антитела связываться in vivo с антигеном CAPRIN-1. Посредством такого связывания in vivo осуществляется функция повреждения опухоли (например, гибель, супрессия или деградация). В частности, антитело, используемое в настоящем изобретении, может представлять собой антитело любого типа, при условии, что оно связывается с белком CAPRIN-1, таким образом, становясь способным повреждать опухоль, такую как лейкоз, лимфома, рак молочной железы, опухоль головного мозга, рак легкого, рак мочевого пузыря, рак шейки матки, рак пищевода, рак желудка, рак почек или рак прямой и ободочной кишки.
В настоящем изобретении примеры антитела включают, но особым образом не ограничены, при условии, что оно является моноклональным антителом, синтетическое антитело, полиспецифичное антителом, человеческое антитело, гуманизированное антитело, химерное антитело, одноцепочечное антитело и фрагмент антитела (например, Fab и F(ab')2). Также антитело может представлять собой молекулу иммуноглобулина любого класса, такого как IgG, IgE, IgM, IgA, IgD и IgY, или любого подкласса, такого как IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Антитело может быть дополнительно модифицировано в дополнение к гликозилированию, ацетилированию, формилированию, амидированию, фосфорилированию, пегилированию (ПЭГ) или тому подобному.
Примеры получения различных моноклональных антител описаны ниже.
Когда антитело является моноклональным антителом, мыши вводят, например, линию раковых клеток молочной железы SK-BR-3, экспрессирующую CAPRIN-1, для иммунизации, из организма мыши извлекают селезенку, отделяют клетки и затем такие клетки и клетки миеломы мышей сливают. Из полученных таким образом слитых клеток (гибридом) отбирают клон, продуцирующий антитело, обладающее эффектом подавления пролиферации раковых клеток. Гибридому, продуцирующую моноклональное антитело, которое оказывает действие, подавляющее пролиферацию раковых клеток, выделяют, гибридому культивируют и затем очищают антитело из надосадка культуры общим способом аффинной очистки, таким образом может быть получено антитело.
Гибридому, продуцирующую моноклональное антитело, также можно получить, например, как описано ниже. Сначала животное иммунизируют сенсибилизирующим антигеном согласно известному способу. Обычно способ осуществляют путем инъекции сенсибилизирующего антигена млекопитающему внутрибрюшинно или подкожно. В частности, сенсибилизирующий антиген разбавляют в PBS (фосфатно-солевом буфере), физиологическом растворе или тому подобном до соответствующего количества, затем суспендируют. Полученную суспензию при необходимости затем смешивают с подходящим количеством обычного адъюванта, такого как полный адъювант Фрейнда. После эмульгирования раствор вводят млекопитающему несколько раз каждый 4-21 день. Кроме того, при иммунизации сенсибилизирующим антигеном также можно использовать подходящий носитель.
Млекопитающего иммунизируют, как описано выше. После подтверждения появления требуемого уровня антител в сыворотке иммунизированные клетки собирают из организма млекопитающего и затем подвергают клеточному слиянию. Особенно предпочтительными иммунизированными клетками являются спленоциты.
Клетки миеломы млекопитающих используют в качестве других клеток-партнеров, сливаемых с иммунизированными клетками. В качестве клеток миеломы предпочтительно используют различные известные линии клеток, такие как P3U1 (P3-X63Ag8U1), P3 (P3x63Ag8. 653) (J. Immunol. (1979) 123, 1548-1550), P3x63Ag8U.1 (Current Topics in Microbiology and Immunology (1978) 81, 1-7), NS-1 (Kohler. G. and Milstein, C. Eur. J. Immunol. (1976) 6, 511-519), MPC-11 (Margulies. D. H. et al., Cell (1976) 8, 405-415), SP2/0 (Shulman, M. et al., Nature (1978) 276, 269-270), FO (deSt. Groth, S. F. et al., J. Immunol. Methods (1980) 35, 1-21), S194 (Trowbridge, I. S. J. Exp. Med. (1978) 148, 313-323) и R210 (Galfre, G. et al., Nature (1979) 277, 131-133).
Слияние иммунизированной клетки и клетки миеломы можно осуществить, в основном, согласно известному способу, такому как, например, способ, описанный Kohler и Milstein (Kohler, G. and Milstein, C. Methods Enzymol. (1981) 73, 3-46).
Более конкретно, описанное выше слияние клеток осуществляют, например, в присутствии ускорителя клеточного слияния в обычной питательной культуральной среде. В качестве такого ускорителя слияния используют полиэтиленгликоль (ПЭГ), вирус Сендай (HVJ), или тому подобные. При необходимости может быть добавлено вспомогательное средство, такое как диметилсульфоксид, и использовано, чтобы усилить эффективность слияния.
Отношение иммунизированных клеток к клеткам миеломы, используемое в настоящем изобретении, может быть установлено произвольно. Например, количество иммунизированных клеток, которое предпочтительно используется, составляет один к десяти к количеству клеток миеломы. В качестве культуральной среды, используемой для указанного выше слияния клеток, можно использовать культуральную среду RPMI1640, подходящую для пролиферации указанной выше линии клеток миеломы, культуральную среду MEM и другие культуральные среды, обычно используемые для культивирования такого вида клеток. Кроме того, вместе со средами можно использовать жидкость, дополняющую сыворотку, такую как фетальная сыворотка теленка (FCS).
Слияние клеток можно осуществлять, тщательно смешивая предварительно определяемые количества указанных выше иммунизированных клеток и клеток миеломы в указанной выше культуральной среде и добавляя раствор ПЭГ (например, имеющего среднюю молекулярную массу в диапазоне примерно от 1000 до 6000), предварительно нагретый примерно до 37°C, обычно в концентрации 30%-60% (масс./об.) и смешивая с получением при этом культуры, содержащей представляющие интерес гибридомы. Затем подходящую культуральную среду последовательно добавляют к полученной таким образом культуре, которую затем центрифугируют, чтобы удалить надосадок, и такую процедуру повторяют, чтобы удалить агент для слияния клеток или тому подобное, что не желательно для роста гибридом.
Полученные таким образом гибридомы культивируют для селекции в обычной культуральной селекционной среде (например, культуральной среде HAT, содержащей гипоксантин, аминоптерин и тимидин). Культивирование в такой культуральной среде HAT продолжают в течение периода времени (обычно от нескольких суток до нескольких недель), достаточного для того, чтобы другие клетки (неслитые клетки), отличные от целевых гибридом, погибли. Затем осуществляют скрининг и разовое клонирование гибридомы, которая продуцирует представляющее интерес антитело, используя общий способ лимитирующего разведения.
Указанные выше гибридомы получают иммунизацией животного, отличного от человека, антигеном. Кроме указанного способа гибридомы, которые продуцируют антитело человека, обладающее требуемой активностью (например, активностью в подавлении пролиферации клеток), также может быть получено сенсибилизацией лимфоцитов человека in vitro, таких как лимфоциты человека, которые были инфицированы вирусом EB, белком, экспрессирующей белок клеткой или ее лизатом, с последующим слиянием сенсибилизированных таким образом лимфоцитов с клетками миеломы, полученными от человека, обладающими способностью непрерывно делиться, такими как U266 (№ регистрации TIB196).
Полученную таким образом гибридому, которая продуцирует представляющее интерес моноклональное антитело, можно пересевать в обычной культуральной среде и можно хранить в жидком азоте в течение длительного периода времени.
В частности, гибридома может быть получена иммунизацией обычным способом иммунизации с использованием в качестве сенсибилизирующего антигена требуемого антигена или клетки, которая экспрессирует требуемый антиген, слиянием полученной таким образом иммунизированной клетки с известной родительской клеткой обычным способом слияния клеток, и затем скринингом в отношении продуцирующей моноклональное антитело клетки (т.е., гибридомы) обычным способом скрининга.
В качестве мыши, продуцирующей антитело человека, известны, например, мышь KM mouse (Kirin Pharma/Medarex) и ксеномышь (Amgen) (например, международные патентные публикации WO 02/43478 и WO 02/092812). Когда такую мышь иммунизируют белком CAPRIN-1 или его фрагментом, полностью человеческие поликлональные антитела могут быть получены из крови. Также собирают спленоциты иммунизированной мыши, и затем моноклональное антитело человеческого типа может быть получено способом слияния с клетками миеломы.
Антиген может быть получен способом с использованием, например, животных клеток (публикация патента Японии (Kohyo) No. 2007-530068) или бакуловируса (например, международная патентная публикация WO 98/46777), например. Когда антиген имеет низкую иммуногенность, антиген может быть связан с макромолекулой, обладающей иммуногенностью, такой как альбумин, и затем может быть осуществлена иммунизация.
Кроме того, ген антитела клонируют из указанной гибридомы и затем включают в подходящий вектор. Затем вектор вводят в хозяина и затем можно применять генетически рекомбинантное антитело, полученное с использованием методики рекомбинации генов (например, см. публикацию Carl, A. K. Borrebaeck, James, W. Larrick, Therapeutic Monoclonal Antibodies, опубликованную в Великобритании MACMILLAN PUBLISHERS LTD, 1990). В частности, кДНК вариабельной области (V-области) антитела синтезируют из мРНК гибридомы, используя обратную транскриптазу. Когда может быть получена ДНК, кодирующая V-область представляющего интерес антитела, такую ДНК лигируют с ДНК, кодирующей константную область (C-область) требуемого антитела и затем полученный слитый продукт включают в экспрессирующий вектор. Альтернативно ДНК, кодирующая V-область антитела, может быть включена в экспрессирующий вектор, содержащий ДНК для C-области антитела. В тоже время ДНК может быть включена в экспрессирующий вектор так, чтобы она экспрессировалась под контролем областей регуляции экспрессии, таких как энхансер и промотор. Затем клетки-хозяева трансформируют экспрессирующим вектором так, чтобы могло экспрессироваться антитело.
Анти-CAPRIN-1-антитело согласно настоящему изобретению характеризуется как моноклональное антитело. Примеры моноклонального антитела включают моноклональные антитела человека, моноклональные антитела животного, отличного от человека (например, моноклональное антитело мыши, моноклональное антитело крысы, моноклональное антитело кролика и моноклональное антитело цыпленка), и химерные моноклональные антитела. Моноклональное антитело может быть получено посредством культивирования гибридомы, полученной слиянием клеток спленоцита млекопитающего, отличного от человека (например, мыши, мыши, продуцирующей антитела человека, цыпленка или кролика), иммунизированного белком CAPRIN-1, с клеткой миеломы. Химерное антитело получают в результате комбинирования последовательностей от разных животных, такое как антитело, содержащее вариабельные области тяжелой цепи и легкой цепи мышиного антитела и константные области тяжелой цепь и легкой цепи антитела человека. Химерное антитело может быть получено с использованием известного способа. Например, химерное антитело может быть получено лигированием ДНК, кодирующей V-область антитела, с ДНК, кодирующей C-область антитела человека, включением полученного в результате слитого продукта в экспрессирующий вектор и затем введением вектора в хозяина для получения химерного антитела. В примерах, описанных далее, получали химерные моноклональные антитела человека-цыпленка и подтверждали их противоопухолевое действие. Такие моноклональные антитела содержат вариабельную область тяжелой цепи (VH), имеющую аминокислотную последовательность SEQ ID NO: 42, и вариабельную область легкой цепи (VL), имеющую аминокислотную последовательность SEQ ID NO: 46, при этом VH-область содержит CDR1, представленную аминокислотной последовательностью SEQ ID NO: 39, CDR2, представленную аминокислотной последовательностью SEQ ID NO: 40, и CDR3, представленную аминокислотной последовательностью SEQ ID NO: 41, и VL-область содержит CDR1, представленную аминокислотной последовательностью SEQ ID NO: 43, CDR2, представленную аминокислотной последовательностью SEQ ID NO: 44, и CDR3, представленную аминокислотной последовательностью SEQ ID NO: 45.
Гуманизированное антитело представляет собой модифицированное антитело, которое также называют реконструированным антителом человека. Гуманизированное антитело может быть сконструировано пересадкой CDR антитела от иммунизированного животного в определяющие комплементарность области антитела человека. Общие методики рекомбинации генов для этого также известны.
В частности, последовательности ДНК, сконструированные так, чтобы они имели каждую из CDR антитела мыши или цыпленка, лигированную с каждой из каркасных областей (FR) антитела человека, синтезируют ПЦР-способом из нескольких олигонуклеотидов, которые получают таким образом, чтобы они, например, имели перекрывающиеся части в своих концевых частях. Гуманизированное антитело может быть получено лигированием полученной таким образом ДНК с ДНК, кодирующей константную область антитела человека, включением полученного в результате слитого продукта в экспрессирующий вектор, введением вектора в хозяина, что таким образом вызывает у хозяина продукцию генного продукта (см. публикацию европейского патента № 239400 и международную патентную публикацию WO 96/02576). В качестве FR антитела человека, которые лигируют посредством CDR, выбирают FR, которые обеспечивают возможность образования антигенсвязывающего участка с хорошими областями, определяющими комплементарность. При необходимости для образования антигенсвязывающего участка, имеющего соответствующие определяющие комплементарность области реконструированного антитела человека, аминокислоты каркасных областей вариабельной области антитела могут быть заменены (Sato, K. et al., Cancer Research, 1993, 53: 851-856). Также аминокислоты FR могут быть заменены аминокислотами каркасных областей их разных антител человека (см. международную патентную публикацию WO 99/51743).
В качестве каркасных областей (FR) антитела человека, которые лигируют посредством CDR, выбирают FR, которые обеспечивают возможность образования антигенсвязывающего участка с хорошими областями, определяющими комплементарность. При необходимости для образования антигенсвязывающего участка, имеющего соответствующие определяющие комплементарность области реконструированного антитела человека, аминокислоты каркасных областей вариабельной области антитела могут быть заменены (Sato, K. et al., Cancer Research, 1993, 53: 851-856).
После получения химерного антитела или гуманизированного антитела аминокислоты в вариабельной области (например, FR) или константной области могут быть заменены другими аминокислотами.
Аминокислотная замена представляет собой замену, например, менее чем 15, менее чем 10, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее аминокислот и предпочтительно замену 1-5 аминокислот и более предпочтительно 1 или 2 аминокислот. Антитело с заменами должно быть функционально эквивалентным антителу без замен. Замена желательно представляет собой замену консервативной аминокислоты (аминокислот) из аминокислот, обладающих аналогичными свойствами, такими как электрический заряд, боковая цепь, полярность и ароматичность. Аминокислоты, обладающие аналогичными свойствами, могут быть классифицированы, например, как основные аминокислоты (аргинин, лизин и гистидин), кислые аминокислоты (аспарагиновая кислота и глутаминовая кислота), незаряженные полярные аминокислоты (глицин, аспарагин, глутамин, серин, треонин, цистеин и тирозин), неполярные аминокислоты (лейцин, изолейцин, аланин, валин, пролин, фенилаланин, триптофан и метионин), аминокислоты с разветвленной цепью (треонин, валин и изолейцин) и ароматические аминокислоты (фенилаланин, тирозин, триптофан и гистидин).
Примеры модифицированного продукта антитела включают антитела, связанные с различными молекулами, такими как полиэтиленгликоль (ПЭГ). Вещества, связываемые в модифицированном продукте антитела согласно настоящему изобретению, не ограничены. Такой модифицированный продукт антитела может быть получен, когда полученное таким образом антитело подвергают химической модификации. Способы такой модификации уже разработаны в данной области.
В используемом в настоящем описании смысле термин «функциональный эквивалент» относится к случаю, когда данное антитело обладает биологической или биохимической активностью, сходной с активностью антитела согласно настоящему изобретению и, в частности, относится к случаю, когда, например, данное антитело обладает функцией повреждения опухоли, по существу не вызывая отторжения при его применении на человеке. Примером такой активности является активность в подавлении клеточной пролиферации или активность связывания.
В качестве способа, хорошо известного специалистам в данной области для получения полипептида, функционально эквивалентного определенному полипептиду, известен способ введения мутации в полипептид. Например, специалисты в данной области могут получить антитело, функционально эквивалентное антителу согласно настоящему изобретению, посредством введения соответствующим образом мутации в антитело с использованием, например, сайт-специфичного мутагенеза (Hashimoto-Gotoh, T. et al., (1995) Gene 152, 271-275; Zoller, MJ., and Smith, M. (1983) Methods Enzymol. 100, 468-500; Kramer, W. et al., (1984) Nucleic Acids Res. 12, 9441-9456; Kramer, W. and Fritz, HJ., (1987) Methods Enzymol. 154, 350-367; Kunkel, TA., (1985) Proc. Natl. Acad. Sci. U.S.A. 82, 488-492; Kunkel (1988) Methods Enzymol. 85, 2763-2766), для примера.
Антитело, которое узнает эпитоп белка CAPRIN-1, узнаваемый описанным выше анти-CAPRIN-1-антителом, может быть получено способом, известным специалистам в данной области. Например, такое антитело может быть получено способом, который включает в себя определение эпитопа белка CAPRIN-1, узнаваемого анти-CAPRIN-1-антителом, обычным способом (например, картированием эпитопов) и затем получение антитела с использованием полипептида, имеющего аминокислотную последовательность, входящую в эпитоп, в качестве иммуногена, или способом, который заключается в определении эпитопа такого антитела, получаемого обычным способом, и затем отборе антитела, имеющего эпитоп, идентичный эпитопу анти-CAPRIN-1-антитела. В используемом в настоящем описании смысле термин «эпитоп» относится к полипептидному фрагменту млекопитающего и предпочтительно человека, обладающему антигенностью или иммуногенностью. Единица минимального размера эпитопа состоит примерно из 7-12 аминокислот и предпочтительно из 8-11 аминокислот.
Константа аффинности Ka (kon/koff) антитела согласно настоящему изобретению предпочтительно составляет, по меньшей мере, 107 М-1, по меньшей мере 108 М-1, по меньшей мере 5×108 М-1, по меньшей мере 109 М-1, по меньшей мере 5×109 М-1, по меньшей мере 1010 М-1, по меньшей мере 5×1010 М-1, по меньшей мере 1011 М-1, по меньшей мере 5×1011 М-1, по меньшей мере, 1012 М-1 или по меньшей мере 1013 М-1.
Антитело согласно настоящему изобретению может быть конъюгировано с противоопухолевым средством. Конъюгирование антитела с противоопухолевым средством можно осуществить через спейсер, имеющий группу, взаимодействующую с аминогруппой, карбоксильной группой, гидроксигруппой, тиольной группой или тому подобной (например, сукцинимидилсукцинатную группу, формильную группу, 2-пиридилдитиогруппу, группу малеимидила, алкоксикарбонильную группу и гидроксигруппу).
Примеры противоопухолевого средства включают следующие известные противоопухолевые средства, описанные в литературе известного уровня техники и тому подобные, такие как паклитаксел, доксорубицин, даунорубицин, циклофосфамид, метотрексат, 5-фторурацил, тиотепа, бусульфан, импросульфан, пипосульфан, бензодопа, карбоквон, метуредопа, уредопа, алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид, триметилоломеламин, буллатацин, буллатацинон, камптотецин, бриостатин, каллистатин, криптофицин 1, криптофицин 8, доластатин, дуокармицин, элеутеробин, панкратистатин, саркодиктиин, спонгистатин, хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин, кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин, калихеамицин, динемицин, клодронат, эсперамицин, аклациномицин, актиномицин, аутрамицин, азасерин, блеомицин, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицин, дактиномицин, деторбицин, 6-диазо-5-оксо-L-норлейцин, адриамицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин, деноптерин, птероптерин, триметрексат, флударабин, 6-меркаптопурин, тиамиприн, тиогуанин, анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, андрогены (например, калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан и тестолактон), аминоглютетимид, митотан, трилостан, фолиновая кислота, ацеглатон, гликозид альдофосфамида, аминолевулиновая кислота, энилурацил, амсакрин, бестрабуцил, бисантрен, эдатраксат, дефофамин, демеколцин, диазихон, элфорнитин, ацетат эллиптиния, эпотилон, этоглуцид, лентинан, лонидамин, мейтанзин, ансамитоцин, митогуазон, митоксантрон, мопиданмол, нитраэрин, пентостатин, фенамет, пирарубицин, лозоксантрон, подофиллиновая кислота, 2-этилгидразид, прокарбазин, разоксан, ризоксин, шизофиллан, спирогерманий, тенуазоновая кислота, триазиквон, роридин A, ангуидин, уретан, виндезин, дакарбазин, манномустин, митобронитол, митолактол, пипоброман, гацитозин, доцетаксел, хлорамбуцил, гемцитабин, 6-тиогуанин, меркаптопурин, цисплатин, оксалиплатин, карбоплатин, винбластин, этопозид, ифосфамид, митоксантрон, винкристин, винорелбин, новантрон, тенипозид, эдатрексат, дауномицин, аминоптерин, кселода, ибандронат, иринотекан, ингибитор топоизомеразы, дифторметилорнитин (DMFO), ретиноевая кислота, капецитабин и их фармацевтически приемлемые соли или производные.
Посредством введения антитела согласно настоящему изобретению в сочетании с противоопухолевым средством можно получить еще более высокие терапевтические эффекты. Такая методика применима как до, так и после операции у пациента с раковым заболеванием в случае экспрессии CAPRIN-1. В частности, после хирургической операции можно достичь более эффективной профилактики рецидивов раковых заболеваний или более длительного периода выживания в случае рака с экспрессией CAPRIN-1, которую обычно лечили только противоопухолевым средством отдельно.
Примеры противоопухолевого средства, вводимого в сочетании с антителом согласно настоящему изобретению, включают следующие известные противоопухолевые средства, которые описаны в литературе известного уровня техники или тому подобные, такие как паклитаксел, доксорубицин, даунорубицин, циклофосфамид, метотрексат, 5-фторурацил, тиотепа, бусульфан, импросульфан, пипосульфан, бензодопа, карбоквон, метуредопа, уредопа, алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид, триметилоломеламин, буллатацин, буллатацинон, камптотецин, бриостатин, каллистатин, криптофицин 1, криптофицин 8, доластатин, дуокармицин, элеутеробин, панкратистатин, саркодиктиин, спонгистатин, хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин, кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин, калихеамицин, динемицин, клодронат, эсперамицин, аклациномицин, актиномицин, аутрамицин, азасерин, блеомицин, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицин, дактиномицин, деторбицин, 6-диазо-5-оксо-L-норлейцин, адриамицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин, деноптреин, птероптерин, триметрексат, флударабин, 6-меркаптопурин, тиамиприн, тиогуанин, анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон, аминоглютетимид, митотан, трилостан, фолиновая кислота, ацеглатон, гликозид альдофосфамида, аминолевулиновая кислота, энилурацил, амсакрин, бестрабуцил, бисантрен, эдатраксат, дефофамин, демеколцин, диазихон, элфорнитин, ацетат эллиптиния, эпотилон, этоглуцид, лентинан, лонидамин, мейтанзин, ансамитоцин, митогуазон, митоксантрон, мопиданмол, нитраэрин, пентостатин, фенамет, пирарубицин, лозоксантрон, подофиллиновая кислота, 2-этилгидразид, прокарбазин, разоксан, ризоксин, шизофиллан, спирогерманий, тенуазоновая кислота, триазиквон, роридин A, ангуидин, уретан, виндезин, дакарбазин, манномустин, митобронитол, митолактол, пипоброман, гацитозин, доцетаксел, хлорамбуцил, гемцитабин, 6-тиогуанин, меркаптопурин, цисплатин, оксалиплатин, карбоплатин, винбластин, этопозид, ифосфамид, митоксантрон, винкристин, винорелбин, новантрон, тенипозид, эдатрексат, дауномицин, аминоптерин, кселода, ибандронат, иринотекан, ингибитор топоизомеразы, дифторметилорнитин (DMFO), ретиноевая кислота, капецитабин и их фармацевтически приемлемые (известные) соли или (известные) производные. Из приведенных выше примеров особенно предпочтительно используют циклофосфамид, паклитаксел, доцетаксел и винорелбин.
Альтернативно известный радиоактивный изотоп, который описан в литературе известного уровня техники или тому подобный, такой как 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 175Lu или 176Lu, может быть связан с антителом согласно настоящему изобретению. Требуемый радиоактивный изотоп является эффективным для лечения или диагностики опухоли.
Антитело согласно настоящему изобретению представляет собой антитело, обладающее иммунологической реактивностью по отношению к CAPRIN-1, или антитело, специфично связывающееся с CAPRIN-1, которое проявляет цитотоксическую активность против рака или оказывает подавляющее рост опухоли действие. Антитело должно иметь такую структуру, чтобы почти или полностью избежать отторжения у данного животного, которому вводят антитело. Примеры такого антитела в том случае, когда данным животным является человек, включают человеческое антитело, гуманизированное антитело, химерное антитело (например, химерное антитело человека-мыши), одноцепочечное антитело и биспецифичное антитело. Такими антителами являются: рекомбинантные антитела, в которых вариабельные области тяжелой цепи и легкой цепи получены из антитела человека; рекомбинантные антитела, в которых вариабельные области тяжелой цепи и легкой цепи содержат определяющие комплементарность области (CDR) (CDR1, CDR2 и CDR3) из антитела животного, отличного от человека и каркасные области из антитела человека; или рекомбинантные антитела, в которых вариабельные области тяжелой цепи и легкой цепи происходят из антитела животного, отличного от человека, и константные области тяжелой цепи и легкой цепи получены из антитела человека. Предпочтительными антителами являются первые два антитела.
Такие рекомбинантные антитела могут быть получены, как указано далее, с использованием клонирования ДНК, кодирующей моноклональное антитело против CAPRIN-1 человека (например, моноклональное антитело человека, моноклональное антитело мыши, моноклональное антитело крысы, моноклональное антитело кролика или моноклональное антитело цыпленка), из продуцирующей антитела клетки, такой как гибридома, получения ДНК, кодирующей вариабельную область легкой цепи и вариабельную область тяжелой цепи антитела способом на основе ОТ-ПЦР, использования ее в качестве матрицы и затем определения последовательности каждой вариабельной области легкой цепи и тяжелой цепи или каждой последовательности CDR1, CDR2 и CDR3 на основе системы нумерации EU по Кабату (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institute of Health, Bethesda, Md. (1991)).
Кроме того, ДНК, кодирующая каждую из таких вариабельных областей, или ДНК, кодирующую каждую CDR, получают, используя методику рекомбинации генов (Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989)) или синтезатор ДНК. В данном случае указанная выше гибридома, продуцирующая моноклональное антитело человека может быть получена иммунизацией животного, продуцирующего антитело человека (например, мыши), CAPRIN-1 человека и затем слиянием спленоцитов, извлеченных из организма иммунизированного животного, с клетками миеломы. Альтернативно ДНК, кодирующую вариабельную область легкой цепи или тяжелой цепи, и константную область из антитела человека получают в случае необходимости с использованием методики рекомбинации генов или синтезатора ДНК.
В случае гуманизированного антитела ДНК получают заменой последовательности, кодирующей CDR, в ДНК, кодирующей вариабельную область легкой цепи или тяжелой цепи, полученную из антитела человека, соответствующей ей последовательностью, кодирующей CDR, из антитела, полученного от животного, отличного от человека (например, мыши, крысы или цыпленка), и затем лигированием полученной таким образом ДНК с ДНК, кодирующей константную область легкой цепи или тяжелой цепи, полученной из антитела человека. Таким образом может быть получена ДНК, кодирующая гуманизированное антитело.
В случае химерного антитела ДНК, кодирующая химерное антитело, может быть получена лигированием ДНК, кодирующей вариабельную область легкой цепи или тяжелой цепи антитела животного, отличного от человека (например, мыши, крысы и цыпленка), с ДНК, кодирующей константную область легкой цепи или тяжелой цепи из антитела человека.
В случае одноцепочечного антитела такое антитело представляет собой антитело, полученное линейным лигированием вариабельной области тяжелой цепи с вариабельной областью легкой цепи через линкер. Таким образом, ДНК кодирующая одноцепочечное антитело, может быть получена связыванием ДНК, кодирующей вариабельную область тяжелой цепи, ДНК, кодирующей линкер, и ДНК, кодирующей вариабельную область легкой цепи. В данном случае и вариабельная область тяжелой цепи, и вариабельная область легкой цепи являются областями из антитела человека, или только CDR заменяют CDR антитела животного, отличного от человека (например, мыши, крысы и цыпленка), хотя другие области являются областями из антитела человека. Также линкер содержит 12-19 аминокислот, например, (G4S)3 из 15 аминокислот (G.-B. Kim et al., Protein Engineering Design and Selection 2007, 20 (9): 425-432).
В случае биспецифичного антитела (диантитела) такое антитело способно специфично связываться с двумя разными эпитопами. Например, ДНК, кодирующую биспецифичное антитело, можно получить связыванием ДНК, кодирующей вариабельную область тяжелой цепи A, ДНК, кодирующей вариабельную область легкой цепи B, ДНК, кодирующую вариабельную область тяжелой цепи B, и ДНК, кодирующей вариабельную область легкой цепи A в указанном порядке (в данном случае ДНК, кодирующая вариабельную область легкой цепи B, связана с ДНК, кодирующей вариабельную область тяжелой цепи B, через ДНК, кодирующую указанный выше линкер). В данном случае вариабельная область тяжелой цепи и вариабельная область легкой цепи происходят из антитела человека, или только CDR заменены CDR антитела животного, отличного от человека (например, мыши, крысы или цыпленка), хотя другие области происходят из антитела человека.
Полученную как описано выше рекомбинантную ДНК включают в один или множество подходящих векторов, векторы вводят в клетки-хозяева (например, клетки млекопитающего, дрожжевые клетки или клетки насекомого) и затем вызывают (ко)экспрессию так, чтобы можно было получить рекомбинантное антитело (P. J. Delves., ANTIBODY PRODUCTION ESSENTIAL TECHNIQUES., 1997 WILEY, P. Shepherd and C. Dean., Monoclonal Antibodies., 2000 OXFORD UNIVERSITY PRESS; J. W. Goding., Monoclonal Antibodies: principles and practice., 1993 ACADEMIC PRESS).
Примеры антитела согласно настоящему изобретению, полученного описанным выше способом, включают антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO: 39, 40 и 41, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO: 43, 44 и 45 (например, антитело, состоящее из вариабельной области тяжелой цепи SEQ ID NO: 42 и вариабельной области легкой цепи SEQ ID NO: 46).
Аминокислотные последовательности, представленные в виде SEQ ID NO: 39, 40 и 41, представляют собой CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела цыпленка. Также аминокислотные последовательности, представленные в виде SEQ ID NO: 43, 44 и 45, представляют собой CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела цыпленка, соответственно.
Также гуманизированное антитело, химерное антитело, одноцепочечное антитело или биспецифичное антитело согласно настоящему изобретению представляет собой, например, следующее антитело:
(i) антитело, в котором вариабельная область тяжелой цепи содержит аминокислотные последовательности SEQ ID NO: 39, 40 и 41 и аминокислотные последовательности каркасных областей из антитела человека, и вариабельная область легкой цепи содержит аминокислотные последовательности SEQ ID NO: 43, 44 и 45 и аминокислотные последовательности каркасных областей из антитела человека (например, антитело, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 42 и вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 46); и
(ii) антитело, в котором вариабельная область тяжелой цепи содержит аминокислотные последовательности SEQ ID NO: 39, 40 и 41 и аминокислотные последовательности каркасных областей из антитела человека, и константная область тяжелой цепи содержит аминокислотную последовательность из антитела человека, и вариабельная область легкой цепи содержит аминокислотные последовательности SEQ ID NO: 43, 44 и 45 и аминокислотные последовательности каркасных областей из антитела человека, и константная область легкой цепи содержит аминокислотную последовательность из антитела человека (например, антитело, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 42 и константная область тяжелой цепи содержит аминокислотную последовательность из антитела человека, а также вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 46 и константная область легкой цепи содержит аминокислотную последовательность из антитела человека).
Кроме того, последовательности константных областей и вариабельных областей тяжелой цепи и легкой цепи антитела человека могут быть получены, например, из NCBI (например, США: GenBank, UniGene). Например, последовательность с номером доступа J00228 может быть отнесена к константной области тяжелой цепи IgG1 человека, последовательность с номером доступа J00230 может быть отнесена к константной области тяжелой цепи IgG2 человека, последовательность с номером доступа X03604 может быть отнесена к константной области тяжелой цепи IgG3 человека, последовательность с номером доступа K01316 может быть отнесена к константной области тяжелой цепи IgG4 человека, последовательности с номерами доступа V00557, X64135, X64133 и тому подобные могут быть отнесены к константным областям легкой цепи κ человека и последовательности с номерами доступа X64132, X64134 и тому подобные могут быть отнесены к константным областям легкой цепи λ человека.
Указанные выше антитела предпочтительно обладают цитотоксической активностью и, следовательно, могут проявлять противоопухолевые эффекты.
Также конкретные последовательности вариабельных областей или CDR тяжелой цепи и легкой цепи в указанных выше антителах приведены просто в целях иллюстрации и, таким образом, четко не ограничены такими конкретными последовательностями. Получают гибридому, способную продуцировать другое антитело человека или антитело животного, отличного от человека (например, мышиное антитело) против CAPRIN-1 человека, собирают моноклональное антитело, которое продуцируется гибридомой, и затем определяют, является ли оно или не является целевым антителом на основе свойства иммунологического связывания с CAPRIN-1 человека и цитотоксической активности в качестве показателей. После идентификации таким образом гибридомы, продуцирующей целевое моноклональное антитело, ДНК, кодирующую вариабельные области тяжелой цепи и легкой цепи целевого антитела получают из гибридомы, как описано выше, осуществляют секвенирование и затем ДНК используют для получения другого антитела.
Кроме того, что касается указанного выше антитела согласно настоящему изобретению, то последовательность каждого из указанных выше антител, в частности последовательность каркасной области и/или последовательность константной области каждого из антител, может иметь замену, делецию или добавление одной или нескольких (предпочтительно 1 или 2) аминокислот при условии, что антитело обладает специфичностью для специфичного узнавания CAPRIN-1. В данном случае термин «несколько» относится к 2-5 и предпочтительно к 2 или 3.
Настоящее изобретение, кроме того, относится к ДНК, кодирующей указанное выше антитело согласно настоящему изобретению, или к ДНК, кодирующей тяжелую цепь или легкую цепь указанного выше антитела, или ДНК, кодирующую вариабельную область тяжелой цепи или легкой цепи указанного выше антитела. Примеры таких ДНК включают в случае антитела (a) ДНК, кодирующую вариабельную область тяжелой цепи, содержащую нуклеотидные последовательности, кодирующие аминокислотные последовательности SEQ ID NO: 39, 40 и 41, и ДНК, кодирующую вариабельную область легкой цепи, содержащую нуклеотидные последовательности, кодирующие аминокислотные последовательности SEQ ID NO: 43, 44 и 45.
Определяющие комплементарность области (CDR), кодируемые последовательностями ДНК, представляют собой области для определения специфичности антитела. Следовательно, последовательности, кодирующие другие области антитела, отличные от CDR (в частности, константную область и каркасную область), могут быть из других антител. В данном случае примеры таких «других антител» включают антитела из организмов животных, отличных от человека, и предпочтительно антитела человека с точки зрения уменьшения побочных эффектов. Таким образом, в случае указанной выше ДНК области, кодирующие каждую каркасную область и каждую область контакта тяжелых цепей и легких цепей, предпочтительно содержат нуклеотидные последовательности, кодирующие соответствующие аминокислотные последовательности из антитела человека.
Следующие альтернативные примеры ДНК, кодирующей антитело согласно настоящему изобретению, включают ДНК, кодирующую вариабельную область тяжелой цепи, содержащую нуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 42, и ДНК, кодирующую вариабельную область легкой цепи, содержащую нуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 46. В данном случае примером нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO: 42, является нуклеотидная последовательность SEQ ID NO: 49. Также примером нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO: 46, является нуклеотидная последовательность SEQ ID NO: 50. В указанных ДНК области, кодирующие каждую константную область тяжелых цепей и легких цепей, предпочтительно содержат нуклеотидные последовательности, кодирующие соответствующие аминокислотные последовательности из антитела человека.
ДНК согласно настоящему изобретению может быть получена, например, указанными выше способами или описанным далее способом. Сначала получают суммарную РНК из гибридомы, относящейся к антителу согласно настоящему изобретению, используя коммерчески доступный набор для экстракции РНК, и затем синтезируют кДНК с использованием обратной транскриптазы и случайных праймеров и тому подобных. Затем кДНК, кодирующую антитело, амплифицируют способом ПЦР, используя в качестве праймеров олигонуклеотиды с последовательностями, консервативными для каждой вариабельной области известных генов тяжелой цепи и легкой цепи мышиных антител. Последовательность, кодирующую константную область, можно получить в результате амплификации известной последовательности способом ПЦР. Нуклеотидная последовательность ДНК может быть определена обычным способом, таким как встраивание в плазмиду или фаг для секвенирования.
Считается, что анти-CAPRIN-1-антитело, применяемое в настоящем изобретении, оказывает противоопухолевое действие, направленное против CAPRIN-1-экспрессирующих раковых клеток, посредством следующего механизма.
Зависимая от антител цитотоксическая активность (ADCC) эффекторных клеток, направленная против CAPRIN-1-экспрессирующих клеток, и зависимая от комплемента цитотоксичность (CDC), направленная против CAPRIN-1-экспрессирующих клеток.
Таким образом, активность анти-CAPRIN-1-антитела, применяемого в настоящем изобретении, можно оценить, как конкретно описано в примерах ниже, с использованием измерения ex vivo указанной выше ADCC-активности или CDC-активности, направленной против CAPRIN-1-экспрессирующих раковых клеток.
Анти-CAPRIN-1-антитело, применяемое в настоящем изобретении, связывается с белком CAPRIN-1 на раковой клетке и оказывает противоопухолевое действие вследствие указанной выше активности и, следовательно, оно применимо для лечения или профилактики рака. В частности, настоящее изобретение относится к фармацевтической композиции для лечения и/или профилактики рака, которая содержит анти-CAPRIN-1-антитело в качестве активного ингредиента. Когда анти-CAPRIN-1-антитело применяют для его введения в организм человека (терапия антителами), предпочтительно оно является антителом человека или гуманизированным антителом, чтобы уменьшить иммуногенность.
Кроме того, чем выше аффинность связывания между анти-CAPRIN-1-антителом и белком CAPRIN-1 на поверхности раковых клеток, тем более высокую противоопухолевую активность анти-CAPRIN-1-антитела можно получить. Следовательно, когда может быть получено анти-CAPRIN-1-антитело, обладающее высокой аффинностью связывания с белком CAPRIN-1, можно ожидать более сильные противоопухолевые эффекты, и становится возможным применение такого антитела в виде фармацевтической композиции в целях лечения и/или профилактики рака. Такая высокая аффинность связывания желательно должна быть такой, как указано далее. Как описано выше, константа связывания (константа аффинности) Ka (kon/koff) предпочтительно составляет, по меньшей мере, 107 М-1, по меньшей мере, 108 М-1, по меньшей мере, 5×108 М-1, по меньшей мере, 109 М-1, по меньшей мере, 5×109 М-1, по меньшей мере, 1010 М-1, по меньшей мере, 5×1010 М-1, по меньшей мере, 1011 М-1, по меньшей мере, 5×1011 М-1, по меньшей мере, 1012 М-1 или, по меньшей мере, 1013 М-1.
Связывание с антигенэкспрессирующей клеткой
Способность антитела связываться с CAPRIN-1 можно установить в анализе связывания с использованием ELISA, способа Вестерн-блоттинга, иммунофлуоресценции и проточно-цитометрического анализа или тому подобного, как описано в примерах.
Иммуногистохимическое окрашивание
Антитело, которое узнает CAPRIN-1, можно тестировать в отношении реактивности к CAPRIN-1 способом иммуногистохимии, известным специалистам в данной области, с использованием фиксированных параформальдегидом или ацетоном замороженных срезов или фиксированных параформальдегидом залитых в парафин срезов ткани, которые готовят из образцов ткани, полученных от пациента во время хирургической операции, или из образцов ткани, полученных от животного, имеющего гетеротрансплантат ткани, инокулированный линией клеток, экспрессирующих CAPRIN-1 естественным образом или после трансфекции.
Антитело, реактивное по отношению к CAPRIN-1, можно красить различными способами иммуногистохимического окрашивания. Например, конъюгированное с пероксидазой хрена антитело козы против Ig мыши или антитело козы против Ig цыпленка подвергают взаимодействию, в результате может быть визуализировано антитело-мишень.
Фармацевтическая композиция
Мишень фармацевтической композиции для лечения и/или профилактики рака согласно настоящему изобретению особым образом не ограничена, при условии, что она является раковым заболеванием (клеткой), экспрессирующей ген CAPRIN-1.
Термины «опухоль» и «рак» в используемом в настоящем описании смысле относятся к злокачественной неоплазме и использованы взаимозаменяемо.
Рак, подвергаемый воздействию согласно настоящему изобретению, представляет собой рак, экспрессирующий гены, кодирующие белки CAPRIN-1, имеющие аминокислотные последовательности, пронумерованные четными числами среди последовательностей SEQ ID NO: 2-30. Примеры такого ракового заболевания включают предпочтительно рак молочной железы, опухоль головного мозга, лейкоз, рак легкого, лимфому, мастоцитому, рак почек, рак шейки матки, рак мочевого пузыря, рак пищевода, рак желудка и рак прямой и ободочной кишки.
Примеры таких конкретных раковых заболеваний включают без ограничения аденокарциному молочной железы, аденокарциному молочной железы комплексного типа, раковую смешанную опухоль молочной железы, внутрипротоковую папиллярную аденокарциному, аденокарциному легкого, плоскоклеточную карциному, мелкоклеточную карциному, крупноклеточную карциному, глиому, которая является опухолью эпителиальной ткани вокруг нейронов, эпендимому, нейроцитому, нейроэктодермальную опухоль плода, шванному, нейрофиброму, менингиому, хронический лимфоцитарный лейкоз, лимфому, лимфому желудочно-кишечного тракта, лимфому пищеварительной системы, мелкоклеточную и среднеклеточную лимфому, рак слепой кишки, рак восходящей ободочной кишки, рак нисходящей ободочной кишки, рак поперечной ободочной кишки, рак сигмовидной ободочной кишки и рак прямой кишки.
Кроме того, предпочтительными субъектами являются млекопитающие, включая приматов, комнатных животных, домашних животных, животных для скачек и тому подобные, и особенно предпочтительными человек, собаки и кошки.
Когда антитело, применяемое в настоящем изобретении, используют в виде фармацевтической композиции, она может быть приготовлена способом, известным специалистам в данной области. Например, антитело может быть использовано парентерально в форме инъекционного препарата, такого как асептический раствор или суспензия, приготовленная с использованием воды или другого фармакологически приемлемого раствора, отличного от воды. Например, она может быть приготовлена смешиванием в стандартной лекарственной форме, требуемой в общепринятой фармацевтической практике, в подходящем сочетании с фармакологически приемлемым носителем или средой, в частности, стерильной водой или физиологическим раствором, растительным маслом, эмульгатором, суспендирующим средством, поверхностно-активным веществом, стабилизатором, корригентом, эксципиентом, носителем, антисептиком, связывающим средством и тому подобным. Количества активных ингредиентов в таких препаратах определяют так, чтобы можно было получить соответствующую дозу в указанном диапазоне.
Асептическая композиция для инъекции может быть назначена согласно общей фармацевтической практике с использованием такого носителя, как дистиллированная вода для инъекций.
Примеры водного раствора для инъекций включают физиологический раствор, изотонический раствор, содержащий декстрозу или другие вспомогательные вещества, такие как D-сорбит, D-манноза, D-маннит и хлорид натрия. Такие примеры можно использовать в сочетании с подходящим солюбилизирующим средством, таким как спирт, в частности, этанол и полиспирт (например, пропиленгликоль и полиэтиленгликоль), и неионогенное поверхностно-активное вещество (например, полисорбат 80 (TM) и HCO-60).
Примеры масла включают кунжутное масло и соевое масло, которые можно использовать в сочетании с солюбилизирующим средством, таким как бензилбензоат или бензиловый спирт. Также с ними можно сочетать буферное средство, такое как фосфатный буфер или натрий-ацетатный буфер, успокаивающее средство, такое как гидрохлорид прокаина, стабилизатор, такой как бензиловый спирт или фенол, и антиоксидант. Подходящую ампулу обычно заполняют приготовленным таким образом инъекционным раствором.
Введение является пероральным или парентеральным введением и предпочтительно является парентеральным введением. Конкретные примеры пути введения включают инъекцию, введение через нос, легочное введение и трансдермальное введение. Примеры инъекции включают внутривенную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию и подкожную инъекцию, так что возможно системное или местное введение.
Также способы введения могут быть соответствующим образом выбраны в зависимости от возраста, массы тела, пола пациента, симптомов и тому подобного. Вводимая доза фармацевтической композиции, содержащей антитело или полинуклеотид, кодирующий антитело, может быть выбрана, например, из диапазона от 0,0001 мг до 1000 мг на кг массы тела. Альтернативно, например, доза может быть выбрана из диапазона от 0,001 мг/организм до 100000 мг/организм пациента. Однако диапазон доз не всегда ограничен указанными числовыми значениями. Доза и способ введения варьируют в зависимости от массы тела, возраста, пола пациента, симптомов и тому подобного, но могут быть соответствующим образом выбраны специалистами в данной области.
Указанную выше фармацевтическую композицию, содержащую антитело или его фрагмент согласно настоящему изобретению, вводят субъекту для того, чтобы можно было лечить и/или предотвращать рак, предпочтительно рак молочной железы, опухоль головного мозга, лейкоз, рак легкого, лимфому, мастоцитому, рак почек, рак шейки матки, рак мочевого пузыря, рак пищевода, рак желудка и рак прямой и ободочной кишки.
Настоящее изобретение, кроме того, охватывает способ лечения и/или профилактики рака, включающий в себя введение субъекту фармацевтической композиции согласно настоящему изобретению в сочетании с приведенными выше примерами противоопухолевого средства или фармацевтической композиции, содержащей такое противоопухолевое средство. Антитело или его фрагмент согласно настоящему изобретению и противоопухолевое средство можно вводить субъекту одновременно или по отдельности. Они могут быть введены по отдельности, независимо от порядка введения. Интервалы введения, доза, путь введения и частота введения могут быть соответствующим образом выбраны специалистом. Примеры другого фармацевтического препарата, вводимого одновременно, включают фармацевтические композиции, получаемые смешиванием антитела или его фрагмента согласно настоящему изобретению с противоопухолевым средством в фармакологически приемлемом носителе (или среде) с последующим приготовлением препарата. Кроме того, к любой из описанных выше фармацевтических композиций, содержащих противоопухолевое средство, или препарату прилагают пояснения, касающиеся назначения, приготовления, пути введения, дозы, ракового заболевания и тому подобного, для введения фармацевтической композиции, содержащей антитело согласно настоящему изобретению, и препарата.
Таким образом, настоящее изобретение также относится к фармацевтическому сочетанию для лечения и/или профилактики рака, содержащему фармацевтическую композицию согласно настоящему изобретению и приведенную выше в качестве примера фармацевтическую композицию, содержащую противоопухолевое средство.
Также настоящее изобретение относится к фармацевтической композиции для лечения и/или профилактики рака, содержащей антитело или его фрагмент согласно настоящему изобретению и противоопухолевое средство вместе с фармакологически приемлемым носителем.
Полипептид и ДНК
Настоящее изобретение, кроме того, относится к следующим полипептидам и ДНК, имеющим отношение к указанным выше антителам.
(i) Полипептид, содержащий аминокислотную последовательность SEQ ID NO: 42, и ДНК, кодирующая данный полипептид, при этом ДНК содержит нуклеотидную последовательность SEQ ID NO: 49.
(ii) Полипептид, содержащий аминокислотную последовательность SEQ ID NO: 46, и ДНК, кодирующая данный полипептид, при этом ДНК содержит нуклеотидную последовательность SEQ ID NO: 50.
(iii) Полипептид CDR тяжелой цепи, состоящий из аминокислотных последовательностей, представленных в виде SEQ ID NO: 39, 40 и 41, и ДНК, кодирующая данный полипептид.
(iv) Полипептид CDR легкой цепи, состоящий из аминокислотных последовательностей, представленных в виде SEQ ID NO: 43, 44 и 45, и ДНК, кодирующая данный полипептид.
Указанные полипептиды и ДНК могут быть получены с использованием методики рекомбинации генов, как описано выше.
Сущность настоящего изобретения
Приведенное выше объяснение настоящего изобретения суммировано следующим образом.
(1) Фармацевтическая композиция для лечения и/или профилактики рака, содержащая антитело, которое содержит вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO: 39, 40 и 41, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO: 43, 44 и 45, или его фрагмент в качестве активного ингредиента и обладает иммунологической реактивностью по отношению к белку CAPRIN-1.
(2) Фармацевтическая композиция по п. (1), указанному выше, в которой раковым заболеванием является рак молочной железы, опухоль головного мозга, лейкоз, лимфома, рак легкого, мастоцитома, рак почек, рак шейки матки, рак пищевода, рак желудка, рак мочевого пузыря или рак прямой и ободочной кишки.
(3) Фармацевтическая композиция по п. (1) или (2), указанному выше, в которой антитело является антителом человека, гуманизированным антителом, химерным антителом, одноцепочечным антителом или биспецифичным антителом.
(4) Антитело, которое содержит вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO: 39, 40 и 41, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO: 43, 44 и 45, и обладает иммунологической реактивностью по отношению к белку CAPRIN-1.
(5) Антитело по п. (4), указанному выше, которое является антителом человека, гуманизированным антителом, химерным антителом, одноцепочечным антителом или биспецифичным антителом
(6) Фармацевтическое сочетание для лечения и/или профилактики рака, содержащее фармацевтическую композицию по любому из п.п. (1)-(3), указанному выше, и фармацевтическую композицию, содержащую противоопухолевое средство.
(7) Способ лечения и/или профилактики рака, включающий в себя введение субъекту фармацевтической композиции по любому из пп. (1)-(3), указанному выше, или антитела по любому из пп. (3)-(5), указанному выше, или его фрагмента.
(8) Способ лечения и/или профилактики рака, включающий в себя применение на субъекте фармацевтических композиций фармацевтического сочетания по п. (6), указанному выше, в сочетании.
Примеры
Настоящее изобретение описано более конкретно на основе примеров, но объем настоящего изобретения не ограничен такими конкретными примерами.
Пример 1. Идентификация нового белка ракового антигена способом SEREX
(1) Получение библиотеки кДНК
Суммарную РНК экстрагировали из ткани семенников здоровой собаки способом с использованием кислоты-гуанидиния-фенола-хлороформа. Поли-A-РНК очищали согласно протоколам, прилагаемым к набору для очистки мРНК Oligotex-dT30 (Takara Shuzo Co., Ltd.), используя набор.
Фаговую библиотеку кДНК семенников собаки синтезировали, используя полученную таким образом мРНК (5 мкг). Для получения фаговой библиотеки кДНК использовали набор для синтеза кДНК ZAP-cDNA, и набор для клонирования ZAP-cDNA gigapack III gold (STRATAGENE) и библиотеку получали согласно протоколам, прилагаемым к набору. Размер полученной таким образом фаговой библиотеки кДНК оставлял 7,73×105 БОЕ/мл.
(2) Скрининг библиотеки кДНК с использованием сыворотки
Иммунологический скрининг осуществляли, используя фаговую библиотеку кДНК семенников собаки, полученную как описано выше. В частности, хозяина Escherichia coli (XL1-Blue MRF') инфицировали фагом так, что 2210 клонов присутствовали на чашке с агарозой NZY ϕ90×15 мм. Клетки культивировали при 42°C в течение 3-4 часов, чтобы вызвать образование бляшек. Чашку покрывали нитроцеллюлозной мембраной (Hybond C Extra: GE HealthCare Bio-Sciences), пропитанной IPTG (изопропил-β-D-тиогалактозидом) при 37°C в течение 4 часов. Белки индуцировали, экспрессировали и затем переносили на мембрану. Затем мембрану извлекали, погружали и встряхивали в TBS (10 мМ трис-HCl, 150 мМ NaCl, pH 7,5), содержащем 0,5% сухого обезжиренного молока, при 4°C в течение ночи, чтобы подавить неспецифичную реакцию. Фильтр подвергали взаимодействию с разбавленной в 500 раз сывороткой собак с раковыми заболеваниями при комнатной температуре в течение 2-3 часов.
В качестве указанной выше сыворотки от собак с раковыми заболеваниями использовали сыворотку, собранную у собак с раком молочной железы. Сыворотки хранили при -80°C и затем подвергали предварительной обработке непосредственно перед использованием. Предварительную обработку сыворотки осуществляли следующим способом. В частности, хозяина Escherichia coli (XL1-Blure MRF') инфицировали фагом λ ZAP Express, в который не был встроен чужеродный ген, и затем культивировали на чашке со средой NZY при 37°C в течение ночи. Затем в чашку добавляли 0,2 М буфер NaHCO3 (pH 8,3), содержащий 0,5 М NaCl, и затем чашку оставляли стоять при 4°C в течение 15 часов. Надосадки собирали в виде экстрактов Escherichia coli/фага. Затем собранный экстракт Escherichia coli/фага пропускали через NHS-колонку (GE HealthCare Bio-Sciences), чтобы иммобилизовать полученный из Escherichia coli/фага белок. Сыворотку собак с раковыми заболеваниями пропускали через колонку, на которой был иммобилизован белок, для взаимодействия, таким образом удаляя из сыворотки антитела к Escherichia coli и антитела, адсорбируемые на фаге. Каждую фракцию сыворотки, которая была пропущена через колонку, разбавляли в 500 раз в TBS, содержащем 0,5% сухого обезжиренного молока, и полученную разбавленную сыворотку использовали в качестве материала для иммунологического скрининга.
Мембрану, на которую с помощью блоттинга переносили обработанную таким образом сыворотку и слитый белок, промывали 4 раза TBS-T (0,05% твин 20/TBS). Мембрану подвергали взаимодействию с антителом козы против IgG собаки (конъюгированное с HRP антитело козы против IgG-h+I собаки: BETHYL Laboratories) в качестве второго антитела, разбавленным в 5000 раз в TBS, содержащем 0,5% сухого обезжиренного молока, при комнатной температуре в течение 1 часа. Регистрацию осуществляли на основе цветной ферментативной реакции, используя раствор для реакции NBT/BCIP (Roche). Колонии, соответствующие участкам позитивной цветной реакции, собирали из чашки с агарозой размером ϕ90×15 мм и затем разбавляли в 500 мкл буфера SM (100 мМ NaCl, 10 мМ MgClSO4, 50 мМ трис-HCl, 0,01% желатин, pH 7,5). Вторичный скрининг и третичный скрининг повторяли способом, подобным указанному выше, вплоть до унификации позитивных в цветной реакции колоний. Таким образом проведен скрининг 30940 фаговых клонов, которые были подвергнуты взаимодействию с IgG сыворотки, и выделено 5 позитивных клонов.
(3) Поиск гомологии выделенного гена антигена
Процедуру превращения фаговых векторов в плазмидные векторы осуществляли для 5 позитивных клонов, выделенных указанным выше способом, с целью проведения анализа нуклеотидных последовательностей клонов. В частности, 200 мкл раствора, содержащего хозяина Escherichia coli (XL1-Blue MRF'), приготовленного так, чтобы получить оптическую плотность OD600 1,0, 250 мкл раствора, содержащего очищенный фаг, и 1 мкл хелперного фага ExAssist (STRATAGENE) смешивали и давали возможность взаимодействовать при 37°C в течение 15 минут. Затем добавляли 3 мл среды LB, клетки культивировали при 37°C в течение 2,5-3 часов и затем полученный продукт сразу помещали на водяную баню при 70°C и инкубировали в течение 20 минут. Центрифугирование осуществляли при 4°C, 1000×g в течение 15 минут и затем собирали надосадок в качестве раствора, содержащего фагмиду. Затем 200 мкл раствора, приготовленного с внесением хозяина фагмиды Escherichia coli SOLR так, чтобы получить оптическую плотность OD600 1,0, и 10 мкл раствора, содержащего очищенный фаг, смешивали, затем подвергали взаимодействию в течение 15 минут при 37°C. 50 мкл полученного продукта высевали на агаризованную среду LB, содержащую ампициллин (в конечной концентрации 50 мкг/мл) и затем культивировали в течение ночи при 37°C. Собирали отдельную колонию трансформированных SOLR и затем культивировали на среде LB, содержащей ампициллин (в конечной концентрации 50 мкг/мл) при 37°C. После культивирования плазмидную ДНК, несущую представляющую интерес вставку, очищали, используя набор для выделения плазмид QIAGEN Miniprep (QIAGEN).
Очищенную плазмиду подвергали анализу полной последовательности вставки способом опосредованной праймером «прогулки», используя праймер T3 с последовательностью SEQ ID NO: 31 и праймер T7 с последовательностью SEQ ID NO: 32. Последовательности генов SEQ ID NO: 5, 7, 9, 11 и 13 получали анализом последовательностей. Используя нуклеотидные последовательности генов и соответствующие им аминокислотные последовательности (SEQ ID NO: 6, 8, 10, 12 и 14), проводили поиск с использованием программы поиска гомологии BLAST search (http://www.ncbi.nlm.nih.gov/BLAST/), чтобы найти гомологию с известными генами. В результате было обнаружено, что все пять полученных генов представляли собой гены, кодирующие CAPRIN-1. Идентичность последовательностей пяти генов составляла 100% на уровне нуклеотидных последовательностей и 99% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Идентичность последовательностей таких генов и гена, кодирующего гомолог человека, составляла 94% на уровне нуклеотидных последовательностей и 98% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Нуклеотидные последовательности гомологов человека представлены в SEQ ID NO: 1 и 3, и их аминокислотные последовательности представлены в SEQ ID NO: 2 и 4. Также идентичности последовательностей полученных генов собаки и гена, кодирующего гомолог коров, составляли 94% на уровне нуклеотидных последовательностей и 97% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Нуклеотидная последовательность гомолога коров представлена в SEQ ID NO: 15, и его аминокислотная последовательность представлена в SEQ ID NO: 16. Кроме того, идентичность последовательностей генов, кодирующих гомологи человека, и гена, кодирующего гомолог коров, составляла 94% на уровне нуклеотидных последовательностей, и 93-97% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Также идентичности последовательностей полученных генов собак и гена, кодирующего гомолог лошади, составляли 93% на уровне нуклеотидных последовательностей и 97% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Нуклеотидная последовательность гомолога лошади представлена в SEQ ID NO: 17, и его аминокислотная последовательность представлена в SEQ ID NO: 18. Кроме того, идентичности последовательностей генов, кодирующих гомологи человека, и гена, кодирующего гомолог лошади, составляли 93% на уровне нуклеотидных последовательностей и 96% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Также идентичности последовательностей полученных генов собаки и генов, кодирующих гомологи мыши, составляли 87-89% на уровне нуклеотидных последовательностей и 95%-97% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Нуклеотидные последовательности гомологов мыши представлены в SEQ ID NO: 19, 21, 23, 25 и 27, а их аминокислотные последовательности представлены в SEQ ID NO: 20, 22, 24, 26 и 28. Кроме того, идентичности последовательностей генов, кодирующих гомологи человека, и генов, кодирующих гомологи мыши, составляли 89-91% на уровне нуклеотидных последовательностей и составляли 95-96% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Также идентичности последовательностей полученных генов собаки и гена, кодирующего гомолог цыпленка, составляли 82% на уровне нуклеотидных последовательностей и 87% на уровне аминокислотных последовательностей в областях, транслируемых в белки. Нуклеотидная последовательность гомолога цыпленка представлена в SEQ ID NO: 29, а его аминокислотная последовательность представлена в SEQ ID NO: 30. Кроме того, идентичности последовательностей генов, кодирующих гомологи человека, и гена, кодирующего гомолог цыпленка, составляли 81-82% на уровне нуклеотидных последовательностей и 86% на уровне аминокислотных последовательностей в областях, транслируемых в белки.
(4) Анализ экспрессии генов в каждой ткани
Экспрессию генов, полученных указанным выше способом, исследовали в нормальных тканях собаки и человека и различных клеточных линиях способом ОТ-ПЦР. Реакцию обратной транскрипции осуществляли следующим образом. Конкретно, суммарную РНК экстрагировали из 50-100 мг ткани или 5-10×106 клеток клеточной линии, используя реагент TRIZOL (Invitrogen) согласно прилагаемым протоколам. На суммарной РНК синтезировали кДНК, используя систему для синтеза первой нити Superscript для ОТ-ПЦР (Invitrogen) согласно пролагаемым протоколам. ПЦР осуществляли следующим образом, используя праймеры с последовательностями SEQ ID NO: 33 и 34, специфичные для полученных генов. В частности, реагенты и прилагаемый буфер добавляли к 0,25 мкл образца, полученного в реакции обратной транскрипции до общего объема 25 мкл, так чтобы полученная смесь содержала указанные выше праймеры по 2 мкМ каждого, dNTP по 0,2 мМ каждого и 0,65 единиц полимеразы ExTaq (Takara Shuzo Co., Ltd.). ПЦР осуществляли повторением цикла: при 94°C в течение 30 секунд, при 60°C в течение 30 секунд и при 72°C в течение 30 секунд, 30 раз, используя термоциклер (BIO RAD). Указанные выше специфичные по отношению к генам праймеры способны амплифицировать область в диапазоне от нуклеотида 206 до нуклеотида 632 в нуклеотидной последовательности SEQ ID NO: 5 (ген CAPRIN-1 собаки) и область в диапазоне от нуклеотида 698 до нуклеотида 1124 в нуклеотидной последовательности SEQ ID NO: 1 (ген CAPRIN-1 человека). В качестве контроля для сравнения также одновременно использовали GAPDH-специфичные праймеры с последовательностями SEQ ID NO: 35 и 36. В результате, как показано на фиг. 1, среди исследованных нормальных тканей собаки сильную экспрессию наблюдали в семенниках, кроме того, наблюдали экспрессию в тканях рака молочной железы собаки и аденокарциномы. Кроме того, также проводили исследование экспрессии гомолога человека с полученных генов. В результате, подобно случаю с геном CAPRIN-1 собаки, из всех нормальных тканей экспрессию можно было наблюдать только семенниках. Однако в случае раковых клеток экспрессию регистрировали во многих типах линий раковых клеток, включая линии раковых клеток молочной железы, опухоли головного мозга, лейкоза, линии раковых клеток легкого и пищевода. Экспрессию, в частности, наблюдали во многих линиях раковых клеток молочной железы. Результаты подтвердили, что экспрессия CAPRIN-1 не наблюдается в нормальных тканях, отличных от ткани семенников, тогда как CAPRIN-1 экспрессировался во многих раковых клетках и, в частности, в линиях раковых клеток молочной железы.
На фиг. 1 цифровой указатель 1 на каждой вертикальной оси обозначает картины экспрессии генов, идентифицированных выше, а цифровой указатель 2 обозначает картины экспрессии гена GAPDH в качестве контроля.
(5) Иммуногистохимическое окрашивание
(5)-1. Экспрессия CAPRIN-1 в нормальных тканях мыши и собаки
У мышей (Balb/c, самки) и собак (бигль, самки) собирали кровь при анестезии эфиром и анестезии кетамином/изофлураном. После лапаротомии каждый орган (желудок, печень, глазное яблоко, вилочковую железу, мышцу, костный мозг, матку, тонкую кишку, пищевод, сердце, почку, слюнную железу, толстую кишку, молочную железу, головной мозг, легкое, кожу, надпочечник, яичник, поджелудочную железу, селезенку и мочевой пузырь) переносили в чашку диаметром 10 см, содержащую PBS. Каждый орган рассекали в PBS и затем подвергали перфузионной фиксации в течение ночи в 0,1 М фосфатном буфере (pH 7,4), содержащем 4% параформальдегида (PFA). Перфузируемый раствор удаляли, поверхность ткани каждого органа промывали PBS, раствор PBS, содержащий 10% сахарозы, заливали в центрифужную пробирку объемом 50 мл, каждую ткань добавляли в пробирку и затем пробирку встряхивали, используя ротор, при 4°C в течение 2 часов. Раствор заменяли раствором PBS, содержащим 20% сахарозы, и затем оставляли стоять при 4°C вплоть до оседания и погружения ткани. Раствор заменяли раствором PBS, содержащим 30% сахарозы и затем оставляли стоять при 4°C вплоть до оседания и погружения ткани. Ткань извлекали и затем нужные части вырезали хирургическим скальпелем. Затем к ткани добавляли соединение OCT (Tissue Tek), так чтобы оно было тщательно нанесено на поверхность ткани, и затем ткань помещали в Cryomold. Cryomold помещали на сухой лед для быстрого замораживания. Затем делали срезы ткани толщиной от 10 мкм до 20 мкм, используя криостат (LEICA). Срезы сушили на воздухе на предметных стеклах, используя фен для волос, в течение 30 минут, получая срезы ткани на предметных стеклах. Затем каждый образец помещали в сосуд для окрашивания, заполненный PBS-T (раствор соли, содержащий 0,05% твин 20), и затем осуществляли замену PBS-T, повторяемую три раза каждые 5 минут. Избыточную воду вокруг срезов удаляли, используя салфетки Kimwipes, и затем срезы обводили, используя карандаш DAKOPEN (DAKO). В качестве блокирующих растворов реагент, блокирующий Ig мыши MOM (VECTASTAIN), и раствор PBS-T, содержащий 10% FBS, наслаивали на ткань мыши и ткань собаки, соответственно, и затем оставляли стоять во влажной камере при комнатной температуре в течение 1 часа. Затем сверху помещали раствор моноклонального антитела против CAPRIN-1 (моноклональное антитело № 1) в концентрации 10 мкг/мл, доведенной с использованием блокирующего раствора, которое взаимодействует с поверхностями раковых клеток и имеет вариабельную область тяжелой цепи SEQ ID NO: 42 и вариабельную область легкой цепи SEQ ID NO: 46, которое было получено, как описано в примере 4, и затем оставляли стоять в течение ночи во влажной камере при 4°C. 10-минутную промывку в PBS-T осуществляли 3 раза и затем наносили меченое биотином анти-IgG-антитело MOM (VECTASTAIN), разбавленное в 250 раз блокирующим раствором, и затем оставляли стоять при комнатной температуре в течение 1 часа во влажной камере. Затем 3 раза проводили десятиминутные (10 минут) промывки PBS-T, сверху наносили реагент авидин-биотин ABC (VECTASTAIN) и затем образец оставляли стоять во влажной камере при комнатной температуре в течение 5 минут. Затем 3 раза осуществляли десятиминутные (10 минут) промывки PBS-T, наносили красящий раствор DAB (DAB 10 мг +30% H2O2 10 мкл/0,05 М трис-HCl (pH 7,6) 50 мл) и затем образец оставляли стоять во влажной камере при комнатной температуре в течение 30 минут. После промывки дистиллированной водой наносили реагент гематоксилин (DAKO), образец оставляли стоять при комнатной температуре в течение 1 минуты и затем промывали дистиллированной водой. Предметные стекла погружали в 70%, 80%, 90%, 95% и затем в 100% растворы этанола в указанном порядке на 1 минуту в каждый и затем оставляли стоять в течение ночи в ксилене. Предметные стекла извлекали, герметично заливали в среду для заливки Glycergel (DAKO) и затем анализировали. В результате незначительная экспрессия CAPRIN-1 наблюдалась в клетках каждой ткани слюнной железы, почки, ободочной кишки и желудка, но экспрессия этого белка не наблюдалась на поверхности клеток. Кроме того, в тканях других органов экспрессию не наблюдали.
(5)-2 Экспрессия CAPRIN-1 в ткани рака молочной железы собаки
Замороженные срезы на стеклах готовили способом, подобным способу, описанному выше, используя 108 замороженных образцов ткани рака молочной железы собак, у которых диагностировано наличие патологии, рака молочной железы, и осуществляли иммуногистохимическое окрашивание, используя моноклональное антитело № 1, полученные как описано в примере 4. В результате экспрессию CAPRIN-1 наблюдали в 100 из 108 образцов (92,5%) и высокую экспрессию CAPRIN-1 наблюдали на поверхности раковых клеток с особенно высокой степенью атипии.
(5)-3 Экспрессия CAPRIN-1 в тканях рака молочной железы человека
Иммуногистохимическое окрашивание осуществляли, используя 188 образцов ткани рака молочной железы, на залитой в парафин матрице тканей рака молочной железы человека (BIOMAX). После 3-часовой обработки матрицы тканей рака молочной железы человека при 60°C матрицу помещали в сосуд для окрашивания, заполненный ксиленом, с последующими сменами ксилена, повторяемыми три раза каждые 5 минут. Затем подобную процедуру осуществляли с использованием этанола и PBS-T вместо ксилена. Матрицу тканей рака молочной железы человека помещали в сосуд для окрашивания, наполненный 10 мМ цитратным буфером (pH 6,0), содержащим 0,05% твин 20. После 5-минутной обработки при 125°C матрицу оставляли стоять при комнатной температуре на 40 минут или больше. Избыточную воду вокруг срезов удаляли, используя салфетки Kimwipes, и затем срезы обводили, используя карандаш DAKOPEN, и по каплям добавляли соответствующие количества блокатора пероксидазы (DAKO). После отстаивания при комнатной температуре в течение 5 минут матрицу помещали в сосуд для окрашивания, наполненный PBS-T, с последующими сменами PBS-T, повторяемыми три раза каждые 5 минут. В качестве блокирующего раствора раствор PBS-T, содержащий 10% FBS наносили на матрицу и затем матрицу оставляли стоять во влажной камере при комнатной температуре в течение 1 часа. Затем наносили раствор, содержащий моноклональное антитело № 1, имеющий концентрацию 10 мкг/мл, которую доводили, используя раствор PBS-T, содержащий 5% FBS, которое взаимодействует с поверхностями раковых клеток, и было получено, как описано в примере 4, и матрицу оставляли стоять в течение ночи во влажной камере при 4°C. Затем 3 раза проводили десятиминутные (10 минут) промывки PBS-T, по каплям добавляли меченый пероксидазой конъюгированный полимер (DAKO) в соответствующих количествах и затем матрицу оставляли стоять во влажной камере при комнатной температуре на 30 минут. Затем 3 раза осуществляли десятиминутные (10 минут) промывки в PBS-T, наносили красящий раствор DAB (DAKO) и затем оставляли стоять при комнатной температуре в течение примерно 10 минут. Красящий раствор удаляли, 3 раза промывали в PBS-T по 10 минут и затем промывали дистиллированной водой. Матрицу погружали в 70%, 80%, 90%, 95% и затем 100% растворы этанола в указанном порядке на 1 минуту в каждый и затем оставляли стоять в ксилене в течение ночи. Предметные стекла извлекали, герметично заливали в среду для заливки Glycergel (DAKO) и затем анализировали. В результате наблюдали сильную экспрессию CAPRIN-1 в 138 из 188 образцов тканей рака молочной железы (73%).
(5)-4 Экспрессия CAPRIN-1 в раковом заболевании головного мозга человека
Иммуногистохимическое окрашивание осуществляли способом, подобным способу, используемому, как описано в разделе (5)-3 выше, на 247 образцах ткани рака головного мозга на залитой в парафин матрице тканей рака головного мозга человека (BIOMAX), используя моноклональное антитело № 1, полученное, как описано в примере 4. В результате наблюдали высокую экспрессию CAPRIN-1 в 227 из 247 образцов тканей рака головного мозга (92%).
(5)-5 Экспрессия CAPRIN-1 в метастазах рака молочной железы человека в лимфатических узлах
Иммуногистохимическое окрашивание осуществляли способом, подобным способу, описанному в разделе (5)-3 выше, используя 150 образцов ткани метастазов рака молочной железы в лимфатических узлах на залитой в парафин матрице метастазов рака молочной железы человека в лимфатических узлах (BIOMAX), используя моноклональное антитело № 1, полученное, как описано в примере 4. В результате наблюдали высокую экспрессию CAPRIN-1 в 136 из 150 образцов тканей метастазов рака молочной железы в лимфатических узлах (90%). В частности, было выявлено, что CAPRIN-1 экспрессируется на высоком уровне также в раковых тканях, которые метастазировали из рака молочной железы.
(5)-6 Экспрессия CAPRIN-1 в различных тканях рака человека
Иммуногистохимическое окрашивание осуществляли способом, подобным способу, описанному выше, используя образцы на различных залитых в парафин матрицах рака человека (BIOMAX) с использованием моноклонального антитела № 1, полученного, как описано в примере 4. В результате наблюдали высокую экспрессию CAPRIN-1 в ткани рака пищевода, рака ободочной кишки, рака прямой кишки, рака легкого, рака почек, рака мочевого пузыря и рака шейки матки.
Пример 2
Получение нового белка ракового антигена человека
(1) Получение рекомбинантного белка
На основе гена с последовательностью SEQ ID NO: 1, полученного, как описано в примере 1, получали рекомбинантный белок с гомологичного гена человека следующим способом. ПЦР осуществляли в общем объеме 50 мкл, содержащем 1 мкл кДНК, два праймера (SEQ ID NO: 37 и 38, содержащие последовательности расщепления ферментами рестрикции Sac I и Xho I) по 0,4 мкМ каждого, 0,2 мМ dNTP и 1,25 единиц полимеразы PrimeSTAR HS (Takara Shuzo Co., Ltd.), полученном добавлением реагентов и прилагаемого буфера. Способом ОТ-ПЦР подтвердили экспрессию кДНК, используемой в данном случае, среди различных кДНК полученных из тканей или клеток человека, полученных согласно примеру 1. ПЦР осуществляли, повторяя следующий цикл: 98°C в течение 10 секунд и 68°C в течение 2,5 минут, 30 раз, используя термоциклер (BIO RAD). Два праймера, указанные выше, способны амплифицировать область, кодирующую полную аминокислотную последовательность SEQ ID NO: 2. После ПЦР амплифицированную таким образом ДНК подвергали электрофорезу в 1% агарозном геле и затем фрагмент ДНК размером примерно 2,1 т.п.н. очищали, используя набор для экстракции из геля QIAquick (QIAGEN).
Очищенный таким образом фрагмент ДНК фрагмент лигировали в клонирующий вектор PCR-Blunt (Invitrogen). После трансформации Escherichia coli указанным вектором собирали плазмиду. Секвенированием было подтверждено, что амплифицированный таким образом фрагмент гена имеет представляющую интерес последовательность. Плазмиду, имеющую последовательность, совпадающую с представляющей интерес последовательностью, обрабатывали ферментами рестрикции Sac I и Xho I и затем очищали, используя набор для экстракции из геля QIAquick. Представляющую интерес последовательность гена встраивали в экспрессирующий вектор Escherichia coli pET30a (Novagen), обработанный ферментами рестрикции Sac I и Xho I. С использованием такого вектора может быть получен слитый с His-меткой рекомбинантный белок. Плазмидой трансформировали Escherichia coli для экспрессии, BL21(DE3), и затем экспрессию индуцировали, используя 1 мМ IPTG, так что клетки Escherichia coli экспрессировали представляющий интерес белок.
(2) Очистка рекомбинантного белка
Полученные как описано выше рекомбинантные клетки Escherichia coli, экспрессирующие ген с последовательностью SEQ ID NO: 1, культивировали в среде LB, содержащей 30 мкг/мл канамицина, при 37°C вплоть до достижения оптической плотности при 600 нм около 0,7, добавляли изопропил-β-D-1-тиогалактопиранозид в конечной концентрации 1 мМ и затем клетки культивировали при 37°C в течение 4 часов. Затем осуществляли центрифугирование при 4800 об/мин в течение 10 минут и затем клетки собирали. Полученный осадок клеток суспендировали в фосфатно-солевом буфере и центрифугировали при 4800 об/мин в течение 10 минут и затем клетки промывали.
Клетки суспендировали в фосфатно-солевом буфере и затем разрушали обработкой ультразвуком на льду. Полученный лизат обработанных ультразвуком клеток Escherichia coli подвергали центрифугированию при 6000 об/мин в течение 20 минут и затем полученный надосадок считали растворимой фракцией, а преципитат считали нерастворимой фракцией.
Растворимую фракцию наносили на никель-хелатную колонку, подготовленную обычным способом (носитель: хелатирующая сефароза Fast Flow (GE HealthCare); емкость колонки 5 мл; и буфер для уравновешивания: 50 мМ гидрохлоридный буфер (pH 8,0)). Неадсорбированные фракции смывали, используя 50 мМ гидрохлоридный буфер (pH 8,0) в количестве, в 10 раз превышающем емкость колонки, и 20 мМ фосфатный буфер (pH 8,0) содержащий 20 мМ имидазола. Сразу после промывки элюировали 6 слоев, используя 20 мМ фосфатный буфер (pH 8,0), содержащий 100 мМ имидазола. Элюирование представляющего интерес белка подтверждали окрашиванием Кумасси фракции, элюируемой 20 мМ фосфатным буфером (pH 8,0), содержащим 100 мМ имидазола, и затем элюированную фракцию наносили на колонку с сильным анионообменником (носитель: Q-сефароза Fast Flow (GE HealthCare); емкость колонки 5 мл; и 20 мМ фосфатный буфер (pH 8,0) в качестве буфера для уравновешивания). Неадсорбированную фракцию смывали 20 мМ фосфатным буфером (pH 7,0) в количестве, в 10 раз превышающим емкость колонки, и 20 мМ фосфатным буфером (pH 7,0), содержащим 200 мМ хлорида натрия. Сразу после промывки элюировали 5 слоев с использованием 20 мМ фосфатного буфера (pH 7,0), содержащего 400 мМ хлорида натрия, и таким образом получали очищенную фракцию белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 2.
200 мкл каждого очищенного образца, полученного описанным выше способом, вносили в 1 мл буфера для реакции (20 мМ трис-HCl, 50 мМ NaCl, 2 мМ CaCl2, pH 7,4) с последующим добавлением 2 мкл энтерокиназы (Novagen). Затем полученную смесь оставлял стоять в течение ночи при комнатной температуре для осуществления реакции, чтобы отщепить His-метку, и затем осуществляли очистку, используя набор для улавливания продукта расщепления энтерокиназой (Novagen) согласно прилагаемым протоколам. Затем 1,2 мл очищенного образца, полученного указанным выше способом, подвергали замене буфера на физиологический фосфатный буфер (Nissui Pharmaceutical Co., Ltd.), используя устройство для ультрафильтрации NANOSEP 10K OMEGA (PALL). Затем осуществляли стерильную фильтрацию, используя HT Tuffryn Acrodisc 0,22 мкм (PALL) и затем полученный материал использовали для дальнейшего эксперимента.
Пример 3. Получение моноклонального антитела цыпленка против CAPRIN-1
300 мкг антигенного белка (CAPRIN-1 человека), показанного в виде SEQ ID NO: 2, полученного согласно примеру 2, смешивали с эквивалентным количеством полного адъюванта Фрейнда и затем использовали в качестве раствора антигена для одного цыпленка. Раствор антигена вводили внутрибрюшинно цыплятам 7-недельного возраста (Japan SLC Inc.) и затем введение осуществляли 7 раз каждые 4 недели, таким образом осуществляя иммунизацию. Каждую селезенку вырезали через 4 дня после конечной иммунизации, и помещали между двумя стерилизованными предметными стеклами и затем раздавливали. Полученный материал промывали PBS(-) (Nissui) и затем центрифугировали при 1500 об./мин в течение 10 минут, чтобы удалить надосадок. Указанную процедуру повторяли 3 раза, получая спленоциты. Полученные таким образом спленоциты и клетки миеломы цыпленка с дефицитом по легкой цепи смешивали в соотношении 5:1. Используемые клетки миеломы цыпленка были получены от цыпленка посредством трансформации с использованием вируса ретикулоэндотелиоза птиц. К смеси добавляли раствор ПЭГ, приготовленный смешиванием 200 мкл среды IMDM, содержащей 10% FBS, нагретой до 37°C, и 800 мкл ПЭГ1500 (Boehringer), оставляли стоять в течение 5 минут для слияния клеток и затем подвергали центрифугированию при 1700 об/мин в течение 5 минут. После удаления надосадка клетки суспендировали в 300 мл среды IMDM, содержащей 10% FBS, с добавлением раствора HAT (Gibco) (2% эквивалент) (селективная среда HAT), и затем суспензию клеток высевали на тридцать 96-луночных планшетов (Nunc) по 100 мкл на лунку. Клетки культивировали в течение 7 суток при 37°C в условиях 5% CO2, получая гибридомы в результате слияния спленоцитов и клеток миеломы цыпленка.
Гибридомы отбирали, используя в качестве маркера аффинность связывания антитела, продуцируемого полученными гибридомами, с белком CAPRIN-1. Раствор белка CAPRIN-1 (1 мкг/мл), полученный, как описано в примере 2, добавляли в 96-луночный планшет по 100 мкл на лунку и затем оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали 3 раза PBS-T, в лунки добавляли по 400 мкл 0,5% раствора бычьего сывороточного альбумина (БСА) (SIGMA) и затем планшет оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли и затем лунки три раза промывали 400 мкл PBS-T на лунку. Надосадок культуры полученных как описано выше гибридом добавляли по 100 мкл на лунку и затем оставляли стоять при комнатной температуре на 2 часа. После промывки каждой лунки три раза PBS-T добавляли HRP-меченое антитело против IgY цыпленка (Sigma), разбавленное в 5000 раз в PBS, по 100 мкл на лунку и затем полученную смесь оставляли стоять при комнатной температуре на 1 час. После промывки лунок три раза PBS-T в лунки добавляли по 100 мкл раствора субстрата TMB (Thermo) и затем оставляли стоять на 15-30 минут для цветной реакции. После развития окраски в лунки добавляли по 100 мкл 1N серной кислоты, чтобы остановить реакцию, и затем измеряли оптическую плотность при 450 нм и 595 нм, используя абсорбционный спектрометр. В результате было отобрано несколько гидридом, продуцирующих антитела, с высокими значениями оптической плотности.
Отобранные таким образом гибридомы добавляли в 96-луночный планшет по 0,5 клеток на лунку и затем культивировали. Спустя 1 неделю наблюдали гибридомы, которые образовали отдельные колонии в лунках. Такие клетки в лунках дополнительно культивировали и затем отбирали гибридомы, используя в качестве маркера аффинность связывания антител, продуцируемых клонированными гибридомами, с белком CAPRIN-1. Раствор белка CAPRIN-1 (1 мкг/мл), полученного согласно примеру 2, добавляли в 96-луночный планшет по 100 мкл на лунку и затем оставляли стоять при 4°C на 18 часов. Каждую лунку промывали три раза PBS-T, добавляли по 400 мкл 0,5% раствора БСА и затем планшет оставляли стоять при комнатной температуре на 3 часа. Раствор удаляли и затем лунки три раза промывали, добавляя по 400 мкл PBS-T на лунку. По 100 мкл каждого надосадка культуры полученных как описано выше гибридом добавляли на лунку и затем планшет оставляли стоять при комнатной температуре на 2 часа. После промывки каждой лунки три раза PBS-T в лунки добавляли по 100 мкл HRP-меченого антитела против IgY цыпленка (Sigma), разбавленного в 5000 раз в PBS, и затем оставляли стоять при комнатной температуре на 1 час. После промывки лунок три раза PBS-T в лунки добавляли по 100 мкл раствора субстрата TMB (Thermo) и затем оставляли стоять на 15-30 минут для цветной реакции. После развития окраски добавляли по 100 мкл 1N серой кислоты на лунку, чтобы остановить реакцию и затем измеряли оптические плотности при 450 нм и 595 нм, используя абсорбционный спектрометр. В результате получили несколько линий клеток гибридом, продуцирующих моноклональные антитела, реактивные по отношению к белку CAPRIN-1.
Затем из указанных моноклональных антител отбирали антитела, реактивные по отношению к клеточным поверхностям раковых клеток молочной железы, экспрессирующих CAPRIN-1. В частности, 5 х 105 клеток линии раковых клеток молочной железы человека MDA-MB-231V центрифугировали в микроцентрифужной пробирке объемом 1,5 мл и в пробирку добавляли 100 мкл надосадка культуры каждой из указанных выше гибридом и затем пробирку оставляли стоять на льду на 1 час. После промывки в PBS добавляли ФИТЦ-меченое антитело козы против IgG (H+L) цыпленка (SouthernBiotech), разбавленное в 30 раз в PBS, содержащем 0,1% FBS, и затем оставляли стоять на льду на 1 час. После промывки PBS измеряли интенсивность флуоресценции, используя FACS caliber (Becton, Dickinson and Company). Тем временем осуществляли операции, сходные с указанными выше, используя среду для культивирования гибридом, получая таким образом контрольный образец. В результате было отобрано одно моноклональное антитело (моноклональное антитело №1), которое давало более высокую интенсивность флуоресценции, чем в контроле, а значит, которое взаимодействовало с клеточными поверхностями раковых клеток молочной железы, экспрессирующих CAPRIN-1.
Пример 4
Характеристика отобранных антител
(1) Клонирование генов вариабельных областей моноклональных анти-CAPRIN-1-антител
мРНК экстрагировали из линии клеток гибридом, полученных от цыпленка, продуцирующих моноклональные антитела (отобранные, как описано в примере 3), взаимодействующие с поверхностями раковых клеток молочной железы, экспрессирующих CAPRIN-1. Способ ОТ-ПЦР с использованием праймеров, специфичных к последовательности, полученной из FR1 цыпленка, и к последовательности, полученной из FR4 цыпленка, и получили ген вариабельной области тяжелой цепи (VH) и ген вариабельной области легкой цепи (VL) антитела. мРНК также экстрагировали из двух линий клеток гибридом, полученных от мыши, продуцирующих моноклональные антитела, взаимодействующие с поверхностями раковых клеток молочной железы, экспрессирующих CAPRIN-1. Осуществляли способ ОТ-ПЦР с использованием праймеров, специфичных к последовательности, полученной из FR1 мыши, и к последовательности, полученной из FR4 мыши, и получили ген вариабельной области тяжелой цепи (VH) и ген вариабельной области легкой цепи (VL) каждого антитела. Для определения последовательности такие гены клонировали в векторе pCR2.1 (Invitrogen).
(1)-1 ОТ-ПЦР
После экстракции суммарной РНК из 106 клеток каждой линии клеток гибридом с использованием набора для выделения высокоочищенной РНК (Roche) синтезировали кДНК, используя набор для синтеза 1-ой нити кДНК PrimeScriptII (Takara). Указанный способ осуществляли согласно протоколам, прилагаемым к каждому набору.
Ген вариабельной области тяжелой цепи антитела цыпленка и ген вариабельной области легкой цепи цыпленка и ген вариабельной области тяжелой цепи антитела мыши и ген вариабельной области легкой цепи антитела мыши амплифицировали способом ПЦР согласно обычной методике, используя синтезированную таким образом кДНК в качестве матрицы и полимеразу KOD-Plus-DNA (TOYOBO).
Чтобы получить ген VH-области антитела цыпленка, использовали праймер, специфичный к последовательности FR1 тяжелой цепи цыпленка, и праймер, специфичный к последовательности FR4 тяжелой цепи цыпленка. Кроме того, чтобы получить ген VL-области, использовали праймер, специфичный к последовательности FR1 легкой цепи цыпленка и праймер, специфичный к FR4 легкой цепи цыпленка. Гены VH- и VL-областей антитела мыши получали способом, подобным способу, описанному выше. В частности, использовали праймер, специфичный к последовательности FR1 тяжелой цепи мыши, праймер, специфичный к последовательности FR4 тяжелой цепи мыши, праймер, специфичный к последовательности FR1 легкой цепи мыши, и праймер, специфичный к FR4 легкой цепи мыши.
Каждый из полученных таким образом продуктов ПЦР подвергали электрофорезу в агарозном геле и полосы ДНК VH-области и VL-области вырезали. Фрагменты ДНК очищали, используя набор для очистки из геля QIAquick (QIAGEN) согласно прилагаемым протоколам. Очищенную кДНК клонировали в векторе pCR2.1, используя набор для клонирования TA (Invitrogen). Лигированным вектором трансформировали компетентные клетки DH5 (TOYOBO) согласно стандартному способу. 10 клонов каждого трансформанта культивировали в течение ночи в среде (100 мкг/мл ампициллина) при 37°C и затем плазмидную ДНК очищали, используя набор Qiaspin Miniprep (QIAGEN).
(1)-2. Определение последовательности
Последовательности генов VH-области и VL-области в каждой плазмиде, полученной как описано выше, анализировали, используя прямой праймер M13 (SEQ ID NO: 47) и обратный праймер M13 (SEQ ID NO: 48) на флуоресцентном секвенаторе (секвенатор ДНК 3130XL; ABI), используя набор для секвенирования Big Dye Terminator Ver3.1 Cycle (ABI) согласно прилагаемым протоколам. В результате определили последовательности каждого гена. Последовательности в 10 клонах были идентичными.
Полученная таким образом последовательность гена, кодирующая вариабельную область тяжелой цепи моноклонального антитела, полученного от цыпленка, представлена в виде SEQ ID NO: 49, и ее аминокислотная последовательность представлена в виде SEQ ID NO: 42, и полученная таким образом последовательность гена, кодирующая вариабельную область легкой цепи, представлена в виде SEQ ID NO: 50, и ее аминокислотная последовательность представлена в виде SEQ ID NO: 46.
В частности, было обнаружено, что моноклональное антитело №1 содержит вариабельную область тяжелой цепи SEQ ID NO: 42 и вариабельную область легкой цепи SEQ ID NO: 46, при этом CDR1, CDR2 и CDR3 в вариабельной области тяжелой цепи состоят из аминокислотных последовательностей SEQ ID NO: 39, 40 и 41, соответственно, и CDR1, CDR2 и CDR3 в вариабельной области легкой цепи состоят из аминокислотных последовательностей SEQ ID NO: 43, 44 и 45, соответственно.
(2) Получение химерного рекомбинантного антитела человека-цыпленка и химерного антитела мыши-цыпленка
Амплифицированный фрагмент гена вариабельной области тяжелой цепи (SEQ ID NO: 42) моноклонального антитела цыпленка №1, полученный, как описано в разделе (1) выше, обрабатывали с обоих концов ферментами рестрикции и затем очищали. Полученный фрагмент обычным способом встраивали в вектор pcDNA4/myc-His (Invitrogen), в который уже были встроены лидерная последовательность, полученная из антитела цыпленка, содержащая последовательность SEQ ID NO: 51, и константная область H-цепи IgG1 человека, содержащая последовательность SEQ ID NO: 52. Кроме того, амплифицированный фрагмент гена вариабельной области легкой цепи моноклонального антитела № 1 цыпленка (SEQ ID NO: 46) обрабатывали с обоих концов ферментами рестрикции и затем очищали. Полученный фрагмент обычным способом встраивали в вектор pcDNA3.1/myc-His (Invitrogen), в который уже были встроены лидерная последовательность, полученная из антитела цыпленка, содержащая последовательность SEQ ID NO: 51, и константная область L-цепи IgG1 человека, содержащая последовательность SEQ ID NO: 53.
Затем полученный, как описано выше, рекомбинантный вектор, в который была встроена вариабельная область тяжелой цепи (SEQ ID NO: 42) моноклонального антитела цыпленка №1, и полученный, как описано выше, рекомбинантный вектор, в который была встроена вариабельная область легкой цепи моноклонального антитела № 1 цыпленка (SEQ ID NO: 46), вводили в клетки CHO-K1 (полученные из банка клеток RIKEN). В частности, 2×105 клеток CHO-K1, культивируемых в 1 мл среды Хама F12 (Invitrogen), содержащей 10% FBS, в лунке 12-луночной чашки для культивирования, промывали PBS(-). Затем добавляли по 1 мл среду Хама F12, содержащей 10% FBS, на лунку и затем в каждую лунку добавляли 250 нг каждого из описанных выше векторов, растворенных в 30 мкл OptiMEM (Invitrogen), и 30 мкл реагенты для трансфекции Polyfect (QIAGEN). Клетки CHO-K1, в которые был введен описанный выше рекомбинантный вектор, культивировали в среде Хама F12, содержащей 10% FBS, с добавлением 200 мкг/мл зеоцина (Invitrogen) и 200 мкг/мл генетицина (Roche). Клетки CHO-K1, в которые был введен указанный выше рекомбинантный вектор, высевали в 96-луночный планшет по 0,5 клеток на лунку. Таким образом получали линию клеток, стабильно продуцирующих химерное антитело № 1 человека-цыпленка (также называемое № 1), имеющее вариабельную область моноклонального антитела № 1 цыпленка. Полученную таким образом линию клеток культивировали во флаконе с площадью 150 см2, содержащем 30 мл бессывороточной среды OptiCHO (Invitrogen), при плотности 5×105 клеток/мл в течение 5 суток. Затем получали надосадок культуры, содержащий антитело №1.
Способом, подобным способу, описанному выше, амплифицированный фрагмент гена вариабельной области тяжелой цепи (SEQ ID NO: 42) моноклонального антитела №1 цыпленка обрабатывали с обоих концов ферментами рестрикции и затем очищали. Полученный фрагмент встраивали обычным способом в вектор pcDNA4/myc-His (Invitrogen), в который уже были встроены лидерная последовательность, полученная из антитела цыпленка, и константная область H-цепи IgG1 мыши. Кроме того, амплифицированный фрагмент гена вариабельной области легкой цепи (SEQ ID NO: 46) моноклонального антитела цыпленка №1 обрабатывали с обоих концов ферментами рестрикции и затем очищали. Полученный фрагмент встраивали обычным способом в вектор pcDNA3.1/myc-His (Invitrogen), в который уже были встроены лидерная последовательность, полученная из антитела цыпленка, и константная область L-цепи IgG1 мыши. Полученный вектор вводили в клетки CHO-K1 описанным выше способом и таким образом получали линию клеток, стабильно продуцирующих химерное антитело №1 мыши-цыпленка, содержащее вариабельную область моноклонального антитела цыпленка №1. Клетки культивировали при плотности 5×105 клеток/мл, используя флакон с площадью 150 см2 и 30 мл бессывороточной среды OptiCHO (Invitrogen), в течение 5 суток, таким образом получали надосадок культуры, содержащий химерное антитело мыши-цыпленка № 1.
(3) Экспрессия CAPRIN-1 на поверхности различных раковых клеток, исследуемая с использованием анти-CAPRIN-1-антитела №1
Затем 7 линий раковых клеток молочной железы (MDA-MB-157, T47D, MRK-nu-1, MDA-MB-231V, BT20, SK-BR-3 и MDA-MB-231T), в случае которых наблюдали экспрессию гена CAPRIN-1, и 3 других линии раковых клеток молочной железы (MDA-MB-231C, MCF-7 и ZR75-1), 5 линий клеток глиомы (T98G, SNB19, U251, U87MG и U373), 4 линии раковых клеток почек (Caki-1, Caki-2, A498 и ACHN), 2 линии раковых клеток желудка (MNK28 и MNK45), 5 линий раковых клеток прямой и ободочной кишки (HT29, LoVo, Caco2, SW480 и HCT116), 3 линии раковых клеток легкого (A549, QG56 и PC8), 4 линии лейкозных клеток (AML5, Namalwa, BDCM, RPI1788), одну линию раковых клеток шейки матки (SW756), одну линию раковых клеток мочевого пузыря (T24), одну линию раковых клеток пищевода (KYSE180) и одну линию клеток лимфомы (Ramos) исследовали в отношении экспрессии белка CAPRIN-1 на поверхности клеток каждой линии клеток, используя надосадки культуры клеток CHO-K1, содержащие антитело № 1, полученное, как описано в разделе (2) выше. 106 клеток каждой линии клеток центрифугировали в микроцентрифужной пробирке объемом 1,5 мл. Каждый надосадок культуры клеток (100 мкл) CHO-K1, содержащие антитело №1, добавляли и затем оставляли стоять на льду в течение 1 часа. После промывки PBS добавляли ФИТЦ-меченое антитело козы против IgG (H+L) человека (SouthernBiotech) и ФИТЦ-меченое антитело против IgG (H+L) мыши (Invitrogen), разбавленное в 500 раз в PBS, содержащем 0,1% FBS, и затем оставляли стоять на льду в течение 1 часа. После промывки PBS измеряли интенсивность флуоресценции, используя FACS Calibur (Becton, Dickinson and Company). При этом в качестве контрольного образца осуществляли операции, подобные описанным выше, используя надосадок культуры клеток CHO-K1, в которые не был введен ген антитела, и среду для культивирования гибридом, получая образец негативного контроля. В результате, клетки, к которым было добавлено антитело №1, имели интенсивность флуоресценции выше на 20% или больше, чем в случае контроля. В частности интенсивность флуоресценции возрастала до 4900% в случае SK-BR-3 и до 5000% в случае MDA-MB-231V. Полученные результаты показали, что белок CAPRIN-1 экспрессировался на поверхностях клеточных мембран указанных выше линий раковых клеток человека. Усиление указанной выше интенсивности флуоресценции в процентах выражали в виде увеличения в процентах средней интенсивности флуоресценции (уровень MFI) в каждом типе клеток и вычисляли по следующей формуле.
Увеличение средней интенсивности флуоресценции в процентах (усиление интенсивности флуоресценции в процентах) (%)=((уровень MFI клеток, подвергнутых взаимодействию с антителом против CAPRIN-1 человека)-(уровень MFI в контроле))/(уровень MFI в контроле)×100.
(4) Противоопухолевые эффекты (ADCC-активность) анти-CAPRIN-1-антитела № 1 против раковых клеток
Затем анти-CAPRIN-1-антитело №1 оценивали в отношении их цитотоксической активности (ADCC-активности), направленной против раковых клеток. Надосадок каждой из культур клеток, продуцирующих антитела № 1 и № 2, полученные, как описано в разделе (2) выше, очищали, используя колонку с белок-A-сефарозой FF Hitrap (GE HealthCare), буфер заменяли на PBS(-) и затем фильтровали, используя фильтр 0,22 мкм (Millipore). Полученные вещества использовали в качестве антител для измерения активности. 106 клеток линии раковых клеток молочной железы человека MDA-MB-157 собирали в центрифужную пробирку объемом 50 мл, добавляли 100 микрокюри хрома-51 и затем осуществляли инкубацию при 37°C в течение 2 часов. Затем полученный материал три раза промывали средой RPMI1640, содержащей 10% FBS. Клетки добавляли в 96-луночный планшет с V-образным дном по 5×103 клеток на лунку для использования в качестве клеток-мишеней. К клеткам добавляли очищенные как описано выше антитела в конечной концентрации 1 мкг. Затем добавляли 2,5×105 клеток лимфоцитов, выделенных из периферической крови человека согласно обычному способу и затем культивировали в течение 4 часов при 37°C в условиях 5% CO2. После культивирования измеряли количество хрома-51, высвобождаемого из поврежденных раковых клеток в надосадок культуры, и вычисляли ADCC-активность для каждого анти-CAPRIN-1-антитела, направленную против раковых клеток. В качестве негативных контрольных образцов использовали образец, полученный добавлением PBS вместо анти-CAPRIN-1-антител, и образец, полученный добавлением антитела для контроля изотипа вместе анти-CAPRIN-1-антител. В результате антитело №1 проявляло 30% или более высокую цитотоксическую активность против MDA-MB-157 (см. фиг. 2). Напротив, активность в образце, полученном добавлением PBS в качестве негативного контроля, и активность в образце, полученном добавлением антитела для контроля изотипа в качестве негативного контроля, составляли 1,1% и 2,0%, соответственно. Подобным образом, антитело №1 исследовали в отношении ADCC-активности, направленной против других раковых клеток, включая линии клеток глиомы T98G и U373, линии раковых клеток легкого A549 и QG56, линии раковых клеток почек Caki-1 и ACHN, линию раковых клеток шейки матки SW756, линию раковых клеток мочевого пузыря T24, линию раковых клеток пищевода KYSE180, линии раковых клеток желудка MNK28 и MNK45, линию раковых клеток прямой и ободочной кишки SW480, линию лейкозных клеток AML5 и линию клеток лимфомы Ramos. В результате анти-CAPRIN-1-антитело №1 проявляло активность 16,4% против T98G (1,2% в случае изотипического контроля), 23,1% против U373 (3,2% в случае изотипического контроля), 36,1% против A549 (3,0% в случае изотипического контроля), 33,5% против QG56 (0,5% в случае изотипического контроля), 28,3% против Caki-1 (2,6% в случае изотипического контроля), 25,1% против ACHN (1,6% в случае изотипического контроля), 27,9% против SW756 (2,2% в случае изотипического контроля), 25,8% против T24 (2,0% в случае негативного контроля), 26,7% против KYSE180 (3,0% в случае изотипического контроля), 21,5% против MNK28 (1,9% в случае изотипического контроля), 23,0% против MNK45 (3,0% в случае изотипического контроля), 24,0% против SW480 (1,8% в случае изотипического контроля), 8,3% против AML5 (1,8% в случае изотипического контроля) и 8,0% против Ramos (2,2% в случае изотипического контроля). Приведенные выше результаты продемонстрировали, что полученное таким образом анти-CAPRIN-1-антитело №1 повреждает различные раковые клетки человека, экспрессирующие CAPRIN-1.
(5) Противоопухолевые эффекты (CDC-активность) анти-CAPRIN-1-антитела №1, направленные против раковой клетки
Затем анти-CAPRIN-1-антитело №1 оценивали в отношении их цитотоксической активности (CDC-активности) против раковых клеток. Кровь, собранную у кролика, добавляли в пробирку Эппендорф, оставляли стоять при комнатной температуре на 60 минут и затем подвергали 5-минутному центрифугированию при 3000 об/мин. Таким образом получали сыворотку для измерения CDC-активности. 106 клеток линии раковых клеток молочной железы человека MDA-MB-231V собирали в центрифужной пробирке объемом 50 мл, добавляли 100 микрокюри хрома-51 и затем инкубировали при 37°C в течение 2 часов. Полученный материал три раза промывали средой RPMI, содержащей 10% FBS. Затем клетки суспендировали в среде RPMI, содержащей полученную, как описано выше сыворотку кролика (50%), и затем добавляли в 96-луночный планшет с V-образным дном по 5×103 клеток на лунку. К клеткам добавляли антитело №1, полученного, как описано в разделе (5), в конечной концентрации 1 мкг/мл, и затем клетки культивировали в течение 4 часов при 37°C в условиях 5% CO2. После культивирования измеряли количество хрома-51, высвобождаемого из поврежденных опухолевых клеток в надосадок культуры, и затем вычисляли CDC-активность, направленную против MDA-MB-231V. В результате, антитело №1 проявляло 25% или более высокую CDC-активность. Следовательно, было обнаружено, что антитело №1 может повреждать раковые клетки, экспрессирующие CAPRIN-1, также посредством CDC-активности.
Пример 5. Противоопухолевые эффекты анти-CAPRIN-1-антитела №1 in vivo у мышей
Затем полученное таким образом анти-CAPRIN-1-антитело №1 оценивали в отношении их противоопухолевых эффектов in vivo у мышей, несущих опухоли. Антитела, используемые в данном случае, получали очисткой на колонке надосадка культуры каждой линии клеток, продуцирующих антитело №1, таким же способом, как способ, описанный выше.
Противоопухолевые эффекты антитела №1 исследовали, используя мышей, несущих опухоли, которым трансплантировали полученную от мышей линию раковых клеток, экспрессирующих CAPRIN-1. Клетки 4T1 (приобретенные из ATCC) трансплантировали подкожно в область спины 20 мышам Balb/c (Japan SLC Inc.) по 5×105 клеток/мышь. Опухолям давали возможность расти до достижения размера примерно 5 мм в диаметре. Антитело №1 вводили внутрибрюшинно 10 мышам, несущим опухоли, из 30 мышей, несущих опухоли, в количестве 200 мкг (в 200 мкл) на одну мышь. Затем такое же количество антитела вводили внутрибрюшинно каждой несущей опухоль мыши 3 раза в течение 2 дней. Размер опухолей измеряли каждый день и определяли противоопухолевые эффекты путем наблюдения. Тем временем в качестве контрольной группы вводили PBS (-) вместо антител остальным 10 несущим опухоли мышам. В результате наблюдения противоопухолевых эффектов в исследуемой группе, в которой вводили анти-CAPRIN-1-антитело №1, было обнаружено, что опухоли регрессировали примерно до 55% на 4 день, примерно 32% на 6 день, примерно 7% на 8 день, и было обнаружено, что опухоли почти полностью подвергались регрессии до 10-14 дня, при условии, что объем опухоли в начале введения антитела принимали за 100% (см. фиг. 3). Полученные результаты продемонстрировали, что полученное антитело №1 оказывает сильное противоопухолевое действие in vivo на раковые клетки, экспрессирующие CAPRIN-1. Размер опухолей (раковых заболеваний) вычисляли в виде объема, используя формулу: длина по основной оси x длина по малой оси x длина по малой оси x 0,5.
Промышленная применимость
Антитела согласно настоящему изобретению применимы для лечения и/или профилактики рака.
Все публикации, патенты и заявки на выдачу патентов, цитированные в настоящем описании, включены в настоящую публикацию в виде ссылки в полном объеме.
Свободный текст списка последовательностей
SEQ ID NO: 31-38, 47 и 48: праймеры
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2011 |
|
RU2607366C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2011 |
|
RU2598258C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2011 |
|
RU2597971C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2013 |
|
RU2633505C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2013 |
|
RU2639522C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2013 |
|
RU2632645C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РАКА | 2013 |
|
RU2631804C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2011 |
|
RU2603742C2 |
| ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2011 |
|
RU2624029C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2009 |
|
RU2498819C2 |

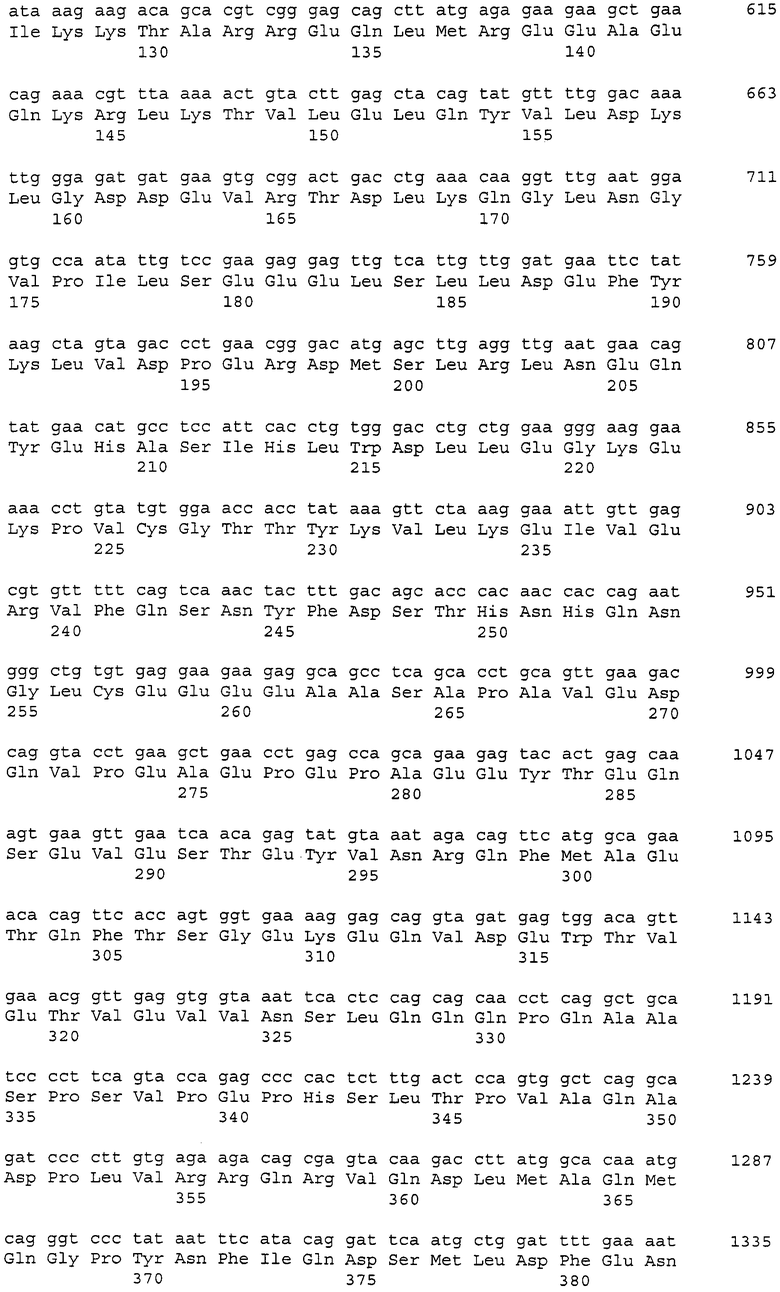
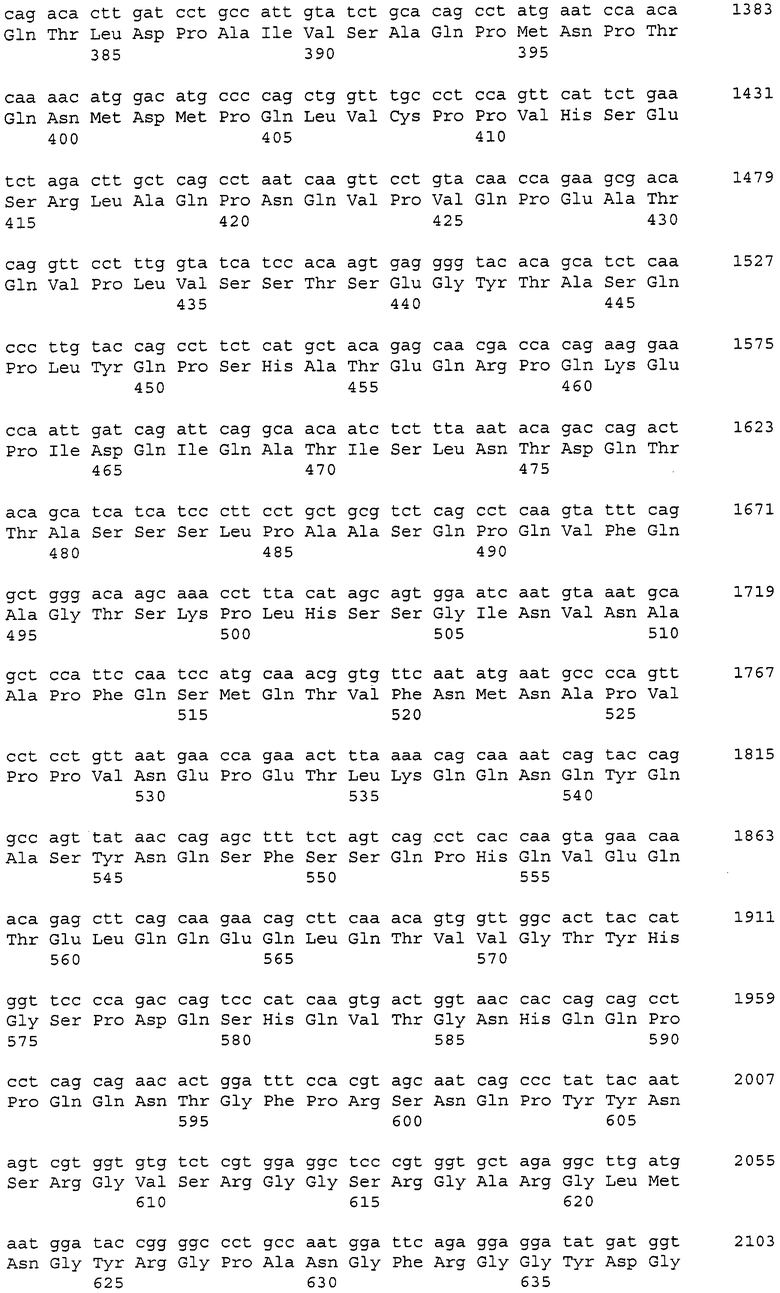






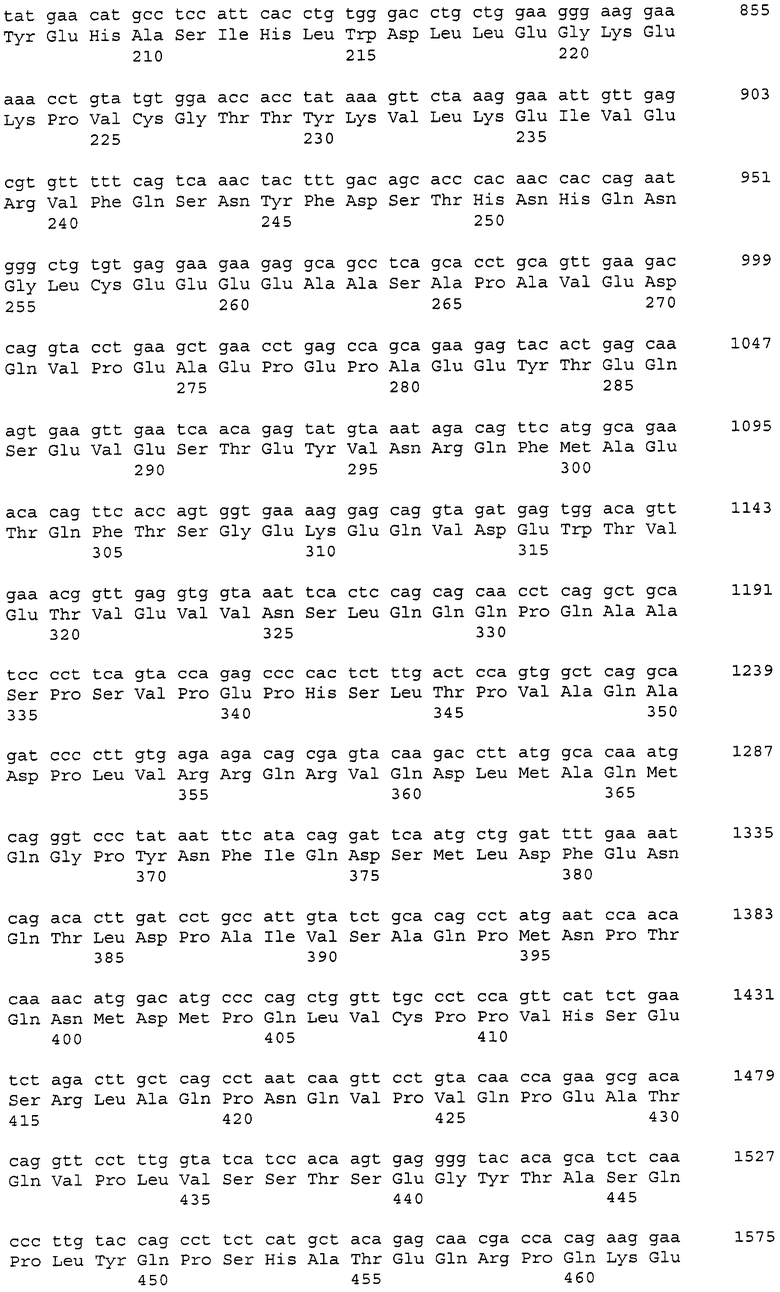




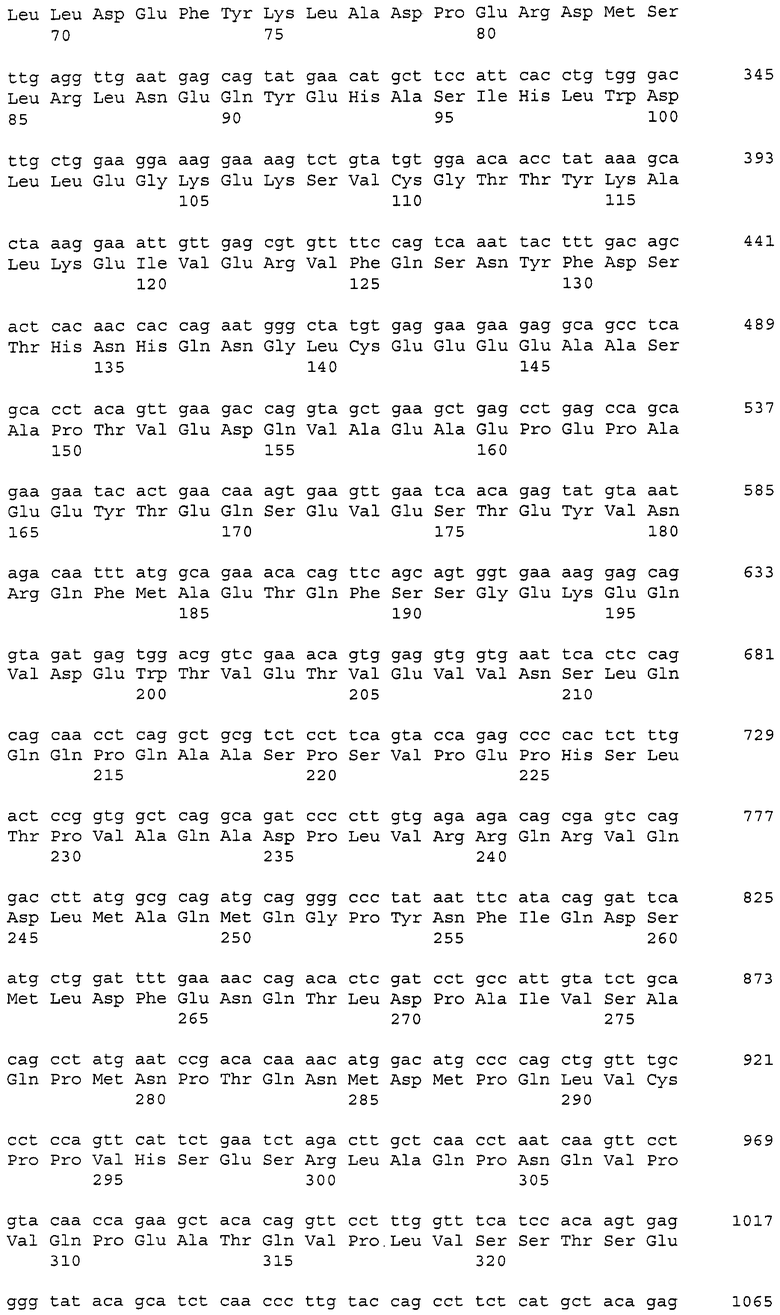



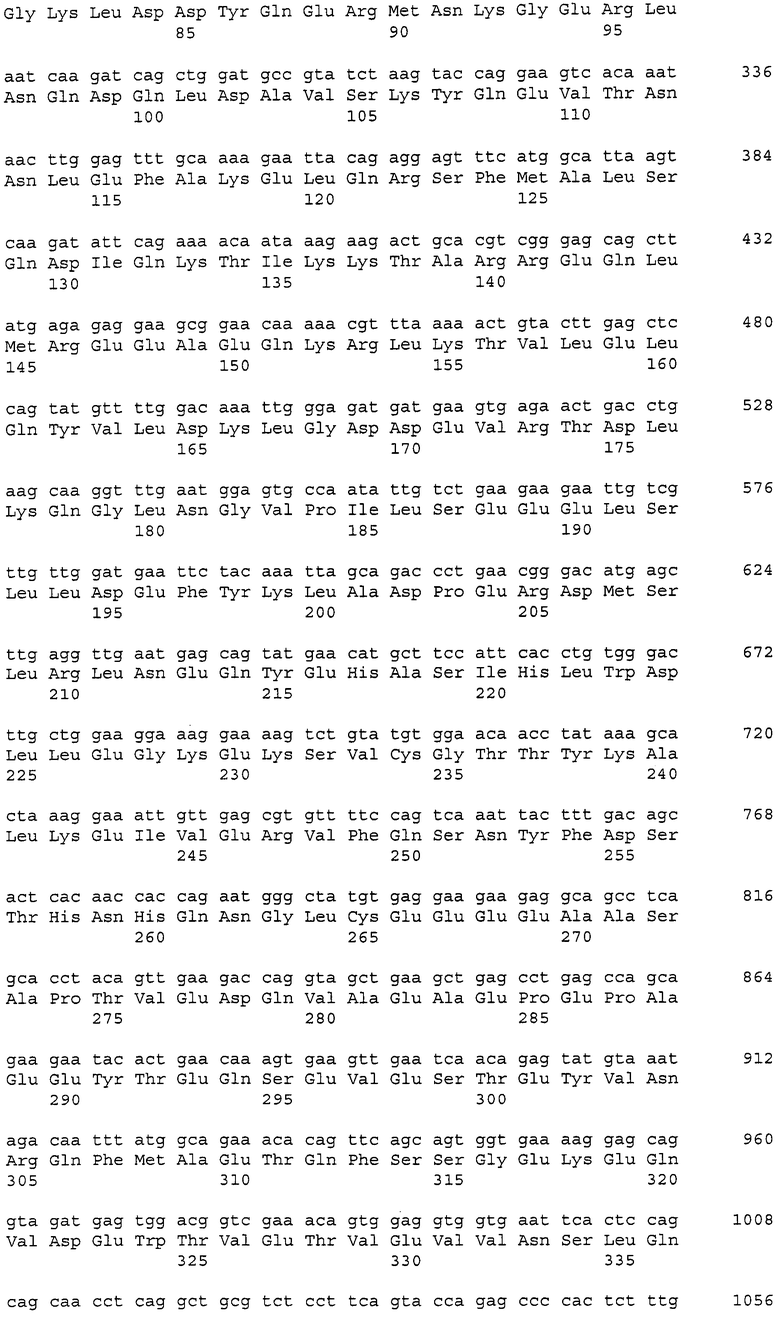
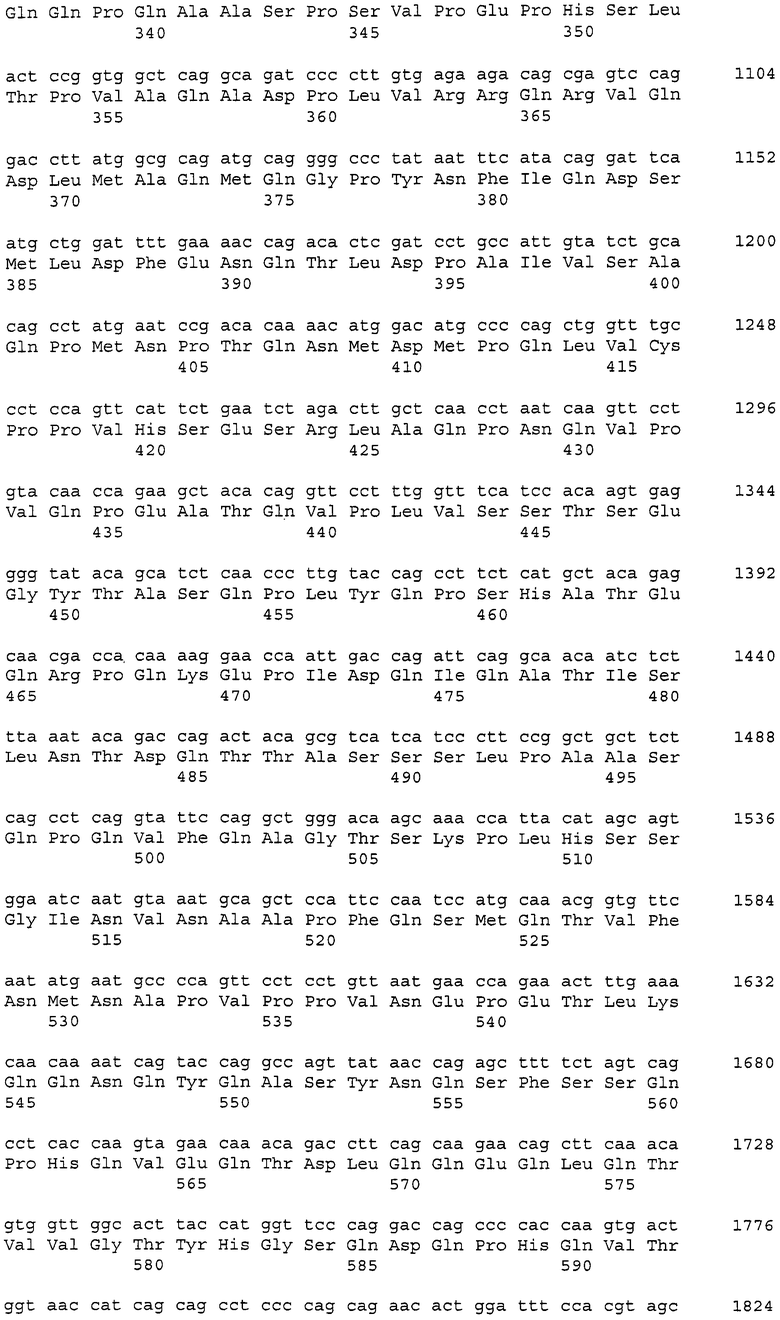





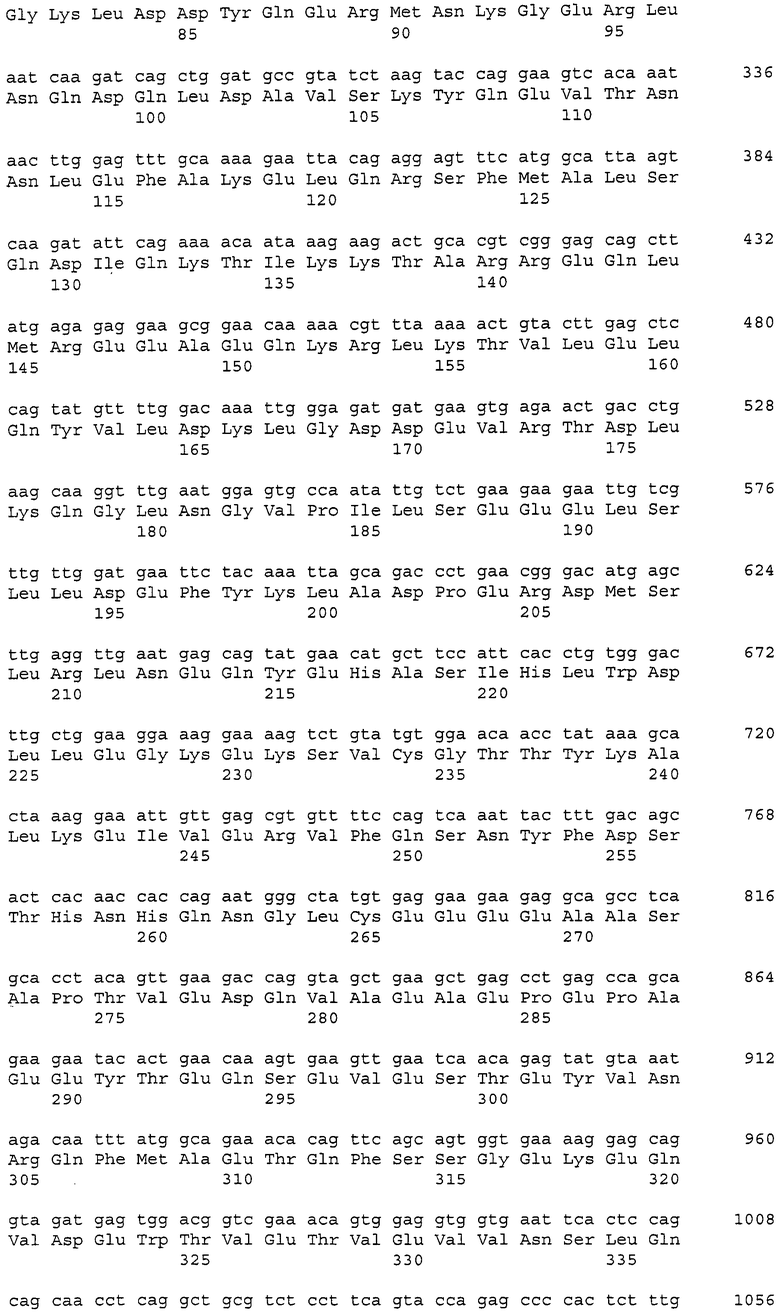
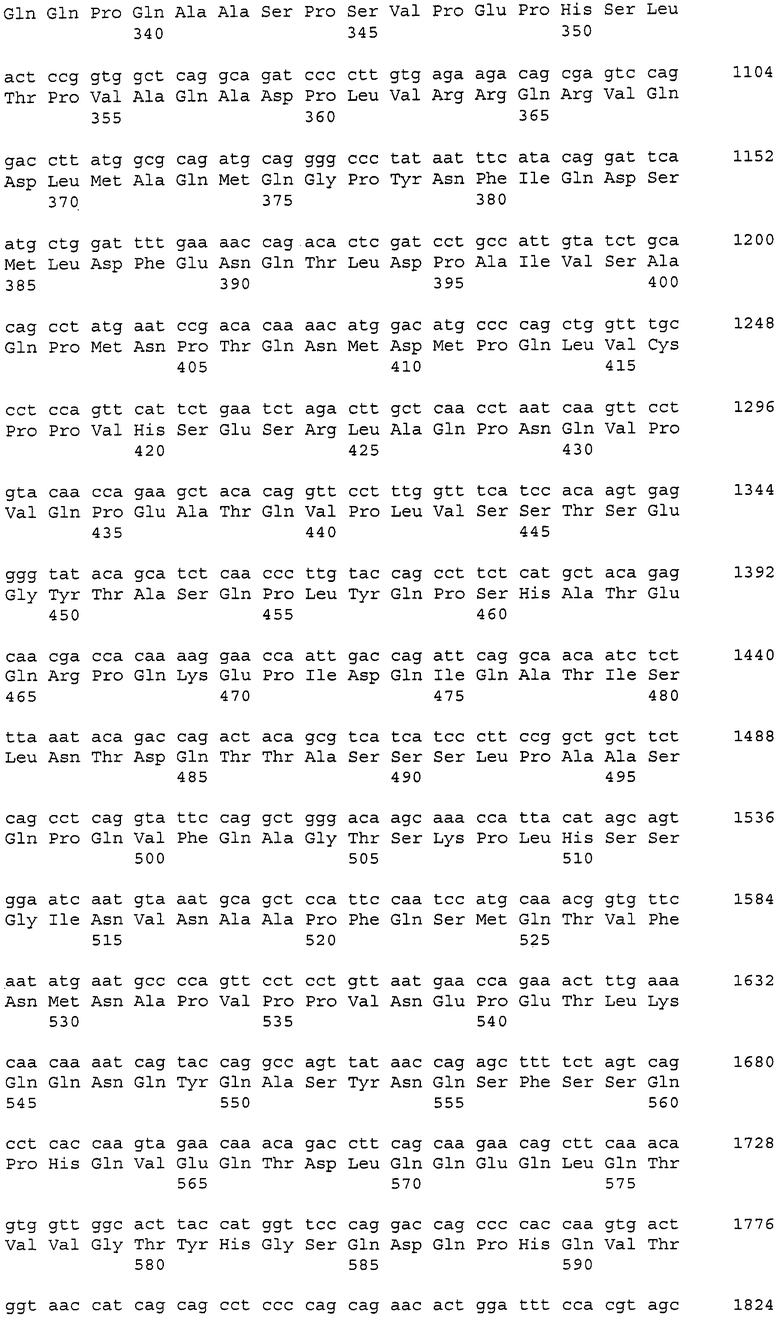







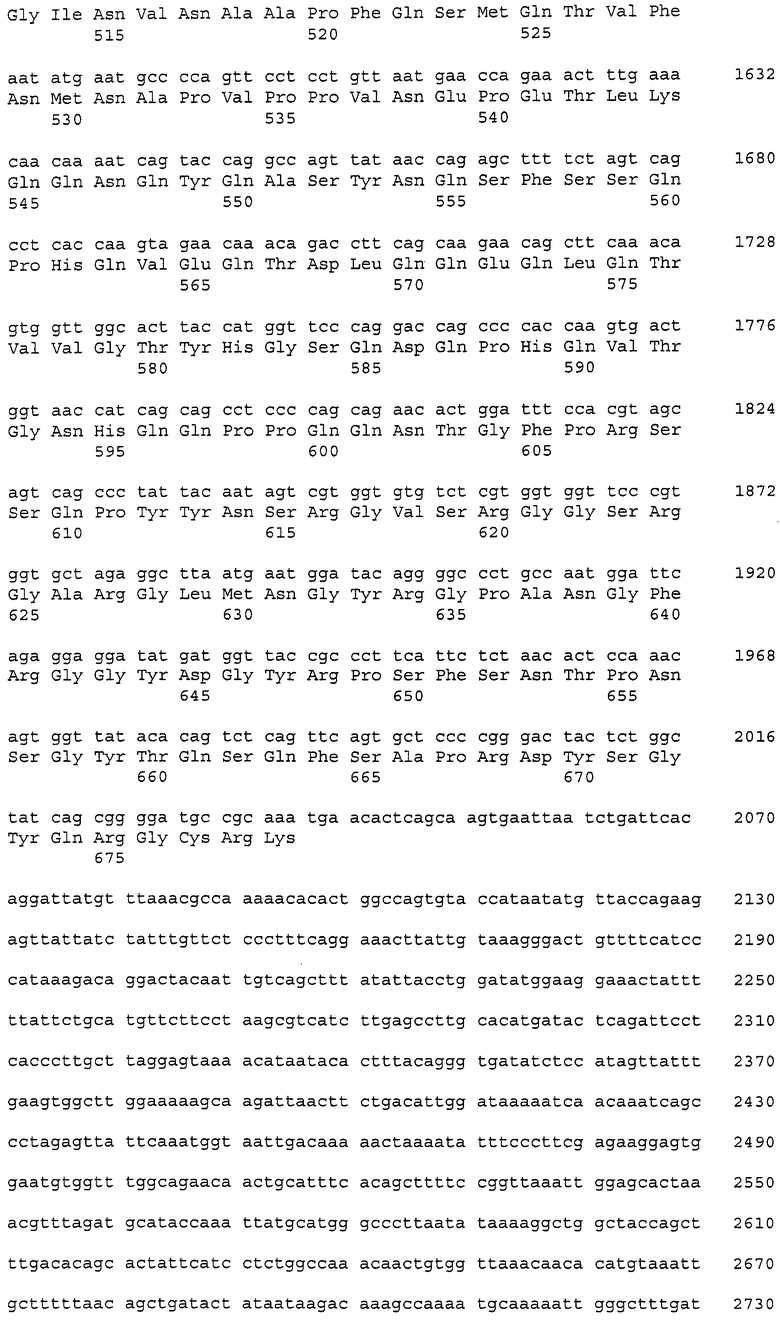




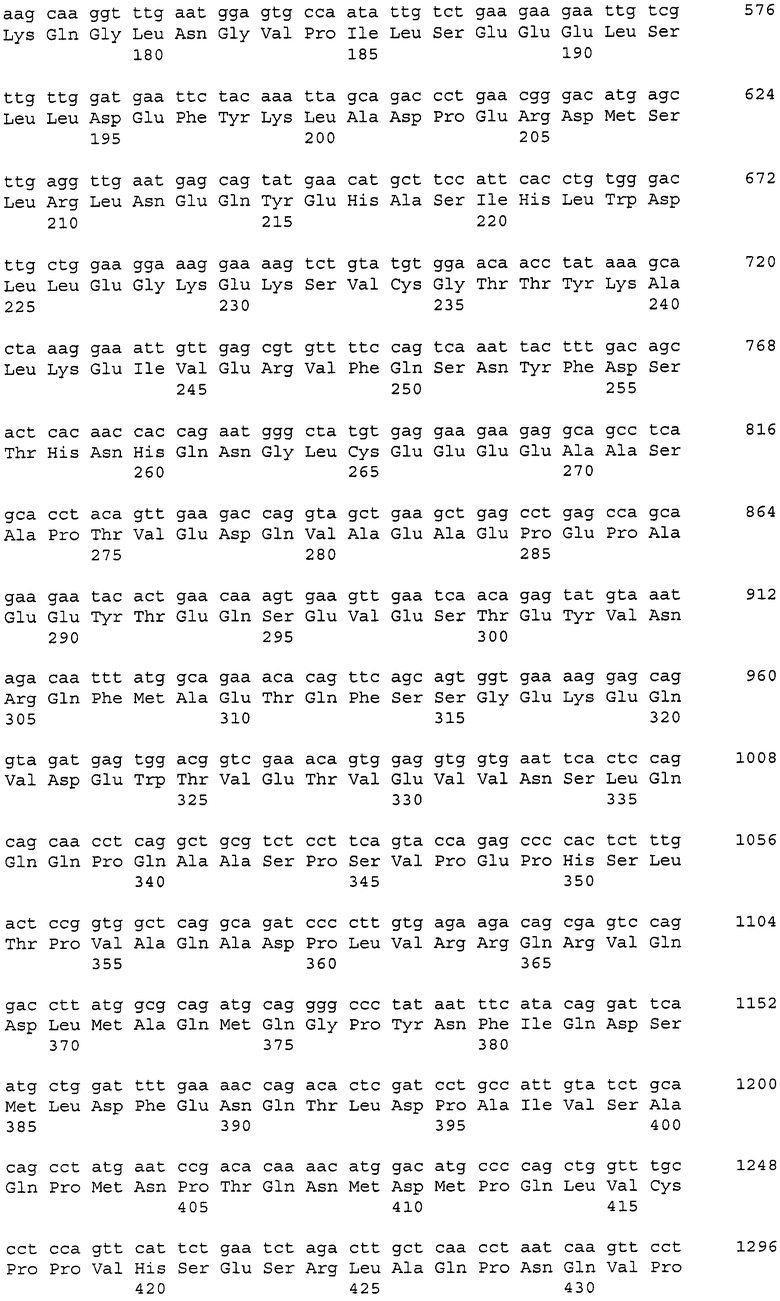
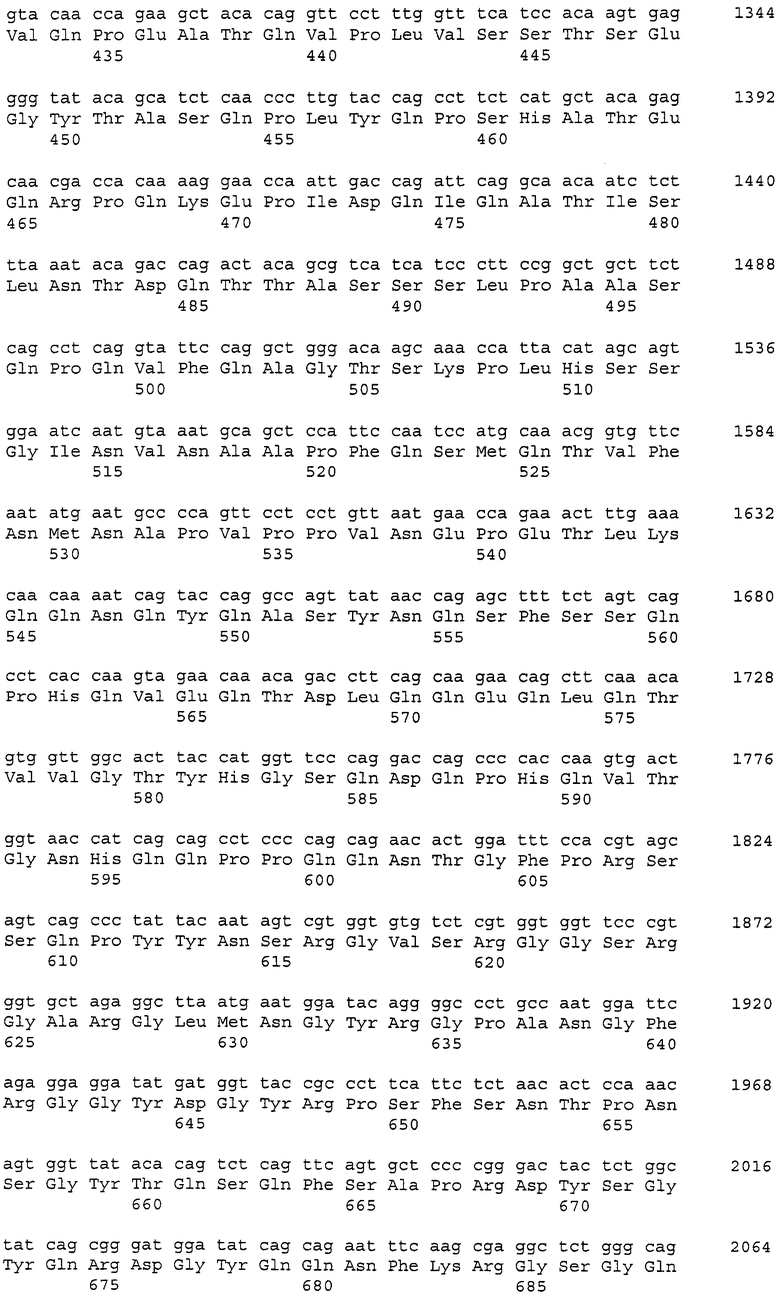





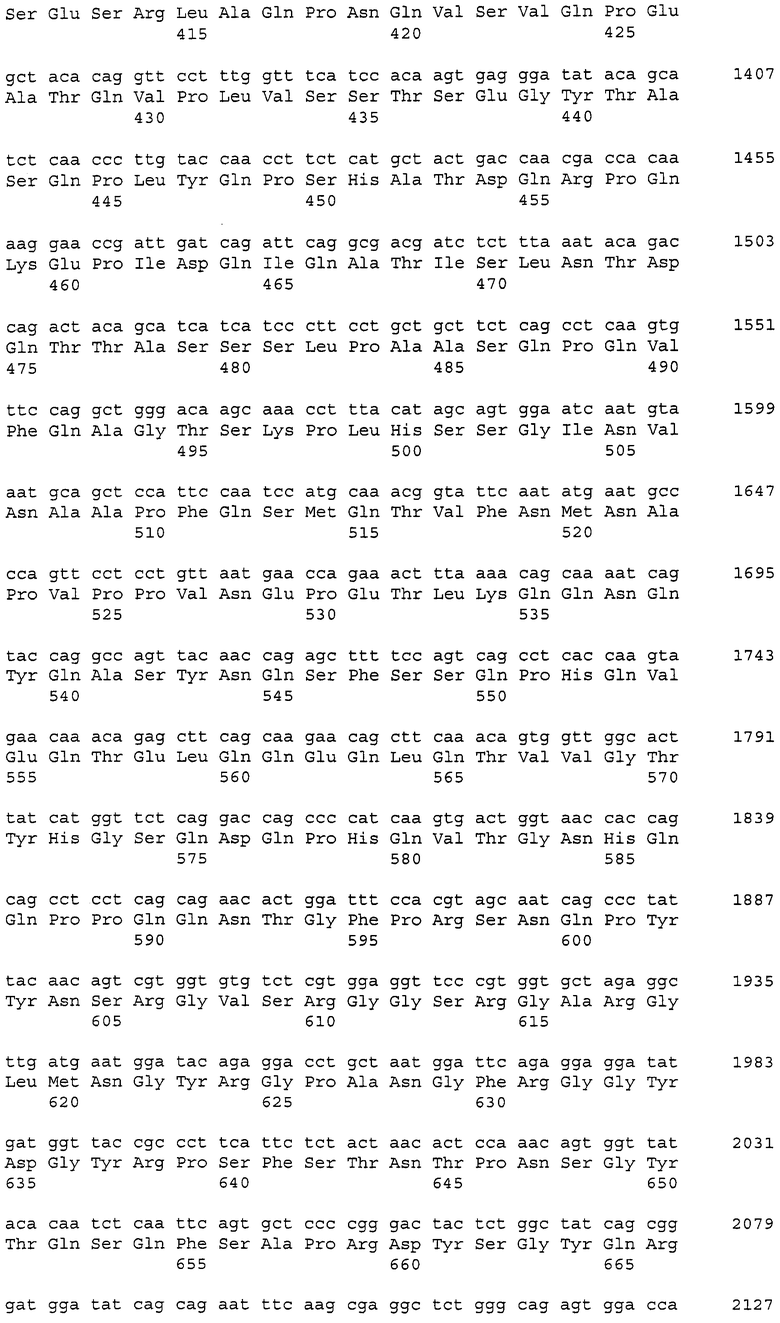




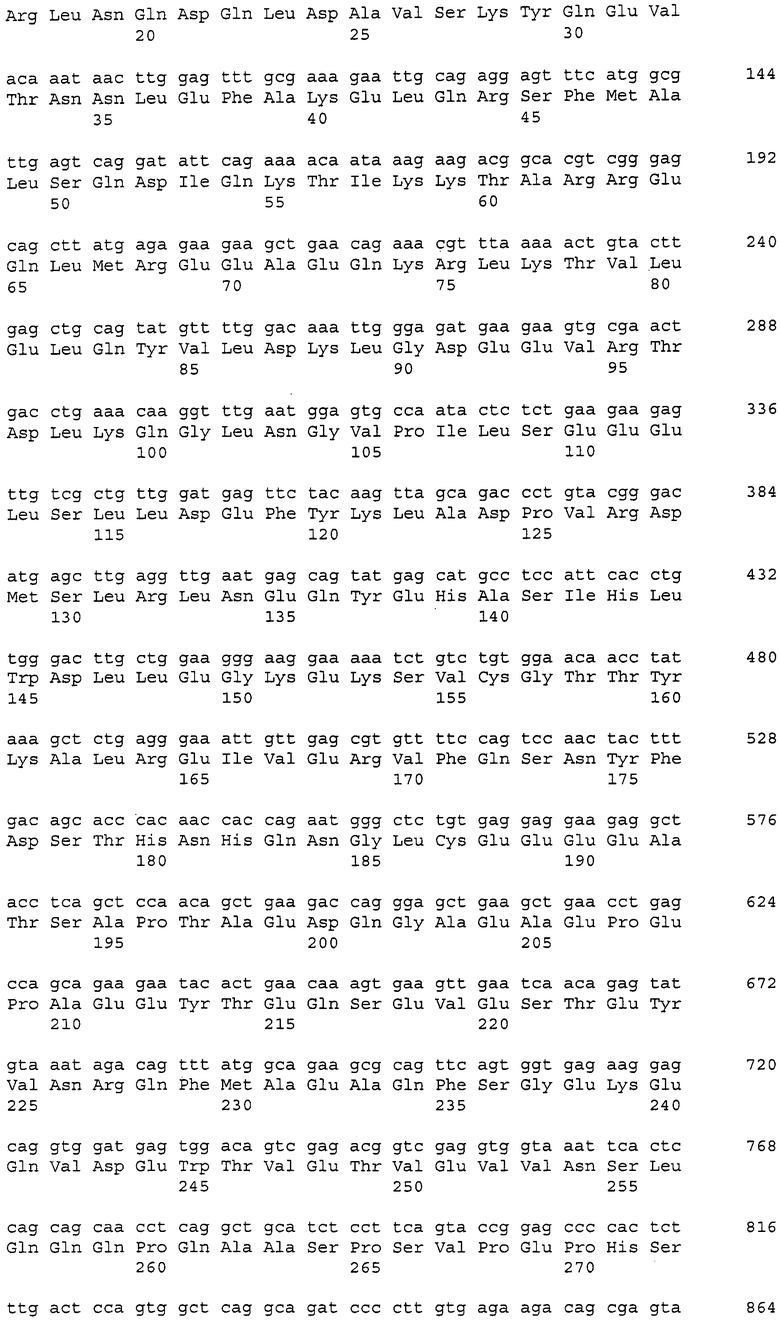
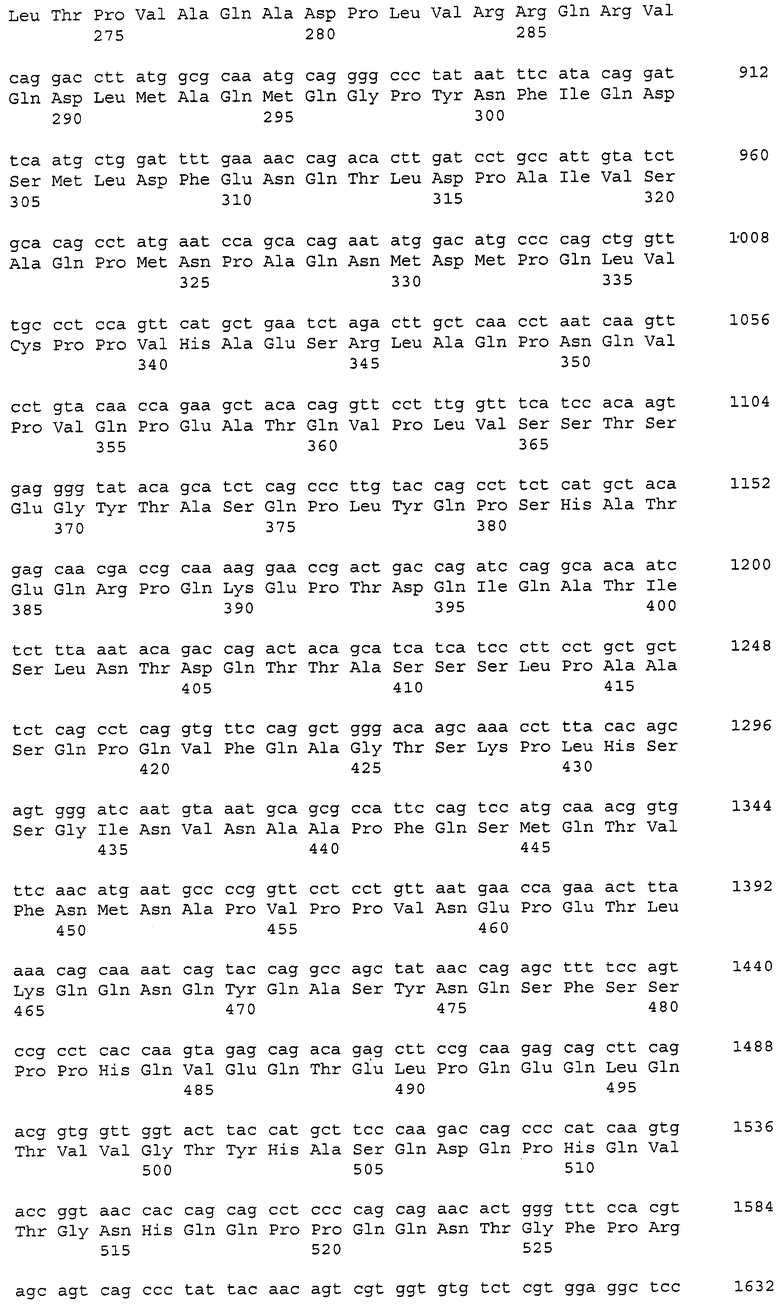




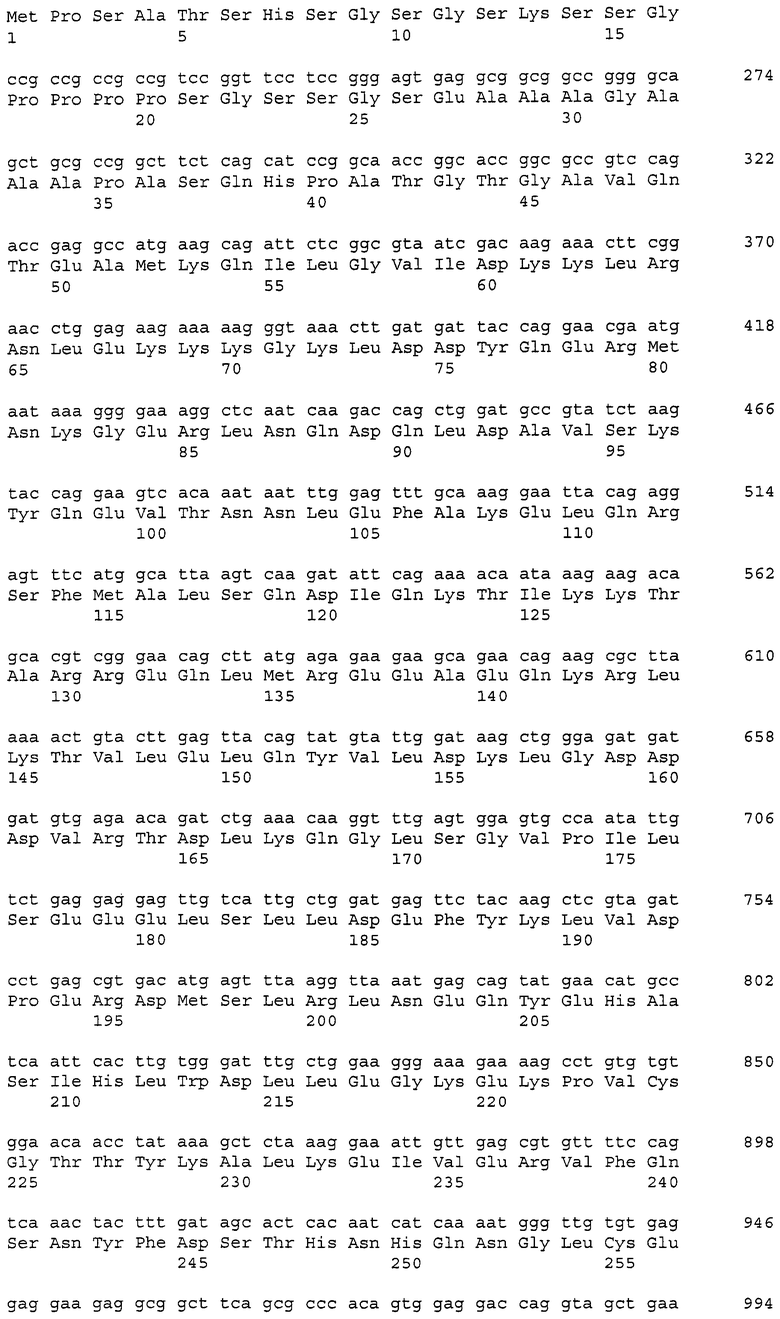
















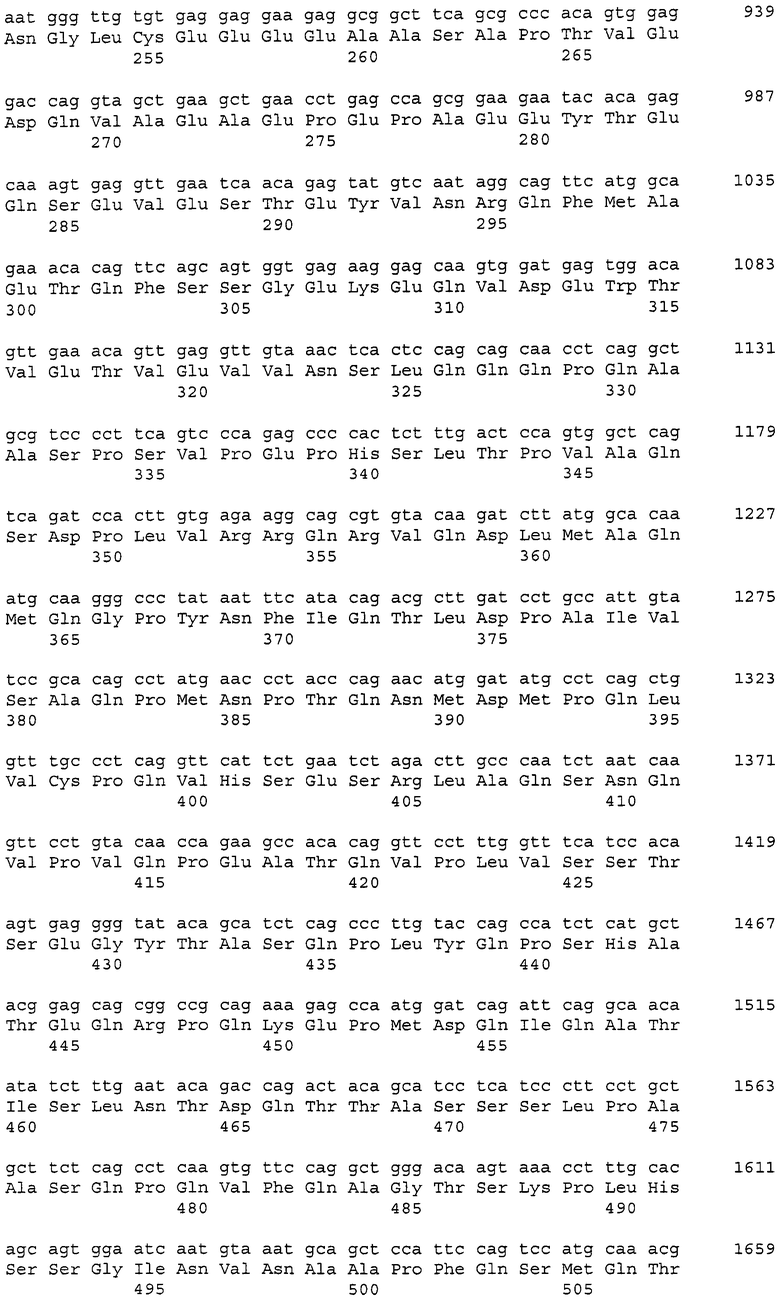
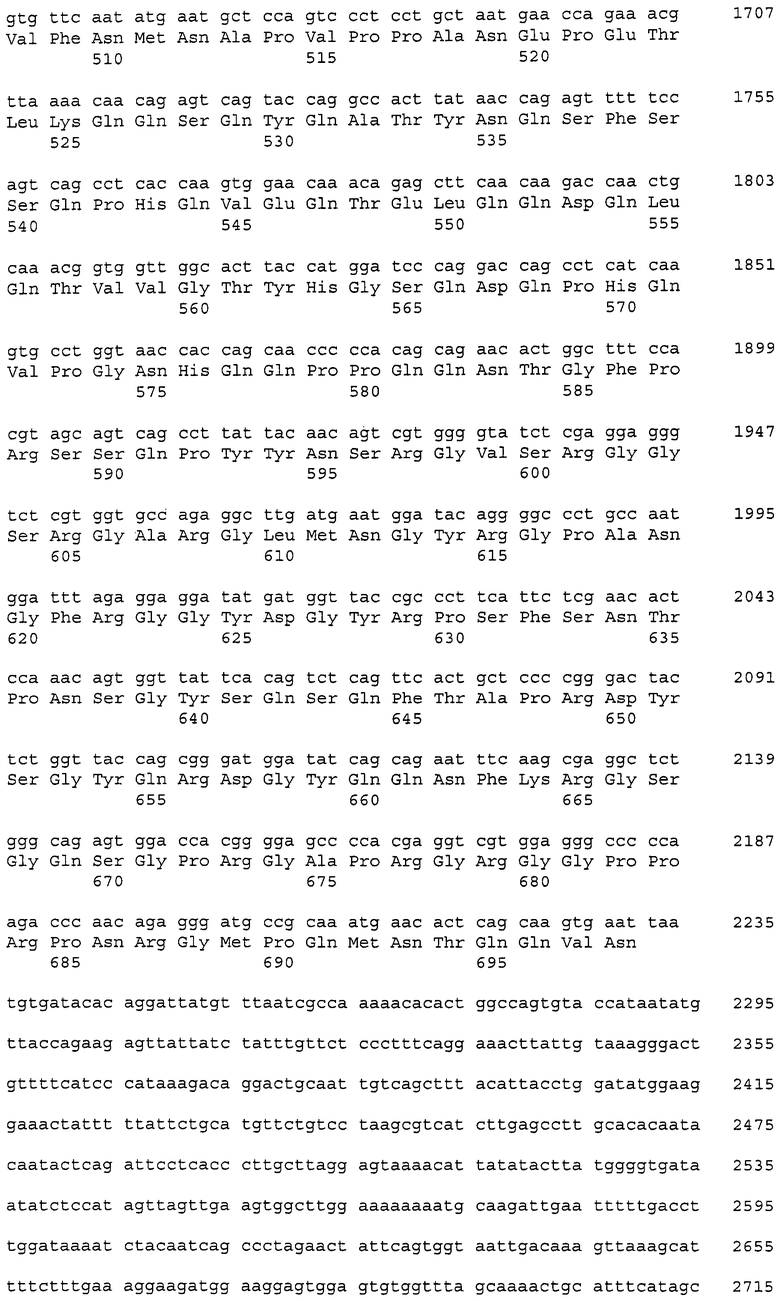





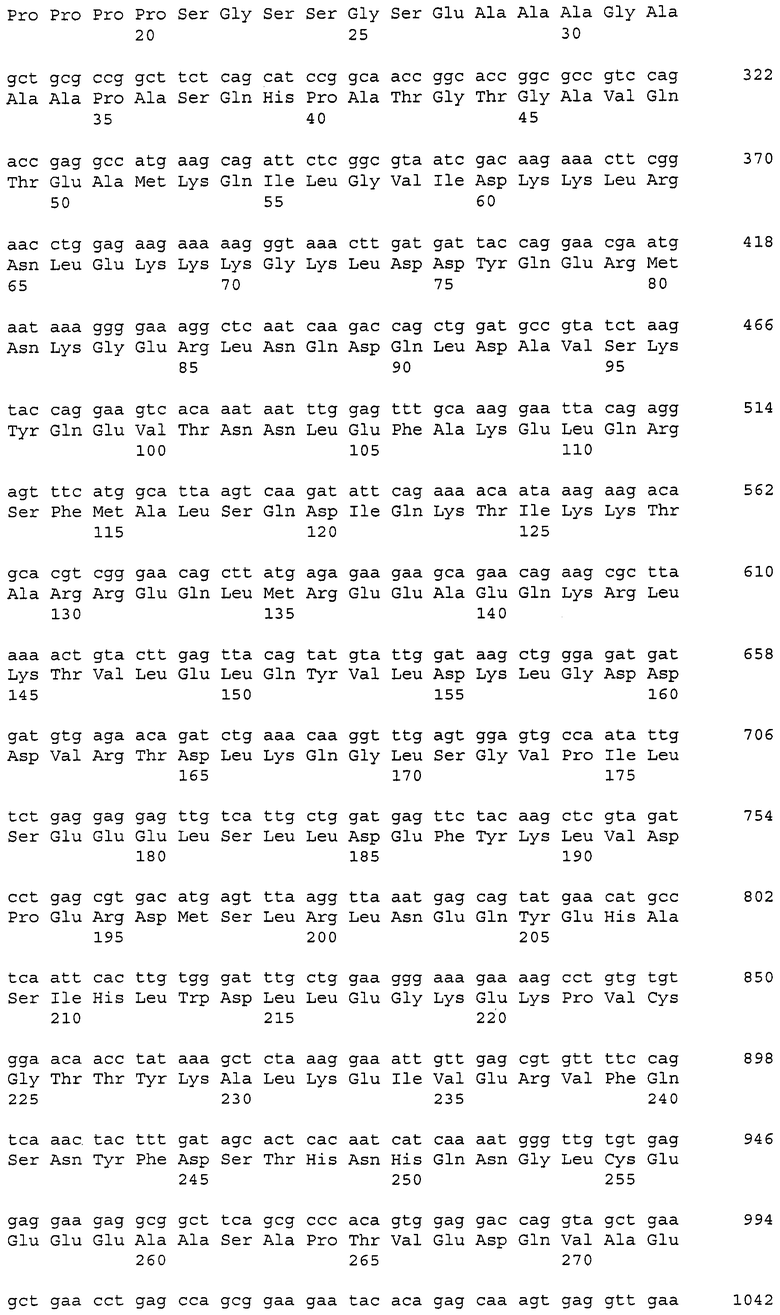
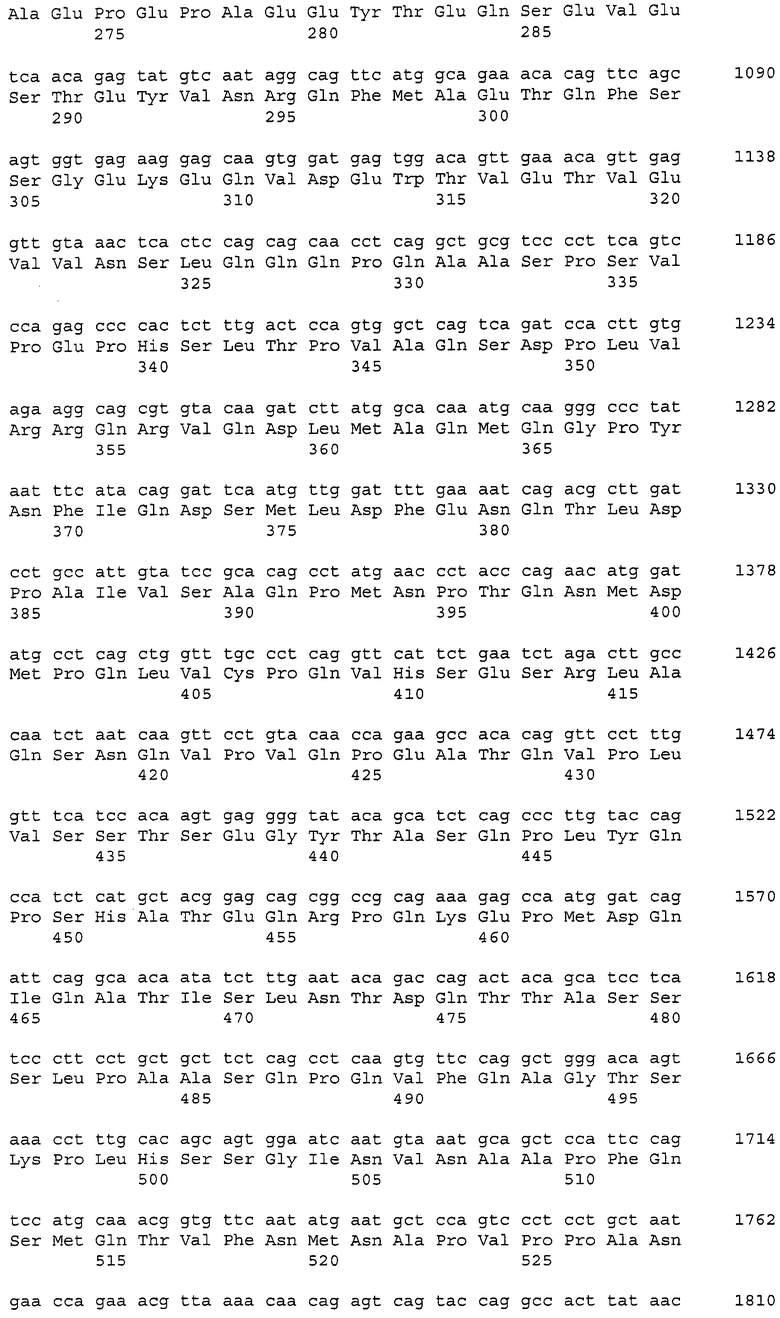













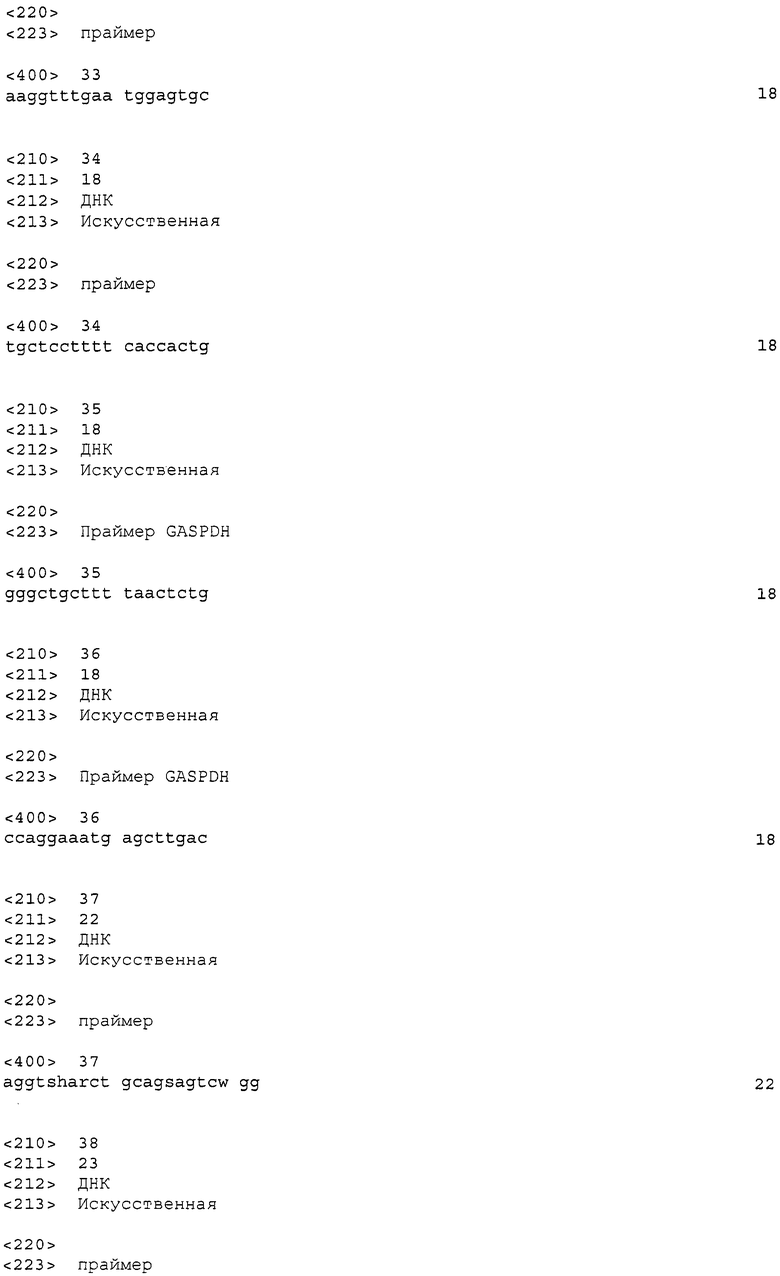


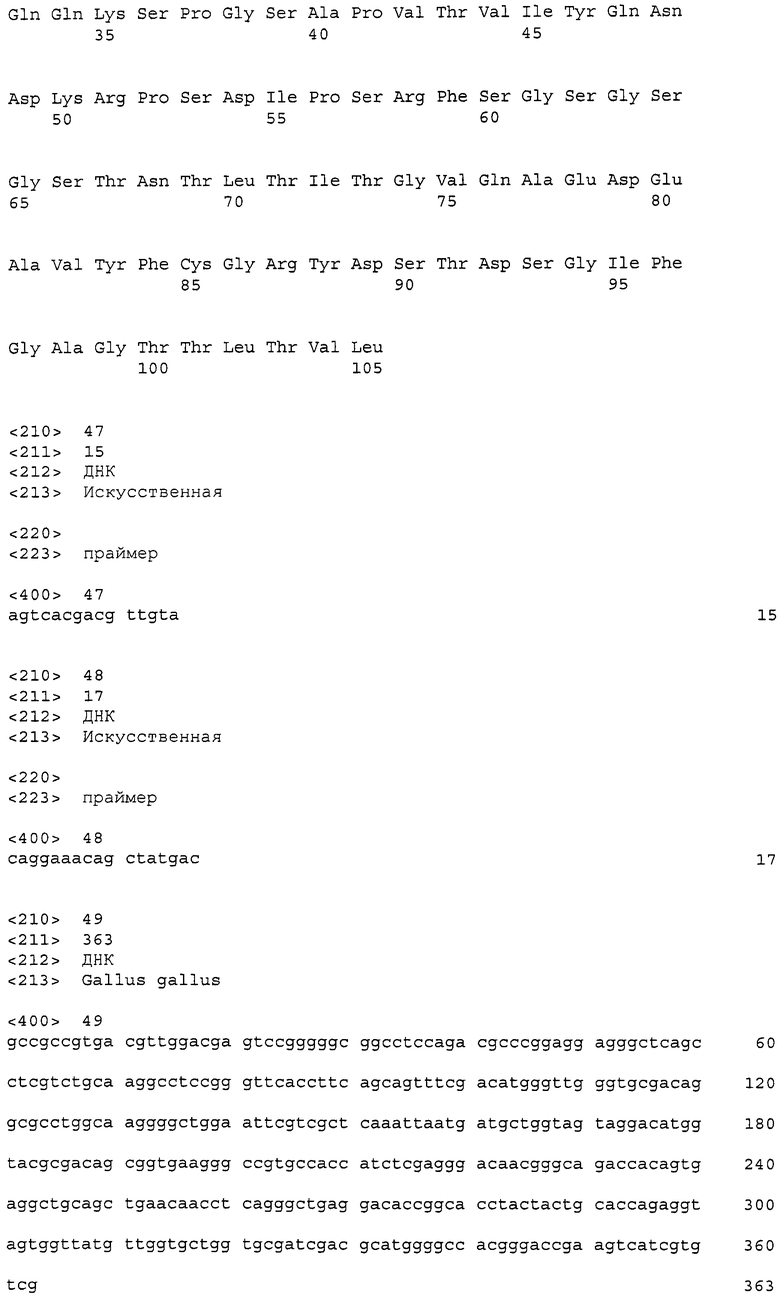


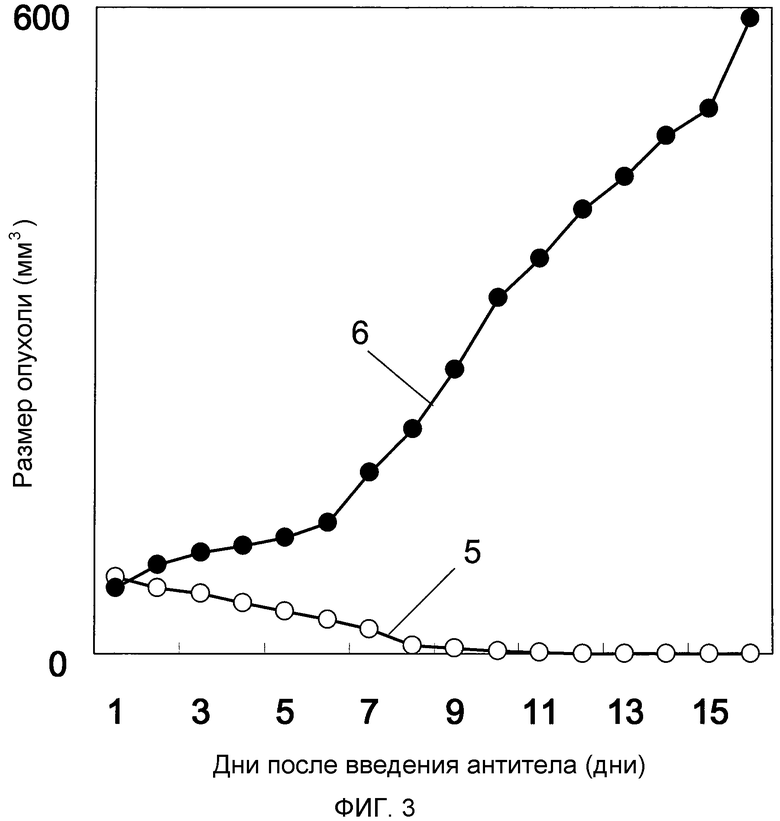
Изобретение относится к области биохимии, в частности к лекарственному средству для лечения или профилактики рака, содержащему антитело в качестве активного ингредиента, которое обладает иммунологической реактивностью по отношению к белку CAPRIN-1. Также раскрыты антитело, которое обладает иммунологической реактивностью по отношению к белку CAPRIN-1, фармацевтическое сочетание, содержащее указанное лекарственное средство, для лечения или профилактики рака. Раскрыт способ лечения или профилактики рака с применением заявленного лекарственного средства и фармацевтического сочетания. Изобретение обладает способностью специфически связываться с CAPRIN-1, что позволяет эффективно лечить заболевания, ассоциированные с экспрессией полипептида CAPRIN-1. 5 н. и 3 з.п. ф-лы, 3 ил., 5 пр.
1. Лекарственное средство для лечения или профилактики рака, содержащее антитело в качестве активного ингредиента, которое обладает иммунологической реактивностью по отношению к белку CAPRIN-1, при этом антитело содержит вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO: 39, 40 и 41, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO: 43, 44 и 45.
2. Лекарственное средство по п. 1, в котором раком является рак молочной железы, опухоль головного мозга, лейкоз, лимфома, рак легкого, мастоцитома, рак почек, рак шейки матки, рак пищевода, рак желудка, рак мочевого пузыря или рак прямой и ободочной кишки.
3. Лекарственное средство по п. 1 или 2, в котором антитело является антителом человека, гуманизированным антителом, химерным антителом или одноцепочечным антителом.
4. Антитело, которое содержит вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO: 39, 40 и 41, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO: 43, 44 и 45, и обладает иммунологической реактивностью по отношению к белку CAPRIN-1.
5. Антитело по п. 4, которое является антителом человека, гуманизированным антителом, химерным антителом или одноцепочечным антителом.
6. Фармацевтическое сочетание для лечения или профилактики рака, содержащее лекарственное средство по любому из пп. 1-3 и фармацевтическую композицию, содержащую противоопухолевое средство.
7. Способ лечения или профилактики рака, включающий в себя введение субъекту лекарственного средства по любому из пп. 1-3 или антитела по любому из пп. 4-5.
8. Способ лечения или профилактики рака, включающий в себя применение на субъекте лекарственного средства и фармацевтической композиции фармацевтического сочетания по п. 6 в сочетании.
| ХИМЕРНЫЙ БЕЛОК ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ЛИМФОМ | 2004 |
|
RU2297241C2 |
| and et al, Two new miR-16 targets: caprin-1 and HMGA1, proteins implicated in cell proliferation, Biology of the Cell, 2009, Vol | |||
| Приспособление для записи звуковых явлений на светочувствительной поверхности | 1919 |
|
SU101A1 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДЫХ ПРОДУКТОВ УПЛОТНЕНИЯ ФОРМАЛЬДЕГИДА С ФЕНОЛАМИ И ДРУГИМИ ВЕЩЕСТВАМИ | 1925 |
|
SU511A1 |
| and et al., Distinct Structural Features of Caprin-1 Mediate Its Interaction with G3BP-1 and Its Induction of Phosphorylation of Eukaryotic Translation | |||
Авторы
Даты
2015-11-10—Публикация
2011-02-04—Подача