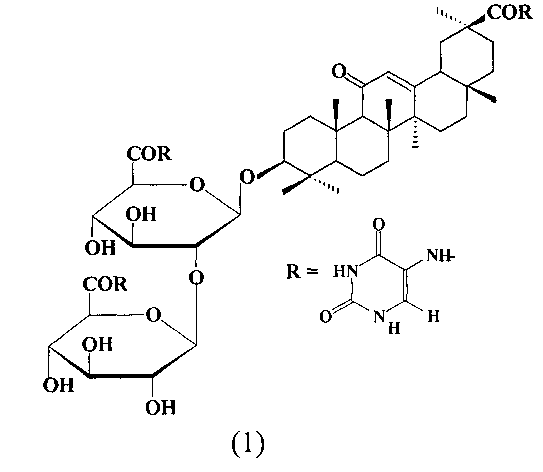
Изобретение относится к химико-фармацевтической промышленности, а именно к средству, представляющему собой амид глицирризиновой кислоты с 5-аминоурацилом формулы (1), проявляющему противовирусную активность в отношении вируса гриппа A/H1N1.
Поиск новых лекарственных средств для лечения вирусных инфекций является одной из важнейших задач медицины и медицинской химии по причине широкого распространения ВИЧ-инфекции, вирусных гепатитов B и C и появления новых социально опасных вирусных инфекций, таких как «птичий» и «свиной» гриппы и др.
Одну из основных угроз человечеству среди повторяющихся инфекций представляет вирус гриппа A, поэтому все исследования, направленные на поиск средств профилактики и лечения этой инфекции, являются высокоприоритетными в здравоохранении многих развитых стран и авторитетных международных организаций, включая Всемирную Организацию Здравоохранения (ВОЗ). Вирусы гриппа A делятся по видам поверхностных гликопротеинов - геммаглютинина (HA) на 16 подтипов и по нейраминидазе (NA) на 9 подтипов. Опасными для людей являются три подтипа - H1N1, H2N2 и H3N2 [Hampson A.W. The influenza viruses // Med. J. Aust., 2006, 185, S39-S43; Black M., Armstrong P. An introduction to avian and pandemic influenza // N.S.W. Public Health Bull, 2006, 17, 99-103]. Ежегодная эпидемия гриппа возникает в результате небольших антигенных изменений на поверхности HA и/или NA. Вирусы гриппа A постоянно циркулируют в человеческой популяции, причем восприимчивость человека к вирусу прямо пропорциональна степени изменения в вирусных HA и NA. Природным источником вирусов гриппа A являются водоплавающие птицы.
Пандемия гриппа A/H1N1 (испанка) 1918-19 гг. унесла 40 млн жизней, азиатский вирус гриппа A/H2N2 1957 г. привел к смерти 4 млн человек, а в 1968 г. от пандемии в Гонконге умерло 2 млн человек [Swartz K.A., Luby J.P. Pandemic Influenza: a primer // Tex. Med., 2007, 103, 31-34; Russel C.J., Webster R.C. The genesis of a pandemic influenza virus // Cell, 2005, 123, 368-371; Heikkinen L.S., Kazlauskas Α., Melen K., Wagner R., Ziegler Th., Julkunen I., Saksela K. Avian and 1918 Spanish influenza A virus NS1 proteins bind to Crk/CrkL SH3 domains to activate host cell signaling // J. Biol. Chem., 2008, 283, 5719-5727]. Эпидемия гриппа A/H1N1, начавшаяся в апреле 2009 г. и получившая название ″свиного гриппа″, вызвала 162380 случаев заболевания и 1154 смертей в 168 странах. В июне 2009 г. ВОЗ объявила о пандемии гриппа, вызванного новым штаммом H1N1, который был идентифицирован как вирус гриппа, образовавшийся в результате тройной реассортации свиного, птичьего и человеческого вирусов и назван вирусом гриппа A/H1N1pdm09. Этот новый вирус вызвал первую пандемию 21-го века. Эта инфекция опасна еще тем, что при начальных симптомах, сходных с симптомами сезонного гриппа, она поражает нижние отделы легких, вызывая тяжелую вирусную пневмонию [Itoh Υ., Shinya K., Kiso Μ., Watanabe Т., Sakoda Y., Hatta Μ., Muramoto Y., Tamura D., Sakai-Tagawa Y, Noda Т., Sakabe S., Imai M., Hatta Y, Watanabe S. In vitro and in vivo characterization of new swine-origin H1N1 influenza viruses // Nature, 2009, 460, 1021-1025; Saxena S.K., Mishra N, Saxena R., Saxena Sh. Swine flu: imfluenza A/H1N1 2009: the unseen and unsaid // Future Microbiol., 2009, 4, 945-947; Hampson A.W. The ″novel″ influenza A(H1N1) enigma: is it a pandemic, how should we respond, what should we call it? // Influenza and other respiratory viruses, 2009, 3, 119-120; Blockwell-Staats C., Webster R.G., Webby R.J. Diversity of influenza viruses in swine and the emergence of a novel human pandemic influenza A (H1N1) // Influenza and other respiratory viruses, 2009, 3, 207-213; Peitris J.S.M., Tu W.W., Yen H.I. A novel H1N1 virus causes the first pandemic of 21st century // Eur. J. Immunol., 2009, 39, 2946-2954; http://www.who.int/csr/don/2009_06_24/en/index.html].
В настоящее время для лечения гриппа А в медицине используются два вида противовирусных препаратов адамантановой структуры - ингибиторы M2 ионных каналов - амантадин и римантадин, ингибиторы нейраминидазы (NA) - занамивир или реленза (zanamivir, relenza) (GlaxoWellcome/Biota) и оселтамивир или тамифлю (osetlamivir, tamiflu) (Hoffman-La-Roche/Gilead). Ингибиторы ΝΑ считаются более эффективными препаратами и появились в результате 60 лет научных исследований как один из первых примеров рационального дизайна лекарственных средств. Оба препарата активны против 9 известных подтипов ΝΑ вируса гриппа и относятся к препаратам первой линии защиты человечества от возможной пандемии. Ингибиторы ΝΑ эффективны на ранних стадиях инфекции (первые 24-48 ч).
Обе группы соединений имеют свои недостатки. В отношении группы производных адамантана можно отметить сравнительно высокую токсичность, узкий спектр действия (препараты активны против гриппа A, но не против гриппа B) и быстрое формирование устойчивости вируса к препаратам. Для ингибиторов нейраминидазы характерны формирование резистентности вирусов и высокая стоимость синтеза, что делает эти препараты менее доступными для широкого использования. Кроме того, для ингибиторов ΝΑ характерна низкая биодоступность. Так, занамивир применяется только в виде ингаляций, что затрудняет его использование у маленьких детей и пожилых пациентов [Hurt А.С., Selleck P., Komadina Ν., Shaw R., Brown L., Barr I.G. Susceptibility of highly pathogenic (H5N1) avian influenza viruses to the neuraminidase inhibitors and adamantanes // Antiviral Res, 2007, 7, 228-231; Zhang J., Xu W. Recent advances in anti-influenza agents with neuraminidase as target // Mini-Rev. Med. Chem., 2006, 6, 429-448].
Ограниченность выбора противовирусных препаратов является причиной низкой эффективности лечения острых и хронических вирусных инфекций. Разнообразные патогенетические и симптоматические препараты, применяемые при лечении гриппа, направлены на корректировку только реактивных процессов в организме и не устраняют причину заболевания.
Многочисленные химические соединения, не дошедшие до клинических испытаний, относятся к различным химическим классам, направлены на различные мишени в жизненном цикле вируса и демонстрируют различный уровень противогриппозной активности в клеточных культурах и в редких случаях лабораторных животных [Kim Y., Narayanan S., Chang K.-O. Inhibition of influenza virus replication by plant-derived isoquercetin //Antiviral Res., 2010, 88 (2), 227-235; Wolf M.C., Freiberg A.N., Zhang Т., Akyol-Ataman Z., Grock Α., Hong P.W., Li J., Watson N.F., Fang A.Q., Aguilar H.C., Porotto M., Honko A.N., Damoiseaux R., Miller J.P., Woodson S.E., Chantasirivisal S., Fontanes V., Negrete O.A., Krogstad P., Dasgupta Α., Moscona Α., Hensley L.E., Whelan S.P., Faull K.F., Holbrook M.R., Jung M.E., Lee B. A broad-spectrum antiviral targeting entry of enveloped viruses. Proc. Natl. Acad. Set USΑ., 2010, 107 (7), 3157-3160; Iwai Y., Takahashi H., Hatakeyama D., Motoshima K., Ishikawa M., Sugita K., Hashimoto Y., Harada Y., Itamura Sh., Kuzuhara T. Anti-influenza activity of phenethylphenylphtalimide analogs derived from thalidomide // Bioorgan. Med. Chem. 2010, 78 (14), 5379-5390; Saha R.K., Takahashi Т., Kurebayashi Y, Fukushima K., Minami Α., Kinbara N., Ichitani M., Sagesaka Y.M., Suzuki T. Antiviral effect of strictinin on influenza virus replication // Antiviral Res., 2010, 88 (1), 10-18; Pleschka S, Stein M, Schoop R, Hudson JB. Anti-viral properties and mode of action of standardized Echinacea purpurea extract against highly pathogenic avian influenza virus (H5N1, H7N7) and swine-origin H1N1 (S-OIV). Virol J, 2009, 6 (13), 197; Song G., Yang S, Zhang W., Cao Y., Wang P., Ding N., Zhang Z., Guo Y., Li Y. Discovery of the first series of small molecule H5N1 entry inhibitors. J. Med. Chem., 2009, 52 (23), 7368-7371].
Известен препарат Нуклеозин, имеющий высокую степень сродства к белку NP вируса гриппа и эффективно ингибирующий его репликацию. Однако все изоляты вируса, вызвавшего пандемию 2009 г., оказались устойчивы к этому препарату [Kao R.Y., Yang D., Lau L.S., Tsui W.H., Hu L., Dai J., Chan M.P., Chan С.М., Wang P., Zheng B.J., Sun J., Huang J.D., Madar J., Chen G., Chen H., Guan Y., Yuen K.Y. Identification of influenza A nucleoprotein as an antiviral target. Nat. Biotechnol, 2010, 28 (6), 600-605].
Известен также препарат Рибавирин, представляющий собой нуклеозидный аналог, эффективный против 85% РНК-геномных вирусов млекопитающих. Применение его ограничено побочными последствиями, преимущественно анемией, проявляющимися вследствие его сходства с субстратами клеточных ферментов. Являясь аналогом нуклеозидов, рибавирин эффективен в субтоксических концентрациях, и системное его применение вызывает побочные реакции, в частности анемию и тератогенный эффект при употреблении во время беременности. Преимущественно рибавирин в комбинации с интерфероном применяется при лечении гепатита, однако эффект его показан при местном (ингаляционном) применении в случае PC-вирусной и ранних стадий гриппозной инфекции. Тем не менее, при появлении случаев заболевания человека атипичной пневмонией (SARS), а позднее - гриппом птиц подтипа H5N1 рибавирин использовался внутривенно при терапии тяжелых случаев заболевания. После использования рибавирина были отмечены случаи облегчения болезни и полного выздоровления пациентов. Рибавирин является препаратом комплексного механизма действия. Он влияет на репликацию вируса гриппа двумя путями - прямо, вмешиваясь в полимеразные процессы при транскрипции и репликации вирусного генома, и опосредованно - угнетая клеточный фермент инозинмонофосфатдегидрогеназу и истощая тем самым клеточный пул ГТФ, необходимого для построения вирусных РНК. Поскольку основная мишень препарата - не вирусный, а клеточный фермент, то устойчивые к рибавирину штаммы вируса гриппа отмечаются крайне редко или не обнаруживаются вообще. В то же время существенные побочные эффекты (согласно рекомендациям FDA - 129 разновидностей) позволяют рекомендовать его только при тяжелых состояниях больных гриппом [Beigel J, Bray Μ. Current and future antiviral therapy of severe seasonal and avian influenza // Antiviral Res., 78, 91-102].
Учитывая все сказанное, необходим постоянный поиск новых поколений противовирусных агентов пролонгированного действия и с улучшенной биодоступностью [Von Itzstein Μ., Thomson R. Anti-influenza drugs: the development of sialidase inhibitors // Antiviral Strategies, 2009, 189. Springer Berlin Heidelberg. P. 111-154; Mitrasinovic P.M. On the structure-based design of novel inhibitors of H5N1 influenza A virus neuraminidase (NA) // Biophys. Chem., 2009, 140, 35-38; Itzstein M, Thomson R. Anti-influenza drugs: the development of inhibitors // Handb. Exp. Pharmacol., 2009, 111-154].
Инновационным подходом в лечении и профилактике вирусных инфекций является использование противовирусных агентов с новым механизмом действия, полученных на основе доступных природных соединений или растительных метаболитов. Несмотря на конкуренцию с другими лекарственными препаратами, природные соединения и их модификанты продолжают уверенно обеспечивать появление новых перспективных клинических кандидатов для лечения вирусных, бактериальных и грибковых инфекций [Rollinger J.Μ., Langer Т., Stuppner Η.. Strategies for efficient lead structure discovery from natural products // Curr. Med. Chem, 2006, 13, 1491-1507]. Продуцируемые растениями биоактивные соединения представляют интерес в качестве скаффолдов (матриц) для синтетических модификаций, синтеза библиотек производных и изучения зависимости структура-активность. Оптимизация структуры лидирующих природных соединений с уже известной противовирусной активностью может вывести на новые соединения-лидеры и кандидаты для доклинических и клинических исследований.
Некоторые соединения, как было уже упомянуто, сочетают в себе несколько типов активности, каждая из которых приводит к снижению вирусной нагрузки, уменьшению интенсивности воспалительных процессов, нормализации структуры ткани при тяжелой гриппозной инфекции, и т.п. Таковы, например, глицирризиновая кислота (ГК) и ее основной метаболит - глицирретовая кислота (ГЛК), выделяемые из корней солодки голой (Glycyrrhiza glabra L.) и уральской (Gl. uralensis Fisher) [Болтина Л.Α., Кондратенко P.M., Болтина Л.А. (мл.), Плясунова О.А., Покровский А.Г., Толстиков Г.A. Перспективы создания новых противовирусных препаратов на основе глицирризиновой кислоты и ее производных // Хим.-фарм. жур., 2009, 45, 3-12; Pompei R., Laconi S., Ingianni A. Antiviral properties of Glycyrrhizic acid and its semisynthetic derivatives// Mini-Rev Med. Chem., 2009, 9, 996-1001]. ГК является эффективным и малотоксичным индуктором IFN-γ. ГК используется для лечения хронических вирусных гепатитов B и C в Китае и Японии (GMP F0115, Beijing Qinwutian Pharmaceutical technology Co., LTD), ингибирует вирус гриппа A [Pompei R., Laconi S., Ingianni A. Antiviral properties of Glycyrrhizic acid and its semisynthetic derivatives // Mini-Rev. Med. Chem., 2009, 9, 996-1001], новые SARS-ассоциированные коронавирусы, вызывающие атипичную пневмонию, и вирус Эпштейна-Барра [Lin J.C., Cherng J.M., Hung M.S., Baltina L.A., Baltina L.A., Kondratenko R.M. Inhibitory effects of some derivatives of Glycyrrhizic acid against Epstein-Barr virus infection: Structure-activity relationships // Antiviral Res., 2008, 79, 6-11; Hoever H, Baltina L.A., Michaelis M., Kondratenko R.M., Baltina L.A., Tolstikov G.A., Doerr H.W., Cinatl J. Antiviral activity of Glycyrrhizic acid derivatives against SARS-Coronavirus // J. Med. Chem., 2005, 48, 1256-1259]. Уникальным свойством ГК является способность ингибировать вирусы на начальных стадиях репликационного цикла, поэтому ГК не влияет на процессы реализации генетической информации вирусов и не вызывает развития резистентности. ГК является природным стимулятором гамма-интерферона, пригодным для профилактики практически любых инфекций, малотоксична для организма млекопитающих (LD50 5000 мг/кг), обладает высокой биодоступностью и подвергается в организме гидролизу до ГЛК, которая метаболизирует в желудочно-кишечном тракте и печени подобно кортикостероидным гормонам.
В работе Utsunomiya et al. [Utsunomiya Τ., Kobayashi Μ., Pollard R.B., Suzuki F. Glycyrrhizin, an active component of licorice roots, reduces morbidity and mortality of mice infected with lethal doses of influenza virus // Antimicrob. Agents Chemother., 1997, 41 (3), 551-556] было показано, что ГК на 100% предотвращает смертность мышей от гриппозной инфекции при заражении дозой вируса A(H2N2) 10 LD50. Параллельная обработка животных антителами к IFN-γ полностью снимала протективный эффект ГК, что доказывает механизм ее защитного действия. С другой стороны [Michaelis Μ., Geiler J., Naczk P., Sithisarn P., Ogbomo H., Altenbrandt В., Leutz Α., Doerr HW., Cinatl J Jr. Glycyrrhizin inhibits highly pathogenic H5N1 influenza A virus-induced pro-inflammatory cytokine and chemokine expression in human macrophages //Med. Microbiol. Immunol, 2010, 199 (4), 291-297], показано, что ГК является мощным иммуномодулятором. В терапевтических дозах на модели гриппозной инфекции макрофагов человека, вызванной высокопатогенным вирусом гриппа H5N1, ГК снижала продукцию провоспалительных цитокинов CXCL10, IL-6 и CCL-5, а также ингибировала вирусиндуцированный апоптоз. При этом не было отмечено никакого влияния этого соединения на продукцию вируса в клетках. В клетках А549, являющихся аналогами альвеолоцитов человека, ГК ингибировала репликацию высокопатогенного вируса гриппа H5N1, снижала степень вирусиндуцированного апоптоза клеток и экспрессию провоспалительных цитокинов [Michaelis Μ., Geiler J., Naczk P., Sithisarn P., Leutz Α., Doerr H.W., Cinatl J.Jr. Glycyrrhizin exerts antioxidative effects in H5N1 influenza A virus-infected cells and inhibits virus replication and pro-inflammatory gene expression // PLoS One, 2011, 6 (5), e19705]. Неясно, является ли такая активность следствием или независима от собственно ее противовирусной активности. Известно, что оболочечные вирусы в процессе слияния вирусной и клеточной мембран нуждаются в определенной текучести липидного бислоя и, следовательно, зависят от реологических свойств клеточной мембраны. Так, снижение текучести мембраны на 5% ингибировало размножение ВИЧ-1 на 56%, а 5% повышение текучести, напротив, повышало инфекционность вируса в 2,4 раза [Harada S., Yusa K., Monde K., Akaike Т. and Maeda Υ. Influence of membrane fluidity on human immunodeficiency virus type 1 entry // Biochem. Biophys. Res. Commun., 2005, 329, 480-486]. Показано также, что те же закономерности применимы и в случае гриппозной инфекции [Wolkerstorfer Α., Kurz Η., Bachhofner Ν., Szolar O.H. Glycyrrhizin inhibits influenza A virus uptake into the cell // Antiviral Res., 2009, 83, 171-178]. В высоких концентрациях ГК препятствует интернализации вирионов гриппа, взаимодействуя с мембранами и снижая их текучесть. Эти свойства объясняют также активность ГК in vitro в отношении других вирусов - SARS-ассоциированного коронавируса, ВИЧ-1, респираторно-синцитиального вируса, вируса гепатита В, арбовирусов, вируса осповакцины, вирусов группы герпеса (вирус варицелла-зостер, вирус простого герпеса 1 типа, вирус Эпштейна-Барр, цитомегаловирус, вирус саркомы Капоши) и вируса везикулярного стоматита [Fiore С, Eisenhut Μ, Krausse R, Ragazzi Ε, Pellati D, Armanini D, Bielenberg J. Antiviral effects of Glycyrrhiza species // Phytother. Res., 2008, 22 (2), 141-148]. В дополнение к уже описанным механизмам подавления вирусной репродукции известно, что ГК снижает мембранный транспорт и сиалирование поверхностного антигена вируса гепатита В, а также ингибирует ферменты фосфорилирования при инфекции, вызванной вирусом везикулярного стоматита [Fiore С, Eisenhut Μ, Krausse R, Ragazzi Ε, Pellati D, Armanini D, Bielenberg J. Antiviral effects of Glycyrrhiza species // Phytother. Res., 2008, 22 (2), 141-148].
Задача, на решение которой направлено заявленное техническое решение, заключается в расширении арсенала лекарственных средств на основе производных ГК для лечения гриппа A/H1N1. Поставленная задача решается средством, представляющим собой амид глицирризиновой кислоты с 5-аминоурацилом (амид ГК) формулы (1), проявляющим противовирусную активность в отношении пандемического вируса гриппа A/H1N1/pnm2009.
В заявленном техническом решении синтез амида ГК (1) осуществляют путем конденсации ГК с 5-аминоурацилом с помощью N,N′-дициклогексилкарбодиимида (DCC) согласно [Балтина Л.А., Васильева Е.В., Давыдова В.А., Исмагилова А.Ф., Зарудий Ф.С., Толстиков Г.А. Синтез и фармакологические свойства ряда новых гетероциклических и ароматических амидов глицирризиновой кислоты // Хим.-фарм. жур., 30 (8), 1996, 14-21].
Цитотоксичность и противовирусные свойства амида ГК (1) в отношении вируса гриппа изучали в культуре клеток MDCK на модели экспериментальной гриппозной инфекции, вызванной пандемическим вирусом гриппа человека A/H1N1/pdm09 (Калифорния). В качестве препаратов сравнения использовали ГК (97% чистоты) и известный противовирусный препарат - римантадин.
Результаты испытаний представлены в таблице. Как видно из представленных данных, испытание активности соединений в опытах in vitro по угнетению репликации вируса выявило, что ни римантадин, ни ГК не снижают инфекционную активность вируса гриппа человека A/H1N1/pdm09, что согласуется с известными данными об устойчивости использованного штамма к римантадину и отсутствии высокой противовирусной активности у ГК.
В то же время амид ГК (1) является в 5 раз менее токсичным для клеток веществом по сравнению с римантадином, что выражалось в более высоком значении 50% цитотоксической концентрации (CTD50) - 300 мкг/мл (у римантадина - 60 мкг/мл). Уровень противовирусной активности амида ГК (1) был в 60 раз выше, а именно 50% эффективная концентрация (EC50) амида (1) составила 0.2 мкг/мл, а у препарата сравнения - римантадина - 12 мкг/мл. На основании полученных результатов был рассчитан индекс селективности (SI) - отношение CTD50 к EC50. Установлено, что амид ГК (1) имеет высокий индекс селективности: SI=1500, превышающий таковой для римантадина (SI=5) в 300 раз. Модификация ГК с введением молекул 5-аминоурацила в структуру природного гликозида привела к снижению 50% эффективной концентрации в 870 раз и увеличению индекса селективности в 500 раз по сравнению с ГК.
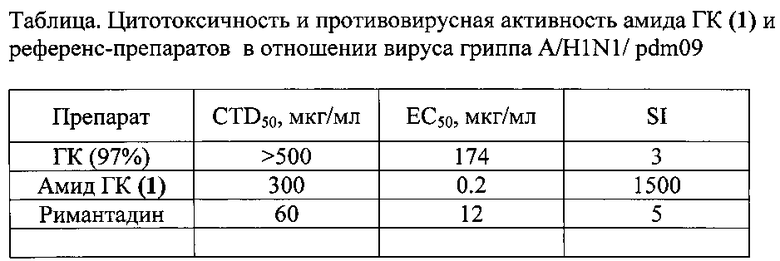
Таким образом, в опытах in vitro установлено, что амид ГК (1) проявляет высокую противовирусную активность в отношении пандемического вируса гриппа человека A/H1N1/pdm09.
Преимущества заявляемого соединения перед его предшественником - ГК, а также римантадином делают его пригодным для использования в качестве противовирусного препарата для борьбы с гриппозной инфекцией.
Сущность технического решения подтверждается следующими примерами.
Пример 1. Синтез амида ГК (1)
К раствору 1.64 г (2 ммоль) ГК (85-87% чистоты) в 40 мл диметилформамида прибавили 1.12 г (8 ммоль) 5-аминоурацила, 20 мл пиридина и 1.4 г (6.8 ммоль) N,N′-дициклогексилкарбодиимида. Смесь перемешивали при комнатной температуре (20-22°C) 1 ч, при 55-60°C - 6 ч. Осадок N,N′-дициклогексилмочевины отфильтровали, фильтрат разбавили холодной водой, подкислили лимонной кислотой до pH 5, осадок отфильтровали, промыли водой, высушили и перекристаллизовали дважды из смеси этанола-хлористого метилена. Выход 1.3 г (56.5%). Полученный амид ГК (1) перемешивали 30 мин в 40 мл ацетона, отфильтровали и высушили. Получили 1.2 г (52.2%) гомогенного по ТСХ соединения (1). [α]D 20+15° (с 0.08, диоксан). ИК-спектр, ν, см-1: 3600-3200, 1670, 1620, 1580, 1550. Спектр ЯМР 1H (300 МГц, DMSO-d6, δ, м.д.): 0.62, 0.72, 0.84, 1.17, 1.22, 1.26, 1.70 (21Н, все с, 7CH3), 1.80-2.25, 3.00-3.20 (м, CH, CH2), 4.45 (1Н, д, J=7.4 Гц, H1′), 4.52 (1Н, д, J=7.4 Гц, H1″), 3.80-4.00, 5.15-5.45 (м, 10Н, H2′-H6′, H2″-H6″), 5.60 (1Н, с, Н12), 7.95, 8.15, 8.73, 8.89 (м, NH). Спектр ЯМР 13С (75.5 МГц, DMSO-d6, δ, м.д.): 199.5 (С11), 174.4 (С30), 169.9 (С13), 167.4 (С6′), 167.0 (С6″), 128.3 (С12), 105.2 (С1″), 103.4 (С1′), 88.4 (С3), 83.2 (С2′), 76.5 (С5″), 76.3 (С3′, С5′), 75.1 (С3′), 74.6 (С2″), 71.8 (С4″), 71.6 (С4′), 61.4 (С9), 55.9 (С5), 50.3 (С18), 47.9 (С8), 46.7 (С20), 45.2 (С14), 43.2 (С19), 39.3 (С4), 39.0 (С1), 36.6 (С22), 36.2 (С10), 33.7 (С7), 32.5 (С17), 31.8 (С21), 28.9 (С29), 27.4 (С28), 26.1 (С16), 25.8 (С15), 25.5 (С2), 23.0 (С27), 18.7 (С26), 16.5 (С6), 15.9 (С24, С25), доп. сигналы: 162.5, 160.8, 160.7, 158.0, 154.6, 149.8, 113.5, 113.2 (С урац.). М.в. 1150.2.
Пример 2. Изучение цитотоксичности препаратов
Цитотоксичность соединений была предварительно изучена в отношении клеток MDCK, которые рассеивали в 96-луночные планшеты и культивировали при 37°C в среде MEM с добавлением 10% сыворотки крупного рогатого скота в атмосфере 5% CO2 до состояния монослоя. Из исследуемых препаратов готовили маточный раствор концентрации 10 мг/мл в диметилсульфоксиде (ДМСО), после чего готовили серию двукратных разведений препаратов в среде MEM от 1000 до 3,75 µg/ml. Растворенные препараты вносили в лунки планшетов и инкубировали 2 суток при 37°C. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером, и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 37°C в атмосфере 5% CO2 в течение 2 часов и промывали 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО, после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. По результатам теста для каждого продукта определяли 50% цитотоксическую дозу (CTD50), т.е. концентрацию препарата, вызывающую гибель 50% клеток в культуре. Результаты экспериментов приведены в таблице.
Пример 3. Оценка противовирусной активности препаратов.
Определение противовирусной активности препаратов проводили на клетках MDCK в 96-луночных планшетах для клеточных культур. Соединения в необходимых концентрациях растворяли в поддерживающей среде для клеток, вносили в лунки панелей с клеточным монослоем и инкубировали в течение 1 часа при 36°C в атмосфере 5% CO2.
Из вируссодержащей жидкости (штамм A/H1N1/pdm09/California/07/09) готовили серию десятикратных разведений от 10-1 до 10-7, добавляли в лунки с препаратами и инкубировали при 36°C в течение 48 часов в атмосфере 5% CO2. По окончании срока инкубации аликвоту культуральной жидкости смешивали с равным объемом 1% куриных эритроцитов в отдельных планшетах с круглым дном. Учет результатов проводили через 60 минут инкубации при 20°C. За титр вируса в контроле и опыте принимали величину, обратную десятичному логарифму наибольшего разведения исходного вируса, способного вызвать положительную реакцию гемагглютинации в лунке, и выражали в количестве 50%) инфекционных доз (ID50). Вирусингибирующее действие исследуемых соединений оценивали по снижению титра вируса в опыте по сравнению с контролем. На основании полученных данных рассчитывали 50% ингибирующую дозу ED50, т.е. концентрацию препарата, снижающую уровень вирусной репликации вдвое (на 0,3 lg ID50), и индекс селективности, или химиотерапевтический индекс (ХТИ), представляющий собой отношение CTD50 к ED50. Полученные данные представлены в таблице.
| название | год | авторы | номер документа |
|---|---|---|---|
| АДАМАНТИЛАМИДЫ СЕРОСОДЕРЖАЩИХ КИСЛОТ И ИХ ПРОТИВОГРИППОЗНАЯ АКТИВНОСТЬ | 2015 |
|
RU2617850C1 |
| СПОСОБ ЗАЩИТЫ ОРГАНИЗМА ОТ ИНФЕКЦИИ, ВЫЗВАННОЙ ШТАММАМИ СУБТИПА H1N1 ВИРУСА ГРИППА А ПРЕПАРАТОМ НА ОСНОВЕ АЛЬФА-2 ИНТЕРФЕРОНА ЧЕЛОВЕКА | 2013 |
|
RU2523554C1 |
| Аминокислотные производные 2-норборнануксусной кислоты и их противогриппозная активность | 2017 |
|
RU2676699C1 |
| ШТАММ ВИРУСА ГРИППА A/IIV-Anadyr/177-ma/2009 (H1N1) pdm09, АДАПТИРОВАННЫЙ К ТКАНЯМ ЛЕГКИХ ЛАБОРАТОРНЫХ МЫШЕЙ | 2012 |
|
RU2487936C1 |
| Противовирусная композиция | 2020 |
|
RU2751108C1 |
| АДАПТИРОВАННЫЕ ПАНДЕМИЧЕСКИЕ ШТАММЫ ВИРУСА ГРИППА A/Tomsk/273/2010-MA1(H1N1pdm09), A/Tomsk/273/2010-MA2(H1N1pdm09) И A/Tomsk/273/2010-MA3(H1N1pdm09) ДЛЯ ОЦЕНКИ ДЕЙСТВИЯ ПРОТИВОВИРУСНЫХ ПРЕПАРАТОВ (ВАРИАНТЫ) | 2015 |
|
RU2605317C1 |
| ПРОТИВОВИРУСНАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2740657C1 |
| ПРОТИВОВИРУСНАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2740660C1 |
| СИММЕТРИЧНЫЕ ДИИМИНЫ НА ОСНОВЕ КАМФОРЫ - ИНГИБИТОРЫ РЕПРОДУКЦИИ ВИРУСА ГРИППА (ШТАММ A/California/07/09 (H1N1)pdm09) | 2013 |
|
RU2520967C1 |
| Применение конъюгатов глицирризиновой кислоты с аминокислотами в качестве ингибиторов флавивирусов Денге 2 и Зика | 2020 |
|
RU2818911C2 |
Изобретение относится к химико-фармацевтической промышленности, а именно к средству, представляющему собой амид глицирризиновой кислоты с 5-аминоурацилом формулы (1), проявляющему противовирусную активность в отношении вируса гриппа A/H1N1. Предлагаемое средство - амид ГК (1) является в 5 раз менее токсичным для клеток MDCK веществом (CTD50 300 мкг/мл), чем известный противовирусный препарат римантадин (CTD50 60 мкг/мл), и обладает более высоким уровнем противовирусной активности, 50% эффективная концентрация (EC50) амида ГК (1) - 0.2 мкг/мл, а у препаратов сравнения: ГК - 174 мкг/мл, римантадина - 12 мкг/мл. Амид ГК (1) имеет более высокий индекс селективности (SI 1500) по сравнению препаратами сравнения и превышает таковой ГК (SI 3.0) в 500 раз и римантадина (SI 5.0) в 300 раз. 1 табл., 3 пр.

Средство, представляющее собой амид глицирризиновой кислоты с 5-аминоурацилом формулы (I), проявляющее противовирусную активность в отношении вируса гриппа A/H1N1

| US 20110052727 A1, 03.03.2011 | |||
| АМИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С 5-АМИНОУРАЦИЛОМ, ПРОЯВЛЯЮЩИЙ АНТИ-ВИЧ АКТИВНОСТЬ | 2001 |
|
RU2199547C2 |
| СРЕДСТВО ДЛЯ ИНДУКЦИИ ЭНДОГЕННОГО ИНТЕРФЕРОНА | 2010 |
|
RU2427373C1 |
| КОНДРАТЕНКО Р.М | |||
| и др | |||
| Синтез новых гетеро- и карбоциклических ароматических амидов глицирризиновой кислоты - потенциальных анти-ВИЧ агентов | |||
| Химико-фармацевтический журнал, 2009, 43(7): 11-15. | |||
Авторы
Даты
2015-11-20—Публикация
2014-11-06—Подача