Изобретение относится к медицине, в частности к фармацевтическим композициям, содержащим эффективное количество рекомбинантного моноклонального антитела против CD3*CD19 формата «флексибоди» и пригодным для длительного хранения, а также к применению таких композиций для лечения злокачественных заболеваний В-клеток или истощения В-клеток.
Биспецифические антитела (БАТ) против CD3*CD19 в настоящее время разрабатываются преимущественно для лечения злокачественных заболеваний В-клеток или истощения В-клеток, в том числе: неходжкинской лимфомы (WO 2010037835, RU2228202), В-клеточного лейкоза (RU 2008129080), детской острой лимфобластической лейкемии (WO 20100052013) и т.д.
Только в России ежегодно регистрируется больше 20000 новых случаев Неходжкинской лимфомы (НХЛ). Менее 5% пациентов выживает в течение 5 лет, при том, что заболеваемость неходжкинскими лимфомами в России составляет 4:100000 человек в год. Стандартом лечения НХЛ в России является сочетание Ритуксимаба и химиотерапевтических препаратов. Однако более 20% первично диагностированных пациентов и около 50% пациентов с рецидивирующей лимфомой перестают отвечать на терапию ритуксимабом, а у изначально отвечающих пациентов эффективность ритуксимаба падает при последующих курсах терапии в связи с развитием резистентности (Br. J. Haematol. 2011, v.155, 426-437).
Проведенные в настоящее время исследования (например, J Clin Oncol, 2011, 29: 2493-8; Cancer, 2010, 116: 5568-74; Science, 2008, 321: 974-7) дают все основания полагать, что лекарственные препараты на основе биспецифических антител против CD3*CD19 обещают стать более эффективными в лечении упомянутых выше заболеваний.
Повышенная эффективность объясняется тем, что БАТ выполняют функцию адаптеров, которые физически соединяют Т-клетки с опухолевыми клетками и запускают мощный сигнальный каскад рецепторного комплекса Т-клеток посредством связывания с инвариантным компонентом CD3 Т-клеточного рецептора. При этом второй (целевой) антигенспецифичный фрагмент узнает CD19. Т.е. БАТ может временно соединить Т-клетку и раковую клетку за счет одновременного связывания с CD3 и антигеном-мишенью. В этом случае происходит активация и пролиферация Т-клеток, образование цитолитического синапса с высвобождением цитотоксических гранул и секреция цитокинов. Направленный лизис раковых клеток включает в себя перфорацию мембраны клетки-мишени с участием перфорина и последующий апоптоз, индуцированный гранзимами. Следует отметить, что Т-клетки, активированные с помощью БАТ, распознают антигены на поверхности раковой клетки так же, как обычные моноспецифические антитела. Таким образом удается перенаправить цитотоксическую функцию Т-клеток против опухолевых клеток, причем активность БАТ наблюдается уже при относительно низких (пикомолярных) концентрациях. Связывание же БАТ только с Т-клеткой в отсутствии клетки-мишени не вызывает Т-клеточную активацию.
Примеры биспецифических антител, известных из уровня техники (Blood, (ASH Annual Meeting Abstracts), 2009, 114:840), свидетельствуют о том, что эффективная терапевтическая концентрация препаратов, полученных на основе использования мультивалентных антител, существенно ниже по сравнению с классическими антительными противораковыми препаратами. Это способствует хорошей переносимости, возможности осуществления длительных курсов лечения и уменьшению риска побочных эффектов. Кроме того, объем и стоимость производства биспецифических антител ниже. Поэтому разработка новой композиции на основе таких антител может помочь существенно сократить производственные расходы и, что самое главное, сделать эти лекарства доступными для всех пациентов, нуждающихся в подобной терапии.
В настоящее время наиболее успешным в клинике БАТ является aura-CD19/анти-CD3 (CD19*CD3) препарат блинатумомаб (blinatumomab, MT103; продукт фирмы Micromet), действие которого основано на мобилизации нестимулированных первичных Т-клеток против CD19+ клеток лимфомы. Блинатумомаб состоит из двух доменов: домена анти-СВ19 scFv из гибридомы HD37 и домена анти-CD3 scFv из гибридомы TR66, которые образуют полипептид следующей структуры: VLCD19-VHCD19-VHCD3-VLCD3 (патент RU 2228202).
Но блинатумомаб имеет относительно небольшие размеры и быстро элиминируется из кровотока. Поэтому для достижения стабильных концентраций препарата в крови используется длительное внутривенное введение препарата в течение 4-8 недель за один цикл, что достаточно тяжело для пациента.
Для преодоления этих недостатков был предложен новый формат антител, называемый «флексибоди», технология создания которого подробно описана в патенте ЕР1293514. Флексибоди состоит из двух пар вариабельных доменов VH и VL, которые размещены на одной полипептидной цепи и соединены линкерами, длина которых определяет возможность образования мультимерных структур: димеров, тримеров и тетрамеров. Наиболее перспективным представляется вариант, когда полученный полипептид представляет собой две нековалентно связанные молекулы биспецифического антитела. В этом случае флексибоди имеет молекулярную массу около 120 кДа и способно к дивалентному связыванию как с клеткой мишенью, так и с эффекторной Т-клеткой, что позволяет повысить терапевтический потенциал молекулы (Kratz F, Senter P, Kiprijanov S. Bispecific Antibodies and Immune Therapy Targeting в книге Drug Delivery in Oncology: From Basic Research to Cancer Therapy. Wiley, 2011) и увеличить время элиминирования из организма. Такая молекула флексибоди имеет модульную структуру, в которой диабоди-модуль служит для димеризации одноцепочечной молекулы. Посредством спаривания комплементарных VH и VL доменов, находящихся на разных пептидных цепях, формируются функциональные Fv модули одинаковой специфичности, и получается стабильный нековалентный белковый димер. Было показано, что флексибоди обладают эффективностью в отношении заболеваний В-клеток.
Однако до сих пор не была разработана фармацевтическая композиция, основанная на использовании антител против CD19*CD3 формата «флексибоди», полезная для лечения заболеваний, связанных с В-клетками и пригодная для длительного хранения.
Именно в создании такой фармацевтической композиции и заключалась задача настоящего изобретения.
Для решения этой задачи авторы изобретения на основе полученных ими ранее двух антител против CD19*CD3 формата «флексибоди» создали фармацевтические композиции, обладающие эффективностью в отношении В-клеточных заболеваний и пригодные для длительного хранения.
Таким образом, технический результат настоящего изобретения заключается в расширении арсенала средств для лечения В-клеточных заболеваний и создании композиции с длительным сроком хранения.
Раскрытие изобретения
Настоящее изобретение относится к фармацевтическим композициям, включающим в качестве активного начала антитело против CD19*CD3 формата «флексибоди», выбранное из следующих полипептидов:
Bis1 с ориентацией VLCD19-L1-VHCD19-L2-VHCD3-L3-VLCD3 (SEQ ID №1) или
Bis2 с ориентацией VHCD19-L1-VLCD19-L2-VLCD3-L3-VHCD3 (SEQ ID №2), в эффективном количестве, а также к применению таких фармацевтических композиций для лечения В-клеточных заболеваний, истощения В-клеток или замедления развития патологических состояний, которые вызываются В-клеточными нарушениями.
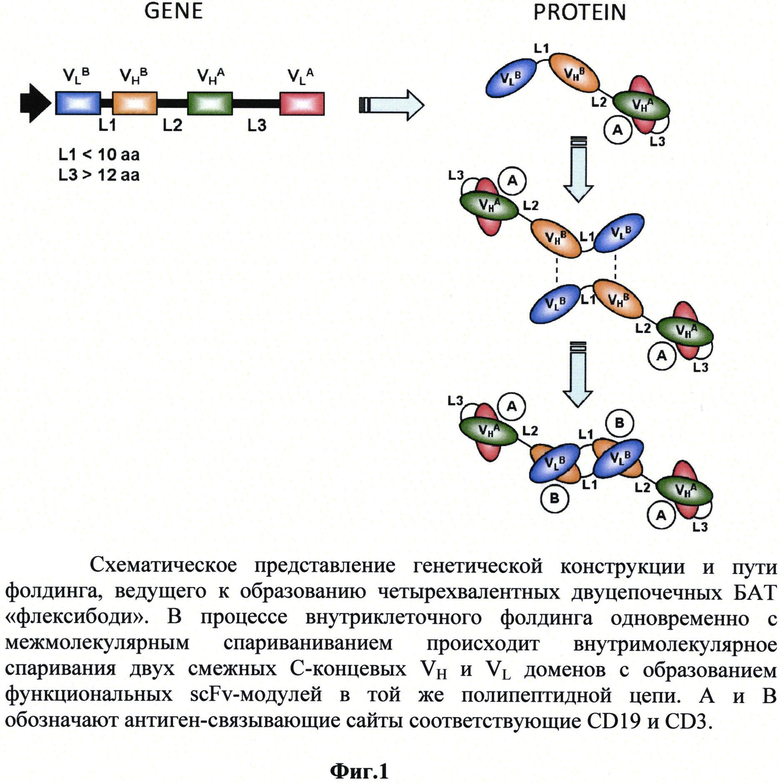
Пространственная структура флексибоди, образуемых полипептидами Bis1 и Bis2 показана на фиг.1. В качестве линкеров (L1, L2 и L3) использованы следующие пептиды:
L1: GGSGGSGGS,
L2: GGSGGS,
L3: GGSGGSGGSGGSGGS.
Для получения этих антител в компании МБЦ «Генериум» были созданы соответствующие экспрессионные вектора, и разработан промышленный способ получения антител в СНО-клетках, включающий этапы культивирования, выделения и очистки. В результате чего мы получили достаточное количество антител для проведения доклинических исследований.
Для терапевтических препаратов важным является сохранение стабильности и активности в течение срока хранения. Поэтому еще одна задача, которую решает настоящее изобретение, это создание препарата, способного сохранять свои свойства при хранении в течение длительного срока, составляющего примерно 1,5-2 года.
В наиболее общем варианте настоящее изобретение раскрывает фармацевтические композиции, в качестве активного компонента содержащие эффективное количество рекомбинантного моноклонального антитела против CD3*CD19 формата «флексибоди», выбранного из группы, включающей антитело Bis1 или антитело Bis2; буфер, обеспечивающий рН=6,8-7,8; поверхностно-активное вещество и стабилизатор, пригодные для длительного хранения.
Предпочтительно использование следующих компонентов: натрий-фосфатный буфер, Твин 80 в качестве поверхностно-активного вещества, маннит - в качестве изотонического агента и гистидин - в качестве стабилизатора. Мы обнаружили, что наибольшей стабильности композиции с сохранением биологической активности удается достичь при применении указанных компонентов в следующих концентрациях:
с рН=6,8-7,8.
При этом наиболее предпочтительным является следующий состав:
с рН=6,8-7,8.
Композиции, содержащие антитела против CD3*CD19 формата «флексибоди», предназначенные для инъекционного введения, дополнительно могут включать изотонические агенты, например различные сахара, а также дополнительные стабилизаторы, например, аминокислоты, такие как аргинин, глицин, метионин, а также фармакологически совместимые консерванты и прочие целевые добавки, как это показано, например, в «Handbook of Pharmaceutical Excipients» (2"d ed. London: The Pharmaceutical Press; 1994).
Фармацевтические композиции по изобретению также могут быть получены в лиофилизированной форме, и в этом случае дополнительно включать фармацевтически приемлемые растворители и разбавители, например, воду, физиологический раствор и другие, обычно применяемые растворители.
Указанные эксципиенты могут использоваться в комбинации с другими активными ингредиентами (например, противораковыми или противовоспалительными средствами), при условии, что они не вызывают нежелательных эффектов.
Дозировка фармацевтических композиций по изобретению у пациентов может корректироваться в зависимости от веса, возраста, пола больного и наличия сопутствующих заболеваний.
Предполагаемый механизм действия антител против CD19*CD3 формата «флексибоди» аналогичен таковому, описанному для анти-CD19/анти-CD3 антитела - препарата блинатумомаб (МТ103); и заключается в активации мультиспецифичного Т-клеточного цитологического ответа против CD19+клеток лимфомы. Поэтому фармацевтические композиции на основе антител против CD19*CD3 формата «флексибоди» согласно настоящему изобретению могут применяться для лечения всех гематологических раковых заболеваний (лимфом и лейкозов) В-клеточной природы. Таких как В-клеточные опухоли из предшественников В-лимфоцитов, в том числе: В-лимфобластная лимфома/В-клеточный острый лимфобластный лейкоз из клеток-предшественников; В-клеточные опухоли из периферических (зрелых) В-лимфоцитов, в том числе: В-клеточный хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов (лимфоцитарная лимфома); В-клеточный пролимфоцитарный лейкоз; лимфоплазмоцитарная лимфома; селезеночная лимфома маргинальной зоны; волосатоклеточный лейкоз; плазмоклеточная миелома/плазмоцитома; экстранодальная В-клеточная лимфома маргинальной зоны MALT-типа; нодальная В-клеточная лимфома маргинальной зоны; фолликулярная лимфома; лимфома из клеток мантийной зоны; диффузная В-крупноклеточная лимфома; медиастинальная диффузная В-крупноклеточная лимфома; первичная экссудативная лимфома; лимфома / лейкоз Беркитта, а также для лечения аутоиммунных заболеваний, вызванных патологической регуляцией В-клеток, таких как ревматоидный артрит, системная красная волчанка и гломерулонефрит.
Описание фигур
Фиг.1. Схематическое представление генетической конструкции и пути фолдинга, ведущего к образованию четырехвалентных двуцепочечных БАТ «флексибоди».
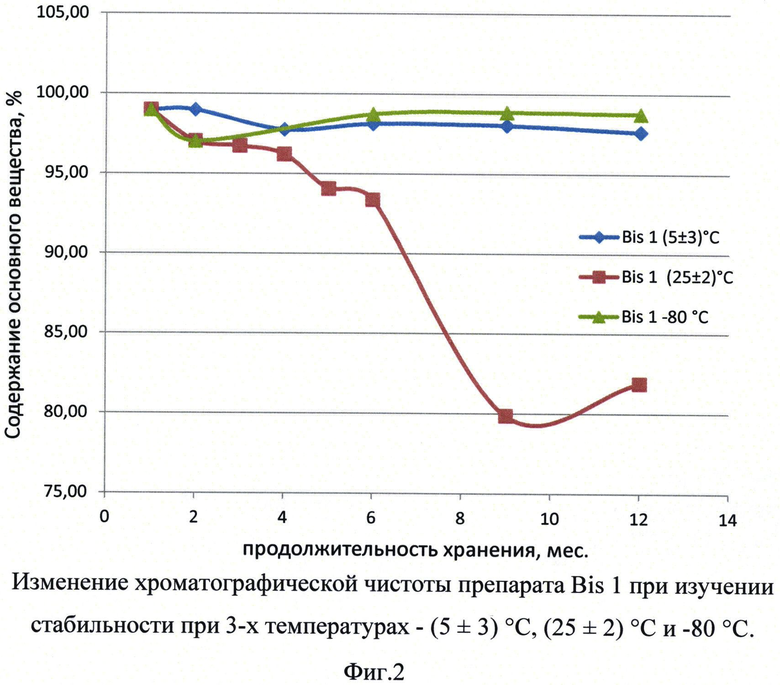
Фиг.2. Изменение хроматографической чистоты препарата Bis1 при изучении стабильности при 3-х температурах.
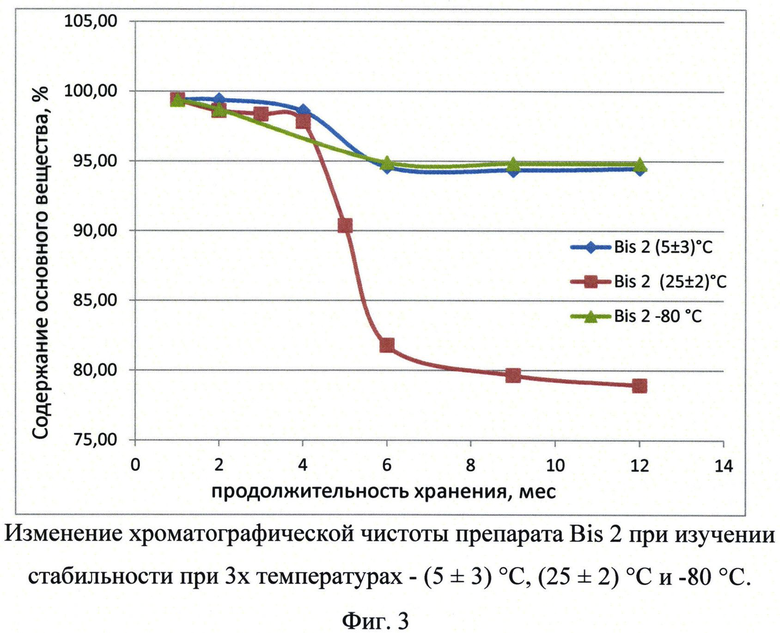
Фиг.3. Изменение хроматографической чистоты препарата Bis2 при изучении стабильности при 3-х температурах.
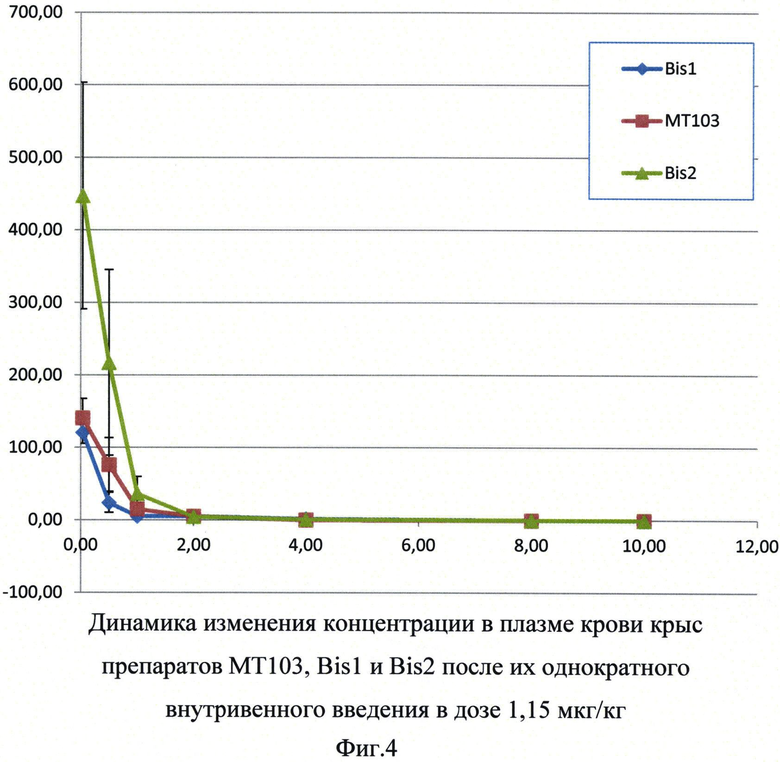
Фиг.4. Динамика изменения концентрации в плазме крови крыс препаратов МТ103, Bis1 и Bis2 после их однократного внутривенного введения в дозе 1,15 мкг/кг.
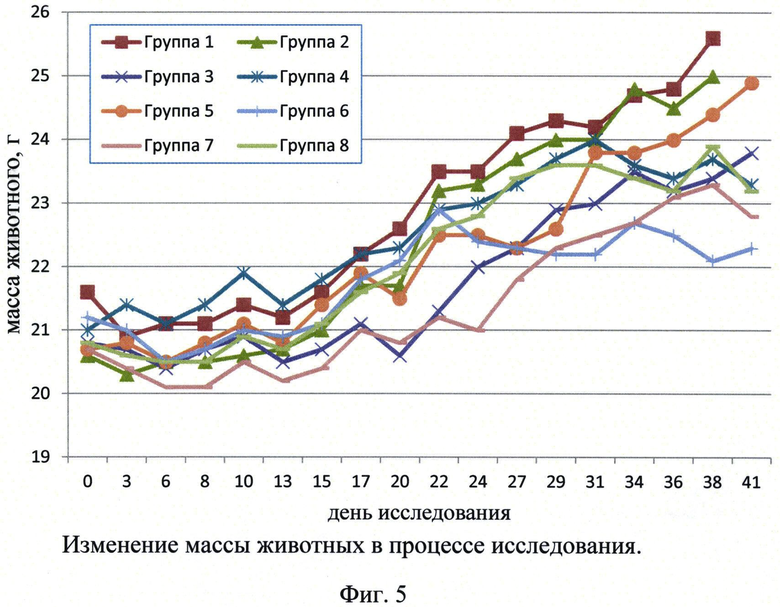
Фиг.5. Изменение массы животных (г) в процессе исследования.
Фиг.6. Изменение среднего объема опухоли (мм3) в процессе исследования.
Описание последовательностей
SEQ ID №1 - аминокислотная последовательность антитела Bis1 против CD3*CD19 формата флексибоди с ориентацией VL αCD19-L1-VH αCD19-L2-VH αCD3-L3-VL αCD3
SEQ ID №2 - аминокислотная последовательность антитела Bis2 против CD3*CD19 формата флексибоди с ориентацией VH αCD19-L1-VL αCD19-L2-VL αCD3-L3-VH αCD3
Изобретение иллюстрируется приведенными ниже примерами.
Пример 1. Разработка фармацевтической композиции и анализ ее стабильности.
При подборе буфера для хранения растворов препаратов Bis1 и Bis2 был взят за основу натрий-фосфатный буфер (далее - НФБ), к которому добавлялись различные стабилизаторы, необходимые для долгосрочной стабильности белка. Исследуемые композиции содержали Твин80 в качестве поверхностно-активного вещества и растворы маннита, сахарозы или трегалозы, а также аминокислоты аргинин, глицин и гистидин в качестве стабилизаторов. Изученные варианты композиций представлены в таблице 1.
Концентрация препарата в каждой композиции составляла 0,5 мг/мл. В качестве характеристики стабильности использовали гельфильтрационную ВЭЖХ, позволяющую дать количественную оценку как наличию олигомерных форм белка, так и фрагментов, образующихся при распаде молекулы. Исследование стабильности препарата при серии повторных замораживаний/ оттаиваний показало важность присутствия стабилизаторов в финальной формуляции. Как видно из приведенных данных (Таблица 2), фосфатно-солевой буфер с добавлением разных количеств ПАВ не предотвращал распад молекулы при замораживании. Добавление сахаров или аминокислот к фосфатно-солевому буферу позволило достичь достаточной стабильности композиции, при которой чистота продукта значительно не изменялась при проведении двух серий замораживания/оттаивания.
Исследование стабильности препарата при ускоренном хранении (при температуре 25±2°С) позволяет экстраполировать полученные данные на больший срок и оценить приблизительный срок годности препарата. В таблице 3 представлены данные хранения препарата Bis1 (в процентах показана чистота основного вещества, оцененная при помощи гельфильтрационной ВЭЖХ) при температуре 25±2°С в течение 1 месяца. Аналогичные результаты были получены и для препарата Bis2.
Как видно из представленных данных, наблюдается резкое падение чистоты препарата при использовании сахарозы или трегалозы в формуляции препарата (композиции №4, 5, 10 и 11). Использование маннита в составе буфера не приводило к значимому изменению чистоты препарата.
На основании полученных данных были отобраны композиции, в которых не произошло заметных изменений, или же, где такие изменения были наименьшими при сравнении с началом исследования. В качестве компонентов итогового буфера для композиции антитела были выбраны Твин80 (поверхностно-активное вещество) и маннит в качестве стабилизатора. В состав финальной формуляции также был включен гистидин для дополнительной стабилизации препарата. Композиции по настоящему изобретению имеют рН в диапазоне 6,8-7,8.
Изучение стабильности препаратов Bis1 и Bis2 проводилось в буфере, содержащем: 150 мМ натрия хлорида, 0,01% Твин 80, 1,8% маннит, 20 мМ гистидин, 20 мМ фосфат натрия. Концентрация антител составляла 0,5 мг/мл.
При исследовании стабильности определялись такие показатели стабильности как хроматографическая и электрофоретическая чистота, а также биологическая активность препарата методом ADCC (антителозависимой клеточно-опосредованной цитотоксичности), позволяющим в условиях in vitro смоделировать процесс иммунной реакции, возникающий в живом организме. В результате этого анализа для антител определялся такой параметр, как концентрация активного вещества, при которой наблюдается половинный биологический эффект, что является качественной характеристикой антителоподобных структур, специфичных к рецепторам клеток.
Для проведения долгосрочных испытаний были заложены на хранение композиции, содержащие Bis1 и Bis2, при температурах 5±3°С, 25±2°С и минус 80°С. Продолжительность долгосрочных испытаний указанных композиций составила 12 месяцев. Результаты представлены в Таблице 4 и на фигурах 2 и 3.
Значение биологической активности препарата оставалось стабильным на протяжении всего периода исследования препаратов Bis1 и Bis2 при температурах 5±3°С и -80°. При температуре 25±2°С через 12 месяцев исследования было детектировано значительное снижение биологической активности как Bis1 так и Bis2.
При определении подлинности методом электрофореза в полиакриламидном геле в образцах Bis1 и Bis2, хранящихся при температуре 25±2°С, обнаруживаются примеси с молекулярной массой менее 55 кДа, причем данные примеси впервые определяются в образцах только через 6 месяцев ускоренного хранения. Экстраполяция полученных данных стабильности препарата согласно инструкции И42-2-82 ("Временная инструкция по проведению работ с целью определения сроков годности лекарственных средств на основе метода ускоренного хранения при повышенной температуре" М.: Минздрав РФ, 1982) позволяет вычислить предположительный срок хранения 2 года при температуре 5±3°С. Полученные результаты согласуются с данными, полученными при определении хроматографической чистоты препарата при данной температуре.
Таким образом, найденный состав композиции позволяет получать препарат, стабильный в течение как минимум 1,5 лет при хранении при температуре 4°С (бытовой холодильник). Данные условия удовлетворяют критериям получения коммерчески доступных препаратов, пригодных для конечного потребителя.
Для полученных композиций была проведена оценка фармакокинетических параметров и противоопухолевой активности, в сравнении с композицией на основе МТ-103, использованной в качестве контроля.
Пример 2. Сравнительная оценка фармакокинетических параметров препаратов Bis1 и Bis2.
Для оценки фармакокинетических параметров использовали следующие фармацевтические композиции:
В состав обоих препаратов, помимо основного действующего вещества, входили следующие компоненты: для фармацевтических композиций, содержащих антитела Bis1 или Bis2: 150 мМ натрия хлорида, 0,01% полисорбат 80, 1,8% маннит, 20 мМ гистидин, 20 мМ фосфата натрия;
для фармацевтических композиций, содержащих МТ103: 150 мМ натрия хлорида, 20 мМ фосфата натрия.
Для доклинического исследования были использованы аутбредные крысы CD (Sprauge Dowley), самки, массой порядка 400 г, полученные из питомника «Пущине» ФИБХ РАН. Всего в эксперименте использована 21 крыса.
Условия содержания животных соответствовали Guide for the Care and Use of Laboratory Animals, 8th edition, 2011, NRC, USA (Руководству по содержанию и использованию лабораторных животных, 8-е издание, 2011 год, Национальный комитет по исследованиям, США).
Был выбран внутривенный путь введения исследуемого препарата - в каудальную хвостовую вену. Данный путь введения обусловлен тем, что внутривенный путь введения предполагается при клиническом применении препарата.
Для количественного измерения протеоформ Bis1, Bis2 и МТ103 в плазме крыс использовали масс-спектрометрический метод. В качестве внутреннего стандарта измерения использовали синтетические пептиды с включением аминокислоты C13N15-Leu, идентичные нативным пептидам измеряемых протеоформ, полученные в результате реакции ферментативного расщепления трипсином.
Результаты измерения концентрации исследуемых препаратов в плазме крови крыс с течением времени представлены на рисунке 4. Результаты расчета фармакокинетических параметров исследованных препаратов представлены в таблице 8.
Таким образом, показано, что периоды полувыведения препаратов Bis2 и МТ103 достоверно значительно не отличаются. Различия в показаниях AUC и Cmax могут быть объяснены разным объемом распределения препаратов, обладающих различной пространственной конформацией.
Пример 3. Сравнение противоопухолевой активности Bis1, Bis2 и МТ 103 на модели опухолевого ксенотрансплантата клеток линии Раджи (Raji) у мышей NOD/SCID при реконституции МКПК человека.
Цель исследования заключалась в сравнении эффективности препаратов Bis1, Bis2 и МТ103 у мышей NOD/SCID при двух уровнях дозы (1 мкг/животное или 10 мкг/животное), на модели ксенотрансплантата опухолевых клеток линии Раджи с одновременной инъекций мононуклеарных клеток периферической крови (МКПК) человека иммунодефицитным мышам NOD/SCID.
Клетки линии Раджи (лимфома Беркитта человека) предварительно смешивали с МКПК человека и инокулировали подкожно с последующим внутривенным введением исследуемых препаратов. Для этого восьми экспериментальным группам иммунодефицитных мышей NOD/SCID (9 животных на группу) в день 0 (д0) подкожно вводили или клетки линии Раджи лимфомы Буркита человека или суспензию предварительно смешанных клеток линии Раджи и МКПК человека. По три животных из каждой группы получали МКПК человека от одного из трех отдельных здоровых доноров (когорты 1, 2 и 3). Животным в день 0 (через 2 часа после инокуляции клеток), в дни 1, 2, 3 и 4 внутривенно вводили или НФБ (натрий-фосфатный буферный раствор) или исследуемые препараты Bis1, Bis2 или МТ 103 в дозе 1 мкг или 10 мкг. Вводимый объем составлял 200 мкл. Во всех группах в течение 39 дней (дни с 3 по 41) оценивали частоту развития и объем опухоли.
Вводимые растворы готовили путем разведения основного раствора Bis1 (0,54 мг/мл), Bis2 (0,59 мг/мл) или МТ103 (0,52 мкг/мл) в 0,9% физиологическом растворе до получения концентрации 50 мкг/мл (доза 10 мкг) или 5 мкг/мл (доза 1 мкг). Экспериментальные группы описаны в таблице 9, представленной ниже:
У экспериментальных животных определяли следующие показатели: выживаемость, масса тела, объем опухоли.
Массу тела определяли в день 0 и в последующем регистрировали три раза в неделю до дня 41. Объем опухоли контролировали 3 раза в неделю с дня 3 до дня 41 путем измерения большого и малого диаметра опухоли циркулем. На основании диаметров вычисляли объем опухоли, используя следующую формулу:
Объем=(малый диаметр)2×большой диаметр×0,5
В контрольной группе 1, получавшей НФБ (только клетки линии Раджи), до дня 41 (завершения исследования) выжили 44,4% животных. Выживаемость снизилась на 0% у животных группы 2, получавших клетки линии Раджи и МКПК человека. В обеих группах смертность была обусловлена исключительно умерщвлением вследствие большого объема опухоли.Введение Bis1, Bis2 и МТ 103 повысило выживаемость в группах 3-8 до 89% или 100%, что отражено в таблице 10, причем при большей дозе исследуемые препараты оказываются более эффективны, чем препарат сравнения:
Критерии завершения: объем опухоли >10% массы тела; изъязвление опухоли; умерщвлено умирающее животное (по этическим соображениям); животное найдено мертвым с признаками ауолиза; снижение массы тела >20%.
Средняя масса тела животных, которым инокулировали смесь клеток линии Раджи и МКПК человека и вводили исследуемые препараты Bis1, Bis2 или МТ 103, в течение исследования увеличилась. При этом относительная средняя масса тела в группах, получавших исследуемый препарат, оказалась ниже, чем в группе 2, получавшей НФБ (см. Фиг.5).
Рост опухоли значительно ингибировался или замедлялся во всех исследуемых группах, получавших Bis1, Bis2 или МТ 103 (группы 3-8) по сравнению с контрольной группой 2, получавшей НФБ. При этом во всех исследуемых группах, получавших Bis1, Bis2 или МТ103, ингибирование роста опухоли оказалось статистически значимым (р<0,05). При завершении исследования доза 10 мкг всех трех исследуемых препаратов Bis1, Bis2 и МТ 103 значительно ингибировала рост опухоли у мышей NOD/SCID до 4% и 5% объема опухоли по сравнению с контрольной группой 2. Противоопухолевый эффект при такой дозе оказался сходным для всех трех исследуемых препаратов. Доза 1 мкг была практически столь же эффективна для всех препаратов, за исключением Bis2. Полученные результаты представлены на фиг.6.







| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ CD3*CD19 | 2015 |
|
RU2651776C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ ПРОТИВ CD3*CD19 ФОРМАТА ФЛЕКСИБОДИ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ | 2014 |
|
RU2577226C2 |
| ОПРЕДЕЛЯЮЩИЕ КОМПЛЕМЕНТАРНОСТЬ УЧАСТКИ ДЛЯ СВЯЗЫВАНИЯ CD3 И СОДЕРЖАЩАЯ ИХ БИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2019 |
|
RU2738802C1 |
| БИСПЕЦИФИЧЕСКИЕ АСИММЕТРИЧНЫЕ ГЕТЕРОДИМЕРЫ, СОДЕРЖАЩИЕ АНТИ-CD3 КОНСТРУКЦИИ | 2013 |
|
RU2650868C2 |
| НОВОЕ ЛЕЧЕНИЕ ОСТРОГО ЛИМФОБЛАСТНОГО ЛЕЙКОЗА | 2009 |
|
RU2536940C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО, СВЯЗАННОГО С ТРАНСПЛАНТАЦИЕЙ И АУТОИММУННОГО ЗАБОЛЕВАНИЯ | 2007 |
|
RU2495882C2 |
| РЕЖИМ ДОЗИРОВАНИЯ ДЛЯ ВВЕДЕНИЯ БИСПЕЦИФИЧНОГО АНТИТЕЛА CD19×CD3 | 2010 |
|
RU2548746C2 |
| CD19XCD3-СПЕЦИФИЧЕСКИЕ ПОЛИПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 1999 |
|
RU2228202C2 |
| Способ повышения уровней экспрессии антигенов | 2014 |
|
RU2681953C2 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2012 |
|
RU2688185C2 |

Группа изобретений относится к медицине и фармацевтике, в частности к фармацевтической композиции, содержащей эффективное количество рекомбинантного моноклонального антитела против CD3*CD19, выбранного из группы, включающей антитело SEQ ID №1 или антитело SEQ ID №2, а также фосфатно-солевой буфер, поверхностно-активное вещество и маннит в концентрации 1,5-3,0%, а также к применению таких композиций для лечения злокачественных заболеваний В-клеток или истощения В-клеток. Группа изобретений обеспечивает длительный срок хранения композиции. 2 н. и 3 з.п. ф-лы, 3 пр., 10 табл., 6 ил.
1. Фармацевтическая композиция, обладающая противоопухолевой активностью в отношении заболеваний В-клеточной природы, включающая эффективное количество рекомбинантного моноклонального антитела против CD3*CD19, выбранного из группы, включающей антитело, характеризующееся последовательностью SEQ ID №1 или антитело, характеризующееся последовательностью SEQ ID №2; а также фосфатно-солевой буфер, поверхностно-активное вещество и маннит в концентрации 1,5-3,0%.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что представляет собой композицию следующего состава:
с pH=6,8-7,8.
3. Фармацевтическая композиция по п. 2, отличающаяся тем, что представляет собой композицию следующего состава:
с pH=6,8-7,8.
4. Применение композиции по любому из пп. 1-3 для лечения злокачественных заболеваний В-клеток или истощения В-клеток.
5. Применение по п. 4, где злокачественное заболевание В-клеток представляет собой неходжкинскую лимфому.
| Устройство для испытания клапанов | 1983 |
|
SU1293514A1 |
| CD19XCD3-СПЕЦИФИЧЕСКИЕ ПОЛИПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 1999 |
|
RU2228202C2 |
| RU2012121895 A, 10.12.2013. | |||
Авторы
Даты
2015-11-20—Публикация
2014-04-18—Подача