ОПИСАНИЕ
Перекрестная ссылка на родственные заявки
Настоящая заявка утверждает приоритет и преимущество предварительной патентной заявки США 61/309393, зарегистрированной 1 марта 2010 года, описание которой включено в настоящий документ в качестве ссылки в полном объеме.
Список последовательностей
Настоящая заявка содержит список последовательностей, который был представлен посредством EFS-Web и включен, таким образом, в качестве ссылки в полном объеме. Указанная ASCII копия, созданная 25 февраля 2011 года, называется ALXN153.txt и имеет размер 61625 байт.
Область техники
Областью изобретения является медицина, иммунология, молекулярная биология и белковая химия.
Уровень техники
Болезнь Дего (также известная как болезнь Кольмейера и злокачественный атрофический папулез (MAP)) представляет собой редкую васкулопатию (примерно 200 зарегистрированных случаев), которая характеризуется тромбозом малых и крупных сосудов. См., например, Lester и Rapini (2009) Curr Opin Gastroenterol 25:66-73 и Englert et al. (1984) Br Med J 289:576. Хотя, в основном, полагают, что болезнь Дего имеет неизвестную этиологию, она ассоциирована с вирусными инфекциями (например, с парвовирусом B19 и ВИЧ) и аутоиммунными нарушениями, такими как красная волчанка (LE), дерматомиозит и первичный антифосфолипидный синдром (APS). См., например, Crowson et al. (2002) J Cutan Pathol 29:596-601; Englert et al. (1984), выше; Heymann (2009) J Am Acad Dermatol 61:505-506; Duril et al. (1969) Arch Dermatol 100(5):575-581; Tsao et al. (1997) J Am Acad Dermatol 36:317-319; и Requena et al. (1998) J Am Acad Dermatol 38:852-856. Некоторые формы болезни Дего могут быть семейными. См., например, Katz et al. (1997) J Am Acad Dermatol 37:480-484 и Penault et al. (2004) Ann Dermatol Venereol 131:989-993. Болезнь Дего может развиваться у пациентов в любом возрасте, однако, по-видимому, она поражает предпочтительно мужчин, больше чем женщин в соотношении приблизительно 3:1. См., например, Katz et al. (1997), выше; Torrelo et al. (2002) Br J Dermatol 146:916-918; и Wilson et al. (2007) Pediatr Dermatol 24(1): 18-24.
Болезнь Дего может проявляться в виде доброкачественной, исключительно кожной формы или в виде агрессивной мультиорганной системной формы, которая приводит к летальному исходу в течение от одного до 12 лет после постановки диагноза. Scheinfeld (2007) Clin Exp Derm 32:483-487. Фенотипическим отличительным признаком кожной болезни Дего является появление одной или нескольких эритематозных, красноватого цвета папул на коже, которые образуют рубцы с белыми атрофичными центрами.
Практически все пациенты с системной формой болезни Дего умирают, средняя продолжительность жизни пациентов после развития системной формы составляет примерно два-три года. См., например, Scheinfeld (2007), выше. Пациенты, как правило, умирают от перфорации кишечника с септическими осложнениями или без них; однако смерть может, кроме того, наступать в результате кишечного инфаркта, сердечно-легочного коллапса и/или неврологического инфаркта и кровотечения. Там же, см. High et al. (2004) J Am Acad Dermatol 50(6):895-899.
Стандартное лечение болезни Дего не определено. Многие терапевтические средства имеют лишь незначительный и/или нестабильный успех в лечении заболевания. См., например, Scheinfeld (2007), выше. Например, у некоторых пациентов с болезнью Дего наступает улучшение от внутривенной иммуноглобулиновой терапии, но в настоящее время невозможно предсказать, какие пациенты будут отвечать на такую терапию, см., например, Dyrsen et al. (2008) J Cutan Pathol 35(Suppl 1):20-25: Zhu et al. (2007) Br J Dermatol 157(1):206-207: и De Breucker et al. (2008) Acta Clin Belg 63(2):99-102 (Abstract).
В связи с вышеуказанным, очевидно, что существует необходимость в новых подходах и лучших способах для лечения пациентов с болезнью Дего.
Сущность изобретения
Настоящее изобретение основано, по меньшей мере частично, на том открытии автора изобретения, что ингибитор комплемента, а именно, гуманизированное антитело против C5, экулизумаб, был высокоэффективен при лечении пациента, страдающего системной формой болезни Дего. Таким образом, изобретение относится к ряду композиций и способов, подходящих для предупреждения и лечения болезни Дего.
В одном из аспектов, изобретение относится к способу лечения пациента, страдающего болезнью Дего, включающему введение пациенту, страдающему болезнью Дего, ингибитора комплемента в количестве, достаточном для лечения заболевания.
В другом аспекте изобретение относится к способу лечения пациента, страдающего болезнью Дего, включающему длительное введение пациенту, страдающему болезнью Дего, ингибитора комплемента в количестве и с частотой, достаточными для поддержания сниженного уровня активности комплемента у пациента, чтобы таким образом лечить заболевание.
В другом аспекте изобретение относится к способу лечения болезни Дего, включающему выявление пациента, страдающего болезнью Дего или с подозрением на болезнь Дего; и введение пациенту ингибитора комплемента в количестве, достаточном для лечения заболевания.
В другом аспекте изобретение относится к способу лечения или предупреждения (например, предупреждения возникновения болезни Дего или предупреждения прогрессирования доброкачественной кожной формы болезни Дего в более запущенную, мультиорганную и/или системную форму заболевания). Способ включает введение нуждающемуся в этом пациенту ингибитора комплемента в количестве, достаточном для лечения или предупреждения заболевания. В некоторых вариантах осуществления ингибитор можно вводить длительно в количестве и с частотой, необходимой для поддержания сниженного уровня активации комплемента в крови пациента в течение лечения.
В некоторых вариантах осуществления любого из способов, описываемых в настоящем документе, болезнь Дего ассоциирована с B19-парвовирусной инфекцией или с инфекцией вирусом иммунодефицита человека. В некоторых вариантах осуществления болезнь Дего является идиопатической.
В некоторых вариантах осуществления любого из способов, описываемых в настоящем документе, болезнь Дего патологически поражает одну или несколько систем из следующих: желудочно-кишечный тракт, центральная нервная система и сердечнососудистая система. В некоторых вариантах осуществления болезнь Дего является мультиорганной системной болезнью Дего. В некоторых вариантах осуществления болезнь Дего представляет собой кожную форму заболевания.
В некоторых вариантах осуществления любого из способов, описываемых в настоящем документе, болезнь Дего устойчива по меньшей мере к одной терапии, выбранной из группы, состоящей из противовоспалительного средства, антикоагулянта, антитромботического средства и внутривенно вводимого иммуноглобулина. Противовоспалительное лекарственное средство может быть, например, выбрано из группы, состоящей из кортикостероидов, фенилбутазона, азатиоприна, метотрексата, циклоспорина, такролимуса и микофенолата мофетила. Антикоагулянт или антитромботическое средство может быть, например, выбрано из группы, состоящей из клопидогреля, аспирина и дипиридамола.
В некоторых вариантах осуществления любого из способов, описываемых в настоящем документе, ингибитор комплемента может быть, например, выбран из группы, состоящей из полипептида, аналога полипептида, нуклеиновой кислоты, аналога нуклеиновой кислоты и низкомолекулярного соединения. В некоторых вариантах осуществления ингибитор комплемента может быть, например, выбран из группы, состоящей из растворимых CR1, LEX-CR1, MCP, DAF, CD59, фактора H, фактора яда кобры, FUT-175, комплестатина и K76 COOH.
В некоторых вариантах осуществления любого из способов, описываемых в настоящем документе, ингибитор комплемента ингибирует экспрессию белка компонента комплемента человека. В некоторых вариантах осуществления ингибитор комплемента может ингибировать активность белка комплемента, в качестве неограничивающих примеров, такого как компонент комплемента C1s, компонент комплемента C1r, конвертаза C3, конвертаза C5, или C5b-9.
В некоторых вариантах осуществления любого из способов, описываемых в настоящем документе, ингибитор комплемента ингибирует расщепление компонента C5, C4, C3 или C2 комплемента человека. Например, ингибитор комплемента может ингибировать расщепление компонента C5 комплемента на фрагменты C5a и C5b.
В некоторых вариантах осуществления ингибитор комплемента представляет собой антитело или его антигенсвязывающий фрагмент, который связывается с белком компонента комплемента человека (например, с белком C5). В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с альфа цепью белка C5. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с бета цепью C5. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с альфа цепью компонента C5 комплемента человека, где антитело (i) ингибирует активацию комплемента в жидкостях тела человека, (ii) ингибирует связывание очищенного компонента C5 комплемента человека с компонентом C3b комплемента человека или с компонентом C4b комплемента человека, и (iii) не связывается с продуктом активации комплемента человека, свободным C5a. В некоторых вариантах осуществления антитело связывается с белком компонента C5 комплемента человека, включающим или состоящим из аминокислотной последовательности, показанной в любом из SEQ ID NO: 1-26. В некоторых вариантах осуществления ингибитор представляет собой антитело или его антигенсвязывающий фрагмент, который связывается с фрагментом C5b компонента комплемента C5.
В некоторых вариантах осуществления антитело может быть моноклональным антителом. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент могут быть выбраны из группы, состоящей из гуманизированного антитела, рекомбинантного антитела, диатела, химеризованного или химерного антитела, деиммунизованного антитела человека, полностью человеческого антитела, одноцепочечного антитела, фрагмента Fv, фрагмента Fd, фрагмента Fab, фрагмента Fab' и фрагмента F(ab')2.
В некоторых вариантах осуществления любого из способов, описываемых в настоящем документе, ингибитор комплемента представляет собой экулизумаб или пекселизумаб.
Еще в одном аспекте изобретение относится к промышленному изделию, которое содержит контейнер, включающий этикетку, и композицию, содержащую ингибитор комплемента, где этикетка указывает, что композиция предназначена для введения человеку с болезнью Дего, с подозрением на болезнь Дего или подверженному риску развития болезни Дего. Ингибитор может быть, например, антителом или его антигенсвязывающим фрагментом, который связывается с белком компонента C5 комплемента человека. Ингибитор может быть, например, антителом или его антигенсвязывающим фрагментом, который связывается с фрагментом белка компонента C5 комплемента человека, таким как C5a или C5b.
В некоторых вариантах осуществления промышленное изделие включает одно или более дополнительных активных средств, в качестве неограничивающих примеров, таких как, одно или несколько противовоспалительных средств, антикоагулянты или антитромботические средства.
Автор изобретения также обнаружил, что у пациента с болезнью Дего, описываемого в настоящем документе, были повышены уровни интерферона альфа в сыворотке, а также в биопсийном образце кожной ткани. Хотя это и не связано с какой-либо конкретной теорией или механизмом действия, но поскольку интерферон альфа активирует приобретенный и врожденный иммунитет, усиливая эффекты любого антигенного триггера, и сообщалось, что введение экзогенного интерферона альфа приводит к кожному тромбозу и изъязвлению, автор изобретения полагает, что ингибирование интерферона альфа является подходящей стратегией для лечения болезни Дего.
Таким образом, в другом аспекте изобретение относится к способу лечения пациента, страдающего болезнью Дего; способу, включающему введение пациенту, страдающему болезнью Дего, ингибитора интерферона альфа в количестве, достаточном для лечения заболевания.
В другом аспекте изобретение относится к способу лечения пациента, страдающего болезнью Дего; способу, включающему длительное введение пациенту, страдающему болезнью Дего, ингибитора интерферона альфа в количестве и с частотой, достаточными для поддержания сниженного уровня активности интерферона альфа у пациента, чтобы таким образом лечить заболевание.
В другом аспекте изобретение относится к способу лечения болезни Дего, который включает выявление пациента, страдающего болезнью Дего или с подозрением на болезнь Дего, и введение пациенту ингибитора интерферона альфа в количестве, достаточном для лечения заболевания.
В другом аспекте изобретение относится к способу лечения или предупреждения (например, предупреждения возникновения болезни Дего или предупреждения прогрессирования доброкачественной кожной формы болезни Дего в более запущенную, мультиорганную и/или системную форму заболевания). Способ включает введение нуждающемуся в этом пациенту ингибитора интерферона альфа в количестве, достаточном для лечения или предупреждения заболевания. В некоторых вариантах осуществления ингибитор можно вводить длительно и в количестве и с частотой, достаточными для поддержания сниженного уровня экспрессии или активности в крови интерферона альфа у пациента в течение лечения.
В некоторых вариантах осуществления ингибитор интерферона альфа может быть, например, выбран из группы, состоящей из полипептида, аналога полипептида, нуклеиновой кислоты, аналога нуклеиновой кислоты и низкомолекулярного соединения. Ингибитор может, например, ингибировать экспрессию клеткой интерферона альфа или рецептора интерферона альфа. Ингибитор может, например, ингибировать активность интерферона альфа или белка рецептора интерферона альфа.
В некоторых вариантах осуществления ингибитор интерферона альфа связывается с интерфероном альфа. В некоторых вариантах осуществления ингибитор интерферона альфа связывается с рецептором интерферона альфа. Например, в некоторых вариантах осуществления ингибитор интерферона альфа представляет собой антитело (или его антигенсвязывающий фрагмент), который связывается с интерфероном альфа или с рецептором интерферона альфа. Антитело может быть моноклональным антителом. Антитело или его антигенсвязывающий фрагмент могут быть, например, выбраны из группы, состоящей из гуманизированного антитела, рекомбинантного антитела, диатела, химеризованного или химерного антитела, деиммунизованного антитела человека, полностью человеческого антитела, одноцепочечного антитела, фрагмента Fv, фрагмента Fd, фрагмента Fab, фрагмента Fab' и фрагмента F(ab')2.
Еще в одном аспекте изобретение относится к промышленному изделию, которое содержит контейнер с этикеткой и композицию, содержащую ингибитор интерферона альфа, где этикетка указывает, что композиция предназначена для введения человеку с болезнью Дего, с подозрением на болезнь Дего или подверженному риску развития болезни Дего. Ингибитор интерферона альфа может быть, например, любым ингибитором интерферона альфа, описываемым в настоящем документе, таким как антитело или его антигенсвязывающий фрагмент, который связывается с интерфероном альфа или с рецептором интерферона.
В некоторых вариантах осуществления промышленное изделие включает одно или более дополнительных активных средств, в качестве неограничивающих примеров, таких как, одно или несколько противовоспалительных средств, антикоагулянты или антитромботические средства.
В некоторых вариантах осуществления способы, описываемые в настоящем документе, могут включать в себя введение (либо в качестве отдельного средства или в комбинации с ингибитором комплемента и/или ингибитором интерферона альфа) терапии, направленной на В-клетки. Например, изобретение относится к способу лечения или предупреждения болезни Дего, способу, включающему введение пациенту с болезнью Дего, с подозрением на болезнь Дего или подверженному риску развития болезни Дего терапевтически эффективного количества терапии, направленной на B-клетки. Терапия, направленная на B-клетки, может быть, например, анти-CD20 связывающим препаратом, в качестве неограничивающих примеров, таким как антитела против CD20. Типичные терапевтические антитела против CD20, которые одобрены для клинического применения или находятся на этапе клинической разработки, и которые можно использовать в способах, описываемых в настоящем документе, в качестве неограничивающих примеров включают, ритуксимаб (Biogen Idec), 90Y-ибритумомаб тиуксетан (Biogen Idec), 131I-тозитумомаб (GlaxoSmithKline), офатумумаб (Genmab), TRU-015 (Trubion), велтузумаб (IMMU-106; Immunomedics), окрелизумаб (Roche) и AME-133v (Applied Molecular Evolution). См., например, Levene et al. (2005), выше; Burge et al. (2008) Clin Ther 30(10): 1806-1816; Kausar et al. (2009) Expert Opin Biol Ther 9(7):889-895; Morschhauser et al. (2009) J Clin Oncol 27(20):3346-3353; и Milani and Castillo (2009) Curr Opin Mol Ther 11(2):200-207.
В другом примере, любые из способов, описываемых в настоящем документе, например, способы, в которых ингибитор комплемента и/или ингибитор интерферона альфа вводят пациенту с болезнью Дего, могут также включать в себя введение терапии, направленной на В-клетки, такой как антитело против CD20.
"Полипептид", "пептид" и "белок" используются взаимозаменяемо и означают любую цепь аминокислот, связанную пептидной связью, вне зависимости от длины или посттрансляционной модификации. Белки-компоненты комплемента, описываемые в настоящем документе (например, белки-компоненты комплемента C2, C3, C4 или C5) могут являться белками дикого типа, или содержать белки дикого типа, или могут представлять собой варианты, которые содержат не более чем 50 консервативных аминокислотных замен (например, не более чем одну, две, три, четыре, пять, шесть, семь, восемь, девять, десять, 12, 15, 20, 25, 30, 35, 40 или 50). Консервативные замены, как правило, включают замены в пределах следующих групп: глицин и аланин; валин, изолейцин и лейцин; аспарагиновая кислота и глутаминовая кислота; аспарагин, глутамин, серин и треонин; лизин, гистидин и аргинин; и фенилаланин и тирозин.
Белки компонентов комплемента человека, описываемые в настоящем документе, также включают в себя "антигенные пептидные фрагменты" белков, которые короче, чем полноразмерные незрелые (пре-про) белки, но сохраняют по меньшей мере 10% (например, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, по меньшей мере 99%, по меньшей мере 99,5% или 100% или более) от способности полноразмерного белка индуцировать антигенный ответ у млекопитающего. Например, антигенный пептидный фрагмент белка C5 может являться любым фрагментом белка, который меньше, чем полноразмерный незрелый белок и сохраняет по меньшей мере 10% от способности полноразмерного белка индуцировать антигенный ответ у млекопитающего. Антигенные пептидные фрагменты белка компонента комплемента включают в себя варианты белка с концевыми, а также внутренними делециями. В вариантах с делециями могут отсутствовать один, два, три, четыре, пять, шесть, семь, восемь, девять, десять, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных сегментов (из двух или более аминокислот) или несмежных одиночных аминокислот.Антигенные пептидные фрагменты могут быть длиной по меньшей мере 6 (например, по меньшей мере 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250, 300, 350, 400, 450, 500 или 600 или больше) аминокислотных остатков (например, по меньшей мере 6 смежных аминокислотных остатков в любом из SEQ ID NO: 1-11). В некоторых вариантах осуществления антигенный пептидный фрагмент белка компонента комплемента человека составляет менее чем 500 (например, менее чем 450, 400, 350, 325, 300, 275, 250, 225, 200, 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 95, 90, 85, 80, 75, 70, 65, 60, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7) аминокислотных остатков в длину (например, менее чем 500 смежных аминокислотных остатков в любом из SEQ ID NO: 1-11). В некоторых вариантах осуществления антигенный пептидный фрагмент полноразмерного незрелого белка компонента комплемента человека (препробелок C5) составляет по меньшей мере 6, но менее чем 500 аминокислотных остатков в длину.
В некоторых вариантах осуществления белок компонента С5 комплемента человека может иметь аминокислотную последовательность, которая идентична на 70% или более (например, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100) белку человека C5 с аминокислотной последовательностью, показанной в SEQ ID NO:1.
Процент идентичности (%) аминокислотной последовательности определяют как процентное содержание аминокислот в кандидатной последовательности, которые идентичны аминокислотам в референсной последовательности, после выравнивания последовательностей и, при необходимости, вставки пропусков для достижения максимального процента идентичности последовательностей. Выравнивание с целью определения процента идентичности последовательности можно проводить различными способами, которые известны специалистам в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Подходящие параметры для измерения выравнивания, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по полной длине сравниваемых последовательностей, можно определять известными способами.
Аминокислотные последовательности типичных белков C5 человека, а также их антигенных пептидных фрагментов, известны в данной области и представлены ниже.
Применяемый на всем протяжении настоящего изобретения, термин "антитело" относится к целой или интактной молекуле антитела (например, IgM, IgG, IgA, IgD или IgE), которую получают любым из ряда способов, известных в данной области и описанных в настоящем документе. Термин "антитело" включает в себя поликлональное антитело, моноклональное антитело, химеризованное или химерное антитело, гуманизированное антитело, деиммунизованное антитело человека и полностью человеческое антитело. Антитело можно производить или получать от любого из ряда видов, например, млекопитающих, таких как люди, не являющиеся человеком приматы (например, обезьяны, бабуины или шимпанзе), лошади, крупный рогатый скот, свиньи, овцы, козы, собаки, кошки, кролики, морские свинки, песчанки, хомяки, крысы и мыши. Антитело может представлять собой очищенное или рекомбинантное антитело.
Применяемый в настоящем документе термин "фрагмент антитела", "антигенсвязывающий фрагмент" или сходные термины относятся к фрагменту антитела, который сохраняет способность связываться с антигеном (например, белком компонента С5 комплемента), например, одноцепочечное антитело, одноцепочечный фрагмент Fv (scFv), фрагмент Fd, фрагмент Fab, фрагмент Fab' или фрагмент F(ab')2. Фрагмент scFv представляет собой единичную полипептиднаую цепь, которая содержит вариабельные области, как тяжелой, так и легкой цепей антитела, из которого получен scFv. Кроме того, диатела (Poljak (1994) Structure 2(12): 1121-1123; Hudson et al. (1999) J Immunol Methods 23(1-2): 177-189, содержание которых включено в настоящий документ в качестве ссылки в полном объеме) и интраантитела (Huston et al. (2001) Hum. Antibodies 10(3-4): 127-142; Wheeler et al. (2003) Mol Ther 8(3):355-366; Stocks (2004) Drug Discov Today 9(22): 960-966, содержание которых включено в настоящий документ в качестве ссылки в полном объеме), которые связываются с белком компонента комплемента (например, с компонентом С5 комплемента) можно включать в композиции, и применять в способах, описываемых в настоящем документе.
Если не определено иначе, все технические и научные термины, использованные в настоящем документе, имеют то же самое значение, как его обычно понимает специалист в данной области, к которой относится изобретение. В случае конфликта, настоящий документ, включая определения, будет иметь преимущество. Предпочтительные способы и материалы описаны ниже, хотя способы и материалы, сходные или эквивалентные описываемым в настоящем документе, также можно использовать в практическом осуществлении или тестировании способов и композиций по настоящему изобретению. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем документе, в полном объеме включены в качестве ссылки.
Другие отличительные признаки и преимущества настоящего изобретения, например, способы лечения или предупреждения болезни Дего, будут очевидны из последующего описания, примеров и формулы изобретения.
Подробное описание
Настоящее изобретение предлагает композиции, содержащие ингибитор комплемента человека (например, антитело, которое связывается с белком компонента С5 комплемента человека) и способы применения композиций для лечения или предупреждения болезни Дего. Типичные композиции (например, фармацевтические композиции и составы) и способы применения композиций разъяснены в деталях ниже и проиллюстрированы в демонстрационных примерах, не являясь в то же время никоим образом ограничивающими.
Каскад комплемента
Система комплемента действует совместно с другими иммунологическими системами организма для защиты против вторжения клеточных и вирусных патогенов. Существует, по меньшей мере, 25 белков комплемента, которые находятся в виде сложного набора белков плазмы и мембранных кофакторов. Плазменные белки составляют приблизительно 10% от глобулинов в сыворотке позвоночных. Компоненты комплемента выполняют свои защитные иммунные функции за счет взаимодействия в серии событий сложного, но точного энзиматического расщепления и связывания с мембраной. Образующийся каскад комплемента приводит к выработке продуктов с опсоническими, иммунорегуляторными и литическими функциями. Краткая сущность биологических активностей, связанных с активацией комплемента, представлена, например, в The Merck Manual, 16th Edition.
Каскад комплемента развивается по классическому пути, альтернативному пути или лектиновому пути. Эти пути имеют много общих компонентов, и в тоже время различаются по начальным этапам, они сходятся и имеют общие "терминальные компоненты" комплемента (с C5 до C9), ответственные за активацию и деструкцию клеток-мишеней.
Классический путь комплемента, как правило, инициируется за счет того, что антитело распознает антигенные участки на клетке-мишени и связывается с ними. Альтернативный путь может быть антителонезависимым, и может инициироваться определенными молекулами на поверхностях патогенов. Дополнительно, лектиновый путь, как правило, инициируется за счет связывания маннозо-связывающего лектина (MBL) с субстратами с высоким содержанием маннозы. Эти пути сходятся в точке, где компонент комплемента C3 расщепляется активной протеазой (разной для каждого пути) с образованием C3a и C3b. Другие пути, активирующие атаку комплемента, могут действовать позже в последовательности событий, приводя к различным аспектам функции комплемента.
C3a представляет собой анафилотоксин. C3b связывается с бактериальными и другими клетками, а также с определенными вирусами и иммунными комплексами, и помечает их для удаления из циркуляции (в этой роли C3b известен как опсонин). Полагают, что опсоническая функция C3b, в основном, является наиболее важным противоинфекционным действием системы комплемента. Пациенты с генетическими дефектами, которые блокируют функцию C3b, имеют склонность к заражению широким спектром патогенных организмов, в то время как обнаружено, что пациенты с дефектами, расположенными дальше в последовательности каскада комплемента, т.е., пациенты с повреждениями, которые блокируют функции C5, являются более предрасположенными только к инфицированию Neisseria, а помимо этого лишь немного более предрасположены к инфекциям.
C3b также формирует комплекс с другими компонентами, уникальный для каждого пути, с образованием классической или альтернативной конвертазы C5, которая расщепляет C5 на C5a и C5b. C3, таким образом, рассматривают как основной белок в последовательности реакций комплемента, поскольку он необходим как для альтернативного, так и для классического пути. Это свойство C3b регулируется сывороточной протеазой Фактор I, которая действует на C3b для получения iC3b. Сохраняя функции опсонина, iC3b не может образовывать активную конвертазу C5.
C5 представляет собой бета-глобулин, массой 190 кДа, который обнаруживается в нормальной сыворотке в концентрации приблизительно 75 мкг/мл (0,4 мкМ). C5 гликозилирован, приблизительно от 1,5 до 3 процентов его массы относится к углеводу. Зрелый C5 представляет собой гетеродимер из 999-аминокислотной альфа цепи, массой 115 кДа, которая соединена дисульфидной связью с 655-аминокислотной бета цепью, массой 75 кДа. C5 синтезируется в виде одноцепочечного предшественника белкового продукта однокопийного гена (Haviland et al. (1991) J Immunol 146:362-368). По кДНК последовательности транскрипта этого гена определяется секретируемый предшественник про-C5 из 1658 аминокислот с лидерной последовательностью из 18 аминокислот (см., например, патент США №6355245).
Предшественник про-C5 расщепляется после аминокислот 655 и 659, с получением бета цепи в качестве аминоконцевого фрагмента (аминокислотные остатки с+1 до 655 вышеуказанной последовательности) и альфа цепи в качестве карбоксиконцевого фрагмента (аминокислотные остатки с 660 до 1658 вышеуказанной последовательности), с четырьмя аминокислотами (аминокислотные остатки 656-659 вышеуказанной последовательности), удаленными между ними двумя.
C5a отщепляется от альфа цепи C5 при помощи альтернативной или классической конвертазы C5 в виде аминоконцевого фрагмента, который содержит первые 74 аминокислоты альфа цепи (т.е., аминокислотные остатки 660-733 вышеуказанной последовательности). Приблизительно 20 процентов из массы C5a в 11 кДа относится к углеводу. Участок расщепления для действия конвертазы находится в аминокислотном остатке 733 вышеуказанной последовательности или непосредственно прилегает к нему. Соединение, которое может связываться с этим участком расщепления или по соседству, будет потенциально блокировать доступ ферментов конвертаз C5 к участку расщепления и, таким образом, действовать как ингибитор комплемента.
C5 можно также активировать способами, иными чем активность конвертазы C5. Ограниченное расщепление трипсином (см., например, Minta and Man (1997) J Immunol 119:1597-1602 и Wetsel and Kolb (1982) J Immunol 128:2209-2216) и обработка кислотой (Yamamoto and Gewurz (1978) J Immunol 120:2008 и Damerau et al. (1989) Molec Immunol 26: 1133-1142) могут также расщеплять C5 и создавать активный C5b.
Расщепление C5 высвобождает C5a, мощный анафилотоксин и хемотаксический фактор, и приводит к образованию терминального литического комплекса комплемента, C5b-9. C5a и C5b-9 обладают также плейотропными способностями активации клеток, усиливая высвобождение последующих воспалительных факторов, таких как ферменты гидролиза, активные формы кислорода, метаболиты арахидоновой кислоты и различные цитокины.
C5b в сочетании с C6, C7 и C8 образует комплекс C5b-8 на поверхности клетки-мишени. После связывания нескольких молекул C9, образуется мембраноатакующий комплекс (МАК, C5b-9, терминальный комплекс комплемента, TCC). Когда достаточное число МАК внедряется в мембраны клеток-мишеней, МАК создают отверстия (поры МАК), которые опосредуют быстрый осмотический лизис клеток-мишеней. Низкие, не-литические концентрации МАК могут вызывать другие эффекты. В частности, внедрение в мембрану эндотелиальных клеток и тромбоцитов небольшого количества комплексов C5b-9 может вызывать вредоносную активацию клетки. В некоторых случаях активация может предшествовать клеточному лизису.
Как указано выше, C3a и C5a представляют собой анафилотоксины. Эти активированные компоненты комплемента могут являться триггером для дегрануляции тучной клетки с высвобождением гистамина из базофилов и тучных клеток, и других медиаторов воспаления, что приводит к сокращению гладких мышц, повышенной проницаемости сосудов, активации лейкоцитов и другим воспалительным явлениям, включая клеточную пролиферацию, которая приводит к гиперклеточности. C5a также выполняет функции хемотаксического пептида, который служит для привлечения провоспалительных гранулоцитов к участку активации комплемента.
Рецепторы C5a обнаружены на поверхности бронхиальных и альвеолярных эпителиальных клеток и гладкомышечных клеток бронхов. Рецепторы C5a также были обнаружены на эозинофилах, тучных клетках, моноцитах, нейтрофилах и активированных лимфоцитах.
Композиции
Композиции, описываемые в настоящем документе, могут содержать ингибитор комплемента человека. Любое соединение, которое связывается с любым из компонентов комплемента человека или иным способом блокирует образование и/или действие любого из компонентов комплемента человека, можно использовать по настоящему изобретению. Например, ингибитором комплемента может быть, например, низкомолекулярное соединение, нуклеиновая кислота или аналог нуклеиновой кислоты, пептидомиметик или макромолекула, которая не является нуклеиновой кислотой или белком. Эти вещества в качестве неограничивающих примеров включают малые органические молекулы, РНК-аптамеры, L-РНК-аптамеры, шпигельмеры, антисмысловые соединения, двухцепочечную РНК, малую интерферирующую РНК, ингибиторы в виде замкнутых нуклеиновых кислот и ингибиторы в виде пептидно-нуклеиновых кислот.В некоторых вариантах осуществления ингибитор комплемента может являться белком или белковым фрагментом.
В некоторых вариантах осуществления композиции содержат антитела, специфичные к компоненту комплемента человека. Некоторые соединения включают в себя антитела, направленные против компонентов комплемента C1, C2, C3, C4, C5 (или их фрагментов; см. ниже), C6, C7, C8, C9, фактора D, фактора B, фактора P, MBL, MASP-1 или MASP-2, таким образом, предупреждая образование анафилотоксической активности, связанной с C5a и/или предупреждая сборку мембраноатакующего комплекса (МАК), ассоциированную с C5b. В некоторых вариантах осуществления ингибитор комплемента ингибирует активность и/или сборку комплекса C5b-9. Например, в некоторых вариантах осуществления ингибитор представляет собой антитело или его антигенсвязывающий фрагмент, который связывается с одним из C6, C7, C8, C9 или C5b, и таким образом, предотвращает сборку и/или активность MAC.
Композиции могут также содержать природные или растворимые формы соединений, ингибирующих комплемент, таких как CR1, LEX-CR1, MCP, DAF, CD59, фактор H, фактор яда кобры, FUT-175, комплестатин и K76 COOH. Другие соединения, которые могут быть использованы для связывания или блокирования иным образом образования и/или активности любых компонентов комплемента человека, в качестве неограничивающих примеров включают белки, белковые фрагменты, пептиды, низкомолекулярные соединения, РНК-аптамеры, в том числе ARC 187 (который коммерчески доступен у Archemix Corporation, Cambridge, MA), L-РНК-аптамеры, шпигельмеры, антисмысловые соединения, ингибиторы сериновых протеаз, молекулы, которые могут быть использованы в РНК-интерференции (иРНК), такие как двухцепочечная РНК, в том числе малая интерферирующая РНК (миРНК), ингибиторы в виде замкнутых нуклеиновых кислот (ЗНК), ингибиторы в виде пептидно-нуклеиновых кислот (ПНК) и т.д.
В некоторых вариантах осуществления ингибитор комплемента ингибирует активацию комплемента. Например, ингибитор комплемента может связываться с С1 и ингибировать активность С1, связанную с активацией комплемента (например, C1q, C1r или C1s) или ингибитор комплемента может связываться с C2, C3 или C4 и ингибировать их (например, ингибировать расщепление). В некоторых вариантах осуществления ингибитор ингибирует формирование или сборку конвертазы C3 и/или конвертазы C5 в альтернативном и/или классическом пути комплемента. В некоторых вариантах осуществления ингибитор комплемента ингибирует терминальное соединение комплемента, например, образование мембраноатакующего комплекса C5b-9. Например, антитело-ингибитор комплемента может включать антитело против C5. Такие антитела против C5 могут взаимодействовать непосредственно с C5 и/или C5b, таким образом, ингибируя образование и/или физиологическую функцию C5b.
В некоторых вариантах осуществления композиции, описываемые в настоящем документе, могут содержать ингибитор компонента C5 комплемента человека (например, антитело, или его антигенсвязывающий фрагмент, который связывается с белком компонента С5 комплемента человека или его биологически активным фрагментом, таким как C5a или C5b). Применяемый в настоящем документе "ингибитор компонента С5 комплемента" представляет собой любое вещество, которое ингибирует: (i) экспрессию, или надлежащий внутриклеточный транспорт или секрецию клеткой белка компонента С5 комплемента; (ii) активность фрагментов расщепления C5-C5a или C5b (например, связывание C5a с его родственными клеточными рецепторами или связывание C5b с C6 и/или другими компонентами терминального комплекса комплемента; см. выше); (iii) расщепление белка C5 человека для образования C5a и C5b; или (iv) надлежащий внутриклеточный транспорт или секрецию клеткой белка компонента С5 комплемента. Ингибирование экспрессии белка компонента С5 комплемента включает: ингибирование транскрипции гена, кодирующего человеческий белок C5; повышенную деградацию мРНК, кодирующую человеческий белок C5; ингибирование трансляции мРНК, кодирующей человеческий белок C5; повышенную деградацию человеческого белка C5; ингибирование надлежащего процессинга препробелка C5 человека; или ингибирование надлежащего транспорта или секреции клеткой человеческого белка C5. Способы для определения, является ли кандидатное вещество ингибитором компонента C5 комплемента человека, известны в данной области и описаны в настоящем документе.
Ингибитор компонента C5 комплемента человека может представлять собой, например, низкомолекулярное соединение, полипептид, аналог полипептида, нуклеиновую кислоту, или аналог нуклеиновой кислоты.
Применяемый в настоящем документе термин "низкомолекулярное соединение" предназначен для обозначения вещества, которое имеет молекулярную массу, менее чем приблизительно 6 кДа и наиболее предпочтительно, менее чем приблизительно 2,5 кДа. Многие фармацевтические компании имеют обширные библиотеки химических и/или биологических смесей, содержащих массивы низкомолекулярных соединений, часто экстракты грибов, бактерий или водорослей, которые можно тестировать любыми способами по заявке. Эта заявка предполагает использование, в частности, малых химических библиотек, пептидных библиотек или коллекций природных продуктов. Tan et al. описали библиотеку более чем с двумя миллионами синтетических соединений, которые совместимы с миниатюризированными анализами на основе клеток (J Am Chem Soc (1998) 120:8565-8566). В пределах объема заявки находится то, что такую библиотеку можно использовать для скрининга на ингибиторы компонента C5 комплемента человека. Существуют многочисленные коммерчески доступные библиотеки соединений, такие как Chembridge DIVERSet. Библиотеки также доступны у академических исследователей, такие как Diversity set из программы развития терапии NCI. Можно также использовать рациональную разработку лекарственных препаратов. Например, рациональная разработка лекарственных препаратов может включать использование информацию о кристаллах или растворах белка компонента С5 комплемента человека. См., например, структуры, описанные в Hagemann et al. (2008) J Biol Chem 283(12):7763-75 и Zuiderweg et al. (1989) Biochemistry 28(1):172-85. Рациональную разработку лекарственных препаратов можно также проводить на основе известных соединений, например, известного ингибитора C5 (например, антитела или его антигенсвязывающего фрагмента, который связывается с белком компонента С5 комплемента человека).
Пептидомиметики представляют собой соединения, в которых по меньшей мере часть оригинального полипептида модифицирована, и трехмерная структура пептидомиметика остается по существу такой же, как и структура оригинального полипептида. Пептидомиметики могут быть аналогами оригинального полипептида по изобретению, которые являются, сами по себе, полипептидами, содержащими одну или несколько замен или других модификаций, внутри последовательности оригинального полипептида. Альтернативно, по меньшей мере часть последовательности оригинального полипептида может быть замещена не-пептидной структурой, таким образом, что трехмерная структура оригинального полипептида по существу сохранена. Другими словами, один, два или три аминокислотных остатка внутри последовательности оригинального полипептида могут быть замещены не-пептидной структурой. Кроме того, другие пептидные части оригинального полипептида могут быть замещены, но не обязательно, не-пептидной структурой. Пептидомиметики (как пептидные, так и не пептидные аналоги) могут обладать улучшенными свойствами (например, сниженным протеолизом, повышенным удержанием или повышенной биодоступностью). Пептидомиметики, в основном, имеют улучшенную пероральную доступность, что делает их особенно удобными для лечения нарушений у человека или животного. Следует отметить, что пептидомиметики могут иметь или не иметь сходные двухмерные химические структуры, но имеют общие трехмерные структурные черты и геометрию. Каждый пептидомиметик может дополнительно иметь один или несколько уникальных дополнительных связывающих элементов.
Ингибиторы синтеза нуклеиновых кислот можно использовать для снижения экспрессии эндогенного гена, например, гена, кодирующего компонент С5 комплемента человека. Антагонист нуклеиновой кислоты может представлять собой, например, миРНК, дцРНК, рибозим, создатель тройной спирали, аптамер или антисмысловую нуклеиновую кислоту. миРНК представляет собой малую двухцепочечную РНК (дцРНК), которая необязательно содержит липкие концы. Например, область дуплекса миРНК составляет приблизительно от 18 до 25 нуклеотидов в длину, например, приблизительно 19, 20, 21, 22, 23 или 24 нуклеотида в длину. Последовательности миРНК могут быть в некоторых вариантах осуществления полностью комплементарны мРНК-мишени. дцРНК и миРНК, в частности, можно использовать для выключения экспрессии гена в клетках млекопитающих (например, клетках человека). См., например, Clemens et al. (2000) Proc Natl Acad Sci USA 97:6499-6503; Billy et al. (2001) Proc Natl Acad Sci USA 98:14428-14433; Elbashir et al. (2001) Nature 411:494-8; Yang et al. (2002) Proc Natl Acad Sci USA 99:9942-9947, и публикации заявки на патент США 20030166282, 20030143204, 20040038278 и 20030224432. Антисмысловые агенты могут включать, например, приблизительно от 8 до приблизительно 80 нуклеиновых оснований (т.е. приблизительно от 8 до приблизительно 80 нуклеотидов), например, приблизительно от 8 до приблизительно 50 нуклеиновых оснований или приблизительно от 12 до приблизительно 30 нуклеиновых оснований. Антисмысловые соединения включают рибозимы, олигонуклеотиды (олигозимы) внешней вспомогательной последовательности (EGS) и другие короткие каталитические РНК или каталитические олигонуклеотиды, которые гибридизуются с нуклеиновой кислотой-мишенью и модулируют ее экспрессию. Антисмысловые соединения могут содержать участок по меньшей мере из восьми последовательных нуклеиновых оснований, которые комплементарны последовательности гена-мишени. Олигонуклеотид необязательно должен быть 100% комплементарен последовательности-мишени нуклеиновой кислоты для того, чтобы иметь возможность специфически гибридизоваться. Олигонуклеотид является специфически гибридизующимся, когда связывание олигонуклеотида с мишенью мешает нормальному функционированию молекулы-мишени, приводя к утрате полезности, и присутствует достаточная степень комплементарности для того, чтобы избегать неспецифического связывания олигонуклеотида с последовательностями, которые не являются мишенями, в условиях, при которых желательно специфическое связывание, т.е., в физиологических условиях в случае анализов in vivo или терапевтического лечения, или в случае анализов in vitro - в условиях, при которых проводят анализы. Гибридизация антисмысловых олигонуклеотидов с мРНК (например, мРНК, кодирующей белок С5 человека) может мешать одной или нескольким нормальным функциям мРНК. Функции мРНК, которые могут быть нарушены, включают все ключевые функции, такие как, например, транслокация РНК к месту трансляции белка, трансляция белка с РНК, сплайсинг РНК для получения одного или нескольких видов мРНК и каталитическая активность, в которую может быть вовлечена РНК. Связывание специфического белка (белков) с РНК также может нарушаться при гибридизации антисмыслового олигонуклеотида с РНК. Типичные антисмысловые соединения содержат последовательности ДНК или РНК, которые специфически гибридизуются с нуклеиновой кислотой-мишенью, например, мРНК, кодирующей белок компонента С5 комплемента человека. Область комплементарности может простираться приблизительно от 8 до приблизительно 80 нуклеиновых оснований. Соединения могут содержать одно или несколько модифицированных нуклеиновых оснований.
Модифицированные нуклеиновые основания могут включать, например, 5-замещенные пиримидины, такие как 5-йодоурацил, 5-йодоцитозин, и C5-пропинил пиримидины, такие как C5-пропинилцитозин и C5-пропинилурацил. Другие подходящие модифицированные нуклеиновые основания включают, например, 7-замещенные-8-аза-7-деазапурины и 7-замещенные-7-деазапурины, такие как, например, 7-йодо-7-деазапурины, 7-циано-7-деазапурины, 7-аминокарбонил-7-деазапурины. Примеры этих соединений включают 6-амино-7-йодо-7-деазапурины, 6-амино-7-циано-7-деазапурины, 6-амино-7-аминокарбонил-7-деазапурины, 2-амино-6-гидрокси-7-йодо-7-деазапурины, 2-амино-6-гидрокси-7-циано-7-деазапурины и 2-амино-6-гидрокси-7-аминокарбонил-7-деазапурины. См., например, патенты США №№4987071; 5116742; и 5093246; "Antisense RNA and DNA," D.A. Melton, Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. (1988); Haselhoff and Gerlach (1988) Nature 334:585-59; Helene, С (1991) Anticancer Drug D 6:569-84; Helene (1992) Ann NY Acad Sci 660:27-36; и Maher (1992) Bioassays 14:807-15.
Аптамеры представляют собой короткие олигонуклеотидные последовательности, которые можно использовать для распознавания и специфического связывания практически любой молекулы, в том числе белков клеточной поверхности. Процесс систематической эволюции лигандов при экспоненциальном обогащении (SELEX) является эффективным и может быть использован для легкой идентификации таких аптамеров. Аптамеры могут быть созданы для широкого спектра белков, важных для терапии и диагностики, таких как факторы роста и антигены клеточной поверхности. Эти олигонуклеотиды связываются со своими мишенями с аффинностью и специфичностью, сходными с антителами. См., например, Ulrich (2006) Handb Exp Pharmacol 173:305-326.
В некоторых вариантах осуществления ингибитор С5 человека представляет собой антитело, или его антигенсвязывающий фрагмент, который связывается с белком компонента С5 комплемента человека (далее в настоящем документе, антитело иногда может обозначаться как "антитело против C5").
В некоторых вариантах осуществления антитело против C5 связывается с эпитопом на белке-предшественнике про-C5 человека. Например, антитело против C5 может связываться с эпитопом на белке компонента С5 комплемента человека, содержащем или состоящем из аминокислотной последовательности, показанной в SEQ ID NO:1 (NCBI Accession No. AAA51925 и Haviland et al, выше).
"Эпитоп" относится к участку на белке (например, белке-компоненте С5 комплемента человека), с которым связывается антитело. "Перекрывающиеся эпитопы" содержат по меньшей мере один (например, два, три, четыре, пять или шесть) общий (общих) аминокислотный остаток (аминокислотных остатков).
В некоторых вариантах осуществления антитело против C5 связывается с эпитопом на белке-предшественнике про-С5 человека с отсутствием лидерной последовательности. Например, антитело против C5 может связываться с эпитопом на белке компонента С5 комплемента человека, содержащим или состоящим из аминокислотной последовательности, показанной в SEQ ID NO:2, которая представляет собой белок С5 человека без аминоконцевой лидерной последовательности.
В некоторых вариантах осуществления антитело против C5 может связываться с эпитопом в альфа цепи белка компонента С5 комплемента человека. Например, антитело против C5 может связываться с эпитопом внутри белка или перекрывающимся с белком, имеющим аминокислотную последовательность, показанную в SEQ ID NO:3, которая представляет собой альфа цепь белка компонента С5 комплемента человека. Антитела, которые связываются с альфа цепью C5 описаны, например, в Ames et al. (1994) J Immunol 152:4572-4581.
В некоторых вариантах осуществления антитело против C5 может связываться с эпитопом в бета цепи белка компонента С5 комплемента человека. Например, антитело против C5 может связываться с эпитопом внутри белка или перекрывающимся с белком, имеющим аминокислотную последовательность, показанную в SEQ ID NO:4, которая представляет собой бета цепь белка компонента С5 комплемента человека. Антитела, которые связываются с бета цепью С5, описаны, например, в Moongkarndi et al. (1982) Immunobiol 162:397; Moongkarndi et al. (1983) Immunobiol 165:323 и Mollnes et al. (1988) Scand J Immunol 28:307-312.
В некоторых вариантах осуществления антитело против C5 может связываться с эпитопом внутри антигенного пептидного фрагмента или перекрывающимся с антигенным пептидным фрагментом белка компонента С5 комплемента человека. Например, антитело против C5 может связываться с эпитопом внутри антигенного пептидного фрагмента или перекрывающимся с антигенным пептидным фрагментом белка компонента С5 комплемента человека фрагментом, содержащим или состоящим из следующей аминокислотной последовательности: 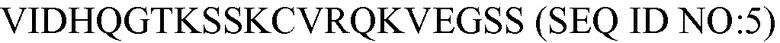 или
или 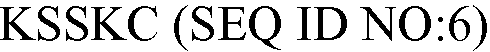 .
.
В некоторых вариантах осуществления антитело против C5 может связываться с эпитопом внутри фрагмента или перекрывающимся с фрагментом белка компонента С5 комплемента человека, фрагментом, содержащим или включающим любую из следующих аминокислотных последовательностей (которые представляют собой типичные антигенные фрагменты из SEQ ID NO:1):


Дополнительные типичные антигенные фрагменты компонента С5 комплемента человека описаны, например, в патенте США №6355245, описание которого включено в настоящий документ в качестве ссылки.
В некоторых вариантах осуществления антитело против C5 специфически связывается с белком компонента С5 комплемента человека (например, белком С5 человека с аминокислотной последовательностью, указанной в SEQ ID NO:1). Термины "специфическое связывание" или "специфически связывается" относятся к двум молекулам, образующим комплекс (например, комплекс между антителом и компонентом С5 комплемента человека), который является относительно стабильным при физиологических условиях. Как правило, связывание считают специфическим, если константа ассоциации (Ka) выше, чем 106 M-1. Таким образом, антитело может специфически связываться с белком C5 с Ka, по меньшей мере (или больше чем) 106 (например, по меньшей мере или больше 107, 108, 109, 1010, 1011, 1012, 1013, 1014 или 1015 или выше) M-1. Примеры антител, которые специфически связываются с белком компонента С5 комплемента человека, описаны, например, в патенте США №6355245, описание которого включено в настоящий документ в качестве ссылки в полном объеме.
Способы для определения того, связывается ли антитело с белковым антигеном, и/или определения аффинности антитела против белковому антигену, известны в данной области. Например, связывание антитела с белковым антигеном может быть выявлено и/или измерено количественно при помощи ряда способов, в качестве неограничивающих примеров, таких как, Вестерн-блоттинг, дот-блот, способ поверхностного плазмонного резонанса (например, система BIAcore; Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.), или твердофазный иммуноферментный анализ (ELISA). См., например, Harlow and Lane (1988) "Antibodies: A Laboratory Manual" Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Benny К. С.Lo (2004) "Antibody Engineering: Methods and Protocols", Humana Press (ISBN: 1588290921); Borrebaek (1992) "Antibody Engineering, A Practical Guide", W.H. Freeman and Co., NY; Borrebaek (1995) "Antibody Engineering", 2nd Edition, Oxford University Press, NY, Oxford; Johne et al. (1993) J Immunol Meth 160:191-198; Jonsson et al. (1993) Ann Biol Clin 51: 19-26; и Jonsson et al. (1991) Biotechniques 11:620-627. См. также патент США №6355245.
В некоторых вариантах осуществления антитело против C5 может перекрестно связываться с другим антителом, которое связывается с эпитопом внутри белка или перекрывающимся с белком компонента С5 комплемента человека. В некоторых вариантах осуществления антитело против C5 может перекрестно связываться с антителом, которое связывается с эпитопом внутри фрагмента или перекрывающимся с пептидным фрагментом белка компонента С5 комплемента человека. Пептидный фрагмент может представлять собой фрагмент белка компонента С5 комплемента человека, имеющий аминокислотную последовательность, показанную в любом из SEQ ID NO: 1-11. Например, пептидный фрагмент может содержать или состоять из следующей аминокислотной последовательности: 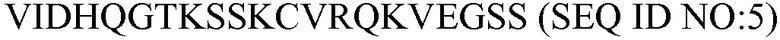 .
.
Применяемый в настоящем документе, термин "перекрестно связывающее антитело" относится к антителу, которое снижает уровень связывания антитела против C5 с эпитопом на белке компонента С5 комплемента человека по сравнению с уровнем связывания антитела против C5 с эпитопом в отсутствие антитела. Подходящие способы для определения того, будет ли первое антитело перекрестно связываться со вторым антителом к эпитопу, известны в данной области. Например, перекрестно связывающие антитела можно выявлять при помощи сравнения связывания 5G1.1 анти-C5 моноклонального антитела (вырабатывается гибридомной клеточной линией, обозначение ATCC HB-11625; см. патент США №6355245) в присутствии и отсутствии исследуемого антитела. Пониженное связывание антитела 5G1.1 в присутствии исследуемого антитела по сравнению со связыванием антитела 5G1.1 в отсутствие исследуемого антитела указывает на то, что исследуемое антитело является перекрестно связывающим антителом.
Способы для выявления эпитопа, с которым связывается конкретное антитело (например, антитело против C5), также известны в данной области. Например, эпитоп, связывающийся с антителом к C5, можно выявлять путем измерения связывания антитела с несколькими (например, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, 10, 15, 20 или 30 или более) перекрывающимися пептидными фрагментами белка компонента С5 комплемента (например, с несколькими перекрывающимися фрагментами белка, имеющего аминокислотную последовательность, указанную в любом из SEQ ID NO: 1-11). Каждый из различных перекрывающихся пептидов затем пришивают в уникальное место на твердой подложке, например, в раздельные лунки в мультилуночном планшете для анализа. Затем детально исследуют антитело против C5 посредством контактирования с каждым из пептидов в планшете для анализа при количестве времени и в условиях, которые позволяют антителу связаться со своим эпитопом. Несвязавшееся антитело против C5 удаляют путем промывания каждой лунки. Затем, детектируемо-меченое вторичное антитело, которое связывается с антителом к C5, если оно присутствует в лунке планшета, наносят в каждую лунку, и удаляют несвязавшееся вторичное антитело при помощи этапов отмывки. Наличие или количество выявляемого сигнала в лунке, вызванного детектируемо-меченым вторичным антителом, является указанием на то, что антитело против C5 связывается с конкретным пептидным фрагментом, ассоциированным с лункой. См., например, Harlow and Lane (выше), Benny K. C. Lo (выше) и публикацию патентной заявки США №20060153836, содержание которых в полном объеме включено в качестве ссылки. Конкретный эпитоп, с которым связывается антитело, можно также выявлять с использованием хроматографических методов BIAcore (см., например, Pharmacia BIAtechnology Handbook, "Epitope Mapping," Section 6.3.2, (May 1994); и Johne et al. (1993) J Immunol Methods 160:20191-8).
Антитела против C5, описываемые в настоящем документе, могут проявлять активность, блокируя образование или действие активных фрагментов C5a и/или C5b белка компонента С5 комплемента (например, белка С5 человека). Посредством этого блокирующего эффекта антитела против C5 ингибируют, например, провоспалительные эффекты C5a и образование мембраноатакующего комплекса (МАК) C5b-9 на поверхности клетки. Антитела против C5, которые обладают способностью блокировать образование C5a, описаны, например, в Moongkarndi et al. (1982) Immunobiol 162:397 и Moongkarndi et al. (1983) Immunobiol 165:323.
В некоторых вариантах осуществления антитело против C5 или его антигенсвязывающий фрагмент может снижать способность белка C5 связываться с компонентом C3b комплемента человека (например, C3b, присутствующим на C5-конвертазном комплексе классического пути или альтернативного пути) на более чем 50% (например, более чем 55, 60, 65, 70, 75, 80, 85, 90 или 95 или более). В некоторых вариантах осуществления после связывания с белком C5, антитело против C5 или его антигенсвязывающий фрагмент может снижать способность белка C5 связываться с компонентом C4b комплемента (например, C4b, присутствующим в конвертазе C5 классического пути) на более чем 50% (например, более чем 55, 60, 65, 70, 75, 80, 85, 90 или 95 или более). Способы для выявления, может ли антитело блокировать образование или действие активных фрагментов C5a и/или C5b белка компонента С5 комплемента, или связывание с компонентами C4b или C3b комплемента, известны в данной области и описаны, например, в патенте США №6355245 и Wurzner et al. (1991) Complement Inflamm 8:328-340.
В некоторых вариантах осуществления антитело против C5 связывается с аминоконцевой областью альфа цепи белка-компонента С5 комплемента, но не связывается со свободным C5a. Эпитопы для антитела против C5 внутри аминоконцевой области альфа-цепи включают, например, эпитопы внутри последовательности человека VIDHQGTKSSKCVRQKVEGSS (SEQ ID NO:5).
В некоторых вариантах осуществления композиция содержит и/или антитело представляет собой экулизумаб (Soliris®; Alexion Pharmaceuticals, Inc., Cheshire, CT). (См., например, Kaplan (2002) Curr Opin Investig Drugs 3(7): 1017-23; Hill (2005) Clin Adv Hematol Oncol 3(11):849-50; и Rother et al. (2007) Nature Biotechnology 25(11):1256-1488).
В некоторых вариантах осуществления композиция содержит и/или антитело представляет собой пекселизумаб (Alexion Pharmaceuticals, Inc., Cheshire, CT). См., например, Whiss (2002) Curr Opin Investig Drugs 3(6): 870-7; Patel et al. (2005) Drugs Today (Barc) 41(3):165-7O; и Thomas et al. (1996) Mol Immunol 33(17-18): 1389-401.
В некоторых вариантах осуществления ингибитор С5 представляет собой антитело, которое связывается с C5a (в настоящем документе иногда называемое как "антитело против C5a"). В некоторых вариантах осуществления антитело связывается с C5a, но не с полноразмерным C5. Как указано выше, про-форма C5, белок-предшественник из 1676 аминокислотных остатков, процессируется посредством серий протеолитического расщепления. Первые 18 пептидов (нумеруются от -18 к -1) составляют сигнальный пептид, который отщепляется от белка-предшественника. Белок из оставшихся 1658 аминокислот расщепляется в двух местах для формирования альфа и бета цепей. Первое расщепление происходит между аминокислотными остатками 655 и 656. Второе расщепление происходит между аминокислотными остатками 659 и 660. Два расщепления приводят к образованию трех отдельных полипептидных фрагментов: (i) фрагмент, содержащий аминокислоты с 1 до 655, обозначаемый как бета цепь; (ii) фрагмент, содержащий аминокислоты с 660 до 1658, обозначаемый как альфа цепь; и (iii) тетрапептидный фрагмент, состоящий из аминокислот с 656 до 659. Полипептидные фрагменты альфа цепи и бета цепи соединены друг с другом посредством дисульфидной связи и образуют зрелый белок C5. Конвертаза С5 классического пути или альтернативного пути активирует зрелый C5 путем расщепления альфа цепи между остатками 733 и 734, что приводит к высвобождению фрагмента C5a (аминокислоты с 660 до 733). Оставшаяся часть зрелого C5 представляет собой фрагмент C5b, который содержит остатки альфа цепи с 734 по 1658, соединенные дисульфидной связью с бета цепью.
In vivo, C5a быстро метаболизируется сывороточным ферментом, карбоксипептидазой B, до формы из 73 аминокислот, которая называется "C5a des-Arg" и у которой отсутствует карбоксиконцевой остаток аргинина. Таким образом, в некоторых вариантах осуществления антитело, которое связывается с C5a, также связывается с C5a, лишенным аргинина. В некоторых вариантах осуществления антитело, которое связывается с C5a, не связывается с C5a, лишенным аргинина.
В некоторых вариантах осуществления ингибитор С5 представляет собой антитело, которое связывается с неоэпитопом, присутствующим в C5a, т.е., эпитопом, который появляется на поверхности после высвобождения C5a из фрагмента альфа цепи зрелого C5. Антитела, которые связываются с C5a (например, с неоэпитопом, присутствующим в C5a) известны в данной области, также как и способы производства таких антител. Например, антитело, которое связывается с C5a, может иметь специфичность связывания антитела, специфичного к неоэпитопу C5a, которое описано, например, в любой из публикаций PCT №WO 01/15731; Ames et al. (1994) J Immunol 152(9):4572-4581; Inoue (1989) Complement Inflamm 6(3):219-222; и патенте США №6866845. В другом примере, антитело, которое связывается с C5a, может иметь специфичность связывания коммерческого антитела, специфичного к неоэпитопу C5a, в качестве неограничивающих примеров, такого как, sc-52633 (Santa Cruz Biotechnology, Inc., Santa Cruz, California), 152-1486 (BD Pharmingen/BD Biosciences), ab11877 (Abcam, Cambridge, Massachusetts), и HM2079 (clone 2952; HyCult Biotechnology, the Netherlands). В других вариантах осуществления, антитело, которое связывается с C5a, может перекрестно связываться с любым из указанных выше антител, специфичных к неоэпитопу C5a.
В некоторых вариантах осуществления ингибитор С5 может представлять собой антитело, которое связывается с белком C5a млекопитающего (например, человека). Например, антитело может связываться с белком C5a человека, имеющим следующую аминокислотную последовательность: 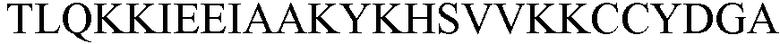
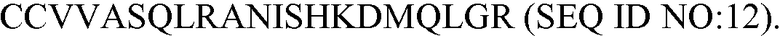
Антитело может связываться с C5a человека с эпитопом внутри аминокислотной последовательности или перекрывающимся с аминокислотной последовательностью:

В некоторых вариантах осуществления антитело может связываться с белком C5a человека или его фрагментом, включающим аминокислотную последовательность, которая содержит или состоит из по меньшей мере четырех (например, по меньшей мере четырех, пяти, шести, семи, восьми, девяти, 10, 11, 12, 13, 14, 15, 16, или 17 или более) последовательных аминокислот, показанных в любом из SEQ ID NO: 12-25. Дополнительные белковые фрагменты C5a, с которыми может связываться антитело, описываемое в настоящем документе, и способы создания подходящих специфичных к C5a антигенсвязывающих участков изложены, например, в патенте США №4686100, описание которого включено в настоящий документ в качестве ссылки в полном объеме.
В некоторых вариантах осуществления связывание антитела с C5a может ингибировать биологическую активность C5a. Способы для измерения активности C5a включают, например, анализы хемотаксиса, радиоиммунный анализ или твердофазный иммуноферментный анализ (см., например, Ward and Zvaifler (1971) J Clin Invest 50(3):606-16 и Wurzner et al. (1991) Complement Inflamm 8:328-340). В некоторых вариантах осуществления связывание антитела с C5a может ингибировать взаимодействие между C5a и C5aR1. Подходящие способы для выявления и/или измерения взаимодействия между C5a и C5aR1 (в присутствии и отсутствии антитела) известны в данной области и описаны, например, в Mary and Boulay (1993) Eur J Haematol 51(5):282-287; Kaneko et al. (1995) Immunology 86(1): 149-154; Giannini et al. (1995) J Biol Chem 270(32): 19166-19172; и публикации патентной заявки США №20060160726. Например, связывание детектируемо-меченого (например, радиоактивно меченого) C5a с мононуклеарными клетками периферической крови, экспрессирующими C5aR1, можно оценивать в присутствии и отсутствии антитела. Уменьшение количества детектируемо-меченого C5a, который связывается с C5aR1 в присутствии антитела, по сравнению с количеством связывания в отсутствие антитела, является указанием на то, что антитело ингибирует взаимодействие между C5a и C5aR1. В некоторых вариантах осуществления связывание антитела с C5a может ингибировать взаимодействие между C5a и C5L2 (см. ниже). Способы для выявления и/или измерения взаимодействия между C5a и C5L2 известны в данной области и описаны, например, в Ward (2009) J Mol Med 87(4):375-378 и Chen et al. (2007) Nature 446(7132):203-207 (см. ниже).
В некоторых вариантах осуществления ингибитор С5 представляет собой антитело, которое связывается с C5b (в настоящем документе иногда называемое как "антитело против C5b"). В некоторых вариантах осуществления антитело связывается с C5b, но не связывается с полноразмерным C5. Структура C5b описана выше, и также подробно описана, например, в Muller-Eberhard (1985) Biochem Soc Symp 50:235-246; Yamamoto and Gewurz (1978) J Immunol 120(6):2008-2015; и Haviland et al. (1991), выше. Как описано выше, C5b в сочетании с C6, C7 и C8 образует комплекс C5b-8 на поверхности клетки-мишени. Промежуточные соединения белкового комплекса, образующиеся во время серии комбинаций, включают C5b-6 (включает C5b и C6), C5b-7 (включает C5b, C6 и C7) и C5b-8 (включает C5b, C6, C7 и C8). После связывания нескольких молекул C9, формируется мембраноатакующий комплекс (МАК, C5b-9 терминальный комплекс комплемента (TCC)). Когда достаточное число МАК внедряется в мембраны клеток-мишеней, МАК создают отверстия (поры МАК), которые опосредуют быстрый осмотический лизис клеток-мишеней.
В некоторых вариантах осуществления связывание антитела с C5b может ингибировать взаимодействие между C5b и C6. В некоторых вариантах осуществления связывание антитела с C5b может ингибировать сборку или активность C5b-9 MAC-TCC. В некоторых вариантах осуществления связывание антитела с C5b может ингибировать комплемент-зависимый лизис клетки (например, in vitro и/или in vivo). Подходящие способы для оценки, ингибирует ли антитело комплемент-зависимый лизис, включают, например, анализы гемолиза или другие функциональные анализы для выявления активности растворимого C5b-9. Например, снижение способности комплемента лизировать клетки в присутствии антитела можно измерять при помощи анализа гемолиза, описанного Kabat and Mayer (eds.), "Experimental Immunochemistry, 2nd Edition", 135-240, Springfield, IL, CC Thomas (1961), страницы 135-139, или общепринятого варианта этого анализа, такого как способ гемолиза эритроцитов курицы, как описано, например, в Hillmen et al. (2004) N Engl J Med 350(6): 552.
Антитела, которые связываются с C5b, а также способы для создания таких антител известны в данной области. См., например, патент США №6355245. Коммерчески доступные анти-C5b антитела доступны у ряда поставщиков, в том числе, например, у Hycult Biotechnology (каталожный номер: HM2080; клон 568) и Abcam™ (ab46151 или ab46168).
В некоторых вариантах осуществления ингибитор C5 представляет собой антитело, которое связывается с формой C5b млекопитающего (например, человека). Например, антитело может связываться с частью белка C5b человека, имеющей следующую аминокислотную последовательность:

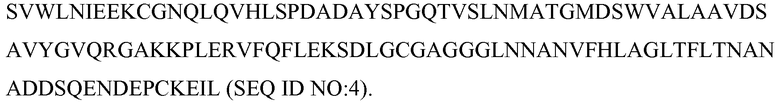
В некоторых вариантах осуществления антитело может связываться с частью белка C5b человека, имеющей следующую аминокислотную последовательность:


В некоторых вариантах осуществления антитело может связываться с белком C5b человека, или его фрагментом, содержащим аминокислотную последовательность, которая включает или состоит из по меньшей мере четырех (например, по меньшей мере четырех, пяти, шести, семи, восьми, девяти, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 или более) последовательных аминокислот, указанных в SEQ ID NO:4 или SEQ ID NO:26.
Дополнительные типичные субфрагменты C5b или C5a человека, с которыми может связываться антитело-ингибитор С5, описаны, например, в патенте США №6355245, описание которого включено в настоящий документ в качестве ссылки.
В некоторых вариантах осуществления ингибитор представляет собой антитело, которое специфически связывается с полипептидом C5a (например, полипептидом C5a человека, имеющим аминокислотную последовательность, показанную в SEQ ID NO: 12). В некоторых вариантах осуществления ингибитор представляет собой антитело, которое специфически связывается с полипептидом C5b.
Способы для выявления, является ли конкретное вещество ингибитором компонента С5 комплемента человека, описаны в настоящем документе и известны в данной области. Например, концентрацию и/или физиологическую активность C5a и C5b в жидкостях организма можно измерять при помощи способов, хорошо известных в данной области. Способы для измерения концентрации или активности C5a включают, например, анализы хемотаксиса, радиоиммунный анализ или твердофазный иммуноферментный анализ (см., например, Ward and Zvaifler (1971) J Clin Invest 50(3):606-16 и Wurzner et al. (1991) Complement Inflamm 8:328-340). Для C5b можно использовать анализы гемолиза или анализы для растворимого C5b-9, как обсуждалось в настоящем документе. Также можно использовать другие анализы, известные в данной области. При помощи этих анализов или других подходящих видов анализов можно отбирать кандидатные вещества, способные ингибировать компонент С5 комплемента человека, такие как антитело против C5, для того чтобы, например, выявить соединения, которые пригодны для способов, описываемых в настоящем документе, и определить подходящие уровни дозировки таких соединений.
Способы для выявления ингибирования экспрессии мРНК или белка (например, ингибирования экспрессии белка С5 человека или экспрессии мРНК, кодирующей белок С5 человека) хорошо известны в данной области молекулярной биологии и включают, например, способы Нозерн блоттинга и ОТ-ПЦР (или количественную ОТ-ПЦР) для детекции мРНК и способы Вестерн-блоттинга, дот блота или ELISA для детекции белка. См., например, Sambrook et al. (1989) "Molecular Cloning: A Laboratory Manual, 2nd Edition," Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.
Способы для определения того, ингибирует ли кандидатное соединение расщепление С5 человека на формы C5a и C5b, известны в данной области и описаны, например, в Moongkarndi et al. (1982) Immunobiol 162:397; Moongkarndi et al. (1983) Immunobiol 165:323; Isenman et al. (1980) J Immunol 124(1):326-31; Thomas et al. (1996) Mol Immunol 33(1748): 1389-401; и Evans et al. (1995) Mol Immunol 32(16):1183-95.
Ингибирование компонента С5 комплемента человека может также снижать способность комплемента лизировать клетки в жидкостях организма индивидуума. Такое наличие снижения способности комплемента лизировать клетки можно измерять способами, хорошо известными в данной области, такими как, например, общепринятый анализ гемолиза, такой как анализ гемолиза, описанный Kabat and Mayer (eds), "Experimental Immunochemistry, 2nd Edition," 135-240, Springfield, IL, CC Thomas (1961), страницы 135-139, или общепринятый вариант этого анализа, такой как способ гемолиза эритроцитов курицы, как описано, например, в Hillmen et al. (2004) N Engl J Med 350(6):552.
В некоторых вариантах осуществления композиции, описываемые в настоящем документе, могут содержать ингибитор интерферона альфа. Любое соединение, которое связывается или иным способом блокирует образование и/или активность интерферона альфа, может быть использовано по настоящему изобретению. Например, ингибитор интерферона альфа может представлять собой, например, низкомолекулярное соединение, нуклеиновую кислоту или аналог нуклеиновой кислоты (например, миРНК, дцРНК, рибозим, создатель тройной спирали, аптамер), пептидомиметик или макромолекулу, которая не является нуклеиновой кислотой или белком. Эти вещества в качестве неограничивающих примеров включают малые органические молекулы, РНК аптамеры, L-РНК аптамеры, шпигельмеры, антисмысловые соединения, двухцепочечную РНК, малую интерферирующую РНК, ингибиторы в виде замкнутых нуклеиновых кислот, и ингибиторы в виде пептидно-нуклеиновых кислот.В некоторых вариантах осуществления ингибитор интерферона альфа может быть белком или белковым фрагментом. В некоторых вариантах осуществления ингибитор интерферона альфа представляет собой ингибитор рецептора (рецептора интерферона альфа), с которым связывается интерферон альфа. Рецептор интерферона альфа человека описан, например, в Novick et al. (1994) Cell 77(3):391-400; Chill et al. (2003) Structure 11(7):791-802; и Uze et al. (2007) Curr Top Microbiol Immunol 316:71-95. В некоторых вариантах осуществления, ингибитор интерферона альфа связывается с интерфероном альфа или его рецептором и ингибирует взаимодействие между интерфероном альфа и его рецептором.
В некоторых вариантах осуществления ингибитор интерферона альфа представляет собой антитело или его антигенсвязывающий фрагмент, который связывается с белком интерферона альфа. (Далее в настоящем документе, антитело может иногда обозначаться как "антитело против интерферона альфа") Типичные антитела против интерферона альфа известны в данной области и описаны, например, в публикациях патентных заявок США 20090324605, 20070059309 и 20080160030; патентах США 7087726 и 4423147, содержание которых включено в настоящий документ в качестве ссылки в полном объеме.
Дополнительные типичные антитела против интерферона альфа, которые можно использовать в композициях и способах, описываемых в настоящем документе, включают, например, MEDI-545 (MDX-1103; AstraZeneca/Medimmune).
Способы для получения антитела
Подходящие способы для получения антитела (например, антитела против C5 или антитела против интерферона альфа) или его антигенсвязывающих фрагментов в соответствии с настоящим изобретением, известны в данной области (см., например, патент США №6355245) и описаны в настоящем документе. Например, моноклональные антитела против C5 можно получать с использованием клеток, экспрессирующих компонент С5 комплемента, полипептид C5 или антигенный фрагмент полипептида C5 в качестве иммуногена, таким образом, наращивая иммунный ответ у животных, от которых могут быть выделены антителопродуцирующие клетки и в свою очередь моноклональные антитела. Можно определить последовательность таких антител, и антител или их вариантов, полученных рекомбинантными способами. Рекомбинантные способы можно использовать для получения химерных, CDR-привитых, гуманизированных и полностью человеческих антител на основе последовательности моноклональных антител, а также полипептидов, способных связываться с компонентом С5 комплемента человека. Сходно, моноклональные антитела против интерферона альфа можно получать с использованием полипептида интерферона альфа или антигенного фрагмента полипептида интерферона альфа в качестве иммуногена, таким образом, наращивая иммунный ответ у животных, от которых могут быть выделены антителопродуцирующие клетки и в свою очередь моноклональные антитела.
Кроме того, антитела, полученные из рекомбинантных библиотек ("фаговые антитела") можно выбирать с использованием антигенных полипептидов, таких как белок-компонент комплемента или интерферон альфа, в качестве приманки для выделения антител или полипептидов на основе их специфичности к мишени. Выработка и выделение не принадлежащих человеку и химерных антител находятся в компетенции специалистов в данной области.
Можно использовать технологию рекомбинантных ДНК для модифицирования одной или нескольких характеристик антител, полученных в клетках, не принадлежащих человеку. Таким образом, химерные антитела могут быть сконструированы для того, чтобы уменьшить их иммуногенность при диагностическом и терапевтическом применении. Кроме того, иммуногенность можно минимизировать путем гуманизации антител посредством прививки CDR и, необязательно, модификации каркаса. См., патенты США №№5225539 и 7393648, содержание которых включено в настоящий документ в качестве ссылки.
Антитела можно получать из сыворотки животного или, в случае моноклональных антител или их фрагментов, производить в клеточной культуре. Можно использовать технологию рекомбинантных ДНК для производства антител согласно общепринятой процедуре, включая процедуры в бактериальной клеточной культуре или, предпочтительно, клеточной культуре млекопитающего. Выбранная система культивирования клеток предпочтительно секретирует в виде продукта антитело.
В другом варианте осуществления способ для производства антитела, описываемого в настоящем документе, включает культивирование клетки-хозяина, например, E.coli или клетки млекопитающего, которая трансформирована при помощи гибридного вектора. Вектор содержит одну или несколько экспрессирующих кассет, включающих в себя промотор, функционально связанный с первой последовательностью ДНК, кодирующей сигнальный пептид, который связан в надлежащей рамке считывания со второй последовательностью ДНК, кодирующей белок антитела. Белок антитела затем собирают и выделяют.Необязательно, экспрессирующая кассета может содержать промотор, функционально связанный с полицистронными (например, бицистронными) последовательностями ДНК, кодирующими белки антитела, каждая из которых индивидуально функционально связана с сигнальным пептидом в надлежащей рамке считывания.
Мультипликацию гибридомных клеток или клеток-хозяев млекопитающих in vitro проводят в подходящих средах для культивирования, которые включают общепринятые стандартные среды для культивирования (такие как, например, модифицированная Дульбекко среда Игла (DMEM) или среда RPMI 1640), необязательно дополненные сывороткой млекопитающих (например, эмбриональной телячьей сывороткой), или микроэлементами и добавками для поддержания роста (например, питающими клетками, такими как, клетки перитонеального экссудата нормальной мыши, клетки селезенки, макрофаги костного мозга, 2-аминоэтанолом, инсулином, трансферрином, липопротеином низкой плотности, олеиновой кислотой или т.п.). Мультипликацию клеток-хозяев, которые представляют собой бактериальные клетки или дрожжевые клетки, осуществляют аналогичным образом в подходящих средах для культивирования, известных в данной области. Например, подходящие среды для культивирования бактерий включают среду LE, NZCYM, NZYM, NZM, Terrific Broth, SOB, SOC, 2 x YT, или минимальную среду M9. Подходящие среды для культивирования дрожжей включают среду YPD, YEPD, минимальную среду или полную минимальную среду без одного компонента.
Производство in vitro обеспечивает относительную чистоту препаратов антитела и позволяет расширять производство для получения большого количества желаемых антител. Способы для культивирования бактериальной клетки, дрожжей, растений или клетки млекопитающего известны в данной области и включают в себя культивирование в гомогенной суспензии (например, в аэролифтном реакторе или в реакторе с непрерывным помешиванием) и культивирование иммобилизированных или захваченных клеток (например, в полых волокнах, микрокапсулах, на агарозных микрогранулах или керамических картриджах).
Большие количества желаемых антител можно также получить путем мультипликации клеток млекопитающих in vivo. Для этой цели, гибридомные клетки, производящие желаемые антитела, инъецируют гистосовместимым млекопитающим для того, чтобы вызвать рост антителопродуцирующих опухолей. Необязательно, животных перед инъекцией примируют при помощи углеводорода, в частности, минеральных масел, таких как пристан (тетраметил-пентадекан). Через одну-три недели выделяют антитела из жидкостей организма этих млекопитающих. Например, гибридомные клетки, полученные путем слияния подходящих миеломных клеток с антителопродуцирующими клетками селезенки от мышей Balb/c или трансфицированные клетки, полученные из гибридомной клеточной линии Sp2/0, которые вырабатывают желаемые антитела, инъецируют интраперитонеально мышам Balb/c необязательно с предварительной обработкой пристаном. Через одну-две недели забирают у животных асцитную жидкость.
Вышеуказанные и другие способы обсуждаются, например, в Kohler and Milstein, (1975) Nature 256:495-497; патенте США №4376110; Harlow and Lane, Antibodies: a Laboratory Manual, (1988) Cold Spring Harbor, содержание которых включено в настоящий документ в качестве ссылки. Способы для получения молекул рекомбинантных антител описаны в вышеуказанных ссылках и также, например, в: WO97/08320; патенте США №5427908; патенте США №5508717; Smith (1985) Science 225:1315-1317; Parmley and Smith (1988) Gene 73:305-318; De La Cruz et al. (1988) Journal of Biological Chemistry 263:4318-4322; патенте США №5403484; патенте США №5223409; WO88/06630; WO92/15679; патенте США №5780279; патенте США №5571698; патенте США №6040136; Davis et al. (1999) Cancer Metastasis Rev 18(4):421-5; и Taylor et al. (1992) Nucleic Acids Research 20: 6287-6295; Tomizuka et al. (2000) Proc Natl Acad Sci USA 97(2): 722-727, содержание которых включено в настоящий документ в качестве ссылки в полном объеме.
Проводят скрининг супернатантов клеточных культур на желаемые антитела посредством, например, иммуноблоттинга иммуноферментного анализа, например, сэндвич-анализа или дот-анализа или радиоиммунологического анализа.
Для выделения антител можно концентрировать иммуноглобулины в культуральных супернатантах или асцитной жидкости, например, при помощи осаждения с сульфатом аммония, диализа через гигроскопичный материал, такой как полиэтиленгликоль, фильтрации через селективные мембраны или т.п.При необходимости и/или по желанию антитела очищают путем общеизвестных способов хроматографии, например, гель-фильтрацией, ионообменной хроматографией, хроматографией с DEAE-целлюлозой и/или (иммуно-) аффинной хроматографией, например, аффинной хроматографией с одним или несколькими поверхностными полипептидами, полученными из клеточной линии, экспрессирующей компонент С5 комплемента, или с Белком-A или -G.
Другой вариант осуществления относится к способу получения бактериальной клеточной линии, секретирующей антитела, направленные против белка (например, белка комплемента или интерферона альфа), в подходящем млекопитающем. Конструируют библиотеку фагового дисплея, произведенную иммунизированным кроликом, конструируют и сортируют по желаемым антителам в соответствии со способами, хорошо известными в данной области (такими как, например, способы, описанные в различных ссылках, включенных в настоящий документ в качестве ссылки).
Также известны гибридомные клетки, секретирующие моноклональные антитела. Предпочтительные гибридомные клетки являются генетически стабильными, секретируют моноклональные антитела желаемой специфичности, описываемые в настоящем документе, и их можно наращивать из культур, замороженных при низкой температуре, путем оттаивания и культивирования in vitro или в виде асцитов in vivo.
В другом варианте осуществления предлагается способ получения гибридомной клеточной линии, секретирующей моноклональные антитела против интересующего белка (например, белка С5 или интерферона альфа). В этом способе, подходящее млекопитающее, например, мышь Balb/c, иммунизируют одним или несколькими интересующими полипептидными антигенами или их антигенными фрагментами. Антителопродуцирующие клетки от иммунизированного млекопитающего выращивают в течение короткого периода в культуре или сливают с клетками подходящей клеточной линии миеломы. Гибридные клетки, полученные при слиянии, клонируют, и отбирают клеточные клоны, секретирующие желаемые антитела. Способы получения гибридомной клеточной линии включают иммунизацию мышей Balb/c путем неоднократной подкожной и/или интраперитонеальной инъекции иммуногенной композицией, которая содержит интересующий белок (или его иммуногенный фрагмент), например, от четырех до шести раз, через несколько месяцев, например, в промежутке между двумя и четырьмя месяцами. У иммунизированных мышей забирают клетки селезенки через 2-4 дня после последней инъекции и сливают с клетками клеточной линии миеломы PAI в присутствии стимулятора слияния, предпочтительно полиэтиленгликоля. Предпочтительно, миеломные клетки сливают с 3-20-кратным избытком клеток селезенки от иммунизированных мышей в растворе, содержащем приблизительно от 30% до приблизительно 50% полиэтиленгликоля с молекулярной массой приблизительно 4000. После слияния клетки наращивают в подходящих средах для культивирования, как описано выше, дополненных средой для селекции, например, средой HAT, через равные интервалы времени для того, чтобы предотвратить зарастание желаемых гибридомных клеток нормальными миеломными клетками.
Антитела и их фрагменты могут быть "химерными". Химерные антитела и их антигенсвязывающие фрагменты содержат части от двух или более различных видов (например, мыши и человека). Химерные антитела можно получать с использованием мышиных вариабельных областей с желаемой специфичностью, сращенных с генетическими сегментами константного домена человека (например, патент США №4816567). Таким образом, не принадлежащие человеку антитела можно модифицировать, чтобы сделать их более подходящими для клинического применения у человека (например, для способов лечения или предупреждения болезни Дего у человека).
Моноклональные антитела по настоящему изобретению включают "гуманизированные" формы не принадлежащих человеку (например, мышиных) антител. Гуманизированные или МАТ с привитым гипервариабельным участком особенно подходят в качестве терапевтических средств для людей, поскольку они не удаляются из циркуляции так быстро, как мышиные антитела и, как правило, не вызывают неблагоприятную иммунную реакцию. Способы получения гуманизированных антител, в основном, хорошо известны в данной области. Например, гуманизацию преимущественно проводят согласно способу Winter и коллег {см., например, Jones et al.(1986) Nature 321:522-525; Riechmann et al. (1988) Nature 332:323-327; и Verhoeyen et al. (1988) Science 239: 1534-1536), путем замещения последовательностей CDR грызуна соответствующей последовательностью антитела человека. Также см., например, Staelens et al. (2006) Mol Immunol 43: 1243-1257. В некоторых вариантах осуществления гуманизированные формы не принадлежащих человеку (например, мышиных) антител представляют собой антитела человека (реципиентное антитело), в которых остатки гипервариабельной области (CDR) реципиентного антитела замещены остатками гипервариабельной области от не являющихся человеком видов (донорное антитело), таких как мышь, крыса, кролик или не являющийся человеком примат, которые имеют желаемую специфичность, аффинность и связывающую способность. В некоторых случаях остатки каркасной области иммуноглобулина человека также замещены соответствующими не принадлежащими человеку остатками (так называемые "обратные мутации"). Кроме того, библиотеки фагового дисплея можно использовать для изменения аминокислот в выбранных положениях внутри последовательности антитела. На свойства гуманизированного антитела также влияет выбор каркаса человека. Кроме того, гуманизированные и химеризованные антитела могут быть модифицированы для включения остатков, которые не встречаются в реципиентном антителе или в донорном антителе, для того чтобы дополнительно улучшить свойства антитела, такие как, например, аффинность или эффекторная функция.
Изобретение предлагает также полностью человеческие антитела. Термин "антитело человека" включает антитела с вариабельными и константными областями (если присутствуют), полученными из зародышевых последовательностей иммуноглобулина человека. Антитела человека могут содержать аминокислотные остатки, которые не кодируются зародышевыми последовательностями иммуноглобулина человека (например, мутации, введенные путем случайного или сайт-специфического мутагенеза in vitro или путем соматической мутации in vivo). Однако термин "антитело человека" не включает антитела, в которых последовательности CDR, полученные из зародышевой линии млекопитающих других видов, таких как мышь, были привиты каркасным последовательностям человека (т.е., гуманизированные антитела). Полностью человеческие или антитела человека могут быть получены из трансгенных мышей, несущих гены антител человека (несущих вариабельные (V), обеспечивающие разнообразие (D), соединительные (J) и константные (C) экзоны), или из клеток человека. Например, теперь можно производить трансгенных животных (например, мышей), которые способны после иммунизации к выработке полного репертуара антител человека в отсутствие эндогенной выработки иммуноглобулинов. См., например, Jakobovits et al. (1993) Proc Natl Acad Sci USA 90:2551; Jakobovits et al. (1993) Nature 362:255-258; Bruggemann et al. (1993) Year in Immunol 7:33; и Duchosal et al. (1992) Nature 355:258. Можно создать линии трансгенных мышей, содержащих последовательности из неаранжированных генов иммуноглобулинов человека. Последовательности человека могут кодировать как тяжелые, так и легкие цепи антител человека и будут функционировать правильно у мышей, подвергаясь перестройке для того, чтобы обеспечить такой же широкий репертуар антител, как и у людей. Трансгенных мышей можно иммунизировать белком-мишенью для создания разнообразного множества специфичных антител и кодирующих их РНК. Нуклеиновые кислоты, кодирующие компоненты цепей таких антител, можно затем клонировать из животного в дисплейный вектор. Как правило, клонируют отдельные популяции нуклеиновых кислот, кодирующие последовательности тяжелой и легкой цепи, и отдельные популяции затем рекомбинируют для вставки в вектор, таким образом, любая копия вектора получает случайную комбинацию тяжелой и легкой цепи. Вектор сконструирован для экспрессии цепей антитела таким образом, что они могут быть собраны и размещены на внешней поверхности дисплейной упаковки, содержащей вектор. Например, цепи антитела можно экспрессировать в виде слитых белков с белком фаговой оболочки с внешней поверхности фага. После этого можно проводить скрининг дисплейных упаковок для выявления антител, связывающихся с мишенью.
Кроме того, антитела человека могут быть получены из библиотек фагового дисплея (Hoogenboom et al. (1991) J Mol Biol 227:381; Marks et al. (1991) J Mol Biol, 222:581-597; и Vaughan et al. (1996) Nature Biotech 14:309 (1996)). Синтетические фаговые библиотеки можно создавать с использованием случайных комбинаций синтетических V-областей антител человека. Путем селекции по антигену можно создать полностью человеческие антитела, в которых V-области являются весьма человекоподобными по природе. См., например, патенты США №№6794132, 6680209, 4634666, и Ostberg et al. (1983), Hybridoma 2:361-367, содержание которых включено в настоящий документ в качестве ссылки в полном объеме.
Для создания антител человека, также см. Mendez et al. (1998) Nature Genetics 15:146-156 и Green and Jakobovits (1998) J Exp Med 188:483-495, содержание которых включено, таким образом, в качестве ссылки в полном объеме. Антитела человека дополнительно обсуждаются и описаны в патентах США №№: 5939598; 6673986; 6114598; 6075181; 6162963; 6150584; 6713610; и 6657103 а также патентных публикациях США №№2003-0229905 A1, 2004-0010810 A1, US 2004-0093622 A1, 2006-0040363 A1, 2005-0054055 A1, 2005-0076395 A1, 2005-0287630 A1. См. также международные публикации WO 94/02602, WO 96/34096 и WO 98/24893, и европейский патент EP 0 463 151 B1. Содержание каждого из вышеприведенных патентов, заявок и ссылок включено, таким образом, в качестве ссылки в полном объеме.
В альтернативном подходе, другие, в том числе GenPharm International, Inc., используют "минилокусный" подход. В минилокусном подходе имитируют экзогенный локус Ig за счет включения кусков (индивидуальных генов) из локуса Ig. Таким образом, один или несколько генов VH, один или несколько генов DH, один или несколько генов JH, константная область mu и вторая константная область (предпочтительно константная область гамма) формируются в конструкцию для вставки в животное. Этот подход описан, например, в патентах США №№: 5545807; 5545806; 5625825; 5625126; 5633425; 5661016; 5770429; 5789650; и 5814318; 5591669; 5612205; 5721367; 5789215; 5643763; 5569825; 5877397; 6300129; 5874299; 6255458; и 7041871, содержание которых включено, таким образом, в качестве ссылки. См. также европейский патент №0546073 B1, публикации междунардных патентных заявок WO 92/03918, WO 92/22645, WO 92/22647, WO 92/22670, WO 93/12227, WO 94/00569, WO 94/25585, WO 96/14436, WO 97/13852 и WO 98/24884, содержание которых включено, таким образом, в качестве ссылки в полном объеме. См. дополнительно Taylor et al. (1992) Nucleic Acids Res 20:6287; Chen et al. (1993) Int. Immunol. 5:647; Tuaillon et al. (1993) Proc Natl Acad Sci USA 90:3720-4; Choi et al. (1993) Nature Genetics 4:117; Lonberg et al. (1994) Nature 368:856-859; Taylor et al. (1994) International Immunology 6:579-591; Tuaillon et al. (1995) J Immunol 154:6453-65; Fishwild et al. (1996) Nature Biotechnology 14:845; и Tuaillon et al. (2000) Eur J Immunol. 10:2998-3005, содержание которых включено, таким образом, в качестве ссылки в полном объеме.
В определенных вариантах осуществления предлагаются деиммунизированные антитела или их антигенсвязывающие фрагменты. Деиммунизированные антитела или их антигенсвязывающие фрагменты представляют собой антитела, которые были модифицированы таким образом, чтобы сделать антитело или его антигенсвязывающий фрагмент неиммуногенным или менее иммуногенным для данных видов (например, для человека). Деиммунизацию можно получить путем модификации антитела или его антигенсвязывающего фрагмента с использованием ряда техник, известных специалистам в данной области (см., например, публикации PCT WO 04/108158 и WO 00/34317). Например, антитело или его антигенсвязывающий фрагмент можно деиммунизировать путем выявления потенциальных T-клеточных эпитопов и/или B-клеточных эпитопов в аминокислотной последовательности антитела или его антигенсвязывающего фрагмента и удаления одного или несколько потенциальных T-клеточных эпитопов и/или B-клеточных эпитопов из антитела или его антигенсвязывающего фрагмента, например, с использованием рекомбинантных способов. Модифицированное антитело или его антигенсвязывающий фрагмент затем необязательно можно производить и тестировать для выявления антител или их антигенсвязывающих фрагментов, которые сохранили один или несколько желаемых видов биологической активности, таких как, например, аффинность связывания, но у которых снижена иммуногенность. Способы для выявления потенциальных эпитопов для T-клеток и/или эпитопов для B-клеток можно осуществлять с применением известных в данной области техник, таких как, например, вычислительные способы (см. например, публикацию PCT WO 02/069232), техники in vitro или in silico и биологические анализы или физические способы (такие как, например, определение связывания пептидов с молекулами MHC, определение связывания комплексов пептид:MHC с T-клеточными рецепторами от видов, из которых получено антитело или его антигенсвязывающий фрагмент, тестирование белков или их пептидных частей с использованием трансгенных животных с молекулами MHC от видов, из которых получено антитело или его антигенсвязывающий фрагмент или тестирование с трансгенными животными, созданными с клетками иммунной системы от видов, из которых получено антитело или его антигенсвязывающий фрагмент, и т.д.). В различных вариантах осуществления деиммунизированные антитела, описываемые в настоящем документе, включают деиммунизированные антигенсвязывающие фрагменты, Fab, Fv, scFv, Fab' и F(ab')2, моноклональные антитела, мышиные антитела, сконструированные антитела (такие как, например, химерные, одноцепочечные, CDR-привитые, гуманизированные, полностью человеческие антитела и искусственно отобранные антитела), синтетические антитела и полусинтетические антитела.
В некоторых вариантах осуществления производится рекомбинантная ДНК, содержащая вставку, кодирующую вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи антитела (например, антитела против C5 или антитела против интерферона альфа), и трансфицируется в клетку-хозяина для экспрессии антитела. Термин ДНК включает кодирующую одноцепочечную ДНК, двухцепочечные ДНК, состоящие из указанной кодирующей ДНК и комплементарной ей ДНК, или эти комплементарные (одноцепочечные) ДНК сами по себе.
Кроме того, ДНК, кодирующую вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи антител против C5, можно синтезировать ферментативно или химически для включения аутентичной последовательности ДНК, кодирующей вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи, или их мутанта. Мутант аутентичной ДНК представляет собой ДНК, кодирующую вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи вышеуказанных антител, в которых одна или несколько аминокислот удалены, вставлены или замещены одной или несколькими другими аминокислотами. Предпочтительно, указанная модификация (модификации) находятся вне CDR вариабельного домена тяжелой цепи и/или вариабельного домена легкой цепи антитела при гуманизации и подходах для оптимизации экспрессии. Термин мутантная ДНК также включает молчащих мутантов, где один или несколько нуклеотидов замещены другими нуклеотидами с образованием новых кодонов, кодирующих ту же самую аминокислоту (аминокислоты). Термин мутантная последовательность также включает вырожденную последовательность. Вырожденные последовательности являются вырожденными в значении, относящемся к генетическому коду, таком, что неограниченное число нуклеотидов замещается другими нуклеотидами и это не приводит к изменениям в изначально кодированной аминокислотной последовательности. Такие вырожденные последовательности могут быть полезны из-за их различных участков рестрикции и/или частоты конкретных кодонов, которые являются предпочтительными для конкретного хозяина, в частности, E.coli, для получения оптимальной экспрессии вариабельного домена тяжелой цепи мышей и/или вариабельного домена легкой цепи мышей.
Подразумевается, что термин мутант включает мутантную ДНК, полученную путем мутагенеза in vitro аутентичной ДНК в соответствии с известными в данной области способами.
Для сборки полных тетрамерных молекул иммуноглобулина и экспрессии химерных антител, вставки с рекомбинантной ДНК, кодирующей вариабельные домены тяжелых и легких цепей, сливают с соответствующей ДНК, кодирующей константные домены тяжелых и легких цепей, затем переносят в подходящие клетки-хозяева, например, после инкорпорации в гибридные векторы.
Другой вариант осуществления относится к рекомбинантным ДНК, кодирующим рекомбинантный полипептид, где вариабельный домен тяжелой цепи и вариабельный домен легкой цепи связаны посредством спейсерной группы, необязательно содержащим сигнальную последовательность, облегчающую процессинг антитела в клетке-хозяине, и/или последовательность ДНК, кодирующую пептид, облегчающий очистку антитела, и/или участок расщепления, и/или пептидный спейсер и/или агент.Под ДНК, кодирующей агент, подразумевается ДНК, кодирующая агент, полезный для диагностического или терапевтического применения. Таким образом, молекулы агента, которые представляют собой токсины или ферменты, в частности, ферменты, способные катализировать активацию пролекарственных средств, указаны особо. ДНК, кодирующая такой агент, имеет последовательность ДНК, кодирующей природный фермент или токсин, или ее мутанта, и ее можно получать способами, хорошо известными в данной области.
Таким образом, моноклональные антитела или антигенсвязывающие фрагменты по изобретению могут представлять собой очищенные антитела или антигенсвязывающие фрагменты, которые не конъюгированы с другими агентами, например, с терапевтическим средством или детектируемой меткой. Альтернативно, моноклональное антитело или антигенсвязывающий фрагмент можно конъюгировать с агентом, таким как, например, цитотоксическое средство, низкомолекулярное соединение, гормон, фермент, фактор роста, цитокин, рибозим, пептидомиметик, химическое вещество, пролекарственное средство, молекула нуклеиновой кислоты, в том числе кодирующие последовательности (такие как антисмысловая, иРНК, конструкции, нацеленные на ген, и т.д.), или детектируемая метка (например, ЯМР- или рентгеноконтрастный агент, флуоресцентная молекула, и т.д.). В определенных вариантах осуществления антитело против C5 или антигенсвязывающий фрагмент (например, Fab, Fv, одноцепочечный scFv, Fab', и F(ab')2) связаны с молекулой, которая увеличивает время полужизни антитела или антигенсвязывающего фрагмента (см. выше).
Несколько возможных векторных систем доступны для экспрессии клонированных генов тяжелой цепи и легкой цепи в клетках млекопитающих. Один класс векторов опирается на интеграцию желаемой генетической последовательности в геном клетки-хозяина. Клетки, в которых есть стабильно интегрированная ДНК, можно отбирать посредством одновременного введения генов лекарственной устойчивости, таких как E.coli gpt (Mulligan and Berg (1981) Proc Natl Acad Sci USA, 78:2072) или Tn5 neo (Southern and Berg (1982) Mol Appl Genet 1:327). Ген селективного маркера может быть или связан с ДНК экспрессируемой последовательности или введен в ту же самую клетку путем ко-трансфекции (Wigler et al. (1979) Cell 16:77). Второй класс векторов использует элементы ДНК, которые придают свойство автономной репликации внехромосомной плазмиде. Эти векторы можно получить из вирусов животных, таких как бычий папилломавирус (Sarver et al. (1982) Proc Natl Acad Sci USA, 79:7147), вирус полиомы (Deans et al. (1984) Proc Natl Acad Sci USA 81:1292), или вирус SV40 (Lusky и Botchan (1981) Nature 293:79).
Поскольку кДНК иммуноглобулинов содержит только последовательности, представляющие зрелую мРНК, кодирующую белок антитела, для синтеза мРНК иммуноглобулина необходимы дополнительные генетические элементы для экспрессии, регулирующие транскрипцию гена и процессинг РНК. Эти элементы могут включать сигналы сплайсинга, промоторы транскрипции, в том числе индуцибельные промоторы, энхансеры и сигналы терминации. кДНК-экспрессирующие векторы, которые содержат такие элементы, включают векторы, описанные Okayama and Berg (1983) Mol Cell Biol 3:280; Cepko et al. (1984) Cell 37: 1053; и Kaufman (1985) Proc Natl Acad Sci USA 82:689.
В терапевтических вариантах осуществления настоящего изобретения рассматриваются биспецифические антитела. Биспецифические антитела представляют собой моноклональные, предпочтительно человеческие или гуманизированные антитела, которые имеют специфичность связывания по меньшей мере к двум различным антигенам. В данном случае, одна специфичность связывания относится к белку комплемента человека или белку интерферона альфа, и другая специфичность связывания относится к любому другому антигену.
Способы получения биспецифических антител находятся в компетенции специалистов в данной области. Традиционно, рекомбинантная выработка биспецифических антител основана на ко-экспрессии двух иммуноглобулиновых пар тяжелая цепь/легкая цепь, где две тяжелые цепи имеют различную специфичность (Milstein and Cuello (1983) Nature 305:537-539). Вариабельные домены антитела с желаемой специфичностью связывания (антитело-антигенсвязывающие участки) можно сливать с последовательностями константных доменов иммуноглобулина. Слияние предпочтительно происходит с константным доменом тяжелой цепи иммуноглобулина, включая по меньшей мере часть шарнира и области CH2 и CH3. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, при желании, легкой цепи иммуноглобулина, вставляют в раздельные экспрессирующие векторы, и совместно трансфицируют подходящий организм-хозяин. Более подробно о типичных, известных в настоящее время способах создания биспецифических антител см., например, Suresh et al. (1986) Methods in Enzymology 121:210; публикация PCT №WO 96/27011; Brennan et al. (1985) Science 229:81; Shalaby et al., J Exp Med (1992) 175:217-225; Kostelny et al. (1992) J Immunol 148(5): 1547-1553; Hollinger et al. (1993) Proc Natl Acad Sci USA 90:6444-6448; Gruber et al. (1994) JImmunol 152:5368; и Tutt et al. (1991) J Immunol 147:60. Биспецифические антитела также включают перекрестно-связанные или гетероконъюгированные антитела. Гетероконъюгированные антитела можно получать с использованием любых подходящих способов перекрестной сшивки. Подходящие сшивающие средства хорошо известны в данной области, и описаны в патенте США №4676980, наряду с техниками перекрестного сшивания.
Различные способы для создания и выделения фрагментов биспецифического антитела непосредственно из культуры рекомбинантных клеток также были описаны. Например, биспецифические антитела производят с использованием лейциновых молний. См., например, Kostelny et al. (1992) J Immunol 148(5): 1547-1553. Пептиды лейциновой молнии из белков Fos и Jun можно соединять с частями Fab' двух различных антител посредством слияния генов. Гомодимеры антител могут быть восстановлены в шарнирной области с образованием мономеров антител, а затем повторно окислены с образованием гетеродимеров антител. Этот способ можно использовать также для выработки гомодимеров антител. Технология "диатела", описанная Hollinger et al. (1993) Proc Natl Acad Sci USA 90:6444-6448, предлагает альтернативный механизм получения фрагментов биспецифического антитела. Фрагменты содержат вариабельный домен (VH) тяжелой цепи, соединенный с вариабельным доменом (VL) легкой цепи посредством линкера, который слишком короток, для того чтобы позволить соединиться двум доменам одной и той же цепи. Таким образом, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, формируя таки образом два антигенсвязывающих участка. Описана также другая стратегия для создания фрагментов биспецифического антитела с использованием димеров одноцепочечного Fv (scFv). См., например, Gruber et al. (1994) J Immunol 152:5368. Альтернативно, антитела могут представлять собой "линейные антитела" как описано, например, в Zapata et al. (1995) Protein Eng. 8(10):1057-1062. В кратком изложении, эти антитела содержат пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Изобретение также относится к вариантным формам биспецифических антител, таким как молекулы тетравалентного двойного вариабельного домена иммуноглобулина (DVD-Ig), описанные в Wu et al. (2007) Nat Biotechnol 25(11): 1290-1297. Молекулы DVD-Ig сконструированы таким образом, что два различных вариабельных домена легкой цепи (VL) из двух различных родительских антител соединены при помощи способов рекомбинации ДНК в тандем напрямую или посредством короткого линкера, с последующим константным доменом легкой цепи. Способы для создания молекул DVD-Ig из двух родительских антител антитела дополнительно описаны, например, в публикациях PCT WO 08/024188 и WO 07/024715, содержание которых включено в настоящий документ в качестве ссылки в полном объеме.
Фармацевтические композиции и составы
Композиции, содержащие ингибитор комплемента (например, ингибитор компонента С5 комплемента человека, такие как антитело против C5 или его антигенсвязывающий фрагмент или ингибитор интерферона альфа) можно формулировать в виде фармацевтической композиции, например, для введения индивидууму для лечения болезни Дего. Фармацевтические композиции, как правило, включают в себя фармацевтически приемлемый носитель. Применяемый в настоящем документе термин "фармацевтически приемлемый носитель" относится к любым растворителям, диспергирующим средам, оболочкам, антибактериальным и противогрибковым средствам, изотоническим веществам и веществам, замедляющим абсорбцию, и т.п., которые являются физиологически совместимыми. Композиции могут включать в себя фармацевтически приемлемую соль, например, соль присоединения кислоты или соль присоединения основания (см., например, Berge et al. (1977) J Pharm Sci 66: 1-19).
Композиции можно формулировать в соответствии со стандартными способами. Фармацевтический состав является общеизвестной областью техники, и дополнительно описан, например, в Gennaro (2000) "Remington: The Science and Practice of Pharmacy," 20th Edition, Lippincott, Williams & Wilkins (ISBN: 0683306472); Ansel et al. (1999) "Pharmaceutical Dosage Forms and Drug Delivery Systems," 7th Edition, Lippincott Williams & Wilkins Publishers (ISBN: 0683305727); и Kibbe (2000) "Handbook of Pharmaceutical Excipients American Pharmaceutical Association," 3rd Edition (ISBN: 091733096X). В некоторых вариантах осуществления композиция может быть сформулирована в виде буферного раствора подходящей концентрации и подходящего для хранения при 2-8°C. В некоторых вариантах осуществления композицию можно формулировать для хранения при температуре ниже 0°C (например, -20°C или -80°C).
Фармацевтические композиции могут представлять собой ряд форм. Эти формы включают, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, растворы для инъекций и инфузий), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит, частично, от предполагаемого способа введения и терапевтического применения. Например, композиции, которые содержат антитело против C5, предназначены для системного или местного введения и могут быть в форме растворов для инъекций или инфузий. Таким образом, композиции можно формулировать для введения парентеральным способом (например, внутривенная, подкожная, интраперитонеальная или внутримышечная инъекция). "Парентеральное введение", "вводимый парентерально" и другие грамматически эквивалентные фразы, применяемые в настоящем документе, относятся к способам введения, иным чем энтеральное и местное введение, как правило, посредством инъекции, и в качестве неограничивающих примеров включают, внутривенную, интраназальную, внутриглазную, легочную, внутримышечную, внутриартериальную, интратекальную, внутрикапсулярную, внутриорбитальную, внутрисердечную, интрадермальную, внутрилегочную, интраперитонеальную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную, эпидуральную, внутримозговую, внутричерепную, внутрикаротидную и интрастернальную инъекцию и инфузию (см. ниже).
Композиции можно формулировать в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для устойчивого хранения при высокой концентрации. Стерильные растворы для инъекций можно получать посредством введения антитела, описываемого в настоящем документе, в требуемое количество подходящего растворителя с одним ингредиентом или комбинацией ингредиентов, перечисленных выше, в случае необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают посредством введения ингибитора комплемента человека (например, антитела против C5) и/или ингибитора интерферона альфа, описываемых в настоящем документе, в стерильный носитель, который содержит основную диспергирующую среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций, способы получения включают вакуумную сушку и лиофильную сушку, которые приводят к получению порошка антитела, описываемого в настоящем документе, плюс любого дополнительного желаемого ингредиента из его предварительно стерильно профильтрованного раствора. Надлежащую текучесть раствора можно поддерживать, например, за счет использования покрытия, такого как лецитин, за счет сохранения требуемого размера частиц в случае дисперсии и за счет использования поверхностно-активных веществ. Пролонгированная абсорбция композиций для инъекций может быть достигнута за счет включения в композицию реагента, замедляющего абсорбцию, например, моностеаратных солей и желатина.
В определенных вариантах осуществления ингибитор комплемента (например, антитело против C5 или его антигенсвязывающий фрагмент) или ингибитор интерферона альфа можно получать с носителем, который будет защищать соединение от быстрого высвобождения, таким как состав с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно использовать биоразлагающиеся биосовместимые полимеры, такие как этилен винилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры, и полимолочная кислота. В данной области известно множество способов для получения таких составов. См., например, J.R. Robinson (1978) "Sustained and Controlled Release Drug Delivery Systems" Marcel Dekker, Inc., New York.
В некоторых вариантах осуществления ингибитор, описываемый в настоящем документе, можно формулировать в композицию, подходящую для внутрилегочного введения (например, для введения при помощи небулайзера) млекопитающему, такому как человек. Способы для приготовления таких композиций хорошо известны в данной области и описаны, например, в публикации патентной заявки США №20080202513; патентах США №№7112341 и 6019968; и публикациях PCT WO 00/061178 и WO 06/122257, содержание которых включено в настоящий документ в качестве ссылки в полном объеме. Составы сухого порошка для ингаляции и подходящие системы для введения составов описаны, например, в публикации патентной заявки США №20070235029, публикация PCT №WO00/69887 и патенте США №5997848.
В некоторых вариантах осуществления ингибитор комплемента человека (например, антитело против C5 или его антигенсвязывающий фрагмент) или ингибитор интерферона альфа, описываемые в настоящем документе, можно модифицировать, например, при помощи функциональной группы, которая улучшает его стабильность и/или удержание в циркуляции, например, в крови, сыворотке или других тканях. Стабилизирующая группа может улучшать стабильность или удержание антитела, по меньшей мере, в 1,5 раза (например, по меньшей мере, в 2, 5, 10, 15, 20, 25, 30, 40 или 50 или более раз).
Ингибиторы нуклеиновых кислот комплемента человека, описываемые в настоящем документе (например, антисмысловая нуклеиновая кислота или миРНК) можно внедрять в генную конструкцию для применения в качестве части протокола генотерапии для доставки нуклеиновых кислот, которые можно использовать для экспрессии и выработки агентов внутри клеток. Экспрессирующие конструкции таких компонентов можно вводить в любой биологически эффективный носитель, например, в любой состав или композицию, способные эффективно доставлять генетический компонент в клетки in vivo. Подходы включают в себя вставку соответствующего гена в вирусные векторы, в том числе рекомбинантные ретровирусы, аденовирус, аденоассоциированный вирус, лентивирус и вирус простого герпеса-1 (HSV-1), или рекомбинантные бактериальные или эукариотические плазмиды. Вирусные векторы могут трансфицировать клетки напрямую; плазмидную ДНК можно доставлять, например, при помощи катионных липосом (липофектин) или производных полилизиновых конъюгатов (например, конъюгированных с антителом), грамицидина S, искусственных вирусных оболочек или других подобных внутриклеточных носителей, а также при помощи прямой инъекции генной конструкции или преципитации с CaPO4, проводимых in vivo. (См. также "Ex vivo Approaches", ниже). Примеры подходящих ретровирусов включают pLJ, pZIP, pWE и pEM, которые известны специалистам в данной области (см., например, Eglitis et al. (1985) Science 230:1395-1398; Danos and Mulligan (1988) Proc Natl Acad Sci USA 85:6460-6464; Wilson et al. (1988) Proc Natl Acad Sci USA 85:3014-3018; Armentano et al. (1990) Proc Natl Acad Sci USA 87:6141-6145; Huber et al. (1991) Proc Natl Acad Sci USA 88:8039-8043; Ferry et al. (1991) Proc Natl Acad Sci USA 88:8377-8381; Chowdhury et al. (1991) Science 254:1802-1805; van Beusechem et al. (1992) Proc Natl Acad Sci USA 89:7640-7644; Kay et al. (1992) Human Gene Therapy 3:641-647; Dai et al. (1992) Proc Natl Acad Sci USA 89:10892-10895; Hwu et al. (1993) J Immunol 150:4104-4115; патенты США №№4868116 и 4980286; публикации PCT WO89/07136, WO89/02468, WO89/05345, и WO92/07573). Другая вирусная система доставки генов использует векторы на основе аденовируса (см., например, Berkner et al. (1988) BioTechniques 6:616; Rosenfeld et al. (1991) Science 252:431-434; и Rosenfeld et al. (1992) Cell 68:143-155). Подходящие аденовирусные векторы, полученные из штамма аденовируса Ad тип 5 dl324 или других штаммов аденовируса (например, Ad2, Ad3, Ad7, и т.д.), известны специалистам в данной области. Еще одна вирусная векторная система, подходящая для доставки соответствующего гена, представляет собой аденоассоциированный вирус (AAV). См., например, Flotte et al. (1992) Am J Respir Cell Mol Biol 7:349-356; Samulski et al. (1989) J Virol 63:3822-3828; и McLaughlin et al. (1989) J Virol 62: 1963-1973.
В некоторых вариантах осуществления можно комбинировать более одного (например, два, три, четыре, пять, шесть, семь, восемь, девять или 10 или более) ингибитора(-ов) (например, один или несколько ингибиторов C5 человека). Например, C5-специфичную миРНК и антитело против C5 можно формулировать вместе.
В некоторых вариантах осуществления ингибитор комплемента человека (например, ингибитор комплемента человека, такой как антитело против C5 или его антигенсвязывающий фрагмент) или ингибитор интерферона альфа, описываемые в настоящем документе, можно формулировать с одним или несколькими дополнительными активными средствами, подходящими для лечения болезни Дего или улучшающие ее симптомы. Например, антитело против C5 можно формулировать с иммуносупрессирующим средством. Иммуносупрессирующие средства включают, например, кортикостероиды, фенилбутазон, азатиоприн, метотрексат, циклоспорин, такролимус и микофенолат мофетил, циклофосфамид и агент против CD20, такой как ритуксимаб (Ритуксан™; Biogen Idec, Cambridge, MA). В некоторых вариантах осуществления ингибитор комплемента человека можно формулировать для введения индивидууму наряду с внутривенной иммуноглобулиновой терапией (IVIG), переливанием эритроцитов, плазмаферезом или замещением плазмы. См., например, Dyrsen et al. (2008), выше и Zhu et al. (2007), выше.
В некоторых вариантах осуществления ингибитор комплемента человека можно формулировать для комбинированной терапии (например, одновременной или параллельной) с антитромботическим средством и/или антикоагулянтом, в качестве неограничивающих примеров, такими как клопидогрель, аспирин, дипиридамол, варфарин (кумадин), гепарин, фениндион, фондапаринукс, идрапаринукс и ингибиторы тромбина (например, аргатробан, лепирудин, бивалирудин или дабигатран). Ингибитор комплемента человека (например, антитело против C5) можно также формулировать для применения с фибринолитическим агентом (например, анкрод, ε-аминокапроновая кислота, антиплазмин-a1, простациклин и дефибротид) для лечения болезни Дего.
В некоторых вариантах осуществления, например, когда болезнь Дего ассоциирована с инфекцией, ингибитор комплемента человека и/или ингибитор интерферона альфа можно формулировать с одним или несколькими агентами для применения в лечении инфекции. Например, ингибитор С5 можно формулировать с антибиотиком или противовирусным средством.
Когда ингибитор комплемента человека используют в комбинации со вторым активным средством, или когда используют два или более ингибиторов комплемента человека (например, антитело против C5 и антитело против фактора B), агенты можно формулировать раздельно или вместе. Например, соответствующие фармацевтические композиции можно смешивать, например, непосредственно перед введением и вводить вместе или можно вводить раздельно, например, в одно и то же или различное время (см. ниже).
Аналогично, когда ингибитор интерферона альфа (например, антитело против интерферона альфа) используют в комбинации со вторым активным средством, или когда используют два или более ингибиторов интерферона альфа, агенты можно формулировать раздельно или вместе.
Как описано выше, композицию можно формулировать, чтобы она включала терапевтически эффективное количество ингибитора комплемента человека (например, антитела против C5 или его антигенсвязывающего фрагмента) или композицию можно формулировать, чтобы она включала субтерапевтическое количество ингибитора и субтерапевтическое количество одного или нескольких дополнительных активных средств, таким образом, чтобы компоненты в совокупности являлись терапевтически эффективными для лечения болезни Дего. В некоторых вариантах осуществления композицию можно формулировать для включения двух или более ингибиторов комплемента человека, каждый в субтерапевтических дозах, таким образом, ингибиторы в совокупности имеют концентрацию, которая является терапевтически эффективной для лечения болезни Дего. Композицию можно формулировать таким образом, чтобы она включала терапевтически эффективное количество ингибитора интерферона альфа (например, антитела против интерферона альфа или его антигенсвязывающего фрагмента) или композицию можно формулировать для включения субтерапевтического количества ингибитора и субтерапевтического количества одного или нескольких дополнительных активных средств, таким образом, чтобы компоненты в совокупности являлись терапевтически эффективными для лечения болезни Дего. В некоторых вариантах осуществления композицию можно формулировать для включения двух или более ингибиторов интерферона альфа, каждый в субтерапевтических дозах, таким образом ингибиторы в совокупности имеют концентрацию, которая является терапевтически эффективной для лечения болезни Дего. В некоторых вариантах осуществления композиция включает в себя ингибитор комплемента человека и ингибитор интерферона альфа. Способы для выявления терапевтически эффективной дозы (например, терапевтически эффективной дозы антитела против C5 или антитела против интерферону) известны в данной области и описаны в настоящем документе.
Способы лечения
Вышеописанные композиции подходят, среди прочего, для способов лечения или предупреждения болезни Дего у индивидуума (например, человека). Композиции можно вводить индивидууму, например, человеку, с использованием ряда способов, которые частично зависят от пути введения. Путь может представлять собой, например, внутривенную инъекцию или инфузию (в/в), подкожную инъекцию (п/к), интраперитонеальную (IP) или внутримышечную инъекцию.
Введение можно производить, например, посредством местного вливания, инъекции или при помощи имплантата. Имплантат может представлять собой пористый, непористый или гелеобразный материал, в том числе мембраны, такие как сиаластовые мембраны, или волокна. Имплантат можно настраивать для непрерывного или периодического высвобождения композиции индивидууму. (См., например, патентную публикацию США №20080241223; патенты США №№5501856; 4863457; и 3710795; EP488401; и EP 430539, содержание которых включено в настоящий документ в качестве ссылки в полном объеме). Композицию можно доставлять индивидууму посредством имплантируемого устройства на основе, например, диффузионных, эрозийных или конвекционных систем, например, осмотических насосов, биоразлагающихся имплантатов, электродиффузионных систем, электроосмотических систем, насосов с давлением водяных паров, электролитических насосов, «шипучих» насосов, пьезоэлектрических насосов, систем, основанных на эрозии или электромеханических систем.
Подходящая доза ингибитора комплемента человека (например, антитела против C5 или его фрагмента) или ингибитора интерферона альфа (например, антитела против интерферона альфа), которая способна лечить или предупреждать болезнь Дего у индивидуума, может зависеть от ряда факторов, в том числе, например, возраста, пола и массы субъекта, которого лечат, и конкретного применяемого ингибитора. Например, может требоваться различная доза миРНК, специфичной для С5 человека, для лечения пациента с болезнью Дего по сравнению с дозой антитела против C5, необходимой для лечения того же самого пациента. Другие факторы, влияющие на дозу, вводимую индивидууму, включают, например, тип или тяжесть болезни Дего. Например, пациенту с кожной формой болезни Дего может требоваться введение других доз ингибитора, чем пациенту с системной формой болезни Дего. Другие факторы могут включать, например, другие заболевания одновременно или ранее поражающие пациента, общее состояние здоровья пациента, генетическая предрасположенность пациента, диету, время введения, уровень экскреции, комбинацию лекарственных средств и любых других терапевтических средств, которые вводят индивидууму. Также следует понимать, что конкретная доза и схема лечения для любого конкретного пациента будет зависеть от решения лечащего врача-терапевта (например, врача или фельдшера).
Ингибитор можно вводить в виде установленной дозы или в дозе миллиграмм на килограмм (мг/кг). В некоторых вариантах осуществления дозу можно также выбирать для того, чтобы уменьшить или избежать выработку антител или других иммунных ответов хозяина против одного или нескольких активных средств в композиции. Никоим образом не предназначаясь для ограничения, типичные дозировки ингибитора комплемента (например, антитела против C5) и/или ингибитора интерферона альфа включают, например, 1-100 мкг/кг, 0,5-50 мкг/кг, 0,1-100 мкг/кг, 0,5-25 мкг/кг, 1-20 мкг/кг, и 1-10 мкг/кг, 1-100 мг/кг, 0,5-50 мг/кг, 0,1-100 мг/кг, 0,5-25 мг/кг, 1-20 мг/кг и 1-10 мг/кг.Типичные дозировки антитела, описываемого в настоящем документе, в качестве неограничивающих примеров включают, 0,1 мкг/кг, 0,5 мкг/кг, 1,0 мкг/кг, 2,0 мкг/кг, 4 мкг кг, и 8 мкг/кг, 0,1 мг/кг, 0,5 мг/кг, 1,0 мг/кг, 2,0 мг/кг, 4 мг/кг и 8 мг/кг.
В некоторых вариантах осуществления человеку можно вводить внутривенно антитело против C5 (например, экулизумаб) в дозе приблизительно 900 мг приблизительно каждые 12 дней (например, приблизительно каждые 10, 11, 13, 14, 15, 16, 17, 18, 19, 20, 21, 28, 30, 42 или 49 или более дней). См., например, Hill et al. (2005) Blood 106(7):2559.
В некоторых вариантах осуществления человеку можно вводить внутривенно антитело против C5 (например, экулизумаб) в дозе приблизительно 600 мг (например, приблизительно 625, 650, 700, 725, 750, 800, 825, 850, 875, 900, 925, 950 или 1000 или более) каждую неделю, необязательно, в течение двух или более (например, трех, четырех, пяти, шести, семи или восьми или более) недель. После начального лечения человеку можно вводить антитело в дозе приблизительно 900 мг приблизительно каждые 14 (например, приблизительно каждые 15, 16, 17, 18, 19, 20, 21, 28, 30, 42 или 49 или более) дней, например, в виде поддерживающей дозы. См., например, Hillmen et al. (2004) N Engl J Med. 350(6):552-9 и Dmytrijuk et al. (2008) The Oncologist 13(9):993.
Фармацевтическая композиция может включать терапевтически эффективное количество ингибитора компонента комплемента человека C5 (например, антитело против C5 или его антигенсвязывающий фрагмент) и/или терапевтически эффективное количество ингибитора интерферона альфа. Такие эффективные количества могут быть легко определены специалистом в данной области частично на основании действия вводимого ингибитора или комбинированного эффекта антитела и одного или нескольких дополнительных активных средств, если используют более одного компонента. Терапевтически эффективное количество ингибитора комплемента человека (например, антитела против C5) также может варьировать в зависимости от факторов, таких как состояние болезни, возраст, пол и масса индивидуума и способность антитела (и одного или нескольких дополнительных активных средств) вызывать желаемую реакцию у индивидуума, например, улучшение, по меньшей мере, одного параметра состояния, например, улучшение, по меньшей мере, одного симптома болезни Дего. Например, терапевтически эффективное количество ингибитора комплемента человека (например, антитела против C5) может ингибировать (уменьшать тяжесть или устранять проявление) и/или предупреждать болезнь Дего и/или любой из симптомов болезни Дего, известный в данной области или описываемый в настоящем документе. Терапевтически эффективное количество также представляет собой то количество, при котором любые токсические или вредные воздействия композиции перевешиваются ее терапевтически положительным воздействием.
Термины "терапевтически эффективное количество" или "терапевтически эффективная доза" или сходные термины, применяемые в настоящем документе, означают количество средства (например, ингибитора комплемента человека), которое будет вызывать желаемый биологический или медицинский ответ (например, улучшение одного или нескольких симптомов болезни Дего). В некоторых вариантах осуществления композиция, описываемая в настоящем документе, содержит терапевтически эффективное количество ингибитора компонента С5 комплемента человека. В некоторых вариантах осуществления композиция, описываемая в настоящем документе, содержит терапевтически эффективное количество антитела или его антигенсвязывающий фрагмент, который связывается с белком компонента С5 комплемента. В некоторых вариантах осуществления композиция содержит два или более (например, три, четыре, пять, шесть, семь, восемь, девять, 10 или 11 или более) различных ингибиторов комплемента человека таким образом, что композиция в целом является терапевтически эффективной. Например, композиция может содержать антитело, которое связывается с белком С5 человека, и миРНК, которая связывается с мРНК, кодирующей белок С5 человека, и способствует ее деградации, где антитело и миРНК находятся в концентрации, которая в комбинации является терапевтически эффективной. В некоторых вариантах осуществления композиция содержит ингибитор и одно или несколько вторых активных средств, таким образом, что композиция в целом является терапевтически эффективной. Например, композиция может содержать антитело, которое связывается с белком С5 человека, и другое средство, подходящее для лечения или предупреждения болезни Дего.
В некоторых вариантах осуществления композиция, описываемая в настоящем документе, содержит терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента против интерферона альфа.
Токсичность и терапевтическую эффективность таких композиций можно определять при помощи известных фармацевтических процедур на клеточных культурах или экспериментальных животных. Эти процедуры можно использовать, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной у 50% популяции). Соотношение доз между токсическим и терапевтическим эффектом называется терапевтический индекс, и его можно выражать в виде соотношения LD50/ED50. Композиции, или ингибиторы комплемента (например, антитела против C5) из композиций, которые демонстрируют высокий терапевтический индекс, являются предпочтительными. Хотя можно использовать композиции, которые проявляют токсичные побочные эффекты, следует тщательно разрабатывать систему доставки, которая нацеливает такие соединения на участки пораженной ткани и минимизирует потенциальное повреждение нормальных клеток и, тем самым, уменьшает побочные эффекты.
Данные, полученные при анализе клеточных культур и исследований на животных, можно использовать в определении диапазона дозировки для применения у людей. Дозировка таких ингибиторов находится, как правило, в диапазоне концентраций циркулирующего ингибитора(-ов) (например, антитела против C5, антитела против интерферона альфа или их антигенсвязывающих фрагментов), который включает ED50 с небольшой токсичностью или с ее отсутствием. Дозировка может варьировать в пределах этого диапазона в зависимости от используемой лекарственной формы и применяемого пути введения. Для ингибитора компонента С5 комплемента человека (например, антитела против C5), применяемого, как описано в настоящем документе (например, для лечения или предупреждения болезни Дего), терапевтически эффективная доза первоначально может быть оценена по анализам на клеточной культуре. Уровни ингибитора комплемента, например, в плазме людей или животных, подвергнутых лечению, можно измерять, например, при помощи высокоэффективной жидкостной хроматографии.
В некоторых вариантах осуществления необходимую дозу ингибитора комплемента человека (например, антитела против C5) можно определять на основании концентрации в крови пациента белка комплемента, на который направлен ингибитор. Например, пациенту с более высокими уровнями концентрации циркулирующего белка С5 человека может потребоваться более высокая доза ингибитора С5 человека, чем пациенту с низкими уровнями циркулирующего С5 человека. Способы определения концентрации комплемента человека в жидком образце, полученном из крови пациента, известны в данной области. Например, способ определения уровней С5 в сыворотке, описан, например, в Rawal et al. (1998) J Biol Chem 273(27): 16828-16835.
Применяемый в настоящем документе "пациент" может быть любым млекопитающим. Например, пациент может быть человеком, не являющимся человеком приматом (например, обезьяной, бабуином или шимпанзе), лошадью, коровой, свиньей, овцой, козой, собакой, кошкой, кроликом, морской свинкой, песчанкой, хомяком, крысой или мышью. В некоторых вариантах осуществления пациент может являться новорожденным (например, новорожденным человека).
В некоторых вариантах осуществления пациентом является тот, кто не поддается лечению одним или несколькими дополнительными терапевтическими средствами, которые вводили для лечения болезни Дего. "Устойчивость" к терапии, "не поддающийся" терапии, и подобные грамматические фразы, применяемые в настоящем документе, относятся к клиническому состоянию пациента, при котором существует снижение эффективности данной терапии при лечении данного нарушения (например, болезни Дего) или снижение эффективности лечения для улучшения одного или нескольких симптомов, связанных с нарушением. Например, терапевтические выгоды от IVIg для пациента, страдающего болезнью Дего, могут уменьшаться с течением времени, таким образом, что заболевание сохраняется или прогрессирует даже с терапией IVIg. См., например, De Breucker et al. (2008), выше.
Применяемый в настоящем документе термин пациент "нуждающийся в лечении", "нуждающийся в предупреждении" или "нуждающийся в этом" относится к пациенту, который по решению соответствующего врача-терапевта (например, врача, фельдшера или практикующей медицинской сестры в случае людей; ветеринара в случае не являющихся человеком млекопитающих), мог бы получить разумное благоприятное воздействие от данного лечения (такого как лечение при помощи композиции, содержащей ингибитор комплемента человека или ингибитор интерферона альфа).
Как применяют в настоящем документе, пациент "с риском развития болезни Дего" представляет собой пациента, имеющего один или несколько (например, два, три, четыре, пять, шесть, семь или восемь или более) факторов риска развития нарушения. Факторы риска болезни Дего хорошо известны в данной области медицины и включают, например, предрасположенность к развитию состояния, т.е., семейный анамнез заболевания или генетический статус, ассоциированный с болезнью Дего, такой как, например, дефицит белка S. См., например, Gileberte et al. (2005) Br J Dermatol 153(3):666-7. Факторы риска болезни Дего также включают те условия, которые ассоциированы с болезнью Дего, в качестве неограничивающих примеров, такие как вирусные инфекции (например, ВИЧ-инфекция или инфекция парвовирусом B19), прокоагулянтное состояние (например, фактор V Лейдена) или аутоиммунное заболевание, такое как красная волчанка, дерматомиозит, склеродермия и антифосфолипидный синдром. Далее в настоящем документе, такие проявления болезни Дего могут быть, при необходимости, обозначены как, например, "болезнь Дего, ассоциированная с инфекцией" или "болезнь Дего, ассоциированная с аутоиммунным заболеванием". Из вышеописанного ясно, что пациентами "с риском развития болезни Дего" являются не все пациенты интересующих видов.
Пациент "с подозрением на болезнь Дего" представляет собой пациента с одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или 10 или более) симптомами состояния. Симптомы этого состояния известны специалистам в данной области медицины и включают, например, поражение кожи (например, одну или несколько индуцированных папул цвета кожи или розового цвета, папулы прогрессируют во вдавленные рубцы с белыми центрами и окружающей их эритемой и телеангиоэктазиями), желудочно-кишечное кровотечение, кровотечение, рвоту, кожно-брюшную фистулу, неврологические симптомы (например, лицевую и периферическую парестезию, головные боли, головокружение, афагию, параплегию, паралич взора, эпилепсию, потерю памяти или изменение чувствительности), инсульты, диплопию, птоз, нарушения зрительного поля, слабость, укорочение дыхания и боль в грудной клетке. В некоторых вариантах осуществления болезнь Дего ассоциирована с наличием у пациентов антител против кардиолипину, волчаночного антикоагулянта, антител против фосфолипиду или сосудистым накоплением IgA. См., например, Englert et al. (1984), выше; Crowson et al. (2002), выше; и Grattan and Burton (1991) Semin Dermatol 10(3): 152-159. Из вышеописанного ясно, что пациентами "с подозрением на болезнь Дего" являются не все пациенты интересующих видов.
В некоторых вариантах осуществления способы могут включать выявление пациентов с болезнью Дего, с подозрением на болезнь Дего или с риском развития болезни Дего. Подходящие способы для выявления пациентов известны в данной области. Например, Ackerman описывает гистологический способ для позитивного выявления кожных повреждений, ассоциированных с болезнью Дего. Am J Dermatopathol (1985) 7(2): 105-7. Как описано выше, Болезнь Дего может быть ассоциирована с наличием у пациентов антител против кардиолипину, волчаночного антикоагулянта и/или антител против фосфолипиду. Диагностические гистологические способы также представлены в качестве примера в демонстрационных примерах. Подходящие способы детекции наличия этих антител в крови пациента известны в данной области и описаны, например, в Caux et al. (1994) Ann Dermatol Venereol 121:537-542. В некоторых вариантах осуществления болезнь Дего может быть ассоциирована с накоплением IgA в кожной сосудистой системе. Способы для детекции такого накопления известны в данной области. См., например, Crowson et al. (2002), выше.
Кроме того, как описано в демонстрационных примерах, болезнь Дего может быть ассоциирована с заметным сосудистым накоплением C5b-9 MAC, а также повышенными сывороточными уровнями C-реактивного белка и фактора VIII. Способы для детекции каждого из этих параметров приведены в качестве примера в настоящем документе.
В некоторых вариантах осуществления композицию можно вводить индивидууму профилактически для предупреждения прогрессирования доброкачественной формы болезни Дего в системную мультиорганную форму заболевания. Например, пациенту с кожной формой болезни Дего можно вводить композицию, описываемую в настоящем документе, для предупреждения или снижения вероятности развития у пациента летальной системной формы болезни Дего. Аналогично, пациенту с болезнью Дего, которая ассоциирована с B19-парвовирусной инфекцией, инфекцией ВИЧ или аутоиммунным заболеванием, можно вводить композицию, описываемую в настоящем документе, для предупреждения или уменьшения вероятности развития болезни Дего у пациента.
Термин "предупреждение" хорошо известен в данной области, и при использовании по отношению к заболеванию широко распространен в данной области, и включает введение композиции, которая снижает частоту или замедляет появление симптомов медицинского состояния у индивидуума по сравнению с индивидуумом, который не получает композицию. Таким образом, предупреждение болезни Дего включает, например, замедление прогрессирования доброкачественной формы болезни Дего в системную мультиорганную форму заболевания в популяции пациентов, получающих профилактическое лечение по сравнению с нелеченной контрольной популяцией, и/или снижает и/или замедляет возникновение одного или нескольких симптомов заболевания у леченной популяции по сравнению с нелеченной контрольной популяцией, например, по статистически и/или клинически значимому количеству.
В некоторых вариантах осуществления ингибитор комплемента человека (например, антитело против C5 или его антигенсвязывающий фрагмент) и/или ингибитор интерферона альфа можно вводить индивидууму в виде монотерапии. Альтернативно, как описано выше, ингибитор можно вводить индивидууму в виде комбинированного лечения с другим лечением, например, другим лечением для болезни Дего. Например, комбинированное лечение может включать введение индивидууму (например, пациенту-человеку) одного или нескольких дополнительных средств (например, антикоагулянтов или противовоспалительных средств), которые обеспечивают терапевтическое благоприятное воздействие индивидууму с болезнью Дего или с риском развития болезни Дего. В некоторых вариантах осуществления ингибитор комплемента человека (например, антитело против C5) или ингибитор интерферона альфа и одно или более дополнительных активных средств вводят одновременно. В других вариантах осуществления ингибитор вводят первым по времени и одно или более дополнительных активных средств вводят вторыми по времени. В некоторых вариантах осуществления одно или более дополнительных активных средств вводят первыми по времени и ингибитор вводят вторым по времени.
Ингибитор комплемента человека или ингибитор интерферона альфа могут замещать или дополнять ранее или в настоящее время проводимую терапию. Например, при лечении антителом к C5 или его антигенсвязывающим фрагментом, введение одного или нескольких дополнительных активных средств можно прекращать или уменьшать, например, вводить в более низких уровнях. В некоторых вариантах осуществления введение предшествующей терапии сохраняется. В некоторых вариантах осуществления предшествующая терапия сохраняется до тех пор, пока уровень ингибитора комплемента человека (например, антитела против C5) или ингибитора интерферона альфа не достигнет уровня, достаточного для обеспечения терапевтического эффекта. Две терапии можно вводить в комбинации.
Мониторинг пациента (например, пациента-человека) на улучшение болезни Дего, как определено в настоящем документе, означает оценку изменения параметров заболевания у пациента, например, улучшение одного или нескольких симптомов заболевания. Например, врач-терапевт может оценить степень накопления C5b-9 MAC в сосудах до и после лечения с использованием ингибитора комплемента, описываемого в настоящем документе. Такие симптомы включают любые симптомы болезни Дего, описываемые в настоящем документе. В некоторых вариантах осуществления оценку проводят по меньшей мере 1 час, например, по меньшей мере 2, 4, 6, 8, 12, 24 или 48 часов, или по меньшей мере 1 день, 2 дня, 4 дня, 10 дней, 13 дней, 20 дней или дольше, или по меньшей мере 1 неделю, 2 недели, 4 недели, 10 недель, 13 недель, 20 недель или дольше, после введения. Пациента можно оценивать в один или несколько следующих периодов: перед началом лечения; в течение лечения; или после того, как введены один или несколько элементов лечения. Оценка может включать в себя оценку необходимости дальнейшего лечения, например, оценку того, следует ли изменить дозировку, частоту введения или длительность лечения. Она может также включать в себя оценку необходимости добавления или удаления выбранной терапевтической модальности, например, добавление или удаление любого лечения болезни Дего, описываемого в настоящем документе.
Подходы ex vivo. Когда ингибитор комплемента человека или ингибитор интерферона альфа представляет собой полипептид (например, антитело) или нуклеиновую кислоту (например, миРНК или антисмысловую нуклеиновую кислоту), стратегия ex vivo для лечения или предупреждения болезни Дего может включать в себя трансфекцию или трансдукцию одной или нескольких клеток, полученных от индивидуума, полинуклеотидом, кодирующим белок, или нуклеиновой кислотой. Например, клетки можно трансфицировать одиночным вектором, кодирующим тяжелую и легкую цепь антитела против C5, или клетки можно трансфицировать первым вектором, кодирующим тяжелую цепь, и вторым вектором, кодирующим легкую цепь антитела.
Трансфицированные или трансдуцированные клетки затем возвращают индивидууму. Клетки могут быть любыми клетками из широкого спектра типов, включая без ограничения, гематопоэтические клетки (например, клетки костного мозга, макрофаги, моноциты, дендритные клетки, T-клетки или B-клетки), фибробласты, эпителиальные клетки, эндотелиальные клетки, кератиноциты или мышечные клетки. Такие клетки могут действовать в качестве источника (например, постоянного или периодического источника) ингибитора комплемента (например, антитела против C5 или его антигенсвязывающего фрагмента, или анти-C5 миРНК) или ингибитора интерферона альфа при условии, что клетки сохраняют жизнеспособность у индивидуума. В некоторых вариантах осуществления векторы и/или клетки могут быть сконфигурированы для индуцибельной или репрессируемой экспрессии антитела (см., например, Schockett et al. (1996) Proc Natl Acad Sci USA 93: 5173-5176 и патент США №7056897.)
Предпочтительно, клетки получают у индивидуума (аутологичные), но потенциально они могут быть получены у другого индивидуума того же вида (аллогенные).
Подходящие способы для получения клеток от индивидуума и трансдукции или трансфекции клеток известны в данной области молекулярной биологии. Например, этап трансдукции можно проводить любыми стандартными способами, которые применяются в генотерапии ex vivo, в том числе фосфат кальция, липофекция, электропорация, вирусная инфекция (см. выше), и биолистический перенос гена. См., например, Sambrook et al. (выше) и Ausubel et al. (1992) "Current Protocols in Molecular Biology," Greene Publishing Associates. Альтернативно, можно использовать липосомы или полимерные микрочастицы. Клетки, которые были успешно трансдуцированы, можно выбирать, например, для экспрессии кодирующей последовательности или гена лекарственной устойчивости.
Наборы
Изобретение также относится к промышленным изделиям или наборам, которые включают в себя контейнер с этикеткой; и композицию, содержащую один или несколько (например, один, два, три, четыре, пять, шесть, семь, восемь, девять или 10 или более) ингибитор(-ов) комплемента человека (например, антитело против C5 или его антигенсвязывающий фрагмент) и/или один или несколько (например, один, два, три, четыре, пять, шесть, семь, восемь, девять или 10 или более) ингибиторов интерферона альфа (например, антитело против интерферона альфа). Этикетка указывает, что композиция предназначена для введения субъекту (например, человеку) с болезнью Дего, с подозрением на болезнь Дего или подверженному риску развития болезни Дего. Набор необязательно может включать способы для введения композиции индивидууму. Например, наборы могут включать один или несколько шприцев.
В некоторых вариантах осуществления наборы могут содержать два или более (например, три, четыре, пять, шесть, семь, восемь, девять или 10 или более) различных типов ингибиторов комплемента человека. Например, набор может содержать антитело против C5 (или его антигенсвязывающий фрагмент) и миРНК, которая связывается с мРНК, кодирующей белок С5 человека. В некоторых вариантах осуществления набор может содержать антитело против C5, миРНК и низкомолекулярный ингибитор комплемента.
В некоторых вариантах осуществления наборы могут дополнительно включать одно или более дополнительных активных средств, таких как любое из описываемых в настоящем документе. Например, наборы могут включать один или несколько антикоагулянтов, антитромботических средств или противовоспалительных средств. Наборы могут также включать одну или несколько терапий, направленных на B-клетки, таких как антитело против CD20. Наборы могут необязательно включать один или несколько способов для определения наличия антител против кардиолипину, волчаночного антикоагулянта, антител против фосфолипиду и/или наличия отложения IgA в сосудах.
Следующие примеры предназначены для иллюстрации изобретения и не являются ограничивающими.
Примеры
Пример 1. Материалы и способы
Обычная световая микроскопия. Срезы ткани, погруженной в парафин и фиксированной формалином, толщиной пять микрон окрашивали гематоксилином и эозином и исследовали при помощи общепринятой световой микроскопии.
Иммуногистохимическая оценка MxA. Предметные стекла, используемые для определения белка MxA, помещали в Tissue Tek Slide Holders и ванночки для окрашивания (Miles, Elkhart, IL) и погружали в 200 мл буфера ЭДТА, pH 8,0 (Zymed Laboratories, South San Francisco, CA). После 30 минут инкубации с первичными антителами, проводили окрашивание с использованием коммерчески доступного набора Vision BioSystems Define с соблюдением протокола. Инкубацию с первичными антителами проводили с использованием следующих разведений: антитело против MxA 1:1600. Делали полукачественную оценку в отношении степени окрашивания на основании приблизительного процента клеток, окрашенных на конкретный маркер, а также распределения окрашивания по предметному стеклу. Предметные стекла заклеивали покровными стеклами при помощи системы Shandon Consul®-Mount Histology (Product No. 9990440) на приборе для автоматического заклеивания покровными стеклами Consul (ThermoShandon, Pittsburgh, PA). См. Magro et al. (2009) J Cutan Pathol (November 4, электронная публикация перед опубликованием; PMID: 19891658).
Иммунофлуоресцентные исследования ткани. Следующие иммунофлуоресцентные исследования (как описано в Crowson and Magro (1996) Human Pathol 27: 15-19) проводили на биопсийном материале кожи, который получали в транспортной среде Михаэлиса и затем хранили при t -30°C. Прямые иммунофлуоресцентные (DIF) исследования на иммуноглобулин G (IgG), IgA, IgM, фибрин и компонент комплемента C3 (DAKO, Carpinteria, CA, USA) проводили на поврежденной коже путем наложения первичных антител, конъюгированных с флуоресцеином, на индивидуальные биопсийные срезы. Способ непрямой иммунофлуоресценции (IF) с кроличьим антителом против мыши, конъюгированным с флуоресцеином, применяли для выявления наличия C5b-9 MAC (DAKO), посредством его связывания с первичным антителом против C5b-9, изначально связавшимся с биопсийным срезом.
Электронная микроскопия. Биопсийную ткань кожи помещали в глутаральдегидный фиксатор для исследования ультраструктуры.
Клеточная культура для исследований с помощью непрямой иммунофлуоресценции и Вестерн-блоттинга. Эндотелиальные клетки кровеносных микрососудов неонатальной дермы человека, HMVEC-dBlNeo (Lonza, Walkersville, MD), культивировали при 37°C в полной среде (минимальная среда EGM®-2, дополненная реагентами EGM®-2 MV BulletKit® и 5% Premium FBS) (Lonza) с 5% CO2. Клетки культивировали в течение периода времени, достаточного для достижения от 75% до 80% конфлюэнтности во флаконах для культивирования. Клетки затем отмывали теплым фосфатно-солевым буфером (PBS) и собирали с использованием раствора 1X трипсин-ЭДТА (Sigma-Aldrich, St. Louis, MO). После дополнительного отмывания PBS, клетки снова рассаживали в предварительно прогретой полной среде на штатив с предметными стеклами для культивирования ткани (Nunc Lab-Tek™ Chamber Slide System, 2 лунки на Permanox™, Sigma-Aldrich) с плотностью 2×104 клеток/мл. Штатив с предметными стеклами культивировали в течение 24 часов при 37°C с 5% CO2, после чего удаляли среду. После удаления среды снимали предметные стекла с каждого штатива, промывали в PBS, а затем высушивали на воздухе в сочетании с бумажными полотенцами для впитывания избытка PBS. Высушенные предметные стекла затем хранили при -80°C в герметичном контейнере до исследования с помощью иммунофлуоресцентной микроскопии.
Исследования при помощи Вестерн-блоттинга. Культивированные клетки HMVEC-dBlNeo лизировали при помощи лизирующего буфера, состоящего из 0,05 M фторида натрия, 1% Тритона X-100, 50 мМ Трис-HCl (pH 8,0), 150 мМ NaCl, 1 мМ ортованадата натрия, 1 мМ фенилметилсульфонил фторида и 1:200 разведения Calbiochem Protease Inhibitor Cocktail Set III (EMD Chemicals, Inc., Gibbstown, NJ) в течение 30 минут при 4°C, изредка встряхивая. Лизаты затем очищали от ядер и другого нерастворимого материала при помощи микроцентрифугирования. Затем буфер с β-меркаптоэтанолом (в конечной концентрации 5%) для нанесения на полиакриламидный гель с додецилсульфатом натрия(SDS-PAGE) добавляли к клеточным лизатам (1:4 разведение 5X буфера для нанесения в лизате) перед кипячением в течение двух минут.Лизаты затем разделяли посредством электрофореза на гелях SDS-PAGE в градиенте Трис-HCl от 8% до 16% (BioRad, Hercules, CA) и переносили на нитроцеллюлозные мембраны Whatman Protran™ (Sigma-Aldrich). Мембраны инкубировали в течение шести часов при комнатной температуре с блокирующим раствором 3% обезжиренного молока в трис-буферный физиологический раствор с 0,1% Твин-20 (TBS-T) на орбитальном встряхивателе, а затем устанавливали в держатель для блотов Miniblotter 25 (Immunetics, Cambridge, MA). Лунки миниблоттера заполняли или сывороткой пациента или здоровой контрольной сывороткой, разведенной 1:250 в TBS-T, содержащем 0,2% бычий сывороточный альбумин, и миниблоттер мягко качался в течение ночи при 4°C на орбитальном шейкере. Затем сыворотку удаляли, лунки отмывали дважды TBS-T, и вынимали мембраны из аппарата. После дополнительного обильного отмывания TBS-T, мембраны окрашивали в течение двух часов при комнатной температуре с разведенным 1:20000 козлиными вторичными антителами против Ig человека (тяжелая и легкая цепь), конъюгированными с пероксидазой хрена (SouthernBiotech, Birmingham, AL). После обильного отмывания мембран TBS-T, выявляли комплексы антител при помощи Supersignal® West Pico Chemiluminiscent Substrate (Thermo Scientific, Rockford, IL) с визуализацией хемилюминисцентных полос на радиоавтографической пленке HyBlot CL™ (Denville Scientific, Inc., Metuchen, NJ).
Непрямые иммунофлуоресцентные исследования для выявления наличия антител против эндотелиальных клеток. Образцы сыворотки разбавляли с фактором разведения 1:100 и инкубировали с эндотелиальными клетками кожи человека. Связывание антител выявляли при помощи козлиных антител против IgG человека, конъюгированных с флуоресцеином (разведенных 1:100 в PBS; Caltag, Burlingame, CA). Комплексы флуоресцент-антитело визуализировали при помощи микроскопа Olympus и записывали изображения при помощи цифровой камеры.
Пример 2. Результаты
История болезни. В течение двухлетнего периода у здорового мужчины 43 лет развились бессимптомные небольшие повреждения кожи, изначально характеризующиеся как индуцированные папулярные повреждения, в результате переходящие в вогнутые белые рубцы. 23 июля 2009 года пациент поступил в отделение неотложной помощи с трехдневной перемежающейся субфебрильной лихорадкой, которая сопровождалась сильной болью в животе и рвотой зеленого оттенка. Провели диагностическую лапаротомию - удалили небольшой сегмент кишки. Образцы и кожи, и кишки демонстрировали классические изменения, связанные с болезнью Дего. Антител против кардиолипину, антител против бета-2 гликопротеину или волчаночного антикоагулянта выявлено не было. Дополнительные лабораторные исследования подтвердили чрезмерно повышенный уровень фактора VIII в сыворотке (на 199 выше нормы), повышенный уровень фактора фон Виллебранда (VWF) (на 217 выше нормы) и повышенный уровень фактора роста сосудистых эндотелиальных клеток (VEGF). В то время как уровни белков компонентов комплемента C2, C3 и C4 определялись в пределах нормы, уровни C5 были повышены.
Пациенту провели торакоцентез для облегчения пневмоторакса. Лечение пациента начали с внутривенного гамма глобулина и Lovenox® в дозе 490 мг ежедневно. К последующему посещению 12 августа 2009 г., пациент похудел на 15 фунтов за счет снижения аппетита из-за постоянной боли в животе. При исследовании дыхательной системы пациент показал снижение дыхательных шумов в нижних отделах. Уровни C-реактивного белка, VWF и VEGF у пациента оставались повышенными - 6,51, 177 и 971, соответственно. После четырех курсов IVIG было некоторое улучшение кожных повреждений у пациента, хотя пациент продолжал страдать от боли в животе. В октябре 2009 г.у пациента развилась боль в груди и одышка, что потребовало госпитализации. У пациента быстро развилась гемодинамическая декомпенсация и он был помещен в медицинское отделение интенсивной терапии. Было замечено, что пациент имеет фракцию выброса 14%, что связано с большим количеством перикардиальной и плевральной жидкости. Получили перикардиальную биопсию, которая подтвердила тяжелую тромботическую микроангиопатию, что согласуется с болезнью Дего. Также наблюдали накопление C5b-9 в сосудах. После этого пациенту ввели экулизумаб. Произошло почти немедленное улучшение состояния пациента. Например, его фракция выброса значительно улучшилась. В течение 24 часов после получения экулизумаба пациент был экстубирован и переведен в терапевтическое отделение. В течение нескольких следующих недель симптомы пациента улучшались, и была задача улучшения внешнего вида его кожных повреждений.
Патология. У пациента получали три набора кожной биопсии. Время, в которое проводили эти биопсии, было связано с изменениями в терапевтическом вмешательстве. Первый набор был получен у пациента перед введением или IVIG, или экулизумаба и включал две фазы развития повреждений кожи. Одна биопсия была из индуцированного папулярного повреждения и выявила экстраординарное накопление муцина в мезенхиме, морфологический показатель, который привел к ошибочному начальному диагнозу отечной красной волчанки двумя годами ранее. Исследование сосудистой системы выявило нарушения, включающие набухание эндотелиальных клеток, некроз и отслойку с очаговым накоплением фибрина пристеночно и в просвете сосудов. Биопсия вдавленной рубцовой папулы фарфорового цвета, связанной с классической болезнью Дего, показала заметное истончение эпидермиса и фиброз дермы с закупоркой сосудов. Сосуды демонстрировали обширную окклюзивную тромботическую микроангиопатию с дегенерацией/некрозом эндотелиальных клеток и отторжением эндотелиальных клеток в просвет сосуда. Все биопсии выявили нехватку воспалительных клеток. Образец кишки показал обширную облитерирующую васкулопатию, поражающую артерии большего калибра в подслизистой.
Через несколько недель после начала IVIG, получали другую биопсию кожи, анализ которой выявил стойкие ишемические изменения кожи, в том числе муцин, фиброз и истончение эпителия. Однако было отмечено снижение объема активного повреждения сосудов. Не наблюдали сосудов, содержащих значительное пристеночное и просветное накопление фибрина.
Дополнительный набор биопсий (третий набор) получали у пациента через две недели после введения экулизумаба. Анализ биопсийной ткани выявил поверхностную фиброплазию с закупоркой сосудов. Сосуды были утолщены, что отражало зону редупликации базальной мембраны. Только редкие сосуды демонстрировали повреждение эндотелиальных клеток и тромбоз.
Оценка интерферона альфа в образцах ткани. Наблюдали обширную экспрессию белка MxA в эндотелиальных клетках, воспалительных клетках и эпидермальных кератиноцитах.
Иммунофлуоресцентные исследования C5b-9. Непрямые иммунофлуоресцентные исследования выявили обширные накопления C5b-9 в сосудистой системе кожи в первом наборе биопсий до начала IVIG и/или экулизумаба. Паттерн отложений был как пристеночным, так и внутри просвета. Объем накоплений был очень заметен и вовлекал несколько сосудов на всем протяжении дермы. Хотя IVIG до некоторой степени снижает накопление C5b-9, объем накопления C5b-9, наблюдаемый в биопсиях, полученных от пациента после терапии экулизумабом, заметно уменьшился. Только три сосуда показали пристеночное накопление C5b-9.
Электронная микроскопия. Ультраструктурный анализ биопсийной ткани, полученной до лечения, показал обширные трубчатые сетчатые структуры в эпидермальных кератиноцитах и в эндотелиальных клетках на всем протяжении дермы. Выстилающие эндотелиальные клетки демонстрировали глубокие дегенеративные изменения с отслойкой клеток в просвет сосудов. Зоны васкулярной базальной мембраны были редуплицированы и также демонстрировали накопление коллагена.
Анализ антител против эндотелиальным клеткам. Сыворотку пациента, полученную до лечения экулизумабом, и сыворотку, полученную через две недели после лечения экулизумабом, инкубировали с эндотелиальными клетками кожи и антителами человека против IgG, конъюгированными с флуоресцеином. Гранулярное окрашивание ядер наблюдали в большинстве эндотелиальных клеток в образцах до и после лечения экулизумабом. Окрашивания не наблюдалось, когда сыворотка пациента контактировала с эндотелиальными клетками пупочной вены человека.
Вестерн-блоттинг исследования с использованием лизатов эндотелиальных клеток. Сыворотку пациента до и после лечения также использовали для анализа вестерн-блоттинга для идентификации белка или белков, с которыми связываются человеческие антитела против антителам человека в сыворотке пациента. Как описано выше, сыворотку до и после лечения инкубировали с мембраной, содержащей разделенные по размеру белки эндотелиальной клетки, и любое связывание антител с белками на мембране выявляли посредством вторичного антитела, конъюгированного с флуоресцеином. Наблюдали четкую полосу иммунореактивности, соответствующую молекулярной массе 92 кДа. Аналогичная полоса реактивности в случаях нормального контроля или на Вестерн-блоттингах лизатов эндотелиальных клеток пупочной вены человека не выявлялась.
Оценка уровней интерферона альфа в сыворотке. Уровни интерферона альфа в периферической крови пациента были очень высокими - измеренное значение 20,56, что было сравнимо с пациентами с красной волчанкой и в несколько раз выше, чем уровни интерферона альфа в крови здоровых пациентов.
Обсуждение. У пациента, описываемого в настоящем документе, развилась мультиочаговая кишечная, перикардиальная, миокардиальная и кожная ишемия, связанная со значительным повреждением эндотелиальных клеток. Симптомы пациента соответствовали болезни Дего. При использовании кожных эндотелиальных клеток в качестве субстрата при помощи способов непрямой иммунофлуоресценции и вестерн-блоттинга были выявлены антитела против эндотелиальных клеток. Доминантный антигенный эпитоп выделяли на основании анализа вестерн-блоттинга, хотя его идентичность остается неясной. Принимая во внимание полученные данные о том, что антитела против эндотелиальных клеток не реагируют с клетками пупочной вены человека, вполне вероятно, что антитела против эндотелиальных клеток, наблюдаемые у этого пациента, были органоселективными, тем самым иммуногенность к эпитопу выбранной эпителиальной клетки зависит от места.
Исследования, описываемые в настоящем документе, подразумевают, что повреждение эндотелия, опосредованное комплементом, является вероятным эффекторным механизмом у пациента с болезнью Дего, которого лечили экулизумабом. Присутствовал значительный объективный клинический и патологический ответ на введение лекарственного средства.
Экспрессия интерферона альфа была заметно повышена в сыворотке пациента, а также в его ткани. Известно, что интерферон альфа активирует приобретенный и врожденный иммунитет, усиливая эффекты любых антигенных триггеров. Сообщалось, что введение экзогенного интерферона альфа является причиной кожных язв и тромбоза в коже. Показатель интерферона альфа в периферической крови пациента был удивительно похож на тот, который наблюдают у пациентов с SLE, хотя у пациента не было специфических клинических признаков системной красной волчанки. Результаты, описываемые в настоящем документе, поддерживают вывод о том, что ингибирование интерферона альфа у пациентов с болезнью Дего может быть полезным для лечения заболевания.
В заключение, экулизумаб определяет важную терапевтическую тактику для лечения болезни Дего, которая в противном случае является летальной. Точный активирующий фактор активации последовательности каскада комплемента неясен. В то время как антитела против эндотелиальных клеток (например, аутоантитела, которые связываются с антигеном массой 92 кДа, присутствующим на эндотелиальных клетках), провоцируя активацию классической последовательности каскада комплемента, могут быть причиной накопления C5b-9, роль распространения эпитопа на поверхности в естественном течении повреждения ткани мешает установлению прямого причинно-следственного воздействия этих антител. Тем не менее, в какой-то момент в течение болезни пациента для лечения болезни Дего может быть полезна дополнительная терапия, направленная на B-клетки, для того чтобы снизить выработку этих антител, при условии, что аутоантитела продолжают существовать.
Хотя настоящее изобретение было описано со ссылкой на его конкретные варианты осуществления, специалистам в данной области следует понимать, что могут быть сделаны различные изменения и могут быть замещены эквиваленты в пределах сущности и объема изобретения. Кроме того, может быть сделано множество модификаций для адаптации к конкретной ситуации, материалу, композиции материала, процессу, этапу или этапам процесса, к задаче, сущности и объему настоящего изобретения. Подразумевается, что все такие модификации находятся в пределах объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-C5a-АНТИТЕЛА И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2773779C2 |
| ПРОДЛЕНИЕ СРОКА ВЫЖИВАЕМОСТИ АЛЛОТРАНСПЛАНТАТА ПУТЕМ ИНГИБИРОВАНИЯ АКТИВНОСТИ КОМПЛЕМЕНТА | 2007 |
|
RU2445975C2 |
| СВЯЗЫВАЮЩИЕ КОМПЛЕМЕНТ АПТАМЕРЫ И СРЕДСТВА ПРОТИВ С5, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ НАРУШЕНИЙ | 2007 |
|
RU2477137C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| Способы лечения состояний, связанных с masp-2 зависимой активацией комплемента | 2012 |
|
RU2662563C2 |
| АНТИТЕЛА К КОМПОНЕНТУ КОМПЛЕМЕНТА С5 | 2015 |
|
RU2693430C2 |
| ГУМАНИЗИРОВАННАЯ МОДЕЛЬ НАРУШЕНИЙ СО СТОРОНЫ ПОЧЕК И ПЕЧЕНИ | 2018 |
|
RU2772583C2 |
| МОДУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА | 2015 |
|
RU2670988C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С MASP-2-ЗАВИСИМОЙ АКТИВАЦИЕЙ КОМПЛЕМЕНТА | 2014 |
|
RU2718850C2 |
| МОДУЛЯТОРЫ АКТИВНОСТИ КОМПЛЕМЕНТА | 2017 |
|
RU2778811C2 |





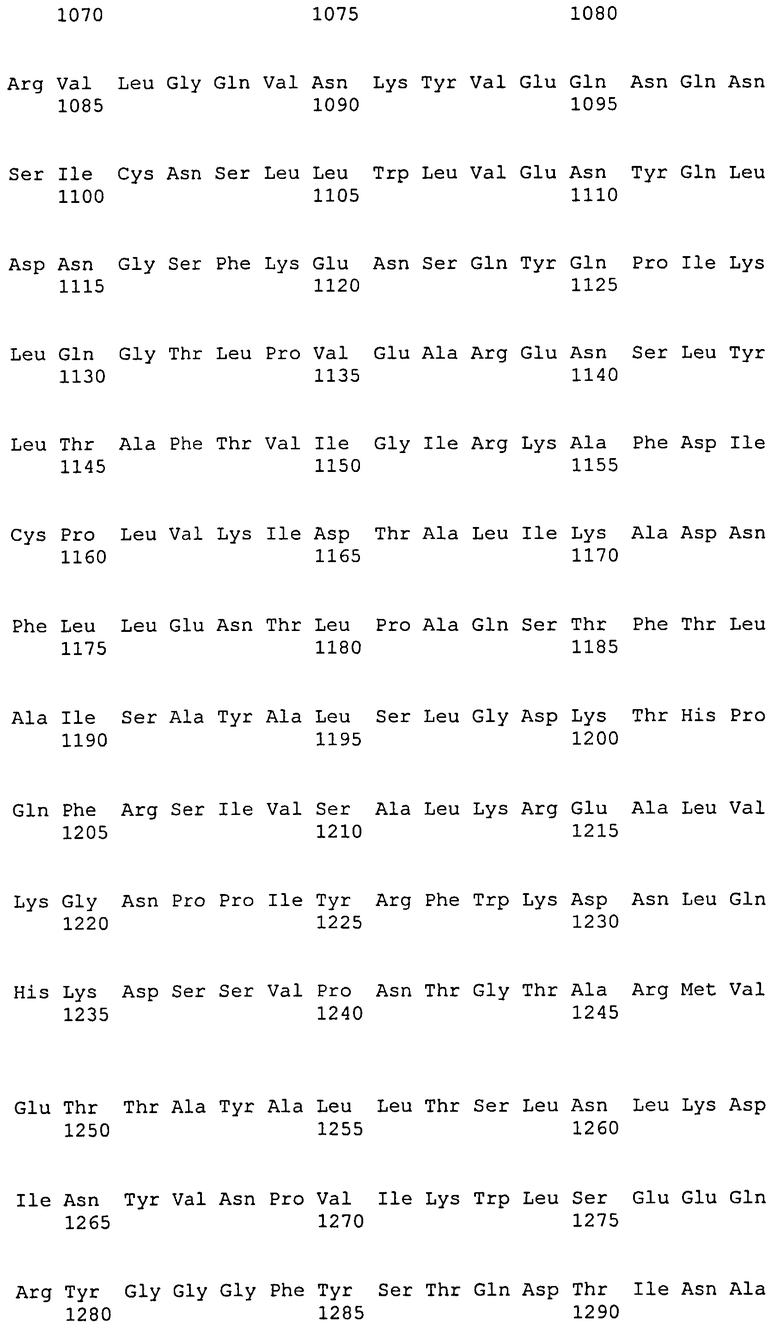




























Настоящее изобретение относится к медицине, а именно к терапии и иммунологии, и касается лечения болезни Дего. Для этого вводят эффективное количество ингибитора комплемента в виде монотерапии или в составе общепринятой комплексной терапии. Это обеспечивает повышение эффективности лечения данного заболевания за счет уменьшения опосредованного комплементом повреждения эндотелия. 14 з.п.ф-лы, 2 пр.
1. Способ лечения пациента, страдающего болезнью Дего, включающий введение пациенту, страдающему болезнью Дего, ингибитора комплемента в количестве, достаточном для лечения заболевания или уменьшения тяжести одного или нескольких симптомов заболевания.
2. Способ по п.1, где ингибитор комплемента вводят пациенту длительно.
3. Способ по п.1, дополнительно включающий выявление пациента, страдающего болезнью Дего, или с подозрением на болезнь Дего.
4. Способ по п.1, где болезнь Дего ассоциирована с B19-парвовирусной инфекцией или инфекцией вирусом иммунодефицита человека.
5. Способ по п.1, где болезнь Дего является идиопатической.
6. Способ по п.1, где болезнь Дего патологически поражает желудочно-кишечный тракт, центральную нервную систему или сердечно-сосудистую систему.
7. Способ по п.1, где болезнь Дего представляет собой мультиорганную системную болезнь Дего.
8. Способ по п.1, где болезнь Дего устойчива по меньшей мере к одной терапии, выбранной из группы, состоящей из противовоспалительного средства, антикоагулянта, антитромботического средства и внутривенно вводимого иммуноглобулина.
9. Способ по п.1, где ингибитор комплемента выбран из группы, состоящей из растворимых CR1, LEX-CR1, МСР, DAF, CD59, фактора H, фактора яда кобры, FUT-175, комплестатина и K76 СООН.
10. Способ по п.1, где ингибитор комплемента представляет собой антитело или его антигенсвязывающий фрагмент, который связывается с белком компонента комплемента человека.
11. Способ по п.10, где антитело или его антигенсвязывающий фрагмент связываются с белком компонента C5 комплемента человека.
12. Способ по п.11, где антитело или его антигенсвязывающий фрагмент ингибируют расщепление компонента C5 комплемента на фрагменты С5a и С5b.
13. Способ по п.10, где антитело или его антигенсвязывающий фрагмент выбраны из группы, состоящей из гуманизированного антитела, рекомбинантного антитела, диатела, химеризованного или химерного антитела, деиммунизованного антитела человека, полностью человеческого антитела, одноцепочечного антитела, фрагмента Fv, фрагмента Fd, фрагмента Fab, фрагмента Fab′ и фрагмента F(ab′)2.
14. Способ по п.10, где ингибитор комплемента представляет собой экулизумаб.
15. Способ по п.10, где ингибитор комплемента представляет собой пекселизумаб.
| RU 2008103312 A 10.08.2009 | |||
| US 2004043019 A1 04.03.2004 | |||
| MOLENAAR WM et al | |||
| "The pathology and pathogenesis of malignanr atrophic papulosis (Degos'disease) | |||
| A case study with reference to other vascular disoders" | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| BALL E | |||
| et al | |||
| "Degos' disease: a | |||
Авторы
Даты
2015-12-10—Публикация
2011-03-01—Подача