Перекрестная ссылка на родственные заявки
Настоящая заявка заявляет приоритет предварительной заявки на патент США № 62/475573, поданной 23 марта 2017 г., содержание которой в полном объеме включено в настоящее описание посредством ссылки.
Заявление о финансовой поддержке государством исследования или развития
Настоящее изобретение было выполнено при государственной поддержке согласно гранту NIH AI44970, выданного Национальными институтами здоровья (NIH). Правительство имеет определенные права на изобретение.
Уровень техники
Система комплемента является частью врожденного иммунитета, который играет ключевую роль в защите организма хозяина. Однако активированный комплемент также потенциально может вызывать значительное повреждение и разрушение тканей, и было обнаружено, что нарушение регуляции активности комплемента ассоциировано с рядом редких и распространенных заболеваний, таких как пароксизмальная ночная гемоглобинурия (PNH), атипичный гемолитико-уремический синдром, ревматоидный артрит, возрастная макулярная дегенерация и т. д. Таким образом, антикомплементная терапия является перспективным способом лечения этих расстройств человека.
C5-компонент системы комплемента является критическим белком на терминальном пути активации комплемента и является белком-предшественником в генерации сильного провоспалительного медиатора C5a, а также цитолитического мембраноатакующего комплекса (MAC), C5b-9.
При некоторых опосредованных комплементом заболеваниях процессы, опосредованные обоими C5a и MAC, могут вносить свой вклад в развитие патогенеза, в то время как при других заболеваниях может вовлекаться только C5a-опосредованное воспаление или MAC-опосредованное повреждение клеток. Поскольку медиаторы комплемента, включая C5a и MAC, также играют важную роль в защите организма хозяина от патогенной инфекции, то желательно, чтобы при разработке терапевтических средств разрабатывались селективные антикомплементные лекарственные препараты, т. е. лекарственные средства, которые блокируют только отрицательное воздействие комплемента в повреждении тканей, оставляя его нормальную защитную функцию для хозяина интактной.
Причиной развития гемолитической болезни PNH является MAC. Существуют другие анти-C5 mAb для лечения PNH. Однако эти антитела чрезмерно блокируют продукцию C5a, подвергая пациентов большему риску инфицирования, чем терапевтическое средство, которое блокирует только MAC. Аналогично, существуют опосредованные комплементом заболевания, которые в основном могут быть опосредованы C5a-зависимым воспалением (например, сепсис), и для таких патологических состояний лекарственное средство на основе анти-C5 mAb, хотя и ожидается, что оно будет эффективным, будет излишне блокировать MAC в качестве побочного эффекта.
Таким образом, в данной области существует потребность в mAb против человеческого C5a, которые могут ингибировать активность, опосредованную C5a, но не блокируют активность MAC. Настоящее изобретение направлено на решение этих и других потребностей.
Сущность изобретения
В одном варианте осуществления настоящее изобретение относится к антителу, которое специфически связывается с C5a. В одном варианте осуществления C5a представляет C5a человека. В одном варианте осуществления антитело представляет моноклональное антитело. В одном варианте осуществления антитело представляет гуманизированное антитело. В некоторых вариантах осуществления антитело представляет полноразмерное антитело. В некоторых вариантах осуществления антитело представляет фрагмент антитела, который включает, не ограничиваясь ими, Fab, Fab', F(ab)2, F(ab')2 и scFv. В некоторых вариантах осуществления антитело является частью конструкции, например, слитой конструкции, содержащей антитело и нацеливающую молекулу или эффекторную молекулу. В некоторых вариантах осуществления антитело является частью конъюгата, такого как конъюгат антитело-лекарственное средство.
В одном варианте осуществления антитело представляет химерное антитело. В одном варианте осуществления антитело содержит, по меньшей мере, один из CDR, выбранный из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10, или их варианта или вариантов. В одном варианте осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10, или их вариант или варианты. В одном варианте осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант. В одном варианте осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант. В одном варианте осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант. В одном варианте осуществления антитело представляет собой 7A12.
В одном варианте осуществления настоящее изобретение относится к способу лечения опосредованного путем комплемента заболевания или расстройства, у индивида, включающему стадию введения указанному индивиду анти-C5a-антитела, описанного в настоящем документе. В одном варианте осуществления заболевание или расстройство, по меньшей мере, выбрано из группы, состоящей из: макулярной дегенерации (MD), возрастной макулярной дегенерации (AMD), ишемического-реперфузионного повреждения, артрита, ревматоидного артрита, волчанки, язвенного колита, инсульта, постоперационного синдрома системного воспалительного ответа, астмы, аллергической астмы, хронической обструктивной болезни легких (COPD), синдрома пароксизмальной ночной гемоглобинурии (PNH), аутоиммунной гемолитической анемии (AIHA), болезни Гоше, миастении гравис, нейромиелита зрительного нерва, NMO, рассеянного склероза, отсроченной функции трансплантата, антитело-опосредованного отторжения, атипичного гемолитико-уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, септического шока, трансплантации органа, воспаления (включая, не ограничиваясь: воспаление, связанное с кардиопульмональным шунтированием и диализом почек), C3-гломерулопатии, мембранозной нефропатии, IgA-нефропатии, гломерулонефрита (включая, не ограничиваясь ими, антинейтрофильные цитоплазматические антитела (ANCA)-ассоциированный гломерулонефрит, волчаночный нефрит и их комбинации), ANCA-ассоциированного васкулита, индуцированного шига-токсином HUS, и индуцированной антифосфолипидными антителами потери беременности, болезни «трансплантат против хозяина» (GVHD) или любых их комбинаций. В некоторых вариантах осуществления AP-опосредованное заболевание представляет сепсис, септический шок, ревматоидный артрит, аутоиммунную гемолитическую анемию, GvHD, антифосфолипидный синдром или болезнь Гоше. В одном варианте осуществления введение анти-C5a-антитела ингибирует активность белка C5a.
В одном варианте осуществления настоящее изобретение относится к способу снижения активности системы комплемента индивида, где способ включает введение антитела индивиду путем введения, выбранным из группы, состоящей из энтерального введения, парентерального введения, и их комбинации, и где антитело содержит шесть определяющих комплементарность участков, имеющих следующие аминокислотные последовательности: SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10, или их вариант или варианты. В одном варианте осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном варианте осуществления настоящее изобретение описывает антитело против человеческого C5a, где антитело имеет вариабельную область тяжелой цепи (VH), которая имеет аминокислотную последовательность, которая более чем примерно на 90% (например, более чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентична SEQ ID NO: 2 или ее варианту. В одном варианте осуществления антитело представляет фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном варианте осуществления настоящее изобретение описывает антитело против человеческого C5a, где антитело имеет вариабельную область легкой цепи (VL), которая имеет аминокислотную последовательность, которая более чем примерно на 90% (например, более чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентична SEQ ID NO: 7 или ее варианту. В одном варианте осуществления антитело представляет фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном варианте осуществления настоящее изобретение представляет собой антитело против человеческого C5a, где антитело имеет вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), где область VH имеет аминокислотную последовательность, которая более чем примерно на 90% (например, более чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентична SEQ ID NO: 2 или ее варианту, и где область VL имеет аминокислотную последовательность, которая более чем примерно на 90% (например, более чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентична SEQ ID NO: 7 или ее варианту. В одном варианте осуществления антитело представляет фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном варианте осуществления настоящее изобретение представляет клетку, содержащую, по меньшей мере, одно из антител, описанных в другом месте данного документа. В одном варианте осуществления клетка продуцирует, по меньшей мере, одно из антител, описанных в другом месте данного документа. В одном варианте осуществления клетка представляет собой гибридому.
В одном варианте осуществления настоящее изобретение представляет клеточную линию, содержащую, по меньшей мере, одно из антител, описанных в настоящем документе. В одном варианте осуществления клеточная линия продуцирует, по меньшей мере, одно из антител, описанных в настоящем документе. В одном варианте осуществления клеточная линия представляет гибридомную клеточную линию.
Краткое описание фигур
Вышеизложенная сущность изобретения, а также последующее подробное описание примерных вариантов осуществления изобретения будет лучше понятно при прочтении в сочетании с прилагаемыми фигурами. Однако следует понимать, что изобретение не ограничивается приготовлением и инструментальными средствами вариантов осуществления, показанных на фигурах. На фигурах:
На фиг. 1, включающей фиг. 1А и фиг. 1В, представлены результаты, показывающие, что mAb 7А12 связывается с человеческим С5. На фиг. 1А показана реактивность 7А12 и 2G1, контрольного анти-С5 mAb, с интактным человеческим С5, оцененная с использованием ELISA. Планшет покрывали очищенным человеческим С5. После инкубации с серийными разведениями 7A12 или контрольного анти-С5 mAb связанные mAb детектировали с помощью HRP-конъюгированного кроличьего антимышиного IgG. 7A12 и контрольное анти-C5a mAb показали высокую реактивность с C5 человека. На фиг. 1В показано с использованием вестерн-блоттинга, что mAb 7A12 и контрольное анти-C5a mAb распознавали очищенный белок C5 человека в невосстанавливающих и восстанавливающих условиях соответственно. Наблюдаемая 7A12-реактивная полоса 190 кДа представляет полный белок C5, в то время как полоса 115 кДа представляет C5-цепь. NR: невосстанавливающие условия; R: восстанавливающие условия.
На фиг. 2 приведены результаты, показывающие, что в отличие от контрольного анти-C5 mAb 2G1, которое ингибирует лизис эритроцитов (RBC), 7A12 не проявляет активности в анализе гемолиза. Сенсибилизированные антителами овечьи эритроциты инкубировали с нормальной человеческой сывороткой (NHS), содержащей серийные разведения 7A12 или контрольного анти-C5a mAb при 37°C в течение 1 ч. Лизис RBC определяли измерением оптической плотности при OD405 нм. Как и ожидалось, контрольное анти-C5 mAb 2G1 ингибировало на 50% NHS-опосредованный лизис овечьих эритроцитов в зависимости от дозы. С другой стороны, mAb 7A12 в дозах от 0,975 до 120 мкг/мл не проявляло 50% ингибирования NHS-опосредованного лизиса овечьих эритроцитов.
На фиг. 3, включающей фиг. 3А и фиг. 3В, приведены результаты, показывающие, что в отличие от контрольного анти-С5 mAb 2G1, которое не связывает С5а, 7А12 связывает человеческий С5а в зависимости от дозы, но оно не связывает мышиный С5а. Планшет покрывали человеческим С5 или мышиным С5. После инкубации с серийными разведениями 7A12 или контрольного анти-С5 mAb связанное mAb детектировали с помощью HRP-конъюгированного кроличьего антимышиного IgG. На фиг. 3А показано, что mAb 7А12 демонстрировало высокую реактивность к человеческому С5а. Поскольку mAb 7A12 реагирует с полным белком C5 (как показано на фиг.1), то можно сделать вывод, что mAb 7A12 связывает как C5a-фрагмент нативного человеческого C5, так и свободный человеческий C5a. С другой стороны, не наблюдали связывания контрольного анти-C5a mAb с C5a человека. На фиг. 3В показано, что связывание mAb 7A12 с C5a было специфическим для человеческого C5a с незначительным связыванием с мышиным C5a.
На фиг. 4, включающей фиг. 4А и фиг. 4В, приведены результаты опытов по оценке аффинности связывания mAb 7А12 с человеческим С5 и С5а. Очищенный человеческий C5 или C5a сочетали на чипе CM4 с использованием метода аминного связывания. Анализ Biacore проводили на приборе Biacore-2000. Между каждым связыванием чип регенерировали, используя 50 мМ NaOH. mAb 7A12 связывается с человеческим C5, как показано на фиг. 4A, и человеческим C5a, как показано на фиг. 4B, с одинаковой аффинностью.
На фиг.5 приведены результаты, показывающие, что mAb 7A12, но не контрольное анти-C5 mAb 2G1, ингибирует C5a-опосредованную миграцию нейтрофилов. Человеческий C5a в концентрации 10 нМ использовали для индукции хемотаксиса линии человеческих моноцитарных клеток, U937, трансфицированных человеческим рецептором C5a. Клетки помещали в верхнюю камеру системы Transwell в присутствии mAb 7A12 или контрольного анти-C5 mAb 2G1, и миграцию клеток количественно определяли подсчетом клеток в нижней камере. mAb 7A12 показало полное ингибирование C5a-индуцированного хемотаксиса в концентрации 10 мкг/мл, тогда как контрольное анти-C5 mAb 2G1 не могло блокировать C5a-индуцированный хемотаксис.
На фиг. 6, включающей фиг. 6A-6D, приведены результаты, показывающие, что mAb 7A12, но не контрольное анти-C5 mAb 2G1, ингибирует C5a-индуцированную внутриклеточную мобилизацию кальция в клетках U937. Мобилизация кальция отсутствовала в клетках U937, экспрессирующих человеческий рецептор C5a (U937-C5aR) в отсутствии стимуляции человеческим C5a, как показано на фиг. 6A. Обработка C5a (10 нМ) приводила к транзиентному притоку кальция в клетках U937-C5aR, как показано на фиг. 6B, который можно было ингибировать предварительной инкубацией с mAb 7A12 (50 мкг/мл), как показано на фиг. 6C, но не с контрольным анти-C5 mAb 2G1 (50 мкг/мл), как показано на фиг. 6D. Стрелки указывают временную точку, на которой C5a или смесь C5a и антитела добавляли к клеточной суспензии.
На фиг. 7, включающей фиг. 7А и фиг. 7В, приведены последовательности вариабельных областей тяжелой и легкой цепей mAb 7А12. На фиг. 7А приведены последовательности нуклеиновых кислот и аминокислотные последовательности VH mAb 7А12. Сигнальный пептид подчеркнут, и последовательности CDR1, CDR2 и CDR3 выделены жирным шрифтом и выделены серым цветом. На фиг. 7В приведены последовательности нуклеиновых кислот и аминокислотные последовательности VL mAb 7A12. Сигнальный пептид подчеркнут, и последовательности CDR1, CDR2 и CDR3 выделены жирным шрифтом и выделены серым цветом.
Подробное описание изобретения
Настоящее изобретение относится к ингибированию сигнального пути комплемента с использованием анти-C5a-антитела. В различных вариантах осуществления изобретение относится к композициям и способам лечения опосредованного комплементом заболевания или опосредованного комплементом расстройства у индивида путем приведения в контакт индивида с анти-C5a-антителом. Опосредованные комплементом заболевания и расстройства, которые можно лечить композициями и способами по изобретению, включают, не ограничиваясь ими, макулярную дегенерацию (MD), возрастную макулярную дегенерацию (AMD), ишемическое-реперфузионное повреждение, артрит, ревматоидный артрит, волчанку, язвенный колит, инсульт, постоперационный синдром системного воспалительного ответа, астму, аллергическую астму, хроническую обструктивную болезнь легких (COPD), синдром пароксизмальной ночной гемоглобинурии (PNH), аутоиммунную гемолитическую анемию (AIHA), болезнь Гоше, миастению гравис, нейромиелит зрительного нерва, NMO, рассеянный склероз, отсроченную функцию трансплантата, антитело-опосредованное отторжение, атипичный гемолитико-уремический синдром (aHUS), окклюзию центральной вены сетчатки (CRVO), окклюзию центральной артерии сетчатки (CRAO), буллезный эпидермолиз, сепсис, септический шок, трансплантацию органа, воспаление (включая, не ограничиваясь: воспаление, связанное с кардиопульмональным шунтированием и диализом почек), C3-гломерулопатию, мембранозную нефропатию, IgA-нефропатию, гломерулонефрит (включая, не ограничиваясь ими, антинейтрофильные цитоплазматические антитела (ANCA)-ассоциированный гломерулонефрит, волчаночный нефрит и их комбинации), ANCA-ассоциированный васкулит, индуцированный шига-токсином HUS, и индуцированную антифосфолипидными антителами потерю беременности, болезнь «трансплантат против хозяина» (GVHD) или любые их комбинации.
Определения
Если не указано иное, то все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится данное изобретение. Несмотря на то, что любые способы и материалы, подобные или эквивалентные тем, которые описаны в настоящем документе, могут использоваться при практическом применении или испытании настоящего изобретения, описаны иллюстративные способы и материалы.
Как используется в настоящем документе, каждый из следующих терминов имеет значение, связанное с ним в данном разделе.
Термины «ингибировать» и «ингибирование», используемые в настоящем документе, означают снижение, подавление, уменьшение или блокирование активности или функции, по меньшей мере, примерно на 10% относительно контрольного значения. В некоторых вариантах осуществления активность подавляется или блокируется, по меньшей мере, примерно на 50% по сравнению с контрольным значением. В некоторых вариантах осуществления активность подавляется или блокируется, по меньшей мере, примерно на 75%. В некоторых вариантах осуществления активность подавляется или блокируется, по меньшей мере, примерно на 95%.
Термины «эффективное количество» и «фармацевтически эффективное количество» относятся к количеству агента, достаточному для обеспечения желаемого биологического результата. Таким результатом может быть уменьшение и/или облегчение признаков, симптомов или причин заболевания или расстройства, или любое другое желаемое изменение биологической системы. Подходящее эффективное количество в любом отдельном случае может быть определено специалистом в данной области с использованием рутинных экспериментов.
Термины «пациент», «индивид», «индивидуум» и тому подобное используются в настоящем документе взаимозаменяемо и относятся к любому животному, в некоторых вариантах осуществления млекопитающему, и в некоторых вариантах осуществления человеку, имеющему систему комплемента, включая человека, нуждающегося в лечении или восприимчивого к развитию состояния или его осложнений. Индивид может включать, например, собак, кошек, свиней, коров, овец, коз, лошадей, крыс, обезьян, мышей и людей.
Термин «аномальный», когда он используется в контексте организмов, тканей, клеток или их компонентов, относится к тем организмам, тканям, клеткам или их компонентам, которые отличаются, по меньшей мере, одной наблюдаемой или детектируемой характеристикой (например, возрастом, лечением, временем суток и т. д.) от тех организмов, тканей, клеток или их компонентов, которые проявляют «нормальную» (ожидаемую/гомеостатическую) соответствующую характеристику. Характеристики, которые являются нормальными или ожидаемыми для одной клетки, типа ткани или индивида, могут быть аномальными для другого типа клетки или ткани.
«Заболевание» представляет собой состояние здоровья индивида, при котором индивид не может поддерживать гомеостаз, и при котором, если заболевание не ослабляется, то состояние здоровья индивида продолжает ухудшаться.
В противоположность, «расстройство» у индивида представляет состояние здоровья, при котором индивид может поддерживать гомеостаз, но состояние здоровья индивида является менее благоприятным, чем это было бы в отсутствии расстройства. Без лечения расстройство не обязательно вызывает дальнейшее ухудшение состояния здоровья индивида.
Заболевание или расстройство «облегчается», если степень тяжести признака или симптома заболевания или расстройства, частота, с которой такой признак или симптом, или оба, ощущаемые пациентом, уменьшается.
«Эффективное количество» или «терапевтически эффективное количество» соединения представляет такое количество соединения, которое является достаточным для обеспечения положительного эффекта для индивида, которому вводят соединение.
Как используется в настоящем документе, термин «инструктивный материал» включает публикацию, запись, диаграмму или любой другой носитель выражения, который можно использовать для сообщения о пригодности соединения, композиции, вектора или системы доставки по изобретению в наборе, для облегчения различных заболеваний или расстройств, указанных в настоящем документе. Необязательно или альтернативно, инструктивный материал может описывать один или несколько способов облегчения заболеваний или нарушений в клетке или ткани млекопитающего. Инструктивный материал набора по изобретению может, например, быть прикреплен к контейнеру, который содержит указанное соединение, композицию, вектор или систему доставки по изобретению, или быть отправлен вместе с контейнером, который содержит указанное соединение, композицию, вектор или систему доставки. В качестве альтернативы, инструктивный материал может быть отправлен отдельно от контейнера с намерением, чтобы инструктивный материал и соединение были использованы получателем совместно.
Как используется в настоящем документе, термин «операбельно связанный» или «оперативно связанный» может означать, что экспрессия гена находится под контролем промотора, с которым он пространственно связан. Промотор может быть расположен 5'(выше) или 3' (ниже) от гена, который находится под его контролем. Расстояние между промотором и геном может быть примерно таким же, как расстояние между ними промотором и геном, который он контролирует, в гене, из которого происходит промотор. Как известно в данной области техники, изменение этого расстояния может быть адаптировано без потери функции промотора.
«Терапевтическое лечение» представляет собой лечение, назначаемое индивиду, у которого проявляются признаки заболевания или расстройства, с целью уменьшения или устранения этих признаков.
Как используется в настоящем документе, термин «лечение заболевания или расстройства» означает снижение частоты проявления и/или тяжести признака и/или симптома заболевания или расстройства, которым страдает пациент.
Как используется в настоящем документе, выражение «биологический образец», «образец» или «проба» предназначено для включения любого образца, содержащего клетку, ткань или жидкость организма, в котором может быть детектирована экспрессия нуклеиновой кислоты или полипептида. Биологический образец может включать любой биологический материал, подходящий для детектирования желаемых биомаркеров, и может содержать клеточный и/или неклеточный материал, полученный от индивида. Примеры таких биологических образцов включают, не ограничиваясь ими, кровь, лимфу, костный мозг, биопсию и мазки. Образцы, которые по своей природе являются жидкими, относятся в настоящем документе к «биологическим жидкостям». Биологические образцы могут быть получены от пациента различными способами, в том числе, например, путем соскабливания или отбора мазка с участка или с помощью иглы для получения жидкостей организма. Способы сбора различных образцов тела хорошо известны в данной области.
Как используется в настоящем документе, термин «антитело» относится к молекуле иммуноглобулина, которая способна специфически связываться с определенным эпитопом антигена. Антитела могут быть интактными иммуноглобулинами, полученными из природных источников или из рекомбинантных источников, и могут представлять иммунореактивные фрагменты интактных иммуноглобулинов. Антитела в настоящем изобретении могут находиться в различных формах, включая, например, поликлональные антитела, моноклональные антитела, внутриклеточные антитела («интратела»), Fv, Fab, Fab', F(ab)2 и F(ab')2, и также одноцепочечные антитела (scFv), антитела тяжелой цепи, такие как верблюжьи антитела, и гуманизированные антитела (Harlow et al., 1999, Harlow et al., 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science, 242:423-426).
Как используется в настоящем документе, термин «синтетическое антитело» означает антитело, которое получено с использованием технологии рекомбинантной ДНК, такое как, например, антитело, экспрессированное бактериофагом. Термин также следует истолковывать как означающий антитело, которое было получено в результате синтеза молекулы ДНК, кодирующей антитело, и такая молекула ДНК экспрессирует белок антитела или аминокислотную последовательность, определяющую антитело, где последовательность ДНК или аминокислотная последовательность были получены с использованием технологии синтетической ДНК или аминокислотной последовательности, которая доступна и хорошо известна в данной области.
Как используется в настоящем документе, термин «антитело тяжелой цепи» или «антитела тяжелой цепи» включает молекулы иммуноглобулина, полученные из видов семейства верблюдовых, или путем иммунизации пептидом и последующим выделением сывороток, или клонированием и экспрессией последовательностей нуклеиновых кислот, кодирующих такие антитела. Термин «антитело тяжелой цепи» или «антитела тяжелой цепи» также охватывает молекулы иммуноглобулина, выделенные от индивида с болезнью тяжелых цепей, или полученные клонированием и экспрессией генов VH (вариабельной области тяжелой цепи иммуноглобулина) от индивида.
«Химерное антитело» относится к типу сконструированного антитела, которое содержит природную вариабельную область (легкой цепи и тяжелой цепи), полученную из донорного антитела в ассоциации с константными областями легкой и тяжелой цепи, полученными из акцепторного антитела.
«Гуманизированное антитело» относится к типу сконструированного антитела, имеющего CDR, полученные из донорного иммуноглобулина, отличного от человеческого, и остальные части молекулы, полученные из иммуноглобулина, происходят из одного (или более) иммуноглобулина(ов) человека. Кроме того, остатки каркасной области могут быть изменены для сохранения аффинности связывания (см., например, 1989, Queen et al., Proc. Natl. Acad Sci USA, 86: 10029-10032; 1991, Hodgson et al., Bio/Technology, 9: 421). Подходящее человеческое акцепторное антитело может представлять антитело, которое выбрано из обычной базы данных, например базы данных KABAT, базы данных Los Alamos и базы данных Swiss Protein, по гомологии с нуклеотидной и аминокислотной последовательностями донорного антитела. Человеческое антитело, характеризующееся гомологией с каркасными областями донорного антитела (на основе аминокислот), может быть подходящим для обеспечения константной области тяжелой цепи и/или каркасного участка вариабельной области тяжелой цепи для вставки донорных CDR. Подходящее акцепторное антитело, способное отдавать константные или вариабельные каркасные области легкой цепи, может быть выбрано аналогичным образом. Следует отметить, что тяжелые и легкие цепи акцепторного антитела необязательно происходят из одного и того же акцепторного антитела. В предшествующем уровне техники описано несколько способов получения таких гуманизированных антител (см., например, EP-A-0239400 и EP-A-054951).
Термин «донорное антитело» относится к антителу (моноклональному и/или рекомбинантному), которое отдает аминокислотные последовательности своих вариабельных областей, CDR или других функциональных фрагментов или их аналоги первому иммуноглобулиновому партнеру, чтобы обеспечить измененную кодирующую область иммуноглобулина, и полученное в результате экспрессированное измененное антитело с антигенной специфичностью и нейтрализующей активностью, характерной для донорного антитела.
Термин «акцепторное антитело» относится к антителу (моноклональному и/или рекомбинантному), гетерологичному для донорного антитела, которое отдает все (или любую часть, но в некоторых вариантах осуществления все) аминокислотные последовательности, составляющие его каркасные области тяжелой и/или легкой цепи и/или его константные области тяжелой и/или легкой цепи первому иммуноглобулиновому партнеру. В определенных вариантах осуществления человеческое антитело является акцепторным антителом.
«CDR» определяются как определяющие комплементарность участки аминокислотных последовательностей антитела, которые представляют собой гипервариабельные области тяжелой и легкой цепей иммуноглобулина. См., например, Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). В вариабельной области иммуноглобулина имеются три CDR тяжелой цепи и три CDR легкой цепи (или участки CDR). Структура и укладка белка антитела могут означать, что другие остатки считаются частью антигенсвязывающей области, и должны пониматься специалистом в данной области таким образом. См., например, Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p 877-883. Специалист в данной области поймет, что существует множество методов и методик, используемых для прогнозирования последовательностей CDR. Таким образом, последовательности CDR конкретного антитела могут несколько различаться в зависимости от того, какие методы и методики используются для прогнозирования последовательностей CDR. Примерные методы и методики включают, не ограничиваясь ими, методы, описанные Lyskov et al., 2013, PLoS One, 8(5):e63906; Kunik, et al., 2012, Nucleic Acids Res. 40:W521-524; Marcatili et al., 2008, Bioinformatics, 24:1953; Chothia et al., 1989, Nature 342:887; Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD; Johnson et al., 2000, Nucleic Acids Res 28:214; Martin et al., 1989, P.N.A.S 86:9268; MacCallum et al., 1996, J. Mol. Biol., 5:732; и Dunbar et al., 20106, Nucleic Acids Res. 44:W474-478.
Как используется в настоящем документе, термин «иммуноанализ» относится к любому анализу связывания, в котором используется антитело, способное специфически связываться с молекулой-мишенью, для детектирования и количественного определения молекулы-мишени.
Как используется в настоящем документе, термин «специфически связывается» в отношении антитела означает антитело, которое распознает и связывается с конкретной молекулой-мишенью, но по существу не распознает и не связывается с другими молекулами в образце. В некоторых случаях термины «специфическое связывание» или «связывание специфически» используются для обозначения того, что распознавание и связывание зависят от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на молекуле-мишени. Если, например, антитело специфически связывается с эпитопом «А», то присутствие немеченой молекулы, содержащей эпитоп А (или свободный, немеченый А), в реакции, содержащей меченный «А» и антитело, приведет к уменьшению количества меченного А, связанного с антителом.
«Кодирующая область» гена состоит из нуклеотидных остатков кодирующей цепи гена и нуклеотидов некодирующей цепи гена, которые гомологичны или комплементарны, соответственно, кодирующей области молекулы мРНК, которая синтезируется транскрипцией гена.
«Кодирующая область» молекулы мРНК также состоит из нуклеотидных остатков молекулы мРНК, которые соответствуют антикодонной области молекулы транспортной РНК во время трансляции молекулы мРНК или которые кодируют стоп-кодон. Таким образом, кодирующая область может включать нуклеотидные остатки, содержащие кодоны для аминокислотных остатков, которые отсутствуют в зрелом белке, кодируемом молекулой мРНК (например, аминокислотные остатки в сигнальной последовательности экспорта белка).
«Дифференциально пониженная экспрессия» или «понижающая регуляция» относится к уровням продукта биомаркера, которые, по меньшей мере, на 10% или более, например, на 20%, 30%, 40% или 50%, 60%, 70%, 80%, 90% ниже или менее, и/или в 2,0 раза, в 1,8 раза, в 1,6 раза, в 1,4 раза, в 1,2 раза, в 1,1 раза ниже или менее, и любые и все полные или частичные интервалы между ними, чем в контроле.
«Дифференциально повышенная экспрессия» или «повышающая регуляция» относится к уровням продукта биомаркера, которые, по меньшей мере, на 10% или более, например, на 20%, 30%, 40% или 50%, 60%, 70%, 80%, 90% выше или более и/или в 1,1 раза, в 1,2 раза, в 1,4 раза, в 1,6 раза, в 1,8 раза, в 2,0 раза выше или более, и любые и все полные или частичные интервалы между ними, чем в контроле.
Термин «комплементарная», как он используется по отношению к нуклеиновой кислоте, относится к широкой концепции комплементарности последовательностей между областями двух цепей нуклеиновой кислоты или между двумя областями одной и той же цепи нуклеиновой кислоты. Известно, что остаток аденина первой области нуклеиновой кислоты способен образовывать специфические водородные связи («спаривание оснований») с остатком второй области нуклеиновой кислоты, которая антипараллельна первой области, если остаток представляет собой тимин или урацил. Аналогично также известно, что остаток цитозина первой цепи нуклеиновой кислоты способен спаривать основания с остатком второй цепи нуклеиновой кислоты, которая антипараллельна первой цепи, если остаток представляет собой гуанин. Первая область нуклеиновой кислоты является комплементарной второй области той же или другой нуклеиновой кислоты, если, когда две области расположены антипараллельно, по меньшей мере, один нуклеотидный остаток первой области способен спаривать основания с остатком второй области. В некоторых вариантах осуществления первая область содержит первый участок, и вторая область содержит второй участок, где, когда первый и второй участок расположены антипараллельно, то, по меньшей мере, примерно 50%, или, по меньшей мере, примерно 75%, или, по меньшей мере, примерно 90% или, по меньшей мере, примерно 95% нуклеотидных остатков первого участка способны к спариванию оснований с нуклеотидными остатками во втором участке. В некоторых вариантах осуществления все нуклеотидные остатки первого участка способны спариваться с нуклеотидными остатками во втором участке.
Как используется в настоящем документе, термин «ДНК» определяется как дезоксирибонуклеиновая кислота.
«Кодирование» относится к присущему свойству специфических последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих либо определенную последовательность нуклеотидов (т. е. рРНК, тРНК и мРНК) или определенную аминокислотную последовательность, и обеспечивать биологические свойства, возникающие в результате. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, продуцирует белок в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК, и обычно указывается в списках последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут упоминаться как кодирующие белок или другой продукт этого гена или кДНК.
Если не указано иное, то «нуклеотидная последовательность, кодирующая аминокислотную последовательность» включает все нуклеотидные последовательности, которые представляют вырожденные варианты друг друга и которые кодируют одну и ту же аминокислотную последовательность. Выражение «нуклеотидная последовательность, которая кодирует белок или РНК», также может включать интроны в той степени, в которой нуклеотидная последовательность, кодирующая белок, может в некотором варианте содержать интрон(ы).
Термин «гибридома» в контексте настоящего описания относится к клетке, получающейся в результате слияния В-лимфоцита и партнера по слиянию, такого как миеломная клетка. Гибридому можно клонировать и поддерживать неограниченно в клеточной культуре, и она способна продуцировать моноклональные антитела. Гибридому также можно рассматривать в качестве гибридной клетки.
«Выделенные» означает измененные или удаленные из природного состояния. Например, нуклеиновая кислота или пептид, присутствующие в нормальном контексте у живого индивида в природе, не являются «выделенными», но та же самая нуклеиновая кислота или пептид, частично или полностью отделенные от сосуществующих веществ своей природной среды, являются «выделенными». Выделенная нуклеиновая кислота или белок могут находиться по существу в очищенной форме или могут находиться в неприродной среде, такой как, например, клетка-хозяин.
«Выделенная нуклеиновая кислота» относится к сегменту или фрагменту нуклеиновой кислоты, который был отделен от последовательностей, фланкирующих его в природном состоянии, т. е. фрагменту ДНК, который был удален из последовательностей, которые обычно являются смежными с фрагментом, т.е. последовательностей, смежных с фрагментом в геноме, в котором он встречается в природе. Термин также используется по отношению к нуклеиновым кислотам, которые по существу очищены от других компонентов, которые сопровождают нуклеиновую кислоту в природе, т. е. РНК или ДНК, или белки, которые сопровождают ее в клетке в природе. Таким образом, данный термин включает, например, рекомбинантную ДНК, которая была включена в вектор, в автономно реплицирующуюся плазмиду или вирус, или в геномную ДНК прокариота или эукариота, или которая находится в виде отдельной молекулы (т. е. в виде кДНК или геномной, или фрагмента кДНК, полученного с помощью ПЦР или расщепления рестриктазами), независимой от других последовательностей. Он также включает рекомбинантную ДНК, которая является частью гибридного гена, кодирующего дополнительную полипептидную последовательность.
В контексте настоящего изобретения используются следующие сокращенные обозначения наиболее часто встречающихся оснований нуклеиновых кислот. «A» относится к аденозину, «C» относится к цитозину, «G» относится к гуанозину, «T» относится к тимидину и «U» относится к уридину.
Как используется в настоящем документе, термин «полинуклеотид» определяется как цепь нуклеотидов. Кроме того, нуклеиновые кислоты являются полимерами из нуклеотидов. Таким образом, термины «нуклеиновые кислоты» и «полинуклеотиды», используемые в настоящем документе, являются взаимозаменяемыми. Специалисту в данной области известно, что нуклеиновые кислоты представляют полинуклеотиды, которые могут гидролизоваться до мономерных «нуклеотидов». Мономерные нуклеотиды могут гидролизоваться до нуклеозидов. Как используется в настоящем документе, полинуклеотиды включают, не ограничиваясь ими, все последовательности нуклеиновых кислот, которые получены любыми доступными в данной области способами, включая, без ограничения, рекомбинантные способы, т. е. клонирование последовательностей нуклеиновых кислот из рекомбинантной библиотеки или клеточного генома, с использованием обычных технологий клонирования и ПЦР и тому подобное, и с помощью синтетических способов.
Как используется в настоящем документе, термины «пептид», «полипептид» и «белок» используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать, по меньшей мере, две аминокислоты, и отсутствует ограничение в отношении максимального количества аминокислот, которые может включать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислот, соединенных друг с другом пептидными связями. Как используется в настоящем документе, термин относится как к коротким цепям, которые также обычно упоминаются в данной области техники, например, как пептиды, олигопептиды и олигомеры, так и к более длинным цепям, которые обычно упоминаются в данной области как белки, которых существует много типов. «Полипептиды» включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки и другие. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинации.
Как используется в настоящем документе, термин «потомство» относится к потомку или потомству и включает потомство млекопитающего, и также включает отличающуюся или не отличающуюся клетку-потомок, полученную из родительской клетки. В одном использовании термин «потомство» относится к клетке-потомку, которая генетически идентична родительской. При другом использовании термин «потомство» относится к клетке-потомку, которая генетически и фенотипически идентична родительской. В еще одном использовании термин «потомство» относится к клетке-потомку, которая отличалась от родительской клетки.
Как используется в настоящем документе, термин «РНК» определяется как рибонуклеиновая кислота.
Как используется в настоящем документе, термин «рекомбинантная ДНК» определяется как ДНК, полученная соединением фрагментов ДНК из разных источников.
Как используется в настоящем документе, термин «рекомбинантный полипептид» определяется как полипептид, полученный с использованием методов рекомбинантной ДНК.
Как используется в настоящем документе, термин «конъюгированный» относится к ковалентному присоединению одной молекулы ко второй молекуле.
«Вариант» как термин, используемый в настоящем документе, представляет собой последовательность нуклеиновой кислоты или пептидную последовательность, которая отличается от референсной последовательности нуклеиновой кислоты или пептидной последовательности соответственно, но сохраняет основные биологические свойства референсной молекулы. Изменения в последовательности варианта нуклеиновой кислоты могут не приводить к изменению аминокислотной последовательности пептида, кодируемого референсной нуклеиновой кислотой, или могут приводить к аминокислотным заменам, добавлениям, делециям, слияниям и усечениям. Изменения в последовательности вариантов пептидов обычно ограничены или являются консервативными, так что последовательности референсного пептида и варианта в целом очень сходны и во многих областях идентичны. Вариантный и референсный пептид могут различаться по аминокислотной последовательности одной или несколькими заменами, добавлениями, делециями в любой комбинации. Вариант нуклеиновой кислоты или пептида может быть встречающимся в природе, таким как аллельный вариант, или может представлять вариант, который, как известно, не встречается в природе. Не встречающиеся в природе варианты нуклеиновых кислот и пептидов могут быть получены методами мутагенеза или прямым синтезом. В различных вариантах осуществления вариантная последовательность, по меньшей мере, на 99%, по меньшей мере, на 98%, по меньшей мере, на 97%, по меньшей мере, на 96%, по меньшей мере, на 95%, по меньшей мере, на 94%, по меньшей мере, 93%, по меньшей мере, на 92%, по меньшей мере, на 91%, по меньшей мере, на 90%, по меньшей мере, на 89%, по меньшей мере, на 88%, по меньшей мере, на 87%, по меньшей мере, на 86%, по меньшей мере, на 85% идентична референсной последовательности.
Как используется в настоящем документе, термин «регуляция» может означать любой способ изменения уровня или активности субстрата. Неограничивающие примеры регуляции в отношении белка включают воздействие на экспрессию (включая транскрипцию и/или трансляцию), влияние на укладку, влияние на деградацию или метаболизм белка и влияние на локализацию белка. Неограничивающие примеры регуляции в отношении фермента дополнительно включают воздействие на ферментативную активность. «Регулятор» относится к молекуле, активность которой включает воздействие на уровень или активность субстрата. Регулятор может быть прямым или опосредованным. Регулятор может функционировать таким образом, чтобы активировать или ингибировать или иным образом модулировать его субстрат.
Как используется в настоящем документе, термин «окно сканирования» относится к сегменту ряда смежных положений, в котором последовательность может оцениваться независимо от любой фланкирующей последовательности. Окно сканирования обычно постепенно смещается по длине последовательности, подлежащей оценке, при этом каждый новый сегмент оценивается независимо. Постепенный сдвиг может составлять 1 или более чем одно положение.
Как используется в настоящем документе, термин «вектор» может означать последовательность нуклеиновой кислоты, содержащую точку начала репликации. Вектор может представлять плазмиду, бактериофаг, бактериальную искусственную хромосому или дрожжевую искусственную хромосому. Вектор может представлять вектор на основе ДНК или РНК. Вектор может быть либо самореплицирующимся внехромосомным вектором, либо вектором, который интегрируется в геном хозяина.
Диапазоны: по всему тексту настоящего раскрытия различные аспекты изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона предназначено только для удобства и краткости и не должно рассматриваться в качестве жесткого ограничения объема изобретения. Соответственно, следует считать, что описание диапазона конкретно раскрывает все возможные поддиапазоны, а также отдельные числовые значения в этом диапазоне. Например, описание диапазона, такого как от 1 до 6, должно рассматриваться как конкретно раскрытые поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т. д., а также отдельные числа в этом диапазоне, например, 1; 2; 2,7; 3; 4; 5; 5,3 и 6. Это применимо независимо от ширины диапазона.
Описание
Настоящее изобретение относится к ингибированию сигнального пути и заболеваний и расстройств, связанных с комплементом, с использованием анти-C5a-антитела. В одном варианте осуществления изобретение направлено на ингибирование сигнального каскада комплемента посредством специфического нацеливания на C5-компонент комплемента и белок C5a, продукт его расщепления, в то время как продукт расщепления C5 C5b остается функциональным. В одном варианте осуществления изобретение направлено на способы лечения и предупреждения воспаления и аутоиммунных заболеваний и расстройств, опосредованных нежелательной, неконтролируемой или чрезмерной активацией комплемента. В одном варианте осуществления изобретение направлено на лечение опосредованного комплементом заболевания или опосредованного комплементом расстройства у индивида путем приведения в контакт индивида с анти-C5a-антителом. В некоторых вариантах осуществления изобретение относится к способам лечения C5a-опосредованного хемотаксиса, оставляя C5b-опосредованную сборку MAC интактной.
В одном варианте осуществления изобретение представляет способ лечения опосредованного комплементом заболевания или расстройства у индивида, включающий стадию введения указанному индивиду анти-C5a-антитела, тем самым избирательно ингибируя эффекты белка C5a. Примеры опосредованных комплементом заболеваний и расстройств, которые можно лечить с использованием способов по изобретению, включают, не ограничиваясь ими, макулярную дегенерацию (MD), возрастную макулярную дегенерацию (AMD), ишемическое-реперфузионное повреждение, артрит, ревматоидный артрит, волчанку, язвенный колит, инсульт, постоперационный синдром системного воспалительного ответа, астму, аллергическую астму, хроническую обструктивную болезнь легких (COPD), синдром пароксизмальной ночной гемоглобинурии (PNH), аутоиммунную гемолитическую анемию (AIHA), болезнь Гоше, миастению гравис, нейромиелит зрительного нерва, NMO, рассеянный склероз, отсроченную функцию трансплантата, антитело-опосредованное отторжение, атипичный гемолитико-уремический синдром (aHUS), окклюзию центральной вены сетчатки (CRVO), окклюзию центральной артерии сетчатки (CRAO), буллезный эпидермолиз, сепсис, септический шок, трансплантацию органа, воспаление (включая, не ограничиваясь: воспаление, связанное с кардиопульмональным шунтированием и диализом почек), C3-гломерулопатию, мембранозную нефропатию, IgA-нефропатию, гломерулонефрит (включая, не ограничиваясь ими, антинейтрофильные цитоплазматические антитела (ANCA)-ассоциированный гломерулонефрит, волчаночный нефрит и их комбинации), ANCA-ассоциированный васкулит, индуцированный шига-токсином HUS, и индуцированную антифосфолипидными антителами потерю беременности, болезнь «трансплантат против хозяина» (GVHD) или любые их комбинации. В некоторых вариантах осуществления AP-опосредованное заболевание представляет сепсис, септический шок, ревматоидный артрит, аутоиммунную гемолитическую анемию, GvHD, антифосфолипидный синдром или болезнь Гоше.
Способность иммунной системы различать «свои» и «не свои» антигены жизненно важна для функционирования иммунной системы в качестве специфической защиты от вторжения микроорганизмов. «Не свои» антигены представляют антигены, которые входят в состав веществ, попадающих или присутствующих в организме, которые заметно отличаются или являются чужеродными по сравнению с собственными компонентами индивида, в то время как «свои» антигены представляют такие антигены, которые у здорового индивида ничем заметно не отличаются или не являются чужеродными по сравнению с собственными компонентами. В различных вариантах осуществления способов активация комплемента, которая ингибируется, представляет активацию, которая была инициирована, по меньшей мере, одним из группы, состоящей из микробного антигена, небиологической чужеродной поверхности, измененной собственной ткани или их комбинаций. Одним из примеров небиологической чужеродной поверхности являются трубки для кровеносных магистралей, такие как трубки, используемые при кардиопульмональном обходном шунтировании или диализе почек. Примеры измененных собственных тканей включают апоптотические, некротические и подвергшиеся ишемии ткани и клетки, или их комбинации.
В некоторых вариантах осуществления анти-C5a-антитела по изобретению ингибируют ниже эффекты активации альтернативного пути комплемента (AP), классического пути (CP) или лектинового пути (LP). Как правило, CP инициируется комплексами антиген-антитело, LP активируется связыванием лектинов с молекулами сахаров на поверхностях микроорганизмов, в то время как AP конститутивно активен на низком уровне, но может быстро усиливаться на поверхностях бактериальных, вирусных и паразитарных клеток за счет отсутствия регуляторных белков. Клетки-хозяева обычно защищены от АР активации комплемента регуляторными белками. Но в некоторых ситуациях, например, когда регуляторные белки являются дефектными или отсутствуют, то АР также может бесконтрольно активироваться на клетках-хозяевах, что приводит к развитию опосредованного комплементом заболевания или расстройства. CP состоит из компонентов C1, C2, C4 и сходится с AP на стадии активации C3. LP состоит из манноза-связывающих лектинов (MBL) и MBL-ассоциированных сериновых протеаз (MASP) и разделяет с CP компоненты C4 и C2. AP состоит из компонентов C3 и нескольких факторов, таких как фактор B, фактор D, ропердин, C5 и фактор H, регулятор в жидкой фазе. Активация комплемента состоит из трех стадий: (a) распознавания, (b) активации ферментов и (c) мембранной атаки, приводящей к гибели клеток. Первая фаза активации CP комплемента начинается с C1. C1 состоит из трех отдельных белков: субъединицы распознавания, C1q, и субкомпонентов сериновой протеазы, C1r и C1s, которые связаны вместе в кальций-зависимом тетрамерном комплексе, C1r2s2. Интактный комплекс C1 необходим для физиологической активации C1. Активация происходит, когда интактный комплекс C1 связывается с иммуноглобулином, находящимся в комплексе с антигеном. Это связывание активирует C1s, который затем расщепляет белки C4 и C2, образуя C4a и C4b, а также C2a и C2b. Фрагменты C4b и C2a объединяются с образованием C3-конвертазы, C4b2a, которая, в свою очередь, расщепляет C3 с образованием C3a и C3b. Активация LP инициируется связыванием MBL с определенными сахарами на поверхности-мишени, и это запускает активацию MBL-ассоциированных сериновых протеаз (MASP), которые затем расщепляют C4 и C2 способом, аналогичным активности C1s на пути CP, приводя к генерации C3-конвертазы, C4b2a. Таким образом, CP и LP активируются разными механизмами, но они имеют одни и те же компоненты C4 и C2, и оба пути приводят к образованию одной и той же C3-конвертазы, C4b2a. Расщепление C3 под действием C4b2a на C3b и C3a является центральным событием пути комплемента по двум причинам. Оно инициирует петлю амплификации AP, поскольку отложенный на поверхности C3b является центральным промежуточным продуктом AP. Оба C3a и C3b биологически важны. C3a является провоспалительным и вместе с C5a относится к анафилатоксинам. C3b и дальнейшие продукты его расщепления также связываются с рецепторами комплемента, находящимися на нейтрофилах, эозинофилах, моноцитах и макрофагах, тем самым способствуя фагоцитозу и клиренсу C3b-опсонизированных частиц. Наконец, C3b может связываться с C4b2a с образованием C5-конвертазы CP и LP для активации терминальной последовательности комплемента, что приводит к образованию C5a, сильного провоспалительного медиатора и сборке литического мембраноатакующего комплекса (MAC), C5-С9.
В одном варианте осуществления активность пути комплемента, которая ингибируется с использованием способа по изобретению, представляет собой активацию пути комплемента, индуцированную, по меньшей мере, одним из группы, выбранным из липополисахарида (LPS), липоолигосахарида (LOS), патоген-ассоциированных молекулярных структур (PAMP) и повреждение-ассоциированных молекулярных структур (DAMP). В другом варианте осуществления активность сигнального пути комплемента, которая ингибируется с использованием способа по изобретению, представляет собой активность белка C5a. В еще одном варианте осуществления активность пути комплемента, которая ингибируется с использованием способа по изобретению, является зависимой от C5a.
В одном варианте осуществления изобретение представляет способ ингибирования инициации воспалительного каскада посредством активации терминального компонента комплемента у индивида, включающий стадию введения указанному индивиду анти-C5a-антитела, тем самым ингибируя инициацию C5a-зависимого воспаления посредством активации терминального компонента комплемента, образующегося в результате активации CP, LP или AP у индивида. Примерами этих вариантов осуществления являются пациенты с сепсисом, которые страдают опосредованным комплементом системным воспалением, и индивиды, страдающие состояниями, которые могут быть вызваны опосредованным комплементом, органоспецифическим воспалением, такими как aHUS, AIHA, антифосфолипидный синдром, GVHD, астма, ишемическое/реперфузионное повреждение, ревматоидный артрит и ANCA-опосредованные заболевания почек. В различных вариантах осуществления изобретения заболевания и расстройства, которые можно лечить с использованием композиций и способов по изобретению, включают, не ограничиваясь ими, опосредованный комплементом гемолиз, опосредованный комплементом aHUS, C3-гломерулопатию, нейромиелит зрительного нерва, миастению гравис, астму, ишемическое/реперфузионное повреждение, сепсис, септический шок, ревматоидный артрит и ANCA-опосредованные заболевания или расстройства почек. В некоторых вариантах осуществления AP-опосредованное заболевание представляет сепсис, септический шок, ревматоидный артрит, аутоиммунную гемолитическую анемию, GvHD, антифосфолипидный синдром или болезнь Гоше.
В различных других вариантах осуществления в настоящем документе обеспечиваются способы идентификации потенциального анти-C5a-антитела, обладающего ингибирующим действием на сигнальный путь комплемента. Один такой способ включает стадии: а) стабильную трансфекцию клеток рецептором С5а; b) посев клеток в буфере для анализа хемотаксиса (среда RPMI с 0,5% BSA) в верхние камеры вставок Transwell; c) добавление 10 нМ рекомбинантного человеческого комплемента C5a, предварительно обработанного антителом, в буфер для анализа хемотаксиса; c) инкубирование в течение 3 ч при 37°С; d) сбор мигрировавших клеток из нижних камер и подсчет клеток с использованием счетчика Коултера; f) сравнение количества посеянных клеток в отношении мигрировавших в нижнюю камеру Transwell, которые получили рекомбинантный человеческий комплемент C5a, с количеством клеток, мигрировавших в нижнюю камеру с положительным контролем в системе Transwell и с отрицательным контролем в системе Transwell; где, когда количество мигрировавших клеток уменьшается по сравнению с положительным контролем, то идентифицируется анти-C5a-антитело.
В различных других вариантах осуществления в настоящем документе обеспечиваются способы идентификации потенциального анти-C5a-антитела, обладающего ингибирующим действием на сигнальный путь комплемента. Один такой способ включает стадии: а) стабильную трансфекцию клеток рецептором С5а; b) отмывку клеток буфером HEPES для анализа мобилизации кальция (25 мМ HEPES, 119 мМ NaCl, 5 мМ KCl, 5,6 мМ глюкозы, 0,4 мМ MgCl2 и 1 мМ CaCl2), содержащим 1 мг/мл бычьего сывороточного альбумина (BSA); с) инкубирование клеток с 1 мкМ индо-1-ацетоксиметилового эфира при комнатной температуре в течение 30 мин; d) отмывку клеток дважды и ресуспендирование в 1,3 мл вышеуказанного буфера; e) смешивание 10 нМ человеческого белка C5a и 50 мкг/мл анти-C5a-антитела до конечной концентрации 10 нМ белка и 50 мкг/мл антитела при комнатной температуре; f) измерение межклеточного Ca2+ при длине волны возбуждения 360 нм и длине волны излучения 415 нм с использованием многорежимного ридера для микропланшетов Infinite F200; g) сравнение C5a-индуцированной межклеточной мобилизации кальция в клетках, обработанных положительным контролем и отрицательным контролем; где, когда мобилизация кальция снижается по сравнению с положительным контролем, то идентифицируется анти-C5a-антитело.
Анти-C5a-антитела
В некоторых вариантах осуществления изобретение включает композиции, содержащие антитело, которое специфически связывается с C5 и C5a. В одном варианте осуществления анти-C5a-антитело по изобретению специфически связывается с C5. В одном варианте осуществления анти-C5a-антитело по изобретению специфически связывается с C5a. В одном варианте осуществления анти-C5a-антитело по изобретению специфически связывается как с С5, так и с С5а. В одном варианте осуществления анти-C5a-антитело по изобретению специфически связывается как с C5a-фрагментом C5, так и со свободным C5a. В некоторых вариантах осуществления анти-C5a-антитело по изобретению специфически связывается с C5, но не блокирует расщепление C5 на C5a и C5b. В одном варианте осуществления анти-C5a-антитело представляет собой поликлональное антитело. В еще одном варианте осуществления анти-C5a-антитело представляет моноклональное антитело. В некоторых вариантах осуществления анти-C5a-антитело не блокирует расщепление C5 на C5a и C5b, но ингибирует C5a-зависимую биологическую активность. В некоторых вариантах осуществления анти-C5a-антитело представляет химерное антитело. В еще одних вариантах осуществления анти-C5a-антитело представляет гуманизированное антитело. В некоторых вариантах осуществления антитело представляет фрагмент антитела. В некоторых вариантах осуществления C5a представляет человеческий C5a.
В некоторых вариантах осуществления связывание антитела или фрагмента антитела с человеческим C5a ассоциировано с уменьшением уровня экспрессии или периода полураспада C5a в интактном организме. В некоторых вариантах осуществления изобретение представляет белок или полипептид, способный связываться с человеческим C5a. В некоторых вариантах осуществления антитело или фрагмент антитела, белок или полипептид связывается с соответствующим участком или фрагментом, или эпитопом человеческого C5a, и связывание антитела, или фрагмента антитела, или белка или полипептида с соответствующим участком человеческого C5a ассоциировано со снижением уровня экспрессии или периода полураспада C5a в интактном организме.
В некоторых вариантах осуществления связывание антитела или фрагмента антитела с человеческим C5a ассоциировано со снижением активности C5a на пути активации комплемента в интактном организме. В некоторых вариантах осуществления изобретение представляет белок или полипептид, способный связываться с человеческим C5a. В некоторых вариантах осуществления антитело или фрагмент антитела, белок или полипептид связывается с соответствующим участком или фрагментом, или эпитопом человеческого C5a; и связывание антитела или фрагмента антитела, или белка или полипептида с соответствующим участком человеческого C5a ассоциировано со снижением активности C5a в интактном организме.
В некоторых вариантах осуществления антитело, связывающееся с С5а человека, или фрагмент антитела, связывающийся с С5а, дополнительно конъюгируют с белком, пептидом или другим соединением. В некоторых вариантах осуществления антитело, связывающееся с С5а, или фрагмент антитела конъюгируют с белком, пептидом или другим соединением. В некоторых вариантах осуществления белок, пептид или другое соединение, с которым конъюгировано антитело, связывающееся с С5, или фрагмент антитела, представляет нацеливающую молекулу (т. е. нацеливающая молекула специфически связывается с молекулой, отличной от С5а). В некоторых вариантах осуществления белок, пептид или другое соединение, с которым конъюгировано антитело, связывающееся с С5а, или фрагмент антитела, представляет собой эффекторную молекулу (например, цитотоксическую молекулу).
В одном варианте осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит, по меньшей мере, один из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10, или их вариант или варианты. В еще одном варианте осуществления анти-C5-антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10, или их вариант или варианты.
В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 3, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 8 или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 3; и VL-CDR1: SEQ ID NO: 8.
В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 4, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или его вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 4; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 5, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 5; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 3, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 4, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 5, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 8, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 9, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 10, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 3, или ее вариант, содержащий примерно до 3 (в частности, любой из 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 4, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 8, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 9, или ее вариант, содержащий примерно до 3 (в частности, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 3; VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 4; VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 8; VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант. В других вариантах осуществления анти-C5a-антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант. В еще одном варианте осуществления анти-C5a-антитело представляет моноклональное антитело, обозначенное mAb 7A12. Моноклональное анти-C5a-антитело, обозначенное mAb 7A12, содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант. В некоторых вариантах осуществления моноклональное анти-C5a-антитело представляет гуманизированное антитело, имеющее один или несколько, или все CDR или их варианты, mAb, обозначенное 7A12. В некоторых вариантах осуществления моноклональное анти-C5a-антитело представляет химерное антитело, имеющее один или несколько, или все CDR или их варианты, mAb, обозначенное 7A12.
В некоторых вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит, по меньшей мере, один из CDR1, CDR2 и CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO: 2, или ее вариант. В других вариантах осуществления анти-C5a-антитело или его антигенсвязывающий фрагмент содержит, по меньшей мере, один из CDR1, CDR2 и CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO: 7, или ее вариант.
В некоторых вариантах осуществления антитела представляют химерные антитела. В некоторых вариантах осуществления антитело против человеческого C5a может содержать константные области человеческой легкой цепи и человеческой тяжелой цепи в комбинации с последовательностями CDR вариабельной области или их вариантом, описанными в другом месте в описании. Специалист в данной области может приготовить и получить химерное антитело, используя известные методики замены соответствующих доменов конкретных антител, представляющих интерес. Такое антитело легко получают прививкой гетерогенных доменов антител, включением одной или более последовательностей CDR, описанных в настоящей заявке. Используя известную рекомбинантную технологию, можно получить и приготовить рекомбинантное антитело, содержащее константные области тяжелой и легкой цепи, кодируемые последовательностями нуклеиновых кислот константных областей человеческой тяжелой и легкой цепи; и вариабельные области тяжелой и легкой цепи, содержащие CDR, кодируемые последовательностями нуклеиновой кислоты, соответствующими последовательностям CDR, приведенным в раскрытии. Специалист в данной области может получить антитело против человеческого C5a, содержащее одну или более последовательностей CDR, описанных в данном раскрытии, где участки одной легкой цепи или участки одной тяжелой цепи заменены областями из антитела, относящегося к другому виду, такому как человек. Человеческое антитело против человеческого C5a, содержащее вариабельные области, имеющие одну или более последовательностей CDR, выбранных из SEQ ID NO: 3-5 и 8-10, или их варианта или вариантов, в комбинации со структурными элементами мышиного или не мышиного антитела вне области CDR, можно получить обычными способами, известными в данной области. В некоторых вариантах осуществления антитела или фрагменты антител дополнительно гуманизируют, используя методики, известные в данной области техники.
В некоторых вариантах осуществления анти-C5a-антитело включает антитело, обладающее, по меньшей мере, примерно 85% идентичностью аминокислотной последовательности с одной или более последовательностями CDR, описанными в настоящем документе, показанными в SEQ ID NO: 3-5 и 8-10.
В одном варианте осуществления изобретение охватывает анти-C5a-антитело, имеющее последовательности CDR, по меньшей мере, примерно на 85% идентичные последовательностям CDR, описанным в настоящем документе. Изобретение охватывает анти-C5a-антитело или его антигенсвязывающий фрагмент, имеющие последовательности CDR, которые, по меньшей мере, примерно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93% 94%, 95%, 96%, 97%, 99% или 100% идентичны последовательностям CDR, описанным в настоящем документе. В одном варианте осуществления антитело против человеческого C5a имеет вариабельную область (VH) тяжелой цепи и вариабельную область (VL) легкой цепи, где область VH имеет аминокислотную последовательность, которая, по меньшей мере, примерно на 85% идентична последовательности SEQ ID NO: 2, и где область VL имеет аминокислотную последовательность, которая, по меньшей мере, примерно на 90% идентична последовательности SEQ ID NO: 7. В некоторых вариантах осуществления антитело или фрагмент антитела является модифицированным. В некоторых вариантах осуществления модификации включают слияние антитела или его антигенсвязывающего фрагмента с участками другого белка или фрагментом белка. В некоторых вариантах осуществления антитело или фрагмент антитела по изобретению модифицируют для увеличения его периода полураспада в кровотоке in vivo. Например, антитело в виде фрагмента может быть слито с молекулой FcRn, которая также известна как неонатальный рецептор Fc, для стабилизации антитела in vivo (Nature Reviews Immunology, 7: 715-725). Специалист в данной области может приготовить человеческий C5a-связывающий одноцепочечный вариабельный фрагмент (scFv), содержащий, по меньшей мере, одну последовательность CDR, выбранную из SEQ ID NO: 3-5 и 8-10. scFv может содержать, по меньшей мере, одну последовательность вариабельной области тяжелой цепи, показанную в SEQ ID NO: 3-5, и, по меньшей мере, одну вариабельную область легкой цепи, показанную в SEQ ID NO: 8-10. Последовательности CDR, включенные в scFv, имеющие идентичность аминокислотной последовательности на уровне 80%, 81%, 82%, 83%, 84%, 85% 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% с последовательностями CDR, описанными в настоящем раскрытии, входят в объем настоящего раскрытия.
В некоторых вариантах осуществления антитело или фрагмент антитела является модифицированным. В некоторых вариантах осуществления модификации включают слияние антитела или его антигенсвязывающего фрагмента с участками другого белка или фрагментом белка. В некоторых вариантах осуществления антитело или фрагмент антитела по изобретению модифицируют для увеличения его периода полураспада в кровотоке in vivo. Например, антитело в виде фрагмента может быть слито с молекулой FcRn, которая также известна как неонатальный рецептор Fc, для стабилизации антитела in vivo (Nature Reviews Immunology, 7: 715-725). В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированы (например, слиты) с эффекторной молекулой и/или другой нацеливающей молекулой (такой как антитело или фрагмент антитела, распознающий другую молекулу, другой антиген или другой эпитоп).
В различных вариантах осуществления любое из антител по изобретению, описанных в настоящем документе, имеющих любую из вариабельных областей, описанных в настоящем документе, может содержать константную область тяжелой цепи человеческого IgG4. В некоторых вариантах осуществления антитело по изобретению содержит константную область тяжелой цепи человеческого IgG4, имеющую мутацию S228P.
Специалист в данной области может приготовить C5a-связывающий одноцепочечный вариабельный фрагмент (scFv), содержащий, по меньшей мере, одну конкретную последовательность CDR, выбранную из SEQ ID NO: 3-5, 8-10, или их варианта или вариантов. scFv может содержать последовательности вариабельной области тяжелой цепи, показанные в SEQ ID NO: 3-5, или их вариант или варианты, и вариабельные области легкой цепи, показанные в SEQ ID NO: 8-10, или их вариант или варианты. Последовательности CDR, включенные в scFv, имеющие идентичность аминокислотной последовательности, по меньшей мере, примерно на уровне 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% с последовательностями CDR, описанными в настоящем раскрытии, входят в объем настоящего раскрытия.
Скрининговые тесты
Настоящее изобретение находит применение в различных скрининговых тестах, включая определение того, может ли анти-C5a-антитело-кандидат ингибировать активность комплемента.
В некоторых вариантах осуществления уровень активности комплемента в присутствии анти-C5a-антитела-кандидата сравнивают с активностью комплемента, установленной для положительного контроля. Положительный контроль включает активацию комплемента в отсутствии добавленного тестируемого соединения или в присутствии другого тестируемого соединения, которое не связывает C5a. В некоторых вариантах осуществления анти-C5a-антитело-кандидат идентифицируют в качестве ингибитора комплемента, когда активность комплемента в присутствии анти-C5a-антитела-кандидата ниже примерно 70% от активности комплемента, установленной в положительном контроле; это соответствует более чем примерно 30% ингибированию активности комплемента в присутствии тестируемого соединения. В еще одних вариантах осуществления анти-C5a-антитело-кандидат идентифицируют в качестве ингибитора комплемента, когда активность комплемента в присутствии анти-C5a-антитела-кандидата составляет ниже примерно 80% от активности комплемента, установленной в положительном контроле; это соответствует более чем примерно 20% ингибированию активности комплемента в присутствии тестируемого соединения. В еще одних вариантах осуществления анти-C5a-антитело-кандидат идентифицируют в качестве ингибитора комплемента, когда активность комплемента в присутствии анти-C5a-антитела-кандидата ниже примерно 90% от активности комплемента, установленной в положительном контроле; это соответствует более чем примерно 10% ингибированию активности комплемента в присутствии тестируемого соединения. В некоторых вариантах осуществления уровень ингибирования комплемента анти-C5a-антителом-кандидатом сравнивают с уровнем ингибирования, установленным в отрицательном контроле.
Разнообразные форматы иммуноанализа, включая конкурентные и неконкурентные форматы иммуноанализа, анализы с захватом антигена, анализы сэндвич-типа с двумя антителами и анализы сэндвич-типа с тремя антителами, являются пригодными способами для изобретения (Self et al., 1996, Curr. Opin. Biotechnol., 7: 60-65). Изобретение не следует истолковывать как ограниченное каким-либо одним типом известного или к настоящему времени неизвестного анализа, при условии, что анализ способен детектировать ингибирование комплемента.
Твердофазный иммуноферментный анализ (ELISA) пригоден для применения в способах по изобретению. Фермент, такой как, не ограничиваясь ими, пероксидаза хрена (HRP), щелочная фосфатаза, бета-галактозидаза или уреаза, может быть связан, например, с антителом или со вторичным антителом для применения в способе по изобретению. Систему детектирования с пероксидазой хрена можно использовать, например, с хромогенным субстратом тетраметилбензидином (TMB), который в присутствии перекиси водорода дает растворимый продукт, детектируемый при 450 нм. Другие подходящие системы, связанные с ферментом, включают, например, систему детектирования с щелочной фосфатазой, которую можно использовать с хромогенным субстратом п-нитрофенилфосфатом с получением растворимого продукта, легко детектируемого при 405 нм. Аналогичным образом, систему детектирования с бета-галактозидазой можно использовать с хромогенным субстратом о-нитрофенил-бета-D-галактопиранозидом (ONPG) с получением растворимого продукта, детектируемого при 410 нм. Альтернативно, можно использовать систему детектирования с уреазой с субстратом, таким как мочевина-бромкрезоловый пурпурный (Sigma Immunochemicals, St. Louis, MO). Пригодные связанные с ферментом первичные и вторичные антитела можно получить из любого ряда коммерческих источников.
Хемилюминесцентное детектирование также пригодно для детектирования ингибирования комплемента. Хемилюминесцентные вторичные антитела могут быть получены из любого ряда коммерческих источников.
Флуоресцентное детектирование также пригодно для детектирования ингибирования комплемента. Пригодные флуорохромы включают, не ограничиваются ими, DAPI, флуоресцеин, Hoechst 33258, R-фикоцианин, B-фикоэритрин, R-фикоэритрин, родамин, техасский красный, и антитела, меченные лиссамином, флуоресцеином или родамином.
Радиоиммуноанализ (RIA) также пригоден в способах по изобретению. Такие анализы хорошо известны в данной области и описаны, например, в публикациях Brophy et al. (1990, Biochem. Biophys. Res. Comm. 167: 898-903) и Guechot et al. (1996, Clin. Chem. 42: 558-563). Радиоиммуноанализ проводят, например, с использованием первичного или вторичного антитела, меченного йодом-125 (Harlow et al., выше, 1999).
Сигнал, испускаемый детектируемым антителом, анализируется, например, с использованием спектрофотометра для детектирования окраски хромогенного субстрата; радиационного счетчика для детектирования радиации, типа гамма-счетчика для определения йода-125; или флуориметра для анализа флуоресценции в присутствии света определенной длины волны. Если используется связанный с ферментами анализ, то количественный анализ проводится с использованием спектрофотометра. Понятно, что анализы по изобретению могут быть выполнены вручную или, при желании, могут быть автоматизированы, и что сигнал, испускаемый от многочисленных образцов, может детектироваться одновременно с использованием многих коммерчески доступных систем.
Способы по изобретению также включают использование иммуноанализов на основе капиллярного электрофореза (CEIA), которые могут быть автоматизированы, если желательно. Иммуноанализы также можно использовать в комбинации с лазерно-индуцированной флуоресценцией, как описано, например, в публикациях Schmalzing et al. (1997, Electrophoresis, 18: 2184-2193) и Bao (1997, J. Chromatogr. B. Biomed. Sci., 699: 463-480). Липосомальные иммуноанализы, такие как проточно-инжекционный липосомальный иммуноанализ и липосомальные иммуносенсоры, также можно использовать в соответствии со способами по изобретению (Rongen et al., 1997, J. Immunol. Methods, 204: 105-133).
Количественный вестерн-блоттинг также можно использовать для определения уровня ингибирования комплемента в способах по изобретению. Вестерн-блоты количественно анализируют с использованием хорошо известных методов, таких как сканирующая денситометрия (Parra et al., 1998, J. Vasc. Surg., 28: 669-675).
Способы введения
Способы по изобретению включают введение терапевтически эффективного количества, по меньшей мере, одного анти-C5a-антитела или его антигенсвязывающего фрагмента (такого как любое из антител или его фрагментов, описанных в другом месте в настоящем документе) индивиду, идентифицированному как имеющего или предположительно имеющего опосредованное комплементом заболевание или расстройство. В одном варианте осуществления индивид представляет млекопитающее, имеющее систему комплемента. В одном варианте осуществления индивид представляет человека. В различных вариантах осуществления, по меньшей мере, одно анти-C5a-антитело или его антигенсвязывающий фрагмент вводят местно, регионарно или системно.
В различных вариантах осуществления заболевание или расстройство по меньшей мере выбрано из группы, состоящей из: макулярной дегенерации (MD), возрастной макулярной дегенерации (AMD), ишемического-реперфузионного повреждения, артрита, ревматоидного артрита, волчанки, язвенного колита, инсульта, постоперационного синдрома системного воспалительного ответа, астмы, аллергической астмы, хронической обструктивной болезни легких (COPD), синдрома пароксизмальной ночной гемоглобинурии (PNH), миастении гравис, нейромиелита зрительного нерва, NMO, рассеянного склероза, отсроченной функции трансплантата, антитело-опосредованного отторжения, атипичного гемолитико-уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, септического шока, трансплантации органа, воспаления (включая, не ограничиваясь: воспаление, связанное с кардиопульмональным шунтированием и диализом почек), C3-гломерулопатии, мембранозной нефропатии, IgA-нефропатии, гломерулонефрита (включая, не ограничиваясь ими, антинейтрофильные цитоплазматические антитела (ANCA)-ассоциированный гломерулонефрит, волчаночный нефрит и их комбинации), ANCA-ассоциированного васкулита, индуцированного шига-токсином HUS, и индуцированной антифосфолипидными антителами потери беременности, болезни «трансплантат против хозяина» (GVHD) или любых их комбинаций. В некоторых вариантах осуществления AP-опосредованное заболевание представляет сепсис, септический шок, ревматоидный артрит, аутоиммунную гемолитическую анемию, GvHD, антифосфолипидный синдром или болезнь Гоше. Способы по изобретению могут включать введение, по меньшей мере, одного анти-C5a-антитела или его антигенсвязывающего фрагмента, но настоящее изобретение никоим образом не следует истолковывать как ограниченное анти-C5a-антителами, описанными в настоящем документе, а скорее следует рассматривать как охватывающее любое анти-C5a-антитело, как известное, так и неизвестное, которое снижает и уменьшает активацию комплемента.
Способ по изобретению включает введение терапевтически эффективного количества, по меньшей мере, одного анти-C5a-антитела или его антигенсвязывающего фрагмента индивиду, где композиция по настоящему изобретению содержит, по меньшей мере, одно анти-C5a-антитело или его антигенсвязывающий фрагмент, самостоятельно или в комбинации, по меньшей мере, с одним другим терапевтическим агентом. Изобретение может быть использовано в комбинации с другими способами лечения, такими как, например, противовоспалительная терапия и тому подобное. Примеры противовоспалительной терапии, которую можно использовать в комбинации со способами по изобретению, включают, например, терапию, в которой используются стероидные лекарственные средства, а также терапию, в которой используются нестероидные лекарственные средства.
Способ по изобретению включает введение индивиду терапевтически эффективного количества анти-С5а-антитела или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления изобретение обеспечивает способ лечения связанных с C5a заболеваний, включающих нарушение регуляции сигнального пути комплемента, введением терапевтически эффективного количества антитела по изобретению или терапевтически эффективного количества фрагмента антитела, так, что в результате имеет место снижение активности C5a у индивида. В некоторых вариантах осуществления изобретение обеспечивает способ лечения заболеваний, связанных с C5a, включающих нарушение регуляции сигнального пути комплемента, введением терапевтически эффективного количества антитела или фрагмента антитела. В некоторых вариантах осуществления изобретение обеспечивает способ лечения заболеваний, связанных с C5a, включающих нарушение регуляции сигнального пути комплемента, введением индивиду эффективного количества антитела, фрагмента антитела, полипептида, пептида или конъюгированного пептида, так что активность комплемента снижается у индивида. В некоторых вариантах осуществления способ лечения включает системное введение индивиду эффективной дозы антитела или фрагмента антитела, посредством чего у индивида происходит системное снижение активности C5a.
Введение анти-С5а-антитела или его антигенсвязывающего фрагмента в способе лечения по изобретению может быть достигнуто различными путями с использованием методов, известных в данной области. Таким образом, терапевтические и профилактические способы по изобретению охватывают применение фармацевтических композиций, содержащих анти-C5a-антитело.
Фармацевтические композиции, пригодные для практического осуществления изобретения, можно вводить для доставки дозы, составляющей, по меньшей мере, примерно 1 нг/кг, по меньшей мере, примерно 5 нг/кг, по меньшей мере, примерно 10 нг/кг, по меньшей мере, примерно 25 нг/кг, по меньшей мере, примерно 50 нг/кг, по меньшей мере, примерно 100 нг/кг, по меньшей мере, примерно 500 нг/кг, по меньшей мере, примерно 1 мкг/кг, по меньшей мере, примерно 5 мкг/кг, по меньшей мере, примерно 10 мкг/кг, по меньшей мере, примерно 25 мкг/кг, по меньшей мере, примерно 50 мкг/кг, по меньшей мере, примерно 100 мкг/кг, по меньшей мере, примерно 500 мкг/кг, по меньшей мере, примерно 1 мг/кг, по меньшей мере, примерно 5 мг/кг, по меньшей мере, примерно 10 мг/кг, по меньшей мере, примерно 25 мг/кг, по меньшей мере, примерно 50 мг/кг, по меньшей мере, примерно 100 мг/кг, по меньшей мере, примерно 200 мг/кг, по меньшей мере, примерно 300 мг/кг, по меньшей мере, примерно 400 мг/кг и, по меньшей мере, примерно 500 мг/кг массы тела индивида. В одном варианте осуществления изобретения вводят дозу, которая обеспечивает концентрацию анти-C5a-антитела или его антигенсвязывающего фрагмента по настоящему изобретению, по меньшей мере, примерно 1 пМ, по меньшей мере, примерно 10 пМ, по меньшей мере, примерно 100 пМ, по меньшей мере, примерно 1 нМ, по меньшей мере, примерно 10 нМ, по меньшей мере, примерно 100 нМ, по меньшей мере, примерно 1 мкМ, по меньшей мере, примерно 2 мкМ, по меньшей мере, примерно 3 мкМ, по меньшей мере, примерно 4 мкМ, по меньшей мере, примерно 5 мкМ, при по меньшей мере около 6 мкМ, по меньшей мере около 7 мкМ, по меньшей мере, примерно 8 мкМ, по меньшей мере, примерно 9 мкМ и по меньшей мере, примерно 10 мкМ, у индивида. В еще одном варианте осуществления изобретение предусматривает введение дозы, которая обеспечивает концентрацию анти-C5a-антитела или его антигенсвязывающего фрагмента по настоящему изобретению, по меньшей мере, примерно 1 пМ, по меньшей мере, примерно 10 пМ, по меньшей мере примерно 100 пМ, при по меньшей мере, примерно 1 нМ, по меньшей мере, примерно 10 нМ, по меньшей мере, примерно 100 нМ, по меньшей мере, примерно 1 мкМ, по меньшей мере, примерно 2 мкМ, по меньшей мере, примерно 3 мкМ, по меньшей мере, примерно 4 мкМ, по меньшей мере, примерно 5 мкМ, по меньшей мере, примерно 6 мкМ, по меньшей мере, примерно 7 мкМ, по меньшей мере, примерно 8 мкМ, по меньшей мере, примерно 9 мкМ и, по меньшей мере, примерно 10 мкМ, в плазме индивида.
В некоторых вариантах осуществления фармацевтические композиции, пригодные для практического осуществления изобретения, можно вводить для доставки дозы, составляющей не более чем примерно 1 нг/кг, не более чем примерно 5 нг/кг, не более чем примерно 10 нг/кг, не более чем примерно 25 нг/кг, не более чем примерно 50 нг/кг, не более чем примерно 100 нг/кг, не более чем примерно 500 нг/кг, не более чем примерно 1 мкг/кг, не более чем примерно 5 мкг/кг, не более чем примерно 10 мкг/кг, не более чем примерно 25 мкг/кг, не более чем примерно 50 мкг/кг, не более чем примерно 100 мкг/кг, не более чем примерно 500 мкг/кг, не более чем примерно 1 мг/кг, не более чем примерно 5 мг/кг, не более чем примерно 10 мг/кг, не более чем примерно 25 мг/кг, не более чем примерно 50 мг/кг, не более чем чем примерно 100 мг/кг, не более чем примерно 200 мг/кг, не более чем примерно 300 мг/кг, не более чем примерно 400 мг/кг и не более чем примерно 500 мг/кг массы тела индивида. В одном варианте осуществления изобретения вводят дозу, которая обеспечивает концентрацию анти-С5а-антитела по настоящему изобретению не более чем примерно 1 пМ, не более чем примерно 10 пМ, не более чем примерно 100 пМ, не более чем примерно 1 нМ, не более чем примерно 10 нМ, не более чем примерно 100 нМ, не более чем примерно 1 мкМ, не более чем примерно 2 мкМ, не более чем примерно 3 мкМ, не более чем примерно 4 мкМ, не более чем примерно 5 мкМ, не более чем примерно 6 мкМ, не более чем примерно 7 мкМ, не более чем примерно 8 мкМ, не более чем примерно 9 мкМ и не более чем примерно 10 мкМ, у индивида. В еще одном варианте осуществления изобретение предусматривает введение дозы, которая обеспечивает концентрацию анти-С5а-антитела по настоящему изобретению не более чем примерно 1 пМ, не более чем примерно 10 пМ, не более чем примерно 100 пМ, не более чем примерно 1 нМ, не более чем примерно 10 нМ, не более чем примерно 100 нМ, не более чем примерно 1 мкМ, не более чем примерно 2 мкМ, не более чем примерно 3 мкМ, не более чем примерно 4 мкМ, не более чем примерно 5 мкМ, не более чем примерно 6 мкМ, не более чем примерно 7 мкМ, не более чем примерно 8 мкМ, не более чем примерно 9 мкМ и не более чем примерно 10 мкМ, в плазме индивида. Также предусматриваются диапазоны доз между любыми из доз, раскрытыми в настоящем документе.
Как правило, дозы, которые можно вводить в способе по изобретению индивиду, в некоторых вариантах осуществления человеку, находятся в количестве от 0,5 мкг до примерно 50 мг на кг массы тела индивида. Хотя точная вводимая дозировка будет варьироваться в зависимости от ряда факторов, включая, не ограничиваясь ими, тип индивида и тип болезненного состояния, подвергаемого лечению, возраст индивида и способ введения. В некоторых вариантах осуществления доза соединения будет варьироваться от примерно 1 мкг до примерно 10 мг на кг массы тела индивида. В еще одних вариантах осуществления доза будет варьироваться от примерно 3 мкг до примерно 1 мг на кг массы тела индивида.
Антитело можно вводить индивиду так часто, как несколько раз в день, или его можно вводить реже, например, один раз в день, два раза в день, три раза в день, один раз в неделю, два раза в неделю, три раза в неделю, один раз в две недели, два раза в две недели, три раза в две недели, один раз в месяц, два раза в месяц, три раза в месяц или даже реже, например один раз в несколько месяцев или даже один или несколько раз в год или меньше. Частота введения доз будет очевидна для специалиста в данной области техники и будет зависеть от ряда факторов, таких как, не ограничиваясь ими, тип и тяжесть заболевания, которое лечат, вид и возраст индивида и т.д. Составы фармацевтических композиций можно приготовить любым способом, известным или разработанным в дальнейшем в области фармакологии. Как правило, такие способы приготовления включают стадию объединения активного ингредиента с носителем или одним или несколькими другими вспомогательными ингредиентами, и затем, если необходимо или желательно, придание формы или упаковку продукта в желаемую разовую или многодозовую единицу.
Несмотря на то, что описание фармацевтических композиций, обеспеченных в настоящем документе, в основном направлено на фармацевтические композиции, которые подходят для этического введения людям, специалисту в данной области будет понятно, что такие композиции в общем подходят для введения индивидам всех видов. Модификация фармацевтических композиций, подходящих для введения людям, с целью обеспечения композиций, подходящих для введения различным индивидам, хорошо понятна, и ветеринарный фармаколог обычной квалификации может разработать и выполнить такую модификацию с помощью просто обычных, если таковые имеются, экспериментов. Индивиды, которым предполагается введение фармацевтических композиций по изобретению, включают, не ограничиваясь ими, людей и других приматов, млекопитающих, включая коммерчески значимых млекопитающих, таких как приматы, отличные от человека, крупный рогатый скот, свиньи, лошади, овцы, кошки и собаки.
Фармацевтические композиции, которые являются пригодными в способах по изобретению, можно изготовить, упаковать или поставлять в продажу в составах, подходящих для глазного, перорального, ректального, интравагинального, парентерального, местного, пульмонального, интраназального, буккального, интраокулярного, интравитреального, внутримышечного, внутрикожного и внутривенного пути введения. Другие предусмотренные составы включают разработанные наночастицы, липосомные препараты, эритроциты, нагруженные и высвобождающие активный ингредиент, и иммунологические составы.
Фармацевтическую композицию по изобретению можно изготовить, упаковать или поставлять в продажу, в виде разовой дозы или множества разовых доз. Разовая доза представляет дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента, как правило, равно дозе активного ингредиента, которую вводят индивиду, или удобной части такой дозы, например, половине или трети такой дозы.
Относительные количества активного ингредиента, фармацевтически приемлемого носителя и любых дополнительных ингредиентов в фармацевтической композиции по изобретению будут варьироваться в зависимости от идентичности, размера и состояния индивида, которого лечат, и, кроме того, в зависимости от пути, которым композиция должна вводиться. Например, композиция может содержать от 0,1% до 100% (мас./мас.) активного ингредиента. В различных вариантах осуществления композиция содержит, по меньшей мере, примерно 1%, по меньшей мере, примерно 2%, по меньшей мере, примерно 3%, по меньшей мере, примерно 4%, по меньшей мере, примерно 5%, по меньшей мере, примерно 6%, по меньшей мере, примерно 7%, по меньшей мере, примерно 8%, по меньшей мере, примерно 9%, по меньшей мере, примерно 10%, по меньшей мере, примерно 11%, по меньшей мере, примерно 12%, по меньшей мере, примерно 13%, по меньшей мере, примерно 14%, по меньшей мере, примерно 15%, по меньшей мере, примерно 16%, по меньшей мере, примерно 17%, по меньшей мере, примерно 18%, по меньшей мере, примерно 19%, по меньшей мере, примерно 20%, по меньшей мере, примерно 21%, по меньшей мере, примерно 22%, по меньшей мере, примерно 23%, по меньшей мере, примерно 24% , по меньшей мере, примерно 25%, по меньшей мере, примерно 26%, по меньшей мере, примерно 27%, по меньшей мере, примерно 28%, по меньшей мере, примерно 29%, по меньшей мере, примерно 30%, по меньшей мере, примерно 31%, по меньшей мере, примерно 32%, при по меньшей мере, примерно 33%, по меньшей мере, примерно 34%, по меньшей мере, примерно 35%, по меньшей мере, примерно 36%, по меньшей мере, примерно 37%, по меньшей мере, примерно 38%, по меньшей мере, примерно 39%, по меньшей мере, примерно 40%, по меньшей мере, примерно 41%, по меньшей мере, примерно 42%, по меньшей мере, примерно 43%, по меньшей мере, примерно 44%, по меньшей мере, примерно 45%, по меньшей мере, примерно 46%, по меньшей мере, примерно 47%, по меньшей мере, примерно 48%, по меньшей мере, примерно 49%, по меньшей мере, примерно 50%, по меньшей мере, примерно 51%, по меньшей мере, примерно 52%, по меньшей мере, примерно 53%, по меньшей мере, примерно 54%, по меньшей мере, примерно 55%, по меньшей мере, примерно 56%, по меньшей мере примерно 57%, по меньшей мере, примерно 58%, по меньшей мере, примерно 59%, по меньшей мере, примерно 60%, по меньшей мере, примерно 61%, по меньшей мере, примерно 62%, по меньшей мере, примерно 63%, по меньшей мере, примерно 64%, по меньшей мере, примерно 65%, по меньшей мере, примерно 66%, по меньшей мере, примерно 67%, по меньшей мере, примерно 68%, по меньшей мере, примерно 69%, по меньшей мере, примерно 70%, по меньшей мере, примерно 71%, по меньшей мере, примерно 72%, по меньшей мере, примерно 73%, по меньшей мере, примерно 74%, по меньшей мере, примерно 75%, по меньшей мере, примерно 76%, по меньшей мере, примерно 77%, по меньшей мере, примерно 78%, по меньшей мере, примерно 79%, по меньшей мере, примерно 80%, по меньшей мере, примерно 81%, по меньшей мере примерно 82%, по меньшей мере, примерно 83%, по меньшей мере, примерно 84%, по меньшей мере, примерно 85%, по меньшей мере, примерно 86%, по меньшей мере, примерно 87%, по меньшей мере, примерно 88%, по меньшей мере, примерно 89%, по меньшей мере, примерно 90%, по меньшей мере, примерно 91%, по меньшей мере, примерно 92%, по меньшей мере, примерно 93%, по меньшей мере, примерно 94%, по меньшей мере, примерно 95%, по меньшей мере, примерно 96%, по меньшей мере, примерно 97%, по меньшей мере, примерно 98%, по меньшей мере, примерно 99% или, по меньшей мере, примерно 100% (мас./мас.) активного ингредиента.
В дополнение к активному ингредиенту фармацевтическая композиция по изобретению может дополнительно содержать один или более дополнительных фармацевтически активных агентов.
Можно приготовить составы с контролируемым или замедленным высвобождением фармацевтической композиции по изобретению с использованием обычной технологии.
Парентеральное введение фармацевтической композиции включает любой путь введения, характеризующийся физическим нарушением целостности ткани индивида и введением фармацевтической композиции через такое нарушение в ткани. Парентеральное введение может быть местным, региональным или системным. Таким образом, парентеральное введение, включает, не ограничиваясь ими, введение фармацевтической композиции инъекцией композиции, введение композиции через хирургический разрез, введение композиции через проникающую в ткани нехирургическую рану и тому подобное. В частности, предполагается, что парентеральное введение включает, не ограничиваясь ими, внутривенную, внутриглазную, интравитреолярную, интравитреальную, подкожную, внутрибрюшинную, внутримышечную, внутрикожную, интрастернальную инъекцию, и интратуморальное введение.
Составы фармацевтической композиции, подходящей для парентерального введения, включают активный ингредиент в комбинации с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический солевой раствор. Такие составы можно изготовить, упаковать или поставлять в продажу в форме, подходящей для болюсного введения или для продолжительного введения. Инъекционные составы можно изготовить, упаковать или поставлять в продажу в разовой лекарственной форме, такой как ампулы, или контейнеры с множеством доз, содержащих консервант. Составы для парентерального введения включают, не ограничиваясь ими, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые составы с замедленным высвобождением или биоразлагаемые составы. Такие составы могут дополнительно содержать один или более дополнительных ингредиентов, включая, не ограничиваясь ими, суспендирующие, стабилизирующие или диспергирующие агенты. В одном варианте осуществления состава для парентерального введения активный ингредиент обеспечивается в сухой (т. е. порошкообразной или гранулированной) форме для восстановления подходящим носителем (например, стерильной апирогенной водой) перед парентеральным введением восстановленной композиции.
Фармацевтические композиции можно изготовить, упаковать или поставлять в продажу в форме стерильной инъецируемой водной или масляной суспензии или раствора. Такая суспензия или раствор могут быть составлены в соответствии с известным уровнем техники и могут содержать, помимо активного ингредиента, дополнительные ингредиенты, такие как диспергирующие агенты, смачивающие агенты или суспендирующие агенты. Такие стерильные инъецируемые составы можно приготовить с использованием нетоксичного приемлемого для парентерального введения разбавителя или растворителя, такого как, например, вода или 1,3-бутандиол. Другие приемлемые разбавители и растворители включают, не ограничиваясь ими, раствор Рингера, изотонический раствор хлорида натрия и жирные масла, такие как синтетические моно- или диглицериды. Другие составы, применяемые для парентерального введения, которые являются пригодными, включают составы, которые содержат активный ингредиент в микрокристаллической форме, в липосомальном препарате или в качестве компонента биоразлагаемых полимерных систем. Композиции для замедленного высвобождения или имплантации могут содержать фармацевтически приемлемые полимерные или гидрофобные материалы, такие как эмульсия, ионообменная смола, плохо растворимый полимер или плохо растворимая соль.
Фармацевтическую композицию по изобретению можно изготовить, упаковать или поставлять в продажу в составе, подходящем для пульмонального введения через ротовую полость. Такая композиция может содержать сухие частицы, которые содержат активный ингредиент и которые имеют диаметр в диапазоне примерно от 0,5 до примерно 7 нм, а в некоторых вариантах осуществления примерно от 1 до примерно 6 нм. Такие композиции удобно находятся в форме сухих порошков для введения с использованием устройства, содержащего резервуар для сухого порошка, в который может быть направлен поток пропеллента для диспергирования порошка, или с использованием самоходного контейнера для распределения растворителя/порошка, такого как устройство, содержащее активный ингредиент, растворенный или суспендированный в низкокипящем пропелленте в герметичном контейнере. В некоторых вариантах осуществления такие порошки содержат частицы, где, по меньшей мере, 98% частиц по массе имеют диаметр более 0,5 нм, и, по меньшей мере, 95% частиц по количеству имеют диаметр менее 7 нм. В некоторых вариантах осуществления, по меньшей мере, 95% частиц по массе имеют диаметр более 1 нм, и, по меньшей мере, 90% частиц по количеству имеют диаметр менее 6 нм. В некоторых вариантах осуществления сухие порошковые композиции включают твердый тонкоизмельченный порошковый разбавитель, такой как сахар, и их удобно вводить в разовой лекарственной форме.
Низкокипящие пропелленты обычно включают жидкие пропелленты, имеющие температуру кипения при атмосферном давлении ниже 65°F. Обычно пропеллент может составлять от 50% до 99,9% (мас./мас.) композиции, и активный ингредиент может составлять от 0,1% до 20% (мас./мас.) композиции. Пропеллент также может содержать дополнительные ингредиенты, такие как жидкое неионогенное или твердое анионогенное поверхностно-активное вещество или твердый разбавитель (в некоторых вариантах осуществления имеющий размер частиц такого же порядка, как у частиц, содержащих активный ингредиент).
Фармацевтические композиции по изобретению, составленные для пульмональной доставки, могут также обеспечивать активный ингредиент в форме капель раствора или суспензии. Такие составы можно изготовить, упаковать или поставлять в продажу в виде водных или разбавленных спиртовых растворов или суспензий, необязательно стерильных, содержащих активный ингредиент, и их можно удобно вводить с использованием любого устройства для разбрызгивания или распыления. Такие составы могут дополнительно содержать один или более дополнительных ингредиентов, включая, не ограничиваясь ими, вкусовое вещество, такое как сахаринат натрия, летучее масло, буферный агент, поверхностно-активное вещество или консервант, такой как метилгидроксибензоат. В некоторых вариантах осуществления капли, обеспечиваемые ими путем введения, имеют средний диаметр в диапазоне примерно от 0,1 до примерно 200 нм.
Составы также пригодны для интраназальной доставки фармацевтической композиции по изобретению.
Еще один состав, подходящий для интраназального введения, представляет собой крупный порошок, содержащий активный ингредиент и имеющий средний размер частиц от примерно 0,2 до 500 мкм. Такую композицию вводят так, как нюхают табак, т. е. быстрым вдыханием через носовой ход из контейнера с порошком, который держат близко к ноздрям.
Составы, подходящие для интраназального введения, могут, например, включать примерно от 0,1% (мас./мас.) до 100% (мас./мас.) активного ингредиента и могут также содержать один или более дополнительных ингредиентов.
Фармацевтическую композицию по изобретению можно изготовить, упаковать или поставлять в продажу в составе, подходящем для буккального введения. Такие составы могут, например, быть в форме таблеток или пастилок, изготовленных с использованием традиционных способов, и могут, например, содержать от 0,1% до 20% (мас./мас.) активного ингредиента, где остальная часть включает растворимую или разлагаемую в ротовой полости композицию и, необязательно, один или более дополнительных ингредиентов. Альтернативно, составы, подходящие для трансбуккального введения, могут содержать порошок или аэролизованный или распыленный раствор или суспензию, содержащие активный ингредиент. В некоторых вариантах осуществления такие порошковые, аэрозолизованные или распыляемые препараты при диспергировании имеют средний размер частиц или капель в диапазоне от примерно 0,1 до примерно 200 нм и могут также содержать один или более дополнительных ингредиентов.
Как используется в настоящем документе, «дополнительные ингредиенты» включают, не ограничиваясь ими, один или более из следующего: эксципиенты; поверхностно-активные вещества; диспергирующие агенты; инертные разбавители; гранулирующие и дезинтегрирующие агенты; связующие агенты; смазывающие агенты; подсластители; ароматизаторы; красители; консерванты; физиологически разлагаемые композиции, такие как желатин; водные носители и растворители; масляные носители и растворители; суспендирующие агенты; диспергирующие или смачивающие агенты; эмульгаторы, смягчающие агенты; буферы; соли; загустители; наполнители; эмульгаторы; антиоксиданты; антибиотики; противогрибковые агенты; стабилизирующие агенты; и фармацевтически приемлемые полимерные или гидрофобные материалы. Другие «дополнительные ингредиенты», которые могут быть включены в фармацевтические композиции по изобретению, известны в данной области и описаны, например, в монографии Remington's Pharmaceutical Sciences (1985, Genaro, ed., Mack Publishing Co., Easton, PA), которая включена в настоящем документе посредством ссылки.
Клетки, продуцирующие антитела и их антигенсвязывающие фрагменты
В некоторых вариантах осуществления изобретение представляет собой клетку или клеточную линию (такую как клетки-хозяева), которая продуцирует, по меньшей мере, одно из анти-C5a-антител или антигенсвязывающих фрагментов, описанных в настоящем документе. В одном варианте осуществления клетка или клеточная линия представляет собой генетически модифицированную клетку, которая продуцирует, по меньшей мере, одно из анти-C5a-антител или антигенсвязывающих фрагментов, описанных в настоящем документе. В одном варианте осуществления клетка или клеточная линия представляет собой гибридому, которая продуцирует, по меньшей мере, одно из анти-C5a-антител или антигенсвязывающих фрагментов, описанных в настоящем документе.
Гибридные клетки (гибридомы) обычно получают из массовых слияний мышиных спленоцитов, высокообогащенных В-лимфоцитами, и миеломных «клеток-партнеров слияния» (Alberts et al., Molecular Biology of the Cell (Garland Publishing, Inc. 1994); Harlow et al., Garland Publishing, Inc. 1994); Harlow et al., Antibodies. A Laboratory Manual (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988). Затем клетки в слиянии распределяются в пулы, которые можно анализировать на продукцию антител с желаемой специфичностью. Пулы, дающие положительный результат, можно дополнительно разделять до тех пор, пока не будут идентифицированы клоны одной клетки, которые продуцируют антитела с желаемой специфичностью. Антитела, продуцируемые такими клонами, называются моноклональными антителами.
Также обеспечиваются нуклеиновые кислоты, кодирующие любое из антител или фрагментов антител, раскрытых в настоящем документе, а также векторы, содержащие нуклеиновые кислоты. Таким образом, антитела и фрагменты по изобретению можно получить экспрессией нуклеиновой кислоты в клетке или клеточной линии, такой как клеточные линии, обычно используемые для экспрессии рекомбинантных или гуманизированных иммуноглобулинов. Таким образом, антитела и фрагменты по изобретению также могут быть получены клонированием нуклеиновых кислот в один или более экспрессионных векторов и трансформацией вектора в клеточную линию, такую как клеточные линии, обычно используемые для экспрессии рекомбинантных или гуманизированных иммуноглобулинов.
Гены, кодирующие тяжелые и легкие цепи иммуноглобулинов или их фрагменты, можно сконструировать в соответствии со способами, включающими, не ограничиваясь ими, полимеразную цепную реакцию (ПЦР), известную в данной области (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, N.Y., 1989; Berger & Kimmel, Methods in Enzymology, Vol. 152: Guide to Molecular Cloning Techniques, Academic Press, Inc., San Diego, Calif., 1987; Co et al., 1992, J. Immunol., 148:1149). Например, гены, кодирующие тяжелые и легкие цепи или их фрагменты, можно клонировать из геномной ДНК клетки, секретирующей антитело, или кДНК получают обратной транскрипцией клеточной РНК. Клонирование проводят обычными методами, включая использование праймеров для ПЦР, которые гибридизуются с последовательностями, фланкирующими или перекрывающими гены или сегменты генов, подлежащих клонированию.
Нуклеиновые кислоты, кодирующие антитело по изобретению, или тяжелую цепь или легкую цепь или их фрагменты, могут быть получены и использованы в соответствии с методиками рекомбинантных нуклеиновых кислот для получения конкретного иммуноглобулина, цепи иммуноглобулина, или их фрагмента или варианта, в различных клетках-хозяевах или в системе трансляции in vitro. Например, нуклеиновые кислоты, кодирующие антитела, или их фрагменты можно поместить в подходящие прокариотические или эукариотические векторы, например, экспрессионные векторы, и ввести в подходящую клетку-хозяин соответствующим способом, например, трансформацией, трансфекцией, электропорацией, инфицированием так, что в результате нуклеиновая кислота становится операбельно связанной с одним или более регуляторными элементами экспрессии, например, в векторе, или интегрируется в геном клетки-хозяина.
В некоторых вариантах осуществления тяжелые и легкие цепи или их фрагменты могут быть помещены в два разных экспрессионных вектора, которые можно использовать для совместной трансфекции клетки-реципиента. В некоторых вариантах осуществления каждый вектор может содержать два или более селектируемых гена, один для селекции в бактериальной системе и один для селекции в эукариотической системе. Такие векторы обеспечивают продукцию и амплификацию генов в бактериальной системе, и также последующую котрансфекцию эукариотических клеток и отбор котрансфектированных клеток. Процедуру селекции можно использовать для выбора экспрессии нуклеиновых кислот антител, введенных в двух разных ДНК-векторах в эукариотическую клетку.
Альтернативно, нуклеиновые кислоты, кодирующие тяжелые и легкие цепи или их фрагменты, можно экспрессировать из одного вектора. Несмотря на то, что легкие и тяжелые цепи кодируются отдельными генами, они могут быть объединены с использованием рекомбинантных методов. Например, два полипептида можно соединить синтетическим линкером, который обеспечивает их получение в виде одной белковой цепи, в которой области VL и VH спарены с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv); см., например, Bird et al., 1988, Science 242: 423-426; and Huston et al., 1988, Proc. Natl. Acad. Sci. USA, 85:5879-5883.
Изобретение обеспечивает выделенную молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, кодирующую тяжелую цепь и/или легкую цепь, а также их фрагменты. Молекула нуклеиновой кислоты, содержащая последовательности, кодирующие как легкую, так и тяжелую цепь, или их фрагменты, может быть сконструирована таким образом, чтобы она содержала синтетическую сигнальную последовательность для секреции антитела или фрагмента при получении в клетке. Кроме того, молекула нуклеиновой кислоты может содержать специфические связи ДНК, которые позволяют вставлять другие последовательности антител и поддерживают трансляционную рамку считывания, чтобы не изменять аминокислоты, обычно встречающиеся в последовательностях антител.
В соответствии с настоящим изобретением последовательности нуклеиновой кислоты, кодирующие антитело, могут быть вставлены в подходящий экспрессионный вектор. В различных вариантах осуществления экспрессионный вектор содержит необходимые элементы для транскрипции и трансляции вставленной нуклеиновой кислоты, кодирующей антитело, так, чтобы генерировать молекулы рекомбинантной ДНК, которые направляют экспрессию последовательностей антитела с образованием антитела или его фрагмента.
Нуклеиновые кислоты, кодирующие антитела или их фрагменты, можно подвергнуть обработке различными методами рекомбинантных нуклеиновых кислот, известными специалистам в данной области, такими как сайт-направленный мутагенез.
Для экспрессии нуклеиновых кислот в клетке можно использовать разнообразные способы. Нуклеиновые кислоты можно клонировать в ряд векторов различных типов. Однако настоящее изобретение не следует истолковывать как ограниченное каким-либо конкретным вектором. Вместо этого настоящее изобретение следует рассматривать как охватывающее широкий ряд векторов, которые легко доступны и/или известны в данной области техники. Например, нуклеиновую кислоту по изобретению можно клонировать в вектор, включающий, не ограничиваясь ими, плазмиду, фагемиду, производное фага, вирус животных и космиду. Векторы, представляющие особый интерес, включают векторы экспрессии, векторы для репликации, векторы для генерации зондов и векторы для секвенирования.
В конкретных вариантах осуществления экспрессионный вектор выбран из группы, состоящей из вирусного вектора, бактериального вектора и вектора клеток млекопитающего. Существуют многочисленные векторные системы экспрессии, которые включают, по меньшей мере, часть или все композиции, обсужденные выше. Системы на основе прокариотического и/или эукариотического вектора можно использовать для использования в настоящем изобретении для получения полинуклеотидов или их родственных полипептидов. Многие такие системы коммерчески и широко доступны.
Технология вирусных векторов хорошо известна в данной области и описана, например, в монографиях Sambrook et al. (2012) и Ausubel et al. (1999), и в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые пригодны в качестве векторов, включают, не ограничиваясь ими, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы простого герпеса и лентивирусы. В некоторых вариантах осуществления вектор на основе вируса мышиных стволовых клеток (MSCV) используется для экспрессии желаемой нуклеиновой кислоты. Было показано, что векторы MSCV эффективно экспрессируют желаемые нуклеиновые кислоты в клетках. Однако изобретение не должно ограничиваться использованием только вектора MSCV, скорее в изобретение включается любой метод ретровирусной экспрессии. Другими примерами вирусных векторов являются векторы на основе вируса мышиного лейкоза Молони (MoMuLV) и ВИЧ. В некоторых вариантах осуществления подходящий вектор содержит точку начала репликации, функционирующий, по меньшей мере, в одном организме, промоторную последовательность, удобные сайты рестрикции и один или более селектируемых маркеров. (См., например, WO 01/96584; WO 01/29058; и патент США № 6326193).
Можно использовать дополнительные регуляторные элементы, например энхансеры, модулирующие частоту инициации транскрипции. Промотор может представлять собой элемент, который связан в природе с последовательностью гена или нуклеиновой кислоты, что может быть получено выделением 5'-некодирующих последовательностей, расположенных перед кодирующим сегментом и/или экзоном. Такой промотор может относиться к «эндогенному» промотору. Аналогичным образом, энхансер может представлять собой энхансер, связанный в природе с последовательностью нуклеиновой кислоты, расположенной ниже или выше от этой последовательности. Альтернативно, определенные преимущества получают размещением сегмента кодирующей нуклеиновой кислоты под контролем рекомбинантного или гетерологичного промотора, который относится к промотору, который обычно не связан с последовательностью нуклеиновой кислоты в его природной среде. Рекомбинантный или гетерологичный энхансер относится также к энхансеру, обычно не связанному с последовательностью нуклеиновой кислоты в ее природной среде. Такие промоторы или энхансеры могут включать промоторы или энхансеры других генов, а также промоторы или энхансеры, выделенные из любых других прокариотических, вирусных или эукариотических клеток, и промоторы или энхансеры, не встречающиеся в природе, например, содержащие разные элементы различных транскрипционных регуляторных областей, и/или мутации, которые изменяют экспрессию. В дополнение к получению последовательностей нуклеиновых кислот промоторов и энхансеров синтетически, последовательности могут быть получены с использованием технологии рекомбинантного клонирования и/или амплификации нуклеиновых кислот, включая ПЦР, для композиций, раскрытых в настоящем документе (патент США № 4683202, патент США № 5928906). Кроме того, полагается, что контрольные последовательности также можно использовать для прямой транскрипции и/или экспрессии последовательностей внутри неядерных органелл, таких как митохондрии, хлоропласты и тому подобное.
Конечно, важно использовать промотор и/или энхансер, который эффективно направляет экспрессию сегмента ДНК в типе клетки, органелле и организме, выбранных для экспрессии. Специалисты в области молекулярной биологии обычно знают, как использовать промоторы, энхансеры и комбинации типов клеток для экспрессии белка, например, см. Sambrook et al. (2012). Используемые промоторы могут быть конститутивными, тканеспецифичными, индуцибельными и/или пригодными в соответствующих условиях для направления высокоуровневой экспрессии введенного сегмента ДНК, что является преимуществом в крупномасштабном производстве рекомбинантных белков и их фрагментов.
Примером промотора является последовательность немедленного раннего промотора цитомегаловируса (CMV). Эта промоторная последовательность является сильной конститутивной промоторной последовательностью, способной обеспечивать высокоуровневую экспрессию любой полинуклеотидной последовательности, операбельно связанной с ней. Однако также можно использовать другие последовательности конститутивного промотора, включая, не ограничиваясь ими, ранний промотор обезьяньего вируса 40 (SV40), промотор вируса опухоли молочной железы мыши (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор вируса Молони, промотор вируса птичьего лейкоза, немедленный ранний промотор вируса Эпштейна-Барра, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, не ограничиваясь ими, промотор актина, промотор миозина, промотор гемоглобина и промотор мышечного креатина. Кроме того, изобретение не должно ограничиваться использованием конститутивных промоторов. Индуцибельные промоторы также предусматриваются в качестве части изобретения. Применение индуцибельного промотора в изобретении обеспечивает молекулярный «переключатель», способный «включать» экспрессию полинуклеотидной последовательности, с которой он операбельно связан, когда такая экспрессия желательна, или «отключать» экспрессию, когда экспрессия нежелательна. Примеры индуцибельных промоторов включают, не ограничиваясь ими, промотор металлотионина, глюкокортикоидный промотор, прогестероновый промотор и тетрациклиновый промотор. Кроме того, изобретение включает применение тканеспецифичного промотора или специфического промотора для определенного типа клеток, который представляет промотор, активный только в желаемой ткани или клетке. Тканеспецифичные промоторы хорошо известны в данной области и включают, не ограничиваются ими, промотор HER-2 и промоторные последовательности, связанные с PSA.
Для оценки экспрессии нуклеиновых кислот экспрессионный вектор, который должен быть введен в клетку, также может содержать селектируемый ген-маркер или репортерный ген, или и то, и другое, для облегчения идентификации и отбора экспрессирующих клеток из популяции клеток, которых подвергаются трансфекции или инфицированию вирусными векторами. В других вариантах осуществления селектируемый маркер может переноситься в отдельной нуклеиновой кислоте и использоваться в процедуре котрансфекции. Как селектируемые гены-маркеры, так и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Пригодные селектируемые гены-маркеры известны в данной области и включают, например, гены устойчивости к антибиотикам, такие как neo и тому подобное.
Репортерные гены используются для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. Репортерные гены, которые кодируют легко анализируемые белки, хорошо известны в данной области. В общем, репортерный ген представляет ген, который отсутствует или не экспрессируется организмом или тканью реципиента и который кодирует белок, экспрессия которого проявляется в некотором легко детектируемом свойстве, например, ферментативной активности. Экспрессию репортерного гена анализируют в соответствующее время после введения ДНК в клетки реципиента.
Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфениколацетилтрансферазу, секретированную щелочную фосфатазу или ген зеленого флуоресцентного белка (см., например, Ui-Tei et al., 2000 FEBS Lett., 479: 79-82). Подходящие системы экспрессии хорошо известны и могут быть получены с использованием хорошо известных методик или получены из коммерческих источников. В общем, конструкция с минимальной 5'-фланкирующей областью, показывающая самый высокий уровень экспрессии репортерного гена, идентифицируется как промотор. Такие промоторные области могут быть связаны с репортерным геном и использоваться для оценки агентов на способность модулировать направляемую промотором транскрипцию.
Способы введения и экспрессии нуклеиновых кислот в клетке известны в данной области. В контексте вектора экспрессии вектор может быть легко введен в клетку-хозяин, например в клетку млекопитающего, бактерии, дрожжей или насекомого, любым способом, известным в данной области. Например, экспрессионный вектор можно ввести в клетку-хозяин физическим, химическим или биологическим способом.
Физические методы введения полинуклеотида в клетку-хозяин включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию, лазеропорацию и тому подобное. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области. См., например, Sambrook et al. (2012) и Ausubel et al. (1999).
Биологические методы введения нуклеиновой кислоты, представляющей интерес, в клетку-хозяин включают использование ДНК- и РНК-векторов. Вирусные векторы и особенно ретровирусные векторы стали наиболее широко используемым методом для вставки генов в клетки млекопитающих, например, в клетки человека. Другие вирусные векторы могут быть получены из лентивируса, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и т.п. См., например, патенты США № 5350674 и № 5585362.
Химические средства для введения нуклеиновой кислоты в клетку-хозяин включают коллоидные дисперсионные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, бусины и системы на основе липидов, включая эмульсии масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидной системой для применения в качестве средства доставки in vitro и in vivo является липосома (например, везикула с искусственной мембраной). Приготовление и применение таких систем хорошо известно в данной области.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку-хозяин или иного воздействия на клетку нуклеиновой кислотой по настоящему изобретению, для подтверждения присутствия последовательности рекомбинантной ДНК в клетке-хозяине, можно выполнить различные анализы. Такие анализы включают, например, «молекулярные, биологические» анализы, хорошо известные специалистам в данной области, такие как саузерн-блоттинг и нозерн-блоттинг, ОТ-ПЦР и ПЦР; «биохимические» анализы, такие как детектирование присутствия или отсутствия определенного пептида, например, иммунологическими методами (ELISA и вестерн-блоттингом) или анализами, описанными в настоящем документе, для идентификации агентов, попадающих в объем изобретения.
Наборы
Изобретение также включает набор, содержащий анти-C5a-антитело или его комбинации по изобретению и инструктивный материал, который описывает, например, введение анти-C5a-антитела или его комбинаций индивиду в качестве терапевтического лечения или применени помимо лечения, как описано в другом месте в настоящем документе. В одном варианте осуществления данный набор дополнительно содержит (необязательно стерильный) фармацевтически приемлемый носитель, подходящий для растворения или суспендирования терапевтической композиции, содержащей анти-C5a-антитело или его комбинации по изобретению, например, до введения антитела индивиду. Необязательно, набор включает аппликатор для введения антитела.
Экспериментальные примеры
Изобретение теперь будет описано со ссылкой на следующие примеры. Эти примеры приведены только с целью иллюстрации, и изобретение никоим образом не следует истолковывать как ограниченное ими примерами, и скорее следует истолковывать как охватывающее любые и все варианты, которые становятся очевидными в результате ознакомления с идеей изобретения, представленной в настоящем документе.
Без дальнейшего описания полагается, что специалист в данной области техники, используя предшествующее описание и следующие иллюстративные примеры, может получить и использовать соединения по настоящему изобретению и применить заявленные способы на практике. Следовательно, следующие рабочие примеры не должны истолковываться как ограничивающие каким-либо образом остальную часть раскрытия.
Пример 1
Система комплемента является частью врожденного иммунитета, который играет ключевую роль в защите организма хозяина. Однако активированный комплемент также потенциально может вызывать значительное повреждение и разрушение тканей, и было обнаружено, что нарушение регуляции активности комплемента ассоциировано с рядом редких и распространенных заболеваний, таких как пароксизмальная ночная гемоглобинурия (PNH), атипичный гемолитико-уремический синдром, ревматоидный артрит, возрастная макулярная дегенерация и т. д. Таким образом, антикомплементная терапия является перспективным способом лечения этих расстройств человека. C5-компонент системы комплемента является критическим белком на терминальном пути активации комплемента и является белком-предшественником в генерации сильного провоспалительного медиатора C5a, а также цитолитического мембраноатакующего комплекса (MAC), C5b-9.
Было разработано и описано в настоящем документе блокирующее фукнцию, моноклональное антитело против человеческого C5a (7A12). Это mAb блокирует C5a-опосредованную активность, но не блокирует активность MAC (по данным гемолитического анализа).
Теперь будут описаны методы и материалы, использованные в этом примере.
Вестерн-блоттинг
Очищенный человеческий белок C5 (1 мкг) кипятили в буфере для образцов и наносили на 6% гели SDS-PAGE в невосстанавливающих или восстанавливающих условиях. Белки переносили на мембраны PVDF, которые зондировали 10 мкг/мл первичного антитела (mAb 7A12 или контрольное анти-C5 mAb) в течение 1 ч с последующим определением с использованием HRP-конъюгированного антимышиного IgG (1:4000, Bio-Rad).
Анализ связывания человеческого C5, C5a и mAb
Микротитрационные полистироловые планшеты покрывали очищенным человеческим C5 или C5a (50 нг/лунку, Hycult) в PBS при 37°C в течение 1 ч. После аспирации раствора C5 или C5a лунки блокировали PBS, содержащим 1% BSA в PBS, при комнатной температуре в течение 1 ч. Лунки без покрытия C5 или C5a служили фоновым контролем. В лунки добавляли различные концентрации mAb 7A12 или контрольного анти-С5 mAb, или химерного 7A12, 50 мкл/лунку в блокирующем растворе. После инкубации в течение 1 ч при комнатной температуре лунки тщательно промывали PBST. Связанные с человеческим C5 или C5a mAb детектировали добавлением HRP-конъюгированного антимышиного IgG в разведении 1:4000 в блокирующем растворе, который оставляли для инкубации на 1 ч при комнатной температуре. После промывания с использованием PBST планшет развивали субстратом HRP в течение 6-10 мин. Реакцию останавливали добавлением 2 Н раствора H2SO4 и планшет анализировали при 450 нм на ридере для микропланшетов.
Анализ связывания мышиного C5a и mAb
Микротитрационные полистироловые планшеты покрывали очищенным мышиным C5a (50 нг/лунку, Hycult) в PBS при 37°C в течение 1 ч. После аспирации раствора C5a лунки блокировали PBS, содержащим 1% BSA в PBS, при комнатной температуре в течение 1 ч. Лунки без покрытия C5a служили фоновым контролем. В лунки добавляли различные концентрации mAb 7A12 или контрольного анти-С5а mAb, или химерного 7A12, 50 мкл/лунку в блокирующем растворе. После инкубации в течение 1 ч при комнатной температуре лунки тщательно промывали PBST. Связанные с мышиным C5a mAb детектировали добавлением HRP-конъюгированного антимышиного IgG 1:4000 в разведении 1:4000 в блокирующем растворе, который оставляли для инкубации на 1 ч при комнатной температуре. После промывания с использованием PBST планшет развивали субстратом HRP в течение 6-10 мин. Реакцию останавливали добавлением 2 Н раствора H2SO4 и планшет анализировали при 450 нм на ридере для микропланшетов.
Получение антител против человеческого C5a
Самок мышей B10.D2/oSnJ (Stock # 000461, питомник Jackson) иммунизировали 30 мкг очищенного человеческого C5 (# A120, Complement Technology, Inc), эмульгированного с адъювантом. На сутки 14 мышей снова иммунизировали 30 мкг очищенного человеческого С5, эмульгированного с адъювантом. Мышам вводили 33 мкг очищенного человеческого С5 три раза перед слиянием. Затем мышей умерщвляли дислокацией шейных позвонков и выделяли селезенку для приготовления суспензии отдельных клеток путем механического разрушения. Суспензию клеток селезенки один раз промывали бессывороточной средой для гибридом (HYB-SFM) (Invitrogen) + 10% среды FBS и клетки подсчитывали и смешивали с клетками миеломы линии X63-Ag8.653 (ATCC) в соотношении 2:1. Смесь клеток снова промывали средой HYB-SFM и клеточный осадок получали центрифугированием (1000 об/мин, × 5 мин). Клеточный осадок осторожно нарушали и разрыхляли, и затем индуцировали слияние клеток, медленно добавляя полиэтиленгликоль (ПЭГ 1500) (1,5 мл ПЭГ на 3×108 клеток). Клетки оставляли на 1 мин при 37°С, и затем к клеткам добавляли 20 мл среды HYB-SFM в течение 3 мин (1 мл в первую минуту, 3 мл в течение второй минуты и 16 мл в течение третьей минуты). Смесь центрифугировали при 1000 об/мин в течение 5 мин и клетки высевали в 24-луночные планшеты в среду HAT (10 мл HAT [Sigma H0262], 5 мл Pen/Strep, 500 мкл гентамицина и 10% FBS в 500 мл среды HYB-SFM). Через 2 недели супернатанты из лунок с видимыми колониями отбирали для скрининга реактивности с очищенным человеческим С5 методом ELISA. Положительные клоны собирали и высевали в 96-луночные планшеты методом серийных разведений для получения отдельных клонов после второго раунда скрининга с помощью ELISA. Положительные клоны размножали в среде HT (10 мл HT, 5 мл Pen/Strep, 500 мкл гентамицина и 10% FBS в 500 мл среды HYB-SFM). Перед сбором антител клетки гибридомы переводили на бессывороточную среду (SF-SFM) на 2-3 суток. Среду для культивирования клеток собирали для очистки mAb с помощью аффинной хроматографии с белком G.
Клонирование mAb
Для клонирования кДНК 7A12 общую фракцию РНК выделяли из клеток гибридомы с использованием реагента TRizol (Sigma). кДНК первой цепи синтезировали обратной транскрипцией с использованием праймера Oligo(dT). Для амплификации кДНК тяжелой цепи (для IgG1, IgG2a/b) в реакциях ПЦР использовали следующие праймеры: 5'-GAG GTG A AGCTG GTG G AG(T/A)C(T/A) GG-3' (SEQ ID NO: 11) и 5'-GGGGCCAGTGGATAGAC-3' (SEQ ID NO: 12). Для амплификации легкой цепи использовали следующие праймеры: смесь из 4 прямых праймеров: 5'-CCAGTTCCGAGCTCCAGATGACCCAGACTCCA-3' (SEQ ID NO: 70); 5'-CCAGTTCCGAGCTCGTGCTCACCCAGTCTCCA-3' (SEQ ID NO: 71); 5'- CCAGTTCCGAGCTCCAGATGACCCAGTCTCCA-3' (SEQ ID NO: 72); 5'-CC AGTTC CG A G CTC GTG ATG AC AC AGTCTCC A -3' (SEQ ID NO: 13); обратный праймер: 5'-GTTGGTGCAGCATCAGC-3' (SEQ ID NO: 14). Ампликоны ПЦР клонировали в вектор pCR TOPO TA 2.1 (Invitrogen) и секвенировали. Для получения сигнальной пептидной (лидерной) последовательности mAb использовали метод 5'-RACE с набором (GeneRacer) от Invitrogen. Полные кДНК вариабельной области амплифицировали с использованием специфических праймеров, определенных с использованием метода 5'-RACE и исходных данных секвенирования.
Анализ гемолиза
Сенсибилизированные антителами овечьи эритроциты (1×107 клеток, Complement Technology, Inc.) инкубировали при 37°С в течение 20 мин с 50% NHS (Complement Technology, Inc) в желатин-вероналовом буфере (GVB2 +, Sigma). Перед добавлением к овечьим эритроцитам NHS предварительно инкубировали с 7A12 mAb или контрольным анти-C5 mAb в течение 1 ч при 4°C. Реакцию лизиса останавливали добавлением охлажденного на льду 40 мМ раствора ЭДТА в PBS. Инкубационные смеси центрифугировали в течение 5 мин при 1500 об/мин, и супернатант собирали и измеряли при OD405 нм. Образцы без добавления NHS или с ЭДТА использовали в качестве отрицательных контролей лизиса, и образец овечьих эритроцитов, полностью лизированных дистиллированной водой, использовали в качестве положительного контроля (100% лизис), против которого нормализовали % лизиса в других образцах.
Анализ миграции в системе Transwell
Клетки U937, стабильно трансфицированные рецептором C5a (клетки U937-C5aR), высевали (из расчета 1×106 клеток на лунку в буфере для анализа хемотаксиса) в верхние камеры 24-луночных вставок Transwell с поликарбонатным мембранным фильтром с размером пор 3,0 мкм (Corning). В нижние камеры Бойдена вносили 10 нМ рекомбинантного человеческого комплемента С5а, предварительно обработанного антителом (1 мкг/мл или 10 мкг/мл) в буфере для анализа хемотаксиса. После инкубации в течение 3 ч при 37°C мигрировавшие клетки в нижних камерах собирали и подсчитывали с использованием счетчика Коултера (Beckman Coulter). (Буфер для анализа хемотаксиса: среда RPMI 1640 с 0,5% BSA).
Анализ мобилизации кальция
1×107 клеток дважды промывали буфером HEPES для анализа мобилизации кальция (25 мМ HEPES, 119 мМ NaCl, 5 мМ KCl, 5,6 мМ глюкозы, 0,4 мМ MgCl2 и 1 мМ CaCl2), содержащим 1 мг/мл BSA, и затем инкубировали с 1 мкМ индо-1-ацетоксиметилового эфира (Anaspec, Inc, Fremont, CA, USA) при комнатной температуре в течение 30 мин. Затем клетки дважды промывали и ресуспендировали в 1,3 мл того же буфера. Человеческий С5а и антитело смешивали до конечной концентрации 10 нМ и 50 мкг/мл соответственно в течение 10 мин при комнатной температуре. Наконец, измерение межклеточного Ca2+ выполняли с использованием многорежимного ридера для микропланшетов Infinite F200 (Tecan Systems Inc, Сан-Хосе, Калифорния, США) с длиной волны возбуждения 360 нм и длиной волны излучения 415 нм. Добавление смеси проводили через 300 с после начала измерения.
Теперь описываются результаты этого примера.
Как приведено на фиг. 1, 7A12, как было показано, связывается с человеческим C5. Реактивность 7A12 и 2G1, контрольного анти-C5 mAb, с интактным человеческим C5 оценивали с помощью ELISA, как показано на фиг.1. Планшет для ELISA покрывали очищенным человеческим C5. После инкубации с серийными разведениями 7A12 или контрольного анти-С5 mAb связанное mAb детектировали с помощью HRP-конъюгированного кроличьего антимышиного IgG. 7A12 и контрольное анти-C5a mAb проявили высокую реактивность с C5 человека. С использованием вестерн-блоттинга было установлено, что mAb 7A12 и контрольное анти-C5a mAb распознавали очищенный человеческий белок C5 в невосстанавливающих и восстанавливающих условиях, соответственно, как показано на фиг. 1B. Наблюдаемая 7A12-реактивная полоса 190 кДа представляет полный белок C5, тогда как полоса 115 кДа представляет α-цепь C5.
В отличие от контрольного анти-C5 mAb 2G1, которое ингибировало лизис эритроцитов (RBC), было показано, что 7A12 не проявляет активности в анализе гемолиза, как представлено на фиг. 2. Сенсибилизированные антителами овечьи эритроциты инкубировали с нормальной сывороткой человека (NHS), содержащей серийные разведения 7А12 или контрольного анти-С5 mAb при 37°С в течение 1 ч. Лизис RBC определяли измерением оптической плотности при OD405 нм. Как и ожидалось, контрольное анти-C5 mAb ингибировало на 50% NHS-опосредованный лизис овечьих эритроцитов в зависимости от дозы. С другой стороны, в дозах от 0,975 до 120 мкг/мл mAb 7A12 не показывало ингибирования 50% NHS-опосредованного лизиса овечьих эритроцитов.
В отличие от контрольного анти-C5 mAb 2G1, которое не связывается с C5a, было показано, что 7A12 связывается с человеческим C5a. Планшет для постановки ELISA покрывали человеческим C5a или мышиным C5a. После инкубации с серийными разведениями 7A12 или контрольного анти-C5 mAb связанное mAb детектировали с помощью HRP-конъюгированного антимышиного IgG. На фиг. 3А показано, что mAb 7А12 проявило высокую реактивность к человеческому С5а. Поскольку mAb 7A12 реагирует с полным белком C5 (как показано на фиг. 1), то можно сделать вывод, что mAb 7A12 связывается как с фрагментом C5a нативного человеческого C5, так и свободным человеческим C5a. С другой стороны, не было обнаружено связывания контрольного анти-C5 mAb с человеческим C5a, как показано на фиг.3B. Было установлено, что связывание mAb 7A12 с C5a специфично для человеческого C5a с небольшим связыванием с мышиным C5a.
Аффинность связывания mAb 7A12 с человеческими C5 и C5a. Очищенный человеческий C5 или C5a связывали на чипе CM4 с использованием метода аминного связывания. Анализ Biacore проводили на приборе Biacore-2000. Между каждым связыванием чип регенерировали, используя 50 мМ NaOH. mAb 7A12 связывается с человеческим C5, как показано на фиг. 4A, и человеческим C5a, как показано на фиг. 4B, с аналогичнй аффинностью.
Результаты, показанные на фиг.5, демонстрируют, что mAb 7A12, но не контрольное анти-C5 mAb 2G1, ингибирует C5a-опосредованную миграцию нейтрофилов. Человеческий C5a в концентрации 10 нМ использовали для индукции хемотаксиса линии человеческих моноцитарных клеток, U937, трансфицированных человеческим рецептором C5a. Клетки помещали в верхнюю камеру системы Transwell в присутствии mAb 7A12 или контрольного анти-C5 mAb 2G1, и миграцию клеток определяли количественно подсчетом клеток в нижней камере. mAb 7A12 показало полное ингибирование C5a-индуцированного хемотаксиса в концентрации 10 мкг/мл, тогда как контрольное анти-C5 mAb 2G1 не могло блокировать C5a-индуцированный хемотаксис.
Результаты, показанные на фиг. 6, демонстрируют, что mAb 7A12, но не контрольное анти-C5 mAb 2G1, ингибирует C5a-индуцированную внутриклеточную мобилизацию кальция в клетках U937. Мобилизация кальция отсутствовала в клетках U937, экспрессирующих человеческий рецептор C5a (U937-C5aR) в отсутствии стимуляции человеческим C5a, как показано на фиг. 6A. Обработка C5a приводила к транзиентному притоку кальция в клетках U937-C5aR, как показано на фиг. 6B, который можно было ингибировать предварительной инкубацией с mAb 7A12 (50 мкг/мл), как показано на фиг. 6C, но не с контрольным анти-C5 mAb 2G1 (50 мкг/мл), как показано на фиг. 6D. Стрелки относятся к временной точке, когда смесь С5а и антитела добавляли к суспензии клеток.
Раскрытие каждого патента, патентной заявки и публикации, цитированных в настоящем документе, включено посредством ссылки во всей их полноте.
Несмотря на то, что настоящее изобретение было раскрыто со ссылкой на конкретные варианты осуществления, очевидно, что другие варианты осуществления и вариации настоящего изобретения могут быть разработаны другими специалистами в данной области техники, не отступая от сущности и объема изобретения. Полагается, что прилагаемая формула изобретения включает все такие варианты осуществления и эквивалентные варианты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЗЕ ТРАСТИЗ ОФ ДЗЕ ЮНИВЕРСИТИ ОФ ПЕНСИЛЬВАНИЯ
СУН, Вэньчао
САТО, Саяка
МИВА, Такаси
ГУЛЛИПАЛЛИ, Дамодар
<120> АНТИ-C5a-АНТИТЕЛА И ИХ ПРИМЕНЕНИЯ
<130> 046483-6157-00-WO.607245
<150> US 62/475,573
<151> 2017-03-23
<160> 17
<170> PatentIn version 3.5
<210> 1
<211> 499
<212> ДНК
<213> Mus musculus
<400> 1
catggactga aggagtagaa atcttcagtc cctgaacaca ctgactgtaa caatggaatg 60
gagctgggtc tctctcttct tcctgtcagt aactacaggt gtccactccc aggttcagct 120
gcaacagtct gacgctgagt tggtgaaacc tggagcttca gtgaagattt cctgcaaggt 180
ttctggctac accttcactg accatattat tcactggatg aaccagaggc ctgaacaggg 240
cctggaatgg attggatata tttatcctag agatggtaat actaactaca atgaaaactt 300
caagggcaag gccacattga ctgcagacaa atcctccagc acagcctaca tgcagctcaa 360
cagcctgaca tctgaggact ctgcagtcta tttctgtgca agagaaagga acttggaata 420
ctttgactac tggggccaag gcaccactct cacagtctcc tcagccaaaa cgacaccccc 480
atctgtctat ccactggcc 499
<210> 2
<211> 149
<212> БЕЛОК
<213> Mus musculus
<400> 2
Met Glu Trp Ser Trp Val Ser Leu Phe Phe Leu Ser Val Thr Thr Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Gln Gln Ser Asp Ala Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe
35 40 45
Thr Asp His Ile Ile His Trp Met Asn Gln Arg Pro Glu Gln Gly Leu
50 55 60
Glu Trp Ile Gly Tyr Ile Tyr Pro Arg Asp Gly Asn Thr Asn Tyr Asn
65 70 75 80
Glu Asn Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Phe Cys Ala Arg Glu Arg Asn Leu Glu Tyr Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser
130 135 140
Val Tyr Pro Leu Ala
145
<210> 3
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 3
Tyr Thr Phe Thr Asp His Ile Ile His
1 5
<210> 4
<211> 14
<212> БЕЛОК
<213> Mus musculus
<400> 4
Trp Ile Gly Tyr Ile Tyr Pro Arg Asp Gly Asn Thr Asn Tyr
1 5 10
<210> 5
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 5
Arg Asn Leu Glu Tyr Phe Asp Tyr
1 5
<210> 6
<211> 459
<212> ДНК
<213> Mus musculus
<400> 6
catggactga aggagtagaa aaagcatcct ctcatctagt tctcagagat ggagacagac 60
acaatcctgc tatgggtgct gctgctctgg gttccaggct ccactggtga cattgtgctg 120
acccaatctc cagcttcttt ggctgtgtct ctagggcaga gggccaccat ctcctgcaag 180
gccagccaaa gtgttgatta tgatggtgat aattatatga actggtacca acagaaacca 240
ggacagccac ccaaactcct catctatgct gcatccaatc tagattctgg gatcccagcc 300
aggtttagtg gcagtgggtc tgggacagac ttcaccctca acatccatcc tgtggaggaa 360
gaagatgctg caacctatta ttgtcagcaa agtaatgagg atccgtacac gttcggaggg 420
gggaccaagc tggaaataaa acgggctgat gctgcacca 459
<210> 7
<211> 137
<212> БЕЛОК
<213> Mus musculus
<400> 7
Met Glu Thr Asp Thr Ile Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser
35 40 45
Val Asp Tyr Asp Gly Asp Asn Tyr Met Asn Trp Tyr Gln Gln Lys Pro
50 55 60
Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Asp Ser
65 70 75 80
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
85 90 95
Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys
100 105 110
Gln Gln Ser Asn Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Ala Asp Ala Ala Pro
130 135
<210> 8
<211> 12
<212> БЕЛОК
<213> Mus musculus
<400> 8
Gln Ser Val Asp Tyr Asp Gly Asp Asn Tyr Met Asn
1 5 10
<210> 9
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 9
Leu Leu Ile Tyr Ala Ala Ser Asn Leu Asp Ser
1 5 10
<210> 10
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 10
Gln Gln Ser Asn Glu Asp Pro Tyr
1 5
<210> 11
<211> 23
<212> ДНК
<213> Mus musculus
<400> 11
gaggtgaagc tggtggagtc tgg 23
<210> 12
<211> 17
<212> ДНК
<213> Mus musculus
<400> 12
ggggccagtg gatagac 17
<210> 13
<211> 32
<212> ДНК
<213> Mus musculus
<400> 13
ccagttccga gctccagatg acccagactc ca 32
<210> 14
<211> 32
<212> ДНК
<213> Mus musculus
<400> 14
ccagttccga gctcgtgctc acccagtctc ca 32
<210> 15
<211> 32
<212> ДНК
<213> Mus musculus
<400> 15
ccagttccga gctccagatg acccagtctc ca 32
<210> 16
<211> 32
<212> ДНК
<213> Mus musculus
<400> 16
ccagttccga gctcgtgatg acacagtctc ca 32
<210> 17
<211> 17
<212> ДНК
<213> Mus musculus
<400> 17
gttggtgcag catcagc
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2792237C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА D И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2799044C2 |
| КОНСТРУКЦИИ ДНК-АНТИТЕЛ ДЛЯ ПРИМЕНЕНИЯ ПРОТИВ БОЛЕЗНИ ЛАЙМА | 2017 |
|
RU2813829C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К TIM-3 ЧЕЛОВЕКА | 2019 |
|
RU2777336C1 |
| EGFL6-СПЕЦИФИЧЕСКИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2779902C2 |
| АНТИТЕЛО К ПРОТИВООПУХОЛЕВОМУ АНТИГЕНУ И СПОСОБЫ ПРИМЕНЕНИЯ | 2011 |
|
RU2598711C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| Гуманизированные антитела к антигену Томсена-Фриденрайха | 2015 |
|
RU2699717C2 |
| РЕКОМБИНАНТНЫЙ ИММУНОТОКСИН, НАЦЕЛЕННЫЙ НА МЕЗОТЕЛИН | 2012 |
|
RU2600067C2 |
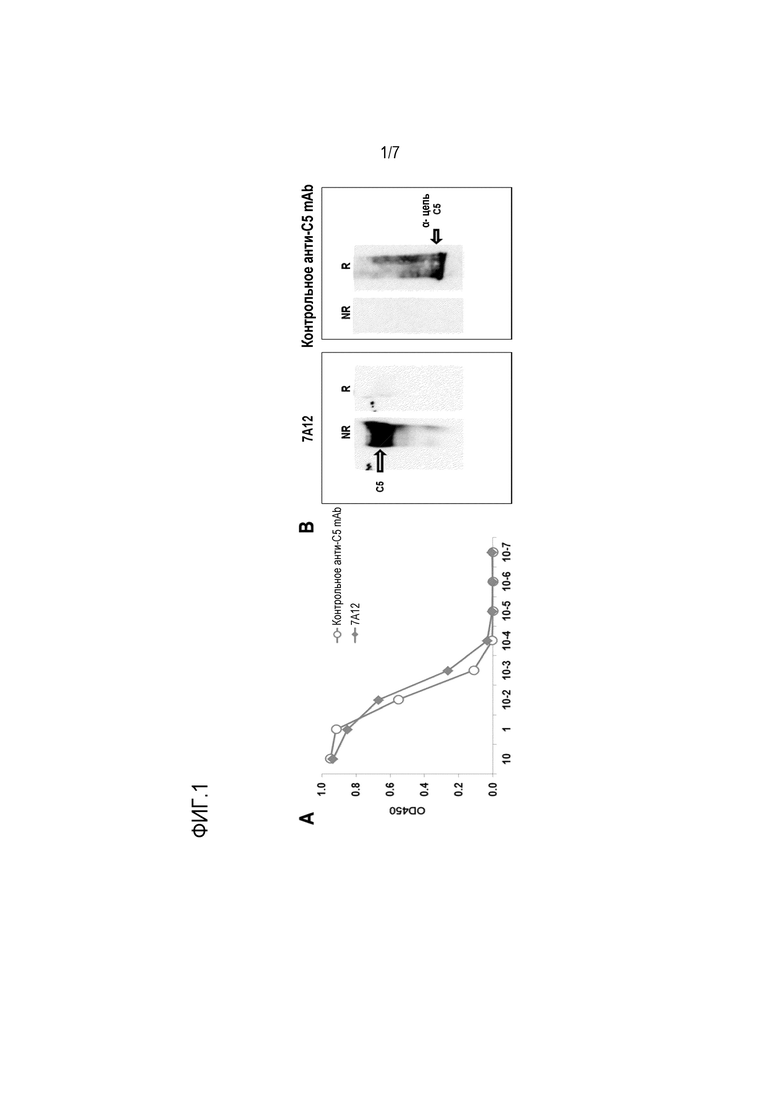
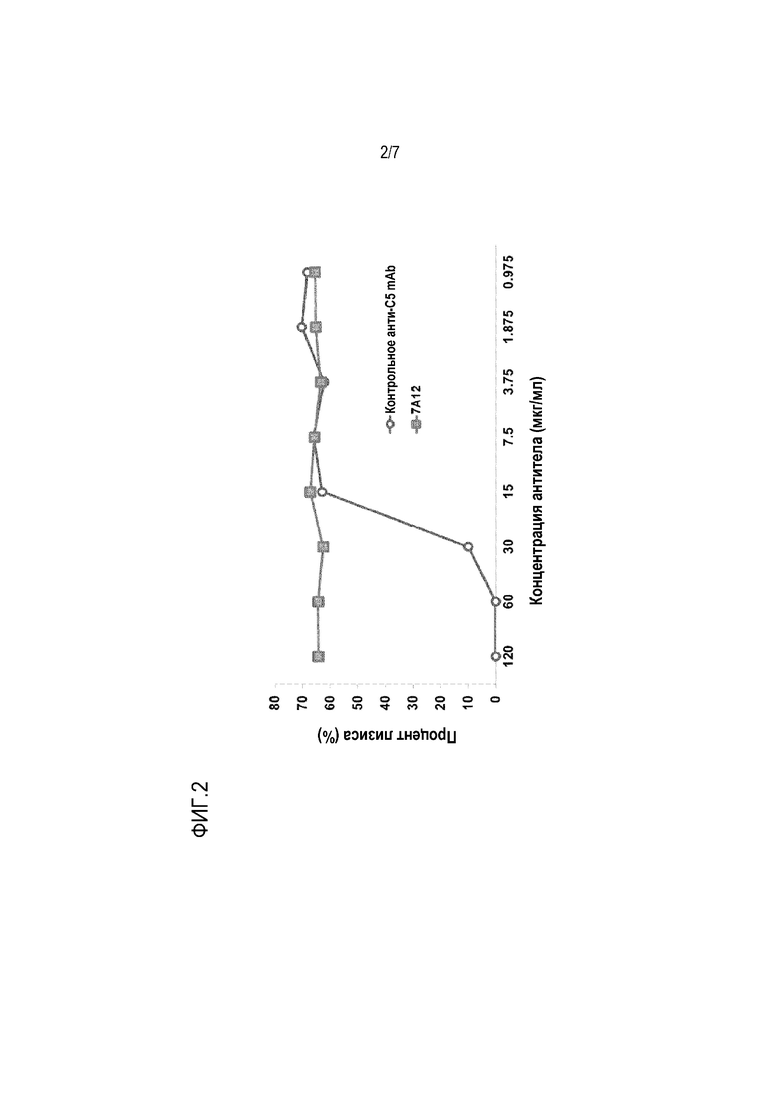
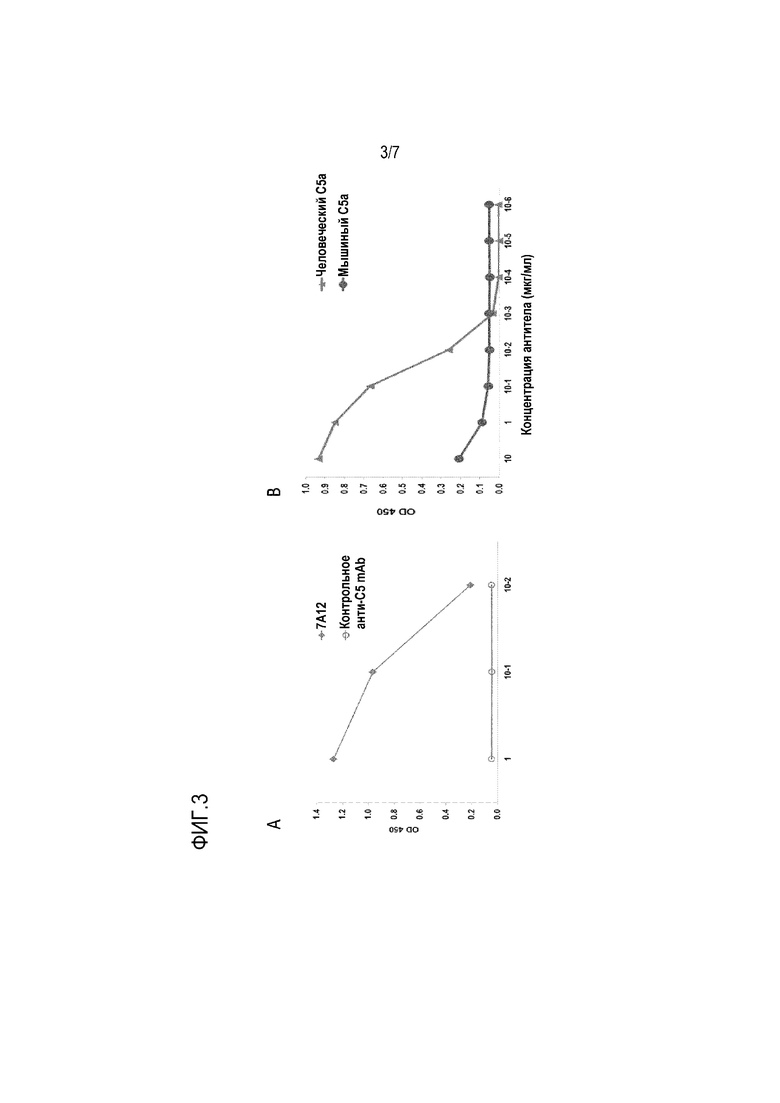
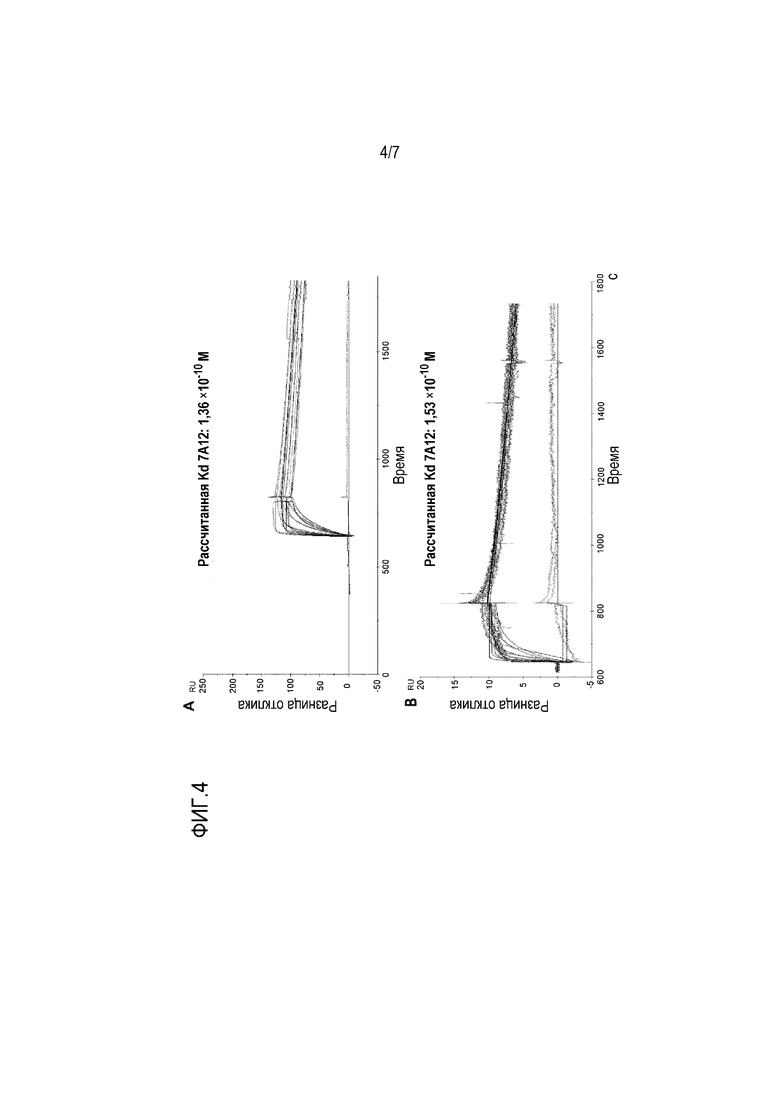
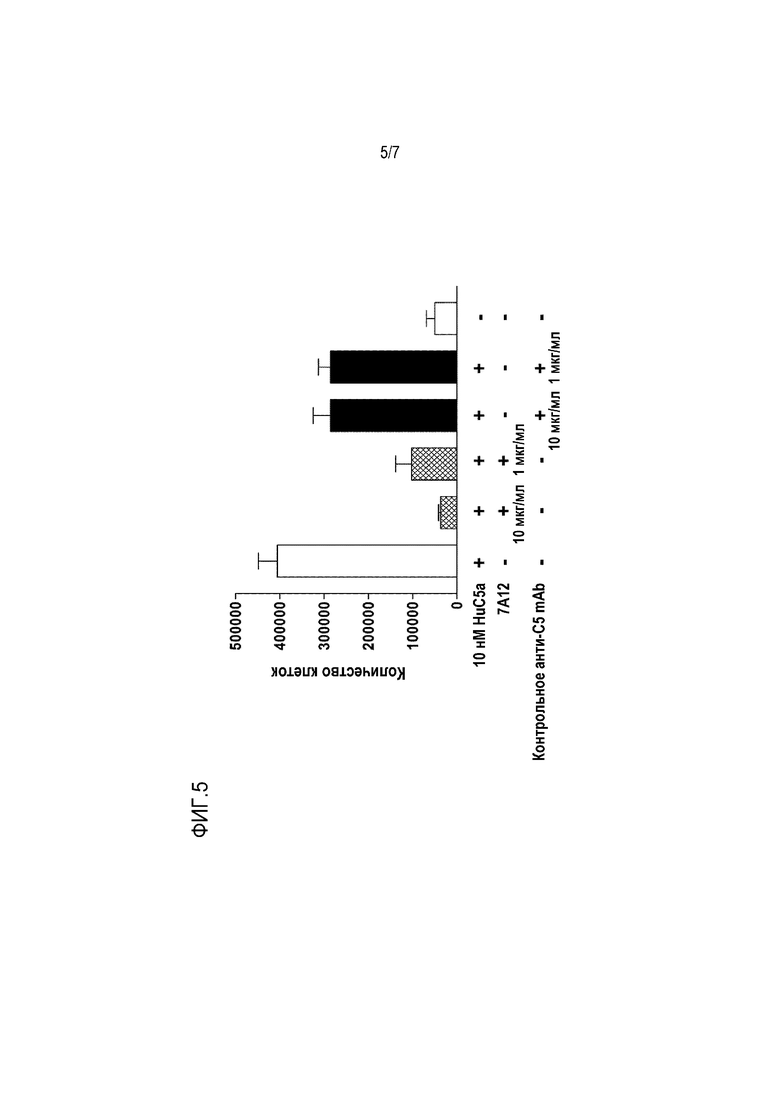
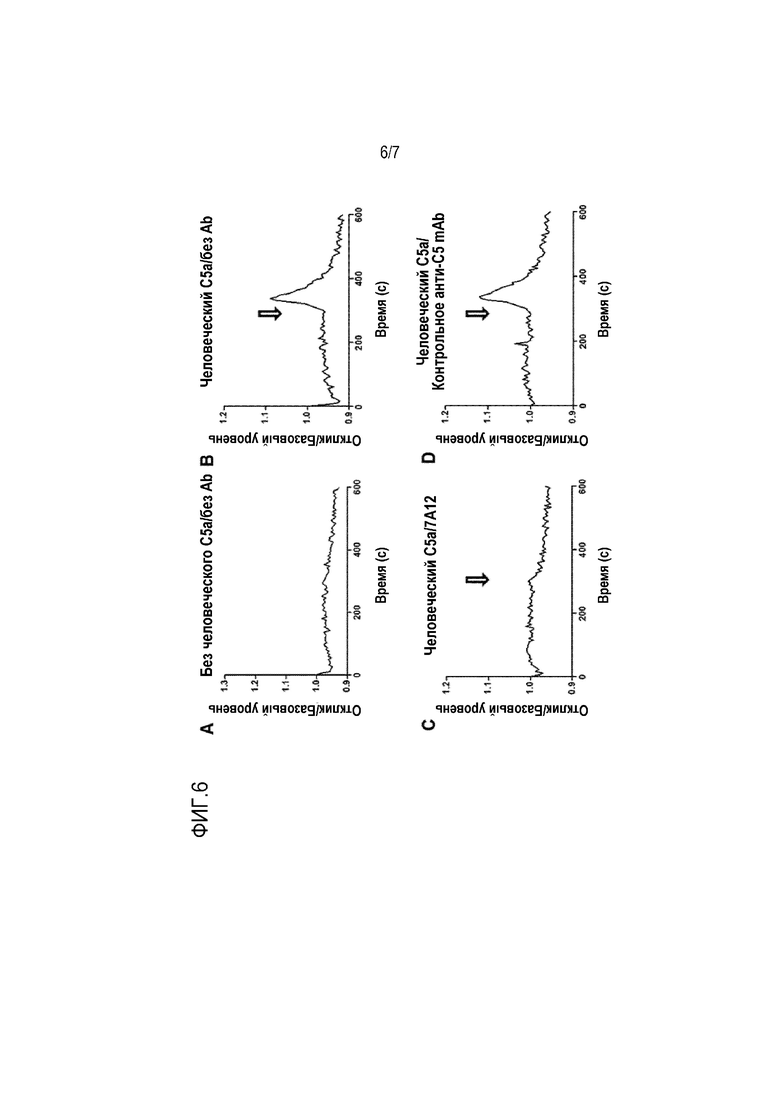

Изобретение относится к области биотехнологии, в частности к антителу, которое специфически связывается с C5a человека, а также к способу снижения активности системы комплемента индивида с его использованием. Также раскрыта клетка для получения антитела, которая содержит нуклеиновую кислоту, кодирующую вышеуказанное антитело. Изобретение эффективно для лечения опосредованного путем комплемента заболевания или расстройства у индивида. 4 н. и 15 з.п. ф-лы, 7 ил., 1 пр.
1. Антитело, которое специфически связывается с C5a человека,
где антитело содержит вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где VH содержит
i) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен;
ii) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен; и
iii) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен; и
где VL содержит
i) VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен;
ii) VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен; и
iii) VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен.
2. Антитело по п.1, где антитело представляет химерное антитело.
3. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO: 3; VH–CDR2: SEQ ID NO: 4; VH–CDR3: SEQ ID NO: 5; VL–CDR1: SEQ ID NO: 8; VL–CDR2: SEQ ID NO: 9; и VL–CDR3: SEQ ID NO: 10.
4. Антитело по п.1, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
5. Антитело по п.1, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
6. Антитело по п.1, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
7. Способ лечения опосредованного путем комплемента заболевания или расстройства у индивида, включающий стадию введения указанному индивиду анти–C5a–антитела по любому из пп.1–6.
8. Способ по п.7, где заболевание или расстройство по меньшей мере выбрано из группы, состоящей из макулярной дегенерации (MD), возрастной макулярной дегенерации (AMD), ишемического–реперфузионного повреждения, артрита, ревматоидного артрита, волчанки, язвенного колита, инсульта, постоперационного синдрома системного воспалительного ответа, астмы, аллергической астмы, хронической обструктивной болезни легких (COPD), синдрома пароксизмальной ночной гемоглобинурии (PNH), аутоиммунной гемолитической анемии (AIHA), болезни Гоше, миастении гравис, нейромиелита зрительного нерва, NMO, рассеянного склероза, отсроченной функции трансплантата, антитело–опосредованного отторжения, атипичного гемолитико–уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, септического шока, трансплантации органа, воспаления (включая, не ограничиваясь: воспаление, связанное с кардиопульмональным шунтированием и диализом почек), C3–гломерулопатии, мембранозной нефропатии, IgA–нефропатии, гломерулонефрита (включая, не ограничиваясь ими, антинейтрофильные цитоплазматические антитела (ANCA)–ассоциированный гломерулонефрит, волчаночный нефрит и их комбинации), ANCA–ассоциированного васкулита, индуцированного шига–токсином HUS, и индуцированной антифосфолипидными антителами потери беременности, болезни «трансплантат против хозяина» (GVHD) или любых их комбинаций.
9. Способ снижения активности системы комплемента индивида, где способ включает введение антитела индивиду путем введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, и где антитело содержит вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где VH содержит
i) VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен;
ii) VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен; и
iii) VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен; и
где VL содержит
i) VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен;
ii) VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен; и
iii) VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, содержащие вплоть до 3, 2 или 1 аминокислотных замен.
10. Способ по п.9, где антитело выбрано из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
11. Антитело по п.1, где антитело имеет вариабельную область (VH) тяжелой цепи с аминокислотной последовательностью, которая более чем на 90% идентична последовательности SEQ ID NO: 2.
12. Антитело по п.11, где антитело выбрано из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
13. Антитело по п.1, где антитело имеет вариабельную область (VL) легкой цепи с аминокислотной последовательностью, которая более чем на 90% идентична последовательности SEQ ID NO: 7, где область VL сохраняет основные биологические свойства и содержит консервативные замены.
14. Антитело по п.13, где антитело выбрано из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
15. Антитело по п.1, где антитело имеет вариабельную область (VH) тяжелой цепи и вариабельную область (VL) легкой цепи, где область VH имеет аминокислотную последовательность, которая более чем на 90% идентична SEQ ID NO: 2, где область VH сохраняет основные биологические свойства и содержит консервативные замены и где область VL имеет аминокислотную последовательность, которая более чем на 90% идентична последовательности SEQ ID NO: 7, где область VL сохраняет основные биологические свойства и содержит консервативные замены.
16. Антитело по п.15, где антитело выбрано из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
17. Клетка для получения антитела, содержащая антитело по меньшей мере по одному из пп.1–6 и 11–16, где клетка содержит нуклеиновую кислоту, кодирующую антитело по любому из пп.1-6 и 11-16.
18. Клетка по п.17, где клетка продуцирует антитело по меньшей мере по одному из пп.1–6 и 11–16.
19. Клетка по п.17, где клетка является гибридомой.
| WO 2011137395 A1, 03.11.2011 | |||
| EP1878441 A2, 16.01.2008 | |||
| WO 2012088247 A2, 28.06.2012 | |||
| TOM E | |||
| MOLLNES et al., Strategies of therapeutic complement inhibition, Molecular Immunology, 2006, 43, p.107-121 | |||
| EA 201291147 A1, 30.08.2013. |
Авторы
Даты
2022-06-09—Публикация
2018-03-23—Подача