Уровень техники
Понимание и контролирование стабильности белков было желанным устремлением биологов, химиков и инженеров. Первая связь между аминокислотной заменой и заболеванием (Ingram. Nature. 1957, 180(4581):326-8) открыла новые и имеющие принципиальное значение горизонты в области исследований стабильности белков в норме и патологии. Серьезное увеличение количества препаратов на основе белков в последнее время, особенно препаратов на основе иммуноглобулинов, привело к появлению новой проблемы. Терапевтические белки хранятся в жидкости в течение нескольких месяцев в очень высоких концентрациях. С течением времени увеличивается процент немономерных видов. Образование агрегатов не только уменьшает эффективность продукта, но также может привести к появлению побочных эффектов, таких как иммунный ответ на введение. Гарантия стабильности белкового фармацевтического препарата в течение срока годности продукта является первоочередным требованием. По причине высокого потенциала антител при лечении различных заболеваний, в настоящее время антитела являются наиболее быстро растущим классом терапевтических препаратов для человека (Carter. Nature Reviews Immunology. 2006, 6(5), 343). С 2001 г., рынок таких препаратов растет в среднем ежегодно со скоростью 35%, с наибольшей скоростью среди всего категорий биотехнологических лекарственных средств (S. Aggarwal, Nature. BioTech. 2007, 25 (10) 1097). Терапевтические антитела получают и хранят в водных растворах в высоких концентрациях, т.к. это требуется для лечения заболеваний. Однако в таких условиях эти иммуноглобулины являются термодинамически нестабильными и деградируют в результате агрегации. Агрегация, в свою очередь, приводит к уменьшению активности антител, делая лекарственное средство неэффективным, и даже может вызвать иммунный ответ. В силу этого, существует острая потребность в разработке понимания механизма того, как в большинстве случаев агрегируют эти антитела и вообще белки для того, чтобы открыть области белка, вовлеченные в агрегацию и разработать стратегии для воспрепятствования агрегации.
Эти эффекты являются особенно важными для терапевтических средств на основе антитела. Один подход стабилизации антител представляет собой прививку CDR-петель, которые придают специфичность антигенного связывания более стабильному каркасу (Ewert, Honegger, and Pluckthun, Biochemistry. 2003, 42(6):1517-28). Этот способ будет работать, только если аминокислотная последовательность в CDR-шпильках не является движущей силой агрегации, и если прививка CDR-шпилек на более стабильный каркас не изменит специфичности связывания антигена.
Технология, относящаяся к прогнозированию областей белка, склонных к агрегации, может быть разделена на две категории, 1) Феноменологических моделей и 2) методик молекулярного моделирования. Феноменологические модели, главным образом, основаны на прогнозировании 'горячих точек' агрегации на основании первичных последовательностей с использованием таких свойств, как гидрофобность, склонность к образованию структуры β-листа и т.д., тогда как методика молекулярного моделирования использует трехмерную структуру и динамические свойства белков для локализации областей, склонных к агрегации. Большинство методик направлено на понимание процесса образования амилоидных фибрилл и агрегации других небольших белков, где превалирует образование структуры β-листа. Феноменологические модели разрабатываются на основе физико-химических свойств, таких как гидрофобность, склонность к образованию структуры β-листа и т.д., для прогнозирования областей, склонных к агрегации на основе первичной последовательности белка (Caflisch, Current Opinion in Chemical Biology. 2006, 10, 437-444; Chiti and Dobson. Annu. Rev. Biochem. 2006, 75:333-366). Одна из первоначальных феноменологических моделей была основана на мутационных исследованиях кинетики агрегации небольшого глобулярного белка человеческой мышечной ацилфосфатазы (АсР) наряду с другими неструктурированными пептидами и нативно развернутыми белками (Chiti et al. Nature. 2003, 424 р.805-808; патент США №7379824). Это исследование обнаружило простые корреляции между агрегацией и физико-химическими свойствами, такими как склонность к образованию структуры β-листа, гидрофобность и заряд. Эти исследования проводили в условиях, при которых белки в основном не структурированы. Таким образом, разработана трехпараметрическая эмпирическая модель, которая связывает последовательность со склонностью к агрегации (Chiti et al. Nature. 2003, 424, 805-808). Эта модель также использовалась для предложения вариантов пептидного гормона кальцитонина, содержащего 32 остатка, для уменьшения его склонности к агрегации (Fowler et al. Proc Natl Acad Sci USA. 2005, 102, 10105-10110). DuBay и сотрудники расширили это трехпараметрическое уравнение (Chiti et al. Nature. 2003, 424, 805-808) до семипараметрической формулы, которая включает собственные свойства полипептидной цепи и внешние факторы, относящиеся к окружающей среде, такие как концентрация пептида, значение рН и ионная сила раствора) (Dubay et al. J Mol Biol. 2004, 341, 1317-1326). Используя эту модель, они были способны воспроизводить in vitro степени агрегации широкого спектра неструктурированных пептидов и белков. Однако основное ограничение семипараметрической модели состоит в том, что все остатки в последовательности имели одинаковую относительную важность. Это не согласуется с экспериментальными наблюдениями и наблюдениями при моделировании, которые демонстрируют, что определенные участки являются более важными, чем другие, в зависимости от склонностей их вторичной структуры. Недавно, этот анализ был дополнительно расширен для включения коэффициентов защиты с целью описания агрегации структурированных полипептидных цепей (Tartaglia G.G., Pawar A.P., Campioni S., Dobson С.М., Chiti F. and Vendruscolo M. J Mol Biol (2008) в печати). Некоторые из прогнозированных сайтов согласовывались с известными сайтами склонности к агрегации для белков, таких как лизоцим, миоглобин и т.д. Была разработана также феноменологическая модель без свободных параметров (Tartaglia et al. Protein Sci 2004. 13, 1939-1941; Tartaglia et al. Protein Sci 2005, 14, 2723-2734) для прогнозирования изменений в степени элонгации агрегированных фибрилл при мутации и для идентификации сегментов, склонных к агрегации. Используемые физико-химические свойства представляют собой изменение в склонности к образованию структуры β-листа при мутации, изменение в количестве ароматических остатков, и изменение общего заряда. Кроме того, принимается во внимание соотношение доступной площади поверхности, если боковые цепи дикого типа и мутантные боковые цепи обе являются полярными или неполярными, тогда как дипольный момент полярной боковой цепи используется в случае мутации с неполярной на полярную (или с полярной на неполярную). Эта модель воспроизводит относительную склонность к агрегации набора из 26 гептапептидных последовательностей, которые, как было спрогнозировано, имеют предпочтение к образованию структуры в виде параллельно расположенных β-листов.
Модель DuBay и сотрудников (Dubay et al. J Mol Biol, 2004, 341, 1317-1326) была модифицирована с включением склонности к образованию структуры ос-спирали и гидрофобного структурирования, и сравнения балльной оценки склонности к агрегации данной аминокислотной последовательности со средней склонностью к агрегации, рассчитанной для набора последовательностей похожей длины (Pawar et al., J Mol Biol. 2005, 350, 379-392). Эта модель была подтверждена с помощью сегментов, склонных к агрегации, трех нативно не структурированных полипептидных цепей: Аβ42, α-синуклеина и tau-белка.
Был разработан другой алгоритм, называемый TANGO (Fernandez-Escamilla, et al., Nat Biotechnol. 2004, 22, 1302-1306), который уравновешивает те же физико-химические параметры, поддержанные предположением того, что аминокислота полностью скрыта в агрегированном состоянии. Это основано на склонности вторичной структуры к десольватации и оценке штрафа за десольватацию для прогнозирования участков β-агрегации последовательности белка, а также мутационных эффектов. В отличие от моделей, обсуждаемых выше, TANGO принимает во внимание стабильность нативного состояния путем использования силового поля FOLD-X. Хотя невозможно рассчитать абсолютные степени агрегации с помощью TANGO, эта модель обеспечивает качественное сравнение между пептидами или белками, значительно отличающимися по последовательности. Serrano и сотрудники (Linding et al., J Mol Biol. 2004, 342, 345-353) использовали TANGO для анализа склонности к β-агрегации набора неизбыточных глобулярных белков с верхним ограничением идентичности последовательности 40%.
Следующий алгоритм. Прогнозирование Агрегации Амилоидной Структуры (PASTA), был недавно представлен путем редактирования попарно функции энергии для остатков, расположенных друг напротив друга внутри β-листа (Trovato et al., Protein Engineering, Design & Selection. 2007, 20(10), 521-523; Trovato et al., PLoS Comput. Biol. 2006, 2, 1608-1618; Trovato et al., J. Phys.: Condens. Matter. 2007 19, 285221). Yoon and Welsh (Yoon and Welsh, Protein Sci 2004, 13:2149-2160) разработали способ на основе структуры для детектирования склонности к β-агрегации сегмента белка, обусловленной рядом третичных контактов. При помощи передвигаемого окна на семь остатков сегменты с сильной тенденцией к образованию структуры β-листа в близко расположенном окружении (т.е. с высоким количеством третичных контактов) были предложены в качестве локальных медиаторов образования фибрилл. В то время, как продемонстрировано, что феноменологические модели, описанные выше, эффективны для небольших пептидов и денатурированных белков, склонность к агрегации может отличаться для глобулярных белков, таких как антитела, где третичная структура и стабильность нативного состояния являются очень важными.
Методы молекулярного моделирования для предсказания областей склонных к агрегации, и для изучения механизма агрегации в основном используют сравнительно простые симуляционные модели (Ма and Nussinov. Curr. Opin. Chem. Biol. 2006, 10, 445-452; Cellmer et al., TRENDS in Biotechnology 2007, 25(6), 254). Наименее подробная из применяемых моделей имитационного моделирования представляет собой решеточную модель, каждый остаток представлен в виде шара, который занимает одиночный участок в трехмерной решетке. Более подробные последующие модели, такие как модель промежуточного разрешения, страдали от такой же неспособности точно представить вторичную и третичную структуру белка.
В отличие от более простых моделей атомистические модели включают все атомистические подробности, такие как образование водородной связи и, таким образом, являются более точными, чем решетчатая модель или модель с промежуточным разрешением. Такие атомистические модели использовались или с явно заданным растворителем или с неявно заданным растворителем, где растворитель рассматривается как сплошная среда. Явная модель является более точной, но также требует больше компьютерных вычислений. Позднее был разработан протокол молекулярно-динамического моделирования для получения структурной информации об упорядоченной β-агрегации амилоидогенных полипептидов (Cecchini et al., J Mol Biol. 2006, 357, 1306-1321). Однако так как такая процедура очень требует компьютерных вычислений, особенно для больших белков, таких как антитела, по-видимому, не существует известного в литературе полного атомистического моделирования. Тем не менее, существуют атомистические модели небольших частей антитела, по большей части Fab-фрагмента (Noon et al., PNAS. 2002, 99, 6466; Sinha and Smith-Gill, Cell Biochemistry and Biophysics. 2005, 43, 253).
Во множестве существующих подходов для предотвращения агрегации иммуноглобулинов прибегают к применению добавок в белковых составах. Такой подход отличается от описанного в данном документе прямого подхода, в котором иммуноглобулин сам по себе изменяют в склонных к агрегации областях, предсказанных с помощью молекулярного моделирования. Добавки, обычно используемые для стабилизации антител, являются солями азотсодержащих оснований, таких как аргинин, гуанидин или имидазол (ЕР0025275). Другими подходящими добавками для стабилизации являются полиэфиры (ЕР А 0018609), глицерин, альбумин и декстрансульфат (патент США №4808705), детергенты и ПАВ, такие как ПАВ на основе полисорбата (публикация DE 2652636 и публикация GB 2175906 (заявка на патент Великобритании № GB8514349)), шапероны, такие как GroEL (Mendoza. Biotechnol. Tech. 1991, (10) 535-540), цитратный буфер (WO 9322335) или хелатирующие агенты (WO 9115509). Хотя эти добавки позволяют в некоторой степени стабилизировать белки в растворе, они страдают от определенных недостатков, таких как необходимость дополнительных стадий обработки для удаления добавок. Таким образом, требуются новые способы для понимания механизмов, вовлеченных в агрегации белков, и для идентификации областей белков, которые опосредуют это явление. Такие способы были бы применимы в разнообразных диагностических и терапевтических областях, и позволили бы непосредственно без использования добавок стабилизировать композиции белков, таких как терапевтические антитела.
Раскрытие изобретения
Настоящее изобретение обеспечивает способы и вычислительные средства, основанные, по меньшей мере, частично на компьютерных симуляциях, которые идентифицируют области белка, склонные к агрегации. В этих областях, склонных к агрегации, затем могут быть сделаны замены для создания белков с повышенной стабильностью и/или уменьшенной склонностью к агрегации.
Кроме того, в настоящем изобретении предлагаются способы и вычислительный аппарат на основе, по меньшей мере, частично, компьютерного моделирования, которые идентифицируют области белка, ответственные за связывание с макромолекулами. В этих областях, ответственных за связывание с макромолекулой, затем могут быть сделаны замены и делеции для создания белков с измененным сродством связывания с макромолекулой.
В одном аспекте изобретение обеспечивает способ вычисления пространственной склонности к агрегации (ПСА) для конкретного атома в белке, содержащий (а) идентификацию одного или более атомов в структурной модели, представляющей белок, где один или более атомов находятся внутри определенной области пространства с центром в конкретном атоме или около него; (b) расчет для одного или более атомов в определенной области пространства соотношения площади поверхности атомов, доступной растворителю (ПДР), к ПДР атомов в идентичном, полностью экспонированном, остатке; (с) умножение каждого соотношения на гидрофобность атома одного или более атомов; и (d) суммирование произведений стадии (с); в результате чего сумма представляет собой ПСА для конкретного атома.
В родственном воплощении способ расчета пространственной склонности к агрегации (ПСА) для конкретного атома в белке содержит (а) идентификацию одного или более аминокислотных остатков в структурной модели, представляющей белок, где один или более аминокислотных остатков содержат, по меньшей мере, один атом внутри определенной области пространства с центром в конкретном атоме или около него; (b) расчет для атомов в определенной области пространства отношения площади поверхности (ПДР) атомов, доступной растворителю, к ПДР атомов в идентичном, полностью экспонированном, остатке, (с) умножение каждого отношения на гидрофобность одного или более аминокислотных остатков, определенную по шкале гидрофобности аминокислот; и (d) суммирование произведений стадии (с); в результате чего сумма представляет собой ПСА для конкретного атома.
Понятно, что в конкретных воплощениях определенная область пространства представляет собой любой 3-мерный объем или область. В конкретных воплощениях определенную область пространства выбирают из группы, содержащей сферу, куб, цилиндр, пирамиду и эллиптический сфероид. В некоторых воплощениях определенная область пространства представляет собой область, имеющую объем, эквивалентный сфере радиусом между 1-30 Å или более. В некоторых воплощениях радиус может составлять 50 Å или более. В некоторых предпочтительных воплощениях радиус определенной области пространства составляет 5 Å или 10 Å.
В предпочтительном воплощении определенная область пространства представляет собой сферу, имеющую радиус в диапазоне 1-30 Å. В некоторых воплощениях центр сферы находится в конкретном атоме, тогда как в других воплощениях центр определенной области пространства или сферы находится на химической связи или в точке пространства около атома, для которого рассчитывается ПСА.
В некоторых воплощениях центр определенной области пространства находится в точке пространства на расстоянии 30 Å от конкретного атома, или в некоторых предпочтительных воплощениях центр определенной области пространства находится в точке пространства на расстоянии 20 Å, 10 Å, 5 Å, 2 Å, 1 Å от конкретного атома.
В некоторых воплощениях один или более атомов внутри определенной области пространства представляют собой атомы в боковой цепи одной или более аминокислот.
В дополнительных воплощениях один или более атомов внутри выбранного радиуса в структурной модели могут быть или требуется, чтобы они были, в боковой цепи одной или более аминокислот. В ином случае, один или более атомов внутри выбранного радиуса в структурной модели могут быть или требуется, чтобы они были, атомами основной цепи одной или более аминокислот.
Площадь поверхности, доступная растворителю (ПДР), которая является частью расчетов ПСА, может, в некоторых воплощениях рассчитываться только для атомов в боковых цепях аминокислот или, в некоторых воплощениях только для атомов основной цепи. Атомы основной цепи могут включать, а могут не включать присоединенные атомы водорода.
В некоторых особенно предпочтительных воплощениях структурная модель белка обрабатывается перед расчетом ПСА, например, путем осуществления молекулярно-динамического моделирования, которое необязательно включает растворитель. Растворитель может представлять собой воду, другой растворитель, известный в данной области, или же растворитель может отсутствовать. В некоторых особенно предпочтительных воплощениях структурная модель белка обрабатывается перед расчетом ПСА, например, путем осуществления моделирования Монте-Карло.
В другом аспекте расчет ПСА может содержать дополнительное осуществление молекулярно-динамических моделирований и вычисление среднего значений ПСА, рассчитанных в течение множества временных интервалов в молекулярно-динамическом моделировании. Например, ПСА для конкретного атома может рассчитываться путем проведения молекулярно-динамического моделирования перед стадией (а) выше и путем повторения стадий (a)-(d), каждый раз проводя дополнительное молекулярно-динамическое моделирование во множестве временных интервалов, получая таким образом кратные суммы, как в стадии (d), и рассчитывая среднее значение сумм; в результате чего рассчитанное среднее значение представляет собой ПСА для конкретного атома. В других примерах, моделирование Монте-Карло может использоваться вместо или в комбинации с молекулярно-динамическим моделированием.
В следующих воплощениях балльные оценки ПСА могут суммироваться для множества аминокислот, например, суммируя около 1-50 аминокислот в области, склонной к агрегации, или на участке поверхности в структурной модели белка. В особенно предпочтительном воплощении ПСА суммируется для 1-20 аминокислот, 1-15 аминокислот, 1-10 аминокислот, 1-5 аминокислот, 1-3 аминокислоты, или ПСА может суммироваться для 2 соседних аминокислот. В некоторых воплощениях сумма может подсчитываться для соседних аминокислот, которые располагаются в непосредственной близости друг от друга в последовательности белка или располагаются в непосредственной близости в пространственной структуре белка.
Там, где способы предусматривают молекулярно-динамическое моделирование, моделирование может проводиться с использованием пакета программ моделирования, выбранных из группы, содержащей или состоящей из ABINIT, AMBER, Ascalaph, CASTEP, CPMD, CHARMM, DL_POLY, FIREBALL, GROMACS, GROMOS, LAMMPS, MDynaMix, MOLDY, MOSCITO, NAMD, Newton-X, ProtoMol, PWscf, SIESTA, VASP, TINKER, YASARA, ORAC и XMD. В особенно предпочтительных воплощениях пакетом программ моделирования является CHARMM. В других предпочтительных воплощениях пакетом программ моделирования является NAMD.
Там, где способы предусматривают осуществление расчетов для одного или более атомов внутри боковой цепи, остатка или белка (например, расчет ПДР для одного или более атомов), специалисту в данной области будет понятно, что расчеты могут осуществляться для атомов, пар атомов, комбинаций или групп атомов, частей атомов или для каждого из или для всех атомов в области пространства, в боковой цепи, остатке, белке и т.д. При осуществлении расчетов, описанных в методиках по изобретению, специалисту в данной области будет также понятно, что расчеты (например, расчеты ПДР) также могут быть произведены для аминокислотных остатков, боковых цепей и так далее, содержащих атомы, группы атомов и т.д.
В дополнительных предпочтительных воплощениях структурная модель представляет собой модель рентгеновской кристаллической структуры белка или его части; или структурная модель может представлять собой теоретическую модель структуры белка или его части. В связанных воплощениях теоретическая структурная модель является гомологичной моделью белка или его части. В других воплощениях теоретическая структурная модель представляет собой ab initio модель структуры белка или его части. В другом аспекте в настоящем изобретении предлагаются способы идентификации областей белка, склонных к агрегации. В одном воплощении способ идентификации области на белке, склонной к агрегации, содержит (а) картирование на структурной модели белка ПСА, рассчитанного согласно любому способу, описанному в настоящем документе для атомов в белке; и (b) идентификацию внутри белка участка, содержащего множество атомов, имеющих ПСА>0; где область, склонная к агрегации содержит аминокислоты, содержащие указанное множество атомов. В некоторых воплощениях способ может содержать идентификацию одной или более аминокислот, содержащих один или более атомов, имеющих ПСА более чем выбранное пороговое значение; где ПСА рассчитывают согласно любому способу, описанному в настоящем документе, и где область, склонная к агрегации, содержит идентифицированные аминокислоты. В другом воплощении способ идентификации на белке области, склонной к агрегации, содержит создание графика из значений ПСА, рассчитанных согласно любому способу, описанному в настоящем документе, с дополнительным расчетом для пиков графика площади под кривой (AUC) и идентификацией одного или более областей белка с положительным значением AUC, где область, склонная к агрегации, содержит идентифицированные участки белка.
В другом аспекте в изобретении предлагаются способы получения вариантов белка, которые проявляют уменьшенную склонность к агрегации. В одном предпочтительном воплощении способ получения варианта белка, который проявляет уменьшенную склонность к агрегации, содержит замену или делецию, по меньшей мере, одного аминокислотного остатка в белке внутри области, склонной к агрегации, где область, склонная к агрегации, идентифицируют с использованием балльных оценок ПСА, рассчитанных согласно любому способу, описанному в настоящем документе; и где, в случае замены аминокислотного остатка, то его заменяют на аминокислотный остаток, который является более гидрофильным, так чтобы уменьшалась склонность к агрегации варианта белка. В некоторых конкретных воплощениях заменяют, по меньшей мере, один остаток и удаляют, по меньшей мере, один остаток.
В другом воплощении способ получения варианта белка, который проявляет уменьшенную склонность к агрегации, содержит (а) получение множества вариантов белка путем замены в каждом варианте, по меньшей мере, одного остатка внутри области, склонной к агрегации, где область, склонная к агрегации, идентифицируют с использованием балльных оценок ПСА, рассчитанных согласно любому способу, описанному в настоящем документе, где в каждом варианте заменяют один или более различных остатков или различных комбинаций остатков; где, по меньшей мере, один остаток заменяют на остаток, который является более гидрофильным; и (b) выбор варианта белка, полученного как описано в стадии (а), который проявляет уменьшенную склонность к агрегации.
В некоторых воплощениях аминокислота, которую выбирают для замены, является наиболее гидрофильной аминокислотой (как определено с помощью известной из уровня техники шкалы гидрофобности) в области, склонной к агрегации. В конкретных воплощениях аминокислота, выбранная для замены, представляет собой Phe, Leu, Ile, Tyr, Trp, Val, Met, Pro, Cys, Ala или Gly. В таких конкретных воплощениях более гидрофильная аминокислота, на которую заменяют аминокислоту в белке, может быть выбрана из группы, состоящей из Thr, Ser, Lys, Gln, Asn, His, Glu, Asp и Arg. Часто, предпочтительная шкала гидрофобности для определения тех остатков, которые более или менее гидрофильны или гидрофобны, чем другие, представляет собой шкалу гидрофобности Блэка и Моулд.
В некоторых воплощениях заменены, по меньшей мере, два аминокислотных остатка внутри области, склонной к агрегации. В связанных воплощениях заменены, по меньшей мере, три аминокислотных остатка внутри области, склонной к агрегации. Также в похожих воплощениях заменен, по меньшей мере, один остаток внутри более чем одной области, склонной к агрегации, внутри белка. В предпочтительных воплощениях способ, описанный в настоящем документе, применяется к белку, который выбирают из группы, состоящей из антитела, Fab-фрагмента, Fab'-фрагмента, Fd-фрагмента, Fv-фрагмента, F(ab')2-фрагмента и Fc-фрагмента.
В других предпочтительных воплощениях способы, описанные в настоящем документе, применяются к белку, который выбран из группы, состоящей из цитокина, хемокина, липокина, миокина, нейромедиатора, нейротрофина, интерлейкина или интерферон. В некоторых конкретных воплощениях белок может представлять собой гормон или фактор роста, рецептор или домен рецептора, нейромедиатор или нейротрофин. В некоторых воплощениях белок представляет собой пептидомиметик, белок, содержащий искусственные аминокислоты, или белок, содержащий особенные аминокислоты. В другом аспекте в изобретении также предлагаются способы расчета эффективной ПДР для аминокислотного остатка в белке. Предпочтительный способ расчета эффективной ПДР для аминокислотного остатка в белке содержит (а) расчет для аминокислоты отношения площади поверхности атомов в аминокислоте, доступной растворителю (ПДР), к ПДР атомов в идентичном остатке, который полностью экспонирован; (b) умножение отношения на гидрофобность аминокислоты, определенную по шкале гидрофобности аминокислот; в результате чего продукт представляет собой эффективную ПДР для аминокислоты. Кроме того, эффективная ПДР для аминокислотного остатка в белке может быть рассчитана с помощью способа, который дополнительно включает суммирование эффективной ПДР для 3 аминокислот или, в некоторых воплощениях для 2, 4, 5 или 6 аминокислот, которые являются соседними в последовательности белка.
В другом аспекте изобретение включает также способы идентификации в белке области связывания с макромолекулами, включающие (а) картирование на структурной модели белка ПСА, рассчитанной согласно любому из предыдущих аспектов для атомов в белке; и (b) идентификацию участка внутри белка, содержащего множество атомов, имеющих ПСА>0; где участок связывания макромолекул содержит аминокислоты, содержащие указанное множество атомов.
В другом аспекте изобретение включает способы идентификации на белке области связывания макромолекул, содержащие идентификацию одной или более аминокислот, содержащих один или более атомов, имеющих ПСА более чем выбранное пороговое значение; где ПСА рассчитывают согласно способу любого из предыдущих аспектов, и где участок связывания макромолекул содержит идентифицированные аминокислоты.
В другом аспекте изобретение включает способы идентификации на белке области связывания макромолекул, содержащие построение графика ПСА-величин, рассчитанных в любом из предыдущих аспектов, и вычисление для пиков на графике площади под кривой (AUC), и идентификацию одного или более участков с положительной AUC, где участок связывания макромолекул содержит идентифицированные участки белка.
В другом аспекте изобретение включает способы получения варианта белка, который проявляет уменьшенное сродство связывания с макромолекулой, содержащий замену или делецию, по меньшей мере, одного аминокислотного остатка в белке внутри области связывания с макромолекулой, где область связывания с макромолекулой идентифицируют с использованием балльных оценок ПСА, рассчитанных согласно любому из предыдущих аспектов; и где если заменяют аминокислотный остаток, то его заменяют на аминокислотный остаток, который является более гидрофильным, так чтобы уменьшалось сродство связывания варианта белка с макромолекулой. В определенных воплощениях заменяют, по меньшей мере, один остаток и, по меньшей мере, один остаток удаляют. В другом аспекте изобретение также включает способы получения варианта белка, который проявляет уменьшенное сродство связывания с макромолекулой, причем способ включает (а) получение множества вариантов белка путем замены в каждом варианте, по меньшей мере, одного остатка внутри области связывания с макромолекулой, где область связывания с макромолекулой идентифицируют с использованием балльных оценок ПСА, рассчитанных согласно любому из предыдущих аспектов, где один или более различные остатки или различные комбинации остатков заменяют в каждом варианте; и (b) выбор варианта белка, полученного как в стадии (а), который проявляет измененное сродство связывания с макромолекулой. В определенных воплощениях, по меньшей мере, один аминокислотный остаток внутри области связывания с макромолекулой является наиболее гидрофобным остатком в области связывания с макромолекулой. В некоторых воплощениях, по меньшей мере, один аминокислотный остаток внутри области, склонной к агрегации, представляет собой Phe, Leu, Ile, Tyr, Trp, Val, Met, Pro, Cys, Ala или Gly. В некоторых воплощениях аминокислотный остаток, который является более гидрофильным, выбирают из группы, состоящей из Thr, Ser, Lys, Gln, Asn, His, Glu, Asp и Arg. В некоторых воплощениях аминокислотный остаток, который является более гидрофильным, представляет собой особенную, искусственную или модифицированную аминокислоту. В некоторых воплощениях аминокислотный остаток, который является более гидрофильным, определяют согласно шкале гидрофобности Блэка и Моулд. В некоторых воплощениях заменены, по меньшей мере, два аминокислотных остатка внутри области связывания с макромолекулой. В некоторых воплощениях заменены, по меньшей мере, три аминокислотных остатка внутри области связывания с макромолекулой. В некоторых воплощениях внутри белка заменен, по меньшей мере, один остаток внутри более чем одной области, склонной к агрегации. В некоторых воплощениях область, склонная к агрегации идентифицируют согласно способу любого из предыдущих аспектов для идентификации на белке области, склонной к агрегации. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, макромолекула представляет собой другой белок, полинуклеотид или полисахарид, В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, белок выбирают из группы, состоящей из антитела, Fab-фрагмента, Fab'-фрагмента, Fd-фрагмента, Fv-фрагмента, F(ab')2-фрагмента и Fc- фрагмента. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, белок представляет собой цитокин, хемокин, липокин, миокин, нейромедиатор, нейротрофин, интерлейкин или интерферон. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, белок представляет собой гормон или фактор роста. В некоторых воплощениях макромолекула представляет собой рецептор гормона или рецептор фактора роста. В некоторых воплощениях белок представляет собой рецептор или домен рецептора. В некоторых воплощениях макромолекула представляет собой рецепторный агонист или рецепторный антагонист рецептора или домена рецептора. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, белок представляет собой нейромедиатор или нейротрофин. В некоторых воплощениях макромолекула представляет собой рецептор нейромедиатора или рецептор нейротрофина.
В другом аспекте изобретение также включает способ получения фармацевтической композиции, содержащей вариант белка, который проявляет измененную склонность к взаимодействию с партнером по связыванию, причем способ содержит составление смеси, включающей вариант белка, полученный согласно способу по любому из предыдущих аспектов, вместе с фармацевтически приемлемым носителем, адъювантом и/или вспомогательным веществом.
Осуществление изобретения
Настоящее изобретение относится к неудовлетворенной потребности в глубоком понимании механизма агрегации белка и для идентификации областей белка, вовлеченных в агрегацию. В изобретении предлагается, по меньшей мере, частично, технология моделирования, которая может использоваться одновременно с экспериментальными способами, описанными в настоящем документе, для улучшения стабильности потенциально терапевтических белков на фоне агрегации. Эта технология демонстрирует огромный научный и коммерческий потенциал, с учетом того, что терапии на основе антител растут огромными темпами по сравнению со всеми другими классами терапевтических средств для человека. Агрегация является распространенной проблемой, встречающейся в большинстве стадий разработки лекарственного средства на основе антител, что препятствует быстрой коммерциализации потенциальных кандидатов лекарственных средств на основе антител. Таким образом, предотвращение агрегации с использованием способов, описанных в настоящем документе, может оказать значительный эффект на разработку белковых лекарственных средств.
Кроме того настоящее изобретение относится к неудовлетворенной потребности в точной идентификации областей белков, вовлеченных в связывание с другими молекулами, которое часто опосредовано, по меньшей мере, частично, посредством больших гидрофобных участков, которые могут быть легко идентифицированы с использованием способов, описанных в настоящем документе. В изобретении предлагается, по меньшей мере, частично, технология моделирования, которая может использоваться одновременно с экспериментальными способами, описанными в настоящем документе, для изменения сродства связывания потенциально всех белок-молекулярных взаимодействий, которые опосредованы, по меньшей мере, частично, посредством больших гидрофобных участков. Эта технология демонстрирует огромный научный и коммерческий потенциал, с учетом того, что терапии на основе антител растут огромными темпами по сравнению со всеми другими классами терапевтических средств для человека.
Способность изменять сродство связывания терапевтического белка с одной или более макромолекулами может использоваться для улучшения эффективности и уменьшения или исключения активностей, опосредованных через нежелательные вторичные участки связывания с макромолекулой.
В настоящем изобретении предлагаются среди прочего способы уменьшения или предотвращения агрегации белка или изменения сродства связывания с макромолекулой. В частности, предлагаются способы для идентификации гидрофобных участков на структуре белка, которые могут участвовать в белковых взаимодействиях, в белок-макромолекулярных взаимодействиях или в агрегации белка. Предлагаемые способы основаны на новом методе, раскрытом в настоящем документе, как «пространственная склонность к агрегации» или «ПСА». С помощью инструмента ПСА также точно идентифицируются области антитела, склонные к связыванию с другими белками. Кроме антитела, этот инструмент мог бы широко применяться ко всем белкам для идентификации областей, склонных к агрегации, или областей, которые связываются с другими белками или лигандами. Способы по настоящему изобретению могут применяться к любому белку, для которого доступна трехмерная структура, или для которого может быть создана трехмерная структура с использованием гомологичного моделирования, молекулярного моделирования или ab initio определения структуры. Вообще, «ПСА» может быть рассчитана многими путями с использованием уравнений и методики, описанной в настоящем документе, например, ПСА может быть рассчитана на структурной модели белка или может быть рассчитана как среднее множества временных интервалов молекулярно-динамического моделирования структурной модели. Хотя определенный метод расчета и полученные результаты могут варьироваться, как описано в настоящем документе, основополагающий принцип основан на том факте, что ПСА представляет собой меру, которая принимает во внимание не только гидрофобность остатков в белке, но также трехмерную структуру белка и соседство аминокислот в свернутой структуре белка. С помощью термина «белок» обозначают любую последовательность из двух или более аминокислот, (также обозначаемых в настоящем документе как «аминокислотные остатки» или «остатки»), соединенных вместе с помощью пептидных связей между карбоксильной группой и аминогруппой соседних аминокислот, независимо от длины, пост-трансляционной модификации, химической модификации или функции. Термины «полипептид», «пептид» и «белок» используются в настоящем документе взаимозаменяемо. В предпочтительных воплощениях способы по настоящему изобретению применяются к белку, который имеет достаточную длину сворачивания в трехмерную структуру. В некоторых воплощениях белок представляет собой природный белок. В некоторых воплощениях белок является химически синтезированным. В некоторых воплощениях белок является рекомбинантным белком, например, гибридным или химерным белком. В некоторых воплощениях белок является комплексным белком (например, белки, взаимодействующие в комплексе). Белки могут быть выделенными (например, из природного источника или из химической среды). В некоторых воплощениях белок может представлять собой модифицированный белок или пептидомиметик. В некоторых воплощениях белок может представлять собой модифицированный белок, например, химически конъюгированный белок (включая, в частности, белки, конъюгированные с полимерами (например, пэгилированные белки)). При использовании в настоящем документе подразумевается, что термин «белок» также включает фрагменты белка. Типичные белки включают антитела (включая, в частности, фрагменты, варианты и их производные).
Действительно, предусматривается, что способы по настоящему изобретению могут применяться к любой молекуле на основе аминокислот, для которой доступна или может быть получена структурная модель. Например, способы, описанные в настоящем документе, могут применяться к модифицированным белкам или к белкам, которые включают особенные или искусственные аминокислоты, как описано в настоящем документе. В некоторых воплощениях структуры особенных, искусственных или модифицированных аминокислот могут быть вычислительно заменены или вставлены в структурную модель для применения способов, описанных в настоящем документе. Способы экспериментального создания пептидных аналогов, производных и миметиков известны из уровня техники. Например, см. Farmer PS. in Drug Design (EJ. Ariens, ed.) Academic Press, New York, 1980, vol.10, pp.119-143; Ball. J.B. and Alewood PF. (1990)/. Mol. Recognition 3:55; Morgan B.A. and Gainor J.A. (1989) Ann. Rep. Med. Chem. 24:243; and Freidinger, R.M. (1989) Trends Pharmacol. Sci. 10:270. См. также Sawyer Т.K. (1995) "Peptidomimetic Design and Chemical Approaches to Peptide Metabolism" in Taylor M.D. and Amidon G.L. (eds.) Peptide-Based Drug Design: Controlling Transport and Metabolism, Chapter 17; Smith A.B. 3rd et al. (1995)/. Am. Chem. Soc. 117:11113-11123; Smith A.B. 3rd et al. (1994)/. Am. Chem. Soc. 116:9947-9962; and Hirschman R. et al. (1993)/. Am. Chem. Soc. 115:12550-12568.
Большое количество и разнообразие пептидных, полипептидных и белковых терапевтических агентов известно из уровня техники, и ожидается, извлечение пользы из способов по настоящему изобретению. Эти терапевтические агенты содержат несколько очень обширных классов, включающих среди прочих гормоны, белки, антигены, иммуноглобулины, репрессоры/активаторы, ферменты, цитокины, хемокины, миокины, липокины, факторы роста, рецепторы, домены рецепторов, нейромедиаторы, нейротрофины, интерлейкины и интерфероны.
Подходящие гормоны, которые могут применяться в рамках настоящего изобретения, включают белковые гормоны, такие как инсулин и глюкагон, которые регулируют сахар в крови. Специалисту в данной области понятно, что упомянутые гормоны обычно применяются для лечения различных патологических состояний и заболеваний, включающих рак, метаболические заболевания, сердечнососудистые заболевания, питуитарные состояний и климактерический период.
Изначально, считалось, что только некоторые белки образуют фибриллы или агрегаты. Совсем недавно были получены доказательства того, что гораздо больше белков, чем ожидалось, содержат области, склонные к агрегации (Fandrich M., Fletcher M. A. and Dobson, С.M. (2001) Nature 410, 165-166). Действительно, доказано, что настолько короткие пептиды, как те, что содержат 4 остатка, могут образовывать фибриллы (J. Biol. Chem., Vol.277, Issue 45, 43243-43246, Nov.8, 2002).
Белковые терапевтические средства представляют собой растущую часть рынка терапевтических средств. Например, инсулин и глюкагон являются важными белковыми терапевтическими средствами, которые регулируют сахар в крови и могут получить пользу от способов по настоящему изобретению. Островковый амилоидный полипептид (Islet Amyloid Polypeptide) (IAPP) представляет собой дополнительный гормон, секретируемый поджелудочной железой, который используется при лечении диабета. Другой белок, представляющий интерес, представляет собой гранулоцит-колониестимулирующий фактор или G-CSF, который представляет собой фактор роста, характерный для крови, который может использоваться для увеличения продуцирования клеток крови. Тканевый активатор плазминогена представляет собой блокатор образования тромбов, используемый при лечении инсульта или инфаркта. Кроме того, эритропоэтин представляет собой гормон, продуцируемый почкой, который может использоваться при лечении СПИДа, анемии, почечной недостаточности и других патологических состояний. Наконец кальцитонин представляет собой пептид, который, как было обнаружено, является эффективным в лечении гиперкальцемии, болезни Педжета, и определенных типов остеопороза.
Дополнительные примеры белков, которые, как ожидается, получат выгоду от способов, описанных в настоящем документе, включают, в частности, адренокортикотронный гормон (АСТН), амилин, ангиотензин, ангиогенин, противовоспалительные пептиды, BNP, эндорфины, эндотелин, GLIP, рилизинг-фактор, гормона роста (GRF), гирудин, инсулинотропин, нейропептид Y, РТН, VIP, рилизинг-гормон гормона роста (GHRH), октреотид, гипофизарные гормоны (например, hGH), ANF, факторы роста, bMSH, соматостатин, фактор, высвобождающий фактор роста тромбоцитов, человеческий хорионический гонадотропин, гирулог hirulog, интерферон альфа, интерферон бета, интерферон гамма, интерлейкины, гранулоцит-макрофаг-колониестимулирующий фактор (GM-CSF), гранулоцит-колониестимулирующий фактор (G-CSF), менотропины (урофоллитропин (FSH) и LH)), стрептокиназу, урокиназу, ANF, ANP, ингибиторы выведения ANP, агонисты антидиуретического гормона, генетически родственный кальцитонину пептид (CGRP), IGF-I, пентигетид, белок С, белок S, тимозин альфа-1, аналоги антагонистов вазопрессина, доминантный негативный TNF-α, альфа-MSH, VEGF, PYY, и полипептиды, фрагменты, аналоги полипептидов и производные, полученные из вышеприведенных белков.
В особенно предпочтительных воплощениях белок представляет собой антитело или иммуноглобулин. Термин «антитело» используется в широком смысле и конкретно включает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), одноцепочечные антитела, химерные антитела, рекомбинантные антитела и фрагменты антител. Полноразмерное антитело представляет собой гликопротеин, содержащий, по меньшей мере, две тяжелые (Н) цепи и две легкие (L) цепи связанные друг с другом с помощью дисульфидных связей. Остаток Asn-297 в CH2 является N-гликозилированным. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначенной в настоящем документе как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. FC-рецепторы связываются с нижним шарнирным участком CH2 и опосредуют эффекторные функции, такие как антителозависимая клеточноопосредованная цитотоксичность (ADCC). Протеин А связывается в месте соединения CH2-CH3 Fc и широко используется в очистке полноразмерных антител. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначенную здесь как VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен, CL. Области VH и VL могут быть далее разделены на области гипервариабельности, называемыми областями, определяющими комплементарность связывания (CDR-complementarity-determining region), перемежаются областями, которые являются более консервативными, называемыми каркасными областями (FR-framework region). Каждая VH и VL состоит из трех CDR и четырех PR размещенных от N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Таким образом, термин «антитело» будет охватывать различные изотипы или подклассы антитела, например, IgA, IgD, IgE, IgG и IgM, или IgG1, IgG2, IgG3 и IgG4. Еще включены Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирном участке; Fab'-фрагмент, который по существу представляет собой Fab с частью шарнирного участка (см., FUNDAMENTAL IMMUNOLOGY (Paul ed., 3rd ed. 1993); Fd-фрагмент, состоящий из доменов VH и CH1; Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела arm of an antibody, dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH; выделенный гипервариабельный участок (CDR); нанотело, вариабельный участок тяжелой цепи, содержащий один вариабельный домен и два константных домена.
При использовании в настоящем документе термин «структурная модель» представляет собой описание трехмерной вторичной, третичной и/или четвертичной структуры белка. Структурная модель охватывает рентгеновские кристаллические структуры, ЯМР-структуры, теоретические структуры белка, структуры, созданные исходя из гомологического моделирования, модели белковой томографии и атомистические модели, построенные исходя из исследований с использованием электронной микроскопии. Обычно термин «структурная модель» не охватывает только первичную аминокислотную последовательность белка, но обеспечивает координаты для атомов белка в трехмерном пространстве, таким образом, демонстрируя сворачивание белка и положения аминокислотных остатков. В предпочтительных воплощениях анализируемая структурная модель представляет собой рентгеновскую кристаллическую структуру, например, структуру, полученную из Белковой Базы Данных (PDB, rcsb.org/pdb/home/home.do), или гомологическую модель, построенную на основе известной структуры похожего белка. В предпочтительных воплощениях структурная модель предварительно обрабатывается перед применением способов по настоящему изобретению. Например, структурная модель может быть осуществлена посредством молекулярно-динамического моделирования, чтобы позволить боковым цепям белка достичь более естественной конформации, или структурная модель может иметь разрешение на взаимодействие с растворителем, например, водой в молекулярно-динамическом моделировании. Предварительная обработка не ограничивается молекулярно-динамическим моделированием и может быть выполнена с использованием любых известных из уровня техники способов для определения движения белка в растворе. Типичным альтернативным методом моделирования является моделирование Монте-Карло. Моделирования могут осуществляться с использованием пакетов программ моделирования или любых других приемлемых вычислительных способов. В определенных воплощениях моделирования для поиска, зонд или конформационное пространство примерного белка могут осуществляться на структурной модели для определения движения белка.
«Теоретическая структура белка» представляет собой трехмерную структурную модель белка, которая создана с использованием вычислительных методов часто без прямых экспериментальных измерений нативной структуры белка. «Теоретическая структура белка» охватывает структурные модели, созданные с помощью методов ab-initio и гомологического моделирования. «Гомологическая модель» представляет собой трехмерную структурную модель белка, которая создается с помощью гомологического моделирования, которое обычно включает сравнение первичной последовательности белка с известной трехмерной структурной похожего белка. Гомологическое моделирование хорошо известно в данной области и описано в публикациях Kolinski et al. Proteins. 1999; 37(4):592-610; Rost et al., B, Potein Sci. 1996; 5(8):1704-1718, и заявке на №7212924; 6256647 и 6125331, которые все включены в настоящий документ посредством отсылки. В частности, в работе Xiang. (Curr Protein Pept Sci. 2006 Jun; 7(3):217-27, включенной в настоящий документ ссылкой) представлено превосходное описание и обзор методов гомологического моделирования, которые могут использоваться для получения структур, применяемых для способов по настоящему изобретению. Действительно, любая программа гомологического моделирования, известная из уровня техники, может использоваться согласно настоящим способам, например MODELLER (Eswar et al., Comparative Protein Structure Modeling With MODELLER. Current Protocols in Bioinformatics, John Wiley & Sons, Inc., Supplement 15, 5.6.1-5.6.30, 200), SEGMOD/ENCAD (Levitt M. J Mol Biol 1992; 226:507-533), SWISS-MODEL (Schwede T., Kopp J., Guex N., Peitsch M.C. Nucleic Acids Research 2003; 31:3381-3385), 3D- JIGSAW (Bates et al., Proteins: Structure, Function and Genetics, Suppl 2001; 5:39-6), NEST (Xiang. Curr Protein Pept Sci. 2006 June; 7(3):217-227) и BUILDER (Koehl and Delarue. Curr Opin Struct Biol 1996; 6(2):222-226.). Для антител, в частности, структура вариабельных областей антител может быть точно получена с использованием метода канонических структур (Chothia С. and Lesk A.M., J.Mol.Biol. 1987, 196, 901; Chothia С. et al., Nature 1989, 342, 877).
В конкретных воплощениях гомологическое моделирование может использоваться для сборки цельных белков, исходя из известных структурных фрагментов, таких как когда Fab-фрагмент антитела моделируется на Fc-фрагмент, или когда Fab-фрагмент создается в виде теоретической белковой структуры и моделируется на кристаллическую структуру Fc-фрагмента. Специалисту понятно, что существуют различные возможности. В одном конкретном воплощении Fab-фрагмент может моделироваться на различные Fc-структуры различных классов или изотипов антитела.
Модели ab initio также могут применяться в способах по настоящему изобретению. «Структурная модель белка ab initio» представляет собой структурную модель белка, которая создается непосредственно исходя из первичной последовательности белка путем моделирования процесса сворачивания белка с использованием уравнений, известных в физической химии (Bonneau and Baker. Annual Review of Biophysics and Biomolecular Structure. 2001, Vol.30, Pages 173-189; Lesk Proteins 1997; 1:151-166. Suppl; Zemla, et al. Proteins 1997; 1:140-150. Suppl; Ingwall., et al. Biopolymers 1968; 6:331-368; и патенты США №6832162; 5878373; 5436850; 6512981; 7158891; 6377893; и заявках на США №9/788006; 11/890863 и 10/113219, которые все включены в настоящий документ посредством отсылки. Обычно экспериментально определенные структуры (например, рентгеновские кристаллические структуры) и гомологические модели являются предпочтительными по отношению к моделям ab initio, так как трудность de novo моделирования сворачивания белка может в некоторых случаях приводить к получению неточных структурных моделей белков.
Понятно, что любой метод получения теоретической структуры белка, известный из уровня техники, может применяться согласно настоящему изобретению. Кроме методов, описанных выше, согласно настоящей методике могут использоваться такие методы, как те, что описаны на конференции «Критическая Оценка Методов Прогнозирования Структуры Белка» (CASP). Различные примеры описаны в работах «CASP», например, в публикациях, относящихся к 7-ому Коллективному Обширному Эксперименту по Критической Оценке Методов Прогнозирования Структуры Белка, Asilomar Conference Center, Pacific Grove, CA November 26-30, 2006, а также в работах CASP6. Proteins: Structure, Function, and Bioinformatics. 2005. 61(S7):1-236; CASP5 proceedings. Proteins: Structure, Function, and Genetics. 2003, 53(S6):333-595; CASP4 proceedings. Proteins: Structure, Function, and Genetics. 2001, 45(S5):1-199; CASP3 proceedings Proteins: Structure, Function and Genetics, 1999, 37(S3):1-237 (1999).
В настоящем изобретении также предлагается способ получения варианта белка, который проявляет уменьшенную склонность к агрегации. При использовании в настоящем документе, «склонность к агрегации» представляет собой тенденцию белка к образованию кластеров или масс. Такие кластеры или массы могут содержать два или более часто 3 или более белков обычно того же типа. Соответственно, белок, который проявляет «уменьшенную склонность к агрегации» представляет собой белок, который при модификации или обработке образует агрегаты меньше по количеству или агрегаты, меньшие по размеру, по сравнению с тем же белком, который не модифицирован или не подвергнут обработке.
Термин «ингибирует» обозначает выражение измеряемого уменьшения явления, часто используется в настоящем документе по отношению к взаимодействиям связывания или агрегации белка. Аминокислотные остатки, кластеры остатков, участки белка или области на поверхности белка часто могут быть описаны как гидрофильные или гидрофобные. Согласно способам по изобретению пространственная склонность к агрегации описывает гидрофобность и рассчитывается отчасти с использованием шкалы гидрофобности аминокислот, известной в данной области. В предпочтительном воплощении шкала гидрофобности аминокислот представляет собой шкалу, представленную в публикации Black and Mould, Anal. Biochem. 1991, 193, 72-82 (включенной в настоящий документ посредством отсылки). Вообще, согласно Блэку и Моулд гидрофобность аминокислот прогрессирует следующим образом (начиная с наиболее гидрофобных остатков): Phe>Leu=Ile>Tyr≈Trp>Val>Met>Pro>Cys>Ala>Gly>Thr>Ser>Lys>Gln>Asn>His>Glu>Asp>Arg. Дифференцированные по шкале величины гидрофобности, как сообщается у Блэка и Моулд, продемонстрированы в таблице 1 ниже.
Соответственно, когда выбирается аминокислота для замены с помощью способов по изобретению (например, по обладанию высокой балльной оценкой ПСА или будучи остатком, идентифицированным в области, склонной к агрегации), она заменяется на другую аминокислоту, которая находится ниже по шкале гидрофобности. Например, если для замены выбирается аминокислота метионин, то она может быть заменена на менее гидрофобную аминокислоту, например Pro, Cys, Ala, Gly и т.д. В особенно предпочтительных воплощениях гидрофобная аминокислота заменяется на Lys. В дополнительных предпочтительных воплощениях гидрофобная аминокислота заменяется на Glu, Gln, Asp, Thr или Ser. Таким образом, когда остаток описывается как «более гидрофобный», «более гидрофильный», «наиболее гидрофобный» или «наиболее гидрофильный», то определение гидрофобности/гидрофильности осуществляется согласно любой шкале гидрофобности, известной из уровня техники, например, предпочтительной шкале Блэка и Моулд.
Практически, любая известная из уровня техники шкала гидрофобности аминокислот может применяться с помощью способов по настоящему изобретению. Таким образом, хотя шкала, описанная в таблице 1, может использоваться во время расчета пространственной склонности к агрегации, она может быть заменена на другие шкалы, известные в данной области. Недавний обзор Biswas et al. (J. Chromatogr. A 1000 (2003) 637-655; включенный в настоящий документ посредством отсылки) описывает различные шкалы гидрофобности, которые могут использоваться согласно настоящему изобретению.
Дополнительно к гидрофобности аминокислот, способы, описанные в настоящем документе, могут оценивать гидрофобность атома внутри белка или структурной модели белка. В одном воплощении «гидрофобность атома» представляет собой соотношение гидрофобности аминокислоты, которая содержит атом, и гидрофобности количества атомов в аминокислоте, или более предпочтительно, и гидрофобности количества атомов в боковой цепи аминокислоты. В похожем воплощении «гидрофобность атома» может представлять собой долю гидрофобности остатка, которая пропорциональна размеру, площади поверхности или объему рассматриваемого атома. Например, если атом кислорода составляет 5% объема аминокислотного остатка, то гидрофобность атома кислорода будет составлять 5% от гидрофобности аминокислотного остатка. В другом воплощении гидрофобность атома может представлять собой долю гидрофобности остатка, эквивалентную или пропорциональную доле площади поверхности, которой соответствует атом в аминокислотном остатке. В сопутствующих воплощениях масса гидрофобности (т.е. доля гидрофобности остатка), определенная по отношению к атому, может отражать долю объема, который занимает атом в остатке, массу атома в остатке, долю вклада атома в гидрофобность и т.д. Как описано выше, гидрофобность аминокислоты определяется согласно шкале гидрофобности, известной из уровня техники.
Термин «область, склонная к агрегации», обсуждаемый выше, представляет собой область на структуре белка, которая обладает склонностью к связыванию с другими белками, таким образом увеличивая вероятность образования агрегатов. Области, склонные к агрегации проявляют гидрофобный характер, как идентифицировано с помощью балльных оценок ПСА, описанных в настоящем документе. В другом воплощении область, склонная к агрегации, представляет собой область, которая является более гидрофобной, чем окружающие области. В определенном воплощении область, склонная к агрегации может представлять собой определенный трехмерный участок пространства, например, сферу радиусом R (или, в ином случае, все аминокислотные остатки, содержащие по меньшей мере один атом внутри радиуса R), окружающую атом, где гидрофобный характер представляет собой балльную оценку ПСА. В следующих воплощениях «область, склонная к агрегации» охватывает любой кластер или группировку остатков или атомов, которые проявляют гидрофобный характер, рассчитанный с помощью балльной оценки ПСА. Альтернативно, «область, склонная к агрегации» может содержать соседние атомы или остатки, которые обладают балльной оценкой ПСА выше, чем некоторое пороговое значение, например, >-0,5,>0,>0,5 и т.д., или в похожем воплощении она может содержать те атомы или остатки, обладающие рассчитанной площадью под кривой (на графике балльных оценок ПСА, описанном ниже) выше некоторого порогового значения, например, >-0,5,>0,>0,5,>1,>1,5,>2,>2,5 и т.д.
В одном аспекте в способах по изобретению применяется метод молекулярного моделирования для предварительной обработки моделей структуры белка и/или для идентификации в белках областей, склонных к агрегации. Например, молекулярно-динамическое моделирование может применяться перед расчетом ПСА или ПДР. Практически, любой метод моделирования/пакет программ, который проводит измерение конформационного пространства, может использоваться согласно способам, описанным в настоящем документе. Предпочтительный способ молекулярного моделирования представляет собой молекулярно-динамическое моделирование (MDS). MDS представляет собой математическое моделирование, где атомы в молекулярной структуре могут двигаться и взаимодействовать согласно законам физики, например, химические связи внутри белков могут изгибаться, вращаться, гнуться и вибрировать внутри белков, как позволяют законы химии и физики. Взаимодействия, такие как электростатические силы, гидрофобные силы, взаимодействия Ван-дер-Ваальса, взаимодействия с растворителем и другие также могут быть смоделированы в моделированиях MDS. Такие моделирования позволяют специалисту в данной области наблюдать за структурой белка, которая может появиться при сольватации или, осуществлять более точные измерения структуры белка путем получения среднего от множества измерений в различных точках во время моделирования. В предпочтительном воплощении молекулярное моделирование проводят с использованием пакета программ CHARMM (Brooks et al. 1983, 4, 187). J. Comput. Chem., 1983, 4, 187). В другом предпочтительном воплощении молекулярное моделирование проводят с использованием пакета программ NAMD (Phillips et al. Journal of Computational Chemistry. 2005, 26, 1781). Специалисту в данной области будет понятно, что могут использоваться многочисленные пакеты программ, например, пакет программ CHARMM может применяться для установки или предварительной обработки структурной модели белка, сольватированной структуры и т.д., а пакет программ NAMD может применяться для моделирований, который становятся частью расчетов пространственной склонности к агрегации. Любая из многочисленных методик, известных из уровня техники, может использоваться согласно настоящему изобретению. Следующие публикации, которые включены в настоящий документ посредством отсылки, описывают многочисленные методики, которые могут применяться: Methods Mol. Biol. 2008; 443:63-88; Norberg and Nilsson. Q Rev Biophys. 2003 Aug; 36(3):257-306; патенты №5424963; 7096167 и заявки на США №11/520, 588 и 10/723, 594. Конкретно, следующие платформы пакетов программного обеспечения могут применяться для моделирований молекулярной динамики: ABINIT (Gonze et al. Comput. Mat. Science. 2002, 25, 478; Gonze et al. Kristallogr. 2005. 220, 558; abinit.org/); AMBER (Duan et al. Journal of Computational Chemistry. 2003, 24(16):1999-2012; amber.scripps.edu); Ascalaph (agilemolecule.com/Products.html, June 19, 2008); CASTEP (Segall et al. J. Phys.: Cond. Matt. 2002, 14(11):2717-2743; Clark et al. Zeitschrift fur Kristallographie. 2005, 220(5-6) pp.567-570; castep.org); CPMD (CMPD manual for CMPD version 3.11.0, March 29, 2006; cpmd.org/manual.pdf); CHARMM (Brooks et al. J Comp Chem. 1983, 4:187-217; charmm.org); DL_POLY (Todorov & Smith, THE DL POLY 3 USER MANUAL. STFC Daresbury Laboratory. Version 3.09.3, February 2008; cse.scitech.ac.uk/ccg/software/DL_POLY/MANUALS/USRMAN3.09.pdf); FIREBALL (fireball.phys.wvu.edu/LewisGroup/fireballHome.html); GROMACS (Van Der Spoel et al., J Comput Chem. 2005, 26(16):1701-18. Hess et al., J Chem Theory Comput. 2008, 4(2):435; gromacs.org); GROMOS (Schuler, Daura, van Gunsteren. Journal of Computational Chemistry. 2001, 22(11):1205-1218; igc.ethz.ch/GROMOS/index); LAMMPS (Plimpton, J Comp Phys. 1995, 117, 1-19; lammps.sandia.gov); MDynaMix (Lyubartsev and Laaksonen. Computer Physics Communications. 2000, 128, 565-589; fos.su.se/~sasha/mdynamix/); MOLDY (Moldy: a portable molecular dynamics simulation program for serial and parallel computers., Computer Physics Communications. 2000, 126(3):309-328; earth.ox.ac.uk/~keithr/moldy.html); MOSCITO (Dietmar Paschek and Alfons Geiger. User's Guide and Manual, M0SCIT0 4, Performing Molecular Dynamics Simulations, April 7, 2003, ganter.chemie.uni-dortmund.de/MOSCITO/manual4.pdf); NAMD (Kumar, et al, IBM Journal of Research and Development. 2007, Volume 52, N 1/2; Phillips et al., Proceedings of SC 2002; charm.cs.uiuc.edu/research/moldyn/); Newton-X (M. Barbatti, G. Granucci, M. Ruckenbauer, M. Persico, H. Lischka, Newton-X: a package for Newtonian dynamics close to the crossing seam, version 0.15b, 2007; univie.ac.at/newtonx; Barbatti et al., J. Photochem. Photobio. A 190, 228 (2007)); ProtoMol (Matthey et al. ACM Trans. Math. Softw., 2004, 30(3):237-265; protomol.sourceforge.net/); PWscf (User's Guide for Quantum-ESPRESSO version 3.2, pwscf.org/guide/3.2.3/users-guide-3.2.3.pdf); SIESTA (Soler et al. Journal of Physics: Condensed Matter. 2002, 14:2745-2779; uam.es/departamentos/ciencias/fismateriac/siesta/); VASP (Georg Kresse and Jugen Furthmuller, VASP the GUIDE, Institut fur Materialphysik, Universitat Wien, Sensengasse 8, A-1130 Austria, Vienna, March 1, 2007; cms.mpi.univie.ac.at/vasp/); TINKER (Ren and Ponder. J. Phys. Chem. B. 2003, 107, 5933-5947; dasher.wustl.edu/tinker/); YASARA (Krieger E., Koraimann G., Vriend GProteins. 2002 47(3):393-402.); ORAC (Procacci et al., Phys. Chem. 2002 47(3):393-402.); ORAC (Procacci et al., Phys. Chem. 1996, 100 10464-10469; chim.unifi.it/orac/); XMD (XMD online manual, XMD - Molecular Dynamics Program Jon Rifkin, v2.5.30 20 Jan 2002).
При использовании в настоящем документе термин «аминокислота» и «аминокислотный остаток» и «остаток» может в некоторых воплощениях использоваться как синоним для аминокислоты, существующей в выделенном состоянии, например, в растворе, где она обладает не связанными амино- и карбокси-концом, или существующей в белке, например, в виде аминокислотного остатка, ковалентно связанного, по меньшей мере, с одной другой аминокислотой посредством пептидной связи. Специалисту в данной области будет понятна подразумевающаяся белковая химия.
При использовании в настоящем документе, термин «искусственная аминокислота» представляет собой аминокислоту, которая, как известно, не существует в природе. Термин «искусственная аминокислота» охватывает аналоги аминокислот. Он может дополнительно охватывать производное природной аминокислоты, содержащее замену или добавление группы, выбранной из группы, содержащей алкильную группу, арильную группу, ацильную группу, азидогруппу, цианогруппу, группу галогена, гидразидную группу, гидроксильную группу, алкенильную группу, алкинильную группу, группу простого эфира, тиольную группу, сульфонильную группу, селеногруппу, сложноэфирную группу, группу тиокислоты, боратную группу, боронатную группу, фосфогруппу, фосфоногруппу, фосфиновую группу, гетероциклическую группу, еноновую группу, иминогруппу, альдегидную группу, гидроксиламиногруппу, кетогруппу, сахарную группу, альфа-гидроксигруппу, циклопропильную группу, циклобутильную группу, циклопентильную группу, 2-нитробензильную группу, 3,5-диметокси-2-нитробензильную группу, 3,5-диметокси-2-нитровератролкарбаматную группу, нитробензильную группу, 3,5-диметокси-2-нитробензильную группу и аминогруппу.
Например, неприродные аминокислоты могут быть без ограничения любыми из следующих аминокислот: гидроксиметионин, норвалин, O-метилсерин, кротилглицин, гидроксилейцин, алло-изолейцин, норлейцин, α-аминомасляную кислоту, трет-бутилаланин, гидроксиглицин, гидроксисерин, F-аланин, гидрокситирозин, гомотирозин, 2-F-тирозин, 3-F-тирозин, 4-метил-фенилаланин, 4-метокси-фенилаланин, 3-гидрокси-фенилаланин, 4-NH2-фенилаланин, 3-метокси-фенилаланин, 2-F-фенилаланин, 3-F-фенилаланин, 4-F-фенилаланин, 2-Br-фенилаланин, 3-Br-фенилаланин, 4-Br- фенилаланин, 2-Cl-фенилаланин, 3-Cl-фенилаланин, 4-Cl-фенилаланин, 4-CN-фенилаланин, 2,3-F2-фенилаланин, 2,4-F2-фенилаланин, 2,5-F2-фенилаланин, 2,6-F2-фенилаланин, 3,4-F2-фенилаланин, 3,5-F2-фенилаланин, 2,3-Br2-фенилаланин, 2,4-Br2-фенилаланин, 2,5-Br2-фенилаланин, 2,6-Br2-фенилаланин, 3,4-Br2-фенилаланин, 3,5-Br2-фенилаланин, 2,3-Cl2-фенилаланин, 2,4-Cl2-фенилаланин, 2,5-Cl2-фенилаланин, 2,6-Cl2-фенилаланин, 3,4-Cl2-фенилаланин, 2,3,4-F3-фенилаланин, 2,3,5-F3-фенилаланин, 2,3,6-F3-фенилаланин, 2,4,6-F3-фенилаланин, 3,4,5-F3-фенилаланин, 2,3,4-Br3-фенилаланин, 2,3,5-Br3-фенилаланин, 2,3,6-Br3-фенилаланин, 2,4,6-Br3-фенилаланин, 3,4,5-Br3-фенилаланин, 2,3,4-Cl3-фенилаланин, 2,3,5-Cl3-фенилаланин, 2,3,6-Cl3-фенилаланин, 2,4,6-Cl3-фенилаланин, 3,4,5-Cl3-фенилаланин, 2,3,4,5-F4-фенилаланин, 2,3,4,5-Br4-фенилаланин, 2,3,4,5-Cl4-фенилаланин, 2,3,4,5,6-F5-фенилаланин, 2,3,4,5,6-Br5-фенилаланин, 2,3,4,5,6-Cl5-фенилаланин, циклогексилаланин, гексагидротирозин, циклогексанол-аланин, гидроксилаланин, гидроксифенилаланин, гидроксивалин, гидроксиизолейцин, гидроксиглутамин, тиенилаланин, пиррол-аланин, NT-метилгистидин, 2-амино-5-оксокапроновая кислота, норвалин, норлейцин, 3,5-F2-фенилаланин, циклогексилаланин, 4-Cl-фенилаланин, п-азидо-фенилаланин, о-азидо-фенилаланин, O-4-аллил-L-тирозин, 2-амино-4-пентановая кислота и 2-амино-5-оксокапроновая кислота. Ожидается, что, по меньшей мере, для искусственных аминокислот, перечисленных выше, и для аминокислот, применяемых согласно методу «Ambrx ReCODE™» (ambrx.com/wt/page/technology), искусственные аминокислоты будут соответствовать шкалам гидрофобности подобно той, что описана у Блэка и Моулд для обычных 20 аминокислот. Альтернативно, гидрофобность любой искусственной или нестандартной аминокислоты может определяться с помощью различных методов, которые хорошо известны из уровня техники, таких как те, что рассмотрены и приведены у Biswas et al. (J. Chromatogr. A 1000 (2003) 637-655).
Термин «аналог аминокислоты» обозначает аминокислоту, где C-концевая карбоксигруппа, N-концевая аминогруппа или функциональная группа боковой цепи была химически модифицирована с получением другой функциональной группы. Например, бета-метиловый эфир аспарагиновой кислоты представляет собой аналог аспарагиновой кислоты; N-этилглицин представляет собой аналог аминокислоты глицина; или карбоксамид аланина представляет собой аналог аминокислоты аланина.
Термин «нестандартные аминокислоты» обозначает те природные аминокислоты, которые являются редкими или по другой причине не принадлежат к наиболее распространенным аминокислотам, где распространенные аминокислоты представляют собой селеноцистеин, аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин.
Следующие частные примеры модифицированных, нестандартных (т.е., редких) искусственных аминокислот или аналогов аминокислот, которые могут быть заменены согласно способам по изобретению, представляют собой: О-метил-L-тирозин, L-3-(2-нафтил)-аланин, 3-метил-L-фенилаланин, фторсодержащий фенилаланин, п-бензоил-L-фенилаланин, п-йод-L-фенилаланин, п-бром-L-фенилаланин, п-амино-L-фенилаланин, 3,4-дигидрокси-L-фенилаланин, изопропил-L-фенилаланин, п-азидо-L-фенилаланин, п-ацетил-L-фенилаланин, м-ацетил-L-фенилаланин, 4-(2-оксо-пропокси)-L-фенилаланин, и аминокислоты (и способы их включения), которые описаны в Пат. США №7,083,970; 7,045,337; заявках на Патент США №10/126931; 11/002387; 11/254170; 11/009635; 11/670354; 11/284259; 10/563686; 11/326970; 10/563656; 10/563655; 11/715672; 11/671036; 11/255601; 11/580223; 11/137850; 11/233508; 10/575991; 11/232425; в Публикациях Wipo WO/2007/094916; WO/2007/130453; и в публикациях Liao J. Biotechnol Prog. 2007 Jan-Feb; 23(1):28-31; Rajesh, and Iqbal. Curr Pharm Biotechnol. 2006 Aug; 7(4):247-59. Cardillo et al. Mini Rev Med Chem. 2006 Mar; 6(3):293-304; Wang et al. Annu Rev Biophys Biomol Struct. 2006; 35:225-49; Chakraborty et al., Glycoconj J. 2005 Mar; 22(3):83-93, которые все включены в настоящий документ посредством отсылки. Следующие примеры нестандартных аминокислот могут быть обнаружены, например, в следующих Патентных Публикациях США, содержания которых включено в настоящий документ посредством отсылки: 2003-0082575, 2005-0250183, 2003-0108885, 2005-0208536, и 2005-0009049.
I. Пространственная склонность к агрегации
Изобретение, представленное в настоящем документе, относится к способам идентификации на поверхности белка областей, склонных к агрегации, для предотвращения или уменьшения агрегации белка, и для идентификации на белке области связывания с макромолекулой. Способы, представленные в настоящем документе, представляют прогресс в способности вычислительных методов идентификации области белков, которые могут быть модифицированы с уменьшением сродства связывания белка с макромолекулой. В частности, способы основываются, по меньшей мере, частично, на расчете ПДР (поверхности доступной растворителю), которая известна в данной области для описания характеристик поверхности белка. ПДР дает площадь поверхности каждой аминокислоты в структуре белка, которая находится в контакте с растворителем. ПДР может быть, как правило, рассчитана путем вычисления локуса центра сферы зонда, который катится по поверхности белка, т.е. поверхности структурной модели белка. Сфера зонда имеет тот же радиус что и молекула воды, R=1,4 Å. Альтернативные способы расчета ПДР, описанные ниже, известные в данной области, сравнимы со способами описанными в данном документе. Хотя ПДР весьма полезна для описания характеристик поверхности белка, было обнаружено, что она не адекватно характеризует гидрофобные участки на поверхности белка, которые являются потенциально склонными к агрегации из-за следующих недостатков:
1. ПДР не делает различия между гидрофобными и гидрофильными областями;
2. значение ПДР не является прямо пропорциональным гидрофобности остатка (например, MET имеет большую площадь поверхности, чем LEU, но является менее гидрофобным);
3. значение ПДР не указывает, находятся ли несколько гидрофобных остатков по близости и таким образом не усиливают ли они гидрофобность определенной области. Эти остатки могут быть поблизости либо в первичной последовательности, либо в третичной структуре, даже если они находятся далеко в первичной последовательности. В любом случае, они могут усиливать гидрофобность определенного участка поверхности антитела.
Одну систему измерений, которая описана в настоящем документе, эффективная ПДР, получают путем расчета гидрофобности экспонированной части аминокислоты, согласно формуле, приведенной ниже:

Следующее воплощение эффективной ПДР дополнительно содержит суммирование эффективной ПДР для, по меньшей мере, трех, по меньшей мере, четырех, по меньшей мере, пяти или, по меньшей мере, шести (например, двух, трех, четырех, пяти, шести и т.д.) аминокислотных остатков, которые являются соседними в первичной последовательности белка. Хотя эффективная ПДР представляет собой улучшение по сравнению с обычной ПДР, ему, тем не менее, не хватает способности в полной мере учитывать структуру свернутого белка и факта того, аминокислоты, которые не являются прилегающими в белкой последовательности, могут находиться в непосредственной близости друг от друга в свернутой вторичной, третичной или четвертичной структуре белка. Такие складки белка могут образовывать области, склонные к агрегации, которые отсутствуют отдельно в первичной структуре, или которые могут быть определены только более сложным анализом свернутой белковой структуры.
В настоящем изобретении предлагается новая, более предпочтительная система измерений, называемая пространственная склонность к агрегации, которая выделяет эффективную гидрофобность определенной области или участка на поверхности белка. Значение пространственной склонности к агрегации вычисляется для определенных областей в пространстве вокруг или около атомов структурной модели белка.
В этом контексте, «определенная область пространства» представляет собой трехмерное пространство или объем, выбранный для захвата местной физической структуры и/или химической среды на структуре белка или около нее. В особенно предпочтительном воплощении пространственная склонность к агрегации вычисляется для сферических областей с радиусом R отцентрованных на атомах в белке (например, на атомах в структурной модели белка). Пространственная склонность к агрегации может быть также рассчитана для сферических областей с радиусом R с центром на химических связях, или расположенных в пространстве около структурной модели. Соответственно, в другом предпочтительном воплощении ПСА может быть рассчитана для определенной области пространства с центром около атома, например, с центром в точке пространства, которое находится на расстоянии между 1-10 Å, более предпочтительно, 1-5 Å, более предпочтительно, 1-2 Å, от центра конкретного атома или химической связи.
В предпочтительных воплощениях выбранный радиус находится в интервале между 1 Å и 50 Å, более предпочтительно между 1 Å и 50 Å. В конкретных воплощениях выбранный радиус составляет по меньшей мере 1 Å, по меньшей мере 3 Å, по меньшей мере 4 Å, по меньшей мере 5 Å, по меньшей мере 6 Å, по меньшей мере 7 Å, по меньшей мере 8 Å, по меньшей мере 9 Å, по меньшей мере 10 Å, по меньшей мере 11 Å, по меньшей мере 12 Å, по меньшей мере 15 Å, по меньшей мере 20 Å, по меньшей мере 25 Å или по меньшей мере 30 Å. В особенно предпочтительных воплощениях выбранный радиус находится в интервале между 5 Å и 15 Å, более предпочтительно между 5 Å и 12 Å, более предпочтительно между 5 Å и 10 Å. В определенных воплощениях выбранный радиус составляет 5 Å или 10 Å. В следующих воплощениях участок, для которого рассчитывают пространственную склонность к агрегации, не является сферическим. Возможная форма области может дополнительно содержать куб, цилиндр, конус, эллиптический сфероид, пирамиду, полусферу или любую другую форму, которая может использоваться для ограничения пространства. В таких воплощениях размер области может выбираться с использованием величин, отличных от радиуса, например, расстояния от центра формы до стороны или вершины.
В предпочтительном воплощении ПСА может использоваться для выбора остатков в белке, которые могут быть заменены, увеличивая таким образом стабильность белка. В предыдущих исследованиях были разработаны два основных подхода стабилизации белка in vitro для (1) создания самой последовательности белка и (2) для включения добавок в жидкий состав. Оба подхода были изучены и были получены значимые результаты. Первый подход базировался на скрининге обширных библиотек случайных вариантов in silico или экспериментально. Во втором подходе высокопроизводительный скрининг стабилизирующих добавок, а также рациональный дизайн добавок, позволяют идентифицировать оптимальные составы для терапевтического белка.
Настоящее изобретение, как ожидается, упростит процесс повышения стабильности путем идентификации существующих горячих точек агрегации путем вычисления, и экспериментальный анализ вариантов с заменами в этих сайтах.
Таким образом, вообще говоря, метод расчета пространственной склонности к агрегации для конкретного атома в белке содержит (а) идентификацию одного или более атомов в структурной модели, представляющей белок, где один или более атомов находятся внутри определенной области пространства с центром в конкретном атоме или около него; (b) расчет для каждого одного или более атомов в определенной области пространства отношения поверхности атомов доступной растворителю (ПДР) к ПДР атомов в идентичном остатке, который полностью экспонирован; (с) умножение каждого отношения на гидрофобность одного или более атомов; и (d) суммирование произведений стадии (с); в результате чего сумма представляет собой ПСА для конкретного атома.
В сопутствующем воплощении ПСА может рассчитываться согласно другому методу, содержащему (а) идентификацию одного или более аминокислотных остатков в структурной модели, представляющей белок, где один или более аминокислотных остатков содержат, по меньшей мере, один атом внутри определенной области пространства с центром в конкретном атоме или около него; (b) расчет для каждого идентифицированного одного или более аминокислотного остатка отношения поверхности атомов в аминокислоте, доступных растворителю (ПДР), к ПДР атомов в идентичном остатке, который полностью экспонирован; (с) умножение каждого отношения на гидрофобность одного или более аминокислотных остатков, определенную по шкале гидрофобности аминокислот; и (d) суммирование произведений стадии (с); в результате чего сумма представляет собой ПСА для конкретного атома. В предпочтительных воплощениях структурная модель обрабатывается перед стадией (а) путем разрешения структурной модели взаимодействовать с растворителем в молекулярно-динамическом моделировании. Когда идентифицируют аминокислотный остаток, содержащий, по меньшей мере, один атом внутри определенной области пространства, то, может потребоваться, чтобы этот, по меньшей мере, один атом представлял собой исключительно атом в боковой цепи аминокислоты. В ином случае, он может представлять собой атом, который, по требованию, является атомом основной цепи. В других воплощениях этот способ может дополнительно необязательно содержать проведение молекулярно-динамического моделирования перед стадией (а) и повторение стадий (a)-(d), каждый раз проводя следующее молекулярно-динамическое моделирование во множестве временных интервалов, получая, таким образом, множество сумм, как в стадии (d), и расчет среднего значения сумм; в результате чего рассчитанное среднее значение представляет собой ПСА для конкретного атома. В других предпочтительных воплощениях ПСА может использоваться для выбора остатков в белке, которые могут быть заменены, уменьшая, таким образом, сродство связывания белка с макромолекулой.
Специалисту в данной области понятно, что воплощение настоящего изобретения, в котором применяется среднее значение величин, рассчитанных во время молекулярно-динамического моделирования, будет более интенсивным в вычислительном отношении. Также в некоторых случаях такое воплощение будет обеспечивать более точную или с более высоким разрешением карту пространственной склонности к агрегации. Однако эксперименты, обсуждаемые в настоящем документе, продемонстрировали, что даже если не применяются усреднение молекулярной динамики, способ все равно является высокоточным. В одном предпочтительном воплощении величины пространственной склонности к агрегации могут быть рассчитаны для всех белковых структур в базе данных, например, в белковой базе данных (PDB), в результате чего быстро идентифицируются гидрофобные остатки и участки на всех известных белковых структурах. Этот способ дает возможность быстрого скрининга больших наборов белков с идентификацией потенциальных областей, склонных к агрегации и/или сайтов взаимодействия белков.
В предпочтительном применении пространственная склонности к агрегации описана следующей формулой:
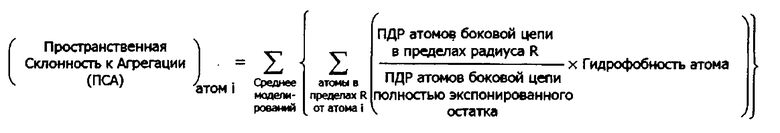
1) ПДР атомов боковой цепи внутри радиуса R рассчитывают в каждый момент моделирования. ПДР предпочтительно рассчитывают в модели имитационного моделирования путем расчета локуса центра зондовой сферы, которая как бы катится по поверхности белка. Сфера зонда имеет такой же радиус, как и радиус молекулы воды, R=1,4 Å. Специалисту в данной области понятно, что другие способы вычисления ПДР будут совместимы с описанными в настоящем документе способами для расчета ПСА. Например, ПДР может быть рассчитана только для атомов боковой цепи аминокислоты. ПДР также может быть рассчитана только на атомах основной цепи аминокислоты (т.е., на тех атомов пептидного остова и ассоциированных атомов водородов). В ином случае, ПДР может быть рассчитана только для атомов основной цепи аминокислоты с исключением ассоциированных атомов водорода;
2) ПДР боковой цепи полностью экспонированного остатка (скажем для аминокислоты 'X') получают в предпочтительном воплощении путем расчета ПДР боковых цепей среднего остатка в полностью раскрытой конформации трипептида 'Ala-Х-Ala'; и
3) Гидрофобность Атома получают, как описано выше с использованием шкалы гидрофобности Блэка и Моулд (Black and Mould, Anal. Biochem. 1991, 193, 72-82). Biochem. 1991, 193, 72-82).
Остаток, который «полностью экспонирован», представляет собой остаток Х в полностью раскрытой конформации трипептида Ala-X-Ala. Специалисту в данной области понятно, что это расположение создается так, чтобы расчет ПДР на таком остатке Х приводил к получению максимальной поверхности, доступной растворителю. Соответственно, предполагается, что другие остатки кроме аланина могут использоваться в расчете без полного нарушения или изменения результатов.
Как описано выше, способы по настоящему изобретению могут применяться к любой структурной модели белка. Соответственно, ПСА, основанная только на рентгеновской структуре, может быть представлена в виде:
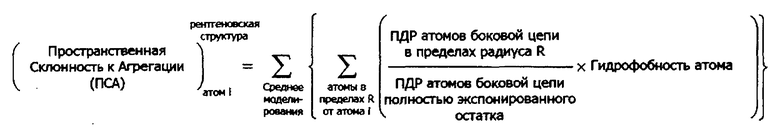
Аналогично, если рентгеновская структура не доступна, то та же пространственная склонность к агрегации может применяться к структуре, полученной посредством гомологического моделирования, и величина ПСА, таким образом, может быть представлена в виде:
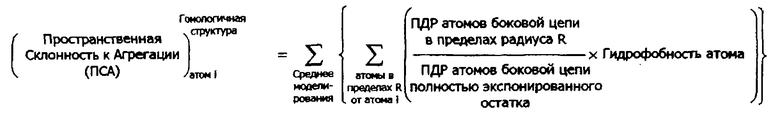
В предпочтительных воплощениях пространственную склонность к агрегации рассчитывают для всех атомов в структурной модели белка. В некоторых воплощениях величины атомистической пространственной склонности к агрегации могут быть усреднены для каждого индивидуального остатка белка или для всех небольших групп остатков.
II. Применение изобретения
В одном аспекте настоящее изобретение может применяться, как описано выше, для идентификации гидрофобных аминокислотных остатков, областей и участков в белке. Не желая придерживаться конкретных пороговых значений, полагаем, что атомы или аминокислотные остатки, обладающие значением пространственной склонности к агрегации >0 рассматриваются как гидрофобные или как принадлежащие области, склонной к агрегации. В зависимости от типа белка, определенной структуры и растворителя в котором он находится, может потребоваться определить атомы или остатки с помощью порога, который находится немного ниже нуля, например, отбором атомов или остатков, которые имеют значение пространственной склонности к агрегации больше чем -0,1, -0,15, -0,2 и т.д. В ином случае, может потребоваться использовать более жесткий предел, например 0, 0,05, 0,1, 0,15, 0,2 и т.д., для того чтобы выбрать наиболее сильные гидрофобные атомы, остатки или области. В другом воплощении выгодным может быть простой отбор атомов или остатков имеющих значение пространственной склонности к агрегации, которое больше чем у атомов или остатков, которые находятся в непосредственной близости либо по последовательности (т.е. вдоль белковой последовательности) либо, в предпочтительном воплощении пространственно (т.е. в трехмерной структуре). Один предпочтительный способ выбора атомов или остатков в гидрофобном участке заключается в картировании рассчитанных величин пространственной склонности к агрегации, например, с использованием цветового кодирования или числового кодирования на структурной модели белка, исходя из которой они были получены, таким образом визуализируя различия в пространственной склонности к агрегации по поверхности белка и, следовательно, давая возможность легкого выбора гидрофобных участков или остатков. В особенно предпочтительном воплощении расчеты для пространственной склонности к агрегации проводятся отдельно с помощью двух значений выбранных для радиуса, одного для высокого разрешения, например, 5 Å, и другого для низкого разрешения, например, 10 Å. В таком воплощении более большие или более широкие гидрофобные участки можно увидеть на поверхности белка с картой низкого разрешения. Поскольку гидрофобные участки интереса выбираются на карте низкого разрешения, эти участки можно увидеть более детально на карте высокого разрешения, которая может, в некоторых воплощения, позволить специалисту в данной области более легко и более точно выбрать остатки для мутации или модификации. Например, при рассмотрении гидрофобного участка на карте с более высоким разрешением, может быть желательным выбор остатка для мутации, который имеет наивысшую балльную оценку ПСА или который является наиболее гидрофобным (например, наиболее гидрофобный остаток в участке согласно шкале Блэка и Моулд, Anal. Biochem. 1991, 193, 72-82). Biochem. 1991, 193, 72-82).
В определенном воплощении способ идентификации на белке области, склонной к агрегации, содержит (а) картирование на структурной модели ПСА, рассчитанных для атомов в белке согласно любому из способов, описанных в настоящем документе; и (b) идентификацию области внутри белка, содержащего множество атомов, имеющих ПСА>0; где область, склонная к агрегации, содержит аминокислоты, содержащие указанное множество атомов. В таком воплощении ПСА может быть рассчитано для всех атомов в белке или для части атомов. Предполагается, что можно только вычислить значение ПСА для определенных остатков ил групп остатков, которые представляют интерес.
В похожем воплощении может быть информативным построение графиков балльных оценок ПСА атомов (или балльных оценок ПСА в виде среднего для аминокислотных остатков). Такой график, демонстрирующий балльную оценку ПСА по всем атомам или остаткам белка, позволяет легко идентифицировать пики, которые могут указывать на кандидаты для замены. В особенно предпочтительном воплощении баллы ПСА по всем атомам или остаткам белка наносятся на график и вычисляется площадь под кривой (Area Under the Curve (AUC)) для пиков на графике. В таком воплощении пики с наибольшими AUC представляют более большие или более гидрофобные участки склонные к агрегации. В конкретных воплощениях желателен выбор для замены одного или более остатков, которые идентифицированы как присутствующие в пике, или, более предпочтительно, в пике с большим значением AUC.
В конкретных воплощениях настоящее изобретение может использоваться для получения варианта белка, который проявляет уменьшенную склонность к агрегации путем замены, по меньшей мере, одного аминокислотного остатка в белке внутри области, склонной к агрегации, идентифицированного с помощью любого из способов, описанных в настоящем документе, на аминокислотный остаток, который является более гидрофильным, чем остаток, который был заменен, так что склонность к агрегации варианта белка уменьшается. При использовании в настоящем документе, когда аминокислотные остатки обозначаются как «более» или «менее» гидрофильные или гидрофобные, то специалисту в данной области понятно, что это обозначает более или менее гидрофобный по сравнению с другой аминокислотой согласно величине гидрофобности (гидрофильности), известной из уровня техники, например, по шкале гидрофобности Блэка и Моулд.
В похожем воплощении настоящее изобретение может использоваться для получения варианта белка, который проявляет уменьшенную склонность к агрегации, путем получения множества вариантов белка путем замены в каждом варианте, по меньшей мере, одного остатка в белке внутри области, склонной к агрегации, идентифицированной с использованием балльных оценок ПСА, рассчитанных согласно любому способу, описанному в настоящем документе, где один или более различных остатков или различных комбинаций остатков заменен в каждом варианте, и где, по меньшей мере, один остаток заменен на остаток, который является более гидрофильным; и (b) выбор варианта белка, полученного как в стадии (а), который проявляет уменьшенную склонность к агрегации.
Кроме того, аминокислотный остаток в области, склонной к агрегации, может быть скорее удален, чем заменен. В некоторых белках, где множество аминокислотных остатков выбрано для замены, некоторые остатки могут быть заменены, в то время как другие удалены.
В дополнительных воплощениях в исходном белке может быть идентифицировано множество областей или остатков, склонных к агрегации, с помощью способов, описанных выше (например, с использованием порогового значения пространственной склонности к агрегации, выше которого отбираются остатки). Впоследствии, может быть получено множество вариантов белка путем замены в указанном исходном белке одного или более выбранных аминокислотных остатков (или одного или более остатков, попавших в выбранный участок) на аминокислотные остатки, которые являются более гидрофильными, так что создается множество вариантов белка, представляющих разнообразие различных аминокислотных замен. Эту популяцию затем можно подвергнуть скринингу для выбора одного или более вариантов белка, которые обладают уменьшенной склонностью к агрегации. Специалисту в данной области будет понятно, что может быть обнаружено множество областей, склонных к агрегации, и что одна или более замен и/или делеций могут быть сделаны в одной или более склонных к агрегации областях. Относительная гидрофобность аминокислот может быть определена по шкале гидрофобности Блэка и Моулд, как описано выше. В конкретных воплощениях аминокислота, выбранная для замены, выбирается из группы, содержащей или состоящей из Phe, Leu, Ile, Tyr, Trp, Val, Met, Pro, Cys, Ala или Gly. В связанных воплощениях более гидрофобная аминокислота, которую заменят в белке, будет выбрана из группы, содержащей или состоящей из Thr, Ser, Lys, Gln, Asn, His, Glu, Asp или Arg.
Варианты белка могут быть сделаны любым способом известным в данной области включая сайтнаправленный мутагенез и другие технологии рекомбинантных ДНК, например, см. патенты США №5284760; 5556747; 5789166; 6878531, 5932419 и 6391548, которые все включены в настоящий документ посредством отсылки.
В конкретных воплощениях настоящее изобретение может использоваться для создания варианта белка, который проявляет уменьшенную склонность к агрегации, путем замены, по меньшей мере, одного аминокислотного остатка в белке внутри области, склонной к агрегации, идентифицированного с помощью любого из способов, описанных в настоящем документе, на природный аминокислотный остаток, модифицированный аминокислотный остаток, нестандартный аминокислотный остаток, искусственный аминокислотный остаток или аналог аминокислоты или производное, которое является более гидрофильным, чем остаток, который заменяется, так что уменьшается склонность варианта белка к агрегации.
Синтез искусственных аминокислот известен специалистам в данной области и дополнительно описан, например, в публикации патента США №2003-0082575. Вообще, может применяться любой известный из уровня техники способ синтеза или включения в белки искусственных, модифицированных или нестандартных аминокислот, включая в частности способы, описанные или указанные в публикациях Liao J. Biotechnol Prog. 2007 Jan-Feb; 23(1):28-31; Rajesh and Iqbal. Curr Pharm Biotechnol. 2006 Aug; 7(4):247-59; Cardillo et al. Mini Rev Med Chem. 2006 Mar; 6(3):293-304; Wang et al. Annu Rev Biophys Biomol Struct. 2006; 35:225-49; Chakraborty et al., and Glycoconj J. 2005 Mar; 22(3):83-93, которые все включены в настоящий документ посредством отсылки. В качестве еще одного примера, технология «Ambrx ReCODE™» может быть использована для разработки и включения искусственных аминокислот, или особенных аминокислот в белки как указано в способах, описанных в данном документе. Варианты белка согласно изобретению могут проявлять повышенную или улучшенную стабильность, определенную, например, с помощью исследований увеличения стабильности. Примерные исследования стабильности включают, в частности, исследования характерной чертой которых является повышенная температура хранения. Уменьшение образования агрегатов, наблюдаемое для варианта белка по сравнению с белком дикого типа или с исходным белком, указывает на повышенную стабильность. Стабильность вариантов белка также может тестироваться путем измерения изменения кривой температуры плавления варианта по сравнению с белком дикого типа или с исходным белком. В таком воплощении при увеличении стабильности очевидным будет увеличение перехода температуры плавления в варианте. Дополнительные способы для измерения агрегации белка описаны в Патенте США №10/176809, которая включена в настоящий документ посредством отсылки.
В другом аспекте изобретения рассчитанная пространственная склонность к агрегации может использоваться для идентификации сайтов белок-белковых взаимодействий на поверхности структуры белка. В данной области известно, что области взаимодействий белков часто содержат гидрофобные остатки или гидрофобные участки. Ожидается, что способы, описанные в данном документе, будут полезны при определении местоположения сайтов связывания путем определения гидрофобных участков. Такие гидрофобные участки будут кандидатами для белок-белковых или белок-лигандных сайтов узнавания.
В другом аспекте изобретение включает также способы идентификации в белке области связывания с макромолекулами, содержащие (а) картирование на структурной модели белка ПСА, рассчитанной согласно любому из предыдущих аспектов для атомов в белке; и (b) идентификацию области внутри белка, содержащей множество атомов, имеющих ПСА>0; где область связывания макромолекул содержит аминокислоты, содержащие указанное множество атомов.
В другом аспекте изобретение включает способы идентификации на белке области связывания макромолекул, содержащие идентификацию одной или более аминокислот, содержащих один или более атомов, имеющих ПСА более чем выбранное пороговое значение; где ПСА рассчитывают согласно способу любого из предыдущих аспектов, и где участок связывания макромолекул содержит идентифицированные аминокислоты.
В другом аспекте изобретение включает способы идентификации на белке области связывания макромолекул, содержащие построение графика значений ПСА, рассчитанных в любом из предыдущих аспектов, и вычисление для пиков на графике площади под кривой (AUC), и идентификацию одного или более участков с положительной AUC, где область связывания макромолекул содержит идентифицированные участки белка.
В другом аспекте изобретение может использоваться для получения варианта белка, который проявляет уменьшенное сродство связывания с макромолекулой, содержащего замену или делецию, по меньшей мере, одного аминокислотного остатка в белке внутри области связывания с макромолекулой, где область связывания с макромолекулой идентифицируют с использованием балльных оценок ПСА, рассчитанных согласно любому из предыдущих аспектов; и где, если заменяют аминокислотный остаток, то его заменяют на аминокислотный остаток, который является более гидрофильным, так чтобы уменьшалось сродство связывания варианта белка с макромолекулой. В определенных воплощениях заменяют, по меньшей мере, один остаток и, по меньшей мере, один остаток удаляют. В другом аспекте изобретение также включает способы получения варианта белка, который проявляет уменьшенное сродство связывания с макромолекулой, причем способ содержит (а) получение множества вариантов белка путем замены в каждом варианте, по меньшей мере, одного остатка внутри области связывания с макромолекулой, где область связывания с макромолекулой идентифицируют с использованием балльных оценок ПСА, рассчитанных согласно любому из предыдущих аспектов, где один или более различные остатки или различные комбинации остатков заменяют в каждом варианте; и (b) выбор варианта белка, полученного как в стадии (а), который проявляет измененное сродство связывания с макромолекулой. В определенных воплощениях по меньшей мере, один аминокислотный остаток внутри области связывания с макромолекулой является наиболее гидрофобным остатком в области связывания с макромолекулой. В некоторых воплощениях, по меньшей мере, один аминокислотный остаток внутри области, склонной к агрегации, представляет собой Phe, Leu, Ile, Tyr, Trp, Val, Met, Pro, Cys, Ala или Gly. В некоторых воплощениях аминокислотный остаток, который является более гидрофильным, выбирают из группы, состоящей из Thr, Ser, Lys, Gln, Asn, His, Glu, Asp и Arg. В некоторых воплощениях аминокислотный остаток, который является более гидрофильным, представляет собой особенную, искусственную или модифицированную аминокислоту. В некоторых воплощениях аминокислотный остаток, который является более гидрофильным, определяют согласно шкале гидрофобности Блэка и Моулд. В некоторых воплощениях заменены, по меньшей мере, два аминокислотных остатка внутри области связывания с макромолекулой. В некоторых воплощениях заменены, по меньшей мере, три аминокислотных остатка внутри области связывания с макромолекулой. В некоторых воплощениях внутри белка заменен, по меньшей мере, один остаток внутри более чем одной области, склонной к агрегации. В некоторых воплощениях область, склонная к агрегации идентифицируют согласно способу любого из предыдущих аспектов для идентификации на белке области, склонной к агрегации. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, макромолекула представляет собой другой белок, полинуклеотид или полисахарид. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, белок выбирают из группы, состоящей из антитела, Fab-фрагмента, Fab'-фрагмента, Fd-фрагмента, Fv-фрагмента, F(ab')2-фрагмента и Fc-фрагмента. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, белок представляет собой цитокин, хемокин, липокин, миокин, нейромедиатор, нейротрофин, интерлейкин или интерферон. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, белок представляет собой гормон или фактор роста. В некоторых воплощениях макромолекула представляет собой рецептор гормона или рецептор фактора роста. В некоторых воплощениях белок представляет собой рецептор или домен рецептора. В некоторых воплощениях макромолекула представляет собой рецепторный агонист или рецепторный антагонист рецептора или домена рецептора. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, белок представляет собой нейромедиатор или нейротрофин. В некоторых воплощениях макромолекула представляет собой рецептор нейромедиатора или рецептор нейротрофина.
В некоторых воплощениях изобретение дополнительно относится к машинной программе для определения ПСА согласно способам по изобретению. В других воплощениях изобретение относится к компьютеру, суперкомпьютеру или кластеру компьютеров предназначенных для исполнения способов изобретения. В еще одном аспекте изобретение обеспечивает вэб-, серверный или Интернет-сервис для определения областей склонных к агрегации в белках, где сервис включает прием данных о белке (например, структурную модель белка) от пользователя (например, через Интернет) или извлечение таких данных из базы данных, так чтобы поставщик услуг мог генерировать, извлечь или получить доступ к статической структуре белка, необязательно включая молекулярно-динамическое моделирование белка для обеспечения динамической структуры белка, определения ПСА для атомов или остатков белка на основе статической или динамической структуры, сгенерированной таким образом, и возвращение пользователю данных о ПСА, например, в виде структурной модели с картированными на ней поставщиком услуг указанными данными о ПСА. В некоторых воплощениях пользователь является человеком. В других воплощениях пользователь является компьютерной системой или автоматическим компьютерным алгоритмом.
В некоторых воплощениях настоящее изобретение утверждает систему расчета ПСА, содержащую: вэб-сервер для обеспечения вэб-сервиса для расчета ПСА для пользовательского терминала через Интернет; базу данных для хранения общей информации о способе расчета, аминокислотной гидрофобности и т.п., и сервер расчета для осуществления расчета ПСА на основе информации в базе данных и информации предоставленной или переданной через Интернет пользователем.
В некоторых воплощениях вэб-сервер и сервер вычислений являются одной и той же компьютерной системой. В некоторых воплощениях компьютерная система является суперкомпьютером, кластерным компьютером или одиночной рабочей станцией или сервером.
В связанном воплощении вэб-сервер системы расчета ПСА дополнительно содержит котроллер для контроля всей операции, устройство для подключения к сети для соединения с интернетом, и блок вэб-сервиса для обеспечения вэб-сервиса для расчета ПСА пользовательскому терминалу соединенному посредством Интернета. Кроме того, к воплощениям настоящего изобретения дополнительно относятся продукты компьютерных запоминающих устройств с машиночитаемой средой, которые содержат программный код для осуществления различных исполняемых компьютером операций, например, расчет ПСА для структурной модели, расчета ПДР, расчета эффективного ПДР, манипулирования структурными моделями, осуществления молекулярно-динамического моделирования, организации и хранения соответствующих данных или осуществления других операций, описанных в данном документе. Машиночитаемая среда является любым устройством хранения данных, которое может хранить данные, которые затем могут быть прочитаны компьютерной системой. Примеры машиночитаемых сред включают, в частности, жесткие диски, флоппи-диски, флэш-диски, оптические диски (например, CD, DVD, HD-DVD, диски Blu-Ray и т.п.) и специально сконфигурированные аппаратные устройства, такие как специализированные микросхемы или программируемые логические устройства. Машиночитаемая среда может также распространяться как сигнал данных, воплощенный в волне несущей частоты по сети спаренных компьютерных систем, так чтобы код машиночитаемой среды хранился и выполнялся в распределенном режиме. Специалистом будет учтено, что выше описанные аппаратные и программные элементы имеют стандартный дизайн и конструкцию. Описанные выше воплощения, связанные с компьютером, Интернетом, сервером и сервисом могут дополнительно применять ПДР и эффективное ПДР а также ПСА.
III. Фармацевтические композиции, содержащие пептиды и варианты пептидов по изобретению
В другом аспекте настоящее изобретение обеспечивает композицию, например, фармацевтическую композицию, содержащую один или более вариантов белка, полученных способами по изобретению, составленные в рецептуре вместе с фармацевтически приемлемым носителем. Фармацевтические композиции изобретения также могут быть введены при комбинированном лечении, т.е. объединены с другими средствами. Например, комбинированное лечение может включать белок по настоящему изобретению, объединенный, по меньшей мере, с одним антинеопластическим средством.
Используемый здесь термин «фармацевтически приемлемый носитель» включает любой или все растворители, дисперсные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и т.п., которые являются физиологически совместимыми. Предпочтительно, носитель является подходящим для внутривенного, внутримышечного, подкожного, парентерального спинального или эпидермального введения (например, инъекцией или инфузией). В зависимости от пути введения, активное соединение, т.е. белок или его вариант по изобретению, может быть покрыто материалом для защиты соединения от действия кислот или других естественных условий, которые могут инактивировать соединение.
Фармацевтические композиции по изобретению могут включать одну или более фармацевтически приемлемых солей. Термин «фармацевтически приемлемая соль» относится к соли, которая сохраняет требуемую биологическую активность родительского соединения и не привносит каких-либо нежелательных токсикологических эффектов (см., например, Berge S.M. et al. (1977) /. Pharm. Sci. 66:1-19). Примеры таких солей включают соли присоединения кислоты и соли присоединения основания. Соли присоединения кислоты включает те из них, которые получаются из нетоксичных неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромоводородная, йодистоводородная, ортофософористая и т.п., а также из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты и т.п. Соли замещения оснований включают те из них, которые происходят из щелочно-земельных металлов, таких как натрий, калий, магний, кальций и т.п., а также из нетоксичных органических аминов, таких как N5N'-дибензилэтилендиамин, N-метилглюкамин, хлоропрокаин, холин, диэтаноламин, этилендиамин, прокаин и т.п.
Фармацевтическая композиция по изобретению также может включать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) маслорастворимые антиоксиданты, такие как аскорбил пальмитат, бутилоксианизол, бутилокситолуол, лецитин, пропил галлат, альфа-токоферол и т.п.; и (3) хелатирующие металлы агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА), сорбит, винная кислота, фосфорная кислота и т.п.
Примеры подходящих водных и неводных носителей, которые могут быть использованы в фармацевтических композициях по изобретению, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), и их подходящие смеси, растительные масла, такие как оливковое масло, и инъекционные органические эфиры, такие как этилолеат. Правильная текучесть может поддерживаться, например, с помощью применения покрывающих материалов, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий, и с помощью использования ПАВ.
Эти композиции могут также содержать адъюванты, такие как консерванты, увлажняющие средства, эмульгаторы и диспергирующие агенты. Предотвращение присутствия микроорганизмов может быть обеспечено процедурами стерилизации, и путем включения различных антибактериальных и противогрибковых агентов, например, парабена, хлоробутанола, фенолсорбиновой кислоты и т.п. Также может потребоваться включение в композиции изотонических агентов, таких как сахара, хлорид натрия и т.п. Кроме того, пролонгированная абсорбция инъецируемой фармацевтической формы может быть достигнуто путем включения агентов, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин. Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсий для немедленного приема. Применение таких сред и агентов для фармацевтически активных веществ известно в данной области. За исключением несовместимых с активным соединением, предусматривается применение в фармацевтических композициях любых традиционных сред или агентов. Дополнительные активные соединения также могут быть включены в композиции.
Примерные составы содержат, по меньшей мере, один вариант белка по изобретению и могут содержать более низкие концентрации стабилизирующих (или дезагрегирующих) агентов, которые могут, в дополнение к способам, раскрытым в настоящем документе, использоваться для предотвращения или уменьшения агрегации белка.
Соответственно, традиционные способы, используемые для предотвращения агрегации, могут использоваться при разработке фармацевтических композиций, содержащих варианты белков, полученных способами по настоящему изобретению. Например, множество стабилизирующих и дезагрегирующих соединений могут быть включены в фармацевтические композиции изобретения в зависимости от их целевого использования и их биологической токсичности. Такие стабилизирующие соединения могут включать, например, циклодекстрин и его производные (Патент США №5730969), алкилгликозидные композиции (Патент США №11/474049), применение молекул шаперонов (например, LEA (Goyal et al., Biochem J. 2005, 388(Pt 1):151-7; способы патента США №5688651), соединения бетаина (Xiao, Burn, Tolbert, Bioconjug Chem. 2008 May 23), поверхностно-активные вещества (например, «Pluronic F127», «Pluronic F68», «Tween 20» (Wei et al. International Journal of Pharmaceutics. 2007, 338 (1-2):125-132)) и способы, описанные в патентах США №5696090, 5688651, 6420122, которые все включены в настоящий документ посредством отсылки.
Типичные составы также содержат вариант белка по изобретению, который проявляет измененную склонность к взаимодействию с партнером по связыванию, вместе с фармацевтически приемлемым носителем, адъювантом и/или вспомогательным веществом.
Кроме того, белки и, в частности, антитела, стабилизируются в составах при применении комбинаций различных классов вспомогательных веществ, например, (1) дисахаридов (например. Сахарозы, Трегалозы) или полиолов (например, Сорбита и Маннита), действующих в качестве стабилизаторов посредством предпочтительного исключения, а также способных действовать в качестве криопротекторов во время лиофилизации, (2) ПАВ (например, Полисорбата 80, Полисорбата 20), действующих путем минимизации взаимодействий белков на границе раздела типа жидкость/лед, жидкость/поверхность материала и/или жидкость/воздух, и (3) буферов (например, фосфатного, цитратного, гистидинового), помогающих контролировать и поддерживать рН состава. Соответственно, такие дисахариды, полиолы, ПАВ и буферы могут использоваться в дополнение к способам по настоящему изобретению для дополнительной стабилизации белков и предотвращения их агрегации.
Терапевтические композиции обычно должны быть стерильными и стабильными в условиях производства и хранения. Рецептура композиции может быть составлена в виде раствора, микроэмульсии, липосомы или других упорядоченных структур подходящих для высоких концентраций лекарственных веществ. Носитель может быть растворителем или дисперсионной средой, содержащей например, воду, этанол, полиол (например, глицерин, пропиленгликоль, и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Правильная текучесть может поддерживаться, например, с помощью применения покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии, и с помощью использования ПАВ. Во многих случаях, предпочтительным будет включение в композицию изотонических агентов, например, Сахаров, полиспиртов, таких как маннит, сорбит, или хлорид натрия.
Пролонгированная абсорбция инъецируемых композиций может быть вызвана в том числе включением в композицию средства для замедления абсорбции, например, солей моностеарата и желатина.
Стерильные инъецируемые растворы могут быть приготовлены путем включения активного соединения в необходимом количестве в соответствующий растворитель с одним или с комбинацией ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизацией микрофильтрацией. В общем, дисперсии готовят путем введения активного соединения в стерильный носитель, который содержит основную дисперсную среду и другие требуемые ингредиенты из тех, что перечислены выше. В случае стерильных порошков для приготовления стерильных инъецируемых растворов, предпочтительными способами приготовления являются вакуумная сушка и сублимационная сушка (лиофилизация), которые дают порошок активного ингредиента плюс любой дополнительный требуемый ингредиент из его предварительно стерильно фильтрованного раствора.
Количество активного ингредиента, которое может быть объединено с материалом носителя для получения одиночной лекарственной формы будет варьировать в зависимости от объекта, подвергаемого лечению и от конкретного пути введения. Количество активного ингредиента, которое может быть объединено с материалом носителя для получения одиночной лекарственной формы будет, в общем, тем количеством композиции, которое производит терапевтический эффект. В общем, из ста процентов, это количество будет находиться в диапазоне от около 0,01 процента до около девяносто девяти процентов активного ингредиента, предпочтительно от около 0,1 процента до около 70 процентов, наиболее предпочтительно от около 1 процента до около 30 процентов активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Режимы дозировки корректируются для обеспечения оптимального требуемого ответа (например, терапевтического ответа). Например, может быть введен одиночный болюс, могут быть введены несколько доз в течение периода времени или дозы могут быть пропорционально уменьшены или увеличены в зависимости от потребностей терапевтической ситуации. Особенно выгодно составлять рецептуру для парентеральных композиций в виде стандартной лекарственной формы для легкого введения и единообразия доз. Стандартная лекарственная форма, используемая в данном документе относится к физически дискретным единицам, пригодным в качестве унитарных доз для объекта подвергаемого лечению; каждая единица содержит заданное количество активного соединения, которое рассчитано для привнесения требуемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Описание для стандартных лекарственных форм по изобретению продиктованы и напрямую зависят от (а) уникальных характеристик активного соединения и определенного терапевтического эффекта, который должен быть достигнут, и (b) от ограничений, присущих области приготовления такого активного соединения для лечения восприимчивости у индивидуумов.
Для введения белка диапазон доз составляет от около 0,0001 до 100 мг/кг, и больше, обычно от 0,01 до 5 мг/кг массы тела хозяина. Например, дозировки могут быть 0,3 мг/кг массы тела, 1 мг/кг массы тела, 3 мг/кг массы тела, 5 мг/кг массы тела или 10 мг/кг массы тела в пределах диапазона 1-10 мг/кг. Примерный режим лечения включает введение раз в неделю, раз каждые две недели, раз каждые три недели, раз каждые четыре недели, раз в месяц, раз каждые три месяца или раз каждые три-шесть месяцев. Предпочтительные схемы дозировки для белка по изобретению включают 1 мг/кг массы тела или 3 мг/кг массы тела посредством внутривенного введения, с антителом дается в одном из следующих режимов дозирования: (i) каждые четыре недели для шести доз, затем каждые три месяца; (ii) каждые три недели; (iii) 3 мг/кг массы тела однократно с последующим 1 мг/кг массы тела каждые три недели.
В ином случае белок по изобретению может быть введен в виде состава с замедленным высвобождением, в случае которого требуется менее частое введение. Дозировка и частота могут варьировать в зависимости от периода полужизни введенной субстанции в пациенте. В общем, человеческие антитела демонстрируют наиболее долгий период полужизни, за ними следуют гуманизированные антитела, химерные антитела и нечеловеческие антитела. Дозировка и частота введения может варьировать в зависимости от того является ли лечение профилактическим или терапевтическим. В профилактических приложениях, относительно низкая дозировка вводится с относительно нечастыми интервалами в течение длительного периода времени. Некоторые пациенты продолжают получать лечение до конца своей жизни. В терапевтических приложениях, относительно высокая дозировка при относительно коротких интервалах иногда требуется до уменьшения или прекращения прогрессии заболевания, и предпочтительно до того как пациент продемонстрирует частичное или полное улучшение симптомов заболевания. После этого введение пациенту может осуществляться в профилактическом режиме. Фактические уровни доз активных ингредиентов в фармацевтических композициях настоящего изобретения могут варьировать для того чтобы количество активного ингредиента являлось эффективным для достижения требуемого терапевтического ответа для конкретных пациента, композиции и режима введения, без оказания токсичного воздействия на пациента. Выбранный уровень дозировки будет зависеть от целого ряда фармакокинетических факторов включая активность определенных композиций, используемых настоящим изобретением, или их эфира, соли или амида, путь введения, время введения, скорость выведения определенного используемого соединения, длительность лечения, другие лекарственные средства, соединения и/или материалы, используемые в комбинации с конкретными используемыми композициями, возраст, пол, массу, состояние, общий уровень здоровья и предыдущую история болезни подвергаемого лечению пациента и т.п. факторы, хорошо известные в медицине.
«Терапевтически эффективная дозировка» иммуноглобулина по изобретению предпочтительно приводит к уменьшению тяжести симптомов заболевания, и увеличению частоты и длительности периодов без симптомов заболевания, или к профилактике нарушений или недееспособности, вызванных недугом. Например, при лечении злокачественных новообразований, «терапевтически эффективная дозировка» предпочтительно ингибирует рост клеток или опухоли, по меньшей мере, на около 20%, более предпочтительно, по меньшей мере, на около 40%, еще более предпочтительно, по меньшей мере, на около 60%, еще более предпочтительно, по меньшей мере, на около 80% относительно не подвергнутых лечению объектов. Способность соединения ингибировать рост злокачественного новообразования может быть оценена в системе модели на животных являющейся эффективно предсказательной для человеческих злокачественных опухолей. В ином случае, это свойство композиции может быть оценено проверкой способности соединения ингибировать; способы анализа такого ингибирования in vitro известны квалифицированному врачу. Терапевтически эффективное количество терапевтического соединения может уменьшить размер опухоли, или, с другой стороны, улучшить симптомы пациента. Любой специалист в данной области будет способен определить такие количества, основываясь на таких факторах, как размер пациента, тяжесть симптомов у пациента, и основываясь на конкретной композиции или на выбранном пути введения.
Композиция настоящего изобретения может быть введена посредством одного или более путей введения с помощью одного или более из множества способов, известных в данной области. Специалистом будет учтено, что способ и/или режим введения будет варьировать в зависимости от требуемых результатов. Предпочтительные пути введения для связывающих компонентов по изобретению включают внутривенное, внутримышечное, внутрикожное, внутрибрюшинное, подкожное, спинальное или другие парентеральные пути введения, например, инъекцией или инфузией. Словосочетание «парентеральное введение», используемое в данном документе, означает режимы введения, отличные от энтерального или местного введения, обычно инъекцией, и включает, без ограничений, внутривенную, внутримышечную, внутриартериальную, внутритрахеальную, внутрикапсулярную, внутриорбитальную, внутрикардиальную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, внутрисуставную, субкапсулярную, субарахноидальную, внутриспинальную, эпидуральную и надчревную инъекцию или инфузию.
В ином случае, иммуноглобулин по изобретению может быть введен непарентеральным путем, таким как местный, эпидермальный или путь введения через слизистую, например, интраназально, перорально, вагинально, ректально, сублингвально или местно.
Активные соединения могут быть приготовлены с носителями, которые будут предохранять соединение от быстрого высвобождения, такие как состав с контролируемым высвобождением, включая импланты, трансдермальные пластыри и микрокапсулированные системы доставки. Могут быть использованы биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Множество способов приготовления таких составов запатентовано или хорошо известно специалистам в данной области. См., например, Sustained and Controlled Release Drug Delivery Systems J.R. Robinson ed., Marcel Dekker, Inc., New York, 1978.
Терапевтические композиции могут быть введены с помощью медицинских устройств известных в данной области.
Например, в предпочтительном воплощении терапевтическая композиция изобретения может быть введена с помощью безиголочного устройства для подкожных инъекций, такого как устройства, раскрытые в патентах США №5399163; 5383851; 5312335; 5064413; 4941880; 4790824 или 4596556. Примеры хорошо известных имплантов и модулей, полезных в настоящем изобретении включают: патент США №4487603, в котором раскрывается имплантируемый насос для микроинфузий для дозирования медикамента контролируемым путем; патент США №4486194, в котором раскрывается терапевтическое устройство для введения медикаментов через кожу; патент США №4447233, в котором раскрывается насос для инфузии медикамента для доставки медикамента с точной скоростью инфузии; патент США №4447224, в котором раскрывается имплантируемое устройство для инфузии с изменяемым потоком для непрерывной доставки лекарственного, препарата; патент США №4439196, в котором раскрывается осмотическая система доставки лекарственных препаратов, обладающая многокамерными отсеками; и патент США №4475196, в котором раскрывается осмотическая система доставки лекарственных препаратов. Патенты включены в настоящий документ посредством отсылки. Специалисту в данной области известны многие другие такие импланты, системы доставки и модули.
ПРИМЕРЫ
Введение в Примеры
Методы молекулярного моделирования для предсказания областей, склонных к агрегации, и для изучения механизма агрегации в основном используют сравнительно простые симуляционные модели (Ма and Nussinov. Curr. Opin. Chem. Biol. 2006, 10, 445-452; Cellmer et al., TRENDS in Biotechnology 2007, 25(6), 254), в отличие от подробных атомистических моделей, которые могут быть использованы в настоящем изобретении. Наименее подробная из применяемых моделей имитационного моделирования представляет собой решеточную модель, которую использовали во множестве исследований агрегации белков (Harrison et al. J. Mol Biol. 1999, 286, 593-606; Dima and Thirumalai. Protein Sci. 2002, 11, 1036-1049; Leonhard et al. Protein Sci. 2004, 13, 358-369; Patro and Przybycien. Biophys. J. 1994, 66, 1274-1289; Patro and Przybycien. Biophys. J. 1996, 70, 2888-2902; Broglia et al. Natl. Acad. Sci. U.S.A. 1998, 95, 12930-12933; Istrail et al. Comput. Biol. 1999, 6, 143-162; Giugliarelli et al. Chem. Phys. 2000, 113, 5072-5077; Bratko et al. J. Chem. Phys. 2001, 114, 561-569; Bratko and Blanch J. Chem. Phys. 2003, 118, 5185-5194; Combe and Frenkel Chem. Phys. 2003, 118, 9015-9022; Toma and Toma. Biomacromolecules 2000, 1, 232-238; Gupta et al. Protein Sci. 1998, 7, 2642-2652; и Nguyen and Hall Biotechnol. Bioeng. 2002, 80, 823-834). В ней каждый остаток представлен в виде шара, который занимает одиночный участок в трехмерной решетке. Из-за своей простоты, решетчатая модель является менее вычислительно сложной и используется для моделирования больших систем в больших временных масштабах. Хотя эти решетчатые модели обеспечивают понимание физических основ, лежащих в основе агрегации белков, они не всегда точно представляют вторичную и третичную структуру и не могут адекватно учесть различные взаимодействия на атомистическом уровне, такие как водородные связи.
Более подробной моделью, по сравнению с решетчатой, является модель с промежуточным разрешением, в которой несколько атомов обычно объединяются в одиночный шар, а псевдосвязи иногда вводятся для сохранения углов связи в каркасе и состояний изомеризации (Smith and Hall, Mol. Biol. 2001, 312, 187-202; Smith and Hall. Proteins: Struct., Funct, Genet. 2001, 44, 344-360; Smith and Hall. Proteins: Struct., Funct, Genet. 2001, 44, 376-391; Nguyen et al., Protein Sci. 2004, 13, 2909-2924; Nguyen and Hall, Proc. Natl. Acad. Sci. USA, 2004, 101(46), 16180-16185; Nguyen and Hall. J. Am. Chem. Soc, 2006, 128, 1890-1901; Jang et al., Biophys. 2004, 86, 31-49; Jang et al., Protein Sci. 2004, 13, 40-53). Данная модель была успешно применена для моделирования образования фибрилл из систем, содержащих от 12 до 96 полиаланиновых пептидов (длиной 16 остатков каждый), начиная со случайного состояния (Nguyen and Hall, Proc. Natl. Acad. Sci. USA, 2004, 101(46), 16180-16185; Nguyen and Hall, J. Am. Chem. Soc, 2006, 128, 1890-1901). Dokholyan и соавторы применили такую модель для изучения образования фибриллярных β-листовых структур восемью модельными белками домена SH3 Src (Ding et al., Mol. Biol. 2002, 324, 851-857) или 28 модельными Аβ (1-40) пептидами (Peng et al., Phys. ReV. E: Stat. Phlnterdiscip. Top. 2004, 69, 41908-41914).
В отличие от более простых моделей, атомистические модели включают все атомистические подробности, такие как образование водородной связи и, таким образом, являются более точными, чем решетчатая модель или модель с промежуточным разрешением. Такие атомистические модели использовались или с явно заданным растворителем, или с неявно заданным растворителем, где растворитель рассматривается как сплошная среда. Явная модель является более точной, чем не явная, но также требует больше компьютерных вычислений. Такая атомистическая модель с неявным растворителем была применена для исследования ранних стадий агрегации гептапептида GNNQQNY (SEQ ID NO:1), который является частью дрожжевого белка Sup35 (Gsponer et al., Proc. Natl. Acad. Sci. USA. 2003, 100, 5154-5159). Похожая модель применялась для агрегации амилоидного пептида Ab16-22 (KLVFFAE (SEQ ID NO:2)) в антипараллельных β-листах (Klimov and Thirumalai, Structure 2003, 11, 295-307). Dokholyan и соавторы (Khare et al., Proteins. 2005, 61, 617-632.) применяли явную атомистическую модель для исследования упорядоченной склонности к агрегации по всей последовательности фермента Cu, Zn - супероксиддисмутазы (SOD1). Они разложили последовательность SOD1 на перекрывающиеся гептапептиды и осуществили большое число молекулярно-динамических моделирований с явной водой (по 0,5 нс каждое) мономерных, димерных и тетрамерных сегментов. При этом они обнаружили местонахождение амилоидогенных областей в последовательности SOD1: два конца, β-цепи 4 и 7, и две пересекающиеся петли.
Позднее был разработан протокол молекулярно-динамического моделирования для получения структурной информации об упорядоченной β-агрегации амилоидогенных полипептидов (Cecchini et al., J Mol Biol. 2006, 357, 1306-1321). Процедура основана на разложении полипептидной цепи на перекрывающиеся сегменты и на равновесных молекулярно-динамических моделированиях малого числа копий каждого сегмента. Склонность к β-агрегации по всей длине последовательности пептида болезни Альцгеймера Аβ (1-42) была найдена крайне гетерогенной с максимумом в сегменте V12HHQKLVFFAE22 (SEQ ID NO:39) и минимумами в четырех петлеподобных дипептидах. С помощью этого метода прогнозируемое изменение склонности к агрегации двойных мутантов в двух сайтах в N-концевом домене дрожжевого приона Ure2p было проверено in vitro с помощью анализа связывания с тиофлавином Т. Такая процедура разложения полипептидной цепи на перекрывающиеся сегменты будет крайне сложной для систем подобных антителам, из-за их огромного размера. Даже атомистическое моделирование одиночного полноразмерного антитела в явном растворителе очень требовательно в вычислительном плане, из-за огромного размера антитела. Поэтому в литературе отсутствуют атомистические модели полноразмерного антитела. Однако существуют атомистические модели небольших частей антитела, по большей части Fab-фрагмента (Noon, et al., PNAS. 2002, 99, 6466; Sinha and Smith-Gill, Cell Biochemistry and Biophysics. 2005, 43, 253). В работе, раскрытой в данном документе, были исполнены атомистические модели молекулы полноразмерного антитела с явным растворителем. Основываясь на этих моделях, с помощью параметра 'пространственной склонности к агрегации', описанного в данной работе, на антителе были обнаружены области, склонные к агрегации. Эти склонные к агрегации области были мутированы для создания антител с улучшенной стабильностью. Описанные в данном документе примеры, относятся к определенным, не ограничивающим, воплощениям изобретения.
Пример 1: Методология молекулярно-динамического моделирования
Молекулярно-динамические моделирования осуществляли для полноразмерного антитела с помощью полной атомной модели. Исходная структура для моделирования полноразмерного антитела была получена из рентгеновских структур индивидуальных фрагментов Fab и Fc. Рентгеновская структура пробной версии (proof-of-concept (РОС)) Fab-фрагмента была отобрана для моделирования на рентгеновской структуре Fc, полученной из IgG1 антитела 1HZH (Saphire et al., Science. 2001, 293, 1155). 1HZH было выбрано, поскольку рентгеновская структура известна для полноразмерного антитела и поскольку структура Fc является одной и той же для всех антител класса IgG1. Затем с помощью использованной в качестве модельного шаблона структуры 1HZH путем выравнивания фрагментов Fab и Fc была получена структура полноразмерного антитела «РОС». В целях выравнивания фрагментов с правильными расстояниями и ориентацией, было сведено к минимуму СКО (среднеквадратичное отклонение) между общими остатками CYS фрагментов и полноразмерной матрицы (1HZH). Остатки CYS были выбраны, потому что каждый поддомен антитела (CH1, CH2 и т.п.) содержит дисульфидную связь, и таким образом остатки CYS широко распространены вдоль всей структуры антитела. Полученная в результате структура полноразмерного антитела затем применялась для осуществления моделирования с явно заданными атомами с 30 нс интервалами. Для моделирования применяли профиль G0-гликозилирования поскольку он является наиболее распространенным профилем, наблюдаемым в антителах.
Пакет для моделирования CHARMM (Brooks et al. 1983, 4, 187) J. Comput. Chem., 1983, 4, 187) применяли для настройки и анализа, а пакет NAMD (Phillips et al. Journal of Computational Chemistry. 2005, 26, 1781) - для проведения моделирования. Полностью атомистическое силовое поле CHARMM (MacKerell et al. J. Phys Chem. B. 1998, 102, 3586) было применено для белка и TIP3P (Jorgensen et al. J. Chem. Phys., 1983, 79, 926) модели растворителя для воды. Моделирования проводили при 298К и 1 атм в системе нормальных давления и температуры. Параметры для сахарных групп, участвующих в гликозилировании Fc-фрагмента, были получены таким образом, чтобы они были совместимыми с силовым полем CHARMM, следующим из силового поля CSFF (Kuttel et al. J, Comput. Chem., 2002, 23, 1236). Протонированные состояния остатков гистидина при рН 7,0 были выбраны на основании пространственной близости электроотрицательных групп. Полноразмерное антитело было сольватировано в орторобмической камере, поскольку она минимизирует количество необходимых молекул воды и таким образом минимизирует вычислительное время. Периодические граничные условия были применены во всех 3 направлениях. Водная сольватная оболочка в 8 Å была применена в каждом направлении орторомбической ячейки. Конечный общий размер системы составил 202130 атомов. Для нейтрализации общего заряда системы добавляли достаточное количество ионов. Нейтральность зарядов измеряли согласно методу суммирования Эвалда, применяемому для расчета вклада электростатических взаимодействий в системе.
После сольватации антитела, энергию минимизировали с помощью метода наискорейшего спуска (Steepest Descents SD) путем фиксирования белка, чтобы дать возможность воде свободно расположиться вокруг белка. Затем ограничения удаляли и структуру дополнительно минимизировали с помощью SD и ABNR (Adopted Basis Newton-Raphson). Систему затем медленно нагревали до комнатной температуры с шагом 5°С каждые 0,5 пс с использованием временных интервалов в 1 фс. Систему затем уравновешивали в течение 1 нс перед вычислением представляющих интерес свойств модели. Во время моделирования для дополнительного статистического анализа сохраняли конфигурации каждые 0,1 пс.
Пример 2: Расчет пространственной склонности к агрегации (ПСА)
Для преодоления недостатков ПДР, был определен описанный выше новый параметр, названный 'пространственная склонность к агрегации'.
В этом примере 'пространственную склонность к агрегации' вычисляли для сферических областей с радиусом R, центрированных на каждом атоме в антителе, которое описано в примере 1. Значение пространственной склонности к агрегации, таким образом, оценивали с 30 нс модельным усреднением, для Fc-фрагмента антитела для двух различных радиусов участков (R=5 Å, 10 Å) (специалисту в данной области понятно, что могут быть выбраны различные временные интервалы для моделирования согласно доступным вычислительным ресурсам и согласно требуемому разрешению результата). В обоих случаях было замечено, что большинство значений были отрицательными, что свидетельствует о том, что наиболее экспонированные области являются гидрофильными. Такой результат ожидался, поскольку наиболее экспонированная поверхность белка, как правило, является гидрофильной. Также было отмечено, что существует несколько областей с положительными пиками пространственной склонности к агрегации, указывающими на экспонированную гидрофобность. Переход с малых радиусов участков (5 Å) на большие радиусы (10 Å) устраняет некоторые пики, тогда как некоторые другие пики увеличиваются. Некоторые пики уменьшаются из-за того что в этих областях малый гидрофобный участок (с радиусом меньше чем 5 Å) окружен гидрофильными участками; таким образом, усреднение по 10 Å приводит к эффективному уменьшению гидрофобности области. В то же время в некоторых других областях пространственная склонность к агрегации при R=10 А усиливается из-за гидрофобных участков окружающих аналогичный гидрофобный участок.
Выше, пространственную склонность к агрегации вычисляли как среднее в ходе 30 нс цикла моделирования. Результаты, вычисленные с помощью моделирования, затем сравнивали со значениями пространственной склонностью к агрегации только рентгеновской структуры, без молекулярного моделирования. Пространственная склонность к агрегации (для рентгеновской структуры) была аналогична значениям усредненного моделирования, и имела пики в тех же местах, но с отличиями по размеру пиков. Отличия были тем больше, чем больше был радиус участка, R=10 Å. Это происходит из-за того, что отличия являются кумулятивными при рассмотрении на большем размере участка. Эти отличия возникают вследствие изменения экспонирования поверхности остатков в цикле динамического моделирования. Тем не менее, это сравнение говорит о том, что хорошую начальную оценку пространственной склонности к агрегации, особенно для малого радиуса участка R, можно получить из самой рентгеновской структуры.
Значения пространственной склонности к агрегации для моделей с R=5 Å и 10 Å были картированы на структуре антитела. В обоих случаях поверхность антитела была окрашена в соответствии со значениями пространственной склонности к агрегации. Положительные величины пространственной склонности к агрегации (гидрофобные) продемонстрированы серым или черным цветом, в то время как отрицательные величины (гидрофильные) окрашены светло-серым или белым цветом. Интенсивность цвета пропорциональна амплитуде SES. Таким образом, высоко экспонированный гидрофобный участок будет глубоко-черного цвета, и, аналогично, высоко экспонированный гидрофильный участок будет ярко-белого цвета. Также структурное изображение антитела основано на поверхности, доступной растворителю, для каждого остатка. При обоих используемых радиусах в расчете пространственной склонности к агрегации (5Å и 10Å) наблюдали, что поверхность окрашена преимущественно в белый цвет, что указывает на то, что поверхность по большей части является гидрофильной. Такой результат ожидался, поскольку наиболее экспонированная поверхность белка, как правило, является гидрофильной. Однако было замечено несколько черных зон, что указывает на экспонированные гидрофильные области. Контраст между черными и белыми областями более ярко выражен в участке большего радиуса, используемого в расчете ПСА, R=10Å. Эти черные (гидрофобные) области имеют превосходную корреляцию с участками антитела, которые, как известно, взаимодействуют с другими белками: участок глубоко черного цвета в шарнирной области, где взаимодействует Fc-рецептор, присутствует черная область в Fc-фрагменте, где взаимодействуют белок А и белок G, и присутствует черный участок в конце Fab-фрагмента, где антитело связывается с антигенами. Величины пространственной склонности к агрегации наносили на график для R=5Å и 10Å, соответственно, где может наблюдаться такая же корреляция пиков с областями взаимодействия. Сайты белковых взаимодействий были получены из рентгеновской структуры белковых комплексов, записи в PDB 1T89, 1FC2 и IFCC (Radaev J. Biol. Chem. 2001, 276 (19) 16469; Deisenhofer et al. Hoppe-Seyler's Z Physiol Chem. 1978. 359, 975-985; Deisenhofer J. Biochemistry. 1981, 20, 2361-2370; Sauer-Eriksson et al. Structure. 1995, 3, 265). Гидрофобные взаимодействия очень хорошо коррелируют с положительными пиками пространственной склонности к агрегации, а гидрофильные взаимодействия очень хорошо коррелируют с отрицательными пиками пространственной склонности к агрегации. Следовательно, параметр пространственной склонности к агрегации помимо прочего может применяться для предсказания областей связывания белков. В малочисленных исключениях, в которых остатки с низким значением пространственной склонности к агрегации (т.е. с близким нулю значением, либо положительным, либо отрицательным) также вступали во взаимодействия, было отмечено, что взаимодействия на самом деле происходили с атомами основной каркасной цепи, а не с атомами боковых цепей.
Кроме черных областей, которые, как уже продемонстрировано, взаимодействуют с другими белками, идентифицировали дополнительные черные области на поверхности антитела. Один участок внизу Fc является гидрофобным в значительной степени, но он отчасти скрыт внутри с гидрофильной областью по его границам. Аналогично, две области являются гидрофобными и экспонированными растворителю, но они обращены в сторону внутренней части антитела. Эти области все равно могут быть потенциально вовлечены во взаимодействия с другими белками, если они будут экспонированы благодаря значительным конформационным изменениям или при разворачивании антитела. Все гидрофобные области также можно наблюдать при меньшем радиусе для участков (R=5 Å), хотя и с меньшим контрастом по сравнению с радиусом для больших участков (R=10 Å). Значения пространственной склонности к агрегации для рентгеновской структуры), основанные только на рентгеновской структуре, также картировали на поверхности антитела для сравнения с усредненными величинами, полученными при моделировании. Черные гидрофобные области, склонные к агрегации, достаточно похожи на пространственную склонность к агрегации, рассчитанную или посредством моделирования или с использованием только рентгеновской структуры. Существуют, конечно, некоторые различия, такие как интенсивность участков в области, где взаимодействуют Белок А и G. Тем не менее, это сравнение демонстрирует, что пространственная склонность к агрегации (для рентгеновской структуры) только на основе рентгеновской структуры может использоваться для получения удовлетворительного описания гидрофобных участков на поверхности. Это важно, поскольку атомистическое моделирование полноразмерного антитела требует серьезных вычислений. Для белков без модели рентгеновской структуры, может применяться параметр пространственной склонности к агрегации такой же, как для структуры, полученной посредством гомологического моделирования или путем ab-initio прогноза структуры. Наблюдаемая гомологичная структура была очень похожа на рентгеновскую структуру, а значения пространственной склонности к агрегации для нее также похожи на значения для рентгеновской структуры.
Таким образом, пространственная склонность к агрегации идентифицирует гидрофобные участки на поверхности антитела, и участки могут быть естественно экспонированными или экспонированными из-за динамических флуктуации или из-за частичного разворачивания антитела. Некоторые из этих гидрофобных участков также хорошо коррелируют с областями, взаимодействующими с другими белками. С целью проверки вовлечения гидрофобных областей, спрогнозированных с помощью пространственной склонности к агрегации, в агрегацию, в определенных областях были осуществлены мутации для замены гидрофобных остатков на гидрофильные. Полученные в результате антитела продемонстрировали менее склонное к агрегации поведение и повышенную стабильность. Кроме идентификации остатков, склонных к агрегации, также наблюдали, что способ ПСА корректно идентифицирует области антитела, предрасполагающие к связыванию с другими белками. Таким образом, способ мог бы широко применяться ко всем белкам для идентификации областей, склонных к агрегации, или участков связывания с другими белками.
Пример 3: Отбор участков антитела для обеспечения стабильности
Сайты, создаваемые для повышенной стабильности антитела, выбирали на основе параметра ПСА. Этот пространственный параметр учитывает (1) Поверхность, доступную растворителю (ПДР), каждого остатка, (2) гидрофобность остатка, и (3) пространственные вклады всех остатков внутри определенного радиуса. В этом примере, гидрофобные остатки, которые соответствуют положительным пикам в СН2, изменяли на не гидрофобные остатки. Ожидалось, что это улучшит общую стабильность белка. Два выбранных сайта (А1 и А2) соответствуют двум очень гидрофобным остаткам. Предприняли анализ замен этих остатков на лизин, очень гидрофильную аминокислоту с положительно заряженной боковой цепью. Вариант А1 и Вариант А2 отличаются от дикого типа единственной аминокислотной заменой.
Пример 4: Экспрессия и очистка вариантов антитела
Варианты антитела получали с помощью сайт-направленного мутагенеза. Все конструкты были подтверждены секвенированием ДНК. Плазмидную ДНК в масштабе порядка мг очищали из бактериальных культур и временно трансфецировали в клетки HEK 293. Антитело дикого типа и варианты очищали из надосадочной жидкости тканевой культуры на колонке с Белком А и пропускали через колонку с Q-сефарозой для удаления отрицательно заряженных примесей. При рН 7,0 и ниже, антитела положительно заряжены и остаются в элюате, в то время как отрицательно заряженные примеси связываются с положительно заряженной матрицей колонки с «Q Sepharose». Раствор с очищенным антителом концентрировали и буфер меняли на 20 мМ His-буфер рН 6,5, доводя до конечной концентрации 150 мг/мл.
В качестве контроля качества, аликвоты очищенных и концентрированных образцов анализировали с помощью SDS-PAGE и циркулярного дихроизма. Условия обоих типов, восстановительные и не восстановительные, использовали для белковых гелей. Мы также сравнили вторичную структуру антитела дикого типа и варианта А1 с помощью циркулярного дихроизма.
Пример 5: Биофизическое описание характеристик
Стабильность Варианта А1 сравнивали с диким типом в эксперименте ускоренной агрегации. Образцы с концентрацией 150 мг/мл в 20 мМ His-буфере при рН 6,5 инкубировали при 58°С в течение до 24 часов. Инкубацию останавливали путем разведения образца до 10 мг/мл с помощью 15 мМ K-фосфатного буфера, рН 6,5, и с помощью гель-фильтрации с ВЭЖХ определяли процент агрегации. Агрегацию рассчитывали в виде суммы площадей всех не мономерных пиков, разделенной на общую площадь всех пиков. Продемонстрировано среднее для 2-4 образцов для каждого момента времени. Агрегаты для Варианта А1 составляют не больше 80% от агрегатов дикого типа. Таким образом, точечная мутация уменьшает образование агрегатов на 20%.
Дикий тип и Вариант А1 сравнивали с помощью дифференциальной сканирующей микро-калориметрии (DSC, Microcal). Полноразмерные антитела представляют собой мультидоменные белки. DSC-анализ выявляет различные температуры плавления для различных доменов (Ionescu R.M. et al., J Pharm Sci. 2008, 97(4): p.1414-26; Mimura Y. et al., J Biol Chem. 2001, 276(49): p.45539-47.). Константные домены, CH2 и CH3, человеческого IgG1 Fc имели температуры плавления около 70°С и 82°С, соответственно, при нейтральном рН (lonescu R.M., et al., J Pharm Sci. 2008, 97(4): р.1414-26; Mimura Y. et al., Role of oligosaccharide residues of IgG1-Fc in Fc gamma RIIb binding. J Biol Chem, 2001. 276(49): p.45539-47.). В зависимости от последовательности вариабельных доменов антитела, Fab-фрагменты могут иметь различные температуры плавления по отношению к CH2 и CH3. Антитело С содержит Fab-домен с развернутыми переходами, что попадает между кривыми CH2 и CH3. Таким образом, CH2 представляет собой домен антитела с наименьшей температурой плавления.
Дикий тип и Вариант A1 анализировали при концентрации 2 мг/мл в 15 мМ His-буфера рН 6,5 и со скоростью нагревания 1,5 градуса в минуту. Данные образцов анализировали с помощью вычитания эталонных данных, нормализации по отношению к концентрации белка и объема кюветы для DSC и интерполяции кубической базовой линии. Сравнение термограмм показало увеличение перехода плавления CH2 в Варианте A1 по сравнению с диким типом.
Анализ Варианта А2, также созданного для стабильности на основе величин пространственной склонности к агрегации, обобщает выводы для Варианта A1.
Вкратце, биофизические анализы созданных вариантов антитела продемонстрировали их уменьшенную агрегацию и повышенную стабильность. Существенная корреляция между созданными сайтами, стабильностью варианта и профилями ДСК являются признаками эффективности методологии стабилизации терапевтических белков.
Пример 6: Эффективная ПДР
Было отмечено, что пики в эффективной ПДР (сумма 3 остатков) могут коррелировать с областями в белковой структуре, склонными к агрегации. Соответственно, эффективная ПДР может использоваться в качестве отдельного, хотя и менее эффективного способа идентификации в белке областей, склонных к агрегации. Значения высокоэффективной ПДР (сумма 3 остатков) выявляют наиболее гидрофобные участки, а низкие значения выявляют наиболее гидрофильные участки. Данные тестируемого белка, который имеет тенденцию к образованию агрегатов, получали исходя из коротких молекулярных моделирований 1,2 нс (свернутый белок) и 1 нс (неправильно свернутый белок). Эффективную ПДР для остатков белка наносили на график и было отмечено, что имеет место удовлетворительная корреляция между пиками эффективной ПДР и разрывами в сети связей структуры белка. Это говорит о том, что эффективная ПДР точно идентифицировала остатки структуры белка, которая вызывает неправильное сворачивание белка или агрегацию. Было сделано несколько мутантов тестируемого белка и, по меньшей мере, один продемонстрировал обещающие результаты в сохранении правильно свернутой структуры белка.
Пример 7: Прогнозирование областей связывания с белками с помощью ПСА
Способ ПСА использовали для прогнозирования сайтов связывания с белками. Области связывания прогнозировали для двух различных белков: антитела IgG1 и EGFR. Хорошо известно, что антитело IgG1 связывается с белками, такими как Fc-рецептор, Протеин А и Протеин G. EGFR связывается с эпидермальным фактором роста (EGF), трансформирующим фактором роста (TGFα) а также с самим собой с образованием димера. Эти участки связывания для антитела IgG1 и EGFR использовали в качестве моделей для демонстрации способности инструмента ПСА прогнозировать участки связывания.
Методы молекулярного моделирования
Молекулярно-динамические моделирования осуществляли для полноразмерного антитела IgG1 с использованием полной атомной модели. Исходную структуру для моделирования полноразмерного антитела получали исходя из рентгеновских структур индивидуальных фрагментов Fab и Fc. Рентгеновскую структуру Fab-фрагмента получали от Novartis Pharma AG. Рентгеновскую структуру Fc-фрагмента получали исходя из структуры Fc-фрагмента другого антитела IgG1 похожей последовательности, 1HZH (Saphire et al., Science. 2001, 293, 1155). Структуру полноразмерного антитела затем получали путем выравнивания Fab- и Fc-фрагментов с использованием структуры 1HZH в качестве модельной матрицы. Эту структуру антитела называли антителом-А. В целях выравнивания фрагментов с правильными расстояниями и ориентацией, было сведено к минимуму СКО (среднеквадратичное отклонение) между общими остатками CYS фрагментов и полноразмерной матрицы (1HZH). Полученная в результате структура полноразмерного антитела затем применялась для осуществления моделирования с явно заданными атомами с 30 нс интервалами. Остатки CYS в полученном в результате антителе А были вовлечены в дисульфидные связи, включая остатки в шарнирной области. Для моделирования применяли профиль G0-гликозилирования, поскольку он является наиболее распространенным профилем, наблюдаемым в антителах.
Пакет для моделирования CHARMM (Brooks et al. 1983, 4, 187) J. Comput. Chem., 1983, 4, 187) применяли для настройки и анализа, а пакет NAMD (Phillips et al. Journal of Computational Chemistry. 2005, 26, 1781) для осуществления моделирований. Полное атомистическое силовое поле CHARMM (Phillips et al. Journal of Computational Chemistry. B. 1998, 102, 3586) было применено для белка и TIP3P (Jorgensen et al. J. Chem. Phys., 1983, 79, 926) модели растворителя для воды. Моделирования проводили при 298К и 1 атм в системе нормальных давления и температуры. Параметры для сахарных групп, участвующих в гликозилировании Fc-фрагмента, были получены таким образом, чтобы они были совместимыми с силовым полем CHARMM, следующим из силового поля CSFF (Kuttel et al. J. Comput. Chem., 2002, 23, 1236). Протонированные состояния остатков гистидина при рН 7,0 были выбраны на основании пространственной близости электроотрицательных групп. Полноразмерное антитело было сольватировано в орторобмической камере, поскольку она минимизирует количество необходимых молекул воды и таким образом минимизирует вычислительное время. Периодические граничные условия были применены во всех 3 направлениях. Водная сольватная оболочка в 8 Å была применена в каждом направлении орторомбической ячейки. Конечный общий размер системы составил 202130 атомов. Было отмечено, что призматическая ячейка оставалась стабильной в течение 30 нс моделирования без какого либо значительного изменения в размерах ячейки по всем трем осям. Исходные размеры ячейки составили 161,9 Å, 145,4 Å и 83,2 Å, соответственно, и они очень мало изменялись во время 30 нс моделирования, с конечными размерами 161,2 Å, 144,7 Å и 82,8 Å соответственно. Антитело не вращалось в значительной степени во время 30 нс моделирования, поддерживая, таким образом, минимальное расстояние между антителом и его периодическими изображениями на уровне более чем 14 Å. Для нейтрализации общего заряда системы добавляли достаточное количество ионов. Нейтральность зарядов измеряют согласно методу суммирования Эвалда, который использовали для расчета вклада электростатических взаимодействий.
После сольватации антитела, энергию минимизировали с помощью SD путем фиксирования белка, чтобы дать возможность воде свободно расположиться вокруг белка. Затем ограничения удаляли и структуру дополнительно минимизировали с помощью SD и ABNR (Adopted Basis Newton-Raphson). Систему затем медленно нагревали до комнатной температуры с шагом 5°С каждые 0,5 пс с использованием временных интервалов в 1 фс. Систему затем уравновешивали в течение 1 нс перед вычислением представляющих интерес свойств модели. Во время моделирования для дополнительного статистического анализа сохраняли конфигурации каждые 0,1 нс.
Инструмент ПСА для прогнозирования областей связывания антитела IgG1
Инструмент ПСА применяли к конфигурациям белка, полученным их молекулярных моделирований. Для более быстрого прогнозирования в высокопроизводительных применениях, инструмент ПСА также можно применять к рентгеновской структуре белка или к структуре, полученной на основе гомологии, с оговоркой, что это может привести к потере точности. Величину ПСА для каждого атома в белке определяли следующим образом,
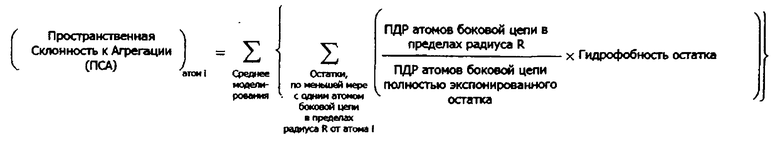
Здесь,
1) ПДР атомов боковой цепи внутри радиуса R рассчитывают в каждый момент моделирования.
2) ПДР боковой цепи полностью экспонированного остатка (скажем для аминокислоты 'X') получают в предпочтительном воплощении путем расчета ПДР боковых цепей среднего остатка в полностью раскрытой конформации трипептида 'Ala-Х-Ala'.
3) Гидрофобность Остатка получают с использованием шкалы гидрофобности Блэка и Моулд (S.D. Black and D.R. Mould, Anal. Biochem. 193, 72 (1991)). Шкала нормализуется таким образом, чтобы глицин имел гидрофобность равную нолю. Следовательно, аминокислоты, которые являются более гидрофобными по сравнению с глицином, являются положительными, а менее гидрофобные по сравнению с глицином являются отрицательными на шкале гидрофобности. ПСА дает динамически экспонированную гидрофобность определенной области с центром в данном атоме на поверхности белка. ПСА рассчитывают для сферических областей с радиусом R с центром на каждом атоме в белке. Это дает уникальную величину ПСА для каждого атома. Затем получают ПСА для остатка путем получения среднего ПСА всех его составляющих атомов. Значения ПСА, таким образом, оценивали с использованием R=10 Å для антитела IgG1, и величины картировали на поверхности антитела с использованием цветной шкалы для указания величины ПСА внутри интервала от -0,5 до +0.5.
Эти значения ПСА рассчитывали путем вычисления среднего в течение 30 нс атомистического моделирования полноразмерного антитела. Следует заметить, что значение ПСА в каждом остатке дает общую экспонированную гидрофобность области с центром на остатке, а не гидрофобность для единственного остатка. Шкалу гидрофобности (S.D. Black and D.R. Mould, Anal. Biochem. 193, 72 (1991)) также непосредственно картировали на поверхность для сравнения. При рассмотрении гидрофобной карты, области гидрофобности, по-видимому, были случайно распределены по поверхности, и было трудно выбрать определенный гидрофобный участок, который бы являлся более доминантным по сравнению с другими. Однако при исследовании карты ПСА такой же структуры, было легко обнаружить области с высоким значением ПСА, которые указывали на динамически экспонированные гидрофобные участки. Для этих участков термодинамически неблагоприятно быть экспонированными воде из-за их гидрофобной природы.
Таким образом, они могли бы быть вовлечены в связывание с белком с целью уменьшения их экспонирования растворителю. Эти участки с высоким значением ПСА идентифицировали от '1' до '6'. Участки '1' и '6' были локализованы в Fab-фрагменте, и участки '2'-'5' были локализованы в Fc-фрагменте. Участки '1'-'3' были открыто экспонированы и, таким образом, могли легко взаимодействовать с другими белками. С другой стороны, участки '4'-'6' были доступны растворителю, но были повернуты внутрь белка, делая затруднительным их взаимодействие с другими белками до тех пор, пока они не станут более открыто эксонированы благодаря разворачиванию белка.
Затем, тестировали корреляцию участков с высокой величиной ПСА, которые представляли экспонированные гидрофобные участки, с областями связывания с белками. Области связывания антитела с Fc-рецептором, протеином А, и протеином G картировали поверх величин ПСА. Сайты белковых взаимодействий были получены из рентгеновской структуры белковых комплексов, записи в PDB 1T89, 1FC2 и IFCC (S. Radaev et al., J. Biol. Chem, 276 (19) 16469 (2001); Deisenhofer J. et al. Hoppe-Seyler's Z. Physiol. Chem. 359, 975-985 (1978); Deisenhofer, J, Biochemistry 20, 2361-2370 (1981); Sauer-Eriksson A. E. et al. Structure, 3, 265 (1995)). Была обнаружена сильная корреляция между гидрофобными участками, идентифицированными посредством ПСА, и участками связывания с белками. Антиген, связанный с участком CDR-петли, отмеченный как участок ПСА '1', Fc-рецептор связывается с участком ПСА '2', и протеин А и протеин G связываются с участком ПСА '3'. Кроме того, DeLano et al. (DeLano W. L. et al., Science 287, 1279 (2000)) продемонстрировали, что участок, где связывается протеин А и протеин G (участок ПСА '3') представляет собой консенсусный участок связывания, который является доминантным для связывания случайных пептидов, выбранных in vitro по высокому сродству. Также известно, что участок '3' связывается с ревматоидным фактором и неонатальным Fc-рецептором. Таким образом, гидрофобная доступность участка '3', выявленная посредством ПСА, делает его благоприятным участком для связывания с многочисленными белками. Достаточно заметно, что все 3 открыто экспонированных участка (участки ПСА '1'-'3') вовлечены в связывание. Сердцевина участка вовлечена в гидрофобные взаимодействия, тогда как края вовлечены в полярные взаимодействия. ПСА при R=10 Å анализировали для обнаружения явных гидрофобных участков, вовлеченных в связывание с другими белками. Эти участки можно было исследовать более подробно с использованием ПСА с более высоким разрешением, т.е., при более низком радиусе R, используемом в расчете ПСА. Таким образом, величины ПСА рассчитывали при R=5 Å для антитела. Эти величины ПСА картировали на поверхности антитела. Здесь положительные величины ПСА указывают на динамически экспонированные гидрофобные участки, тогда как отрицательные величины ПСА указывают на динамически экспонированные гидрофильные участки. Также идентифицировали области связывания с Fc-рецептором, протеином А и протеином G. Подобно результатам для ПСА при R=10Å, ПСА при R=5 Å также демонстрировали сильную корреляцию между областями связывания с белками и пиками значений ПСА. Гидрофобные области связывания хорошо коррелировали с положительными пиками, а гидрофильные (полярные) области связывания хорошо коррелировали с отрицательными пиками. В малочисленных исключениях, в которых остатки с низким значением пространственной склонности к агрегации (т.е. с близким к нулю значением, либо положительным, либо отрицательным) также вступали во взаимодействия, было отмечено, что взаимодействия на самом деле происходили с атомами основной каркасной цепи, а не с атомами боковых цепей.
ПСА прогнозирует как области связывания, так и области, склонные к агрегации
Было продемонстрировано, что пики в ПСА также соответствуют областям, которые способствуют белковой самоагрегации (Chennamsetty, N. et al. Design of therapeutic antibodies with enhanced stability (Submitted)). Агрегация представляет собой главный путь деградации для терапевтических белков, приводящая к потере их активности и к потенциальной иммуногенности. Мутации, созданные на пиках ПСА, приводили к получению стабильных антител с меньшей склонностью к агрегации (Chennamsetty N. et al. Design of therapeutic antibodies with enhanced stability (Submitted)). Путем замены гидрофобных остатков в пиках ПСА, на гидрофильные остатки, были получены 8 мутантов: A1 (L235K), А2 (I253K), A3 (L309K), А4 (L235K L309K), А5 (L234K L235K), А6 (L235S), А7 (V282KL) и А8 (L235K V282K L309K). Далее мутанты тестировали на предмет их агрегационного поведения с использованием экспериментов ускоренной агрегации при тепловом стрессе в концентрации 150 мг/мл. Результаты гель-фильтрации с ВЭЖХ продемонстрировали увеличение количества мономера от 91% для дикого типа до 92-97% для вариантов, что говорит о меньшей склонности к агрегации у мутантов. Таким образом, сайты с высокой величиной ПСА также представляют участки высокой склонности к агрегации.
Инструмент ПСА, таким образом, прогнозирует как области связывания с белками, так и области, склонные к агрегации.
Вероятное объяснение заключается в том, что агрегация белка также представляет собой форму белок-белкового взаимодействия, хотя и внутри белков одного типа. Кроме того, было продемонстрировано, что существует перекрывание между некоторыми из областей, склонных к агрегации, и областями связывания с белками. Это перекрывание очевидно из остатков L235 и I253, которые вовлечены одновременно и в связывание с белком, и в агрегацию. Похожий ПСА-анализ и белковую инженерию осуществляли на другом антителе IgG1, где было продемонстрировано, что области, склонные к агрегации, перекрываются с областями связывания с белками (Chennamsetty N. et al. Design of therapeutic antibodies with enhanced stability (Submitted)). В этом случае, мутации проводили в CDR-участках, где антитело связывается с антигеном. Полученные в результате мутанты в CDR-участках демонстрировали меньшую склонность к агрегации, но не могли связываться с антигеном и потеряли свою активность. Таким образом, существуют общие характеристики для областей связывания с белками и областей, склонных к агрегации. Это согласуется с другими вычислительными прогнозами, сделанными исходя из последовательностей, которые перекрывают области связывания с белками и области, склонные к агрегации (Wang, X. et al., mAbs, 1, 1-14 (2009)). Таким образом, динамически экспонированные гидрофобные участки, идентифицированные посредством ПСА, вовлечены и в связывание с белками и в самоагрегацию белка. Перекрывание между сайтами связывания с белками и сайтами, склонными к агрегации, однако представляет новую проблему в дизайне терапевтических белков, так как агрегация должна быть предотвращена, в то время как сохранение связывания белка необходимо для его функционирования. Для решения этой проблемы можно использовать ПСА-анализ с более высоким разрешением (при R=5 Å) для локализации и модификации сайтов, склонных к агрегации, около участков связывания без нарушения связывания с белками. Например, с использованием ПСА-анализа на антителе IgG1, было определено, что сайты I253, L309 и V282 все являются частью широкого участка (участок ПСА '3'), вовлеченного в агрегацию (Chennamsetty N. et al. Design of therapeutic antibodies with enhanced stability (Submitted)). Были созданы мутанты, включающие сайты L309 и V282 A3 (L309K), А4 (L235K L309K), А7 (V282K) и А8 (L235K V282K L309K), исключая сайт 1253, который был вовлечен в связывание с протеином А. Полученные в результате мутанты продемонстрировали меньшую склонность к агрегации, и в то же время могли связываться с протеином А. Таким образом, технология ПСА может эффективно использоваться для создания белков с более низкой склонностью к агрегации, при этом с сохранением способности связывания с белками.
ПСА прогнозирует области связывания EGFR
В дополнение к антителам, ПСА-анализ осуществляли на другом белке, называемом рецептором эпидермального фактора роста (EGFR), для прогнозирования его областей связывания. EGFR представляет собой рецептор клеточной поверхности, активируемый связыванием специфических лигандов, включающих эпидермальный фактор роста (EGF) и трансформирующий фактор роста β (TGFβ). Сверхэкспрессия и сверхактивация EGFR ассоциирована с рядом злокачественных новообразований, таких как рак легкого и рак мозга. EGFR также связывается с самим собой с образованием димеров. ПСА-анализ осуществляли на EGFR, чтобы посмотреть, совпадают ли прогнозированные области связывания с областями связывания EGF, TGFβ, и с другим EGFR в димерной форме.
Величины ПСА, которые оценивали для EGFR при R=10 Å, картировали на поверхности EGFR. Эти значения ПСА вычисляли путем осуществления анализа непосредственно на рентгеновской структуре EGFR, полученной из записи в PDB 1IVO (Ogiso H. et al., Cell, 110: Шкалу гидрофобности (S.D. Black and D.R. Mould, Anal. Biochem. 193, 72 (1991)) также непосредственно картировали на поверхность для сравнения. Также как было видно ранее в случае антитела, гидрофобные остатки EGFR были распределены по поверхности, и было трудно изолировать те остатки, которые потенциально вовлечены в связывание. Однако было относительно легко выделить участки с высоким значением ПСА, которые указывали на пространственно экспонированные гидрофобные участки. Два таких главных участка идентифицировали и отметили как '1' и '2'.
Известные области связывания EGFR с EGF, TGFα и с другим EGFR в димерной форме картировали поверх величин ПСА. Эти сайты связывания с белками получали, исходя из рентгеновских структур комплексов белков, записи в PDB 1IVO and IMOX (Ogiso H. et al. Cell, 110:775-787 (2002); Garrett T.P.J. et al. Cell, 110:763-773 (2002)). Картирование указывало на сильную корреляцию между гидрофобными участками, идентифицированными посредством ПСА, и областями связывания с белками. EGFR связывается с EGF и TGFα в участке ПСА '1' и в другом меньшем участке. Он также связывается с другим EGFR в участке ПСА '2'. Таким образом, два главных участка ПСА оба вовлечены в связывание. Также как в случае антитела, сердцевина участков была вовлечена в гидрофобные взаимодействия, тогда как края были вовлечены в полярные взаимодействия. Таким образом, ПСА точно прогнозирует участки связывания EGFR.
Выводы
Описан вычислительный инструмент, называемый ПСА, который обеспечивает оценку динамического экспонирования гидрофобных участков, которая может использоваться для прогнозирования участков связывания с белками. Используя два модельных белка, антитело IgG1 и EGFR, было продемонстрировано, что ПСА точно прогнозирует области связывания с белками. В случае антитела IgG1, области связывания с Fc-рецептором, протеином А и протеином G хорошо коррелировали с пиками ПСА. Для EGFR участки связывания с EGF, TGFα и с другим EGFR хорошо коррелировали с пиками ПСА. Таким образом, было продемонстрировано, что ПСА является точным инструментом в прогнозировании областей связывания, и была продемонстрирована важность гидрофобных экспонированных участков для белок-белкового связывания. Такой же ПСА-анализ можно осуществить на других белках, а также спрогнозировать их области связывания. Кроме того, было продемонстрировано, что некоторые из областей связывания с белками перекрываются с областями, склонными к агрегации. Данный факт представляет собой проблему для дизайна терапевтических белков, так как неблагоприятная агрегация должна быть предотвращена, в то время как сохранение связывания с белками необходимо для его функционирования. Было продемонстрировано, что эта проблема может быть преодолена с использованием ПСА-анализа с последующей белковой инженерией. Используя ПСА, сайты около сайта связывания, которые вовлечены в агрегацию, могут быть детектированы и модифицированы для уменьшения склонности к агрегации, но при этом с сохранением связывания. С помощью антитела IgG1 было продемонстрировано, что при модификации для уменьшения агрегации областей, склонных к агрегации, около сайтов связывания с протеином А, была сохранена способность связывания. Похожая белковая инженерия на основе ПСА может быть осуществлена около областей связывания с антигеном для уменьшения склонности к агрегации с сохранением активности. Таким образом, инструмент ПСА, описанный в настоящем документе, может использоваться для создания стабильных терапевтических белков с сохранением их сайтов связывания. Инструмент ПСА также может использоваться для определения у многочисленных белков еще неизвестных сайтов связывания, выведенных исходя из структурных геномных закономерностей, с получением, таким образом, важных подсказок относительно их функции.
Эквиваленты
Специалисту в данной области понятно или он способен выявить с использованием не более чем обычного экспериментирования множества эквивалентов конкретных воплощений изобретения, описанного в настоящем документе. Подразумевается, что такие эквиваленты охвачены нижеследующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОГЛОБУЛИНЫ С УМЕНЬШЕННОЙ АГРЕГАЦИЕЙ | 2009 |
|
RU2532226C2 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ САЙТОВ ДЛЯ КОНЪЮГАЦИИ IgG | 2010 |
|
RU2569186C2 |
| МОДИФИЦИРОВАННЫЕ АНТИ-EGFR АНТИТЕЛА С УМЕНЬШЕННОЙ ИММУНОГЕННОСТЬЮ | 2002 |
|
RU2297245C2 |
| АГРЕГАЦИЯ, ЗАВИСЯЩАЯ ОТ ПОСЛЕДОВАТЕЛЬНОСТЕЙ | 2010 |
|
RU2567804C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА | 2011 |
|
RU2558298C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ УМЕНЬШЕНИЯ АГРЕГАЦИИ МАКРОМОЛЕКУЛ ПРИ ФИЗИОЛОГИЧЕСКИХ УСЛОВИЯХ | 2009 |
|
RU2563823C2 |
| АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ NKG2D И ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2563343C2 |
| СПОСОБЫ МОДИФИКАЦИИ АНТИТЕЛ И МОДИФИЦИРОВАННЫЕ АНТИТЕЛА С УЛУЧШЕННЫМИ ФУНКЦИОНАЛЬНЫМИ СВОЙСТВАМИ | 2008 |
|
RU2540150C2 |
| ОПТИМИЗИРОВАННЫЕ Fc-ВАРИАНТЫ, ИМЕЮЩИЕ ИЗМЕНЕННОЕ СВЯЗЫВАНИЕ С FcγR, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2004 |
|
RU2337107C2 |
| ОПТИМИЗАЦИЯ РАСТВОРИМОСТИ ИММУНОСВЯЗЫВАЮЩИХ СРЕДСТВ | 2014 |
|
RU2653441C2 |

Данное изобретение относится к области биоинформатики. Рассмотрен способ определения на белке гидрофобной области, которая является областью, склонной к агрегации, и/или областью связывания макромолекулы, включающий получение структурной модели белка и определение пространственной склонности к агрегации (ПСА), исходя из отношения площади поверхности, доступной растворителю (ПДР), к соответствующему ПДР атомов в полностью экспонированном остатке и гидрофобности атома или аминокислотного остатка. На основе способа определения гидрофобной области предложены способы получения варианта белка, который проявляет уменьшенную склонность к агрегации или уменьшенное, или измененное сродство связывания с макромолекулой, а также способы получения композиции, содержащей вариант антитела, который проявляет уменьшенную склонность к агрегации или измененную склонность к взаимодействию с партнером по связыванию. Настоящее изобретение позволяет получить белки с повышенной стабильностью, уменьшенной склонностью к образованию агрегатов и/или измененным сродством к другим молекулам, что может найти применение в создании различных терапевтических препаратов. 7 н. и 9 з.п. ф-лы, 1 табл., 7 пр.
1. Способ определения на белке гидрофобной области, которая является областью, склонной к агрегации, и/или областью связывания макромолекулы, включающий:
(a) получение структурной модели белка, охватывающей рентгеновскую кристаллическую структуру, ЯМР-структуру, модель белковой томографии или атомистическую модель, построенную исходя из исследований с использованием электронной микроскопии;
(b) картирование на структурной модели белка пространственной склонности к агрегации (ПСА) для атомов в белке, рассчитанной для конкретного атома путем:
(i) определения одного или более атомов или аминокислотных остатков в структурной модели, представляющей белок, где один или более атомов находятся внутри заданной области пространства с центром в конкретном атоме или один или более аминокислотных остатков содержат по меньшей мере один атом внутри заданной области пространства с центром в конкретном атоме;
(ii) расчета для каждого одного или более атомов в заданной области пространства отношения площади поверхности, доступной растворителю (ПДР), каждого одного или более атомов к ПДР атомов в идентичном, полностью экспонированном остатке, или для каждого из одного или нескольких аминокислотных остатков, определенных на стадии (i), отношения ПДР атомов боковой цепи, находящихся внутри определенной области пространства к ПДР соответствующих атомов боковой цепи в идентичном, полностью экспонированном остатке;
(iii) умножения каждого отношения на гидрофобность атома для одного или более атомов или гидрофобность одного или более аминокислотных остатков, определенную по шкале гидрофобности аминокислот; и,
(iv) суммирования произведений стадии (iii); где сумма представляет собой ПСА для конкретного атома; или
где ПСА для конкретного атома рассчитывают путем проведения молекулярно-динамического моделирования на структурной модели белка перед стадией (i) и путем повторения стадий (i)-(iv), каждый раз проводя дополнительное молекулярно-динамическое моделирование для множества временных шагов, получая в результате множество сумм, как на стадии (iv), и расчета среднего значения сумм,
где рассчитанное среднее значение представляет собой ПСА для конкретного атома; и
(с) определение области внутри белка, содержащей множество атомов, имеющих ПСА, которая превосходит установленный порог гидрофобности;
где область, склонная к агрегации и/или область связывания макромолекулы, содержит аминокислоты, содержащие указанное множество атомов.
2. Способ по п.1, в котором заданная область пространства представляет собой сферу, имеющую радиус в диапазоне от 1 до 30 Å.
3. Способ по п.2, в котором радиус составляет 5 Å.
4. Способ по п.1, в котором проводят молекулярно-динамическое моделирование с использованием пакета программ моделирования, выбранного из группы, включающей ABINIT, AMBER, Ascalaph, CASTEP, CPMD, CHARMM, DL_POLY, FIREBALL, GROMACS, GROMOS, LAMMPS, MDynaMix, MOLDY, MOSCITO, NAMD, Newton-X, ProtoMol, PWscf, SIESTA, VASP, TINKER, YASARA, ORAC и XMD.
5. Способ по п.1, в котором определение включает построение графика величин ПСА; расчет для пиков на графике площади под кривой (AUC); и определение одной или более областей белка с положительным значением AUC, где область, склонная к агрегации, содержит эти установленные области белка.
6. Способ получения варианта белка, который проявляет уменьшенную склонность к агрегации, включающий
(i) определение на белке области, склонной к агрегации, используя способ согласно п.1;
(ii) замену или делетирование по меньшей мере одного аминокислотного остатка в пределах данной области белка, склонной к агрегации,
где если заменяют аминокислотный остаток, то его заменяют на аминокислотный остаток, который является более гидрофильным, так что склонность варианта к агрегации уменьшается.
7. Способ получения варианта белка, который проявляет уменьшенную склонность к агрегации, включающий
(i) определение на белке области, склонной к агрегации, используя способ согласно п.1;
(b) получение множества вариантов белка путем замены в каждом варианте по меньшей мере одного аминокислотного остатка в пределах данной области белка, склонной к агрегации,
где заменяют один или более различных аминокислотных остатков или различные комбинации аминокислотных остатков в каждом варианте, где по меньшей мере один аминокислотный остаток заменяют на аминокислотный остаток, который является более гидрофильным; и
(с) отбор варианта белка, полученного на стадии (b), который проявляет уменьшенную склонность к агрегации.
8. Способ по п.6, где заменяют по меньшей мере два аминокислотных остатка внутри области, склонной к агрегации.
9. Способ по п.6, где внутри белка заменяют по меньшей мере один остаток внутри более чем одной области, склонной к агрегации.
10. Способ по п.6, где белок выбирают из группы, состоящей из антитела, Fab-фрагмента, Fab′-фрагмента, Fd-фрагмента, Fv-фрагмента, F(ab′)2-фрагмента и Fc-фрагмента.
11. Способ получения композиции, содержащей вариант антитела, который проявляет уменьшенную склонность к агрегации, включающий:
(a) получение варианта антитела, который проявляет уменьшенную склонность к агрегации, используя способ по п.6; и
(b) заключение варианта антитела, полученного на стадии (а), в эффективном количестве в рецептуру вместе с носителем, адъювантом и/или вспомогательным веществом.
12. Способ получения варианта белка, который проявляет уменьшенное сродство связывания с макромолекулой, включающий
(i) определение на белке области связывания макромолекулы, используя способ согласно п.1; и
(ii) замену или делетирование по меньшей мере одного аминокислотного остатка в белке внутри данной области связывания макромолекулы,
где если заменяют аминокислотный остаток, то его заменяют на аминокислотный остаток, который является более гидрофильным, так что сродство связывания варианта в отношении макромолекулы уменьшается.
13. Способ получения варианта белка, который проявляет измененное сродство связывания с макромолекулой, включающий:
(а) определение на белке области связывания макромолекулы, используя способ согласно п.1; и
(b) получение множества вариантов белка путем замены в каждом варианте по меньшей мере одного аминокислотного остатка в белке в пределах данной области связывания макромолекулы,
где заменяют один или более различных аминокислотных остатков или различные комбинации аминокислотных остатков в каждом варианте; и
(c) отбор варианта белка, полученного как на стадии (b), который проявляет измененное сродство связывания в отношении макромолекулы.
14. Способ по п.12, где заменяют, по меньшей мере, два аминокислотных остатка внутри области связывания макромолекулы.
15. Способ по п.12, где в белке заменяют по меньшей мере один остаток внутри более чем одной области связывания макромолекулы.
16. Способ получения композиции, содержащей вариант антитела, который проявляет измененную склонность к взаимодействию с партнером по связыванию, включающий:
(a) получения антитела, которое проявляет измененную склонность к взаимодействию с партнером по связыванию, используя способ по п.12; и
(b) заключение варианта антитела, полученного согласно стадии (а), в эффективном количестве в рецептуру вместе с носителем, адъювантом и/или вспомогательным веществом.
| HOU T | |||
| et al., "An extended aqueous solvation model based on atom-weighted solvent accessible surface areas: SAWSA v2 | |||
| 0 model", Journal of molecular modeling, 2005, 11(1): 26-40 | |||
| RASCHKE T | |||
| M | |||
| et al., "Quantification of the hydrophobic interaction by simulations of the aggregation of small hydrophobic solutes in water", Proceedings of the National |
Авторы
Даты
2015-12-20—Публикация
2009-06-19—Подача