Настоящее изобретение относится к вакцинной композиции, а конкретнее относится к вакцинной композиции против гриппа.
Человеческий и птичий грипп являются распространенными пандемиями с высокими уровнями смертности и заболеваемости в течение каждого сезона. Среди вирусов гриппа, которые являются покрытыми оболочкой РНК-вирусами, принадлежащими к семейству Orthomyxoviridae, основной причиной гриппа является вирус гриппа А. Вирус гриппа А может быть дополнительно разделен на подтипы по антигенным свойствам своих поверхностных белков: гемагглютинина (Н) и нейраминидазы (N). До настоящего времени были определены пятнадцать Н и девять N подтипов. Хотя в животных были обнаружены множество комбинаций этих подтипов, только H1, H2, Н3, N1 и N2 адаптировались в виде стабильных линий в человеческой популяции начиная с 1918 года.
Грипп А обладает высокой скоростью мутации и часто изменяет свои антигенные характеристики либо путем постепенного антигенного дрейфа с течением времени (иначе говоря путем случайных точечных мутаций, внесенных вирусной полимеразой, которые транслируются в изменения в аминокислотной последовательности соответствующих белков), либо путем внезапной рекомбинации с другим вирусным подтипом, которая известна как антигенная изменчивость (когда хозяин одновременно инфицируется двумя различными штаммами вируса гриппа). Основной стратегией, применяемой для борьбы с заболеванием, является вакцинация либо инактивированными, либо живыми ослабленными вакцинами.
Против гриппа были разработаны различные вакцины, такие как вакцины против сезонного гриппа «Fluzone®», «Vaxigrip®», «Mutagrip®» и «Imovax Gripe®», введенные в коммерческий оборот компанией «Sanofi-Pasteur», «Fluarix®», «Gripovax®» и «FluLaval®», введенные в коммерческий оборот компанией «GlaxoSmithKline», «FluMist®», введенная в коммерческий оборот компанией «Medlmmune», «Afluria®» введенная в коммерческий оборот компанией «CSL Biotechnologies» или «Beghvac®», «Fluad®», «Fluvirin®» и «Agrippal®», введенные в коммерческий оборот компанией «Novartis». Вакцины против гриппа также включают вакцины против пандемического гриппа, такие как «Celvapan®» (Baxter), «Daronrix®», «Pandemrix®» и «Prepandrix®» (GlaxoSmithKline Biologicals), «Focetha®» и «Optaflu®» (Novartis Vaccines and Diagnostics), «IDflu®» и «Intanza®» (Sanofi Pasteur). Тем не менее имеющиеся вакцины активны в течение коротких периодов времени и только против конкретных типов штаммов (гемагглютинины). Появление устойчивых вирусных вариантов и неблагоприятное воздействие создали необходимость совершенствования профилактики инфекции вирусов гриппа, в частности одновременной профилактики инфекций различными штаммами вируса гриппа.
Неожиданно авторы обнаружили, что применение производного галактозилцерамидов в качестве адъюванта к вакцине против гриппа увеличивает активность вакцинной композиции. В частности, они показали, что такие соединения увеличивали переключения изотипов (повышенное продуцирование lgG2a и lgG2b) и неожиданно индуцировали активацию цитотоксических Т-лимфоцитов против эпитопа гриппа, в частности активацию Th1, в то время как современные вакцины против гриппа в основном увеличивают продуцирование IgG. Кроме того, изобретатели неожиданно обнаружили, что применение производного галактозилцерамидов в качестве адъюванта в вакцине против гриппа индуцировало перекрестную защиту, т.е. они повысили активность вакцинной композиции по отношению к инфицирующему штамму, отличному от штамма, применяемого для изготовления вакцины против гриппа.
Настоящее изобретение относится к вакцинной композиции, содержащей:
- по меньшей мере один профилактически активный агент против гриппа, необязательно содержащий адъювант, и
- по меньшей мере один адъювант, который является производным галактозилцерамида.
В контексте изобретения, «вакцинная композиция» или «вакцина» относится к композиции, которая при введении объекту индуцирует клеточный и/или гуморальный иммунные ответы. В данном документе «объект» означает животное, такое как позвоночное или млекопитающее, предпочтительно млекопитающее, не являющееся человеком, или человек. Примеры позвоночных включают птиц и домашнюю птицу, в частности курицу. Примеры млекопитающих, не являющихся человеком, включают грызунов, лошадей, свиней и приматов. Наиболее предпочтительным объектом является человек.
В контексте изобретения, «инфлюэнца» или «грипп» относится к инфекционному заболеванию птиц и млекопитающих, вызванному РНК-содержащими вирусами семейства Orthomyxoviridae, которые называются вирусом гриппа. У людей распространенными симптомами заболевания являются озноб и лихорадка, боль в горле, мышечные боли, сильная головная боль, кашель, слабость и общий дискомфорт. В более серьезных случаях, грипп вызывает пневмонию, которая может оказаться смертельной, особенно у маленьких детей и пожилых людей. Грипп может передаваться от инфицированных млекопитающих через воздух кашлем или чиханием, которые создают аэрозоли, содержащие вирус, и от инфицированных птиц через их помет. Грипп может также передаваться слюной, выделениями из носа, калом и кровью. Инфекции могут также возникать в результате контакта с этими телесными жидкостями или с загрязненными поверхностями.
В контексте изобретения, «вирусом гриппа» называется возбудитель гриппа. Этот покрытый оболочкой РНК-вирус с сегментированным геномом содержит восемь одноцепочечных антисмысловых сегментов РНК и принадлежит к семейству Orthomyxoviridae. Вирусы гриппа в соответствии с изобретением охватывают три подтипа: вирус гриппа А, вирус гриппа В и вирус гриппа С. Эти подтипы основываются на антигенных различиях в двух структурных белках вируса - матриксного белка М2 и нуклеопротеина. Предпочтительно, если вирусом гриппа в соответствии с изобретением является вирус гриппа А. Более предпочтительно, если вирус гриппа выбран из группы, состоящей из штаммов H1N1, H1N2, H2N2, H3N1, H3N2, H5N1 и H7N7. Конкретнее, специалистам в данной области хорошо известно, что грипп может быть сезонным или пандемическим. Сезонный грипп, как правило, вызывается штаммом, определенным и рекомендованным Международной организацией здравоохранения. В настоящее время (в 2009), циркулирующими штаммами вируса гриппа, вызывающими сезонный грипп, являются, в частности, штаммы гриппа H1N1, H3N2 и В. В прошлом штамм гриппа H2N2 также был ответственен за сезонный грипп. До 2008 года пандемический грипп был, например, вызван штаммами гриппа H1N1 или H7N7.
«Профилактически активный агент», при использовании в данном документе, относится к любому соединению организма, которое ответственно за индукцию иммунного ответа против инфекции вирусом гриппа. Примеры профилактически активных агентов, которые могут быть пригодны против гриппа, включают полипептид, полинуклеотид, углеводную составляющую, гликопротеин, целый вирус гриппа, расщепленный вирус гриппа. Предпочтительно, если по меньшей мере один профилактически активный агент против гриппа в соответствии с изобретением выбирается из группы, состоящей из живого неослабленного вируса гриппа; живого ослабленного вируса гриппа; убитого или инактивированного вируса гриппа; антигена вируса гриппа, например субъединицы вируса гриппа, рекомбинантного полипептида или белка из вируса гриппа; кДНК из вируса гриппа или рекомбинантного вируса гриппа.
Предпочтительно, если по меньшей мере один профилактически активный агент против гриппа в соответствии с изобретением содержит по меньшей мере один штамм вируса гриппа А, и по меньшей мере один штамм вируса гриппа В, и необязательно другой штамм вируса гриппа А или один штамм вируса гриппа С.
В данном документе «живой неослабленный вирус гриппа» относится к живому покрытому оболочкой РНК-вирусу с сегментированным геномом, состоящим из восьми одноцепочечных антисмысловых РНК-сегментов, который принадлежит к семейству Orthomyxoviridae.
В данном документе, «живой ослабленный вирус гриппа» относится к штамму живого вируса гриппа, который демонстрирует естественную слабую вирулентность. Живые ослабленные вирусы гриппа включают штаммы гриппа, которые являются адаптированными к холоду и чувствительными к температуре. Способы получения живых ослабленных вирусов хорошо известны специалистам в данной области и включают серийные разведения в куриных яйцах до получения мутантов, которые потеряли свой патогенный потенциал (Hilleman (2002) Vaccine 20:3068-3087).
В данном документе, «убитый вирус гриппа» или «инактивированный вирус гриппа» относится к убитым вирусам гриппа, полученным известными способами, наиболее распространенным из которых является выращивание вируса в оплодотворенных куриных яйцах, с очисткой его и инактивированием его, например, обработкой детергентом.
При использовании в данном документе «субъединица вируса гриппа» относится к нуклеиновой кислоте, полипептиду, белку из указанного вируса гриппа или к их смеси. В частности, субъединица вируса гриппа является белком указанного вируса гриппа выбранная из группы, состоящей из гемагглютинина, нейраминидазы, нуклеопротеинов, M1, М2, NS1, NS2 (NEP), PA, PB1, PB1-F2 и РВ2. В соответствии с изобретением предпочтительно, если субъединицей вируса гриппа являются гемагглютинин и/или нейраминидаза.
Предпочтительно, если вирус гриппа в соответствии с изобретением имеет происхождение из хозяина, который является животным, в частности млекопитающим или птицей. Более предпочтительно, если хозяин вируса гриппа выбран из группы, состоящей из человека, лошади и птицы.
В контексте изобретения «адъювант» относится к веществу, которое увеличивает или изменяет иммуногенную активность профилактически активного агента.
При использовании в данном документе, выражение «производное галактозилцерамида» обозначает галактозилцерамиды, такие как α-галактозилцерамид, а конкретнее их производные.
Предпочтительно, если производное галактозилцерамида в соответствии с изобретением является производным галактозилцерамида, которое активирует Т-клетки естественные киллеры (NKT cell). При использовании в данном документе «производное галактозилцерамида, которое активирует Т-клетки естественные киллеры», относится к производному галактозилцерамида, которое приводит к (i) секреции Т-клетками естественными киллерами Th1- и Th2-цитокинов, таких как IFN-γ, IL-4, IL-2, IL-10, IL-13, GM-CSF или TNF-α, или комбинации этих цитокинов, при контакте с CD1d-представляющими стимулирующими антигенами, или приводит к (ii) повышенной экспрессии маркеров клеточной поверхности для активированных Т-клеток, таких как CD69, или приводит к (iii) активации В-клеток, или приводит к (iv) понижающей регуляции рецепторов Т-клеток (TCR) на поверхности Т-клеток естественных киллеров. Предпочтительно, если адъювантом в соответствии с изобретением является соединение, имеющее следующую формулу (V):
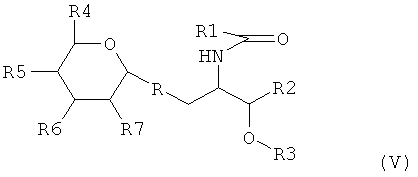
где R является атомом кислорода, или серы, или -СН2-;
R1 является насыщенной или ненасыщенной, необязательно ароматической, линейной или разветвленной углеводородной цепью, такой как алкильная, арильная, аралкильная, алкенильная, или аралкенильная цепь, содержащая от 1 до 150 атомов углерода, необязательно содержащая один или несколько гетероатомов или групп, предпочтительно выбранных из О, N, S или карбонильной группы, и необязательно замещенная одной или несколькими гидроксильными или циклопропильными группами;
R2 является насыщенной или ненасыщенной, необязательно ароматической, линейной или разветвленной углеводородной цепью, такой как алкильная, арильная, аралкильная, алкенильная или аралкенильная цепь, которая содержит от 1 до 150 атомов углерода, необязательно, содержит один или несколько гетероатомов или групп, предпочтительно выбранных из О, N, S или карбонильной группы, и которая необязательно замещена одним или несколькими гидроксильными группами или насыщенной или ненасыщенной углеводородной цепью, содержащей от 1 до 20 атомов углерода;
R3 является атомом водорода или насыщенной или ненасыщенной, необязательно ароматической, линейной или разветвленной углеводородной цепью, такой как алкильная, арильная, аралкильная, алкенильная или аралкенильная цепь, которая содержит от 1 до 120 атомов углерода;
R4, R5, R6 и R7 одинаковые или различные представляют собой (i) гидроксильную группу или (ii) насыщенную или ненасыщенную, необязательно ароматическую, линейную или разветвленную углеводородную цепь, такую как алкильная, арильная, аралкенильная, алкенильная или аралкенильная цепь, которая содержит от 1 до 100 атомов углерода, необязательно содержащая один или несколько гетероатомов или групп, предпочтительно выбранных из О, N, S или карбонильной группы; или (iii) аминную, сульфатную, фосфатную или карбоксильную группу, или (iv) цепь от 1 до 4 гексоз, необязательно замещенную одной или несколькими группами, выбранными из аминогруппы, сульфатной, фосфатной и карбоксильной групп, гексоз, связанных друг с другом атомами кислорода или серы или -СН2-.
Более предпочтительно, если адъювант в соответствии с изобретением является соединением, которое имеет следующую формулу (VI):
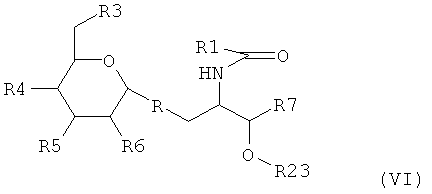
где R1 является
(i) -(CH2)XCH3 где Х является целым числом от 1 до 100; или
(ii) -(СН2)XCH=СН(СН2)YCH3 или -(СН2)XCH=СН(СН2)YCH=СН(СН2)ZCH3
где X, Y и Z являются целыми, независимо выбранными в диапазоне от 1 до 14; или
(iii) группой, представленной в формуле (А)
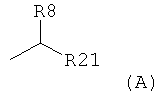
где R8 является Н или ОН и R21 является C1-С30 алкилом, где C1-С30 алкил является насыщенным или ненасыщенным или содержит одну или несколько циклопропильных групп;
R2 является линейным или разветвленным С3-С100 алкилом;
R3, R4 и R6, одинаковые или различные представляют собой
(i) -O-R22
где R22 является водородом, C1-С6 алкилом, С6-С12 аралкилом или C1-С6 ацилом; или
(ii) -NR24-CO-CH3; где R24 является водородом, C1-C20 алкилом, необязательно замещенным галогеном, гидроксилом, алкокси, амино, алкиламино, диалкиламино, сульфатом или фосфатом; или арилом, необязательно замещенным галогеном, галогеналкилом, гидроксилом, алкокси, нитро, амино, алкиламино, диалкиламино, сульфатом или фосфатом; или
(iii) -OSO3H, -SO3H, -PO4, -РО3Н, -СООН или группой, представленной формулой (В)
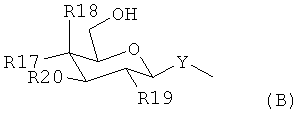
где Y является -O-,-СН2- или -S-;
R17, R18, R19 и R20 независимо выбраны из -Н, -ОН, -OSO3H, -SO3H, -PO4,-РО3Н, -NH-СО-СН3 и -СООН; или
R20 является группой, представленной формулой (В), где Y, R17, R18, R19 и R20 являются определенными выше;
Или
(iv) N(R9)R10 где
R9 является
(a) водородом или
(b) -SO2R11, где R11 является:
галогеном; гидроксилом, OR12, OR13, аминокислотой, NHR12, N(R12)2, NHR13, N(R13)2, аралалкиламино, или
С1-C12 алкил, необязательно замещенный галогеном, гидроксилом, оксо, нитро, OR12, OR13, ацилокси, амино, NHR12, N(R12)2, NHR13, N(R13)2, аралкиламино, меркапто, тиоалкокси, S(O)R12, S(O)R13, SO2R12, SO2R13, NHSO2R12, NHSO2R13, сульфатом, фосфатом, циано, карбоксилом, C(O)R12, C(O)R13, C(O)OR12, C(O)NH2, C(O)NHR12, C(O)N(R12)2, С3-С10 циклоалкилом, содержащим 0-3 R14, С3-С10 гетероциклилом, содержащим 0-3 R14, С2-С6 алкенилом, С2-С6 алкинилом, С5-С10 циклоалкенилом, С5-С10 гетероциклоалкенилом, С6-С20 арилом, содержащим 0-3 R15, или гетероарилом, содержащим 0-3 R15, или
С3-С10 циклоалкилом, С3-С10 гетероциклилом, С5-С10 циклоалкенилом, или С5-С10 гетероциклоалкенилом, необязательно замещенным одним или несколькими из галогено, гидрокси, оксо, OR12, OR13, ацилокси, нитро, амино, NHR12, N(R12)2, NHR13, N(R13)2, аралкиламино, меркапто, тиоалкокси, S(O)R12, S(O)R13, SO2R12, SO2R13, NHSO2R12, NHSO2R13, сульфата, фосфата, циано, карбоксила, C(O)R12, C(O)R13, C(O)OR12, C(O)NH2, C(O)NHR12, C(O)N(R12)2, алкила, галогеналкила, С3-С10 циклоалкила, содержащего 0-3 R14, С3-С10 гетероциклила, содержащего 0-3 R14, С2-С6 алкенила, С2-С6 алкинила, С5-С10 циклоалкенила, С5-С10 гетероциклоалкенила, С6-С20 арила, содержащего 0-3 R15, или С6-С20 гетероарила, содержащего 0-3 R15, или
С2-С6 алкенил, С2-С6 алкинил, арил или гетероарил, необязательно замещенный одним или несколькими из галогено, гидрокси, OR12, OR13, ацилокси, нитро, амино, NHR12, N(R12)2, NHR13, N(R13)2, аралкиламино, меркапто, тиоалкокси, S(O)R12, S(O)R13, SO2R12, SO2R13, NHSO2R12, NHSO2R13, сульфат, фосфат, циано, карбоксила, C(O)R12, C(O)R13, C(O)OR12, C(O)NH2, C(O)NHR12, C(O)N(R12)2, алкила, галогеналкила, С3-С10 циклоалкила, содержащего 0-3 R14, С3-С10 гетероциклила, содержащего 0-3 R14, С2-С6 алкенила, С2-С6 алкинила, С5-С10 циклоалкенила, С5-С10 гетероциклоалкенила, С6-С20 арила, содержащего 0-3 R15, или С6-С20 гетероарила, содержащего 0-3 R15, или
-L-Ar, в котором отсутствует L или спейсерная составляющая, предпочтительно алкил, необязательно прерванный одной или несколькими карбонильными группами, а Ar является ароматической группой необязательно замещенной, или
(c) -С(О)R11, где значение R11 определено выше, или
(d) -C(R11)2(R16), где значение R11 определено выше, a R16 является водородом, R11, или R16 и R10 взятые вместе образуют двойную связь между атомами углерода и азота, к которым они прикреплены, или
(e) R9 и R10 взятые вместе с N образуют гетероцикл из 3-10 атомов в кольце, необязательно замещенный R11;
R10 является водородом или C1-С6 алкилом, или R10 и R16 взятые вместе образуют двойную связь между атомами углерода и азота, к которым они прикреплены, или R10 и R9 взятые вместе образуют гетероциклил из 3-10 атомов в кольце, необязательно замещенный R11,
R12 является водородом или C1-C20 алкилом, необязательно замещенным галогеном, гидроксилом, алкокси, амино, алкиламино, диалкиламино, сульфатом или фосфатом;
R13 представляет собой арил, необязательно замещенный галогеном, галогеналкилом, гидроксилом, алкокси, нитро, амино, алкиламино, диалкиламино, сульфатом, фосфатом,
каждый R14 является независимо галогеном, галогеналкилом, гидроксилом, алкокси, оксо, амино, алкиламино, диалкиламино, сульфатом или фосфатом;
каждый R15 независимо является галогеном, галогеналкилом, гидроксилом, алкокси, оксо, амино, алкиламино, диалкиламино, сульфатом или фосфатом;
а Х равен 1-100; или
(v) моносахаридом или олигосахаридом;
R5 является
(i) -0-R22, где R22 представляет собой определенное выше, или
(ii) -NR24-CO-CH3, где R24 представляет собой определенное выше, или
(iii) -OSO3H, -SO3H; -PO4, -РО3Н или -СООН или
(iv) -OSO3 -Na+;
R7 является
(i) -CH(OR18)R2, или
(ii) -CH=CH(CH2)R2, или
(iii) линейный или разветвленный С3-С100 алкил,
где R2 представляет собой определенное выше;
R18 и R2, являются независимо друг от друга водородом, C1-С6 алкилом, C6-C12 аралкилом или C1-С6 ацилом;
R является -O-, -СН2- или -S-.
Тем не менее предпочтительно, если адъювант в соответствии с изобретением является соединением, имеющим следующую формулу (VII):
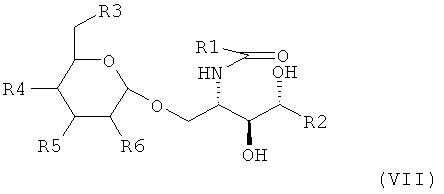
где R1 является
a) - (CH2)XCH3, где Х является целым числом, выбранным от 1 до 100; или
b) -(СН2)XCH=СН(СН2)СН3 или -(СН2)XCH=СН(СН2)YCH=СН(СН2)ZCH3, где X, Y, Z являются целыми, независимо выбранными от 1 до 14, и
R2 является линейным или разветвленным С3-С100 алкилом;
R3, R4, R5 и R6, одинаковые или разные, являются -ОН или -NH-СО-СН3 при условии, что по меньшей мере один из R3-R6 представляет собой -NH-CO-СН3.
В указанных формулах (VI) и (VII), предпочтительно, где R1 является -(СН2)XCH3, Х является целым числом, выбранным в диапазоне от 18 до 26, более предпочтительно от 22 до 24.
Если R1 является -(СН2)XCH=СН(СН2)YCH3 или -(СН2)XCH=СН(СН2)YCH=СН(СН2)ZCH3, то X, Y, Z предпочтительно являются целыми числами, независимо выбранными в диапазоне от 5 до 14.
Если R1 является -(СН2)XCH=СН(СН2)YCH3, то предпочтительным может быть, если Х+Y<23, желательно, если 15<X+Y<23.
Если R1 является -(СН2)XCH=СН(СН2)YCH=СН(СН2)ZCH3, то предпочтительным может быть, если Х+Y+Z<21, предпочтительно, если 13<X+Y+Z<21.
Также предпочтительно, если в формулах (VI) или (VII) R2 является линейным или разветвленным C11-C16 алкилом, а еще более предпочтительно, если является линейным или разветвленным С14 алкилом.
Более предпочтительно, если производное галактозилцерамида изобретения является N-ацетил α-галактопиранозиллипидом следующей формулы (I)
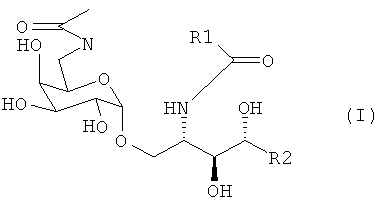
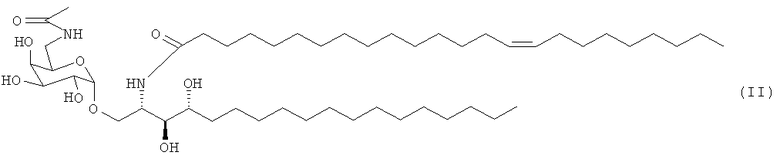
где R1 и R2 являются теми же, что определены в формуле (VII). В предпочтительном воплощении адъювант по изобретению является соединением, названным PBS-57 следующей формулы (II)
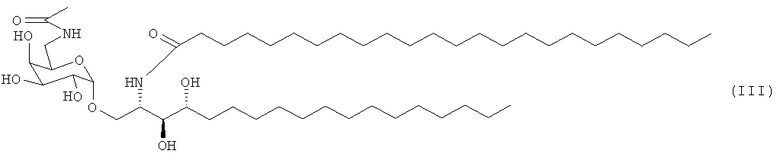
В другом предпочтительном воплощении адъювант по изобретению является соединением, названным PBS-96 следующей формулы (III)
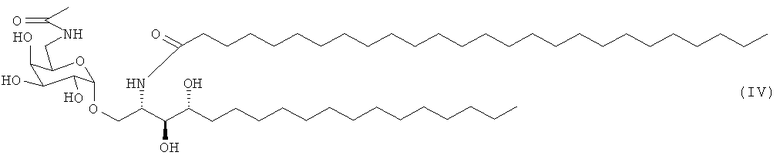
В другом предпочтительном воплощении адъювант по изобретению является соединением, которое называется PBS-14 следующей формулы (IV)
Если адъювант по изобретению соответствует формуле (I), то он может дополнительно нести ПЭГ-2000 составляющую, связанную с амидной составляющей. Такие соединения являются, например, соединениями следующей формулы (VIII):
 ;
;
или соединениями следующей формулы (IX):
 .
.
Используемый в данном документе термин «алкил» относится к углеводородной цепи, которая может быть прямой или разветвленной цепью, содержащей указанное количество атомов углерода. Для примера, С3-С100 алкил указывает на то, что группа может иметь от 3 до 100 (включительно) атомов углерода. Термины «арилалкил» или «аралкил» относятся к алкильной составляющей, в которой алкильный атом водорода заменен арильной группой. Примеры «арилалкила» или «аралкила» включают бензильную и 9-флуоренильную группы.
Термин «ацил» относится к алкилкарбонильным, циклоалкилкарбонильным, арилкарбонильным, гетероциклилкарбонильным или гетероарилкарбонильным заместителям, любой из которых может быть затем замещен заместителями.
Термин «циклоалкил» при использовании в данном документе включает насыщенные циклические, бициклические, трициклические или полициклические углеводородные группы, имеющие от 3 до 12 атомов углерода, где любой атом кольца, способный к замещению, может быть замещен заместителем. Примеры циклоалкильных составляющих включают, но не ограничиваются перечисленным, циклогексил и адамантил.
Термин «арил» относится к ароматической моноциклической, бициклической или трициклической углеводородной кольцевой системе, в которой любой атом кольца, способный к замещению, может быть замещен заместителем. Примеры ар ильных составляющих, включают, но не ограничиваются перечисленным, фенил, нафтил и антраценил.
Термин «гетероциклил» относится к неароматической 3-10 членной моноциклической, 8-12 членной бициклической или 11-14 членной трициклической системе, обладающей 1-3 гетероатомами в случае моноциклической, 1 -6 атомами в случае бициклической или 2-9 атомами в случае трициклической системы, где указанные гетероатомы выбираются из О, N или S (например, атомы углерода и 1-3, 1-6, 1-9 гетероатомов О, N или S в случае моноциклической, бициклической или трициклической системы, соответственно), где любой атом кольца, способный замещению, может быть замещен заместителем.
Термин «гетероарил» относится к ароматической 5-8 членной моноциклической, 8-12 членной бициклической, или 11-14 членной трициклической кольцевой системе, обладающей 1-3 гетероатомами в случае моноциклической, 1-6 гетероатомами в случае бициклической или 1-9 гетероатомами в случае трициклической системы, где указанные гетероатомы выбраны из О, N или S (например, углеродные атомы и 1-3, 1-6 или 1-9 гетероатомов N, О или S в случае моноциклической, бициклической или трициклической системы, соответственно), где любой атом кольца, способный к замене, может быть замещен заместителем. Термин «оксо» относится к атому кислорода, который образует карбонил при присоединении к углероду, и N-оксид при прикреплении к азоту, и сульфоксид или сульфон при присоединении к сере.
Термин «заместители» относится к группе, «замещенной» на алкильную, циклоалкильную, гетероциклильную, арильную или гетероарильную группы в любом атоме этой группы. Подходящие заместители включают, без ограничений, алкил, алкенил, алкинил, алкокси, галоген, гидроксил, циано, нитро, амино, SO3H, сульфат, фосфат, перфторалкил, перфторалкокси, метилендиокси, этилендиокси, карбоксил, оксо, тиоксо, имино (алкил, арил, аралкил), S(O)n алкил (где n=0-2), S(O)n арил (где n=0-2), S(O)n гетероарил (где n=0-2), S(O)n гетероциклил (где n=0-2), амин (моно-, ди-, алкил, циклоалкил, аралкил, гетероаралкил, и их комбинации), эфир (алкил, аралкил, гетероаралкил), амид (моно-, ди -, алкил, аралкил, гетероаралкил и их комбинации), сульфаниламид (моно-, диалкил, аралкил, гетероаралкил и их комбинации), незамещенный арил, незамещенный гетероарил, незамещенный гетероциклил и незамещенный циклоалкил.
Композиция адъюванта согласно изобретению может быть составлена в виде любой приемлемой формы, например, суспензии, микро- или макро-эмульсии, мицелл, депонирующего состава, такого как инъекция вещества замедленного всасывания, сухой смеси, в частности, подходящей для местного и трансдермального введения или в липосомах.
Композиция адъюванта также может быть составлена в виде состава с контролируемым высвобождением, например, путем комбинации с полимерами, такими как PGA (полигликолевая кислота) или путем комбинации с циклодекстринами.
Вакцинная композиция по изобретению может содержать один или несколько других адъювантов в дополнение к адъюванту на основе производного галактозилцерамида. Другими адъювантами могут быть, например, адъювант, зависимый от толл-подобного рецептора (TLR) такой как «Ampligen» (Hemispherx), «AS01», «AS02», «AS04» (GSK); «MPL (monophopshoryl lipid A) RC-529» (Dynavax), «E6020» (Eisai/Sanofi Pasteur), «TLR-technology» (Vaxinnate), CpG-олигонуклеотиды, в частности, «CpG 7909» (Pfizer), «ISS» (Dynavax), «IC31» (Intercell) и флагеллин; или адъювант независимый от TLR, такой как алюминиевые квасцы (например, гидроксид алюминия, фосфат алюминия), «AS03» (GSK), «MF59» (Novartis), «Provax» (Biogen Idee), «Montanide» (Seppic C.A., Bioven, Cancervax), «TiterMax» (CytRx), «Advax» (Vaccine Pty), «QS21» (очищенный сапонин из Quillaja saponaha; Antigenics, GSK), «Quil A» (Statens Serum Institute), ISCOMs (структурированный комплекс сапонинов и липидов) и липосомы.
Действительно, по меньшей мере один профилактически активный агент против гриппа может быть вакциной против гриппа такой как, например, авторизованная или разрабатываемая вакцина против гриппа. Если хотя бы один профилактически активный агент против гриппа является вакциной против гриппа, то он может уже содержать адъювант: например «Fluad®» содержит «MF59», «Focetria®» содержит «MF59C.1» (смесь сквалена, полисорбат 80 сорбитана триолеата), «Pandemhx®» содержит «AS03», который является адъювантом, состоящим из сквалена, DL-α-токоферола и полисорбата 80.
Предпочтительно, если вакцинная композиция по изобретению дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый носитель» относится к носителю, который может быть введен пациенту, вместе с соединением изобретения, и не нарушает его фармакологическую активность, и является нетоксичным при введении в дозах, достаточных для доставки фармацевтически эффективного количества соединения. Фармацевтически приемлемые носители и средства доставки, которые могут быть применены в вакцинных композициях данного изобретения, включают, но не ограничиваются перечисленным, ионообменники, глинозем, алюминия стеарат, лецитин, самоэмульгирующие системы доставки лекарств (self-emulsifying drug delivery systems - SEDDS), такие как d-α-токоферол полиэтиленгликоль 1000 сукцинат, поверхностно-активные вещества, используемые в фармацевтических лекарственных формах, такие как «Tween» или другие аналогичные полимерные матрицы доставки, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, двузамещенный фосфорнокислый натрий, фосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, магния тиосиликат, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натриевая соль карбоксиметилцеллюлозы, полиакрилаты, воски, полиэтилен-полиоксипропилен-блок-полимеры, полиэтиленгликоль и шерстяной жир. Циклодектстрины, такие как α-, β-, и γ-циклодекстрин, или химически модифицированные производные, такие как гидроксиалкилциклодестрины, в том числе 2- и 3-гидроксипропил-β-циклодекстрины, или другие солюбилизированные производные могут также быть с успехом использованы для улучшения доставки композиции по изобретению.
Предпочтительно, если по меньшей мере один адъювант входит в вакцинную композицию по изобретению, такой как полный или неполный адъювант Фрейнда или гидроксид алюминия.
Специалистам понятно, что для того, чтобы быть совместимыми с целевым путем введения, вакцины составляются подходящим образом. Примеры подходящих путей введения включают парентеральный, например, внутривенный, внутрикожный, подкожный, внутримышечный, внутрибрюшинный, пероральный {например, внутриротовое введение, ингаляцию, назальный и пульмонарный распылитель), внутрикожный, трансдермальный (местное введение), чресслизистый, внутриглазной и ректальный путь введения.
Вакцинная композиция по изобретению может быть доставлена в дозах в диапазоне от около 0,01 мкг/кг до около 5000 мкг/кг, в ином случае от около 0,1 до около 1000 мкг/кг, в ином случае от около 1 до около 500 мкг/кг.
Эффективные дозы также будут меняться в зависимости от пути введения, а также в зависимости от возможности совместного применения с другими агентами.
Настоящее изобретение также относится к вакцинной композиции, как это определено выше, для применения при профилактике или лечении гриппа.
«Осуществление профилактики» или «профилактика» гриппа, при использовании в данном документе, относится к ингибированию инфекции, т.е. относится к осуществлению профилактики распространения вируса гриппа, т.е. в другие области объекта или от одного объекта к другому.
«Осуществление лечения» или «лечение» гриппа, при использовании в данном документе, включает в себя ограничение тяжести заболевания, осуществление профилактики рецидивирующих инфекций, т.е. ограничение реактивации латентных или персистирующих инфекций, а также осуществление временного облегчения симптомов гриппа.
В предпочтительном воплощении, вакцинная композиция по изобретению применяется при лечении гриппа, где грипп обусловлен первым штаммом вируса гриппа, как определено выше, и по меньшей мере один профилактически активный агент против гриппа выбирается из группы, состоящей из живого неослабленного вируса гриппа, живого ослабленного вируса гриппа, убитого или инактивированного вируса гриппа, субъединицы вируса гриппа, рекомбинантного полипептида или белка, кДНК или рекомбинатного вируса гриппа, как определено выше, второго штамма вируса гриппа, как определено выше.
Настоящее изобретение также относится к способу лечения или профилактики гриппа у объекта, включающему введение указанному объекту профилактически или терапевтически эффективного количества вакцинной композиции, определенной выше.
«Профилактически или терапевтически эффективное количество» означает количество вакцинной композиции, которое оказывает профилактическое или терапевтическое воздействие на подвергаемый лечению объект. Терапевтическое воздействие может быть объективным (например, измеряемое некоторыми тестами или маркерами) или субъективным (например, объект дает показания или рассказывает о своих ощущениях в ответ на воздействие). Эффективное количество вакцинной композиции, описанной выше, может находиться в диапазоне от 0,01 мкг/кг до 5000 мкг/кг, в ином случае от около 0,1 до 1000 мкг/кг, в ином случае от около 1 до 500 мкг/кг. Эффективные дозы, кроме того, будут меняться в зависимости от пути введения, а также в зависимости от возможности совместного применения с другими агентами.
В предпочтительном варианте, вакцинная композиция может быть для применения для индукции перекрестной защиты против штаммов гриппа. Перекрестная защита достигается, когда вакцинная композиция осуществляет профилактику и/или лечение инфекции гриппа, вызванной первым штаммом вируса гриппа как определено выше, при том что по меньшей мере один профилактически активный агент против гриппа выбирается из группы, состоящей из живого неослабленного вируса гриппа, живого ослабленного вируса гриппа, убитого или инактивированного вируса гриппа, субъединицы вируса гриппа, рекомбинантного полипептида или белка, кДНК или рекомбинатного вируса гриппа, как определено выше, второго штамма вируса гриппа, как определено выше. Предпочтительно, если по меньшей мере один профилактически активный агент против гриппа происходит из штамма сезонного гриппа, а применение адъюванта по изобретению делает его также эффективным против штамма гриппа, которого нет в профилактически активном агенте против гриппа. Например, по меньшей мере один профилактически активный агент против гриппа происходит из штамма гриппа H1N1 и является эффективным для профилактики и/или лечения инфекции гриппа, вызванной штаммом гриппа H1N1, и инфекции гриппа, вызванной штаммом гриппа, который выбран из группы, состоящей из H1N2, H2N2, H3N2, H5N1 и H7N7. По меньшей мере один профилактически активный агент против гриппа может происходить из штамма гриппа H1N2 и являться эффективным при профилактике и/или лечении инфекции гриппа, вызванной штаммом гриппа H1N2, и инфекции гриппа, вызванной штаммом гриппа, который выбран из группы, состоящей из H1N1, H2N2, H3N1, H3N2, H5N1 и H7N7. По меньшей мере один профилактически активный агент против гриппа может происходить из штамма гриппа H2N2 и являться эффективным для профилактики и/или лечения инфекции гриппа, вызванной штаммом гриппа H2N2, и инфекции гриппа, вызванной штаммом гриппа, который выбран из группы, состоящей из H1N1, H1N2, H3N1, H3N2, H5N1 и H7N7. По меньшей мере один профилактически активный агент против гриппа может происходить из штамма гриппа H3N1 и являться эффективным для профилактики и/или лечения инфекции гриппа, вызванной штаммом гриппа H3N1, и инфекции гриппа, вызванной штаммом гриппа, который выбран из группы, состоящей из H1N1, H1N2, H2N2, H3N2, H5N1 и H7N7. По меньшей мере один профилактически активный агент против гриппа может происходить из штамма гриппа H3N2 и являться эффективным для профилактики и/или лечения инфекции гриппа, вызванной штаммом гриппа H3N2, и инфекции гриппа, вызванной штаммом гриппа, который выбран из группы, состоящей из H1N1, H1N2, H2N2, H3N1, H5N1 и H7N7. По меньшей мере один профилактически активный агент против гриппа может происходить из штамма гриппа H5N1 и являться эффективным для профилактики и/или лечения инфекции гриппа, вызванной штаммом гриппа H5N1, и инфекции гриппа, вызванной штаммом гриппа, который выбран из группы, состоящей из H1N1, H1N2, H2N2, H3N1, H3N2 и H7N7. По меньшей мере один профилактически активный агент против гриппа может происходить из штамма гриппа H7N7 и являться эффективным для профилактики и/или лечения инфекции гриппа, вызванной штаммом гриппа H7N7, и инфекции гриппа, вызванной штаммом гриппа, который выбран из группы, состоящей из H1N1, N2H1, H2N2, H3N1, H3N2 и H5N1. Как правило, по меньшей мере один профилактически активный агент против гриппа происходит из штамма гриппа H1N1 и H3N2, и является эффективным для профилактики и/или лечения инфекции гриппа, вызванной штаммом гриппа H1N1 или H3N2, и инфекции гриппа, вызванной штаммом гриппа H5N1 или H3N8.
Кроме того, адъювант по изобретению обладает свойством повышения эффективности по меньшей мере одного профилактически активного агента против гриппа. В частности, применение адъюванта по изобретению дает возможность уменьшить количество вводимых доз профилактически активного агента против гриппа. Например, введение одной дозы вакцины по изобретению, содержащей профилактически активный агент против гриппа с адъювантом по изобретению, является эффективным в той же мере что и введение двух доз вакцины, содержащей профилактически активный агент против гриппа без адъюванта по изобретению. Подобным образом, введение одной или двух доз вакцины по изобретению, содержащей профилактически активный агент против гриппа с адъювантом по изобретению, является эффективным в той же мере что и введение трех доз вакцины, содержащей профилактически активный агент против гриппа без адъюванта по изобретению. В частности, применение адъюванта по изобретению дает возможность уменьшить количество вводимых доз профилактически активного агента против гриппа.
Адъювант по изобретению также имеет свойство активировать цитотоксические Т-лимфоциты против эпитопа гриппа, в частности индуцировать Th1-ответ, в то время как по меньшей мере один профилактически активный агент против гриппа в отдельности только повышает продуцирование IgG.
Более того, в то время как профилактически активный агент против гриппа, как правило, применяемый в вакцинах, является менее эффективным в детях (т.е. человеческих существах в возрасте от рождения до 18 лет), и у лиц пожилого возраста (т.е. человеческих существах от 65 лет и старше), адъювант по изобретению увеличивает эффективность указанного профилактически активного агента против гриппа у детей и у лиц пожилого возраста.
Изобретение дополнительно иллюстрируется следующими фигурами и примерами.
Краткое описание чертежей
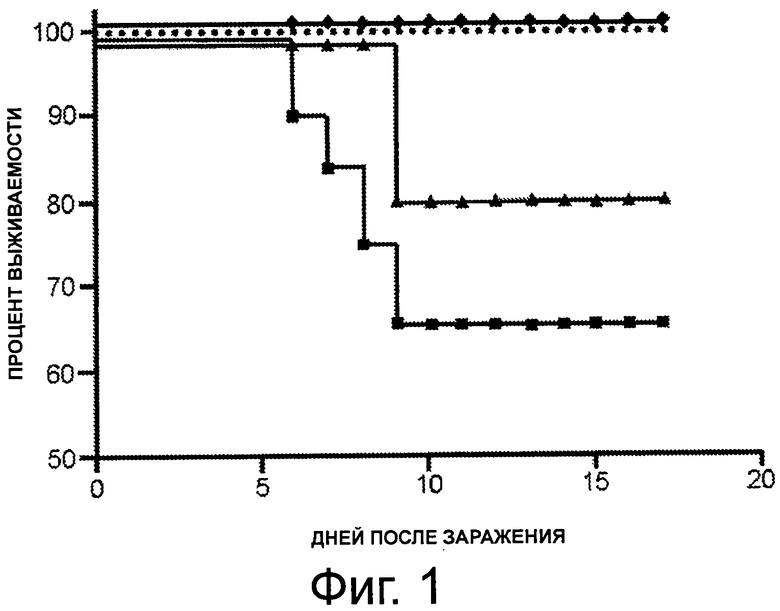
На фигуре 1 показан график, представляющий процентное выживание среди мышей, незараженных (пунктирная линия), зараженных штаммом вируса гриппа H3N8 без предварительной иммунизации (■), после иммунизации вакциной против гриппа «Protec-Flu®», отдельно (▲) и с 1 мкг PBS-57 (♦) в различные дни после введения.
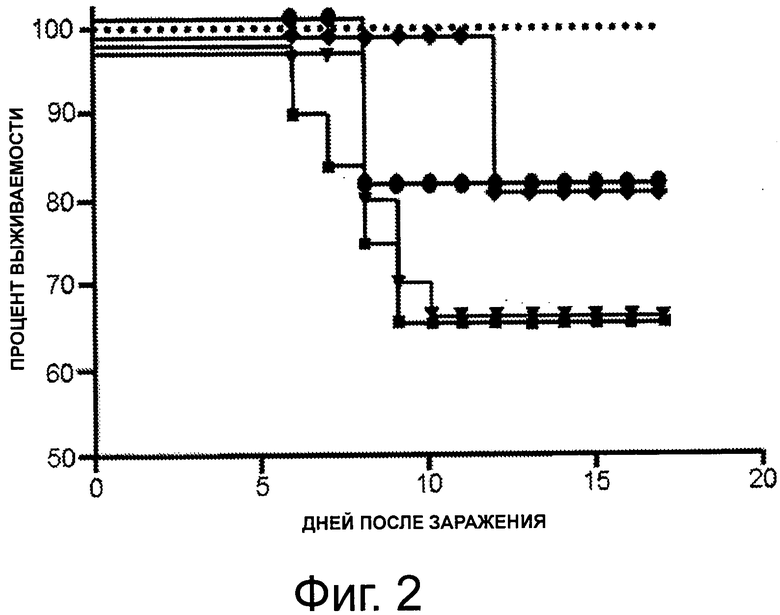
На фигуре 2 показан график, представляющий процентное выживание среди мышей, незараженных (пунктирная линия), зараженных штаммом вируса гриппа H3N8 без предварительной иммунизации (■), после иммунизации вакциной против гриппа «Agrippal®», отдельно (▼) и с 1 мкг PBS-57 (♦) или 1 мкг PBS-96 (●), в различные дни после введения.
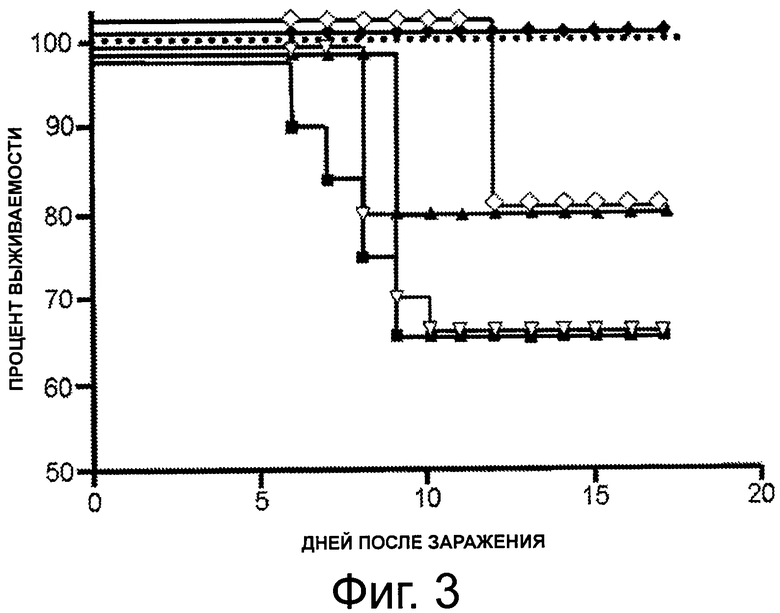
На фигуре 3 показан график, представляющий процентное выживание среди мышей, незараженных (пунктирная линия), зараженных штаммом вируса гриппа H3N8 без предварительной иммунизации (■), после иммунизации вакциной против гриппа «Protec-Flu®», отдельно (▲) и с 1 мкг PBS-14 (♦), или после иммунизации вакциной против гриппа «Agrippal®», отдельно (∇) и с 1 мкг PBS-14 (0) в различные дни после введения.
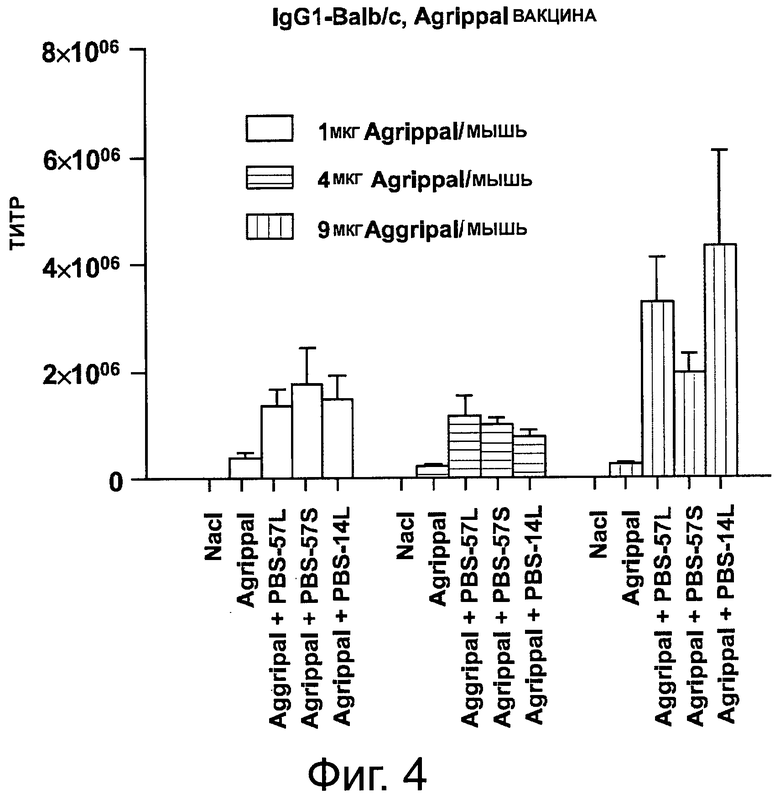
На фигуре 4 показан уровень IgG1, детектируемый в сыворотке мышей, иммунизированных дважды отдельно PBS, отдельно вакциной «Agrippal®» или вакциной «Agrippal®», объединенной с адъювантом PBS-57 или PBS-14 (/S: ПЭГилированная форма; /L: липосомная). Эксперименты были проведены с 1, 4 или 9 мкг вакцины «Aggripal®» на мышь.
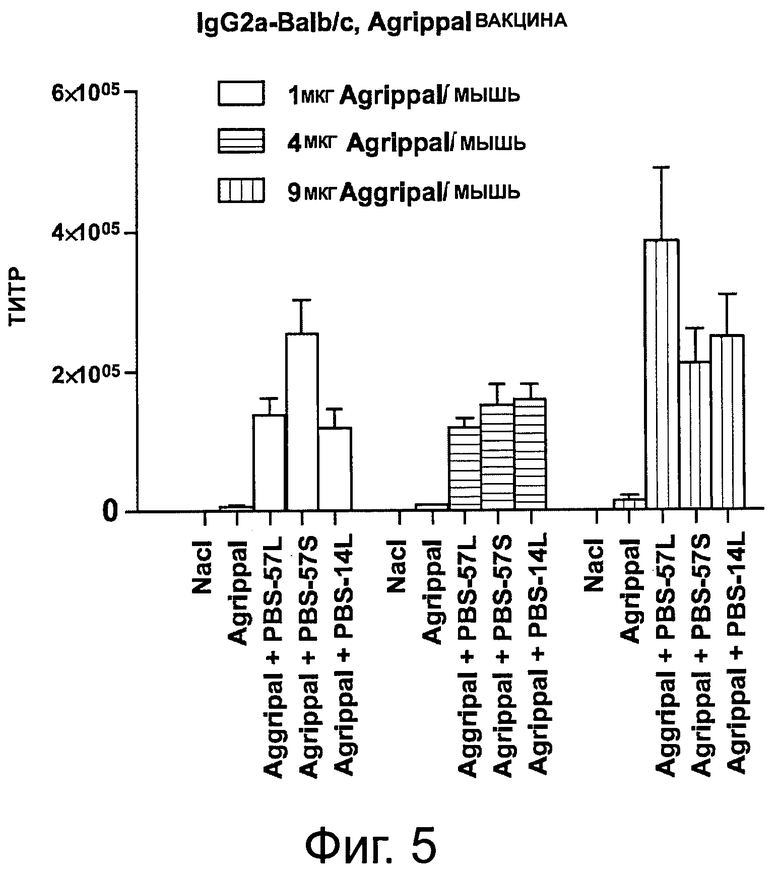
На фигуре 5 показан уровень IgG1, детектируемый в сыворотке мышей, иммунизированных дважды отдельно PBS, отдельно вакциной «Agrippal®» или вакциной «Agrippal®», объединенной с адъювантом PBS-57 или PBS-14 (/S: ПЭГилированная форма; /L: липосомная). Эксперименты были проведены с 1, 4 или 9 мкг вакцины «Aggripal®» на мышь.
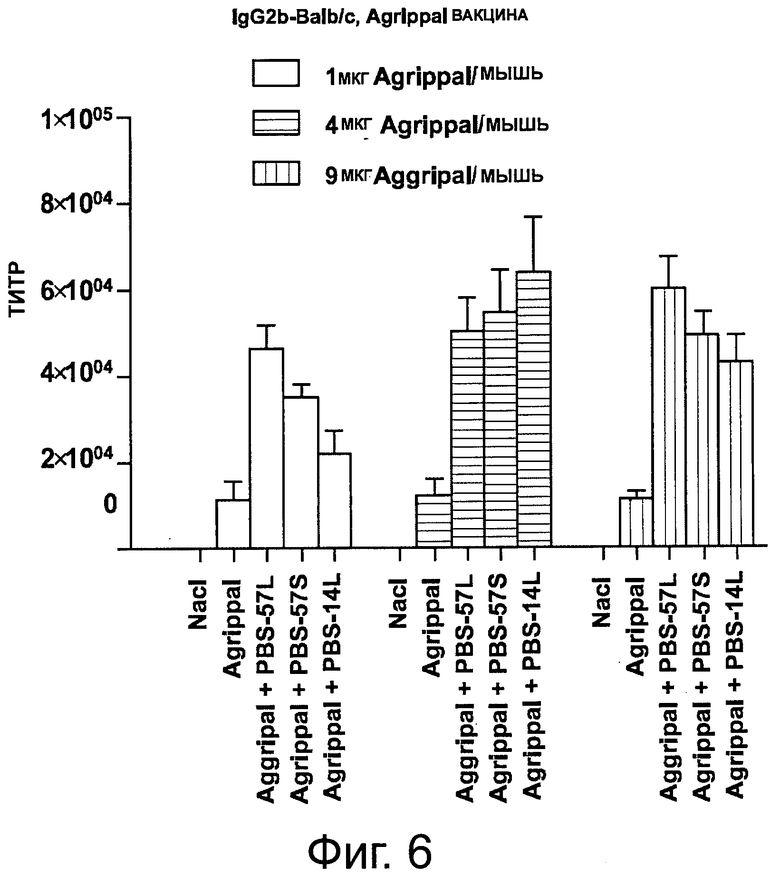
На фигуре 6 показан уровень IgG2b, детектируемый в сыворотке мышей, иммунизированных дважды отдельно PBS, отдельно вакциной «Agrippal®» или вакциной «Agrippal®», объединенной с адъювантом PBS-57 или PBS-14 (/S: ПЭГилированная форма; /L: липосомная). Эксперименты были проведены с 1, 4 или 9 мкг вакцины «Aggripal®» на мышь.
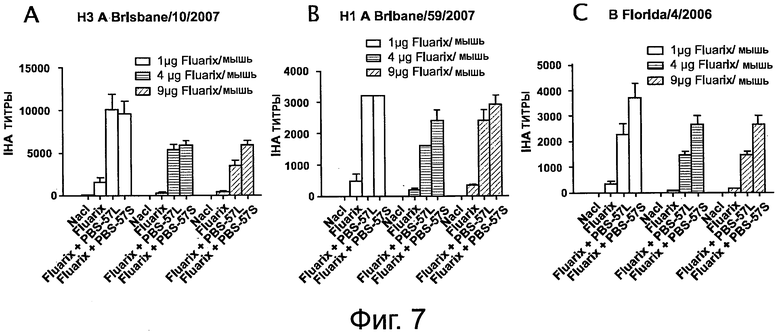
На фигуре 7 показаны титры анализа реакции непрямой гемагглютинации (IHA - indirect hemagglutination assay), измеренные в мышах, иммунизированных дважды 1 мкг вакцины «Fluarix®» отдельно или 1 мкг вакцины «Fluarix®», объединенной с PBS-57/S или PBS-57/L (/S: ПЭГилированная форма; /L: липосомная). А: Титр анализа реакции непрямой гемагглютинации для штамма A/Brisbane/10/2007; В: Титр анализа реакции непрямой гемагглютинации для штамма A/Brisbane/5 9/2007; С: Титр анализа реакции непрямой гемагглютинации для штамма B/Florida/4/2006. Эксперименты были проведены с 1, 4 или 9 мкг вакцины @Fluarix®@ на мышь.
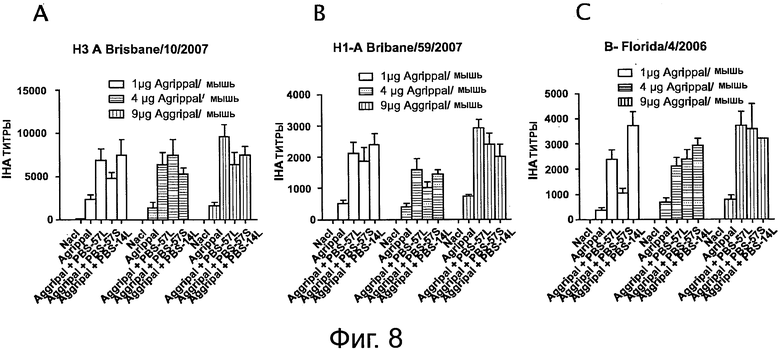
На фигуре 8 показаны титры анализа реакции непрямой гемагглютинации (IHA - indirect hemagglutination assay), измеренные в мышах, иммунизированных дважды 4 мкг или 8,9 мкг вакцины «Agrippal®», отдельно или объединенной с PBS-57/S, PBS-57/L или PBS-14/L (/S: ПЭГилированная форма; /L: липосомная). А: Титр анализа реакции непрямой гемагглютинации для штамма A/Brisbane/10/2007; В: Титр анализа реакции непрямой гемагглютинации для штамма A/Brisbane/5 9/2007; С: Титр анализа реакции непрямой гемагглютинации для штамма B/Florida/4/2006. Эксперименты были проведены с 1, 4 или 9 мкг вакцины «Aggripal®» на мышь.
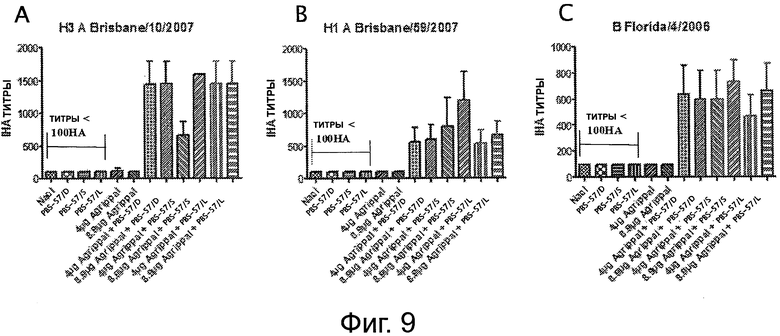
На фигуре 9 показаны титры анализа реакции непрямой гемагглютинации (IHA - indirect hemagglutination assay), измеренные в мышах, иммунизированных один раз 4 мкг или 8,9 мкг вакцины «Agrippal®», отдельно или объединенной с PBS-57/S, PBS-57/L или αα (/S: ПЭГилированная форма; /L: липосома; /D: ДМСО). А: Титр анализа реакции непрямой гемагглютинации для штамма A/Brisbane/10/2007; В: титр анализа реакции непрямой гемагглютинации для штамма A/Brisbane/59/2007; С: Титр анализа реакции непрямой гемагглютинации для штамма B/Florida/4/2006.
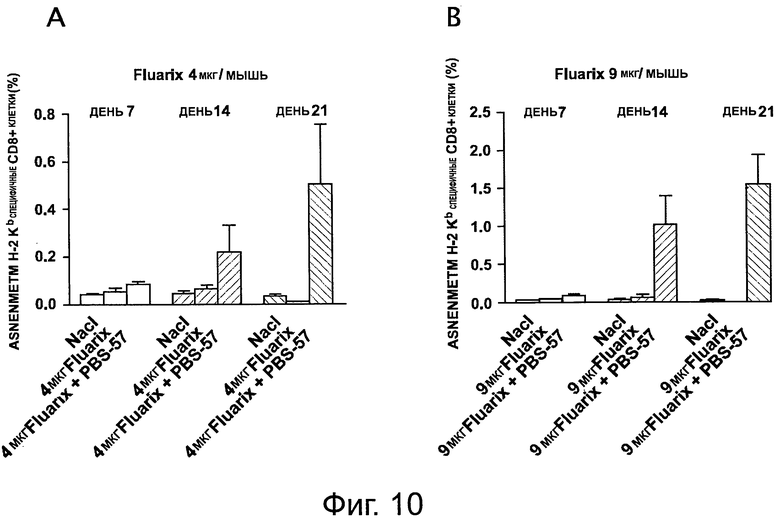
На фигуре 10 показаны пентамер-специфичные CD8+ Т-клеточные ответы в крови мышей, иммунизированных 4 мкг (левая панель) или 9 мкг (правая панель) вакцины «Fluarix®» отдельно или в комбинации с PBS-57. Т-клеточные ответы наблюдали на 7, 14 или 21 день после иммунизации.
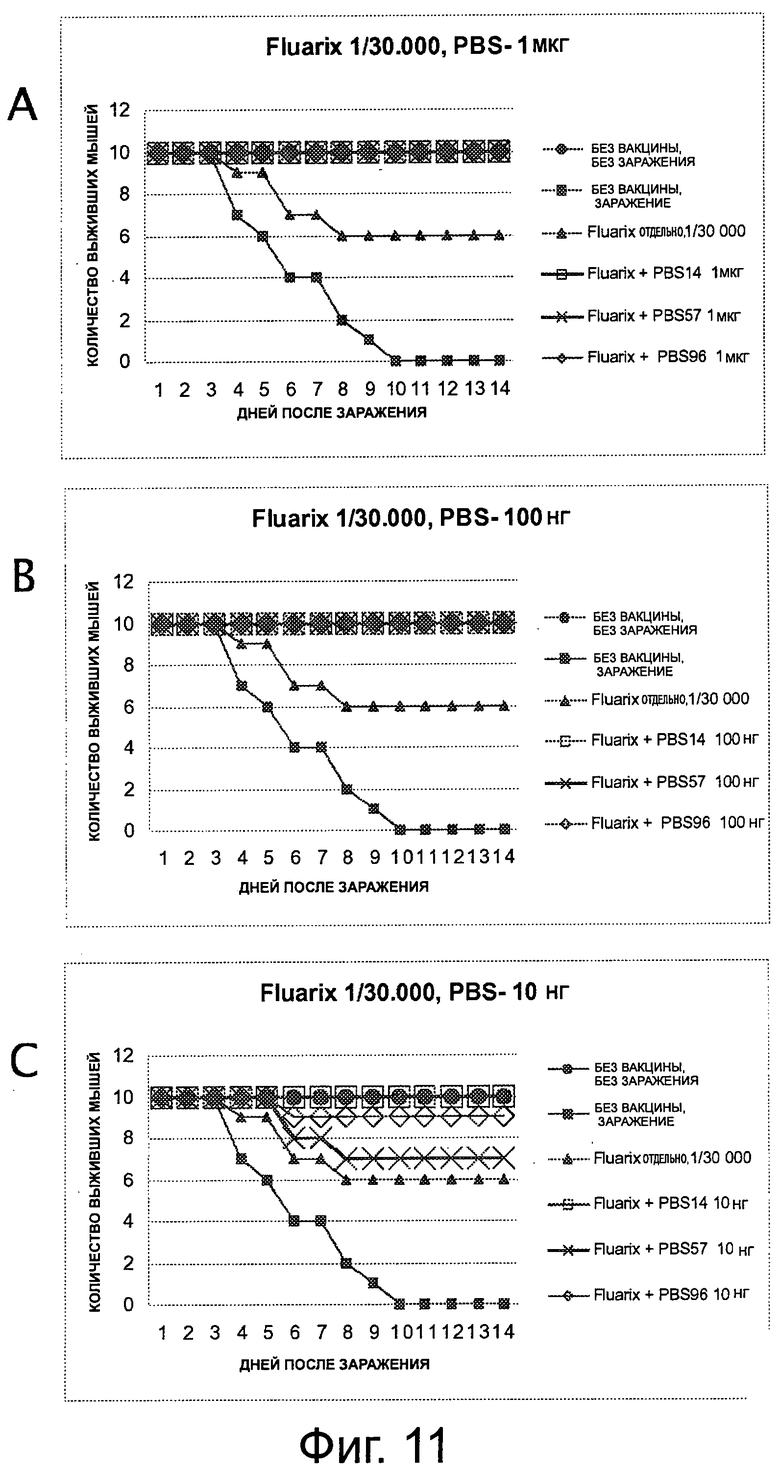
На фигуре 11 показано выживание мышей в модели заражения высокопатогенным штаммом гриппа H3N8. Мышей вакцинировали в день 0 вакциной «Fluarix®» 1/30000 и липосомами PBS-14, PBS-57 или PBS-96 1 мкг (А), 100 нг (В) или 10 нг (С), и заражали на 21 день H3N8.
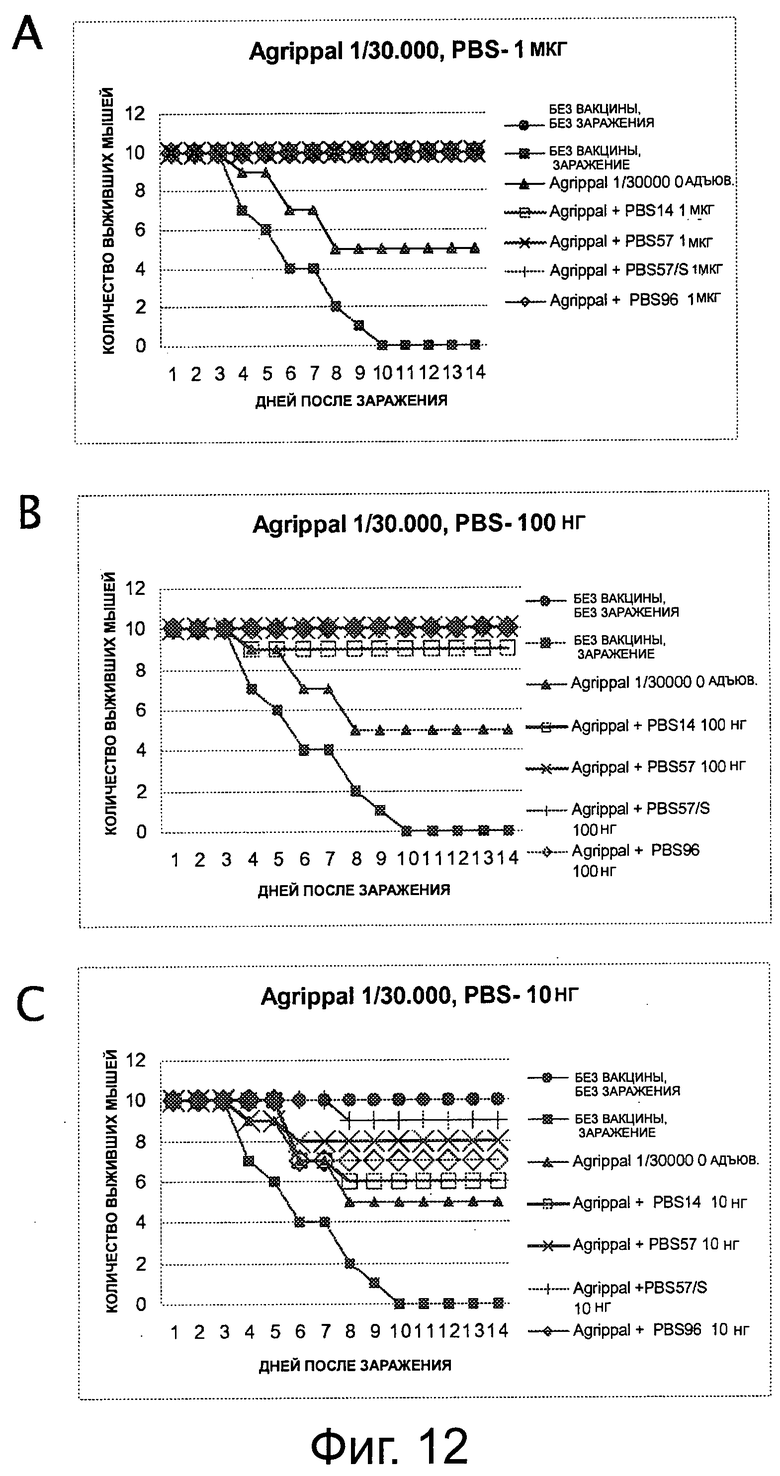
На фигуре 12 показано выживание мышей в модели заражения высокопатогенным штаммом гриппа H3N8. Мышей вакцинировали в день 0 вакциной «Agrippal®» 1/30000 и липосомами с PBS-14, PBS-57, или PBS-96, или PBS-57/S (ПЭГилированная форма) 1 мкг (А), 100 нг (В) или 10 нг (С), и заражали на 21 день H3N8.
На фигуре 13 показано увеличение количества Т-клеток естественных киллеров через 7 дней из мононуклеарных клеток периферической крови (РВМС - peripheral blood mononuclear cells) взрослых (n=15).
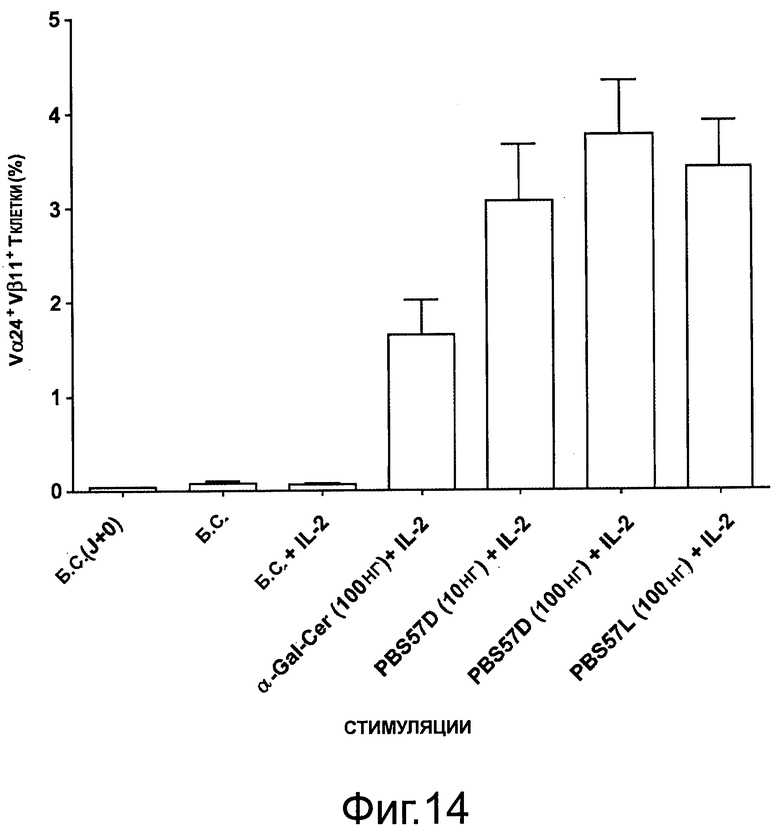
На фигуре 14 показано увеличение количества Т-клеток естественных киллеров через 7 дней из мононуклеарных клеток пуповинной крови (СВМС - cord blood mononuclear cells) (n=20).
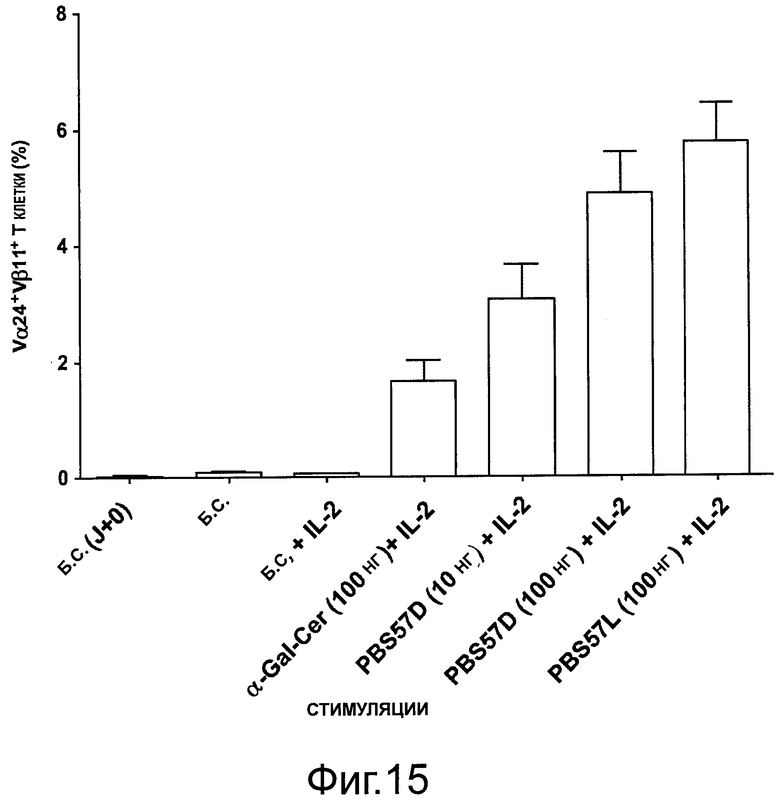
На фигуре 15 показано увеличение количества Т-клеток естественных киллеров через 7 дней из РВМС пожилых особей (n=15).
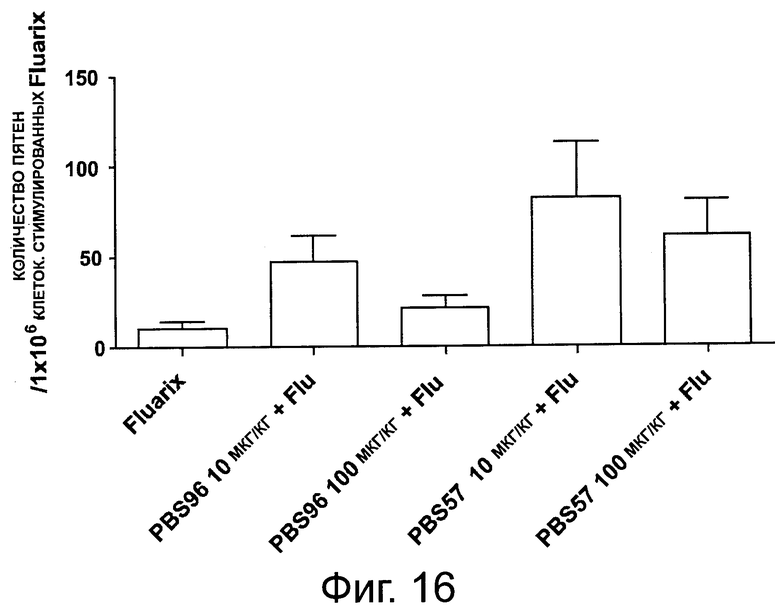
На фигуре 16 показаны результаты анализа «ELISPOT», осуществленного на РВМС 60 обезьян, иммунизированных «Fluarix®», «Fluarix®» + PBS-96 или «Fluarix®» + PBS-57.
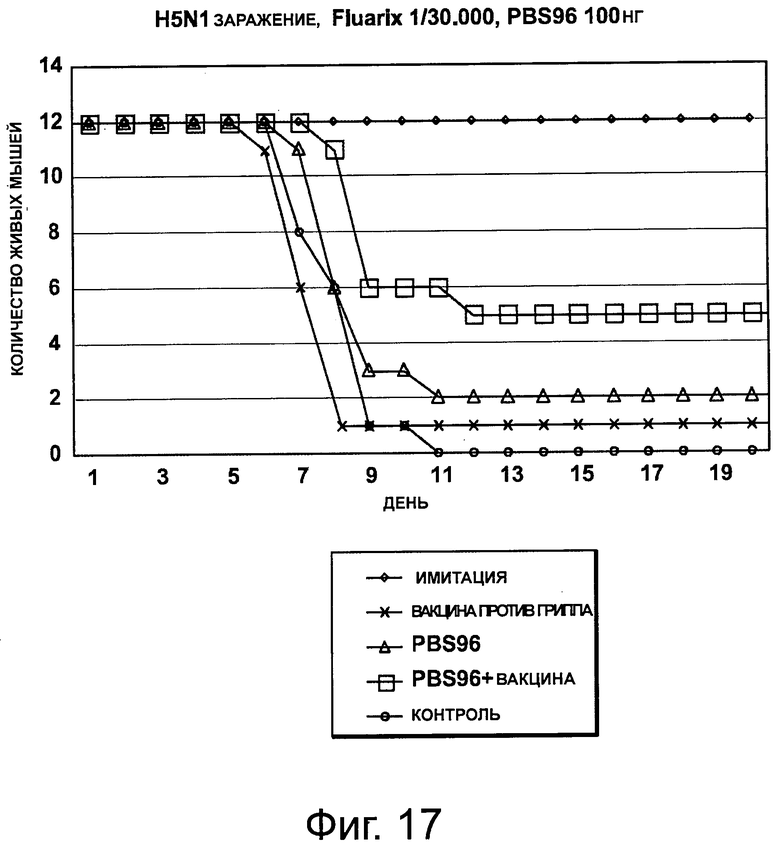
На фигуре 17 показан график, на котором показано количество живых мышей без иммунизации (контроль), после иммунизации «Fluarix®», PBS-96 или «Fluarix®» + PBS-96 и инфекции H5N1, или после иммунизации имитатором или без инфекции (имитация).
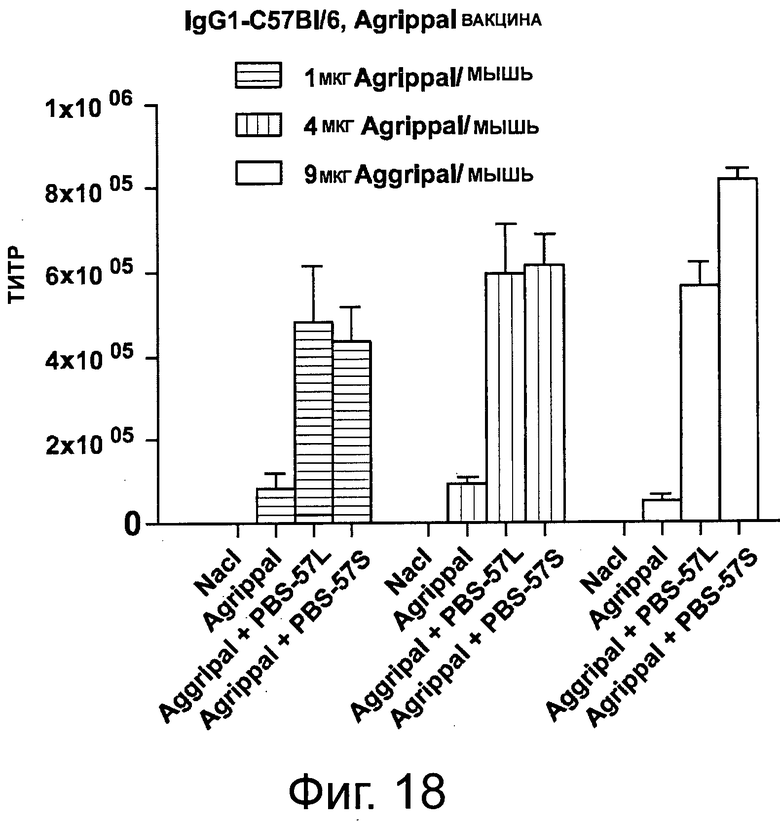
На фигуре 18 показан уровень IgG1, детектируемый в сыворотке мышей, иммунизированных один раз отдельно PBS, отдельно вакциной «Agrippal®» или вакциной «Agrippal®», объединенной с адъювантом PBS-57 (/S: ПЭГилированная форма; /L: липосомная). Эксперименты были проведены с 1, 4 или 9 мкг вакцины «Aggripal®» на мышь.
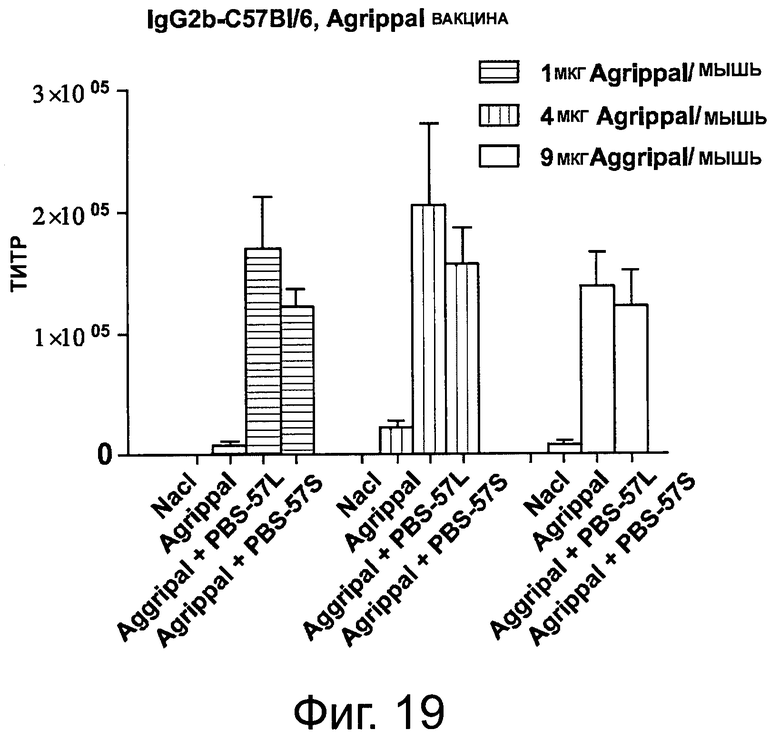
На фигуре 19 показан уровень lgG2b, детектируемый в сыворотке мышей, иммунизированных один раз отдельно PBS, отдельно вакциной «Agrippal®» или вакциной «Agrippal®», объединенной с адъювантом PBS-57 (/S: ПЭГилированная форма; /L: липосомная). Эксперименты были проведены с 1, 4 или 9 мкг вакцины «Aggripal®» на мышь.
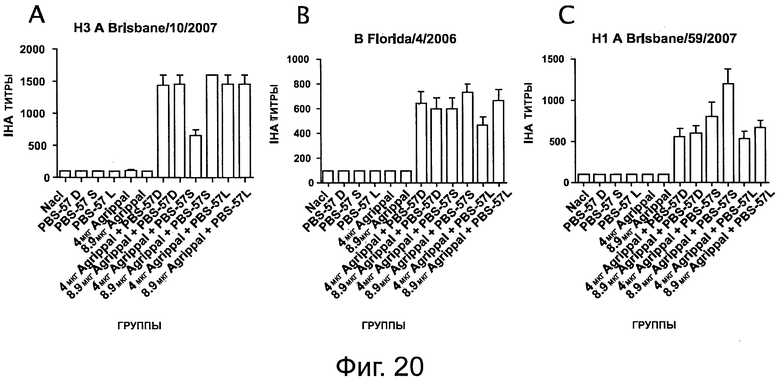
На фигуре 20 показаны титры анализа реакции непрямой гемагглютинации (IHA - indirect hemagglutination assay), измеренные в мышах, иммунизированных один раз 4 мкг или 8,9 мкг вакцины «Agrippal®», отдельно или объединенной с PBS-57/S, PBS-57/L или PBS-57/D (/S: ПЭГилированная форма; /L: липосома; /D: ДМСО). А: Титр анализа реакции непрямой гемагглютинации для штамма A/Brisbane/10/2007; В: Титр анализа реакции непрямой гемагглютинации для штамма A/Brisbane/59/2007; С: Титр анализа реакции непрямой гемагглютинации для штамма B/Florida/4/2006.
Сведения, подтверждающие возможность осуществления изобретения
Следующие примеры подчеркивают повышенную защиту и перекрестную защиту против вируса гриппа, полученные с помощью N-ацетилгликолипидов в вакцинных композициях.
Пример 1: Повышение выживаемости мышей и перекрестной защиты, индуцированных N-ацетилгликолипидными адъювантами
Материалы и методы
В экспериментах применяли две различные вакцины.
Коммерческая человеческая вакцина «Agrippal®» (приобретенная у Novartis) получена из штамма вируса гриппа A H1N1, а коммерческая лошадиная вакцина «Equi Protec-Flu®» (приобретенная у Merial) получена из штамма вируса гриппа A H3N8. 0,5 мл каждой вакцины разводили 1/10000 в 0,9% растворе NaCl до использования.
Соответственно 100 мкл липосомного препарата с PBS-57, липосомного препарата с PBS-96 или липосомного препарата с PBS-14 разводили 1/10 в 0,9% растворе NaCl. 110 мкл этого разведения добавляли к 440 мкл каждого вакцинного препарата, так чтобы соответственно 1 мкг PBS-57, PBS-96 или PBS-14 содержалось в 50 мкл каждого вакцинного препарата.
Для контроля, 100 мкл липосомного препарата разводили 1/5 в 0,9% растворе NaCl. 110 мкл этого разведения затем добавляли к 440 мкл каждого вакцинного препарата.
3-4 недельных отлученных от матери самок мышей линии С57В1/6 случайным образом распределяли в одну из 9 групп обработки. Мыши были акклиматизированы в течение не менее чем 5 дней и получали следующие обработки:
- группа 1: незараженный контроль
- группа 2: зараженные, необработанные
- группа 3: только «Agrippal®»
- группа 4: «Agrippal®» + 1 мкг PBS-57
- группа 5: «Agrippal®» + 1 мкг PBS-96
- группа 6: «Agrippal®» + 1 мкг PBS-14
- группа 7: только «Protec-Flu®»
- группа 8: «Protec-Flu®» + 1 мкг PBS-57
- группа 9: «Protec-Flu®» + 1 мкг PBS-14
При вирусных заражениях применяли лошадиный вирус H3N8 (A/Equine/2/Miami/1/63 (ATCC-VR-317), полученный из института Пастера, Париж, Франция). Животные получали внутривенно 100 мкл препарата инокулята гриппа.
Схема обработки была следующая:
- в день 0, вакцину (контроль, «Agrippal®» или «Protec-Flu®») инъецировали в мышей внутримышечно, с или без тестируемого адъюванта,
- в день 7, в мышей внутривенно инъецировали вирус H3N8,
- в день 21-24 (14-17 после заражения) проверяли здоровье и массу мышей и оценивали скорости выживаемости и заболеваемости.
Результаты
На 10 день после заражения, выжило около 60% необработанных мышей, зараженных штаммом вируса H3N8.
Среди мышей, которые были обработаны вакциной «Protec-Flu®» (полученной из штамма H3N8) на 15 день после заражения, были живы только 80% мышей, обработанных отдельно «Protec-Flu®», в то время как 100% мышей, обработанных «Protec-Flu®» + PBS-57, и мышей, обработанных «Protec-Flu®» + PBS-14, все еще были живы (фигура 1 и 3).
Авторы, таким образом, продемонстрировали, что применение N-ацетилгликолипидов значительно повышает эффективность вакцины против вируса гриппа.
Среди мышей, которые были обработаны вакциной «Agrippal®» (полученной из штамма H1N1) на 15 день после заражения, только 65% мышей, обработанных отдельно «Agrippal®», были живы, в то время как 80% мышей, обработанных «Agrippal®» + PBS-96, и мышей, обработанных «Agrippal®» + PBS-57, все еще были живы (фигура 2 и 3).
Соответственно, авторы продемонстрировали, что применение N-ацетилгликолипидов PBS-57, PBS-96 и PBS-14 не только повышает эффективность вакцины против вируса гриппа, но также позволяет защищать животных от штамма вируса гриппа, отличного от вируса, примененного при изготовлении вакцины.
Пример 2: Обнаружение IgGI, lgG2a и lgG2b в мышиной сыворотке после внутримышечного введения вакцины «Agrippal®» и N-ацетилгликолипидных адъювантов
Мышей инъецировали в день 0 и день 21 с:
- PBS,
- 1 мкг «Agrippal®» отдельно,
- 1 мкг «Agrippal®» + 1 мкг PBS-57 в ПЭГилированной форме или в липомосомном составе (PBS-57/S или PBS-57/L) или PBS-14 в липосомном составе (PBS-14/L),
- 4 мкг «Agrippal®» отдельно,
- 4 мкг «Agrippal®» + 1 мкг PBS-57/S, или PBS-57/L, или PBS-14/L,
- 8,9 мкг «Agrippal®» отдельно, или
- 8,9 мкг «Agrippal®» + 1 мкт PBS-57/, или PBS-57/L, или PBS-14/L.
Сыворотку собирали на 42 день и анализировали с помощью ИФА содержание в сыворотке IgG1, lgG2a и lgG2b. Результаты представлены на фигурах 4-6. Анализы демонстрируют, что в то время как повышенные уровни «Agrippal®», при введении отдельно, не повышают уровень продуцируемых IgG1, lgG2a и lgG2b, комбинация «Agrippal®» с PBS-57 или PBS-14, даже с наиболее малой дозой «Agrippal®», увеличивает количество детектируемых IgG1, lgG2a и lgG2b.
Примечательно, что уровни IgG1, lgG2a и lgG2b далее значимо не повышались, когда была увеличена доза «Agrippal®» в сочетании PBS-57 или PBS-14.
Пример 3: Анализ реакции непрямой гемагглютинации в сыворотке мышей, дважды иммунизированных внутримышечно «Fluarix®»
Мышей инъецировали внутримышечно в день 0 и день 21:
- NaCl,
- 1 мкг «Fluarix®» отдельно,
- 1 мкг «Fluarix®» + 1 мкг PBS-57/S, или
- 1 мкг «Fluarix®» + 1 мкг PBS-57/L.
Вакцина «Fluarix®» содержит смесь штаммов A/Brisbane/10/2007-подобный, A/Brisbane/59/2007-подобный и B/Florida/4/2006-подобный.
Сыворотку собирали на 42 день и реактивность с тремя прототипными штаммами (A/Brisbane/10/2007, A/Brisbane/59/2007 и B/Florida/4/2006) вакцины «Fluarix®» тестировали путем измерения титров IHA для каждого из этих штаммов (см. фигуру 7).
Было обнаружено, что PBS-57, будь-то в растворе или в липосомном составе, значимо повышал титры IHA, индуцируемые вакцинацией «Fluarix®» против штаммов A/Brisbane/10/2007 и B/Florida/4/2006 (Таблица 1). Титры IHA против штамма A/Brisbane/59/2007 также были повышены, но на менее значимом уровне.
Такие же результаты были получены с PBS-14 и PBS-96.
Пример 4: Анализ реакции непрямой гемагглютинации в сыворотке мышей, дважды иммунизированных «Agrippal®»
Мышам внутримышечно инъецировали в день 0 и в день 21:
- ничего (исходные мыши),
- 4 мкг «Agrippal®» отдельно,
- 8,9 мкг «Agrippal®» отдельно,
- 4 мкг «Agrippal®» + 1 мкг PBS-57 в липосомном составе (PBS-57/L) или PBS-14 в липосомном составе (PBS-14/L), или
- 8,9 мкг «Agrippal®» + 1 мкг PBS-57 в ПЭГилированной форме (PBS-57/S) или PBS-57/L или PBS-14/L.
Вакцина «Agrippal®» содержит смесь штаммов A/Brisbane/10/2007-подобный, A/Brisbane/59/2007-подобный и B/Florida/4/2006-подобный. Сыворотку собирали на 42 день и реактивность с тремя прототипными штаммами (Н3 A/Brisbane/10/2007, H1 A/Brisbane/59/2007 и B/Florida/4/2006) вакцины «Agrippal®» тестировали путем измерения титров IHA для каждого из этих штаммов (см. фигуру 8).
Было обнаружено, что PBS-57 и PBS-14 повышали титры IHA по сравнению с вакциной «Agrippal®» отдельно (Таблица 2).
Такие же результаты были получены с PBS-96.
Пример 5: Анализ реакции непрямой гемагглютинации в сыворотке мышей, иммунизированных однократно «Agrippal®»
Мышей инъецировали внутримышечно в день 0:
- NaCl,
- PBS-57/D отдельно,
- PBS-57/L отдельно,
- PBS-57/S отдельно,
- 4 мкг «Agrippal®» отдельно,
- 8,9 мкг «Agrippal®» отдельно,
- 4 мкг «Agrippal®» + 1 мкг PBS-57 в липосомном составе (PBS-57/L), или в ПЭГилированной форме (PBS-57/S), или в ДМСО (PBS-57/D), или
- 8,9 мкг «Agrippal®» + 1 мкг PBS-57/L, или PBS-57/S, или PBS-57/D.
Сыворотку собирали на 21 день и реактивность с тремя прототипными штаммами (Н3 A/Brisbane/10/2007, H1 A/Brisbane/59/2007 и B/Florida/4/2006) вакцины «Agrippal®» тестировали путем измерения титров IHA для каждого из этих штаммов (см. фигуру 9). PBS-57 и PBS-14 повысили титры IHA титры по сравнению с вакциной «Agrippal®» отдельно после одиночной инъекции.
Эти результаты говорят о том, что адъюванты позволяют избежать вакцинации по протоколу «прайм-буст» при сезонном гриппе.
Пример 6: Активация специфичных Т-клеток в мышах, иммунизированных «Fluarix®» и PBS-57
Мышей иммунизировали внутримышечно 4 мкг и 9 мкг НА-антигена в сочетании или без PBS-57 (1 мкг). H-2Kb NP(ASNENMETM; SEQ ID NO:1) - специфичные CD8+ Т-клетки наблюдали в крови в различные временные точки с помощью анализа мультимерного пептида/комплексов класса I.
Наибольшая экспансия H-2Kb NP-специфичных CD8+ Т-клеток была обнаружена в вакцинированных животных, через 14 дней после иммунизации, с PBS-57, в протестированных дозах (фигура 10). На 21 день после первичной иммунизации, встречаемость этих клеток в крови была стабильной по сравнению с 14 днем. Похожие результаты были получены с PBS-14 и PBS-96 и с «Aggripal®» вместо «Fluarix®».
Пример 7: Модель вакцинации при заражении гриппом
Исследование, подобное представленному в Примере 1, было осуществлено авторами, но в более жестких условиях и при большем количестве условий.
a) Протокол иммунизации
Мышам Balb/c инъецировали в день 0 внутримышечно «Fluarix®» 1/30000 или «Agrippal®» 1/30000, необязательно объединенные с PBS-14/L, PBS-57-L или PBS-96/L. Концентрации «Fluarix®» и «Agrippal®» выбирали для достижения 50% выживания в течение периода мониторинга, когда вакцина против гриппа вводится отдельно.
На 21 день анестезированных мышей инокулировали внутриназально штаммом H3N8 с высокой патогенностью (0% выживание в группе необработанных мышей, зараженных вирусом).
С 21 по 35 день отслеживали здоровье и массу мышей и определяли скорости выживания и заболеваемости.
b) Результаты
Результаты, полученные с «Fluarix®» и «Agrippal®», показаны соответственно на фигурах 11 и 12. Увеличением числа выживших мышей продемонстрировано, что адъюванты усиливают защиту против заражения по сравнению с вакциной «Fluarix®» или «Agrippal®», введенной отдельно.
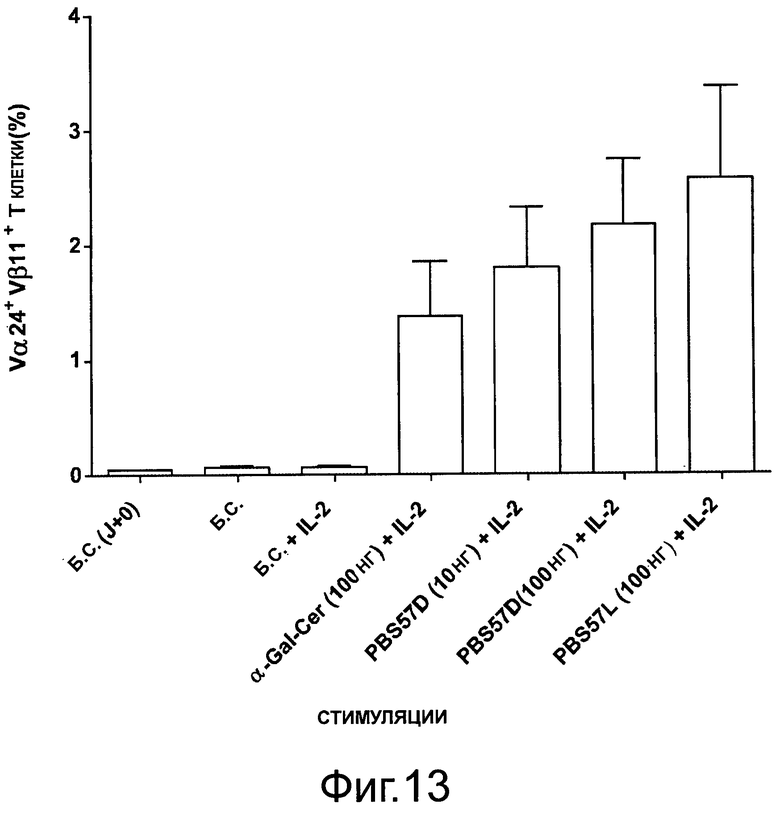
Пример 8: In vitro активация iNKT (инвариантные Т-клетки естественные киллеры)
Мононуклеарные клетки периферической крови (РВМС) взрослых и мононуклеарные клетки пуповинной крови (СВМС) были либо нестимулированными, либо культивируемыми in vitro отдельно с IL-2, либо с IL-2 объединенного с 100 нг α-GalCer, или PBS-57/D, или PBS-57/L (в концентрации 10 нг/мл или 100 нг/мл).
Через 7 дней в культуре, активацию iNKT определяли оценкой процента Vβ11/Vα24+ клеток, амплифицированных из РВМС или СВМС (фигура 13 и 14).
Авторы показали, что PBS-57 индуцирует сильную активацию iNKT по сравнению с α-GalCer как в РВМС взрослых, так и в СВМС.
Были проведены такие же эксперименты на РВМС пожилых, т.е. на РВМС из взрослых от 65 лет и старше. Получены схожие результаты (фигура 15).
Пример 9: «ELISPOT» на РВМС из обезьян, иммунизированных с адъювантами
Материалы и методы
Животные
Молодые Масаса fascicularis 3,5 кг из Маврикия были использованы с разрешения комитета по этике «Noveprim». Каждая макака несет индивидуальный идентификационный номер, вытатуированный на внутренней поверхности правого бедра.
Иммунизация
«Fluarix®» отдельно, или с 10 мкг/кг, или 100 мкг/кг PBS-57, или PBS-96 вводили дважды в одну и ту же ипсилатеральную мышечную область.
Сбор образцов
Отбор крови осуществляли на 0, 21 или 42 день после иммунизации. РВМС выделяли из крови с помощью очистки в градиенте плотности. Затем их культивировали и стимулировали с помощью гриппозных Т-клеточных эпитопов или вакцины для оценки IFN-γ ответов в анализах «ELISPOT».
Результаты
Авторы показали, что повышенное количество пятен было получено, если обезьян иммунизировали с помощью «Fluarix®» + PBS-57 или «Fluarix®» + PBS-96 по сравнению с «Fluarix®» отдельно (фигура 16).
Пример 10: Исследование заражения H5N1 в мышах с применением сезонной вакцины «Fluarix®» с PBS-96.
Это исследование продемонстрировало активность PBS-96 при индукции перекрестной защиты по отношению к штамму гриппа, отличного от штамма присутствующего в тестируемой вакцине.
Использовали мышей Balb/c, которых иммунизировали:
1) NaCl имитация (без инфекции)
2) «Fluarix®» отдельно (1/30000)
3) PBS-96 (100 нг)
4) «Fluarix®» + PBS-96
5) NaCl T+
Мышей также инъецировали интраназально вирусом H5N1 (штамм A/Vietnam 1194/04) 104 CCID50. Количество живых мышей определяли каждый день.
Авторы показали, что в то время как мыши, иммунизированные «Fluarix®», почти все умирали через 8 дней после инфекции, 41% мышей, иммунизированных «Fluarix®» + PBS-96, оставались живыми через 20 дней после инфекции (фигура 17).
Пример 11: Обнаружение IgG1 и lgG2b в мышиной сыворотки после одиночного внутримышечного введения вакцины «Agrippal®» и N-ацетилгликолипидных адъювантов
Мышей инъецировали в день 0 и день 21:
- PBS,
1 мкг «Agrippal®» отдельно,
- 1 мкг «Agrippal®» + 1 мкг PBS-57 в ПЭГилированной форме или в липосомном составе (PBS-57/S или PBS-57/L),
- 4 мкг «Agrippal®» отдельно,
- 4 мкг «Agrippal®» + 1 мкг PBS-57/S или PBS-57/L,
- 8,9 мкг «Agrippal®» отдельно, или
- 8,9 мкг «Agrippal®» + 1 мкг PBS-57/S или PBS-57/L.
Сыворотку собирали на 21 день и содержание IgG1 и lgG2b в сыворотке анализировали с помощью ИФА. Результаты представлены на фигурах 18 и 19. Анализы демонстрируют, что в то время как повышенные уровни «Agrippal®», введенного отдельно, не повышают уровень продуцируемых IgG1 и lgG2b, комбинация «Agrippal®» с PBS-57, даже при низкой дозе «Agrippal®», повышает количество обнаруживаемых IgG1 и lgG2b. Примечательно, что уровни IgG1 и lgG2b далее значимо не повышались, когда доза «Agrippal®» в сочетании с PBS-57 была увеличена.
Похожие результаты были получены с PBS-14 и PBS-96.
Пример 12: Анализ реакции непрямой гемагглютинации (IHA) в сыворотке мышей, иммунизированных однократно «Agrippal®»
Мышей инъецировали внутримышечно в день 0:
- PBS,
- 1 мкг PBS-57 в ДМСО (PBS-57/D) отдельно,
- 1 мкг PBS-57 в ПЭГилированной форме (PBS-57/S) отдельно,
- 1 мкг PBS-57 в липосомном составе (PBS-57/L) отдельно,
- 4 мкг «Agrippal®» отдельно,
- 8,9 мкг «Agrippal®» отдельно,
- 4 мкг «Agrippal®» + 1 мкг PBS-57/D, PBS-57/S или PBS-57/L, или
- 8,9 мкг «Agrippal®» + 1 мкг PBS-57/D, PBS-57/S или PBS-57/L.
Вакцина «Agrippal®» содержит смесь штаммов A/Brisbane/10/2007-подобный, A/Brisbane/59/2007-подобный и B/Florida/4/2006-подобный. Сыворотку собирали на 21 день и реактивность с тремя прототипными штаммами (Н3 A/Brisbane/10/2007, H1 A/Brisbane/59/2007 и B/Florida/4/2006) вакцины Agrippal® тестировали путем измерения титров IHA для каждого из этих штаммов (см. фигуру 20).
Было обнаружено, что PBS-57 повышает титры IHA по сравнению с вакциной «Agrippal®» отдельно.
Похожие результаты были получены с PBS-96 и PBS-14 и с «Fluarix®» вместо «Agrippal®».
| название | год | авторы | номер документа |
|---|---|---|---|
| УСИЛЕНИЕ ИММУННОГО ОТВЕТА И НАПРАВЛЕННОСТИ НА МИШЕНЬ С ПОМОЩЬЮ АНТИГЕНОВ И/ИЛИ ЛЕКАРСТВА | 2008 |
|
RU2548685C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ УСИЛЕНИЯ ИМУННОГО ОТВЕТА НА АНТИГЕНЫ | 2008 |
|
RU2537188C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ПОПУЛЯЦИЯХ СУБЪЕКТОВ С ОСЛАБЛЕННЫМ ИММУНИТЕТОМ | 2013 |
|
RU2661408C2 |
| ПОЛИВАЛЕНТНАЯ ВАКЦИНА ПРОТИВ ГРИППА НА ОСНОВЕ НАНОЧАСТИЦ | 2019 |
|
RU2805552C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИННЫХ АНТИГЕНОВ, ПОЛУЧАЕМЫЕ ВАКЦИННЫЕ АНТИГЕНЫ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2703147C2 |
| КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УВЕЛИЧЕНИЯ ИММУНОГЕННОСТИ ВАКЦИНЫ (ВАРИАНТЫ) | 2008 |
|
RU2491090C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ НЕИММУНИЗИРОВАННЫХ ИНДИВИДУУМОВ | 2013 |
|
RU2661407C2 |
| УЛУЧШЕННАЯ ВАКЦИНАЦИЯ ПРОТИВ ГРИППА | 2013 |
|
RU2599496C2 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2006 |
|
RU2520081C2 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2711807C2 |

Изобретение раскрывает применение вакцинной композиции, содержащей по меньшей мере один профилактически активный агент против гриппа и по меньшей мере один адъювант, являющийся соединением PBS-96 следующей формулы (III)

или соединением PBS-14 следующей формулы (IV)

для изготовления лекарственного средства, предназначенного для предотвращения или лечения гриппа. Применение производных галактозилцерамидов в качестве адъювантов к вакцине против гриппа увеличивает активность вакцинной композиции. 6 з.п. ф-лы, 20 ил., 3 табл., 12 пр.
1. Применение вакцинной композиции содержащей:
- по меньшей мере один профилактически активный агент против гриппа, и
- по меньшей мере один адъювант, являющийся соединением PBS-96 следующей формулы (III)
 или
или
соединением PBS-14 следующей формулы (IV)

для изготовления лекарственного средства, предназначенного для предотвращения или лечения гриппа.
2. Применение по п. 1, где по меньшей мере один профилактически активный агент против гриппа выбирается из группы, состоящей из живого неослабленного вируса гриппа, живого ослабленного вируса гриппа, убитого или инактивированного вируса гриппа, субъединицы вируса гриппа, рекомбинантного полипептида или белка из вируса гриппа, кДНК из вируса гриппа или рекомбинантного вируса гриппа.
3. Применение по п. 1, где субъединицей вируса гриппа является гемагглютинин.
4. Применение по любому из пп. 2 или 3, где хозяин вируса гриппа выбран из группы, состоящей из человека, лошади и птицы.
5. Применение по п. 2, где вирус гриппа выбирается из группы, состоящей из штаммов H1N1, H1N2, H2N2, H3N1, H3N2, H5N1 и H7N7.
6. Применение по п. 1, где по меньшей мере один профилактически активный агент против гриппа содержит адъювант.
7. Применение по п. 1, где грипп вызывается первым штаммом вируса гриппа и по меньшей мере один профилактически активный агент против гриппа, который входит в состав вакцины, выбирают из группы, состоящей из живого неослабленного вируса гриппа, живого ослабленного вируса гриппа, убитого или инактивированного вируса гриппа, субъединицы вируса гриппа, рекомбинантного полипептида или белка, кДНК или рекомбинатного вируса гриппа, второго штамма вируса гриппа.
| WO2007007946 A1, 18.01.2007 | |||
| WO2007126163 A1, 08.11.2007 | |||
| WO2008082156 A1, 10.07.2008 | |||
| H | |||
| KAMIJUKU et al., Mechanism of NKT cell activation by intranasal coadministration of -galactosylceramide, which can induce cross-protection against influenza viruses, Mucosal Immunology Vol | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2015-12-20—Публикация
2009-10-05—Подача