Изобретение относится к химико-фармацевтической промышленности, а именно к получению спрея назального, содержащего налоксона гидрохлорид, и может быть использовано в качестве антидота при тяжелой интоксикации опиоидами. Интраназальный путь введения наиболее полно отвечает задачам быстрого купирования острого отравления опиоидами, что связано с технической простотой применения спрея, хорошей биодоступностью лекарственных веществ, а также с тем, что данный путь введения перспективен для веществ, которые легко разрушаются при пероральном применении.
В настоящее время существует и сохраняется достаточно высокий уровень смертности среди потребителей инъекционных наркотиков, чему способствуют наркотические передозировки, влекущие за собой смертельную опасность. В качестве антидотов при лечении отравлений, вызванных передозировкой наркотических анальгетиков, а также при комплексном лечении наркомании применяют конкурентные антагонисты опиоидов. В медицинской практике используются различные препараты - антагонисты опиатных рецепторов, в т.ч. налоксон (1, 2, 3, 12, 13).
В настоящее время налоксон применяется в форме инъекционного раствора для внутривенного и внутримышечного введения. При инъекционном применении налоксон устраняет действие как эндогенных опиоидных пептидов, так и экзогенных опиоидных анальгетиков; при этом налоксон снимает симптомы угнетения дыхания, уменьшает седативное и эйфоризирующее действие, ослабляет гипотензивный эффект, вызванные применением героина и других опиатов. Однако инъекционный путь введения не всегда применим на догоспитальном этапе при необходимости оказания быстрой доврачебной неотложной помощи при острой интоксикации опиоидами и при оказании первой медицинской помощи, он связан с травматизацией пациента, требует соблюдения правил асептики и т.д. То есть инъекционный путь введения налоксона не всегда доступен и технически сложен. Применение налоксона внутрь малоперспективно ввиду его низкой биодоступности и неэффективности при пероральном применении (2, 4, 5, 6, 23, 24).
Налоксон - (5альфа)-4,5-эпокси-3,14-дигидрокси-17-(2-пропенил) морфинан-6-он используется в виде гидрохлорида. Налоксона гидрохлорид - белый или почти белый порошок, растворим в воде, разбавленных кислотах и концентрированных щелочах, плохо растворим в спирте, практически нерастворим в эфире и хлороформе (7, 8, 9).
Из уровня техники, помимо инъекционных, известны лекарственные формы составов, содержащих налоксона гидрохлорид и применяемых в лечении наркомании различными способами.
Известен способ лечения героиновой наркомании, согласно которому используют налоксона гидрохлорид в виде капель в каждый носовой ход, т.е. в дозе 80-120 мкг 3 раза в сутки в течение всего курса лечения (патент РФ №2344822, 2006 г.).
В международной заявке WO 82/03768, приоритет 1981 г. раскрыты составы назальных гелей и мазей, содержащие налоксон.
Известен подъязычный спрей на основе налоксона гидрохлорида (патент Китая CN 101057830, приоритет 2007 г.), содержащий налоксона гидрохлорид 0,5-10%, ускорители процесса всасывания 0,5-5%, регуляторы осмотического давления 0,1-5%, сгустители 0,5-30%, ароматизаторы 0,01-20%, консерванты 0,01-0,5%, воду 45-95% от массы.
Также известен спрей для полости носа и полости рта на основе гидрохлорида налоксона (патент Китая CN 101036651, приоритет 2006 г.). В его состав входят такие вспомогательные вещества, как: абсорбирующие вещества, регуляторы осмотического давления, загустители, антисептические средства, поверхностно-активные соединения.
Применение подъязычного спрея неудобно для медицинского персонала для быстрого купирования острого отравления опиоидами.
Задачей данного изобретения является получение отечественного препарата для расширения арсенала удобных в применении лекарственных средств на основе налоксона гидрохлорида, применяемых в качестве антидота при тяжелой интоксикации опиоидами.
Для решения поставленной задачи предлагается спрей назальный, содержащий активный компонент налоксона гидрохлорид и вспомогательные вещества, в качестве которых используют пропиленгликоль, макрогол 400, полоксамер 407, кислоты лимонной моногидрат и воду, мас.%:
Поставленная задача также решается способом получения раствора налоксона гидрохлорида, заключающимся в том, что в воду очищенную, содержащую кислоты лимонной моногидрат, последовательно загружают пропиленгликоль и макрогол 400, полоксамер 407, налоксона гидрохлорид и после каждой загрузки перемешивают под вакуумом глубиной от минус 0,05 до минус 0,07 МПа, полученный раствор расфасовывают в баллоны, вставляют насос-дозатор и герметизируют баллоны.
Концентрация налоксона гидрохлорида в препарате была выбрана на основании результатов исследований биодоступности при интраназальном введении по сравнению с внутривенным и внутримышечным введением раствора налоксона гидрохлорида для инъекций 0,4 мг/мл. Были исследованы уровни концентрации налоксона в плазме крови кроликов при различных путях введения: внутривенном и внутримышечном для препарата Налоксон для инъекций в дозе 0,6 мг/кг и интраназальном для препарата Налоксон спрей назальный в различных дозах. Профили фармакокинетических кривых налоксона при интраназальном введении аналогичны профилю фармакокинетической кривой при внутримышечном введении. Анализ полученных данных свидетельствует, что фармакокинетика налоксона характеризуется быстрым всасыванием его в кровь с последующей быстрой элиминацией. Абсолютная биодоступность налоксона при интраназальном введении кроликам составляет около 30% (при введении равных доз) и пропорционально возрастает при двукратном увеличении дозы препарата (7, 9, 25).
Исходя из результатов фармакокинетических исследований, доза налоксона гидрохлорида при интраназальном введении, эквивалентная 0,4 мг налоксона гидрохлорида при инъекционном введении, рассчитывается следующим образом:
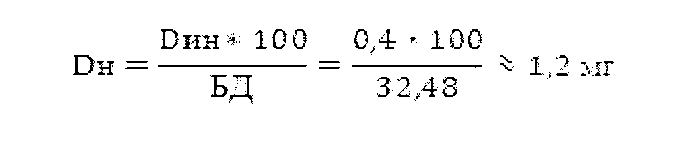
где Dн - доза налоксона гидрохлорида при интраназальном введении, мг;
Dин - доза налоксона гидрохлорида при инъекционном введении, мг;
БД - абсолютная биодоступность налоксона гидрохлорида при интраназальном введении, %.
Таким образом, доза налоксона гидрохлорида при интраназальном введении должна составлять 1,2 мг, что соответствует однократному введению 100 мкл 1,2% раствора препарата (две дозы по 50 мкл, по одной дозе в каждую ноздрю).
При выборе вспомогательных веществ необходимо было решить следующие задачи:
1) включить в состав препарата поверхностно-активное вещество (ПАВ), обеспечивающее хорошее смачивание препаратом слизистой оболочки полости носа и его растекание по слизистой оболочке, чтобы обеспечить максимальную биологическую поверхность для всасывания налоксона гидрохлорида;
2) поскольку налоксона гидрохлорид всасывается через слизистую оболочку полости носа посредством пассивной диффузии, необходимо подобрать состав осмотически активных гидрофильных веществ таким образом, чтобы обеспечить максимальную скорость и степень высвобождения налоксона гидрохлорида из препарата в опытах in vitro;
3) выбрать пределы рН раствора налоксона гидрохлорида и подобрать состав буферных веществ для оптимального рН, обеспечивающего стабильность налоксона гидрохлорида при хранении;
4) подобрать состав антимикробных консервантов, обеспечивающих надлежащую эффективность антимикробного консервирующего действия и микробиологическую чистоту препарата в соответствии с требованиями Государственной фармакопеи РФ XII изд. (10, 11).
В качестве ПАВ в состав препарата был включен полоксамер 407, представляющий собор блоксополимер оксида этилена и оксида пропилена. В концентрации около 1% полоксамер 407 выполняет свое функциональное назначение - усиливает поверхностно-активные свойства препарата, что должно способствовать хорошему растеканию препарата и хорошему смачиванию им слизистой оболочки полости носа (15).
Для быстрого и полного всасывания налоксона гидрохлорида препарат должен обладать повышенной осмотической активностью, которая является движущей силой процесса пассивной диффузии через биомембраны. Исходя из современных представлений, местное применение гиперосмолярных препаратов может быть безвредно для тканей, если эти препараты содержат как минимум два гидрофильных компонента: низкомолекулярный, который легко проникает в живые клетки и удерживает в них воду, и высокомолекулярный, который в них не проникает, но абсорбирует внеклеточную воду. Такая комбинация позволяет избежать осмотического шока клеток и местнораздражающего действия, а также способствует быстрому и полному высвобождению и всасыванию лекарственного вещества. Высвобождение является первым этапом всасывания лекарственного вещества в системный кровоток и моделирует прохождение его молекул/ионов через биомембраны. Для обеспечения быстрого и полного высвобождения налоксона гидрохлорида были исследованы комбинации водных растворов различных растворителей в разных соотношениях (28, 29).
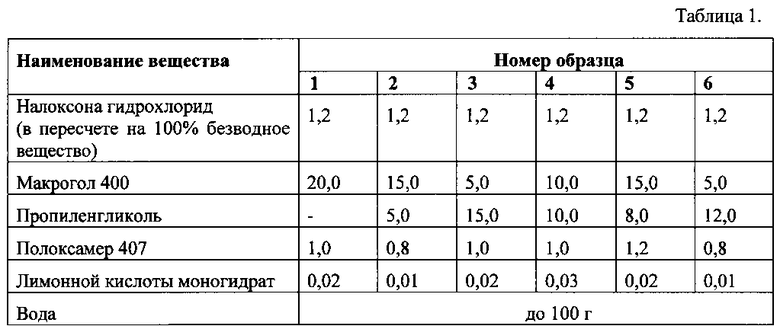
Составы модельных растворов для исследования высвобождения налоксона гидрохлорида приведены в таблице 1.
Высвобождение налоксона гидрохлорида через полупроницаемую мембрану для исследуемых растворов приведено в таблице 2.
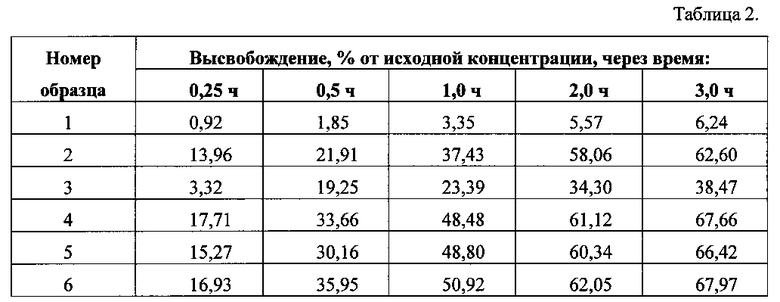
Анализ данных показал, что наименьшая скорость и степень высвобождения налоксона гидрохлорида наблюдается при содержании макрогола 400 20%. Замена 5% макрогола 400 на 5% пропиленгликоля приводит к резкому увеличению скорости высвобождения налоксона гидрохлорида - в течение 3 часов с 6,24% до 62,60%. Замена 10% макрогола 400 на 10% пропиленгликоля приводит к дальнейшему повышению скорости высвобождения налоксона гидрохлорида и степени его высвобождения до 67,66%. При увеличении содержания пропиленгликоля до 15% резко уменьшается скорость высвобождения налоксона гидрохлорида, снижается степень его высвобождения с 67,77% до 38,47% (16,17).
Выбранный нами количественный и качественный состав вспомогательных веществ для препарата Налоксон спрей назальный обеспечивает эффективное высвобождение действующего вещества (образцы 4, 5 и 6).
В растворах со щелочной средой налоксона гидрохлорид разлагается с образованием избыточного количества примесей. Во всех инъекционных препаратах установлен нижний предел рН 3,0, а верхний предел варьируется от 4,5 до 6,5 (Британская фармакопея, Фармакопея США). рН разрабатываемого препарата без буферных веществ составляет около 4,5. Поскольку в составе препарата должен присутствовать регулятор рН, установили пределы рН от 3,0 до 4,0. В назальных препаратах часто используют цитратный буфер. Заданное (целевое) значение рН достигается при концентрации лимонной кислоты моногидрата от 0,01% до 0,03% (10, 11, 26, 27).
Выбранные пределы рН и регулятор рН (кислоты лимонной моногидрат) обеспечили стабильность налоксона гидрохлорида в препарате на протяжении срока годности препарата.
Препарат Налоксон спрей назальный является нестерильным лекарственным средством и по требованиям ГФ РФ XII изд. относится к категории 2. Роль антимикробного консерванта в препарате может выполнять пропиленгликоль, обладающий антимикробным действием. Результаты изучения эффективности антимикробного консервирующего действия препарата Налоксон спрей назальный, дополнительно не содержащего консерванта, показали, что в образцах препарата (образец 4) после инокуляции наблюдается быстрая гибель бактерий и дрожжеподобных грибов (таблица 3).
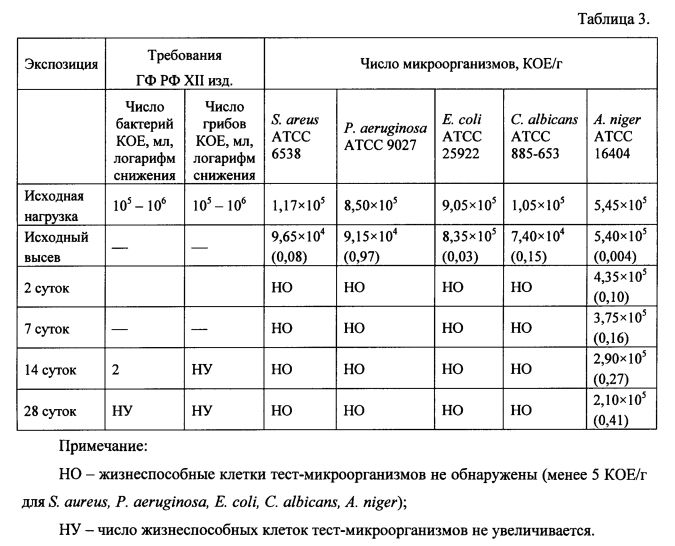
Представленные результаты показывают, что препарат Налоксон спрей назальный обладает высокой эффективностью антимикробного консервирующего действия в отношении бактерий и дрожжеподобных грибов, которая соответствует требованиям ГФ РФ XII изд. Через 14 суток после инокуляции и при последующем высеве жизнеспособные клетки этих тест-микроорганизмов не были обнаружены. В отношении плесневых грибов эффективность антимикробного консервирующего действия препарата Налоксон спрей назальный также соответствует требованиям ГФ РФ XII изд., так как через 14 и 28 суток после инокуляции не наблюдалось увеличения числа жизнеспособных клеток A. niger по сравнению с исходной нагрузкой (21, 22).
При применении препарата Налоксон спрей назальный капли аэрозольной струи должны осаждаться в полости носа, а не попадать в легкие при вдохе или удаляться из полости носа при выдохе, которые могут сопровождаться впрыскиванием препарата. В связи с этим капли в аэрозольной струе должны иметь размер частиц более 10 мкм. В данном изобретении средний размер частиц в аэрозольной струе составляет 40-50 мкм, при этом количество частиц размером менее 10 мкм составляет 1,35%, а количество частиц размером более 100 мкм составляет 12%.
Исследование биологических свойств препарата было проведено на экспериментальных животных (крысы, кролики) и включало исследование фармакокинетики, специфического действия и общетоксического действия. В качестве препарата сравнения использовали зарегистрированный в РФ препарат Налоксон раствор для инъекций 0,4 мг/мл (АО «Варшавский фармацевтический завод ПОЛЬФА», Польша) при внутривенном и внутримышечном введении (20).
Исследованы фармакокинетические свойства, включая биодоступность, препарата Налоксон спрей назальный (ОАО «Мосхимфармпрепараты» им. Н.А. Семашко) при интраназальном введении.
Фармакокинетические исследования проведены в экспериментах на кроликах при однократном введении препаратов налоксона (образцы 4, 5, 6) в дозах: 0,6 мг/кг, 1,2 мг/кг и 1,8 мг/кг - интраназально и 0,6 мг/кг - внутривенно и внутримышечно.
Установлено, что при однократном интраназальном введении кроликам препарата Налоксон спрей назальный наблюдается очень быстрое всасывание налоксона в кровь, сопоставимое с его внутримышечным введением: время достижения максимальной концентрации (Tmax) для обоих путей введения составляет 5-10 мин. Независимо от пути введения налоксон характеризуется быстрой элиминацией и коротким временем циркуляции в крови. Абсолютная биодоступность налоксона при интраназальном введении составляет около 30% (при введении в равной дозе) и пропорционально возрастает при двукратном повышении дозы.
Изучена специфическая фармакологическая активность препарата Налоксон спрей назальный (ОАО «Мосхимфармпрепараты» им. Н.А. Семашко») по устранению фармакологических (седативного, анальгетического) эффектов морфина у крыс.
Влияние препаратов на морфин-индуцированную седацию крыс оценивали методом «открытого поля» путем регистрации показателей спонтанной двигательной активности, поведенческих и вегетативных реакций. Установлено, что однократное интраназальное введение препарата Налоксон спрей назальный (образцы 4, 5, 6) и внутримышечное введение препарата Налоксон раствор для инъекций 0,4 мг/мл крысам в дозах 0,2 мг/кг, 1,0 мг/кг и 3,0 мг/кг (по налоксона гидрохлориду) дозозависимо предотвращает морфин-индуцированное угнетение ЦНС, более эффективно восстанавливая нарушенные поведенческие и вегетативные реакции. Ингибирующие эффекты налоксона в дозах 0,2 мг/кг, 1 мг/кг и 3 мг/кг на морфин-индуцированное угнетение интегральной активности ЦНС составили: при интраназальном введении, соответственно, 8,5%, 33,1% и 53,1% при внутримышечном введении - 12,8%, 46,5% и 60,3%. ЭД50 (эффективная доза средняя, вызывающая фармакологический эффект у 50% подопытных животных) препарата Налоксон спрей назальный составила 2,6 (1,3÷3,8) мг/кг, что незначительно уступает ЭД50 налоксона при внутримышечном введении - 2,0 (0,8÷3,2) мг/кг.
В тесте «tail-flick» однократное интраназальное и внутримышечное введение налоксона в тех же дозах дозозависимо уменьшает вплоть до полного устранения анальгетическое действие морфина у крыс. ЭД50 препарата Налоксон спрей назальный составила 2,2 (0,7÷3,8) мг/кг, не имея достоверных различий с ЭД50 раствора налоксона для инъекций - 2,1 (0,1÷4,0) мг/кг. Зависимости «доза-эффект» для назального спрея и инъекционного раствора налоксона характеризуются насыщением в дозах выше 1 мг/кг.
Результаты изучения специфической фармакологической активности препарата Налоксон спрей назальный свидетельствуют, что разработанный препарат обладает характерным для налоксона антагонизмом в отношении фармакологических (седативного, анальгетического) эффектов морфина. По количественной выраженности специфических фармакологических эффектов препарат Налоксон спрей назальный в целом соответствует препарату сравнения Налоксон раствор для инъекций 0,4 мг/мл (АО «Варшавский фармацевтический завод ПОЛЬФА», Польша) при несколько более высокой активности препарата для инъекций.
Также проведена оценка общетоксического действия препарата Налоксон спрей назальный (ОАО «Мосхимфармпрепараты» им. Н.А. Семашко»).
Установлено, что острое воздействие препарата Налоксон спрей назальный при назальном применении в дозах 36,6 мг/кг (самцы) и 39,4 (самки) по налоксона гидрохлориду не вызывало гибели крыс, не оказывало токсического влияния на общее состояние и поведение животных, потребление пищи и воды.
Изучение субхронической активности показало, что назальное введение в течение 7 суток препарата Налоксон спрей назальный в дозах 3,8 мг/кг и 7,7 мг/кг (самцы), а также 4,2 мг/кг и 8,4 мг/кг (самки) по налоксона гидрохлориду, что составляет приблизительно 1/10 1/5 от дозы, изученной в остром опыте, не оказывало токсического влияния на общее состояние и поведение животных, потребление пищи и воды, функциональные показатели ЦНС, электрофизиологическую активность миокарда, показатели периферической крови, не вызывало патологических сдвигов основных биохимических показателей крови и мочи, характеризующих метаболические процессы в печени и почках.
На основании результатов патоморфологического исследования установлено, что исследованный препарат не приводит к развитию визуализированных изменений внешнего вида и относительной массы внутренних органов крыс, а также не вызывает морфо-функциональных изменений. Препарат в субхроническом опыте не проявил местнораздражающего действия на слизистую оболочку носа, что подтверждено гистологически (31, 32, 33).
Таким образом, на этапе доклинических исследований установлено, что при интраназальном применении препарата Налоксон спрей назальный налоксона гидрохлорид быстро всасывается в системный кровоток и оказывает характерные для него виды специфического действия при отсутствии общетоксического и местнораздражающего действия.
При изучении стабильности препарата Налоксон спрей назальный в процессе хранения при температуре (25±1)°С содержание налоксона гидрохлорида находилось в установленных пределах, что свидетельствует как об отсутствии его разложения, так и об отсутствии сколько-нибудь значительной сорбции этого действующего вещества материалами первичной упаковки (14, 19).
Критическим фактором для стабильности налоксона гидрохлорида является воздействие света, повышенной температуры, кислорода воздуха. Поэтому необходимо избегать воздействия прямых солнечных лучей на субстанцию и раствор, температура раствора и воздуха в помещении не должна превышать 25°С, процесс вести под вакуумом (7, 15, 17, 18, 30).
Ниже приведен пример осуществления предлагаемого способа получения назального спрея на основе налоксона гидрохлорида.
В вакуумный реактор, снабженной мешалкой, загружают 38,9 литров очищенной воды и 0,01 кг лимонной кислоты моногидрата и перемешивают до полного растворения. Последовательно загружают 5 кг пропиленгликоля и 5 кг макрогола 400, создают вакуум глубиной от минус 0,05 до минус 0,07 МПа и перемешивают мешалкой 5-10 минут до однородности. Загружают 0,5 кг полоксамера 407, создают вакуум глубиной от минус 0,05 до минус 0,07 МПа, перемешивают до полного растворения. Выдерживают раствор без перемешивания 20-40 минут для дегазации. При необходимости в случае пенообразования периодически сбрасывают вакуум для разрушения пены. После дегазации контролируют рН раствора, который должен быть в пределах от 3,0 до 4,5. Загружают 0,6 кг налоксона гидрохлорида, создают вакуум глубиной от минус 0,05 до минус 0,07 МПа, перемешивают мешалкой до полного растворения налоксона гидрохлорида. Значение рН раствора должно быть от 3,0 до 4,0. При необходимости проводят корректировку добавлением кислоты лимонной моногидрата.
Полученный раствор расфасовывают по 10 г при температуре 20°С в алюминиевые баллоны с внутренним лаковым покрытием, вставляют насосы-дозаторы, герметизируют с помощью закаточной цанги. На каждый насос-дозатор, зафиксированный на баллоне, надевают насадку-распылитель с защитным колпачком, маркируют, упаковывают в пачку.
Заявленное соотношение ингредиентов является оптимальным, найдено экспериментально и обеспечивает необходимое качество, его соответствие требованиям ГФ XII и срок годности более двух лет.
ЛИТЕРАТУРА
1. Софронов А.Г. Клинико-экспериментальное обоснование новых подходов к оказанию психиатрической и токсикологической помощи при злоупотреблении опиатами: Автореф. дис. … д-ра мед. наук. - СПб, 1995. - 41 с.
2. Традиционные и перспективные сферы применения налоксона в клинической практике (обзор) / Линский И.В., Самойлова Е.С., Первомайский Э.Б., Голощапов В.В. // Український вісник психоневрології. - 2008. - Т. 16, вып.2. - С.111-116.
3. Машковский М.Д. Лекарственные средства. - 15-е изд., перераб., испр. и доп. - М.: ООО «Издательство Новая волна», 2005. - С.157.
4. Schmidt B.L., Gear R.W., Levine J.D. Response of neuropathic trigeminal pain to the combination of low-dose nalbuphine plus naloxone in humans // Neuroscience Letters. - 2003. - Vol.343, №2. - P. 144-146.
5. Intranasal administration of naloxone by paramedics // Barton E.D., Ramos J., Colwell C. et all. // Prehospital Emergency Care. - 2002. - V. 6, №1. - P. 54-58.
6. Kelly A.M., Kerr D., Dietze P. et all. Randomised trial of intranasal versus intramuscular naloxone in prehospital treatment for suspected opioid overdose // Medical Journal of Austria. - 2005. - Vol.182, №1. - P. 24-27.
7. Naloxone Hydrochloride Dihydrate. - European Pharmacopoeia 7.0. - P. 2473.
8. Naloxone Hydrochloride Dihydrate. - British Pharmacopoeia 2009. - Volume I & II. - 4 p.
9. Naloxone Hydrochloride. - USP 33 - NF 28. - P. 3953.
10. Naloxone Injection. - British Pharmacopoeia 2009. - Volume III. - 2 p.
11. Naloxone Hydrochloride Injection. - USP 33 - NF 28. - P. 3954.
12. Справочник Видаль. Лекарственные препараты в России / М.: АстраФармСервис, 2010.
13. Регистр лекарственных средств России: Энциклопедия лекарств. - internet-version. -http://www.rlsnet.ru
14. Фармацевтический сектор: основы законодательства в Европейском Союзе / Авт.-составители Н.А. Ляпунов, В.А. Усенко, А.Л. Спасокукоцкий, Е.П. Безуглая. - К.: МОРИОН, 2002. - С.7-65.
15. Poloxamers. - European Pharmacopoeia 7.0. - P. 2751.
16. Macrogols. - European Pharmacopoeia 7.0. - P. 2402.
17. Propylene glycol. - European Pharmacopoeia 7.0. - P. 2814.
18. Citric acid monohydrate. - European Pharmacopoeia 7.0. - P. 1706.
19. 2.2.29. Liquid chromatography. - European Pharmacopoeia 7.0. - P. 45.
20. Методические указания по проведению доклинических исследований фармакокинетики фармакологических веществ и лекарственных средств / Фирсов А.А., Жердев В.П., Барманова Е.Ю. и др. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под общей ред. Р.У. Хабриева. - 2-е изд., перераб. и доп. - М.: ОАО «Издательство «Медицина», 2005. - С.217-229.
21. Efficacy of antimicrobial preservation - 5.1.3. - European Pharmacopoeia 7.0. - P. 505.
22. Государственная фармакопея Российской Федерации. - М.: Издательство «Научный центр экспертизы средств медицинского применения», 2008. - 704 с.
23. Intranasal naloxone delivery is an alternative to intravenous naloxone for opioid overdoses / Merlin M., Saybolt M., Kapitanyan R. et al // Am. J. Emerg. Med. - 2010. - Vol.28, №3. -P. 296-303.
24. Intranasal Naloxone Is a Viable Alternative to Intravenous Naloxone for Prehospital Narcotic Overdose / Robertson Т., Hendey G., Stroh G., Shalit M. // Prehospital Emergency Care. - 2009.-Vol.13, №4. - P. 512-515.
25. НД 42-14673-07. - Налоксона гидрохлорид, субстанция для приготовления стерильных и нестерильных лекарственных форм // Заявитель и производитель фирма «Н.В. Органон» (Нидерланды).
26. Martindale: The Complete Drug Reference. London: Pharmaceutical Press. - Sweetman SC (Ed) - Electronic version (2007).
27. НД 42-10711-05. - Налоксон раствор для инъекций 0,4 мг/мл // Заявитель и производитель АО «Варшавский фармацевтический завод ПОЛЬФА» (Польша).
28. Работы ГНЦЛС по созданию, внедрению и стандартизации мягких лекарственных средств и суппозиториев / Н.А. Ляпунов, Е.П. Безуглая, Н.Г. Козлова и др. // Фармаком. - 1999. -№3. - С.61-64.
29. Теория и практика местного лечения гнойных ран / Безуглая Е.П., Белов С.Г., Гунько В.Г. и др. / Под ред. Б.М. Даценко. - К.: Здоров′я, 1995. - 384 с.
30. European Pharmacopoeia 7.0.- Nasal Preparations. - P. 719-721.
31. Отчет о сравнительном исследовании специфической фармакологической активности препарата Налоксон спрей дозированный назальный 1% (заявитель и производитель ОАО «Мосхимфармпрепараты» им. Н.А. Семашко) и зарегистрированного препарата Налоксон раствор для инъекций («Варшавский фармацевтический завод Польфа АО», Польша), ГП «Государственный научный центр лекарственных средств и изделий медицинского назначения», Харьков, 2011 г.
32. Отчет о сравнительном исследовании фармакокинетики препарата Налоксон спрей дозированный назальный 1% (заявитель и производитель ОАО «Мосхимфармпрепараты» им. Н.А. Семашко) и зарегистрированного препарата Налоксон раствор для инъекций («Варшавский фармацевтический завод Польфа АО», Польша), ГП «Государственный научный центр лекарственных средств и изделий медицинского назначения», Харьков, 2011 г.
33. Отчет о доклиническом исследовании общетоксического действия препарата Налоксон спрей назальный 1% (заявитель и производитель ОАО «Мосхимфармпрепараты» им. Н.А. Семашко), ГП «Государственный научный центр лекарственных средств и изделий медицинского назначения», Харьков, 2011 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция в виде назального спрея на основе кеторолака и способ ее получения | 2015 |
|
RU2611659C1 |
| Фармацевтическая композиция диоксотетрагидрокситетрагидронафталина | 2016 |
|
RU2618417C1 |
| Суппозитории нефопама для лечения острого и хронического болевого синдрома на гидрофильной эмульсионной основе и способ их получения | 2017 |
|
RU2661617C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ В ФОРМЕ РЕКТАЛЬНЫХ СУППОЗИТОРИЕВ, СОДЕРЖАЩИЕ НЕФОПАМА ГИДРОХЛОРИД (ВАРИАНТЫ), ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ОСТРОГО И ХРОНИЧЕСКОГО БОЛЕВОГО СИНДРОМА И СПОСОБЫ ПОЛУЧЕНИЯ | 2015 |
|
RU2646495C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ N,N'-БИС[2-(1Н-ИМИДАЗОЛ-4-ИЛ)ЭТИЛ]МАЛОНАМИДА | 2022 |
|
RU2818073C2 |
| ИНТРАНАЗАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ ДОЗИРОВАННЫЕ ФОРМЫ, СОДЕРЖАЩИЕ НАЛОКСОН | 2012 |
|
RU2657441C1 |
| СОСТАВЫ, УСТРОЙСТВА И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ АЛКОГОЛЬНОЙ ЗАВИСИМОСТИ | 2017 |
|
RU2767062C2 |
| ИНТРАНАЗАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ ДОЗИРОВАННЫЕ ФОРМЫ, СОДЕРЖАЩИЕ НАЛОКСОН | 2012 |
|
RU2587051C2 |
| Стабильная комбинированная фармацевтическая композиция диоксидина и анестетиков | 2017 |
|
RU2733714C2 |
| НАЗАЛЬНОЕ ПРОТИВОМИКРОБНОЕ СРЕДСТВО | 2013 |
|
RU2605313C2 |
Изобретение относится к химико-фармацевтической промышленности, а именно к получению спрея назального, содержащего налоксона гидрохлорид, и может быть использовано в качестве антидота при тяжелой интоксикации опиоидами. Фармацевтическая композиция в виде назального спрея содержит в качестве активного компонента налоксона гидрохлорид и вспомогательные вещества: пропиленгликоль, макрогол 400, полоксамер 407, кислоты лимонной моногидрат и воду при определенном соотношении ингредиентов. Также описан способ получения фармацевтической композиции. Полученный препарат обеспечивает необходимое качество, его соответствие требованиям ГФ XII изд. и срок годности более двух лет. 2 н. п. ф-лы, 3 табл.
1. Фармацевтическая композиция в виде назального спрея для быстрого купирования острого отравления опиоидами на основе налоксона гидрохлорида, отличающаяся тем, что дополнительно содержит пропиленгликоль, макрогол 400, полоксамер 407, лимонной кислоты моногидрат, воду очищенную, при этом соотношение компонентов, мас. %:
2. Способ получения фармацевтической композиции в виде назального спрея на основе налоксона гидрохлорида, охарактеризованной в п. 1, отличающийся тем, что в воду очищенную, содержащую лимонной кислоты моногидрат, последовательно загружают пропиленгликоль и макрогол 400, полоксамер 407, налоксона гидрохлорид и после каждой загрузки перемешивают под вакуумом глубиной от минус 0,05 до минус 0,07 МПа, полученный раствор расфасовывают в баллоны, вставляют насос-дозатор и герметизируют баллоны.
| WO 00/62757 A1, 26.10.2000 | |||
| Машина для разделения сыпучих материалов и размещения их в приемники | 0 |
|
SU82A1 |
| СПОСОБ ЛЕЧЕНИЯ ГЕРОИНОВОЙ НАРКОМАНИИ | 2006 |
|
RU2344822C2 |
| CN 101057830 A, 24.10.2007 | |||
| CN 101036651 A, 19.09.2007. | |||
Авторы
Даты
2015-12-27—Публикация
2013-10-21—Подача