Техническая область изобретения
Настоящее изобретение относится к области химического синтеза. Более конкретно, настоящее изобретение относится к новым способам, полезным для синтеза радиоизотопного индикатора для позитронной эмиссионной томографии (PET), и к новым промежуточным соединениям, пригодным для использования в указанном способе.
Описание предшествующего уровня техники
В WO 94/27591 раскрыт ряд замещенных гуанидинов и их применение для лечения и/или профилактики неврологических состояний, таких как эпилепсия, нейродегенеративные состояния и/или гибель нервных клеток в результате, например, гипоксии, гипогликемии, ишемии головного или спинного мозга, травмы головного или спинного мозга. В WO 94/27591 показано, что замещенные гуанидины могут быть получены посредством взаимодействия амина, как правило, соли амина, такой как гидрохлорид амина, с предварительно образованным алкил- или арилцианамидом (Safer ef а/1948 J Org Chem; 13: 924) или соответствующим N-замещенным алкил- или арилцианамидом.
В WO 2004/007440 и WO 2006/136846 раскрыты меченные радиоактивной меткой гуанидиновые производные и их применение для визуализации рецепторов центральной нервной системы (CNS), и предложен синтез этих меченных радиоактивным изотопом производных из соединений - предшественников. Например, в WO 2006/136846 предложено соединение формулы (A):

или его соль или сольват, где:
R1 представляет собой водород или С1-4 алкил;
каждый из R2 и R4 независимо выбран из С1-4алкила, [11С]-С1-4-алкила и [18F]-C1-4фторалкила при условии, что по меньшей мере один из R2 и R4 представляет собой [11С]-C1-4алкил или [18Р]-C1-4фторалкил; и
R3 представляет собой галогено.
В WO 2006/136846 раскрыто, что вышеописанное соединение формулы (A) синтезируют посредством взаимодействия подходящего источника C или F с соединением - предшественником формулы (B):
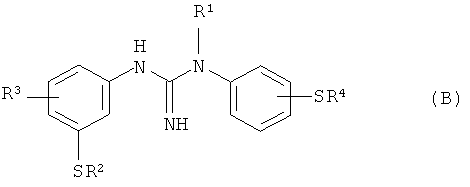
где один из R2 или R4 представляет собой водород, а другой представляет собой водород, C1-4алкил или защитную группу для тиола, такую как бензил; R1 представляет собой водород или C1-4алкил, и R3 представляет собой галогено.
В WO 2006/136846 также раскрыто, что способ получения вышеописанного соединения - предшественника формулы (B), где R2 представляет собой водород, базируется на способе, описанном Hu et а/ (J. Med. Chem. 1997; 40(26): 4281-9), при котором соединение формулы (C):

или его соль или сольват, где R3 представляет собой галогено, и R1 представляет собой защитную группу для тиола;
подвергают взаимодействию с соединением формулы (D):

где R1 представляет собой водород или C1-4алкил, и R4 является таким, как определено для целевого соединения формулы (B).
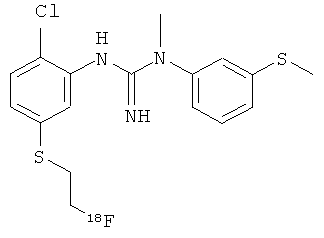
Об этом способе недавно сообщалось Robins et al (2010 Bioorg Med Chem Lett; 20: 1749-51) как об успешном пути получения следующих 18F-меченных S-фторалкильных диарилгуанидинов:
 ,
, 
Однако, вышеописанный способ получения меченного радиоактивным изотопом предшественника формулы (B) имеет ряд проблем. Прежде всего, на стадии восстановления, используемой в получении соединения формулы (C) из сульфонилхлоридного исходного материала, используют хлорид олова. Остаточное олово осложняет обработку гелеобразующими гидроксидами олова при pH более 2. Кроме того, после этой стадии восстановления в тиол вводят бензильную защитную группу, и эту группу необходимо удалить в конце синтеза, что требует применения AlCl3 с последующей флэш-хроматографией. Поэтому существует потребность в способе получения этого меченного радиоактивным изотопом предшественника, который бы позволил преодолеть эти проблемы.
Кроме того, и это не раскрыто в уровне техники, авторы настоящего изобретения обнаружили, что соединение формулы (B), где R2 представляет собой водород, разлагается с образованием дисульфидной примеси, даже в условиях, которые считаются "инертными" условиями, что осложняет последующее введение радиоактивного изотопа с получением соответствующего соединения формулы (A). Поэтому также существует потребность в альтернативных стратегиях для получения указанного соединения формулы (A), которые не обладали бы этим недостатком.
Краткое изложение сущности изобретения
В настоящем изобретении предложен способ получения меченного радиоактивным изотопом гуанидинового производного. Также предложены новое промежуточное соединение и способ его синтеза. В способе по изобретению использование стадии, включающей окисление иодом, обеспечивает преимущество, заключающееся в том, что иод окисляет все олово, присутствующее как результат стадии восстановления исходного хлорида олова. В способе по изобретению не требуются защитные группы, что устраняет необходимость в стадии снятия защиты. Кроме того, способ по изобретению преодолевает проблему, отмеченную авторами настоящего изобретения и заключающуюся в образовании дисульфидной примеси. Таким образом, способ по изобретению преодолевает ряд проблем, ассоциированных с известными способами получения меченных радиоактивным изотопом гуанидиновых производных.
Подробное описание изобретения
В одном аспекте настоящего изобретения предлагается способ получения радиоизотопного индикатора для позитронной эмиссионной томографии (PET) формулы I:
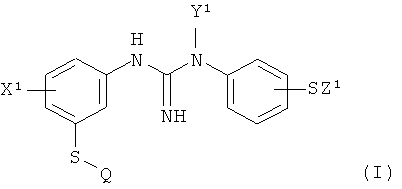 ,
,
X1 представляет собой группу X, выбранную из C1-4алкила или галогено;
Y1 представляет собой группу Y, выбранную из водорода или C1-4алкила;
Z1 представляет собой группу Z, которая представляет собой C1-4алкил; и
Q представляет собой [11C] C1-4алкил- или [18F]- C1-4фторалкил-;
где указанный способ включает:
(a) предоставление соединения формулы II:
 ,
,
X11 и X12 являются одинаковыми и обе представляют собой группу X, как определено для X1;
Y11 и Y12 являются одинаковыми и обе представляют собой группу Y, как определено для Y1; и
Z11 и Z12 являются одинаковыми и обе представляют собой группу Z, как определено для Z1;
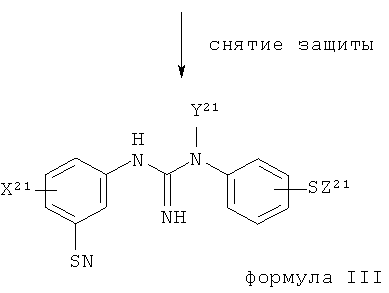
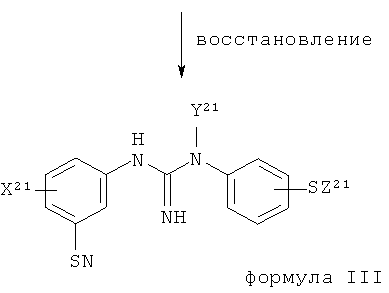
(b) восстановление указанного соединения формулы II с помощью восстанавливающего агента с получением соединения формулы III:
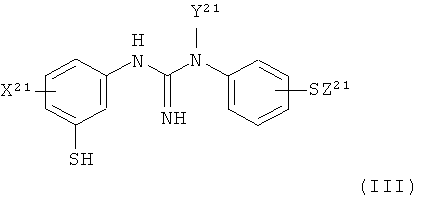 ,
,
X21 представляет собой группу X, как определено для X1;
Y21 представляет собой группу Y, как определено для Y1; и
Z21 представляет собой группу Z, как определено для Z1;
(c) взаимодействие соединения формулы III, полученного на стадии (б), с [11С]C1-4алкил-LG1 или [18F]-C1-4фторалкил-LG2, где LG1 и LG2 независимо представляют собой галогено или группу -O-SO2-R1, где R1 представляет собой возможно замещенный C6-10арил, возможно замещенный C1-4алкил или C1-4фторалкил, где указанное взаимодействие осуществляют в подходящем растворителе.
Термин "радиоизотопный индикатор для PET" относится к химическому соединению, которое содержит радионуклид, который претерпевает позитронный эмиссионный распад (также известный как позитивный бета распад) и поэтому может быть обнаружен с помощью PET визуализации. Наиболее часто используемыми радионуклидами для PET являются 18F и 11C.
Термин "алкил", один или в комбинации, означает алкильный радикал с прямой или разветвленной цепью, имеющий общую формулу CnH2n+1. Примеры таких радикалов включают метил, этил и изопропил.
Термин "галоген" или "галогено" в контексте настоящего изобретения означает заместитель, выбранный из фтора, хлора, брома или иода.
Термин "восстанавливающий агент" (также часто именуемый как "восстановитель" или "редуцирующий агент") представляет собой элемент в реакции окисления-восстановления, который отдает электрон другим веществам.
Для настоящего изобретения неограничивающие примеры подходящих восстанавливающих агентов для использования на стадии (б) в вышеописанном способе включают: борогидрид натрия (NaBH4), цинк в соляной кислоте, цинк в уксусной кислоте, магний в соляной кислоте, гидротеллурид натрия (NaTeH) в этаноле, алюмогидрид лития (LiAIH4) в тетрагидрофуране, индий в хлориде аммония и гидрид натрия (NaH). Предпочтительным восстанавливающим агентом является NaBH4. В предпочтительном воплощении восстанавливающий агент связан с твердой фазой, такой как смола в форме частиц, таких как шарики.
Термин "фторалкил" относится к алкилу, как он определен выше, который содержит атом фтора вместо водорода. Более конкретно, термин фторалкил, как он используется в описании, означает [18F]фторалкил, и содержащийся в нем атом фтора как таковой является радиоактивным 18F. Предпочтительно указанный фторалкил содержит единственный атом 18F, наиболее предпочтительно в концевой части химической группы.
Термин "уходящая группа" относится к группировке, пригодной для нуклеофильного замещения, и представляет собой молекулярный фрагмент, который «уходит» с парой электронов при гетеролитическом расщеплении связи.
Термин "арил" относится к одновалентному ароматическому углеводороду, имеющему одно кольцо (например фенил) или конденсированные кольца (например нафталин).
Химическая группа, определенная здесь как "возможно замещенная", либо может не иметь заместителей, либо может включать один или более заместителей. Предпочтительные заместители включают C1-4алкил, C1-4галогеноалкил, галогено и нитро, где алкил является таким, как определено выше, "галогеноалкил" представляет собой алкил, как определено выше, который содержит галогено, галогено является таким, как определено выше, и "нитро" относится к группе -NO2. Соответственно, примеры предпочтительных групп -O-SO2-R для настоящего изобретения включают: толуолсульфоновую кислоту, нитробензолсульфоновую кислоту, бензолсульфоновую кислоту, трифторметансульфоновую кислоту, фторсульфоновую кислоту и перфторалкилсульфоновую кислоту.
Стадия взаимодействия (c) с [11C] C1-4алкил-LG1 или [18F]-C1-4фторалкил-LG2 представляет собой реакцию алкилирования, проводимую в подходящем растворителе. "Подходящий растворитель" - это такой растворитель, в котором взаимодействующие вещества хорошо растворимы и легко вступают во взаимодействие с получением целевого продукта. Такой подходящий растворитель может быть выбран из группы, содержащей N,N-диметилформамид (DMF), ацетон, дихлорметан (DCM), хлороформ, диметилсульфоксид (DMS), метанол, этанол, пропанол, изопропанол, тетрагидрофуран (THF) или ацетонитрил.
В предпочтительном воплощении способа по изобретению указанное соединение формулы II представляет собой соединение формулы IIа:
 ,
,
где:
X11 и X12 являются одинаковыми и обе представляют собой группу X, как приемлемо и предпочтительно здесь определено;
Y11 и Y12 являются одинаковыми и обе представляют собой группу Y, как приемлемо и предпочтительно здесь определено; и
Z11 и Z12 являются одинаковыми и обе представляют собой группу Z, как приемлемо и предпочтительно здесь определено.
Предпочтительно для способа по изобретению указанная группа X представляет собой галогено, наиболее предпочтительно хлоро.
Предпочтительно для способа по изобретению указанная группа Y представляет собой C1-4алкил, наиболее предпочтительно метил.
Предпочтительно для способа по изобретению указанная группа Z представляет собой метил.
В предпочтительном воплощении для промежуточных соединений и продукта способа по изобретению указанная группа X представляет собой хлоро, указанная группа Y представляет собой метил, и указанная группа Z представляет собой метил.
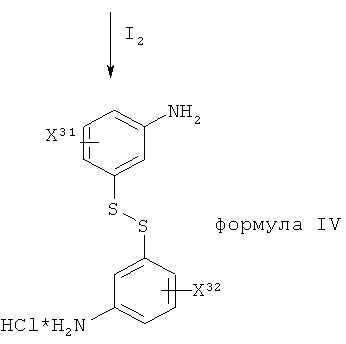
В общем, соединение формулы II, обеспечиваемое на стадии (a) способа по изобретению, получают посредством взаимодействия соединения формулы IV:
 ,
,
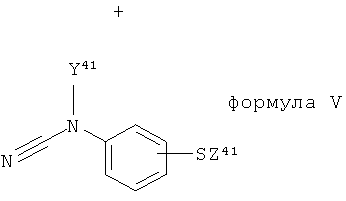
где X31 и X32 являются одинаковыми и обе представляют собой группу X, как приемлемо и предпочтительно здесь определено; с соединением формулы V:
 ,
,
где Y41 представляет собой группу Y, как приемлемо и предпочтительно здесь определено, и Z41 представляет собой группу Z, как приемлемо и предпочтительно здесь определено.
Сочетание соединение формулы IV с цианамидом формулы V может быть осуществлено без растворителя или в присутствии высококипящего апротонного растворителя, такого как хлорбензол, толуол или ксилол. Это взаимодействие может быть осуществлено при повышенной температуре, например от 50 до 200°C, предпочтительно при приблизительно 130°C.
Определенное выше соединение формулы IV получают посредством йодного окисления соединения формулы VI:
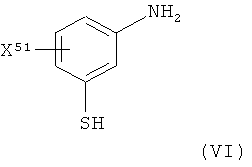 ,
,
где X51 представляет собой группу X, как приемлемо и предпочтительно здесь определено.
Таблица 1 ниже иллюстрирует известный способ получения соединения формулы III параллельно со способами, используемыми в настоящем изобретении:


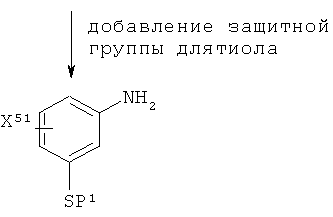



В Таблице 1:
каждая группа X, Y и Z является такой, как приемлемо и предпочтительно здесь определено для X, Y и Z, соответственно; и
P1 представляет собой защитную группу для тиола.
Защитные группы хорошо известны специалистам в данной области. Для тиольных групп подходящими защитными группами являются бензил, тритил и 4-метоксибензил. Применение других защитных групп описано в 'Protective Groups in Organic Synthesis', Theorodora W. Greene and Peter G. M.Wuts, (Fourth Edition, John Wiley & Sons, 2007).
Цианамидное исходное соединение формулы V в Таблице 1 может быть получено в соответствии со способом, описанным Ни et al (1997 J Med Chem; 40: 4281-4289), посредством взаимодействия цианогенбромида с первичным амином в диэтиловом эфире или посредством алкилирования арилцианамида гидридом натрия или алкилгалогенидом в тетрагидрофуране.
Нитробензолсульфонилхлоридное исходное соединение, проиллюстрированное в Таблице 1, имеется в продаже. Первая стадия в Таблице 1, общая для способа из уровня техники и способа по настоящему изобретению, представляет собой восстановление нитробензолсульфонилхлоридного исходного соединения с образованием аминобензолтиольного промежуточного соединения формулы VI. На второй стадии способа из уровня техники в тиольную группу вводят защитную группу, которую удаляют в конце синтеза, используя известные способы. Например, когда защитная группа для тиола представляет собой бензол, для ее удаления могут быть использованы AlCl3 и флэш-хроматография. Дисульфид формулы IV в способе по изобретению получают посредством йодного окисления аминобензолтиольного промежуточного соединения формулы VI. Эта стадия имеет преимущество, заключающееся в том, что иод дополнительно окисляет все присутствующее олово. В способе из уровня техники остаточное олово осложняет процесс, поскольку гидроксиды олова образуют гели при рН выше 2. Способ, используемый в настоящем изобретении, преодолевает эту проблему, поскольку окисленное олово не образует гели, что облегчает экстрактивную обработку продукта. Способ обладает дополнительным преимуществом, поскольку использование дисульфидного промежуточного соединения формулы IV устраняет необходимость в защите тиольной группы. Способ, используемый в настоящем изобретении для получения соединения формулы III, проиллюстрированный в Таблице 1 выше, может рассматриваться как еще один аспект настоящего изобретения.
Авторы настоящего изобретения установили, что соединение формулы III разлагается с образованием дисульфида формулы II даже в условиях, которые считаются "инертными" условиями. Эта проблема эффективно преодолевается посредством хранения дисульфидного соединения формулы II вместо соединения формулы III. В способе получения радиоизотопного индикатора для PET формулы I соединение формулы II восстанавливают на стадии (b) немедленно перед стадией введения радиоактивного изотопа (c). Для облегчения этого процесса стадии (b) и (c) предпочтительно осуществляют с одном и том же сосуде. Дополнительное преимущество этой стратегии по сравнению со способами из уровня техники заключается в том, что нет необходимости включать основание в реакционную стадию (с). Включение основания в реакцию требуется в способах, раскрытых в уровне техники, для того, чтобы депротонировать тиол с тем, чтобы обеспечить возможность взаимодействия с меченным радиоактивным изотопом синтоном. Подходящие основания, предлагаемые в способах из уровня техники, включают неорганические основания, такие как карбонат калия, гидроксид калия или гидрид натрия, либо органические основания, такие как триалкиламин, например триэтиламин, диизопропилэтиламин или диметиламинопиридин. В способе по настоящему изобретению, как только соединение формулы II восстанавливают на стадии (b), его на стадии (c) можно непосредственно подвергнуть взаимодействию с [11C]C1-4алкил-LG1 или [18F]-C1-4фторалкил-LG2 с получением радиоизотопного индикатора для PET формулы I без какой-либо необходимости в добавлении основания.
[11C]C1-4алкил-LG1, предоставляемый на стадии (c) способа, может быть получен, используя способы, хорошо известные в области радиохимии. Например, [11С]метилиодид может быть получен восстановлением диоксида [11С]углерода с помощью алюмогидрида лития с последующим взаимодействием с йодистоводородной кислотой. Диоксид [11С]углерода обычно получают реакцией 14N(ρ,α)11C из газообразного азота, содержащего следовые количества кислорода. [11С]метилтрифлат может быть получен из [11С]метилиодида или посредством взаимодействия в газовой фазе [11C]метилбромида, полученного из [11С]метана. Все эти способы описаны более подробно в "Aspects on Synthesis of 11C-Labelled Compounds", Chapter 3 of Handbook of Radiopharmaceuticals (2003 Welch & Redvanly eds. pp 141-194). Предпочтительный [11С]C1-4алкил-LG1 выбран из [11С]метил-LG1 или [11С]этил-LG1, и LG1 предпочтительно представляет собой иодо.
[18F]-C1-4фторалкил-LG2, предоставляемый на стадии (c) способа, может быть получен посредством введения радиоактивного изотопа в алкилдигалогениды или сульфонаты с помощью [18F]фторида. [18F]фторид обычно получают в виде водного раствора, который представляет собой продукт облучения мишени [18O]-вода. Широко распространенной практикой является осуществление разных стадий для того, чтобы превратить [18F]фторид в реакционноспособный нуклеофильный реагент, такой, чтобы он был пригоден для использования в нуклеофильных реакциях введения радиоактивного изотопа. Эти стадии включают элиминирование воды из [18F]-фторид-иона и обеспечение подходящего противоиона (Handbook of Radiopharmaceuticals 2003 Welch & Redvanly eds. ch. 6 pp 195-227). Подходящие противоионы включают крупные, но мягкие ионы металлов, таких как рубидий или цезий, комплексы калия с криптандом, такие как Kryptofix™, или соли тетраалкиламмония. Предпочтительный [18F]-C1-4фторалкил-LG2 представляет собой [18F]-фторэтил-LG2, где LG2 предпочтительно представляет собой сульфонат, наиболее предпочтительно тозилат.
Предпочтительно для способа получения указанного радиоизотопного индикатора для PET формулы I стадию восстановления (b) и стадию взаимодействия (с) осуществляют непосредственно друг за другом. Термин "непосредственно друг за другом" следует понимать как означающий, что стадию взаимодействия (c) осуществляют как можно быстрее, то есть непосредственно сразу после стадии восстановления (b), так что между этими двумя стадиями имеется настолько малый промежуток времени, насколько эти практически возможно, и в идеале между этими двумя стадиями отсутствует промежуток времени. Таким образом сводится к минимуму любое разложение соединения формулы III с образованием дисульфида, тем самым облегчая протекание реакции введения радиоактивного изотопа.
В особенно предпочтительном воплощении вышеописанный способ получения указанного радиоизотопного индикатора для PET формулы I является автоматизированным. Радиоизотопные индикаторы для PET и [18F]-радиоизотопные индикаторы в частности, в настоящее время часто удобным образом получают в автоматизированном аппарате для радиосинтеза. Имеется несколько коммерчески доступных моделей такого аппарата, включая Tracerlab™ и Fastlab™ (оба от GE Healthcare Ltd). Такой аппарат обычно содержит "кассету", часто для одноразового использования, в которой осуществляют радиохимические взаимодействия, которая пригнана к аппарату для того, чтобы осуществлять радиосинтез. Такая кассета обычно включает разводку для подачи жидкости, реакционный сосуд и порты для получения флаконов реагентов, а также какие-либо картриджи для твердофазной экстракции, используемые на стадиях очистки после радиохимического синтеза. В другом аспекте настоящего изобретения предложена кассета для осуществления этих стадий, содержащая:
(1) сосуд, содержащий соединение формулы II, как оно подходящим и предпочтительным образом здесь определено;
(2) средство для осуществления взаимодействия указанного соединения формулы II с восстанавливающим агентом с образованием соединения формулы III, где указанный восстанавливающий агент и указанное соединение формулы III являются такими, как приемлемо и предпочтительно здесь определено; и
(3) средство для осуществления взаимодействия указанного соединения формулы III с [11С]C1-4алкил-LG1 или [18F]-C1-4фторалкил-LG2 с получением радиоизотопного индикатора для PET формулы I, где LG1, LG2 и указанный радиоизотопный индикатор для PET формулы I являются такими, как приемлемо и предпочтительно здесь определено.
Средство для осуществления взаимодействия указанного соединения формулы II с указанным восстанавливающим агентом может представлять собой сосуд, содержащий восстанавливающий агент в форме раствора (или в растворенной форме), где восстанавливающий агент пропускают через сосуд, содержащий соединение формулы II, для того, чтобы осуществить восстановление. Альтернативно, указанное средство может представлять собой сосуд, в котором восстанавливающий агент связан с твердой фазой, где соединение формулы II пропускают через сосуд, содержащий восстанавливающий агент, для того, чтобы осуществить восстановление. Приемлемые и предпочтительные воплощения, описанные здесь для стадии восстановления (b) и стадии взаимодействия (c), также применимы для способа, осуществляемого в кассете по изобретению.
Кассета может дополнительно содержать:
(1) ионообменный картридж для удаления избытка [11С] C1-4алкил-LG1 или [18F]-C1-4фторалкил-LG2.
Радиоизотопный индикатор для PET формулы I, полученный способом по изобретению, полезен в качестве радиоактивного лиганда для NMDA (N-метил-O-аспартат) рецептора и может быть использован в способе in vivo диагностики или визуализации, таком как позитронная эмиссионная томография (PET). Радиоизотопный индикатор для PET формулы I, как определено выше, или его соль или сольват могут быть использованы для визуализации NMDA рецепторов у здоровых волонтеров-людей. Поскольку радиоизотопный индикатор для PET формулы I полезен для in vivo визуализации NMDA рецепторов, он может также найти применение в диагностике NMDA-опосредованных расстройств, таких как удар, травма головного или спинного мозга, эпилепсия, болезнь Альцгеймера или болезнь Гентингтона.
Краткое описание Примеров
Пример 1 описывает синтез соединения 1,1′-(5,5-дисульфандиилбис(2-хлор-5,1-фенилен))бис(3-метил-3-(3-(метилтио)фенил)гуанидин).
Пример 2 описывает синтез соединения 3-(2-хлор-5-меркаптофенил)-1-метил-1-(3-(метилтио)фенил)гуанидин.
Пример 3 описывает синтез соединения 3-(2-хлор-5-((2-фторэтил)тио)фенил)-1-метил-1-(3-(метилтио)фенил)гуанидин.
Пример 4 описывает синтез соединения 3-(2-хлор-5-((2-фторэтил)тио)фенил)-1-метил-1-(3-(метилтио)фенил)гуанидин с использованием связанного со смолой борогидрида.
Перечень сокращений, используемых в Примерах
DCM дихлорметан
EtOH этанол
г грамм(ы)
HPLC высокоэффективная жидкостная хроматография
M молярный
MeOH метанол
мг миллиграмм(ы)
мл миллилитр(ы)
ммоль миллимоль(и)
ЯМР ядерный магнитный резонанс
KT комнатная температура
Примеры
Если не указано иного, промежуточные соединения и реагенты, используемые в примерах, были получены от Sigma Aldrich, Merck или Alfa Aesar.
Пример 1: Синтез соединения 1.1′-(5.5′-дисульФандиилбис(2-хлор-5.1-фенилен))бис(3-метил-3-(3-(метилтио)фенил)гуанидин)
1(a) Синтез хлорида 5.5′-дисульФандиил6ис(2-хлор6ензоламиния)

Хлорид олова (II) (33,32 г, 175,74 ммоль) растворяли в 30%-ной соляной кислоте (99,7 мл) и добавляли 4-хлор-3-нитробензол-1-сульфонилхлорид (5,00 г, 19,553 ммоль), после чего погружали колбу в предварительно нагретую до 125°C масляную баню. Через 3 часа весь твердый материал растворялся, и реакционную смесь оставляли охлаждаться до КТ, что вызывало спонтанную кристаллизацию.
Кристаллы (загрязненные оловом) отфильтровывали, растворяли в воде (250 мл) и порциями добавляли раствор иода (50 мг/мл) до тех пор, пока HPLC анализ не подтверждал, что весь 2-хлор-5-меркаптобензоламиний хлорид превращался в 5,5'-дисульфандиилбис(2-хлорбензоламиний) хлорид. Раствор фильтровали и к фильтрату добавляли воду (400 мл), после чего перемешивали и нейтрализовали с помощью раствора NaOH (приблизительно 1 мл, 10%). Раствор экстрагировали диэтиловым эфиром (4×150 мл), сушили с помощью сульфата магния (безводный) и фильтровали. К эфирному раствору добавляли HCl (сухой, 1 М в диэтиловом эфире, 10 мл), раствор фильтровали и фильтрат сушили под вакуумом с получением хлорида 5,5′-дисульфандиилбис(2-хлорбензоламиния) в виде не совсем белого порошка (21,47 г, 63%).
1Н ЯМР (400 МГц, CDCl3): δ 7.154 (d, J=8,3 Гц, 2Н), 6 6.865 (d, J=2,2 Гц, 2H), 6 6.783 (dd, J1=2,2 Гц, J2=8,3 Гц, 2Н), 6 4.080 (широкий s, 4H).
1(б) Синтез соединения 1,1′-(5,5′-дисульФандиилбис(2-хлор-5,1-Фенилен))бис(3-метил-3-(3-(метилтио)фенил)гуанидин)
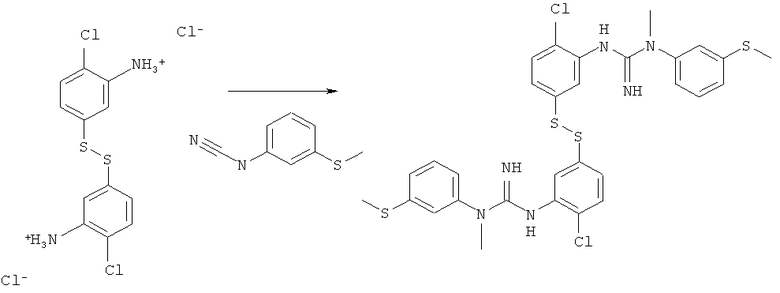
Смесь хлорида 5,5′-дисульфандиилбис(2-хлорбензоламиния) (1,0 г, 2,6 ммоль) и N-метил-N-(3-(метилтио)фенил)цианамида (1,83 г, 10,3 ммоль) нагревали до 130°C. Этот густой медленно перемешиваемый расплав оставляли на 17 ч (выход согласно HPLC через 1 час составлял приблизительно 80%), затем оставляли охлаждаться до КТ. Твердое вещество растворяли в DCM (25 мл), экстрагировали водой (3×200 мл) и объединенные водные фазы снова экстрагировали DCM (50 мл). Водную фазу нейтрализовали с помощью NaHCO3 и экстрагировали диэтиловым эфиром (3×150 мл). Объединенные органические фазы сушили с помощью сульфата магния (приблизительно 5 г), фильтровали и концентрировали досуха при пониженном давлении с получением соединения 1,1′-(5,5′-дисульфандиилбис(2-хлор-5,1-фенилен))бис(3-метил-3-(3-(метилтио)фенил)-гуанидин) (1,16 г, 1,7 ммоль, 67%, чистота согласно HPLC 94,8%) в виде не совсем белого порошка.
1Н ЯМР (400 МГц, CDCl3): δ 7.300 (t, J=7,9 Гц, 2Н), δ 7.298 (d, J=8,3 Гц, 2Н), δ 7.175 (t, J=1,9 Гц, 2Н), δ 7.122 (ddd, J1=1,0, J2=1,8 Гц, J3=7,9 Гц, 2Н), δ 7.108 (d, J=2,3 Гц, 2Н), δ 7.054 (ddd, J1=1,0, J2=2,2 Гц, J3=7,9 Гц, 2Н), δ 7.049 (dd,=2,3, J2=8,3 Гц, 2H), δ 3.893 (широкий s, 4Н), δ 3.338 (s, 6Н), δ 2.494 (s, 6Н).
Пример 2: Синтез соединения 3-(2-хлор-5-меркаптофенил)-1-метил-1-(3-(метилтио)фенил)гуанидин
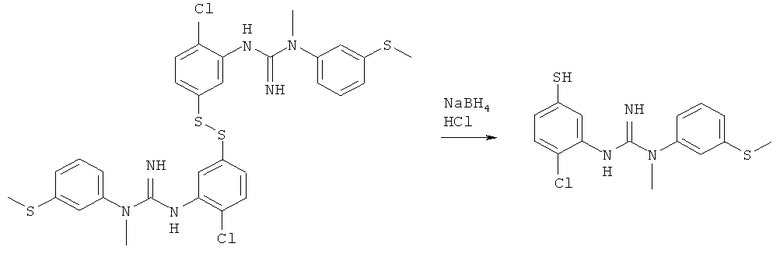
1,1′-(Дисульфандиилбис(2-хлор-5,1-фенилен))бис(3-метил-3-(3-(метилтио)-фенил)гуанидин) (3,1 г, 4,6 ммоль), полученный как описано в Примере 1, суспендировали в EtOH (62 мл) и затем порциями добавляли борогидрид натрия (0,5 г, 13,8 ммоль). Реакционный раствор оставляли перемешиваться в течение ночи в инертной атмосфере. Реакционную смесь охлаждали до 10 градусов, после чего гасили соляной кислотой в эфире (2 М) и концентрировали досуха при пониженном давлении с получением кремообразного твердого вещества. Это твердое вещество очищали колоночной хроматографией (CHCl3->7% МеОН в CHCl3) с получением 3-(2-хлор-5-меркаптофенил)-1-метил-1-(3-(метилтио)фенил)гуанидина (2,5 г, 6,7 ммоль, 73,6%) в виде белой пены.
1H ЯМР (500 МГц, CDCl3): δ 9.686 (s, 1Н), δ 8.531 (s, 2Н), δ 7.132 (t, J=7,8 Гц, 1Н), δ 7.032 (d, J=8,4 Гц, 1Н), δ 7.022 (d, J=7,8 Гц, 1Н), δ 7.014 (s, 1Н), δ 6.922 (s, 1Н), δ 6.892 (d, J=8,4 Гц, 1Н), δ 6.855 (d, J=7,8 Гц, 1Н), δ 3.740 (s, 1Н), δ 3.656 (s, 3H), δ 2.460 (s, 3H).
Пример 3: Синтез 3-(2-хлор-5-((2-Фторэтил)тио)Фенил)-1-метил-1-(3-(метилтио)фенил)гуанидина
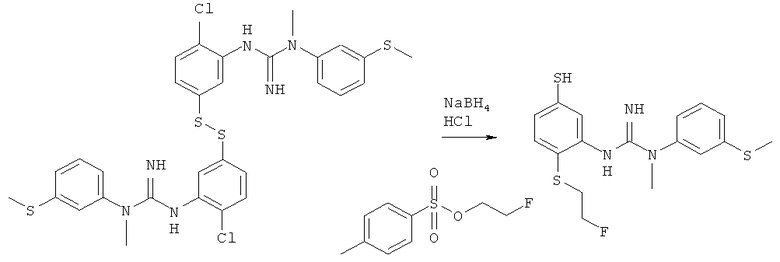
1,1′-(Дисульфандиилбис(2-хлор-5,1-фенилен))бис(3-метил-3-(3-(метилтио)-фенил)гуанидин) (3,0 г, 4,45 ммоль), полученный как описано в Примере 1, растворяли в этаноле (120 мл) и добавляли 2-фторэтил-4-метилбензолсульфонат (2,1 г, 9,8 ммоль). Прозрачный раствор нагревали до 60°C в инертной атмосфере и порциями добавляли борогидрид натрия (0,8 г, 22,3 ммоль). Реакционную смесь нагревали в течение 45 минут, после чего концентрировали досуха при пониженном давлении. Неочищенное вещество очищали колоночной хроматографией (CHCl3->2% МеОН в CHCl3) с получением 3-(2-хлор-5-((2-фторэтил)тио)фенил)-1-метил-1-(3-(метилтио)фенил)гуанидина (2,2 г, 5,6 ммоль, 62,9%) в виде прозрачного медленно кристаллизовавшегося масла.
1H ЯМР (400 МГц, CDCl3): δ 7.28-7.35 (m, 2Н), δ 7.05-7.25 (m, 4Н), δ 6.90-6.95 (dd, J1=3,18 Гц, J2=8,33 Гц 1Н), δ 4.6 (t, J=6,75 Гц, 1Н), δ 4.5 (t, J=6,75 Гц, 1Н), δ 3.9 (широкий S, 1Н), δ 3.4 (s, 3H),δ 3.2(t, J=6,75 Гц, 1H), δ 3.15(t, J=6,75 Гц, 1Н), δ 2.52 (S, 3H, δ 1.65 (широкий S, 1Н).
Пример 4: Синтез 3-(2-хлор-5-((2-фторэтил)тио)фенил)-1-метил-1-(3-(метилтио)Фенил)гуанидина с использованием связанного со смолой борогидрида
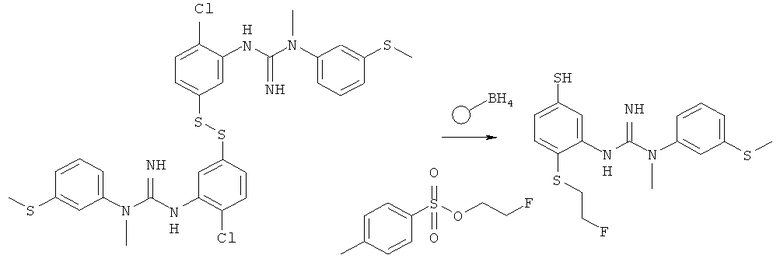
1,1′-(Дисульфандиилбис(2-хлор-5,1-фенилен))бис(3-метил-3-(3-(метилтио)-фенил)гуанидин) (0,15 г, 0,22 ммоль), полученный как описано в Примере 1, и 2-фторэтил-4-метилбензолсульфонат (0,10 г, 0,45 ммоль) растворяли в этаноле (96%, 10 мл) и добавляли борогидрид, присоединенный к твердой фазе (0,45 г, приблизительно 1,11 ммоль). Полученную реакционную суспензию нагревали в инертной атмосфере до 60°C в течение 17 часов. Суспензию фильтровали и материал твердой фазы промывали этанолом (96%, 2,5 мл). Объединенные органические фазы концентрировали при пониженном давлении с получением влажного неочищенного вещества, которое перерастворяли в дихлорметане (10 мл), сушили с помощью сульфата магния (приблизительно 0,3 г, 2,492 ммоль), фильтровали и концентрировали досуха с получением 3-(2-хлор-5-((2-фторэтил)тио)фенил)-1-метил-1-(3-(метилтио)фенил)гуанидина (0,13 г, 0,32 ммоль, 70,7%-ный выход) в виде прозрачного масла.
1H ЯМР (400 МГц, CDCl3): δ 7.28-7.35 (m, 2Н), δ 7.05-7.25 (m, 4Н), 6 6.90-6.95 (dd, J1=3,18 Гц, J2=8,33 Гц 1Н), 6 4.6 (t, J=6,75 Гц, 1Н), 5 4.5 (t, J=6,75 Гц, 1Н), 6 3.9 (широкий S, 1Н), 6 3.4 (s, 3H), 6 3.2 (t, J=6,75 Гц, 1Н), 6 3.15 (t, J=6,75 Гц, 1Н), 6 2.52 (S, 3H), 6 1.65 (широкий S, 1Н).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ синтеза F-меченых биомолекул | 2012 |
|
RU2620598C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА, ПОДХОДЯЩИЕ ДЛЯ ВИЗУАЛИЗАЦИИ НЕЙРОВОСПАЛЕНИЯ | 2009 |
|
RU2512288C2 |
| НОВЫЕ АМИНОАЛКИЛБЕНЗОТИАЗЕПИНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2679891C2 |
| НОВЫЕ СОЕДИНЕНИЯ МИМЕТИКИ ОБРАТНОГО ПОВОРОТА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2457210C2 |
| НОВЫЕ ПИПЕРИДИНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ ХЕМОКИНОВ (CCR) | 2005 |
|
RU2348616C2 |
| ПРОИЗВОДНЫЕ ИЗАТИНА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ АГЕНТОВ ВИЗУАЛИЗАЦИИ IN VIVO | 2009 |
|
RU2535975C2 |
| 1,4,5-ТРИЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2196139C2 |
| КАТАЛИТИЧЕСКАЯ СИСТЕМА | 2003 |
|
RU2326123C2 |
| НОВЫЕ 2-ГЕТЕРОАРИЛ-ЗАМЕЩЕННЫЕ БЕНЗОТИОФЕНЫ И БЕНЗОФУРАНЫ 709 | 2008 |
|
RU2472789C2 |
| ТРИЦИКЛИЧЕСКИЕ ИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ЛИГАНДОВ PBR | 2010 |
|
RU2525196C2 |
Изобретение относится к способу получения меченного радиоактивным изотопом гуанидинового производного для позитронной эмиссионной томографии (PET) формулы I:
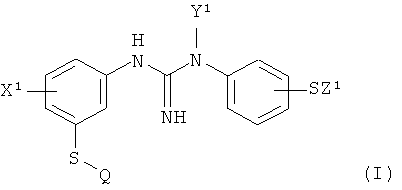 ,
,
где X1 представляет собой группу X, выбранную из C1-4алкила или галогено; Y1 представляет собой группу Y, выбранную из водорода или C1-4алкила; Z1 представляет собой группу Z, которая представляет собой C1-4алкил; и Q представляет собой [11C]C1-4алкил- или [18F]-C1-4фторалкил-. 3 н. и 11 з.п. ф-лы, 1 табл., 4 пр.
1. Способ получения радиоизотопного индикатора для позитронной эмиссионной томографии (PET) формулы I:
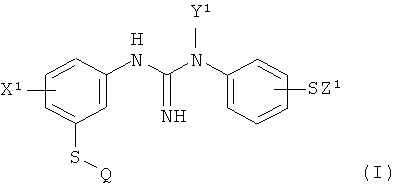 ,
,
где X1 представляет собой группу X, выбранную из C1-4алкила или галогено;
Y1 представляет собой группу Y, выбранную из водорода или C1-4алкила;
Z1 представляет собой группу Z, которая представляет собой C1-4алкил; и
Q представляет собой [11C]C1-4алкил- или [18F]-C1-4фторалкил-;
где указанный способ включает:
(a) предоставление соединения формулы II:
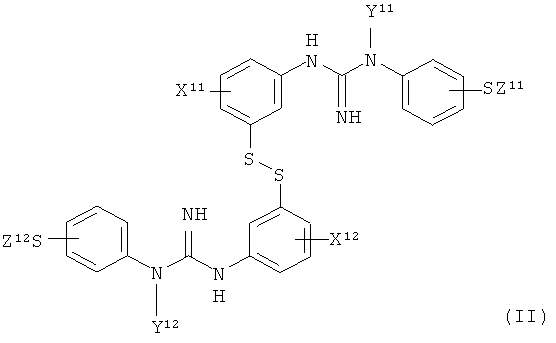 ,
,
где X11 и X12 являются одинаковыми и обе представляют собой группу X, как определено для X1;
Y11 и Y12 являются одинаковыми и обе представляют собой группу Y, как определено для Y1; и
Z11 и Z12 являются одинаковыми и обе представляют собой группу Z, как определено для Z1;
(b) восстановление указанного соединения формулы II с помощью восстанавливающего агента с получением соединения формулы III:
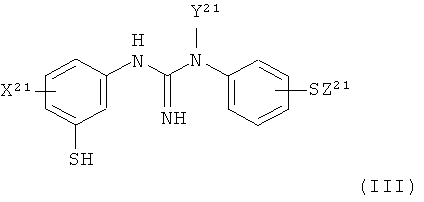 ,
,
X21 представляет собой группу X, как определено для X1;
Y21 представляет собой группу Y, как определено для Y1; и
Z21 представляет собой группу Z, как определено для Z1;
(c) взаимодействие соединения формулы III, полученного на стадии (b), с [11C]C1-4алкил-LG1 или [18F]-C1-4фторалкил-LG2, где LG1 и LG2 независимо представляют собой галогено или группу -O-SO2-R1, где R1 представляет собой возможно замещенный C6-10арил, возможно замещенный C1-4алкил или C1-4фторалкил, где указанное взаимодействие осуществляют в подходящем растворителе.
2. Способ по п.1, где указанное соединение формулы II представляет собой соединение формулы IIa:
 ,
,
где X11 и X12 являются одинаковыми и обе представляют собой группу X, как определено в п.1;
Y11 и Y12 являются одинаковыми и обе представляют собой группу Y, как определено в п.1; и
Z11 и Z12 являются одинаковыми и обе представляют собой группу Z, как определено в п.1.
3. Способ по п.1, где указанная группа X представляет собой галогено.
4. Способ по п.1, где указанная группа Y представляет собой C1-4алкил.
5. Способ по п.1, где указанная группа Z представляет собой метил.
6. Способ по п.1, где указанная группа X представляет собой хлоро, указанная группа Y представляет собой метил, и указанная группа Z представляет собой метил.
7. Способ по п.1, где указанный восстанавливающий агент, используемый на стадии (b), выбран из борогидрида натрия (NaBH4), цинка в соляной кислоте, цинка в уксусной кислоте, магния в соляной кислоте, гидротеллурида натрия (NaTeH) в этаноле, алюмогидрида лития (LiAlH4) в тетрагидрофуране, индия в хлориде аммония и гидрида натрия (NaH).
8. Способ по п.1, где на указанной стадии взаимодействия (c) соединение формулы III подвергают взаимодействию с [18F]-C1-4фторалкил-LG2.
9. Способ по п.1, где указанную стадию восстановления (b) и указанную стадию взаимодействия (с) осуществляют немедленно друг за другом.
10. Способ по п.1, где указанную стадию восстановления (b) и указанную стадию взаимодействия (c) осуществляют в одном и том же сосуде.
11. Способ по любому из пп.1-10, где указанный способ является автоматизированным.
12. Способ получения соединения формулы III, как определено в любом из пп.1 и 3-6, включающий взаимодействие соединения формулы IV:
 ,
,
где X31 и X32 являются одинаковыми и обе представляют собой группу X, как определено в любом из пп.1, 3 и 6;
с соединением формулы V:
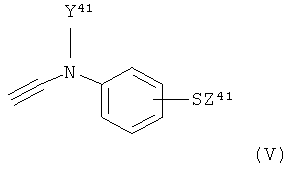 ,
,
где Y41 представляет собой группу Y, как определено в любом из пп.1, 4 и 6, и Z41 представляет собой группу Z, как определено в любом из пп.1, 5 и 6;
с получением соединения формулы II, как определено в любом из пп.1-6; и
восстановление указанного соединения формулы II с помощью восстанавливающего агента, как определено в любом из пп.1 или 7, с получением указанного соединения формулы III.
13. Кассета для осуществления способа по п.11, где указанная кассета содержит:
1) сосуд, содержащий соединение формулы II, как определено в любом из пп.1-6;
2) средство для осуществления взаимодействия указанного соединения формулы II с восстанавливающим агентом с образованием соединения формулы III, как определено в любом из пп.1 и 3-6; и
3) средство для осуществления взаимодействия указанного соединения формулы III с [11C]C1-4алкил-LG1 или [18F]-C1-4фторалкил-LG2 с получением радиоизотопного индикатора для PET формулы I, где LG1, LG2 и указанный радиоизотопный индикатор для PET формулы I являются такими, как определено в п.1.
14. Кассета по п.13, которая дополнительно содержит:
4) ионообменный картридж для удаления избытка [11C]C1-4алкил-LG1 или [18F]-С1-4фторалкил-LG2.
| RU 2007146237, A,27.07.2009 | |||
| WO 2004007440,A1,22.01.2004 | |||
| E.G/ROBINS ET AL., "Synthesis and in vitro evaluation of 18F-labelled S-fluoroalkyl diarylguanidines:Novel high-affinity NMDA receptor antagonists for imaging with PET", BIOORGANIC & MEDICINAL CHEMISTRY LETTERS, vol.20, no.5, pp.1749-1751, 2010. |
Авторы
Даты
2016-01-20—Публикация
2011-05-13—Подача